Кристаллический ингибитор ахат - RU2394020C2
Код документа: RU2394020C2
Чертежи


Описание
Область техники, к которой относится изобретение
Настоящее изобретение направлено на кристаллическую форму N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида и его применение для производства лекарственных средств.
Уровень техники
Человеческую кожу составляют три основных слоя: роговой слой, эпидермис и дерма. Наружным слоем является роговой слой. Его основной функцией является образование барьера с окружающей средой. На поверхность рогового слоя секретируются липиды. Эти липиды уменьшают проницаемость рогового слоя для воды. Кожное сало обычно составляет 95% от этих липидов. Abramovits et al, Dermatologic Clinics, vol 18, Number 4, Oct. 2000.
Кожное сало образуется сальными железами. Эти железы имеются на большей части поверхности тела. Самая большая концентрация этих желез обнаруживается на скальпе, лбу и лице. Несмотря на то важное физиологическое значение, которое играет кожное сало, у многих лиц наблюдается избыточное его образование, особенно в области лица. Продукцию избыточного количества кожного сала ассоциируют с повышением частоты возникновения угревой сыпи. Даже у лиц, не страдающих от угревой сыпи, кожное сало может придать коже “засаленный вид”, уменьшая ее привлекательность. Abramovits et al, supra.
Изначально была открыта способность ингибиторов ацил-СоА- холестерин-ацил-трансферазы (АХАТ) лечить повышенный уровень холестерина в крови. В патенте US 6133326 раскрыто, что в дополнение к снижению уровня холестерина ингибиторы АХАТ снижают секрецию кожного сала. В WO 05/034931 А1 раскрыто, что использование специфического класса диамидных ингибиторов АХАТ приводит к снижению продуцирования кожного сала. N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамид является одним из компонентов, использование которого отражено в заявке '931. N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамид изначально описывали в заявке ЕР 0433662 (см. стр. 11, строка 50, где на него ссылаются как на N'-[2,6-бис(1-метилэтил)-фенил]-N-(1-метилэтил)-N-(фенилметил)пропандиамид) как ингибитор АХАТ для лечения повышенного уровня холестерина. Европейская заявка '662 не раскрывает применение этих соединений для регулирования секреции кожного сала.
Сущность изобретения
В соответствии с настоящим изобретением раскрыта кристаллическая форма N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида. Структура N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида показана ниже:
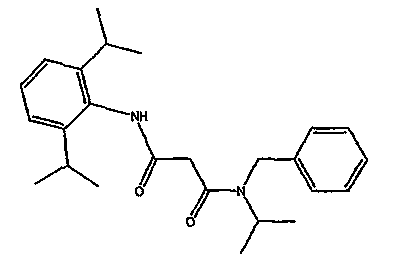
Кристаллическую форму N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида обозначают как полиморфную модификацию А. Она характеризуется порошковой рентгенограммой, описанной далее (XRPD).
Кристаллическая форма может быть использована в качестве ингибитора АХАТ. Ее можно вводить пациентам для регулирования повышенных уровней холестерина и/или для снижения секреции кожного сала. В более специфическом воплощении кристаллическую форму включают в состав лекарственной формы для местного нанесения, который используется пациентами для снижения секреции кожного сала, для улучшения жирной кожи, уменьшения выраженности угревой сыпи, снижения эффекта “блестящей” кожи или для устранения других косметических дефектов, обычно связанных с гиперпродукцией кожного сала.
В последующем воплощении изобретение относится к изделию (то есть набору), содержащему одну из этих лекарственных форм для местного применения, и упакованному для розничного распространения. К нему прилагаются инструкции и рекомендации потребителю о том, как использовать продукт для облегчения кожных расстройств, связанных с избыточным образованием кожного сала.
Краткое описание чертежей
Фиг. 1 иллюстрирует порошковую рентгенограмму полиморфной модификации А, полученной согласно примеру 2, по шкале в диапазоне от 6,4° 2θ до 41° 2θ.
Фиг. 2 иллюстрирует порошковую рентгенограмму полиморфной модификации А, полученной согласно примеру 2, по шкале в диапазоне от 2,0° 2θ до 38° 2θ, полученную при помощи другого дифрактометра.
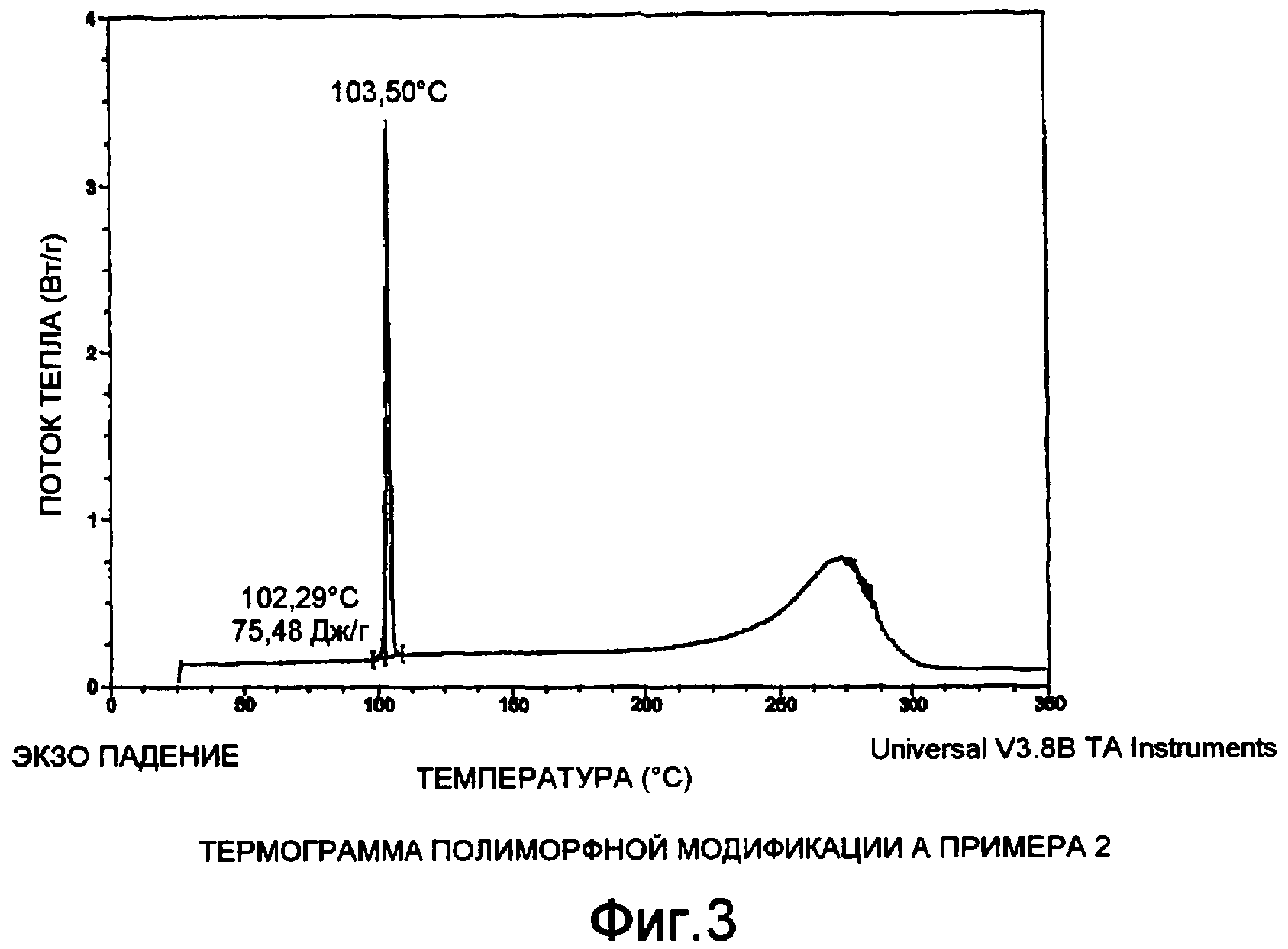
Фиг. 3 иллюстрирует термограмму полиморфной модификации А.
Подробное описание изобретения
А. Способы идентификации
1) Рентгеновская дифрактометрия порошка
Экспериментальная порошковая рентгенограмма, представленная в фиг. 1 (т.е. XRPD), была получена при помощи порошкового дифрактометра Bruker D8 с ДСПОД (Детекторная система полной области дифракции), С2 системы с единичной конфигурацией зеркала Goebel. Образцы подвергали действию Cu-К-альфа-излучения (λ=0,15056 нм) при помощи рентгеновской трубки при условиях эксплуатации 40 кВ и 40 мА. Сканирование проводили при помощи детектора на 15,0 см. Тэта 1 или калиматор был установлен на 7°, и тэта 2 или детектор был установлен на 17°. Ось сканирования представляла собой ось 2-омега шириной 3°. В конце каждого сканирования тэта 1 составляло 10°, и тэта 2 - 14°. Образцы исследовали в течение 60 секунд, и изображения, полученные в ходе сканирования, интегрировали от 6,4° до 41°2θ. Изображения, полученные в ходе сканирования, оценивали при помощи программного обеспечения DiffracPlus, 2003 года выпуска, и Eva версия 9.0. Образцы исследовали в держателях образцов ASC-6, поставляемых Gem Dugout (State College, PA). Образцы помещали в полость в середине держателя образца и выравнивали при помощи шпателя таким образом, чтобы он был на одном уровне с поверхностью держателя. Все анализы проводили при комнатной температуре, которая обычно находилась в диапазоне от 24°С до 28°С.
Экспериментальная порошковая рентгенограмма, представленная на фиг. 2, (т.е. XRPD), была получена при помощи усовершенствованной дифракционной системы ScintagX1, управляемой при помощи программного обеспечения DMS/NT3 1.36b. При эксплуатации системы используется медный рентгеновский источник, установочные параметры которого для обеспечения CuKα1 эмиссии 1,5406 Å составляют 45 кВ и 40 мА, и твердофазный детектор, охлаждаемый элементом Пельтье. Апертура пучка регулируется при помощи отклонения трубки и щелей, предотвращающих рассеивание, 2 и 4 мм, и щелей, предотвращающих рассеивание, и приемных щелей 0,5 и 0,3 мм шириной. Данные собирали в диапазоне 2° до 38° два-тэта (2θ) пошаговым сканированием 0,03°/точка, и время счета составляло 1 секунда/точка. Использовали загружаемые сверху емкости с округлым отверстием Scintag из нержавеющей стали для образцов с 9-мм алюминиевой спейсерной вставкой.
Образец получали измельчением порции образца в агатовой ступке с пестиком, помещали образец в полость устройства и уплощали стальным блоком таким образом, чтобы он находился на уровне наружного обода диска. Анализ проводили при комнатной температуре и атмосферном давлении.
Специалисту, квалифицированному в данной области, будет очевидно, что результаты любой дифракции рентгеновских лучей при прохождении через порошок могут варьироваться и дальнейшие XRPD не будут идентичны, даже если исследования выполняются для одной и той же партии вещества. Это несоответствие может быть следствием отклонений при получении тестируемого образца, колебаний температуры, конкретной используемой модели дифрактометра рентгеновских лучей, различных приемов оператора и т.д.
Термин «приблизительно» при его использовании для определения пика на порошковой рентгенограмме означает, что величина 2θ устанавливается как величина 2θ±0,2° 2θ. Любое утверждение, что кристаллическая форма представляет собой полиморфную модификацию А, включенную в формулу изобретения, необходимо интерпретировать в свете возможности несоответствий согласно данному тесту.
Данное несоответствие представлено на фиг. 1 и 2. N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамид из одной и той же партии использовали для получения XRPD на различных дифрактометрах различными операторами. Характеристические пики, обсуждаемые ниже, присутствуют в каждой фигуре, подтверждая, что исследуемое вещество представляет собой полиморфную модификацию А. Однако относительная интенсивность этих пиков, равно как и интенсивность других пиков, варьируются.
2) Дифференциальная сканирующая калориметрия
Эксперимент проводили при помощи прибора DSC Q1000 (TA instruments, New castle, DE). Для пропускания использовали азот со скоростью потока 50 мл/мин для ячейки ДСК и 110 мл/мин для рефрижераторной системы охлаждения. Калориметр калибровали для данной температуры и постоянной ячейки при помощи индия (точка плавления 156,61°С, энтальпия плавления 28,71 Дж/г). Для экспериментов использовали герметично закрытые алюминиевые тигли с маленьким отверстием, в которых нагревали образцы (3-5 мг) со скоростью 10°С/мин. Анализ данных проводили при помощи программного обеспечения TA instruments' Universal Analysis 2000 для Windows ver 3.8B.
В) Полиморфная модификация А
Как указано выше, была обнаружена кристаллическая форма N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида. В данном описании эта кристаллическая форма обозначается как полиморфная модификация А. Полиморфную модификацию А можно идентифицировать по порошковой рентгенограмме. Согласно фиг.1 и 2 полиморфная модификация А характеризуется наличием трех характеристических пиков. Характеристический пик имеет относительно большую интенсивность на XRPD и служит для идентификации кристаллических форм. Один из них находится приблизительно при 28,1 градусов 2θ. Второй находится приблизительно при 16,0 градусах 2θ. Третий находится приблизительно при 19,6 градусов 2θ. Любой из данных пиков отдельно или в сочетании может быть использован для идентификации полиморфной модификации А.
Кроме характеристических пиков на фиг. 1 и 2 обнаруживаются другие идентифицирующие пики. Интенсивность этих дополнительных пиков может варьироваться в зависимости от конкретной ориентации полиморфного образца. Эти дополнительные пики можно использовать для подтверждения присутствия полиморфной модификации А, но их отсутствие не должно исключать того, что конкретное вещество является полиморфной модификацией А. Эти идентифицирующие пики включают: 7,3, 10,3, 10,8, 11,3, 12,1, 14,6, 14,9, 16,5, 17,9, 18,1, 18,9, 19,1, 20,7, 21,8, 22,9, 23,2, 25,0 и 26,0 (выражаются в градусах 2θ, ±0,2 2θ, т.е. приблизительно).
Также полиморфная модификация А может быть охарактеризована при помощи дифференциальной сканирующей калориметрии (ДСК). Как показано на фиг. 3, имеет место выраженная эндотерма при 102°С. Эта точка соответствует точке плавления полиморфной модификации А. Различные образцы полиморфной модификации А характеризуются точкой плавления приблизительно 100°±6°С.
Таким образом, в одном воплощении изобретение направлено на полиморфную модификацию кристаллического N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида, обладающую типичной порошковой рентгенограммой, включающей, по меньшей мере, один характеристический пик, находящийся при, приблизительно, 28,1, 16,0 или 19,6 градусов 2θ. В последующем воплощении изобретение направлено на полиморфную модификацию кристаллического N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида, обладающего характеристическими пиками, находящимися при, приблизительно, 28,1, 16,0 или 19,6 градусов 2θ, и для которой необязательно наблюдается, по меньшей мере, один дополнительный пик, находящийся при, приблизительно, 7,3, 10,3, 16,5, 17,9, 20,7, 19,1 или 25,0 2θ. В следующем воплощении изобретение направлено на полиморфную модификацию кристаллического N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида, обладающего характеристическими пиками, находящимися при, приблизительно, 16,0, 19,6 28,1 градусов 2θ, и для которой необязательно наблюдается, по меньшей мере, два дополнительных пика, находящихся при 7,3, 10,3, 10,8, 11,3, 12,1, 14,6, 14,9, 16,5, 17,9, 18,1, 18,9, 19,1, 20,7, 21,8, 22,9, 23,2, 25,0 или 26,0 2θ.
Дополнительно, изобретение направлено на полиморфную модификацию кристаллического N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида, обладающую:
1) характеристическими пиками, находящимися при приблизительно 16,0, 19,6, 28,1 градусов 2θ и 2) по меньшей мере, одним или двумя дополнительными пиками, наблюдаемыми при приблизительно 7,3, 10,3, 10,8, 11,3, 12,1, 14,6, 14,9, 16,5, 17,9, 18,1, 18,9, 19,1, 20,7, 21,8, 22,9, 23,2, 25,0 или 26,0 2θ, и 3) точкой плавления 100°±6°С.
С) Способ получения
Полиморфная модификация А может быть получена, как показано в схеме реакции I, представленной ниже.

Один из реагентов представляет собой N-(2-6-изопропил-фенил)-моноамид малоновой кислоты, который может быть получен как описано в заявке ЕР 0433662. Другой реагент представляет собой бензил-изопропиламин, который можно получить из коммерческих источников. Реакцию обычно проводят путем взаимодействия эквивалентных количеств амина и кислоты в органическом растворителе (таком как дихлорметан) в присутствии основания (такого как триэтиламин) и сшивающего агента (такого как 1-этил-3-(3-диметиламинопропил)-карбодиимида (“EDAC”) или дициклогексилкарбодиимида (“DCC”). Реагенты обычно смешивают при 0°С, оставляют для нагревания до комнатной температуры и затем перемешивают до завершения реакции. По завершении реакцию гасят и разбавляют органическим растворителем. При выпаривании растворителя N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропилмалонамид выделяется в виде масла. Масло может быть необязательно очищено при помощи хроматографии, как известно специалистам в данной области.
Затем полиморфная модификация А может быть получена путем перекристаллизации масла из гептана. Обычно масло растворяют в гептане и перемешивают в течение продолжительного времени. Это время может составлять от 18 до 24 часов в зависимости от количеств перерабатываемого вещества. Перекристаллизацию можно проводить как при пониженных температурах, так и при комнатной температуре. При желании для ускорения процесса можно использовать затравку кристаллизации.
D) Применение в сфере медицины и косметике
Процесс ингибирования фермента ацил-СоА холестерин-ацил-трансферазы (АХАТ) подавляет этерификацию свободного холестерина с образованием сложных эфиров холестерина. Эфиры холестерина являются основной транспортируемой и депонируемой формой холестерина у животных. Как показано, в кишечнике ингибиторы АХАТ подавляют абсорбцию холестерина из просвета кишки. Как показано, в печени ингибирование АХАТ подавляет образование и секрецию содержащих холестерин липопротеинов путем снижения количества холестериновых эфиров в ядре липопротеина. По этим причинам ингибиторы АХАТ были изначально показаны для снижения уровня сывороточного холестерина.
Кожные сальные железы являются голокриновыми железами, которые секретируют смесь липидов, известную как кожное сало. Кожное сало составляют триглицериды, воск, стериновые эфиры и сквален. Существуют значительные колебания в составе человеческого кожного сала, зависящие от индивидуальных различий, таких как возраст, пол, питание и состояние здоровья. Кожное сало, выделяющееся в ацинарных клетках сальных желез, накапливается в клетках в процессе их жизнедеятельности и перемещается по направлению к центру железы. При созревании ацинарные клетки подвергаются лизису и высвобождают кожное сало в просвет протока, из которого оно секретируется.
Образование кожного сала регулируется множеством гормонов, которые в первую очередь влияют на скорость метаболизма липидов. В ацинарных клетках воска и стерины превращаются благодаря множеству трансфераз ацильных и жирных кислот в стабильные эфиры для последующего хранения. Перед высвобождением эти эфиры затем депонируются в виде липидных отложений в ацинарных клетках.
Лекарственные средства, изготовляемые из полиморфной модификации А N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропилмалонамида (далее “соединение”), блокируют превращение свободного холестерина в эфир, приводя к увеличению уровня свободного холестерина в ацинарных клетках. Под воздействием ингибитора АХАТ ацинарные клетки производят меньшее количество кожного сала, клеточный механизм данного процесса в настоящее время не совсем ясен.
Таким образом, соединение ингибирует секрецию кожного сала и снижает количество кожного сала на поверхности кожи. Соединение можно использовать для лечения множества заболеваний кожи, таких как угревая сыпь или себорейный дерматит.
В дополнение к лечению заболеваний, связанных с избыточной продукцией кожного сала, соединение также можно использовать для достижения косметических эффектов. Некоторые потребители полагают, что страдают от гиперактивности сальных желез. Они ощущают, что их кожа является жирной, и считают ее непривлекательной. Данные индивиды могут использовать соединение для снижения количества кожного сала на поверхности их кожи. Снижение секреции кожного сала улучшит состояние жирной кожи у индивидуумов, страдающих от указанных состояний.
С целью получения биологических эффектов, описанных выше, соединение нужно вводить в количестве, достаточном для снижения продукции и/или секреции кожного сала сальными железами и ацинарными клетками. Необходимое количество может варьироваться в зависимости от конкретного заболевания/состояния, предназначенного для лечения, выраженности заболевания/состояния пациента, особенностей пациента, пути введения, наличия сопутствующих болезненных состояний у пациента и т.д. При системном введении соединение обычно проявляет свой эффект в интервале доз от 0,1 мг/кг/сутки до 100 мг/кг/сутки для всех заболеваний, упомянутых выше. Кратность суточного введения может устанавливаться по желанию и может варьироваться согласно состоянию, отмеченному выше. Используемый в данном описании термин “пациент” относится к млекопитающему, которым, как правило, является человек.
Соединение можно вводить множеством способов. Оно эффективно при пероральном введении. Соединение также можно вводить парентерально (а именно подкожно, внутривенно, внутримышечно, внутрибрюшинно или интратекально), ректально или местно.
Согласно типичному воплощению соединение используется для изготовления лекарственных форм, вводимых местно. Местное введение особенно подходит для лечения угрей и в косметических целях. Лекарственное средство для местного нанесения накладывается на области кожи, подверженные гиперпродукции кожного сала. Доза может варьироваться, но согласно рекомендациям общего порядка предусмотрено присутствие соединения в дерматологически приемлемом носителе в количестве от 0,01 до 10 мас.%, и дерматологический препарат наносят на пораженную кожу 1-4 раза ежедневно. Термин “дерматологически приемлемый” относится к носителю, который наносят на кожу, волосы и скальп и который позволяет препарату диффундировать в место приложения действия (а именно к сальным железам и ацинарным клеткам).
E) Косметические и фармацевтические композиции
По желанию соединение может быть введено непосредственно без какого-либо носителя. Однако для облегчения введения его обычно объединяют с фармацевтическим носителем.
Для перорального введения соединение вводят в состав твердых или жидких препаративных форм, представляющих собой капсулы, пилюли, таблетки, пастилки, массы, порошки, суспензии или эмульсии. Твердая однократная лекарственная форма может представлять собой обычную желатиновую капсулу, содержащую, например, поверхностно-активные вещества, смазывающие вещества и инертные наполнители, такие как лактоза, сахароза и кукурузный крахмал, или могут представлять собой форму замедленного высвобождением.
В другом воплощении соединение может быть таблетировано с общепринятыми таблеточными основами, такими как лактоза, сахароза и кукурузный крахмал, в сочетании со связующими веществами, такими как акация, кукурузный крахмал или желатин, разрыхляющими агентами, такими как картофельный крахмал или альгиновая кислота, и смазывающими веществами, такими как стеариновая кислота или стеарат магния. Жидкие препаративные формы получают путем растворения соединения в водном или безводном фармацевтически приемлемом растворителе, который также может содержать суспендирующие агенты, подсластители, агенты, придающие вкус, и консерванты, широко известные специалистам в данной области.
Для парентерального введения соединение может быть растворено в физиологически приемлемом фармацевтическом носителе и вводиться либо в виде раствора, либо в виде суспензии. Иллюстрацией таких подходящих фармацевтических носителей может быть вода, физиологический раствор, растворы декстрозы, растворы фруктозы, этанол или масла животного, растительного или синтетического происхождения. Фармацевтические носители могут также содержать консерванты, буферы и подобные, известные специалистам в данной области. Как известно специалистам в данной области, при введении соединения интратекально его можно растворять в спинномозговой жидкости.
Однако, обычно, соединение включают в композицию, подходящую для местного нанесения. Возможно использование любой формы композиции для местного введения, известной в данной области. Примерами подобных форм для местного нанесения могут служить лосьоны, спреи, кремы, мази, бальзамы, гели и т.д. Действительные способы изготовления препаративных форм для местного нанесения известны специалистам в данной области и подробно описаны в Remington's Pharmaceutical Sciences 1990 (выше) и Pharmaceutical Dosage Forms and Delivery Systems, 6th ed., Williams & Wilkins (1995).
Согласно последующему воплощению композиции, описанные выше, могут быть упакованы для розничного распространения (а именно в виде набора или продукта производителя). Упаковка содержит инструкции, дающие рекомендации пациенту, как использовать продукт для облегчения состояний, таких как угревая сыпь, маслянистая кожа и т.д. Подобные инструкции могут быть напечатаны на коробке, на отдельном листке или на поверхности контейнера, содержащего препарат и т.д.
Соединение может быть также смешано с любым инертным носителем, используемым в лабораторных исследованиях с целью определения концентрации соединений в сыворотке, моче (и т.д.) пациента, как известно специалистам в данной области. Соединение также может быть использовано в качестве средства для исследований.
Несмотря на то, что изобретение было описано в связи с его специфическими воплощениями, в дальнейшем станет понятно, что возможно его дальнейшее модифицирование, и данная заявка включает любые вариации, применения или улучшения изобретения, придерживающиеся, в основном, принципов изобретения и включающие известные и практикуемые отступления от настоящего раскрытия, согласно области, к которой относится изобретение. Следующие примеры и биологические данные представлены для иллюстрирования изобретения. Данное раскрытие никоим образом не должно рассматриваться как ограничение данного изобретения.
ПРИМЕРЫ
Для дополнительного иллюстрирования изобретения представлены следующие примеры. Они не должны рассматриваться как ограничивающие изобретение.
Пример 1
Данный пример иллюстрирует получение N-(2,6-диизопропил-фенил)-моноамида малоновой кислоты, одного из исходных веществ для получения N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида.
Стадия А) этиловый эфир N-(2,6-диизопропил-фенил)-моноамида малоновой кислоты
5 л 4-горлую колбу снабжали механической мешалкой и термометром и затем продували жидким азотом. В колбу помещали 200 мл (188 г, 1,06 моль) 2,6-диизопропиланилина, 163 мл (118 г, 1,17 моль) триэтиламина и 2,5 л этилацетата. Прозрачный желтый раствор охлаждали до 0°С при перемешивании и добавляли 143 мл (168 г, 95% степень чистоты, 1,06 моль) этилмалонил хлорида в течение 15 мин. При добавлении температура внутри колбы поднималась до 22°С. Ледяную баню удаляли и желтую суспензию перемешивали в течение 100 минут (завершение реакции детектировали при помощи ВЭЖХ). Суспензию фильтровали, и фильтрат упаривали на Rotavap с получением желтоватого твердого вещества. Затем неочищенный эфир перекристаллизовывали из 3,0 л гептана с получением 240,24 г (78%) метилового эфира N-(2,6-диизопропил-фенил)-моноамида малоновой кислоты в виде желтоватых кристаллов. Анализ ВЭЖХ показал более 99% степень чистоты (как указано выше). Данные1Н-ЯМР спектра соответствовали структуре.
Стадия В) N-(2,6-диизопропил-фенил)-моноамид малоновой кислоты
5 л 4-горлую колбу снабжали механической мешалкой и помещали в нее 1200 мл метанола и 240,24 г (824 ммоль) метилового эфира N-(2,6-диизопропил-фенил)-моноамида малоновой кислоты, непосредственно после его получения, как указано выше. К прозрачному оранжевому раствору добавляли 483 мл (966 ммоль) 2,0 N гидроксида натрия. Раствор перемешивали, пока анализ ВЭЖХ не показал завершение реакции (приблизительно 2,5 часа), и затем подкисляли до рН 3 N хлороводородной кислотой. Суспензию разбавляли 2,0 л этилацетата и 0,5 л воды. Водные слои удаляли и затем промывали органический слой 0,5 л воды и 0,5 л солевого раствора. Водные слои снова экстрагировали 0,5 л этилацетата, и затем объединенные органические слои сушили над сульфатом магния. Суспензию упаривали на Rotavap с получением 216 г (99%) сырой кислоты в виде желтоватого твердого вещества. Сырое вещество суспендировали в 2,2 л гептана и затем выделяли фильтрацией. Твердое вещество промывали гептаном и петролейным эфиром и затем сушили на воздухе с получением 202,53 г N-(2,6-диизопропил-фенил)-моноамида малоновой кислоты в виде желтоватого твердого вещества. Анализ ВЭЖХ - степень чистоты более 99% (как указано выше). Данные1Н-ЯМР спектра соответствовали структуре.
Пример 2
Данный пример иллюстрирует получение полиморфной модификации А N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида.
В 2 л колбу, оснащенную мешалкой и трубкой для ввода и вывода азота, помещали N-(2,6-диизопропил-фенил)-моноамид малоновой кислоты (100 г, 0,380 моль) и N-бензилизопропиламин (82 мл, 74 г, 0,5 моль). Полученный раствор перемешивали на ледяной ацетоновой бане, пока он не охладился до -5°С, затем добавляли EDAC (80 г, 0,42 моль), с последующим добавлением триэтиламина (75 мл, 54 г, 0,54 моль). Смесь перемешивали и оставляли, пока ее температура не стала равна комнатной, затем оставляли на ночь. Анализ ТХ (этилацетат:метанол, 95:5) показал наличие непрореагировавшей кислоты. Добавляли еще 8 г EDAC и 15 мл триэтиламина, и смесь перемешивали при комнатной температуре еще в течение 4 ч. Анализ ТХ не показал изменений, и реакционную смесь обрабатывали промыванием, сначала 2 N HCl (500 мл), затем 2 N NaOH (закисление после промывания основанием привело к осаждению ~13 г непрореагировавшего моноамида малоновой кислоты). После промывания кислотой и основанием органический раствор промывали водой (500 мл), затем солевым раствором (250 мл). Затем его сушили над сульфатом магния, фильтровали и концентрировали до состояния густого масла. Сырой продукт растворяли в небольшом объеме теплого гептана и фильтровали через ~500 г силикагеля, который промывали 10% этилацетатом в гептане до выхода желаемого продукта. На силикагеле сверху остался тонкий слой полярных примесей, и был получен почти чистый раствор продукта. Большую часть растворителя упаривали на Rotavap для удаления этилацетата, и затем масло растворяли в гептане (1 литр). Раствор остывал, и в него вносили несколько кристаллов полиморфной модификации А, и перемешивали при комнатной температуре до полного выпадения осадка продукта. Затем суспензию перемешивали в течение 24 часов, затем охлаждали до 0°С и фильтровали при помощи вакуумного насоса. Собранный продукт сушили на воздухе при комнатной температуре с получением 98 г полиморфной модификации А N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида. Точку плавления 102,3°С определяли ДСК, как описано выше.
Пример 3
Данный пример иллюстрирует получение полиморфной модификации А N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида.
N-(2,6-диизопропил-фенил)-моноамид малоновой кислоты (2,759 кг, 9,88 моль) растворяли в дихлорметане (12,5 л), и раствор охлаждали до -5°С. Затем добавляли EDAC (2,08 кг, 10,9 моль) и триэтиламин (2,05 л, 14,8 моль) и смесь перемешивали в течение 1 часа при -5°С. При данной температуре добавляли N-бензилизопропиламин (2,3 л, 13,8 моль), и смесь оставляли нагреваться до комнатной в течение ночи. Анализ ИПХ (ВЭЖХ) показал неполную конверсию, и добавляли дополнительное количество EDAC (0,378 кг, 2,0 моль) и триэтиламина (0,27 л), и продолжали перемешивание смеси при комнатной температуре в течение 3 часов. Анализ ИПХ (ВЭЖХ) показал почти полную конверсию, и реакционную смесь промывали 2 N HCl (15 л). Органический слой промывали 2 N NaOH (15 л) и наполовину насыщенным солевым раствором (28 л) (при каждом промывании отделяли тяжелую фракцию). Органический слой отделяли и концентрировали при пониженном давлении. Добавляли гептан (12 л), и при перегонке отгоняли 10,7 л. Добавляли этилацетат (2 л) с получением суспензии. При нагревании до 50°С получали раствор, который перемешивали при 20°С более часа. Раствор фильтровали через силикагель (12,2 кг) и смывали смесью этилацетат:гептан 3:7 (160 л). Получали 80 л, содержащих продукт. Образцы растворов, элюированные до и после основной фракции, упаривали, во фракции, выходящей до основной, не было обнаружено вещества, в 20 л после основной фракции было обнаружено только 12,5 г продукта. Решили не объединять эту фракцию с основной. Раствор концентрировали в реакторе при 100-150 мбар при 50°С. Добавляли гептан (28 л) и суспензию нагревали до 80°С с получением раствора. После перемешивания в течение выходных суспензию охлаждали до 0°С и перемешивали в течение следующих 2 ч при данной температуре. Суспензию фильтровали, промывали гептаном (3 л), сушили в потоке азота и упаривали досуха на Rotavap с получением 1985 г беловатого осадка со степенью чистоты 99,82% (как указано выше) согласно анализу ВЭЖХ.
Пример 4
Данный пример также иллюстрирует получение полиморфной модификации А N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида.
В резервуар емкостью 50 галлонов помещали 13,2 кг (68,2 моль, 1,25 эквив.) EDC гидрохлорида и 42,5 кг ДМФ («диметилформамид») и охлаждали до 0-5°С. В реактор емкостью 100 галлонов помещали 14,38 кг (54,5 моль, 1,0 эквив.) N-(2,6-диизопропил-фенил)-моноамида малоновой кислоты, 3,75 кг (27,2 моль, 0,5 эквив.) безводного 1-гидроксибензотриазола и 19 кг ДМФ. Смесь охлаждали до 0-5°С. Затем к данной смеси добавляли 9,0 кг (60,1 моль, 1,1 эквив.) N-изопропилбензиламина и затем промывали 5 кг ДМФ. В переносной контейнер из нержавеющей стали (ПКНС) емкостью 60 л помещали 8,5 кг (82 моль, 1,5 эквив.) триэтиламина и переносили к месту проведения реакции, поддерживая температуру ниже 5°С. Суспензию из резервуара емкостью 50 галлон переносили в реактор, поддерживая температуру ниже 10°С. Смесь нагревали до 20-30°С и перемешивали при данной температуре в течение 12 часов, и анализировали ВЭЖХ для детектирования завершения реакции. Реакционную смесь разбавляли 141 л этилацетата и обрабатывали 3 М хлороводородной кислотой, полученной путем перемешивания 56 л воды и 22,6 кг хлороводородной кислоты. Смесь тщательно перемешивали, и слой, содержащий меньшее количество воды, отбрасывали. Слой этилацетата снова промывали 2 М хлороводородной кислотой, полученной путем перемешивания 73 л воды и 18,8 кг хлороводородной кислоты. Затем органический слой промывали 90 л 5% раствора бикарбоната натрия и 94 л воды. Затем слой этилацетата концентрировали до приблизительно 90 л и переносили в резервуар для хранения. После того как резервуары были очищены и проверены на наличие конечного продукта выделения, раствор продукта в этилацетате из резервуара для хранения был перенесен обратно в реактор через встроенный фильтр. Перегонку проводили пока объем не снизился до 55 л с доведением до азеотропы 2×103 кг гептаном, и концентрировали до конечного объема приблизительно 132 л. Смесь нагревали до 70-75°С для растворения осадка и медленно охлаждали до 15-25°С последовательным неконтролируемым медленным изменением температуры. Перемешивание при 15-25°С продолжали в течение 20 часов. Кристаллы из аликвоты смеси фильтровали на стеклянной воронке, промывали гептаном и в течение короткого периода сушили в вакуумной печи. Затем суспензию из реактора фильтровали на нутч-фильтре, промывали гептаном и сушили азотом при 40°С. После пропускания через устройства для измельчения порошкообразных продуктов продукт упаковывали с получением 19,19 кг полиморфной модификации А.
Реферат
Изобретение направлено на полиморфную модификацию А N-бензил-N'-(2,6-диизопропил-фенил)-N-изопропил-малонамида, которая характеризуется порошковой рентгенограммой с характеристическими пиками, находящимися при, приблизительно, 16,0, 19,6 и 28,1 градусов 2θ и ее применение для производства лекарственного средства для снижения секреции кожного сала и лечения кожных расстройств. 3 н. и 3 з.п. ф-лы, 3 ил.
Формула
Документы, цитированные в отчёте о поиске
Производное бензола

Комментарии