Применение соединений для повышения активности пируватдегидрогеназы - RU2242224C2
Код документа: RU2242224C2
Описание
Настоящее изобретение относится к соединениям, которые повышают активность пируватдегидрогеназы (PDH), к способам их получения, к содержащим их в качестве активного ингредиента фармацевтическим композициям, способам лечения болезненных состояний, связанных с пониженной активностью PDH, к их применению в качестве лекарственных средств и к их применению при производстве лекарственных препаратов, используемых для повышения активности PDH у теплокровных животных, например человека. Энергию для синтеза комплексных молекул в тканях и в мышцах для сокращения обеспечивает аденозинтрифосфат (АТР). АТР генерируется в результате расщепления богатых энергией субстратов, например глюкозы или свободных жирных кислот с длинной цепью. В окисляемых тканях, таких как мышцы, большая часть АТР генерируется из ацетил КоА, который поступает в результате цикла лимонной кислоты, поэтому поступление (восполнение) ацетил КоА является решающим фактором для продуцирования АТР в окисляемых тканях. Ацетил КоА получается или за счет β -окисления жирных кислот, или в результате метаболизма глюкозы посредством гликолитического пути обмена. При регулировании скорости образования из глюкозы ацетил КоА основным регуляторным ферментом является PDH, который катализирует окисление пирувата в ацетил КоА и диоксид углерода с сопутствующим восстановлением никотинамидадениндинуклеотида (NAD) в NADH.
При болезненных состояниях, таких как неинсулинозависимый (NIDDM) и инсулинозависимый (IDDM) сахарный диабет, увеличивается окисление липидов, сопровождаемое уменьшением использования глюкозы, что способствует гипергликемии. Уменьшенное использование глюкозы при IDDM и NIDDM связано с уменьшением активности PDH. Кроме того, дополнительным последствием уменьшенной активности PDH может быть увеличение концентрации пирувата, результатом которого является повышенная доступность лактата в качестве субстрата для печеночного глюконеогенеза. Можно вполне ожидать, что кроме уменьшения выброса печеночной глюкозы повышение активности PDH может увеличить скорость окисления глюкозы и, следовательно, ее общее использование.
Другим фактором, способствующим развитию сахарного диабета, является пониженная секреция инсулина, которая, как было показано (в генетической модели сахарного диабета грызунов Zhou et al. (1996), Diabetes 45:580-586), связана с уменьшенной активностью PDH в панкреатических β -клетках.
Окисление глюкозы способно давать большее количество молекул АТР/моль кислорода, чем окисление жирных кислот. При таких состояниях, когда потребность в энергии может превосходить подвод энергии, например при ишемии миокарда, перемежающейся хромоте, церебральной ишемии и реперфузии, можно ожидать (Zaidan et al., 1998, J.Neurochem. 70:233-241), что сдвиг баланса использования субстрата в пользу метаболизма глюкозы, за счет повышения активности PDH, улучшит способность поддержания уровней АТР и, следовательно, функцию.
Можно ожидать, что средство, которое способно повышать активность PDH, является полезным при лечении таких состояний, при которых является очевидным избыток циркулирующей молочной кислоты, например в некоторых случаях сепсиса.
Было показано (Vary et al., 1988, Circ.Shock, 24:3-18), что агент дихлоруксусная кислота (DCA), который повышает активность PDH после экстренного введения животным, оказывает предсказанное действие на уменьшение гликемии (Stacpoole et al., 1978; N.Engl. J.Med. 298:526-530) и является лекарственным средством для лечения ишемии миокарда (Bersin and Stacpoole, 1997; American Heart Journal, 134:841-855) и молочной ацидемии (Stacpoole et al., 1983; N.Engl.J.Med. 309:390-396).
PDH представляет собой интрамитохондриальный многоферментный комплекс, состоящий из многочисленных копий нескольких субъединиц, включающий три ферментативные активности Е1, Е2 и Е3, необходимые для завершения превращения пирувата в ацетил КоА (Patei and Roche, 1990; FASEB J., 4:3224-3233). E1 катализирует необратимое удаление из пирувата СO2; Е2 образует ацетил КоА и Е3 восстанавливает NAD в NADH. С комплексом связаны две дополнительные ферментативные активности: специфическая киназа, которая способна к фосфорилированию трех сериновых остатков Е1, и свободносвязанная специфическая фосфатаза, которая изменяет направление фосфорилирования. Фосфорилирование только одного из трех сериновых остатков делает Е1 неактивной. Доля PDH в его активном (дефосфорилированном) состоянии определяется балансом между активностью киназы и фосфатазы. Активность киназы можно регулировать in vivo относительной концентрацией метаболических субстратов, например NAD/NADH, КоА/ацетил КоА и адениндифосфата (ADP)/ATP, а также доступностью самого пирувата.
В описаниях Европейских патентов №617010 и 524781 раскрыты соединения, которые способны расслаблять гладкую мышцу мочевого пузыря и которые могут быть использованы при лечении недержания мочи. Заявитель обнаружил, что соединения настоящего изобретения являются в значительной степени подходящими для повышения активности PDH, т.е. свойство, которое не упоминается в ЕР 0617010 и ЕР 524781.
Настоящее изобретение основано на неожиданном обнаружении того, что определенные соединения повышают активность PDH, это свойство имеет особое значение для лечения болезненных состояний, связанных с нарушениями использования глюкозы, например сахарного диабета, ожирения (Curto et al., 1997; Int.J.Obes. 21:1137-1142) и молочной ацидемии. Ожидается, что, кроме того, соединения могут найти применение при лечении таких заболеваний, где ограничена подача в ткани богатых энергией субстратов, например при лечении заболеваний периферических сосудов (включая перемежающуюся хромоту), сердечной недостаточности и некоторых кардиальных миопатий, мышечной слабости, гиперлипемии и атеросклероза (Stacpoole et al., 1978; N.Eng.J.Med. 298:526-530). Соединение, которое активирует PDH, может быть также пригодным для лечения болезни Альцгеймера (AD) (J.Neural Transm (1998) 105, 855-870).
В соответствии с одним аспектом настоящее изобретение предусматривает применение соединений формулы (I)

их солей и фармацевтически приемлемых расщепляемых in vivo пролекарств указанного соединения формулы (I); фармацевтически приемлемых солей указанного соединения или указанных пролекарств при производстве лекарственных препаратов, применяемых для повышения активности PDH у теплокровных животных, например людей, где
кольцо С является таким, как определено в (а) или (b);
R1 является таким, как определено в (с) или (d);
n равно 1 или 2;
R2 и R3 являются такими, как определено в (е) или (f);
(А-В) имеет значения, как определено в (g) или (h), и
R4 является таким, как определено в (i) или (j),
где (а) кольцо С является фенилом или углерод-связанным гетероарилом, выбранным из пиридила, пиразинила, пиримидинила и пиридазинила, где указанный фенил или гетероарил замещен на углероде в одном или обоих мета-положениях относительно положения связующей группы А-В или на углероде в пара-положении относительно положения связующей группы А-В заместителем Р1 и Р2 (где Р1 и Р2 являются такими, как они определены далее), и, кроме того, указанный фенил или гетероарил необязательно замещен на углероде в любом оставшемся мета-положении(ях) или пара-положении заместителем Р1 или Р3 (где Р1 и Р3 являются такими, как они определены далее);
(b) кольцо С выбирают из следующих пяти групп:
(i) фенила или углерод-связанного гетероарила, выбранного из пиридила, пиразинила, пиримидинила и пиридазинила, где указанный фенил или гетероарил является незамещенным, за исключением замещения посредством (R1)n, где R1 и n являются такими, как они определены далее;
(ii) углерод-связанного триазина, необязательно замещенного на кольцевом углероде в мета- или и пара-положении относительно связующей группы А-В одним заместителем, выбранным из Р1, Р2, Р3 и Р4, где Р1, Р2, Р3 и Р4 являются такими, как они определены далее;
(iii) 6-членной углерод-связанной гетероарильной группы, содержащей 1-3 атома азота, где один или более кольцевых атомов азота окислены с образованием N-оксида, и гетероарильная группа необязательно замещена в любом из мета- или пара-положений относительно связующей группы А-В 1-3 заместителями, выбранными из Р1, Р2, Р3 и Р4, где Р1, Р2, Р3 и Р4являются такими, как они определены далее;
(iv) фенила или углерод-связанного гетероарила, выбранного из пиридила, пиразинила, пиримидинила и пиридазинила, где указанный фенил или гетероарил замещен в мета- или пара-положении относительно связующей группы А-В одним заместителем, выбранным из Р3 и Р4, где Р3 и Р4 являются такими, как они определены далее, и
(v) фенила или углерод-связанного гетероарила, выбранного из пиридила, пиразинила, пиримидинила и пиридазинила, где указанный фенил или гетероарил замещен в любом из мета- или пара-положений относительно связующей группы А-В 2-3 заместителями, выбранными из Р1, Р2, Р3и Р4, при условии, что, если один или более заместителей являются Р1 или Р2, тогда, по меньшей мере, одним из других заместителей является Р4, при этом Р1, Р2, Р3 и Р4 являются такими, как они определены далее;
Р1 является циано, трифторметилом, нитро, трифторметокси или трифторметилсульфанилом;
Р2 является -Y1Ar1, где Аr1 выбирают из группы, состоящей из фенила, углерод-связанного 6-членного гетероарильного кольца, содержащего 1-2 атома азота, и углерод-связанного 5-членного гетероарильного кольца, содержащего 1-2 гетероатома, независимо выбранных из О, N и S, при этом указанное фенильное или гетероарильное кольцо необязательно замещено на углероде 1-4 заместителями, выбранными из Q1, где Q1 является таким, как он определен далее, и Y1 выбирают из -СО-, -SO- и -SО2-;
Р3 является C1-4-алкилом, галоген-С2-4-алкилом, C1-4-алкокси, галоген-C2-4-алкокси, С2-С4-алкенилокси, галогеном или гидрокси;
Р4 выбирают из следующих восьми групп:
1) галогенсульфонила, цианосульфанила;
2) -X1-R5, где X1 является прямой связью, -О-, -S-, -SO-, -SO2-, -OSO2-, -SO2O-, -NR6-, -N+O-R6-, -CO-, -COO-, -OCO-, -CONR7-, -NR8CO-, -OCONR9-, -CONR10SO2-, -NR11SO2-, -CH2-, -NR12COO-, -CSNR13-, -NR14CS-, -NR15CSNR16-, -NR17CONR18- или -NR19CONR20SO2 - (где каждый из R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, R17, R18, R19 и R20 независимо представляет собой водород или C1-4-алкил, который может быть необязательно замещен одной или более группами, выбранными из гидрокси, амино, галогена, C1-4-алкоксикарбонила, карбокси, C1-6-алкокси или C1-3-алкилсульфанила) и R5 выбирают из водорода, С1-6-алкила, С3-7-циклоалкила, С2-6-алкенила и С2-6-алкинила, при этом C1-6-алкил, С3-7-циклоалкил, С2-6-алкенил или С2-6-алкинил необязательно замещен одной или более группами, выбранными из гидрокси, амино, галогена, C1-4-алкоксикарбонила, карбокси, C1-6-алкокси и гидрокси-С1-6-алкила, при условии, что Р4 не является трифторметилсульфанилом, гидрокси, C1-4-алкилом, галоген-C1-4-алкилом, C1-4-алкокси, галоген-С1-4-алкокси или С2-4-алкенилокси;
3) -X1-C1-6-aлкил-X2-R21, где X1 является таким, как он определен выше, X2 является прямой связью, -О-, -S-, -SO-, -SО2-, -OSO2-, -SO2O-, -NR22-, -N+O-R22-, -CO-, -COO-, -OCO-, -CONR23-, -NR24 CO-, -NR25COO-, -SO2NR26-, -NR27SO2-, -CH2-, -SO2NR28CO-, -OCONR29-, -CSNR30-, -NR31CS-, -NR32CSNR33-, -NR34CONR35-, -CONR36SO2-, -NR37CONR38SO2-, -SO2NR39 CONR40- или -SO2NR39CNNR40- (где каждый из R22, R23, R24, R25, R26, R27, R28, R29, R30, R31, R32, R33, R34, R35, R36, R37, R38 R39 и R40 независимо представляет собой водород или C1-4-алкил, причем C1-4-алкил может быть необязательно замещен одной или более группами, выбранными из гидрокси, амино, галогена, С1-С4-алкоксикарбонила, карбокси, C1-6-алкокси или C1-3-алкилсульфанила) и R21 является водородом или C1-4-алкилом, причем C1-4 -алкил необязательно замещен одной или более группами, выбранными из гидрокси, амино, галогена, C1-4-алкоксикарбонила, карбокси, C1-6-алкокси и гидрокси-C1-6-алкила, или R21 является R41, где R41 является фенилом или 4-12-членной гетероциклической группой, содержащей 1-4 гетероатома, независимо выбранных из О, N и S, причем гетероциклическая группа может быть ароматической или неароматической, и указанный фенил или гетероциклическая группа необязательно замещена 1-6 заместителями, выбранными из Q3, где Q3является таким, как он определен далее, при условии, что Р4не является C1-4-алкилом, галоген-С1-4-алкилом, C1-4-алкокси или галоген-С1-4 -алкокси;
4) -Х1-С2-6-алкенил-Х2-R21, где Х1, X2 и R21 являются такими, как они определены выше при условии, что Р4 не является С2-4-алкенилокси;
5) -Х1-С2-6-алкинил-Х2-R21, где X1, X2 и R21 являются такими, как они определены выше;
6) -Х1-С3-7-циклоалкил-Х2-R21, где Х1, X2 и R21 являются такими, как они определены выше;
7) -Х1-С1-6-алкил-С3-7-циклоалкил-Х2-R21, где Х1, X2 и R21являются такими, как они определены выше, и
8) -Y2Ar2, где Y2 является X1, где Х1 является таким, как он определен выше, и Ar выбирают из следующих шести групп:
(i) фенила, углерод-связанного 6-членного гетероарильного кольца, содержащего 1-2 атома азота, и углерод-связанного 5-членного гетероарильного кольца, содержащего 1-2 гетероатома, независимо выбранных из О, N и S, где указанный фенил или гетероарильное кольцо замещено на углероде 1-4 заместителями, выбранными из Q1 и Q2, выключающими, по меньшей мере, один заместитель, выбранный из Q2, где Q1 и Q2 являются такими, как они определены далее;
(ii) углерод-связанного триазина или углерод-связанного 5-членного гетероарильного кольца, содержащего 3-4 гетероатома, независимо выбранных из О, N и S, где указанное гетероарильное кольцо необязательно замещено 1-4 заместителями, выбранными из Q1 и Q2, где Q1 и Q2 являются такими, как они определены далее;
(iii) 4-12-членной неароматической гетероциклической группы, содержащей 1-4 гетероатома, независимо выбранных из О, N и S, где указанная гетероциклическая группа необязательно замещена 1-6 заместителями, выбранными из Q3, где Q3является таким, как он определен далее, при условии, что если Аr2 является азот-связанным гетероциклическим кольцом, Y2не является -SO2-;
(iv) 5-членного гетероарильного кольца, содержащего 1-4 гетероатома, независимо выбранных из О, N и S, причем гетероарильное кольцо содержит, по меньшей мере, один атом азота, замещенный группой, выбранной из C1-6-алкила, C1-6-алканоила, C1-6-алкилсульфонила, C1-6-алкоксикарбонила, карбамоила, N-(C1-6-алкил)карбамоила, N,N-(C1-6-алкил)2 карбамоила, бензоила или фенилсульфонила, и при этом гетероарильное кольцо необязательно замещено 1-3 заместителями, выбранными из Q3, где Q3 является таким, как он определен далее;
(v) углерод-связанной 7-12-членной ароматической гетероциклической группы, содержащей 1-4 гетероатома, независимо выбранных из О, N и S, где указанная гетероциклическая группа необязательно замещена 1-6 заместителями, выбранными из Q3, где Q3 является таким, как он определен далее, и
(vi) Ar1, при условии, что если Аr2 имеет значение Аr1, тогда Y2 не является -СО-, -SO- или -SO2-; Q1 является C1-4-алкилом, галоген-С1-4-алкилом, C1-4 -алкокси, галоген-С1-4-алкокси, C2-4-алкенилокси, циано, нитро, галогеном или трифторметилсульфанилом;
Q2 выбирают из следующих десяти групп:
(1) кислорода (образующего при связывании с кольцевым углеродом оксогруппу и при окислении кольцевого азота N-оксид);
(2) галогенсульфонила, цианосульфанила;
(3) -X3-R5, где X3 является прямой связью, -О-, -S-, -SO-, -SO2-, -OSO2-, -SO2O-, -NR42-, -N+O-R42-, -CO-, -COO-, -OCO-, -CONR43-, -NR44CO-, -NR45COO-, -SO2NR46-, -NR47SO2-, -CH2-, -SO2NR48CO-, -OCONR49-, -CSNR50-, -NR51CS-, -NR52CSNR53-, -NR54CONR55-, -CONR56SO2-, -NR57 CONR58SO2-, -SO2NR57CNNR58- или -SO2NR59CONR60- (где каждый из R42, R43, R44, R45, R46, R47, R48, R49, R50, R51, R52, R53, R54, R55, R56, R57, R58, R59 и R60 независимо представляет собой водород или C1-4-алкил, при этом C1-4-алкил может быть необязательно замещен одной или несколькими группами, выбранными из гидрокси, амино, галогена, C1-4-алкоксикарбонила, карбокси, C1-6-алкокси или C1-3-алкилсульфанила), и R5 является таким, как он определен выше, но при условии, что Q2 не является трифторметилсульфанилом, C1-4-алкилом, галоген-С1-4-алкилом, C1-4-алкокси, галоген-С1-4 -алкокси или С2-4-алкенилокси;
(4) R41, где R41 является таким, как он определен выше;
(5) X3-С1-6-алкил-Х2R21, где X3, X2 и R21 являются такими, как они определены выше, но при условии, что Q2 не является C1-4-алкилом, галоген-С1-4-алкилом, C1-4-алкокси или галоген-C1-4-алкокси;
(6) -х3-C2-6-алкенил -X2-R21, где X3, X2 и R21 являются такими, как они определены выше, при условии, что Q2 является С2-4-алкенилокси;
(7) -Х3-C2-6-алкинил-Х2 -R21, где X3, X2 и R21 являются такими, как они определены выше;
(8) -X3-С3-7-циклоалкил-Х2R21, где X3, X2 и R21 являются такими, как они определены выше;
(9) -х3-С1-6-алкил-С3-7-циклоалкил-Х2-R21, где X3, X2 и R21являются такими, как они определены выше, и
(10) -X3-R41, где R41 и X3 являются такими, как они определены выше;
Q3 выбирают из следующих четырех групп:
1) кислорода (образующего при связывании с кольцевым углеродом оксогруппу и при окислении кольцевого азота N-оксид);
2) циано, нитро или галогена;
3) галогенсульфонила, цианосульфанила и
4) -X4-R61, где X4 является прямой связью, -О-, -S-, -SO-, -SО2-, -OSO2-, -SO2O-, -NR62-, -N+O-R62-, -CO-, -COO-, -OCO-, -CONR63-, -NR64CO-, -NR65COO-, -SO2NR66-, -NR67-, -CH2-, -SO2NR68CO-, -OCONR69-, -CSNR70 -, -NR71CS-, -NR72CSNR73-, -NR74CONR75-, -CONR76SO2-, -NR77CONR78SO2-, -SO2 NR79CNNR80- или -SO2NR79CONR80- (где каждый из R62, R63, R64, R65, R66, R67, R68, R69, R70, R71, R72, R73, R74, R75, R76, R77, R78, R79 и R80 независимо представляет собой водород или C1-4-алкил, при этом C1-4-алкил может быть необязательно замещен одной или более группами, выбранными из гидрокси, амино, галогена, C1-4-алкоксикарбонила, карбокси, C1-6-алкокси или C1-3-алкилсульфанила) и R61 выбирают из водорода, C1-6-алкила, С3-7 -циклоалкила, С2-7-алкенила и С2-6-алкинила, при этом C1-6-алкил, С3-7-циклоалкил, С2-6-алкенил или С2-6-алкинил необязательно замещен одной или более группами, выбранными из гидрокси, амино, галогена, C1-4-алкоксикарбонила, карбокси, C1-6-алкокси и гидрокси-С1-6-алкила;
(с) R1 связан с кольцом С в орто-положении углерода относительно положения связующей группы А-В, и его выбирают из группы, состоящей из C1-4-алкила, галоген-С1-4-алкила, C1-4-алкокси, галоген-С1-4-алкокси, С2-4-алкенилокси, циано, нитро, галогена, трифторметилсульфанила и гидрокси;
(d) R1 связан с кольцом С в орто-положении кольцевого атома углерода относительно положения связующей группы А-В, и его выбирают из следующих двух групп:
1) -X5-R81, где X5 является прямой связью, -О-, -S-, -SO-, -SO2-, -OSO2-, -SO2O-, -NR82-, -CO-, -COO-, -OCO-, -CONR83-, -NR84CO-, -NR85COO-, -SO2NR86-, -NR87SO2-, -CH2-, -SО2NR88CO-, -OCONR89-, -CSNR90-, -NR91CS-, -NR92 CSNR93-,-NR94CONR95-, -CONR96SO2-, -NR97CONR98SO2-, -SO2NR99CNNR100- или -SO2NR99CONR100- (где каждый из R82, R83, R84, R85, R86, R87, R88, R89, R90, R91, R92, R93, R94, R95, R96, R97, R98, R99 и R100 независимо представляет собой водород или C1-4-алкил, при этом C1-4-алкил может быть необязательно замещен одной или более группами, выбранными из гидрокси, амино, галогена, C1-4-алкоксикарбонила, карбокси, C1-6-алкокси или C1-3-алкилсульфанила) и R81 выбирают из водорода, C1-6-алкила, С3-7-циклоалкила, С2-6-алкенила и С2-6-алкинила, при этом C1-6-алкил, С3-7-циклоалкил, С2-6-алкенил или С2-6-алкинил необязательно замещен одной или более группами, выбранными из гидрокси, амино, галогена, C1-4-алкоксикарбонила, карбокси, C1-6-алкокси и гидрокси-С1-6-алкила, при условии, что R1 не является трифторметилсульфанилом, гидрокси, C1-4-алкилом, галоген-С1-4-алкилом, C1-4-акокси, галоген-С1-4-алкокси или С2-4-алкенилокси, и
2) X6-R101, где X6 выбирают из прямой связи -СО-, -О-, -ОСН2-, -S-, -SO-, -SO2- и -NR102- (где R102 является водородом или C1-4-алкилом, при этом C1-4-алкил может быть необязательно замещен одной или более группами, выбранными из гидрокси, амино, галогена, C1-4-алкоксикарбонила, карбокси, C1-6-алкокси или C1-3-алкилсульфанила) и R101 является фенилом, который необязательно замещен 1-4 заместителями, выбранными из циано, нитро, трифторметилсульфанила, C1-6-алкила, галоген-С1-6-алкила, C1-6-алкокси, галоген-С1-6-алкокси, С2-6-алкенилокси, галогена, гидрокси и амино;
n равно 1 или 2;
(е) каждый из R2 и R3 независимо является C1-3-алкилом, необязательно замещенным атомами в количестве от 1 до (2k+1), выбранными из фтора и хлора, где k представляет собой число атомов углерода в C1-3-алкиле, при условии, что R2 и R3 оба не могут быть метилом,
или R2 и R3, вместе с атомом углерода, к которому они присоединены, образуют 3-5-членное циклоалкильное кольцо, необязательно замещенное атомами фтора в количестве от 1 до (2m-2), где m представляет собой число атомов углерода в указанном кольце;
(f) R2 и R3 оба являются метилом или один из R2 и R3 является водородом или галогеном и другой является галогеном или C1-3 -алкилом, необязательно замещенным атомами в количестве от 1 до (2k+1), выбранными из фтора и хлора, где k представляет собой число атомов углерода в C1-3-алкиле, при условии, что когда или R2, или R3 является галогеном, R4 не является гидрокси, и при условии, что когда или R2, или R3 является водородом, R4 не является водородом;
(g) А-В выбирают из -NHCO-, -OCH2-, -SCH2-, -NHCH2-, транс-винилена и этинилена;
(h) А-В является -NHCS- или -СОСН2 -;
(i) R4 является гидрокси;
(j) R4 является водородом, галогеном, амино или метилолом,
но исключая соединения, где кольцо С выбирают из (а), и R1 выбирают только из (с), и R2 и R3 выбирают из (е), и А-В выбирают из (g), и R4 выбирают из (i).
Q1 преимущественно является C1-2-алкилом, галоген-С1-2-алкилом, C1-2-алкокси, циано или галогеном.
В одном варианте настоящего изобретения Аr является фенилом или 4-пиридилом и необязательно замещенным, как определено выше.
В другом варианте настоящего изобретения Аr1 является фенилом и необязательно замещенным, как определено выше.
Y1 предпочтительно является -SO2- или -SO-, более предпочтительно -SO2-.
Преимущественными значениями Х1 являются прямая связь, -О-, -S-, -SO-, -SO2-, -NR6-, -CO-, -COO-, -OCO-, -CONR7-, -NR8СO-, -OCONR9-, -CONR10SO2-, -NR11SO2-, -CH2-, -NR12COO-, -CSNR13-, -NR14CS-, -NR15CSNR16-, -NR17CONR18- и -NR19CONR20SO2- (где каждый из R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, R17, R18, R19 и R20 независимо представляет собой водород или C1-2-алкил, или C1-2-алкоксиэтил).
Предпочтительными значениями X1 являются
-О-, -SO-, -SO2-, -NR6-, -COO-, -CONR7-, NR8СO-, -NR11SO2-, -CH2- и -NR12COO- (где каждый из R6, R7, R8, R11 и R12 независимо представляет собой водород, C1-2-алкил или C1-2 -алкоксиэтил).
Более предпочтительными значениями X1 являются -SO- и -SО2-.
R5 преимущественно выбирают из водорода, C1-4 -алкила, С3-7-циклоалкила, C2-4-алкенила и C2-4-алкинила, при этом C1-4-алкил, С3-7-циклоалкил, С2-4-алкенил или C2-4 -алкинил необязательно замещен, как определено выше.
R5 предпочтительно выбирают из водорода, C1-4-алкила и С3-7-циклоалкила, при этом C1-4 -алкил или С3-7-циклоалкил необязательно замещен, как определено выше.
Преимущественными значениями X2 являются -О-, -NR22-, -S-, -SO- и -SO2 - (где R22 является водородом или C1-4-алкилом).
Предпочтительными значениями X2 являются -О-, -NR22-, -S-, -SO- и -SO2- (где R22 является водородом или C1-2-алкилом).
Более предпочтительными значениями X2 являются -О- и -NR22- (где R22 является водородом или C1-2-алкилом).
Преимущественными значениями X4 являются прямая связь, -О-, -S-, -SO-, -SO2, -NR62-, -CO-, -COO-, -OCO-, -CONR63 -, -NR64CO-, -NR65COO-, -SO2NR66-, -NR67SO2-, -CH2-, -SO2NR68CO-, -OCONR69-, -CSNR70-, -NR71CS-, -NR72CSNR73-, -NR74CONR75-, -CONR76SO2-, -NR77CONR78SO2- и -SО2NR79CONR80- (где каждый из R62, R63, R64, R65, R66, R67, R68, R69, R70, R71, R72, R73, R74, R75, R76, R77, R78, R79 и R80 независимо представляет собой водород, C1-2-алкил или C1-2-алкоксиэтил).
Предпочтительными значениями X4 являются -О-, S-, -SO-, -SО2-, -NR62-, -COO-, -CONR63 -, -NR64CO- и -NR67SO2-, (где каждый из R62, R63, R64 и R67 независимо представляет собой водород, C1-2-алкил или C1-2-алкоксиэтил).
Более предпочтительными значениями X4 являются -О-, -S-, -SO- и -SO2-.
В соответствии с другим аспектом изобретения более предпочтительными значениями X4 являются -О-, -S-, -SO-, -CONR63- и -SO2-.
R61 преимущественно выбирают из водорода, C1-4-алкила, С3-7-циклоалкила, С2-4-алкенила и С2-4-алкинила, при этом C1-4-алкил, С3-7-циклоалкил, С2-4-акенил или С2-4-алкинил необязательно замещен, как определено выше.
R61 предпочтительно выбирают из водорода, C1-4-алкила и С3-7-циклоалкила, при этом C1-4-алкил или С3-7-циклоалкил необязательно замещен, как определено выше.
Q3 преимущественно выбирают из следующих трех групп:
(i) кислорода (образующего при связывании с кольцевым углеродом оксогруппу и при окислении кольцевого азота N-оксид);
(ii) циано, нитро или галогена и
(iii) -X4-R61, где X4 и R61 являются такими, как они определены выше.
R41 преимущественно является фенилом, 5-6-членным гетероциклическим ароматическим кольцом, содержащим 1-4 гетероатома, независимо выбранных из О, N и S, или 5-7-членной гетероциклической неароматической группой, содержащей 1-2 гетероатома, независимо выбранных из О, N и S, при этом фенил, гетероциклическое ароматическое кольцо или гетероциклическая неароматическая группа необязательно замещены, как определено выше.
R21 преимущественно является водородом или C1-4-алкилом.
X3 преимущественно является прямой связью, -О-, -S-, -SO-, -SO2-, -NR42-, -CO-, -COO-, -OCO-, -CONR43-, -NR44CO-, -NR45COO-, -SO2NR46-, -NR47SO2-, -CH2-, -SO2NR48CO-, -OCONR49-, -CSNR50-, -NR51CS-, -NR52CSNR53-, -NR54CONR55-, -CONR56SO2-, -NR57CONR58SO2- или -SO2 NR59CONR60- (где каждый из R42, R43, R44, R45, R46, R47, R48, R49, R50, R51, R52, R53, R54, R55, R56, R57, R58, R59 и R60 независимо представляет собой водород, C1-2-алкил или C1-2-алкоксиэтил).
X3 предпочтительно является -О-, -S-, -SO-, -SO2-, -NR42-, -COO-, -CONR43-, -NR44 CO-, -SO2NR46-, -NR47SO2-, -SO2NR48CO- и -CONR56SO2-, (где каждый из R42, R43, R44, R46, R47, R48 и R56независимо представляет собой водород, C1-2-алкил или C1-2-алкоксиэтил).
Q2 преимущественно выбирают из следующих семи групп:
1) кислорода (образующего при связывании с кольцевым углеродом оксогруппу и при окислении кольцевого азота N-оксид);
2) галогенсульфонила, цианосульфанила;
3) -х3-R5, где X3 и R5 являются такими, как они определены выше, но при условии, что Q2 не является трифторметилсульфанилом, C1-4-акилом, галоген-С1-4-алкилом, C1-4-алкокси, галоген-C1-4-алкокси или С2-4-алкенилокси;
4) R41, где R41 является таким, как он определен выше;
5) -х3-С1-4-алкил-Х2-R21, где X3, X2 и R21 являются такими, как они определены выше;
6) -х3-С3-7-циклоалкил-Х2-R21, где X3, X2 и R21 являются такими, как они определены выше, и
7) -х3-R41, где R41 и X3 являются такими, как они определены выше.
Q2 предпочтительно является -х3-R5, где X3 и R5 являются такими, как они определены выше, но при условии, что Q2 не является трифторметилсульфанилом, C1-4-алкилом, галоген-С1-4-алкилом, C1-4-алкокси, галоген-С1-4-алкокси или С2-4-алкенилом.
Аr2 преимущественно выбирают из следующих двух групп:
(1) фенила, углерод-связанного 6-членного гетероарильного кольца, содержащего 1-2 атома азота, и углерод-связанного 5-членного гетероарильного кольца, содержащего 1-2 гетероатома, независимо выбранных из О, N и S, где указанный фенил или гетероарильное кольцо замещены при углероде 1-4 заместителями, выбранными из Q1 и Q2, включающими, по меньшей мере, один заместитель, выбранный из Q2, где Q1 и Q2являются такими, как они определены выше, и
(2) Аr1, при условии, что если Аr2 имеет значение Аr1, тогда Y2 не является -СО-, -SO- или -SO2-.
Аr2 предпочтительно является фенилом, замещенным одним заместителем, выбранным из Q2.
Р4 преимущественно выбирают из следующих пяти групп:
(1) галогенсульфонила, цианосульфанила;
(2) -X1-R5, где X1 и R5 являются такими, как они определены выше, при условии, что Р4 не является трифторметилом, трифторметокси, трифторметилсульфанилом, гидрокси, C1-4-алкилом, галоген-С1-4-алкилом, C1-4-алкокси, галоген-С1-4-алкокси или С2-4-алкенилокси;
(3) -Х1-С1-4-алкил-Х2-R21, где X1, X2 и R21 являются такими, как они определены выше;
(4) -Х1 -С3-7-циклоалкил-Х2R21, где X1, X2 и R21 являются такими, как они определены выше, и
(5) -Y2-Ar2, где Y2 и Аr2 являются такими, как они определены выше.
Р4 предпочтительно выбирают из следующих трех групп:
(1) галогенсульфонила, цианосульфанила;
(2) -X1-R5, где X1 и R5 являются такими, как они определены выше, при условии, что Р4 не является трифторметилом, трифторметокси, трифторметилсульфанилом, гидрокси, C1-4-алкилом, галоген-С1-4-алкилом, C1-4-алкокси, галоген-С1-4-алкокси или С2-4-алкенилокси, и
(3) -Y2Ar2, где Y2 и Аr2 являются такими, как они определены выше.
R101 преимущественно является фенилом, который необязательно замещен 1-4 заместителями, выбранными из циано, нитро, трифторметилсульфанила, C1-4-алкила, галоген-С1-4-алкила, C1-4-алкокси, галоген-С1-4-алкокси, C1-2-алкенилокси, галогена, гидрокси и амино.
X6 преимущественно выбирают из прямой связи, -СО-, -О-, -ОСН2-, -S-, -SO-, -SO2- и -NR102- (где R102 является водородом или C1-2-алкилом).
R81 преимущественно выбирают из водорода, C1-4-алкила, С3-7-циклоалкила, С2-4-алкенила и С2-4-алкинила, при этом C1-4-алкил, С3-7-циклоалкил, С2-4-алкенил или С2-4-алкинил необязательно замещен, как определено выше.
R81 предпочтительно выбирают из водорода, C1-4-алкила, С3-7-циклоалкила, при этом C1-4-алкил и С3-7-циклоалкил необязательно замещен, как определено выше.
X5 преимущественно является прямой связью, -О-, -S-, -SO-, -SO2-, -NR82-, -CO-, -COO-, -OCO-, -CONR83-, -NR84CO-, -NR85COO-, -SO2NR86-, -NR87SO2-, -CH2-, -SO2NR88CO-, -OCONR89-, -CSNR90-, -NR91CS-, -NR92CSNR93-, -NR94CONR95-, -CONR96SO2-, -NR97CONR98SO2- или -SO2NR99CONR100- (где каждый из R82, R83, R84, R85, R86, R87, R88, R89, R90, R91, R92, R93, R94, R95, R96, R97, R98, R99 и R100 независимо представляет собой водород, C1-2-алкил или C1-2-алкоксиэтил).
X5 предпочтительно является прямой связью, -О-, -NR82-, -СО-, -COO-, -CONR83-, -NR84CO-, -NR87SO2- (где каждый из R82, R83, R84 и R87 независимо представляет собой водород, C1-2-алкил или C1-2-алкоксиэтил).
Преимущественными значениями R1 в группе (с) являются C1-4-алкил, C1-4-галогеналкил, C1-4-алкокси, циано, нитро, галоген и гидрокси.
Предпочтительными значениями R1 в группе (с) являются C1-2-алкил, C1-2-алкокси, циано, нитро, галоген и гидрокси.
Более предпочтительными значениями R1 в группе (с) являются метил, метокси, нитро, фтор, хлор, бром и гидрокси.
В особенности предпочтительными значениями R1 в группе (с) являются метокси, нитро, фтор, хлор, бром и гидрокси.
В соответствии с одним аспектом изобретения R1предпочтительно выбирают из галогена, нитро, C1-4-алкила, C2-4-алкенила, С2-4-алкинила и водорода.
В соответствии с другим аспектом изобретения R1 предпочтительно выбирают из C1-4-алкокси, галогена, нитро или R1является X5-R81, где X5 является прямой связью, -NH-, -NHCO-, -SO-, -SO2-, -NHSO2- и R81 является Н, C1-6-алкилом, С2-6-алкенилом, С2-6-алкинилом или R1 является -X6-R101, где X6 является -СО- и R101 является фенилом, замещенным галогеном.
В соответствии с еще одним аспектом изобретения R1 предпочтительно выбирают из фтора и хлора.
В соответствии с дополнительным аспектом изобретения R1предпочтительно не является водородом.
n предпочтительно равно 1.
Предпочтительным значением А-В в группе (g) является NHCO.
Преимущественными значениями кольца С в группе (а) являются
фенил или углерод-связанный пиридил, где указанный фенил или пиридил замещен, как определено выше.
Более преимущественными значениями кольца С в группе (а) являются
фенил или углерод-связанный пиридил, где указанный фенил или пиридил замещен на углероде в пара-положении относительно связующей группы А-В группой, выбранной из циано, трифторметила, нитро, трифторметокси, трифторметилфсульфанила и группы Р2 (где А-В и Р2 являются такими, как они определены выше).
Предпочтительными значениями кольца С в группе (а) являются
фенил или углерод-связанный пиридил, где указанный фенил или пиридил замещен на углероде в пара-положении относительно связующей группы А-В группой, выбранной из циано, трифторметила, нитро и группы Р2 (где А-В и Р2 являются такими, как они определены выше).
Более предпочтительными значениями кольца С в группе (а) являются
фенил или углерод-связанный пиридил, где указанный фенил или пиридил замещен на углероде в пара-положении относительно связующей группы А-В группой Р2 (где А-В и Р2 являются такими, как они определены выше).
В особенности предпочтительным значением кольца С в группе (а) является фенил, который замещен, как определено выше.
Наиболее предпочтительным значением кольца С в группе (а) является фенил, который замещен на углероде в пара-положении относительно связующей группы А-В группой Р2 (где А-В и Р2 являются такими, как они определены выше).
Преимущественными значениями кольца С в группе (b) являются
(i) фенил или пиридил, где указанный фенил и пиридил является незамещенным, за исключением замещения посредством (R1)n, где R1 и n являются такими, как они определены выше;
(ii) углерод-связанный триазин, необязательно замещенный в кольцевом углероде в пара-положении относительно связующей группы А-В одним заместителем, выбранным из Р1, Р2, Р3 и Р4, где А-В, Р1, Р2, Р3 и Р4 являются такими, как они определены выше;
(iii) 6-членная углерод-связанная гетероарильная группа, содержащая 1-3 атома азота, где один или более кольцевых атомов азота окислены с образованием N-оксида, при этом гетероарильная группа необязательно замещена в пара-положении относительно связующей группы А-В одним заместителем, выбранным из Р1, Р2, Р3 и Р4, где А-В, Р1, Р2, Р3 и Р4 являются такими, как они определены выше;
(iv) фенил или углерод-связанный пиридил, где указанный фенил или пиридил замещен в пара-положении относительно связующей группы А-В одним заместителем, выбранным из Р3 и Р4, где А-В, Р3 и Р4 являются такими, как они определены выше, и
(v) фенил или углерод-связанный пиридил, где указанный фенил или пиридил замещен в любом из мета- или пара-положении относительно связующей группы А-В 2-3 заместителями, выбранными из Р1, Р2, Р3 и Р4, при условии, что если одним или более из указанных заместителей являются Р1 или Р2, тогда, по меньшей мере, одним из других заместителей является Р4, где А-В, Р1, Р2, Р3 и Р4 являются такими, как они определены выше.
Более преимущественными значениями кольца С в группе (b) являются
(i) фенил или пиридил, где указанный фенил или пиридил является незамещенным, за исключением замещения посредством (R1)n, где R1 и n являются такими, как они определены выше;
(ii) 6-членная углерод-связанная гетероарильная группа, содержащая 1-3 атома азота, где один или более кольцевых атомов азота окислены с образованием N-оксида, при этом гетероарильная группа необязательно замещена в пара-положении относительно связующей группы А-В одним заместителем, выбранным из Р1, Р2, Р3 и Р4, где А-В, Р1, Р2, Р3 и Р4 являются такими, как они определены выше, и
(iii) фенил или углерод-связанный пиридил, где указанный фенил или пиридил замещен в пара-положении относительно связующей группы А-В одним заместителем, выбранным из Р3 и Р4, где А-В, Р3 и Р4 являются такими, как они определены выше.
Предпочтительными значениями кольца С в группе (b) являются
(i) фенил или пиридил, где указанный фенил или пиридил является незамещенным, за исключением замещения посредством (R1)n, где R1 и n являются такими, как они определены выше, и
(ii) фенил или углерод-связанный пиридил, где указанный фенил или пиридил замещен в пара-положении относительно связующей группы А-В одним заместителем, выбранным из Р3 и Р4, где А-В, Р3 и Р4 являются такими, как они определены выше.
Более предпочтительными значениями кольца С в группе (b) являются
(i) фенил или пиридил, где указанный фенил или пиридил является незамещенным, за исключением замещения посредством (R1)n, где R1 и n являются такими, как они определены выше;
(ii) фенил или углерод-связанный пиридил, где указанный фенил или пиридил замещен в пара-положении относительно связующей группы А-В заместителем -Y2Ar2, где А-В, Y2 и Аr2являются такими, как они определены выше.
В особенности предпочтительным значением кольца С в группе (b) является фенил, причем указанный фенил замещен в пара-положении относительно связующей группы А-В заместителем -Y2Ar2, где А-В, Y2 и Аr2 являются такими, как они определены выше.
В соответствии с одной отличительной особенностью изобретения кольцо С предпочтительно является фенилом, замещенным одной группой, выбранной из Р4, где Р4 является таким, как он определен выше.
Более предпочтительно кольцо С является фенилом, замещенным в пара-положении относительно связующей группы А-В группой, выбранной из
1) -X1-R5, где X1 является прямой связью, -О-, -S-, -SO-, -SO2-, -NR6- или -CONR7- (где каждый из R6 и R7 независимо представляет собой водород или C1-4-алкил, при этом C1-4-алкил может быть необязательно замещен одной или более группами, выбранными из гидрокси или C1-C6-алкокси), и R5 выбирают из водорода и C1-6-алкила, при этом C1-6-алкил необязательно замещен одной или более группами, выбранными из гидрокси и C1-6-алкокси и гидрокси-С1-6-алкила, при условии, что -X1-R5 не является гидрокси, C1-4-алкилом или C1-4-алкокси;
2) -Х1-С1-6-алкил-Х2-R21, где X1 является прямой связью, -О-, -S-, -SO-, -SO2-, -NR6- или -CONR7- (где каждый из R6 и R7независимо представляет собой водород или C1-4-алкил, при этом C1-4-алкил может быть необязательно замещен одной или более группами, выбранными из гидрокси или C1-6-алкокси), X2является прямой связью, -О-, -S-, -SO-, -SO2-, -NR22- или -CONR23- (где каждый из R22 и R23 независимо представляет собой водород или C1-4-алкил, при этом C1-4-алкил может быть необязательно замещен одной или более группами, выбранными из гидрокси или C1-6 -алкокси), и R21 является водородом или C1-4-алкилом, при этом C1-4-алкил необязательно замещен одной или более группами, выбранными из гидрокси или C1-6 -алкокси, или R21 является R41, где R41 является таким, как он определен выше, при условии, что Х1-С1-6-алкил-Х2-R21 не является C1-4-алкилом или C1-4-алкокси;
3) -Y2Ar2, где Y2 является Х1, при этом X1 является прямой связью, -О-, -S-, -SO-, -SO2-, -NR6- или -CONR7- (где каждый из R6 и R7 независимо представляет собой водород или C1-4-алкил, при этом C1-4-алкил может быть необязательно замещен одной или более группами, выбранными из гидрокси или C1-6-алкокси) и Аr2 является таким, как он определен выше.
Выбранные из группы (е) R2 и R3 преимущественно независимо являются C1-3-алкилом, необязательно замещенным атомами в количестве от 1 до (2k+1), выбранными из фтора и хлора, где k является числом атомов углерода в C1-3-алкиле, при условии, что R2 и R3 оба не являются метилом, или
R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклопропановое кольцо, необязательно замещенное атомами фтора в количестве от 1 до 4.
Выбранные из группы (е) R2 и R3 предпочтительно независимо являются C1-3-алкилом, необязательно замещенным атомами фтора в количестве от 1 до (2k+1), где k является числом атомов углерода в C1-3 -алкиле, при условии, что R2 и R3 оба не являются метилом, или R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклопропановое кольцо, необязательно замещенное атомами фтора в количестве от 1 до 4.
Выбранные из группы (е) R2 и R3 более предпочтительно независимо являются метилом, фторметилом, дифторметилом, трифторметилом, 2,2,2-трифторэтилом и перфторэтилом, при условии, что R2 и R3 оба не являются метилом, или
R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклопропановое кольцо, необязательно замещенное атомами фтора в количестве от 1 до 4.
Выбранные из группы (е) R2 и R3 в особенности предпочтительно независимо являются метилом, фторметилом, дифторметилом и трифторметилом, при условии, что R2 и R3 оба не являются метилом, или
R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклопропановое кольцо, необязательно замещенное атомами фтора в количестве от 1 до 4.
Выбранные из группы (f) R2 и R3 преимущественно оба являются метилом или один из R2 и R3 является водородом или галогеном, а другой является галогеном или C1-3-алкилом, необязательно замещенным атомами в количестве от 1 до (2k+1), выбранными из фтора и хлора, где k является числом атомов углерода в C1-3 -алкиле, при условии, что когда или R2, или R3является галогеном, R4 не является гидрокси, и при условии, что когда или R2, или R3 является водородом, R4 не является водородом.
Выбранные из группы (f) R2 и R3 более преимущественно оба являются метилом или один из R2 и R3 является водородом или хлором, а другой является хлором или метилом, при условии, что когда или R2, или R3 является хлором, R4 не является гидрокси, и при условии, что когда или R2, или R3 является водородом, R4 не является водородом.
Выбранные из группы (f) R2 и R3 предпочтительно оба являются метилом или хлором, при условии, что когда R2 и R3 оба являются хлором, R4 не является гидрокси.
Выбранные из группы (f) R2 и R3 более предпочтительно оба являются метилом.
Выбранный из группы (j) R4 предпочтительно является водородом.
Когда это является пригодным, предпочтительную стереохимию соединений формулы (I) представляет обычно R-конфигурация.
R1 предпочтительно выбирают из группы (с), которая определена выше.
А-В предпочтительно выбирают из группы (g), которая определена выше.
R4 предпочтительно выбирают из группы (i), которая определена выше.
В соответствии с другим аспектом изобретения R4 предпочтительно является гидрокси, водородом или метилом.
Кольцо С преимущественно выбирают из следующих значений из группы (а):
фенила, замещенного в пара-положении относительно положения связующей группы А-В заместителем -Y1Ar1, где Y1 является -SO- или -SO2-, и Аr1 является фенилом или 3-пиридилом, при этом фенил или 3-пиридил необязательно замещен, как определено выше,
или из следующих значений из группы (b):
(i) незамещенного фенила, за исключением замещения посредством (R1)n, где R1 и n являются такими, как они определены выше, и
(ii) фенила, замещенного в пара-положении относительно положения связующей группы А-В одним заместителем, выбранным из Р3и Р4, где Р3 и Р4 являются такими, как они определены выше.
Более преимущественно кольцо С выбирают из следующих значений из группы (а):
фенила, замещенного в пара-положении относительно положения связующей группы А-В заместителем -Y1-Ar1, где Y1 является -SO- или -SO2- и Аr1 является фенилом или 3-пиридилом, при этом фенил или 3-пиридил необязательно замещен, как определено выше,
или из следующих значений из группы (b):
(i) незамещенного фенила, за исключением замещения посредством (R1)n, где R1 и n являются такими, как они определены выше, и
(ii) фенила, замещенного в пара-положении относительно положения связующей группы А-В одним заместителем, выбранным из галогена и Р4, где Р4 выбирают из трех следующих групп:
1) галогенсульфонила, цианосульфанила;
2) -X1-R5, где X1 и R5 являются такими, как они определены выше, при условии, что Р4 не является трифторметилом, трифторметокси, трифторметилсульфанилом, гидрокси, C1-4-алкилом, галоген-С1-4-алкокси или С2-4-алкенилокси, и
3) -Y2Ar2, где Y2 и Аr2 являются такими, как они определены выше.
Кольцо С выбирают из следующих значений из группы (а):
фенила, замещенного в пара-положении относительно положения связующей группы А-В заместителем Y1Ar1, где Y1 является -SO- или -SO2- и Аr1 является фенилом или 3-пиридилом, при этом фенил или 3-пиридил необязательно замещен, как определено выше;
или из следующих значений из группы (b):
(i) незамещенного фенила, за исключением замещения посредством (R1)n, где R1 и n являются такими, как они определены выше, и
(ii) фенила, замещенного в пара-положении относительно положения связующей группы А-В одним заместителем, выбранным из галогена и Р4, где Р4 выбирают из трех следующих групп:
1) галогенсульфонила;
2) -X1-R5, где X1 и R5 являются такими, как они определены выше, при условии, что Р4 не является трифторметилом, трифторметокси, трифторметилсульфанилом, гидрокси, C1-4-алкилом, галоген-С1-4-алкилом, C1-4-алкокси, галоген-С1-4-алкокси или С2-4-алкенилокси, и
3) -Y2Ar2, где
(i) Ar2 является или фенилом, или 3-пиридилом, где указанный фенил или пиридил замещен при углероде 1-4 заместителями, выбранными из Q1 и Q2, включающими, по меньшей мере, один заместитель, выбранный из Q2, где Q1 и Q2 являются такими, как они определены выше, и Y2 является -S-, -SO-, -SO2- или -CONR7-, где R7 является водородом, C1-4-алкилом или C1-3-алкокси-С2-3-алкилом, или
(ii) Ar2 является фенилом или 3-пиридилом, где указанный фенил или пиридил замещен при углероде 1-4 заместителями, выбранными из Q1, где Q1 является таким, как он определен выше, и Y2 является -S- или -CONR7-, где R7 является водородом, C1-4-алкилом или С1-3-алкокси-С2-3-алкилом.
R2 и R3 предпочтительно выбирают из следующих значений из группы (е):
R2 и R3 независимо являются метилом, фторметилом, дифторметилом и трифторметилом, при условии, что R2 и R3 оба не являются метилом, или
R2 и R3 выбирают из следующих значений из группы (f):
R2 и R3 оба являются метилом.
Более предпочтительно один из R2 и R3 является трифторметилом, а другой является метилом или R2 и R3 оба являются метилом.
В соответствии с одним аспектом изобретения R2 и R3 предпочтительно независимо являются Сk-алкилом, необязательно замещенным атомами в количестве от 1 до (2k+1), выбранными из фтора и хлора, где k равно 1-3, или R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют 3-членное циклоалкильное кольцо.
В соответствии с другим аспектом изобретения R2 и R3 предпочтительно независимо являются Ck-алкилом, необязательно замещенным атомами в количестве от 1 до (2k+1), выбранными из фтора и хлора, где k равно 1-3.
Согласно другому аспекту настоящего изобретения предусматреваются соединения формулы (I), которые определены выше, и их соли, и фармацевтически приемлемые расщепляемые in vivo пролекарства соединения формулы (I), и фармацевтически приемлемые соли указанного соединения или указанных пролекарств, но при этом исключая следующие соединения:
2-гидрокси-N-(2-метоксифенил)-2-метилпропанамид; 2-гидрокси-N-(2-метилфенил)-2-метилпропанамид; 2-гидрокси-N-(2-метилфенил)пропанамид; N-(2,4-диметилфенил)-2-гидроксипропанамид; N-(2,5-диметилфенил)-2-гидроксипропанамид; N-(2, 6-диметилфенил)-2-гидроксипропанамид; N-(2-хлорфенил)-2-гидроксипропанамид; 2-гидрокси-N-(2-метоксифенил)пропанамид; N-(2,5-диметоксифенил)-2-гидроксипропанамид; N-(2-этоксифенил)-2-гидроксипропанамид; N-(2,5-диметоксифенил)-2-гидрокси-2-метилпропанамид; N-(2-этоксифенил)-2-гидрокси-2-метилпропанамид; 3-хлор-N-(2,5-дихлорфенил)-2-гидрокси-2-метилпропанамид, 3-хлор-N-(2, 4-дихлорфенил)-2-гидрокси-2-метилпропанамид; N-(2,3-дихлор-5-нитрофенил)-2-гидрокси-2-метилпропанамид; 2-гидрокси-2-метил-N-(2,3,4-трихлорфенил)пропанамид; 1-(2, 5-дигидроксифенил)-3-гидрокси-3-метилбут-1-ен; 1-(2,4-дихлорфенил)-3-гидрокси-4,4,4-трифтор-3-трифторметил-бут-1-ен; 2-гидpoкcи-N-(5-метоксикарбонил-2-метилфенил)-2-метилпропиламин; 1-(2, 6-диметоксифенокси)-2-изопропилпропан-2-ол; 1-(2,6-диметоксифенокси)-2-метилпентан-2-ол; 1-(2,6-диметоксифенокси)-2-метилбутан-2-ол; 1-(2,5-диметоксифенокси)-2-метилпентан-2-ол; 1-(2, 4-диметоксифенокси)-2-метилпентан-2-ол; 1-(2,3-диметоксифенокси)-2-метилпентан-2-ол; 1-(2,6-диметоксифенокси)-2-этилбутан-2-ол; 2-этил-1-(2-метилфенокси)бутан-2-ол; 1-(2-[2-этил-2-гидроксибутокси]фенокси)-2-этилбутан-2-ол; 2-этил-1-(2-метоксифенокси)бутан-2-ол; 1-(2-метоксифенокси)-2-метилбутан-2-ол и 2-этил-1-(2-метоксифенокси)пентан-2-ол.
В соответствии с еще одним аспектом настоящего изобретения предусмотрены соединения формулы (I), которые определены выше, и их соли, и фармацевтически приемлемые расщепляемые in vivo пролекарства соединения формулы (I) и фармацевтически приемлемые соли указанного соединения или указанных пролекарств, при условиях, что
(i) кольцо С имеет в пара-положении относительно положения связующей группы А-В другую, чем водород, группу;
(ii) когда А-В является -СОСН2-, -SCH2-, -ОСН2-, транс-виниленом или этиниленом, кольцо С не имеет атома кислорода, связанного в орто-положении со связующей группой А-В;
(iii) когда А-В является этиниленом, кольцо С не имеет атомов фтора, связанных в обоих орто-положениях со связующей группой А-В;
(iv) когда А-В является транс-виниленом, кольцо С не имеет метильных групп в обоих орто-положениях относительно связующей группы А-В и не имеет формильной группы в орто-положении относительно связующей группы А-В;
(v) когда А-В является -СОСН2-, кольцо С не имеет метильных групп в обоих орто-положениях относительно связующей группы А-В;
(vi) когда А-В является -OCH2-, кольцо С не имеет атомов хлора, связанных в обоих орто-положениях со связующей группой А-В, и не имеет нитрогрупп в обоих орто-положениях относительно связующей группы А-В;
(vii) когда А-В является -NHCH2-, кольцо С не имеет двух нитрогрупп в орто- и пара-положениях относительно связующей группы А-В и не имеет двух метильных групп в мета- и пара-положениях относительно связующей группы А-В, и
(viii) когда А-В является -SCH2-, кольцо С не имеет одновременно аминогруппу в орто-положении относительно связующей группы А-В и нитрогруппу в пара-положении относительно связующей группы А-В,
при этом исключая следующие соединения:
N-(4-хлор-2-нитрофенил)-2-гидрокси-2-метилпропанамид; N-(4,5-дихлор-2-(2-гидрокси-2-метилпропанамидо)фенил)-2-гидрокси-2-метилпропанамид; N-(4-хлор-2-бензоилфенил)-2-гидрокси-2-метилпропанамид; N-(2, 4-диметилфенил)-2-гидроксипропанамид; 3-хлор-N-(2,4-дихлорфенил)-2-гидрокси-2-метилпропанамид; 2-гидрокси-2-метил-N-(2,3,4-трихлорфенил)пропанамид; 1-(2,4-дихлорфенил)-3-гидрокси-4,4, 4-трифтор-3-трифторметилбут-1-ен; 1-(4-бром-2-фторфенил)-3-гидрокси-3-метилбут-1-ин; 1-(2-фтор-4-пент-1-енилфенил)-3-гидрокси-3-метилбут-1-ин; 1-(4-[3-гидрокси-3-метилбут-1-ин-1-ил]-2-фе-нилфенил)-3-гидрокси-3-метилбут-1-ин; 1-(2-фтор-4-пентоксифенил)-3-гидрокси-3-метилбут-1-ин; 1-(2-фтор-4-трифторметилфенил)-3-гидрокси-3-метилбут-1-ин; 1-(2, 5-диметил-4-[3-гидрокси-3-метилбут-1-ин-1-ил]фенил)-3-гидрокси-3-метилбут-1-ин; 1-(2,4-ди[3-гидрокси-3-метилбут-1-ин-1-ил]фенил)-3-гидрокси-3-метилбут-1-ин; 3-гидрокси-3-метил-1-(2,4, 5-три[3-гидрокси-3-метилбут-1-ин-1-ил]фенил)бут-1-ин; 3-гидрокси-3-метил-1-(2,3,4,5-тетра[3-гидрокси-3-метилбут-1-ин-1-ил]фенил)бут-1-ин и 3-гидрокси-3-метил-1-(2,3,4,5, 6-пента[3-гидрокси-3-метилбут-1-ин-1-ил]фенил)бут-1-ин и их соли.
В соответствии с дополнительным аспектом настоящего изобретения предусмотрены соединения формулы (I), которые определены выше, где А-В является -NHCO-, и их соли, и фармацевтически приемлемые расщепляемые in vivo пролекарства соединения формулы (I); и фармацевтически приемлемые соли указанного соединения или указанных пролекарств, при условии, что кольцо С имеет в пара-положении относительно связующей группы А-В другую, чем водород, группу, при этом исключая следующие соединения: N-(4-хлор-2-нитрофенил)-2-гидрокси-2-метилпропанамид; N-(4,5-дихлор-2-(2-гидрокси-2-метилпропанамидо)фенил)-2-гидрокси-2-метилпропанамид; N-(4-хлор-2-бензоилфенил)-2-гидрокси-2-метилпропанамид; N-(2, 4-диметилфенил)-2-гидроксипропанамид; 3-хлор-N-(2,4-дихлорфенил)-2-гидрокси-2-метилпропанамид и 2-гидрокси-2-метил-N-(2,3,4-трихлорфенил)пропанамид и их соли.
В соответствии с другим аспектом настоящего изобретения предусматривается применение соединений формулы (I)

их солей и фармацевтически приемлемых расщепляемых in vivo пролекарств указанного соединения формулы (I), и фармацевтически приемлемых солей указанного соединения или указанных пролекарств при производстве лекарственных препаратов, полезных для повышения активности PDH у теплокровных животных, например человека,
где кольцо С является таким, как определено в (а) или (b);
R1 является таким, как определено в (с) или (d);
n равно 1 или 2;
R2 и R3 являются такими, как определено в (е) или (f);
А-В имеет значения, как определено в (g) или (h) и
R4 является таким, как определено в (i) или (j),
где (a) кольцо С является фенилом или углерод-связанным гетероарилом, выбранным из пиридила, пиразинила, пиримидинила и пиридазинила, где указанный фенил или гетероарил замещен на углероде в одном или обоих мета-положениях относительно положения связующей группы А-В или на углероде в пара-положении относительно положения связующей группы А-В заместителем Р1 или Р2 (где Р1 и Р2 являются такими, как они определены далее) и, кроме того, указанный фенил и гетероарил необязательно замещен на углероде в любом оставшемся мета-положении(ях) или пара-положении заместителем Р1 или Р3 (где Р1 и Р3 являются такими, как они определены далее);
(b) кольцо С выбирают из следующих пяти групп:
(i) фенила или углерод-связанного гетероарила, выбранного из пиридила, пиразинила, пиримидинила и пиридазинила, где указанный фенил или гетероарил является незамещенным, за исключением замещения посредством (R1)n, где R1 и n являются такими, как они определены далее;
(ii) углерод-связанного триазина, необязательно замещенного на кольцевом углероде в мета- или пара-положении относительно связующей группы А-В одним заместителем, выбранным из Р1, Р2, Р3 и Р4, где Р1, Р2, Р3 и Р4 являются такими, как они определены далее;
(iii) 6-членной углерод-связанной гетероарильной группы, содержащей 1-3 атома азота, где один или более кольцевых атомов азота окислены с образованием N-оксида и гетероарильная группа необязательно замещена в любом из мета- или пара-положений относительно связующей группы А-В 1-3 заместителями, выбранными из Р1, Р2, Р3 и Р4, где Р1, Р2, Р3 и Р4являются такими, как они определены далее;
(iv) фенила или углерод-связанного гетероарила, выбранного из пиридила, пиразинила, пиримидинила и пиридазинила, где указанный фенил или гетероарил замещен в мета- или пара-положении относительно связующей группы одним заместителем, выбранным из Р3 и Р4, где Р3 и Р4 являются такими, как они определены далее, и
(v) фенила или углерод-связанного гетероарила, выбранного из пиридила, пиразинила, пиримидинила и пиридазинила, где указанный фенил или гетероарил замещен в любом из мета- или пара-положений относительно связующей группы А-В 2-3 заместителями, выбранными из Р1, Р2, Р3 и Р4, при условии, что, если один или более из заместителей являются Р1 или Р2, тогда, по меньшей мере, одним из других заместителей является Р4, где Р1, Р2, Р3 и Р4 являются такими, как они определены далее;
Р1 является циано, трифторметилом, нитро, трифторметокси или трифторметилсульфанилом;
Р2 является -Y1Ar1, где Аr1 выбирают из группы, состоящей из фенила, углерод-связанного 6-членного гетероарильного кольца, содержащего 1-2 атома азота, и углерод-связанного 5-членного гетероарильного кольца, содержащего 1-2 гетероатома, независимо выбранных из О, N и S, при этом указанное фенильное или гетероарильное кольцо необязательно замещено на углероде 1-4 заместителями, выбранными из Q1, где Q1 является таким, как он определен далее, и Y1 выбирают из -СО-,-SO- и -SO2-;
Р3 является C1-4-алкилом, галоген-С2-4-алкилом, C1-4-алкокси, галоген-С2-4-алкокси, С3-4-алкенилокси, галогеном или гидрокси;
Р4 выбирают из следующих пяти групп:
1) галогенсульфонила, цианосульфанила;
2) -X1-R5, где X1 является прямой связью, -О-, -S-, -SO-, -SO2-, -NR6-, -CO-, -COO-, -OCO-, -CONR7-, -NR8O-, -OCONR9-, -CONR10SO2-, -NR11SO2-, -CH2-, -NR12COO-, -CSNR13-, -NR14CS-, -NR15CSNR16-, -NR17CONR18- или -NR19CONR20SO2- (где каждый из R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, R17, R18, R19 и R20независимо представляет собой водород, C1-4-алкил или C1-3-алкокси-С2-3-алкил), и R5 выбирают из водорода, C1-6-алкила, С3-7-циклоалкила, С2-6-алкенила и С2-6-алкинила, при этом C1-6-алкил, С3-7-циклоалкил, С2-6-алкенил или С2-6-алкинил необязательно замещен одной или несколькими группами, выбранными из гидрокси, амино, галогена, C1-4-алкоксикарбонила, карбокси, C1-6-алкокси и гидрокси-С1-6-алкила, при условии, что Р4 не является трифторметилом, трифторметокси, трифторметилсульфанилом, гидрокси, C1-4-алкилом, галоген-С1-4-алкилом, C1-4-алкокси, галоген-С1-4-алкокси или С1-4 -алкенилокси;
3) -Xl-Cl-6-aлкил-X2-R21, где X1 является таким, как он определен выше, X2 -является прямой связью, -О-, -S-, -SO-, -SO2-, -NR22-, -CO-, -COO-, -OCO-, -CONR23-, -NR24CO-, -NR25COO-, -SO2NR26-, -NR27SO2-, -CH2-, -SO2NR28CO-, -OCONR29-, -CSNR30-, -NR31CS-, -NR32CSNR33-, -NR34CONR35-, -CONR36SO2-, -NR37CONR38SO2- или -SO2NR39CONR40- (где каждый из R22, R23, R24, R25, R26, R27, R28, R29, R30, R31, R32, R33, R34, R35, R36, R37, R38, R39 и R40 независимо представляет собой водород, C1-4-алкил или C1-3-алкокси-С2-3-алкил), и R21 является водородом, C1-4-алкилом или R41, где R41 является фенилом или 4-12-членной гетероциклической группой, содержащей 1-4 гетероатома, независимо выбранных из О, N и S, при этом гетероциклическая группа может быть ароматической или неароматической, и фенил или гетероциклическая группа необязательно замещены 1-6 заместителями, выбранными из Q3, где Q3 является таким, как он определен далее;
4) -Х1-С3-7-циклоалкил -Х2-R21, где X1, X2 и R21 являются такими, как они определены выше, и
5) -Y2Ar2, где Y2 является X1, где X1 является таким, как он определен выше, и Аr выбирают из следующих четырех групп:
(i) фенила, углерод-связанного 6-членного гетероарильного кольца, содержащего 1-2 атома азота, и углерод-связанного 5-членного гетероарильного кольца, содержащего 1-2 гетероатома, независимо выбранных из О, N и S, где указанный фенил или гетероарильное кольцо замещено на углероде 1-4 заместителями, выбранными из Q1 и Q2, включающими, по меньшей мере, один заместитель, выбранный из Q2, где Q1 и Q2 являются такими, как они определены далее;
(ii) углерод-связанного триазина или углерод-связанного 5-членного гетероарильного кольца, содержащего 3-4 гетероатома, независимо выбранных из О, N и S, где указанное гетероарильное кольцо необязательно замещено 1-4 заместителями, выбранными из Q1 и Q2, где Q1 и Q2 являются такими, как они определены далее;
(iii) 4-12-членной неароматической гетероциклической группы, содержащей 1-4 гетероатома, независимо выбранных из О, N и S, где указанная гетероциклическая группа необязательно замещена 1-6 заместителями, выбранными из Q3, где Q3является таким, как он определен далее, при условии, что если Аr2 является азот-связанным гетероциклическим кольцом, Y не является -SO2-, и
(iv) Аr1, при условии, что если Аr2 имеет значение Аr1, тогда Y2 не является -СО-, -SO- или -SO2-;
Q1 является C1-4-алкилом, галоген-С1-4-алкилом, C1-4-алкокси, галоген-С1-4-алкокси, С2-4-алкенилокси, циано, нитро, галогеном или трифторметилсульфанилом;
Q2 выбирают из следующих семи групп:
1) кислорода (образующего при связывании с кольцевым углеродом оксогруппу и при окислении кольцевого азота N-оксид);
2) галогенсульфонила, цианосульфанила;
3) -х3-R5, где X3 является прямой связью, -О-, -S-, -SO-, -SO2-, -NR42-, -CO-, -COO-, -OCO-, -CONR43-, -NR44CO-, -NR45COO-, -SO2NR46-, -NR47SO2-, -CH2-, -SO2NR48CO-, -OCONR49-, -CSNR50-, -NR51CS-, -NR52CSNR53-, -NR54CONR55-, -CONR56SO2-, -NR57CONR58SO2- или -SO2NR59CONR60- (где каждый из R42, R43, R44, R45, R46, R47, R48, R49, R50, R51, R52, R53, R54, R55, R56, R57, R58, R59 и R60 независимо представляет собой водород, C1-4-алкил или C1-3-алкокси-С2-3-алкил), и R5 является таким, как он определен выше, но при условии, что Q2 не является трифторметилсульфанилом, C1-4-алкилом, галоген-С1-4-алкилом, C1-4-алкокси, галоген-C1-4-алкокси или С2-4-алкенилокси;
4) R41, где R41 является таким, как он определен выше;
5) -Х3-С1-6-алкил-Х-R21, где X3, X2 и R21 являются такими, как они определены выше;
6) -Х3-С3-7-циклоалкил-Х2-R21, где X3, X2 и R21 являются такими, как они определены выше, и
7) -х3-R41, где R41 и X3 являются такими, как они определены выше;
Q3 выбирают из следующих четырех групп:
1) кислорода (образующего при связывании с кольцевым углеродом оксогруппу и при окислении кольцевого азота N-оксид);
2) циано, нитро или галогена;
3) галогенсульфонила, цианосульфанила и
4) -X4-R61, где X4 является прямой связью, -О-, -S-, -SO-, -SO2 -, -NR62-, -СО-, -COO-, -ОСО-, -CONR63-, -NR64CO-, -NR65COO-, -SO2NR66-, -NR67SO2-, -CH2-, -SO2NR68CO-, -OCONR69-, -CSNR70-, -NR71CS-, -NR72CSNR73-, -NR74CONR75-, -CONR76SO2-, -NR77CONR78SO2- или -SO2NR79CONR80- (где каждый из R62, R63, R64, R65, R66, R67, R68, R69, R70, R71, R72, R73, R74, R75, R76, R77, R78, R79 и R80 независимо представляет собой водород, C1-4-алкил или С2-3-алкокси-С2-3-алкил), и R61 выбирают из водорода, C1-6-алкила, С3-7-циклоалкила, С2-6-алкенила и С2-6-алкинила, при этом C1-6-алкил, С3-7-циклоалкил, С2-6-алкенил или С2-6-алкинил необязательно замещен одной или более группами, выбранными из гидрокси, амино, галогена, C1-4-алкоксикарбонила, карбокси, C1-6-алкокси и гидрокси-С1-6-алкила;
(c) R1 связан с кольцом С в орто-положении углерода относительно положения связующей группы А-В и его выбирают из группы, состоящей из C1-4-алкила, галоген-С1-4-алкила, C1-4-алкокси, галоген-С1-4-алкокси, C2-4-алкенилокси, циано, нитро, галогена, трифторметилсульфанила и гидрокси;
(d) R1 связан с кольцом С в орто-положении кольцевого атома углерода относительно положения связующей группы А-В и его выбирают из следующих двух групп:
1) -X5-R81, где X5 является прямой связью, -О-, -S-, -SO-, -SO2-, -NR82-, -CO-, -COO-, -OCO-, -CONR83-, -NR84CO-, -NR85COO-, -SO2NR86-, -NR87SO2-, -CH2-, -SO2NR88CO-, -OCONR89-, -CSNR90-, -NR91CS-, -NR92CSNR93-, -NR94CONR95-, -CONR96SO2-, -NR97CONR98SO2- или -SO2NR99CONR100- (где каждый из R82, R83, R84, R85, R86, R87, R88, R89, R90, R91, R92, R93, R94, R95, R96, R97, R98, R99 и R100 независимо представляет собой водород, C1-4-алкил или C1-3-алкокси-С2-3-алкил), и R81 выбирают из водорода, C1-6-алкила, С3-7-циклоалкила, С2-6-алкенила и С2-6-алкинила, при этом C1-6-алкил, С3-7-циклоалкил, С2-6-алкенил или С2-6-алкинил необязательно замещен одной или более группами, выбранными из гидрокси, амино, галогена, C1-4-алкоксикарбонила, карбокси, C1-6-алкокси и гидрокси-С1-6-алкила, при условии, что R1 не является трифторметилсульфанилом, гидрокси, C1-4-алкилом, галоген-C1-4 -алкинилом, C1-4-алкокси, галоген-С1-4-алкокси или C1-4-алкенилокси, и
2) -X6-R101, где X6 выбирают из прямой связи, -СО-, -О-, -ОСН2-, -S-, -SO-, -SO2- и -NR102- (где R102 является водородом или C1-4-алкилом), и R101 является фенилом, который необязательно замещен 1-4 заместителями, выбранными из циано, нитро, трифторметилсульфанила, C1-6-алкила, галоген-С1-6-алкила, C1-6-алкокси, галоген-C1-6 -алкокси, С2-6-алкенилокси, галогена, гидрокси и амино;
n равно 1 или 2;
(е) каждый из R2 и R3 независимо является C1-3 -алкилом, необязательно замещенным атомами в количестве от 1 до (2k+1), выбранными из фтора и хлора, где k представляет собой число атомов углерода в C1-3-алкиле, при условии, что R2 и R3 оба не являются метилом,
или R2 и R3, вместе с атомом углерода, к которому они присоединены, образуют 3-5-членное циклоалкильное кольцо, необязательно замещенное атомами фтора в количестве от 1 до (2m-2), где m представляет собой число атомов углерода в кольце;
(f) R2 и R3 оба являются метилом или один из R2 и R3 является водородом или галогеном, а другой является галогеном или C1-3-алкилом, необязательно замещенным атомами в количестве от 1 до (2k+1), выбранными из фтора и хлора, где k представляет собой число атомов углерода в C1-3-алкиле, при условии, что когда или R2, или R3 является галогеном, R4 не является гидрокси, и при условии, что когда или R2, или R3является водородом, R4 не является водородом;
(g) А-В выбирают из -NHCO-, -OCH2-, -SCH2-, -NHCH2-, транс-винилена и этинилена;
(h) А-В является -NHCS- или -COCH2-;
(i) R4 является гидрокси;
(j) R4 является водородом, галогеном или метилом,
но при этом исключая соединения, где кольцо С выбирают из (а) и R1 выбирают только из (с), и R2 и R3 выбирают из (е), и А-В выбирают из (g), и R4 выбирают из (i).
В соответствии с еще одним аспектом изобретения предусмотрено соединение формулы (I’)

и его соли, и фармацевтически приемлемые расщепляемые in vivo пролекарства указанного соединения формулы (I’), и фармацевтически приемлемые соли указанного соединения или указанных пролекарств;
где в формуле (I’) n равно 1 или 2;
Ra является хлором, фтором, бромом, нитро или метокси;
Rb является C1-6-алкилом, необязательно замещенным одной или более группами, выбранными из гидрокси, амино, галогена, C1-4-алкоксикарбонила, карбокси или C1-6-алкокси, или R6является фенилом, углерод-связанным 6-членным гетероарильным кольцом, содержащим 1-2 атома азота, или углерод-связанным 5-членным гетероарильным кольцом, содержащим 1-3 гетероатома, независимо выбранных из О, N и S, где указанный фенил или гетероарильное кольцо замещено одной или более группами, выбранными из i)-iii), и, кроме того, необязательно замещено группой, выбранной из iv):
i) -Xa-Rc, где Xa является прямой связью, -О-, -S-, -SO-, -SO2-, -NRd- или CONRe (где каждый из Rd и Re независимо представляет собой водород или C1-4-алкил, при этом C1-4-алкил необязательно замещен одной или более группами, выбранными из гидрокси или C1-4-алкокси), и Rc выбирают из водорода или C1-6-алкила, причем C1-6-алкил необязательно замещен одной или более гидрокси или C1-4-алкокси, при условии, что -Xa-Rc не является C1-4-алкилом или C1-4-алкокси;
ii) 4-12-членной гетероциклической группы, содержащей 1-4-гетероатома, независимо выбранных из О, N, S, при этом гетероциклическая группа может быть ароматической или неароматической и необязательно замещенной одной или более группами, выбранными из гидрокси, галогена, C1-4-алкокси, C1-4-алкила или циано;
iii) -Хa-С1-6 -алкил-Хb-Rc, где Xa и Rc являются такими, как они определены выше, и Xb является -S-, -SO- или -SO2-;
(iv) циано, гидрокси, галогена, C1-4-алкокси, C1-4-алкила.
Предпочтительные значения для соединения формулы (I’) являются следующими:
Ra предпочтительно является хлором или фтором. Более предпочтительно Ra является хлором.
Rb предпочтительно является C1-4-алкилом, необязательно замещенным одной или более гидрокси, или Rb является фенилом, углерод-связанным 6-членным гетероарильным кольцом, содержащим 1-2 атома азота, или углерод-связанным 5-членным гетероарильным кольцом, содержащим 1-2 гетероатома, при этом указанный фенил или гетероарильное кольцо замещено одной или несколькими группами, выбранными из i)-iii):
i) -XaRc-, где Xa является -SO-, -SO2-, -NRd- или -CONRe- (где каждый из Rd и Re независимо представляет собой водород или C1-4-алкил) и Rc выбирают из водорода или C1-6-алкила, при этом C1-6-алкил необязательно замещен одной или более гидрокси;
ii) 4-12-членной гетероциклической группы, содержащей 1-4 гетероатома, независимо выбранных из О, N и S, при этом гетероциклическая группа может быть ароматической или неароматической;
iii) -Хa-С1-6 -алкил-Хb-Rc, где Xa и Rc являются такими, как они определены выше, и Xb является -S-.
Более предпочтительно Rb является C1-4-алкилом, необязательно замещенным гидрокси, или Rb является фенилом, где указанный фенил замещен одной группой, выбранной из i)-iii):
i) -Xa-Rc, где Xa является -SO-, -SO2-, -NRd- или -CONRe- (где каждый из Rd и Re независимо представляет собой водород или C1-4-алкил) и Rc выбирают из водорода или C1-6-алкила, при этом C1-6-алкил необязательно замещен одной или несколькими гидрокси;
ii) 4-12-членной гетероциклической группы, содержащей 1-4 гетероатома, независимо выбранных из О, N и S, при этом гетероциклическая группа может быть ароматической или неароматической;
iii) -Хa-С1-6-алкил-Хb-Rc, где Xa и Rc являются такими, как они определены выше, и Xb является -S-.
В особенности предпочтительно Rb является этилом, 2-гидроксиэтилом, 4-N,N-диметилкарбамоилфенилом, 4-(2-гидроксиэтиламино)фенилом, 4-метилсульфинилфенилом, 4-мезилфенилом, 4-аминофенилом, 4-(2-оксопирролидин-1-ил)фенилом и 4-(2-метилтиоэтиламино)фенилом.
В соответствии с одним аспектом изобретения n предпочтительно равно 1.
В соответствии с другим аспектом изобретения n равно 2.
В соответствии с одним аспектом изобретения группа Rb-S(O)n- предпочтительно находится в пара-положении относительно группы -NH-C(O)-.
В соответствии с другим аспектом изобретения группа Rb-S(O)n- предпочтительно находится в мета-положении относительно группы -NH-C(O)-.
Третичный центр формулы (I’) -С(ОН)(СF3)(Me) предпочтительно имеет R стереохимию.
Предпочтительными соединениями формулы (I) или (I’) являются соединения примеров 14, 43, 63, 71, 74, 87, 128, 144, 215 и 355 и их соли, и фармацевтически приемлемые расщепляемые in vivo пролекарства указанного соединения формулы (I), и фармацевтически приемлемые соли указанного соединения или указанных пролекарств.
Соединения настоящего изобретения включают
N-(2,6-диметилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-цианофенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-2-хлор-4-[(2-гидрокси-2-метил-3,3,3-трифторпропанамидо)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-2-нитро-4-[(2-гидрокси-2-метил-3,3,3-трифторпропанамидо)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-[2-(4-хлорбензоил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-[2-карбокси-4-(фенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(4-бром-2-хлорфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2, 4-дихлорфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-хлорфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-фторфенил)-2-гидрокси-2-метил-3,3, 3-трифторпропанамид;
N-(бифен-2-ил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-ацетилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-иодфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-бромфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
2-гидрокси-2-метил-N-[2-(фенилсульфонил)фенил]-3, 3,3-трифторпропанамид;
N-(2-метоксифенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-гидроксифенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
(R)-N-(4-бром-2,6-дихлорфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
(R)-N-[2-хлор-4-(фенилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
(S)-N-[2-хлор-4-(фенилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
(R)-N-[2-фтор-4-(фенилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
(R)-N-(4-бром-2-метилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-[2-хлор-4-(фенилсульфонил)фенил]-2-гидроксипропанамид;
N-(2-фтор-4-иодфенил)-2-гидроксипропанамид;
N-{4-[(бензилоксикарбонил)амино]-2-фторфенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-[2-(гидроксиметил)-4-иодфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(4-бензил-2-метилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-карбамоил-4-иодфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(4-иод-2-метоксикарбонилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(4-иод-2-нитрофенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-бром-4-метоксикарбонилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(4-бром-2-метилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-[2-хлор-4-(бензоиламино)фенил]-2-гидрокси-2-метилпропанамид;
N-[2-хлор-4-[(фенилсульфонил)амино]фенил]-2-гидрокси-2-метилпропанамид;
N-(4-хлор-2-метоксифенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
2-гидрокси-N-(4-метокси-2-метилфенил)-2-метил-3,3,3-трифторпропанамид;
N-(2,3-диметилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(3-хлор-2-метилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамиид;
N-(4-бром-2-трифторметилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(4-хлор-2-бензоилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(4-хлор-2-трифторметилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(4-хлор-2-метилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-[4-хлор-2-(2-хлорбензоил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-хлор-4-мезилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-хлор-4-фторсульфонилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2, 4-дииодфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-бром-4-метилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-бром-4-бутилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-(2-хлор-4-тиоцианатофенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-[2-фтор-4-(аллилоксикарбонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид;
N-[2-фтор-4-{N-[(1,3-диэтоксикарбонил)пропил]карбамоил}фенил]-2-гидрокси-2-метил-3,3, 3-трифторпропанамид;
N-(4-амино-2-хлорфенил)-2-гидрокси-2-метилпропанамид;
N-[2-хлор-4-(4-аминофенилсульфанил)фенил]-2-гидрокси-2-метилпропанамид;
примеры 106, 108, 110-113, 149, 151, 171, 173, 197 и 205 и их соли, и фармацевтически приемлемые расщепляемые in vivo сложные эфиры или сульфиды указанных соединений, и фармацевтически приемлемые соли указанных соединений или сложных эфиров, или сульфидов.
Преимущественные соединения настоящего изобретения включают примеры 184-186 и их соли, и фармацевтически приемлемые расщепляемые in vivo сложные эфиры или сульфиды указанных соединений; фармацевтически приемлемые соли указанных соединений или сложных эфиров, или сульфидов.
Предпочтительные соединения настоящего изобретения включают примеры 15, 114, 171, 172 и 182 и их соли, и фармацевтически приемлемые расщепляемые in vivo сложные эфиры или сульфиды указанных соединений; фармацевтически приемлемые соли указанных соединений или сложных эфиров, или сульфидов.
Более предпочтительные соединения настоящего изобретения включают примеры 14 и 87 и их соли, фармацевтически приемлемые расщепляемые in vivo сложные эфиры или сульфиды указанных соединений; фармацевтически приемлемые соли указанных соединений или сложных эфиров, или сульфидов.
Наиболее предпочтительные соединения настоящего изобретения включают примеры 1, 2, 13, 16, 54, 86, 104, 212, 213 и 214 и их соли, и фармацевтически приемлемые расщепляемые in vivo сложные эфиры или сульфиды указанных соединений; фармацевтически приемлемые соли указанных соединений или сложных эфиров, или сульфидов.
В соответствии с другим аспектом изобретения предпочтительными соединениями изобретения являются любые из соединений примеров 1-428 и их соли; фармацевтически приемлемые расщепляемые in vivo пролекарства указанного соединения формулы (I); фармацевтически приемлемые соли указанных соединений или указанных пролекарств.
Предпочтительные аспекты изобретения включают такие аспекты, которые относятся к соединению или его фармацевтически приемлемой соли.
В данном описании термин “алкил” включает алкильные группы как с прямой, так и с разветвленной цепью, но ссылки, сделанные на отдельные алкильные группы, такие как “пропил” относятся только к алкильным группам с прямой цепью.
Аналогичное условие относится к другим общим терминам. Тем не менее, если не указано иным образом, термин “алкил” преимущественно относится к цепям, содержащим 1-6 атомов углерода, предпочтительно 1-4 атома углерода.
В данном описании термин “алкокси” относится к алкильной группе, которая определена выше, связанной с атомом кислорода.
В данном описании термин “циклоалкил” относится к циклическим неароматическим кольцам, содержащим атомы углерода.
В данном описании термин “циклоалкокси” относится к циклоалкильной группе, которая определена выше, связанной с атомом кислорода.
В данном описании термин “галоген” включает, если не указано иначе, фтор, хлор, бром и иод.
В данном описании термин “галогеналкил” включает алкильную группу, которая определена выше, замещенную одной или более галогеновыми группами, включающими, например, трифторметил.
В данном описании термин “гидроксиалкил” включает алкильную группу, которая определена выше, замещенную одной или более гидроксильными группами.
В данном описании термин “арил” включает С5-12-ароматические группы, которые могут, в случае необходимости и, если не определено иначе, иметь один или более заместителей, выбранных из галогена, алкила, алкокси, циано, нитро или трифторметила (где алкил или алкокси являются такими, как они определены выше). Подходящие значения для арила включают фенил и нафтил.
Термин “арилокси” означает арильную группу, которая определена выше, связанную с атомом кислорода. Подходящие значения для арилокси включают фенокси и нафт-1-илокси.
Термин “гетероарил” включает арильные группы, которые определены выше, содержащие один или более гетероатомов, выбранных из О, N и S.
Подходящие значения для “6-членной углерод-связанной гетероарильной группы, содержащей 1-3 атома азота, где один или более атомов азота окислены с образованием N-оксида”, включают пиридил-N-оксид, пиримидил-N-оксид и пиразинил-N-оксид.
Подходящие значения для “углерод-связанного 6-членного гетероарильного кольца, содержащего 1-2 атома азота” включают пиридил, пиримидил, пиразинил и пиридазинил.
Подходящие значения для “углерод-связанного 5-членного гетероарильного кольца, содержащего 1-2 гетероатома, независимо выбранные из О, N и S”, включают фурил, тиенил, пирролил, тиазолил, изоксазолил, оксазолил, имидазолил и пиразолил.
Подходящие значения для “углерод-связанного 5-членного гетероарильного кольца, содержащего 3-4 гетероатома, независимо выбранных из О, N и S”, включают оксадиазолил, фуразанил, триазолил и тиадиазолил.
Подходящие значения для “5-6-членного гетероциклического ароматического кольца, содержащего 1-4 гетероатома, независимо выбранных из О, N и S”, включают фурил, тиенил, пирролил, тиазолил, изоксазолил, оксазолил и пиразолил, тетразолил, имидазолил, оксадиазолил, фуразанил, триазолил, тиадиазолил, пиридил, пиримидил, пиразинил и пиридазинил.
Подходящие значения для “5-7-членной гетероциклической неароматической группы, содержащей 1-2 гетероатома, независимо выбранных из О, N и S”, включают морфолино, пиперазинил, пиперидинил, гомопиперазинил, оксазолидинил, тиазолинил, оксаксолинил, дигидропиранил и тетрапиранил.
Подходящие значения для “5-членного гетероарильного кольца, содержащего 1-4 гетероатома, независимо выбранных из О, N и S”, включают пирролил, фурил, тиенил, пиразолил, имидазолил, триазолил и тетразолил.
Подходящие значения для “углерод-связанного 5-членного гетероарильного кольца, содержащего 1-3 гетероатома”, включают пирролил, фурил, тиенил, пиразолил, имидазолил и триазолил.
Подходящие значения для “7-12-членной ароматической гетероциклической группы, содержащей 1-4 гетероатома, независимо выбранных из О, N, S”, включают индолил, бензофурил, бензотиенил, бензимидазолил, пуринил, хинолинил и изохинолинил.
“4-12-членная гетероциклическая группа, содержащая 1-4 гетероатома, независимо выбранных из О, N и S, которая может быть ароматической или неароматической”, является насыщенным, частично насыщенным или ненасыщенным (включая ароматическое) моно- или бициклическим кольцом, которое, если не указано иначе, может быть углерод- или азот-связанным, и, если не указано иначе, в кольцевом углероде или азоте могут быть (необязательные) заместители (где упомянутое кольцо представляет собой кольцо, содержащее группу -NH-, замещающую водород), где группа -CH2- может быть необязательно замещена -С(О)-, кольцевой атом азота может необязательно иметь C1-6-алкильную группу и образовывать четвертичное соединение, или кольцевой атом азота и/или серы может быть необязательно окислен с образованием N-оксида и/или S-оксидов. Примерами и подходящими значениями термина “гетероциклическая группа” являются морфолино, пиперидил, пиридил, пиранил, пирролил, изотиазолил, оксазолинил, оксазолидинил, индолил, хинолил, тиенил, 1,3-бензодиоксолил, тиадиазолил, пиперазинил, тиазолидинил, пирролидинил, тиоморфолино, пирролинил, гомопиперазинил, тетрагидропиранил, имидазолил, пиримидил, пиразинил, пиридазинил, изоксазолил, N-метилпирролил, 4-пиридон, 1-изохинолон, 2-пирролидон, 4-тиазолидон, пиридин-N-оксид и хинолин-N-оксид.
“4-12-членная неароматическая гетероциклическая группа, содержащая 1-4 гетероатма, независимо выбранных из О, N и S”, является такой, как она определена в вышеприведенном абзаце, но она не включает в себя такие соединения, которые являются полностью ароматическими.
В данном описании термин “неароматический” включает полностью насыщенные кольца, а также частично насыщенные кольца, но при этом он не включает ароматические ненасыщенные кольца.
Термин “гетероциклический” включает ароматические и неароматические циклические группы, содержащие один или более гетероатомов, выбранных из О, N и S.
В данном описании, если не указано иначе, термин “алкенил” включает алкенильные группы как с прямой, так и с разветвленной цепью, но ссылки, сделанные на отдельные алкенильные группы, например 2-бутенил, относятся только к алкенилам с прямой цепью. В данном описании, если не указано иначе, термин “алкинил” включает алкинильные группы как с прямой, так и с разветвленной цепью, но ссылки, сделанные на отдельные алкинильные группы, например 2-бутинил, относятся только к алкинилам с прямой цепью.
Во избежание сомнений следует иметь в виду, что когда X1 является, например, группой формулы -NR8O-, а именно атом азота имеет группу R8, которая соединена с кольцом С, и карбонильную группу, соединенную с R5, тогда как, когда X1является, например, группой формулы -CONR7-, карбонильная группа соединена с кольцом С и атом азота, имеющий группу R7, соединен с R5. Когда X1 является -NR11SO2-, атом азота имеет группу R11, которая соединена с кольцом С, и сульфонильную группу, которая соединена с R5. Аналогичные условия применимы к подобным группам. Когда X1 является -NR6-, атом азота имеет группу R6, которая связана с кольцом С и R5. Когда X1 является -ОСО-, первый атом кислорода связан с кольцом С и карбонильная группа связана с R5. Когда X1 является -СОО-, карбонильная группа связана с кольцом С, а другой атом кислорода связан с R5. Аналогичные условия применимы к подобным группам. Кроме того, следует понимать, что когда X1представляет собой -NR6-, где R6 является С1-3 -алкокси-С1-3-алкилом, С2-3-алкильная группа связана с атомом азота X1, аналогичные условия применимы к другим группам.
Когда X3 является -OCONR49-, первый атом кислорода связан с Аr2 и карбонильной группой, тогда как атом азота связан с карбонильной группой, R49 и R5.
Когда X3 является -NR47SO2-, атом азота связан с Аr2, R47и сульфонильной группой, и сульфонильная группа связана с R5, аналогичные условия применимы к подобным группам.
Во избежание сомнений следует иметь в виду, что когда С5-6-алкильная группа имеет C1-4-алкоксикарбонильный заместитель, карбонильная группа связана с С5-6-алкилом и аналогичные условия применимы к другим группам.
Следует понимать, что в настоящем изобретении соединение формулы (I) или его соль могут проявлять явление таутомерии и что имеющиеся в описании структурные формулы могут представлять только одну из возможных таутомерных форм. Понятно, что изобретение включает в себя любую таутомерную форму, которая повышает активность PDH, и оно не ограничено только одной таутомерией формой, показанной в структурных формулах. Имеющиеся в описании формулы могут представлять только одну из возможных таутомерных форм, и следует иметь в виду, что описание включает в себя все возможные таутомерные формы соединений, а не только такие формы, которые было возможно показать в данном описании.
Специалистам в данной области понятно, что определенные соединения формулы (I) содержат асимметрически замещенный атом углерода и/или серы и соответственно соединения могут существовать и могут быть выделены в оптически активных и рацемических формах. Некоторые соединения могут проявлять полиморфизм. Следует понимать, что настоящее изобретение включает в себя любую рацемическую, оптически активную, полиморфную или стереоизомерную форму или их смеси, при этом указанная форма обладает свойствами, полезными для повышения активности PDH, в данной области хорошо известно, каким образом можно получить оптически активные формы (например, путем расщепления рацемической формы посредством методов перекристаллизации, синтезом из оптически активных исходных веществ, хиральным синтезом, ферментативным расщеплением (например, как описано в WO 9738124), биопревращением или хроматографическим разделением с использованием хиральной неподвижной фазы) и как можно определить эффективность повышения активности PDH описанными далее стандартными испытаниями.
Расщепляемые in vivo пролекарства соединений формулы (I) включают, например, гидролизуемые in vivo сложные эфиры соединений формулы (I), содержащие карбоксильную группу, например фармацевтически приемлемый сложный эфир, который гидролизуется в организме человека или животного с получением родительской кислоты, например фармацевтически приемлемый сложный эфир, образованный из C1-6-спирта, такого как метанол, этанол, этиленгликоль, пропанол или бутанол, или фенола или бензилового спирта, или замещенного фенола или бензилового спирта, где заместитель является, например, галогеном (таким как фтор или хлор), C1-4-алкилом (например, метилом) или C1-4-алкоксигруппой (например, метокси).
Расщепляемые in vivo пролекарства соединений формулы (I) включают также, например, гидролизуемые in vivo амиды соединений формулы (I), содержащие карбоксильную группу, например N-C1-4-алкил- или N,N-ди-С1-6-алкиламид, например N-метил-, N-этил-, N-пропил-, N,N-диметил-, N-этил-N-метил- или N,N-диэтиламид.
Следует иметь в виду, что некоторые соединения формулы (I) и их соли могут существовать в сольватированных, а также в несольватированных формах, например в гидратированных формах. Понятно, что изобретение включает в себя все такие сольватированые формы, которые повышают активность PDH.
Соединение формулы (I) или его соль и другие соединения изобретения (которые определены далее) могут быть получены любым известным способом, подходящим для получения химически родственных соединений. Эти способы включают, например, такие, которые представлены в заявках на Европейский патент №0524781, 0617010, 0625516, в патенте Великобритании №2278054 и международных заявках WO 9323358 и WO 9738124.
В соответствии с другим аспектом настоящее изобретение предусматривает способ получения соединения формулы (I) или его фармацевтически приемлемой соли или гидролизуемого in vivo его сложного эфира (при этом, если не указано иначе, переменные группы являются такими, как они определены для формулы (I)), способ включает:
(а) для соединений формулы (I), где R4 является гидрокси: удаление защитной группы у защищенного соединения формулы (II)

где Рg является защитной группой для спирта;
(b) для соединений формулы (I), где Y1, Y2 или Х1 является -С(О)-: окисление соответствующего спирта формулы (III)

где кольцо D1 имеет любое из значений, определенных выше для кольца С, но где место одного из возможных заместителей на кольце С занято АrСН(ОН), и Ra1 является группой, присоединенной к Y1, Y2 или X1 (возможные значения которых определены выше);
(с) для соединений формулы (I), где Y1, Y2 или X1 представляет собой группу -С(О)-: удаление защитной группы соответствующего соединения формулы (IV)

где кольцо D2 имеет любое из значений, определенных выше для кольца С, но при этом место одного из возможных заместителей на кольце С занято Аr-С(-O-(CH2)3-O-)- и Ra1 является таким, как определено выше;
(d) для соединений формулы (I), где кольцо С имеет присоединенный к нему заместитель Ra2-CH2-, где Ra2 является группой, которая присоединена к кольцу С через группу -CH2 -(возможные значения определены выше): восстановление соединения формулы (III) или (V)

где кольцо D1 имеет любое из значений, определенных выше для кольца С, но при этом место одного из возможных заместителей на кольце С занято АrС(О)-;
(е) для соединений формулы (I), где кольцо С имеет заместитель Ra3-C(O)-, где Ra3 является ароматической группой или алкенильной группой (возможные значения определены выше): обработку соединения формулы (VI)
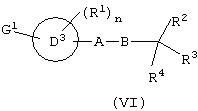
где кольцо D3 имеет любое из значений, определенных выше для кольца С, но при этом место одного из возможных заместителей в кольце С занято G1 и G1 является отщепляемой группой, монооксидом углерода и соединением олова, имеющим формулу (R6)p1Sn(Ra3)p2 (где R6 является C1-4-алкилом и p1+p2=4), или соединением алюминия, имеющим формулу (R6)p3Al(Ra3)p4 (где R6 является C1-4-алкилом и р3+р4=3);
(f) для соединений формулы (I), где кольцо С имеет заместитель Ra4S(O)- или Ra4S(O)2-, Ra4 является группой, присоединенной через посредство сульфоксидной или сульфоновой группы (возможные значения являются такими, как определены выше), и А-В не является SСН2 или NHCH2: окисление соединения формулы (VI), где G1 является Ra4S;
(g) для соединения формулы (I), в которой А-В является -NHC(O)-: взаимодействие соединений формулы (VII)

где J является NH2,
с кислотой формулы (VIII)

где Х является ОН;
(h) для соединения формулы (I), в которой А-В является -NHC(O)-: взаимодействие анилина формулы (VII), где J является -NH2-, с активированным производным кислоты формулы (VIII);
(i) для соединения формулы (I), в которой А-В является -NHC(O)- или -NHC(S)-, и R4 является гидрокси: взаимодействие соединения формулы (IX)

где Х является О или S,
с основанием с получением дианиона, последующую обработку дианиона кислородом в присутствии восстановителя или последующую обработку пероксикислотой;
(j) для соединения формулы (I), в которой А-В является -NHC(O)-: взаимодействие соединения формулы (VII), где J является хлором или фтором, с анионом амида щелочного металла, имеющего формулу (X)

где М является щелочным металлом;
(k) для соединения формулы (I), которое не содержит карбонильных групп, R4 является гидрокси и R2=R3: взаимодействие соединения формулы (XI)

где R4 является C1-4-алкилом,
с реактивом Гриньяра формулы R2MgBr или R2 MgCl, или литийорганическим реагентом формулы LiR2;
(1) для соединения формулы (I), которое не содержит карбонильных групп и R4 является гидрокси: взаимодействие соединения формулы (XII)

с соединением формулы R2M, где М является щелочным металлом, или реактивом Гриньяра формулы R2MgBr или R2MgCl;
(m) для соединения формулы (I), которое имеет N-связанный сульфонамид, N-связанный N-алкилсульфонамид или заместитель, являющийся сложноэфирным сульфинатом, присоединенный к кольцу С: обработку сульфонилхлоридом соответствующего соединения формулы (XIII)

где кольцо D3 имеет любое из вышеопределенных значений для кольца С, но где место одного из возможных заместителей в кольце С занято G2, где G2 является амино или гидрокси;
(n) для соединения формулы (I), в которой А-В является этиниленом и R4 не является хлором, и когда R4 является гидроксигруппой, она защищена: взаимодействие соответствующего соединения формулы (VII), где J является отщепляемой группой, с соответствующим ацетиленом формулы (XIV)

(о) для соединения формулы (I), в которой А-В является этиниленом и R4 является гидрокси: взаимодействие соответствующего алкина формулы (XV)
где Z является водородом,
с основанием и последующую обработку кетоном формулы (XVI)

(р) для соединения формулы (I), в которой А-В является транс-виниленом: восстановление соответствующего соединения формулы (I), в которой А-В является этиниленом, соответствующим восстановителем;
(q) для соединения формулы (I), в которой А-В является транс-виниленом: дегидратацию соединения формулы (XVII)

(r) для соединения формулы (I), в которой А-В является транс-виниленом и R4 является гидрокси: катализируемое основанием раскрытие эпоксида формулы (XVIII)

(s) для соединения формулы (I), в которой А-В является -NHCH2-: восстановление соответствующего соединения формулы (I), в которой А-В является -NHC(O)-;
(t) для соединения формулы (I), в которой А-В является -ОСН2-, -SCН2- или -NНСН2-: взаимодействие этиленоксида формулы (XIX)

с соответствующим соединением формулы (VII), где J является -ОН, -SH- или -NH2;
(u) для соединения формулы (I), в которой А-В является -NHC(S)-: взаимодействие соединения формулы (I), в которой А-В является -NHC(O)-, с сульфонирующим реагентом;
(v) для соединения формулы (I), в которой кольцо С является замещенным заместителем АrС(О)-, где Аr является ароматической группой (возможные значения являются такими, как они определены выше для формулы (I)) и А-В является -NHCO-: ацилирование соединения формулы (I);
(w) для соединения формулы (I), в которой А-В является -С(O)СН2- и R4 является гидрокси: взаимодействие кетона формулы (XX)

с сильным основанием и последующее взаимодействие с кетоном формулы (XVI);
(х) для соединения формулы (I), в которой А-В является -С(O)СН2- и R4 является гидрокси: взаимодействие соединения формулы (XXI)
где R’’ является C1-6-алкильной группой,
с кетоном формулы (XVI);
(у) для соединения формулы (I), в которой А-В является -С(O)СН2-: взаимодействие соединения формулы (VII), где J является Li, с соединением формулы (XXII)

(z) для соединения формулы (I), в которой А-В является -С(O)СН2-: взаимодействие соединения формулы (XXIII)
с соединением формулы (XXIV)

(а1) для соединений формулы (I), где кольцо С имеет заместитель PhS-: обработку соединения формулы (VI), где G1является отщепляемой группой, тиофенолом в присутствии катализатора;
(b1) для соединения формулы (I), где кольцо С имеет заместитель ArS-, где Аr является таким, как он определен выше: обработку в присутствии катализатора соединения формулы (VI), где G1 является SH, ароматическим соединением, содержащим замещаемую группу в присутствии катализатора;
(с1) для соединений формулы (I), где кольцо С имеет заместитель ArS-, где Аr является таким, как он определен выше, и А-В не является NHCO: обработку в присутствии основания соединения формулы (VI), где G1 является отщепляемой группой, соединением формулы ArSH в присутствии основания;
(d1) для соединений формулы (I), где кольцо С имеет заместитель Ra2-NC(O)-, где Ra2 является группой, которая присоединена через амидную связь (возможные значения определены выше): обработку соединения формулы (VI), где кольцо D3 имеет любое из значений, определенных выше для кольца С, но в котором место одного из возможных заместителей в кольце С занято G1, где G1 является отщепляемой группой, монооксидом углерода и амином, имеющим формулу -NRa2;
(е1) для соединений формулы (I), где кольцо (С) имеет заместитель Ra2-OSO2-, где Ra2 является группой, которая присоединена через сульфинатную сложноэфирную связь (возможные значения являются такими, как они определены выше): обработку соединения формулы (VI), где кольцо D3 имеет любое из значений, определенных выше для кольца С, но в котором место одного из возможных заместителей в кольце С занято G1, где G1является сульфонилхлордом Cl2OS-, спиртом, имеющим формулу -ORa2, и далее, в случае необходимости:
(i) превращают соединения формулы (I) в другое соединение формулы (I);
(ii) удаляют защитные группы или
(iii) образовывают фармацевтически приемлемую соль или гидролизуемый in vivo сложный эфир.
Примеры реакций для превращения соединения формулы (I) в другое соединение формулы (I) известны в данной области. С целью иллюстрации они включают
(i) образование в арильной или гетероарильной группе в качестве заместителя гидроксильной группы расщеплением соответствующего простого алкилового эфира или сложного ацилоксиэфира. Общепринятые способы включают, например, расщепление метоксильной группы с применением трибромида бора и расщепление трет-бутоксильной группы с применением трифторуксусной кислоты; расщепление ацетатной группы с применением, например, гидроксида лития в низшем спирте (например, таком как метанол или этанол);
(ii) образование R4 в виде гидроксильной группы.
Соединение формулы (I), где R4 является хлором, может быть получено, например, реакцией соединения формулы (I), в которой R4 является гидроксильной группой, с реагентом, таким как тионилхлорид, в подходящем растворителе, таком как дихлорметан или тетрагидрофуран, при температуре в диапазоне от 0 до 70° С. Реакцию можно необязательно осуществлять в присутствии катализатора, такого как N,N-диметилформамид.
Рg является защитной группой для спирта, подходящими значениями для Рg являются, например, бензильные группы, силильные группы или ацетильные защитные группы.
Когда G1 является отщепляемой группой, подходящими значениями являются бром, иод или трифлат.
Когда формула (VIII) представляет собой активированное производное кислоты, подходящие значения для Х включают галоген (например, хлор или бром), ангидриды и арилоксигруппы (например, фенокси или пентафторфенокси).
В формуле (X) М является щелочным металлом, подходящие значения М включают натрий или литий. Подходящие значения М в формуле (XII) включают литий.
В формуле (VII), где J является отщепляемой группой, подходящими значениями являются бром, иод или трифлат.
Конкретные условия вышеприведенных реакций являются следующими.
(a) Примеры подходящих реагентов для удаления защитной группы для спирта формулы (II) включают следующие:
1) когда Рg является бензилом:
(i) водород в присутствии палладиевого катализатора на угле, т.е. гидрогенолиз, или
(ii) бромистый водород или йодистый водород;
2) когда Рg является силильной защитной группой:
(i) тетрабутиламмонийфторид или
(ii) водный раствор фтористоводородной кислоты;
3) когда Рg является ацетилом:
(i) водный раствор слабого основания, например гидроксида лития.
Реакцию можно проводить в подходящем растворителе, например этаноле, метаноле, ацетонитриле или диметилсульфоксиде, и ее можно обычно осуществлять при температуре в диапазоне от -40 до 100° С.
(b) Эти условия хорошо известны в данной области, например, могут быть использованы окислители, такие как пиридинийдихромат, и растворители, такие как метанол или дихлорметан.
(с) Для удаления защитной группы могут быть обычно использованы насыщенный водный раствор кислоты, такой как щавелевая, или минеральной кислоты, такой как хлористоводородная или серная кислоты. Реакцию можно осуществлять при температуре в диапазоне от 0 до 100° С в растворителе, таком как низший спирт (например, метанол или этанол), или в смеси двух растворителей, такой как вода/дихлорметан, вода/тетрагидрофуран или вода/ацетон.
(d) Могут быть использованы восстановители, такие как борогидрид натрия (для соединений формулы (V), обеспечивающие получение соединений формулы (III)), и триэтилсилан (для соединений формулы (III)). Восстановление с применением борогидрида натрия осуществляют обычно в растворителях, таких как низший спирт (например, метанол или этанол), и восстановление с применением триэтилсилана обычно осуществляют, например, в таком растворителе, как трифторметилсульфокислота.
(е) Данную реакцию обычно осуществляют с применением соединения олова в присутствии подходящего катализатора, например, такого как бис(трифенилфосфин)палладийдихлорид, при температуре в диапазоне от 0 до 100° С и в растворителе, например, таком как тетрагидрофуран, 1,3-диметил-3,4,5,6-тетрагидро-2-(1Н)-пиримидинон или диметилсульфоксид. Реакцию с соединением алюминия обычно осуществляют в присутствии подобного катализатора, при подобной температуре и в таком растворителе, как, например, диэтиловый эфир, бензол, толуол или тетрагидрофуран.
(f) Подходящие окислители включают перманганат калия, OXONE, периодат натрия, трет-бутилгидропероксид (в виде раствора в толуоле), перкислоты (например, такие как 3-хлорпероксибензойная кислота), пероксид водорода, ТРАР (тетрапропиламмонийперрутенат) или кислород. Реакцию можно проводить в подходящем растворителе, таком как диэтиловый эфир, дихлорметан, метанол, этанол, вода, уксусная кислота или в смеси двух или более растворителей. Реакцию можно обычно осуществлять при температуре в диапазоне от -40 до 100° С.
(g) Реакцию можно осуществлять в присутствии подходящего связующего вещества. В качестве подходящих связующих веществ могут быть использованы стандартные пептидные связующие вещества, известные в данной области, например, такие как дициклогесилкарбодиимид. Реакцию необязательно осуществляют в присутствии катализатора, например диметиламинопиридина или 4-пирролидинопиридина, необязательно в присутствии основания, такого как триэтиламинопиридин или 2,6-диалкилпиридины (например, 2,6-лутидин или 2,6-ди-трет-бутилпиридин), или 2,6-дифенилпиридин. Подходящие растворители включают диметилацетамид, дихлорметан, бензол, тетрагидрофуран и диметилформамид. Реакцию сочетания можно обычно осуществлять при температуре в диапазоне от -40 до 40° С.
(h) Реакцию сочетания можно необязательно осуществлять в присутствии основания, такого как триэтиламин, пиридин, 2,6-диалкилпиридины (например, 2,6-лутидин или 2, 6-ди-трет-бутилпиридин), или 2,6-дифенилпиридин. Подходящие растворители включают диметилацетамид, дихлорметан, бензол, тетрагидрофуран и диметилформамид. Реакцию сочетания можно обычно осуществлять при температуре в диапазоне от -40 до 40° С.
(i) Подходящие основания для получения дианиона являются сильными основаниями, такими как диалкиламиды лития (например, диизопропиламид лития). Подходящие восстановители включают трифенилфосфин. Подходящие пероксикислоты включают 3-хлорпероксибензойную кислоту. Реакцию можно обычно осуществлять при температуре в диапазоне от -100° С до комнатной температуры в подходящем растворителе, таком как тетрагидрофуран или диэтиловый эфир.
(j) Реакцию можно обычно осуществлять при температуре в диапазоне от -40 до 100° С в подходящем растворителе, таком как диметилформамид, DMSO или тетрагидрофуран. Соответствующий дионион образуется в том случае, когда R4 является гидроксильной группой.
(k) Реакцию можно обычно осуществлять при температуре в диапазоне от -100 до 20° С, предпочтительно при температуре в диапазоне от -20 до 20° С в подходящем растворителе, таком как тетрагидрофуран или диэтиловый эфир.
(l) Реакцию можно обычно осуществлять при температуре в диапазоне от -100 до 25° С и в растворителе, таком как тетрагидрофуран, диэтиловый эфир или 1,2-диметоксиэтан.
(m) Реакцию можно обычно осуществлять в присутствии основания, такого как пиридин, триэтиламин или карбонат калия, при температуре в диапазоне от 0 до 120° С в подходящем растворителе, таком как N,N-диметилформамид или ацетонитрил. В случае наличия N-связанных N-алкилсульфонамидов затем проводят алкилирование с применением, например, алкилиодида или алкилбромида. Реакцию алкилирования можно обычно осуществлять при температуре в диапазоне от 0 до 120° С в подходящем растворителе, например, таком как N, N-диметилформамид или ацетон, в присутствии основания, такого как карбонат калия.
(n) Реакцию можно обычно осуществлять в присутствии катализатора, например комбинации иодид меди (I)/бис(трифенилфосфин)палладийдихлорид или ацетата палладия(II). Реакцию можно осуществлять в инертном растворителе, таком как тетрагидрофуран, бензол или толуол, или в основном растворителе, таком как диэтиламин (DEA, ДЭА) или триэтиламин (TEA, ТЭА) при температуре в диапазоне от -20 до 110° С.
(о) Подходящие основания включают диизопропиламид лития (LDA), н-бутиллитий или трет-бутиллитий. Реакцию можно осуществлять при температуре в диапазоне от -100 до 40° С, предпочтительно при температуре в диапазоне от -70 до -40° С, и в растворителе, таком как тетрагидрофуран, диэтиловый эфир или 1,2-диметоксиэтан.
(р) Подходящими восстановителями являются, например, алюмогидрид лития или бис(метоксиэтокси)алюмогидрид натрия. Реакцию можно осуществлять в подходящем растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре в диапазоне от 0 до 50° С.
(q) Эту реакцию можно обычно осуществлять в присутствии кислотного катализатора (например, п-толуолсульфокислоты) в растворителе, таком как толуол или дихлорметан, при температуре в диапазоне от 0 до 200° С, предпочтительно при температуре в диапазоне от 20 до 100° С.
(r) Раскрытие кольца можно осуществлять в подходящем органическом растворителе, например, таком как простые эфиры или толуол. Предпочтительными являются простые эфиры, например тетрагидрофуран. Подходящие основания включают трет-бутоксид калия или гидрид натрия. Раскрытие можно осуществлять при температуре в диапазоне от -50 до 100° С, предпочтительно при температуре в диапазоне от 0 до 50° С.
(s) Подходящие восстановители включают алюмогидрид лития или боран лития. Реакцию можно обычно осуществлять при температуре в диапазоне от 0° С до температуры кипения с обратным холодильником в растворителях, например, таких как диэтиловый эфир, тетрагидрофуран или 1,2-диметоксиэтан.
(t) Когда J является -ОН или -SH, реакцию можно обычно осуществлять в присутствии основания, например гидрида натрия или триэтиламина. Реакцию можно проводить в растворителе, таком как дихлорметан, тетрагидрофуран или диэтиловый эфир, при температуре от 0° С до температуры кипения с обратным холодильником. Когда J является -NH2, реакцию можно обычно осуществлять с помощью методики, описанной в JOC (1999),

(u) Подходящими сульфонирующими реагентами являются, например, пентасульфид фосфора или реагент Лоэссона (2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфид). Реакцию можно необязательно осуществлять в присутствии подходящего основания, например, такого как пиридин или триэтиламин. Подходящие для реакции растворители включают, например, толуол, тетрагидрофуран, 1, 3-диоксан или ацетонитрил. Реакцию обычно осуществляют при температуре в диапазоне от 0° С до температуры кипения с обратным холодильником.
(v) Могут быть использованы ацилирующие реагенты, такие как карбоновые кислоты или их производные, в присутствии соответствующего активирующего реагента, такого как полифосфорная кислота. Реакцию можно обычно осуществлять при температуре в диапазоне от 0 до 200° С с применением, в случае необходимости, растворителя, такого как N,N-диметилформамид, 1,3-диметил-3,4,5,6-тетрагидро-2-(1Н)пиримидинон, DMSO (ДМСО) или этиленгликоль, с последующим образованием амида, как описано ранее в (g) или (h) (Staskum B. J.Оrg.Chem. (1964), 29, 2856-2860; Ohnmacht С. J.Med.Сhem. (1996), 39, 4592-4601).
(w) подходящими сильными основаниями являются, например:
i) гидрид натрия в подходящем растворителе, таком как тетрагидрофуран или N,N-диметилформамид. Реакцию обычно осуществляют при температуре в диапазоне от - 78 до 25° С;
ii) диизопропиламид лития в подходящем растворителе, таком как тетрагидрофуран. Реакцию обычно осуществляют при температуре в диапазоне от - 78 до 25° С.
(х) R’’ предпочтительно является метилом. Эту реакцию можно осуществлять в присутствии кислоты Льюиса, такой как тетрахлорид титана, в подходящем растворителе, таком как дихлорметан. Эту реакцию обычно осуществляют при температуре в диапазоне от - 78 до 50° С.
(у) Эту реакцию предпочтительно осуществляют в подходящем растворителе, например тетрагидрофуране, при температуре от - 78 до 100° С.
(z) Эту реакцию обычно осуществляют при стандартных для реакций Фриделя-Крафтса условиях, например в присутствии трихлорида алюминия в растворителе, таком как дихлорметан или нитробензол, при температуре от 0 до 150° С.
(а1) Подходящие катализаторы включают тетракис(трифенилфосфин)палладий(0), хлорид меди(I) или стехиометрическое количество оксида меди(I). Эту реакцию можно обычно проводить в подходящем инертном растворителе, таком как низший спирт, смесь пиридина и хинолина, диметилформамид, N-метилпирролидинон или толуол, и необязательно в присутствии основания, такого как метоксид натрия или карбонат калия.
(b1) Подходящие замещаемые группы включают галоген или трифлат. Подходящие катализаторы включают тетракис(трифенилфосфин)палладий(0), хлорид меди(I) или стехиометрическое количество оксида меди(I). Реакцию можно обычно проводить в подходящем инертном растворителе, таком как низший спирт или смесь пиридина и хинолина, или N-метилпирролидинон, или диметилформамид, и, если необходимо, в присутствии основания, такого как метоксид натрия, при температуре 25-180° С.
(с1) Подходящей отщепляемой группой является фтор. Подходящим основанием является карбонат калия. Реакцию можно обычно осуществлять при температуре в диапазоне от 30 до 200° С в растворителе, таком как N,N-диметилформамид, 1,3-диметил-3,4,5,6-тетрагидро-2-(1Н)-пиримидинон, ДМСО или этиленгликоль.
(d1) Эту реакцию с амином осуществляют обычно в присутствии подходящего катализатора, например, такого как бис(трифенилфосфин)палладийдихлорид или дихлорбис(трифенилфосфин)палладий(II), при температуре в диапазоне от 0° С до температуры кипения с обратным холодильником с применением растворителя, такого как тетрагидрофуран, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)пиримидинон, диметилсульфоксид, или с применением в качестве необходимого растворителя амина, такого как трибутиламин.
(е1) Реакцию можно обычно осуществлять в присутствии основания, например, такого как пиридин, триэтиламин или карбонат калия, при температуре в диапазоне от 0 до 120° С в подходящем растворителе, таком как дихлорметан, диэтиловый эфир, N,N-диметилформамид или ацетонитрил.
Если исходное сырье является коммерчески недоступным, необходимое для осуществления, например, вышеописанных методик сырье может быть получено способами, выбранными из стандартных способов, принятых в органической химии, которые являются аналогичными синтезу известных структурно-родственных соединений, или способами, которые аналогичны вышеописанному способу или способам, приведенным в примерах.
Так, например, следует принимать во внимание, что некоторые из необязательных ароматических заместителей в соединениях настоящего изобретения могут быть введены стандартными реакциями замещения в ароматическом ядре или могут быть генерированы обычной модификацией функциональной группы или до осуществления последующих вышеупомянутых процессов, или непосредственно перед их осуществлением и включены в способ изобретения как таковые. Такие реакции и модификации включают, например, введение заместителя реакцией замещения в ароматическом ядре, восстановления заместителей, алкилирования заместителей и окисления заместителей. Реагенты и условия реакций для таких методик хорошо известны в области химии. Конкретные примеры реакций замещения в ароматическом ядре включают введение нитрогруппы с применением концентрированной азотной кислоты, введение ацильной группы с применением, например, ацилгалогенида и кислоты Льюиса (такой как трихлорид алюминия) в условиях реакции Фриделя-Крафтса; введение алкильной группы с применением алкилгалогенида и кислоты Льюиса (такой как трихлорид алюминия) в условиях реакции Фриделя-Крафтса; введение галогеновой группы. Конкретные примеры модификаций включают восстановление нитрогруппы до аминогруппы, например, каталитическим гидрированием с применением никелевого катализатора или обработкой железом в присутствии хлористоводородной кислоты при нагревании; окисление алкилтиогруппы до алкилсульфинила или алкилсульфонила с применением, например, нагревания пероксида водорода в уксусной кислоте или 3-хлорпероксибензойной кислоты.
Далее представлены для иллюстрации конкретные примеры методик, применяемых для получения вышеописанных исходных продуктов, но неограничивающие их, в которых переменные группы, если не указано иным образом, являются такими, как они определены для формулы (I).
1) Получение соединений формулы (II):
(а) соединения формулы (II), в которой А-В является -ОСН2-, -SCH2- или -NHCH2-, могут быть получены обработкой соответствующего соединения формулы (VII), в которой J является -ОН, -SH или -NH2, соединением формулы (XXV)
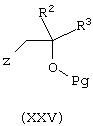
где Z является отщепляемой группой, например мезилатом, при температуре от комнатной до температуры кипения с обратным холодильником с применением растворителя, такого как тетрагидрофуран, диметилсульфоксид, N,N-диметилформамид или 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)пиримидинон.
Соединение формулы XXV, где Z является мезилатом, может быть получено взаимодействием соединения формулы XXV, где Z является ОН, с метансульфонилхлоридом в присутствии основания, например триэтиламина, в растворителе, таком как дихлорметан, при температуре от около -78 до 25° С.
Соединения формулы XXV, где Z является ОН, получают восстановлением соединения формулы (VIII), где Х является ОН и R4 является защищенной гидроксильной группой, или соединения формулы (XXVI)

где Е является защитной группой для карбокси (например, Me) и R4 является защищенной гидроксильной группой,
подходящим восстановителем, например алюмогидридом лития, в растворителе, таком как диэтиловый эфир или тетрагидрофуран, при температуре от около 0 до около 25° С.
(b) Соединение формулы (II), где А-В является -NHC(O)-, может быть получено взаимодействием соединения формулы (VII), где J является -NH2, с соединением формулы (VIII), где Х является ОН и R4 является защищенной гидроксильной группой, способом, аналогичным описанному в (g) или (h), где раскрыто получение соединения формулы (I). Соединения формулы (VIII), где Х является ОН и R4 является защищенной гидроксильной группой, могут быть получены общепринятыми методиками, например расщеплением сложноэфирной группы соединения формулы (XXVI), где Е является защитной группой для карбокси (например, Me), в стандартных условиях, таких как слабощелочная среда, например, с применением водного раствора гидроксида лития.
Соединения формулы (XXVI), где R4 является защищенной гидроксильной группой, могут быть получены защитой соединения формулы (XXVI), где R4 является гидроксильной группой, реакцией с соединением, таким как бензилхлорид или бензилбромид (в присутствии подходящего основания, такого как гидрид натрия, и необязательно с применением катализатора, такого как иодид натрия или аммония, для обеспечения бензильной защитной группы), или с любым из общепринятых известных силилирующих агентов, применяемых для этой цели (например, с 2-триметилсилилэтоксиметилхлоридом, в присутствии подходящего основания, такого как триэтиламин, и необязательно в присутствии катализатора, такого как N,N-диметиламинопиридин).
Соединения формулы (XXVI), где R4 является гидрокси, получают этерификацией кислоты формулы (VIII), где Х является ОН, осуществляемой обычной этерификацией, например реакцией с C1-4-спиртом (например, метанолом) в присутствии кислотного катализатора (например, серной кислоты).
(с) Соединение формулы (II), где А-В является этиниленом, может быть получено взаимодействием соединения формулы (VII), где J является отщепляемой группой, такой как бром, иод или трифлат, с ацетиленом формулы (XXVII)

в которой, если R4 является защищенной гидроксильной группой, в присутствии катализатора, такого как комбинация иодида меди(I) и бис(трифенилфосфин)палладийдихлорида или ацетата палладия(II). Реакцию можно проводить при температуре в диапазоне от -20 до 110° С в инертном растворителе, таком как тетрагидрофуран, бензол или толуол, или в основном растворителе, таком как диэтиламин или триэтиламин.
Соединение формулы (XXVII), где R4 является защищенной гидроксильной группой, может быть получено взаимодействием соединения формулы (XXVII), где R4 является ОН, с общепринятой защитной группой для гидрокси, например с такой, которая была описана выше, или с такой, которая будет описана далее.
(а) Соединение формулы (II), где А-В является транс-виниленом, может быть получено взаимодействием соединения формулы (XXVIII)

где М является алкилметаллической группой, такой как триалкилолово (например, трибутил- или триметилолово) или бис-алкилоксибораном (например, катехолбораном), и R4 является защищенной гидроксильной группой,
с соединением формулы (VII), где J является отщепляемой группой, например иодидом, бромидом или трифлатом, в присутствии катализатора, такого как бис(трифенилфосфин)палладийдихлорид или тетракис(трифенилфосфин)палладий(0). Реакцию можно обычно проводить в подходящем инертном растворителе, таком как тетрагидрофуран или диметилформамид, в инертной атмосфере при температуре 0-150° С.
Соединение формулы (XXVIII) может быть получено взаимодействием соединения формулы (XXVII)
(i) с реагентом, таким как катехолборан, с образованием винилборанового соединения формулы (XXVIII), где М является катехолбораном, или
(ii) с триалкилгидридом олова в присутствии каталитического количества инициатора цепи радикалов, например, такого как аза-бис-изобутиронитрил, или с применением триалкилгидрида олова, предварительно обработанного сильным J основанием (например, алкиллитием), и цианидом меди(I), или с применением катализатора, являющегося переходным металлом, например, такого как тетракис(трифенилфосфин)палладий(0), с образованием соединения формулы (XXVIII), где М является триалкилоловом.
Эти реакции можно обычно осуществлять в подходящем инертном растворителе, таком как тетрагидрофуран, толуол или ксилол, в инертной атмосфере при температуре 0-150° С.
Соединения формулы (XXVII) могут быть получены взаимодействием соединения формулы (XVI) с ацетилидом щелочного металла (например, ацетилидом лития) или ацетилидом щелочноземельного металла (например, ацетилидом магния). Реакцию можно проводить в растворителе, таком как тетрагидрофуран, диэтиловый эфир или 1,2-диметоксиэтан, при температуре от -100 до 25° С.
2) Получение соединения формулы (IV):
(а) Соединение формулы (IV), где А-В является этиниленом и R4 является ОН, может быть получено взаимодействием соответствующего соединения формулы (XXIX)

где кольцо D5 имеет любое из значений, определенных выше для кольца С, но в котором место одного из возможных заместителей в кольце С занято Ar(-C-O-(CH2)3-O-),
с основанием, таким как алкиллитий (например, бутиллитий), с последующим добавлением кетона, имеющего формулу (XVI). Реакцию можно проводить при температуре от около -100 до около -40° С в растворителе, таком как тетрагидрофуран, диметиловый эфир или 1,2-диметоксиэтан.
(b) Соединение формулы (IV), где А-В является транс-виниленом, может быть получено восстановлением соответствующего соединения формулы (IV), где А-В является этиниленом, соответствующим восстановителем, таким как алюмогидрид лития или натрий–бис-(2-метоксиэтокси)алюминий в растворителе, таком как тетрагидрофуран. Реакцию можно проводить при температуре от около -40 до около 40° С.
(c) Соединение формулы (XXIX) может быть получено обработкой соответствующего кетона 1,3-пропандиолом в присутствии кислотного катализатора, такого как п-толуолсульфокислота (ТsОН), с применением растворителя дефлегмации, такого как толуол, и с использованием аппарата Дина-Старка или высушенных молекулярных сит.
3) Получение соединения формулы (VI):
(a) Соединение формулы (VI), где G1 является галогеном, например бромом или иодом, может быть получено (1) обработкой соответствующего соединения формулы (VI), где G1 является нитро, восстановителем, таким как хлорид олова(II), в присутствии водного раствора кислоты, такой как уксусная кислота, с получением соответствующего амина и (2) последующей обработкой амина комбинацией реагентов, состоящей из азотной и серной кислоты, или трет-бутилнитритом, для осуществления диазотирования, и затем (3) обработкой диазотированного соединения соответствующим галогенидом меди(I), таким как бромид меди(I) или иодид калия.
(b) Соединение формулы (VI), где G1 является SH, может быть получено:
1) взаимодействием соединения формулы (VI), где G1 является отщепляемой группой, такой как галоген или трифлат, с триизопропилсилантиолатом в присутствии палладиевого катализатора, как описано Arnould et al. в Tet. Let. (1996), 37 (26), стр.4523, с последующим удалением защитной группы тетрабутиламмонийфторидом в растворителе, таком как тетрагидрофуран, при температуре от -78 до около 25° С, или
2) перегруппировкой Пуммерера (Pummerer), которая описана в Tet. Let. (1984), 25 (17), стр.1753, соединения формулы (VI), где G1 является СН3S(О)-, которое может быть получено из соединения формулы (VI), где G1 является отщепляемой группой, такой как галоген или трифлат, с использованием катализируемой палладием реакции сочетания с метантиолом, которая описана, например, в Zheng et al. J.Org. Chem. (1998), 63, стр.9606, с последующим окислением образованного сульфида до соответствующего сульфоксида с применением, например, в качестве окислителя трет-бутилгидропероксида, или
3) восстановлением соединения формулы (VI), где G является SO2Cl, восстанавливая сульфонилхлорид с использованием, например, небольшого избытка трифенилфосфина в растворителе, таком как дихлорметан, в присутствии катализатора, такого как диметилформамид, с последующей кислотной обработкой.
(с) Соединение формулы (VI), где G1 является SO2C1, может быть получено обработкой при стандартных условиях соединения формулы (VI), где G1 является Н, хлорсульфокислотой.
4) Получение соединений формулы (XII):
Соединение формулы (XII), где А-В является этиниленом, может быть получено обработкой соответствующего соединения формулы (XV), где Z является защитной группой, такой как триметилсилил, фтористым основанием (например, тетрабутиламмонийфторидом (TBAF)) и хлорангидридом формулы R3-CO-Cl, с получением желаемого соединения.
5) Получение соединений формулы (VII):
Соединение формулы (VII), где J является галогеном, может быть получено обработкой (1) хлоридом олова(II) или (2) порошкообразным железом и концентрированной хлористоводородной кислотой в 95% этаноле соответствующего соединения формулы (VII), где J является нитро, для восстановления нитрогруппы и образования вследствие этого соответствующего амина, (3) затем амин может быть обработан, например, нитритом (таким как трет-бутилнитрит или нитрит натрия в присутствии минеральной кислоты) с образованием соответствующей соли диазония, которая, в свою очередь, может быть обработана солью меди (I) (такой как бромид или хлорид меди (I)) или иодидом калия. Реакции диазотирования и замещения могут быть проведены в растворителе, таком как ацетонитрил, при температуре от 0 до 25° С.
6) Получение соединений формулы (XIV):
Соединение формулы (XIV), где R4 является ОН, может быть получено взаимодействием соответствующего кетона, имеющего формулу (XVI), с ацетилидом щелочного металла (например, ацетилидом лития) или ацетилидом щелочноземельного металла (например, ацетилидом магния). Реакцию можно проводить в растворителе, таком как тетрагидрофуран, диэтиловый эфир или 1,2-диметоксиэтан, при температуре от около -100 до около 25° С.
7) Получение соединений формулы (XIII):
Соединение формулы (XIII), где G2 является амино и А-В является NHCO, может быть получено обработкой в стандартных условиях соединения формулы (XIII), где G2 является нитро, например, восстановителем, таким как хлорид олова(II) или порошкообразное железо в сочетании с концентрированной кислотой, или применяя металлический палладий на носителе, которым является уголь, и газообразный водород в растворителе, таком как низший спирт (метанол или этанол) или этилацетат.
8) Получение соединений формулы (VII):
(i) соединение формулы (VII), где R1 является орто-галогеном или орто-гидрокси и J является -NH2, может быть получено обработкой соединения формулы (XXX)

где аминогруппа находится в орто-положении относительно нитрогруппы, (1) комбинацией реагентов, состоящей из азотной и серной кислоты, или трет-бутилнитритом для осуществления диазотирования и (2) дальнейшей обработкой диазотированного соединения соответствующим галогенидом меди(I), таким как бромид или хлорид меди(I), или нагреванием в разбавленной серной кислоте с образованием соответствующего фенола и (3) последующим восстановлением нитрогруппы (смотри 8) ii) или 7)). Реакции диазотирования и замещения могут быть проведены в растворителе, таком как ацетонитрил, при температуре 0-25° С. Соединение формулы (XXX) может быть получено, например, в соответствии с методиками, подобными тем, которые описаны в J.Med.Chem., (1975),

(ii) соединение формулы (VII), где J является NH2, может быть получено восстановлением соединения формулы (XXXI)

в стандартных условиях восстановителем, таким как хлорид олова(II) или порошкообразное железо, в сочетании с концентрированной кислотой, или применяя металлический палладий на носителе, которым является уголь, и газообразный водород в растворителе, таком как низший спирт (метанол или этанол) или этилацетат.
(iii) соединение формулы (VII), где J является NH2, R1является -NO2 и кольцо С замещено АrSО2, может быть получено взаимодействием соединения формулы (XXXII)

где кольцо D4 имеет любое из значений, определенных выше для кольца С, но в котором место одного из возможных заместителей в кольце С занято АrSO2,
с азотной кислотой и последующей обработкой нитрированного соединения в слабощелочных условиях (т.е. с применением, например, такого основания как гидроксид лития) для расщепления ацетатной группы и получения амина;
(iv) соединение формулы (VII), где J является -ОН, может быть получено диазотированием в стандартных условиях соединения формулы (VII), где J является -NH2, с последующим нагреванием полученного соединения в разбавленной серной кислоте;
(v) соединение формулы (VII), где J является -SH, может быть получено взаимодействием соединения формулы (VII), где J является отщепляемой группой (например, фтором или хлором) с избытком метантиола в присутствии гидрида натрия;
(vi) соединения формулы (VII), где J является Li, могут быть получены
a) обменом галоген-металл, например обработкой соединения формулы (VII), где J является Вr или J, литийорганическим реагентом, таким как н-бутиллитий или трет-бутиллитий в растворителе, таком как тетрагидрофуран, при низкой температуре, например при температуре от –100 до -50° С.
b) обработкой соединения формулы (XXIII) алкиллитиевым основанием для соединений, где R1 является металлирующим заместителем в орто-положении. Реакции этого типа рассмотрены в V.Snieckus, Chem.Rev., 1990, 90, 879-933.
9) Расщепление соединений формулы (VIII), где X является ОН.
Если необходима расщепленная кислота, она может быть получена любым из методов, известных для получения оптически активных форм (например, перекристаллизацией хиральной соли (например, как в WO 9738124), ферментативным расщеплением, биопревращением или хроматографическим разделением с применением хиральной неподвижной фазы). Так, например, если требуется (R)-(+) -расщепленная кислота, ее можно получить способом, представленным на схеме 2 в описании заявки РСТ WO 9738124, для получения (S)-(-)-кислоты, т.е. с применением классического метода расщепления, описанного также для получения (S)-(-)-кислоты в заявке на Европейский патент ЕР 0524781, за исключением того, что в последней заявке вместо (S)-(-)-1-фенилэтиламина может быть использован (1S, 2R)норфедрин.
10) Получение соединений формулы (XV):
Соединение формулы (XV), где Z является Н, может быть получено взаимодействием соединения формулы (VII), где J является отщепляемой группой, такой как бром, иод или трифлат, с триметилсилилацетиленом в присутствии катализатора, такого как комбинация бис(трифенилфосфин)палладийдихлорида и иодида меди(I) в диэтиламине или триэтиламине, последующей обработкой основанием (например, карбонатом калия) в C1-6-спирте (таком как метанол) в качестве растворителя для удаления триметилсилильной группы.
11) Получение соединений формулы (XVII):
Соединение формулы (XVII) может быть получено из соединения формулы (XXXIII)

восстановлением в стандартных условиях с применением, например, гидрида, такого как борогидрид натрия.
Соединение формулы (XXXIII) может быть получено депротонированием соединения формулы (VII), где J является Me, сильным основанием, например диизопропиламидом лития, в органическом растворителе, таком как тетрагидрофуран, при температуре от -78 до 100° С с последующим добавлением амида формулы (XXXIV)

в которой каждый из R19 и R20 независимо представляет собой C1-6-алкил, предпочтительно метил, или вместе с атомами, к которым они присоединены, образуют 5-7-членное кольцо.
Амид формулы (XXXIV) может быть получен из кислоты формулы (VIII) или ее реакционноспособного производного реакцией с гидроксиламином формулы R19(R20O)NH в стандартных условиях, например таких, которые описаны в способе (g) или (h) для получения вышеприведенного соединения формулы (I).
12) Получение соединений формулы (XVIII):
Соединение формулы (XVIII) может быть получено из диола формулы (XXXV)

с применением подходящего дегидратирующего агента, такого как бис-[α , α -бис-(трифторметил)бензолметанолато]дифенилсеры.
13) Получение соединений формулы (XIX):
Соединение формулы (XIX) может быть получено обработкой соединения формулы (XVI) солью триметилсульфония (например, иодидом триметилсульфония) и основанием (например, гидроксидом щелочного металла) в растворителе, таком как дихлорметан.
14) Получение соединений формулы (XX):
Соединение формулы (XX) могут быть получены хорошо известными в данной области реакциями синтеза, например:
(i) ацилированием соединения формулы (XXIII) ацетилхлоридом в соответствии с реакцией Фриделя-Крафтса в условиях, которые описаны выше в (z);
(ii) реакцией соединения формулы (VII), где J является Li, с амидом формулы (XXXVI)

в условиях, которые описаны выше в 8) vi) b);
(iii) окислением соединения формулы (XXXVII)

15) Получение соединений формулы (XXI):
Соединения формулы (XXI) могут быть получены из соединений формулы (XX) обработкой основанием, таким как диизопропиламид лития или триэтиламин, и силилирующим агентом, таким как триметилсилилхлорид, в растворителе, таком как тетрагидрофуран, или триметилсилилтрифлат в растворителе, таком как дихлорметан. Реакцию можно обычно осуществлять при температуре в диапазоне от -78 до 70° С.
16) Получение соединений формулы (XXII):
Соединения формулы (XXII) могут быть получены из кислоты формулы (XXXVIII)

или ее реакционноспособного производного реакцией с гидроксиламином формулы R19(R20O)NH в стандартных условиях, например, таких, которые описаны выше в способе (g) или (h) для получения вышеприведенного соединения формулы (I).
В соответствии с дополнительной отличительной особенностью изобретения предусмотрен способ получения соединения формулы (I’), в котором применяется один из любых способов a), f), g), h), i) или l), и с последующим, если необходимо
(i) превращением соединения формулы (I’) в другое соединение формулы (I’);
(ii) удалением защитных групп или
(iii) образованием фармацевтически приемлемой соли или расщепляемого in vivo сложного эфира.
Следует отметить, что многие из исходных веществ, необходимые для вышеописанных методов синтеза, являются коммерчески доступными и/или широко известными из научной литературы или могут быть получены из коммерчески доступных соединений модифицированием способов, описанных в научной литературе.
Следует иметь в виду, что в некоторых реакциях, описанных выше, может быть необходимой/желательной защита в соединениях чувствительных групп. Случаи, для которых необходима или желательна защита, и подходящие способы защиты хорошо известны специалистам в данной области. Так, например, если реагенты включают такие группы как амино, карбокси или гидрокси, в некоторых из вышеупомянутых реакций может быть желательной защита таких групп.
Подходящей защитной группой для амино- или алкиламиногруппы является, например, ацильная группа, например алканоильная группа, такая как ацетил, алкоксикарбонильная группа, например метоксикарбонильная, этоксикарбонильная или трет-бутоксикарбонильная группы, арилметоксикарбонильная группа, например бензилоксикарбонил, или ароильная группа, например бензоил. Условия удаления вышеприведенных защитных групп неизбежно будут изменяться в зависимости от выбора защитной группы. Так, например, ацильная группа, такая как алканоил, или алкоксикарбонильная группа или ароильная группа, могут быть удалены, например, гидролизом с использованием подходящего основания, такого как гидроксид щелочного металла, например гидроксид лития или натрия. Альтернативно ацильная группа, такая как трет-бутокси-карбонильная группа, может быть удалена, например, обработкой подходящей кислотой, такой как хлористоводородная, серная или фосфорная кислота, или трифторуксусной кислотой, и арилметоксикарбонильная группа, такая как бензилоксикарбонильная группа, может быть удалена, например, гидрированием над катализатором, таким как палладий на угле, или обработкой кислотой Льюиса, такой как трис-(трифторацетат) бора. Подходящей альтернативной защитной группой для первичной аминогруппы является, например, фталоильная группа, которая может быть удалена обработкой алкиламином, таким как диметиламинопропиламин, или гидразином.
Подходящей защитной группой для гидроксильной группы является, например, ацильная группа, например алканоильная группа, такая как ацетил, ароильная группа, например бензоил, или арилметильная группа, например бензил. Условия удаления вышеприведенных защитных групп будут неизбежно меняться в зависимости от выбора защитной группы. Так, например, ацильная группа, такая как алканоильная или ароильная группа, могут быть удалены, например, гидролизом с использованием подходящего основания, такого как гидроксид щелочного металла, например гидроксид лития или натрия. Альтернативно арилметильная группа, такая как бензильная группа, может быть удалена, например, гидрированием над катализатором, таким как палладий на угле.
Подходящей защитной группой для фенола является, например, простой алкиловый эфир, например метиловый, силиловый эфир, например триметилсилиловый или трет-бутилдиметилсилиловый, простой оксиалкиловый эфир, например метоксиметиловый или метоксиэтоксиметиловый, или сложный эфир, например ацетат или бензоат. Условия удаления вышеприведенных защитных групп будут неизбежно изменяться в зависимости от выбора защитной группы. Так, например, простой алкиловый эфир может быть удален обработкой подходящим реагентом, таким как иодтриметилсилан, или подходящей кислотой Льюиса, такой как трибромид бора. Альтернативно силиловый эфир может быть удален гидролизом, катализируемым кислотой или фторид-ионом. Альтернативно оксиалкиловые эфиры могут быть удалены обработкой соответствующей кислотой, такой как уксусная кислота или хлористоводородная кислота. Альтернативно сложные эфиры могут быть удалены гидролизом с помощью соответствующей кислоты или соответствующего основания.
Подходящей защитной группой для карбоксильной группы является, например, сложноэтерифицирующая группа, такая как метильная и этильная, которая может быть удалена, например, гидролизом с использованием основания, такого как гидроксид натрия, или, например, трет-бутильная группа, которая может быть удалена, например, обработкой кислотой, такой как органическая кислота, например трифторуксусная, или, например, бензильная группа, которая может быть удалена, например, гидрированием над катализатором, таким как палладий на угле.
Защитные группы могут быть удалены на любой подходящей стадии синтеза с использованием общепринятых методик, хорошо известных в области химии.
В таких случаях, когда соединения формулы (I) являются достаточно основными или кислыми для того, чтобы образовывать устойчивые кислые или основные соли, их удобно вводить в виде соли, и фармацевтически приемлемые соли могут быть получены общепринятыми способами, например такими, которые описаны далее. Примеры подходящих фармацевтически приемлемых солей включают аддитивные соли органических кислот, образованные с использованием таких кислот, которые образуют физиологически приемлемый анион, например тозилат, метансульфонат, ацетат, тартрат, цитрат, сукцинат, бензоат, аскорбат, α -кетоглутарат и α -глицерофосфат. Могут быть также образованы подходящие неорганические соли, такие как сульфат, нитрат и гидрохлорид.
Фармацевтически приемлемые соли могут быть получены с использованием стандартных методов, хорошо известных в данной области, например взаимодействием достаточно основного соединения формулы (I) (или его сложного эфира) с соответствующей кислотой, дающей физиологически приемлемый анион. С применением большинства соединений изобретения можно также получить соль соответствующего щелочного металла (например, натрия, калия или лития) или щелочноземельного металла (например, кальция) обработкой соединения формулы (I) (и в некоторых случаях сложного эфира) одним эквивалентом гидроксида или алкоксида щелочного или щелочноземельного металла (например, этоксида или метоксида) в водной среде, с последующей очисткой общепринятыми методами.
Расщепляемые in vivo сложные эфиры соединений изобретения могут быть получены взаимодействием с фармацевтически приемлемой карбоновой кислотой или ее активированным производным. Такое взаимодействие можно осуществить, например, обработкой соединения формулы (I) соответствующим хлорангидридом (например, ацетилхлоридом, пропионилхлоридом или бензоилхлоридом) или ангидридом кислоты (например, уксусным ангидридом, пропионовым ангидридом или бензойным ангидридом) в присутствии соответствующего основания, такого как триэтиламин. Специалистам в данной области понятно, что для образования расщепляемых сложных эфиров in vivo могут быть использованы также другие подходящие карбоновые кислоты (включая их активированные производные), такие кислоты также включены в объем изобретения. Полезными для применения являются также катализаторы, такие как 4-диметиламинопиридин.
Многие из определенных в данном описании промежуточных соединений являются новыми и предусмотрены как дополнительная отличительная особенность изобретения.
Предметом настоящего изобретения является идентификация соединений, которые повышают активность PDH. Эти свойства могут быть оценены, например, с применением одной или нескольких представленных ниже методик.
(а) Повышение активности PDH in vitro
Данный анализ определяет способность испытуемого соединения повышать активность PDH. Комплементарная ДНК (кДНК), кодирующая PDH киназу, может быть получена цепной реакцией полимеразы (PCR) и последующим клонированием. Получение полипептида с активностью PDH киназы может быть выражено в подходящей системе экспрессии. Так, например, было найдено, что PDH киназа II крысы (kPDNKII), полученная экспрессией рекомбинантного белка Escherichia coli (E.coli), проявляет активность PDH киназы.
В случае kPDHKII (номер в банке генов U10357) из комплементарной ДНК печени крысы посредством PCR был выделен 1,3 kb фрагмент, кодирующий белок, и клонирован в вектор (например, pQE32-Quiagen Ltd.). Рекомбинантная конструкция была трансформирована в E.coli (например, M15 pRep 4-Quigen Ltd.). Были идентифицированы рекомбинантные клоны, выделена плазмида ДНК и подвергнута анализу последовательности аминокислотных остатков. Для экспрессии был выбран один клон, который имел ожидаемую последовательность нуклеиновых кислот. Подробности, касающиеся способов сборки молекул рекомбинантной ДНК и экспрессии рекомбинантных белков в бактериальных системах, можно найти в учебниках, например в Sambrook et al., 1989, Molecular Cloning - A laboratory Manual, 2nd Edidion. Cold Spring Harbour Laboratory Press. Другие применяемые в анализах известные PDH киназы могут быть клонированы и выражены подобным образом.
Для выражения активности kPDHKII клетки штамма E.coli M15 pRep4 трансформировались вектором pQE32, содержащим kPDHKII кДНК. Этот вектор включает метку 6-гистидина на белке в его N-окончании. E.coli выращивали до оптической плотности 0,6 (600 нМ) и экспрессию белка индуцировали добавлением 10 мкМ изопропилтио-β -галактозидазы. Клетки выращивали при 18° С в течение 18 часов и собирали центрифугированием. Повторно суспендированную клеточную пасту лизировали гомогенизацией и в течение 1 часа центрифугированием при 24000× g удаляли нерастворимые вещества. С применением матрицы (Quiagen) нитрилотриуксуснокислотной смолы (Ni-NTA: Quiagen Ltd.), образующей хелатное соединение с Ni, из надосадочной жидкости удаляли меченный 6-гистамином белок и перед элюированием связанного белка, применения буферную смесь, содержащую 20 мМ трис(гидроксиметил)аминометангидрохлорида, 200 мМ имидазола, 0,15 М хлорида натрия, рН 8, промывали смесью, содержащей 20 мМ трис-(гидроксиметил)аминометангидрохлорида, 20 мМ имидазола, 0,5 М хлорида натрия, рН 8. Элюированные фракции, содержащие меченный 6-гистамином белок, собирали и хранили в виде аликвотных проб при температуре -80° С в 10% глицерине.
Для определения концентрации, дающей в условиях анализа примерно 90% ингибирование PDH, каждую новую порцию исходного фермента титровали. В типичной порции исходный фермент разбавляли до концентрации 7,5 мкг/мл.
Для анализа активности новых соединений соединения разбавляли 10% диметилсульфоксидом (ДМСО) и 10 мкл переносили в отдельные лунки 96-луночных планшетов. Контрольные лунки содержали вместо соединения 20 мкл 10% ДМСО. 40 мл буфера, содержащего 50 мМ калий-фосфатного буфера, рН 7,0, 10 мМ этиленгликоль-бис-(β -аминоэтиловый эфир)-N,N,N,N-тетрауксусной кислоты (EGTA), 1 мМ бензамидина, 1 мМ фенилметилсульфонилфторида (PMSF), 0,3 мМ тозил-L-лизинхлорметилкетона (TLCK), 2 мМ дитиотреита (DTT), рекомбинантную kPDHKII и соединения, инкубировали при комнатной температуре в течение 45 минут в присутствии PDH киназы. Для определения максимальной скорости реакции PDH включали второй ряд контрольных лунок, содержащих вместо соединения 10% ДМСО, при этом kPDNKII не использовали. Затем инициировали активность PDH киназы добавлением в общий объем, равный 50 мкл, 5 мкМ АТР, 2 мМ хлорида магния и 0,04 U/мл PDH (PDH сердца свиньи Sigma P7032), и планшеты инкубировали при комнатной температуре в течение еще 45 минут. Затем определяли остаточную активность PDH добавлением в общий объем, равный 80 мл, субстратов (2,5 мМ кофермента А, 2,5 мМ тиаминпирофосфата (кокарбоксилаза), 2,5 мМ пирувата натрия, 6 мМ NAD, и планшеты инкубировали при комнатной температуре в течение 90 минут. Продуцирование восстановленного NAD (NADH) устанавливали измерением оптической плотности при 340 нм, используя спектрофотометр с контрольной панелью. Значения ED50 испытуемого соединения определяли обычным путем, используя результаты, полученные при испытаниях соединений с 12 различными концентрациями.
(b) Повышение активности PDH in vitro в выделенных первичных клетках
В данном анализе определяется способность соединений стимулировать окисление пирувата в первичных гепатоцитах крысы.
Гепатоциты выделяли двухступенчатой методикой биологической переработки коллагеназы, описанной Сегленом (Methods Cell Biol. (1976), 13, 29-33), и высевали в 6-луночные планшеты с культурой (Falcon Primaria), причем в каждой лунке содержалось 600000 жизнеспособных клеток в среде Dulbecco’s Modified Eagles Medium (DMEM, Gibco BRL), содержащей 10% утробной сыворотки теленка (FCS), 10% пенициллин/стрептомицин (Gibco BRL) и 10% незначимых аминокислот (NEAA, Gibco BRL). Через 4 часа инкубации при 37° С в 5% СО2 среду заменяли средой Minimum Essential Medium (MEM, Gibco BRL), содержащей дополнительно к 10 нМ дексаметазона и 10 нМ инсулина, указанные выше NEAA и пенициллин/стрептомицин.
На следующий день клетки промывали фосфатным буферным солевым раствором (PBS) и среду заменяли забуферированным с помощью 1 мл HEPES раствором Кребса (25 мМ HEPES, 0,15 мМ хлорида натрия, 25 мМ бикарбоната натрия, 5 мМ хлорида калия, 2 мМ хлорида кальция, 1 мМ сульфата магния, 1 мМ первичного кислого фосфата калия), содержащим испытуемое соединение при требуемой концентрации в 0,1% ДМСО.
Контрольные лунки содержали только 0,1% ДМСО, максимальную ответную реакцию определяли, используя обработку 10 мкМ известного активного соединения. После предварительной инкубации в течение 40 минут при 37° С в 5% СО2 клетки или пульсировали в течение 12 минут пируватом натрия до конечной концентрации 0,5 мМ пирувата натрия (содержащий 1-14 C пируват натрия (продукт CFA 85 фирмы Amersham) 0,18 Ci/ммоль). Затем среду удаляли и переносили в трубку, которую сразу же герметизировали пробкой с отверстием, содержащим взвешенную центральную ячейку. Находящийся в центральной ячейке абсорбент насыщали 50% фенилэтиламином и при добавлении 0,2 мл 60% (вес./об.) перхлорной кислоты (РСА) в среде выделялся СО2. Выделенный14СО2, уловленный в абсорбенте, определяли сцинтил-ляционным счетчиком для жидких радиоактивных веществ. Значения ED50 испытуемого соединения определяли обычным путем с использованием результатов, полученных при испытаниях соединений с 7 различными концентрациями.
(с) Повышение активности PDH in vivo
Способность соединений повышать активность PDH в соответствующих тканях крыс может быть измерена с применением далее описанного испытания. Обычно увеличение доли PDH в активной нефосфорилированной форме может быть обнаружено в мышцах, сердце, печени и жировой ткани после однократного введения активного соединения. Ожидается, что это может привести к уменьшению в крови глюкозы после повторного введения соединения. Так, например, однократное интраперитонеальное введение DCA дозой 150 мг/кг, известного как соединение, активирующее PDH посредством ингибирования PDH киназы (Whitehouse, Cooper and Randle (1974), Biochem.J., 141, 761-774) увеличивало долю PDH в ее активной форме (Vary et al. (1988), Circ. Shock 24, 3-18), и после повторного введения приводило к значительному уменьшению в крови глюкозы (Evans and Stacpoole (1982), Biochem. Pharmacol. 31, 1295-1300).
Группы крыс (весом в диапазоне 140-180 г) обрабатывали однократной дозой или многократными дозами представляющего интерес соединения в соответствующем носителе пероральным введением через зонд. Контрольную группу крыс обрабатывали только растворителем. Через заданное после конечного введения соединения время животных анестезировали, удаляли ткани и замораживали в жидком азоте. Для определения активности PDH образцы мышцы разрывали под жидким азотом в течение 1/30 секунды перед гомогенизацией в гомогенизаторе Polytron в 4 объемах буфера, содержащего 40 мМ фосфата калия, рН 7,0, 5 мМ EDTA, 2 мM DTT, 1% Triton X-100, 10 мМ пирувата натрия, 10 мкМ фенилметилсульфонилхлорида (PMSF) и 2 мкг/мл каждого из лейпептина, пепстаина А и апротинина. Перед анализом экстракты подвергли центрифугированию. Часть экстракта обрабатывали фосфатазой PDH, полученной из сердца свиней способом, описанным Siess и Wieland (Eur.J.Biochem. (1972), 26, 96), 20 мкл экстракта, 40 мкл фосфатазы (разведение 1:20) в конечном объеме, равном 125 мкл, содержащем 25 мМ хлорида магния, 1 мМ хлорида кальция. Активность необработанного образца сравнивали с активностью полученного таким образом дефосфорилированного экстракта. Активность PDH анализировали методом Stansbie et al. (Biochem. J. (1976), 154, 225). 50 мкл экстракта инкубировали с 0,75 мМ NAD, 0,2 мМ КоА, 1,5 мМ тиаминпирофосфата (ТРР) и 1,5 мМ пирувата натрия в присутствии 20 мкг/мл п-(п-аминофенилазо)бензолсульфокислоты (AABS) и 50 мU/мл ариламинтрансферазы (ААТ) в буфере, содержащем 100 мМ трис-(гидроксиметил)аминометана, 0,5 мМ EDTA, 50 мМ фторида натрия, 5 мМ 2-меркаптоэтанола и 1 мМ хлорида магния, рН 7,8. АТТ получали из печени свиней методом Tabor et al. (J.Biol.Chem. (1953), 204, 127). Скорость образования ацетил КоА определялась скоростью уменьшения AABS, на которую указывало уменьшение оптической плотности при 460 нм.
Образцы печени получали по существу подобным способом, за исключением того, что из буфера исключали пируват натрия добавляли к фосфатазе при инкубировании до конечной концентрации 5 мМ.
Обработка животного активным соединением приводит к повышению активности комплекса PDH в тканях. На это указывает увеличение количества активной PDH (определенного активностью необработанного экстракта в виде процентного содержания от общей активности PDH в этом же экстракте после обработки фосфатазой).
В соответствии с другим аспектом изобретения предусмотрена фармацевтическая композиция, включающая определенное выше соединение формулы (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым эксципиентом или носителем.
В соответствии с дополнительным аспектом изобретения предусмотрена фармацевтическая композиция, включающая определенное выше соединение формулы (I') или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым эксципиентом или носителем.
Препарат может быть в форме, подходящей для перорального введения, например в виде таблеток или капсул, для парентеральной инъекции (включая внутривенную, подкожную, внутримышечную, внутрибрюшинную и вливание), например в виде стерильного раствора, суспензии или эмульсии, для местного нанесения, например в виде мази или крема, или для ректального введения, например в виде суппозиториев. В основном вышеуказанные композиции могут быть получены общепринятым способом с использованием обычных эксципиентов.
Композиции настоящего изобретения преимущественно присутствуют в виде стандартных лекарственных форм.
Соединение обычно следует вводить теплокровным животным в виде стандартной дозы, составляющей 5-5000 мг/м2 поверхности тела животного, т.е. примерно 0,1-100 мг/кг веса тела. Применяется стандартная доза в диапазоне, например, 1-100 мг/кг, предпочтительно 1-50 мг/кг, и такая доза обычно является терапевтически эффективной дозой. Стандартные лекарственные формы, такие как таблетки или капсулы, будут обычно содержать, например, 1-250 мг активного ингредиента.
В соответствии с еще одним аспектом изобретения предусмотрено соединение формулы (I) или его определенная выше фармацевтически приемлемая соль для применения в способе лечения человека или животного лекарственной терапией.
В соответствии с дополнительным аспектом настоящего изобретения предусмотрено соединение формулы (I’) или его определенная выше фармацевтически приемлемая соль для применения в способе лечения человека или животного лекарственной терапией.
Заявитель обнаружил, что соединения настоящего изобретения повышают активность PDH и поэтому представляет интерес своим действием на понижение содержания глюкозы в крови.
Дополнительной отличительной особенностью настоящего изобретения является соединение формулы (I) или его фармацевтически приемлемая соль для применения в качестве лекарственного средства, преимущественно соединение формулы (I) или его фармацевтически приемлемая соль для применения в качестве лекарственного средства, продуцирующего повышение активности PDH у теплокровных животных, например человека.
Еще одной отличительной особенностью настоящего изобретения является соединение формулы (I’) или его фармацевтически приемлемая соль для применения в качестве лекарственного средства, преимущественно соединение формулы (I’) или его фармацевтически приемлемая соль для применения в качестве лекарственного средства, продуцирующего повышение активности PDH у теплокровных животных, например человека.
Поэтому в соответствии с дополнительным аспектом изобретения предусмотрено применение соединения формулы (I) или его фармацевтически приемлемой соли при производстве лекарственного препарата, применяемого для продуцирования повышения активности PDH у теплокровных животных, например человека.
Поэтому в соответствии с еще одним аспектом изобретения предусмотрено применение соединения формулы (I’) или его фармацевтически приемлемой соли при производстве лекарственного препарата, применяемого для продуцирования повышения активности PDH у теплокровных животных, например человека.
В соответствии с еще одной отличительной особенностью изобретения предусмотрен способ продуцирования повышения активности PDH у теплокровных животных, например человека, который, в случае необходимости, включает введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, определенных выше.
Как отмечалось выше, величина дозы, необходимой для терапевтического или профилактического лечения конкретного болезненного состояния, будет неизбежно изменяться в зависимости от подвергаемого лечению хозяина, способа введения лекарственного средства и тяжести подвергаемого лечению заболевания. Предпочтительно применяется суточная доза в диапазоне 1-50 мг/кг массы тела. Однако суточная доза будет неизбежно изменяться в зависимости от подвергаемого лечению хозяина, способа введения лекарственного средства и тяжести подвергаемого лечению заболевания. Соответственно оптимальная доза может быть определена практикующим врачом, лечащим конкретного пациента.
Описанное здесь повышение активности PDH может быть осуществлено за счет применения одиночной терапии или может включать в дополнение к предмету настоящего изобретения применение одного или нескольких других веществ и/или лечений. Такое комбинированное лечение может быть достигнуто способом одновременного, последовательного или раздельного введения отдельных компонентов лечения. Так, например, при лечении сахарного диабета химиотерапия может включать следующие основные виды лечения:
(i) инсулин;
(ii) средства, усиливающие секрецию инсулина, предназначенные для стимуляции такой секреции (например, глибенкламид, толбутамид, другие сульфонилмочевины);
(iii) гипогликемические средства для перорального приема, например метформин, тиазолидиндионы;
(iv) средства, предназначенные для уменьшения поглощения глюкозы из кишечника (например, акарбоза);
(v) средства, предназначенные для лечения осложнений затянувшейся гипергликемии;
(vi) другие средства, применяемые для лечения молочной ацидемии;
(vii) ингибиторы окисления жирных кислот;
(viii) средства, уменьшающие содержание липидов;
(ix) средства, применяемые для лечения ишемической болезни сердца и заболевания периферических сосудов, такие как аспирин, пентоксифиллин, цилостазол, и/или
(х) тиамин.
Как отмечалось выше, определенные в настоящем изобретении соединения представляют интерес вследствие их способности повышать активность PDH. Поэтому такие соединения изобретения могут быть полезными для лечения болезненных состояний, включающих сахарных диабет, заболевание периферических сосудов (включая перемежающуюся хромоту (болезнь Шарко)), сердечную недостаточность и некоторые кардиальные миопатии, ишемию миокарда, церебральную ишемию и реперфурию, мышечную слабость, гиперлипемию, болезнь Альцгеймера и атеросклероз.
Кроме применения в терапевтической медицине, соединения формулы (I) и их фармацевтически приемлемые соли полезны при разработке новых терапевтических средств и являются также полезными в качестве фармакологического инструмента для расширения и стандартизации систем для испытаний in vitro и in vivo, с целью оценки действия средств, повышающих активность PDH у лабораторных животных, таких как кошки, собаки, кролики, обезьяны, крысы и мыши.
Следует иметь в виду, что применяемый в любом месте данного описания термин “простой эфир” относится к диэтиловому эфиру.
Далее изобретение будет проиллюстрировано следующими неограничивающими примерами, в которых, если не указано иначе, то
(i) температуры даны в градусах Цельсия (° С); все операции осуществлялись при комнатной температуре или температуре окружающей среды, т.е. при температуре в диапазоне 18-25° С в атмосфере инертного газа, например, аргона;
(ii) органические растворы сушились над безводным сульфатом магния; выпаривание растворителя осуществляли с использованием роторного испарителя при пониженном давлении (600-4000 Паскалей; 4,5-30 мм рт.ст.) с температурой бани до 60° С;
(iii) хроматография означает флэш-хроматографию на силикагеле; тонкослойную хроматографию (TLC) осуществляли на силикагельных пластинках; силикагельная колонка Меgа Bond Elut означает колонку, содержащую 10 или 20 г диоксида кремния с размером частиц 40 микрон, который содержался в 60 мл шприце и поддерживался пористым диском, полученную от Varian, Harbor City, California, USA, под названием "Меgа Bond Elut SI"; "Меgа Bond Elut" является торговой маркой;
(iv) колонка Chem Elut означает экстракционную гильзу "Hydromatrix" для поглощения водного материала, т.е. полипропиленовую трубку, содержащую специальный сорт подвергнутой термощелочной обработке инертной диатомовой земли высокой чистоты, предварительно забуферированной до рН 4,5 или 9,0, включающую фильтрующий материал, предназначенный для разделения фаз, применяемую в соответствии с рекомендациями производителя, и полученную от Varian Harbor City, California, USA, под названием "Extube, Chem Elut"; "Extube" является зарегистрированной торговой маркой фирмы "International Sorbent Technology Limited",
(v) колонка "ISOLUTE" означает гильзу для ионообменной экстракции, предназначенную для поглощения щелочных или кислотных веществ, т.е. полипропиленовую трубку, содержащую специальный сорт ионообменного сорбента высокой чистоты, имеющего на поверхности рН ~7, включающую фильтрующий материал для разделения фаз, применяемую в соответствии с рекомендациями изготовителя и полученную от Varian, Harbor City, California, USA, под названием "Extube, Chem. Elut, ISOLUTE"; "Extube" является зарегистрированной торговой маркой фирмы "International Sorbent Technology Limited";
(vi) за ходом реакции следили с помощью TLC (тонкослойной хроматографии) и время протекания реакций дано только с целью иллюстрации;
(vii) температуры плавления являются некорректированными и (разл.) означает разложение; представленные температуры плавления являются температурами плавления полученных описанных веществ; в некоторых приготовлениях полиморфизм может быть результатом выделения веществ с различными температурами плавления;
(viii) конечные продукты имели удовлетворительный спектр протонного ядерного магнитного резонанса (ЯМР) и/или удовлетворительные данные масс-спектрального анализа;
(ix) выходы даны только с целью иллюстрации и не являются обязательно такими, которые могут быть получены тщательно проведенным способом, если требовалось большее количество веществ, их получение повторяли;
(х) данные ЯМР представлены в виде дельта-значений для основных диагностических протонов в миллионных долях (ppm, м.д.) относительно тетраметилсилана (TMS) в качестве внутреннего эталона, определенных при 300 МГц с использованием в качестве растворителя пердейтерийдиметилсульфоксида (ДМСО-δ6), если не указано иначе; другие растворители (когда это указано в тексте описания) включают дейтерированный хлороформ CDС13 и дейтерированную уксусную кислоту АсОН-δ4; константы взаимодействия (J) даны в Гц; Аr означает ароматический протон;
(xi) химические символы имеют их общепринятые значения; применяются единицы и символы системы СИ;
(xii) пониженные давления даны в виде абсолютных давлений в Паскалях (Па); повышенные давления даны в виде избыточных давлений в барах;
(xiii) отношения растворителей даны в обьемных единицах (об./об.);
(xiv) масс-спектр (МС) получали с использованием энергии электронов 70 электрон-вольт в способе химической ионизации (CI), в котором использовалась проба, подвергнутая прямой экспозиции; ионизацию осуществляли посредством электронного удара (EI), бомбардировки ускоренными атомами (FAB) или электрораспылением (EPS); даны значения m/z; представлены только ионы, которые показывают материнскую массу, и, если не указано иначе, цитированным значением является (М-Н)-;
(xv) Оксон (Охоn) является торговой маркой фирмы E.I. du Pout de Nemours & Co., Inc., и относится к пероксимоносульфату калия;
(xvi) применяются следующие сокращения:
ЭА - элементный анализ;
ДМФ - N,N-диметилформамид;
ДМА - N,N-диметилацетамид;
ТФУ - трифторуксусная кислота;
ИМП - N-метилпирролидин-2-он;
Исх. - исходное вещество (сырье, способ, пример);
ДХМ - дихлорметан и
ТГФ - тетрагидрофуран;
(xvii) в тексте описания сделаны ссылки на следующие методы ВЭЖХ (HPLC):
Способы а и b
Метод ЖХ/МС (LC/MS)
Модель аппарата HP 1100
Колонка Hichrom RPB 100 А 4,6 мм × 10 см
Длина волны 254 нм
Впрыскивание 10 мкл
Скорость потока 1 мл/минуту
Растворитель А 0,1% муравьиная кислота/вода
Растворитель В 0,1% муравьиная кислота/ацетонитрил
Градиент растворителя для метода а

Градиент растворителя в методе b

Способ с
Колонка Dynamax-60AC18 83-201-C 7,5 мм× 25 см
Скорость потока 1 мл/минуту
Градиент растворителя в методе с

Способ d
Колонка HIRPB 4,5 мм× 10 см
Скорость потока 1 мл/минуту
Градиент растворителя 50-70% МеОН в воде +0,1% ТФУ в течение 10 минут.
(xviii) если в начале названия указана стереохимия (R) или (S) и если не указано иначе, то следует понимать, что указанная стереохимия относится к центру А-В-С* (R2)(R3)(R4), изображенному в формуле (I).
Пример 1
(R)-N-[2-Хлор-4-(2-метилсульфанилфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-[2-хлор-4-(2-фторфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (способ 63) (0,15 г) в NМП (1,5 мл) добавляли метантиолат натрия (49,5 мг) и смесь нагревали при 120° С в течение 18 часов и затем охлаждали. Добавляли насыщенный водный раствор хлорида аммония (15 мл) и смесь экстрагировали этилацетатом (2× 50 мл). Органические экстракты объединяли, промывали рассолом и сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 0,20% этилацетат/гексан, при этом получали названное соединение (0,10 г) в виде твердого вещества. ЯМР (CDCl3): 1,75 (с, 3Н), 2,4 (с, 3Н), 3,6 (широкий с, 1Н), 7,3 (т, 1Н), 7,35 (т, 1Н), 7,55 (м, 1Н), 7,9 (дд, 1Н), 8,05 (д, 1Н), 8, 25 (дд, 1Н), 8,6 (д, 1Н), 9,25 (широкий с, 1Н). МС (ESP-): 452.
Примеры 2-12
Следуя методике примера 1, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 1.
Пример 13
(R)-N-{2-Хлор-4-(2-метилсульфинил)фенилсульфонил)фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-[2-хлор-4-(2-метилсульфанилфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 1) (0,384 г) в ДХМ (40 мл) добавляли м-хлорпероксибензойную кислоту (50%, 0,293 г). Смесь перемешивали при комнатной температуре в течение 6 часов, затем ее промывали насыщенным водным раствором бикарбоната натрия (3× 100 мл), водой (100 мл) и рассолом и сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 50-70% этилацетат/гексан, при этом получали названное соединение (0, 26 г) в виде твердого вещества. Температура плавления 118-120° С. ЯМР (CDCl3): 1,70 (с, 3Н), 3,0 (м, 3Н), 4,85 (широкий с, 1Н), 7,75 (т, 1Н), 7,85 (м, 2Н), 8,0 (м, 1Н), 8,15 (д, 1H), 8,3 (д, 1Н), 8,65 (дд, 1H), 9,40 (широкий с, 1H). MC (ESP-): 468. ЭА: найдено: С 44,3; Н 3,7; N, 2,6%; для C17H15ClF3NO5S2·0,125 C4H8O2·0,3 С4Н10О вычислено: С 44,64; Н 3,81, N 2,78%.
Примеры 14-15
Следуя методике примера 13, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 2.
Пример 16
(R)-N-[2-Хлор-4-(2-мезилфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-[2-хлор-4-(2-метилсульфанилфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3, 3-трифторпропанамида (пример 1) (1,3 г) в ДХМ (100 мл) добавляли м-хлорпероксибензойную кислоту (50%, 2,39 г) и смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли еще одну порцию м-хлорпероксибензойной кислоты (0,82 г) и смесь перемешивали в течение 24 часов, затем ее промывали насыщенным водным раствором бикарбоната натрия (3× 70 мл), водой (50 мл) и рассолом и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали флэш-хроматографией при элюировании смесью 50% этилацетат/гексан, при этом получали названное соединение (0,606 г) виде твердого вещества. Температура плавления 114-116° С. ЯМР (CDCl3): 1,75 (с, 3Н), 3,45 (с, 3Н), 3,65 (широкий с, 1Н), 7,8-7,95 (м, 3Н), 8,10 (д, 1Н), 8,35 (дд, 1Н), 8,55 (дд, 1Н), 8,60 (д, 1Н), 9,30 (широкий с, 1Н). МС (ESP-): 484. ЭА: найдено: С 42,3; Н 3,3; N 2,6%; для С17Н15С1F3NО6S2 вычислено: С 42,02; Н 3,11; N 2,88%.
Примеры 17-53
Следуя методике примера 16, с использованием соответствующих исходных веществ получали соединения, приведенные в табоице 3.
Пример 54
(R)-N-{2-Хлор-4-[2-(2-гидроксиэтиламино)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-[2-хлор-4-(2-фторфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (способ 63) (0,10 г) в NМП (1,5 мл) добавляли этаноламин (0,014 мл), раствор нагревали при 120° С в течение 18 часов и затем охлаждали. Добавляли насыщенный водный раствор хлорида аммония (10 мл) и смесь экстрагировали этилацетатом (2× 20 мл). Органические экстракты объединяли, промывали рассолом и сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 0-50% этилацетат/гексан, при этом получали названное соединение (0,074 г) в виде твердого вещества. Температура плавления: 68-70° С. ЯМР (CDCl3): 1,75 (с, 3Н), 3,3 (кв, 2Н), 3,90 (м, 2Н), 3,95 (широкий с, 1Н), 6,50 (широкий т, 1Н), 6,70 (д, 1Н), 6,80 (м, 1Н), 7,4 (м, 1Н), 7,85 (м, 2Н) 8,00 (д, 1Н), 8,55 (д, 1Н), 9,25 (широкий с, 1Н). МС (ESP-): 465. ЭА: найдено: С 46,6; Н 4,0; N 5,8%; для C18H18ClF3N2O5S вычислено: С 46,31; Н 3,89; N 6,00%.
Примеры 55-85
Следуя методике примера 54, с использованием следующих исходных веществ получали соединения, приведенные в таблице 4.
Пример 86
(R)-N-{2-Хлор-4-[4-(метилсульфинил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-{2-хлор-4-[4-(метилсульфанил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 2) (0,247 г) и d-камфорсульфокислоты (0,012 г) в хлороформе (5 мл) добавляли трет-бутилгидропероксид (0,36 мл 3М раствора в толуоле) и смесь перемешивали при комнатной температуре в течение 64 часов. Реакционную смесь непосредственно переносили в колонку с силикагелем Меgа Bond Elut и элюировали смесью 0-80% этилацетат/гексан, при этом получали названное соединение (0,237 г) в виде пены. ЯМР (CDCl3): 1,74 (с, 3Н), 2,74 (с, 3Н), 4,2 (широкий с, 1Н), 7,79 (д, 2Н), 7,89 (дд, 1Н), 8,0 (м, 1Н), 8,1 (д, 2Н), 8,65 (д, 1Н), 9,38 (широкий с, 1Н). МС (ЕSР-): 468. ЭА: найдено: С 43,3; Н 3,1; N 2,98%. Для C17H15ClF3NO5S2 вычислено: С 43,3; Н 3,1; N 2,8%.
Примеры 87-103
Следуя методике примера 86, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 5.
Пример 104
(R)-N-[4-(4-Ацетамидофенилсульфонил)-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К перемешиваемой суспензии (R)-(+)-2-гидрокси-2-метил-3,3,3-трифторпропановой кислоты (способ 9) (0,077 г) в ДХМ (2,5 мл), содержащей ДМФ (1 каплю), добавляли оксалилхлорид (0,047 мл). Смесь перемешивали при комнатной температуре в течение 2 часов и затем ее добавляли к раствору 4-(4-ацетамидофенилсульфонил)-2-хлоранилина (способ 10) (0,160 г) в ДХМ (2,5 мл) и перемешивали в течение еще 2 часов.
Добавляли простой эфир (50 мл) и смесь промывали водой (2× 50 мл), рассолом и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 0-70% этилацетат/толуол, при этом получали названное соединение (0,025 г) в виде твердого вещества. ЯМР: 1,6 (с, 3Н), 2,05 (с, 3Н), 7,1-7,3 (широкий м, 1Н), 7,8 (д, 2Н), 7,9 (м, 3Н), 7,97-8,05 (широкий с, 2Н), 8,25 (д, 1Н), 10,36 (широкий с, 1Н). МС (ЕSР-): 463. ЭА: найдено: С 47,8; Н 3,6; N 5,4%; для С18Н16С1F3N2О5S2·0,2С7Н8 вычислено: С 48,2; Н 3,7; N 5,8%.
Примеры 105-112
Следуя методике примера 104, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 6.
Пример 114
N-(2-Фтор-4-фенилсульфонилфенил)-2-гидрокси-2-метилпропанамид
К раствору N-(2-фтор-4-фенилсульфанилфенил)-2-гидрокси-2-метилпропанамида (пример 205) (0,34 г) в ледяной уксусной кислоте (1,1 мл) добавляли пероксид водорода (0,45 мл 30 вес.% раствора в воде), смесь перемешивали, нагревали при 100° С в течение 2 часов и затем охлаждали. К полученному осадку добавляли воду (2 мл), собирали твердое, промывали дополнительным количеством воды (2× 5 мл) и сушили в вакууме при 60° С, при этом получали названное соединение (0,347 г) в виде твердого вещества. Температура плавления 155,5-156,5° С. ЯМР: 1,34 (с, 6Н), 6,08 (широкий с, 1Н), 7,56-7,7 (м, 3Н), 7,8 (д, 1Н), 7,9 (д, 1Н), 7,96 (д, 2Н), 8,31 (т, 1Н), 9,5 (с, 1Н). МС (ЕSР-): 336. ЭА: найдено: С 57,1; Н 4,7; N 4,1; S 9,7%; для C16H16FNO4S2 вычислено: С 57,0; Н 4,8; N 4,2; S 9,5%.
Примеры 115-170
Следуя методике примера 114, с использованием соответствующих исходных веществ, экстракции и, если необходимо, последующей хроматографии для выделения и очистки продукта получали соединения, приведенные в таблице 7.
Пример 171
N-[2-Хлор-4-(4-ацетамидофенилсульфонил)фенил]-2-гидрокси-2-метилпропанамид
К перемешиваемому раствору N-[2-хлор-4-(4-ацетамидофенилсульфонил)фенил]-2-ацетокси-2-метилпропанамида (способ 16) (0,230 г) в метаноле (2 мл) добавляли раствор моногидрата гидроксида лития (0,106 г) в воде (1 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли воду (5 мл) и раствор подкисляли 1 М хлористоводородной кислотой до рН 2,3. Добавляли этилацетат (20 мл), органический слой промывали водой (20 мл) и рассолом и затем сушили.
Выпариванием удаляли летучие вещества и беловатое твердое вещество промывали простым эфиром, при этом получали названное соединение (0,150 г) в виде твердого вещества. ЯМР (СDСl3): 1,3 (с, 6Н), 2,2 (с, 3Н), 7,4 (с, 1Н), 7,7 (д, 2Н), 7,8 (м, 3Н), 7,9 (с, 1Н), 8,7 (д, 1Н), 9,6 (с, 1Н). MC (ESP-): 409.
Примеры 172-181
Следуя методике примера 171, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 8.
Пример 182
N-[2-Хлор-4-(4-мезиламинофенилсульфонил)фенил]-2-гидрокси-2-метилпропанамид
К раствору N-[2-хлор-4-(4-мезиламинофенилсульфанил)фенил]-2-гидрокси-2-метилпропанамида (пример 207) (0,22 г) в ДХМ (5 мл) добавляли м-хлорпероксибензойную кислоту (50%, 0,55 г) и смесь перемешивали при комнатной температуре в течение 15 часов. Добавляли ДХМ (10 мл), затем насыщенный водный раствор карбоната натрия (20 мл) и смесь вливали в колонку Varian Chem Elut. Через 3 минуты колонку промывали ДХМ (20 мл) и концентрировали органические фракции. Остаток очищали флэш-хроматографией при элюировании смесью 40-70% этилацетат/гексан, при этом получали названное соединение (0,15 г) в виде пены. ЯМР (СDСl3): 1,8 (с, 6Н), 3,1 (с, 3Н) , 7,3 (м, 3Н), 7,9 (м, 4Н), 9,6 (м, 2Н). МС (ESP-) : 445. ЭА: найдено: С 45,1; Н 4,4; N 6,2%; для C17H19ClN2О6S2·0,3Н2О вычислено: С 45,1; Н 4,4; N 6,2%.
Пример 183
Следуя методике примера 182, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 9.
Пример 184
N-[2-Амино-4-(фенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К перемешиваемой суспензии 10% палладия на угле (0,03 г) в метаноле (2 мл) в атмосфере аргона добавляли суспензию N-[2-нитро-4-(фенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (J.Med.Chem., 1996, 39, 4592) (0,293 г) в метаноле (5 мл). Добавляли раствор формиата аммония (0,176 г) в воде (2 мл), смесь нагревали при температуре кипения с обратным холодильником в течение 2 часов и затем охлаждали. Добавляли этилацетат (20 мл) и смесь фильтровали через диатомовую землю. Фильтр промывали этилацетатом (2× 10 мл) и фильтраты объединяли, промывали водой и рассолом и затем сушили. После выпаривания летучих веществ получали названное соединение (0, 261 г) в виде твердого вещества. ЯМР: 1,55 (с, 3Н), 5,3 (с, 2Н), 7,1 (дд, 1Н), 7,3 (д, 1Н), 7,4 (м, 2Н), 7,5-7,7 (м, 3Н), 7,85 (д, 2Н), 9,6 (с, 1Н). МС (ESP-): 387.
Пример 185
N-[2-Ацетамидо-4-(фенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К охлажденному льдом раствору N-[2-амино-4-(фенилсульфонил) фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 184) (0,097 г) в пиридине (1 мл) добавляли ацетилхлорид (0,018 мл) и в течение 2 часов раствор нагревали до комнатной температуры. Добавляли воду и смесь экстрагировали этилацетатом. Органические экстракты объединяли, промывали рассолом и сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 10-40% этилацетат/гексан, при этом получали названное соединение (0,89 г) в виде твердого вещества. Температура плавления 205-207° С. ЯМР: 1,5 (с, 3Н), 2,1 (с, 3Н), 7,57-7,75 (м, 4Н), 7,8-7,9 (м, 2Н), 7,9-8,05 (м, 3Н), 9,8 (широкий с, 1Н), 10,1 (широкий синглет, 1Н). МС (ESP-): 429.
Пример 186
Следуя методике примера 185, с использованием вместо ацетилхлорида метансульфонилхлорида получали следующее соединение, приведенное в таблице 10.
Пример 187
(R)-N-[2-Хлор-4-(2-фторфенилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К дезоксигенированной смеси (R)-N-(2-хлор-4-иодфенил-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 197) (1,0 г), 2-фтортиофенола (0,263 мл) и метоксида натрия (0,288 г) в этаноле (50 мл) добавляли тетракис(трифенилфосфин)палладий(0) (0,147 г). Затем после откачки газа и наполнения аргоном (3 цикла) смесь дезоксигенизировали и нагревали при температуре кипения с обратным холодильником при перемешивании в атмосфере аргона в течение 18 часов. Смесь обрабатывали еще одной порцией тетракис(трифенилфосфин)палладия(0) (0,147 г), нагревали в течение еще 24 часов, затем охлаждали и фильтровали. Выпариванием удаляли летучие вещества и остаток очищали флэш-хроматографией при элюировании смесью 20% этилацетат/гексан, при этом получали названное соединение (0,906 г) в виде масла. ЯМР (CDCl3): 1,75 (с, 3Н), 3,58 (с, 1Н), 7,1 (т, 2Н), 7,2-7,35 (м, 3Н), 7,37 (д, 1Н), 8,3 (д, 1Н), 8,82 (широкий с, 1Н). МС (ESP-): 392.
Примеры 188-196
Следуя методике примера 187, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 11.
Пример 197
(R)-N-(2-Хлор-4-иодфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К перемешиваемой суспензии (R)-(+)-2-гидрокси-2-метил-3,3,3-трифторпропановой кислоты (способ 9) (1,95 г) в ДХМ (42 мл) и ДМФ (0,8 мл) добавляли по каплям оксалилхлорид (1,07 мл). Смесь перемешивали при комнатной температуре в течение 2 часов, затем в течение 35 минут добавляли к раствору 2-хлор-4-иоданилина (2,5 г) и 2,6-ди-трет-бутилпиридина (2,94 мл) в ДХМ (40 мл) и перемешивали в течение еще 18 часов. Выпариванием удаляли летучие вещества и остаток очищали флэш-хроматографией на силикагеле при элюировании ДХМ, при этом получали названное соединение (2,85 г) в виде твердого вещества. ЯМР: 1,6 (с, 3Н), 7,7 (м, 2Н), 7,8(д, 1Н), 7,9 (широкий с, 1Н). МС (ЕSР-): 392.
Примеры 198-201
Следуя методике примера 197, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 12.
Пример 202
(R)-N-{2-Хлор-4-([5-этоксикарбонил-3-пиридил]сульфанил)фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-(2-хлор-4-(триизопропилсилилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (0,74 г) (способ 28) в безводном ДМА (5 мл) в атмосфере аргона добавляли фторид цезия (0,26 г) и смесь перемешивали в течение 17 часов. Добавляли хлорид меди(I) (0,17 г), затем 3-бром-5-карбоэтоксипиридин (0,37 г), смесь нагревали до 155° С в течение 4 часов и охлаждали до комнатной температуры. Добавляли этилацетат (20 мл) и рассол (20 мл) и смесь фильтровали через подушку диатомовой земли, которую промывали этилацетатом (3× 50 мл). Фильтраты объединяли, промывали рассолом (3× 50 мл) и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали на силикагеле в колонке Меgа Bond Elut при элюировании смесью 10-40% этилацетат/изогексан, при этом получали названное соединение (выход 53%) в виде пены. ЯМР (CDCl3): 1,39 (т, 3Н), 1,57 (с, 3Н), 4,00 (с, 1Н), 4,40 (кв, 2Н), 7,34-7,37 (м, 1Н), 7,46 (д, 1Н), 8,18 (с, 1Н), 8,42 (д, 1Н), 8,62 (с, 1Н), 9,03 (с, 1Н), 9,04 (с, 1Н). МС (ESP-): 447.
Пример 203
По методике примера 202 из соответствующих исходных веществ получали соединение, приведенное в таблице 13.
Пример 204
Следуя методике способа 22 (смотри ниже) и с использованием исходных веществ примера 197 получали соединение, приведенное в таблице 14.
Пример 205
N-(2-Фтор-4-фенилсульфанилфенил)-2-гидрокси-2-метилпропанамид
К раствору 2-фтор-4-фенилсульфаниланилина (способ 7) (0,64 г) и пиридина (0, 28 мл) в ДХМ (10 мл) добавляли 2-ацетокси-2-метилпропаноилхлорид (0,47 мл). Раствор перемешивали при комнатной температуре в течение 90 минут, затем выпариванием удаляли летучие вещества. Остаток растворяли в метаноле (20 мл) и добавляли раствор моногидрата гидроксида лития (0,378 г) в воде (2,5 мл). Перемешивание продолжали в течение еще 1 часа и затем смесь подкисляли 2 М хлористоводородной кислотой до рН 1 и концентрировали выпариванием примерно до 5 мл. Добавляли воду (10 мл) и продукт экстрагировали этилацетатом. Органические слои промывали рассолом, затем объединяли и сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 10-20% этилацетат/гексан, при этом получали названное соединение (0, 784 г) в виде твердого вещества. Температура плавления 91-92,5° С. ЯМР: 1,34 (с, 6Н), 5,96 (с, 1Н), 7,15 (д, 1Н), 7,23 (дд, 1Н), 7,27-7,4 (м, 5Н), 8,02 (т, 1Н), 9,3 (с, 1Н). MC (ESP- ): 304. ЭА: найдено: С 62,8; Н 5,3; N 4,5; S 10,5%; для C16H16FNО2S вычислено: С 62,9; Н 5,3; N 4,6; S 10,5%.
Пример 206
Следуя методике примера 205, с использованием соответствующих исходных веществ получали соединение, приведенное в таблице 15.
Пример 207
N-[2-Хлор-4-(4-мезиламинофенилсульфанил)фенил]-2-гидрокси-2-метилпропанамид
К перемешиваемому раствору N-{2-хлор-4-[4-(N, N-диме-зиламино)фенилсульфанил]фенил}-2-ацетокси-2-метилпропанамида (способ 26) (0,45 г) в метаноле (3,5 мл) добавляли раствор моногидрата гидроксида лития (0,177 г) в воде (1,8 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. Добавляли воду (3 мл) и раствор подкисляли 1 М хлористоводородной кислотой до рН 2-3. Добавляли ДХМ (20 мл) и органический слой промывали водой (20 мл) и рассолом, затем сушили. Выпариванием удаляли летучие вещества и остаток очищали флэш-хроматографией при элюировании смесью 30-70% этилацетат/гексан, при этом получали названное соединение (0,30 г) в виде твердого вещества. Температура плавления 138-140° С. ЯМР (CDCl3): 1,5 (с, 6Н), 3,0 (с, 3Н), 7,1-7,4 (м, 7Н), 8,4 (д, 1H), 9,3 (с, 1Н). МС (ESP- ): 413. ЭА: найдено: С 48,9; Н 4,4; N 6,5%; для C17H19ClN2O4S2 вычислено: С 49,2; Н 4,6 ; N 6,8%.
Примеры 208-209
Следуя методике способа 30 (смотри ниже), с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 16.
Пример 210
(R)-N-(2-Хлор-4-меркаптофенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К (R)-N-(2-хлор-4-метилсульфинилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамиду (пример 92) (0,188 г) добавляли трифторуксусный ангидрид. Смесь перемешивали и нагревали при температуре кипения с обратным холодильником в течение 45 минут, затем охлаждали и выпаривали до получения сухого остатка. К остатку добавляли смесь триэтиламина (5 мл) и метанола (5 мл). Эту смесь перемешивали в течение еще 45 минут и затем выпаривали до получения сухого остатка. Остаток растворяли в хлороформе (50 мл), промывали насыщенным водным раствором хлорида аммония (50 мл), сушили и концентрировали выпариванием, при этом получали названное соединение (0,177 г) в виде смолы, которую применяли без очистки. МС (ESP-): 298.
Пример 211
С использованием способа примера 250 указанные исходные вещества контактировали с соответствующим тиолом или галогенидом и ацилировали с использованием методики примера 197 (см. таблицу 17).
Пример 212
Следуя методике способа 63 (смотри ниже), с использованием соответствующих исходных веществ получали соединение, приведенное в таблице 18.
Примеры 213-214
Следуя методике способа 13 (смотри ниже), с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 19.
Пример 215
(R)-N-{2-Хлор-4-[4-(N,N-диметилкарбамоил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К перемешиваемой суспензии (R)-N-[2-хлор-4-(4-(карбок-сифенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 121) (1,81 г) в ДХМ (100 мл), содержащей ДМФ (10 капель), добавляли оксалилхлорид (0,45 мл). Смесь перемешивали в течение 5 часов, затем добавляли раствор диметиламина (4,2 мл, 2 М раствор в метаноле) и раствор перемешивали в течение ночи. Реакционную смесь промывали разбавленным раствором хлористоводородной кислоты (2× 25 мл) и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 0-10% метанол/ДХМ, при этом получали названное соединение (0,68 г) в виде твердого вещества. Температура плавления 120,5° С (аппаратура Метлера FP 62). ЯМР (CDCl3): 1,70 (с, 3Н), 2,90 (с, 3Н), 3,10 (с, 3Н), 5,20 (с, 1Н), 7,55 (д, 2Н), 7,85 (д, 1Н), 7,90-8,00 (м, 3Н), 8,60 (д, 1Н), 9,40 (с, 1Н). МС (ЕSР-): 477.
Примеры 216-249
Следуя методике примера 215, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 20.
Пример 250
(R)-N-{2-Хлор-4-[4-(пирролидин-1-илсульфонил)фенилсульфанил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К смеси (R)-N-(2-хлор-4-меркаптофенил)-2-гидрокси-2-метил-3,3, 3-трифторпропанамида (пример 210) (0,21 г), N-(4-иодбензолсульфонил)пирролидина (0,258 г) и метоксида натрия (0,042 г) в ДМА (5 мл) добавляли хлорид меди(I) (0,038 г).
Смесь нагревали при 150° С при перемешивании в течение 4 часов, затем охлаждали и выпариванием удаляли ДМА. Добавляли этилацетат (20 мл) и воду (20 мл) и смесь фильтровали. Водный слой экстрагировали этилацетатом (3× 20 мл) и органические слои объединяли и сушили. Выпариванием удаляли летучие вещества и остаток очищали на силикагеле в колонке Меgа Bond Elut при элюировании смесью метанол/0-10% ДХМ, при этом получали названное соединение (0,16 г) в виде твердого вещества. ЯМР (СDСl3): 1,75 (с, 3Н), 1,75-1,85 (м, 4Н), 3,2-3,3 (м, 4Н), 4,0 (с, 1Н), 7,2-7,3 (м, 2Н), 7, 4-7,45 (м, 1Н), 7,6 (с, 1Н), 7,7 (д, 2Н), 8,45 (д, 1Н), 9,15 (с, 1Н). МС (ESP-): 507.
Примеры 251-279
Следуя методике примера 250, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 21.
Пример 280
(R)-N-[2-Хлор-4-(4-карбоксифенилсульфинил)фенил]-2-гидрокси-2-метил-3,3, 3-трифторпропанамид
К смеси (R)-N-[2-хлор-4-[4-карбоксифенилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 291) (1 г) в метаноле (25 мл) добавляли оксон (1,47 г) в виде раствора в 1 М растворе ацетата натрия (12 мл) и смесь перемешивали в течение 2 часов. Реакционную смесь фильтровали, твердое промывали водой и сушили в вакууме, при этом получали названное соединение в виде твердого вещества (1,02 г), содержащего 9% соответствующего сульфона. ЯМР: 1,6 (с, 3Н), 7,75 (д, 1Н), 7,8-7,9 (м, 3Н), 7,95 (д, 1Н), 8,0-8,05 (м, 3Н), 8,15 (д, 1Н), 9,8 (с, 1Н). МС (ЕSР-): 434.
Примеры 281-283
Следуя методике примера 280 (за исключением того, что продукты очищали хроматографией с использованием в качестве элюента смеси этилацетат/гексан), с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 22.
Пример 284
(R)-N-{2-Хлор-4-[4-(2-гидроксиэтилсульфанил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К охлажденной смесью лед/вода суспензии гидрида натрия (0,205 г) в NMH (6 мл) добавляли по каплям 2-меркаптоэтанол (0,358 мл). После прекращения выделения пузырьков газа охлаждающую среду удаляли и продолжали перемешивание в течение еще 15 минут. Добавляли (R)-N-[2-хлор-4-(4-фторфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (способ 69) (1,556 г) и смесь нагревали при 118° С в течение 2 часов, затем ее охлаждали и вливали в насыщенный водный раствор хлорида аммония (60 мл). Смесь экстрагировали этилацетатом (2× 200 мл), органические экстракты промывали рассолом (300 мл) и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией при элюировании смесью 60% этилацетат/гексан, при этом получали названное соединение в виде твердого вещества. ЯМР (СDС13): 1,74 (с, 3Н), 1,91 (т, 1Н), 3,19 (т, 2Н), 3,62 (с, 1Н), 3,82 (кв, 21Н), 7,4 (д, 2Н), 7,8 (д, 2Н), 7,83 (дд, 1Н), 7,97 (д, 1Н), 8,59 (д, 2H), 9,25 (широкий с, 1Н). МС (ESP-): 482. ЭА: найдено: С 44,6; Н 3,6; N 2, 7%; для C18H17ClF3NO5S2 вычислено: С 44,7; Н 3,5; N 2,9%.
Примеры 285-290
Следуя методике примера 284, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 23.
Пример 291
(R)-N-[2-Хлор-4-(4-карбоксифенилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
Смесь 4-меркаптобензойной кислоты (0,308 г), (R)-N-(2-хлор-4-иодфенил)-2-гидрокси-2-метил-3, 3,3-трифторпропанамида (пример 197) (0,786 г) и оксида меди(I) (0,143 г) в ДМФ (5 мл) перемешивали и нагревали при температуре кипения с обратным холодильником в течение 1 часа. Дополнительно добавляли 4-меркаптобензойную кислоту (0,308 г) и продолжали нагревание в течение еще 2 часов. Смесь охлаждали, фильтровали и фильтр промывали ДМФ (5 мл). Фильтраты концентрировали выпариванием и твердый остаток экстрагировали кипящим этилацетатом (2× 60 мл). Экстракты абсорбировали на дезактивированный диоксид кремния (диоксид кремния дезактивировали обработкой 10% воды) и очищали хроматографией при элюировании смесью 5% метанол/этилацетат, при этом получали названное соединение (0,803 г) в виде твердого вещества. ЯМР: 1,63 (с, 3Н), 7,31 (д, 2H), 7,5 (дд, 1Н), 7,68 (д, 1Н), 7, 89 (д, 2H), 8,22 (д, 1Н), 9,8 (широкий с, 1Н). МС (ESP-): 418. ЭА: найдено: С 48,2; Н 3,1; N 3,2%; для C17H13NClF3O4S вычислено: С 48, 6; Н 3,1; N 3,3%.
Примеры 292-293
Следуя методике примера 291, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 24.
Пример 294
(R)-N-{2-Хлор-4-[4-(N-2-гидроксиэтилкарбамоил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
Раствор 1,1’-карбонилдиимидазола (0,169 г) и ® -N-[2-хлор-4-(4-карбоксифенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 121) (0,30 г) в смеси ДМФ (1 мл)/этилацетат (9 мл) нагревали при 50° С в течение 30 минут. Добавляли этаноламин (0,055 мл) и смесь нагревали и перемешивали в течение еще 17 часов. Смесь охлаждали, разбавляли этилацетатом (50 мл), промывали разбавленным водным раствором хлористоводородной кислоты (25 мл), водой (25 мл), насыщенным водным раствором бикарбоната натрия (25 мл) и рассолом и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией при элюировании смесью 2,5% метанол/этилацетат, при этом получали названное соединение (0,25 г) в виде твердого вещества. ЯМР (СDС13+ДМСО-δ6): 1,58 (с, 3Н), 3,44 (м, 2Н), 3,62 (м, 2Н), 4,26 (т, 1Н), 7,05 (с, 1Н), 7,76 (дд, 1Н), 7,83-8,01 (м, 6Н), 8,56 (д, 1Н), 9,73 (широкий с, 1Н). МС (ESP+): 495.
Примеры 295-303
Следуя методике примера 294, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 25.
Пример 304
(R)-N-[2-Хлор-4-(4-анилинокарбонилфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифорпропанамид
К раствору 4-(диметиламино)пиридина (0,25 г), (R)-N-[2-хлор-4-(4-карбоксифенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 121) (0,317 г) и анилина (0,075 мл) в ДХМ (30 мл) добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (0,195 г) и смесь перемешивали в течение 6 дней. Затем выпариванием удаляли растворитель и остаток распределяли между этилацетатом (50 мл) и разбавленным водным раствором хлористоводородной кислоты (25 мл). Водный слой дополнительно экстрагировали этилацетатом (50 мл). Органические экстракты объединяли, промывали рассолом и сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией при элюировании смесью 40% этилацетат/гексан, при этом получали названное соединение (0,179 г) в виде твердого вещества. ЯМР (СDС13+ДМСО-δ6): 1,59 (с, 3Н), 7,03 (т, 1Н), 7,25 (т, 2Н), 7,48 (широкий с, 1Н), 7,64 (д, 2Н), 7,78 (дд, 1Н), 7,92 (м, 3Н), 8,06 (д, 2Н), 8,56 (д, 1Н), 9,72 (с, 1Н), 9,9 (с, 1Н). МС (ESP-): 525.
Примеры 305-306
Следуя методике примера 304, с использованием в качестве исходных веществ соединений примера 125 получали соединения, приведенные в таблице 26.
Пример 307
(R)-N-[2-Хлор-4-(тиен-2-илметилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-[2-хлор-4-(тиен-2-илметилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 418) (0,085 г) в дезоксигенированном ацетонитриле (10 мл) добавляли N-метилморфолин-N-оксид (0,75 г) и молекулярные сита 4
Пример 308
(R)-N-{2-Фтор-4-[4-(N-метилкарбамоилметилсульфанил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К дезоксигенированной смеси меркаптоацетамида (0, 14 мл) и метоксида натрия (0,08 г) в безводном NМП (2 мл) добавляли (R)-N-[2-фтор-4-(4-фторфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифтопропанамид (0,65 г) (способ 71). Реакционную смесь нагревали до 140° С в течение 6 часов, затем охлаждали, после чего ее разбавляли простым эфиром (80 мл), промывали насыщенным водным раствором хлорида аммония (100 мл) и сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 10-60% этилацетат/гексан, при этом получали названное соединение (0,46 г) в виде смолы. ЯМР (СDС13): 1,75 (с, 3Н), 2,8 (д, 3Н), 3,69 (с, 2Н), 7,3 (д, 2Н), 7,69-7,75 (м, 2Н), 7,83 (д, 1Н), 8,8-8,85 (м, 1Н), 9,0 (синглет, 1Н). МС (ЕSР-): 493.
Примеры 309-311
Следуя методике примера 308, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 27.
Пример 312
(R)-N-[2-Хлор-4-(N,N,-диметиламиноэтилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К дезоксигенированному раствору (R)-N-[2-хлор-4-(этилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 283) (0,044 г) в безводном ТГФ (1 мл) добавляли 2 М раствор диметиламина (0,06 мл) в безводном метаноле. Смесь перемешивали при комнатной температуре в атмосфере аргона в течение 2 часов, затем выпариванием удаляли летучие вещества, при этом получали названное соединение (выход 89%) в виде твердого вещества. ЯМР: 1,69 (с, 3Н), 2,65 (с, 6Н), 2,55 (т, 2H), 3,55 (т, 2H), 7,9 (д, 1H), 8,08 (с, 1H), 8,34 (д, 1H). МС (ЕSР-): 403.
Пример 313
(R)-N-[2-Этенил-4-(4-мезилфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К дезоксигенированной суспензии (R)-N-[2-бром-4-(4-мезилфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 140) (0,50 г) и трис(дибензилиденацетон)дипалладия(0) (0,05 г) в безводном толуоле (10 мл) добавляли трибутилвинилолово (0,28 мл). Смесь нагревали при температуре кипения с обратным холодильником при перемешивании. Через 14 часов добавляли еще одну порцию трис(дибензилиденацетон)дипалладия (0) (0,05 г) и трибутилвинилолова (0,28 мл) и нагревание продолжали в течение еще 7 часов. Реакционной смеси довали охладиться и выпариванием удаляли летучие вещества. Остаток очищали на силикагеле в колонке Меgа Bond Elut при элюировании смесью 5-50% этилацетат/гексан, при этом получали названное соединение (0,146 г) в виде твердого вещества. ЯМР (CDCl3): 1,74 (с, 3Н), 3,06 (с, 3Н), 5,65-5,82 (дд, 2Н), 6,67-6,77 (дд, 1Н), 7,86-7,89 (дд, 1Н), 7,95 (с, 1Н), 8,06-8,16 (м, 4Н), 8,35 (д, 1Н), 8,79 (с, 1Н). MC (ESP-): 477.
Пример 314
(R)-N-[2-Хлор-4-(карбоксиметилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К перемешиваемому раствору (R)-N-[2-хлор-4-(метоксикар-бонилметилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 142) (0,36 г) в метаноле (6 мл) добавляли гидроксид натрия (2,5 мл 2 М водного раствора) и смесь перемешивали в течение 1 часа. Добавляли хлористоводородную кислоту (3 мл 2 М водного раствора) и выпариванием удаляли летучие вещества. Добавляли этилацетат (80 мл) и смесь промывали рассолом (50 мл), сушили и выпариванием удаляли летучие вещества. Остаток растворяли в ДХМ (50 мл), промывали насыщенным водным раствором бикарбоната натрия (100 мл). Водный слой обрабатывали хлористоводородной кислотой (25 мл, 10% об./об.), экстрагировали этилацетатом (2× 100 мл) и сушили. Выпариванием удаляли летучие вещества, при этом получали названное соединение (0,28 г) в виде пены. ЯМР: 1,62 (с, 3Н), 4,57 (с, 2Н), 7,9 (д, 2Н), 8,02 (с, 1Н), 8,06 (с, 1Н), 8,32 (д, 1Н), 9,92 (с, 1Н). MC (ESP-): 388.
Пример 315
(R)-N-[2-Хлор-4-(N, N-диметиламинопропилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К перемешиваемому раствору (R)-N-[2-хлор-4-(3-N, N-диметиламинопропилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 404) (0,198 г) в ледяной уксусной кислоте (10 мл) добавляли раствор перманганата калия (0,12 г) в воде (8 мл). Реакционную смесь перемешивали в течение 30 минут, затем добавляли сульфит натрия до тех пор, пока реакционная смесь становилась прозрачной и бесцветной. Добавляли этилацетат (100 мл) и смесь промывали рассолом (2× 50 мл), насыщенным водным раствором бикарбоната натрия (150 мл) и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 0-15% метанол/этилацетат, при этом получали названное соединение (выход 33%) в виде твердого вещества. ЯМР: 1,61 (с, 3Н), 1,61-1,68 (м, 2Н), 2,05 (с, 6Н), 2,23 (т, 2Н), 3,28-3,36 (м, 2Н), 7,89 (д, 1Н), 8,04 (с, 1Н), 8,33 (д, 1Н). МС (ESP-): 415.
Примеры 316-326
Следуя методике примера 315, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 28.
Пример 327
(R)-N-[2-Хлор-4-(этилсульфанил)фенил]-2-гидрокси-2-метил-3,3, 3-трифторпропанамид
К дезоксигенированному раствору (R)-N-(2-хлор-4-иодфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 197) (2,0 г) в хинолине (6 мл) и пиридине (1,5 мл) последовательно добавляли хлорид меди(I) (0,5 г) и этантиолат натрия (0,54 г). Смесь нагревали до 200° С в атмосфере аргона в течение 18 часов, затем ее охлаждали, растворяли в этилацетате (200 мл), промывали разбавленным водным раствором хлористоводородной кислоты (2× 100 мл) и рассолом (2× 50 мл) и после этого сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле при элюировании смесью 10-40% этилацетат/изогексан, при этом получали названное соединение в виде смолы (1,4 г). ЯМР (СDСl3): 1,29 (т, 3Н), 1,57 (с, 3Н), 2,91 (кв, 2Н), 3,69 (с, 1Н), 7,24 (д, 1Н), 7,35 (с, 1Н), 8,24 (д, 1Н), 8,77 (с, 1Н). МС (ЕSР-): 326.
Пример 328
Следуя методике примера 327, с использованием соответствующих исходных веществ получали соединение, приведенное в таблице 29.
Пример 329
(R)-N-{2-Хлор-4-[4-(N-метилкарбамоилметилсульфинил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
Пробу (R)-N-{2-хлор-4-(N-метилкарбамоилметилсульфанил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 288) оставляли на открытом воздухе в течение примерно одной недели, затем очищали хроматографией на силикагеле при элюировании смесью 0-5% метанол/ДХМ, при этом получали названное соединение (выход 10%) в виде твердого вещества. ЯМР (CDCl3): 1,7 (с, 3Н), 2,8 (д, 3Н), 3,4 (д, 1Н), 3,75 (д, 1Н), 3,9 (с, 1Н) 6,6 (м, 1Н) 7,75 (д, 2Н), 7,85 (м, 1Н), 8,00 (дд, 1Н), 8,1 (д, 2Н), 8,65 (д, 1Н), 9,35 (широкий с, 1Н). МС (ESP-): 525.
Пример 330
Посредством метода примера 329 с использованием соответствующих исходных вещества получали соединение, приведенное в таблице 30.
Пример 331
(R)-N-[2-Хлор-4-(3-нитрофенилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
Смесь 3-нитрофенилдисульфида (0,176 г) и (R)-S-(2-хлор-4-иодфенил)-2-гидрокси-2-метил-3,3, 3-трифторпропанамида (пример 197) (0,15 г) в дифениловом эфире (5 мл) нагревали и перемешивали при 250° С в течение 2 дней. Реакционную смесь охлаждали, разбавляли изогексаном (5 мл) и очищали хроматографией при элюировании смесью 10-100% ДХМ/гексан, при этом получали названное соединение (0,05 г) в виде масла. ЯМР (CDCl3): 1,8 (с, 3Н), 3,6 (с, 1Н), 7,4-7,55 (м, 4Н), 8,1 (широкий с, 2Н), 8,45 (д, 1Н), 9,05 (широкий с, 1Н). МС (ESP-): 421 (M+H)+.
Пример 332
(R)-N-[2-Хлор-4-(N-фенилкарбамоил)фенил]-2-гидрокси-2-метил-3,3, 3-трифторпропанамид
Смесь (R)-N-(2-хлор-4-иодфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 197) (0,35 г), анилина (0,117 мл), трибутиламина (0,232 мл) и дихлорбис(трифенилфосфин)палладия(II) (0,009 г) нагревали при 100° С в атмосфере моноксида углерода в течение 4 часов. Добавляли этилацетат (10 мл), смесь промывали водой и рассолом и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 5-50% этилацетат/гексан и затем пропускали через колонку Varian Isolute SCX, при этом получали названное соединение (0,17 г) в виде твердого вещества. ЯМР: 1,6 (с, 3Н), 7,1 (т, 1Н), 7,35 (т, 2Н), 7,75 (д, 2Н), 7,92 (с, 1Н), 7,98 (дд, 1Н), 8,12 (с, 1Н), 8,2 (д, 1Н), 9,8 (с, 1Н), 10,26 (широкий с, 1Н). МС (ESP-): 386.
Примеры 333-334
По методу примера 332 с использованием в качестве исходных веществ соединений примера 197 получали соединения, приведенные в таблице 31.
Пример 335
3-Гидрокси-3-метил-1-(2-фтор-4-фенилсульфонилфенил)бут-1-ин
К раствору 2-метил-3-бутин-2-ола (0,11 мл) и 2-фтор-4-фенилсульфонилбромбензола (способ 1) (0,548 г) в триэтиламине (3 мл) и ДМФ (1 мл) добавляли хлорид бис(трифенилфосфин)палладия(II) (0,034 г) и смесь нагревали при 70° С в течение 18 часов. Смесь вливали в воду (50 мл) и экстрагировали этилацетатом (2× 50 мл). Экстракты промывали рассолом и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 40-100% этилацетат/гексан, затем растирали с гексаном, при этом получали названное соединение (0, 112 г) в виде твердого вещества. ЯМР (СDСl3): 1,6 (с, 6Н), 7,5-7,7 (м, 6Н), 7,9 (д, 2Н). МС (EI): 318 (М+).
Пример 336
(R)-N-{2-Хлор-4-[2-(изопропиламинокарбонил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-[2-хлор-4-(2-карбоксифенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 125) (0,10 г) и 2-пропиламина (0,024 мл) в ДХМ (20 мл) при 0° С добавляли N-метилморфолин (1, 22 мл) и о-бензотриазол-1-ил-N,N,N’,N’-тетраметилуронийгексафторфосфат (0,092 г). Реакционную смесь перемешивали при этой температуре в течение 30 минут, затем нагревали до комнатной температуры, перемешивали в течение еще 3 часов и затем выпаривали до образования сухого остатка. Остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 50% этилацетат/гексан, затем растирали со смесью простой эфир/гексан, при этом получали названное соединение (0,05 г) в виде твердого вещества. ЯМР (CDCl3): 1,3 (д, 6Н), 1,6 (с, 3Н), 4,2-4,32 (м, 1Н), 5,8 (широкий д, 1Н), 7,4 (д, 1Н), 7,5-7,7 (м, 3Н), 7,9 (дд, 1Н), 8,05-8,13 (м, 2Н), 8,6 (д, 1Н), 9,3 (широкий с, 1Н). МС (ESP-): 491.
Примеры 337-349
Исходное вещество анилин ацилировали соответствующим хлорангидридом по методике способа 17 или сульфонилировали соответствующим сульфонилхлоридом по методике способа 26 и затем гидролизовали по методике примера 171. Таким образом получали соединения, приведенные в таблице 32.
Примеры 350-352
Следуя методике способа 10, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 33.
Пример 353
(R)-N-[2-Хлор-4-(4-диметиламиноацетиламинофенилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-{2-хлор-4-[4-(2-хлорацетиламино)фе-нилсульфанил]фенил}-2-ацетокси-2-метил-3,3,3-трифторпропанамида (способ 19) (0,25 г) в ацетоне (1,5 мл) добавляли диметиламин (0,17 мл 40% раствора в воде). Через 24 часа выпариванием удаляли летучие вещества, остаток растворяли в этилацетате, промывали водой и органической слой вливали в колонку Varian Chem Elut. После элюирования этилацетатом получали названное соединение (0,25 г) в виде пены. ЯМР: 1,6 (с, 3Н), 3,1 (с, 2Н), 3,3 (с, 6Н), 7,2 (д, 1Н), 7,3 (с, 1Н), 7,4 (д, 2Н), 7,7 (м, 3Н), 7,9 (д, 1Н), 9,7 (с, 1Н), 9,9 (с, 1Н). МС (ESP-): 474.
Пример 354
(R)-N-{2-Хлор-4-[4-(3-этилуреидо)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
(R)-2,3,4, 5-Н4-3-{2-Хлор-4-[4-(3-этилуреидо)фенилсульфанил]фенил}-2,4-диоксо-5-метил-5-трифторметилоксазол (способ 42) окисляли по методике способа 63, затем гидролизовали способом примера 171, при этом получали названное соединение. ЯМР: 1,0 (с, 3Н), 1,6 (с, 3Н), 3,1 (с, 2Н), 6,2 (с, 1Н), 7,6 (д, 2Н), 7,9 (м, 5Н), 8,2 (д, 1Н), 9,0 (с, 1Н), 9,8 (с, 1Н). МС (ESP-): 492.
Пример 355
По методике примера 354 с использованием соответствующих исходных веществ получали соединение, приведенное в таблице 34.
Примеры 356-380
Исходное вещество анилин ацилировали соответствующим хлорангидридом по методике способа 17 или сульфонилировали соответствующим сульфонилхлоридом по методике способа 26. Таким образом получали соединения, приведенные в таблице 35.
Пример 381
(R)-N-[2-Хлор-4-(3-фенилуреидо)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
Смесь (R)-N-[2-хлор-4-аминофенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 208) (0,198 г) и фенилизоцианата (0,09 мл) в диэтиловом эфире (10 мл) перемешивали в течение 22 часов и затем выпаривали до образования сухого остатка. Остаток распределяли между водой (25 мл) и этилацетатом (50 мл). Органическую фазу промывали рассолом (25 мл), сушили и концентрировали выпариванием, при этом получали названное соединение (170 мг) в виде пены. ЯМР: 1,66 (с, 3Н), 7,04 (т, 1Н), 7,35 (м, 3Н), 7,52 (д, 1Н), 7,71 (с, 1Н), 7,86 (м, 2Н), 8,77 (с, 1Н), 8,92 (с, 1Н), 9,63 (с, 1Н). МС (ESP-): 400.
Пример 382
(R)-N-{2-Хлор-4-[N-(4-метилфенилсульфонил)(N-метил)амино]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
Смесь (R)-N-[2-хлор-4-(4-метилфенилсульфонамидо)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 356) (0,137 г), безводного карбоната калия (0,043 г) и иодметана (0,038 мл) в ацетоне (8 мл) перемешивали в течение 64 часов. Выпариванием удаляли летучие вещества и остаток растворяли в этилацетате, промывали водой и рассолом и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали элюированием в колонке Varian Isolute, содержащей 10 г диоксида кремния, используя в качестве элюента смесь 30% этилацетат/гексан, при этом получали названное соединение (0,079 г). ЯМР: 1,60 (с, 3Н), 2,38 (с, 3Н), 3,11 (с, 3Н), 7,11 (д, 3Н), 7,32 (с, 1Н), 7,43 (м, 4Н), 7,94 (д, 1Н), 9,67 (широкий с, 1Н). МС (ESP-): 449.
Примеры 383-387
По методике примера 382 с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 36.
Примеры 388-389
Следуя методике способа 30 (смотри ниже), с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 37.
Пример 390
(R)-N-[2-Хлор-4-(3-метилсульфанилпропиламино)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору 3-метилсульфанилпропионового альдегида (0,1 мл) и (R)-N-(2-хлор-4-аминофенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 208) (0,282 г) в 1,2-дихлорэтане (6 мл) добавляли триацетоксиборогидрид натрия (0,297 г). Смесь перемешивали в течение 16 часов. Добавляли насыщенный водный раствор бикарбоната натрия (25 мл) и смесь экстрагировали этилацетатом (40 мл). Экстракты промывали рассолом (15 мл) и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией в силикагельной колонке Varian Isolute с использованием в качестве элюента смеси 25% этилацетат/гексан. Полученное твердое растирали в порошок с простым эфиром, при этом получали названное соединение (0,089 г) в виде твердого вещества. ЯМР: 1,54 (с, 3Н), 1,78 (м, 2Н), 2,05 (с, 3Н), 2,55 (кв, 2H), 3,09 (кв, 2H), 5,93 (т, 1Н), 6,54 (дд, 1Н), 6,65 (с, 1Н), 7,46 (м, 2H), 9,33 (с, 1Н). МС (ESP-): 369.
Примеры 391-393
По методике примера 390 с использованием соответствующих исходных веществ и примера 208 получали соединения, приведенные в таблице 38.
Пример 394
(R)-N-[2-Хлор-4-(фенилсульфонил)фенил]-2-аминопропанамид
К раствору (R)-N-[2-хлор-4-(фенилсульфонил)фенил}-2-(трет-бутоксикарбониламино)пропанамида (способ 2) (0,090 г) в сухом ДХМ (5 мл) добавляли по каплям ТФУ (0,5 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Выпариванием удаляли летучие вещества. Образованный остаток повторно растворяли в ДХМ (10 мл) и выпариванием удаляли летучие вещества. Эту процедуру повторяли, образовавшийся остаток сушили в течение 30 минут на линии высокого вакуума. Затем остаток растворяли в ДХМ и пропускали через колонку Varian Isolute SPE, содержащую щелочные остатки, с использованием в качестве элюента ДХМ получали названное соединение (0,067 г) в виде смолы. ЯМР (СDСl3): 1,32-1,40 (д, 3Н), 1,52 (широкий с, 2Н), 3,51-3,64 (кв, 1Н), 7,40-7,55 (м, 3Н), 7,71-7,80 (м, 1Н), 7,81-7,95 (м, 3Н), 8,58-8,65 (м, 1Н), 10,46 (широкий с, 1Н). МС (ESP+): 339,3 (M+H)+.
Примеры 395-396
По методике примера 394 с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 39.
Пример 397
(R)-N-[2-Хлор-4-(4-{3-гидроксипропокси}фенилсульфинил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-[2-хлор-4-(4-гидроксифенилсульфинил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 89) (0,5 г) в ДМФ (5 мл) при 0° С добавляли гидрид натрия (0,06 г 60% дисперсии в масле). Смесь перемешивали в течение 15 минут, затем в виде раствора в ДМФ (3 мл) добавляли 3-бромпропанол (0,12 мл). Смесь перемешивали при комнатной температуре в течение 16 часов. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на сигикагеле в колонке Меgа Bond Elut при элюировании смесью 0-10% метанол/ ДХМ, при этом получали названное соединение (0,34 г) в виде смолы. ЯМР (CDCl3): 1,25 (дд, 2Н), 1,7 (с, 3Н), 1,8 (с, 1Н), 3,8-3,9 (м, 2Н), 4,1-4,2 (м, 2Н), 5,1 (с, 1Н), 6,95 (д, 2Н), 7,4 (д, 1Н), 7,5 (д, 2Н), 7,6-7,65 (м, 1Н), 8,45-8,55 (м, 1Н), 9,3 (с, 1Н). MC (ESP-): 464.
Примеры 398-400
Посредством методики примера 397 и с использованием в качестве исходных веществ соединений примера 89 получали соединения, приведенные в таблице 40.
Пример 401
По методике способа 26 (смотри ниже) и с использованием в качестве исходных веществ соединений примера 396 получали соединение, приведенное в таблице 41.
Пример 402
(R)-N-[2-Хлор-4-(N,N-диметилкарбамоилметилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К (R)-N-[2-хлор-4-(триизопропилсилилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамиду (способ 28) (0,50 г) в безводном ТГФ (5 мл) при -70° С добавляли тетрабутиламмонийфторид (1,1 мл 1 М раствора в ТГФ). Через 15 минут добавляли 2-хлордиметилацетамид (0,17 мл), смесь нагревали и затем перемешивали при комнатной температуре в течение 45 минут. Добавляли этилацетат (80 мл) и смесь промывали рассолом (100 мл), затем сушили и выпариванием удаляли летучие вещества. Остаток очищали на силикагеле в колонке Меgа Bond Elut при элюировании смесью 10-50% этилацетат/гексан, при этом получали названное соединение (0,30 г) в виде твердого вещества. ЯМР (СDСl3): 1,72 (с, 3Н), 2,97 (с, 3Н), 3,08 (с, 3Н), 3,71 (с, 2Н), 4,76 (с, 1Н), 7,32-7,36 (м, 1Н) 7,53 (д, 1Н), 8,32 (д, 1Н), 9,05 (с, 1Н). МС (ЕSР-): 383.
Примеры 403-412
Следуя методике примера 402, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 42.
Пример 413
(R)-N-[2-Фтор-4-(4-метилсульфанилфенилсульфанил)фенил]-2-гидрокси-2-трифторметил-3,3,3-трифторпропанамид
К перемешиваемому раствору R-[2-фтор-4-(4-метилсульфа-нилфенилсульфанил)фенил]-2-(трет-бутилдиметилсилилкоси)-2-трифторметил-3,3,3-трифторпропанамида (0,278 г) (способ 55) в безводном ТГФ (5 мл) при -78° С в атмосфере аргона добавляли тетра-н-бутиламмонийфторид (0,48 мл 1 М раствора в ТГФ). Через 30 минут добавляли этилацетат (50 мл), смесь промывали водным раствором хлористоводородной кислоты (2 М, 30 мл) и рассолом (30 мл) и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали на силикагеле в колонке Меgа Bond Elut при элюировании смесью 10-30% этилацетат/изогексан, при этом получали названное соединение (0,199 г) в виде бледно-желтого твердого вещества. ЯМР (CDCl3): 2,50 (с, 3Н), 5,12 (с, 1Н), 6,98 (д, 1Н), 7,05 (д, 1Н), 7,23 (д, 2Н), 7,35 (д, 2Н), 8,05-8,08 (м, 1Н). MC (ESP-): 458.
Пример 414
(R)-N-{2-Хлор-4-(2-пропенилсульфонил)фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-{2-хлор-4-(2-пропенилсульфанил)фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 407) (0,389 г) в метаноле (15 мл) добавляли раствор оксона (1,44 г) в воде (15 мл). Смесь перемешивали в течение 1,5 часов. Добавляли воду (50 мл) и смесь экстрагировали в этилацетат (100 мл) и сушили. Выпариванием удаляли летучие вещества и остаток очищали на силикагеле в колонке Меgа Bond Elut при элюировании смесью 20-30% этилацетат/изогексан, при этом получали названное соединение (0,180 г) в виде пены. ЯМР: 1,61 (с, 3Н), 4,18 (д, 2Н), 5,18-5,32 (м, 2Н), 5,61-5,75 (м, 1Н), 7,82-7,85 (м, 1Н), 7,98 (с, 1Н), 8,01 (с, 1Н), 8,33 (д, 1Н), 9,91 (с, 1Н). МС (ЕSР-): 370.
Пример 415
(R)-N-[2-Хлор-4-(2-гидроксиэтилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К дезоксигенированному раствору 2-меркаптоэтанола (0,18 мл), метоксида натрия (0,14 г) и хлорида меди(I) (0,2 г) в хинолине (2 мл) и пиридине (2 мл) добавляли раствор (R)-N-[2-хлор-4-иодфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 197) (0,8 г) в пиридине (1 мл). Смесь нагревали до 190° С в атмосфере аргона в течение 18 часов. Смеси давали охладиться до комнатной температуры, затем ее растворяли в этилацетате (100 мл), промывали разбавленным водным раствором хлористоводородной кислоты (2× 50 мл) и рассолом (2× 50 мл) и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 10-60% этилацетат/изогексан, при этом получали названное соединение в виде смолы. ЯМР (СDСl3): 1,76 (с, 3Н), 3,10 (т, 2Н), 3,75-3,80 (м, 2Н), 7,31-7,34 (м, 1Н), 7,47 (с, 1Н), 8,31 (д, 1Н), 8,86 (с, 1Н). МС (ЕSР-): 342.
Примеры 416-427
Следуя методике примера 415, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 43.
Пример 428
® -N-(2-Хлор-4-{(4-ацетамидофенилокси)сульфонил}фенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К перемешиваемому раствору 4-ацетамидофенола (151 мг, 1,00 ммоль), диметиламинопиридина (10 мг, 0,08 ммоль) и пиридина (0,45 мл, 2,0 ммоль) в ДХМ (25 мл) добавляли раствор ® -N-{2-хлор-4-[4-хлорсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамида (способ 73) (366 мг, 1,00 ммоль) в ДХМ (25 мл). Полученную смесь перемешивали при комнатной температуре в течение ночи и выпаривали до образования сухого остатка, который затем обрабатывали 1 М водным раствором хлористоводородной кислоты (25 мл). Водный раствор экстрагировали этилацетатом, этилацетатные экстракты промывали насыщенным водным раствором бикарбоната натрия, рассолом, сушили и выпаривали, при этом получали названное соединение в виде пены (450 мг, 0,94 ммоль). ЯМР 1,6 (с, 3Н), 2,0 (с, 3Н), 7,00 (д, 2Н), 7,55 (д, 2Н), 7,8 (дд, 1Н), 8,0 (д, 1Н), 8,1 (с, 1Н), 8,4 (д, 1Н), 9,9 (с, 1Н), 10,03 (с, 1Н). МС: м/z 479.
Получение исходных веществ
Исходные вещества для вышеприведенных примеров являются или коммерчески доступными, или могут быть легко получены стандартными способами из известных веществ. Следующие реакции получения некоторых из исходных веществ, использованных в реакциях вышеприведенных примеров, представлены лишь с целью иллюстрации, а не с целью какого-либо ограничения.
Способы 1-2
Следуя методике способа 63 (смотри ниже), с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 44.
Способы 3-8
Следуя методике примера 187, с использованием соответствующих исходных веществ (ИСХ.1 и ИСХ.2) получали соединения, приведенные в таблице 45.
Способ 9
(R)-(+)-2-Гидрокси-2-метил-3,3, 3-трифторпропановая кислота
Названное соединение разделяли в соответствии со способом разделения, описанным в заявке на Европейский патент ЕР 524781 (где описывается получение (S)-(-)кислоты), за исключением того, что вместо (1R, 2S)-норфедрина или (S)-(-)-1-фенилэтиламина использовали (1S, 2R)-норфедрин. Анализ кислоты методом ЯМР в присутствии (R)-(+)-1-фенилэтиламина обеспечил энантиомерную чистоту >98%. ЯМР (CDCl3): 1,27 (с, 3Н) для (R)-энантиомера и 1,21 (с, 3Н) для (S)-энантиомера.
Способ 10
4-(4-Ацетамидофенилсульфонил)-2-хлоранилин
К перемешиваемой смеси 4-(4-ацетамидофенилсульфонил)-2-хлорнитробензола (способ 13) (0,67 г), воды (2 мл), концентрированной хлористоводородной кислоты (0,5 мл) и этанола (10 мл) добавляли порошообразное железо (2,5 г). Смесь нагревали при температуре кипения с обратным холодильником в течение 1 часа, затем ее выпаривали до образования почти сухого остатка и распределяли между этилацетатом и водой. Отделяли органический слой и водный слой экстрагировали этилацетатом (3× 15 мл). Органические экстракты объединяли и сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 0-2% метанол/ДХМ, при этом получали названное соединение (0, 18 г) в виде твердого вещества. ЯМР: 2,05 (с, 3Н), 6,4 (с, 2Н), 6,8 (д, 1Н), 7,5 (д, 1Н), 7,6 (д, 1Н), 7,8 (кв, 4Н), 10,3 (широкий с, 1Н). МС (ЕSР-): 323.
Способы 11-12
Следуя методике способа 10, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 46.
Способ 13
4-(4-Ацетамидофенилсульфонил)-2-хлорнитробензол
К раствору 4-(4-ацетамидофенилсульфанил)-2-хлорнитробензола (способ 14) (0,78 г) в ледяной уксусной кислоте (5 мл) добавляли пероксид водорода (0,9 мл 30 вес.% раствора в воде) и смесь перемешивали и нагревали при 95° С в течение 75 минут, затем ее вливали в воду (15 мл) и экстрагировали этилацетатом (3× 10 мл). Органические экстракты объединяли, промывали рассолом и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией в колонке Меgа Bond Elut при элюировании смесью 0-50% этилацетат/гексан, при этом получали названное соединение (0,68 г). ЯМР: 2,05 (с, 3Н), 7,8 (д, 2Н), 7,98 (д, 2Н), 8,2-8,3 (м, 2Н), 8,3-8,45 (м, 1Н), 10,04 (широкий с, 1Н). МС (EPS-): 353.
Способ 14
4-(4-Ацетамидофенилсульфанил)-2-хлорнитробензол
Раствор 2-амино-4-(4-ацетамидофенилсульфанил)нитробензола (способ 15) (2,4 г) в теплой ледяной уксусной кислоте (15 мл) вливали на лед (24 мл). Добавляли концентрированную хлористоводородную кислоту (4,5 мл), смесь перемешивали и охлаждали до температуры <5° С. В течение 7 минут добавляли раствор нитрита натрия (0,601 г) в воде (5 мл) и смесь перемешивали в течение 2 часов при температуре 0-5° С. Затем добавляли водный раствор сульфаминовой кислоты (10 вес./об.%). В отдельной колбе к раствору хлорида меди(I) (0,852 г) в воде (1,2 мл) и концентрированной хлористоводородной кислоте (1,3 мл) добавляли толуол и смесь охлаждали до <0° С. Затем к холодной смеси хлорида меди(I) в течение 5 минут добавляли диазониевую соль и полученную смесь перемешивали при комнатной температуре в течение 18 часов. Отделяли органический слой и водный слой экстрагировали толуолом (3× 10 мл). Органические экстракты объединяли, промывали водой и рассолом и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 0-15% этилацетат/гексан, при этом получали названное соединение (0,789 г). ЯМР: 2,1 (с, 3Н), 7,1 (дд, 1Н), 7,3 (д, 1Н), 7,5 (д, 2Н), 7,7 (д, 2Н), 7,95 (д, 1Н), 10,2 (широкий с, 1Н).
Способ 15
2-Амино-4-(4-ацетамидофенилсульфанил)нитробензол
К этанолу (20 мл) добавляли натрий (0,269 г), полученный раствор охлаждали до комнатной температуры и затем добавляли 4-ацетамидотиофенол (1,94 г). Смесь перемешивали в течение 5 минут и затем добавляли 5-хлор-2-нитроанилин (2 г). Затем смесь нагревали при температуре кипения с обратным холодильником в течение 3 часов и охлаждали. Полученное твердое собирали фильтрацией, промывали этанолом и сушили, при этом получали названное соединение (2,46 г) в виде твердого вещества. ЯМР: 2,05 (с, 3Н), 6,3 (дд, 1Н), 6,6 (с, 1Н), 7,4 (широкий с, 2Н), 7,5 (д, 2Н), 7,7 (д, 2Н), 7,9 (д, 2Н). МС (ESP+): 304 (М+Н)+.
Способ 16
N-[2-Хлор-4-(4-ацетамидофенилсульфонил)фенил]-2-ацетокси-2-метилпропанамид
К раствору N-[2-хлор-4-(4-ацетамидофенилсульфанил)фенил]-2-ацетокси-2-метилпропанамида (способ 17) (0,30 г) в ДХМ (10 мл) добавляли м-хлорпероксибензойную кислоту (50%, 0,735 г) и смесь перемешивали при комнатной температуре в течение 15 часов. Добавляли этилацетат (20 мл), раствор промывали насыщенным водным раствором карбоната натрия (10 мл) и рассолом и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали флэш-хроматографией при элюировании смесью 50-80% этилацетат/гексан, при этом получали названное соединение (0,29 г) в виде твердого вещества. ЯМР (СDСl3): 1,7 (с, 6Н), 2,2 (2х с, 2х3Н), 7,5 (с, 1Н), 7,7 (д, 2Н), 7,8 (м, 3Н), 8,0 (м, 1Н), 8,6 (м, 2Н). МС (ESP-): 451. ЭА: найдено: С 52,9; Н 4,4; N 6,1%; для С20Н21ClN2 О6S вычислено: С 53,0; Н 4,6 ; N 6,2%.
Способ 17
N-[2-Хлор-4-(4-ацетамидофенидсульфанил)фенил]-2-ацетокси-2-метилпропанамид
N-[2-Хлор-4-(4-аминофенилсульфанил)фенил]-2-ацетокси-2-метилпропанамид (способ 22) (0,50 г) растворяли в ДХМ (10 мл) и охлаждали на бане со льдом до 0-5° С. Добавляли триэтиламин (0,46 мл) и затем по каплям ацетилхлорид (0,1 мл) и смеси давали нагреться до комнатной температуры в течение 2 часов. Добавляли этилацетат (20 мл), раствор промывали водой (2× 10 мл) и рассолом и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали флэш-хроматографией при элюировании смесью 40-80% этилацетат/гексан, при этом получали названное соединение (0,470 г) в виде твердого вещества. ЯМР (CDCl3): 1,8 (с, 6Н), 2,2 (д, 6Н), 7,2-7,3 (м, 5Н), 7,5 (д, 2Н), 8,3 (д, 1Н), 8,4 (с, 1Н). MC (ESP-): 419. ЭА: найдено: С 56,7; Н 5,0; N 6,0%; для C20 H21ClN2O4S· 0,4 EtOAс вычислено: С 56,9; Н 5,3; N 6,1%.
Способы 18-21
Следуя методике способа 17, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 47.
Способ 22
N-[2-Хлор-4-(4-аминофенилсульфанил)фенил]-2-ацетокси-2-метилпропанамид
К смеси N-[2-хлор-4-иодфенил]-2-ацетокси-3-метилпропанамида (способ 23) (8,3 г), 4-аминотиофенола (1,07 мл) и карбоната калия (9,1 г) в ДМФ (100 мл) добавляли хлорид меди(I) (0,90 г). Смесь нагревали при 135° С при перемешивании в атмосфере аргона в течение 3 часов, охлаждали и затем ее фильтровали через диатомовую землю. Фильтр промывали этилацетатом (3× 20 мл) и фильтраты объединяли, промывали водой (50 мл), рассолом и затем сушили. Выпариванием удаляли летучие вещества. Неочищенный продукт очищали флэш-хроматографией при элюировании смесью 20-40% этилацетат/гексан, при этом получали названное соединение (4,99 г) в виде твердого вещества. Температура плавления 130-132° С. ЯМР (CDCl3): 1,7 (с, 6Н), 2,1 (с, 3Н), 3,8 (с, 2Н), 6,6 (д, 2Н), 7,1 (м, 2Н), 7,2 (м, 2Н), 8,2 (д, 1Н), 8,4 (с, 1Н). МС (ESP-): 377.
Способ 23
N-[2-Хлор-4-иодфенил]-2-ацетокси-3-метилпропанамид
2-Хлор-4-иоданилин (5 г) растворяли в ДХМ (100 мл) и охлаждали на бане со льдом до 0-5° С. Добавляли пиридин (2,1 мл), затем по каплям 2-ацетокси-2-метилпропаноилхлорид (3,44 мл) и смеси давали нагреться до комнатной температуры в течение 15 часов. Выпариванием удаляли летучие вещества и остаток очищали флэш-хроматографией при элюировании смесью 10-50% этилацетат/гексан, при этом получали названное соединение (7,5 г) в виде твердого вещества. Температура плавления 156-158° С. ЯМР (CDCl3): 1,7 (с, 6Н), 2,2 (с, 3Н), 7,6 (д, 1Н), 7,7 (д, 1Н), 8,2 (д, 1Н), 8,4 (с, 1Н). МС (ESP-): 380.
Способ 24
Следуя методике способа 23, с использованием соответствующих исходных веществ получали соединение, приведенное в таблице 48.
Способ 25
Следуя методике способов 23, 22, 17 и 16, с использованием соответствующих исходных веществ получали соединение, приведенное в таблице 49.
Способ 26
N-[2-Хлор-4-{4-(N,N-димезиламино)фенилсульфанил}фенил]-2-ацетокси-2-метилпропанамид
N-[2-Хлор-4-(4-аминофенилсульфанил)фенил]-2-ацетокси-2-метилпропанамид (способ 22) (0,50 г) растворяли в ДХМ (10 мл) и охлаждали на бане со льдом до 0-5° С. Добавляли триэтиламин (0,55 мл), затем по каплям метилсульфонилхлорид (0,11 мл) и смесь нагревали до комнатной температуры в течение 2 часов. Раствор концентрировали, затем твердое вещество растворяли в ДХМ (5 мл) и добавляли воду (5 мл). Раствор загружали в колонку Varian Chem Ehut и через 3 минуты промывали ДХМ (20 мл). Затем слой ДХМ концентрировали, твердое вещество промывали простым эфиром и фильтровали, при этом получали названное соединение (0,58 г) в виде твердого вещества. ЯМР (CDCl3): 1,7 (с, 6Н), 2,2 (с, 3Н), 3,4 (с, 6Н), 7,2 (с, 4Н), 7,4 (д, 1Н), 7,5 (д, 1Н), 8,4 (д, 1Н), 8,5 (д, 1Н). МС (ESP-): 533. ЭА: найдено: С 44,4; Н 4,5; N 5,1%; для С20Н23 СlN2O7S3 вычислено: С 44,9; Н 4,3; N 5,2%.
Способ 27
2-Бром-4-(4-метилфсульфанилфенилсульфанил)нитробензол
К суспензии бромида меди(II) (4,4 г) в ацетонитриле (85 мл) при 0° С добавляли трет-бутилнитрит (3,1 мл). В течение 5 минут порциями добавляли 2-амино-4-(4-метилсульфанилфенилсульфанил)нитробензол (5,09 г) (полученный способом, описанным в J.Med.Chem., 1975, 18, 1164, для получения 2-нитро-5-фенилсульфаниланилина, но вместо тиофенола использовали 4-метилсульфанилтиофенол) и смесь перемешивали в течение еще 2 часов при 0° С, нагревали до комнатной температуры и перемешивали в течение еще 16 часов. Выпариванием удаляли летучие вещества и остаток очищали флэш-хроматографией на силикагеле при элюировании смесью 10-30% этилацетат/гексан, при этом получали названное соединение (4,5 г) в виде твердого вещества. ЯМР (СDСl3): 2,52 (с, 3Н), 7,03-7,08 (м, 1Н), 7,3 (д, 2Н), 7,36-7,38 (м, 1Н), 7,44 (д, 2Н), 7,77 (д, 1Н).
Способ 28
(R)-N-[2-Хлор-4-(триизопропилсилилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К перемешиваемой суспензии гидрида натрия (60% дисперсия минерального масла, 0,53 г) в безводном ТГФ (40 мл), охлажденной в атмосфере аргона до 0° С, добавляли триизопропилсилантиол (2,8 мл). Через 15 минут при этой температуре добавляли тетракис(трифенилфосфин)палладий(0) (1/21 г), этот раствор добавляли к (R)-N-(2-хлор-4-иодфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамиду (пример 197) (5,2 г) в безводном толуоле (40 мл) и полученную смесь нагревали в течение 2 часов до 85° С. Смеси давали охладиться до комнатной температуры, добавляли этилацетат (200 мл) и смесь промывали рассолом (100 мл) и сушили. Выпариванием удаляли летучие вещества и остаток очищали флэш-хроматографией на силикагеле при элюировании смесью 1-20% этилацетат/гексан, при этом получали названное соединение (6,51 г) в виде смолы. ЯМР (CDCl3): 1,07-1,1 (д, 18Н), 1,20-1,28 (м, 3Н), 1,74 (с, 3Н), 3,64 (с, 1Н), 7,39-7,42 (м, 1Н), 7,53 (с, 1Н), 8,23 (д, 1Н), 8,81 (с, 1Н). МС (ESP-): 454.
Способ 29
2-Хлор-4-бензилнитробензол
К раствору 3-хлор-4-нитробензофенона (2,0 г) (полученному, как описано R.B.Davis and J.D.Benigni, J.Org.Chem., 1962, 27, 1605) в этаноле добавляли борогидрид натрия (1,45 г) и смесь перемешивали в течение 18 часов. Выпариванием удаляли летучие вещества, остаток суспендировали в воде (100 мл), осторожно подкисляли разбавленным водным раствором хлористоводородной кислоты (50 мл) и перемешивали в течение еще 2 часов. Реакционную смесь подщелачивали 2 М водным растворим гидроксида натрия и экстрагировали ДХМ. Экстракты объединяли, сушили и концентрировали выпариванием до получения масла. Масло растворяли в ТФУ (12,1 мл) при охлаждении на бане со льдом, затем обрабатывали по каплям триэтилсиланом (5,05 мл) и смесь перемешивали в течение ночи. Реакционную смесь вливали в водный раствор карбоната натрия и экстрагировали ДХМ. Экстракты объединяли, сушили и выпаривали до получения масла, которое очищали хроматографией при элюировании смесью 20-50% этилацетат/гексан, при этом получали названное соединение (0,60 г) в виде масла. ЯМР (СDСl3): 4,0 (с, 3Н), 7,1-7,4 (м, 8Н). МС(СI): 247 (М+).
Способ 30
2-Хлор-4-бензиланилин
Раствор 2-хлор-4-бензилнитробензола (способ 29) (0,60 г) в этилацетате обрабатывали в атмосфере аргона 10% Pd/C (0,06 г). Затем смесь перемешивали в атмосфере водорода в течение 10 часов. Смесь фильтровали в атмосфере аргона и экстрагировали водным раствором хлористоводородной кислоты (50 об./об.%, 50 мл). Водный слой отделяли, подщелачивали 2 М водным раствором NaOH и экстрагировали этилацетатом, при этом получали названное соединение в виде масла (0,237 г). ЯМР: 3,6 (с, 2Н), 5,1 (широкий с, 2Н), 6,7 (д, 1Н), 6,9 (дд, 1Н), 7,0 (д, 1Н), 7,1-7,3 (м, 5Н). МС(СI): 218 (М+).
Способы 31-32
Следуя методике способа 30, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 50.
Способ 33
N-[2-Хлор-4-фенилсульфонилфенил]-2-ацетокси-2-метилпропанамид
2-Хлор-4-фенилсульфаниланилин (способ 5) ацилировали 2-ацетокси-2-метилпропаноилхлоридом по методике способа 23, затем неочищенный продукт окисляли по методике примера 114, при этом получали названное соединение (выход 91%) в виде клейкого твердого вещества. ЯМР: 1,57 (с, 6Н), 2,05 (с, 3Н), 7,6-7,75 (м, 4Н), 7,8 (д, 1Н), 7,92 (дд, 1Н), 8,0 (кажущийся д, 2Н), 8,08 (д, 1Н), 9,4 (с, 1Н).
Способ 34
(R)-N-[2-Хлор-4-{4-уреидофенилсульфанил}фенил]-2-ацетокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-[2-хлор-4-{4-аминофенилсульфанил}фенил]-2-ацетокси-2-метил-3,3, 3-трифторпропанамида (0,432 г) (способ 22) в ТГФ (0,8 мл) добавляли воду (0,34 мл), уксусную кислоту (0,54 мл) и цианат натрия (0,104 г, растворенный в 0,3 мл воды). Смесь перемешивали в течение 2 часов, затем ее разбавляли водой (5 мл) и экстрагировали этилацетатом (2× 20 мл). Экстракты вливали в колонку Varian Chem Elut и элюировали этилацетатом. Выпариванием удаляли летучие вещества и остаток растирали с простым эфиром, при этом получали названное соединение (0,31 г) в виде твердого вещества. ЯМР: 1,8 (с, 3Н), 2,2 (с, 3Н), 5,9 (с, 2Н), 7,1 (с, 3Н), 7,4 (д, 2Н), 7,5 (д, 2Н), 8,8 (с, 1Н), 9,9 (с, 1Н). МС (ESP-): 474.
Способ 35
Следуя методике способа 34, с использованием соответствующих исходных веществ получали соединение, приведенное в таблице 51.
Способы 36-40
Указанные исходные вещества подвергали взаимодействию с соответствующим тиолом или галогенидом по методике примера 250, ацилировали по методике способа 17, затем восстанавливали методикой способа 10, при этом получали соединения, приведенные в таблице 52.
Способ 41
(R)-N-[2-Хлор-4-{4-(2-морфолиноацетиламино)фенилсульфанил)фенил]-2-ацетокси-2-метил-3,3,3-трифторпропанамид
Следуя методике примера 353, за исключением того, что вместо водного раствора диметиламина использовали морфолин, получали названное соединение (0,25 г) в виде пены. ЯМР: 1,8 (с, 3Н), 2,2 (с, 3Н), 3,1(с, 2Н), 3,3 (с, 4Н), 3,6 (м, 4Н), 7,1 (с, 2Н), 7,2 (с, 1Н), 7,4 (д, 2Н), 7,7 (д, 2Н), 9,9 (с, 2Н). МС (ESP-): 558.
Способ 42
(R)-2,3,4,5-Н4-3-{2-Хлор-4-[4-(3-этилуреидо)фенилсульфанил]фенил)-2, 4-диоксо-5-метил-5-трифторметилоксазол
К раствору (R)-2,3,4,5-Н4-3-[2-хлор-4-(4-аминофенилсульфанил)фенил]-2,4-диоксо-5-метил-5-трифторметилоксазола (способ 40) (0,3 г) в безводном простом эфире (0,5 мл) и ТГФ (2 мл) добавляли этилизоцианат (0,062 мл) и смесь перемешивали в течение 24 часов. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 5-60% этилацетат/гексан, при этом получали названное соединение (0,29 г) в виде клейкого твердого вещества. ЯМР: 1,8 (кв, 2H), 2,0 (с, 3Н), 3, 1 (м, 3Н), 6,1 (т, 1Н), 7,2 (д, 2H), 7,5 (д, 2H), 7,6 (д, 2H), 7,6 (д, 1Н), 8,7 (с, 1Н). МС (ESP-): 486.
Способы 43-44
Следуя методике способа 42, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 53.
Способ 45
N,N-Ди(трет-бутоксикарбонил)-2-хлор-4-нитроанилин
К охлажденному льдом раствору ди-трет-бутилдикарбоната (2,401 г) в ТГФ (50 мл) добавляли 2-хлор-4-нитроанилин (1,726 г). Смеси давали нагреться до комнатной температуры. Добавляли 4-диметиламинопиридин (0,01 г) и раствор перемешивали в течение еще 19 часов, затем нагревали при 60° С в течение 26 часов. Выпариванием удаляли летучие вещества и остаток распределяли между водой (100 мл) и ДХМ (200 мл). Органическую фазу промывали рассолом, затем сушили и повторно концентрировали. Остаток очищали хроматографией на силикагеле, при этом получали названное соединение (1, 261 г) в виде твердого вещества. ЯМР 1,35 (с, 18Н), 7,78 (д, 1Н), 8,22 (дд, 1Н), 8,42 (с, 1Н). МС: 372 (М+).
Способ 46
3-Хлор-4-[ди(трет-бутилоксикарбонил)амино]-1-(2-нитроанилино)фенил
Смесь 1,1’-бис(дифенилфосфино)ферроцена (0,1 г) и ацетата палладия(II) (0,028 г) в толуоле (4 мл) перемешивали в атмосфере аргона в течение 1 часа при 100° С. Ее добавляли к смеси высушенного карбоната цезия (0,912 г), 3-хлор-4-[ди-(трет-бутилоксикарбонил)амино]анилина (способ 31) (0,822 г ) и 2-бром-1-нитробензола (0,404 г) в толуоле (7 мл). Смесь перемешивали в течение 23 часов при 100° С в атмосфере аргона, затем ее охлаждали, фильтровали и концентрировали выпариванием. Остаток растворяли в этилацетате (75 мл), промывали 1 М водным раствором хлористоводородной кислоты (2× 5 мл), водой (25 мл) и рассолом (25 мл) и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 10% этилацетат/гексан, при этом получали названное соединение (0,889 г) в виде смолы. ЯМР: 1,40 (с, 18 Н), 7,00 (т, 1H), 7,27 (м, 2Н), 7,36 (д, 1Н), 7,45 (с, 1Н), 7,58 (т, 1H), 8,10 (д, 1H), 9,28 (с, 1H). МС (ЕSР-): 462.
Способ 47
2-Хлор-4-(2-нитроанилино)анилин
К раствору 3-хлор-4-[ди(трет-бутилоксикарбонил)амино]-1-(2-нитроанилино) фенила (способ 46) (0,88 г) в ДХМ (15 мл) добавляли ТФУ (3 мл). Через 2 часа раствор выпаривали до образования сухого остатка. Остаток растворяли в этилацетате (100 мл), промывали 1 М водным раствором гидроксида натрия (50 мл), водой (50 мл) и рассолом (50 мл), затем сушили и повторно концентрировали, при этом получали названное соединение (0,45 г) в виде твердого вещества. МС (ЕSР-): 264 (М+Н)+.
Способ 48
(R)-N-[2-Хлор-4-(фенилсульфанил)фенил]-2-(трет-бутоксикарбониламино)пропанамид
(на основе методики Villeneuve G.B. et al., Tetrahedron Letters (1997), 38(77), 6489)).
К охлажденному (-78° С) раствору гексахлорацетона (0,18 мл) и N-трет-бутилоксикарбонил-2-метилаланина (0,441 г) в сухом ДХМ (15 мл) в атмосфере аргона добавляли трифенилфосфин (0,0612 г). Полученную смесь перемешивали при низкой температуре в течение 20 минут. Затем добавляли 2-хлор-4-(фенилсульфанил)анилин (0,5 г) (способ 5) и сухой триэтиламин (0,33 мл). Перед перемешиванием в течение 1 часа при комнатной температуре образовавшуюся смесь медленно нагревали до комнатной температуры в среде аргона. Добавляли насыщенный водный раствор хлорида аммония (15 мл) и смесь экстрагировали ДХМ (2× 50 мл). Органические экстракты объединяли, промывали рассолом и сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией в колонке с силикагелем при элюировании смесью 2% этилацетат/ДХМ, при этом получали названное соединение. ЯМР (CDCl3): 1,40-1,45 (м, 12Н), 4,29-4,40 (м, 1Н), 4,86-4,95 (м, 1Н), 7,20-7,40 (м, 7Н), 8,30-8,38 (м, 1Н), 8, 64 (широкий с, 1Н). МС (ESP-): 405.
Способ 49
(S)-2-Ацетокси-2-метил-3,3,3-трифторпропаноилхлорид
К перемешиваемому раствору (R)-2-гидрокси-2-метил-3,3,3-трифторпропановой кислоты (10 г) (способ 9) в толуоле (100 мл), охлажденному на бане со льдом, добавляли по каплям ацетилхлорид (11,7 мл). Затем смесь нагревали до 80° С и после растворения суспензии получался прозрачный раствор. Через 2 часа реакционную смесь охлаждали и затем концентрировали до получения масла. Масло повторно растворяли в ДХМ (140 мл) и ДМФ (4 капли) и добавляли оксалилхлорид (6 мл). Раствор энергично барботировал, и реакционную смесь перемешивали левовращением в течение 15 часов. Полученный раствор названного соединения использовали непосредственно без дополнительной очистки.
Способ 50
(R)-N-(2-Хлор-4-{3-трет-бутокси-2-гидроксипропиламино}фенил)-2-ацетокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-(2-хлор-4-аминофенил)-2-ацетокси-2-метил-3,3,3-трифторпропанамида (0,325 г) (способ 32) в диэтиловом эфире (5 мл) добавляли трет-бутилглицидиловый эфир (0,19 мл) и трифторметансульфонат меди (II) (0,018 г). Смесь перемешивали в течение 40 часов, выпариванием удаляли летучие вещества и остаток очищали хроматографией, при этом получали названное соединение (0,1 г) в виде пены. МС (ESP-): 453.
Способ 51
3,4-Дифторбензолтиол
Во время добавления 3,4-дифторбензолсульфонилхлорида (10 г) раствор трифенилфосфина (37,0 г) и ДМФ (2 мл) в ДХМ (100 мл) поддерживали при температуре 20° С с помощью бани со льдом. Смесь перемешивали при комнатной температуре в течение 2 часов, затем добавляли водный раствор хлористоводородной кислоты (50 мл 1 М раствора). Смесь перемешивали в течение еще 1 часа. Органический слой отделяли, сушили, выпариванием удаляли растворитель, при этом получали названное соединение в виде масла, которое использовали без очистки.
Способ 52
2-(4-Триизопропилсилилсульфанилфенил)пиримидин
К раствору 2-(4-бромфенил)пиримидина (1,751 г) (полученному, как описано в заявке на патент США US96-692869 (СА 129:136175)) в толуоле (40 мл) добавляли тетракис(трифенилфосфин)палладий(0) (0,28 г) и смесь нагревали при 80° С в атмосфере аргона в течение одного часа. К перемешиваемой суспензии гидрида натрия (0,4 г 60% дисперсии в масле) в сухом ТГФ (20 мл), охлажденной смесью лед/вода, добавляли по каплям триизопропилсилантиол (2,14 мл). Охлаждающую баню удаляли и смесь перемешивали в течение 10 минут, при этом получали прозрачный раствор. Этот раствор добавляли к реагентам в толуоле, смесь перемешивали при температуре кипения с обратным холодильником в течение 16 часов и затем охлаждали. Добавляли воду (50 мл) и смесь экстрагировали этилацетатом (3× 50 мл). Экстракты объединяли, промывали рассолом (100 мл) и сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией при элюировании смесью 20% этилацетат/гексан, при этом получали названное соединение (1,49 г) в виде твердого вещества. ЯМР (при 343 К): 0,86-1,07 (м, 21Н), 7,4 (т, 1Н), 7,7 (м, 2Н), 8,39 (м, 2Н), 8,87 (м, 2Н). МС (EI): 344 (М+).
Способ 53
6-Иодхиназолиндион
Смесь 2-амино-5-иодбензойной кислоты (3,5 г) и мочевины (1,56 г) в NМП (15 мл) нагревали при 160° С в течение 6 часов и затем охлаждали. Добавляли воду (200 мл) и образовавшийся остаток собирали, промывали водой и сушили, при этом получали названное соединение (3,35 г) в виде твердого вещества. МС (CI+): 289 (М+Н)+.
Способ 54
1,3-Диметил-6-иодхиназолиндион
К перемешиваемому раствору 6-иодхиназолиндиона (0,58 г) (способ 53) и иодметана (0,63 мл) в ДМФ (10 мл) порциями добавляли гидрид натрия (0,24 г 60% дисперсии в масле). Смесь перемешивали в течение 1 часа, затем ее осторожно добавляли к насыщенному водному раствору хлорида аммония (200 мл). Экстракцией этилацетатом с последующей перекристаллизацией из этанола с небольшим количеством хлороформа получали названное соединение (0,48 г) в виде твердого вещества. МС (CI+): 317 (M+H)+.
Способ 55
N-[2-Фтор-4-(4-метилсульфанилфенилсульфанил)фенил]-2-трет-бутилдиметилсилилокси-2-трифторметил-3,3,3-трифторпропанамид
К перемешиваемому раствору 2-трет-бутилдиметилсилилокси-2-трифторметил-3,3,3-трифторпропановой кислоты, сложного трет-бутилдиметилсилилового эфира (способ 56) (1,05 г) в ДХМ (10 мл) добавляли ДМФ (2 капли) и оксалилхлорид (0,23 мл). Реакционную смесь перемешивали в течение 17 часов и затем ее добавляли к раствору 2-фтор-4-(4-метилсульфанилфенилсульфанил)анилина (способ 6) (0,63 г) в ДХМ (5 мл) и пиридина (0,22 мл). Реакционную смесь перемешивали при комнатной температуре в течение 48 часов, выпаривали при пониженном давлении и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 5-20% этилацетат/изогексан, при этом получали названное соединение (0,278 г) в виде желтой смолы. ЯМР (CDCl3): 0,29 (с, 6Н), 0,98 (с, 9Н), 2,48 (с, 3Н), 6,96-7,0 (м, 1Н), 7,06 (д, 1Н), 7,2 (д, 2Н), 7,31 (д, 2Н), 8,23 (т, 1Н), 8,62 (широкий с, 1Н).
Способ 56
трет-Бутилдиметилсилиловый эфир 2-трет-бутилдиметилсилилокси-2-трифторметил-3,3, 3-трифторпропановой кислоты
Перемешиваемый раствор 2-гидрокси-2-трифторметил-3,3,3-трифторпропановой кислоты (2,26 г) в безводном ДМФ (11 мл) обрабатывали в атмосфере аргона трет-бутилдиметилсилилхлоридом (3,37 г) и затем имидазолом (3,02 г). Реакционную смесь перемешивали в течение 17 часов, затем ее экстрагировали изогексаном (3× 100 мл), органическую фазу промывали водным раствором бикарбоната натрия (2× 200 мл) и сушили. Выпариванием удаляли летучие вещества, при этом получали названное соединение (3,09 г) в виде масла. ЯМР (CDCl3): 0,01 (с, 6Н) , 0,87 (с, 9Н). МС (EI+): 383 (М-С4H9).
Способ 57
(R)-N-[2-(2-Триметилсилилэтинил)-4-(4-мезилфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-[2-бром-4-(4-мезилфенилфсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 140) (0,311 г) в безводном ТГФ (10 мл) в атмосфере аргона добавляли бис(трифенилфосфин)палладий(II)хлорид (0,01 г), трифенилфосфин (0,0038 г), триметилсилилацетилен (0,17 мл), триэтиламин (0,16 мл) и иодид меди(I) (0,0013 г). Смесь нагревали при 50° С в течение 3 часов, затем опять добавляли бис(трифенилфосфин)палладий(II)хлорид (0,01 г) и триметилсилилацетилен (0,17 мл) и нагревание продолжали в течение еще 3 часов. Реакционной смеси давали охладиться, добавляли этилацетат (50 мл) и смесь фильтровали через подушку диатомовой земли, которую промывали эталацетатом (3× 20 мл). Фильтраты объединяли и выпариванием удаляли летучие вещества. Остаток очищали хроматографией при элюировании смесью 10-40% этилацетат/изогексан, при этом получали названное соединение (выход 89%) в виде твердого вещества. ЯМР (CDCl3): 0,29 (с, 9Н), 1,74 (с, 3Н), 3,05 (с, 3Н), 3,69 (с, 1Н), 7,88-7,92 (м, 1Н), 8,02 (д, 1Н), 8,05-8,13 (м, 4Н), 8,61 (д, 1Н), 9,46 (с, 1Н). МС (ESP-): 546.
Способ 58
5-Иод-2Н-бензимидазол-2-он
Смесь монохлорида иода и 2Н-бензимидазол-2-она (0,67 г) (способ 59) в ледяной уксусной кислоте (8 мл) нагревали до 80° С в течение 1 часа и затем охлаждали. Смесь распределяли между насыщенным водным раствором сульфита натрия и ДХМ. Органический слой выпаривали до образования сухого остатка, затем повторно растворяли в этилацетате. Водный слой экстрагировали этилацетатом, затем все этилацетатные экстракты объединяли и промывали насыщенным водным раствором бикарбоната натрия, водой и рассолом. Органические экстракты пропускали через колонку Variam Chem Elut и промывали этилацетатом. Выпариванием удаляли летучие вещества, при этом получали названное соединение (0,36 г) в виде твердого вещества, которое использовали без очистки. МС (ЕSР-): 261 (М+Н)+.
Способ 59
2Н-Бензимидазол-2-он
Раствор фенилендиамина (6,48 г) в сухом ТГФ (150 мл) охлаждали до 5° С. К этому раствору в течение 15 минут при поддержании температуры ниже 10° С добавляли суспензию 1,1-карбонилдиимидазола (10,7 г) в ТГФ (100 мл). Смесь перемешивали в течение 16 часов, полученное твердое вещество собирали и сушили, при этом получали названное соединение (4,5 г). ЯМР: 6,9 (с, 4Н), 10,5 (с, 2Н). МС (ЕSР-): 135 (М+Н)+.
Способы 60-62
Следуя методике примера 197, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 54.
Способ 63
(R)-N-[2-Хлор-4-(2-фторфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-[2-хлор-4-(2-фторфенилсульфанил)фенил]-2-гидрокси-2-метил-3,3, 3-трифторпропанамида (пример 187) (0,906 г) в ДХМ (60 мл) добавляли м-хлорпероксибензойную кислоту (55%, 2,39 г) и смесь перемешивали при комнатной температуре в течение 6 часов. Затем смесь промывали насыщенным водным раствором бикарбоната натрия (3× 100 мл), водой (100 мл) и рассолом и затем сушили. Выпариванием удаляли летучие вещества и остаток растирали с гексаном, при этом получали названное соединение (0,808 г) в виде твердого вещества. Температура плавления 90-92° С. ЯМР (СDСl3): 1,75 (с, 3Н), 3,65 (широкий с, 1Н), 7,15 (т, 1Н), 7,35 (т, 1Н), 7,60 (м, 1Н), 7, 95 (дуплет, 1Н), 8,10 (м, 2Н), 8,60 (д, 1Н), 9,30 (широкий с, 1Н). МС (ЕSР-): 424.
Способы 64-66
Следуя методике способа 63, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 55.
Способы 67-68
Следуя методике способа 16, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 56.
Способ 69
(R)-N-[2-Хлор-4-(4-фторфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К раствору (R)-N-[2-хлор-4-(4-фторфенилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 188) (0,283 г) в ледяной уксусной кислоте (1,0 мл) добавляли пероксид водорода (0, 3 мл 30 вес.% раствора в воде), смесь перемешивали и нагревали при 100° С в течение 80 минут, затем охлаждали. Добавляли этилацетат (40 мл), раствор промывали водой (20 мл), насыщенным водным раствором бикарбоната натрия (20 мл) и рассолом и затем сушили. Выпариванием удаляли летучие вещества и остаток очищали хроматографией на силикагеле в колонке Меgа Bond Elut при элюировании смесью 0-25% этилацетат/гексан, при этом получали названное соединение (0,261 г, 72%) в виде твердого вещества. Температура плавления 131-133° С. ЯМР: 1,6 (с, 3Н), 7,46 (т, 2Н), 8,0 (дд, 1Н), 8,08 (м, 2Н), 8,15 (д, 1Н), 8,3 (д, 1Н), 9,85 (широкий синглет, 1Н). МС (ESP+): 426 (M+H)+.
Способ 70-72
Следуя методике способа 69, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 57.
Способ 73
(R)-N-(2-Хлор-4-хлорсульфонилфенил)-2-гидрокси-2-метил-3,3, 3-трифторпропанамид
К охлажденному раствору (0° С) хлорсульфокислоты (25 мл) в течение 15 минут добавляли порциями (R)-N-(2-хлорфенил)-2-гидрокси-2-метил-3,3, 3-трифторпропанамид (способ 74) (13,8 г, 52 ммоль) и затем смесь нагревали до 85° С. Через 4,5 часа реакционную смесь охлаждали на бане со льдом и затем очень медленно вливали в перемешанную смесь воды со льдом. После перемешивания в течение 15 минут смесь экстрагировали этилацетатом (2× 100 мл) и объединенный органический слой промывали рассолом, сушили и концентрировали до получения масла коричневого цвета. Масло очищали колоночной флэш-хроматографией с использованием смеси изогексан/этилацетат, 10:1, при этом получали названное соединение в виде бледно-желтого твердого вещества (11 г, 30 ммоль). ЯМР: 1,6 (с, 3Н), 7,55 (дд, 1Н), 7,6 (д, 1Н), 7,95 (д, 1Н) , 9,7 (широкий с, 1Н). МС: 364.
Способ 74
(R)-N-(2-Хлорфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид
К перемешиваемому раствору (R)-2-гидрокси-2-метил-3,3,3-трифторпропановой кислоты (способ 9) (10 г, 63 ммоль) в толуоле (100 мл), охлажденному на бане со льдом, добавляли по каплям ацетилхлорид (11,7 мл, 164 ммоль). Затем смесь нагревали до 80° С и полученная суспензия растворялась, при этом раствор становился прозрачным. Через 2 часа реакционную смесь охлаждали и затем концентрировали до получения масла светло-коричневого цвета. Затем это масло повторно растворяли в ДХМ (140 мл), добавляли ДМФ (4 капли) и затем оксалилхлорид (6 мл, 69 ммоль). Раствор энергично барботировал и реакционную смесь перемешивали левовращением. Через 15 часов эту реакционную смесь медленно добавляли к перемешиваемому раствору 2-хлоранилина (8,7 г, 68 ммоль) и пиридина (5,5 мл, 68 ммоль) в ДХМ (150 мл). После перемешивания в течение 15 часов при комнатной температуре полученную смесь концентрировали и остаток растворяли в метаноле (500 мл). Затем добавляли раствор моногидрата гидроксида лития (7,8 г, 0,19 моль) в воде (120 мл) и смесь перемешивали в течение 4 часов. Затем смесь концентрировали и остаток подкисляли до рН 2 (добавлением концентрированной хлористоводородной кислоты). Добавляли этилацетат (150 мл) и смесь промывали водой (2× 100 мл) и рассолом, сушили и выпаривали до образования сухого остатка. Остаток очищали колоночной флэш-хроматографией с использованием смеси изогексан/этилацетат, 6:1, при этом получали названное соединение в виде белого твердого вещества (13,8 г, 52 ммоль). ЯМР: 1,6 (синглет, 3Н), 7,1-7,25 (м, 1Н), 7,3-7,4 (м, 1Н), 7,55 (дд, 1Н), 7,8 (с, 1Н), 8,0 (дд, 1Н), 9,7 (широкий с, 1Н). МС: 266.
Способ 75
Следуя методике способа 63, с использованием соответствующих исходных веществ получали соединения, приведенные в таблице 58.
Пример 429
Далее проиллюстрираваны представители фармацевтических дозированных форм, содержащих соединение формулы (I) или его фармацевтически приемлемую соль (далее соединение X), применяемые для терапевтического или профилактического лечения людей.
(а) Таблетка (I) мг/таблетка
Соединение Х 100
Лактоза Ph. Eur. 182,75
Натрийкроскармеллоза 12,0
Паста маисового крахмала
(5 мас./об.% паста) 2,25
Стеарат магния 3,0
(b) Таблетка (II) мг/таблетка
Соединение Х 50
Лактоза Ph. Eur. 223,75
Натрийкроскармеллоза 6,0
Маисовый крахмал 15,0
Поливинилпирролидон (5 мас./об.% паста) 2,25
Стеарат магния 3,0
(c) Таблетка III мг/таблетка
Соединение Х 1,0
Лактоза Ph. Eur. 93,25
Натрийкроскармеллоза 4,0
Паста маисового крахмала (5 мас./об.%
паста) 0,75
Стеарат магния 1,0
(d) Капсула мг/капсула
Соединение Х 10
Лактоза Ph. Eur. 488,5
Стеарат магния 1,5
(e) Инъекционный раствор (I) 50 мг/мл
Соединение Х 5,0 мас./об.%
1 н. раствор гидроксида натрия 15 об./об.%
0,1 н. хлористоводородная кислота (для доведения рН до 7,6)
Полиэтиленгликоль 400 4,5 мас./об.%
Вода для инъекции До 100%
(f) Инъекционный раствор II 10 мг/мл
Соединение Х 1,0 мас./об.%
Фосфат натрия ВР 3,6 мас./об.%
0,1 н. раствор гидроксида натрия 15,0 об./об.%
Вода для инъекции До 100%
(g) Инъекционный раствор III (1 мг/мл,
забуферированный
до рН 6,0)
Соединение Х 0,1 маc./об.%
Фосфат натрия ВР 2,26 маc./об.%
Лимонная кислота 0,38 маc./об.%
Полиэтиленгликоль 400 3,5 маc./об.%
Вода для инъекций До 100 %
Вышеприведенные композиции могут быть получены с использованием общепринятых методик, хорошо известных в области фармацевтики. Таблетки (а)-(с) с помощью обычных средств могут быть покрыты энтеросолюбильным покрытием, например покрытием из ацетатфталата целлюлозы.



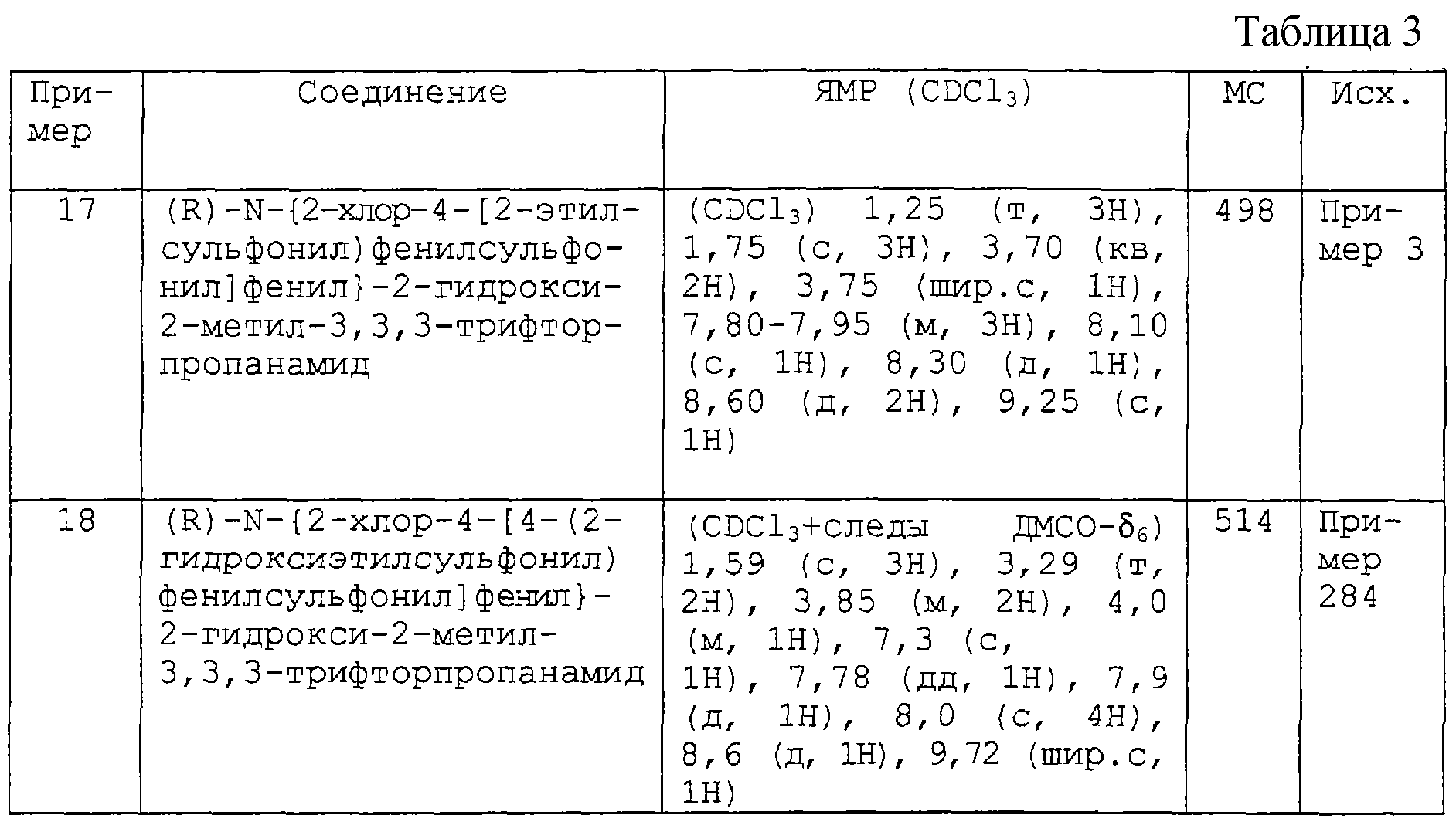






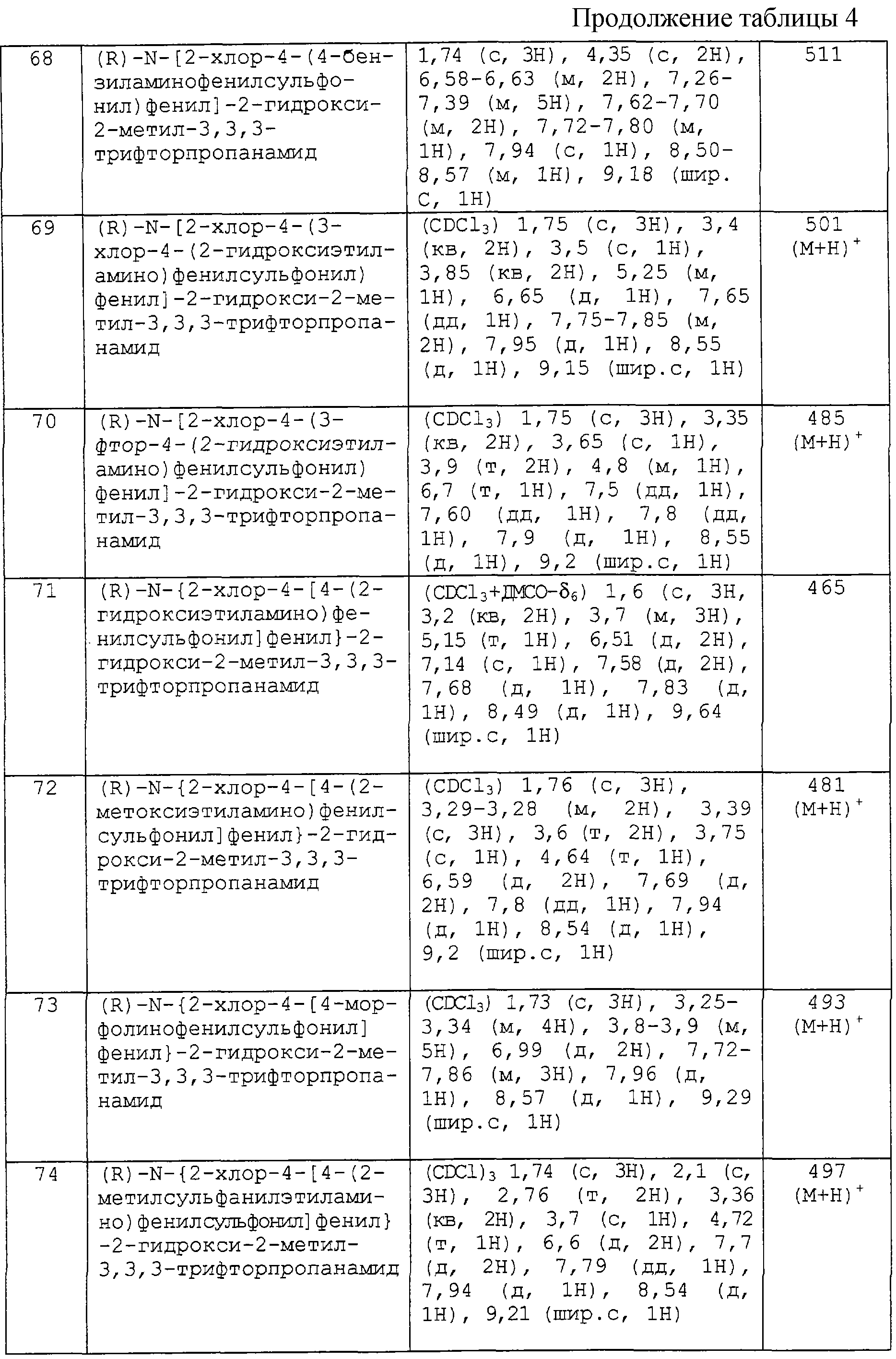
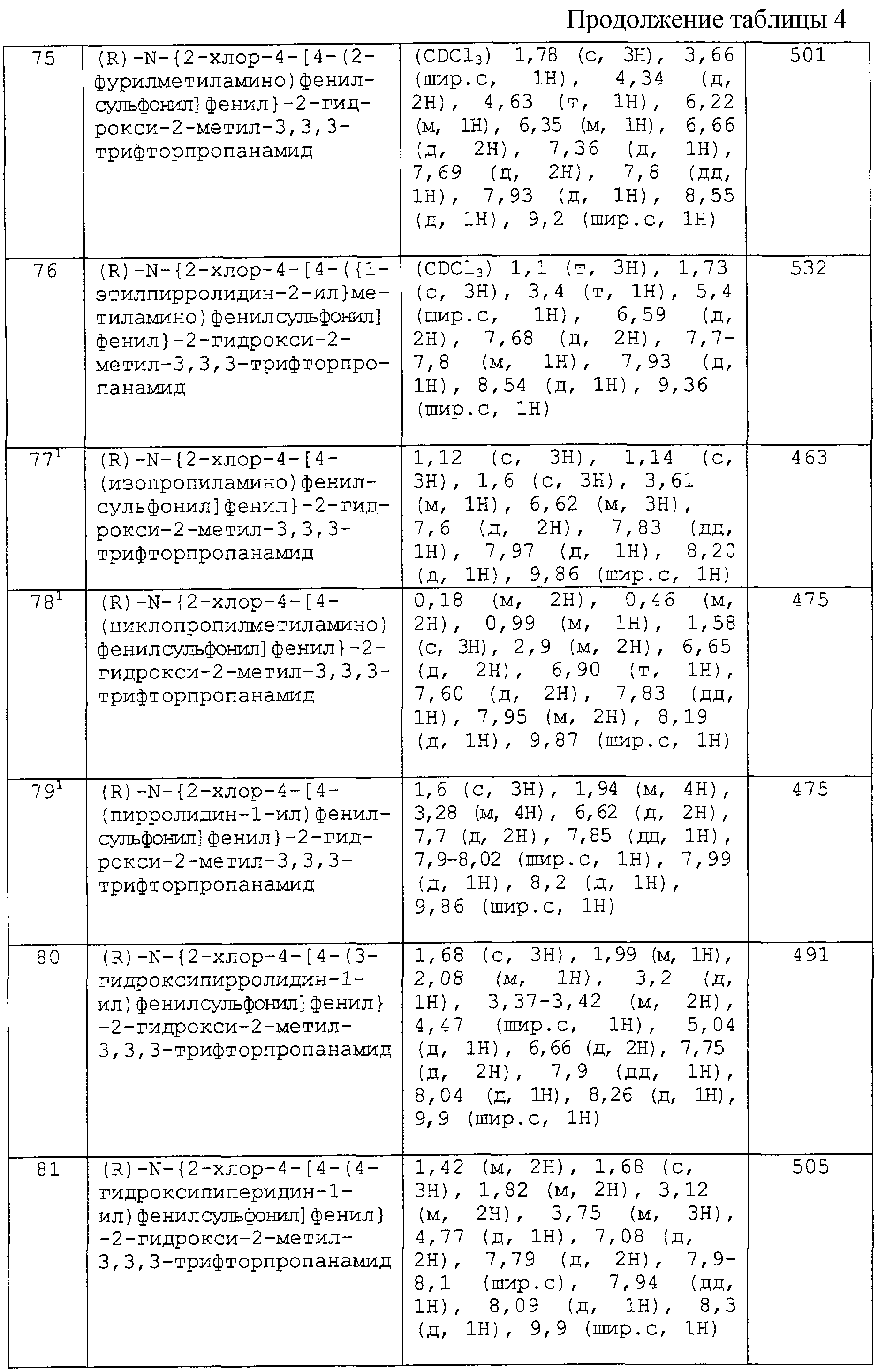


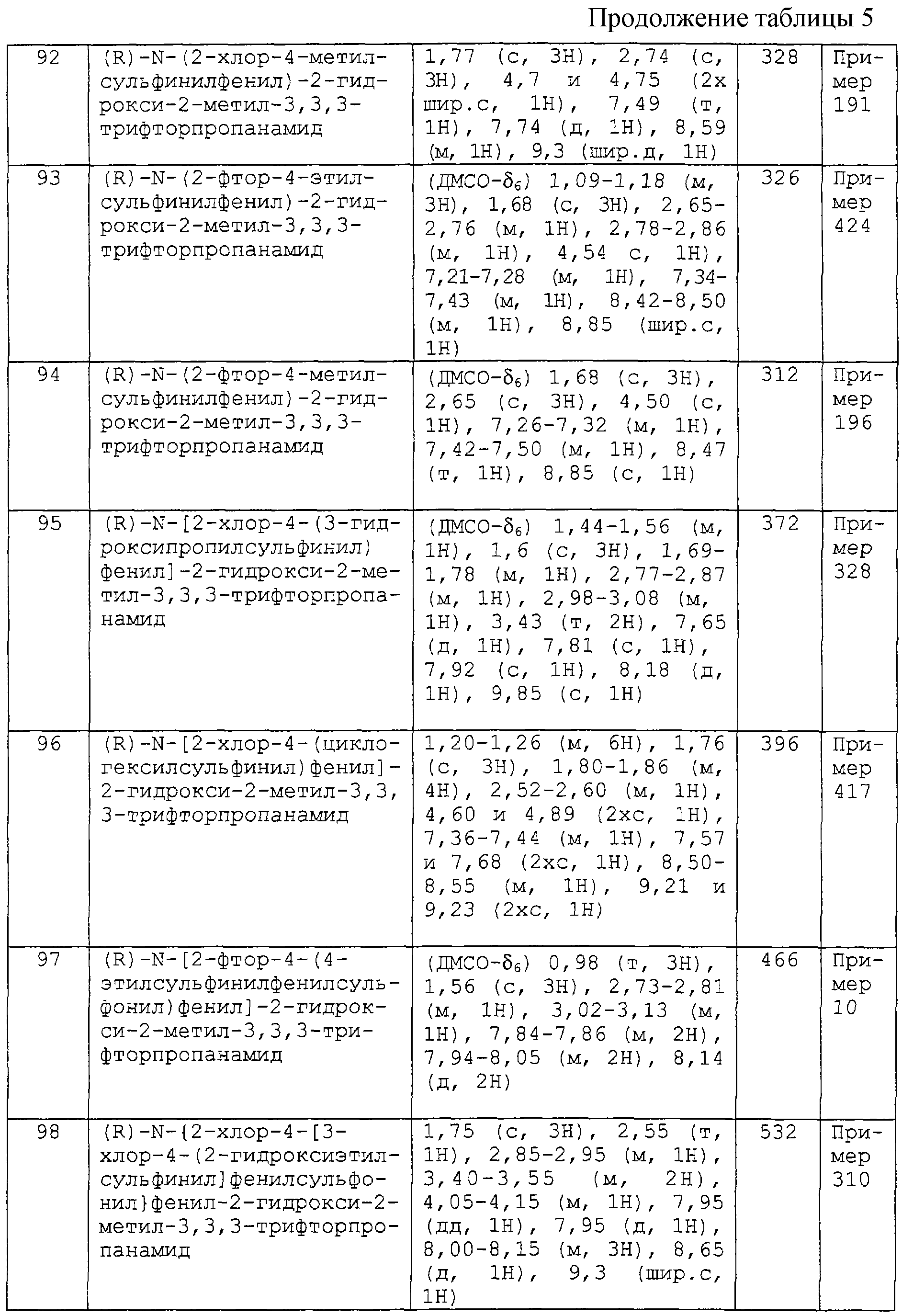








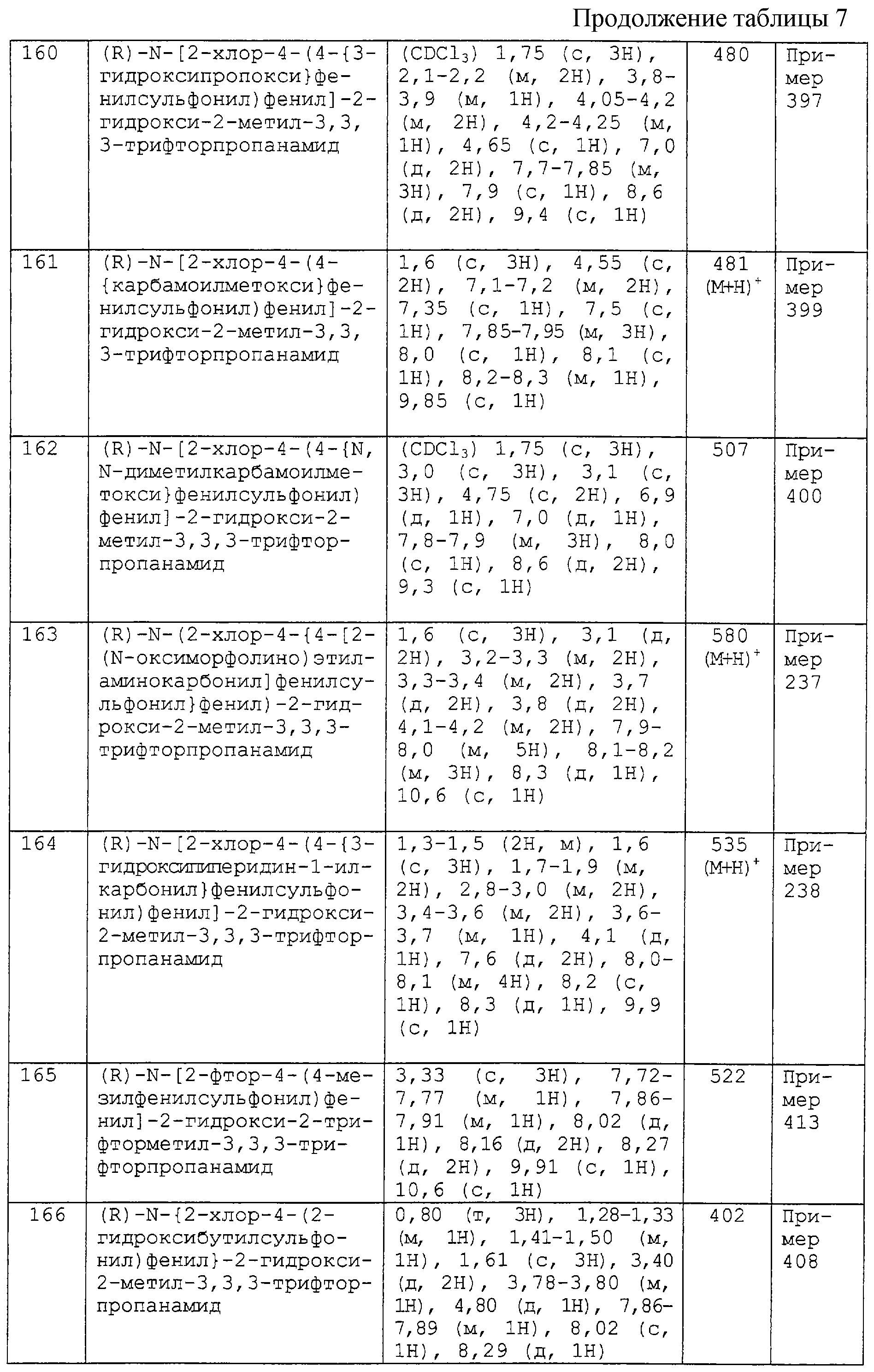





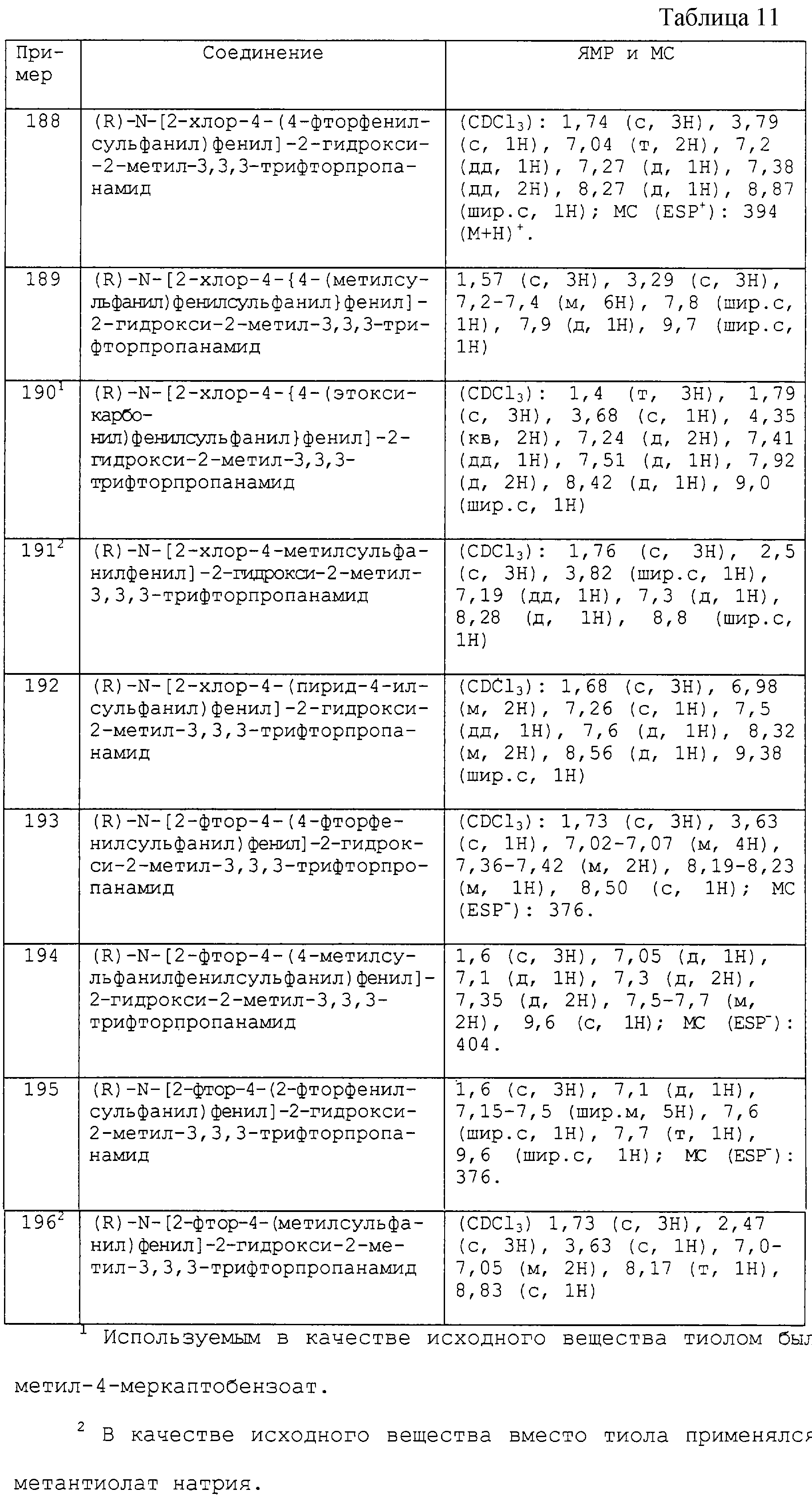
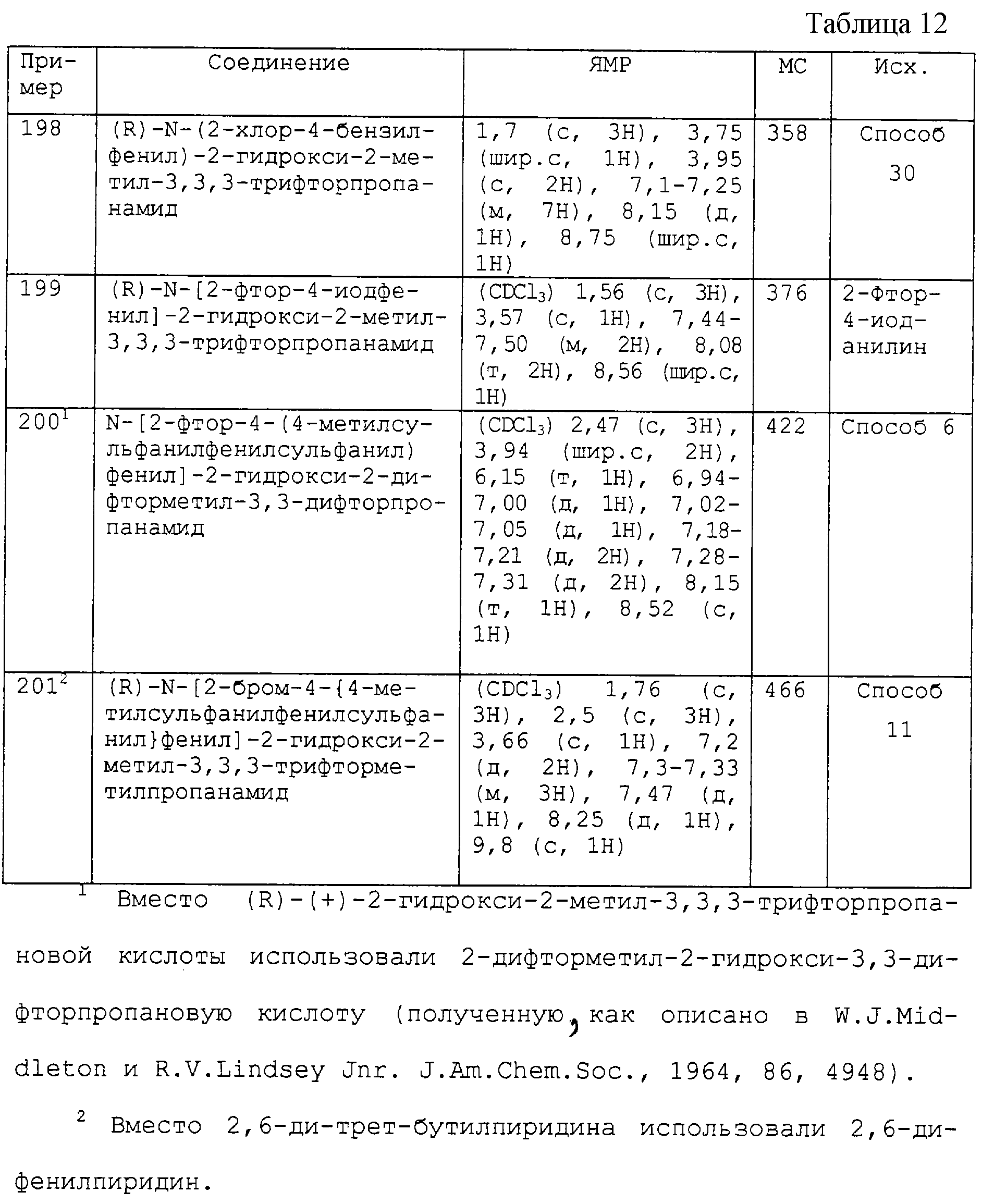



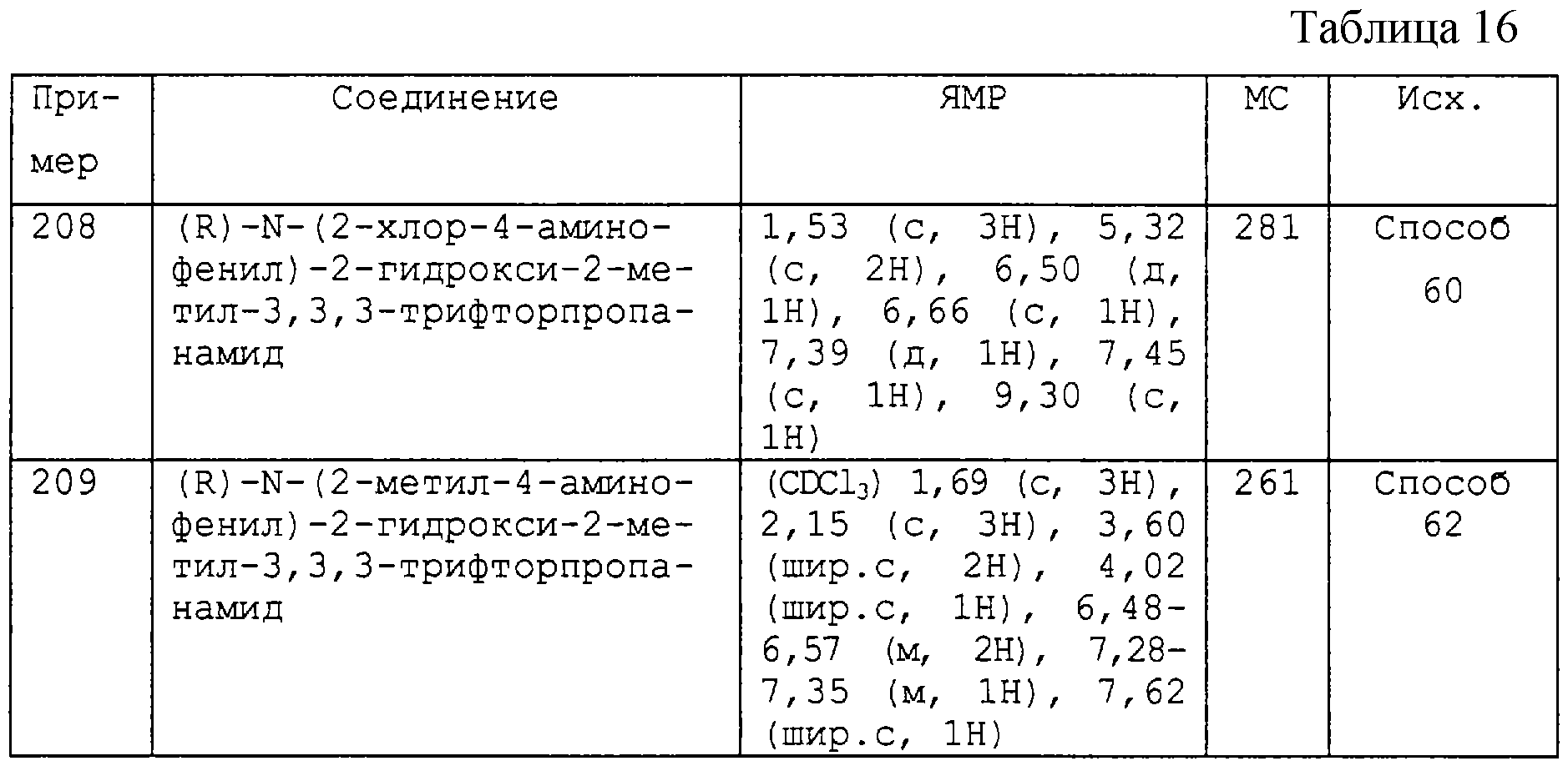
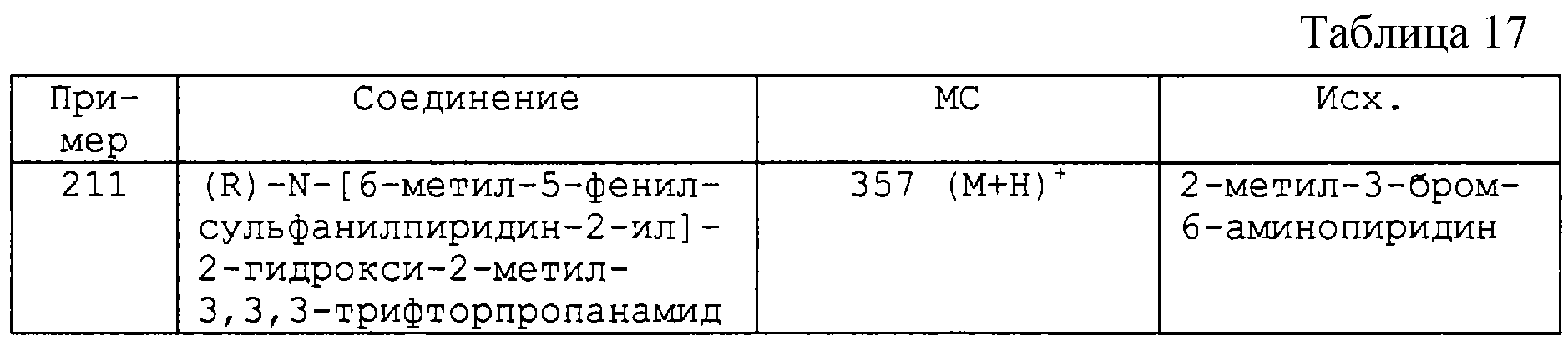

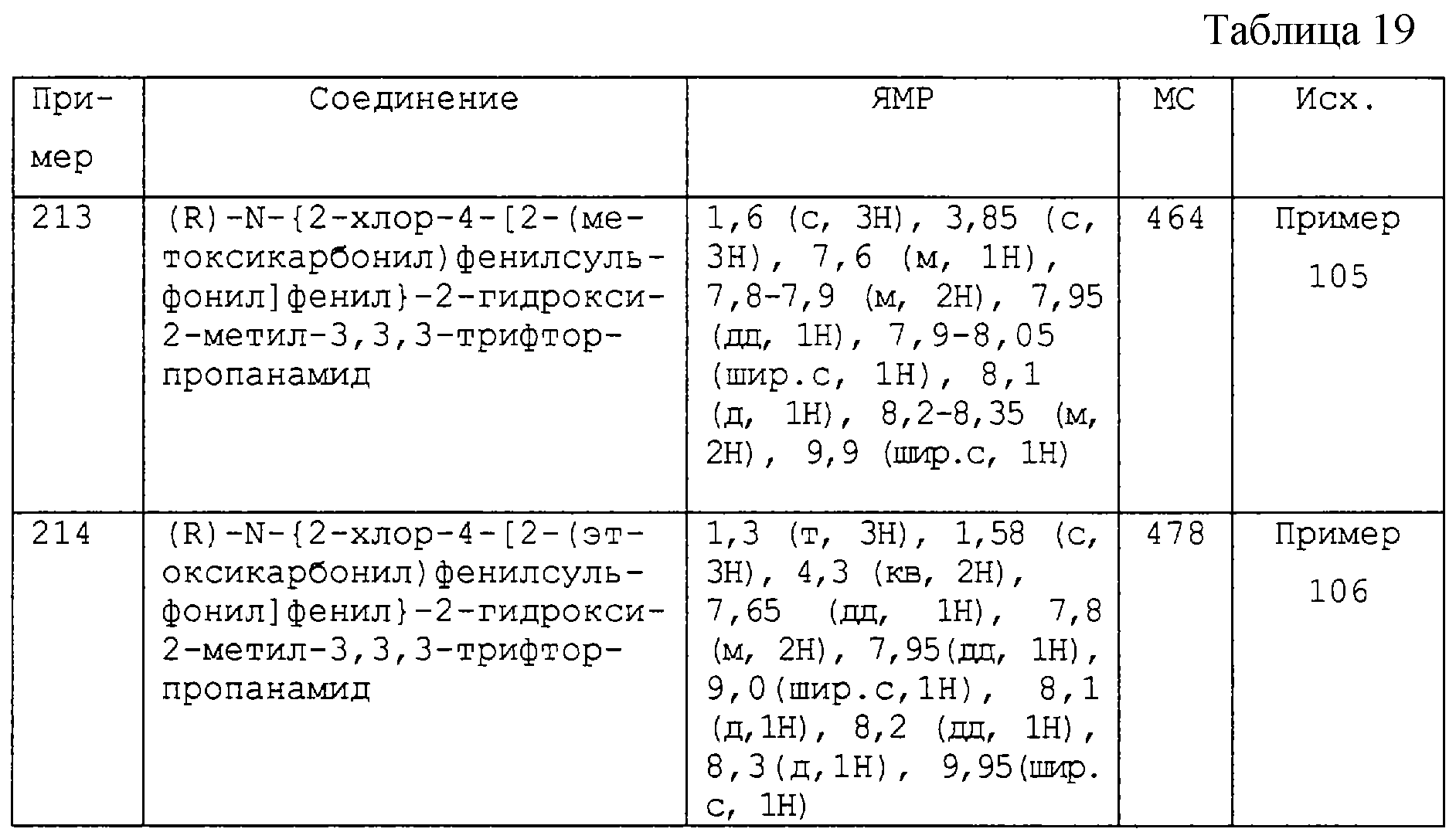




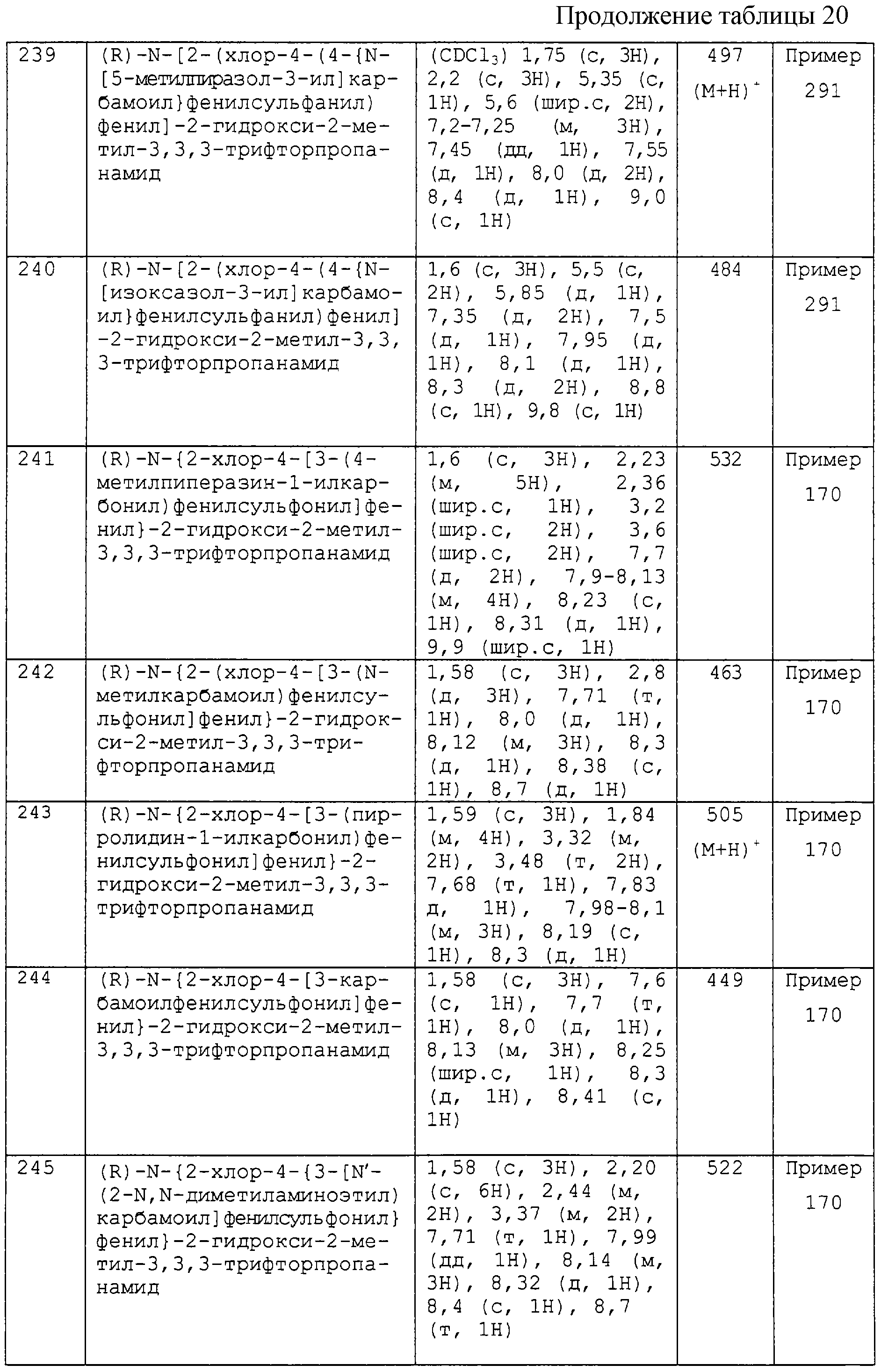



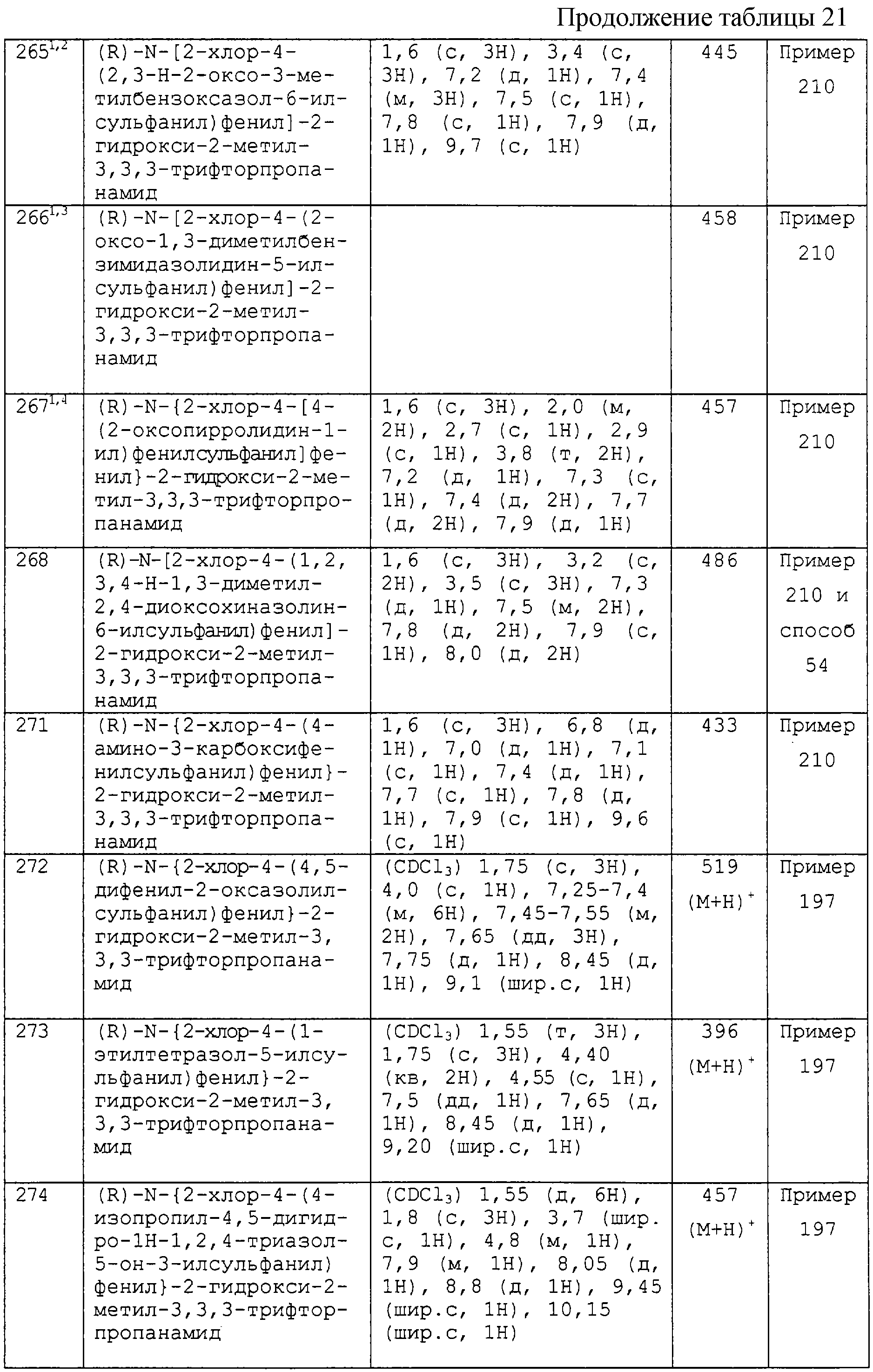
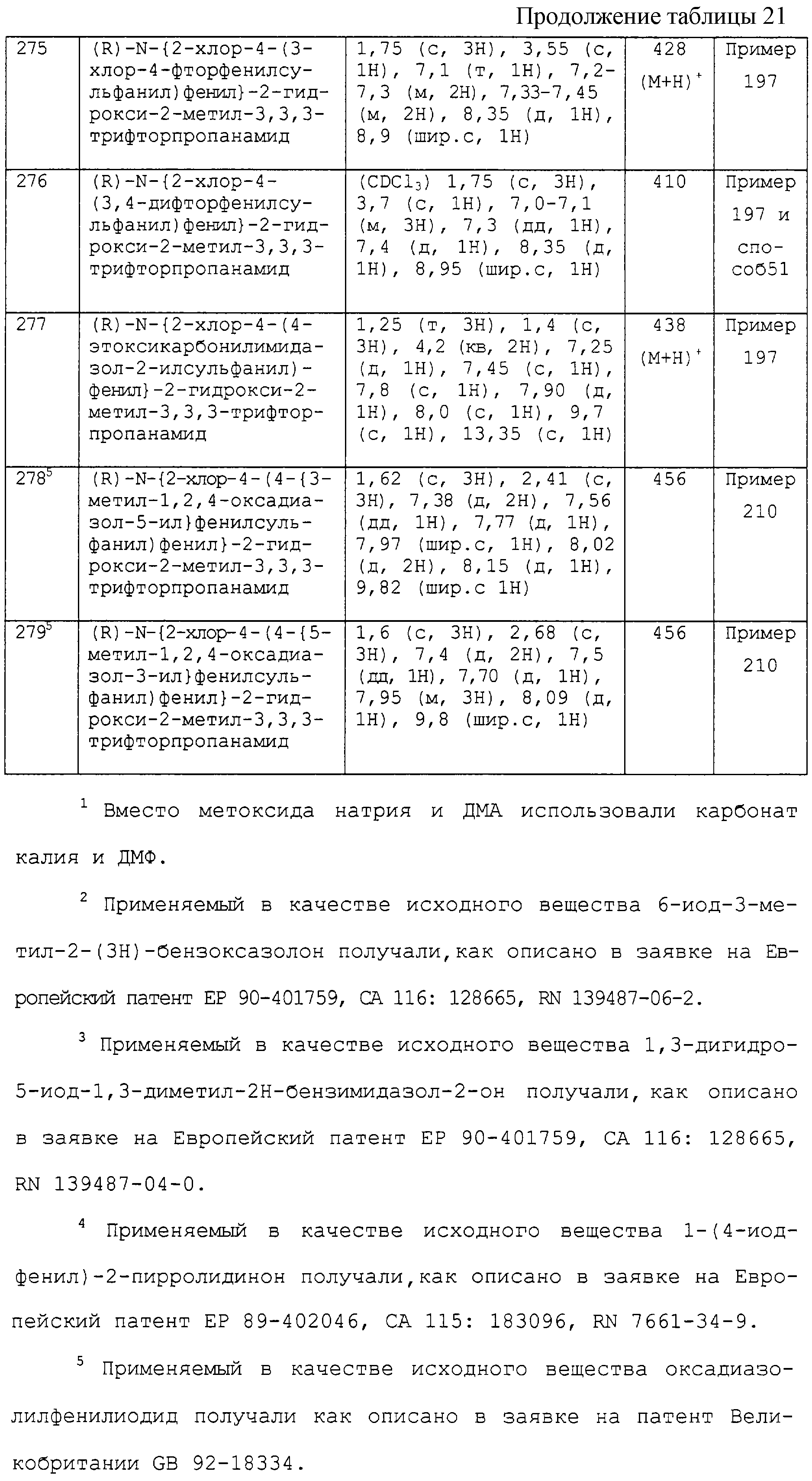

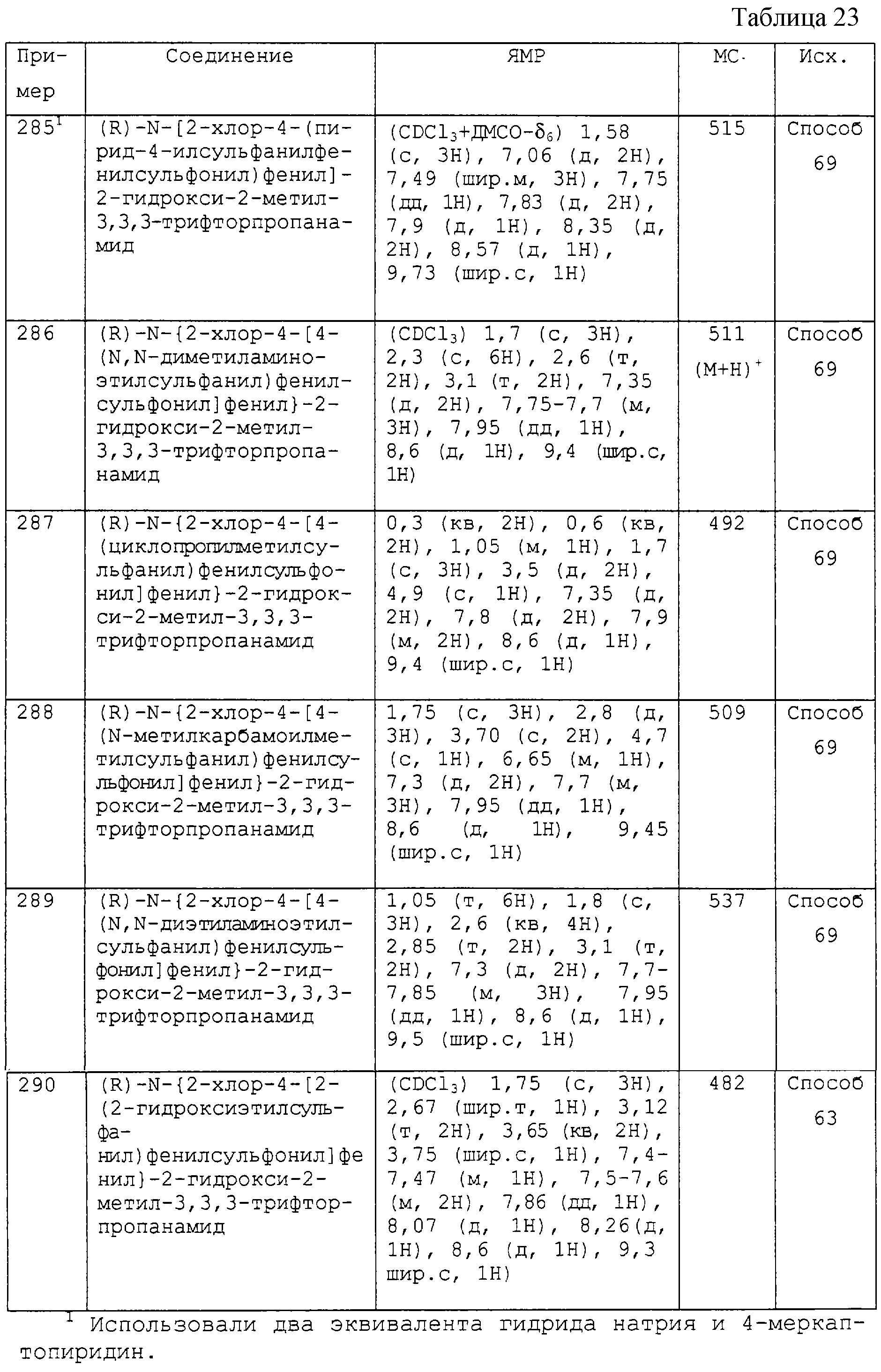


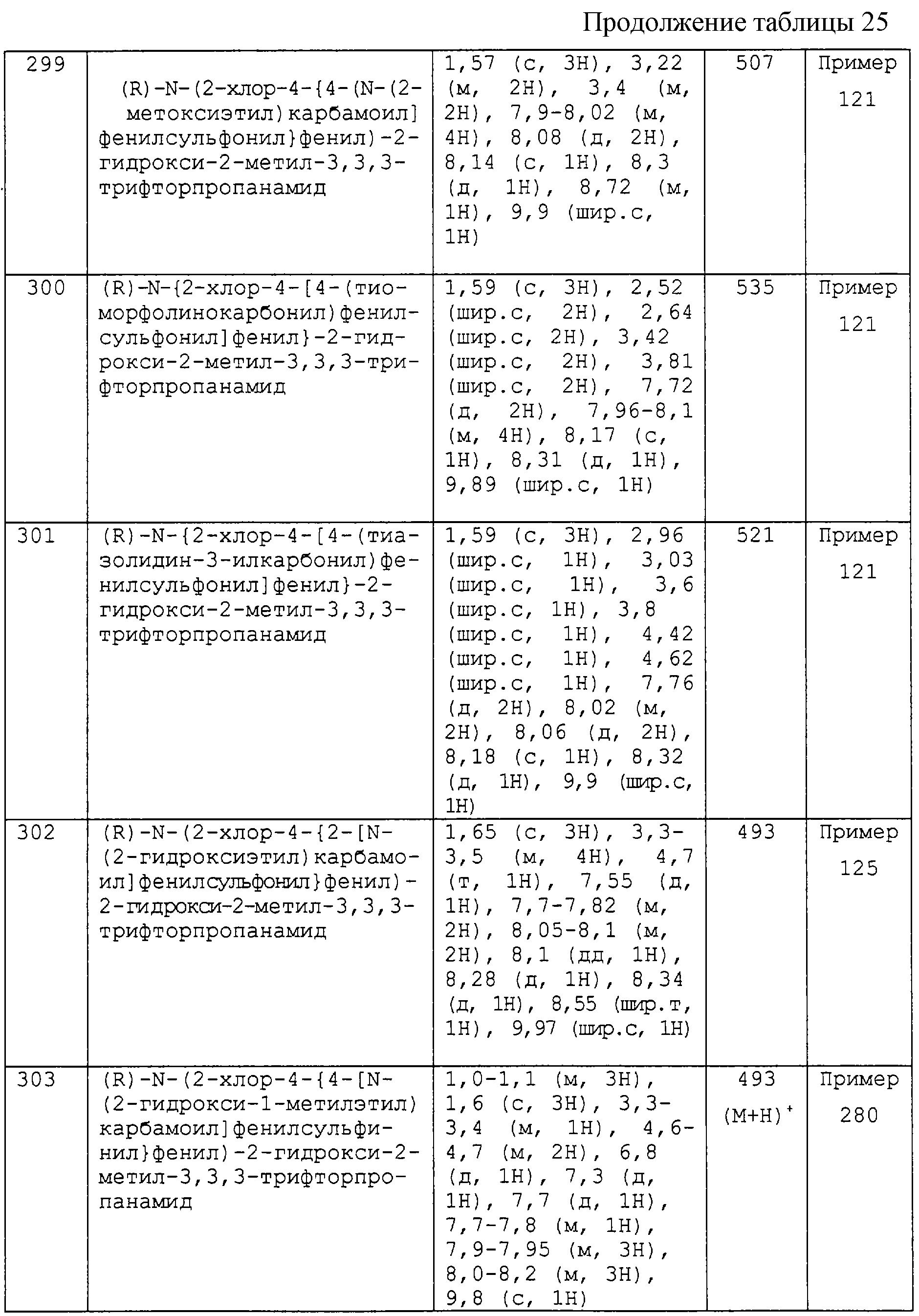








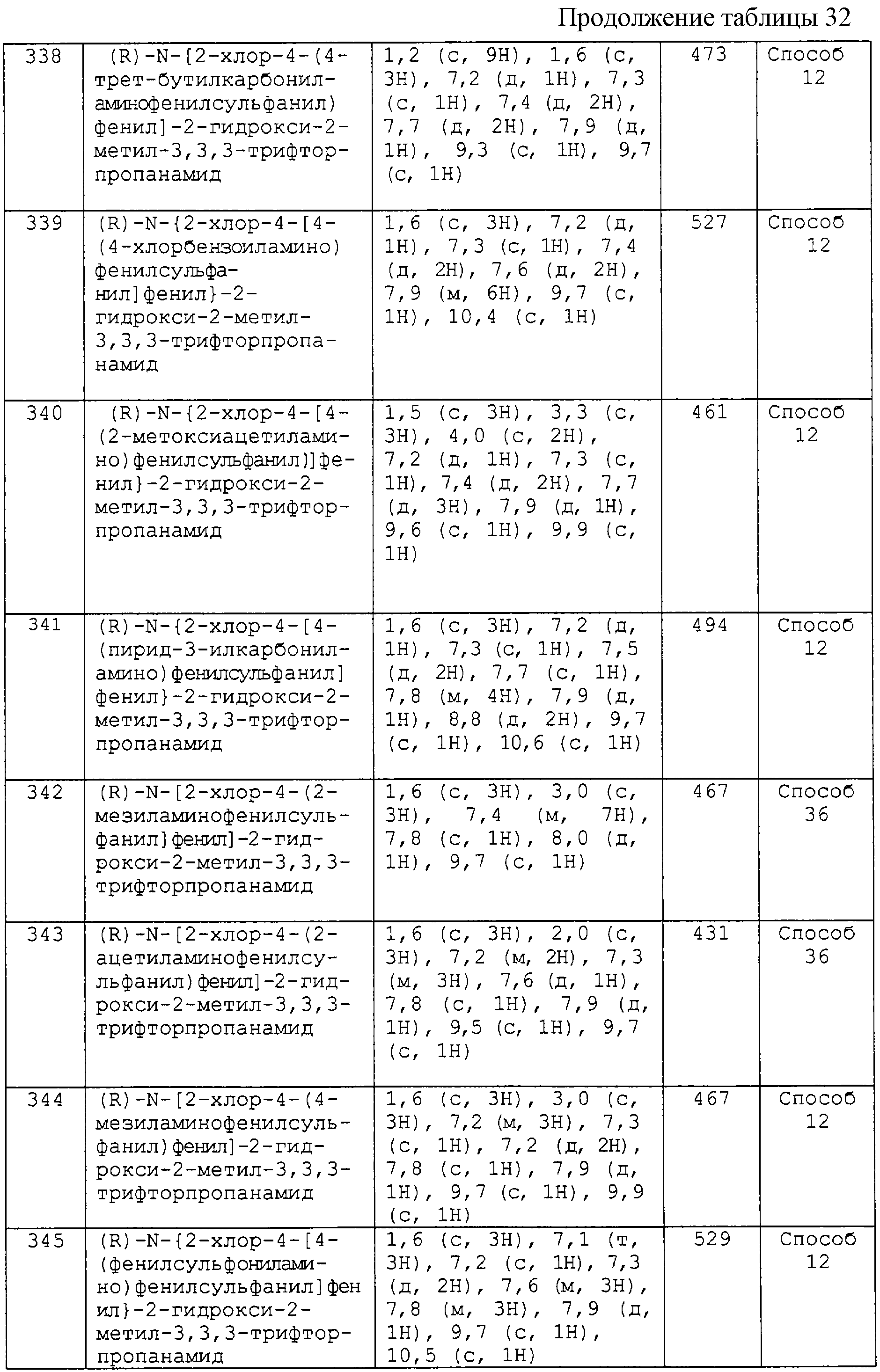







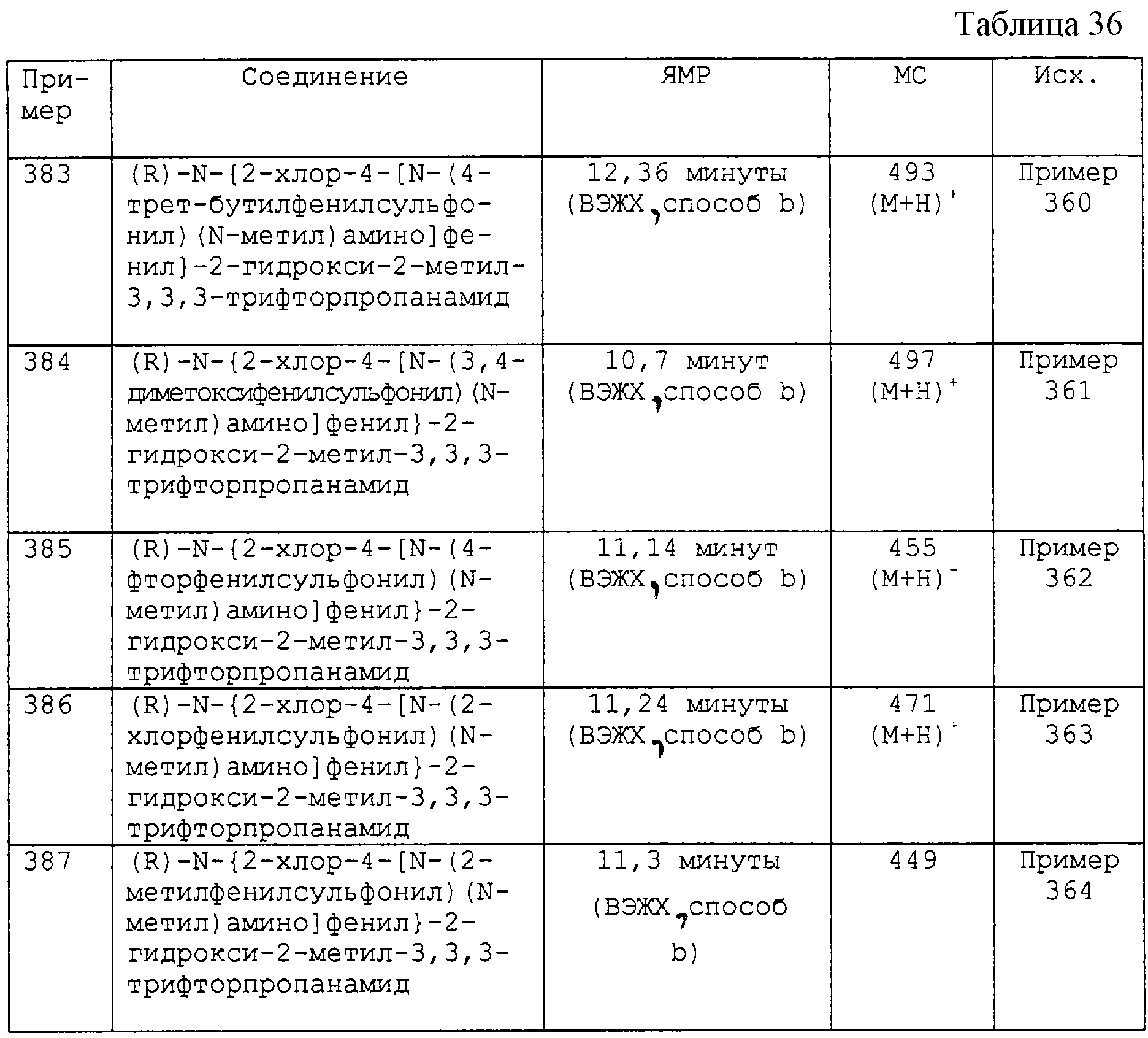


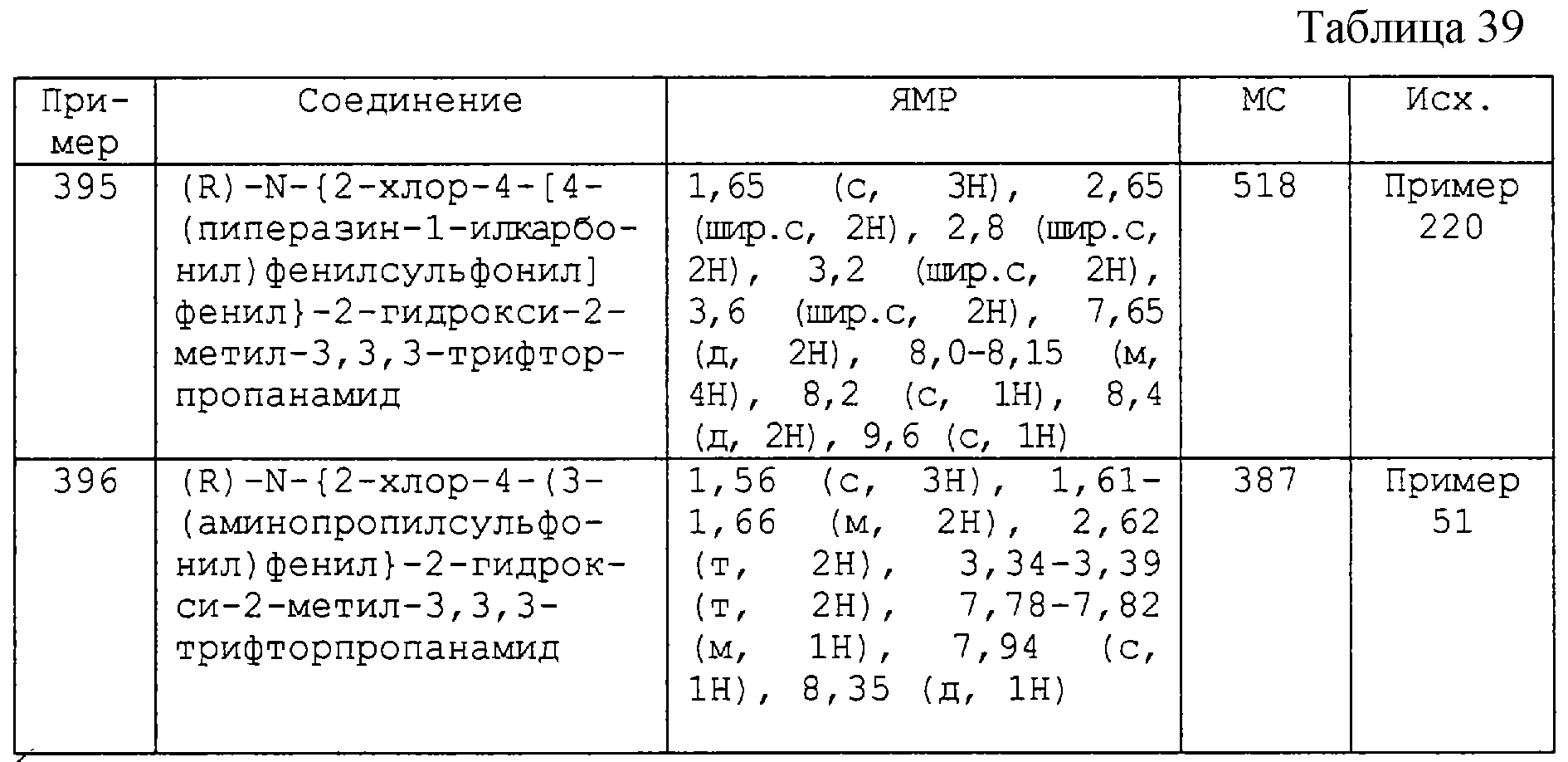








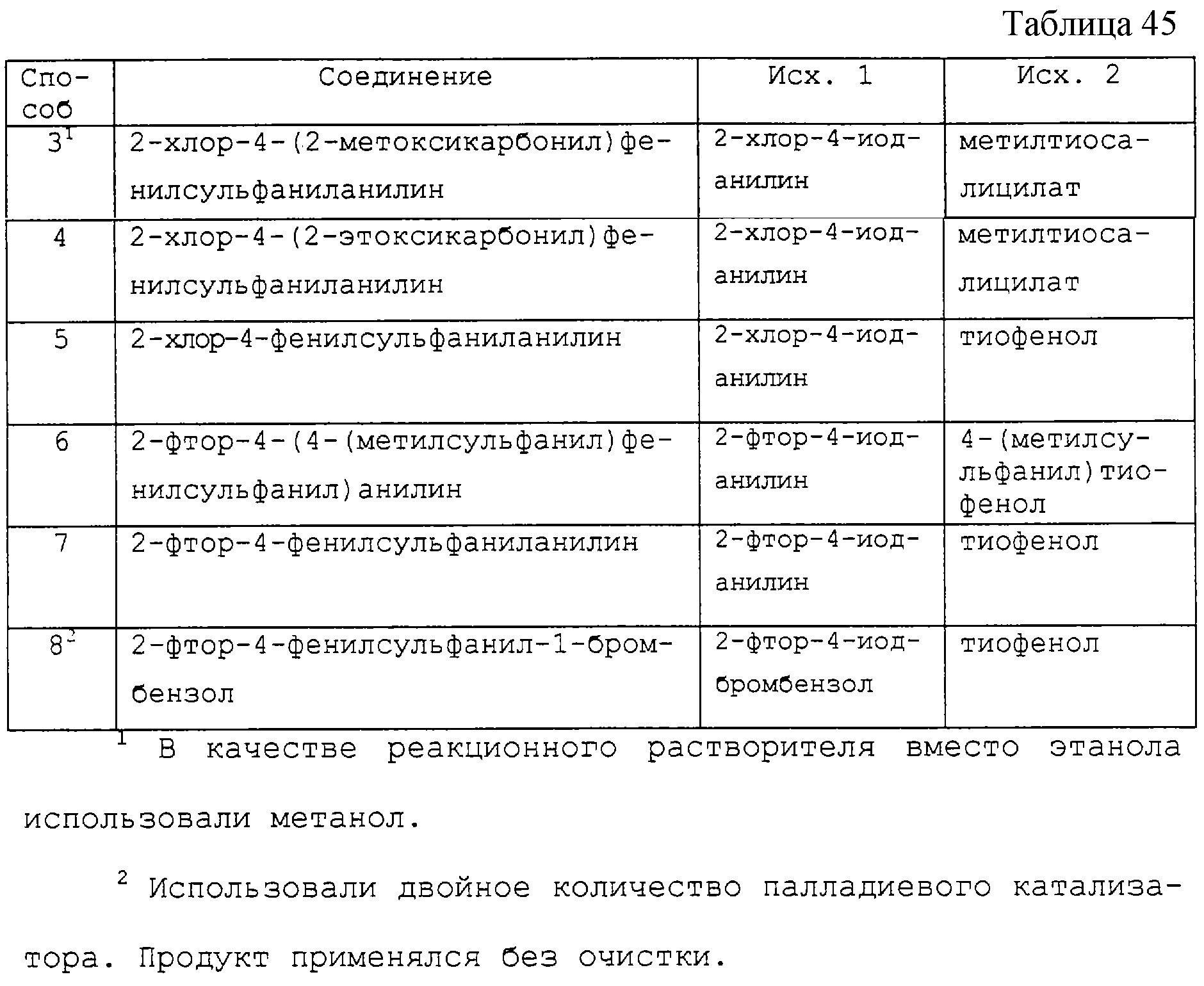




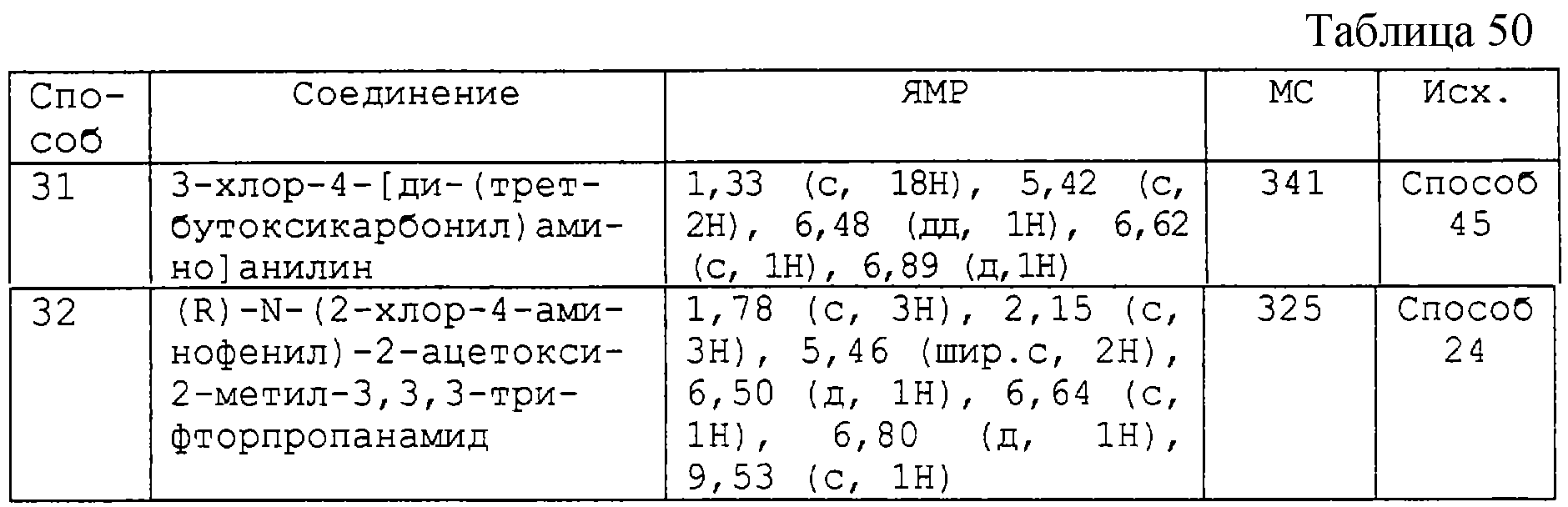

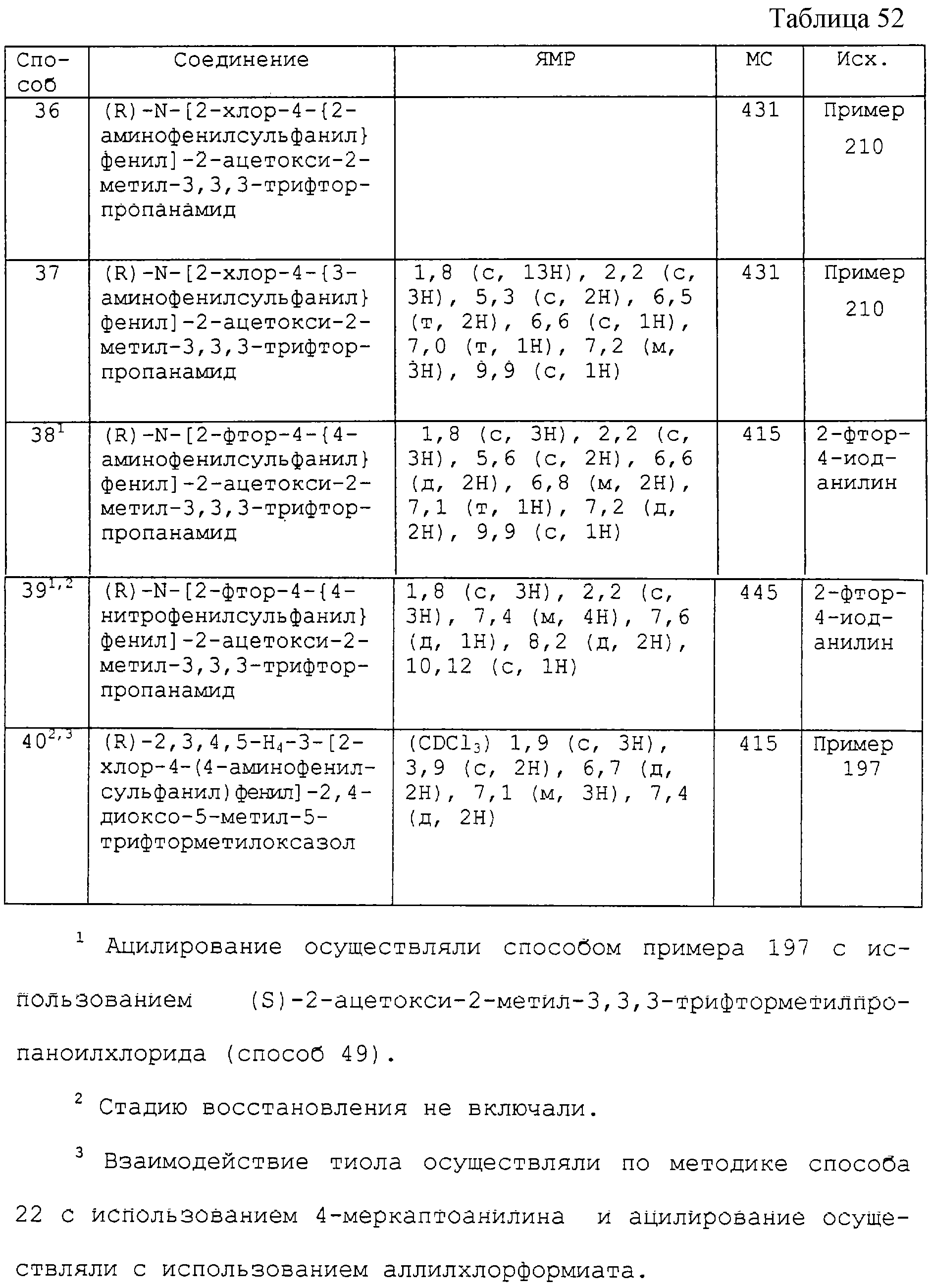
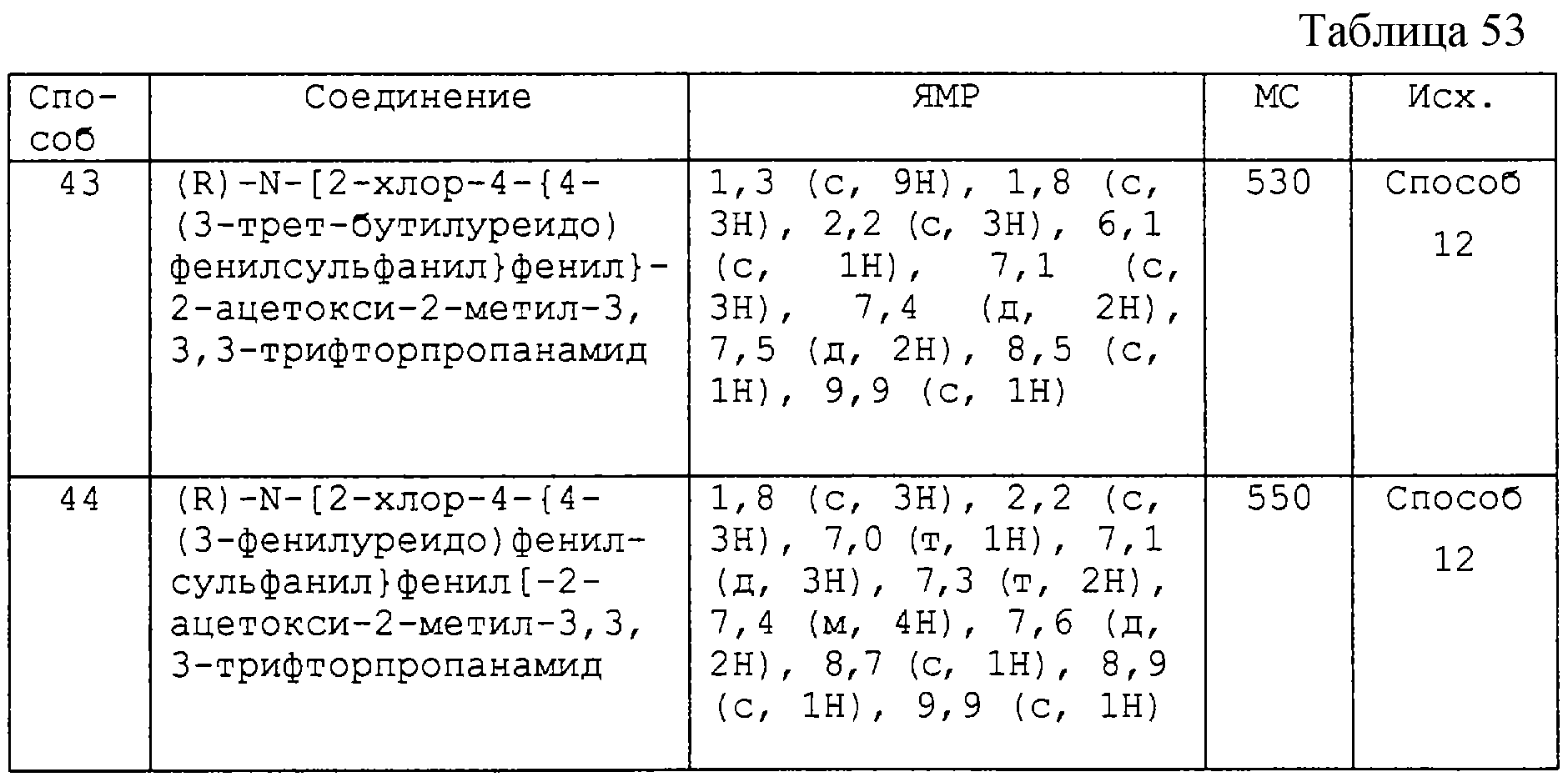

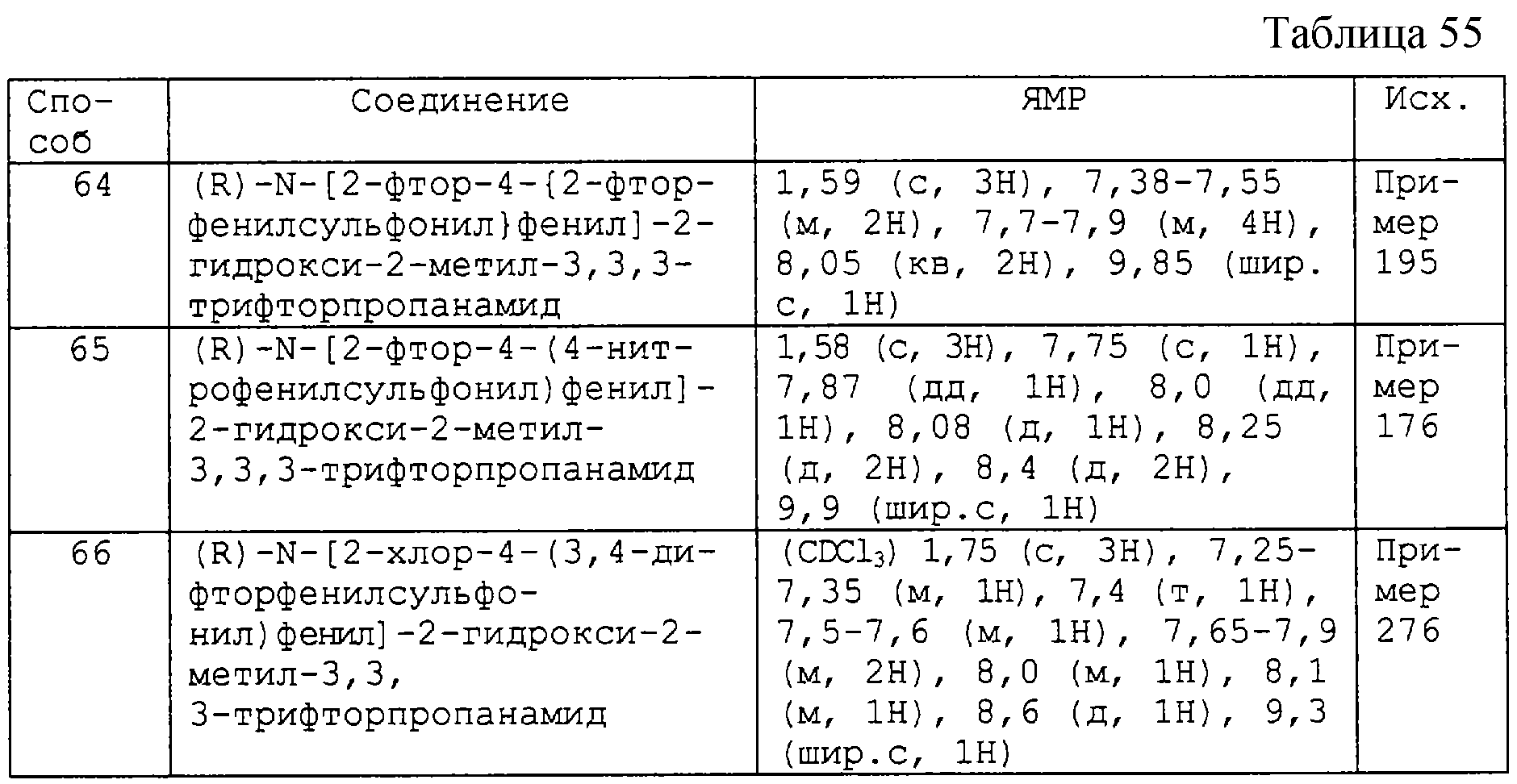



Реферат
Изобретение относится к области медицины и касается применения соединений формулы I для повышения активности пируватдегидрогеназы, что обеспечивает более эффективное лечение целого ряда заболеваний человека. 4 н. и 18 з.п. ф-лы, 61 табл.
Формула




Комментарии