Генетические маркеры для прогнозирования ответа на терапию поднимающими уровень hdl или имитирующими hdl агентами - RU2703192C2
Код документа: RU2703192C2
Чертежи

















Описание
Область изобретения относится к лечению или профилактике субъекта, страдающего сердечно-сосудистым расстройством.
Принятая двадцать лет концепция «универсальной терапии, подходящей всем» привела к появлению важных лекарственных препаратов, ставших лидерами продаж. Сегодня секвенирование генома человека и успехи технологии молекулярного профилирования позволяют перейти к более стратифицированному или персонализированному подходу в разработке лекарственных средств. Эти достижения позволяют разделить индивидов на субпопуляции, подверженные риску определенного заболевания, субпопуляции, в которых заболевание поддается определенному лечению, и субпопуляции, в которых заболевание не поддается определенному лечению или высок риск развития нежелательных явлений на фоне терапии. Таким образом, генетические тесты могут применяться, чтобы способствовать постановке диагноза, определению прогноза и выбору терапии. Многочисленные исследования показали зависимость между генотипом и ответом на фармакотерапию. Данный подход широко использовался в последние годы, в частности в онкологии, где был разработан ряд персонализированных терапевтических подходов, позволивших добиться значительного улучшения клинических результатов.
При сердечно-сосудистых заболеваниях стратификация популяции в зависимости от генотипа перед проведением определенных терапевтических вмешательств применяется редко. Одной из задач данного изобретения является демонстрация того, что популяция пациентов, страдающих сердечно-сосудистыми заболеваниями, может быть гетерогенной и, следовательно, по-разному реагировать на определенную терапию. Снижение LDL (от англ. low density lipoprotein, липопротеины низкой плотности) является важной терапевтической стратегией в контролировании сердечно-сосудистых заболеваний. Так, статины, снижающие LDL, такие как крестор, липитор, правахол и зокор, нашли широкое применение и являются наиболее часто выписываемыми лекарствами. Некоторое время назад полагали, что повышение уровня HDL (от англ. high density lipoprotein, липопротеины высокой плотности) также может оказывать терапевтическое воздействие при сердечно-сосудистых заболеваниях. Было разработано несколько поднимающих уровень HDL препаратов, в том числе, ниацин и ингибиторы белка-переносчика эстерифицированного холестерина, такие как торцетрапиб, анацетрапиб, эвацетрапиб и дальцетрапиб.
Белок-переносчик эстерифицированного холестерина (СЕТР, от англ. Cholesterylester transfer protein), также носит название белка, переносящего липиды плазмы, и представляет собой гидрофобный гликопротеин, который синтезируется в нескольких типах тканей, но преимущественно, в печени. СЕТР осуществляет перенос эфиров холестерина и триглицеридов между частицами липопротеинов плазмы в обоих направлениях. Первые свидетельства влияния активности СЕТР на липопротеины плазмы были получены при наблюдениях за людьми с генетически обусловленной недостаточностью СЕТР. Мутация СЕТР, являвшаяся причиной выраженного повышения C-HDL, была впервые выявлена в Японии в 1989 году. С тех пор было выявлено 10 мутаций, ассоциированных с недостаточностью СЕТР у азиатов и одна у европейцев. Оказалось, что в Японии 57% субъектов с уровнем С-HDL выше 100 мг/дл имеют мутации гена СЕТР. Кроме того, мутации гена СЕТР имеют 37% японцев с уровнем C-HDL от 75 до 100 мг/дл. Впоследствии, исследования на животных, получавших антитела к СЕТР, показали, что ингибирование СЕТР приводило к существенному повышению концентрации С-HDL. Позже обнаружили, что лекарственные ингибиторы СЕТР повышают концентрацию холестерина HDL и apoA-l (основного аполипопротеина HDL) у человека, что согласуется с данными наблюдений за пациентами с недостаточностью СЕТР, а также результатами исследований на кроликах, получавших антитело к СЕТР. Многочисленные эпидемиологические исследования, в том числе исследования мутаций у человека, выявили взаимосвязь между изменением активности СЕТР и риском ишемической болезни сердца (Hirano, K.I. Yamishita, S. and Matsuzawa Y. (2000) Curr. Opin. Lipido. 11(4), 389-396).
Атеросклероз и его клинические осложнения, включая ишемическую болезнь сердца (ИБС), инсульт и заболевание периферических сосудов, тяжким бременем ложатся на системы здравоохранения во всем мире. Лекарства, ингибирующие СЕТР (ингибиторы СЕТР), в течение некоторого времени находились в разработке в расчете на их эффективность в лечении или предупреждении атеросклероза. Ряд классов ингибиторов СЕТР, включая дальцетрапиб, торцетрапиб, анацетрапиб, эвацетрапиб, BAY 60-5521 и другие (Таблица 1), продемонстрировали способность повышать HDL, снижать LDL у человека и оказывать терапевтическое воздействие при лечении атеросклероза и сердечно-сосудистых заболеваний.
Однако, есть данные, что эти лекарства безопасны и эффективны не для всех пациентов. Клинические исследования торцетрапиба были остановлены на III фазе по причине более высокой смертности среди пациентов, одновременно получавших торцетрапиб и аторвастатин, по сравнению с пациентами, получавшими аторвастатин в виде монотерапии. Клиническое исследование дальцетрапиба также было прекращено на III фазе, в данном случае из-за отсутствия эффективности по сравнению с монотерапией статинами. Другие ингибиторы СЕТР по-прежнему находятся на стадии клинических исследований или на более ранних стадиях разработки. В целом, стратегии терапии с использованием ингибиторов СЕТР, обеспечивающих большую эффективность и меньше побочных эффектов, могут оказаться эффективными в клинической практике. Существует потребность в биомаркерах, способах и стратегиях предсказания ответа на ингибиторы СЕТР и оценки риска нежелательных явлений, связанных с введением ингибиторов СЕТР.
Ингибиторы СЕТР могут найти применение в лечении и/или профилактике атеросклероза, заболевания периферических сосудов, дислипидемии, гипербеталипопротеинемии, гипоальфалипопротеинемии, гиперхолестеринемии, гипертриглицеридемии, семейной гиперхолестеринемии, сердечно-сосудистых заболеваний, стенокардии, ишемии, ишемии сердца, инсульта, инфаркта миокарда, реперфузионного повреждения, рестеноза после ангиопластики, гипертензии и сосудистых осложений диабета, ожирения или эндотоксемии.
Клинические исследования показали, что отклик пациентов на лечение лекарственными препаратами зачастую бывает гетерогенным. Существует острая необходимость усовершенствования разработки лекарственных препаратов, клинических разработок и терапевтического эффекта лекарственных препаратов для отдельных пациентов или категорий пациентов. Для выявления пациентов, наиболее подходящих для терапии конкретными фармацевтическими агентами, можно использовать однонуклеотидные полиморфизмы (ОНП) (эту область исследований часто называют «фармакогеномикой»). Также, ОНП можно использовать для исключения пациентов из определенной терапии вследствие повышенной вероятности развития токсических побочных эффектов или вероятности отсутствия у них отклика на лечение. Фармакогеномика также может применяться в фармацевтических исследованиях и способствовать разработкам лекарств и процессу отбора. Linder et al, Clinical Chemistry 43:254 (1997); Marshall, Nature Biotechnology 15:1249 (1997); международная заявка на патент WO 97/40462, Spectra Biomedical; and Schafer et al, Nature Biotechnology 16:3 (1998).
Исследование заболеваемости и смертности на фоне приема дальцетрапиба (dal-OUTCOMES) было двойным слепым рандомизированным плацебо-контролируемым многоцентровым исследованием на параллельных группах пациентов со стабильной ИБС, недавно госпитализированных по поводу острого коронарного синдрома (ОКС). Исследование проводили для проверки гипотезы, что ингибирование СЕТР будет снижать риск повторных сердечно-сосудистых событий у пациентов с недавно имевшим место ОКС за счет повышения уровня C-HDL благодаря ингибированию СЕТР. Удовлетворяющие критериям пациенты включались в простое слепое исследование с назначением плацебо в течение подготовительного периода, длившегося от 4 до 6 недель, для стабилизации состояния пациентов и завершения запланированных процедур реваскуляризации. После окончания подготовительного периода удовлетворяющих критериям пациентов в стабильном состоянии рандомизировали в соотношении 1:1 в группы, где наряду с оказанием научно-обоснованной медицинской помощи по поводу ОКС назначали 600 мг дальцетрапиба или плацебо. Дальцетрапиб представляет собой ингибитор белка-переносчика эстерифицированного холестерина (СЕТР). Показано, что он индуцирует дозозависимое снижение активности СЕТР и повышает уровень C-HDL у некоторых видов животных и у человека. Снижение активности СЕТР разными способами продемонстрировало антиатеросклеротический эффект в нескольких моделях на животных. Исследование было прекращено в мае 2012 Независимым комитетом по мониторингу данных как бесперспективное. В исследовании dal-OUTCOMES были получены неожиданные результаты, связанные с прогрессированием сердечно-сосудистых заболеваний. Несмотря на повышение C-HDL, у пациентов, получавших лечение, существенного уменьшения частоты сердечно-сосудистых событий не наблюдалось, и исследование было прекращено.
После остановки исследования dal-OUTCOMES была выдвинута гипотеза, что подгруппа пациентов, участвовавших в исследовании, по-разному реагировала на дальцетрапиб, и что дальцетрапиб мог оказывать значимое терапевтическое воздействие на субпопуляцию пациентов. Для изучения межиндивидуальной вариабельности ответа на дальцетрапиб и выявления генетических маркеров, предсказывающих ответ на терапию дальцетрапибом или другими ингибиторами СЕТР для стратификации пациентов и выбора лечения, провели фармакогеномное исследование пациентов, участвовавших в исследовании dal-OUTCOMES.
В данном изобретении предложены способы генотипирования, реагенты и композиции для выбора индивидуумов, которым терапия поднимающим уровень HDL или имитирующим HDL агентом, в частности, ингибитором/модулятором СЕТР, может принести пользу, в частности, когда индивидуум страдает сердечнососудистым расстройством. В изобретении также предложены способы лечения пациентов, страдающих сердечно-сосудистым расстройством, включающие генотипирование, и выбора пациентов, которым терапия поднимающим уровень HDL или имитирующим HDL агентом, в частности, ингибитором/модулятором СЕТР, может принести пользу. Неожиданно, фармакогеномное исследование когорты пациентов dal-OUTCOMES позволило обнаружить однонуклеотидные полиморфизмы (ОНП), генетические маркеры, ассоциированные с ответом индивидуума на дальцетрапиб, которые могут найти применение в предсказании ответа на терапию поднимающим уровень HDL или имитирующим HDL агентом (в частности, ингибитором/модулятором СЕТР) и в лечении пациентов поднимающим уровень HDL и имитирующим HDL агентом (в частности, ингибитором/модулятором СЕТР).
В изобретении также предложены способы лечения или предупреждения сердечно-сосудистого расстройства, включающие введение субъекту, которому это необходимо, поднимающего уровень HDL или имитирующего HDL агента, в количестве, эффективном для лечения или предупреждения сердечно-сосудистого расстройства, где субъект имеет полиморфизм по rs11647778 гена ADCY9 субъекта. В некоторых воплощениях пациент имеет rs11647778 с генотипом СС. В некоторых воплощениях поднимающий уровень HDL или имитирующий HDL агент представляет собой ниацин, фибраты, глитазон, дальцетрапиб, анацетрапиб, эвацетрапиб, DEZ-001, АТН-03, DRL-17822 (Dr. Reddy"s), DLBS-1449, RVX-208, CSL-112, CER-001 или ApoA1-Milano.
Генетические маркеры, выявленные способами генотипирования по изобретению, включают: 20 ОНП, которые могут присутствовать в гене аденилатциклазы 9 типа (ADCY9) на хромосоме 16, rs11647778 и, возможно, rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs2531971, rs2238448, rs12599911, rs12920508, или rs13337675, в частности, rs11647778 или rs1967309, находящиеся в сильном неравновесном сцеплении друг с другом (r2=0,79)
Другие генетические маркеры по изобретению включают ОНП гена ADCY9, которые либо находятся в неравновесном сцеплении с rs11647778 или rs1967309, либо ассоциированы с клиническими событиями со статистической значимостью Р<0,05, и могут служить полезными суррогатными биомаркерами rs11647778 или rs1967309. В одном воплощении детектируют суррогатный биомаркер, представляющий собой ОНП, унаследованный в неравновесном сцеплении с rs11647778 или rs1967309, и делают заключение о генотипе rs11647778 или rs1967309.
Данное изобретение относится к способам генотипирования пациентов и/или лечения пациентов поднимающим уровень HDL лекарственным средством, в частности, ингибитором СЕТР. В конкретных воплощениях способы включают оценку генотипа пациента по rs11647778. Три генотипа по rs11647778 позволяют предсказать ответ индивидуума на поднимающее уровень HDL лекарственное средство, в частности, ингибитор СЕТР: СС, CG и GG. Из них генотип СС ассоциирован с лучшим ответом пациента на терапию среди пациентов, получавших поднимающее уровень HDL лекарственное средство, генотип CG ассоциирован с частичным ответом, а генотип GG ассоциирован с отсутствием ответа. В контексте данного изобретения пациентам, несущим генотип СС, лечение поднимающим уровень HDL лекарственным средством может приносить пользу; пациентам, несущим генотип CG, лечение поднимающим уровень HDL лекарственным средством может приносить пользу, а пациентам, несущим генотип GG, лечение поднимающим уровень HDL лекарственным средством не может приносить пользу. Два генотипа rs11647778, СС и CG, указывают на ответ на терапию ингибитором СЕТР, в частности, дальцетрапибом, у пациентов, страдающих сердечно-сосудистым расстройством. В частности, СС генотип rs11647778 указывают на более выраженный ответ на терапию ингибитором СЕТР, в частности, дальцетрапибом, у пациентов, страдающих сердечно-сосудистым расстройством.
Данное изобретение относится к молекулам нуклеиновых кислот, содержащим полиморфизмы или варианты генов, вариантам белков, кодируемым указанными молекулами нуклеиновых кислот, реагентам для выявления полиморфных молекул нуклеиновых кислот и к способам применения молекул нуклеиновых кислот и белков, а также к способам применения реагентов для их выявления (например, праймеров и зондов для применения в способах генотипирования по изобретению).
В одном воплощении изобретения предложены способы детекции вариантов генов по изобретению и реагенты для детекции, такие как зонды или праймеры для применения в указанных способах.
В частности, в изобретении предложены генетические маркеры, ассоциированные с ответом на терапию поднимающим уровень HDL или имитирующим HDL агентом, в частности, ингибитором/модулятором СЕТР, и искусственно синтезированные молекулы нуклеиновых кислот (включая молекулы ДНК и РНК), содержащие предложенные варианты генов. В изобретении также предложены варианты белков, кодируемые молекулами нуклеиновых кислот, содержащими указанные варианты генов, антитела к кодируемым вариантам белков, компьютерные системы и системы хранения данных, содержащие информацию о новых генетических вариантах или ОНП, способы детектирования указанных ОНП в исследуемом образце, способы выявления индивидуумов, отвечающих на терапию при введении поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, на основании наличия или отсутствия одного или более предложенных вариантов генов или детектирования одного или нескольких кодируемых вариантов продуктов (например, транскриптов мРНК или вариантов белков), и способы лечения индивидуумов, страдающих сердечно-сосудистыми заболеваниями, являющихся носителями одного или нескольких предложенных вариантов генов.
Примеры воплощений данного изобретения также включают способы выбора или назначения режима терапии (например, способы определения, следует ли назначать индивидууму терапию поднимающим уровень HDL или имитирующим HDL агентом, в частности, ингибитором/модулятором СЕТР).
В различных воплощениях данного изобретения также предложены способы отбора индивидуумов, которым можно вводить поднимающий уровень HDL или имитирующий HDL агент (в частности, ингибитор/модулятор СЕТР) в составе терапии на основании генотипа пациента и способы отбора индивидуумов для участия в клиническом исследовании поднимающего уровень HDL или имитирующего HDL агента (в частности, ингибитора/модулятора СЕТР) на основании генотипа индивидуума (например, отбора для участия в исследовании индивидуумов, которые наиболее вероятно будут хорошо реагировать на терапию и/или исключения из исследования индивидуумов, у которых хороший ответ на терапию маловероятен, на основании их генотипов, в частности, СС генотипа rs11647778, ТТ генотипа rs2238448, и/или АА генотипа rs1967309, или отбора индивидуумов, у которых хороший ответ маловероятен, для участия в клиническом исследовании альтернативного препарата, способного принести им пользу.
Молекулы нуклеиновых кислот по изобретению можно встраивать в экспрессирующий вектор для получения вариантов белков в клетке-хозяине. Таким образом, в изобретении также предложен вектор, включающий в себя предложенную ОНП-содержащую молекулу нуклеиновой кислоты, генетически модифицированную клетку-хозяина, содержащую вектор, и способы экспрессии рекомбинантного варианта белка с использованием таких клеток-хозяев. В другом конкретном воплощении клетки-хозяева, ОНП-содержащие молекулы нуклеиновых кислот и/или варианты белков могут применяться в качестве мишеней в способах скрининга или идентификации терапевтических агентов, которые представляют собой поднимающие уровень HDL или имитирующие HDL агенты (в частности, ингибиторы/модуляторы СЕТР).
Примеры ОНП ADCY9, которые можно выявить/оценить предложенным способом для выявления лучшего ответа на дальцетрапиб или для лечения или предупреждения сердечно-сосудистого заболевания у пациента, представляют собой ОНП, в которых мутация приводит к замене нуклеотидной последовательности в позиции 4,062,592, 4,065, 583, 4,059,439 и 4,051,380 (геном сборки GRCh37.p5), также известным под названием однонуклеотидных полиморфизмов с идентификаторами rs12595857, rs1967309, rs2238448 и rs11647778, соответственно, как показано в SEQ. ID. NO. 1, 19 и 21.
Данное изобретение основано на выявлении генетических полиморфизмов, позволяющих предсказать повышенную вероятность того, что лечение поднимающим уровень HDL или имитирующим HDL агентом, в частности, ингибитором/модулятором СЕТР, может оказать благотворное влияние на пациентов, страдающих сердечно-сосудистыми расстройствами.
Фиг. 1. ОНП rs1967309 сильно ассоциирован с уменьшением числа сердечно-сосудистых событий (летальный исход по причине ишемической болезни сердца, реанимация при остановке сердечной деятельности, нефатальный инфаркт миокарда, нефатальный ишемический инсульт, нестабильная стенокардия или непредвиденная реваскуляризация коронарных артерий) у пациентов, получавших ингибитор СЕТР дальцетрапиб. На Фиг. показаны результаты полногеномного поиска ассоциаций у пациентов из группы, получавшей дальцетрапиб, в исследовании dal-OUTCOMES. Панель А: график типа Манхэттен показывает наличие сильного сигнала в области гена ADCY9 на хромосоме 16. Каждая точка представляет значение Р, полученное при анализе взаимосвязи между ОНП с частотой минорного аллеля >0,05 и возникновением сердечно-сосудистых событий в ходе лечения, при помощи модели пропорциональных рисков Кокса, с поправкой на пол и 5 главных компонент, описывающих генетическое происхождение. Панель Б: результаты для однонуклеотидных полиморфизмов в области ADCY9 и 6 предсказанных ОНП со значениями Р<10-6. На оси X показано расположение гена ADCY9 на хромосоме 16. На левой оси Y показаны взятые с отрицательным знаком показатели десятичного логарифма значений Р, полученные в рамках регрессионной логистической модели и взвешенные с учетом вероятности предсказания при сравнении субъектов с наличием и отсутствием сердечнососудистых событий. На правой оси Y показана частота рекомбинации. Степень неравновесия по сцеплению представлена показателем r2, который оценивали на референтных образцах CEU из базы данных НарМар (показан градиентом серого).
Фиг. 2. Частота сердечно-сосудистых событий (первичный составной исход в dal-OUTCOMES или незапланированная реваскуляризация коронарных артерий) по окончании исследования отдельно для групп, получавших дальцетрапиб и плацебо, и для генотипов rs1967309 гена ADCY9. Показана частота событий, выраженная в процентах, с 95% ДИ.
Фиг. 3. Кумулятивная частота сердечно-сосудистых событий (первичный составной исход в dal-OUTCOMES или незапланированная реваскуляризация коронарных артерий) отдельно для групп, получавших дальцетрапиб и плацебо, стратифицированная по трем генотипам ОНП rs1967309 гена ADCY9 (GG, AG, АА).
Фиг. 4. Показаны изменения уровня липидов на протяжении 24 месяцев в зависимости от генотипа на фоне терапии дальцетрапибом. Панель А. Среднее ± стандартна ошибка среднего (мг/дл) изменения липидных показателей через 1 месяц по сравнению с исходным в группах генотипов ОНП ADCY9 rs1967309 в группе дальцетрапиба. Приведены значения Р, полученные с помощью одномерных статистических методов, при анализе изменений липидных показателей в зависимости от генотипа. Панель Б. Среднее ±95% ДИ для абсолютных показателей C-LDL в группе пациентов, получавших дальцетрапиб, в периоде наблюдения в исследовании dal-Outcomes. Значения Р получены с помощью смешанной многомерной регрессионной модели.
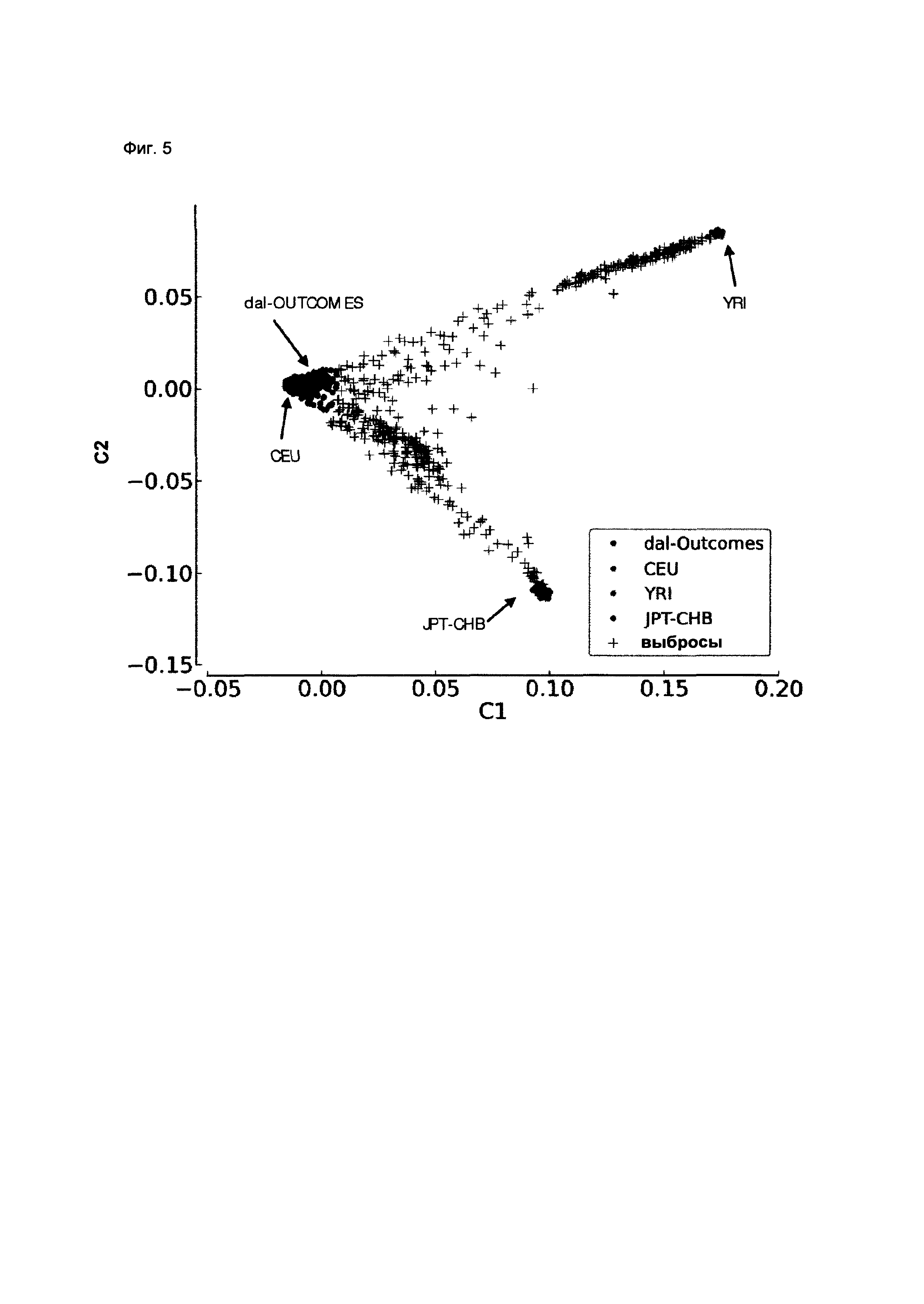
Фиг. 5. График многомерного шкалирования, показывающий первые две координаты (С1, С2) для 76 854 ОНП у 6297 индивидуумов, участвовавших в генетическом исследовании dal-Outcomes, а также 83 представителей популяции CEU, 186 JPT-CHB и 88 представителей популяции YRI из базы данных «1000 genome». Из массива данных исключили 436 субъектов, выпадающих из этнических групп (обозначены +), также показаны образцы из исследования dal-Outcomes, вошедшие в анализ.
Фиг. 6 График, построенный для первых десяти компонент, объясняющих генетическое разнообразие, выделенных методом главных компонент при анализе 76 854 ОНП у 6297 индивидуумов, участвовавших в генетическом исследовании dal-Outcomes, а также 83 представителей популяции CEU, 186 JPT-CHB и 88 представителей популяции YRI из базы данных «1000 genome».
Фиг. 7. График квантиль-квантиль (QQ) наблюдаемых -log10 (значений Р) относительно ожидаемых согласно нулевой гипотезе при полногеномном поиске ассоциаций ОНП с частотой минорного аллеля ≥0,05. Заштрихованная область обозначает зону, в которой сосредоточены 95% значений при расчете 2,5 и 97,5 процентилей распределения согласно нулевой гипотезе. Точками обозначены ранжированные значения Р, полученные с помощью модели пропорциональных рисков Кокса, для времени наступления сердечно-сосудистых событий у участников в группе дальцетрапиба, с поправкой на пол и 5 главных компонент, описывающих генетическое происхождение. Наблюдаемое значение увеличивающего множителя (т.н. genomic inflation factor), характеризующего распределение статистики критерия, составляло 1,01.
Фиг. 8. Показаны значения r2, характеризующие неравновесие по сцеплению 27 генотипированных ОНП гена ADCY9, блоки неравновесия по сцеплению, рассчитанные с помощью метода доверительных интервалов (показаны черным) и показатель D' (показан оттенками красного). Неравновесие по сцеплению для 5686 европеоидов в исследовании dal-Outcomes.
Фиг. 9. Показаны значения r2, характеризующие неравновесие по сцеплению 27 генотипированных ОНП гена ADCY9, блоки неравновесия по сцеплению, рассчитанные с помощью метода доверительных интервалов (показаны черным) и показатель D' (показан оттенками красного). Неравновесие по сцеплению для 386 участников исследования dal-Plaque-2.
Фиг. 10. График типа Манхэттен, демонстрирующий взаимосвязь вариантов генов с событиями (первичная комбинированная конечная точка) в группе, получавшей дальцетрапиб в dal-Outcomes, где в рамках логистической регрессионной модели использовали ожидаемое число копий «аллелей риска» предсказанных ОНП, анализ проводили с помощью программы PLINK и вносили поправку на пол и 5 главных компонент, описывающих генетическое происхождение.
В данном описании изложены различные признаки и воплощения данного изобретения, однако для специалиста в соответствующей области техники не составит труда на основе изложенной информации найти другие признаки изобретения, варианты и эквиваленты. Описанное изобретение не ограничивается приведенными примерами и воплощениями, специалисту в области техники будут очевидны различные альтернативные варианты. В данном документе все термины в единственном числе охватывают термины во множественном числе, за исключением случаев, когда из контекста не следует противоположное. Например, термин «клетка» также охватывает термин «клетки».
Термин «приблизительно», употребляемый при упоминании численных значений, означает упомянутые численные значения плюс или минус 10% включительно от упомянутого численного значения. Например, «приблизительно 100» означает от 90 до 110.
«Аллель» означает одну или несколько альтернативных форм указанного гена. В диплоидной клетке или организме представители аллельной пары (т.е. двух аллелей данного гена) занимают соответствующие позиции (локусы) в паре гомологичных хромосом и если указанные аллели генетически идентичны, говорят, что клетка или организм «гомозиготны», а если они генетически различны, то говорят, что клетка или организм «гетерозиготны» по конкретному гену.
«Ген» представляет собой упорядоченную последовательность нуклеотидов, расположенных в конкретной позиции на конкретной хромосоме, кодирующую определенный функциональный продукт и может включать нетранслируемые и нетранскрибируемые последовательности, расположенные вблизи кодирующих областей. Такие некодирующие последовательности могут содержать регуляторные последовательности, необходимые для транскрипции и трансляции последовательности или интрона и т.д., или могут выполнять любую присущую им функцию, помимо возникновения ОНП, представляющего интерес.
«Генотипирование» означает определение генетической информации, которую несет индивидуум в одной или нескольких позициях генома. Например, генотипирование может включать определение, какой аллель или аллели одного ОНП несет индивидуум, или определение, какой аллель или аллели нескольких ОНП несет индивидуум. Например, нуклеотидами rs1967309 могут быть А у одних индивидуумов и G у других индивидуумов. Индивидуумы, у которых в указанной позиции присутствует А, имеют аллель А, а те, у которых присутствует G, имеют аллель G. У диплоидного организма индивидуум будет иметь две копии последовательности, включающей в себя полиморфную позицию, таким образом, индивидуум может иметь аллель А и аллель G, либо, в альтернативном случае, две копии аллеля А или две копии аллеля G. Те индивидуумы, которые имеют две копии аллелей G, являются гомозиготными по аллелю G, те индивидуумы, которые имеют две копии аллелей А, являются гомозиготными по аллелю А, а те индивидуумы, которые имеют по одной копии каждого аллеля, являются гетерозиготными. Основной аллель часто обозначают аллелем А, а минорный аллель - аллелем В. Генотипы могут представлять собой АА (гомозиготный по А), ВВ (гомозиготный по В) или АВ (гетерозиготный). Способы генотипирования обычно позволяют идентифицировать образец как АА, ВВ или АВ.
Термин «содержащий» означает, что композиции и способы включают указанные элементы, но не исключают других элементов.
«Поднимающий уровень HDL или имитирующий HDL агент» относится к соединениям, которые повышают уровень HDL посредством одного из следующих механизмов: ингибируют/модулируют СЕТР, выступают агонистом PPAR, выступают агонистом LXR, выступают агонистом НМ74 (рецептора ниацина), выступают агонистом рецептора тиреотропного гормона, ингибируют липазы и катаболизм HDL, являются индукторами АроА1, к соединениям, которые обеспечивают по меньшей мере одну из атеропротекторных функций HDL, как соединения, которые усиливают отток липидов (холестерина и/или фосфолипидов) из клеток, обладают антиоксидантной и противовоспалительной активностью. В частности, имитирующий HDL агент представляет собой АроА1 и производное АроА1 (такое как ароА1 Milano, АроА1 Paris) и другие аналоги, реконструированные HDL, содержащие АроА1 и/или ApoAII и соответствующие липиды, такие как фосфолипиды. АроЕ, производные, аналоги и пептидомиметики амфипатических липопротеинов. Примерами «поднимающего уровень HDL или имитирующего HDL агента» являются ниацин, фибраты, глитазон, дальцетрапиб, анацетрапиб, эвацетрапиб, DEZ-001 (ранее известный как ТА-8995) (Mitsubishi Tanabe Pharma), АТН-03 (Affris), DRL-17822 (Dr. Reddy's), DLBS-1449 (Dexa Medica), RVX-208 (Resverlogix), CSL-112 (Cls Behring), CER-001 (Cerenis), ApoA1-Milano (Medicine Company). Конкретными примерами «поднимающего уровень HDL или имитирующего HDL агента» являются ниацин, фибраты, глитазон, дальцетрапиб, анацетрапиб, эвацетрапиб, торцетрапиб, предпочтительно, ниацин, фибраты, глитазон, дальцетрапиб, анацетрапиб или эвацетрапиб. Более конкретно, поднимающий уровень HDL или имитирующий HDL агент выбран из ингибитора/модулятора СЕТР. Примерами ингибитора/модулятора СЕТР являются дальцетрапиб, анацетрапиб, эвацетрапиб, DEZ-001 (ранее известный как ТА-8995) (Mitsubishi Tanabe Pharma), ATH-03 (Affris), DRL-17822 (Dr. Reddy's), DLBS-1449 (Dexa Medica). Более конкретно, примерами ингибитора/модулятора СЕТР являются дальцетрапиб, анацетрапиб, эвацетрапиб и торцетрапиб, предпочтительно, дальцетрапиб, анацетрапиб и эвацетрапиб. Более конкретно, поднимающий уровень HDL или имитирующий HDL агент по изобретению будет относиться к ингибитору/модулятору СЕТР, особенно когда ингибитором/модулятором СЕТР является дальцетрапиб.
«Ингибитор/модулятор СЕТР» обозначает соединение, понижающее активность СЕТР (которую оценивают стандартными методами исследования переноса липидов), за счет ингибирования СЕТР и/или индукции конформационных изменений полипептида СЕТР после связывания с полипептидом СЕТР. Конформационные изменения полипептида СЕТР опосредуют функциональную активность СЕТР, ускоряют кругооборот частиц HDL, увеличивая образование насцентных (формирующихся, или незрелых) пре-бета HDL. Предпочтительно, ингибитор/модулятор СЕТР относится ко всем соединениям, которые связываются с цистеином 13 полипептида СЕТР. Более предпочтительно, «ингибитор/модулятор СЕТР» выбран из S-[2-[1-(2-этилбутил)циклогексилкарбониламино]-фенил] 2-метилтиопропионата, (2-меркапто-фенил)-амида 1-(2-этил-бутил)-циклогексанкарбоновой кислоты и/или бис [2-[1-(2-этилбутил)циклогексилкарбониламино]фенил] дисульфида. Более предпочтительно, «ингибитор/модулятор СЕТР» представляет собой S-[2-[1-(2-этилбутил)циклогексилкарбониламино]-фенил]2-метилтиопропионат, как пролекарство, или (2-меркапто-фенил)-амид 1-(2-этил-бутил)-циклогексанкарбоновой кислоты, как его активный метаболит.
«Анацетрапиб» относится к ((4S,5R)-5-[3,5-бис(трифторметил)фенил]-3-{[4'-фтор-2'-метокси-5'-(пропан-2-ил)-4-(трифторметил)[1,1'-бифенил]-2-ил]метил}-4-метил-1,3-оксазолидин-2-ону), также известному как МК 0859, CAS 875446-37-0 или соединению формулы (ХА).

Анацетрапиб, а также способы получения и применения соединения описаны в WO 2006/014413, WO 2006/014357, WO 2007005572.
«Эвацетрапиб» относится к транс-4-({(5S)-5-[{[3,5-бис(трифторметил)фенил]метил}(2-метил-2Н-тетразол-5-ил)амино]-7,9-диметил-2,3,4,5-тетрагидро-1H-бензазепин-1-ил}метил) циклогексанкарбоновой кислоте, также известной как LY2484595, С AS 1186486-62-3 или соединение формулы (XB)

Эвацетрапиб, а также способы получения и применения соединения описаны в WO 2011002696.
«Торцетрапиб» относится к этиловому эфиру (2R,4S)-4-[(3,5-бистрифторметилбензил)метоксикарбониламино]-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты, также известному как СР-529,414, CAS 262352-17-0 или соединение формулы (XC)
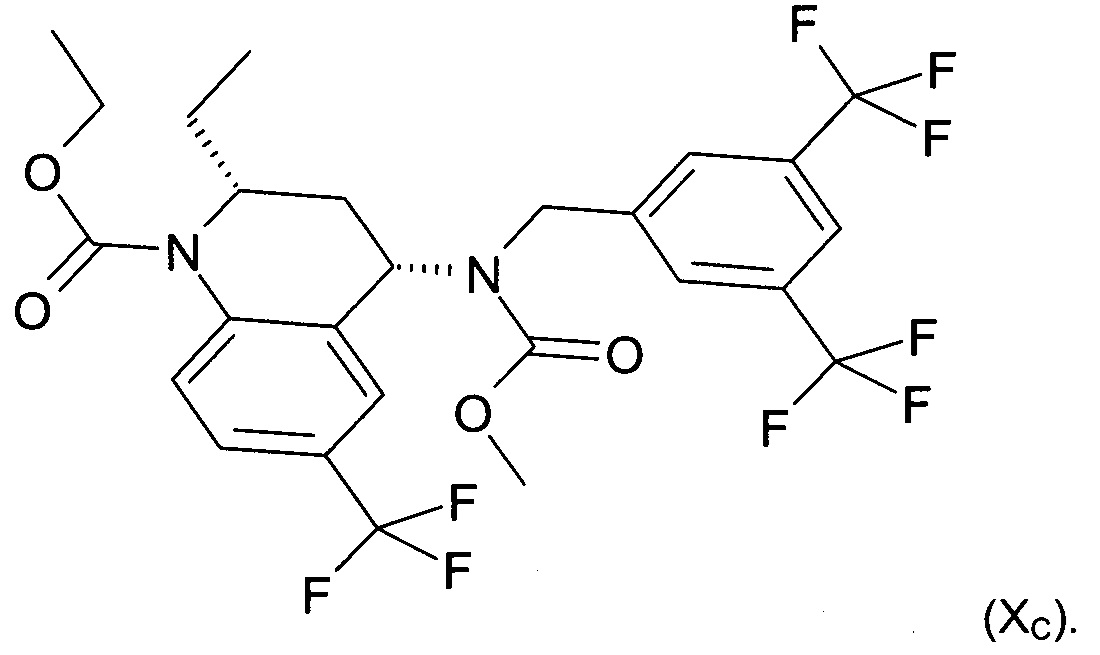
Торцетрапиб, а также способы получения и применения соединения описаны в WO 0017164 или WO 0140190.
«BAY 60-5521» относится к 4-циклогексил-2-циклопентил-3-[(S)-фтор[4-(трифторметил)фенил]метил]-5,6,7,8-тетрагидро-7,7-диметилу, также известному как CAS 893409-49-9 или соединению формулы (XD).

BAY 60-5521, а также способы получения и применения соединения описаны в WO2006063828.
«Терапия» относится как к лечебным, так и к профилактическим или превентивным мероприятиям. Тем, кому необходима терапия, включают тех, кто уже страдает расстройством, а также тех, у кого следует предупредить или замедлить развитие расстройства.
Термин «полиморфизм», «полиморфный сайт», «сайт полиморфизма» или «сайт однонуклеотидного полиморфизма» (сайт ОНП) или «однонуклеотидный полиморфизм» относится к местоположению в последовательности гена, в котором у представителей популяции встречаются отличия. Полиморфизм представляет собой наличие двух или более форм гена или позиции в «аллеле» гена в популяции, встречающееся с такой частотой, что наличие наиболее редких форм нельзя объяснить исключительно мутацией. Предпочтительные полиморфные сайты имеют по меньшей мере два аллеля. Подразумевают, что полиморфные аллели обусловливают определенную фенотипическую изменчивость хозяев. Полиморфизм может возникать как в кодирующих областях, так и в некодирущих областях генов. Полиморфизм может затрагивать одиночные нуклеотидные сайты или может приводить к вставкам или делециям. Расположение такого полиморфизма можно охарактеризовать позицией нуклеотида в составе гена, на хромосоме или в транскрипте, по аминокислотам, которые изменяются в результате полиморфизма нуклеотида. Отдельным полиморфизмам также присваивают уникальные идентификаторы («Reference SNP», «refSNP» или «rs#»), известные специалистам в области техники, и используют, например, в базе данных однонуклеотидных полиморфизмов (dbSNP) вариантов нуклеотидных последовательностей, доступ к которой можно получить на сайте NCBI.
Термин «неравновесное сцепление» или «неравновесие по сцеплению» или «LD» (от англ. linkage disequilibrium) обозначает неслучайную ассоциацию аллелей у совокупности индивидуумов, или другими словами, представляет собой предпочтительную сегрегацию конкретной полиморфной формы с другой полиморфной формой, расположенной в другом локусе хромосомы, частота которой превышает частоту, ожидаемую при случайном распределении. Напротив, аллели, частота распределения которых совпадает с ожидаемой, называют находящимися в «равновесии по сцеплению».
Приставка «rs» относится к ОНП в базе данных NCBI, находящейся по адресу http://www.ncbi.nlm.nih.gov/snp/?term. Нумерация «rs» представляет собой форму идентификаторов однонуклеотидных полиморфизмов, принятую NCBI.
Термин «образец» охватывает любой биологический образец, взятый у пациента или индивидуума, включая клетку, образец ткани или жидкости организма. Например, образец может охватывать образец кожи, образец клеток щеки, слюны или клеток крови. Образец может охватывать одиночные клетки, множество клеток, фрагменты клеток, аликвоту жидкости организма, цельную кровь, тромбоциты, сыворотку, плазму, эритроциты, лейкоциты, эндотелиальные клетки, биоптат ткани, синовиальную жидкость и лимфу. В частности, «образец» относится к клеткам крови.
Термин «терапевтический агент» относится к агентам, способным лечить или предупреждать сердечно-сосудистое расстройство. В данном описании агент, «способный лечить или предупреждать сердечно-сосудистое расстройство», относится к молекуле, которая способна лечить или предупреждать сердечно- сосудистое расстройство у человека и/или на клеточной модели или модели указанного сердечно-сосудистого расстройства у животных.
«Полиморфизм, ассоциированный с лучшим ответом», «генотип, ассоциированный с лучшим ответом» или «генотип, ассоциированный с ответом» в данном описании относятся к аллельному варианту или генотипу по одному или нескольким полиморфным сайтам в составе гена ADCY9, описанным в данном документе (например, rs11647778/CC), который предсказывает, что у субъекта будет получен отклик на терапию, и терапия поднимающим уровень HDL или имитирующим HDL агентом принесет ему пользу (которую можно оценить по уменьшению числа сердечно-сосудистых событий) при сравнении с аллельным вариантом или генотипом или полиморфизмом (например, rs11647778/CG или rs11647778/GG), предсказывающим менее выраженный отклик субъекта на введение поднимающего уровень HDL или имитирующего HDL агента. «Сниженный ответ», «частичный ответ», «отсутствие ответа» или «отсутствие терапевтического эффекта» можно оценивать по относительному увеличению числа сердечно-сосудистых событий при сравнении с субъектами, обладающими «генотипом, ассоциированным с лучшим ответом». В альтернативном случае «улучшенный ответ», «достижение лечебного эффекта» или «терапевтическую эффективность» можно оценивать по относительному уменьшению числа сердечно-сосудистых событий в сравнении с субъектами, которые являются носителями полиморфизмов, ассоциированных с «отсутствием ответа» или «частичным ответом» на поднимающий уровень HDL или имитирующий HDL агент. В частности, генотипами, ассоциированными с лучшим ответом, являются rs11647778/СС и, возможно, rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG, rs8061182/AA и rs2238448/TT. Более конкретно, генотипами, ассоциированный с лучшим ответом, являются rs11647778/СС и, возможно, rs1967309/AA и rs2238448/TT. Более конкретно, генотипами, ассоциированный с лучшим ответом, являются rs11647778/СС и rs1967309/AA.
«Сердечно-сосудистые события» в данном описании относятся к летальному исходу по причине сердечно-сосудистой патологии, нефатальному инфаркту миокарда (ИМ), нефатальному ишемическому инсульту, госпитализации по причине нестабильной стенокардии и реваскуляризации коронарных артерий.
«Олигонуклеотиды» в данном описании представляют собой нуклеиновые кислоты или полинуклеотиды различной длины. Такие олигонуклеотиды могут применяться в качестве зондов, праймеров и в изготовлении микрочипов (чипов) для детекции и/или амплификации определенных нуклеиновых кислот. Такие цепочки ДНК или РНК можно синтезировать путем последовательного добавления (5'-3' или 3'-5') активированных мономеров к растущей цепи, которая может быть присоединена к нерастворимому носителю. В области техники известны различные способы синтеза олигонуклеотидов для последующего самостоятельного применения или применения в качестве части нерастворимого носителя, например, в чипах (BERNFIELD MR. and ROTTMAN FM. J. Biol. Chem. (1967) 242(18):4134-43; SULSTON J. et al. PNAS (1968) 60(2):409-415; GILLAM S. et al. Nucleic Acid Res.(1975) 2(5):613-624; BONORA GM. et al. Nucleic Acid Res.(1990) 18(11):3155-9; LASHKARI DA. et al. PNAS (1995) 92(17):7912-5; MCGALL G. et al. PNAS (1996) 93(24):13555-60; ALBERT TJ. et al. Nucleic Acid Res.(2003) 31(7):e35; GAO X. et al. Biopolymers (2004) 73(5):579-96; and MOORCROFT MJ. et al. Nucleic Acid Res.(2005) 33(8):e75). Как правило, олигонуклеотиды синтезируют посредством пошагового добавления активированных и защищенных мономеров в разных условиях, в зависимости от используемого способа. Затем, определенные защитные группы можно удалять для возможности дальнейшей элонгации, а затем, по окончании синтеза можно удалить все защитные группы и отделить олигонуклеотиды от твердой основы для очистки собранных цепей, если это необходимо.
Термин «генотип» относится к генетической конституции организма, обычно применительно к одному гену или нескольким генам или области гена, рассматриваемым в конкретном контексте (т.е. локусам генов, отвечающих за конкретный генотип). В частности, к определенной комбинации аллелей в заданной позиции гена, например, возможными генотипами ОНП rs1967309 являются генотипы АА, AG или GG.
«Фенотипом» называют наблюдаемые характеристики организма. В Таблицах 2, 3, 4 и 5 показана корреляция генотипов ОНП ADCY9, где значения указывают на ответ на терапию поднимающим уровень HDL или имитирующим HDL агентом при сердечно-сосудистых расстройствах.
Термин «биомаркер» в данном описании относится к характеристике последовательности конкретного варианта аллеля (полиморфного сайта, такого как ОНП) или аллеля дикого типа. Биомаркер также относится к пептиду или эпитопу, кодируемому конкретным вариантом аллеля или аллелем дикого типа.
Термин «суррогатный маркер» в данном описании относится к генетическому варианту, включая ОНП, который находится в неравновесии по сцеплению с генотипом, ассоциированным с лучшим ответом, согласно данному изобретению, в частности, rs11647778/СС.
Термин «генетический маркер» в данном описании относится к вариантам полиморфных сайтов конкретного гена, которые ассоциированы с ответом на поднимающий уровень HDL или имитирующий HDL агент, в частности, ингибитор/модулятор СЕТР. В частности, «генетический маркер» в данном описании относится к вариантам полиморфных сайтов гена ADCY9, которые ассоциированы с ответом на поднимающий уровень HDL или имитирующий HDL агент, в частности, ингибитор/модулятор СЕТР.
Предсказать ответ индивидуума на поднимающее уровень HDL лекарственное средство, в частности, ингибитор СЕТР: позволяют три генотипа rs11647778: СС, CG и GG. Из них генотип СС ассоциирован с лучшим ответом пациента на терапию поднимающим уровень HDL лекарственным средством, генотип CG ассоциирован с частичным ответом, а генотип GG ассоциирован с отсутствием ответа. В контексте данного изобретения терапия поднимающим уровень HDL лекарственным средством может приносить пользу пациентам, которые являются носителями генотипа СС, и пациентам, которые являются носителями генотипа CG, и не может приносить пользу пациентам, которые являются носителями генотипа GG. Генотипы СС и CG rs11647778, указывают на ответ на терапию ингибитором СЕТР, в частности, дальцетрапибом, у пациентов, страдающих сердечно-сосудистым расстройством. В частности, генотип СС rs11647778 указывает на более выраженный ответ на терапию ингибитором СЕТР, в частности, дальцетрапибом, у пациентов, страдающих сердечно-сосудистым расстройством.
Предсказать ответ индивидуума на поднимающее уровень HDL лекарственное средство, в частности, ингибитор СЕТР: позволяют три генотипа rs2238448: ТТ, ТС и СС. Из них генотип ТТ ассоциирован с лучшим ответом пациента на терапию среди пациентов, получавших поднимающие уровень HDL лекарственное средство, тогда как генотип СС ассоциирован с отсутствием ответа. Терапия поднимающим уровень HDL лекарственным средством может принести пользу пациентам, которые являются носителями генотипа ТС, поскольку данный генотип ассоциирован с частичным ответом. В контексте данного изобретения терапия поднимающим уровень HDL лекарственным средством может приносить пользу пациентам, которые являются носителями генотипа ТТ или СТ, и не может приносить пользу пациентам, которые являются носителями генотипа СС. Генотип ТТ rs2238448 указывает на более выраженный ответ на терапию ингибитором СЕТР, в частности, дальцетрапибом, у пациентов, страдающих сердечно-сосудистым расстройством, в сравнении с другими генотипами.
В описанных здесь способах выявления или отбора индивидуумов, которым терапия поднимающим уровень HDL или имитирующим HDL агентом, в частности, ингибитором/модулятором СЕТР, будет приносить пользу, используют один или несколько биомаркеров. ОНП биомаркер для применения в изобретении может предсказывать наличие ответа на терапию (R) или отсутствие ответа на терапию (NR). В Таблице 2 показаны генотипы, отмеченные в когорте dal-Outcomes, присутствующие в полиморфном сайте rs1967309, которые можно использовать в качестве биомаркеров для предсказания ответа на дальцетрапиб или поднимающий уровень HDL или имитирующий HDL агент, в частности, на ингибитор/модулятор СЕТР. В Таблице 4 показаны генотипы, отмеченные в когортах dal-Outcomes и dal-Plaque-2, присутствующие в полиморфном сайте rs11647778, которые можно использовать в качестве биомаркеров для предсказания ответа на дальцетрапиб или поднимающий уровень HDL или имитирующий HDL агент, в частности, на ингибитор/модулятор СЕТР. Каждый генотип, приведенный в Таблицах 2-5, в отдельности или в комбинации с генотипами по другим полиморфным сайтам, можно применять в качестве биомаркера для предсказания ответа на поднимающий уровень HDL или имитирующий HDL агент, в частности, на ингибитор/модулятор СЕТР.

R: Наличие ответа
PR: Частичный ответ
NR: Отсутствие ответа


R: Наличие ответа
PR: Частичный ответ
NR: Отсутствие ответа

R: Наличие ответа
PR: Частичный ответ
NR: Отсутствие ответа


R: Наличие ответа
PR: Частичный ответ
NR: Отсутствие ответа
Rs11647778, rs1967309 и rs12595857 расположены в интронной (некодирующей) области гена ADCY9 в области, которая обусловливает наличие регуляторной активности при экспрессии гена ADCY9.
В некоторых описанных здесь способах индивидуумов, которым терапия поднимающим уровень HDL или имитирующим HDL агентом, в частности, ингибитором/модулятором СЕТР, будет приносить пользу, идентифицируют и отбирают для лечения, применяя способы генотипирования по изобретению. В частности, для лечения способами по изобретению отбирают пациентов, которые являются носителями rs11647778/СС и, возможно, одного или нескольких генотипов, ассоциированных с лучшим ответом: rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA,rs74702385/AA, rs8049452/GG, rs8061182/AA, rs2238448/TT. Более конкретно, для лечения способами по изобретению отбирают пациентов, которые являются носителями rs11647778/СС и, возможно, rs12595857/GG, rs2238448/TT и/или rs1967309/AA. Более конкретно, для лечения способами по изобретению отбирают пациентов, которые являются носителями генотипов rs11647778/СС и rs1967309/AA.
В другом воплощении изобретения предложен способ выявления субъекта, которому поднимающий уровень HDL или имитирующий HDL агент будет приносить пользу, включающий определение генотипа указанного субъекта (например, генотипирование) по одному или нескольким полиморфным сайтам гена ADCY9.
В другом воплощении изобретения предложен способ предсказания ответа индивидуума на поднимающий уровень HDL или имитирующий HDL агент, который включает определение генотипа указанного субъекта (например, генотипирование) по rs11647778 и, возможно, по одному или нескольким rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs13337675, rs12920508, rs12599911, rs2531971 или rs2238448, с применением одного или нескольких праймеров или зондов, описанных в данном документе.
В другом воплощении изобретения предложен способ предсказания ответа индивидуума на поднимающий уровень HDL или имитирующий HDL агент, в частности, на ингибитор СЕТР, который включает определение генотипа указанного субъекта (например, генотипирование) по rs11647778 и, возможно, по одному или нескольким rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967 или rs3730119, rs13337675, с применением одного или нескольких праймеров или зондов, описанных в данном документе.
В конкретном воплощении изобретения предложен способ, описанный в данном документе, где полиморфный сайт содержит rs11647778 и, возможно, один или несколько из следующих сайтов, выбранных из группы, состоящей из: rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs13337675, rs12920508, rs12599911, rs2531971 или rs2238448, в частности, где полиморфный сайт выбран из группы, состоящей из rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119 и rs13337675, более конкретно, где полиморфным сайтом является rs11647778 и, возможно, rs1967309 или rs12595857, более конкретно, где полиморфным сайтом является rs11647778 и, возможно, rs1967309, в частности, где соответствующие генотипы содержат СС и АА, соответственно.
В конкретном воплощении изобретения предложен способ генотипирования одного или нескольких полиморфных сайтов, где по меньшей мере один полиморфный сайт представляет собой rs11647778 и один или несколько необязательных полиморфных сайтов выбраны из группы, состоящей из: rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs13337675, rs12920508, rs12599911, rs2531971 или rs2238448, в частности, где необязательный полиморфный сайт выбран из группы, состоящей из rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119 и rs13337675, более конкретно, где необязательным полиморфным сайтом является rs1967309 или rs12595857, более конкретно, где необязательным полиморфным сайтом является rs1967309.
В конкретном воплощении изобретения предложен способ, в котором терапия поднимающим уровень HDL или имитирующим HDL агентом приносит пользу субъекту, являющемуся носителем rs11647778/СС и, возможно, одного или нескольких из rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG, rs8061182/AA или rs2238448/TT, в частности, когда поднимающий уровень HDL или имитирующий HDL агент представляет собой ингибитор/модулятор СЕТР, и более конкретно, когда поднимающий уровень HDL или имитирующий HDL агент представляет собой S-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловый) эфир. В конкретном воплощении изобретения предложен способ, в котором указанному субъекту вводят поднимающий уровень HDL или имитирующий HDL агент.
В конкретном воплощении изобретения предложен способ, в котором субъекта, который является носителем rs11647778/СС и, возможно, одного или нескольких из rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG, rs8061182/AA или rs2238448/TT, лечат поднимающим уровень HDL или имитирующим HDL агентом, в частности, когда поднимающий уровень HDL или имитирующий HDL агент представляет собой ингибитор/модулятор СЕТР, и более конкретно, когда поднимающий уровень HDL или имитирующий HDL агент представляет собой S-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловый) эфир.
В конкретном воплощении изобретения предложен способ, в котором субъекту, который является носителем rs11647778/СС и, возможно, одного или нескольких из rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG, rs8061182/AA или rs2238448/TT, вводят поднимающий уровень HDL или имитирующий HDL агентом, в частности, когда поднимающий уровень HDL или имитирующий HDL агент представляет собой ингибитор/модулятор СЕТР, и более конкретно, когда поднимающий уровень HDL или имитирующий HDL агент представляет собой S-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловый) эфир.
В конкретных воплощениях изобретения предложен способ, в котором субъект страдает сердечно-сосудистым расстройством, в частности, когда сердечно-сосудистое расстройство выбрано из группы, состоящей из атеросклероза, заболевания периферических сосудов, дислипидемии, гипербеталипопротеинемии, гипоальфалипопротеинемии, гиперхолестеринемии, гипертриглицеридемии, семейной гиперхолестеринемии, стенокардии, ишемии, ишемии сердца, инсульта, инфаркта миокарда, реперфузионного повреждения, рестеноза после ангиопластики, гипертензии и сосудистых осложений диабета, ожирения или эндотоксемии у млекопитающего, более конкретно, когда сердечно-сосудистое расстройство выбрано из группы, состоящей из сердечно-сосудистого заболевания, ишемической болезни сердца, атеросклеротической болезни сердца, гипоальфалипопротеинемии, гипербеталипопротеинемии, гиперхолестеринемии, гиперлипидемии, атеросклероза, гипертензии, гипертриглицеридемии, гиперлипопротеинемии, заболевания периферических сосудов, стенокардии, ишемии и инфаркта миокарда.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства у субъекта, которому это необходимо, включающий:
(a) выбор субъекта, имеющего ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип по одному или нескольким из следующих сайтов: rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs13337675, rs12920508, rs12599911, rs2531971 или rs2238448;
(b) введение указанному субъекту поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства у субъекта, которому это необходимо, включающий:
(a) выбор субъекта, имеющего ассоциированный с лучшим ответом генотип rs11647778 и, возможно, определяющий улучшенный ответ генотип в одном или нескольких из следующих сайтов: rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs13337675;
(b) введение указанному субъекту поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР.
В конкретном воплощении изобретения предложен способ лечения сердечнососудистого расстройства у субъекта, которому это необходимо, включающий:
(а) выбор субъекта, имеющего ассоциированный с лучшим ответом полиморфизм rs11647778 и, возможно, ассоциированный с лучшим ответом полиморфизм rs1967309 и/или rs2238448, в частности, где субъект имеет rs11647778 с генотипом СС, rs1967309 с генотипом АА и rs2238448 с генотипом ТТ;
(b) введение указанному субъекту поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР.
В конкретном воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства у субъекта, которому это необходимо, включающий:
(a) выбор субъекта, имеющего ассоциированный с лучшим ответом полиморфизм rs11647778 и, возможно, ассоциированный с лучшим ответом полиморфизм rs1967309, в частности, где субъект имеет rs11647778 с генотипом СС и rs1967309 с генотипом АА;
(b) введение указанному субъекту поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства у субъекта, которому это необходимо, включающий:
(a) генотипирование субъекта по rs11647778 и, возможно, по одному или нескольким из следующих сайтов: rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs13337675, rs12920508, rs12599911, rs2531971 или rs2238448;
(b) введение указанному субъекту поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства у субъекта, которому это необходимо, включающий:
(a) генотипирование субъекта по rs11647778 и, возможно, по одному или нескольким из следующих сайтов: rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs13337675;
(b) введение указанному субъекту поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР.
В изобретении также предложен способ лечения или профилактики пациента, включающий:
a. исследование образца пациента на предмет наличия генетического маркера rs11647778/СС и, возможно, одного или нескольких генетических маркеров, выбранных из группы, состоящей из rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG и rs8061182/AA, и
b. введение пациенту, который является носителем одного или нескольких из указанных генетических маркеров поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР.
В изобретении также предложен способ лечения пациента, включающий:
a. исследование образца пациента на предмет наличия генетического маркера rs11647778/СС и, возможно, одного или нескольких генетических маркеров, выбранных из группы, состоящей из rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA;, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG и rs8061182/AA, и
b. лечение пациента, который является носителем одного или нескольких из указанных генетических маркеров, поднимающим уровень HDL или имитирующим HDL агентом, в частности, ингибитором/модулятором СЕТР.
В конкретном воплощении изобретения предложен способ, в котором определяют генотип rs11647778 и, возможно, одного или нескольких сайтов, выбранных из rs1967309 и rs12595857.
В конкретном воплощении данного изобретения предложен способ предсказания ответа пациента на поднимающее уровень HDL лекарственное средство, включающий:
a. взятие образца у пациента, где образец содержит генетический материал;
b. приведение в контакт образца с реагентом, таким как зонды или праймеры, образование комплекса между реагентом и генетическим маркером, выбранным из Таблицы 10;
c. детекцию комплекса для получения массива данных, связанных с образцом, и
d. анализ массива данных для определения наличия или отсутствия генетического маркера.
В конкретном воплощении данного изобретения предложен способ предсказания ответа пациента, имеющего один или несколько симптомов сердечнососудистого заболевания, на поднимающее уровень HDL лекарственное средство, включающий:
a. взятие образца у пациента, где образец содержит генетический материал;
b. приведение в контакт образца с реагентом, таким как зонд или комплект праймеров, для образования комплекса между реагентом и генетическим маркером, выбранным из Таблицы 10;
c. детекцию комплекса для получения массива данных, связанных с образцом;
d. анализ массива данных для определения наличия или отсутствия генетического маркера и
e. установление, что пациент, имеющий один или несколько генетических маркеров, может быть кандидатом на получение поднимающего уровень HDL лекарственного средства.
Комплекс между реагентом (таким как зонды или праймеры) и генетическим маркером, образованный при осуществлении способа генотипирования, может образоваться в ходе полимеразной цепной реакции (ПЦР) или секвенирования ДНК. Указанные способы описаны в данном документе и хорошо известны специалистам в области техники.
В изобретении предложены реагенты (такие как зонды или праймеры) для генотипирования генетического маркера, выбранного из rs11647778/СС, rs12595857/GG; rs1967309/AA; rs111590482/AG; rs111590482/GG; rs11647828/GG; rs12935810/GG; rs17136707/GG; rs2239310/GG; rs2283497/AA; rs2531967/AA; rs3730119/AA; rs4786454/AA; rs74702385/GA; rs74702385/AA; rs8049452/GG; rs11647778/CG, rs8061182/AA; rs1967309/GA, rs12595857/AG, rs13337675/AG, rs13337675/GG, rs17136707/AG, rs2239310/AG, rs2283497/CA, rs2531967/GA, rs3730119/GA, rs4786454/GA, rs8049452/GA, rs8061182/AG, rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG, rs8061182/AA, rs12935810/GA, rs12935810/AA, rs11647828/AA, rs2531967/GG, rs3730119/GG, rs2239310/AA, rs12595857/AA, rs111590482/AA, rs74702385/GG, rs11647778/GG, rs1967309/GG, rs2283497/CC, rs8061182/GG, rs17136707/AA, rs2238448/TT, rs22384487TC, rs2238448/CC, rs8049452/AA, rs4786454/GG, rs13337675/AA и rs11647828/AG, предпочтительно rs11647778, в частности, праймер или зонд.
В конкретном воплощении праймер содержит цепь ДНК, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с участком 16 хромосомы, примыкающим к rs11647778, rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs13337675, rs12920508, rs12599911, rs2531971 или rs2238448.
В конкретном воплощении праймер содержит цепь ДНК, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с участком 16 хромосомы, примыкающим к rs11647778.
В конкретном воплощении праймер содержит цепь ДНК, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с участком 16 хромосомы, примыкающим к rs11647778, rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs2238448 или rs13337675.
В конкретном воплощении праймер содержит цепь ДНК, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с участком 16 хромосомы, примыкающим к rs11647778,
В другом воплощении реагент представляет собой праймер, который содержит цепь ДНК, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с участком 16 хромосомы, перекрывающимся с rs11647778, rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs13337675, rs12920508, rs12599911, rs2531971 или rs2238448.
В другом воплощении реагент представляет собой праймер, который содержит цепь ДНК, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с участком 16 хромосомы, перекрывающимся с rs11647778.
В другом воплощении реагент представляет собой праймер, который содержит цепь ДНК, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с участком 16 хромосомы, перекрывающимся с rs11647778, rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs2238448 или rs13337675.
В другом воплощении реагент представляет собой праймер, который содержит цепь ДНК, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с участком 16 хромосомы, перекрывающимся с rs11647778.
В другом воплощении зонд представляет собой нуклеиновую кислоту, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с участком 16 хромосомы, перекрывающимся с rs11647778, rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs13337675, rs12920508, rs12599911, rs2531971 или rs2238448.
В другом воплощении зонд представляет собой нуклеиновую кислоту, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с участком 16 хромосомы, перекрывающимся с rs11647778.
В другом воплощении зонд представляет собой нуклеиновую кислоту, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с участком 16 хромосомы, перекрывающимся с rs11647778, rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs2238448 или rs13337675.
В другом воплощении зонд представляет собой нуклеиновую кислоту, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с участком 16 хромосомы, перекрывающимся с rs11647778.
В другом воплощении зонд представляет собой нуклеиновую кислоту, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с олигонуклеотидом, выбранным из SEQ. ID. NO. 1 - SEQ. ID. NO. 21.
В другом воплощении зонд представляет собой нуклеиновую кислоту, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с олигонуклеотидом, имеющим последовательность SEQ. ID NO. 21.
В другом воплощении зонд представляет собой нуклеиновую кислоту, которая имеет длину от 15 до 30 нуклеотидов и гибридизуется в жестких условиях с олигонуклеотидом, имеющим последовательность SEQ. ID NO. 19.
В конкретном воплощении изобретения предложен способ, в котором поднимающий уровень HDL или имитирующий HDL агент представляет собой ингибитор/модулятор СЕТР, в частности, где поднимающим уровень HDL или имитирующим HDL агентом является S-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловый) эфир.
В следующем воплощении изобретения предложено применение поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, в изготовлении лекарственного средства для лечения или профилактики сердечно-сосудистого расстройства у субъекта, которому это необходимо, где субъект имеет ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип по одному или нескольким из следующих сайтов: rs 1967309, rs 12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs2238448 или rs13337675.
В конкретном воплощении изобретения предложено применение согласно данному описанию, где субъект имеет ассоциированный с лучшим ответом полиморфизм rs11647778.
В другом воплощении изобретения предложены поднимающий уровень HDL или имитирующий HDL агент, в частности, ингибитор/модулятор СЕТР для применения в лечении или предупреждении сердечно-сосудистого расстройства у субъекта, которому это необходимо, где субъект является носителем генетического маркера rs11647778/СС и, возможно, одного или нескольких генетических маркеров, выбранных из rs12595857/GG; rs1967309/AA; rs111590482/AG; rs111590482/GG; rs11647828/GG; rs12935810/GG; rs17136707/GG; rs2239310/GG; rs2283497/AA; rs2531967/AA; rs3730119/AA; rs4786454/AA; rs74702385/GA; rs74702385/AA; rs8049452/GG; rs8061182/AA; rs1967309/GA, rs12595857/AG, rs13337675/AG, rs13337675/GG, rs17136707/AG, rs2239310/AG, rs2283497/CA, rs2531967/GA, rs3730119/GA, rs4786454/GA, rs8049452/GA, rs8061182/AG, rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG, rs8061182/AA, rs12935810/GA, rs12935810/AA, rs11647828/AA, rs2531967/GG, rs3730119/GG, rs2239310/AA, rs12595857/AA, rs111590482/AA, rs74702385/GG, rs1967309/GG, rs2283497/CC, rs8061182/GG, rs17136707/AA, rs8049452/AA, rs4786454/GG, rs13337675/AA, rs2238448/TT и rs11647828/AG.
В другом воплощении изобретения предложены способы лечения или предупреждения сердечно-сосудистого расстройства, включающие введение субъекту, которому это необходимо, терапевтически эффективного количества поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, где субъект имеет ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип в одном или нескольких из следующих сайтов: rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119 rs223844 и rs13337675.
В другом воплощении изобретения предложены способы лечения или предупреждения сердечно-сосудистого расстройства, включающие введение субъекту, которому это необходимо, поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, в количестве, эффективном для лечения или предупреждения сердечно-сосудистого расстройства, где субъект имеет ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип в одном или нескольких из следующих сайтов: rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs2238448 и rs13337675.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства, включающий введение субъекту, имеющему ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип в одном или нескольких из следующих сайтов: rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs13337675, rs2238448, терапевтически эффективного количества поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства, включающий введение субъекту, имеющему ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип в одном или нескольких из следующих сайтов: rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs13337675, rs2238448, поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, в количестве, эффективном для лечения или предупреждения сердечно-сосудистого расстройства.
В конкретном воплощении изобретения предложен способ лечения сердечнососудистого расстройства, включающий введение субъекту, которому это необходимо, терапевтически эффективного количества поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, где субъект, получающий терапию, имеет ассоциированный с лучшим ответом генотип, где генотип представляет собой rs11647778/СС и, возможно, rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA;, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG и/или rs8061182/AA
В конкретном воплощении изобретения предложены способы лечения или предупреждения сердечно-сосудистого расстройства, включающие введение субъекту, которому это необходимо, поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, в количестве, эффективном для лечения или предупреждения сердечно-сосудистого расстройства, где субъект является носителем генотипа rs11647778/СС и, возможно, rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG, rs2238448/TT и/или rs8061182/AA.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства, включающий введение субъекту, имеющему ассоциированный с лучшим ответом генотип rs11647778/СС и, возможно, rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG и/или rs8061182/AA, терапевтически эффективного количества поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства, включающий введение субъекту, имеющему генотип rs11647778/СС и, возможно, rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG, rs2238448/TT и/или rs8061182/AA, поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, в количестве, эффективном для лечения или предупреждения сердечно-сосудистого расстройства.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства, включающий введение субъекту, которому это необходимо, терапевтически эффективного количества поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, где субъект имеет ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип rs1967309, rs2238448 или rs12595857.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства, включающий введение субъекту, которому это необходимо, поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, в количестве, эффективном для лечения или предупреждения сердечно-сосудистого расстройства, где субъект имеет ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип rs1967309, rs2238448 или rs12595857.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства, включающий введение субъекту, имеющему ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип rs1967309, rs2238448 или rs12595857, терапевтически эффективного количества поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства, включающий введение субъекту, имеющему ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип rs1967309, rs2238448 или rs12595857, поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, в количестве, эффективном для лечения или предупреждения сердечно-сосудистого расстройства.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства, включающий введение субъекту, которому это необходимо, терапевтически эффективного количества поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, где субъект имеет ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип rs1967309.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства, включающий введение субъекту, которому это необходимо, поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, в количестве, эффективном для лечения или предупреждения сердечно-сосудистого расстройства, где субъект имеет ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип rs1967309.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства, включающий введение субъекту, имеющему ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип rs1967309, терапевтически эффективного количества поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР.
В другом воплощении изобретения предложен способ лечения или предупреждения сердечно-сосудистого расстройства, включающий введение субъекту, имеющему ассоциированный с лучшим ответом генотип rs11647778 и, возможно, ассоциированный с лучшим ответом генотип rs1967309, поднимающего уровень HDL или имитирующего HDL агента, в частности, ингибитора/модулятора СЕТР, в количестве, эффективном для лечения или предупреждения сердечнососудистого расстройства.
В конкретном воплощении изобретения предложен поднимающий уровень HDL или имитирующий HDL агент, в частности, ингибитор/модулятор СЕТР, для применения в лечении или предупреждении сердечно-сосудистого расстройства, где получающий терапию субъект является носителем ассоциированного с лучшим ответом генотипа rs11647778.
В конкретном воплощении изобретения предложен поднимающий уровень HDL или имитирующий HDL агент согласно данному описанию, где ассоциированный с лучшим ответом генотипом является СС.
В конкретном воплощении изобретения предложен поднимающий уровень HDL или имитирующий HDL агент, в частности, ингибитор/модулятор СЕТР, для применения в лечении или предупреждении сердечно-сосудистого расстройства у субъекта, где субъект является носителем ассоциированный с лучшим ответом генотипа rs11647778. В конкретном воплощении изобретения предложен поднимающий уровень HDL или имитирующий HDL агент согласно данному описанию, где ассоциированным с лучшим ответом генотипом rs11647778 является СС.
В конкретном воплощении изобретения предложен поднимающий уровень HDL или имитирующий HDL агент согласно данному описанию, где сердечнососудистое расстройство выбрано из группы, состоящей из атеросклероза, заболевания периферических сосудов, дислипидемии, гипербеталипопротеинемии, гипоальфалипопротеинемии, гиперхолестеринемии, гипертриглицеридемии, семейной гиперхолестеринемии, стенокардии, ишемии, ишемии сердца, инсульта, инфаркта миокарда, реперфузионного повреждения, рестеноза после ангиопластики, гипертензии и сосудистых осложений диабета, ожирения или эндотоксемии у млекопитающего.
В конкретном воплощении изобретения предложен поднимающий уровень HDL или имитирующий HDL агент согласно данному описанию, где сердечнососудистое расстройство выбрано из группы, состоящей из сердечно-сосудистого заболевания, ишемической болезни сердца, атеросклеротической болезни сердца, гипоальфалипопротеинемии, гипербеталипопротеинемии, гиперхолестеринемии, гиперлипидемии, атеросклероза, гипертензии, гипертриглицеридемии, гиперлипопротеинемии, заболевания периферических сосудов, стенокардии, ишемии или инфаркта миокарда.
В конкретном воплощении изобретения предложен поднимающий уровень HDL или имитирующий HDL агент согласно данному описанию, где поднимающий уровень HDL или имитирующий HDL представляет собой ингибитор/модулятор СЕТР, более конкретно, S-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловый) эфир.
В другом воплощении изобретения предложен S-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловый) эфир для лечения или предупреждения сердечно-сосудистого расстройства у субъекта, которому это необходимо, имеющему генотип rs11647778/СС и, возможно, rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG, rs2238448/TT или rs8061182/AA, более конкретно, где генотип представляет собой rs11647778/СС и, возможно, rs1967309/AA.
В другом воплощении изобретения предложен S-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловый) эфир для лечения или предупреждения сердечно-сосудистого расстройства у пациента, который является носителем ассоциированного с лучшим ответом генотипа rs11647778/СС и, возможно, rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG или rs8061182/AA, более конкретно, где генотип представляет собой rs11647778/СС и, возможно, rs1967309/AA.
В конкретном воплощении изобретения предложен Э-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловый) эфир для лечения или предупреждения сердечно-сосудистого расстройства у пациента, который является носителем ассоциированного с лучшим ответом генотипа, где сердечно-сосудистое расстройство выбрано из группы, состоящей из атеросклероза, заболевания периферических сосудов, дислипидемии, гипербеталипопротеинемии, гипоальфалипопротеинемии, гиперхолестеринемии, гипертриглицеридемии, семейной гиперхолестеринемии, стенокардии, ишемии, ишемии сердца, инсульта, инфаркта миокарда, реперфузионного повреждения, рестеноза после ангиопластики, гипертензии и сосудистых осложнений диабета, ожирения или эндотоксемии у млекопитающего.
В конкретном воплощении изобретения предложен S-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловый) эфир для лечения или предупреждения сердечно-сосудистого расстройства у субъекта, которому это необходимо, имеющего ассоциированный с лучшим ответом генотип, где сердечно-сосудистое расстройство представляет собой атеросклероз, заболевание периферических сосудов, дислипидемию, гипербеталипопротеинемию, гипоальфалипопротеинемию, гиперхолестеринемию, гипертриглицеридемию, семейную гиперхолестеринемию, стенокардию, ишемию, ишемию сердца, инсульт, инфаркт миокарда, реперфузионное повреждение, рестеноз после ангиопластики, гипертензию и сосудистые осложнения диабета, ожирения или эндотоксемии.
В конкретном воплощении изобретения предложен S-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловый) эфир для лечения или предупреждения сердечно-сосудистого расстройства у пациента, который является носителем ассоциированного с лучшим ответом генотипа, где сердечно-сосудистое расстройство выбрано из группы, состоящей из сердечно-сосудистого заболевания, ишемической болезни сердца, атеросклеротической болезни сердца, гипоальфалипопротеинемии, гипербеталипопротеинемии, гиперхолестеринемии, гиперлипидемии, атеросклероза, гипертензии, гипертриглицеридемии, гиперлипопротеинемии, заболевания периферических сосудов, стенокардии, ишемии и инфаркта миокарда.
В конкретном воплощении изобретения предложен S-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловый) эфир для лечения или предупреждения сердечно-сосудистого расстройства у субъекта, которому это необходимо, имеющего ассоциированный с лучшим ответом генотип, где сердечно-сосудистое расстройство представляет собой сердечно-сосудистое заболевание, ишемическую болезнь сердца, атеросклеротическую болезнь сердца, гипоальфалипопротеинемию, гипербеталипопротеинемию, гиперхолестеринемию, гиперлипидемию, атеросклероз, гипертензию, гипертриглицеридемию, гиперлипопротеинемию, заболевание периферических сосудов, стенокардию, ишемию или инфаркт миокарда.
В другом воплощении изобретения предложен способ предсказания, повышена ли вероятность того, что лечение поднимающим уровень HDL или имитирующим HDL агентом, в частности, ингибитором/модулятором СЕТР, будет приносить пользу пациенту, у которого диагностировано сердечно-сосудистое заболевание или у которого имеются один или несколько симптомов сердечнососудистого заболевания, включающий скрининг образца, полученного у указанного пациента на наличие генетического маркера в гене аденилатциклазы 9 типа (ADCY9), выбранного из rs11647778/СС, rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG, rs2238448/TT или rs8061182/AA, где наличие генетического маркера указывает на повышенную вероятность того, что указанное лечение поднимающим уровень HDL или имитирующим HDL агентом будет приносить пользу пациенту. В конкретном воплощении генетический маркер, скрининг которого осуществляют, представляет собой rs11647778/СС и, возможно, rs12595857/GG, rs2238448/TT и/или rs1967309/AA. Более конкретно, генетический маркер, скрининг которого осуществляют, представляет собой rs11647778/СС и, возможно, rs1967309/AA.
В другом воплощении изобретения предложен способ предсказания, повышена ли вероятность того, что лечение поднимающим уровень HDL или имитирующим HDL агентом, в частности, ингибитором/модулятором СЕТР, будет приносить пользу пациенту, страдающему сердечно-сосудистым расстройством, включающий скрининг образца, взятого у указанного пациента на наличие генетического маркера в гене аденилатциклазы 9 типа (ADCY9), выбранного из rs11647778/СС, rs12595857/GG, rs1967309/AA, rs111590482/AG, rs111590482/GG, rs11647828/GG, rs12935810/GG, rs17136707/GG, rs2239310/GG, rs2283497/AA, rs2531967/AA, rs3730119/AA, rs4786454/AA, rs74702385/GA, rs74702385/AA, rs8049452/GG, rs8061182/AA, где повышена вероятность того, что указанное лечение поднимающим уровень HDL или имитирующим HDL агентом будет приносить пользу пациенту. В конкретном воплощении генетический маркер, скрининг которого осуществляют, представляет собой rs11647778/СС и, возможно, выбран из rs12595857/GG, rs1967309/AA. Более конкретно, генетический маркер, скрининг которого осуществляют, представляет собой rs11647778/СС и, возможно, rs1967309/AA.
В следующем воплощении изобретения предложен способ отбора пациента, у которого с большей вероятностью будет получен отклик на поднимающий уровень HDL или имитирующий HDL агент, где способ включает:
(a) определение генотипа rs11647778 в образце пациента, у которого диагностировано сердечно-сосудистое расстройство или у которого имеются один или несколько симптомов сердечно-сосудистого расстройства, и
(b) выбор пациента, имеющего генотип СС, у которого с большей вероятностью будет получен отклик на поднимающий уровень HDL или имитирующий HDL агент.
В следующем воплощении способ дополнительно включает определение генотипа rs1967309 и/или rs2238448 и выбор пациента, имеющего rs1967309 с генотипом АА и/или rs2238448 с генотипом ТТ, у которого с большей вероятностью будет получен отклик на поднимающий уровень HDL или имитирующий HDL агент. В некоторых воплощениях способ дополнительно включает введение поднимающего уровень HDL или имитирующего HDL агента (например, дальцетрапиба) выбранному пациенту.
В следующем воплощении изобретения предложен способ выбора пациента, страдающего сердечно-сосудистым расстройством, у которого с большей вероятностью будет получен отклик на терапию, включающую поднимающий уровень HDL или имитирующий HDL агент, где способ включает:
(а) обнаружение rs11647778 с генотипом СС в образце, взятом у пациента,
(b) выбор пациента, у которого с большей вероятностью будет получен отклик на терапию, включающую поднимающий уровень HDL или имитирующий HDL агент, когда в образце, взятом у пациента, обнаружен rs11647778 с генотипом СС.
В следующем воплощении изобретения предложен способ выбора пациента, страдающего сердечно-сосудистым расстройством, у которого с большей вероятностью будет получен отклик на терапию, включающую поднимающий уровень HDL или имитирующий HDL агент, где способ включает:
(a) обнаружение rs11647778 с генотипом СС и rs1967309 с генотипом АА в образце, взятом у пациента,
(b) выбор пациента, у которого с большей вероятностью будет получен отклик на терапию, включающую поднимающий уровень HDL или имитирующий HDL агент, когда в образце, взятом у пациента, обнаружен rs11647778 с генотипом СС и rs1967309 с генотипом АА.
В конкретном воплощении изобретения предложен способ, описанный в данном документе, где наличие rs11647778 с генотипом СС в референтном образце (до начала терапии поднимающим уровень HDL или имитирующим HDL агентом согласно изобретению) указывает на то, что у пациента с большей вероятностью будет получен отклик на терапию поднимающим уровень HDL или имитирующим HDL агентом.
В конкретном воплощении изобретения предложен способ, описанный в данном документе, где наличие rs11647778 с генотипом СС и rs1967309 с генотипом АА в референтном образце указывает на то, что у пациента с большей вероятностью будет получен отклик на терапию поднимающим уровень HDL или имитирующим HDL агентом.
В конкретном воплощении изобретения предложен способ, описанный в данном документе, который дополнительно включает в) выбор терапии, включающей поднимающий уровень HDL или имитирующий HDL агент.
В конкретном воплощении изобретения предложен способ, описанный в данном документе, где определение генотипа rs11647778 в образце, взятом у пациента, включает приведение в контакт образца с реагентом, специфическим к генотипу (например, праймером и/или зондом), который связывается с последовательностью rs11647778, с формированием комплекса между реагентом и последовательностью rs11647778 и определение сформированного комплекса, и, таким образом определение генотипа rs11647778.
Способ прогнозирования клинического ответа у пациентов-людей на поднимающий уровень HDL или имитирующий HDL агент, включающий определение наличия по меньшей мере одного полиморфизма в гене ADCY9 пациента, где полиморфизм ассоциирован с замедленным, частичным, субоптимальным ответом или отсутствием клинического ответа на указанный поднимающий уровень HDL или имитирующий HDL агент, где по меньшей мере одним полиморфным сайтом является rs11647778.
Способ прогнозирования клинического ответа у пациентов-людей на поднимающий уровень HDL или имитирующий HDL агент, включающий определение наличия по меньшей мере одного полиморфизма в гене ADCY9 пациента, где полиморфизм ассоциирован с замедленным, частичным, субоптимальным ответом или отсутствием клинического ответа на указанный поднимающий уровень HDL или имитирующий HDL агент, где по меньшей мере два полиморфных сайта представляют собой rs11647778 и rs1967309.
В другом воплощении изобретения предложен способ прогнозирования клинического ответа у пациентов-людей на поднимающий уровень HDL или имитирующий HDL агент, включающий определение генотипа по меньшей мере одного полиморфного сайта в гене ADCY9 пациента, где полиморфный сайт ассоциирован с замедленным, частичным, субоптимальным ответом или отсутствием клинического ответа на указанный поднимающий уровень HDL или имитирующий HDL агент. В одном воплощении полиморфным сайтом является rs11647778, а генотип GG указывает на замедленный, частичный, субоптимальный ответ или отсутствие клинического ответа на указанный поднимающий уровень HDL или имитирующий HDL агент. В другом воплощении полиморфным сайтом является rs1967309, а генотип GG указывает на замедленный, частичный, субоптимальный ответ или отсутствие клинического ответа на указанный поднимающий уровень HDL или имитирующий HDL агент. В другом воплощении полиморфным сайтом является rs2238448, а генотип СС указывает на замедленный, частичный, субоптимальный ответ или отсутствие клинического ответа на указанный поднимающий уровень HDL или имитирующий HDL агент.
В конкретном воплощении изобретения предложен способ, описанный в данном документе, где полиморфизм определяют посредством генотипирования.
В конкретном воплощении изобретения предложен способ, описанный в данном документе, где генотипирование включает в себя микрочиповый анализ или масс-спектрометрический анализ или использование специфических в отношении полиморфизма праймеров и/или зондов, в частности, реакции достройки праймеров.
В конкретном воплощении изобретения предложен способ, описанный в данном документе, где поднимающий уровень HDL или имитирующий HDL агент представляет собой ингибитор/модулятор СЕТР, более конкретно, S-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловый) эфир.
В конкретном воплощении «модулятор СЕТР» представляет собой S-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловый эфир тиоизобутировой кислоты, также известный как S-[2-([[1-(2-этилбутил)-циклогексил]-карбонил]амино)фенил]2-метилпропантиоат, дальцетрапиб или соединение формулы I

Показано, что S-[2-([[1-(2-этилбутил)циклогексил]карбонил] амино) фенил] 2-метилпропантиоат является модулятором активности СЕТР у человека (de Grooth et al., Circulation, 105, 2159-2165 (2002)) и кролика (Shinkai et al., J. Med. Chem., 43, 3566-3572 (2000); Kobayashi et al., Atherosclerosis, 162, 131-135 (2002); and Okamoto et al., Nature, 406 (13), 203-207 (2000)). Показано, что S-[2-([[1-(2-этилбутил)циклогексил] карбонил] амино) фенил] 2- метилпропантиоат повышает уровень холестерина HDL у человека (de Grooth et al., см. выше) и кролика (Shinkai et al., см. выше; Kobayashi et al., см. выше; Okamoto et al., см. выше). Кроме того, показано, что S-[2-([[1-(2-этилбутил)циклогексил] карбонил] амино) фенил] 2-метилпропантиоат понижает уровень холестерина LDL у человека (de Grooth et al., см. выше) и кролика (Okamoto et al., см. выше). S-[2-([[1-(2-этилбутил)циклогексил] карбонил] амино) фенил] 2-метилпропантиоат, а также способы получения и применения соединения описаны в патенте ЕР1020439, Shinkai et al., J. Med. Chem. 43:3566-3572 (2000) или WO 2007/051714, WO 2008/074677 или WO2011/000793.
В предпочтительном воплощении ингибитор/модулятор СЕТР (например, соединение формулы I) представляет собой твердое соединение в кристаллической или аморфной форме, или, более предпочтительно, в кристаллической форме. В конкретном воплощении S-[2-([[1-(2-этилбутил)-циклогексил]-карбонил]амино)фенил]2-метилпропантиоат находится в кристаллической форме А, как описано в WO 2012/069087. Для формы А характерно наличие пиков приблизительно на 7,9°, 8,5°, 11,7°, 12,7°, 17,1°, 18,0°, 18,5°, 20,2°, 22,1°, 24,7±°0,2° в картине порошковой рентгеновской дифракции, в частности, дифракционные пики наблюдаются в области углов 2Theta 7,9°, 11,7°, 17,1°, 18,5° (±0,2°).
Другие ингибиторы СЕТР, которые известны в области техники и могут найти применение в данном изобретении, включают: эвацетрапиб, анацетрапиб и торцетрапиб, в частности, эвацетрапиб и анацетрапиб.
Соответственно, в изобретении предложен способ лечения или предупреждения сердечно-сосудистого расстройства у млекопитающего, включающий введение млекопитающему (предпочтительно, млекопитающему, которому это необходимо) терапевтически эффективного количества фармацевтической композиции. Предпочтительно, млекопитающим является человек (т.е. мужчина или женщина). Человек может быть любой расы (например, европеоидной или монголоидной).
Сердечно-сосудистое расстройство, в частности, представляет собой атеросклероз, заболевание периферических сосудов, дислипидемию, гипербеталипопротеинемию, гипоальфалипопротеинемию, гиперхолестеринемию, гипертриглицеридемию, семейную гиперхолестеринемию, стенокардию, ишемию, ишемию сердца, инсульт, инфаркт миокарда, реперфузионное повреждение, рестеноз после ангиопластики, гипертензию и сосудистые осложения диабета, ожирения или эндотоксемии. Более конкретно, сердечно-сосудистое расстройство представляет собой сердечно-сосудистое заболевание, ишемическую болезнь сердца, атеросклеротическую болезнь сердца, гипоальфалипопротеинемию, гипербеталипопротеинемию, гиперхолестеринемию, гиперлипидемию, атеросклероз, гипертензию, гипертриглицеридемию, гиперлипопротеинемию, заболевания периферических сосудов, стенокардию, ишемию или инфаркт миокарда.
В некоторых воплощениях данного изобретения субъектам или пациентам вводят от 100 мг до 600 мг S-[2-([[1-(2-этилбутил)-циклогексил]-карбонил]амино)фенил]2-метилпропантиоата. В частности, субъектам или пациентам вводят от 150 мг до 450 мг S-[2-([[1-(2-этилбутил)-циклогексил]-карбонил]амино)фенил]2-метилпропантиоата. Более конкретно, субъектам или пациентам вводят от 250 мг до 350 мг S-[2-([[1-(2-этилбутил)-циклогексил]-карбонил]амино)фенил]2-метилпропантиоата. Более конкретно, субъектам или пациентам вводят от 250 мг до 350 мг S-[2-([[1-(2-этилбутил)-циклогексил]-карбонил]амино)фенил]2-метилпропантиоата.
В другом воплощении данного изобретения для применения в педиатрии субъектам вводят от 25 мг до 300 мг S-[2-([[1-(2-этилбутил)-циклогексил]-карбонил]амино)фенил]2-метилпропантиоата. В частности, для применения в педиатрии субъектам вводят от 75 мг до 150 мг S-[2-([[1-(2-этилбутил)-циклогексил]-карбонил]амино)фенил]2-метилпропантиоата.
Ингибитор СЕТР можно вводить млекопитающим в любой подходящей дозировке (например, для достижения терапевтически эффективного количества). Например, подходящая дозировка терапевтически эффективного количества S-[2-([[1-(2-этилбутил)-циклогексил]-карбонил]амино)фенил]2-метилпропантиоата для введения пациенту будет составлять приблизительно от 100 мг до 1800 мг в сутки. Рекомендуемая доза предпочтительно составляет приблизительно от 300 мг до приблизительно 900 мг в сутки. Предпочтительная доза составляет приблизительно 600 мг в сутки.
Способы генотипирования
Установление конкретного генотипа образца ДНК может осуществляться любым из множества способов, хорошо известных специалистам в области техники. Например, выявление полиморфизма может осуществляться путем клонирования аллеля и его секвенирования способами, хорошо известными в области техники. В альтернативном случае, последовательности генов можно амплифицировать из геномной ДНК, например, с помощью ПЦР, и секвенировать продукт. В области техники известно множество способов выделения ДНК субъекта и определения в ней конкретного генетического маркера, включая полимеразную цепную реакцию (ПЦР), лигазную цепную реакцию (ЛЦР) или лигазную амплификацию и такие способы амплификации, как самоподдерживающаяся репликация последовательности. Ниже описано несколько способов анализа ДНК пациента на наличие мутаций в конкретных генных локусах, которые не являются исчерпывающими.
Можно применять технологию ДНК-микрочипов, например, ДНК-чипов и микрочипов высокой плотности для высокопроизводительного скрининга и микрочипов более низкой плотности. Способы изготовления микрочипов хорошо известны в области техники и включают различные технологии и способы струйного и микроструйного нанесения или раскапывания, способы фотолитографического синтеза олигонуклеотидов in situ или на-чипе, а также способы электронной адресации ДНК-зондов. Гибридизацию с ДНК-микрочипами успешно используют в анализе экспрессии генов и генотипировании точечных мутаций, однонуклеотидных полиморфизмов (ОНП) и коротких тандемных повторов. Дополнительные способы включают микрочипы, основанные на РНК-интерференции, и комбинации микрочипов с другими способами, такими как лазерная захватывающая микродиссекция (LCM, от англ. laser capture micro-dissection), сравнительная геномная гибридизация (CGH, от англ. comparative genomic hybridization) и иммунопреципитация хроматина (ChiP, от англ. chromatin immunoprecipitation). См., например, Не et al. (2007) Adv. Exp.Med. Biol. 593: 117-133 и Heller (2002) Annu. Rev. Biomed. Eng. 4: 129-153. Другие способы включают ПЦР, хМАР, анализ Invader, масс-спектрометрию и пиросеквенирование (Wang et al. (2007) Microarray Technology and Cancer Gene Profiling Vol 593 of book series Advances in Experimental Medicine and Biology, pub. Springer New York).
Другими способами детекции являются аллель-специфическая гибридизация с помощью зондов, перекрывающихся с полиморфным сайтом и содержащих вокруг полиморфного участка приблизительно 5 или, в альтернативном случае, 10 или, в альтернативном случае, 20 или, в альтернативном случае, 25 или, в альтернативном случае, 30 нуклеотидов. Например, несколько зондов, способных специфически гибридизоваться с аллельным вариантом или генетическим маркером, представляющим интерес, присоединены к твердому носителю, например, «чипу». Олигонуклеотидные зонды можно присоединять к твердому носителю с помощью различных процессов, включая литографию. Детекция мутаций с помощью таких чипов, содержащих олигонуклеотиды, которую также называют «анализом с использованием ДНК-зондов», описана, например, Cronin et al. (1996) Human Mutation 7':244.
В других способах детекции перед тем, как идентифицировать аллельный вариант, вначале необходимо амплифицировать по меньшей мере часть гена. Амплификацию можно осуществлять, например, посредством ПЦР и/или ЛЦР или другими способами, хорошо известными в области техники.
В некоторых случаях присутствие определенного аллеля в ДНК субъекта можно продемонстрировать при помощи рестрикционного анализа. Например, конкретный нуклеотидный полиморфизм может приводить к тому, что нуклеотидная последовательность будет содержать сайт рестрикции, который отсутствует в нуклеотидной последовательности другого аллельного варианта.
В следующем воплощении для детекции ошибочных оснований в гетеродуплексах РНК/РНК, ДНК/ДНК или РНК/ДНК можно использовать защиту от расщепляющих реагентов (таких как нуклеаза, гидроксиламин или тетраоксид осмия с пиперидином) (см., например, Myers et al. (1985) Science 230:1242). Как правило, методика «расщепления ошибочных нуклеотидов» начинается с того, что берут дуплекс, образованный гибридизующимся зондом, например, РНК или ДНК, который может быть меченым, содержащим нуклеотидную последовательность аллельного варианта гена, с образцом нуклеиновой кислоты, полученной из образца ткани. Двуцепочечные дуплексы обрабатывают агентом, который расщепляет одноцепочечные области дуплекса, как те, что образуются вследствие несовпадения пар оснований у цепей контроля и образца. Например, для ферментативного расщепления некомплементарных участков дуплексы РНК/ДНК можно обрабатывать РНКазой, а гибриды ДНК/ДНК - нуклеазой SI. В альтернативном случае для расщепления некомплементарных участков дуплексы ДНК/ДНК или РНК/ДНК можно обрабатывать гидроксиламином или тетраоксидом осмия и пиперидином. После расщепления некомплементарных участков полученный материал затем разделяют по размеру в полиакриламидном геле в присутствии денатурирующего агента и определяют, имеют ли нуклеиновые кислоты в контроле и в образце идентичную нуклеотидную последовательность или нуклеотиды в них различаются. См., например, патент US 6,455,249; Cotton et al. (1988) Proc. Natl. Acad. Sci. USA 85:4397; Saleeba et al. (1992) Meth. Enzymol. 217:286-295.
Также, для идентификации конкретного аллельного варианта можно использовать изменение электрофоретической подвижности. Например, одноцепочечный конформационный полиморфизм (SSCP, от англ. single strand conformation polymorphism) можно использовать для детекции различий в электрофоретической подвижности между мутантной нуклеиновой кислотой и нуклеиновой кислотой дикого типа (Orita et al. (1989) Proc Natl. Acad. Sci USA 86:2766; Cotton (1993) Mutat. Res. 285: 125-144 and Hayashi (1992) Genet. Anal. Tech. Appl. 9:73-79). Одноцепочечные фрагменты ДНК нуклеиновых кислот образца и контроля подвергают денатурации и ренатурации. Вторичная структура одноцепочечных нуклеиновых кислот варьирует в зависимости от последовательности; происходящее изменение электрофоретической подвижности позволяет детектировать изменение даже единственного основания. Фрагменты ДНК могут быть меченными или для их детекции можно использовать меченные зонды. Чувствительность анализа можно повысить при использовании РНК (а не ДНК), вторичная структура которой более чувствительна к изменениям последовательности. В другом предпочтительном воплощении в способе используют гетеродуплексный анализ для разделения молекул двуцепочечных гетеродуплексов по изменению электрофоретической подвижности (Keen et al. (1991) Trends Genet. 7:5).
Аллельный вариант или генетический маркер можно также идентифицировать путем анализа перемещения нуклеиновой кислоты, содержащей полиморфный участок, в полиакриламидном геле, содержащем градиент денатурирующего агента, что осуществляют при помощи денатурирующего градиентного гель-электрофореза (DGGE, от англ. denaturing gradient gel electrophoresis) (Myers et al. (1985) Nature 313:495). Когда в качестве аналитического способа используют DGGE, ДНК модифицируют, чтобы она не денатурировала полностью, например, добавляя GC-застежку длиной приблизительно 40 пн, представленную богатой GC ДНК с высокой температурой плавления, при помощи ПЦР. В другом воплощении для идентификации различий в подвижности ДНК в контроле и образце вместо градиента денатурирующего агента используют градиент температуры (Rosenbaum and Reissner (1987) Biophys. Chem. 265:1275).
Примеры способов определения различий между 2 нуклеиновыми кислотами по меньшей мере по одному нуклеотиду включают селективную гибридизацию нуклеотидов, селективную амплификацию или селективную достройку праймеров. Например, можно создавать олигонуклеотидные зонды, в которых известные полиморфные нуклеотиды размещены в центральной части (аллель-специфические зонды) и затем осуществлять гибридизацию с целевой ДНК в условиях, обеспечивающих гибридизацию только в случае абсолютной комплементарности (Saiki et al. (1986) Nature 324:163); Saiki et al. (1989) Proc. Natl. Acad. Sci. USA 86:6230). Такую методику аллель-специфической гибридизации олигонуклеотидов используют для детекции вариантов нуклеотидов в полиморфной области гена. Например, олигонуклеотидные зонды, имеющие нуклеотидную последовательность конкретного аллельного варианта, присоединяют к гибридизующей мембране и затем эта мембрана гибридизуется с меченым образцом нуклеиновой кислоты. Последующий анализ гибридизационного сигнала позволит идентифицировать нуклеотиды в образце нуклеиновой кислоты.
В альтернативном случае можно использовать технологию аллель-специфической амплификации, которая основана на селективной ПЦР-амплификации и может применяться в контексте данного изобретения.
Олигонуклеотиды, которые используют в качестве праймеров для специфической амплификации, могут нести аллельный вариант, представляющий интерес, в центральной части молекулы (таким образом, амплификация будет зависеть от неодинаковой гибридизации) (Gibbs et al. (1989) Nucl. Acids Res. 17:2437-2448) или на 3' конце одного из праймеров, когда в соответствующих условиях несовпадение может предупреждать или ограничивать достройку праймера полимеразой (Prossner (1993) Tibtechl 1:238 and Newton et al. (1989) Nucl. Acids Res. 17:2503). Данная методика носит название "PROBE" от англ. PRobeOligo Base Extension (достройка оснований олигонуклеотидного праймера). Кроме того, может быть целесообразным введение нового сайта рестрикции в области мутации для осуществления детекции, основанной на расщеплении (Gasparini et al. (1992) Mol. Cell. Probes 6:1).
В другом воплощении аллельный вариант или генетический маркер идентифицируют с помощью лигирования олигонуклеотидных зондов (oligonucleotide ligation assay, OLA), как описано, например, в патенте US 4,998,617 и Laridegren, U. et al. Science 241:1077-1080, 1988). В протоколе OLA используют два олигонуклеотидных зонда, которые способны гибридизоваться встык с одноцепочечными последовательностями мишени. Один из нуклеотидов связан с маркером, обеспечивающим выделение, например, биотинилирован, а другой несет метку, обеспечивающую детекцию. Если в молекуле-мишени присутствует абсолютно комплементарная последовательность, олигонуклеотиды будут гибридизоваться таким образом, что их концы будут располагаться встык и являться субстратом лигазы. Лигирование позволяет выделять меченые олигонуклеотиды с помощью авидина или другого лиганда биотина. Nickerson, D. A. et al. описали детектирование нуклеиновых кислот, в котором сочетаются свойства ПЦР и OLA (Nickerson, D.A. et al. (1990) Proc. Natl. Acad. Sci. USA 87:8923-8927). В данном способе ПЦР используют для экспоненциальной амплификации ДНК-мишени, которую затем детектируют с помощью OLA. Вариант метода OLA описан Tobe et al. (1996) Nucleic Acids Res. 24:3728, где каждый аллель-специфический праймер помечен уникальным гаптеном, т.е. дигоксигенином и флуоресцеином, а для регистрации каждой реакции OLA используют гаптен-специфические антитела, меченные ферментами-репортерами.
В изобретении предложены способы детекции однонуклеотидного полиморфизма (ОНП) в ADCY9. Поскольку однонуклеотидные полиморфизмы фланкированы областями неизменяющейся последовательности, их анализ требует всего лишь идентификации одного альтернативного нуклеотида и нет необходимости определять всю последовательность гена для каждого пациента. Для облегчения анализа ОНП разработано несколько способов.
Однонуклеотидный полиморфизм можно определять с помощью специальных резистентных к экзонуклеазам нуклеотидов, как описано, например, в патенте US 4,656,127. Согласно способу, праймер, комплементарный аллельной последовательности, непосредственно примыкающей в направлении 3' к полиморфному сайту, гибридизуется с молекулой-мишенью, полученной у конкретного животного или человека. Если полиморфный сайт молекулы-мишени содержит нуклеотид, комплементарный конкретному производному резистентного к экзонуклеазам нуклеотида, то это производное будет присоединяться к концу гибридизованного праймера. Такое присоединение делает праймер устойчивым к экзонуклеазам и, таким образом, обеспечивает его детекцию. Поскольку резистентное к экзонуклеазам производное известно, тот факт, что праймер приобрел устойчивость к экзонуклеазам свидетельствует, что нуклеотид, присутствующий в полиморфном сайте молекулы-мишени, был комплементарен производному нуклеотида, использовавшемуся в реакции. Преимуществом способа является то, что он не требует генерировать большой объем избыточных данных.
Для идентификации полиморфного сайта нуклеотида способ также можно осуществлять в растворе (WO 91/02087). Как описано выше, используют праймер, комплементарный аллельной последовательности, непосредственно примыкающей в направлении 3' к полиморфному сайту. Способ позволяет идентифицировать нуклеотид данного сайта с помощью меченых производных дидезоксинуклеотидов, которые, будучи комплементарны нуклеотиду полиморфного сайта, будут присоединяться к концу праймера.
Альтернативный способ описан в WO 92/15712. В данном способе используют смеси меченых терминаторов и праймер, комплементарный последовательности, расположенной в направлении 3' относительно полиморфного сайта. Таким образом, определяют присоединяющийся меченый терминатор, комплементарный нуклеотиду, присутствующему в полиморфном сайте исследуемой молекулы-мишени. Способ обычно выполняют в формате гетерогенного исследования, где праймер или молекула-мишень иммобилизованы на твердой фазе.
Для исследования полиморфных сайтов ДНК описано множество других процедур праймер-опосредованного включения нуклеотидов (Komher, J.S. et al. (1989) Nucl. Acids. Res. 17:7779-7784; Sokolov, B.P. (1990) Nucl. Acids Res. 18:3671; Syvanen, A.-C, et al. (1990) Genomics 8:684-692; Kuppuswamy, M.N. et al. (1991) Proc. Natl. Acad. Sci. USA 88:1143-1147; Prezant, T.R. et al. (1992) Hum. Mutat. 1:159-164; Ugozzoli, L. et al. (1992) GATA 9: 107-112; Nyren, P. et al. (1993) Anal.Biochem. 208:171-175). Все указанные способы основаны на включении меченых дезоксинуклеотидов для распознавания оснований в полиморфном сайте.
Кроме того, следует понимать, что любой из указанных способов детекции изменений гена или генного продукта или полиморфных вариантов также можно использовать для наблюдения за ходом лечения или терапии.
При осуществлении описанных в данном документе способов можно, например, применять заранее упакованные диагностические наборы, такие как описанные ниже, содержащие по меньшей мере один зонд, нуклеотидный праймер или реагент, который удобно использовать для генотипирования, например, анализа генетического маркера, присутствующего в гене ADCY9 для определения, существует ли повышенная вероятность того, что лечение поднимающим уровень HDL или имитирующим HDL агентом, включая поднимающий уровень HDL или имитирующий HDL агент, в частности, ингибитор/модулятор СЕТР, принесет пользу индивидууму. В частности, генетические маркеры являются такими, как описано ниже.
Праймеры или зонды согласно данному изобретению, предназначенные для применения в качестве реагентов для генотипирования генетических маркеров, присутствующих в гене ADCY9, содержат синтетическую нуклеотидную последовательность, комплементарную и гибридизующуюся с непрерывной последовательностью в составе гена ADCY9, предпочтительно состоящую из 12-30 нуклеотидов, прилегающих к одному или нескольким ОНП или включающих в себя один или несколько ОНП, выбранных из rs11647778, rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs2238448 и rs13337675, предпочтительно, rs11647778. В других аспектах праймер содержит 100 или менее нуклеотидов, в некоторых аспектах от 12 до 50 нуклеотидов или от 12 до 30 нуклеотидов. Праймер по меньшей мере на 70% идентичен непрерывной последовательности или последовательности, комплементарной непрерывной нуклеотидной последовательности, предпочтительно по меньшей мере на 80% идентичен, и более предпочтительно, по меньшей мере на 90% идентичен. Праймер или зонд по изобретению предпочтительно имеет длину 15-50 нуклеотидов, содержащих область из 15-20 нуклеотидов, комплементарных последовательности, выбранной из SEQ. ID. NO 1-21, в частности, комплементарных последовательности SEQ. ID No 1, 19 или 21. Степень комплементарности между зондом или праймером и последовательностью SEQ. ID. NO. 1-21 может составлять 100%, 95%, 90%, 85%, 80% или 75%.
Олигонуклеотиды, включая зонды и праймеры, «специфичные» в отношении аллеля гена или генетического маркера, связываются либо с полиморфной областью гена, либо с областью, примыкающей к полиморфной области гена. Применительно к олигонуклеотидам, которые предназначены для применения в качестве праймеров для амплификации, праймеры являются примыкающими, если они достаточно близки, чтобы применяться для получения пол и нуклеотида, содержащего полиморфную область. В одном воплощении олигонуклеотиды являются примыкающими, если они связываются приблизительно в пределах 1-2 тпн, например, на расстоянии менее 1 тпн от полиморфизма. Некоторые олигонуклеотиды способны гибридизоваться с последовательностью и при подходящих условиях не будут связываться с последовательностью, отличающейся по единственному нуклеотиду.
Олигонуклеотиды по изобретению, используемые в качестве зондов или праймеров, могут нести детектируемую метку. Метки можно детектировать либо напрямую, например, флуоресцентные метки, либо опосредовано. Опосредованная детекция включает любой способ детекции, известный специалистам в области техники, включая взаимодействие биотин-авидин, связывание антител и т.п. Флуоресцентно меченые олигонуклеотиды также содержат молекулу-гаситель. Олигонуклеотиды могут быть присоединены к поверхности. В некоторых воплощениях поверхность представляет собой кремний или стекло. В некоторых воплощениях поверхность представляет собой металлический электрод.
Зонды можно применять непосредственно для определения генотипа образца или применять одновременно с амплификацией или по окончании амплификации. Термин «зонд» охватывает одно- или двуцепочечные нуклеиновые кислоты естественного происхождения или рекомбинантные или нуклеиновые кислоты, синтезированные химическим способом. Они могут быть мечеными в ходе ник-трансляции, заполнения липких концов с помощью фрагмента Кленова, с помощью ПЦР или другими способами, известными в области техники. Зонды по данному изобретению, их получение и/или мечение описаны Sambrook et al. (1989) см. выше. Зонд может представлять собой полинуклеотид любой длины, подходящий для селективной гибридизации с нуклеиновой кислотой, содержащей полиморфную область по изобретению. Длина используемого зонда будет, отчасти, определяться особенностями применяемого анализа и условиями гибридизации.
Для амплификации полиморфизма также можно использовать меченые зонды (Holland et al. (1991) Proc. Natl. Acad. Sci. USA 88:7276-7280). Патент US 5,210,015 описывает способы определения продуктов амплификации в ходе ПЦР в реальном времени на основе флуоресценции. В указанных способах применяют либо интеркалирующие красители (такие как бромистый этидий), указывающие количество присутствующей двуцепочечной ДНК, либо зонды, содержащие гасители флуоресценции (также обозначаемые «TaqMan®»), где зонд отщепляется в ходе амплификации с высвобождением флуоресцентных молекул, концентрация которых пропорциональна количеству присутствующей двуцепочечной ДНК. В ходе амплификации зонд расщепляется благодаря нуклеазной активности полимеразы, затем гибридизуется с последовательностью мишени, при этом флуоресцентная молекула и молекула-гаситель расходятся, в результате чего молекула-репортер испускает флуоресценцию. В подходе TaqMan® используют зонд, содержащий пару молекула-репортер - молекула-гаситель, которая специфически отжигается в участке полинуклеотида-мишени, содержащем полиморфизм.
Зонд может быть фиксирован на поверхности для использования в «генных чипах». Такие генные чипы могут применяться для выявления генетической изменчивости с использованием ряда методик, известных специалистам в данной области. В одной из методик олигонуклеотиды располагают на генном чипе для определения последовательности ДНК путем секвенирования с помощью гибридизационного похода, как описано в патентах US 6,025,136 и 6,018,041. Зонды по изобретению также можно использовать для флуоресцентной детекции последовательностей генов. Такие методики описаны, например, в патентах US. Зонды по изобретению также можно использовать для флуоресцентной детекции последовательностей генов. Такие методики описаны, например, в патентах US 5,968,740 и 5,858,659. Также, зонд может быть фиксирован на поверхности электрода для электрохимической детекции последовательностей нуклеиновых кислот, как описано в патенте US 5,952,172 и Kelley, S.О. et al. (1999) Nucl. Acids Res. 27:4830-4837. Один или несколько зондов для детекции ОНП по изобретению (Таблицы 2, 3, 4, 5 или 10, в частности, Таблица) могут быть фиксированы на чипе и такое устройство может применяться для предсказания ответа на поднимающий уровень HDL или имитирующий HDL агент, в частности, ингибитор/модулятор СЕТР, и для выбора эффективного лечения индивидуума, страдающего сердечно-сосудистым заболеванием. Допускают, что зонды для детекции ОНП по изобретению можно наносить на чип наряду с множеством других зондов для других применений, помимо предсказания ответа на поднимающий уровень HDL или имитирующий HDL агент, в частности, ингибитор/модулятор СЕТР.
Кроме того, синтетические олигонуклеотиды, используемые в качестве зондов или праймеров, могут быть модифицированы для придания им большей стабильности. Примеры молекул модифицированных нуклеиновых кислот включают незаряженные связи, такие как фосфорамидатные, фосфоротиоатные и метилфосфонатные аналоги ДНК (см. также патенты US 5,176,996; 5,264,564 и 5,256,775). Зонды и праймеры по изобретению могут включать, например, метилирование с включением метки, межнуклеотидные модификации, такие как подвешенные компоненты (например, полипептиды), интеркаляторы (например, акридин, псорален), хелаторы, алкилирующие агенты и модифицированные связи (например, альфа-аномерные нуклеиновые кислоты (с аномерным центром в альфа-конфигурации)). Сюда также входят синтетические молекулы, которые имитируют молекулы нуклеиновых кислот по своей способности связываться с заданной последовательностью посредством водородных связей и других химических взаимодействий, включая образование пептидных связей, замещающих фосфатные связи в нуклеотидном остове.
Изобретение относится к синтетическим олигонуклеотидным молекулам, праймерам и зондам, которые гибридизуются в условиях высокой жесткости с олигонуклеотидами естественного происхождения, описанными в данном документе, генетическими маркерами гена ADCY9. Олигонуклеотиды можно детектировать и/или выделять при помощи специфической гибридизации в условиях высокой жесткости. «Условия высокой жесткости» известны в области техники и обеспечивают специфическую гибридизацию первого олигонуклеотида со вторым олигонуклеотидом, когда существует высокая степень комплементарности между первым и вторым олигонуклеотидами. Для способов генотипирования, описанных в данном документе, данная степень комплементарности составляет от 80% до 100%, предпочтительно от 90 до 100%.
ОНП по изобретению также можно детектировать на основании уже существующих данных, таких как результаты секвенирования полного генома, представленные в базе данных. В изобретении предложен компьютерный способ анализа данных генома для определения генотипа для предсказания ответа пациента на ингибитор СЕТР и лечения указанного пациента соответствующим образом, т.е. лечения ингибитором СЕТР пациентов, у которых может быть достигнут лечебный эффект.
Образец нуклеиновой кислоты для применения в способах генотипирования, выборе лечения или способах лечения может быть получен из любого типа клеток или тканей субъекта. Например, образец жидкости из организма субъекта (например, крови) может быть получен известными способами. В альтернативном случае, исследования нуклеиновых кислот можно проводить на сухих образцах (например, волос или кожи). Более конкретно, образец нуклеиновой кислоты для применения в способах генотипирования, в выборе лечения или в способах лечения может быть получен из клеток крови.
Описанное в данном документе изобретение относится к способам и реагентам, которые могут найти применение в определении и идентификации аллелей rs11647778, присутствующих в гене ADCY9 и, возможно, аллелей rs1967309, rs2238448 или rs12595857, или любого другого генетического варианта, находящегося в неравновесии по сцеплению с указанными ОНП, как показано на Фиг. 8 и 9, располагающихся между позициями chrl 6:4049365 и chrl 6:4077178 (сборка GRCh37/hg19). В частности, изобретение также относится к способам и реагентам для определения и идентификации аллелей rs11647778, присутствующих в гене ADCY9 и, возможно, аллелей rs1967309, rs12595857, rs2239310, rs11647828, rs8049452, rs12935810, rs74702385, rs17136707, rs8061182, rs111590482, rs4786454, rs2283497, rs2531967, rs3730119, rs13337675, rs2238448, более конкретно, rs11647778 и, возможно, rs1967309 и/или rs12595857, и наиболее конкретно, rs11647778 и, возможно, rs1967309.
В соответствии с данным описанием, в изобретении также предложены способы выбора лечения, включающие определение одного или нескольких генетических маркеров, присутствующих в гене ADCY9. В некоторых воплощениях в способах применяют зонды или праймеры, содержащие последовательности нуклеотидов, которые комплементарны полиморфному участку ADCY9. Соответственно, в изобретении предложены наборы, содержащие зонды и праймеры для осуществления способов генотипирования по изобретению.
В некоторых воплощениях изобретения предложены наборы, которые могут найти применение для определения, существует ли повышенная вероятность того, что лечение поднимающим уровень HDL или имитирующим HDL агентом, в частности, ингибитором/модулятором СЕТР, принесет пользу пациенту, страдающему сердечно-сосудистым расстройством. Такие наборы содержат один или несколько реагентов, в частности, праймеров или зондов, описанных в данном документе, а также инструкции по применению. Например, в изобретении также предложены наборы, содержащие первый олигонуклеотид и второй олигонуклеотид, специфичные в отношении полиморфизма СС ОНП rs11647778 ADCY9 и, возможно, в отношении полиморфизма АА ОНП rs1967309 ADCY9, которые могут найти применение для определения, существует ли повышенная вероятность того, что лечение S-(2-{[1-(2-этил-бутил)-циклогексанкарбонил]-амино}-фениловым) эфиром тиоизобутировой кислоты принесет пользу пациенту, страдающему сердечнососудистым расстройством.
Набор может содержать по меньшей мере один зонд или праймер, способный специфически гибридизоваться с полиморфным участком ADCY9, а также инструкции по применению. Наборы могут содержать по меньшей мере одну из указанных выше нуклеиновых кислот.Наборы, которые можно применять для амплификации по меньшей мере части ADCY9, обычно содержат два праймера, из которых по меньшей мере один способен гибридизоваться с последовательностью аллельного варианта. Такие наборы подходят для детекции генотипа, например, флуоресцентным методом, электрохимическим методом или другим методом.
Другие наборы по изобретению содержат по меньшей мере один реагент, подходящий для проведения исследования. Например, набор может содержать фермент.В альтернативном случае набор может содержать буфер или любой другой необходимый реагент.
Наборы могут иметь в своем составе все или некоторые из описанных в данном документе положительных контролей, отрицательных контролей, реагентов, праймеров, маркеров секвенирования, зондов и антител для определения генотипа субъекта в полиморфном участке ADCY9.
Следующие примеры предназначены исключительно для иллюстрации осуществления данного изобретения и не ограничивают изобретение.
Данное изобретение относится к следующим нуклеотидным и аминокислотным последовательностям:
Приведенные в данном документе последовательности размещены в базе данных NCBI и к ним можно получить доступ по адресу в интернете ncbi.nlm.nih.gov/sites/entrez?db=gene; Указанные последовательности также относятся к аннотированным и модифицированным последовательностям. В данном изобретении также предложены методы и способы, в которых применяют гомологичные последовательности и варианты конкретных последовательностей, приведенных в данном документе. Предпочтительно, указанные «варианты» представляют собой генетические варианты. Нуклеотидная последовательность, кодирующая аденилатциклазу 9 типа Homo sapiens (ACDY9) размещена в базе данных NCBI.
Аденилатциклаза 9 типа Homo sapiens (ADCY9) RefSeqGene на хромосоме 16
Референтная последовательность NCBI: Номер доступа NCBI: NG_011434.1
Homo sapiens геномный контиг хромосомы 16, первичная сборка GRCh37.p10
Референтная последовательность NCBI: Номер доступа NCBI: NT_010393.16
Интронные последовательности для ОНП гена ACDY9 Homo sapiens с обозначениями "rs", аллели и соответствующие номера SEQ ID указаны в Таблицах 6, 7 и 8. Идентифицированные полиморфизмы выделены жирным шрифтом и взяты в скобки.

1. Источник: референтная геномная последовательность NCBI сборки 37.3
Таблица 7. Перечень генетических вариантов в гене ADCY9 на хромосоме chr16, которые оказались ассоциированы (Р<0.05) с ответом на терапию дальцетрапибом при полногеномном поиске ассоциаций, референтные последовательности взяты из документации к чипу для генотипирования, использованного в эксперименте (lllumina OMNI2.5SV.






Chr: номер хромосомы; значение Р: для ассоциации с сердечно-сосудистыми событиями (первичное комбинированное событие или незапланированная реваскуляризация коронарных артерий) у пациентов, получавших лечение ингибитором СЕТР дальцетрапибом; 1: Референтная последовательность из общедоступной базы данных 1000 Genomes, представленная в файле с аннотацией для чипа ILLUMINA OMNI 2.5S Chip HumanOmni25Exome-8v1_A.csv; 2; Референтная последовательность из общедоступной базы данных dbSNP версии 131 из NCBI, представленная в файле с аннотацией для чипа ILLUMINA OMNI 2.5S Chip HumanOmni25Exome-8v1_A.csv.


Примечания: a. rs1967309
1. Расположение, значения r2 и D' согласно общедоступной базе данных 1000 Genomes
2. Референтная последовательность и обозначения HGV из общедоступной базы данных dbSNP версии 137, разработанной и поддерживаемой NCBI
Пример 1.
Исследование Dal-OUTCOMES (NC20971) представляло собой двойное слепое рандомизированное плацебо-контролируемое многоцентровое исследование III фазы в параллельных группах для оценки безопасности и эффективности ингибитора СЕТР дальцетрапиба у пациентов, недавно госпитализированных по поводу острого коронарного синдрома (ОКС). На момент промежуточного анализа в исследовании участвовало 15871 рандомизированных пациентов, поделенных на две группы, получавших плацебо (7933 пациента) или дальцетрапиб (600 мг в сутки; 7938 пациентов). Исследование не продемонстрировало снижения частоты событий в первичной конечной точке оценки эффективности в группе дальцетрапиба по сравнению с группой плацебо. Подробное описание исследования dal-OUTCOMES представлено G. Schwartz et al., N. Engl. J. Med. 367; 22, 2012.
Пациентов для исследования dal-Outcomes набирали через 4-12 недель после госпитализации по поводу острого коронарного синдрома, характеризовавшегося повышением кардиальных биомаркеров, с симптомами острой ишемии миокарда, новых или предположительно новых электрокардиографических признаков ишемии или потери жизнеспособного миокарда при визуализирующем исследовании. Пациенты без повышения кардиальных биомаркеров допускались к участию, если симптомы острой ишемии миокарда сопровождались новыми или предположительно новыми электрокардиографическими изменениями и дополнительными признаками обструктивной коронарной болезни. (Schwartz GG et al. Am Heart J 2009; 158:896-901 е3). Пациенты, у которых инфаркт миокарда был ассоциирован с чрескожным коронарным вмешательством, также допускались к участию. Все пациенты следовали персонализированным схемам лечения, нацеленным на снижение уровня холестерина LDL до 100 мг/дл (2,5 ммоль/л) или ниже при помощи статинов, при их переносимости, и диеты. Конкретный препарат статина не упоминали и пациентов не исключали по показателям холестерина LDL. Всех пациентов с уровнем триглицеридов сыворотки 400 мг/дл (4,5 ммоль/л) или выше исключали. (Schwartz GG et al. N Engl J Med 2012; 367:2089-99). Удовлетворяющие критериям dal-Outcomes пациенты включались в простое слепое исследование с назначением плацебо в течение подготовительного периода, длившегося от 4 до 6 недель, для стабилизации состояния пациентов и завершения запланированных процедур реваскуляризации. После окончания подготовительного периода удовлетворяющие критериям пациенты были рандомизированы в соотношении 1:1 в группы, получавшие 600 мг дальцетрапиба или плацебо в дополнение к научно обоснованной медицинской помощи при ОКС. Заключение о сердечно-сосудистых событиях выносил независимый комитет по оценке конечных точек. Для фармакогеномного исследования было набрано 6338 пациентов с апреля 2008 по июль 2010 в 461 центре в 14 странах, которые подписали информированное согласие на участие в генетическом исследовании dal-OUTCOMES. ДНК выделяли из цельной крови. После очистки геномных данных образцы 5749 пациентов европейской расы использовали для полногеномного поиска ассоциаций.
Генотипирование
Для полногеномного поиска ассоциаций у 5749 участников исследования dal-OUTCOMES европеоидной расы использовали чип lllumina Infinium HumanOmni2.5Exome-8v1_A BeadChip, включающий 2 567 845 генетических вариантов (lllumina, San Diego, California). Участок хромосомы 16, включающий 5 генов, расположенных в направлении 5' и 3' относительно гена аденилатциклазы 9 типа (ADCY9) (CHR16: 3,400,000-4,600,000) предсказали с помощью программы IMPUTE2 и получили для анализа 17 764 вариантов, при этом полнота генотипирования составила в среднем 99,76%. Панель Sequenom использовали для подтверждения генотипа предсказанных однонуклеотидных полиморфизмов (ОНП) гена ADCY9, идентифицированных в dal-OUTCOMES, и для поиска ассоциаций в исследовании dal-PLAQUE-2, в том числе для генотипирования 20 ОНП, для которых при разведочном полногеномном поиске ассоциаций были получены значения Р<0,05.
ДНК выделяли из 1 мл цельной крови с помощью набора QiaSymphony DNA midi kit версии 1.1 (Qiagen, Garstilgweg, Швейцария), для ее количественного определения использовали систему QuantiFluor™ dsDNA System (Promega, Madison, Wl), получив среднюю концентрацию 91,5 нг/мкл и средний выход 18,3 мкг.97,9% образцов ДНК имели концентрацию выше 25 нг/мкл. Электрофорез в агарозном геле подтвердил высокое качество ДНК и отсутствие признаков деградации. ДНК нормализовали до 50 нг/мкл.
Полногеномный поиск ассоциаций: для полногеномного генотипирования использовали 200 нг геномной ДНК, генотипирование проводили в центре фармакогеномики Beaulieu-Saucier (Монреаль, Канада), соответствующем стандартам надлежащей лабораторной практики. Чип lllumina Infinium HumanOmni2.5Exome-8v1_A BeadChip (lllumina, Сан-Диего, Калифорния), включающий 2 567 845 геномных маркеров, использовали в соответствии с инструкциями производителя. Данный чип включает более 200000 экзонных вариантов, идентифицированных благодаря консорциуму Exome Chip. Оставшуюся часть чипа BeadChip занимает смесь редких и распространенных ОНП из проекта 1000 Genome, включенных для максимальной информативности у различных популяций населения планеты. Каждый чип BeadChip сканировали и анализировали с помощью считывающего устройства lllumina iScan Reader. Сканированные изображения анализировали с помощью программы lllumina's GenomeStudio версии 2011.1 и алгоритма GenTrain 2.0 cluster, с пороговым значением «No-Call» 0,15, без корректировки кластеров вручную и с применением файла кластеров lllumina HumanOmni25Exome-8v1_A от производителя. Файлы данных генотипирования состояли из трех частей сопоставимого размера, сгенерированных по мере появления данных.
Секвеном - разработали единую панель Sequenom и валидировали с использованием образцов ДНК НарМар. Панель включала 27 ОНП гена ADCY9, выбранных согласно следующим критериям: значение Р≤0,05 при разведочном полногеномном поиске ассоциаций (n=15), значение Р<10-6 при предсказании (n=6; 1 - неудача при разработке), предсказанная регуляторная функция (n=5; 1 исключен из-за низкой частоты минорного аллеля) или данные литературы (n=4; 1 - неудача при производстве). Использовали систему Sequenom MassArray Maldi-TOF (Sequenom, La Jolla, CA) с программным обеспечением Sequenom's Typer 4.0.22. Для каждой плашки кластеризацию проводили автоматически и при необходимости вносили коррективы вручную. Два образца ДНК из института Кориэлл (NA11993 и NA07357), которые использовали в качестве контроля на каждом планшете для генотипирования, показали 100% совпадение репликатов на всех плашках и 100% совпадение распознанных генотипов с ожидаемыми для соответствующих ОНП согласно референтным базам данных 1000 Genomes и НарМар. У 17 ОНП, генотипированных при полногеномном поиске ассоциаций и с помощью панели Sequenom, генотипы совпали в среднем на 99,95% (мин: 99,41, макс: 100,00%), а у 11 ранее предсказанных ОНП средняя степень совпадения генотипа с наиболее вероятным генотипом (предсказание с вероятностью >0,80) составила 99,75 (мин: 98,48, макс: 99,96).
Контроль качества генотипирования
Разведочный полногеномный поиск ассоциаций Dal-Outcomes Файлы генотипирования в формате PLINK, созданные программой GenomeStudio, объединяли и трансформировали в бинарный формат PLINK. Для построения графиков половой принадлежности, отношения Log R и частоты В-аллеля использовали файлы итогового отчета GenomeStudio. Для контроля качества использовали программы PyGenClean (Lemieux Perreault LP et al. Bioinformatics 2013; 29:1704-5) и PLINK версии 1.07, а также процесс очистки генетических данных. Эксперимент по генотипированию включал 68 планшетов с образцами ДНК. На каждом планшете было два контроля, один образец ДНК из института Кориэлла (по очереди один из четырех заранее выбранных образцов NA11993, NA11992, NA10860 и NA12763) и один внутренний контроль ДНК из четырех заранее выбранных образцов. При попарном сравнении образцов из института Кориэлла совпадение составило от 0,999807 до 0,999958. При попарном сравнении четырех внутренних контролей совпадение составило от 0,99976 до 0,99995. Сравнение генотипов образцов из института Кориэлла с ожидаемыми на основании данных 1000 Genomes показало совпадение в пределах от 0,996028 до 0,997783.
Этапы очистки данных генотипирования подробно представлены в Таблице 9. У дублирующихся ОНП оценивали степень совпадения, полноту генотипирования, распознавание аллеля и частоту минорного аллеля. Оставляли ОНП с различным распознаванием аллелей или ОНП с различной частотой минорного аллеля. Идентичные и совпадающие ОНП совмещали. Показатель полноты генотипирования для образцов и ОНП (доля генотипированных ОНП в образце и доля образцов с генотипированными ОНП, соответственно) установили на уровне 98%. ОНП, у которых отмечалась систематическая погрешность (обусловленная использованием 96-луночных планшетов для разведения образцов ДНК), отмечали флажками, но не отбрасывали, поскольку было невозможно исключить влияние генетического происхождения. Для выявления близкородственных связей использовали попарный анализ идентичности по статусу (IBS, от англ. identity-by-state). Пары родственников, а также дублирующиеся образцы (отношение IBS2*>0,80, для расчетов выбирали некоррелированные ОНП (r2<0,1)) отмечали флажками и оставляли для анализа только одного представителя. Матрицу попарного анализа идентичности по статусу использовали как меру расстояния для идентификации скрытых родственных связей между образцами и «выпадающих» образцов посредством многомерного шкалирования. На графике откладывали первые две компоненты многомерного шкалирования для каждого субъекта, включая данные для генотипов CEU, JPT-CHB и YRI из проекта НарМар (оставляя только индивидуумов-основателей). Образцы, выпадающие из основного кластера европеоидов, отмечали флажком и удаляли методом k ближайших соседей (Фиг. 5).
Для построения графика Кеттела и расчета кумулятивной объяснимой дисперсии использовали программу smartpca пакета EIGENSOFT (версия 3.0). Для опции numoutlieriter (максимальное число итераций удаления резко отклоняющихся значений) выбирали значение 0 (опция отключена), а для опции altnormstyle (формула нормализации) выбирали вариант NO (нет). (Price AL Nat Genet 2006; 38:904-9) (Фиг. 6)
Предсказание
Последовательность участка 16 хромосомы, включающего 5 генов в направлении 5' и 3' от ADCY9 (CHR16: 3,401,847-4,598,558; сборка NCBI GRCh37) предсказывали с помощью программ IMPUTE2 (версия 2.3.0) и GTOOL (версия 0.7.0) на Linux, используя 1096 генотипированных ОНП и 5749 образцов, полученных у пациентов европеоидной расы в исследовании dal-Outcomes. (Howie BN et Al. PLoS Genet 2009;5:e1000529). В случае ОНП, отличных от А/Т и C/G, для определения ориентации цепей нуклеотиды автоматически заменяли комплементарными. Допускающие двоякое толкование ОНП А/Т и C/G считали пропущенными и предсказывали. Для предсказания использовали стандартный пакет программ Impute2 ALL_1000G_phase1integrated_v3_chr16_impute. Пороговое значение вероятности предсказания для генотипа и для индивидуума установили на уровне 0,80, а показатель полноты генотипирования на уровне 98% или выше. У оставшихся 17 764 анализируемых вариантов полнота генотипирования в среднем составила 99,76%.
Согласно модели пропорциональных рисков Кокса, из проанализированных в масштабе генома 1 223 798 распространенных ОНП, достоверно ассоциирован с сердечно-сосудистыми событиями в группе дальцетрапиба оказался единственный участок, что позволило идентифицировать ОНП в гене ADCY9 на хромосоме 16: rs1967309 (Р=2,41×10-8) (Фиг 1А). Частота минорного аллеля генетического варианта в данной позиции составляла 0,41, а аддитивный генетический эффект одного аллеля (А) выражался ОР=0,65 (95% ДИ 0,56, 0,76) сердечно-сосудистого события в группе дальцетрапиба (Таблица 12а). Соседние ОНП, находящиеся в неравновесии по сцеплению с rs1967309, которые продемонстрировали менее выраженную, но достоверную ассоциацию, располагались в едином блоке сцепления (Фиг. 1Б). Предсказание в данном участке позволило идентифицировать 9 дополнительных ОНП гена ADCY9 с уровнем значимости Р<10-5, в том числе 6 с уровнем значимости Р<10-6 (Фиг 10). Ни один из 835 255 редких ОНП, проанализированных методом SKAT в группах 36 268 генов, не достиг порогового уровня значимости для включения в последующий анализ.
В группе, получавшей только плацебо, генетический эффект rs1967309 не определялся (модель пропорциональных рисков Кокса, ОР=0,92; Р=0,25) (Таблица 126). Было обнаружено статистически значимое взаимодействие между факторами «воздействие» и «ген» (Р=0,0014; бета: -0,340). Стратификация по генотипам в группе дальцетрапиба показала, что отношение рисков у гомозигот по минорному аллелю (АА) и гетерозигот (AG) по сравнению с гомозиготами GG по rs1967309 составляет 0,40 (95% ДИ 0,28, 0,57) и 0,68 (95% ДИ 0,55, 0,84), соответственно (Фиг. 3). Если принимали во внимание только пациентов с гомозиготным генотипом АА по rs1967309 (n=961), в группе дальцетрапиба по сравнению с группой плацебо отмечалось 39% снижение частоты предусмотренной комбинированной конечной точки, представляющей собой летальный исход по причине ишемической болезни сердца, реанимацию при остановке сердечной деятельности, нефатальный инфаркт миокарда, нефатальный ишемический инсульт, нестабильную стенокардию или непредвиденную реваскуляризацию коронарных артерий (ОР=0,61; 95% ДИ 0,41, 0,92). Схожие результаты были получены при исключении из первичной конечной точки реваскуляризации коронарных артерий (ОР=0,60; 95% ДИ 0,35, 1,02). При рассмотрении только пациентов с гомозиготным генотипом GG по rs1967309 (n=1984), наблюдалось 27% увеличение числа сердечно-сосудистых событий при терапии дальцетрапибом по сравнению с плацебо (ОР=1,27; 95% ДИ 1,02, 1,58). Гетерозиготные носители демонстрировали промежуточный ответ (n=2796; ОР=0,94; 95% ДИ 0,77, 1,16). Результаты подтверждали генотипированием 27 ОНП в гене ADCY9 с использованием технологии Sequenom (Таблица 10).
В когорте 5749 пациентов разведочного фармакогеномного исследования dal OUTCOMES всего 8 полиморфизмов (генотипированных или предсказанных) продемонстрировали ассоциацию с предусмотренной комбинированной конечной точкой, представляющей собой летальный исход по причине ишемической болезни сердца, реанимацию при остановке сердечной деятельности, нефатальный инфаркт миокарда, нефатальный ишемический инсульт, нестабильную стенокардию с объективными признаками ишемии или непредвиденную реваскуляризацию коронарных артерий, с уровнем значимости Р менее 10-6. В данном разведочном полногеномном поиске ассоциаций два из указанных восьми ОНП в гене ADCY9 продемонстрировали ассоциацию со значениями Р менее 5×10-8. В случае полиморфного нуклеотида rs1967309 у пациентов с генотипом АА (минорный или более редкий аллель) происходило снижение числа сердечно-сосудистых событий на 39% при лечении с дальцетрапибом по сравнению с плацебо, тогда как при носительстве генотипа GG (основной аллель) происходило увеличение риска на 27%. У гетерозиготных пациентов с генотипом AG ответ был промежуточным. Данные результаты наблюдались только в группе дальцетрапиба, но не в группе плацебо, и статистически значимое взаимодействие между полиморфизмами и воздействием (дальцетрапиб или плацебо), ассоциированное с клиническими событиями, подтверждало связь с геном ADCY9. Отношение рисков было схожим, когда из анализа исключали коронарную реваскуляризацию, что позволяло проводить прямое сравнение с первичной комбинированной конечной точкой глобального исследования dal-OUTCOMES (ишемическая болезнь сердца, реанимация при остановке сердечной деятельности, нефатальный инфаркт миокарда, нефатальный ишемический инсульт или нестабильная стенокардия). Все 8 полиморфизмов были в сильном неравновесии по сцеплению (r2>0,77), что подкрепляло предположение, что данный участок гена ADCY9 определяет клинический ответ на дальцетрапиб.
Липиды плазмы
Генотипы ОНП rs1967309 были достоверно ассоциированы с изменениями липидных показателей во времени, вызванными дальцетрапибом в исследовании dal-OUTCOMES. Одномерный статистический анализ показал ассоциацию генотипов с изменением общего холестерина через 1 месяц (Р=0,0001; Р=0,004 с учетом пола и генетического происхождения): у носителей генотипа GG повышение было менее выраженным (10,0±23,3 мг/дл) по сравнению с носителями AG (12,9±30,3) и АА (13,8±24,0). Данный эффект не наблюдался в группе плацебо. Аналогичный результат наблюдался в отношении динамики холестерина LDL через 1 месяц лечения дальцетрапибом: Изменения составили -2,0±20,0, -1,0±20,0 и+0,6±21,0 мг/дл у носителей rs1967309 с генотипами GG, AG и АА соответственно (Р=0,003 одномерный анализ; скорректированное значение Р=0,006). На протяжении лечения дальцетрапибом у носителей GG уровень холестерина LDL в целом был немного ниже (скорректированное значение Р=0,048; анализ повторных изменений, Фиг. 4).

1 из анализа исключили один образец в связи с выявлением возможной мозаичности ХО/ХХ
2 для 10 образцов было более одной причины исключить их из массива данных
Таблица 10. Отношение рисков (ОР) для показателя «время до наступления события» (летальный исход по причине ишемической болезни сердца, ИМ, госпитализация по поводу ОКС, реанимация при остановке сердечной деятельности, атеротромботический инсульт или непредвиденная реваскуляризация коронарных артерий) в группе, получавшей дальцетрапиб, по сравнению с группой плацебо, стратифицированное по генотипам ОНП гена ADCY9, ассоциированным с сердечно-сосудистыми событиями. Эффект терапии дальцетрапибом в сравнении с плацебо у 5686 пациентов из популяции, вошедшей в исследование dal-Outcomes, стратифицированных по генотипам 20 ОНП, генотипированных с использованием технологии Sequenom с целью валидации. Для расчета частоты минорного аллеля и значения r2 использовали данные всех индивидуумов (п=5686) 1МРх=отсутствие ответа; PR=частичный ответ; R=наличие ответа:
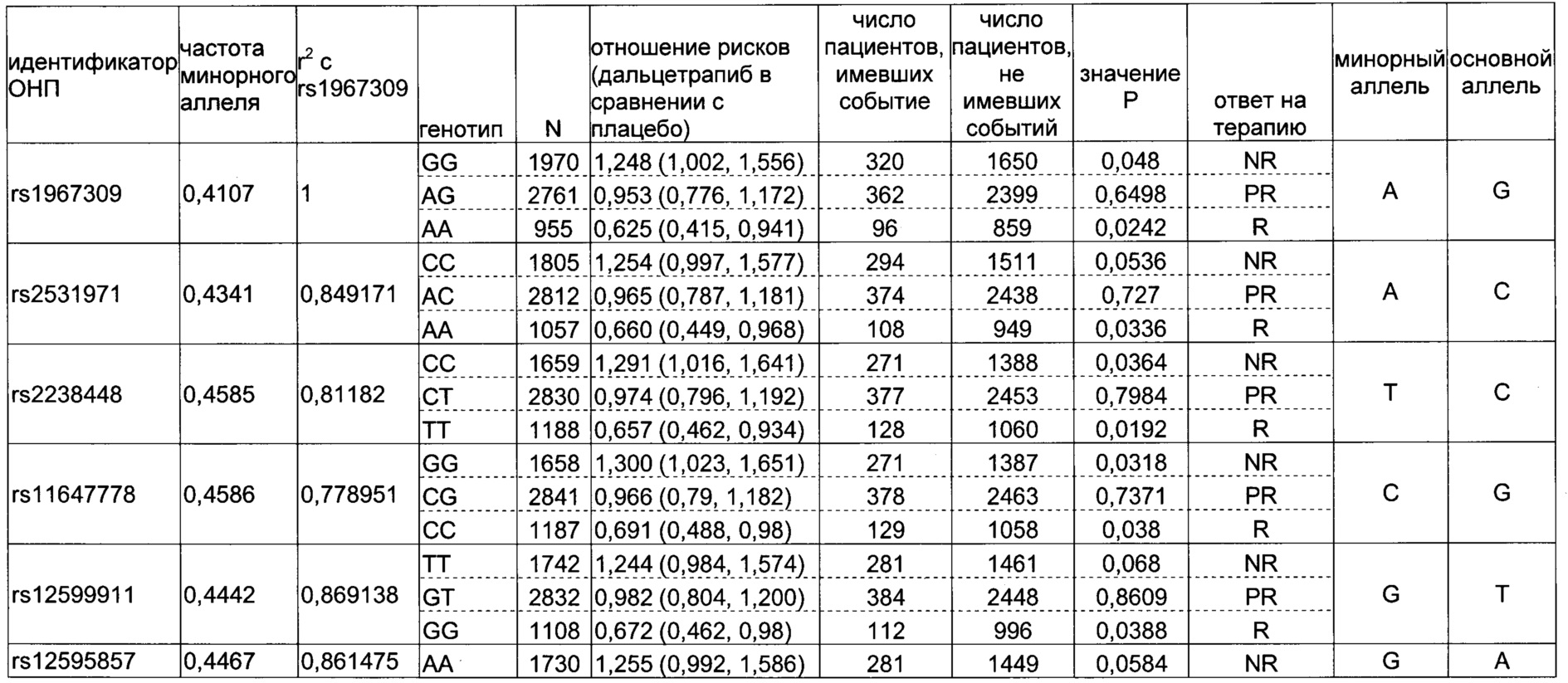



Таблица 12. Результаты полногеномного поиска ассоциаций dal-OUTCOMES с уровнем значимости Р<5Х10-8
а. Результаты, полученные с использованием модели пропорциональных рисков Кокса в группе дальцетрапиба в исследовании dal-OUTCOMES (n=2845)

1. Оценка параметра регрессии для аддитивного генетического эффекта, скорректированного на пол и 5 главных компонент, описывающих генетическое происхождение, где гомозиготы по основному аллелю обозначены 0, гетерозиготы обозначены 1, а гомозиготы по редкому аллелю обозначены 2; 2. тест отношения правдоподобия влияния генотипа, где Н0: βg=0; ОР: отношение рисков; ОНП: однонуклеотидный полиморфизм
Пример 2.
Исследование dal-PLAQUE-2 (Tardif JC et al, Circulation Cardiovascular imaging 2011; 4:319-33) представляло собой многоцентровое двойное слепое рандомизированное плацебо-контролируемое исследование фазы 3Б в параллельных группах для оценки влияния дальцетрапиба на прогрессирование атеросклероза у пациентов с признаками атеросклеротической болезни сердца и толщиной комплекса интима-медиа дальней (задней) стенки общих сонных артерий, оцениваемой с помощью ультразвукового исследования в В-режиме, по меньшей мере 0,65 мм. В общей сложности 931 пациента рандомизировали на группы, получавшие дальцетрапиб по 600 мг в сутки или соответствующее плацебо, с предполагаемой продолжительностью терапии 24 месяца. Однако, исследование было досрочно прекращено одновременно с остановкой исследования dal OUTCOMES (последнее было прекращено вследствие отсутствия целесообразности). Пациенты продолжали получать исследуемый препарат до прихода на повторное исследование сонной артерии через 12 месяцев. Ультрасонограммы, записанные в В-режиме при исследовании сонной артерии исходно, через 6 и 12 месяцев, анализировали централизовано в ведущей лаборатории института кардиологии Монреаля. Анализировали толщину комплекса интима-медиа дальней стенки общих сонных артерий. Сегмент общей сонной артерии длиной 10 мм анализировали при периодическом обследовании с применением программы автоматизированного выделения контуров изображения (анализатор сонной артерии Carotid Analyzer, Medical Imaging Applications, Coralville, Айова). Из 411 участников исследования dal-PLAQUE-2, давших согласие на участие в генетическом исследовании, у 386 имелись результаты визуализирующего исследования, полученные исходно, через 6 месяцев и 12 месяцев (у 194 и 192 в группах, получавших дальцетрапиб и плацебо, соответственно). ДНК выделяли из цельной крови. Протоколы исследования были утверждены соответствующими экспертными советами или этическими комитетами и все участники подписали информированное согласие.
Централизованный анализ ультрасонограмм сонных артерий в исследовании dal-Plaque-2
Анализ всех ультрасонограмм сонной артерии проводили опытные специалисты ведущей лаборатории института кардиологии Монреаля под контролем врача. Сонограммы должны были соответствовать критериям качества и критериям включения и исключения перед рандомизированным назначением исследуемого воздействия. Метод анализа толщины комплекса интима-медиа сонных артерий включал параллельное рассмотрение результатов исходного обследования и последующих обследований.
Сегменты стенки сонных артерий оценивали в продольном срезе, позиционируя перпендикулярно по отношению к УЗ лучу, так чтобы изображение артерии располагалось горизонтально для возможности визуализировать границы между кровью и структурами сосудистой стенки на максимально долгом протяжении. Расположение конца общей сонной артерии использовали как контрольную точку для последующего правильного позиционирования изображения и сравнительного анализа длины сегментов при исходном и последующих обследованиях. Для снижения разброса результатов измерений толщину комплекса интима-медиа анализировали по задней стенке правой и левой общих сонных артерий. Использовалось усредненное значение средней толщины комплекса интима-медиа правой и левой общих сонных артерий. В серии исследований (исходно, через 6 мес, и через 12 мес.) анализировали один и тот же сегмент общей сонной артерии длиной 10 мм, начинавшийся в 5 мм проксимальнее ее бифуркации. Для анализа толщины комплекса "интима-медиа" использовали программу определения контуров изображения Carotid Analyzer (Medical Imaging Applications LLC, Coralville, Айова) в автоматическом режиме. На сонной артерии определяли две границы: Вначале определялась граница между медией и адвентицией и верифицировалась оператором. В случае необходимости ее расположение корректировали в полуавтоматическом режиме до правильного уровня. После того, как устанавливали эти границы, автоматически определяли границы между интимой и просветом сосуда, используя ранее полученную границу между медией и адвентицией. Из видео-петли, фиксировавшей толщину комплекса "интима-медиа", выбирали для анализа отдельные кадры, при необходимости исключая из анализа кадры низкого качества.
Из 27 ОНП, выбранных для генотипирования по технологии Sequenom, 20 ОНП в гене ADCY9 характеризовались значением Р<0,05 в разведочной когорте. В исследовании dal-PLAQUE-2 проводили поиск ассоциации с указанными ОНП для подтверждения наличия ассоциации, основываясь на результатах визуализации, полученных через 6 и 12 месяцев терапии в группе дальцетрапиба (n=194). 10 из 20 ОНП были ассоциированы с показателями толщины комплекса интима-медиа в dal-PLAQUE-2 (Р<0,05, Таблица 13). Следует отметить, что маркер rs2238448 (который находился в неравновесном сцеплении с rs1967309 (r2=0,80)) был ассоциирован с показателями толщины комплекса интима-медиа в dal-plaque-2 (Р=0,009) и с событиями в dal-OUTCOMES (P=8,88×10-8; ОР=0,67, 95% ДИ 0,58, 0,78). Через 12 месяцев лечения дальцетрапибом изменения толщины комплекса интима-медиа составили -0,027±0,079 мм у гомозиготных носителей минорного аллеля (ТТ), 0,000±0,048 мм у гетерозигот и+0,009±0,038 мм у гомозиготных носителей основного аллеля (СС) rs2238448 (Р=0,009). Данный эффект проявлялся через 6 месяцев. Снижение толщины комплекса интима-медиа наблюдалось для всех 20 ОНП, что согласовывалось с результатами исследования dal-OUTCOMES, где генотип был ассоциирован со снижением риска сердечно-сосудистых событий (Таблица 13). Ни один из генотипированных ОНП не продемонстрировал ассоциации в группе плацебо (все значения Р>0,05). В исследовании dal-PLAQUE-2 взаимодействие факторов «ген» и «воздействие» достигало уровня значимости (Р=0,024) только в случае rs2531967, что по всей видимости, было обусловлено малым размером выборки. В случае ОНП rs1967309 уровень значимости не достигал критического значения в исследовании dal-PLAQUE-2 (Р=0,114), однако снижение толщина комплекса интима-медиа было сопоставимо с тем, которое наблюдалось в случае rs2238448 и согласовывалось с результатами dal-OUTCOMES. Через 12 месяцев терапии дальцетрапибом изменения толщины комплекса интима-медиа составили -0,021±0,083 мм у гомозигот АА, 0,000±0,048 мм у гетерозигот и +0,001±0,048 мм у гетерозигот и +0,005±0,042 мм у гомозигот GG по rs1967309.
Таблица 13. Изменения толщины комплекса интима-медиа через 6 и 12 месяцев терапии дальцетрапибом по сравнению с исходными. Результаты исследования dal-PLAQUE-2 приведены для 20 ОНП, у которых в исследовании dal-OUTCOMES был уровень значимости Р<0,05.


GWAS: полногеномный поиск ассоциаций; HR: отношение рисков; MAF: частота минорного аллеля; OR: отношение шансов; SNP: однонуклеотидный полиморфизм; М06, М12: измерение через 6 и 12 месяцев терапии дальцетрапибом.
1. Расположение вариантов в геноме сборки GRCh37 NCBI
2. Рассчитано по 386 образцам исследуемой популяции dal-Plaque-2
3. Рассчитано с помощью смешанной регрессионной модели для показателей изменения толщины комплекса интима-медиа через 6 и 12 месяцев с поправкой на исходные значения
4. Анализировали с использованием модели пропорциональных рисков Кокса в программе SAS с поправкой на пол и 5 главных компонент, описывающих генетическое происхождение, рассчитывали ОР при увеличении числа копий минорного аллеля согласно модели аддитивного действия генов.
5. Приведены результаты для ОНП, генотипированных с помощью OMNI2.5, а также для предсказанных ОНП, генотипированных с помощью панели Sequenom.
Статистический анализ для обоих примеров 1 и 2
Полногеномный поиск ассоциаций выполняли с помощью программы JMP Genomics версии 6.1, для валидации значимых результатов использовали программу SAS (версии 9.3) (SAS Institute Inc., Сагу, NC, США). Исследовали аддитивный генетический эффект аллеля (число степеней свободы =1), при этом генотипы обозначали 0, 1 или 2, по числу минорных аллелей. При наличии ковариат для расчета значения Р при исследовании аддитивного генетического эффекта аллеля вносили поправки на ковариаты, так чтобы

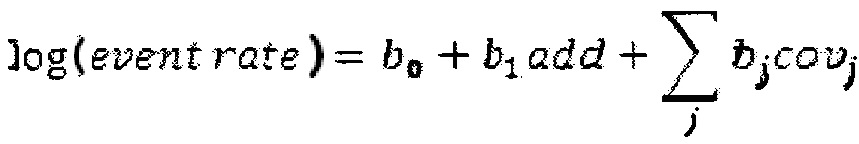
Для популяции dal-Plaque-2 строили смешанные регрессионные модели для анализа повторных измерений с помощью программы SAS. Конечная точка для популяции dal-Plaque-2 представляла собой среднее арифметическое значение толщины комплекса интима-медиа общих сонных артерий через 6 и 12 месяцев, где исходное значение использовали в качестве ковариаты. Порог статистической значимости не корректировали на множественные сравнения 27 ОНП, генотипированных с использованием панели Sequenom, поскольку между выбранными ОНП существовала сильная корреляция. Для справки, оценивали число независимых тестов (Meff) согласно методу Gao et al, Genet Epidemiol 2008;32:361-9, получив для выборки dal-Outcomes значение Meff=8.
Графики неравновесия по сцеплению (Фиг. 8 и 9) строили с помощью программы Haploview (version 4.2) (Barrett JC et al. Bioinformatics 2005; 21:263-5), значения r2, характеризующие степень неравновесия по сцеплению между парами ОНП, представлены в виде матрицы, значения коэффициента D' обозначены цветовой кодировкой. Блоки неравновесия по сцеплению определяли, используя метод доверительных интервалов, где верхний 95% доверительный предел >0,98, нижний 95% доверительный предел >0,70 свидетельствовали о сильном неравновесии по сцеплению, а верхний доверительный предел 0,9 свидетельствовал о рекомбинации.
Реферат
Данное изобретение относится к биотехнологии. Предложены способы генотипирования и композиции для выбора пациентов, страдающих сердечно-сосудистым заболеванием, которым может принести пользу терапия поднимающим уровень HDL или имитирующим HDL агентом, в частности ингибитором/модулятором белка-переносчика эстерифицированного холестерина (СЕТР). 6 н. и 90 з.п. ф-лы, 10 ил., 13 табл., 2 пр.

Комментарии