Способ лечения андроген-рецептор(ar)-положительных форм рака молочной железы с использованием селективных модуляторов андрогенных рецепторов (sarm) - RU2717835C2
Код документа: RU2717835C2
Чертежи
















Описание
Область изобретения
Настоящее изобретение относится к лечению андроген-рецептор-положительного рака молочной железы у субъекта, например, субъекта женского пола. Соответственно, настоящее изобретение предусматривает способы: a) лечения субъекта, страдающего раком молочной железы; b) лечения субъекта, страдающего метастатическим раком молочной железы; c) лечения субъекта, страдающего рефрактерным раком молочной железы; d) лечения субъекта, страдающего AR-положительным раком молочной железы; e) лечения субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечения субъекта, страдающего AR-положительным метастатическим раком молочной железы; g) лечения субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечения субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии эстрогенного рецептора (ER), прогестеронового рецептора (PR) и/или рецептора эпидермального фактора роста человека 2 (HER2); i) лечения субъекта, страдающего трижды негативным раком молочной железы; j) лечения субъекта, страдающего распространенным раком молочной железы; k) лечения субъекта, страдающего раком молочной железы, лечение которого с помощью селективных модуляторов эстрогенных рецепторов (SERM) (тамоксифена, торемифена), ингибитора ароматазы (AI), трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечения субъекта, страдающего ER-положительным раком молочной железы; m) лечения, профилактики, подавления или ингибирования метастазирования у субъекта, страдающего раком молочной железы; n) продления выживания субъекта с раком молочной железы; o) замедления прогрессирования рака молочной у субъекта; и/или p) продления выживания субъекта с раком молочной железы без прогрессирования; включающие введение субъекту терапевтически эффективного количества соединения селективного модулятора андрогенного рецептора (SARM).
Предпосылки изобретения
Рак молочной железы является заболеванием, которое убивает более 45000 женщин в год в одних только Соединенных Штатах. Более 180000 новых случаев рака молочной железы диагностируется ежегодно, и, по оценкам, у одной из восьми женщин разовьется рак молочной железы. Данные цифры показывают, что рак молочной железы является одним из наиболее опасных заболеваний, с которыми сталкиваются женщины сегодня. Исследования рака не смогли определить причину рака молочной железы, и не определили пригодного способа лечения или профилактики.
Стандарт лечения в настоящее время включает скрининг опухоли на уровни экспрессии гормональных рецепторов, эстрогенного рецептора (ER) и прогестеронового рецептора (PR), и киназы - рецептора эпидермального фактора роста 2 (HER2). В настоящее время женщина, которой поставлен диагноз рак молочной железы, может получать предварительное хирургическое лечение, химиотерапию (необязательную в некоторых случаях) и лучевую терапию до начала таргетной терапии. Гормон-рецептор-положительные формы рака молочной железы чувствительны к гормональной терапии с использованием селективных модуляторов эстрогенных рецепторов или SERM (например, тамоксифена, торемифена), ингибиторов ароматазы (например, анастрозола) или селективных деструкторов эстрогенных рецепторов или SERD (например, фулвестранта). Гормональные препараты, такие как ингибиторы ароматазы (AI), блокируют продукцию эстрогенов в организме (обычно применяются у женщин после менопаузы), тогда как SERM и SERD блокируют пролиферативное действие эстрогенов на клетки рака молочной железы. HER2-положительные формы рака молочной железы чувствительны к ингибиторам киназы HER2 (например, трастузумаб и лапатиниб) и, как правило, применяются при метастатическом заболевании. Антиангиогенный препарат (бевацизумаб) также одобрен при метастатическом заболевании. Несмотря на несколько данных уровней таргетных способов лечения, у пациентов часто присутствуют или развиваются рефрактерные формы рака молочной железы. Примеры рефрактерного рака молочной железы включают первичные опухоли, которыми являются трижды негативные опухоли (ER, PR, HER2), гормонорезистентные (SERM-, SERD- или AI-резистентные) или резистентные к ингибитору киназы, или метастатический рак молочной железы. Если таргетные препараты не дают результата или опухоли метастазируют, для удаления рефрактерных злокачественных опухолей молочной железы необходимы лучевая терапия и высокодозная химиотерапия. Современные химиотерапевтические средства, пригодные для лечения рефрактерного рака молочной железы включают антрациклины, таксаны и эпотилоны, которые являются токсичными, опасными, дорогостоящими и часто неэффективными, особенно при лечении метастазирования.
Многочисленные клинические данные свидетельствуют о том, что андрогены, как правило, ингибируют рост молочной железы. Например, женщины с недостатком андрогенов обладают повышенным риском развития рака молочной железы. Передача андрогенного сигнала играет важнейшую роль в гомеостазе молочной железы, устраняя пролиферативные эффекты передачи эстрогенного сигнала в молочной железе. Однако если андрогены превращаются в эстрогены (ароматазный путь), они повышают пролиферацию клеток и риск канцерогенеза в молочной железе. В прошлом стероидные агонисты андрогенного рецептора тестостерон, флуоксиместерон и калустерон применялись при распространенном раке молочной железы. Данные средства обладали побочными эффектами, такими как избыточная вирилизация, перекрестная реактивность с эстрогенным рецептором и ароматизация с образованием эстрогенов. Применение стероидных андрогенов при распространенном раке молочной железы предшествовало скринингу рака молочной железы на гормональные и киназные рецепторы. Недавно обнаружили, что AR экспрессируется в 50-90% опухолей молочных желез, обеспечивая механизм для применения андрогенов в качестве таргетной терапии AR-положительных форм рака молочной железы.
Селективные модуляторы андрогенных рецепторов (SARM) являются соединениями, которые демонстрируют AR-опосредованную тканевую избирательную активность. В отличие от их стероидных предшественников SARM не ароматизируются, как правило, не демонстрируют никакой активности в отношении других стероидных рецепторов, включая ER и PR, и не являются вирилизирующими. Дополнительно, SARM могут являться эффективными у пациентов с рефрактерным раком молочной железы в связи с их гипермиоанаболическими эффектами, которые должны улучшить их толерантность к высокодозной химиотерапии.
Новые инновационные подходы крайне необходимы как в фундаментальной науке, так и на клинических уровнях для разработки соединений, которые пригодны для: a) лечения субъекта, страдающего раком молочной железы; b) лечения субъекта, страдающего метастатическим раком молочной железы; c) лечения субъекта, страдающего рефрактерным раком молочной железы; d) лечения субъекта, страдающего AR-положительным раком молочной железы; e) лечения субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечения субъекта, страдающего AR-положительным метастатическим раком молочной железы; g) лечения субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; и/или h) лечения, профилактики, подавления или ингибирования метастазирования у субъекта, страдающего раком молочной железы.
Краткое описание изобретения
В одном варианте осуществления настоящее изобретение относится к лечению андроген-рецептор-положительного рака молочной железы у субъекта, например, субъекта женского пола. Соответственно, настоящее изобретение предусматривает способы: a) лечения субъекта, страдающего раком молочной железы; b) лечения субъекта, страдающего метастатическим раком молочной железы; c) лечения субъекта, страдающего рефрактерным раком молочной железы; d) лечения субъекта, страдающего AR-положительным раком молочной железы; e) лечения субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечения субъекта, страдающего AR-положительным метастатическим раком молочной железы; g) лечения субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечения субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR, и/или HER2; i) лечения субъекта, страдающего трижды негативным раком молочной железы; j) лечения субъекта, страдающего распространенным раком молочной железы; k) лечения субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечения субъекта, страдающего ER-положительным раком молочной железы; m) лечения, профилактики, подавления или ингибирования метастазирования у субъекта, страдающего раком молочной железы; n) продления выживания субъекта с раком молочной железы; o) замедления прогрессирования рака молочной у субъекта; и/или p) продления выживания субъекта с раком молочной железы без прогрессирования; включающие введение субъекту терапевтически эффективного количества соединения селективного модулятора андрогенного рецептора (SARM), представленного соединением формулы I:

I,
X представляет собой связь, O, CH2, NH, S, Se, PR, NO или NR;
G представляет собой O или S;
T представляет собой OH, OR, -NHCOCH3 или NHCOR;
R представляет собой алкил, галогеналкил, дигалогеналкил, тригалогеналкил, CH2F, CHF2, CF3, CF2CF3, арил, фенил, галоген, алкенил или OH;
R1 представляет собой CH3, CH2F, CHF2, CF3, CH2CH3 или CF2CF3,
R2 представляет собой H, F, Cl, Br, I, CH3, CF3, OH, CN, NO2, NHCOCH3, NHCOCF3, NHCOR, алкил, арилалкил, OR, NH2, NHR, N(R)2, SR;
R3 представляет собой H, F, Cl, Br, I, CN, NO2, COR, COOH, CONHR, CF3, Sn(R)3, или R3 вместе с бензольным кольцом, к которому он присоединен, образует систему с сочлененными кольцами, представленную структурой:

Z представляет собой NO2, CN, COR, COOH или CONHR;
Y представляет собой CF3 F, Br, Cl, I, CN или Sn(R)3;
Q представляет собой CN, алкил, галоген, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R или SR;
или Q вместе с бензольным кольцом, к которому он присоединен, представляет собой систему с сочлененными кольцами, представленную структурой A, B или C:

n представляет собой целое число от 1 до 4; и
m представляет собой целое число от 1 до 3;
и/или его аналога, производного, изомера, метаболита, фармацевтически приемлемой соли, фармацевтического препарата, гидрата, N-оксида, кристалла, полиморфной формы, пролекарственной формы или любой их комбинации, которые описаны в данном документе. В одном варианте осуществления субъект является субъектом женского пола. В одном варианте осуществления субъект является субъектом мужского пола.
Краткое описание графических материалов
Объект, рассматриваемый в качестве настоящего изобретения, в подробностях указан и четко заявлен в заключительной части описания. Настоящее изобретение, однако, как в отношении организации, так и способа действий, вместе с его целями, признаками и преимуществами, можно лучше всего понять со ссылкой на следующее подробное описание при его прочтении со ссылками на прилагаемые графические материалы.
На фигуре 1 показано, что DHT и соединение формулы IX ингибируют рост клеток трижды негативного рака молочной железы MDAMB-231. На фигуре 1A показана экспрессия AR клетками MDA-MB-231 после трансфекции. На фигуре 1B показано IC50 в AR-положительных клетках MDAMB-231. На фигурах 1C, 1D, 1E, 1F, 1G, 1H, 1I и 1J показано влияние DHT, формулы IX, бикалутамида и (R) энантиомера формулы IX на процент клеточного выживания (%). (Клетки на фигурах 1C, 1E, 1G и 1I обрабатывали очищенной на активированном угле FBS. Клетки на фигурах 1D, 1F, 1H и 1J обрабатывали цельной сывороткой.) ● MDA-MB-231 с lacZ; ○ MDA-MB231 с AR 200 мкл; ▲ MDA-MB-231 с AR 500 мкл.
На фигуре 2 показано, что DHT и формула IX ингибируют HCC-38 рост клеток трижды негативного рака молочной железы. На фигуре 2A показана экспрессия AR клетками HCC-38 после трансфекции. На фигуре 2B показано IC50 в AR положительных клетках HCC-38. На фигурах 2C, 2D, 2E, 2F, 2G и 2H показано влияние DHT, формулы IX и бикалутамида на процент (%) клеточного выживания. (Клетки на фигурах 2C, 2E и 2G обрабатывали очищенной на активированном угле FBS. Клетки на фигурах 2D, 2F и 2H обрабатывали цельной сывороткой). ● HCC-38 с lacZ; ○ HCC-38 с AR 200 мкл; ▲HCC-38 с AR 500 мкл.
На фигуре 3 показано, что эффект DHT и формулы IX на клетки MDA-MB-231 отменялся бикалутамидом. На фигурах 3A, 3B, 3C и 3D показано влияние DHT или формулы IX в присутствии или в отсутствие бикалутамида на процент (%) клеточного выживания. (Клетки на фигурах 3A и 3C обрабатывали очищенной на активированном угле FBS. Клетки на фигурах 3B и 3D обрабатывали цельной сывороткой). ● lacZ и с 10 мкМ бикалутамида; ○ lacZ; ▲AR с 10 мкМ бикалутамида; ∆ AR. На фигуре 3E показаны значения IC50 в AR-положительных клетках в присутствии или в отсутствие предварительной обработки бикалутамидом.
На фигуре 4 показано, что агонисты AR ингибируют рост клеток трижды негативного рака молочной железы. На фигурах 4A, 4B, 4E, 4F, 4G, 4H, 4K, 4L, 4M, 4N, 4О и 4P показано влияние агонистов AR на процент (%) клеточного выживания. На фигурах 4C и 4D показано влияние антагонистов AR на процент (%) клеточного выживания. На фигурах 4I и 4J показано влияние вещества, не связывающего AR, на процент (%) клеточного выживания. Клетки на фигурах 4A, 4C, 4E, 4G, 4I, 4M и 4О обрабатывали очищенной на активированном угле FBS. Клетки на фигурах 4B, 4D, 4F, 4H, 4J, 4L, 4N и 4P обрабатывали цельной сывороткой. На фигуре 4Q показны значения EC50 и IC50 в AR-положительных клетках.
На фигуре 5 показано, что ингибирующие рост лиганды являются агонистами AR в клетках MDA MB-231.
На фигуре 6 показано, что ингибирующие рост эффекты в клетках MDA-MB-231 являются селективными относительно AR. На фигурах 6A и 6B показана экспрессия ERα или ERβ в клетках MDA-MB231 после трансфекции, соответственно. На фигурах 6C, 6D и 6E показано влияние эстрадиола (E2) или ICI 182780 (ICI) на процент (%) клеточного выживания. (Клетки на фигуре 6C обрабатывали очищенной на активированном угле сывороткой. Клетки на фигурах 6D и 6E обрабатывали цельной сывороткой).
На фигуре 7 показано, что DHT изменяет морфологию клеток MDA-MB-231.
На фигуре 8 показан эффект формулы VIII на трансактивацию стероидных рецепторов (действие агонистов).
На фигуре 9 изображена кривая зависимости доза-эффект активности PR (действие антагонистов) для соединения формулы VIII, формулы IX, R- нантиомера формулы IX и RU486. Закрашенные кружки (●) соответствуют экспериментальным точкам формулы VIII (IC50 = 17,05 нМ); незакрашенные кружки (o) соответствуют формуле IX (IC50 = 162,9 нМ); закрашенные треугольники (▼) соответствуют R-энантиомеру формулы IX (IC50 = 1689 нМ); и незакрашенные треугольники (∆) соответствуют RU486 (IC50 = 0,048 нМ).
На фигуре 10 продемонстрировано, что SARM (формула VIII) ингибирует рост опухоли MDA-MB-231-AR. Массу тела (A) и размер опухоли (B) измеряли в течение 35 дней у интактных самок голых мышей с опухолями 150-200 мм3 из MDA-MB-231-AR клеток трижды негативного рака молочной железы, а затем перорально вводили носитель (

На фигуре 11 продемонстрировано, что SARM (формула VIII) ингибирует рост опухоли MDA-MB-231-AR. Размер опухоли в мм3 (A) и% изменения размера опухоли (B), а также вес опухоли (C) измеряли через 35 дней у интактных самок голых мышей с опухолями 150-200 мм3 из MDA-MB-231-AR клеток трижды негативного рака молочной железы и затем получавших пероральное введение носителя или 30 мг/кг формулы VIII.
На фигуре 12 продемонстрирована морфология MDA-MB-231 клеток рака молочной железы, стабильно трансфицированных AR (клетки MDA-MB-231-AR). Результаты показывают, что агонисты AR, DHT, формула IX и формула VIII изменяли морфологию на более фиксированный фенотип по сравнению с носителем, бикалутамидом или неактивным изомером формулы IX. Это может указывать на менее метастатический фенотип рака молочной железы.
На фигуре 13 продемонстрировано связывание и трансактивация указанных лигандов с HEK-293 (A) или клетками MDA-MB-231 (B & C). DHT, формула IX и формула VIII являются агонистами AR в клетках рака молочной железы. (пример 16).
На фигуре 14 продемонстрирована антипролиферативная активность DHT и SARM в MDA-MB-231 клетках рака молочной железы, стабильно трансфицированных AR. Клетки MDA-MB-231, стабильно трансфицированные AR с использованием лентивируса, обрабатывали указанными лигандами в течение 6 дней и подсчитывали число клеток с использованием счетчика Коултера. DHT и SARM, но не антагонист AR, бикалутамид, ингибировали пролиферацию MDA-MB-231 клеток трижды негативного рака молочной железы, стабильно трансфицированных AR.
Подробное описание изобретения
В одном варианте осуществления настоящее изобретение относится к лечению андроген-рецептор-положительного рака молочной железы у субъекта. Соответственно, настоящее изобретение предусматривает способы: a) лечения субъекта, страдающего раком молочной железы; b) лечения субъекта, страдающего метастатическим раком молочной железы; c) лечения субъекта, страдающего рефрактерным раком молочной железы; d) лечения субъекта, страдающего AR-положительным раком молочной железы; e) лечения субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечения субъекта, страдающего AR-положительным метастатическим раком молочной железы; g) лечения субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечения субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечения субъекта, страдающего трижды негативным раком молочной железы; j) лечения субъекта, страдающего распространенным раком молочной железы; k) лечения субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджета), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безусппешным; l) лечения субъекта, страдающего ER-положительным раком молочной железы; m) лечения, профилактики, подавления или ингибирования метастазирования у субъекта, страдающего раком молочной железы; n) продления выживания субъекта с раком молочной железы; o) замедление прогрессирования рака молочной железы у субъекта; и/или p) продления выживания субъекта с раком молочной железы без прогрессирования; путем введения субъекту терапевтически эффективного количества соединения по настоящему изобретению и/или его аналога, производного, изомера, метаболита, фармацевтически приемлемой соли, фармацевтического препарата, гидрата, N-оксида, кристалла, полиморфной формы, пролекарственной формы или любой их комбинации, которые описаны в данном документе. В одном варианте осуществления субъект является субъектом мужского пола. В одном варианте осуществления субъект является субъектом женского пола.
В одном варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего метастатическим раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения метастатического рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего рефрактерным раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения рефрактерного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего AR-положительным раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения AR-положительного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В одном варианте осуществления AR-положительный рак молочной железы является ER, PR и HER2-положительным. В другом варианте осуществления AR-положительный рак молочной железы является ER, PR и HER2-отрицательным. В одном варианте осуществления AR-положительный рак молочной железы является ER-положительным и PR и HER2-отрицательным. В другом варианте осуществления AR-положительный рак молочной железы является ER и PR-положительным и HER2-отрицательным. В еще одном варианте осуществления AR-положительный рак молочной железы является ER и HER2-положительныи и PR-отрицательным. В еще одном варианте осуществления AR-положительный рак молочной железы является ER-отрицательным и PR и HER2-положительным. В дополнительном варианте осуществления AR-положительный рак молочной железы является ER и PR-отрицательным и HER2-положительным. В еще одном дополнительном варианте осуществления AR-положительный рак молочной железы является ER и HER2-отрицательным и PR-положительным. В одном варианте осуществления AR-положительный рак молочной железы является ER-отрицательным. В другом варианте осуществления AR-положительный рак молочной железы является ER-положительным.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего AR-положительным рефрактерным раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения AR-положительного рефрактерного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего AR-положительным метастатическим раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения AR-положительного метастатического рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего AR-положительным и ER-положительным раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения AR-положительного метастатического рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего ER-положительным раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения ER-положительного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В одном варианте осуществления ER-положительный рак молочной железы является AR-положительным. В другом варианте осуществления ER-положительный рак молочной железы является AR-отрицательным.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего трижды негативным раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения трижды негативного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего распространенным раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения распространенного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего раком молочной железы, лечение которого с помощью (SERM) (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения рака молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептин, адо-трастузумаб эмтанзин), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным, у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
Применяемый в данном документе в одном варианте осуществления термин “лечение” может относиться к лечению, профилактике, задержке развития, предотвращению рецидива или лечению рецидива. В одном варианте осуществления термин “лечение” относится к снижению заболеваемости, смертности или их комбинации в связи с раком молочной железы.
Применяемый в данном документе термин “рак молочной железы” может относиться к раку молочной железы; распространенному раку молочной железы; метастатическому раку молочной железы; AR-положительному раку молочной железы; ER-положительному раку молочной железы; AR-положительному раку молочной железы с или без экспрессии ER, PR и/или HER2; AR-положительному раку молочной железы с или без экспрессии ER; ER-положительному раку молочной железы с или без экспрессии AR; AR-положительному и ER-положительному раку молочной железы; рефрактерному раку молочной железы; AR-положительному рефрактерному раку молочной железы; ER-положительному рефрактерному раку молочной железы; AR-положительному метастатическому раку молочной железы; ER-положительному метастатическому раку молочной железы; раку молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; или трижды негативному раку молочной железы; или любой их комбинации.
В одном варианте осуществления термин “рак молочной железы” относится к состоянию, которое характеризуется аномальной быстрой пролиферацией аномальных клеток в одной или обеих молочных железах у субъекта. Аномальные клетки часто называют “неопластическими клетками”, что относится, в некоторых вариантах осуществления, к трансформированным клеткам, которые могут образовывать солидную опухоль. Термин “опухоль”, в некоторых вариантах осуществления, относится к аномальной массе или популяции клеток (т.е. двум или более клеткам), которая возникает в результате избыточного или аномального деления клеток, либо злокачественной, либо доброкачественной, и предраковым, и раковым клеткам. Злокачественные опухоли отличаются от доброкачественных образований или опухолей, в дополнение к неконтролируемой клеточной пролиферации, тем, что они могут прорастать в окружающие ткани и могут метастазировать.
При раке молочной железы неопластические клетки можно идентифицировать только в одной или обеих молочных железах и не в другой ткани или органе, в одной или обеих молочных железах и одной или нескольких смежных тканях или органах (например, лимфатическом узле), или в молочной железе и одной или нескольких несмежных тканях или органах, в которые клетки рака молочной железы метастазировали.
Термин “метастазирование”, в некоторых вариантах осуществления, относится к процессу, при котором раковые клетки перемещаются от одного органа или ткани к другому, не смежному органу или ткани. Раковые клетки в молочной железе (железах) могут распространиться в ткани и органы субъекта, и наоборот, раковые клетки из других органов или тканей могут прорастать или метастазировать в молочную железу. Раковые клетки из молочной железы (желез) могут прорастать или метастазировать в любой другой орган или ткань тела. Клетки рака молочной железы часто прорастают в клетки лимфатических узлов и/или метастазируют в печень, головной мозг и/или кости и распространяют рак в данных тканях и органах. Термин "прорастание", в некоторых вариантах осуществления, относится к распространению раковых клеток в смежные окружающие ткани.
Применяемый в данном документе термин “распространенный рак молочной железы” относится к раку, который распространился в другие места в организме и который, как правило, невозможно излечить или контролировать с помощью современных способов лечения.
Применяемый в данном документе термин “AR-положительный рак молочной железы” может относиться к раку молочной железы, где, по меньшей мере, часть раковых клеток экспрессируют, по меньшей мере, андрогенный рецептор (AR).
Применяемый в данном документе термин “ER-положительный рак молочной железы” может относиться к раку молочной железы, где, по меньшей мере, часть раковых клеток экспрессируют, по меньшей мере, эстрогенный рецептор (ER).
Применяемый в данном документе термин “трижды негативный рак молочной железы” может относиться к клеткам рака молочной железы, которые не обладают эстрогенными рецепторами (ER), прогестероновыми рецептоами (PR) или большими количествами белка HER2/neu. “Трижды негативный рак молочной железы” также может упоминаться в данном документе как “ER-отрицательный PR-отрицательный HER2/neu-отрицательный рак молочной железы”.
Применяемый в данном документе термин “рефрактерный” может относиться к раку молочной железы, который не поддается лечению. Рак молочной железы может являться устойчивым в начале лечения или он может стать устойчивым во время лечения. "Рефрактерный рак молочной железы", также может упоминаться в данном документе как “устойчивый рак”.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения, профилактики, подавления или ингибирования метастазирования у субъекта, страдающего раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения, профилактики, подавления или ингибирования метастазирования у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ продления выживания субъекта с раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для продления выживания субъекта с раком молочной железы. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ замедления прогрессирования рака молочной железы у субъекта, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для замедления прогрессирования рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ продления выживания субъекта с раком молочной железы без прогрессирования, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для продления выживания субъекта с раком молочной железы без прогрессирования. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ снижения уровней биомаркеров у субъекта с раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для снижения уровней биомаркеров у указанного субъекта. В другом варианте осуществления способ включает этап, на котором вводят соединение по формулe I-XIV по настоящему изобретению.
Применяемый в данном документе термин “биомаркер” может относиться к веществу, применяемому в качестве индикатора процесса, явления или состояния. Биомаркер может являться биомолекулой, такой как молекула нуклеиновой кислоты (например, микроРНК геномная ДНК и т.д.), белка, полисахарида и тому подобное. Биомаркеры включают опухолевые антигены и опухолевые маркеры. В одном варианте осуществления биомаркер указывает на наличие рака, например, рака молочной железы. В одном варианте осуществления биомаркер может применяться для определения эффективности лечения. В одном варианте осуществления биомаркер может применяться для определения прогрессирования состояния, например, рака молочной железы.
Ассоциированный антиген MUC-1, или CA 27.29, является раковым антигеном, в высокой степени ассоциированный с раком молочной железы. Применяемый в данном документе термин “биомаркер CA27.29” относится к биомаркеру рака молочной железы. В одном варианте осуществления CA27.29 является биомаркером распространенного рака молочной железы.
“Биомаркер PSA (простатический специфический антиген)” применяется в качестве биомаркера рака простаты, однако более высокие уровни PSA также обнаружены в крови женщин с раком молочной железы по сравнению с женщинами без рака молочной железы. PSA пригоден также в качестве биомаркера рака молочной железы.
“Биомаркер CTX” и “биомаркер NTX” являются C-телопептидом и N-телопептидом коллагена типа I, соответственно, которые применяются в качестве биомаркеров ремоделирования кости. Биомаркеры NTX и CTX могут являться чувствительными индикаторами наличия костных метастазов у пациентов с раком молочной железы.
В одном варианте осуществления способ по настоящему изобретению понижает уровень биомаркера CA27.29 у субъекта. В одном варианте осуществления способ по настоящему изобретению понижает уровень биомаркера PSA у субъекта. В одном варианте осуществления способ по настоящему изобретению понижает уровень биомаркера CTX у субъекта. В одном варианте осуществления настоящего изобретения способ по настоящему изобретению понижает уровень биомаркера NTX у субъекта. В другом варианте осуществления способ по настоящему изобретению поддерживает уровень CA27.29 у субъекта. В другом варианте осуществления способ по настоящему изобретению поддерживает уровень PSA у субъекта. В другом варианте осуществления способ по настоящему изобретению поддерживает уровень биомаркера CTX у субъекта. В другом варианте осуществления способ по настоящему изобретению поддерживает уровень биомаркера NTX. В одном варианте осуществления субъект страдает раком молочной железы. В одном варианте осуществления субъект страдает распространенным раком молочной железы. В другом варианте осуществления субъект страдает рефрактерным раком молочной железы. В еще одном варианте осуществления субъект страдает AR-положительным раком молочной железы. В еще одном варианте осуществления субъект страдает ER-положительным раком молочной железы.
В одном варианте осуществления соединение по настоящему изобретению является антагонистом. В другом варианте осуществления соединение по настоящему изобретению является агонистом. В еще одном варианте осуществления соединение по настоящему изобретению является частичным агонистом/частичным антагонистом. В одном варианте осуществления соединение по настоящему изобретению является агонистом AR. В другом варианте осуществления соединение является антагонистом AR. В еще одном варианте осуществления соединение является частичным агонистом AR и частичным антагонистом AR. В одном варианте осуществления соединение по настоящему изобретению является агонистом PR. В другом варианте осуществления соединение является антагонистом PR. В еще одном варианте осуществления соединение является частичным агонистом PR и антагонистом PR.
В одном варианте осуществления соединение по настоящему изобретению является агонистом AR и антагонистом PR.
Соединения SARM по настоящему изобретению могут являться пригодными, в некоторых вариантах осуществления, для: a) лечения, профилактики, задержки наступления, увеличения времени до первого осложнения, связанного со скелетом (SRE), подавления или ингибирования, или снижения риска развития осложнения, связанного со скелетом (SRE), такого как патологические переломы костей, хирургия кости, лучевая терапия кости, компрессия спинного мозга, новый костный метастаз и/или потеря костной массы у субъекта; b) лечения, профилактики, подавления или ингибирования, или снижения риска развития разнообразных, связанных с гормонами, состояний у субъекта, например, для повышения полового влечения; и/или для c) улучшение качества жизни субъекта.
Остеопороз является системным заболеванием скелета, характеризующимся низкой костной массой и разрушением костной ткани, с последующим увеличением ломкости костей и подверженностью переломам. В США данное состояние поражает более 25 миллионов человек и вызывает более 1,3 миллиона переломов каждый год, включая 500000 переломов позвоночника, 250000 переломов шейки бедра и 240000 переломов костей запястья ежегодно. Переломы шейки бедра являются наиболее серьезным последствием остеопороза, при котором 5-20% пациентов умирают в течение одного года, и более 50% выживших теряют трудоспособность. Пожилые люди подвергаются наибольшему риску остеопороза, и, следовательно, по прогнозам, проблема значительно возрастет по мере старения населения. В мировом масштабе прогнозируется увеличение частоты переломов в три раза в течение следующих 60 лет, и, по оценкам одного исследования, ожидается 4,5 миллиона переломов шейки бедра по всему миру в 2050.
Женщины подвержены большему риску остеопороза, чем мужчины. Женщины испытывают резкое ускорение потери костной массы в течение пяти лет после менопаузы. Другие факторы, которые увеличивают риск, включают курение, злоупотребление алкоголем, малоподвижный образ жизни и низкое потребление кальция. Однако остеопороз также часто возникает у мужчин. Хорошо установлено, что минеральная плотность костей у мужчин уменьшается с возрастом. Снижение содержания минералов и плотности кости коррелирует со снижением прочности кости, и создает предрасположение к переломам. Молекулярные механизмы, лежащие в основе плейотропных эффектов половых гормонов в нерепродуктивных тканях, только начинают проясняться, но ясно, что физиологические концентрации андрогенов и эстрогенов играют важную роль в поддержании гомеостаза кости на протяжении всего жизненного цикла. Следовательно, если возникает андрогенная или эстрогенная недостаточность, в результате происходит увеличение скорости костного ремоделирования, что отклоняет баланс резорбции и формирования в пользу резорбции, что способствует общей потере костной массы. У особей мужского пола естественное снижение половых гормонов в период зрелости (непосредственное снижение андрогенов, а также более низкие уровни эстрогенов, полученных путем периферической ароматизации андрогенов) связано с хрупкостью костей. Данный эффект также наблюдается у кастрированных особей мужского пола.
В одном варианте осуществления настоящее изобретение предусматривает применение соединения, которое описано в данном документе, или его пролекарственной формы, аналога, изомера, метаболита, производного, фармацевтически приемлемой соли, фармацевтического препарата, полиморфной формы, кристалла, примеси, N-оксида, гидрата, или любой их комбинации для: a) лечения нарушения, связанного с костной тканью; b) профилактики нарушения, связанного с костной тканью; c) подавления нарушения, связанного с костной тканью; d) ингибирования нарушения, связанного с костной тканью; e) повышения прочности кости у субъекта; f) увеличения костной массы у субъекта; g) применения для ингибирования остеокластогенеза.
В одном варианте осуществления настоящее изобретение предусматривает применение соединения, которое описано в данном документе, или его пролекарственной формы, аналога, изомера, метаболита, производного, фармацевтически приемлемой соли, фармацевтического препарата, полиморфной формы, кристалла, примеси, N-оксида, гидрата, или любой их комбинации для: a) ускорения регенерации кости; b) лечения костных нарушений; c) лечения потери плотности костной ткани; d) лечения низкой минеральной плотности кости (BMD); e) лечения сниженной костной массы; f) лечения нарушения метаболизма костной ткани; g) стимуляции роста или возобновления роста кости; h) стимуляции восстановления кости; i) стимуляции заживления перелома кости; j) стимуляции костного ремоделирования; k) лечения повреждения кости после реконструктивного оперативного вмешательства, включая оперативное вмешательство на лице, шейке бедра или суставах; l) повышения прочности и функции кости; m) увеличения кортикальной костной массы; n) усиления трабекулярного соединения.
В одном варианте осуществления нарушение, связанное с костной тканью, является генетическим нарушением, или в другом варианте осуществления индуцировано в результате схемы лечения для заданного заболевания. Например, и в одном варианте осуществления, соединения, которые описаны в данном документе, пригодны для лечения нарушения, связанного с костной тканью, которое возникает в результате метастазирования рака в костную ткань, или в другом варианте осуществления в результате антиандрогенной терапии, например, проводимой в ответ на канцерогенез простаты у субъекта.
Применяемый в данном документе термин “антиэстрогенная терапия” может относиться к терапии, которую проводят в ответ на рак молочной железы у субъекта. Известные способы лечения включают лечение с помощью SERM, SERD или ингибиторов ароматазы (AI). Например, и в одном варианте осуществления, соединения, которые описаны в данном документе, пригодны для лечения нарушения, связанного с костной тканью, которое возникает в результате метастазирования рака в костную ткань, или в другом варианте осуществления в результате антиэстрогенной терапии, например, проводимой в ответ на рак молочной железы у субъекта.
В одном варианте осуществления нарушение, связанное с костной тканью, является потерей минеральной плотности кости (BMD). В другом варианте осуществления нарушение, связанное с костной тканью, является остеопорозом. В другом варианте осуществления нарушение, связанное с костной тканью, является остеопенией. В другом варианте осуществления нарушение, связанное с костной тканью, является повышенной костной резорбцией. В другом варианте осуществления нарушение, связанное с костной тканью, является переломом кости. В другом варианте осуществления нарушение, связанное с костной тканью, является хрупкостью кости. В другом варианте осуществления нарушение, связанное с костной тканью, является любой комбинацией остеопороза, остеопении, повышенной костной резорбции, перелома кости, хрупкости кости и потери BMD. Каждое нарушение представляет отдельный вариант осуществления настоящего изобретения.
“Остеопороз” относится, в одном варианте осуществления, к истончению костей с уменьшением костной массы вследствие истощения кальция и костного белка. В другом варианте осуществления остеопороз является системным заболеванием скелета, характеризующимся низкой костной массой и разрушением костной ткани, с последующим увеличением ломкости костей и подверженностью переломам. У пациентов с остеопорозом прочность кости является аномальной, в одном варианте осуществления, с увеличением в результате риска перелома. В другом варианте осуществления остеопороз истощает как кальций, так и белок коллаген, обычно находящиеся в кости, в одном варианте осуществления, приводя в результате либо к аномальному качеству кости, либо к снижению плотности костной ткани. В другом варианте осуществления кости под воздействием остеопороза могут ломаться при лишь незначительном падении или травме, которые обычно не приводят к перелому кости. Перелом может проявляться, в одном варианте осуществления, либо в виде раскалывания (как при переломе шейки бедра), либо разрушения (как при компрессионном переломе позвоночника). Позвоночник, шейка бедра и запястья являются распространенными областями переломов костей, вызванных остеопорозом, хотя переломы также могут происходить и в других областях скелета. Неконтролируемый остеопороз может приводить, в другом варианте осуществления, к изменениям в положении тела, соматическим нарушениям и снижению подвижности.
В одном варианте осуществления остеопороз возникает в результате андрогенной депривации. В другом варианте осуществления остеопороз следует за андрогенной депривацией. В другом варианте осуществления остеопороз возникает в результате антиэстрогенной терапии. В другом варианте осуществления остеопороз следует за антиэстрогенной терапией. В другом варианте осуществления является первичным остеопорозом. В другом варианте осуществления является вторичным остеопорозом. В другом варианте осуществления остеопороз является постменопаузальным остеопорозом. В другом варианте осуществления остеопороз является ювенильным остеопорозом. В другом варианте осуществления остеопороз является идиопатическим остеопорозом. В другом варианте осуществления остеопороз является старческим остеопорозом.
В другом варианте осуществления первичный остеопороз является первичным остеопорозом типа I. В другом варианте осуществления первичный остеопороз является первичным остеопорозом типа II. Каждый тип остеопороза представляет отдельный вариант осуществления настоящего изобретения.
В соответствии с данным аспектом настоящего изобретения и в одном варианте осуществления нарушение, связанное с костной тканью, лечат с помощью соединения, которое описано в данном документе, или его комбинации. В другом варианте осуществления другие стимулирующие костную ткань соединения могут предусматриваться для субъекта до, одновременно с или после введения соединения или соединений, которые описаны в данном документе. В одном варианте осуществления такое стимулирующее костную ткань соединение может содержать природные или синтетические материалы.
В одном варианте осуществления стимулирующее костную ткань соединение может содержать костный морфогенетический белок (BMP), фактор роста, такой как эпидермальный фактор роста (EGF), фактор роста фибробластов (FGF), трансформирующий фактор роста (TGF), инсулиноподобный фактор роста (IGF), тромбоцитарный фактор роста (PDGF), белки hedgehog, такие как sonic, indian и desert hedgehog, гормон, такой как фолликулостимулирующий гормон, паратиреоидный гормон, родственный паратиреоидному гормону пептид, активины, ингибины, фоллистатин, белки frizzled, frzb или frazzled, BMP-связывающие белки, такие как хордин и фетуин, цитокин, такой как IL-3, IL-7, GM-CSF, хемокин, такой как эотаксин, коллаген, остеокальцин, остеонектин и другие, как будет понятно специалисту в данной области.
В другом варианте осуществления композиции для применения при лечении нарушения костной ткани по настоящему изобретению могут содержать соединение или соединения, которые описаны в данном документе, дополнительное стимулирующее костную ткань соединение или соединения и остеогенные клетки. В одном варианте осуществления остеогенная клетка может являться стволовой клеткой или клеткой-предшественником, причем можно индуцировать дифференцировку которой в остеобласты. В другом варианте осуществления клетка может являться остеобластом. В другом варианте осуществления субъекту можно вводить нуклеиновые кислоты, которые кодируют стимулирующие костную ткань соединения, что следует рассматривать как часть настоящего изобретения.
В одном варианте осуществления настоящее изобретение предусматривает лечение, профилактику, подавление или ингибирование, или снижение риска развития осложнения, связанного со скелетом (SRE), такого как переломы костей, хирургия кости, лучевая терапия кости, компрессия спинного мозга, новый костный метастаз, потеря костной массы, или их комбинации у субъекта с раком, включающее введение соединения, которое описано в данном документе, и/или его аналога, производного, изомера, метаболита, фармацевтически приемлемой соли, фармацевтического препарата, гидрата, N-оксида или любой их комбинации. Настоящее изобретение относится, inter alia, к лечению SRE с помощью соединения по настоящему изобретению: (a) у субъекта с раком предстательной железы, подвергающегося или подвергшегося антиандрогенной терапии (ADT); или (b) у субъекта с раком молочной железы, подвергающегося или подвергшегося антиэстрогенной терапии.
В одном варианте осуществления осложнения, связанные со скелетом, которые лечат, применяя способы, предусмотренные в данном документе, и/или используя композиции, предусмотренные в данном документе, являются переломами, которые в одном варианте осуществления являются патологическими переломами, нетравматическими переломами, переломом позвонка, невертебральными переломами, морфометрическими переломами или их комбинацией. В некоторых вариантах осуществления переломы могут являться простыми, сложными, поперечными, по типу зеленой ветки или оскольчатыми переломами. В одном варианте осуществления переломы могут происходить в любой кости тела, что в одном варианте осуществления является переломом любой одной или нескольких костей плеча, запястья, кисти, пальца, нижней конечности, лодыжки, стопы, пальца ноги, шейки бедра, ключицы или их комбинацией.
В другом варианте осуществления способы и/или композиции, предусмотренные в данном документе, являются эффективными в лечении, профилактике, подавлении, ингибировании или снижении риска развития осложнений, связанных со скелетом, таких как патологические переломы, компрессия спинного мозга, гиперкальциемия, боль в костях, или их комбинации.
В другом варианте осуществления осложнения, связанные со скелетом, которые требуют лечения с применением способов, предусмотренных в данном документе и/или использованием композиций, предусмотренных в данном документе, включают необходимость костной хирургии и/или лучевой терапии кости, предназначенных, в некоторых вариантах осуществления, для лечения боли, вследствие, в одном варианте осуществления, повреждения кости или сдавления нерва. В другом варианте осуществления осложнения, связанные со скелетом, которые требуют лечения с применением способов, предусмотренных в данном документе и/или использованием композиций, предусмотренных в данном документе, включают компрессию спинного мозга или необходимость изменений в противоопухолевой терапии, включая изменения в гормональной терапии, у субъекта. В некоторых вариантах осуществления осложнения, связанные со скелетом, которые требуют лечения с применением способов, предусмотренных в данном документе и/или использованием композиций, предусмотренных в данном документе, включают лечение, подавление, профилактику, снижение частоты возникновения или задержку прогрессирования или тяжести костных метастазов или потери костной массы. В одном варианте осуществления потеря костной массы может включать остеопороз, остеопению или их комбинацию. В одном варианте осуществления осложнения, связанные со скелетом, могут включать любую комбинацию вариантов осуществления, перечисленных в данном документе.
В одном варианте осуществления способы, предусмотренные в данном документе, и/или использование композиций, предусмотренных в данном документе, эффективны в снижении метастазов в кости, например, в отношении количества очагов, размера очагов или их комбинации. В соответствии с данным аспектом настоящего изобретения и в одном варианте осуществления в данном документе предусматривается способ профилактики или ингибирования метастазирования рака в кость у субъекта, включающий этап, на котором субъекту вводят композицию, содержащую торемифен, ралоксифен, тамоксифен или аналог, функциональное производное, метаболит или их комбинацию, или их фармацевтически приемлемую соль. В одном варианте осуществления такие метаболиты могут включать оспемифен, фиспемифен или их комбинацию. В одном варианте осуществления рак является раком предстательной железы. В одном варианте осуществления рак является раком молочной железы.
В одном варианте осуществления осложнения, связанные со скелетом, являются результатом терапии рака. В одном варианте осуществления осложнения, связанные со скелетом, являются результатом антигормональной терапии, тогда как в другом варианте осуществления они являются результатом антиандрогенной терапии (ADT), и другом варианте осуществления они являются результатом антиэстрогенной терапии.
Применяемый в данном документе термин “половое влечение” может относиться к сексуальному влечению, или как определено в примере 9.
Применяемый в данном документе термин “качество жизни” может относиться к фокусированию на здоровье и жизни субъекта, страдающего от состояния или заболевания, например, страдающего раком молочной железы, после лечения до конца жизни. Он охватывает физические, психологические и экономические вопросы, с которыми сталкивается субъект помимо фаз диагностики и лечения. Термин “качество жизни” может также упоминаться в данном документе как “выживаемость”. В одном варианте осуществления выживаемость включает вопросы, связанные с возможностью получения медицинской помощи и последующего лечения, отдаленными последствиями лечения, вторичными формами рака и качеством жизни. Члены семьи, друзья и лица, осуществляющие уход, также рассматриваются как часть опыта выживаемости.
В одном варианте осуществления способы по настоящему изобретению применимы к субъекту, который является человеком. В одном варианте осуществления субъект является субъектом мужского пола. В другом варианте осуществления субъект является субъектом женского пола. В некоторых вариантах осуществления, в то время как способы, которые описаны в данном документе, могут являться пригодными для лечения либо мужчин, либо женщин, женщины могут реагировать более эффективно на введение определенного соединения при определенных способах. В других вариантах осуществления, в то время как способы, которые описаны в данном документе, могут являться пригодными для лечения либо мужчин, либо женщин, мужчины могут реагировать более эффективно на введение определенного соединения при определенных способах.
Соединения селективного модулятора андрогенного рецептора (SARM)
В одном варианте осуществления соединение по настоящему изобретению, которое эффективно при: a) лечении субъекта, страдающего раком молочной железы; b) лечении субъекта, страдающего метастатическим раком молочной железы; c) лечении субъекта, страдающего рефрактерным раком молочной железы; d) лечении субъекта, страдающего AR-положительным раком молочной железы; e) лечении субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечении субъекта, страдающего AR-положительным метастатическим раком молочной железы; g) лечении субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечении субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечении субъекта, страдающего трижды негативным раком молочной железы; j) лечении субъекта, страдающего распространенным раком молочной железы; k) лечении субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептин, адо-трастузумаб эмтанзин), пертузумаба (перджеты), лапатиниба, эксеместана (аромазин), бевацизумаба (авастин) и/или фулвестранта оказалось безуспешным; l) лечении субъекта, страдающего ER-положительным раком молочной железы; m) лечении, профилактике, подавлении или ингибировании метастазирования у субъекта, страдающего раком молочной железы; n) продлении выживания субъекта с раком молочной железы; o) замедлении прогрессирования рака молочной железы у субъекта; и/или p) продлении выживания субъекта с раком молочной железы без прогрессирования; является соединением, представленным структурой формулы I, и/или его аналогом, производным, изомером, метаболитом, фармацевтически приемлемой солью, фармацевтическим препаратом, гидратом, N-оксидом, кристаллом, полиморфной формой, пролекарственной формой или любой их комбинацией:

I
X представляет собой связь, O, CH2, NH, S, Se, PR, NO или NR;
G представляет собой O или S;
T представляет собой OH, OR, -NHCOCH3 или NHCOR;
R представляет собой алкил, галогеналкил, дигалогеналкил, тригалогеналкил, CH2F, CHF2, CF3, CF2CF3, арил, фенил, галоген, алкенил или OH;
R1 является CH3, CH2F, CHF2, CF3, CH2CH3 или CF2CF3
R2 является H, F, Cl, Br, I, CH3, CF3, OH, CN, NO2, NHCOCH3, NHCOCF3, NHCOR, алкилом, арилалкилом, OR, NH2, NHR, N(R)2, SR;
R3 является H, F, Cl, Br, I, CN, NO2, COR, COOH, CONHR, CF3, Sn(R)3, или R3 вместе с бензольным кольцом, к которому он присоединен, образует систему с сочлененными кольцами, представленную структурой:

Z является NO2, CN, COR, COOH или CONHR;
Y является CF3 F, Br, Cl, I, CN или Sn(R)3;
Q является CN, алкилом, галогеном, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR,
OCONHR, CONHR, NHCSCH3, NHCSCF3,
NHCSR NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R или SR;
или Q вместе с бензольным кольцом, к которому он присоединен, представляет собой систему с сочлененными кольцами, представленную структурой A, B или C:

n представляет собой целое число от 1 до 4; и
m представляет собой целое число от 1 до 3.
В одном варианте осуществления G в формуле I является O. В другом варианте осуществления X в формуле I является O. В другом варианте осуществления T в формуле I является OH. В другом варианте осуществления R1 в формуле I является CH3. В другом варианте осуществления Z в формуле I является NO2. В другом варианте осуществления Z в формуле I является CN. В другом варианте осуществления Y в формуле I является CF3. В другом варианте осуществления Y в формуле I является Cl. В другом варианте осуществления Q в формуле I является CN. В другом варианте осуществления Q в формуле I является галогеном. В другом варианте осуществления Q в формуле I является F. В другом варианте осуществления Q в формуле I является Cl. В другом варианте осуществления Q в формуле I является NHCOCH3. В другом варианте осуществления Q в формуле I является CN, и R2 является F. В другом варианте осуществления Q в формуле I является Cl, и R2 является F. В другом варианте осуществления Q в формуле I находится в пара-положении. В другом варианте осуществления Z в формуле I находится в пара-положении. В другом варианте осуществления Y в формуле I находится в мета-положении.
Заместители Z, Y и R3 могут находиться в любом положении кольца, несущего данные заместители (в дальнейшем "кольцо А"). В одном варианте осуществления заместитель Z находится в пара-положении кольца A. В другом варианте осуществления заместитель Y находится в мета-положении кольца A. В другом варианте осуществления заместитель Z находится в пара-положении кольца A и заместитель Y находится в мета-положении кольца A.
Заместители Q и R2 могут находиться в любом положении кольца, несущего данные заместители (в дальнейшем “кольцо B”). В одном варианте осуществления заместитель Q находится в пара-положении кольца B. В другом варианте осуществления заместитель R2 находится в мета-положении кольца B. В другом варианте осуществления заместитель Q является CN и находится в пара-положении кольца B.
Как предусмотрено в данном документе, когда целые числа m и n больше одного, заместители R2 и R3 не ограничиваются одним определенным заместителем, и могут являться любой комбинацией заместителей, перечисленных выше.
В другом варианте осуществления соединение по настоящему изобретению, которое эффективно при: a) лечении субъекта, страдающего раком молочной железы; b) лечении субъекта, страдающего метастатическим раком молочной железы; c) лечении субъекта, страдающего рефрактерным раком молочной железы; d) лечении субъекта, страдающего AR-положительным раком молочной железы; e) лечении субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечении субъекта, страдающего ARположительным метастатическим раком молочной железы; g) лечении субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечении субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечении субъекта, страдающего трижды негативным раком молочной железы; j) лечении субъекта, страдающего распространенным раком молочной железы; k) лечении субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечении субъекта, страдающего ER-положительным раком молочной железы; m) лечении, профилактике, подавлении или ингибировании метастазирования у субъекта, страдающего раком молочной железы; n) продлении выживания субъекта с раком молочной железы; o) замедлении прогрессирования рака молочной железы у субъекта; и/или p) продлении выживания субъекта с раком молочной железы без прогрессирования; является соединением, представленным соединением формулы II, и/или его аналогом, производным, изомером, метаболитом, фармацевтически приемлемой солью, фармацевтическим препаратом, гидратом, N-оксидом, кристаллом, полиморфной формой, пролекарственной формой или любой их комбинацией:

II
где X представляет собой связь, O, CH2, NH, Se, PR или NR;
G представляет собой O или S;
T представляет собой OH, OR, -NHCOCH3 или NHCOR;
Z является NO2, CN, COR, COOH или СONHR; Y является I, CF3, Br, Cl или Sn(R)3
Q является CN, алкилом, галогеном, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R или SR;
или Q вместе с бензольным кольцом, к которому он присоединен, представляет собой систему с сочлененными кольцами, представленную структурой А, В или С:

R является C1-C4алкилом, арилом, фенилом, алкенилом, гидроксилом, C1-C4галогеналкилом, галогеном или галогеналкенилом; и
R1 является CH3, CF3, CH2CH3, или CF2CF3.
В одном варианте осуществления G в формуле II является O. В другом варианте осуществления X в формуле II является O. В другом варианте осуществления T в формуле II является OH. В другом варианте осуществления R1 в формуле II является CH3. В другом варианте осуществления Z в формуле II является NO2. В другом варианте осуществления Z в формуле II является CN. В другом варианте осуществления Y в формуле II является CF3. В другом варианте осуществления Y в формуле II является галогеном. В другом варианте осуществления Y в формуле II является Cl. В другом варианте осуществления Q в формуле II является CN. В другом варианте осуществления Q в формуле II является галогеном. В другом варианте осуществления Q в формуле II является Cl. В другом варианте осуществления Q в формуле II является F. В другом варианте осуществления Q в формуле II является NHCOCH3. В другом варианте осуществления Q в формуле II находится в пара-положении. В другом варианте осуществления Z в формуле II находится в пара-положении. В другом варианте осуществления Y в формуле II находится в мета-положении. В другом варианте осуществления G в формуле II является O, T является OH, R1 является CH3, X является O, Z является CN, Y является CF3 или галогеном и Q является CN или F. В другом варианте осуществления G в формуле II является O, T является OH, R1 является CH3, X является O, Z является NO2, Y является CF3 и Q является NHCOCH3, F или Cl.
Заместители Z и Y могут находиться в любом положении кольца, несущего данные заместители (в дальнейшем “кольцо A”). В одном варианте осуществления заместитель Z находится в пара-положении кольца A. В другом варианте осуществления заместитель Y находится в мета-положении кольца A. В другом варианте осуществления заместитель Z находится в пара-положении кольца A и заместитель Y находится в мета-положении кольца A.
Заместитель Q может находиться в любом положении кольца, несущего данный заместитель (в дальнейшем “кольцо B”). В одном варианте осуществления заместитель Q находится в пара-положении кольца B. В другом варианте осуществления заместитель Q является CN и находится в пара-положении кольца B.
В другом варианте осуществления соединение по настоящему изобретению, которое эффективно при: a) лечении субъекта, страдающего раком молочной железы; b) лечении субъекта, страдающего метастатическим раком молочной железы; c) лечении субъекта, страдающего рефрактерным раком молочной железы; d) лечении субъекта, страдающего AR-положительным раком молочной железы; e) лечении субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечении субъекта, страдающего ARположительным метастатическим раком молочной железы; g) лечении субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечении субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечении субъекта, страдающего трижды негативным раком молочной железы; j) лечении субъекта, страдающего распространенным раком молочной железы; k) лечении субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептин, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечении субъекта, страдающего ER-положительным раком молочной железы; m) лечении, профилактике, подавлении или ингибировании метастазирования у субъекта, страдающего раком молочной железы; n) продлении выживания субъекта с раком молочной железы; o) замедлении прогрессирования рака молочной железы у субъекта; и/или p) продлении выживания субъекта с раком молочной железы без прогрессирования; является соединением, представленным структурой формулы III, и/или его аналогом, производным, изомером, метаболитом, фармацевтически приемлемой солью, фармацевтическим препаратом, гидратом, N-оксидом, кристаллом, полиморфной формой, пролекарственной формой или любой их комбинацией:

III
где
Z является NO2, CN, COOH, COR, NHCOR или CONHR;
Y является CF3, F, I, Br, Cl, CN, C(R)3 или Sn(R)3;
Q является CN, алкилом, галогеном, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R или SR;
или Q вместе с бензольным кольцом, к которому он присоединен, представляет собой систему с сочлененными кольцами, представленную структурой A, B или C:

R представляет собой алкил, галогеналкил, дигалогеналкил, тригалогеналкил, CH2F, CHF2, CF3, CF2CF3, арил, фенил, галоген, алкенил или OH.
В одном варианте осуществления Z в формуле III является NO2. В другом варианте осуществления Z в формуле III является CN. В другом варианте осуществления Y в формуле III является CF3. В другом варианте осуществления Y в формуле III является Cl. В другом варианте осуществления Y в формуле III является галогеном. В другом варианте осуществления Q в формуле III является CN. В другом варианте осуществления Q в формуле III является галогеном. В другом варианте осуществления Q в формуле III является F. В другом варианте осуществления Q в формуле III является Cl. В другом варианте осуществления Q в формуле III является NHCOCH3. В другом варианте осуществления Z является CN, Y является CF3 или галоген, и Q является CN или F. В другом варианте осуществления Z является NO2, Y является CF3, и Q является NHCOCH3, F или Cl.
В другом варианте осуществления соединение по настоящему изобретению, которое эффективно при: a) лечении субъекта, страдающего раком молочной железы; b) лечении субъекта, страдающего метастатическим раком молочной железы; c) лечении субъекта, страдающего рефрактерным раком молочной железы; d) лечении субъекта, страдающего AR-положительным раком молочной железы; e) лечении субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечении субъекта, страдающего ARположительным метастатическим раком молочной железы; g) лечении субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечении субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечении субъекта, страдающего трижды негативным раком молочной железы; j) лечении субъекта, страдающего распространенным раком молочной железы; k) лечении субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечении субъекта, страдающего ER-положительным раком молочной железы; m) лечении, профилактике, подавлении или ингибировании метастазирования у субъекта, страдающего раком молочной железы; n) продлении выживания субъекта с раком молочной железы; o) замедлении прогрессирования рака молочной железы у субъекта; и/или p) продлении выживания субъекта с раком молочной железы без прогрессирования; является соединением, представленным структурой формулы IV, и/или его аналогом, производным, изомером, метаболитом, фармацевтически приемлемой солью, фармацевтическим препаратом, гидратом, N-оксидом, кристаллом, полиморфной формой, пролекарственной формой или любой их комбинацией:
G

IV
где X представляет собой связь, O, CH2, NH, S, Se, PR, NO или NR;
G представляет собой O или S;
R1 является CH3, CH2F, CHF2, CF3, CH2CH3 или CF2CF3
T представляет собой OH, OR, -NHCOCH3 или NHCOR;
R представляет собой алкил, галогеналкил, дигалогеналкил, тригалогеналкил, CH2F, CHF2, CF3, CF2CF3, арил, фенил, галоген, алкенил или OH;
A является кольцом, которое выбирают из:

B является кольцом, которое выбирают из:

где A и B не могут одновременно являться бензольным кольцом;
Z является NO2, CN, COOH, COR, NHCOR или CONHR;
Y является CF3, F, I, Br, Cl, CN, C(R)3 или Sn(R)3,
Q1 и Q2 независимо являются водородом, алкилом, галогеном, CF3, CN, C(R)3, Sn(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R, SR,
или

Q3 и Q4независимо друг от друга являются водородом, алкилом, галогеном, CF3, CN, C(R)3, Sn(R)3, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR, NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R или SR;
W1 является O, NH, NR, NO или S; и
W2 является N или NO.
В одном варианте осуществления G в формуле IV является O. В другом варианте осуществления X в формуле IV является O. В другом варианте осуществления T в формуле IV является OH. В другом варианте осуществления R1 в формуле IV является CH3. В другом варианте осуществления Z в формуле IV является NO2. В другом варианте осуществления Z в формуле IV является CN. В другом варианте осуществления Y в формуле IV является CF3. В другом варианте осуществления Y в формуле IV является галогеном. В другом варианте осуществления Y в формуле IV является Cl. В другом варианте осуществления Q1 в формуле II является CN. В другом варианте осуществления Q1 в формуле IV является F. В другом варианте осуществления Q1 в формуле IV является Cl. В другом варианте осуществления Q1 в формуле II является NHCOCH3. В другом варианте осуществления Q1 в формуле IV находится в пара-положении. В другом варианте осуществления Z в формуле IV находится в пара-положении. В другом варианте осуществления Y в формуле IV находится в мета-положении. В другом варианте осуществления G в формуле IV является O, T является OH, R1 является CH3, X является O, Z является NO2 или CN, Y является CF3 или галогеном и Q1 является CN, F, Cl или NHCOCH3.
Заместители Z и Y могут находиться в любом положении кольца, несущего данные заместители (в дальнейшем “кольцо A”). В одном варианте осуществления заместитель Z находится в пара-положении кольца A. В другом варианте осуществления заместитель Y находится в мета-положении кольца A. В другом варианте осуществления заместитель Z находится в пара-положении кольца A, и заместитель Y находится в мета-положении кольца A.
Заместители Q1 и Q2 могут находиться в любом положении кольца, несущего данные заместители (в дальнейшем “кольцо B”). В одном варианте осуществления заместитель Q1 находится в пара-положении кольца B. В другом варианте осуществления заместителем является Q2, который является H. В другом варианте осуществления заместитель Q1 находится в пара-положении кольца B, и заместителем является Q2,который является H. В другом варианте осуществления заместитель Q1 является CN и находится в пара-положении кольца B, и заместителем является Q2,который является H.
Как предусмотрено в данном документе, другими конкретными вариантами осуществления соединений, которые включены в объем настоящего изобретения, и которые пригодны для: a) лечения субъекта, страдающего раком молочной железы; b) лечения субъекта, страдающего метастатическим раком молочной железы; c) лечения субъекта, страдающего рефрактерным раком молочной железы; d) лечения субъекта, страдающего AR-положительным раком молочной железы; e) лечения субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечения субъекта, страдающего AR-положительным метастатическим раком молочной железы; g) лечения субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечения субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечения субъекта, страдающего трижды негативным раком молочной железы; j) лечения субъекта, страдающего распространенным раком молочной железы; k) лечения субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечения субъекта, страдающего ER-положительным раком молочной железы; m) лечения, профилактики, подавления или ингибирования метастазирования у субъекта, страдающего раком молочной железы; n) продления выживания субъекта с раком молочной железы; o) замедления прогрессирования рака молочной железы у субъекта; и/или p) продления выживания субъекта с раком молочной железы без прогрессирования; являются формулы V или VI. Понятно, что в объем настоящего изобретения включены аналоги, производные, метаболиты, изомеры, фармацевтически приемлемые соли, фармацевтические препараты, гидраты, N-оксиды, полиморфные формы, кристаллы, пролекарственные формы или их комбинации из данных соединений:

V
или

VI
где Q является CN, алкилом, галогеном, N(R)2, NHCOCH3, NHCOCF3, NHCOR, NHCONHR, NHCOOR, OCONHR, CONHR, NHCSCH3, NHCSCF3, NHCSR NHSO2CH3, NHSO2R, OR, COR, OCOR, OSO2R, SO2R или SR;
или Q вместе с бензольным кольцом, к которому он присоединен, представляет собой систему с сочлененными кольцами, представленную структурой A, B или C:

R представляет собой алкил, галогеналкил, дигалогеналкил, тригалогеналкил, CH2F, CHF2, CF3, CF2CF3, арил, фенил, галоген, алкенил или OH.
В одном варианте осуществления Q в формуле V или VI является CN. В одном варианте осуществления Q в формуле V или VI является галогеном. В одном варианте осуществления Q в формуле V или VI является F. В одном варианте осуществления Q в формуле V или VI является Cl. В одном варианте осуществления Q в формуле V или VI является NHCOCH3.
В другом варианте осуществления соединение по настоящему изобретению, которое эффективно при: a) лечении субъекта, страдающего раком молочной железы; b) лечении субъекта, страдающего метастатическим раком молочной железы; c) лечении субъекта, страдающего рефрактерным раком молочной железы; d) лечении субъекта, страдающего AR-положительным раком молочной железы; e) лечении субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечении субъекта, страдающего ARположительным метастатическим раком молочной железы; g) лечении субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечении субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечении субъекта, страдающего трижды негативным раком молочной железы; j) лечении субъекта, страдающего распространенным раком молочной железы; k) лечении субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечении субъекта, страдающего ER-положительным раком молочной железы; m) лечении, профилактике, подавлении или ингибировании метастазирования у субъекта, страдающего раком молочной железы; n) продлении выживания субъекта с раком молочной железы; o) замедлении прогрессирования рака молочной железы у субъекта; и/или p) продлении выживания субъекта с раком молочной железы без прогрессирования; является соединением, представленным структурой формулы VII, и/или его аналогом, производным, изомером, метаболитом, фармацевтически приемлемой солью, фармацевтическим препаратом, гидратом, N-оксидом, кристаллом, полиморфной формой, пролекарственной формой или любой их комбинацией:

где Z является Cl или CF3.
В другом варианте осуществления соединение, которое эффективно при: a) лечении субъекта, страдающего раком молочной железы; b) лечении субъекта, страдающего метастатическим раком молочной железы; c) лечении субъекта, страдающего рефрактерным раком молочной железы; d) лечении субъекта, страдающего AR-положительным раком молочной железы; e) лечении субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечении субъекта, страдающего ARположительным метастатическим раком молочной железы; g) лечении субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечении субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечении субъекта, страдающего трижды негативным раком молочной железы; j) лечении субъекта, страдающего распространенным раком молочной железы; k) лечении субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечении субъекта, страдающего ER-положительным раком молочной железы; m) лечении, профилактике, подавлении или ингибировании метастазирования у субъекта, страдающего раком молочной железы; n) продлении выживания субъекта с раком молочной железы; o) замедлении прогрессирования рака молочной железы у субъекта; и/или p) продлении выживания субъекта с раком молочной железы без прогрессирования; является соединением, представленным структурой формулы VIII, и/или его аналогом, производным, изомером, метаболитом, фармацевтически приемлемой солью, фармацевтическим препаратом, гидратом, N-оксидом, кристаллом, полиморфной формой, пролекарственной формой или любой их комбинацией:

VIII
В другом варианте осуществления соединение, которое эффективно при: a) лечении субъекта, страдающего раком молочной железы; b) лечении субъекта, страдающего метастатическим раком молочной железы; c) лечении субъекта, страдающего рефрактерным раком молочной железы; d) лечении субъекта, страдающего AR-положительным раком молочной железы; e) лечении субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечении субъекта, страдающего ARположительным метастатическим раком молочной железы; g) лечении субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечении субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечении субъекта, страдающего трижды негативным раком молочной железы; j) лечении субъекта, страдающего распространенным раком молочной железы; k) лечении субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечении субъекта, страдающего ER-положительным раком молочной железы; m) лечении, профилактике, подавлении или ингибировании метастазирования у субъекта, страдающего раком молочной железы; n) продлении выживания субъекта с раком молочной железы; o) замедлении прогрессирования рака молочной железы у субъекта; и/или p) продлении выживания субъекта с раком молочной железы без прогрессирования; является соединением, представленным структурой формулы IX, и/или его аналогом, производным, изомером, метаболитом, фармацевтически приемлемой солью, фармацевтическим препаратом, гидратом, N-оксидом, кристаллом, полиморфной формой, пролекарственной формой или любой их комбинацией:

IX
В другом варианте осуществления соединение, которое эффективно при: a) лечении субъекта, страдающего раком молочной железы; b) лечении субъекта, страдающего метастатическим раком молочной железы; c) лечении субъекта, страдающего рефрактерным раком молочной железы; d) лечении субъекта, страдающего AR-положительным раком молочной железы; e) лечении субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечении субъекта, страдающего ARположительным метастатическим раком молочной железы; g) лечении субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечении субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечении субъекта, страдающего трижды негативным раком молочной железы; j) лечении субъекта, страдающего распространенным раком молочной железы; k) лечении субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечении субъекта, страдающего ER-положительным раком молочной железы; m) лечении, профилактике, подавлении или ингибировании метастазирования у субъекта, страдающего раком молочной железы; n) продлении выживания субъекта с раком молочной железы; o) замедлении прогрессирования рака молочной железы у субъекта; и/или p) продлении выживания субъекта с раком молочной железы без прогрессирования; является соединением, представленным структурой формулы X, и/или его аналогом, производным, изомером, метаболитом, фармацевтически приемлемой солью, фармацевтическим препаратом, гидратом, N-оксидом, кристаллом, полиморфной формой, пролекарственной формой или любой их комбинацией:

X
В другом варианте осуществления соединение, которое эффективно при: a) лечении субъекта, страдающего раком молочной железы; b) лечении субъекта, страдающего метастатическим раком молочной железы; c) лечении субъекта, страдающего рефрактерным раком молочной железы; d) лечении субъекта, страдающего AR-положительным раком молочной железы; e) лечении субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечении субъекта, страдающего ARположительным метастатическим раком молочной железы; g) лечении субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечении субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечении субъекта, страдающего трижды негативным раком молочной железы; j) лечении субъекта, страдающего распространенным раком молочной железы; k) лечении субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечении субъекта, страдающего ER-положительным раком молочной железы; m) лечении, профилактике, подавлении или ингибировании метастазирования у субъекта, страдающего раком молочной железы; n) продлении выживания субъекта с раком молочной железы; o) замедлении прогрессирования рака молочной железы у субъекта; и/или p) продлении выживания субъекта с раком молочной железы без прогрессирования; является соединением, представленным структурой формулы XI, и/или его аналогом, производным, изомером, метаболитом, фармацевтически приемлемой солью, фармацевтическим препаратом, гидратом, N-оксидом, кристаллом, полиморфной формой, пролекарственной формой или любой их комбинацией:

XI
В другом варианте осуществления соединение, которое эффективно при: a) лечении субъекта, страдающего раком молочной железы; b) лечении субъекта, страдающего метастатическим раком молочной железы; c) лечении субъекта, страдающего рефрактерным раком молочной железы; d) лечении субъекта, страдающего AR-положительным раком молочной железы; e) лечении субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечении субъекта, страдающего ARположительным метастатическим раком молочной железы; g) лечении субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечении субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечении субъекта, страдающего трижды негативным раком молочной железы; j) лечении субъекта, страдающего распространенным раком молочной железы; k) лечении субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечении субъекта, страдающего ER-положительным раком молочной железы; m) лечении, профилактике, подавлении или ингибировании метастазирования у субъекта, страдающего раком молочной железы; n) продлении выживания субъекта с раком молочной железы; o) замедлении прогрессирования рака молочной железы у субъекта; и/или p) продлении выживания субъекта с раком молочной железы без прогрессирования; является соединением, представленным структурой формулы XII, и/или его аналогом, производным, изомером, метаболитом, фармацевтически приемлемой солью, фармацевтическим препаратом, гидратом, N-оксидом, кристаллом, полиморфной формой, пролекарственной формой или любой их комбинацией:

XII
В другом варианте осуществления соединение, которое эффективно при: a) лечении субъекта, страдающего раком молочной железы; b) лечении субъекта, страдающего метастатическим раком молочной железы; c) лечении субъекта, страдающего рефрактерным раком молочной железы; d) лечении субъекта, страдающего AR-положительным раком молочной железы; e) лечении субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечении субъекта, страдающего ARположительным метастатическим раком молочной железы; g) лечении субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечении субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечении субъекта, страдающего трижды негативным раком молочной железы; j) лечении субъекта, страдающего распространенным раком молочной железы; k) лечении субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечении субъекта, страдающего ER-положительным раком молочной железы; m) лечении, профилактике, подавлении или ингибировании метастазирования у субъекта, страдающего раком молочной железы; n) продлении выживания субъекта с раком молочной железы; o) замедлении прогрессирования рака молочной железы у субъекта; и/или p) продлении выживания субъекта с раком молочной железы без прогрессирования; является соединением, представленным соединением формулы XIII, и/или его аналогом, производным, изомером, метаболитом, фармацевтически приемлемой солью, фармацевтическим препаратом, гидратом, N-оксидом, кристаллом, полиморфной формой, пролекарственной формой или любой их комбинацией:

XIII
В другом варианте осуществления соединение, которое эффективно при: a) лечении субъекта, страдающего раком молочной железы; b) лечении субъекта, страдающего метастатическим раком молочной железы; c) лечении субъекта, страдающего рефрактерным раком молочной железы; d) лечении субъекта, страдающего AR-положительным раком молочной железы; e) лечении субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечении субъекта, страдающего ARположительным метастатическим раком молочной железы; g) лечении субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечении субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечении субъекта, страдающего трижды негативным раком молочной железы; j) лечении субъекта, страдающего распространенным раком молочной железы; k) лечении субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечении субъекта, страдающего ER-положительным раком молочной железы; m) лечении, профилактике, подавлении или ингибировании метастазирования у субъекта, страдающего раком молочной железы; n) продлении выживания субъекта с раком молочной железы; o) замедлении прогрессирования рака молочной железы у субъекта; и/или p) продлении выживания субъекта с раком молочной железы без прогрессирования; является соединением, представленным структурой формулы XIV, и/или его аналогом, производным, изомером, метаболитом, фармацевтически приемлемой солью, фармацевтическим препаратом, гидратом, N-оксидом, кристаллом, полиморфной формой, пролекарственной формой или любой их комбинацией:

XIV
В одном варианте осуществления способы по настоящему изобретению включают этап, на котором вводят аналог соединения формулы I-XIV. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят производные соединения формулы I-XIV. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят изомер соединения формулы I-XIV. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят метаболит соединения формулы I-XIV. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят фармацевтически приемлемую соль соединения формулы I-XIV. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят фармацевтический препарат соединения формулы I-XIV. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят гидрат соединения формулы I-XIV. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят N-оксид соединения формулы I-XIV. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят полиморфную форму соединения формулы I-XIV. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят кристалл соединения формулы I-XIV. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят пролекарственную форму соединения формулы I-XIV. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят комбинацию любых из аналога, производного, метаболита, изомера, фармацевтически приемлемой соли, фармацевтического препарата, гидрата, N-оксида, полиморфной формы, кристалла или пролекарственной формы соединения формулы I-XIV.
В одном варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы I-XIV. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы I. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы II. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы III. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы IV. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы V. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы VI. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы VII. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы VIII. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы IX. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы X. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы XI. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы XII. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы XIII. В другом варианте осуществления способы по настоящему изобретению включают этап, на котором вводят соединение формулы XIV.
Соединения по настоящему изобретению, либо по отдельности, либо в виде фармацевтической композиции, применимы для: a) лечения субъекта, страдающего раком молочной железы; b) лечения субъекта, страдающего метастатическим раком молочной железы; c) лечения субъекта, страдающего рефрактерным раком молочной железы; d) лечения субъекта, страдающего AR-положительным раком молочной железы; e) лечения субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечения субъекта, страдающего AR-положительным метастатическим раком молочной железы; g) лечения субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечения субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечения субъекта, страдающего трижды негативным раком молочной железы; j) лечения субъекта, страдающего распространенным раком молочной железы; k) лечения субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечения субъекта, страдающего ER-положительным раком молочной железы; m) лечения, профилактики, подавления или ингибирования метастазирования у субъекта, страдающего раком молочной железы; n) продления выживания субъекта с раком молочной железы; o) замедления прогрессирования рака молочной железы у субъекта; и/или p) продления выживания субъекта с раком молочной железы без прогрессирования.
Соединения по настоящему изобретению обеспечивают существенное преимущество по сравнению с лечением с помощью стероидных андрогенов, так как лечение рака молочной железы с помощью данных соединений не будет сопровождаться серьезными побочными эффектами, неудобными способами введения или высокими затратами, и все же будет обладать преимуществами биодоступности при пероральном введении, отсутствия перекрестной реактивности с другими стероидными рецепторами и продолжительного биологического периода полувыведения.
В одном варианте осуществления настоящее изобретение относится к лечению андроген-рецептор-положительного рака молочной железы у субъекта. Соответственно, настоящее изобретение предусматривает способы: a) лечения субъекта, страдающего раком молочной железы; b) лечения субъекта, страдающего метастатическим раком молочной железы; c) лечения субъекта, страдающего рефрактерным раком молочной железы; d) лечения субъекта, страдающего AR-положительным раком молочной железы; e) лечения субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечения субъекта, страдающего AR-положительным метастатическим раком молочной железы; g) лечения субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечения субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечения субъекта, страдающего трижды негативным раком молочной железы; j) лечения субъекта, страдающего распространенным раком молочной железы; k) лечения субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечения субъекта, страдающего ER-положительным раком молочной железы; m) лечения, профилактики, подавления или ингибирования метастазирования у субъекта, страдающего раком молочной железы; n) продления выживания субъекта с раком молочной железы; o) замедления прогрессирования рака молочной железы у субъекта; и/или p) продления выживания субъекта с раком молочной железы без прогрессирования; путем введения субъекту терапевтически эффективного количества селективного модулятора андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналога, производного, изомера, метаболита, фармацевтически приемлемой соли, фармацевтического препарата, гидрата, N-оксида, кристалла, полиморфной формы, пролекарственной формы или любой их комбинации, которые описаны в данном документе.
Как определено в данном документе, термин “изомер” включает, но без ограничений, оптические изомеры и аналоги, структурные изомеры и аналоги, конформационные изомеры и аналоги, и тому подобное. Применяемый в данном документе термин "изомер" также может упоминаться в данном документе как "энантиомер", обладая при этом всеми качествами и свойствами “изомера”.
В одном варианте осуществления настоящее изобретение включает в себя применение различных оптических изомеров селективного модулятора андрогенных рецепторов. Как будет понятно специалистам в данной области, селективные модуляторы андрогенного рецептора по настоящему изобретению содержат, по меньшей мере, один хиральный центр. Соответственно, селективные модуляторы андрогенного рецептора, применяемые в способах по настоящему изобретению, могут существовать в, и их можно выделить в оптически активной или рацемической формах. Некоторые соединения также могут проявлять полиморфизм. Следует понимать, что настоящее изобретение охватывает любую рацемическую, оптически активную, полиморфную или стереоизомерную форму, или любую их комбинацию, при этом форма обладает свойствами, пригодными при лечении андроген-ассоциированных состояний, описываемых в данном документе. В одном варианте осуществления селективные модуляторы андрогенного рецептора являются чистыми (R)-изомерами. В другом варианте осуществления селективные модуляторы андрогенного рецептора являются чистыми (S)-изомерами. В другом варианте осуществления селективные модуляторы андрогенного рецептора являются смесью (R) и (S) изомеров. В другом варианте осуществления селективные модуляторы андрогенного рецептора являются рацемической смесью, содержащей равное количество (R) и (S) изомеров. В данной области хорошо известно, как получить оптически-активные формы (например, путем разделения рацемической формы, с помощью методов рекристаллизации, путем синтеза из оптически-активных исходных материалов, путем хирального синтеза, или путем хроматографического разделения с применением хиральной неподвижной фазы).
Настоящее изобретение включает “фармацевтически приемлемые соли” соединений по настоящему изобретению, которые можно получить с помощью реакции соединения по настоящему изобретению с кислотой или основанием.
Настоящее изобретение включает фармацевтически приемлемые соли аминозамещенных соединений с органическими и неорганическими кислотами, например, лимонной кислотой и соляной кислотой. Настоящее изобретение также включает N-оксиды аминозаместителей соединений, которые описаны в данном документе. Фармацевтически приемлемые соли также можно получать из фенольных соединений путем обработки неорганическими основаниями, например, гидроксидом натрия. Также, сложные эфиры фенольных соединений можно получать с алифатическими и ароматическими карбоновыми кислотами, например, сложные эфиры уксусной кислоты и бензойной кислоты.
Пригодные фармацевтически приемлемые соли соединений формулы I-XIV можно получать из неорганической кислоты или из органической кислоты. В одном варианте осуществления примерами неорганических солей соединений по настоящему изобретению являются бисульфаты, бораты, бромиды, хлориды, гемисульфаты, гидроброматы, гидрохлораты, 2-гидроксиэтилсульфонаты (гидроксиэтансульфонаты), иодаты, иодиды, изотионаты, нитраты, персульфаты, фосфаты, сульфаты, сульфаматы, сульфанилаты, сульфоновые кислоты (алкилсульфонаты, арилсульфонаты, галогензамещенные алкилсульфонаты, галогензамещенные арилсульфонаты), сульфонаты и тиоцианаты.
В одном варианте осуществления примеры органических солей соединений по настоящему изобретению можно выбрать из алифатического, циклоалифатического, ароматического, аралифатического, гетероциклического, карбонового и сульфонового классов органических кислот, примерами которых являются ацетаты, аргинины, аспартаты, аскорбаты, адипаты, антранилаты, альгенаты, алканкарбоксилаты, замещенные алканкарбоксилаты, альгинаты, бензолсульфонаты, бензоаты, бисульфаты, бутираты, бикарбонаты, битартраты, цитраты, камфораты, камфорсульфонаты, циклогексилсульфаматы, циклопентанпропионаты, кальция эдетаты, камсилаты, карбонаты, клавуланаты, циннаматы, дикарбоксилаты, диглюконаты, додецилсульфонаты, дигидрохлориды, деканоаты, энантуаты, этансульфонаты, эдетаты, эдизилаты, эстолаты, эзилаты, фумараты, формиаты, фториды, галактуронаты глюконаты, глутаматы, гликоляты, глюкорат, глюкогептаноаты, глицерофосфаты, глюцептаты, гликолиларсанилаты, глутараты, глутамат, гептаноаты, гексаноаты, гидроксималеаты, гидроксикарбоновые кислоты, гексилрезорцинаты, гидроксибензоаты, гидроксинафтоат, гидрофторат (hydrofluorate), лактаты, лактобионаты, лаураты, малаты, малеаты, метиленбис(бетаоксинафтоаты), малонаты, манделаты, мезилаты, метансульфонаты, метилбромиды, метилнитраты, метансульфонаты, монокалиймалеаты, мукаты, монокарбоксилаты, митраты, нафталинсульфонаты, 2-нафталинсульфонаты, никотинаты, напсилаты, N-метилглюкамины, оксалаты, октаноаты, олеаты, памоаты, фенилацетаты, пикраты, фенилбензоаты, пивалаты, пропионаты, фталаты, фенилацетат, пектинаты, фенилпропионаты, пальмитаты, пантотенаты, полигалактураты, пируваты, хинаты, салицилаты, сукцинаты, стеараты, сульфанилат, основные уксуснокислые соли, тартраты, теофиллинацетаты, п-толуолсульфонаты (тозилаты), трифторацетаты, терефталаты, таннаты, теоклаты, тригалогенацетаты, триэтиодид, трикарбоксилаты, ундеканоаты и валераты.
В одном варианте осуществления соли можно получать с помощью обычных способов, например, путем взаимодействия продукта в форме свободного основания или свободной кислоты с одним или несколькими эквивалентами соответствующей кислоты или основания в растворителе или среде, в которой соль нерастворима, или в растворителе, таком как вода, который удаляют in vacuo или путем лиофилизации, или путем обмена ионов существующей соли на другой ион или пригодную ионообменную смолу.
Настоящее изобретение дополнительно включает производные селективных модуляторов андрогенного рецептора. Термин “производные” включает, но без ограничений, эфирные производные, производные кислот, амидопроизводные, сложноэфирные производные и тому подобное. В дополнение, настоящее изобретение дополнительно включает гидраты селективных модуляторов андрогенного рецептора. Термин “гидрат” включает, но без ограничений, гемигидрат, моногидрат, дигидрат, тригидрат и тому подобное.
Настоящее изобретение дополнительно включает метаболиты селективных модуляторов андрогенного рецептора. Термин “метаболит” означает любое вещество, полученное из другого вещества посредством метаболизма или метаболического процесса.
Настоящее изобретение дополнительно включает фармацевтические препараты селективных модуляторов андрогенного рецептора. Термин “фармацевтический препарат” означает композицию, пригодную для фармацевтического применения (фармацевтическая композиция), как определено в данном документе.
Настоящее изобретение дополнительно включает пролекарственные формы селективных модуляторов андрогенного рецептора. Термин “пролекарственная форма” означает вещество, которое может преобразовываться in vivo в биологически активное средство посредством таких реакций, как гидролиз, этерификация, деэтерификация, активация, солеобразование и тому подобное.
Настоящее изобретение дополнительно включает кристаллы селективных модуляторов андрогенного рецептора. Кроме того, настоящее изобретение предусматривает полиморфные формы селективных модуляторов андрогенного рецептора. Термин “кристалл” означает вещество в кристаллическом состоянии. Термин “полиморфная форма” относится к определенному кристаллическому состоянию вещества, обладающему определенными физическими свойствами, такими как дифракция рентгеновских лучей, ИК-спектры, температура плавления и тому подобное.
В одном варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего раком молочной железы, включающий этап, на котором субъекту вводят соединение по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего метастатическим раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения метастатического рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего рефрактерным раком молочной железы, включающий этап, на котором субъекту вводят a селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения рефрактерного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего AR-положительным раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения AR-положительного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В одном варианте осуществления AR-положительный рак молочной железы является ER, PR и HER2-положительным. В другом варианте осуществления AR-положительный рак молочной железы является ER, PR и HER2-отрицательным. В одном варианте осуществления AR-положительный рак молочной железы является ER-положительным и PR и HER2-отрицательным. В другом варианте осуществления AR-положительный рак молочной железы является ER и PR-положительным и HER2-отрицательным. В еще одном варианте осуществления AR-положительный рак молочной железы является ER и HER2-положительным и PR-отрицательным. В еще одном варианте осуществления AR-положительный рак молочной железы является ER-отрицательным и PR и HER2-положительным. В дополнительном варианте осуществления AR-положительный рак молочной железы является ER и PR-отрицательным и HER2-положительным. В еще одном дополнительном варианте осуществления AR-положительный рак молочной железы является ER и HER2-отрицательным и PR-положительным. В одном варианте осуществления AR-положительный рак молочной железы является ER-отрицательным. В другом варианте осуществления AR-положительный рак молочной железы является ER-положительным.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего AR-положительным рефрактерным раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения AR-положительного рефрактерного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего AR-положительным метастатическим раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения AR-положительного метастатического рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего ER-положительным раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения ER-положительного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего AR-положительным и ER-положительным раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения AR- положительного метастатического рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего ER-положительным рефрактерным раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения ER-положительного рефрактерного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего ER-положительным метастатическим раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения ER-положительного метастатического рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В одном варианте осуществления ER-положительный рак молочной железы является AR-положительным. В другом варианте осуществления ER-положительный рак молочной железы является AR-отрицательным.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего распространенным раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения распространенного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего AR-положительным и ER-положительным раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения ARположительного и ER-положительного рефрактерного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего AR-положительным и ER-отрицательным раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения AR-положительного и ER-отрицательного метастатического рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего трижды негативным раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения трижды негативного рака молочной железы у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения рака молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным, у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения, профилактики, подавления или ингибирования метастазирования у субъекта, страдающего раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения, профилактики, подавления или ингибирования метастазирования у субъекта В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения и/или профилактики осложнений, связанных со скелетом, у страдающего субъекта, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения и/или профилактики осложнений, связанных со скелетом, у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ повышения полового влечения у субъекта, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для повышения полового влечения у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ улучшения качества жизни субъекта, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для улучшения качества жизни субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения, профилактики, подавления или ингибирования метастазирования у субъекта, страдающего раком молочной железы, включающий этап, на котором субъекту вводят селективный модулятор андрогенного рецептора по формулам I-XIV по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтически приемлемую соль, фармацевтический препарат, гидрат, N-оксид, кристалл, полиморфную форму, пролекарственную форму или любую их комбинацию в количестве, эффективном для лечения, профилактики, подавления или ингибирования метастазирования у субъекта. В одном варианте осуществления субъект является субъектом женского пола. В другом варианте осуществления субъект является субъектом мужского пола.
Заместитель R определен в данном документе как алкил, галогеналкил, дигалогеналкил, тригалогеналкил, CH2F, CHF2, CF3, CF2CF3 арил, фенил, галоген, алкенил или гидроксил (OH).
“Алкильная” группа относится к насыщенным алифатическим углеводородам, включая алкильные группы с прямой цепью, разветвленной цепью и циклические алкильные группы. В одном варианте осуществления алкильная группа содержит 1-12 атомов углерода. В другом варианте осуществления алкильная группа содержит 1-7 атомов углерода. В другом варианте осуществления алкильная группа содержит 1-6 атомов углерода. В другом варианте осуществления алкильная группа содержит 1-4 атомов углерода. Алкильная группа может являться незамещенной или замещенной одной или несколькими группами, которые выбирают из галогена, гидрокси, алкоксикарбонила, амидо, алкиламидо, диалкиламидо, нитро, амино, алкиламино, диалкиламино, карбоксила, тио и тиоалкила.
Группа "галогеналкил" относится к алкильной группе, определенной выше, которая замещена одним или несколькими атомами галогена, например, F, Cl, Br или I.
“Арильная” группа относится к ароматической группе, содержащей, по меньшей мере, одну карбоциклическую ароматическую группу или гетероциклическую ароматическую группу, которая может являться незамещенной или замещена одной или несколькими группами, которые выбирают из галогена, галогеналкила, гидрокси, алкоксикарбонила, амидо, алкиламидо, диалкиламидо, нитро, амино, алкиламино, диалкиламино, карбокси или тио, или тиоалкила. Неограничивающими примерами арильных колец являются фенил, нафтил, пиранил, пирролил, пиразинил, пиримидинил, пиразолил, пиридинил, фуранил, тиофенил, тиазолил, имидазолил, изоксазолил и тому подобное.
“Гидроксильная” группа относится к группе OH. “Алкенильная” группа относится к группе, содержащей, по меньшей мере, одну углерод-углеродную двойную связь. Галогеновая группа относится к F, Cl, Br или I.
“Арилалкильная” группа относится к алкилу, связанному с арилом, где алкил и арил являются такими, как определено выше. Примером аралкильной группы является бензильная группа.
Биологическая активность селективных модуляторов андрогенного рецептора
Селективные модуляторы андрогенного рецептора, предусмотренные в данном документе, являются новым классом соединений, которые подавляют рост AR-положительных форм рака молочной железы. Соединения по настоящему изобретению обладают тканеселективным профилем миоанаболической активности нестероидного лиганда для андрогенного рецептора. Кроме того, соединения по настоящему изобретению не поддаются ароматизации, являются невирилизирующими и обычно не обладают перекрестной реактивностью с ER и PR. В дополнение, в одном варианте осуществления селективные модуляторы андрогенного рецептора (SARM) по настоящему изобретению являются эффективными у пациентов с рефрактерным раком молочной железы, подвергающихся химиотерапии в связи с анаболизмом.
Как предусмотрено в данном документе, соответствующим образом замещенные селективные модуляторы андрогенных рецепторов по настоящему изобретению применимы для: a) лечения субъекта, страдающего раком молочной железы; b) лечения субъекта, страдающего метастатическим раком молочной железы; c) лечения субъекта, страдающего рефрактерным раком молочной железы; d) лечения субъекта, страдающего AR-положительным раком молочной железы; e) лечения субъекта, страдающего AR-положительным рефрактерным раком молочной железы; f) лечения субъекта, страдающего AR-положительным метастатическим раком молочной железы; g) лечения субъекта, страдающего AR-положительным и ER-положительным раком молочной железы; h) лечения субъекта, страдающего AR-положительным раком молочной железы с или без экспрессии ER, PR и/или HER2; i) лечения субъекта, страдающего трижды негативным раком молочной железы; j) лечения субъекта, страдающего распространенным раком молочной железы; k) лечения субъекта, страдающего раком молочной железы, лечение которого с помощью SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептин, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина) и/или фулвестранта оказалось безуспешным; l) лечения субъекта, страдающего ER-положительным раком молочной железы; m) лечения, профилактики, подавления или ингибирования метастазирования у субъекта, страдающего раком молочной железы; n) продления выживания субъекта с раком молочной железы; o) замедления прогрессирования рака молочной железы у субъекта; и/или p) продления выживания субъекта с раком молочной железы без прогрессирования.
В одном варианте осуществления “рефрактерный рак молочной железы” является раком молочной железы, который не ответил на лечение. В другом варианте осуществления “рефрактерный рак молочной железы” является раком молочной железы, устойчивым к лечению. В одном варианте осуществления рефрактерный рак молочной железы является рефрактерным метастатическим раком молочной железы. В одном варианте осуществления рефрактерный рак молочной железы не ответил на лечение с помощью антрациклинов, таксанов, капецитабина, иксабепилона, SERM (тамоксифена, торемифена), ингибитора ароматазы, трастузумаба (герцептина, адо-трастузумаба эмтанзина), пертузумаба (перджеты), лапатиниба, эксеместана (аромазина), бевацизумаба (авастина), фулвестранта или любой их комбинации.
В одном варианте осуществления “трижды негативный рак молочной железы” определяется отсутствием экспрессии рецепторов эстрогена, прогестерона и ErbB2 (также известного как рецептор эпидермального фактора роста человека 2 (HER2)). Данная подгруппа составляет 15% всех типов рака молочной железы. Данный подтип рака молочной железы клинически характеризуется как более агрессивный и менее чувствительный к стандартному лечению и ассоциируется с более плохим общим прогнозом для пациента.
В одном варианте осуществления способы по настоящему изобретению направлены на лечение субъекта, страдающего AR-положительным раком молочной железы, независимо от степени, стадии или предшествующего лечения.
В одном варианте осуществления способы по настоящему изобретению являются первой, второй, третьей или четвертой линией терапии рака молочной железы. Терапия первой линии относится к лекарственной терапии, рекомендованной для первоначального лечения заболевания, признака или симптома. Терапию второй линии применяют, если первоначальное лечение (терапия первой линии) не работает или перестает работать. Терапию третьей линии применяют, если и первоначальное лечение (терапия первой линии), и последующее лечение (терапия второй линии) не работает или перестает работать и т.д.
Как применяется в данном документе, “киназы” являются группой ферментов, которые катализируют перенос фосфатной группы от донора, такого как ADP или ATP, к акцептору. В одном варианте осуществления фосфорилирование приводит к функциональному изменению белка-мишени (субстрата) путем изменения ферментативной активности, клеточной локализации или ассоциации с другими белками киназами. Киназы регулируют большинство клеточных путей, особенно тех, которые участвуют в передаче сигналов. В одном варианте осуществления нерегулируемая киназная активность является частой причиной заболевания, в частности, рака, где киназы регулируют многие аспекты, которые контролируют рост клеток, движение и гибель. В одном варианте осуществления лекарственные средства, которые ингибируют специфические киназы, применяются для лечения связанных с киназами заболеваний, включая рак. В одном варианте осуществления HER2-положительные формы рака молочной железы чувствительны к ингибиторам HER2 киназы (например, трастузумаб и лапатиниб), которые, как правило, применяются при заболевании с метастазами. Однако некоторые формы рака молочной железы являются рефрактерными к лечению ингибиторами HER2 киназы.
Как применяется в данном документе, рецепторы для внеклеточных сигнальных молекул совместно упоминаются как “клеточные сигнальные рецепторы”. Многие клеточные сигнальные рецепторы являются трансмембранными белками на поверхности клетки; когда они связывают внеклеточную сигнальную молекулу (т.е. лиганд), они активируются таким образом, чтобы генерировать каскад внутриклеточных сигналов, которые изменяют поведение клетки. Напротив, в некоторых случаях рецепторы находятся внутри клетки, и для их активации сигнальный лиганд должен проникнуть в клетку; следовательно, данные сигнальные молекулы должны являться достаточно малыми и гидрофобными для диффузии через плазматическую мембрану клетки.
Стероидные гормоны являются одним из примеров малых гидрофобных молекул, которые диффундируют непосредственно через плазматическую мембрану клеток-мишеней и связываются с внутриклеточными рецепторами системы клеточных сигналов. Данные рецепторы являются структурно родственными и составляют суперсемейство внутриклеточных рецепторов (или суперсемейство рецепторов стероидных гормонов). Рецепторы стероидных гормонов включают, но без ограничений, прогестероновые рецепторы, эстрогенные рецепторы, андрогенные рецепторы, глюкокортикоидные рецепторы и минералокортикоидные рецепторы. В одном варианте осуществления настоящее изобретение относится к андрогенным рецепторам. В одном варианте осуществления настоящее изобретение относится к агонистам андрогенных рецепторов. В одном варианте осуществления настоящее изобретение относится к прогестероновым рецепторам. В одном варианте осуществления настоящее изобретение относится к антагонистам прогестероновых рецепторов.
В дополнение к связыванию лигандов с рецепторами рецепторы могут блокироваться для предотвращения связывания лигандов. Когда вещество связывается с рецептором, трехмерная структура вещества помещается в пространство, созданное трехмерной структурой рецептора, в конформации по типу шарового шарнира. Чем лучше шар вмещается в гнездо, тем более плотно он удерживается. Данное явление называется аффинность. Если аффинность вещества больше чем у исходного гормона, оно будет конкурировать с гормоном и связывать сайт связывания более часто. После связывания сигналы могут передаваться через рецептор в клетки, заставляя клетки отвечать определенным образом. Это называется активация. При активации активированный рецептор затем непосредственно регулирует транскрипцию специфических генов. Но вещество и рецептор могут обладать определенными характеристиками, помимо аффинности, для активации клетки. Могут образовываться химические связи между атомами вещества и атомами рецепторов. В некоторых случаях данное приводит к изменению в конформации рецептора, и этого достаточно для начала процесса активации (называемого передачей сигнала).
В одном варианте осуществления соединения по настоящему изобретению ингибируют внутриопухолевую экспрессию генов и путей, которые способствуют развитию рака молочной железы посредством своего воздействия на AR. В одном варианте осуществления соединение по настоящему изобретению ингибирует внутриопухолевую экспрессию Muc1, SLUG, VCAM1, SPARC или MMP2, или любой их комбинаци. В другом варианте осуществления соединение VIII ингибирует экспрессию гена, который способствует раку молочной железы.
В одном варианте осуществления антагонист рецептора является веществом, которое связывает рецепторы и инактивирует их. В одном варианте осуществления селективный модулятор андрогенного рецептора является молекулой, которая демонстрирует in vivo тканевую селективность, активируя сигнальную активность андрогенного рецептора (AR) в анаболических (мышцы, кости и т.д.) тканях в большей степени, чем в андрогенных тканях. Таким образом, в одном варианте осуществления селективные модуляторы андрогенного рецептора по настоящему изобретению пригодны для связывания и активации рецепторов стероидных гормонов. В одном варианте осуществления соединение SARM по настоящему изобретению является агонистом, который связывает андрогенный рецептор. В другом варианте осуществления соединение обладает высокой аффинностью к андрогенному рецептору.
Анализы для определения того, являются ли соединения по настоящему изобретению агонистами или антагонистами AR, хорошо известны специалисту в данной области. Например, AR-агонистическую активность можно определить путем мониторинга способности селективных модуляторов андрогенного рецептора поддерживать и/или стимулировать рост AR-содержащей андрогенной ткани, такой как предстательная железа и семенные пузырьки, при измерении по весу у кастрированных животных. AR-антагонистическую активность можно определить путем мониторинга способности селективных модуляторов андрогенного рецептора ингибировать рост AR-содержащей ткани у интактных животных или противодействовать эффектам тестостерона у кастрированных животных.
Андрогенный рецептор (AR) является андрогенным рецептором любого вида, например, млекопитающего. В одном варианте осуществления андрогенный рецептор является андрогенным рецептором человека. Таким образом, в другом варианте осуществления селективные модуляторы андрогенного рецептора обратимо связываются с андрогенным рецептором человека. В другом варианте осуществления селективные модуляторы андрогенного рецептора обратимо связываются с андрогенным рецептором млекопитающего.
Предусматриваемый в данном документе термин “селективный модулятор андрогенного рецептора” (SARM) относится, в одном варианте осуществления, к молекуле, которая демонстрирует in vivo тканевую селективность, активируя сигнальную активность андрогенного рецептора в анаболических (мышцы, кости и т.д.) тканях в большей степени, чем в андрогенных тканях. В другом варианте осуществления селективный модулятор андрогенного рецептора селективно связывает андрогенный рецептор. В другом варианте осуществления селективный модулятор андрогенного рецептора селективно влияет на передачу сигнала через андрогенный рецептор. В одном варианте осуществления SARM является частичным агонистом. В одном варианте осуществления SARM является тканеселективным агонистом или, в некоторых вариантах осуществления, ткане селективным антагонистом.
В одном варианте осуществления SARM по настоящему изобретению оказывает свое действие на андрогенный рецептор тканезависимым образом. В одном варианте осуществления SARM по настоящему изобретению будет обладать IC50 или EC50 в отношении AR при определении с помощью анализов трансактивации AR, которые известны в данной области, или, в других вариантах осуществления, которые описаны в данном документе.
Термин “IC50” относится, в некоторых вариантах осуществления, к концентрации SARM, которая снижает активность мишени (например, AR) до половины максимального уровня.
Термин “EC50” относится, в некоторых вариантах осуществления, к концентрации SARM, которая оказывает полумаксимальный эффект.
Например, используя анализы трансактивации, на фигуре 5 показано, что соединения по настоящему изобретению демонстрируют AR-агонистическую активность в клетках MDA-MB-231, трансфицированных AR.
Применяемый в данном документе термин “контактирование” означает, что селективные модуляторы андрогенного рецептора по настоящему изобретению вводят в образец, содержащий фермент, в пробирке, колбе, тканевой культуре, чипе, матрице, планшете, микропланшете, капилляре и т.п., и инкубируют при температуре и времени, достаточных для обеспечения связывания селективных модуляторов андрогенного рецептора с рецептором. Способы контактирования образцов с селективными модуляторами андрогенного рецептора или другими специфическими связывающими компонентами известны специалистам в данной области, и могут выбираться в зависимости от типа протокола проводимого анализа. Способы нкубирования также являются стандартными и известны специалистам в данной области.
В другом варианте осуществления термин “контактирование” означает, что селективные модуляторы андрогенного рецептора по настоящему изобретению вводят субъекту, получающему лечение, и обеспечивают возможность селективному модулятору андрогенного рецептора вступить в контакт с андрогенным рецептором in vivo.
Применяемый в данном документе термин “лечение” включает профилактическое, а также купирующее нарушения лечение. Применяемые в данном документе термины “снижение”, “подавление” и “ингибирование” обладают своими обычно понимаемыми значениями уменьшения или снижения. Применяемый в данном документе термин “прогрессирование” означает увеличение в объеме или тяжести, распространение, рост или ухудшение. Применяемый в данном документе термин “рецидив” означает возвращение заболевания после ремиссии. Применяемый в данном документе термин “задержка” означает прекращение, затруднение, замедление, отсрочку, остановку или препятствование. Применяемый в данном документе термин “метастазирование” относится к перемещению заболевания от одного органа или его части к другому, непосредственно не связанному с ним. Метастазирование может происходить, например, в результате перемещения злокачественных клеток из одного органа (например, молочной железы) в другие органы.
В одном варианте осуществления “лечение” относится к снижению опухолевого роста на 75%, как показано в примере 8. В другом варианте осуществления лечение относится к снижению опухолевого роста, по меньшей мере, на 75%. В другом варианте осуществления лечение относится к снижению опухолевого роста, по меньшей мере, на 50%. В другом варианте осуществления лечение относится к снижению опухолевого роста, по меньшей мере, на 25%. В другом варианте осуществления лечение относится к снижению опухолевого роста на 50-100%. В другом варианте осуществления лечение относится к снижению опухолевого роста на 70-80%. В другом варианте осуществления лечение относится к снижению опухолевого роста на 25-125%.
В другом варианте осуществления “лечение” относится к снижению веса опухоли на 50%, как показано в примере 8. В другом варианте осуществления лечение относится к снижению веса опухоли, по меньшей мере, на 50%. В другом варианте осуществления лечение относится к снижению веса опухоли, по меньшей мере, на 40%. В другом варианте осуществления лечение относится к снижению веса опухоли, по меньшей мере, на 30%. В другом варианте осуществления лечение относится к снижению веса опухоли, по меньшей мере, на 20%. В другом варианте осуществления лечение относится к снижению опухолевого роста на 25-75%. В другом варианте осуществления лечение относится к снижению опухолевого роста на 25-100%.
Применяемый в данном документе термин “введение” относится к обеспечению контакта субъекта с соединением по настоящему изобретению. Как применяется в данном документе, введение может осуществляться in vitro, т.е. в пробирке, или in vivo, т.е. в клетках или тканях живых организмов, например, человека. В одном варианте осуществления настоящее изобретение охватывает введение соединений по настоящему изобретению субъекту.
В одном варианте осуществления соединение по настоящему изобретению вводят субъекту один раз в неделю. В другом варианте осуществления соединение по настоящему изобретению вводят субъекту два раза в неделю. В другом варианте осуществления соединение по настоящему изобретению вводят субъекту три раза в неделю. В другом варианте осуществления соединение по настоящему изобретению вводят субъекту четыре раза в неделю. В другом варианте осуществления соединение по настоящему изобретению вводят субъекту пять раз в неделю. В другом варианте осуществления соединение по настоящему изобретению вводят субъекту ежедневно. В другом варианте осуществления соединение по настоящему изобретению вводят субъекту еженедельно. В другом варианте осуществления соединение по настоящему изобретению вводят субъекту каждые две недели. В другом варианте осуществления соединение по настоящему изобретению вводят субъекту ежемесячно.
В одном варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора в виде единственного активного ингредиента. Однако в объем настоящего изобретения также включены способы гормональной терапии для лечения рака молочной железы, для задержки прогрессирования рака молочной железы и для профилактики и лечения рецидивов рака молочной железы и/или метастазирования рака молочной железы, при которых селективные модуляторы андрогенного рецептора вводят в комбинации с одним или несколькими терапевтическими средствами. Данные средства включают, но без ограничений: селективные модуляторы эстрогенных рецепторов (SERM), селективные деструкторы эстрогенных рецепторов (фулвестрант), ингибиторы HER2 (лапатиниб, трастузумаб), бевацизумаб, химиотерапевтические средства, таксаны, антрациклины, эпотилоны, аналоги LHRH, обратимые антиандрогены, антиэстрогены, противоопухолевые лекарственные средства, ингибиторы 5-альфа-редуктазы, ингибиторы ароматазы (эксеместан, анастрозол, летрозол, ворозол, форместан, фадрозол), прогестины, средства, действующие посредством других ядерных гормональных рецепторов, таких как прогестероновые и эстрогенные рецепторы, эстрогены, прогестины, ингибиторы PDE5, апоморфин, бисфосфонат, ингибиторы фактора роста (такие, как те, которые ингибируют VEGF, IGF и т.п.) или один или несколько дополнительных селективных модуляторов андрогенного рецептора (SARM).
Дополнительные терапевтические средства, которые можно вводить в комбинации с соединением селективного модулятора андрогенного рецептора по настоящему изобретению, включают, но без ограничений: абитрексат (R)(метотрексат), абраксан (стабилизированный альбумином состав наночастиц паклитаксела), адо-трастузумаб эмтанзин, адриамицин PFS (доксорубицина гидрохлорид), адриамицин RDF (доксорубицина гидрохлорид), адруцил (фторурацил), афинитор (эверолимус), анастрозол, аримидекс (анастрозол), аромазин (эксеместан), капецитабин, клафен (циклофосфамид), циклофосфамид, цитоксан (циклофосфамид), доцетаксел, доксорубицина гидрохлорид, эфудекс (фторурацил), элленс (эпирубицина гидрохлорид), эпирубицина гидрохлорид, эверолимус, эксеместан, фарестон (торемифен), фазлодекс (фулвестрант), фемара (летрозол), флуороплекс (фторурацил), фторурацил, фолекс (метотрексат), фолекс PFS (метотрексат), фулвестрант, гемцитабина гидрохлорид, гемзар (гемцитабина гидрохлорид), герцептин (трастузумаб), иксабепилон, икземпра (иксабепилон), лапатиниба дитозилат, летрозол, метотрексат, метотрексат LPF (метотрексат), мексат (метотрексат), мексат–AQ (метотрексат), неозар (циклофосфамид), нолвадекс (тамоксифена цитрат), паклитаксел, стабилизированная альбумином нанокомпозиция паклитаксела, перджета (пертузумаб), пертузумаб, ямоксифена цитрат, таксол (паклитаксел), таксотер (доцетаксел), трастузумаб, торемифен, тикерб (лапатиниба дитозилат), кселода (капецитабин).
Таким образом, в одном варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора в комбинации с селективным модулятором эстрогенного рецептора. Таким образом, в одном варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора в комбинации с селективным деструктором эстрогенного рецептора (фулвестрант). Таким образом, в одном варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора в комбинации с ингибитором HER2 (лапатиниб, трастузумаб). Таким образом, в одном варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора в комбинации с ингибитором VEGF-A (бевацизумаб). Таким образом, в одном варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора в комбинации с химиотерапевтическим средством. В одном варианте осуществления химиотерапевтическим средством является таксан. В другом варианте осуществления химиотерапевтическим средством является антрациклин. В одном варианте осуществления химиотерапевтическим средством является эпотилон (иксабепилон). Таким образом, в одном варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора в комбинации с аналогом LHRH. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора в комбинации с обратимым антиандрогеном. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора в комбинации с антиэстрогеном. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора в комбинации с противоопухолевым лекарственным средством. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора в комбинации с ингибитором 5-альфа-редуктазы. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора в комбинации с ингибитором ароматазы. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с прогестином. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации со средством, действующим посредством других ядерных гормональных рецепторов. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с селективными модуляторами эстрогенных рецепторов (SERM). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с прогестином или антипрогестином. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора в комбинации с эстрогеном. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с ингибитором PDE5. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с апоморфином. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с бисфосфонатом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с ингибитором фактора роста. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с одним или несколькими дополнительными селективными модуляторами андрогенного рецептора (SARM).
В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с абитрексатом (метотрексат). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с абраксаном (стабилизированная альбумином нанокомпозиция паклитаксела). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с адо-трастузумабом эмтанзином. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с адриамицином PFS (доксорубицина гидрохлорид). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с адриамицин RDF (доксорубицина гидрохлорид). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с адруцилом (фторурацил). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с афинитором (эверолимус). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с анастрозолом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с аримидексом (анастрозол). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с аромазином (эксеместан). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с капецитабином. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с клафеном (циклофосфамид). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с циклофосфамидом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с цитоксаном (циклофосфамид). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с доцетакселом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с доксорубицина гидрохлоридом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с эфудексом (фторурацил). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с элленсом (эпирубицина гидрохлорид). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с эпирубицина гидрохлоридом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с эверолимусом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с эксеместаном. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с фарестоном (торемифен). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с фазлодексом (фулвестрант). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с фемарой (летрозол). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с флуороплексом (фторурацил). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с фторурацилом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с фолексом (метотрексат). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с фолексом PFS (метотрексат). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с фулвестрантом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с гемцитабина гидрохлоридом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с гемзаром (гемцитабина гидрохлорид). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с герцептином (трастузумаб). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с иксабепилоном. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с икземпрой (иксабепилон). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с лапатиниба дитозилатом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с летрозолом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с метотрексатом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с метотрексатом LPF (метотрексат). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с мексатом (метотрексат). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с мексатом-AQ (метотрексат). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с неозаром (циклофосфамид). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с нолвадексом (тамоксифена цитрат). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с паклитакселом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации со стабилизированной альбумином нанокомпозицией паклитаксела. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с перджетой (пертузумаб). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с пертузумабом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с тамоксифена цитратом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с таксолом (паклитаксел). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с таксотером (доцетаксел). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с трастузумабом. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с оремифеном. В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с тикербом (лапатиниба дитозилат). В другом варианте осуществления способы по настоящему изобретению включают введение селективного модулятора андрогенного рецептора по данному изобретению в комбинации с кселодой (капецитабин).
В одном варианте осуществления способы по настоящему изобретению включают введение фармацевтической композиции (или фармацевтического препарата, применяемого в данном документе взаимозаменяемо), содержащей селективный модулятор андрогенного рецептора по настоящему изобретению и/или его аналог, производное, изомер, метаболит, фармацевтический препарат, гидрат, N-оксид, полиморфную форму, кристалл, пролекарственную форму или любую их комбинацию; и пригодный носитель или разбавитель.
Фармацевтические композиции
Применяемый в данном документе термин “фармацевтическая композиция” означает терапевтически эффективные количества селективного модулятора андрогенного рецептора вместе с пригодными разбавителями, консервантами, солюбилизаторами, эмульгаторами, вспомогательными средствами и/или носителями. Термин “терапевтически эффективное количество”, применяемый в данном документе, относится к такому количеству, которое обеспечивает терапевтический эффект при определенном состоянии и режиме введения. Такие композиции являются жидкостями или лиофилизированными или иным образом высушенными составами и включают разбавители с различным содержанием буферов (например, трис-HCL, ацетатный, фосфатный), pH и ионной силой, добавки, такие как альбумин или желатин, для предотвращения поглощения поверхностями, детергенты (например, твин 20, твин 80, Pluronic F68, соли желчных кислот), солюбилизирующие средства (например, глицерин, полиэтиленглицерин), антиоксиданты (например, аскорбиновая кислота, метабисульфит натрия), консерванты (например, тимеросал, бензиловый спирт, парабены), объемообразующие вещества или модификаторы тоничности (например, лактоза, маннит), ковалентное присоединение полимеров, таких как полиэтиленгликоль, к белку, комплексообразование с ионами металлов или внесение материала в или на дисперсные препараты полимерных соединений, таких как полимолочная кислота, полигликолевая кислота, гидрогели и т.д., или на липосомы, микроэмульсии, мицеллы, однослойные или многослойные везикулы, "тени" эритроцитов или сферопласты). Такие композиции будут влиять на физическое состояние, растворимость, стабильность, скорость высвобождения in vivo и уровень клиренса in vivo. Композиции с контролируемым или замедленным высвобождением включают состав в липофильных депо (например, жирных кислотах, восках, маслах).
Также настоящее изобретение охватывает дисперсные композиции, покрытые полимерами (например, полоксамерами или полоксаминами). Другие варианты осуществления композиций по настоящему изобретению включают защитные покрытия, дисперсные формы, ингибиторы протеаз или усилители проникновения для различных путей введения, включая парентеральный, легочный, назальный и оральный. В одном варианте осуществления фармацевтическую композицию вводят парентерально, рядом с опухолью, трансмукозально, трансдермально, внутримышечно, внутривенно, внутрикожно, подкожно, внутрибрюшинно, интравентрикулярно, интравагинально, интракраниально и внутрь опухоли.
Дополнительно, применяемые в данном документе “фармацевтически приемлемые носители” хорошо известны специалистам в данной области и включают, но без ограничений, 0,01-0,1 M и предпочтительно 0,05 M фосфатного буфера или приблизительно 0,8% солевой раствор. Дополнительно такие фармацевтически приемлемые носители могут являться водными или неводными растворами, суспензиями и эмульсиями. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат. Водные носители включают воду, растворы спирт/вода, эмульсии или суспензии, включая солевой раствор и буферные среды.
Носители для парентерального введения включают раствор хлорида натрия, раствор Рингера с декстрозой, декстрозу и хлорид натрия, раствор Рингера с лактатом и нелетучие масла. Носители для внутривенного введения включают жидкость и добавки питательных веществ, добавки электролитов, такие как добавки на основе раствора Рингера с декстрозой, и тому подобное. Могут также присутствовать консерванты и другие добавки, такие как, например, антимикробные средства, антиоксиданты, хелатирующие средства, инертные газы и тому подобное.
Композиции с контролируемым или замедленным высвобождением включают состав в липофильных депо (например, жирных кислотах, восках, маслах). Также настоящее изобретение охватывает дисперсные композиции, покрытые полимерами (например, полоксамерами или полоксаминами), и соединение, связанное с антителами, направленными против тканеспецифических рецепторов, лигандов или антигенов, или связанное с лигандами тканеспецифических рецепторов.
Другие варианты осуществления композиций по настоящему изобретению включают дисперсные формы, защитные покрытия, ингибиторы протеаз или усилители проникновения для различных путей введения, включая парентеральный, легочный, назальный и оральный.
Как известно, соединения, модифицированные путем ковалентного присоединения водорастворимых полимеров, таких как полиэтиленгликоль, сополимеры полиэтиленгликоля и полипропиленгликоля, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон или полипролин, демонстрируют значительно более продолжительный период полувыведения из крови после внутривенной инъекции, чем соответствующие немодифицированные соединения (Abuchowski et al., 1981; Newmark et al., 1982; и Katre et al., 1987). Такие модификации также могут повышать растворимость соединения в водных растворах, устранять агрегацию, повышать физическую и химическую стабильность соединение и значительно уменьшить иммуногенность и реакционную способность соединения. В результате, требуемую биологическую активность in vivo можно достичь путем введения таких аддуктов полимер-соединение менее часто или в меньших дозах, чем немодифицированное соединение.
В еще одном варианте осуществления фармацевтическая композиция может доставляться в системе с контролируемым высвобождением. Например, средство можно вводить, применяя внутривенную инфузию, имплантируемый осмотический насос, трансдермальный пластырь, липосомы или другие способы введения. В одном варианте осуществления можно применять насос (смотри Langer, supra; Sefton, CRC Crit. Ref. Biomed. Eng. 14:201 (1987); Buchwald et al., Surgery 88:507 (1980); Saudek et al., N. Engl. J. Med. 321:574 (1989). В другом варианте осуществления можно применять полимерные материалы. В еще одном варианте осуществления систему с контролируемым высвобождением можно помещать в непосредственной близости от терапевтической мишени, т.е. мозга, таким образом, требуется только часть системной дозы (смотри, например, Goodson, in Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138 (1984). Другие системы с контролируемым высвобождением обсуждаются в обзоре Langer (Science 249:1527-1533 (1990).
Фармацевтический препарат может содержать селективный модулятор андрогенного рецептора отдельно, или может дополнительно включать фармацевтически приемлемый носитель, и может находиться в твердой или жидкой форме, такой как таблетки, порошки, капсулы, пеллеты, растворы, суспензии, эликсиры, эмульсии, гели, кремы или суппозитории, включая ректальные и уретральные суппозитории. Фармацевтически приемлемые носители включают камеди, крахмалы, сахара, целлюлозные материалы, и их смеси. Фармацевтический препарат, содержащий селективный модулятор андрогенного рецептора, можно вводить субъекту, например, путем подкожной имплантации пеллета; в дополнительном варианте осуществления пеллет обеспечивает контролируемое высвобождение селективного модулятора андрогенного рецептора в течение периода времени. Препарат также можно вводить путем внутривенной, внутриартериальной или внутримышечной инъекции жидкого препарата, перорального введения жидкого или твердого препарата путем местного нанесения. Введение также можно осуществлять путем применения ректального суппозитория или уретрального суппозитория.
Фармацевтические препараты по настоящему изобретению можно получать с помощью известных способов растворения, смешивания, гранулирования или формирования таблеток. Для перорального введения селективные модуляторы андрогенного рецептора или их физиологически переносимые производные, такие как соли, сложные эфиры, N-оксиды и тому подобное, смешивают с добавками, обычными для данной цели, такими как носители, стабилизаторы или инертные разбавители, и преобразуют обычными способами в пригодные формы для введения, такие как таблетки, покрытые оболочкой таблетки, твердые или мягкие желатиновые капсулы, водные, спиртовые или масляные растворы. Примерами пригодных инертных носителей являются обычные основы таблеток, такие как лактоза, сахароза или кукурузный крахмал, в комбинации со связывающими веществами, такими как аравийская камедь, кукурузный крахмал, желатин, с дезинтегрирующими средствами, такими как кукурузный крахмал, картофельный крахмал, альгиновая кислота, или со скользящим веществом, таким как стеариновая кислота или стеарат магния.
Примерами пригодных масляных носителей или растворителей являются растительные масла или животные жиры, такие как подсолнечное масло или жир печени рыб. Препараты можно получать как в виде сухих, так и влажных гранул. Для парентерального введения (подкожная, внутривенная, внутриартериальная или внутримышечная инъекция) селективные модуляторы андрогенного рецептора или их физиологически переносимые производные, такие как соли, сложные эфиры, N-оксиды и тому подобное, преобразуют в раствор, суспензию или эмульсию, по желанию с веществами обычными и пригодными для данной цели, например, солюбилизаторами или другими вспомогательными средствами. Примерами являются стерильные жидкости, такие как вода и масла, с или без добавления поверхностно-активного вещества и других фармацевтически приемлемых вспомогательных веществ. Иллюстративными маслами являются масла, полученные из нефти, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло или минеральное масло. В целом, вода, солевой раствор, водный раствор декстрозы и подобные сахарные растворы, и гликоли, такие как пропиленгликоль или полиэтиленгликоль, являются предпочтительными жидкими носителями, в частности, для инъекционных растворов.
Получение фармацевтических композиций, которые содержат активный компонент, хорошо известно в данной области. Такие композиции можно получать в виде аэрозолей активного компонента, доставляемого в носоглотку, или в виде инъекционных форм, в виде жидких растворов или суспензий; однако также можно получать твердые формы, пригодные для растворения или суспендирования в жидкости перед инъекцией. Препарат также можно эмульгировать. Активный терапевтический ингредиент часто смешивают со вспомогательными веществами, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом. Пригодными вспомогательными веществами являются, например, вода, солевой раствор, декстроза, глицерин, этанол и тому подобное, или любая их комбинация.
В дополнение, композиция может содержать незначительные количества вспомогательных веществ, таких как увлажняющие или эмульгирующие средства, рН буферные средства, которые усиливают эффективность активного ингредиента.
Активный компонент можно включать в композицию в форме нейтрализованных фармацевтически приемлемых солей. Фармацевтически приемлемые соли включают соли присоединения кислоты (образованные со свободными аминогруппами полипептида или молекулы антитела), которые образованы с неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или такими органическими кислотами, как уксусная, щавелевая, винная, миндальная и тому подобное. Соли, образованные из свободных карбоксильных групп, также можно получить из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа, и таких органических оснований, как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и тому подобное.
Для местного нанесения на поверхности тела с применением, например, кремов, гелей, капель и тому подобного, селективные модуляторы андрогенного рецептора или их физиологически переносимые производные, такие как соли, сложные эфиры, N-оксиды и тому подобное, получают и наносят в виде растворов, суспензий или эмульсий в физиологически приемлемом разбавителе с или без фармацевтического носителя.
В другом варианте осуществления активное соединение можно доставлять в везикуле, в частности, липосоме (смотри Langer, Science 249:1527-1533 (1990); Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez- Berestein and Fidler (eds.), Liss, New York, pp. 353-365 (1989); Lopez-Berestein, там же., pp. 317-327; в целом смотри там же).
Для применения в медицине соли селективного модулятора андрогенного рецептора являются фармацевтически приемлемыми солями. Другие соли могут, однако, являться пригодными в получении соединений по настоящему изобретению или их фармацевтически приемлемых солей. Пригодные фармацевтически приемлемые соли соединений по настоящему изобретению включают соли присоединения кислоты, которые можно получить, например, путем смешивания раствора соединения по настоящему изобретению с раствором фармацевтически приемлемой кислоты, такой как соляная кислота, серная кислота, метансульфокислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная: кислота, щавелевая кислота, лимонная кислота, винная кислота, угольная кислота или фосфорная кислота.
В одном варианте осуществления термин “приблизительно” относится к отклонению от 0,0001 до 5% от указанного числа или диапазона чисел. В одном варианте осуществления термин “приблизительно” относится к отклонению от 1 до 10% от указанного числа или диапазона чисел. В одном варианте осуществления термин “приблизительно” относится к отклонению до 25% от указанного числа или диапазона чисел.
В некоторых вариантах осуществления терми “содержать” или его грамматические формы относится к включению указанного действующего вещества, такого как соединение по настоящему изобретению, а также включению других действующих веществ и фармацевтически приемлемых носителей, вспомогательных веществ, мягчительных средств, стабилизаторов и т.д., которые известны в фармацевтической промышленности. В некоторых вариантах осуществления термин “по существу состоящий из” относится к композиции, единственным активным ингредиентом которой является указанный активный ингредиент, однако, могут включаться другие соединения, которые предназначены для стабилизации, консервирования и т.д. состава, но не связаны непосредственно с терапевтическим эффектом указанного активного ингредиента. В некоторых вариантах осуществления термин “по существу состоящий из” может относиться к компонентам, которые оказывают терапевтический эффект посредством механизма, отличного от механизма указанного активного ингредиента. В некоторых вариантах осуществления термин “по существу состоящий из” может относиться к компонентам, которые оказывают терапевтический эффект и принадлежат к классу соединений, отличному от класса указанного активного ингредиента. В некоторых вариантах осуществления термин “по существу состоящий из” может относиться к компонентам, которые оказывают терапевтический эффект и принадлежат к классу соединений, отличному от класса указанного активного ингредиента, действуя посредством другого механизма действия, например, и представляя вариант осуществления настоящего изобретения, полипептиды, содержащие Т-клеточные эпитопы, присутствующие в композиции, могут находиться в специфической комбинации с полипептидами, содержащими B-клеточные эпитопы. В некоторых вариантах осуществления термин “по существу состоящий из” может относиться к компонентам, которые способствуют высвобождению активного ингредиента. В некоторых вариантах осуществления термин “включающий” относится к композиции, которая содержит активный ингредиент и фармацевтически приемлемый носитель или вспомогательное вещество.
Дополнительно, применяемый в данном документе термин “содержащий” означает, что система включает перечисленные элементы, но не исключая другие, которые могут являться необязательными. Под фразой “по существу состоящий из” подразумевается способ, который включает перечисленные элементы, но исключает другие элементы, которые могут оказывать основное значительное влияние на эффективность способа. Термин “состоящий из”, таким образом, должен означать исключение наименьших признаков других элементов. Варианты осуществления, определенные каждым из данных переходных терминов, входят в объем настоящего изобретения.
В одном варианте осуществления настоящее изобретение предусматривает комбинированные препараты. В одном варианте осуществления термин “комбинированный препарат” определяет в частности “набор частей” в том смысле, что компоненты комбинации, определенные выше, можно дозировать независимо или с применением различных фиксированных комбинаций с различными количествами компонентов комбинации, т.е. одновременно, параллельно, отдельно или последовательно. В некоторых вариантах осуществления части набора частей затем можно, например, вводить одновременно или чередуя в хронологическом порядке, то есть в различные моменты времени и с равными или разными временными интервалами для любой части набора частей. В комбинированном препарате можно вводить, в некоторых вариантах осуществления, соотношение общих количеств компонентов комбинации. В одном варианте осуществления комбинированный препарат можно изменять, например, в целях удовлетворения потребностей субпопуляции пациентов, подлежащих лечению, или потребностей отдельного пациента, причем отличные потребности могут быть связаны с конкретным заболеванием, тяжестью заболевания, возрастом, полом или массой тела, что легко осуществимо специалистом в данной области.
В одном варианте осуществления форма единственного числа или “один” означает по меньшей мере один. В одном варианте фраза “два или более” может означать любое наименование числа, которое будет отвечать определенной цели. В одном варианте осуществления “приблизительно” может включать отклонение от указанного значения +1% или в некоторых вариантах осуществления -1%, или в некоторых вариантах осуществления ±2,5%, или в некоторых вариантах осуществления ±5%, или в некоторых вариантах осуществления ±7,5%, или в некоторых вариантах осуществления ±10%, или в некоторых вариантах осуществления ±15%, или в некоторых вариантах осуществления ±20%, или в некоторых вариантах осуществления ±25%.
Следующие примеры представлены для более полной иллюстрации предпочтительных вариантов осуществления настоящего изобретения. Однако их никоим образом не следует рассматривать как ограничивающие широкий объем настоящего изобретения.
Раздел подробностей экспериментов
Общие экспериментальные способы
Условия роста клеток
HCC 1937, HCC 1954, HCC 38, T47D-Kbluc, MDA-MB-453, и MDA-MB231 выращивали в среде RPMI-1640, содержащей 2 мМ L-глутамина с добавлением 10% фетальной бычьей сыворотки (FBS). Клетки поддерживали в увлажненной атмосфере с 5% C02/95% воздуха при 37°C.
Анализ с сульфородамином-В (SRB)
SRB анализ применяли для определения количества клеток в ходе экспериментов по определению цитотоксичности. Применяли следующий протокол:
1. Клетки отделяли с помощью 0,25% трипсина.
2. Экспериментальные культуры культивировали в 96-луночных планшетах для микротитрования (200 мкл среды для роста на лунку; 1000-200000 клеток на лунку).
3. Культуры фиксировали с помощью 50 мкл 50% TCA (4 °C). (подробнее смотри в протоколе фиксации клеток).
4. Фиксированные клетки окрашивали с помощью 50 мкл 0,4% (в отношении веса к объему) SRB в 1% уксусной кислоте в течение 10 минут.
5. SRB удаляли и культуры быстро* промывали 5 раз с помощью 1% уксусной кислоты для удаления несвязанного красителя.**
6. Культуры высушивали на воздухе в течение ночи до исчезновения заметной влаги.
7. Клеточный связанный с белком SRB растворяли в 200 мкл безбуферного трис- основания (10 мМ, pH 10,5) в течение 30 минут на шейкере с качающейся платформой.
8. Оптическую плотность считывали при 540 нм.
* быстрое выполнение процесса промывания осуществляли для предотвращения десорбции связанного с белком SRB
** полностью удаляется остаточный промывочный раствор путем резкого стряхивания планшетов над раковиной.
Фиксация клеток, прикрепленных к пластиковому субстрату
Для фиксации клеток применяли следующий протокол:
- 50 мкл 50% TCA (4 °C) осторожно наслаивали на верхнюю часть среды для роста в каждой лунке для получения конечной концентрации TCA 10%.
- Культуры инкубировали при 4°С в течение 1 часа.
- Культуры промывали 5 раз водопроводной водой для удаления TCA, среды для роста, низкомолекулярных метаболитов и сывороточного белка.
- Планшеты высушивали на воздухе в течение ночи до исчезновения заметной влаги.
Пример 1
Влияние формулы ix на рост в различных клеточных линиях рака молочной железы, экспрессирующих андрогенный рецептор
Материалы и способы
Клетки MDA-MB-231 и HCC-38 трижды негативного рака молочной железы применяли для анализа влияния различных соединений на рост.
Клетки MDA-MB-231 и HCC-38 трижды негативного рака молочной железы инфицировали с использованием 200 мкл или 500 мкл аденовируса, содержащего LacZ (отрицательный контроль) или AR, и обрабатывали различными лигандами AR (агонисты: DHT и формула IX, и антагонист: бикалутамид) или не связывающим AR веществом, которое структурно подобно формуле IX, R-энантиомером формулы IX. Клетки обрабатывали очищенной на активированном угле FBS (фигуры 1C, 1E,1G и 1I; 2C, 2E и 2G) или цельной сывороткой (фигуры 1D, 1F, 1H и 1J; 2D, 2F и 2H) в течение 3 дней, фиксировали и окрашивали с помощью сульфородамина синего (SRB) для измерения жизнеспособности клеток. Рассчитывали значения IC50.
Результаты
Экспрессию AR в клетках, инфицированных AR или LacZ, оценивали с помощью вестерн-блоттинга (фигура 1A и фигура 2A).
Только агонисты AR, DHT и формула IX, ингибировали рост клеток MDA-MB-231 и HCC-38 трижды негативного рака молочной железы (фигуры 1C, 1D, 1E, 1F и фигура 2C, 2D, 2E и 2F). Такое ингибирование наблюдали только в присутствии AR (сравните w/lacZ и w/AR). Значения IC50 в AR-положительных клетках для DHT и формулы IX представлены на фигуре 1B и фигуре 2B.
Пример 2
Обращение эффекта формулы ix на рост
Материалы и способы
Для определения того, является ли ингибирование роста, наблюдаемое с DHT и формулой IX в AR-положительных клетках, AR-зависимым, клетки MDA-MB-231 инфицировали аденовирусом, содержащим LacZ (отрицательный контроль) или AR, и обрабатывали агонистами AR, DHT или формулой IX, в присутствии или в отсутствие антагонста AR, бикалутамида. Клетки обрабатывали очищенной на активированном угле FBS (фигуры 3A и 3C) или цельной сывороткой (фигура 3B и 3D) в течение 3 дней, фиксировали и окрашивали с помощью сульфородамина синего (SRB) для измерения жизнеспособности клеток. Рассчитывали значения IC50.
Результаты
Как DHT, так и формула IX требовали AR для ингибирования роста клеток MDA-MB-231, о чем свидетельствует ослабление эффектов ингибирования роста в присутствии бикалутамида (фигура 3A, 3B, 3C, 3D). Значения IC50 для DHT и формулы IX в AR-положительных клетках, предварительно обработанных с использованием или без безбикалутамида, представлены на фигуре 3E.
Пример 3
Влияние лигандов ar на рост клеток рака молочной железы
Материалы и способы
Для определения того, все ли лиганды AR ингибируют рост клеток трижды негативного рака молочной железы, клетки MDA-MB-231 инфицировали аденовирусом, содержащим LacZ или AR, и обрабатывали различными лигандами AR (агонисты: DHT, формула VIII, формула IX, формула X, формула XIII, формула XIV; антагонист: бикалутамид) и не связывающим AR веществом: R-энантиомером формулы IX. Клетки обрабатывали очищенной на активированном угле FBS (фигуры 4A, 4C, 4E, 4G, 4I , 4K, 4M и 4O) или цельной сывороткой (4B, 4D, 4F, 4H, 4J, 4L, 4N и 4P) в течение 3 дней, фиксировали и окрашивали с помощью сульфородамина синего (SRB) для измерения жизнеспособности клеток. Антипролиферативные значения IC50 рассчитывали для клеток рака молочной железы и сравнивали со значениями трансактивации, т.е. значениями EC50 (агонисты) и IC50 (антагонисты), полученными в клетках HEK-293. Свойства, регулирующие рост в клетках рака молочной железы, данных молекул в клетках рака молочной железы сопоставимы со значениями трансактивации, полученными в клетках HEK-293.
Результаты
Только агонисты AR ингибировали рост клеток MDA-MB-231 (фигура 4A-4B, 4E-4H и 4K-4P), и потенциал ингибирования роста у данных лигандов стоит в одном ряду с их агонистической активностью, наблюдаемой в клетках HEK-293 (фигура 4Q).
В примере 14 продемонстрировано также, что агонисты AR ингибировали пролиферацию клеток MDA-MB-231, стабильно трансфицированных AR.
Пример 4
Анализы трансактивации ar в клетках рака молочной железы
Материалы и способы
С целью убедиться в том, что лиганды, которые выявляли ингибирующие рост свойства, являются агонистами в клетках MDA-MB-231, в клетках MDA-MB-231 проводили анализы трансактивации AR. Хотя анализ трансактивации AR проводили в клетках HEK-293, способность лигандов функционировать в качестве агонистов или антагонистов зависит от клеточного микроокружения. Таким образом, клетки MDA-MB-231 трансфицировали с использованием липофектамина с AR, GRE-LUC и CMV-LUC в качестве нормировочного контроля. Клетки обрабатывали через 24 ч после трансфекции, и проводили люциферазный анализ через 48 ч после трансфекции.
Результаты
На фигуре 5 показано, что все лиганды AR, которые проявили анти-пролиферативную активность, являются агонистами в клетках MDA-MB-231, трансфицированных AR, и их агонистические и ингибирующие рост стоят наравне. Другими словами, ингибирующие рост лиганды являются агонистами AR в клетках MDA-MB-231, трансфицированных AR.
Пример 5
Анализ ингибирующих рост эффектов в клетках рака молочной железы, экспрессирующих эстрогенный рецептор
Материалы и способы
С целью убедиться в том, что ингибирующие рост эффекты в клетках MDA-MB-231 являются селективными в отношении AR, и определить, являются ли лиганд-зависимые ингибирующие рост эффекты исключительными для AR, а также целью убедиться в том, что данные эффекты не являются артефактами аденовирусной инфекции, клетки MDA-MB231 трижды негативного рака молочной железы инфицировали аденовирусными конструктами ER-α или ER-β и обрабатывали агонистом ER: эстрадиолом (E2) или антагонистом ER: ICI 182780 (ICI) в очищенной на активированном угле сыворотке (фигура 6C) или цельной сыворотке (фигуры 6D и 6E) в течение 3 дней. Клетки фиксировали и окрашивали сульфородамином синим (SRB) для измерения жизнеспособности клеток. Экспрессию ER в инфицированных клетках оценивали с помощью вестерн-блоттинга.
Результаты
На фигурах 6A-6B показано наличие или отсутствие ER-α или ER-β в клетках MDA-MB-231 после трансфекции.
На фигурах 6C-6E показано, что сверхэкспрессия ER-α или ER-β в клетках MDA-MB-231 не вызывала ингибирования роста как в присутствии агонистов ER, так и антагонистов. Таким образом, наблюдаемые ингибирующие рост эффекты в клетках MDA-MB-231 являются селективными в отношении присутствия AR и агонистов AR.
Пример 6
Влияние агониста ar на морфологию клеток рака молочной железы
Материалы и способы
Клетки MDA-MB-231 стабильно трансфицировали AR, применяя лентивирус. После трансфекции клетки обрабатывали в течение 3 дней с использованием указанных концентраций DHT или бикалутамида. Живые клетки визуализировали с помощью светового микроскопа и фотографировали. Изображения клеток получили при том же увеличении и при тех же условиях микроскопирования.
Результаты
На фигуре 7 показано, что DHT изменял морфологию клеток MDA-MB-231 в сторону более зависимых от культуральной подложки и дифференцированных клеток, указывая, что связанные с агонистом AR-экспрессирующие клетки рака молочной железы будут в меньшей степени обладать инвазивными и миграционными свойствами (например, метастазировать с меньшей вероятностью).
DHT и SARM изменяют морфологию AR-положительных клеток MDA-MB-231. Клетки MDA-MB-231 стабильно трансфицировали AR, применяя лентивирус, и обрабатывали и носителем или агонистами AR в указанных концентрациях. В конце 3 дней инкубации клетки визуализировали под микроскопом (40X).
DHT и SARM, но не антагонист AR, бикалутамид (данные не показаны), или неактивный изомер формулы IX, изменяли морфологию клеток в сторону более зависимого от культуральной подложки фенотипа (фигура 12).
Пример 7
Перекрестная реактивность формулы viii с другими ядерными гормональными рецепторами
С целью определения того, влияли ли соединения по настоящему изобретению на передачу сигнала другого ядерного гормонального рецептора, анализировали способность соединения, представленного формулой VIII, стимулировать (агонист) или ингибировать (антагонист) ER-α-, ER-β-, GR-, PR- или MR-опосредованную активацию транскрипции.
Материалы и способы
Временная трансфекция
Крысиные GR, MR, PR, ER-α и ER-β по отдельности клонировали в каркас вектора pCR3.1. Проводили секвенирование для проверки отсутствия каких-либо мутаций. Клетки HEK-293 высевали при 90000 клеток на лунку 24-луночного планшета в модифицированную по способу Дульбекко минимальную поддерживающую среду с добавлением 5% очищенной на активированном угле FBS. Клетки трансфицировали, с помощью липофектамина (Invitrogen, Карлсбад, Калифорния), применяя 0,25 мкг GRE-LUC для GR, MR и PR, и ERE-LUC для ER-α и ER-β, 0,5 нг CMV-LUC (люцифераза Renilla) и 12,5-25 нг соответствующего вектора экспрессии для каждого рецептора. Клетки обрабатывали через 24 часа после трансфекции формулой VIII в отсутствие (режим агонистов) и присутствии (режим антагонистов) известных агонистов (эстрадиола для ER; дексаметазона для GR; альдостерона для MR; прогестерона для PR) в качестве контроля. Люциферазные анализы проводили через 48 ч после трансфекции. Значения активации транскрипции представлены как люцифераза светлячка, нормированная на люциферазу Renilla.
Результаты
Тестировали агонистические эффекты формулы VIII на ER-β, ER-α, GR, PR и MR, а также сравнивали с активностями известных лигандов, (фигура 8). Соединение формулы VIII не активировало ER-β или ER-α даже в наивысшей тестируемой концентрации (1 мкМ), тогда как 1 нМ эстрадиола 3- и 5-кратно индуцировал ER-α- и ER-β-опосредованную трансактивацию, соответственно. Соединение формулы VIII не активировало GR- или MR-опосредованную трансактивацию. Соединение формулы VIII при всех тестируемых концентрациях не индуцировало GR- или MR-опосредованную трансактивацию, тогда как известные лиганды (дексаметазон и альдостерон) 70- и 60-кратно индуцировали активность GR или MR, соответственно, в концентрации 1 нМ. Однако соединение формулы VIII 3- и 8-кратно увеличивало трансактивацию PR при 1 мкМ и 10 мкМ, соответственно. Прогестерон 23-кратно активировал PR в концентрации 1 нМ, указывая на то, что соединение формулы VIII больше чем 10000 раз слабее, чем эндогенный агонист для PR.
Также тестировали способность соединения формулы VIII ингибировать эффекты известного агониста для каждого из указанных выше рецепторов.
Коинкубация клеток HEK 293 с указанными концентрациями формулы VIII не изменяла эстрадиол-индуцированной активности ER-β или ER-α, дексаметазон-индуцированной GR-опосредованной трансактивации или альдостерон-индуцированной MR-опосредованной трансактивации.
Кривая доза-эффект для соединения формулы VIII в режиме антагонистов сильно частично ингибировала активность PR (фигура 9). По сравнению с формулой IX формула VIII являлась в 10 раз более сильной и в 100 раз более сильной, чем R-энантиомер формулы IX. По сравнению с RU486 формула VIII являлась приблизительно в 1000 раз слабее как антагонист PR, чем RU486.
Соединения по формулам VIII и IX являются специфичными для AR и не стимулируют или ингибируют рецептор-опосредованную трансактивацию ERα, ERβ, GR или MR. Неожиданно, формула VIII продемонстрировала частичную агонистическую активность умеренной силы в отношении PR, и мощный частичный PR антагонизм (смотри фигуру 9). Комбинированный AR-агонизм и PR-антагонизм будет полезным при определенных формах рака молочной железы (например, PR-положительные формы рака молочной железы).
Пример 8
Формула VIII ингибирует опухолевый рост клеток трижды негативного рака молочной железы у мышей
Материалы и способы
Клетки MDA-MB-231-AR трижды негативного рака молочной железы (2 миллиона клеток/мышь; клетки MDA-MB-231, стабильно трансфицированные AR с помощью лентивируса) смешивают с матригелем (1:1) и инъецировали подкожно в бок интактных самок голых мышей (n=5/группу). Когда опухоли достигали 150-200 мм3, животных разделяли на две группы, одна получала носитель, а другая получала 30 мг/кг формулы VIII перорально. Объем опухоли измеряли три раза в неделю, и рассчитывали% ингибирования роста опухоли (TGI). В конце 35 дней лечения животных умерщвляли, опухоли вырезали, взвешивали и собирали для различных анализов. Кровь собирали и отделяли сыворотку для измерения концентрации лекарственного средства.
Результаты
Формула VIII значительно сократила рост опухоли с TGI ~75% (фигура 10В). Массы опухолей также снизились более чем на 50% с помощью лечения формулой VIII (фигура 11C), как и размеры опухолей (фигуры 11A-B). Формула VIII установила данные результаты без какой-либо сопутствующей токсичности или изменений массы тела (фигура 10A). Вес матки также увеличился в ответ на лечение формулой VIII (не показано), указывая на in vivo андрогенной ответ.
В заключение, SARM формулы VIII является чрезвычайно эффективным при регрессии роста AR-экспрессирующих ксенотрансплантатов трижды негативного рака молочной железы у мышей, и, вероятно, будет эффективным при широком разнообразии AR-положительных форм рака молочной железы у людей, как описано supra и infra.
Пример 9
Эффект формулы IX у женщин с метастатическим или ER- и/или AR-положительным рефрактерным раком молочной железы
Данное клиническое испытание оценивает безопасность и эффективность соединения, представленного структурой формулы IX (формула IX), у субъектов-женщин, которые страдают эстроген-рецептор (ER) и андроген-рецептор (AR)-положительным метастатическим раком молочной железы, и которые ранее ответили на гормональную терапию. Целью данного исследования является определение важности AR-статуса в качестве терапевтической мишени у женщин с ER-положительным метастатическим раком молочной железы, которые ранее ответили на гормональную терапию.
Материалы и способы
Популяция субъектов
Субъекты женского пола с ER-положительным метастатическим раком молочной железы, которые ранее подвергались лечению с помощью предшествующей гормональной терапии до 3-х раз для лечения рака молочной железы. Субъекты должны были подвергаться лечению с помощью и ответить на предшествующую адъювантную терапию в течение ≥ 3 лет или гормональную терапию метастатического заболевания в течение ≥ 6 месяцев до прогрессирования. Подробная информация о критериях отбора субъектов представлена ниже.
Для получения права на участие в данном исследовании субъекты должны соответствовать всем следующим критериям, в том числе дать добровольное подписанное информированное согласие в соответствии с институционной политикой; являться женщиной, у которой диагностирован ER-положительный метастатический рак молочной железы; и находиться в клинически подтвержденом постменопаузальном периоде. Субъекты должны были перенести возникновение спонтанной, медицинской или хирургической менопаузы до начала данного исследования. (Спонтанная менопауза определяется как естественное прекращение функции яичников, на что указывает аменорея в течение по меньшей мере 12 месяцев. Если у субъектов аменорея в течение ≥ 6 месяцев, но < 12 месяцев, они должны обладать сывороточной концентрацией FSH ≥ 50 мМЕ/мл и концентрацию эстрадиола ≤ 25 пг/мл; медицинская менопауза определяется как лечение с помощью агониста рецепторов лютеинизирующего гормона; и хирургическая менопауза определяется как результат двустороннего удаления яичников).
Дополнительное требование, которому должны удовлетворять субъекты, включает то, чтобы они подвергались лечению и ответили на предшествующую адъювантную гормональную терапию в течение ≥ 3 лет или предшествующую гормональную терапию метастатического заболевания в течение ≥ 6 месяцев до прогрессирования заболевания; чтобы они не подвергались лучевой терапии рака молочной железы в пределах 2 недель рандомизации для данного исследования и не планировали получать лучевую терапию во время участия в данном исследовании. Субъекты должны быть готовы предоставить образец ткани из биопсии очага (очагов) метастатической опухоли для определения AR и ER-статуса. Образцы ткани из биопсии очага первичной опухоли также будут представлены, при наличии. Дополнительно субъекты должны иметь оценку по шкале ECOG ≤ 2 и находиться в возрасте ≥ 18 лет.
Субъекты с любым из следующих критериев исключения НЕ будут иметь права для регистрации в данном исследовании: наличие трижды негативного рака молочной железы; наличие, по заключению исследователя, клинически значимого сопутствующего заболевания или психологического, семейного, социологического, географического или другого сопутствующего условия, которое будет препятствовать адекватному последующему наблюдению и соблюдению протокола исследования; наличие неконтролируемой гипертонии, застойной сердечной недостаточности или стенокардии; наличие 4 стадии хронического обструктивного заболевания легких (COPD); наличие положительного результата скрининга на гепатит B, включающего HBsAg (поверхностный антиген вируса гепатита B), если только субъекту не поставили диагноз > 10 лет до зачисления, и отсутствуют свидетельства активного заболевания печени; наличие ALT/SGOT или AST/SGPT в 1,5 раза выше верхней границы нормы (ULN); наличие положительного результата скрининга на антитела IgM к вирусу гепатита A или HIV; получение химиотерапии по поводу метастатического рака молочной железы в пределах 3 месяцев до включения в исследование или ожидаемое получение химиотерапии по поводу метастатического рака молочной железы в течение исследования; прием в настоящее время тестостерона, метилтестостерона, оксандролона (Oxandrin®), оксиметолона, даназола, флюоксиместерона (Halotestin®), тестостероноподобных средств (таких как дегидроэпиандростерон (DHEA), андростендиона и других андрогенных соединений, включая лекарственные средства из растительного сырья), или антиандрогенов; предшествующая терапия тестостероном и тестостероноподобными средствами допустима с 30-дневным отмывочным периодом (если предыдущая терапия тестостероном проводилась препаратами пролонгированного действия в пределах последних 6 месяцев, исследовательский центр должен обратиться к медицинскому наблюдателю в данном исследовании для определения соответствующего отмывочного периода); наличие не подвергавшихся лечению или неконтролируемых метастазов в головной мозг; постановка диагноза или лечение злокачественного новообразования в пределах предыдущих двух лет помимо рака молочной железы или немеланомного рака кожи.
Андроген-рецепторный (AR) статус будут оценивать у всех субъектов из первичных и/или метастатических очагов после регистрации. Ожидается, что у большинства (70-95%) субъектов с ER-положительным раком молочной железы также будет экспрессироваться AR и специфический антиген простаты (PSA) в образцах их первичных опухолей (Niemeier LA, et.al. Androgen receptor in breast cancer: expression in estrogen receptor-positive tumors and in estrogen-negative tumors with apocrine differentiation. Modern Pathology 23:205-212, 2010; Narita D, et al. Immunohistochemical expression of androgen receptor and prostate-specific antigen in breast cancer. Folia Histochemica Et Cytobiologica 44:165-172, 2006). Высокий процент (72-84%) метастатических очагов, полученных от женщин с распространенным раком молочной железы, как обнаружено, также являются AR-положительными (Lea OA. et al. Improved measurement of androgen receptors in human breast cancer. Cancer Research 49:7162-7167, 1989).
Так как у 70% или более женщин с ER-положительным раком молочной железы, как ожидается, присутствуют опухоли, которые являются AR-положительными, исследование разработано с включением приблизительно 27 субъектов с AR-положительным раком молочной железы в каждой дозовой группе, что обеспечивает возможность оценки первичного конечного показателя у AR-положительных субъектов, а также вторичных и третичных конечных показателей в подгруппах на основании AR статуса (т.е. все субъекты, AR-положительные субъекты и AR-отрицательные субъекты).
Лечение
Субъекты будут получать либо 3 мг суточной дозы, либо 9 мг суточной дозы формулы IX при ступенчатой схеме введения доз, с исходными и регулярными в период исследования оценками безопасности и эффективности.
Сорок (40) субъектов будут получать формулы IX 3 мг, и 40 субъектов будут получать формулы IX 9 мг. Включение в данное исследование будет ступенчатым, так что первые 40 субъектов будут включены в дозовую группу 3 мг формулы IX. У данных субъектов будет оцениваться эффективность и безопасность. Когда последний субъект в дозовой группе 3 мг формулы IX включен в данную дозовую группу, и существует приемлемый уровень безопасности на основе анализа нежелательных явлений и клиническая эффективность по оценке спонсора, начнется включение оставшихся 40 субъектов в дозовую группу 9 мг формулы IX.
Таблица 1
Измеримые и неизмеримые очаги (первичные и/или метастатические) будут идентифицированы и оценены с помощью модифицированной классификации критериев оценки ответа солидных опухолей (RECIST 1.1) в течение данного исследования (подробно описано ниже).
Продолжительность исследования
Каждый субъект, включенный в данное исследование, будет получать лечение согласно исследованию до достижения конечного показателя выживания без прогрессирования (PFS) (прогрессирование опухоли или смерть). Субъекты будут наблюдаться после прекращения лечения только с целью оценки жизненного статуса.
Конечные показатели эффективности
Первичным анализом эффективности будет являться клиническая эффективность у субъектов с AR-положительным раком молочной железы через 6 месяцев при измерении с помощью модифицированной классификации критериев оценки ответа солидных опухолей (RECIST 1.1). Также будут оцениваться ключевые вторичные конечные показатели клинической эффективности у всех субъектов и AR-отрицательных субъектов, а также частота объективных ответов, выживаемость без прогрессирования, время до прогрессирования, длительность ответа, частота возникновения SRE и время до первого SRE у субъектов на основании AR статуса (т.е. все субъекты, AR-положительные субъекты и AR-отрицательные субъекты). Влияние на CA 27-29, PSA, маркеры костного ремоделирования, QOL и половое влечение будут оцениваться как третичные конечные показатели.
Первичный конечный показатель
Клиническая эффективность у субъекта определяется как полный ответ [CR], частичный ответ [PR] или стабильное заболевание [SD] при измерении с помощью модифицированной RECIST 1.1, которая подробно описана ниже. (Eisenhauer EA et al. New response evaluation criteria in solid tumors: revised RECIST guideline (version 1.1). European Journal of Cancer 45:228-247, 2009).
Для субъектов с неизмеримым (не являющимся целью) заболеванием только в начале исследования, SD будут определяться как таковые с не-CR/не-PD комбинированным ответом. Первичным конечным показателем исследования будет являться оценка доли субъектов с клинической эффективностью (PCB) через 6 месяцев (CR+PR+SD) среди субъектов с AR-положительным раком молочной железы.
Вторичные конечные показатели
Вторичные конечные показатели эффективности включают:
- Оценку клинической эффективности у всех субъектов с раком молочной железы, получавших лечение формулой IX. Клиническая эффективность определяется как доля субъектов с полным ответом [CR] + частичным ответом [PR] + стабильным заболеванием [SD] при измерении с помощью модифицированной RECIST 1.1 (Eisenhauer EA et al. New response evaluation criteria in solid tumors: revised RECIST guideline (Version 1.1). European Journal of Cancer 45:228-247, 2009).
- Для субъектов с неизмеримым (не являющимся целью) заболеванием только в начале исследования, SD будут определяться как таковые с не-CR/не-PD комбинированным ответом.
- Оценку частоты объективных ответов (ORR) у субъектов с раком молочной железы, получавших лечение формулой IX. Частота объективных ответов определяется как доля субъектов с CR или PR через 6 месяцев при измерении с помощью модифицированной RECIST 1.1. Для субъектов с неизмеримым (не являющимся целью) заболеванием только в начале исследования, ORR определяется как доля субъектов с CR через 6 месяцев при измерении с помощью модифицированной RECIST 1.1.
- Оценку выживания без прогрессирования (PFS) у субъектов с раком молочной железы, получавших лечение формулой IX. PFS определяется как время, прошедшее между началом лечения и прогрессированием опухоли, при измерении с помощью модифицированной RECIST 1.1, или смертью.
- Оценку времени до прогрессирования (TTP) у субъектов с раком молочной железы, получавших лечение формулой IX. Время до прогрессирования опухоли определяется как время, прошедшее между началом лечения и прогрессированием опухоли, при измерении с помощью модифицированной RECIST 1.1.
- Оценку длительность ответа у субъектов с раком молочной железы, получавших лечение формулой IX.
- Оценку частоты возникновения осложнений, связанных со скелетом (SRE) у субъектов, получавших лечение формулой IX.
- Оценку времени до первого осложнения, связанного со скелетом (SRE) у субъектов, получавших лечение формулой IX.
- Третичные конечные показатели
- Оценка изменений CA 27-29 в сыворотке у субъектов с раком молочной железы, получавших лечение формулой IX.
- Оценка изменений PSA в сыворотке у субъектов с раком молочной железы, получавших лечение формулой IX.
- Оценка изменений маркеров костного ремоделирования (сывороточный остеокальцин, перекрестносшитый С-телопептид коллагена I типа [CTX] в сыворотке, перекрестносшитый N-телопептид коллагена I типа [NTX] в сыворотке, костно-специфическая щелочная фосфатаза в сыворотке и NTX в моче у субъектов, получавших лечение формулой IX.
- Оценка влияния формулы IX на качество жизни (QOL) при измерении с помощью опросника FACIT-F у субъектов, получавших лечение формулой IX.
- Оценка влияния формулы IX на половое влечение при измерении с помощью опросника для подсчета индекса сексуальной функции женщин (FSFI) у субъектов, получавших лечение формулой IX.
- Изучение взаимосвязи различных уровней экспрессии AR, определяемых с помощью иммуногистохимии, с первичными, вторичными и третичными показателями.
Модифицированная RECIST 1.1
Будут применяться определения модифицированной RECIST 1.1, описанные ниже:
Измеримые очаги
Измеримый очаг определяется как один очаг, самый длинный диаметр которого (LD) можно точно измерить как ≥ 10 мм методом CT или MRI, применяя алгоритм реконструкции изображений с использованием прилегающих срезов 5 мм.
Измеримые очаги должны составлять, по меньшей мере, в 2 раза больше толщины среза или, по меньшей мере, в два раза больше размера шага спирали CT-исследования.
Очаги, видимые при рентгенографии органов грудной клетки, но не подтвержденные с помощью CT или MRI-исследования, не принимаются в качестве измеримых очагов для данного исследования.
Для того, чтобы считаться патологически увеличенным и измеримым, лимфатический узел должен составлять > 15 мм по короткой оси при оценке с помощью CT-исследования (толщина среза CT-исследования рекомендуется не больше, чем 5 мм). В начале исследования и при последующем наблюдении измеряться и отслеживаться будет только короткая ось.
Измеримое заболевание определяется как наличие, по меньшей мере, одного измеримого очага.
Все измерения будут проводиться и регистрироваться в миллиметрах с применением способа электронного измерения.
Неизмеримые очаги
Неизмеримые очаги определяются как любые очаг(и), которые меньше, чем критерии для измеримых очагов, указанные выше (не узловые очаги с самым длинным диаметром < 10 мм или патологические лимфатические узлы от ≥ 10 мм до < 15 мм по короткой оси), или действительно неизмеримые очаги (или пораженные участки). Очагами, считающимися действительно неизмеримыми, являются очаги в костях (литические очаги или смешанные литически-бластические очаги без идентифицируемых компонентов мягких тканей, и бластические очаги), лептоменингеальное заболевание, асцит, плевральный/перикардиальный выпот, лимфангит кожи/легких, воспалительное заболевание молочной железы, объемные образования брюшной полости, не подтвержденные с помощью методов визуализации, и кистозные очаги.
Очаги-мишени
Очаги-мишени должны являться измеримыми очагами.
Все очаги-мишени, не более двух очагов на орган и пять очагов всего, характерные для всех вовлеченных органов будут отобраны/утверждены в качестве очагов-мишеней, зарегистрированных и измеренных в начале исследования.
Очаги-мишени должны выбираться на основании их размера (очаги самого длинного диаметра) и их пригодности для точных повторяющихся измерений с помощью методов CT/MRI визуализации и являться наиболее характерными для опухолевой массы субъекта.
Очаги-мишени будут измеряться в одном параметре путем оценки размера их диаметра. Сумма диаметров (самого длинного для не узловых очагов и самого короткого для узловых очагов) для всех очагов-мишеней будет рассчитываться и отмечаться в каждый момент времени. Исходная сумма диаметров будет применяться как референтная для дополнительного определения характеристик объективного опухолевого ответа по измеряемому параметру заболевания.
Очаги, не являющиеся мишенями
Все другие очаги (или пораженные участки) и любые измеримые очаги, которые не отобрали в качестве очагов-мишеней, следует определять как очаги, не являющиеся мишенями, и указывать как присутствующие на момент начала исследования.
Можно проводить измерения очагов, не являющихся мишенями, однако продолжающееся присутствие или отсутствие, а также исчезновение или состояние прогрессирования данных очагов будет отмечаться при оценивании в период последующего наблюдения.
Новые очаги
Во время визитов последующего наблюдения будут отмечаться новые очаги независимо от того, возникли ли они в анатомических областях, которые постоянно подвергались наблюдению, или в областях без заболевания в начале исследования, и для которых последующее изучение выполняют при клиническом подозрении на новое заболевание. Новые лимфатические узлы должны обладать минимальным размером 10 мм по их малой оси. Новые не узловые очаги не должны являться измеримыми или обладать минимальным размером. Можно проводить измерения новых очагов.
Определения критериев ответа
Следующие критерии ответа будут применяться для очагов, являющихся и не являющихся мишенями:
Критерии ответа очагов-мишеней
Полный ответ (CR): исчезновение всех очагов-мишеней. Пораженные лимфатические узлы-мишени, которые становятся < 10 мм в их наименьшем диаметре, будут рассматриваться как нормальные (не патологические), и их фактическое измерение будет регистрироваться. Таким образом, следует, что если все пораженные узлы-мишени стали < 10 мм, и все другие не узловые очаги исчезли (являющиеся или не являющиеся мишенями), общий ответ будет рассматриваться как CR.
Частичный ответ (PR): уменьшение суммы диаметров очагов-мишеней, по меньшей мере, на 30%, принимая в качестве стандарта исходную сумму диаметров.
Стабильное заболевание (SD): отсутствие достаточного уменьшения размеров, чтобы отвечать требованиям PR, и отсутствие достаточного увеличения, чтобы отвечать требованиям PD, принимая в качестве стандарта наименьшую сумму диаметров (низшая точка).
Прогрессирующее заболевание (PD): увеличение суммы диаметров очагов-мишеней, по меньшей мере, на 20%, принимая в качестве стандарта наименьшую сумму диаметров (низшая точка), зарегистрированную с момента начала лечения. В дополнение к относительному увеличению на 20% сумма диаметров также должна продемонстрировать абсолютное увеличение, по меньшей мере, на 5 мм.
Оценка отсутствует (NE): NE может применяться, если невозможно оценить повторные измерения по таким причинам, как неудовлетворительная или отсутствующая визуализация.
Критерии ответа очагов, не являющихся мишенями
Полный ответ (CR): исчезновение всех очагов-мишеней. Все лимфатические узлы должны обладать непатологическим размером (< 10 мм по короткой оси). Исчезновение костных очагов, определяемое на остеосцинтиграфии.
Не-CR/не-PD: сохранение одного или нескольких очагов, не являющихся мишенями. Стабильность, снижение или умеренное увеличение накопления костных очагов на остеосцинтиграфии.
Прогрессирующее заболевание (PD): однозначное прогрессирование существующих очагов, не являющихся мишенями. Воспринимаемое увеличение заболевания костей в ранее существовавшей области не будет рассматриваться как прогрессия. По меньшей мере, два новых очага требуются при остеосцинтиграфии для того, чтобы сделать заключение об определенном присутствии новых очагов, за исключением тех случаев, когда один или несколько данных очагов подтверждены с помощью рентгенографии, CT или MRI.
Оценка отсутствует (NE): NE может применяться, если невозможно оценить повторные измерения по таким причинам, как неудовлетворительная или отсутствующая визуализация.
Определения комбинированного ответа в каждый момент времени
Определение общего ответа на каждый момент времени основано на комбинации ответов очагов, являющихся мишенями, не являющихся мишенями, и присутствии или отсутствии новых очагов с применением алгоритма, изложенного в таблицах C1 и C2 ниже.
Таблица C1. Краткое изложение определений ответа для пациентов с измеримым (мишень) заболеванием в начале исследования
Таблица C2. Краткое изложение определений ответа для пациентов с неизмеримым (не являющимся мишенью) заболеванием только в начале исследования
Пример 10
Синтез (s) энантиомера формулы VIII

(2R)-1-Метакрилоилпирролидин-2-карбоновая кислота. D-пролин, 14,93 г, 0,13 моль) растворяли в 71 мл 2 н. NaOH и охлаждали на ледяной бане; Полученный щелочной раствор разбавляли ацетоном (71 мл). Ацетоновый раствор (71 мл) метакрилоилхлорида (13,56 г, 0,13 моль) и 2 н. раствор NaOH (71 мл) одновременно добавляли в течение 40 мин к водному раствору D-пролина на ледяной бане. pH смеси поддерживали при 10-11oC в течение добавления метакрилоилхлорида. После перемешивания (3 часа при комнатной температуре) смесь выпаривали in vacuo при температуре 35-45 °C для удаления ацетона. Полученный раствор промывали этиловым эфиром и подкисляли до pH 2 with концентрированной HCl. Кислую смесь насыщали NaCl и экстрагировали с помощью EtOAc (100 мл × 3). Комбинированные экстракты высушивали над Na2SO4, фильтровали через целит и выпаривали in vacuo с получением неочищенного продукта в виде бесцветного масла. После перекристаллизации масла из этилового эфира и гексанов получили 16,2 г (68%) требуемого соединения в виде бесцветных кристаллов: температура плавления 102-103 °C; спектр ЯМР данного соединения показал существование двух ротамеров указанного в заголовке соединения.1H ЯМР (300 МГц, DMSO-d6) δ 5,28 (с) и 5,15 (с) для первого ротамера, 5,15 (с) и 5,03 (с) для второго ротамера (в целом 2H для обоих ротамеров, винил CH2), 4,48-4,44 для первого ротамера, 4,24-4,20 (м) для второго ротамера (в целом 1H для обоих ротамеров, CH в хиральном центре), 3,57-3,38 (м, 2H, CH2), 2,27-2,12 (1H, CH), 1,97-1,72 (м, 6H, CH2, CH, Me);13C ЯМР (75 МГц, DMSO-d6) δ для основного ротамера 173,3, 169,1, 140,9, 116,4, 58,3, 48,7, 28,9, 24,7, 19,5: для минорного ротамера 174,0, 170,0, 141,6, 115,2, 60,3, 45,9, 31,0, 22,3, 19,7; IR (KBr) 3437 (OH), 1737 (C=O), 1647 (CO, COOH), 1584, 1508, 1459, 1369, 1348, 1178 см-1; [α]D26+80,8° (c = 1, MeOH); аналитически рассчитано для C9H13NO3: C 59,00, H 7,15, N 7,65. Определили: C 59,13, H 7,19, N 7,61.

(3R,8aR)-3-бромметил-3-метил-тетрагидро-пирроло[2,1-c][1,4]оксазин-1,4-дион. Раствор NBS (23,5 г, 0,132 моль) в 100 мл DMF добавляли по каплям к перемешиваемому раствору (метил-акрилоил)-пирролидина (16,1 г, 88 ммоль) в 70 мл DMF в атмосфере аргона при комнатной температуре, и полученную смесь перемешивали 3 дня. Растворитель удаляли in vacuo, и осаждали твердое вещество желтого цвета. Твердое вещество суспендировали в воде, перемешивали в течение ночи при комнатной температуре, фильтровали и высушивали с получением 18,6 г (81%) (уменьшение веса при высушивании ~ 34%) указанного в заголовке соединения в виде твердого вещества желтого цвета: температура плавления 152-154 °C;1H ЯМР (300 МГц, DMSO-d6) δ 4,69 (дд, J = 9,6 Гц, J = 6,7 Гц, 1H, CH в хиральном центре), 4.02 (д, J = 11,4 Гц, 1H, CHHa), 3,86 (д, J = 11,4 Гц, 1H, CHHb), 3,53-3,24 (м, 4H, CH2), 2,30-2,20 (м, 1H, CH), 2,04-1,72 (м, 3H, CH2 и CH), 1,56 (с, 2H, Me);13C ЯМР (75 МГц, DMSO-d6) δ 167,3, 163,1, 83,9, 57,2, 45,4, 37,8, 29,0, 22,9, 21,6; IR (KBr) 3474, 1745 (C=O), 1687 (C=O), 1448, 1377, 1360, 1308, 1227, 1159, 1062 см-1; [α]D26+124,5 ° (c = 1,3, хлороформ); Anal. Calcd. для C9H12BrNO3: C 41,24, H 4,61, N 5,34. Определили: C 41,46, H 4,64, N 5,32.

(2R)-3-бром-2-гидрокси-2-метилпропановая кислота. Смесь бромлактона (18,5 г, 71 ммоль) в 300 мл 24% HBr нагревали в колбе с обратным холодильником в течение 1 ч. Полученный раствор разбавляли насыщенным солевым раствором (200 мл) и экстрагировали этилацетатом (100 мл x 4). Комбинированные экстракты промывали насыщенным NaHCO3 (100 мл x 4). Водный раствор подкисляли концентрированной HCl до pH = 1, которую, в свою очередь, экстрагировали этилацетатом (100 мл × 4). Комбинированный органический раствор высушивали над Na2SO4, фильтровали через целит и выпаривали in vacuo до сухого состояния. После перекристаллизации из толуола получили 10,2 г (86%) требуемого соединения в виде бесцветных кристаллов: температура плавления 107-109 °C;1H ЯМР (300 МГц, DMSO-d6) δ 3,63 (д, J = 10,1 Гц, 1H, CHHa), 3,52 (д, J = 10,1 Гц, 1H, CHHb), 1,35 (с, 3H, Me); IR (KBr) 3434 (OH), 3300-2500 (COOH), 1730 (C=O), 1449, 1421, 1380, 1292, 1193, 1085 см-1; [α]D26+10,5° (c = 2,6, MeOH); Anal. Calcd. для C4H7BrO3: C 26,25, H 3,86. Определили: C 26,28, H 3,75.

(R)-3-бром-2-гидрокси-2-
метилпропановая кислота
R-18

Синтез (2R)-3-бром-N-(3-хлор-4-цианофенил)-2-гидрокси-2-метилпропанамида. Тионилхлорид (7,8 г, 65,5 ммоль) добавляли по каплям к охлажденному раствору (менее 4оC) (R)-3-бром-2-гидрокси-2-метилпропановой кислоты (9,0 г, 49,2 моль) в 50 мл THF в атмосфере аргона. Полученную смесь перемешивали в течение 3 часов при тех же условиях. К данному добавляли Et3N (6,6 г, 65,5 моль) и перемешивали в течение 20 мин при тех же условиях. Через 20 мин добавляли 4-амино-2-хлорбензонитрил (5,0 г, 32,8 ммоль) и 100 мл THF, и затем смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении с получением твердого вещества, которое обрабатывали с использованием 100 мл H2O, экстрагировали с использованием EtOAc (2 × 150 мл). Комбинированные органические экстракты промывали насыщенным раствором NaHCO3 (2 × 100 мл) и насыщенным солевым раствором (300 мл), последовательно. Органический слой высушивали над MgSO4 и концентрировали при пониженном давлении с получением твердого вещества, которое очищали с помощью колоночной хроматографии, применяя EtOAc/гексан (50:50) с получением 7,7 г (49,4%) целевого соединения в виде твердого вещества коричневого цвета.
1H ЯМР (CDCl3/TMS) δ 1,7 (с, 3H, CH3), 3,0 (с, 1H, OH), 3,7 (д, 1H, CH), 4,0 (д, 1H, CH), 7,5 (д, 1H, ArH), 7,7 (д, 1H, ArH), 8,0 (с, 1H, ArH), 8,8 (с, 1H, NH). MS:342,1 (M+23). Температура плавления 129°C.

Синтез (S)-N-(3-хлор-4-цианофенил)-3-(4-цианофенокси)-2-гидрокси-2-метилпропанамида. Смесь бромамида (2,0 г, 6,3 ммоль), безводного K2CO3 (2,6 г, 18,9 ммоль) в 50 мл ацетона нагревали с обратным холодильником в течение 2 ч, а затем концентрировали при пониженном давлении с получением твердого вещества. Полученное твердое вещество обрабатывали 4-цианофенолом (1,1 г, 9,5 ммоль) и безводным K2CO3 (1,7 г, 12,6 ммоль) в 50 мл 2-пропанола, нагревали с обратным холодильником в течение 3 ч и затем концентрировали при пониженном давлении с получением твердого вещества. Остаток обрабатывали с использованием 100 мл H2O, а затем экстрагировали с использованием EtOAc (2 ×100 мл). Комбинированные EtOAc экстракты промывали с использованием 10% NaOH (4 × 100 мл) и насыщенного солевого раствора, последовательно. Органический слой высушивали над MgSO4 и затем концентрировали при пониженном давлении с получением масла, которое очищали с помощью колоночной хроматографии, применяя EtOAc/гексан (50:50) с получением твердого вещества. Твердое вещество перекристаллизовывали из CH2Cl2/гексана с получением 1,4 г (61,6%) (S)-N-(3-хлор-4-цианофенил)-3-(4-цианофенокси)-2-гидрокси-2-метилпропанамида в виде бесцветного твердого вещества.
1H ЯМР (CDCl3/TMS) δ 1,61 (с, 3H, CH3), 3,25 (с, 1H, OH), 4,06 (д, J = 9,15 Гц, 1H, CH), 4,50 (д, J = 9,15 Гц, 1H, CH), 6,97 – 6,99 (м, 2H, ArH), 7,53-7,59 (м, 4H, ArH), 7,97 (д, J = 2,01 Гц, 1H, ArH), 8,96 (с, 1H, NH). Расчетная масса: 355,1, [M+Na]+ 378,0. Температура плавления: 103-105°C.
Пример 11
Синтез (S) энантиомера формулы IX

(R)-3-бром-2-гидрокси-2-
метилпропановая кислота

Синтез (2R)-3-бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамида. Тионилхлорид (46,02 г, 0,39 моль) добавляли по каплям к охлажденному раствору (менее 4 °С) (R)-3-бром-2-гидрокси-2-метилпропановой кислоты (51,13 г, 0,28 моль) в 300 мл THF в атмосфере аргона. (R)-3-бром-2-гидрокси-2-метилпропановую кислоту получали, как описано в примере 10. Полученную смесь перемешивали в течение 3 часов при тех же условиях. К данному добавляли Et3N (39,14 г, 0,39 моль) и перемешивали в течение 20 мин при тех же условиях. Через 20 мин добавляли 5-амино-2-цианобензотрифторид (40,0 г, 0,21 моль), 400 мл THF, а затем смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении с получением твердого вещества, которое обрабатывали с использованием 300 мл H2O, экстрагировали с использованием EtOAc (2 × 400 мл). Комбинированные органические экстракты промывали насыщенным раствором NaHCO3 (2 × 300 мл) и насыщенным солевым раствором (300 мл). Органический слой высушивали над MgSO4 и концентрировали при пониженном давлении с получением твердого вещества, которое очищали с помощью колоночной хроматографии, применяя CH2Cl2/EtOAc (80:20), с получением твердого вещества. Данное твердое вещество перекристаллизовывали из CH2Cl2/гексана с получением 55,8 г (73,9%) (2R)-3-бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамида в виде твердого вещества светло-желтого цвета.
1H ЯМР (CDCl3/TMS) δ 1,66 (с, 3H, CH3), 3,11 (с, 1H, OH), 3,63 (д, J = 10,8 Гц, 1H, CH2), 4,05 (д, J = 10,8 Гц, 1H, CH2), 7,85 (д, J = 8,4 Гц, 1H, ArH), 7,99 (дд, J = 2,1, 8,4 Гц, 1H, ArH), 8,12 (д, J = 2,1 Гц, 1H, ArH), 9,04 (уш.с, 1H, NH). Расчетная масса: 349,99, [M-H]- 349,0. Температура плавления: 124-126ºC.

Синтез (S)-N-(4-циано-3-(трифторметил)фенил)-3-(4-цианоыфенокси)-2-гидрокси-2-метилпропанамида. Смесь бромамида ((2R)-3-бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамида, 50 г, 0,14 моль), безводного K2CO3 (59,04 г, 0,43 моль), 4-цианофенола (25,44 г, 0,21 моль) в 500 мл 2-пропанола нагревали с обратным холодильником в течение 3 ч, а затем концентрировали при пониженном давлении с получением твердого вещества. Полученный остаток обрабатывали с использованием 500 мл H2O и затем экстрагировали с использованием EtOAc (2 × 300 мл). Комбинированные EtOAc экстракты промывали с использованием 10% NaOH (4 × 200 мл) и насыщенного солевого раствора. Органический слой высушивали над MgSO4 и затем концентрировали при пониженном давлении с получением масла, которое обрабатыва с использованием 300 мл этанола и активированного угля. Реакционную смесь нагревали с обратным холодильником в течение 1 ч, а затем горячую смесь фильтровали через целит. Фильтрат концентрировали при пониженном давлении с получением масла. Данное масло очищали с помощью колоночной хроматографии, применяя CH2Cl2/EtOAc (80:20) с получением масла, которое кристаллизовали из CH2Cl2/гексана с получением 33,2 г (59,9%) (S)-N-(4-циано-3-(трифторметил)фенил)-3-(4-цианофенокси)-2-гидрокси-2-метилпропанамида в виде бесцветного твердого вещества (типа хлопка).
1H ЯМР (CDCl3/TMS) δ 1,63 (с, 3H, CH3), 3,35 (с, 1H,OH), 4,07 (д, J = 9,04 Гц, 1H, CH), 4,51 (д, J = 9,04 Гц, 1H, CH), 6,97 – 6,99 (м, 2H, ArH), 7,57-7,60 (м, 2H, ArH), 7,81 (д, J = 8,55 Гц, 1H, ArH), 7,97 (дд, J = 1,95, 8,55 Гц, 1H, ArH), 8,12 (д, J = 1,95 Гц, 1H, ArH), 9,13 (уш.с, 1H, NH). Расчетная масса: 389,10, [M-H]- 388,1. Температура плавления: 92-94°C.
Пример 12
Синтез (R) энантиомера формулы IX

Синтез (2S)-3-бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамида (предшественник R-энантиомера формулы IX). Тионилхлорид (46,02 г, 0,39 моль) добавляли по каплям к охлажденному раствору (менее 4°C) (S)-3-бром-2-гидрокси-2-метилпропановой кислоты (51,13 г, 0,28 моль) в 300 мл THF в атмосфере аргона. Полученную смесь перемешивали в течение 3 часов при тех же условиях. К данному добавляли Et3N (39,14 г, 0,39 моль) и перемешивали в течение 20 мин при тех же условиях. Через 20 мин добавляли 5-амино-2-цианобензотрифторида (40,0 г, 0,21 моль), 400 мл THF и затем смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении с получением твердого вещества, которое обрабатывали с использованием 300 мл H2O, экстрагировали с использованием EtOAc (2 X 400 мл). Комбинированные органические экстракты промывали насыщенным раствором NaHCO3 (2 X 300 мл) и насыщенным солевым раствором (300 мл). Органический слой высушивали над MgSO4 и концентрировали при пониженном давлении с получением твердого вещества, которое очищали с помощью колоночной хроматографии, применяя CH2Cl2/EtOAc (80:20), с получением твердого вещества. Данное твердое вещество перекристаллизовывали из EtOAc/гексана с получением 55,8 г (73,9%) целевого соединения в виде твердого вещества светло-желтого цвета.
1H ЯМР (CDCl3/TMS) δ 1,66 (с, 3H, CH3), 3,11 (с, 1H, OH), 3,63 (д, J = 10,8 Гц, 1H, CH2), 4,05 (д, J = 10,8 Гц, 1H, CH2), 7,85 (д, J = 8,4 Гц, 1H, ArH), 7,99 (дд, J = 2,1, 8,4 Гц, 1H, ArH), 8,12 (д, J = 2,1 Гц, 1H, ArH), 9,04 (уш.с, 1H, NH).
Расчетная масса: 349,99, [M-H]- 349,0. Температура плавления: 124-126°C.
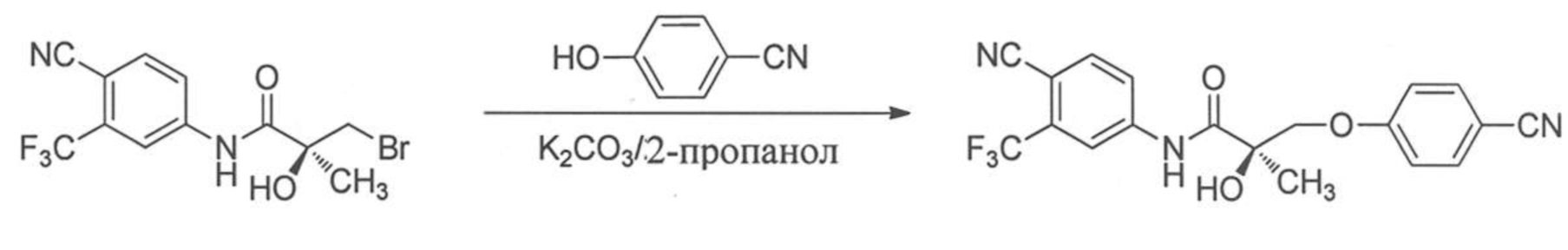
Синтез (R)-N-(4-циано-3-(трифторметил)фенил)-3-(4-цианофенокси)-2-гидрокси-2-метилпропанамида (R-энантиомера формулы IX). Смесь бромамида (50,0 г, 0,14 моль), безводного K2CO3 (59,04 г, 0,43 моль), 4-цианофенола (25,44 г, 0,21 моль) в 500 мл 2-пропанола нагревали с обратным холодильником в течение 3 ч, а затем концентрировали при пониженном давлении с получением твердого вещества. Полученный остаток обрабатывали с использованием 500 мл H2O и затем экстрагировали с использованием EtOAc (2 X 300 мл). Комбинированные EtOAc экстракты промывали с использованием 10% NaOH (4 X 200 мл) и насыщенного солевого раствора. Органический слой высушивали над MgSO4 и затем концентрировали при пониженном давлении с получением масла, которое обрабатывали с использованием 300 мл этанола и активированного угля. Реакционную смесь нагревали с обратным холодильником в течение 1 ч, а затем горячую смесь фильтровали через целит. Фильтрат концентрировали при пониженном давлении с получением масла. Данное масло очищали с помощью колоночной хроматографии, применяя гексан/EtOAc (20:80), с получением масла, которое кристаллизовали из EtOAc/гексана с получением 33,2 г (59,9%) (R)-N-(4-циано-3-(трифторметил)фенил)-3-(4-цианофенокси)-2-гидрокси-2-метилпропанамида (R-изомер формулы IX) в виде бесцветного твердого вещества.
1H ЯМР (CDCl3/TMS) δ 1,63 (с, 3H, CH3), 3.44 (с, 1H,OH), 4,07 (д, J = 9,16 Гц, 1H, CH), 4,51 (д, J = 9,16 Гц, 1H, CH), 6,97 – 6,99 (м, 2H, ArH), 7,57-7,59 (м, 2H, ArH), 7,81 (д, J = 8,54 Гц, 1H, ArH), 7,97 (дд, J = 2,07, 8,54 Гц, 1H, ArH), 8,12 (д, J = 2,07 Гц, 1H, ArH), 9,15 (уш.с, 1H, NH). Расчетная масса: 389,10, [M-H]- 388,1. Температура плавления: 92-94°C
Пример 13
от 0оС до 4оС/3 часа часа
Синтез (S) энантиомера формулы X

Синтез (2R)-3-бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамида. Тионилхлорид (46,02 г, 0,39 моль) добавляли по каплям к охлажденному раствору (менее 4°C) R-131 (51,13 г, 0,28 моль) в 300 мл THF в атмосфере аргона. Полученную смесь перемешивали в течение 3 часов при тех же условиях. К данному добавляли Et3N (39,14 г, 0,39 моль) и перемешивали в течение 20 мин при тех же условиях. Через 20 мин добавляли 5-амино-2-цианобензотрифторид (40,0 г, 0,21 моль), 400 мл THF, а затем смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении с получением твердого вещества, которое обрабатывали с использованием 300 мл H2O, экстрагировали с использованием EtOAc (2 X 400 мл). Комбинированные органические экстракты промывали насыщенным раствором NaHCO3 (2 X 300 мл) и насыщенным солевым раствором (300 мл). Органический слой высушивали над MgSO4 и концентрировали при пониженном давлении с получением твердого вещества, которое очищали с помощью колоночной хроматографии, применяя CH2Cl2/EtOAc (80:20) с получением твердого вещества. Данное твердое вещество перекристаллизовывали из CH2Cl2/гексана с получением целевого соединения (55,8 г, 73,9%) в виде твердого вещества светло-желтого цвета.
1H ЯМР (CDCl3/TMS) δ 1,66 (с, 3H, CH3), 3,11 (с, 1H, OH), 3,63 (д, J = 10,8 Гц, 1H, CH2), 4,05 (д, J = 10,8 Гц, 1H, CH2), 7,85 (д, J = 8,4 Гц, 1H, ArH), 7,99 (дд, J = 2,1, 8,4 Гц, 1H, ArH), 8,12 (д, J = 2,1 Гц, 1H, ArH), 9,04 (уш.с, 1H, NH). Расчетная масса: 349,99, [M-H]- 349,0. Температура плавления: 124-126оC.

Синтез (S)-N-(4-циано-3-(трифторметил)фенил)-3-(4-фторфенокси)-2-гидрокси-2-метилпропанамида (формула X). Смесь бромамида (10,0 г, 28,5 ммоль), безводного K2CO3 (11,8 г, 85,4 ммоль) в 150 мл ацетона нагревали с обратным холодильником в течение 1 ч, а затем концентрировали при пониженном давлении с получением твердого вещества. Полученный остаток обрабатывали с использованием 4-фторфенола (4,8 г, 42,7 ммоль), безводного K2CO3 (7,9 г, 57,0 ммоль), 150 мл 2-пропанола и затем нагревали с обратным холодильником в течение 2 ч. Полученную смесь концентрировали при пониженном давлении с получением твердого вещества. Данное твердое вещество обрабатывали с использованием 300 мл H2O и экстрагировали с использованием EtOAc (2 X 250 мл). Комбинированные EtOAc экстракты промывали с использованием насыщенного раствора NaHCO3 (2 X 250 мл) и насыщенного солевого раствора. Органический слой высушивали над MgSO4 и затем концентрировали при пониженном давлении с получением масла, которое очищали с помощью колоночной хроматографии, применяя CH2Cl2/EtOAc (80:20), с получением твердого вещества. Данное твердое вещество перекристаллизовывали из CH2Cl2/гексана с получением (S)-N-(4-циано-3-(трифторметил)фенил)-3-(4-фторфенокси)-2-гидрокси-2-метилпропанамида (формула X, 10,04 г, 92,2%) в виде бесцветного твердого вещества.
1H ЯМР (CDCl3/TMS) δ 1,59 (s, 3H, CH3), 3,36 (с, 1H, OH), 3,95 (д, J = 9,00 Гц, 1H, CH), 4,43 (д, J = 9,00 Гц, 1H, CH), 6,87–6,88 (м, 2H, ArH), 6,96-7,02 (м, 2H, ArH), 7,81 (д, J = 8,45 Гц, 1H, ArH), 7,94-7,98 (м, 1H, ArH), 8,10 (д, J = 1,79 Гц, 1H, ArH), 9,11 (с, 1H, NH). Расчетная масса: 382,31, [M-H]- 380,9. Температура плавления: 139-141оC.
Пример 14
Синтез (S) энантиомера формулы XIII

Синтез (2R)-3-Бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамида. Тионилхлорид (46,02 г, 0,39 моль) добавляли по каплям к охлажденному раствору (менее 4°C) R-18 (51,13 г, 0,28 моль) в 300 мл THF в атмосфере аргона. R-18, который является (R)-3-бром-2-гидрокси-2-метилпропановой кислотой, получали, как описано в примере 10. Полученную смесь перемешивали в течение 3 часов при тех же условиях. К данному добавляли Et3N (39,14 г, 0,39 моль) и перемешивали в течение 20 мин при тех же условиях. Через 20 мин добавляли 5-амино-2-цианобензотрифторид (40,0 г, 0,21 моль), 400 мл THF, а затем смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении с получением твердого вещества, которое обрабатывали с использованием 300 мл H2O и экстрагировали с использованием EtOAc (2 × 400 мл). Комбинированные органические экстракты промывали с использованием насыщенного раствора NaHCO3 (2 × 300 мл) и насыщенного солевого раствора (300 мл). Органический слой высушивали над MgSO4 и концентрировали при пониженном давлении с получением твердого вещества, которое очищали с помощью колоночной хроматографии, применяя CH2Cl2/EtOAc (80:20), с получением твердого вещества. Данное твердое вещество перекристаллизовывали из CH2Cl2/гексана с получением 55,8 г (73,9%) (2R)-3-бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамида (R-19) в виде твердого вещества светло-желтого цвета.
1H ЯМР (CDCl3/TMS) δ 1,66 (с, 3H, CH3), 3,11 (с, 1H, OH), 3,63 (д, J = 10,8 Гц, 1H, CH2), 4,05 (д, J = 10,8 Гц, 1H, CH2), 7,85 (д, J = 8,4 Гц, 1H, ArH), 7,99 (дд, J = 2,1, 8,4 Гц, 1H, ArH), 8,12 (д, J = 2,1 Гц, 1H, ArH), 9,04 (уш.с, 1H, NH). Расчетная масса: 349,99, [M-H]- 349.0. Температура плавления: 124-126°C.

Синтез (S)-N-(4-циано-3-(трифторметил)фенил)-3-(4-циано-3-фторфенокси)-2-гидрокси-2-метилпропанамида (формула XIII). Смесь бромамида ((2R)-3-бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамида, R-19 (2,0 г, 5,70 ммоль), безводного K2CO3 (2,4 г, 17,1 ммоль) в 50 мл ацетона нагревали с обратным холодильником в течение 2 ч, а затем концентрировали при пониженном давлении с получением твердого вещества. Полученное твердое вещество обрабатывали с использованием 2-фтор-4-гидроксибензонитрила (1,2 г, 8,5 ммоль) и безводного K2CO3 (1,6 г, 11,4 ммоль) в 50 мл 2-пропанола, нагревали с обратным холодильником в течение 3 ч, а затем концентрировали при пониженном давлении с получением твердого вещества. Остаток обрабатывали с использованием 100 мл H2O и затем экстрагировали с использованием EtOAc (2 × 100 мл). Комбинированные EtOAc экстракты промывали с использованием 10% NaOH (4 × 100 мл) и насыщенного солевого раствора, последовательно. Органический слой высушивали над MgSO4 и затем концентрировали при пониженном давлении с получением масла, которое кристаллизовали из CH2Cl2/гексана с получением 0,5 г (23%) (S)-N-(4-циано-3-(трифторметил)фенил)-3-(4-циано-3-фторфенокси)-2-гидрокси-2-метилпропанамида в виде бесцветного твердого вещества.
1H ЯМР (CDCl3/TMS) δ 1,63 (с, 3H, CH3), 3,34 (уш.с, 1H, OH), 4,08 (д, J = 9,17 Гц, 1H, CH), 4,50 (д, J = 9,17 Гц, 1H, CH), 6,74 – 6,82 (м, 2H, ArH), 7,50-7,55 (м, 1H, ArH), 7,81 (д, J = 8,50 Гц, 1H, ArH), 7,97 (к, J = 2,03, 8,50 Гц, 1H, ArH), 8,11 (д, J = 2,03 Гц, 1H, ArH), 9,12 (с, 1H, NH). Расчетная масса: 407,1, [M+Na]+ 430,0. Температура плавления: 124-125°C.
Пример 15
Синтез (S) энантиомера формулы XIV
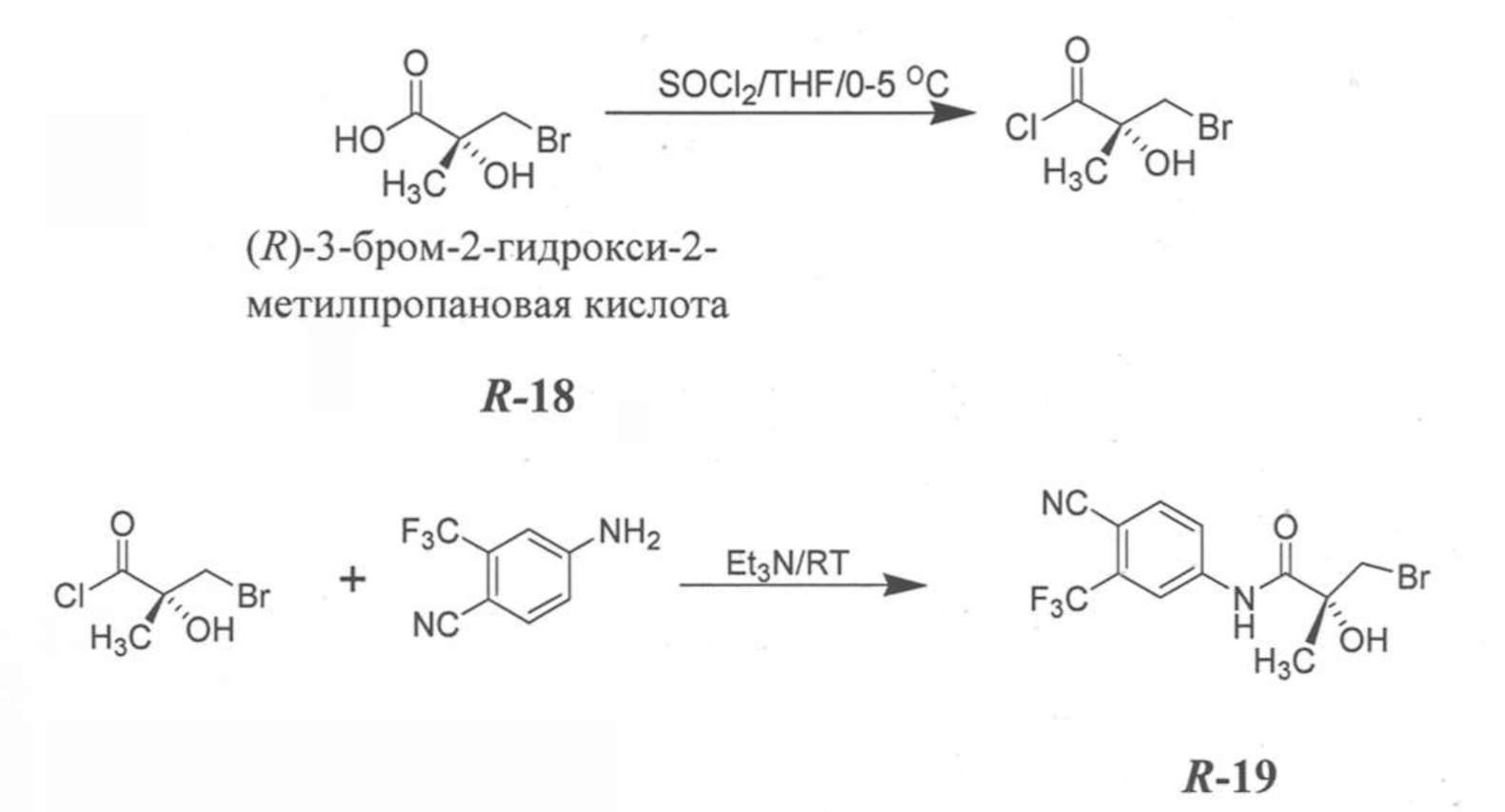
Синтез (2R)-3-бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамида. Тионилхлорид (46,02 г, 0,39 моль) добавляли по каплям к охлажденному раствору (менее 4°C) R-18 (51,13 г, 0,28 моль) в 300 мл THF в атмосфере аргона. R-18, который является (R)-3-бром-2-гидрокси-2-метилпропановой кислотой, получали, как описано в примере 10. Полученную смесь перемешивали в течение 3 часов при тех же условиях. К данному добавляли Et3N (39,14 г, 0,39 моль) и перемешивали в течение 20 мин при тех же условиях. Через 20 мин добавляли 5-амино-2-цианобензотрифторид (40,0 г, 0,21 моль), 400 мл THF, а затем смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении с получением твердого вещества, которое обрабатывали с использованием 300 мл H2O, экстрагировали с использованием EtOAc (2 X 400 мл). Комбинированные органические экстракты промывали с использованием насыщенного раствора NaHCO3 (2 X 300 мл) и насыщенного солевого раствора (300 мл). Органический слой высушивали над MgSO4 и концентрировали при пониженном давлении с получением твердого вещества, которое очищали с помощью колоночной хроматографии, применяя CH2Cl2/EtOAc (80:20), с получением твердого вещества. Данное твердое вещество перекристаллизовывали из CH2Cl2/гексана с получением 55,8 г (73,9%) (2R)-3-бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамида (R-19) в виде твердого вещества светло-желтого цвета.
1H ЯМР (CDCl3/TMS) δ 1,66 (с, 3H, CH3), 3,11 (с, 1H, OH), 3,63 (д, J = 10,8 Гц, 1H, CH2), 4,05 (д, J = 10,8 Гц, 1H, CH2), 7,85 (д, J = 8,4 Гц, 1H, ArH), 7,99 (дд, J = 2,1, 8,4 Гц, 1H, ArH), 8,12 (д, J = 2,1 Гц, 1H, ArH), 9,04 (уш.с, 1H, NH). Расчетная масса: 349,99, [M-H]- 349,0. Температура плавления: 124-126оC.

R-19
Синтез (S)-3-(4-хлор-3-фторфенокси)-N-(4-циано-3-(трифторметил)фенил)-2-гидрокси-2-метилпропанамид (формула XIV). Смесь бромамида ((2R)-3-бром-N-[4-циано-3-(трифторметил)фенил]-2-гидрокси-2-метилпропанамид, (R-19) 2,0 г, 5,70 ммоль), безводного K2CO3 (2,4 г, 17,1 ммоль) нагревали с обратным холодильником в течение 2 ч, а затем концентрировали при пониженном давлении с получением твердого вещества. Полученное твердое вещество обрабатывали с использованием 4-хлор-3-фторфенола (1,3 г, 8,5 ммоль) и безводного K2CO3 (1,6 г, 11,4 ммоль) в 50 мл 2-пропанола, нагревали с обратным холодильником в течение 3 ч, а затем концентрировали при пониженном давлении с получением твердого вещества. Остаток обрабатывали с использованием 100 мл H2O и затем экстрагировали с использованием EtOAc (2 X 100 мл). Комбинированные EtOAc экстракты промывали с использованием 10% NaOH (4 X 100 мл) и насыщенного солевого раствора, последовательно. Органический слой высушивали над MgSO4 и затем концентрировали при пониженном давлении с получением масла, которое очищали с помощью колоночной хроматографии, применяя EtOAc/гексан (50:50) с получением твердого вещества, которое перекристаллизовывали из CH2Cl2/гексана с получением 1,7 г (70,5%) (S)-3-(4-хлор-3-фторфенокси)-N-(4-циано-3-(трифторметил)фенил)-2-гидрокси-2-метилпропанамида в виде бесцветного твердого вещества.
1H ЯМР (CDCl3/TMS) δ 1,60 (с, 3H, CH3), 3,28 (с, 1H, OH), 3,98 (д, J = 9,05 Гц, 1H, CH), 6,64 – 6,76 (м, 2H, ArH), 7,30 (д, J = 8,67 Гц, 1H, ArH), 7,81 (д, J = 8,52 Гц, 1H, ArH), 7,96 (к, J = 2,07, 8,52 Гц, 1H, ArH), 8,10 (д, J = 2,07 Гц, 1H, ArH), 9,10 (с, 1H, NH). Расчетная масса: [M-H]- 414,9. Температура плавления: 132-134ºC.
Пример 16
Связывание и трансактивация sarm в клетках рака молочной железы
В целях определения, являются ли соединения по настоящему изобретению агонистами в клетках рака молочной железы, клетки HEK-293 или MDA-MB-231 трансфицировали с использованием 0,25 мкг GRE-LUC, 10 нг CMV-renilla LUC и 25 нг CMV-hAR, применяя липофектамин. Через двадцать четыре часа после трансфекции клетки обрабатывали DHT, соединением формулы VIII и соединением формулы IX и проводили люциферазный аналих через 48 часов после трансфекции. Конкурентное связывание DHT, соединения формулы VIII и соединения формулы IX измеряли, применяя in vitro анализ конкурентного связывания с радиолигандом с использованием [17α-метил-3H]-миболерона ([3H]MIB), известного стероидного и с высокой аффинностью лиганда AR, и очищенного белка AR-LBD.
Результаты
DHT, соединение формулы VIII и формулы IX являются агонистами AR в клетках рака молочной железы, как представлено на фигуре 13. Относительные значения аффинности связывания (RBA) с AR у DHT, формулы IX, формулы VIII и бикалутамида составляли 1,0, 0,330, 0,314 и 0,016, соответственно, демонстрируя связывание AR с высокой аффинностью для соединений SARM по данному изобретению.
Пример 17
Ингибирование внутриопухолевой экспрессии генов
Агонисты AR дифференциально регулируют гены в клетках AR-положительного и AR-отрицательного рака молочной железы. Клетки MDA-MB-231 и MCF-7, инфицированные аденовирусом, содержащим AR или GFP, поддерживали в среде, содержащей очищенную на активированном угле сыворотку, в течение 3 дней и обрабатывали DHT или соединением VIII. После обработки в течение ночи клетки собирали, изолировали РНК и проводили ПЦР в режиме реального времени для указанных генов. Экспрессию различных генов в ответ на DHT либо соединение VIII измерили и нормировали на GAPDH, и представили в виде сводных данных (одинаковые эффекты DHT и соединения VIII) в таблице 2.

VCAM1 – васкулярный белок клеточной адгезии-1 – важен для зависимого от культуральной подложки роста клеток, а также является хемоаттрактантом.
SPARC – секретируемый кислый белок, обогащенный цистеином (aka остеонектин) – внеклеточный гликопротеин, важный для ангиогенеза.
MUC1 – муцин 1 – внеклеточной гликопротеин, связанный со злокачественными новообразованиями,– его промотор обладает сильным ARE.
SLUG – фактор транскрипции с доменом типа "цинковый палец" – его промотор обладает сильным ARE.
MMP2 – матриксная металлопротеиназа-2 – ген, который активируется с помощью межклеточного кластерообразования.
В то время как некоторые отличительные признаки настоящего изобретения проиллюстрированы и описаны в данном документе, многие модификации, замены, изменения и эквиваленты станут возникать у обычных специалистов в данной области. Таким образом, следует понимать, что прилагаемая формула изобретения предназначена для охвата всех таких модификаций и изменений, которые находятся в пределах истинной сущности настоящего изобретения.
Реферат
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения субъекта, страдающего HER2-положительным раком молочной железы. Для этого субъекту вводят селективный модулятор андрогенного рецептора (SARM). Изобретение обеспечивает лечение HER2-положительного рака молочной железы у субъекта. 4 з.п. ф-лы, 14 ил., 4 табл., 17 пр.
Формула


Документы, цитированные в отчёте о поиске
Лечение рака молочной железы, негативного по трем рецепторам
Патенты аналоги
Лечение рака молочной железы, негативного по трем рецепторам

Комментарии