Дикалиевая соль n-(3-гидроксибензоил)таурина, обладающая антиагрегантной и антитромботической активностью в сочетании с церебропротективным действием - RU2730835C1
Код документа: RU2730835C1
Чертежи





Описание
Изобретение относится к новым водорастворимым производным 3-гидроксибензойной кислоты и таурина - дикалиевая соль N-(3-гидроксибензоил) таурина - и его применению как антиагрегантного и антитромботического средства.
По данным ВОЗ, тромбозы и связанные с ними осложнения являются одной из наиболее частых причин инвалидности и смертности в экономически развитых странах. По сообщениям специалистов, изучавших данную проблему, частота тромбозов нативных фистул составляет 7-25% в год, сосудистых протезов - до 50% в год. Распространенность тромбозов и их негативное влияние на показатели здоровья и смертность населения обосновывают актуальность исследований, изучающих этиологические и патогенетические факторы внутрисосудистого тромбообразования. Очевидно, что идентификация значимых факторов риска тромбозов способствует разработке дифференцированных подходов и новых лекарственных средств для профилактики образования и лечения.
Особое значение профилактика тромбозов приобретает в неврологической практике, а именно при терапии и реабилитации пациентов, перенесших острое нарушение мозгового кровообращения или живущих с хроническим его формами. Ишемические повреждения, возникающие вследствие острых и хронических нарушений мозгового кровообращения, приводят к нарушению эндотелиальной функции и сосудисто-тромбоцитарного звена системы гемостаза, следствием чего является прогрессирующее снижение мозговой гемодинамики и повышение риска повторной окклюзии и нарастания ишемических поражений мозга.
Известны средства, обладающие аниагрегантной и антитромбогенной активностью. По этим видам активности наиболее близким (прототипом) является ацетилсалициловая кислота (АСК), обладающая, антиагрегантной и антитромботической активностью.
Средства, обладающие аниагрегантной активностью - пентоксифилин, ацетилсалициловая кислота, тиклопидин, дипиридамол, клопидогрел [Реестр лекарственных средств России 2019].
Как известно, основная причина смерти больных сахарным диабетом его сердечно-сосудистые осложнения. Ключевую роль в их развитии играют эндотелиальная дисфункция, дислипидемия и повышенная агрегация тромбоцитов. Обнаружено, что таурин способен связывать липидные гидроперекиси, нарушающие целостность эндотелия, и таким образом предотвращать апоптоз клеток, а также развитие эндотелиальной дисфункции [Новые N-гидроксибензоил производные таурина Брель А.К., Лисина С.В., Будаева Ю.Н., Попов С.С., Верхоляк Д.В; Анциферов М.Б. Роль таурина и его дефицита в организме человека и животных. Фарматека. 2012. №.16. C. 60;Franconi F, Miceli М, Fazzini A, et al. Taurine and diabetes - humans and experimental models. Adv Exp Med Biol 1996; 403:579-82].
Цель изобретения заключается в получении высокоэффективного водорастворимого производного дикалиевой соли N-(3-гидроксибензоил) таурина, сочетающего основные терапевтические эффекты, присущие антиагрегантным, антитромботическим и церебропротективным средствам.
Сущность изобретения заключается в синтезе дикалиевой соли N-(3-гидроксибензоил) таурина формулы

и использования его в качестве антиагрегантного, антитромботического средства с дополнительным церебропротективным действием.
Пример 1. Дикалиевая соль N-(3-гидроксибензоил) таурина.
Первый этап: получение N-(3-гидроксибензоил)таурина. В реактор, снабженный мешалкой, помещают раствор 2-аминоэтансульфоновой кислоты (таурина) в 25.00 мл воды и приливают 6 н. раствор гидроксида натрия. По каплям, в раствор глицина прикапывают хлорангидрид 3-гидроксибензойной кислоты в течение 1.5 ч при охлаждении. Затем реакционную смесь перемешивают еще 1.5 ч (при охлаждении), контролируя рН среды (рН>7). Полученную смесь выливают в лед и подкисляют хлороводородной кислотой до рН=5, выпавшие кристаллы перекристаллизовывают из изопропанола, отфильтровывают и сушат. Выход 33.8%. Т пл. = 199-201°С, Rf = 0.636 (н-бутанол - этанол - вода = 5:2:1). ЯМР 1Н, м. д. (ДМСО): 6,95-7.33 м (4Н, ароматические), 7.50-7.83 м (1Н, NH), 9.81 с (1Н, Ph-OH и SO2-OH), 2.67-3.02 м (4Н, С2Н4). Для C9H11NO5S найдено, %: С (44,09), Н (4,55), N (5.69); S (13.05); вычислено, %: С (44.08), Н (4.52), N (5.71), S (13.07).
Второй этап: получение дикалиевой соли N-(3-гидроксибензоил) таурина. В 3-гордый реактор снабженный мешалкой, обратным холодильником и термометром, загружают 4.60 г (100 ммоль) этилата калия, 100,00 г бензола 12.26 г (50 ммоль) N-(3-гидроксибензоил) таурина и перемешивают при температуре 100°С в течение 30 мин. После охлаждения продукт отделяют фильтрованием, промывают небольшим количеством спиртового раствора щелочи и сушат. Выход 94.5%. Т. разл. = 275°С.
Найдено, %: С 33.61; Н 2.79; К 24.31; N 4.33; О 24.86; S 9.97. Вычислено, %: С 33.63; Н 2.82; К 24.33; N 4.36; О 24.89; S 9.98.
Пример 2. Исследование антитромбоцитарной активности дикалиевой соли N-(3-гидроксибензоил) таурина.
Изучение влияния соединения на агрегационную активность выполнялось по методу Born G. в модификации Габбасова В.А. (1989) на двухканальном лазерном анализаторе агрегации тромбоцитов «Биола» 220LA (Россия). Патентуемое вещество добавляли в кровь, полученную от интактных, старых (3 года) и животных с алаксановой моделью сахарного диабета.
Исследования проводились на богатой тромбоцитами плазме крыс по способу, описанному Люсовым В.А., Белоусовым Ю.Б. (1971). Для данного исследования кровь забирали из брюшной аорты крыс, стабилизировали 3,8% раствором цитрата натрия в соотношение с кровью 9:1, а затем центрифугировали в течение 10 мин при 1000 об/мин на центрифуге СМ-6м (ELMI, Латвия). Для получения бедной тромбоцитами плазму центрифугировали при 3000 об/мин в течение 15 мин. В основе данного метода исследования лежит регистрация изменения светопропускания богатой тромбоцитами плазмы при добавлении к ней индукторов агрегации, а также анализе флюктуаций светопропускания образца суспензии, вызванных случайным изменением количества частиц в оптическом анализе прибора. Важным условием агрегации тромбоцитов является механическое перемешивание плазмы (800 об/мин), которое проводилось с помощью магнитной мешалки, прилагаемой к агрегометру. Предварительно, перед началом эксперимента, проводилась калибровка агрегометра по двум точкам с использования ЭДТА. При этом за 0% принималось светопропускания бедной тромбоцитами плазмы, а за 100% - богатой тромбоцитами плазмы. Для получения контрольных проб в ходе эксперимента в кювету анализатора вводили 300 мкл богатой тромбоцитами плазмы и 10 мкл индуктора агрегации тромбоцитов АДФ (Sigma Aldrich, USA), в конечной концентрации 5 мкМ. Для изучения антиагрегантой активности патентуемого соединения in vitro в кювету с 270 мкл богатой тромбоцитами плазмы добавляется 30 мкл раствора дикалиевой соли N-(3-гидроксибензоил) таурина в концентрациях от 10-4 до 10-8М. Пробы инкубировали в термостатируемых ячейках агрегометра при 37°С в течение 5 мин.
При изучении антиагрегантной активности соединений in vivo животным, которым за 2 часа до исследования внутрижелудочно с помощью металлического атравматического зонда вводили дикалиевую соль N-(3-гидроксибензоил) таурина и ацетилсалициловую кислоту. Контрольной группе животных вводился растворитель в эквивалентном объеме. Пробы инкубировали в термостатируемых ячейках агрегометра при 37°С в течение 5 мин.
После включения агрегатограммы, в кювету добавляли АДФ на 10 секунде регистрации процесса. В качестве препарата сравнения использовали АСК. В ходе регистрации процесса агрегации тромбоцитов в течение 5 мин.
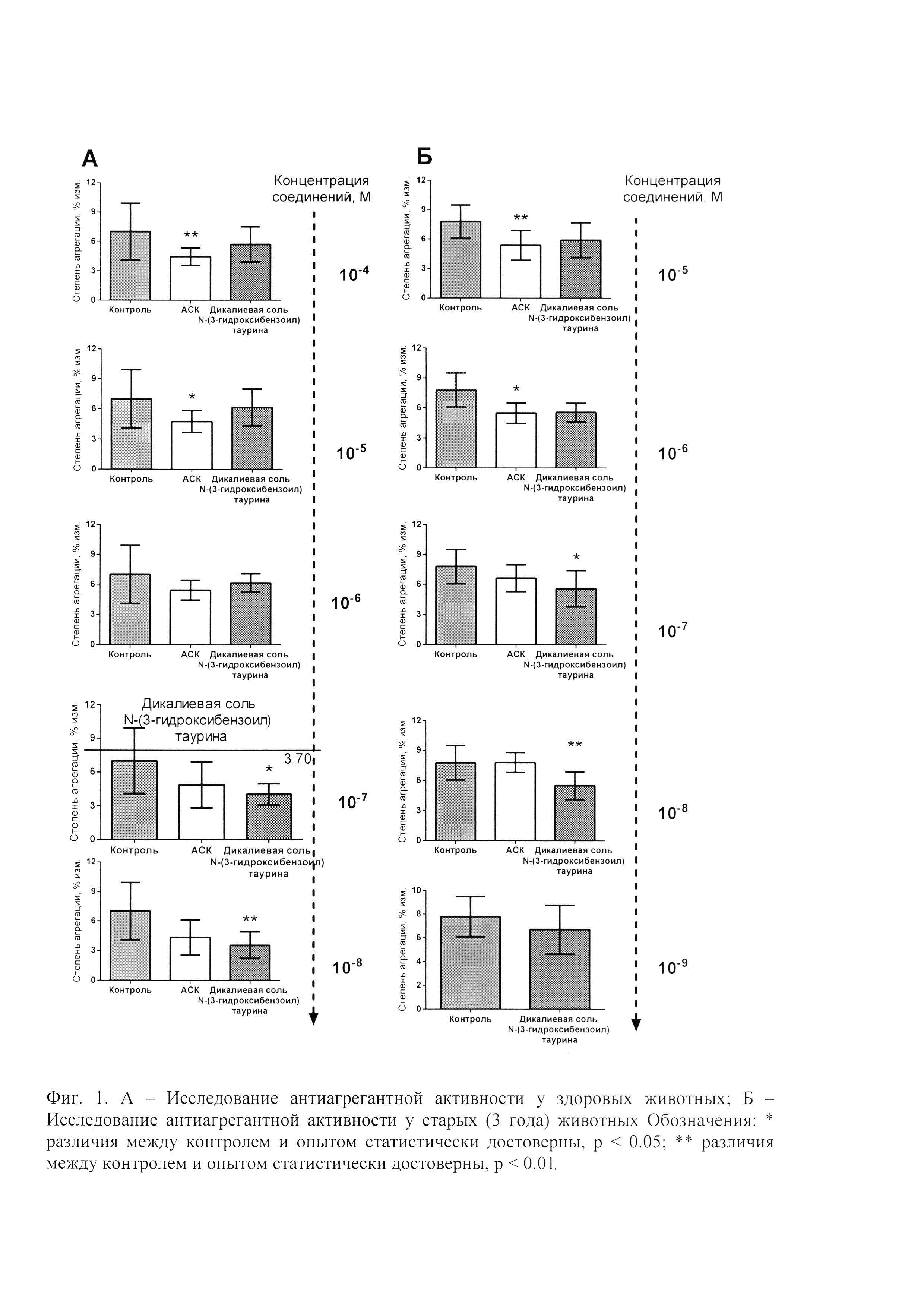
Патентуемое соединение - дикалиевая соль N-(3-гидроксибензоил) таурина - обладает антитромбоцитарной активностью на модели АДФ -индуцированной агрегации тромбоцитов в крови полученной от интактных и старых (3 года) животных. У животных итактной группы степень агрегации тромбоцитов составляла 7,01±0,49%, тогда как этот показатель при добавлении АСК в концентрациях 10-5М, 10-6М 10-7М, 10-8М составил 4.77±0.33, 5.43±0.31, 4.88±0.64 и 4.33±0.73 соответственно, что на 32%, 23%, 30% и 38% меньше референтных значений. При добавлении к плазме интактных животных раствора патентуемого соединения в аналогичных с АСК концентрациях были получены следующие значения степени агрегации 6.16±0.68, 6.16±0.41, 4.05±0.38, 3.56±0.51, что на 12.1%, 12.2%, 42.3% и 49.3% меньше референтных значений (Фиг. 1А).
У 3 годовалых (старых) животных контрольной группы степень агрегации тромбоцитов составляла 7.78±0.43%, тогда как при добавлении АСК этот показатель снижался. Так добавление АСК в плазму в концентрациях 10-5М снижало показатель агрегации до 5.36±0.53, 10-6М до 5.49±0.36, 10-7М до 6.44±0.47, что на 31%, 29.5% и 17% соответственно меньше референтных значений. Добавление АСК в концентрации 10-8М не оказывало антиагрегантного действия. При добавлении к плазме, полученной из крови старых животных раствора патентуемого соединения в аналогичных АСК концентрациях были получены следующие значения степени агрегации 10-5М - 5.88±0.59, 10-6М - 5.55±0.37, 10-7М - 5.58±0.53, 10-8М - 5.50±0.39, что на 24%, 28.6%, 28.3% и 29.3% меньше референтных значений (Фиг. 1 Б). Таким образом, дикалиевая соль N-(3-гидроксибензоил) таурина обладает антитромбоцитарной активностью на модели АДФ - индуцированной агрегации тромбоцитов у интактных молодых и старых животных.
Результаты исследования аниагрегантной активности у старых животных in vivo,
В крови полученной от старых животных степень агрегации в контрольной группе составила 9.1±1.4, у животных, получавших АСК 2.7±0.5, что на 70% меньше, чем у контрольной группы. При введение дикалиевой соли N-(3-гидроксибензоил) таурина были получены следующие значения степени агрегации 244.0±0.3, что на 73% меньше, чем у контрольной группы и на 11% меньше, чем у группы с препаратом сравнения (Фиг. 2 А).
На основании полученных данных можно заключить, что при пероральном введении 3 летним животным дикалиевой соли N-(3-гидроксибензоил)таурина обладает антитромбоцитарной активностью на модели АДФ - индуцированной агрегации тромбоцитов.
Результаты исследования аниагрегантной активности у кроликов.
Эксперименты выполнены на кроликах-самцах породы Шиншилла, кровь забирали из ушной краевой вены. У животных контрольной группы степень агрегации тромбоцитов составляла 4.6±0.7%, при добавлении к плазме патентуемое соединение в концентрациях 10-6М, 10-7М и 10-8М были получены следующие значения степени агрегации в концентрации 3.2±0.2, 2.2±0.3, 2.4±0.4 соответственно, что было на 30%, 51% и 47%, меньше референтных значений (Фиг. 2 В).
Таким образом, можно сделать вывод о том, что дикалиевая соль N-(3-гидроксибензоил) таурина на модели АДФ - индуцированной агрегации тромбоцитов у кроликов обладает антитромбоцитарной активностью.
Результаты исследования времени кровотечения.
Среднее время кровотечения (Фиг. 2 Д) из хвостовой вены крыс контрольной группы составило 177.1±17.5 сек. В группе животных получавших ацетилсалициловую кислоту среднее время кровотечения составило 320±18.3 сек, что на 81% больше, чем у контрольной группы. В группе животных, получавших дикалиевую соль N-(3-гидроксибензоил) таурина среднее время кровотечения составило 237±11.5 сек, что на 34% больше, чем у контрольной группы, но на 26% меньше, чем у животных, которым вводили препарат сравнения АСК.
На основании полученных данных можно предположить, что у дикалиевой соли N-(3-гидроксибензоил) таурина не будет сильно выражен побочный эффект в виде кровотечений.
Пример 3. Исследование антитромбогенной активности дикалиевой соли N-(3-гидроксибензоил) таурина.
Данное исследование проводилось in vivo на модели артериального тромбоза, индуцированного аппликацией 50% раствора хлорида железа (III) на сонную артерию крыс, согласно методу Kurz K.D (1990). Изучаемые соединения вводились животным внутрижелудочно. Через 60 мин после введения веществ, животных наркотизировали хлоралгидратом (внутрибрюшинно, 400 мг/кг). Для получения доступа к сонной артерии, послойно вскрывали кожу и ткани на шее животного, после чего, отделяя блуждающий и симпатические нервы, отпрепаровывали сонную артерию на 3 см в длину и укладывали пленку Parafilm для изоляции окружающих тканей. На участок сосуда длиной примерно 1 см помещали ватный диск размером 2 мм × 8 мм, предварительно смоченный 50% раствором хлорида железа (III) (0.025 мл). Исследование проводили с использованием ультразвукового допплерографа («Мини-Макс Допплер», Санкт-Петербург, РФ). Ультразвуковой датчик прибора устанавливали на артерию у ватного диска ближе к голове. Регистрация кровотока проводилась до полной окклюзии сосуда тромбом.
Сахарный диабет моделировали путем интраперитонеального введения аллоксана 120 мг/кг после 12 часового голодания. В эксперимент включали животных, у которых в течение 14 дней после введения аллоксана отмечалась гипергликемия (концентрация глюкозы в крови натощак 18-22 ммоль/л). Концентрацию глюкозы в крови измеряли портативным глюкометром Bayer CS и тест полосок к нему.
Обработка данных производилась с помощью пакетов программ «Statistica 6.0» (StatSoft, США), Excel из пакета Office ХР (Microsoft, США) и Graph.Pad.Prism 6.0 (США).
Уровень кровотока (Таблица 1) в сонной артерии крыс контрольной группы составлял 13.0±2.65 мл/мин. После аппликации хлорида железа на поверхность сонной артерии у всех животных происходило полное прекращение кровотока по сосуду. Среднее время полной остановки кровотока до нуля составило 1089.57±37.79 секунд. Значение исходного кровотока у крыс получавших АСК 7.5±0.68 мл/сек, время полной окклюзии 1245.43±197.70, что на 14% больше, чем у животных в контрольной группе. Патентуемое соединение N-(3-гидроксибензоил) таурин исходный кровоток составлял 8.7±0.35 мл/мин, время полной окклюзии 1439.17±336.58 сек, что на 32% больше, чем у животных в контрольной группе (Таблица 1). Таким образом, N-(3-гидроксибензоил)таурин вызывает увеличение времени образования тромба по сравнению с группой контрольных животных и обладает антитромбогенной активностью (Фиг. 2 Б, Г, Е).
Использование дикалиевой соли N-(3-гидроксибензоил)таурина вызывает увеличение времени образования тромба по сравнению с группой контрольных животных и обладает выраженной антитромбогенной активностью.
Пример 4. Определение церебропротективного действия на модели необратимой окклюзии общих сонных артерий.
Церебропротективное действие патентуемого соединения изучали при его курсовом терапевтическом внутрижелудочном (однократно в сутки, первое введение осуществлялось после выхода животных из наркоза) введении животным с перевязанными общими сонными артериями. Операцию по моделированию ишемии головного мозга проводили под общей анестезией (хлоралгидрат 400 мг/кг, в/бр). Гибель животных регистрировали на первые (24 часа) и последние (72 часа) сутки после операции. Поведению в тестах УРПИ и ТЭИ обучали за сутки до операции, а повторно через 72 часа после перевязки артерий. Сенсомоторную функция животных оценивали в тестах «Ротарод» и «Адгезивный тест», которые проводили через 24 и 72 часа после моделирования ишемии головного мозга. Двигательную (количество пересеченных секторов) и ориентировочно-исследовательскую (сумма актов вставания на задние лапы и заглядываний в отверстия имитирующие норки) активности оценивали в тесте «открытое поле» через 72 часа после операции.
Перевязка общих сонных артерий, очевидно, приводила к ишемии головного мозга, в результате которой отмечалась гибель животных во всех группах. Больше всего крыс погибло в группе плацебо (физиологический раствор). Так через 24 после операции в ней погибло 3 животных и еще 3 к 72 часу наблюдения. Терапевтическое введение дикалиевой соли N-(3-гидроксибензоил)таурина (25 мг/кг) и препаратов сравнения ацетилсалициловой кислоты (50 мг/кг) и кавинтона (3.2 мг/кг) в некоторой степени препятствовало гибели животных. Так через сутки после операции в этих группах погибло по 2 животных, а через 72 часа общая летальность в группе патентуемого соединения составила 3 крысы, АСК - 5 и кавинтон - 5 крыс. Таким образом, пероральное терапевтическое введение патентуемого соединения животным с перевязанными сонными артериями более выраженно чем АСК и кавинтон препятствует гибели экспериментальных животных.
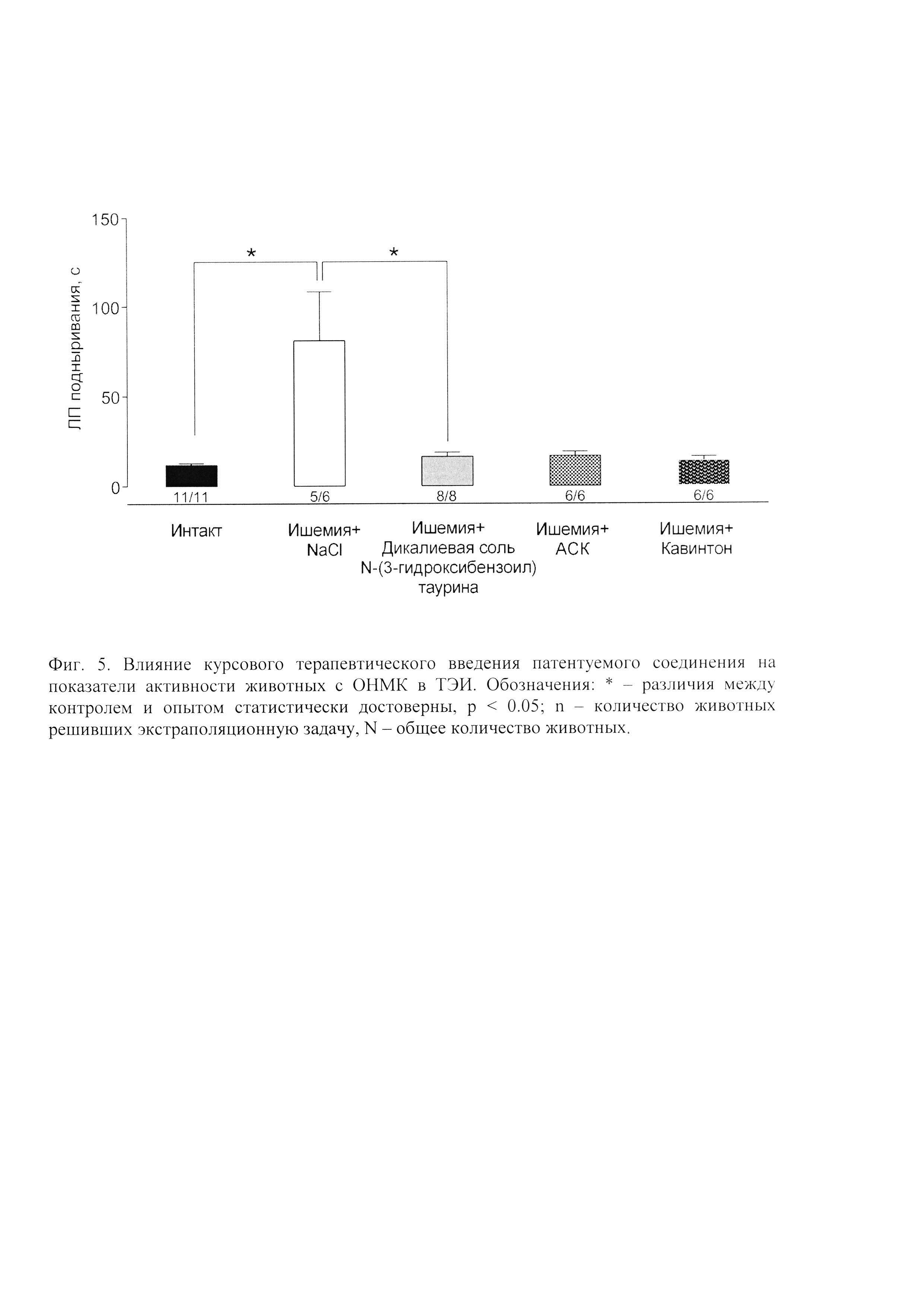
У животных с перевязанными общими сонными артериями через 72 часа после операции значительно снижалась двигательная и ориентировочно-исследовательская активности были ниже, в то время как курсовое введение дикалиевой соли N-(3-гидроксибензоил) таурина и препаратов сравнения, очевидно, несколько ограничивало развитие ишемии. Количество поведенческих актов, свидетельствующих о двигательной и ориентировочно-исследовательской активности, были значительно выше, чем у животных получавших плацебо (Фиг. 3). Ишемия головного мозга вызывала нарушения памяти у животных. Так крысы, которым внутрибрюшинно вводили плацебо быстрее и в большем количестве забывали о электроболевом раздражении в темном отсеке установки УРПИ (Фиг. 4), дольше и в меньшем количестве вспоминали о решении экстраполяционной задачи в ТЭИ (Фиг. 5). Курсовое введение дикалиевой соли N-(3-гидроксибензоил) таурина, АСК и кавинтона приводило к сохранению памяти, так они медленнее и в меньшем количестве посещали темный отсек установки УРПИ и быстрее контрольных решали экстраполяционную задачу в ТЭИ (Фиг. 5).
Пероральное введение дикалиевой соли N-(3-гидроксибензоил)таурина, АСК и кавинтона животным с перевязкой общих сонных артерий улучшало чувствительность передних конечностей и мелкой моторики, что выражалось в более быстром обнаружении и удалении инородного предмета с плантарной поверхности лап, чем у крыс, которым моделировали ишемию и вводили плацебо (Фиг. 6).
Результаты тестирования двигательной активности, цепкости и работоспособности животных в тесте Ротарод показали, что животные интактной группы суммарно дольше тех, кому смоделировали ОСА ходили на вращающемся стержне. Показатели животных, которым смоделировали ОСА, через сутки и 72 часа протестировали на установке Ротарод, существенно не отличались между собой. Повторное тестирование животных показало, что курсовое дикалиевой соли N-(3-гидроксибензоил) таурина позволило повысить общее время удержания животных на вращающемся стержне более чем в два раза (Фиг. 7 А) и более выраженно, чем в группе животных, которые получали АСК или кавинтон (Фиг. 7 Б).
Таким образом, курсовое пероральное введение животным с перевязанными общими сонными артериями дикалиевой соли N-(3-гидроксибензоил)таурина способствует выживаемости животных, сохранению у них высокой двигательной и ориентировочно-исследовательской активности, памяти тактильной чувствительности, мелкой моторики, цепкости и координации движений, что свидетельствует о выраженной церебропротективной активности патентуемого соединения.
Пример 5. Определение острой токсичности.
Острую суточную токсичность при однократном введении изучали на мышах-самках массой 30-40 г. Патентуемое соединение в виде водного раствора животным вводили однократно, в возрастающих дозах, внутрибрюшинно и внутрижелудочно. Наблюдение за животными вели в течение суток, отмечая количество погибших и животных с симптомами интоксикации (отсутствие движений, аномальное дыхание, тремор, гиперсаливация и подобные признаки общетоксического действия). Расчет LD50 проводили методом пробит анализа.
Исследования острой токсичности показали, что по классификации токсичности веществ при их введении под кожу и в брюшную полость животных заявляемое вещество относится к классу малотоксичных (таблица 3).



Реферат
Изобретение относится к водорастворимому производному дикалиевой соли N-(3-гидроксибензоил) таурина, которое обладает антиагрегантным и антитромботическим действием, проявляет церебропротективные свойства. 3 табл., 5 пр., 7 ил.
Формула


Комментарии