Регенерация кислых хроматных растворов методом мембранного электролиза - RU2723177C1
Код документа: RU2723177C1
Описание
Использование: в гальваническом производстве.
Изобретение относится к способу регенерации (восстановления работоспособности) кислых хроматных растворов, например, пассивации, осветления, в том числе содержащих ионы щелочных металлов, методом мембранного электролиза.
Предлагаемый способ позволяет регенерировать кислые хроматные растворы пассивации, осветления, в том числе содержащие ионы щелочных металлов. Кислые хроматные растворы осветления и пассивации применяются, соответственно, для подготовки металлической поверхности и для получения противокоррозионной хроматной пассивационной пленки на поверхности гальванически осажденных металлических покрытий чаще всего из цинка или кадмия.
Цель изобретения: разработать способ регенерации кислых хроматных растворов пассивации, осветления, в том числе содержащих ионы щелочных металлов методом мембранного электролиза. Способ должен обеспечивать высокую скорость регенерации часто используемых в промышленности кислых хроматных растворов осветления и пассивации.
Составы растворов пассивации весьма разнообразны, но основными компонентами хроматных растворов пассивации можно считать хромовую, серную и азотную кислоту, либо их натриевые или калиевые соли, при этом указанные соли и/или кислоты используются в различных концентрациях и в различных соотношениях друг с другом. Перед осуществлением процесса пассивации часто проводят процесс осветления металлического покрытия, полученного гальваническим путем, с целью сглаживания шероховатости и получения ровной поверхности. Процесс осветления проводят в растворах, содержащих, либо только азотную кислоту, либо ее смесь с серной и/или хромовой кислотой. Для совмещения (одновременного осуществления) процесса осветления и процесса пассивации в раствор пассивации вводят азотную кислоту или ее соль, при этом полученный раствор часто называется раствором осветления-пассивации. Растворы пассивации содержат Cr(VI) от нескольких единиц г/л до 50 и более г/л. Примеры составов, г/л: Na2Cr2O7 100-150, H2SO4 8-10; CrO3 80-100, H2SO4 3-4, HNO3 10-30; CrO3 4-10 (или Na2Cr2O7 25-35), Na2SO4 10-15, HNO3 3-7 [1].
Регенерация кислых хроматных растворов пассивации, не содержащих ионы щелочных металлов, к которым также можно отнести растворы осветления-пассивации, а также растворов осветления, методом мембранного электролиза известна и проводится в двухкамерном мембранном электролизере с использованием катионообменной мембраны и кислого католита [1], [2], [3]. Процесс не вызывает особых сложностей при его осуществлении. Ионы тяжелых металлов: меди, кадмия, хрома и цинка под действием электрического тока мигрируют из кислого обрабатываемого раствора - анолита через катионообменную мембрану в кислый католит, как правило, содержащий раствор серной кислоты, где восстанавливаются на катоде до металла при создании необходимых условий: рН католита, электродный потенциал катода и катодная плотность тока. Доля тока, переносимая ионами тяжелых металлов, мала, и, как правило, не превышает нескольких процентов по двум причинам: 1) в регенерируемом растворе высокая мольная эквивалентная концентрация намного более подвижных катионов водорода, 2) мольная эквивалентная концентрация удаляемых катионов металлов мала. Малая доля тока, переносимая ионами тяжелых металлов, обуславливает, по определению, низкую абсолютную и относительную скорость регенерации отработанного раствора пассивации или осветления. Необходимо отметить, что рН католита в течение длительного времени остается в области кислых значений. В процессе мембранного электролиза происходит удаление ионов тяжелых металлов из регенерируемого раствора с одновременным их замещением на эквивалентное количество катионов водорода, которые образуются на нерастворимом аноде при окислении молекул воды. Это приводит к уменьшению рН раствора до номинальных значений, отвечающих свежему раствору.
Регенерация методом мембранного электролиза кислых хроматных растворов пассивации и/или осветления-пассивации, а также осветления, содержащих ионы щелочных металлов, с использованием кислого католита будет происходить аналогично регенерации кислых хроматных растворов пассивации, осветления-пассивации, осветления, не содержащих ионы щелочных металлов, однако, осложняется следующими процессами:
1. Скорость удаления ионов тяжелых металлов из регенерируемого раствора через катионообменную мембрану в кислый католит весьма мала и уменьшается с уменьшением их концентрации, и также она значительно меньше скорости удаления ионов щелочных металлов. Удаление ионов щелочных металлов из регенерируемого раствора сопровождается заменой их эквивалентным количеством ионов водорода, что приводит к быстрому снижению рН регенерируемого раствора. Снижение рН ниже допустимых значений является критически важным, например, для растворов пассивации. В результате сочетания указанных выше двух процессов может получиться так, что в регенерируемом растворе рН уменьшится ниже минимума раньше, чем произойдет снижение концентрации удаляемых катионов тяжелых металлов (цинка, кадмия) до необходимых значений.
2. Быстрый расход катионов водорода в католите приводит к увеличению рН католита и связан с миграцией в католит катионов щелочных металлов, которые не восстанавливаются на катоде в водных растворах. Данный процесс приводит к достижению рН католита, соответствующему сначала слабокислым, затем нейтральным, а потом и щелочным значениям. При миграции в этих условиях через катионообменную мембрану катионов тяжелых металлов это приведет к образованию осадков нерастворимых гидроксидов тяжелых металлов в теле мембраны, что сопровождается блокированием мембраны и значительным падением напряжения на мембране. В этом случае скорость удаления ионов тяжелых металлов из регенерируемого раствора практически полностью прекращается.
С учетом сказанного выше, необходимо разработать такой способ регенерации кислых хроматных растворов пассивации, осветления-пассивации, осветления, содержащих ионы щелочных металлов, который решает указанные выше проблемы, а также отличается высокой степенью очистки, высокой скоростью процесса регенерации, использует рецикл применяемых химикатов и позволяет, по возможности, получать извлеченные примеси ионов тяжелых металлов в виде индивидуальных металлов или их соединений.
Сущность изобретения: к отработанному кислому хроматному раствору пассивации, осветления-пассивации, осветления добавляют твердый гидроксид натрия или калия или их водные растворы с концентрацией 1-40% мас. для достижения рН раствора 4-10 для осаждения нерастворимых хроматов и/или гидроксидов тяжелых металлов, осадки которых отделяют от обработанного таким образом раствора пассивации, осветления-пассивации, осветления фильтрованием. Реакции идут по уравнениям, например:


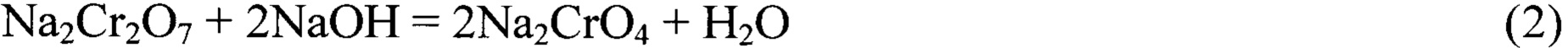


При добавлении щелочи сначала происходит нейтрализация серной кислоты (1) и азотной кислоты (1а), далее образование хромата натрия из бихромата натрия (2). Ионы тяжелых металлов: меди, кадмия, железа, хрома, цинка образуют нерастворимые осадки хроматов (3) или гидроксидов (4) или их смеси, которые отделяются фильтрованием. Удаление из раствора катионов тяжелых металлов позволяет в дальнейшем проводить обработку полученного раствора методом мембранного электролиза, при котором образуются растворы с противоположными значениями рН (щелочной и кислый раствор), не опасаясь при этом блокировки катионообменной мембраны гидроксидами тяжелых металлов в процессе электролиза.
Фильтрат, содержащий хромат натрия и сульфат натрия и еще нитрат натрия, если обрабатывается раствор осветления-пассивации или раствор осветления, подвергается мембранному электролизу, для чего фильтрат направляется в анодное пространство двухкамерного мембранного электролизера с катионообменной мембраной типа МК-40, МК-40Л или перфторированной катионообменной мембраной типа МФ4СК, где в качестве католита используется 1-40% масс. раствор гидроксида натрия или калия, в качестве катода - Ni, Fe при катодной плотности тока, iк=1-20 А/дм2. В процессе электролиза ионы натрия или калия из анолита, находящегося в анодном пространстве, мигрируют через катионообменную мембрану в католит, находящийся в катодном пространстве, где концентрация щелочи увеличивается. В анолите из раствора, содержащего хромат натрия и сульфат натрия и еще нитрат натрия, если обрабатывается раствор осветления-пассивации или раствор осветления, получают раствор, содержащий бихромат натрия и серную кислоту и еще азотную кислоту, если обрабатывается раствор осветления-пассивации или раствор осветления. В анодном пространстве электролиз ведут при анодной плотности тока, ia=1-20 А/дм2, при этом в качестве нерастворимого анода при отсутствии нитрат-ионов или азотной кислоты можно использовать Pt/Ti, Pt/Nb, а также PbO2/Pb как более дешевый и доступный материал, а в случае присутствия нитрат-ионов или азотной кислоты в концентрации не более 10-20 г/л можно использовать Pt/Ti, Pt/Nb. При наличии нитрат-ионов или азотной кислоты и, тем более, при присутствии нитрат-ионов или азотной кислоты в концентрации свыше 10-20 г/л рекомендуется использовать нерастворимый анод из PbO2, изготовленный согласно [4]. Результатами анализа периодически контролируют содержание в анолите бихромата натрия, серной или смеси серной и азотной кислот. Для расчетов конца электролиза также можно использовать изменение количества гидроксида натрия или калия в католите за время электролиза. По достижении номинальных значений концентрации бихромата натрия, серной или смеси серной и азотной кислот, соответствующих свежему раствору, электролиз прекращают. Часть раствора щелочи из катодного пространства используется повторно для протекания реакций (1)-(4) для регенерации новой порции отработанного кислого хроматного раствора пассивации, осветления-пассивации или осветления, а также для обработки осадка, содержащего хроматы тяжелых металлов, см. ниже.
Необходимо отметить, что, если технологический процесс, использующий кислые хроматные растворы пассивации, осветления-пассивации, осветления, не содержащие изначально в своем номинальном составе катионы щелочных металлов, допускает наличие солей натрия и калия (хроматов, нитратов, сульфатов) в составе этих растворов, то рассмотренным выше способом можно обрабатывать и кислые хроматные растворы пассивации, осветления-пассивации, осветления, не содержащие изначально в своем номинальном составе катионов щелочных металлов. В этом случае процесс удаления катионов натрия или калия проводится до достижения номинальной концентрации хромовой, серной и азотной кислот. Такое положение связано с тем, что для полной очистки раствора от катионов натрия или калия методом мембранного электролиза потребуется много времени.
Поскольку осадок, отделенный от регенерируемого раствора при его обработке щелочью, содержит токсичные и ценные компоненты (хроматы тяжелых металлов - меди, кадмия, железа, хрома и цинка), то его необходимо переработать с получением этих компонентов, желательно, в виде индивидуальных металлов или их соединений. Ниже приводится вариант селективной дробной переработки осадка с выделением различных компонентов.
Осадок, содержащий хроматы тяжелых металлов - меди, кадмия, железа, хрома и цинка, смешивается с ограниченным количеством раствора щелочи, в качестве которого, например, можно использовать раствор щелочи, накапливающийся в католите двухкамерного мембранного электролизера, см. выше, при этом из хроматов образуются соответствующие гидроксиды тяжелых металлов, например:

Реакция возможна, благодаря получению соединения с меньшим значением произведения растворимости [5].
После отделения раствора хромата натрия осадок гидроксидов тяжелых металлов смешивается с ограниченным количеством раствора щелочи и раствором пероксида водорода для окисления в щелочной среде гидроксида трехвалентного хрома до хромата натрия [6].
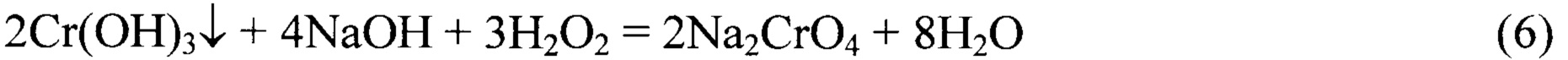
Избыток пероксида водорода самопроизвольно разлагается по реакции (7):

Раствор хромата натрия, полученный по реакции (5) и (6), можно добавить к раствору, находящемуся в анодном пространстве, при проведении процесса электромембранного синтеза раствора, содержащего бихромат натрия и серную кислоту или ее смесь с азотной кислотой из раствора, содержащего хромат натрия и сульфат натрия или его смесь с нитратом натрия. Данный способ позволяет вернуть в производственный цикл соединения шестивалентного хрома.
После отделения осадка смеси гидроксидов тяжелых металлов - меди, кадмия, железа и цинка от раствора хромата натрия, осадок промывается водой и обрабатывается избытком раствора гидроксида натрия. Гидроксид трехвалентного железа, гидроксид кадмия и подавляющая часть гидроксида меди остается в осадке и отфильтровывается. Фильтрат, содержащий цинкат натрия и следы купрата натрия, подвергается электролизу с нерастворимым анодом из никеля или железа. На катоде возможно раздельное выделение металлов - сначала выделяется осадок металлической меди, а потом металлического цинка [7-8], полученный раствор щелочи используется повторно для растворения гидроксида цинка.
После отделения гидроксида цинка, осадок, содержащий смесь гидроксидов тяжелых металлов - меди, кадмия, железа промывается водой и смешивается с водным раствором аммиака. Гидроксид трехвалентного железа остается в осадке и отделяется фильтрованием. Фильтрат, содержащий аммиачные комплексные соединения кадмия и меди, очищается от ионов меди, для чего фильтрат смешивается с эквивалентным количеством порошка металлического кадмия, получающийся в результате реакции осадок металлической меди отделяется фильтрованием. Образующийся фильтрат подвергается электролизу с нерастворимым анодом (графит), в процессе которого на катоде выделяется металлический кадмий и высвобождается эквивалентное количество аммиака [7-8]. Металлический кадмий используется повторно для выделения металлической меди. Получающийся раствор аммиака, не содержащий ионов кадмия и меди, используется повторно для растворения гидроксида кадмия и меди.
Приведенный вариант последовательной обработки осадка, содержащего хроматы ионов тяжелых металлов - меди, кадмия, железа, хрома и цинка позволяет получить индивидуальные металлы или их соединения.
Пример 1. К 250 мл отработанного кислого хроматного раствора пассивации на основе бихромата натрия и серной кислоты добавляли при перемешивании твердый гидроксид натрия до достижения рН получившегося раствора равного 7. Выпавший осадок, содержащий хроматы и гидроксиды тяжелых металлов - цинка, кадмия и трехвалентного хрома отделили фильтрованием. 200 мл получившегося фильтрата, содержащего 1 моль/л хромата натрия и 0,1 моль/л сульфата натрия, поместили в анодное пространство двухкамерного электролизера с катионообменной мембраной марки МК40Л. В катодное пространство этого же электролизера поместили 200 мл раствора гидроксида натрия с концентрацией 0,5 моль/л. В качестве катода использовали никель, iк=5 А/дм2, в качестве нерастворимого анода Pt/Nb, ia=5 А/дм2. Провели электролиз, который закончили после пропускания через электролизер количества электричества равного 11,6 Ач. После завершения электролиза раствор в католите содержит 1,8 моль/л гидроксида натрия, а раствор в анолите содержит 0,45 моль/л (117,9 г/л) бихромата натрия и 0,1 моль/л (9,8 г/л) серной кислоты, что отвечает составу свежеприготовленного кислого хроматного раствора пассивации, содержащего, в г/л: Na2Cr2O7 100-150, H2SO4 8-10.
Источники информации.
1. Виноградов С.С. Экологически безопасное гальваническое производство. / Под ред. проф. В.Н. Кудрявцева. - М.: Производственно-издательское предприятие " Глобус", 1998. - 302 с.
2. Тураев Д.Ю. Излечение катионов тяжелых металлов из кислых растворов методом мембранного электролиза // Оборонный комплекс - научно-техническому прогрессу России. 2008. №3. С. 59-64.
3. Тураев Д.Ю. Исследование устойчивости нерастворимого диоксидсвинцового титанового анода в процессе регенерации раствора осветления цинкового и кадмиевого покрытий методом мембранного электролиза // Гальванотехника и обработка поверхности. 2008. Т. 16. №2. С. 34-37.
4. Тураев Д.Ю. Способ изготовления электрода из диоксида свинца. Патент RU 2318080 С1 Россия. Заявлено 12.05.06. Опубликовано 27.02.08 Бюл. №6.
5. Краткий справочник по химии. Под общ. ред. Куриленко О.Д., Киев. Наукова думка, 1974, 991 с.
6. Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ. М. Химия. 2000, 480 с.
7. Справочник химика. т.3. Химическое равновесие и кинетика, свойства растворов, электродные процессы. М.-Л. 1965, 1004 с.
8. Справочник по электрохимии. Под A.M. Сухотина. - Л. Химия, 1981. - 488 с.
Реферат
Изобретение относится к способу регенерации кислых хроматных растворов пассивации, осветления-пассивации, осветления реагентно-мембранно-электролизным методом. К отработанному раствору добавляют твердый гидроксид натрия или калия или их водные растворы с концентрацией 1-40% масс. для достижения рН раствора 4-10 для осаждения нерастворимых хроматов и/или гидроксидов тяжелых металлов. Осадки отделяют от обработанного раствора фильтрованием. Полученный фильтрат подвергают мембранному электролизу, для осуществления которого фильтрат направляется в анодное пространство с нерастворимым анодом двухкамерного мембранного электролизера с катионообменной мембраной, где в католите находится катод и раствор гидроксида натрия или калия. По достижении номинальных значений в анолите концентрации бихромата натрия, серной или смеси серной и азотной кислот, соответствующих свежему раствору пассивации, осветления-пассивации или осветления, электролиз прекращают. Технический результат заключается в повышении степени очистки и скорости процесса регенерации, а также рецикле применяемых химикатов. 3 з.п. ф-лы.
Формула
Документы, цитированные в отчёте о поиске
Способ регенерации хроматных растворов пассивирования

Комментарии