Композиция, ингибирующая белки meis - RU2755212C2
Код документа: RU2755212C2
Чертежи





Описание
Область техники
Настоящее изобретение относится к композиции, ингибирующей белки MEIS, эффективные при пролиферации гемопоэтических стволовых клеток (HSC).
Предпосылки создания изобретения
Наиболее значимыми особенностями гемопоэтических стволовых клеток (HSC) являются способность к самообновлению и способность преобразовываться в клетки множества видов. Благодаря этим способностям HSC могут трансформироваться в клетки крови всех типов, сохраняя при этом способность к регенерации, необходимую для гемопоэтической активности организма в будущем. HSC, благодаря их способности к самообновлению, часто используются при трансплантации HSC для лечения гематологических заболеваний. Однако, даже если для этих трансплантаций найдены подходящие доноры, количество аллогенных HSC, полученных из источников таких как пуповинная кровь, не является достаточным для эффективной трансплантации. Поэтому для таких вариантов терапевтического применения необходимо проведение исследований по пролиферации HSC ex vivo. Кроме того, среди гемопоэтических клеток после применения методов генной регуляции, требуется отбор отдельных клеток и пролиферация этих клеток.
В некоторых применениях, описанных в литературе, было экспериментально обнаружено, что делеция генов сайленсинга HSC у мышей приводит к пролиферации HSC. Белок Meis1 представляет собой один из наиболее поразительных белков из числа этих мишеней, и его используют как терапевтическую мишень в технологиях пролиферации стволовых клеток.
Белки MEIS (Meis1, Meis2 и Meis3) состоят из различных доменов. Домен Pbx1 эффективен при взаимодействии и коактивации Meis1 с белком Pbx1. Этот домен расположен на аминокислотах 69-194 на N-конце белка Meis1. Другим важным доменом является домен трансактивации, который обычно содержит С-конец, содержащий аминокислоты 335-390. Другим важным доменом является домен гомеобокса (также называемый гомеодоменом), в честь которого названы эти белки. Размер этого домена составляет около 62 аминокислот у белка Meis1 и охватывает аминокислоты 272-335. Meis1-специфическая нуклеотидная последовательность белка Meis1 в ДНК позволяет ему связываться с TGACAG. Этот связывающий домен имеет белковую последовательность, которая защищена и одинакова в белках MEIS, то есть в белках Meis1, Meis2 и Meis3. Тот факт, что белки MEIS связываются с ДНК через этот домен и имеют Meis1-специфическую ДНК-связывающую нуклеотидную последовательность, делает гомеодомен идеальной мишенью для исследований ингибиторов.
Белки MEIS (Meis1, Meis2 и Meis3) принадлежат к семейству гомеобоксных белков, содержащих гомеодомен класса TALE. Гомеобоксные белки являются ядерными белками, и они главным образом функционируют как факторы транскрипции. Белок Meis1 также обладает способностью ингибировать клеточный цикл кардиомиоцитов при регенерации сердца.
Патентный документ США № US 20150353890 касается наборов, композиций и способов, необходимых для размножения эмбриональных гемопоэтических стволовых клеток и обеспечения гемопоэтической функции пациентам, нуждающимся в этом.
В ЕР 2236131 раскрыты способ и композиция для модуляции активности деацетилазных белков сиртуинов.
В WO 2015148716 раскрыты способы и композиции, полученные для ex vivo размножения человеческих гемопоэтических клеток/клеток-предшественников.
Краткое изложение сущности изобретения
Целью настоящего изобретения является создание композиции, ингибирующей белки MEIS (Meis1, Meis2 и Meis3), эффективные при пролиферации гемопоэтических стволовых клеток.
Другой целью настоящего изобретения является создание композиции, которая может легко проходить через клеточную мембрану и проявлять свою активность в клетке.
Еще одной целью настоящего изобретения является создание композиции, которая ингибирует активность белков MEIS дозозависимым образом.
Другой целью настоящего изобретения является создание композиции, которая индуцирует ex vivo размножение мышиных гемопоэтических стволовых клеток.
Другой целью настоящего изобретения является создание композиции, которая индуцирует ex vivo размножение гемопоэтических стволовых клеток пуповинной крови человека.
Другой целью настоящего изобретения является создание композиции, которая индуцирует ex vivo размножение человеческого костного мозга и периферических гемопоэтических стволовых клеток.
Еще одной целью настоящего изобретения является создание композиции, которая индуцирует размножение гемопоэтических стволовых клеток после регуляции генов в гемопоэтических клетках.
Другой целью настоящего изобретения является создание композиции, которая усиливает размножение гемопоэтических стволовых клеток путем осуществления ингибирования MEIS при доклинических исследованиях in vivo.
Другой целью настоящего изобретения является создание композиции, которая снижает экспрессию генов р21, Hif1a, Hif2a.
Еще одной целью настоящего изобретения является создание композиции, которая увеличивает количество колоний гемопоэтических стволовых клеток GEMM (гранулоцитов, эритроцитов, макрофагов, мегакариоцитов) в более чем 5 раз.
Другой целью настоящего изобретения является создание композиции, которая увеличивает количество предшественников эритроцитов.
Еще одной целью настоящего изобретения является создание композиции, которая ингибирует транскрипционную активацию белков MEIS.
Подробное описание изобретения
Настоящее изобретение представляет собой композицию, состоящую из малых молекул, ингибирующих белки MEIS, которые также эффективны при пролиферации HSC ex vivo и in vivo.
Белки Meis1, Meis2 и Meis3, представляющие собой белки MEIS, составляющие композицию, соответствующую настоящему изобретению, внесли значительный вклад в технологии пролиферации стволовых клеток, необходимые для трансплантации стволовых клеток.
* Ингибитор, который раскрыт в настоящем описании и который является предметом настоящего изобретения, кратко назван «MEISi-l», и на него ссылаются как на ингибитор MEIS-1.
* MEISi-2 означает ингибитор MEIS-2. Фигуры, имеющие отношение к "Композиции, ингибирующей белки MEIS", которая разработана для достижения целей настоящего изобретения, приведены в приложении, где
Фиг. 1 является графическим представлением информации об ингибировании активности р21-люциферазы с помощью MEISi-1;
Фиг. 2 является графическим представлением информации об ингибировании активности р21-люциферазы с помощью MEISi-2;
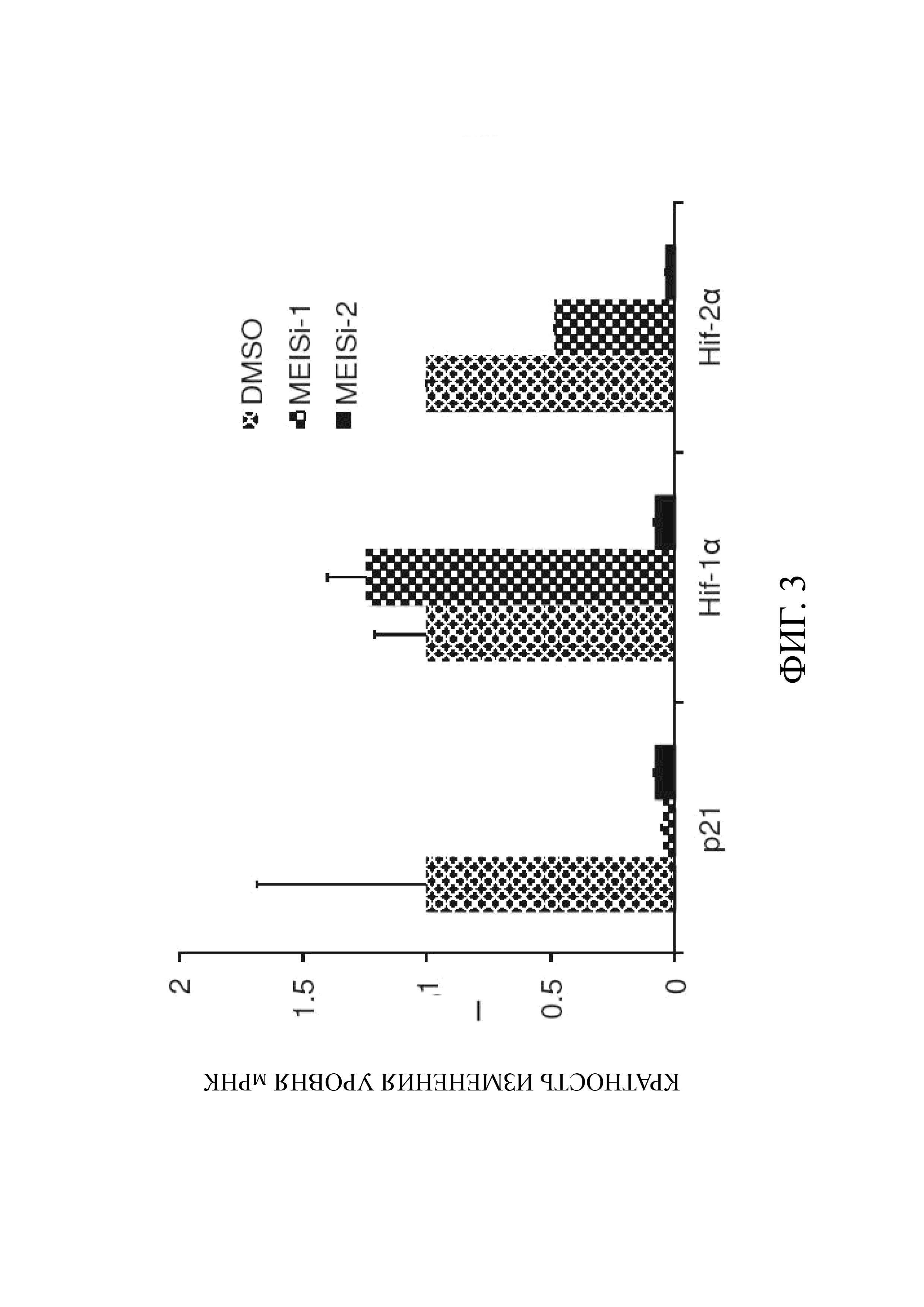
Фиг. 3 является графическим представлением информации ПЦР-исследования в реальном масштабе времени действия ингибиторов MEIS (MEISi-1 и MEISi-2) на пути Meis1 (р21, Hif1a, Hif2a);
Фиг. 4 является графическим представлением информации о воздействии ингибиторов MEIS через 7 дней после их введения на дозозависимую пролиферацию мышиных гемопоэтических клеток;
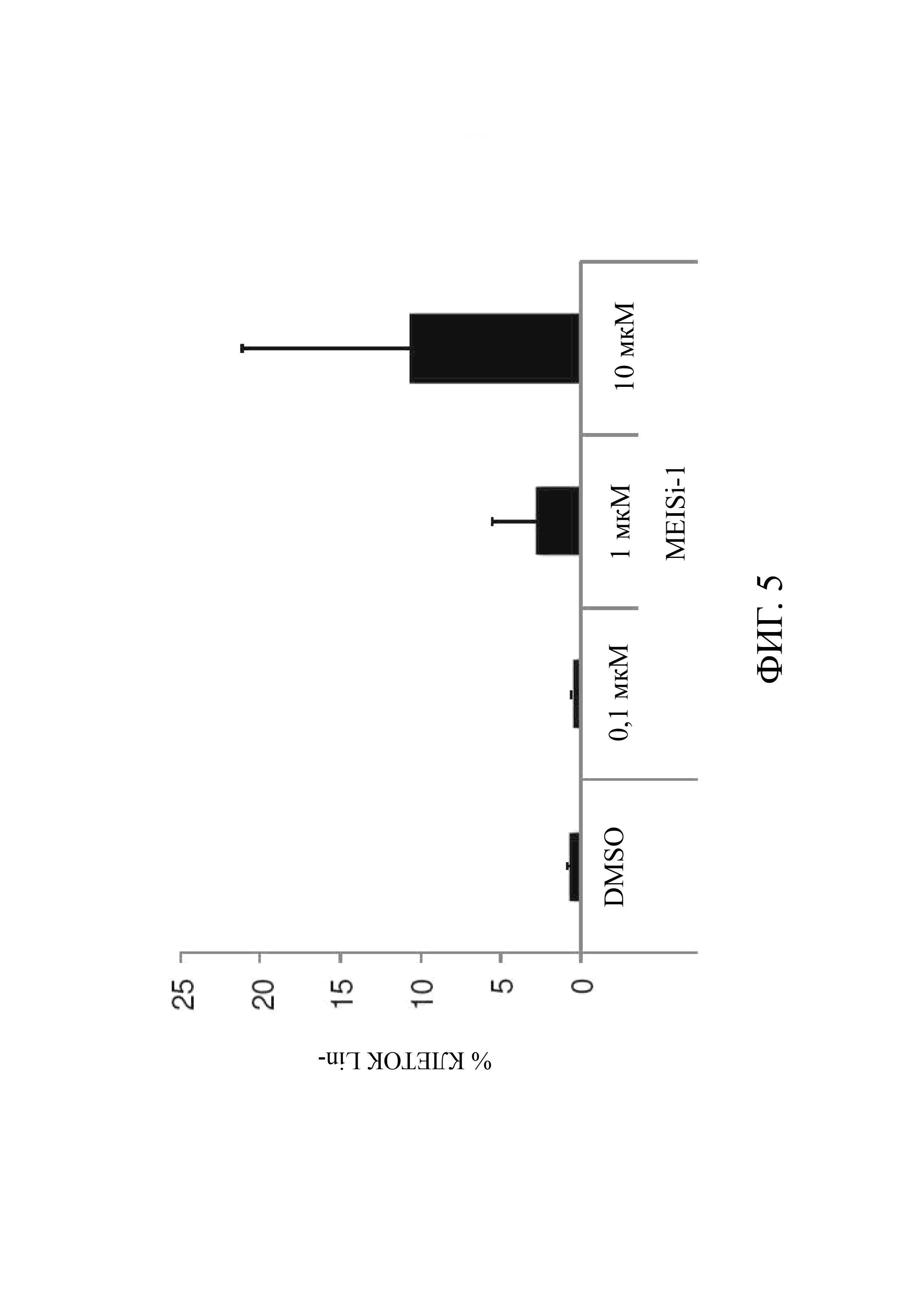
Фиг. 5 является представлением проточного анализа LSK (лейкемических стволовых клеток) в случае применения MEISi-1 на Lin-стволовых клетках и предшественниках, выделенных из костного мозга и полученных в результате магнитной сепарации, и их размножения с MEISi-1 через 7 дней;
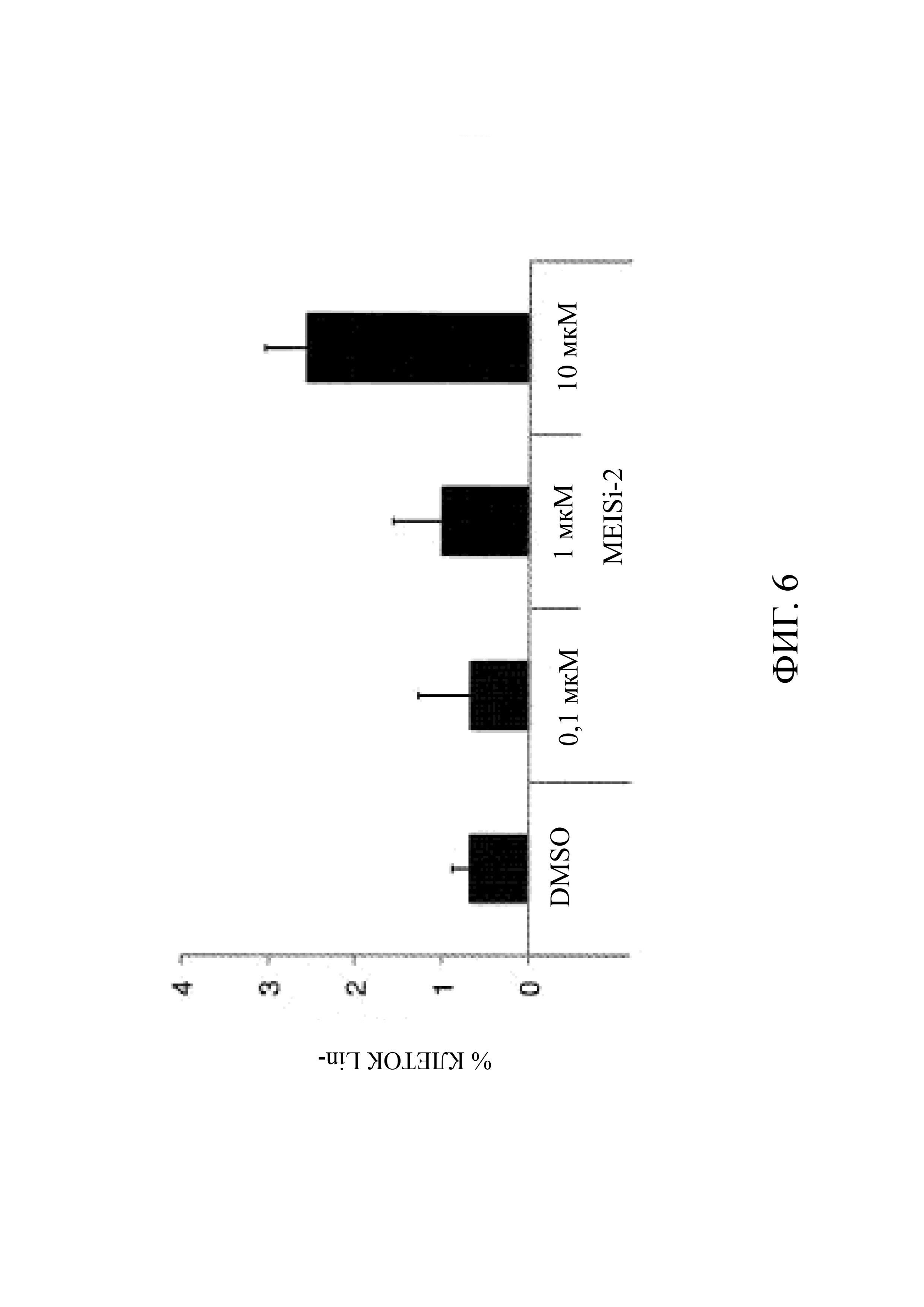
Фиг. 6 является представлением проточного анализа LSK (лейкемических стволовых клеток) в случае применения MEISi-2 на Lin-стволовых клетках и предшественниках, выделенных из костного мозга и полученных в результате магнитной сепарации, и их размножения с MEISi-2 через 7 дней;
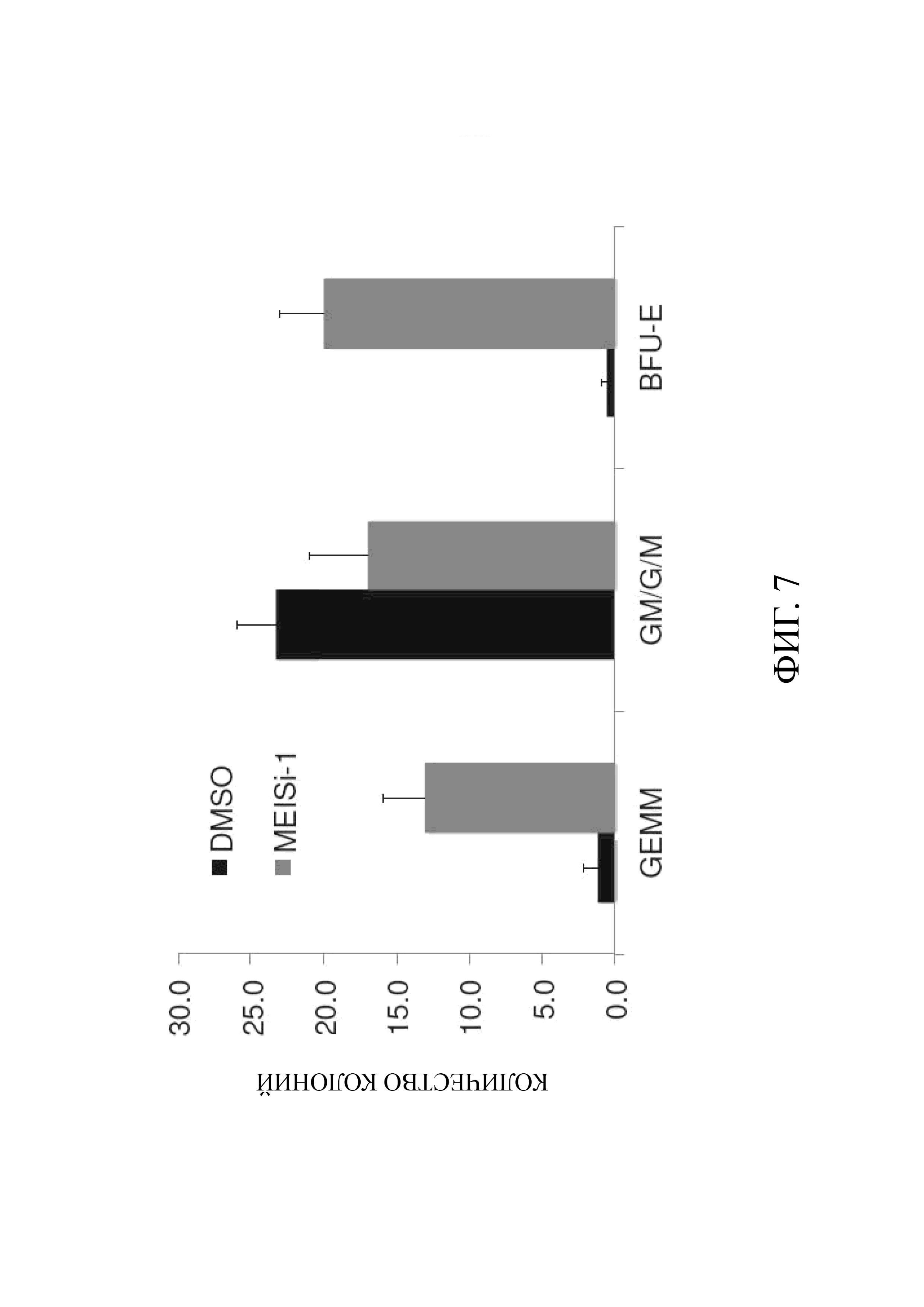
Фиг. 7 показывает функциональную пролиферацию in vitro мышиных HSC в экспериментах по определению КОЕ и соотношения различных образовавшихся колоний;
Фиг. 8 является графическим представлением результатов проточного анализа по подсчету клеток при воздействии ингибиторов MEIS на пролиферацию гемопоэтических клеток человека;
Антитела против (A) CD34+, (В) CD133+, (С) CD34+ CD133+, (D) ALDHbr;
Фиг. 9 показывает результат проточного анализа функциональной пролиферации in vivo последующих клеток через 10 дней после подкожного введения мышам ингибиторов MEIS MEISi-1 и MEISi-2;
(A) гемопоэтических стволовых клеток с низким содержанием LSKCD150+CD48 (LSKCD150+CD48-low HSC);
(B) гемопоэтических стволовых клеток с низким содержанием LSKCD34 (LSKCD34-low HSC).
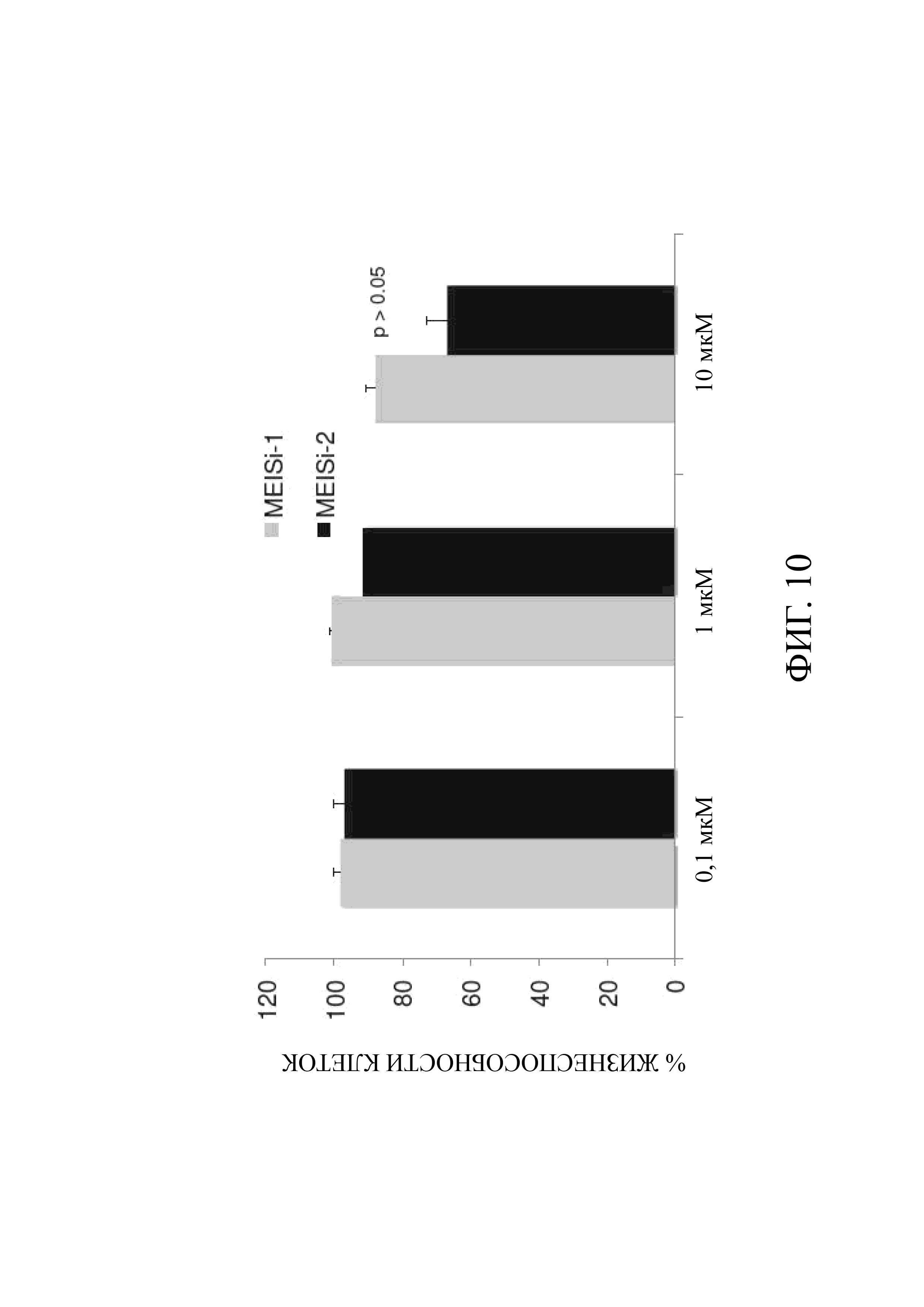
Фиг. 10 является графическим представлением информации исследования цитотоксичности ингибиторов MEIS (MEISi-1 и MEISi-2), испытанных на клеточной линии (мышиных фибробластов) L929;C помощью экспериментов in silico, in vitro и in vivo получена композиция, ингибирующая белки MEIS (Meis1, Meis2, Meis3).
Экспериментальные исследования
Композиция, соответствующая настоящему изобретению, содержит:
- ингибитор MEISi,
- клетки, полученные в результате выделения,
- питательную среду,
- фактор роста.
Ингибитор MEISi содержит MEISi-1 и MEISi-2.
Соответственно, расчет молярности для ингибитора MEISi-1 проводили, принимая за основу 4-[2-(бензиламино)-2-оксоэтокси]-N-(2,3-диметилфенил)бензамид с молекулярной массой 388,49 г/моль.
Эффективная доза была определена равной 1 мкМ посредством экспериментов in vitro для определения зависимого от дозы эффекта.
Расчет молярности для ингибитора MEISi-2 проводили, принимая за основу 4-гидрокси-N'-[(7)-(2-оксонафталин-1-илиден)метил]бензогидразид с молекулярной массой 306,32 г/моль.
Эффективная доза была определена равной 1 мкМ с помощью дозозависимых экспериментов in vitro.
Клетки были получены из костного мозга мыши, костного мозга человека и пуповинной крови человека. Эти клетки инкубировали в питательной среде Stem Span, которая представляет собой бессывороточную культуральную питательную среду.
В качестве среды была использована среда Stem Span; и эта среда содержит бычий сывороточный альбумин, рекомбинантный инсулин, трансферрин, 2-меркаптоэтанол и питательную среду IMDM, дополненную питательными веществами. Значение рН этой среды составляет 7,2. Перед использованием среду Stem Span готовят для каждой культуры заново и обогащают факторами роста.
Упомянутыми используемыми факторами роста являются: SCF, который представляет собой фактор гемопоэтических стволовых клеток, Flt3L, который представляет собой лиганд тирозинкиназы-3 печени плода, и ТРО, который представляет собой тромбопоэтин.
Исследования, проводимые с целью определения характеристик
В композиции по настоящему изобретению, полученной как описано выше, клетки, полученные в результате выделения, высевали в среду, обогащенную факторами роста стволовых клеток, и обрабатывали MEISi-1 или MEIS-2. Затем, после инкубации при 5% СО2 и нормальном уровне О2 при температуре 37°С в течение от приблизительно 1 недели до 10 дней, исследовали пролиферацию клеток, не прибегая к методике регуляции генов. В результате этой пролиферации наблюдалось значительное увеличение количества клеток, и результаты были подтверждены исследованиями методом проточной цитометрии.
Перечисленные далее исследования для определения характеристик были проведены для ингибиторов MEIS:
1 - in silico скрининг лекарственных препаратов;
2 - in vitro тесты на люциферазу;
3 - ПЦР-исследование путей;
4 - исследования размножения HSC ex vivo:
5 - размножение HSC in vivo, и
6 - исследование цитотоксичности.
1 - In vitro скрининг лекарственных препаратов на гомеодомен MEIS
Для проведения in silico скрининга лекарственных препаратов на MEIS, гомеодомен был исследован для определения аминокислот, взаимодействующих с ДНК-мишенью.
Для определения аминокислот, через которые гомеодомен MEIS связывается с нуклеотидами TGACAG, следуют по двум разным путям:
a) Были исследованы гомологичные/защищенные аминокислотные домены в гомеодоменах MEIS и белках TALE, к которым он принадлежит, и защищенные аминокислоты для связывания с ДНК.
b) Pbx1 представляет собой белок, принадлежащий к тому же самому семейству, что и MEIS. Была определена кристаллическая структура гомеодомена Pbx1; были выполнены трехмерные сравнения этой структуры с кристаллической структурой гомеодомена MEIS; и были выявлены возможные аминокислоты, с помощью которых гомеодоменный белок MEIS связывается с ДНК.
Затем вокруг гомеодоменных аминокислот MEIS, которые необходимы для связывания с ДНК, был определен гридбокс, и был проведен виртуальный скрининг ингибиторов.
- Из баз данных PubChem и ZINC были получены трехмерные структуры 1 миллиона малых молекул. Автоматизированный скрининг 1 миллиона молекул был осуществлен с использованием AutoDockVina 1.1.2 и программы PaDEL-ADV, и были проанализированы вероятные взаимодействующие элементы.

Кроме того, результаты проведенного исследования сравнивали с другими гомеодоменами TALE, определяли их энергии связывания и, таким образом, были определены MEIS-специфические ингибиторы (Таблица 1).
2 - Определение ингибиторов Meis1 с помощью in vitro исследования люциферазного репортера
Ингибиторы MEIS были протестированы путем проведения исследования люциферазного репортера. Наблюдалось, что белок MEIS активировал люциферазные репортеры, содержавшие увеличивающиеся дозы промоторов р21. В исследованиях люциферазного репортера использовали векторы pGL2, содержащие промотор гена р21, который активируется Meis1. Таким образом, 0,8 мкг p21-pGL2, 400 нг экспрессирующего вектора Meis1 pCMVSPORT6-Meis1 (Open BioSystems) и 0,2 мкг вектора р CMV-LacZ (внутренний контроль) были совместно трансфицированы в клетки COS. Через 4 ч клетки обрабатывали опытным образцом ингибиторов MEIS (в концентрациях 0,1 мкМ, 1 мкМ и 10 мкМ). Для трансфекции использовали 6-луночные планшеты и липофектамин. Через 48 часов клетки лидировали, собирали образцы и определяли активность люциферазы. Для этого использовалась репортерная система компании Promega (Promega Dual-GLO® Luciferase Assay System). Измерения люциферазы были нормализованы в соответствии с измерениями β-gal (измерения производились при 420 нм). Для измерения люциферазы использовалось устройство Thermo Lab Systems Lumino scan Ascent. В результате этих экспериментальных исследований, исследование in silico, имеющее целью гомеодомен MEIS и проведенное в сопоставлении с другим гомеодоменом TALE, позволило определить специфические для MEIS совпадения (экспериментальные результаты (ER): ER-A).
3 - Тестирование ингибиторов MEIS с помощью ПЦР в реальном масштабе времени
HSC готовили для каждого ингибитора (3 повтора в 6 лунках), а в качестве контрольной группы использовали группы клеток, содержащие DMSO (диметилсульфоксид). Исследования для каждой потенциальной маленькой молекулы проводились при концентрациях 0,1 мкМ, 1 мкМ и 10 мкМ; клетки трипсинизировали, собирали через 3 дня и хранили в тризоле до выделения РНК. Выделение РНК проводили с использованием мини-набора RNeasy от Qiagen и протокола производителя. кДНК синтезировали из 2 мкг РНК с использованием системы Superscript II RT от Invitrogen. Исследования проводились в устройстве CFX 96 Real Time PCR от BioRad с использованием SyberGreen (Applied Biosystems). GAPDH (глицеральдегид-3-фосфатдегидрогеназа), использовавшаяся в качестве контрольного гена, применялась для нормализации экспрессии гена методом ddCT. Уровни экспрессии генов р21, Hif-1alpha (Hif-1α), Hif-2alpha (Hif-2α), которые, как известно, активируются Meis1, определялись и контролировались по контрольной группе из DMSO (Фиг. 3) (ER: В).
4 - Определение влияния ингибитора MEIS на пролиферацию HSC ex vivo.
Осуществляли выделение мышиного костного мозга и очистку HSC. Для этого, после безболезненного умерщвления мышей в возрасте 8-12 недель с помощью изофлурана, из бедренной и большеберцовой костей отбирали клетки костного мозга. Кратко, путем окрашивания клеточной линии коктейлем с биотином (анти-CD3, анти-CD5, анти-В220, анти-Мас-1, анти-Gr1, анти-Ter119; Stem Cell Technologies) были получены клетки Lin-, Sca1+, c-Kit+, CD341ow (гемопоэтические стволовые клетки длительного культивирования), которые затем были окрашены стрептавидином-РЕ/Су5.5, анти-Sca-1-FITC, анти-KIT-APC и анти-CD34-PE. В культуре изолированных клеток костного мозга использовали среду для HSC, известную как среда SCF. Среда SCF состоит из бессывороточной среды Stem Span (Stem-Cell Technologies), в которую добавляли 10 мкг/мл гепарина (Sigma-Aldrich), 10 нг/мл мышиного SCF (R&D System), 20 нг/мл мышиного ТРО (R&D System), 20 нг/мл мышиного IGF-2 (R&D System).
Частота и количество HSC. Клетки Lin-, полученные из костного мозга, в течение 10 дней обрабатывали в клеточной культуре ингибиторами MEIS или DMSO с последующим определением количества гемопоэтических клеток (Фиг. 4) и процентного содержания HSC (Фиг. 5 и Фиг. 6). Для определения количества HSC, представляющие интерес поверхностные антигены (Lin-, Sca1+, c-Kit+, CD34-) окрашивали антителом, конъюгированным с люминофором, как в предыдущих исследованиях, после чего анализировали с помощью проточной цитометрии (ER: С).
In vitro функциональная пролиферация HSC и увеличение числа колоний. После 7 дней культивирования клеток определяли количество HSC, обработанных ингибитором MEIS или DMSO. Клетки, обработанные DMSO, являлись контрольной группой. 2000 клеток культивировали в подходящей полутвердой агаровой среде (Methocult, М3434, Stem Cell Technologies), и через 10-14 дней определяли количество колоний и проводили количественный анализ с подсчетом колониеобразующих единиц (CFU-Assay). С помощью количественного анализа КОЕ были продемонстрированы функциональная пролиферация HSC in vitro и соотношения гранулоцитов, эритроцитов, макрофагов, мегакариоцитов (GEMM), гранулоцитов моноцитов (GM) и BFU-E в полученных различных колониях (Фиг. 7) (ER: D).
Размножение человеческих HSC. Клетки, полученные из костного мозга или пуповинной крови, разделяли перколлом, и получали мононуклеарные клетки. Их переносили в пробирки, содержащие среду для HSC. Среду для HSC, известную как среда SCF, использовали в культуре изолированных HSC костного мозга и пуповинной крови. Среда SCF состоит из бессывороточной среды Stem Span (Stem-Cell Technologies), содержащей коктейль с цитокинами человека (StemSpan™ СС100, Stem-Cell Technologies, номер по каталогу 02690) и 1% PSA (10000 единиц/мл пенициллина, 10000 мкг/мл). стрептомицина и 25 мкг/мл амфотерицина В, Gibco, номер по каталогу 15240062). После очистки HSC высевали в 96-луночный планшет (Corning, 3799) из расчета 200-300 HSC на лунку; и после добавления в каждую лунку максимум 200 мкл ингибиторов MEIS, смешивавшихся со средой SCF, их инкубировали при 5% СО2 и нормальном уровне О2 при температуре 37°С в течение 7-10 дней. Затем определяли количество и процентное содержание (частоту) HSC и других гемопоэтических клеток-предшественников. Результаты сравнивали с контрольной группой, обработанной DMSO (ER: Е).
5 - Пролиферация HSC in vivo с ингибиторами MEIS
В качестве альтернативы пролиферации HSC ex vivo с использованием малых молекул, была показана возможность непосредственного применения ингибиторов MEIS для пролиферации HSC in vivo. Ингибиторы MEIS вводили внутрибрюшинно в диапазоне от 0,5 мг/кг до 10 мг/кг. Для обеспечения эффективной инкубации, ингибиторы вводили мышам в 3 разных дозах; и через 10 дней после введения определяли количество HSC, полученных из костного мозга мышей (Фиг. 9) (ER: F).
6 Цитотоксический анализ ингибиторов MEIS
Для цитотоксического исследования ингибиторов MEIS была использована линия мышиных фибробластов L929. Клетки высевали в 96-луночный планшет (Corning, 3799) из расчета 2000 клеток на лунку. На следующий день после посева клетки были обработаны различными дозами по методу градиентной концентрации, используя конечные концентрации 0,1 мкМ, 1 мкМ, 10 мкМ, с примешиванием в каждую лунку ингибитора Meis1-1 (MEISi-1) и ингибитора Meis1-2 (MEISi-2), в максимальном количестве 200 мкл среды DMEM, и их инкубировали при 5% СО2 и нормальном уровне О2 при температуре 37°С. Через 4 дня после инкубации добавляли 10 мкл раствора для пролиферации клеток WST1 (Boster, AR1159), и после инкубации в течение 4 часов измеряли оптическую плотность при 450 нм с использованием системы Multiskan Spektrum Thermo Lab (ER-G).
Результаты экспериментов
Экспериментальные результаты были кратко обозначены (ER), и представляющие интерес результаты приведены ниже.
А- С помощью проведенных in vitro исследований люциферазы впервые были определены ингибиторы MEIS, которые авторы назвали ингибитором MEIS-1 (MEISi-1) и ингибитором MEIS-2 (MEISi-2). Эти ингибиторы (MEISi-1 и MEISi-2) ингибируют репортер p21-Luc MEIS дозозависимым образом (Фиг. 1 и Фиг. 2).
В- Было установлено, что MEISi-1 и MEISi-2, которые входят в число разработанных ингибиторов MEIS, снижают экспрессию генов р21, Hif-1альфа (Hif-1α), Hif-2альфа (Hif-2α) на пути Meis1 (Фиг. 3).
С- За 10 дней было выявлено 2,5-кратное дозозависимое увеличение числа гемопоэтических клеток, обработанных MEISi-1 и MEISi-2 (Фиг. 4). При обработке MEISi-1 наблюдалось почти 10-кратное увеличение количества HSC (Фиг. 5). Это увеличение является дозозависимым (Фиг. 5). Кроме того, в клетках Lin, обработанных MEISi-2, наблюдалось увеличение количества HSC до 3 раз (Фиг. 6).
D- По возросшему количеству колоний CFU-GEMM экспериментально обнаружено, что применение ингибиторов MEIS увеличивает количество HSC (Фиг. 7). Ингибитор MEIS эффективно обеспечивает функциональное увеличение количества HSC.
Е- При анализе всех результатов, наблюдается, что ингибиторы MEIS запускают функциональную пролиферацию ex vivo человеческих HSC (Фиг. 8). Когда применяли MEISi-1 и MEISi-2, количество CDSC+HSC (Фиг. 8А), количество CD133+HSC (Фиг. 8В), количество CD34+CD133 HSC (Фиг. 8С) и количество HSC ALDHBr (Фиг. 8D) в культуре гемопоэтических клеток человека увеличивалось в 2 раза по сравнению с контрольной группой DMSO.
F- Было продемонстрировано, что применение MEISi-1 и MEISi-2 in vivo успешно увеличивало количество HSC в мышином костном мозге (Фиг. 9А, клетки LSKCD150+CD48-) и количество HSC в крови (Фиг. 9 В, клетки LSKCD341ow). Кратко, было экспериментально показано, что ингибиторы MEIS осуществляют функциональную пролиферацию ex vivo мышиных и человеческих HSC (Фиг. 5-8).
G- По полученным результатам видно, что ингибиторы MEIS MEISi-1 MEISi-2 не являются цитотоксичными в дозах 0,1 мкМ, 1 мкМ и 10 мкМ (Фиг. 10).
В результате в проведенных исследованиях впервые были определены ингибиторы MEIS. Исследования in silico, имеющие целью гомеодомен MEIS и проведенные в сопоставлении с другими гомеодоменами TALE, позволили определить специфические для MEIS совпадения (Таблица 1).
Эти ингибиторы
ингибируют репортеры MEIS p21-Luc. (Фиг. 1 и Фиг. 2)
снижают экспрессию генов на пути Meis1. (Фиг. 3)
ингибиторы MEIS запускают пролиферацию ex vivo функциональных HSC мышей и человека (Фиг. 4, Фиг. 5, Фиг. 6, Фиг. 7, Фиг. 8).
Было показано, что применение MEISi-1 и MEISi-2 in vivo увеличивало количество HSC в костном мозге и периферической крови (Фиг. 9).
Было определено, что ингибитор MEIS 1 (MEISi-1) и ингибитор MEIS 2 (MEISi-2) не являются цитотоксичными (Фиг. 10).
Применение изобретения
Настоящее изобретение используется для in vitro и ex vivo пролиферации стволовых клеток пуповинной крови и стволовых клеток костного мозга человека. Кроме того, с использованием настоящего изобретения, стимулируется размножение отдельных клеток после отбора отдельных гемопоэтических стволовых клеток, полученных после регуляции генов, и обеспечивается размножение гемопоэтических стволовых клеток, полученных из тканей взрослого человека и эмбриональных клеток. В дополнение к этому обеспечивается размножение резидентных стволовых клеток сердца и кардиомиоцитов; размножение ex vivo мононуклеарных клеток до трансплантации костного мозга; размножение ex vivo фибробластных, хрящевых, эндотелиальных, лимбальных и мезенхимальных стволовых клеток; ингибирование MEIS при раке и в раковых стволовых клетках с высокой экспрессией семейства генов MEIS.
Реферат
Настоящее изобретение относится к биотехнологии, а именно к композиции, ингибирующей белки MEIS, эффективные при пролиферации гемопоэтических стволовых клеток. Композиция содержит ингибитор MEISi, который представляет MEISi-1 или MEISi-2, клетки, полученные в результате выделения, питательную среду, фактор роста. Композиция может легко проходить через клеточную мембрану и проявлять свою активность в клетке и может ингибировать активность MEIS дозозависимым образом. Композиция может индуцировать размножение ex vivo гемопоэтических стволовых клеток мышиной, человеческой пуповинной крови и костного мозга человека. Применение настоящего изобретения in vivo запускает размножение гемопоэтических стволовых клеток в костном мозге и периферической крови. 2 н. и 6 з.п. ф-лы, 1 табл., 10 ил.

Комментарии