Ариламиды, фармацевтическая композиция и способ ингибирования tnα-активированной репликации ретровируса - RU2162839C2
Код документа: RU2162839C2
Описание
Изобретение относится к способу снижения уровня TNFα у млекопитающих и к соединениям и композициям, применяемым по этому способу.
TNFα, или фактор некроза опухоли, представляет собой цитокин, который высвобождается преимущественно моноядерными фагоцитами в ответ на действие различных иммуностимуляторов. При введении в организм животных или человека он вызывает воспаление, лихорадочное состояние, сердечно-сосудистые реакции, кровотечение, коагуляцию и острофазные реакции, сходные с теми, которые наблюдаются при острых инфекциях и шоковых состояниях.
Избыточные или нерегулируемое образование TNFα имеет место в случае множества заболеваний или болезненных состояний. Они включают эндотоксемию и/или синдром токсического шока {Tracey et al. Nature 330, 662-664 (1987) and Hinshaw et al., Circ. Shock 30, 279-292 (1990)}; кахексию {Dezube et al. , Lancet, 335, (8690), 662 (1990)} и респираторный дистресс-синдром взрослых, при котором в легочном аспирационном материале больных с РДСВ - (респираторным дистресс-синдромом взрослых) была выявлена концентрация TNFα, превышающая 12000 пг/миллилитр { Millar, et al. Lancet 2(8665), 712-714 (1989)} . Системное вливание рекомбинантного TNFα также приводит к изменениям, наблюдаемым обычно при РДСВ {Ferrai - Baliviera et al., Arch. Surg. 124(12), 1400-1405 (1989)}.
TNFα, по всей видимости, принимает участие в механизме различных заболеваний, связанных с резорбцией кости, включая артрит, в случае которого было обнаружено, что лейкоциты при активировании продуцируют активность, направленную на резорбцию костей, и полученные данные свидетельствуют о том, что и TNFα способствует данной активности. {Bertolini et al. Nature 319, 516-518 (1986) and Johnson et al., Endocrinology 124(3), 1424-1427 (1989)}. Было замечено, что ФНОКα стимулирует резобцию костей и ингибирует образование костей in vitro и in vivo через механизм стимуляции образования остеокласта и активации в сочетании с ингибированием функции остеобластов. Хотя TNFα возможно вовлечен во многие заболевания резорбции костей, включая артрит, наиболее неотразимая связь этого фактора с заболеванием заключается в ассоциации продуцирования TNFα опухолями или тканями организма с гиперкальциемией, возникающей при злокачественных новообразованиях {Calci. Tissue Int. (US) 46 (Suppl.), S3-10 (1990). При реакции "трансплантат против хозяина" повышенный уровень TNFα в сыворотке крови ассоциируется с серьезными осложнениями, развивающимися после острой алогенной трансплантации костного мозга {Holier et al. Blood, 75(4), 1011-1016 (1990)}.
Церебральная малярия представляет собой летальный сверхострый неврологический синдром, связанный с высоким уровнем TNFα в крови, и наиболее тяжелые осложнения наблюдаются у пациентов, больных малярией. Сывороточный уровень TNFα коррелирует напрямую с тяжестью заболевания и с прогнозом развития заболевания у пациентов с острыми приступами малярии. {Grau et al., N. Engl. J. Med. 320(24), 1586-1591 (1989)}.
TNFα играет определенную роль в хронических воспалительных заболеваниях легких. Отложение частиц кремнезема ведет к развитию силикоза, заболевания, характеризующегося прогрессирующей дыхательной недостаточностью, вызванной фибротической реакцией. Антитела к TNFα полностью блокируют индуцируемый кремнеземом фиброз легких у мышей { Pignet et al., Nature, 344:245-247 (1990)} . На моделях животных с фиброзом, вызванным отложением кремнезема и асбеста, был продемонстрирован высокий уровень образования. TNFα, (в сыворотке и в выделенных макрофагах) {Bissonnette et al. Inflammation 13(3), 329-339 (1989)} . Было также обнаружено, что у пациентов с легочным саркоидозом альвеолярные макрофаги спонтанно высвобождают большие количества TNFα в сравнении с макрофагами, полученными от здоровых доноров {Baughman et al., J. Lab. Clin. Med. 115(1), 36-42 (1990)}.
TNFα также принимает участие в воспалительной реакции, которая развивается при так называемом реперфузионном повреждении и возникает после реперфузии, представляя собой основную причину повреждения тканей при потере крови {Vedder et al., PNAS 87, 2643-2646 (1990)}. TNFα также изменяет свойства эндотелиальных клеток и обладает разнообразной прокоагулянтной активностью, такой как продуцирование увеличения коагулянтной активности тканевого фактора и супрессия с пути антикоагулянтного белка, а также способен осуществлять отрицательную регуляцию экспрессии тромбомодулина {Sherry et al. , J. Cell Biol. 107, 1269-1277 (1988)}. TNFα обладает противовоспалительной активностью, которая вместе с ранним ее появлением (в начальной стадии воспаления) делает его вероятным медиатором повреждения ткани в ряде серьезных заболеваний, включая, но не ограничиваясь, такие как инфаркт миокарда, инсульт и сосудистый шок. Определенную важность может представлять TNFα индуцированная экспрессия молекул адгезии, таких как внутриклеточная молекула адгезии (ICAM) или молекула адгезии эндотелиальных лейкоцитов (ELAM) на эндотелиальных клетках {Munro et al. Am. J. Path. 135(1), 121-132 (1989)}.
Кроме того, в настоящее время известно, что ФНОКα представляет собой мощный активатор репликации ретровирусов, включая активацию ВИЧ-1. {DUH et al. , Proc. Nat. Acad. Sci. 86, 5974-5978 (1989); Poll et al., Proc. Nat. Acad. Sci. 87,782-785 (1990); Monto et al. Blood 79, 2670 (1990); Clouse et al., J. Immunol. 142,431-438 (1989); Poll et al., AIDS Res. Hum. Retrovirus, 191-197 (1992)} . СПИД возникает в результате инфекции Т-лимфоцитов вирусом иммунодефицита человека (ВИЧ). Было идентифицировано по меньшей мере три типа, или штамма ВИЧ, а именно ВИЧ-1, ВИЧ-2 и ВИЧ-З. Вследствие ВИЧ-инфекции ухудшается Т-клеточный иммунитет и инфицированный организм обнаруживает тяжелые условно патогенные инфекции и/или необычные неоплазмы. Для вторжения ВИЧ в Т-лимфоцит требуется активация Т-лимфоцита. Другие вирусы, такие как ВИЧ-1 и ВИЧ-2, инфицируют Т-лимфоциты после активации Т-клеток, и экспрессия и/или репликация таких вирусных белков опосредуется или поддерживается Т-клеточной активацией. Как только активированный Т-лимфоцит инфицируется ВИЧ, для осуществления экспрессии ВИЧ-гена и/или репликации ВИЧ Т-лимфоцит должен постоянно поддерживаться в активированном состоянии. Цитокины, в частности TNFα, выполняют свою роль в экспрессии ВИЧ белка и/или репликации вируса, опосредованных активированными Т-клетками, участвуя в поддержании Т-лимфоцитов в активированном состоянии.
Поэтому, препятствия проявления цитокиновой активности, такие как предотвращение или ингибирование продукции цитокина, в частности TNFα у ВИЧ-инфицированных индивидуумов, помогает ограничить уровень активирования Т-лимфоцитов, вызванного ВИЧ-инфекцией.
В поддержании ВИЧ-инфекции принимают также участие моноциты, макрофаги и родственные им клетки, такие как клетки Купфера и глиальные клетки. Такие клетки, как, например, Т-клетки, являются клетками-мишенями для репликации вирусов, и уровень вирусной репликации зависит от уровня активирования этих клеток { Rosenberg et al. The Immunopathogenesis of HIV Infection, Advances in Immunology, 57, (1989)}. Было показано, что цитокины, такие как TNFα, активируют репликацию ВИЧ в моноцитах и/или макрофагах {Poli et al., Proc. Natl. Acad. Sci: 87, 782-784 (1990)}, поэтому - предотвращение или ингибирование продуцирования цитокинов или их активности помогает ограничить прогрессирование ВИЧ, аналогично тому, что было отмечено в отношении Т-клеток. В дополнительных исследованиях было показано, что TNFα представляет собой обычно вовлекаемый в активацию ВИЧ in vitro фактор, при этом была предложена ясная схема механизма его действия через регуляторные ядерные белки, обнаруженные в цитоплазме клеток (Osborn, et al., PNAS 86, 2336- 2340). Данное свидетельство говорит о том, что снижение синтеза TNFα может оказывать антивирусное воздействие на ВИЧ-инфекцию за счет снижения транскрипции и, таким образом, продуцирования вируса.
Вирусная репликация при СПИДе латентного ВИЧ в Т-клеточных и макрофаговых линиях может индуцироваться TNFα {Folks et al., PNAS 86, 2365-2368 (1989)} . Был предложен молекулярный механизм осуществления вирус-индуцирующей активности, определяемый способностью TNFα активировать ген регуляторного белка (NFkB), обнаруженный в цитоплазме клеток, который усиливает ВИЧ-репликацию за счет связывания с регуляторной генной последовательностью вируса (LTR) { Osborn et al., PNAS 86, 2336-2340 (1989)}. Наличие TNFα у больных СПИДом и раковой кахексией подтверждается повышенным уровнем TNFα в сыворотке крови таких пациентов и высокими уровнями спонтанного пpoдуциpoвaния TNFα в периферических моноцитах крови {Wright et al., J. Immunol, 141 (1), 99-104 (1988)} . {Eur J. Gastroen Hepat, 6(9), 821-829. (1994)}. {J. Exp. Med., 1121-1227 (1988)}.
TNFα по различным указанным выше причинам выполняет разнообразные функции и при других вирусных инфекциях, таких как инфекция вирусом цитомегалии (CMV), вирусом гриппа, аденовирусом и вирусами из семейства вирусов герпеса.
В связи с вышесказанным, можно ожидать, что предотвращение или ингибирование продуцирования или действия TNFα может представлять собой эффектный способ лечения многих воспалительных, инфекционных, иммунологических заболеваний или злокачественных новообразований. Такие заболевания включают, не ограничиваясь ими, септический шок, сепсис, эндотоксический шок, гемодинамический шок и септический синдром, пост-ишемическое реперфузионное повреждение, малярию, микобактериальную инфекцию, менингит, псориаз, застойную сердечную недостаточность, фибротическое заболевание, кахексию, отторжение трансплантата, рак, аутоиммунные заболевания, условно патогенные инфекции при СПИДе, ревматоидный артрит, ревматоидный спондилит, остеоартрит, другие артритные состояния, болезнь Крона, язвенный колит, множественный или рассеянный склероз, системную красную волчанку, узловатую эритему при лепре, радиационное поражение и гипероксическое альвеолярное повреждение. Усилия, направленные на подавление действия TNFα, могут варьироваться от использования стероидов, таких как дексаметазон и преднизолон, до использования, как поликлональных, так и моноклональных антител {Beutler et а1. Science 234, 470-474 (1985); WO 92/11383}.
Ядерный фактор kB (NFkB) представляет собой плейотропный активатор транскрипции (Lenardo, et al. Cell 1989, 58, 227-29). NFkB функционирует как активатор транскрипции в патогенезе множества заболеваний и воспалительных состояний и, считается, что он регулирует уровень цитокинов, включая, но не ограничиваясь, TNFα, а также может быть активатором ВИЧ-транскрипции (Dbaibo, et al. J. Biol. Chem. 1993, 17762-66; Duh et al. Proc. Natl. Acad. Sci. 1989, 86, 5974-78; Bachelerie et al. Nature 1991, 350, 709-12; Boswas et al. J. Acquired Immune Deficiency Syndrome 1993, 6, 776-786; Suzuki et al. Biochem. And Biophys. Res. Comm. 1993, 193, 277-83; Suzuki et al. Biochem. And Biophys. Res. Comm. 1992, 189, 1709-15; Suzuki et al. Biochem. Mol. Bio. Int. 1993, 31 (4), 693-700; Shakhov et al. 1990, 171,35-47; And Staal et al. Proc. Natl. Acad. Sci. USA 1990, 87, 9943-47).
Таким образом, ингибирование связывания NFkB может регулировать транскрипцию гена(ов) цитокина и посредством такой модуляции и других механизмов быть полезным при подавлении многих болезненных состояний.
Заявленные в настоящем патенте соединения могут ингибировать активность NFkB в ядре и, таким образом, могут быть полезными при лечении множества заболеваний, включающих, но не ограничивающихся ими, ревматоидный артрит, ревматоидный спондилит, остеоартрит, другие артритные состояния, септический шок, сепсис, эндотоксический шок, болезнь "трансплантат против хозяина", истощение, болезнь Крона, язвенный колит, множественный склероз, системную красную волчанку, узловатую эритему при лепре, ВИЧ-инфекции, СПИД и условно патогенные инфекции при СПИДе.
Уровни TNFα и NFkB находятся под обоюдным воздействием закона обратной связи. Как отмечалось выше, соединения по настоящему изобретению воздействуют на уровень и TNFα, и NFkB. В настоящее время неизвестно, однако, как соединения по настоящему изобретению регулируют уровень TNFα, NFkB или обоих из них.
Подробное описание изобретения
Настоящее изобретение основывается на открытии того факта, что класс
не-полипептидных имидов более полно описанных в данной заявке ингибируют действие TNFα.
Настоящее изобретение относится к соединениям формулы
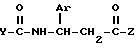
в которой Ar представляет 3,4-дизамещенный фенил, в котором каждый заместитель выбран независимо из группы, состоящей из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, алкила с 1-10 атомами углерода, алкокси с 1-10 атомами углерода, и галогена;
Z представляет алкокси с 1-10 атомами углерода, бензилокси, амино или алкиламино с 1-10 атомами углерода, и
Y представляет (i) фенил, незамещенный или замещенный одним или более заместителями, каждый из которых независимо друг от друга выбран из группы, состоящей из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, алкила с 1-10 атомами углерода, алкокси с 1-10 атомами углерода, и галогена, или (ii) нафтил.
Первый предпочтительный подкласс относится к соединениям, в которых Ar представляет собой фенил, замещенный двумя метоксигруппами; и Y обозначает фенильное кольцо, незамещенное или замещенное одной аминогруппой.
Типичные соединения по настоящему изобретению
включают:
N-бензоил-3-амино-3-(3',4'-диметоксифенил)пропанамид,
N-бензоил-3-амино-3-(3',4'-диэтоксифенил)пропанамид,
N-бензоил-3-амино-3-(3',4'-диэтилфенил)пропанамид,
N-бензоил-3-амино-3-циклогексил)пропанамид,
N-(3''-aминобензоил)-3-aмино-3-(3',4'-диэтоксифенил)пропанамид,
метил N-бензоил-3-амино-3-(3',4'-диэтоксифенил)пропаноат,
метил N-(3''-aминобензоил)-3-aмино-3-(3',4'-диэтоксифенил)пропаноат,
метил N-(3''-метоксибензоил)-3-aмино-3-(3',4'-диэтоксифенил)пропаноат,
метил N-(4''-метоксибензоил)-3-амино-3-(3',
4'-диэтоксифенил)пропаноат,
N-(3''-метоксибензоил)-3-амино-3-(3',4'-диэтоксифенил)пропанамид,
N-(4''-метоксибензоил)-3-амино-3-(3',4'-диэтоксифенил)пропанамид,
метил
N-бензоил-3-амино-3-(4-трифторметилфенил)пропаноат,
метил Н-бензоил-3-амино-3-(4-ацетилфенил)пропаноат.
Используемый в описании настоящего изобретения термин алкил обозначает моновалентную насыщенную разветвленную или линейную углеводородную цепь. Если особо не оговорено иное, такие цепи могут содержать от 1 до 18 атомов углерода. Представителями таких алкильных групп являются метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, гексил, изогексил, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил и др. В том случае, когда алкильная группа квалифицируется как "низшая", она содержит от 1 до 6 атомов углерода. То же самое количество атомов углерода относится к исходному термину "алкан" и к производным терминам, таким как "алкокси".
Соединения могут использоваться под наблюдением квалифицированных специалистов для подавления или ингибирования нежелательных действий TNFα. Соединения могут вводиться в организм млекопитающего, нуждающегося в лечении, перорально, ректально или парентерально, сами по себе или в сочетании с другими терапевтическими средствами, включая антибиотики, стероиды и др. Пероральные дозированные формы включают таблетки, капсулы, драже и другие подобные им, имеющие форму прессованные фармацевтические формы. Изотонические солевые растворы, содержащие 20-100 миллиграмм/миллилитр, могут использоваться для парентерального введения, включая внутримышечный, внутриоболочечный, внутривенный и внутриартериальный способы введения. Ректальное введение может быть осуществлено с помощью суппозиториев, приготовленных с использованием традиционных носителей, таких как масло какао.
Режим дозирования должен быть подобран в соответствии с показаниями для лечения, с учетом возраста, массы и общего физического состояния пациента, а также желательной реакции, и обычно составляет от около 1 до около 500 миллиграмм/день, по потребности, в виде разовых или многократных ежедневных введений. В целом, на начальном этапе лечения может практиковаться тот режим, для которого была показана эффективность соединений настоящего изобретения по сдерживанию проявления активности ФНОКα в случае других опосредовательных ФНОКα болезненных состояний. При лечении у пациентов регулярно проверяется уровень Т-клеток и соотношение T4/T8 и/или измеряются показатели вирусемии, такие как уровень обратной транскриптазы или уровень вирусных белков, и/или проверяется прогрессирование осложнений, связанных с цитокин-опосредованными заболеваниями, такими как кахексия или мышечная дегенерация. Если после обычного режима лечения не видно никакого эффекта, количество средства, мешающего проявлению цитокиновой активности, увеличивают, например, на 50% в неделю.
Соединения по настоящему изобретению можно использовать также топически при лечении или профилактике местных заболеваний, опосредованных или обостренных в результате избыточного продуцирования TNFα, соответственно, таких как вирусные инфекции, например инфекции, вызванные вирусами герпеса, или вирусный конъюктивит и др.
Соединения по настоящему изобретению могут также найти применение в ветеринарии при лечении млекопитающих, отличных от человека, когда возникает необходимость предупреждения или подавления продуцирования TNFα. TNFα - опосредованные заболевания, в случае которых показано терапевтическое или профилактическое применение указанных соединений у животных, включают отмеченные выше болезненные состояния, и в особенности вирусные инфекции. Примерами таких инфекций является вирус кошачьего иммунодефицита, вирус лошадиной инфекционной анемии, вирус козлиного артрита, вишна вирус и меди вирус, а также другие лентивирусы.
Некоторые из указанных соединений имеют центры хиральности и могут существовать в виде оптических изомеров. В объем настоящего изобретения входят как рацематы этих изомеров, так и индивидуальные изомеры, а также диастереомеры, когда имеются два хиральных центра. Рацематы могут использоваться сами по себе или могут быть разделены на индивидуальные изомеры, механически или хроматографически с применением хирального абсорбента. Альтернативно, индивидуальные изомеры можно получить в хиральной форме или выделить химически из смеси с помощью образования солей с хиральной кислотой, такой как индивидуальные энантиомеры 10-камфорсульфоновой кислоты, камфорной кислоты, альфа-бромкамфорной кислоты, метоксиуксусной кислоты, винной кислоты, диацетилвинной кислоты, яблочной кислоты, пирролидон-5-карбоновой кислоты и других, и затем выделить одно или оба расщепленных основания, не обязательно при повторении процесса, так чтобы получить либо один, либо оба из них, по существу свободных от примесей каждого другого из двух изомеров, т.е. в форме, имеющей оптическую чистоту > 95%.
Действенность профилактики или подавления образования TNFα указанными соединениями можно успешно оценить при проведении анализа с использованием антител к TNFα. Например, пластинки (Nunc Immunoplates, Roskilde, DK) обрабатывают 5 мкг/миллилитр очищенных антител из кролика к TNFα) при 4oC в течение времени от 12 до 14 часов. После этого пластинки блокируют в течение 2 часов при 25oC добавлением ФБР/0,05% Твина, содержащего 5 миллиграмм/миллилитр БСА. После промывания пластинок наносят по 100 мкл исследуемых образцов и контролей, и пластинки инкубируют при 4oC в течение времени от 12 до 14 часов. Затем пластинки промывают и анализируют на наличие конъюгата пероксидазы (из хрена) и моноклональных мышиных антител к TNFα, измеряя при 492 нм развившееся при взаимодействии их с о-фенилендиамином в фосфат-цитратном буфере, содержащем 0,012% перекиси водорода, окрашивание.
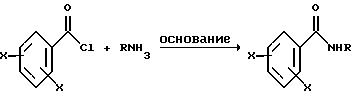
Описываемые соединения можно получить с помощью известных методов, применяемых для получения имидов. Общая реакционная схема включает взаимодействие замещенного амина или
аммония с замещенным бензоилхлоридом в соответствии со следующей реакцией:
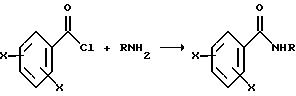
Приведенные ниже примеры служат для описания настоящего изобретения и не должны трактоваться как ограничительные в отношении объема настоящего изобретения, который определяется только формулой изобретения.
ПРИМЕР 1
Метил N-бензоил-3-амино-3-(3',
4'-диметоксифенил)пропионат.
К охлажденной на ледяной бане перемешиваемой суспензии гидрохлорида метил 3-амино-3-(3',4'-диметоксифенил) пропионата (0,689 грамм, 2,50 ммоль) и
триэтиламина (0,7 миллилитров, 5 ммоль) в 15 миллилитрах тетрагидрофурана добавляют 0,3 миллилитра бензоилхлорида (2,6 ммоль). Через 15 минут удаляют охлаждающую баню и перемешивают смесь еще в
течение 45 минут. Затем реакционную смесь разбавляют 15 миллилитрами солевого раствора и 15 миллилитрами воды, после чего проводят частичное концентрирование в вакууме для удаления тетрагидрофурана.
Реакционную кашицу фильтруют, высушивают на воздухе полученное твердое вещество и затем высушивают в вакууме (60oC, < 1 мм) с получением 0,86 г (100%) белого порошкообразного
продукта:
1Н ЯМР (ДМСО-d6, 250 МГц) δ 8,84 (д, J= 8,3 Гц, 1H, NH), 7,83 (м, 2H, Ar), 7,60-7,35 (м, 3H, Ar), 7,06 (с, 1H, Ar), 6,90 (м, 2H, Ar), 5,50-5,30 (м, 1H,
CHN), 3,75 (с, 3H, OCH3), 3,72 (с, 3H, OCH3), 3,46 (с, 3H, СO2CH3), 3,05-2,75 (м, 2H, CH2);
13С ЯМР (ДМСО-d6)
δ 170,8, 165,6, 148,6, 147,9, 134,9, 134,5, 131,2, 128,3, 127,3, 118,5, 111,6, 110,6, 55,5, 55,5, 51,4, 49,7, 40,6.
Аналитические данные по C19H21NO5:
Вычислено: С 66,46; H 6,16; N 4,08.
Найдено: С 66,22; H 6,05; N 3,98.
ПРИМЕР 2
Метил H-(3-нитробензоил)-3-амино-3-(3,
4-диметоксифенил)пропионат.
К охлажденной на ледяной бане перемешиваемой суспензии гидрохлорида метил 3-амино-3-(3,4-диметоксифенил)пропионата (1,38 грамм, 5,00 ммоль) и триэтиламина
(1,5 миллилитра, 10,8 ммоль) в 10 миллилитрах тетрагидрофурана добавляют в виде одной порции 3-нитробензоилхлорид (0,928 грамм, 5,00 ммоль). Получают густую кашицу. Через 15 минут удаляют охлаждающую
баню, смесь разбавляют 10 миллилитрами тетрагидрофурана и перемешивают еще в течение часа. Затем реакционную смесь разбавляют 50 миллилитрами воды, после чего проводят частичное концентрирование в
вакууме для удаления тетрагидрофурана. Реакционную кашицу фильтруют, полученное твердое вещество промывают несколькими порциями воды, высушивают на воздухе и затем высушивают в вакууме (60o
C, < 1 мм) с получением 1,85 г (95%) белого порошкообразного продукта:
1H ЯМР (CDCl3, 250 МГц) δ 8,63 (д, J=l,9 Гц, 1H) 8,35 (м, 1H, Ar), 8,20 (м, 1H, Ar),
7,77 (д, J=8 Гц, 1H, NH), 7,63 (т, J=8,0 Гц, 1H), 6,95-6,75 (м, 3H, Ar), 5,86 (м, 1H, CHCO), 3,85 (с, 3H, OCH3), 3,84 (с, 3H, OCH3), 3,68 (с, 3H, CO2CH3), 3,
01 (м, 2H, CH2);
13C ЯМР (CDCl3) δ 172,0, 164,1, 149,1, 148,6, 148,2, 135,8, 133,1, 132,7, 129,8, 126,1, 122,0, 118,2, 111,2, 109,9, 55,9, 55,8, 52,0,
50,2, 39,5.
ПРИМЕР 3
Метил N-(3-аминобензоил)-3-амино-3-(3,4-диметоксифенил)пропионат.
К раствору метил N-(3-нитробензоил)-3-амино-3-(3,4-диметоксифенил)
пропионата (1,25 грамм, 3,22 ммоль) в смеси 150 миллилитров этилацетата и 75 миллилитров метанола (смесь осторожно нагревают для растворения всех твердых веществ и затем охлаждают до комнатной
температуры) добавляют 0,25 грамм 10% Pd/C. Затем через смесь в течение 2,5 часов пропускают H2 под давлением 60 фунтов/дюйм2 (340135,2 Па) с помощью смесителя Parr Type Shaker.
Ход реакции оценивают с помощью ТСХ (1/9 этилацетат/метиленхлорид, Уф) и останавливают реакцию через 2,5 часа. Реакционную смесь фильтруют через целит для удаления катализатора. Фильтрат концентрируют
в вакууме (60oC, < 1мм) с получением 1,07 грамм (93%) целевого продукта:
1H ЯМР (ДМСО-d6, 250 МГц) δ 8,60 (д, J=8,5 Гц, 1H, NH), 7,15-6,8 (м, 6H,
Ar), 6,67 (м, 1H, Ar), 5,40 (м, 1H, CHCO), 5,24 (м, 2H, ArNH2), 3,75 (с, 3H, OCH3), 3,72 (с, 3H, OCH3), 3,56 (с, 3H, CO2CH3), 2,95 (дд, J= 8,9,
15,4 Гц, 1H), 2,81 (дд, J= 6,3, 15,4 Гц, 1H);
13C ЯМР (ДМСО-d6) δ 170,9, 166,4, 148,6, 148,6, 147,8, 135,6, 135,1, 128,6, 118,5, 116,4, 114,4, 112,8, 111,6, 110,6,
55,5, 55,5, 51,4, 49,6, 40,7.
ПРИМЕР 4
Метил N-(4-нитробензоил)-3-амино-3-(3,4-диметоксифенил)пропионат.
К охлажденной на ледяной бане перемешиваемой суспензии
гидрохлорида метил 3-амино-3-(3,4-диметоксифенил) пропионата (1,38 грамм, 5,00 ммоль) и триэтиламина (1,5 миллилитра, 10,8 ммоль) в 25 миллилитрах тетрагидрофурана добавляют в виде одной порции
4-нитробенэоилхлорид (0,928 грамм, 5,00 ммоль). Через 15 минут удаляют охлаждающую баню и реакционную смесь перемешивают еще в течение 45 минут. Затем реакционную смесь разбавляют 50 миллилитрами
воды. Реакционную кашицу фильтруют, полученное твердое вещество промывают водой, высушивают на воздухе и затем высушивают в вакууме (60oC, < 1 мм) с получением 1,86 г (94%) желтого
порошкообразного продукта:
1H ЯМР (CDCl3/TMS, 250 МГц) δ 8,27 (д, J=8,8 Гц, 2H), 7,98 (д, J=8,8 Гц, 2H), 7,77 (д, J=8,l Гц, 1H, NH), 6,95-6,75 (м, 3H, Ar), 5,55 (м,
1H, CH), 3,86 и 3,85 (2c, 6H, 2 OCH3), 3,68 (с, 3H, CO2CH3), 3,00 (м, 2H, CH2);
13С ЯМР (CDCl/TMS) δ 172,2, 164,4, 149,6, 149,1,
148,7, 139,7, 132,6, 128,2, 123,8, 118,1, 111,2, 109,9, 55,9, 55,8, 52,0, 50,0, 39,3.
ПРИМЕР 5
Метил N-(4-аминобензоил)-3-амино-3-(3,4-диметоксифенил)пропионат.
К раствору метил N-(3-нитробензоил)-3-амино-3-(3,4-диметоксифенил) пропионата (1,25 грамм, 3,22 ммоль) в смеси 100 миллилитров этилацетата и 50 миллилитров метанола (смесь осторожно нагревают для
растворения всех твердых веществ и затем охлаждают до комнатной температуры) добавляют 0,25 грамм 10% Pd/C. Затем через смесь в течение 2,5 часов пропускают H2, под давлением 60
фунтов/дюйм2 (340135,2 Па) с помощью перемешивателя Parr Type Shaker. Ход реакции оценивают с помощью ТСХ (1/9 этилацетат/метиленхлорид, Уф) и останавливают реакцию через 2,5 часа.
Реакционную смесь фильтруют через целит для удаления катализатора. Фильтрат концентрируют в вакууме (60oC, < 1мм) с получением 1,10 грамм (96%) целевого продукта:
1H ЯМР (ДМСО-d6, 250 МГц) δ 8,32 (д, J=8,5 Гц, 1H, NH), 7,57 (д, J=8,6 Гц, 1H, Ar), 7,03 (с, 1H, Ar), 6,88 (м, 2H, Ar), 6,54 (д, J=8,6, 2H, Ar), 5,62 (с, 2H, NH2), 5,
38 (м, 1H, CHCO2), 3,74,(с, 3H, OCH3), 3,71 (с, 3H, OCH3), 3,56 (с, 3H, CO2CH3), 2,94 (дд, J=8,8, 15,3 Гц, 1H), 2,80 (дд, J=6,5, 15,3 Гц, 1H),
13С ЯМР (ДМСО-d6) δ 170,9, 165,5, 151,7, 148,5, 147,8, 135,4, 128,8, 121,1, 118,5, 112,5, 111,6, 110,6, 55,5, 55,5, 51,3, 49,4, 40,8.
ПРИМЕР 6
Метил N-(3-метоксибензоил)-3-амино-3-(3',4'-диметоксифенил)пропионат.
В охлажденную на ледяной бане перемешиваемую суспензию гидрохлорида метил 3-амино-3-(3',4'-диметоксифенил)
пропионата (0,689 грамм, 2,50 ммоль) и 0,7 миллилитров триэтиламина в 20 миллилитрах безводного тетрагидрофурана вносят шприцем 3-метоксибензоилхлорид (2,5 ммоль). Через 30 минут реакционную смесь
нагревают до комнатной температуры и перемешивают еще в течение 1 часа. Затем реакционную смесь обрабатывают 20 миллилитрами воды. Тетрагидрофуран удаляют в вакууме и полученную смесь экстрагируют
метиленхлоридом (2 раза по 25 миллилитров). Объединенные экстраты сушат над сульфатом натрия и концентрируют с получением густого масла. Сырой продукт очищают флэш-хроматографией (силикагель, 1,4/8,6
этилацетат/гексаны) с получением 0,5 грамм (56%) бледно-зеленого твердого вещества (в виде воска): Тпл. 123,5-125oC;
1H ЯМР (CDCl3/TMS) δ 8,96 (д, J=7,9
Гц, 2H), 8,19 (м, 1H), 7,45 (м, 1H), 7,12-6,68 (м, 5H), 5,59 (м, 1H), 4,00 (с, 3H, OCH3), 3,87 (с, 3H, OCH3), 3,85 (с, 3H, OCH3), 3,63 (с, 3H, OCH3), 2,96
(м, 2H, CH2);
13С ЯМР (CDCl3/TMS) δ 171,6, 164,4, 157,6, 148,9, 148,2, 133,8, 132,8, 123,3, 121,2, 118,1, 111,3, 111,2, 109,9, 55,8, 55,8, 51,6, 49,7,
40,4.
TCX (2/8 этилацетат/гексаны, Уф) Rf = 0,26.
Аналитические данные по C20H23NO6:
Вычислено: С 64,33; H 6,21; N 3,75.
Найдено: С 64,31; H 6,25; N 3,63.
ПРИМЕР 7
Метил N-никотинил-3-амино-3-(3',4'-диметоксифенил)пропионат.
К охлажденной (0oC) перемешиваемой
суспензии гидрохлорида метил 3-амино-3-(3', 4'-диметоксифенил) пропионата (1,38 грамм, 5,00 ммоль) и триэтиламина (1,5 миллилитра, 10,8 ммоль) в 20 миллилитрах тетрагидрофурана добавляют гидрохлорид
никотиноилхлорида (0,89 грамм, 5,00 ммоль). Полученную густую кашицу перемешивают в течение 15 минут, затем нагревают до комнатной температуры и продолжают перемешивание еще в течение 2 часов. Затем
реакционную смесь обрабатывают 20 миллилитрами воды с получением окрашенного коричневого раствора. Тетрагирофуран удаляют в вакууме и водный слой экстрагируют метиленхлоридом (3 раза по 25
миллилитров). Объединенные экстракты сушат над сульфатом магния и концентрируют в вакууме с получением масла, которое при стоянии в течение ночи затвердевает. Белое твердое вещество сушат в вакууме
(60oC, < 1 мм) с получением 0,52 грамм (30%) сырого продукта. Сырой продукт очищают флэш-хроматографией (силикагель, 5% метанол/метиленхлорид) и сушат в вакууме (60oC,
< 1 мм) с получением 0,38 грамм (22%) белого твердого продукта:
1H ЯМР (CDCl3) δ 9,10-9,00 (м, 1H), 8,80-8,69 (м, 1H), 8,19-8,08 (м, 1H), 7,65-7,31 (м, 2H),
6,96-6,76 (м, 3H), 5,64-5,50 (м, 1H), 3,87 (с, 3H), 3,86 (с, 3H), 3,67 (с, 3H), 3,14-2,37 (м, 2H);
13C ЯМР (CDCl3) δ 172,1, 164,6, 152,4, 149,2, 148,7, 148,1, 135,
0, 132,8, 129,9, 123,5, 118,1, 111,3, 111,2, 109,9, 109,8, 55,9, 52,0, 49,8, 39,5.
Данные ВЭЖХ: 99,47%.
ПРИМЕР 8
Метил N-ацетил-3-(3,
4-диметоксифенил)пропионат.
К охлажденной на ледяной бане перемешиваемой суспензии гидрохлорида метил 3-амино-3-(3',4'-диметоксифенил)пропионата (1,97 грамм, 7,14 ммоль) и триэтиламина
(2,15 миллилитра, 15,43 ммоль) в 30 миллилитрах тетрагидрофурана добавляют ацетилхлорид (0,51 миллилитра, 7,14 ммоль). Через 15 минут удаляют охлаждающую баню и смесь перемешивают еще в течение 2
часов. Реакционную смесь разбавляют водой (25 миллилитров) и затем частично концентрируют в вакууме для удаления тетрагидрофурана. Оставшуюся водную смесь экстрагируют метиленхлоридом (3 раза по 20
миллилитров), а объединенные органические экстракты сушат над сульфатом магния. Метиленхлорид удаляют в вакууме с получением 1,40 грамм сырого продукта в виде масла оранжевого цвета. Сырой продукт
очищают флэш-хроматографией (силикагель, 5% метанол/метиленхлорид) с получением 1,22 грамм (56%) масляного продукта, который позже затвердевает, при этом в нем сохраняется небольшое количество
примесей, и это твердое вещество повторно кристаллизируют из смеси гексан/этилацетат. Белое твердое вещество сушат в вакууме (60oC, < 1 мм) с получением 0,81 грамм (41%) белого
твердого продукта:
1H ЯМР (CDCl3) δ 6,92-6,79 (м, 3H), 6,56-6,39 (м, 1H), 5,45-5,03 (м, 1H), 3,87 (с, 3H), 3,86 (с, 3H), 3,63 (с, 3H), 3,02-2,75 (м, 2H), 2,02 (с,
3H);
13С ЯМР (CDCl3) δ 171,7, 169,2, 149,1, 148,5, 133,1, 118,1, 111,2, 110,0, 55,9, 51,8, 49,4, 39,7, 23,4.
Данные ВЭЖХ: 98,63%.
ПРИМЕР 9
Таблетки, каждая содержащая по 50 миллиграмм активного ингредиента, могут быть получены следующим образом.
Компоненты (из расчета на 1000 таблеток)
активный
ингредиент - 50,0 г
лактоза - 50,7 г
пшеничный крахмал - 7,5 г
Полиэтиленгликоль 6000 - 5,0 г
тальк - 5,0 г
стеарат магния - 1,8 г
деминерализованная вода - q.s.
Твердые вещества вначале продавливают через сито с размером меш 0,6 мм. Затем смешивают активный ингредиент, лактозу, тальк, стеарат магния и половину крахмала. Другую половину крахмала суспендируют в 40 мл воды и добавляют полученную суспензию к кипящему раствору полиэтиленгликоля в 100 мл воды. Полученную пасту добавляют к измельченным веществам и гранулируют смесь, если необходимо, при добавлении воды. Гранулят высушивают в течение ночи при 35 С, продавливают через сито с размером меш 1,2 мм и прессуют в таблетки диаметром около 6 мм, имеющие на обеих сторонах вогнутость.
ПРИМЕР 10
Таблетки, каждая содержащая по 100 миллиграмм активного ингредиента, могут быть получены следующим образом.
Компоненты
(из расчета на 1000 таблеток)
активный ингредиент - 100,0 г
лактоза - 100,0 г
пшеничный крахмал - 47,0 г
стеарат магния - 3,0 г
Твердые вещества вначале
продавливают через сито с размером меш 0,6 мм. Затем смешивают активный ингредиент, лактозу, стеарат магния и половину крахмала. Другую половину крахмала суспендируют в 40 мл воды и добавляют
полученную суспензию к 100 мл кипящей воды. Полученную пасту добавляют к измельченным веществам и гранулируют смесь, если необходимо, при добавлении воды. Гранулят высушивают в течение ночи при 35oC, продавливают через сито с размером меш 1,2 мм и прессуют в таблетки диаметром около 6 мм, имеющие на обеих сторонах вогнутость.
ПРИМЕР 11
Жевательные таблетки,
каждая содержащая по 75 миллиграмм активного ингредиента, могут быть получены следующим образом.
Композиция (из расчета на 1000 таблеток)
активный ингредиент - 75,0 г
маннит - 230,0 г
лактоза - 150,0 г
тальк - 21,0 г
глицин - 12,5 г
стеариновая кислота - 10,0 г
сахарин - 1,5 г
5% раствор желатина - g.s.
Все твердые вещества вначале продавливают через сито с размером меш 0,25 мм. Смешивают маннит и лактозу, гранулируют при добавлении желатинового раствора, продавливают через сито с размером меш 2 мм, высушивают при 50oC и снова продавливают через сито с размером меш 1,7 мм. Активный ингредиент, глицин и сахарин тщательно перемешивают, добавляют ко всей массе гранулят маннита и лактозы, стеариновую кислоту и тальк, все перемешивают и прессуют полученную массу в таблетки диаметром около 10 мм, имеющие на обеих сторонах вогнутость и разделяющую бороздку на верхней стороне.
ПРИМЕР 12
Таблетки, каждая содержащая по 10 миллиграмм активного ингредиента, могут быть получены следующим образом.
Композиция (из расчета на 1000 таблеток)
активный ингредиент - 10,0 г
лактоза - 328,5 г
кукурузный крахмал - 7,5 г
Полиэтиленгликоль 6000 - 5,0 г
тальк - 25,0 г
стеарат магния - 4,0 г
деминерализованная вода - q.s.
Твердые вещества вначале продавливают через сито с размером меш 0,6 мм. Затем хорошо перемешивают активный ингредиент, лактозу, тальк, стеарат магния и половину крахмала. Другую половину крахмала суспендируют в 65 мл воды и добавляют полученную суспензию к кипящему раствору полиэтиленгликоля в 260 мл воды. Полученную пасту добавляют к измельченным веществам и гранулируют всю смесь, если необходимо, при добавлении воды. Гранулят высушивают в течение ночи при 35oC, продавливают через сито с размером меш 1,2 мм и прессуют в таблетки диаметром около 10 мм, имеющие на обеих сторонах вогнутость и разделяющую насечку на верхней стороне.
ПРИМЕР 13
Желатиновые капсулы с сухим содержимым, каждая
содержащая по 100 миллиграмм активного ингредиента, могут быть получены следующим образом.
Композиция (из расчета на 1000 таблеток)
активный ингредиент - 100,0 г
микрокристаллическая целлюлоза - 30,0 г
лаурилсульфат натрия - 2,0 г
стеарат магния - 8,0 г
Лаурилсульфат натрия пропускают через сито с размером меш 0,2 мм в активный
ингредиент и хорошо перемешивают оба компонента в течение 10 минут. Затем через сито с размером меш 0,9 мм вносят микрокристаллическую целлюлозу и снова все тщательно перемешивают в течение 10 минут.
Наконец добавляют стеарат магния, пропуская его через сито с размером меш 0,8 мм, и, после перемешивания в течение 3 минут, смесь вводят отдельными порциями по 140 миллиграмм каждая в желатиновые
капсулы для сухих веществ размером 0 (удлиненные).
ПРИМЕР 14
0,2% раствор для инъекций или вливаний может быть приготовлен, например, следующим образом;
активный
ингредиент - 5,0 г
хлорид натрия - 22,5 г
фосфатный буфер, pH 7,4 - 300,0 г
деминерализованная вода - до 2500,0 миллилитров
Активный ингредиент растворяют в 1000
миллилитрах воды и фильтруют через микрофильтр. Затем добавляют буферный раствор и объем всей смеси доводят до 2500 миллилитров водой. Для приготовления единичных дозированных форм порции объемом от 1,
0 до 2,5 мл вводят в стеклянные ампулы (каждая содержит соответственно 2,0 или 5,0 миллиграмм активного ингредиента).
Реферат
Описываются новые соединения общей формулы I Y-C(=O)-NH-CH(R2)-CH2-C(= O)-Z, в которой R2 представляет 3,4-дизамещенный фенил, в котором каждый заместитель выбран независимо из группы, состоящей из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, алкила с 1 - 10 атомами углерода, алкокси с 1 - 10 атомами углерода и галогена; Z представляет алкокси с 1 - 10 атомами углерода, бензилокси, амино или алкиламино с 1 - 10 атомами углерода; Y представляет (i) фенил, незамещенный или замещенный одним или более заместителями, каждый из которых независимо друг от друга выбран из группы, состоящей из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, алкила с 1 - 10 атомами углерода, алкокси с 1 - 10 атомами углерода и галогена, или (ii) нафтил. Ариламиды общей формулы I являются ингибиторами фактора некроза опухолевых клеток α и могут использоваться для борьбы с кахексией, эндотоксическим шоком и репликацией ретровирусов. Описывается также фармацевтическая композиция и способ ингибирования TNFα - активированной репликации ретровируса. 3 с. и 13 з.п. ф-лы.
Формула
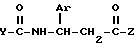
в которой Ar представляет 3,4-дизамещенный фенил, в котором каждый заместитель выбран независимо из группы, состоящей из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, алкила с 1 - 10 атомами углерода, алкокси с 1 - 10 атомами углерода и галогена;
Z представляет алкокси с 1 - 10 атомами углерода, бензилокси, амино или алкиламино с 1 - 10 атомами углерода;
Y представляет (i)фенил, незамещенный или замещенный одним или более заместителями, каждый из которых независимо друг от друга выбран из группы, состоящей из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, алкила с 1 - 10 атомами углерода, алкокси с 1 - 10 атомами углерода и галогена, или (ii) нафтил.

Комментарии