Электрохимический способ получения лития - RU2250274C2
Код документа: RU2250274C2
Чертежи
Описание
Предложенное изобретение относится к улучшенному электрохимическому способу получения лития из водных растворов солей лития, которые используют при ускоренном повторном цикле лития.
Также предложенное изобретение относится к осуществлению этого способа в подходящем электролизере или определенном производственном аппарате.
Литий является важным неорганическим основным химикатом и имеет ряд применений, например, для получения литийорганических соединений; в качестве легирующей добавки к алюминию или марганцу, и для литиевых аккумуляторов. Литий получают техническим способом через электролиз расплава эвтектической смеси хлорида лития и хлорида калия при температуре 400-460°С (Ullmann's Encyclopedia of Industrial Chemistry, Sixth Edition, 1998 Electronic Release).
При проведении этого процесса происходит высокий расход энергии (28-32 киловатт-час/кг лития). Также существенным недостатком данного способа является возможность использования только безводного хлорида лития. Поэтому основной хлорид лития, представленный в виде водного раствора, должен быть переработан с помощью энергии в безводное твердое вещество. Так как хлорид лития является гигроскопичным, его сушка и обработка требуют особых затрат.
В патенте США US 4156635 и в J.F.Cooper et al., Proc. Electrochem. Soc. 1995, 95-11, 280-290 описан электрохимический способ получения лития из водного раствора соли лития при использовании литий-амальгамного электрода. Раствор соли лития, особенно раствор гидроксида лития, подвергают электролизу при использовании амальгамного катода. При этом образуется амальгама лития, которая действует в двойном электролизере в качестве анода. Катод в виде лития и анод в виде амальгамы разделяют при помощи уплотнений в виде нитрида бора. В этом двойном электролизере 2 см соляного расплава двух иодидов щелочных металлов используют в качестве электролита (предпочтительно иодид лития и иодид цезия, или иодид лития и иодид калия), в то время пока происходит отделение катодного металла лития. Плотность тока составляет 1-4 кА/м2, без лимитирования массопередачи. Согласно этому способу при получении лития из амальгамы выход по току достигает только 81-87%. Наиболее серьезной проблемой является загрязнение полученного лития ртутью, так как возможно диффундирование ртути через электролиты.
В европейском патенте ЕР-В 0497410 описан электрохимический способ для изменения концентрации лития в жидком металле группы аммония, меди, цинка, олова и свинца. При этом используют электрохимические электролизеры, которые состоят из жидкого металла и одного электропроводного материала, который может абсорбировать литий. Между этими двумя составляющими находится сухой электролит, который, наряду с ионами лития, может проводить другие ионы щелочных металлов. Постоянный ток подают таким образом, чтобы ионы лития и другие ионы 1 основной группы жидких металлов проходили через сухой электролит и были абсорбированы от электрического проводника. Жидкий литий является анодом, а проводящий материал на другой стороне сухого электролита является катодом. При этом используют следующие сухие электролиты: β-Аl2О3, β"-Аl2O3 , смесь Na2O и Аl2О3, NASICON и висмут или сплав висмута.
В патенте Англии GB-B 1155927 описан электрохимический способ, по которому при использовании натриевого проводника ионов, например β-Аl2О3, с амальгамой в качестве анода и натрием в качестве катода можно получить металл натрия из амальгамы натрия. Однако осуществление способа, описанного в патенте Англии GB-B 1155927, не приводит к указанным там результатам относительно соли лития, чистоты продукта и плотности тока. Кроме того, при соблюдении заданного температурного режима описанная система через несколько дней ведет себя нестабильно.
Задачей предложенного изобретения является разработка улучшенного электрохимического способа получения лития из водных растворов минимум одной соли лития через амальгаму лития, что позволяет получить литий при небольших энергетических затратах путем используемого в настоящее время электролиза расплава.
Для этого способы, описанные в патенте США US 4156635 и в J.F.Cooper et al., Proc. Electrochem. Soc. 1995, 95-11, 280-290, необходимо изменить таким образом, чтобы устранить вышеназванные проблемы и сделать возможным проведение способа в промышленных масштабах. Также необходимо добиться высокого выхода по току (патент США US 4156635 и в J.F.Cooper et al., Proc. Electrochem. Soc. 1995, 95-11, 280-290). Для получения лития из амальгамы необходимо кардинально улучшить способ, описанный в патенте Англии GB-B 1155927.
При этом должны быть выполнены следующие важные требования: способ проводят обычным образом в промышленном масштабе при использовании растворов солей лития, которые, например, получают путем растворения карбоната лития в водном растворе соляной кислоты. Также должна быть возможной переработка растворов солей лития, которые, например, возникают при синтезе литийорганических соединений в виде отходов. Поступление металла лития должно быть основным при таком отсутствии примесей, чтобы было возможно проведение следующих стадий процесса. Для этого содержание твердых металлов лития должно составлять ниже 1 части на млн. Способ необходимо осуществлять в промышленном масштабе, поэтому должны быть возможными достаточно высокие плотность тока, выходы по току, по объему и по времени.
Таким образом, предложенное изобретение относится к способу получения металла лития из водного раствора, по крайней мере, одной соли лития, который включает две стадии:
(1) получение амальгамы лития из водного раствора, по крайней мере, одной соли лития; и
(2) электролиз анода, содержащего амальгаму лития, твердого электролита, проводящего ионы лития и жидкого лития в качестве катода, отличающийся тем, что твердый электролит является герметичным в отношении гелия и используемую в качестве анода амальгаму лития поддерживают в состоянии движения.
Понятие “амальгама лития” обозначает раствор лития в ртути, который при реакционной температуре является жидким.
Новый способ осуществляют аналогично электролизу растворов хлоридов щелочных металлов по методу амальгамирования.
Кроме этого, предложенное изобретение относится к способу, по которому отходы лития, например отходы из аккумуляторов и реакционных растворов, используют повторно или в качестве исходных веществ для получения водных растворов солей лития, которые применяют согласно данному изобретению. Например, при проведении литийорганических реакций получают достаточное количество галогенидов лития в виде водных растворов. Из литий-ионных аккумуляторов возможно повторное получение водных растворов различных солей лития, например галогенидов лития, сульфатов лития, сульфонатов лития или солей органических кислот лития. Следующим возможным повторным получением такого рода растворов солей лития является кислотное растворение электролитов и электродов, используемых в аккумуляторах, например, в соляной кислоте или в серной кислоте. По предпочтительному варианту осуществления отходы лития превращают, например, при помощи соляной кислоты в водный раствор хлорида натрия.
В рамках предложенного способа на первой стадии процесса водный раствор соли лития подвергают электролизу растворов хлоридов щелочных металлов в электролизере с ртутным катодом. При использовании растворов хлоридов лития образуется анодированный хлор. Хлор выводят по обычной технологии, очищают и пускают в обычное использование. Получение хлора осуществляют аналогично известному способу получения хлора из хлорида натрия по методу амальгамирования (Ullmann's Encyclopedia of Industrial Chemistry, 6th, Edition, 1998 Electronic Release), В случае использования сульфатов лития невозможно получение анодированного кислорода. Соляные растворы на основе представленных солей лития имеют уровень рН 2-4.
Литий в восстановленной форме в виде металла превращают через катодный процесс в жидкую амальгаму. При этом ртуть или амальгама течет вдоль катода электролизера. Над ртутью течет раствор хлорида лития с содержанием хлорида лития 220-350 г/л. Анодированный хлор и раствор хлорида лития (160-210 г/л) выводят из электролизера. Чтобы амальгама оставалась текучей, содержание лития в амальгаме должно составлять 0,02-0,19% масс. (около 0,5-5 ат%), предпочтительно 0,04-0,1% масс. (около 1-3 ат%). Текущую амальгаму предпочтительно направлять при сопротивлении. В качестве анода возможно использование титана, графита. Плотность тока составляет до 10 кА/м2. ЭДС составляет при U = 4 до 5 V. Выход по току составляет более 90% (относительно хлора), как правило, 95-97%. Температура реакции составляет 50-100°С, предпочтительно 70-90°С.
Отделение хлора и обработку ртути проводят соответственно стандартам, полученным при электролизе растворов хлоридов щелочных металлов.
В рамках предложенного способа потенциал анода регулируют таким образом, чтобы было возможным только анодное окисление лития, в качестве иона его транспортируют через твердый электролит в электрическое поле и проводят только катодное восстановление.
Предложенное изобретение представлено следующими фигурами:
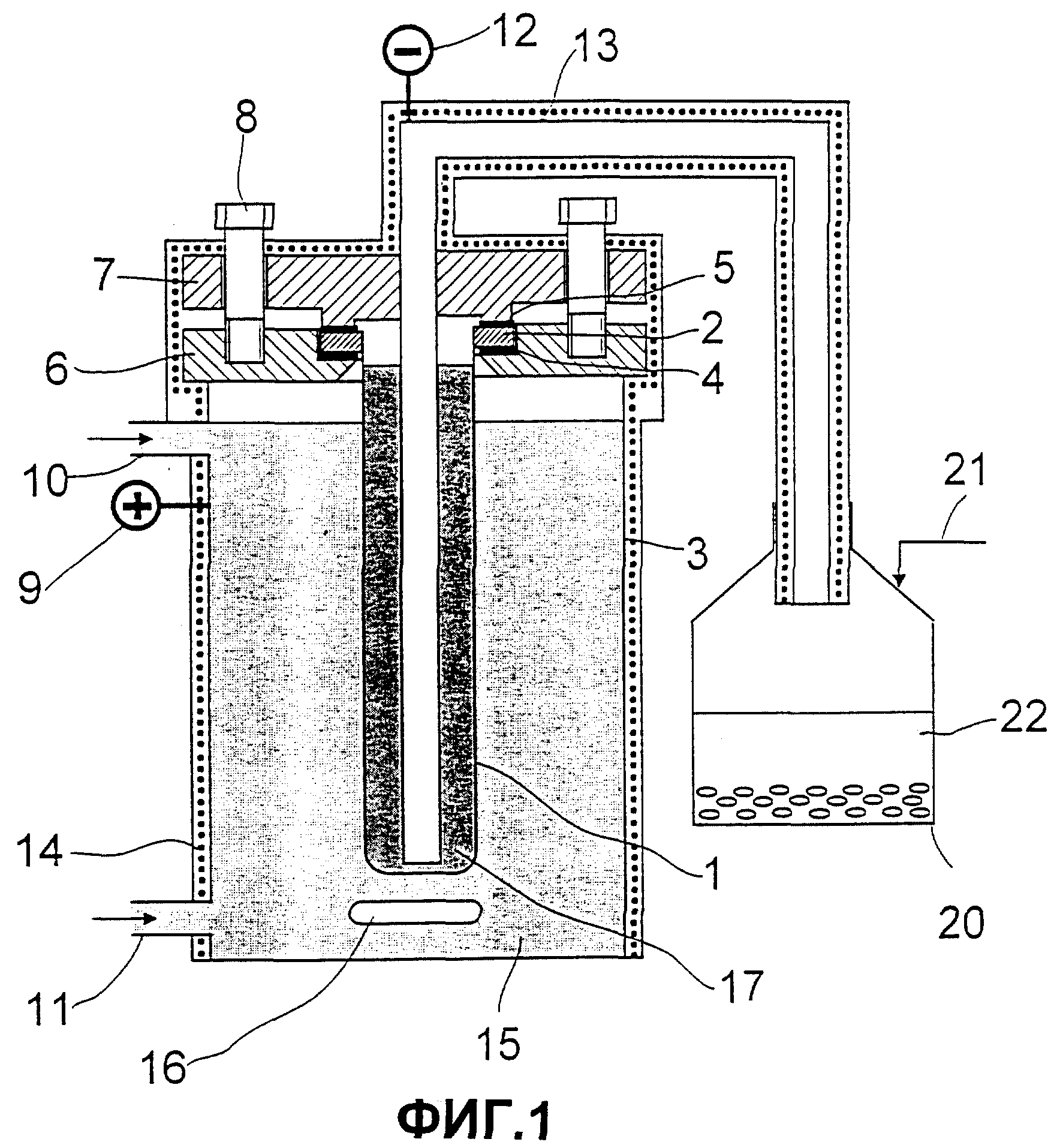
Фиг.1: схематическое изображение электролизера, который используют на двух стадиях предложенного способа и который включает в себя мешалку.
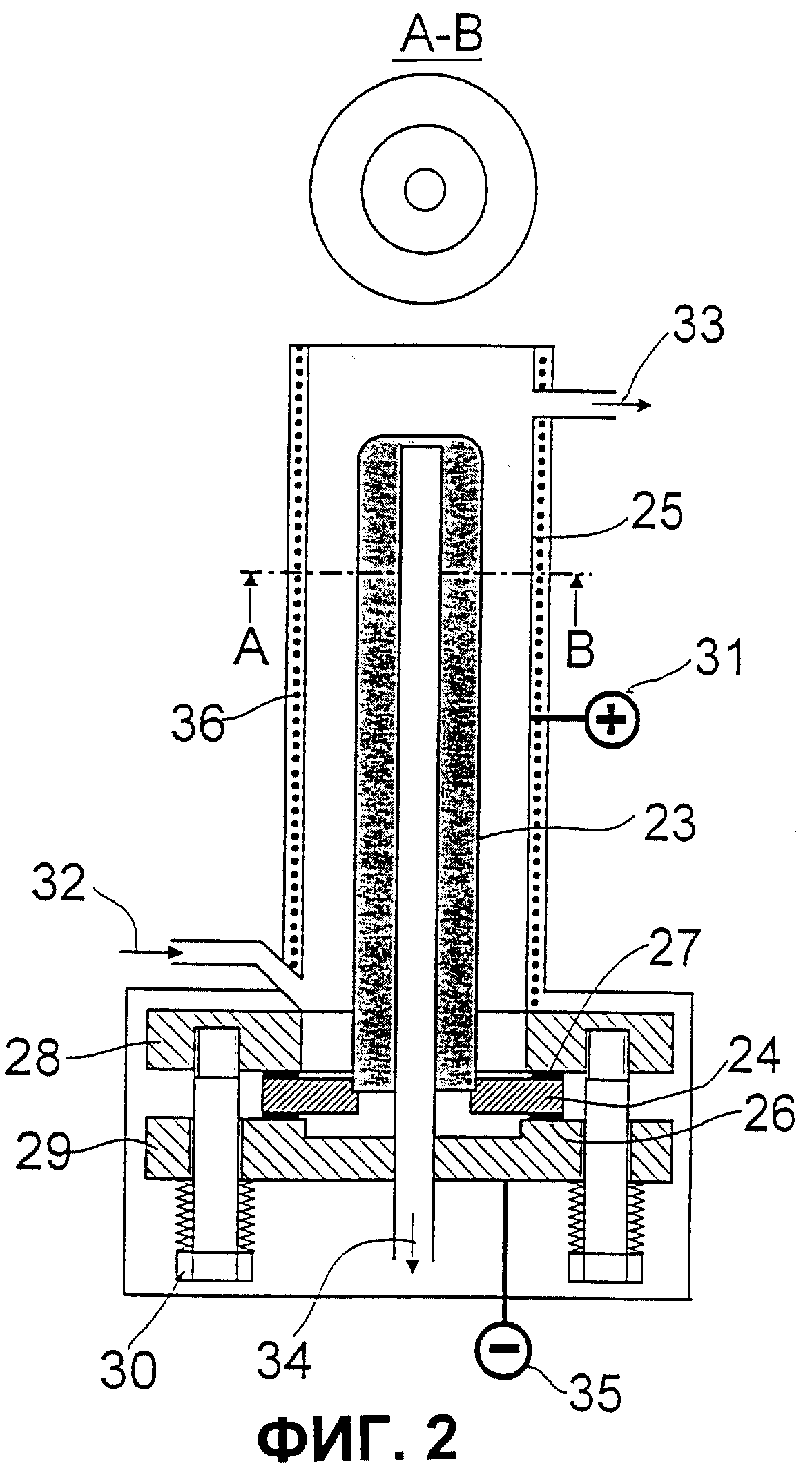
Фиг.2: схематическое изображение электролизера, который используют на второй стадии предложенного способа, включающего закрытые с одной стороны твердые электролиты в виде труб, которые собраны в трубу из концентрированной высококачественной стали.
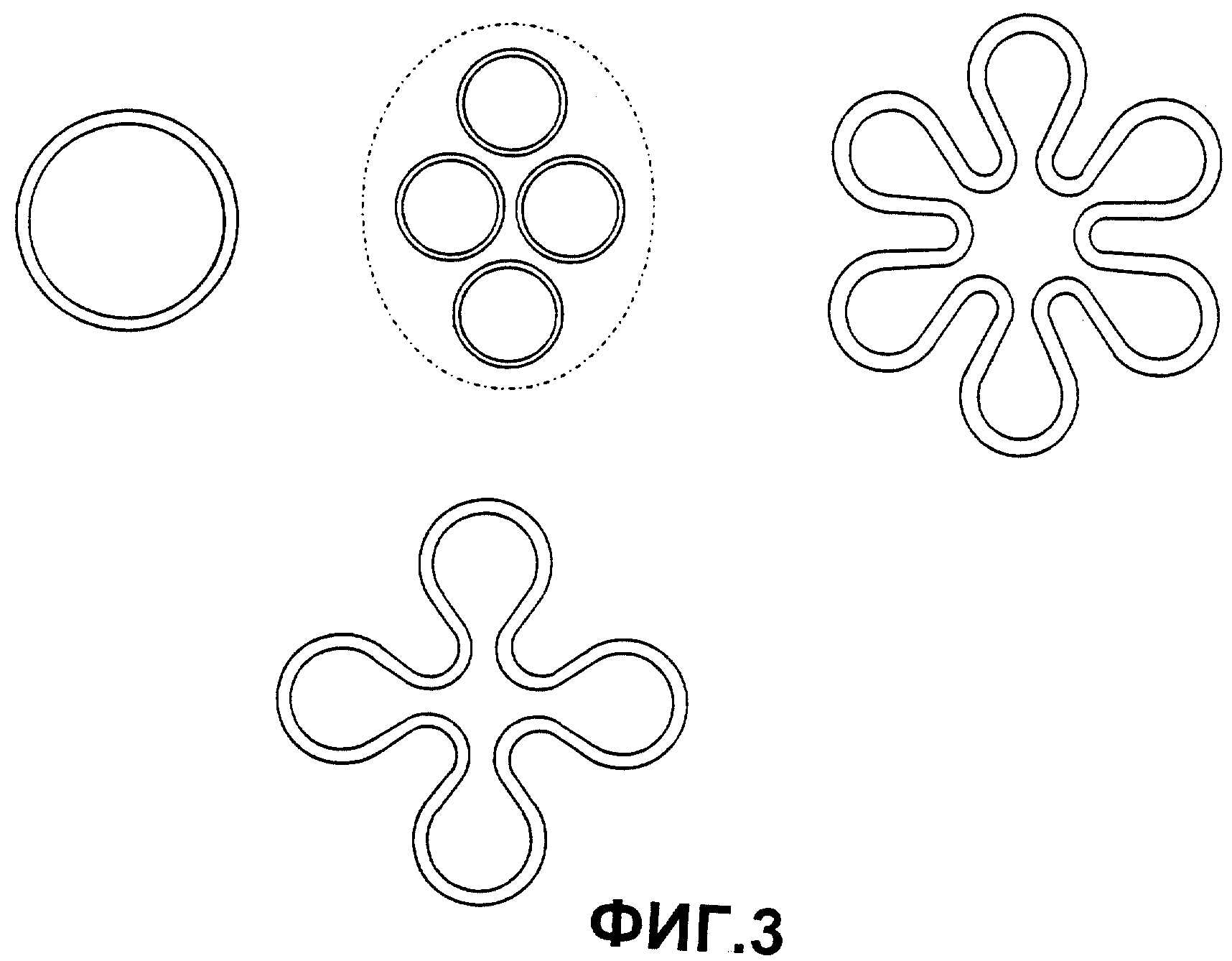
Фиг.3: схематическое изображение поперечного разреза предпочтительных вариантов предложенных используемых твердых электролитов.
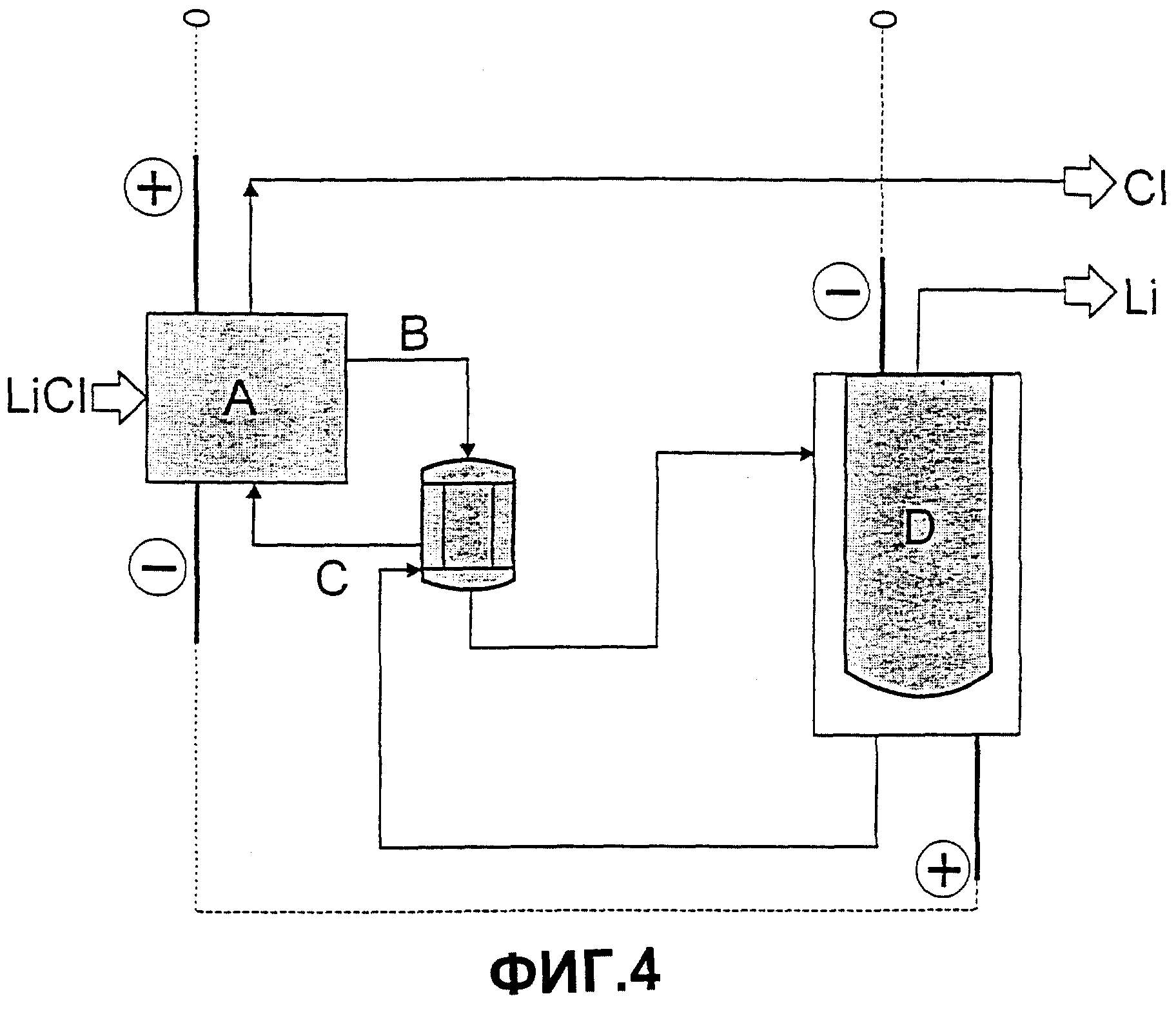
Фиг 4: схематическое изображение предложенного способа.
Вторую стадию предложенного способа осуществляют в электролизере с подвижным жидким анодом в виде лития/амальгамы. Речь идет о подвижном жидком аноде, который в течение эксплуатации обладает достаточным содержанием лития, таким образом анод в виде амальгамы, богатой литием, например, используют в электролизе для получения амальгамы лития и хлора из хлорида лития.
Возможно проведение этого процесса простым техническим способом, так как жидкая амальгама лития не имеет проблем при взаимодействии. На первой стадии концентрированный поток жидкой амальгамы проводят, как правило, при сопротивлении для того, чтобы отделить водный раствор хлорида лития. Затем поток амальгамы нагревают в теплообменном аппарате при рабочей температуре предложенного способа и загружают подвижный жидкий анод. Процесс целесообразно осуществлять в теплообменном аппарате с противотоком, чтобы эта текущая, обогащенная амальгама подогревала приток.
Возмещение обогащенной амальгамы проводят как при периодическом, так и при непрерывном процессе. При периодическом процессе получают высокую концентрацию лития через усредненное превращение циклов. Однако непрерывный процесс является более простым в эксплуатации. Недостаток, как правило, поступающий концентрат, разбавляют обогащенной амальгамой лития, в результате этого становится возможным многостадийное осуществление способа.
Перемещение жидкого анода целесообразно при перемешивании и/или при использовании насоса при циркуляции атмосферного или немного повышенного давления. Движение, вызванное при проведении возмещения амальгамы, или термическая конвекция являются не достаточными по сравнению с конвейерным движением в предложенном способе, при осуществлении которого получают предпочтительную плотность тока.
При использовании неподвижных жидких анодов, описанных в патенте Англии GB-B 1155927, плотность тока составляет только 20-50 А/м2. При увеличении ЭДС возможно лишь незначительное повышение плотности тока, поскольку сопротивление электролизера прибавляется к увеличенной плотности тока. Было неожиданно замечено, что при движении анода при уменьшении ЭДС, то есть ЭДС равна 0,9-3,5 вольт, плотность тока достигает 250-2000 А/м2, если анод является подвижным. Движение анода происходит при перемешивании, например, через вспенивание газа, или при механическом перемешивании, или при использовании насоса. Предпочтительным является движение в виде вынужденных потоков, которые возможны при циркуляции амальгамы с помощью насоса.
Проведение тока со стороны анода целесообразно проводить в электролизер через корпус из высококачественной стали, который стабилен при реакционных условиях. Анод и катод электрически изолируют подходящим способом.
Катод состоит из лития, который является жидким при температурах, необходимых для стабилизации анодирования. При монтаже электролизера литий вводят в катодное пространство предпочтительно в виде твердого резервуара. Для начала электролиза литий расплавляют. Также возможно введение лития в жидком виде. Возможно введение лития, полученного согласно предложенному изобретению, в катодное пространство через верхнее течение простым техническим способом, чтобы давление со стороны лития было выше, чем давление со стороны амальгамы. При этом микропоры и прочие неплотности уменьшают потенциальное загрязнение полученного лития ртутью. Повышенное давление катода относительно анода в предложенном способе составляет 0,1-5 бар, предпочтительно 0,5-1 бар.
Электроснабжение катода целесообразно проводить через литий и отводные трубы или присоединенные фланцы.
Анодное и катодное пространство отделяют друг от друга посредством герметичных в отношении гелия твердых электролитов, проводящих ионы лития. Для этой цели используют керамические или стеклянные материалы.
При этом проводники ионов предпочтительно выполняют следующие требования:
1. Проводники ионов демонстрируют хорошую удельную проводимость ионов Li+при реакционной температуре (σ≥0,005 плотность тока/см).
2. Проводники ионов являются стабильными относительно жидкого лития и жидкой амальгамы лития.
3. Проводники ионов имеют незначительную электронную электропроводимость.
Наиболее подходящими являются следующие твердые электролиты:
1. Li-β"-Al2О3 или Li-β-Аl2O3, их получение возможно из Na-β’’-Al2O3 или Na-β-Аl2О3 через обмен ионов натрия на ионы лития (O.Schaf, T.Widmer, U.Guth, lonics 1997, 3, 277-281).
2. Аналоги лития из керамики от NASICON, которые состоят из цепи [М2(РO4)3] при М = Zr, Ti, Ge, Hf. Они имеют общую эмпирическую формулу: Li1-xM2-xAx(PO4)3 или Li1+xM2-xM'x(PO4)3 при М = Zr, Ti, Ge, Hf; A = Nb, Та; In, Sc, Ga, Cr, Al (A.D.Robertson, A.R.West, A.G.Ritchie, Solid State lonics 1997, 104, 1-11 и приведенные там ссылки).
3. LISICONS, которые имею структуру γII-Li3 РO4 и эмпирическую форму: Li2+2xZn1-xGeO4 при -0,36<х<+0,87 или Li3+xY1-xXxO4 при Х = Si, Ge, Ti и Y = Р, V, Cr (A.D.Robertson, A.R.West, A.G.Ritchie, Solid State lonics 1997, 104, 1-11 и приведенные там ссылки).
4. Проводники ионов лития со структурой Perowskit общей эмпирической формулы Li0,5-3xLa0,5+xTiO3 или Li0,5-3xLn0,5+xTiO3 (A.D.Robertson, A.R.West, A.G.Ritchie, Solid State lonics 1997, 104, 1-11 и приведенные там ссылки, европейский патент ЕР 0835951 Al).
5. Сульфидные стеклянные материалы (R.Mercier, J.P.Malugani, B. Fahys, G. Robert, Solid State lonics 1981, 5, 663-666; патент США US 4465746; S. Sahami, S. Shea, J. Kennedy, J. Electrochem. Soc. 1985, 132, 985-986).
Предпочтительными являются литиевый β"-оксид алюминия, литиевый β-оксид алюминия и литиевый β/β"-оксид алюминия, которые могут быть получены через катионный обмен натриевого β"-оксида алюминия, натриевого β-оксида алюминия или натриевого β /β"-оксида алюминия. Также предпочтительными являются аналоги лития, например керамика от NASICON. Твердые электролиты предпочтительно имеют форму тонкостенной и, тем не менее, прочной при сжатии, закрытой с одной стороны трубы (см. европейский патент ЕР-В 0424673), на ее открытый конец надевают электрически изолированное кольцо при помощи заполненного гелием электрически изолированного стеклоприпоя (см. патент Англии GB 2207545, европейский патент ЕР-В0482785). Толщина стенок электролитов, проводящих ионы лития, составляет 0,3-5 мм, предпочтительно 1-3 мм, наиболее предпочтительно 1-2 мм. Вид поперечного разреза закрытой с одной стороны трубы в виде окружности является предпочтительной конструктивной формой, в дальнейших конструктивных формах используют виды поперечных разрезов с увеличенной поверхностью, которые могут быть получены, например, из соединения нескольких круговых поверхностей, как изображено на Фиг.3. В предложенном способе важное значение имеет герметичность твердых электролитов, проводящих ионы лития, так как ртуть может поступать в получаемый литий через места утечек в твердых электролитах или уплотняющих системах. В этом случае в предложенном способе анодные потенциалы регулируют таким образом, чтобы образование ионов ртути было прекращено. Как правило, используют твердые электролиты, которые при проведении теста на утечку гелия имеют долю утечки менее 1·10-9 мбар ·литр ·с-1, таким образом определяют границы плотности гелия.
Кроме этого растворимые уплотняющие соединения используют таким образом, чтобы литий и амальгама стали герметичными в атмосфере окружающей среды. Однако по возможности следует избегать помещения растворимых уплотнений между литием и амальгамой, так как растворимые уплотнения как правило заполнены жидкостью, и не являются газонепроницаемыми, поэтому пары ртути могут диффундировать через растворимые уплотнения и загрязнять литий. Согласно предпочтительному варианту осуществления в качестве растворимых уплотняющих соединений используют плоские уплотнения, предпочтительно из графита, например не усиленный GRAPHIFLEX®, или из усиленного высоким давлением SIGNAFLEX® от фирмы SGL Carbon. Уплотнения омывают инертным газом, например аргоном или азотом, чтобы прекратить диффундирование кислорода. При использовании герметичных в отношении гелия электролитов и уплотняющей системы содержание остатков ртути в литии составляет 0,05-0,3 частей на млн.
На Фиг.1 продемонстрировано типичное опытное устройство: подобно описанному в патенте Англии GB 115927 для натрия, в центре электролизера находится закрытая с одной стороны труба 1 из твердых электролитов, проводящих ионы лития, с толщиной стенок предпочтительно 1-3 мм, вместо описанных в патенте Англии 115927 5 мм. На открытый конец трубы при помощи заполненного гелием стеклоприпоя надевают кольцо из непроводящего материала 2. Через это кольцо вставляют трубу проводящую ионы лития с отверстием наверх в цилиндрический резервуар 3 из аустенитной высококачественной стали 1.4571 и герметизируют. Для этого кольцо 2 затягивают одним плоским уплотнением ниже 4 и одним плоским уплотнением выше 5 через корпусный фланец 6 и фланец крышки 7 тремя натяжными болтами 8.
К резервуару из высококачественной стали пристраивают анодный токоподвод 9. Для подачи амальгамы наверху сбоку приваривают штуцер 10, для слива амальгамы внизу сбоку штуцер 11. Из фланца крышки выходит труба из высококачественной стали 13 в качестве катодного токоподвода 12 в отверстие трубы 13, проводящей ионы лития. Эта труба 13 проходит через фланец крышки и наверху сбоку служит для вывода жидкого лития. Всю аппаратуру нагревают (14).
Амальгама является анодом 15 между корпусом и наружной стенкой трубы из твердых электролитов, проводящих ионы лития. Анод постоянно движется через магнитную мешалку 16. Катодом 17 является жидкий литий внутри трубы из твердых электролитов, проводящих ионы лития. Образованный жидкий литий выходит через нагретую выводную трубу, например, через аргон 21, в резервуар 20, который частично наполнен инертной жидкостью 22.
При первичном использовании твердых электролитов, проводящих ионы лития, часто наблюдают относительно высокое сопротивление керамики, которое при следующих режимах эксплуатации остается неизменным. Сопротивление твердых электролитов может быть повышено относительно достижимых уровней до фактора 15. Это является вероятным объяснением недостатка поверхностной реактивности.
Уменьшение сопротивления керамики возможно вследствие проведения кондиционирования керамики.
При этом возможно, например, четкое понижение сопротивления керамики, если вначале проводят перемену полярности в электролизере, то есть анод используют в качестве катода. В этом случае катод может как обычно состоять из амальгамы лития. Плотность тока при перемене полярности в течение 1-44 часов, предпочтительно 2-6 часов повышается от 50 А/м2 до 1000 А/м2.
Пониженное сопротивление керамики получают, если при использовании рабочей температуры 250-400°С в течение 1-24 часов анодом вначале является жидкий литий, который затем заменяют амальгамой. Этот вариант кондиционирования является наиболее предпочтительным.
При проведении предложенного способа необходимо обязательно исключить воздействия водного пара на керамику, проводящую ионы лития. Для этого, как правило, нагревают амальгаму, проводящую водные микрочастицы, водный пар удаляют и затем в безводную смесь амальгамы/ртути помещают жидкий анод. Удаление водных паров целесообразно проводить через отгонку инертным газом или при повышенном давлении.
Плотность тока составляет 0,3-10 кА/м2, предпочтительно 0,5-3 кА/м2. Плотность тока регулируют на внешних источниках тока, как правило, сетевом детекторе.
По предпочтительному варианту осуществления электролизер, используемый на второй стадии согласно изобретению, интегрируют в систему электропитания хлорного электролизера, выделяющего амальгаму на первой стадии, таким образом отпадает необходимость в дополнительном использовании сетевого детектора (Фиг.4).
По предпочтительному варианту осуществления керамика, проводящая ионы лития, представляет собой закрытую с одной стороны трубу, которая находится во внутреннем пространстве большой внешней трубы. Внешняя труба состоит из материала, который является очень прочным и стойким относительно горячей амальгамы. Таким материалом является предпочтительно высококачественная сталь и графит. Кольцевая щель проходит между внешним кольцом и керамическим кольцом вдоль жидкого анода. Диаметр кольцевой щели составляет 1-10 мм, предпочтительно 2-5 мм, наиболее предпочтительно 2,5-3 мм. Скорость потока составляет 0,03-1,0 м/с, предпочтительно 0,05-0,6 м/с, наиболее предпочтительно 0,1-0,3 м/с. Более высокая скорость потока допускает более высокую плотность тока. Другим преимуществом использования анода в виде кольцевой щели являются относительно небольшие объемы анода, относительно площади анода. В результате становится возможным выполнение таких требований, как уменьшение веса оборудования и акцептированная способность циркуляции ртути.
На Фиг.2 продемонстрировано типичное осуществление способа: в центре электролизере находится закрытая с одной стороны труба 23 из твердых электролитов, проводящих ионы лития. На открытый конец при помощи наполненного гелием стеклоприпоя надевают кольцо из изолированного материала 24. Через это кольцо 24 присоединяют трубу, поводящую ионы лития, с отверстием вниз в трубу из концентрированной высококачественной стали 25 таким образом, чтобы кольцевая щель составляла 2-5 мм. Определенное анодное пространство над кольцевой трещиной и длину трубы заполняют относительно небольшим объемом ртути. При использовании других наполнителей возможно их эффективное прохождение, относительно плотности тока, через анодное пространство в осевом направлении поперечного сечения трубы. Для герметизации кольцо 24 затягивают одним плоским уплотнением ниже 26 и одним плоским уплотнением выше 27 через корпусный фланец 28 и фланец крышки 29 тремя или четырьмя натяжными болтами 30.
К резервуару из высококачественной стали присоединяют анодный токоподвод 31. Для подачи амальгамы внизу сбоку приваривают штуцер 32, для слива амальгамы наверху сбоку штуцер 33. Из фланца крышки выводят трубу из высококачественной стали 34 в качестве катодного токоподвода 35 в отверстие трубы 34 из твердых электролитов. Труба 34 проходит через фланец крышки и служит для свободного выхода жидкого лития. Электролизер нагревают (36).
Анодом является амальгама в кольцевом пространстве между внутренней стальной трубой и внешней стеной трубы из твердых электролитов, проводящей ионы лития. Катодом является жидкий литий внутри трубы из твердых электролитов, проводящей ионы лития.
ЭДС понижают двумя отдельными способами: через электрохимический потенциал окислительно-восстановительной системы лития до амальгамы лития и падение омического напряжения при электрическом сопротивлении керамических электролитов. ЭДС выполняет функцию плотности тока. Электрохимический потенциал измеряют при обесточенном режиме, его регулируют соответственно концентрации лития в жидком аноде. При концентрации лития 0,05% масс. при обесточенном режиме ЭДС регулируют, например, 0,92 вольт. При плотности тока 1000 А/м2 ЭДС регулируют, например, 1,95 вольт.
ЭДС контролируют и лимитируют, чтобы исключить анодные потенциалы, при которых возможно окисление металлических примесей стали после ряда электрохимических напряжений на подвижном аноде.
Значение ЭДС может быть индикатором для массопередачи на подвижном жидком аноде к поверхности керамики, и ее, как правило, регулируют. Лимитирование массопередачи может быть вызвано низкой концентрацией лития на аноде, и недостаточным потоком или слишком высокой плотностью тока.
Лимитирование массопередачи, то есть при повышенной ЭДС, устанавливают на короткий период времени, так как после многодневного применения этой области предельного тока возникают необратимые повреждения керамики, например потеря электропроводимости и хрупкость с образованием трещин.
В предпочтительном способе перемену полярности направления тока проводят с интервалами от 1 до 24 часов в течение 1-10 минут, между тем происходит короткое замыкание анода и катода через внешнее сопротивление. Сопротивление соразмеряют таким образом, чтобы сила тока при перемене полярности соответствовала примерно 1,5-кратной силе тока при эксплуатации. В предложенном способе выход полученного лития является полным относительно лития, используемого на стороне анода. Выход по току полученного лития равен 100% при обычной полярности. При перемене полярности средний выход по току уменьшается до уровня 95-98%.
Количество амальгамы, проводящей анод, по предпочтительному варианту осуществления достигает 0,1% масс. на 0,03% лития. Не использованный литий, который выходит при электролизе растворов хлоридов щелочных металлов, не теряют, так как он возвращается обратно в электролизер для электролиза растворов хлоридов щелочных металлов и уже оттуда выходит через циркуляцию амальгамы.
Для этого раствор соли лития восстанавливают на амальгамном или ртутном катоде. Несмотря на то что принципиально используют все водные растворы солей лития, в связи с проведением электролиза растворов хлоридов щелочных металлов предпочтительно подвергают превращению водный раствор хлорида лития.
Реферат
Способ получения металла лития из водного раствора, по крайней мере, одной соли лития включает две стадии: (1) получение амальгамы лития из водного раствора, по крайней мере, одной соли лития; и (2) электролиз с применением анода, содержащего амальгаму лития, твердого электролита, проводящего ионы лития, и жидкого лития в качестве катода, причем амальгама лития действует в качестве анода, при этом твердый электролит является герметичным в отношении гелия и используемую в качестве анода амальгаму лития поддерживают в состоянии движения, обеспечивается снижение энергетических затрат и повышение выхода лития по току. 7 з.п. ф-лы, 4 ил.

Комментарии