Новое ариламидиновое производное, его соль и противогрибковое средство, содержащее такие соединения - RU2359959C2
Код документа: RU2359959C2
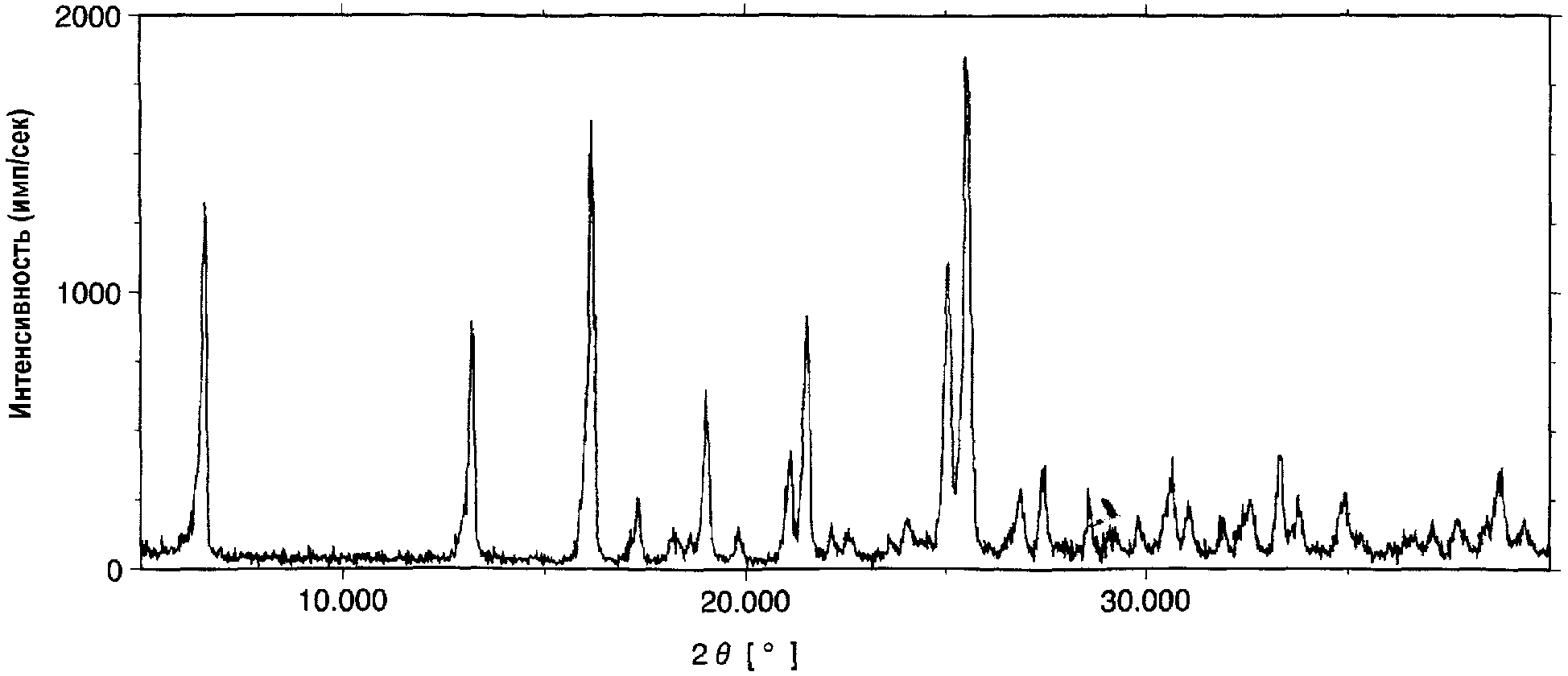
Чертежи
Описание
Область изобретения
Настоящее изобретение относится к новому ариламидиновому производному или его соли, обладающему противогрибковой активностью, и к противогрибковому средству, содержащему такие соединения в качестве активного ингредиента.
Предпосылки изобретения
Опасный глубокий микоз, такой как инвазивный кандидоз, часто становится смертельным заболеванием. Ранее считалось, что основным защитным механизмом организма хозяина против грибков, таких как Candida, должна быть неспецифическая иммунизация нейтрофилами. Когда такой защитный механизм нормально функционирует, то риск заражения грибковой инфекцией незначителен. Однако в последние годы риск заболевания глубоким микозом сильно увеличился из-за увеличения количества пациентов, страдающих заболеваниями, на фоне которых снижается иммунологическая функция организма, такими как злокачественные опухоли и СПИД, частого применения противоопухолевых средств или иммуносуппрессоров, широкого применения антибиотиков или стероидных гормонов, длительного применения усиленного питания через центральные вены или катетеризации вен и т.п. (непатентный документ 1).
Существует только 6 лекарственных средств, применяемых для лечения такого глубокого микоза, а именно, амфотерицин B, флуцитозин, миконазол, флуконазол, интраконазол и микафунгин. Амфотерицин B обладает чрезвычайно сильным фунгицидным действием; однако с ним связаны проблемы возникновения побочных эффектов, таких как нефротоксичность, и поэтому его клиническое применение ограничено. Флуцитозин в настоящее время редко используют отдельно, поскольку это средство создает проблемы, например развитие резистентности. Микафунгин обладает низкой активностью против рода Cryptococcus. Другие средства имеют общее название “азольные противогрибковые средства”, и они наиболее часто применяются в настоящее время, учитывая баланс эффективности и безопасности, хотя их противогрибковое действие, как правило, ниже по сравнению с амфотерицином B (непатентный документ 2).
В настоящее время в орофарингеальных кандидозных поражениях у пациентов со СПИДом, которым постоянно вводили флуконазол, часто обнаруживают флуконазол-резистентный Candida albicans (C. albicans). Более того, большинство резистентных штаммов демонстрируют перекрестную резистентность к интраконазолу и другим азольным средствам. Кроме того, сообщалось, что такие резистентные штаммы были выделены у не страдающих СПИДом пациентов, у которых развился хронический кандидоз, поражающий кожу и слизистые оболочки, или глубокий кандидоз (непатентный документ 3). Проблемы, связанные с резистентностью, серьезно влияют на лечение пациентов с глубоким микозом, количество которых постоянно увеличивается (непатентный документ 3).
[Непатентный документ 1]: Rinsho to Biseibutsu (Clinics and Microorganisms), Vol.17: pp.265-266, 1990
[Непатентный документ 2]: Rinsho to Biseibutsu (Clinics and Microorganisms), Vol.21: pp.277-283, 1994
[Непатентный документ 3]: Rinsho to Biseibutsu (Clinics and Microorganisms), Vol.28: pp.51-58, 2001.
Раскрытие изобретения
Задачи, решаемые настоящим изобретением
Существует настоятельная необходимость в противогрибковом средстве, механизм действия которого отличается от механизма действия существующих средств и которое является эффективным даже против грибков, резистентных к азольным средствам, но при этом имеет меньше побочных эффектов. WO03/074476 описывает, что ариламидиновое производное обладает сильным противогрибковым действием и является полезным в качестве противогрибкового средства; однако существует потребность в соединении, которое имеет еще меньше побочных эффектов и улучшенные физические свойства, такие как гигроскопичность и расплывание на влажном воздухе, и, кроме того, в соединении, которое также обладает превосходным эффектом против протозойных и т.п.
Средства для решения задач
В таких обстоятельствах в результате интенсивных исследований авторы настоящего изобретения обнаружили, что соединение, представленное общей формулой (1):
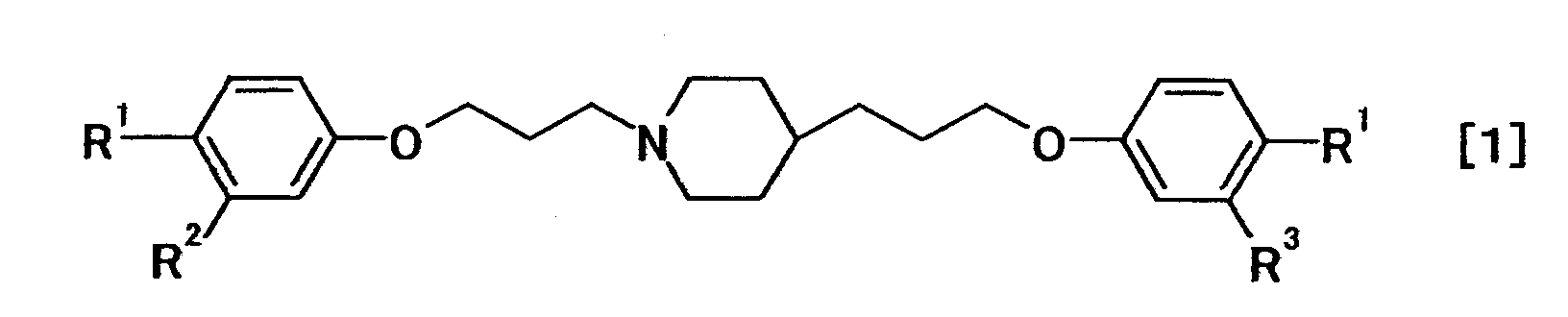
где R1 представляет необязательно защищенную или замещенную амидиногруппу; и R2 и R3 являются одинаковыми или отличными друг от друга, и каждый представляет собой атом водорода или атом галогена; или его соль является эффективным даже против грибков, резистентных к азольным средствам, и при этом имеет меньше побочных эффектов; в частности, соединение общей формулы (1), где R1 представляет собой амидиногруппу и каждый R2 и R3 представляет собой атом водорода, демонстрирует сильную активность против грибков, включая те, которые являются резистентными к азольным средствам, и при этом является высоко безопасным; и, кроме того, тригидрохлорид пентагидрат соединения общей формулы (1), где R1 представляет собой амидиногруппу и каждый R2 и R3представляет собой атом водорода, является превосходным по химической стабильности, и при этом он не расплывается на влажном воздухе или негигроскопичен и является подходящим в качестве лекарственного средства, и, кроме того, обладает отличным антипротозойным действием, таким образом, было создано настоящее изобретение.
Преимущества настоящего изобретения
Соединение по настоящему изобретению обладает высокой активностью против грибков, включая грибки, резистентные к азольным средствам, обладает превосходными физическими свойствами, а также высокой безопасностью и является полезным в качестве противогрибкового средства. Кроме того, соединение обладает превосходным антипротозойным действием и является полезным в качестве антипротозойного средства.
Лучший способ осуществления изобретения
Ниже представлено подробное описание настоящего изобретения.
В описании, если не указано иное, атом галогена относится к атому фтора, атому хлора, атому брома или атому иода; алкильная группа относится, например, к линейной или разветвленной С1-С12алкильной группе, такой как метил, этил, пропил, изопропил, бутил, втор-бутил, изобутил, трет-бутил, пентил, изопентил, гексил, гептил и октил; низшая алкильная группа относится, например, к линейной или разветвленной С1-С6алкильной группе, такой как метил, этил, пропил, изопропил, бутил, втор-бутил, изобутил, трет-бутил, пентил и изопентил; алкенильная группа относится, например, к линейной или разветвленной С1-С12алкенильной группе, такой как винил, аллил, пропенил, изопропенил, бутенил, изобутенил, пентенил, гексенил, гептенил и октенил; арильная группа относится, например, к такой группе как фенил и нафтил; аралкильная группа относится, например, к С1-С6аралкильной группе, такой как бензил, дифенилметил, тритил, фенетил и нафтилметил; алкоксигруппа относится, например, к линейной или разветвленной С1-С6алкилоксигруппе, такой как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси и изопентилокси; аралкилоксигруппа относится, например, к ар-C1-6-алкилоксигруппе, такой как бензилокси, дифенилметилокси, тритилокси, фенетилокси и нафтилметилокси; алкоксиалкильная группа относится, например, к С1-С6алкилокси-С1-С6алкильной группе, такой как метоксиметил и 1-этоксиэтил; циклоалкилоксигруппа относится, например, к C3-8 циклоалкилоксигруппе, так как циклопропокси, циклобутокси, циклопентилокси и циклогексилокси; аралкилоксиалкильная группа относится, например, к ар-С1-С6алкилокси-С1-С6алкильной группе, такой как бензилоксиметил и фенетилоксиметил;
Ацильная группа относится, например, к линейной или разветвленной C2-12 алканоильной группе, такой как формил, ацетил, пропионил и изовалерил, ар-С1-С6алкилкарбонильной группе, такой как бензилкарбонил, ароильной группе, такой как бензоил и нафтоил, гетероциклической карбонильной группе, такой как никотиноил, теноил, пирролидинокарбонил и фуроил, карбокси-С1-С6алкилкарбонильной группе, такой как 3-карбоксипропаноил и 4-карбоксибутаноил, С1-С6алкилоксикарбонил-С1-С6алкилкарбонильной группе, такой как 3-(метоксикарбонил)пропаноил и 4-(метоксикарбонил)бутаноил, сукцинильной группе, глутарильной группе, малеоильной группе, фталоильной группе или линейной или разветвленной α-аминоалканоильной группе, N-конец которой является необязательно защищенным, полученной из аминокислоты (включая, например, глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, аспарагиновую кислоту, глутаминовую кислоту, аспарагин, глутамин, аргинин, лизин, гистидин, гидроксилизин, фенилаланин, тирозин, триптофан, пролин или гидроксипролин);
алкилоксикарбонильная группа относится, например, к линейной или разветвленной C1-12 алкилоксикарбонильной группе, такой как метоксикарбонил, этоксикарбонил, 1,1-диметилпропоксикарбонил, изопропоксикарбонил, 2-этилгексилоксикарбонил, трет-бутоксикарбонил и трет-пентилоксикарбонил; циклоалкилоксикарбонильная группа относится, например, к С3-8 циклоалкилоксикарбонильной группе, такой как циклопентилоксикарбонил и циклогексилоксикарбонил; аралкилоксикарбонильная группа относится, например, к ар-С1-С6алкилоксикарбонильной группе, такой как бензилоксикарбонил и фенетилоксикарбонил; арилоксикарбонильная группа относится, например, к такой группе как фенилоксикарбонил; ацилоксигруппа относится, например, к линейной или разветвленной C2-6 алканоилоксигруппе, такой как ацетилокси и пропионилокси, или ароилоксигруппе, такой как бензоилокси; арилтиогруппа относится, например, к такой группе как фенилтио; алкансульфонильная группа относится, например, к С1-С6алкансульфонильной группе, такой как метансульфонил, этансульфонил и пропансульфонил; арилсульфонильная группа относится, например, к такой группе как бензолсульфонил, толуолсульфонил и нафталинсульфонил; алкансульфонилоксигруппа относится, например, к С1-С6 алкансульфонилоксигруппе, такой как метансульфонилокси и этансульфонилокси; арилсульфонилоксигруппа относится, например, к такой группе как бензолсульфонилокси и толуолсульфонилокси;
алкилтиокарбонильная группа относится, например, к С1-С6алкилтиокарбонильной группе, такой как метилтиокарбонил и этилтиокарбонил; циклоалкилиденовая группа относится, например, к такой группе как циклопентилиден и циклогексилиден; аралкилиденовая группа относится, например, к такой группе как бензилиден и нафтилметилен; диалкиламиноалкилиденовая группа относится, например, к такой группе как N,N-диметиламинометилен и N,N-диэтиламинометилен; диаралкилфосфорильная группа относится, например, к такой группе как дибензилфосфорил; диарилфосфорильная группа относится, например, к такой группе как дифенилфосфорил;
кислородсодержащая гетероциклическая группа относится, например, к такой группе как тетрагидрофурил и тетрагидропиранил; кислородсодержащая гетероциклическая алкильная группа относится, например, к такой группе как 5-метил-2-оксо-2Н-1,3-диоксол-4-илметил; содержащая серу гетероциклическая группа относится, например, к такой группе как тетрагидротиопиранил; гетероциклическая оксикарбонильная группа относится, например, к такой группе как 2-фурфурилоксикарбонил и 8-хинолилоксикарбонил; азотсодержащая гетероциклическая алкилиденовая группа относится, например, к такой группе как 3-гидрокси-4-пиридилметилен; и замещенная силильная группа относится, например, к такой группе как триметилсилил, триэтилсилил и трибутилсилил.
Каждая из вышеуказанных групп может быть дополнительно замещена одной или несколькими группами, выбранными из атома галогена, необязательно защищенной аминогруппы, необязательно защищенной гидроксильной группы, нитрогруппы, низшей алкильной группы, алкенильной группы, алкоксигруппы, аралкилоксигруппы, арильной группы, ацильной группы и оксогруппы.
Аминозащитные группы охватывают все традиционные группы, которые можно использовать в качестве защитных групп для аминогруппы, и включают, например, ацильную группу, алкилоксикарбонильную группу, аралкилоксикарбонильную группу, арилоксикарбонильную группу, аралкильную группу, алкоксиалкильную группу, аралкилоксиалкильную группу, арилтиогруппу, алкансульфонильную группу, арилсульфонильную группу, диалкиламиноалкилиденовую группу, аралкилиденовую группу, азотсодержащую гетероциклическую алкилиденовую группу, циклоалкилиденовую группу, диарилфосфорильную группу, диаралкилфосфорильную группу, кислородсодержащую гетероциклическую алкильную группу и замещенную силильную группу.
Гидроксилзащитные группы охватывают все традиционные группы, которые можно использовать в качестве защитных групп для гидроксильной группы, и включают, например, ацильную группу, алкилоксикарбонильную группу, аралкилоксикарбонильную группу, гетероциклическую оксикарбонильную группу, алкильную группу, алкенильную группу, аралкильную группу, кислородсодержащую гетероциклическую группу, содержащую серу гетероциклическую группу, алкоксиалкильную группу, аралкилоксиалкильную группу, алкансульфонильную группу, арилсульфонильную группу и замещенную силильную группу.
Амидинозащитные группы охватывают все традиционные группы, которые можно использовать в качестве защитных групп для амидиногруппы, и включают, например, ацильную группу, алкилоксикарбонильную группу, аралкилоксикарбонильную группу, арилоксикарбонильную группу, циклоалкилоксикарбонильную группу, аралкильную группу, алкоксиалкильную группу, аралкилоксиалкильную группу, арилтиогруппу, алкансульфонильную группу, арилсульфонильную группу, циклоалкилоксикарбонильную группу, алкилтиокарбонильную группу, диалкиламиноалкилиденовую группу, аралкилиденовую группу, азотсодержащую гетероциклическую алкилиденовую группу, циклоалкилиденовую группу, кислородсодержащую гетероциклическую алкильную группу и замещенную силильную группу.
Заместители для амидиногруппы включают, например, гидроксильную группу, необязательно замещенную ацильной группой, и необязательно замещенные алкокси- и аралкилоксигруппы.
Удаляемые группы включают, например, атом галогена, алкансульфонилоксигруппу, арилсульфонилоксигруппу и ацилоксигруппу.
Соли соединения формулы (1) включают, например, соли с минеральными кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота и серная кислота; соли с органическими карбоновыми кислотами, такими как муравьиная кислота, уксусная кислота, трихлоруксусная кислота, L-молочная кислота, L-винная кислота, лимонная кислота, янтарная кислота, малеиновая кислота, фумаровая кислота и трифторуксусная кислота; и соли с сульфоновыми кислотами, такими как метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, мезитиленсульфоновая кислота и нафталинсульфоновая кислота.
Предпочтительные соли соединения формулы (1) включают фармакологически приемлемые соли. В соответствии с настоящим изобретением, предпочтительные соединения включают следующие соединения.
Предпочтительным является соединение, где R1 представляет собой амидиногруппу, необязательно замещенную гидроксильной группой, необязательно замещенной ацильной группой; более предпочтительным является соединение, где R1 представляет собой амидиногруппу, необязательно замещенную гидроксильной группой; еще более предпочтительным является соединение, где Rl представляет собой амидиногруппу.
Предпочтительным является соединение, где R2 и R3 являются одинаковыми или отличными друг от друга, и каждый представляет собой атом водорода или атом фтора; и более предпочтительным является соединение, где R2 и R3, каждый, представляет собой атом водорода.
Соединение, где R1 представляет собой амидиногруппу, и R2 и R3, каждый, представляет собой атом водорода, предпочтительно, представляет собой соль с хлористоводородной кислотой, фосфорной кислотой, серной кислотой, уксусной кислотой, L-молочной кислотой или метансульфоновой кислотой, более предпочтительно - соль с хлористоводородной кислотой, фосфорной кислотой или серной кислотой, еще более предпочтительно - соль с хлористоводородной кислотой.
Гидрохлорид соединения, где R1представляет собой амидиногруппу, и R2 и R3, каждый, представляет собой атом водорода, предпочтительно, представляет собой дигидрохлорид или тригидрохлорид, более предпочтительно - тригидрохлорид.
Тригидрохлорид, предпочтительно, находится в форме моногидрата или пентагидрата, более предпочтительно - в форме пентагидрата.
Ниже описан способ получения соединения по настоящему изобретению.
Соединение по настоящему изобретению получают путем сочетания способов, известных per se, и, например, при помощи способов получения, представленных ниже.
(Способ получения 1)
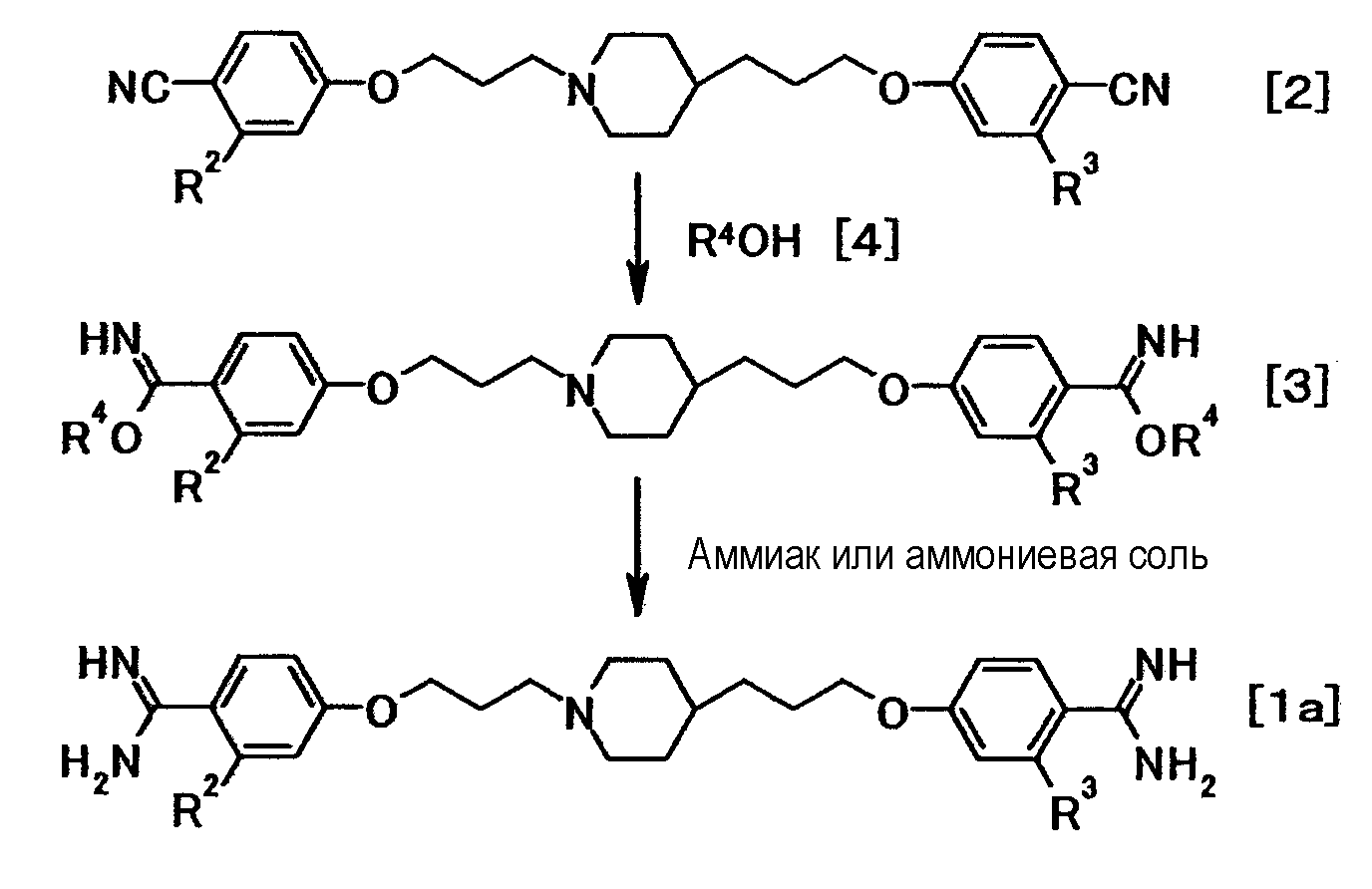
где R4 представляет собой низшую алкильную группу; и R2 и R3 имеют значения, определенные выше.
Соединение общей формулы (1a) можно получить путем взаимодействия соединения общей формулы (2) с соединением общей формулы (4) с преобразованием в соединение общей формулы (3), с последующим взаимодействием соединения общей формулы (3) с аммиаком или солью аммония. Эту реакцию можно осуществить способом, описанным, например, в W096/16947 и J. Org. Chem., 64:12-13, 1999, или аналогичным способом.
Такая последовательность реакций подробно описана ниже.
(1-1)
Соединение общей формулы (3) можно получить путем взаимодействия соединения общей формулы (2) с соединением общей формулы (4) в присутствии кислоты.
Растворитель, используемый в этой реакции, конкретно не органичен, при условии, что он не оказывает негативного влияния на реакцию, и примеры такого растворителя включают спирты, такие как метанол, этанол, 2-пропанол и 2-метил-2-пропанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; сульфоксиды, такие как диметилсульфоксид; кетоны, такие как ацетон и 2-бутанон; сложные эфиры, такие как этилацетат; и карбоновые кислоты, такие как уксусная кислота. Такие растворители можно использовать в виде смеси. Соединение общей формулы (4) также можно использовать в качестве растворителя.
Примеры кислоты, используемой в реакции, включают хлористый водород, бромистый водород, перхлорную кислоту, п-толуолсульфоновую кислоту и метансульфоновую кислоту, и используемое количество такой кислоты составляет 1-200-кратное мольное количество, предпочтительно, 5-100-кратное мольное количество, в расчете на соединение общей формулы (2).
В этой реакции используемое количество соединения общей формулы (4) может составлять 2-1000-кратное мольное количество в расчете на соединение общей формулы (2) и предпочтительно используется в качестве растворителя.
Реакцию можно осуществлять при температуре от -30 до 150°C, предпочтительно от 10 до 50°C, в течение времени от 30 минут до 24 часов.
(1-2)
Соединение общей формулы (1a) можно получить путем взаимодействия соединения общей формулы (3) с аммиаком или солью аммония.
Растворитель, используемый в этой реакции, конкретно не органичен, при условии, что он не оказывает негативного влияния на реакцию, и примеры такого растворителя включают спирты, такие как метанол, этанол, 2-пропанол и 2-метил-2-пропанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид; гетероароматические соединения, такие как пиридин; и воду. Такие растворители можно использовать в виде смеси.
Примеры соли аммония включают хлорид аммония, бромид аммония и ацетат аммония. Используемое количество аммиака или соли аммония может составлять 3-100-кратное мольное количество, предпочтительно, 3-10-кратное мольное количество, в расчете на соединение общей формулы (3).
Реакцию можно осуществлять при температуре от 0 до 150°C, предпочтительно от 20 до 120°C, в течение времени от одной минуты до 24 часов.
(Способ получения 2)
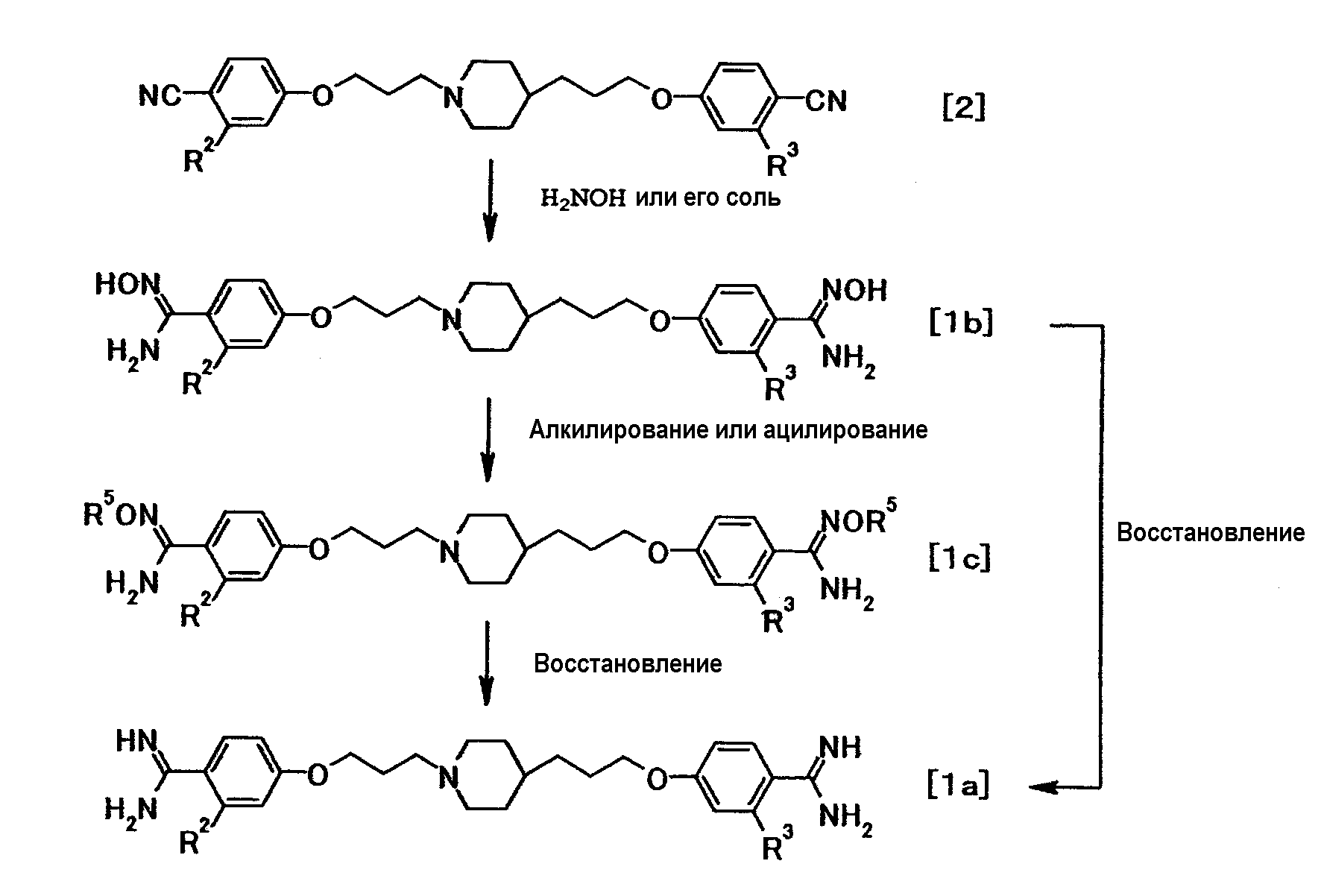
где R5 представляет собой необязательно замещенный ацил, низшую алкильную или аралкильную группу; и R2 и R3 имеют значения, указанные выше.
Соединение общей формулы (1b) можно получить из соединения общей формулы (2). Соединение общей формулы (1b) затем можно подвергнуть алкилированию или ацилированию с получением соединения общей формулы (Ic). Соединение общей формулы (Ic) затем можно подвергнуть восстановлению с получением соединения общей формулы (1a). Кроме того, соединение общей формулы (1b) может быть восстановлено с получением соединения общей формулы (1a). Эти реакции можно осуществить способами, описанными, например, в Tetrahedron, 51:12047-12068, 1995; Synthetic Communication, 26:4351-15 4367, 1996; Synthesis, 16:2467-2469, 2003; Heterocycles, 60:1133-1145, 2003; и Bioorganic and Medicinal Chemistry Letter, 12:1203-1208, 2002, или аналогичными способами.
Такая последовательность реакций подробно описана ниже.
(2-1)
Соединение общей формулы (1b) можно получить путем взаимодействия соединения общей формулы (2) с гидроксиламином или его солью в присутствии или в отсутствие основания.
Растворитель, используемый в этой реакции, конкретно не органичен, при условии, что он не оказывает негативного влияния на реакцию, и примеры такого растворителя включают спирты, такие как метанол, этанол, 2-пропанол и 2-метил-2-пропанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; сульфоксиды, такие как диметилсульфоксид; кетоны, такие как ацетон и 2-бутанон; гетероароматические соединения, такие как пиридин; и воду. Такие растворители можно использовать в виде смеси.
Примеры основания, используемого в реакции, если это желательно, включают алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и трет-бутоксид натрия; неорганические соли, такие как гидроксид натрия, гидроксид калия, гидрокарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия и гидрид калия; и органические основания, такие как триэтиламин и пиридин.
Используемое количество основания может составлять 2-100-кратное мольное количество, предпочтительно 2-20-кратное мольное количество, в расчете на соединение общей формулы (2).
Примеры соли гидроксиламина включают гидрохлориды и сульфаты.
Используемое количество гидроксиламина или его соли может составлять 2-100-кратное мольное количество, предпочтительно 2-20-кратное мольное количество, в расчете на соединение общей формулы (2).
Реакцию можно осуществлять при температуре от 0 до 150°C, предпочтительно от 50 до 150°C, в течение времени от одной минуты до 24 часов.
(2-2)
Соединение общей формулы (Ic) можно получить путем взаимодействия соединения общей формулы (1b) с реакционноспособным производным или агентом алкилирования, в присутствии или в отсутствие основания.
Растворитель, используемый в этой реакции, конкретно не ограничен, при условии, что он не оказывает негативного влияния на реакцию, и примеры такого растворителя включают амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид; кетоны, такие как ацетон и 2-бутанон; сложные эфиры, такие как этилацетат; карбоновые кислоты, такие как уксусная кислота; гетероароматические соединения, такие как пиридин; и воду. Такие растворители можно использовать в виде смеси.
Примеры реакционноспособного производного включают ангидриды кислот, такие как ацетилформилоксид, уксусный ангидрид, трихлоруксусный ангидрид и трифторуксусный ангидрид; смешанные ангидриды кислот органических карбоновых кислот, например уксусной кислоты, и моноалкиловых эфиров карбоновых кислот, таких как этилхлоркарбонат и изобутилхлоркарбонат; смешанные ангидриды кислот органических карбоновых кислот, например уксусной кислоты, и органических кислот, таких как пивалиновая кислота; хлорангидриды кислот, такие как ацетилхлорид, трихлорацетилхлорид и трифторацетилхлорид; бромангидриды кислот, такие как ацетилбромид; и активные сложные эфиры, такие как п-нитрофениловый сложный эфир, N-гидроксисукцинимидный сложный эфир и N-гидроксифталимидный сложный эфир. Такие реакционноспособные производные можно использовать без их выделения.
Реакционноспособное производное может быть образовано в системе с использованием агента сочетания. Примеры агента сочетания включают карбодиимиды, такие как N,N'-дициклогексилкарбодиимид и N-этил-N'-(3-диметиламинопропил)карбодиимид; карбонилы, такие как карбонилдиимидазол; азиды кислот, такие как дифенилфосфорилазид; цианиды кислот, такие как диэтилфосфорилцианид; 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин; O-бензотриазол-1-ил-1,1,3,3-тетраметилуроний гексафторфосфат; и O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат.
Примеры агента алкилирования включают галогенированные алкилы, такие как метилиодид и этилиодид; галогенированные аралкилы, такие как бензилхлорид и бензилбромид; и сульфаты, такие как диметилсульфат. Примеры основания, используемого в реакции, если это желательно, включают алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и трет-бутоксид натрия; неорганические соли, такие как гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия и гидрид калия; и органические основания, такие как триэтиламин и пиридин.
Используемое количество реакционноспособного производного, агента алкилирования и основания может составлять, для каждого из них, 2-100-кратное мольное количество, предпочтительно 2-10-кратное мольное количество, в расчете на соединение общей формулы (1b).
Реакцию можно осуществлять при температуре от -20 до 100°C, предпочтительно от 0 до 50°C, в течение времени от одной минуты до 24 часов.
(2-3)
Соединение общей формулы (1a) можно получить, подвергая соединение общей формулы (1b) реакции восстановления. Кроме того, соединение общей формулы (1a) можно получить, подвергая соединение общей формулы (Ic) реакции восстановления.
Примеры используемой в данном случае реакции восстановления включают реакцию каталитического гидрирования с использованием металлического катализатора и восстановление с использованием металла и кислоты, таких как цинк-уксусная кислота.
Когда соединение общей формулы (1b) или соединение общей формулы (Ic) подвергают реакции каталитического гидрирования, используемый растворитель конкретно не органичен, при условии, что он не оказывает негативного влияния на реакцию, и примеры такого растворителя включают спирты, такие как метанол, этанол, 2-пропанол и 2-метил-2-пропанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; кетоны, такие как ацетон и 2-бутанон; сложные эфиры, такие как этилацетат; карбоновые кислоты, такие как уксусная кислота; гетероароматические соединения, такие как пиридин; и воду. Такие растворители можно использовать в виде смеси.
Примеры металлического катализатора включают палладиевые катализаторы, такие как палладий на углероде, оксид палладия, гидроксид палладия и палладиевая чернь, никелевые катализаторы, такие как никель Ренея, и оксид платины, и используемое количество таких соединений может составлять 0,001-1-кратное (мас./мас.) количество, предпочтительно 0,01-0,5-кратное (мас./мас.) количество, в расчете на количество соединения общей формулы (1b) или соединения общей формулы (1c).
Примеры восстановителей, отличных от водорода, включают муравьиную кислоту; формиаты, такие как формиат натрия, формиат аммония и триэтилформиат аммония; циклогексен; и циклогексадиен, и используемое количество таких соединений может составлять 2-100-кратное мольное количество, предпочтительно 2-10-кратное мольное количество, в расчете на соединение общей формулы (1b) или соединение общей формулы (1c).
Когда соединение общей формулы (1b) подвергают реакции каталитического гидрирования, давление водорода может составлять от нормального давления до давления 30 атмосфер, предпочтительно давление от 2 до 10 атмосфер.
Когда соединение общей формулы (1c) подвергают реакции каталитического гидрирования, давление водорода может быть нормальным давлением.
Реакцию можно осуществлять при температуре от 0 до 200°C, предпочтительно от 0 до 100°C, в течение времени от одной минуты до 24 часов.
(Способ получения 3)
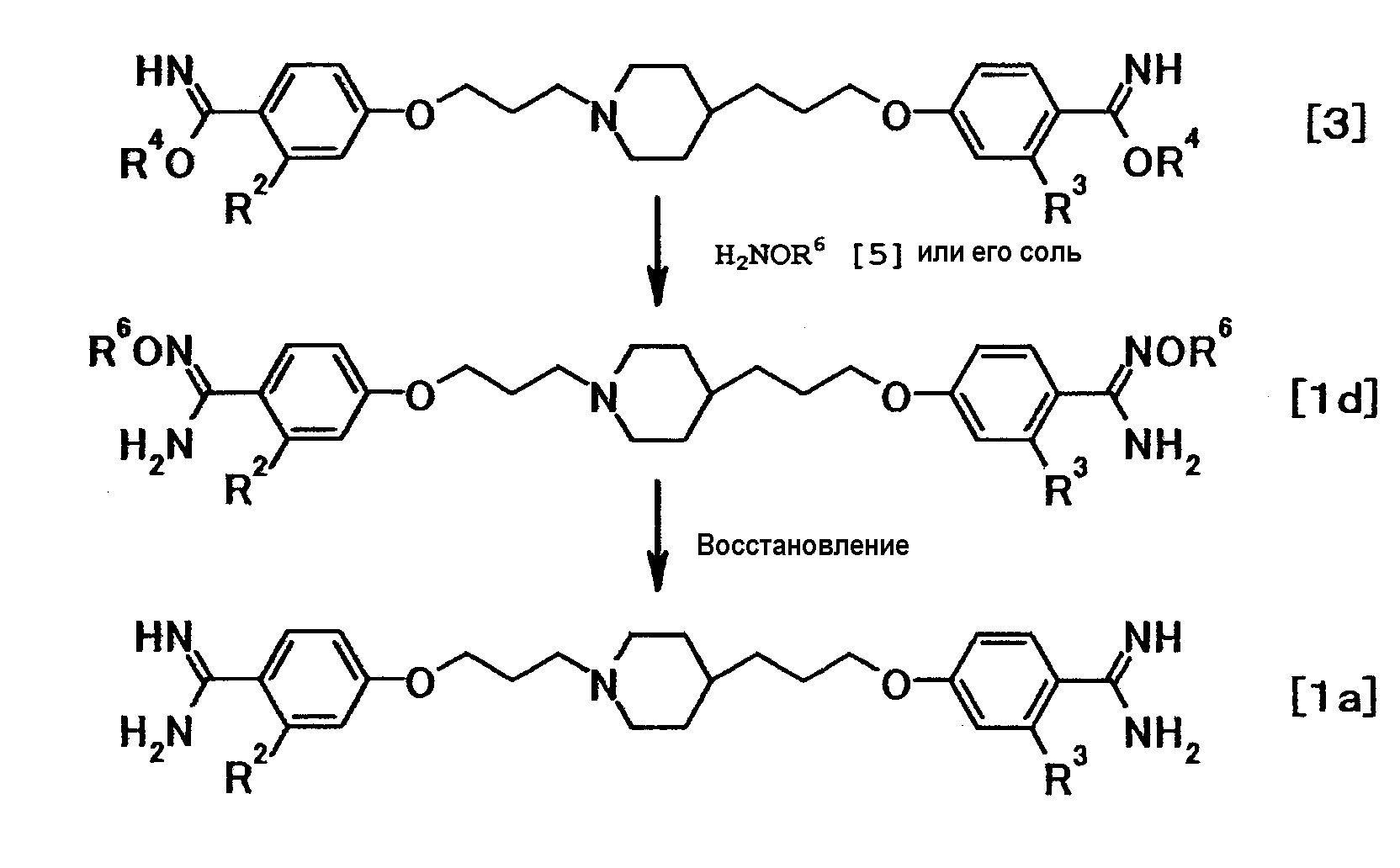
где R6 представляет собой необязательно замещенную низшую алкильную или аралкильную группу; и R2, R3 и R4 имеют значения, указанные выше.
Соединение общей формулы (1d) можно получить из соединения общей формулы (3). Затем соединение общей формулы (1d) может быть восстановлено с получением соединения общей формулы (1a).
Такая последовательность реакций подробно описана ниже.
(3-1)
Соединение общей формулы (1d) можно получить путем взаимодействия соединения общей формулы (3) с соединением общей формулы (5) или его солью.
Примеры соединения общей формулы (5) включают O-метилгидроксиламин и O-бензилгидроксиламин.
Примеры соли соединения общей формулы (5) включают гидрохлориды и сульфаты.
Эту реакцию можно осуществить в соответствии со способом получения (1-2).
(3-2)
Соединение общей формулы (1a) можно получить путем восстановления соединения общей формулы (1d). Эту реакцию можно осуществить в соответствии со способом получения (2-3).
(Способ получения 4)
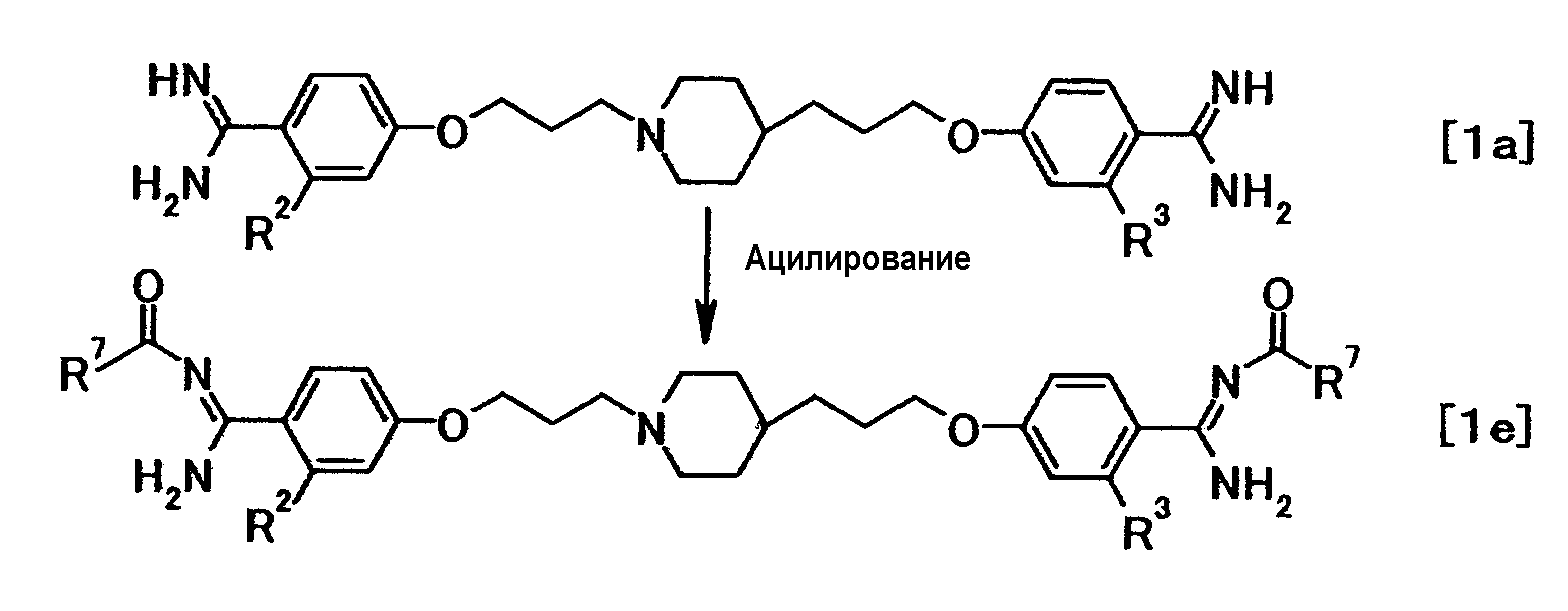
где R7 представляет собой необязательно замещенную низшую алкильную, аралкильную, арильную, алкокси, циклоалкилокси или аралкилокси группу; R2 и R3 имеют значения, указанные выше.
Соединение общей формулы (1e) можно получить путем взаимодействия соединения общей формулы (1a) с реакционноспособным производным в присутствии или в отсутствие основания.
Эту реакцию можно осуществить в соответствии со способом получения (2-2).
(Способ получения 5)
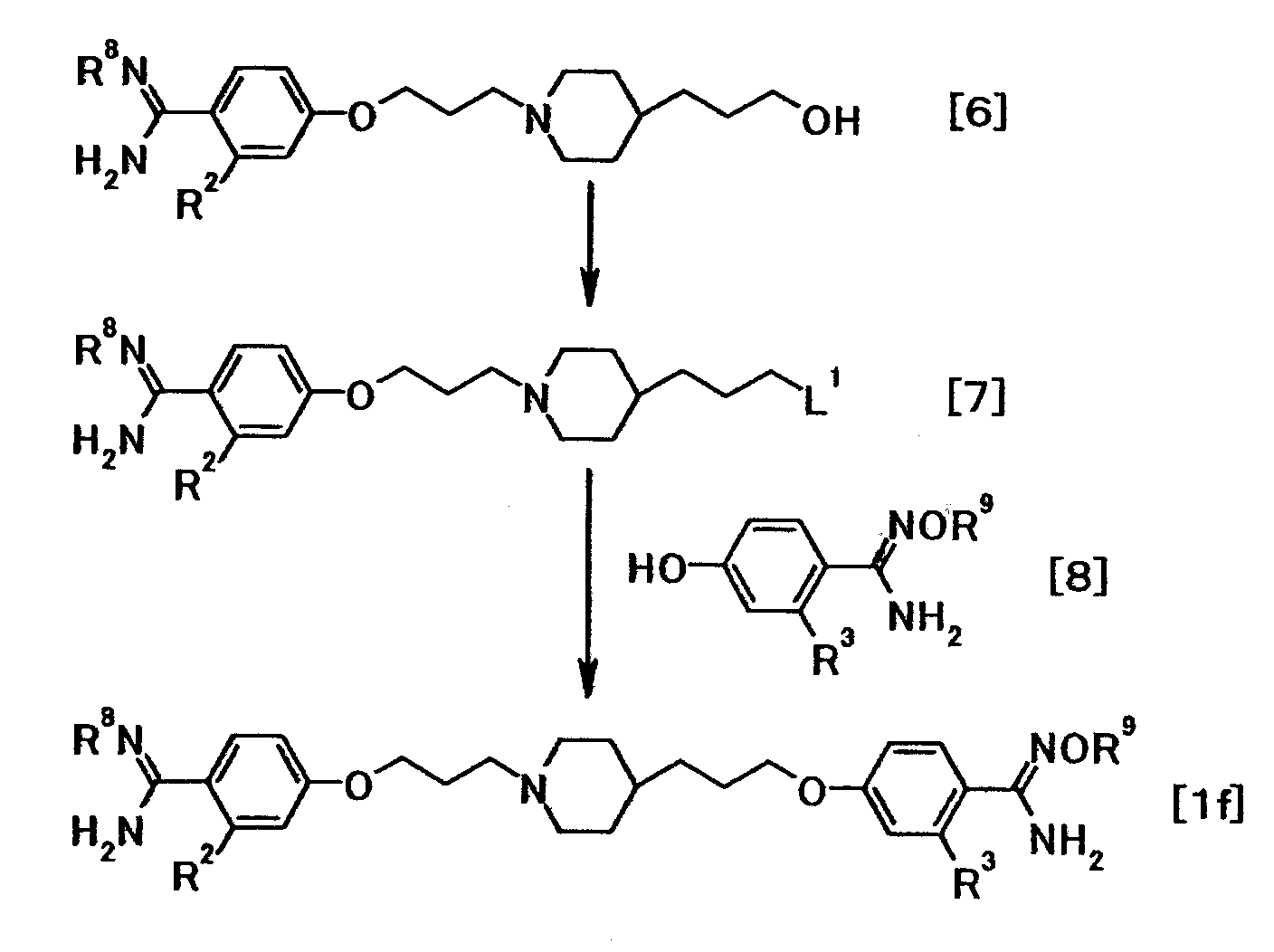
где R8 представляет амидинозащитную группу; R9представляет атом водорода или необязательно замещенную низшую алкильную или аралкильную группу; L1 представляет удаляемую группу; и R2 и R3 имеют значения, указанные выше.
Соединение общей формулы (7) можно получить из соединения общей формулы (6). Соединение общей формулы (7) затем можно подвергнуть взаимодействию с соединением общей формулы (8) с получением соединения общей формулы (1f).
Такая последовательность реакций подробно описана ниже.
(5-1)
Соединение общей формулы (7) можно получить путем преобразования гидроксильной группы соединения общей формулы (6) в удаляемую группу.
Когда удаляемая группа представляет собой алкансульфонилоксигруппу или арилсульфонилоксигруппу, соединение общей формулы (6) можно подвергнуть взаимодействию, в присутствии или в отсутствие основания, например, с алкансульфонилхлоридом, таким как метансульфонилхлорид или арилсульфонилхлорид, такой как хлорангидрид п-толуолсульфоновой кислоты.
Примеры основания, используемого в этой реакции, если это желательно, включают алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия и гидрид калия; и органические основания, такие как триэтиламин, N,N-диизопропилэтиламин и пиридин.
Используемое количество алкансульфонилхлорида или арилсульфонилхлорида может составлять 1-10-кратное мольное количество, предпочтительно 1-3-кратное мольное количество, в расчете на соединение общей формулы (6).
Когда удаляемая группа представляет собой атом галогена, соединение общей формулы (6) можно подвергнуть взаимодействию, например, с тионилхлоридом, тионилбромидом, трибромидом бора или тетрабромидом углерода-трифенилфосфином.
Используемое количество таких реагентов может составлять для каждого из этих реагентов 1-10-кратное мольное количество, предпочтительно 1-3-кратное мольное количество, в расчете на соединение общей формулы (6).
Растворитель, используемый в этой реакции, конкретно не органичен, при условии, что он не оказывает негативного влияния на реакцию, и примеры такого растворителя включают амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид; и гетероароматические соединения, такие как пиридин. Такие растворители можно использовать в виде смеси.
(5-2)
Соединение общей формулы (1f) можно получить путем взаимодействия соединения общей формулы (7) с соединением общей формулы (8) в присутствии или в отсутствие основания.
Растворитель, используемый в этой реакции, конкретно не органичен, при условии, что он не оказывает негативного влияния на реакцию, и примеры такого растворителя включают спирты, такие как метанол, этанол, 2-пропанол и 2-метил-2-пропанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид; кетоны, такие как ацетон и 2-бутанон; сложные эфиры, такие как этилацетат; гетероароматические соединения, такие как пиридин; и воду. Такие растворители можно использовать в виде смеси.
Примеры основания, используемого в этой реакции, если это желательно, включают алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия и гидрид калия; и органические основания, такие как триэтиламин, N,N-диизопропилэтиламин и пиридин.
Используемое количество основания может составлять 1-10-кратное мольное количество, предпочтительно 1-3-кратное мольное количество, в расчете на соединение общей формулы (7).
Используемое количество соединения общей формулы (8), используемого в этой реакции, может составлять 1-20-кратное мольное количество, предпочтительно 1-5-кратное мольное количество, в расчете на соединение общей формулы (7).
Реакцию можно осуществлять при температуре от 0 до 200°C, предпочтительно от 0 до 150°C, в течение времени от одной минуты до 24 часов.
Удаление амидинозащитной группы, представленной R8, можно осуществить способом, описанным, например, в Protective Groups in Organic Synthesis, 3:494-653, 1999, или аналогичным способом.
(Способ получения 6)
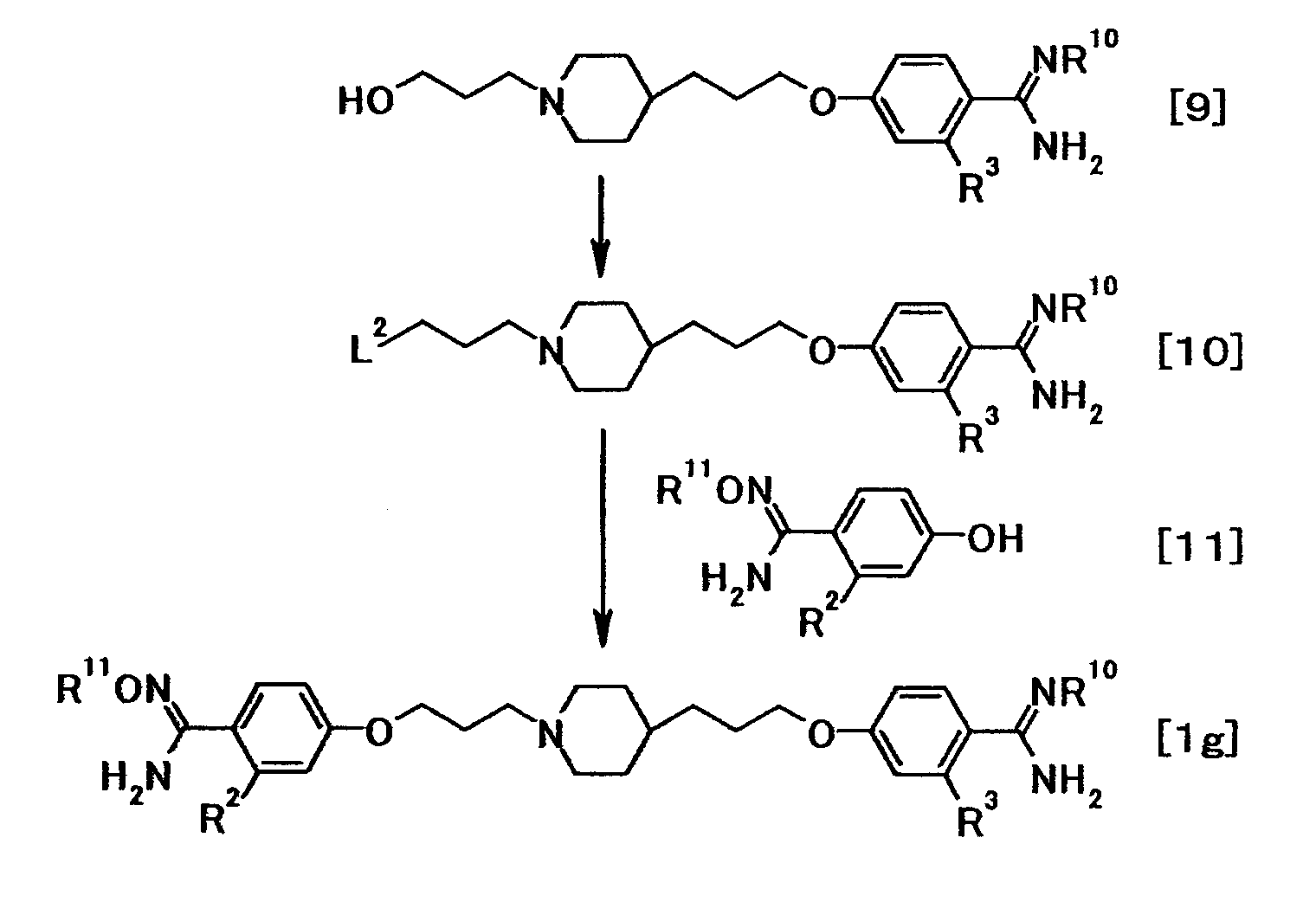
где R10 представляет собой амидинозащитную группу; R11представляет собой атом водорода или необязательно замещенную низшую алкильную или аралкильную группу; L2 представляет собой удаляемую группу; и R2 и R3 имеют значения, указанные выше.
Соединение общей формулы (10) можно получить из соединения общей формулы (9). Соединение общей формулы (10) затем можно подвергнуть взаимодействию с соединением общей формулы (11) с получением соединения общей формулы (1g).
Такая последовательность реакций подробно описана ниже.
(6-1)
Соединение общей формулы (10) можно получить путем преобразования гидроксильной группы соединения общей формулы (9) в удаляемую группу. Эту реакцию можно осуществить в соответствии со способом получения (5-1).
(6-2)
Соединение общей формулы (1g) можно получить путем взаимодействия соединения общей формулы (10) с соединением общей формулы (11) в присутствии или в отсутствие основания. Эту реакцию можно осуществить в соответствии со способом получения (5-2). Удаление амидинозащитной группы, представленной R10, можно осуществить способом, описанным, например, в Protective Groups in Organic Synthesis, 3:494-653, 1999, или аналогичным способом.
Каждое из соединений в описанных выше способах получения 1-6 также можно использовать в форме соли, и примеры соли включают соли, указанные для соединения общей формулы (1).
Каждое из промежуточных соединений, полученных в описанных выше способах получения (1)-(6), также можно использовать без выделения для последующей реакции.
Соединения общих формул (1a), (1b), (1c), (1d), (1e), (1f) и (1g), полученные таким образом, или их соли могут быть преобразованы в другие соединения общей формулы (1) или их соли, например, с использованием реакции, известной per se, такой как конденсация, присоединение, окисление, восстановление, перегруппировка, замещение, галогенирование, дегидратация или гидролиз, или путем подходящего сочетания этих реакций.
Когда в соединениях в описанных выше способах получения присутствуют изомеры (например, оптический изомер, геометрический изомер и таутомер), эти изомеры также можно использовать, а также можно использовать сольваты, гидраты и кристаллы в различных формах.
Ниже представлено описание способов получения соединений общих формул (2), (6), (8), (9) и (11), используемых в качестве исходных веществ для получения соединений по настоящему изобретению. Соединения общих формул (2), (6), (8), (9) и (11) получают путем сочетания способов, известных per se, и, например, их можно получить следующими способами.
(Способ получения A)
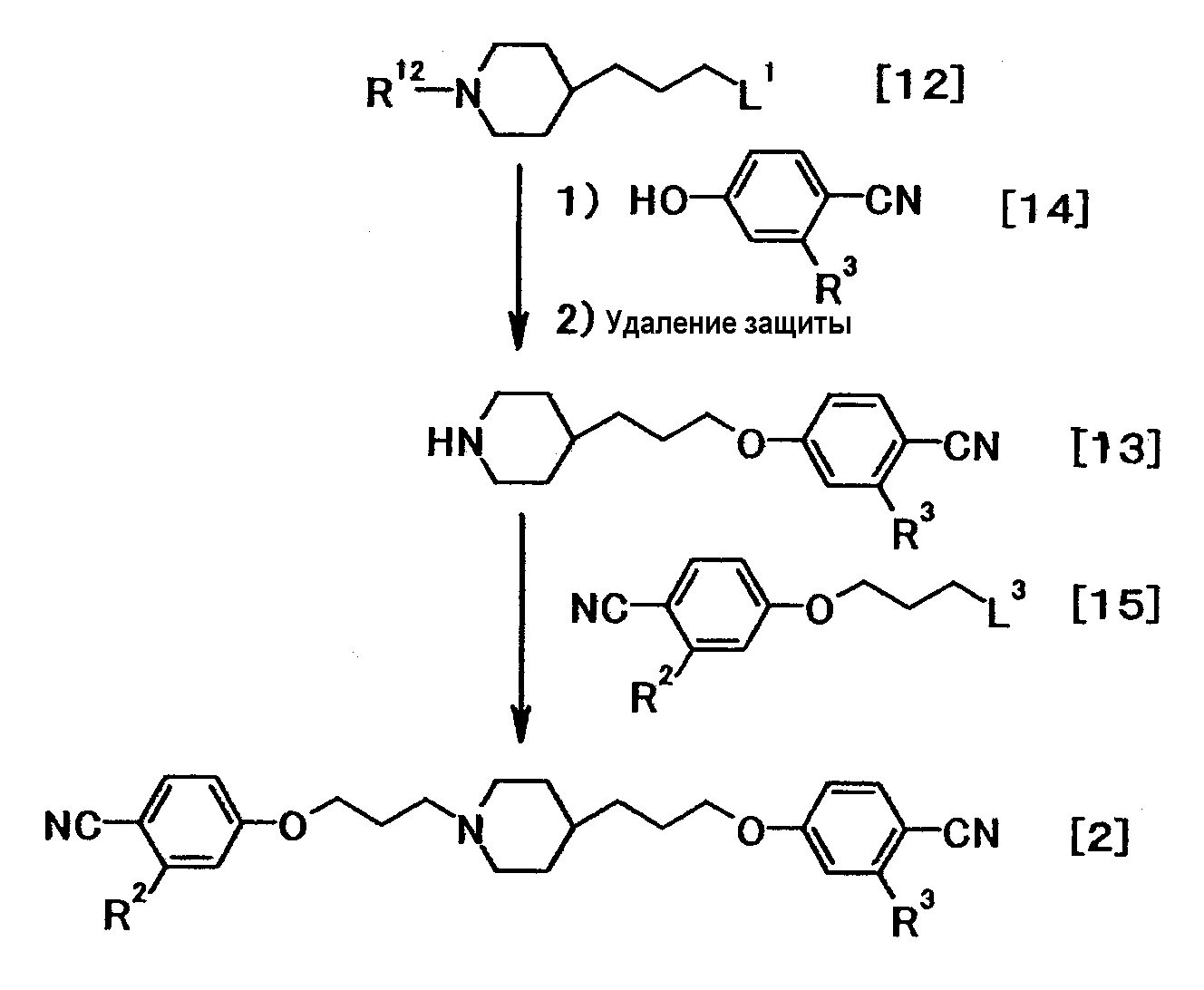
где R12 представляет собой аминозащитную группу; L3представляет собой удаляемую группу; и R2, R3 и L1 имеют значения, указанные выше.
Примеры соединения общей формулы (12) включают бензил 4-(3-бромпропил)пиперидин-1-карбоксилат (J. Med. Chem., 46:2606-2620, 2003), трет-бутил 4-(3-бромпропил)-1-пиперидинкарбоксилат (Tetrahedron, 55:11619-11639, 1999) и 3-[N-[(трет-бутокси)карбонил]пиперидин-4-ил]пропилиодид (J. Med. Chem., 37:2537-2551, 1994). Кроме того, синтез можно осуществить путем сочетания известных способов с использованием в качестве исходного вещества трет-бутил 4-(3-гидроксипропил)-1-пиперидинкарбоксилата или т.п.
Примеры соединения общей формулы (14) включают 4-цианофенол и 4-циано-3-фторфенол.
(A-1)
Соединение общей формулы (13) можно получить путем взаимодействия соединения общей формулы (12) с соединением общей формулы (14) в присутствии или в отсутствие основания, с последующим удалением защитных групп.
Растворитель, используемый в этой реакции, конкретно не органичен, при условии, что он не оказывает негативного влияния на реакцию, и примеры такого растворителя включают спирты, такие как метанол, этанол, 2-пропанол и 2-метил-2-пропанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид; кетоны, такие как ацетон и 2-бутанон; сложные эфиры, такие как этилацетат; гетероароматические соединения, такие как пиридин; и воду. Такие растворители можно использовать в виде смеси.
Примеры основания, используемого в этой реакции, если это желательно, включают алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия и гидрид калия; и органические основания, такие как триэтиламин, N,N-диизопропилэтиламин и пиридин.
Используемое количество основания может составлять 1-10-кратное мольное количество, предпочтительно 1-3-кратное мольное количество, в расчете на соединение общей формулы (12).
Используемое количество соединения общей формулы (14), используемого в этой реакции, может составлять 1-20-кратное мольное количество, предпочтительно 1-5-кратное мольное количество, в расчете на соединение общей формулы (12).
Реакцию можно осуществлять при температуре от 0 до 200°C, предпочтительно от 0 до 150°C, в течение времени от одной минуты до 24 часов.
Удаление амино-защитной группы, представленной R12, можно осуществить способом, описанным, например, в Protective Groups in Organic Synthesis, 3:494-653, 1999, или аналогичным способом.
(А-2)
Соединение общей формулы (2) можно получить путем взаимодействия соединения общей формулы (13) с соединением общей формулы (15). Эту реакцию можно осуществить в соответствии со способом получения (A-1).
(Способ получения В)

где R13 представляет гидроксилзащитную группу; и R2, R3, L1 и L3 имеют значения, указанные выше.
Соединение общей формулы (17) можно получить путем сочетания известных способов, с использованием в качестве исходного вещества трет-бутил 4-(3-гидроксипропил)-1-пиперидинкарбоксилата или т.п.
(B-1)
Соединение общей формулы (16) можно получить путем взаимодействия соединения общей формулы (15) с соединением общей формулы (17), с последующим удалением защитных групп. Эту реакцию можно осуществить в соответствии со способом получения (A-1).
Удаление гидроксилзащитной группы, представленной R13, можно осуществить способом, описанным, например, в Protective Groups in Organic Synthesis, 3:17-245, 1999 или аналогичным способом.
(В-2)
Соединение общей формулы (18) можно получить путем преобразования гидроксильной группы соединения общей формулы (16) в удаляемую группу. Эту реакцию можно осуществить в соответствии со способом получения (5-1).
(В-3)
Соединение общей формулы (2) можно получить путем взаимодействия соединения общей формулы (18) с соединением общей формулы (14). Эту реакцию можно осуществить в соответствии со способом получения (A-1).
(Способ получения C)

где L4 представляет собой удаляемую группу; и R2 и L3имеют значения, указанные выше.
Примеры соединения общей формулы (19) включают 4-цианофенол. Примеры соединения общей формулы (21) включают 3-бром-1-пропанол.
(C-1)
Соединение общей формулы (20) можно получить путем взаимодействия соединения общей формулы (19) с соединением общей формулы (21). Эту реакцию можно осуществить в соответствии со способом получения (A-1).
(C-2)
Соединение общей формулы (15) можно получить путем преобразования гидроксильной группы соединения общей формулы (20) в удаляемую группу. Эту реакцию можно осуществить в соответствии со способом получения (5-1).
(Способ получения D)
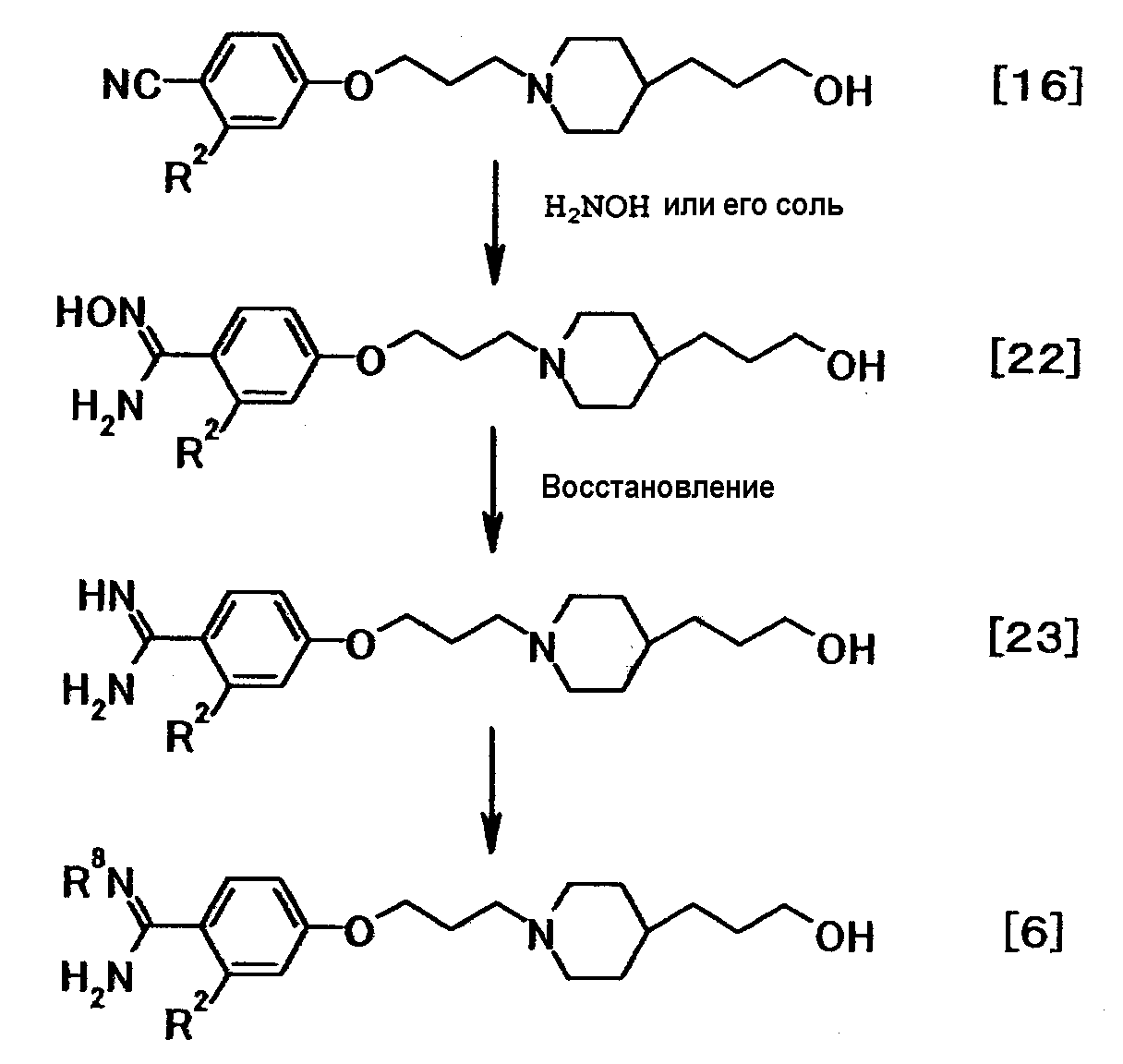
где R2 и R8 имеют значения, указанные выше.
(D-1)
Соединение общей формулы (22) можно получить путем взаимодействия соединения общей формулы (16) с гидроксиламином или его солью, в присутствии или в отсутствие основания. Эту реакцию можно осуществить в соответствии со способом получения (2-1).
(D-2)
Соединение общей формулы (23) можно получить, подвергая соединение общей формулы (22) реакции восстановления. Эту реакцию можно осуществить в соответствии со способом получения (2-3).
(D-3)
Соединение общей формулы (6) можно получить путем защиты амидиногруппы соединения общей формулы (23). Эту реакцию можно осуществить способом, описанным, например, в Protective Groups in Organic Synthesis, 3:494-653, 20 1999, или аналогичным способом.
(Способ получения Е)

где R3, R10 и L4 имеют значения, указанные выше.
(E-1)
Соединение общей формулы (24) можно получить путем взаимодействия соединения общей формулы (13) с соединением общей формулы (21). Эту реакцию можно осуществить в соответствии со способом получения (A-1).
(Е-2)
Соединение общей формулы (25) можно получить путем взаимодействия соединения общей формулы (24) с гидроксиламином или его солью в присутствии или в отсутствие основания. Эту реакцию можно осуществить в соответствии со способом получения (2-1).
(E-3)
Соединение общей формулы (26) можно получить, подвергая соединение общей формулы (25) реакции восстановления. Эту реакцию можно осуществить в соответствии со способом получения (2-3).
(E-4)
Соединение общей формулы (9) можно получить путем защиты амидиногруппы соединения общей формулы (26). Эту реакцию можно осуществить в соответствии со способом получения (D-3).
(Способ получения F)

где R3 и R9 имеют значения, указанные выше.
Соединение общей формулы (8) можно получить путем взаимодействия соединения общей формулы (14) с соединением общей формулы (27) или его солью. Эту реакцию можно осуществить в соответствии со способом получения (2-1).
(Способ получения G)
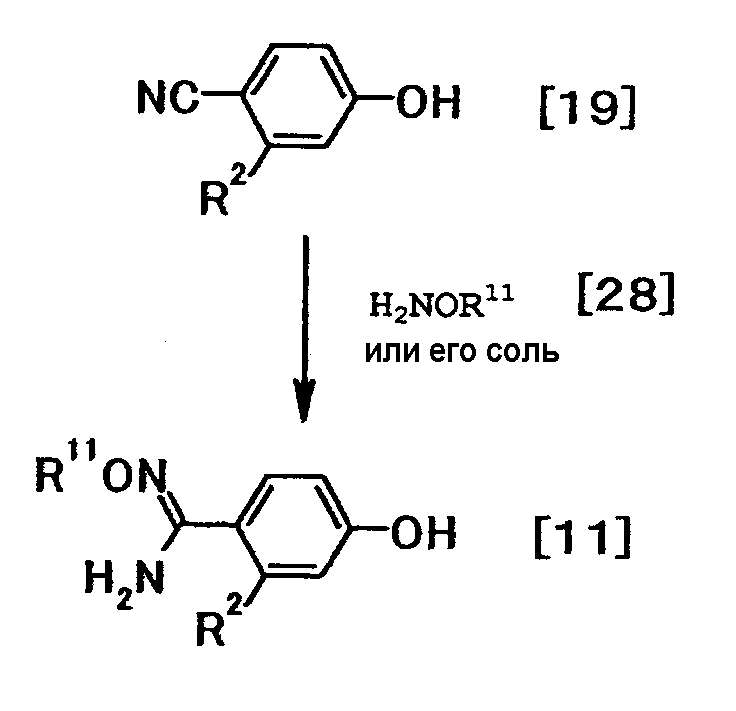
где R2 и R11 имеют значения, указанные выше.
Соединение общей формулы (11) можно получить путем взаимодействия соединения общей формулы (19) с соединением общей формулы (28) или его солью. Эту реакцию можно осуществить в соответствии со способом получения (2-1).
Когда соединение по настоящему изобретению используют в качестве лекарственного средства, его, как правило, подходящим образом смешивают с фармацевтическими добавками, такими как эксципиент, носитель и разбавитель, используемыми для композиции, которую можно перорально или парентерально вводить в форме таблеток, капсул, порошков, сиропов, гранул, пилюль, суспензий, эмульсий, растворов, порошковых препаратов, суппозиториев, глазных капель, назальных капель, ушных капель, пластырей, мазей или инъекций, в соответствии с традиционными способами. Кроме того, способ введения, дозу и частоту введения можно подходящим образом выбрать в зависимости от возраста, веса тела и симптомов пациента. Типично, 0,01-1,000 мг/кг можно вводить перорально или парентерально (например, путем инъекции, капельного вливания или ректального введения) взрослому пациенту, один раз в день или в виде нескольких раздельных доз.
Для установления полезности соединения по настоящему изобретению были проведены испытания его противогрибкового действия, токсичности при многократном введении доз, активности по ингибированию пролиферации клеток Vero, стабильности и антипротозойного действия.
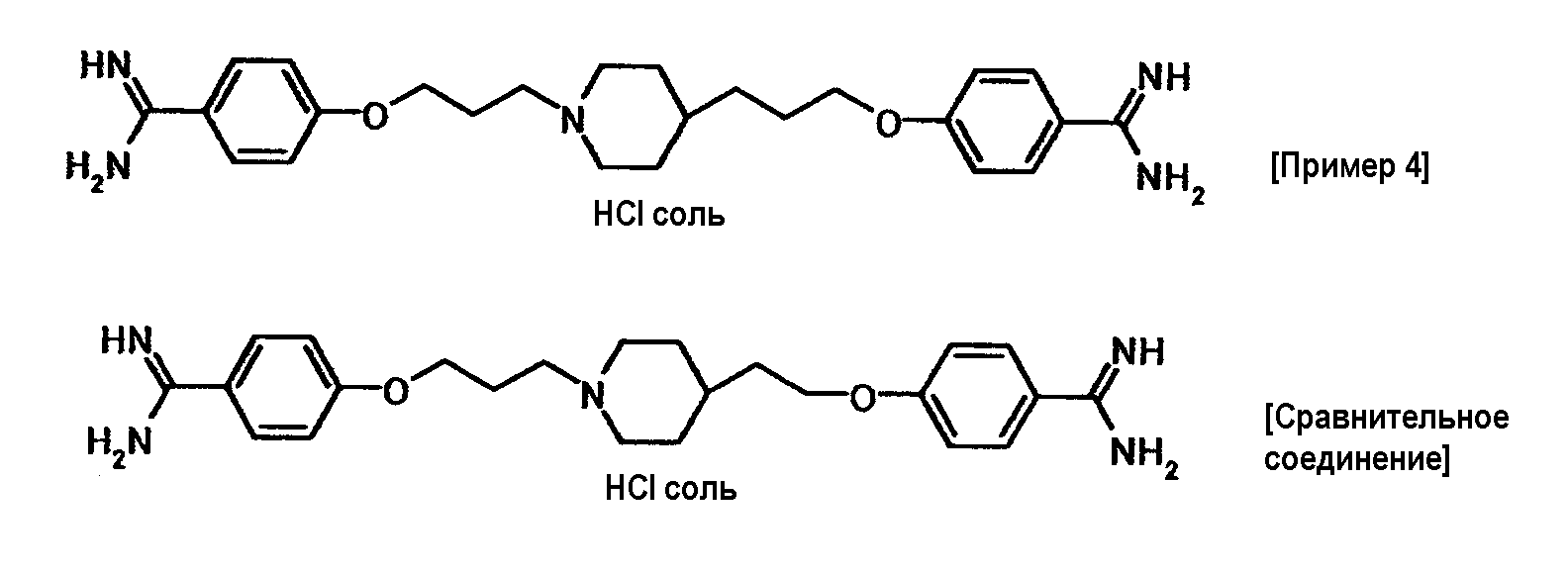
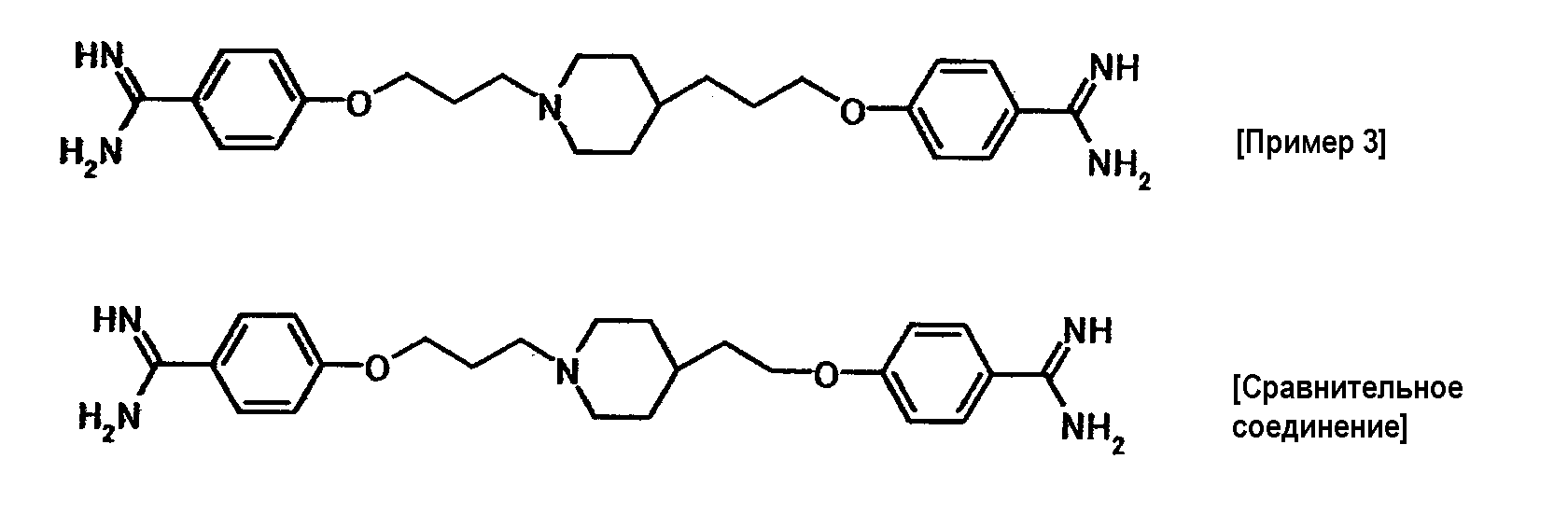
Пример испытания 1: противогрибковое действие соединения примера 4 было выбрано в качестве соединения по настоящему изобретению. Соединение, описанное в примере WO03/074476, имеющее структуру, наиболее схожую со структурой соединения по настоящему изобретению, было выбрано в качестве сравнительного соединения. Химические структуры этих соединений следующие:

Испытание восприимчивости грибков осуществляли с использованием метода микроразведений бульонной питательной среды. Среда, используемая в испытании восприимчивости, представляла собой среду RPMI1640 (RPMI/MOPS), доведенную до pH 7,0 с использованием 0,165 моль/л морфолинпропансульфоновой кислоты (MOPS) и 1,0 моль/л гидроксида натрия. Испытываемое соединение растворяли в стерильной воде и затем подвергали двукратному серийному разведению с использованием 100 мкл RPMI/MOPS в 96-луночном круглодонном планшете. Candida albicans TIMM1623 культивировали в течение ночи при 35°C на агаровой среде Sabouraud и суспендировали в стерилизованном физиологическом солевом растворе. Количество клеток подсчитывали под биологическим микроскопом; получали суспензию инокулята (2×103 клеток/мл) с использованием RPMI/MOPS, и затем в каждую лунку распределяли по 100 мкл этой суспензии; и в конце подготавливали микропланшет, содержащий заданную концентрацию испытываемого соединения, питательную среду и грибковые клетки. Планшет культивировали при 35°C в течение 48 часов. По завершении культивирования определяли поглощение при 630 нм с использованием автоматического спектрофотометра. Наименьшую концентрацию испытываемого соединения, при которой наблюдали 50% ингибирование роста по сравнению с ростом в контрольных лунках, в которые не добавляли испытываемого соединения, определяли как ИК50. Результаты представлены в таблице 1.
Соединение примера 4 обладало такой же или лучшей противогрибковой активностью, чем сравнительное соединение.
Пример испытания 2: испытание токсичности у мышей при многократном введении доз (1)
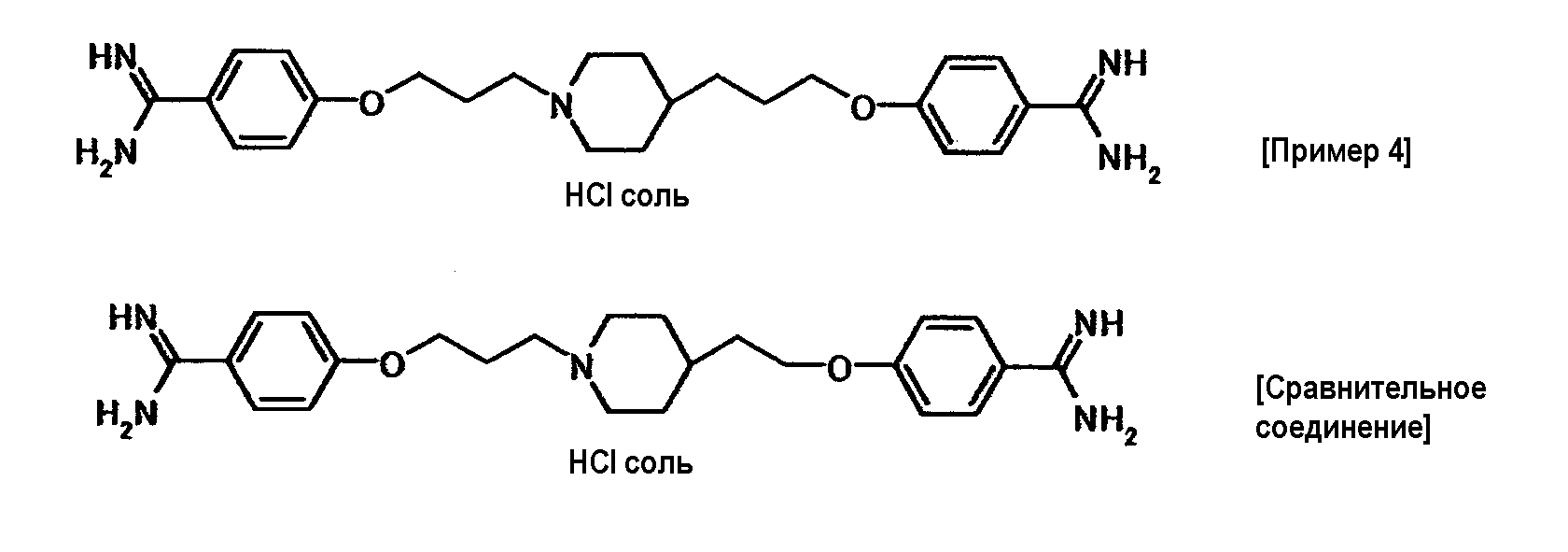
Соединение примера 4 было выбрано в качестве соединения по настоящему изобретению. Из соединений, описанных в примерах WO03/074476, соединение, имеющее структуру, наиболее схожую со структурой соединения по настоящему изобретению, было выбрано в качестве сравнительного соединения. Химические структуры этих соединений следующие:
Мышей ICR возраста шесть недель (масса тела в пределах от 30,6 до 34,8 г, количество животных в каждой группе: 5) использовали для исследования токсичности при многократном введении доз. Раствор каждого испытываемого соединения получали путем растворения в дистиллированной воде. Каждое соединение вводили подкожно при дозе 6,25 мг/кг раз день в течение 7 дней. Контрольной группе вводили стерилизованный физиологический солевой раствор. По окончании периода введения каждую мышь анестезировали эфиром. Для сбора крови из абдоминальной части полой вены использовали шприц для инъекций, содержащий раствор гепарина (Novo-Heparin Injection 1000, Aventis Pharma K.K.) в качестве антикоагулянта. Гематологическое испытание осуществляли для определения следующих показателей. Значения, полученные в группах обработки испытываемым соединением, когда значение в контрольной группе устанавливали как 100, представлены в таблице 2.
(Показатели гематологического испытания и способы определения)
Число эритроцитов (RBC): лазерная проточная цитометрия под двумя углами
Число ретикулоцитов: проточная цитометрия после РНК окрашивания
Соединение примера 4 не снижало число ретикулоцитов и поэтому обладало большей безопасностью, чем сравнительное соединение.
Пример испытания 3: Испытание токсичности у мышей при многократном введении доз (2)
Соединение примера 3 было выбрано в качестве соединения по настоящему изобретению. Из соединений, описанных в примерах WO03/074476, соединение, имеющее структуру, наиболее схожую со структурой соединения по настоящему изобретению, было выбрано в качестве сравнительного соединения. Химические структуры этих соединений следующие:
Мышей ICR возраста шесть недель (масса тела в пределах от 27,4 до 33,7 г, количество животных в каждой группе: 5) использовали для исследования токсичности при многократном введении доз. Раствор каждого испытываемого соединения получали путем растворения в 0,1 моль/л хлористоводородной кислоте. Каждое соединение вводили подкожно при дозе 6,25 или 3,13 мг/кг раз день в течение 14 дней. Контрольной группе вводили стерилизованный физиологический солевой раствор. По окончании периода введения каждую мышь анестезировали эфиром. Для сбора крови из абдоминальной части полой вены использовали шприц для инъекций, содержащий раствор гепарина (Novo-Heparin Injection 1000, Aventis Pharma K.K.) в качестве антикоагулянта. Гематологическое испытание осуществляли для определения следующих показателей. Значения, полученные в группах обработки испытываемым соединением, когда значение в контрольной группе устанавливали как 100, представлены в таблице 3.
(Показатели гематологического испытания и способы определения)
Число эритроцитов (RBC): лазерная проточная цитометрия под двумя углами
Число ретикулоцитов: проточная цитометрия после РНК окрашивания
Сравнительное соединение снижало число ретикулоцитов при дозе 3,13 мг/кг. С другой стороны, соединение примера 3 не снижало число ретикулоцитов даже при дозе 6,25 мг/кг и поэтому обладало большей безопасностью, чем сравнительное соединение.
Пример испытания 4: испытание ингибирования пролиферации клеток Vero
Соединение примера 4 было выбрано в качестве соединения по настоящему изобретению. Из соединений, описанных в примерах WO03/074476, соединение, имеющее структуру, наиболее схожую со структурой соединения по настоящему изобретению, было выбрано в качестве сравнительного соединения. Химические структуры этих соединений следующие:
Цитотоксичность каждого соединения определяли с использованием клеток Vero. Каждое испытываемое соединение растворяли в диметилсульфоксиде (DMSO), затем подвергали серийному разведению при помощи 10% FBS-содержащей E'MEM и добавляли в 96-луночный планшет. Клетки суспендировали в 10% FBS-содержащей E'MEM, инокулировали в количестве 3000 клеток/лунка (96-луночный планшет) и культивировали в CO2 инкубаторе при 37°C в течение 3 дней. Степень роста клеток Vero определяли при помощи анализа с использованием 2,3-бис-(2-метокси-4-нитро-5-сульфофенил)-5-[(фениламино)карбонил]-2H-тетразолия внутренней мононатриевой соли (XTT). Таким образом, XTT раствор, содержащий 1 мг/мл XTT и 25 мкмоль/л феназинметосульфата (PMS), добавляли в каждую лунку, которые затем инкубировали в CO2 инкубаторе в течение 2 часов, с последующим определением поглощения в лунке при 450 нм (стандарт: 655 нм) с использованием аппарата для чтения микропланшетов. Рассчитывали отношение поглощения между контролем (без добавления соединения) и каждой лункой и вычисляли концентрацию (CC50; мкг/мл) соединения, ингибирующую клеточную пролиферацию на 50%. Результаты представлены в таблице 4.
Соединение примера 4 обладало более высокой безопасностью, чем сравнительное соединение.
Пример испытания 5: испытание гигроскопичности (1)
Соединение примера 4 было выбрано в качестве соединения по настоящему изобретению. Из соединений, описанных в примерах WO03/074476, соединение, имеющее структуру, наиболее схожую со структурой соединения по настоящему изобретению, было выбрано в качестве сравнительного соединения. Химические структуры этих соединений следующие:

Соединение примера 4 и сравнительное соединение хранили в условиях комнатной температуры и относительной влажности 75% или при 60°C и относительной влажности 75% в течение одной недели. В результате, соединение примера 4 сохраняло форму порошка без каких-либо изменений внешнего вида в любых условиях. С другой стороны, сравнительное соединение изменяло свою форму на пасту и в тех и в других условиях.
Соединение примера 4 обладало более высокой стабильностью, чем сравнительное соединение.
Пример испытания 6: испытание гигроскопичности (2)
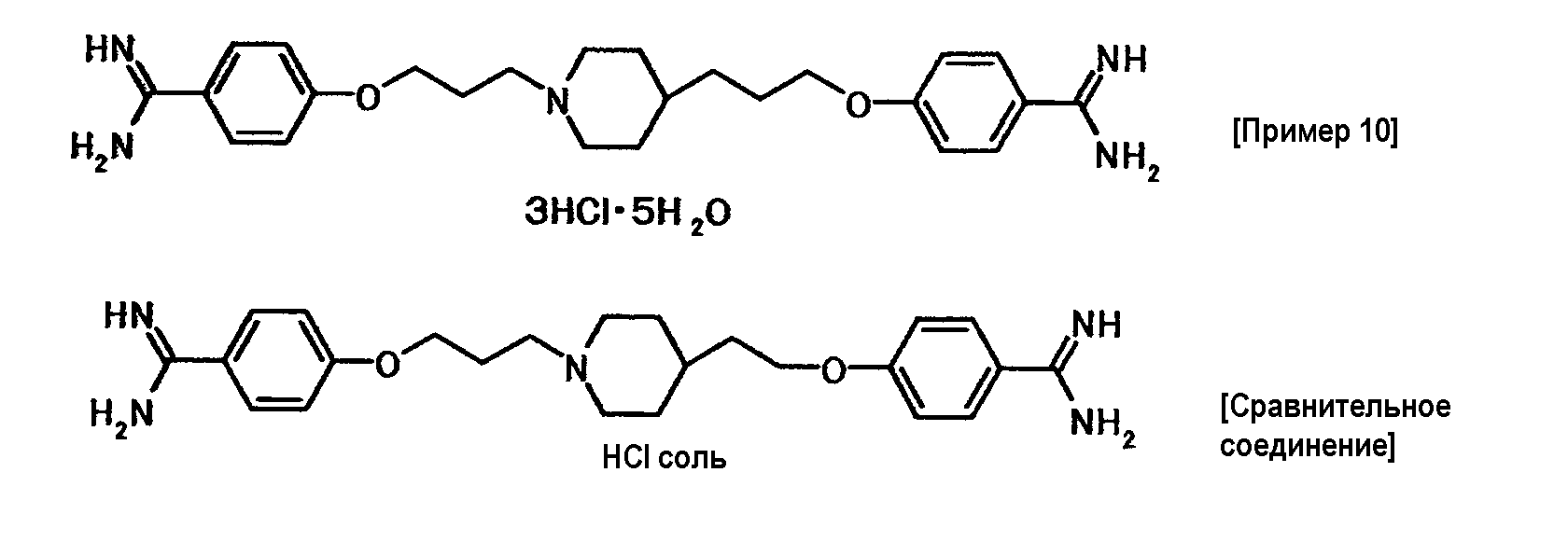
Соединение примера 10 было выбрано в качестве соединения по настоящему изобретению. Из соединений, описанных в примерах WO03/074476, соединение, имеющее структуру, наиболее схожую со структурой соединения по настоящему изобретению, было выбрано в качестве сравнительного соединения. Химические структуры этих соединений следующие:

Соединение примера 10 и сравнительное соединение хранили в условиях комнатной температуры и относительной влажности 100% в течение одной недели и взвешивали. Результаты представлены в таблице 5.
Соединение примера 10 было абсолютно негигроскопичным и обладало более высокой стабильностью, чем сравнительное соединение.
Пример испытания 7: испытание гигроскопичности (3)
Соединение примера 10 было выбрано в качестве соединения по настоящему изобретению. Из соединений, описанных в примерах WO03/074476, соединение, имеющее структуру, наиболее схожую со структурой соединения по настоящему изобретению, было выбрано в качестве сравнительного соединения. Химические структуры этих соединений следующие:
Соединение примера 10 и сравнительное соединение хранили при температуре 60°C и относительной влажности 100% в течение одной недели. В результате сравнительное соединение расплывалось на влажном воздухе. С другой стороны, соединение примера 10 не расплывалось на влажном воздухе и оставалось стабильным.
Пример испытания 8: антипротозойное действие
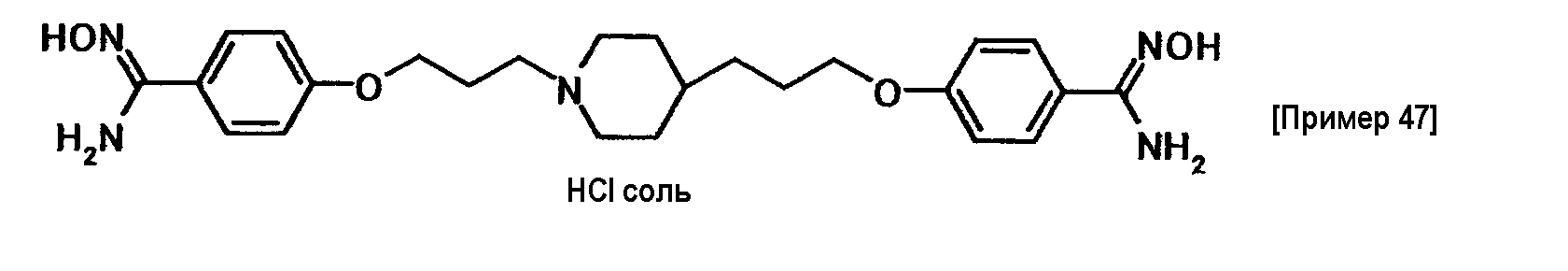
Определяли антипротозойное действие соединения примера 3.
Trichomonas vaginalis CDC337 культивировали в среде Diamond трипсиказа-дрожжи-мальтоза (pH 6,8), содержащей 8% фетальной телячьей сыворотки (FBS). Простейшие организмы, которые перед этим культивировали при 37°C в течение 2 дней, центрифугировали (1500 об/мин, 10 минут), осуществляли замену среды свежей средой, а затем доводили до 2×104 организмов/мл с последующим добавлением их при 100 мкл/лунка в микропланшет (96-луночный, круглодонный). Испытываемое соединение растворяли с использованием 0,1 моль/л хлористоводородной кислоты, которую затем разбавляли до заданной концентрации при помощи указанной среды, с последующим распределением в микропланшет при 100 мкл/лунка. Минимальную концентрацию испытываемого соединения, при которой не наблюдалось движения организмов после культивирования при 37°C в анаэробных условиях в течение 2 дней, определяли как МИК (минимальная ингибирующая концентрация).
МИК соединения примера 10 составила 16 мкг/мл.
Пример испытания 9: испытание инфицирования Candida на модели мыши (пероральное введение)
Соединение примера 47 было выбрано в качестве соединения по настоящему изобретению. Химическая структура этого соединения следующая:
Candida albicans TIMM1623 на пластине SDA, культивированные в течение ночи при 35°C, суспендировали в стерилизованном физиологическом солевом растворе, который затем разбавляли для получения суспензии инокулята. Чтобы мыши быстро стали подверженными риску заражения, им внутрибрюшинно вводили циклофосфамид при 200 мг/кг за 4 дня до заражения и при 100 мг/кг на следующий день после заражения. В хвостовую вену мышей инокулировали 0,2 мл приготовленного раствора инокулята Candida albicans TIMM1623, чтобы вызвать заражение (примерно 3×104 КОЕ/мышь). Испытываемое соединение суспендировали в 0,5% метилцеллюлозы и перорально вводили при 1 мг/кг массы тела мыши. Лечение начинали через 2 часа после заражения и осуществляли в течение 7 дней. Наблюдение и регистрацию количества выживших мышей осуществляли в течение 21 дня.
В результате, в группе, которой не вводили испытываемое соединение, все мыши умерли, но в группе, которой вводили соединение примера 47, 80% мышей выжили.
Соединение примера 47 также обладало отличным терапевтическим эффектом, даже при пероральном введении.
В испытаниях in vitro и in vivo соединения по настоящему изобретению имели такую же противогрибковую активность как сравнительное соединение или лучшую активность. В испытании токсичности у мышей при многократном введении доз соединения по настоящему изобретению не снижали число ретикулоцитов и были более безопасными, чем сравнительное соединение. Кроме того, сравнительное соединение оказалось трудным для контроля качества, поскольку оно было гигроскопичным и расплывалось на влажном воздухе, но соединения по настоящему изобретению не были гигроскопичными и как лекарственное средство оказались лучше, чем сравнительное соединение. Более того, соединения по настоящему изобретению обладали отличным антипротозойным действием.
Примеры
Настоящее изобретение далее будет описано в следующих ссылочных примерах и примерах. Однако настоящее изобретение не ограничивается этими примерами.
Все смешиваемые соотношения для элюентов указаны как объемные соотношения, а носитель, используемый для колоночной хроматографии, представляет собой B.W. Silica Gel или BW-127ZH (Fuji Silysia Chemical Ltd.), если не указано иное.
Используемые в примерах аббревиатуры означают следующее.
Ac: ацетил, Boc: трет-бутоксикарбонил,tBu: трет-бутил, Et: этил, Me: метил, Ms: метансульфонил
DMSO-d6: диметилсульфоксид-d6
Ссылочный пример 1

К раствору 10,7 г трет-бутил 4-(3-гидроксипропил)-1-пиперидинкарбоксилата в тетрагидрофуране (110 мл) добавляли при охлаждении водой 19,0 г тетрабромида углерода, к полученной смеси затем в течение 13 минут добавляли 15,0 г трифенилфосфина. Полученную смесь перемешивали при комнатной температуре в течение 2 часов и 30 минут и давали выстояться в течение 13 часов. К реакционной смеси добавляли воду, этилацетат и насыщенный водный раствор хлорида натрия. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (элюент; гексан:этилацетат = 3:1), с получением 13,2 г трет-бутил 4-(3-бромпропил)-1-пиперидинкарбоксилата в виде бесцветного маслянистого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,00-1,20 (2H, м), 1,20-1,50 (3H, м), 1,45 (9H, с), 1,60-1,70 (2H, м), 1,80-1,95 (2H, м), 2,60-2,75 (2H, м), 3,40 (2H, т, J=6,8 Гц), 3,90-4,25 (2H, м).
Ссылочный пример 2
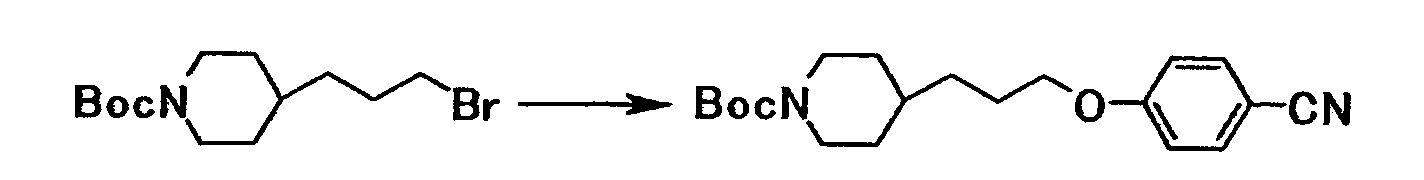
К раствору 13,2 г трет-бутил 4-(3-бромпропил)-1-пиперидинкарбоксилата в диметилсульфоксиде (130 мл) добавляли при комнатной температуре 5,13 г 4-цианофенола и 11,9 г карбоната калия, полученную смесь затем перемешивали при указанной температуре в течение 26 часов. Реакционную смесь добавляли к смеси толуола и воды. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении с получением 14,5 г трет-бутил 4-[3-(4-цианофенокси)пропил]-1-пиперидинкарбоксилата в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,05-1,20 (2H, м), 1,40-1,50 (3H, м), 1,46 (9H, с), 1,65-1,75 (2H, м), 1,75-1,90 (2H, м), 2,60-2,80 (2H, м), 3,99 (2H, т, J=6,3 Гц), 4,00-4,20 (2H, м), 6,93 (2H, д, J=8,7 Гц), 7,58 (2H, д, J=8,7 Гц).
Ссылочный пример 3
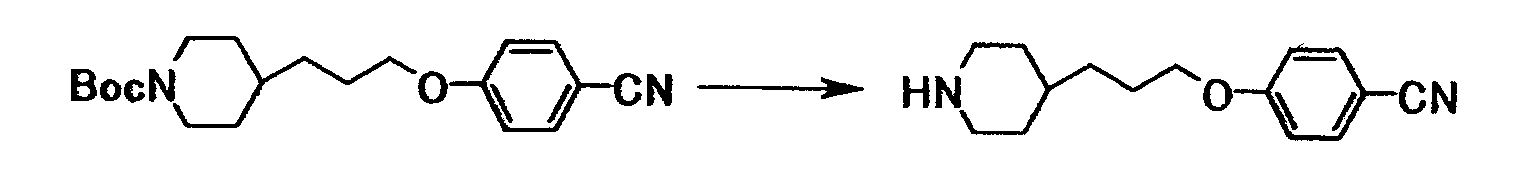
К раствору 14,0 г трет-бутил 4-[3-(4-цианофенокси)пропил]-1-пиперидинкарбоксилата в хлороформе (100 мл) добавляли по каплям 40 мл трифторуксусной кислоты при охлаждении водой в течение 10 минут. Полученную смесь перемешивали при указанной температуре в течение 20 минут и затем перемешивали при комнатной температуре в течение 35 минут. После отгонки растворителя при пониженном давлении добавляли хлороформ и воду. К смеси добавляли водный раствор гидроксида натрия для доведения до pH 13,0. Органический слой отделяли и водный слой экстрагировали хлороформом. Органический слой и экстракт объединяли, полученную смесь затем промывали водным раствором гидроксида натрия и сушили при помощи карбоната калия с последующей отгонкой растворителя при пониженном давлении с получением 10,3 г 4-[3-(4-пиперидинил)пропокси]бензонитрила в виде бледно-желтого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,05-1,20 (2H, м), 1,35-1,45 (3H, м), 1,65-1,90 (4H, м), 2,50-2,65 (2H, м), 3,00-3,15 (2H, м), 3,99 (2H, т, J=6,6 Гц), 4,78 (1H, с), 6,93 (2H, д, J=9,0 Гц), 7,58 (2H, д, J=9,0 Гц).
Ссылочный пример 4
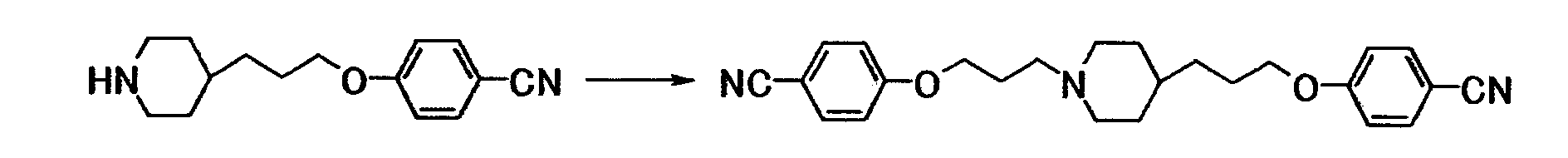
К раствору 10,2 г 4-[3-(4-пиперидинил)пропокси]бензонитрила в N,N-диметилформамиде (150 мл) последовательно добавляли 11,2 г карбоната калия и 9,72 г 4-(3-бромпропокси)бензонитрила при комнатной температуре, полученную смесь затем перемешивали при указанной температуре в течение 18 часов. К реакционной смеси добавляли толуол и воду. Осадок собирали фильтрованием с получением 13,7 г 4-(3-{4-[3-(4-цианофенокси)пропил]-1-пиперидинил}пропокси)бензонитрила в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,45 (5H, м), 1,65-2,05 (8H, м), 2,40-2,55 (2H, м), 2,85-3,00 (2H, м), 3,99 (2H, т, J=6,5 Гц), 4,06 (2H, т, J=6,3 Гц), 6,93 (2H, д, J=8,8 Гц), 6,94 (2H, д, J=8,8 Гц), 7,57 (2H, д, J=8,8 Гц), 7,57 (2H, д, J=8,8 Гц).
Ссылочный пример 5

Раствор 1,12 г трет-бутил 4-(3-бромпропил)-1-пиперидинкарбоксилата в 2-бутаноне (7,6 мл) добавляли к раствору в 2-бутаноне (7,0 мл) смеси 0,50 г 2-фтор-4-гидроксибензонитрила и 0,56 г карбоната калия, полученную смесь затем нагревали до температуры кипения с обратным холодильником в течение 6 часов и 30 минут. После охлаждения до комнатной температуры реакционную смесь добавляли к смеси этилацетата и воды. Органический слой отделяли, промывали водой и сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле (элюент; гексан:этилацетат = 4:1) с получением 0,72 г трет-бутил 4-[3-(4-циано-3-фторфенокси)пропил]-1-пиперидинкарбоксилата в виде бесцветного маслянистого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,05-1,20 (2H, м), 1,35-1,45 (3H, м), 1,46 (9H, с), 1,65-1,75 (2H, м), 1,75-1,90 (2H, м), 2,60-2,75 (2H, м), 3,99 (2H, т, J=6,3 Гц), 4,00-4,20 (2H, м), 6,65-6,80 (2H, м), 7,45-7,54 (1H, м).
Ссылочный пример 6

К раствору 0,66 г трет-бутил 4-[3-(4-циано-3-фторфенокси)пропил]-1-пиперидинкарбоксилата в метиленхлориде (5,5 мл) добавляли по каплям 1,8 мл трифторуксусной кислоты при охлаждении льдом в течение 2 минут, полученную смесь затем перемешивали при комнатной температуре в течение 6 часов. Растворитель отгоняли при пониженном давлении и хлороформ и к полученному остатку добавляли 1,0 моль/л водного раствора гидроксида натрия. Органический слой отделяли и сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (элюент; хлороформ:метанол = 4:1), с получением 0,28 г 2-фтор-4-[3-(4-пиперидинил)пропокси]бензонитрила в виде бледно-желтого маслянистого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,05-1,20 (2H, м), 1,30-1,45 (3H, м), 1,50-1,75 (2H, м), 1,75-1,90 (2H, м), 2,50-2,65 (2H, м), 3,00-3,15 (2H, м), 3,98 (2H, т, J=6,5 Гц), 6,69 (1H, дд, J=11,0, 2,3 Гц), 6,75 (1H, дд, J=8,5, 2,3 Гц), 7,50 (1H, дд, J=8,5, 8,5 Гц).
Ссылочный пример 7

К раствору 0,10 г 2-фтор-4-[3-(4-пиперидинил)пропокси]бензонитрила в N,N-диметилформамиде (2,0 мл) последовательно добавляли 0,10 г карбоната калия и 0,13 г 4-(3-бромпропокси)бензонитрила при комнатной температуре, полученную смесь затем перемешивали при указанной температуре в течение 13 часов. К реакционной смеси добавляли этилацетат, воду и толуол. Органический слой отделяли и сушили при помощи безводного сульфата натрия с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (элюент; хлороформ:метанол = 4:1), с получением 68 мг 4-(3-{1-[3-(4-цианофенокси)пропил]-4-пиперидинил}пропокси)-2-фторбензонитрила в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,45 (5H, м), 1,65-2,05 (8H, м), 2,40-2,55 (2H, м), 2,85-3,00 (2H, м), 3,98 (2H, т, J=6,5 Гц), 4,06 (2H, т, J=6,3 Гц), 6,69 (1H, дд, J=11,0, 2,4 Гц), 6,74 (1H, дд, J=8,8, 2,4 Гц), 6,94 (2H, д, J=8,7 Гц), 7,45-7,55 (1H, м), 7,57 (2H, д, J=8,7 Гц).
Ссылочный пример 8
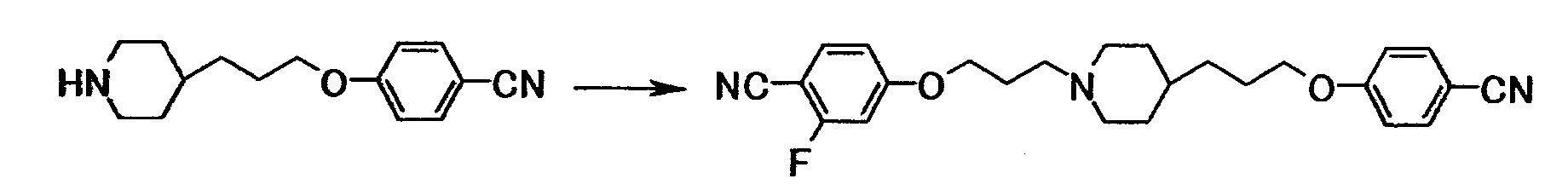
Как описано в ссылочном примере 7, использовали 0,12 г 4-[3-(4-пиперидинил)пропокси]бензонитрила и 0,15 г 4-(3-бромпропокси)-2-фторбензонитрила с получением 0,10 г 4-(3-{4-[3-(4-цианофенокси)пропил]-1-пиперидинил}пропокси)-2-фторбензонитрила в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,35 (3H, м), 1,35-1,45 (2H, м), 1,60-2,05 (8H, м),2,40-2,50 (2H, м), 2,85-3,00 (2H, м), 3,99 (2H, т, J=6,5 Гц), 4,06 (2H, т, J=6,3 Гц), 6,70-6,80 (2H, м), 6,93 (2H, д, J=9,0 Гц), 7,45-7,55 (1H, м), 7,57 (2H, д, J=9,0 Гц).
Ссылочный пример 9
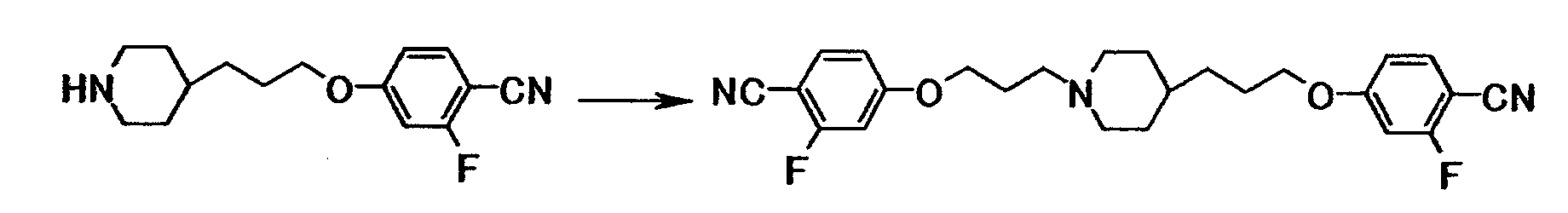
К раствору 0,26 г 2-фтор-4-[3-(4-пиперидинил)пропокси]бензонитрила и 0,21 г 4-(3-хлорпропокси)-2-фторбензонитрила в диметилсульфоксиде (4,0 мл) добавляли 0,88 мл N-этилдиизопропиламина, полученную смесь затем перемешивали при температуре от 80 до 90°C в течение 8 часов и 15 минут. Реакционную смесь охлаждали до комнатной температуры, к полученной смеси затем добавляли воду с последующей экстракцией этилацетатом. Экстракт два раза промывали водой и сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (элюент; хлороформ:метанол = 10:1), с получением 0,25 г 4-(3-{1-[3-(4-циано-3-фторфенокси)пропил]-4-пиперидинил}пропокси)-2-фторбензонитрила в виде коричневого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,45 (5H, м), 1,65-2,05 (8H, м), 2,40-2,50 (2H, м), 2,85-3,00 (2H, м), 3,98 (2H, т, J=6,5 Гц), 4,06 (2H, т, J=6,3 Гц), 6,65-6,80 (4H, м), 7,45-7,55 (2H, м).
Ссылочный пример 10
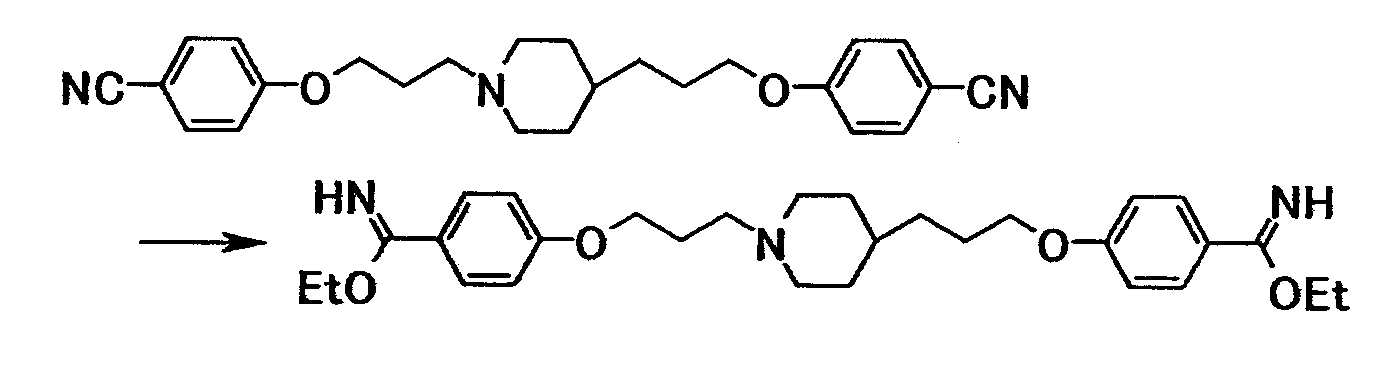
Хлористый водород вводили в суспензию 0,80 г 4-(3-{4-[3-(4-цианофенокси)пропил]-1-пиперидинил}пропокси)бензонитрила в этаноле (16 мл) при охлаждении льдом, полученную смесь затем перемешивали при комнатной температуре в течение 15 часов. Растворитель отгоняли при пониженном давлении и полученный остаток растворяли в хлороформе и добавляли к смеси насыщенного водного раствора бикарбоната натрия и хлороформа. Органический слой отделяли и сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении с получением 0,77 г этил 4-{3-[4-(3-{4-[этокси(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензимидата в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,45 (5H, м), 1,41 (3H, т, J=7,1 Гц), 1,41 (3H, т, J=7,1 Гц), 1,65-2,05 (8H, м), 2,45-2,55 (2H, м), 2,90-3,00 (2H, м), 3,98 (2H, т, J=6,5 Гц), 4,04 (2H, т, J=6,3 Гц), 4,20-4,40 (4H, м), 6,89 (2H, д, J=8,5 Гц), 6,90 (2H, д, J=8,8 Гц), 7,60-7,80 (4H, м).
Ссылочный пример 11
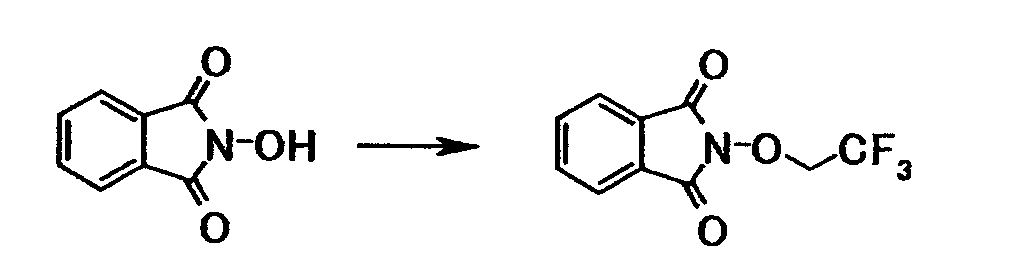
Раствор 3,9 мл 2,2,2-трифторэтанола и 4,3 мл пиридина в дихлорметане (21 мл) добавляли по каплям к раствору в дихлорметане (83 мл) 9,0 мл трифторметансульфонового ангидрида при охлаждении льдом в течение 25 минут. К смеси в течение 45 минут добавляли по каплям при указанной температуре раствор 8,50 г N-гидроксифталимида и 18,5 мл N,N-диизопропилэтиламина в дихлорметане (60 мл), полученную смесь затем перемешивали в течение 22 часов. К реакционной смеси добавляли 100 мл 1 моль/л хлористоводородной кислоты. Органический слой отделяли, промывали последовательно 1 моль/л хлористоводородной кислотой и насыщенным водным раствором хлорида натрия и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (элюент; гексан:этилацетат = 3:1), и промывали гексаном с получением 4,43 г N-(2,2,2-трифторэтокси)фталимида в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 4,56 (2Н, кв, J=8,0 Гц), 7,75-7,95 (4Н, м).
Ссылочный пример 12

К раствору 4,30 г N-(2,2,2-трифторэтокси)фталимида в смеси дихлорметана (45 мл)/метанола (5,9 мл) добавляли по каплям 0,85 мл моногидрата гидразина при комнатной температуре, полученную смесь затем перемешивали при указанной температуре в течение 3 часов. К реакционной смеси добавляли 10 мл 2,9 моль/л хлористого водорода/этанола с последующей отгонкой растворителя при пониженном давлении с получением 2,65 г гидрохлорида O-(2,2,2-трифторэтил)гидроксиламина в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 4,60 (2Н, кв, J=9,0 Гц), 7,80-7,85 (1Н, м).
Ссылочный пример 13

Раствор 1,00 г 4-нитрофенилхлорформиата в тетрагидрофуране (10 мл) добавляли по каплям при охлаждении льдом к раствору 0,44 г пентанола и 0,76 мл триэтиламина в тетрагидрофуране (5 мл). Смесь перемешивали при комнатной температуре в течение 2 часов и 20 минут и затем к реакционной смеси добавляли этилацетат и воду. Органический слой отделяли, промывали последовательно 5% водным раствором карбоната калия и насыщенным водным раствором хлорида натрия и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении, с получением 1,20 г 4-нитрофенилпентилкарбоната в виде бесцветного маслянистого вещества.
1Н-ЯМР (CDCl3) значение δ: 0,94 (3H, т, J=7,1 Гц), 1,30-1,50 (4H, м), 1,70-1,85 (2H, м), 4,29 (2H, т, J=6,7 Гц), 7,39 (2H, д, J=9,3 Гц), 8,28 (2H, д, J=9,3 Гц).
Ссылочный пример 14
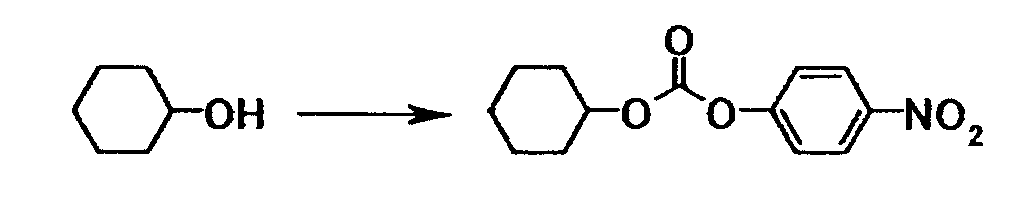
Как описано в ссылочном примере 13, получали 1,49 г циклогексил-4-нитрофенилкарбоната в виде белого твердого вещества исходя из 0,50 г циклогексанола и 1,00 г 4-нитрофенилхлороформиата.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,65 (6H, м), 1,75-1,85 (2H, м), 1,95-2,05 (2H, м), 4,70-4,80 (1H, м), 7,39 (2H, д, J=9,0 Гц), 8,28 (2H, д, J=9,0 Гц).
Ссылочный пример 15
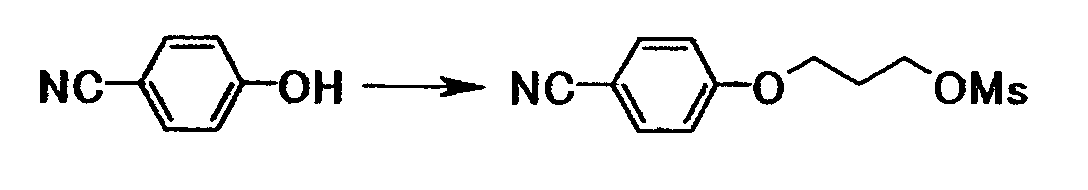
К суспензии 9,42 г трет-бутоксида калия в N,N-диметилформамиде (15 мл) добавляли при охлаждении водой 10,0 г 4-цианофенола и 7,02 мл 3-хлор-1-пропанола, полученную смесь затем перемешивали при 100°C в течение одного часа. Реакционную смесь охлаждали до комнатной температуры и затем добавляли воду и этилацетат. Органический слой отделяли, промывали последовательно 5% водным раствором карбоната калия и насыщенным водным раствором хлорида натрия и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. 11,9 г полученного маслянистого вещества растворяли 100 мл диоксана. К этой смеси добавляли 9,28 мл триэтиламина, затем в течение 8 минут добавляли по каплям при охлаждении льдом 5,15 мл метансульфонилхлорида с последующим перемешиванием при комнатной температуре в течение 10 минут. К реакционной смеси добавляли по каплям 100 мл воды, затем перемешивали при комнатной температуре в течение 45 минут. Осадок собирали фильтрованием и промывали водой и 2-пропанолом с получением 12,3 г 3-(4-цианофенокси)пропилметансульфоната в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 2,27 (2H, тт, J=6,0, 6,0 Гц), 3,02 (3H, с), 4,15 (2H, т, J=6,0 Гц), 4,45 (2H, т, J=6,0 Гц), 6,96 (2H, д, J=8,9 Гц), 7,60 (2H, д, J=8,9 Гц).
Ссылочный пример 16
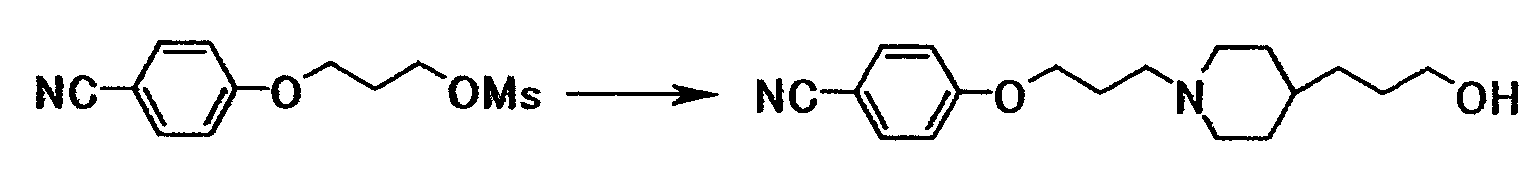
К раствору 50,0 г 3-(4-цианофенокси)пропилметансульфоната в N,N-диметилформамиде (250 мл) добавляли при комнатной температуре 32,5 г иодида калия, 32,9 г бикарбоната натрия и 37,0 г гидрохлорида 3-(4-пиперидинил)-1-пропанола, полученную смесь затем перемешивали при 70°C в течение 6 часов и 50 минут. Реакционную смесь охлаждали до комнатной температуры, затем добавляли воду и толуол с последующим доведением до pH 1,0 при помощи хлористоводородной кислоты. Водный слой отделяли, доводили до pH 10,0 при помощи 20% водного раствора гидроксида натрия и перемешивали при комнатной температуре в течение 15 минут, а затем при охлаждении льдом в течение 30 минут. Осадок собирали фильтрованием и промывали водой и толуолом с получением 52,3 г 4-{3-[4-(3-гидроксипропил)-1-пиперидинил]пропокси}бензонитрила в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,75 (10H, м), 1,85-2,05 (4H, м), 2,40-2,55 (2H, м), 2,85-3,00 (2H, м), 3,64 (2H, т, J=6,6 Гц), 4,06 (2H, т, J=6,3 Гц), 6,94 (2H, д, J=9,0 Гц), 7,57 (2H, д, J=9,0 Гц).
Ссылочный пример 17

К раствору 18,7 г 4-{3-[4-(3-гидроксипропил)-1-пиперидинил]пропокси}бензонитрила в диметилсульфоксиде (200 мл) добавляли при комнатной температуре 8,92 мл 50% водного раствора гидроксиламина, полученную смесь затем перемешивали при указанной температуре в течение 5 часов и 30 минут. К смеси добавляли при комнатной температуре 8,92 мл 50% водного раствора гидроксиламина и полученную смесь перемешивали при указанной температуре в течение 15 часов и 50 минут. К реакционной смеси добавляли 2-пропанол и воду, затем перемешивали при комнатной температуре в течение одного часа. Осадок собирали фильтрованием и промывали водой с получением 17,5 г N'-гидрокси-4-{3-[4-(3-гидроксипропил)-1-пиперидинил]пропокси}бензамидина в виде белого твердого вещества.
1Н ЯМР (ДМСО-d6) значение δ: 1,00-1,25 (5H, м), 1,35-1,45 (2H, м), 1,55-1,65 (2H, м), 1,75-1,90 (4H, м), 2,35-2,45 (2H, м), 2,80-2,90 (2H, м), 3,30-3,40 (2H, м), 4,00 (2H, т, J=6,5 Гц), 4,34 (1H, т, J=5,1 Гц), 5,60-5,80 (2H, ушир), 6,90 (2H, д, J=8,7 Гц), 7,58 (2H, д, J=8,7 Гц), 9,43 (1H, с).
Ссылочный пример 18
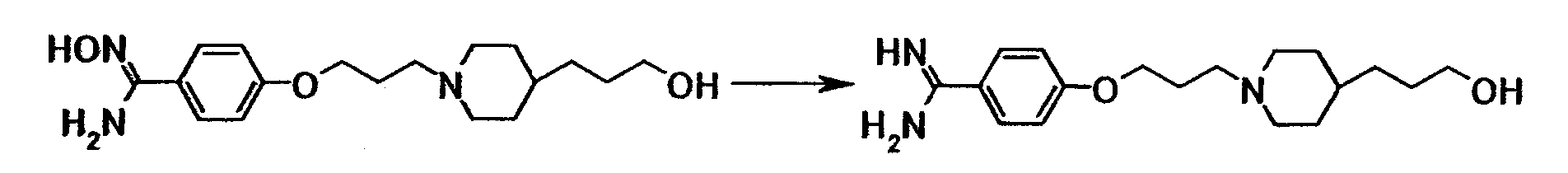
К суспензии 10,0 г N'-гидрокси-4-{3-[4-(3-гидроксипропил)-1-пиперидинил]пропокси}бензамидина в уксусной кислоте (80 мл) добавляли при комнатной температуре 5,31 мл уксусного ангидрида и 0,50 г 5% палладия на углероде, полученную смесь перемешивали при комнатной температуре в атмосфере водорода в течение 12 часов и 50 минут. После того как нерастворимое вещество отфильтровывали, растворитель отгоняли при пониженном давлении. К полученному остатку добавляли 6 моль/л хлористоводородной кислоты с последующей отгонкой растворителя при пониженном давлении, а затем очисткой при помощи колоночной хроматографии на силикагеле (силикагель: ODS-A от YMC, элюент; вода). Элюат концентрировали до около 100 мл при пониженном давлении и затем доводили до pH 12 при помощи 5 моль/л водного раствора гидроксида натрия. Осадок собирали фильтрованием и промывали водой с получением 8,43 г 4-{3-[4-(3-гидроксипропил)-1-пиперидинил]пропокси}бензамидина в виде белого твердого вещества.
1Н ЯМР (ДМСО-d6) значение δ: 1,00-1,25 (5H, м), 1,35-1,45 (2H, м), 1,55-1,65 (2H, м), 1,75-1,90 (4H, м), 2,30-2,45 (2H, м), 2,80-2,90 (2H, м), 3,30-3,40 (2H, м), 4,03 (2H, т, J=6,3 Гц), 6,95 (2H, д, J=8,8 Гц), 7,72 (2H, д, J=8,8 Гц).
Ссылочный пример 19
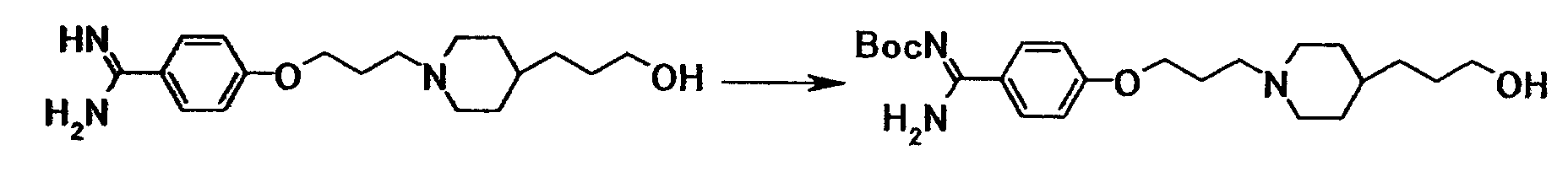
К суспензии 2,00 г 4-{3-[4-(3-гидроксипропил)-1- пиперидинил]пропокси}бензамидина в диоксане (10 мл) последовательно добавляли 1,37 г ди-трет-бутилдикарбоната, 4 мл N,N-диметилформамида и 10 мл 2,5 моль/л водного раствора гидроксида натрия при комнатной температуре, полученную смесь затем перемешивали при указанной температуре в течение 45 минут. К смеси добавляли 1,37 г ди-трет-бутилдикарбоната при комнатной температуре, затем перемешивали при указанной температуре в течение 2 часов и 45 минут. Нерастворимое вещество отфильтровывали и к фильтрату добавляли хлороформ и воду. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле (элюент; хлороформ:метанол = 4:1) с получением 2,35 г трет-бутил[1-амино-1-(4-{3-[4-(3-гидроксипропил)-1-пиперидинил]пропокси}фенил)метилиден]карбамата в виде бледно-красного твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,15-1,35 (5H, м), 1,35-1,75 (4H, м), 1,55 (9H, с), 1,85-2,05 (4H, м), 2,45-2,55 (2H, м), 2,85-3,00 (2H, м), 3,64 (2H, т, J=6,6 Гц), 4,05 (2H, т, J=6,5 Гц), 6,91 (2H, д, J=8,8 Гц), 7,83 (2H, д, J=8,8 Гц).
Ссылочный пример 20
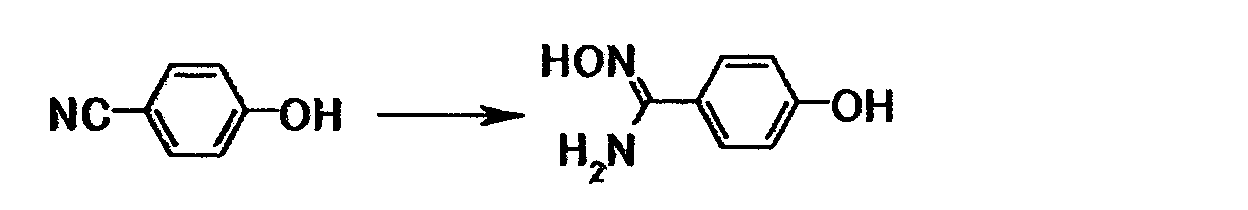
К раствору 10,0 г 4-цианофенола в диметилсульфоксиде (100 мл) добавляли по каплям 12,9 мл 50% водного раствора гидроксиламина при комнатной температуре в течение 6 минут, полученную смесь затем перемешивали при указанной температуре в течение 14 часов. К реакционной смеси добавляли хлороформ, 1 моль/л водного раствора гидроксида натрия и воду. Водный слой отделяли и промывали последовательно толуолом, хлороформом и толуолом, к полученной смеси затем добавляли воду с последующим доведением до pH 7,2 при помощи 6 моль/л хлористоводородной кислоты. После перемешивания этой смеси при комнатной температуре в течение 30 минут осадок собирали фильтрованием и промывали водой с получением 8,88 г N',4-дигидроксибензамидина в виде белого твердого вещества.
1Н ЯМР (ДМСО-d6) значение δ: 5,50-5,70 (2H, ушир), 6,73 (2H, д, J=8,5 Гц), 7,47 (2H, д, J=8,5 Гц), 9,34 (1H, с), 9,50-9,60 (1H, ушир).
Ссылочный пример 21

К раствору 9,81 г 4-[3-(4-пиперидинил)пропокси]бензонитрила в N,N-диметилформамиде (70 мл) добавляли 8,02 г карбоната калия и 2,62 мл 3-бром-1-пропанола при комнатной температуре, полученную смесь затем перемешивали при указанной температуре в течение 2 часов и 15 минут. К смеси добавляли 2,62 мл 3-бром-1-пропанола, полученную смесь затем перемешивали при указанной температуре в течение 1 часа и 45 минут. К реакционной смеси добавляли хлороформ и воду. Органический слой отделяли, промывали последовательно 1 моль/л водного раствора гидроксида натрия и насыщенным водным раствором хлорида натрия и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле (элюент; хлороформ:метанол = 4:1) с получением 4,28 г 4-{3-[1-(3-гидроксипропил)-4-пиперидинил]пропокси}бензонитрила в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,15-1,45 (5H, м), 1,65-2,00 (8H, м), 2,55-2,65 (2H, м), 3,00-3,10 (2H, м), 3,81 (2H, т, J=5,2 Гц), 3,98 (2H, т, J=6,5 Гц), 6,92 (2H, д, J=8,5 Гц), 7,57 (2H, д, J=8,5 Гц).
Ссылочный пример 22
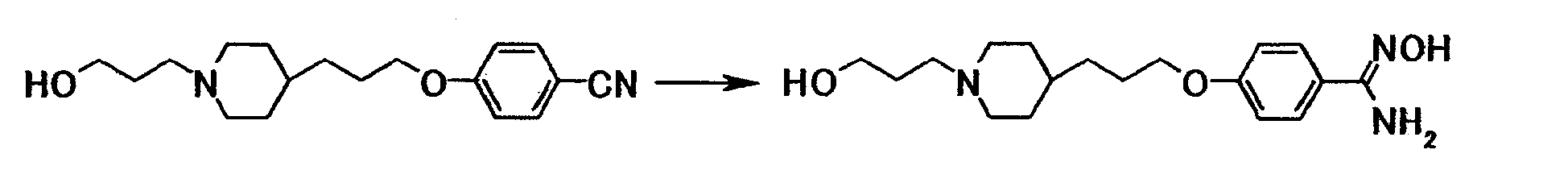
К суспензии 4,27 г 4-{3-[1-(3-гидроксипропил)-4-пиперидинил]пропокси}бензонитрила в диметилсульфоксиде (43 мл) добавляли при комнатной температуре 4,32 мл 50% водного раствора гидроксиламина, полученную смесь затем перемешивали при температуре от 40 до 50°C в течение 3 часов и 30 минут. Реакционную смесь охлаждали до комнатной температуры, затем добавляли по каплям 50 мл воды в течение 10 минут с последующим перемешиванием при комнатной температуре в течение 30 минут. Осадок собирали фильтрованием и промывали водой с получением 4,59 г N'-гидрокси-4-{3-[1-(3-гидроксипропил)-4-пиперидинил]пропокси}бензамидина в виде белого твердого вещества.
1Н ЯМР (ДМСО-d6) значение δ: 1,00-1,40 (5H, м), 1,50-1,85 (8H, м), 2,25-2,35 (2H, м), 2,75-2,90 (2H, м), 3,42 (2H, т, J=6,2 Гц), 3,96 (2H, т, J=6,5 Гц), 4,40-4,60 (1H, ушир), 5,60-5,80 (2H, ушир), 6,90 (2H, д, J=8,8 Гц), 7,58 (2H, д, J=8,8 Гц), 9,43 (1H, с).
Ссылочный пример 23
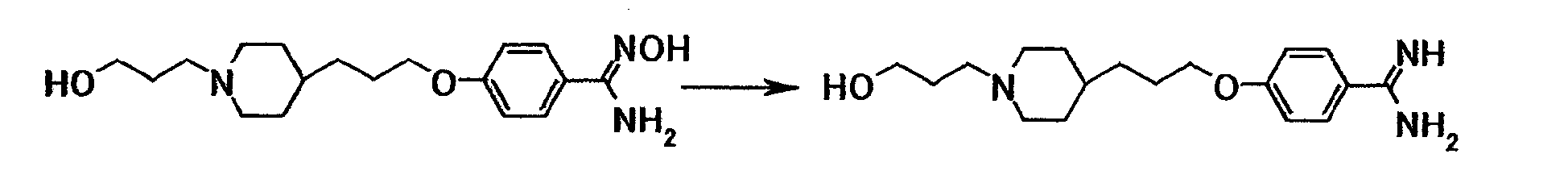
К суспензии 4,58 г N'-гидрокси-4-{3-[1-(3-гидроксипропил)-4-пиперидинил]пропокси}бензамидина в уксусной кислоте (50 мл) добавляли 2,59 мл уксусного ангидрида при комнатной температуре, полученную смесь затем перемешивали при указанной температуре в течение одного часа. К реакционной смеси добавляли 0,50 г 5% палладия на углероде, затем перемешивали при комнатной температуре в атмосфере водорода в течение 5 часов и 30 минут. Нерастворимое вещество отфильтровывали и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли воду, смесь доводили до pH 12,5 при помощи 5 моль/л водного раствора гидроксида натрия. Осадок собирали фильтрованием и промывали водой с получением 4,82 г 4-{3-[1-(3-гидроксипропил)-4-пиперидинил]пропокси}бензамидина в виде белого твердого вещества.
1Н ЯМР (ДМСО-d6) значение δ: 1,00-1,40 (5H, м), 1,50-1,90 (8H, м), 2,25-2,35 (2H, м), 2,75-2,90 (2H, м), 3,42 (2H, т, J=6,2 Гц), 4,01 (2H, т, J=6,5 Гц), 7,01 (2H, д, J=8,8 Гц), 7,74 (2H, д, J=8,8 Гц), 8,10-9,20 (2H, ушир).
Ссылочный пример 24

К суспензии 2,00 г 4-{3-[1-(3-гидроксипропил)-4-пиперидинил]пропокси}бензамидина в диоксане (10 мл) добавляли 2,05 г ди-трет-бутилдикарбоната, 4 мл N,N-диметилформамида и 10 мл 2,5 моль/л водного раствора гидроксида натрия при комнатной температуре, полученную смесь затем перемешивали при указанной температуре в течение 1 часа и 15 минут. Затем к реакционной смеси при комнатной температуре добавляли 10 мл 2,5 моль/л водного раствора гидроксида натрия и затем перемешивали при указанной температуре в течение 1 часа и 15 минут. К реакционной смеси добавляли хлороформ и воду. Органический слой отделяли и водный слой экстрагировали хлороформом. Органический слой и экстракт объединяли, затем промывали насыщенным водным раствором хлорида натрия и после этого сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле (элюент; хлороформ:метанол = 4:1) с получением 1,75 г трет-бутил[1-амино-1-(4-{3-[1-(3-гидроксипропил)-4-пиперидинил]пропокси}фенил)метилиден]карбамата в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,15-2,00 (13H, м), 1,55 (9H, с), 2,55-2,65 (2H, м), 3,00-3,10 (2H, м), 3,80 (2H, т, J=5,2 Гц), 3,97 (2H, т, J=6,5 Гц), 6,90 (2H, д, J=8,9 Гц), 7,83 (2H, д, J=8,9 Гц).
Ссылочный пример 25
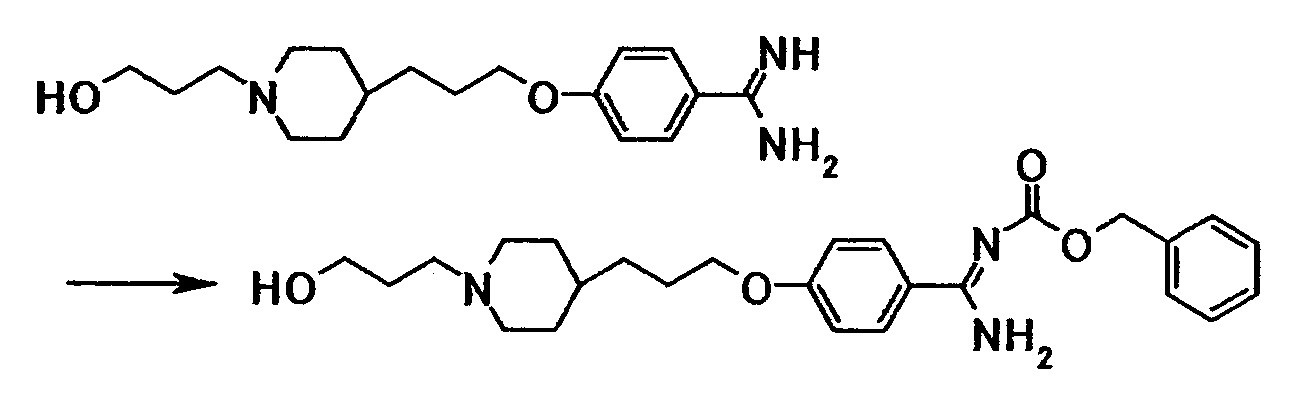
К суспензии 1,00 г 4-{3-[1-(3-гидроксипропил)-4-пиперидинил]пропокси}бензамидина в N,N-диметилформамиде (10 мл) добавляли 1,28 г бензил-4-нитрофенилкарбоната при комнатной температуре, полученную смесь затем перемешивали при указанной температуре в течение одного часа. К реакционной смеси добавляли 1 мл 5 моль/л водного раствора гидроксида натрия при комнатной температуре, затем перемешивали при указанной температуре в течение 15 минут. К смеси добавляли 5 мл 5 моль/л водного раствора гидроксида натрия при комнатной температуре, затем перемешивали при указанной температуре в течение 5 минут. К реакционной смеси добавляли хлороформ и 5% водный раствор карбоната калия. Органический слой отделяли, промывали последовательно 5% водным раствором карбоната калия и насыщенным водным раствором хлорида натрия и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле (элюент; хлороформ:метанол = 4:1) с получением 1,22 г бензил[1-амино-1-(4-{3-[1-(3-гидроксипропил)-4-пиперидинил]пропокси}фенил)метилиден]карбамата в виде бледно-желтого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,15-1,45 (5H, м), 1,75-2,00 (8H, м), 2,55-2,65 (2H, м), 3,00-3,10 (2H, м), 3,75-3,85 (2H, м), 3,98 (2H, т, J=6,6 Гц), 5,21 (2H, с), 6,91 (2H, д, J=8,9 Гц), 7,20-7,50 (5H, м), 7,85 (2H, д, J=8,9 Гц).
Ссылочный пример 26
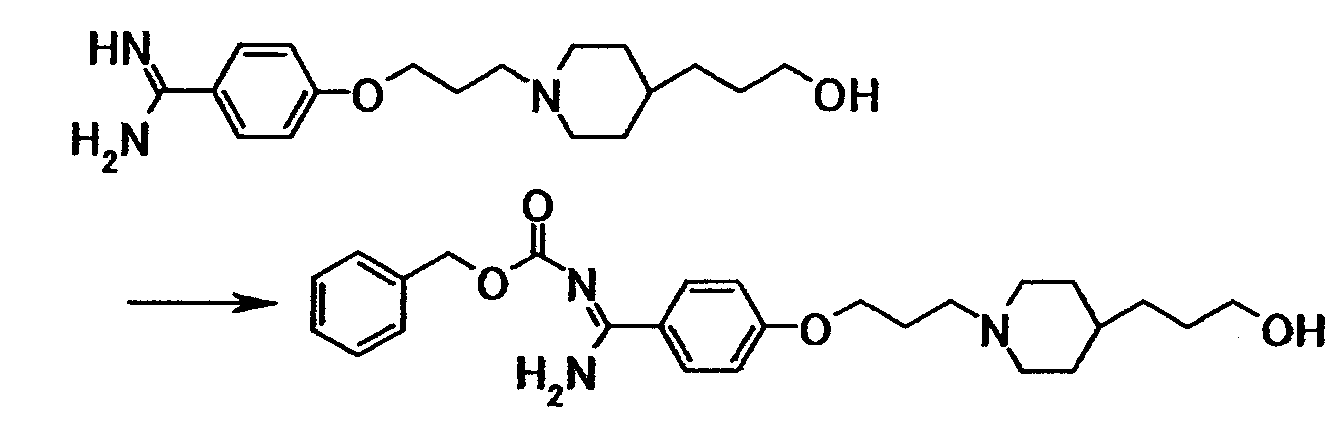
К раствору 1,00 г 4-{3-[4-(3-гидроксипропил)-1-пиперидинил]пропокси}бензамидина в N,N-диметилформамиде (20 мл) добавляли 2,14 г бензил-4-нитрофенилкарбоната при комнатной температуре, полученную смесь затем перемешивали при указанной температуре в течение 18 часов. К реакционной смеси добавляли хлороформ, воду и 5% водный раствор карбоната калия. Органический слой отделяли, промывали последовательно 5% водным раствором карбоната калия и насыщенным водным раствором хлорида натрия и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле (элюент; хлороформ:метанол = 8:1) с получением 0,93 г бензил[1-амино-1-(4-{3-[4-(3-гидроксипропил)-1-пиперидинил]пропокси}фенил)метилиден]карбамата в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,35 (5H, м), 1,50-1,75 (4H, м), 1,85-2,05 (4H, м), 2,45-2,55 (2H, м), 2,85-3,00 (2H, м), 3,62 (2H, т, J=6,7 Гц), 4,04 (2H, т, J=6,3 Гц), 5,21 (2H, с), 6,88-6,93 (2H, д, J=8,8 Гц), 7,25-7,50 (5H, м), 7,84 (2H, д, J=8,8 Гц).
Пример 1

К суспензии 12,6 г 4-(3-{4-[3-(4-цианофенокси)пропил]-1-пиперидинил}пропокси)бензонитрила в диметилсульфоксиде (126 мл) добавляли 19,1 мл 50% водного раствора гидроксиламина, полученную смесь затем перемешивали при 50°C в течение 19 часов. Смесь охлаждали до комнатной температуры, добавляли по каплям в течение 50 минут 260 мл воды с последующим перемешиванием при комнатной температуре в течение 30 минут, а затем при охлаждении водой в течение 2 часов. Осадок собирали фильтрованием с получением 15,0 г 4-(3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}-N'-гидроксибензамидина в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,05-1,40 (5H, м), 1,60-1,80 (4H, м), 1,80-1,90 (4H, м), 2,35-2,45 (2H, м), 2,80-2,90 (2H, м), 3,96 (2H, т, J=6,5 Гц), 4,01 (2H, т, J=6,5 Гц), 5,65-5,75 (4H, м), 6,85-6,95 (4H, м), 7,55-7,65 (4H, м), 9,43 (1H, с), 9,43 (1H, с).
Пример 2
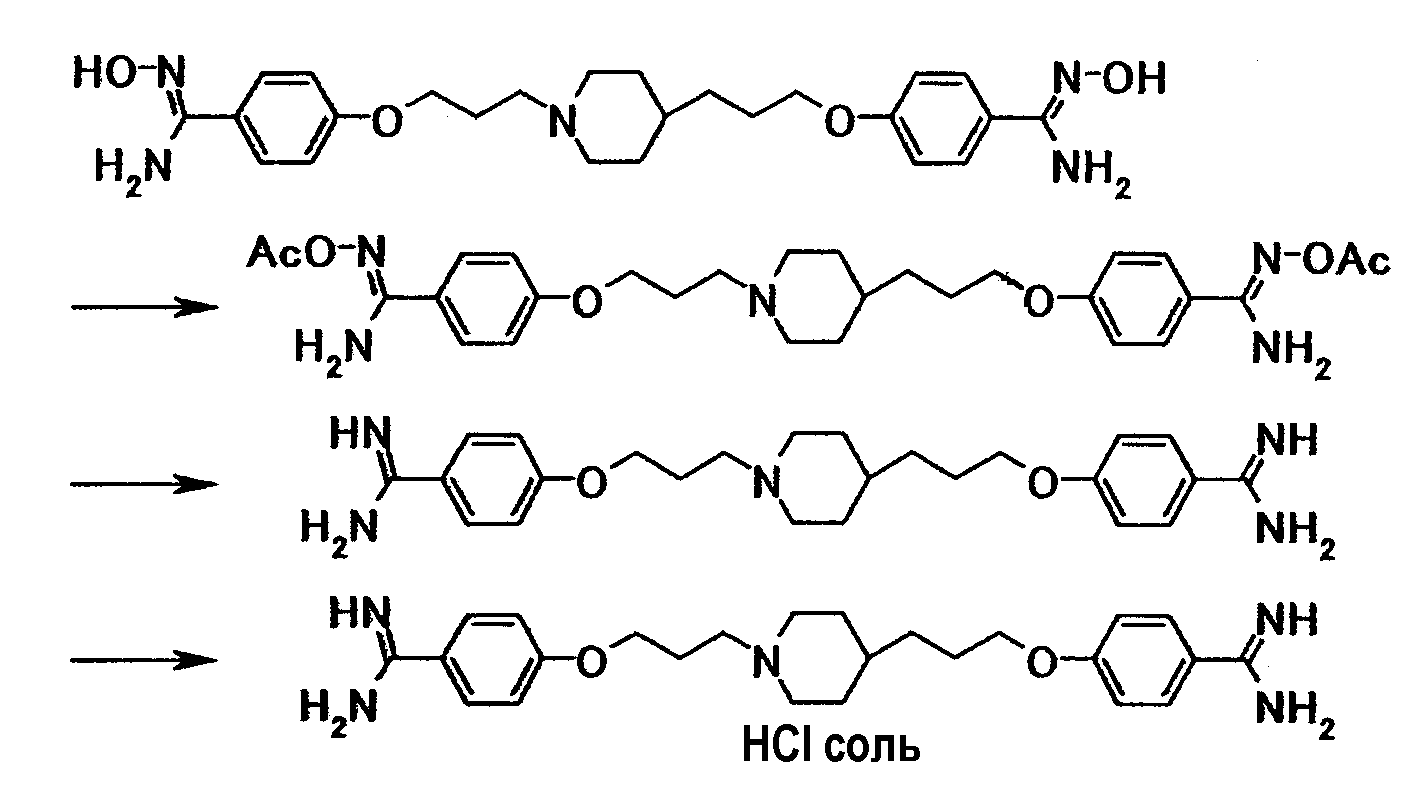
(2-1)
К суспензии 1,07 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}-N'-гидроксибензамидина в уксусной кислоте (10 мл) добавляли 0,64 мл уксусного ангидрида при комнатной температуре и полученную смесь затем перемешивали при комнатной температуре в течение 40 минут. К этой смеси добавляли 0,10 г 5% палладия на углероде, полученную смесь затем перемешивали в атмосфере водорода в течение 2 часов и 15 минут. Нерастворимое вещество отфильтровывали, а затем добавляли 4 мл 6,0 моль/л хлористоводородной кислоты и нерастворимое вещество отфильтровывали с последующей отгонкой растворителя при пониженном давлении. К полученному остатку добавляли 5,0 моль/л водный раствор гидроксида натрия для доведения pH до 12,5, а затем твердое вещество собирали фильтрованием с получением 0,61 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина в виде белого твердого вещества.
(2-2)
К суспензии 14,9 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}-N'-гидроксибензамидина в уксусной кислоте (150 мл) добавляли при комнатной температуре 5,97 мл уксусного ангидрида, полученную смесь затем перемешивали при комнатной температуре в течение 1 часа и 20 минут. К этой смеси добавляли 1,50 г 5% палладия на углероде, полученную смесь затем перемешивали в атмосфере водорода в течение 4 часов и 40 минут. Нерастворимое вещество отфильтровывали и затем добавляли 55 мл 6,0 моль/л хлористоводородной кислоты. Растворитель отгоняли при пониженном давлении и к полученному остатку добавляли этанол. Твердое вещество собирали фильтрованием с получением 14,0 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,30-1,45 (2H, м), 1,45-1,70 (3H, м), 1,70-1,90 (4H, м), 2,15-2,30 (2H, м), 2,80-3,00 (2H, м), 3,10-3,20 (2H, м), 3,45-3,55 (2H, м), 4,10 (2H, т, J=6,2 Гц), 4,19 (2H, т, J=6,1 Гц), 7,15 (2H, д, J=8,4 Гц), 7,16 (2H, д, J=8,4 Гц), 7,84 (2H, д, J=8,4 Гц), 7,86 (2H, д, J=8,4 Гц), 8,90-9,00 (4H, м), 9,15-9,30 (4H, м), 10,60-10,80 (1H, ушир).
Пример 3
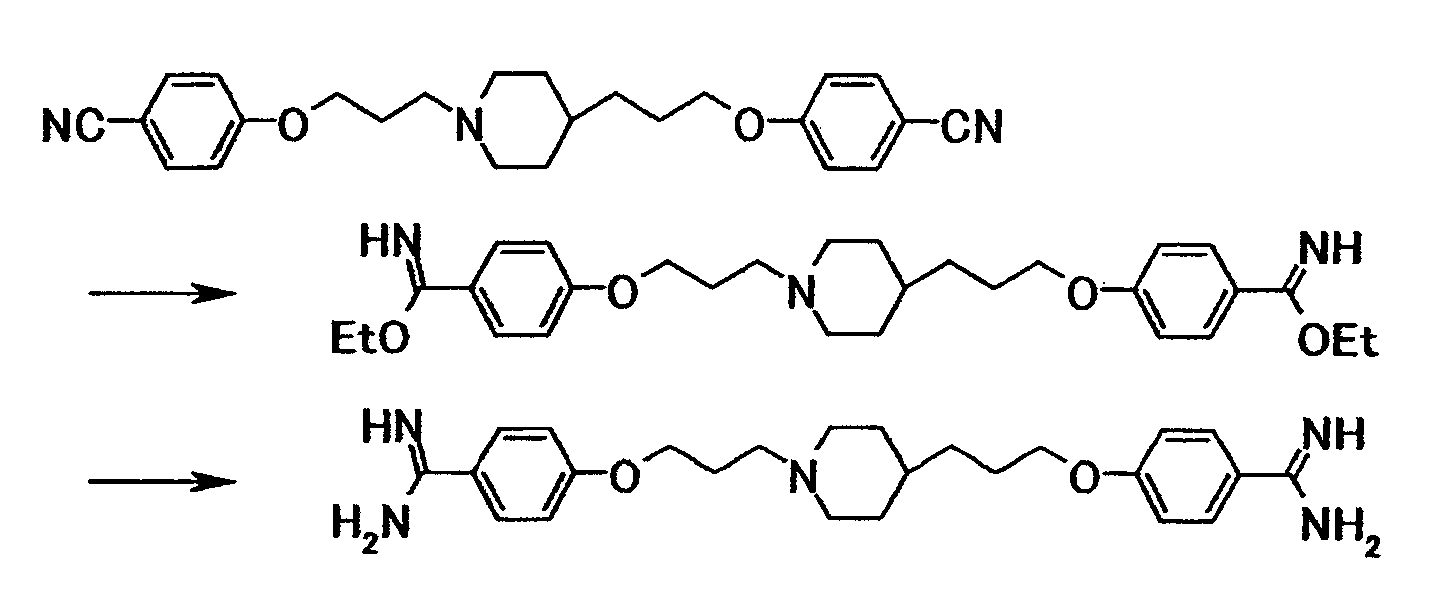
Хлористый водород вводили при охлаждении льдом в суспензию 1,15 г 4-(3-{4-[3-(4-цианофенокси)пропил]-1-пиперидинил}пропокси)бензонитрила в этаноле (20 мл), полученную смесь затем перемешивали при комнатной температуре в течение 24 часов. Растворитель отгоняли при пониженном давлении и полученный остаток растворяли в 20 мл этанола. К смеси добавляли 1,54 г ацетата аммония, полученную смесь затем нагревали до температуры кипения с обратным холодильником в течение 3 часов и 45 минут. Реакционную смесь охлаждали до комнатной температуры, к смеси добавляли воду с последующей отгонкой этанола при пониженном давлении. К полученному остатку добавляли хлороформ, затем к смеси добавляли 5,0 моль/л водный раствор гидроксида натрия для доведения pH до 12,5. Осадок собирали фильтрованием с получением 1,13 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,00-1,40 (5H, м), 1,60-1,80 (4H, м), 1,80-1,95 (4H, м), 2,35-2,45 (2H, м), 2,80-2,90 (2H, м), 3,98 (2H, т, J=6,5 Гц), 4,03 (2H, т, J=6,3 Гц), 6,30-7,20 (4H, ушир), 6,85-7,00 (4H, м), 7,65-7,80 (4H, м).
Пример 4

К суспензии 0,50 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина в этаноле (10 мл) добавляли при комнатной температуре 1,77 мл 2,6 моль/мл раствор хлористого водорода в этаноле, полученную смесь затем перемешивали при комнатной температуре в течение 4 часов и 15 минут. Осадок собирали фильтрованием с получением 0,49 г гидрохлорида 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина в виде бесцветного твердого вещества.
Данные спектра1H-ЯМР в ДМСО-d6 согласовывались со значениями примера 2.
Пример 5

К суспензии 67 мг 4-(3-{1-[3-(4-цианофенокси)пропил]-4-пиперидинил}пропокси)-2-фторбензонитрила в диоксане (3,0 мл) добавляли 1,0 мл 50% водного раствора гидроксиламина, полученную смесь затем нагревали до температуры кипения с обратным холодильником в течение 2 часов. Смесь охлаждали до комнатной температуры, затем добавляли по каплям 10 мл воды с последующим перемешиванием при охлаждении льдом в течение 30 минут. Осадок собирали фильтрованием с получением 63 мг 4-{3-[1-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-4-пиперидинил}пропокси}-2-фтор-N'-гидроксибензамидина в виде бледно-желтого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,00-1,40 (5H, м), 1,60-1,80 (4H, м), 1,80-1,95 (4H, м), 2,35-2,45 (2H, м), 2,80-2,90 (2H, м), 3,98 (2H, т, J=6,4 Гц), 4,00 (2H, т, J=6,0 Гц), 5,60-5,80 (4H, м), 6,70-6,85 (2H, м), 6,90 (2H, д, J=8,8 Гц), 7,35-7,45 (1H, м), 7,58 (2H, д, J=8,8 Гц), 9,43 (1H, с), 9,50 (1H, с).
Пример 6
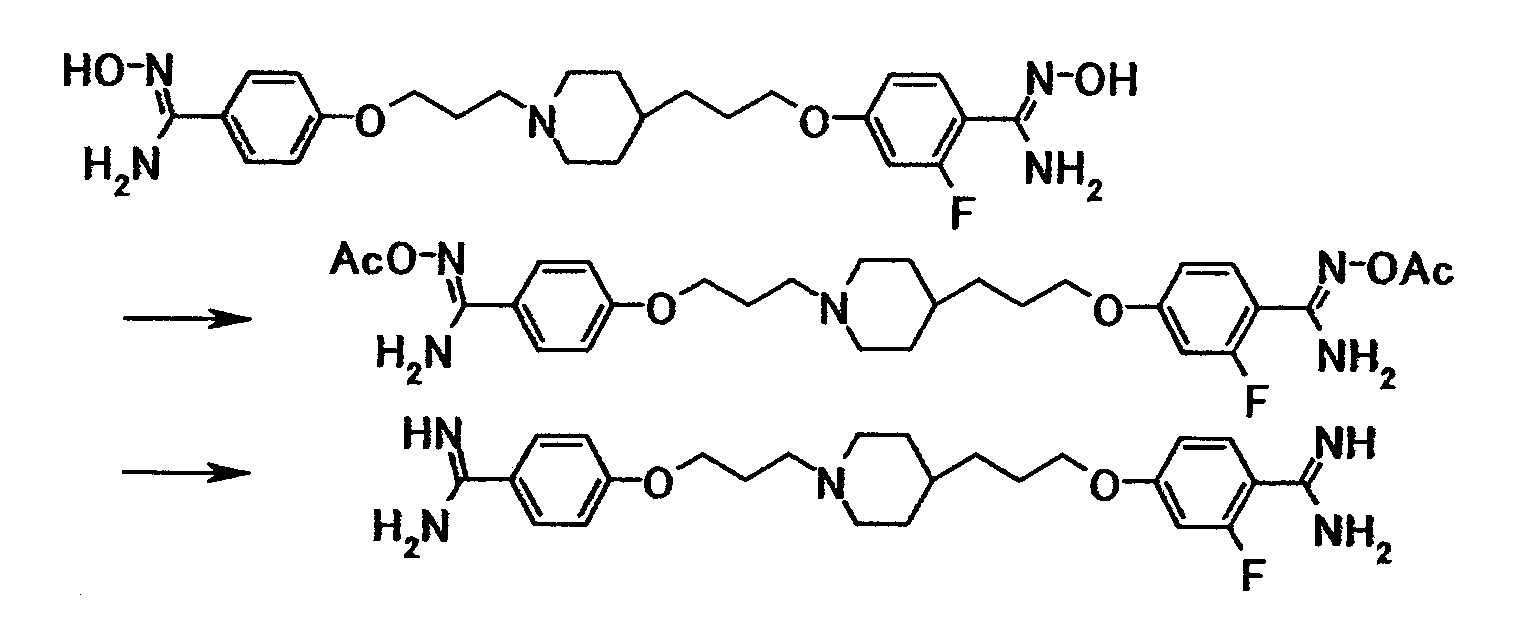
К суспензии 56 мг 4-{3-[1-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-4-пиперидинил]пропокси}-2-фтор-N'-гидроксибензамидина в уксусной кислоте (2,0 мл) добавляли 0,043 мл уксусного ангидрида при комнатной температуре, полученную смесь затем перемешивали при указанной температуре в течение одного часа. К смеси добавляли 5,0 мг 5% палладия на углероде, полученную смесь затем перемешивали в атмосфере водорода в течение 2 часов. Нерастворимое вещество отфильтровывали и растворитель отгоняли при пониженном давлении. К смеси добавляли раствор 6,0 моль/л хлористоводородной кислоты и воду с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (силикагель: ODS-AM120-S50 от YMC, элюент; вода). Полученный остаток растворяли в 5,0 мл воды, затем к полученной смеси добавляли 5,0 моль/л водный раствор гидроксида натрия для доведения pH до 12,2. Раствор перемешивали при охлаждении льдом в течение 20 минут и осадок собирали фильтрованием с получением 43 мг 4-{3-[1-(3-{4-[амино(имино)метил]фенокси}пропил)-4-пиперидинил]пропокси}-2-фторбензамидина в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,05-1,40 (5H, м), 1,60-2,05 (8H, м), 2,30-2,45 (2H, м), 2,80-2,90 (2H, м), 3,98 (2H, т, J=6,5 Гц), 4,02 (2H, т, J=6,3 Гц), 6,20-6,70 (4H, ушир), 6,75-6,85 (2H, м), 6,92 (2H, д, J=8,4 Гц), 7,45-7,55 (1H, м), 7,71 (2H, д, J=8,4 Гц).
Пример 7

Как описано в примере 5, использовали 0,10 г 4-3-{4-[3-(4-цианофенокси)пропил]-1-пиперидинил}пропокси)-2-фторбензонитрила с получением 0,11 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}-2-фтор-N'-гидроксибензамидина в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,00-1,40 (5H, м), 1,60-1,75 (4H, м), 1,75-1,90 (4H, м), 2,30-2,40 (2H, м), 2,80-2,90 (2H, м), 3,96 (2H, т, J=6,5 Гц), 4,03 (2H, т, J=6,3 Гц), 5,65-5,80 (4H, м), 6,75-6,90 (2H, м), 6,90 (2H, д, J=8,9 Гц), 7,35-7,45 (1H, м), 7,58 (2H, д, J=8,9 Гц), 9,43 (1H, с), 9,50 (1H, с).
Пример 8
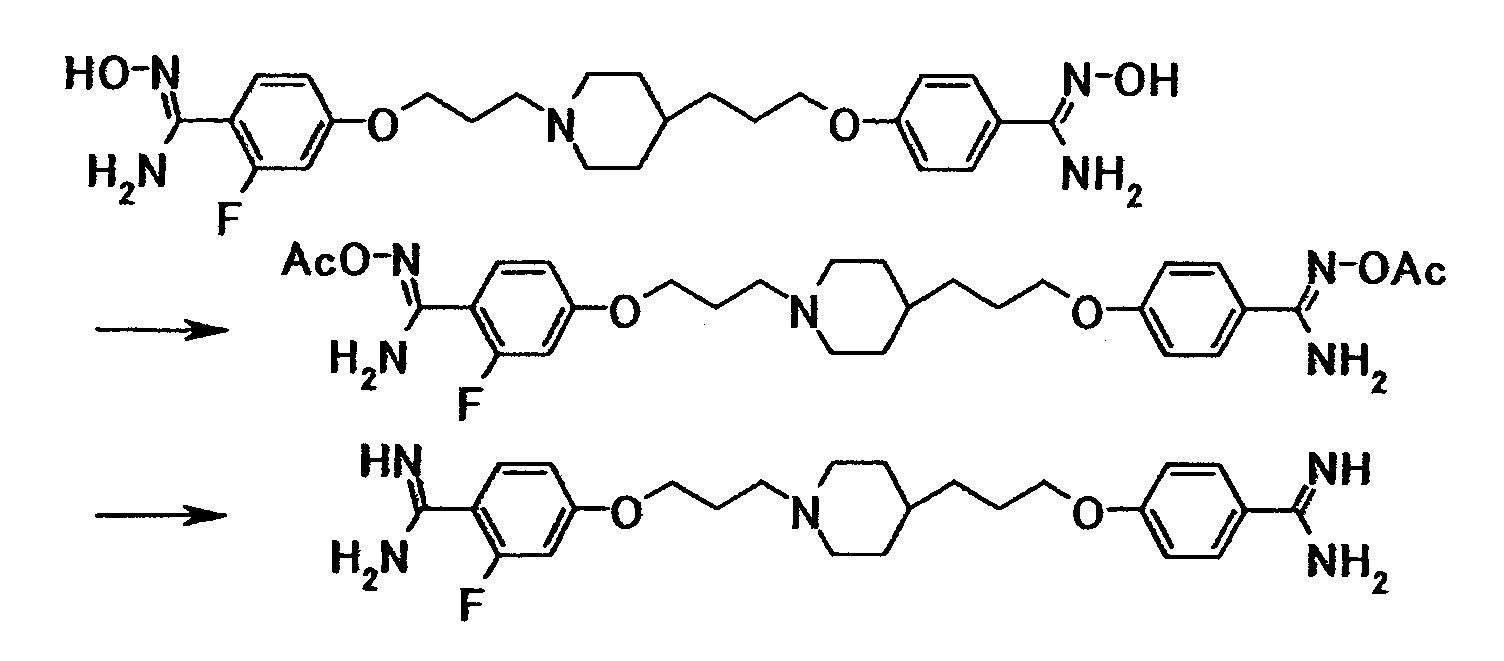
Как описано в примере 6, использовали 90 мг 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}-2-фтор-N'-гидроксибензамидина с получением 34 мг 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}-2-фторбензамидина в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,05-1,40 (5H, м), 1,60-1,90 (8H, м), 2,30-2,45 (2H, м), 2,80-2,90 (2H, м), 3,98 (2H, т, J=6,5 Гц), 4,03 (2H, т, J=6,0 Гц), 6,30-6,75 (4H, ушир), 6,75-6,85 (2H, м), 6,93 (2H, д, J=8,7 Гц), 7,45-7,55 (1H, м), 7,71 (2H, д, J=8,7 Гц).
Пример 9
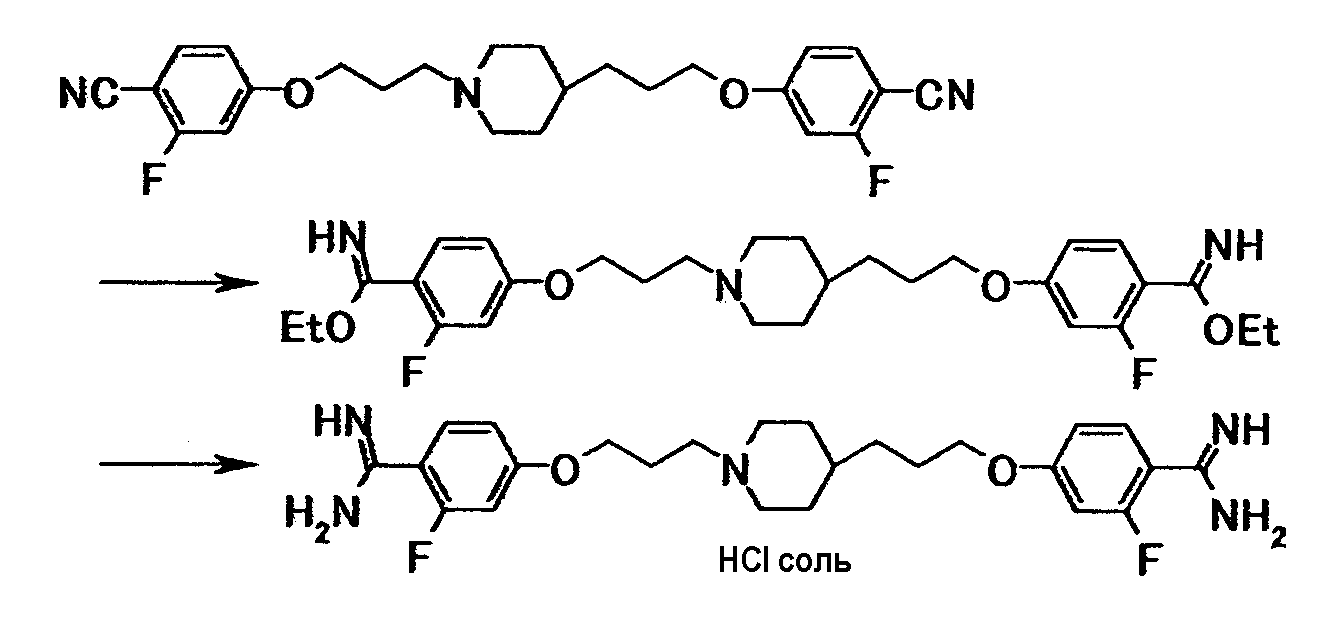
Хлористый водород вводили при охлаждении льдом в суспензию 0,10 г 4-(3-{1-[3-(4-циано-3-фторфенокси)пропил]-4-пиперидинил}пропокси)-2-фторбензонитрила в этаноле (10 мл), полученную смесь затем перемешивали при указанной температуре в течение 1 часа и 10 минут и при комнатной температуре в течение 17 часов. Растворитель отгоняли при пониженном давлении и полученный остаток суспендировали в 5,0 мл этанола, затем к полученной смеси добавляли 44 мг ацетата аммония с последующим нагреванием до температуры кипения с обратным холодильником в течение 5 часов и 30 минут. Растворитель отгоняли при пониженном давлении и полученный остаток растворяли в 8,0 мл 1,0 моль/л хлористоводородной кислоты с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле (силикагель: ODS-AM120-S50 от YMC, элюент; вода) с получением 46 мг гидрохлорида 4-{3-[1-(3-{4-[амино(имино)метил]-3-фторфенокси}пропил)-4-пиперидинил]пропокси}-2-фторбензамидина в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,30-1,45 (2H, м), 1,50-1,70 (3H, м), 1,70-1,90 (4H, м), 2,20-2,30 (2H, м), 2,80-2,95 (2H, м), 3,10-3,20 (2H, м), 3,40-3,55 (2H, м), 4,10 (2H, т, J=6,0 Гц), 4,20 (2H, т, J=5,7 Гц), 6,95-7,05 (2H, м), 7,05-7,15 (2H, м), 7,60-7,75 (2H, м), 9,20-9,50 (8H, м), 10,95-11,10 (1H, ушир).
Пример 10

(10-1)
К суспензии 1,0 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина в воде (2,3 мл) добавляли при комнатной температуре 0,72 г хлористоводородной кислоты, 6 мл 2-пропанола и 0,5 мл воды, полученную смесь затем перемешивали при 40°C. К смеси добавляли 9 мл 2-пропанола, затем перемешивали при охлаждении льдом в течение одного часа. Осажденные кристаллы собирали фильтрованием с получением 1,4 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина тригидрохлорида пентагидрата в виде бесцветных кристаллов. Эти кристаллы использовали в качестве затравочных кристаллов.
Содержание воды: 14,5%
Данные спектра1H-ЯМР в ДМСО-d6 согласовывались со значениями примера 2.
(10-2)
К суспензии 20,0 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина в воде (40 мл)/2-пропаноле (80 мл) добавляли 14,3 г хлористоводородной кислоты, полученную смесь затем перемешивали при 60°C в течение 10 минут. К смеси добавляли 120 мл 2-пропанола, добавляли 100 мг затравочных кристаллов с последующим перемешиванием при комнатной температуре в течение 35 минут и при охлаждении льдом в течение 2 часов. Осажденные кристаллы собирали фильтрованием с получением 28,3 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина тригидрохлорида пентагидрата в виде бесцветных кристаллов.
Содержание воды: 14,0%
Пики, полученные методом дифракции рентгеновских лучей на порошке (°): 6,6, 13,2, 16,1, 21,5, 25,5 (2и) (показаны на чертеже)
Данные спектра1H-ЯМР в ДМСО-d6 согласовывались со значениями примера 2.
Пример 11
Как описано в примере 10, 31,1 г дигидрата 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидинтриметансульфоната получали исходя из 20,0 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина и 13,6 г метансульфоновой кислоты.
Содержание воды: 4,6%
1Н-ЯМР (ДМСО-d6) значение δ: 1,36-1,79 (7H, м), 1,86-1,96 (2H, м), 2,15-2,25 (2H, м), 2,34 (9H, с), 2,85-2,98 (2H, м), 3,18-3,26 (2H, м), 3,50-3,58 (2H, м), 4,09 (2H, т, J=6,3 Гц), 4,16 (2H, т, J=5,9 Гц), 7,15 (2H, д, J=8,8 Гц), 7,16 (2H, д, J=9,0 Гц), 7,82 (2H, д, J=8,5 Гц), 7,84 (2H, д, J=8,3 Гц), 8,77-8,87 (3H, м), 9,10-9,18 (3H, м).
Пример 12
Как описано в примере 10, 21,6 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидиндиацетата 1/2-гидрата получали исходя из 20,0 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина и 8,5 г уксусной кислоты.
Содержание воды: 1,4%
1Н-ЯМР (ДМСО-d6) значение δ: 1,10-1,40 (5H, м), 1,62-1,80 (6H, м), 1,75 (6H, с), 2,40-2,47 (2H, м), 2,50-2,60 (2H, м), 2,84-2,92 (2H, м), 4,00-4,15 (4H, м), 7,10-7,15 (4H, м), 7,78 (4H, д, J=8,8 Гц).
Пример 13
Как описано в примере 10, 30,3 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина 3/2-сульфата тригидрата получали исходя из 20,0 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина и 15,1 г серной кислоты.
Содержание воды: 7,7%
1Н-ЯМР (ДМСО-d6) значение δ: 1,40-1,90 (7H, м), 2,02-2,10 (2H, м), 2,24-2,33 (2H, м), 2,94-3,04 (2H, м), 3,30-3,36 (2H, м), 3,62-3,69 (2H, м), 4,17 (2H, т, J=6,3 Гц), 4,25 (2H, т, J=5,7 Гц), 7,14-7,16 (4H, м), 7,78 (2H, д, J=9,0 Гц), 7,78 (2H, д, J=9,0 Гц).
Пример 14
Как описано в примере 10, 25,0 г дигидрата 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидинтрифосфата получали исходя из 20,0 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина и 16,9 г фосфорной кислоты.
Содержание воды: 4,2%
1Н-ЯМР (ДМСО-d6) значение δ: 1,43-1,76 (5H, м), 1,84-1,94 (2H, м), 2,05-2,12 (2H, м), 2,27-2,33 (2H, м), 2,96-3,06 (2H, м), 3,32-3,38 (2H, м), 3,64-3,70 (2H, м), 4,19 (2H, т, J=6,2 Гц), 4,27 (2H, т, J=5,6 Гц), 7,17 (4H, д, J=8,8 Гц), 7,80 (2H, д, J=9,0 Гц), 7,80 (2H, д, J=9,0 Гц).
Пример 15
Как описано в примере 10, 26,5 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина ди-L-лактата 3/2-гидрата получали исходя из 20,0 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина и 15,5 г L-молочной кислоты.
Содержание воды: 4,1%
1Н-ЯМР (ДМСО-d6) значение δ: 1,33-1,35 (6H, м), 1,40-1,70 (5H, м), 1,84-1,90 (2H, м), 1,99-2,07 (2H, м), 2,22-2,29 (2H, м), 2,86-2,92 (2H, м), 3,21-3,25 (2H, м), 3,50-3,56 (2H, м), 4,09-4,14 (2H, м), 4,19 (2H, т, J=6,5 Гц), 4,26 (2H, т, J=5,7 Гц), 7,15-7,19 (4H, м), 7,80 (2H, д, J=9,0 Гц), 7,80 (2H, д, J=8,3 Гц).
Пример 16
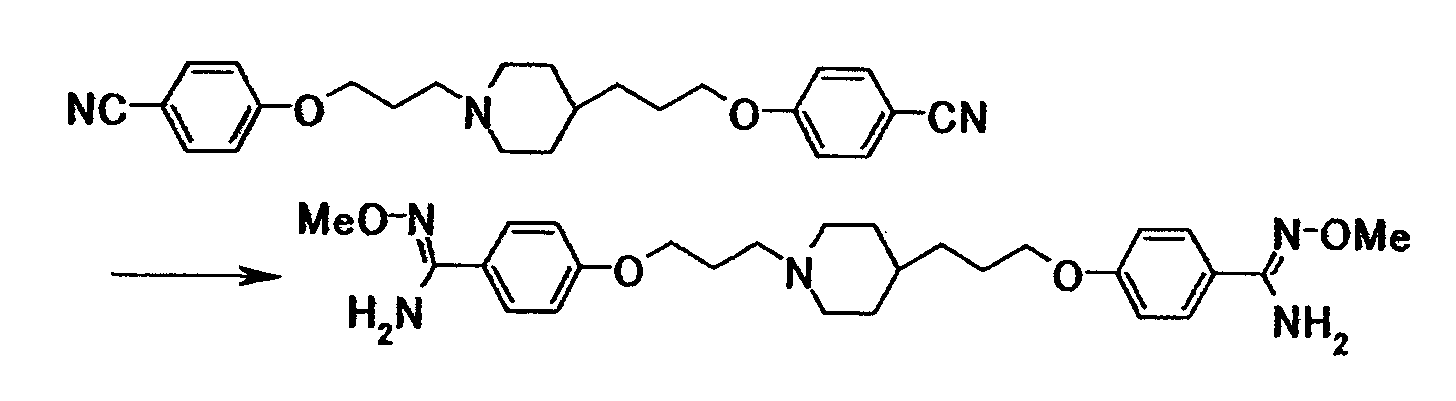
Хлористый водород вводили при охлаждении льдом в суспензию 1,00 г 4-(3-{4-[3-(4-цианофенокси)пропил]-1-пиперидинил}пропокси)бензонитрила в этаноле (20 мл), затем полученную смесь перемешивали в течение 18 часов. Растворитель отгоняли при пониженном давлении и полученный остаток растворяли в 60 мл этанола. К этому раствору добавляли 2,07 г гидрохлорида О-метилгидроксиламина, затем к смеси в течение 2 минут добавляли по каплям при охлаждении льдом 10,4 мл триэтиламина. После перемешивания при комнатной температуре в течение 18 часов реакционную смесь добавляли к смеси воды и хлороформа, полученную смесь затем доводили до pH 10 при помощи 1,0 моль/л водного раствора гидроксида натрия. Органический слой отделяли, промывали водой и затем сушили при помощи безводного сульфата натрия с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (элюент; хлороформ:метанол = 30:1), затем добавляли этанол, твердое вещество собирали фильтрованием с получением 0,99 г 4-{3-[4-(3-{4-[амино(метоксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамид О-метилоксима в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,45 (5H, м), 1,65-1,84 (4H, м), 1,88-2,04 (4H, м), 2,45-2,55 (2H, м), 2,90-2,98 (2H, м), 3,90 (6H, с), 3,96 (2H, т, J=6,6 Гц), 4,02 (2H, т, J=6,4 Гц), 4,74 (4H, с), 6,88 (2H, д, J=8,8 Гц), 6,90 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц).
Пример 17
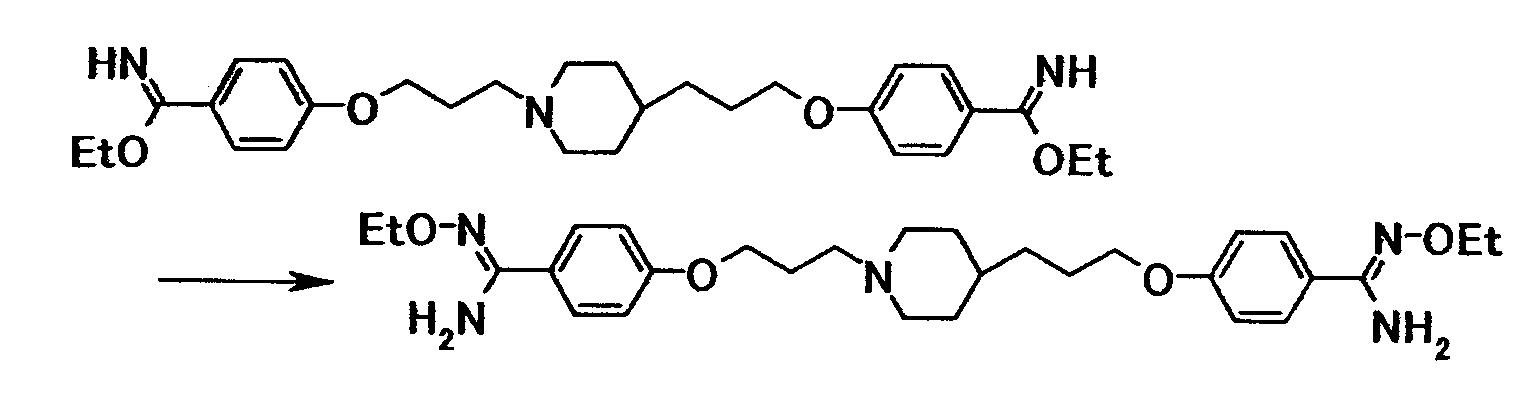
К суспензии 0,20 г этил 4-{3-[4-(3-{4-[этокси(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензимидата в этаноле (8 мл) последовательно добавляли при охлаждении льдом 0,39 г гидрохлорида O-этилгидроксиламина и 0,84 мл триэтиламина, полученную смесь затем перемешивали при комнатной температуре в течение 3,5 дней. Реакционную смесь добавляли к смеси хлороформа и воды, полученную смесь затем доводили до pH 9,7 при помощи 20% водного раствора гидроксида натрия. Органический слой отделяли, промывали водой и затем сушили при помощи безводного сульфата натрия с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (элюент; хлороформ:этанол = 20:1), с получением 0,20 г 4-{3-[4-(3-{4-[амино(этоксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамид О-этилоксима в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,45 (5H, м), 1,32 (3H, т, J=7,0 Гц), 1,32 (3H, т, J=7,0 Гц), 1,65-1,85 (4H, м), 1,85-2,05 (4H, м), 2,45-2,52 (2H, м), 2,90-3,00 (2H, м), 3,96 (2H, т, J=6,6 Гц), 4,02 (2H, т, J=6,3 Гц), 4,14 (2H, кв, J=7,0 Гц), 4,14 (2H, кв, J=7,0 Гц), 4,74 (4H, с), 6,88 (2H, д, J=8,8 Гц), 6,89 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц).
Пример 18

К суспензии 0,20 г этил 4-{3-[4-(3-{4-[этокси(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензимидата в этаноле (6 мл) при комнатной температуре добавляли 0,61 г гидрохлорида O-(2,2,2-трифторэтил)гидроксиламина и 0,84 мл триэтиламина, полученную смесь затем перемешивали при указанной температуре в течение одной недели. К реакционному раствору добавляли хлороформ и воду. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (элюент; хлороформ:этанол = 30:1), затем к смеси добавляли гексан, а затем твердое вещество собирали фильтрованием с получением 0,12 г 4-{3-[4-(3-{4-[амино(2,2,2-трифторэтоксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамид О-(2,2,2-трифторэтил)оксима в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,45 (5H, м), 1,65-2,05 (8H, м), 2,45-2,55 (2H, м), 2,90-3,00 (2H, м), 3,96 (2H, т, J=6,6 Гц), 4,03 (2H, т, J=6,2 Гц), 4,43 (2H, кв, J=8,6 Гц), 4,43 (2H, кв, J=8,6 Гц), 4,82 (4H, с), 6,89 (2H, д, J=8,8 Гц), 6,90 (2H, д, J=8,8 Гц), 7,54 (2H, д, J=8,8 Гц), 7,54 (2H, д, J=8,8 Гц).
Пример 19

К раствору 0,35 г пропионовой кислоты в N-метил-2-пирролидоне (10 мл) при комнатной температуре добавляли 0,76 г 1,1'-карбонилдиимидазола, полученную смесь затем перемешивали при указанной температуре в течение одного часа. К смеси при комнатной температуре добавляли раствор 1,00 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидоксима в N-метил-2-пирролидоне (10 мл), затем перемешивали в течение 15 часов. Реакционную смесь добавляли к смеси хлороформа и воды. Осадок собирали фильтрованием и промывали этилацетатом с получением 0,58 г 4-{3-[4-(3-{4-[амино(пропионилоксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамид О-(пропионил)оксима в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,08 (3H, т, J=7,6 Гц), 1,08 (3H, т, J=7,6 Гц), 1,10-1,40 (5H, м), 1,60-1,80 (4H, м), 1,80-1,95 (4H, м), 2,35-2,45 (2H, м), 2,45 (2H, кв, J=7,6 Гц), 2,45 (2H, кв, J=7,6 Гц), 2,80-2,90 (2H, м), 3,99 (2H, т, J=6,5 Гц), 4,04 (2H, т, J=6,3 Гц), 6,65 (4H, с), 6,95-7,00 (4H, м), 7,60-7,70 (4H, м).
Пример 20
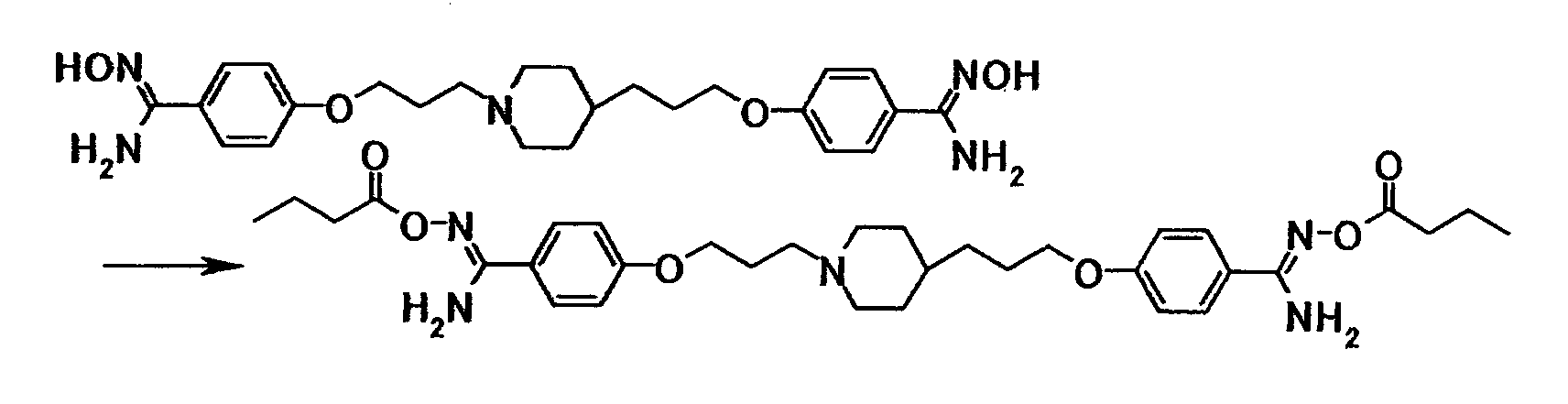
К раствору 0,42 г масляной кислоты в N-метил-2-пирролидоне (10 мл) добавляли при комнатной температуре 0,76 г 1,1'-карбонилдиимидазола, полученную смесь затем перемешивали при указанной температуре в течение одного часа. К смеси при комнатной температуре добавляли раствор 1,00 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидоксима в N-метил-2-пирролидоне (10 мл), полученную смесь затем перемешивали при указанной температуре в течение 14 часов. Реакционную смесь добавляли к смеси этилацетата и воды. Осадок собирали фильтрованием и промывали этилацетатом с получением 1,10 г 4-{3-[4-(3-{4-[амино(н-бутилоксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамид О-(бутирил)оксима в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 0,92 (3H, т, J=7,4 Гц), 0,92 (3H, т, J=7,4 Гц), 1,05-1,40 (5H, м), 1,55-1,90 (12H, м), 2,35-2,45 (2H, м), 2,42 (2H, т, J=7,3 Гц), 2,42 (2H, т, J=7,3 Гц), 2,80-2,90 (2H, м), 3,99 (2H, т, J=6,5 Гц), 4,04 (2H, т, J=6,5 Гц), 6,64 (4H, с), 6,95-7,00 (4H, м), 7,63-7,66 (4H, м).
Пример 21
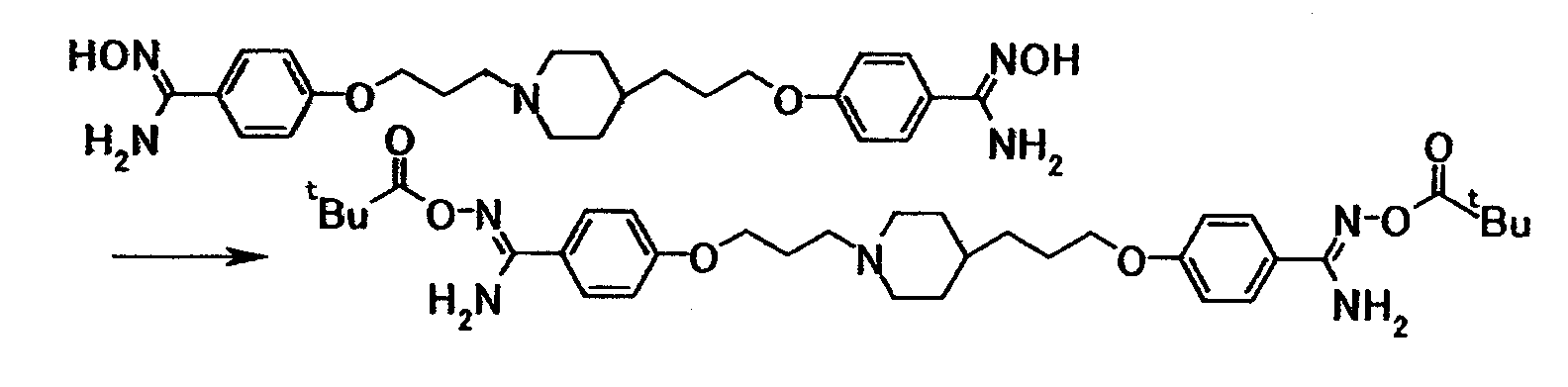
К раствору 0,47 г пивалиновой кислоты в N-метил-2-пирролидоне (10 мл) добавляли при комнатной температуре 0,76 г 1,1'-карбонилдиимидазола, полученную смесь затем перемешивали при указанной температуре в течение 1 часа и 20 минут. К смеси добавляли при комнатной температуре раствор 1,00 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидоксима в N-метил-2-пирролидоне (10 мл), полученную смесь затем перемешивали при указанной температуре в течение 2 часов. Реакционную смесь добавляли к смеси этилацетата и воды. Осадок собирали фильтрованием и промывали этилацетатом с получением 0,81 г 4-{3-[4-(3-{4-[амино(2,2-диметилпропионилоксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамид О-(2,2-диметилпропионил)оксима в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,45 (5H, м), 1,34 (9H, с), 1,34 (9H, с), 1,65-1,85 (4H, м), 1,85-2,05 (4H, м), 2,45-2,55 (2H, м), 2,90-3,00 (2H, м), 3,97 (2H, т, J=6,5 Гц), 4,04 (2H, т, J=6,5 Гц),4,92 (4H,с), 6,90 (2H, д, J=8,8 Гц), 6,91 (2H, д, J=8,8 Гц), 7,64 (2H, д, J=8,8 Гц), 7,64 (2H, д, J=8,8 Гц).
Пример 22

К раствору 0,42 г монометилсукцината в N-метил-2-пирролидоне (5 мл) добавляли при комнатной температуре 0,52 г 1,1'-карбонилдиимидазола, полученную смесь затем перемешивали при указанной температуре в течение 2 часов. К смеси добавляли при комнатной температуре раствор 0,50 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидоксима в N-метил-2-пирролидоне (10 мл), полученную смесь затем перемешивали при указанной температуре в течение 3 часов. Реакционную смесь добавляли к смеси этилацетата и воды. Нерастворимое вещество отфильтровывали с последующим доведением до pH 7,0 при помощи 5 моль/л водного раствора гидроксида натрия, а затем добавляли насыщенный водный раствор хлорида натрия. Органический слой отделяли и сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. К полученному остатку добавляли этилацетат и воду. Органический слой отделяли, промывали водой и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток суспендировали в диизопропиловом эфире и твердое вещество собирали фильтрованием и промывали этилацетатом и диизопропиловым эфиром с получением 0,24 г 4-(3-{4-[3-(4-{амино[(4-метокси-4-оксобутилил)оксиимино]метил}фенокси)пропил]-1-пиперидинил}пропокси)бензамид О-[(4-метокси-4-оксо)бутилил]оксима в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,45 (5H, м), 1,65-2,05 (8H, м), 2,45-2,55 (2H, м), 2,70-2,80 (4H, м), 2,80-2,90 (4H, м), 2,90-3,00 (2H, м), 3,71 (3H, с), 3,71 (3H, с), 3,97 (2H, т, J=6,6 Гц), 4,04 (2H, т, J=6,3 Гц), 5,00-5,20 (4H, ушир), 6,90 (2H, д, J=8,7 Гц), 6,91 (2H, д, J=8,7 Гц), 7,63 (2H, д, J=8,7 Гц), 7,63 (2H, д, J=8,7 Гц).
Пример 23
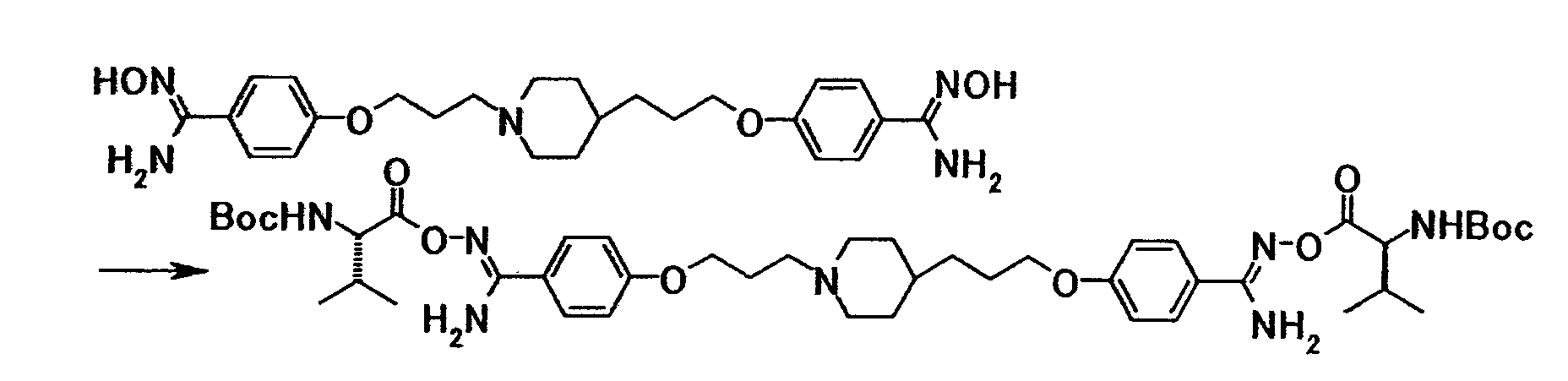
К раствору 0,23 г N-(трет-бутоксикарбонил)-L-валина в N-метил-2-пирролидоне (4 мл) добавляли при комнатной температуре 0,18 г 1,1'-карбонилдиимидазола, полученную смесь затем перемешивали при указанной температуре в течение 3 часов. К смеси добавляли при комнатной температуре раствор 0,25 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидоксима в N-метил-2-пирролидоне (6 мл), затем смесь перемешивали при указанной температуре в течение 18 часов. Реакционную смесь добавляли к смеси этилацетата и воды. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток суспендировали в диизопропиловом эфире и твердое вещество собирали фильтрованием и очищали, используя колоночную хроматографию на силикагеле (элюент; хлороформ:метанол = 20:1), с получением 0,27 г 4-(3-{4-[3-(4-{амино[(2S)-2-(трет-бутоксикарбонил)амино-3-метилбутилилоксиимино]метил}фенокси)пропил]-1-пиперидинил}пропокси)бензамид О-[(2)-2-(трет-бутоксикарбонил)амино-3-метилбутилил]оксима в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 0,90 (6H, д, J=6,8 Гц), 0,90 (6H, д, J=6,8 Гц), 1,05-1,45 (5H, м), 1,41 (9H, с), 1,41 (9H, с), 1,60-1,95 (8H, м), 2,00-2,10 (2H, м), 2,35-2,45 (2H, м), 2,80-2,90 (2H, м), 3,95-4,10 (6H, м), 6,65-6,85 (4H, ушир), 6,97-7,00 (4H, м), 7,30-7,40 (2H, ушир), 7,60-7,70 (4H, м).
Пример 24
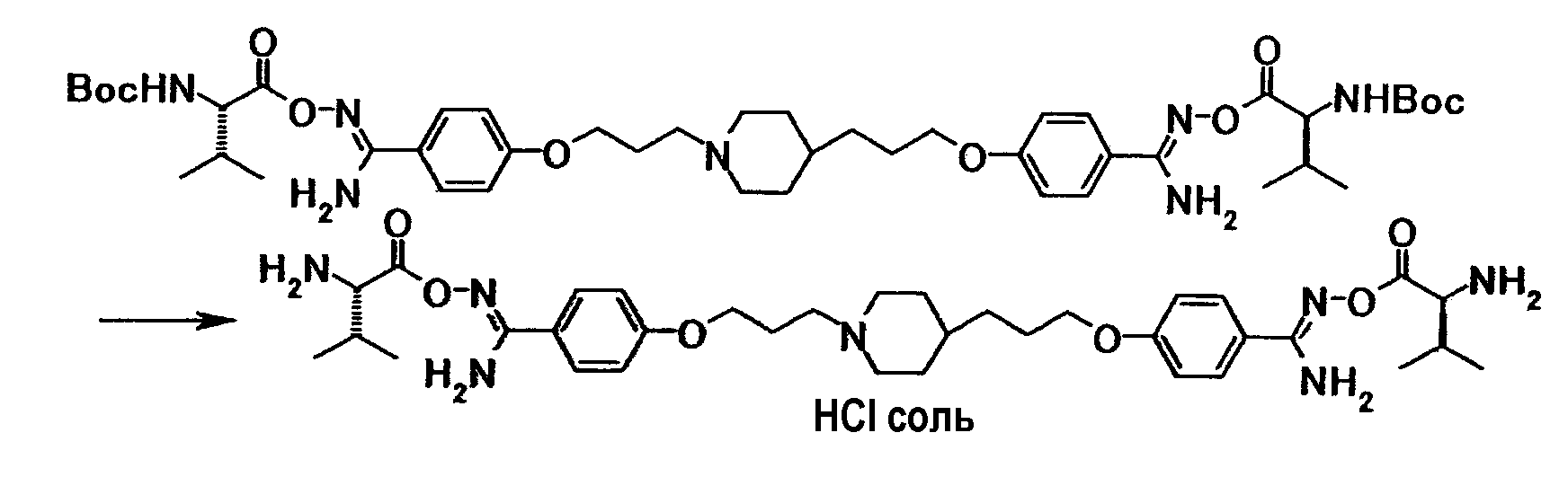
К раствору 0,10 г 4-(3-{4-[3-(4-{амино[(2S)-2-(трет-бутоксикарбонил)амино-3-метилбутилилоксиимино]метил}фенокси)пропил]-1-пиперидинил}пропокси)бензамид О-[(2S)-2-(трет-бутоксикарбонил)амино-3-метилбутилил]оксима в этаноле (2 мл) добавляли при комнатной температуре 5 мл раствора 2,9 моль/л хлористый водород/этанол, полученную смесь затем перемешивали в течение 30 минут. Растворитель отгоняли при пониженном давлении и полученный остаток суспендировали в диизопропиловом эфире, затем твердое вещество собирали фильтрованием, после чего промывали диизопропиловым эфиром с получением 80 мг гидрохлорида 4-{3-[4-(3-{4-[амино((2S)-2-амино-3-метилбутилилоксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамид О-((2S)-2-амино-3-метилбутилил)оксима в виде бледно-желтого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,00-1,07 (12H, м), 1,30-1,95 (9H, м), 2,10-2,35 (4H, м), 2,30-2,50 (2H, м), 2,80-3,00 (2H, м), 3,10-3,25 (2H, м), 3,90-4,15 (6H, м), 6,90-7,20 (8H, м), 7,65-7,75 (4H, м), 8,60-8,80 (4H, ушир).
Пример 25
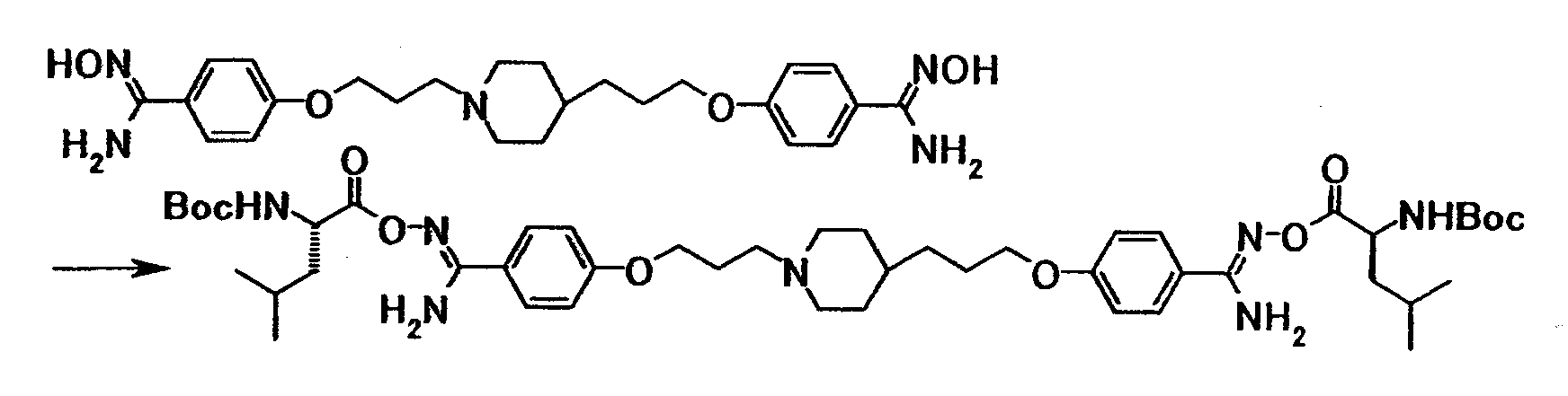
К раствору 0,23 г моногидрата N-(трет-бутоксикарбонил)-L-лейцина в N-метил-2-пирролидоне (5 мл) добавляли при комнатной температуре 0,34 г 1,1'-карбонилдиимидазола, полученную смесь затем перемешивали при указанной температуре в течение 1 часа и 30 минут. К смеси добавляли при комнатной температуре раствор 0,20 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидоксима в N-метил-2-пирролидоне (5 мл), полученную смесь затем перемешивали при указанной температуре в течение 5 часов. Реакционную смесь добавляли к смеси этилацетата и воды. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (элюент; хлороформ:метанол = 10:1), с получением 0,14 г 4-(3-{4-[3-(4-{амино[(2S)-2-(трет-бутоксикарбонил) амино-4-метилпентаноилоксиимино]метил}фенокси)пропил]-1-пиперидинил}пропокси)бензамид О-[(2S)-2(трет-бутоксикарбонил)амино-4-метилпентаноил]оксима в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 0,97 (3H, д, J=5,9 Гц), 0,97 (3H, д, J=5,9 Гц), 0,99 (3H, д, J=6,1 Гц), 0,99 (3H, д, J=6,1 Гц), 1,25-1,90 (15H, м), 1,45 (9H, с), 1,45 (9H, с), 1,95-2,15 (4H, м), 2,55-2,65 (2H, м), 3,00-3,10 (2H, м), 3,97 (2H, т, J=6,3 Гц), 4,04 (2H, т, J=6,3 Гц), 4,40-4,50 (2H, м), 4,95-5,05 (2H, м), 5,15-5,35 (4H, ушир), 6,88-6,91 (4H, м), 7,63 (4H, д, J=8,4 Гц).
Пример 26
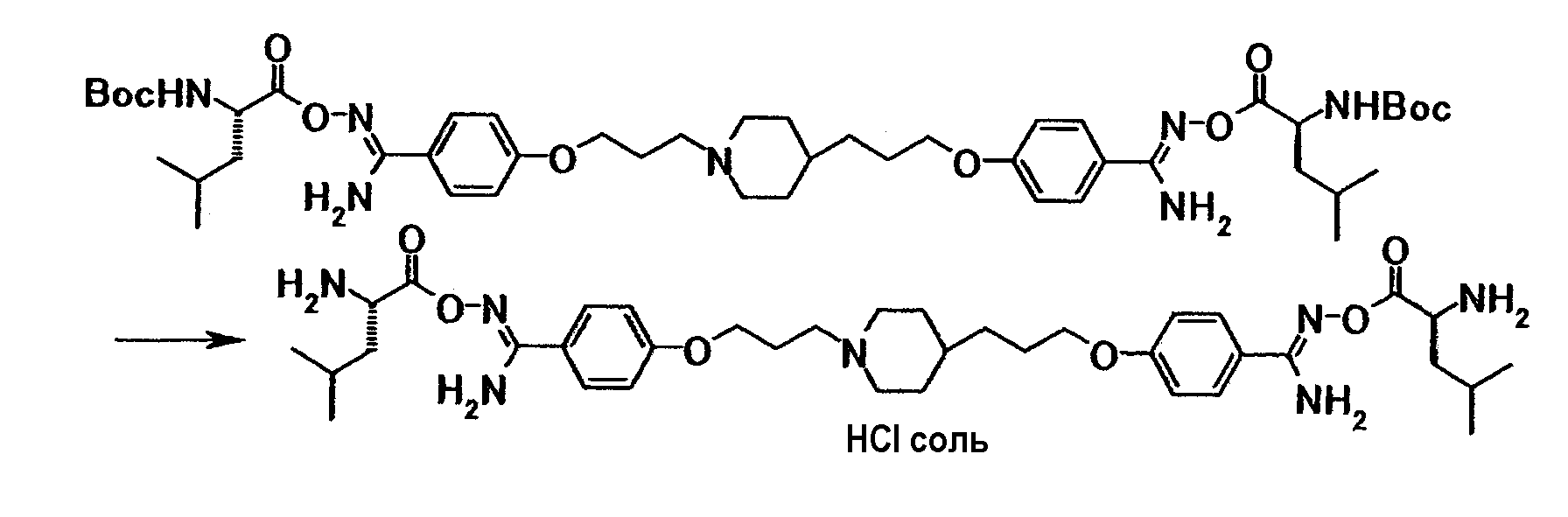
К раствору 0,10 г 4-(3-{4-[3-(4-{амино[(2S)-2-(трет-бутоксикарбонил)амино-4-метилпентаноилоксиимино]метил}фенокси)пропил]-1-пиперидинил}пропокси)бензамид О-[(2S)-2-(трет-бутоксикарбонил)амино-4-метилпентаноил]оксима в хлороформе (5,0 мл) добавляли при охлаждении льдом 20 мкл трифторуксусной кислоты, полученную смесь затем перемешивали при комнатной температуре в течение 2 часов и 10 минут. К реакционной смеси добавляли 0,1 мл трифторуксусной кислоты, затем перемешивали в течение 21 часа. К смеси добавляли 1 мл трифторуксусной кислоты и затем перемешивали в течение 3 часов. Растворитель отгоняли при пониженном давлении и добавляли раствор 2,9 моль/л хлористый водород/этанол с последующей отгонкой растворителя при пониженном давлении. Полученное твердое вещество суспендировали в диизопропиловом эфире, затем твердое вещество собирали фильтрованием, а затем промывали диизопропиловым эфиром с получением 0,04 г гидрохлорида 4-{3-[4-(3-{4-[амино((2S)-2-амино-4-метилпентаноилокси)имино]метил}фенокси)пропил]-1-пиперидинил]пропокси}бензамид О-((2S)-2-амино-4-метилпентаноил)оксима в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 0,90 (3H, д, J=6,6 Гц), 0,90 (3H, д, J=6,6 Гц), 0,91 (3H, д, J=6,3 Гц), 0,91 (3H, д, J=6,3 Гц), 1,30-1,45 (2H, м), 1,50-1,95 (15H, м), 2,20-2,30 (2H, м), 2,80-2,95 (2H, м), 3,10-3,20 (2H, м), 3,75-4,30 (6H, м), 7,10-7,20 (4H, м), 7,65-7,80 (4H, м), 8,25-8,40 (2H, ушир), 8,40-8,60 (4H, ушир), 11,05-11,20 (2H, ушир).
Пример 27

К раствору 0,65 г N-(трет-бутоксикарбонил)-L-изолейцина 1/2-гидрата в N-метил-2-пирролидоне (10 мл) добавляли при комнатной температуре 1,14 г 1,1'-карбонилдиимидазола, полученную смесь затем перемешивали при указанной температуре в течение 1 часа и 30 минут. К смеси добавляли при комнатной температуре раствор 1,00 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидоксима в N-метил-2-пирролидоне (15 мл), затем полученную смесь перемешивали при указанной температуре в течение 2 дней. Реакционную смесь добавляли к смеси этилацетата и воды и нерастворимое вещество отфильтровывали. Органический слой отделяли, промывали водой и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле (элюент; хлороформ:метанол = 30:1) и полученное твердое вещество суспендировали в диизопропиловом эфире, затем твердое вещество собирали фильтрованием, а затем промывали диизопропиловым эфиром с получением 0,38 г 4-(3-{4-[3-(4-{амино[(2S,3S)-2-(трет-бутоксикарбонил)амино-3-метилпентаноилоксиимино]метил}фенокси)пропил]-1-пиперидинил}пропокси)бензамид О-[(2S,3S)-2-(трет-бутоксикарбонил)амино-3-метилпентаноил]оксима в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 0,95 (3H, т, J=7,4 Гц), 0,95 (3H, т, J=7,4 Гц), 1,02 (3H, д, J=6,8 Гц), 1,02 (3H, д, J=6,8 Гц), 1,15-1,50 (7H, м), 1,45 (9H, с), 1,45 (9H, с), 1,50-2,20 (12H, м), 2,60-2,70 (2H, м), 3,05-3,20 (2H, м), 3,97 (2H, т, J=6,5 Гц), 4,04 (2H, т, J=6,2 Гц), 4,25-4,40 (2H, м), 5,10-5,25 (4H, м), 6,85-6,95 (4H, м), 7,60-7,65 (4Н, м).
Пример 28
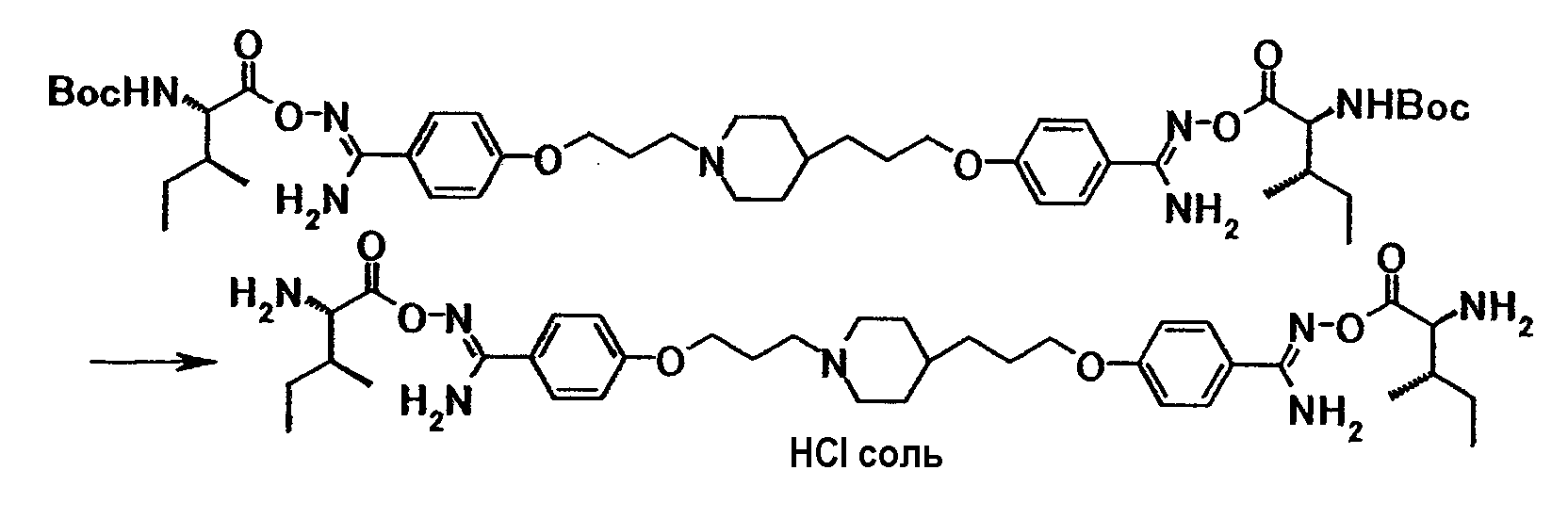
К раствору 0,20 г 4-(3-{4-[3-(4-{амино[(2S,3S)-2-(трет-бутоксикарбонил)амино-3-метилпентаноилоксиимино]метил}фенокси)пропил]-1-пиперидинил}пропокси)бензамид О-[(2S,3S)-2(трет-бутоксикарбонил)амино-3-метилпентаноил]оксима в этаноле (5 мл) добавляли при комнатной температуре 2 мл раствора 2,9 моль/л хлористый водород/этанол, полученную смесь затем перемешивали при указанной температуре в течение 5 часов. К смеси добавляли 2 мл раствора 2,9 моль/л хлористый водород/этанол, полученную смесь затем перемешивали в течение 26 часов. К смеси добавляли 1 мл раствор 2,9 моль/л хлористый водород/этанол, затем смесь перемешивали в течение 3 дней. Растворитель отгоняли при пониженном давлении и полученное твердое вещество суспендировали в диизопропиловом эфире, затем твердое вещество собирали фильтрованием, а затем промывали диизопропиловым эфиром с получением 0,13 г гидрохлорида 4-{3-[4-(3-{4-[амино((2S,3S)-2-амино-3-метилпентаноилоксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамид О-((2S,3S)-2-амино-3-метилпентаноил)оксима в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 0,85-0,95 (6H, м), 0,99 (3H, д, J=6,8 Гц), 0,99 (2H, д, J=6,8 Гц), 1,20-2,10 (17H, м), 2,15-2,30 (2H, м), 2,80-2,95 (2H, м), 3,10-3,20 (2H, м), 3,95-4,30 (6H, м), 6,95-7,05 (4H, м), 7,05-7,20 (4H, м), 7,65-7,75 (4H, м), 8,50-8,60 (2H, ушир), 8,75-8,90 (6H, ушир).
Пример 29
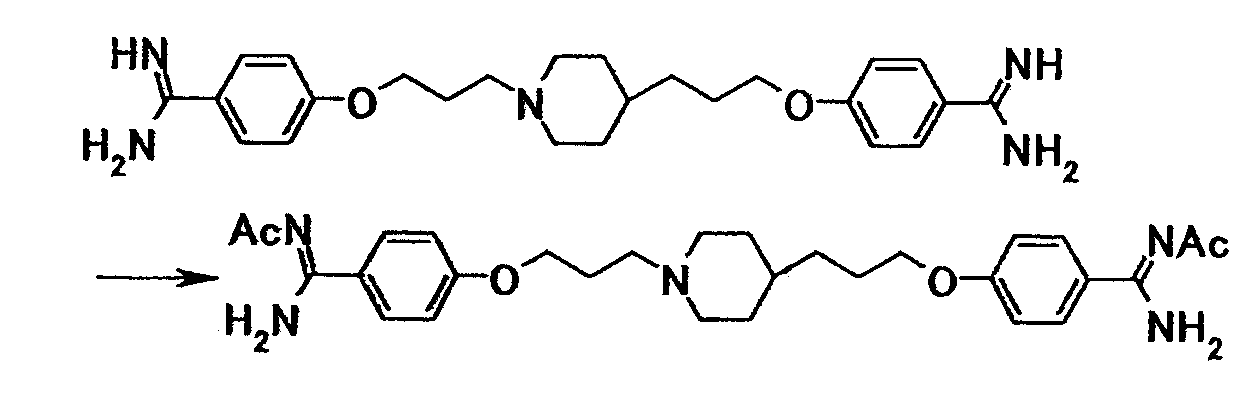
К суспензии 1,00 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина в N,N-диметилформамиде (10 мл) добавляли при комнатной температуре 4-нитрофенилацетат, полученную смесь затем перемешивали при указанной температуре в течение 1 часа и 15 минут. К реакционной смеси добавляли хлороформ и 5% водный раствор карбоната калия и нерастворимое вещество отфильтровывали. Органический слой отделяли, промывали последовательно 5% водным раствором карбоната калия и насыщенным водным раствором хлорида натрия и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. К полученному остатку добавляли этилацетат и воду, полученную смесь затем доводили до pH 3,0 при помощи хлористоводородной кислоты. Водный слой отделяли и промывали этилацетатом, полученную смесь затем доводили до pH 12,0 при помощи водного раствора гидроксида натрия. Осадок собирали фильтрованием с получением 0,80 г N'-ацетил-4-{3-[4-(3-{4-[(ацетилимино)(амино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,00-1,40 (5H, м), 1,60-1,90 (8H, м), 2,09 (3H, с), 2,09 (3H, с), 2,35-2,45 (2H, м), 2,80-2,85 (2H, м), 4,02 (2H, т, J=6,3 Гц), 4,07 (2H, т, J=6,3 Гц), 6,90-7,10 (4H, м), 7,95-8,05 (4H, м).
Пример 30
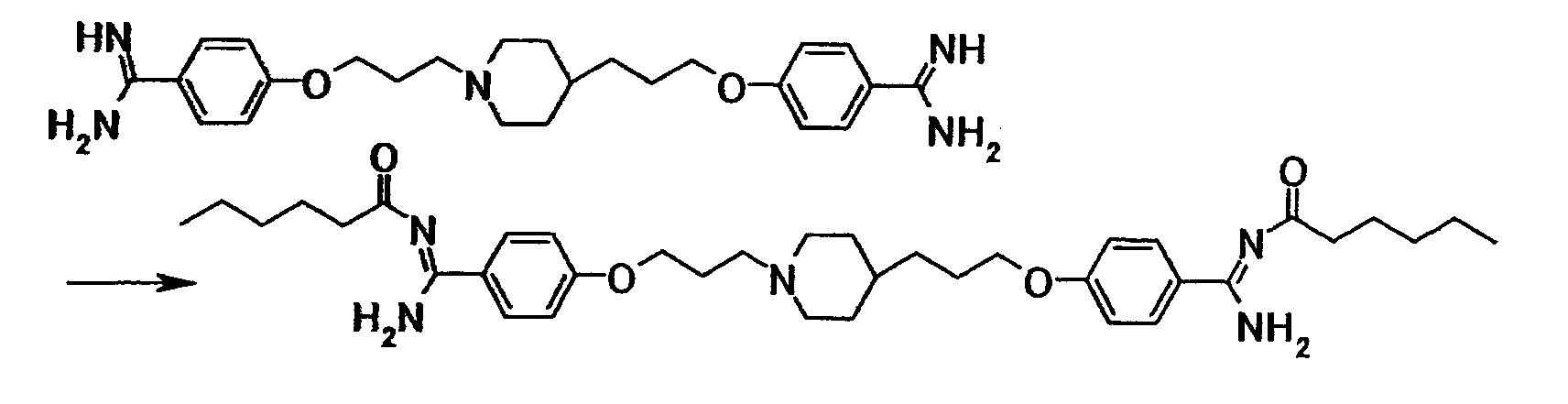
Как описано в примере 29, получали 0,62 г 4-{3-[4-(3-{4-[амино(гексаноилимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}-N'-(гексаноил)бензамидина в виде белого твердого вещества исходя из 0,50 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина и 0,68 г 4-нитрофенилгексаноата.
1Н-ЯМР (CDCl3) значение δ: 0,91 (3H, т, J=6,7 Гц), 0,91 (3H, т, J=6,7 Гц), 1,20-1,45 (13H, м), 1,65-2,05 (12H, м), 2,45-2,55 (2H, м), 2,54 (2H, т, J=7,5 Гц), 2,54 (2H, т, J=7,5 Гц), 2,90-3,00 (2H, м), 4,00 (2H, т, J=6,5 Гц), 4,06 (2H, т, J=6,3 Гц), 6,93 (2H, д, J=8,7 Гц), 6,94 (2H, д, J=8,7 Гц), 7,84 (2H, д, J=8,7 Гц), 7,84 (2H, д, J=8,7 Гц).
Пример 31
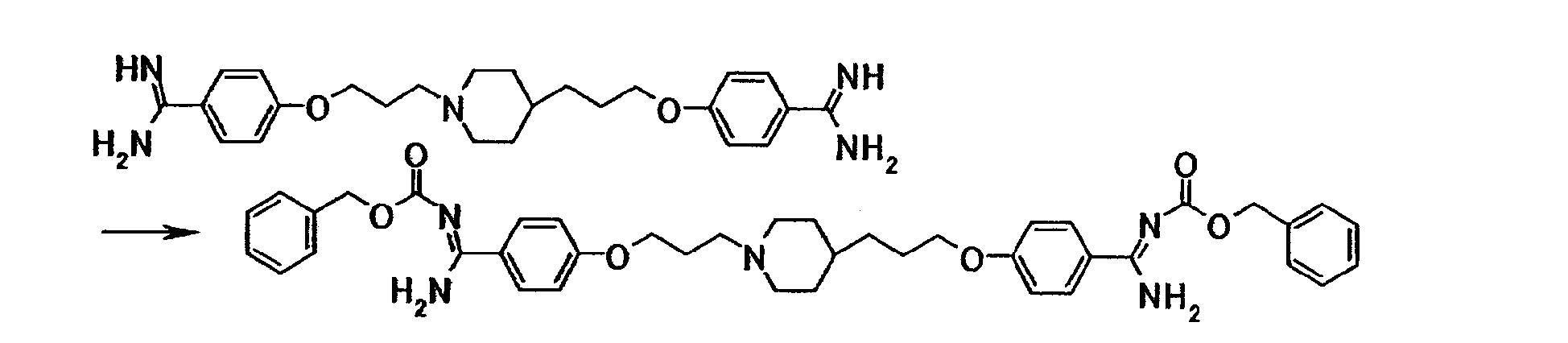
К суспензии 0,50 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина в N,N-диметилформамиде (10 мл) добавляли при комнатной температуре 0,78 г бензил-4-нитрофенилкарбоната, полученную смесь затем перемешивали при указанной температуре в течение 50 минут. К реакционной смеси добавляли хлороформ и воду. Органический слой отделяли, промывали последовательно 5% водным раствором карбоната калия и насыщенным водным раствором хлорида натрия, затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (элюент; хлороформ:метанол = 4:1), с получением 0,67 г 4-{3-[4-(3-{4-[амино-(бензилоксикарбонилимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}-N'-(бензилоксикарбонил)бензамидина в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,45 (5H, м), 1,65-2,05 (8H, м), 2,45-2,55 (2H, м), 2,85-3,00 (2H, м), 3,99 (2H, т, J=6,6 Гц), 4,06 (2H, т, J=6,3 Гц), 5,21 (2H, с), 5,21 (2H, с), 6,91 (2H, д, J=8,7 Гц), 6,93 (2H, д, J=8,7 Гц), 7,20-7,50 (10H, м), 7,85 (2H, д, J=8,7 Гц), 7,85 (2H, д, J=8,7 Гц).
Пример 32
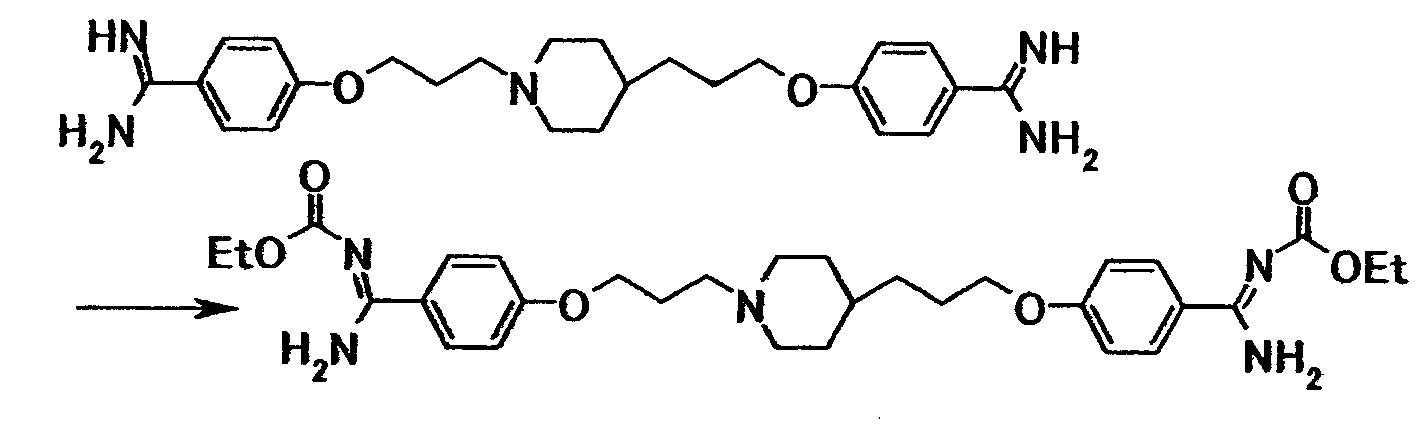
К суспензии 0,50 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина в N,N-диметилформамиде (10 мл) добавляли при комнатной температуре 0,60 г этил-4-нитрофенилкарбоната, полученную смесь затем перемешивали при указанной температуре в течение 2 часов и 30 минут. К реакционной смеси добавляли хлороформ и воду. Органический слой отделяли, промывали последовательно водой, 5% водным раствором карбоната калия и насыщенным водным раствором хлорида натрия, затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле (элюент; хлороформ:этанол = 4:1) с получением 0,58 г 4-{3-[4-(3-{4-[амино(этоксикарбонилимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}-N'-(этоксикарбонил}бензамидина в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,45 (5H, м), 1,36 (3H, т, J=7,1 Гц), 1,36 (3H, т, J=7,1 Гц), 1,65-2,05 (8H, м), 2,45-2,55 (2H, м), 2,90-3,00 (2H, м), 4,00 (2H, т, J=6,5 Гц), 4,06 (2H, т, J=6,3 Гц), 4,22 (2H, кв, J=7,1 Гц), 4,22 (2H, кв, J=7,1 Гц), 6,92 (2H, д, J=8,8 Гц), 6,93 (2H, д, J=8,8 Гц), 7,86 (2H, д, J=8,8 Гц), 7,86 (2H, д, J=8,8 Гц).
Пример 33

Как описано в примере 31, получали 0,23 г 4-{3-[4-(3-{4-[амино(пентилоксикарбонилимино)метил]фенокси}пропил)-1-пиперидинил}пропокси}-N'-(пентилоксикарбонил)бензамидина в виде белого твердого вещества, исходя из 0,50 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина и 1,20 г 4-нитрофенил-пентилкарбоната.
1Н-ЯМР (CDCl3) значение δ: 0,91 (3H, т, J=7,1 Гц), 0,91 (3H, т, J=7,1 Гц), 1,20-2,05 (25H, м), 2,45-2,55 (2H, м), 2,90-3,00 (2H, м), 3,99 (2H, т, J=6,6 Гц), 4,06 (2H, т, J=6,6 Гц), 4,15 (2H, т, J=6,8 Гц), 4,15 (2H, т, J=6,8 Гц), 6,92 (2H, д, J=8,6 Гц), 6,93 (2H, д, J=8,6 Гц), 7,85 (2H, д, J=8,6 Гц), 7,85 (2H, д, J=8,6 Гц).
Пример 34
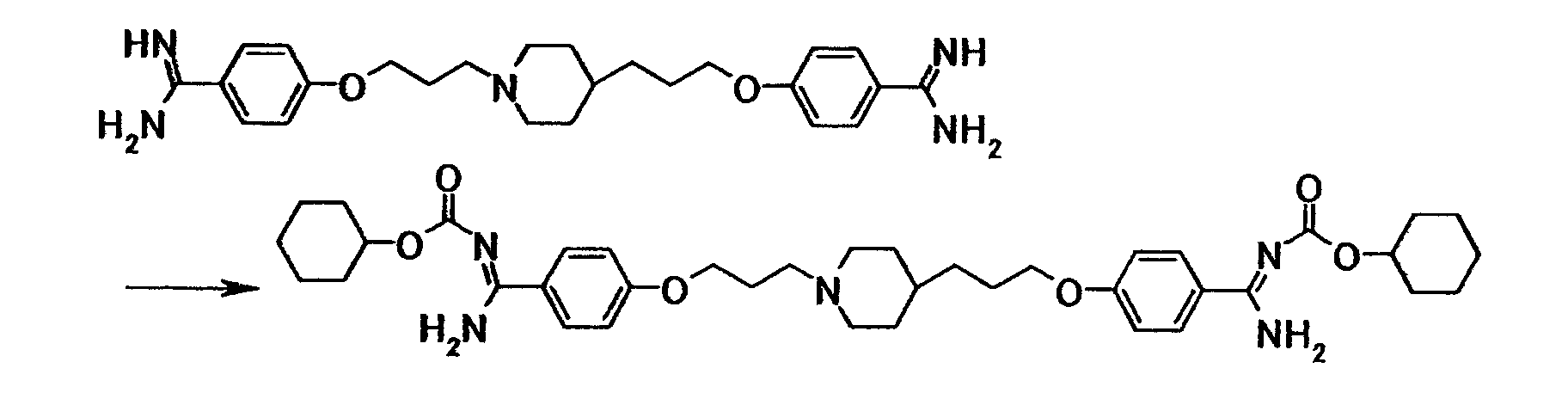
Как описано в примере 31, получали 0,33 г 4-{3-[4-(3-{4-[амино(циклогексилоксикарбонилимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}-N'-(циклогексилоксикарбонил)бензамидина в виде белого твердого вещества исходя из 0,50 г 4-{3-[4-(3-{4-[амино(имино)метил}фенокси}пропил)-1-пиперидинил]пропокси}бензамидина и 0,76 г циклогексил-4-нитрофенилкарбоната.
1Н-ЯМР (CDCl3) значение δ: 1,15-2,10 (33H, м), 2,45-2,55 (2H, м), 2,90-3,00 (2H, м), 3,99 (2H, т, J=6,5 Гц), 4,06 (2H, т, J=6,3 Гц), 4,60-4,75 (2H, м), 6,91 (2Н, д, J=8,8 Гц), 6,92 (2H, д, J=8,8 Гц), 7,85 (2H, д, J=8,8 Гц), 7,85 (2H, д, J=8,8 Гц).
Пример 35

Как описано в примере 31, получали 0,72 г 4-{3-[4-(3-{4-[амино(2,2,2-трихлорэтоксикарбонилимино)метил]фенокси}пропил)-1-пиперидинил}пропокси}-N'-(2,2,2-трихлорэтоксикарбонил)бензамидина в виде белого твердого вещества исходя из 0,50 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина и 0,90 г 4-нитрофенил-2,2,2-трихлорэтилкарбоната.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,45 (5H, м), 1,65-2,05 (8H, м), 2,45-2,55 (2H, м), 2,90-3,00 (2H, м), 4,01 (2H, т, J=6,5 Гц), 4,08 (2H, т, J=6,3 Гц), 4,87 (2H, с), 4,87 (2H, с), 6,94 (2H, д, J=8,8 Гц), 6,95 (2H, д, J=8,8 Гц), 7,89 (2H, д, J=8,8 Гц), 7,90 (2H, д, J=8,8 Гц).
Пример 36
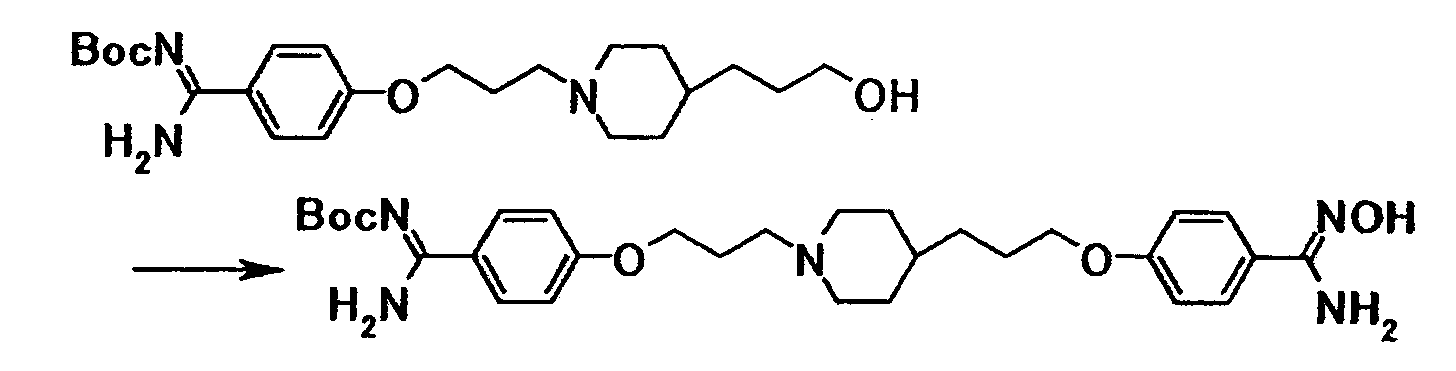
К раствору 2,17 г трет-бутил[1-амино-1-(4-{3-[4-(3-гидроксипропил)-1-пиперидинил]пропокси}фенил)метилиден]карбамата в хлороформе (20 мл) добавляли при комнатной температуре 0,86 мл триэтиламина, к полученной смеси добавляли по каплям при охлаждении льдом 0,48 мл метансульфонилхлорида с последующим перемешиванием при комнатной температуре в течение одного часа. К этой смеси добавляли при охлаждении льдом 0,36 мл триэтиламина и 0,20 мл метансульфонилхлорида, полученную смесь затем перемешивали при комнатной температуре в течение 50 минут. К реакционной смеси добавляли воду. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия, затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток растворяли в 20 мл диметилсульфоксида, к смеси добавляли 1,43 г карбоната калия и 0,79 г N',4-дигидроксибензамидина с последующим перемешиванием при 70°C в течение одного часа. Реакционную смесь охлаждали до комнатной температуры, затем к полученной смеси добавляли воду, хлороформ и водный раствор гидроксида натрия. Органический слой отделяли, последовательно промывали водным раствором гидроксида натрия и насыщенным водным раствором хлорида натрия, затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (элюент; хлороформ:метанол = 4:1), и суспендировали в смеси хлороформа и водного раствора гидроксида натрия, затем твердое вещество собирали фильтрованием с получением 0,38 г трет-бутил[1-амино-1-(4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}фенил)метилиден]карбамата в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,05-1,40 (5H, м), 1,44 (9H, с), 1,60-1,80 (4H, м), 1,80-1,95 (4H, м), 2,35-2,45 (2H, м), 2,80-2,90 (2H, м), 3,96 (2H, т, J=6,6 Гц), 4,06 (2H, т, J=6,3 Гц), 5,70 (2H, с), 6,90 (2H, д, J=8,8 Гц), 6,98 (2H, д, J=8,8 Гц), 7,58 (2H, д, J=8,8 Гц), 7,94 (2H, д, J=8,8 Гц), 8,70-9,30 (2H, ушир), 9,43 (1H, с).
Пример 37
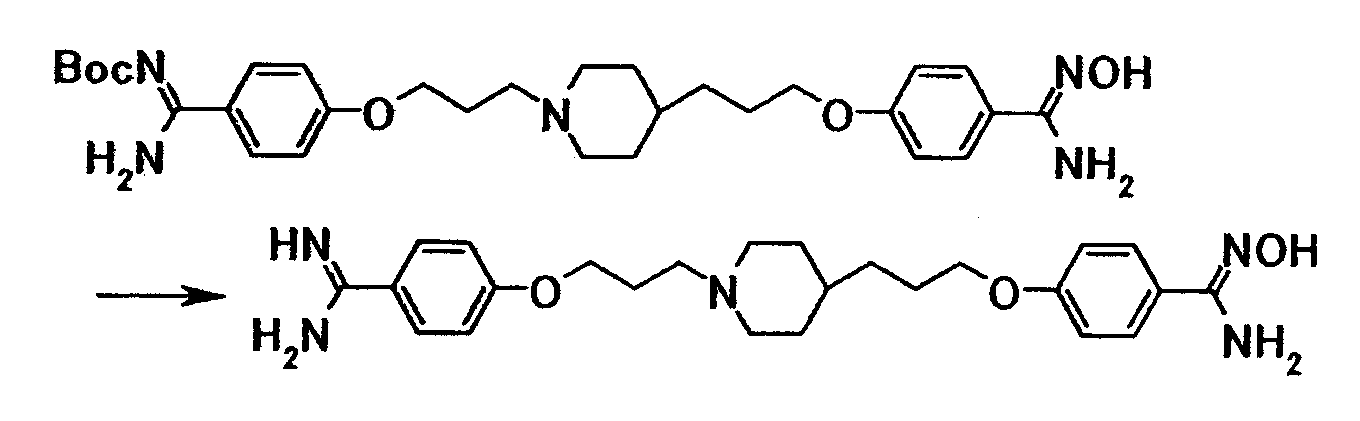
К суспензии 0,30 г трет-бутил[1-амино-1-(4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}фенил)метилиден]карбамата в этаноле (5 мл) добавляли при комнатной температуре 5 мл хлористоводородной кислоты, затем смесь перемешивали при указанной температуре в течение 15 часов. Растворитель отгоняли при пониженном давлении и затем к полученному остатку добавляли воду, затем полученную смесь доводили до pH 12,5 при помощи 1 моль/л водного раствора гидроксида натрия. Осадок собирали фильтрованием и промывали водой с получением 0,22 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,05-1,40, (5H, м), 1,60-1,90 (8H, м), 2,35-2,45 (2H, м), 2,80-2,90 (2H, м), 3,96 (2H, т, J=6,3 Гц), 4,02 (2H, т, J=6,2 Гц), 5,70 (2H, с), 6,85-6,95 (4H, м), 7,58 (2H, д, J=8,8 Гц), 7,71 (2H, д, J=8,5 Гц).
Пример 38
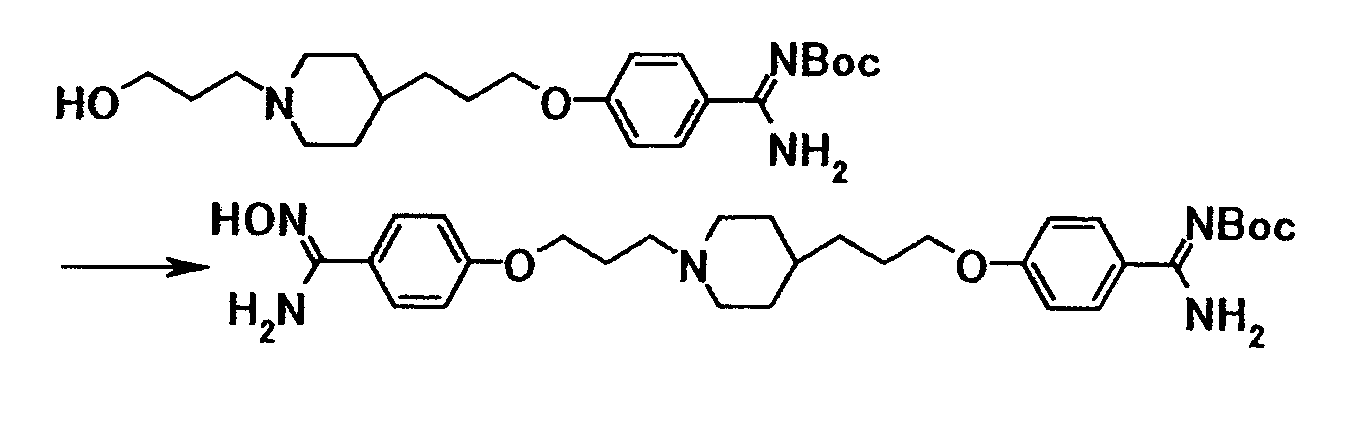
К суспензии 1,59 г трет-бутил[1-амино-1-(4-{3-[1-(3-гидроксипропил)-4-пиперидинил]пропокси}фенил)метилиден]карбамата в тетрагидрофуране (20 мл) добавляли при комнатной температуре 10 мл метиленхлорида и 0,63 мл триэтиламина. К полученной смеси добавляли по каплям при охлаждении льдом 0,35 мл метансульфонилхлорида, затем смесь перемешивали при комнатной температуре в течение 20 минут. К реакционной смеси добавляли хлороформ и воду. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток растворяли в 20 мл N,N-диметилформамида, затем к полученной смеси добавляли 1,05 г карбоната калия и 0,58 г N',4-дигидроксибензамидина с последующим перемешиванием при температуре от 60 до 70°C в течение одного часа. Реакционную смесь охлаждали до комнатной температуры, затем к полученной смеси добавляли хлороформ и воду, а затем осадок собирали фильтрованием с получением 2,23 г трет-бутил[1-амино-1-(4-{3-[1-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-4-пиперидинил]пропокси}фенил}метилиден]карбамата в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,00-1,50 (5H, м), 1,44 (9H, с), 1,60-1,90 (8H, м), 2,35-2,55 (2H, м), 2,80-2,90 (2H, м), 3,95-4,05 (4H, м), 5,70 (2H, с), 6,90 (2H, д, J=8,8 Гц), 6,98 (2H, д, J=8,8 Гц), 7,58 (2H, д, J=8,8 Гц), 7,93 (2H, д, J=8,8 Гц), 8,60-9,40 (2H, ушир), 9,43 (1H, с).
Пример 39

К суспензии 0,50 г трет-бутил[1-амино-1-(4-{3-[1-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-4-пиперидинил]пропокси}фенил)метилиден]карбамата в этаноле (5 мл) добавляли при комнатной температуре 1 мл хлористоводородной кислоты, полученную смесь затем перемешивали при указанной температуре в течение 15 часов и 30 минут. К реакционной смеси добавляли при комнатной температуре 4 мл хлористоводородной кислоты, затем смесь перемешивали при указанной температуре в течение 2 часов и 30 минут. Растворитель отгоняли при пониженном давлении и затем добавляли воду с последующим доведением до pH 12,5 при помощи 5 моль/л водного раствора гидроксида натрия. Осадок собирали фильтрованием и промывали водой. Полученное твердое вещество растворяли в 1 моль/л хлористоводородной кислоте с последующей отгонкой растворителя при пониженном давлении, а затем очисткой при помощи колоночной хроматографии на силикагеле (силикагель: ODS-A от YMC, элюент; вода:этанол = 95:5). Элюат концентрировали до около 20 мл, полученную смесь затем доводили до pH 12 при помощи 5 моль/л водного раствора гидроксида натрия. Осадок собирали фильтрованием и промывали водой с получением 0,17 г 4-{3-[4-(3-[4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}-N'-гидроксибензамидина в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,05-1,40 (5H, м), 1,60-1,85 (8H, м), 2,35-2,45 (2H, м), 2,80-2,90 (2H, м), 3,95-4,05 (4H, м), 5,70 (2H, с), 6,90 (2H, д, J=8,7 Гц), 6,91 (2H, д, J=8,7 Гц), 7,58 (2H, д, J=8,7 Гц), 7,71 (2H, д, J=8,7 Гц).
Пример 40

К раствору 1,06 г бензил[1-амино-1-(4-{3-[1-(3-гидроксипропил)-4-пиперидинил]пропокси}фенил)метилиден]карбамата в тетрагидрофуране (10 мл) добавляли при охлаждении льдом 0,39 мл триэтиламина. К смеси добавляли по каплям 0,22 мл метансульфонилхлорида, затем смесь перемешивали при указанной температуре в течение 15 минут. К реакционной смеси добавляли хлороформ и воду. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия, затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток растворяли в 20 мл N,N-диметилформамида, к смеси затем добавляли 0,36 г N',4-дигидроксибензамидина и 0,65 г карбоната калия с последующим перемешиванием при 60°C в течение 40 минут. Реакционную смесь охлаждали до комнатной температуры, затем к полученной смеси добавляли этилацетат и 5% водный раствор карбоната калия. Осадок собирали фильтрованием и промывали последовательно водой и этилацетатом с получением 0,55 г бензил[1-амино-1-(4-{3-[1-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-4-пиперидинил]пропокси}фенил)метилиден]карбамата в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,05-1,40 (5H, м), 1,60-1,90 (8H, м), 2,30-2,45 (2H, м), 2,80-2,90 (2H, м), 3,95-4,05 (4H, м), 5,09 (2H, с), 5,70 (2H, с), 6,90 (2H, д, J=8,9 Гц), 7,00 (2H, д, J=8,9 Гц), 7,25-4,45 (5H, м), 7,58 (2H, д, J=8,9 Гц), 7,97 (2H, д, J=8,9 Гц), 8,90-9,60 (3H, ушир).
Пример 41

К раствору 89 мг N-(трет-бутоксикарбонил)-L-валина в N,N-диметилформамиде (5 мл) добавляли при комнатной температуре 66 мг 1,1'-карбонилдиимидазола, затем смесь перемешивали при указанной температуре в течение 2 часов и 30 минут. К смеси добавляли при комнатной температуре 0,20 г бензил[1-амино-1-(4-{3-[1-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-4-пиперидинил]пропокси}фенил)метилиден]карбамата, затем полученную смесь перемешивали при указанной температуре в течение 3 дней. К реакционной смеси добавляли этилацетат и воду. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (элюент; хлороформ:метанол = 4:1), с получением 0,34 г 4-{3-[4-(3-{4-[амино(бензилоксикарбонилимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамид О-[(2S)-2-(трет-бутоксикарбонил)амино-3-метилбутилил]оксима в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,01 (3H, д, J=6,8 Гц), 1,05 (3H, д, J=6,6 Гц), 1,25-1,50 (5H, м), 1,45 (9H, с), 1,65-1,85 (4H, м),1,95-2,05 (4H, м), 2,10-2,25 (1H, м), 2,50-2,60 (2H, м), 2,95-3,05 (2H, м), 3,99 (2H, т, J=6,5 Гц), 4,04 (2H, т, J=6,3 Гц), 4,25-4,35 (1H, м), 5,05-5,20 (3H, м), 5,21 (2H, с), 6,85-6,95 (4H, м), 7,25-7,50 (5H, м), 7,60-7,65 (2H, м), 7,80-7,90 (2H, м).
Пример 42

К раствору 0,10 г 4-{3-[4-(3-{4-[амино(бензилоксикарбонилимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамид О-[(2S)-2-(трет- бутоксикарбонил)амино-3-метилбутилил]оксима в хлороформе (10 мл) добавляли при комнатной температуре 2 мл трифторуксусной кислоты, полученную смесь затем перемешивали при указанной температуре в течение одного часа. Растворитель отгоняли при пониженном давлении и затем добавляли 2,9 моль/л раствора хлористый водород/этанол с последующей отгонкой растворителя при пониженном давлении. Полученное твердое вещество суспендировали в диизопропиловом эфире и твердое вещество собирали фильтрованием и промывали диизопропиловым эфиром с получением 0,04 г гидрохлорида 4-{3-[4-(3-{4-[амино(бензилоксикарбонилимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамид О-((2S)-2-амино-3-метилбутилил)оксима в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,01 (3H, д, J=6,8 Гц), 1,03 (3H, д, J=6,8 Гц), 1,30-1,95 (9H, м), 2,10-2,35 (3H, м), 2,80-3,00 (2H, м), 3,10-3,20 (2H, м), 3,45-3,55 (2H, м), 3,90-4,00 (1H, м), 4,05-4,20 (4H, м), 5,36 (2H, с), 7,02 (2H, д, J=9,0 Гц), 7,05-7,15 (2H, ушир), 7,15 (2H, д, J=8,8 Гц), 7,35-7,55 (5H, м), 7,69 (2H, д, J=8,8 Гц), 7,81 (2H, д, J=9,0 Гц), 8,60-8,75 (3H, ушир).
Пример 43

К раствору 0,93 г бензил[1-амино-1-(4-{3-[4-(3-гидроксипропил)-1-пиперидинил]пропокси}фенил)метилиден]карбамата в тетрагидрофуране (20 мл) добавляли при комнатной температуре 0,37 мл триэтиламина, затем к полученной смеси при охлаждении льдом добавляли 0,19 мл метансульфонилхлорида с последующим перемешиванием при комнатной температуре в течение 30 минут. К реакционной смеси добавляли этилацетат, воду и насыщенный водный раствор хлорида натрия. Органический слой отделяли и сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученное маслянистое вещество растворяли в 20 мл N,N-диметилформамида, затем к полученной смеси добавляли 0,25 г N',4-дигидроксибензамидина и 0,45 г карбоната калия с последующим перемешиванием при 70°C в течение 4 часов. К смеси добавляли 0,12 г N',4-дигидроксибензамидина и затем перемешивали при 70°C в течение одного часа. Реакционную смесь охлаждали до комнатной температуры и затем добавляли к смеси этилацетата и воды. Органический слой отделяли, промывали водой, затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток суспендировали в диизопропиловом эфире и твердое вещество собирали фильтрованием и очищали, используя колоночную хроматографию на силикагеле (элюент; хлороформ:метанол =5:1), с получением 0,22 г бензил[1-амино-1-(4-{3-[4-(3-{4- [амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}фенил)метилиден]карбамата в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,20-1,45 (5H, м), 1,65-2,05 (8H, м), 2,45-2,55 (2H, м), 2,90-3,00 (2H, м), 3,96 (2H, т, J=6,5 Гц), 4,06 (2H, т, J=6,3 Гц), 4,79 (2H, с), 5,21 (2H, с), 6,89 (2H, д, J=8,5 Гц), 6,93 (2H, д, J=8,8 Гц), 7,25-7,60 (5H, м), 7,55 (2H, д, J=8,5 Гц), 7,85 (2H, д, J=8,8 Гц).
Пример 44
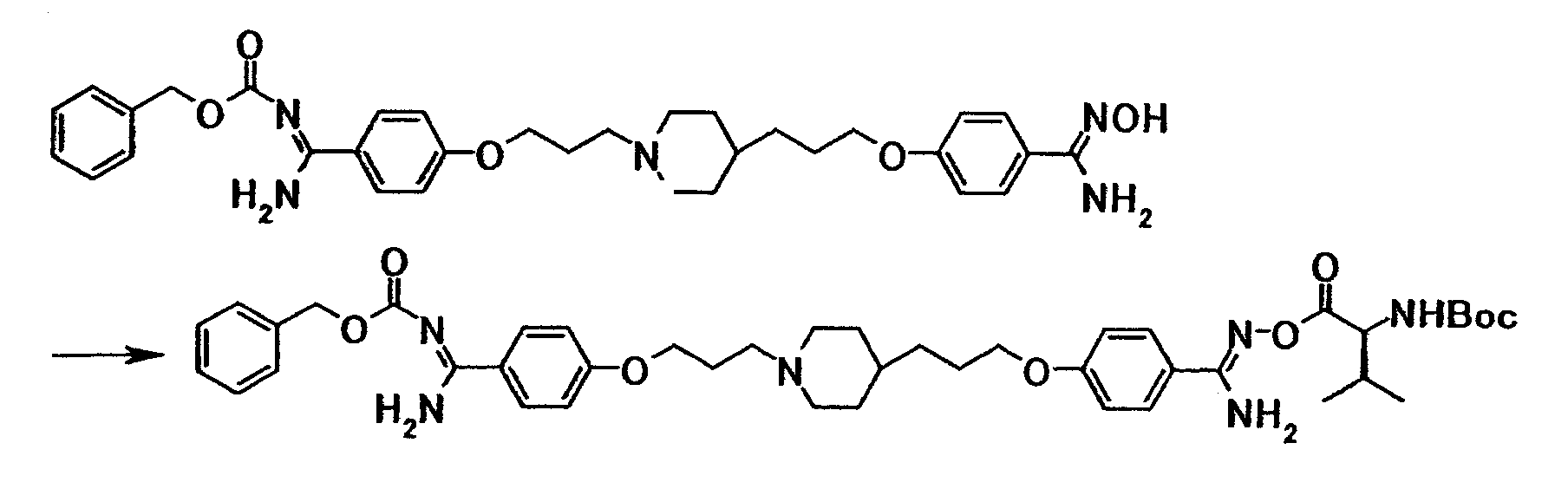
К раствору 44 мг N-(трет-бутоксикарбонил)-L-валина в N-метил-2-пирролидоне (10 мл) добавляли при комнатной температуре 33 мг 1,1'-карбонилдиимидазола, затем полученную смесь перемешивали при указанной температуре в течение 3 часов. К смеси добавляли при комнатной температуре 0,10 г бензил[1-амино-1-(4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}фенил)метилиден]карбамата, затем смесь перемешивали при указанной температуре в течение 17 часов. Реакционную смесь добавляли к смеси этилацетата и воды. Органический слой отделяли, промывали водой и затем сушили при помощи безводного сульфата магния с последующей отгонкой растворителя при пониженном давлении. Полученный остаток очищали, используя колоночную хроматографию на силикагеле (элюент; хлороформ:метанол = 30:1), с получением 0,11 г 4-(3-{4-[3-(4-{амино[(2S)-2-(трет-бутоксикарбонил)амино-3-метилбутилилоксиимино]метил}фенокси)пропил]-1-пиперидинил}пропокси)-N'-бензилоксикарбонилбензамидина в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,01 (3H, д, J=6,8 Гц), 1,05 (3H, д, J=6,8 Гц), 1,25-1,45 (5H, м), 1,45 (9H, с), 1,60-2,25 (9H, м), 2,50-2,60, (2H, м), 2,95-3,05 (2H, м), 3,97 (2H, т, J=6,5 Гц), 4,06 (2H, т, J=6,3 Гц), 4,25 4,35 (1H, м), 5,05-5,20 (2H, м), 5,21 (2H, с), 6,85-6,95 (4H, м), 7,25-7,40 (3H, м), 7,40-7,50 (2H, м), 7,60-7,70 (2H, м), 7,80-7,90 (2H, м).
Пример 45

К раствору 0,02 г 4-(3-{4-[3-(4-{амино[(2S)-2-(трет-бутоксикарбонил)амино-3-метилбутилилоксиимино]метил}фенокси)пропил]-1-пиперидинил}пропокси)-N'-бензилоксикарбонилбензамидина в хлороформе (1,0 мл) добавляли при комнатной температуре 0,5 мл трифторуксусной кислоты, полученную смесь затем перемешивали при указанной температуре в течение 2 часов. Растворитель отгоняли при пониженном давлении и затем к полученному остатку добавляли раствор 2,9 моль/л хлористый водород/этанол с последующей отгонкой растворителя при пониженном давлении. Полученный остаток суспендировали в диизопропиловом эфире и твердое вещество собирали фильтрованием и промывали диизопропиловым эфиром с получением 14 мг гидрохлорида 4-{3-[4-(3-{4-[амино((2S)-2-амино-3-метилбутилилоксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}-N'-бензилоксикарбонилбензамидина в виде бледно-коричневого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,01 (3H, д, J=6,8 Гц), 1,02 (3H, д, J=6,8 Гц), 1,30-1,65 (5H, м), 1,70-1,95 (4H, м), 2,15-2,35 (3H, м), 2,80-2,95 (2H, м), 3,10-3,25 (2H, м), 3,45-3,55 (2H, м), 3,90-4,25 (5H, м), 5,36 (2H, с), 7,00 (2H, д, J=8,8 Гц), 7,15 (2H, д, J=9,0 Гц), 7,38-7,50 (5H, м), 7,65-7,75 (2H, м), 7,83 (2H, д, J=8,8 Гц), 8,55-8,65 (2H, ушир).
Пример 46
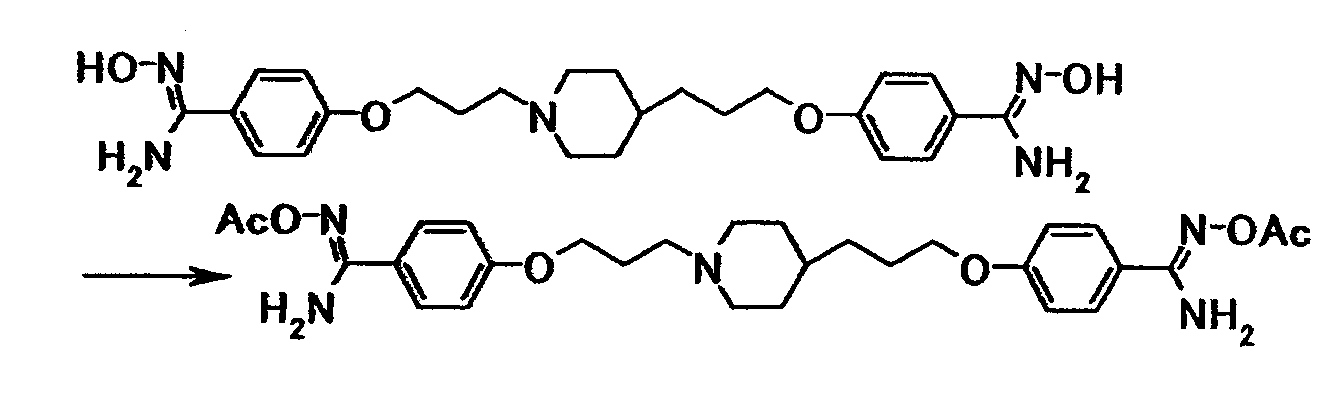
К суспензии 1,00 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидоксима в уксусной кислоте (15 мл) добавляли при комнатной температуре 0,48 мл уксусного ангидрида, полученную смесь затем перемешивали при указанной температуре в течение одного часа. Растворитель отгоняли при пониженном давлении и затем полученный остаток добавляли к смеси воды и хлороформа, полученную смесь затем доводили до pH 7,5 при помощи насыщенного водного раствора бикарбоната натрия. Осадок собирали фильтрованием и промывали водой и хлороформом с получением 1,07 г 4-{3-[4-(3-{4-[амино(ацетилоксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамид О-ацетилоксима в виде белого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,05-1,40 (5Н, м), 1,60-1,80 (4H, м), 1,80-1,95 (4H, м), 2,12 (3H, с), 2,12 (3H, с), 2,35-2,45 (2H, м), 2,80-2,90 (2H, м), 3,99 (2H, т, J=6,5 Гц), 4,03 (2H, т, J=6,3 Гц), 6,60-6,80 (4H, ушир), 6,95-7,00 (4H, м), 7,64 (2H, д, J=7,6 Гц), 7,64 (2H, д, J=7,6 Гц).
Пример 47

К суспензии 4,00 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидоксима в 2-пропаноле (20 мл) добавляли при комнатной температуре 4 мл воды и 2,37 мл хлористоводородной кислоты, затем полученную смесь нагревали до температуры кипения с обратным холодильником в течение 3 минут. Смесь охлаждали до комнатной температуры, затем к полученной смеси добавляли при охлаждении льдом 10 мл 2-пропанола с последующим перемешиванием при указанной температуре в течение одного часа. Осадок собирали фильтрованием и промывали 90% (об/об) водным раствором 2-пропанола с получением 3,94 г гидрохлорида 4-{3-[4-(3-{4-[амино-(гидроксиимино)метил}фенокси}пропил)-1-пиперидинил]пропокси}бензамидоксима.
1Н-ЯМР (ДМСО-d6) значение δ: 1,30-1,65 (5H, м), 1,70-1,95 (4H, м), 2,15-2,30 (2H, м), 2,80-3,00 (2H, м), 3,10-3,20 (2H, м), 3,45-3,55 (2H, м), 4,08 (2H, т, J=6,3 Гц), 4,17 (2H, т, J=6,1 Гц), 7,05-7,20 (4H, м), 7,70-7,80 (4H, м), 8,50-9,50 (4H, ушир), 10,70-10,90 (1H, ушир), 11,00-11,20 (2H, ушир).
Пример 48

К раствору 0,56 г N-(трет-бутоксикарбонил)-L-фенилаланина в N-метил-2-пирролидоне (10 мл) добавляли при комнатной температуре 0,35 г 1,1'-карбонилдиимидазола, полученную смесь затем перемешивали при указанной температуре в течение 2 часов. К смеси добавляли при комнатной температуре 0,50 г 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидоксима, затем смесь перемешивали при этой температуре в течение 3 часов и 40 минут. Реакционную смесь добавляли к смеси этилацетата и воды и осадок собирали фильтрованием с получением 0,82 г 4-(3-{4-[3-(4-{амино[(2S)-2-(трет-бутоксикарбонил)амино-3-фенилпропионилоксиимино]метил}фенокси)пропил]-1-пиперидинил}пропокси)-N'-[(2S)-2-(трет-бутоксикарбонил)амино-3-фенилпропионилокси]бензамидина в виде белого твердого вещества.
1Н-ЯМР (CDCl3) значение δ: 1,24-1,28 (3H, м), 1,43 (9H, с), 1,43 (9H, с), 1,65-1,85 (4H, м), 1,90-2,10 (5H, м), 2,45-2,50 (2H, м), 2,90-2,95 (2H, м), 3,05-3,40 (5H, м), 3,90-4,05 (4H, м), 4,75-4,85 (4H, м), 5,15-5,20 (2H, м), 6,85-6,90 (4H, м), 7,20-7,35 (10Н, м), 7,55-7,60 (4H, м).
Пример 49
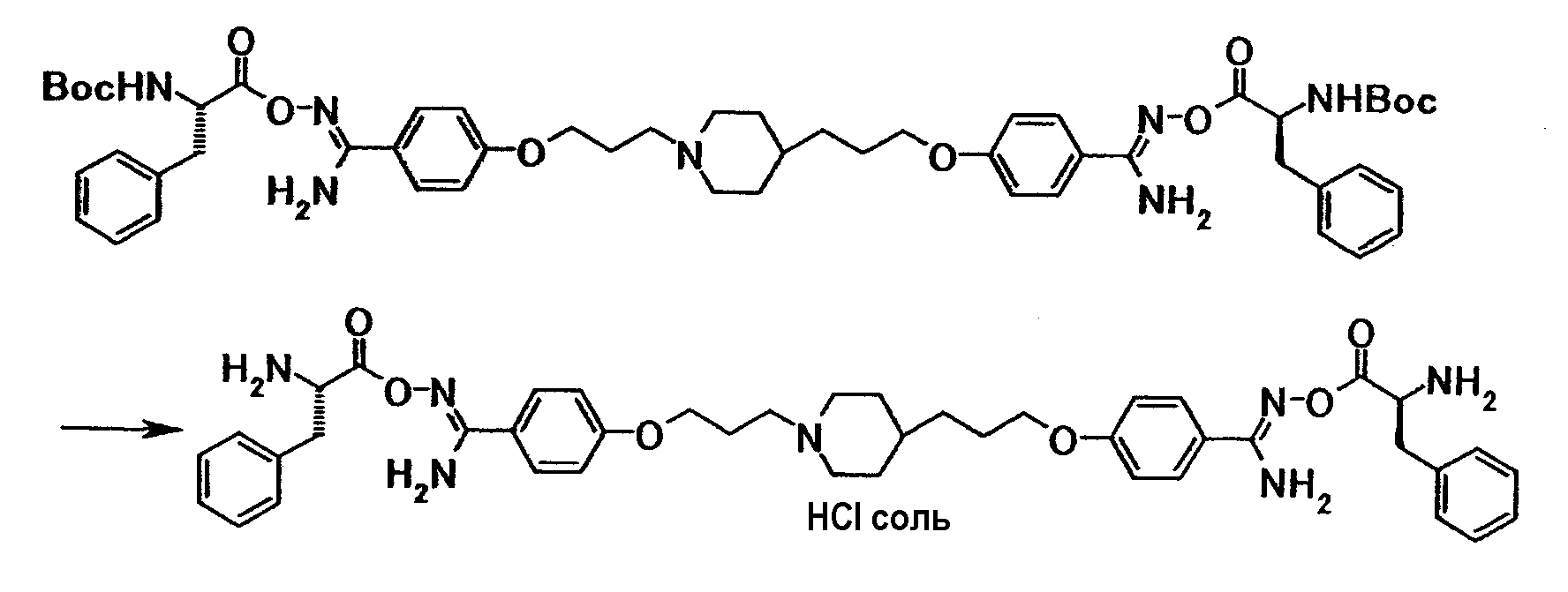
К суспензии 0,50 г 4-(3-{4-[3-(4-{амино[(2S)-2-(трет-бутоксикарбонил)амино-3-фенилпропионилоксиимино]метил}фенокси)пропил]-1-пиперидинил}пропокси)-N'-[(2S)-2-(трет-бутоксикарбонил)амино-3-фенилпропионилокси]бензамидина в этаноле (10 мл) добавляли при охлаждении льдом 5 мл раствора 2,9 моль/л хлористый водород/этанол, полученную смесь затем перемешивали при указанной температуре в течение 20 минут, а затем давали выстояться при комнатной температуре в течение 26 часов. Растворитель отгоняли при пониженном давлении и полученный остаток суспендировали в хлороформе, затем твердое вещество собирали фильтрованием с получением 0,50 г гидрохлорида 4-{3-[4-(3-{4-[амино((2S)-2-амино-3-фенилпропионилоксиимино)метил]фенокси}пропил)-1-пиперидинил]пропокси}-N'-((2S)-2-амино-3-фенилпропионилокси)бензамидина в виде бледновато-желтого твердого вещества.
1Н-ЯМР (ДМСО-d6) значение δ: 1,35-1,40 (2H, м), 1,55-1,70 (3H, м), 1,70-1,95 (5H, м), 2,20-2,30 (2H, м), 2,85-2,95 (2H, м), 3,10-3,35 (4H, м), 3,45-3,50 (2H, м), 4,05-4,15 (4H, м), 4,15-4,25 (3H, м), 7,10-7,20 (4H, м), 7,25-7,40 (10H, м), 7,70-7,80 (4H, м).
Пример препарата 1
В воде для инъекций растворяли 1,25 г соединения, полученного в примере 2, и 5,0 г D-маннита до получения общего количества 100 мл. Раствор фильтровали через 0,22-мкм мембранный фильтр и 10 мл полученного раствора лекарственного средства загружали в ампулу и герметично закрывали, после чего стерилизовали паром с получением препарата для инъекций.
Пример препарата 2
В воде для инъекций растворяли 1,02 г соединения, полученного в примере 10, и 31,5 г хлорида натрия до получения общего количества 3,5 л. Раствор фильтровали через 0,22-мкм мембранный фильтр и 10 мл полученного раствора лекарственного средства загружали в ампулу и герметично закрывали, после чего стерилизовали паром с получением препарата для инъекций.
Пример препарата 3
Смешивали 500 мг соединения, полученного в примере 1, 350 мг лактозы, 250 мг кукурузного крахмала и 400 мг кристаллической целлюлозы (торговое наименование: Ceolus PHlOl; Asahi Kasei Chemicals Corporation), к полученной смеси затем добавляли 0,6 мл 5% водного раствора гидроксипропилцеллюлозы и воду, а затем смесь перемешивали. Полученную смесь сушили при 60°C с последующим добавлением 100 мг кросповидона (торговое наименование: Kollidon CL: BASF), 100 мг светлой безводной кремневой кислоты и 20 мг стеарата магния, а затем осуществляли смешивание. Для получения таблетки круглой формы с диаметром 8 мм 175 мг смеси подвергали таблетированию с получением таблетки.
Пример препарата 4
Смешивали 500 мг соединения, полученного в примере 1, 200 мг лактозы и 530 мг кукурузного крахмала, к этой смеси затем добавляли 0,6 мл 5% водного раствора гидроксипропилцеллюлозы и воду, а затем смесь перемешивали. Полученную смесь сушили при 60°C с последующим добавлением 70 мг кросповидона (торговое наименование: Kollidon CL: BASF), 180 мг кристаллической целлюлозы (торговое наименование: Ceolus PH302; Asahi Kasei Chemicals Corporation) и 20 мг стеарата магния, а затем осуществляли смешивание. В желатиновую капсулу № 3 загружали 150 мг полученной смеси с получением капсулы.
Промышленная применимость
Соединение по настоящему изобретению является полезным в качестве превосходного противогрибкового средства, поскольку оно обладает высокой активностью против грибков, включая грибки, резистентные к азольным средствам, и имеет отличные физические свойства, а также является высоко безопасным в испытаниях токсичности при многократном введении доз, оно также является полезным в качестве антипротозойного средства, поскольку обладает отличной антипротозойной активностью.
Краткое описание чертежей
Чертеж представляет порошковую рентгенограмму 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидина тригидрохлорида пентагидрата.
Реферат
Изобретение относится к новым ариламидиновым производным, представленным общей формулой: ! ! где R1 представляет собой амидиногруппу, необязательно замещенную одной или несколькими группами, представляющими ацильную группу; алкилоксикарбонильную группу; аралкилоксикарбонильную группу; арилоксикарбонильную группу; циклоалкилоксикарбонильную группу; алкоксиалкильную группу; циклоалкилиденовую группу; гидроксильную группу, необязательно замещенную ацильной группой; алкокси, и аралкилоксигруппы, необязательно замещенные галогеном, алкильной группой, алкоксигруппой, алкоксиалкильной группой, аминогруппой; и R2 и R3 являются одинаковыми или отличными друг от друга, и каждый представляет собой атом водорода или атом галогена; или к его соли. Изобретение также относится к 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидину, 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперидинил]пропокси}бензамидину тригидрохлорид пентагидрату, 4-{3-[4-(3-{4-[амино(гидроксиимино)метил] фенокси} пропил)-1-пиперидинил]пропокси}бензамидоксиму или к их солям, а также к противогрибковому средству. Технический результат - получение новых биологически активных соединений, обладающих противогрибковой активностью. 5 н. и 2 з.п. ф-лы, 5 табл., 1 ил.
Формула

где R1 представляет собой амидиногруппу, необязательно замещенную одной или несколькими группами, представляющими ацильную группу; алкилоксикарбонильную группу; аралкилоксикарбонильную группу; арилоксикарбонильную группу; циклоалкилоксикарбонильную группу; алкоксиалкильную группу; циклоалкилиденовую группу; гидроксильную группу, необязательно замещенную ацильной группой; алкокси и аралкилоксигруппы, необязательно замещенные галогеном, алкильной группой, алкоксигруппой, алкоксиалкильной группой, аминогруппой; и R2 и R3 являются одинаковыми или отличными друг от друга, и каждый представляет собой атом водорода или атом галогена; или его соль.
-1-пиперидинил]пропокси}бензамидин или его соль.
-1-пиперидинил]пропокси}бензамидин тригидрохлорид пентагидрат.
-1-пиперидинил]пропокси}бензамидоксим или его соль.

Комментарии