Электрод для получения хлора - SU1134122A3
Код документа: SU1134122A3
Чертежи


Описание
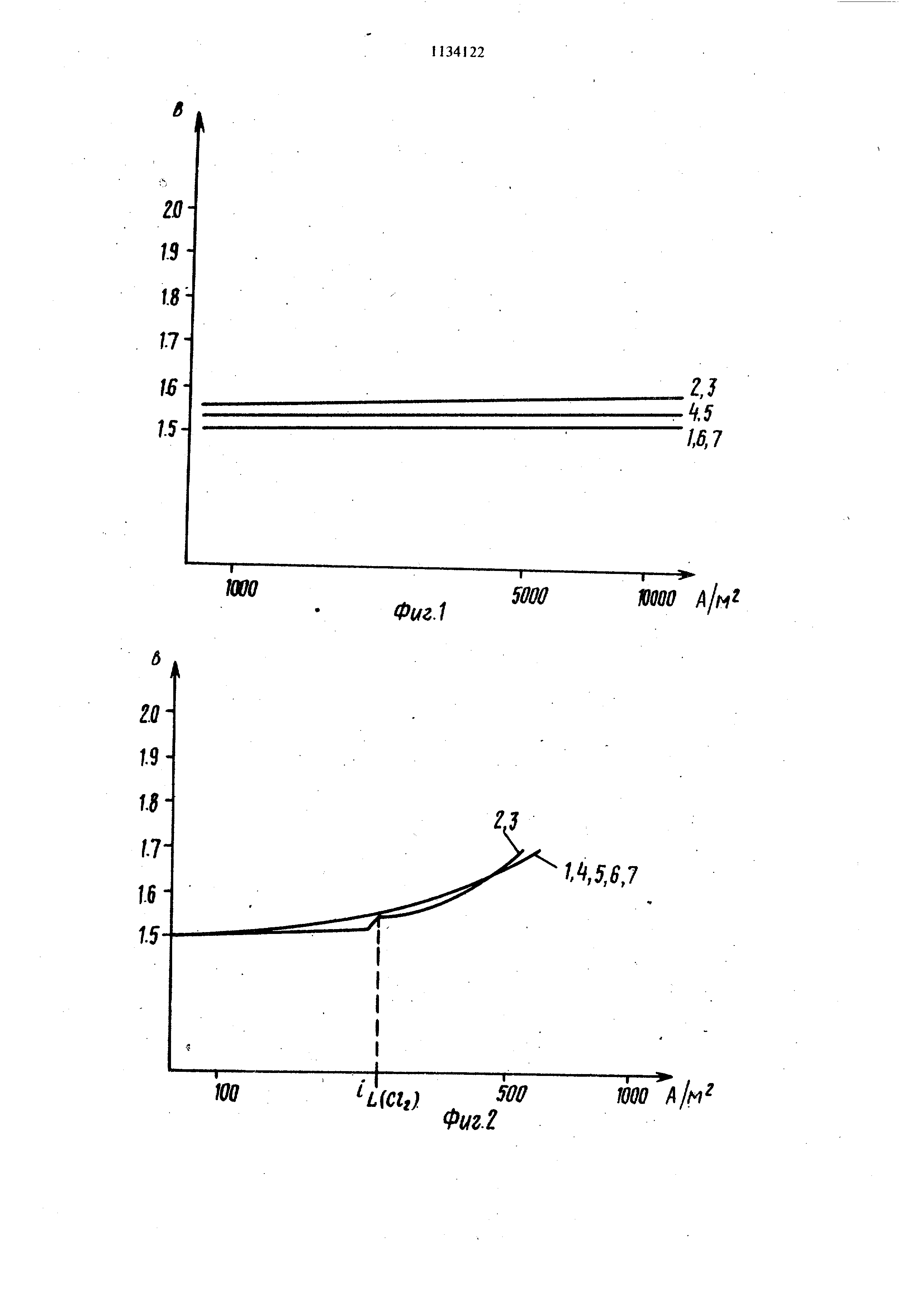
Изобретение относится к электрохимическим производствам, в частности к электрода используемым для получения хлора электрол зом водных растворов хлорида щелочного металла. Известен электрод, применяемый в указан процессах; содержапдий -основу из вентильного металла с нанесенным на нее электрокаталит ческим покрытием, содержащим смесь окислов олова и сурьмы, а также окислов метал ла платиновой группы и окислов вентильного металла (1 . Недостатком известного электрода являетс загрязнение получаемого пара, особенно при электролизе разбавленных растворов, значительными количествами кислорода. Цель изобрете1шя - повышение чистоты получаемого хлора. Поставленная цель достигается тем, что по лучение хлора электролизом водного раствора хлорида щелочного металла ведут с использо ванием электрода, содержащего основу из вентильного металла с нанесенным на нее электрокаталитическим покрытием, содержащим смесь по крайней мере одного окисла металла платиновой группы, по крайней мере одного окисла вентильного металла двуокиси олова и окисла металла группы V периодической системы, в качестве последнег покрытие содержит трехокись висмута, причем трехокись висмута покрыЛе содержит в твердом растворе с двуокисью олова, и дополнительно - окись Ko6anbTaj.при следующем соотношении компонентов: Окись металла платиновой группы30-50 . Окись вентильного металла 30-60 Твердый раствор двуокиси олова и трехокиси вис мута 5-15 Окись кобальта 1-6 Причем массовое соотношение двуокиси олова и трехокиси висмута в твердом растворе составляет 4-9:1. Основными областями применения электро дов с указанным многокомпонентным покры тием являются электролиз морской воды даж при низких температурах, извлечение галоген из разбавленных отработанных вод, электролиз рассола ртутных элементов при высокой плотности тока (более 10 кА/м ), электролиз с использованием мембран при технологии на основе элементов с- электролитом в виде твердого полимера. В электродах, используемых в элементах с электролитом в виде твердого полимера, активное покрытие не наносится непосредственно на подложку, а наносится или входит в состав гидравлически и/или ионопроницаемых сепараторов, которыми обычно являются ионообменные мембраны, а подложкой электрода обычно является сетка из титана, которая контактирует с активным материалом, нанесенным на сепаратор. Пример. Несколько анодов изготавливают следующим образом. Титановые пластины размером 10x10x1 мм подвергают пес коструйной обработке, протравливают в 20%-ной соляной кислоте и тщательно промывают в воде. Затем пластины покрывают с помощью кисти. растворенными в этиловом спирте хлоридом рутения и ортобутилом титаната (пластина 1), раствор, которым осуществляют покрытие, содержит также четыреххлористое олово и треххлористый висмут для четырех пластин (пластины 2-10) и, кроме того , хлористый кобальт для четырех пластин (пластины 11-14). Каждое покрытие сущат при 95-100 С и покрытие пластины затем подвергают тепловой обработке при 450 С в течение 15 мин в термостате с применением принудительной вентиляции. Такая операция повторяется пять раз, а затем пластины подвергают окончательной тепловой обработке при 450 С в течение 60 мин. Количество компонентов в покрывающих растворах изменяют таким образом, чтобы окончательный состав покрытия соответствовал приведенному в табл. 1, где все отнощения определяют массовое содержание соответствующих металлов относительно общего содержания металлов. Пластины 1-7 испытаны в качестве анодов при электролизе водного раствора, содержащего 200 г/л N82304, при и при плотности тока 10 кА/м. На фиг. 1 приведена кривая анодной поляризации , показывающая измеренные потенциалы , выделения кислорода. Аноды 2-5, содержащие смесьSri02Bi O, имеют бодее высокий потенциал выделения кислорода, чем анод 1 (не содержит ни SnOg, ни ) и анод 6 (содержит только Бпф или анод 7 (содержит только BijO). Указанное синергическое воадействие смещанных кристаллов или смесей SnOj- BigO обусловлено тем, что SnO BijO блокирует радикалы ОН, образуя стабильные комплексные соединения солей перкислоты, и препятствует, таким образом, вьщелению кислорода. Электроды с содержанием 30-50 мас.% RuO (образцы 15 и 16) обладают повышенной селективностью.. Образец 20 с содержанием 25% RuO дает лищь нормальную селективность . Образец 19 повторен с 55 мас.% RuO, и 25 мас.% ТЮ, или в обоих случаях наблюдается лишь стандартная селектив31 ность. Образцы 17 и 18 демонстрируют хорошие результаты в пределах предусмотренного диапазона для и ZrO как окислов вентильного металла. Потенциал выделения хлора, измеренный для анодов 1-10 при плотностях тока до 10 кА/м в насыщенных растворах NaCI. не меняется в зависимости от наличия или отсутствия SnO -BijO. На фиг. 2 показан анодный потенциал пластин 1-7, помеи1енных в ненасыщенный раствор NaCt/NajSOj -CNaC 10 г/л; 5 г/л) при 15 с и при плотности тОка вплоть до 500 А/м . При зтих условиях для пластин 2 и 3 проявляется предельный ток i (CCj) выделения хлора, который мог быть измерен. На фиг. 3 приведена завис;имость эффективности вьщеления кислорода как функции плот ности тока в указанном разбавленном растворе NaCi/NajSO при 15 с. Этот график показывает , что анод 3i имеет более низкую кислородную зффективность, чем анод I, и, следовательно, преимущественно вьщеляет хлор Фиг. 4 аналогична фиг. 1, потенциалы выде ления кислорода для анодов 1, 3, 8, 9 и 10 при тех же условиях, что и на фиг. 1, т. е. в растворе, содержащем 200 г/л Na-SO, и имеющем температуру . График показывав ет, что при зтих условиях анод 9 с содержанием 10 мас.% SnOvBi-O 2 г 3 проявляет оптимальные свойства с точки зрения ингибирования кислорода. В табл. 2 показана разность анодных потенциалов для нежелательной побочной реакции выделения кислорода и требуемой реакции выделения хлора, вычисленная на основе данных измерения анодных потенциалов при 10 к А/м 2 в насыщенном растворе NajSOj и NaCi для электродов 1, 8, 3, 9 и 10. Из кривых анодной поляризации для насыщенного раствора NaCi- при плотностях тока вплоть до 10 кА/м найдено, что наличие С.о,.О при небольщом процентном содержании (пластины 11-14) снижает потенциал выделения хлора, не оказывая влияния на потенциал выделения кислорода (особенно важно, что не увеличивает его); это найдено при измерениях проведенных при злектролизе раствора Na SO. концентрации 200 г/л при 60® С. На фиг. 5, аналогичной фиг. 2, приведен анодный потенциал .пластин 9-14, измеренный 24 в растворе, содержащем 10 т/л NaCt- и 5 г/л NajSOj , при 15 С. При зтих условиях из графика можно видеть, что наличие умеиьщает потенциал вплоть до предельного тока выделения хлора, и следовательно, увеличивает отнощение Cf2./O2 вплоть до зтого предела. Это влияние СолОц оказывается наибольщим при пороговом содержании кобальта, составляющем около 5%. Из приведенных данных следует, что указанные количества компонентов позволяют 311ачительно замедлить выделение кислорода при включении в покрытие .твердого раствора двуокиси олова и трехокиси висмута. Оптимальным массовым соотнощением двуокиси олова и трехокиси висмута является 9-4:1, однако двуокись олова может находиться в некоторйм избытке, так что часть окиси олова присутствует в виде отдельной фазы. Сравнительные испытания предпочтительного варианта известного злектрода SnO 81,9%; 8,9%; RuO2 7,9%; TiO 1,3% и злектрода, .имеющего такой же, состав, как образец 1, описанный в табл. 1. (RuO 45%; TiO 55%), проводят в производственном диафрагменном электролизере для получения хлора с использованием рассола 310 г/л NaCI при рН 7 и при 45 С, а также при постоянной плотности тока 1550 А/м Я Электролизер работает до тех пор, пока не обеспечивается устойчивая работа (по меньщей мере 18 ч). Отбирают и анализируют - образцы газа (хлора) анодного отделенияч Когда образец 1 используют в качестве анода, т. е. анод с высоким содержанием RuO и TiO, хлор содержит в среднем 0,24% кислорода; когда используют известный анод; хлор содер жит в среднем 0,42% кислорода, т. е. почти в два раза больше. Таким образом, известный анод значительно хуже образца 1 по кислородной избирательности. Путем сравнения -данных в табл. 2 можно установить, что образец 1 хуже по избирательности 4То срав1 еншо с анодами , модифицированными путем включения ЗпОл-Bi-O-, Эти аноды могут быть еще больще улучшены путем снижения потенциала выделения хлора за счет включения небольшого количества окиси кобальта. Таким образом , по кислородной избирательности аноды изобретения. намного претосходях известный анод.
Таблица 1
Таблица 2




Реферат
1. ЭЛЕКТРОД ДЛЯ ПОЛУЧЕНИЯ . ХЛОРА электролизом водного раствора хлорида щелочного металла, содержащий основу из вентильного металла с нанесенным на нее электрокаталитическим покрытием, содержащим .смесь по крайней мере одного окисла металла платиновой группы, по крайней мере одного окисла вентильного металла, двуокиси олова и окисла металла группы V периодическ кой системы, отличающийс.я тем, что, с целью повьпиения чистоты хлора, в качестве окисла металла группы V покрытие содержит трехокись висмута, причем последнюю покрытие содержит в твердом растворе с двуокисью олова, и дополнительно - окись кобальта при следующем соотношении компонентов, мас.%: Окись металла платиноэой группы30-50 Окись вентильного металла30-60 Твердый раствор двуокиси олова и трехокиси висмута5-15 Окись кобальта1-6 2. Электрод по п. I, о т л и .ч а ю щ и и с я тем, что массовое соотнощение двуокиси олова и трехокиси висмута в. твердом растворе составляет 4-9:1.


Комментарии