Растения огурца, устойчивые к заболеваниям - RU2418405C2
Код документа: RU2418405C2
Чертежи






Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к области растений, устойчивых к заболеваниям, и к разведению растений, более подробно, к разведению растений огурца, устойчивых к мучнистой росе и к клостеровирусу.
Уровень техники изобретения
Коммерческое производство огурцов (Cucumis sativus) может нести убытки из-за ряда их заболеваний. Вирусы желтухи вызывают одно из таких заболеваний и могут быть причиной значительного экономического ущерба выращивания огурцов. Семейство клостеровирусов (Closteroviridae), которое образует самую высокую таксонометрическую группу вирусов желтухи, поражающих огурец, включает более 30 извитых и нитевидных вирусов растений, переносимых насекомыми. Семейство состоит из трех родов, из которых род Crinivirus, переносимый белокрылкой, включает виды, к которым особенно чувствительны огурцы. Данный род включает, среди прочих, виды вируса болезни желтой задержки роста огурца (CYSDV), вируса инфекционной желтухи салата (LIYV), вируса псевдожелтухи свеклы (BPYV). Наибольшую угрозу для производителей огурцов представляют CYSDV и BPYV. Вирусы обычно находятся в насекомом-переносчике инфекции и переносятся на растение путем питательной активности насекомых.
Следовательно, клостеровирус огурцов можно контролировать посредством применения инсектицидов. Однако, предпочтительно, контроль клостеровируса в агрокультуре и овощеводстве достигается благодаря получению устойчивых к вирусу культиваров растений-хозяев. В настоящее время по меньшей мере два локуса количественных признаков, или QTL, в геноме устойчивых вариантов огурца распознаются как связанные с устойчивостью к клостеровирусу (см. WO 02/22836). Соответствующая интрогрессия генетического материала, связанного с устойчивостью к клостеровирусу, в линиях растений-потомков может отслеживаться путем обнаружения специфических маркеров, связанных с такими QTL. Следовательно, знание о QTL может иметь значение для разведения культиваров, устойчивых к клостеровирусам.
Другим важным заболеванием, которое отрицательно влияет на коммерческое производство огурцов, является мучнистая роса огурцов (PM). РМ огурцов может быть вызвана грибами S.fuliginea и E.cichoracearum. Заболевание является широко распространенным и может встречаться круглогодично. Симптомы начинаются с маленьких пятен тонкой белой грибковой нити на поверхности инфицированных листьев, которые затем могут увеличиваться и в конечном счете покрывать стебли и листву белой мучнистой массой спор и гиф. Тяжелая инфекция приводит к обесцвечиванию и потере листьев и сопутствующему уменьшению числа и размера плодов. Хотя ряд фунгицидов является эффективным против мучнистой плесени, обнаруживается устойчивость гриба против химикатов.
У различных штаммов огурцов был показан некоторый уровень устойчивости к мучнистой росе. Такие штаммы включают, например, образец PI 197088 дикого индийского огурца и образцы PI 200815, PI 200818, так же, как и культивары Natsufushinari и Asomidori (Morishita и др., 2003). Также известны другие гены, связанные с устойчивостью к РМ (Fanourakis, 1984; Fujieda и Akiya, 1962; Kooistra, 1968, 1971; Shanmugasundarum и др., 1971, 1972), включая pm-1 и pm-2 в Natsufushinari, pm-3 в PI 200815 и PI 200818 и "pm-h" в культигене Wis. SMR 18 (ген "pm-h" является без ограничения к локусу pm выявляемым pm-h далее в настоящем документе). Хотя доступны несколько коммерческих сортов огурцов с частичной устойчивостью к РМ, большинство коммерческих производителей до сих пор полагаются на лиственные фунгициды. Частично это связано с тем фактом, что устойчивость к РМ сложно привнести в линии, у которых показаны другие типы устойчивости. Например, селекционеры столкнулись с таким недостатком, как чувствительность к клостеровирусу, и наоборот, у линий, имеющих устойчивые к РМ аллели, хотя прежде они не были чувствительны. Фактически эксперименты по скрещиванию пока не дали линий огурцов, у которых показана устойчивость как к РМ, так и к клостеровирусу. На сегодняшний день эффективные рекомбинанты с двойной устойчивостью не получены. Это удивительно, поскольку объединение различных признаков в один геном может быть достигнуто относительно простыми селекционными процедурами.
Целью настоящего изобретения является получение растений огурца, у которых показана устойчивость к вирусам семейства клостеровирусов, которые поражают огурец, в частности BPYV и CYSDV, и растение у которого, кроме того, показана устойчивость к мучнистой росе огурца, вызываемой грибами S.fuliginea и/или E.cichoracearum.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторами настоящего изобретения был обнаружен ряд растений огурца, у которых показана устойчивость как к CYSDV, так и к РМ. Кроме того, ими было обнаружено, что указанные растения огурца с двойной устойчивостью включают два локуса количественных признаков (QTL), связанных с устойчивостью к мучнистой росе (обнаруженные в настоящем документе как pm-l и pm-h), и один большой QTL, связанный с устойчивостью к клостеровирусу (обозначенный в настоящем документе как QTL-1). Наиболее важно, что авторы изобретения обнаружили, что все QTL локализованы в одной генетической группе сцепления. Таким образом, авторы настоящего изобретения преимущественно обнаружили, что в данных растениях гены устойчивости к клостеровирусу и мучнистой росе находятся на одной хромосоме. Такие растения являются крайне эффективными для селекции растений.
Кроме того, авторы изобретения обнаружили возможный механизм, в отсутствие которого не могли быть получены растения огурца с двойной устойчивостью (с помощью экспериментов по скрещиванию). Не привязываясь к какой-либо теории, полагают, что интрогрессия генетического элемента, незаменимого для устойчивости к одному заболеванию, приводила к потере генетического элемента, важного для устойчивости к другому заболеванию. Благодаря данному открытию авторы изобретения разработали схемы селекции, с помощью которых можно решить данную проблему, получая при этом требуемые растения с двойной устойчивостью.
В первом аспекте настоящее изобретение относится к растению вида Cucumis sativus, растению, у которого показана устойчивость к клостеровирусам огурцов, а также устойчивость к мучнистой росе огурцов.
В предпочтительном варианте осуществления такого растения по изобретению геномный(ые) регион(ы), ответственный(ые) за устойчивость к клостеровирусу (QTL-1), и геномный(ые) регион(ы), ответственный(ые) за устойчивость к мучнистой росе огурцов (pm-h и/или pm-l), находятся на одной хромосоме. В еще более предпочтительном варианте осуществления такого растения присутствуют оба pm-h и pm-l, а QTL-1 расположен между pm-h и pm-l.
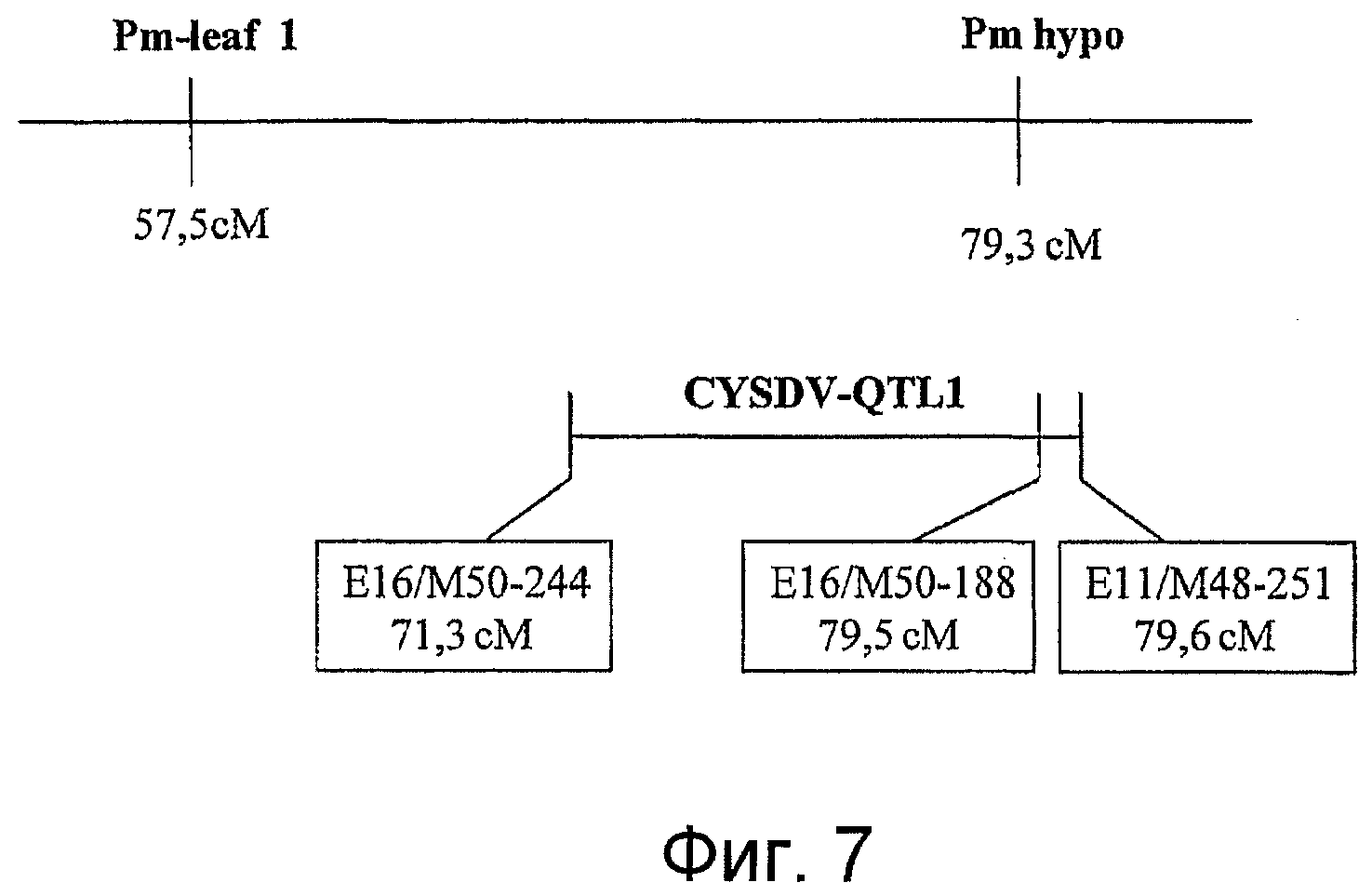
В другом варианте осуществления растения по изобретению присутствие QTL-1 выявляют на наличие по меньшей мере одного фланкирующего маркера, выбранного из группы, состоящей из маркеров E16/M50-244, E16/M50-188, и E11/M48-251, как описано более подробно в документе WO 02/22836, ссылка на который приводится в данном контексте.
В другом варианте осуществления растения по изобретению присутствие QTL, обозначенного pm-h, выявляют по наличию последовательности нуклеиновой кислоты, включающей по меньшей мере одну мутацию, происходящую в результате однонуклеотидного полиморфизма (SNP), связанного с устойчивостью к мучнистой росе в указанном растении, где указанный по меньшей мере один однонуклеотидный полиморфизм (SNP) выбран из SNP1 и SNP2, как показано в таблице 2 далее.
В другом варианте осуществления растения по изобретению присутствие QTL, обозначенного pm-h, выявляют по наличию последовательности нуклеиновой кислоты, включающей по меньшей мере одну мутацию, происходящую в результате однонуклеотидного полиморфизма (SNP), обозначаемого как SNP 3 в таблице 3 далее, связанного с устойчивостью к мучнистой росе в указанном растении или включающего по меньшей мере одну мутацию, обозначаемую как 5-bp, вставка 5'-AATTT-3' в таблице 3 далее, связанную с устойчивостью к мучнистой росе в указанном растении.
Таким образом, изобретение предпочтительно относится к растению, которое устойчиво к клостеровирусу огурца и мучнистой росе огурца, где указанное растение представляет собой растение вида Cucumis sativus, причем указанное растение содержит на одной хромосоме по меньшей мере один хромосомальный регион, который придает устойчивость к клостеровирусу и по меньшей мере один хромосомальный регион, который придает устойчивость к мучнистой росе, где указанный по меньшей мере один регион, который придает устойчивость к клостеровирусу, связан по меньшей мере с одним маркером, выбранным из группы, состоящей из маркеров E16/M50-244, E16/M50-188 и E11/M48-251, и
где указанный по меньшей мере один хромосомальный регион, который придает устойчивость к мучнистой росе, связан с по меньшей мере одним маркером, выбранным из группы, состоящей из:
маркера однонуклеотидного полиморфизма 39T→G в SEQ ID NO:1,
маркера однонуклеотидного полиморфизма 29G→A в SEQ ID NO:2,
маркера однонуклеотидного полиморфизма 193C→T в SEQ ID NO:3,
мутации вставки 5'-AATTT-3' в позиции 221 в SEQ ID NO:4 и
маркеров E16/M50-F-194, E11/M48-F-251, E23/M38-M001, E23/M40-M003, E24/M46-M002, E24/M46-M003, E12/M91-M003, E26/M43-M003, E14/M59-F-134 и E14/M59-F-200.
Растение по изобретению может по желанию содержать второй QTL, связанный с устойчивостью к клостеровирусу (QTL-2, описанный в WO 02/22836, ссылка в настоящем описании дана для более подробной информации о локализации и характеристиках данного QTL). Показано, что QTL расположен на отдельной хромосоме.
В другом аспекте изобретение относится к части растения огурца по изобретению, как описано выше. Предпочтительно, указанная часть растения выбрана из пыльцы, семязачатков, листьев, корней, кончиков корней, пыльников, цветов, плодов, стеблей, отростков, прививочных черенков, корневых побегов, семян, протопластов и каллий, и наиболее предпочтительно, из семени.
В другом аспекте изобретение относится к семени F1, полученному путем скрещивания растения огурца по изобретению с двойной устойчивостью (устойчивость к клостеровирусу плюс устойчивость к РМ [включая РМ-лист (pm-l) и РМ-гипокотиль (pm-h) устойчивый фенотип]), как описано ранее, со вторым растением огурца или другим видом растения, предпочтительно, из ряда огурцов, которое включает желаемые с коммерческой точки зрения характеристики. Предпочтительно, указанное второе растение огурца включает по меньшей мере pm-h в виде рецессивного гена. Указанное второе растение огурца представляет собой в данном случае по меньшей мере гетерозиготу, предпочтительно, гомозиготу по рецессивному pm-h признаку. В другом предпочтительном варианте осуществления указанное второе растение огурца является чувствительным к клостеровирусу и, более предпочтительно, является инбредным растением.
В другом аспекте изобретение относится к гибридному растению, полученному путем выращивания семени F1 по изобретению, как описано ранее.
В другом аспекте изобретение относится к части гибридного растения по изобретению, как описано ранее. Предпочтительно, указанная часть растения выбрана из пыльцы, семязачатков, листьев, корней, кончиков корней, пыльников, цветов, плодов, стеблей, отростков, прививочных черенков, корневых побегов, семян, протопластов и каллий и, предпочтительно, указанная часть растения представляет собой плоды.
Как указано выше, интрогрессия генетического элемента, незаменимого для устойчивости к РМ или к клостеровирусу, путем скрещивания растений, каждое из которых устойчиво только к одному заболеванию, как считают, приводит к потере генетического элемента, незаменимого для устойчивости к другому заболеванию. С помощью настоящего открытия авторы изобретения разработали схемы селекции, с помощью которых данная проблема может быть решена с получением при этом требуемых растений с двойной устойчивостью. Авторы настоящего изобретения раскрыли, что для эффективного создания растения огурца с двойной устойчивостью из гибрида между растением родительской линии огурца, устойчивой к клостеровирусу, где указанная устойчивость обусловлена QTL-1, и растением линии огурца, устойчивой к РМ, где указанная устойчивость обусловлена pm-h и pm-l, процесс скрещивания должен включать стадию разрешения образования рекомбинантов (т.е. допускать осуществление актов гомологичной рекомбинации в одной хромосоме) с последующей стадией отбора растений, имеющих QTL-1 и pm-l или QTL-1 и pm-h в одной хромосоме. Предпочтительно, указанная стадия отбора включает отбор растений, имеющих QTL-1 и pm-l и pm-h в одной хромосоме. Еще более предпочтительно, QTL-1 вводят в геномный регион между регионами, содержащими pm-h и pm-l, так что фактически QTL-1 для клостеровируса размещен между двумя QTL устойчивости к РМ.
Присутствие любого QTL, описанного в настоящем документе, связанного с устойчивостью к РМ или к клостеровирусу, может быть выявлено путем обнаружения одного или нескольких генетических маркеров, связанных с соответствующим QTL на хромосоме растения, генетических маркеров нарушения равновесия связи с соответствующим QTL на хромосоме растения или их комбинации.
Подходящий способ выявления присутствия и/или расположения указанных QTL в указанных растениях включает применение AFLP маркеров, характеризующих указанные QTL. Предпочтительно, указанная стадия отбора растений, имеющих QTL-1 и pm-l и pm-h в одной хромосоме, включает обнаружение по меньшей мере одного AFLP маркера, характеризующего локус количественного признака QTL-1, связанный с устойчивостью к клостеровирусу на той же хромосоме, которая содержит локус количественного признака (QTL) для pm-l или, альтернативно, на той же хромосоме, которая содержит локус количественного признака (QTL) для pm-h, связанного с устойчивостью к РМ, предпочтительно, на той же хромосоме, которая содержит локусы количественных признаков pm-h и pm-l, и в этом случае указанный маркер QTL-1 расположен в хромосомальном регионе между QTL pm-h и QTL pm-l. Таким образам, процесс отбора может включать обнаружение одного или нескольких маркеров, выбранных из группы маркеров, состоящих из маркеров таблицы 2, 3 и 4.
В другом аспекте настоящее изобретение относится к способу отбора растения вида Cucumis sativus, у которого показана устойчивость к клостеровирусу огурцов и к мучнистой росе огурцов, включающий обнаружение в указанном растении присутствия на одной хромосоме QTL-1 и по меньшей мере одного из QTL pm-l и pm-h.
В одном из вариантов осуществления данного способа способ включает стадии:
а) предоставления образца геномной ДНК из растения огурца, указанный образец содержит фрагменты геномной ДНК достаточной длины;
b) проведение реакции очистки для отбора фрагментов, которые содержат по меньшей мере первый QTL или молекулярный маркер, связанный с этим, из группы, состоящей из QTL-1, pm-l и pm-h;
с) выполнение реакции амплификации нкулеиновых кислот на указанных выбранных фрагментах для обнаружения фрагментов, которые включают по меньшей мере второй QTL или молекулярный маркер, связанный с этим, из группы, состоящей из QTL-1, pm-l и pm-h, и
d) обнаружение в продукте реакции стадии с) амплифицированного фрагмента ДНК, имеющего прогнозированную длину или прогнозированную последовательностью нуклеиновой кислоты.
В предпочтительном варианте осуществления указанная стадия b) включает применение по меньшей мере одного набора праймеров для определения молекулярного маркера для указанного первого QTL или применение по меньшей мере одного зонда для нуклеиновой кислоты с основной последовательностью, которая, по существу, комплементарна последовательности нуклеиновой кислоты, определяющей указанный маркер, и зонда для нуклеиновой кислоты, который специфически гибридизуется в жестких условиях гибридизации с последовательностью нуклеиновых кислот, определяющей указанный маркер(ы).
В другом предпочтительном варианте осуществления указанная стадия с) включает применение по меньшей мере одного набора праймеров для определения указанного второго QTL или применение по меньшей мере одного набора праймеров, которые специфически гибридизируются в жестких условиях с последовательностью нуклеиновых кислот молекулярного маркера указанного второго QTL.
В другом варианте осуществления способ по изобретению имеет стадию обнаружения в указанном растении присутствия указанных QTL на одной хромосоме осуществляют с применением техник гибридизации in situ или техник амплификации in situ. В свою очередь, в данных способах подходящим образом используют зонды и праймеры для определения молекулярного маркера для указанных QTL или те, которые специфически гибридизируются в жестких условиях с последовательностью нуклеиновых кислот молекулярного маркера для указанной QTL.
В аспектах изобретения молекулярные маркеры представляют собой, предпочтительно, SNP, маркеры мутации вставки или маркеры AFLP, более предпочтительно, маркеры, выбранные из группы, состоящей из маркеров, перечисленных в таблицах 2-4, и маркеры из ссылок литературы, специально приводимых в настоящем документе.
В другом аспекте настоящее изобретение относится к способу получения растения вида Cucumis sativus, у растения которого показана устойчивость к клостеровирусу огурцов и к мучнистой росе огурцов, включающему стадии:
а) отбора первого растения огурца, которое включает хромосомальный регион, который придает устойчивость к клостеровирусу огурца, путем обнаружения в геноме указанного растения присутствия по меньшей мере одного маркера, связанного с QTL, придающим устойчивость к клостеровирусу огурцов, показанным маркерами E16/M50-244, E16/M50-188 и E11/M48-251;
b) отбора второго растения огурца, которое включает по меньшей мере один хромосомальный регион, который придает устойчивость к мучнистой росе, путем обнаружения в геноме указанного растения присутствия по меньшей мере одного маркера, связанного с первым QTL, придающим устойчивость к мучнистой росе, показанным следующими маркерами:
- маркер однонуклеотидного полиморфизма 39T→G в SEQ ID NO:1,
- маркер однонуклеотидного полиморфизма 29G→A в SEQ ID NO:2 и
- маркеры E16/M50-F-194, E11/M48-F-251, E23/M38-M001; или
путем обнаружения в геноме указанного растения присутствия по меньшей мере одного маркера, связанного со вторым QTL, придающим устойчивость к мучнистой росе, показанным следующими маркерами:
- маркер однонуклеотидного полиморфизма 193C→T в SEQ ID NO:3,
- мутация вставки 5'-AATTT-3' в позиции 221 в SEQ ID NO:4 и
- маркеры E23/M40-M003, E24/M46-M002, E24/M46-M003, E12/M91-M003, E26/M43-M003, E14/M59-F-134 и E14/M59-F-200;
с) скрещивания указанных растений из стадии а) и стадии b) для получения F1 семян;
d) выращивания некоторого количества семян F1 в растения F1, создание следующей популяции потомков из указанных растений F1 путем скрещивания или самоопыления и
e) отбора из числа следующих растений-потомков растения, которое включает по меньшей мере один маркер, связанный с QTL, придающим устойчивость к клостеровирусу огурца, как определено на стадии а), и по меньшей мере один маркер, связанный с QTL, придающим устойчивость к мучнистой росе огурца, как определено на стадии b).
Специалисту в данной области понятно, что указанная следующая популяция потомков должна быть достаточного размера, который позволяет обнаружить присутствие растений в указанной следующей популяции потомков, которые перенесли по меньшей мере два акта гомологичной рекомбинации на одной хромосоме. В целом, популяция из примерно 1000 растений должна быть достаточной. Преимуществом техники селекции с предлагаемым маркером является то, что в популяции таких размеров можно легко провести отбор на присутствие интересующих генотипов, которые могут не выявляться фенотипически.
В предпочтительном варианте осуществления способа по настоящему изобретению стадия отбора второго растения огурца на стадии b) включает отбор второго растения огурца, имеющего только один из указанных, первый или второй, QTL, придающий устойчивость к мучнистой росе огурца, и где указанный способ дополнительно включает стадию:
f) отбора третьего растения огурца, имеющего другой, чем указанные первый или второй, QTL, придающие устойчивость к мучнистой росе огурца (т.е. QTL, который не представлен в указанном втором растении огурца);
g) скрещивания растений F1, полученных на стадии е), с указанным третьим растением огурца для получения последующих растений-потомков и
h) отбора из числа растений-потомков растения, которое включает QTL, придающий устойчивость к клостеровирусу огурца, как определено на стадии а), и оба QTL, придающие устойчивость к мучнистой росе огурца, как определено на стадии b).
В предпочтительном варианте осуществления выбирают растения, которые включают оба локуса pm-h и pm-l, придающих устойчивость к мучнистой росе, и в которых локус, придающий устойчивость к клостеровирусу, характеризующийся QTL-1, расположен между локусами pm-h и pm-l, придающими устойчивость к мучнистой росе.
Таким образом, в другом предпочтительном варианте осуществления способа получения растения вида Cucumis sativus, у которых показана устойчивость к клостеровирусу и к мучнистой росе огурца, стадия отбора растения огурца, которое содержит хромосомальный регион, который придает устойчивость к мучнистой росе огурца, как определено на стадиях b), e), f) или h), включает:
- обнаружение присутствия в геноме указанного растения по меньшей мере одного маркера, связанного с первым QTL, придающим устойчивость к мучнистой росе огурцов, показанным SNP маркером 39Т→G в SEQ ID NO:1, SNP маркером 29G→A в SEQ ID NO:2 и маркерами E16/M50-F-194, E11/M48-F-251, E23/M38-M001; и
- обнаружение в геноме указанного растения присутствия по меньшей мере одного маркера, связанного со вторым QTL, придающим устойчивость к мучнистой росе огурцов, показанным SNP маркером 193C→T в SEQ ID NO:3, мутацией вставки 5'-AATTT-3' в позиции 221 в SEQ ID NO:4 и маркерами E23/M40-M003, E24/M46-M002, E24/M46-M003, E12/M91-M003, E26/M43-M003, E14/M59-F-134 и E14/M59-F-200.
В другом предпочтительном варианте осуществления способа получения растения вида Cucumis sativus, у которого показана устойчивость к клостеровирусу и к мучнистой росе огурца, по меньшей мере одна из стадий a), b), e), f) или h) включает стадию получения образца геномной ДНК из указанного растения и обнаружения в указанном образце геномной ДНК указанного по меньшей мере одного маркера.
В альтернативном предпочтительном варианте осуществления стадия е) включает обнаружение в геноме растений по меньшей мере одного маркера, связанного с QTL-1, и по меньшей мере одного маркера, связанного с pm-h и pm-l, предпочтительно, обнаружение в геноме растений и на одной хромосоме по меньшей мере одного маркера, связанного с QTL-1, по меньшей мере одного маркера, связанного с pm-h, и по меньшей мере одного маркера, связанного с pm-l, предпочтительно, содержание маркеров, выбраных из группы маркеров, перечисленных в таблицах 2, 3 и 4.
В другом предпочтительном варианте осуществления стадию е) осуществляют способом по изобретению для отбора растения вида Cucumis sativus с двойной устойчивостью, как описано выше.
Следует понимать, что способ, описанный в стадиях с)-е), в котором происходит по меньшей мере два акта гомологичной рекомбинации в одной хромосоме при однократном скрещивании с продукцией F1 с двойной устойчивостью, может быть осуществлен при многократных генерациях таких, так что предлагаемые (по меньшей мере два) акта гомологичной рекомбинации и, таким образом, образование растения с двойной устойчивостью реализуется в F2, F3, F4, F5 или в любой последующей генерации. Такие вариации входят в рамки настоящего изобретения и могут быть легко осуществлены специалистом в данной области.
В альтернативном способе получения растения вида Cucumis sativus, которое устойчиво к клостеровирусу и к мучнистой росе огурца, способ может включать стадии:
а) отбора первого растения вида Cucumis sativus с устойчивостью к клостеровирусу и к мучнистой росе огурца осуществлением способа по изобретению;
b) инбридинга указанного растения с получением линии растений, гомозиготной по указанным QTL;
с) скрещивания указанных растений стадии а) и стадии b) с получением семян F1;
d) выращивания семян F1 в растения F1.
В другом аспекте изобретение относится к растениям, полученным способами по изобретению, или к их частям.
Настоящее изобретение делает возможным очень быстрый скрининг растений-потомков с целью отбора растений, способных к двойной устойчивости. Например, среди растений-потомков можно обнаружить растения, которые имеют по меньшей мере один из pm-h маркеров, по меньшей мере один из pm-l маркеров и по меньшей мере один из QTL-1 маркеров. Эти растения, возможно, приобрели желаемую интрогрессию. Скрининг дополнительных маркеров может повысить уровень достоверности прогноза того, что растение-потомок имеет двойную устойчивость. После обнаружения растений с по меньшей мере одним маркером каждого из трех QTL растение может быть отобрано и использовано в программах разведения или в дополнительных экспериментах по определению характеристик.
Преимуществом растений по настоящему изобретению, в котором признаки расположены на одной и той же хромосоме, является то, что они предоставляют улучшенные возможности для более свободного перемещения генов, которые контролируют обе формы устойчивости, в другие (гибридные) растения при использовании обычного разведения, хотя если признаки были расположены на отдельных хромосомах, то было бы намного сложнее получить гибриды, содержащие сочетание обоих признаков путем применения техник обычного разведения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
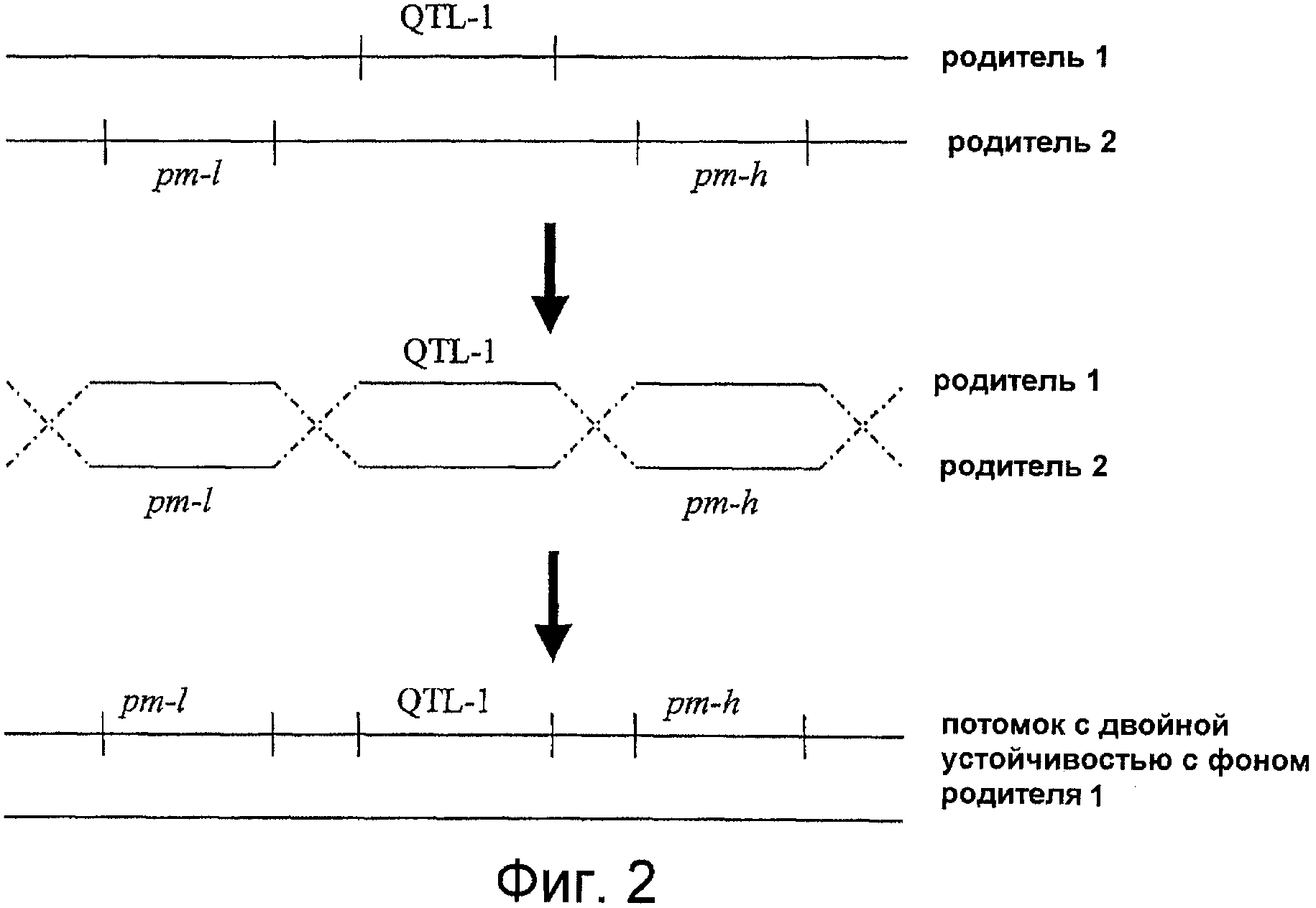
На фигурах 1-6 показаны возможные сценарии рекомбинации, в которых устойчивость к мучнистой росе (pm) и к клостеровирусу (QTL-1) двух отдельных растений объединяют в одном растении-потомке. Следует учитывать, что различные родители, указанные как имеющие локусы множественной устойчивости, сами могут быть результатом скрещиваний или самоопыления. Таким образом, растение, имеющее оба QTL, pm-l и pm-h, может быть получено скрещиванием растений, имеющих один QTL.
На фигуре 7 показано расположение различных генов устойчивости к мучнистой росе (pm) из Cucumis sativus NPI и генов устойчивости к клостеровирусу (QTL-1) из C.sativus Khira в одной группе сцепления. В настоящем документе Pm-leaf является эквивалентом pm-l и Pm hypo является эквивалентом pm-h.
На фигуре 8 показана последовательность ДНК в районе SNP и маркеры вставки, которые показаны с помощью соответствующих SEQ ID в таблицах 2 и 3.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Термин "огурец", использованный в настоящем документе, относится к растению, или его части, вида Cucumis sativus, включающему, без ограничения, растения, обычно обозначаемые как огурец (Cucumber), американский корнишон (American gherkin), кассабанана (Cassabanana), зеленец (Cuke), корнишон (Gherkin), парниковый огурец (Hothouse cucumber), огурец-лимон (Lemon cucumber), огурец Mandera (Mandera cucumber), корнишон (Pickling cucumber), змеевидный огурец (Serpent cucumber), салатный огурец (Slicing cucumber), змеевидный огурец (Snake cucumber) и огурец вестиндский (West Indian gherkin).
Использованный в настоящем документе термин "часть растения" обозначает часть растения, включая единичные клетки и клеточные ткани, такие как растительные клетки, которые являются интактными в растениях, скопления клеток и культуры клеток, из которых могут быть регенерированы растения. Примеры частей растения включают, без ограничения, единичные клетки и ткани из пыльцы, семязачатков, листьев, эмбрионов, корней, кончиков корней, пыльников, цветов, плодов, боковых побегов; так же, как и пыльцу, семязачатки, листья, эмбрионы, корни, отростки корней, пыльники, цветы, стебли отростков, побеги, корневые побеги, семена, протопласты и каллии и т.п.
Термин "клостеровирус", использованный в настоящем документе, относится к вирусу семейства Closteriviridae, включающему, но ими не ограничивающийся, вирусы, обычно называемые вирусом болезни желтой задержки роста огурца (CYSDV), вирусом инфекционной желтухи салата (LIYV), вирусом псевдожелтухи свеклы (BPYV; также известный под синонимами вирус хлоротической пятнистости огурца (CCSV), вирусом желтухи огурца, вирусом желтухи мускатной дыни или вирус паллидоза клубники), предпочтительно, BPYV и CYSDV, наиболее предпочтительно, CYSDV. Предпочтительно в отношении растений огурца термин "клостеровирус" относится к роду особо важного для растений огурцов, т.е. Criniviideae.
Термин "мучнистая роса", использованный в настоящем документе, относится к грибковому заболеванию, вызываемому в огурце (Cucumis sativus L.) грибом Sphaerotheca fuliginea (также известным как Podosphaera xanthii и S.cucurbitae), и/или грибом Erysiphe cichoracearum (также известным как Golovinomyces cichoracearum), и/или грибом Leveillula taurica (также известным как Oidiopsis taurica, Erysiphe taurica, Ovulariopsis cynarea, Leveillula solanacearum).
Термин "QTL" используют в настоящем документе в его принятом в данной области значении хромосомального региона, содержащего аллели (например, в форме генов или регуляторных последовательностей), связанные с экспрессией постоянно представленного (количественного) фенотипического признака.
Термин "QTL устойчивости к заболеванию" относится к региону, расположенному на конкретной хромосоме, который связан по меньшей мере с одним из генов, который кодирует устойчивость, или по меньшей мере с регуляторным регионом, т.е. регионом хромосомы, который контролирует экспрессию одного или нескольких генов, связанных с устойчивостью. Для рассмотрения QTL, связанных с устойчивостью, в настоящем документе используют более короткий эквивалент "локус, придающий устойчивость". QTL могут быть установлены путем выявления их генетической локализации в геноме специфического образца Cucumis sativus, используя один или несколько молекулярных генетических маркеров. Один или несколько маркеров, в свою очередь, выявляют специфический локус. Расстояния между локусами обычно измеряют за счет частоты кроссинговера между локусами на той же самой хромосоме. Чем более отдаленными являются два локуса, тем более вероятен между ними кроссинговер. И напротив, если два локуса находятся рядом друг с другом, то кроссинговер (между ними) менее вероятен. Как правило, один сантиморган (функция карт Косамби (сМ)) приблизительно эквивалентна 1% рекомбинации между локусами (маркерами) (Lui, 1997). Когда QTL может быть показан множественными маркерами, то генетическое расстояние между маркерами концевых точек указывает размер QTL.
Термин "хромосома" используют в настоящем документе в его принятом в данной области значении самореплицирующейся генетической структуры в клеточном ядре, содержащей клеточную ДНК и несущей в своей нуклеотидной последовательности линейный набор генов.
Использованный в настоящем документе термин "группа сцепления" относится ко всем генам или генетическим признакам, которые расположены на одной и той же хромосоме. Внутри группы сцепления те локусы, которые достаточно близки друг к другу, будут образовывать сцепление при генетических скрещиваниях. Поскольку вероятность кроссинговера повышается при физической отдаленности генов на хромосоме, то гены, чье расположение значительно удалено друг от друга внутри группы сцепления, могут не проявлять какого-либо сцепления в прямых генетических тестах. Термин "группа сцепления" используют, главным образом, в отношении генетических локусов, у которых наблюдается сцепленное поведение в генетических системах, где хромосомальные распределения еще не были сделаны. Таким образом, в настоящем контексте термин "группа сцепления" является синонимом (физический объект) хромосомы.
Использованный в настоящем документе термин "аллель (аллели)" означает любую одну или несколько из альтернативных форм гена и относится по меньшей мере к одному признаку или характеристике. В диплоидной клетке два аллеля данного гена занимают соответствующие локусы на паре гомологичных хромосом. Поскольку настоящее изобретение относится к QTL, т.е. геномным регионам, которые могут включать один или несколько генов или регуляторных последовательностей, то в ряде случаев более точно говорить о "гаплотипе" (т.е. аллеле хромосомального сегмента) вместо аллеля, однако в таких случаях следует понимать, что термин "аллель" включает термин "гаплотип".
В настоящем документе "геном" обозначает единицу наследственности, состоящую из последовательности ДНК, которая занимает специфическое положение на хромосоме и которая содержит генетическое указание для конкретной характеристики или признака организма.
В настоящем документе "локусом" обозначают позицию, которую занимает данный ген или регуляторная последовательность на хромосоме данного вида.
"Гомологичная рекомбинация" представляет собой обмен ("кроссинговер") фрагментами ДНК между двумя молекулами ДНК или хроматидами парных хромосом в регионе идентичных нуклеотидных последовательностей. Под "актом рекомбинации" в настоящем документе следует понимать мейотический кроссинговер.
Использованный в настоящем документе термин "молекулярный маркер" относится к индикатору, который используют в способах визуализации различий в характеристиках последовательностей нуклеиновых кислот. Примерами таких индикаторов являются маркеры полиморфизма длины рестрикционных фрагментов (RFLP), маркеры полиморфизма длины амплифицированных фрагментов (AFLP), однонуклеотидные полиморфизмы (SNP), мутации вставки, микросателлитные маркеры (SSR), маркеры амплифицированного региона с охарактеризованной последовательностью (SCAR), маркеры расщепленной амплифицированной полиморфной последовательности (CAPS) или изоферментные маркеры или комбинации маркеров, описанных в настоящем документе, которые определяют специфическое генетическое или хромосомальное расположение. "Молекулярный маркер, связанный с QTL", как определено в настоящем документе, может, таким образом, относится к SNP, мутациям вставки, а также к более привычным AFLP маркерам или к любому другому типу маркера, применяемому в данной области. В контексте AFLP маркеров, упомянутых в настоящем документе, маркеры показывают специфическую последовательность ДНК огурца, фланкированную двумя AFLP-праймерами, такие праймеры состоят из "центральных праймеров" Е и М, соответствующих сайтам рестрикции ферментов EcoRI и MseI, (Vos et al., 1995; Bai et al. 2003), за которыми следуют 2 или 3 дополнительных селективных основания в качестве индикаторных, каждое сопровождается двухзначным кодом, идентифицирующим селективные нуклеотиды, с помощью которых увеличивается "центральный праймер" (коды указаны в таблице 1).
E16/M50-244 представляет собой маркер, полученный с использованием праймеров амплификации EcoRI + CC и MseI + CAT, для получения фрагмента, имеющего общую длину 244 п.о. Длина фрагмента может зависеть от способа, использованного для обнаружения фрагмента, и представляет собой приближенное значение его истинной длины плюс или минус несколько оснований. При определении маркера, как предусмотрено в настоящем документе, должна быть сделана ссылка на положение на хромосоме этого маркера относительно других маркеров в карте сцепления. Таким образом, маркер E16/M50-244 определяют с помощью последовательности его праймеров и с помощью его длины в качестве продукта амплификации и с помощью его положения относительно E14/M59-F-200 и/или E23/M38-M003 или, как предусмотрено в настоящем документе, с помощью его положения относительно других маркеров, как показано в пронумерованном списке, с соответствующим расстоянием в cM в матриксе, в таблице 4. Однако следует принимать во внимание, что скрещивания растений могут приводить к потере определенных маркеров, так что отсутствие определенного маркера не исключает присутствия генетического элемента, который придает устойчивость к заболеванию и с которым связан указанный маркер.
Термин "специфическая ДНК последовательность огурца" обозначает полинуклеотидную последовательность с гомологией нуклеотидной последовательности более чем 80%, предпочтительно, более чем 85%, более предпочтительно, более чем 90%, еще более предпочтительно, более чем 95%, еще более предпочтительно, более чем 97%, наиболее предпочтительно, более чем 99%, с последовательностью генома вида Cucumis sativus, которая демонстрирует наибольшее сходство с ней, предпочтительно, в случае маркеров QTL-1, часть последовательности ДНК образца огурца PI 250147, фланкирующая маркеры QTL-1.
Термин "гомология нуклеотидной последовательности", использованный в настоящем документе, обозначает гомологию между двумя полинуклеотидами. Полинуклеотиды имеют "гомологичные" последовательности, если последовательность нуклеотидов в двух последовательностях является одинаковой, если она выровнена для максимального соответствия. Сравнение последовательностей двух или более полинуклеотидов обычно проводят путем сравнения частей двух последовательностей в окне сравнения для установления и сравнения сходства локальных регионов в последовательностях. Окно сравнения обычно составляет от 20 до 200 соседних нуклеотидов. "Процент гомологии последовательностей" полинуклеотидов, такой как 50, 60, 70, 80, 90, 95, 98, 99 или 100 процентов гомологии последовательностей, может быть установлен путем сравнения двух оптимально выровненных последовательностей в окне сравнения, где часть полинуклеотидной последовательности в окне сравнения может включать добавления или делеции (т.е. пропуски) по сравнению с эталонной последовательностью (которая не содержит добавлений или делеций) для оптимального выравнивания двух последовательностей. Процент рассчитывают с помощью: (а) определения числа положений, в которых одинаковое основание нуклеиновой кислоты находится в обеих последовательностях, и подсчета числа совпавших положений; (b) деления числа совпавших положений на общее число положений в окне сравнения и (с) умножения результата на 100 с получением процента гомологии последовательностей. Оптимальное выравнивание последовательностей для сравнения может быть проведено с помощью компьютерных программ с известными алгоритмами или путем визуальной проверки. Легко доступными алгоритмами сравнения последовательностей и множественного выравнивания последовательностей являются соответственно программы «the Basic Local Alignment Search Tool» (BLAST) (Altschul et al., 1990; Altschul et al, 1997) и «ClustalW», доступные в интернете. Другие подходящие программы включают, не ограничиваясь, GAP, BestFit, PlotSimilarity и FASTA в пакете программного обеспечения Wisconsin Genetics (Genetics Computer Group (GCG), Madison, WI, USA) (Devereux et al., 1984).
Термин "pm-h", использованный в настоящем документе, относится к предполагаемому гену устойчивости к мучнистой росе, экспрессированному в гипокотиле, предпочтительно определяемому по присутствию специфических SNP, перечисленных в таблице 2.
Термин "pm-l", использованный в настоящем документе, относится к предполагаемому гену устойчивости к мучнистой росе pm-leaf, предпочтительно определяемому по присутствию специфических мутаций, перечисленных в таблице 3.
Термин "QTL-1" относится к геномному региону, связанному с устойчивостью к клостеровирусу, определяемому с помощью маркеров E16/M50-244, E16/M50-188 и/или E11/M48-251, описанных подробно в международном патенте WO 02/22836, приведенном в данном контексте в качестве ссылки.
Термин "растение-потомок" относится к любому растению, образующемуся как потомство при вегетативной или половой репродукции от одного или нескольких родительских растений или их потомков. Например, растение-потомок может быть получено клонированием или самооплодотворением родительского растения или скрещиванием двух родительских растений и охватывает самоопыление так же, как и F1 или F2 или еще более отдаленные генерации.
F1 представляет собой потомок первой генерации, полученный от родителей, по меньшей мере один из которых используют первый раз в качестве донора признака, в то время как потомок второй генерации (F2) или последующих генераций (F3, F4 и т.д.) представляет собой экземпляры, полученные самоопылением растений F1, F2 и т.д. Таким образом, F1 может быть (и обычно является) гибридом, полученным в результате скрещивания двух гомозиготных родителей, в то время как F2 может быть (и обычно является) потомком, полученным в результате самоопыления указанных F1 гибридов.
Использованный в настоящем документе термин "гетерозигота" означает такое генетическое состояние, когда различные аллели располагаются в соответствующих локусах на гомологичных хромосомах.
Использованный в настоящем документе термин "гомозигота" означает такое генетическое состояние, когда одинаковые аллели располагаются в соответствующих локусах на гомологичных хромосомах.
Термин "гибрид" в контексте разведения растений относится к растению, которое является потомком генетически отличающихся родителей, полученный путем скрещивания растений различных линий, или пород, или видов, включая, но ими не ограничиваясь, скрещивание между двумя инбредными линиями.
Использованный в настоящем документе термин "инбредный" означает, по существу, гомозиготного индивида или линию.
Использованные в настоящем документе термины "интрогрессия", "интрогрессивный" и "интрогрессирующий" относятся как к естественному, так и к искусственному процессу, при котором геномные регионы одного вида, сорта или культивара переносят в геном другого вида, сорта или культивара путем кроссиноговера указанных видов. Процесс, необязательно, может быть дополнен обратным кроссинговером с рекуррентным родителем.
"Генная инженерия", "трансформация" и "генетическая модификация" используются в настоящем документе как синонимы перемещения изолированных и клонированных генов в ДНК, обычно в хромосомную ДНК или геном, другого организма.
Использованный в настоящем документе термин "популяция" означает генетически гетерогенную совокупность растений, имеющих общее генетическое происхождение.
Использованные в настоящем документе термины "сорт" и "культивар" означают группу похожих растений, которые по структурным или генетическим особенностям и/или по продуктивности могут быть обособлены от других сортов одного вида.
Термины "устойчивый" и "устойчивость" включают частичную и полную устойчивость к инфекции. Чувствительное растение может или быть неустойчивым, или иметь низкие уровни устойчивости к инфекции. Термин используется для включения таких отдельно идентифицируемых форм устойчивости, как "полная устойчивость", "иммунитет", "средняя устойчивость", "частичная устойчивость", "гиперчувствительность" и "толерантность".
"Полная устойчивость" относится к полной неспособности заболевания развиться после инфицирования, и она может быть либо результатом неспособности заболевания проникнуть в клетку (нет начальной инфекции), либо может быть результатом неспособности агента размножаться в клетке и инфицировать последующие клетки (нет сублиминальной инфекции, нет распространения).
Термин "чувствительный" используют в настоящем документе по отношению к растению, не имеющему устойчивости к заболеванию, приводящему к поражению растения заболеванием, влекущим за собой симптомы заболевания. Термин "чувствительный" соответственно является эквивалентным термину "неустойчивый".
Термин "гибрид" в контексте нуклеиновых кислот относится к двухцепочечной молекуле нуклеиновой кислоты, или дуплексу, образованному водородной связью между комплементарными нуклеотидными основаниями.
Термины "гибридизировать" или "ренатурировать" относятся к процессу, с помощью которого одиночные цепи последовательностей нуклеиновых кислот образуют двуспиральные сегменты при помощи водородной связи между комплементарными основаниями.
Термин "зонд" относится к одноцепочечной олигонуклеотидной последовательности, которая образует водородно-связанный дуплекс с комплементарной последовательностью в аналите мишеневой последовательности нуклеиновых кислот или ее производной кДНК.
Термин "праймер", использованный в настоящем документе, относится к олигонуклеотиду, который способен к ренатурации с мишенью амплификации и позволяет присоединиться ДНК-полимеразе, являясь при этом точкой инициации синтеза ДНК, при помещении в условия, при которых индуцируется синтез продукта, удлиняющегося за счет праймера, т.е. в присутствии нуклеотидов и агента полимеризации, такого как ДНК-полимераза, и при соответствующей температуре и рН. Для максимальной эффективности в амплификации праймер (амплификации) предпочтительно является одноцепочечным. Предпочтительно, праймер представляет собой олигодезоксирибонуклеотид. Праймер должен быть достаточно длинным для запуска синтеза удлиняющихся сегментов в присутствии агента полимеризации. Конкретные значения длины праймеров зависят от многих факторов и включают температуру и композицию (содержание А/Т и G/C) праймера. Пара двунаправленных праймеров состоит из одного прямого и одного обратного праймера, обычно используемых для амплификации ДНК, например для ПЦР-амплификации. Следует понимать, что термин "праймер", использованный в настоящем документе, может относиться более чем к одному праймеру, особенно в случае, где есть некоторая неоднозначность информации о терминальной последовательности (последовательностях) мишеневого региона для амплификации. Поэтому термин "праймер" включает группу олигонуклеотидов праймеров, содержащую последовательности, представляющие возможные варианты в последовательности, или включает нуклеотиды, которые позволяют типичное соединение пар оснований. Олигонуклеотидные праймеры могут быть получены любым подходящим способом. Способы получения олигонуклеотидов специфической последовательности хорошо известны в данной области и включают, например, клонирование и рестрикцию подходящих последовательностей и прямой химический синтез. Способы химического синтеза могут включать, например, фосфоди- или фосфотриэфирный способ, диэтилфосфорамидатный способ и способ на твердой подложке, описанный, например, в международном патенте WO 4458066. Праймеры, по желанию, могут быть помечены включением в них средств, определяемых, например, спектроскопически, флюоресцентно, фотохимически, биохимически, иммунохимически или химическими средствами. Зависимое от матрицы удлинение олигонуклеотидного праймера (праймеров) катализируется полимеризующим агентом в присутствии соответствующих количеств четырех дезоксирибонуклеотидтрифосфатов (dATP, dGTP, dCTP и dTTP, т.е. dNTP) или их аналогов в реакционной среде, которая включает подходящие соли, катионы металлов и буферную систему рН. Подходящие полимеризующие агенты включают ферменты, которые катализируют синтез ДНК, зависимый от праймера и матрицы. Известные ДНК-полимеразы включают, например, ДНК-полимеразу I E.coli или фрагмент Кленова, Т4 ДНК-полимеразу и Taq ДНК-полимеразу. Условия реакции катализа синтеза ДНК с данными ДНК-полимеразами известны в данной области. Продукты синтеза представляют собой двойные молекулы, состоящие из цепочек матрицы и цепочек удлинения праймера, которые включают заданную последовательность. Данные продукты, в свою очередь, служат в качестве матрицы другого цикла репликации, цепочка удлинения праймера первого цикла ренатурируется со своим комплементарным праймером; синтез дает короткий продукт, который связывается по обоим 5'- и 3'-концам последовательностей праймера или их дополнениями. Повторяющиеся циклы денатурации, ренатурации праймера и удлинения приводят к экспоненциальному накоплению целевого региона, определенного праймерами.
Для получения желаемого количества полинуклеотида, содержащего мишеневый регион нуклеиновой кислоты, проводят достаточное число циклов. Желаемое количество может изменяться и определяется функцией полинуклеотидного продукта. ПЦР-метод подробно описан в руководствах и хорошо известен специалисту в данной области.
После амплификации с помощью ПЦР мишеневые полинуклеотиды можно определить гибридизацией с полинуклеотидом зонда, который образует стабильный гибрид с такой мишеневой последовательностью, при условиях гибридизации и отмывки в условиях от жестких до умеренно жестких. Если ожидают, что зонды будут, по существу, комплементарны (т.е. около 99% или более) мишеневой последовательности, то используют жесткие условия. Если ожидают некоторое несовпадение, например, если ожидают варианты штаммов с таким результатом, что зонд не будет полностью комплементарен, то жесткость гибридизации может быть уменьшена. Однако выбирают условия, которые исключают неспецифическое/случайное связывание. Условия, которые влияют на гибридизацию и которые подбирают против неспецифического связывания, известны в данной области и описаны, например, в Sambrook и Russell, 2001. В целом, белее низкая концентрация соли и более высокая температура повышают жесткость условий гибридизации.
Фраза "жесткие условия гибридизации" относится к условиям, при которых полинуклеотид будет гибридизироваться со своей мишеневой последовательностью, обычно в комплексной смеси нуклеиновых кислот, но существенно без других последовательностей. Жесткие условия зависят от последовательности и будут различаться при различных обстоятельствах. Подробное описание гибридизации нуклеиновых кислот можно найти в Tijssen, 1993. Как правило, выбирают жесткие условия, которые на 5-10°C ниже, чем точка плавления (Tm) для специфической последовательности при определенной ионной силе рН. Tm представляет собой температуру (при определенной ионной силе pH и концентрации нуклеиновых кислот), при которой 50% зондов, комплементарных мишени, гибридизуется с мишеневой последовательностью в положении равновесия (поскольку мишеневые последовательности представлены в избытке, в Tm, 50% зондов находится в положении равновесия).
Жесткими условиями являются такие условия, при которых концентрация соли составляет менее чем 1,0 М ионов натрия, обычно концентрация ионов натрия (или других солей) составляет примерно от 0,01 до 1,0 M при рН от 7,0 до 8,3, и температура равна по меньшей мере 30°C для коротких зондов (например, от 10 до 50 нуклеотидов) и по меньшей мере 60°C для длинных зондов (например, более 50 нуклеотидов). Жесткие условия могут быть достигнуты путем добавления дестабилизирующих агентов, таких как формамид.
Для селективной или специфической гибридизации положительный сигнал равен по меньшей мере двухкратной, предпочтительно, 10-кратной фоновой гибридизации. Примерными условиями жесткой гибридизации часто являются следующие условия: 50% формамид, 5×SSC и 1% SDS, инкубирование при 42°C, или 5×SSC, 1% SDS, инкубирование при 65°C, с отмывкой в 0,2×SSC и 0,1% SDS при 65°C. Для ПЦР температура около 36°C является типичной для нестрогой амплификации, хотя температуры отжига могут меняться между примерно 32°C и 48°C, в зависимости от длины праймера. Дополнительные рекомендации для подбора параметров гибридизации предоставлены в многочисленных ссылках (например, Ausubel, et al., 1999).
Описание предпочтительных вариантов осуществления
Получение растений с двойной устойчивостью
Целью селекционных программ в сельском хозяйстве и садоводстве является усиление продуктивности растений путем улучшения их генетического состава. В сущности, такое улучшение нарастает с увеличением частоты наиболее благоприятных аллелей генов, влияющих на представляющие интерес характеристики продуктивности. Линии диких растений обеспечивают богатые ресурсы генетического и фенотипического многообразия. В сельскохозяйственной или садовой практике традиционно используют указанное многообразие путем отбора линии дикого растения или его потомков для желаемых генотипических или потенциальных фенотипических свойств, скрещивания его с линией, имеющей дополнительные желаемые генотипические или потенциальные фенотипические свойства, и отбора среди растений-потомков тех растений, которые демонстрируют (увеличение частоты) желаемые генотипические или потенциальные фенотипические свойства.
Все большее понимание и использование законов менделевской наследственности в комбинации со средствами молекулярной генетики облегчили процесс селекции в последнее столетие. Например, стали доступны способы отбора растений с желаемыми генотипическими или потенциальными фенотипическими свойствами, основанными на тестировании указанного растения на присутствие локуса количественного признака (QTL), т.е. на присутствие хромосомального региона, содержащего аллели, связанные с экспрессией непрерывно представленного (количественного) фенотипического признака. Обычно QTL характеризуется одним или несколькими маркерами, которые статистически связаны с количественным разнообразием в фенотипическом признаке, и, по существу, он является синонимом гена. Картирование QTL позволяет идентифицировать локусы-кандидаты, влияющие на экспрессию признака, представляющего интерес. В селекции растений картирование QTL позволяет проводить селекцию с помощью маркера (MAS), т.е. селекцию растений, имеющих благоприятные аллели, путем обнаружения в растениях маркеров, связанных с QTL.
Одной из самых больших трудностей программ селекции культурных растений является наличие отрицательной генетической корреляции между отдельными признаками. Например, случай с отрицательной генетической корреляцией между репродуктивной способностью и продуктивностью в различных линиях растений, устойчивых к заболеваниям. Объяснение появляется, если показать, что интрогрессии ДНК из генома одной линии растений в другую могут мешать или влиять на экспрессию основных репродуктивных признаков. Аналогичным образом попытка интрогрессировать генетические последовательности, придающие устойчивость, из одного растения в другое может удалить признаки устойчивости, уже существующие в реципиентной линии.
Знания о наследовании различных признаков позволяют, например, селекцию линий, гомозиготных по QTL, связанному с устойчивостью к заболеванию. Применение знаний о генетическом происхождении и расположении желаемого признака в программе селекции увеличивает точность прогнозированного результата селекции и ускоряет селекцию по сравнению с традиционными программами селекции. Например, тот факт, что генетический базис желаемого признака наследственно связан с другим признаком, помогает повысить однородность указанных двух признаков у потомства, потому что родительская гомозигота по желаемым аллелям будет передавать их большинству потомства, что будет появляться в виде ослабленной сегрегации в потомстве.
Как указывалось ранее, авторы настоящего изобретения исследовали растения, которые были устойчивы к клостеровирусу и к мучнистой росе. Такие растения не были известны ранее. Попытки интрогрессировать ДНК линий, устойчивых к клостеровирусу, в линию растений, уже имеющую устойчивость к мучнистой росе, или наоборот ранее успеха не имели.
Кроме того, авторы изобретения обнаружили, что в растениях с двойной устойчивостью гены устойчивости к клостеровирусу и мучнистой росе являются тесно связанными, что, по существу, они являются одновременно наследуемыми как одна единица. Такую генетическую конфигурацию настолько тесно связанных генов иногда обозначают аллелями в фазе сцепления (in cis). В таких случаях обычно считают, что гены находятся на одной хромосоме. Фактически, если делают ссылку на присутствие генов или QTL на одной хромосоме, то это означает, что они находятся в фазе сцепления.
Авторы изобретения обнаружили, что в растениях с двойной устойчивостью гены устойчивости к клостеровирусу и мучнистой росе представлены в группе сцепления 4. Согласно Horejsi et al. (2000), группа сцепления 4 Cucumis sativus L также включает гены устойчивости к ложной мучнистой росе, (dm) устойчивость. Далее LG 4 можно охарактеризовать (либо) одним либо комбинацией следующих RFLP маркеров (определенных с помощью пакета программного обеспечения INTMAP, Keygene, Wageningen, The Netherlands; положение на карте в cM в скобках): CsC032a/El (25.9); CsP357/H3 (31.7); CsC588/H3 (34.2); CsC477H3 (35.3); CsC694/E5 (38.5); CsP347/H3 (38.5); CsC365/El (41); CsC386/El (41); CsC230/El (41.7); CsP064/El (45.5).
Точный номер хромосомы огурца, на которой расположены QTLl устойчивости к клостеровирусу и pm-l и pm-h устойчивости к мучнистой росе, еще не определен.
Несмотря на это, хромосома может быть обозначена с помощью ссылки на группу сцепления (LG 4), в которой расположены эти и другие геномные регионы. Термин "группа сцепления", использованный в настоящем документе, относится к физической единице генома, на которой находятся аллели, придающие устойчивость, и которая имеет такой же иерархический уровень, как и хромосома.
Последствия обнаружения того, что гены устойчивости к клостеровирусу и pm расположены на одной хромосоме, имеют двойное значение.
Во-первых, для селекционных целей очень удобно иметь гены, расположенные на одной хромосоме, более предпочтительно, еще на наиболее близком сегменте хромосомы, поскольку они будут совместно передаваться растениям-потомкам. В результате физической связи между генами, ответственными за устойчивость к мучнистой росе, и генами, ответственными за устойчивость к клостеровирусу, растения-потомки скрещивания, в котором растение по настоящему изобретению с двойной устойчивостью используют в качестве родителя, обеспечивают низкие частоты сегрегации в растениях-потомках.
Во-вторых, указанные знания могут облегчить селекцию растений, поскольку они дают возможное объяснение, почему так сложно совместить два признака в одной линии растений. Не привязываясь к какой-либо теории, считают, что специфическое положение QTL, ответственного за устойчивость к клостеровирусу, и селекция по такому QTL мешали формированию желаемых интрогрессий или по меньшей мере допускали возникновение очень немногих желаемых интрогрессий. QTL, связанные с устойчивостью к мучнистой росе, и QTL устойчивости к клостеровирусу были расположены в такой тесной близости, что интрогрессия QTL признака второй устойчивости (например, к клостеровирусу) в линию растения, уже имеющего первую устойчивость (например, к мучнистой росе), могла приводить к (частичной) потере признака первой устойчивости. В случаях, когда линия растения имеет оба QTL устойчивости к мучнистой росе (pm-l и pm-h), интрогрессия QTL устойчивости к клостеровирусу может произойти только в очень маленький участок генома, без "повреждения" генетической информации, лежащей в основе устойчивости к мучнистой росе.
Таким образом, помимо обнаружения того, что гены различной устойчивости находились на одной хромосоме, было установлено, что, если оба аллеля устойчивости к мучнистой росе были представлены в растениях с двойной устойчивостью, то QTL, связанный с устойчивостью к клостеровирусу (QTL-1), располагался между двумя QTL, связанными с устойчивостью к PM (pm-h и pm-l).
Это открытие может дополнительно, по меньшей мере частично, объяснить отмеченную низкую частоту рекомбинации в желаемом генотипе. Кроме того, оно предполагает по меньшей мере три возможных сценария того, как данные растения могут "быть созданы", допуская несколько воспроизводимых способов их получения.
Первый способ мог бы включать интрогрессию локуса, придающего устойчивость к клостеровирусу (обозначаемого в настоящем документе как QTL-1) растения первой линии, представляющей интерес, в устойчивое к мучнистой росе растение второй линии, представляющей интерес и несущей два локуса, придающих устойчивость к PM, pm-h и pm-l. Если это дает в результате наследственность второй линии, представляющей интерес, то способ мог бы включать интрогрессию QTL-I в геномный регион между двумя локусами, придающими устойчивость к PM, pm-h и pm-l, чтобы дать в результате набор геномной последовательности ДНК, имеющий конфигурацию pm-l - QTL-1 -pm-h в растении-потомке, имеющем наследственность второй линии, представляющей интерес (смотри фигуру 1). На этом основании предполагают, что только акт двойной гомологичной рекомбинации (т.е. один акт для каждого кроссинговера) в специфическом регионе одной хромосомы способен привести в результате к фенотипу с двойной устойчивостью к клостеровирусу и PM в наследственности второй линии, представляющей интерес.
Установление нужной интрогрессии в растениях-потомках может быть проверено с помощью специфических маркеров QTL-1, pm-1 и pm-h.
Во втором способе возможно объединить признаки устойчивости в другой генетической среде, например, в первой линии, представляющей интерес. Этот способ может включать интрогрессию обоих локусов, придающих устойчивость к PM, pm-h и pm-l, из растения второй линии, представляющей интерес, в растение, устойчивое к клостеровирусу первой линии, представляющей интерес, которая несет локус QTL-I. В данном случае способ мог бы включать интрогрессию обоих локусов, pm-h и pm-l, независимо, по обе стороны от локуса QTL-1, с получением в результате набора генетической последовательности ДНК, имеющий конфигурацию pm-l - QTL-1 - pm-h в растении-потомке, имеющем наследственность первой линии, представляющей интерес (смотри фигуру 2). На основе данной конфигурации предсказывают, что требуется по меньшей мере два акта гомологичной рекомбинации (т.е. четыре акта кроссинговера) в специфических регионах одной хромосомы для получения фенотипа двойной устойчивости по клостеровирусу и по PM. Установление нужной интрогрессии в растениях-потомках опять может быть проверено с помощью специфических маркеров QTL-1, pm-1 и pm-h.
Сказанным выше можно объяснить, почему интрогрессия CYSDV устойчивости, например, из дикого типа, например, в PM-устойчивую, коммерчески ценную линию огурца является очень редким событием. Также можно объяснить, почему интрогрессия обоих локусов PM устойчивости, например, из дикого образца, например, в устойчивую к клостеровирусу, коммерчески ценную линию огурца является еще более редким событием.
Рекомбинация представляет собой обмен информацией между двумя гомологичными хромосомами во время мейоза. В рекомбинантном растении ДНК, которая исходно находится на особом месте в хромосоме, обменивается на ДНК другого растения (т.е. материнская на отцовскую или наоборот). В двойном рекомбинанте такой обмен произошел дважды, например, по обеим сторонам гена/локуса. Для того чтобы изменить только нужный материал и как можно больше сохранить важную исходную информацию на хромосоме, обычно требуется провести четыре кроссинговера (смотри выше). Обычный путь обнаружения такого двойного рекомбинанта представляет собой массовое обследование популяции растений F2. Данная популяция должна иметь достаточный размер для обнаружения редких (низкой частоты) двойных рекомбинантов. Частота двойной рекомбинации является произведением частот одиночных рекомбинаций. Например, рекомбинант в области 10 cM может быть обнаружен с частотой 10%, и двойные рекомбинанты могут быть обнаружены с частотой 10% × 10% = 1% (1 сантиморган определяют как 1% рекомбинантного потомства при тестовом скрещивании).
Одним из путей обхода указанной проблемы низких частот встречаемости является проведение "параллельной рекомбинации". По существу, это означает, после двух актов рекомбинации в двух различных растениях, проводят совмещенные акты в одном растении рекомбинации путем простого скрещивания и селекции в полученном F2. В результате получают уменьшенное число растений для скрининга.
Поэтому третий способ получения растения с двойной устойчивостью мог бы включать интрогрессию одного из двух локусов, придающих устойчивость к PM, pm-h или pm-l, из первой линии, представляющей интерес, в растение, устойчивое к клостеровирусу второй линии, представляющей интерес, которая несет локус QTL-1, с получением в результате набора последовательности геномной ДНК, имеющего конфигурацию pm-l - QTL-1 или QTL-1 - pm-h, и интрогрессии оставшегося из двух локусов, придающих устойчивость к PM, pm-h или pm-l, из третьей линии, представляющей интерес, в другое растение, устойчивое к клостеровирусу второй линии, представляющей интерес, которое несет локус QTL-1 с получением в результате набора последовательности геномной ДНК, имеющий конфигурацию QTL-1 - pm-h или pm-l - QTL-1 (смотри фигуру 3). Затем скрещивают растения-потомки, содержащие интрогрессии из каждой индивидуальной рекомбинации, с получением набора последовательности геномной ДНК, имеющего конфигурацию pm-l - QTL-1 - pm-h (смотри фигуру 3). Установление нужной интрогрессии в различных растениях-потомках опять может быть проверено с помощью специфических маркеров QTL-1, pm-l и pm-h, на основе которых отбирают растения для дальнейших скрещиваний. Другие способы могут быть получены специалистом в данной области из фигур 4-6.
Способ ограничения числа растений для скрининга может быть осуществлен, например, следующим образом: скрестить две особи, одну, содержащую оба аллеля PM устойчивости (pm-l и pm-h), и одну, содержащую аллель устойчивости к QTL, QTL-1. Отобрать растения с 1-им кроссовером между одним из pm аллелей и QTL-1 следующим образом: если генетическое расстояние между двумя конечными точками двух pm-аллелей составляет 10 cM и QTL-1 расположен приблизительно 5 cM между QTL-1 любой из pm-1 или pm-h, тогда такая рекомбинация между QTL-1 и любым pm-локусом происходит с частотой 5%. В связи с этим проводят первый отбор 200 растений-потомков скрещивания, из которых 10 будут рекомбинантами типа A и 10 - рекомбинантами типа B. Самоопыляют идентифицированные таким образом рекомбинанты и проводят отбор 10 растений потомства на гомозиготы с помощью введения маркеров, фланкирующих оба локуса, QTL-1 и pm-локус. Проводят 10 скрещиваний между гомозиготами A × B (10 гомозигот А скрещивали с 10 гомозиготами B) и в полученных потомках F2 проводят отбор 10 растений, чтобы найти 1 двойной рекомбинант. В конце получают 10 независимых двойных рекомбинантов. Число растений в скрининге всего составляет 500, в то время как при обычном способе потребовалось бы проводить скрининг 4000 растений, чтобы получить в результате 10 независимых двойных рекомбинантов (расстояние 5 cM между QTL-1 и любым pm-локусом с частотой двойных рекомбинантов, равной 0,05×0,05=0,25%). Настоящее изобретение предоставляет усовершенствованные модели селекции с использованием маркеров (MAS). Поэтому изобретение относится к способам разведения растений и к способам селекции растений, в частности растений огурца, особенно культивируемых растений огурца, в качестве производителя растений для использования в программах разведения или культивируемых растений огурца для получения желаемых генотипических или потенциальных фенотипических свойств, в особенности связанных с получением ценных плодов огурца, также называемых в настоящем документе коммерчески ценными растениями. В настоящем документе культивируемым растением называют растение, которое специально отбирали или которое произошло от растения, которое специально отбирали в сельскохозяйственной или садоводческой практике для получения желаемых генотипических или потенциальных фенотипических свойств, в частности растение, полученное инбридингом.
Растения с двойной устойчивостью по настоящему изобретению могут иметь, например, генотип AABBcc, AABbcc, AaBBcc или AaBbcc, где "A" представляет собой генотип устойчивости, основанный на доминантном локусе pm-l, и "a" является его соответствующим аллелем неустойчивости; "B" представляет собой генотип устойчивости, основанный на доминантном локусе QTL-1, и "b" является его соответствующим аллелем неустойчивости; и "c" представляет собой генотип устойчивости, основанный на рецессивном локусе pm-h. Таким образом, растения с двойной устойчивостью по настоящему изобретению включают гомозиготные растения и гибридные растения. Эти генотипы могут быть получены осуществлением следующих скрещиваний (генотип родительских гамет): ABc×ABc; ABc×Abс; ABc×aBc; ABc×abc, и Abc×aBc. Таким образом, видно, что растение, дающее гамету abc (растение, которое не является устойчивым, исключая pm-h), тем не менее, может быть использовано для получения растения (гибрида) по изобретению с двойной устойчивостью по изобретению. В особенно предпочтительном варианте изобретения растение по изобретению с двойной устойчивостью является инбредным растением, гомозиготным по аллелям устойчивости. Поскольку локус pm-h является рецессивным, то его нельзя проконтролировать в F1 или BC1 с помощью биоэкспериментов, как происходит при использовании чувствительного родителя для получения F1/BC1 (как принято в разведении). Следовательно, особенным преимуществом является то, что установление нужной интрогрессии в растениях-потомках можно наблюдать с помощью QTL-специфических маркеров, как предусмотрено в настоящем документе. Путем использования способов MAS или MAB специалист в данной области, следовательно, имеет в распоряжении способы отбора растений.
Таким образом, настоящее изобретение также относится к способам отбора растения вида Cucumis sativus с устойчивостью против клостеровируса огурца и мучнистой росы огурца, включающим обнаружение в указанном растении наличия на одной хромосоме QTL-1, описанного в настоящем документе, и по меньшей мере одного из QTL, pm-l и pm-h, описанных в настоящем документе. В предпочтительном способе по изобретению для отбора такого растения способ включает:
a) получение образца геномной ДНК из растения огурца;
b) обнаружение в указанном образце геномной ДНК по меньшей мере одного молекулярного маркера, связанного с QTL, выбранным из группы, состоящей из QTL-1, pm-l и pm-h, более предпочтительно, обнаружение по меньшей мере двух молекулярных маркеров из указанной группы, где один маркер выявляет устойчивость к клостеровирусу и другой маркер выявляет устойчивость к мучнистой росе.
Стадия получения образца геномной ДНК из растения огурца может быть осуществлена стандартными способами выделения ДНК, хорошо известными в данной области.
Стадия обнаружения молекулярного маркера (стадия b) может включать в предпочтительном варианте осуществления применение набора двунаправленных маркеров, которые были использованы в способе AFLP для получения продукта амплификации, который, как было доказано позже, является подходящим маркером для QTL. Такой набор праймеров обозначают как праймеры, которые определяют AFLP маркер или маркер-специфические праймеры. "Двунаправленный" означает, что ориентация праймеров является такой, что один праймер функционирует как прямой и другой функционирует как обратный праймер в реакции амплификации нуклеиновой кислоты.
Альтернативно стадия обнаружения молекулярного маркера (стадия b) может включать в другом предпочтительном варианте осуществления применение зонда нуклеиновой кислоты с основной последовательностью, которая, в основном, комплементарна последовательности нуклеиновой кислоты, определяющей указанный молекулярный маркер, и зонда нуклеиновой кислоты, который специфически гибридизируется при жестких условиях с последовательностью нуклеиновой кислоты, определяющей указанный молекулярный маркер. Подходящим зондом нуклеиновой кислоты может быть, например, одиночная нить продукта амплификации, соответствующая маркеру.
Стадия обнаружения молекулярного маркера (стадия b) может также включать осуществление реакции амплификации нуклеиновой кислоты на указанной геномной ДНК для обнаружения одного или нескольких QTL. Это может быть сделано путем проведения ПЦР-реакции с использованием набора маркер-специфических праймеров. В предпочтительном варианте осуществления указанная стадия b) включает применение по меньшей мере одного набора праймеров, определяющих AFLP маркер для указанного QTL, или набора праймеров, которые специфически гибридизируются при жестких условиях с последовательностью нуклеиновой кислоты AFLP маркера для указанного QTL.
Стадия обнаружения амплифицированного фрагмента ДНК, имеющего прогнозированную длину или прогнозированную последовательность нуклеиновой кислоты стадии d), предпочтительно осуществляется так, что амплифицированный фрагмент ДНК имеет длину, которая соответствует (плюс или минус несколько оснований, например приблизительно длина одного, двух или трех оснований) ожидаемой длине, исходя из сходной реакции с теми же праймерами с ДНК из растения, в котором впервые обнаружили маркер, или последовательность нуклеиновой кислоты, которая соответствует (имеет гомологию более чем 80%, предпочтительно более чем 90%, более предпочтительно более чем 95%, еще более предпочтительно 97%, еще более предпочтительно более чем 99%) ожидаемой последовательности на основании последовательности маркера, связанного с QTL, в растении, в котором впервые обнаружили указанный маркер. Специалисту в данной области известно, что маркеры, которые отсутствуют в устойчивых растениях, в то время как они присутствовали в чувствительных родителях (так называемые транс-маркеры), также могут быть эффективны в экспериментах по обнаружению устойчивости у растений-потомков, хотя тестирование на отсутствие маркера для обнаружения присутствия спцифического признака не является оптимальным.
Стадия обнаружения амплифицированного фрагмента ДНК с предсказанной длиной или предсказанной последовательностью нуклеиновой кислоты может быть осуществлена стандартными способами гель-электрофореза или с помощью автоматизированных ДНК-секвенаторов. Нет необходимости описывать указанные способы в настоящем документе, поскольку они хорошо известны специалисту в данной области.
Для обнаружения в растении присутствие двух QTL на одной хромосоме также могут быть использованы способы окрашивания хромосомы. В таких способах по меньшей мере первый QTL и по меньшей мере второй QTL могут быть обнаружены в одной хромосоме с помощью гибридизации in situ или ПЦР техник in situ. Указанные техники также могут быть использованы для вычисления позиции QTL-1 относительно pm-l и pm-h в указанной хромосоме, и они известны в данной области (например, vide Jiang et al., 1995). Тот факт, что два QTL представлены на одной хромосоме, более удобно подтвердить, показывая, что они находятся в фазе сцепления, т.е. что признаки демонстрируют меньшую сегрегацию по сравнению с генами, находящимися на отдельных хромосомах.
Молекулярные маркеры и QTL
Молекулярные маркеры используют для визуализации различий в последовательностях нуклеиновых кислот. Такая визуализация возможна благодаря техникам гибридизации ДНК-ДНК после расщепления ферментом рестрикции (RFLP) и/или техникам, использующим полимеразную цепную реакцию (например, STS, микросателлиты, AFLP). Все различия между двумя родительскими генотипами будут выделены при картировании популяции (например, BC1, F2; смотри фигуру 2), основанном на скрещивании данных родительских генотипов. Можно сравнить сегрегацию различных маркеров и вычислить частоты рекомбинации. Частоты рекомбинации молекулярных маркеров на различных хромосомах обычно составляют 50%. Частота рекомбинации между маркерами, расположенными на одной хромосоме, зависит от расстояния между ними. Низкая частота рекомбинации соответствует небольшому генетическому расстоянию между маркерами на хромосоме. Сравнение всех частот рекомбинации даст в результате наиболее логичный порядок молекулярных маркеров на хромосоме. Данный наиболее логичный порядок может быть изображен на карте сцепления (Paterson, 1996). Группа расположенных рядом или непрерывных маркеров на карте сцепления, которая ассоциируется с возросшим уровнем устойчивости к заболеванию, например, с уменьшением заболеваемости после инфекционного контакта с агентом заболевания и/или уменьшение скорости роста повреждений после установления инфекции, точно указывает положение QTL, связанного с устойчивостью к данному заболеванию.
Маркеры, указанные в настоящем документе, могут быть использованы в различных аспектах изобретения, как теперь будет проиллюстрировано. Аспекты изобретения не ограничены применением маркеров, указанных в настоящем документе. Авторы настоящего изобретения подчеркивают, что в аспектах могут использоваться маркеры, не раскрытые явным образом в настоящем документе или же еще не идентифицированные. Отличная от «гена» генетическая единица, на которой фенотипическая экспрессия зависит от большого числа факторов, которые не могут быть предсказаны, генетическая единица "QTL" обозначает участок генома, который непосредственно относится к фенотипическому, количественно измеряемому признаку. Таким образом, если гены сами по себе мало связаны или не связаны с разведением растений, то QTL является непосредственно используемым в разведении растений. Авторы настоящего изобретения показали, что QTL, описанные в настоящем документе, для придания устойчивости к клостеровирусу и к мучнистой росе должны иметь особое положение относительно друг друга в геноме растений-потомков. Авторы изобретения сделали это открытие на основе наблюдения, что наличие цепочки непрерывных генетических маркеров, принадлежащих различным QTL на одной хромосоме в геноме огурца, коррелировало с присутствием обоих фенотипических признаков устойчивости, и авторы изобретения показали, что геномная организация может наследоваться согласно обычным законам наследования Менделя.
QTL, описанные в настоящем документе, расположены на одной хромосоме или группе сцепления, и их положение лучше всего характеризуется несколькими другими произвольно выбранными маркерами. В настоящей работе были использованы маркеры полиморфизма длины амплифицированных фрагментов (AFLP), однонуклеотидных молиморфизмов (SNP) и маркеры мутации вставки, хотя также могли быть использованы маркеры полиморфизма длины фрагментов рестрикции (RFLP), микросателлитные маркеры (например, SSR), маркеры амплифицированного региона с охарактеризованной нуклеотидной последовательностью (SCAR), маркеры расщепленной амплифицированной полиморфной последовательности (GAPS) или изоферментные маркеры или комбинации указанных. В целом, QTL может перекрыть участок в несколько миллионов оснований. Поэтому предоставление информации о полной последовательности QTL является практически невозможным, но и также излишним, т.к. способ, которым впервые обнаружили QTL - благодаря наблюдаемой корреляции между наличием цепочки непрерывных генетических маркеров и наличием определенного фенотипического признака - позволяет находить в популяции растений-потомков те растения, которые имеют генетический потенциал для проявления определенного фенотипического признака. Настоящее изобретение относится к не ограниченному списку маркеров, тем самым обеспечивая для программы разведения эффективное свойство QTL. Маркер является специфическим для определенной линии сорта. Таким образом, специфический признак связан с определенным маркером. Маркеры, представленные в настоящем документе, не только показывают расположение QTL, они также находятся в связи с присутствием специфического фенотипического признака в растении. Важно отметить, что непрерывные генетические маркеры, которые показывают расположение QTL в геноме, являются, в принципе, произвольными или неограниченными. В целом, расположение QTL определяют с помощью непрерывной цепочки маркеров, которые демонстрируют статистическую корреляцию с фенотипическим признаком. Как только маркер обнаруживается вне цепочки (т.е. маркер, который имеет (LOD-score), показатель предела обнаружения ниже определенного критического уровня, показывающего, что маркер является настолько удаленным, что рекомбинация на участке между маркером и QTL происходит так часто, что присутствие маркера не коррелирует статистически значимым образом с наличием фенотипа), то устанавливают границы QTL. Таким образом, также возможно показать расположение QTL с помощью других маркеров, расположенных в данном указанном регионе.
Далее важно отметить, что непрерывные геномные маркеры также могут быть использованы, чтобы показать присутствие QTL (и таким образом фенотипа) в отдельном растении, т.е. они могут быть использованы в процедурах селекции с использованием маркеров (MAS). В принципе, количество потенциально подходящих маркеров ограничено, но может быть очень большим, и специалист в данной области может легко определить дополнительные маркеры, кроме маркеров, которые указаны в настоящем документе. В процедурах MAS может быть использован любой маркер, который связывается с QTL, например, попадающий внутрь физических границ геномного региона, перекрываемого маркерами, имеющими установленные показатели предела обнаружения LOD выше определенного критического уровня, показывая тем самым, что между маркером и QTL не происходит рекомбинации или происходит очень небольшая рекомбинация при скрещиваниях; а также любой маркер в неслучайном распределении с QTL; а также маркеры, которые представляют действительно каузальные мутации внутри QTL. Это означает, что маркеры, именуемые в настоящем документе как связанные с QTL, такие как AFLP маркеры E16/M50-244, E16/M50-188 и E11/M48-251 для QTL-1, являются просто примерами маркеров, подходящих для применения в MAS процедурах. Кроме того, когда QTL, или его специфическую часть, привносящий признак, интрогрессируют в другую генетическую среду (т.е. в геном растения другого вида), то некоторые маркеры могут уже не обнаруживаться в потомстве, хотя сам признак в нем представлен, указывая на то, что данные маркеры находятся вне геномного региона, который является специфической частью QTL, дающей признак, только в исходной родительской линии, и указывая на то, что новая генетическая среда имеет другую геномную организацию.
Эти маркеры, отсутствие которых показывает успешную интродукцию генетического элемента в потомстве, называют "трансмаркерами" и они могут быть столь же удобными в MAS процедурах в рамках по настоящему изобретению.
После идентификации QTL эффект QTL (устойчивость) может быть подтвержден, например, путем оценки устойчивости в BC2S1 потомках, выделяющихся по изучаемым QTL. Оценка устойчивости может быть осуществлена с помощью биотеста на устойчивость, известного в данной области как для клостеровируса, так и для мучнистой росы огурцов. Например, может быть использован изолят CYSDV, который хранится с номером доступа PV-0592/EWSN_6 в коллекции the DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (Braunschweig, Germany), и экспериментальная инфекция может быть вызвана, например, путем передачи через белокрылку табачную (Bemisia tabaci) (B biotype). Кроме того, могут быть проведены (полевые) испытания в природных инфекционных условиях для оценки устойчивости к CYSDV или другим клостеровирусам. Устойчивость к мучнистой росе может быть оценена с помощью искусственного заражения растительных материалов. Маркеры, предоставленные настоящим изобретением, могут быть использованы для обнаружения присутствия одного или нескольких QTL по изобретению в растении огурца, предположительно устойчивом к мучнистой росе и/или клостеровирусу, и, следовательно, могут быть использованы в способах, включающих разведение с использованием маркеров и селекцию растений огурца, устойчивых к клостеровирусу и мучнистой росе. Предпочтительно, обнаружение присутствия QTL изобретения выполняют по меньшей мере с одним из маркеров для QTL, описанных в настоящем документе. Поэтому в другом аспекте настоящее изобретение относится к способу обнаружения присутствия QTL устойчивости к мучнистой росе и/или клостеровирусу, включающему обнаружение присутствия последовательности нуклеиновой кислоты указанного QTL в растении огурца, предположительно устойчивом к мучнистой росе и/или клостеровирусу, присутствие которой может быть обнаружено с помощью указанных маркеров.
Нуклеотидная последовательность QTL по настоящему изобретению может быть установлена, например, определением нуклеотидной последовательности одного или нескольких маркеров, связанных с указанным QTL, и конструированием внутренних праймеров для указанных маркерных последовательностей, которые затем могут быть использованы для дальнейшего определения последовательности QTL вне указанных маркерных последовательностей. Например, нуклеотидная последовательность AFLP маркеров из таблиц 2, 3 и 4 может быть получена выделением указанных маркеров из электрофорезного геля, использованного для определения присутствия указанных маркеров в геноме испытуемого растения, и определением нуклеотидной последовательности указанных маркеров, например, с помощью дидезокси-методов обрыва цепи, хорошо известных в данной области.
В вариантах осуществления указанных способов для обнаружения присутствия QTL в растении огурца, предположительно устойчивом к мучнистой росе и/или клостеровирусу, способ может также включать стадии предоставления олигонуклеотида или полинуклеотида, способного гибридизироваться в жестких условиях гибридизации с последовательностью нуклеиновой кислоты маркера, связанного с указанным QTL, предпочтительно выбранного из маркеров таблиц 2, 3 и 4; взаимодействия указанного олигонуклеотида или полинуклеотида с обработанной геномной нуклеиновой кислотой растения огурца, предположительно устойчивого к мучнистой росе и/или клостеровирусу, и определения наличия специфической гибридизации указанного олигонуклеотида или полинуклеотида с указанной обработанной геномной нуклеиновой кислотой.
Предпочтительно, указанный способ осуществляют на образце нуклеиновой кислоты, полученном из указанного растения огурца, предположительно устойчивого к мучнистой росе и/или клостеровирусу, хотя также могут быть использованы методы гибридизации in situ. Альтернативно и в более предпочтительном варианте осуществления, если определена нуклеотидная последовательность QTL, то специалист в данной области может создать специфические гибридизационные зонды или олигонуклеотиды, способные к гибридизации в жестких условиях с последовательностью нуклеиновой кислоты указанного QTL, и может использовать указанные гибридизационные зонды в способах обнаружения присутствия QTL изобретения в растении огурца, предположительно устойчивом к мучнистой росе и/или клостеровирусу.
Маркер локуса главного гена устойчивости к клостеровирусу может быть получен с помощью селективной амплификации фрагментов ДНК огурца от устойчивых особей и чувствительных особей, происходящих из родительских сортов:
- в которых указанные фрагменты подвергали фазе обработки ферментами рестрикции (например, EcoRI и MseI) с последующей сшивкой для присоединения по их концам адапторов дополнительных фрагментов для праймеров, которые имеют на своем конце один или несколько специфических нуклеотидов, где один или несколько праймеров из пары праймеров является помеченным для обнаружения;
- выделение продуктов амплификации с помощью электрофореза в геле в денатурирующих условиях и
- сравнение профилей гель-электрофореза, полученных со смесями фрагментов, полученных из устойчивого потомства, и со смесями, происходящими из чувствительного потомства, с фрагментами, происходящими из родительских сортов, чтобы идентифицировать полиморфные полосы, которые генетически связаны с локусом устойчивости. После указанной идентификации следует стадия проверки, при которой происходит осуществление контроля на всех особях и рассчитывают скорость генетической рекомбинации между маркером и локусом устойчивости.
В принципе, отдельные маркеры AFLP, использованные в настоящем документе, имеют назначенный код маркера. Данный код обозначает два праймера, необязательно в комбинации с цифрой, указывающей длину продукта амплификации праймеров в заданном образце (также смотри описание для таблицы 1 выше). Таким образом, маркер определяет фрагмент одноцепочечной или двухцепочечной ДНК, полученный проведением реакции амплификациина геномной ДНК огурца, которая в случае указанного образца дает в результате фрагмент указанной длины. Кроме того, маркер содержит в 5'-3' направлении последовательность, состоящую из последовательности первого праймера, специфической ДНК последовательности огурца и последовательности второго праймера и ее дополнения. Таким образом, специфическая ДНК-последовательность огурца является фланкированной двумя праймерами. Термин "специфическая ДНК-последовательность огурца" обозначает нуклеотидную последовательность региона, фланкированного соответствующими праймерами, и представляет собой последовательность, амплифицированную из образца огурца Khira PI250147, как описано в международной патентной заявке WO 02/22836, с помощью указанных праймеров, или последовательность, имеющую гомологию с указанной последовательностью по меньшей мере 90%, предпочтительно 95% и, наиболее предпочтительно, по меньшей мере 98%.
Получение растений огурца, устойчивых к мучнистой росе и клостеровирусу, трансгенными способами.
Согласно другому аспекту по настоящему изобретению последовательность нуклеиновой кислоты (предпочтительно ДНК), содержащая по меньшей мере QTL-1 и один, предпочтительно, оба pm-l и pm-h или их части, придающие устойчивость, может быть использована для получения растения огурца по настоящему изобретению с двойной устойчивостью. В этом аспекте изобретение предусматривает применение QTL, описанных в настоящем документе, или их частей, придающих устойчивость, для получения растения огурца с двойной устойчивостью, использование которых включает введение последовательности нуклеиновой кислоты, содержащей указанный QTL, в подходящее растение-реципиент. Как указано, данная последовательность нуклеиновой кислоты может быть получена из подходящего растения-донора, устойчивого к клостеровирусу и/или мучнистой росе.
Подходящим источником локуса устойчивости к клостеровирусу, обозначенному в настоящем документе как QTL-1, является огурец ландрас Кира, PI 250147, происходящий из Пакистана. Ряд PM устойчивых культиваров огурца вместе с их коммерческими источниками перечислен, например, на http://cuke.hort.ncsu.edu/cucurbit/cuke/cukemain.html. PM устойчивые растения могут быть получены, например, при помощи T. C. Wehner, куратора по генетике огурцов в (Cucurbit Genetics Cooperative) (CGC), департамент садоводства, университет штата Северная Королина, Raleigh, NC 27695-7609 США. Источником обоих pm локусов, описанных в настоящем документе, является NPI, который был получен скрещиванием Natsufushinari (PI 279465) с PI 200815. Образцы могут быть получены, например, из Centre for Genetic Resources, the Netherlands (CGN), Вагенинген, Нидерланды. Несколько баз данных растений являются общедоступными для помощи в выборе подходящих репозитарных коллекций, такие как the ECP/GR Cucurbits Database, размещенная Центром по сохранению и разведению агроразнообразия (Center for the Conservation and Breeding of Agrodiversity) (COMAV) в Валенсии, Испания, или the Germplasm Resources Information Network (GRIN), размещенная the USDA's National Germplasm Resources Laboratory, Beltsville, Maryland. Другие растения огурца, у которых показана устойчивость либо к клостеровирусу, либо к мучнистой росе, также могут быть использованы в качестве растений-доноров устойчивости, поскольку в настоящем изобретении описано, как данный материал может быть идентифицирован.
После того как последовательность нуклеиновой кислоты, которая содержит QTL устойчивости к клостеровирусу или мучнистой росе или их часть, придающую устойчивость, идентифицирована в подходящем донорском растении, она может быть перенесена в подходящее растение-реципиент любым доступным способом. Например, указанная последовательность нуклеиновой кислоты может быть перенесена скрещиванием растения-донора, устойчивого к клостеровирусу или мучнистой росе, с чувствительным растением-реципиентом (т.е. с помощью интрогрессии), трансформацией, слиянием протопластов, техникой двойных гаплоидов или спасением эмбриона или любой другой системой переноса нуклеиновой кислоты, необязательно с последующим отбором растений-потомков, содержащих QTL, и у которых показана устойчивость. Для трансгенных способов переноса последовательность нуклеиновой кислоты, содержащая QTL устойчивости к клостеровирусу или мучнистой росе, или их часть, придающую устойчивость, может быть выделена из указанного растения-донора с помощью способов, известных в данной области, и, таким образом, изолированная последовательность нуклеиновой кислоты может быть перенесена в растение-рецепиент трансгенными способами, например посредством вектора, в гамете или в любом другом подходящем передающем элементе, таком как баллистическая частица, покрытая указанной последовательностью нуклеиновой кислоты.
Обычно трансформация растения включает создание вектора экспрессии, который будет работать в клетках растения. В настоящем изобретении такой вектор включает QTL устойчивости к клостеровирусу или мучнистой росе или их часть, придающую устойчивость, вектор, который может содержать ген, придающий устойчивость к клостеровирусу или мучнистой росе, который находится под контролем или оперативно связан с регуляторным элементом, таким как промотор. Вектор экспрессии может содержать один или несколько функционально связанных комбинаций ген/регуляторный элемент, при условии, что по меньшей мере один из генов, содержащихся в комбинациях, кодирует устойчивость к клостеровирусу или мучнистой росе. Вектор (векторы) может быть в форме плазмиды и может быть использован отдельно или в комбинации с другими плазмидами, чтобы предоставить трансгенные растения, которые устойчивы к клостеровирусу и мучнистой росе, используя способы трансформации, известные в данной области, такие как система трансформации Agrobacterium.
Векторы экспрессии могут включать по меньшей мере один маркерный ген, функционально связанный с регуляторным элементом (таким как промотор) что позволяет выделять трансформированные клетки, содержащие маркер, с помощью отрицательной селекции (ингибированием роста клеток, которые не содержат селектируемый маркерный ген) или положительной селекции (скринингом на продукт, кодируемый маркерным геном). Многие широко используемые селектируемые маркерные гены для трансформации растений известны в данной области и включают, например, гены, которые кодируют ферменты, которые метаболически нейтрализуют выборочный химический агент, который может быть антибиотиком или гербицидом, или гены, которые кодируют видоизмененную мишень, которая является нечувствительной к ингибитору. В данной области известны несколько способов положительной селекции, таких как селекция по маннозе. Альтернативно для получения растений без упомянутых маркерных генов может быть использована безмаркерная трансформация, методики которой известны в данной области.
Один из способов для введения вектора экспрессии в растение основан на природной системе трансформации Agrobacterium (смотри, например, Horsch et al., 1985). A.tumefaciens и A.rhizogenes представляют собой растительные патогенные почвенные бактерии, которые генетически трансформируют клетки растений. Плазмиды Ti и Ri A.tumefaciens и A.rhizogenes соответственно несут гены, ответственные за генетическую трансформацию растения (смотри, например, Kado, 1991). Способы введения векторов экспрессии в ткани растения включают прямое инфицирование или совместное культивирование клеток растения с Agrobacterium tumefaciens (Horsch et al., 1985). Описания Agrobacterium векторных систем и способов Agrobacterium-опосредованного генного переноса предоставлены Gruber и Crosby, 1993 и Moloney et al., 1989. Также смотри патент США № 5591616. Общие описания растительных векторов экспрессии и репортерных генов и протоколы трансформации и описания Agrobacterium векторных систем и способы Agrobacterium-опосредованного генного переноса можно найти в Gruber и Crosby, 1993. Общие способы культивирования тканей растений приводятся, например, Miki et al., 1993 и Phillips, et al., 1988. Подходящим справочником по техникам молекулярного клонирования и соответствующим векторам экспрессии является Sambrook and Russell, 2001.
Другой способ для введения вектора экспрессии в растение основан на трансформации, опосредованной микроснарядами, где ДНК переносится на поверхности микроснарядов. Вектор экспрессии вводится в ткани растения биолистическим устройством, которое разгоняет микроснаряды до скорости от 300 до 600 м/сек, которая является достаточной для проникновения (смотри Sanford et al., 1987, 1993; Sanford, 1988, 1990; Klein et al., 1988, 1992). Другой способ введения ДНК в растения представляет собой обработку ультразвуком клеток-мишеней (смотри Zhang et al., 1991). Альтернативно для введения векторов экспрессии использовали слияние липосом или сферопластов (смотри, например, Deshayes et al., 1985 и Christou et al., 1987). Сообщали также о прямом введении ДНК в протопласты с помощью осаждения CaCl2, поливинилового спирта или поли-L-орнитина (смотри, например, Hain et al., 1985 и Draper et al., 1982). Электропорация протопластов и целых клеток и тканей также была описана (D'Halluin et al., 1992 и Laursen et al., 1994).
Другие хорошо известные техники, такие как использование BAC, в которых части генома огурца вводят в бактериальные искусственные хромосомы (BAC), т.е. векторы, использованные для клонирования ДНК фрагментов (100 - 300 т.п.н. размер вставки; среднее, 150 т.п.н.) в клетки Escherichia coli, основанные на природной плазмиде P-фактор, обнаруженной в бактерии E.coli. (Zhao and Stodolsky, 2004), могут быть использованы, например, в комбинации с системой BIBAC (Hamilton, 1997) для получения трансгенных растений.
После трансформации тканей-мишеней огурца экспрессия описанных выше селективных маркерных генов позволяет избирательную селекцию трансформированных клеток, тканей и/или растений, используя методы регенерации и селекции, хорошо известные в данной области.
Получение растений огурца, устойчивых к клостеровирусу и мучнистой росе, нетрансгенными способами
В альтернативном варианте осуществления для получения растения огурца, устойчивого к клостеровирусу и мучнистой росе, может быть использовано слияние протопластов для переноса нуклеиновых кислот из растения-донора в растение-реципиент. Слияние протопластов представляет собой вызванное или самопроизвольное соединение, такое как соматическая гибридизация, двух или более протопластов (клетки, стенки которых удалены обработкой ферментами) для создания одной двух- или многоядерной клетки. Гибридную клетку, которая может быть получена даже с видами растений, которые не скрещиваются в природе, выращивают в культуре тканей в гибридное растение, демонстрирующее желаемую комбинацию признаков. Более подробно, первый протопласт может быть получен из растения огурца или линии другого растения, которое проявляет устойчивость к заражению клостеровирусом или мучнистой росой. Второй протопласт может быть получен из второго огурца или растения другого сорта, предпочтительно, линии огурца, которая содержит в себе коммерчески ценные характеристики, без ограничения, такие как устойчивость к заболеваниям, устойчивость к насекомым, ценные плодовые характеристики и т.д. Затем протопласты соединяют, используя обычные процедуры для соединения протопластов, которые известны в данной области.
Альтернативно, спасение эмбриона может быть применено для переноса нуклеиновой кислоты, включающей один или несколько QTL, описанных в настоящем документе, из растения-донора в растение-реципиент. Спасение эмбриона может быть использовано как процедура для изоляции эмбрионов из скрещиваний, в которых растения не в состоянии произвести жизнеспособные семена. В данном процессе опыленную завязь или незрелое семя растения выращивают в культуре тканей для создания новых растений (Pierik, 1999).
Настоящее изобретение также относится к способу получения растения огурца, устойчивого к клостеровирусу и мучнистой росе, включающему стадии осуществления способа обнаружения присутствия локуса количественных признаков (QTL), связанного с устойчивостью к клостеровирусу или мучнистой росе в донорском растении огурца согласно описанному выше изобретению, и переноса последовательности нуклеиновой кислоты, включающей по меньшей мере один QTL, обнаруживаемый таким образом, или его часть, придающую устойчивость к клостеровирусу или мучнистой росе, из указанного растения-донора в реципиентное растение огурца, чувствительное к клостеровирусу или мучнистой росе. Перенос указанной последовательности нуклеиновой кислоты может быть осуществлен любым способом, ранее описанным в настоящем документе.
Предпочтительный вариант осуществления способа включает перенос с помощью интрогрессии указанной последовательности нуклеиновой кислоты из донорского растения огурца, устойчивого к клостеровирусу или мучнистой росе, в реципиентное растение огурца, чувствительное к клостеровирусу или мучнистой росе, с помощью скрещивания указанных растений. Указанный перенос может быть выполнен с помощью общепринятых техник разведения. Предпочтительно QTL интрогрессируют в коммерческие сорта огурцов с помощью селекции с использованием маркеров (MAS) или разведения с использованием маркеров (MAB). MAS и MAB включают использование одного или нескольких молекулярных маркеров для идентификации и селекции таких растений-потомков, которые содержат один или несколько генов, которые кодируют желаемый признак. В настоящем случае указанная идентификация и селекция основана на селекции QTL по настоящему изобретению или связанных с ними маркеров. Также MAS может быть использована для создания близких к изогенным линий (NIL), содержащих QTL, представляющий интерес, позволяя более детальное изучение каждого эффекта QTL, и MAS также является эффективным способом для создания популяций инбредных линий обратного скрещивания (BIL) (смотри, например, Nesbitt et al., 2001; van Berloo et al., 2001). Растения огурца, созданные согласно данному варианту осуществления, могут получить большинство своих признаков из растения-реципиента и получить устойчивость к клостеровирусу и мучнистой росе из растения-донора.
Как вкратце обсуждалось выше, общепринятые техники разведения могут быть использованы для интрогресии последовательности нуклеиновой кислоты, кодирующей устойчивость к клостеровирусу или мучнистой росе, в реципиентное растение огурца, чувствительное к клостеровирусу и к мучнистой росе. В одном из способов, который относят к чистопородному разведению, донорское растение огурца, у которого показана устойчивость к клостеровирусу или мучнистой росе, и включает последовательность нуклеиновой кислоты, кодирующую устойчивость к клостеровирусу и мучнистой росе, скрещивают с реципиентным растением огурца, чувствительным к клостеровирусу или мучнистой росе, которое предпочтительно демонстрирует коммерчески желаемые характеристики, без ограничения такие, как устойчивость к заболеваниям, устойчивость к насекомым, ценные характеристики плодов и т.д. Полученную популяцию растений (представляющая гибриды F1) затем самоопыляют и высаживают семена (семена F2). Растения F2, выращенные из семян F2, затем отбирают на устойчивость к клостеровирусу и мучнистой росе. Популяция может быть обследована несколькими различными путями.
Во-первых, популяция может быть обследована с использованием общепринятого скрининга заболевания. Такой скрининг заболевания известен в данной области. Предпочтительно, используют количественный биотест. Во-вторых, может быть осуществлена селекция с использованием маркеров с применением одного или нескольких описанных выше молекулярных маркеров, чтобы идентифицировать тех потомков, которые содержат последовательность нуклеиновой кислоты для устойчивости к клостеровирусу или мучнистой росе. Могут быть использованы другие способы, именуемые выше методами для обнаружения присутствия QTL. Кроме того, селекция с использованием маркеров может быть использована для подтверждения результатов, полученных в количественных биотестах, и поэтому некоторые способы также могут быть использованы в комбинации.
Инбредные линии растений огурца, устойчивые к клостеровирусу и мучнистой росе, могут быть созданы с помощью техник рекуррентной селекции и обратного скрещивания, самоопыления и/или дигаплоидов или любой другой техники, использованной для создания родительских линий. В способе рекурентной селекции и обратного скрещивания устойчивость к клостеровирусу и мучнистой росе может быть интрогрессирована в рецепиентное растение-мишень (рекуррентный родитель) скрещиванием рекуррентного родителя с первым растением-донором, которое отличается от рекуррентного родителя и называется в настоящем документе "нерекуррентый родитель". Рекуррентый родитель представляет собой растение, которое является неустойчивым или имеет низкий уровень устойчивости к клостеровирусу и мучнистой росе и обладает коммерчески желаемыми характеристиками, такими как, без ограничения, (дополнительная) устойчивость к заболеваниям, устойчивость к насекомым, ценные характеристики плодов и т.д. Нерекуррентый родитель имеет устойчивость к клостеровирусу и мучнистой росе и заключает в себе последовательность нуклеиновой кислоты, которая кодирует устойчивость к клостеровирусу и мучнистой росе. Нерекуррентый родитель может быть растением любого сорта или инбредной линии, которое является перекрестно-плодным с рекуррентным родителем. Потомство, полученное из скрещивания между рекуррентным родителем и нерекуррентным родителем, скрещивают обратным скрещиванием с рекуррентным родителем. Затем в полученной популяции растений проводят скрининг на желаемые характеристики, указанный скрининг может быть осуществлен разными путями. Например, отбор в популяции может быть произведен с помощью сортировок по фенотипической патологии или количественных биотестов, известных в данной области. Альтернативно, вместо использования биотестов, может быть выполнена селекция с использованием маркеров (MAS) с помощью одного или нескольких описанных ранее молекулярных маркеров, гибридизационных зондов или полинуклеотидов для идентификации указанного потомства, которое содержит в себе последовательность нуклеиновой кислоты, кодирующую устойчивость к клостеровирусу и мучнистой росе. Также MAS может быть использована для подтверждения результатов количественных биотестов. И в этом случае рецессивная природа pm-h означает, что данный ген не может быть обнаружен в F1 или BC1 популяции с помощью фенотипических сортировок, таких как биотесты на устойчивость. Следовательно, маркеры, описанные в настоящем документе, в конечном счете являются подходящими для отбора соответствующих растений-потомков с помощью генотипического сканирования.
После скрининга гибридные растения F1, которые проявляют фенотип устойчивости к клостеровирусу и к мучнистой росе или, более предпочтительно, генотип и, следовательно, заключают в себе требуемую последовательность нуклеиновой кислоты, кодирующую устойчивость к клостеровирусу и мучнистой росе, затем отбирают и проводят обратное скрещивание с рекуррентным родителем на протяжении ряда поколений, чтобы увеличить инбредность растения огурца. Данный процесс может быть осуществлен на протяжении от двух до пяти поколений. В принципе, потомство, получающееся в результате процесса скрещивания рекуррентного родителя с нерекуррентным родителем, устойчивым к клостеровирусу и мучнистой росе, является гетерозиготным по одному или нескольким генам, которые кодируют устойчивость к клостеровирусу и мучнистой росе.
Следует помнить, что, например, когда в линию растений интрогрессируют оба локуса pm-l и pm-h, то локус pm-h является рецессивным, и в растениях-потомках устойчивый фенотип будет появляться только в условиях, при которых могут формироваться гомозиготные pm-h растения.
Как правило, способ введения желаемого признака в гибридный сорт огурца включает стадии:
(a) скрещивание инбредного огурца-родителя с другим растением огурца, которое включает один или несколько желаемых признаков, для получения растений потомства F1, в которых желаемый признак отбирают из группы, состоящей из устойчивости к клостеровирусу и устойчивости к мучнистой росе;
(b) отбор указанных растений потомства F1, которые имеют желаемый признак, для получения отобранных растений потомства F1, предпочтительно используя молекулярные маркеры, описанные в настоящем документе;
(c) обратное скрещивание отобранных растений потомства с указанным инбредным родительским растением огурца для получения растений-потомков обратного скрещивания;
(d) отбор растений-потомков обратного скрещивания, которые имеют желаемый признак и морфологические и физиологические характеристики указанного инбредного родительского растения огурца, где указанный отбор включает выделение геномной ДНК и тестирование указанной ДНК на присутствие по меньшей мере одного молекулярного маркера для QTL-1, pm-l и/или pm-h, предпочтительно описанных в настоящем документе;
(e) повторение стадий (c) и (d) два и несколько раз в сукцессии для получения растений-потомков третьего или более обратного скрещивания;
(f) необязательно самоопыление отобранного потомства обратного скрещивания для установления гомозиготных растений;
(g) скрещивание по меньшей мере одного потомства обратного скрещивания или самоопыленных растений с другим инбредным родительским растением огурца (предпочтительно растением, которое является pm hypo устойчивым, т.е. является гомозиготным по pm-h) для создания гибридного сорта огурца с желаемым признаком и всеми морфологическими и физиологическими характеристиками гибридного сорта огурца, когда он выращен в тех же условиях окружающей среды.
Как показано, потомство последнего обратного скрещивания можно самоопылить для того, чтобы обеспечить гомозиготное потомство чистого разведения (инбредного) по устойчивости к клостеровирусу и к мучнистой росе. Таким образом, результат рекуррентной селекции обратного скрещивания и самоопыления представляет собой создание линий, которые являются генетически единообразными по генам, связанным с устойчивостью к клостеровирусу и мучнистой росе, а также по другим генам, связанным с признаками, представляющими коммерческий интерес.
Растения и семена огурца, устойчивые к клостеровирусу и мучнистой росе
Целью разведения растений является совмещение в одном сорте или гибриде различных желаемых признаков. Для коммерческих культур такие признаки могут включать устойчивость к заболеваниям и насекомым, способность переносить жару и засуху, ускоренное созревание, большая урожайность и лучшее агрономическое качество. Однородность характеристик растений, таких как прорастание и образование травостоя, скорость роста, созревание и высота растения, также могут иметь большое значение.
Коммерческие культуры разводят с помощью техник, которые используют преимущество растительного способа опыления. Растение является самоопыляющимся, если пыльца из одного цветка переносится на тот же самый или другой цветок того же самого растения. Растение является сиб-опыляющимся, когда для опыления используются особи одного семейства или линии. Растение является перекрестно опыляемым, если пыльца цветка поступает на другое растение из другого семейства или линии.
Растения, которые самоопыляли и отбирали по типу на протяжении многих генераций, становятся гомозиготными почти по всем локусам генов и дают единообразную популяцию потомства разведения гомозигот. Скрещивание двух различных линий гомозигот дает единообразную популяцию гибридных растений, которые могут быть гетерозиготными по многим локусам генов. Скрещивание двух растений, каждое из которых является гетерозиготным по нескольким локусам генов, будет давать популяцию гетерозиготных растений, которые отличаются генетически, и она не будет единообразной.
Создание гибридного сорта огурцов в программе разведения включает три стадии: (1) отбор растений из различных пулов зародышевой плазмы для начальных селекционных скрещиваний; (2) самоопыление отобранных растений из селекционных скрещиваний на протяжении нескольких поколений из селекционных скрещиваний для получений серий инбредных линий, которые каждая в отдельности передают признак потомству и являются очень единообразными; и (3) скрещивание отобранной инбредной линии с неродственной инбредной линией для получения гибридного потомства (F1). После достаточного количества инбридинга последующие дочерние поколения будут служить лишь для увеличения семян созданного инбреда. Предпочтительно, инбредная линия должна содержать гомозиготные аллели, приблизительно, в 95% или более локусах.
Важным последствием гомозиготности и однородности инбредных линий является то, что гибрид, созданный скрещиванием определенной пары инбредов, всегда будет одинаковым. Как только идентифицированы инбреды, из которых создан превосходный гибрид, то можно создать постоянный запас семян гибрида с использованием данных инбредных родителей, и затем гибридные растения огурца могут быть выращены из данного запаса гибридных семян.
Растение огурца, устойчивое к клостеровирусу и мучнистой росе, или его часть, полученная способом изобретения, представляет собой аспект по настоящему изобретению.
Другой аспект по настоящему изобретению относится к растению огурца, устойчивому к клостеровирусу и мучнистой росе, или к его части, включающей QTL в любой конфигурации, как подробно описано ранее, где по меньшей мере один из указанных QTL находится не в своей природной генетической среде. Растения огурца по настоящему изобретению, устойчивые к клостеровирусу и мучнистой росе, могут быть любого генетического типа, такие как инбредные, гибридные, гаплоидные, диплоидные или трансгенные. Далее, растения по настоящему изобретению могут быть гетерозиготными или гомозиготными по признакам устойчивости, предпочтительно гомозиготными. Хотя QTL по настоящему изобретению и их части, придающие устойчивость, могут быть трансфецированы в любое растение, чтобы предоставить растение, устойчивое к клостеровирусу и мучнистой росе, способы и растения по изобретению предпочтительно относятся к виду Cucumis sativus.
Инбредные линии огурца, устойчивые к клостеровирусу и мучнистой росе, описанные в настоящем документе, могут быть использованы в дополнительных скрещиваниях для создания гибридных растений, устойчивых к клостеровирусу и мучнистой росе. Например, первое инбредное растение огурца изобретения, устойчивое к клостеровирусу и мучнистой росе, может быть скрещено со вторым инбредным растением огурца, несущим коммерчески ценные признаки, такие как, но без ограничения, устойчивость к заболеваниям, устойчивость к насекомым, желаемые плодовые характеристики и т.д. Указанная вторая инбредная линия огурца может быть или не быть устойчивой к клостеровирусу и мучнистой росе. Предпочтительно данная линия является гомозиготной по pm-h, чтобы данный рецессивный признак экспрессировался в гибридных растениях-потомках.
Другой аспект по настоящему изобретению относится к способу получения семян, из которых могут быть выращены растения, устойчивые к клостеровирусу и мучнистой росе. В одном варианте осуществления способ включает стадии предоставления растения огурца изобретения, устойчивого к клостеровирусу и мучнистой росе, скрещивания указанного растения, устойчивого к клостеровирусу и мучнистой росе, с другим растением огурца и сбор семян, получившихся в результате указанного скрещивания, которые при посадке дают растения, устойчивые к клостеровирусу и мучнистой росе.
В другом варианте осуществления способ включает стадии предоставления растения огурца изобретения, устойчивого к клостеровирусу и мучнистой росе, скрещивания указанного растения, устойчивого к клостеровирусу и мучнистой росе, с растением огурца и сбор семян, получившихся в результате указанного скрещивания, восстановление указанных семян в растения, отбор растений, устойчивых к клостеровирусу и мучнистой росе, любым из способов, описанных в настоящем документе, самоопыление отобранных растений для достаточного числа генераций, чтобы получить растения, в которых закреплен аллель, который придает устойчивость к клостеровирусу и мучнистой росе, обратное скрещивание растений с получением, таким образом, растений огурца, имеющих желаемые фенотипические признаки для достаточного числа генераций, чтобы получить растения огурца, которые являются устойчивыми к клостеровирусу и мучнистой росе и имеют желаемые фенотипические признаки, и сбор семян, произведенных растениями, получившихся в результате последнего обратного скрещивания, которые при посадке дают растения огурца, которые являются устойчивыми к клостеровирусу и мучнистой росе.
В таблице 4 показано в формате матрикса наличие или отсутствие в растениях с двойной устойчивостью известных маркеров, которые показывают происхождение либо от pm-устойчивого родителя, либо от родителя, устойчивого к клостеровирусу (показано как присутствие в устойчивом родителе). Далее матрикс показывает происхождение и относительное положение AFLP маркеров, связанных с линиями растений с двойной (PM и клостеровирус) устойчивостью. "Маркеры", обозначенные терминами pm-l и pm-h, отмечают центральные положения двух соответствующих локусов устойчивости к мучнистой росе, названных в настоящем документе. Положение локуса QTL-l не было установлено, хотя, используя положения маркеров, связанных с клостеровирусом, можно было определить, что локус был расположен между двумя локусами pm. Из таблицы понятно, что пул Pool nrs. 1-6 получил более короткую интрогрессию из родителя, устойчивого к клостеровирусу, чем получил пул Pool nrs. 10-15. Объяснение матрикса представляет собой следующее: маркер E23/M40-M003 (56.9 cM), например, был представлен в pm-устойчивом родителе и также представлен в потомстве с двойной устойчивостью, в то время как маркер E11/M80-M003 (79.1 cM) был представлен в родителе, устойчивом к клостеровирусу, но отсутствует в потомстве с двойной устойчивостью. Таким образом, маркер E23/M40-M003 является PM связанным маркером, чье присутствие означает наличие pm-l связанного генетического региона в тестируемой линии растений, в то время как маркер E11/M80-M003, с другой стороны, показывает генетический регион по соседству с QTL-l локусом, связанным с устойчивостью к клостеровирусу, но который не является важным для экспрессии pm-hypo (pm-h) устойчивости.
Таблица 4
Показатели AFLP маркеров в растениях изобретения с двойной устойчивостью

+ = присутствует в виде гомозиготы (полоса высокой интенсивности)
- = отсутствует
+/- = присутствует в виде гетерозиготы (полоса низкой интенсивности)
D = среднее присутствие (полоса средней интенсивности)


СПИСОК ЛИТЕРАТУРЫ
Ausubel FM, Brent R, Kingston RE, Moore DD, Seidman JG, Smith JA, Struhl K (eds.) (1998) Current Protocols in Molecular Biology Wiley, New York.
Bai YL, Huang CC, van der Hulst R, Meijer Dekens F, Bonnema G, Lindhout P (2003) QTLs for tomato powdery mildew resistance (Oidium lycopersici) in Lycopersicon parviflorum Gl.1601 co-localize with two qualitative powdery mildew resistance genes. Mol. plant microbe interactions 16: 169-176.
Christou P, Murphy JE, and Swain WF (1987) Stable transformation of soybean by electroporation and root formation from transformed callus. Proc. Natl. Acad. Sd. USA 84:3962-3966.
Deshayes A, Herrera-Estrella L, Caboche M (1985) Liposome-mediated transformation of tobacco mesophyll protoplasts by an Escherichia coli plasmid. EMBO J. 4:2731-2737.
D'Halluin K, Bonne E, Bossut M, De Beuckeleer M, Leemans J (1992) Plant. Cell 4: 1495-1505.
Draper J, Davey MR, Freeman JP, Cocking EC and Cox BJ (1982) Ti plasmid homologous sequences present in tissues from Agrobacterium plasmid-transformed Petunia protoplasts. Plant and Cell Physiol. 23, 451-458.
Fanourakis NE (1984) Inheritance and linkage studies of the fruit epidermis structure and investigation of linkage relations of several traits and of meiosis in cucumber. Ph. D. Diss., Univ. of Wisconsin, Madison.
Fujieda K, and Akiya R (1962) Genetic study of powdery mildew resistance and spine color on fruit in cucumber. J. Jpn. Soc. Hort. Sci. 31:30-32.
Ganal MW (1996) Isolation and analysis of high-molecular-weight DNA from plants, In: Nonmammalian Genomic Analysis: A Practical Guide. Academic Press Inc., San Diego, 61-73.
Gruber MY, Crosby WL (1993) Vectors for plant transformation. In BR Glick, JE Thompson, eds, Methods in Plant Molecular Biology and Biotechnology. CRC Press, Baton Rouge, LA, pp.89-119.
Hain R, Stabel P, Czernilofsky AP, Steinbliss HH, Herrera-Estrella L, Schell J (1985) Uptake, integration, expression and genetic transmission of a selectable chimaeric gene to plant protoplasts. Mol. Gen. Genet. 199:161-168.
Hamilton CM. (1997) A binary-BAC system for plant transformation with high-molecular- weight DNA. Gene 200: 107-116.
Horejsi T, Staub JE and Thomas C. (2000) Linkage of random amplified polymorphic DNA markers to downy mildew resistance in cucumber (Cucumis sativus L.) Euphytica 115 (2):105-113.
Horsch RB, Fraley RT, Rogers SG, Sanders PR, Lloyd A (1985) A simple and general method for transferring genes into plants. Science 227: 1229-1231.
Jiang J, Gill BS, Wang GL, Ronald PC and Ward DC (1995) Metaphase and interphase fluorescence in situ hybridization mapping of the rice genome with bacterial artificial chromosomes. Proc. Natl. Acad. Sci. USA 92:4487-4491.
Kado CI (1991): Molecular mechanisms of crown gall tumorigenesis. Crit. Rev. Plant Sci. 10, 1-32.
Klein TM, Gradziel T, Fromm ME, Sanford JC (1988). Factors influencing gene delivery into zea mays cells by high velocity microprojectiles. Biotechnology 6: 559-563.
Klein TM, Arentzen R, Lewis PA, and Fitzpatrick-McElligott S (1992) Transformation of microbes, plants and animals by particle bombardment. Bio/Technology 10:286-291.
Kleine M, Cai D, Hermann RG, and Jung C (1995) Physical mapping and cloning of a translocation in sugar beet (Beta vulgaris L.) carrying a gene for nematode (Heterodera schachtii) resistance from B. procumbens. Theor Appl Genet 90: 399-406.
Kooistra E (1968) Powdery mildew resistance in cucumber. Euphytica 17:236-244.
Kooistra E (1971) Inheritance of flesh and skin colors in powdery mildew resistant cucumbers (Cucumis sativus L.). Euphytica 20:521-523.
Lui BH (1997) Statistical Genomics: Linkage Mapping and QTL Analysis. CRC Press, pg 18-19.
Miki BL, Fobert PF, Charest PJ, Iyer VN. 1993. Procedures for Introducing Foreign DNA into Plants. In: Glick BR and Thompson JE (Eds.) Methods in Plant Molecular Biology & Biotechnology, CRC Press, pp. 67-88.
Moloney MM, Walker JM, Sharma KK (1989) High efficiency transformation of Brassica napus using Agrobacterium vectors. Plant Cell Rep 8: 238-242.
Morishita M, Sugiyama K, Saito T, and Sakata Y (2003) Review: Powdery Mildew Resistance in Cucumber. JARQ 37(1), 7-14.
Nesbitt TC, Tanksley SD (2001) fw2.2 directly affects the size of developing tomato fruit, with secondary effects on fruit number and photosynthate distribution. Plant Physiol. 127: 575-583.
Paterson AH (1996) Mapping genes responsible for differences in phenotype. p.41-54. In A.H. Paterson (ed.) Genome mapping in plants. R.G. Landes Company.
Phillips RL, Somers DA, Hibberd KA. 1988. Cell/tissue culture and in vitro manipulation. In: G. F. Sprague & J. W. Dudley, eds. Corn and corn improvement, 3rd ed., p. 345-387. Madison, WI, USA, American Society of Agronomy.
Pierik, R. L. M. (1999) In vitro Culture of Higher Plants, 4th edition. Martinus Nijhoff Publishers, Dordrecht.
Sambrook J, and Russell DW (2001). Molecular Cloning: A Laboratory Manual. New York, NY, USA., Cold Spring Harbor Laboratory Press.
Sanford JC, Klein TM, Wolf ED, Allen N (1987). Delivery of substances into cells and tissues using a particle bombardment process. J. Particulate Sd. Technol. 5:27-37.
Sanford JC (1988) The biolistic process. Trends in Biotechnology 6:299-302.
Sanford JC (1990) Biolistic plant transformation. Physiologica Plantarum, 79, 206-209.
Sanford JC, Smith FD, and Russell JA (1993) Optimizing the biolistic process for different biological applications. Methods in Enzymology 217:483-509.
Shanmugasundarum S, Williams PH, and Peterson CE (1971) Inheritance of resistance to powdery mildew in cucumber. Phytopathology 61:1218-1221.
Shanmugasundarum S, Williams PH, and Peterson CE (1972) A recessive cotyledon marker gene in cucumber with pleiotropic effects. HortScience 7:555-556.
Tijssen P (1993) Hybridization with Nucleic Acid Probes. Part I. Theory and Nucleic Acid Preparation. In: Laboratory Techniques in Biochemistry and Molecular Biology. Elsevier.
Van Berloo R, Aalbers H, Werkman A, Niks RE (2001) Resistance QTL confirmed through development of QTL-NILs for barley leaf rust resistance. Mol. Breeding 8: 187-195.
Vos P, Hogers R, Bleeker M, Reijans M, van de Lee T, Hornes M, Frijters A, Pot J, Peleman J, Kuiper M (1995) AFLP: a new technique for DNA fingerprinting. Nucl. Acids Res. 23: 4407-4414.
Zhang L, Cheng L, Xu N, Zhao M, Li C, Yuan J, and Jia S (1991) Efficient transformation of tobacco by ultrasonication. Biotechnology. 9:996-997.
Zhao S, and Stodolsky M (2004) Bacterial Artificial Chromosomes. Methods in Molecular Biology Vol 255. Humana Press Inc. Totowa, NJ, USA.
Реферат
Настоящее изобретение относится к растению, которое является устойчивым к клостеровирусу и к мучнистой росе огурцов, где указанное растение представляет собой растение вида Cucumis sativus и содержит на одной хромосоме по меньшей мере одну область, которая придает устойчивость к клостеровирусу, и по меньшей мере одну область, которая придает устойчивость к мучнистой росе. Область хромосомы, которая придает устойчивость к клостеровирусу, связана по меньшей мере с одним маркером, выбранным из группы, состоящей из маркеров Е16/М50-244, Е16/М50-188 и Е11/М48-251. Область хромосомы, которая придает устойчивость к мучнистой росе, связана по меньшей мере с одним маркером, выбранным из группы, состоящей из: маркера однонуклеотидного полиморфизма 39T→ G в SEQ ID NO:1, маркера однонуклеотидного полиморфизма 29G→ А в SEQ ID NO:2, маркера однонуклеотидного полиморфизма 193С→ Т в SEQ ID NO:3, мутации вставки 5'-ААТТТ-3' в положении 221 в SEQ ID NO:4 и маркеров E16/M50-F-194, E11/M48-F-251, Е23/М38-М001, Е23/М40-М003, Е24/М46-М002, Е24/М46-М003, Е12/М91-М003, Е26/М43-М003, E14/M59-F-134 и E14/M59-F-200. 10 н. и 15 з.п. ф-лы, 8 ил., 4 табл.
Формула
где указанная по меньшей мере одна хромосомная область, которая придает устойчивость к клостеровирусу, связана по меньшей мере с одним маркером, выбранным из группы, состоящей из маркеров Е16/М50-244, Е16/М50-188 и E11/M48-251, и
где указанная по меньшей мере одна область, которая придает устойчивость к мучнистой росе, связана по меньшей мере с одним маркером, выбранным из группы, состоящей из:
маркера однонуклеотидного полиморфизма 39Т→ G в SEQ ID NO:1,
маркера однонуклеотидного полиморфизма 29G→ А в SEQ ID NO:2,
маркера однонуклеотидного полиморфизма 193С→ Т в SEQ ID NO:3,
мутации вставки 5'-ААТТТ-3' в положении 221 в SEQ ID NO:4, и
маркеров E16/M50-F-194, E11/M48-F-251, Е23/М38-М001, Е23/М40-М003, Е24/М46-М002, Е24/М46-М003, Е12/М91-М003, Е26/М43-М003, E14/M59-F-134 и E14/M59-F-200.
маркера однонуклеотидного полиморфизма 39Т→ G в SEQ ID NO:1,
маркера однонуклеотидного полиморфизма 29G→ А в SEQ ID NO:2, и
маркеров E16/M50-F-194, E11/M48-F-251, Е23/М38-М001,
и где вторая из указанных по меньшей мере двух областей связана по меньшей мере с одним маркером, выбранным из группы, состоящей из:
маркера однонуклеотидного полиморфизма 193С→ Т в SEQ ID NO:3,
мутации вставки 5'-ААТТТ-3' в положении 221 в SEQ ID NO:4, и
маркеров Е23/М40-М003, Е24/М46-М002, Е24/М46-М003, Е12/М91-М003, Е26/М43-М003, E14/M59-F-134 и E14/M59-F-200.
маркера однонуклеотидного полиморфизма 39Т→ G в SEQ ID NO:1,
маркера однонуклеотидного полиморфизма 29G→ А в SEQ ID NO:2,
маркера однонуклеотидного полиморфизма 193С→ Т в SEQ ID NO:3,
мутации вставки 5'-ААТТТ-3' в положении 221 в SEQ ID NO:4, и
маркеров E16/M50-F-194, E11/M48-F-251, Е23/М38-М001, Е23/М40-М003, Е24/М46-М002, Е24/М46-М003, Е12/М91-М003, Е26/М43-М003, E14/M59-F-134 и E14/M59-F-200.
a) детекции в геноме указанного растения по меньшей мере одного маркера, связанного с устойчивостью к клостеровирусу, выбранного из группы, состоящей из маркеров Е16/М50-244, Е16/М50-188 и Е11/М48-251, и
b) детекции в геноме указанного растения по меньшей мере одного маркера, связанного с устойчивостью к мучнистой росе, выбранного из группы, состоящей из:
маркера однонуклеотидного полиморфизма 39Т→ G в SEQ ID NO:1,
маркера однонуклеотидного полиморфизма 29G→ А в SEQ ID NO:2,
маркера однонуклеотидного полиморфизма 193С→ Т в SEQ ID NO:3,
мутации вставки 5'-ААТТТ-3' в положении 221 в SEQ ID NO:4, и
маркеров E16/M50-F-194, E11/M48-F-251, Е23/М38-М001, Е23/М40-М003, Е24/М46-М002, Е24/М46-М003, Е12/М91-М003, Е26/М43-М003, E14/M59-F-134 и E14/M59-F-200.
детекцию в геноме указанного растения по меньшей мере одного маркера, связанного с первым QTL, придающим устойчивость к мучнистой росе огурцов, показанным SNP маркером 39Т→ G в SEQ ID NO:1, SNP маркером 29G→ А в SEQ ID NO:2 и маркерами E16/M50-F-194, E11/M48-F-251, Е23/М38-М001; и
детекцию в геноме указанного растения по меньшей мере одного маркера, связанного со вторым QTL, придающим устойчивость к мучнистой росе огурцов, показанным SNP маркером 193С→ Т в SEQ ID NO:3, мутацией вставки 5'-ААТТТ-3' в положении 221 в SEQ ID NO:4, и маркерами Е23/М40-М003, Е24/М46-М002, Е24/М46-М003, Е12/М91-М003, Е26/М43-М003, E14/M59-F-134 и E14/M59-F-200.
a) получение образца геномной ДНК из указанного растения;
b) детекцию указанного по меньшей мере одного маркера, связанного с устойчивостью к клостеровирусу, и указанного по меньшей мере одного маркера, связанного с устойчивостью к мучнистой росе, в указанном образце геномной ДНК из указанного растения.
a) получение образца геномной ДНК из указанного растения;
b) детекцию указанного по меньшей мере одного маркера, связанного с устойчивостью к клостеровирусу, и указанного по меньшей мере одного маркера, связанного с устойчивостью к мучнистой росе, в указанном образце геномной ДНК из указанного растения.
а) отбора первого растения огурца, которое содержит хромосомную область, которая придает устойчивость к клостеровирусу огурца, путем обнаружения в геноме указанного растения по меньшей мере одного маркера, связанного с QTL, придающим устойчивость к клостеровирусу огурцов, выявленному маркерами Е16/М50-244, Е16/М50-188, и Е11/М48-251;
b) отбора второго растения огурца, которое содержит по меньшей мере одну хромосомную область, которая придает устойчивость к мучнистой росе, путем обнаружения в геноме указанного растения по меньшей мере одного маркера, связанного с первым QTL, придающим устойчивость к мучнистой росе, показанным следующими маркерами:
маркер однонуклеотидного полиморфизма 39Т→ G в SEQ ID NO:1,
маркер однонуклеотидного полиморфизма 29G→ А в SEQ ID NO:2, и
маркеры E16/M50-F-194, E11/M48-F-251, Е23/М38-М001; или
путем обнаружения в геноме указанного растения по меньшей мере одного маркера, связанного со вторым QTL, придающим устойчивость к мучнистой росе, показанным следующими маркерами:
маркер однонуклеотидного полиморфизма 193С→ Т в SEQ ID NO:3,
мутация вставки 5'-ААТТТ-3' в положении 221 в SEQ ID NO:4, и
маркеры Е23/М40-М003, Е24/М46-М002, Е24/М46-М003, Е12/М91-М003, Е26/М43-М003, E14/M59-F-134 и E14/M59-F-200;
c) скрещивания указанных растений стадии а) и стадии b) с получением семян F1;
d) выращивания некоторого количества семян F1 до растений F1, создавая следующую популяцию потомков из указанных растений F1 путем скрещивания или самоопыления, и
e) отбора из числа следующих растений-потомков растения, которое содержит по меньшей мере один маркер, связанный с QTL, придающим устойчивость к клостеровирусу огурца, как определено на стадии а), и по меньшей мере один маркер, связанный с QTL, придающим устойчивость к мучнистой росе огурца, как определено на стадии b).
f) отбора третьего растения огурца, имеющего другой, чем указанные первый или второй QTL, придающие устойчивость к мучнистой росе огурца (т.е. QTL, который не представлен в указанном втором растении огурца);
g) скрещивания растений F1, полученных на стадии е) с указанным третьим растением огурца с получением последующих растений-потомков, и
h) отбора из числа растений-потомков растения, которое содержит QTL, придающий устойчивость к клостеровирусу огурца, как определено на стадии а), и оба QTL, придающие устойчивость к мучнистой росе огурца, как определено на стадии b).
обнаружение в геноме указанного растения по меньшей мере одного маркера, связанного с первым QTL, придающим устойчивость к мучнистой росе огурца, показанным SNP маркером 39Т→ G в SEQ ID NO:1, SNP маркером 29G→ А в SEQ ID NO:2 и маркерами E16/M50-F-194, E11/M48-F-251, Е23/М38-М001; и
обнаружение в геноме указанного растения по меньшей мере одного маркера, связанного со вторым QTL, придающим устойчивость к мучнистой росе огурцов, показанным SNP маркером 193С→ Т в SEQ ID NO:3, мутацией вставки 5'-ААТТТ-3' в положении 221 в SEQ ID NO:4, и маркерами Е23/М40-М003, Е24/М46-М002, Е24/М46-М003, Е12/М91-М003, Е26/М43-М003, E14/M59-F-134 и E14/M59-F-200.
обнаружение в геноме указанного растения по меньшей мере одного маркера, связанного с первым QTL, придающим устойчивость к мучнистой росе огурца, показанным SNP маркером 39Т→ G в SEQ ID NO:1, SNP маркером 29G→ А в SEQ ID NO:2 и маркерами E16/M50-F-194, E11/M48-F-251, Е23/М38-М001; и
обнаружение в геноме указанного растения по меньшей мере одного маркера, связанного со вторым QTL, придающим устойчивость к мучнистой росе огурцов, показанным SNP маркером 193С→ Т в SEQ ID NO:3, мутацией вставки 5'-ААТТТ-3' в положении 221 в SEQ ID NO:4, и маркерами Е23/М40-М003, Е24/М46-М002, Е24/М46-М003, Е12/М91-М003, Е26/М43-М003, E14/M59-F-134 и E14/M59-F-200.
a) отбора растения вида Cucumis sativus, которое содержит хромосомные области, которые придают устойчивость против клостеровируса огурца и мучнистой росы огурца путем осуществления способа любого из пп.12-17;
b) инбридинга указанного растения с получением гомозиготной линии растения указанных QTL;
c) скрещивания указанных растений стадии а) и стадии b) с получением семян F1 и d) выращивание указанных семян F1 до растений-потомков F1.

Комментарии