Трициклические соединения, композиции, содержащие указанные соединения, и их применения - RU2624446C9
Код документа: RU2624446C9
Чертежи




Описание
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к трициклическим соединениям, композициям, содержащим указанные соединения, и их применению для лечения ожирения и связанных с ним расстройств.
УРОВЕНЬ ТЕХНИКИ
Ожирение является одной из основных предотвратимых причин смертности во всем мире, характеризуется ростом распространенности у взрослых и детей и считается одной из самых серьезных и широко распространенных проблем общественного здравоохранения 21-го века.
Избыточный вес связан с различными физическими и психическими заболеваниями и состояниями, в частности сердечно-сосудистыми заболеваниями, сахарным диабетом 2 типа, синдромом обструктивного апноэ во сне, некоторыми видами рака, остеоартритом и депрессией. В результате ожирение приводит к снижению продолжительности жизни. Если раньше ожирение считалось проблемой только в странах с высоким уровнем дохода, то сейчас число случаев ожирения растет во всем мире, поражая как развитые, так и развивающиеся страны.
На сегодняшний день ведутся постоянные поиски эффективного и безопасного способа лечения ожирения, нарушения распределения жира и всех связанных с ними угрожающих здоровью состояний.
Жировая ткань, или адипозная ткань, представляет собой рыхлую соединительную ткань, состоящую из жировых клеток. Жировая ткань является производной липобластов. Ее главной ролью является хранение энергии в форме липидов, хотя она также служит «подушкой» и изолирует тело. Жировая ткань включает в себя все виды жировой ткани в организме, включая брюшной жир, эпикардиальный жир и подкожную жировую клетчатку.
Установлено, что жировая ткань участвует в эндокринных процессах, в том числе в выработке гормонов, таких как лептин, эстроген, резистин и цитокин - фактор некроза опухоли-альфа (ФНОα). Кроме того, жировая ткань может влиять на другие органы и системы организма и может вызывать заболевание.
Ожирение у человека и большинства животных зависит не от массы тела, а от количества жировой ткани.
Существует два типа жировой ткани: белая жировая ткань (WAT), которая в первую очередь хранит жир, и бурая жировая ткань (ВАТ), которая задействована в процессе сжигания жира для выработки (Farmer SR, Gene & Development 22, 1269-1275 (2008), Petrovic Ν, JBC 258, 7153-7164 (2010)). Возможность превращения WAT в BAT была продемонстрирована, например, путем применения агонистов PPARy (Ohno H. et al., Cell Metabolism 15: 395-404 (2012)). Тем не менее, если рассматривать организм в целом, активация PPARy оказывает также и другое влияние на другие ткани с конечным результатом, заключающемся в увеличении массы тела у пациентов, проходивших лечение агонистами PPARy.
Одной из возможных стратегий лечения ожирения и связанных с ним состояний, заболеваний и расстройств, характеризующихся аномальным распространением WAT, является индукция превращения WAT в ВАТ. Известные ранее способы лечения ожирения по такому механизму включали применение тиазолидазиновых соединений, которые повышали чувствительность организма к инсулину. У таких соединений было выявлено много побочных эффектов, в том числе токсичность для печени, потеря костной массы и увеличение веса.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложено соединение общей формулы (I):
где

каждый из R1-R8 независимо выбран из группы, состоящей из Н, ОН, SH, галогена, нитро, амино, нитрило, нитрозо, ацетила, ацетамидо, ациламидо, алкиламино, линейного или разветвленного С1-С5 алкила, линейного или разветвленного С1-С5 алкенила, линейного или разветвленного С1-С5 алкинила, линейного или разветвленного С1-С5 алкокси, линейного или разветвленного С1-С5 карбоксила, линейного или разветвленного С1-С5 сложного эфира, линейного или разветвленного С1-С5 тиокси, линейного или разветвленного С1-С5 сульфинила и линейного или разветвленного С1-С5 тионила;
R9 и R10 независимо выбраны из отсутствующего радикала, линейного или разветвленного C1-C9 алкила, линейного или разветвленного С1-С9 алкенила, линейного или разветвленного С1-С9 алкинила, пиперазинила, пиридинила, пиперидинила, морфолинила и тиоморфолинила;
причем каждый из указанных R9 и R10 независимо возможно замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из амино (включая четвертичный аммоний), фосфония, линейного или разветвленного С1-С5 алкокси, линейного или разветвленного C1-С5 карбоксила, линейного или разветвленного С1-С5 сложного эфира, линейного или разветвленного С1-С5 тиокси, линейного или разветвленного C1-C5 сульфинила, линейного или разветвленного С1-С5 тионила;
X выбран из СН, N и Р;
Y выбран из отсутствующего радикала, СН, Ν, Р, -СН2, -NH, О, S, -СН-СН2, -СН=СН2, -С=O и N-C=O.
Согласно другому аспекту, в настоящем изобретении предложено соединение общей формулы (I):

где
каждый из R1-R8 независимо выбран из группы, состоящей из Н, ОН, SH, галогена, нитро, амино, нитрило, нитрозо, ацетила, ацетамидо, ациламидо, алкиламино, линейного или разветвленного С1-С5 алкила, линейного или разветвленного С1-С5 алкенила, линейного или разветвленного С1-С5 алкинила, амина, линейного или разветвленного С1-С5 алкокси, линейного или разветвленного С1-С5 карбоксила, линейного или разветвленного С1-С5 сложного эфира, линейного или разветвленного С1-С5 тиокси, линейного или разветвленного С1-С5 сульфинила, линейного или разветвленного C1-С5 тионила;
R9 и R10 независимо выбраны из отсутствующего радикала, линейного или разветвленного С1-С9 алкила, линейного или разветвленного С1-С9 алкенила, линейного или разветвленного С1-С9 алкинила, пиперазинила, пиридинила, пиперидинила, морфолинила и тиоморфолинила;
причем по меньшей мере один из указанных R9 и R10 замещен по меньшей мере одной четвертичной амино (аммониевой) группой или фосфониевой группой;
X выбран из СН, N и Р;
Y выбран из отсутствующего радикала, СН, Ν, Р, СН2, NH, О, S, СН-СН2, СН=СН2, С=O и N-C=O.
В некоторых вариантах реализации Y представляет собой отсутствующий радикал. В таких вариантах реализации центральное кольцо в трициклической кольцевой системе представляет собой пятичленное кольцо. Таким образом, в таких вариантах реализации, соединение согласно настоящему изобретению имеет общую формулу (II):

В других вариантах реализации X представляет собой N. В таких вариантах реализации соединение согласно настоящему изобретению имеет общую формулу (III):

В других вариантах реализации X представляет собой N и Y представляет собой отсутствующий радикал. В таких вариантах реализации соединение согласно настоящему изобретению имеет общую формулу (IV):

В других вариантах реализации R9 представляет собой линейный или разветвленный C1-C9 алкил. В других вариантах реализации указанный линейный или разветвленный С1-С9 алкил замещен по меньшей мере одним амино. В других вариантах реализации R9 представляет собой линейный или разветвленный С1-С9 алкил. В других вариантах реализации указанный линейный или разветвленный С1-С9 алкил замещен по меньшей мере одной четвертичной аминогруппой.
В других вариантах реализации указанный амино (аммоний) имеет общую формулу (V):

где каждый из R', R'' и R''' независимо выбран из группы, состоящей из линейного или разветвленного C1-C9 алкила, линейного или разветвленного С1-С9 алкенила, линейного или разветвленного С1-С9 алкинила. В некоторых вариантах реализации каждый из R', R'' и R''' независимо представляет собой линейный или разветвленный С1-С9 алкил.
В других вариантах реализации R9 представляет собой линейный или разветвленный С1-С9 алкил. В других вариантах реализации указанный линейный или разветвленный С1-С9 алкил замещен по меньшей мере одной фосфониевой группой. В других вариантах реализации указанная фосфониевая группа имеет общую формулу (VI):

где каждый из R', R'' и R''' независимо выбран из группы, состоящей из линейного или разветвленного С1-С9 алкила, линейного или разветвленного С1-С9 алкенила, линейного или разветвленного С1-С9 алкинила. В некоторых вариантах реализации каждый из R', R'' и R''' независимо представляет собой линейный или разветвленный С1-С9 алкил.
В других вариантах реализации по меньшей мере один из R1-R4 представляет собой галоген. В других вариантах реализации по меньшей мере один из R5-R8 представляет собой галоген. В других вариантах реализации по меньшей мере один из R1-R4 представляет собой галоген и по меньшей мере один из R5-R8 представляет собой галоген. В некоторых вариантах реализации указанный галоген представляет собой Br.
В других вариантах реализации по меньшей мере один из R1-R4 представляет собой ОН. В других вариантах реализации по меньшей мере один из R5-R8 представляет собой ОН.
В других вариантах реализации по меньшей мере один из R1-R4 представляет собой нитро. В других вариантах реализации по меньшей мере один из R1-R4 представляет собой нитро и по меньшей мере один из R5-R8 представляет собой нитро.
В настоящем изобретении также предложено соединение, выбранное из следующих:

5-(3,6-дибром-9H-карбазол-9-ил)-N,N,N-триметилпентан-1-аминий (МТК-012)

3-(3,6-дибром-9H-карбазол-9-ил)-N,N,N-триметилпропан-1-аминий (MTK-013)

5-(9Н-карбазол-9-ил)-N,N,N-триметилпентан-1-аминий

5-(2-гидрокси-9H-карбазол-9-ил)-N,N,N-триметилпентан-1-аминий
Термин «галоген», согласно своему значению, включает любой галогеновый фрагмент, выбранный из F, Cl, Br и I.
Термин «нитро» представляет собой фрагмент -NO2.
Термин «амино» обозначает -NH2, -NHR, -NRR', где R, R' и R'' каждый независимо выбраны из линейного или разветвленного C1-С10 алкила (также называемого «алкиламино»), линейного или разветвленного С2-С10 алкенила, линейного или разветвленного С2-С10 алкинила. Термин «амино» также включает четвертичный аммониевый фрагмент вида -+RR'R'', где R, R' и R'' такие, как определено выше.
Термин «нитрило» обозначает -CN.
Термин «нитрозо» обозначает NO фрагмент, включающий С-нитрозные фрагменты (например, нитрозоалканы -R-N=O, где R выбран из линейного или разветвленного C1-С10 алканила, линейного или разветвленного С2-С10 алкенилена, линейного или разветвленного С2-С10 алкинилена), S-нитрозные фрагменты (нитрозотиолы; -S-N=O или -RS-N=O, где R выбран из линейного или разветвленного C1-C10 алканила, линейного или разветвленного С2-С10 алкенилена, линейного или разветвленного С2-С10 алкинилена), N-нитрозные фрагменты (например, нитрозамины; -N=N=O, RN-N=O, -RR'N-N=O) и О-нитрозные фрагменты (-O-N=O, -RO-N=O, где R выбран из линейного или разветвленного C1-С10 алканила, линейного или разветвленного С2-С10 алкенилена, линейного или разветвленного С2-С10 алкинилена).
Термин «ацетил» обозначает фрагмент -С(=O)СН3.
Термины «ацетамидо» и «ациламидо» обозначают -CH2C(=O)NH2 и СН3С(=O)NH-, соответственно.
Термины «линейный или разветвленный С1-С5 алкил» и «линейный или разветвленный C1-C9 алкил» включают насыщенную углеводородную цепь, имеющую от 1 до 5 или от 1 до 9 атомов углерода.
Термины «линейный или разветвленный С2-С5 алкенил» и «линейный или разветвленный С2-С9 алкенил» включают углеводородную цепь, имеющую от 1 до 5 или от 1 до 9 атомов углерода и по меньшей мере одну двойную связь.
Термины «линейный или разветвленный С2-С5 алкинил» и «линейный или разветвленный С2-С9 алкинил» включают углеводородную цепь, имеющую от 1 до 5 или от 1 до 9 атомов углерода и по меньшей мере одну тройную связь.
Термин «линейный или разветвленный C1-C5 алкокси», согласно своему значению, включает любой фрагмент -OR, где R выбран из линейного или разветвленного С1-С10 алкила, линейного или разветвленного С2-С10 алкенила и линейного или разветвленного С2-С10 алкинила.
Термин «линейный или разветвленный C1-C5 карбоксила» обозначает фрагмент -R-C(=O)OH, где R выбран из линейного или разветвленного C1-С10 алканила, линейного или разветвленного С2-С10 алкенилена и линейного или разветвленного С2-С10 алкинилена.
Термин «линейный или разветвленный C1-C5 сложный эфир» обозначает фрагмент RC(=O)O-, где R выбран из линейного или разветвленного C1-С10 алкила, линейного или разветвленного С2-С10 алкенила и линейного или разветвленного С2-С10 алкинила.
Термин «линейный или разветвленный С1-С5 тиокси» обозначает фрагмент RS-, где R выбран из линейного или разветвленного C1-С10 алкила, линейного или разветвленного С2-С10 алкенила и линейного или разветвленного С2-С10 алкинила.
Термины «линейный или разветвленный С1-С5 сульфинил» и «линейный или разветвленный С1-С5 тионил» обозначает фрагмент RS(=O)-, где R выбран из линейного или разветвленного C1-С10 алкила, линейного или разветвленного С2-С10 алкенила и линейного или разветвленного С2-С10 алкинила.
Термин «фосфоний» обозначает фрагмент -P+RR'R'', где R, R' и R'' каждый выбраны из линейного или разветвленного C1-С10 алкила, линейного или разветвленного С2-С10 алкенила и линейного или разветвленного С2-С10 алкинила.
Термин «пиперазинил» включает фрагмент, выбранный из:

Термин «пиридинил» включает фрагмент:

Термин «пиперидинил» включает фрагмент, выбранный из:

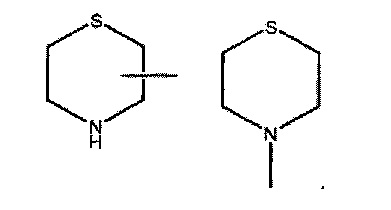
Термин «морфолинил» включает фрагмент, выбранный из:

Термин «тиоморфолинил» включает фрагмент, выбранный из:
Соединения согласно настоящему изобретению, описанные выше, имеют возможность кристаллизоваться с образованием более чем одной формы, характеристики, которая известна как полиморфизм, и следует понимать, что такие полиморфные формы («полиморфы») входят в объем формул (I). Полиморфизм, как правило, может возникать в ответ на изменения температуры или давления, или оба этих изменения, и может также возникать вследствие различий в процессе кристаллизации. Полиморфы можно различать по различным физическим характеристикам, известным в данной области, таким как рентгеновские дифрактограммы, растворимость и температура плавления.
В настоящем документе термин «замещенный» обозначает замещение указанным заместителем или заместителями, где разрешена множественная степень замещения, если не указано иное.
Некоторые соединения, описанные в настоящем документе, могут содержать один или более хиральных атомов или, с другой стороны, могут быть существовать в виде двух энантиомеров или в виде двух или более диастереомеров. Соответственно, соединения согласно настоящему изобретению включают смеси энантиомеров, а также очищенные энантиомеры или энантиомерно обогащенные смеси. Кроме того, соединения согласно настоящему изобретению включают смеси диастереомеров, а также очищенные диастереомеры или диастереомерно обогащенные смеси. Также в объем настоящего изобретения входят отдельные изомеры соединений согласно настоящему изобретению, описанных выше, а также полные или частичные их смеси. Настоящее изобретение также охватывает отдельные изомеры соединений, представленных вышеприведенными формулами, в виде смесей с их изомерами, в которых один или более хиральных центров являются инвертированными.
Также следует отметить, что соединения согласно настоящему изобретению могут образовывать таутомеры. Следует понимать, что все таутомеры и смеси таутомеров соединений согласно настоящему изобретению включены в объем соединений согласно настоящему изобретению.
Согласно другому аспекту, в настоящем изобретении предложена композиция, содержащая соединение общей формулы (I), определенное в настоящем документе выше, или его соль.
В некоторых вариантах реализации указанная композиция представляет собой фармацевтическую композицию, при этом указанная соль представляет собой фармацевтически приемлемую соль.
Фармацевтические композиции согласно настоящему изобретению могут дополнительно содержать любые другие подходящие вещества, такие как другие терапевтически подходящие вещества, диагностически подходящие вещества, фармацевтически приемлемые носители и т.п.
В некоторых вариантах реализации соединение или композицию согласно настоящему изобретению вводят (они подходят для введения) в жировую ткань субъекта. В некоторых вариантах реализации указанные соединение или композицию согласно настоящему изобретению вводят непосредственно в жировую ткань субъекта. В других вариантах реализации указанное введение производят путем инъекции. В других вариантах реализации указанное введение представляет собой трансдермальное введение. В таких вариантах реализации трансдермальное введение может быть произведено с помощью трансдермального состава, известного в данной области, и/или с помощью устройства трансдермальной доставки (например, пластыря, содержащего соединение или композицию согласно изобретению) в непосредственной близости к месту расположения жировой ткани у указанного субъекта (например, непосредственно в кожу или слизистую оболочку, находящуюся в контакте с жировой тканью).
Фармацевтические композиции согласно настоящему изобретению содержат соединение согласно настоящему изобретению в смеси с фармацевтически приемлемыми вспомогательными веществами и, необязательно, другие терапевтические агенты. Указанные вспомогательные вещества должны быть «приемлемыми», то есть являться совместимыми с другими ингредиентами композиции и не вредными для реципиента.
Фармацевтические композиции включают композиции, подходящие для перорального, ректального, назального, местного (в том числе трансдермального, трансбуккального и подъязычного), вагинального или парентерального введения (включая подкожное, внутримышечное, внутривенное введение, введение внутрь жировой ткани и интрадермальное введение) или введения через имплантат. Композиции могут быть получены любым способом, хорошо известным в области фармации. Такие способы включают стадию объединения соединений, используемых в настоящем изобретении, или их комбинаций с любым вспомогательным агентом. Указанный(ые) вспомогательный(ые) агент(ы), также называемый(ые), дополнительным(ыми) ингредиентом(ами), включают агенты, известные в данной области, такие как носители, наполнители, связующие вещества, разбавители, разрыхлители, смазывающие вещества, красители, вкусоароматические вещества, антиоксиданты и увлажняющие агенты.
Фармацевтические композиции, подходящие для перорального введения, могут быть представлены в виде дискретных дозировочных единиц, таких как пилюли, таблетки, драже или капсулы (включая мягкие гелевые капсулы), или в виде порошка или гранул, или в виде раствора или суспензии. Активный ингредиент может также быть представлен в виде болюса, жидкого состава или пасты. Композиции могут быть дополнительно обработаны с получением суппозитория или клизмы дл ректального введения.
Кроме того, настоящее изобретение включает фармацевтическую композицию, описанную выше, в комбинации с упаковочным материалом, включая инструкции по применению композиции для применения, описанного выше.
Для парентерального введения подходящие композиции включают водные и неводные стерильные композиции для инъекций. Композиции могут быть представлены в единичной дозе или в многодозовых емкостях, например закрытых флаконах и ампулах, и могут храниться в высушенном замораживанием (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например воды, перед применением. Для трансдермального введения могут быть рассмотрены, например, гели, пластыри или спреи. Композиции или составы, подходящие для введения в легкие, например путем назальной ингаляции, включают тонкоизмельченные порошки или аэрозоли, которые могут быть получены с помощью дозированных аэрозолей под давлением, распылителей или инсуффляторов.
В некоторых вариантах реализации композиции согласно настоящему изобретению включают также композиции, в которых соединение согласно настоящему изобретению приготовлено в составе жировой эмульсии (т.е. приготовлено посредством обычного процесса приготовления с получением эмульсии, содержащей по меньшей мере один жировой компонент либо из природного, либо из синтетического источника), такой как, например, состав Интралипид (Intralipid) (в любой концентрации).
Точная доза и режим введения композиции обязательно будут зависеть от терапевтического или питательного эффекта, который необходимо достичь, и могут варьировать в зависимости от конкретного состава, пути введения, а также возраста и состояния индивидуального субъекта, которому необходимо вводить указанную композицию.
Настоящее изобретение также включает любую соль соединения согласно настоящему изобретению, включая любую фармацевтически приемлемую соль, при этом соединение согласно изобретению имеет суммарный заряд (либо положительный, либо отрицательный) и к нему добавлен по меньшей мере один противоион (имеющей противоположный отрицательный или положительный заряд) с получением указанной соли. Фраза «фармацевтически приемлемая(ые) соль(и)» в настоящем документе означает такие соли соединений согласно настоящему изобретению, которые являются безопасными и эффективными для фармацевтического применения у млекопитающих и которые обладают требуемой биологической активностью. Фармацевтически приемлемые соли включают соли кислотных или основных групп, присутствующих в соединениях согласно настоящему изобретению. Фармацевтически приемлемые соли присоединения кислот включают, но не ограничиваются только ими, гидрохлоридные, гидробромидные, гидроиодидные, нитратные, сульфатные, бисульфатные, фосфатные, кислые фосфатные, изоникотинатные, ацетатные, лактатные, салицилатные, цитратные, тартратные, пантотенатные, битартратные, аскорбатные, сукцинатные, малеатные, гентизинатные, фумаратные, глюконатные, глюкуронатные, сахаратные, формиатные, бензоатные, глутаматные, метансульфонатные, этансульфонатные, бензолсульфонатные, п-толуолсульфонатные и памоатные (то есть 1,1'-метилен-бис-(2-гидрокси-3-нафтоатные)) соли. Соли согласно настоящему изобретению могут также включать в качестве противоиона анион, представляющий собой анион галогена, такой как, например, хлоридный и бромидный анионы. Некоторые соединения согласно настоящему изобретению могут образовывать фармацевтически приемлемые соли с различными аминокислотами. Подходящие соли включают, но не ограничиваются только ими, соли алюминия, кальция, лития, магния, калия, натрия, цинка и диэтаноламина. Обзор фармацевтически приемлемых солей см. в источнике BERGE ET AL., 66 J. PHARM. SCI. 1-19 (1977), включенном в настоящий документ посредством ссылки.
Согласно другому аспекту, в настоящем изобретении предложено соединение общей формулы (I), определенное в настоящем документе выше, для применения в качестве лекарственного средства.
Согласно другому аспекту, в настоящем изобретении предложено применение соединения общей формулы (I), определенного в настоящем документе выше, для получения лекарственного средства.
В некоторых вариантах реализации указанное лекарственное средство предназначено для лечения ожирения и связанных с ним состояний или заболеваний.
Термин «ожирение», согласно своему значению, включает состояние субъекта, имеющего лишний жир в организме. Ожирение определяется по индексу массы тела (ИМТ) и дополнительно оценивается в отношении распределения жира посредством отношения талия-бедра и общих факторов риска сердечно-сосудистых заболеваний.
Дополнительными параметрами измерения степени ожирения являются процент жира в организме и общий жира в организме. Субъекты, страдающие от ожирения, имеют значение ИМТ более 25. В некоторых вариантах реализации термин «ожирение» включает субъектов, имеющих значения ИМТ от примерно 25,0 до примерно 29,9 (повышенный вес), в некоторых других вариантах реализации от примерно 30,0 до примерно 34,9 (ожирение класса I), в других вариантах реализации от примерно 35,0 до примерно 39,9 (ожирение класса II), в других вариантах реализации более 40,0 (ожирение класса III), в других вариантах реализации от примерно 40 до примерно 49,9 (морбидное ожирение) и в других вариантах реализации >50 (сверхожирение).
В других вариантах реализации лекарственное средство предназначено для лечения ненормального распределения жира и связанных с ним состояний или заболеваний.
Термин «ненормальное распределение жира», согласно своему значению, включает любое неравномерное распределение жировой ткани в, рядом или на органе субъекта или его частях. Жировая или адипозная ткань включает все жировой ткани в организме, включая брюшной жир, эпикардиальный жир и подкожную жировую клетчатку. Данный термин также включает любое неравномерное распределение жировой ткани в восприятии субъекта, который этим страдает, и тем самым связано с низкой самооценкой и связанными с ней психическими расстройствами.
В некоторых вариантах реализации связанные с ожирением состояния или заболевания или ненормальное распределение жира включают, но не ограничиваются только ими, диабет, сердечно-сосудистые заболевания, синдром обструктивного апноэ во сне, липому, рак, остеоартрит, эндокринологические заболевания и расстройства, заболевания и расстройства репродуктивной системы, неврологические заболевания и расстройства, психические заболевания и расстройства, ревматологические заболевания и расстройства и ортопедические заболевания и расстройства и любые их комбинации.
Настоящее изобретение также относится к применению соединения общей формулы (I), определенного в настоящем документе выше, для получения композиции для ремоделирования белой жировой ткани (WAT) с получением жировой ткани, подобной бурой жировой ткани (ВАТ).
WAT-адипоциты содержат одно липидное вкрапление. ВАТ-адипоциты содержат многочисленные мелкие вкрапления липидов и большее количество митохондрий. ВАТ также содержит больше кровеносных капилляров, чем WAT.
Термин «ремоделирование белой жировой ткани (WAT) с получением жировой ткани, подобной бурой жировой ткани (ВАТ)», согласно своему значению, включает любое качественное или количественное различие или изменение в гистологии WAT между исходным состоянием WAT и состоянием WAT после лечения. Указанное количественное или качественное различие может проявляться в изменении размера WAT-адипоцитов, их абляции, в том числе связанного с макрофагами липонекроза, а также во внешнем виде ВАТ-подобных адипоцитов.
Кроме того, в настоящем изобретении предложено применение соединения общей формулы (I), определенного в настоящем документе выше, для получения композиции для лечения заболевания, расстройства или состояния, связанных с ремоделированием WAT до ВАТ, или на которые указанное ремоделирование оказывает благоприятный эффект.
В настоящем изобретении также предложено применение соединения общей формулы (I), определенного в настоящем документе выше, для получения композиции для уменьшения белой жировой ткани (WAT) у нуждающегося в этом субъекта.
Следует отметить, что уменьшение WAT может быть измерено любым способом, известным специалисту в данной области, это может быть, например, уменьшение толщины ткани, изменение плотности ткани и так далее. Такое уменьшение WAT у субъекта, которому вводили соединение согласно настоящему изобретению, может быть произведено для любых известных целей, таких как, например, косметические, медицинские (то есть лечение состояний и заболеваний, связанных с избыточным или аномальным уровнями WAT), или для обеих этих целей.
Согласно другому аспекту, в настоящем изобретении предложено соединение общей формулы (I), определенному в настоящем документе выше, для применения для лечения ожирения и связанных с ним состояний или заболеваний.
Согласно другому аспекту, в настоящем изобретении предложено соединение общей формулы (I), определенному в настоящем документе выше, для применения для лечения ненормального распределения жира и связанных с ним состояний или заболеваний.
Кроме того, в настоящем изобретении предложено соединение общей формулы (I), определенное в настоящем документе выше, для применения для ремоделирования белой жировой ткани с получением жировой ткани, подобной бурой жировой ткани.
Кроме того, в настоящем изобретении предложено соединение общей формулы (I), определенное в настоящем документе выше, для применения для лечения заболевания, расстройства или состояния, связанных с ремоделированием белой жировой ткани с получением жировой ткани, подобной бурой жировой ткани, или на которые указанное ремоделирование оказывает благоприятный эффект.
В настоящем изобретении также предложено соединение общей формулы (I), определенное в настоящем документе выше, для применения для уменьшения белой жировой ткани у нуждающегося в этом субъекта.
Кроме того, в настоящем изобретении предложено соединение, определенное в настоящем документе выше, для применения для ингибирования протеинкиназы CDC42-связывающая протеинкиназа-альфа (CDC42BPA или MRCKA).
Следует отметить, что скрининг действия соединения согласно изобретению: 5-(3,6-дибром-9Н-карбазол-9-ил)-N,N,N-триметилпентан-1-аминия (МТК-012) - в отношении 191 различных протеинкиназ показал значительно селективное ингибирование протеинкиназы CDC42-связывающая протеинкиназа-альфа (также известной как CDC42BPA или MRCKA).
В некоторых вариантах реализации указанное ингибирование связано с лечением по меньшей мере одного заболевания, расстройства или состояния, выбранных из ожирения, избыточного веса или ненормального распределения жира и связанных с ними состояний или заболеваний.
В еще одном аспекте настоящего изобретения предложен способ лечения ожирения и связанных с ним состояний или заболеваний у нуждающегося в этом субъекта, включающий введение эффективного количества соединения общей формулы (I), определенного в настоящем документе выше.
Согласно другому аспекту, в настоящем изобретении предложен способ лечения ненормального распределения жира и связанных с ним состояний или заболеваний у нуждающегося в этом субъекта, включающий введение эффективного количества соединения общей формулы (I), определенного в настоящем документе выше.
Согласно другому аспекту, в настоящем изобретении предложен способ активации ремоделирования белой жировой ткани с получением жировой ткани, подобной бурой жировой ткани, у субъекта, включающий введение эффективного количества соединения общей формулы (I), определенного в настоящем документе выше.
Согласно другому аспекту, в настоящем изобретении предложен способ лечения заболевания, расстройства или состояния, связанных с ремоделированием белой жировой ткани с получением жировой ткани, подобной бурой жировой ткани, или на которые указанное ремоделирование оказывает благоприятный эффект, у субъекта, включающий введение указанному субъекту эффективного количества соединения общей формулы (I), определенного в настоящем документе выше.
Термин «лечение» в настоящем документе обозначает введение терапевтического количества соединения и/или композиции согласно настоящему изобретению, которое эффективно для уменьшения выраженности нежелательных симптомов, связанных с заболеванием, предотвращения проявления таких симптомов до их возникновения, замедления прогрессирования заболевания или состояния, замедления ухудшения симптомов, ускорения наступления периода ремиссии, замедления необратимого вреда, полученного в прогрессирующей хронической стадии заболевания или состояния, отсрочки наступления указанной прогрессирующей стадии, уменьшения тяжести или излечения заболевания или состояния, улучшения выживаемости или более быстрого восстановления, или для предотвращения возникновения формы заболевания или состояния, или для обеспечения комбинации двух или более из вышеперечисленных эффектов.
«Эффективное количество» для целей, описанных в настоящем документе, определяется из соображений, которые могут быть известными в данной области. Количество должно быть эффективным для достижения желаемого терапевтического эффекта, описанного выше, в зависимости, среди прочего, от типа и тяжести заболевания, подлежащего лечению, и схемы лечения. Эффективное количество, как правило, определяется в надлежащим образом спланированных клинических испытаниях (исследованиях диапазона доз), и человек, разбирающийся в данной области, будет знать, как правильно проводить такие испытания, чтобы определить эффективное количество. Как известно, эффективное количество зависит от множества факторов, включая сродство соединения к его белку-мишени (белкам-мишеням), его профиль распределения в организме, различные фармакологические параметры, такие как период полувыведения из организма, от нежелательных побочных эффектов, если таковые имеются, от таких факторов, как масса, ИМТ, возраст и пол и т.д.
Следует отметить, что используемые в данном описании и прилагаемой формуле изобретения формы единственного числа включают формы множественного числа, если явно не указано иное.
В описании и последующей формуле изобретения, если контекст не требует иного, слово «содержать» и его вариации, такие как «содержит» и «содержащий», следует понимать как включение указанного целого, или стадии, или группы целых или стадий, но данные термины не подразумевают исключение любого целого, или стадии, или группы целых и стадий.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Для понимания изобретения и демонстрации того, как оно может быть реализовано на практике, далее исключительно в качестве неограничивающего примера описаны варианты реализации со ссылкой на прилагаемые чертежи, на которых:
Фиг. 1 демонстрирует изменение массы тела 42-недельных самцов мышей после внутрибрюшинной инъекции 5-(3,6-дибром-9Н-карбазол-9-ил)-N,N,N-триметилпентан-1-аминия(МТК-012).
На фиг. 2А-2В приведена показательная иллюстрация уменьшения массы брюшного жира у мышей, получавших лечение с помощью МТК-012 после прекращения эксперимента (контроль (фиг. 2А) и получавшие лечение животные (фиг. 2В) согласно описанию в Примере 5).
На фиг. 3A-3D приведена показательная иллюстрация уменьшения подкожного жира через 3 недели после однократного подкожного (s.с.) введения МТК-012 крысам. Уменьшение подкожного жира проявляется в четкой видимости находящихся ниже кровеносных сосудов, которые в противном случае находятся под жировым слоем у контрольных крыс (интактные - фиг. 3А и 3С, по сравнению с получавшими лечение животными на фиг. 3В и 3D).
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ РЕАЛИЗАЦИИ
Пример 1: Получение 5-(3,6-дибром-9H-карбазол-9-ил)-N,N,N-триметилпентан-1-аминия хлорида (МТК-012)
1,0 г (3,0 мМ) 3,6-дибромкарбазола растворяли в 100 мл диметилформамида (ДМФ). Сразу же добавляли 0,57 г (3,0 мМ) (5-бромпентил)-триметиламмония бромида. Перемешивали 10 мин при помощи магнитной мешалки, после чего добавляли 1,40 г (10 мМ) карбоната калия. После перемешивания еще в течение 10 мин температуру повышали до 50°С и перемешивали смесь при данной температуре в течение 4 ч. Раствор охлаждали до комнатной температуры (КТ), после чего его переносили в делительную воронку и добавляли 200 мл H2O и 200 мл дихлорметана. Смесь растворителей перемешивали встряхиванием и собирали нижнюю фазу. Верхнюю водную фазу подвергали четырехкратной экстракции 50 мл дихлорметана: метанола 3:1 и полученные 5 нижних фаз объединяли и промывали 100 мл насыщенного раствора хлорида натрия. Проводили сушку при помощи MgSO4, фильтровали и упаривали досуха. Остаток кристаллизовали из H2O. Выход: 1,28 г. Протонный ЯМР в CD3OD: 1,31 m2H, 1,70 m2H, 1,93 m 2H, 3,01 s 9H, 3,16 m 2H, 4,39 t 2H, J=0,6, 7,47 d 2H, J=2,0, 7,54 dd 2H, J1=2,0, J2=0,4, 8,21 d 2H, J=0,4. MS: 451, 453, 455 M+ (симметричный 2 ушир. триплет) 452, 454, 456 (MH)+ (симметричный 2 ушир. триплет).
Пример 2: Получение 5-(3,6-дибром-9H-карбазол-9-ил)-N,N,N-триметилпропан-1-аминия хлорида
1,2 г (3,7 мМ) 3,6-дибромкарбазола растворяли в 150 мл диметилформамида (ДМФ). Сразу же добавляли 1,0 г (3,8 мМ). (5-бромпентил)-триметиламмония бромида. Перемешивали 10 мин при помощи магнитной мешалки, после чего добавляли 1,40 г (10 мМ) карбоната калия. После перемешивания еще в течение 10 мин температуру повышали до 50°С и перемешивали смесь при данной температуре в течение 4 ч. Раствор охлаждали до КТ, после чего его переносили в делительную воронку и 200 мл 0,5 н. гидроксида натрия и 200 мл дихлорметана. Смесь растворителей перемешивали встряхиванием и собирали нижнюю фазу. Верхнюю водную фазу подвергали четырехкратной экстракции 50 мл дихлорметана: метанола 3:1 и полученные 5 нижних фаз объединяли и промывали 100 мл насыщенного раствора хлорида натрия. Проводили сушку при помощи MgSO4, фильтровали и упаривали досуха. Выход: 1,1 г.
Пример 3: Получение 5-(9H-карбазол-9-ил)-N,N,N-триметилпентан-1-аминия хлорида
335 мг (2,0 мМ) карбазола растворяли в 50 мл диметилформамида (ДМФ). Сразу же добавляли 0,4 г (2,1 мМ) (5-бромпентил)-триметиламмония бромида. Перемешивали 10 мин. при помощи магнитной мешалки, после чего добавляли 8,4 г (6,0 мМ) карбоната калия. После перемешивания еще в течение 10 мин. температуру повышали до 50°С и перемешивали смесь при данной температуре в течение 4 ч. Раствор охлаждали до КТ, после чего его переносили в делительную воронку и добавляли 100 мл Н20 и 100 мл дихлорметана. Смесь растворителей перемешивали встряхиванием и собирали нижнюю фазу. Верхнюю водную фазу подвергали четырехкратной экстракции 30 мл дихлорметана: метанола 3:1 и полученные 5 нижних фаз объединяли и промывали 60 мл насыщенного раствора хлорида натрия. Проводили сушку при помощи MgSO4, фильтровали и упаривали досуха. Выход: 0,75 г.
Пример 4: Получение 5-(2-гидрокси-9Н-карбазол-9-ил)-N,N,N-триметилпентан-1-аминия хлорида
458 мг (2,5 мМ) 2-гидроксикарбазола растворяли в 80 мл диметилформамида (ДМФ). Сразу же добавляли 0,51 г (2,5 мМ) (5-бромпентил)-триметиламмония бромида. Перемешивали 10 мин при помощи магнитной мешалки, после чего добавляли 1,1 г (7,5 мМ) карбоната калия. После перемешивания еще в течение 10 мин температуру повышали до 50°С и перемешивали смесь при данной температуре в течение 4 ч. Раствор охлаждали до КТ, после чего его переносили в делительную воронку и 100 мл H2O и 100 мл дихлорметана. Смесь растворителей перемешивали встряхиванием и собирали нижнюю фазу. Верхнюю водную фазу подвергали четырехкратной экстракции 40 мл дихлорметана: метанола 3:1 и полученные 5 нижних фаз объединяли и промывали 60 мл насыщенного раствора хлорида натрия. Проводили сушку при помощи MgSO4, фильтровали и упаривали досуха. Выход: 0,6.
Пример 5: Получение 5-(3,6-дибром-9H-карбазол-9-ил)-N,N,N-триметилпентан-1-аминия хлорида
1 г (3,0 ммоль) 3,6-дибромкарбазола растворяли в 100 мл ацетонитрила (CH3CN). Сразу же добавляли 0,63 г (3,3 ммоль) (5-бромпентил)-триметиламмония бромида. Перемешивали 10 мин при помощи магнитной мешалки, после чего при комнатной температуре (КТ) добавляли 1,55 г (11 ммоль) карбоната калия (безводного). Температуру повышали до 75°С и перемешивали смесь при данной температуре в течение 5 ч. Раствор охлаждали до КТ, после чего его переносили в круглодонную колбу и упаривали досуха. Далее добавляли 200 мл Н2О и 200 мл н-бутилового спирта и переносили полученный раствор в делительную воронку. Смесь растворителей перемешивали встряхиванием и собирали верхнюю бутанольную фазу. Нижнюю водную фазу подвергали экстракции 150 мл н-бутилового спирта. Полученные две бутанольные фазы объединяли и далее один раз промывали 200 мл насыщенного раствора хлорида натрия, содержащего 0,5 н. HCl и 4 раза 200 мл насыщенного раствора хлорида натрия. Проводили сушку от воды при помощи MgSO4, фильтровали и упаривали досуха. Продукт кристаллизовали из Н2О. Выход: 1,49 г. Протонный ЯМР в CD3OD: 1,31 m 2Н, 1,70 m 2Н, 1,93 m 2Н, 3,01 s 9Н, 3,16 m 2Н, 4,39 t 2Н, J=0,6, 7,47 d 2Н, J=2,0, 7,54 dd 2Н, J1=2,0, J2=0,4, 8,21 d 2Н, J=0,4. MS: 451, 453, 455 M+ (симметричный 2 ушир. триплет) 452, 454, 456 (МН)+ (симметричный 2 ушир. триплет).
Пример 6: Внутрибрюшинная (i.p.) инъекция МТК-012 мышам
42-недельным самцам мышей (с массой тела 35-42 г) делали i.p. инъекцию носителя (=Контроль, 10 мышей) или МТК-012, растворенного в указанном носителе (10 мышей).
Композиция носителя: водный раствор 4% Tween 20 (Sigma, Р7949) и 20% пропиленгликоль (Sigma, Р4347).
МТК-012 растворяли в композиции носителя с конечной концентрацией 5 мг/мл.
Мышам сначала (t=0) вводили дозу 20 мг/кг или эквивалентный объем носителя для контрольной группы (жирная стрелка на фиг. 1). Через три недели мышам вводили двойную дозу, составляющую 40 мг/кг МТК-012 или 40 мг/кг носителя (пунктирная стрелка на фиг. 1).
Массу тела измеряли один раз в неделю, результаты показаны на фиг. 1 и выражены в виде % изменения массы тела по отношению к массе тела в день 0. Животные в группе лечения чувствовали себя хорошо и были активными аналогично контрольным.
В t=6 недель животных умерщвляли и расчленяли для исследований макропатологии. Видимых изменений не было отмечено, за исключением абляции брюшной жировой ткани в группе мышей, получавших МТК-012, представленной на фиг. 2А-2В, что демонстрирует значительное различие в брюшной жировой ткани у не получавших лечение животных (фиг. 2А) и получавших лечение животных (фиг. 2В).
Пример 7: Однократная подкожная (s.c.) инъекция МТК-012 привела к существенному уменьшению подкожного жира.
Самцам крыс SD с массой тела примерно 400 г однократно (t=0) делали s.c. инъекцию после легкой анестезии кетамином-ксилазином.
МТК-012 в конечной концентрации 10 мг/мл растворяли в носителе, содержащем 2,3% деканоат натрия (С10, Sigma, С4151), 2,3% додеканоат натрия (С12, Sigma, L9755), 10% Солютол HS 15 (Solutol HS 15) (BASF, cat# 06466701), 40% пропиленгликоль (Sigma, Р4347) и 45% Триацетин (Aldrich, cat# 525073).
Инъекцию 1 мл МТК-012 (=25 мг/кг) осуществляли следующим образом: левую часть тела крыс брили и в 5 мест вводили s.c. инъекции, 0,2 мл каждая, с равномерно распределением по левой стороне тела крыс. Крыс умерщвляли через 3 недели и исследовали внутреннюю часть их кожи. Очевидно, что подвергнутая s.c. инъекции жировая ткань уменьшилась (что видно визуально) у крыс, получавших лечение (фиг. 3В и 3D), что проявлялось в воздействии находящихся ниже кровеносных сосудов, по сравнению с анатомической областью на фиг. 3А и 3С. Следует отметить, что хотя инъекцию делали с одной стороны, эффект распространился на весь подкожный слой.
Пример 8: Инъекция МТК-012 и МТК-013 в жировую подушку затылка песчанок (psammomys)
Животные
Десять 2-месячных самок песчанок подвергали диете с высоким содержанием жира в течение 5 недель до начала проведения эксперимента.
Группы лечения
Группа I: 0,1 мл носителя (2,3% деканоат натрия (С10, Sigma, С4151), 2,3% додеканоат натрия (С12, Sigma, L9755), 10% Солютол HS 15 (BASF, cat# 06466701), 40% пропиленгликоль (Sigma, Р4347) и 45% триацетин (Aldrich, cat# 525073))
Группа II: 0,1 мл МТК-012 (концентрация 4 мг/мл в указанном выше носителе).
Группа III: 0,1 мл МТК-013 (концентрация 4 мг/мл в указанном выше носителе).
Введение
Инъекции каждой композиции в жировую подушку затылка делали животным каждой из групп лечения (3, 3 и 4 животных в каждой группе лечения, соответственно), два раза в неделю в течение 2 недель, поддерживая животных на диете с высоким содержанием жира. Всех животных умерщвляли через 4 дня после последней инъекции.
Результаты
В приведенной ниже таблице 1 представлены результаты по массе затылочной WAT через 4 дня после лечения. Очевидно, что наблюдалось значительное уменьшение WAT при лечении МТК-012 и МТК-013 (группы лечения II и III) по сравнению с носителем (группа лечения I).
Кроме того, наблюдался обширный некроз жира без воспаления для групп лечения II и III. Гистологическое исследование ткани WAT показали гигантские адипоциты в некротическом сайте и в окружающей жировой ткани. Кроме того, подвергнутые лечению ткани демонстрировали меньшее по сравнению с нормальным количество адипоцитов и увеличение кровоснабжения в областях, удаленных от места некроза, по сравнению с контрольной группой.

Реферат
Изобретение относится к соединениям общей формулы (IV),,в которой каждый из R-Rнезависимо выбран из группы, состоящей из Н, ОН, галогена или нитро; Rвыбран из линейного или разветвленного С-Салкила, замещенного по меньшей мере одной четвертичной аминогруппой; и где по меньшей мере один из указанных R-Rпредставляет собой галоген; или по меньшей мере один из указанных R-Rпредставляет собой галоген; или по меньшей мере один из указанных R-Rпредставляет собой галоген и по меньшей мере один из указанных R-Rпредставляет собой галоген; или по меньшей мере один из указанных R-Rпредставляет собой ОН; или по меньшей мере один из указанных R-Rпредставляет собой ОН; или по меньшей мере один из указанных R-Rпредставляет собой нитро; или по меньшей мере один из указанных R-Rпредставляет собой нитро и по меньшей мере один из указанных R-Rпредставляет собой нитро; где указанная четвертичная аминогруппа представляет собой группу общей формулы (V), где каждый из R', R'' и R''' независимо выбран из группы, состоящей из линейного или разветвленного С-Салкила. Изобретение также относится к фармацевтической композиции для лечения ожирения, избыточного веса или ненормального распределения жира. Технический результат: получены новые соединения общей формулы (IV), которые могут применяться при лечении ожирения, избыточного веса или ненормального распределения жира. 2 н. и 5 з.п. ф-лы, 7 ил., 1 табл., 8 пр.
Формула






Комментарии