Селективность в отношении мутантных форм и комбинации соединения, представляющего собой ингибитор фосфоинозитид-3-киназы, и химиотерапевтических агентов для лечения рака - RU2665949C2
Код документа: RU2665949C2
Чертежи





























Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В целом данное изобретение относится к лечению гиперпролиферативных расстройств, таких как рак, соединениями, которые ингибируют активность PI3-киназы. Изобретение также относится к способам применения соединений для диагностики или обработки in vitro, in situ и in vivo клеток млекопитающих или лечения ассоциированных патологических состояний.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Применение комбинаций противораковых фармацевтических терапевтических средств, вводимых в режиме одновременного или последовательного дозирования, в настоящее время является общепризнанным подходом в лечении рака. Успешная комбинированная терапия обеспечивает получение улучшенного и даже синергетического эффекта по сравнению с монотерапией, т.е. фармацевтическим лечением, ограниченным одним лекарственным средством (Ouchi et al. (2006) Cancer Chemother. Pharmacol. 57:693-702; Higgins et al. (2004) Anti-Cancer Drugs 15: 503-512). Доклиническое изучение составляет основу для предсказания синергизма комбинаций противораковых фармацевтических терапевтических средств, таких как капецитабин и таксаны, на клинической стадии в отношении лечения рака молочной железы (Sawada et al. (1998) Clin. Cancer Res., 4: 1013-1019). Некоторые дозы и режимы проведения комбинированной терапии могут повысить безопасность без ухудшения эффективности (O'Shaughnessy et al. (2006) Clin. Breast Cancer, Apr 7(1): 42-50). Синергетические эффекты in vitro коррелировали с синергизмом на клинической стадии (Steinbach et al. (2003) Clin. Inf. Dis. Oct 1; 37 Suppl. 3: S188-224).
Активация сигнального пути фосфоинозитид-3-киназа/протеинкиназа В (phosphoinositide-3 kinase (PI3K)/Akt) является общим признаком большинства раковых заболеваний (Yuan and Cantley (2008) Oncogene, 27: 5497-510). Генетические отклонения, касающиеся данного пути, были обнаружены во многих случаях рака у человека (Osaka et al. (2004) Apoptosis, 9: 667-76), и их влияние преимущественно связано со стимулированием пролиферации, миграции и выживаемости клеток. Активация данного пути происходит вследствие активирующих точечных мутаций или амплификации гена PI3KCA, кодирующего изоформы р110а PI3K (Hennessy et al. (2005) Nat. Rev. Drug Discov., 4: 988-1004). Генетическая делеция или приводящие к потере функциональности мутации в гене онкосупрессора PTEN (phosphatase and tensin homolog deleted on chromosome 10 - фосфатаза и гомолог тензина с делецией по 10-й хромосоме), фосфатазы с функцией, противоположной PI3K, также усиливает PI3K-опосредованный путь передачи сигнала (Zhang and Yu (2010) Clin. Cancer Res., 16: 4325-30). Эти нарушения приводят к усилению последующих звеньев передачи сигнала с участием таких киназ, как Akt и mTOR mammalian target of rapamycin - мишень рапамицина у млекопитающих), и высказано предположение, что повышение активности PI3K-пути является признаком резистентности к лечению рака (Opel et al. (2007) Cancer Res., 67: 735-45; Razis et al. (2011) Breast Cancer Res. Treat., 128: 447-56).
Фосфатидилинозитол-3-киназа (phosphatidylinositol 3-kinase; PI3K) является основным узлом пути передачи сигнала для ключевых сигналов, связанных с выживаемостью и ростом в случае лимфом, и она обладает активностью, противоположной активности фосфатазы PTEN. PI3K-путь нарушен при агрессивных формах лимфомы (Abubaker (2007) Leukemia, 21: 2368-2370). В восьми процентах случаев диффузной В-клеточной крупноклеточной лимфомы (diffuse large B-cell lymphoma; DLBCL) имеются миссенс-мутации в гене PI3KCA (каталитической альфа-субъединицы фосфатидилинозитол-3-киназы), а 37% случаев по данным иммуногистохимического тестирования являются PTEN-отрицательными.
Фосфатидилинозит является одним из ряда фосфолипидов, обнаруженных в клеточных мембранах и принимающих участие во внутриклеточной передаче сигнала. Передача сигнала клетками, опосредованная 3'-фосфорилированными фосфоинозитидами, вовлечена в целый ряд клеточных процессов, например, малигнизацию, передачу сигнала с участием ростовых факторов, воспаление и иммунитет (Rameh et al. (1999) J. Biol. Chem. 274: 8347-8350). Фермент, ответственный за образование таких фосфорилированных продуктов сигнального пути, фосфатидилинозитол-3-киназу (также обозначаемую как PI3-киназа или PI3K), изначально идентифицировали по активности, ассоциированной с вирусными онкобелками и тирозинкиназами - рецепторами ростовых факторов, которые фосфорилируют фосфатидилинозит (phosphatidylinositol; PI) и его фосфорилированные производные по 3'-гидроксилу кольца инозита (Panayotou et al. (1992) Trends Cell Biol. 2: 358-60). Фосфоинозитид-3-киназы (PI3K) представляют собой липидкиназы, которые фосфорилируют липиды по 3'-гидроксильному остатку кольца инозита (Whitman et al. (1988) Nature, 332: 664). 3'-Фосфорилированные фосфолипиды (3-phosphorylated phospholipids; PIP3), образованные с помощью Р13-киназ, действуют в качестве вторичных мессенджеров, вовлекающих киназы с липид-связывающими доменами (включая плекстрин-гомологичные (РН; plekstrin homology) участки), такие как Akt и фосфоинозитид-зависимая киназа-1 (PDK1; phosphoinositide-dependent kinase-1) (Vivanco et al. (2002) Nature Rev. Cancer 2: 489; Phillips et al. (1998) Cancer 83: 41).
Семейство Р13-киназ содержит по меньшей мере 15 разных ферментов, систематизированных по структурной гомологии и разделенных на 3 класса на основе гомологии последовательностей и продукта, образующегося в результате ферментативного катализа. Р13-киназы I класса состоят из 2 субъединиц: каталитической субъединицы с молекулярной массой (ММ) 110 кДа и регуляторной субъединицы с ММ 85 кДа. Регуляторные субъединицы содержат 8Н2-домены (src-гомологичные домены 2) и связываются с остатками тирозина, фосфорилированными под действием рецепторов ростовых факторов, обладающих тирозинкиназной активностью, или продуктов онкогенов, индуцируя тем самым PI3K-активность каталитической субъединицы р110, которая фосфорилирует свой липидный субстрат. Р13-киназы I класса вовлечены в важные события передачи сигнала вниз по пути цитокинов, интегринов, ростовых факторов и иммунорецепторов, что предполагает, что регулирование этого пути может приводить к получению важных терапевтических эффектов, таких как модулирование клеточной пролиферации и канцерогенеза. PI3K I класса могут фосфорилировать фосфатидилинозит (PI), фосфатидилинозит-4-фосфат и фосфатидилинозит-4,5-бифосфат (PIP2) с получением фосфатидилинозит-3-фосфата (PIP), фосфатидилинозит-3,4-бифосфата и фосфатидилинозит-3,4,5 трифосфата, соответственно. PI3K II класса фосфорилируют PI и фосфатидилинозит-4-фосфат. PI3K III класса могут фосфорилировать только PI. Ключевой изоформой Р13-киназ при раке является PI3-киназа I класса, содержащая р110а, на что указывают неоднократно повторяющиеся онкогенные мутации в р110а (Samuels et al. (2004) Science 304: 554; US 5824492; US 5846824; US 6274327). Другие изоформы могут играть важную роль при раке и также вовлечены в сердечно-сосудистые и иммуновоспалительные заболевания (Workman Р (2004) Biochem. Soc. Trans., 32: 393-396; Patel et al. (2004) Proc. Am. Assoc. of Cancer Res. (Abstract LB-247) 95th Annual Meeting, March 27-31, Orlando, Florida, USA; Ahmadi К and Waterfield MD (2004) "Phosphoinositide 3-Kinase: Function and Mechanisms" Encyclopedia of Biological Chemistry (Lennarz WJ, Lane MD eds) Elsevier/Academic Press). Онкогенные мутации р110-альфа со значительной частотой были обнаружены в солидных опухолях толстой кишки, молочной железы, головного мозга, печени, яичников, желудка, легкого и головы и шеи. Примерно 35-40% случаев раковых опухолей молочной железы, положительных в отношении рецепторов гормонов (hormone receptor positive; HR+), содержат мутацию PIK3CA. Нарушения в PTEN обнаруживаются при глиобластоме, меланоме, раке предстательной железы, эндометрия, яичников, молочной железы, легкого, головы и шеи, гепатоклеточном раке и раке щитовидной железы.
PI3-Киназа представляет собой гетеродимер, состоящий из субъединиц р85 и р110 (Otsu et al. (1991) Cell, 65: 91-104; Hiles et al. (1992) Cell, 70: 419-29). Были идентифицированы четыре разных PI3K I класса, обозначенных как PI3K-α (альфа), -β (бета), -δ (дельта) и -γ (гамма), каждая из которых содержит индивидуальную каталитическую субъединицу (110 кДа) и регуляторную субъединицу. Каждая из трех каталитических субъединиц, т.е. р110-альфа, р110-бета и р110-дельта, взаимодействует с одной и той же регуляторной субъединицей, р85; тогда как р110-гамма взаимодействует с другой регуляторной субъединицей, р101. Картины экспрессии для каждой из этих PI3K в клетках и тканях человека различаются. В случае каждого из подтипов PI3K, альфа, бета и дельта, субъединица р85 действует таким образом, чтобы локализовать PI3-киназу в плазматической мембране посредством взаимодействия ее 5Н2-домена с фосфорилированными остатками тирозина (имеющимися в соответствующем окружении последовательностей) в белках-мишенях (Rameh et al. (1995) Cell, 83: 821-30; Volinia et al. (1992) Oncogene, 7: 789-93).
Измерение уровней экспрессии биомаркеров (например, белков, секретируемых в плазму) может быть эффективным средством выявления пациентов и групп пациентов, которые будут отвечать на конкретные терапии, включая, например, лечение химиотерапевтическими агентами. Существует потребность в более эффективных средствах определения того, какие пациенты с гиперпролиферативными расстройствами, такими как рак, будут отвечать на лечение какими химиотерапевтическими агентами, и потребность во включении результатов таких определений в более эффективные схемы лечения пациентов независимо от того, используются ли данные химиотерапевтические агенты в виде отдельных агентов или в комбинации с другими агентами.
Путь PI3-киназа/Akt/PTEN представляет собой привлекательную мишень для разработки противораковых лекарственных средств, поскольку ожидается, что такие агенты будут ингибировать клеточную пролиферацию, подавлять сигналы от стромальных клеток, обеспечивающих раковым клеткам выживаемость и химиорезистентность, реверсировать подавление апоптоза и преодолевать внутреннюю резистентность раковых клеток к цитотоксическим агентам. Данные об ингибиторах PI3-киназ опубликованы (Yaguchi et al. (2006) Jour, of the Nat. Cancer Inst., 98(8): 545-556; US 7173029; US 7037915; US 6608056; US 6608053; US 6838457; US 6770641; US 6653320; US 6403588; US 7750002; WO 2006/046035; US 7872003; WO 2007/042806; WO 2007/042810; WO 2004/017950; US 2004/092561; WO 2004/007491; WO 2004/006916; WO 2003/037886; US 2003/149074; WO 2003/035618; WO 2003/034997; US 2003/158212; EP 1417976; US 2004/053946; JP 2001247477; JP 08175990; JP 08176070).
Некоторые соединения тиенопиримидинов обладают активностью в отношении связывания с р110-альфа и ингибирования PI3-киназы и подавляют рост раковых клеток (Wallin et al. (2011) Mol. Can. Then, 10(12): 2426-2436; Sutherlin et al. (2011) Jour. Med. Chem., 54: 7579-7587; US 2008/0207611; US 7846929; US 7781433; US 2008/0076758; US 7888352; US 2008/0269210). GDC-0941 (регистрационный № в Химической реферативной службе (Chemical abstracts service; CAS) 957054-30-7, Genentech Inc.) представляет собой селективный, биодоступный при пероральном введении ингибитор PI3K с многообещающими фармакокинетическими и фармацевтическими свойствами (Folkes et al. (2008) Jour, of Med. Chem., 51(18): 5522-5532; US 7781433; Belvin et al., American Association for Cancer Research Annual Meeting, 2008, 99th: April 15, Abstract 4004; Folkes et al., American Association for Cancer Research Annual Meeting, 2008, 99th: April 14, Abstract LB-146; Friedman et al., American Association for Cancer Research Annual Meeting, 2008, 99th: April 14, Abstract LB-110) и демонстрирует синергетическую активность in vitro и in vivo в комбинации с некоторыми химиотерапевтическими агентами в отношении клеточных линий солидных опухолей (US 2009/0098135).
GDC-0032 (Roche RG7604, регистрационный № в CAS 1282512-48-4) с названием 2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо-[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамид обладает сильной активностью в отношении PI3K (WO 2011/036280; US 8242104; US 8343955), и в настоящее время проходят его исследования на пациентах с локально распространенными или метастатическими солидными опухолями.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Эта заявка также включает любую комбинацию перечисленных ниже аспектов изобретения.
Было установлено, что аддитивные или синергетические эффекты ингибирования роста раковых клеток in vitro и in vivo могут быть достигнуты путем введения соединения GDC-0032 или его фармацевтически приемлемой соли в комбинации с некоторыми другими определенными химиотерапевтическими агентами. Комбинации и способы могут быть использованы в лечении гиперпролиферативных расстройств, таких как рак.

В одном из аспектов изобретение относится к способу лечения гиперпролиферативного расстройства, включающему введение терапевтической комбинации в виде объединенной композиции или путем чередования млекопитающему, где терапевтическая комбинация содержит терапевтически эффективное количество GDC-0032, имеющего структуру:

и терапевтически эффективное количество химиотерапевтического агента, выбранного из 5-FU (5-фторурацил), доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола.
В одном из аспектов согласно изобретению предложен способ лечения гиперпролиферативного расстройства, где введение GDC-0032 и одного или более химиотерапевтических агентов, выбранных из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, обеспечивает синергетический эффект при лечении гиперпролиферативного расстройства. В следующем аспекте синергетический эффект имеет значение показателя для комбинации (combination index) менее чем примерно 0,8.
В одном из аспектов изобретения предложена терапевтическая комбинация, дополнительно содержащая карбоплатин.
В одном из аспектов изобретение включает терапевтическую комбинацию, дополнительно содержащую антитело к сосудистому эндотелиальному фактору роста (vascular endothelial growth factor; VEGF).
В одном из аспектов изобретения антителом к VEGF является бевацизумаб.
В одном из аспектов изобретение включает фармацевтически приемлемую соль GDC-0032, выбранную из соли, образованной с использованием соляной кислоты, бромистоводородной кислоты, йодистоводородной кислоты, серной кислоты, азотной кислоты, фосфорной кислоты, метансульфоновой кислоты, бензолсульфоновой кислоты, муравьиной кислоты, уксусной кислоты, трифторуксусной кислоты, пропионовой кислоты, щавелевой кислоты, малоновой кислоты, янтарной кислоты, фумаровой кислоты, малеиновой кислоты, молочной кислоты, яблочной кислоты, винной кислоты, лимонной кислоты, этансульфоновой кислоты, аспарагиновой кислоты и глутаминовой кислоты.
В одном из аспектов изобретение относится к способу лечения гиперпролиферативного расстройства у пациента, включающему введение пациенту терапевтически эффективного количества GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, при этом биологический образец, полученный от пациента до введения комбинации пациенту, протестирован на статус биомаркера, и при этом статус биомаркера указывает на отвечаемость пациентом на терапию GDC-0032 или комбинацией GDC-0032 и химиотерапевтического агента. В одном из воплощений биологический образец протестирован посредством измерения уровня функционального биомаркерного белка, при этом повышенный уровень функционального биомаркера указывает на то, что пациент будет резистентным к GDC-0032 или указанной комбинации. В другом воплощении биологический образец протестирован посредством измерения уровня функционального биомаркера, при этом повышенный или пониженный уровень функционального биомаркера указывает на то, что пациент будет резистентным к GDC-0032 или указанной комбинации.
В одном из аспектов изобретение включает фармацевтическую композицию, содержащую GDC-0032 и химиотерапевтический агент, выбранный из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола.
В одном из аспектов изобретение включает применение терапевтической комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, в изготовлении лекарственного средства для лечения гиперпролиферативного расстройства.
В одном из аспектов изобретение включает применение терапевтической комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, в изготовлении лекарственного средства для лечения рака, выбранного из рака молочной железы, шейки матки, толстой кишки, эндометрия, глиомы, рака легкого, меланомы, рака яичников, поджелудочной и предстательной железы.
В одном из аспектов изобретение включает терапевтическую комбинацию GDC-0032, имеющего структуру:

и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, для применения при лечении гиперпролиферативного расстройства.
В одном из аспектов изобретение включает терапевтическую комбинацию GDC-0032, имеющего структуру:

и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, для применения в лечении рака, выбранного из рака молочной железы, шейки матки, толстой кишки, эндометрия, глиомы, рака легкого, меланомы, рака яичников, поджелудочной и предстательной железы.
В одном из аспектов изобретение включает применение терапевтической комбинации GDC-0032, имеющего структуру:

и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, для применения при лечении гиперпролиферативного расстройства.
В одном из аспектов изобретение включает применение терапевтической комбинации GDC-0032, имеющего структуру:

и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, в лечении рака, выбранного из рака молочной железы, шейки матки, толстой кишки, эндометрия, глиомы, рака легкого, меланомы, рака яичников, поджелудочной и предстательной железы. В одном из аспектов изобретение включает изобретение, как оно изложено в данном описании ранее.
В одном из аспектов изобретение включает изделие производства для лечения гиперпролиферативного расстройства, содержащее:
a) терапевтическую комбинацию GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола; и
b) инструкции по применению.
В одном из аспектов изобретение включает продукт, содержащий GDC-0032 и химиотерапевтический агент, выбранный из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, в виде объединенной композиции для раздельного, одновременного или последовательного применения при лечении гиперпролиферативного расстройства.
В одном из аспектов изобретение включает способ, где терапевтически эффективное количество GDC-0032 и терапевтически эффективное количество химиотерапевтического агента вводят в виде объединенной композиции.
В одном из аспектов изобретение включает способ, где терапевтически эффективное количество GDC-0032 и терапевтически эффективное количество химиотерапевтического агента вводят млекопитающему путем чередования.
В одном из аспектов изобретение включает способ, где млекопитающему вводят химиотерапевтический агент и после этого вводят GDC-0032.
В одном из аспектов изобретение включает способ, где терапевтическую комбинацию вводят в режиме введения, когда терапевтически эффективное количество GDC-0032 вводят в диапазоне от двух раз в сутки до одного раза каждые три недели и терапевтически эффективное количество химиотерапевтического агента вводят в диапазоне от двух раз в сутки до одного раза каждые три недели.
В одном из аспектов изобретение включает способ, где данный режим введения повторяют один или более раз.
В одном из аспектов изобретение включает способ, где введение терапевтической комбинации приводит к синергетическому эффекту.
В одном из аспектов изобретение включает способ, где введение терапевтической комбинации приводит к получению значения показателя для комбинации и менее чем примерно 0,7.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой рак, выбранный из рака молочной железы, шейки матки, толстой кишки, эндометрия, желудка, глиомы, рака легкого, меланомы, рака яичников, поджелудочной и предстательной железы.
В одном из аспектов изобретение включает способ, где раковая опухоль экспрессирует мутантную форму PIK3CA с мутацией, выбранной из Е542К, Е545К, Q546R, H1047L и H1047R.
В одном из аспектов изобретение включает способ, где раковая опухоль экспрессирует мутантную форму PTEN.
В одном из аспектов изобретение включает способ, где рак является HER2(рецептор эпидермального фактора роста человека 2 типа)-положительным.
В одном из аспектов изобретение включает способ, где млекопитающее представляет собой пациента с раком молочной железы, при этом данный пациент является HER2-отрицательным, ER(рецептор эстрогенов)-отрицательным и PR(рецептор прогестерона)-отрицательным.
В одном из аспектов изобретение включает способ, где рак молочной железы является раком базального или люминального подтипа.
В одном из аспектов изобретение включает способ, где пациенту вводят GDC-0032 и эрибулин.
В одном из аспектов изобретение включает способ, где GDC-0032 и химиотерапевтический агент каждый вводят в количестве от примерно 1 мг до примерно 1000 мг на стандартную лекарственную форму.
В одном из аспектов изобретение включает способ, где GDC-0032 и химиотерапевтический агент вводят в соотношении от примерно 1:50 до примерно 50:1 по массе.
В одном из аспектов изобретение включает фармацевтическую композицию, содержащую GDC-0032 и химиотерапевтический агент, выбранный из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола.
В одном из аспектов изобретение включает фармацевтическую композицию, дополнительно содержащую фармацевтически приемлемый глидант, выбранный из диоксида кремния, порошкообразной целлюлозы, микрокристаллической целлюлозы, стеаратов металлов, алюмосиликата натрия, бензоата натрия, карбоната кальция, силиката кальция, кукурузного крахмала, карбоната магния, талька без примеси асбеста, стеаровета (stearowet) С, крахмала, крахмала 1500, лаурилсульфата магния, оксида магния и их комбинаций.
В одном из аспектов изобретение включает фармацевтическую композицию, в которой содержание каждого из GDC-0032 и химиотерапевтического агента составляет от примерно 1 мг до примерно 1000 мг на стандартную лекарственную форму.
В одном из аспектов изобретение включает фармацевтическую композицию для применения в способе лечения рака.
В одном из аспектов изобретение включает способ определения соединений, предназначенных для применения в комбинации для лечения рака, включающий:
a) обработку in vitro опухолевой клеточной линии с мутацией K-ras терапевтической комбинацией GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, и
b) измерение синергетического или несинергетического эффекта; посредством чего определяют синергетическую терапевтическую комбинацию для лечения рака.
В одном из аспектов изобретение включает способ выбора соединений, предназначенных для использования в комбинации для лечения рака, включающий:
a) введение в опухолевые клетки терапевтической комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола;
b) измерение изменения уровня фосфорилированной киназы Akt (pAkt); и
c) выбор синергетической терапевтической комбинации, которая демонстрирует увеличение уровней pAkt.
В одном из аспектов изобретение относится к способу лечения гиперпролиферативного расстройства у пациента, включающему введение пациенту терапевтически эффективного количества GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, при этом биологический образец, полученный от пациента до введения комбинации пациенту, протестирован на статус мутации PIK3CA или PTEN, и при этом статус мутации PIK3CA или PTEN указывает на отвечаемость пациентом на терапию данной комбинацией. Пациенту вводят терапевтически эффективное количество GDC-0032 в виде отдельного агента или комбинации GDC-0032 и химиотерапевтического агента. Биологический образец может быть протестирован посредством измерения уровня функционального белка PI3K после введения GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, при этом изменение уровня функционального белка PI3K указывает на то, что пациент будет резистентным к GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента либо будет отвечать на GDC-0032 или комбинацию GDC-0032 и химиотерапевтического агента.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой HER2-экспрессирующий рак молочной железы.
В одном из аспектов изобретение включает способ, где биологический образец протестирован посредством измерения уровня функционального белка PI3K после введения GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, при этом изменение уровня функционального белка PI3K указывает на то, что пациент будет резистентным к GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента либо будет отвечать на GDC-0032 или комбинацию GDC-0032 и химиотерапевтического агента.
В одном из аспектов изобретение относится к способу мониторинга того, будет ли пациент с гиперпролиферативным расстройством отвечать на лечение с применением GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, включающему:
(а) детекцию мутации PIK3CA или PTEN в биологическом образце, полученном от пациента после введения по меньшей мере одной дозы GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола; и
(b) сравнение статуса мутации PIK3CA или PTEN в биологическом образце, полученном от пациента до введения данному пациенту GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента,
при этом изменение или модулирование статуса мутации PIK3CA или PTEN в образце, полученном после введения GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, позволяет идентифицировать пациента, который будет отвечать на лечение с применением GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой HER2-экспрессирующий рак молочной железы.
В одном из аспектов изобретение относится к способу оптимизации терапевтической эффективности GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, включающему:
(a) детекцию мутации PIK3CA или PTEN в биологическом образце, полученном от пациента после введения по меньшей мере одной дозы GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола; и
(b) сравнение статуса мутации PIK3CA или PTEN в биологическом образце, полученном от пациента до введения пациенту GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента,
при этом изменение или модулирование PIK3CA или PTEN в образце, полученном после введения GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, позволяет идентифицировать пациента, который имеет более высокую вероятность получения пользы от лечения с применением GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой HER2-экспрессирующий рак молочной железы.
В одном из аспектов изобретение относится к способу идентификации биомаркера для мониторинга отвечаемости на GDC-0032 или комбинацию GDC-0032 и химиотерапевтического агента, включающему:
(a) детекцию экспрессии, модулирования или активности биомаркера, выбранного из мутантной формы PIK3CA или PTEN, в биологическом образце, полученном от пациента, получившего по меньшей мере одну дозу GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола; и
(b) сравнение экспрессии, модулирования или активности биомаркера со статусом биомаркера в образце сравнения, представляющем собой биологический образец, полученный от пациента до введения данному пациенту GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента;
при этом модулирование изменений биомаркера по меньшей мере в 2 раза в меньшую или большую сторону по сравнению с образцом сравнения позволяет идентифицировать биомаркер как биомаркер, полезный для мониторинга отвечаемости на GDC-0032 или комбинацию GDC-0032 и химиотерапевтического агента. В одном из воплощений биомаркер представляет собой pAkt.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой HER2-экспрессирующий рак молочной железы.
В одном из аспектов изобретение относится к способу лечения гиперпролиферативного расстройства у пациента, включающему введение пациенту терапевтически эффективного количества GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, при этом лечение основывается на данных об образце, полученном от пациента, имеющего мутацию PIK3CA или PTEN. Такой мутацией биомаркера может быть мутация H1047R, H1047L, Е545К или Е542К в PIK3CA.
В одном из аспектов изобретение включает способ, где мутация в биомаркере представляет собой мутацию H1047R или H1047L в PIK3CA.
В одном из аспектов изобретение включает способ, где мутация в биомаркере представляет собой мутацию Е542К, Е545К или Q546R в PIK3CA.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой HER2-экспрессирующий рак молочной железы.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой положительный в отношении рецепторов эстрогенов (ER+) рак молочной железы.
В одном из аспектов изобретение относится к применению GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента при лечении гиперпролиферативного расстройства у пациента, включающем введение пациенту терапевтически эффективного количества GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола,
при этом биологический образец, полученный от пациента до введения пациенту GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, протестирован на статус мутации PIK3CA или PTEN, и при этом статус мутации PIK3CA или PTEN указывает на отвечаемость пациентом на терапию с применением GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента.
В одном из аспектов изобретение включает применение, где гиперпролиферативное расстройство представляет собой HER2-экспрессирующий рак молочной железы.
В одном из аспектов изобретение включает применение, где гиперпролиферативное расстройство представляет собой положительный в отношении рецепторов эстрогенов (ER+) рак молочной железы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
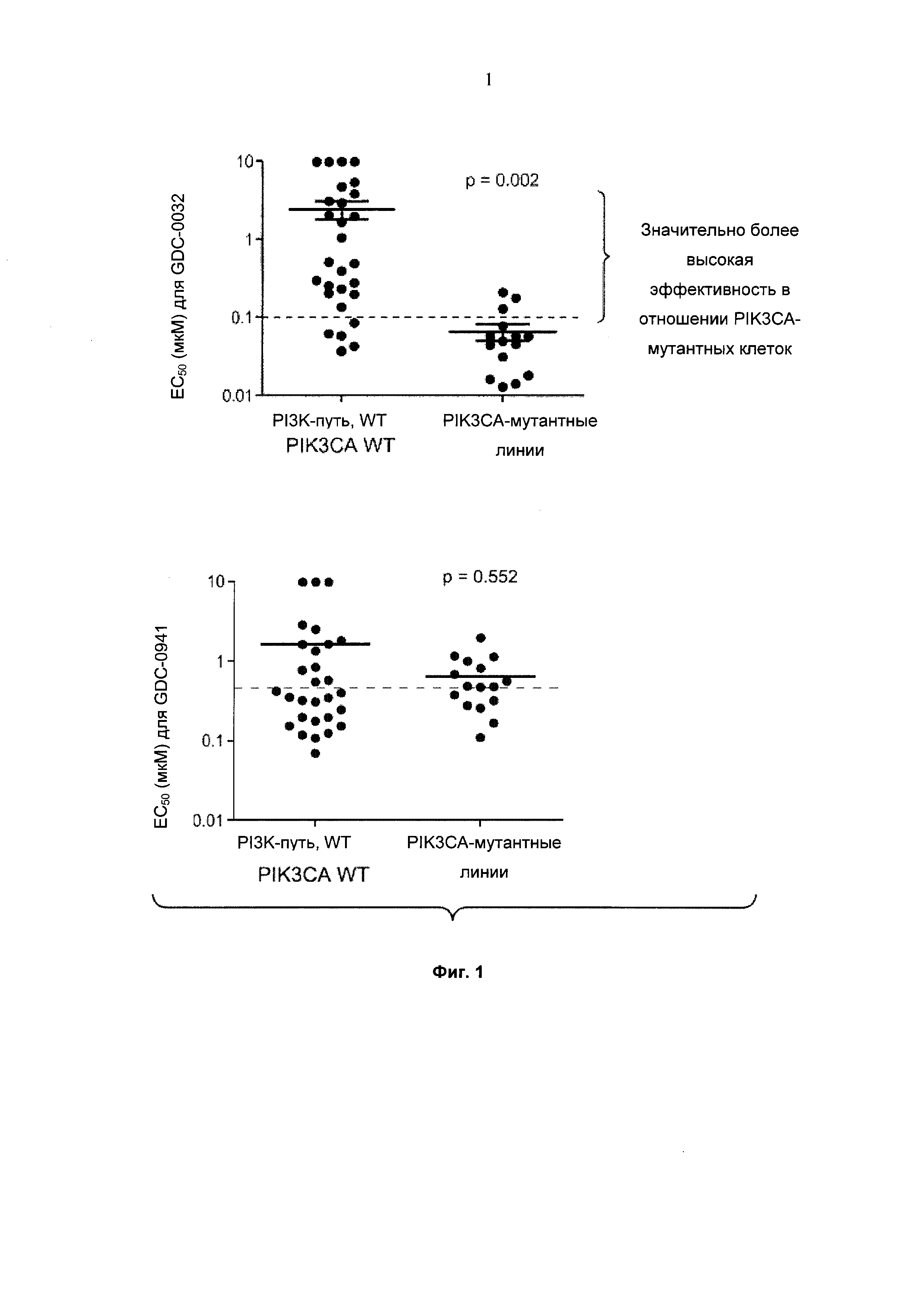
На Фиг. 1 приведены два графика, демонстрирующие эффективность (EC50, микромолярная концентрация) GDC-0032 и GDC-0941 (4-(2-(1Н-индазол-4-ил)-6-((4-(метилсульфонил)пиперазин-1-ил)метил)тиено[3,2-d]пиримидин-4-ил)морфолина) в анализе клеточной пролиферации (Cell-Titer Glo®, Promega), выполненном в отношении клеточных линий с PIK3CA дикого типа (wild type; WT) и PIK3CA-мутантных клеточных линий. Каждая точка относится к отдельной раковой клеточной линии.
На Фиг. 2 приведены два графика, демонстрирующие эффективность (EC50, микромолярная концентрация) GDC-0032 и GDC-0941 в анализах клеточной пролиферации, выполненных в отношении клеточных линий с PIK3CA дикого типа (WT), PIK3CA-мутантных, HER2-экспрессирующих и PI3K-мутантных/HER2-экспрессирующих клеточных линий. Каждая точка относится к отдельной клеточной линии.
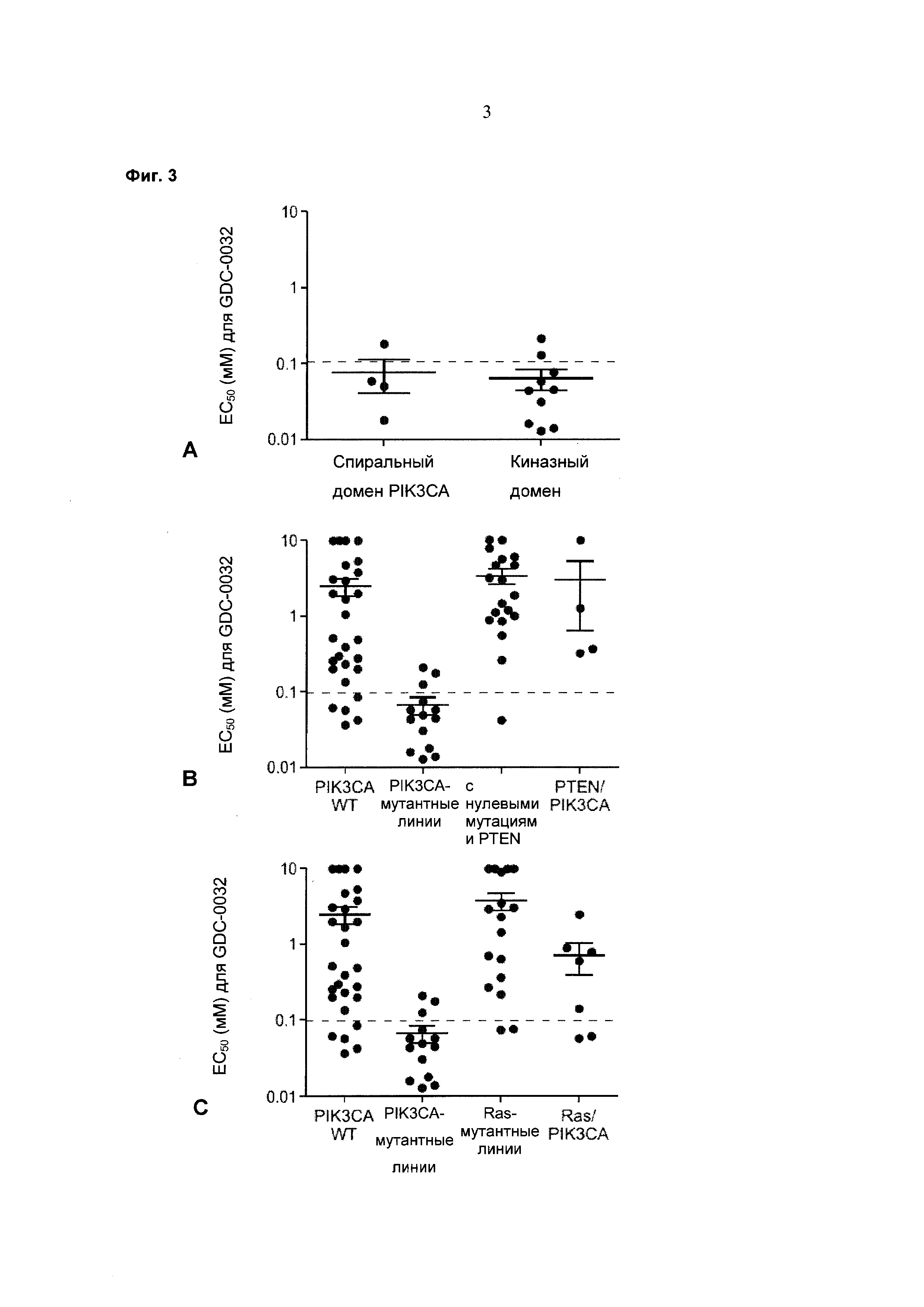
На Фиг. 3 приведены три графика, демонстрирующие эффективность (EC50, микромолярная концентрация) GDC-0032 в отношении: (3а, верх) клеточных линий с мутацией по спиральному и киназному домену PIK3CA; (3b, середина) клеточных линий с PIK3CA дикого типа, PIK3CA-мутантных клеточных линий, клеточных линий с нулевыми мутациями PTEN (PTEN null) и PTEN/PIKSCA-мутантных клеточных линий; и (3с, низ) клеточных линий с PIK3CA дикого типа, PIK3CA-мутантных, Ras-мутантных и Ras/PIK3CA-мутантных клеточных линий в анализах жизнеспособности Cell-Titer Glo® на 4-е сутки. Каждая точка относится к отдельной клеточной линии.
Фиг. 4а демонстрирует эффективность GDC-0032 в отношении набора изогенных клеточных линий SW48. Родительские клетки SW48 и субклоны мутантов с направленными вставками (knock-in mutant subclones), несущие обычные мутации PIK3CA в горячих точках, Е545К или H1047R, получали от Horizon Discovery. Значения EC50, характеризующие жизнеспособность клеток при обработке GDC-0032, определяли в этих линиях с использованием анализа CellTiter-Glo® на 4-е сутки.
На Фиг. 4b приведены проявленные авторадиографией вестерн-блоты после гель-электрофореза клеточных лизатов, полученных после воздействия GDC-0032 в диапазоне концентраций в течение 18 часов на изогенные клетки SW48: родительские и PIK3CA-мутанты с направленными вставками, Е545К и H1047R.
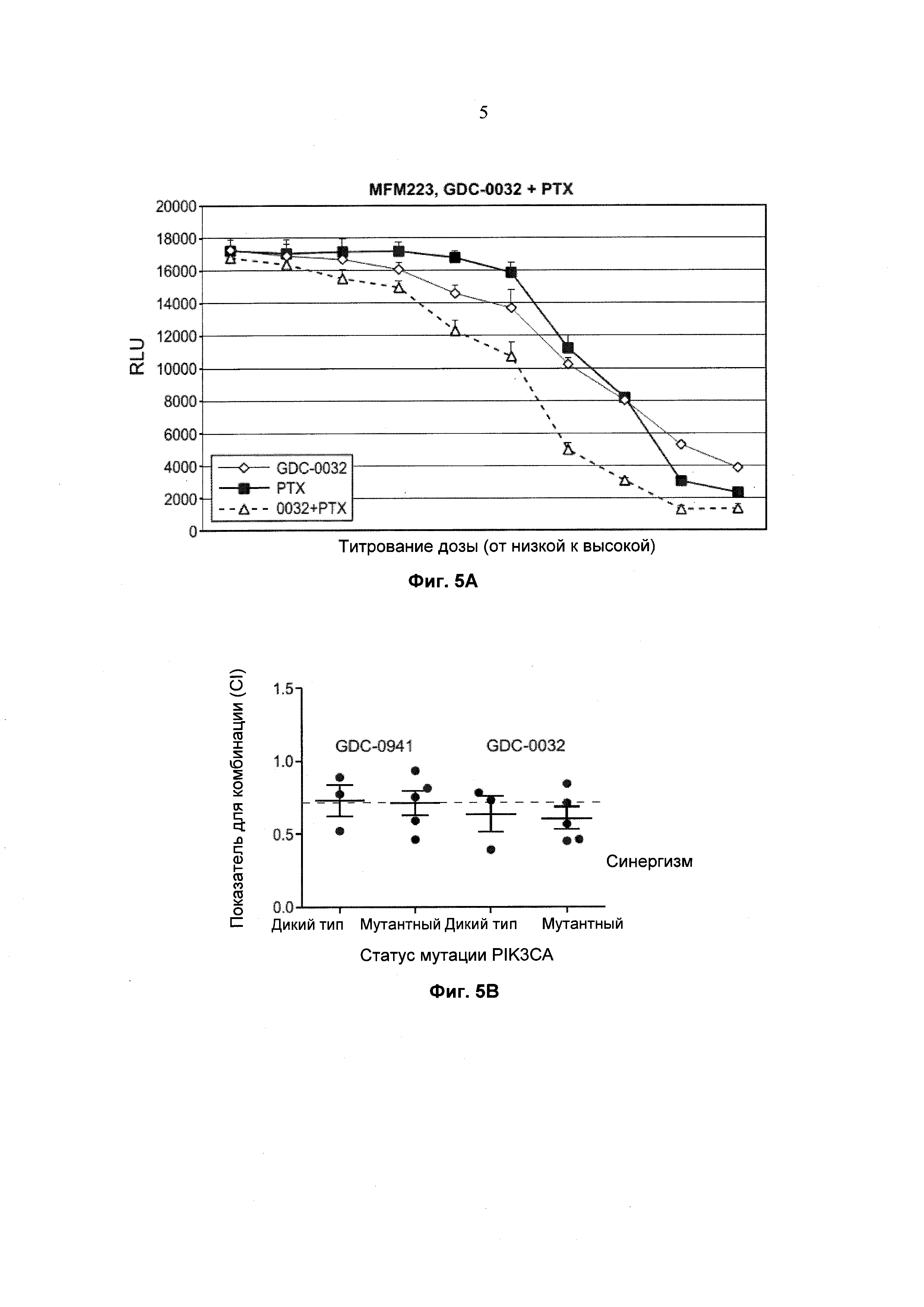
На Фиг. 5а показано влияние GDC-0032, паклитаксела (paclitaxel; РТХ) и комбинации GDC-0032 и паклитаксела на клеточную линию рака молочной железы MFM223 с мутациями H1047R и D350N в PIK3CA. В анализе in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки (relative light units (RLU) - относительные световые единицы) при варьировании концентраций ингибиторов, используя титрование дозы путем 2-кратных разведений GDC-0032, паклитаксела (РТХ) и комбинации GDC-0032 и паклитаксела.
На Фиг. 5b приведены показатели для комбинации (combination indices; CI) для GDC-0032+паклитаксел и GDC-0941+паклитаксел в отношении клеточных линий с PIK3CA дикого типа и мутантных клеточных линий рака молочной железы как базального, так и люминального типов. Мутации PIK3CA включают Е545К и H1047R. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к раковой клеточной линии.
На Фиг. 6а показано влияние GDC-0032, эрибулина и комбинации GDC-0032 и эрибулина на клеточную линию рака молочной железы Cal51 базального типа с мутацией Е542К в PIK3CA и потерей PTEN. В анализе выживаемости и пролиферации клеток in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки (RLU - относительные световые единицы) при варьировании концентраций ингибиторов, используя титрование дозы путем 2-кратных разведений GDC-0032, эрибулина и комбинации GDC-0032 и эрибулина.
На Фиг. 6b приведены показатели для комбинации (CI) для GDC-0032+эрибулин, GDC-0032+доцетаксел, GDC-0941+эрибулин и GDC-0941+доцетаксел в отношении клеточных линий рака молочной железы как базального, так и люминального типов. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к клеточной линии рака молочной железы.
На Фиг. 7 приведены показатели для комбинации (CI) для GDC-0032 + эрибулин и GDC-0941+эрибулин в отношении клеточных линий с PIK3CA дикого типа и PIK3CA-мутантных (Е545К, H1047R) клеточных линий рака молочной железы как базального, так и люминального типов. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к раковой клеточной линии.
На Фиг. 8а показано влияние GDC-0032, доцетаксела и комбинации GDC-0032+доцетаксел на клеточную линию рака молочной железы Саl51 базального типа с мутацией Е542К в PIK3CA и нулевыми мутациями PTEN. В анализе in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки (RLU относительные световые единицы) при варьировании концентраций ингибиторов, используя титрование дозы путем разведений GDC-0032, доцетаксела и комбинации GDC-0032+доцетаксел.
На Фиг. 8b приведены показатели CI для комбинаций GDC-0032+доцетаксел и GDC-0941+доцетаксел в отношении клеточных линий с PIK3CA дикого типа и мутантных клеточных линий рака молочной железы. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к раковой клеточной линии.
На Фиг. 9а показано влияние GDC-0032, трастузумаба и комбинации GDC- 0032+трастузумаб на клеточную линию рака молочной железы SKBR3 с высоким уровнем экспрессии HER2. В анализе выживаемости и пролиферации клеток in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки (RLU -относительные световые единицы) при варьировании концентраций ингибиторов, используя титрование дозы путем разведений GDC-0032, трастузумаба и комбинации GDC-0032+трастузумаб.
На Фиг. 9b приведены показатели для комбинации (CI) для комбинаций GDC-0032+доцетаксел и GDC-0941+доцетаксел в отношении HER2+клеточных линий с PIK3CA дикого типа и PIK3CA-мутантных клеточных линий рака молочной железы, включая Е545К и H1047R. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к раковой клеточной линии.
На Фиг. 10а показано влияние трастузумаба, GDC-0032, паклитаксела и комбинаций GDC-0032+трастузумаб, паклитаксел+трастузумаб, GDC-0032+паклитаксел и тройной комбинации GDC-0032+паклитаксел+трастузумаб на клеточную линию рака молочной железы KPL4 с HER2, с мутациями H1047R и D350N в PIK3CA. В анализе выживаемости и пролиферации клеток in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки (RLU - относительные световые единицы) при варьировании концентраций ингибиторов, используя титрование дозы путем разведений.
На Фиг. 10b показано влияние трастузумаба, GDC-0032, паклитаксела и комбинаций GDC-0032+трастузумаб, паклитаксел+трастузумаб, GDC-0032+паклитаксел и GDC-0032+паклитаксел+трастузумаб на клеточную линию рака молочной железы SKBR3 с высоким уровнем экспрессии HER2. В анализе выживаемости и пролиферации клеток in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки при варьировании концентраций ингибиторов, используя титрование дозы путем разведений (RLU - относительные световые единицы).
На Фиг. 11а показано влияние 5-FU, GDC-0032 и комбинации 5-FU и GDC-0032 на ER+клеточную линию рака молочной железы НСС1428. В анализе выживаемости и пролиферации клеток in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки при варьировании концентраций ингибиторов, используя титрование дозы путем разведений (RLU - относительные световые единицы) 5-FU, GDC-0032 и комбинации 5-FU+GDC-0032.
На Фиг. 11b приведены показатели для комбинации (CI) для GDC-0032+5-FU и GDC-0941+5-FU в отношении HER2+(HER2-положительных) клеточных линий с PIK3CA дикого типа и PIK3CA-мутантных, включая Е545К и H1047R, клеточных линий рака молочной железы базального и люминального подтипов. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к раковой клеточной линии.
На Фиг. 12а приведены показатели CI для комбинаций GDC-0032+традиционные химиотерапевтические агенты, включая 5-FU, гемцитабин, паклитаксел, доцетаксел и эрибулин, в отношении раковых клеточных линий. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к отдельной клеточной линии, использованной при исследовании комбинации химиотерапевтический агент+GDC-0032.
На Фиг. 12b приведены показатели CI для комбинаций GDC-0032+химиотерапевтические агенты направленного действия, включая трастузумаб (Herceptin®), трастузумаба эмтанзин (T-DM1) и ингибитор МЕК (МЕК inhibitor; MEKi) (GDC-0973), в отношении раковых клеточных линий. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к отдельной клеточной линии.
На Фиг. 13 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты опухоли молочной железы НСС1954.х1 с мутацией H1047R в PIK3CA (PI3Kα), которым один раз в сутки перорально (РО) вводили разбавитель (МСТ; 0,5% метилцеллюлозы/0,2% твина 80), GDC-0941 и GDC-0032. Термин "мкл" означает микролитр.
На Фиг. 14 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты опухоли молочной железы KPL4 с HER2+ и мутацией H1047R в PIK3CA, которым перорально (РО) вводили разбавитель и GDC-0032.
На Фиг. 15 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты раковой опухоли молочной железы MCF7-neo/HER2 (HER2+, Е545К в PIK3CA), которым один раз в сутки перорально (РО) вводили разбавитель и GDC-0032.
На Фиг. 16 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты раковой опухоли молочной железы MCF7 с мутацией Е545К в PIK3CA, которым один раз в сутки перорально (РО) вводили разбавитель МСТ и GDC-0032.
На Фиг. 17 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты опухоли яичников SKOV3 с мутацией H1047R в PIK3CA, которым один раз в сутки перорально (РО) вводили разбавитель и GDC-0032.
На Фиг. 18 приведен построенный по точкам график изменения объема опухоли за 6+суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты опухоли колоректальной зоны НМ-7 с мутацией (H1047R) в PI3K-альфа (α), которым один раз в сутки перорально (РО) вводили разбавитель и GDC-0032.
На Фиг. 19 приведен построенный по точкам график изменения объема опухоли за 14 суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты опухоли предстательной железы РСЗ с нулевыми мутациями PTEN, которым один раз в сутки перорально (РО) вводили разбавитель и GDC-0032.
На Фиг. 20 приведен построенный по точкам график изменения объема опухоли за 24 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты опухоли предстательной железы 22RV1 с мутацией (Q546R) в PI3Kα, которым перорально (РО) вводили разбавитель и GDC-0032.
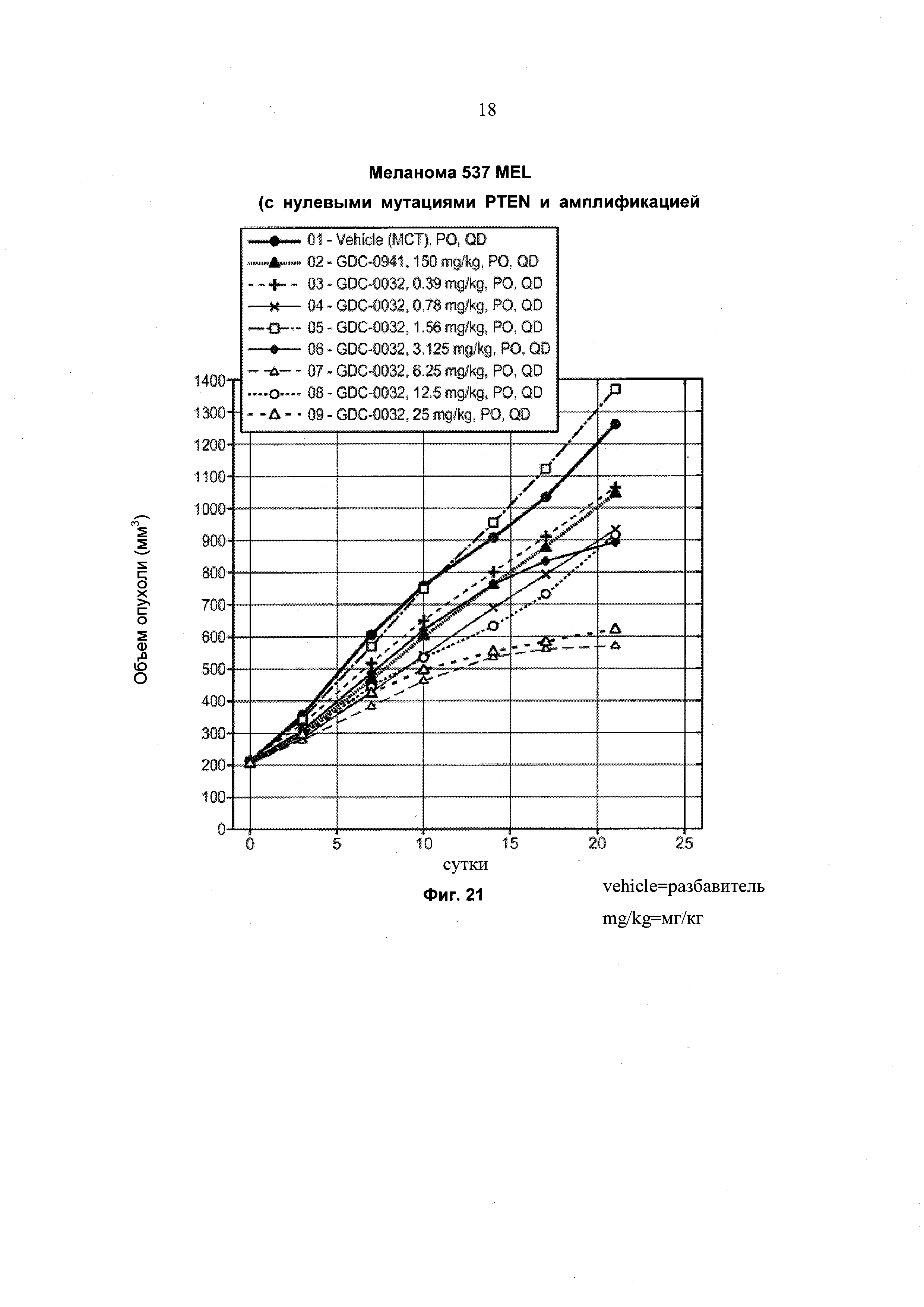
На Фиг. 21 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих опухолевые ксенотрансплантаты меланомы 537 MEL, являющиеся дефектными по PTEN и имеющие амплификации гена B-Raf, которым перорально (РО) вводили разбавитель, GDC-0941 и GDC-0032.
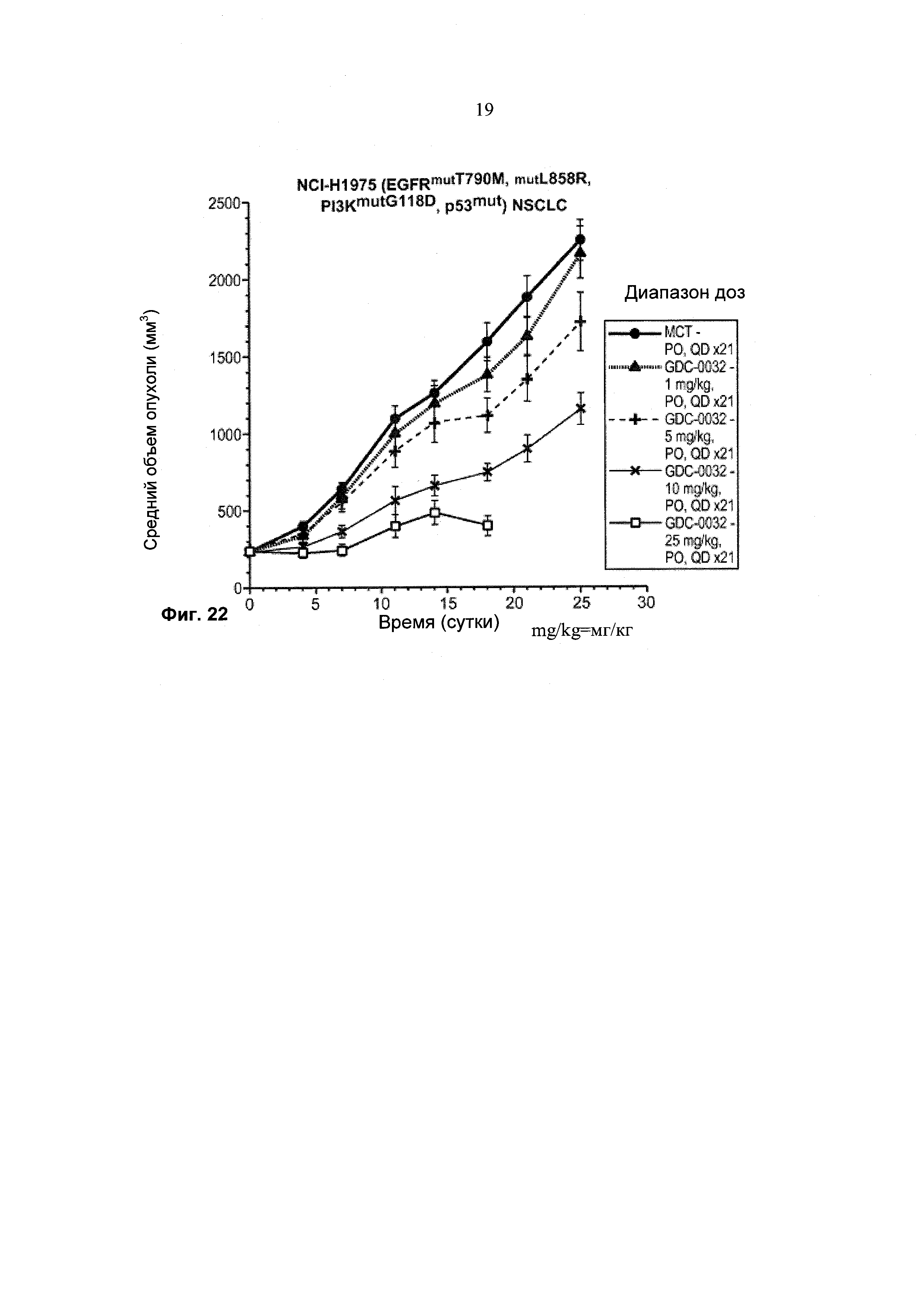
На Фиг. 22 приведен построенный по точкам график изменения объема опухоли за 0-24+суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих опухолевые ксенотрансплантаты немелкоклеточного рака легкого (non-small cell lung cancer; NSCLC) NCI-H1975 с двумя мутациями L858R и Т790М в EGFR (epidermal growth factor receptor - рецептор эпидермального фактора роста), мутацией G118D в PIK3CA, мутацией в р53, которым перорально (РО) вводили разбавитель (МСТ) и GDC-0032.
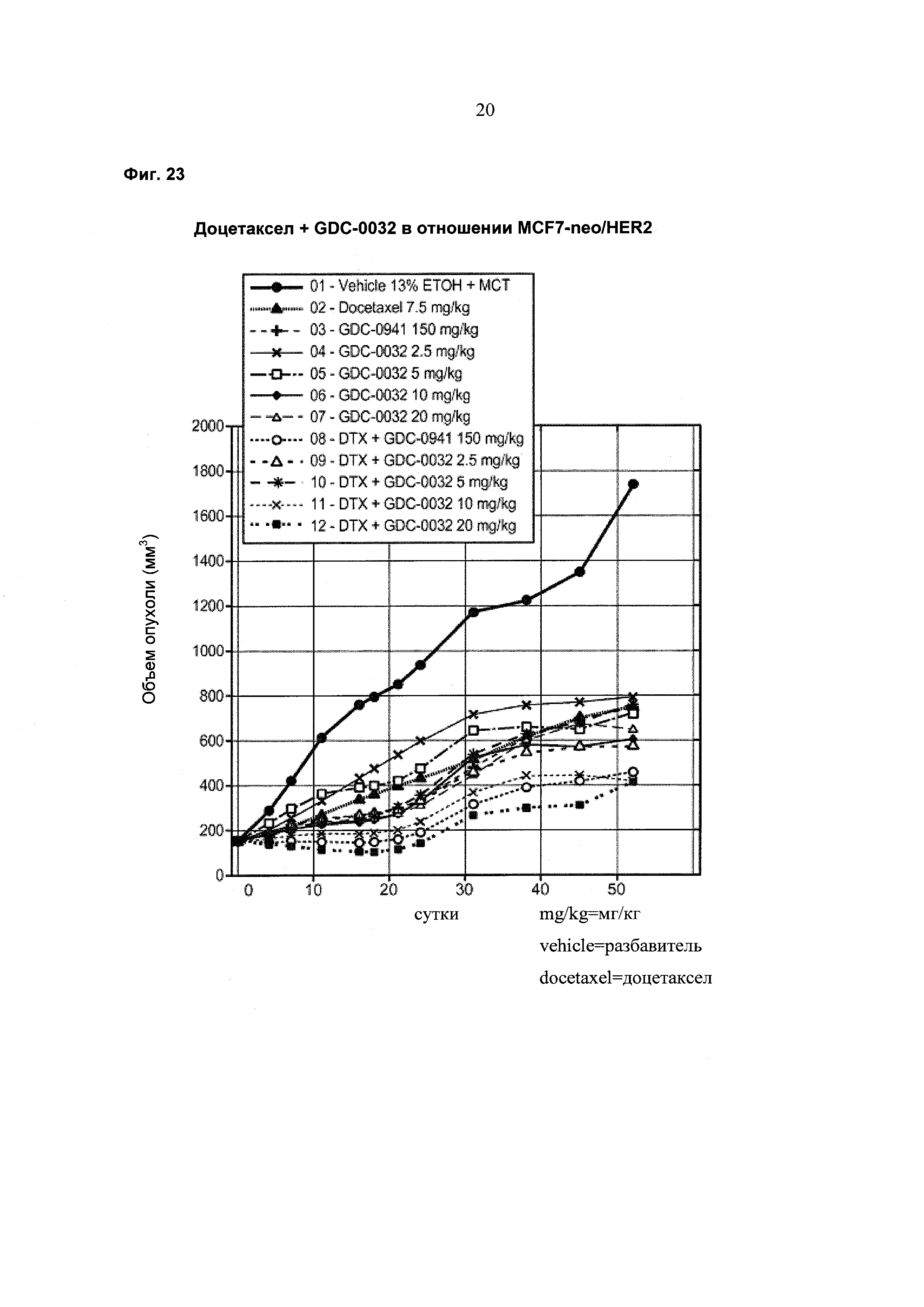
На Фиг. 23 приведен построенный по точкам график изменения объема опухоли за 51 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты опухоли молочной железы MCF-7 neo/HER2 с мутацией (Е545К) в PI3K-альфа, которым вводили дозы в соответствии со схемой, приведенной в Таблице 5. GDC-0032 и GDC-0941 вводили один раз в сутки посредством перорального (РО) введения, а доцетаксел посредством внутрибрюшинного (IP) введения, с заключительным дозированием на 21-е сутки. Группы получали разбавитель, доцетаксел (DTX), GDC-0941, GDC-0032 и комбинации доцетаксел+GDC-0941 и доцетаксел+GDC-0032.
На Фиг. 24 приведен построенный по точкам график изменения объема опухоли за 25 суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты трижды отрицательной (по рецептору эстрогенов (EFC), по рецептору прогестерона (PFC) и HER2-отрицательной (HER2-)) раковой опухоли молочной железы МХ-1 с нулевыми мутациями PTEN, которым вводили разбавитель, доцетаксел, GDC-0032 и комбинации GDC-0032+доцетаксел.
На Фиг. 25 приведен построенный по точкам график изменения объема опухоли за 26 суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты опухоли яичников SKOV3 с мутацией H1047R в PIK3CA (PI3Kα), которым в течение 21 суток вводили разбавитель, доцетаксел, GDC-0032 и комбинации GDC-0032+доцетаксел.
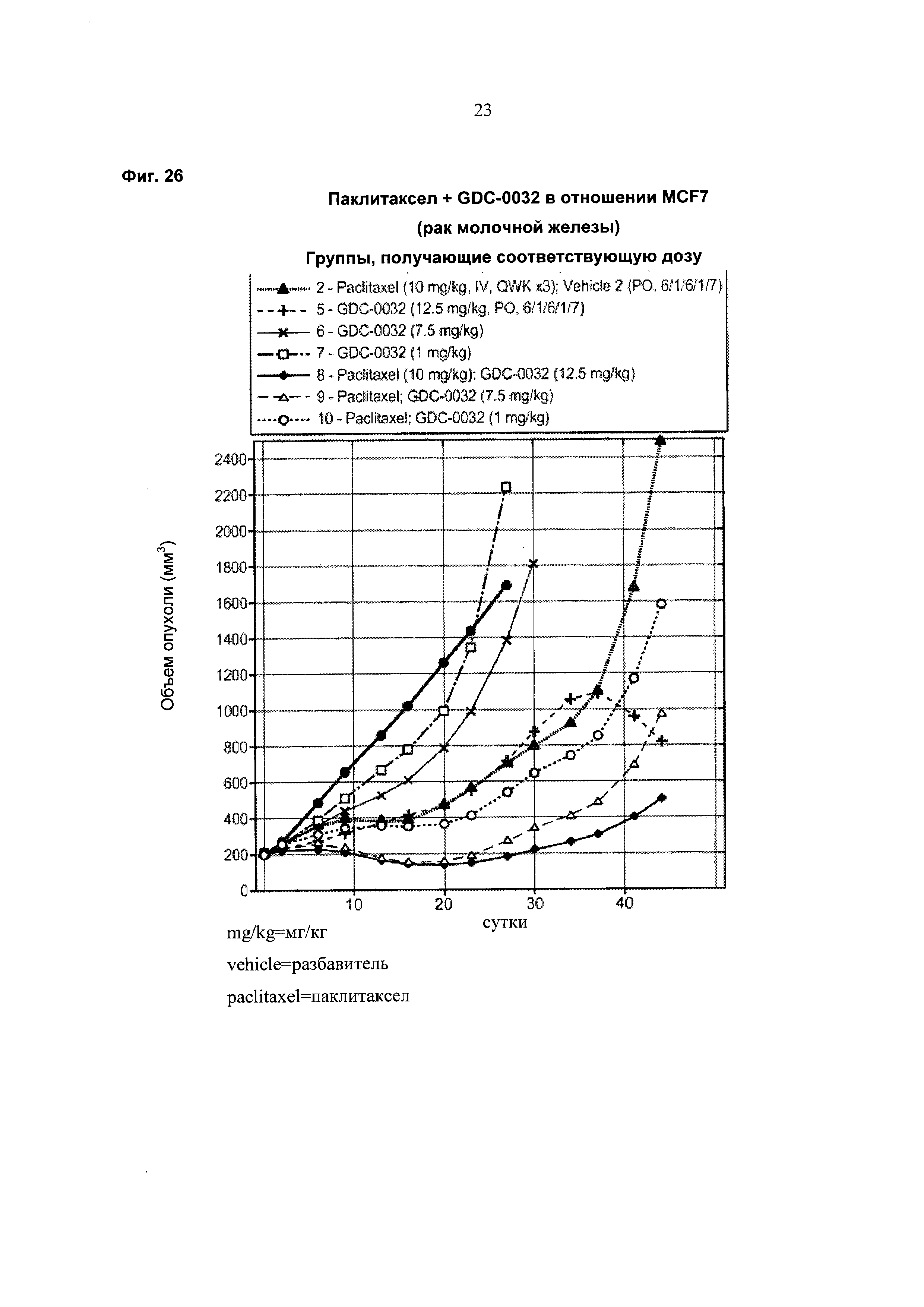
На Фиг. 26 приведен построенный по точкам график изменения объема опухоли за 40 суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты опухоли молочной железы MCF-7 с мутацией (Е545К) в PI3Kα (PIK3CA), которым в течение 21 суток вводили разбавитель, паклитаксел, GDC-0032 и комбинации паклитаксел+GDC-0032.
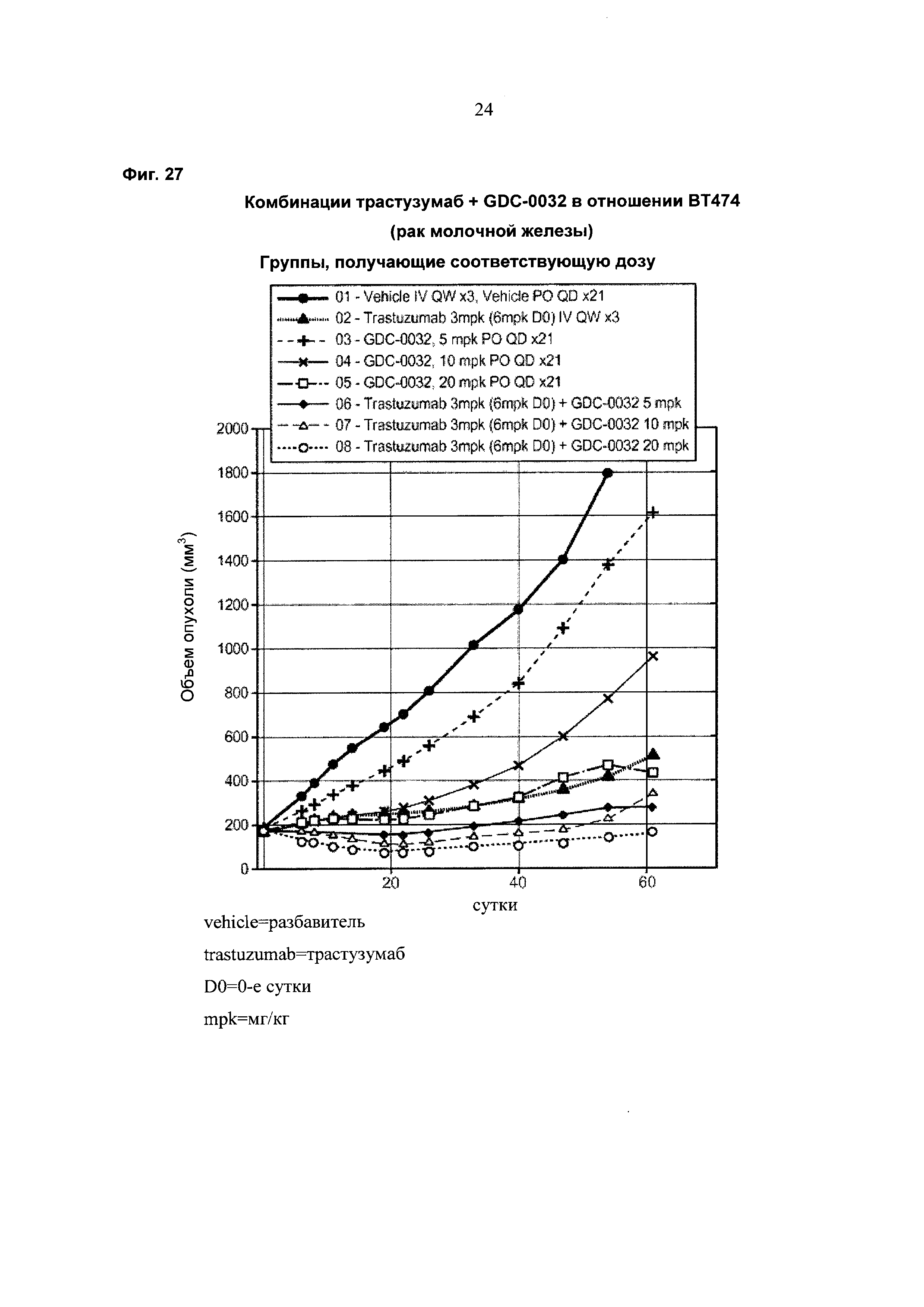
На Фиг. 27 приведен построенный по точкам график изменения объема опухоли за 61 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты HER2+раковой опухоли молочной железы ВТ474, которым в течение 21 суток вводили разбавитель, трастузумаб, GDC-0032 и комбинации трастузумаб+GDC-0032.
На Фиг. 28 приведен построенный по точкам график изменения объема опухоли за 14 суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты HER2+раковой опухоли молочной железы ВТ474, которым в течение 21 суток вводили разбавитель, трастузумаб, трастузумаба эмтанзин (T-DM1), GDC-0032, комбинацию трастузумаб+GDC-0032 и комбинацию трастузумаба эмтанзина и GDC-0032.
На Фиг. 29 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты HER2+ раковой опухоли молочной железы ВТ474, которым вводили трастузумаб (Herceptin®), доцетаксел, GDC-0032, комбинацию трастузумаба и доцетаксела и тройную комбинацию трастузумаба, доцетаксела и GDC-0032.
На Фиг. 30 приведен построенный по точкам график изменения объема опухоли за 42 суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты MCF-7 (ER+) с мутацией (Е545К) в PIK3CA (PI3Kα), которым в течение 21 суток перорально (РО) вводили фулвестрант, GDC-0032 и комбинацию фулвестранта и GDC-0032.
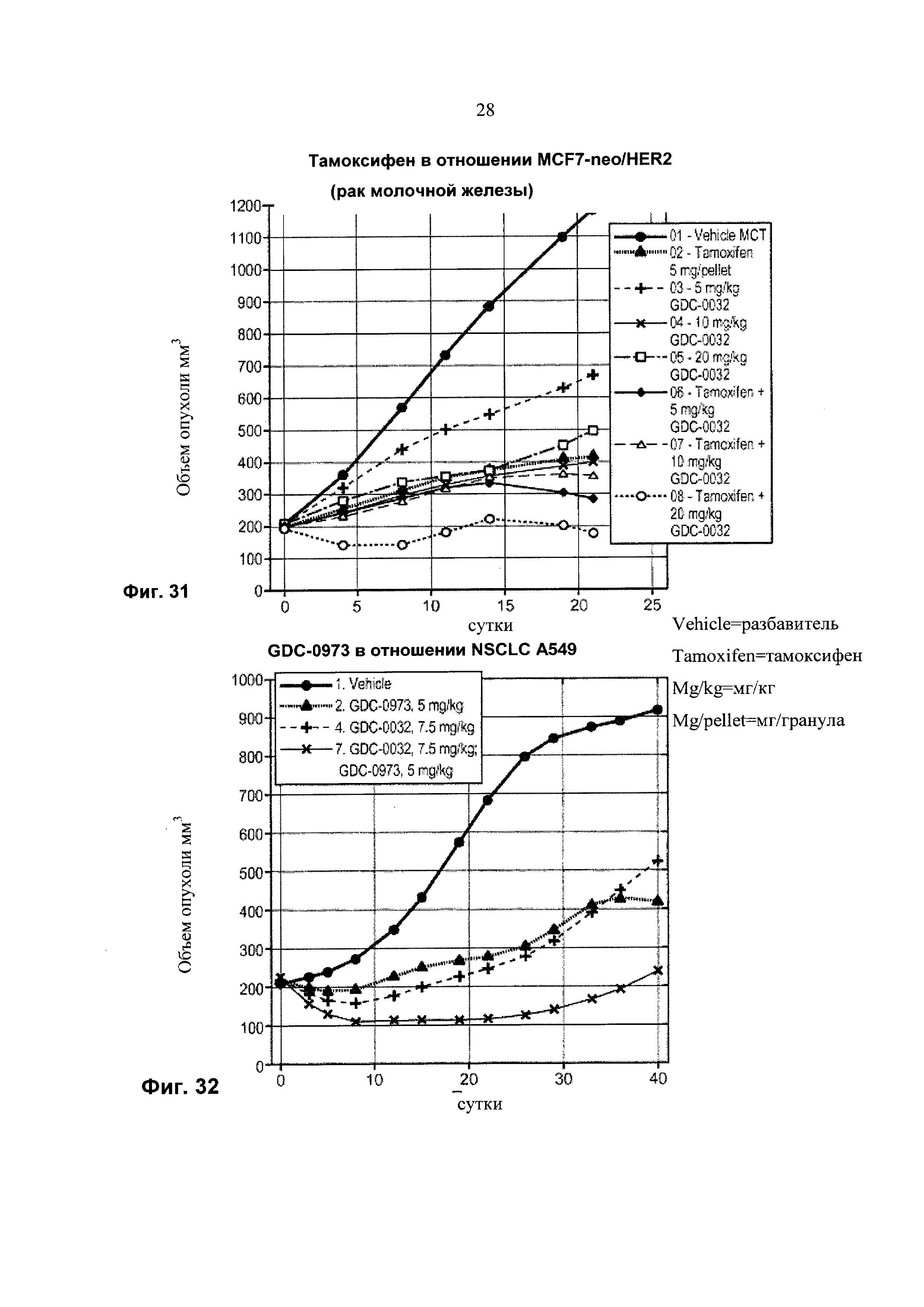
На Фиг. 31 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты раковой опухоли молочной железы MCF-7 neo/HER2 (ER+, мутация (Е545К) в PIK3CA (PI3Kα), HER2+), которым вводили тамоксифен, GDC-0032 и комбинацию тамоксифена и GDC-0032.
На Фиг. 32 приведен построенный по точкам график изменения объема опухоли за 40 суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты немелкоклеточного рака легкого (NSCLC) А549, которым один раз в сутки в течение 21 суток перорально (РО) вводили GDC-0973, GDC-0032 и комбинацию GDC-0973 и GDC-0032.
На Фиг. 33 приведен построенный по точкам график изменения объема опухоли за 18 суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих опухолевые ксенотрансплантаты множественной миеломы ММ.1, которым вводили дексаметазон, GDC-0980, GDC-0032, комбинацию дексаметазона и GDC-0980 и комбинацию дексаметазона и GDC-0032.
На Фиг. 34 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты раковой опухоли молочной железы MCF-7 neo/HER2, которым перорально (РО) вводили капецитабин (Xeloda®), GDC-0032 и комбинацию капецитабина и GDC-0032.
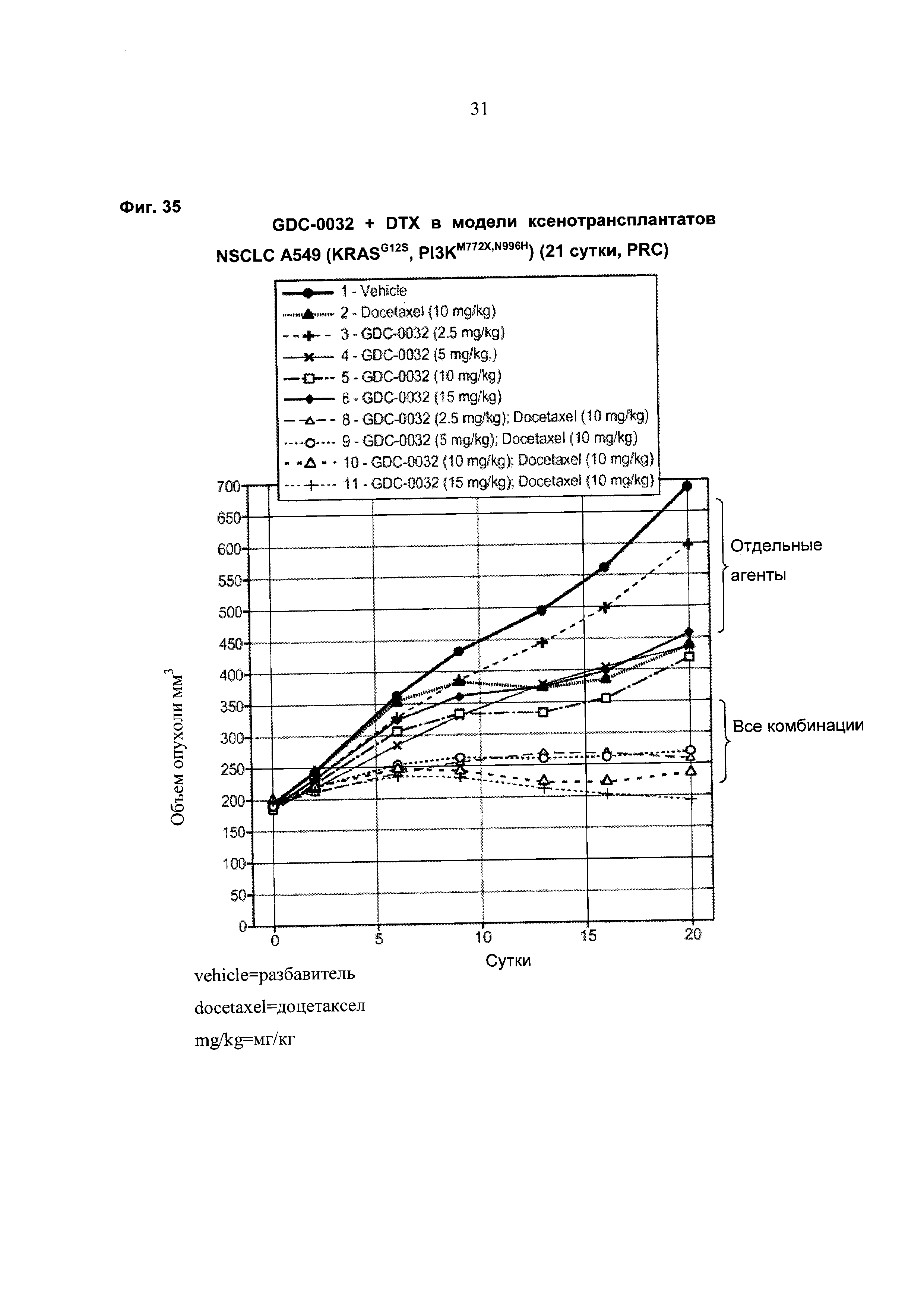
На Фиг. 35 приведен построенный по точкам график изменения объема опухоли за 20 суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты немелкоклеточного рака легкого (NSCLC) А549 (KRASG12S, PI3KM772X,N996H), которым вводили разбавитель, доцетаксел, GDC-0032 и комбинации GDC-0032+доцетаксел.
На Фиг. 36 приведен построенный по точкам график изменения объема опухоли за 28 суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты немелкоклеточного рака легкого (NSCLC) Н520 (p53mut), которым вводили разбавитель, доцетаксел, GDC-0032 и комбинации GDC-0032+доцетаксел.
На Фиг. 37 показана активность летрозола и GDC-0032 в ароматаза-экспрессирующих клетках MCF7 с андростендионом и без него.
На Фиг. 38 показано, что GDC-0032 хорошо сочетается с летрозолом in vitro по данным количественной оценки ингибирования жизнеспособности клеток по Блиссу (BLISS) и с использованием наиболее эффективного отдельного агента (HSA; highest single agent).
На Фиг. 39 показано взаимное влияние путей PI3K и ER, подтверждающее механизм действия комбинации GDC-0032 и летрозола.
На Фиг. 40 показано, что у резистентных к эндокринной терапии клеток MCF7-ARO усилена передача сигнала через PI3K-путь и что они обладают чувствительностью к GDC-0032 после обработок в течение 24 ч согласно анализу CellTiter-Glo на 4-е сутки.
На Фиг. 41 показано ингибирование роста опухоли (% TGI, tumor growth inhibition) в процентном отношении к разбавителю в качестве контроля на 21-е сутки, измеренное на мышах MCF-7/ER+/HER2-, которым вводили фулвестрант и GDC-0032 по отдельности и в комбинации, и на мышах MCF-7/ER+/HER2+, которым вводили тамоксифен и GDC-0032 по отдельности и в комбинации.
На Фиг. 42 приведен построенный по точкам график изменения объема опухоли за 23 суток в группах из 12 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты рака молочной железы MCF-7 (PI3Kmut, ER+), которым вводили разбавитель, паклитаксел, GDC-0032 и комбинации GDC-0032 и паклитаксела. GDC-0032 вводили перорально (РО) и либо один раз в сутки (QD, с пропуском одних суток перед введением дозы паклитаксела) в течение 21 суток, либо каждые 4 суток (Q4D) по 5 циклов. Паклитаксел вводили внутривенно каждые 4 суток по 5 циклов, используя дозу лекарственного средства 7,5 мг/кг.
На Фиг. 43 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты рака молочной железы KPL-4 (PI3Kmut, Her2+), которым вводили разбавитель, трастузумаб, пертузумаб, GDC-0032 и тройные комбинации GDC-0032 плюс трастузумаб и пертузумаб. GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 21 суток. Трастузумаб вводили внутрибрюшинно один раз в неделю в течение 3 недель, используя дозу лекарственного средства 3 мг/кг, пертузумаб вводили внутрибрюшинно один раз в неделю в течение 3 недель, используя дозу лекарственного средства 2,5 мг/кг.
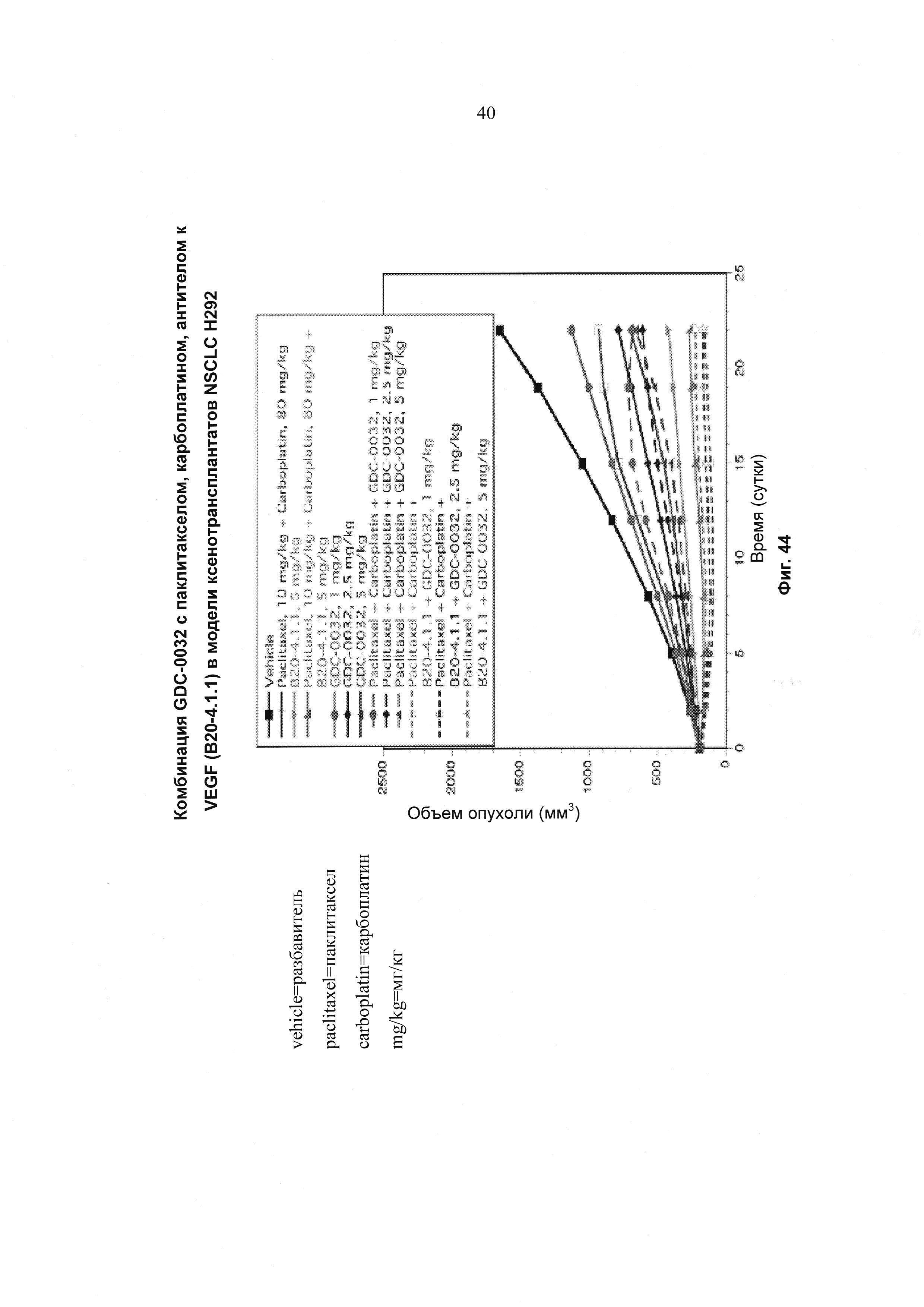
На Фиг. 44 приведен построенный по точкам график изменения объема опухоли за 22 суток в группах из 10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты немелкоклеточного рака легкого (NSCLC) Н292 (KRASmut), которым вводили разбавитель, паклитаксел, карбоплатин, антитело к VEGF (В20-4.1.1), GDC-0032 и тройные и четверные комбинации GDC-0032+паклитаксел (РТХ), карбоплатин, +/- антитело к VEGF. GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 21 суток. Паклитаксел вводили внутривенно в 1-е сутки, используя дозу лекарственного средства 10 мг/кг, карбоплатин вводили внутрибрюшинно в 1-е сутки, используя дозу лекарственного средства 80 мг/кг, а антитело к VEGF вводили внутрибрюшинно два раза в неделю в течение 3 недель, используя дозу лекарственного средства 5 мг/кг.
ПОДРОБНОЕ ОПИСАНИЕ ТИПИЧНЫХ ВОПЛОЩЕНИЙ
Теперь будет приведена подробная ссылка на некоторые воплощения изобретения, примеры которых иллюстрируются сопровождающими структурами и формулами. Несмотря на то, что изобретение будет описано в сочетании с приведенными воплощениями, очевидно, что изобретение не предполагает ограничения этими воплощениями. Напротив, предполагается, что изобретение охватывает все альтернативные варианты, модификации и эквиваленты, которые могут быть включены в объем настоящего изобретения, определенный формулой изобретения. Специалисту в данной области техники будут известны многие способы и вещества, аналогичные или эквивалентные изложенным в данном описании, которые могут быть использованы при практическом применении настоящего изобретения. Настоящее изобретение никоим образом не ограничено описанными способами и веществами. В том случае, если в одном или более чем одном из включенных литературы, патентов и аналогичных материалов имеется отличие от этой заявки или противоречие с этой заявкой, включая, но не ограничиваясь этим, определенные термины, употребление терминов, описанные методики или тому подобное, то эта заявка является контрольным документом.
ОПРЕДЕЛЕНИЯ
Слова "содержат", "содержащий", "включают", "включающий" и "включает", когда они используются в этом описании и формуле изобретения, предназначены для конкретизации наличия установленных признаков, нечто целого, компонентов или стадий, но они не исключают наличия или добавления одного или более чем одного их других признаков, нечто целого, компонентов, стадий или их групп.
Термины "лечить или обрабатывать" и "лечение или обработка" относятся как к терапевтическому лечению, так и к профилактическим или превентивным мерам, при которых у объекта должно быть предотвращено или замедлено (снижено) нежелательное физиологическое изменение или расстройство, такое как рост, развитие или распространение рака. Для целей данного изобретения полезные или желаемые клинические результаты включают, но не ограничиваются этим, облегчение симптомов, уменьшение степени заболевания, состояние стабильности (т.е. без ухудшения) заболевания, задержку или замедление прогрессирования заболевания, улучшение или временное облегчение болезненного состояния и ремиссию (будь то частичную или полную), как детектируемые, так и недетектируемые. "Лечение" также может означать продление выживаемости по сравнению с ожидаемой выживаемостью в отсутствие получения лечения. Нуждающиеся в таком лечении, включают уже имеющих данное состояние или расстройство, а также тех, кто предрасположен к данному состоянию или расстройству, или тех, у которых данное состояние или расстройство должно быть предотвращено.
Фраза "терапевтически эффективное количество" означает количество соединения по настоящему изобретению, которое (1) лечит конкретное заболевание, состояние или расстройство, (2) ослабляет, улучшает или устраняет один или более симптомов конкретного заболевания, состояния или расстройства или (3) предотвращает или задерживает начало развития одного или более симптомов конкретного заболевания, состояния или расстройства, изложенного в данном описании. В случае рака терапевтически эффективное количество лекарственного средства может уменьшать количество раковых клеток; уменьшать размер опухоли; ингибировать (т.е. замедлять до некоторой степени и предпочтительно останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. замедлять до некоторой степени и предпочтительно останавливать) опухолевый метастаз; ингибировать до некоторой степени опухолевый рост; и/или ослаблять до некоторой степени один или более симптомов, ассоциированных с раком. В зависимости от возможности лекарственного средства предотвращать рост и/или уничтожать существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. Что касается терапии рака, то эффективность может быть измерена, например, путем оценки времени до прогрессирования заболевания (time to disease progression; TTP) и/или определения коэффициента ответа (response rate; RR).
Термин "детекция" включает в себя любой способ детекции, в том числе прямую и опосредованную детекцию.
Термин "дианостика" используется в данном описании для обозначения идентификации или классификации молекулярного или патологического статуса, заболевания или состояния. Например, "диагностика" может относиться к идентификации конкретного типа рака, например, рака легкого. "Диагностика" также может относиться к классификации конкретного типа рака, например, по гистологии (например, немелкоклеточный рак легкого), по молекулярным признакам (например, рак легкого, характеризующийся нуклеотидной(ыми) и/или аминокислотной(ыми) вариацией(ями) в конкретном гене или белке) или по ним обоим.
Термин "прогноз" используется в данном описании для обозначения предсказания вероятности смерти от рака или прогрессирования рака, включая, например, рецидив, поражение метастазами и лекарственную устойчивость неопластического заболевания, такого как рак.
Термин "предсказание" (и такие варианты, как прогнозирование) используется в данном описании для обозначения вероятности того, что пациент будет давать либо благоприятный, либо неблагоприятный ответ на лекарственное средство или комбинацию лекарственных средств. В одном из воплощений предсказание относится к степени выраженности таких ответов. В другом воплощении предсказание относится к возможности и/или вероятности того, что пациент будет жить после лечения, например, лечения конкретным терапевтическим агентом, и/или после хирургического удаления первичной опухоли, и/или химиотерапии, в течение некоторого периода времени без рецидива рака. Способы прогнозирования по изобретению можно использовать в условиях клиники с целью принятия решения относительно лечения путем выбора наиболее приемлемых способов лечения для любого конкретного пациента. Способы прогнозирования по настоящему изобретению являются чрезвычайно полезными инструментами в прогнозировании того, имеет ли пациент вероятность давать благоприятный ответ на схему лечения, такую как назначенная схема лечения, включая, например, введение заданного терапевтического агента или комбинации, хирургическое вмешательство, химиотерапию и т.д., или того существует ли вероятность долговременной выживаемости у пациента, после выполнения схемы лечения.
Термин "повышенная резистентность" к конкретному терапевтическому агенту или варианту лечения, при использовании его в соответствии с изобретением, означает ослабленный ответ на стандартную дозу лекарственного средства или на стандартный протокол лечения.
Термин "пониженная чувствительность" к конкретному терапевтическому агенту или варианту лечения, при использовании его в соответствии с изобретением, означает ослабленный ответ на стандартную дозу агента или на стандартный протокол лечения, при этом ослабленный ответ можно компенсировать (по меньшей мере частично) путем увеличения дозы агента или интенсивности лечения.
"Ответ пациента" может быть оценен с использованием любого ожидаемого результата, указывающего на получение пациентом пользы, включая, без ограничения, (1) ингибирование до некоторой степени опухолевого роста, в том числе замедление или полное прекращение роста; (2) уменьшение количества опухолевых клеток; (3) уменьшение размера опухоли; (4) ингибирование (например, ослабление, замедление или полную остановку) инфильтрации опухолевых клеток в расположенные рядом периферические органы и/или ткани; (5) ингибирование (например, ослабление, замедление или полную остановку) метастаза; (6) усиление противоопухолевого иммунного ответа, который может, но не обязательно должен, приводить к регрессии или отторжению опухоли; (7) облегчение до некоторой степени одного или более симптомов, ассоциированных с опухолью; (8) увеличение времени выживаемости после лечения; и/или (9) снижение летальности к определенному моменту времени после лечения.
Термин "биомаркер" имеет отношение к характеристике, которую реально измеряют и оценивают в качестве индикатора нормальных биологических процессов, патогенных процессов или фармакологических ответов на терапевтическое вмешательство. Биомаркеры могут быть нескольких типов: предиктивные, прогностические или фармакодинамические (PD). По предиктивным биомаркерам предсказывают, какие пациенты имеют вероятность давать ответ на конкретную терапию или получать пользу от нее. По прогностическим биомаркерам предсказывают вероятное течение заболевания у пациента, и они могут быть основанием при назначении лечения. По фармакодинамическим биомаркерам подтверждают наличие активности у лекарственного средства, и они дают возможность оптимизировать дозу и схему введения.
"Изменение" или "модулирование" статуса биомаркера, включающего в себя мутацию в PIK3CA или набор мутаций в PIK3CA, которое оно происходит in vitro или in vivo, детектируют посредством анализа биологического образца с использованием одного или более методов, обычно применяемых при определении фармакодинамики (PD; pharmacodynamics), включая: (1) секвенирование геномной ДНК или полученных с использованием обратной транскрипции продуктов ПЦР (полимеразная цепная реакция) из биологического образца, посредством чего детектируют одну или более мутаций; (2) оценивание уровней генной экспрессии путем количественного определения уровня матричной РНК (message level) или оценки числа копий; и (3) анализ белков методами иммуногистохимии, иммуноцитохимии, ELISA или масс-спектрометрии, посредством чего детектируют деградацию, стабилизацию или посттрансляционные модификации белков, такие как фосфорилирование или убиквитинилирование.
Термины "рак" и "раковый" относятся к физиологическому состоянию или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом. "Опухоль" содержит одну или более раковых клеток. Примеры рака включают, но не ограничиваются этим, карциному, лимфому, бластому, саркому и лейкоз или лимфолейкозы. Более конкретные примеры таких видов рака включают плоскоклеточный рак (например, раковые клетки плоского эпителия), рак легкого, в том числе мелкоклеточный рак легкого, немелкоклеточный рак легкого ("NSCLC"), аденокарциному легкого и плоскоклеточный рак легкого, рак брюшины, гепатоклеточный рак, рак желудочно-кишечного тракта или желудка, в том числе гастроинтестинальный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, рак эндометрия или матки, рак слюнных желез, рак почки или почечный рак, рак предстательной железы, рак вульвы, рак щитовидной железы, печеночный рак, анальный рак, рак пениса, а также рак головы и шеи. Термин "рак желудочно-кишечного тракта", использованный в данном описании, включает рак желудка, который может развиваться в любой части желудка и может распространяться по всему желудку и в направлении других органов; в частности, пищевода, легких, лимфатических узлов и печени.
Термин "гематопоэтическая злокачественная опухоль" относится к раковому или гиперпролиферативному расстройству, возникающему в процессе гематопоэза с вовлечением таких клеток, как лейкоциты, лимфоциты, естественные клетки-киллеры, плазматические клетки и миелоидные клетки, такие как нейтрофилы и моноциты. Гематопоэтические злокачественные опухоли включают неходжкинскую лимфому, диффузную крупноклеточную гематопоэтическую лимфому, фолликулярную лимфому, лимфому из клеток мантийной зоны, хронический лимфоцитарный лейкоз, множественную миелому, острый миелогенный лейкоз и миелоидный лейкоз. Лимфоцитарный (или "лимфобластный") лейкоз включает острый лимфобластный лейкоз (acute lymphoblastic leukemia; ALL) и хронический лимфоцитарный лейкоз (chronic lymphocytic leukemia; CLL). Миелогенный лейкоз (также "миелоидный" или "нелимфоцитарный") включает острый миелогенный (или миелобластный) лейкоз (acute myelogenous (or myeloblastic) leukemia; AML) и хронический миелогенный лейкоз (chronic myelogenous leukemia; CML).
"Химиотерапевтический агент" представляет собой биологическое (высокомолекулярное) или химическое (низкомолекулярное) соединение, полезное в лечении рака, независимо от механизма действия.
Термин "млекопитающее" включает, но не ограничивается этим, людей, мышей, крыс, морских свинок, обезьян, собак, кошек, лошадей, крупный рогатый скот, свиней и овец.
Термин "инструкция по применению" используется в отношении инструкций, обычно вкладываемых в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, противопоказаниях и/или предупреждениях, касающихся применения таких терапевтических продуктов.
Фраза "фармацевтически приемлемая соль", использованная в данном описании, относится к фармацевтически приемлемым органическим или неорганическим солям соединения по изобретению. Типичные соли включают, но не ограничиваются этим, соли сульфат, цитрат, ацетат, оксалат, хлорид, бромид, иодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат (мезилат), этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (т.е., 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)). При образовании фармацевтически приемлемой соли возможно включение другой молекулы, такой как ацетат-ион, сукцинат-ион или другой противоион. Противоион может представлять собой любую органическую или неорганическую группировку, которая стабилизирует заряд на исходном соединении. Кроме того, фармацевтически приемлемая соль может иметь в своей структуре больше одного заряженного атома. В случаях, когда часть фармацевтически приемлемой соли представлена многими заряженными атомами, противоионов может быть много. Следовательно, фармацевтически приемлемая соль может иметь один или более заряженных атомов и/или один или более чем один противоион.
Желаемую фармацевтически приемлемую соль можно получить любым подходящим способом, доступным в данной области. Например, обработкой свободного основания неорганической кислотой, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, метансульфоновая кислота, фосфорная кислота и тому подобное, или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидиловая кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-оксикислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как п-толуолсульфоновая кислота или этансульфоновая кислота, или тому подобное. Кислоты, которые в большинстве случаев считаются подходящими для образования фармацевтически полезных или приемлемых солей из основных фармацевтических соединений, рассмотрены, например, в P. Stahl et al., Camille G. (eds.) Handbook of Pharmaceutical Salts. Properties, Selection and Use. (2002) Zurich: Wiley-VCH; S. Berge et al., Journal of Pharmaceutical Sciences (1977), 66(1), 1-19; P. Gould, International J. of Pharmaceutics (1986) 33, 201-217; Anderson et al., The Practice of Medicinal Chemistry (1996), Academic Press, New York; Remington's Pharmaceutical Sciences, 18th ed., (1995) Mack Publishing Co., Easton PA; и в Оранжевой книге (Управление по контролю качества пищевых продуктов и лекарственных средств США, Вашингтон, Федеральный суд (District Court; D.C.) на их веб-сайте). Эти описания включены в данную заявку посредством ссылки на них.
Фраза "фармацевтически приемлемый" указывает на то, что вещество или композиция должны быть совместимы химически и/или токсикологически с другими ингредиентами, входящими в состав композиции, и/или с млекопитающим, подвергаемым лечению ими.
Термин "синергетический", использованный в данном описании, относится к действию терапевтической комбинации, которое более эффективно, чем аддитивные эффекты двух или более отдельных агентов. В основе определения синергетического взаимодействия между соединением GDC-0032, или его фармацевтически приемлемой солью, и одним или более чем одним химиотерапевтическим агентом могут лежать результаты, полученные из анализов, изложенных в данном описании. Результаты этих исследований могут быть проанализированы с использованием метода Chou и Talalay для комбинации и анализа зависимости эффекта от дозы с применением программного обеспечения CalcuSyn с целью получения показателя для комбинации (combination index) (Chou and Talalay, 1984, Adv. Enzyme Regul. 22: 27-55). Комбинации, предложенные согласно данному изобретению, оценены в нескольких аналитических системах, и данные могут быть проанализированы с использованием стандартной программы для количественного определения синергизма, аддитивизма и антагонизма среди противораковым агентов. Предпочтительно используемой программой является программа, описанная Chou и Talalay в "New Avenues in Developmental Cancer Chemotherapy", Academic Press, 1987, часть 2. Величины показателя для комбинации менее 0,8 указывают на синергетическое действие, величины выше 1,2 указывают на антагонизм, а величины от 0,8 до 1,2 указывают на аддитивные эффекты. Комбинированная терапия может обеспечивать "синергизм" и демонстрировать "синергетический характер", т.е. эффект, достигаемый при совместном использовании активных ингредиентов, больше суммы эффектов, получаемых в результате использования соединений по отдельности. Синергетический эффект может быть получен, когда активные ингредиенты: (1) изготавливают совместно и вводят или доставляют одновременно в комбинированной, стандартной лекарственной композиции; (2) доставляют путем чередования или параллельно в виде отдельных композиций; или (3) доставляют с использованием какой-либо другой схемы (введения). При доставке с использованием чередующейся терапии синергетический эффект может быть получен, когда соединения вводят или доставляют последовательно, например, посредством разных инъекций в отдельных шприцах или в отдельных пилюлях или таблетках. В общем случае, при чередующейся терапии эффективную дозировку каждого активного ингредиента вводят последовательно, т.е. сериями, тогда как при комбинированной терапии эффективные дозировки двух или более активных ингредиентов вводят совместно. Эффекты, производимые комбинациями, оценивали, используя как независимую модель (independence model) по Блиссу, так и модель с применением наиболее эффективного отдельного агента (HSA) (Lehar et al. 2007, Molecular Systems Biology, 3: 80). Оценки по Блиссу количественно определяют степень усиления действия, обусловленного отдельными агентами, и оценка по Блиссу >0 свидетельствует о более чем просто аддитивности. HSA-оценка >0 свидетельствует об эффекте, производимом комбинацией, превышающем максимальную сумму ответов от отдельных агентов в соответствующих концентрациях.
"ELISA" (enzyme linked immunosorbent assay - иммуноферментный твердофазный анализ) представляет собой популярный формат "мокрой лаборатории (wet-lab)" типа аналитического биохимического анализа, в котором для детекции присутствия вещества в жидком образце или влажном образце используется один из подтипов гетерогенного твердофазного иммуноферментного анализа (enzyme immunoassay; EIA) (Engvall E, Perlman P (1971), "Enzyme-linked immunosorbent assay (ELISA). Quantitative assay of immunoglobulin G". Immunochemistry, 8 (9): 871-4; Van Weemen BK, Schuurs AH (1971), "Immunoassay using antigen-enzyme conjugates", FEBS Letters, 15 (3): 232-236). В ELISA могут быть реализованы другие формы анализов связывания с лигандами вместо собственно "иммуно"-анализов, хотя в оригинальном названии и присутствует "иммуно" ввиду широкого применения и истории развития этого метода. По-существу, для данного метода необходим какой-либо реагент для связывания с лигандом, который может быть иммобилизован на твердой фазе, и детектирующий реагент, который будет специфически связываться и который конъюгирован с ферментом, чтобы генерировать сигнал, который можно надлежащим образом количественно измерить. В промежутках между промывками только лиганд и его специфически связывающиеся аналоги остаются специфически связанными с твердой фазой или "иммуносорбированными " на ней благодаря взаимодействиям антиген-антитело, в то время как неспецифические или несвязавшиеся компоненты вымываются. В отличие от других спектрофотометрических форматов "wet lab''-анализов, где одну и ту же реакционную ячейку (например, кювету) можно повторно использовать после промывки, на планшетах для ELISA имеются продукты реакции, иммуносорбированные на твердой фазе, которая является частью планшета, и поэтому они не пригодны для повторного использования. Для проведения ELISA необходимо по меньшей мере одно антитело со специфичностью к конкретному антигену. Образец с неизвестным количеством антигена иммобилизуют на твердой подложке (обычно на титрационном микропланшете из полистирола) либо неспецифически (посредством адсорбции на поверхности), либо специфически (посредством захвата другим антителом, специфичным к этому же антигену, в "сэндвич''-ELISA). После иммобилизации антигена добавляют детектирующее антитело, при этом образуется комплекс с антигеном. Детектирующее антитело может быть ковалентно связано с ферментом или может быть само обнаружено с помощью вторичного антитела, которое связывается с ферментом посредством биоконъюгирования. В промежутках между всеми стадиями планшет обычно промывают слабым раствором детергента для удаления любых неспецифически связавшихся белков или антител. По окончании заключительной стадии промывки планшет "проявляют", добавляя ферментативный субстрат для получения видимого сигнала, который указывает количество антигена в образце.
"Иммуногистохимия" (immunohistochemistry; IHC) относится к способу детекции антигенов (например, белков) в клетках тканевого среза с использованием принципа специфического связывания антител с антигенами в биологических тканях. Иммуногистохимическое окрашивание широко используется в диагностике аномальных клеток, например таких, которые обнаруживаются в раковых опухолях. Конкретным клеточным событиям, таким как пролиферация или гибель клеток (апоптоз), характерны специфические молекулярные маркеры. IHC также широко используется для понимания распределения и локализации биомаркеров и разнообразно экспрессированных белков в разных частях биологической ткани. Визуализация взаимодействия антитело-антиген может быть выполнена рядом способов. В самом общем случае антитело конъюгируют с ферментом, таким как пероксидаза, которая может катализировать цветную реакцию (см. иммунопероксидазное окрашивание). Альтернативно, антитело также может быть помечено флуорофором, таким как флуоресцеин или родамин (см. иммунофлуоресценция).
"Иммуноцитохимия" (immunocytochemistry; ICC) представляет собой общий лабораторный метод, в котором используют антитела, направленные на конкретные пептиды или белковые антигены в клетке через специфические эпитопы. Такие связанные антитела затем могут быть обнаружены разными способами. С помощью ICC можно оценить, экспрессируют ли клетки или нет рассматриваемый антиген в конкретном образце. В тех случаях, когда обнаруживается иммуноположительный сигнал, с помощью ICC также можно определить, какой из субклеточных компартментов в этот момент экспрессирует данный антиген.
ПОДРОБНОЕ ОПИСАНИЕ ТИПИЧНЫХ ВОПЛОЩЕНИЙ
ПОЛУЧЕНИЕ GDC-0032
Соединение по изобретению известно как GDC-0032 (регистрационный № в CAS 1282512-48-4) с названием 2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамид и имеет структуру:

в том числе стереоизомеры, геометрические изомеры, таутомеры и их фармацевтически приемлемые соли.
GDC-0032 может быть получен и охарактеризован так, как описано в WO 2011/036280, US 8242104 и US 8343955 или как описано в приведенном ниже примере.
ХИМИОТЕРАПЕВТИЧЕСКИЕ АГЕНТЫ
Некоторые химиотерапевтические агенты продемонстрировали удивительные и неожидаемые свойства в комбинации с GDC-0032 в отношении ингибирования клеточной пролиферации in vitro и in vivo. Такие химиотерапевтические агенты включают: 5-FU, доцетаксел, эрибулин, гемцитабин, GDC-0973, GDC-0623, паклитаксел, тамоксифен, фулвестрант, дексаметазон, пертузумаб, трастузумаба эмтанзин, трастузумаб и летрозол.
5-FU (фторурацил, 5-фторурацил, регистрационный № в CAS 51-21-8) представляет собой ингибитор тимидилатсинтазы и уже несколько десятилей используется в лечении рака, в том числе колоректального рака и рака поджелудочной железы (US 2802005; US 2885396; Duschinsky et al. (1957) J. Am. Chem. Soc. 79: 4559; Hansen, R.M. (1991) Cancer Invest. 9: 637-642). 5-FU называют 5-фтор-1Н-пиримидин-2,4-дион, и он имеет структуру:

Доцетаксел (TAXOTERE®, Sanofi-Aventis) применяют для лечения случаев рака молочной железы, яичников и NSCLC (US 4814470; US 5438072; US 5698582; US 5714512; US 5750561; Mangatal et al. (1989) Tetrahedron, 45: 4177; Ringel et al. (1991) J. Natl. Cancer Inst, 83: 288; Bissery et al. (1991) Cancer Res., 51: 4845; Herbst et al. (2003) Cancer Treat. Rev., 29: 407-415; Davies et al. (2003) Expert. Opin. Pharmacother., 4: 553-565). Доцетакселом называют (2R,3S)-N-карбокси-3-фенилизосерин, сложный N-трет-бутиловый эфир, сложный 13-иловый эфир, содержащий 5,20-эпокси-1,2,4,7,10,13-гексагидрокситакс-1-ен-9-он, 4-ацетат, 2-бензоат, тригидрат (US 4814470; ЕР 253738; регистрационный № в CAS 114977-28-5), и он имеет структуру:

Эрибулин (HALAVEN®, Eisai Co., Е7389, ER-086526, NSC 707389 (обозначение Национального института рака (National Cancer Institute; NCI) NS) одобрен для лечения пациентов с метастатическим раком молочной железы, которые перед химиотерапией получали лечение по меньшей мере по двум схемам для рака молочной железы на поздних стадиях, и исследуется на предмет лечения других солидных опухолей, включая немелкоклеточный рак легкого (NSCLC), рак предстательной железы и саркому. Эрибулин является аналогом природного продукта халихондрина В из морских губок (Towle et al. (2001) Cancer Res., 61(3): 1013-1021; Yu et al. (2005) Anticancer agents from natural products. Wash. DC, Taylor & Francis, ISBN 0-8493-1863-7; Kim et al. (2009) J. Am. Chem. Soc, 131(43): 15636-15641) из рода губок Halichondra (Hirata, Y. and Uemura D. (1986) Pure Appl. Chem., 58 (5): 701-710; Bai et al. (1991) J. Biol. Chem., 266 (24): 15882-15889). Эрибулин является ингибитором микротрубочек, преимущественно связывающимся с отдельной группой высокоаффинных сайтов на плюс-концах существующих микротрубочек, и оказывает свои противораковые эффекты, запуская апоптоз раковых клеток после длительного и необратимого блокирования митоза (Jordan et al. (2005) Mol. Cancer Ther., 4 (7): 1086-1095; Okouneva et al. (2008) Mol. Cancer Ther., 7 (7): 2003-2011; Smith et al. (2010) Biochem., 49 (6): 1331-1337; Kuznetsov et al. (2004) Cancer Res., 64 (16): 5760-5766; Towle et al. (2011 Cancer Res., 71 (2): 496-505). Эрибулином называют 2-(3-амино-2-гидроксипропил)гексакозагидро-3-метокси-26-метил-20,27-бис(метилен)11,15-18,21-24,28-триэпокси-7,9-этано-12,15-метано-9H,15Н-фуро(3,2-1)фуро(2',3'-5,6)пирано(4,3-b)(1,4)диоксацикло-пентакозин-5-(4Н)-он (регистрационный № в CAS 253128-41-5), и он имеет структуру:

Гемцитабин (GEMZAR®, Lilly, регистрационный № в CAS 95058-81-4) представляет собой аналог нуклеозидов, который блокирует репликацию ДНК, и его применяют для лечения различных карцином, включая рак поджелудочной железы, рак молочной железы, NSCLC, и лимфом (US 4808614; US 5464826; Hertel et al. (1988) J. Org. Chem., 53: 2406; Hertel et al. (1990) Cancer Res., 50: 4417; Lund et al. (1993) Cancer Treat. Rev., 19: 45-55). Гемцитабином называют 4-амино-1-[3,3-дифтор-4-гидрокси-5-(гидроксиметил)тетрагидрофуран-2-ил]-1Н-пиримидин-2-он, и он имеет структуру:
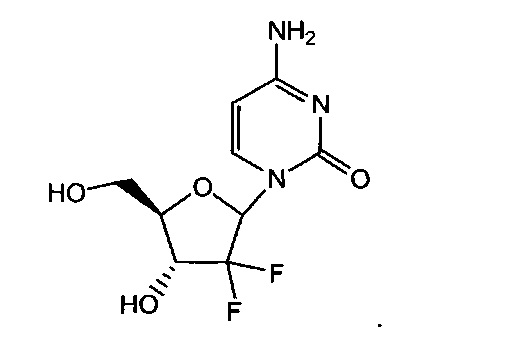
GDC-0973 (XL-518, регистрационный номер в CAS 934660-93-2, Genentech Inc. и Exelixis) представляет собой сильнодействующий и высокоселективный низкомолекулярный ингибитор киназы МЕК, предназначенный для перорального введения и для возможного лечения рака, в том числе солидных опухолей (US 7803839; US 7999006; US 7915250). GDC-0973 и GDC-0941, ингибитор PI3K I класса, оба проходят ранние стадии клинических испытаний как в качестве отдельных агентов, так и в комбинации (Hoeflich et al. (2012) Cancer Research, 72 (1): 210-219; US 20110086837). Аберрантная активация ERK-пути является общим показателем для опухолей человека. Этот путь состоит из трехъярусного киназного модуля, содержащего киназы, индуцирующие быстро прогрессирующую фибросаркому (rapidly accelerated fibrosarcoma; RAF), киназу митоген-активируемой протеинкиназы (mitogen-activated protein kinase; МАРК) (МЕК) и внеклеточную сигнал-регулируемую киназу (extracellular signal related kinase; ERK), которая действует как усилитель отрицательной обратной связи для обеспечения устойчивости и стабилизации выходного сигнала пути. Поскольку ERK-путь часто является разрегулированным в случаях рака у человека, в настоящее время предпринимаются интенсивные усилия для разработки противораковых лекарственных средств на основе селективных ингибиторов ERK-пути. Объединение GDC-0973 с ингибитором PI3K GDC-0941 привело к сочетанному действию in vitro и in vivo в результате индукции биомаркеров, ассоциированных с апоптозом, включая Bcl-2-семейство проапоптотических регуляторов. GDC-0973 называют (8)-(3,4-дифтор-2-((2-фтор-4-иодфенил)амино)фенил)(3-гидрокси-3-(пиперидин-2-ил)азетидин-1-ил)метанон, и он имеет структуру:

GDC-0623 (регистрационный номер в CAS 1168091-68-6, Genentech Inc.) представляет собой сильнодействующий и высокоселективный низкомолекулярный ингибитор МЕК, предназначенный для перорального введения и для возможного лечения рака, в том числе солидных опухолей (US 7923456; US 2011/0158990). GDC-0623 называют 5-((2-фтор-4-иодфенил)амино)-N-(2-гидроксиэтокси)имидазо[1,5-а]пиридин-6-карбоксамид, и он имеет структуру:

Паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Princeton, NJ, регистрационный № в CAS 33069-62-4) представляет собой соединение, выделенное из коры дерева тиса тихоокеанского, Taxus brevifolia, и применяется для лечения рака легкого, яичников, молочной железы и распространенных форм саркомы Калоши (Wani et al. (1971) J. Am. Chem. Soc, 93: 2325; Mekhail et al. (2002) Expert. Opin. Pharmacother., 3: 755-766). Паклитакселом называют β-(бензоиламино)-α-гидрокси-6,12b-бис(ацетилокси)-12-(бензоилокси)-2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагидро-4,11-дигидрокси-4а,8,13,13-тетраметил-5-оксо-7,11-метано-1Н-циклодека(3,4)бенз(1,2-б)-оксет-9-иловый эфир (2aR-(2a-α,4-,4a-β,6-β,9-α(α-R*,β-S*),11-α,12-α,12a-α,2b-α))-бензолпропановой кислоты, и он имеет структуру:

Тамоксифен (NOLVADEX®, ISTUBAL®, VALODEX®, регистрационный № в CAS 10540-29-1) представляет собой антагонист рецептора эстрогенов в ткани молочной железы при посредстве своего активного метаболита гидрокситамоксифена. В других тканях, таких как эндометрий, он ведет себя как агонист и поэтому может быть охарактеризован как смешанный агонист/антагонист (New Engl. J. Med. (2009) 361: 766, Aug. 20, 2009). Применение тамоксифена относится к обычной эндокринной (антиэстрогенной) терапии положительного в отношении рецепторов гормонов рака молочной железы у женщин предменопаузального периода, а также к стандартной терапии у женщин постменопаузального периода, хотя в этих условиях также часто используют ингибиторы ароматазы. В настоящее время тамоксифен применяют для лечения как раннего, так и распространенного ER+ (положительного в отношении рецепторов эстрогенов) рака молочной железы у женщин пред- и постменопаузального периода (Jordan V. (1993) Br. J. Pharmacol., 110 (2): 507-17). Тамоксифеном называют (Z)-2-[4-(1,2-дифенилбут-1-енил)фенокси]-N,N-диметил-этанамин, и он имеет структуру:

Применение фулвестранта (FASLODEX®, AstraZeneca, регистрационный № в CAS 129453-61-8) относится к лекарственной терапии положительного в отношении рецепторов гормонов метастатического рака молочной железы у женщин постменопаузального периода с прогрессированием заболевания после антиэстрогенной терапии (Kansra (2005) Mol. Cell Endocrinol., 239 (1-2): 27-36). Он является антагонистом рецептора эстрогенов без каких-либо агонистических эффектов, который работает, одновременно подавляя и разрушая рецептор эстрогенов (Croxtall (2011) Drugs, 71(3): 363-380). Фулвестрант является селективным негативным регулятором рецептора эстрогенов (selective estrogen receptor down-regulator; SERD). Фулвестрант показан для лечения положительного в отношении рецепторов гормонов метастатического рака молочной железы у женщин постменопаузального периода с прогрессированием заболевания после антиэстрогенной терапии (Flemming et al. (2009) Breast Cancer Res. Treat., May, 115(2): 255-68; Valachis et al. (2010) Crit. Rev. Oncol. Hematol., Mar, 73(3): 220-7). Фулвестрантом называют (7α,17β)-7-{9-[(4,4,5,5,5-пентафторпентил)сульфинил]нонил}эстра-1,3,5(10)-триен-3,17-диол, и он имеет структуру:
Дексаметазон является сильнодействующим глюкокортикоидным стероидным гормоном с противовоспалительной и иммуносупрессорной активностью. В случае онкологических заболеваний дексаметазон назначают раковым пациентам, подвергающимся химиотерапии, чтобы противостоять некоторым побочным эффектам получаемого ими противоопухолевого лечения. Дексаметазон может усиливать противорвотный эффект антагонистов 5-НТ3-рецепторов подобно ондансетрону. Дексаметазон также используют при некоторых гематологических злокачественных новообразованиях, в частности при лечении множественной миеломы, при которой дексаметазон назначают отдельно или вместе с талидомидом (thal-dex - комбинация талидомид-дексаметазон) или в виде комбинации с адриамицином (доксорубицином) и винкристином (VAD - винкристин-адриамицин-дексаметазон). В случае опухолей головного мозга (первичных или метастатических) дексаметазон используют, чтобы противостоять развитию отека, который мог бы с течением времени приводить к сдавливанию других структур головного мозга. Дексаметазоном называют (8S,9R,10S,11S,13S,14S,16R,17R)-9-фтор-11,17-дигидрокси-17-(2-гидроксиацетил)-10,13,16-триметил-6,7,8,11,12,14,15,16-октагидроциклопента[а]-фенантрен-3-он (регистрационный № в CAS 50-02-2), и он имеет структуру:
Пертузумаб (OMNITARG®, 2С4, rhuMAb (recombinant humanized monoclonal antibody) 2C4, Genentech) представляет собой рекомбинантное гуманизированное моноклональное антитело, которое ингибирует димеризацию HER2 (US 6054297; US 6407213; US 6800738; US 6627196, US 6949245; US 7041292). Пертузумаб и трастузумаб направленно воздействуют на разнообразные внеклеточные участки рецептора тирозинкиназы HER-2 (Nahta et al. (2004) Cancer Res., 64: 2343-2346). Гибридомная клеточная линия, экспрессирующая 2С4 (пертузумаб), депонирована в Американской коллекции типовых культур (American Type Culture Collection; АТСС), 10801 University Boulevard, Manassas, Va. 20110-2209, USA под номером АТСС HB-12697 8 апреля 1999 года. Пертузумаб блокирует способность рецептора HER2 действовать совместно с другими членами семейства рецепторов HER, т.е. HER1/EGFR, HER3 и HER4 (Agus et al. (2002) Cancer Cell, 2: 127-37; Jackson et al. (2004) Cancer Res., 64: 2601-9; Takai et al. (2005) Cancer, 104: 2701-8; US 6949245). В раковых клетках такое нарушение способности HER2 действовать совместно с другими рецепторами HER-семейства блокирует передачу сигнала в клетке и в конечном итоге может приводить к ингибированию роста и к гибели раковых клеток. Ингибиторы димеризации HER (HER dimerization inhibitors; HDI), вследствие своего уникального способа действия, обладают способностью работать в большом разнообразии опухолей, включая те, которые не сверхэкспрессируют HER2 (Mullen et al. (2007) Molecular Cancer Therapeutics, 6: 93-100). В настоящее время пертузумаб предложен для лечения метастатического HER2-положительного (+) рака молочной железы.
Трастузумаба эмтанзин (KADCYLA™, трастузумаб-DMI, PR-132365, PRO-132365; R-3502, RG-3502; Tmab-MCC-DM1, трастузумаб-мертанзин, Трастузумаб-MCC-DM1, T-DM1, Genentech Inc.) представляет собой конъюгат антитело-лекарственное средство (регистрационный № в CAS 139504-50-0), одобренный для лечения HER2-положительного (HER2+) метастатического рака молочной железы (Burris et al. (2011) Clinical Breast Cancer, 11 (5): 275-82; Phillips et al. (2008) Cancer Res., 2008, 68(22): 9280-9290). Трастузумаба эмтанзин имеет структуру:
где Tr представляет собой трастузумаб, соединенный через линкерную группировку МСС (4-(N-малеимидометил)циклогексан-1-карбоксилат) с группировкой лекарственного средства майтанзиноида, DM1 (US 5208020; US 6441163). Соотношение лекарственное средство-антитело или содержание лекарственного средства представлено значением p в приведенной выше структуре трастузумаб-MCC-DMI и лежит в диапазоне целых чисел от 1 до примерно 8. Значение содержания лекарственного средства p составляет от 1 до 8. Трастузумаб-MCC-DMI включает все смеси конъюгатов антитело-лекарственное средство с различным содержанием и присоединением, где 1, 2, 3, 4, 5, 6, 7 и 8 группировок лекарственного средства ковалентно присоединены к антителу трастузумабу (US 7097840; US 2005/0276812; US 2005/0166993).
Трастузумаб (HERCEPTIN®, huMab4D5-8, rhuMAb HER2, Genentech) представляет собой полученную с использованием рекомбинантной ДНК гуманизированную, lgG1 -каппа, моноклональную антительную версию мышиного антитела к HER2, которая селективно связывается с высокой аффинностью в анализе с использованием клеток (Kd составляет 5 нМ) с внеклеточным доменом белка - рецептора-2 эпидермального фактора роста человека, HER2 (ErbB2) (US 5821337; US 6054297; US 6407213; US 6639055; Coussens L, et al. (1985) Science, 230: 1132-9; Slamon DJ, et al. (1989) Science, 244: 707-12). Трастузумаб содержит каркасные области антитела человека с определяющими комплементарность участками мышиного антитела (4D5), которое связывается с HER2. Трастузумаб связывается с антигеном HER2 и ввиду этого ингибирует рост раковых клеток. Как в анализах in vitro, так и на животных показано, что трастузумаб ингибирует пролиферацию опухолевых клеток человека, которые сверхэкспрессируют HER2 (Hudziak RM et al. (1989) Mol. Cell Biol., 9: 1165-72; Lewis GD, et al. (1993) Cancer Immunol. Immunother., 37: 255-63; Baselga J, et al. (1998) Cancer Res., 58: 2825- 2831). Трастузумаб является медиатором антитело-зависимой клеточной цитотоксичности, ADCC (Hotaling ТЕ, et al. (1996) [abstract]. Proc. Annual Meeting Am. Assoc. Cancer Res., 37: 471; Pegram MD, et al. (1997) [abstract]. Proc. Am. Assoc. Cancer Res., 38: 602; Sliwkowski et al. (1999) Seminars in Oncology, 26(4), Suppl 12: 60-70; Yarden Y. and Sliwkowski, M. (2001) Nature Reviews: Molecular Cell Biology, Macmillan Magazines, Ltd., Vol.2: 127-137). HERCEPTIN® был одобрен в 1998 году для лечения пациентов с ErbB2-сверхэкспрессирующими метастатическими случаями рака молочной железы (Baselga et al., (1996) J. Clin. Oncol., 14: 737-744). HERCEPTIN® был одобрен Управлением по контролю качества пищевых продуктов и лекарственных средств США (Food and Drug Administration; FDA) в 2006 году в качестве части схемы лечения, состоящей из доксорубицина, циклофосфамида и паклитаксела, для адъювантного лечения пациентов с HER2-положительным раком молочной железы с поражением лимфоузлов. Имеется существенная клиническая потребность в разработке дополнительных HER2-направленных терапий рака для таких пациентов с HER2-сверхэкспрессирующими опухолями или другими заболеваниями, ассоциированными с экспрессией HER2, которые не отвечают или слабо отвечают на лечение с применением HERCEPTIN®.
Летрозол (FEMARA®, Novartis Pharm.) представляет собой пероральный нестероидный ингибитор ароматазы для лечения чувствительного к гормонам рака молочной железы после хирургического вмешательства (Bhatnagar et al. (1990) J. Steroid Biochem. and Mol. Biol., 37: 1021; Lipton et al. (1995) Cancer, 75: 2132; Goss, P.E. and Smith, R.E. (2002) Expert Rev. Anticancer Ther., 2: 249-260; Lang et al. (1993) The Journal of Steroid Biochem. and Mol. Biol., 44(4-6): 421-8; EP 236940; US 4978672). Препарат FEMARA® одобрен FDA для лечения локального или метастатического рака молочной железы, являющегося положительным в отношении рецепторов гормонов (HR+) или имеющего неизвестный рецепторный статус, у женщин постменопаузального периода. Летрозолом называют 4,4'-((1Н-1,2,4-триазол-1-ил)метилен)дибензонитрил (регистрационный № в CAS 112809-51-5), и он имеет структуру:
Карбоплатин (регистрационный № CAS 41575-94-4) представляет собой химиотерапевтическое лекарственное средство, применяемое в случае карциномы яичников, рака легкого, рака головы и шеи (US 4140707). Карбоплатином называют азанид, циклобутан-1,1-дикарбоксилат платины, и он имеет структуру:
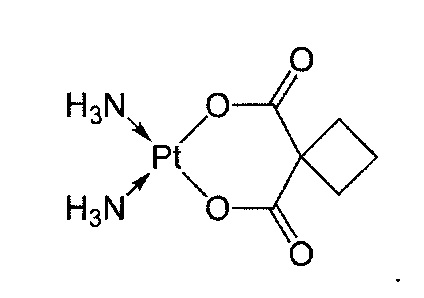
Бевацизумаб (регистрационный № в CAS 216974-75-3, AVASTIN®, Genentech) представляет собой моноклональное антитело к VEGF-сосудистому эндотелиальному фактору роста (US 7227004; US 6884879; US 7060269; US 7169901; US 7297334), применяемое в лечении рака, где оно ингибирует опухолевый рост путем блокирования образования новых кровеносных сосудов. Бевацизумаб был первым доступным в клинике ингибитором ангиогенеза в Соединенных Штатах Америки, одобренным FDA в 2004 году к применению в комбинации со стандартной химиотерапией в лечении метастатического рака толстой кишки и большинства форм метастатического немелкоклеточного рака легкого. В настоящее время проводятся отдельные поздние стадии клинических исследований с целью определения его безопасности и эффективности для пациентов с: поддающимся лечению адъювантной терапией/неметастатическим раком толстой кишки, метастатическим раком молочной железы, метастатическим почечноклеточным раком, метастатической мультиморфной глиобластомой, метастатическим раком яичников, метастатическим гормоно-резистентным раком предстательной железы и метастатическим или неоперабельным локально распространенным раком поджелудочной железы.
Обычно антитело к VEGF не будет связываться ни с другими гомологами VEGF, такими как VEGF-B или VEGF-C, ни с другими факторами роста, такими как плацентарный фактор роста (placenta growth factor; PIGF), фактор роста тромбоцитов (platelet-derived growth factor; PDGF) или основный фактор роста фибробластов (basic fibroblast growth factor; bFGF). Предпочтительные антитела к VEGF включают моноклональное антитело, которое связывается с тем же эпитопом, что и моноклональное антитело к VEGF А4.6.1, продуцируемое гибридомой с номером АТСС НВ 10709; рекомбинантное гуманизированное моноклональное антитело к VEGF, полученное согласно Presta et al. (1997) Cancer Res., 57: 4593-4599, включая бевацизумаб, но им не ограничиваясь, который содержит подвергнутые мутации каркасные области человеческого lgG1 и антиген-связывающие определяющие комплементарность участки от мышиного моноклонального антитела к hVEGF А4.6.1, которое блокирует связывание VEGF человека (hVEGF) с его рецепторами. Приблизительно 93% аминокислотной последовательности бевацизумаба, включая большинство каркасных областей, происходит из lgG1 человека и примерно 7% последовательности происходит из мышиного антитела А4.6.1. Бевацизумаб имеет молекулярную массу примерно 149000 дальтон и является гликозилированным. Бевацизумаб и другие гуманизированные антитела к VEGF также описаны в US 6884879. Дополнительные антитела к VEGF включают G6- или В20-серии антител (например, G6-31, В20-4.1), которые представлены на любой из Фиг. 27-29 в WO 2005/012359. В одном из воплощений антитело В20-серии связывается с функциональным эпитопом VEGF человека, содержащим остатки F17, М18, D19, Y21, Y25, Q89, 191, К101, Е103 и С104. Гибридомные клеточные линии А 4.6.1 (АТСС НВ 10709) и В 2.6.2 (АТСС НВ 10710), экспрессирующие антитело к VEGF, депонированы и поддерживаются Американской коллекцией типовых культур (АТСС), 10801 University Boulevard, Manassas, VA 20110-2209, USA. B20-4.1.1 представляет собой заменитель бевацизумаба (Liang et al. (2006) Jour. Biol. Chem., 281: 951-961). Клон, экспрессирующий полипептид VEGF-E (US 6391311), кодируемый вставкой с нуклеотидной последовательностью, с идентификатором депозита в АТСС DNA29101-1276, депонирован 5 марта 1998 года и поддерживается под номером АТСС 209653 Американской коллекцией типовых культур, 10801 University Boulevard, Manassas, Va. 20110-2209, USA.
БИОЛОГИЧЕСКАЯ ОЦЕНКА
Измеряли биологические активности GDC-0032 в виде отдельного агента и в комбинации с разнообразными химиотерапевтическими агентами, включая как низкомолекулярные, так и высокомолекулярные агенты (белки, антитела). Эти биологические активности GDC-0032, в виде отдельного агента и в комбинациях, сравнивали с активностями ингибиторов PI3K GDC-0941 и GDC-0980, каждый из которых разрабатывается Genentech для лечения рака.
GDC-0941 (пиктрелисиб (pictrelisib), Genentech Inc., Roche, RG-7321) представляет собой сильнодействующий многонаправленный (пан)-ингибитор изоформ PI3K I класса. В настоящее время GDC-0941 проходит фазу II клинических испытаний на предмет лечения распространенных форм солидных опухолей. GDC-0941 называют 4-(2-(1Н-индазол-4-ил)-6-((4-(метилсульфонил)пиперазин-1-ил)метил)тиено[3,2-d]пиримидин-4-ил)морфолин (US 7781433; US 7750002; Folkes et al. (2008) Jour, of Med. Chem., 51(18): 5522-5532), и он имеет структуру:

в том числе стереоизомеры, геометрические изомеры, таутомеры и их фармацевтически приемлемые соли.
GDC-0980 (Genentech Inc., Roche, RG-7422) представляет собой сильнодействующий двойной ингибитор mTOR и PI3K (Wallin et al. (2011) Mol. Can. Ther., 10(12): 2426-2436; Sutherlin et al. (2011) Jour. Med. Chem., 54: 7579-7587). GDC-0980 демонстрирует широкий спектр активности в доклинических моделях ксенотрансплантатов рака: молочной железы, яичников, легкого и предстательной железы, и в настоящее время разрабатывается для возможного лечения рака с использованием перорального введения, в том числе солидных опухолей и неходжкинской лимфомы (Wagner AJ, Burs III НА, de Bono JS et al. AACR-NCI-EORTC International Congress (2009), 21st: November 17 (Abs. B137) "Pharmacokinetics and Pharmacodynamic biomarkers for the dual PI3K/mTOR inhibitor GDC-0980: initial phase I evaluation"; US 7888352; US 2009/0098135; US 2010/0233164). В настоящее время GDC-0980 проходит фазу II клинических испытаний на предмет лечения распространенных форм солидных опухолей. GDC-0980 называют (S)-1-(4-((2-(2-аминопиримидин-5-ил)-7-метил-4-морфолинотиено[3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-он, и он имеет структуру:

в том числе стереоизомеры, геометрические изомеры, таутомеры и их фармацевтически приемлемые соли.

Фосфоинозитид-3-киназный (PI3K) каскад передачи сигнала, ключевой медиатор выживаемости, роста и метаболизма клеток, часто претерпевает изменения при раке у человека. Активирующие мутации в PIK3CA, гене, который кодирует α-каталитическую субъединицу PI3K, встречаются приблизительно в 30% случаев рака молочной железы. Результатом этих мутаций является конститутивная активность фермента, и они являются онкогенными. Экспрессия PIK3CA с мутацией H1047R в эпителий просвета протоков молочной железы индуцирует возникновение гетерогенных опухолей, которые экспрессируют люминальные и базальные маркеры и являются положительными в отношении рецепторов эстрогенов. Онкоген PIK3CA с мутацией H1047R направленно воздействует на плюрипотентные клетки-предшественники и воспроизводит признаки опухолей молочной железы человека с PIK3CA с мутацией H1047R (Meyer et al. (2011) Cancer Res., 71 (13): 4344-51). Гиперактивация PI3K может произойти в результате соматических мутаций в PIK3CA, гене, кодирующем р110а-субъединицу PI3K. Онкоген HER2 амплифицирован в 25% всех случаев рака молочной железы, и некоторые из этих опухолей также несут мутации гена PIK3CA. PI3K может усиливать трансформацию и придавать резистентность к HER2-направленным терапиям. Мутации Е545К и H1047R в PI3K, введенные в эпителиальные клетки опухоли молочной железы человека MCF10A, которые также сверхэкспрессируют HER2, придавали клеткам функцию MCF10A/HER2. Ароматаза-экспрессирующие клетки MCF7 превращают андростендион в эстроген в культуре. Экспрессия PI3K с мутацией H1047R, но не PI3K с Е545К, заметно активировала лиганд к HER3/HER4 - херегулин (HER-3/HER-4 ligand heregulin; HRG) (Chakrabarty et al. (2010) Oncogene, 29 (37): 5193-5203).
АКТИВНОСТЬ IN VITRO GDC-0032 КАК ОТДЕЛЬНОГО АГЕНТА
Цитотоксическую или цитостатическую активность GDC-0032 как отдельного агента измеряли посредством: адаптирования линии пролиферирующих опухолевых клеток млекопитающих в среде для культивирования клеток, добавления тестируемого соединения, культивирования клеток в течение периода времени от примерно 6 часов до примерно 5 суток и измерения жизнеспособности клеток (пример 3). Для измерения жизнеспособности, т.е. пролиферации (IC50), цитотоксичности (EC50) и индукции апоптоза (активации каспаз) применяли анализы in vitro, основанные на использовании клеток.
Эффективность in vitro GDC-0032 измеряли в анализе клеточной пролиферации из примера 3, люминесцентном анализе жизнеспособности клеток CellTiter-Glo®, набор для которого поставляется Promega Corp., Madison, WI. Этот гомогенный метод анализа основан на использовании экспрессии рекомбинантной люциферазы Coleoptera (US 5583024; US 5674713; US 5700670), и в нем определяют число жизнеспособных клеток в культуре на основании количественного определения присутствующего аденозинтрифосфата (АТФ), индикатора метаболически активных клеток (Crouch et al. (1993) J. Immunol. Meth., 160: 81-88; US 6602677). Анализ CellTiter-Glo® проводили в 96- или 384-луночном формате, что делает его пригодным для автоматизированного высокопроизводительного скрининга (high-throughput screening; HTS) (Cree et al. (1995) Anticancer Drugs, 6: 398-404). Процедура данного гомогенного анализа включает добавление единственного реагента (реагента CellTiter-Glo®) непосредственно к клеткам, культивируемым в дополненной сывороткой среде. Стадий промывки клеток, удаления среды и многократного пипетирования не требуется. Система регистрирует минимально 15 клеток/лунка в 384-луночном формате через 10 минут после добавления реагента и перемешивания.
Результатом применения гомогенного формата "добавить-перемешать-измерить" является лизис клеток и генерация сигнала люминесценции, пропорционального количеству присутствующего АТФ. Количество АТФ прямо пропорционально числу клеток, присутствующих в культуре. В анализе CellTiter-Glo® генерируется сигнал люминесценции типа свечения ("glow-type"), производимый под действием люциферазной реакции, который в общем случае характеризуется временем полужизни более пяти часов в зависимости от используемого типа клеток и используемой среды. Количество жизнеспособных клеток выражают в относительных единицах люминесценции (relative luminescence units; RLU). Субстрат, люциферин жука, подвергается окислительному декарбоксилированию под действием рекомбинантной люциферазы светлячков с одновременным превращением АТФ в АМФ (аденозинмонофосфат) и генерацией фотонов. Продолжительное время полужизни устраняет необходимость в применении инжекторов для реагентов и обеспечивает оперативность в отношении осуществления обработки многочисленных планшетов в непрерывном или периодическом режиме. Этот анализ клеточной пролиферации можно использовать в различных многолуночных форматах, например 96- или 384-луночном формате. Данные можно регистрировать с помощью люминометра или визуализирующего устройства на основе камеры, содержащей прибор с зарядовой связью (charge coupled device; CCD). Выходной сигнал люминесценции приведен в виде относительных световых единиц (RLU), измеренных во времени.
Антипролиферативные эффекты GDC-0032 и, для сравнения, GDC-0941 измеряли в анализе CellTiter-Glo® (пример 3) в отношении линий опухолевых клеток, приведенных на Фиг. 1-4 и в Таблице 2. Для этих экспериментов оценивали величины EC50. Диапазон in vitro активностей в отношении потенциала клеток (cell potency activities) составлял от примерно 100 нМ до примерно 10 мкМ.



В Таблице 2 показана значительная эффективность GDC-0032 в виде отдельного активного агента в анализах клеточной пролиферации in vitro в отношении клеточных линии с PIK3CA и амплифицированным HER2.
На Фиг. 1 приведены два графика, демонстрирующие эффективность (EC50, микромолярная концентрация) GDC-0032 и GDC-0941 (4-(2-(1Н-индазол-4-ил)-6-((4-(метилсульфонил)пиперазин-1-ил)метил)тиено[3,2-d]пиримидин-4-ил)морфолина) в анализах клеточной пролиферации, выполненных в отношении клеточных линий с PIK3CA дикого типа (WT) и Р1К3СА-мутантных клеточных линий, включая НСС-1954 с мутацией H1047R. Верхний график на Фиг. 1 демонстрирует, что GDC-0032 имеет более широкое терапевтическое окно в отношении PIK3CA-мутантных клеточных линий, чем пан-ингибитор (pan inhibitor) GDC-0941 (нижний график). На Фиг. 2 приведены два графика, демонстрирующие эффективность (EC50, микромолярная концентрация) GDC-0032 и GDC-0941 в анализах клеточной пролиферации, выполненных в отношении клеточных линий с PIK3CA дикого типа (WT), PIK3CA-мутантных, HER2- экспрессирующих и PI3K-мутантных/HER2-экспрессирующих клеточных линий. Фиг. 1 и 2 демонстрируют, что GDC-0032 более эффективен в отношении PIK3CA-мутантных клеток и HER2+ клеток рака молочной железы, чем GDC-0941. Раковые клеточные линии с амплификацией HER2 примерно в 44 раза более чувствительны к GDC-0032, чем таковые без амплификации HER2, по сравнению с тем, что они в 9 раз более чувствительны к GDC-0941.
На Фиг. 2 приведены два графика, демонстрирующие эффективность (EC50, микромолярная концентрация) GDC-0032 и GDC-0941 в анализах клеточной пролиферации, выполненных в отношении клеточных линий с PIK3CA дикого типа (WT), PIK3CA-мутантных, HER2-экспрессирующих и PI3K-мутантных/HER2-экспрессирующих клеточных линий. Каждая точка относится к отдельной клеточной линии.
На Фиг. 3 приведены три графика, демонстрирующие эффективность (ЕС50, микромолярная концентрация) GDC-0032 в отношении: (3a, верх) клеточных линий с мутацией по спиральному и киназному домену PIK3CA; (3b, середина) клеточных линий с PIK3CA дикого типа, PIK3CA-мутантных клеточных линий, клеточных линий с нулевыми мутациями PTEN и PTEN/PIKSCA-мутантных клеточных линий; и (3c, низ) клеточных линий с PIK3CA дикого типа, PIK3CA-мутантных, Ras-мутантных и Ras/PIKSCA-мутантных клеточных линий. Данные результаты демонстрируют, что GDC-0032 является менее эффективным, когда PIK3CA-мутантные опухоли имеют сопутствующие мутации в Ras или потерю PTEN.
Фиг. 4а демонстрирует эффективность GDC-0032 в отношении набора изогенных клеточных линий SW48. Родительские клетки SW48 и субклоны мутантов с направленными вставками, несущие обычные мутации PIK3CA в горячих точках, Е545К или H1047R, получали от Horizon Discovery. Значения EC50, характеризующие жизнеспособность клеток при обработке GDC-0032, определяли в этих линиях с использованием анализа CellTiter-Glo® на 4-е сутки (Promega). Значения EC50, характеризующие жизнеспособность трех клеточных подтипов, составляли 0,022 мкМ для родительских клеток, 0,005 мкМ для клеток с Е545К и 0,008 мкМ для клеток с H1047R. В своей совокупности изогенные клеточные линии с мутациями в PI3K демонстрируют повышенную чувствительность к GDC-0032.
На Фиг. 4b приведены авторадиограммы после гель-электрофореза лизатов, полученных через 18 часов после воздействия на изогенные клетки SW48: родительские и PIK3CA-мутантные с мутациями с направленными вставками, Е545К и H1047R. GDC-0032 индуцирует апоптоз в клетках, несущих мутации в PI3K, при очень низких концентрациях соединений. Аналогичные эффекты наблюдали в PI3K-мутантных изогенных клетках из клеточных линий рака молочной железы MCF10 и НСС-1954 (клеточной линии рака молочной железы с мутацией H1047R в PI3K).
АКТИВНОСТЬ IN VITRO КОМБИНАЦИИ GDC-0032 И ХИМИОТЕРАПЕВТИЧЕСКИХ АГЕНТОВ
Цитотоксическую или цитостатическую активность комбинации GDC-0032 и типичных химиотерапевтических агентов измеряли посредством: внедрения адаптирования линии пролиферирующих опухолевых клеток млекопитающих в среду для культуривирования клеток, добавления тестируемого соединения, культивирования клеток в течение периода времени от примерно 6 часов до примерно 5 суток и измерения жизнеспособности клеток (пример 3). Для измерения жизнеспособности, т.е. пролиферации (IC50), цитотоксичности (EC50) и индукции апоптоза (активации каспаз) применяли анализы in vitro, основанные на использовании клеток.
Эффективность in vitro комбинаций GDC-0032 с химиотерапевтическими агентами измеряли в анализе клеточной пролиферации из примера 3; люминесцентном анализе жизнеспособности клеток CellTiter-Glo®, поставляемом Promega Corp., Madison, WI. Этот гомогенный метод анализа основан на использовании экспрессии рекомбинантной люциферазы Coleoptera (US 5583024; US 5674713; US 5700670), и в нем определяют число жизнеспособных клеток в культуре на основании количественного определения присутствующего АТФ, индикатора метаболически активных клеток (Crouch et al. (1993) J. Immunol. Meth., 160: 81-88; US 6602677). Анализ CellTiter-Glo® проводили в 96- или 384-луночном формате, что делает его пригодным для автоматизированного высокопроизводительного скрининга (HTS) (Сгее et al. (1995) Anticancer Drugs, 6: 398-404). Процедура данного гомогенного анализа включает добавление единственного реагента (реагента CellTiter-Glo®) непосредственно к клеткам, культивируемым в дополненной сывороткой среде. Стадий промывки клеток, удаления среды и многократного пипетирования не требуется. Система регистрирует минимально 15 клеток/лунка в 384-луночном формате через 10 минут после добавления реагента и перемешивания.
Антипролиферативные эффекты GDC-0032 и, для сравнения, GDC-0941 измеряли в анализе CellTiter-Glo® (пример 3) в отношении линий опухолевых клеток, приведенных на Фиг. 1-4 и в Таблице 2. Для этих экспериментов оценивали величины ЕС50. Диапазон in vitro активностей в отношении потенциала клеток составлял от примерно 100 нМ до примерно 10 мкМ.
Индивидуальные измеренные в отношении конкретного типа клеток величины EC50 для GDC-0032 сравнивают с величиной EC50 для комбинации. Показатель для комбинации (индекс комбинирования, combination index, CI) в баллах рассчитывают по методу Chou и Talalay (Chou, Т. and Talalay, P. (1984) Adv. Enzyme Regul., 22: 27-55). CI менее чем примерно 0,7 указывает на синергизм. CI от 0,8 до 1,2 указывает на аддитивность. CI больше чем 1,2 указывает на антагонизм. Эффективность синергизма оценивают согласно методу Chou и Talalay. Некоторые терапевтические комбинации, приведенные на Фиг. 4-6, демонстрируют удивительное и неожидаемое свойство синергизма в анализах клеточной пролиферации in vitro с использованием линий клеток опухолевого типа, в том числе неходжкинской лимфомы (non-Hodgkin's lymphoma; NHL), диффузной В-клеточной крупноклеточной лимфомы (DLBCL) и множественной миеломы. Другие комбинации не демонстрируют никакого синергизма, а демонстрируют только одну лишь аддитивность или один лишь антагонизм. Некоторые комбинации проявляют синергетическое действие в отношении опухолей одного или более типов, но не других типов. Синергизм, продемонстрированный в анализах клеточной пролиферации in vitro, дает основание ожидать соответствующее синергетическое действие при лечении рака у пациентов-людей.
На Фиг. 5а показано влияние GDC-0032, паклитаксела (РТХ) и комбинации GDC-0032 и паклитаксела на клеточную линию рака молочной железы MFM223 с мутациями H1047R и D350N. В анализе выживаемости и пролиферации клеток in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки при варьировании концентраций ингибиторов путем титрования дозы (RLU - относительные световые единицы) GDC-0032, паклитаксела (РТХ) и комбинации GDC-0032 и паклитаксела. При объединении этих двух лекарственных средств наблюдают заметное улучшение ингибирования жизнеспособности клеток.
На Фиг. 5b приведены показатели CI для комбинаций GDC-0032+паклитаксел и GDC-0941+паклитаксел в отношении клеточных линий с PIK3CA дикого типа и мутантных клеточных линий рака молочной железы как базального, так и люминального типов. Мутации PIK3CA включают Е545К и H1047R. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к раковой клеточной линии. Результаты демонстрируют схожие тенденции, касающиеся активности этих двух комбинаций в отношении PIK3CA дикого типа и мутантных клеточных линий рака молочной железы.
На Фиг. 6а показано влияние GDC-0032, эрибулина и комбинации GDC-0032 и эрибулина на клеточную линию рака молочной железы Саl51 базального подтипа с мутацией Е542К в PIK3CA и потерей экспрессии белка PTEN. В анализе выживаемости и пролиферации клеток in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки при варьировании концентраций ингибиторов путем титрования дозы (RLU - относительные световые единицы) GDC-0032, эрибулина и комбинации GDC-0032 и эрибулина.
На Фиг. 6b приведены показатели для комбинации (CI) для комбинаций GDC-0032+эрибулин, GDC-0032+доцетаксел, GDC-0941+эрибулин и GDC-0941+доцетаксел в отношении клеточных линий с PIK3CA дикого типа и с мутациями Е545К, H1047R, PTEN-отрицательных и PTEN-отриц./Е545К-мутантных клеточных линий рака молочной железы как базального, так и люминального типов. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к раковой клеточной линии. Для этих комбинаций наблюдали синергизм при оценке большинства клеточных линий.
На Фиг. 7 приведены показатели для комбинации (CI) для комбинаций GDC-0032+эрибулин и GDC-0941+эрибулин в отношении клеточных линий с PIK3CA дикого типа и PIK3CA-мутантных (Е545К, H1047R) клеточных линий рака молочной железы как базального, так и люминального типов. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к раковой клеточной линии. Для этих комбинаций наблюдали синергизм при оценке большинства клеточных линий.





Из Таблицы 3 видно, что синергизм наблюдается для GDC-0032 в комбинации с несколькими различными химиотерапевтическими лекарственными средствами и агентами направленного действия.
GDC-0032 демонстрировал более высокий уровень синергизма (CI 0,25) по сравнению с GDC-0941 (CI 0,39) в комбинации с трастузумаба эмтанзином (Т-DM1) в отношении клеток рака молочной железы MCF7.1-neo/HER2 с мутацией Е545К в PIK3CA.
На Фиг. 8а показано влияние GDC-0032, доцетаксела и комбинации GDC- 0032+доцетаксел на клеточную линию рака молочной железы Са151 базального подтипа с мутацией Е542К в PIK3CA и потерей экспрессии белка PTEN. В анализе in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки при варьировании концентраций ингибиторов (RLU - относительные световые единицы), путем титрования дозы GDC-0032, доцетаксела и комбинации GDC-0032+доцетаксел. При объединении этих двух лекарственных средств наблюдают заметное улучшение ингибирования жизнеспособности клеток.
На Фиг. 8b приведены показатели CI для комбинаций GDC-0032+доцетаксел и GDC-0941+доцетаксел в отношении клеточных линий с PIK3CA дикого типа и мутантных клеточных линий рака молочной железы. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к отдельной клеточной линии. Для этих комбинаций наблюдали синергизм при оценке большинства клеточных линий.
На Фиг. 9а показано влияние GDC-0032, трастузумаба и комбинации GDC-0032+трастузумаб на клеточную линию рака молочной железы SKBR3 с высоким уровнем экспрессии HER2. В анализе выживаемости и пролиферации клеток in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки при варьировании концентраций ингибиторов путем титрования дозы (RLU - относительные световые единицы) GDC-0032, трастузумаба и комбинации GDC-0032+трастузумаб. При объединении этих двух лекарственных средств наблюдают улучшение ингибирования жизнеспособности клеток.
На Фиг. 9b приведены показатели CI для комбинаций GDC-0032+доцетаксел и GDC-0941+доцетаксел в отношении HER2+клеточных линий с PIK3CA дикого типа и PIK3CA-мутантных клеточных линий рака молочной железы, включая Е545К и H1047R. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к отдельной клеточной линии. Для этих комбинаций наблюдали синергизм при оценке большинства клеточных линий.
На Фиг. 10а показано влияние трастузумаба, GDC-0032, паклитаксела и комбинаций GDC-0032+трастузумаб, паклитаксел+трастузумаб, GDC-0032+паклитаксел и тройной комбинации GDC-0032+паклитаксел+трастузумаб на клеточную линию рака молочной железы KPL4 с мутациями H1047R и D350N в PIK3CA. В анализе выживаемости и пролиферации клеток in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки при варьировании концентраций ингибиторов путем титрования дозы (RLU - относительные световые единицы). Комбинация паклитаксел+GDC-0032 снижала жизнеспособность клеток. Трастузумаб в такой комбинации не оказывал эффекта на жизнеспособность клеток для этой клеточной линии.
На Фиг. 10b показано влияние трастузумаба, GDC-0032, паклитаксела и комбинаций GDC-0032+трастузумаб, паклитаксел+трастузумаб, GDC-0032+паклитаксел и GDC-0032+паклитаксел+трастузумаб на клеточную линию рака молочной железы SKBR3 с высоким уровнем экспрессии HER2. В анализе выживаемости и пролиферации клеток in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки при варьировании концентраций ингибиторов путем титрования дозы (RLU - относительные световые единицы). Заметное улучшение, заключающееся в снижении жизнеспособности клеток, наблюдали при использовании двойных и тройной комбинаций для этой клеточной линии.
На Фиг. 11а показано влияние 5-FU, GDC-0032 и комбинации 5-FU и GDC-0032 на клеточную линию рака молочной железы НСС1428. В анализе выживаемости и пролиферации клеток in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки при варьировании концентраций ингибиторов путем титрования дозы (RLU - относительные световые единицы) 5-FU, GDC-0032 и комбинации 5-FU+GDC-0032. При объединении этих двух лекарственных средств для этой клеточной линии наблюдали заметное улучшение ингибирования жизнеспособности клеток.
На Фиг. 11 b приведены показатели CI для комбинаций GDC-0032+5-FU и GDC-0941+5-FU в отношении HER2+клеточных линий с PIK3CA дикого типа и PIK3CA-мутантных, включая Е545К и H1047R, клеточных линий рака молочной железы базального и люминального подтипов. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к отдельной клеточной линии. Для этих комбинаций наблюдали синергизм для нескольких из оцениваемых клеточных линий.
На Фиг. 12а приведены показатели CI для комбинаций GDC-0032+традиционные химиотерапевтические агенты, включая 5-FU, гемцитабин, паклитаксел, доцетаксел и эрибулин, в отношении раковых клеточных линий. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к отдельной клеточной линии. Значения CI, указывающие на синергизм, наблюдали при оценке большинства клеточных линий и комбинаций с химиотерапевтическими агентами.
На Фиг. 12b приведены показатели CI для комбинаций GDC-0032+химиотерапевтические агенты направленного действия, включая трастузумаб (Herceptin®), трастузумаба эмтанзин (T-DM1) и MEKi (GDC-0973), в отношении раковых клеточных линий. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к отдельной клеточной линии. Для комбинаций с агентами направленного действия наблюдали синергизм при оценке большинства клеточных линий.
Эндокринные терапии, например летрозолом или фулвестрантом, представляют собой широко используемые варианты лечения для метастатического, положительного в отношении рецепторов гормонов (HR+) рака молочной железы, однако пациенты в конечном итоге переносят рецидив. Фосфатидилинозит-3-киназы (PI3K) регулируют рост, миграцию и выживаемость клеток опухоли молочной железы. Альфа-изоформа PI3K часто находится в мутированном и активированном состоянии в HR+раковой опухоли молочной железы и непосредственно связана с резистентностью к эндокринным терапиям. Поэтому использование ингибиторов PI3K для комбинирования с эндокринными терапиями является привлекательным. GDC-0032 представляет собой биодоступный при пероральном введении, сильнодействующий и селективный ингибитор альфа-, дельта- и гамма-изоформ PI3K I класса, при этом ингибирование бета-изоформы PI3K происходит в 30 раз слабее по сравнению с альфа-изоформой PI3K. Доклинические данные показывают, что GDC-0032 обладает более высокой активностью в отношении раковых клеточных линий с мутацией по альфа-изоформе PI3K (PIK3CA) и с амплифицированным HER2. Исследования для отдельных агентов и комбинаций выполняли с целью определения того, усиливает ли GDC-0032 противоопухолевую активность эндокринных терапий в моделях рака молочной железы у человека. На Фиг. 37 показана активность летрозола и ингибитора PI3K GDC-0032 в ароматаза-экспрессирующих клетках MCF7. Чувствительность к эндокринным терапиям повышается в клетках MCF7-ARO, растущих в присутствии предшественника эстрогенов андростендиона в среде. Ароматаза-экспрессирующие клетки MCF7 превращают андростендион в эстроген в культуре. Клетки MCF7 (положительные в отношении рецепторов эстрогенов (ER+) с мутацией Е545К по PI3K-альфа) трансфицировали геном ароматазы и отбирали стабильные клоны (MCF7-ARO), которые способны преобразовывать превращать андростендион в эстроген в культуре. При выращивании в присутствии андростендиона рост клеток MCF7-ARO был более зависим от эстрогена. Чувствительность к эндокринным терапиям повышается в клетках MCF7-ARO, растущих в присутствии предшественника эстрогенов в среде. В этих условиях клетки обрабатывали GDC-0032 в комбинации с эндокринными терапиями и анализировали на предмет жизнеспособности клеток, модулирования маркеров PI3K-пути и ER-пути и индукции апоптоза. Комбинация GDC-0032 и эндокринных терапий снижала жизнеспособность клеток MCF7-ARO и усиливала апоптоз по сравнению с использованием одного отдельного агента из этих двух. Комбинация GDC-0032 и летрозола усиливает апоптоз в восприимчивых клетках, поскольку летрозол ослабляет передачу сигнала по PI3K-пути в направлении mTOR и летрозол активирует рАКТ и HER2, как это делает фулвестрант.
На Фиг. 38 показано, что GDC-0032 хорошо сочетается с летрозолом in vitro по данным количественной оценки ингибирования жизнеспособности клеток по Блиссу и с использованием HSA. На Фиг. 39 показано взаимное влияние путей PI3K и ER, которое подтверждает механизм действия для комбинации GDC-0032 и летрозола. Обработка клеток в течение двадцати четырех часов летрозолом увеличивает количество HER2 и pAkt, но уменьшает pmTOR и pp70S6K. На Фиг. 40 показано, что у резистентных к эндокринной терапии клеток MCF7-ARO усилена передача сигнала по PI3K-пути и что они обладают чувствительностью к GDC-0032. Резистентные к эндокринной терапии клетки MCF7-ARO получали, повышая дозу летрозола в течение примерно 4 месяцев. Клетки были резистентными к эксеместану, фулвестранту, тамоксифену и летрозолу. Эти данные обеспечивают научное обоснование для оценки применимости GDC-0032 в комбинации с эндокринными терапиями для лечения HR+ рака молочной железы в клинике.
АКТИВНОСТЬ IN VIVO GDC-0032 КАК ОТДЕЛЬНОГО АГЕНТА В ОТНОШЕНИИ ОПУХОЛЕВЫХ КСЕНОТРАНСПЛАНТАТОВ
Эффективность GDC-0032 измеряли in vivo посредством имплантации ксенотрансплантатов опухолевых клеток, представляющих собой клетки рака молочной железы, немелкоклеточного рака легкого, рака яичников, предстательной железы, меланомы и колоректального рака, мышам с ослабленным иммунитетом и обработки опухоленесущих животных с использованием GDC-0032. Результаты зависят от клеточной линии, присутствия или отсутствия некоторых мутаций в опухолевых клетках, режима введения GDC-0032 и других факторов. Испытуемых мышей обрабатывали лекарственным(и) средством(ами) или контролем (разбавителем) и проводили мониторинг в течение нескольких недель или более с целью определения времени удвоения опухоли, порядка уменьшения числа клеток (log cell kill) и ингибирования (роста) опухоли (пример 4). На Фиг. 13-22 показаны графики изменения объема опухоли во времени после обработки опухоленесущих мышей с использованием GDC-0032 в соответствии с протоколом из примера 4.
На Фиг. 13 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах (бестимусных) мышей с ослабленным иммунитетом, несущих ксенотрансплантаты опухоли молочной железы НСС1954.х1 с мутацией в PI3Kα (H1047R), которым в соответствии со схемой из Таблицы 4 вводили перорально (РО) и один раз в сутки (QD) разбавитель (МСТ; 0,5% метилцеллюлозы/0,2% твина 80), GDC-0941 и GDC-0032. Наблюдали дозозависимое усиление ингибирования роста опухоли (TGI) при введении GDC-0032 один раз в сутки и максимального TGI в 138% достигали в конце введения на 21-е сутки. Регрессию опухолей наблюдали в дозах GDC-0032, составляющих 12,5 и 25 мг/кг. Термин "мкл" означает микролитр.


На Фиг. 14 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах мышей с ослабленным иммунитетом (SCID (severe combined immunodeficiency) beige mice - мышей с врожденным отсутствием клеток-киллеров и синдромом тяжелого комбинированного иммунодефицита), несущих ксенотрансплантаты опухоли молочной железы KPL4 с мутацией в PIK3CA (H1047R), которым перорально (РО) и один раз в сутки (QD) вводили разбавитель (МСТ; 0,5% метилцеллюлозы/0,2% твина-80) и GDC-0032. В модели с ксенотрансплантатами KPL4 при введении GDC-0032 один раз в сутки достигали дозозависимого уменьшения объема опухоли с усилением регрессии опухолей, наблюдаемым в дозе GDC-0032 25 мг/кг, в сравнении с контрольными мышами, обработанными разбавителем, в конце лечения на 21-е сутки.
На Фиг. 15 приведен построенный по точкам график изменения объема опухоли за 20 суток в группах мышей с ослабленным иммунитетом (бестимусных), несущих ксенотрансплантаты опухоли молочной железы MCF7-neo/HER2 с мутацией в PI3Kα (Е545К), которым перорально (РО) и один раз в сутки (QD) вводили разбавитель (МСТ; 0,5% метилцеллюлозы/0,2% твина-80) и GDC-0032. В модели с ксенотрансплантатами MCF7-neo/HER2 при введении GDC-0032 один раз в сутки достигали дозозависимого уменьшения объема опухоли с усилением регрессии опухолей, наблюдаемым в дозе GDC-0032 22,5 мг/кг, в сравнении с контрольными мышами, обработанными разбавителем, через 10 суток лечения.
На Фиг. 16 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах мышей с ослабленным иммунитетом (бестимусных), несущих ксенотрансплантаты опухоли молочной железы MCF7 с мутацией в PI3Kα (Е545К), которым перорально (РО) и один раз в сутки (QD) вводили разбавитель (МСТ; 0,5% метилцеллюлозы/0,2% твина-80) и GDC-0032. Дозозависимого уменьшения объема опухоли достигали при введении GDC-0032 один раз в сутки в модели с ксенотрансплантатами MCF7. Усиление регрессии опухолей наблюдали для всех протестированных доз GDC-0032 в сравнении с разбавителем в качестве контроля.
На Фиг. 17 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах мышей с ослабленным иммунитетом (бестимусных), несущих ксенотрансплантаты опухоли яичников SKOV3 с мутацией в PI3Kα (H1047R), которым перорально (РО) и один раз в сутки (QD) вводили разбавитель (МСТ; 0,5% метилцеллюлозы/0,2% твина-80) и GDC-0032. Дозозависимого уменьшения объема опухоли достигали при введении GDC-0032 один раз в сутки в течение 21 суток лечения в модели с ксенотрансплантатами SKOV3.
На Фиг. 18 приведен построенный по точкам график изменения объема опухоли за 7 суток в группах мышей с ослабленным иммунитетом (бестимусных), несущих ксенотрансплантаты раковой опухоли колоректальной зоны НМ-7 с мутацией в PI3Kα (H1047R), которым перорально (РО) и один раз в сутки (QD) вводили разбавитель (МСТ; 0,5% метилцеллюлозы/0,2% твина-80) и GDC-0032. В модели с ксенотрансплантатами НМ-7 при введении GDC-0032 один раз в сутки достигали дозозависимого уменьшения объема опухоли с усилением регрессии опухолей, наблюдаемым в дозе GDC-0032 25 мг/кг, в сравнении с контрольными мышами, обработанными разбавителем, в конце лечения на 7-е сутки.
На Фиг. 19 приведен построенный по точкам график изменения объема опухоли за 14 суток в группах мышей с ослабленным иммунитетом (бестимусных), несущих ксенотрансплантаты раковой опухоли предстательной железы РС3, являющиеся PTEN-отрицательными (с нулевыми мутациями PTEN), которым перорально (РО) и один раз в сутки (QD) вводили разбавитель (МСТ; 0,5% метилцеллюлозы/0,2% твина-80) и GDC-0032. Дозы GDC-0032 менее 12,5 мг/кг были неэффективны после введения GDC-0032 один раз в сутки в течение 14 суток. Тем не менее, противоопухолевый ответ наблюдали в модели с ксенотрансплантатами РС3 при самой высокой протестированной дозе (25 мг/кг) и его характеризовали как остановку роста опухоли.
На Фиг. 20 приведен построенный по точкам график изменения объема опухоли за 24 сутки в группах мышей с ослабленным иммунитетом (бестимусных), несущих ксенотрансплантаты раковой опухоли предстательной железы 22RV1, являющиеся PTEN-отрицательными (с нулевыми мутациями PTEN), которым перорально (РО) и один раз в сутки (QD) вводили разбавитель (МСТ; 0,5% метилцеллюлозы/0,2% твина-80) и GDC-0032. Дозозависимого уменьшения объема опухоли достигали при введении GDC-0032 один раз в сутки в модели с ксенотрансплантатами 22RV1.
На Фиг. 21 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах мышей с ослабленным иммунитетом (бестимусных), несущих ксенотрансплантаты раковой опухоли меланомы 537 MEL, имеющие нулевые мутации PTEN и имеющие амплификации гена В-Raf, которым перорально (РО) и один раз в сутки (QD) вводили разбавитель (МСТ; 0,5% метилцеллюлозы/0,2% твина-80), GDC-0941 и GDC-0032. Дозозависимого уменьшения объема опухоли достигали при введении GDC-0032 один раз в сутки в модели с ксенотрансплантатами 537 MEL.
На Фиг. 22 приведено усредненное изменение объема опухоли за 24 суток в группах мышей с ослабленным иммунитетом (бестимусных), несущих опухолевые ксенотрансплантаты немелкоклеточного рака легкого (NSCLC) NCI-Н1975 с мутациями в EGFR (L858R и Т790М), мутацией в PIK3CA (G118D), мутацией в р53, которым перорально (РО) и один раз в сутки (QD) вводили разбавитель (МСТ; 0,5% метилцеллюлозы/0,2% твина-80) и GDC-0032. Дозозависимое уменьшение объема опухоли наблюдали в течение 24 суток лечения с применением GDC-0032 в сравнении с разбавителем в качестве контроля.
АКТИВНОСТЬ GDC-0032 И ХИМИОТЕРАПЕВТИЧЕСКИХ КОМБИНАЦИЙ IN VIVO В ОТНОШЕНИИ ОПУХОЛЕВЫХ КСЕНОТРАНСПЛАНТАТОВ
Эффективность комбинаций GDC-0032 и различных химиотерапевтических агентов, включая низкомолекулярные и высокомолекулярные агенты направленного действия, измеряли in vivo посредством имплантации аллотрансплантатов или ксенотрансплантатов раковых клеток грызунам и обработки опухоленесущих животных данными лекарственными комбинациями. Результаты зависят от клеточной линии, присутствия или отсутствия некоторых мутаций в опухолевых клетках, последовательности введения GDC-0032 и химиотерапевтического агента, режима введения и других факторов. Испытуемых мышей обрабатывали лекарственным(и) средством(ами) или контролем (разбавителем) и проводили мониторинг в течение нескольких недель или более с целью определения времени удвоения опухоли, порядка уменьшения числа клеток (log cell kill) и ингибирования (роста) опухоли (пример 4). На Фиг. 23-36 показаны графики изменения объема опухоли во времени после лечения опухоленесущих мышей, обработанных комбинациями GDC-0032 и различных химиотерапевтических агентов в соответствии с протоколом из примера 4.
На Фиг. 23 приведено усредненное изменение объема опухоли за 51 сутки в группах мышей с ослабленным иммунитетом (бестимусных), несущих ксенотрансплантаты раковой опухоли молочной железы MCF-7 neo/HER2, которым в соответствии со схемой из Таблицы 5 вводили разбавитель, доцетаксел (DTX), GDC-0941, GDC-0032 и комбинации доцетаксел+GDC-0941 или доцетаксел+GDC-0032. GDC-0941 и GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 21 суток. Доцетаксел вводили внутривенно и один раз в неделю (QW) в течение 3 недель. По окончании введения на 21-е сутки проводили мониторинг состояния мышей на предмет повторного роста опухолей в течение еще 30 суток. В сравнении с каждым отдельным агентом как таковым для комбинации на основе GDC-0032 наблюдали повышение противоопухолевой активности DTX, выражающееся в повышении регрессии опухолей. При самых высоких протестированных дозах (20 мг/кг) действие GDC-0032 в комбинации с DTX было сопоставимо с точки зрения % TGI с действием GDC-00941 в комбинации с DTX (Таблица 5).
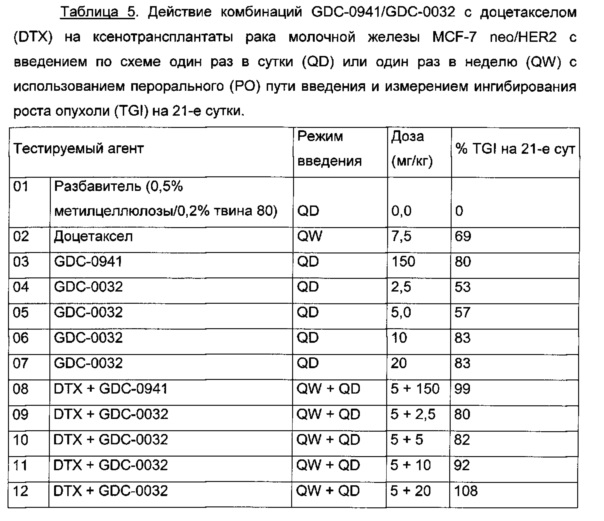
На Фиг. 24 приведено усредненное изменение объема опухоли за 25 суток в группах мышей с ослабленным иммунитетом, несущих ксенотрансплантаты трижды отрицательной (по рецептору эстрогенов (ER¯), по рецептору прогестерона (PR¯), по рецептору HER2 (neu/HER2-)) раковой опухоли молочной железы МХ-1, являющиеся PTEN-негативными (с нулевыми мутациями PTEN), которым вводили разбавитель (0,5% метилцеллюлозы/0,2% твина-80), доцетаксел, GDC-0032 и комбинации GDC-0032+доцетаксел. GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 21 суток. DTX вводили внутривенно и один раз в неделю (QW) в течение 3 недель, используя дозу лекарственного средства 2,5; 5,0 и 7,5 мг/кг. По окончании введения на 21-е сутки проводили мониторинг состояния мышей на предмет повторного роста опухолей в течение еще 4 суток. GDC-0032 повышал противоопухолевую активность DTX во всех протестированных дозах. Максимальную активность в случае комбинаций наблюдали для комбинаций GDC-0032 в дозе 5 и 10 мг/кг плюс DTX в дозе 7,5 мг/кг в сравнении с каждым лекарственным средством по отдельности.
На Фиг. 25 приведено усредненное изменение объема опухоли за 26 суток в группах мышей с ослабленным иммунитетом, несущих ксенотрансплантаты раковой опухоли яичников SKOV3 с мутацией в PI3K (H1047R), которым вводили разбавитель (0,5% метилцеллюлозы/0,2% твина-80), доцетаксел (DTX), GDC-0032 и комбинации GDC-0032+доцетаксел. GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 21 суток. DTX вводили внутривенно и один раз в неделю (QW) в течение 3 недель, используя дозу лекарственного средства 7,5 мг/кг. По окончании введения на 21-е сутки проводили мониторинг состояния мышей на предмет повторного роста опухолей в течение еще 4 суток. GDC-0032 повышал противоопухолевую активность DTX во всех протестированных дозах GDC-0032. Максимальную активность в случае комбинаций наблюдали для комбинаций GDC-0032 в дозе 15 мг/кг плюс DTX в дозе 7,5 мг/кг в сравнении с каждым лекарственным средством по отдельности.
На Фиг. 26 приведено усредненное изменение объема опухоли за 40+суток в группах мышей с ослабленным иммунитетом (бестимусных), несущих ксенотрансплантаты опухоли молочной железы MCF-7 с мутацией в PI3K (Е545К), которым вводили разбавитель (0,5% метилцеллюлозы/0,2%) твина-80), паклитаксел, GDC-0032 и комбинации паклитаксел+GDC-0032. GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 21 суток. Паклитаксел вводили внутривенно и один раз в неделю (QW) в течение 3 недель, используя дозу лекарственного средства 10 мг/кг. GDC-0032 в дозе 7,5 и 12,5 мг/кг усиливал противоопухолевую активность паклитаксела в сравнении с каждым лекарственным средством по отдельности.
На Фиг. 27 приведено усредненное изменение объема опухоли за 60 сутки в группах мышей с ослабленным иммунитетом, несущих ксенотрансплантаты HER2+раковой опухоли молочной железы ВТ474 с мутацией в PI3K (K111N), которым перорально (РО) вводили разбавитель (0,5% метилцеллюлозы/0,2% твина-80), трастузумаб (Herceptin®), GDC-0032 и комбинации трастузумаб+GDC-0032. GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 21 суток в дозах 5, 10 и 20 мг/кг. Трастузумаб вводили внутривенно (IV) и один раз в неделю (QW) в дозе 3 мг/кг. Ударную дозу трастузумаба 6 мг/кг вводили перед IV введением. GDC-0032 повышал эффективность трастузумаба дозозависимым образом.
На Фиг. 28 приведено усредненное изменение объема опухоли за 10+суток в группах мышей с ослабленным иммунитетом (бестимусных), несущих аллотрансплантаты HER2+опухоли молочной железы Founder 5 (Fo5), разработанные для сверхэкспрессии HER2 с помощью вируса опухоли молочной железы мышей (mouse mammary tumor virus; MMTV), которым перорально (РО) вводили разбавитель (0,5% метилцеллюлозы/0,2% твина-80), трастузумаб (Herceptin®), трастузумаба эмтанзин (T-DM1), GDC-0032, комбинацию трастузумаб+GDC-0032 и комбинацию T-DM1+GDC-0032. GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 15 суток, используя дозу лекарственного средства 25 мг/кг. Трастузумаб вводили внутривенно (IV) и один раз в неделю (QW) в дозе 30 мг/кг, a T-DM1 вводили IV однократно. В сравнении с каждым агентом по отдельности комбинация на основе GDC-0032 повышала противоопухолевую активность трастузумаба и T-DM1 и индуцировала остановку роста опухоли. Различий в активности комбинаций с GDC-0032 и трастузумабом по сравнению с GDC-0032 и T-DM1 не наблюдали.
На Фиг. 29 приведено усредненное изменение объема опухоли за 21 сутки в группах мышей с ослабленным иммунитетом (бестимусных), несущих ксенотрансплантаты HER2+раковой опухоли молочной железы ВТ474, которым перорально (РО) вводили разбавитель (0,5% метилцеллюлозы/0,2% твина-80), трастузумаб (Herceptin®), доцетаксел, GDC-0032, комбинацию трастузумаба и доцетаксела или тройную комбинацию трастузумаба, доцетаксела и GDC-0032. GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 21 суток в дозе 5, 10 и 15 мг/кг. Трастузумаб вводили внутривенно (IV) и один раз в неделю (QW) в дозе 3 мг/кг. Доцетаксел вводили внутривенно и один раз в неделю (QW) в течение 3 недель, используя дозу лекарственного средства 7,5 мг/кг. В сравнении с монотерапией трастузумабом и доцетакселом применение комбинации обоих лекарственных средств приводило к усилению регрессии опухоли. Добавление GDC-0032 во всех протестированных дозах к двойной комбинации доцетаксела и трастузумаба дополнительно усиливало регрессию опухоли за время лечения.
На Фиг. 30 приведено усредненное изменение объема опухоли за 40+суток в группах мышей с ослабленным иммунитетом (бестимусных), несущих ксенотрансплантаты раковой опухоли молочной железы MCF-7 с мутацией (Е545К) в PI3K, которым перорально (РО) вводили разбавитель (0,5% метилцеллюлозы/0,2% твина-80), фулвестрант, GDC-0032 и комбинацию фулвестранта и GDC-0032. GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 21 суток в дозе 5, 10 и 15 мг/кг. Фулвестрант вводили подкожно, используя 5 мг лекарственного средства, один раз в неделю (QW) в течение 3 недель. В сравнении с монотерапией, GDC-0032 в дозах 5 и 10 мг/кг усиливал противоопухолевую активность фулвестранта за время лечения и в течение еще 20 суток после окончания введения. В сравнении с активностью GDC-0032 как отдельного агента применение комбинации GDC-0032 в дозе 15 мг/кг и фулвестранта приводило к устойчивому ингибированию роста опухоли по окончании периода лечения.
На Фиг. 31 приведено усредненное изменение объема опухоли за 20+суток в группах мышей с ослабленным иммунитетом (бестимусных), несущих ксенотрансплантаты раковой опухоли молочной железы MCF-7 neo/HER2 с мутацией (Е545К) в PI3K, которым перорально (РО) вводили разбавитель (0,5% метилцеллюлозы/0,2% твина-80), тамоксифен, GDC-0032 и комбинацию тамоксифена и GDC-0032. GDC-0032 вводили перорально (РО) и один раз в сутки в течение 21 суток в дозе 5, 10 и 20 мг/кг. Тамоксифен вводили в виде гранул (5 мг), подкожно имплантированных мышам. В сравнении с монотерапией, GDC-0032 в дозе 20 мг/кг усиливал противоопухолевую активность тамоксифена, и их применение приводило к регрессии опухоли.
На Фиг. 32 приведено усредненное изменение объема опухоли за 40 суток в группах мышей с ослабленным иммунитетом (бестимусных), несущих содержащие мутации опухолевые ксенотрансплантаты немелкоклеточного рака легкого (NSCLC) А549, которым перорально (РО) вводили разбавитель (0,5% метилцеллюлозы/0,2% твина-80), GDC-0973, GDC-0032 и комбинацию GDC-0973 и GDC-0032. GDC-0032 и GDC-0973 вводили один раз в сутки в течение 21 суток в дозах 7,5 и 5,0 мг/кг, соответственно. Применение комбинации GDC-0032 и GDC-0973 приводило к усилению регрессии опухоли за время лечения. Эффекты комбинации обоих лекарственных средств были продолжительными, поскольку устойчивую противоопухолевую активность наблюдали в течение еще 19 суток после окончания лечения.
На Фиг. 33 приведено усредненное изменение объема опухоли, за 15+суток в группах мышей с ослабленным иммунитетом (SCID-мышей с врожденным отсутствием клеток-киллеров), несущих опухолевые ксенотрансплантаты множественной миеломы ММ.1, которым вводили разбавители, дексаметазон, GDC-0980, GDC-0032, комбинацию дексаметазона и GDC-0980 и комбинацию дексаметазона и GDC-0032. GDC-0032 вводили перорально (РО) и один раз в сутки, используя дозы лекарственного средства 1 и 4 мг/кг. GDC-0980 вводили перорально и один раз в сутки, используя дозу лекарственного средства 1 мг/кг. В сравнении с монотерапией применение комбинации на основе GDC-0032 в дозах лекарственного средства 1 и 4 мг/кг усиливало противоопухолевую активность дексаметазона (2,5 мг/кг). Противоопухолевый эффект комбинации, наблюдаемый для GDC-0032 и дексаметазона, был сопоставим с эффектом комбинации GDC-0980 с дексаметазоном.
На Фиг. 34 приведено усредненное изменение объема опухоли за 21 сутки в группах из 10 мышей, несущих ксенотрансплантаты раковой опухоли молочной железы MCF-7 neo/HER2, которым перорально (РО) вводили капецитабин (Xeloda®), GDC-0032 и комбинацию капецитабина и GDC-0032.
На Фиг. 35 приведен построенный по точкам график изменения объема опухоли за 20 суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты немелкоклеточного рака легкого (NSCLC) А549 (KRASG12S, PI3KM772X,N996H), которым вводили разбавитель, доцетаксел, GDC-0032 и комбинации GDC-0032+доцетаксел. GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 21 суток. DTX вводили внутривенно и один раз в неделю (QW) в течение 3 недель, используя дозу лекарственного средства 10 мг/кг. По окончании введения на 21-е сутки проводили мониторинг состояния мышей на предмет повторного роста опухолей в течение еще 4 суток. GDC-0032 повышал противоопухолевую активность DTX во всех протестированных дозах GDC-0032. Максимальную активность в случае комбинаций наблюдали для комбинаций GDC-0032 в дозе 15 мг/кг плюс DTX в дозе 10 мг/кг в сравнении с каждым лекарственным средством по отдельности.
На Фиг. 36 приведен построенный по точкам график изменения объема опухоли за 28 суток в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты немелкоклеточного рака легкого (NSCLC) Н520 (p53mut), которым вводили разбавитель, доцетаксел, GDC-0032 и комбинации GDC-0032+доцетаксел. GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 21 суток. DTX вводили внутривенно и один раз в неделю (QW) в течение 3 недель, используя дозу лекарственного средства 10 мг/кг. По окончании введения на 21-е сутки проводили мониторинг состояния мышей на предмет повторного роста опухолей в течение еще 4 суток. GDC-0032 повышал противоопухолевую активность DTX во всех протестированных дозах GDC-0032, за исключением 2,5 мг/кг. Максимальную активность в случае комбинаций наблюдали для комбинаций GDC-0032 в дозе 15 мг/кг плюс DTX в дозе 10 мг/кг в сравнении с каждым лекарственным средством по отдельности.
На Фиг. 41 показана повышенная противоопухолевая активность in vivo в случаях объединения GDC-0032 с антиэстрогенными агентами фулвестрантом и тамоксифеном. Ингибирование роста опухоли (%TGI) в процентном отношении к разбавителю в качестве контроля на 21-е сутки измеряли на мышах MCF-7/ER+/HER2-, которым вводили фулвестрант и GDC-0032 по отдельности и в комбинации, и на мышах MCF-7/ER+/HER2+, которым вводили тамоксифен и GDC-0032 по отдельности и в комбинации. Комбинации GDC-0032 с обоими антагонистами рецепторов эстрогенов фулвестрантом и тамоксифеном показывают более высокие значения TGI в сравнении с этими агентами по отдельности, что демонстрирует синергетические эффекты.
На Фиг. 42 приведен построенный по точкам график изменения объема опухоли за 23 суток в группах из 12 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты рака молочной железы MCF-7 (PI3Kmut, ER+), которым вводили разбавитель, паклитаксел, GDC-0032 и комбинации GDC-0032+паклитаксел. GDC-0032 вводили перорально (РО) и либо один раз в сутки (QD, с пропуском одних суток перед введением дозы паклитаксела) в течение 21 суток, либо каждые 4 суток (Q4D) по 5 циклов. Паклитаксел вводили внутривенно каждые 4 суток по 5 циклов, используя дозу лекарственного средства 7,5 мг/кг. В случае обоих режимов введения (QD и Q4D) GDC-0032 усиливал противоопухолевую активность комбинации. Максимальную активность в случае комбинаций наблюдали для комбинаций GDC-0032 в дозе 40 мг/кг плюс паклитаксел в сравнении с каждым лекарственным средством по отдельности.
На Фиг. 43 приведен построенный по точкам график изменения объема опухоли за 21 сутки в группах из 8-10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты рака молочной железы KPL-4 (PI3Kmut, Her2+), которым вводили разбавитель, трастузумаб, пертузумаб, GDC-0032 и тройные комбинации GDC-0032 плюс трастузумаб и пертузумаб. GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 21 суток. Трастузумаб вводили внутрибрюшинно один раз в неделю в течение 3 недель, используя дозу лекарственного средства 3 мг/кг, пертузумаб вводили внутрибрюшинно один раз в неделю в течение 3 недель, используя дозу лекарственного средства 2,5 мг/кг. GDC-0032 повышал противоопухолевую активность комбинации во всех протестированных дозах GDC-0032. Максимальную активность в случае комбинаций наблюдали для комбинаций GDC-0032 в дозах 1,56-6,25 мг/кг плюс трастузумаб и пертузумаб в сравнении с каждым лекарственным средством по отдельности или с комбинацией без GDC-0032.
На Фиг. 44 приведен построенный по точкам график изменения объема опухоли за 22 суток в группах из 10 мышей с ослабленным иммунитетом, несущих ксенотрансплантаты немелкоклеточного рака легкого (NSCLC) Н292 (KRASmut), которым вводили разбавитель, паклитаксел, карбоплатин, антитело к VEGF (В20-4.1.1) (Bagri et al. (2010) Clin. Cancer Res., 16: 3887; Shrimali et al. (2010) Cancer Res., 70(15): 6171-6180), GDC-0032 и тройные и четверные комбинации GDC-0032+паклитаксел (РТХ), карбоплатин, +/- антитело к VEGF В20-4.1.1. В20-4.1.1 представляет собой заменитель бевацизумаба (AVASTIN®, Genentech Inc.) (Liang et al. (2006) Jour. Biol. Chem., 281: 951-961). GDC-0032 вводили перорально (РО) и один раз в сутки (QD) в течение 21 суток. Паклитаксел вводили внутривенно в 1-е сутки, используя дозу лекарственного средства 10 мг/кг, карбоплатин вводили внутрибрюшинно в 1-е сутки, используя дозу лекарственного средства 80 мг/кг, а антитело к VEGF вводили внутрибрюшинно два раза в неделю в течение 3 недель, используя дозу лекарственного средства 5 мг/кг. GDC-0032 повышал противоопухолевую активность комбинации во всех протестированных дозах GDC-0032. Максимальную активность в случае комбинаций наблюдали для комбинаций GDC-0032 в дозе 5 мг/кг плюс паклитаксел (РТХ), карбоплатин и антитело к VEGF в сравнении с каждым лекарственным средством по отдельности или с комбинацией без GDC-0032.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ПРЕПАРАТЫ
Фармацевтические композиции или композиции по настоящему изобретению включают комбинации GDC-0032, химиотерапевтического агента и одного или более чем одного фармацевтически приемлемого носителя, глиданта, разбавителя или эксципиента.
GDC-0032 и химиотерапевтические агенты по настоящему изобретению могут существовать в несольватированных, а также сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное, и подразумевается, что изобретение охватывает как сольватированные, так и несольватированные формы.
Соединения по настоящему изобретению также могут существовать в разных таутомерных формах, и все такие формы включены в объем данного изобретения. Термин "таутомер" или "таутомерная форма" относится к структурным изомерам, обладающим разной энергией, взаимопревращение которых протекает через низкий энергетический барьер. Например, протонные таутомеры (также известные как прототропные таутомеры) характеризуются взаимопревращениями в результате миграции протона, как например при кето-енольной и имин-енаминной изомерии. Валентные таутомеры включают взаимопревращения посредством реогранизации некоторых из связывающих электронов.
Фармацевтические композиции охватывают как нерасфасованную композицию, так и индивидуальные стандартные лекарственные формы, содержащие более одного (например, два) фармацевтически активных агента, включая GDC-0032 и химиотерапевтический агент, выбранный из перечня дополнительных агентов, изложенных в данном описании, наряду с любыми фармацевтически неактивными эксципиентами, разбавителями, носителями или глидантами. Нерасфасованная композиция и каждая индивидуальная стандартная лекарственная форма может содержать фиксированные количества вышеуказанных фармацевтически активных агентов. Нерасфасованная композиция представляет собой вещество, которое еще не прошло технологическую обработку для придания ей индивидуальной стандартной лекарственной формы. Иллюстративной стандартной лекарственной формой является пероральная стандартная лекарственная форма, такая как таблетки, пилюли, капсулы и тому подобное. Аналогично, также предполагается, что способы лечения пациента Путем введения фармацевтической композиции охватывают введение нерасфасованной композиции и индивидуальных стандартных лекарственных форм.
Фармацевтические композиции также включают в себя меченные изотопом соединения по настоящему изобретению, которые идентичны соединениям, приведенным в данном описании, если не считать, что один или более чем один атом заменен атомом, имеющим атомную массу или массовое число, отличную(ое) от атомной массы или массового числа, обычно встречающихся в природе. Все изотопы любого указанного конкретного атома или элемента включены в объем соединений по изобретению и их применений. Типичные изотопы, которые могут быть инкорпорированы в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и йода, такие как2H,3H,11C,13C,14C,13N,15N,15O,17O,18O,32P,33P,35S,18F,36Cl,123I и125I. Некоторые меченные изотопом соединения по настоящему изобретению (например, соединения, меченные3H и14C) полезны в анализах распределения соединения и/или субстрата в тканях. Изотопы трития (3H) и углерода-14 (14C) полезны ввиду простоты их получения и способности к детекции. Кроме того, замена на более тяжелые изотопы, такие как дейтерий (2H), может давать некоторые терапевтические преимущества, обусловленные большей метаболической стабильностью (например, увеличенный in vivo период полувыведения или снижение дозировки) и поэтому может быть предпочтительна в некоторых обстоятельствах. Излучающие позитроны изотопы, такие как15O,13N,11C и18F, полезны в исследованиях с использованием позитронно-эмиссионной томографии (PET) для изучения степени занятости рецепторов субстратом. В общем случае, меченные изотопом соединения по настоящему изобретению могут быть получены по методикам, аналогичным тем, которые изложены в данном описании ниже в разделе Примеры, с заменой не меченного изотопом реагента меченным изотопом реагентом.
Композицию на основе GDC-0032 и химиотерапевтических агентов изготавливают в соответствии с обычной фармацевтической практикой для применения в виде терапевтической комбинации для терапевтического лечения (включая профилактическое лечение) гиперпролиферативных расстройств у млекопитающих, в том числе людей. Согласно изобретению предложена фармацевтическая композиция, содержащая GDC-0032 вместе с одним или более чем одним фармацевтически приемлемым носителем, глидантом, разбавителем, вспомогательным веществом или эксципиентом.
Подходящие носители, разбавители, вспомогательные вещества и эксципиенты хорошо известны специалистам в данной области техники и включают такие вещества, как углеводы, воски, растворимые и/или набухаемые в воде полимеры, гидрофильные или гидрофобные вещества, желатин, масла, растворители, вода и тому подобное. Выбор конкретного используемого носителя, разбавителя или эксципиента будет зависеть от средства и назначения, по которому соединение по настоящему изобретению будет применяться. Как правило, растворители выбирают из растворителей, признанных специалистами в данной области техники безвредными (generally recognized/regarded as safe; GRAS) для введения млекопитающему. В общем случае, безвредными растворителями являются нетоксичные водные растворители, такие как вода и другие нетоксичные растворители, которые растворимы в воде или смешиваются с водой. Подходящие водные растворители включают воду, этанол, пропиленгликоль, полиэтиленгликоли (например, ПЭГ400, ПЭГ300) диметилеульфоксид (DMSO), кремофор (например, CREMOPHOR EL®, BASF) и их смеси. Композиции также могут включать в себя одно или более чем одно из следующего: буферы, стабилизирующие агенты, поверхностно-активные вещества, увлажняющие агенты, смазывающие вещества, эмульгаторы, суспендирующие агенты, консерванты, антиоксиданты, придающие непрозрачность агенты, глиданты, технологические добавки, красители, подсластители, отдушки, корригенты и другие известные вспомогательные вещества для обеспечения наилучшей презентации лекарственного средства (т.е. соединения по настоящему изобретению или фармацевтической композиции на его основе) или для содействия производству фармацевтического продукта (т.е. лекарственного средства).
Композиции могут быть изготовлены с использованием традиционных методик растворения и смешивания. Например, лекарственную субстанцию (т.е. соединение по настоящему изобретению или стабилизированную форму соединения, например, комплекс с производным циклодекстрина или другим известным агентом комплексообразования) растворяют в подходящем растворителе в присутствии одного или более эксципиентов, описанных выше. При изготовлении, соединение по настоящему изобретению обычно вводят в состав фармацевтических лекарственных форм, обеспечивающих легко контролируемую дозировку лекарственного средства и облегчающих соблюдение больным предписанной схемы лечения.
Фармацевтическая композиция (или препарат) для применения может быть упакована по-разному в зависимости от способа, используемого для введения лекарственного средства. В общем случае, изделие, предназначенное для распространения, содержит контейнер с размещенным в нем фармацевтическим препаратом в соответствующей форме. Подходящие контейнеры хорошо известны специалистам в данной области и включают такие материалы, как бутылки (пластиковые и стеклянные), саше, ампулы, пластиковые пакеты, металлические цилиндрические сосуды и тому подобное. Контейнер также может включать в себя блок, предохраняющий от неумелого обращения, для предупреждения неосторожного доступа к содержимому упаковки. Помимо этого, контейнер снабжен этикеткой с описанием содержимого контейнера. Этикетка также может содержать соответствующие предупреждения.
Фармацевтические композиции соединений по настоящему изобретению могут быть изготовлены для различных путей и типов введения. Например, GDC-0032 желаемой степени чистоты возможно может находиться в смеси с фармацевтически приемлемыми разбавителями, носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences (1995), 18th edition, Mack Publ. Co., Easton, PA) в форме лиофилизированной композиции, размолотого порошка или водного раствора. Изготовление композиций может быть осуществлено путем смешивания при температуре окружающей среды при соответствующем значении рН и желаемой степени чистоты с физиологически приемлемыми носителями, т.е. носителями, являющимися нетоксичными для реципиентов в применяемых дозировках и концентрациях. Величина рН композиции зависит главным образом от конкретного применения и концентрации соединения, однако может изменяться в диапазоне от примерно 3 до примерно 8.
Фармацевтическая композиция предпочтительно является стерильной. В частности, композиции, которые будут использованы для введения in vivo, должны быть стерильными. Такую стерилизацию легко осуществляют посредством фильтрования через мембраны для стерильной фильтрации.
Как правило, фармацевтическую композицию можно хранить в виде твердой композиции, лиофилизированной композиции или в виде водного раствора. Дозирование и введение фармацевтических композиций по изобретению будет осуществлено способом, согласующимся с надлежащей медицинской практикой, т.е. с учетом количеств, концентраций, схем, порядка, наличия разбавителей и путей введения. Факторы, рассматриваемые в этом контексте, включают конкретное подлежащее лечению расстройство, конкретное подлежащее лечению млекопитающее, клиническое состояние отдельного пациента, причину расстройства, место доставки агента, способ введения, схему введения и другие факторы, известные врачам. "Терапевтически эффективное количество" подлежащего введению соединения будет обусловлено такого рода соображениями и составляет минимальное количество, необходимое для предупреждения, улучшения или лечения расстройства, опосредованного фактором свертывания крови. Предпочтительно, чтобы такое количество было ниже количества, которое является токсичным для реципиента или которое делает реципиента значительно более подверженным кровоизлиянию.
Первоначальное фармацевтически эффективное количество GDC-0032, вводимого перорально или парентерально, из расчета на одну дозу будет находиться в диапазоне примерно 0,01-100 мг/кг, а именно, от примерно 0,1 до 20 мг/кг массы тела пациента в сутки, при этом типичный начальный диапазон для используемого соединения составляет 0,3-15 мг/кг/сутки. Доза GDC-0032 и доза химиотерапевтического агента, которая должны быть введена, может изменяться для каждого из них от примерно 1 мг до примерно 1000 мг на стандартную лекарственную форму или от примерно 10 мг до примерно 100 мг на стандартную лекарственную форму. Дозы соединения GDC-0032 и химиотерапевтического агента можно вводить в соотношении от примерно 1:50 до примерно 50:1 по массе или в соотношении от примерно 1:10 до примерно 10:1 по массе.
Приемлемые разбавители, носители, эксципиенты и стабилизаторы нетоксичны для реципиентов в применяемых дозировках и концентрациях и включают буферы, например, на основе фосфата, цитрата и других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметонийхлорид; бензалконийхлорид, бензетонийхлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропил-парабен; катехол; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA (этилендиаминтетрауксусная кислота); сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как ион натрия; комплексы с металлами (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN™, CREMOPHOR EL®, PLURONICS™ или полиэтиленгликоль (ПЭГ). Кроме того, активные фармацевтические ингредиенты могут быть заключены в микрокапсулы, приготовленные, например, с использованием методов коацервации или путем межфазной полимеризации, например, в микрокапсулы из гидроксиметилцеллюлозы или желатина и микрокапсулы из поли-(метилметакрилата), соответственно, в коллоидные системы лекарственной доставки (например, липосомы, микросферы из альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в Remington's Pharmaceutical Sciences, 18th edition, (1995 Mack Publ. Co., Easton, PA.
Можно изготовить препараты с длительным высвобождением GDC-0032 и химиотерапевтических соединений. Подходящие примеры препаратов с длительным высвобождением включают полупроницаемые матрицы из гидрофобных полимеров в твердой форме, содержащие GDC-0032, причем эти матрицы существуют в форме штампованных изделий, например, пленок или микрокапсул. Примеры матриц с длительным высвобождением включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтил-метакрилат) или поливиниловый спирт), полилактиды (US 3773919), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата, неразлагаемый этилен-винилацетат, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и из ацетата лейпролида) и поли-D-(-)-3-гидроксимасляная кислота.
Фармацевтические композиции включают композиции, подходящие для способов введения, подробно изложенных в данном описании. Может быть удобным представление композиций в стандартной лекарственной форме, и они могут быть изготовлены любым из способов, хорошо известных в фармацевтики. Методы и композиции обычно можно найти в Remington's Pharmaceutical Sciences, 18th Ed. (1995), Mack Publishing Co., Easton, PA. Такие способы включают стадию приведения активного ингредиента в ассоциацию с носителем, который состоит из одного или более дополнительных ингредиентов. В общем случае композиции изготавливают путем непрерывного и равномерного приведения активного ингредиента в ассоциацию с жидкими носителями или тонкоизмельченными твердыми носителями или ими обоими и затем, при необходимости, придания формы продукту.
Композиции на основе GDC-0032 и/или химиотерапевтического агента, подходящие для перорального введения, могут быть изготовлены в виде дискретных единиц, таких как пилюли, твердые или мягкие, например желатиновые капсулы, облатки, лепешки, пастилки для рассасывания, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, сиропы или эликсиры, каждая из которых содержит предварительно определенное количество GDC-0032 и/или химиотерапевтического агента. Такие количества GDC-0032 и химиотерапевтического агента при изготовлении могут быть введены в состав пилюли, капсулы, раствора или суспензии в виде объединенной композиции. Альтернативно, GDC-0032 и химиотерапевтический агент при изготовлении могут быть введены в состав пилюли, капсулы, раствора или суспензии по отдельности для введения путем чередования.
Композиции могут быть изготовлены в соответствии с любым способом, известным в области изготовления фармацевтических композиций, и такие композиции могут содержать один или более агентов, включая подсластители, корригенты, красители и консерванты, с целью придания препарату приятного вкуса. Прессованные таблетки могут быть изготовлены в подходящей машине путем прессования активного ингредиента в свободно текучей форме, такой как порошок или гранулы, возможно в смеси со связующим веществом, смазывающим веществом, инертным разбавителем, консервантом, поверхностно-активным или диспергирующим агентом. Формованные таблетки могут быть изготовлены в подходящей машине путем формования смеси порошкообразного активного ингредиента, увлажненного инертным жидким разбавителем. Возможно, что таблетки могут иметь покрытие или риску и возможно могут быть изготовлены таким образом, чтобы обеспечить медленное или регулируемое высвобождение из нее активного ингредиента.
Эксципиенты для таблеточной фармацевтической композиции по изобретению могут включать: наполнитель (или разбавитель) для увеличения общего объема порошкового лекарственного средства, из которого изготавливается таблетка; разрыхлители для способствования распаданию таблетки на небольшие фрагменты, в идеале на отдельные лекарственные частицы, при ее проглатывании и для стимулирования быстрого растворения и всасывания лекарственного средства; связующее вещество для обеспечения возможности образования гранул и таблеток с необходимой механической прочностью и сохранения целостности таблетки после ее прессования, предотвращающее таблетки от распадания на составляющие их порошки в процессе упаковывания, транспортировки и традиционного манипулирования; глидант для улучшения сыпучести порошка, составляющего таблетку, в процессе изготовления; смазывающее вещество для обеспечения того, чтобы в процессе изготовления таблетируемый порошок не прилипал к оборудованию, используемому для прессования таблетки (все они улучшают сыпучесть порошковых смесей при прохождении через прессы и минимизируют истирание и разламывание при извлечении готовых таблеток из оборудования); антиагезивное вещество с функцией, аналогичной глиданту, уменьшающее в процессе изготовления прилипание порошка, составляющего таблетку, к машине, используемой для штампования формы таблетки; корригент, включаемый в таблетки для придания им более приятного вкуса или для маскировки неприятного вкуса; и краситель для облегчения идентификации и соблюдения больным режима и схемы лечения.
Приемлемыми являются таблетки, содержащие активный ингредиент в смеси с нетоксичным фармацевтически приемлемым эксципиентом, подходящим для изготовления таблеток. Этими эксципиентами могут быть, например, инертные разбавители, такие как карбонат кальция или натрия, лактоза, фосфат кальция или натрия; гранулирующие и разрыхляющие агенты, такие как кукурузный крахмал или альгиновая кислота; связующие вещества, такие как крахмал, желатин или аравийская камедь; и смазывающие вещества, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут не иметь покрытия или могут быть покрыты с использованием известных методов, включая микроинкапсулирование, для задержки распадаемости и всасывания в желудочно-кишечном тракте и тем самым для обеспечения непрерывного действия в течение более длительного периода времени. Например, можно использовать такое вещество-замедлитель, как глицерилмоностеарат или глицерилдистеарат, сами по себе или вместе с воском. Для лечения глазных или других внешних тканей, например, полости рта и кожи, предпочтительно применяют композиции в виде мази или крема для местного применения, содержащие активный(е) ингредиент(ы) в количестве, например, 0,075-20% масс/масс. При изготовлении композиции в виде мази активные ингредиенты могут быть использованы либо с парафиновой, либо со смешивающейся с водой мазевой основой. Альтернативно, на основе активных ингредиентов могут быть изготовлены композиции в виде крема с использованием основы для крема типа масло-в-воде.
При желании водная фаза основы для крема может включать многоатомный спирт, т.е., спирт, имеющий две или более чем две гидроксильные группы, такой как пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин и полиэтиленгликоль (включая ПЭГ400) и их смеси. Композиции для местного применения при желании могут включать соединение, которое усиливает всасывание или проникновение активного ингредиента через кожу или другие зоны воздействия. Примеры таких усилителей проникновения через кожу включают диметилсульфоксид и родственные аналоги.
Масляная фаза эмульсий по данному изобретению может быть составлена из известных ингредиентов известным образом, включая смесь по меньшей мере одного эмульгатора с жиром или маслом либо и с жиром, и с маслом обоими. Предпочтительно, гидрофильный эмульгатор включают вместе с липофильный эмульгатором, который действует как стабилизатор. Эмульгатор(ы) совместно со стабилизатором(ами) или без него(них) образуют эмульгирующий воск, и этот воск вместе с маслом и жиром составляет эмульгирующую мазевую основу, которая образует масляную дисперсионную фазу композиций в форме крема. Эмульгаторы и стабилизаторы эмульсий, подходящие для использования в композиции по изобретению, включают Tween® 60, Span® 80, цетостеариловый спирт, бензиловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия.
Водные суспензии фармацевтических композиций по изобретению содержат активные вещества в смеси с эксципиентами, подходящими для изготовления водных суспензий. Такие эксципиенты включают суспендирующий агент, такой как карбоксиметилцеллюлозы натриевая соль, кроскармелоза, повидон, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь, и диспергирующие или увлажняющие агенты, такие как природный фосфатид (например, лецитин), продукт конденсации алкиленоксида с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида с длинноцепочечным алифатическим спиртом (например, гептадекаэтиленокси-цетанол), продукт конденсации этиленоксида с неполным сложным эфиром, являющимся производным жирной кислоты и ангидрида гексита (например, полиоксиэтиленсорбитан-моноолеат). Водная суспензия также может содержать один или более консервантов, таких как этил- или н-пропил-п-гидроксибензоат, один или более красителей, один или более корригентов и один или более подсластителей, таких как сахароза или сахарин.
Фармацевтические композиции могут быть в форме стерильного препарата для инъекций, такого как стерильная водная или масляная суспензия для инъекций. Эта суспензия может быть изготовлена согласно известным в данной области техники способам с использованием таких подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов, которые упомянуты выше. Стерильный препарат для инъекций может представлять собой раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, как например, раствор в 1,3-бутандиоле, или может быть изготовлен из лиофилизированного порошка. Среди приемлемых разбавителей и растворителей, которые могут быть использованы, находятся вода, раствор Рингера и изотонический раствор хлорида натрия; Помимо этого, в качестве растворителя или суспендирующей среды традиционно можно использовать стерильные нелетучие масла. Для этой цели может быть использовано любое маловязкое нелетучее масло, включая синтетические моно- или диглицериды. В дополнение к этому, в изготовлении инъекционных средств таким же образом могут быть использованы жирные кислоты, такие как олеиновая кислота.
Количество активного ингредиента, которое можно комбинировать с веществом-носителем для изготовления разовой лекарственной формы, будет варьировать в зависимости от подвергаемого лечению реципиента и конкретного способа введения. Например, композиция с замедленным высвобождением, предназначенная для перорального введения людям, может содержать приблизительно 1-1000 мг активного вещества в смеси с соответствующим и удобным количеством вещества-носителя, которое может варьировать от примерно 5 до примерно 95% от массы всей композиции (масса:масса). Фармацевтическая композиция может быть изготовлена таким образом, чтобы беспрепятственно обеспечить введение измеряемого количества. Например, водный раствор, предназначенный для внутривенной инфузии, может содержать примерно 3-500 мкг активного ингредиента на один миллилитр раствора с тем, чтобы можно было осуществлять инфузию подходящего объема со скоростью примерно 30 мл/ч.
Композиции, подходящие для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатики и растворенные вещества, делающие композицию изотоничной крови предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать в себя суспендирующие агенты и загустители.
Композиции, подходящие для местного введения в глаз, также включают глазные капли, где активный ингредиент растворен или суспендирован в подходящем носителе, в частности в водном растворителе для активного ингредиента. Активный ингредиент предпочтительно присутствует в таких композициях в концентрации примерно 0,5-20% масс/масс, например примерно 0,5-10% масс/масс, например примерно 1,5% масс/масс.
Композиции, подходящие для местного введения в ротовую полость, включают пастилки для рассасывания, содержащие активный ингредиент в корригентной основе, обычно сахарозе и аравийской камеди или трагаканте; пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь; и жидкости для полоскания рта, содержащие активный ингредиент в подходящем жидком носителе.
Композиции для ректального введения могут быть представлены в виде суппозитория с подходящей основой, содержащей, например масло какао или салицилат.
Композиции, подходящие для внутрилегочного или назального введения, имеют размер частиц, например, в диапазоне от 0,1 до 500 микрон (в том числе размеры частиц в диапазоне от 0,1 до 500 микрон с таким шагом, как 0,5, 1, 30 микрон, 35 микрон и т.д.), которые вводят посредством быстрой ингаляции через носовой проход или посредством ингаляции через рот, чтобы достичь альвеолярных мешочков. Подходящие композиции включают водные или масляные растворы активного ингредиента. Композиции, подходящие для введения аэрозоля или сухого порошка, могут быть изготовлены традиционными способами и могут быть доставлены вместе с другими терапевтическими агентами, такими как соединения, используемые до сих пор в лечении или профилактике расстройств, которые описаны ниже.
Композиции, подходящие для вагинального введения, могут быть представлены в виде композиций в форме пессариев, тампонов, кремов, гелей, паст, пенок или спрея, содержащих помимо активного ингредиента такие носители, целесообразность использования которых в данной области техники известна.
Композиции могут быть упакованы в контейнеры для однократного приема или для многократного приема, например, герметично закрытые ампулы и флаконы, и их можно хранить в высушенном сублимационной сушкой (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например воды, для инъекций непосредственно перед применением. Экстемпоральные растворы и суспензии для инъекций готовят из стерильных порошков, гранул и таблеток описанного ранее вида. Предпочтительными стандартными дозированными лекарственными формами являются такие, которые содержат суточную дозу или стандартную суточную субдозу активного ингредиента, как приведено в данном описании выше, или соответствующую ее долю.
Согласно изобретению также предложены ветеринарные композиции, содержащие по меньшей мере один активный ингредиент, который определен выше, вместе с приемлемым в ветеринарии носителем, соответственно. Приемлемыми в ветеринарии носителями являются вещества, полезные для введения композиции, и они могут быть твердыми, жидкими или газообразными веществами, которые в других отношениях инертны или приемлемы в области ветеринарии и совместимы с активным ингредиентом. Эти ветеринарные композиции могут быть введены парентерально, перорально или любым другим желаемым способом.
КОМБИНИРОВАННАЯ ТЕРАПИЯ
GDC-0032 может быть применен в комбинации с некоторыми химиотерапевтическими агентами для лечения гиперпролиферативного расстройства, включая солидную опухоль или гематопоэтическую злокачественную опухоль наряду с предраковыми и не являющимися неопластическими или раковыми гиперпролиферативными расстройствами. В некоторых воплощениях GDC-0032 объединяют с химиотерапевтическим агентом в единой композиции в виде единой таблетки, пилюли, капсулы или единого раствора для одновременного введения комбинации. В других воплощениях GDC-0032 и химиотерапевтический агент вводят в соответствии с режимом введения или курсом терапии в отдельных композициях в виде отдельных таблеток, пилюль, капсул или растворов для последовательного введения GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола. Такой химиотерапевтический агент обладает антигиперпролиферативными свойствами или полезен для лечения гиперпролиферативного расстройства. Комбинация GDC-0032 и химиотерапевтического агента может обладать синергетическими свойствами. Химиотерапевтический агент в такой фармацевтической комбинированной композиции или режиме введения предпочтительно обладает активностью, дополняющей активность GDC-0032, и такой, что они не оказывают неблагоприятного влияния друг на друга. Такие соединения, присутствующие в терапевтической комбинации, можно вводить в количествах, эффективных для намеченной цели. В одном из воплощений фармацевтическая композиция по данному изобретению содержит GDC-0032 и химиотерапевтический агент, как например, изложенный в данном описании. В другом воплощении терапевтическую комбинацию вводят согласно режиму введения, при котором терапевтически эффективное количество GDC-0032 вводят в диапазоне от двух раз в сутки до одного раза каждые три недели (q3wk), а терапевтически эффективное количество химиотерапевтического агента вводят отдельно, в свою очередь, в диапазоне от двух раз в сутки до одного раза каждые три недели.
Терапевтические комбинации по изобретению включают в себя GDC-0032 и химиотерапевтический агент, выбранный из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, для раздельного, одновременного или последовательного применения при лечении гиперпролиферативного расстройства.
Введение при комбинированной терапии может быть осуществлено по одновременной или последовательной схеме. В случае последовательного введения комбинация может быть введена за два или более чем два раза.
Комбинированное введение включает совместное введение, при котором используются отдельные композиции или единая фармацевтическая композиция, и последовательное введение в любом порядке, при котором, предпочтительно, есть период времени, когда оба активных агента (или все активные агенты) одновременно проявляют свои биологические активности.
Подходящими дозировками для любого из вышеупомянутых вводимых совместно агентов являются дозировки, используемые в настоящее время, и они могут быть снижены вследствие объединенного действия (синергизма) нового идентифицированного агента и других химиотерапевтических агентов или схем лечения, например, вследствие уменьшения терапевтического индекса или ослабления токсичности или других побочных эффектов или последствий.
В конкретном воплощении противораковой терапии терапевтическая комбинация может быть объединена с хирургической терапией и лучевой терапией в качестве адъювантной терапии. Комбинированные терапии по настоящему изобретению включают введение GDC-0032 и применение по меньшей мере одного или более чем одного другого способа или тактики лечения рака. Количества GDC-0032 и химиотерапевтического(их) агента(ов) и соответственное хронометрирование введения будут выбраны с тем, чтобы достичь желаемого комбинированного терапевтического эффекта.
ВВЕДЕНИЕ ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ
Терапевтические комбинации по изобретению могут быть введены любым способом, соответствующим подвергаемому лечению состоянию. Подходящие способы включают пероральный, парентеральный (в том числе подкожный, внутримышечный, внутривенный, интраартериальный, ингаляционный, интрадермальный, интратекальный, эпидуральный и методы инфузии), трансдермальный, ректальный, назальный, местный (в том числе трансбуккальный и сублингвальный), вагинальный, внутрибрюшинный, внутрилегочный и интраназальный. Местное введение также может включать в себя использование трансдермального введения, как например, трансдермальных пластырей или устройств для ионофореза. Технология изготовления композиций лекарственных средств обсуждается в Remington's Pharmaceutical Sciences, 18th Ed., (1995) Mack Publishing Co., Easton, PA. Другие примеры лекарственных композиций можно найти в Liberman Н.A. and Lachman L, Eds., Pharmaceutical Dosage Forms, Marcel Decker, Vol.3, 2nd Ed., New York, NY. Что касается местного иммуносупрессивного лечения, то соединения можно вводить в область поражения, включая перфузию трансплантата ингибитором или иное приведение трансплантата в контакт с ингибитором перед трансплантацией. Очевидно, что предпочтительный способ может меняться, например, в зависимости от состояния реципиента. Если соединение вводят перорально, то на его основе может быть изготовлена композиция в виде пилюли, капсулы, таблетки и т.д. вместе с фармацевтически приемлемым носителем, глидантом или эксципиентом. Если соединение вводят парентерально, то на его основе может быть изготовлена композиция вместе с фармацевтически приемлемым парентеральным наполнителем или разбавителем и в стандартной инъекционной лекарственной форме, как подробно описано ниже.
Доза для лечения пациентов, являющихся людьми, может изменяться от приблизительно 1 мг до приблизительно 1000 мг GDC-0032, например от приблизительно 5 мг до приблизительно 20 мг соединения. Дозу можно вводить один раз в сутки (QD), два раза в сутки (BID) или чаще, в зависимости от фармакокинетических (pharmacokinetic; РК) и фармакодинамических (PD) свойств, включая всасывание, распределение, метаболизм и экскрецию конкретного соединения. К тому же, на дозировку и схему введения могут влиять факторы, определяющие токсичность. При пероральном введении пилюля, капсула или таблетка могут приниматься путем проглатывания два раза в сутки, один раз в сутки или с меньшей частотой, например, один раз в неделю или один раз каждые две или три недели, в течение определенного периода времени. Эта схема может быть повторена для ряда циклов терапии.
СПОСОБЫ ЛЕЧЕНИЯ
Способы по изобретению включают:
способы диагностики, основанные на идентификации биомаркера;
способы определения того, будет ли пациент отвечать на GDC-0032 или комбинацию GDC-0032 и химиотерапевтического агента;
способы оптимизации терапевтической эффективности посредством мониторинга выведения GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента;
способы оптимизации терапевтического режима введения GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента посредством мониторинга выявления мутаций, связанных с терапевтической резистентностью; и
способы идентификации того, который из пациентов получит пользу от лечения GDC-0032 или от терапии комбинацией GDC-0032 и химиотерапевтического агента, и мониторинга пациентов по их чувствительности к лечению и отвечаемости на лечение GDC-0032 или терапию комбинацией GDC-0032 и химиотерапевтического агента.
Способы по изобретению полезны для ингибирования аномального клеточного роста или лечения гиперпролиферативного расстройства, такого как рак, у млекопитающего (например, человека). Например, способы полезны для диагностики, мониторинга и лечения множественной миеломы, лимфомы, лейкозов, рака предстательной железы, рака молочной железы, гепатоклеточной карциномы, рака поджелудочной железы и/или колоректального рака у млекопитающего (например, человека).
Терапевтические комбинации: (1) GDC-0032 и (2) химиотерапевтического агента полезны для лечения заболеваний, состояний и/или расстройств, включая, но не ограничиваясь этим, таковые, характеризующиеся активацией PI3-киназного пути. Соответственно, другой аспект данного изобретения включает способы лечения заболеваний или состояний, которые могут быть подвергнуты лечению посредством ингибирования липидкиназ, включая PI3K. В одном из воплощений способ лечения солидной опухоли или гематопоэтической злокачественной опухоли включает введение млекопитающему терапевтической комбинации в виде объединенной композиции или путем чередования, при этом терапевтическая комбинация содержит терапевтически эффективное количество GDC-0032 и терапевтически эффективное количество одного или более из химиотерапевтических агентов, выбранных из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола. Терапевтические комбинации: (1) GDC-0032 и (2) химиотерапевтического агента могут быть применены для лечения гиперпролиферативного заболевания или расстройства, включая гематопоэтическую злокачественную опухоль, опухоли, раковые опухоли и неопластическую ткань, вместе с предраковыми и не являющимися неопластическими или злокачественными гиперпролиферативными расстройствами. В одном из воплощений пациента-человека лечат терапевтической комбинацией и фармацевтически приемлемым носителем, адъювантом или разбавителем, при этом GDC-0032 или его метаболит в указанной терапевтической комбинации присутствует в количестве, необходимом для детектируемого ингибирования активности Р13-киназы.
Гематопоэтические злокачественные опухоли включают неходжкинскую лимфому, диффузную крупноклеточную гематопоэтическую лимфому, фолликулярную лимфому, лимфому из клеток мантийной зоны, хронический лимфоцитарный лейкоз, множественную миелому, AML и MCL.
Согласно другому аспекту данного изобретения предложена фармацевтическая композиция или терапевтическая комбинация для применения в лечении заболеваний или состояний, изложенных в данном описании, у млекопитающего, например, человека, страдающего от такого заболевания или состояния. Также предложено применение фармацевтической композиции в изготовлении лекарственного средства для лечения заболеваний и состояний, изложенных в данном описании, у теплокровного животного, такого как млекопитающее, например, человек, страдающего от такого расстройства.
ИЗДЕЛИЯ ПРОИЗВОДСТВА
В другом воплощении изобретения предложены изделие производства или "набор", содержащие GDC-0032, полезный для лечения описанных выше заболеваний и расстройств. В одном из воплощений набор включает в себя контейнер, содержащий GDC-0032. Кроме того, набор может содержать этикетку или инструкцию по медицинскому применению препарата, находящуюся на контейнере или вместе с ним. Термин "инструкция по применению" обычно относится к инструкциям, традиционно включаемым в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, противопоказаниях и/или предупреждениях касательно применения таких терапевтических продуктов. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы, блистерную упаковку и т.д. Контейнер может быть сделан из разнообразных материалов, таких как стекло или пластик. Контейнер может включать в себя GDC-0032 или композицию на его основе, которые эффективны для лечения указанного состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой мешочек или флакон для внутривенных растворов, имеющий пробку, поддающуюся прокалыванию иглой для подкожных инъекций). По меньшей мере одним активным агентом в композиции является GDC-0032. На этикетке или в инструкции по применению указывается, что данную композицию применяют для лечения выбранного состояния, такого как рак. В одном из воплощений на этикетке или в инструкциях по применению указывается, что композицию, содержащую соединение формулы I, можно использовать для лечения расстройства, являющегося результатом аномального клеточного роста. На этикетке или в инструкции по применению также может быть указано, что данную композицию можно использовать для лечения других расстройств. Альтернативно или помимо этого изделие производства может дополнительно включать в себя второй контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать в себя другие материалы, подходящие с коммерческой точки зрения и точки зрения потребителя, в том числе другие буферы, разбавители, фильтры, иглы и шприцы.
Набор может дополнительно содержать указания относительно введения GDC-0032 и, если она присутствует, то второй фармацевтической композиции. Например, если набор включает в себя первую композицию, содержащую GDC-0032, и вторую фармацевтическую композицию, то такой набор может дополнительно содержать указания для одновременного, последовательного или раздельного введения первой и второй фармацевтических композиций нуждающемуся в этом пациенту.
В другом воплощении наборы подходят для доставки твердых пероральных форм GDC-0032, таких как таблетки или капсулы. Такой набор предпочтительно включает в себя ряд стандартных дозировок. Такие наборы могут включать в себя карточку с дозировками, расположенными в порядке их предполагаемого применения. Примером такого набора является "блистерная упаковка". Блистерные упаковки хорошо известны в упаковочной индустрии и широко используются для упаковывания фармацевтических стандартных лекарственных форм. При желании может быть придана памятка, например, в виде чисел, букв или других маркировок либо с календарем-вкладышем, где указаны дни в схеме лечения, в которые можно вводить дозировки.
Согласно одному из воплощений набор может включать в себя (а) первый контейнер с содержащимся в нем GDC-0032; и возможно (b) второй контейнер с содержащейся в нем второй фармацевтической композицией, при этом вторая фармацевтическая композиция содержит второе соединение, обладающее антигиперпролиферативной активностью. Альтернативно или помимо этого набор может дополнительно включать в себя третий контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, он может включать в себя другие материалы, подходящие с коммерческой точки зрения и точки зрения потребителя, в том числе другие буферы, разбавители, фильтры, иглы и шприцы.
Если набор содержит GDC-0032 и второй терапевтический агент, т.е. химиотерапевтический агент, то такой набор может содержать контейнер для помещения в него отдельных композиций, такой как разделенная бутылка или разделенный пакет из фольги, однако, отдельные композиции также могут содержаться в одном неразделенном контейнере. Обычно, набор содержит указания по введению отдельных компонентов. Форма набора имеет особое преимущество в тех случаях, когда отдельные компоненты предпочтительно вводят в разных лекарственных формах (например, пероральной и парентеральной), вводят с различными интервалами дозирования или в тех случаях, когда согласно предписанию врача желательно титрование индивидуальных компонентов комбинации.
ПРИМЕРЫ
Пример 1. 2-(4-(2-(1-Изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамид (GDC-0032)
Стадия 1: этил-2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропаноат
9-Бром-2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо-[f]имидазо[1,2-d][1,4]оксазепин (500 мг; 0,001 моль) и этил-2-метил-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразол-1-ил)пропаноат (594 мг; 0,0015 моль) приводили во взаимодействие в условиях катализируемого палладием сочетания по Сузуки с облучением микроволнами (uW), в присутствии Pd(dppf)Cl2 и Cs2CO3, воды и диметоксиэтана (DME), получая этил-2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропаноат вместе с соответствующей кислотой. LC/MS (ESI+) (жидкостная хроматография/масс-спектрометрия (electrospray ionization - электрораспылительная ионизация в режиме положительных ионов)): m/z 490 (М+Н).
Стадия 2: 2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропановая кислота

Этил-2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидро-бензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропаноат (250 мг; 0,5 ммоль) обрабатывали 1 М гидроксидом лития в воде (2 мл) и метаноле (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Подкисляли 10%-ной водной лимонной кислотой до рН 5 и дважды экстрагировали EtOAc. Объединенные органические слои промывали рассолом, сушили и концентрировали. Полученную 2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[т]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропановую кислоту использовали в том виде, как она есть, без каких-либо дополнительных стадий очистки. LC/MS (ESI+): m/z 462 (М+Н).1Н ЯМР (500 МГц, DMSO) δ 8.44 (s, 1Н), 8.36 (d, J=8,4 Гц, 1Н), 7.97 (s, 1Н), 7.86 (s, 1Н), 7.44 (dd, J=8,4; 1,7 Гц, 1Н), 7.35 (d, J=1,7 Гц, 1Н), 5.82 (dt, J=13,1; 6,6 Гц, 1Н), 4.52 (s, 4Н), 2.25 (s, 3Н), 1.78 (s, 6Н), 1.45 (t, J=13,9 Гц, 6Н).
Стадия 3: 2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропановую кислоту (90 мг; 0,2 ммоль) растворяли в DMF (диметилформамид; 2 мл) и обрабатывали NH4Cl (40 мг; 0,8 ммоль), DIPEA (диизопропилэтиламин; 0,3 мл; 2 ммоль), затем N,N,N',N'-тетраметил-O-(7-азабензотриазол-1-ил)урония гексафторфосфатом (HATU, 100 мг; 0,4 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли насыщенный бикарбонат натрия и смесь экстрагировали EtOAc. Объединенные органические экстракты сушили над сульфатом натрия и концентрировали. Неочищенный продукт очищали смесью 10% МеОН/EtOAc, затем растиранием с минимальным количеством EtOAc, получая 74 мг (выход 82%) 2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамида (GDC-0032, регистрационный № в CAS 1282512-48-4). LC/MS (ESI+): m/z 463(М+Н).1Н ЯМР (500 МГц, DMSO) δ 8.44-8.26 (m, 2Н), 8.01 (s, 1Н), 7.86 (s, 1Н), 7.44 (dd, J=8,4; 1,8 Гц, 1Н), 7.35 (d, J=1,7 Гц, 1Н), 7.15 (s, 1Н), 6.79 (s, 1Н), 5.82 (dt, J=13,3; 6,6 Гц, 1Н), 4.52 (s, 4Н), 2.25 (s, 3Н), 1.75 (s, 6Н), 1.47 (d, J=6,6 Гц, 6Н).
Пример 2. Анализ связывания р110α (альфа) PI3K
Анализы связывания: начальные эксперименты по поляризации проводили на Analyst НТ 96-384 (Molecular Devices Corp, Sunnyvale, CA). Образцы для измерения аффинности методом поляризации флуоресценции готовили, добавляя р110-альфа PI3K (Upstate Cell Signaling Solutions, Charlottesville, VA) в серийных разведениях 1:3, начиная с концентрации 20 мкг/мл, в буфере для измерения поляризации (10 мМ Трис, рН 7,5; 50 мМ NaCl; 4 мМ MgCl2; 0,05% CHAPS (3-[(3-холамидопропил)-диметиламмонио]-1-пропан-сульфонат) и 1 мМ DTT (дитиотреит)), к PIP2 (Echelon-lnc, Salt Lake City, UT.) в конечной концентрации 10 мМ. После инкубации в течение 30 минут при комнатной температуре реакции останавливали, добавляя GRP-1 (general receptor of phosphoinositides - основной рецептор фосфоинозитидов) и зонд PIP3-TAMRA (Echelon-lnc, Salt Lake City, UT) в конечных концентрациях 100 нМ и 5 нМ, соответственно. Измерения проводили, используя стандартные фильтры с ограниченной полосой пропускания для флуорофора родамина (λвозб.=530 нМ; λисп.=590 нМ) в 384-луночных черных планшетах на малые объемы Proxiplates® (PerkinElmer, Wellesley, MA). Строили график зависимости величин поляризации флуоресценции от концентрации белка. Значения EC50 получали путем аппроксимации данных к четырехпараметрическому уравнению с использованием программного обеспечения KaleidaGraph® (программное обеспечение для анализа синергетического действия (synergy software), Reading, РА). В этом эксперименте также устанавливают концентрацию белка, подходящую для использования в последующих экспериментах по конкуренции с ингибиторами.
Величины IC50 для ингибиторов определяли, добавляя р110-альфа PI3K (конечная концентрация 0,04 мг/мл) вместе с PIP2 (конечная концентрация 10 мМ) в лунки, содержащие серийные разведения (1:3) антагонистов в растворе АТФ в конечной концентрации 25 мМ (Cell Signaling Technology, Inc., Danvers, MA) в буфере для измерения поляризации. После инкубации в течение 30 минут при комнатной температуре реакции останавливали, добавляя GRP-1 и зонд PIP3-TAMRA (Echelon-lnc., Salt Lake City, UT) в конечной концентрации 100 нМ и 5 нМ, соответственно. Измерения проводили, используя стандартные фильтры с ограниченной полосой пропускания для флуорофора родамина (λвозб.=530 нМ; λисп.=590 нМ) в 384-луночных черных планшетах на малые объемы Proxiplates® (PerkinElmer, Wellesley, MA). Строили график зависимости величин поляризации флуоресценции от концентрации антагонистов и путем аппроксимации данных к четырехпараметрическому уравнению с использованием программного обеспечения Assay Explorer (MDL, San Ramon, CA) получали значения IC50.
Альтернативно, ингибирование PI3K определяли в радиометрическом анализе с использованием очищенного рекомбинантного фермента и АТФ в концентрации 1 мкМ (микромолярной). Выполняли серийные разведения соединения в 100%-ном DMSO. Реакционную смесь с киназой инкубировали в течение 1 ч при комнатной температуре и реакцию останавливали, добавляя PBS (забуференный фосфатом физиологический раствор). Затем определяли значения IC50, используя аппроксимацию зависимости доза-ответ к сигмоидальной кривой (с вариабельным наклоном).
Пример 3; Анализ клеточной пролиферации in vitro
Эффективность GDC-0032 и химиотерапевтических соединений измеряли в анализе клеточной пролиферации, применяя следующий далее протокол (Mendoza et al. (2002) Cancer Res., 62: 5485-5488).
Люминесцентный анализ жизнеспособности клеток CellTiter-Glo® представляет собой гомогенный метод определения числа жизнеспособных клеток в культуре на основании количественного определения присутствующего АТФ, индикатора наличия метаболически активных клеток. Анализ CellTiter-Glo® разработан для применения в форматах многолуночных планшетов, что делает его идеальным для автоматизированного высокопроизводительного скрининга (HTS), анализов клеточной пролиферации и цитотоксичности. Процедура данного гомогенного анализа включает добавление единственного реагента (реагента CellTiter-Glo®) непосредственно к клеткам, культивируемым в дополненной сывороткой среде. Стадий промывки клеток, удаления среды и многократного пипетирования не требуется. Люминесцентный анализ жизнеспособности клеток Cell Titer-Glo®, включая реагенты и протокол, имеются в продаже (Promega Corp., Madison, WI, Технический бюллетень ТВ288).
В данном анализе оценивается способность соединений проникать в клетки и ингибировать клеточную пролиферацию. Принцип анализа основан на определении числа присутствующих жизнеспособных клеток посредством количественного определения присутствующего АТФ в гомогенном анализе, в котором добавление реагента Cell-Titer Glo® приводит к лизису клеток и генерации сигнала люминесценции в результате люциферазной реакции. Сигнал люминесценции пропорционален количеству присутствующего АТФ.
Методика
1-е сутки - посев в планшеты для клеток (cell plates) (384-луночные черные микропланшеты для тканевых культур (tissue culture (ТС)) с прозрачным дном и крышкой от Falcon, №353962): собрать клетки, провести посев клеток из расчета 1000 клеток в 54 мкл на одну лунку 384-луночных планшетов для клеток для проведения анализа через 3 суток. Среда для культивирования клеток: RPMI (Roswell Park Memorial Institute) или DMEM (Dulbecco's modified Eagle's medium -модифицированная Дульбекко среда Игла) с высоким содержанием глюкозы, 10% фетальной телячьей сыворотки, 2 мМ L-глутамином, P/S (пенициллин/стрептомицин). Инкубировать в течение ночи (О/N) при 37°C, 5% CO2.
2-е сутки - добавить к клеткам лекарственное средство в виде разведения соединений в планшетах для DMSO (DMSO plates) (серийные разведения 1:2 для 9 точек), а именно: во 2-ю колонку 96-луночного планшета добавить по 20 мкл соединения в концентрации 10 мМ. В этом планшете выполнить серийные разведения 1:2 по горизонтали (10 мкл+20 мкл 100%-ного DMSO) в общей сложности для 9 точек, используя Precision. В планшеты для сред (media plates) 96-луночные полипропиленовые планшеты с коническим дном от Nunc (№ по кат.249946) (для получения разведения 1:50) добавить по 147 мкл среды во все лунки. Перенести по 3 мкл смеси DMSO+соединение из каждой лунки планшета для DMSO в каждую соответствующую лунку на планшете для сред, используя Rapidplate® (Caliper, Perkin-Elmer Co.). Для исследований комбинации 2-х лекарственных средств перенести одно лекарственное средство в виде 1,5 мкл смеси DMSO+соединение из каждой лунки планшета для DMSO в каждую соответствующую лунку планшета для сред, используя Rapidplate. Затем перенести другое лекарственное средство (1,5 мкл) в планшет для сред.
Добавление лекарственного средства к клеткам в планшете для клеток (разведение 1:10): добавить по 6 мкл смеси среды+соединение непосредственно к клеткам (клетки уже находятся в 54 мкл среды). Инкубировать в течение 3 суток при 37°C , 5% CO2 в инкубаторе, который не следует часто открывать.
5-е сутки - окраска планшетов: разморозить буфер Cell Titer-Glo® при комнатной температуре. Извлечь планшеты для клеток с 37°C и уравновесить до комнатной температуры в течение примерно 30 минут. Добавить буфер Cell Titer-Glo® к субстрату Cell Titer-Glo® (бутылка к бутылке). Добавить по 30 мкл реагента Cell Titer-Glo® (Promega, № по кат.G7572) в каждую лунку с клетками. Поместить на планшетный шейкер примерно на 30 минут. Снять показания люминесценции, используя планшетный ридер Analyst НТ (полсекунды на лунку).
Анализы жизнеспособности клеток и анализы действия комбинаций: клетки высевали в количестве 1000-2000 клеток/лунка в 384-луночные планшеты на 16 ч. На вторые сутки готовили по девять серийных 1:2 разведений соединений в DMSO в 96-луночном планшете. Дальнейшие разведения соединений выполняли в ростовой среде, используя Rapidplate® (Zymark Corp., Hopkinton, MA). Разведенные соединения затем добавляли в четырех повторах в лунки 384-луночных планшетов для клеток и инкубировали при 37°C и 5% CO2. Через 4 суток измеряли относительные количества жизнеспособных клеток по люминесценции, используя Cell Titer-Glo® (Promega) в соответствии с инструкциями производителя, и снимали показания на Wallac Multilabel Reader® (PerkinElmer, Foster City). Значения EC50 рассчитывали, используя программное обеспечение Prism® 4.0 (GraphPad, San Diego). Лекарственные средства при проведении анализов действия комбинаций вводили, начиная от концентраций 4Х EC50. В случаях, где значение EC50 лекарственного средства превышало 2,5 мкМ, самая высокая использованная концентрация составляла 10 мкМ. Во всех анализах GDC-0032 и химиотерапевтические агенты добавляли одновременно или по отдельности с интервалом 4 часа (одно перед другим). Дополнительный типичный анализ клеточной пролиферации in vitro включает следующие стадии.
1. Аликвоту клеточной культуры объемом 100 мкл, содержащую примерно 104 клеток (см. Таблицу 3 для клеточных линий и типа опухолей) в среде, помещали в каждую лунку 384-луночного планшета с непрозрачными стенками.
2. Готовили контрольные лунки, содержащие среду и не содержащие клеток.
3. В экспериментальные лунки добавляли соединение и инкубировали в течение 3-5 суток.
4. Планшеты уравновешивали до комнатной температуры в течение приблизительно 30 минут.
5. В каждую лунку добавляли реагент CellTiter-Glo® в объеме, равном объему присутствующей среды для культивирования клеток.
6. Содержимое перемешивали в течение 2 минут на орбитальном шейкере, чтобы индуцировать лизис клеток.
7. Планшеты инкубировали при комнатной температуре в течение 10 минут для стабилизации сигнала люминесценции.
8. Сигналы люминесценции регистрировали и отображали на графиках в виде относительных единиц люминесценции (RLU).
9. Анализ выполняли с использованием метода Chou и Talalay для комбинации и анализа зависимости эффекта от дозы с применением программного обеспечения CalcuSyn (Biosoft, Cambridge, UK) с целью получения показателя для комбинации.
Альтернативно, клетки рассевали при оптимальной плотности в 96-луночный планшет и инкубировали в течение 4 суток в присутствии тестируемого соединения. Затем в среду для анализа добавляли Alamar Blue™ и клетки инкубировали в течение 6 ч, после чего снимали показания при возбуждении при 544 нм, испускании при 590 нм. Значения EC50 расчитывали, используя аппроксимацию сигмоидальных кривых доза-ответ.
Альтернативно, пролиферацию/жизнеспособность анализировали через 48 ч обработки лекарственным средством, используя реагент Cell Titer-Glo® (Promega Inc., Madison, WI). Обработку DMSO во всех анализах жизнеспособности использовали в качестве контроля. Значения IC50 рассчитывали, используя программное обеспечение XLfit (IDBS, Alameda, СА). Клеточные линии получали или от Американской коллекции типовых культур (АТСС, Manassas, VA), или DSMZ (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH - Немецкая коллекция микроорганизмов и клеточных культур, Braunschweig, DE). Клетки культивировали в среде RPMI 1640, дополненной 10% фетальной телячьей сыворотки, пенициллином (100 единиц/мл), 2 мМ L-глутамином и стрептомицином (100 мкг/мл) (Life Technology, Grand Island, NY), при 37°C в атмосфере 5% CO2.
Пример 4. Эффективность in vivo в отношении опухолевых ксенотрансплантатов мышей
Мыши: самки мышей с тяжелым комбинированным иммунодефицитом (Fox Chase SCID®, С. В-17/IcrHsd, Harlan) или бестимусных мышей (Taconic Farms, Harlan) на 0-е сутки исследования находились в возрасте 8-9 недель и имели массу тела (body weight; BW) в диапазоне от 15,1 до 21,4 грамма. Животные получали без ограничения воду (обратный осмос, 1 млн-1 Cl) и модифицированный и облученный корм NIH (National Institutes of Health -Национальный институт здравоохранения (США)) 31 Lab Diet®, содержащий 18,0% общего белка, 5,0% общего жира и 5,0% сырой клетчатки. Мышей содержали на облученных подстилках для лабораторных животных ALPHA-Dri® bed-o'cobs® в статических микроизоляторах в условиях 12-часового светового цикла при 21-22°C (70-72°F) и 40-60%-ной влажности. PRC точно соответствует рекомендациям Руководства по содержанию и использованию лабораторных животных в отношении ограничения, условий содержания, хирургических процедур, регулирования питания и приема жидкости и ветеринарного обслуживания. Программа PRC по содержанию и использованию аккредитована Международной ассоциацией по аттестации и аккредитации (условий) содержания лабораторных животных (Association for Assessment and Accreditation of Laboratory Animal Care; AAALAC International), которая обеспечивает соблюдение принятых стандартов по содержанию и использованию лабораторных животных.
Имплантация опухолей: образование ксенотрансплантатов инициировали, используя раковые клетки. Клетки культивировали в среде RPMI 1640, дополненной 10% фетальной телячьей сыворотки, 2 мМ глутамином, пенициллином (100 единиц/мл), стрептомицинсульфатом (100 мкг/мл) и гентамицином (25 мкг/мл). Клетки собирали во время экспоненциальной фазы роста и ресуспендировали в забуференном фосфатом физиологическом растворе (PBS) в концентрации 5×106 или 10×106 клеток/мл в зависимости от времени удвоения клеточной линии. Опухолевые клетки имплантировали подкожно в правый бок и проводили мониторинг опухолевого роста по мере приближения среднего размера к целевому диапазону от 100 до 150 мм3. На двадцать первые сутки после имплантации опухоли, обозначенные как 0-е сутки исследования, мышей сортировали на 4 группы, каждая из которых состояла из 10 мышей, с индивидуальными объемами опухолей в диапазоне 75-172 мм3 и средними объемами опухолей в группе 120-121 мм3 (см. Приложение А). Объем рассчитывали, используя формулу;
объем опухоли (мм3)=(w2×l)/2, где w обозначает ширину, а l обозначает длину опухоли в мм. Массу опухоли можно оценить в предположении, что 1 мг эквивалентен 1 мм3 объема опухоли.
Терапевтические агенты: GDC-0032 поставляли в виде сухого порошка в солевой форме, которая содержала 73% активного агента, и хранили при комнатной температуре с защитой от света. Дозы лекарственного средства готовили один раз в неделю в смеси 0,5% метилцеллюлозы:0,2% твина 80 в деионизованной воде ("разбавитель") и хранили при 4°C. При изготовлении композиции на основе доз G-033829 учитывали, что солевая форма содержит 73% активного агента. Дозы GDC-0032 готовили в каждые сутки введения, разбавляя аликвоту концентрированного раствора стерильным физиологическим раствором (0,9% NaCl). Все дозы готовили так, чтобы обеспечить доставку указанной в мг/кг дозировки в объеме 0,2 мл на 20 граммов массы тела (10 мл/кг).
Обработка: все дозы рассчитывали в соответствии с массами тел отдельных животных и вводили способом, указанным на каждой из фигур.
Ожидаемый результат: объем опухоли измеряли в 2 направлениях (по длине и ширине), используя циркули Ultra Cal IV (модель 54 10 111; Fred V. Fowler Company), как приведено ниже: объем опухоли (мм3)=(длина×ширина2)×0,5, и анализировали, используя Excel-версию 11.2 (Microsoft Corporation). Для анализа повторного измерения объемов опухолей во времени у одних и тех же животных использовали подход с моделированием линейных смешанных эффектов (linear mixed effect; LME) (Pinheiro J, et al. nlme: linear and nonlinear mixed effects models. R package version 3.1 92, 2009; Tan N, et al. Navitoclax enhances the efficacy of taxanes in non-small cell lung cancer models. Clin. Cancer Res., 2011, 17 (6): 1394-1404). Такой подход предусматривает как повторные измерения, так и незначительные количества выбывших из исследования вследствие любой не связанной с лечением гибели животных до завершения исследования. Кубическую сплайн-регрессию использовали для аппроксимации нелинейного профиля зависимости объема опухоли (в log2 координатах) от времени лечения при каждом уровне доз. Затем эти нелинейные профили относили к дозе в смешанной модели. Ингибирование роста опухоли в процентном отношении к контролю-разбавителю (% TGI) рассчитывали как процентное отношение площади под кривой (area under the curve; AUC), полученной с помощью аппроксимации, для группы, принимающей соответствующую дозу в сутки, относительно разбавителя, используя следующую формулу: % TGI=100×(1-AUCдоза/AUCразб.). При использовании этой формулы значение TGI, равное 100%, указывает на остановку роста опухоли, значение TGI больше 1%, но меньше 100% указывает на задержку опухолевого роста, а значение TGI больше 100% указывает на регрессию опухоли. Частичный ответ (partial response; PR) для животного определяли как регрессию опухоли, составляющую более 50%, но меньше 100% от начального объема опухоли. Полный ответ (complete response; CR) определяли как 100%-ную регрессию опухоли (т.е. как не поддающаяся измерению опухоль) в любой день после исследования.
Токсичность: животных взвешивали один раз в сутки в течение первых суток исследования и после этого два раза в неделю. Массы тела животных измеряли, используя весы Adventurer Pro® AV812 (Ohaus Corporation). Изменение массы в процентах рассчитывали так, как приведено ниже:
изменение массы тела (%)=[(массадругие сут-масса0-е сут)/масса0-е сут]×100.
Мышей часто наблюдали в отношении явных признаков каких-либо неблагоприятных, связанных с лечением побочных эффектов, и при наблюдении регистрировали клинические признаки токсичности. Приемлемую токсичность определяют как токсичность, приводящую к средней потере массы тела (BW) в группе, составляющей менее 20% в процессе исследования, и не более чем к одному случаю смерти в результате лечения (treatment-related (TR) death) из десяти подвергнутых лечению животных. Любой режим введения, который приводит к более высокой токсичности, считается превышающим максимальную переносимую дозу (maximum tolerated dose; MTD). Смерть классифицируется как смерть, являющаяся результатом лечения (TR), если относится к побочным эффектам лечения, что подтверждено клиническими признаками и/или результатами вскрытия, или также может быть классифицирована как TR, если наступает вследствие неизвестных причин во время периода введения или в течение 10 суток после последней дозы. Смерть классифицируется как не являющаяся результатом лечения (NTR), если нет никаких доказательств того, что смерть была связана с побочными эффектами лечения.
Хотя изложенное выше изобретение описано довольно подробно посредством иллюстрации и примеров для ясности понимания, эти описания и примеры не следует истолковывать как ограничивающие объем данного изобретения. Описания всей патентной и научной литературы, приведенной в данном описании, явным образом включены во всей своей полноте посредством ссылки.
Реферат
Группа изобретений относится к медицине и может быть использована для лечения рака. Способы, фармацевтические композиции, применения, изделие, продукт и терапевтическая комбинация по изобретению касаются лечения рака введением ингибитора фосфоинозитид-3-киназы (PI3K), GDC-0032 и химиотерапевтического агента, выбранного из фулвестранта и летрозола. Использование изобретений позволяет усилить противоопухолевую активность за счет синергетического эффекта комбинации. 13 н. и 26 з.п. ф-лы, 5 табл., 44 ил., 4 пр.
Формула



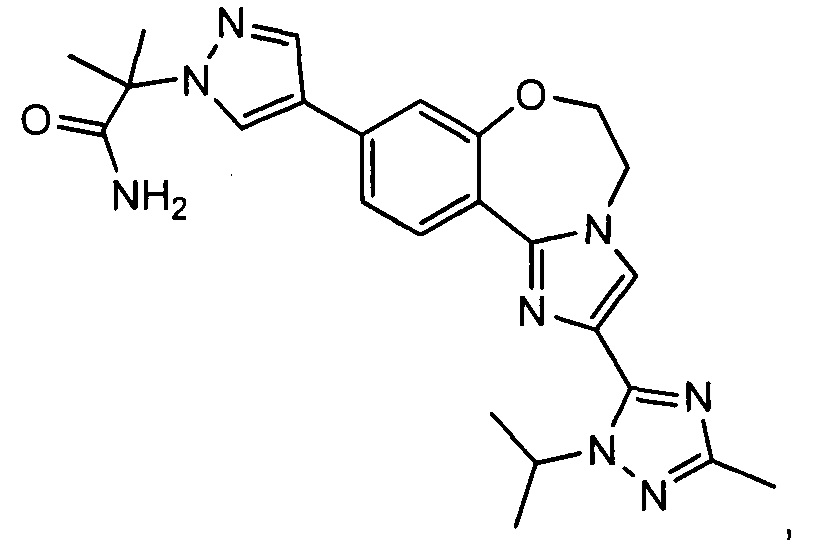


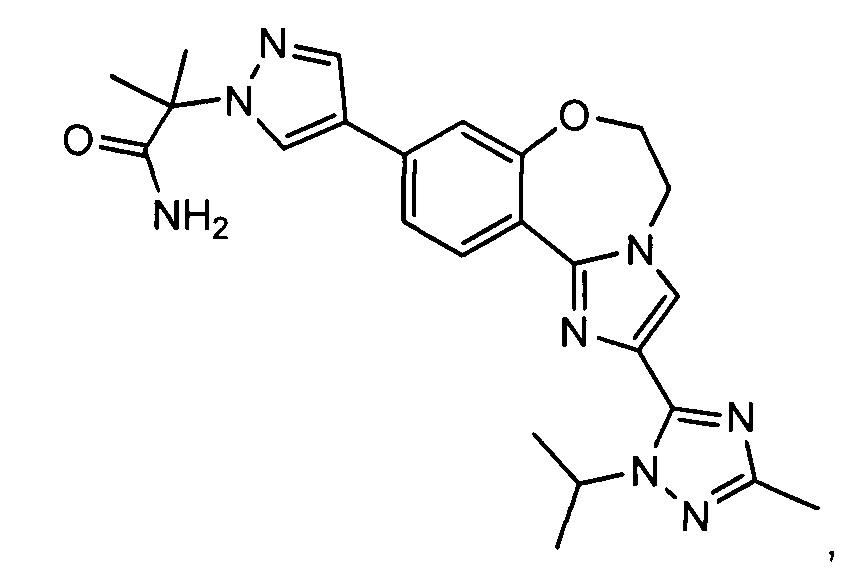

Комментарии