Конъюгат, медицинское средство и способы лечения и/или профилактики депрессии и болезни, связанной с отложением телец леви - RU2664452C2
Код документа: RU2664452C2
Чертежи






























Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к конъюгатам, содержащим нуклеиновую кислоту, специфичную к интересуемой мишени, и группу, которая обеспечивает доставку нуклеиновых кислот к определенным клеткам в пределах центральной нервной системы за счет их сродства к молекулам-переносчикам нейромедиаторов на поверхности указанных клеток.
Уровень техники
Доказано, что использование нуклеиновых кислот оказывается эффективным для изменения состояния клетки. Введение дезоксирибонуклеиновой кислоты (ДНК) или рибонуклеиновой кислоты (РНК) в клетку может быть использовано для активирования или подавления экспрессии отдельных генов в клетке и, тем самым, для оказания воздействия на одно или несколько биохимических направлений. Среди технологий на основе нуклеиновых кислот под общим термином РНК-интерференция (РНКи) обозначается процесс регулирования экспрессии генов на посттранскрипционном уровне в разнообразных организмах. Подавление экспрессии гена посредством РНКи может быть осуществлено с использованием коротких (21-23 пары азотистых оснований) фрагментов двухцепочечной РНК (дсРНК), известных под названием малая интерферирующая РНК или миРНК. При введении длинной дсРНК в клеточную линию, клеточный фермент Дайсер расщепляет ее на молекулы малой интерферирующей РНК (миРНК). Теперь малая интерферирующая РНК становится руководящей РНК. Руководящая РНК направляет индуцированный РНК комплекс сайленсинга (RISC) на гомологичную мРНК-мишень. После формирования гибридной структуры гомологичной последовательности мРНК RICS расщепляет мРНК. В результате более не продуцируется белок, кодируемый мРНК, что приводит к сайлесингу гена. РНК-интерфенерция относится к процессам последовательно-специфического сайлесинга посттранскрипционного гена у животных, опосредованным малыми интерферирующими РНК (миРНК).
Однако основным препятствием для развития способов лечения мозговых нарушений на основе РНКи является гематоэнцефалический барьер (ГЭБ). Мозг защищен от потенциально токсичных веществ за счет наличия двух защитных систем: гематоэнцефалического барьера (ГЭБ) и гематоликворный барьера (ГЛБ). Считается, что ГЭБ является основным путем сывороточных лигандов, поскольку площадь его поверхности приблизительно в 5000 раз больше площади поверхности ГЛБ. Эндотелий мозга, из которого состоит ГЭБ, является основным препятствием для использования потенциальных лекарств против многих расстройств ЦНС. Как правило, только небольшие липофильные молекулы могут проходить сквозь ГЭБ, т.е. из системы кровообращения в мозг. Многие лекарственные вещества с большим размером или более высокой гидрофобностью показывают перспективные результаты в исследованиях на животных в отношении лечения расстройств ЦНС.
Помимо прямого внутримозгового введения описаны различные способы достижения сайлесинга генов в ЦНС посредством систематически вводимых молекул интерферирующей РНК. Например, Kumar et al. (Nature, 2007, 448: 39-44) описывают конъюгаты миРНК и пептидов, полученных из гликопротеинов вируса бешенства, содержащих девятичленный полимер аргинина, и указывают на их способность подавлять экспрессию генов в мозге после внутривенной инъекции. Xia et al. (Pharmaceutical Research, 2007, 24: 2309-2316) описывают конъюгаты, содержащие биотинилированную миРНК, и конъюгат, содержащий антитело к авидин-анти-трансферинновым рецепторам, которые способны подавлять экспрессию генов в центральной нервной системе после систематического введения. В заявке WO 200979790 описываются конъюгаты, содержащие миРНК и ряд пептидов под общим названием ангиопепы, которые способны проходить через гематоэнцефалический барьер за счет опосредованного рецепторами трансцитоза с помощью ЛПНП (липопротеины низкой плотности) - подобного рецепторного белка 1 (ЛПБ-1) и которые обеспечивают доставку в ЦНС систематически вводимых конъюгатов, содержащих указанные пептиды. В WO 2007107789 описывается использование соединений, способных вызывать РНК-интерференцию и которые специфичны к мишеням, присутствующим в ЦНС, и обеспечивать их доставку в ЦНС путем интраназального введения.
Однако тогда как все такие системы обеспечивают доставку систематически вводимых миРНК в ЦНС, но не обеспечивают доставку в определенные типы клеток внутри мозга. Фактически на сегодняшний день в литературе не описаны системы доставки, которые бы обеспечивали доставку лечебных веществ в определенные типы клеток в пределах ЦНС. Возможность доставки миРНК заведомой специфичности в центральную нервную систему полезно для лечения болезней, возникающих в результате нежелательной активности/экспрессии определенного гена, в том числе депрессии, когнитивных расстройств, болезни Паркинсона, болезни Альцгеймера и т.д.
Считается, что депрессия - это болезнь центральной нервной системы. Депрессия - это биологически и генетически неоднородное расстройство с симптомами, проявляемым на психологическом, поведенческом и физиологическом уровне. Более того, депрессия характеризуется высокой степенью сопутствующих заболеваний в виде тревожных расстройств, а беспокойств само по себе (обычно, преждевременное беспокойство) - это один из наиболее преобладающих симптомов у депрессивных больных. В действительности, большинство тревожных расстройств также лечат с помощью антидепрессорных лекарств.
Первыми лекарственными веществами, использованными для лечения большого депрессивного эпизода, являлись трициклические антидепрессанты (ТЦА) имипраминового типа и ингибиторы моноаминоксидазы (ИМАО). Эти лекарственные вещества были открыты в конце 1950-х гг и показали эффективность, хотя у них и имеется ряд серьезных побочных эффектов, что привело к разработке новых лекарств, таких как селективные ингибиторы обратного захвата серотонина (СИОЗС) или селективные ингибиторы обратного захвата норадреналина и серотонина (СИОЗНС).
Открытие того, что ТЦА (а позже и СИОЗС и СИОЗНС) ингибируют обратный захват моноаминов серотонина (5-гидрокситриптамина, 5-НТ) и норадреналина (НА) в предсинаптическую клетку, повышая уровень 5-НТ в синаптической щели, что тем самым повышает их активность у постсинаптическиго рецептора, привело к выдвижению первой гипотезы об этиологии депрессии, т.е. предположения о том, что она обусловлена недостаточной активностью данных моноаминергических нейромедиаторных систем в головном мозге. С тех пор все коммерческих антидепрессорные лекарства содержат направленные серотонинергические и/или норадренергические переносчики или рецепторы.
5-НТ рецепторы расположены на клеточной мембране нервных клеток и других типах клеток в организме животного. За исключением рецептора 5-НТ3 все другие 5-НТ рецепторы представляют собой сопряженные с G-белком семисегментные трансмембранные (или гептаспиральные) рецепторы, которые активируют каскад вторичных мессенджеров. К некоторым из идентифицированных 5-НТ рецепторов относятся рецепторы 5-HT1A и 5-HT1B/1D, экспрессируемые предсинаптически на серотониновых нейронах (ауторецепторы) и на нейронах, расположенных постсинаптически на 5-НТ нервных окончаниях. 5-НТ рецептор, более непосредственно связанный с антидепрессивными эффектами СИОЗС, представлял собой 5-HT1A рецептор.
В настоящее время для новых антидепрессорных лекарств отмечены механизмы действия, основанные на относительно селективном подавлении обратного захвата норэпинефрина (ИОЗНА), как например, для ребоксетина, или двойной блокаде (ИОЗНС), как например, для венлафаксина и дулоксетина. Другие лекарства, такие как нефазодон, тразодон или миртазапин, обладают более слабым действием на переносчиков моноаминов, но блокируют моноаминергические рецепторы.
Однако несмотря на коммерческие успехи СИОЗС у этих соединений имеется два главных недостатка: 1) только 60% пациентов испытывают лечебный эффект (снижение тяжести заболевания до половины от основного уровня) и 2) эффект наступает только через несколько недель продолжительного лечения. Это связано с механизмом отрицательной обратной связи, имеющим место в предсинаптическом нейроне. Вкратце, высокие уровни серотонина в результате блокады обратного захвата серотонина приводят не только к активации постсинаптических серотониновых рецепторов, но и активируют предсинаптические ауторецепторы, которые выполняют роль датчиков обратной связи для клетки. Активация 5-HT1A ауторецептора посредством 5-НТ (также именуемого предсинаптическим 5-HT1A рецептором или предсинаптическим 5-HT1AR) или селективных агонистов подавляет возбуждение клеток и импульсно-зависимое выделение 5-НТ, тогда как 5-HT1B рецепторы регулируют синтез и выделение 5-НТ на последней стадии. Как 5-HT1A, так и 5-HT1B рецепторы также локализованы на нейронах, постсинаптических к 5-НТ нервным окончаниям, главным образом, в кортиколимбических областях. Повышение внеклеточного 5-НТ, продуцируемого при блокаде обратного захвата сертралином (SERT, один из СИОСЗ) приводит к активации предсинаптического 5-HT1A рецептора в серотонинергических нейронах ядер шва в срединном мозге, что подавляет возбуждение клеток и конечное выделение, эффект, который ослабляет повышение внеклеточного 5-НТ, продуцируемого при блокаде обратного захвата. 5-HT1B ауторецепторы вызывают схожую отрицательную обратную связь на локальном уровне. После повторного введения СИОЗС 5-HT1A рецепторы десенсибилизируются, что дает возможность серотонинергическим нейронам восстановить клеточное возбуждение и приводит к увеличению внеклеточного 5-НТ до более высокого уровня в сравнении с уровнем, наблюдающимся после однократного лечения. Эти (медленно протекающие) процессы нейрофизиологической адаптации мозговой ткани являются причиной того, почему для полного проявления антидепрессорного действия обычно необходимо несколько недель непрерывного применения СИОЗС, но и того, почему в первые дни или недели применения обычным побочным эффектом является повышенное беспокойство. Известно, что блокада данных механизмов отрицательной обратной связи антагонистами рецепторов 5-HT1A и/или 5-HT1B делает возможным повышение уровня 5-НТ, продуцируемого СИОЗС, и тем самым может способствовать ускорению клинических эффектов от СИОЗС.
Фармакологический подход по усилению антидепрессорного эффекта посредством блокирования действия предсинаптических 5-HT1A рецепторов во время введения СИОЗС был испытан с использованием (±) пиндолола. Это соединение представляет собой антагонист β1-2 адренергических рецепторов, оказывающий предполагаемое антагонистическое действие на 5-HT1A рецепторы. (±) Пиндолол вызывает несколько антагонистических действий, опосредованных активацией центральных 5-HT1A рецепторов, таких как пониженная температура тела или секреция гормонов. В общем, добавление пиндолола к СИОЗС ускоряет антидепрессорный эффект. Однако хотя в некоторых исследованиях показано, что пиндолол частично захватывает 5-HT1A рецепторы в головном мозге человека в клинических дозах, в других исследованиях указывалось на низкий уровень захвата. Кроме того, не следует забывать, что 5-HT1A рецепторы локализованы на серотонинергических нейронах, а также на нейронах, постсинаптических к сероторинергическим нейронам. В действительности, важное значение имеет отсутствие селективности этих веществ по отношению к предсинаптическим 5-HT1A рецепторам в сравнении с постсинаптическими 5-HT1A рецепторами. полная блокада постсинаптических рецепторов может свести на нет повышенную трансмиссию через 5-HT1A рецепторы переднего мозга, вызываемую антидепрессорными лекарствами.
Таким образом, несмотря на преимущества, достигнутые при разработке антидепрессантов, до сих пор имеется необходимость в альтернативных соединениях, которые бы специфично воздействовали на предсинаптические 5-HT1A рецепторы.
Болезнь Паркинсона (БП) представляет собой дегенеративное расстройства центральной нервной системы, которое часто приводит к нарушениям двигательных навыков, речи и других функций у пациента (Olanow). Симптомы болезни Паркинсона возникают в результате очень пониженной активности дофаминергических клеток в компактной зоне черного вещества мозга (SNpc) (Olanow, Dawson). Эти нейроны переносятся к полосатому телу, а их потеря приводят к изменениям активности рефлекторной дуги в базальном ядре, которое регулирует движение, а по сути, подавление прямого пути обмена и возбуждение непрямого пути. Прямой путь обмена облегчает движение, а непрямой путь подавляет движение, и поэтому потеря данных клеток приводит к гипокинетическому нарушению движений. Отсутствие дофамина приводит к повышенному ингибированию вентрального переднего ядра таламуса, который посылает возбудительные сигналы в двигательную область коры головного мозга, что приводит тем самым к гипокинезии.
БП характеризуется прогрессирующей потерей дофаминергических нейронов в SNpc и наличием внутриклеточных включений, называемых тельцами Леви (ТЛ). Нейрохимически БП характеризуется нарушением функции митохондриального комплекса I и повышенными показателями оксидативного стресса. Предложено несколько механизмов развития болезни Паркинсона, включающие оксидативный и нитрозативный стресс, митохондриальную дисфункцию, неправильное скручивание и агрегация белков, а также апоптоз. БП - это главным образом спорадическое заболевание, но показано, что некоторые случаи БП связаны с наследственностью. Первым идентифицированным геном БП, связанным с наследственностью, являлся α-синуклеин (α-син), который фактически является основным компонентом телец Леви у всех больных БП. Функция α-синуклеина недостаточна понятна. α-Синуклеин может связываться с липидами и в нейронах связывается с пресинаптическими пузырьками и цитоплазматической мембраной, возможно за счет липидных рафтов. Осажденные патологические формы α-синуклеина агрегируются и характеризуются пониженной растворимостью в сравнении с обычным белком. Описано, что три точковые мутации являются причиной наследственной БП, но также сообщалось, что дупликации и трипликации гена синуклеина-альфа (SNCA) являются причиной БП и болезни телец Леви. Поэтому даже без изменений последовательности дозирование α-синуклеина может оказаться причиной болезни телец Леви.
α-Синуклеин воздействует на митохондрию и возможно вызывает апоптоз. На самом деле имеются накопленные доказательства в пользу тесной взаимосвязи между α-синуклеином и оксидативным поражением: Сверхэкспрессия мутантного α-синуклеина делает нейроны более восприимчивыми к окислительному стрессу и поражению дофамином и ингибиторами комплекса I, что приводит к повышенному карбонилированию белков и перекисному окислению липидов in vitro и in vivo. Напротив, дисфункцию митохондриального комплекса I связывают со спорадическими формами БП. Зависимое от комплекса I оксидативное поражение и нарушенная митохондриальная функция являются основной причиной неврональной дегенерации и гибели клеток при БП. Нарушенная таким образом митохондриальная функция и образование активных форм кислорода (АФК) приводит к увеличению уровня пула цитохрома С в митохондриальном межмембранном пространстве, что дает возможность для его быстрого выделения при активации агониста гибели клеток Вах.
В итоге, сценарием при БП мог бы быть случай нейрональной митохондриальной дисфункции с повышенным образованием АФК, что с одной стороны может повышать накопление α-синуклеина, а с другой стороны активировать Вах-опосредованную гибель клеток. Кроме того, накопление α-синуклеина в свою очередь могло быть повышать продуцирование клеточных АФК и возбуждение неврональной дегенерации.
Наиболее широко используемым способом лечения БП является введение L-дигидроксифенилаланина (L-ДОФА). Однако в дофаминергические нейроны входит только 1-5% L-ДОФА. Оставшееся количество L-ДОФА в процессе обмена веществ зачастую превращается в дофамин в других местах, вызывая разнообразные побочные эффекты. Ингибиторы ДОФА декарбоксилазы, такие как карбидопа и бенсеразид, также используются для лечения БП, поскольку они способствуют предотвращению метаболизму L-ДОФА до того, как он достигнет дофаминергических нейронов, и обычно вводятся в виде составных препаратов карбидопа-леводопа и бенсеразид-леводопа. Более того, дофаминовые агонисты оказывают среднее воздействие и действуют путем стимулирования некоторых дофаминергических рецепторов. Однако, они делают дофаминергические рецепторы все менее чувствительными, что в конечном счете приводит к усилению симптомов.
Полезные могут также оказаться антисмысловые подходы; сообщалось, что они работают в головном мозге крыс и мышей. Данный подход основан на идее о том, что на самом деле α-синуклеин несуществен для функционирования ЦНС у человека, поскольку, по-видимому, он работает у мышей, но возможно, что даже самое незначительное уменьшение уровня белка может быть достаточным для уменьшения развития БП.
Однако, несмотря на успехи, достигнутые в разработке в лечении БП, до сих пор имеется необходимость в альтернативных соединениях, которые бы, в частности, могли препятствовать сниженной активности дофаминергических клеток в компактной зоне черного вещества мозга.
Системы мезокортикального и мезолимбическиого дофамина (ДА) играют решающую роль во многих нарушениях психики, включая шизофрению. Общий способ по улучшению мозговой дофаминергической нейропередачи при шизофрении был предложен на основе фармакологических данных (Seeman и Lee, 1975; Creese et al., 1976). Однако, в текущих представлениях указывается на повышенную активность субкортикальной ДА трансмиссии наряду с пониженной активностью мезокортикального ДА. Суммарная эффективность классических нейролептических средств (антагонистов ДА Д2 рецептора) в отношении лечения положительных (психотических) симптомов схожа с таковой для атипичных нейролептических средств (АНС, антагонистов, избирательных к 5-HT2A/2C рецепторам в сравнении с DA D2 рецепторам). Напротив, некоторые препараты из последней группы и, в частности, клозапин, превосходят классические нейролептики в отношении лечения отрицательных симптомов и когнитивных нарушений. Данный клинический признак относят, как минимум, отчасти, к способности повышать выделения ДА в мезокортикальном пути метоболизма, при этом данный эффект вызывает атипичиными, а не классическими нейролептиками. В действительности, префронтальная функция ДА очень важна для функций памяти и управляющей функции.
Выделение ДА в мезкортикальном и мезолимбическом путях метаболизма ДА определяется несколькими факторами. Во-первых, оно зависит от способа возбуджения (тонический/фазовый) ВТО (вентральная тегментальная область) ДА нейронов. Во-вторых, оно тесно связано с активацией соматодендритических и терминальных D2/3 ауторецепторов, которые регулируют возбуждение клеток и выделения ДА. Наконец, обратный захват, опосредованный переносчиком ДА (ДАТ), является один из ключевых механизмов, определяющих кинетику снижения концентраций внеклеточного ДА. В предыдущих исследованиях указывалось на различную плотность ДАТ в предлобной коре (ПЛК) и полосатом теле.
Более того, норадреналиновые (НА) нейриты могут содействовать удалению ДА из внеклеточного пространства головного мозга, поскольку переносчик норадреналина (HAT) проявляет схожее сродство к НА и ДА. Таким образом, ингибиторы HAT преимущественно повышают концентрацию внеклеточного ДА в средней предлобной коре (сПЛК) в сравнении с хвостатым ядром и прилежащим ядром (ПЯ). Поэтому НА нейриты из нервных клеток голубого пятна (ГП) могут участвовать в регулировании концентрации внеклеточного ДА в ПЛК либо за счет поглощения или совместного высвобождения ДА. Некоторыми исследователями было показано, что эффекты от нового комбинированного лечения на основе лекарств НА-направленных лекарств (ингибитор HAT вместе с α2-адренергическим антагонистом) селективно усиливают мезокортикальную передачу ДА.
Однако, до сих пор имеется необходимость в соединениях, способных улучшать мезокортикальную передачу ДА.
Раскрытие изобретения
Изобретатели разработали конструкции нуклеиновых кислот, которые содержат нуклеиновую кислоту, специфичную к определенному гену-мишени, и селективный ингибитор переносчика нейромедиатора. Показано, что данные конструкции особенно пригодны для доставки интересуемой нуклеиновой кислоты во внутреннюю часть клетки, экспрессирующией переносчик нейромедиатора. Не стремясь связать это с какой-либо теорией, полагают, что ингибитор переносчика нейромедиатора будет связываться с соответствующим переносчиком нейромедиатора на поверхности клетки, в которой экспрессируется переносчик, который в свою очередь перемещает комплекс нуклеиновая кислота-ингибитор во внутреннюю часть клетки. Таким образом, как показано в примере 3 настоящего изобретения введение конструкции, содержащей миРНК, специфичную к серотониновому 5-HT1A рецептору, и специфичный ингибитор переносчика серотонина (сертралин) приводит к снижению мРНК 5-HT1A рецептора и отсутствию гипотермической реакции в ответ на 8-ОН-ДПАТ (мера передачи серотонинергических сигналов), которое оказалось намного большим в сравнении с тем, что было получено при введении неконъюгированной миРНК.
Специалист в данной области техники примет во внимание, что данное изобретение не ограничено конъюгатом для доставки серотонинергических нейронов. Напротив, результаты, представленные в настоящем изобретении, показывают, что механизм, используемый нейронами для переноса нейромедиатора, является адекватным средством для содействия доставке в клетки малых молекул, связанных с молекулами, проявляющими сродство к указанному переносчику нейромедиатора.
Таким образом, в первом аспекте изобретение относится к конъюгату, содержащему:
i) по меньшей мере, один агент селективности, который специфично связывается с одним или несколькими переносчиками нейромедиатора и
ii) по меньшей мере, одну нуклеиновую кислоту, которая способна специфично связываться с молекулой-мишенью, экспрессируемой в той же самой клетке, где экспрессируется переносчик нейромедиатора.
Во втором аспекте данное изобретение относится к изобретенному конъюгату для медицинского применения.
В дополнительном аспекте данное изобретение относится к конъюгату изобретения, в котором:
(i) селективное вещество выбрано из группы, состоящей из селективного ингибитора обратного захвата серотонина (СИОЗС), и
(ii) олигонуклеотид способен специфично связываться с молекулой-мишенью, выбранной из группы мРНК, кодирующей рецептор серотонина типа 1А (5-HT1A), или мРНК, кодирующей переносчик серотонина (переносчик 5-ННТ или SERT), или мРНК, кодирующей рецептор серотонина типа 1В ((5-HT1B), или мРНК, кодирующей калиевый канал TREK-1 или калиевый канал Gir-К)
для использования при лечении и/или профилактике фиброза расстройства, связанного с депрессией.
В дополнительном аспекте данное изобретение относится к конъюгату изобретения, в котором:
(i) селективное вещество выбрано из группы, состоящей из ингибитора обратного захвата дофамина (ИОЗД) или ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), или ингибитора обратного захвата серотонина, норэпинефрина и дофамина (ИОЗСНД или тройной блокатор) и
(ii) олигонуклеотид способен специфически связываться с молекулой-мишенью, которой является мРНК, кодирующая альфа-синуклеин, для использования при лечении или профилактике болезни, связанной с нарушениями функции нейромедиаторных везикул и осаждения телец Леви.
В дополнительном аспекте данное изобретение относится к конъюгату изобретения, в котором:
(i) селективное вещество выбрано из группы, состоящей из ингибитора обратного захвата дофамина (ИОЗД) или ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), или ингибитора обратного захвата серотонина, норэпинефрина и дофамина (ИОЗСНД или тройной блокатор) и
(ii) олигонуклеотид способен специфически связываться с молекулой-мишенью, которой является мРНК, кодирующая ВАХ,
для использования при лечении или профилактике болезни, связанной апоптозом нервных клеток и гибелью клеток (болезни Паркинсона или Альцгеймера).
В дополнительном аспекте данное изобретение относится к конъюгату изобретения, в котором:
(i) селективное вещество выбрано из группы, включающей ингибитор обратного захвата норэпинефрина (ИОЗН), и
(ii) олигонуклеотид способен специфически связываться с молекулой-мишенью, которой является мРНК, кодирующая дофамин-бета-гидроксилазу, или мРНК, кодирующая переносчик норэпинефрина (НЭТ) или полипептид дофамин-бета-гидроксилазы,
для использования при лечении или профилактике болезни, связанной с недостатком дофамина в норадренергических проекциях, например, процесс запоминания или познания, сопровождающийся слабоумием, депрессией или нейродегенеративными заболеваниями.
В дополнительном аспекте данное изобретение относится к конъюгату изобретения, в котором:
(i) селективное вещество выбрано из группы, включающей ингибитор обратного захвата норэпинефрина (ИОЗН), и
(ii) олигонуклеотид способен специфически связываться с молекулой-мишенью, которой является мРНК, кодирующая переносчик норэпинефрина (НЭТ) или полипептид переносчика норэпинефрина (НЭТ),
для использования при лечении или профилактике болезни, связанной с недостатком дофамина в норадренергических проекциях, например, процесс запоминания или познания, сопровождающийся слабоумием, депрессией или нейродегенеративными заболеваниями.
В дополнительном аспекте данное изобретение относится к конъюгату изобретения, в котором:
(i) селективное вещество выбрано из группы, состоящей из ингибитора обратного захвата дофамина (ИОЗД) или ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), или ингибитора обратного захвата серотонина, норэпинефрина и дофамина (ИОЗСНД или тройной блокатор) и
(ii) олигонуклеотид способен специфически связываться с молекулой-мишенью, которой является мРНК, кодирующая Tau, для использования при лечении или профилактике болезни, связанной с нейродегенерации вследствие мутаций тау-белка, например, болезни Альцгеймера.
В дополнительном аспекте данное изобретение относится к конъюгату изобретения, в котором:
(i) селективное вещество выбрано из группы, состоящей из ингибитора обратного захвата дофамина (ИОЗД) или ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), или ингибитора обратного захвата серотонина, норэпинефрина и дофамина (ИОЗСНД или тройной блокатор) и
(ii) олигонуклеотид способен специфически связываться с молекулой-мишенью, которой является мРНК, кодирующая Хантингтон, для использования при лечении или профилактике нейродегенеративного заболевания, возникающего вследствие накопления измененной (внутригенная дупликация) экспрессии Хантингтона.
В дополнительном аспекте данное изобретение относится к конъюгату изобретения, в котором:
(i) селективное вещество выбрано из группы, включающей ингибитор обратного захвата норэпинефрина (ИОЗН), и
(ii) олигонуклеотид способен специфически связываться с молекулой-мишенью, которой является мРНК, кодирующая дофамин-бета-гидроксилазу, или мРНК, кодирующая переносчик норэпинефрина (НЭТ),
для использования при лечении или профилактике болезни, связанной с недостатком дофамина в норадренергических проекциях, например, процесс запоминания или познания, сопровождающийся слабоумием, депрессией или нейродегенеративными заболеваниями.
В другом аспекте изобретение относится к конъюгату, содержащему:
(i) по меньшей мере, один агент селективности, который специфично связывается с одним или несколькими переносчиками нейромедиатора и
(ii) контрастное вещество или маркирующего вещества.
В еще одном аспекте данное изобретение относится к конъюгату, содержащему контрастное вещество или маркирующего вещества для использования в качестве диагностического средства.
Эти и другие объекты настоящего изобретения будут дополнительно описаны в нижеследующем разделе подробного описания и не предназначены для ограничения настоящего изобретения. Если не указано что-либо иное, все технические и научные термины, используемые в данном документе, имеют значения, которые общепонятны специалисту в области техники, к которой относится данное изобретение. При осуществлении настоящего изобретения на практике можно использовать способы и материалы, схожие или эквивалентные тем, что описываются в данном документе. Предполагается, что на всем протяжении описания и формулы изобретения слово "содержать" и вариации этого слова не исключают других технических признаков, добавлений, компонентов или этапов.
Краткое описание чертежей
ФИГ.1. Отсутствие гипотермической реакции, вызванной гидробромидом (R)-(+)-8-гидрокси-2-(ди-н-пропиламино)тетралина (8-ОН-ДПАТ, селективным агонистом 5-HT1AR) у мышей, которым местно был введен 5-HT1AR-направленная миРНК (оголенной (неизолированной) или конъюгированной) в дорсальном ядре шва (ДЯШ) в качестве примера функциональной меры предсинаптической 5-HT1AR активности. Мышам вводили: i) среду, (ii) нонсенс оголенную миРНК (нс оголенную миРНК), iii) нонсенс NLF-миРНК (нс NLF-миРНК), (iv) оголенную 5-HT1AR-миРНК или (v) 5-HT1AR-NLF-миРНК (0,3 мкг/1 мл/2 дня в ДЯШ). Также оценивали дополнительную группу мышей с выключением гена 5-HT1AR. Оценивали температуру тела за 5 минут до и через 15, 30, 60 и 120 мин после введения 8-ОН-ДПАТ (1 мг/кг интраперитонеально). Показаны значения в виде среднего изменения температуры тела ± стандартная ошибка среднего у 5-7 мышей на группу. ** p<0,01 достоверное различие со средой, нс оголенной миРНК и нс NLF-миРНК, соответственно, с помощью дисперсионного анализа, в котором лечение выступало в качестве межгруппового фактора, а время в качестве внутригрупповой переменной, с последующим использованием критерия множественного сравнения Ньюмена-Кеулса
ФИГ.2. Местная инфузия 5-HT1AR-направленной-миРНК (оголенной или конъюгированной) в дорсальное ядро шва (ДЯШ) вызывала специфическое снижение уровня 5-HT1AR белка. Мышам вводили: i) среду, (ii) нонсенс оголенную миРНК (нс оголенную миРНК), iii) нонсенс NLF-миРНК (нс NLF-миРНК), (iv) оголенную 5-HT1AR-миРНК или (v) 5-HT1AR-NLF-миРНК (0,3 мкг/1 мл/2 дня в дорсальное ядро шва). Черточками показана денситометрическая количественная оценка связывания [3H]-8-ОН-ДПАТ с 5-HT1RR в дорсальном ядре шва мышей, выраженная в виде среднего значения 5-HT1AR фмоль/мг тканевого белка ± средняя ошибка среднего (два наблюдения у 3 ПЗ уровней дорсального ядра шва для каждого животного, 4-5 животных на группу). * p<0,05, ** p<0,01 достоверное различие от групп, получавших среду, нс оголенную миРНК и нс NLF-миРНК с помощью однофакторного дисперсионного анализа и последующей процедурой множественного сравнения Ньюмена-Кеулса.
ФИГ.3-5. Сайленсинг селективного 5-HT1A ауторецептора посредством интрацеребровентрикулярного (ицв) введения конъюгированной 5-HT1AR-NLF-миРНК. Фиг.3: экспрессия 5-HT1AR в ядрах шва оценивалась посредтвом гибридизации in situ. Мышам однократо вводили в тыльный 3 желудочек (D3V): i) среду, (ii) нонсенс оголенную миРНК (нс оголенную миРНК), iii) нонсенс NLF-миРНК (нс NLF-миРНК), (iv) оголенную 5-HT1AR-миРНК или (v) 5-HT1AR-NLF-миРНК (30 мкг/2,5 мл/1 день). а1-а555 изображает коронарные срезы ядра шва в мозгу мышей, связанного с33P-меченым нуклеотидом в 3 различных переднезадних (ПЗ) координатах в мм: -4,84/-4,96, -4,36/-4,60 и -4,24/-4,36 от брегмы (хвостовой-ростральной слева-направо). Масштабная метка, 2 мм. Фиг.4: Большое увеличение среза, показано в а111-а555. Масштабная метка, 500 мкм. Фиг.5: Гистограмма, на которой показано снижение уровня мРНК рецептора 5-HT1AR в дорсальном ядре шва под воздействием 5-HT1AR-NLF-миРНК. Денситометрическая оценка положительных зерен мРНК рецептора 5-HT1AR, измеренных в пленках, представлена в виде значений средней оптической плотности (ОП) в процентах ± стандартная ошибка среднего (n=4-5 мышей на группу и два-четыре наблюдения у 3 ПЗ уровней ядра шва). ** p<0,01 достоверное различие со средой, нс оголенная миРНК и оголенная 5-HT1AR-миРНК с помощью однофакторного дисперсионного анализа и последующей процедурой множественного сравнения Ньюмена-Кеулса.
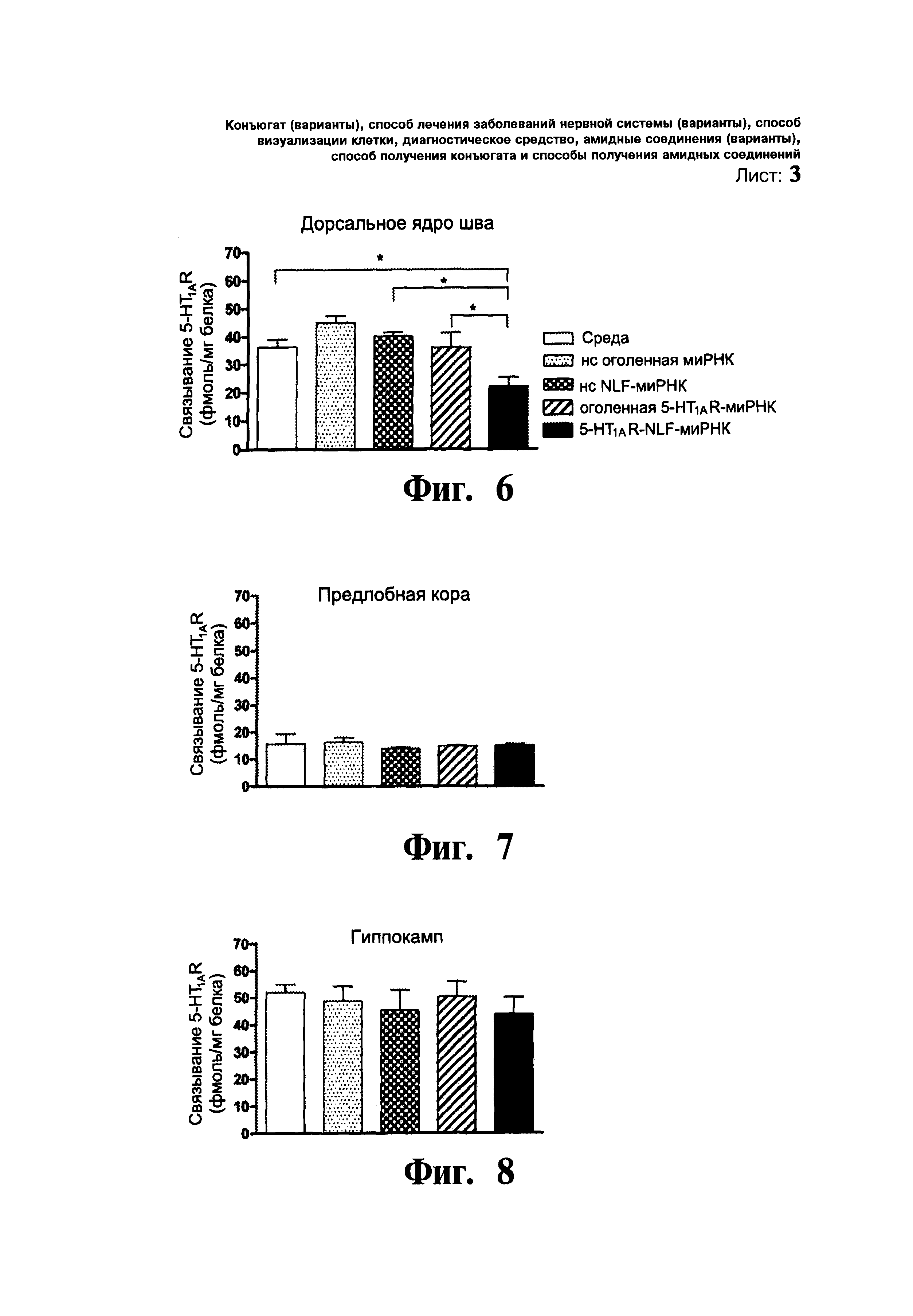
ФИГ.6-8. 5-HT1AR-NLF-миРНК вызывала специфичный нокдаун 5-HT1AR в предсинаптических, но не постсинаптических местах. Уровни белка 5-HT1AR в дорсальном ядре шва (Фиг.6), предлобной коре (Фиг.7) и гиппокампе (Фиг.8) оценивали ауторадиографическим связыванием с помощью3[Н]-8-ОН-ДПАТ. Мышам однократо вводили в тыльный 3 желудочек (D3V): i) среду, (ii) нонсенс оголенную миРНК (нс оголенную миРНК), iii) нонсенс NLF-миРНК (нс NLF-миРНК), (iv) оголенную 5-HT1AR-миРНК или (v) 5-HT1AR-NLF-миРНК (30 мкг/2,5 мл/1 день). Черточками показано среднее значение 5-HT1AR в фмоль/мг тканевого белка ± стандартная ошибка среднего (n=4-5 мышей на группу и два наблюдения у 3 ПЗ уровней ядра шва и два наблюдения у левого и правого участков предлобной коры и гиппокампа). * p<0,05 достоверное различие от всех других способов лечения, при использовании однофакторного дисперсионного анализа и последующим использованием процедуры множественного сравнения Ньюмена-Кеулса.
ФИГ.9 и 10. Уровни связывания переносчика серотонина 5-НТ (5-НТТ) и рецептора 5-HT1B (5-HT1BR) в дорсальном ядре шва не подвергались изменению при лечении 5-HT1AR-миРНК. Фиг.9: Уровни белка 5-HT1AR в дорсальном ядре шва (А) оценивали по ауторадиографическому связыванию с помощью3[H]-циталопрам. Фиг.10: Уровни белка 5-HT1AR в дорсальном ядре шва (А) оценивали по ауторадиографическому связыванию с помощью125[I]-цианопиндолола в присутствии изопреналина для блокирования β-адренегрических участков. Мышам однократо вводили в тыльный 3 желудочек (D3V): i) среду, (ii) нонсенс оголенную миРНК (нс оголенную миРНК), iii) нонсенс NLF-миРНК (нс NLF-миРНК), (iv) оголенную 5-HT1AR-миРНК или (v) 5-HT1AR-NLF-миРНК (30 мкг/2,5 мл/1 день). На гистограмме показано: А) средний уровень 5-НТТ в фмоль/мг тканевого белка ± стандартная ошибка среднего (n=4 мыши на группу и два-четыре наблюдения у 3 ПЗ уровней ядра шва).
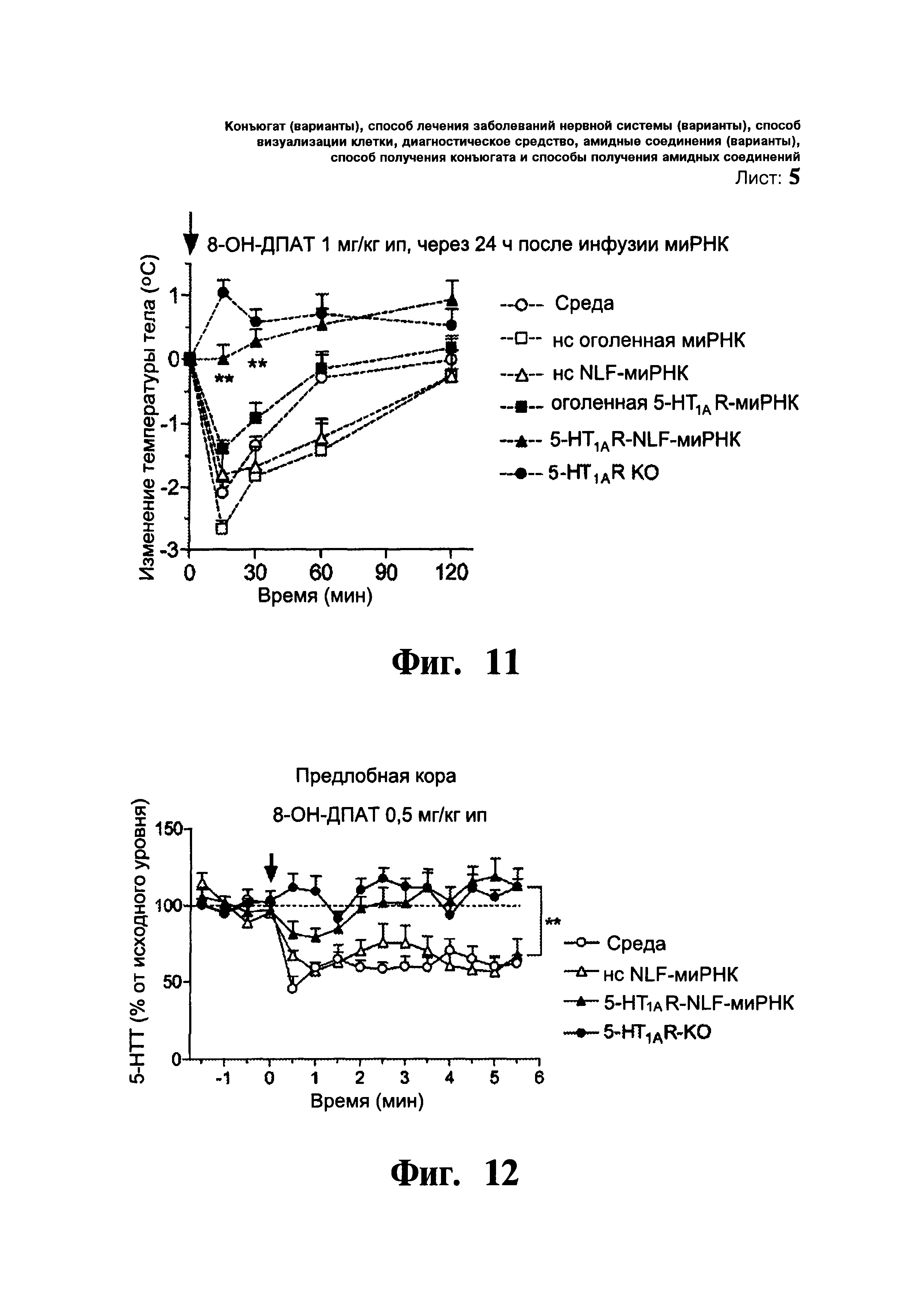
ФИГ.11. Гипотермическая реакция, вызванная гидробромидом (R)-(+)-8-гидрокси-2-(ди-н-пропиламино)тетралина (8-ОН-ДПАТ, селективным агонистом 5-HT1AR) в качестве функциональной меры предсинаптической 5-HT1AR активности. Мышам однократо вводили в тыльный 3 желудочек (D3V): i) среду, (ii) нонсенс оголенную миРНК (нс оголенную миРНК), iii) нонсенс NLF-миРНК (нс NLF-миРНК), (iv) оголенную 5-HT1AR-миРНК или (v) 5-HT1AR-NLF-миРНК (30 мкг/2,5 мл/1 день). Также оценивали дополнительную группу мышей с выключением гена 5-HT1AR. Оценивали температуру тела за 5 минут до и через 15, 30, 60 и 120 мин после введения 8-ОН-ДПАТ (1 мг/кг интраперитонеально). Отмечают отсутствие влияния 8-ОН-ДПАТ на температуру тела у мышей с конъюгированной 5-HT1AR-NLF-миРНК и генным нокаутом 5-HT1AR-KO. Показаны значения в виде среднего изменения температуры тела ± стандартная ошибка среднего у 7-10 мышей на группу. ** p<0,01 достоверное различие со средой, нс оголенной миРНК и нс NLF-миРНК, соответственно, с помощью дисперсионного анализа с повторением измерений, в котором лечение выступало в качестве межгруппового фактора, а время в качестве внутригрупповой переменной, с последующим использованием критерия множественного сравнения Ньюмена-Кеулса.
ФИГ.12. Влияние систематического введения гидробромида (R)-(+)-8-гидрокси-2-(ди-н-пропиламино)тетралина (8-ОН-ДПАТ, 0,5 мг/кг интраперитонеально) на уровень диализированного 5-НТ в средней предлобной коре (сПЛК) мышей. Мышей разделяют на группы, которым вводили: i) среду, (ii) нонсенс NLF-миРНК (нс NLF-миРНК), iii) 5-HT1AR-направляющую NLF-миРНК (5-HT1AR-NLF-миРНК) и (iv) мыши с генным нокаутом 5-HT1AR (5-HT1AR-KO). Мышам вливали среду или миРНК в концентрации 30 мкг/2,5 мкл/1 день, интрацеребровентрикулярно и проводили микродиалитические эксперименты через 24-48 ч после вливания. Отмечают отсутствие влияния 8-ОН-ДПАТ на снижение уровня 5-НТ в сПЛК мышей с нокдауном 5-HT1A ауторецептора и генным нокаутом 5-HT1AR-KO. Данные выражены в процентах от исходного уровня и представлены в виде среднего значения ± стандартная ошибка среднего (n=5-9 мышей на группу). ** p<0,01 достоверное различие от групп, получавших среду и нс NLF-миРНК, с помощью дисперсионного анализа с повторением измерений, в котором лечение выступало в качестве межгруппового фактора, а время в качестве внутригрупповой переменной, с последующим использованием критерия множественного сравнения Ньюмена-Кеулса.
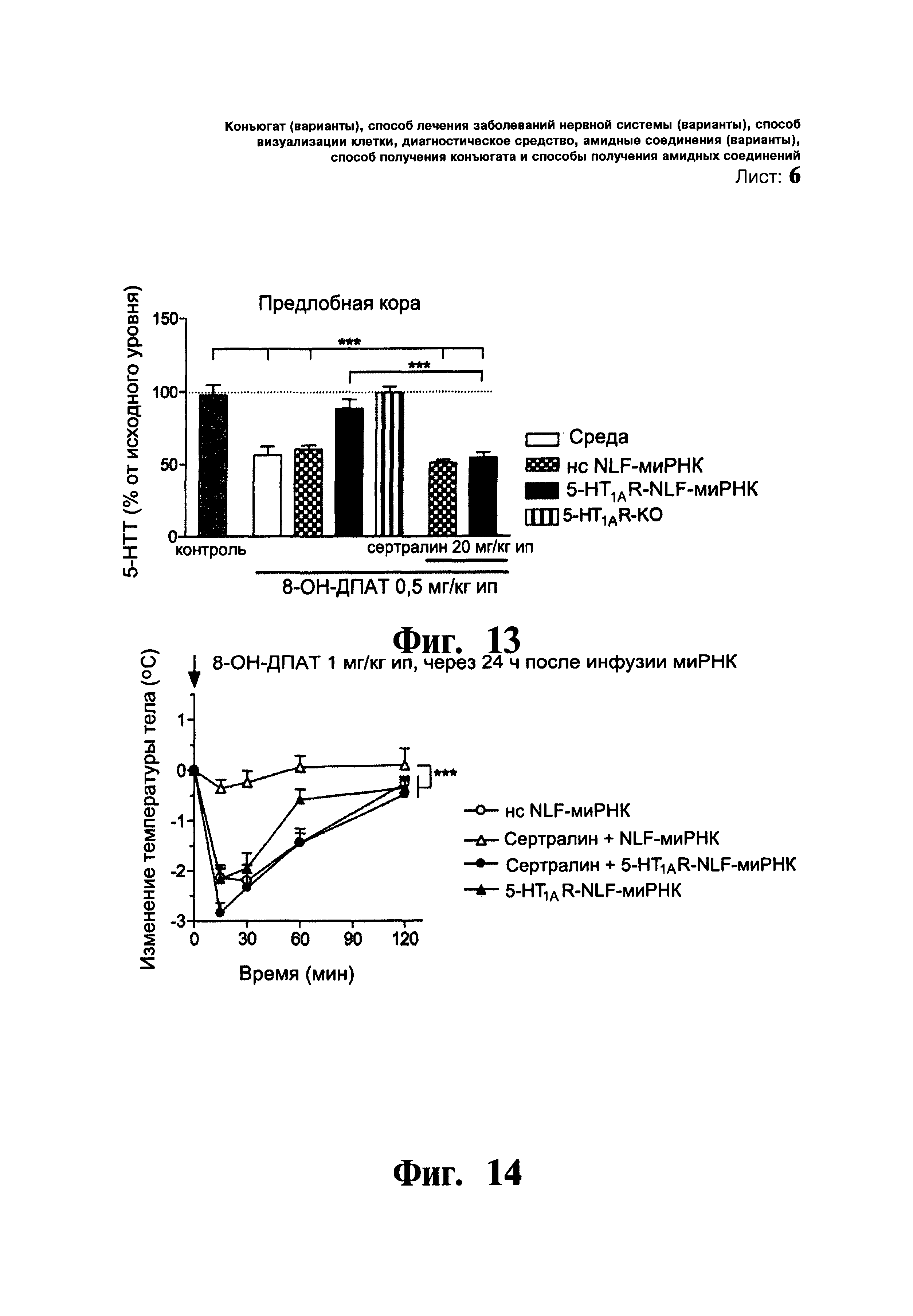
ФИГ.13 и 14. Влияние сертралина (селективного ингибитора переносчика серотонина 5-НТТ) на доставку конъюгированной 5-HT1AR-NLF-миРНК к 5-НТ нейронам. Фиг.13: Однократное инъекция сертралина (20 мг/кг, интраперитонеально) позволяет избежать выключение 5-НТ1А ауторецептора посредством конъюгированной 5-HT1AR-NLF-миРНК, и однократное введение 8-ОН-ДПАТ (селективный 5-HT1AR агонист, 0,5 мг/кг интраперитонеально) снижает уровень 5-НТ в средней предлобной коре. Мышей разделяют на группы, которым вводили: i) среду, (ii) нонсенс NLF-миРНК (нс NLF-миРНК), iii) 5-HT1AR-направляющую NLF-миРНК (5-HT1AR-NLF-миРНК) и (iv) мыши с генным нокаутом 5-HT1AR (5-HT1AR-KO). Мыши получали однократную инъекцию селективного ингибитора 5-НТТ, инфузию сертралина (20 мг/кг интраперитонеально) за 3 ч перед инфузией миРНК в D3V (30 мкг/2,5 мкл/1 день, интрацеребровентрикулярно). Кроме того, группа мышей получала среду интраперитонеально и среду в область D3V. Микродиалитические эксперименты проводили через 24 ч после интрацеребровентрикулярного введения среды или введения миРНК. Данные выражены в процентах от исходного уровня и представлены в виде среднего значения ± стандартная ошибка среднего (n=5-8 мышей на группу). ** p<0,001 достоверное различие от групп контроля и 5-HT1AR-NLF-миРНК, при использовании однофакторного дисперсионного анализа с последующей процедурой множественного сравнения Ньюмена-Кеулса. Фиг.14: Влияние введения 8-ОН-ДПАТ (1 мг/кг, интраперитонеально) на температуру тела в мышей NLF-миРНК, ранее обработанных селективных ингибитором 5-НТТ и сертралином (20 мг/кг, интраперитонеально). Группы мышей схожи в сравнении с мышами на панели А. В отличие от группы 5-HT1AR-NLF-миРНК введение 8-ОН-ДПАТ приводит к гипотермической реакции у мышей 5-HT1AR-NLF-миРНК, предварительно обработанных сертралином. Показаны значения в виде среднего изменения температуры тела ± стандартная ошибка среднего у 6-10 мышей на группу. ** p<0,001 с использованием двухфакторного дисперсионного анализа и последующей процедурой множественного сравнения Ньюмена-Кеулса.
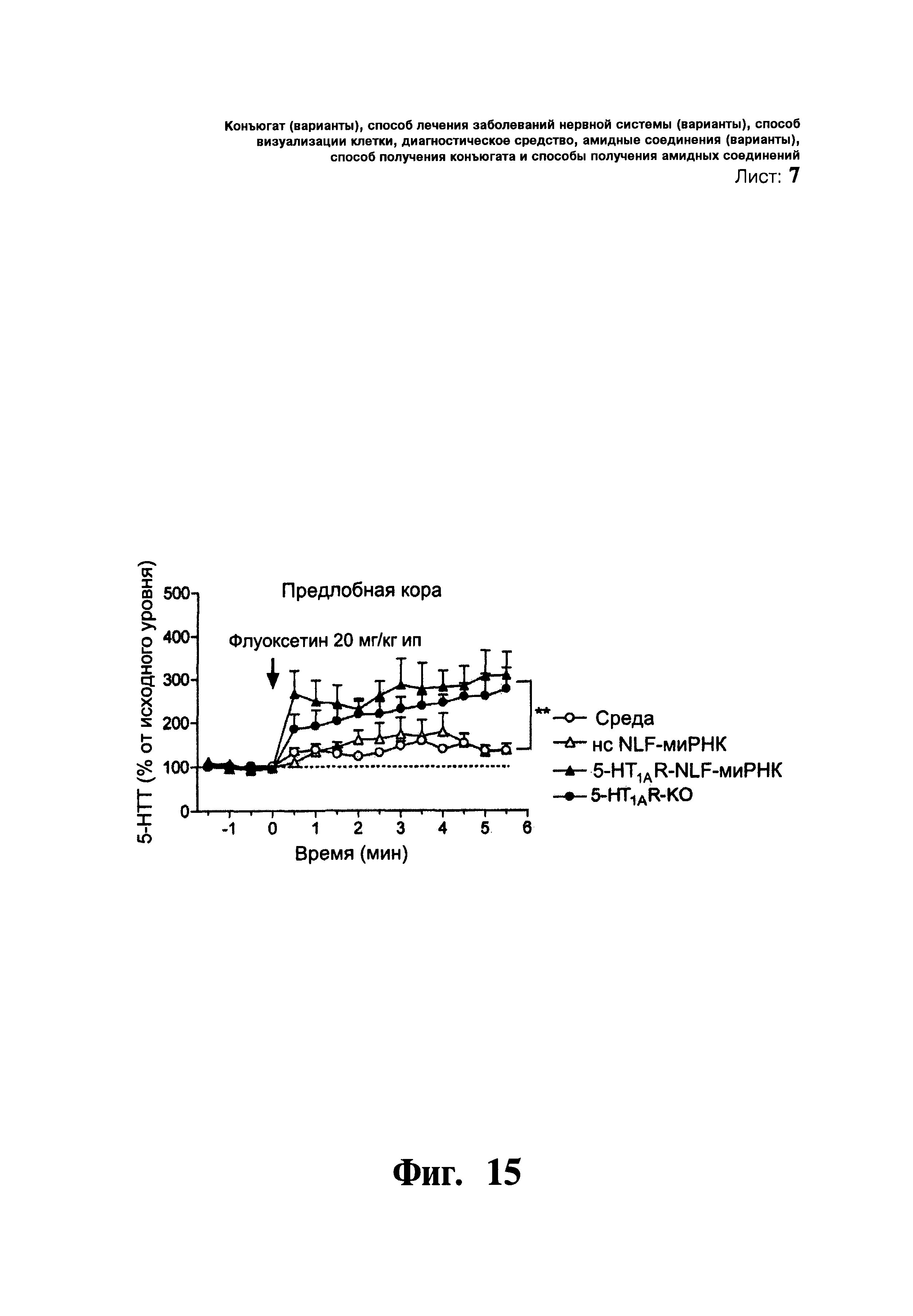
ФИГ.15. Влияние однократного введения флуоксетина (селективного ингибитора переносчика серотонина 5-НТТ, 20 мг/кг интраперитонеально) на уровень диализированного 5-НТ в средней предлобной коре (сПЛК) мышей. Мышей разделяют на группы, которым вводили: i) среду, (ii) нонсенс NLF-миРНК (нс NLF-миРНК), iii) 5-HT1AR-направляющую NLF-миРНК (5-HT1AR-NLF-миРНК) и (iv) мыши с генным нокаутом 5-HT1AR (5-HT1AR-KO). Мышам вливали среду или миРНК в концентрации 30 мкг/2,5 мкл/1 день, интрацеребровентрикулярно и проводили микродиалитические эксперименты через 24-48 ч после вливания. Отмечают усиленное влияние флуоксетина на уровень 5-НТ в сПЛК мышей с нокдауном 5-HT1A ауторецептора, схожих с тем, что наблюдалось у мышей с генным нокаутом 5-HT1AR-KO. Данные выражены в процентах от исходного уровня и представлены в виде среднего значения ± стандартная ошибка среднего (n=4-6 мышей на группу). ** p<0,01 достоверное различие от групп, получавших среду и нс NLF-миРНК, с помощью дисперсионного анализа с повторением измерений, в котором лечение выступало в качестве межгруппового фактора, а время в качестве внутригрупповой переменной, с последующим использованием критерия множественного сравнения Ньюмена-Кеулса.
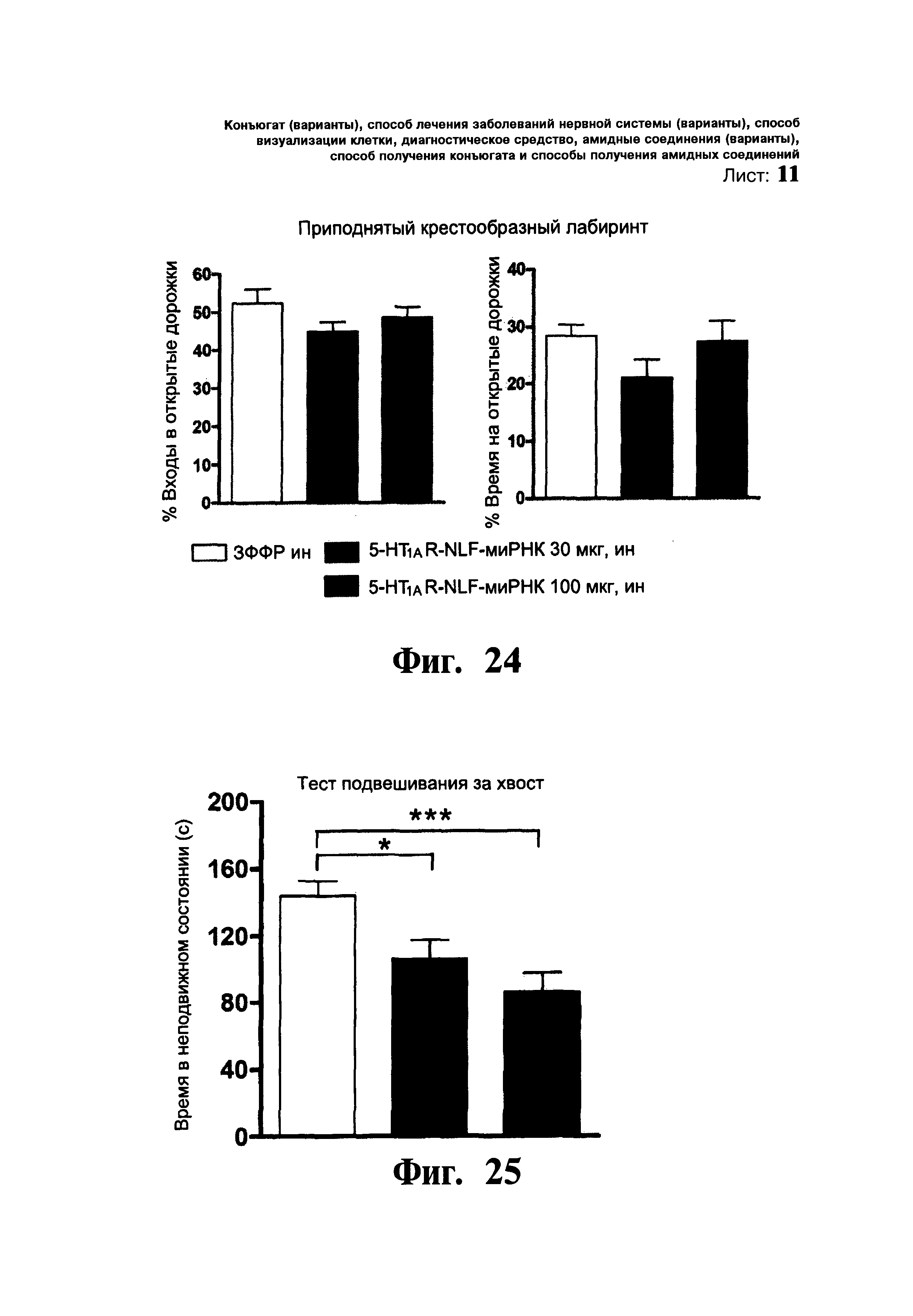
ФИГ.16 и 17. Нет изменений в тревожном поведении, но измененная реакция при испытании, обусловленном стрессом или депрессией, у мышей с нокдауном 5-HT1A ауторецептора. Мышей разделяют на группы, которым вводили: i) среду, (ii) 5-HT1AR-направленную NLF-миРНК (5-HT1AR-NLF-миРНК) и iii) мыши с генным нокаутом 5-HT1AR (5-HT1AR-КО). Мышам вливали среду или миРНК в концентрации 30 мкг/2,5 мкл/1 день, интрацеребровентрикулярно в область D3V. Фиг.16: Состояние тревожности оценивали по методике приподнятого крестообразного лабиринта через 24 ч после введения среды или миРНК. В отличие от мышей с нокаутом 5-HT1AR (5-HT1AR-KO) у мышей с нокдауном 5-HT1A ауторецептора (5-HT1AR-NLF-миРНК) не наблюдались различия в количестве входов и времени, затраченным на открытых дорожках поднятого над уровнем пола лабиринта. Фтг.17: В качестве способа оценки реакции при острой стрессовой/депрессионной ситуации был выбран тест подвешивания за хвост. Данные тест проводился через 48 ч после введения среды или миРНК. У мышей с нокдауном 5-HT1A ауторецептора и нокаутом 5-HT1AR-КО наблюдалась повышенная подвижность при стрессовой ситуации в сравнении с группой, получавшей среду. Данные представлены в виде среднего значения ± стандартная ошибка среднего (n=12-18 мышей/группу). * p<0,05, ** p<0,01, *** p<0,001 достоверное различие от группы, получавшей среду, при использовании однофакторного дисперсионного анализа и последующим использованием процедуры множественного сравнения Ньюмена-Кеулса.
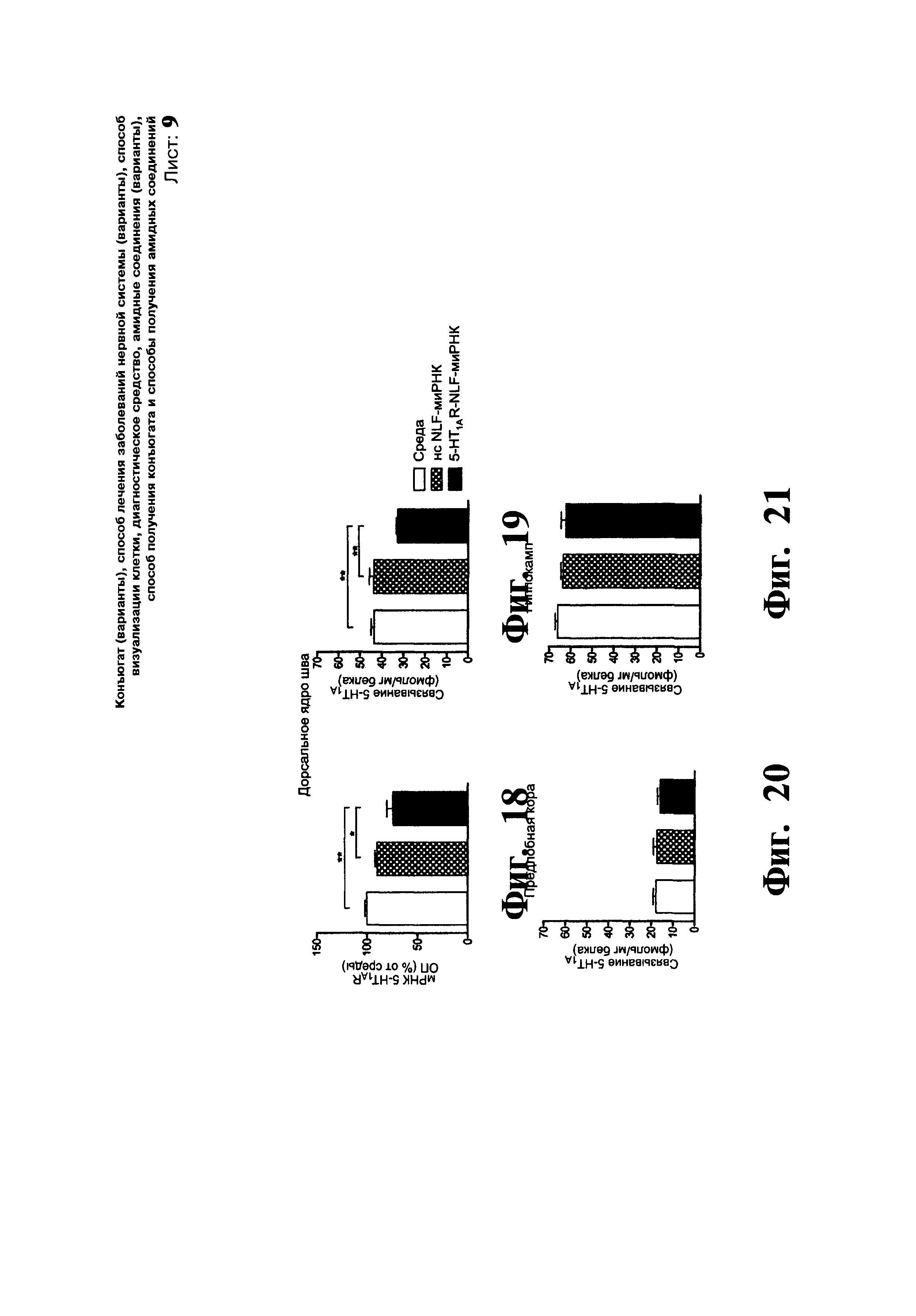
ФИГ.18-21. Сайленсинг селективного 5-HT1A ауторецептора посредством интраназального введения конъюгированной 5-HT1AR-NLF-миРНК. Мышам однократно через нос вводили: i) среду, (ii) нонсенс NLF-миРНК (нс NLF-миРНК) и iii) 5-HT1AR-NLF-миРНК (15 мкг/5 мкл в каждую ноздрю). Фиг.18: Оценивали экспрессию 5-HT1AR в дорсальном ядре шва посредтвом гибридизации in situ. Гистограмма, на которой показано снижение уровня мРНК рецептора 5-HT1AR в дорсальном ядре шва под воздействием 5-HT1AR-NLF-миРНК. Денситометрическая оценка положительных зерен мРНК рецептора 5-HT1AR, измеренных в пленках, представлена в виде средних значений оптической плотности (ОП) в процентах ± стандартная ошибка среднего (n=4 мыши на группу и два наблюдения у 3 ПЗ уровней ядра шва). Фиг.19-21: 5-HT1AR-NLF-миРНК вызывала специфичный нокдаун 5-HT1AR на предсинаптических, а не постсинаптических участках. Уровни белка 5-HT1AR в дорсальном ядре шва (Фиг.19), предлобной коре (Фиг.20) и гиппокампе (Фиг.21) оценивали ауторадиографическим связыванием с помощью3[H]-8-ОН-ДПАТ. Черточками показано среднее значение 5-HT1AR в фмоль/мг тканевого белка ± стандартная ошибка среднего (n=4 мыши на группу и два наблюдения у 3 ПЗ уровней ядра шва и два наблюдения у левого и правого участков предлобной коры и гиппокампа). * p<0,05, ** p<0,01 достоверное различие от групп, получавших среду и нс NLF-миРНК при использовании однофакторного дисперсионного анализа с последующей процедурой множественного сравнения Ньюмена-Кеулса.
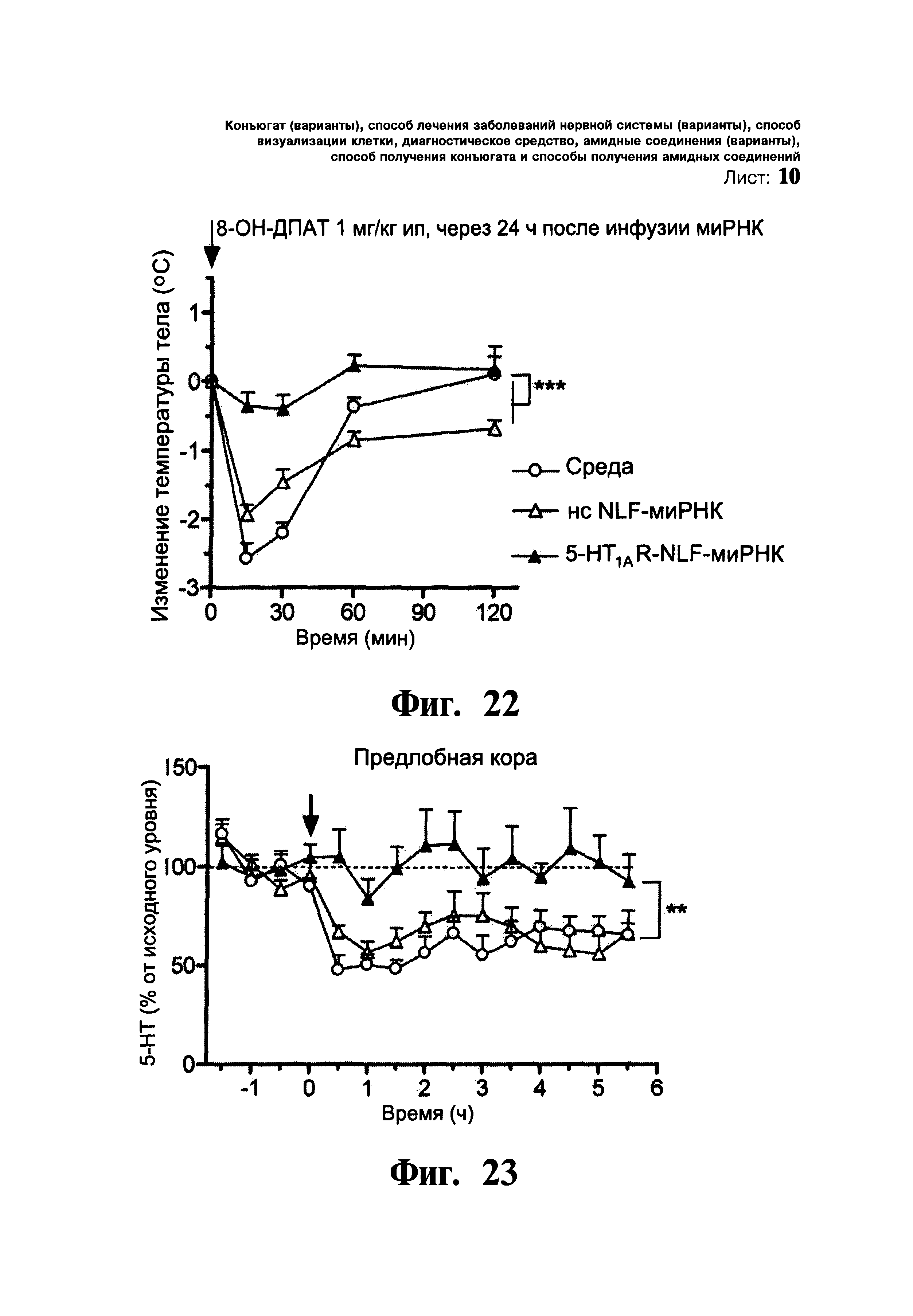
ФИГ.22 и 23. Отсутствие влияния 8-ОН-ДПАТ (селективного агониста 5-HT1AR) на физиологические и нейрохимические параметры у мышей с нокдауном 5-HT1A ауторецептора. Мышей подразделяли на группы, которым однократно через нос вводили: i) среду, (ii) нонсенс NLF-миРНК (нс NLF-миРНК) и iii) 5-HT1AR-NLF-миРНК (15 мкг/5 мкл в каждую ноздрю). Фиг.22: В отличие от групп, обработанных средой и нс NLF-миРНК, введение 8-ОН-ДПАТ дозой 1 мг/кг интраперитонеально не приводило к каким-либо изменениям температуры тела у мышей, получавших 5-HT1AR-NLF-миРНК. Данные представлены в виде средного изменения температуры тела ± стандартная ошибка среднего (n=4-7 на группу). Фиг.23: Уровень внеклеточного 5-НТ измерен посредством in vivo микродиализа в сПЛК мышей, получавших среду, нс NLF-миРНК и 5-HT1AR-NLF-миРНК, после систематического введения 8-ОН-ДПАТ. Уровень 5-НТ снижался в сПЛК как у мышей, получавших среду, так и у мышей, получавших нс NLF-миРНК. Однако, у мышей, получавших 5-HT1AR-NLF-миРНК, наблюдалось отсутствие влияния 8-ОН-ДПАТ на уровень 5-НТ в сПЛК. Данные выражены в процентах от исходного уровня и представлены в виде среднего значения ± стандартная ошибка среднего (n=4-9 мышей на группу). ** p<0,01, *** p<0,001 достоверное различие от групп, получавших среду и нс NLF-миРНК, соответственно, при использовании двухфакторного дисперсионного анализа с последующей процедурой множественного сравнения Ньюмена-Кеулса.
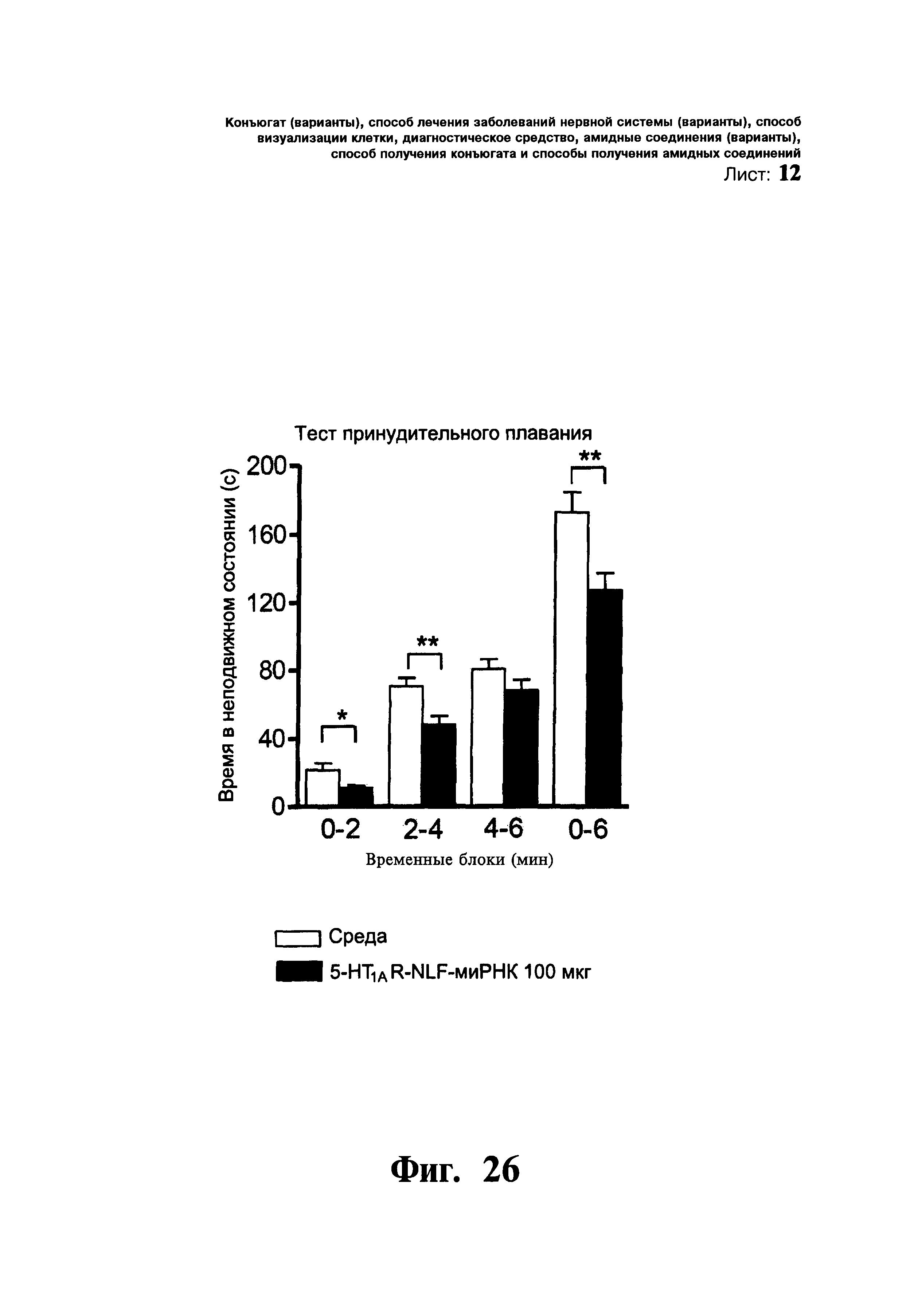
ФИГ.24-26. Интраназальное введение 5-HT1AR-NLF-миРНК приводит к сайленсингу 5-HT1A-ауторецепторов и вызывает антидепрессивную реакцию. Мышам однократно через нос вводили: i) среду, (ii) 5-HT1AR-NLF-миРНК (15 мкг/5 мкл в каждую ноздрю) и iii) 5-HT1AR-NLF-миРНК (50 мкг/5 мкл в каждую ноздрю). Фиг.24: 5-HT1AR-NLF-миРНК в ни одной из доз не оказывала влияния на реакцию тревожности в тесте приподнятого крестообразного лабиринта (n=6). Данные представлены в виде среднего значения ± стандартная ошибка среднего. Фиг.25: Однократное интраназальное введение 5-HT1AR-NLF-миРНК (30 или 100 мкг) приводило к дозозависимому снижению неподвижности в тесте подвешивания за хвост (n=10-15). Данные представлены в виде среднего значения ± стандартная ошибка среднего. В однофакторном дисперсионном анализе выявлен достоверный эффект группы, F2,34=8,70, p<0,001. * p<0,05, *** p<0,001 в сравнении с группой, получавшей среду. Фиг.26: Однократное интраназальное введение 5-HT1AR-NLF-миРНК (100 мкг) приводило к снижению неподвижности в тесте принудительного плавания (n=13-16). Данные представлены в виде среднего значения ± стандартная ошибка среднего. В однофакторном дисперсионном анализе выявлен достоверный эффект группы, * p<0,05, ** p<0,01 в сравнении с группой, получавшей среду.
ФИГ.27 и 28. Специфичный сайленсинг переносчика 5-НТ (5-НТТ) посредством интраназального введения конъюгированной 5-НТТ-NLF-миРНК. Фиг.27: Оценивали экспрессию 5-НТТ в дорсальном ядре (ДЯ) шва посредтвом гибридизации in situ. Мышам однократно вводили: i) среду, (ii) 5-HTT-NLF-миРНК дозой 5 мкг/5 мкл в каждую ноздрю (5-HTT-NLF-миРНК 10) и iii) 5-HTT-NLF-миРНК дозой 15 мкг/5 мкл в каждую ноздрю (5-HTT-NLF-миРНК 30). а1-а555 изображает коронарные срезы ядер шва в мозгу мышей, связанных с 33P-меченым 5-НТТ-специфичным олигонуклеотидом в 3 различных переднезадних (ПЗ) координатах в мм: -4,24/-4,36, -4,36/-4,60 и -4,72/-4,84 от брегмы (хвостовой-ростральной слева-направо). Масштабная метка, 500 мкм. Фиг.28: Гистограмма, на которой показано снижение уровня мРНК 5-НТТ в дорсальном ядре шва под воздействием 5-НТТ-NLF-миРНК. Денситометрическая оценка положительных зерен мРНК 5-НТТ, измеренных в пленках, представлена в виде средних значений оптической плотности (ОП) в процентах ± стандартная ошибка среднего (n=4 мыши на группу и два-четыре наблюдения у 3 ПЗ уровней ядра шва). * p<0,05, ** p<0,01, достоверное различие от группы, получавши среду, при использовании однофакторного дисперсионного анализа с последующей процедурой множественного сравнения Ньюмена-Кеулса.
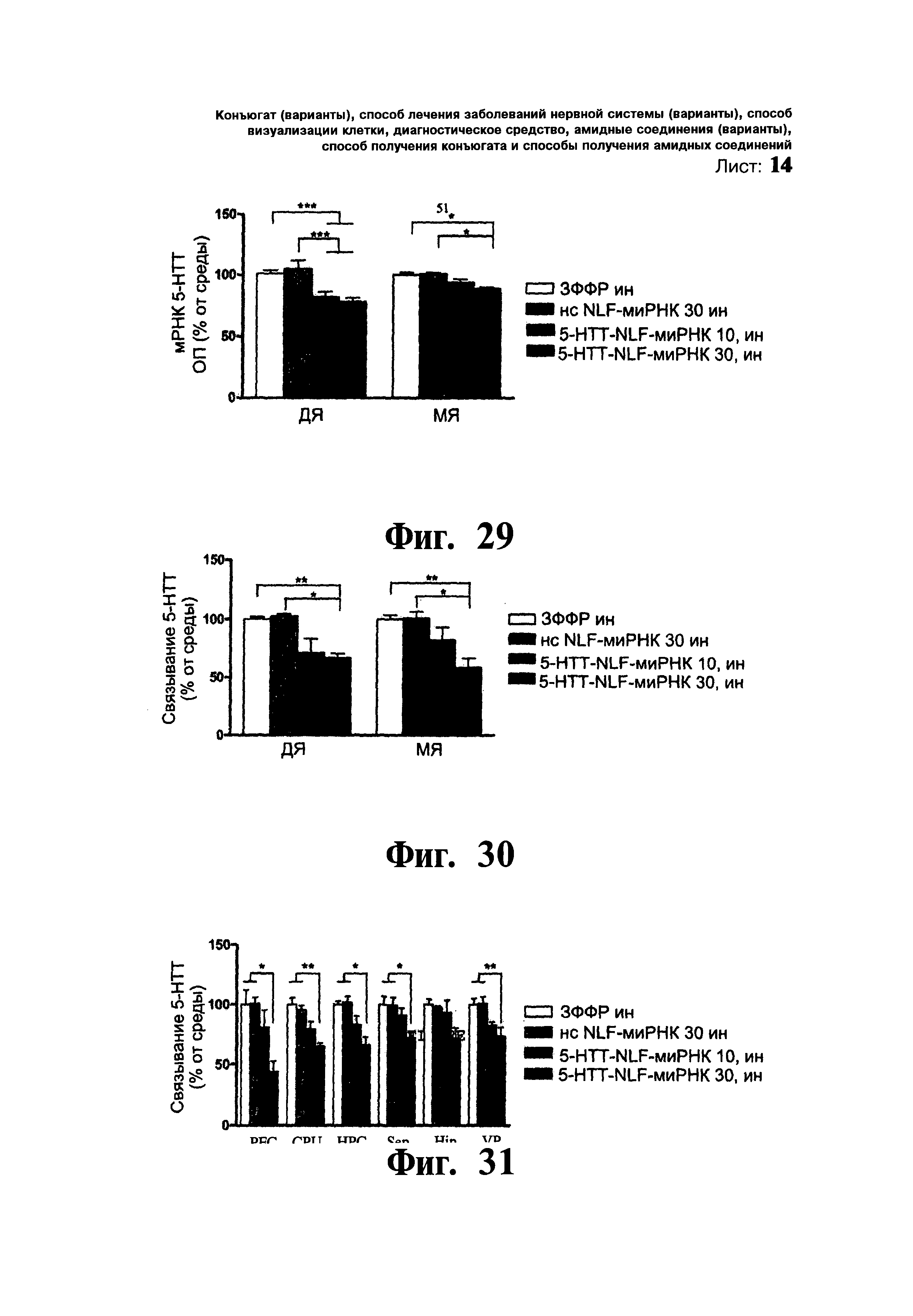
ФИГ.29-31. 5-HTT-NLF-миРНК вызывала специфичный нокдаун переносчика серотонина, что оценивалось посредством гибридизации in situ и ауторадиографического связывания. Мышам однократно вводили: i) среду, (ii) нонсенс-NLF-миРНК дозой 15 мкг/5 мкл в каждую ноздрю, iii) 5-HTT-NLF-миРНК дозой 5 мкг/5 мкл в каждую ноздрю (5-HTT-NLF-миРНК 10) и iv) 5-HTT-NLF-миРНК дозой 15 мкг/5 мкл в каждую ноздрю (5-HTT-NLF-миРНК 30). Фиг.29: Гистограмма, на которой показано снижение уровня мРНК 5-НТТ в дорсальном (ДЯ) и медианном (МЯ) ядрах шва под воздействием 5-HTT-NLF-миРНК. Денситометрическая оценка положительных зерен мРНК 5-НТТ, измеренных в пленках, представлена в виде средних значений оптической плотности (ОП) в процентах ± стандартная ошибка среднего (n=7-10 мышей на группу). * p<0,05, ** p<0,001 достоверное различие от групп, получавших среду и нонсенс-NLF-миРНК, в той же самой области при использовании однофакторного дисперсионного анализа с последующей процедурой множественного сравнения Ньюмена-Кеулса. Фиг.30 и 31: Денситометрическая оценка специфического связывания 5-НТТ представлена в процентных значениях связывания на соответствующем участке мыши (Префронтальная кора головного мозга - PFC; Мозжечок - CPU; Гипоталамус - НРС; Проекционные зоны коры головного мозга - Sep; Гиппокамп - Hip; Зрительная кора - VP), получившей инфузию среды, с целью иллюстрации степени NLF-миРНК-обусловленного снижения количества 5-НТТ на каждом участке. Столбиками показаны средние значения±стандартная ошибка среднего (6-9 мышей/группу). * p<0,05, ** p<0,01 достоверное различие от групп, получавших среду и нонсенс-NLF-миРНК, в той же самой области при использовании однофакторного дисперсионного анализа с последующей процедурой множественного сравнения Ньюмена-Кеулса.
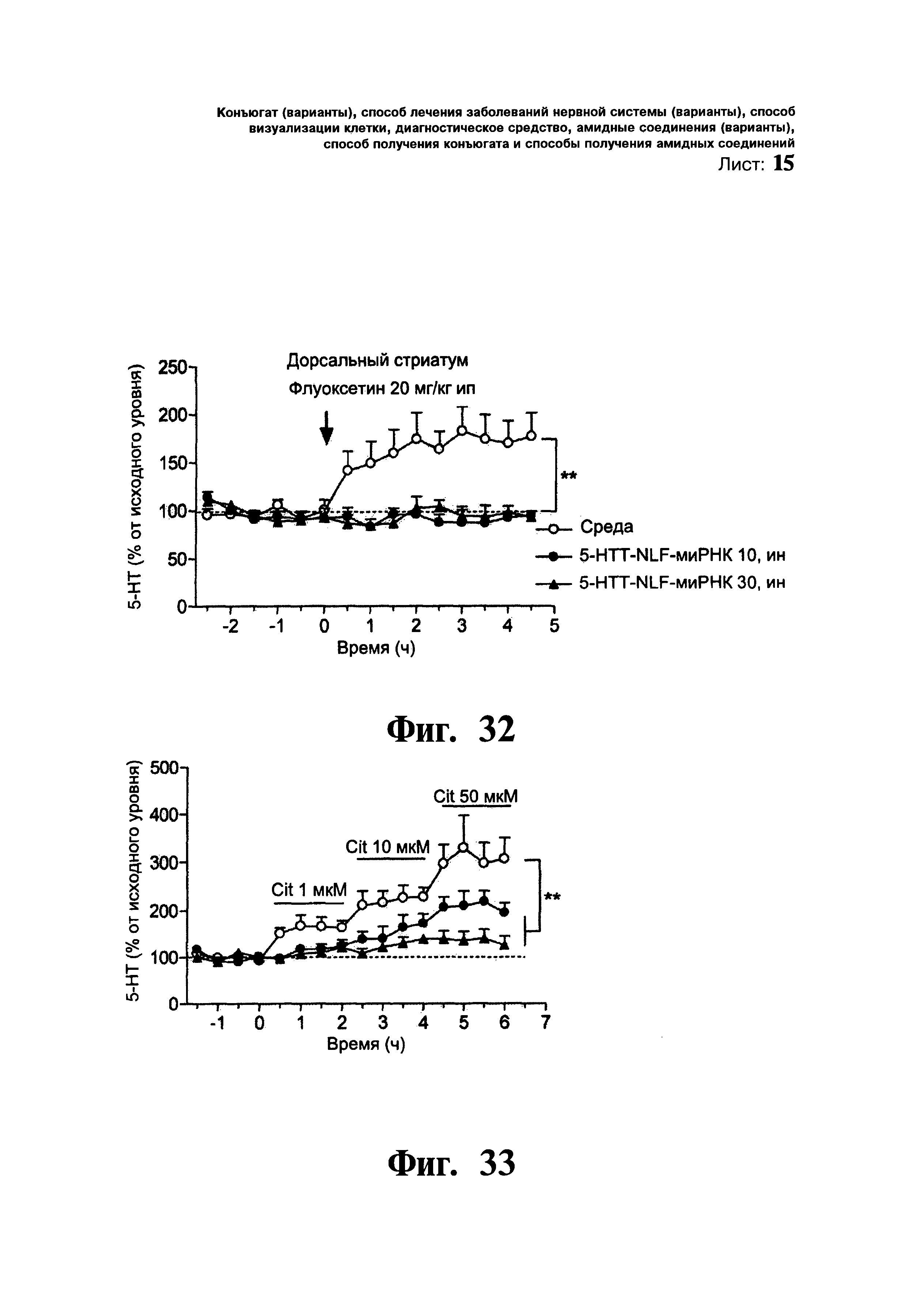
ФИГ.32. Влияние однократного введения флуоксетина (селективного ингибитора переносчика 5-НТ, 20 мг/кг интраперитонеально) на уровень диализированного 5-НТ в дорсальном стриатуме мышей. Мышам однократно вводили: i) среду, (ii) 5-HTT-NLF-миРНК дозой 5 мкг/5 мкл в каждую ноздрю (5-HTT-NLF-миРНК 10) и iii) 5-HTT-NLF-миРНК дозой 15 мкг/5 мкл в каждую ноздрю (5-HTT-NLF-миРНК 30). Микродиалитические эксперименты проводили через 24-48 ч после введения. Введение флуоксетина приводило к увеличению уровня 5-НТ в дорсальном стриатуме в группе, получавшей среду, а не в группе, получавшей 5-HTT-NLF-миРНК.
ФИГ.33. Местный эффект селективного ингибитора переносчика 5-НТ, циталопрам (Cit) на уровень 5-НТ в дорсальном стриатуме мышей, получавших среду и 5-HTT-NLF-миРНК. Местное введение циталопрама приводило к концентрационно-зависимому увеличению уровня 5-НТ в дорсальном стриатуме в группе, получавшей среду. Однако, введение циталопрама в концентрации 50 мкМ приводило только к небольшому увеличению уровня 5-НТ в полосатом теле мышей из группы, получавшей 5-HTT-NLF-миРНК. Данные выражены в процентах от исходного уровня и представлены в виде среднего значения ± стандартная ошибка среднего (n=7-8 мышей на группу). ** p<0,01 достоверное различие от групп, получавших среду, при использовании дисперсионного анализа с повторением измерений, в котором лечение выступало в качестве межгруппового фактора, а время в качестве внутригрупповой переменной, с последующим использованием критерия множественного сравнения Ньюмена-Кеулса.
ФИГ.34-37. Селективное направленное воздействие на дофаминергические нейроны компактной зоны черного посредством NLF-NS-миРНК-Су3. На Фиг.34 и 36 показана красная маркировка NLF-NS-миРНК-Су3, соответственно, через 1 и 3 часа после ИЦВ введения миРНК в вентральную часть среднего мозга. На Фиг.35 и 37 показана та же самая маркировка в сочетании с окрашиванием тирозингидроксилазой (ТГ). Через 1 час после ИЦВ введения NLF-NS-миРНК-Су3 (Фиг.34 и 35) можно обнаружить красные метки (Су3) в пределах ТГ-положительных нейронов черного вещества (голубой цвет), но не в ГАМК-эргических нейронах ретикулярной части черного вещества (*). Красная маркировка отслеживается по окрашенным пятнам (на вставке). Через 3 часа после инъекции невозможно обнаружить каких-либо красных внутриклеточных меток (Фиг.36 и 37).
ФИГ.38-41. Селективное направленное воздействие на норадренергические нейроны голубого пятна посредством NLF-NS-миРНК-Су3. На Фиг.38 и 40 показана красная маркировка NLF-NS-миРНК-Су3, соответственно, через 1 и 3 часа после ИЦВ введения миРНК. На Фиг.39 и 41 показана та же самая маркировка в сочетании с окрашиванием тирозингидроксилазой (ТГ). Через 1 час после ИЦВ введения NLF-NS-миРНК-Су3 (Фиг.38 и 40) можно обнаружить красные метки (Су3) в пределах ТГ-положительных норадренергических нейронов (голубой цвет). Красная маркировка отслеживается по окрашенным пятнам (на вставке). Через 3 часа после инъекции невозможно обнаружить каких-либо красных внутриклеточных меток (Фиг.39 и 41).
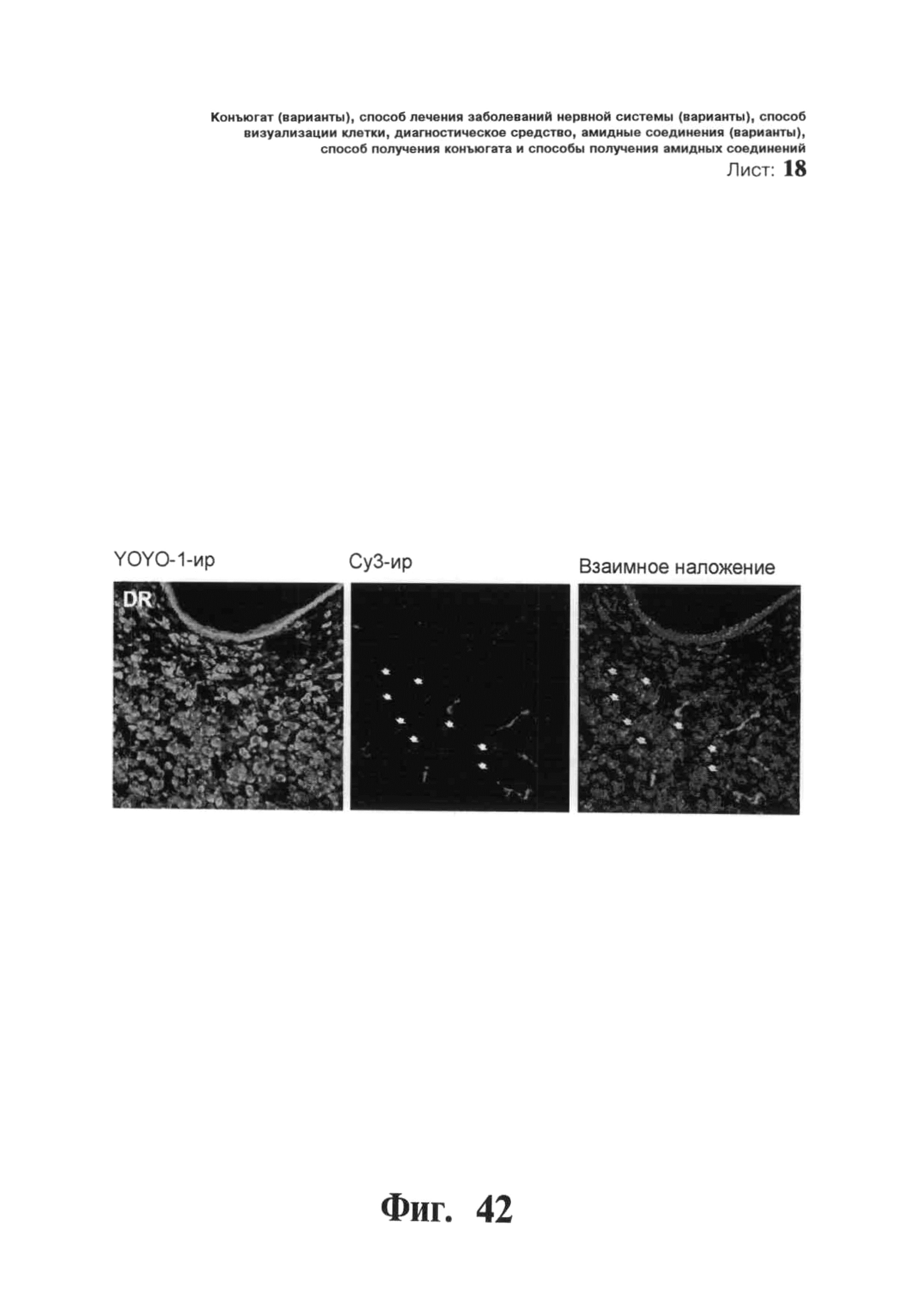
ФИГ.42. Селективное накопление сертралин-конъюгированного 2-O’-метил (ТОМ)-модифицированного нонсенс-олигонуклеотида (С-нс-ТОМ) в серотонинергических нейронов ядер шва. Мышам вводили однократную интрацеребровентрикулярную инфузию Су3-меченого С-нс-ТОМ (30 мкг) в дорсальный третий желудочек и умерщвляли через 24 ч после инфузии (n=2 мыши). Конфокальные лазерные изображения YOYO1-иммунореактивных ядер клеток (зеленый цвет), на которых показан иммунолокализованный Су3-меченный С-нс-ТОМ (красный цвет). Масштабная метка, 40 мкм.
Осуществление изобретения
Авторы настоящего изобретения неожиданным образом обнаружили, что возможно селективно направление нуклеиновой кислоты в интересуемую клетку, которая экспрессирует переносчик нейромедиатора, за счет ковалентного связывания указанной нуклеиновой кислоты с молекулой, способной специфически связываться с указанным переносчиком нейромедиатора, и, в частности, с ингибитором указанного переносчика.
А. Конъюгаты изобретения
В первом аспекте изобретение относится к конъюгату, содержащему:
i) по меньшей мере, один агент селективности, который специфично связывается с одним или несколькими переносчиками нейромедиатора и
ii) по меньшей мере, один нуклеотид, который способен специфично связываться с молекулой-мишенью, экспрессируемой в той же самой клетке, где экспрессируется переносчик нейромедиатора.
Используемый в данном документе термин "конъюгат" относится к любому соединению, образующемуся в результате ковалентного связывания двух или более индивидуальных соединений. В настоящем изобретении конъюгат относится к молекуле, содержащей нуклеиновую кислоту и агент селективности, которые связаны ковалентно, при этом указанное связывание происходит непосредственно или через связующее соединение.
Термины "ковалентное связывание" или "ковалентное присоединение" означают, что нуклеиновая кислота и агент селективности связаны с друг с другом либо посредством прямой ковалентной связи, либо связаны друг с другом не напрямую через промежуточную компоненту или компоненты, такие как линкер, мост или спейсер.
А.1. Агент селективности
Используемое в данном документе выражение "агент селективности, который специфично связывается с одним или несколькими переносчиками нейромедиатора" относится к любому веществу, которое связывается с переносчиком нейромедиатора. Такая специфичность связывания позволяет доставлять молекулу, соединенную с указанным агентом селективности, в клетку, ткань или орган, который содержит переносчик нейромедиатора. Таким путем конъюгат, несущий указанный агент селективности, будет специфично направляться в указанные клетки при введении его животному или при контакте in vitro с популяцией клеток различных типов.
Для целей настоящего изобретения специфичное связывание первой молекулы со второй молекулой относится к способности первой молекулы связывать указанную вторую молекулу таким образом, который в известной мере отличается от неспецифического взаимодействия. Агент селективности согласно настоящему изобретению может иметь КД в отношении мишени (переносчика нейромедиатора), составляющую, по меньшей мере, 10-4 М, либо, по меньшей мере, около 10-5 М, либо, по меньшей мере, около 10-6 М, либо, по меньшей мере, около 10-7 М, либо, по меньшей мере, около 10-8 М, либо, по меньшей мере, около 10-9 М, либо, по меньшей мере, около 10-10 М, либо, по меньшей мере, около 10-11 М, либо, по меньшей мере, около 10-12 М или более.
Используемый в данном документе термин "переносчик нейромедиатор" относится к белку, принадлежащему к классу мембранных белков-переносчиков, которые присоединяются к мембранам нервных клеток и основной функцией которых является перенос нейромедиаторов через данные мембраны и направление пути их дальнейшего переноса к определенным положениям внутри клетки. К переносчикам нейромедиаторов, которые могут направляться агентами селективности изобретения, относятся, помимо прочего, переносчики обратного захвата в цитоплазматической мембране нервных и глиальных клеток, которые перемещают нейромедиаторы из внеклеточного пространства в клетку. Данный процесс основан на градиенте содержания Na+ через цитоплазматическую мембрану, в частности, контранспорте Na+ через мембрану. Идентифицировано два семейства белков. Одно семейство включает переносчики ГАМК (гамма-аминомасляной кислоты), моноаминов, таких как норадреналин, дофамин, серотонин, и аминокислот, таких как глицин и пролин. Обычные структурные компоненты включают двенадцать предполагаемых трансмембранных α-односпиральных доменов, цитоплазматические N- и С-концы и большую гликозилированную внеклеточную петлю, разделяющую 3 и 4 трансмембранный домены. Данное семейство гомологических белков получают энергию из котранспорта ионов Na+ и Cl- вместе с нейромедиатором в клетку (Na+/Cl- переносчики нейромедиаторов). Второе семейство включает переносчики возбуждающих аминокислот, таких как глютамат. Обычные структурные компоненты включают 6-10 предполагаемых трансмембранных доменов, цитоплазматические N- и С-концы и гликозилированные домены во внеклеточных петлях. Переносчики возбуждающих аминокислот не зависят от ионов Cl- и для них могут быть необходимо внутриклеточные ионы К+ (Na+/К+-переносчики нейромедиаторов) (Liu, Y. et al. (1999) Trends Cell Biol. 9: 356-363).
К переносчикам нейромедиаторов, которые могут направляться агентами селективности изобретения, также относятся переносчики нейромедиаторов, присутствующие во внутриклеточных везикулярных мембранах, как правило, мембранах синаптических везикул, основной функцией которых является концентрирование нейромедиатора из цитоплазмы в везикулу до начала процесса экзоцитоза содержимого везикулы при передачи возбуждения по синапсам. В основе везикулярного транспорт лежит явление градиента электрохимического потенциала через везикулярную мембрану, порождаемый Н+-АТФазой. Два семейства белков участвуют в переносе нейромедиаторов в везикулы. Одно семейство использует явление протонного обмена для осуществления переноса в секреторные пузырьки и включает переносчики моноаминов и ацетилхолина. Например, переносчики моноаминов обмениваются двумя протонами просвета на на каждую молекулу цитоплазматического медиатора. Второе семейство включает переносчики ГАМА, перенос которых основан на положительном заряде внутри синаптического пузырька. У двух классов везикулярных переносчиков не наблюдается сходство последовательностей и их структура отлична от структура отлична от структуры переносчиков цитоплазматической мембраны (Schloss, P. et al. (1994) Curr. Opin. Cell Biol. 6: 595-599; Liu, Y. et al. (1999) Trends Cell Biol. 9: 356-363).
К особым типам нейромедиаторов, которые могут направляться агентами селективности изобретения, относятся переносчик глутамата/аспартата, в том числе переносчик возбуждающей аминокислоты 1 (ЕААТ1), переносчик возбуждающей аминокислоты 2 (ЕААТ2), переносчик возбуждающей аминокислоты 3 (ЕААТ3), переносчик возбуждающей аминокислоты 4 (ЕААТ4), переносчик возбуждающей аминокислоты 5 (ЕААТ5), пузырьковый переносчик глутамата 1 (VGLUT1), пузырьковый переносчик глутамата 2 (VGLUT2) и пузырьковый переносчик глутамата 3 (VGLUT3); переносчики ГАМА, в том числе переносчик ГАМА 1 типа (GAT1), переносчик ГАМА типа 2 (GAT2), переносчик ГАМА типа 3 (GAT3), переносчик бетаина (BGT1) и пузырьковый переносчик ГАМА (VGAT); переносчики глицина, в том числе переносчик глицина типа 1 (GlyT1), переносчик глицина типа 2 (GlyT2); переносчики моноаминов, в том числе переносчик дофамина (DAT), переночик норэпинефрина (NET), переносчик серотонина (SERT), пузырьковый переносчик моноаминов 1 (VMAT1), пузырьковый переносчик моноаминов 2 (VMAT2); переносчики аденозина, в том числе уравновешивающий переносчик нуклеозидов 1 (ENT1), уравновешивающий переносчик нуклеозидов 2 (ENT2), уравновешивающий переносчик нуклеозидов 3 (ENT3) и уравновешивающий переносчик нуклеозидов 4 (ENT4), а также пузырьковый переносчик ацетилхолина (VAChT).
В предпочтительном варианте осуществления агент селективности не является пептидом.
В предпочтительном варианте осуществления агент селективности выбран из группы, состоящей из ингибиторов обратного захвата серотонина (ИОЗС), селективного ингибитора обратного захвата серотонина (СИОЗС), ингибитора обратного захвата серотонина и норэпинефрина (ИОЗСН), норадренергического и специфического серотонинергического антидепрессанта (НССА), ингибитора обратного захвата норадреналина (ИОЗН), ингибитора обратного захвата дофамина (ИОЗД), ингибитора обратного захвата эндоканнабиноида (ИОЗэК), ингибитора обратного захвата аденозина (ИОЗАдо), ингибитора обратного захвата возбуждающей аминокислоты (ИОЗВАК), ингибитора обратного захвата глутамата (ИОЗГлу), ингибитора обратного захвата ГАМА (ИОЗГ), ингибитора обратного захвата глицина (ИОЗГли) и ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД).
Термин "ингибитор обратного захвата серотонина" или " ИОЗС" относится к молекуле, которая способна блокировать обратный захват серотонина и включает как селективные ингибиторы обратного захвата серотонина (СИОЗС) (которые специфично блокируют обратный захват серотонина без существенного воздействия на другие нейромедиаторы), а также неселективные ингибиторы обратного захвата серотонина, такие как ингибиторы обратного захвата серотонина и норэпинефрина (ИОЗСН) и ингибиторы обратного захвата серотонина, норэпинефрина и дофамина (ИОЗСНД).
Термин "селективный ингибитор обратного захвата серотонина" или "СИОЗС" относится к селективным ингибиторам обратного захвата серотонина, которые не оказывают существенного воздействие на другие системы обратного захвата или переноса нейромедиаторов. Эти соединения действуют главным образом у предсинаптической серотонинергической клетки, приводя к увеличению внеклеточного уровня нейромедиатора серотонина, что тем самым повышает уровень серотонина, доступного для связывания с постсинаптическим рецептором, и восполняет недостаток активности данной моноаминергической нейромедиаторной системы в головном мозге. К иллюстративным неограничительным примерам СИОЗС относятся сертралин (CAS 79617-96-2), структурный аналог сертралина флуоксетин (CAS 54910-89-3), флувоксамин (CAS 54739-18-3), пароксетин (CAS 61869-08-7), индаплин (CAS 63758-79-2), зимельдин (CAS 56775-88-3), циталопрам (CAS 59729-33-8) и эсциталопрам (CAS 219861-08-2). Параметром для определения того, действует ли заданное соединение в качестве СИОЗС, является, например, способность снижать ex vivo обратный захват серотонина и противодействовать серотонин-истощающему действию п-хлорамфетамина, не оказывая воздействия на обратный захват в внутривенного [3H]норэпинефрина в сердце крысы, что в основном описано в Кое et al. (J. Pharmacol. Exp. Ther., 1983, 226: 686-700).
В предпочтительном варианте осуществления СИОЗС - это сертралин или его структурный аналог со структурой (I)
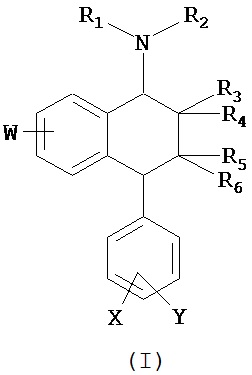
где группы R1, R2, R3, R4, R5 и R6 независимо друг от друга представляют собой водород или необязательно замещенный С1-С6-алкил; каждая из групп Х и Y выбрана из группы, состоящей из водорода, фторной, хлорной, бромной, трифторметильной, С1-С3-алкокси и цианогруппы; a W выбрана из группы, состоящей из водорода, фторной, хлорной, бромной, трифторметильной, нитро и трифторметильной, нитро и С1-С3-алкокси группы. В некоторых вариантах осуществления аналоги сертралина имеют цис-изомерную конфигурацию. Термин "цис-изомерный" относится к взаимной ориентации NR1R2 и фенильного заместителей относительно циклогексенового цикла (т.е. оба этих заместителя направлены в одну и ту же сторону относительно цикла). Поскольку атомы углерода как в 1, так и 4 положениях являются асимметрическими, каждое цис-соединение имеет две оптически активные энантиомерные формы обозначаемые (относительно атома углерода в положении 1) как цис-(1R)-, так и цис-(1S)-энантиомеры.
Конкретными примерам пригодных аналогов сертралина являются следующие соединения, находящиеся либо в (1S)-энантиомерной форме, либо в (1S)(1R)-рацемической форме.
- цис-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафтиламин;
- цис-N-метил-4-(4-бромфенил)-1,2,3,4-тетрагидро-1-нафтиламин;
- цис-N-метил-4-(4-хлорфенил)-1,2,3,4-тетрагидро-1-нафтиламин;
- цис-N-метил-4-(3-трифторметил-фенил)-1,2,3,4-тетрагидро-1-нафтиламин;
- цис-N-метил-4-(3-трифторметил-4-хлорфенил)-1,2,3,4-тетрагидро-1-нафтиламин;
- цис-N,N-диметил-4-(4-хлорфенил)-1,2,3,4-тетрагидро-1-нафтиламин;
- цис-N,N-диметил-4-(3-трифторметил-фенил)-1,2,3,4-тетрагидро-1-нафтиламин;
- цис-N-метил-4-(4-хлорфенил)-7-хлор-1,2,3,4-тетрагидро-1-нафтиламин.
Интерес представляет также (1R)-энантиомер цис-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафтилнамина.
Аналоги сертралина также описаны в патенте США №4536518. К другим родственным соединениям относятся (S,S)-N-десметилсертралин, рацемический цис-N-десметилсертралин, (1S,4S)-десметилсертралин, 1-дес(метиламин)-1-оксо-2-(R,S)-гидроксисертралин, (1R,4R)-десметилсертралин, сертралинсульфамид, сертралинамид метансульфокислоты, 1R,4R-энантиомерсертралина, N,N-диметилсертралин, нитросертралин, сертралин анилин, сертралинйодид, сертралинсульфамид NH2, сертралинсульфонамидоэтанол, сертралиннитрил, сертралин-КМЭ, диметилсертралинсульфонамид (обратный порядок замещения), сертралинсульфонамид (обратный порядок замещения с СН2 линкером), орто-метокси-сертралин (замещенный по кольцу В), метиловый эфир сертралин (замещенный по кольцу А) карбоновой кислоты, сертралин (замещенный по кольцу А) этанол, сертралин N,N-диметилсульфонамид, сертралин (замещенный по кольцу А) карбоновая кислота, пара-феноксисертралин (замещенный по кольцу В), пара-трифторметилсертралин (замещенный по кольцу В), N,N-диметилсертралин (замещенный по кольцу В) и пара-трифторметилсертралин. Структурные формулы этих аналогов показаны ниже.
Термин "ингибитор обратного захвата серотонина и норэпинефрина" или "ИОЗСН" относится к семейству соединений, которые способны ингибировать обратный захват серотонина путем блокирования переносчика серотонина и обратный захват норэпинефрина путем блокирования переносчика норэпинефрина. Данное семейство включает такие соединения, как венлафаксин (CAS 93413-69-5), десвенлафаксин (CAS 93413-62-8), дулоксетин (CAS 116539-59-4), милнаципран (CAS 92623-85-3), сибутрамин (106650-56-0), трамадол (CAS 27203-92-5) и бицифадин (CAS 71195-57-8). Параметром для определения возможности заданного соединения действовать в качестве ИОЗСН является, например, способность снижать обратный захват серотонина и норэпинефрина синаптосомами мозга, что по существу описано в Bolden-Watson С., Richelson E. (Life Sci. 1993; 52(12): 1023-9). Отдельным типом ИОЗСН являются трициклические антидепрессанты, которые представляют собой ИОЗСН, молекулярная структура которых содержит три цикла. Среди известных трициклических антидепрессантов линейные трициклические соединения, например, имипрамин, дезипрамин, амитриптилин, нортриптилин, протриптилин, доксепин, кетипрамин, миансерин, дотиепин, амоксапин, дибензепин, мелитрацен, мапротилин, флупентиксло, азафен, тианептин и родственные соединения, проявляющие схожую активность. Угловые трициклические соединения включают индрилин, клодазон, номифензин и родственные соединения. Было показано, что целый ряд других структурно отличных антидепрессантов, например, иприндол, веллбутрин, ниаламид, милнаципран, фенелзин и транилципромин проявляют схожую активность. Они функционально эквивалентны трициклическим антидепрессантам и поэтому входят в объем настоящего изобретения. Таким образом, настоящим изобретателем подразумевается, что термин трициклический антидепрессант охватывает широкий класс антидепрессантов, описанных выше, которые вместе с родственными соединения обладают общим свойством, заключающимся в проявлении ими антидепрессорной активности, и которые включает, помимо прочего, такие соединения, как амитриптилин, амитриптилиноксид, карбамазепин, бутриптилин, кломипрамин, демексиптилин, дезипрамин, дибензепин, диметакрин, досулепин/дотиепин, доксепин, имипрамин, иприндол, имипрамин, имипраминоксид, иприндол, лофепрамин, мелитрацен, метапрамин, нитроксазепин, нортриптилин, ноксиптилин, прегабалин, пропизепин, протриптилин, хинупрамин и тримипрамин.
Термины "ингибитор обратного захвата норадреналина", "ИОЗСН", "ИОЗНЭ", "адренергический ингибитор обратного захвата" или "АИОЗ" относятся к семейству соединений, которые способны блокировать обратный захват норадреналина и адреналина путем блокирования действия переносчика норэпинефрина (NET). Данное семейство соединений включает селективные ИОЗН, которые блокируют только NET, не оказывая воздействия на другие переносчики моноаминов, а также неселективные ИОЗН, такие как ИОЗСН, которые блокируют переносчик норэпинефрина и переносчик серотонина (см. выше), ингибиторы обратного захвата норэпинефрина и дофамина (ИОЗНД), которые блокируют переносчики норэпинефрина и дофамина (см. ниже), трициклические антидепрессанты и тетрациклические антидепрессанты (см. выше). К подходящим селективным ИОЗН, отвечающим требованиям настоящего изобретения, относятся, помимо прочего, атомоксетин/томоксетин (страттера или CAS 83015-26-3), мазиндол (мазанор, санорекс или CAS 22232-71-9), ребоксетин (эдронакс, вестра или CAS 98819-76-2) и вилоксазин (вивалан или CAS 46817-91-8).
Термин "ингибитор обратного захвата дофамина" или "ИОЗД" подразумевает ингибитор нейромедиатора дофамина, действующий за счет блокирования действия переносчика дофамина (DAT). Это, в свою очередь, приводит к увеличению внеклеточной концентрации дофамина и тем самым к увеличению дофаминергической нейропередачи. К подходящим ИОЗД относятся, помимо прочего, лекарственные препараты, такие какаминептин, бензатропин/бензтропин, бупропион, дексметилфенидат, эскетамин, этибензатропин/этиб, поналид, фенкамфамин, фенкамин, кетамин, лефетамин, медифоксамин, мезокарб, метилфенидат, нефопам, номифенсин, пипрадол, пролинтан, пировалерон, тилетамин и трипеленнамин; исследовательские химические вещества, такие как алтропан, амфонелевая кислота, беноциклидин, бразофенсин, бромантан, DBL-583, дихлоропан, диклофенсин, диэтициклидин, дифлуоропин, гациклидин, GBR-12935, индатралин, иофлупан, иометопан, манифаксин, радафаксин, таметралин, тезофенсин, тропарил и ваноксерин. Подходящие ИОЗД могут быть идентифицированы по способам анализа, известным специалистам в данной области техники, например, путем определения способности предполагаемого ИОЗД ингибировать обратный захват дофамина с высоким сродством посредством синаптосомальных препаратов, получаемых из полосатого тела крыс, по методике, описанной Kula et al., (Life Sciences 34: 2567-2575, 1984).
Используемый в данном документе термин "ингибитор обратного захвата эндоканнабиноида" или "ИОЗэКБ" относится к любому соединению, выступающему в качестве ингибитора обратного захвата в отношении эндоканнабиноидов путем блокирования действия переносчика эндоканнабиноидов. Соединения, обладающие данным типом активности, могут быть идентифицированы по способу, описанному в Beltramo, M. et al. (Science, 1997, 277: 1094-1097) на основе способности предполагаемого ингибитора обратного захвата эндоканнабиноида блокировать обратный захват анандамида нервными и астроглиальными клетками крыс; к данным соединениям относятся, помимо прочего, АМ404, арванил и олванил.
Термин "ингибитор обратного захвата аденозина" или "ИОЗА" относится к соединению, выступающему в качестве ингибитора обратного захвата пуринового нуклеозида и аденозина нейромедиатора путем блокирования действия одного или нескольких уравновешивающих нуклеозидных переносчиков. Это, в свою очередь, приводит к увеличению внеклеточной концентрации аденозина и тем самым к увеличению аденозинергической нейропередачи. Соединения, обладающие активностью ИОЗАдо, могут быть идентифицированы по in vitro способам анализа на основе способности предполагаемых ИОЗАдо ингибировать обратный захват аденозина посредством эритроцитов, а также по in vivo способам анализа на основе способности предполагаемого ИОЗАдо подавлять сосудорасширяющее действие аденозина, а также предотвращать аденозин-опосредованную стимуляцию роста коллатеральных сосудов, все эти способы могут быть осуществлены по существу так, как описано в патенте США №6984642. К подходящим ИОЗАдо относятся, помимо прочего, акадезин, ацетат, барбитураты, бензодиазепины, блокаторы кальциевых каналов, карбамазепин, каризопродол, цилостазол, циклобензаприн дилазеп, дипиридамол, эстрадиол, этанол (спирт), флумазенил, гексобендин, гидроксизин, индометацин, инозин, KF24345, мепробамат, нитробензилтиогуанозин, нитробензилтиоинозин, папаверин, пентоксифиллин, фенотиазины, фенитоин, прогестерон, пропентофиллин, пропофол, пуромицин, R75231, RE 102 BS, солуфлазин, тойокамицин, траказолат, трициклические антидепрессанты.
Термин "ингибитор обратного захвата возбуждающей аминокислоты" или "ИОЗВАК" относится к соединениям, которые ингибируют обратный захват возбуждающей аминокислоты путем блокирования переносчика возбуждающей аминокислоты или ЕААТ. Известно много соединений, которые связываются с ЕААТ и ингибируют функцию переноса. Ингибиторы ЕААТ делятся на два основных класса, которые отличаются по способу действия: нетранспортабельные блокаторы и кон курирующие субстраты. К подходящим ИОЗВАК относятся, помимо прочего, DL-трео-бета-бензилоксиаспартат, каинит, дигидрокаинат, 2S4R4MG, трео-β-гидроксиаспартат, L-транс-пирролидин-2,4-дикарбоновая кислота (транс-2,4-ПДК). Подходящие ИОЗВАК могут быть идентифицированы, например, по способам анализа, описанным Shimamoto et al. (Molecular Pharmacology, 1998, 53: 195-201), на основе способности предполагаемого ИОЗВАК ингибировать обратный захват радиомеченого глутамата посредством Cos-1 клеток, экспрессирующих человеческий переносчик возбуждающей аминокислоты 1 (ЕААТ1) или человеческий переносчик возбуждающей аминокислоты 2 (ЕААТ2).
Термин "ингибитор обратного захвата глутамата" или "ИОЗГлу" относится к соединению, выступающему в качестве ингибитора переносчика одного или нескольких переносчиков глутамата. Подходящие ингибиторы обратного захвата глутамата включают любые ингибиторы, уже известные в данной области техники, в том числе, например, трео-3-гидрокси-DL-аспарагиновая кислота (ТГА), (2S)-транс-пирролидин-2,4-дикарбоновая кислота (ПДК), аминокапроновая кислота и (2S,3S)-3-{3-[4-(трифторметил)бензоиламино]бензилокси}аспартат. Соединения, обладающие активностью ИОЗГлу, могут быть идентифицированы, например, по способам анализа, описанным Shimamoto et al. (Molecular Pharmacology, 1998, 53: 195-201), на основе способности предполагаемого ИОЗГлу ингибировать обратный захват радиомеченого глутамата посредством Cos-1 клеток, экспрессирующих человеческий переносик возбуждающей аминокислоты 1 (ЕААТ1) или человеческий переносик возбуждающей аминокислоты 2 (ЕААТ2).
Термин "ингибитор обратного захвата ГАМК" или "ИОЗГ" относится к соединению, выступающему в качестве ингибитора обратного захвата нейромедиатора гамма-аминомасляной кислоты (ГАМК) путем блокирования действия переносчиков гамма-аминомасляной кислоты (GAT). Это, в свою очередь, приводит к увеличению внеклеточной концентрации ГАМК и тем самым к увеличению ГАМК-эргической нейропередачи. К подходящим ингибиторам обратного захвата ГАМК относятся, помимо прочего, адгиперфорин (содержится в зверобое пронзеннолистном (зверобое)), CI-966, дерамциклан (EGIS-3886), гувацин (С10149), гиперфорин (содержится в зверобое пронзеннолистном (зверобое)), нипекотиновая кислота, NNC 05-2090, NNC-711, SKF-89976A, SNAP-5114, стирипентол и тиагабин (габитрил), которые описаны в Borden L.A. et al. (Eur J Pharmacol. 1994, 269: 219-224). Способы определения того, является ли заданное соединение обратным ингибитором ГАМК, известны в данной области техники и описаны, например, в патентах США №№6906177, 6225115, 4383999 и Ali, F.E., et al. (J. Med. Chem. 1985, 28, 653-660). Эти способы обычно включают взаимодействие клетки с радиомеченой ГАМК и обнаружение обратного захвата ГАМК в присутствии и отсутствии соединения-кандидата.
Термин "ингибитор обратного захвата глицина" или "ИОЗГли" относится к соединению, которое выступает в качестве ингибитора обратного захвата нейромедиатора глицина путем блокирования действия переносчиков глицина (GlyT), в том числе соединениям, которые блокируют переносчик глицина 1 типа (GlyT1), участвующий в удалении глицина из синаптической щели, а также GlyT2, который необходим для обратного захвата и перезагрузки глицина в синаптический пузырек (Gomeza et al., 2003; Curr Opin Drug Discov Devel 6(5): 675-82). К ингибиторам обратного захвата глицина, подходящим для использования в настоящем изобретении, относятся GlyT1-специфичные ингибиторы, такие как N-метил-N-[[(1R,2S)-1,2,3,4-тетрагидро-6-метокси-1-фенил-2-нафтил]метилглицин (свободное основание MTHMPNMглицина), 4-[3-фтор-4-пропоксифенил]-спиро[2Н-1-бензопиран-2,4’-пиперидин]-1’-уксусная кислота (свободное основание FPPSBPAA), которые описаны в WO 0007978 и WO 0136423, ALX 5407, саркозин (метилглицин), 5,5-диарил-2-амино-4-пентеноаты или соединения, описанные в WO 0208216, а также GlyT2-специфичные ингибиторы, например, ингибиторы, описанные в WO 05044810 A, содержание которых включено по ссылке во всей полноте. Способы обнаружения GlyT1-специфичных или GlyT2-специфичных ингибиторов обратного захвата известны в данной области техники и включают, например, способ, описанный в WO 05018676 A или WO 05044810, в котором клетки, экспрессирующие соответствующий рецептор (GlyT1 или GlyT2), вводятся в контакт с радиомеченым глицином в присутствии соединения, у которого проверяется активность в отношении ингибирования обратного захвата, и определяется количество глицина, обнаруживаемого внутри клетки через определенное время.
Термин "ингибитор обратного захвата норэпинефрина и дофамина" или "ИОЗНД" относится к соединению, выступающему в качестве ингибитора обратного захвата нейромедиаторов норэпинефрина и дофамина путем блокирования действия переносчика норэпинефрина (NET) и переносчика дофамина (DAT), соответственно. Это, в свою очередь, приводит к увеличению внеклеточной концентрации как норэпинефрина, так и дофамина и тем самым к увеличению адренергической и дофаминергической нейропередачи. К ИОЗНД, подходящим для использования в конъюгатах настоящего изобретения, относятся, помимо прочего, аминептин (сурвектор, манеон, директин), бупропион (веллбутрин, зибан), дексметилфенидат (фокалин), фенкамфамин (глюкоэнерган, реактиван), фенкамин (альтимина, сикоклор), лефетамин (сантенол), метилфенидат (риталин, концерта), номифенсин (меритал), пипрадол (меретран), пролинтан (промотил, катовит), пировалерон (центротон, тимергикс), нефопам (акупан), адгиперфорин (содержится в зверобое пронзеннолистном (зверобое)), гиперфорин (содержится в зверобое пронзеннолистном (зверобое)), кокаин, дезоксипипрадол (2-DPMP), дифенилпролинол (D2PM), метилендиоксипировалерон (МДПВ), цилобамин, манифаксин (GW-320,659), радафаксин (GW-353,162), таметралин (СР-24,441).
В предпочтительном варианте осуществления конъюгат изобретения содержит агент селективности, который представляет собой селективный ингибитор обратного захвата серотонина (СИОЗС). В более предпочтительном варианте осуществления СИОЗС - это сертралин или его структурный аналог, указанный выше.
А.2. Нуклеиновая кислота конъюгатов изобретения
Вторым компонентом конъюгатов согласно настоящему изобретению является нуклеиновая кислота, которая способна специфично связываться с молекулой-мишенью, экспрессируемой в той же самой клетке, где экспрессируется переносчик нейромедиатора. Как правило, нуклеиновая кислота изобретения способна подавлять функцию молекулы-мишени. Таким образом, если молекулой-мишенью является мРНК, то нуклеиновая кислота (как правило, миРНК, коротка шпилечная РНК (кшРНК) или антисмысловая нуклеиновая кислота) действует как ингибитор трансляция мРНК, приводя к уменьшению уровня белка, кодируемого мРНК. Если молекулой-мишенью является белок, то нуклеиновая кислота (обычно, аптамер) ингибирует активность белка.
Используемый в данном документе термин "нуклеиновая кислота" относится к полимеру, содержащему две или более молекулы дезорибонуклеотидов, рибонуклеотидов или аналогов нуклеотидов, а также молекулы, которые структурно схожи с нативной нуклеиновой кислотой, но отличаются от нативной нуклеиновой кислоты (например, путем химической модификации) одним или несколькими нукелиновокислыми остовами (например, фосфатом в нативных нуклеиновых кислотах), углеводным остатком нуклеиновой кислоты (например, дезоксирибозой в случае нативной ДНК или рибозы в нативной РНК) и основанием нуклеиновой кислоты (такими как аденозин, цитозин, гуанин или тимидин в нативных нуклеиновых кислотах).
Олигонуклеотид может предствалять собой двухцепоченый или одноцепочечный олигонуклеотид, в том числе, помимо прочего, малые интерферирующие РНК (миРНК), короткие шпилечные РНК (кшРНК), микро-РНК (миРНК), антисмысловые олигонуклеотиды или рибозимы. При использовании двухцепочечных нуклеиновых кислот они содержат первую кодирующая нить, которая комплементарна целевой нуклеиновой кислоте, и вторую антисмысловую нить, которая комплементарна смысловому кодону, что дает возможность для образования двухцепочечной ДНК за счет спаривания оснований первой и второй нитей.
Термин "антисмысловая нить" относится к нити двухцепочечной нуклеиновой кислоты, которая включает область, которая по существу комплементарна целевой последовательности. При этом область комлементарности не полностью комлементарна целевой последовательности, несоответствия наиболее допустимы за пределами 2-7 нуклеотидов 5’-конца антисмысловой нити.
Используемый в данном документе термин "кодирующая нить" относится к нити дцРНК, включающей область, которая по существу комплементарна области антисмысловой нити.
Термин малая интерферирующая РНК ("миРНК") относится к двойным спиралям малых ингибирующих РНК, которые вызывают РНК-интерференцию. Эти молекулы могут варьироваться по длине (обычно 18-30 пар оснований) и обладают различной степенью комплементарности с целевой мРНК в антисмысловой нити. Некоторые (но не все) миРНК имеют непарные выступающие основания при 5’ или 3’-конце кодирующей нити и/или антисмысловой нити. Термин "миРНК" включает двойные спирали двух отдельных нитей. Для целей настоящего изобретения молекулы миРНК не ограничены молекулами РНК, но также охватывают нуклеиновые кислоты с одним или несколькими химически модифицированными нуклеотидами, такими как морфолинос.
Используемый в данном документе термин "кшРНК" или "коротка шпилечная РНК" относится к дцРНК, в которой две нити соединены посредством непрерывной цепи нуклеотидов между 3’-концом одной нити и 5’-концом соответствующей второй нити с образованием спаренной структуры (структуры двойной спирали).
Термин "микро-РНК" или "миРНК" относится к молекулам короткой одноцепочечной РНК, как правило, длиной около 21-23 нуклеозида, которые способны регулировать экспрессию генов. миРНК могут быть синтетическими (т.е. рекомбинантными) или природными. Природные микро-РНК кодируются генами, которые транскрибируются из ДНК и вопроизводятся из первичных транскриптов ("первичных микро-РНК") в короткие стебле-петлеобразные структуры ("пре-микро-РНК") и в итоге в зрелую микро-РНК. Молекулы зрелой микро-РНК частично комплементарны одной или нескольким молекулам мРНКи понижающе регулируют экспрессию генов через процесс, схожий с РНК-интерференцией, или путем ингибирования трансляции мРНК.
Используемый в этом документе термин "антисмысловая последовательность" относится к антисмысловым или смысловым олигонуклеотидам, содержащим последовательность одноцепочечной нуклеиновой кислоты (либо РНК, либо ДНК), способной связываться с последовательностями целевой мРНК (смысловой) или ДНК (антисмысловой). Способность производить антисмысловой или смысловой олигонуклеотид на основе последовательности кДНК, кодирующей заданный белок, описана, например, в Stein и Cohen, Cancer Res. 48: 2659, (1988) и van der Krol et al., BioTechniques 6: 958, (1988).
Используемый в этом документе термин "рибозим" или "РНК фермент", или "каталитическая РНК" относится к молекуле РНК, которая катализирует химическую реакцию. Многие природные рибозимы катализируют либо гидролиз одной из своих собственных фосфодиэфирных связей, либо гидролиз связей в других РНК, но также было найдено, что они катализируют аминотрансферазную активность рибосомы, лигазную активность ДНК-лигазы и ряд других химических реакций, протекающих с участием традиционных белковых ферментов.
Используемый в этом документе термин "аптамер" относится к нуклеиновокислому лиганду, который связывается с несколькими центрами молекулы-мишени, при этом связывание не является "комплементарным", т.е. происходит не в результате образования пары оснований между нуклеиновокислым лигандом и последовательностью целевой нуклеиновой кислоты. Аптамер можно сконструировать так, что он будет связываться с любой воображаемой мишенью, включая полипептиды. Аптамеры оказываются полезными для биотехнологических и терапевтических приложений, поскольку они обладают свойствами молекулярного распознавания, конкурируя по данным свойствам с обычно используемой биомолекулой, антителами. Помимо свойства селективного распознавания аптамеры дают преимущества в сравнении с антителами, поскольку они могут быть полностью сконструированы в пробирке, легко получаются химическим синтезом, обладают необходимой стойкостью при хранении и приводят к появлению незначительной иммуногености или вообще не приводят к появлению иммуногенности в лечебных приложениях. Аптамеры могут быть синтезированы по повторным циклам in vitro деления, селекции и амплификации " методике, известной в данной области технике под названием "SELEX" (Систематическая эволюция лигандов экспоненциальным обогащением) (Shamah et al., Асе. Chem. Res. 2008, 41 pp.130-8). В качестве альтернативы, они могут быть получены, например, ступенчатым твердофазным синтезом.
Нуклеиновая кислота изобретения может содержать одну или несколько модификаций в области нуклеиновых оснований, углеводов и/или внутринуклеотидных связей.
Модификация одного или нескольких скелетных остатков нуклеиновых кислот может включать одну или несколько из нижеследующих процедур: модификация углеводного остатка по положению 2’, например, 2’-O-метил (2’-ОМе), 2’-O-метоксиэтил (2’-МОЕ), 2’-O-метоксиэтокси, 2’-фтор (2’-F), 2’-аллил, 2’-O-[2-(метиламино)-2-оксоэтил], 2’-O-(N-метилкарбамат); модификация углеводного остатка по положению 4’, в том числе 4’-тио 4’-СН2-O-2’-мостик, 4-(СН2)2-O-2’-мостик; запертая нуклеиновая кислота (ЗНК); пепти-нуклеиновая кислота (ПНК); интеркалирующая нуклеиновая кислота (ИНК); скрученная интеркалирующая нуклеиновая кислота (СИНК); гексит-нуклеиновая кислота (ГНК); арабинонуклеиновая кислота (АНК); циклогексан-нуклеиновые кислоты (ЦНК); циклогексенилнукелиновая кислота (ЦеНК); треозилнуклеиновая кислота (ТНК); морфолинолигонуклеотиды; Гэп-меры; смешанные олигомеры; введение обогащенных аргинином пептидов; присоединение 5’-фосфата к синтетическим РНК; РНК аптамеры (Que-Gewirth N.S., Gene Ther. 2007 Feb; 14(4): 283-91.); РНК аптамеры, регулируемые антидотами на объекте специфичного РНК аптамера (ссылка Oney S., Oligonucleotides. 2007 Fall; 17(3): 265-74.) или любые их комбинации.
Модификация одного или нескольких внутринуклеозидных связей нуклеиновых кислот может включать одно или несколько нижеследующих соединений: Фосфотиоат, фосфорамидат, фосфордиамидат, фосфодитиоат, фосфорселеноат, фосфордиселеноат, фосфоранилотиоат и фофсфоранилидат или любые их комбинации.
Запертая нуклеиновая кислота (ЗНК), часто именуемая недоступной РНК, является модифицированной молекулой РНК. Рибозная компонента ЗНК нуклеотида модифицирована дополнительным мостиком, соединяющим атомы углерода в положениях 2’ и 4’ (O2’,С4’-метиленовый мостик). Мостик запирает рибозу в 3’-эндо структурную конформацию, которая часто находится в А-форме ДНК или РНК. ЗНК нуклеотиды могут быть смешаны с ДНК или РНК основаниями в нуклеиновой кислоте при необходимости. Такие олигомеры являются коммерчески доступными. Запертая конформация рибозы улучшает межплоскостное взаимодействие оснований и предварительную организацию скелета. Это существенно повышает термостойкость (температуру плавления) и сродство ЗНК-модифицированных нуклеиновых кислот к гибридизации, помимо улучшенной способности к различению несоответствий. Данные свойства делают их полезными в антисмысловых технологиях. Кроме того, ЗНК анти-микрорибо олигонуклеотиды были испытаны на приматах, показав обнадеживающие результаты и низкую токсичность.
Пептид-нуклеиновая кислота (ПНК) представляет собой искусственно синтезированный полимер, схожий с ДНК или РНК, и используется в биологических исследованиях и при лечении. Нет данных о том, что ПНК встречается в природе. ДНК и РНК содержат дезоксирибозный и рибозный остатки, соответственно, тогда как скелет ПНК состоит из повторяющихся звеньев N-(2-аминоэтил)-глицина, связанных пептидными связями. Различные пуриновые и пиримидиновые основания связаны со скелетом посредством метиленкарбонильных связей. ПНК изображают подобно пептидам, при этом N-конец находится в первом (левом) положении, а С-конец " справа. Поскольку скелет ПНК не содержит заряженных фосфатных групп, связывание между нитями ПНК/ДНК сильнее, чем между нитями ДНК/ДНК из-зша отсутствия электростатического отталкивания. Молекулы ПНК со смешанными основаниями являются подлинными имитаторами молекул ДНК в отношении распознавания пар азотистных оснований. Связывание ПНК/ПНК сильнее, чем связывание ПНК/ДНК.
Интеркалирующая нуклеиновая кислота (ИНК) представляет собой модифицированный аналог нуклеиновой кислоты, состоящий из обычных дезоксирибонуклеотидов, ковалентно связанных с гидрофобными вставками. ИНК обладает высоким сродством к комплементарной ДНК, при этом имеет место стабилизация вплоть до 11 степени для каждой модификации. ИНК обладает более высокой специфичностью к полностью сопряженной мишени относительно несопряженных мишеней, чем обычная ДНК. Более высокое сродство ИНК к ДНК делает возможным использование более коротких зондов и тем самым еще более повышает специфичность. Кроме того, ИНК представляет собой селективный олигонуклеотидный аналог ДНК с уникальной способностью проводить различие между ДНК и РНК. Хоть и ИНК обладает высоким сродством к комплементарной ДНК, она обладает более низким сродством к комплементарной последовательности комплементарных ИНК. Скрученные интеркалирующие нуклеиновые кислоты обозначаются аббревиатурой СИНК.
Гексит-нуклеиновые кислоты (ГНК) представляют собой олигонуклеотиды, состоящие из природных нуклеиновых оснований и фосфорилированного 1,5-ангидрогекситного остова. Молекулярные ассоциаты между ГНК и РНК более устойчивы, чем ассоциаты между ГНК и ДНК и ассоциаты между природными нуклеиновыми кислотами (дцДНК, дцДНК, ДНК/РНК). К другим синтетическим модифицированным олигонуклеотидам относятся АНК (арабинонуклеиновая кислота), ЦНК (циклогексаннукелиновые кислоты), ЦеНК (циклогексеннуклеиновая кислота) и ТНК (треозилнукелиновая кислота).
Морфолино представляют собой синтетические молекулы, полученные в результате перестройки структуры природных нуклеиновых кислот. В структурном отношении, различие между морфолино и ДНК или РНК заключается в том, что в морфолиносе со стандартными нуклеиновыми основаниями эти основания связаны с 6-членными морфолиновыми циклами вместо дезоксирибозных/рибозных циклов, а неионные фосфородиамидатные межсубъединичные связи замещают анионные фосфодиэфирные связи. Морфолиносы иногда обозначают как ФМО (фосфородиамидат-морфолинонуклеотид). 6-членный цикл морфолина имеет химическую формулу O-(СН2-СН2)2-NH.
Гэпмеры или "рваные олигомерные соединения" являются химерными олигонуклеотидными зондами РНК-ДНК-РНК, в которых окна или "разрывы" ДНК включены в обычные или модифицированные РНК олигонуклеотиды, так называемые "крылья". Такая модификация повышает устойчивость олигонуклеотида in vivo и степень взаимодействия зонда с мишенью таким образом, что более короткие зонды можно использовать более эффективно. Предпочтительно, крылья представляют собой 2’-O-метил (ОМе) ил 2’-O-метоксиэтил (МОЭ) рибонуклеотиды, которые защищают внутренний блок от разрушения под действием нуклеазы. Более того, нуклеотиды, образующие разрыв или крылья, могут быть соединены посредством фосфодиэфирных связей или фосфотиоатных связей, что делает их более стойкими к разрушению под действием рибонуклеазы. Кроме того, нуклеотиды, образующие крылья, могут быть также модифицированы путем включения оснований, связанных посредством 3’-метилфосфонатных связей.
Нуклеиновая кислота конъюгатов изобретения способая специфично связываться с молекулой-мишенью, экспрессируемой в той же самой клетке, где экспрессируется переносчик нейромедиатора. Связывание нуклеиновой кислоты с молекулой-мишенью может происходить посредством взаимодействий по Уотсону-Крику, при котором молекула-мишень представляет собой нуклеиновую кислоту, которая содержит последовательность, комплементарную последовательности нуклеиновой кислоты. В качестве альтернативы, если молекула-мишень представляет собой полипептид, то нуклеиновая кислота конъюгатов изобретения может также взаимодействовать с указанной молекулой, при этом нуклеиновая кислота действует как аптамер.
В том случае, когда нуклеиновая кислота, составляющая часть конъюгатов изобретения, комплементарна последовательности целевой мРНК, то в распоряжении специалиста в данной области техники имеются различные критериии для выбора наиболее сооветствующей нуклеиновой кислоты. Например, когда нуклеиновая кислота, составляющая часть конъюгата, представляет мобой миРНК, то выбор может быть проведен путем сканирования последовательности мРНК мишени на наличие АА динуклеотидов и записи 19 нуклеотидов, следующих сразу после АА. Для выбора нуклеиновых кислот-мишеней можно использовать и другие способы. В одном примере выбор последовательности миРНК-мишени определяется чисто эмпирическим путем (см., например, Sui G et al., Proc. Natl. Acad. Sci. USA 99: 5515-20 (2002)) при условии, что последовательность мишени начинается с GG и не характеризуется существенной гомологией последовательностей с другими генами, что анализируется путем поиска по программе BLAST. В другом примере используют более тщательно разработанный способ для выбора последовательности миРНК-мишени. В данной процедуре используется результат наблюдений, заключающийся в том, что любой доступный сайт на эндогенной мРНК может быть направленно подвергнуть разрушению по способу синтетический олигодезоксирибонуклеотид/РНКаза Н (см., например, Lee NS et al., Nature Biotechnol. 20: 500-05 (2002)).
В качестве альтернативы, конструируется полигенный экспрессирующий кластер шпилечной миРНК, который содержит кодирующую нить мишени, после которой следует короткий спейсер, антисмысловая нить мишени и 5-6 Ts в качестве терминатора транскрипции. Порядок смысловой и антисмысловой нитей в экспрессионных конструкциях миРНК может быть изменен без оказания воздействия на активность шпилечной миРНК по подавлению транскрипции гена. В некоторых примерах изменения направления порядка на обратный может вызывать частичное снижение активности по сайленсингу гена.
Длина нуклеотидной последовательности, используемой в качестве ствола полигенного экспрессирующего кластера миРНК, может составлять, к примеру, от 19 до 29. Размер петли может варьироваться от 3 до 23 нуклеотидов. Можно также использовать последовательности с другой длиной и/или размером петли.
В еще одном варианте осуществления можно использовать 5’-липкий конец в конструкции шпилечной миРНК, при условии что шпилечная миРНК выполняет функцию в процессе сайленсинга гена. В одном конкретном примере 5’-липкий конец включает около 6 нуклеотидных остатков.
В еще одном варианте осуществления целевая последовательность РНКи представляет собой фрагмент 21-мерной последовательности. 5’-конец целевой последовательности содержит динуклеотид "NA", где "N" может представлять собой любое основание, а "А" - это аденин. В оставшаяся 19-мерной последовательности содержание GC составляет от 35 до 55%. Кроме того, оставшаяся 19-мерная последовательность не содержит в одном ряду четырех последовательных остатков А или Т (т.е. АААА или ТТТТ), трех последовательных G или С (т.е. GGG или ССС) или семь "GC".
Можно использовать дополнительные критерии для выбора последовательности РНКи-мишени. Например, содержание GC в оставшейся 19-мерной последовательности может быть ограничено в пределах от 45 до 55%. Более того, исключена любая 19-мерная последовательность с тремя последовательными одинаковыми основаниями (т.е. GGG, ССС, ТТТ или ААА) или палиндромная последовательность с 5 или более основаниями. Кроме того, можно подобрать оставшуюся 19-мерную последовательность таким образом, чтобы она обладала низкой гомологией последовательностей с другими генами. В одном особом примере проводят поиск потенциальных последовательностей-мишеней с помощью программы BLASTN по базе данных UniGene Национального центра биотехнологической информации (НЦБИ-NCBI), которая содержит кластеры последовательностей человека. База данных UniGene по человеческим генам содержит статистически неопределимые наборы генно-ориентированных кластеров. Каждый кластер UniGene включает последовательности, которые представляют уникальный ген. При поиске BLASTN могут быть выбраны 19-мерные последовательности, не дающая попаданий на другие человеческие гены. В ходе поиска е-значение может быть установлено с наложенными ограничениями (точно) (например, "1").
Эффективность последовательностей миРНК, а также любых других последовательностей РНКи, полученных согласно настоящему изобретению, в подавлении экспрессии гена-мишени может быть оценена различными способами, известными в данной области техники.
Термин "сайленсинг", "ингибирование экспрессии", "регуляция экспрессии в сторону уменьшения", "подавление экспрессии" и т.п., в отношении гена-мишени, в данном документе относятся к, по меньшей мере, частичному подавлению экспрессии гена-мишени, что проявляется по снижению количества мРНК-мишени, которая может быть выделена из первой клетки или группы клеток, где происходит траснкрипция гена-мишени, и которые подвергаются обработке таким образом, что ингибируется экспрессия гена-мишени, в сравнении со второй клеткой или группой клеток, по существу идентичных первой клетке или группе клеток, но не подвергнутые такой обработке (контрольные клетки). Степень ингибирования обычно выражается в виде:
(мРНК в контрольных клетках) - (мРНК в обработанных клетках) * 100% (мРНК в контрольных клетках)
В качестве альтернативы, степень ингибирования может быть представлена в виде уменьшения параметра, который функционально связан с экспрессией гена-мишени, например, количества белка, кодируемого геном-мишенью или количества клеток с определенным фенотипом. В принципе, сайленсинг генома-мишени может быть определен в любой клетке, экспрессирующей мишень либо конститутивно, либо методом геномной инженерии, а также любым подходящим способом анализа. Однако, когда нуждаются в сравнении с целью определения того, подавляет ли заданная нуклеиновая кислота экспрессию гена-мишени в определенной степени и поэтому охватывается настоящим изобретением, в качестве такого сравнения выступает способ анализа, обеспеченный в нижеследующих примерах, и способы анализа, известные в данной области техники. Например, в некоторых примерах экспрессия гена-мишени подавляется, по меньшей мере, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50% за счет введения двухцепочечного олигонуклеотида. В некоторых вариантах осуществления экспрессия гена-мишени подавляется, по меньшей мере, на 60%, 70% или 80% за счет введения двухцепочечного олигонуклеотида. В некоторых вариантах осуществления экспрессия гена-мишени подавляется, по меньшей мере, на 85, 90% или 95% за счет введения двухцепочечного олигонуклеотида.
Например, последовательность нуклеиновой кислоты согласно настоящему изобретению может быть введена в клетку, экспрессирующую ген-мишень. Уровень мРНК гена-мишени в клетке может быть определен по ОТ-ПЦР (полимеразной цепной реакции с обратной транскрипцией), нозерн-блоттингом или любым другим стандартным способом. В качестве альтернативы, уровень полипептида, кодируемого целевой мРНК, может быть измерен вестерн-блоттингом, анализом ELISA (твердофазным иммуноферментным анализом) или любым другим иммунологическим или неиммунологическим способом анализа. Существенное изменение уровня экспрессии мРНК или белка, кодируемого геном-мишенью, после введения последовательности миРНК указывает на эффективность последовательности миРНК в подавлении экспрессии гена-мишени. Водном конкретном примере наблюдают также за уровнем экспрессии других генов до и после введения последовательности миРНК. Может быть подобрана такая последовательности миРНК, которая обладает ингибирующем действием на экспрессию генов-мишеней, но не оказывает существенного воздействия на экспрессию других генов. В другом конкретном примере в одну и ту же клетку-мишень можно ввести несколько последовательностей миРНК или других РНКи. Эти последовательности миРНК и РНКи специфично подавляют экспрессию гена-мишени, но не подавляют экспрессию других генов. В еще одном конкретном примере можно использовать последовательности миРНК или других РНКи, которые подавляют экспрессию гена-мишени и другого гена или генов.
Специалист в данной области техники примет во внимание, что конкретный выбор молекулы нуклеиновой кислоты, вводимой в конъюгаты изобретения, будет зависеть от типа агента селективности, присутствующего в конъюгате. Таким образом, нуклеиновая кислота будет специфична к молекуле-мишени, которая экспрессируется в клетках, экспрессирующих переносчик нейромедиатора, который специфично связывается с агентом селективности.
В предпочтительном варианте осуществления нуклеиновая кислота специфична к серотониновому рецептору 1А типа (5-HT1A). В тех случаях, когда нуклеиновая кислота является антисмысловой, миРНК, кшРНК или рибозимом, ее действие происходит посредством спаривания оснований с молекулой-мишенью, при этом молекула-мишень представляет собой мРНК, кодирующую серотониновый рецептор 1А типа (5-HT1A). Если нуклеиновая кислота является аптамером, то молекула-мишень представляет собой полипептид серотонинового рецептора 1А типа (5-HT1A).
Используемый в данном документе термин "серотониновый рецептор 1А типа" или "5-HT1A" относится к типу серотонинового рецептора, который находится преимущественно в предсинаптическом серотонинергическом нейроне. Эти рецепторы активируются внеклеточным серотонином, приводя к снижению активности по возбуждению клеток и, в свою очередь, к уменьшению выделения серотонина в основных зонах переднего мозга. Данная отрицательная обратная связь ограничивает прирост синаптического нейрона, который может быть резко вызван антидепрессантами. Со временем соматодендритические ауторецепторы становятся менее восприимчивыми, что дает возможность для проявления полного действия СИОЗС, экспрессируемых в переднем мозге. Было найдено, что данный период времени соотвествует скрытому периоду начала проявления антидепрессорной активности [Perez, V., et al., The Lancet, 1997, 349: 1594-1597]. Таким образом, в клетках, в которых серотониновый рецептор 1А типа инактивирован, увеличение уровня внеклеточного серотонина вследствие блокирования переносчика серотонина не приведет к снижению активности по возбуждению клеток, тем самым препятствуя отрицательной обратной связи, имеющей отношение к обработке ингибиторами обратного захвата серотонина.
Рецептором серотонина 1А типа, который может становиться мишенью для нуклеиновой кислоты конъюгатов изобретения, может быть любой серотониновый рецептор 1А типа, включая, помимо прочего, человеческий 5-HT1AR, последовательность которого представлена в базе данных SwissProt под инвентарным номером Р08908, мышиный 5-HT1AR, последовательность которого представлена в базе данных SwissProt под инвентарным номером Q64264, крысиный 5-HT1AR, последовательность которого представлена в базе данных SwissProt под инвентарным номером 19327, собачий 5-HT1AR, последовательность которого представлена в базе данных SwissProt под инвентарным номером Q6XXX9.
Специалист в данной области техники примет во внимание, что нуклеиновая кислота изоберетиня специфичная по отношению к мРНК, кодирующей 5-HT1AR, может быть выбрана по любому из выше-указанных способов и испытана на способность вызывать существенное уменьшение уровня соответствующей мРНК. Авторы настоящего изобретения идентифицировали области в пределах последовательности мРНК рецептора 5-HT1AR, которые преимущественно становятся мишенями для нуклеиновых кислот изобретения. Эти области соответствуют областям, которые являются высококонсервативными среди различных видов или областей, соответствующих некодирующим областями первичного транскрипта, во избежание возможных взаимодействий с трансляционными комплексами внутри кодирующей области.
Таким образом, в предпочтительном варианте осуществления последовательности нуклеиновых кислот комплементарны области, соответствующей нуклеотидам 621-1640 или нуклеотидам 1880-2400 в мышиной мРНК рецептора 5-HT1AR (последовательность под инвентарным номером NM_008308 в базе данных НЦБИ), или соответствующим областям в кДНК 5-HT1AR других видов. Указанные соответствующие области могут быть определены попарным выравниванием указанных кДНК с мышиной кДНК рецептора 5-HT1AR или множественным выравниванием различных кДНК 5-HT1AR и идентификацией областей в указанных других кДНК, которые перекрываются с выбранными областями в мышиной кДНК 5-HT1AR.
Способы попарного выравнивания двух последовательностей нуклеиновых кислот общеизвестны специалистам в данной области техники и могут быть осуществлены по стандартным алгоритмам типа BLASTN [BLAST Manual, Altschul, S., et al., NCBI NLM NIH Bethesda, Md. 20894; Altschul, S., et al., J. Mol. Biol. 215: 403-410 (1990)] с использованием параметров по умолчанию. Способы выравнивания нескольких последовательностей нуклеиновых кислоты могут быть осуществлены с использованием стандартных алгоритмов типа CLUSTALW (Thompson J.D. et al., Nucleic Acids Res, 1994, 22: 4673-4680) с использованием параметров по умолчанию. После идентификации областей в кДНК 5-HT1AR у различных видов, возможно проведение идентификации подходящих последовательностей нуклеиновых кислот, которые могут быть введены в нуклеиновые кислоты конъюгатов изобретения. В предпочтительном варианте осуществления конъюгат изобретения содержит последовательность нуклеиновой кислоты, которая содержит последовательность, которая становится мишенью по отношению к области в мРНК 5-HT1AR, выбранную из группы последовательностей SEQ ID NO: 1 (нуклеотиды 1841-1910 мышиной мРНК рецептора 5-HT1AR), SEQ ID NO: 2 (нуклеотиды 591-700 мышиной мРНК рецептора 5-HT1AR), SEQ ID NO: 3 (нуклеотиды 831-940 мышиной мРНК рецептора 5-HT1AR) и SEQ ID NO: 4 (нуклеотиды 2120-4441 мышиной мРНК рецептора 5-HT1AR).
В более предпочтительном варианте осуществления нуклеиновая кислота конъюгатов изобретения содержит последовательность, выбранную из группы SEQ ID NO 5, SEQ ID NO 7, SEQ ID NO: 9 и SEQ ID NO: 11 (см. Таблицу 2).
Если нуклеиновые кислоты обеспечены в виде двухцепочечных нуклеиновых кислоты (например, таких как миРНК), то олигонуклеотиды совмещаются с соответствующей антисмысловой нитью, которая обеспечена в SEQ ID NO 6, SEQ ID NO 8, SEQ ID NO: 10 и SEQ ID NO: 12 (см. Таблицу 2).
В другом варианте осуществления нуклеиновая кислота изобретения направлена на мРНК, кодирующую переносчик серотонина (при этом действие нуклеиновой кислоты происходит путем спаривания оснований с мишенью) или на переносчик серотонина, как таковой (при этом нуклеиновая кислота действует как аптамер путем непосредственного связывания и ингибирования активности полипептида).
Используемый в данном документе термин "переносчик серотонина" или "SERT" относится к полипептиду, который представляет собой интегральный мембранный белок, переносящий нейромедиатор серотонин из синаптического пространства в предсинаптические нейроны. Последовательности человеческого, крысиного, мышиного или бычьего SERT представлены в базе данных SwissProt под инвентарными номерами Р31645, Р31652, Q60857 и Q9XT49, соответственно. По аналогии с нуклеиновыми кислотами, направленных на кДНК 5-HT1AR, любая область в кДНК SERT может становиться мишенью в той мере, насколько она приводит к существенному ингибированию уровня соответствующей мРНК или белка, кодируемого указанной мРНК. Таким образом, подходящие SERT-специфичные нуклеиновые кислоты могут быть идентифицированы так, как описано выше, путем измерения уровня мРНК SERT или белка SERT в клетках, экспрессирующих SERT после контактирования указанных клеток с тестируемой нуклеиновой кислотой.
Например, можно использовать SERT-специфичные миРНК, описанные в Mol. Psychiatry. 2005 Aug; 10(8): 782-9, 714 и J. Recept. Signal Transduct. Res. 2006; 26: 527-47. В еще более предпочтительном варианте осуществления SERT-специфичная миРНК содержит последовательность
5’CUCCUGGAACACUGGCAACdTdT3’ (SEQ ID NO: 13)
В еще одном варианте осуществления SERT-специфичные миРНК содержат последовательность, указанную в Таблице X.
Помимо предсинаптического 5-HT1A также возможно модулирование действия 5-HT1A путем модулирования некоторых ионных каталов, которые находятся после действия 5-HT1A, таких как TREK-1 или GIRK. Эти каналы модулируют активность нейронов посредством гиперполяризации мембраны, что приводит к большому притоку калия. Такое изменение потенциала мембраны ингибирует возбуждение нейронов. Было предположено, что агонисты TREK-1 или GirK будут увеличивать активность нейронов. Что в итоге нарушит ингибирующее действие предсинаптического 5-HT1A при высоком уровне серотонина.
В другом варианте осуществления нуклеиновая кислота изобретения направлена на мРНК, кодирующую ионный канал, действующий после действия 5-HT1A (при этом действие нуклеиновой кислоты происходит путем спаривания оснований с мишенью) или, на ионный канал, действующий после действия 5-HT1A, как таковой (при этом нуклеиновая кислота действует как аптамер путем непосредственного связывания и ингибирования активности полипептида). Эти каналы модулируют активность нейронов посредством гиперполяризации мембраны, что приводит к большому притоку калия. Такое изменение потенциала мембраны ингибирует возбуждение нейронов. Что в итоге нарушает ингибирующее действие предсинаптического 5-HT1A при высоком уровне серотонина. В предпочтительном варианте осуществления ионный канал, действующий после 5-HT1A, представляет собой TREK-1 или GIRK.
Используемый в данном документе термин "TREK-1" относится к полипетиду, известном также под названием KCNK2, TREK, TPKC1, К2р2.1, TREK1, hTREK-1c, hTREK-1e, MGC126742, MGC126744 или KCNK2, который представляет собой фоновый калиевый канал двухпорового домена, образованный двумя гомодимерами, создающими канал, который пропускает калий из клетки, регулируя остаточный потенциал мембраны. Однако канал может открываться некоторыми анестетиками, при растяжении мембраны, внутриклеточном ацидозе и нагреве. У людей имеются три изоформы, возникающие в результате альтернативного сплайсинга гена TREK, которые представлены в базе данных НЦБИ под инвентарными номерами NP_001017424.1, NP_001017425.2 и NP_055032.1. Отрологичные гены TREK-1 собаки (Canis familiaris), шимпанзе (Pan troglodytes), коровы (Bos taurus), крысы (Rattus norvegicus) и мыши (Mus musculus) представлены в базе данных НЦБИ под инвентарными номерами ХР_849278, ХР_001171677, NP_777111, NP_742038 и NP_034737, соответственно. По аналогии с нуклеиновыми кислотами, направленными на кДНК 5-HT1AR, любая область в кДНК TREK-1 может становиться мишенью в той мере, насколько она приводит к существенному ингибированию уровня соответствующей мРНК или белка, кодируемого указанной мРНК. Таким образом, подходящие TREK-1 - специфичные нуклеиновые кислоты могут быть идентифицированы так, как описано выше, путем измерения уровня мРНК TREK-1 или белка TREK-1 в клетках, экспрессирующих TREK-1 после контактирования указанных клеток с тестируемой нуклеиновой кислотой.
К TREK-1-специфичным миРНК, которые могут быть использованы в конъюгатах настоящего изобретения, относятся, помимо прочего, sc-37180 миРНК, обеспечиваемая компанией Santa Cruz Biotechnology, и антисмысловые молекулы, описанные в патенте США №2009317811.
Используемые в данном документе термины, сопряженные с G-белком калиевые каналы внутреннего выпрямления, GIRK или Kir3.x относятся к любому члену семейства ионных калиевых каналов внутреннего выпрямления, которые активируются (открываются) посредством каскада сигнальной трансдукции, начинающегося с лиганда, возбуждающегося сопряженные с G-белком рецепторы (GPCR). GPCR, в свою очередь, выделяют активированные βγ субъединицы G белка (Gβγ) из неактивных комплексов гетеротримерных G-белков (Gαβγ). В конечном итоге, Gβγ димерный белок взаимодействует с GIRK каналами, открывая их так, что они становятся проницаемыми для ионов калия, приводя к гиперполяризации клетки. Сопряженные с G-белком калиевые каналы внутреннего выпрямления относятся к типу ионных каналов, регулируемых G-белком, по причине данной прямой активации GIRK каналов G-белковыми субъединицами.
К подходящим GIRK относятся, помимо прочего, все члены подсемейства J, в том числе член 3 (также известный под названием GIRK1 или Kir3.1), например, человеческий GIRK1, соответствующий нуклеиновой кислоте, идентифицируемой в базе данных НЦБИ под инвентарным номером U39196 или его мозговой вариант под названием GIRKd, член 6 (также известный под названием GIRK2 или Kir3.2), например, человеческий GIRK2, соответствующий нуклеиновой кислоте, идентифицируемой в базе данных НЦБИ под инвентарным номером U24660, член 9 (также известный под названием GIRK3 или Kir3.3), например, человеческий GIRK3, соответствующий нуклеиновой кислоте, идентифицируемой в базе данных НЦБИ под инвентарным номером U52152, член 5 (также известный под названием GIRK4 или Kir3.4), например, человеческий GIRK4, соответствующий нуклеиновой кислоте, идентифицируемой в базе данных НЦБИ под инвентарным номером U39195, член 2 (также известный под названием IRK1 или Kir2.1), например, человеческий IRK1, соответствующий нуклеиновой кислоте, идентифицируемой в базе данных НЦБИ под инвентарным номером U24055, и член 4 (также известный под названием IRK3 или Kir2.3), например, человеческий IRK3, соответствующий нуклеиновой кислоте, идентифицируемой в базе данных НЦБИ под инвентарным номером U07364.
К подходящим нуклеиновым кислотам, способным нацеливаться на GIRK, относятся, например, рибозимы, антисмысловые молекулы, описанные в WO 2005054848.
Те нуклеиновые кислоты, которые нацеливаются на мРНК 5-HT1AR или 5-HT1AR белок, мРНК или белок SERT, мРНК или белок TREK-1 или мРНК или белок GIRK, предпочтительно спариваются с агентом селективности, который способен связываться с переносчиком нейромедиатора, присутствующим в клетках, в которых экспрессирется 5-HT1AR, SERT, TREK-1 или GIRK, а именно, в дофаминергических нейронах. Соответственно, конъюгаты настоящего изобретения содержат 5-HT1AR-специфичную нуклеиновую кислоту, SERT-специфичную нуклеиновую кислоту, TREK1-специфичную нуклеиновую кислоту или GIRK-специфичную нуклеиновую кислоту, которая соединяется с агентом селективности, способным связываться с переносчиком серотонина, которым может являться неселективный переносчик серотонина (такой ИОЗС или ИОЗСН), или, более предпочтительно, селективный ингибитор обратного захвата серотонина (СИОЗС).
В другом варианте осуществления нуклеиновая кислота, составляющая часть конъюгатов изобретения, направлена на синуклеин.
Используемый в данном документе термин "синуклеин" относится к полипептиду из семейства синуклеинов, который содержит высококонсервативный альфа-спиральный липид-связывающий мотив, обладающий схожестью с липид-связывающими доменами класса А2 взаимозаменяемых аполипопротеинов, которые способны образовывать внутриклеточные агрегаты, известные как тельца Леви, проявляющиеся при некоторых нервных заболеваниях, таких как болезнь Паркинсона, болезнь Альцгеймера и болезнь телец Леви. Термин "синуклеин" относится к α-синуклеину, β-синуклеину или γ-синуклеину. В предпочтительном варианте осуществления нуклеиновые кислоты, составляющие часть конъюгатов изобретения, специфичны к α-синуклеину.
Последовательности человеческого, крысиного, мышиного или бычьего α-синуклеина представлены в базе данных SwissProt под инвентарными номерами Р37840, Р37377, O55042 и Q3T0G8, соответственно. По аналогии с нуклеиновыми кислотами, направленными на кДНК 5-HT1AR, α-синуклеин-специфичные нуклеиновые кислоты могут быть идентифицированы или выбраны по любому вышеописанном способу и протестированы на способность вызывать существенное ингибирование уровня соответствующей мРНК или белка, кодируемого указанной мРНК. Таким образом, подходящие α-синуклеин-специфичные нуклеиновые кислоты могут быть идентифицированы так, как описано выше, путем измерения уровня мРНК α-синуклеина или белка α-синуклеина в клетках, экспрессирующих α-синуклеин после контактирования указанных клеток с тестируемой нуклеиновой кислотой.
В предпочтительном варианте осуществления α-синуклеин-специфичные нуклеиновые кислоты направлены на область человеческой α-синуклеин-кДНК. В другом варианте осуществления нуклеиновая кислота изобретения направлена на мРНК, кодирующую ионный канал, действующий после действия 5-HT1A (при этом действие нуклеиновой кислоты происходит путем спаривания оснований с мишенью) или, на ионный канал, действующий после действия 5-HT1A, как таковой (при этом нуклеиновая кислота действует как аптамер путем непосредственного связывания и ингибирования активности полипептида). Эти каналы модулируют активность нейронов посредством гиперполяризации мембраны, что приводит к большому притоку калия. Такое изменение потенциала мембраны ингибирует возбуждение нейронов. Что в итоге нарушает ингибирующее действие предсинаптического 5-HT1A при высоком уровне серотонина. В предпочтительном варианте осуществления ионный канал, действующий после 5-HT1A, представляет собой TREK-1.
К подходящим областям-мишеням в α-синуклеин-мРНК относятся, помимо прочего, те области, что описаны в WO 07135426 (например, нуклеиновые кислоты и, в частности, миРНК, содержащие последовательность, выбранную из группы миРНК, описанных в WO 2006039253, такую как
5’-GGAAAGACAAAAGAGGUGdTdT-3’ SEQ ID NO: 16
5’-GGAAAGACAAAAGAGGUGdTdT-3’ SEQ ID NO: 17
5’-GGAGGAAUUUUAGAAGAGGdTdT-3’ SEQ ID NO: 18
5’-UGUUGGAGGAGCAGUGGUGdTdT-3’ SEQ ID NO: 19
5’-GGACCAGUUGGGCAAGAAUdTdT-3’ SEQ ID NO: 20
или шпилечные олигонуклеотиды с последовательностью
5’-GATCCCCGGACCAGTTGGGCAAGAATTTCAAGAGAATTCTTGCCAACTGGTCCTTTTTGGAAA-3’
и
5’-CTAGTTTCCAAAAAGGACCAGTTGGGCAAGAATTCTCTTGAAATTCTTGCCCAACTGGTCCGGG-3’
соответствующие последовательностям SEQ ID NO: 21 и 22, соответственно.
Другие последовательности синуклеин-специфичных миРНК - это последовательности, описанные в заявке на патент США №2008139799 (последовательности, показанные в примере XVII, содержание которых включено при сем по ссылке) и последловательности миРНК, описанные в WO 2009079399, выбранные из:
5’-GGUGUGGCAACAGUGGCUGAG-3’ SEQ ID NO: 23
5’-AACAGUGGCUGAGAAGACCAA-3’ SEQ ID NO: 24
5’-AUUGCAGCAGCCACUGGCUUU-3’ SEQ ID NO: 25
5’-AAGUGACAAAUGUUGGAGGAG-3’ SEQ ID NO: 26
5’-GAAGAAGGAGCCCCACAGGAA-3’ SEQ ID NO: 27
5’-CGGGUGUGACAGCAGUAGCdTdT-3’ SEQ ID NO: 28
5’-UCCUGACAAUGAGGCUUAUdTdT-3’ SEQ ID NO: 29
5’-U*CCUGACAAUGAGGCUUAUdT*dT-3’ SEQ ID NO: 30
5’-CUACGAACCUGAAGCCUAAdTdT-3’ SEQ ID NO: 31
5’-C*UACGAACCUGAAGCCUAAdT*dT-3’ SEQ ID NO: 32
5’-C*UACGAACCUGAAGCCUAAdT*dT-3’ SEQ ID NO: 33
5’-CUAUUGUAGAGUGGUCUAUdTdT-3’ SEQ ID NO: 34
5’-C*UAUGAGCCUGAAGC*UAAT*T-3’ SEQ ID NO: 35
5’-C*UAUGAGCCUGAAGCCUAAT*T-3’ SEQ ID NO: 36
где * обозначает тиофосфатную связь, подчеркнутые нуклеотиды обозначают 2’-O-Ме модификацию.
Эти последовательности предпочтительно спарены с агентом селективности, который способен связываться с переносчиком нейромедиатора, присутствующим в клетках, в которых экспрессируется синуклеин. Соответственно, конъюгаты изобретения содержат синуклеин-специфичную нуклеиновую кислоту, которая связана с агентом селективности, способным участвовать в интернализации в моноаминергические нейроны. Соответственно, нуклеиновые кислоты, направленные на мРНК или белок синуклеина, связаны с агентом селективности, способным стимулировать интернализацию указанной нуклеиновой кислоты в серотонинергические, норадренергические и/или дофаминергические нейроны. Таким образом, в предпочтительном варианте осуществления синуклеин-специфичная нуклеиновая кислота связана с агентом селективности в отношении серотонинергических, норадренергических и дофаминергических нейронов, который выбран из группы, состоящей из ингибитора обратного захвата дофамина (ИОЗД), ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), или ингибитора обратного захвата серотонина, норэпинефрина и дофамина (ИОЗСНД или тройной блокатор).
В другом варианте осуществления нуклеиновая кислота, составляющая часть конъюгатов изобретения, направлена на синтазу оксида азота (СОА-NOS).
Используемый в данном документе термин "синтаза оксида азота" или "СОА" означает природный фермент, который катализирует in vitro синтез оксида азота. Оксид азота (NO) синтезируется из гуанидиновой группы L-аргинина семейством ферментом под названием синтаза оксида азота (СОА). Этот термин применяется ко всем изоформам синтазы оксида азота (СОА), найденным в живых системах, и включает, помимо прочего, конститутивную форму СОА, эндотелиальную синтазу оксида азота (эСОА), нейрональную синтазу оксида азота (нСОА) и индуцибельную синтазу оксида азота (иСОА).
Последовательности человеческой, крысиной, мышиной, собачье и бычьей иСОА представлены в базе данных SwissProt под инвентарными номерами Р35228, Q06518, Р29477, O62699 и Q27995, соответственно. Последовательности человеческой, крысиной, мышиной и бычьей эСОА представлены в базе данных SwissProt под инвентарными номерами Р29474, Q62600, Р70313 и Р29473, соответственно. Последовательности человеческой, крысиной, мышиной и бычьей нСОА представлены в базе данных SwissProt под инвентарными номерами Р29475, Р29476, Q9Z0J4 и Р29473, соответственно.
Любая область в кДНК СОА может становиться мишенью в той мере, насколько она приводит к существенному ингибированию уровня соответствующей мРНК или белка, кодируемого указанной мРНК. Таким образом, подходящие СОА-специфичные нуклеиновые кислоты могут быть идентифицированы так, как описано выше, путем измерения уровня мРНК СОА или белка СОА в клетках, экспрессирующих СОА после контактирования указанных клеток с тестируемой нуклеиновой кислотой, или путем определения активности СОА в обрабатываемых клетках. Активность СОА может быть измерена любым известным в данной области техники способом определения активностей иСОА, эСОА и нСОА в зависимости от конкретного случая. Например, активность СОА может быть определена путем измерения превращения [3H]-аргинина в [3Н] L-цитруллин радиометрическим способом или по образованию оксида азота с помощью анализа реактивом Грисса.
К подходящим СОА-специфичным подавляющим экспрессию веществам относятся, помимо прочего, нСОА-специфичные миРНК, описанные в WO 08100591 и полученные посредством следующих полинуклеотидных пар:
- CAAAGAGATCGACACCATC (SEQ ID NO: 58) (смысловая),
GATGGTGTCGATCTCTTTGTT (SEQ ID NO: 59) (антисмысловая);
- CACGCATGTCTGGAAAGGC (SEQ ID NO: 60) (смысловая) и
GCCTTTCCAGACATGCGTGTT (SEQ ID NO: 61) (антисмысловая);
- GGTCTATCCAATGTCCACA (SEQ ID NO: 62) (смысловая) и
TGTGGACATTGGATAGACCTT (SEQ ID NO: 63) (антисмысловая)
- иСОА-специфичная миРНК с последовательностью
5’-CCACCAGTATGCAATGAAT-3’ (SEQ ID NO: 64)
- эСОА-специфичная миРНК, доступная от фирмы Invitrogen (Carlsbad, СА), с олиго-идентификационными номерами HSS 107326, HSS 107327 и S 107328.
- иСОА-специфичные миРНК, описанные в таблице 2 в Fang et al. (RNA, 2010, 16: 1429-1435).
- иСОА-специфичные миРНК с последовательностями
5’-ACAACAGGAACCUACCAGCTT-3’ (SEQ ID NO: 65) (смысловая) и
5’-GCUGGUAGGUUCCUGUUGUTT-3’ (SEQ ID NO: 66) (антисмысловая).
Иллюстративные и неограничительные примеры СОА-специфичных антисмысловых молекул, пригодных для использования в настоящем изобретении, включают:
- иСОА-специфичный антисмысловой олигонуклеотид с последовательностью
5’-ACAGCTCAGTCCCTTCACCAA-3’ (SEQ ID NO: 67), описанной в Grasso et al. (Exp. Biol. Med., 2003, 228: 491-8).
- иСОА-специфичный антисмысловой олигонуклеотид с последовательностью
5’-TTTGCCTTATACTGTTCC-3’ (SEQ ID NO: 68), описанной в Hemmrich et al. (Am. J. Physiol. Cell Physiol., 2003, 285: C489-C498).
- иСОА-специфичные антисмысловые олигонуклеотиды, описанные WO 0152902 в Таблицах 1 и 2.
- иСОА-специфичные антисмысловые молекулы, описанные в таблице 1 в Fang et al. (RNA, 2010, 16: 1429-1435).
СОА-специфичные подавляющие экспрессию вещества предпочтительно спарены с агентом селективности, который способен связываться с переносчиком нейромедиатора, присутствующим в клетках, в которых экспрессируется СОА. Соответственно, конъюгаты изоберетения содержат СОА-специфичную нуклеиновую кислоту, которая связана с агентом селективности, способным участвовать в интернализации в моноаминергические нейроны. Соответственно, нуклеиновые кислоты, направленные на мРНК или белок синуклеина, связаны с агентом селективности, способным стимулировать интернализацию указанной нукелиновой кислоты в серотонинергические, норадренергические и/или дофаминеригческие нейроны. Таким образом, в предпочтительном варианте осуществления синуклеин-специфичная нуклеиновая кислота связана с агентом селективности в отношении серотонинергических, норадренергических и дофаминергических нейронов, который выбран из группы, состоящей из ингибитора обратного захвата дофамина (ИОЗД), ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), или ингибитора обратного захвата серотонина, норэпинефрина и дофамина (ИОЗСНД или тройной блокатор).
В другом варианте осуществления нуклеиновая кислота, составляющая часть конъюгатов изобретения, направлена на переносчик норадреналина.
Термины "переносчик норадреналина", "NAT", "переносчик норэпинефрина" или "NET" используются в данном документе взаимозаменяемо в отношении транспортера моноамина, который переносит нейромедиаторы норэпинефрин (норадреналин) и дофамин из синапса обратно к его везикулам с целью хранения до более позднего использования. NET состоит из 617 аминокислот по длине, содержит 12 трансмембранных доменов и кодируется геном SLC6A2.
Последовательности переносчиков норэпинефрина человека, собаки (Canis familiaris), шимпанзе (Pan troglodytes), коровы (Bos taurus), крысы (Rattus norvegicus) и мыши (Mus musculus) представлены в базе данных НЦБИ под инвентарными номерами Р23975, ХМ_544398.2, ХМ_001167680.1, NM_174608.2, NM_031343.1 и NM_009209.2, соответственно. Любая область в кДНК NET может становиться мишенью в той мере, насколько она приводит к существенному ингибированию уровня соответствующей мРНК или белка, кодируемого указанной мРНК. Таким образом, подходящие NET-специфичные нуклеиновые кислоты могут быть идентифицированы так, как описано выше, путем измерения уровня мРНК NET или белка NET в клетках, экспрессирующих NET после контактирования указанных клеток с тестируемой нуклеиновой кислотой.
К подходящим NET-специфичным нуклеиновым кислотам относятся, помимо прочего, любая SLC6A2-специфичная РНКи, например, РНКи, доступные от фирмы Invitrogen под инвентарными номерами HSS109852, HSS109853 и HSS185858.
В другом варианте осуществления нуклеиновая кислота, составляющая часть конъюгатов изобретения, направлена на дофамин-β-гидроксилазу.
Используемый в данном документе термин "дофамин-β-гидроксилаза" относится к полипептиду, который способен превращать дофамин в норэпинефрин.
Последовательности человеческой, крысиной, мышиной или бычьей дофамин-β-гидроксилазы представлены в базе данных белков НЦБИ под инвентарными номерами NP_000778, NP_037290, NP_620392 и NP_851338, соответственно. По аналогии с нуклеиновыми кислотами, направленными на другие нуклеиновые кислоты согласно изобретению, любая область в кДНК дофамин-β-гидроксилазы может становиться мишенью в той мере, насколько она приводит к существенному ингибированию уровня соответствующей мРНК или белка, кодируемого указанной мРНК. Таким образом, подходящие нуклеиновые кислоты, специфичные к дофамин-β-гидроксилазе, могут быть идентифицированы так, как описано выше, путем измерения уровня мРНК или белка дофамин-β-гидроксилазы в клетках, экспрессирующих дофамин-β-гидроксилазу после контактирования указанных клеток с тестируемой нуклеиновой кислотой.
К подходящим нуклеиновым кислотам, специфичным к дофамин-β-гидроксилазе, относятся, помимо прочего, нуклеиновая кислота, описанная в WO 2008019159, с последовательностью
5’-GACCACGUACUGGUGCUACAUTA-3’ (SEQ ID NO: 37)
А также коммерчески доступные нуклеиновые кислоты, специфичные к дофамин-β-гидроксилазе, например, дофамин-β-гидроксилаза-специфичная миРНК, доступная от фирмы Santa Cruz Biotechnology (№ по каталогу sc-35180), от фирмы Invitrogen (№ по каталогу HSS175953, HSS175954 и HSS175955), от фирмы Abnova (№ по каталогу Н00001621-R01), фирмы Applied Biosystems (миРНК с идентификационными номерами s3946, s3947 и s3945).
Нуклеиновые кислоты, направленные на мРНК или белок дофамин-β-гидроксилазы, предпочтительно спарены с агентом селективности, который способен связываться с переносчиком нейромедиатора, присутствующим в клетках, в которых экспрессируется дофамин-β-гидроксилаза и в которых для уменьшения недостатка нейромедиатора, вызывающего определенное патологическое расстройство, необходимо уменьшение количества дофамин-β-гидроксилазы. Соответственно, конъюгаты изоберетения содержат дофамин-β-гидроксилаза-специфичную нуклеиновую кислоту, которая спарена с агентом селективности, способным связываться с ингибитором обратного захвата норэпинефрина (ИОЗН).
В другом варианте осуществления нуклеиновая кислота, составляющая часть конъюгатов изобретения, специфична к ВАХ. Используемый в данном документе термин "ВАХ" или "BCL2-ассоциированный Х белок" относится к члену проапоптозного семейства BCL-2, активация которого включает субклеточную транслокацию и димеризацию. В жизнеспособных клетках существенная доля BCL2-ассоциированного Х белка является мономерной и либо находится в цитозоле, либо слабо связана с мембранами. После смертельного возбуждения цитозольный мономерный BCL2-ассоциированный Х белок транслоцируется в митохондрии, где он превращается в сшиваемый интегральный белок мембраны. Способность BCL2-ассоциированного Х белка образовывать отчетливые ион-проводящие поры мембраны может быть объяснено отчасти нарушением функции митохондрии, приводящей к смерти клеток (Korsmeyer et al., Cold Spring Harb. Symp. Quant. Biol., 1999, 64, 343-350; Korsmeyer et al., Cell Death Differ., 2000, 7, 1166-1173). Термин "ВАХ" относится к любому из его сплайс-вариантов, включая ВАХ-альфа (инвентарный номер в GenBank L22473), ВАХ-бета (инвентарный номер в GenBank NM004324), ВАХ-гамма (Oltvai et al., Cell, 1993, 74, 609-619), BAX-дельта (инвентарный номер в GenBank AI382305) (Apte et al., Genomics, 1995, 26, 592-594), ВАХ-омега (инвентарный номер в GenBank AF008196) (Zhou et al., J. Biol. Chem., 1998, 273, 11930-11936) и ВАХ-эпсилон (инвентарный номер в GenBank AF007826) (Shi et al., Biochem. Biophys. Res. Commun., 1999, 254, 779-785). Последовательности нуклеотидов, кодирующие ВАХ-альфа, ВАХ-бета и ВАХ-гамма, раскрыты и заявлены в патентах США №5691179 и №5955595. Последовательности нуклеотидов, кодирующие ВАХ-омега, раскрыты и заявлены в патенте США №6140484 и соответствующей публикации согласно РСТ WO 97/01635. Также в патенте США №6140484 раскрывается 22-мерный антисмысловой олигонуклеотид, направленный против сочленения экзон5-интрон5 человеческого ВАХ-омега.
К ВАХ-специфичным нуклеиновым кислотам, пригодным для использования в конъюгатах согласно настоящему изобретению, относятся:
- последовательность 5’-UCGAUCCUGGAUGAAACCCtg-3’(SEQ ID NO: 38) (описанная в CN 101255422),
- Антисмысловые олигонуклеотиды, нацеленные на основания 83-102 и 103-122 человеческого ВАХ, как описано в Manfredini et al., Antisense Nucleic Acid Drug Dev., 1998, 8, 341-350, и нейтрофилы (Dibbert et al., Proc. Natl. Acad. Sci. U.S.A., 1999, 96, 13330-13335).
- Любая из последовательностей, раскрытых в заявке на патент США US 20040077583 (Таблицы 1 и 3), содержание которых включено в данный документ по ссылке.
Нуклеиновые кислоты, направленные на мРНК или белок ВАХ, предпочтительно спарены с агентом селективности, который способен связываться с переносчиком нейромедиатора, присутствующим в клетках, в которых экспрессируется синуклеин. Соответственно, конъюгаты изоберетения содержат ВАХ-специфичную нуклеиновую кислоту, которая связана с агентом селективности, способным участвовать в интернализации в серотонинергические, норадренергические и дофаминергические нейроны. Таким образом, в предпочтительном варианте осуществления агент селективности выбран из группы, состоящей из ингибитора обратного захвата дофамина (ИОЗД) или ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), или ингибитора обратного захвата серотонина, норэпинефрина и дофамина (ИОЗСНД или тройной блокатор).
В другом варианте осуществления нуклеиновые кислоты конъюгатов изобретения направлены на мРНК или белок тау-белков, ассоциированных с микротрубочками. Термин "тау" относится к любому белку из семейства тау-белков, включая, помимо прочего, природный мономер тау-белка, тау-белки-предшественники, тау-пептиды, тау-интермедиаты, метаболиты и тау производные любого происхождения, в том числе от человека (Р10636), собаки (ХМ_844939), шимпанзе (NM_001009068.1), мыши (Z12133), данио (BI981282.1) и С.Elegans (NM_001027407.2), которые способны подвергаться гипер-фосфорилированию, приводящему к самосборке клубков спаренных спиральных нитей и прямых нитей, которые участвуют в патогенезе болезни Альцгеймера и других тау-патологиях.
К подходящим тау-специфичным нуклеиновым кислотам относятся, помимо прочего:
- миРНК, описанные в WO 2005118858, с последовательностями
5’-AATCACACCCAACGTGCAGAA-3’ (SEQ ID NO: 39) и
5’-AACTGGCAGTTCTGGAGCAAA-3’ (SEQ ID NO: 40)
- миРНК, описанные в заявке на патент США №2004241854, с последовательностями
- тау-специфичные антисмысловые нуклеиновые кислоты, описанные Caceres et al. (J. Neuroscience, 1991, 11: 1515-1523, с последловательностями:
GGTTCAGCCATGCTGCTTCAAAGCC SEQ ID NO: 53 и
TGATAATCGACAGGAGGCGAGGACA SEQ ID NO: 54
Нуклеиновые кислоты, направленные на тау мРНК или белок, предпочтительно спарены с агентом селективности, который способен связываться с переносчиком нейромедиатора, присутствующим в клетках, в которых экспрессируется Тау. Соответственно, конъюгаты изоберетения содержат Тау-специфичную нуклеиновую кислоту, которая связана с агентом селективности, способным участвовать в интернализации в моноаминергические нейроны, в частности, в серотонинергические, норадренергические и дофаминергические нейроны. Таким образом, в предпочтительном варианте осуществления агент селективности выбран из группы, состоящей из ингибитора обратного захвата дофамина (ИОЗД) или ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), или ингибитора обратного захвата серотонина, норэпинефрина и дофамина (ИОЗСНД или тройной блокатор).
В другом варианте осуществления нуклеиновые кислоты конъюгатов изобретения направлены на мРНК или белок Хантингтин. Термин "Хантингтин" относится к белку массой 350 кДа с неизвестной функцией, представленному в базе данных UniPortKB под инвентарным номером Р42858, а также к белкам, кодируемым последловательностью нуклеиновой кислоты, депонированной под инвентарным номером L12392, и ее ортологам, найденным у собаки (инвентарный номер в базе данных НЦБИ ХР_536221.2), шимпанзе (инвентарный номер в базе данных НЦБИ ХР_517080.2), коровы (инвентарный номер в базе данных НЦБИ ХР_871851.2), крысы (инвентарный номер в базе данных НЦБИ ХР_573634.1) или мыши (инвентарный номер в базе данных НЦБИ NP_034544.11), а также его вариантам, возникающим в результате увеличения CAG повторений (CAG6-37 повторения в белке дикого типа - CAG35-121 повторения в мутантном белке). Увеличение CAG приводит к образованию мутантного белка, где увеличение происходит в полиглутаминовом тракте в белке хантингтин.
К подходящим хантингтин-специфичным нуклеиновым кислотам относятся, помимо прочего, антисмысловые олигонуклеотиды, описанные в Таблицах 4 и 5 в заявке на патент США №2008039418 А, а также в Таблицах 1, 2, 7, 8, 9 и 10 в патенте США №7320965, миРНК, описанная в заявке на патент США №2005042646 А и имеющая последовательность
5’-AAGAGGAGGAGGCCGACGCCC-3’ (SEQ ID NO: 55)
Нуклеиновые кислоты, направленные на мРНК или белок Хантингтин, предпочтительно спарены с агентом селективности, который способен связываться с переносчиком нейромедиатора, присутствующим в клетках, в которых экспрессируется Хантингтин. Соответственно, конъюгаты изоберетения содержат Хантингтин-специфичную нуклеиновую кислоту, которая связана с агентом селективности, способным участвовать в интернализации в моноаминергические нейроны, в частности, в серотонинергические, норадренергические и дофаминергические нейроны. Таким образом, в предпочтительном варианте осуществления агент селективности выбран из группы, состоящей из ингибитора обратного захвата дофамина (ИОЗД) или ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), или ингибитора обратного захвата серотонина, норэпинефрина и дофамина (ИОЗСНД или тройной блокатор).
Подходящие комбинации агента селективности и нуклеиновых кислот согласно настоящему изобретению приведены вкратце в Таблице 1.
А.3. Линкерные области конъюгатов изобретения
Нуклеиновая кислота и агент селективности могут быть связаны непосредственно. Однако, предпочтительно, чтобы обе компоненты были связаны через соединяющую группу.
Термины "соединяющая группа" и "линкер" являются грамматическими эквивалентами и используются в данном документе для обозначения органической частицы, соединяющей две части соединения. Агент селективности может быть прикреплен к любому смысловому или антисмысловому нуклеотиду в нуклеиновой кислоте, но предпочтительно связан через 3’-концевой нуклеотид и/или 5’-концевой нуклеотид. Внутренний конъюгат может быть присоединен непосредственно или опосредованно через линкер к нуклеотиду в положении 2’ рибозной группы или в другом подходящем положении.
В случае, когда нуклеиновая кислота является двухцепочечной нуклеиновой кислотой, конъюгат может быть присоединен к смысловому 3’-концевому нуклеотиду, смысловому 5’-концевому нуклеотиду, антисмысловому 3’-концевому нуклеотиду и/или антисмысловому 5’-концевому нуклеотиду.
Не стремясь ограничиться определениями или допущениями, в данной заявке длина линкера описывается путем подсчета числа атомов, которые находятся на самом коротком расстоянии между атомом, который соединяет компонент конъюгата с линкером, и атомом кислорода терминальной фосфатной группы, связанной с олигонуклеотидом, посредством которого линкер присоединяется к олигонуклеотиду. В случае, когда линкер содержит одну или несколько циклических структур, подсчет атомов предпочтительно ведется вокруг цикла, который представляет собой кратчайшее расстояние.
К линкерным группам, подходящим для использования в настоящем изобретении, относятся, помимо прочего, модифицированные или немодифицированные нуклеотиды, нуклеозиды, полимеры, сахара, углеводы, полиалкилены, такие как полиэтиленгликоли и полипропиленгликоли, полиспирты, полипропилены, смеси этилен- и пропиленгликолей, полиалкиламины, полиамины, такие как полилизин и спермидин, сложные полиэфиры, такие как поли(этилакрилат), полифосфодиэфиры, алифатические углеводороды и алкены. Более того, химические составы линкера(ов), которые включает омега-амино-1,3-диолы, омега-амино-1,2-диолы, гидроксипролинолы, омега-амино-алканолы, диэтаноламины, омега-гидрокси-1,3-диолы, омега-гидроки-1,2-диолы, омега-тио-1,3-диолы, омега-тио-1,2-диолы, омега-карбокси-1,3-диолы, омега-карбокси-1,2-диолы, со-гидрокси-алканолы, омега-тио-алканолы, омега-карбокси-алканолы, функционализированные олигоэтиленгликоли, аллиламин, акриловая кислота, аллиловый спирт, пропаргиламин, пропаргиловый спирт и т.д., могут применяться в данном контексте для образования линкеров подходящей длины.
Линкер может также придавать олигонуклеотидному конъюгату и другие необходимые свойства, такие как повышенная растворимость в воде, оптимальное расстояние между компонентом конъюгата и олигонуклеотидом, гибкость (или ее отсутствие), определенная ориентация, образование разветвлений и др.
Предпочтительно, указанная соединяющая группа имеет следующую структуру
в которой:
m, n и p выбраны из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 и 13,
при этом сумма m+n+р равна целому числу, выбранному из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 и 18, и
в которой k равняется 0 или 1.
В предпочтительном варианте осуществления p равняется 5, n-2, k-1, а m-6, при этом линкер имеет структуру

В другом предпочтительном варианте осуществления p равняется 5, n и k равняется 0, а m - 6, при этом линкер имеет структуру

В отдельном варианте осуществления линкер содержит более одной группы, связывающейся с агентом селективности. В предпочтительном варианте осуществления линкер является двухвалентным или трехвалентным, т.е. может связываться, соответственно, с 2 или 3 молекулами агента селективности.
В случае, когда с нуклеиновой кислотой через линкер связывается более одной молекулы агента селективности, указанные молекулы могут представлять собой одинаковые или различные агенты селективности.
В отдельном варианте осуществления двухвалентный или трехвалентный линкер имеет следующую формулу:

или
в которой:
m, m’, m’’, n, n’, n’’, p, p’, p’’, r, r’, r’’, s, s’, s’’, t, u выбраны независимо друг от друга из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 и 13;
k, k’, k’’, v выбраны независимо друг от друга из 0 и 1; а
X1, X2 и X3 выбраны независимо друг от друга из СН2, О, S, NH, СО, С(O)O и С(O)NH.
В зависимости от значения вышеуказанных групп, разветвленные линкеры могут быть симметричными или асимметричными.
В отдельном варианте осуществления линкер представляет собой двухвалентный линкер, показанный выше, в котором p и p’ равны 5, n и n’ - 2, k и k’ - 1, a m и m’ - 6. В отдельном варианте осуществления линкер представляет собой двухвалентный линкер, в котором p и p’ равны 5, n, n’, k и k’ равны 0, а m и m’ - 6.
В отдельном варианте осуществления линкер представляет собой двухвалентный линкер, показанный выше, в котором r и r’ равны 4, s и s’ - 1, t и v - 0, а X1 и X2 представляют собой С(O)NH. В другом варианте осуществления линкер представляет собой двухвалентный линкер, в котором r равно 2, r’ - 0, s - 1, s’ - 0, t и v - 0, а X1 и X2 представляют собой CH2.
В отдельном варианте осуществления линкер представляет собой двухвалентный линкер, в котором p и p’ равняются 5, n и n’ - 2, k и k’ - 1, m и m’ - 6, r и r’ - 4, s и s’ - 1, t и v - 0, а X1 и X2 представляют собой С(O)NH. В другом варианте осуществления линкер представляет собой двухвалентный линкер, в котором p и p’ равняются 5, n и n’ - 2, k и k’ - 1, m и m’ - 6, r - 2, r’ - 0, s - 1, s’ - 0, t и v - 0, а X1 и X2 представляют собой CH2.
В другом варианте осуществления линкер представляет собой двухвалентный линкер, в котором p и p’ равняются 5, n, n’, k и k’ - 0, m и m’ - 6, r и r’ - 4, s и s’ - 1, t и v - 0, а X1 и X2 представляют собой C(O)NH.
В другом варианте осуществления линкер представляет собой двухвалентный линкер, в котором p и p’ равняются 5, n, n’, k и k’ - 0, m и m’ - 6, r - 2, r’ - 0, s - 1, s’ - 0, t и v - 0, а X1 и X2 представляют собой CH2.
В отдельном варианте осуществления линкер представляет собой трехвалентный линкер, показанный выше, в котором p, p’ и p’’ равны 5, n, n’, и n’’ - 2, k, k’ и k’’ - 1, a m, m’ и m’’ - 6. В отдельном варианте осуществления линкер представляет собой трехвалентный линкер, в котором p, p’ и p’’ равны 5, n, n’, n’’, k, k’ и k’’ - 0, а m, m’ и m’’ - 6.
В отдельном варианте осуществления линкер представляет собой трехвалентный линкер, показанный выше, в котором r, r’ и r’’ равны 3, s, s’ и s’’ - 1, t - 1, v - 0, а X1, X2 и X3 представляют собой О. В другом варианте осуществления линкер представляет собой трехвалентный линкер, в котором r, r’ и r’’ равны 3, s, s’ и s’’ - 1, t - 1, u - 3, v - 1, а X1, X2 и X3 представляют собой О.
В отдельном варианте осуществления линкер представляет собой трехвалентный линкер, в котором p, p’, p’’ равняются 5, n, n’, n’’ - 2, k, k’, k’’ - 1, m, m’, m’’ - 6, r, r’, r’’ - 3, s, s’, s’’ - 1, t - 1, v - 0, a X1, X2 и Х3 представляют собой О.
В другом варианте осуществления линкер представляет собой трехвалентный линкер, в котором p, p’, p’’ равняются 5, n, n’, n’’ - 2, k, k’, k’’ - 1, m, m’, m’’ - 6, r, r’, r’’ - 3, s, s’, s’’ - 1, t - 1, u - 3, v - 1, a X1, X2 и Х3представляют собой О.
В другом варианте осуществления линкер представляет собой трехвалентный линкер, в котором p, p’, p’’ равняются 5, n, n’, n’’, k, k’, k’’ - 0, m, m’, m’’ - 6, r, r’, r’’ - 3, s, s’, s’’ - 1, t - 1, v - 0, а X1, X2 и X3 представляют собой О.
В другом варианте осуществления линкер представляет собой трехвалентный линкер, в котором p, p’, p’’ равняются 5, n, n’, n’’, k, k’, k’’ - 0, m, m’, m’’ - 6, r, r’, r’’ - 3, s, s’, s’’ - 1, t - 1, u - 3, v - 1, a X1, X2 и Х3представляют собой О.
А.4. Нацеливающие компоненты конъюгатов изобретения
Другой способ модификации конъюгатов изобретения включает химическое связывание одной или нескольких компонент или конъюгатов с нуклеиновой кислотой или защитной группой, что улучшает активность, клеточное распределение нуклеиновой кислоты или поглощение нуклеиновой кислоты клеткой. К таким компонентам относятся, помимо прочего, липидные вещества, такие как холестерин (Letsinger et al., Proc. Natl. Acid. Sci. USA, 199, 86, 6553-6556), холевая кислота (Manoharan et al., Biorg. Med. Chem. Let., 1994 4 1053-1060), тиоэфир, например, берил-3-тритилтиол (Manoharan et al., Ann. N.Y. Acad. Sci., 1992, 660, 306-309; Manoharan et al., Biorg. Med. Chem. Let., 1993, 3, 2765-2770), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20, 533-538), алифатическая углеводородная цепь, например, додекандиол или ундециловые остатки (Saison-Behmoaras et al., EMBO J, 1991, 10, 1111-1118; Kabanov et al., FEBS Lett., 1990, 259, 327-330; Svinarchuk et a/., Biochimie, 1993, 75, 49-54), фосфолипид, например, ди-гексадецил-рац-глицерин или триэтиламмоний 1,2-ди-О-гексадецил-рац-глицеро-3-Н-фосфонат (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654; Shea et al., Nucl. Acids Res., 1990, 18, 3777-3783), полиаминовая или полиэтиленгликолевая цепь (Manoharan et al., Nucleosides and Nucleotides, 1995, 14, 969-973) или адамантануксусная кислота (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654), пальмитильная компонента (Mishra et al., Biochim. Biophys. Acta, 1995, 1264, 229-237) или октадециламин или гексиламино-карбонилоксихолестериновая частица (Crooke et al., J. Pharmacol. Exp. Ther., 1996, 277, 923-937).
В качестве альтернативы, компонентой, способной улучшать клеточное распределение, может являться низкомолекулярное соединение или полипептид, который способен специфично переноситься через биологические барьеры за счет рецептор-опосредованного эндоцитоза с помощью специфичных переносчиков, присутствующих в указанных биологических барьерах. В данной области техники известны разнообразные рецепторы и носители обратного захвата с более широким набором рецептор-специфичных лигандов. К предпочтительным лигандам для рецепторов, которые участвуют в эндоцитозе и/или трансцитозе, для использования в соответствии с настоящим изобретением относятся, например, лиганды для или лиганды, которые специфически связываются с переносчиком тиамина, рецептор фолиевой кислоты, рецептор витамина В12, асиалогликопротеиновые рецепторы, альфа(2,3)-сиалогликопротеиновый рецептор (например, с FC5 и FC44 нанотелами, состоящими из однодоменных антител ламы (sdAb) в качестве рецептор-специфичных лигандов), рецепторы трансферрина-1 и трансферрина-2, фагоцитарные рецепторы (класса А или В, типа I, II или III, или CD36 или CD163), рецептор липопротеина низкой плотности (ЛНП), рецептор ЛНП-связанного белка 1 (LRP1, тип В), рецептор LRP2 (также известный под названием мегалин или гликопротеин 330), рецептор дифтерийного токсина (РДТ, который является мембран-связанным предшественником гепарин-связанного фактора роста, подобного эпидермальному фатору роста (ГС-ЭФР)), инсулиновый рецептор, рецептор инсулиноподобный фактор роста (ИФР), лептиновый рецептор, рецептор вещества Р, глутатионовый рецептор, глутаматные рецепторы и рецептор манноза-6-фосфата.
К предпочтительным лигандам, которые связываются с данными рецепторами, для использования в соответствии с настоящим изобретением относятся, например, лиганды, выбранные из группы, состоящей из: липопротеинлипаза (ЛПЛ), альфа2-макроглобулин (альфа2М), рецептор-связанный белок (РСБ), лактоферрин, десмотеплаза, тканевый активатор плазминогена и активатор плазминогена урокиназного типа (тАП/уАП), ингибитор активатора плазминогена (ИАП-1), комплексы тАП/уАП:ИАП-1, меланотрансферрин (или Р97), тромбоспондин 1 и 2, печеночная липаза, ингибитор фактора VIIa/ингибитор пути тканевого фактора (ИПТФ), фактор VIIIa, фактор IXa, Абетал-40, белок-предшественник амилоида-бета (БПА), С1-ингибитор, комлемент С3, аполипротеинЕ (ароЕ), синегнойный экзотоксин А, CRM66, ВИЧ-1 Tat белок, риновирус, матриксная металлопротеиназа 9 (ММП-9), ММП-13 (коллагеназа-3), белок активатора сфинолипида (БАС), белок зоны беременности, антитромбин III, кофактор гепарина II, альфа-1-антитрипсин, белок теплового шока 96 (БТШ-96), тромбоцитарный фактор роста (ТФР), аполипротеин J (apoJ или кластерин), АВЕТА, связанный с apoJ и ароЕ, апротинин, ангиопеп-1, липопротеин очень низкой плотности (ЛОНП), трансферрин, инсулин, лептин, инсулиноподобный фактор роста, эпидермальные факторы роста, лектины, пептидомиметик и/или гуманизированные моноклональные антитела или пептиды, специфичные к указанным рецепторам (например, последовательности HAIYPRH и THRPPMWSPVWP, которые связываются с человеческим трансферриновым рецептором или моноклональное антитело А24 против человеческого трансферринового рецептора (ТфР), гемоглобин, нетоксичная часть полипептидной цепи дифтерийного токсина, вся или часть цепи дифтерийного токсина В (в том числе DTB-His (описанный Spilsberg et al., 2005, Toxicon., 46(8): 900-6)), весь или часть нетоксичного мутанта дифтерийного токсина CRM197, аполипопротеин В, аполипопротеин Е (например, после связывания с полисорб-80 покрытием на наночастицах), витамин D-связывающий белок, витамин А/ретинол-связывающий белок, витамин В12/кобаламин плазменный белок-носитель cobalamin plasma carrier protein, глутатион и транскобаламин-В12.
А.5. Защитные группы
Нуклеиновые кислоты, составляющие часть конъюгатов изобретению, надлежит охранять от воздействия разрушающих факторов, таких как нуклеазы (эндо/экзонуклеазы), в процессе их транспорта через различные текучие среды и отделы организма. С этой целью конструируют олигонуклеотиды для противодействия ферментативному перевариванию и улучшения in vivo устойчивости и биодоступности олигонуклеотида. Предпочтительно, нуклеиновые кислоты химически модифицированы за счет наличия группы, препятствующей разложению, опосредованному нуклеазой.
Следует понимать, что для целей настоящего изобретения термины "кэп-структура" или "защитная группа" означают химические модификации, которые были введены в любой конец олигонуклеотида. К неограничительным примерам 5’-кэп структуры относятся АР-остаток (фрагмент), 4’,5’-метиленовый нуклеотид; 1-(бета-D-эритрофуранозил)нуклеотид, 4’-тионуклеотид, карбоциклический нуклеотид; 1,5-ангидрогекситный нуклеотид; L-нуклеотиды; альфа-нуклеотиды; нуклеотид с модифицированным основанием; фосфодитиоатная (дитиофосфатная) связь; трео-пентофуранозил нуклеотид; ациклический 3’,4’-секонуклеотид; ациклический 3,4-гидроксибутилнуклеотид; ациклический 3,5-дигидроксипентилнуклеотид, 3’-3’-инвертированный нуклеотидный фрагмент; 3’-3’-инвертированный фрагмент с удаленными азотистыми основаниями; 3’-2’-инвертированный нуклеотидный фрагмент; 3’-2’-инвертированный фрагмент с удаленными азотистыми основаниями; 1,4-бутандиолфосфат; 3’-фосфорамидат; гексилфосфат; аминогексилфосфат; 3’-фосфат; 3’-фосфотиоат; фосфодитиоат; или мостиковая или немостиковая метилфосфонатная группа. Подробности описаны в заявке WO 97/26270, включенной в данный документ по ссылке. 5’-кэп включает, например, 4’,5’-метиленовый нуклеотид; 1-(бета-D-эритрофуранозил)нуклеотид, 4’-тионуклеотид, карбоциклический нуклеотид; 5’-аминоалкилфосфат; 1,3-диамино-2-пропилфосфат, 3-аминопропилфосфат; 6-аминогексилфосфат; 1,2-аминододецилфосфат; гидроксипропилфосфат; 1,5-ангидрогексит нуклеотид; L-нуклеотид; альфа-нуклеотид; нуклеотид с модифицированным основанием; фосфодитиоаты; трео-пентофуранозил нуклеотид; ациклический 3’,4’-секонуклеотид; 3,4-гидроксибутилнуклеотид; 3,5-дигидроксипентилнуклеотид, 5’-5’-инвертированный нуклеотидный фрагмент; 5’-5’-инвертированный фрагмент с удаленными азотистыми основаниями; 5’-фосфоамидат; 5’-фосфодитиоат; 1,4-бутандиолфосфат, 5’-амино; мостиковый или немостиковый 5’-фосфоамидат, фосфотиоат и/или фосфоодитиоат, мостиковая или немостиковая метилфосфонатная и 5’-меркаптогруппа. См. также статью Beaucage и lyer, 1993, Tetrahedron 49, 1925, содержание которой включено в данный документ по ссылке.
В предпочтительном варианте осуществления кэп-структура, которая присоединена к нуклеиновой кислоте конъюгатов изобретения, имеют следующую общую формулу:
в которой:
М - это Н, липидный фрагмент или направляющая группа, определенная выше;
А и В представляют собой мономерные звенья, выбранные независимо из группы, состоящей из моносахарида и (С2-С20)-алкиленгликоля;
L1, L2 и L3 - это связующие соединения, независимо выбранные из группы, состоящей из фосфодиэфира, фосфотиоата, карбамата, метилфосфоната, гуанидиния, сульфамата, сульфамида, формацеталя, тиоформацеталя, сульфона, амида или их смесей;
а и b - это целые числа в пределах от 0 до 50;
с - это целое число в пределах от 0 до 30;
d - это целое число, которое составляет, по меньшей мере, 1;
Используемый в данном документе термин "липидная группа" относится к группе органических соединений, обладающих липофильными и амфифильными свойствами, к которым относятся, помимо прочего, жиры, жирные масла, эфирные масла, воски, стероиды, стероидные спирты, фосфолипиды, гликолипиды, сульфолипиды, аминолипиды, хромолипиды (липохромы) и жирные кислоты. Термин "липид" охватывает как природные, так синтетически полученные липиды. Липидные группы обычно повышают липофильные свойства олигонуклеотида и способствуют внутриклеточному захвату in vivo олигонуклеотидной конструкции. К липидам, подходящим для использования, относятся жирные кислоты, жиры, масла, воски, холестерин, стероидные спирты, жирорастворимые витамины, такие как витамин А, D, Е и К; моноглицериды, диглицериды и фосфолипиды. Предпочтительными являются жирные кислоты, выбранные из группы, состоящей из лауролеиновой кислоты (С12), миристиновой кислоты (С14), пальмитиновой кислоты (С16), стеариновой кислоты (С18), докозановой (бегеновой) кислоты (С22) и гибрида литохолевой кислоты и олеиламина (литохолевый-олеиламин, С43). Липид может быть выбран специалистом в данной области техники в зависимости от условий с учетом ткани-мишени, клетки-мишени, способа введения, пути, по которому, как ожидается, будет следовать олигонуклеотид, и т.д.
Используемый в данном документе термин "моносахарид" общеизвестен в данной области техники и относится к обычной форме сахара, состоящей из одиночного сахаридного звена, которое невозможно далее разложить на более мелкие сахаридные строительные блоки или группы. Предпочтительные сахарные компоненты для данной соединительной группы выбраны из группы, состоящей из фуранозы, фруктозы, глюкозы, галактозы, маннозы, модифицированного моносахарида, сиаловой кислоты, эритрозы и их смесей. Моносахариды могут находиться в линейной или циклической форме (полуацеталевые циклические изомеры). Фураноза является простым сахаром, содержащим пятичленный фуранозный цикл, например, D-рибозный или фруктозный остаток (D-(-)-фруктофураноза). Путем комбинации моносахаридов можно получить составные сахарные структуры. Фруктоолигосахариды (ФОС) и галактоолигосахариды (ГОС) являются комбинациями, представляющими особый интерес, так же как и дисахариды сахароза или лактоза, или полисахариды инулин, декстрин, крахмал или гликоген.
Используемые в данном документе термины "алкиленгликоль", "поли(алкиленгликоль)", "окись алкилена" охватывают семейства полиэфирных полимеров, описываемых общей формулой
-О-[(CH2)m-О-]n-, в которой m - это число метиленовых групп, присутствующих в каждом алкиленгликолевом звене, a n - число повторяющихся звеньев, которое тем самым отражает размер или длину полимера. Термин включает, помимо прочего, этиленгликоль, пропиленгликоль, диалкиленгликоль (например, диэтиленгликоль), триалкиленгликоль (например, триэтиленгликоль) и гликоли, такие как соответствующие моно- и диалкиловые эфиры вышеупомянутых гликолей, в которых алкиловые эфиры - это низшие алкиловые эфиры с 1-6 атомами углерода (например, метиловый, этиловый, пропиловый эфир и т.п.).
В другом варианте осуществления группа с формулой (I) содержит (C2-С20)-алкиленгликолевое звено, которое может представлять собой любую линейную или разветвленную молекулу с 2-20 атомами углерода или, в зависимости от значений а и b, полиалкиленгликолевый полимер с несколькими (С2-С20)-алкиленгликолевыми мономерными звеньями. Предпочтительно, алкиленгликолевая группа выбрана из C16-C20-алкиленгликоля. Еще более предпочтительно, алкиленгликолевая группа выбрана из С18-алкиленгликоля.
К защитным группам, подходящим для конъюгатов настоящего изобретения, относятся, помимо прочего:
- ПЭГ + сахар, соответствующий вышеуказанной формуле, в которой М - это H, d равно 0, А - это ПЭГ, В - это сахар, а и b равны 1, a L1 и L2 - это фосфодиэфирные связи;
- ПЭГ + (сахар) 2, соответствующий вышеуказанной формуле, в которой А - это ПЭГ, В - это сахар, а равно 1, b равно 1, М - это Н, d равно 0, а L1 и L2 - это фосфодиэфирные связи;
- (ПЭГ) 2 + сахар, соответствующий вышеуказанной формуле, в которой А - это ПЭГ, В - это сахар, а равно 2, b равно 1, М - это Н, d равно 0, а L1 и L2 - это фосфодиэфирные связи;
- (ПЭГ) 3 + сахар, соответствующий вышеуказанной формуле, в которой А - это ПЭГ, В - это сахар, а равно 3, b равно 1, М - это Н, d равно 0, а L1 и L2 - это фосфодиэфирные связи;
- (ПЭГ) 5 + сахар, соответствующий вышеуказанной формуле, в которой А - это ПЭГ, В - это сахар, а равно 2, b равно 1, М - это Н, d равно 0, а L1 и L2 - это фосфодиэфирные связи;
Термины "ПЭГ" и "сахар" используются по существу в тех же значениях, что указаны выше, и включают фуранозу в качестве сахара и ПЭГ, выбранный из группы С3, С9 и С18-спейсеров.
В. Структура конъюгатов изобретения
Различные элементы конъюгатов согласно настоящему изобретению могут быть расположены различным образом. Так, агент селективности может быть связан с 5’-концом и/или 3’-концом нуклеиновой кислоты. Более того, нуклеиновая кислота и агент селективности могут быть связаны непосредственно или посредством линкера. Подобным же образом, линкер может быть связан с 5’-концом и/или 3’-концом нуклеиновой кислоты. Таким образом, в тех случаях, когда нуклеиновая кислота изобретения содержит одиночную цепь нуклеиновой кислоты, возможны следующие расположения:
- нуклеиновая кислота содержит агент селективности, связанный с 5’-концом,
- нуклеиновая кислота содержит агент селективности, связанный с 3’-концом,
- нуклеиновая кислота содержит агент селективности, связанный с 5’-концом, и защитную группу, связанную с 3’-концом, и
- нуклеиновая кислота содержит защитную группу, связанную с 5’-концом, и агент селективности, связанный с 3’-концом.
- Модифицированная нуклеиновая кислота содержит первый и второй агент селективности, при этом указанные первый и второй агенты селективности одинаковы или различны, оба агента селективности соединены с двумя концами двухфункционального линкера, который соединен с 5’-концом нуклеиновой кислоты,
- Модифицированная нуклеиновая кислота содержит первый и второй агент селективности, при этом указанные первый и второй агенты селективности одинаковы или различны, оба агента селективности соединены с двумя концами двухфункционального линкера, который соединен с 3’-концом нуклеиновой кислоты,
- Модифицированная нуклеиновая кислота содержит четыре агента селективности, при этом указанные агенты селективности одинаковы или различны, два агента селективности соединены с обоими концами первого двухфункционального линкера, который соединен с 5’-концом нуклеиновой кислоты, а другие два агента селективности соединены с обоими концами второго двухфункционального линкера, который соединен с 3’-концом нуклеиновой кислоты.
Кроме того, конъюгаты изобретения могут содержать несколько цепей нуклеиновой кислоты, которая модулируется экспрессией молекулы-мишени. Например, конструкция данного изобретения может содержать вплоть до пяти различных нуклеиновых кислот, объединенных в пары через фосфодиэфиры, нацеленные на различные области заданной молекулы-мишени.
Более того, в тех случаях, когда нуклеиновая кислота является двухцепочечной, агент селективности может быть связан со смысловой и/или антисмысловой нитью непосредственно или через линкерную группу.
Нуклеиновые кислоты, составляющие часть конъюгатов изобретения, следует защищать от воздействия разрушающих факторов, таких как нуклеазы (эндо/экзонуклеазы), в процессе их транспорта через различные текучие среды и отделы организма. С этой целью конструируют олигонуклеотиды для противодействия ферментативному перевариванию и улучшения in vivo устойчивости и биодоступности олигонуклеотида. Клеточные экзонуклеазы используют свободные 5’-концы в качестве мишеней. Таким образом, в случае одноцепочечных нуклеиновых кислот агент селективности может выступать в качестве стабилизирующей группы при связывании с 5’-концом нуклеиновой кислоты. Однако, в случае конъюгатов, содержащих двухцепочечные нуклеиновые кислоты или одноцепочечную нуклеиновую кислоту, в которых агент селективности связан с 3’-концом, конъюгат может, кроме того, содержать стабилизирующую группу или кэп-структуру, которой обычно является группа, предотвращающая разложение нуклеиновой кислоты под воздействием экзонуклеаз. В случае двухцепочечных нуклеиновых кислот возможны следующие расположения:
[1] агент селективности присоединен к 5’-концу одной из нитей, при этом полезно присоединить кэп-структуру к 5’-концу противоположной нити. Кроме того, кэп-структура может также находиться в одном или двух 3’-концах.
[2] агент селективности присоединен к 3’-концу одной из нитей, при этом полезно присоединить кэп-структуру к 5’-концам смысловой и антисмысловой нитей. Кроме того, кэп-структура может также находиться у свободного 3’-конца.
[3] Конъюгаты, содержащие несколько агентов селективностей, которые могут быть одинаковыми или разными, при этом агенты селективности связаны с 5’-концами смысловой и антисмысловой нитей. Необязательно, кэп-структура может быть связана с одним или двумя свободными 3’-концами.
В предпочтительном варианте осуществления, нуклеиновая кислота представляет собой двухцепочечную РНК, в которой агент селективности связан с 5’-концом антисмысловой нити, а защитная группа связана с 5’-концом смысловой нити. В более предпочтительном варианте осуществления защитная группа имеет структуру
в которой М - это Н, d равно 0, А - это С18-спейсер на основе полиэтиленгликоля, В - это фураноза, а равно 2, b и с - 1, a L2 и L3 - это фосфодиэфирные связи.
В предпочтительном варианте осуществления конъюгат изобретения содержит:
(i) по меньшей мере, один агент селективности, который специфично связывается с одним или несколькими переносчиками нейромедиатора, при этом агент селективности выбран из группы, состоящей из ингибитора обратного захвата серотонина (ИОЗС), селективного ингибитора обратного захвата серотонина (СИОЗС), ингибитора обратного захвата серотонина и норэпинефрина (ИОЗСН) и
(ii) нуклеиновую кислоту, которая способна специфично связываться с молекулой-мишенью, при этом молекула-мишень выбрана из группы, состоящей из серотонинового рецептора типа 1А (5-HT1A), мРНК, кодирующей серотониновый рецептор типа 1А (5-HT1A), белок переносчика серотонина и мРНК, кодирующей переносчик серотонина.
В более предпочтительном варианте осуществления нуклеиновая кислота, которая способна специфически связываться с мРНК, кодирующей серотониновый рецептор типа 1А (5-HT1A), содержит последовательность, выбранную из группы SEQ ID NO 1, SEQ ID NO 2, SEQ ID NO: 3 и SEQ ID NO: 4.
В еще более предпочтительном варианте осуществления конъюгат изобретения имеет структуру (I)
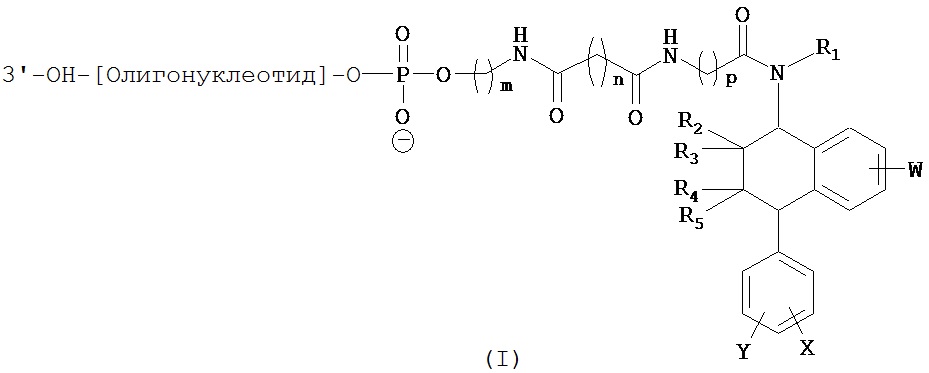
в которой:
R1, R2, R3, R4 и R5 независимо друг от друга выбраны из водорода и С1-С6-алкила;
Х и Y независимо выбраны из водорода, галогена, С1-С3-алкила, С1-С3-галогеналкила, ORa и SRb, где Ra и Rb независимо выбраны из С1-С3-алкила и C6-С10-арила;
W выбран из водорода, галогена, CN, NO2, С1-С3-алкила, С1-С3-галогеналкила, NRcRd, SO2NReRf, NRgSO2Rh, CO2Ri, где Rc, Rd, Re, Rf, Rg, Rh и Ri независимо выбраны из водорода и С1-С3-алкила;
m, n и p выбраны из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 и 13, где сумма m+n+p - это целое число, выбранное из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 и 18, и в которой олигонуклеотид содержит последовательность, выбранную из группы SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4.
В другом варианте осуществления конъюгат изобретения имеет структуру:
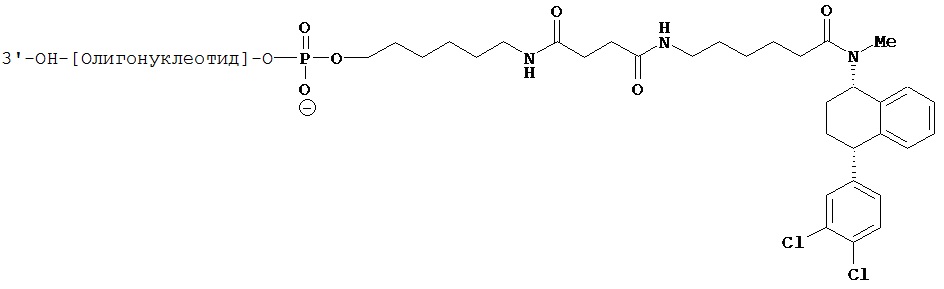
в которой олигонуклеотид содержит последовательность, выбранную из группы SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4.
В еще более предпочтительном варианте осуществления конъюгат изобретения имеет структуру (XIV)
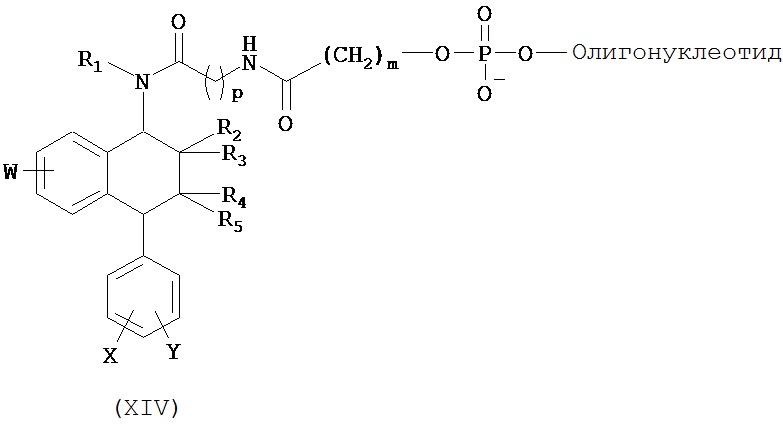
в которой:
R1, R2, R3, R4 и R5 независимо друг от друга выбраны из водорода и С1-С6алкила;
Х и Y независимо выбраны из водорода, галогена, С1-С3-алкила, С1-С3-галогеналкила, ORa и SRb, где Ra и Rb независимо выбраны из С1-С3-алкила и С6-С10-арила;
W выбран из водорода, галогена, CN, NO2, С1-С3-алкила, С1-С3-галогеналкила, NRcRd, SO2NReRf, NRgSO2Rh, CO2Ri, где Rc, Rd, Re, Rf, Rg, Rh и Ri независимо выбраны из водорода и С1-С3-алкила;
m и p выбраны из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 и 13, где сумма m+p - это целое число, выбранное из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 и 18, и
в которой олигонуклеотид содержит последовательность, выбранную из группы SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4.
В отдельном варианте осуществления конъюгат имеет структуру:
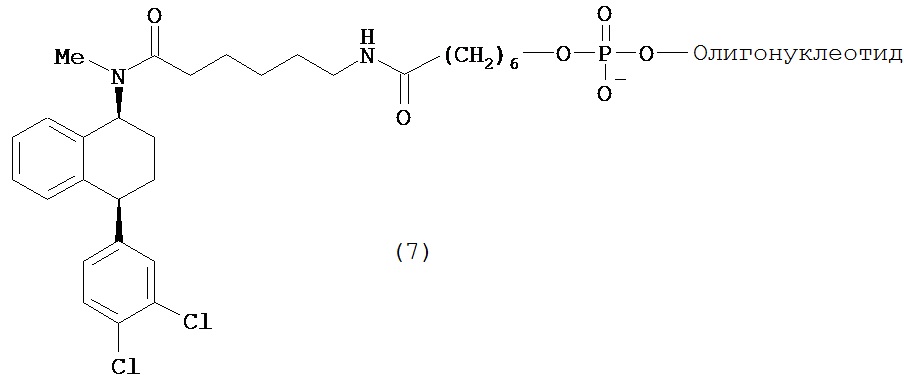
в которой олигонуклеотид содержит последовательность, выбранную из группы SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4.
В другом предпочтительном варианте осуществления, конъюгат изобретения содержит двухцепочечную нуклеиновую кислоту, в которой 5’-конец смысловой нити связан с защитной группой, а 5’-конец антисмысловой нити связан с агентом селективности. При этом защитная группа имеет структуру:
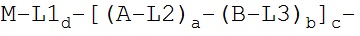
в которой М - это Н, d равно 0, А - это С18-спейсер на основе полиэтиленгликоля, В - это фураноза, а равно 2, b и с - 1, a L2 и L3 - это фосфодиэфирные связи, и в которой защитная группа - это сертралин, соединение изобретения имеет структуру:

В еще более предпочтительном варианте осуществления соединение изобретения имеет структуру:
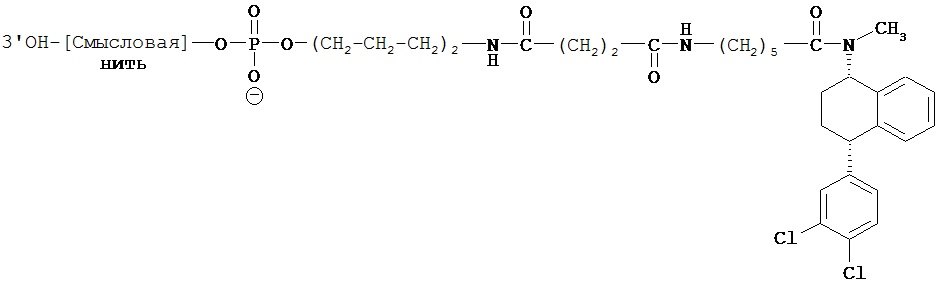
В еще более предпочтительном варианте осуществления соединение изобретения имеет структуру:
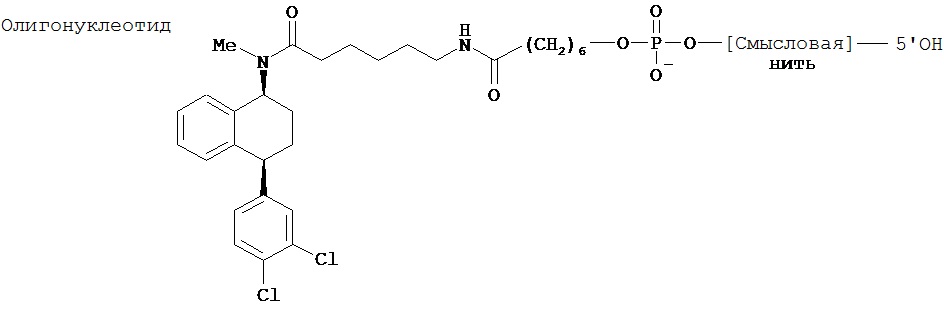
В другом варианте осуществления конъюгат имеет следующую структуру:

в которой:
R1 - это водород, низшая алкильная группа или бензильная группа,
R2 - это водород, метильная, хлорная или фторная группа,
R2’ - это водород, метильная, метокси, гидроксильная или галогенидная группа,
R3 и R4 - это водород, низшая алкильная группа,
R5 - это водород, хлорная или метокси-группа в положении 5 или 6, а
p равняется 2-6.
В более предпочтительном варианте осуществления конъюгат имеет следующую структуру

В еще более предпочтительном варианте осуществления олигонуклеотид, составляющий часть вышеуказанных конъюгатов, способен специфично связываться с молекулой-мишенью, выбранной из группы, состоящей из:
- дофамин-β-гидроксилазы,
- мРНК, кодирующей дофамин-β-гидроксилазу,
- ВАХ,
- мРНК, кодирующей ВАХ,
- тау,
- мРНК, кодирующей Тау,
- Хантингтина и
- мРНК, кодирующей Хантингтин.
В контексте изобретения защитная группа указанной формулы может быть связана с 5’-ОН или 3’-ОН группами олигонуклеотида посредством связывающего соединения (обозначаемого в группе с формулой (I) как "L’"), что таким образом дает конъюгат-олигонуклеотид. Химические свойства олигонуклеотида и группы с формулой (I) дают возможность для нескольких вариантов осуществления.
Например, можно связать в одиночную молекулу олигонуклеотида различное число групп с формулой (I), обычно от 2 до 4 таких групп, в зависимости от того, является ли олигонуклеотид двухцепочечным или одноцепочечным, при условии, что связывание осуществляется через 5’-ОН и/или 3’-ОН. Также возможно, что цепь из нескольких групп с формулой (I) будут связаны с олигонуклеотидом, при этом указанные группы с формулой (I) связаны друг с другом посредством связывающих соединений, таких как производные фосфорамидатов, которые образуют фосфодиэфирную связь между молекулами и/или олигонуклеотидом. Также олигонуклеотидная конструкция может содержать цепь, в которой несколько групп с формулой (I) связаны с одним концом олигонуклеотида, а другая группа с формулой (I) связана с другим концом олигонуклеотида.
Также нуклеотидные конструкции изобретения могут содержать несколько нацеливающих веществ, которые распределены во всевозможных комбинациях между 5’-ОН и 3’-ОН-концами двух нитей олигонуклеотида либо связаны с группой с формулой (I). Более того, при наличии нескольких нацеливающих веществ, они могут быть связаны последовательно с группой с формулой (I) и/или олигонуклеотидом.
Если олигонуклеотидная конструкция содержит несколько нацеливающих веществ, то возможны различные комбинации. Например, защитная группа может быть связана с 5’-ОН или 3’-ОН концевыми группами одной из нитей олигонуклеотида. Другая возможная комбинация включает лекараственное соединение, связанное с 5’-ОН группой одной олигонуклеотидной нити, и ряд аптамеров, соединенных с концевым звеном группы с формулой (I), которая связана с другой олигонуклеотидной нитью.
С. Фармацевтические композиции изобретения
Изобретатели обнаружили, что конъюгаты изобретения способны модулировать экспрессию нуклеиновой кислоты, которая становится мишенью для последовательностей нуклеиновых кислот конъюгатов. Например, в случае конъюгатов, содержащих нуклеиновую кислоту, специфичную к предсинаптическому 5-HT1AR, при введении конструкции больному она может эффективно вызывать специфичный нокдаун 5-HT1AR в ядрах шва среднего мозга больных (т.е. в области мозга, в которой расположены тела серотонинергических нейронов).
Таким образом, специалисту в данной области техники ясно, что конъюгаты изобретения пригодны для лечения болезней за счет снижения уровня экспрессии генов, на которые нацеливаются нуклеиновые кислоты, присутствующие в конъюгатах изобретения. Таким образом, в другом аспекте изобретение относится к конъюгату согласно изобретению, пригодному для медицинского применения. Кроме того, изобретение относится к фармацевтической композиции, содержащей конъюгат согласно изобретению и фармацевтически приемлемую среду.
Олигонуклеотидные конструкции изобретения могут быть составлены в подходящих количествах вместе с фармацевтически приемлемыми вспомогательными веществами и/или носителями с целью получения фармацевтической композиции. Композиция, включающая конъюгат согласно изобретению, может быть доставлена в организм больного разнообразными способами. К примерным способам относятся инстрастриарный, интрацеребровентрикулярный, интратекальный, интрапаренхиматозный (например, в область полосатого тела), интраназальный и глазной способы доставки. Композиция может быть также доставлена системным способом, например, внутривенной, подкожной или внутримышечной инъекцией, что особенно удобно для доставки конъюгатов в периферические нейроны. Кроме того, также возможно введение конъюгатов изобретения через нос, что обеспечивает возможность для системного введения неагрессивным способом. Также подходящим может быть внутрижелудочковый способ введения. Предпочтительным способом доставки является непосредственное введение в головной мозг, например, в желудочки или гипоталамус мозга, либо в боковую или тыльную область мозга.
Фармацевтические композиции изобретения могут содержать несколько различных конъюгатов, при этом различные конъюгаты содержат нуклеиновые кислоты, которые нацеливаются на различные области одной и той же молекулы-мишени. Таким образом, фармацевтические композиции могут содержать, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5, по меньшей мере, 6 и более 6 различных конъюгатов, каждый из которых содержит различные нуклеиновые кислоты.
Специалисту в данной области техники известные принципы и методики, описанные в широко известных и доступных источниках информации, таких как справочник "Фармацевтическая наука" Ремингтона (Remington’s Pharmaceutical Science, 17-oe изд., Mack Publishing Co., Easton, Pa., 1985) и учебник Гудмана и Гилмана "Фармакологические основы терапии" (Goodman and Gilman’s The Pharmaceutical Basis of Therapeutics, 8-oe изд., Pergamon Press, Elmsford, N.Y., 1990), оба издания включены в данный документ по ссылке.
В предпочтительном варианте осуществления настоящего изобретения, конъюгаты составлены по стандартной методике приготовления фармацевтической композиции, приспособленной для введения в организм человека и других млекопитающих. Обычно композиции для внутривенного внутрижелудочкового введения представляют собой растворы в стерильном изотоническом водном буфере.
При необходимости композиция может также включать солюбилизирующее вещество и местный анестетик для смягчения боли в месте инъекции. Как правило, ингредиенты поставляются либо по отдельности, либо в смешанном виде в дозированной лекарственной форме, например, в виде сухого лиофилизированного порошка или безводного концентрата в герметичном контейнере, таком как ампула или пакет-саше с указателем количества активного ингредиента. При введении композиции путем вливания ее можно распределить с помощью бутыли для инфузии, содержащим стерильную воду фармацевтического качества или физиологический раствор. При введении композиции путем инъекции ампула со стерильной водой для инъекции или физиологическим раствором может быть обеспечена так, чтобы ингредиенты можно было смешать до введения.
При иных способах введения, отличных от внутривенного способа, композиция может содержать небольшие количества увлажняющего, эмульгирующего или регулирующего рН буферного вещества. Композиция может также представлять собой жидкий раствор, суспензию, эмульсию, гель, полимер или состав с замедленным высвобождением. Композиция может быть составлена с использованием традиционных связывающих веществ и носителей, известных в данной области техники. Составы могут включать стандартные носители, такие как фармацевтически приемлемый манит, лактоза, крахмал, стеарат магния, сахаринат натрия, целлюлоза, карбонат магния и т.д, инертные носители, обладающие признанными функциональными свойствами при приготовлении лекарственных препаратов. Известны и могут использоваться различные системы доставки для введения лекарственного вещества настоящего изобретения, в том числе инкапсулирование в липосомы, микрочастицы, микрокапсулы и т.п.
В еще одном предпочтительном варианте осуществления лекарственные препараты, содержащие конъюгаты изобретения, могут быть составлены в нейтральной форме или в виде солей. К фармацевтически приемлемым солям относятся соли, образованные из свободных аминогрупп, например, соли, полученные при присоединении соляной, фосфорной, уксусной, щавелевой, винной и тому подобных кислот, и соли, образованные из свободных карбоксильных групп, например, соли, полученные из гидроксидов натрия, калия, аммония, кальция и железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и схожих веществ.
В тех вариантах осуществления, где композиция доставляется через гематоэнцефалический барьер, она включает, например, липосому, описанную, например, в патенте США №6372250 (Pardridge) и фармацевтически приемлемый носитель. Липосомы, описанные в данном документе, могут доставлять биологически активные вещества через гематоэнцефалический барьер с последующей экспрессией в головном мозге. Липосомы и наночастицы являются примерными формами наноконтейнеров, которые обычно используются для инкапсулирования лекарств. Липосомы, предпочтительно, имеют диаметр менее 200 нанометров. Предпочтительны липосомы с диаметром от 50 до 150 нанометров. Особенно предпочтительными являются липосомы или другие наноконтейнеры с внешним диаметром около 80 нанометров. Липосомы подходящих типов составляют вместе с нейтральными фосфолипидами, такими как 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфорилхолин (ПОФХ), дифосфатидилфосфорилхолин, дистеароилфосфатидилэтаноламин (ДСФЭ) или холестерин, наряду с небольшим количеством (1%) катионного липида, такого как дидодецилдиметиламмония бромид (ДДАБ), чтобы стабилизировать ДНК внутри липосомы.
Липосома может быть замещена наночастицей или любым иным молекулярным наноконтейнером с диаметром менее 200 нм, который инкапсулирует ДНК и защищает нуклеиновую кислоту от нуклеаз в период нахождения состава в крови или при переходе из крови во внутриклеточное пространство клетки-мишени. К тому же, вместо использования конъюгирующих веществ, таких как ПЭГ нити, к поверхности липосомы или наноконтейнера можно присоединить одно или несколько полимерных веществ, таких как сфингомиелин, которые выполняют двойную функцию, обеспечивая остов для конъюгации "переносимого пептида" и для задержки вывода состава из крови и оптимизируя фармакокинетические параметры плазмы крови. Кроме того, настоящее изобретения предполагает доставку ДНК в любую группу клеток или органов, у которых имеются специфические рецепторы-мишени. Липосомы могут быть использованы для доставки ДНК в органы, такие как печень, легкие и селезенка.
К другим подходящим контейнерам для доставки конъюгатов изобретения относятся дендримеры. Термин "дендример" относится к макромолекуле, имеющей остов и несколько оболочек ветвящихся структур, выходящих из остова. Форма и размер дендритного носителя могут варьироваться. В некоторых случаях дендритный носитель по форме может быть почти сферическим или глобулярным. Более того, дендритный носитель может иметь диаметр в диапазоне от 15 ангстрем (Ǻ) до 250 Ǻ и соответствующую молекулярную массу, например, в диапазоне от 500 Дальтон до 2 миллионов Дальтон. Дендримеры могут быть получены коммерчески из различных источников (например, от фирмы (Dendritech, Midland, Michigan) или синтезированы по способам, известным специалистам в данной области техники. Дендритные молекулы можно разделить грубо на низкомолекулярные и высокомолекулярные. К первой категории относятся дендримеры и дендроны, тогда как вторая категория охватывает древовидные полимеры, сверхразветвленные полимеры и щеточные полимеры (также называемые "бутылочными щетками"). Дендримеры и дендроны - это многократно разветвленные, монодисперсные и обычно высокосимметричные соединения. Не существует явных различий при определении дендримера и дендрона. Дендрон обычно содержит одну химически доступную группу, которая называется фокальной точкой. Из-за отсутствия молекулярно-массового распределения высокомолекулярные дендримеры и дендроны являются макромолекулами, но не полимерами. Свойства дендримеров преимущественно определяются функциональными группами на молекулярной поверхности. Дендритное инкапсулирование функциональных молекул позволяет изолировать активный центр, структуру, которая имитируют структуру активных центров в биоматериалах, поскольку дендритный остов разделяет внутреннюю и внешнюю функции. Например, дендример может быть водорастворимым в том случае, когда его концевой группой является гидрофильная молекула, подобная карбоксильной группе.
Дендримеры могут, в общем, характеризоваться следующими особенностями: (i) инициаторным ядром (I), в котором может иметься один или несколько реакционных центров и которое может быть точечным или иметь существенный размер, для того чтобы оказывать воздействие на конечную топологию дендримера; (ii) одним или несколькими слоями разветвленных повторяющихся звеньев, присоединенных с инициаторному ядру; (iii) функциональными концевыми группами, такими как анионные или катионные группы, которые соединены, необязательно через связывающие группы, с поверхностью дендримера.
Дендримеры, рассматриваемые в данном документе, могут содержать лизин или строительные элементы на основе аналогов лизина. Термин "аналог лизина" относится к молекуле, в вершине которой имеется одна карбоксильная группа для соединения с предыдущем слоем строительных звеньев или две-три первичные аминогруппы, с которыми соединяются последующие строительные звенья, блокирующие группы, линкеры или арилкислотные группы. Примеры "аналогов лизина", рассматриваемых в данном документе, описаны в PCT/AU 2007/000352, как например, глицил-лизин. В некоторых отдельных примерах дендример содержит только лизин или один тип аналога лизина в качестве строительного элемента.
К другим дендримерам, рассматриваемых в данном документе, относятся дендримеры, содержащие полиамидоаминные (ПАМАМ), поли(эфиргидроксиламинные) (ПЭГАМ) или полипропилениминные строительные элементы. В отдельных примерах дендримеров дендример содержит только полиамидоамин (ПАМАМ), поли(эфиргидроксиламин) (ПЭГАМ) или полипропиленимин в качестве строительного элемента.
Ядерная компонента может содержать только 1 точку для присоединения к строительному элементу или может содержать 2, 3 или более 3 точек, которые могут быть, а могут и не быть использованы для присоединения строительных элементов. Как правило, точкой присоединения является свободная аминогруппа. Ядерные компоненты могут состоять из, содержать или быть образованы из строительного элемента или могут представлять собой молекулу, отличную от строительных элементов. Примерные ядерные компоненты проиллюстрированы в данном документе и описаны в PCT/AU 2007/000352.
Липосомы и дендримеры могут быть совмещены с любым подходящим фармацевтически приемлемым носителем для внутривенного введения. Внутривенное введение композиции является предпочтительным способом введения, поскольку этот способ является наименее инвазивным. При желании возможны и другие способы введения. К подходящим фармацевтически приемлемым носителям относятся физиологический раствор, Трис буфер, фосфатный буфер или любой иной водный раствор. Подходящая дозировка может быть установлена по методикам, хорошо известным обычным специалистам в данной области техники.
D. Терапевтическое использование конъюгатов изобретения
Следует понимать, что возможность излечения клинического расстройства конъюгатами изобретения будет зависеть от специфичности нуклеиновой кислоты, являющейся частью конъюгата. Таким образом, конъюгаты изобретения могут быть использованы для лечения любой болезни, которая может быть излечена посредством нокдауна интересуемого гена в клетке, экспрессирующей переносчик нейромедиатора. Специалист в данной области техники понимает, что конъюгаты пригодны для лечения болезней, характеризующихся аномальной экспрессией белка в клетке (например, накопление α-синуклеина в тельцах Леви) или болезней, при которых белок-мишень экспрессируется на нормальном уровне, но которые могут быть излечены путем снижения экспрессии указанного белка-мишени.
D.1. Конъюгаты, содержащие нуклеиновые кислоты, нацеливающиеся на 5-HT1A рецепторы, переносчик серотонина или ионные каналы, расположенные в серотонинергических нейронах
Как упомянуто выше, при введении СИОЗС больному, нуждающемуся в нем, имеет место механизм обратной отрицательной связи в результате активации 5-HT1A рецепторов, расположенных в серотонинергических нейронах (предсинаптический 5-HT1AR). Действие СИОЗС приводит к повышению уровня серотонина, вызванному блокадой обратного захвата серотонина, опосредованной переносчиками обратного захвата серотонина (SERT), которые расположены в серотонинергических нейронах. Данное явление не только активирует постсинаптические серотониновые рецепторы, но и предсинаптические 5-HT1AR, которые выполняют роль датчика обратной связи для клетки. Активация этих 5-HT1AR вызывает снижение уровня серотонина из-за подавления возбуждения клеток и импульсно-зависимого выделения серотонина, тем самым ограничивая воздействие вводимого СИОЗС.
Данный эффект показан, например, в примерах 2 и 3 настоящего изобретения, где показано, что вливание конъюгата, содержащего сертралин и 5-HT1AR-специфичной миРНК, может предотвращать гипотермическую реакцию, индуцированную селективный агонистом 5-HT1AR). Данный эффект позволяет использовать конъюгаты изобретения при всех клинических заболеваниях, при которых желательно подавить экспрессию гена, комплементарного нуклеиновой кислоте, являющейся частью конъюгатов.
Этот факт является существенным открытием в области терапии антидепрессантами, поскольку олигонуклеотиды изобретения могут быть полезны при нейтрализации побочных эффектов от коммерческих СИОЗС, указанных выше, а именно, замедленное начало действия и ограниченная эффективность. Кроме того, за счет использования высокоселективных олигонуклеотидных конструкций настоящего изобретения для достижения желаемого эффекта достаточно введения только малых доз терапевтического олигонуклеотида. В результате конструкции изобретения полезны при лечении заболеваний, который связаны с аномальной концентрацией серотонина, присутствующего в синаптической зоне, в особенности, при лечении заболеваний, связанных с недостаточным переносом серотонина (т.е. уменьшением концентрации в синапсе), например, заболеваний, связанных с депрессией.
Соответственно, если нуклеиновая кислота нацелена на компонент предсинаптических серотонинергических нейронов, конъюгаты подходят для лечения заболеваний, при которых необходимо снизить активность предсинаптических серотонинергических нейронов. Таким образом в другом аспекте изобретение относится к конъюгату изобретения, в котором:
(i) агент селективности выбран из группы, состоящей из селективного ингибитора обратного захвата серотонина (СИОЗС), ингибитора обратного захвата серотонина и норэпинефрина (ИОЗСН) или норадренергического и специфичного серотонинергического антидепрессанта (НАССА) и
(ii) олигонуклеотид способен специфично связываться с молекулой-мишенью, выбранной из группы, состоящей из мРНК серотонинового рецептора типа 1А (5-HT1A), мРНК переносчика серотонина, мРНК ТРЕК-1, полипептида серотонинового рецептора типа 1А (5-HT1A), полипептида переносчика серотонина и полипептида TREK-1.
для использования при лечении и/или профилактике расстройства, связанного с депрессией.
В качестве альтернативы, изобретение относится к способу лечения или профилактики связанного с депрессией расстройства, который включает введение нуждающемуся больному конъюгата изобретения, в котором
(i) агент селективности выбран из группы, состоящей из селективного ингибитора обратного захвата серотонина (СИОЗС), ингибитора обратного захвата серотонина и норэпинефрина (ИОЗСН) или норадренергического и специфичного серотонинергического антидепрессанта (НАССА) и
(ii) олигонуклеотид способен специфично связываться с молекулой-мишенью, выбранной из группы, состоящей из мРНК, кодирующей серотониновый рецептор типа 1А (5-HT1A), мРНК переносчика серотонина, мРНК TREK-1, полипептида серотонинового рецептора типа 1А (5-HT1A), полипептида переносчика серотонина и полипептида TREK-1.
Выражение "связанное с депрессией расстройство", используемое в данном документе, относится к тем расстройствам, которые характеризуются аномально низким уровнем серотонина в синапсе и определены в справочнике Diagnostic and Statistical Manual of Mental Disorders-4-oe изд. (DSM-IV), опубликованном Американской ассоциацией психиатров (Вашингтон), и включает, помимо прочего, большую депрессию, длительную депрессию, стойкую к лечению депрессию, дистимию, психическое состояние депрессивного настроения, характеризуемое ощущениями печали, отчаяния, уныния, тоски, меланхолии, ощущениями заниженной самооценки, комплекса вины и самообвинения, отход от межличностных контактов и соматическими симптомами, такими как нарушение питания и сна. Предпочтительно, связанное с депрессией расстройство выбрано из группы, состоящей из большой депрессии, обсессивно-компульсивного расстройства (ОКР), общего расстройство психологического развития (ОРПР), посттравматического стрессового расстройства (ПТСР), тревожных расстройств, биполярных расстройств, расстройств пищевого поведения и хронической боли.
Кроме того, при введении конъюгатов изобретения, содержащих агент селективности, специфичный к серотонинергическим нейронам, и олигонуклеотид, который понижающе регулирует рецептор 5-HT1A, выделение серотонина в предлобной коре увеличивается приблизительно на 150-200% от исходного значения в сравнении с 50% увеличением при введении антидепрессанта в отдельности (см. Фиг.13 и 14). Как указано выше, традиционные антидепрессанты разработаны для улучшения переноса серотонина, но обладают ограниченным воздействием из-за активации предсинаптических 5-HT1A рецепторов. Таким образом, с использованием олигонуклеотидных конструкций изобретения преодолеваются основные ограничения указанных антидепрессантов (медленное начало действия и ограниченная эффективность). В результате, положительная реакция на лечение антидепрессантами может быть достигнута за короткий период времени, а количество пациентов, поддающихся лечению, может быть повышено в сравнении с лечением только коммерческими антидепрессантами (т.е. СИОЗС). Таким образом, в другом аспекте изобретение относится к способу лечения связанного с депрессией расстройства, который включает введение конъюгата согласно изобретению и антидепрессанта.
Олигонуклеотидная конструкция изобретения может вводиться одновременно с существующими антидепрессантами (СИОЗС, ИОЗНА, ИМАО, ТЦА и т.д.). Введение олигонуклеотидной последовательности, блокирующей экспрессию 5-HT1A ауторецепторы, позволяет улучшить эффект этих антидепрессантов путем ингибирования уменьшения уровня внеклеточного 5-НТ за счет блокады обратного захвата.
D.2. Конъюгаты, содержащие нуклеиновые кислоты, нацеленные на синуклеин
В другом аспекте изобретение относится к конъюгату изобретения, в котором:
(i) агент селективности выбран из группы, состоящей из ингибитора обратного захвата дофамина (ИОЗД) и ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), и
(ii) олигонуклеотид способен специфически связываться с молекулой-мишенью, которой является мРНК, кодирующая альфа-синуклеин или полипептид альфа-синуклеина,
для лечения или профилактики болезни, связанной с отложением телец Леви.
Термин "болезнь, связанная с отложением телец Леви" относится к состоянию, которое характеризуется расстройством метаболизма альфа-синуклеина, что приводит к образованию ненормальных нейрональных включений альфа-синуклеина. К конкретным болезням телец Леви относятся болезнь Паркинсона (БП), деменция с тельцами Леви (ДТЛ), БП со слабоумием (БПС) и множественная системная атрофия.
Предпочтительно, конъюгат настоящего изобретения может быть введен вместе с коммерческим антидепрессантом, таким как СИОЗС, для лечения депрессии и/или связанных с депрессией расстройств.
D.3. Конъюгаты, содержащие нуклеиновые кислоты, нацеленные на переносчик норэпинефрина
Как пояснялось в разделе по уровню техники, увеличение переноса мезокортикального ДА может быть полезно для лечения шизофрении. Поскольку переносчик НА (NAT) проявляет схожее сродство к НА и ДА, ингибиторы NAT преимущественно повышают концентрацию внеклеточного ДА в средней предлобной коре (сПЛК) в сравнении с хвостатым ядром и прилежащим ядром (ПЯ). Поэтому НА нейриты из нервных клеток голубого пятна (ГП) могут участвовать в регулировании концентрации внеклеточного ДА в ПЛК либо за счет поглощения или совместного высвобождения ДА.
В другом аспекте изобретение относится к конъюгату изобретения, в котором:
(i) агент селективности выбран из группы, состоящей из ингибитора обратного захвата дофамина, ингибитора обратного захвата норадреналина, ингибитора обратного захвата серотонина и норадреналина и ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), и
(ii) олигонуклеотид способен специфически связываться с молекулой-мишенью, которой является мРНК, кодирующая переносчик норэпинефрина или полипептид норэпинефрина,
для лечения или профилактики болезни, опосредованной или восприимчивой к ингибированию обратного захвата норэпинефрина.
К таким медицинским расстройствам относятся, например, болевые расстройства, такие как невропатическая боль и хроническая боль, депрессивные расстройства, такие как большая депрессия, аффективные расстройства, такие как тревожное расстройство, синдром дефицита внимания с гиперактивностью, когнитивные расстройства, такие как слабоумие, недержание мочи при напряжении.
D.4. Конъюгаты, содержащие нуклеиновые кислоты, нацеленные на дофамин-бета-гидроксилазу
Как пояснялось в разделе по уровню техники, увеличение переноса мезокортикального ДА может быть полезно для лечения шизофрении. Такое увеличение может быть достигнуто за счет использования ингибиторов переносчика норадреналина или, в качестве альтернативы, за счет ингибирования дофамин-бета-гидроксилазы. Данный фермент отвечает за превращение дофамина в норадреналин и поэтому при снижении его активности может происходить увеличение уровня дофамина в НА нейронах. Это, в свою очередь, приводит к появлению норадренергических пузырьков, содержащих НА и повышенный уровень ДА. Это повышает уровень ДА в НА проекционных зонах, улучшая познавательную функцию и функцию, связанную с памятью, в головном мозге.
Таким образом, в другом аспекте изобретение относится к конъюгату изобретения, в котором:
(i) агент селективности выбран из группы, состоящей из ингибитора переносчика норэпинефрина (СИОЗСДН) и ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), и
(ii) олигонуклеотид способен специфически связываться с молекулой-мишенью, которой является мРНК, кодирующая дофамин-бета-гидроксилазу или полипептид дофамин-бета-гидроксилазы, для лечения или профилактики болезни, связанной с недостатком дофамина в норадренергических проекциях.
Используемое в данном документе выражение "болезнь, связанная с недостатком дофамина в норадренергических проекциях" относится к процессам запоминания или познания, сопровождающихся слабоумием, депрессией или нейродегенеративными заболеваниями.
D.5. Конъюгаты, содержащие нуклеиновые кислоты, нацеленные на ВАХ
В другом аспекте изобретение относится к конъюгату изобретения, в котором:
(i) агент селективности выбран из группы, состоящей из ингибитора обратного захвата серотонина, дофамина и норэпинефрина (ИОЗСДН) и ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), и
(ii) олигонуклеотид способен специфически связываться с молекулой-мишенью, которой является мРНК, кодирующая ВАХ или полипептид ВАХ,
для лечения или профилактики болезни, связанной с апоптозом нейронов или гибелью клеток.
Используемый в данном документе термин "болезнь, связанная с апоптозом нейронов или гибелью клеток" относится к конечной точке многих неврологических нарушений у человека, включая, помимо прочего, болезни Альцгеймера, Паркинсона и Хантингтона, приступ/травму, множественный и боковой амиотрофический склероз. Апоптозная гибель гиппокампальных и кортикальных нейронов является причиной появления симптомов болезни Альцгеймера; смерть среднемозговых нейронов, которые используют нейромедиатор дофамин, лежит в основе болезни Паркинсона; болезнь Хантингтона включает смерть нейронов в полосатом теле, которое регулирует движения тела; а смерть мотонейронов спинного мозга проявляется в виде бокового амиотрофического склероза. Кроме того, малокровие и травма головного мозга вызывают некроз небольшой области мозга, которая далее приводит к потере нервных клеток за счет апоптоза на большей области мозга из-за действия нейротоксичного материала, выделяемого омертвелыми клетками. Апоптозная потеря нервных клеток также наблюдается в стареющем головном мозге как физиологический процесс.
D.6. Конъюгаты, содержащие нуклеиновые кислоты, нацеленные на тау
В другом аспекте изобретение относится к конъюгату изобретения, в котором:
(i) агент селективности выбран из группы, состоящей из ингибитора обратного захвата серотонина, дофамина и норэпинефрина (ИОЗСДН) и ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), и
(ii) олигонуклеотид способен специфически связываться с молекулой-мишенью, которой является мРНК, кодирующая тау или полипептид Тау,
для использования при лечении и/или профилактике тау-ассоциированного заболевания.
Используемый в данном документе термин "тау-ассоциированное заболевание" относится к болезням, связанным с нарушениями Тау, а также болезням, которые представляют собой "таупатии". К тау-ассоциированным болезням относятся, помимо прочего, лобно-височная деменция, в том числе подтип лобно-височной деменции и паркинсонизм, связанный с хромосомой 17 (FTDP-17), прогрессирующий супрануклеарный паралич, кортикобазальная дегенерация, болезнь Пика, болезнь аргирофильных волокон, а также болезнь Паркинсона, синдром Дауна, постэнцефалитический паркинсонизм, миотоническая дистрофия, болезнь Ниманна-Пика С, боксерская деменция, болезнь Блинта, прионные инфекции, боковой амиотрофический склероз (БАС)-паркинсонизм-деменция (синдром Гуама), множественный склероз, глаукома, диабетическая ретинопатия, травматическое повреждение мозга, а также болезнь Хантингтона, деменция с тельцами Леви, амиотрофия Шарко-Мари-Тута, наследственная параплегия и множественная системная атрофия. Определенная в данном документе "таупатия" означает нейродегенеративное заболевание, связанное с фибриллярными формами тау-белка (клубками) в головном мозге. К данным заболеваниям относится БА; к другим таупатиям относятся, помимо прочего, лобно-височная деменция, в том числе подтип лобно-височной деменции и паркинсонизм, связанный с хромосомой 17 (FTDP-17), прогрессирующий супрануклеарный паралич, кортикобазальная дегенерация, болезнь Пика и болезнь аргирофильных волокон.
D.7. Конъюгаты, содержащие нуклеиновые кислоты, нацеленные на Хантингтин
В другом аспекте изобретение относится к конъюгату изобретения, в котором:
(i) агент селективности выбран из группы, состоящей из ингибитора обратного захвата серотонина, дофамина и норэпинефрина (ИОЗСДН) и ингибитора обратного захвата норэпинефрина и дофамина (ИОЗНД), и
(ii) олигонуклеотид способен специфически связываться с молекулой-мишенью, которой является мРНК, кодирующая Хантингтин или полипептид Хантингтина,
для использования при лечении и/или профилактике хантингтин-ассоциированного заболевания.
Используемый в данном документе термин "хантингтин-ассоциированное заболевание" относится к болезням, обусловленным искаженной конформацией, агрегацией или экспрессией мутантного белка хантингтина, и включает, помимо прочего, болезнь Хантингтона и ее варианты.
Количество лекарственного вещества настоящего изобретения, являющееся действенным при лечении определенного расстройства или состояния, будет зависеть от природы расстройства или состояния и может быть определено по стандартным клиническим методикам, признанным в области введения лекарственных веществ. Точная доза, используемая в составе, будет также зависеть от способа введения и тяжести заболевания или расстройства и должна определяться по усмотрению врача-практика и в соответствии с нуждами пациента. Подходящие диапазоны доз для внутричерепного введения обычно составляют от 103 до 1015 инфекционных единиц вирусного вектора на микролитр, при этом объем однократной инъекционной дозы составляет от 1 до 3000 микролитров. Дополнительные количество инфекционных единиц вектор на мкл обычно содержат 104, 105, 106, 107, 108, 109, 1010, 1011, 1012, 1013, 1014 инфекционных единиц вирусного вектора, доставляемого в 10, 50, 100, 200, 500, 1000 и 2000 мкл. Эффективные дозы могу быть экстраполированы из кривых дозовой зависимости, полученных из in vitro или in vivo тест-систем.
При внутрижелудочковом введении конъюгатов изобретения можно имплантировать несколько катетеров с входными отверстиями определенному пациенту для полного лечения. В предпочтительном варианте осуществления имеется одно отверстие и катетерная система на полушарие головного мозга или полушарие мозжечка, а может быть и несколько таких отверстий и систем. После проведения имплантации нейрохирургом невролог больного может провести курс лечения, состоящий из повторных болюсных инъекций конъюгатов на протяжении от нескольких недель до месяцев, наряду с наблюдением за терапевтическим эффектом со временем. Устройства могут оставаться в имплантированном состоянии на протяжении от нескольких месяцев до нескольких лет в течение полного курса лечения. После подтверждения терапевтической эффективности входящие отверстия могут быть необязательно извлечены из организма, а катетеры могут быть загерметизированы и оставлены либо могут быть также извлечены из организма. Материал устройства не должен мешать магнитно-резонансному исследованию и, конечно, препараты малой интерферирующей РНК должны быть совместимы с материалами отверстий и катетера и любыми поверхностными покрытиями.
Е. Синтез конъюгатов изобретения
Конъюгаты изобретения обычно синтезируют по стандартным методикам органического синтеза. Специалисту в данной области техники ясно, что точное количество стадий синтеза зависит от конкретной структуры конъюгата, который необходимо синтезировать. Например, если конъюгат содержит одиночную нить нуклеиновой кислоты, конъюгированную с агент селективности через свой 5’-конец, то синтез обычно осуществляют так, как поясняется ниже, посредством введения во взаимодействие амино-активированного олигонуклеотида и реакционноспособного активированного агента селективности.
Если конъюгат содержит двухнитевую нуклеиновую кислоту, то смысловую и антисмысловую нити синтезируют по отдельности и соединяют in vitro по стандартным методикам молекулярной биологии. В типичном конъюгате первая нить нуклеиновой кислоты несет агент селективности, а вторая нить нуклеиновой кислоты несет защитную группу. В более предпочтительном варианте осуществления агент селективности связан с 5’-концом первой нити нуклеиновой кислоты и/или защитная группа присоединена к 5’-концу второй нити нуклеиновой кислоты, хотя присоединение агента селективности или защитной группы может быть также осуществлено по 3’-концу нитей нуклеиновой кислоты.
Синтез конъюгатов может быть осуществлен следующим образом:
[1] Конъюгаты со структурой
Агент селективности-[Олигонуклеотид]-3’ обычно синтезируют по следующим стадиям:
(i) Активация агента селективности. Предпочтительно активационной группой в агенте селективности является сукцинимидная группа или аминогруппа.
(ii) Активация олигонуклеотида на его 5’-конце. Предпочтительно активационной группой в олигонуклеотиде является аминогруппа (при этом агент селективности активирован сукцинимидной группой) или карбоксильная группа (при этом агент селективности активирован аминогруппой) и
(iii) Взаимодействие активированного агента селективности с активированным олигонуклеотидом в условиях, подходящих для реакции между двумя активационными группами.
[2] Конъюгаты со структурой
Защитная группа-[Смысловая нить]-3’
3’-[Антисмысловая нить]-Агент селективности обычно синтезируют по следующим стадиям:
(i) Активация агента селективности. Предпочтительно активационной группой в агенте селективности является сукцинимидная или аминогруппа.
(ii) Активация смысловой нити по 5’-концу. Предпочтительно активационной группой в олигонуклеотиде является аминогруппа (при этом агент селективности активирован сукцинимидной группой) или карбоксильная группа (при этом агент селективности активирован аминогруппой),
(iii) Взаимодействие активированного агента селективности с активированной смысловой нитью в условиях, подходящих для реакции между двумя активационными группами.
(iv) Присоединение защитной группы к иммобилизованной антисмысловой нити. Данная стадия предпочтительно осуществляется с использованием олигонуклеотида, реакционные группы которого блокированы путем ацетилирования или бензилирования (фуранозные группы), 2-цианоэтилирования (фосфодиэфирные связи) и флуорен-9-ил)метоксикарбонилирования (ФМОК) (экзоциклические аминогруппы).
(v) Соединение смысловой и антисмысловой нитей.
Е.1. Синтез конъюгатов, содержащих нуклеиновую кислоту и СИОЗС, присоединенный к 5’-концу
Конъюгаты изобретения могут быть получены по способам, известным специалистам в данной области техники. Синтез конъюгатов может включать селективную защиту функциональных групп и снятие защитных групп. Подходящие защитные группы хорошо известны специалисту в данной области техники. Например, общий обзор по защитным группам в органической химии представлен Wuts, P.G.M. и Greene T.W. в Protecting Groups in Organic Synthesis (4th Ed. Wiley-Interscience), и Kocienski P.J. в Protecting Groups (3rd Ed. Georg Thieme Verlag).
В контексте настоящего изобретения следующие термины имеют нижеприведенные значения.
- Термин "C1-C6-алкил" относится к линейному или разветвленному углеводородному радикалу, состоящему из атомов углерода и водорода, в котором нет ненасыщенных групп, количество атомов углерода составляет от одного до шести, предпочтительно, от одного до трех (С1-С3-алкил), и который соединен с оставшейся частью молекулы посредством одинарной связи. К примерам алкильных групп относятся, помимо прочего, метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, трет-бутил, пентил и гексил. Предпочтительно, алкильной группой является метил.
- Термин "галоген" относится к брому, хлору, йоду или фтору.
- Термин "галогеналкил" относится к алкильной группе, определенной выше, в которой, по меньшей мере, один атом водорода замещен на атом галогена. К примерам галогеналкильных групп относятся, помимо прочего, CF3, CCl3, CHF2, CF2CF3. Предпочтительно, галогеналкильной группой является CF3.
- Термин "C6-C10-арил" относится к ароматической группе с 6-10 атомами углерода, содержащей 1 или 2 ароматических ядра, которые связан посредством углерод-углеродной связи или сочленены, в том числе, например, фенил, нафтил или дифенил. Предпочтительно, арильной группой является фенил.
Термин "гетероциклил" относится к устойчивому 3-10-членному циклическому радикалу, предпочтительно, 5- или 6-членному циклу, который состоит из атомов углерода и одного-пяти гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, и который является частично или полностью насыщенным или ароматическим ("гетероарил"). Для целей настоящего изобретения гетероцикл может представлять собой моноциклическую, бициклическую или трициклическую систему, которая может включать системы с конденсированными ядрами. В отдельном варианте осуществления гетероциклической группой является сукцинимид.
Соединения настоящего изобретения, представленные вышеуказанной формулой (I), могут иметь стереоизомеры в зависимости от наличия хиральных центров. Одиночные изомеры, энантиомеры или диастереомеры и их смеси находятся в пределах объема настоящего изобретения.
Если не оговорено противное, то предполагается, что соединения, используемые в изобретении, включают соединения, которые отличаются только наличием одного или несколько изотопно-обогащенных атомов. Например, соединения, имеющие вышеуказанную структуру, но без замещения водорода на дейтерий или тритий или замещения углерода на атому углерода, обогащенный изотопом13С или14С, или на обогащенный изотопом15N атом азота, находятся в пределах объема данного изобретения.
i. Синтез с использованием амино-дериватизованной нуклеиновой кислоты и активированного производного сертралина
В первом варианте осуществления конъюгаты согласно изобретению могут быть получены путем связывания амино-дериватизованной нуклеиновой кислоты с активированным производным сертралина или его аналогом, при этом активированное производное агента селективности представляет собой соединение с формулой (II):
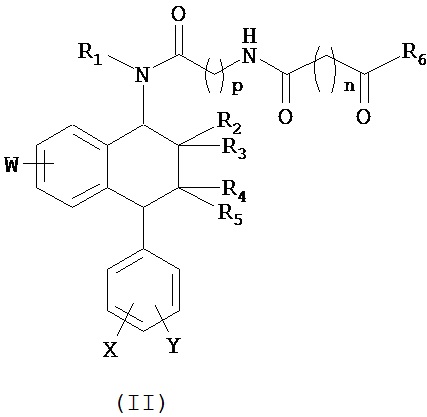
в которой:
R1, R2, R3, R4 и R5 независимо друг от друга выбраны из водорода и C1-C6-алкила;
Х и Y независимо выбраны из водорода, галогена, С1-С3-алкила, С1-С3-галогеналкила, ORa и SRb, где Ra и Rb независимо выбраны из С1-С3-алкила и C6-С10-арила;
R6 - активирующий карбонильную группу заместитель;
W выбран из водорода, галогена, CN, NO2, С1-С3-алкила, С1-С3-галогеналкила, NRcRd, SO2NReRf, NRgSO2Rh, CO2Ri, где Rc, Rd, Re, Rf, Rg, Rh и Ri независимо выбраны из водорода и С1-С3-алкила;
n и p выбраны из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 и 13.
Термин "радикал, активирующий карбонильную группу" относится к заместителю при карбонильной группе, который обеспечивает способность карбонильной группы подвергаться нуклеофильному присоединению. В отдельном варианте осуществления вместе с карбонильной группой он образует ангидрид, галоидангидрид или сложноэфирную группу. В предпочтительном варианте осуществления заместитель, активирующий карбонильную группу, выбран из галогена, -OC(O)R, -OR’, -SR’’; где R, R’ и R’’ независимо выбраны из C1-C6-алкила, галогеналкила, гетероциклила, арила и гетероарила.
В отдельном варианте осуществления R6 - это сукцинимидоксигруппа. Поэтому в другом варианте осуществления конъюгаты согласно изобретению могут быть получены путем связывания амино-дериватизованной нуклеиновой кислоты с активированным производным сертралина или его аналогом, при этом активированное производное агента селективности представляет собой соединение с формулой (III):
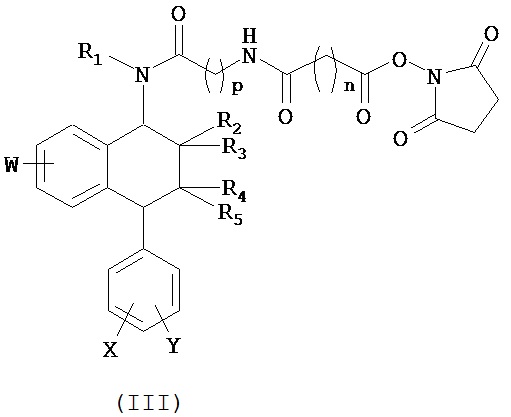
в которой:
R1, R2, R3, R4 и R5 независимо друг от друга выбраны из водорода и C1-C6-алкила;
Х и Y независимо выбраны из водорода, галогена, С1-С3-алкила, С1-С3-галогеналкила, ORa и SRb, где Ra и Rb независимо выбраны из С1-С3-алкила и C6-С10-арила;
W выбран из водорода, галогена, CN, NO2, С1-С3-алкила, С1-С3-галогеналкила, NRcRd, SO2NReRf, NRgSO2Rh, CO2Ri, где Rc, Rd, Re, Rf, Rg, Rh и Ri независимо выбраны из водорода и С1-С3-алкила;
n и p выбраны из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 и 13.
Согласно отдельному варианту осуществления активированное соединение с формулой (III) - это соединение (1):

Согласно одному варианту осуществления соединения с формулой (I) могут быть получены по последовательности стадий, включающей:
а) взаимодействие соединения формулы (IV)
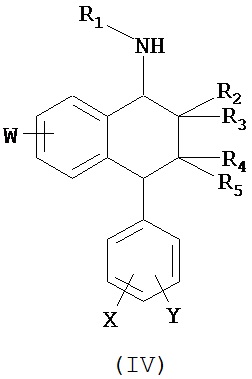
с ацилирующим реагентом формулы (V):

в которой p имеет вышеуказанное значение, Z - это галоген или ОН, a PG - защитная группа для амина, которое приводит к образованию соединения формулы (VI)
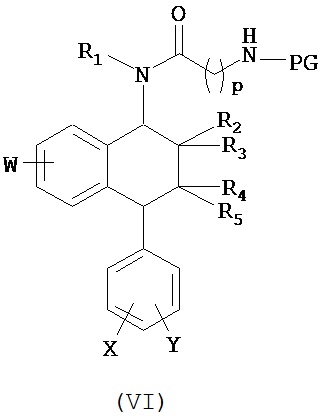
Защитные группы, обычно используемые для защиты аминов, включают карбаматы, такие как трет-бутил, бензил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, 9Н-флуоренилметил (ФМОК), аллил или нитрофенилкарбаматы; амиды, такие как формамиды, амид уксусной кислоты, трифторацетамиды, сульфонамиды, трифторметансульфониламиды или трет-бутилсульфониламиды; и арил или алкиламины, такие как п-метоксифенил, бензил, п-метоксибензил, 3,4-диметоксибензил, диметокситритил или монометокситритиламины. В отдельном варианте осуществления ацилирующий агент с формулой (V) - это 9Н-флуоренилметоксикаборнил-6-аминокапроновая кислота.
Соединения формулы (IV) могут, в свою очередь, быть получены, например, по способу, описанному в патенте США №455736. В частности, если соединение формулы (IV) - это сертралин, то он может быть получен из соответствующего хлоргидрата (коммерчески доступного) обработкой подходящим основанием, включая органические и неорганические основания, такие как карбонаты или гидроксиды щелочных или щелочноземельных металлов, аммиак или амины, такие как триметиламин, триэтиламин, диизопропилэтиламин, пиридин, пиперидин, морфолин и т.п.
b) снятие аминозащитной группы в соединении формулы (IV) с образованием соединения формулы (VII):

Подходящие условия для снятия защитных групп известны специалистам в данной области техники и описаны, например, в Protecting Groups in Organic Synthesis (Wuts, P.G.M. и Greene T.W., 4th Ed. Wiley-Interscience) и в Protecting Groups (Kocienski P.J., 3rd Ed. Georg Thieme Verlag). В отдельном варианте осуществления защитная группа снимается в присутствии амина, такого как пиперидин, морфолин, дициклогексиламин, диизопропилэтиламин или диметиламинопиридин, предпочтительно, в присутствии пиперидина.
с) взаимодействие соединения формулы (VII) с ацилирующим реагентом формулы (VIII) или (IX):
в которой n имеет вышеуказанное значение, Z - это галоген или ОН, которое приводит к образованию соединения формулы (X):

В отдельном варианте осуществления ацилирующий реагент формулы (VII) - янтарный ангидрид,
d) обработка соединения формулы (X) карбонил-активирующей группой.
Термин "карбонил-активирующая группа" относится к соединению, которое превращает карбонил карбоксикислотной группы с группу, которая склонна к нуклеофильному присоединению, такую как ангидриды, галогенангидриды карбоновых кислот, карбодиимиды, галогенирующие агенты, дисульфиды и т.д. В отдельном варианте осуществления карбонил-активирующая группа выбрана из галогенирующего агента, OCR(O)COC(O)R, RC(O)галогена, R’OH, R’’SH, R’’SSR’’; где R, R’ и R’’ независимо выбраны из C1-C6-алкила, галогеналкила, гетероциклила, арила и гетероарила.
В отдельном варианте осуществления карбонил-активирующей группой является N-гидрокси-сукцинимид. В данном случае реакция предпочтительно проводится в присутствии дополнительной карбонил-активирующей группы.
Поэтому в отдельном варианте осуществления стадия d) включает обработку соединения формулы (X) N-гидроксисукцинимидом в присутсвии дополнительной карбонил-активирующей группы.
Карбонил-активирующая группа, подходящая для данного процесса, включает карбодиимиды, такие как дициклогексилкарбодиимид (ДЦК) и диизопропилкарбодиимид (ДИК), и триазолы, такие как 1-гидрокси-бензотриазол (НО-БТ) и 1-гидрокси-7-аза-бензотриазол (НО-АТ). В предпочтительном варианте осуществления соединение формулы (VI) реагирует с N-гидроксисукцинимидом в присуствии диизопропилкарбодиимида, давая активированное производное формулы (II).
Согласно другому аспекту изобретение относится к интермедиату формулы (VI)
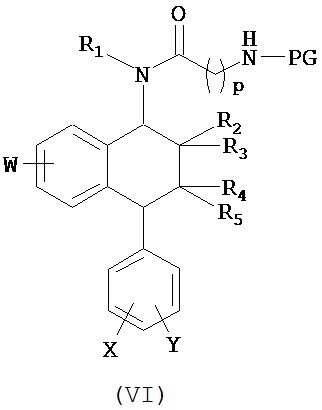
в которой R1-R5, X, Y, W, p и PG имеют вышеуказанные значения. В предпочтительном варианте осуществления R1 - это метил, R2-R5 - это водород, Х и Y - хлорид, W - водород, p равно 5, а PG - это 9Н-флуоренилметоксикарбонил. Более предпочтительно, соединение формулы (VI) - это соединение (2)
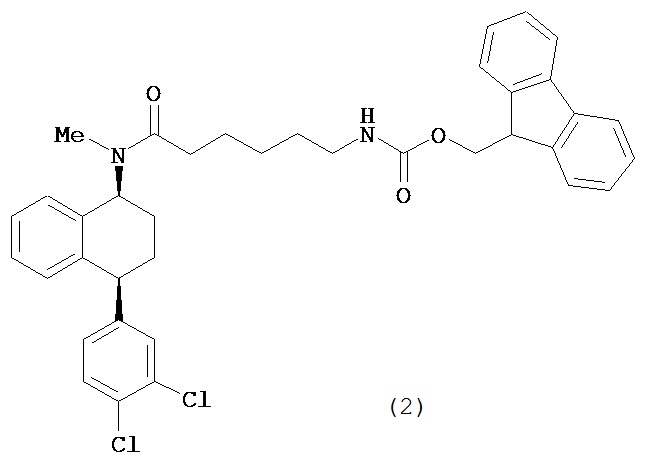
Согласно другому аспекту изобретение относится к интермедиату формулы (VII),
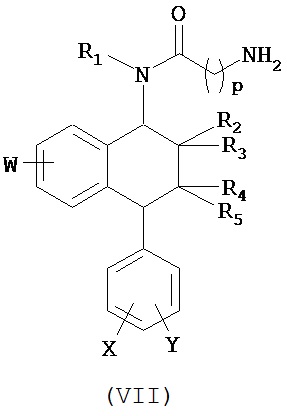
в которой R1-R5, X, Y, W и p имеют вышеуказанные значения. В предпочтительном варианте осуществления R1 - это метил, R2-R5 - это водород, Х и Y - хлорид, W - водород, а p равно 5. Более предпочтительно, соединение формулы (V) - это соединение (3)

Согласно другому аспекту изобретение относится к интермедиату формулы (X)

в которой R1-R5, X, Y, W, p и n имеют вышеуказанные значения. В предпочтительном варианте осуществления R1 - это метил, R2-R5 - это водород, Х и Y - хлорид, W - водород, p равно 5, а n равно 2. Более предпочтительно, соединение формулы (VIII) - это соединение (4):

Согласно другому аспекту изобретение относится к интермедиату формулы (II),

в которой R1-R6, X, Y, W, p и n имеют вышеуказанные значения.
Согласно другому аспекту изобретение относится к интермедиату формулы (III)
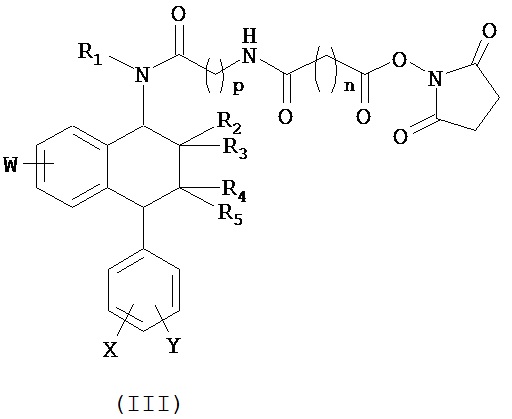
в которой R1-R5, X, Y, W, p и n имеют вышеуказанные значения. В предпочтительном варианте осуществления R1 - это метил, R2-R5 - это водород, Х и Y - хлорид, W - водород, p равно 5, а n равно 2. Более предпочтительно, соединение формулы (II) - это соединение (1):

Нить миРНК, которую собираются присоединить к агенту селективности, получают постадийным твердофазным синтезом на твердой подложке по способу, раскрытому в "Oligonucleotide synthesis, a practical approach." под ред. M.J.Gait. IRL Press - 1985.
Для конъюгирования лиганда селективности олигонуклеотид необходимо подвергнуть превращению в производное по аминогруппе. Эту процедуру можно осуществить по 5’-концу или по 3’-концу. В предпочтительном варианте осуществления лиганд селективности присоединен к 5’-концу.
Согласно одному варианту осуществления конъюгаты формулы (I) могут быть получены по реакции соединения формулы (II) или (III), описанного выше, с амино-модифицированным олигонуклеотидом формулы (XII):
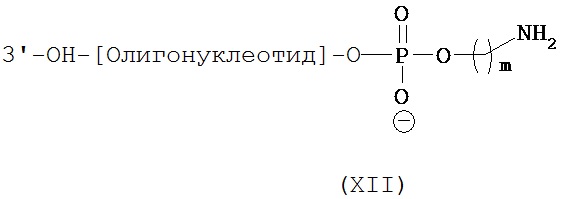
Общий способ активации олигонуклеотида с использованием аминолинкерного модификатора обычно проводится по нижеуказанной схеме:
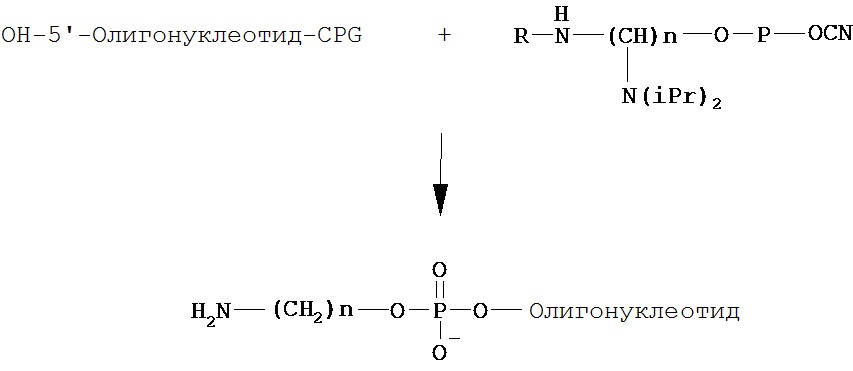
Соединение формулы (XII) может быть получено взаимодействием 5’-ОН группы олигонуклеотида с аминомодификатором формулы (XIII):

в которой m имеет вышеуказанное значение, a PG - защитная группа для амина. Защитные группы, обычно используемые для защиты аминов, включают карбаматы, такие как трет-бутил, бензил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, 9Н-флуоренилметил (ФМОК), аллил или нитрофенилкарбаматы; амиды, такие как формамиды, амид уксусной кислоты, трифторацетамиды, сульфонамиды, трифторметансульфониламиды или трет-бутилсульфониламиды; и арил или алкиламины, такие как п-метоксифенил, бензил, п-метоксибензил, 3,4-диметоксибензил, диметокситритил или монометокситритиламины. В отдельном варианте осуществления аминолинкер формулы (XIII) - это 6-(трифторацетиламино)гексил-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидит (5’-ТФА-С6-аминомодификатор-ЦЭП) или 6-(4-монометокситритиламино)гексил-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидит (5’-ММТ-С6-аминомодификатор-ЦЭП).
После связывания 5’-ОН группы олигонуклеотида с аминолинкером защитная группа для амина снимается в известных условиях. Например, снятие защитной группы с ТФА-защищенных аминопроизводных могут быть осуществлено обработкой аммиаком; тогда снятие защитной группы с ММТ-защищенных аминопроизводных может быть осуществлено обработкой уксусной кислотой, хлоруксусной кислотой, дихлоруксусной кислотой или трифторуксусной кислотой.
Общий способ синтеза аминомодифицированного олигонуклеотида:
(i) готовят раствор молекулы линкера/модификатора (высушенной под вакуумом) в безводном ацетонитриле (для большинства коммерчески доступных амидитов используют 0,1 М раствор) и помещают его в дополнительный резервуар вашего синтезатора (Y)
(ii) в начале синтеза необходимой олигонуклеотидной последовательности присоединяют Y-основание к 5’-концу. Это позволяет связать молекулу линкера/модификатора из Y резервуара с концом олигонуклеотидной последовательности;
(iii) начинают синтез по соответствующему циклу связывания. Тот же самый цикл связывания проводят для связывания молекулы линкера/модификатора;
(iv) в конце синтеза олигонуклеотида промывают подложку и в заключение высушивают подложку потоком газа;
(v) извлекают твердую подложку из колонки и переносят ее во флакон с завинчивающейся крышкой и завершают 2 стадию по снятию защитной группы.
Снятие защитной группы с аминомодифицированного олигонуклеотида следует осуществлять для последующего конъюгирования с агентом селективности. С этой целью все остающиеся защитные группы в олигонуклеотиде снимают следующим образом. Добавляют 500 мкл смеси, содержащей 20% (по объему) метиламина (40% (по отношению массы к объему) водный раствор) и 80% (по объему) насыщенного раствора аммиака (содержащего 30-32% (по отношению массы к объему) NH3) в пробирку Эппендорфа с олигонуклеотидом (200 нмоль). Пробирку герметично закрывают и нагревают в течение 45 минут до температуры 65 °С. Эта процедура позволяет снять защитные группы с атома фосфора нуклеотидов (ацетилирование или бензоилирование фуранозы и 2-цианоэтилирование фосфодиэфирных связей) и защитные группы с экзоциклических аминогрупп (Bz, Ac, i-Bu). Затем смесь охлаждают и фильтруют, а надосадочную жидкость высушивают. Оставшийся шарик вводят в реакцию с 1М фторидом триэтиламмония в течение 3 часов при 65 °С для расщепления связи защитных групп в положении 2’ нуклеотидов (2-трет-бутилдиметилсилил - ТБДМС). Наконец, полученный в результате раствор обессоливают на колонке Сефадекс, в результате остается аминомодифицированный 5’-олигонуклеотид.
В случае включения аминомодифицированного линкера в 3’ОН-конец, следует использовать соответствующую полимерную подложку (CPG шарики); схема синтеза соответствует следующей диаграмме:

(гидролиз можно проводить с помощью гидроксида аммония или реагента Бэкмана, смеси метиламин:гидроксид аммония).
В обоих случаях стадии снятия защитной групп одинаковы и способы конъюгирования в таких случаях также одинаковы, но осуществляются с различной степенью эффективности. В большинстве случаев наилучшие результаты достигнуты при получении 5’-аминопроизводного.
В предпочтительном варианте осуществления олигонуклеотид содержит последовательность, выбранную из группы SEQ ID NO: 5-12.
Аминоактивированный олигонуклеотид далее реагирует с активированным производным агента селективности формулы (II) или (III), указанным выше. Получают конъюгат со структурой

в которой R1-R5, X, Y, W, p и n имеют вышеуказанные значения, a m принимает значения от 2 до 10.
В предпочтительном варианте осуществления конъюгат имеет структуру:
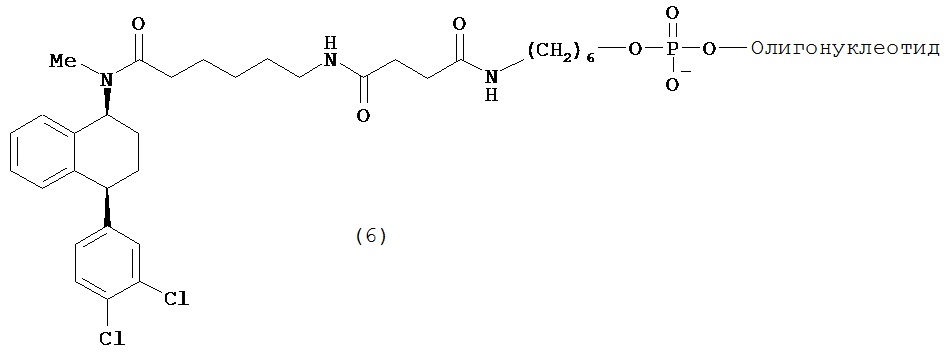
В отдельном варианте осущетвления олигонуклеотид предварительно вводится в реакцию с двухвалентным или трехвалентным фосфорамидом. Данным способом может быть получено соединение с двумя или тремя связывающими положениями, так что две или три молекулы агента селективности могут быть связаны с олигонуклеотидом. Указанные две или три молекулы агента селективности могут быть одинаковыми или различными.
В отдельном варианте осуществления две или три молекулы того же самого агента селективности связаны с олигонуклеотидом. В другом варианте осуществления две или три молекулы различных агентов селективности связаны с олигонуклеотидом.
В варианте осущетвления олигонуклеотид реагирует с двухвалентным или трехвалентным фосфорамидом, давая соединения формулы (XX) или (XXI):
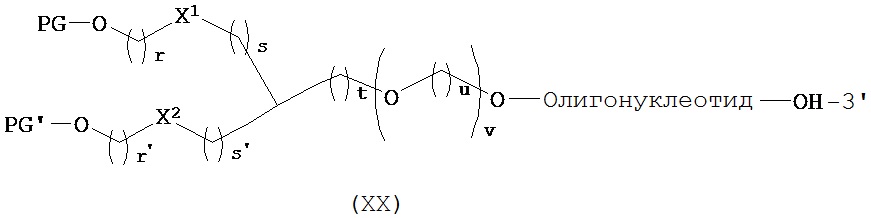

в которой:
PG, PG’’ и PG’’’ независимо выбраны из водорода и гидрокси-защитной группы;
r, r’, r’’, s, s’, s’’, t и u независимо выбраны из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 и 13;
v независимо выбрано из 0 и 1; а
X1, X2 и X3 выбраны независимо друг от друга из CH2, О, S, NH, СО, С(O)O и С(O)NH.
Защитные группы для гидрокси-группы, а также подходящие условия защиты или снятие защитной группы, известны специалистам в данной области техники и описаны, например, в Protecting Groups in Organic Synthesis (Wuts, P.G.M. и Greene T.W., 4th Ed. Wiley-Interscience) и в Protecting Groups (Kocienski P.J., 3rd Ed. Georg Thieme Verlag).
В отдельном варианте осуществления защитные группы для гидроксила выбраны из простых эфиров, простых силиловых эфиров, сложных эфиров, сульфонатов, сульфенатов, сульфинатов, карбонатов и карбаматов. В предпочтительном варианте осуществления защитные группы для гидроксила выбраны из ацетила, бензоила, бензила, метоксиэтоксилметилового эфира (МЭМ), диметокситритила (ДМТ), метоксиметилового эфира (MOM), метокситритила (ММТ), п-метоксибензилового эфира (ПМБ), метилтиометилового эфира, пивалоила (Piv), тетрагидропиранила (ТГП), тритила (Tr или Тр), 9Н-флуоренилметила (Fmoc или ФМОК), триметилсилила (ТМС), трет-бутилдиметилсилила (ТБДМС), трет-бутилдиметилсилоксиметила (ТОМ) и триизопропилсилилового (ТИПС) эфира. Предпочтительно, PG, PG’’ и PG’’’ независимо выбраны из Н, ДМТ и Fmoc (ФМОК).
В отдельном варианте осуществления защитные группы для гидроксила в соединении формулы (XX) или (XXI) являются различными, так что они могут быть селективно сняты и связаны, при желании, с различными молекулами.
Отдельный вариант осуществления относится к соединению формулы (XX), в которой r и r’ равны 4, s и s’ - 1, t и v - 0, X1 и X2 представляют собой С(O)NH, а PG1 и PG2 независимо выбраны из Н, ДМТ и Fmoc (ФМОК). Другой вариант осуществления относится к соединению формулы (XX), в которой r равно 2, r’ равно 0, s - 1, s’ - 0, t и v - 0, X1 и X2 представляют собой СН2, а PG1 и PG2 независимо выбраны из Н и ДМТ.
Вариант осуществления относится к соединению формулы (XXI), в которой r, r’ и r’’ равны 3, s, s’ и s’’ - 1, t - 1, v - 0, X1, X2 и X3 представляют собой О, a PG1, PG2 и PG3 независимо выбраны из Н и ДМТ. Другой вариант осуществления относится к соединению формулы (XXI), в которой r, r’ и r’’ равны 3, s, s’ и s’’ - 1, t - 1, u - 3, v - 1, X1, X2 и X3 представляют собой О, а PG1, PG2 и PG3 независимо выбраны из Н и ДМТ.
Соединения формул (XX) и (XXI) могут быть затем подвергнуты обработке для снятия защитных групп, при желании, и введены в реакцию с аминомодификатором формулы (XIII)

в которой m и PG имеют вышеуказанные значения, с образованием соединений формулы (XXII) или (XXIII), соответственно.
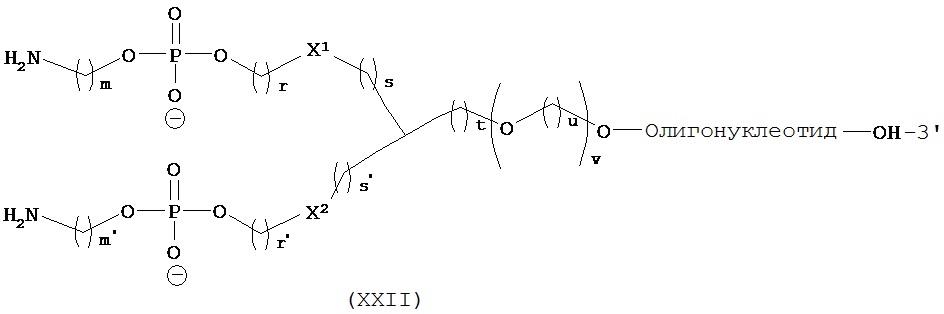
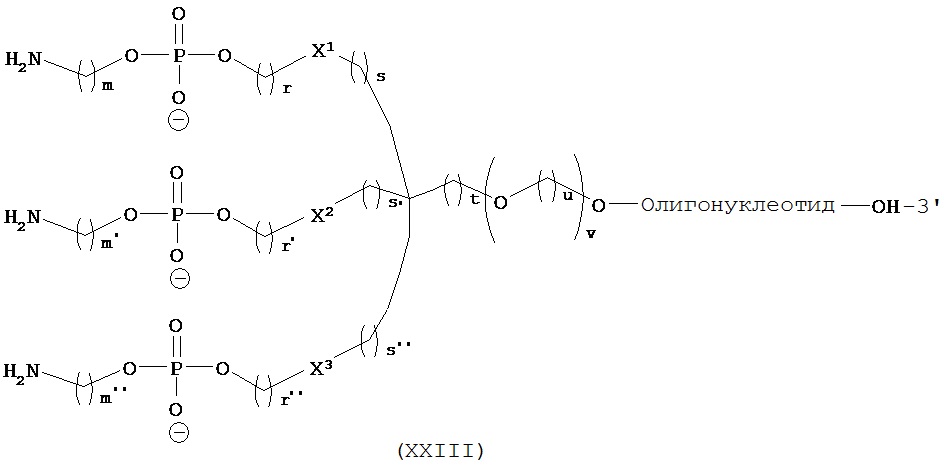
в которой:
m, m’, m’’, r, r’, r’’, s, s’, s’’, t, u, v, X1, X2 и X3 имеют значения, указанные ранее.
Соединения формул (XXII) и (XXIII) далее могут быть введены в реакцию с соединением формулы (II), предпочтительно, с соединением формулы (III), давая конъюгаты (XXIV) и (XXV), соответственно.

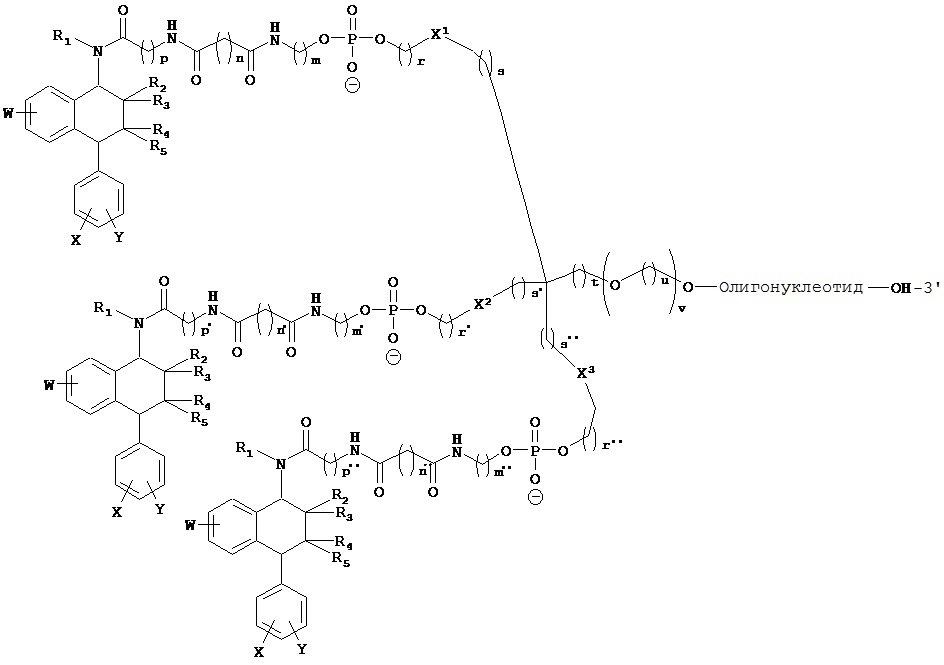
в которой:
m, m’, m’’, n, n’, n’’, p, p’, p’’, r, r’’, r’’, s, s’, s’’, t, u, v, X1, X2, X3, R1-R5, W, X, Y и Z имеют ранее указанные значения.
Отдельный вариант осуществления относится к соединению формулы (XXIV), указанному выше.
Другой вариант осуществления относится к соединению формулы (XXIV), в которой агент селективности - это сертралин, p и p’ равны 5, n и n’ - 2, m и m’ - 6, r и r’ - 4, s и s’ - 1, t и v - 0, a X и X’ представляют собой C(O)NH. Другой вариант осуществления относится к соединению формулы (XXIV), в которой агент селективности - это сертралин, p и p’ равны 5, n и n’ - 2, m и m’ - 6, r - 2, r’ - 0, s - 1, s’ - 0, t и v - 0, а Х и X’ представляют собой СН2.
Отдельный вариант осуществления относится к соединению формулы (XXV), указанному выше.
Отдельный вариант осуществления относится к соединению формулы (XXV), В которой агент селективности - это сертралин, p, p’, p’’ равны 5, n, n’, n’’ - 2, m, m’, m’’ - 6, r, r’, r’’ - 3, s, s’, s’’ - 1, t - 1, v - 0, a X, X’ и Х’’ представляют собой О. Отдельный вариант осуществления относится к соединению с формулой (XXV), в которой агент селективности - это сертралин, p, p’, p’’ равны 5, n, n’, n’’ - 2, m, m’, m’’ - 6, r, r’, r’’ - 3, s, s’, s’’ - 1, t - 1, u - 3, v - 1, a X, X’ и Х’’ представляют собой О.
ii. Синтез с использованием карбоксил-дериватизованной нуклеиновой кислоты и амино-дериватизованного сертралина
В другом варианте осуществления конъюгат изобретения получен конъюгированием аминодериватизованного агента селективности и карбоксил-дериватизованного олигонуклеотида.
В отдельном варианте осуществления активированное производное агента селективности - это соединение формулы (VII)
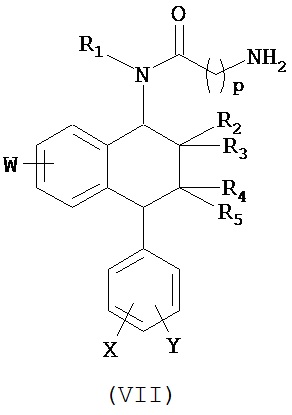
в которой:
R1, R2, R3, R4 и R5 независимо друг от друга выбраны из водорода и C1-C6-алкила;
Х и Y независимо выбраны из водорода, галогена, С1-С3-алкила, С1-С3’галогеналкила, ORa и SRb, где Ra и Rb независимо выбраны из С1-С3-алкила и C6-С10-арила;
W выбран из водорода, галогена, CN, NO2, С1-С3-алкила, С1-С3-галогеналкила, NRcRd, SO2NReRf, NRgSO2Rh, CO2Ri, где Rc, Rd, Re, Rf, Rg, Rh и Ri независимо выбраны из водорода и С1-С3-алкила;
р выбрано из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 и 13.
Согласно отдельному варианту осуществления активированное соединение формулы (II) - это соединение (3), описанное выше:

Соединения формулы (VII) могут быть получены так, как описано выше, по последовательности стадий, включающей:
(i) взаимодействие соединения формулы (IV)

с ацилирующим реагентом формулы (V):

в которой p имеет вышеуказанное значение, Z - это галоген или ОН, а PG - защитная группа для амина, которое приводит к образованию соединения формулы (VI)

Защитные группы, обычно используемые для защиты аминов, включают карбаматы, такие как трет-бутил, бензил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, 9Н-флуоренилметил (ФМОК), аллил или нитрофенилкарбаматы; амиды, такие как формамиды, амид уксусной кислоты, трифторацетамиды, сульфонамиды, трифторметансульфониламиды или трет-бутилсульфониламиды; и арил или алкиламины, такие как п-метоксифенил, бензил, п-метоксибензил, 3,4-диметоксибензил, диметокситритил или монометокситритиламины. В отдельном варианте осуществления ацилирующий агент формулы (VII) - это 9Н-флуоренилметоксикаборнил-6-аминокапроновая кислота.
Соединения формулы (III) могут, в свою очередь, быть получены по вышеописанному способу.
(ii) снятие аминозащитной группы в соединении формулы (VI) с образованием соединения формулы (VII):

Подходящие условия для снятия защитных групп известны специалистам в данной области техники и описаны, например, в Protecting Groups in Organic Synthesis (Wuts, P.G.M. и Greene T.W., 4th Ed. Wiley-Interscience) и в Protecting Groups (Kocienski P.J., 3rd Ed. Georg Thieme Verlag). В отдельном варианте осуществления защитная группа снимается в присутствии амина, такого как пиперидин, морфолин, дициклогексиламин, диизопропилэтиламин или диметиламинопиридин, предпочтительно, в присутствии пиперидина.
В предпочтительном варианте осуществления аминомодифицированный агент селективности соответствует соединению (3).

Нить миРНК, которую собираются присоединить к агенту селективности, получают постадийным твердофазным синтезом на твердой подложке по способу, раскрытому в "Oligonucleotide synthesis, a practical approach." под ред. M.J.Gait. IRL Press - 1985.
Для конъюгирования лиганда селективности олигонуклеотид необходимо подвергнуть превращению в производное по карбоксигруппе. Эту процедуру можно осуществить по 5’-концу или по 3’-концу. В предпочтительном варианте осуществления лиганд селективности присоединен к 5’-концу.
Согласно одному варианту осуществления конъюгаты с формулой (XIV) могут быть получены по реакции соединения формулы (VII), описанного выше, с карбокси-модифицированным олигонуклеотидом формулы (XV):
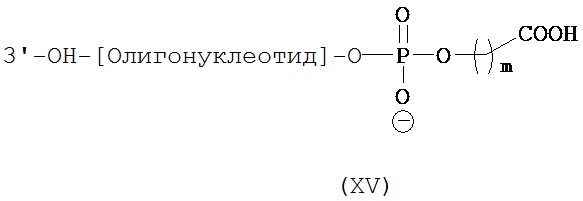
Общий способ активации олигонуклеотида с использованием модификатора карбоксильного линкера обычно проводится по нижеуказанной схеме:

Общий способ синтеза карбоксимодифицированного олигонуклеотида:
(i) готовят раствор молекулы модификатора в безводном ацетонитриле и помещают его в дополнительный резевуар вашего синтезатора (Y);
(ii) в начале синтеза необходимой олигонуклеотидной последовательности присоединяют Y-основание к 5’-концу. Это повзоляет связать молекулу линкера/модификатора из Y резервуара с концом олигонуклеотидной последовательности;
(iii) начинают синтез по соответствующему циклу связывания. Тот же самый цикл связывания проводят для связывания молекулы линкера/модификатора;
(iv) в конце синтеза олигонуклеотида промывают подложку и в заключение высушивают подложку потоком газа;
(v) извлекают твердую подложку из колонки и переносят ее во флакон с завинчивающейся крышкой и завершают 2 стадию по снятию защитной группы.
Снятие защитной группы с карбоксимодифицированного олигонуклеотида следует осуществлять для последующего конъюгирования с агентом селективности. С этой целью все остающиеся защитные группы в олигонуклеотиде снимают следующим образом. Добавляют 500 мкл смеси, содержащей 20% (по объему) метиламина (40% (по отношению массы к объему) водный раствор) и 80% (по объему) насыщенного раствора аммиака (содержащего 30-32% (по отношению массы к объему) NH3) в пробирку Эппендорфа с олигонуклеотидом (200 нмоль). Пробирку герметично закрывают и нагревают в течение 45 минут до температуры 65 °С. Эта процедура позволяет снять защитные группы с атома фосфора нуклеотидов (ацетилирование или бензоилирование фуранозы и 2-цианоэтилирование фосфодиэфирных связей) и защитные группы с экзоциклических аминогрупп (Bz, Ac, i-Bu). Затем смесь охлаждают и фильтруют, а надосадочную жидкость высушивают. Оставшийся шарик вводят в реакцию с 1М фторидом триэтиламмония в течение 3 часов при 65 °С для расщепления связи защитных групп в положении 2’ нуклеотидов (2-трет-бутилдиметилсилил - ТБДМС). Наконец, полученный в результате раствор обессоливают на колонке Сефадекс, в результате остается карбоксимодифицированный 5’-олигонуклеотид.
В предпочтительном варианте осуществления олигонуклеотид содержит последовательность, выбранную из группы SEQ ID NO: 5-12.
Карбоксил-активированный олигонуклеотид далее реагирует с активированным производным агента селективности формулы (VII), указанным выше. Получают соединение общей формулы:

В отдельном варианте осуществления конъюгат имеет структуру:

В другом отдельном варианте осуществления конъюгат имеет структуру:

В варианте осуществления олигонуклеотид вначале реагирует с двухвалентным или трехвалентным фосфорамидом, давая соединения формулы (XX) или (XXI), указанным ранее. Соединения формул (XX) и (XXI) могут быть затем подвергнуты обработке для снятия защитных групп, при желании, и введены в реакцию карбокси-модификатором с образованием соединения формулы (XXVI) или (XXVII), соответственно:
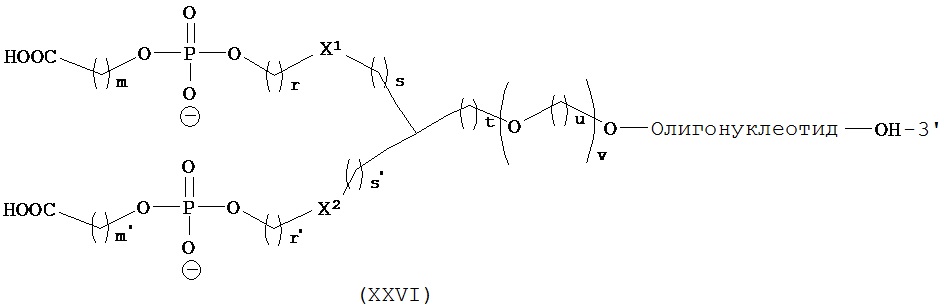
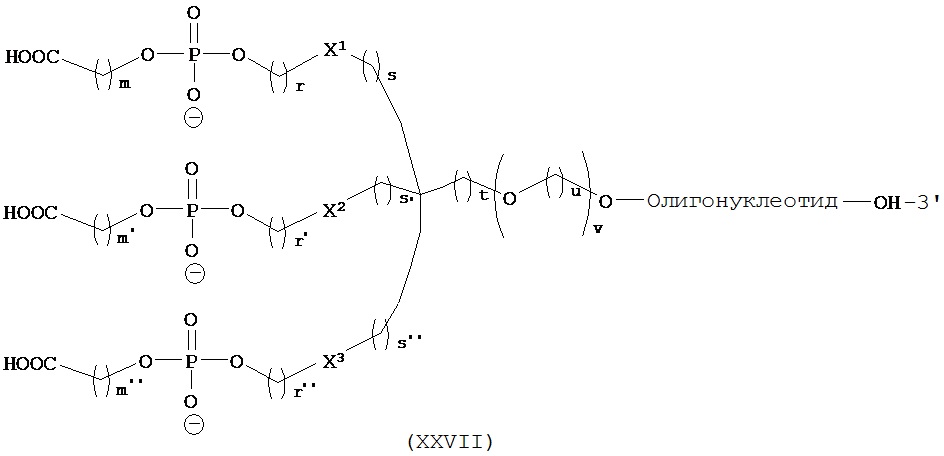
в которой:
m, m’, m’’, r, r’, r’’, s, s’, s’’, t, u, v, X1, X2 и X3 имеют значения, указанные ранее.
Соединения формул (XXVI) и (XXVII) далее могут быть введены в реакцию с соединением формулы (VII), предпочтительно, с образованием конъюгатов (XXVIII) и (XXIX), соответственно.
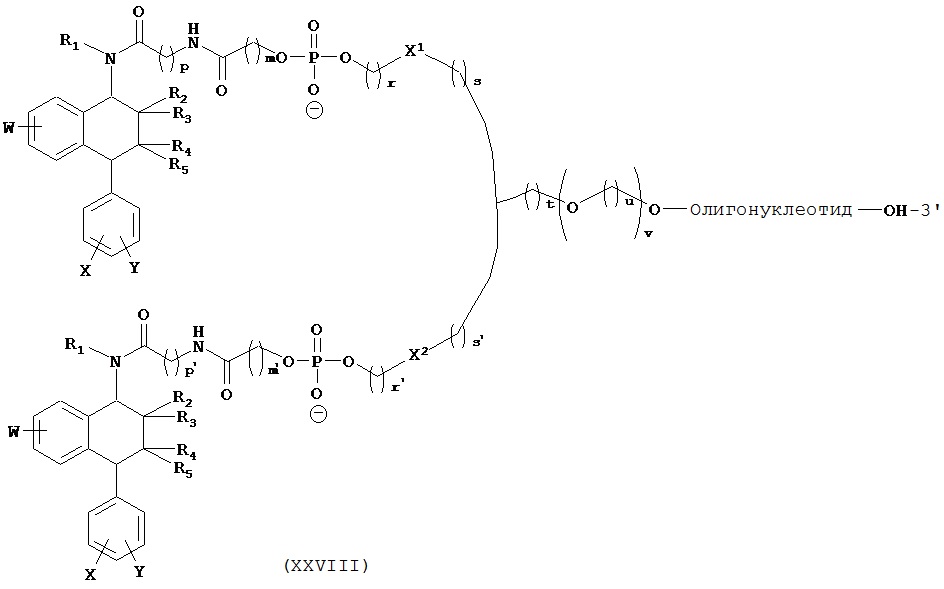
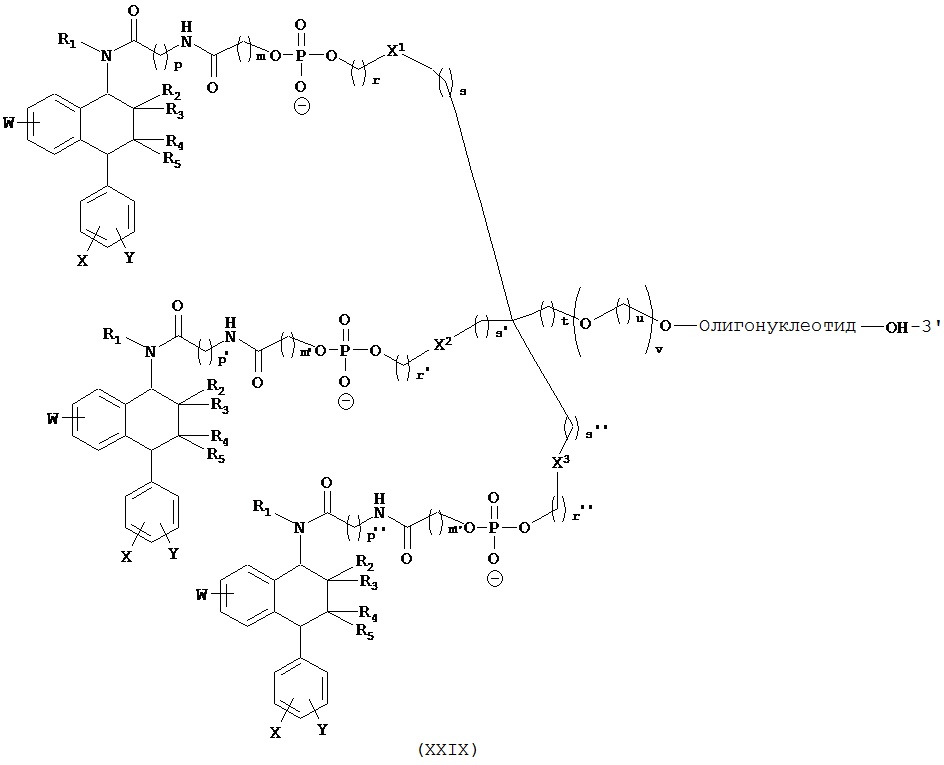
в которой:
m, m’, m", p, p’, p’’, r, r’, r’’, s, s’, s’’, t, u, v, X1, X2, X3, R1-R5, W, X, Y и Z имеют ранее указанные значения.
Отдельный вариант осуществления относится к соединению формулы (XXVIII), указанному выше.
Отдельный вариант осуществления относится к соединению формулы (XXVIII), в которой агент селективности - это сертралин, p и p’ равны 5, m и m’ - 6, r и r’ - 4, s и s’ - 1, t и v - 0, а Х и X’ представляют собой С(O)NH.
Другой вариант осуществления относится к соединению формулы (XXVIII), в которой агент селективности - это сертралин, p и p’ равны 5, m и m’ - 6, r - 2, r’ - 0, s - 1, s’ - 0, t и v - 0, а Х и X’ представляют собой CH2.
Отдельный вариант осуществления относится к соединению формулы (XXVIII), в которой агент селективности - это сертралин, p и p’ равны 5, m и m’ - 9, r и r’ - 4, s и s’ - 1, t и v - 0, а Х и X’ представляют собой С(O)NH. Другой вариант осуществления относится к соединению формулы (XXVIII), в которой агент селективности - это сертралин, p и p’ равны 5, m и m’ - 9, r - 2, r’ - 0, s - 1, s’ - 0, t и v - 0, а Х и X’ представляют собой CH2.
Отдельный вариант осуществления относится к соединению формулы (XXIX), указанному выше.
Отдельный вариант осуществления относится к соединению формулы (XXIX), в которой агент селективности - это сертралин, p, p’, p’’ равны 5, m, m’, m’’ - 6, r, r’, r’’ - 3, s, s’, s’’ - 1, t - 1, v - 0, а X, X’ и X’’ представляют собой О. Другой вариант осуществления относится к соединению формулы (XXIX), в которой агент селективности - это сертралин, p, p’, p’’ равны 5, m, m’, m’’ - 6, r, r’’, r’’ - 3, s, s’, s’’ - 1, t - 1, u - 3, v - 1, а X, X’ и X’’ представляют собой О.
Отдельный вариант осуществления относится к соединению формулы (XXIX), в которой агент селективности - это сертралин, p, p’, p’’ равны 5, m, m’, m’’ - 9, r, r’, r’’ - 3, s, s’, s’’ - 1, t - 1, v - 0, а X, X’ и X’’ представляют собой О. Другой вариант осуществления относится к соединению формулы (XXIX), в которой агент селективности - это сертралин, p, p’, p’’ равны 5, m, m’, m’’ - 9, r, r’, r’’ - 3, s, s’, s’’ - 1, t - 1, u - 3, v - 1, а X, X’ и X’’ представляют собой О.
iii. Синтез с использованием карбоксил-дериватизованной нуклеиновой кислоты и амино-дериватизованного номифензина
Номифензин и его аналоги содержат аминогруппу, которая в принципе может быть использована для связывания с карбокси-модифицированным олигонуклеотидом. Однако, аминогруппу непосредственно связана с ароматическим кольцом, что понижает ее реакционноспособность и создает пространственные затруднения. Таким образом, получают аминомодифицированный номифензин или его вариант формулы (XVI)
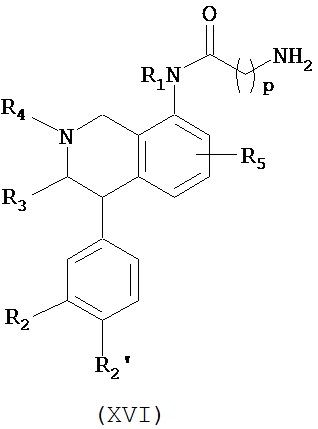
R1 - это водород, C1-C6-алкильная группа или бензильная группа,
R2 - это водород, метильная, хлорная или фторная группа,
R2’ - это водород, метильная, метокси, гидроксильная и галогенидная группа,
R3 и R4 - это водород, C1-C6-алкильная группа.
R5 - это водород, хлорная или метокси-группа в положении 5 или 6, а
p равно 2-6.
В отдельном варианте осуществления активированное производное агента селективности - это соединение (5), в котором R1, R2, R2’, R3 и R5 - это Н, a R4 - метил.
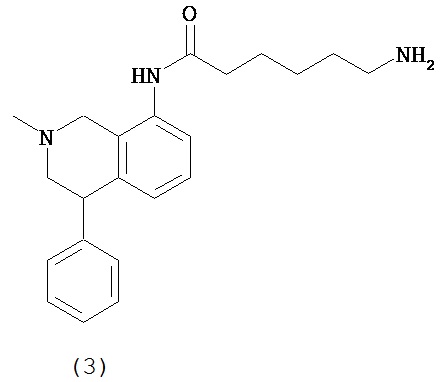
Согласно одному варианту осуществления соединения формулы (XVI) могут быть получены по последовательности стадий, включающей:
а) взаимодействие соединения формулы (XVII)

с ацилирующим реагентом формулы (V):

в которой p имеет вышеуказанное значение, Z - это галоген или ОН, a PG - защитная группа для амина, которое приводит к образованию соединения формулы (XVIII)
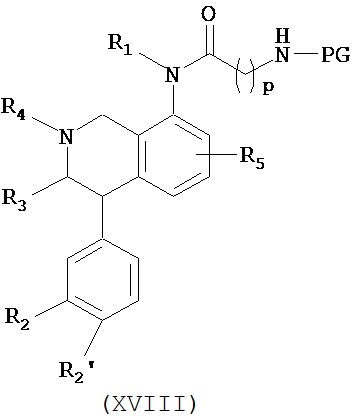
Защитные группы, обычно используемые для защиты аминов, включают карбаматы, такие как трет-бутил, бензил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, 9Н-флуоренилметил (ФМОК), аллил или нитрофенилкарбаматы; амиды, такие как формамиды, амид уксусной кислоты, трифторацетамиды, сульфонамиды, трифторметансульфониламиды или трет-бутилсульфониламиды; и арил или алкиламины, такие как п-метоксифенил, бензил, п-метоксибензил, 3,4-диметоксибензил, диметокситритил или монометокситритиламины. В отдельном варианте осуществления ацилирующий агент формулы (V) - это 9Н-флуоренилметоксикаборнил-6-аминокапроновая кислота.
Соединения формулы (XVII) могут, в свою очередь, быть получены, например, по способу, описанному в патенте США №4185105. В частности, если соединение формулы (III) - это номифензин, то он может быть получен из соответствующего хлоргидрата (коммерчески доступного) обработкой подходящим основанием, включая органические и неорганические основания, такие как карбонаты или гидроксиды щелочных или щелочноземельных металлов, аммиак или амины, такие как триметиламин, триэтиламин, диизопропилэтиламин, пиридин, пиперидин, морфолин и т.п.
b) снятие аминозащитной группы в соединении формулы (XVIII) с образованием соединения формулы (XIX):

Подходящие условия для снятия защитных групп известны специалистам в данной области техники и описаны, например, в Protecting Groups in Organic Synthesis (Wuts, P.G.M. и Greene T.W., 4th Ed. Wiley-Interscience) и в Protecting Groups (Kocienski P.J., 3rd Ed. Georg Thieme Verlag). В отдельном варианте осуществления защитная группа снимается в присутствии амина, такого как пиперидин, морфолин, дициклогексиламин, диизопропилэтиламин или диметиламинопиридин, предпочтительно, в присутствии пиперидина.

Согласно другому аспекту изобретение относится к интермедиату формулы (XVIII), в которой R1-R5, X, Y, W, p и PG имеют вышеуказанные значения. В предпочтительном варианте осуществления R1 - это метил, R2-R5 - это галоген, Х и Y - это хлорид, W - это водород, p равно 5, а PG - это 9Н-флуоренилметоксикарбонил. Более предпочтительно, соединение формулы (XVIII) - это соединение (8)

Нуклеиновую кислоту, которую собираются присоединить к агенту селективности, получают постадийным твердофазным синтезом на твердой подложке по способу, раскрытому в "Oligonucleotide synthesis, a practical approach." под ред. M.J.Gait. IRL Press - 1985.
Для конъюгирования лиганда селективности олигонуклеотид необходимо подвергнуть превращению в производное по карбоксигруппе. Эту процедуру можно осуществить по 5’-концу или по 3’-концу. В предпочтительном варианте осуществления лиганд селективности присоединен к 5’-концу.
Согласно одному варианту осуществления конъюгаты формулы (XVI) могут быть получены по реакции соединения формулы (XIX), описанного выше, с амино-модифицированным олигонуклеотидом формулы (XV)
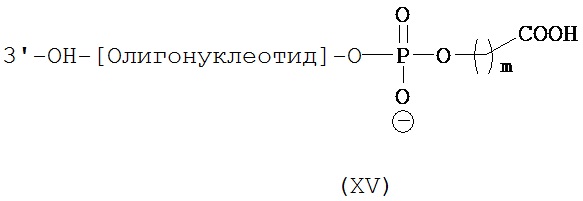
в которой m принимает значения от 2 до 6.
Активация олигонуклеотида с использованием карбокси-группы проводится так, как пояснялось выше.
В предпочтительном варианте осуществления, олигонуклеотид, который связывается с номифензином или его производным, выбран из группы, состоящей из:
(i) нуклеиновой кислоты, которая комплементарна альфа-синуклеину, предпочтительно, нуклеиновой кислоты, содержащей последовательность, выбранную из последовательностей SEQ ID NO: 16-36;
(ii) нуклеиновой кислоты, которая комплементарна ВАХ, предпочтительно, нуклеиновой кислоты, содержащей последовательность SEQ ID NO: 38;
(iii) нуклеиновой кислоту, которая комплементарна Тау;
(iv) нуклеиновой кислоты, которая комплементарна NET;
(v) нуклеиновой кислоты, которая комплементарна хантингтину, предпочтительно, нуклеиновой кислоты, содержащей последовательность, выбранную из последовательностей SEQ ID NO: 39-55.
Карбоксил-активированный олигонуклеотид далее реагирует с активированным производным агента селективности формулы (XVI), указанным выше, приводя к образованию соединения общей структуры:
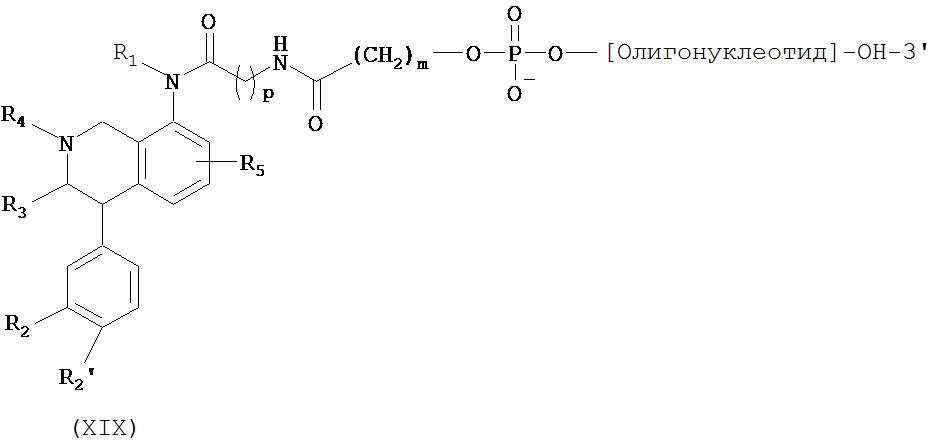
В предпочтительном варианте осуществления конъюгат имеет структуру:

В другом предпочтительном варианте осуществления конъюгат имеет структуру:

В отдельном варианте осуществления соединение формулы (XVI) реагирует с соединением формулы (XXVI) или (XXVII), приводя к образованию конъюгатов (XXX) и (XXXI), соответственно:
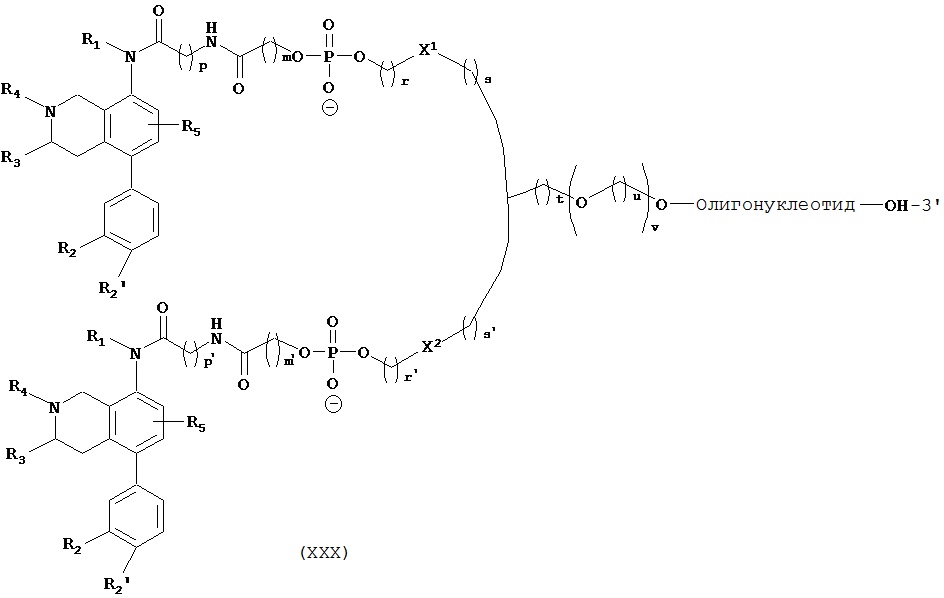

в которой:
m, m’, m’’, p, p’, p’’, r, r’, r’’, s, s’, s’’, t, u, v, X1, X2, X3 и R1-R5 имеют ранее указанные значения.
Отдельный вариант осуществления относится к соединению формулы (XXX), указанному выше.
Отдельный вариант осуществления относится к соединению формулы (XXX), в которой агент селективности - это номифензин, р и р’ равны 5, m и m’ - 6, r и r’ - 4, s и s’ - 1, t и v’ 0, а Х и X’ представляют собой C(O)NH. Другой вариант осуществления относится к соединению формулы (XXVIII), в которой агент селективности - это номифензин, р и р’ равны 5, m и m’ - 6, r - 2, r’ - 0, s - 1, s’ - 0, t и v - 0, а Х и X’ представляют собой CH2.
Отдельный вариант осуществления относится к соединению формулы (XXX), в которой агент селективности - это номифензин, р и р’ равны 5, m и m’ - 9, r и r’ - 4, s и s’ - 1, t и v - 0, а Х и X’ представляют собой С(O)NH. Другой вариант осуществления относится к соединению формулы (XXVIII), в которой агент селективности - это номифензин, р и р’ равны 5, m и m’ - 9, r - 2, r’ - 0, s - 1, s’ - 0, t и v - 0, а Х и X’ представляют собой CH2.
Отдельный вариант осуществления относится к соединению формулы (XXXI), указанному выше.
Отдельный вариант осуществления относится к соединению формулы (XXXI), в которой агент селективности - это номифензин, р, р’, р’’ равны 5, m, m’, m’’ - 6, r, r’, r’’ - 3, s, s’, s’’ - 1, t - 1, v - 0, a X, X’ и X’’ представляют собой О. Другой вариант осуществления относится к соединению формулы (XXXI), в которой агент селективности - это номифензин, р, р’, р’’ равны 5, m, m’, m’’ - 6, r, r’, r’’ - 3, s, s’, s’’ - 1, t - 1, u - 3, v - 1, а X, X’ и X’’ представляют собой О. Отдельный вариант осуществления относится к соединению формулы (XXXI), в которой агент селективности - это номифензин, р, р’, р’’ равны 5, m, m’, m’’ - 9, r, r’, r’’ - 3, s, s’, s’’ - 1, t - 1, v - 0, а X, X’ и X’’ представляют собой О. Другой вариант осуществления относится к соединению формулы (XXXI), в которой агент селективности - это номифензин, р, р’, р’’ равны 5, m, m’, m’’ - 9, r, r’, r’’ - 3, s, s’, s’’ - 1, t - 1, u - 3, v - 1, a X, X’ и X’’ представляют собой О.
iv. Синтез дважды дериватизованного олигонуклеотида с использованием карбоксил-дериватизованной нуклеиновой кислоты, бифункционального линкера, амино-дериватизованного номифензина и амино-дериватизованного сертралина
Защитные группы для гидроксила PG, PG’ и PG’’ в соединениях формул (XX) и (XXI) могут быть одинаковыми или различными.
В отдельном варианте осуществления защитные группы PG и PG’ в соединении формулы (XX) являются различными, так что они могут быть сняты независимо друг от друга, и соединение формулы (XX) при желании может быть связано с двумя различными активированными агентами селективности.
В отдельном варианте осуществления соединение формулы (XX), в которой PG и PG’ отличаются друг от друга, последовательно взаимодействует с карбокси-модификатором, а затем с соединением формулы (VII), в то время как по другому связывающему положению оно реагирует с карбокси-модификатором, а затем с соединением формулы (XVI), давая конъюгат формулы (XXXII)

в которой m, m’, p, p’, r, r’, s, s’, t, u, v, X1, X2, R1-R5, X, Y и Z имеют ранее указанные значения.
В предпочтительном варианте осуществления соединение формулы (XX), в которой PG и PG’ отличаются друг от друга, последовательно взаимодействует с карбокси-модификатором, а затем с соединением (10), в то время как по другому связывающему положению оно реагируете карбокси-модификатором, а затем с соединением (11), давая конъюгат формулы (XXXIIa)
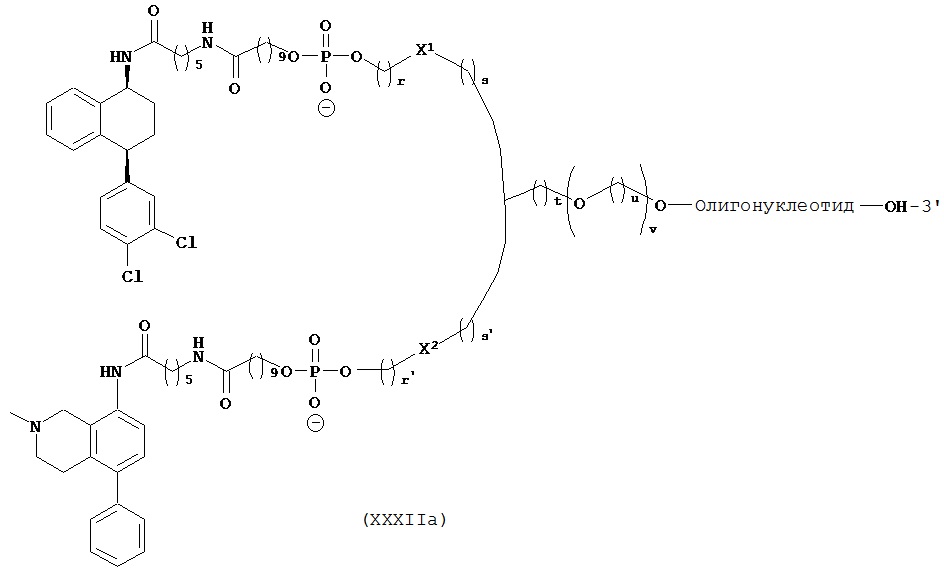
в которой r, r’, s, s’, t, u, v, X1 и X2 имеют значения, указанные ранее.
В отдельном варианте осуществления r и r’ равны 4, s и s’ - 1, t и v - 0, а X1 и X2 представляют собой С(O)NH в соединениях формулы (XXXII) или (XXXIIa).
В отдельном варианте осуществления изобретения соединение формулы (XX), в которой PG и PG’ отличаются друг от друга, представляет собой соединение формулы (ХХа)

В предпочтительном варианте осуществления соединение формулы (XXXIIa) имеет следующую формулу

В отдельном варианте осуществления изобретение относится к соединению формул (XXXII) и (XXXIIa), в которой m, m’, p, p’, r, r’, s, s’, t, u, v, X1, X2, R1-R5, X, Y и Z имеют ранее указанные значения.
В предпочтительном варианте осуществления изобретение относится к соединению (12), указанному выше.
Е.2. Синтез конъюгатов, содержащих нуклеиновую кислоту и защитную группу, присоединенную к 5’-концу.
Синтез начинают с присоединения защитной к первой нити. Если защитная группа состоит из нескольких компонент, то различные компоненты, составляющие часть защитных групп, присоединяют к нуклеиновой кислоте по способу, схожему с тем, что использовался при присоединении нуклеотидов с существующей нуклеиновой кислоте, т.е. вначале активируются присоединяемые группы с целью повышения реакционноспособности свободных гидроксигрупп. К подходящим активирующим реагентам относятся, помимо прочего, тиофосфатное соединение, карбаматное соединение, метилфосфонатное соединение, соединения гуанидиния, сульфаматное соединение, сульфамидное соединение, формацетальное соединение, тиоформацетальное соединение, сульфон, фосфорамидатное соединение. В предпочтительном варианте осуществления группы защитной группы активируют фосфорамидитным соединением или его смесями.
Типичными фосфорамидатами, подходящими для активации свободных ОН групп, являются, например, (2-цианоэтил)-N,N,N’,N’-тетрадиизопропилфосфордиамидит с формулой:

и (2-цианоэтил)-N-диизопропил,N’-алкиламинфосфорамидит
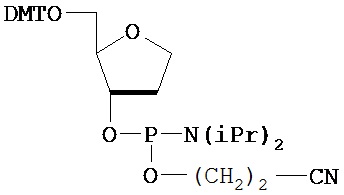
в котором n принимает значения от 6 до 12.
Типичная реакция включает следующие стадии:
А) Фуранозное звено (соответствующая стехиометрия очевидна специалисту в данной области техники) реагирует с 4,4’-диметокситритилхлоридом (DMTr-CI) в условия, способствующих взаимодействию только по первичным положениям гидроксильной группы. Затем, оставшиеся гидроксильные группы реагируют с ацетилирующими или бензоилирующими защитными группами. Обычно активированная фураноза имеет структуру:

B) одну нить интересуемой миРНК (которой является смысловая (s) нить или антисмысловая (а) нить) получают постадийным твердофазным синтезом на твердой подложке, где 5’-ОН группа концевого подзвена в растущей нити, которая обычно защищена диметокситритилом (ДМТ), обрабатывается в кислых условиях для снятия 5’-ОН ДМТ защитной группы, при этом пуриновое и пиримидиновые основания остаются защищенными (флуорен-9-ил)метоксикарбонилом (ФМОК). Другими подходящими защитными группами являются соединения с 6-членным морфолиновым циклом, связанным с фосфорамидатным соединением, фосфортиоатные соединения и O-метильная (оксометильная) и O-этильная (оксоэтильная) группы.
C) после снятия защиты 5’-ОН группа нити миРНК реагирует с реакционноспособной фуранозой из стадии А), приводя к образованию первично-конъюгированного олигонуклеотида. Наконец, в кислых условиях снимают ДМТ защитную группу с первичной гидроксильной группы фуранозы, в результате остается 5’-ОН группа.
D) реакционноспособный С18-членный линкер (обозначаемый далее как C18) мономер алкиленгликоля с 6 мономерными звеньями этиленгликоля (12 атомов углерода и 6 атомов кислорода) - получают присоединением к терминальной ОН группе в условиях фосфитилирования фосфорамидитного соединения, такого как (2-цианоэтил)N,N’-диизопропилфосфорамидита, описанного выше.
Фосфорамидитные соединения особенно пригодня для образования фосфодиэфирных связей, подобных связям, присутствующим в полинуклеотидном или олигонуклеотидном остове. Другими подходящими соединениями для придания реакционноспособности полиэтиленгликолю являются с 6-членным морфолиновым циклом, связанным с фосфорамидатным соединением, фосфортиоатные соединения и O-метильная (оксометильная) и O-этильная (оксоэтильная) группы.
Обычно, реакционноспособный (С18) мономер алкиленгликоля с 6 мономерными звеньями этиленгликоля имеет структуру
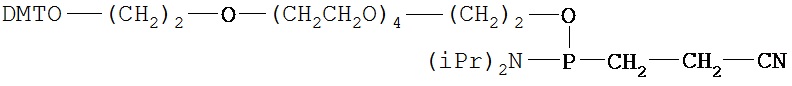
Е) после снятия защиты 5’-ОН группа соединения фураноза-миРНК нить реагирует с реакционноспособным мономером (С18)алкиленгликоля из стадии D), приводя таким образом к образованию вторичноконъюгированного олигонуклеотида с формулой:
ДМТ-(С18)алкиленгликоль-фосфодиэфир-фураноза-фосфодиэфир-РНКнить.
F) в кислых условиях снимают ДМТ защитную группу с первичной гидроксильной группы (С18) алкиленгликоля, в результате остается 5’-ОН группа.
G) после снятия защиты 5’-ОН группа соединения (C18)алкиленгликоль-фосфодиэфир-фураноза-фосфодиэир-РНК нить реагирует со вторым реакционноспособным мономером (C18)алкиленгликоля, подобным мономеру из стадии D), приводя таким образом к образованию третично-конъюгированного олигонуклеотида с формулой:
ДМТ-(С18)алкиленгликоль-фосфодиэфир-(С18)алкиленгликоль-фосфодиэфир-фураноза-фосфодиэфир-РНК нить.
Н) в кислых условиях снимают ДМТ защитную группу с первичной гидроксильной группы концевого (C18) алкиленгликоля, в результате остается 5’-ОН группа, свободная для последующих манипуляций.
Если защитная группа содержит липидую компоненту, то способ полуения олигонуклелотидной конструкции согласно изобретению включает дополнительную стадию между стадиями Н) и I), при этом липидная компонента, предпочтитетльно, в форме активного сложного эфира, амина, тиола или жирной кислоты, связана с терминальной группой (фуранозой или С18-алкиленгликолем, в зависимости от конкретного случая). Специалист в данной области техники может подобрать подходящие условия, реагенты и т.д., для осуществления указанной стадии в зависимости от природы липида и указанной группы. Предпочтительные условия заключаются в получении производных жирных кислот с использованием фосфорамидита для создания активированной молекулы, которая способна конденсироваться через фосфордиэфирную связь с олигонуклеотидной конструкцией за счет свободных терминальных 5’-ОН или 3’-ОН групп.
Е.3. Синтез ми РНК посредством соединения конъюгата, содержащего первую нуклеиновую кислоту и защитную группу при 5’-конце, и конъюгата, содержащего нуклеиновую кислоту, комплементарную нити и СИОЗС, присоединенный в положение 5’.
Комплементарную нить миРНК, конъюгированной с СИОЗС по способу, описанному выше в разделе Е.1., соединяют с модифицированной нитью миРНК, полученной по способу, указанному в разделе Е.2. С этой целью все остающиеся защитные группы в РНК нитях предварительно снимают следующим образом. Добавляют 500 мкл смеси, содержащей 20% (по объему) метиламина (40% (по отношению массы к объему) водный раствор) и 80% (по объему) насыщенного раствора аммиака (содержащего 30-32% (по отношению массы к объему) NH3) в пробирку Эппендорфа с миРНК (200 нмоль). Пробирку герметично закрывают и нагревают в течение 45 минут до температуры 65 °С. Эта процедура позволяет снять защитные группы с атома фосфора нуклеотидов (ацетилирование или бензоилирование фуранозы и 2-цианоэтилирование фосфодиэфирных связей) и защитные группы с экзоциклических аминогрупп (ФМОК). Затем смесь охлаждают и фильтруют, а надосадочную жидкость высушивают. Оставшийся шарик вводят в реакцию с 1М фторидом триэтиламмония в течение 3 часов при 65 °С для расщепления связи защитных групп в положении 2’ нуклеотидов (2-трет-бутилдиметилсилил - ТБДМС). Наконец, полученный в результате раствор обессоливают на колонке Сефадекс.
Условия гибридизации нуклеиновой кислоты, подходящие для образования таких двухцепочечных структур, описаны в Joseph Sambrook, et al. (Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2001) и в Haymes, В.D., et al. (Nucleic Acid Hybridization, A Practical Approach, IRL Press, Washington, D.C., 1985).
Эффективность олигонуклеотидных конструкций настоящего изобретения показана на примерах ниже. В примере 2 показано, что изобретенные олигонуклеотидные последовательности миРНК с фуранозой и двумя С18-алкиленгликолями, связанными с одной нитью миРНК, и молекулой сертралина, связанной с другой нитью через линкерную ветвь, подавляют экспресссию целевого предсинаптического 5-HT1AR в большей степени, чем соответствующая миРНК в оголенной форме.
F. Диагностические конъюгаты и их использование
Возможность специфической доставки терапевтических соединений к клетке-мишени с помощью агентов селективности, способных с высоким сродством связываться с переносчиками нейромедиаторов, может быть применена для доставки соединений, которые могут быть использованы в диагностических целях. Таким образом, в другом варианте осуществления изобретение обеспечивает конъюгат, содержащий:
(i) по меньшей мере, один агент селективности, который специфично связывается с одним или несколькими переносчиками нейромедиатора и
(ii) контрастное вещество.
Термины "агент селективности" и "переносчик нейромедиатора" описаны выше более подробно и для диагностических конъюгатов изобретения могут пониматься в одинаковом значении.
Термины "вещество для визуализации" и "контрастное вещество" используются в данном документе взаимозаменяемо и относятся к биосовместимому соединению, использование которого облегчает дифференциацию различных частей изображения за счет увеличения "контраста" между упомянутыми различными частями изображения. Термин "контрастные вещества" охватывает вещества, которые используются для повышения качества изображения, которое может быть также получено и без указанного вещества (как это имеет место, например, в МРТ), а также вещества, которые обязательно необходимы для создания изображения (как это имеет место, например, радионуклидной визуализации). К подходящим контрастным веществам относятся, помимо прочего, контрастные вещества для радионуклидной визуализации, компьютерной томографии, спектроскопии комбинационного рассеяния, магнитно-резонансной томографии (МРТ) и оптического формирования изображений.
Контрастные вещества для радионуклидной визуализации включают радиофармацевтические препараты, которые обычно метят позитронно-активными радионуклидами, такими как11С,13N,15O,18F,82Rb,62Cu и68Ga. Радиофармпрепараты для ОФЭКТ обычно метят излучателями позитронов, такими как94mTc,201TI и67Ga. Способы радионуклидной визуализации (позитрон-эмиссионная томография (ПЭТ), однофотонная эмиссионная компьютерная томография (ОФЭКТ)) являются методами диагностической поперечной визуализации, которые отображают расположение и концентрацию меченого радиоиндикатора. ПЭТ и ОФЭКТ могут быть использованы для локализации и характеризации радионуклида путем измерения метаболической активности. ПЭТ и ОФЭКТ дают информацию на клеточном уровне, например, информацию о клеточной жизнеспособности. В ПЭТ пациент принимает внутрь или ему вводится инъекция слаборадиоактивного вещества, которое испускает позитроны, что можно наблюдать по движению вещества внутри организма. В одном распространенном приложении, например, пациенты принимают глюкозу с присоединенными излучателями позитронов, после чего проводится мониторинг их головного мозга по мере выполнения пациентами различных заданий. Поскольку по мере работы головной мозг использует глюкозу, то ПЭТ изображение показывает, в каких местах высока активность головного мозга. В определенных вариантах осуществления изобретения клетку метят ex vivo для ПЭТ или СПЭКТ визуализации in vivo. С ПЭТ тесно связана однофотонная эмиссионная компьютерная томография или ОФЭКТ. Основным отличием между двумя этими способами является то, что вместо позитронно-активного вещества в СПЭКТ используется радиоактивный индикатор, который испускает низкоэнергетические фотоны.
Контрастные вещества для КТ визуализации включают, например, йодированные или бромированные контрастные среды. К примерам таких веществ относятся йоталамат, йогексил, диатризоат, йопамидол, этиодол и иопанат. Сообщалось также, что соединения гадолиния находят применения в качестве контрастных веществ для КТ (см., например, Henson et al., 2004). Например, производные гадопентетовой кислоты использовались в качестве контрастных веществ для КТ (обсуждается в Strunk and Schild, 2004). В контексте настоящего изобретения под компьютерной томографией (КТ) подразумевается способ визуализации. Путем снятия серии рентгенограмм, иногда более тысячи, от различных углов, и последующим объединением их с помощью компьютера, КТ делает возможным построении трехмерного изображения любой части тела. Компьютер запрограммирован на отображение двухмерных срезов от любого угла и на любой глубине. В КТ внутривенная инъекция непроницаемого для излучения контрастного вещества, например, веществ, описанных в данном документе, может содействовать идентификации и очерчиванию контура мягких тканевых образований в том случае, когда первоначальные срезы КТ неотличимы.
Контрастные вещества для оптической визуализации включают, например, флуоресцеин, производное флуоресцеина, индоцианиновый зеленый, Орегоновый зеленый, производное орегонового зеленого, родаминовый зеленый, производное родаминового зеленого, эозин, эритрозин, техасовый красный, малахитовый зеленый, нанозолото-сульфосукцинимидиловый эфир, каскадный голубой, производное кумарина, нафталин, производное пиридилоксазола, каскадный желтый краситель, дапоксиловый краситель и другие различные флуоресцирующие соединения, раскрытые в данном документе.
В предпочтительном варианте осуществления контрастное вещество - это соединение, способное давать изображение с помощью магнитно-резонансного томографа. Контрастные вещества, которые могут быть визуализированы магнитно-резонансным томографом, отличаются от веществ, используемых в других способах визуализации. Их функцию состоит в содействии проведению различия между тканевыми компонентами с одинаковыми характеристиками сигнала и в сокращении времени релаксации (которое дает более сильный сигнал на Т1-взвешенных спин-эхо МР изображениях и менее интенсивный сигнал на Т2-взвешенных томограммах). К примерам контрастных веществ для МРТ относятся хелатные соединения гадолиния, хелатные соединения марганца, хелатные соединения хрома и частицы железа. В одном отдельном варианте осуществления контрастным веществом для МРТ является19F. КТ и МРТ дают информация анатомического характера, которая помогает различить границы тканей. В сравнении с КТ к недостаткам МРТ относятся низкая переносимость больным, противопоказания при наличии кардиостимуляторов и других имплантированных металлических устройств и другие артефакты, возникающие по многим причинам, но отнюдь не из-за движения. С другой стороны, КТ является быстрым, хорошо переносимым и легкодоступным способом, но обладает меньшим контрастным разрешением в сравнении с МРТ и требует введения йодированного контраста и ионизирующее излучение. Недостатком как КТ, так и МРТ является то, что ни один из этих способов визуализации не дают функциональной информации на клеточном уровне. Например, ни один из способов не дает информации относительно клеточной жизнеспособности. Магнитно-резонансная томография (МРТ) является способом визуализации, который является более новым в сравнении с КТ, где для получения изображения используется мощный магнит и радиочастотные сигналы. Наиболее распространенным молекулярным соединением в биологических тканях является вода. Именно квантово-механический спин ядер протонов воды в конечном счете отвечает за сигнал в экспериментах по визуализации. В МРТ визуализируемый образец помещают в сильное статическое магнитное поле (1-12 Тл) и возбуждают спины высокочастотными (ВЧ) импульсами для получения результирующей намагниченности в образце. Различные градиент магнитного поля и другие ВЧ импульсу воздействуют на спины, кодируя информацию о пространственных параметрах в регистрируемые сигналы. Путем получения и анализа данных сигналов возможен расчет трехмерного изображения, которое, подобно КТ срезу, обычно отображается на двумерных срезах.
К контрастным веществам для МРТ относятся комплексы металлов, выбранных из группы, состоящей из хрома (III), марганца (II), железа (III), железа (II), кобальта (II), никеля (II), меди (II), неодима (III), самария (III), иттербия (III), гадолиния (III), ванадия (II), тербия (III), диспрозия (III), гольмия (III) и эрбия (III). В предпочтительном варианте осуществления соединение, которое может быть визуализировано посредством магнитно-резонансного томографа, представляет собой соединение на основе гадолиния.
Используемый в данном документе термин "соединение на основе гадолиния" означает (при использовании его в отношении визуализации) любое гадолиний-содержащее вещество, вводимое больному, которое приводит к внутрисосудистому усилению. В другом варианте осуществления гадолиний-содержащее вещество выбрано из группы, состоящей из гадолиния, пентата гадолиния и гадодиамида.
Количество вводимого гадолиний-содержащего контрастного вещества варьируется в диапазоне около 10 мг на кг веса тела. В другом варианте осуществления вторую магнитно-резонансную томограмму получают примерно через 45 минут после введения гадолиний-содержащего контрастного вещества. Данное изобретение также обеспечивает вышеописанный способ, который, кроме того, включает стадию интраперитонеального введения физиологического раствора (например, раствора Рингера) больному, при этом введение проводят либо по стадии (с) либо по стадии (d).
Изобретение также обеспечивает использование вышеуказанного конъюгата в качестве диагностического вещества и способы обнаружения клеток, экспрессирующих переносчик нейромедиатора на своей поверхности. В зависимости от типа клетки, которую необходимо визуализировать, конъюгаты будут включать один или несколько агентов селективности. В следующей таблице описаны агенты селективности, которые используются в зависимости от типа визуализируемой клетки.
Изобретение также обеспечивает комбинированные способы визуализации. Определенные варианты осуществления настоящего изобретения относятся к способам визуализации больного или участка внутри тела больного с использованием нескольких способов визуализации, которые включают измерение нескольких сигналов. В некоторых вариантах осуществления несколько сигналов возникают от одной метки на клетке или внутри клетки. Как изложено выше, любой способ визуализации, известный специалистам в данной области техники, может быть применен в данных вариантах осуществления настоящих способов визуализации.
Способы визуализации проводят в любое время во время или после введения меченой композиции, например, меченой клетки. Например, исследования по визуализации можно проводить во время введения меченой клетки настоящего изобретения, т.е., чтобы способствовать направленной доставке с определенное положение, или в любой момент времени после ее введения.
Дополнительные способы визуализации могут быть осуществлены одновременно с первым способом визуализации или в любой момент времени после проведения первого способа визуализации. Например, дополнительные способы визуализации могут быть проведены примерно через 1 с, 1 ч, 1 день или через более длительный период времени после завершения первого способа визуализации, или в любой момент времени в период между двумя указанными моментами времени. В некоторых вариантах осуществления настоящего изобретения несколько способов визуализации проводятся одновременно, так что их начинают проводить в одно и то же время после введения меченой клетки или вещества. Специалисту в данной области техники может быть известна процедура проведения различных способов визуализации, рассматриваемых в настоящем изобретении.
В некоторых вариантах осуществления настоящих способов визуализации, для проведения первого и второго способов визуализации используют одно и то же устройство для формирования изображения. В других вариантах осуществления для проведения различных способов визуализации используют различные устройства для формирования изображения. Специалисту в данной области техники может быть знаком с устройствами для формирования изображения, которые доступны для проведения способов визуализации, описанных в данном документе.
Настоящее изобретение обеспечивает способы визуализации клеток по одному или нескольким способам визуализации. В некоторых вариантах осуществления клетки метят несколькими контрастными веществами, а в других аспектах клетки метят момомаркерным веществом. В некоторых вариантах осуществления мономаркерным веществом является вещество, детектируемое несколькими способами.
Следующие примеры и чертежи представлены с целью иллюстрации и не предназначены для ограничения настоящего изобретения.
ПРИМЕРЫ
Пример 1. Синтез конъюгата изобретения, содержащего сертралин и олигонуклеотид
Синтез активированного Сертралина (4)
Активированный сертралин получают по следующей схеме.
А.1. Синтез соединения (1)
Смесь гидрохлорида сертралина (коммерчески доступного, 34 мг), 9Н-флуоренлиметоксикарбонил-6-аминокапроновой кислоты (Фмок-АКК), 49 мг), ДМФА (2 мл), N-метил-морфолина (22 мкл) и тетрафторбората O-(бензотриазол-1-ил)-N,N,N’,N’-тетраметилурония (ТБТУ, 68 мг) перемешивают при комнатной температуре на протяжении ночи. За реакцией наблюдают по ТСХ (элюент - 10% СН3ОН-CHCl3). Смесь упаривают, получая густое масло, которое далее промывают петролейным эфиром (3×5 мл). К полученному маслянистому соединению добавляют 2 мл воды, и выпавший осадок промывают снова водой (2×10 мл). Осадок растворяют в 20 мл дихлорметана (ДХМ) и обрабатывают 20 мл раствора NaCl, а затем высушивают над Na2SO4. Раствор упаривают досуха, а затем высушивают на механическом насосе, получая твердое вещество (129 мг сырого продукта). Сырой продукт очищают на колонке с силикагелем, элюируя смесью 1% метанола-ДХМ, 2% метанола-ДХМ, а затем смесью 5% метанола-ДХМ. Полученные фракции объединяют и упаривают досуха. Продукт высушивают на вакууме в течене 6 часов, получая 90 мг чистого соединения (1).
А.2. Синтез соединения (2)
Соединение (1) (90 мг) растворяют в 3 мл 20% раствора пиперидина в ДХМ в течение 1 ч. За реакцией наблюдают по ТСХ (элюент - 10% метанол-CHCl3). Смесь упаривают, получая масло, которое промывают петролейным эфиром (3×10 мл). Полученный сырой продукт (54 мг) оказывается достаточно чистым для проведения следующей реакции без дополнительной очистки.
А.3. Синтез соединения (3)
Смесь соединения (2) (54 мг), пиридина (3 мл), янтарного ангидрида (16 мг) и N,N-диметиламинопиридина (ДМАП, 18 мг) перемешивают при комнатной температуре на протяжении ночи. За реакцией наблюдают по ТСХ (85:10:5 - ДХМ:метанол:уксусная кислота). Добавляют к реакционной смеси 10 мл воды. Смесь концентрируют до образования смолистого остатка, затем суспендируют в 10 мл ДХМ. Органическую фазу промывают 5% раствором NaHCO3 (2×10 мл), 5% раствором лимонной кислоты (10 мл) и концентрированным раствором хлорида натрия (10 мл). Раствор высушивают над сульфатом натрия и упаривают, получая соединение (30 в виде белой пены (46 мг).
А.4. Синтез соединения (4)
Смесь соединения (3) (46 мг), гидроксисукцинимида (13 мг), N,N-диизопропилкарбодиимида (ДИК, 60 мкл) в ДХМ (4 мл) перемешивают при комнатной температуре на протяжении ночи, при этом за реакцией наблюдают по ТСХ (10% метанола-CHCl3). Раствор упаривают досуха, получая 10 мг сырого твердого продукта. Сырой продукт очищают препаративной ТСХ (толщина слоя 2 мм, 20×20 см), ТСХ проявляют смесью 7% метанола-CHCl3, содержащей 1% уксусную кислоту. Соответствующу полосу вырезают и помещают в воронку с фильтром. После элюирования смесью 15% метанола-CHCl3, раствор упаривают досуха, получая 35 мг соединения (4) (чистота по ВЭЖХ 98%).
В. Синтез аминомодифицированных олигонуклеотидов (5) и (6)
Синтез проводят на автоматическом синтезаторе с использованием коммерчески доступных аминолинкеров 6-(4-монометокситритиламино)гексил-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидита (5’-ММТ-С6-аминомодификатор-ЦЭП) и 6-(трифторацетиламино)гексил-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидита (5’-ТФА-С6-аминомодификатор-ЦЭП), соответственно.


После чего проводят следующие стадии:
1. - Аминолинкеры-ЦЭП растворяют в безводном ацетонитриле (100 мкМ в 1 мл) в инертной атмосфере (аргон или азот). Раствор помещают в чистый дополнительный резервуар (положение 5-9 в синтезаторе Expedite 8900 или вспомогательный канал на каком-либо ином синтезаторе). Первичную обработку линии проводят вручную в течение нескольких секунд или с помощью программы, так что подающая трубка заполняется данным реагентом.
2. - Записывают необходимую последовательность, при этом у 5’-конца имеется дополнительное основное положение (5-9), так что модицирующий реагент включается на последней стадии синтеза с помощью прибора.
3. - Проверяют последовательность, так чтобы у программы синтеза имелась возможность ДМТ защиты, поскольку олигонуклеотид необходимо подвергнуть ВЭЖХ очистке.
4. - Начинают синтез с использованием программы связывания подходящей величины (0,2-1,0 мкМ) на приборе.
5. - В конце синтеза вынимают колонку из прибора и промывают подложку этанолом (3×1 мл) с помощью шприца для удаления оставшейся кислоты (из стадии детритилирования) и йода (из стадии окисления).
С. Снятие защитной группы и снятие олигонуклеотидов с подложек
Проводят следующие стадии:
1. - Высушенную подложку из предыдущей стадии переносят во флакон с завинчивающейся крышкой (1,5-2 мл).
2. - Добавляют 500 мкл (0,2 мкМ по концентрационной шкале) концентрированного раствора NH4OH (30%).
3. - Крышку плотно закрывают и суспензию выдерживают при 55 °С, как минимум, 8 ч на протяжении ночи (для последовательностей, обогащенный G-основанием, необходимо более длительное время).
4. - Надосадочную жидкость охлаждают до 0 °С и переносят в другую микроцентрифужную пробирку.
5. - Подложку промывают таким же количеством дейтерированной воды и эту промывку добавляют к аммиачной надосадочной жидкости. Полученный аммиачный раствор содержит непроцессированный олигонуклеотид со свободной аминогексильной группой при 5’-конце (в случае включения N-ТФА-аминогексилфосфорамидита) либо защищенный аминогексил-связанный олигонуклеотид вместе с ненуклеозидным материалом и короткими последовательностями.
Очистку олигонуклеотидов со свободными аминогексильными линкерами получается осуществить анионно-обменной ВЭЖХ, осаждением этанолом или электрофорезом в полиакриламидном геле (PAGE).
D. Включение активированного сертралина в свободный первичный амин
Мечение 5’-конца амино-связанных олигонуклеотидов, полученных на стадии В и С, прозводными N-гидроксисукцинимидного эфира, полученными на стадии А, осуществляют в растворе по следующей методике:
А. - Внедрение метки
1. - Частично или полностью очищенный аминосвязанный олигонуклеотид из предыдущей стадии (20-25 ЕОП (единиц оптической плотности) А260 (поглощение при 260 нм) - 700 мкг) растворяют в 250 мкл смеси 1,0М NaHCO3/Na2CO3 (рН 9,0). Проверяют рН полученного раствора, чтобы убедиться в его щелочности.
2. - Добавляют 500 мкл раствора активированного производного из стадии А (5-6 мг) к смеси 1,0М NaHCO3/Na2CO3 буфер с рН=9,0:ДМФА:Вода (5:2:3 в объемном отношении).
3. - Смесь перемешивают на вортексе и помещают в пробику Эппендорфа, обернутую алюминиевой фольгой для защиты от света.
4. - После 20 ч выдерживания при комнатной температуре смеси гасят 1М раствором ацетата триэтиламмония.
В. - Удаление избычтоного маркера с использованием колонки Shephadex G-25
1. - Образец активированного производного наносят на колонку.
2. - Колонку элюируют водой и собирают фракции по 1,0 мл в пробирки Эппендорфа. Целевой продукт начинают элюироваться после прохождения мертвого объема, при этом большая часть целевого продукта элюируется в фракциях 3-9.
3. - Фракции, содержащие большую часть материала, объединяют и концентрируют.
4. - Обычно получают 12-15 ЕОП А260 (7%), что соответствует молекуле, свободной от избыточного красителя/маркера. При необходимости продукт дополнительно очищают электрофорезом (20% PAGE) на обращенно-фазной ВЭЖХ.
Пример 2. Синтез миРНК, содержащей смысловой олигонуклеотид, конъюгированный с сертралином и антисмысловой олигонуклеотид, содержащий защитную группу с формулой С18-L3-С18-L2-фураноза-L1-[олигонуклеотид]-3’, в которой L1, L2 и L3 - это фосфодиэфирные связи.
Синтез проводят по следующим стадиям:
(a) РНК олигонуклеотид получают постадийным твердофазным синтезом на твердой подложке, где 5’-ОН группа концевого подзвена в растущей нити, которая обычно защищена диметокситритилом (ДМТ), обрабатывается в кислых условиях для снятия 5’-ОН ДМТ защитной группы, при этом пуриновое и пиримидиновые основания остаются защищенными (флуорен-9-ил) метоксикарбонилом (ФМОК).
(b) Фуранозное звено, такое как D-рибоза или D-(-)-фруктофураноза, вводится в реакцию с 4,4’-диметокситритилхлоридом (DMTr-CI) в условиях, способствующих взаимодействию только по первичным положениям гидроксильной группы. Затем, оставшиеся гидроксильные группы вводятся в реакцию с ацетилирующей или бензоилирующей защитной группой. Наконец, в кислых условиях снимают ДМТ защитную группу с первичной гидроксильной группы. После снятия защиты указанная гидроксильная группа фуранозы вводится в реакцию с незащищенной 5’-ОН группой нити миРНК, полученной на стадии (а), что приводит к образованию первично-конъюгированного олигонуклеотида.
(c) Реакционноспособный полиэтиленгликоль с 6 мономерами полиэтиленгликоля (ПЭГ), дающий спэйсер с 18 ковалентно-связанными звеньями (С18-спэйсер), получают присоединением к терминальной ОН группе в условиях фосфитилирования фосфорамидатного соединения, такого как (2-цианоэтил)-N,N’-диизопропилфосфорамидита с формулой (II)

(d) После снятия защиты 5’-ОН группа фуранозы реагирует с реакционноспособным полиэтиленгликолем из стадии (с), приводя к образованию нити миРНК со структурой:
ОН-С18-L2-фураноза-L1-[олигонуклеотид]-3’,
в которой L1 и L2 - это фосфодиэфирные связи.
(е) Второй реакционноспособный полиэтиленгликоль с 6 мономерами полиэтиленгликоля (ПЭГ), дающий спэйсер с 18 ковалентно-связанными звеньями (С18-спэйсер), получают присоединением к терминальной ОН группе в условиях фосфитилирования фосфорамидатного соединения, такого как (2-цианоэтил)-N,N’-диизопропилфосфорамидита с формулой (II)

(f) После снятия защиты 5’-ОН группа С18 реагирует со вторым С18 реакционноспособным полиэтиленгликолем из стадии (е), приводя к образованию нити миРНК со структурой:
С18-L3-С18-L2-Фураноза-L1-[олигонуклеотид]-3’
в которой L1, L2 и L3 - это фосфодиэфирные связи.
(g) Комплементарную нить миРНК, конъюгированной с сертралином по способу, описанному в примере 1, соединяют с модифицированной нитью миРНК из стадии (f). С этой целью все остающиеся защитные группы в РНК нитях предварительно снимают следующим образом. Добавляют 500 мкл смеси, содержащей 20% (по объему) метиламина (40% (по отношению массы к объему) водный раствор) и 80% (по объему) насыщенного раствора аммиака (содержащего 30-32% (по отношению массы к объему) NH3) в пробирку Эппендорфа с миРНК (200 нмоль). Пробирку герметично закрывают и нагревают в течение 45 минут до температуры 65 °С. Эта процедура позволяет снять защитные группы с атома фосфора нуклеотидов (ацетилирование или бензоилирование фуранозы и 2-цианоэтилирование фосфодиэфирных связей) и защитные группы с экзоциклических аминогрупп (ФМОК). Затем смесь охлаждают и фильтруют, а надосадочную жидкость высушивают. Оставшийся шарик вводят в реакцию с 1М фторидом триэтиламмония в течение 3 часов при 65 °С для расщепления связи защитных групп в положении 2’ нуклеотидов (2-трет-бутилдиметилсилил - ТБДМС). Наконец, полученный в результате раствор обессоливают на колонке Сефадекс.
Пример 3. Оценка эффективности 5-HT1AR-нацеливающийся миРНК, конъюгированной с группой с формулой (I) и одним нацеливающим веществом (обозначаемой далее NLF-миРНК), и оголенной 5-HT1AR-нацеливающийся миРНК (далее в этом документе, оголенная миРНК) посредством in vivo местной инфузии в область дорсального ядра шва (ДЯШ) мышей
В данном примере показано, что NLF-миРНК и оголенная миРНК характеризуются схожей эффективностью в отношении нокдауна предсинаптического 5-HT1AR, что измерено по уменьшению уровня белка этого рецептора и его функции, при их местном введении в дорсальное ядро шва, где расположена группа серотонинергических нейронов. Это указывает на то, что группа с формулой (I) и нацеливающее вещества, используемое в конструкциях данного изобретения, не мешают действию интерферирующего олигонуклеотида.
Ряд соединений со структурой, показанной в примерах 1 и 2, синтезируют так, как раскрыто выше, и имеют следующую структуру.
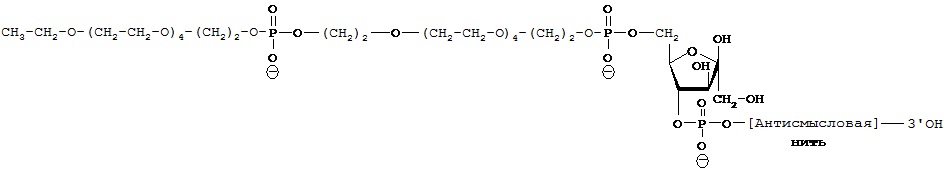
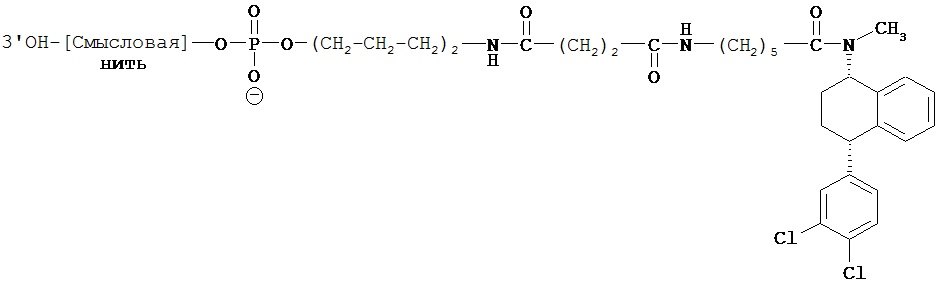
Конструируют миРНК для нацеливания на следующие области последовательности серотонинового рецептора 5-НТ типа 1А (5-HT1AR) из Mus Musculus (мышь, номер доступа в базе данных GenBank: NM_008308): 633-651, 852-870, 1889-1907 и 2167-2185. Химическим способом синтезируют антисмысловую и смысловую нити каждой миРНК (SEQ ID NO 5-10, Таблица 1) и соединяют их в изотоническом буфере для гибридизации РНК (100 мМ ацетат калия, 30 мМ ГЭПЭС (N-2-гидроксиэтил-пиперазин-N-2-этансульфоновая кислота)-КОН с рН 7.4, 2 мМ ацетат магния) путем смешивания 50 мкМ растворов каждой нити. Затем раствор выдерживают 1 минуту при 90 °С, центрифугируют 15 секунд и выдерживают 1 час при 37 °С. Гибридизованный раствор очищают методом ВЭЖХ и подвергают лиофилизации отобранные фракции миРНК. Маточные растворы миРНК готовят ресуспендированием лиофилизированного продукта в воде без рибонуклеаз и хранят при -20 °С до использования. Перед использованием все маточные растворы миРНК разбавляют до конечной концентрации в искусственной цереброспинальной жидкости (125 мМ NaCl, 2,5 мМ KCl, 1,26 мМ CaCl2, 1,18 мМ MgCl2 и 5% глюкозы), подходящей среде для введения в мозг (местно или интрацеребровентрикулярно).
Все последовательности миРНК включают антисмысловые последовательности, комплементарные мРНК рецептора 5-HT1A и поэтому способны подавлять указанную мРНК и блокировать ее экспрессию. Во всех экспериментах используют эквимолярную смесь этих последовательностей. В качестве контроля вводят инфузию последовательности нонсенс миРНК (нс миРНК). Эта нс миРНК не комплементарна любому мышиному гену при сравнении по алгоритму выравнивания BLAST с полным транскриптом мышей. Нс миРНК имеет следующую последовательность:
нс миРНК - cAGUACUGCUUACGAUACGG SEQ ID NO: 56
нс миРНК - aCCGUAUCGUAAGCAGUACU SEQ ID NO: 57
Во всех последовательностях имеются терминальные ДНК димеры нуклеотидов, содержащих, по меньшей мере, один тимин (Т) (не показан) во избежание взаимодействия с белками, регулирующими мРНК в обычных процессах в клетке. Эта процедура хорошо известна специалистам в данной области техники. Вместе с данными терминальными димерами в олигонуклеотидах имеется 21-23 пары оснований, что обеспечивает эффективный механизм РНКи.
В экспериментах используют последовательности миРНК из Таблицы 1, конъюгированной с группой с формулой (I) и одним нацеливающим веществом (обозначаемой далее NLF-миРНК), нонсенс миРНК, конъюгированную с группой с формулой (I) и одним нацеливающим веществом (нс NLF-миРНК), и оголенные олигонуклеотиды без модификаций (оголенная миРНК из Таблицы 1 или нс оголенная миРНК).
Для инфузии миРНк систему микроканюль имплантируют по стандартным стереотаксическим способам, ранее описанным в данной области техники. Впускную микроканюлю продевали через трубки 25 размера, состоящие из капиллярных трубок из плавленого кварца с внешним диаметром 110 мкм и внутренним диаметром 40 мкм. Предварительно определенную длину микроканюль задавали на основе глубины нацеливаемой области мозга (т.е. 1 мм для дорсального ядра шва).
Мужским особям мышей C57BL/6J (21-29 г, возраст 9-12 недель) имплантируют одну микроканюлю в дорсальное ядро шва (ДЯШ). Стереотаксические координаты (в мм) - АР: -4.5, L: -1.0, DV: -4.4, при латеральном угле 20°, от брегмы и верхней части черепа по атласу Паксиноса и Франклина (1997). Микроканюлю фиксировали на черепе с помощью зубного цемента и двух 2-мм длинных винтов диаметром 0,95 мм. Эксперименты по микроинфузии проводят через 20-24 ч после хирургической операции на ненаркотизированных мышах. Инъекционную микроканюлю соединяют через полиэтиленовую трубку со шприцом, управляемым прецизионным насосом со скоростью 0,5 мкл/мин.
Для испытания функциональной меры активности предсинаптического 5-HT1AP мы оценивали гипотермическую реакцию, вызванную гидробромидом (R)-(+)-8-гидрокси-2-(ди-н-пропиламино)тетралина (8-ОН-ДПАТ, селективным агонистом 5-HT1AR) через 24 часа после инфузии пула огологенной миРНК или NLF-миРНК в дорсальное ядро шва (ДЯШ, 0,3 мкг (0,02 ммоль)/1 мкл/2 дня). Контрольные группы получали такое же количество среды (искусственная цереброспинальная жидкость: 125 мМ NaCl, 2,5 мМ KCl, 1,26 мМ CaCl2, 1,18 мМ MgCl2 и 5% глюкозы), нс оголенную миРНК и нс NLF-миРНК. Мышей содержат в индивидуальных клетках в экпериментальной комнате при стабильной температуре 22 °С в течение 1 ч до эксперимента. Все эксперименты проводят в период от 10:00 до 14:00. Температуру тела измеряют помещением смазанного зонда в прямую кишку за 5 минут до считывания показания температуры, при этом мыши могли свободно двигаться. Показания получают с помощью цифрового термометра. Исходное значение измеряют за 5 минут до и через 15, 30, 60 и 120 мин после введения 8-ОН-ДПАТ. 8-ОН-ДПАТ растворяют в физиологическом растворе и вводят интраперитонеально (ип) дозой 1 мг/кг в объеме 5 мл/кг. Выбор дозы 8-ОН-ДПАТ для индуцирования гипотермии основан на предыдущих работах. Температуру тела оценивают через 24 ч после последнего введения 5-HT1A-нацеливающей-миРНК в ДЯШ у различных групп мышей и соответствующих им контролей. Проводят дополнительные эксперименты по измерению температуры тела через прямую кишку у 5-HT1AR КО мышей (мыши с нулевым 5-HT1AR) для оценки отсутствия 8-ОН-ДПАТ-индуцированной гипотермии.
Как показано на Фиг.1, при нокдауне 5-HT1AR местной инфузией миРНК отсутствует гипотермическая реакция, вызванная 8-ОН-ДПАТ подобно 5-HT1AR КО мышам.
После проведения данного анализа мышей умерщвляют обезглавливанием и быстро извлекают головной мозг, замораживают на сухом льду и хранят при -20 °С. Нарезают срезы ткани толщиной 14 мкм с помощью криостатируемого микротома, при оттаивании закрепляют на предметных стеклах, покрытых АПТС (3-аминопропилтриэтоксисиланом) и хранят при -20 °С до использования.
Для оценки плотности 5-HT1AR белка мы использовали [3H]8-ОН-ДПАТ для ауторадиографической визуализации 5-HT1A рецепторных участков. Экспериментальные условия выдерживания для [3H]8-ОН-ДПАТ ранее были описаны в данной области техники. Вкратце, замороженные срезы тканей оттаивают и высушивают, предварительно выдерживают в смеси 170 мМ Трис-HCl с рН 7,6, 4 мМ CaCl2 и 0,01% аскорбиновой кислоты в течение 30 минут при комнатной температуре, а затем выдерживают в том же самом буфере, содержащем 1 нм [3H]-ОН-ДПАТ (234,0 Ки/ммоль) и 10-5 М паргилина, в течение 60 минут при комнатной температуре. Неспецифическое связывание определяют по остаточному связыванию в присутствии 10-5 М 5-НТ. После выдерживания и промывки срезы тканей погружают в дистиллированную воды, охлажденную до температуры замерзания, и быстро высушивают под холодным током воздуха. Ткани подвергают воздействию на тритий-восприимчивой пленке вместе с пластиковыми3H-стандартами в течение 60 дней при 4 °С.
Используют тканевые срезы ДЯШ в 3 различных переднезадних (ПЗ) координатах в ядре шва среднего мозга мыши (приблизительно ПЗ -4,84, -4,60 и -4,24 мм от брегмы; Franklin и Paxinos, 1997) для подсчета рецепторных участков, их обрабатывают одновременно в одинаковых экспериментальных условиях. Количественный анализ ауторадиограмм проводят с помощью компьютерной системы анализа изображений AISR.
Как видно из Фиг.2, наблюдается уменьшение плотности 5-HT1AR белка в группах, получавших оголенную миРНК и NLF-миРНК, примерно на 40-50% по сравнению с контрольными группами (среда, нс оголенная миРНК и нс NLF-миРНК). Такое изменение сопоставимо с подавлением гипотермической реакции, показанным на Фиг.1.
Данные эксперименты показывают, что химическая модификация NLF-миРНК в обоих нитях не снижает способность миРНК осуществлять нокдаун гена-мишени в сравнении с оголенной миРНК. Более того, местное введение 5-НТ1А рецептор-специфичных миРНК в ДЯШ путем инфузии приводит к нокдауну целевой мРНК независимо от того, является ли миРНК оголенной или связана с нацеливающей частицей. Это может быть объяснено тем, что способ введения приводит к быстрому переносу миРНК в нейрональное тело за счет физического давления, прилагаемого во время введения, и тем самым нет необходимости в транслокации через нейрональную мембрану.
В следующих примерах показано, что оголенные миРНК, специфичные к 5-HT1A рецептору, не способны вызывать нокдаун целевой мРНК при интрацеребровентрикулярном (ицв) или интраназальном введении и что присутствие нацеливающей молекулы, присоединенной к миРНК, позволяет осуществить эффективный ноукдаун целевой мРНК.
Пример 4. Неодинаковая селективность к серотонинергическим нейронам в среднемозговом ядре шва и оценка эффективности NLF-миРНК конструкции данного изобретения в отношении оголенной миРНК при in vivo интрацеребровентрикулярной (ицв) инфузии в третий дорсальный желудочек (D3V) мышей
В данном примере показано, что NLF-миРНК конструкция и оголенная миРНК проявляют различную селективность к серотонинергическим нейронам и эффективность в отношении нокадуна 5-HT1AR при введении их в 3-ий дорсальный желудочек (D3V), что обеспечивает доступ ко всей области головного мозга через спинномозговую жидкость (СМЖ). Данное явление оценивалось путем измерения снижения уровня экспрессии мРНК, снижения уровня белка, по функциональным изменениям и усилению фармакологического действия антидепрессанта.
Проводят инфузию ряда молекул (группы, получавшие среду, нс оголенную миРНК, нс NLF-миРНК, оголенную миРНК и NLF-миРНК), описанных в примере 3, дозой 30 мкг/2,5 мкл/1 день (2,3 нмоль) в 3-ий дорсальный желудочек (D3V) при следующих стереотаксических координатах (в мм: АР: -2.0, L: 0, DV: -2.1) с использованием схожих видов мышей и инфузионной системы, описанной в примере 2. Для определения уровня экспрессии мРНК 5-HT1AR мы проводили анализ гибридизации in situ, используя одновременно четыре олигодезоксирибонуклеотидные пробы для 5-HT1AR, комплементарные основаниями 82-122, 123-171, 885-933 и 1341-1389.
Каждый олигонуклеотид 5-HT1A рецептора метили индивидуально (2 пмоль) по 3’-концу с помощью [33P]-dATФ (>2500 Ки/моль) с использованием терминальной дезоксинуклеотидилтраснферазы и очищали с помощью набора для удаления нуклеотидов QIAquick. Протоколы проведения мономаркерной гибридизации in situ основаны на ранее описанных методиках. Вкратце, замороженные срезы тканей, описанные в примере 2, вначале доводят до комнатной температуры, фиксируют в течение 20 мин при 4 °С в 4% параформе в забуференном фосфатом физиологическом растворе (1×ЗФФР: 8 мМ Na2HPO4, 1,4 мМ KH2PO4, 136 мМ NaCl, 2,6 мМ KCl), промывают в течение 5 мин в 3×ЗФФР при комнатной температуре, дважды промывают по 5 минут в 1×ЗФФР и выдерживают 2 мин при 21 °С в растворе предварительно переваренной проназы с конечной концентрацией 24 Ед/мл в 50 мМ Трис-HCl рН 7,5, 5 мМ ЭДТА. Действие фермента прекращают погружением на 30 с в 2 мг/мл глицин в 1×ЗФФР. Под конец ткани прополаскивают 1×ЗФФР и обезвоживают пропусканием через ряд этанольных растворов разной концентрации. Для гибридизации радиоактивно меченые зонды разбавляют в растворе, содержащем 50% формамида, 4 × раствор цитрата и хлорида натрия (ЦХН) (1 × ЦХН: 150 мМ NaCl, 15 мМ цитрат натрия), 1 × раствор Дернхардта (0,02% Фиколл, 0,02% поливинилпирролидон, 0,02% бычий сывороточный альбумин), 10% сульфат декстрана, 1% саркозил, 20 мМ фосфатный буфер с рН 7,0, 250 мкг/мл дрожжей тРНК и 500 мкг/мл ДНК из молок лососевых. Конечные концентрации радиоактивных зондов в гибридизационном буфере находятся в том же самом диапазоне (1,5 нМ). Срезы тканей покрывают гидбридизационным раствором, содержащим меченые зонды, покрывают покровными стеклами Nescofilm и выдерживают на протяжении ночи при 42 °С в увлажнительных камерах. Затем срезы промывают четыре раза (по 15 мин) в 1 × ЦХН при 60 °С и один раз в 1 × ЦХН при комнатной температуре в течение 30 мин, обезвоживают и подвергают воздействию на пленке в течение 3-4 недель. Оптическую плотность пленки полуколичественно оценивают с помощью компьютерной системы анализа изображений AISR.
Для той же группы мышей, использованных при гибридизации in situ, мы оценивали плотность белка 5-HT1AR с помощью [3H]8-ОН-ДПАТ для ауторадиографической визуализации 5-HT1A рецепторных участков так, как описано в примере 2.
Белки 5-HT1AR сильно экспрессируются в предсинаптической области на серотонинергических нейронах (среднемозговое ядро шва) и на нейронах, постсинаптических к 5-НТ нервным окончаниям, главным образом, в кортиоклимбических областях (т.е. гиппокампе).
Как видно из Фиг.3 и 4, только молекулы NLF-миРНк вызывают специфическое понижение уровня мРНК 5-HT1AR в трех различных переднезадних координатах в ядре шва среднего мозга мышей, где расположены тела серотонинергических нейронов.
Как видно из Фиг.5, денситометрическое определение положительных зерен мРНК 5-HT1AR, измеренных в пленках в дорсальном ядре шва, указывает на снижение на 50% уровня экспрессии в группе NLF-миРНК в сравнении с другими анализируемыми группами. Различия в экспрессии мРНК 5-HT1AR заметны главным образом в области ДЯШ.
Как видно из Фиг.6-8, только молекулы NLF-миРНк вызывают специфическое понижение уровня белка 5-HT1AR (примерно на 50%) в предсинаптических (дорсальное ядро шва), но не постсинаптических (гиппокамп и предлобная кора) областях мозга, что определено по анализу связывания на 5-HT1AR рецепторных участках с использованием [3Н]8-ОН-ДПАТ. Различия в экспрессии мРНК и белка 5-HT1AR заметны главным образом в области ДЯШ.
Эти результаты указывают на то, что NLF-миРНК селективно направляет олигонуклеотиды, которые осуществляют интерференцию мРНК в специфичные серотонинергические нейроны, расположенные в дорсальном ядре шва, тем самым повышая эффективность указанной РНК-интерференции с экспрессией целевых нейрональных рецепторов.
Для проверки возможности влияния специфического нокдауна 5-HT1A рецептора на экспрессию родственных 5-НТ белков, таких как переносчик серотонина (5-НТТ или SERT) или 5-HT1B рецептор, определяли плотность белка переносчика серотонина и 5-HT1B рецептора в ДЯШ.
Для анализа плотности белка переносчика серотонина мы использовали [3H]циталопрам для ауторадиографической визуализации 5-НТТ участков. Вкратце, замороженные срезы тканей оттаивают и высушивают, предварительно выдерживают в 50 мМ Трис-HCl буфере (рН 7,4 при 25 °С), содержащем 120 мМ NaCl и 5 мМ KCl в течение 15 мин при комнатной температуре. Затем выдерживают в том же самом буфере, содержащем 1,5 нМ [3H]циталопрам (70,0 Ки/ммоль), в течение 60 мин при комнатной температуре. Неспецифическое связывание определяют по остаточному связыванию в присутствии 1 мкМ флуоксетина. После выдерживания и промывки срезы тканей погружают в дистиллированную воды, охлажденную до температуры замерзания, и быстро высушивают под холодным током воздуха. Ткани подвергают воздействию на тритий-восприимчивой пленке вместе с пластиковыми3H-стандартами в течение 40 дней при 4 °С.
Используют тканевые срезы ДЯШ в 3 различных переднезандних (ПЗ) координатах в ядре шва среднего мозга мыши (приблизительно ПЗ 4,84/-4,96, -4,60/-4,36 и -4,24 мм от брегмы; Franklin и Paxinos, 1997) для подсчета 5-НТТ участков, их обрабатывают одновременно в одинаковых экспериментальных условиях. Количественный анализ ауторадиограмм проводят с помощью компьютерной системы анализа изображений AISR. Как видно из Фиг.9, группы, получавшие среду, оголенную миРНК и NLF-миРНК, не показывают какого-либо снижения или изменения уровня белка 5-НТТ (переносчика серотонина, SERT) в дорсальном ядре шва.
Для оценки плотности белка 5-HT1B рецептора (5-HT1BR) мы использовали [125I]йодцианопиндолол для ауторадиографической визуализации 5-HT1BR участков. Срезы предварительно выдерживают в течение 10 мин при комнатной температуре в 170 мМ Трис-HCl буфере (рН 7,4), содержащем 150 мМ NaCl, а затем выдерживают в течение 2 ч в том же самом буфере с добавкой 100 пМ [125I]йодцианопиндолола ([125I]ЦИП, 200 Ки/ммоль) и 100 нм 8-ОН-ДПАТ для блокирования 5- HT1AR участков и 30 мкМ изопреналина для блокирования β-адренергических центров. Неспецифическое связывание определяют соседним срезам, выдержанным в тех же самых условиях, но в присутствии 10 мкМ 5-НТ. Срезы прополаскивают два раза в том же самом буфере, быстро погружают в дистиллированную воды при 4 °С, высушивают под током холодном воздуха и подвергают воздействия на чувствительной пленке (Hyperfilm-3H) при 4 °С в течение одного дня. Оптическую плотность пленки полуколичественно оценивают с помощью компьютерной системы анализа изображений AISR. Как видно из Фиг.10, группы, получавшие среду, оголенную миРНК и NLF-миРНК, не показывают какого-либо снижения или изменения уровня белка 5-HT1B рецептора в дорсальном ядре шва.
Для оценки влияния NLF-миРНК на функциональные особенности 5-HT1AR мы оценивали гипотермическую реакцию, вызываемую 8-ОН-ДПАТ, и выделение 5-НТ в среднюю предлобную кору (сПЛК). Мы оценивали гипотермическую реацкию, вызванную 8-ОН-ДПАТ через 24 часа после инфузии пула оголенных миРНК или NLF-миРНК (как описанов в примере 2) в 3-ий дорсальный желудочек (D3V, 30 мкг/2,5 мкл/1 день). Как показано на Фиг.11, только при нокдауне 5-HT1AR инфузионно-введенной миРНК отсутствует гипотермическая реакция, вызванная 8-ОН-ДПАТ подобно 5-HT1AR КО мышам. Другие группы, получавшие оголенную миРНК, и группы контроля (среда, нс оголенная миРНК и нс NLF-миРНК) не оказывают нокдаун-эффект на 5-HT1AR (как было видно на Фиг.6-10) и это соответствовало типично кривой при гипотермической реакции, вызванной 8-ОН-ДПАТ.
Как упомянуто выше, активация 5-HT1AR, расположенного в серотонинергических нейронах, эндогенным агонистом 5-НТ (нейромедиатора серотонина) или селективными агонистами (такими как 8-ОН-ДПАТ) подавляет возбуждение клеток и импульсно-зависимое выделение 5-НТ в среднемозговом ядре шва и в терминальных проекциях областей головного мозга, таких как средняя предлобная кора, гиппокам и т.д, приводят понижение уровня 5-НТ (влияние 8-ОН-ДПАТ). Для оценки выделения 5-НТ используют методику интрацеребрального микродиализа, описанную в данном уровне техники. Вкратце, наконечник зонда изготавливают из трубки из нержавеющей стали 25 размера (внешний диаметр 501 мкм и внутренний диаметр 300 мкм) и длиной 15 мм. Впускные и выпускные трубки продевали через трубки 25 размера, состоящие из капиллярных трубок из плавленого кварца с внешним диаметром 110 мкм и внутренним диаметром 40 мкм. Верхние свободные концы кварцевых трубок помещают в трубку из нержавеющей стали 27 размера (внешний диаметр 410 мкм и внутренний диаметром 220 мкм) длиной 7 мм. Мышей анестезируют этаниналом натрия (40 мг/кг, ип) и помещают в стереотаксическую рамку. Каждой мыши имплантируют один зонд для диализа, снабженный мембраной Cuprophan (длина 2 мм, молекулярная масса 5000 Да), в среднюю предлобную кору (сПЛК) (в мм: АР +2.2, L -0.2, DV -3.4 от брегмы, по атласу Паксиноса и Франклина, 1997).
Микродиалитические эксперименты проводят через 48-72 после хирургического вмешательства на свободно двигающихся мышах с использованием непрерывно протекающих зондов с СМЖ (125 мМ NaCl, 2,5 мМ KCl, 1,26 мМ CaCl2, 1,18 мМ MgCl2) со скоростью 2,0 мкл/мин с помощью шприцевого насоса WPI модель sp220i, присоединенного к верхнему поворотному держателю жидкости. Собирают образцы диализата объемом 60 мкл через каждые 30 мин в микроцентрифужные пробирки.
После первоначального 60-мин период стабилизации собирают четыре исходных образца до системного введения 8-ОН-ДПАТ (0,5 мг/кг, ип), а затем собирают последовательные образцы диализата. По заверешению биологических экспериментов мышей умерщвляют и сразу же извлекают головной мозг, который замораживают при -70 °С. После этого нарезают коронарные срезы (50 мкм) головного мозга на криостате и окрашивают крезиловым фиолетовым по стандартным методикам для локализации участка перфузии. Используют только данные, полученные от животных с гистологически правильными размещениями зондов, для последующего статистического анализа.
Концентрацию 5-НТ в образцах диализата определяют методом ВЭЖХ на колонке 3 мкм октадецил диоксидом кремния (ОДДК) (7,5×0,46 см) и измеряют амперометрически на детекторной установке Hewlett-Packard 1049 при потенциале окисления 0,6 В. Подвижная фаза состоит из 0,15 М NaH2PO4*H2O, 1,8 мМ октилсульфата натрия, 0,2 мМ ЭДТА (доводят до рН 2,8 добавлением фосфорной кислоты) и 30% метанола и прокачивается со скоростью 0,7 мл/мин. Время удерживания 5-НТ составляет 3,5-4 мин, а предел обнаружения - 2 фмоль/образец.
Как видно из Фиг.12, группы, наблюдается отсутствие влияния 8-ОН-ДПАТ на выделение серотонина в предлобной коре у группы мышей, получавших NLF-миРНК, в сравнении с группой мышей, получавших нс NLF-миРНК. Это свидетельствует о том, что нокдаун 5-HT1AR в серотонинергических нейронах может быть оценен функционально по снижению влияния агониста 8-ОН-ДПАТ на количество 5-НТ в терминальных областях мозга.
Пример 5. Сравнительный анализ свободного лиганда селективности (сертралина) и конструкции NLF-миРНК согласно изобретению путем измерения функциональных параметров серотонинергического нейрона у мышей, предварительно обработанных лигандом с последующей in vivo интрацеребровентрикулярной (ицв) инфузией NLF-миРНК
Для того чтобы определить, является ли лиганд селективности, конъюгированный с миРНК в NLF-миРНК, ключевым компонентом при доставке в клетки дорсального ядра шва (главным образом, в серотонинергические нейроны) проводят несколько сравнительных анализов. Мыши получали однократную инъекцию селективного свободного лиганда "сертралина" ингибитора 5-НТТ (20 мг/кг, ип) за 3 ч перед инфузией миРНК в D3V (30 мкг/2,5 мкл/1 день, ицв). Кроме того, группа мышей получала среду интраперитонеально и среду в область D3V.
Микродиалитические эксперименты проводили через 24 ч после интрацеребровентрикулярного введения среды или введения миРНК. Как видно из Фиг.13, однократная инъекция сертралина (20 мг/кг, ип) позволяет избежать сайленсинг 5-HT1A ауторецептора посредством конъюгированной 5-HT1AR-NLF-миРНК, и однократное введение 8-ОН-ДПАТ (селективного агониста 5-HT1AR, 0,5 мг/кг ип) снижает уровень 5-НТ в средней предлобной коре, подобно контрольным группам.
Также оценивают влияние введения 8-ОН-ДПАТ (1 мг/кг, ип) на температуру тела у мышей, получавших NLF-миРНК и ранее обработанных селективным ингибитором 5-НТТ - сертралином (20 мг/кг, ип), которое оказалось схожим с эффектом у мышей, показанным на Фиг.13. На Фиг.14 показано, что сертралин эффективно конкурирует с 5-HT1AR-NLF-миРНК, таким образом приводя к гипотермической реакцией, схожей с реакцией у контрольных групп, что указывает на отсутствует трансфекции и нокдауна мPHK 5-HT1AR.
Эти результаты демонстрируют, что однократного введение свободного лиганда селективности (сертралина) блокируется или конкурирует с сертралин-конъюгированными миРНК (NLF-миРНК) за одну и ту же точку входа в нейроны-мишени (т.е. 5-НТТ, переносчик серотонина). С одной стороны, сертралин обладает высокой специфичностью и сродством (на наномолярном уровне) к переносчику 5-НТ, и за счет конъюгирования с миРНК, как например, в NLF-миРНК, в новом конъюгате поддерживается сродство к данному переносчику 5-НТ. С другой стороны, переносчик 5-НТ только экспрессируется в 5-НТ нейронах и такая комбинация высокого сродства к переносчику и специфичной экспрессии клеточного типа определяет характер селективности NLF-миРНК, которые конъюгированы с сертралином или СИОЗС лигандом.
Пример 6. Потенцирование при увеличении уровня 5-НТ в предлобной коре после однократного применения антидепрессанта (т.е. флуоксетина) посредством in vivo интрацеребровентрикулярной (ицв) инфузии NLF-миРНК в 3-ий дорсальный желудочек (D3V) мышей в сравнении с контрольными группами
В физиологических условиях СИОЗС (т.е. флуоксетин) вызывает заметное повышение внеклеточной концентрации серотонина в среднемозговом ядре шва и переднем мозге. Повышение внеклеточного 5-НТ, продуцируемого при блокаде обратного захвата переносчика серотонина (SERT) приводит к активации 5-HT1A ауторецепторов в среднемозговом ядре шва, подавляя возбуждение клеток и терминальное выделение, эффект, который ослабляет повышение внеклеточного 5-НТ, продуцируемого при блокаде обратного захвата. Следовательно, активация постсинаптических рецепторов серотонина, ответственных за терапевтическое действие, оказывает ниже, чем ожидалось. Известно, что блокада данных механизмов отрицательной обратной связи антагонистами рецепторов 5-HT1A (т.е. пиндололом) усиливает фармакологический эффект от повышения уровня 5-НТ, продуцируемого СИОЗС, и тем самым может способствовать ускорению клинических эффектов от СИОЗС.
Как видно из Фиг.15, концентрация диализированного серотонина в средней предлобной коре примерно на 50% выше исходной концентрации после системного введения флуоксетина мышам из группы, получавшей нонсенс NLF-миРНК (нс NLF-миРНК), при этом ожидалось, что 5-HT1A рецептор будет полностью функциональным, как было показано ранее. У мышей из группы NLF-миРНК нокдаун предсинаптического 5-HT1A рецептора усиливает эффект от системного введения флуоксетина до 150% от исходного терминаьлного уровня 5-НТ в средней предлобной коре.
Эти результаты ясно показывают, что олигонуклеотидные последовательности изобретения (NLF-миРНК), связанные с молекулой сертралина, блокируют экспрессию 5-HT1A рецептора за счет нокдауна соответствующего мРНК транскрипта, который должен бы транслироваться. Олигонуклеотидные последовательности изобретения (NLF-миРНК) подавляют указанную экспрессию в большей степени, чем соответствующая миРНК в оголенной форме (оголенная миРНК). Поэтому олигонуклеотиды изобретения более эффективны, чем эквивалентные количества таких же последовательностей миРНК, в которой не проводилось модификаций (оголенная миРНК).
Данные наблюдения позволяют заключить, что группа с формулой (I) не участвует в подавлении экспрессии рецептора. Более того, присутствие дополнительной конъюгированной молекулы повышает эффективность ингибирования по механизму РНКи.
Пример 7. Исследование поведения антидепрессантов и анксиолитиков в отношении интрацеребровентрикулярной (ицв) инфузии NLF-миРНК и сравнение с мышами с выключением (КО) 5-HT1AR
Для анализа возможного антидепрессивного действия от нокдауна предсинаптического 5-HT1A рецептора, проводят анализ поведения у взрослых мышей возрастом 9-12 недель. Анализ проводят в следующем порядке с интервалом, по меньшей мере, 1 день между испытаниями: приподнятый крестообразный лабиринт и тест подвешивания за хвост. Тест приподнятый крестообразный лабиринт проводят с использованием лабиринта с двумя пересекающими дорожками длиной 30 см и шириной 5 см, приподнятого на 31 см от пола в слабо освещаемом помещении (50 люкс). Животных помещают в среднюю часть лабиринта лицом к открытой дорожке и дают возможность свободно произвести разведку в течение 5 мин. Измеряют затраченное время и расстояние, пройденное на открытой и закрытой дорожках, с помощью видеозаписывающей системы. Устройство протирают 70% этанолом и дают возможность высушиться в промежутке между испытаниями на мышах. Все испытания проводят в период времени от 11:00 до 14:00. В день испытания животных переносят в слабо освещаемую лабораторию для анализа поведения и оставляют в спокойном состоянии, по меньшей мере, на 1 ч до проведения испытания. В тест подвешивания за хвост мышей подвешивают за хвост и мы используем ленту для закрепления их на горизонтальной полосе. Животных подвешивают на 6 мин и оценивают неподвижность в течение данного времени с использованием пакета программ для автоматической видеозаписи.
Как видно из Фиг.16 и 17, не наблюдается изменений в тревожном поведении, но наблюдается измененная реакция при испытании, обусловленном стрессом или депрессией, у мышей с нокдауном 5-HT1A ауторецептора. Потенциальная антидепрессорная способность NLF-миРНК находится в интервале между КО мышами и дикими мышами из контрольной группы. Предполагается, что 5-HT1A рецептор способен становиться новой мишенью при лечении депрессии. Из депрессивных пациентов порядка 40% не отвечают на лечение традиционными СИОЗС, которыми могут стать первыми кандидатами на лечение болезни по новому терапевтическому способу.
Пример 8. Различная эффективность подавления посредством 5-HT1AR NLF-миРНКв сравнении с NLF-миРНК в функциональных серотонинергических измерениях при in vivo интраназальном (ин) введении у мышей
Для утверждения интраназального способа в качестве возможного способа терапевтического применения, оценивают среду и NLF-миРНК в отношении гипотермической реакции, уровня мРНК в дорсальном ядре шва и 5-НТ диализата в предлобной коре.
Мышей анестезируют пентобарбиталом (40 мг/кг, ип) и кладут на спину. Медленно и аккуратно добавляют по каплям ЗФФР и NLF-миРНК попеременно в каждую ноздрю с помощью микродозатора в виде аликвот по 5 мкл.
Как видно из Фиг.18-21, интраназальное введение NLF-миРНК или среды приводит к уменьшению уровня мРНК 5-HT1A рецептора, что определено гибридизацией in situ, и уменьшению рецептора 5-HT1A, что определено по анализу связывания лиганда, которое схоже с результатами, полученными после ицв введения. В частности, предсинаптический нокдаун составляет 30% (в сравнении с 50% нокдауном при внутрижелудочковом введении NLF-миРНК) (см. Фиг.18-21). Более того, интраназальное введение NLF-миРНК приводит к уменьшению гипотермической реакции после введения 8-ОН-ДПАТ (см. Фиг.22) и прекращению снижения диализированного уровня 5-НТ в предлобной коре после однократного применения 8-ОН-ДПАТ (Фиг.23).
Более того, оценивают потенциальное антидепрессивное действие 5-HT1AR-NLF-siRNA с помощью теста подвешивания за хвост, как описано в примере 7. Также оценивают тревожное поведение по тесту "приподнятый крестообразный лабиринт". Как видно из Фиг.24-26, в экспериментах не наблюдается изменений в тревожном поведении (Фиг.24), но выявлено уменьшение времени в неподвижном состоянии при испытании, обусловленном стрессом или депрессией, у мышей с нокдауном 5-HT1A ауторецептора (Фиг.25) и уменьшение времени в неподвижном состоянии в тесте принудительного плавания (Фиг.26).
Пример 9. Оценка эффективности 5-HT1AR-нацеливающейся миРНК (миРНК переносчика серотонина), конъюгированной с группой с формулой (I) и одним нацеливающим веществом (обозначаемой далее 5HTT-NLF-миРНК), дозой 10 или 30 мкг/мышь и среды в качестве контрольной группы при in vivo местном применении на мышах
Ряд соединений со структурой, показанной в примерах 1 и 2, синтезируют так, как раскрыто выше. Конструируют миРНК для нацеливания на следующую область последовательности серотонинового рецептора (5-НТТ) из Mus Musculus (мышь, номер доступа в базе данных GenBank: NM_010484): 1230-1250. Химическим способом синтезируют антисмысловую и смысловую нити миРНК (SEQ ID NO 1-2, Таблица 2) и соединяют их в изотоническом буфере для гибридизации РНК (100 мМ ацетат калия, 30 мМ ГЭПЭС (N-2-гидроксиэтил-пиперазин-N-2-этансульфоновая кислота)-КОН с рН 7.4, 2 мМ ацетат магния) путем смешивания 50 мкМ растворов каждой нити. Затем раствор выдерживают 1 минуту при 90 °С, центрифугируют 15 секунд и выдерживают 1 час при 37 °С. Гибридизованный раствор очищают методом ВЭЖХ и подвергают лиофилизации отобранные фракции миРНК. Маточные растворы миРНК готовят ресуспендированием лиофилизированного продукта в воде без рибонуклеаз и хранят при -20 °С до использования. Перед использованием все маточные растворы миРНК разбавляют до конечной концентрации в ЗФФР буфере - подходящей среде для интраназального применения.
Последовательность миРНК включает антисмысловые последовательности, комплементарные мРНК переносчика 5-НТ (5-НТТ) и поэтому способна подавлять указанную мРНК и блокировать ее экспрессию. Во всех последовательностях имеются терминальные ДНК димеры нуклеотидов, содержащих, по меньшей мере, один тимин (Т) (не показан) во избежание взаимодействия с белками, регулирующими мРНК в обычных процессах в клетке. Эта процедура хорошо известна специалистам в данной области техники. Вместе с данными терминальными димерами в олигонуклеотидах имеется 21-23 пары оснований, что обеспечивает эффективный механизм РНКи.
В экспериментах используют последовательности миРНК из Таблицы 2, конъюгированной с группой с формулой (I) и одним нацеливающим веществом, как описано выше (5-HTT-NLF-миРНК).
Пример 10. Различная эффективность подавления, определенная при анализе функциональных показателей 5-НТТ-NLF-миРНК, взятой в двух дозах (10 и 30 мкг/мышь), при in vivo интраназальном (ин) применении на мышах
Мужские особи мышей C57BL/6J (21-29 г, возраст 9-12 недель) анестезируют пентобарбиталом (40 мг/кг, ип) и кладут на спину. Медленно и аккуратно добавляют по каплям ЗФФР или 5HTT-NLF-миРНК попеременно в каждую ноздрю с помощью микродозатора в виде аликвот по 5 мкл. Оцененные дозы 5-HTT-NLF-миРНК составляют 5 мкг/5 мкл и 15 мкг/5 мкл в каждую ноздрю (общая доза NLF-миРНК: 10 и 30 мкг/мышь за один день).
Через 24 ч после обработки мышей умерщвляют обезглавливанием и быстро извлекают головной мозг, замораживают на сухом льду и хранят при -20 °С. Нарезают срезы ткани толщиной 14 мкм с помощью криостатируемого микротома, при оттаивании закрепляют на предметных стеклах, покрытых АПТС (3-аминопропилтриэтоксисиланом) и хранят при -20 °С до использования.
Для определения уровня экспрессии мРНК 5-НТТ проводят анализ гибридизацией in situ с использованием олигодезоксирибонуклеотидного зонда, специфичного к 5-НТТ, который комплементарен основаниям 820-863 (мышь, номер доступа в базе данных GenBank: NM_010484). 5-НТТ олигонуклеотиды метят (2 пмоль) индивидуально для каждой мыши по 3’-концу с помощью [33P]-dATФ (>2500 Ки/ммоль) с использованием терминальной дезоксинуклеотидилтрансферазы, очищают центрифугирования с использованием набора для удаления нуклеотидов QIAquick. Протоколы проведения мономаркерной гибридизации in situ основаны на ранее описанных методиках. Вкратце, замороженные срезы тканей, описанные в примере 2, вначале доводят до комнатной температуры, фиксируют в течение 20 мин при 4 °С в 4% параформе в забуференном фосфатом физиологическом растворе (1×ЗФФР: 8 мМ Na2HPO4, 1,4 мМ KH2PO4, 136 мМ NaCl, 2,6 мМ KCl), промывают в течение 5 мин в 3×ЗФФР при комнатной температуре, дважды промывают по 5 минут в 1×ЗФФР и выдерживают 2 мин при 21 °С в растворе предварительно переваренной проназы с конечной концентрацией of 24 Ед/мл в 50 мМ Трис-HCl рН 7,5, 5 мМ ЭДТА. Действие фермента прекращают погружением на 30 с в 2 мг/мл глицин в 1×ЗФФР. Под конец ткани прополаскивают 1×ЗФФР и обезвоживают пропусканием через ряд этанольных растворов разной концентрации. Для гибридизации радиоактивно меченый зонд разбавляют в растворе, содержащем 50% формамида, 4 × раствор цитрата и хлорида натрия (ЦХН) (1 × ЦХН: 150 мМ NaCl, 15 мМ цитрат натрия), 1 × раствор Дернхардта (0,02% Фиколл, 0,02% поливинилпирролидон, 0,02% бычий сывороточный альбумин), 10% сульфат декстрана, 1% саркозил, 20 мМ фосфатный буфер с рН 7,0, 250 мкг/мл дрожжей тРНК и 500 мкг/мл ДНК из молок лососевых. Конечная концентрация радиоактивного зонда в гибридизационном буфере находится в том же самом диапазоне (1,5 нМ). Срезы тканей покрывают гидбридизационным раствором, содержащим меченый зонд, покрывают покровными стеклами Nescofilm и выдерживают на протяжении ночи при 42 °С в увлажнительных камерах. Затем срезы промывают четыре раза (по 15 мин) в 1×ЦХН при 60 °С и один раз в 1×ЦХН при комнатной температуре в течение 30 мин, обезвоживают и подвергают воздействию на пленке в течение 1-3 дней. Оптическую плотность пленки полуколичественно оценивают с помощью компьютерной системы анализа изображений AISR.
Как видно из Фиг.27, обе дозы молекулы 5-HTT-NLF-миРНК вызывают специфичный нокдаун мРНК НТТ в дорсальном ядре шва в трех различных переднезадних координатах.
Как видно из Фиг.28, денситометрическое определение положительных зерен мРНК 5-НТТ, измеренных в пленках в среднемозговом ядре шва, указывает на снижение на 30% уровня экспрессии в группе NLF-миРНК в сравнении группой, получавшей среду.
Эти результаты указывают на то, что NLF-миРНК селективно направляет олигонуклеотиды, которые осуществляют интерференцию мРНК в специфичные серотонинергические нейроны, расположенные в среднемозговом ядре шва.
Плотность белка переносчика серотонина анализируют так, как описано в примере 3, с использованием [3H]циталопрама для ауторадиографической визуализации 5-НТТ участков. Через 24-48 ч после интраназального введения NLF-миРНК мышей умерщвляют и извлекают их головной мозг, получают последовательные коронарные срезы толщиной 14 мкм при следующих ПЗ координатах (в мм) относительно брегмы (по атласу Паксиноса и Франклина, 1997): 2,2 (предлобная кора - ПЛК), 1,1÷0,6 (хвостатое ядро - ХЯ, боковое и среднее септальные ядра - Сеп, вентральный паллидум - ВП), -1,5 ÷ -1,8 (гиппокам - ГПК, гипоталамус - Гип) и -4,24 ÷ -4,96 (дорсальное ядро шва - ДЯ и срединное ядро шва - СЯ). Вкратце, замороженные срезы тканей оттаивают и высушивают, предварительно выдерживают в 50 мМ Трис-HCl буфере (рН 7,4 при 25 °С), содержащем 120 мМ NaCl и 5 мМ KCl в течение 15 мин при комнатной температуре. Затем выдерживают в том же самом буфере, содержащем 1,5 нМ [3H]циталопрам (70,0 Ки/ммоль), в течение 60 мин при комнатной температуре. Неспецифическое связывание определяют по остаточному связыванию в присутствии 1 мкМ флуоксетина. После выдерживания и промывки срезы тканей погружают в дистиллированную воды, охлажденную до температуры замерзания, и быстро высушивают под холодным током воздуха. Ткани подвергают воздействию на тритий-восприимчивой пленке вместе с пластиковыми3H-стандарта ми в течение 40 дней при 4 °С.
Количественный анализ ауторадиограмм проводят с помощью компьютерной системы анализа изображений AISR. Используя калиброванные по тканям данные от совместно облучаемых радиоактивных стандартов значения ОП на ауторадиограммах переводят в уровень радиоактивности (нКи/мг тканевого белка), связанной со определенными областями мозга в тканевых срезах.
Как видно из Фиг.29-31, интраназальное введение 5-HTT-NLF-миРНК вызывает снижение уровня переносчика серотонина в различных областях мозга в сравнении с интраназальным введением среды или NLF-нонсеснс-миРНК, что определено по ауторадиографическому анализу связывания.
Пример 11. Увеличение уровня 5-НТ в предлобной коре у обработанных мышей при in vivo интраназальном (ин) введении 5-HTT-NLF-миРНК в дозах 10 и 30 мкг/мышь в сравнении с контрольными группами
Для оценки влияния NLF-миРНК на функциональные свойства 5-НТТ оценивают нейрохимическое влияние селективных ингибиторов переносчика 5-НТ на уровень 5-НТ в дорсальном стриатуме относительно 5-НТТ NLF-миРНК. С этой целью мужские особи мышей C57BL/6J (21-29 г, возраст 9-12 недель) анестезируют пентобарбиталом (40 мг/кг, ип) и помешают в стереотаксическую рамку. Каждой мыши имплантируют один зонд для диализа, снабженный мембраной Cuprophan (длина 1,5 мм, молекулярная масса 5000 Да), в среднюю предлобную кору (сПЛК) (в мм: АР +0,5, L -1,7, DV -4,5 от брегмы, по атласу Паксиноса и Франклина, 1997).
Микродиалитические эксперименты проводят через 24-72 после хирургического вмешательства на свободно двигающихся мышах с использованием непрерывно протекающих зондов с СМЖ (125 мМ NaCl, 2,5 мМ KCl, 1,26 мМ CaCl2, 1,18 мМ MgCl2) со скоростью 2,0 мкл/мин с помощью шприцевого насоса WPI модель sp220i, присоединенного к верхнему поворотному держателю жидкости. Собирают образцы диализата объемом 60 мкл через каждые 30 мин в микроцентрифужные пробирки.
После первоначального 60-мин период стабилизации собирают четыре-шесть исходных образцов до местного введения циталопрама (1-10-50 мкМ) или системного введения флуоксетина, а затем собирают последовательные образцы диализата. По заверешении диалатических экспериментов мышей умерщвляют и сразу же извлекают головной мозг, который замораживают при -70 °С. После этого нарезают коронарные срезы (50 мкм) головного мозга на криостате и окрашивают крезиловым фиолетовым по стандартным методикам для локализации участка перфузии. Используют только данные, полученные от животных с гистологически правильными размещениями зондов, для последующего статистического анализа.
Концентрацию 5-НТ в образцах диализата определяют методом ВЭЖХ на колонке 3 мкм октадецил диоксидом кремния (ОДДК) (7,5×0,46 см) и измеряют амперометрически на детекторной установке Hewlett-Packard 1049 при потенциале окисления 0,6 В. Подвижная фаза состоит из 0,15 М NaH2PO4*H2O, 1,8 мМ октилсульфата натрия, 0,2 мМ ЭДТА (доводят до рН 2,8 добавлением фосфорной кислоты) и 30% метанола и прокачивается со скоростью 0,7 мл/мин. Время удерживания 5-НТ составляет 3,5-4 мин, а предел обнаружения - 2 фмоль/образец.
Как видно из Фиг.32 и 33, группы, наблюдается отсутствие или уменьшение реакции 5-НТТ на селективные ингибиторы 5-НТТ, включая влияние флуоксетина и циталопрама на уровень серотонина в дорсальном стриатуме мышей из группы, получавшей 5-HTT-NLF-миРНК, в сравнении с группой, получавшей среду. Это свидетельствует о том, что нокдаун 5-HT1AR в серотонинергических нейронах может быть оценен функционально по снижению влияния селективного ингибитора переносчика на количество 5-НТ в терминальных областях мозга.
Эти результаты демонстрируют, что введение сертралин-конъюгированных миРНК (NLF-миРНК) нацеливает серотонинергические нейроны за счет селективного взаимодействия с 5-НТТ, помимо последовательности нуклеиновокислотной компоненты (миРНК).
В примерах 3-8 показано, что NLF-миРНК, направленная на 5-HT1AR, способна специфично выключать ген-мишень в 5-НТ нейронах, расположенных в дорсальном ядре шва. Данный эффект наблюдается как после интрацеребровентрикулярного, так и после интраназального применения.
В примерах 10-11 показано, что NLF-миРНК, специфичная к 5-НТТ, также способна специфично выключать ген-мишень, в данном случае, мРНК 5-НТТ. Нацеливающаяся способность NLF-миРНК конструкции данного изобретения наблюдалась как после интрацеребровентрикулярного введения в третий желудочек (3DV), так и после интраназального введения дозой 0,3-1,0 мг/кг (10-30 мкг молекулы миРНК на мышь). Это наиболее принятый терапевтический диапазон в терапии посредством миРНК и представляется потенциально высоким достижением для лечения человека. Результаты по неинвазивному интраназальному введению также повышают применимость молекулы NLF-миРНК в качестве лекарственного вещества.
Пример 12. Проверка нацеливания миРНК, конъюгированной с номифензином (NLF-NS-миРНК) при in vivo интрацеребровентрикулярной инфузии в область правого бокового желудочка
В данном примере показано, что NLF-NS-миРНК, вводимая интрацеребровентрикулярной инфузией, способно достигать специфических нейронов, расположенных в черном веществе головного мозга и голубом пятне. Эти клетки положительно окрашиваются тирозингидроксилазой, т.е. они представляют собой дофаминергические и норадренергические нейроны.
Используемая последовательность - это нонсенс (нс) миРНК, которая не гомологична какому-либо гену человека, мыши или крысы.
NS-миРНК-с AGUACUGCUUACGAUACGG SEQ ID NO: 69
NS-миРНК-а CCGUAUCGUAAGCAGUACU SEQ ID NO: 70
В последовательности имеются терминальные ДНК димеры нуклеотидов, содержащих, по меньшей мере, один тимин (Т) (не показан) во избежание взаимодействия с белками, регулирующими мРНК в обычных процессах в клетке. Эта процедура хорошо известна специалистам в данной области техники. Вместе с данными терминальными димерами в олигонуклеотидах имеется 21 пара оснований, что обеспечивает эффективный механизм РНКи. Антисмысловая (а) последовательность также содержит молекулу Су3, что позволяет рассматривать ее в конфокальном микроскопе.
Для инфузии миРНК мужские особи C57BI/6Ncrl мышей сильно анестезируют изофлуораном и помещают в держатель для мыш (номер по каталогу Stoelting 51625), прикрепленный к стереотаксической рамке с цифровым показанием индикатора (David Kopf Instruments, модель 940). После проделывания отверстия в черепе с помощью стерильной иглы размером 21 G × 1,5 дюйма, инъекционным шприцом (10 мкл, Hamilton) вводят 2 мкл раствора NLF-NS-миРНК-Су3 в дистиллированной воде (общая доза 100 мкг) или вводят среду в правый боковой желудочек (от брегмы АР +0,26; L -0,75, DV -2,5) с помощью шприцевого насоса (KD Scientific, KDS 310) с постоянной скоростью потока 0,5 мкл/мин (n=2 для каждого момента времени). Иголка оставляют на месте на 3 мин во избежание восходящего потока раствора миРНК.
Мышей опрыскивают 4% параформом в двух различных моментах времени, через 1 и 3 часа после введения миРНК. Препарируют головной мозг и затем фиксируют в растворе 4% параформа в течение 24 ч при 4 °С. Затем головной мозг помещают в 30% раствор сахарозы на 48 ч при 4 °С. Мозг замораживают в 2-метилбутане при температуре -30 ÷ -40 °С и хранят при -80 °С. Делают срезы мозга на криостате Leica CM3050 S (30 мм). Свободно плавающие срезы промывают и хранят при 4 °С в 0,1М ЗФФР и 0,001% азиде натрия.
Срезы промывают в ЗФФР, блокируют 2% козлиной сывороткой и 0,1% Тритоном и выдерживают вместе с антителами против тирозингидроксилазы (1:800 мышь) на протяжении ночи при 4 °С. После промывки срезы выдерживают со вторичным антителом - антимышиным иммуноглобулином Alexa Fluor 647 (Invitrogen) в течение 1 ч при комнатной температуре. Под конец, срезы заключают в флуоресцентную заливочную среду Dako и анализируют с помощью конфокального спектрального микроскопа (FV1000 Olympus). Получают картины с помощью визуализатора FV10-ASW 1.7.
Как видно из Фиг.34-41, через 1 ч после ицв инфузии некоторые ТГ-положительные клетки в компактной зоне черного вещества и голубом пятне также положительны в отношении Су3. Не все ТГ-положительные клетки оказываются положительными к Су3, но большая их доля характеризуется флуоресценцией Су3 внутри клеток, что указывает на включение молекулы NLF-NS-миРНК-Су3 в некоторые ТГ-положительные нейроны.
Пример 13. Проверка нацеливания Су3-меченого нонсенс 2-O’-метил-модифицированного гэпмеры, конъюгированного с сертралином, на серотонинергические нейроны при интравентрикулярном введении
Синтезируют конъюгат, содержащий РНК ответвления 3 нуклеотидов, каждый из которых содержит 2-O’-метильную группу, и длинный бессмысленный гэп-участок из 10 нуклеотидов с неспецифической (нонсенс) последовательностью. Гэпмер конъюгирован с сертралином через свой 5’-конец и с Су3 через 3’-конец. Мышам вводят однократную интрацеребровентрикулярную инфузию (30 мкг) Су3-конъюгата в дорсальный третий желудочек и умерщвляют через 24 ч после инфузии (n=2 мыши). Затем определяют локализацию Су3-меченого конъюгата лазерной конфокальной микроскопией. Эксперимент показывает (Фиг.42), что гэпмер специфически локализуется в серотонинергических нейронах.
Реферат
Группа изобретений относится к медицине и касается конъюгата, включающего по меньшей мере один агент селективности, специфично связывающийся с по меньшей мере одним переносчиком нейромедиатора и выбранный из группы, включающей селективный ингибитор обратного захвата серотонина (СИОЗС), ингибитор обратного захвата норадреналина (ИОЗН), ингибитор обратного захвата норэпинефрина и дофамина (ИОЗНД) и ингибитор обратного захвата серотонина, норэпинефрина и дофамина (ИОЗСНД), и по меньшей мере одну нуклеиновую кислоту, выполненную с возможностью специфично связываться с молекулой-мишенью, экспрессируемой в клетке, в которой экспрессируется переносчик нейромедиатора. Группа изобретений также касается применения указанного конъюгата при лечении и/или профилактике расстройства, связанного с депрессией, при лечении и/или профилактике болезни, связанной с отложением телец Леви. Группа изобретений обеспечивает запуск интернализации нуклеиновых кислот заявленных коньюгатов в клетках, экспрессирующих транспортеры нейромедиаторов, с которыми они взаимодействуют. 3 н. и 15 з.п. ф-лы, 42 ил., 2 табл., 13 пр.
Формула
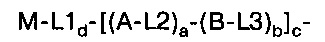


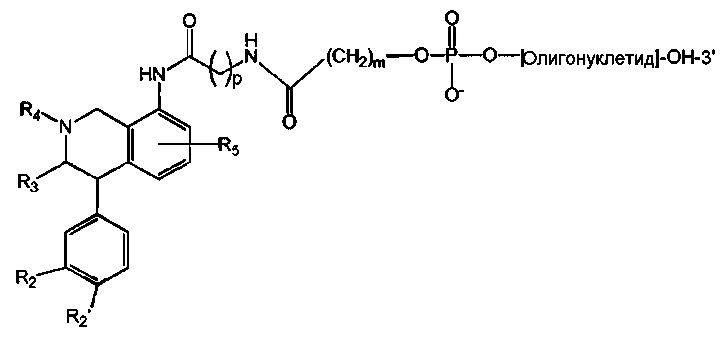


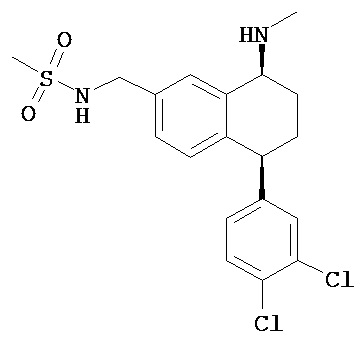
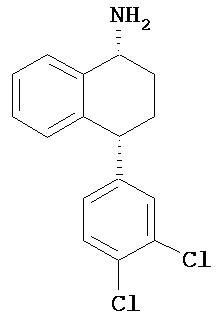
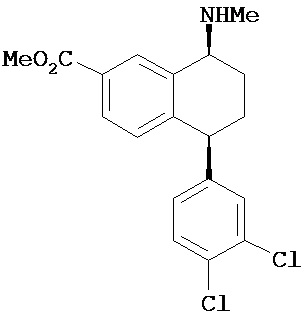
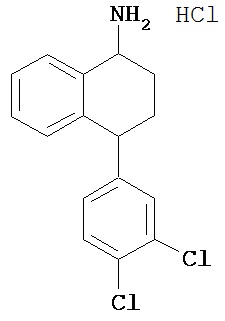



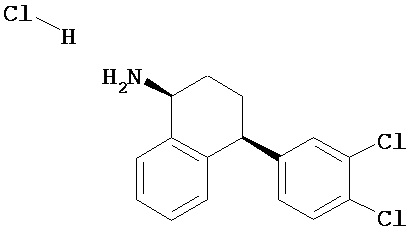




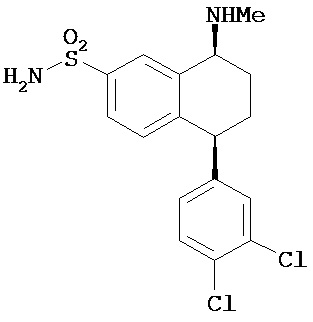
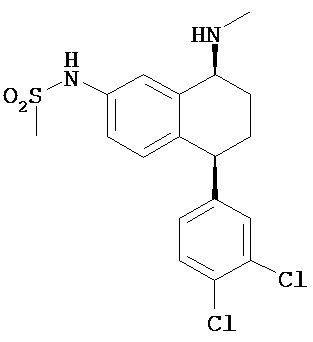

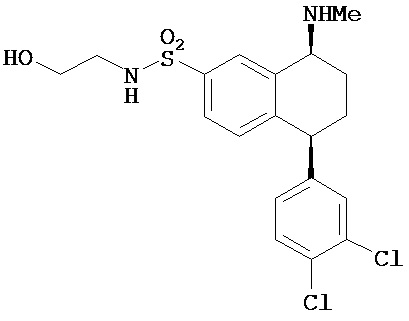



Комментарии