Применение 3-о-сульфамоилокси-7β-метил-d-гомо-6-оксаэстра-1,3,5(10),8(9)-тетраен-17а-она для лечения рака молочной железы, включая трижды негативную форму - RU2678845C1
Код документа: RU2678845C1
Описание
Изобретение относится к области медицины и химико-фармацевтической промышленности и касается средств для лечения рака молочной железы.
Рак молочной железы является ведущим онкологическим заболеванием у женщин [Parkin D.M., Bray F., Ferlay J., and Pisani P., CA Cancer J. Clin., 2005, vol. 55, p.74-108]. По данным ВОЗ, в мире 2.09 миллионов больных, а ежегодно умирают от рака молочной железы 627 тыс. женщин [http://www.who.int/news-room/fact-sheets/detail/cancer].
Значительная часть опухолей этой локализации прогрессирует под действием эстрогенов [Yue W., Yager J.D., Wang J.-P., Jupe E.R., Santen R.J., Steroids, 2013, vol. 78, p. 161-170]. При иммуногистохимическом исследовании рака молочной железы определяются рецепторы эстрогенов (ER), прогестерона (PR) и her2neu («чувствительность к герцептину»). Значительная часть опухолей содержат рецепторы эстрогенов, прогестерона и/или HER2NEU 3+. Если опухоль не имеет рецепторов и не чувствительна к герцептину (ER0, PR0, HER2NEU 0-1) ее рассматривают как трижды негативную (ER-/PR-/HER-2-). Это одна из самых смертоносных форм рака молочной железы по причине отсутствия мишеней для подавления ее роста. На сегодняшний день в мире нет лекарственных препаратов для лечения этой формы рака.
Эстрогены циркулируют в крови и накапливаются в опухоли в виде сульфатов, не способных связываться с рецепторами эстрогенов, однако после превращения в свободные гормоны они активируют рост опухоли. Поэтому перспективной является стратегическая линия лечения, в основе которой лежит применение ингибиторов, блокирующих образование этой группы свободных гормонов в опухоли.
К препаратам из группы селективных модуляторов рецепторов эстрогенов, которые блокируют эффекты эстрогена на гормонозависимые ткани, в том числе -на ткани молочной железы, относится тамоксифен. Тамоксифен является стандартом гормональной терапии для женщин в пременопаузе и постменопаузе. Наиболее характерными побочными эффектами, возникающими на фоне применения тамоксифена, являются: повышение риска развития тромбоза вен, усугубление течения заболеваний сердечно-сосудистой системы (включая приступы стенокардии), а также появление новообразований эндометрия (полипы, и рак эндометрия), а также фиброма матки. Кроме того, тамоксифен гепатотоксичен. По биофармацевтической классификационной системе (БКС), разработанной Gordon Amidon с соавторами в 1995 году, тамоксифен отнесен ко второму классу - препарат имеет низкую растворимость и высокую проницаемость.
Большую эффективность по сравнению с тамоксифеном показали ингибиторы ароматазы, в частности, нашли применение летрозол и анастразол, которые отнесены к первому классу. Они имеют высокую растворимость и высокую проницаемость. Побочные эффекты ингибиторов ароматазы - остеопороз, приливы, головные боли.
Кроме того, привлекает внимание стероидная сульфатаза в связи с локальным межтканевым образованием эстрогенов из обильного пула циркулирующего сульфата эстрона. Стероидная сульфатаза катализирует гидролиз сульфата эстрона до эстрона и сульфата DHEA до DHEA (Dibbelt 1., Biol. Chem., Hoppe-Seyler, 1991, 372, 173-185; Stein С., J. Biol. Chem., 1989, 264, 13865-13872).
Самым известным ингибитором стероидной сульфатазы является ЕМАТЕ-сульфамат эстрона (Ahmed S., Curr. Med. Chem., 2002, vol 9, no. 2, p.263-273). Однако он обладает существенным недостатком. Под действием ингибиторов сульфатазы эстрона, имеющих в своем составе сульфаматную группу, происходит необратимая дезактивация фермента с высвобождением свободного лиганда [Howarth N.M., Purohit A., Reed M.J. J. Med. Chem., 1994, vol. 37, p. 219-221]. В частности, сульфамат эстрона ингибирует сульфатазу эстрона, однако высвобождение свободного гормона приводит к появлению сильной утеротропной активности [Shields-Botella J. et al., J. Steroid Biochem. Mol. Biol., 2003, vol. 84, p.327-335].
Ряд ингибиторов сульфатазы эстрона защищены в патенте WO9933858 (А2) - 1999-07-08, где в качестве ингибиторов сульфатазы эстрона для лечения или профилактики эстрогензависимых расстройств, таких как рак молочной железы, могут быть использованы производные общей формулы
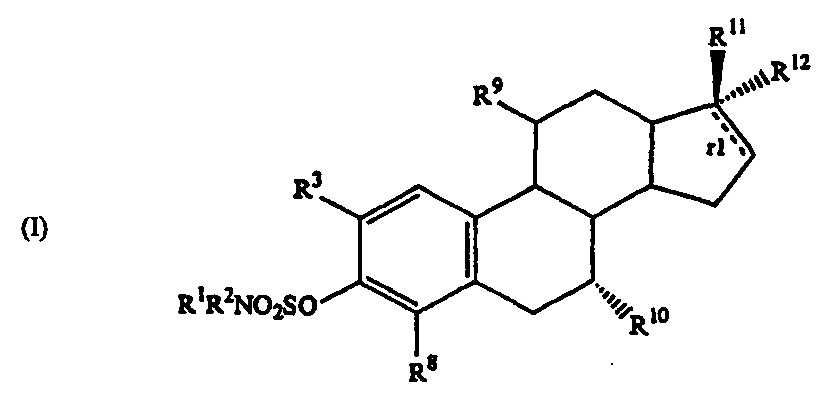
Данные производные обладают также утеротропной активностью.
Таким образом, при поиске новых противораковых агентов необходимо учесть, что носитель сульфаматной группы ингибитора сульфатазы эстрона не должен обладать гормональной активностью.
Выполнение этих условий привело к расширению области применения сульфаматов на основе эстрогенов ввиду широкого потенциала их действия, в частности, при рецидивирующем раке молочной железы [Shah R. Et al., Sulfatase inhibitors for recidivist breast cancer treatment: A chemical review, Eur. J. Med. Chem., 2016. vol. 114, p. 170-190]. В частности, описаны 17α-замещенные производные сульфамата эстрадиола.
Из уровня техники также известно соединение 3,17aβ-дисульфамоилокси-7β-метил-D-гомо-6-окса-эстра-1,3,5(10),8,14-пентаен формулы
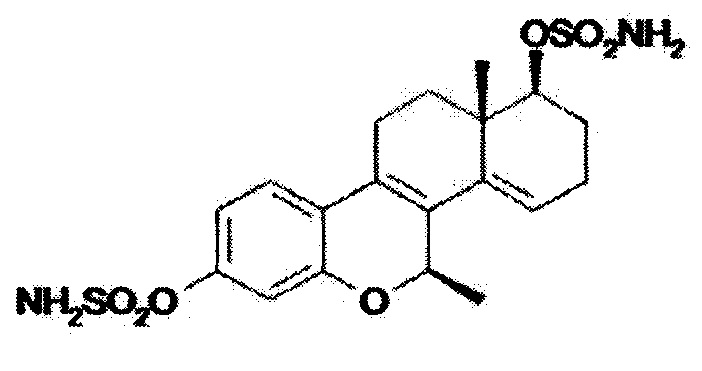
в качестве ингибитора роста клеток рака молочной железы MCF-7 (RU 2619457, опубл. 16.05.2017). Данное соединение может быть указано в качестве ближайшего аналога.
Задачей настоящего изобретения является поиск и разработка эффективного синтеза соединений, которые могут быть использованы в качестве противораковых агентов при моно- и адъювантной терапии рака молочной железы, в том числе при его самой смертоносной форме- трижды-негативной (ER-/PR-/HER-2-).
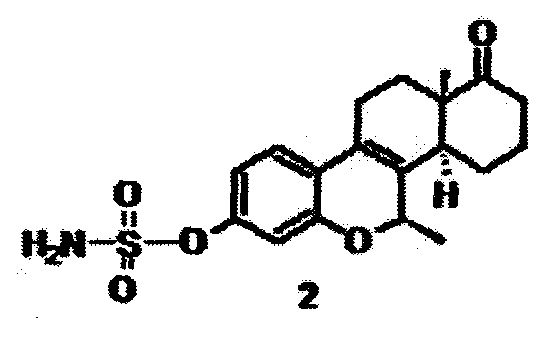
Задача решается использованием соединения 3-O-сульфамоилокси-7β-метил-D-гомо-6-оксаэстра-1,3,5(10),8(9)-тетраен (2), который ингибирует сульфатазу эстрона,
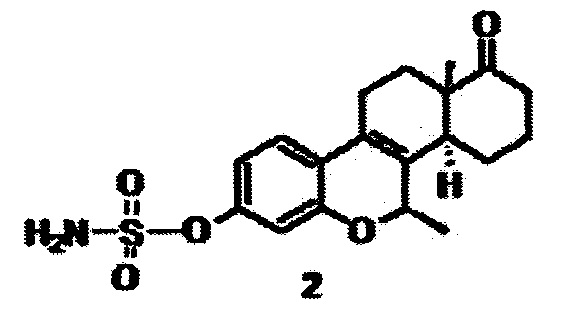
и может применяться как противоонкологический агент при моно- и адъювантной терапии рака молочной железы, включая трижды негативную форму (ER-/PR-/HER-2-) рака молочной железы.
Схема синтеза целевого соединения (2) представлена ниже.
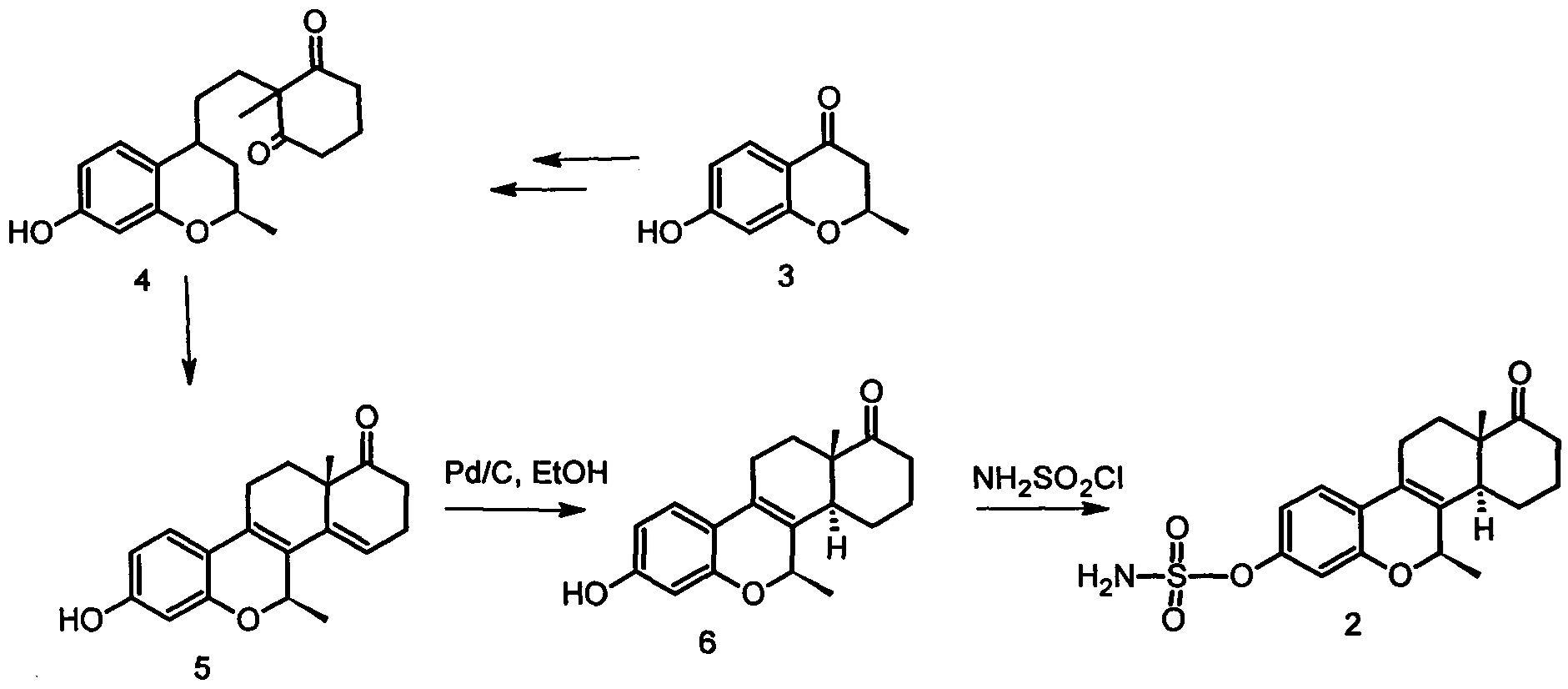
Соединение (3) вводили в реакцию с винилмагнийбромидом, конденсация полученного винилкарбинола с 2-метилциклогексан-1,3-дионом приводила к образованию секосоединения (4). Реакцию циклодегидратации соединения 4 проводили в соляной кислоте. Эстратетраен 6 получили гидрированием над Pd/С в этаноле, выход 75%. Сульфамат 2 получен с выходом 86%.
Полученный противоонкологический агент относится к 4 классу опасности (LD50>300-2000 мг/кг). Полученные данные позволяют оценить дозы для исследования противоопухолевой активности как безопасные. Терапевтически эффективные дозы препарата предпочтительно составляют от 0.1 до 20 мг.
Технические результаты:
- отсутствие утеротропного действия,
- активность против трижды негативного рака молочной железы,
- отсутствие токсичности
- гипохолестеринемическое действие и отсутствие влияния на содержание триглицеридов в сыворотке крови.
- отсутствие негативного влияния на эндометрий.
- повышенная антиоксидантная активность.
Несмотря на значительный прогресс в клинической онкологии, хирургический метод играет ведущую роль в лечении больных злокачественными новообразованиями молочной железы. Однако, многие пациенты впоследствии погибают. Это означает, что у этих больных наряду с первичной опухолью уже имеются микрометастазы, которые, к сожалению, не всегда можно выявить с помощью самых современных методов исследования. С целью длительного подавления таких микрометастаз, как правило, используется адъювантная терапия -вспомогательное, дополняющее хирургические или лучевые методы, химиотерапевтическое лечение. Адьювантная терапия в основном проводится в течение 5-10 лет, что может привести к различным побочным эффектам на другие ткани и органы. Предложенное соединение обеспечивает проведение такой терапии с большей эффективностью.
Изобретение может быть проиллюстрировано следующими ниже представленными примерами осуществления изобретения.
Пример 1.
Синтез 3-Гидрокси-7β-метил-D-гомо-6-оксаэстра-1,3,5(10),8(9),8,14-пентаен-17а-он (5).
Секосоединение 4 получали из 6 г хроманона (3).
К раствору секостероида 4 в 100 мл метаноле добавляли 6 мл соляной кислоты, кипятили 10 ч. Охлажденную реакционную смесь выливали в охлажденную воду, последовательно промывали 5% раствором NaHCOa, водой до нейтральной реакции, сушили над Na2SO4. Растворитель отгоняли на ротационном испарителе. Получали продукт с т.пл. 237-240°С.
Спектр ЯМР1Н (CDCl3), м.д.: 7.08; 6.45; 6.39; 5.84; 5.30; 5.00 с (1H, С3-ОН); 2.79; 2.74-2.40; 2.14,1.69; 1.28; 1.24 с (3Н).
Спектр ЯМР13C (DMSO-d6), м.д.: 214.6; 158.6,152.6 (С-3, С-5), 137.4; С); 123.9, 125.4; 124.1; 115.7; 118.3; 108.7; 103.8; 69.9; 45.0; 35.4; 28.6; 24.1; 21.1; 18.1.
3-Гидрокси-7β-метил-D-гомо-6-оксаэстра-1,3,5(10),8(9)-тетраен-17а-он (6) получали из 100 мг эстрапентаена. Продукт реакции кристаллизовали из МеОН, сушили. Получили 76 мг (75%) соединения, Т>254°С.
Спектр ЯМР1Н, (DMSO-d6), м.д.: 9.44 с (С3-ОН); 6.96; 6.33, 6.22; 4.84, 2.80; 2.51; 2.46,2.18; 2.12; 2.06; 1.91; 1.83; 1.62; 1.52; 1.16,1.08 с (3Н).
Спектр ЯМР13С (DMSO-d6), м.д.: 214.4; 158.1, 152.4; 128.2; 122.3; 116.4; 123.8; 108.5; 103.7; 70.5; 46.8; 45.4; 37.0; 29.0; 25.9; 22.3; 21.8; 19.6; 16.4.
Полноту протекания реакций и индивидуальность соединений проверяли, используя тонкослойную хроматографию (ТСХ) на пластинах Silufol UV254 фирмы Kavalier и Alugram SIL G/UV254 фирмы Machereynagel в системах растворителей гексан/петролейный эфир 40-70 - этилацетат в различном соотношении. Детектирование веществ проводилось в ультрафиолетовом свете (λmax=254 нм), адсорбцией паров йода или при реакции с серной кислотой в метаноле (3:1) при нагревании.
Для очистки веществ колоночной хроматографией использовали силика-гель 60 (0.035 - 0.070 мм; 0.060-0.200 мм) фирмы Acros Organics.
Спектры ЯМР1H и13С снимали в CDCl3 (если не оговорено особо) на приборе Bruker DPX-300 соответственно на частотах 400.130 и 100.613 МГц для ядер1Н и13С соответственно при 298 К. Для спектров ЯМР1Н использовали растворы 3-5 мг вещества в 0.6 мл CDCl3, а для ЯМР13С - 20-50 мг в том же объеме. Химические сдвиги измеряли по отношению к тетраметилсилану, присвоив сигналу растворителя (CDCl3/CHCl3=99.9/0.1) значения: 7.26 м.д. (1Н) и 77.16 м.д. (13С).
Пример 2.
Изучение фармакологической активности
Клеточные культуры и условия культивирования
Работа проведена на перевиваемой культуре клеток человека MCF-7 (аденокарцинома молочной железы). В качестве отрицательного контроля использовали нормальные кожные фибробласты человека (КФЧ) ранних пассажей. Клетки культивировали во флаконах Карреля в среде DMEM/F12 (Биолот) с добавлением 1% эмбриональной сыворотки крупного рогатого скота (Биолот), без антибиотиков, в 5% СО2 атмосфере, при 37°С.
Оценка пролиферативной активности клеток.
Клетки высаживались на флаконы Карреля по 50 × 104 клеток на флакон. Для изучения пролиферативной активности клеток в условиях подавления сульфатазы через 24 часа после посева культуральную среду заменяли на среду, содержащую ингибиторы сульфатаз до конечной концентрации 50 мкг/мл, после чего инкубировали данные опухолевые клеточные линии в течение различных промежутков времени (от 24 до 72 ч). Ингибитор растворяют в ДМСО. Конечная концентрация ДМСО в культуральной среде не превышала 0.5%. Для исключения цитотоксического действия ДМСО ставили контроль с добавлением ДМСО без ингибитора сульфатаз. Для исключения неспецифического губительного действия веществ использовали нормальные кожные фибробласты человека. Далее клетки снимали раствором версена-трипсина (Биолот), рассеивали на флаконы Карреля, содержащие новую полную культуральную среду. Подсчет клеток проводили в момент достижения необработанными контрольными клетками максимальной плотности клеток на единицу площади поверхности культурального флакона (монослой), при этом их количество определялось как 100%. Пролиферативную активность всех исследованных клеточных культур при воздействии ингибиторов сульфатаз определяли не менее трех раз.
Исследование влияние полученного сульфамата на рост перевиваемой культуры клеток человека MCF-7 (аденокарцинома молочной железы) показало, что стероид 2 полностью блокирует рост опухолевых клеток при концентрации 20 мкг/мл, при этом он не влияет на рост кожных фибробластов человека, не имеющих рецепторов эстрогенов. Рост опухолевых клеток ингибируется в той же степени, что и под действием тамоксифена, применяемого в медицинской практике более 30 лет. Это весьма важно, поскольку сульфаматы и тамоксифен имеют разные механизмы действия, поэтому есть перспективы их совместного применения.
В экспериментах на мышах линии FVB, трансгенной по HER-2/neu (ER-/PR-/HER2+), с опухолями молочных желез, агент ингибирует рост опухолей сравнимо с применяемым в клинической практике тамоксифеном, что предполагает их совместное использование для лечения рака молочной железы.
На клеточной линии трижды негативного рака молочной железы MDA-MB-231 соединение ингибирует рост клеток, IC50=4.8 μМ, что сравнимо с применяющимся в клинической практике химиотерапевтическим препаратом этопозидом.
На животных моделях, с привитой человеческой опухолью трижды негативного рака молочной железы препарат показал более высокую активность, по сравнению с использующими в клинической практике тамоксифеном и ингибитором ароматазы летрозолом.
Указания к применению;
- Моно- и адьювантная терапия раннего гормоноположительного рака молочной железы у женщин в постменопаузе.
- Лечение трижды негативного рака молочной железы.
- Моно- и адьювантная терапия рака молочной железы у женщин в постменопаузе после 2-3 летнего применения тамоксифена.
- Лечение распространенного рака молочной железы на поздних стадиях.
Реферат
Изобретение относится к применению 3-O-сульфамоилокси-7β-метил-D-гомо-6-оксаэстра-1,3,5(10),8(9)-тетраен-17а-она в качестве противоонкологического агента при моно- и адъювантной терапии рака молочной железы, включая трижды негативную форму. Технический результат: получено новое соединение 3-O-сульфамоилокси-7β-метил-D-гомо-6-оксаэстра-1,3,5(10),8(9)-тетраен-17а-он, которое может применяться в качестве противоонкологического агента. 2 пр.
Формула

Комментарии