Новая терапия транстиретин-ассоциированного амилоидоза - RU2747536C2
Код документа: RU2747536C2
Чертежи
Описание
Настоящее изобретение связано с областью амилоидных заболеваний и, в частности с новыми соединениями для предупреждения и/или лечения транстиретин-ассоциированного амилоидоза.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Амилоидозом называют множество состояний, при которых амилоидные белки патологически откладываются в органах и/или тканях. Эти амилоидные белки иногда существуют в патологической волокнистообразной форме, называемой амилоидные фибриллы или отложения амилоида, которые встраиваются и постепенно нарушают структуру и функцию пораженных органов по всему организму. С различными типами амилоидного заболевания связаны различные белки, и лечение зависит от конкретного амилоидного белка.
Транстиретин-ассоциированный амилоидоз представляет собой общее название группы амилоидных заболеваний, которые, главным образом, связаны с патологическим неправильным сворачиванием, агрегацией (образованием фибрилл) и последующим отложением транстиретина. Белок транстиретин (TTR) представляет собой переносчик тиреоидного гормона тироксина и ретинола в сыворотке и спинномозговой жидкости. Мутации в гене TTR, который расположен на человеческой хромосоме 18q12.1-11.2, иногда приводят к дестабилизации белка TTR, что приводит к патологической агрегации и транстиретин-ассоциированному амилоидному заболеванию. Известно более 80 образующих амилоид вариантов TTR, наиболее часто встречающихся из них называется TTR V30M.
Семейная амилоидная полинейропатия (FAP), также называемая транстиретин-ассоциированный наследственный амилоидоз, транстиретиновый амилоидоз или болезнь Корино де Андраде, представляет собой аутосомное доминантное нейродегенеративное заболевание. Обычно проявляется в возрасте от 20 до 40 лет, характеризуется болью, парестезией, мышечной слабостью и вегетативной дисфункцией. В ее терминальном состоянии поражаются почки и сердце. FAP характеризуется системным отложением амилоидных вариантов белка TTR, особенно в периферической нервной системе, вызывая прогрессирующую сенсорную и двигательную полинейропатию. Это заболевание, вне всяких сомнений, является наиболее распространенным типом наследственного амилоидоза в мире.
Другие типы транстиретин-ассоциированного амилоидоза представляют собой семейную амилоидную кардиомиопатию и сенильный системный амилоидоз, вызванные отложением амилоидного TTR в сердце, и лептоменингеальный амилоидоз, при котором амилоидные отложения TTR обнаруживаются в стенках лептоменингеальных сосудов, в мягкой и паутинной оболочках мозга, и также в отложениях, расположенных в пространстве под мягкой оболочкой мозга. Последнее состояние ассоциировано с клинической картиной проявления нарушения функций центральной нервной системы в виде деменции, атаксии и спастичности.
Хотя все еще отсутствует лечение, которое блокирует отложение амилоида или ускоряет его удаление, лечение амилоидных заболеваний направлено на поддержание функции ослабленных органов. Пересадку печени часто применяли в качестве лечения транстиретин-ассоциированного амилоидоза, в частности FAP, поскольку белок TTR в основном образуется в печени. Замещение печени, содержащей мутантный ген TTR, печенью, в которой образуется нормальный белок транстиретин, направлено на предупреждение образования дополнительного амилоида и может стабилизировать заболевание. Пересадка печени была проведена у пациентов с FAP в большинстве случаев с большим успехом. Однако не всегда пересадка печени является подходящим вариантом и, кроме того, по мере приобретения опыта становится очевидным, что пересадку печени в случае FAP следует производить еще до того, как произошло слишком сильное повреждение нервов или сердца. К сожалению, последнее может происходить, не вызывая никаких симптомов.
Было описано очень немного соединений, проявляющих ингибиторную активность в отношении образования фибрилл и последующего отложения TTR. Среди них, йододифлунизал, о котором сообщали как о сильном ингибиторе амилоида in vitro Gales et al (Gales L, Macedo-Ribeiro S, Arsequell G, Valencia G, Saraiva MJ, Damas AM. “Human transthyretin in complex with iodoflusinal: structural features associated with a potent amyloid inhibitor”. Biochem J, 2005, vol. 388, p. 615-621). Кроме того, в патентной заявке WO 2005/113523 раскрываются бензоксазольные соединения для стабилизации амилоидного белка TTR, предупреждающие, тем самым, образование амилоидных фибрилл из TTR. Заявляется, что эти соединения применимы для лечения транстиретин-ассоциированных амилоидных заболеваний.
В частности, было описано, что производное бензоксазола, называемое тафамидис, 2-(3,5-дихлорфенил)-1,3-беноксазол-6-карбоновая кислота, ингибирует патологическую агрегацию TTR и образование фибрилл, и оно проходит клинические испытания в отношении лечения FAP. Несмотря на то, что он является многообещающей перспективой, тафамидис все еще проходит экспертизу в основных официальных медицинских органах регистрации. А значит, клиническую значимость тафамидиса все еще необходимо выяснять.
Несмотря на значительные усилия, которые были проделаны в данной области, до настоящего времени не существует эффективной фармакологической терапии для лечения FAP. Вследствие этого, желательным было бы обеспечение альтернативных соединений для лечения FAP и других транстиретин-ассоциированных амилоидозов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили, что ингибиторы катехол-O-метилтрансферазы (COMT) пригодны для предупреждения и/или лечения TTR-ассоциированного амилоидоза.
Как показано в примерах ниже, ингибитор COMT толкапон обладает сильной ингибирующей активностью в отношении образования амилоида из TTR. Хорошая ингибиторная активность толкапона выявляется по его низкому значению IC50 и высокому значению процента снижения амилоидоза (RA%).
Таким образом, первый аспект настоящего изобретения относится к ингибитору COMT для применения при предупреждении и/или лечении TTR-ассоциированного амилоидоза. Этот аспект можно переформулировать как применение ингибитора COMT для получения лекарственного препарата для предупреждения и/или лечения TTR-ассоциированного амилоидоза.
Частью настоящего изобретения также является способ предупреждения и/или лечения TTR-ассоциированного амилоидоза, включающий введение ингибитора COMT субъекту, нуждающемуся в этом. В конкретном варианте осуществления субъект, нуждающийся в предупреждении и/или лечении, является млекопитающим, в том числе человеком. В дополнительном предпочтительном варианте осуществления млекопитающее является человеком.
По сравнению с тафамидисом, который на сегодняшний день является наиболее передовым фармакологическим соединением для лечения FAP, толкапон обладает в четыре раза более низким IC50in vitro, что означает, что концентрация толкапона, необходимая для 50% ингибирования образования фибрилл из TTR, намного ниже таковой тафамидиса (см. примеры ниже). Примеры ниже дополнительно демонстрируют, что толкапон связывается с TTR и предупреждает TTR-индуцированную цитотоксичность в большей степени, чем тафамидис. В соответствии с этими результатами толкапон более эффективен при снижении образования фибрилл из TTR, чем эталонное соединение тафамидиса. Кроме предупреждения образования фибрилл из TTR, авторы настоящего изобретения обнаружили, что толкапон проявляет значительную активность дезинтеграции в отношении существующих фибрилл из TTR. Результаты, представленные ниже, показывают, что активность толкапона, связанная с дезинтеграцией фибрилл из TTR, выше таковой тафамидиса.
Ингибиторы COMT хорошо известны из уровня техники, как соединения, которые ингибируют действие катехол-O-метилтрансферазы, фермента, который вовлечен в деградацию нейротрансмиттеров (Mannisto and Kaakkola, Pharm. Rev., 1999,vol 51, p. 593-628). Активность ингибитора COMT можно определять с помощью способов, известных в области техники, например, способов, раскрытых в Zürcher et al (Biomedical Chromatography, 1996, vol. 10, p. 32-36). Ингибиторы COMT хорошо известны в области фармакологии для лечения болезни Паркинсона в сочетании с допаминэргическими средствами, такими как L-DOPA.
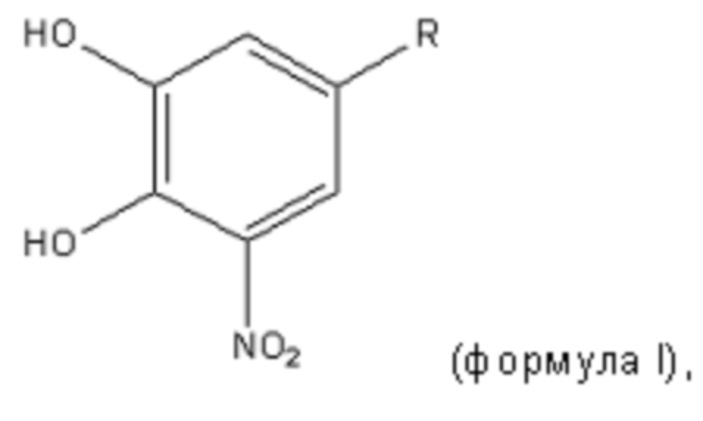
Было описано несколько ингибиторов COMT. Толкапон, энтакапон и нитекапон принадлежат к так называемым “ингибиторам COMT второго поколения”, которые, как было показано, являются сильными, высокоселективными и активными при пероральном введении ингибиторами COMT. Нитрокатехол является ключевой структурой в этих молекулах (Pharm. Rev., 1999,vol 51, p. 593-628, выше). Таким образом, в одном варианте осуществления ингибитор COMT для применения при предупреждении и/или лечении TTR-ассоциированного амилоидоза представляет собой нитрокатехоловое соединение. В конкретном варианте осуществления нитрокатехоловое соединение характеризуется следующей формулой I,
или является его фармацевтически приемлемой солью, где
R= -C(O)-PhCH3, -CH=C(CN)-C(O)-NEt2 или -CH=C(C(O)CH3)2.
В другом варианте осуществления первого аспекта настоящего изобретения ингибитор COMT представляет собой толкапон, энтакапон или нитекапон или их фармацевтически приемлемые соли.
В конкретном варианте осуществления ингибитор COMT представляет собой толкапон или его фармацевтически приемлемую соль. Толкапон (формула II) является желтым, не имеющим запаха, негигроскопичным, кристаллическим соединением с относительной молекулярной массой 273,25. Его эмпирическая формула C14H11NO5. Химическое название толкапона 3,4-дигидрокси-4'-метил-5-нитробензофенон, и его идентификационный номер по CAS 134308-13-7.
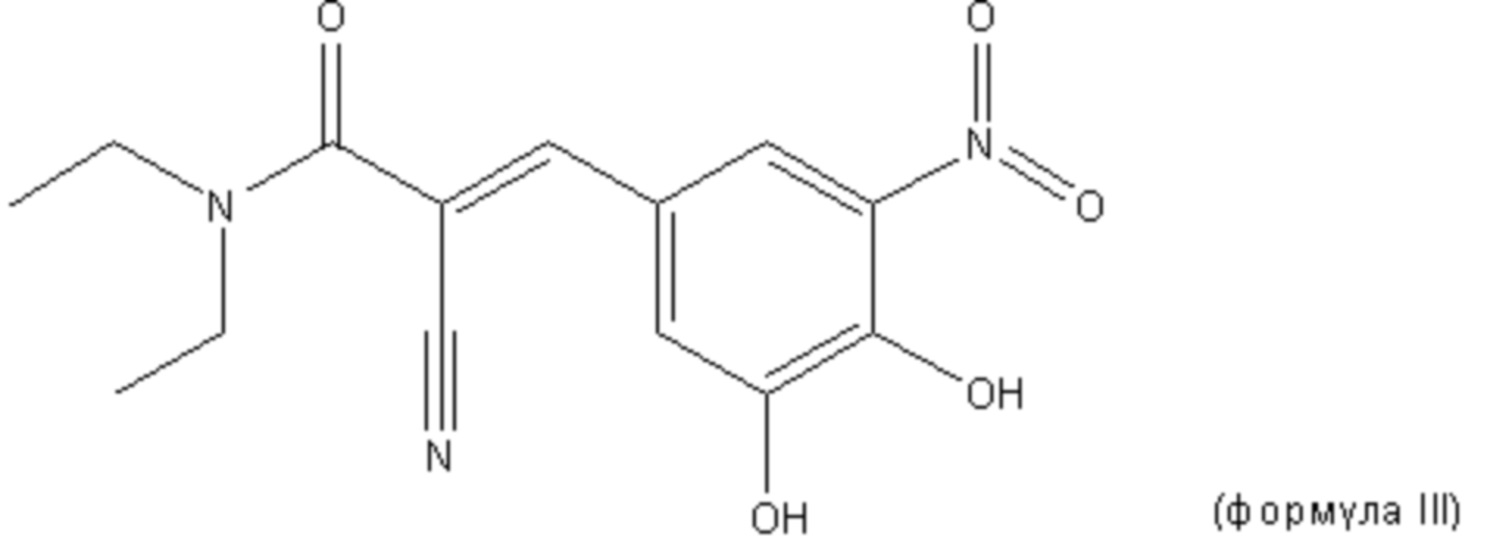
В другом варианте осуществления первого аспекта настоящего изобретения ингибитор COMT представляет собой энтакапон или его фармацевтически приемлемую соль. Энтакапон (формула III) является желтым кристаллическим соединением с молекулярной массой 305,29. Его эмпирическая формула C14H15N3O5. Химическое название энтакапона (2E)-2-циано-3-(3,4-дигидрокси-5-нитрофенил)-N,N-диэтил-2-пропенамид и его идентификационный номер по CAS 130929-57-6.
Поскольку эти соединения являются лекарственными средствами, которые были одобрены для медицинского применения при лечении болезни Паркинсона Управлением по контролю качества продуктов питания и лекарственных средств (FDA) и Европейским агентством по лекарственным средствам (EMA) в 1998 году, биодоступность и профиль безопасности толкапона и энтакапона были изучены в нескольких клинических испытаниях. Соответственно, эти соединения обладают приемлемым профилем безопасности для применения у человека и хорошей биодоступностью. Их профиль безопасности в сочетании с их высокой ингибиторной активностью в отношении образования фибрилл из TTR делает ингибиторы COMT весьма многообещающими лекарственными средствами для предупреждения и/или лечения TTR-ассоциированного амилоидоза.
Кроме того, поскольку эти соединения уже были подвергнуты клиническим испытаниям в отношении лечения заболевания человека, клиническая проверка обоснованности концепции сопряжена с меньшими рисками (и более быстрая) в том, что касается осуществления, по сравнению с классической разработкой новых химических объектов. В этом смысле важно подчеркнуть, что значительно меньше исследований необходимо проводить на людях и животных, что, как следствие, предполагает более низкие затраты на разработку и, что более важно, уменьшение страданий людей и животных.
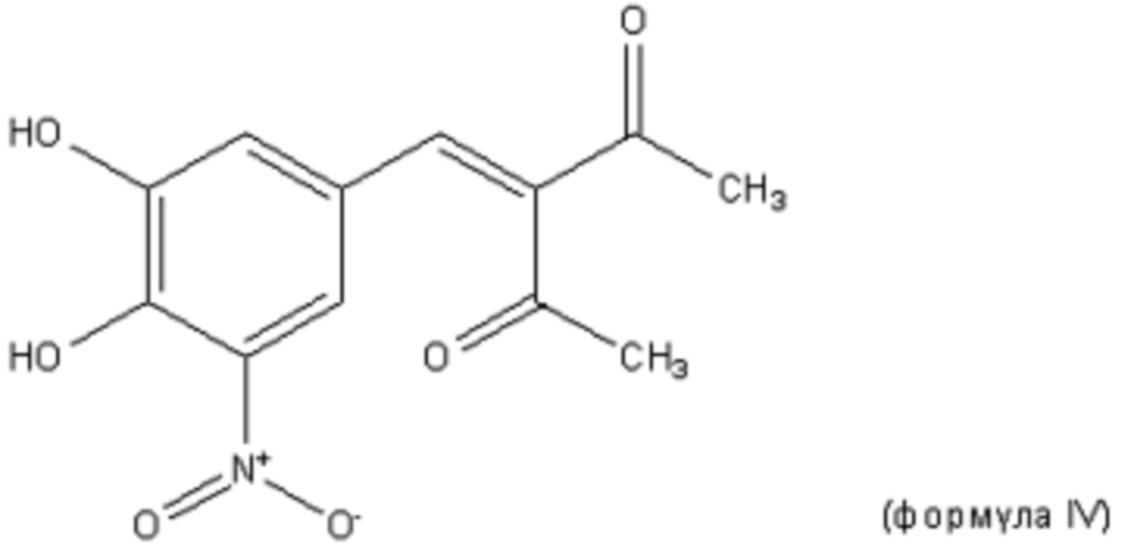
В другом варианте осуществления первого аспекта настоящего изобретения ингибитор COMT представляет собой нитекапон или его фармацевтически приемлемую соль. Нитекапон (формула IV) представляет собой соединение с молекулярной массой 265,21. Его эмпирическая формула C12H11NO6, химическое название 3-[(3,4-дигидрокси-5-нитрофенил)метилен]-2,4-пентандион и идентификационный номер по CAS 116313-94-1.
В предпочтительном варианте осуществления настоящего изобретения TTR-ассоциированный амилоидоз представляет собой FAP. В другом варианте осуществления TTR-ассоциированный амилоидоз представляет собой сенильный системный амилоидоз. В другом варианте осуществления TTR-ассоциированный амилоидоз представляет собой семейную амилоидную кардиомиопатию. В еще одном варианте осуществления TTR-ассоциированный амилоидоз представляет собой лептоменингеальный амилоидоз.
Ингибиторы COMT, такие как те, которые определены выше, можно применять либо отдельно, либо в комбинации с другими лечебными средствами для предупреждения и/или лечения TTR-ассоциированного амилоидоза. Таким образом, во втором аспекте настоящее изобретение относится к комбинации ингибитора COMT и дополнительного лечебного средства для предупреждения и/или лечения TTR-ассоциированного амилоидоза. Этот вариант осуществления можно переформулировать как комбинация ингибитора COMT и дополнительного лечебного средства для предупреждения и/или лечения TTR-ассоциированного амилоидоза. Кроме того, частью настоящего изобретения также является способ предупреждения и/или лечения транстиретин-ассоциированного амилоидоза, который включает введение субъекту, нуждающемуся в этом, комбинации ингибитора COMT и дополнительного лечебного средства. Неограничивающими примерами дополнительных лечебных средств для применения во втором аспекте настоящего изобретения являются другой ингибитор COMT, производное бензоксазола, йододифлунизал, дифлунизал, ресвератрол, тауроурсодезоксихолевая кислота, доксоциклин и эпигаллокатехин-3-галлат (EGCG). Предпочтительно, ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения. Специалист в данной области техники поймет, что фармацевтически приемлемые соли вышеупомянутых дополнительных лечебных средств также можно применять в комбинации по второму аспекту настоящего изобретения.
В одном варианте осуществления второго аспекта настоящего изобретения предусматривается комбинация ингибитора COMT и дополнительного лечебного средства, выбранного из группы, состоящей из другого ингибитора COMT, производного бензоксазола и йододифлунизала, для применения при предупреждении и/или лечении транстиретин-ассоциированного амилоидоза. Предпочтительно, ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения.
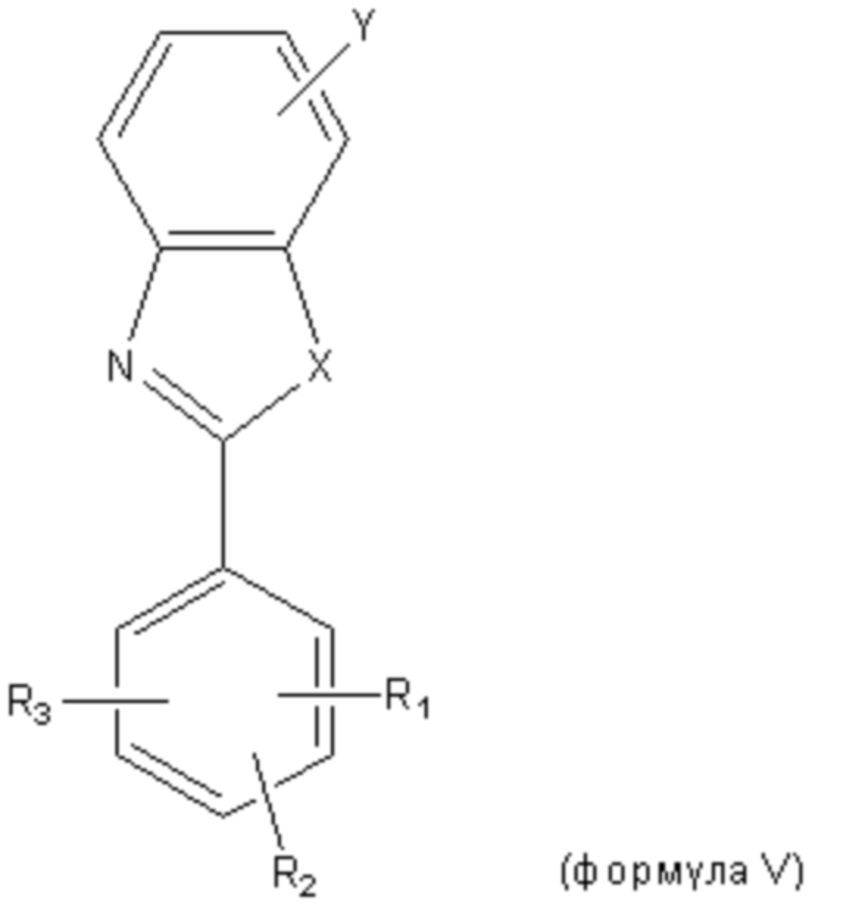
Производные бензоксазола раскрыты в международной патентной заявке WO2005113523 как соединения, которые стабилизируют нативное состояние TTR, тем самым ингибируя неправильное сворачивание белка. В одном варианте осуществления второго аспекта настоящего изобретения производные бензоксазола представляют собой соединения формулы V,
или их фармацевтически приемлемую соль, где
Y представляет собой COOR, тетразолил, CONHOR, B(OH)2 или OR;
X представляет собой O; и
каждый из R1, R2 и R3 независимо выбран из водорода, галогена, OR, B(OH)2 или CF3, и
при этом R представляет собой водород, C1-C6алкил, C1-C6алкенил, C1-C6алкинил, C1-C6циклоалкил, C1-C6гетероциклил, фенил, ксилил, нафтил, тиенил, индолил или пиридил.
В конкретном варианте осуществления второго аспекта настоящего изобретения ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения, и дополнительное лечебное средство представляет собой производное бензоксазола формулы V или его фармацевтически приемлемую соль, как определено выше.
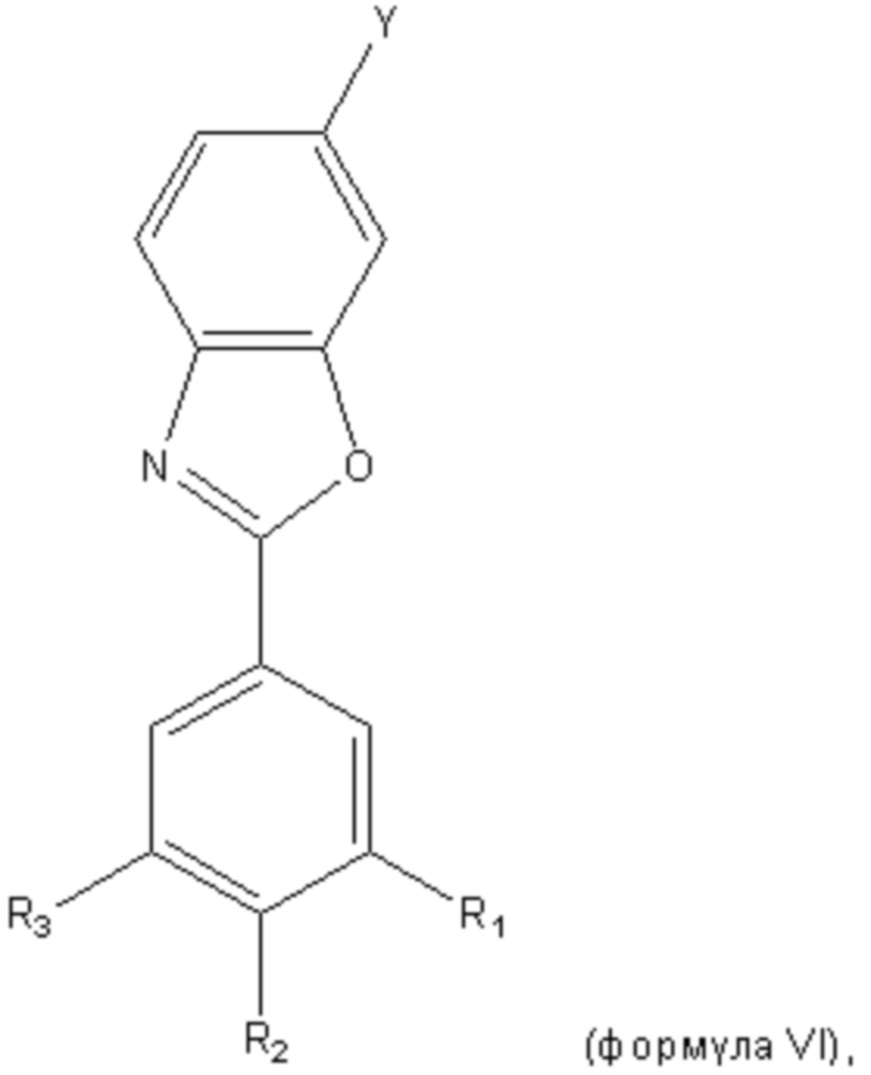
В другом варианте осуществления второго аспекта настоящего изобретения производное бензоксазола представляет собой соединение формулы VI,
или его фармацевтически приемлемую соль, где
Y представляет собой COOH или OH; и
каждый из R1, R2 и R3 независимо выбран из водорода, галогена, OH, B(OH)2 или CF3.
В конкретном варианте осуществления ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения, и дополнительное лечебное средство представляет собой производное бензоксазола формулы VI или его фармацевтически приемлемую соль, как определено выше.
В другом варианте осуществления производное бензоксазола представляет собой тафамидис. В конкретном варианте осуществления ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения, и дополнительное лечебное средство представляет собой тафамидис. В другом конкретном варианте осуществления ингибитор COMT представляет собой толкапон или его фармацевтически приемлемую соль, и дополнительное лечебное средство представляет собой тафамидис.
В другом варианте осуществления второго аспекта настоящего изобретения дополнительное лечебное средство представляет собой йододифлунизал. В конкретном варианте осуществления ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения, и дополнительное лечебное средство представляет собой йододифлунизал. В другом конкретном варианте осуществления ингибитор COMT представляет собой толкапон или его фармацевтически приемлемую соль, и дополнительное лечебное средство представляет собой йододифлунизал.
В другом конкретном варианте осуществления ингибитор COMT объединяют с другим ингибитором COMT. Предпочтительно, ингибиторы COMT представляют собой нитрокатехоловые соединения формулы I или их фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения. Например, настоящее изобретение предусматривает комбинацию толкапона и энтакапона для предупреждения и/или лечения TTR-ассоциированного амилоидоза.
В дополнительном варианте осуществления второго аспекта настоящего изобретения предусматривается комбинация ингибитора COMT и дополнительного лечебного средства, выбранного из группы, состоящей из дифлунизала, ресвератрола, тауроурсодезоксихолевой кислоты, доксоциклина и EGCG, для применения при предупреждении и/или лечении TTR-ассоциированного амилоидоза. EGCG представляет собой основной и самый важный полифенол в зеленом чае. В контексте настоящего изобретения EGCG может применяться как выделенное соединение или входить в состав растительного экстракта, в частности, экстракта чая. Предпочтительно, ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения. Более предпочтительно, ингибитор COMT представляет собой толкапон или его фармацевтически приемлемую соль. Конкретный вариант осуществления предусматривает комбинацию толкапона или его фармацевтически приемлемой соли и EGCG для применения при предупреждении и/или лечении TTR-ассоциированного амилоидоза.
Специалистам в данной области техники будет очевидно, что комбинация по настоящему изобретению является эффективной не только тогда, когда активные ингредиенты применяют в одной композиции, но также при применении их в двух различных композициях, которые вводятся либо одновременно, либо последовательно, либо отдельно после определенного периода времени. Более того, специалисты в данной области поймут, что ингибитор COMT могут прописывать для применения вместе с другим активным ингредиентом в комбинированной терапии для предупреждения и/или лечения транстиретин-ассоциированного амилоидоза и наоборот.
Таким образом, третий аспект настоящего изобретения предусматривает ингибитор COMT для применения при предупреждении и/или лечении транстиретин-ассоциированного амилоидоза в комбинированной терапии с дополнительным лечебным средством. Этот вариант осуществления можно переформулировать как применение ингибитора COMT для получения лекарственного препарата для предупреждения и/или лечения транстиретин-ассоциированного амилоидоза в комбинированной терапии с дополнительным лечебным средством. Частью настоящего изобретения также является способ предупреждения и/или лечения транстиретин-ассоциированного амилоидоза, который включает введение субъекту, нуждающемуся в этом, ингибитора COMT в комбинации с дополнительным лечебным средством.
Неограничивающими примерами дополнительных лечебных средств для применения в третьем аспекте настоящего изобретения являются другой ингибитор COMT, производное бензоксазола, йододифлунизал, дифлунизал, ресвератрол, тауроурсодезоксихолевая кислота, доксоциклин и EGCG. Предпочтительно, ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения. Специалист в данной области техники поймет, что фармацевтически приемлемые соли вышеупомянутых дополнительных лечебных средств также можно применять в комбинированной терапии по третьему аспекту настоящего изобретения.
В одном варианте осуществления третьего аспекта настоящего изобретения предусматривается ингибитор COMT для применения при предупреждении и/или лечении транстиретин-ассоциированного амилоидоза в комбинированной терапии с дополнительным лечебным средством, выбранным из группы, состоящей из другого ингибитора COMT, производного бензоксазола и йододифлунизала. Предпочтительно, ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения.
В конкретном варианте осуществления третьего аспекта настоящего изобретения дополнительное лечебное средство представляет собой другой ингибитор COMT. Предпочтительно, ингибиторы COMT представляют собой нитрокатехоловые соединения формулы I или их фармацевтически приемлемые соли, как определено для первого аспекта настоящего изобретения. Например, настоящее изобретение предусматривает толкапон для предупреждения и/или лечения TTR-ассоциированного амилоидоза в комбинации с энтакапоном. В другом конкретном варианте осуществления дополнительное лечебное средство представляет собой производное бензоксазола. Предпочтительно, указанное производное бензоксазола представляет собой соединение формулы V или VI или его фармацевтически приемлемые соли, как определено для второго аспекта настоящего изобретения. Например, настоящее изобретение предусматривает ингибитор COMT для предупреждения и/или лечения TTR-ассоциированного амилоидоза в комбинации с тафамидисом. Предпочтительно, ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения. Более предпочтительно, ингибитор COMT представляет собой толкапон или его фармацевтически приемлемую соль. Таким образом, настоящее изобретение предусматривает толкапон для предупреждения и/или лечения TTR-ассоциированного амилоидоза в комбинации с тафамидисом. В еще одном варианте осуществления дополнительное лечебное средство представляет собой йододифлунизал. В еще одном варианте осуществления дополнительное лечебное средство представляет собой йододифлунизал, и ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения. Настоящее изобретение, таким образом, предусматривает толкапон или его фармацевтически приемлемую соль для предупреждения и/или лечения TTR-ассоциированного амилоидоза в комбинации с йододифлунизалом.
В дополнительном варианте осуществления третьего аспекта настоящего изобретения предусматривается ингибитор COMT для применения при предупреждении и/или лечении транстиретин-ассоциированного амилоидоза в комбинированной терапии с дополнительным лечебным средством, выбранным из группы, состоящей из дифлунизала, ресвератрола, тауроурсодезоксихолевой кислоты, доксоциклина и EGCG, для применения при предупреждении и/или лечении TTR-ассоциированного амилоидоза. Предпочтительно, ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения. Более предпочтительно, ингибитор COMT представляет собой толкапон или его фармацевтически приемлемую соль. В конкретном варианте осуществления настоящее изобретение предусматривает толкапон или его фармацевтически приемлемую соль для применения при предупреждении и/или лечении транстиретин-ассоциированного амилоидоза в комбинированной терапии с EGCG.
Четвертый аспект настоящего изобретения предусматривает лечебное средство, выбранное из группы, состоящей из производного бензоксазола, йододифлунизала, дифлунизала, ресвератрола, тауроурсодезоксихолевой кислоты, доксоциклина и EGCG, для применения при предупреждении и/или лечении транстиретин-ассоциированного амилоидоза в комбинированной терапии с ингибитором COMT. Предпочтительно, ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения. Специалист в данной области техники будет понимать, что фармацевтически приемлемые соли вышеупомянутых лечебных средств также можно применять в комбинированной терапии по четвертому аспекту настоящего изобретения.
В одном варианте осуществления четвертого аспекта настоящего изобретения предусматривается лечебное средство, выбранное из группы, состоящей из производного бензоксазола и йододифлунизала, для применения при предупреждении и/или лечении транстиретин-ассоциированного амилоидоза в комбинированной терапии с ингибитором COMT. Предпочтительно, ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения.
В конкретном варианте осуществления четвертого аспекта настоящего изобретения лечебное средство представляет собой производное бензоксазола. Предпочтительно, указанное производное бензоксазола представляет собой соединение формулы V или VI или его фармацевтические соли, как определено для второго аспекта настоящего изобретения. Например, настоящее изобретение предусматривает тафамидис для предупреждения и/или лечения TTR-ассоциированного амилоидоза в комбинации с ингибитором COMT. Предпочтительно, ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено в отношении первого аспекта настоящего изобретения. Более предпочтительно, ингибитор COMT представляет собой толкапон или его фармацевтически приемлемую соль. Таким образом, настоящее изобретение предусматривает тафамидис для предупреждения и/или лечения TTR-ассоциированного амилоидоза в комбинации с толкапоном или его фармацевтически приемлемой солью. В еще одном варианте осуществления лечебное средство представляет собой йододифлунизал. В еще одном варианте осуществления дополнительное лечебное средство представляет собой йододифлунизал, и ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения. Настоящее изобретение предусматривает йододифлунизал для предупреждения и/или лечения TTR-ассоциированного амилоидоза в комбинации с толкапоном или его фармацевтически приемлемой солью.
В дополнительном варианте осуществления четвертого аспекта настоящего изобретения предусматривается лечебное средство, выбранное из группы, состоящей из дифлунизала, ресвератрола, тауроурсодезоксихолевой кислоты, доксоциклина и EGCG, для применения при предупреждении и/или лечении транстиретин-ассоциированного амилоидоза в комбинированной терапии с ингибитором COMT. Предпочтительно, ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения. Более предпочтительно, ингибитор COMT представляет собой толкапон или его фармацевтически приемлемую соль. Конкретный вариант осуществления предусматривает EGCG для применения при предупреждении и/или лечении TTR-ассоциированного амилоидоза в комбинированной терапии с толкапоном или его фармацевтически приемлемой солью.
Дополнительно, ингибитор COMT можно применять в качестве дополнительного лечения перед и/или после пересадки печени у пациента с TTR-ассоциированным амилоидозом. Предпочтительно, указанный ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения.
Настоящее изобретение также предусматривает фармацевтическую композицию, содержащую терапевтически эффективное количество ингибитора COMT вместе с фармацевтически приемлемыми наполнителями и/или носителями, для предупреждения и/или лечения TTR-ассоциированного амилоидоза. Предпочтительно, указанный ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения.
Выражение "терапевтически эффективное количество", также называемое “дозой”, относится к количеству соединения, которое, при введении, является достаточным для предупреждения развития или облегчения, в какой-то степени, одного или нескольких симптомов заболевания, на которое направлено лечение. Конкретную дозу соединения, которую вводят в соответствии с данным изобретением, будут определять по конкретным обстоятельствам, связанным со случаем, в том числе вводимому соединению, пути введения, конкретному состоянию, подлежащему лечению, и подобным факторам.
Выражение "фармацевтически приемлемые наполнители и/или носители" относится к фармацевтически приемлемым материалам, композициям или средам. Каждый компонент должен быть фармацевтически приемлемым, в том смысле, что он является совместимым с другими ингредиентами фармацевтической композиции. Он также должен подходить для применения в контакте с тканью или органом людей и животных без чрезмерной токсичности, раздражения, аллергического ответа, иммуногенности или других проблем или осложнений, сопоставимых с целесообразным соотношением польза/риск.
Любую фармацевтически приемлемую соль ингибитора COMT можно применять для целей настоящего изобретения. Термин “фармацевтически приемлемая соль” относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований. Предпочтительно, соль представляет собой соль щелочного или щелочноземельного металла.
В одном варианте осуществления настоящего изобретения ингибитор COMT вводят пациенту в пероральной единичной лекарственной форме. Лекарственные формы включают твердые лекарственные формы, как таблетки, порошки, капсулы, пакетики, а также жидкие сиропы, суспензии и эликсиры. Ингибиторы COMT и наполнители можно составлять в композиции и лекарственные формы в соответствии со способами, известными в данной области техники. В конкретном варианте осуществления ингибитор COMT вводят в виде таблетки, драже или капсулы. Однако ингибиторы COMT также можно вводить пациенту в качестве ингредиента инъекционных лекарственных форм. Инъекционные лекарственные формы могут включать жидкости для внутрикожной, внутривенной, внутримышечной или подкожной инъекции, растворы для перфузии, порошок для восстановления жидких инъекционных препаратов и предварительно заполненные шприцы. В контексте настоящего изобретения отвечающим требованиям также может быть составление ингибитора COMT для интраназального или ингаляционного введения, или для местного нанесения в форме, например, крема, геля, мази или кожного пластыря. Способы получения этих составов известны в данной области техники. Кроме того, ингибитор COMT можно составлять в виде лекарственной формы с контролируемым высвобождением. Лекарственные формы с контролируемым высвобождением известны в данной области техники и, в частности, желательны для лечения хронических заболеваний или для введения активных средств, которые могут быть токсичными при высоких дозах или которые демонстрируют низкий период полувыведения при введении пациенту. Предпочтительно, ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения.
Как упомянуто выше, терапевтически эффективное количество (или доза) ингибитора COMT, в контексте настоящего изобретения, представляет собой количество указанного соединения, которое достаточно для предупреждения или облегчения, в некоторой степени, одного или нескольких симптомов TTR-ассоциированного амилоидоза. Например, эффективная ежедневная доза толкапона для применения у человека может находиться в диапазоне от 20 до 600 мг, а эффективная ежедневная доза энтакапона для применения у человека может находиться в диапазоне от 1600 до 2000 мг.
Таким образом, доза ингибитора COMT, подлежащего введению, может составлять от 0,1 до 16000 мг/день, или от 0,1 до 12000 мг/день, или от 0,1 до 10000 мг/день, или от 0,1 до 5000 мг/день, или от 0,1 до 3000 мг/день. В конкретном варианте осуществления доза ингибитора COMT, подлежащего введению, составляет от 1 до 3000 мг/день. В другом варианте осуществления доза составляет от 1 до 2000 мг/день. Предпочтительно, ингибитор COMT представляет собой нитрокатехоловое соединение формулы I или его фармацевтически приемлемую соль, как определено для первого аспекта настоящего изобретения.
На протяжении всего описания и формулы изобретения подразумевается, что слово "содержит" и вариации этого слова не исключают других технических характеристик, добавок, компонентов или этапов. Дополнительные объекты, преимущества и особенности настоящего изобретения будут очевидны для специалистов в данной области техники при изучении описания или могут выясняться при осуществлении настоящего изобретения на практике. Следующие примеры представлены для иллюстрации, и они не предназначены для ограничения настоящего изобретения. Более того, настоящее изобретение охватывает все возможные комбинации конкретных и предпочтительных вариантов осуществления, описанных в данном документе.
КРАТКОЕ ОПИСАНИЕ ФИГУР
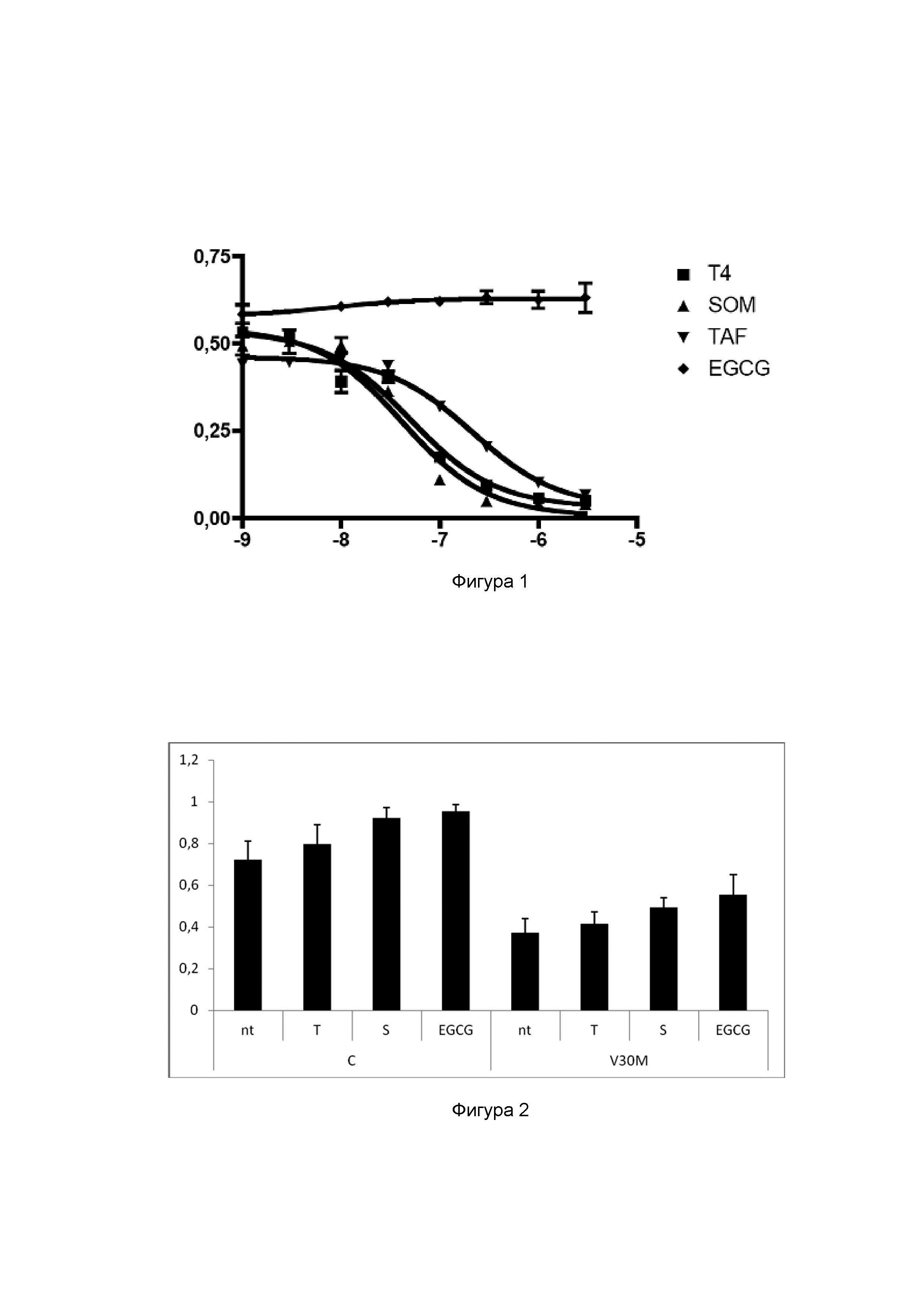
Фигура 1. Анализ конкуренции с T4 за связывание с TTR дикого типа (WT) с помощью гель-фильтрации: кривые вытеснения T4 от TTR WT с помощью различных соединений. Y-ось: количество T4, связавшегося с TTR/общее количество T4; X-ось: log10 концентрации соединения (молярные единицы). Значения соответствуют типичному эксперименту, проведенному в двух повторностях, представлены как среднее +/- стандартное отклонение. Тестовые соединения: тироксин (T4), толкапон (SOM), тафамидис (TAF) и (-)-эпигаллокатехин-3-галлат (EGCG).
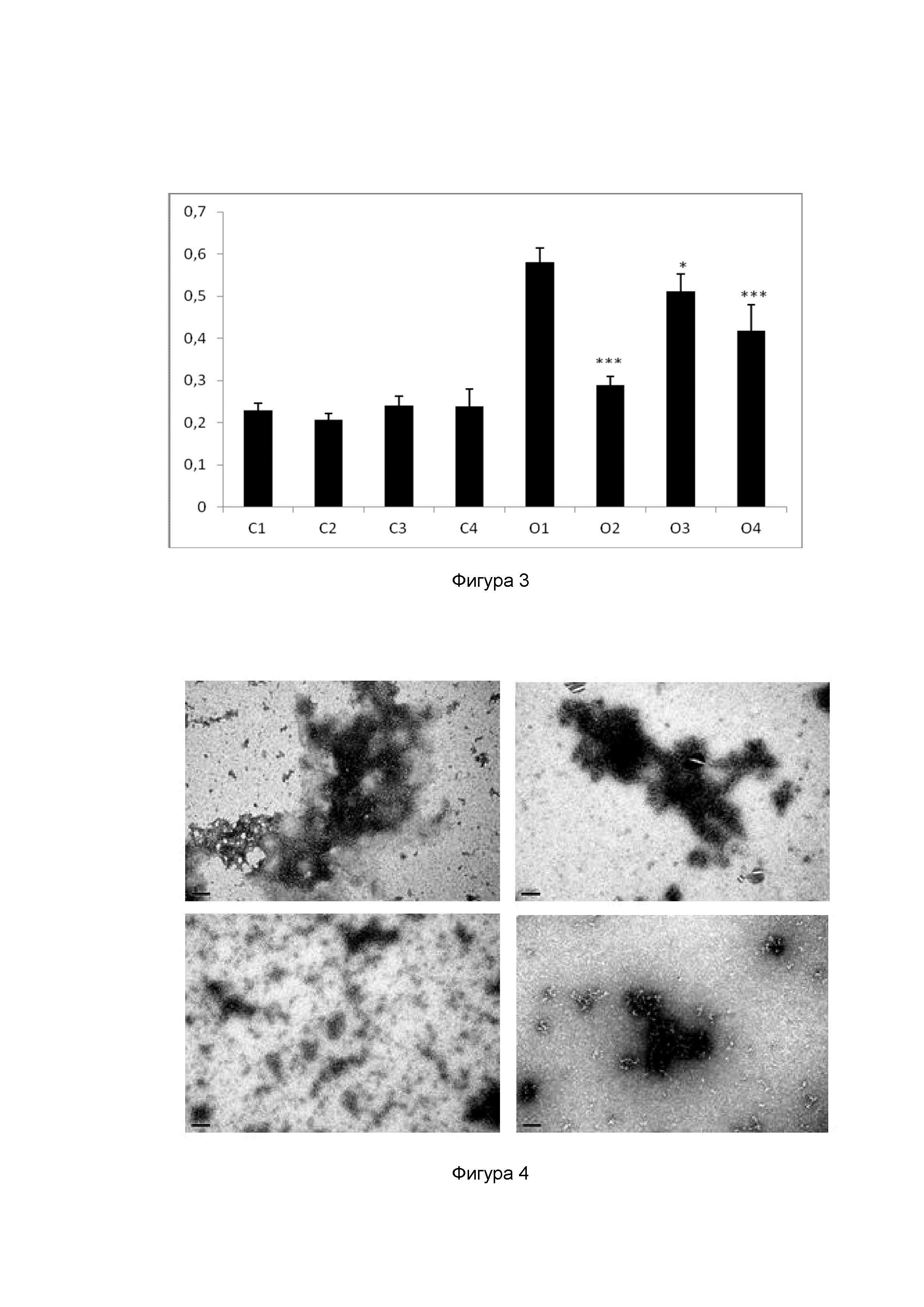
Фигура 2. Стабильность тетрамеров TTR в присутствии различных соединений с помощью IEF: плазму от контрольных индивидуумов (C) и от пациентов с семейной амилоидной полинейропатией, несущих мутацию V30M (V30M), обрабатывали тестовыми соединениями тафамидис (T); толкапон (S); эпигаллокатехин-3-галлат (EGCG) или оставляли необработанной (nt); и подвергали IEF при полуденатурирующих условиях, как описано в тексте. Соотношение тетрамер TTR/общее TTR для каждого состояния рассчитывали и представляли как среднее +/- sem (стандартная ошибка среднего).
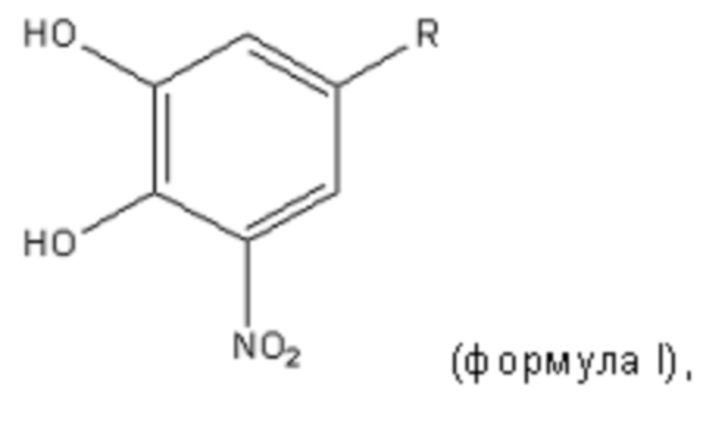
Фигура 3. Активация каспазы-3. Клетки шванномы крысы (клеточная линия RN22) инкубировали 24 ч. в отсутствие или в присутствии олигомеров TTR Y78F, полученных в отсутствие или в присутствии тестируемых соединений (из расчета 20 мкМ). Активацию каспазы-3 измеряли в клеточных лизатах и выражали как флуоресценция/содержание белка. Образцы: контрольные клетки (C1); клетки, обработанные EGCG (C2); клетки, обработанные тафамидисом (C3); клетки, обработанные толкапоном (C4); контрольные клетки, обработанные олигомером, полученным в отсутствие соединений (O1); клетки, обработанные олигомером, полученным в присутствии EGCG (O2); клетки, обработанные олигомером, полученным в присутствии тафамидиса (O3); клетки, обработанные олигомером, полученным в присутствии толкапона (O4). Результаты представляют собой среднее значение 4 повторностей и стандартное отклонение. Значимые отличия относительно контроля O1 рассчитывали с помощью T-критерия Стьюдента: *: P<0,05; ***: P<0,005.
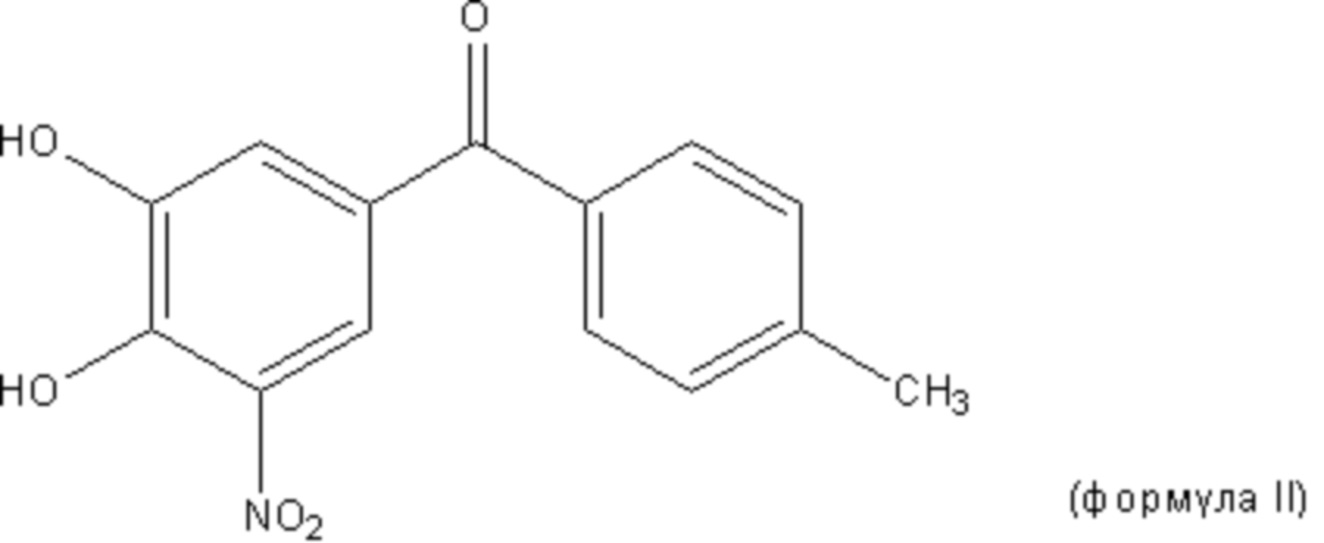
Фигура 4. Анализ при помощи трансмиссионной электронной микроскопии предварительно образованной фибриллы из TTR после 4 дней инкубации с различными соединениями из расчета 36 мкМ. Сверху слева, по часовой стрелке: контроль, тафамидис, EGCG, толкапон.
ПРИМЕРЫ
Пример 1: Кинетический анализ помутнения
Материалы
Рекомбинантный белок Y78F TTR, который представляет собой высокоамилоидoгенную вариацию человеческого TTR Tyr78Phe, получали, как описано в Dolado et al (Dolado I, Nieto J, Saraiva MJ, Arsequell G, Valencia G, Planas A. “Kinetic Assay for High-Throughput Screening of In Vitro Transthyretin Amyloid Fibrillogenesis Inhibitors”. J. Comb. Chem., 2005, vol. 7, p. 246-252).
Толкапон получали от Santa Cruz Biotechnology, Inc. Йододифлунизал получали из дифлунизала (Sigma) с помощью реакции с бис(пиридин)иодония тетрафторборатом (IPy2BF4), как описано Barluenga et al (Barluenga J, González JM, García-Martín MA, Campos PJ, Asensio G. "An expeditious and general aromatic iodination procedure. J Chem Soc Chem Commun, 1992, vol. 14, p. 1016-1017). Тафамидис можно получать с помощью способов, раскрытых в международной патентной заявке WO2005113523. Основные растворы соединений, анализируемых в качестве ингибиторов, растворяли в DMSO (степень чистоты для спектрофотометрии от Sigma) из расчета концентрации 1,5 мМ. Рабочие растворы получали путем разведения основного раствора 1:4 в H2O/DMSO (2:1). Во всех случаях, концентрацию DMSO доводили до 5% (объем/объем) в конечной реакционной смеси для анализа.
Методики
Анализ проводили согласно методике, описанной у Dolado et al. (выше). Анализ включал две стадии, первую стадию, на которой белок Y78F инкубировали вместе с ингибитором в течение 30 минут, и вторую стадию, на которой путем изменения pH индуцировали образование фибрилл и измеряли поглощение в течение 1,5 ч. Кратко, анализ проводили следующим образом.
Сначала получали следующие растворы: основной раствор белка Y78F: 4 мг/мл в 20 мМ фосфате, 100 мМ KCl, pH 7,6. Буфер для инкубации: 10 мМ фосфат, 100 мМ KCl, 1 мМ EDTA, pH 7,6. Буфер для разведения: 400 мМ ацетат натрия, 100 мМ KCl, 1 мМ EDTA, pH 4,2.
Для каждого ингибитора действовали в соответствии со следующим протоколом: точную концентрацию белка в основном растворе определяли с помощью Abs280, и в соответствии с этим значением рассчитывали объем основного раствора Y78F, который добавляли для получения конечной концентрации белка в лунке 0,4 мг/мл, и распределяли его в 6 лунок 96-луночного микропланшета. Различные объемы рабочего раствора ингибитора добавляли для получения конечных концентраций в диапазоне от 0 до 40 мкМ, и конечное содержание DMSO в каждой лунке доводили до 5% путем добавления соответствующего объема раствора H2O/DMSO (1:1). Затем добавляли буфер для инкубации до объема 100 мкл. Планшет инкубировали при 37°C в термостатированном планшет-ридере с орбитальным встряхиванием по 15 с каждую минуту в течение 30 мин. В каждую лунку распределяли 100 мкл порцию буфера для разведения, и смесь инкубировали при 37°C со встряхиванием (по 15 с каждую минуту) в планшет-ридере. Поглощение при 340 нм отслеживали в течение 1,5 ч. с интервалами в 1 минуту. Данные собирали и анализировали с применением программного обеспечения Microsoft Excel. Все анализы осуществляли в двух повторностях.
Анализ результатов
После завершения общей процедуры, указанной выше, получали кривые зависимости от времени, на основании которых рассчитывали первоначальные скорости образования фибрилл (V0), как углы наклона линейного увеличения поглощения. При нанесении на график первоначальных скоростей против концентрации ингибитора в случае всех анализируемых ингибиторов наблюдали экспоненциальное затухание. По данным подбирали уравнение (1):
V0 = A + B*e-C[I] (1),
где V0 представляет собой первоначальную скорость образования фибрилл (в единицах поглощения в час, Abs*h-1), и [I] представляет собой концентрацию ингибитора (мкМ). Подгоняемые параметры представляют собой A (Abs*h-1), скорость остаточной агрегации при высокой концентрации ингибитора; B (Abs*h-1), амплитуда или максимальное снижение первоначальной скорости образования фибрилл; и C (мкМ-1), экспоненциальная константа. A + B равняется первоначальной скорости образования фибрилл в условиях анализа в отсутствие ингибитора.
Следующие параметры подсчитывали для оценки активности соединения как ингибитора образования фибрилл. IC50: концентрация ингибитора, при которой первоначальная скорость образования фибрилл составляет половину таковой без ингибитора. RA(%) = 100*B/(A + B): процентное снижение скорости образования фибрилл при высокой концентрации ингибитора по сравнению со скоростью при [I] = 0. Результаты оценки ингибиторных свойств анализируемых соединений обобщены в таблице 1.
Таблица 1. Значения IC50 и процента снижения амилоидоза (RA) для ингибиторов образования фибрилл из TTR
При помощи вышеуказанных результатов можно наблюдать, что толкапон представляет собой эффективный ингибитор образования фибрилл из TTR, поскольку он демонстрирует низкую IC50 и высокий RA. На основании значений IC50 толкапон имеет способность к ингибированию, аналогичную йододифлунизалу, о котором сообщалось как об одном из наиболее сильных ингибиторов образования фибрилл из TTR in vitro. Кроме того, на основании IC50, толкапон более эффективен, чем тафамидис, поскольку он демонстрирует IC50 в четыре раза ниже, чем у тафамидиса. Эти результаты показывают, что толкапон представляет собой многообещающее лекарственное средство в отношении TTR-связанного амилоидоза, такого как FAP, семейная амилоидная кардиомиопатия, сенильный системный амилоидоз и лептоменингеальный амилоидоз.
Пример 2: Конечный анализ помутнения с мутантным вариантом TTR, вызывающим семейную амилоидную кардиомиопатию
Материалы
Рекомбинантный белок V122I TTR, который представляет собой амилоидoгенную вариацию человеческого TTR, ассоциированную с семейной амилоидной кардиомиопатией (FAC), получали в соответствии с такой же процедурой, как описано для варианта Y78F, применяемого в примере 1. Плазмидную ДНК, экспрессирующую мутант V122I, получали с помощью сайт-направленного мутагенеза, как сообщали для Y78F у Dolado et al. (выше), но с применением следующих праймеров: 5'-GGATTGGTGATGACAGCCGT-3' и 5'-ACGGCTGTCATCACCAATCC-3'. Толкапон и йододифлунизал получали, как описано в примере 1.
Методики
Данный анализ применяли для вариантов TTR с более низкой амилоидогенностью, чем у варианта Y78F, когда кинетический анализ помутнения являлся недостаточно чувствительным для точных измерений. Методика, в соответствии с которой тестировали ингибиторы с помощью данного конечного анализа в 72 ч., описан у Dolado et al, (выше). V122I TTR инкубировали с ингибитором при таких же условиях, как описаны выше для кинетического анализа помутнения (пример 1), с применением белка V122I с концентрацией 0,4 мг/мл и трех различных концентраций ингибитора: 3,6, 7,2 и 21,8 мкМ, которые соответствуют 0,5x[белок], 1x[белок] и 3x[белок]. После индукции кислотой (добавления буфера для разведения) образцы инкубировали без встряхивания в течение 72 ч. при 37°C и затем гомогенизировали путем перемешивания для ресуспендирования всех присутствующих фибрилл. Помутнение измеряли при 340 нм и нормализовали относительно амилоидoгенеза в отсутствие ингибитора.
Результат
Ингибиторную активность тестируемых соединений оценивали как процент снижения поглощения образцов, содержащих ингибитор, при сравнении с контрольными образцами, не содержащими ингибитор.
Таблица 2. Значения % уменьшения фибрилл для ингибиторов образования фибрилл из V122I TTR
% уменьшения фибрилл=100 x (1- помутнение образца/помутнение холостой пробы), где помутнение образца представляет собой помутнение, измеренное в присутствии ингибитора, и помутнение холостой пробы представляет собой таковое в отсутствие ингибитора.
Вышеприведенные результаты показывают, что толкапон эффективно ингибирует образование фибрилл мутантным V122I ATTR даже при молярном соотношении ингибитор:белок 1:2 (0,5x[белок]). На основании этих значений толкапон имеет способность к ингибированию, аналогичную йододифлунизалу. Эти результаты показывают, что толкапон является многообещающим лекарственным средством в отношении TTR-связанного амилоидоза, в том числе семейной амилоидной кардиомиопатии, которая в основном вызывается мутацией V122I.
Примеры 3-6
Материалы для примеров 3-6
Толкапон и тафамидис получали, как описано в примере 1. Эпигаллокатехин-3-галлат (EGCG, № по CAS 989-51-5) приобретали у Cayman Chemicals (# 70935). Рекомбинантные варианты TTR дикого типа (TTR WT), TTR Y78F и TTR L55P получали в бактериальной системе экспрессии с применением Escherichia coli BL21. Рекомбинантные TTR выделяли и очищали, как описано ранее (Ferreira et al, 2009, FEBS Lett, vol. 583, p. 3569-76). Цельную кровь от гетерозиготных носителей TTR V30M и от контрольных индивидуумов получали из коллекции образцов, доступных в Molecular Neurobiology Group, IBMC (Университет Порту). Образцы крови были собраны в присутствии EDTA, и их центрифугировали для отделения плазмы. Образцы плазмы держали замороженными при -20°C.
Пример 3: Анализ конкуренции с тироксином (T4) за связывание с TTR дикого типа (WT) с помощью гель-фильтрации
Связывание низкомолекулярных лигандов с участками связывания для T4 на TTR может стабилизировать тетрамер TTR и замедлять диссоциацию тетрамера и амилоидoгенез in vitro. Для оценки связывания конкуренцию тестовых соединений с T4 (Sigma-Aldrich) за связывание с TTR WT оценивали количественно с помощью методики гель-фильтрации с применением постоянного количества TTR (100 мкл 60 нМ раствора), инкубируемого со следовым количеством меченного радиоактивной меткой [125I]T4 (соответствующего 50000 cpm; специфическая активность 125I- T4 1250 мкКи/мкг от Perkin-Elmer, Массачуссетс, США) и с 100 мкл раствора каждого из тестовых соединений или T4 (положительный контроль) при различных концентрациях, а именно 0, 20, 60, 200, 600, 2000, 6000 и 20000 нМ (конечная концентрация 0-10 мкМ) (Ferreira et al, 2011, FEBS Lett., vol. 585, p. 2424-30). Отрицательный контроль получали с помощью белка, а также меченного T4, а также100 мкл TNE (в отсутствие конкурента). Все растворы получали в буфере TNE (Tris 0,1 M, NaCl 0,1 M, EDTA 1 мМ). Все образцы получали в двух повторностях. Радиоактивность измеряли в каждом образце с помощью сцинтилляционного гамма-счетчика Wizard 14701, Wallac. Затем образцы инкубировали на протяжении ночи при 4°C. После инкубации T4, связавшийся с TTR, отделяли от несвязавшегося T4 путем фильтрации через колонку для гель-фильтрации P6DG (1 мл, BioRad). Радиоактивность измеряли в элюированных образцах. Результаты выражали как количество T4, связавшегося с TTR/общее количество T4 против Log общей концентрации тестовых соединений (конкурентов). По данным подбирали кривую нелинейной регрессии применительно к конкуренции за связывание по одному участку с помощью программного обеспечения GraphPad Prism с применением следующего уравнения: Y=Bottom + (Top-Bottom)/(1+10^(X-LogEC50)).
На фигуре 1 показаны результаты конкуренции с T4 за связывание с TTR дикого типа для конкурентов: тироксина (T4), толкапона (SOM), тафамидиса (TAF) и (-)-эпигаллокатехин-3-галлата (EGCG). Результаты показаны как кривые вытеснения T4 от TTR WT с помощью различных соединений. На основании каждой кривой доза-ответ определяли значение EC50 (концентрация ингибитора, при которой вытесняется половина связанного T4) для каждого соединения. Кроме того, также рассчитывали относительную активность в отношении ингибирования связывания T4, определяемую как соотношение EC50 (T4)/EC50 (тестируемого соединения), и она показана в таблице 3.
Таблица 3: EC50 и относительная активность ингибирования лекарственным средством связывания T4
Эти результаты показывают, что толкапон и тафамидис имеют аналогичную аффинность связывания с TTR, тогда как EGCG не конкурирует с T4 за связывание с TTR. EC50 толкапона была в 4 раза ниже таковой тафамидиса, что показывает, что толкапон является более эффективным при связывании тетрамера TTR, что позволяет предположить более высокий противоамилоидoгенный потенциал.
Пример 4: Оценка стабильности тетрамера TTR с помощью изоэлектрического фокусирования (IEF)
Для оценки эффекта тестируемых соединений на устойчивость тетрамера TTR к диссоциации, стабильность TTR оценивали с помощью IEF в полуденатурирующих условиях, как описано ранее (Ferreira et al, 2009, FEBS Lett, vol. 583, p. 3569-76). Образцы получали следующим образом: 30 мкл человеческой плазмы от контрольных индивидуумов и носителей TTR V30M инкубировали с 5 мкл 10 мМ раствора тестовых соединений и контрольных (EGCG) соединений на протяжении ночи при 4°C с последующей инкубацией при RT в течение 1 ч. Препараты подвергали нативного PAGE (5% акриламид) и полоску геля, содержащую TTR, вырезали и наносили на гель для IEF (5% акриламид). IEF проводили в полуденатурирующих условиях (4 M мочевина) при содержании 5% (объем/объем) амфолитов с pH 4-6,5 (GE Healthcare), при 1200 В в течение 6 часов. Белки окрашивали Кумасси голубым, гели сканировали и подвергали измерению оптической плотности с применением программы ImageQuant (HP Scanjet 4470c, Hewlett Packard). В отсутствие какого-либо соединения TTR плазмы имеет характерный паттерн полосок, образованный мономером, окисленным мономером и несколькими полосками с более низкой изоэлектрической точкой (pI), соответствующими различным формам тетрамеров. Всего 12 образцов плазмы (5 от контрольных индивидуумов и 7 от носителей TTR V30M) анализировали в 3 гелях для IEF. Для каждого условия обработки обрабатывали минимум по 4 образца от различных доноров. Соотношение тетрамера TTR к общему количеству TTR (тетрамер TTR + мономер) рассчитывали для каждого образца плазмы и представили на фигуре 2. Это соотношение в норме выше в плазме от нормальных индивидуумов, чем в плазме от гетерозиготных носителей TTR V30M, как видно на фигуре 2. Обработка толкапоном повышает количество тетрамера TTR относительно мономерных форм по сравнению с необработанными контрольными образцами плазмы как в случае нормального, так и мутантного TTR; и в большей степени, чем тафамидис.
Повышение соотношения тетрамер/общее количество TTR, индуцированное путем обработки тестовыми соединениями, объединяли для всех образцов и представили в таблице 4 как % стабилизации. Эти значения рассчитывали после нормализации соотношения тетрамер/общее количество TTR, полученного для каждого образца, с соотношением, полученным для необработанной плазмы соответствующего индивидуального донора, как описано ниже:
% стабилизации=100x((соотношение образца - соотношение nt)/ соотношение nt). При этом “соотношение образца” представляет собой соотношение тетрамер/общее количество TTR в присутствии соединения; а “соотношение nt” представляет собой соотношение тетрамер/общее количество TTR необработанной плазмы от того же донора.
Таблица 4. Стабильность тетрамера TTR в присутствии соединений
Обработка стабилизатором TTR, таким как тафамидис или толкапон, повышает соотношение тетрамера к мономерным формам. Результаты, показанные выше, явно демонстрируют, что толкапон обеспечивает лучший эффект стабилизации на тетрамеры TTR, чем тафамидис.
Пример 5: Анализы клеточной токсичности
Для оценки TTR-индуцированной цитотоксичности и профилактического эффекта тестируемых соединений клетки шванномы крысы (RN22, полученные из Американской коллекции типовых культур ATCC), клетки с 80% конфлюентностью в минимальной питательной среде Дульбекко с 10% фетальной бычьей сывороткой, в течение 24 часов подвергали воздействию 2 мкМ олигомеров TTR Y78F. Эти олигомеры получали путем инкубации растворимого TTR Y78F либо в отсутствие, либо в присутствии 10x молярного избытка (конечная концентрация составляет 20 мкМ) тестовых соединений или контроля (EGCG) при 37°C в течение 6 дней. Затем клетки трипсинизировали и клеточные лизаты применяли для определения активации каспазы-3 с помощью флуориметрической аналитической системы CaspACE на основе 96-луночного планшета (Sigma). Концентрацию белка в лизатах определяли с помощью набора для анализа белка Bio-Rad.
Результаты, полученные в отношении активности каспазы-3 и количественного определения белка в каждой лунке с клеточной культурой, представлены на фигуре 3. Внеклеточное добавление необработанных олигомеров TTR Y78F (контроль, O1) приводило к повышению внутриклеточных уровней каспазы-3, и, таким образом, гибель клеток. Олигомеры TTR Y78F, полученные в присутствии соединений, которые ингибируют образование токсических разновидностей олигомеров (O2-O4), приводили к более низким уровням активации каспазы-3 в клетках RN22. Снижение клеточной токсичности в присутствии соединений (выраженное как 100 - % относительно контроля O1) показано в таблице 5. Можно наблюдать, что толкапон демонстрировал большее снижение клеточной токсичности (29%) по сравнению с тафамидисом (12%).
Таблица 5. Снижение клеточной токсичности в присутствии соединений
Пример 6: Дезинтеграция фибрилл
Для изучения эффекта тестовых соединений на дезинтеграцию фибрилл из TTR применяли предварительно образованные фибриллы из TTR, полученные путем инкубации профильтрованного (через 0,2 мкм фильтры) раствора TTR L55P (2 мг/мл в PBS ≈ 3,6 мкМ) в течение 15 дней при 37°C. Впоследствии образцы инкубировали либо в отсутствие (контроль), либо в присутствии 10x молярного избытка (36 мкМ) (конечная концентрация) тестовых соединений в течение 4 дней при 37°C. Эффект дезинтеграции оценивали с помощью трансмиссионной электронной микроскопии (TEM) и динамического рассеяния света (DLS), как описано ранее (Ferreira et al, 2009, FEBS Lett, vol. 583, p. 3569-76).
Наблюдали, что контрольный образец предварительно образованных фибрилл из TTR (контроль) в основном был образован крупными агрегатами и фибриллами (частицами с диаметром больше 1000 нм), и лишь небольшое количество белка находилось в растворимой форме (частицы диаметром 10 нм). Поскольку фибриллы подвергались дезинтеграции под действием тестируемых соединений, относительное количество крупных агрегатов уменьшалось, а малых агрегатов и растворимого белка увеличивалось (см. фигуру 4).
Активность дезинтеграции фибрилл определяли количественно на основании DLS-анализа как относительную интенсивность (%) по отношению к агрегатам и растворимым частицам после 4 дней обработки с помощью 36 мкM соединений (таблица 6).
Таблица 6. DLS-анализ фибрилл из TTR
Можно наблюдать, что в образцах, обработанных толкапоном, имелось в результате большее количество малых агрегатов и растворимых белков, таким образом проявлялась значительная активность дезинтеграции. Результаты также демонстрируют, что толкапон обладает более высокой активностью дезинтеграции фибрилл, чем тафамидис.
Результаты, полученные с помощью экспериментов 1-6, явно показывают, что толкапон обладает высокой ингибиторной активностью в отношении образования амилоидных фибрилл из TTR, и такая ингибиторная активность является более высокой, чем у тафамидиса, который был описан для лечения FAP. Кроме того, толкапон может обеспечивать дезинтеграцию предварительно образованных амилоидных фибрилл из TTR эффективнее, чем тафамидис. В целом, результаты указывают на то, что толкапон можно эффективно применять в качестве лекарственного препарата для лечения всех типов TTR-ассоциированного амилоидоза.
Реферат
Изобретение относится к медицине, а именно к неврологии, и может быть использовано для дезинтеграции амилоидных фибрилл из TTR (транстиретина). Способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества по меньшей мере одного ингибитора катехол-O-метилтрансферазы (COMT) формулы I или его фармацевтически приемлемой солигде R выбран из группы, состоящей из -C(O)-PhCH3, -CH=C(CN)-C(O)-NEt2и -CH=C(C(O)CH3)2. Использование изобретения позволяет достичь значительной дезинтеграции и высокой ингибиторной активности в отношении образования амилоидных фибрилл из TTR. 1 н. и 16 з.п. ф-лы, 6 табл., 6 пр., 4 ил.
Формула

Комментарии