Применение 3-о-сульфамата-16,16-диметил-d-гомоэквиленина для лечения онкологических заболеваний - RU2680603C1
Код документа: RU2680603C1
Описание
Изобретение относится к области медицины и химико-фармацевтической промышленности и касается средств для лечения рака, в том числе рака молочной железы.
Рак молочной железы является ведущим онкологическим заболеванием у женщин [Parkin D.M., Bray F., Ferlay J., Pisani P., CA Cancer J. Clin., 2005, vol. 55, p.74-108]. По данным ВОЗ, в мире 2.09 миллионов больных, а ежегодно умирают от рака молочной железы 627 тыс. женщин [http://www.who.int/news-room/fact-sheets/detail/cancer].
Значительная часть опухолей этой локализации прогрессирует под действием эстрогенов [Yue W., Yager J.D., Wang J. - P., Jupe E.R., Santen R.J., Steroids, 2013, vol. 78, p.161-170]. При иммуногистохимическом исследовании рака молочной железы определяются рецепторы эстрогенов (ER), прогестерона (PR) и her2neu («чувствительность к герцептину»). Значительная часть опухолей содержат рецепторы эстрогенов, прогестерона и/или HER2NEU 3+. Если опухоль не имеет рецепторов и не чувствительна к герцептину (ER0, PR0, HER2NEU 0-1) ее рассматривают как трижды негативную (ER-/PR-/HER-2-). Это одна из самых смертоносных форм рака молочной железы по причине отсутствия мишеней для подавления ее роста. На сегодняшний день в мире нет лекарственных препаратов для лечения этой формы рака.
Эстрогены циркулируют в крови и накапливаются в опухоли в виде сульфатов, не способных связываться с рецепторами эстрогенов, однако после превращения в свободные гормоны они активируют рост опухоли. Поэтому перспективной является стратегическая линия лечения, в основе которой лежит применение ингибиторов, блокирующих образование этой группы свободных гормонов в опухоли.
К препаратам из группы селективных модуляторов эстрогеновых рецепторов, которые блокируют эффекты эстрогена на гормонозависимые ткани, в том числе - на ткани молочной железы, относится тамоксифен. Тамоксифен является стандартом гормональной терапии для женщин в пременопаузе и постменопаузе. Наиболее характерными побочными эффектами, возникающими на фоне применения тамоксифена, являются: повышение риска развития тромбоза вен, усугубление течения заболеваний сердечно-сосудистой системы (включая приступы стенокардии), а также появление новообразований эндометрия (полипы, и рак эндометрия), а также фиброма матки. Также тамоксифен обладает гепатотоксичностью. По биофармацевтической классификационной системе (БКС), разработанной Gordon Amidon с соавторами в 1995 году, тамоксифен отнесен ко второму классу - препарат, который имеет низкую растворимость и высокую проницаемость.
Большую эффективность по сравнению с тамоксифеном показали ингибиторы ароматазы. В настоящее время нашли применение в данной области такие ингибиторы ароматазы как летрозол и анастразол, которые по системе БКС отнесены к первому классу - препараты, которые имеют высокую растворимость и высокую проницаемость. К побочным эффектам ингибиторов ароматазы является остеопороз, приливы, головные боли.
Кроме того, привлекает внимание стероидная сульфатаза в связи с локальным межтканевым образованием эстрогенов из обильного пула циркулирующего сульфата эстрона. Стероидная сульфатаза катализирует гидролиз сульфата эстрона до эстрона и сульфата DHEA до DHEA (Dibbelt l., Biol. Chem., Hoppe-Seyler, 1991, 372,173-185; Stein С., J. Biol. Chem., 1989, 264, 13865-13872).
Самым известным ингибитором стероидной сульфатазы является ЕМАТЕ-сульфамат эстрона (Ahmed S., Curr. Med. Chem., 2002, vol. 9, no. 2, p. 263-273). Однако он обладает существенным недостатком. Под действием ингибиторов сульфатазы эстрона, имеющих в своем составе сульфаматную группу, происходит необратимая дезактивация фермента с высвобождением свободного лиганда [Howarth N.M., Purohit A., Reed M.J. J. Med. Chem., 1994, vol. 37, p. 219-221]. В частности, сульфамат эстрона ингибирует сульфатазу эстрона, однако высвобождение свободного гормона приводит к появлению сильной утеротропной активности [Shields-Botella J. et al., J. Steroid Biochem. Mol Biol, 2003, vol. 84, p. 327-335].
Таким образом, при поиске новых противоонкологических агентов исследователи должны учесть, что носитель сульфаматной группы ингибитора сульфатазы эстрона не должен обладать гормональной (утеротропной) активностью.
В качестве средства профилактики карциномы молочной железы известно применение d-эквиленина, который не обладает канцерогенными свойствами. На основе производных эквиленина получены препараты с гипохолестеринемическим действием, лишенные утеротропной и гипертриглицеридемической активности [Урусова Е.А., Глуздиков И.А., Селиванов С.И., Старова Г.Л., Николаев С.В., Шавва А.Г. // Синтез и исследование производных эквиленина и его модифицированных аналогов. ЖОрХ. 2004. Т. 40. Вып. 4. С. 506-512].
Соединения эквиленинового ряда входят в состав терапевтических средств (Premarin®), используемых в гормонозаместительной терапии. Наличие указанных свойств желательно, так как использование ингибиторов метаболизма стероидных эстрогенов подразумевает их длительное применение.
Задачей настоящего изобретения является поиск и разработка эффективного синтеза соединений, которые могут быть использованы в качестве противоонкологических агентов при моно- и адъювантной терапии онкологических заболеваний, таких как гепатокарцинома, карцинома желудка, рак легкого, хроническая миелогенная лейкемии, рак молочной железы, в том числе при его самой смертоносной форме- трижды негативной (ER-/PR-/HER-2-).
Задача решается использованием соединения 3-O-сульфамат-16,16-диметил-D-гомоэквиленина (3), который ингибирует сульфатазу эстрона.

Схема синтеза целевого соединения (3) представлена ниже. Отличительной особенностью, в отличие от опубликованных данных, отработанная схема позволяет масштабировать получение целевого соединения в промышленных масштабах.
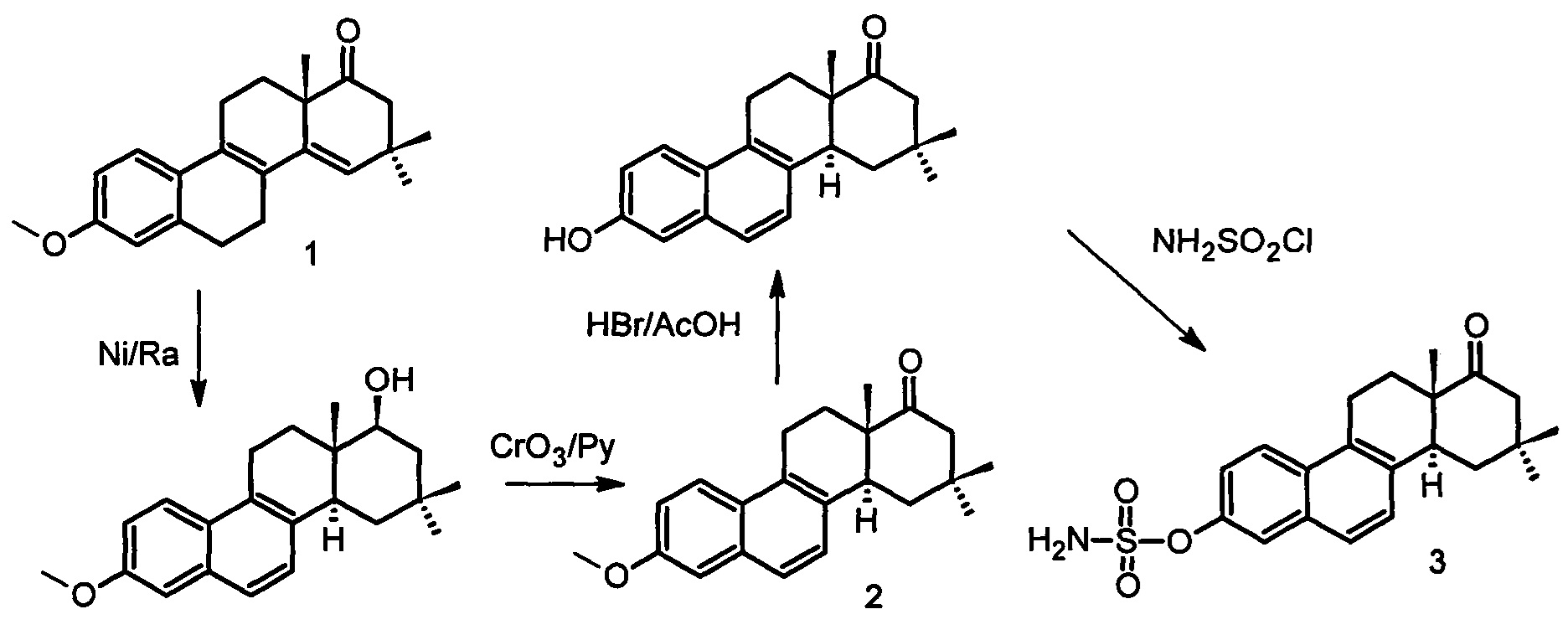
Реакция известной изотиурониевой соли [Аль Сафар, Захарычев А.В., Ананченко С.Н., Торгов И.В. // Синтез некоторых 16,16-диметил-D-гомостероидов. Изв. АН СССР. Сер. Хим. 1968. №10. С. 2326-2332] с 2,4,4-триметилциклопентан-1,3-дионом приводит к образованию секостероида, циклодегидратация которого позволяет получить эстрапентаен (1). После обработки последнего Ni/Ra в условиях, предложенных ранее для синтеза близкого по структуре D-гомоаналога [Gluzdikov LA., Egorov M.S., Selivanov S.I., Starova G.L., Shavva A.G. New analogues of D-homoequilenene with substitutents in the D ring. Russian J. Org. Chem., 2006, vol. 42, no. 11, pp. 1675-1682], выделили метиловый эфир 16,16-диметил-D-гомоэквиленин (2) [Глуздиков И.А. Дисс. на соискание степени канд. наук, 2007, Санкт-Петербург]. Сульфамат 3 получали по известной методике [Морозкина С.Н., Глуздиков И.А., Дроздов А.С., Селиванов С.И., Ковалев Р.А., Филатов М.В., Шавва А.Г. ЖОрХ, 2015, т. 51, N3, с. 425-430].
Результаты моделирования связывания стероида показали, что структура этого стероида плохо совместима с геометрией лигандсвязывающего кармана рецептора. Расстояние между кислородом кетогруппы стероида и NH His524 составляет 4.9



Несоответствие между геометрией стероида и областью рецептора, ответственной за связывание лиганда, будет причиной низкого сродства рассматриваемого соединения к рецептору, в результате чего данный стероид практически не обладает утеротропной активностью.
Соединение полностью ингибирует пролиферацию опухолевых клеток MCF-7. Препарат относится к 4 классу опасности (LD50>300-2000 мг/кг). Полученные данные позволяют оценить дозы для исследования противоопухолевой активности как безопасные.
При изучении связывания с рецепторами эстрогенами, показано, что сульфамат не обладает гормональным действием в концентрациях -0.001 и 0.01, 0.1 и 1.0 микромоль.
На животных моделях, с привитой человеческой опухолью триждынегативного рака молочной железы заявленный препарат более эффективен по сравнению с использующими в клинической практике тамоксифеном и ингибитором ароматазы летрозолом.
Таким образом, область применения соединения - лечение рака молочной железы, включая трижды-негативную форму. Технические результаты:
- отсутствие утеротропного действия,
- широкий спектр противоонкологической активности, включая активность против триады негативного рака молочной железы,
- отсутствие токсичности,
- гипохолестеринемическое действие и отсутствие влияния на содержание триглицеридов в сыворотке крови,
- отсутствие негативного влияния на эндометрий.
Экспериментальная часть
Клеточные культуры и условия культивирования
Работа проведена на перевиваемой культуре клеток человека MCF-7 (аденокарцинома молочной железы). В качестве отрицательного контроля использовали нормальные кожные фибробласты человека (КФЧ) ранних пассажей. Клетки культивировали во флаконах Карреля в среде DMEM/F12 (Биолот) с добавлением 1% эмбриональной сыворотки крупного рогатого скота (Биолот), без антибиотиков, в 5% СО2 атмосфере, при 37°С.
Оценка пролиферативной активности клеток Клетки высаживались на флаконы Карреля по 50×104 клеток на флакон. Для изучения пролиферативной активности клеток в условиях подавления сульфатазы через 24 часа после посева культуральную среду заменяли на среду, содержащую ингибиторы сульфатаз до конечной концентрации 50 мкг/мл, после чего инкубировали данные опухолевые клеточные линии в течение различных промежутков времени (от 24 до 72 ч). Ингибитор растворяют в ДМСО. Конечная концентрация ДМСО в культуральной среде не превышала 0.5%. Для исключения цитотоксического действия ДМСО ставили контроль с добавлением ДМСО без ингибиторасульфатаз. Для исключения неспецифического губительного действия веществ использовали нормальные кожные фибробласты человека. Далее клетки снимали раствором версена-трипсина (Биолот), рассеивали на флаконы Карреля, содержащие новую полную культуральную среду. Подсчет клеток проводили в момент достижения необработанными контрольными клетками максимальной плотности клеток на единицу площади поверхности культурального флакона (монослой), при этом их количество определялось как 100%. Пролиферативную активность всех исследованных клеточных культур при воздействии ингибиторов сульфатаз определяли не менее трех раз.
Исследование влияние полученного сульфамата на рост перевиваемой культуры клеток человека MCF-7 (аденокарцинома молочной железы) показало, что стероид (3) полностью блокирует рост опухолевых клеток при концентрации 20 мкг/мл, при этом он не влияет на рост кожных фибробластов человека, не имеющих рецепторов эстрогенов. Рост опухолевых клеток ингибируется в той же степени, что и под действием тамоксифена, применяемого в медицинской практике более 30 лет. Это весьма важно, поскольку сульфаматы и тамоксифен имеют разные механизмы действия, и есть перспективы их совместного применения.
В экспериментах на мышах линии FVB, трансгенной по HER-2/neu (ER-/PR-/HER2+), с опухолями молочных желез, стероид ингибирует рост опухолей сравнимо с применяемым в клинической практике тамоксифеном, что предполагает их совместное использование для лечения рака молочной железы.
На клеточной линии трижды негативного рака молочной железы MDA-MB-231 соединение ингибирует рост клеток на 83%, что сравнимо с применяющимся в клинической практике химиотерапевтическим препаратом этопозидом.
Препарат показал активность против клеток гепатокарциномы SK-Hep-1 (IC50=53.4 μМ), рака легких А549 (IC50=29.6 μМ), аденокарцинома желудка SNU638 (IC50=22.8 μМ), а также против клеток хронической миелогенной лейкемии (К562).
Указания к применению:
1. Моно- и адьювантная терапия раннего гормоноположительного рака молочной железы у женщин в постменопаузе.
2. Моно- и адьювантная терапия раннего гормоноположительного рака молочной железы у женщин в постменопаузе после 2-3 летнего применения тамоксифена.
3. Лечение распространенного рака молочной железы на поздних стадиях.
4. Лечение трижды негативного рака молочной железы.
5. Моно- и адьювантная терапия гепатокарциномы.
6. Моно- и адьювантная терапия карциномы желудка.
7. Моно- и адьювантная терапия рака легкого.
8. Моно- и адьювантная терапия хронической миелогенной лейкемии.
Реферат
Изобретение относится к применение 3-О-Сульфамат-16,16-диметил-D-гомоэквиленина в качестве противоонкологического агента при моно- и адъювантной терапии онкологических заболеваний, таких как гепатокарцинома, карцинома желудка, рак легкого, хроническая миелогенная лейкемия, рак молочной железы, включая трижды негативную форму рака молочной железы. Технический результат: предложено применение 3-О-Сульфамат-16,16-диметил-D-гомоэквиленина в качестве противоонкологического агента, не обладающего утеротропной активностью.
Формула


Комментарии