Производные амина и их применение для лечения офтальмологических заболеваний и расстройств - RU2536040C2
Код документа: RU2536040C2
Чертежи
Описание
Предпосылки создания изобретения
Нейродегенеративные заболевания, такие как глаукома, дегенерация желтого пятна и болезнь Альцгеймера, поражают миллионы людей по всему миру. Исследование лекарственных препаратов и разработки в данной области являются очень важными из-за значительного снижения качества жизни, связанного с этими заболеваниями.
Возрастная макулярная дегенерация (ВМД) поражает от десяти до пятнадцати миллионов пациентов в США и является основной причиной слепоты у пожилого населения по всему миру. ВМД поражает центральное зрение и вызывает потерю фоторецепторных клеток в центральной части сетчатки, которая называется макулой. Дегенерация желтого пятна может быть классифицирована на два типа: сухой тип и влажный тип. Сухой тип является более распространенным, чем влажный тип; примерно у 90% пожилых пациентов с возрастной макулярной дистрофией диагностируют сухой тип. Влажный тип заболевания и географическая атрофия, которая является фенотипом поздней стадии ВМД сухого типа, вызывает самую серьезную потерю зрения. Полагают, что все пациенты, у которых развился влажный тип ВМД, ранее имели сухой тип ВМД в течение продолжительного периода времени. Точные причины ВМД до сих пор остаются неизвестными. Сухой тип ВМД может быть результатом старения и утончения тканей желтого пятна, связанного с отложением пигмента в пигментном эпителии макулярной области сетчатки. При влажном типе ВМД за сетчаткой начинают расти новые кровеносные сосуды, образуют рубцовую ткань, могут дать кровотечение и просачивание жидкости. Вышележащая сетчатка может серьезно пострадать, создавая «слепые» области в центральном зрении.
До настоящего времени не существует эффективного лечения для большинства пациентов, имеющих сухой тип ВМД. Так как сухой тип ВМД предшествует развитию влажного типа ВМД, терапевтическое воздействие будет благоприятным для предотвращения или задержки прогрессирования заболевания пациентов с сухим типом ВМД, а также снижения вероятности возникновения влажного типа ВМД.
Индикатором ВМД может служить замеченное пациентом ухудшение зрения или выявленные офтальмологом характерные признаки во время обследования глаз. Формирование «друз» или мембранного дебриса под пигментным эпителием сетчатки в области желтого пятна часто является первым физикальным признаком развития ВМД.
Симптомы поздней стадии включают ощущаемое искривление прямых линий и на запущенных стадиях темную, расплывчатую область, или область с отсутствием зрения, которая появляется в центре поля зрения; и/или возможные изменения цветового восприятия.
Разные формы генетически связанных макулярных деградации также могут появляться у более молодых пациентов. В других случаях макулопатий факторами заболевания являются наследственность, питание, травма, инфекция или прочие экологические факторы.
Глаукома является широким термином, который используется для описания группы заболеваний, вызывающих медленную прогрессирующую потерю зрения, обычно протекающую бессимптомно. Отсутствие симптомов может привести к поздней диагностике глаукомы, вплоть до конечных стадий заболевания. Распространение глаукомы предположительно составляет 2.2 миллиона в США с 120,000 случаями, отнесенными к состоянию полной слепоты. Заболевание особенно распространено в Японии, где зафиксировано четыре миллиона случаев заболевания. Во многих частях мира лечение является менее доступным, чем в США или Японии, поэтому глаукома относится к основной причине слепоты в мире. Даже если пациенты, пораженные глаукомой, не становятся слепыми, их зрение часто является серьезно ослабленным.
Прогрессирующая потеря периферического поля зрения при глаукоме вызвана гибелью ганглиоцитов в сетчатке. Ганглиоциты являются специфическим типом проекционного нейрона, который соединяет глаз с мозгом. Глаукома обычно сопровождается увеличением внутриглазного давления. Текущее лечение включает использование лекарственных препаратов, которые понижают внутриглазное давление; однако, современные методы понижения внутриглазного давления часто являются безуспешными для полной остановки развития заболевания. Считается, что ганглиоциты чувствительны к давлению и могут испытывать постоянное ухудшение до понижения внутриглазного давления. Возросшее число случаев глаукомы с нормальным давлением наблюдается тогда, когда ганглиоциты разрушаются без наблюдаемого повышения внутриглазного давления. Современные лекарственные препараты от глаукомы лечат лишь внутриглазное давление и являются неэффективными для предотвращения или остановки дегенерации ганглиоцитов. Согласно последним данным, глаукома является нейродегенеративным заболеванием, аналогичным заболеванию Альцгеймера и болезни Паркинсона в головном мозге, за исключением того, что оно специфично поражает нейроны сетчатки. Нейроны сетчатки глаза берут начало от нейронов промежуточного мозга. Несмотря на то, что часто ошибочно полагают, что нейроны сетчатки не являются частью мозга, ретинальные клетки являются ключевыми компонентами центральной нервной системы, передающими сигналы от светочувствительных клеток.
Болезнь Альцгеймера (AD) является самой распространенной формой слабоумия у пожилых людей. Слабоумие является нарушением функций мозга, которое серьезно влияет на способность человека осуществлять ежедневную деятельность. Болезнь Альцгеймера (AD) является заболеванием, которое только в США поражает четыре миллиона человек. Оно характеризуется потерей нервных клеток в участках мозга, которые являются жизненно важными для памяти и других психических функций. Современные доступные лекарственные препараты могут уменьшать симптомы заболевания в течение ограниченного периода времени, но не существует препаратов, которые лечат заболевание или полностью останавливают прогрессирующее ухудшение психических функций. На основании последних исследований полагают, что глиальные клетки, которые окружают нейроны или нервные клетки, могут иметь дефекты у пациентов с AD, но причина AD остается неизвестной. Пациенты с AD, по-видимому, имеют более высокую частоту заболевания глаукомой и возрастной макулярной дегенерацией, что указывает на то, что аналогичный патогенез может лежать в основе этих нейродегенеративных заболеваний глаза и мозга. (См. Giasson et. al., Free Radic. Biol. Med. 32:1264-75 (2002); Johnson et al, Proc. Natl. Acad. Sci. USA 99:11830-35 (2002); Dentchev et al., Mol. Vis. 9:184-90 (2003)).
Гибель нервных клеток лежит в основе патологии этих заболеваний. К сожалению, было разработано очень мало композиций и методов, которые повышают выживаемость нервных клеток сетчатки, в частности выживаемость фоторецепторных клеток. Таким образом, существует потребность в определении и разработке композиций, которые можно применять для лечения и профилактики ряда заболеваний и нарушений сетчатки, в которых гибель нервных клеток является первичным или сопутствующим элементом в их патогенезе.
В фоторецепторных клетках позвоночных излучение фотонов вызывает изомеризацию 11-цис-ретинилиден хромофора в полностью-транс-ретинилиден и отсоединение от зрительных рецепторов опсинов. Эта фотоизомеризация инициирует конформационные изменения опсинов, которые, в свою очередь, инициируют биохимическую цепь реакций, называемых фототрансдукцией. (Filipek et al., Annu. Rev. Physiol. 65:851-79 (2003)). Регенерация зрительных пигментов требует, чтобы хромофор был конвертирован обратно в 11-цис-конфигурацию в процессах, совокупно называемых ретиноидным (зрительным) циклом (см., например., МсВее et al., Prog. Retin. Eye Res. 20:469-52 (2001)). Сначала хромофор отделяется от опсина и восстанавливается в фоторецепторе с помощью дегидрогеназы сетчатки. Продукт, полностью-транс-ретинол, захватывается прилегающим пигментным эпителием сетчатки (ПЭС) в форме эфиров нерастворимых жирных кислот в субклеточных структурах, известных как ретиносомы (Imanishi et al., J. Cell Biol. 164:373-87(2004)).
В болезни Штаргардта (Allikmets et al., Nat. Genet. 15:236-46 (1997)), заболевание, связанное с мутациями в гене ABCR транспортере, который функционирует как флипаза, накопление полностью-транс-ретиналя может отвечать за образование пигмента липофуцина, А2Е, который является токсичным по отношению к клеткам пигментного эпителия сетчатки и вызывает прогрессирующую дегенерацию сетчатки и, следовательно, потерю зрения (Mata et al., Proc. Natl. Acad. Sci. USA 97:7154-59 (2000); Weng et al., Cell 98:13-23 (1999)). Лечение пациентов ингибитором ретинол-дегидрогеназы, 13-цис-ретиноидной кислотой (13-цис-RА) (Isotretinoin, Accutane®, Roche), рассматривалось как терапия, которая может предотвратить или замедлить образование А2Е и обладать защитными свойствами для сохранения нормального зрения (Radu et al., Proc. Natl. Acad. Sci. USA 100:4742-47 (2003)). 13-цис-RА применяли для замедления синтеза 11-цис-ретиналя путем ингибирования 11-цис-ретинол дегидрогеназы (11-цис-RDH) (Law et al., Biochem. Biophys. Res. Commun. 161:825-9 (1989)), но его применение может быть также связано со значительной ночной слепотой. Другие предполагали, что 13-цис-RА функционирует для предотвращения регенерации хромофора путем присоединения белка RPE65, достаточного для процесса изомеризации в глазу (Gollapalli et al., Proc. Natl. Acad. Sci. USA 101:10030-35 (2004)). Gollapalli et al. утверждал, что 13-цис-RА блокирует образование А2Е и предложил, что это лечение может ингибировать накопление липофусцина и, таким образом, задерживать наступление потери зрения при болезни Штаргардта или возрастной макулярной дегенерации, которые связаны с накоплением липофусцина в пигментном эпителии сетчатки. Однако, блокирование ретиноидного цикла и образование не лигандного опсина может приводить к более серьезным последствиям и ухудшению прогноза пациента (см., например.. Van Hooser et al., J. Biol. Chem. 277:19173-82 (2002); Woodruff et al., Nat. Genet. 35:158-164 (2003)). Невозможность образования хромофора может привести к прогрессирующей дегенерации сетчатки и может создать фенотип, аналогичный Leber Congenital Amaurosis (LCA), который является очень редким генетическим состоянием, поражающим детей сразу же после рождения.
Краткое описание изобретения
В данной области существует потребность в эффективном методе лечения офтальмологических заболеваний или нарушений, приводящих к офтальмологической дисфункции, включая дисфункции, описанные выше. В частности, существует острая потребность в композициях и способах лечения болезни Штаргардта, и возрастной макулярной дистрофии без возникновения дополнительных нежелательных побочных эффектов, таких как прогрессирующая дегенерация желтого пятна, LCA-подобных условий, ночной слепоты или системного дефицита витамина А. В данной области также существует потребность в эффективных способах лечения других офтальмологических заболеваний и нарушений, которые неблагоприятно воздействуют на сетчатку.
Настоящее изобретение относится к аминопроизводным соединениям, которые являются ингибиторами стадии изомеризации ретиноидного цикла и являются эффективными для лечения офтальмологических заболеваний и нарушений. Также, обеспечены фармацевтические композиции, включающие аминопроизводные соединения и способы лечения различных офтальмологических заболеваний с использованием этих соединений.
Соответственно, в одном варианте представлено соединение Формулы (А) или его таутомер, стереоизомер, геометрический изомер или фармацевтически приемлемый сольват, гидрат, соль, N-оксид или их пролекарства:

в которой
Z представляет собой связь, -C(R1)(R2)-, -C(R9)(R10)-C(R1)(R2)-, -X-C(R31)(R32)-, -C(R9)(R10)-C(R1)(R2)-C(R36)(R37)- или Х-С(R31)(R32)-C(R1)(R2)-;
Х представляет собой -O-, -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -C(=CH2)-, -C(=N-NR35)- или -C(=N-OR35)-;
G является выбранным из -C(R41)2-C(R41)2-R40, -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -С(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6 алкила или две R41 группы вместе могут образовывать оксо;
каждый R42 является независимо выбранным из водорода или алкила;
R1 и R2 независимо друг от друга являются выбранными из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, является выбранным из водорода, галогена, С1-С5 алкила, фторалкила, -OR6 или -NR7R8; или R36 и R37 вместе образуют оксо; или дополнительно, R36 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R36 и R1 вместе образуют прямую связь, и R37 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R3 и R4 каждый, независимо друг от друга, являются выбранными из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют амино;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, CO2R13 или SO2NR24R25; или R7и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R9 и R1 вместе образуют прямую связь, и R10 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R23, -C(NH)NH2, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12, вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый из R13 и R22 и R23, независимо друг от друга, является выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35, каждый, независимо друг от друга, представляет собой водород или алкил;
R20 и R21, каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый из R24, R25, R26, R27, R28 и R29, независимо друг от друга, является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
R16 и R17, каждый, независимо друг от друга, является выбранным из водорода, алкила, галогена, арила, гетероарила, аралкила, гетероариалкила или фторалкила; или R16и R17, вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4; при условии, что G не является незамещенным нормальным алкилом и при условии, что соединением Формулы А не является:



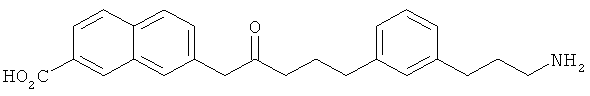
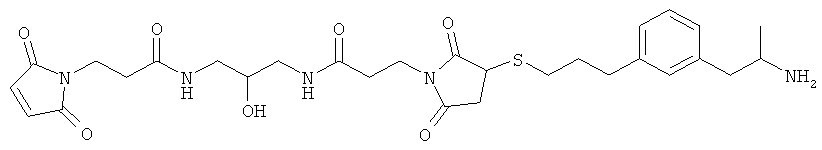
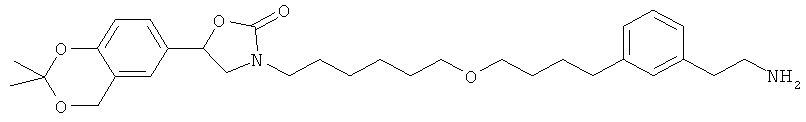
В другом варианте представлено соединение Формулы (А), в которой
Z представляет собой связь, -С(R1)(R2)-, -C(R9)(R10)-C(R1)(R2)-, -Х-C(R31)(R32)-, -C(R9)(R10)-C(R1)(R2)-C(R36)(R37)- или Х-С(R31)(R32)-С(R1)(R2)-;
Х является -O-, -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -C(=CH2)-, -C(=N-NR35)- или -C(=N-OR35)-;
R1 и R2, каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкала, фторалкила, -OR6 или -NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранными из водорода, C1-C5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, является выбранными из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R36 и R37 вместе образуют оксо;
R3 и R4 каждый, независимо друг от друга, является выбранными из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, является выбранными из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, CО2R13 или SO2NR24R25; или R7и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранными из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо;
R11 и R12 каждый, независимо друг от друга, является выбранными из водорода, алкила, карбоциклила, -C(=O)R23, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый из R13, R22 и R23 независимо друг от друга является выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35 каждый, независимо друг от друга, представляет собой водород или алкил;
R20 и R21 каждый, независимо друг от друга, является выбранными из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый из R24, R25, R26, R27, R28 и R29 независимо друг от друга является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
каждый из R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4.
В еще одном варианте представлено соединение Формулы (А), имеющее структуру Формулы (В)

в которой
Z представляет собой -С(R9)(R10)-С(R1)(R2)- or -О-С(R31)(R32)-;
R1 и R2 независимо друг от друга являются выбранными из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, С1-C5 алкила или фторалкила;
R3 и R4 каждый, независимо друг от друга, являются выбранными из водорода или алкила; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R13; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, являются выбранными из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 вместе образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R9 и R1 вместе образуют прямую связь, и R10 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, являются выбранными из водорода, алкила, карбоциклила или -C(=O)R23; или R11 и R12, вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый из R13, R22 и R23, независимо друг от друга, является выбранным из алкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19 и R34 каждый, независимо друг от друга, представляет собой водород или алкил;
каждый R33 независимо является выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R22; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый из R24, R25, R26, R27, R28 и R29 независимо друг от друга, является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила.
В другом варианте представлено соединение Формулы (В), в которой:
Z представляет собой -C(R9)(R10)-C(R1)(R2)- или -О-C(R31)(R32)-;
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода или алкила; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R13; или R7 и R8, вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR19R21 или карбоциклила; или R9 и R10 вместе образуют оксо;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R23; или R11 и R12, вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R13, R22 и R23 независимо является выбранным из алкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19 и R34 независимо являются водородом или алкилом;
каждый R33 независимо является выбранным из галогена, OR34 или фторалкила; и n равно 0, 1, 2, 3 или 4;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R22; или R20 и R21, вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 независимо является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила.
В другом варианте представлено соединение Формулы (В), в которой:
G является выбранным из -C(R41)2-C(R41)2-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила или две R41 группы вместе могут формировать оксо.
В другом варианте представлено соединение Формулы (В), в которой:
G является выбранным из -C(R41)2-C(R41)2-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила или две R41 группы вместе могут формировать оксо.
В другом варианте представлено соединение Формулы (В), которое имеет структуру Формулы (С),
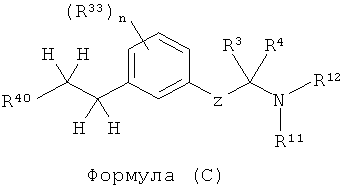
в которой
Z представляет собой -C(R9)(R10)-C(R1)(R2)- or -O-C(R31)(R32)-;
R40 является выбранным из -C(R16)(R17)(R18)» арила или гетероарила;
R16 и R17 каждый, независимо друг от друга являются выбранными из водорода, алкила, гало, арила, гетероарила, аралкила, гетероариалкила или фторалкила; или R16 и R17, вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R33 каждый, независимо друг от друга, является выбранными из водорода, C1-C5 алкила или фторалкила;
R3 и R4 каждый, независимо друг от друга, является выбранными из водорода или алкила; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R13; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 вместе образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R9 и R1 вместе образуют прямую связь, и R10 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, является выбранными из водорода, алкила, карбоциклила или -C(=O)R23; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R13, R22 и R23 независимо является выбранным из алкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19 и R34 каждый, независимо друг от друга, представляет собой водород или алкил;
каждый R33 независимо является выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4;
R20 и R21 каждый, независимо друг от друга, представляет собой водород, алкил, карбоциклил, -C(=O)R22; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила.
В другом варианте представлено соединение Формулы (С), в которой
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 вместе образуют оксо.
В другом варианте представлено соединение Формулы (С), которое имеет структуру Формулы (D):
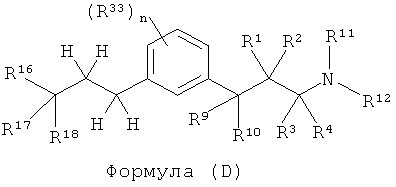
в которой
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила,, -OR6 или -NR7R8; или R1 и R2 вместе образуют оксо;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода или алкила; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R13; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 вместе образуют оксо;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R23; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый R13, R22 и R23 является независимо выбранным из алкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19 и R34 являются независимо водородом или алкилом;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила,, -C(=O)R22; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, C1-C13 алкила, гало или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4; и
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила.
В другом варианте представлено соединение Формулы (D), где n равно 0 и каждый из R11 и R12 является водородом. В другом варианте представлено соединение, в котором каждый из R3, R4, R14 и R15 является водородом. В еще другом варианте представлено соединение, в котором:
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, С1-C5 алкила или -OR6;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила или -OR19; или R9 и R10 вместе образуют оксо;
R6 и R19 каждый, независимо является водородом или алкилом;
R16 и R17, вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл; и
R18 является выбранным из водорода, алкокси или гидрокси. В еще другом варианте представлено соединение, в котором R16 и R17, вместе с атомом углерода, к которому они присоединены, образуют циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, и R18 является водородом или гидрокси.
В другом варианте представлено соединение Формулы (D), в которой R11 является водородом и R12 является -C(=O)R23, где R23 представляет собой алкил.
В другом варианте представлено соединение Формулы (D), в которой
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, С1-С5 алкила, или -OR6;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила; или -OR19; или R9 и R10 вместе образуют оксо;
R6 и R19 каждый, независимо друг от друга, являются выбранными из водорода или алкила;
R16 и R17, вместе с атомом углерода, к которому они присоединены, образуют карбоциклил; и
R18 является водородом, гидрокси или алкокси.
В еще другом варианте представлено соединение Формулы (D), в которой:
n равно 0;
R16 и R17, вместе с атомом углерода, к которому они присоединены, образуют циклопентил, циклогексил или циклогексил; и
R18 является водородом или гидрокси.
В еще другом варианте представлено соединение Формулы (D), в которой:
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила или -OR6;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила или -OR19; или R9 и R10 вместе образуют оксо;
R6 и R19 каждый, независимо друг от друга является водородом или алкилом;
R16 и R17 каждый, независимо друг от друга является выбранным из C1-C13 алкила; и
R18 является водородом, гидрокси или алкокси.
В другом варианте представлено соединение Формулы (С), которое имеет структуру Формулы (Е):

в которой
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода или алкила; или R3 и R4 вместе образуют имино;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R23; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R23 является выбранным из алкила, алкенила, арила, карбоциклила, гетероарила или гетероциклила;
R14 и R15 каждый, независимо друг от друга, является выбранным из водорода или алкила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, C1-C13 алкила, гало или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
R34 является водородом или алкилом; и
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4.
В другом варианте представлено соединение Формулы (Е), в которой n рано 0 и каждый из R11 и R12 является водородом.
В еще другом варианте представлено соединение Формулы (Е), в которой каждый R3, R4, R14 и R15 является водородом.
В еще другом варианте представлено соединение Формулы (Е), в которой,
R31 и R32 каждый, независимо друг от друга, является водородом или C1-C5 алкилом;
R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил; и
R18 является водородом, гидрокси или алкокси.
В еще другом варианте представлено соединение Формулы (Е), в которой R16 и R17вместе с атомом углерода, к которому они присоединены, образуют циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, и R18 является водородом или гидрокси.
В еще другом варианте представлено соединение Формулы (Е), в которой R31 и R32 каждый, независимо друг от друга, является выбранным из водорода или C1-C5 алкила; и R18 является водородом, гидрокси или алкокси.
В еще другом варианте представлено соединение Формулы (Е), в которой
R31 и R32 каждый, независимо друг от друга, является водородом или C1-C5 алкилом;
R6 и R19 каждый, независимо друг от друга, является водородом или алкилом;
R16 и R17 каждый, независимо друг от друга, является выбранным из C1-C13 алкила; и
R18 является водородом, гидрокси или алкокси.
В другом варианте представлено соединение Формулы (А), в которой
Z представляет собой связь, -X-C(R31)(R32)- или -X-C(R31)(R32)-C(R1)(R2)-; и
Х является -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -C(=CH2)-, -C(=N-NR35)- или -C(=N-OR35)-.
В еще другом варианте представлено соединение Формулы (А), в которой
G является выбранным из -C(R41)2-C(R41)2-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила или две R41 группы вместе могут формировать оксо.
В другом варианте представлено соединение Формулы (А), имеющее структуру
Формулы (F):

в которой
Х представляет собой -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -С(=СН2)-, -C(=N-NR35)- или -C(=N-OR35)-;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода или алкила; или R3 и R4 вместе образуют имино;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R23; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил:
R23 является выбранным из алкила, алкенила, арила, карбоциклила, гетероарила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, C1-C13 алкила, гало или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R30, R34 и R35 каждый, независимо друг от друга, являются водородом или алкилом;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4.
В еще другом варианте представлено соединение Формулы (F), в которой n равно 0, и каждый R11 и R12 является водородом.
В еще другом варианте представлено соединение Формулы (F), в которой каждый R3, R4, R14 и R15 является водородом.
В еще другом варианте представлено соединение Формулы (F), в которой,
R31 и R32 каждый, независимо друг от друга, является водородом или C1-C5 алкилом;
R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл; и
R18 является водородом, гидрокси или алкокси.
В еще другом варианте представлено соединение Формулы (F), в которой R16 и R17вместе с атомом углерода, к которому они присоединены, образуют циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, и R18 является водородом или гидрокси.
В еще другом варианте представлено соединение Формулы (F), в которой R31 и R32каждый, независимо друг от друга, является выбранным из водорода или C1-C5 алкила; R16 и R17 являются независимо выбранными из C1-C13 алкила; и R18 является водородом, гидрокси или алкокси.
В одном варианте представлено соединение, имеющее структуру Формулы (I):

в виде таутомера или смеси таутомеров, или в виде фармацевтически приемлемой соли, гидрата, сольвата, N-оксида или их пролекарств, в которой:
R1 и R2 являются одинаковыми или разными и независимо друг от друга представляют собой водород, галоген, C1-C5 алкил, фторалкил, -OR6, -NR7R8 или R1 и R2 образуют оксо;
R3 и R4 являются одинаковыми или разными и независимо друг от друга представляют собой водород или алкил;
R5 представляет собой C5-C15 алкил, аралкил, гетероциклилалкил, гетероарилалкил или карбоциклилалкил;
R6 представляет собой водород или алкил;
R7 и R8 являются одинаковыми или разными и независимо друг от друга представляют собой водород, алкил, карбоциклил или -C(=O)R13; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
Х представляет собой -С(R9)(R10)- или -O-;
R9 и R10 являются одинаковыми или разными и независимо друг от друга представляют собой водород, галоген, алкил, фторалкил, -OR6, -NR7R8 или карбоциклил; или R9 и R10 образуют оксо;
R11 и R12 являются одинаковыми или разными и независимо друг от друга представляют собой водород, алкил или -C(=O)R13; или
R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
R13 представляет собой алкил, алкенил, арил, карбоциклил, гетероарил или гетероциклил.
В другом варианте представлено соединение Формулы (I), имеющей структуру Формулы (Iа):
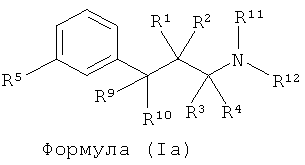
в виде таутомера или смеси таутомеров, или в виде фармацевтически приемлемой соли, гидрата, сольвата, N-оксида или их пролекарств, в которой:
R1 и R2 каждый, являются одинаковым или разными и независимо друг от друга представляют собой водород, галоген, C1-C5 алкил, фторалкил, -OR6 или -NR7R8; или R1 и R2 образуют оксо;
R3 и R4 каждый, являются одинаковыми или разными и независимо друг от друга представляют собой водород или алкил;
R5 является C5-C15 алкилом, аралкилом, гетероциклилалкилом, гетероарилалкилом или карбоциклилалкилом;
R6 является водородом или алкилом;
R7 и R8 каждый, являются одинаковыми или разными и независимо друг от друга представляют собой водород, алкил, карбоциклил или -C(=O)R13; или
R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, являются одинаковыми или разными и независимо друг от друга представляют собой водород, галоген, алкил, фторалкил, -OR6, -NR7R8 или карбоциклил; или R9 и R10 образуют оксо;
R11 и R12 каждый, являются одинаковыми или разными и независимо друг от друга представляют собой водород, алкил или -C(=O)R13; или
R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
R13 представляет собой алкил, алкенил, арил, карбоциклил, гетероарил или гетероциклил.
В другом варианте представлено соединение Формулы (Iа), в которой каждый из R11 и R12 является водородом.
В другом варианте представлено соединение Формулы (Iа), в которой каждый из R9 и R10 независимо является водородом, галогеном, алкилом или -OR6, где R6представляет собой водород или алкил.
В другом варианте представлено соединение Формулы (Iа), в которой R5 является С5-С9 алкилом, аралкилом или карбоциклилалкилом.
В другом варианте представлено соединение Формулы (Iа), в которой
каждый из R1, R2, R3 и R4 является водородом;
каждый из R9 и R10 независимо является водородом или -ОR6, где R6 является водородом или алкилом; и
R5 представляет собой C5-C9 алкил.
В другом варианте представлено соединение Формулы (Iа), в которой R5 является C5-C9 алкилом, замещенным -OR6, где R6 является водородом или алкилом.
В другом варианте представлено соединение Формулы (Ia), в которой
каждый из R1, R2, R3 и R4 является водородом;
каждый из R9 и R10 независимо является водородом или -OR6, где R6 является водородом или алкилом; и
R5 является аралкилом.
В еще другом варианте представлено соединение Формулы (Iа), в которой
каждый из R1, R2, R3 и R4 является водородом;
каждый из R9 и R10 независимо является водородом или -OR6, где R6 является водородом или алкилом; и
R5 является карбоциклилалкилом.
В другом варианте представлено соединение Формулы (I), имеющей структуру Формулы (Ib):

в качестве таутомера или смеси таутомеров, или в качестве фармацевтически приемлемой соли, гидрата, сольвата, N-оксида или их пролекарств, в которой:
R1 и R2 каждый, являются одинаковыми или разными, и независимо друг от друга представляют собой водород, С1-С5 алкил или фторалкил;
R3 и R4 каждый, являются одинаковыми или разными, и независимо друг от друга представляют собой водород или алкил;
R5 представляет собой C5-C15 алкил, аралкил, гетероциклилалкил, гетероарилалкил или карбоциклилалкил;
R11 и R12 каждый, являются одинаковыми или разными, и независимо друг от друга представляют собой водород, алкил или -C(=O)R13; или
R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и R13 представляет собой алкил, алкенил, арил, карбоциклил, гетероарил или гетероциклил.
В другом варианте представлено соединение Формулы (Ib), в которой R11 и R12являются водородом.
В другом варианте представлено соединение Формулы (Ib), в которой каждый из R3 и R4 являются водородом.
В другом варианте представлено соединение Формулы (Ib), в которой
каждый из R1, R2, R3 и R4 является водородом, и
R5 представляет собой C5-C9 алкил, карбоциклилалкил, гетероарилалкил или гетероциклилалкил.
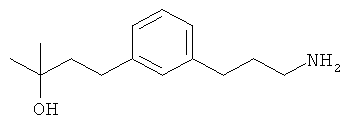
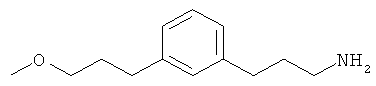
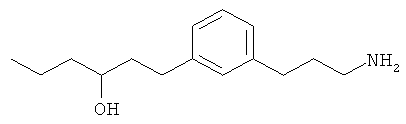
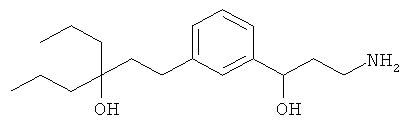
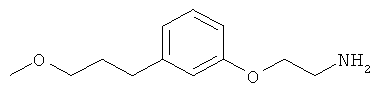
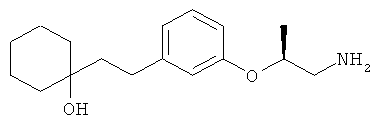
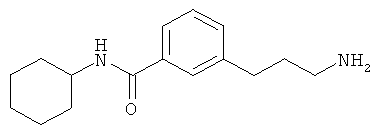
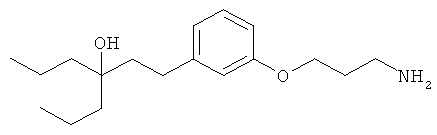
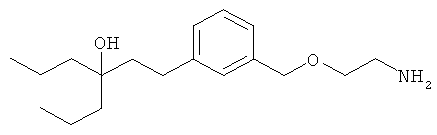
В еще другом варианте представлено соединение Формулы (I), которое выбрано из группы, включающей:
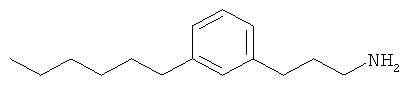
3-(3-пентилфенил)пропан-1-амин;
3-(3-гексилфенил)пропан-1-амин;
3-(3-(3,3-диметилбутил)фенил)пропан-1-амин;
3-(3-(октан-4-ил)фенил)пропан-1-амин;
4-(3-(3-аминопропил)фенил)бутан-1-ол;
6-(3-(3-аминопропил)фенил)гексан-1-ол;
3-(3-(6-метоксигексил)фенил)пропан-1-амин;
4-(3-(3-аминопропил)фенетил)гептан-4-ол;
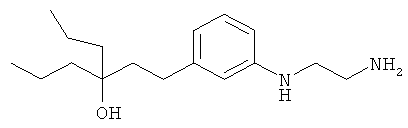
1-(3-(3-аминопропил)фенил)-3-этилпентан-3-ол;
4-(3-(3-аминопропил)фенил)-2-метилбутан-2-ол;
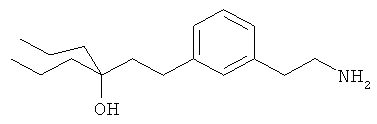
3-(3-(3-аминопропил)фенил)пропан-1-ол;
3-(3-(3-метоксипропил)фенил)пропан-1-амин;
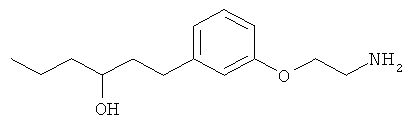
1-(3-(3-аминопропил)фенил)гексан-3-ол;
4-(3-(3-амино-1-гидроксипропил)фенетил)гептан-4-ол;
3-(3-(2,6-диметилфенетил)фенил)пропан-1-амин;
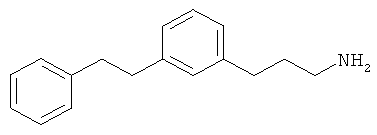
3-(3-фенетилфенил)пропан-1-амин;
3-(3-(3-фенилпропил)фенил)пропан-1-амин;
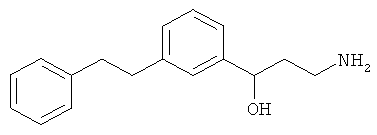
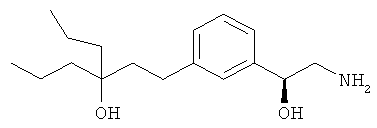
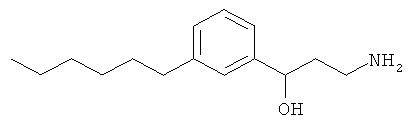
3-амино-1-(3-(3-фенилпропил)фенил)пропан-1-ол;
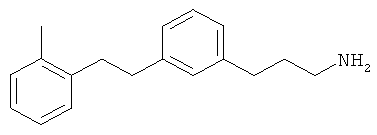
3-(3-(2-метилфенетил)фенил)пропан-1-амин;
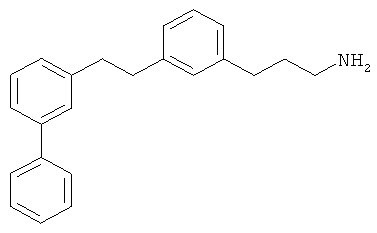
3-(3-(2-(бифенил-3-ил)этил)фенил)пропан-1-амин;
3-(3-(4-фенилбутил)фенил)пропан-1-амин;
3-(3-(2-(нафтален-2-ил)этил)фенил)пропан-1-амин;
3-(3-(2-циклогексилэтил)фенил)пропан-1-амин;
3-(3-(2-циклопентилэтил)фенил)пропан-1-амин;
3-амино-1-(3-(2-циклопентилэтил)фенил)пропан-1-ол;
1-(3-(3-аминопропил)фенетил)циклогексанол;
1-(3-(3-амино-1-гидроксипропил)фенетил)циклогексанол;
1-(3-(3-аминопропил)фенетил)пиклогептанол;
1-(3-(3-амино-1-гидроксипропил)фенетил)циклогептанол;
4-(3-(2-аминоэтокси)фенетил)гептан-4-ол;
1-(3-(2-аминоэтокси)фенетил)циклогексанол;
1-(3-(2-аминоэтокси)фенетил)циклогептанол;
4-(3-(2-аминоэтокси)фенетил)тетрагидро-2Н-тиопиран-4-ол;
6-(3-(2-аминоэтокси)фенил)гексан-1-ол;
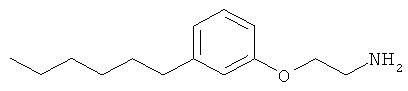
2-(3-(3-циклопентилпропил)фенокси)этанамин;
2-(3-(2-(пиридин-3-ил)этил)фенокси)этанамин;
2-(3-(2-(пиридин-2-ил)этил)фенокси)этанамин; и
2-(3-(2-(тиофен-2-ил)этил)фенокси)этанамин.
В другом варианте представлено соединение Формулы (В), в которой
G является выбранным из -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
R42 является выбранным из водорода или алкила.
В другом варианте представлено соединение Формулы (В), в которой
G является выбранным из -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
R42 является выбранным из водорода или алкила.
В другом варианте представлено соединение Формулы (В), в которой
G является выбранным из -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40.
В другом варианте представлено соединение Формулы (В), в которой
G является выбранным из -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40.
В другом варианте представлено соединение Формулы (В), в которой
G является выбранным из -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40.
В другом варианте представлено соединение Формулы (В), в которой
R42 представляет собой водород или C1-С3 алкил; и
R40 является арилом или гетероарилом.
В другом варианте представлено соединение Формулы (В), в которой
R40 является выбранным из -C(R16)(R17)(R18);
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероарилалкила или фторалкила; и
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила.
В другом варианте представлено соединение Формулы (В), в которой
R40 является выбранным из -C(R16)(R17)(R18);
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероарилалкила или фторалкила; и R16 и R17 вместе с углеродом, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила.
В дополнительном варианте представлено соединение Формулы (А), в которой один или более одного, или все необмениваемые атомы1Н замещены атомами2Н.
В еще другом варианте представлено соединение Формулы (А), выбранное из следующей группы, состоящей из:
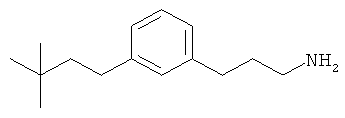



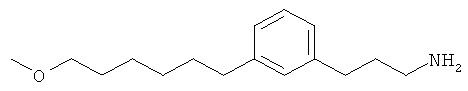





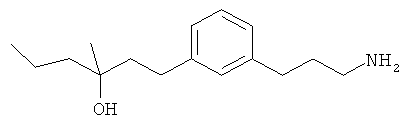
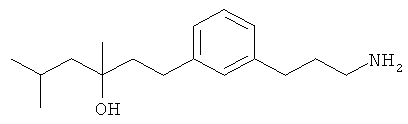

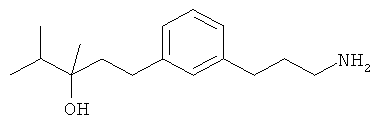
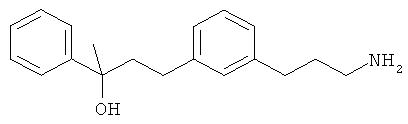
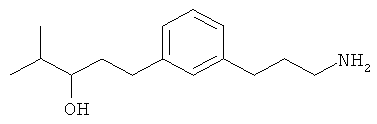




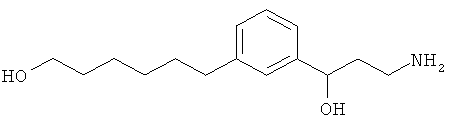

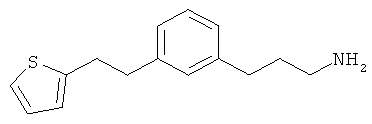


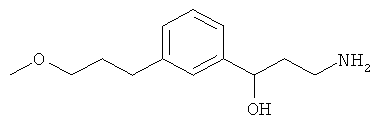
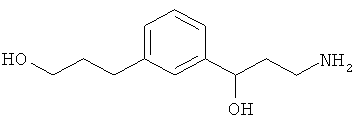
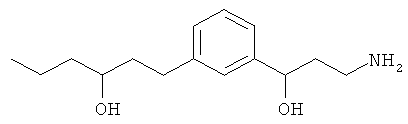

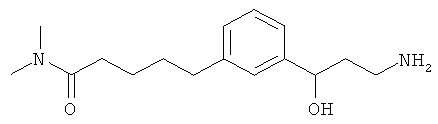
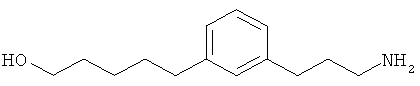
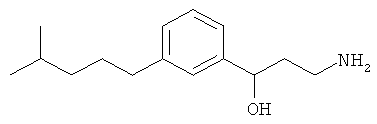
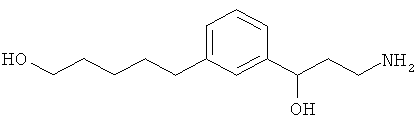
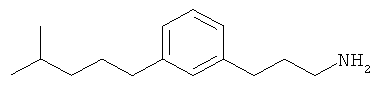








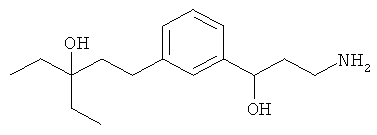
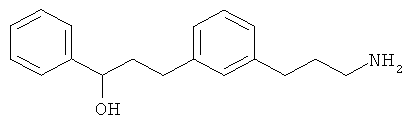


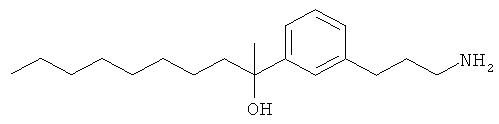


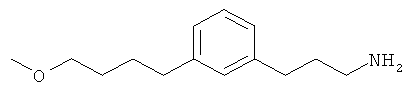
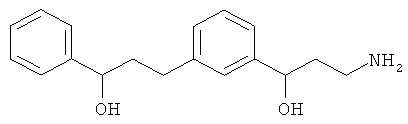
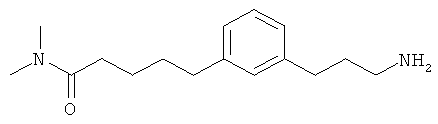


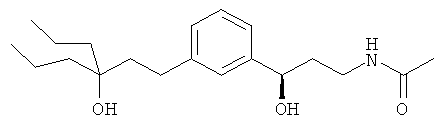


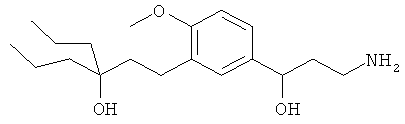
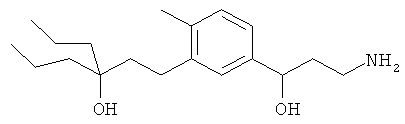



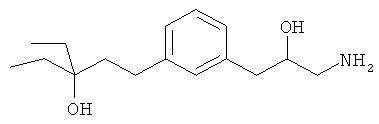
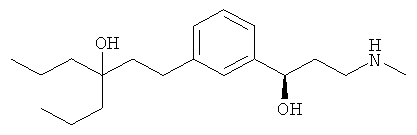

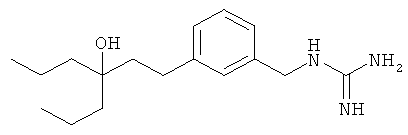
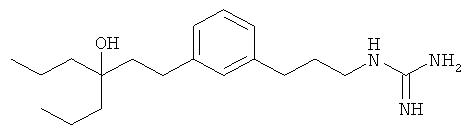



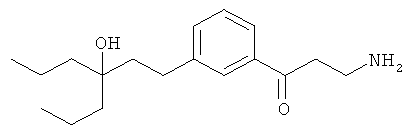
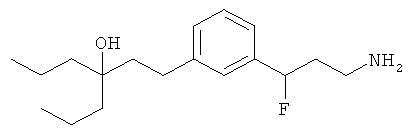
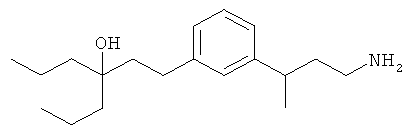



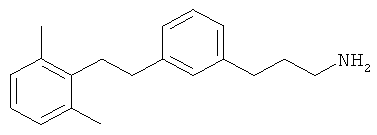








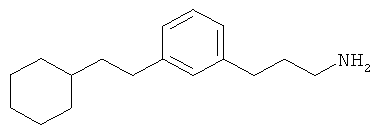

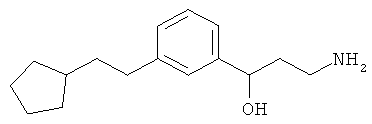

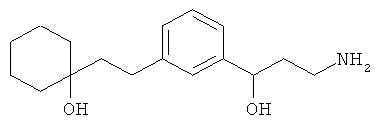


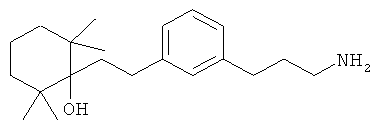

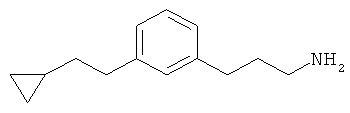
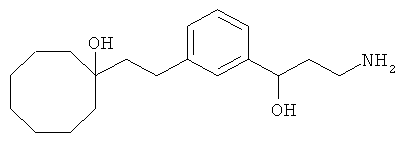

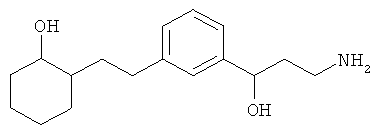
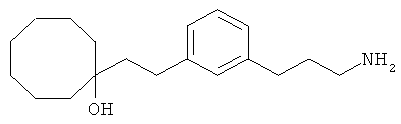








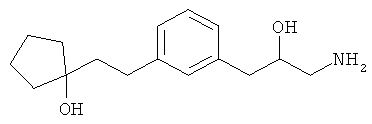
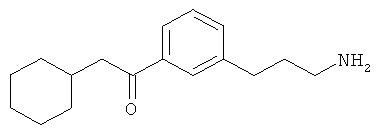
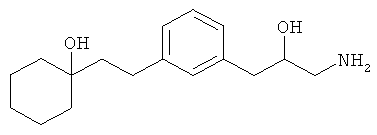

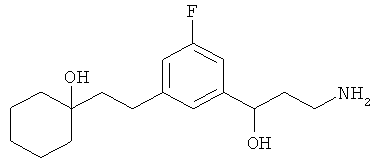






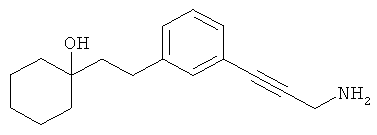
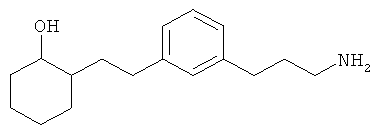
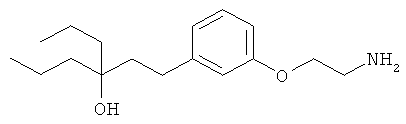
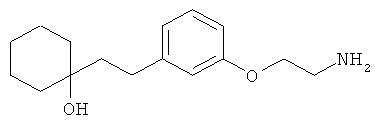



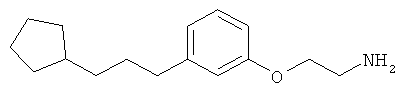




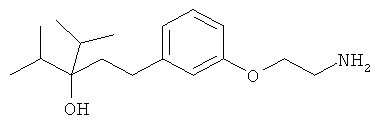

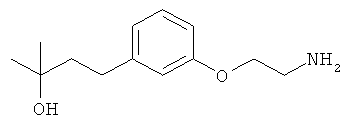
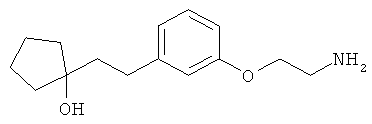


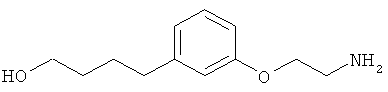


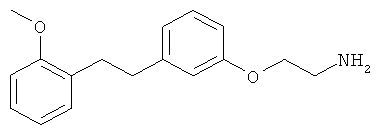
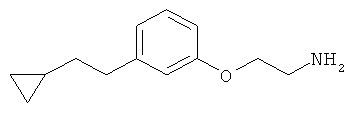
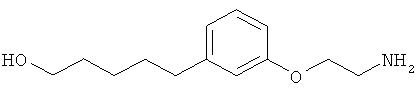





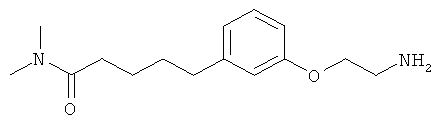
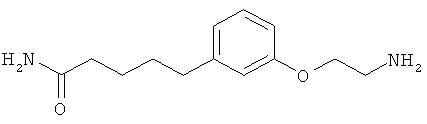
















В одном варианте представлена фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение Формулы (А) или таутомера, стереоизомера, геометрического изомера или фармацевтически приемлемого сольвата, гидрата, соли, N-оксида или их пролекарств:
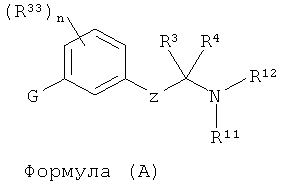
в которой,
Z представляет собой связь, -C(R1)(R2)-, -C(R9)(R10)-C(R1)(R2)-, -X-C(R31)(R32)-, -C(R9)(R10)-C(R1)(R2)-C(R36)(R37)- или X-C(R31)(R32)-C(R1)(R2)-;
X представляет собой -O-, -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(O)-, -С(=СН2)-, -C(=N-NR35)- или -C(=N-OR35)-;
G является выбранным из -C(R41)2-C(R41)2-R40, -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -С(R16)(R17)(R18) арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила или две R41 группы вместе могут формировать оксо;
каждый R42 является независимо выбранным из водорода или алкила;
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R36 и R37 вместе образуют оксо; или дополнительно, R36 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R36 и R1 вместе образуют прямую связь, и R37 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, CO2R13 или SO2NR24R25; или R7и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R9 и R1 вместе образуют прямую связь, и R10 и R2вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R23, -C(NH)NH2, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый из R13, R22 и R23 является независимо друг от друга выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35 каждый, независимо друг от друга, является водородом или алкилом;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо друг от друга выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероарилалкила или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4; при условии, что G не является незамещенным нормальным алкилом и при условии, что соединение Формулы А не является:







В дополнительном варианте представлено не ретиноидное соединение, которое ингибирует реакцию изомеразы, что приводит к образованию 11-цис ретинола, при этом указанная реакция изомеразы происходит в ПЭС, и указанное соединение имеет величину ED50=1 мг/кг или менее при введении пациенту. В другом варианте представлено не ретиноидное соединение, при этом величина ED50 измеряется после введения однократной дозы соединения указанному пациенту в течение 2 часов или более. В другом варианте представлено не ретиноидное соединение, при этом не ретиноидным соединением является алкоксисоединение. В дополнительном варианте представлена фармацевтическая композиция, включающая фармацевтически приемлемый носитель и не ретиноидное соединение, как описано выше. В дополнительном варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и не ретиноидное соединение, как описано выше.
В дополнительном варианте представлено соединение, которое ингибирует образование 11-цис-ретинола с величиной IC50 примерно 1 мкМ или менее при анализе in vitro, с использованием экстракта клеток, экспрессирующих RPE65 и LRAT, при этом экстракт, кроме того, включает CRALBP, и соединение является стабильным в растворе в течение, по меньшей мере, 1 недели при комнатной температуре. В другом варианте, соединение ингибирует образование 11-цис-ретинола с величиной IC50 примерно 0.1 мкМ или менее. В дугом варианте, соединение ингибирует образование 11-цис-ретинола с величиной IС50 примерно 0.01 мкМ или менее. В другом варианте соединение, которое ингибирует образование 11-цис-ретинола, является не ретиноидным соединением. В дополнительном варианте представлена фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано выше. В дополнительном варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано здесь. В дополнительном варианте представлен способ модулирования мембранного транспорта хромофоров в ретиноидном цикле, включающий введение пациенту соединения, которое ингибирует образование 11-цис-ретинола, как описано здесь.
В дополнительном варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, включающий введение пациенту соединения Формулы (G) или таутомера, стереоизомера, геометрического изомера или фармацевтически приемлемого сольвата, гидрата, соли, N-оксида или их пролекарств.

в которой, Z представляет собой связь, -C(R1)(R2)-, -C(R9)(R10)-C(R1)(R2)-, -X-C(R31)(R32)-, -C(R9)(R10)-C(R1)(R2)-C(R36)(R37)- или X-C(R31)(R32)-C(R1)(R2)-;
X представляет собой -O-, -S-, -S(O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -C(=CH2)-, -C(=N-NR35)- или -C(=N-OR35)-;
G является выбранным из -C(R41)2-C(R41)2-R40, -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -С(=О)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила, или две R41 группы вместе могут формировать оксо;
каждый R42 является независимо выбранным из водорода или алкила;
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R36 и R37 вместе образуют оксо; или дополнительно, R36 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R36 и R1 вместе образуют прямую связь, и R37 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют имино;
R5 представляет собой C5-C15 алкил или карбоциклилалкил;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, CO2R13 или SO2NR24R25; или R7и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R9 и R1 вместе образуют прямую связь, и R10 и R2вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R23, -C(NH)NH2, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый R13, R22 и R23 является независимо выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35 каждый, независимо друг от друга, является водородом или алкилом;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероарилалкила или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4.
В дополнительном варианте представлен способ модулирования мембранного транспорта хромофоров в ретиноидном цикле, включающий введение пациенту соединения Формулы (G). В другом варианте представлен способ, приводящий к уменьшению липофусцинового пигмента, накопленного в глазу пациента. В другом варианте представлен способ, приводящий к уменьшению липофусцинового пигмента, накопленного в глазу пациента, в котором липофусциновым пигментом является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, приводящий к уменьшению липофусцинового пигмента, накопленного в глазу у пациента. В другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, приводящий к уменьшению липофусцинового пигмента, накопленного в глазу у пациента, при этом липофусциновым пигментом является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, при этом офтальмологическим заболеванием или нарушением является возрастная макулярная дегенерация или макулярная дистрофия Штаргардта. В другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, при этом офтальмологическое заболевание или нарушение является выбранным из отслоения сетчатки, геморрагической ретинопатии, пигментной дистрофии сетчатки, дистрофии Сорсби, невропатии зрительного нерва, воспалительного заболевания сетчатки, диабетической ретинопатии, закупорки кровеносного сосуда сетчатки, ретролентальной фиброплазии или ишемически-реперфузионного повреждения сетчатки, пролиферативной витреоретинопатии, дистрофии сетчатки, врожденной невропатии зрительного нерва, увеита, повреждения сетчатки, нарушения сетчатки, связанного с болезнью Альцгеймера, нарушения сетчатки, связанного с рассеянным склерозом, нарушения сетчатки, связанного с болезнью Паркинсона, нарушения сетчатки, связанного с вирусной инфекцией, нарушения сетчатки, связанного с чрезмерным воздействием света, миопии и нарушения сетчатки, связанного со СПИДом. В другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, приводящий к уменьшению липофусцинового пигмента, накопленного в глазу у пациента. В другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, описанного здесь приводящий к уменьшению липофусцинового пигмента, накопленного в глазу у пациента, при этом липофусциновым пигментом является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В другом варианте представлен способ ингибирования темновой адаптации палочковой фоторецепторной клетки сетчатки, включающий контактирование сетчатки с соединением Формулы (G). В другом варианте представлен способ ингибирования темновой адаптации палочковой фоторецепторной клетки сетчатки, включающий контактирование сетчатки с не ретиноидным соединением, как описано здесь. В другом варианте представлен способ ингибирования темновой адаптации палочковой фоторецепторной клетки сетчатки, включающий контактирование сетчатки с соединением, которое ингибирует образование 11-цис-ретинола, как описано здесь.
В другом варианте представлен способ ингибирования регенерации родопсина в палочковой фоторецепторной клетке сетчатки, который включает контактирование сетчатки с соединением Формулы (G). В другом варианте представлен способ ингибирования регенерации родопсина в палочковой фоторецепторной клетке сетчатки, который включает контактирование сетчатки с не ретиноидным соединением, как описано здесь. В другом варианте представлен способ ингибирования регенерации родопсина в палочковой фоторецепторной клетке сетчатки, который включает контактирование сетчатки с соединением, которое ингибирует образование 11-цис-ретинола, как описано здесь.
В другом варианте представлен способ снижения ишемии в глазу пациента, который включает введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение Формулы (G).
В дополнительном варианте представлен способ снижения ишемии в глазу пациента, который включает введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и не ретиноидное соединение, как описано здесь. В дополнительном варианте представлен способ снижения ишемии в глазу пациента, который включает введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано здесь. В другом варианте представлен способ снижения ишемии в глазу пациента, при этом фармацевтическая композиция вводится в условиях и времени, достаточных для ингибирования темновой адаптации палочковой фоторецепторной клетки, тем самым снижая ишемия в глазу.
В дополнительном варианте представлен способ ингибирования неоваскуляризации в сетчатке глаза у пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и не ретиноидное соединение, как описано здесь. В дополнительном варианте представлен способ ингибирования неоваскуляризации в сетчатке глаза у пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано здесь. В еще другом варианте представлен способ ингибирования неоваскуляризации в сетчатке глаза у пациента, при этом фармацевтическая композиция вводится в условиях и времени, достаточных для ингибирования темновой адаптации палочковой фоторецепторной клетки, тем самым ингибируя неоваскуляризацию сетчатки.
В дополнительном варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, включающий контактирование сетчатки с соединением Формулы (G). В дополнительном варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, включающий контактирование сетчатки с не ретиноидным соединением, как описано здесь. В дополнительном варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, включающий контактирование сетчатки с соединением, которое ингибирует образование 11-цис-ретинола, как описано здесь.
В другом варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, при этом ретинальной клеткой является нейрональная клетка. В еще другом варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, при этом нейрональной клеткой сетчатки является фоторецепторная клетка.
В другом варианте представлен способ уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение Формулы (G). В дополнительном варианте представлен способ уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, при этом липофусцином является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В дополнительном варианте представлен способ ингибирования уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и не ретиноидное соединение, как описано здесь. В дополнительном варианте представлен способ уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано здесь. В дополнительном варианте представлен способ уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, при этом липофусцином является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В дополнительном варианте представлен способ модулирования мембранного транспорта хромофора в ретиноидном цикле, включающий введение пациенту соединения Формулы (G) или таутомера, стереоизомера, геометрического изомера или фармацевтически приемлемого сольвата, гидрата, соли, N-оксида или их пролекарств:

в которой
Z представляет собой связь, -C(R1)(R2)-, -C(R9)(R10)-C(R1)(R2), -X-C(R31)(R32)-, -C(R9)(R10)-C(Rl)(R2)-C(R36)(R37)- или -X-C(R31)(R32)-C(R1)(R2)-;
Х представляет собой -O-, -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -C(=CH2)-, -C(=N-NR35)- или -C(=N-OR35)-;
G является выбранным из -C(R41)2-C(R41)2-R40, -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила, или две R41 группы вместе могут формировать оксо;
каждый R42 является независимо выбранным из водорода или алкила;
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R36 и R37 вместе образуют оксо; или дополнительно, R36 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R36 и R1 вместе образуют прямую связь, и R37 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют имино;
R5 представляет собой C1-C15 алкил или карбоциклилалкил;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, CO2R13 или SO2NR24R25; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R9 и R1 вместе образуют прямую связь, и R10 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R23, -C(NH)NH2, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый R13, R22 и R23 является независимо друг от друга выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35 каждый, независимо друг от друга, является водородом или алкилом;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероарилалкила или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4.
В другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, который включает введение пациенту соединения Формулы (G), при этом соединение Формулы (G) является выбранным из группы, состоящей из:























































































































































































Включение признаков путем ссылки
Все публикации, патенты и патентные заявки, приведенные в данном описании, включены здесь в виде ссылки в том же объеме, как если бы каждая отдельная публикация, патент или патентная заявка были специально и индивидуально включены в виде ссылки.
Краткое описание чертежей
Новые характеристики изобретения подробно изложены в прилагаемой формуле. Более полное понимание характеристик и преимуществ настоящего изобретения может быть получено при обращении к нижеследующему подробному описанию, которое предлагает иллюстративные варианты, использующие принципы изобретения, и сопровождающие чертежи, в которых:
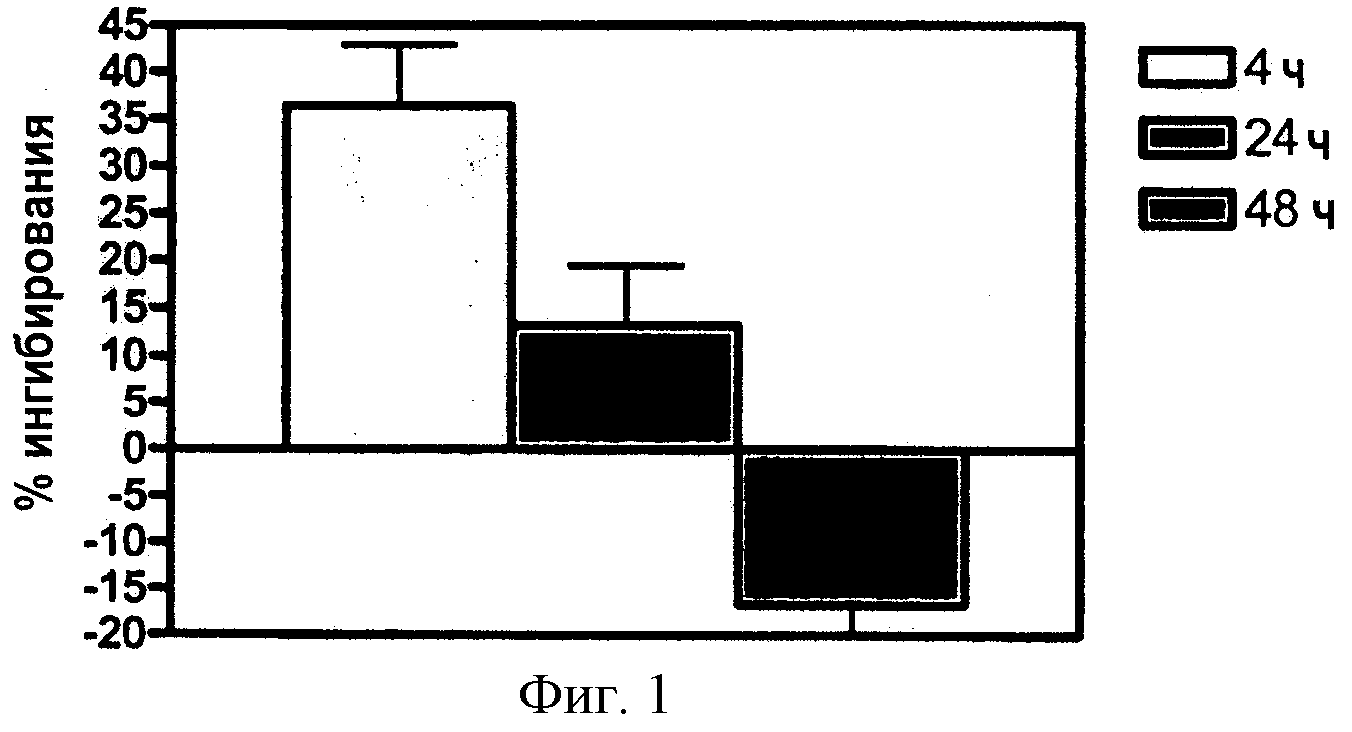
Фигура 1 иллюстрирует изомераз-ингибирующую активность соединения Примера 3 (Соединение 3). Животным орально через зонд вводили 1 мг/кг соединения, затем «фотообесцвечивали» (5000 Lux белого света в течение 10 мин) через 4,24 и 48 часов после введения дозы, после чего возвращали в темновое состояние для восстановления содержания 11-цис-ретиналя глаз. Мышей умерщвляли через 2 часа после обесцвечивания, глаза удаляли и содержание ретиноида анализировали с помощью ВЭЖХ.
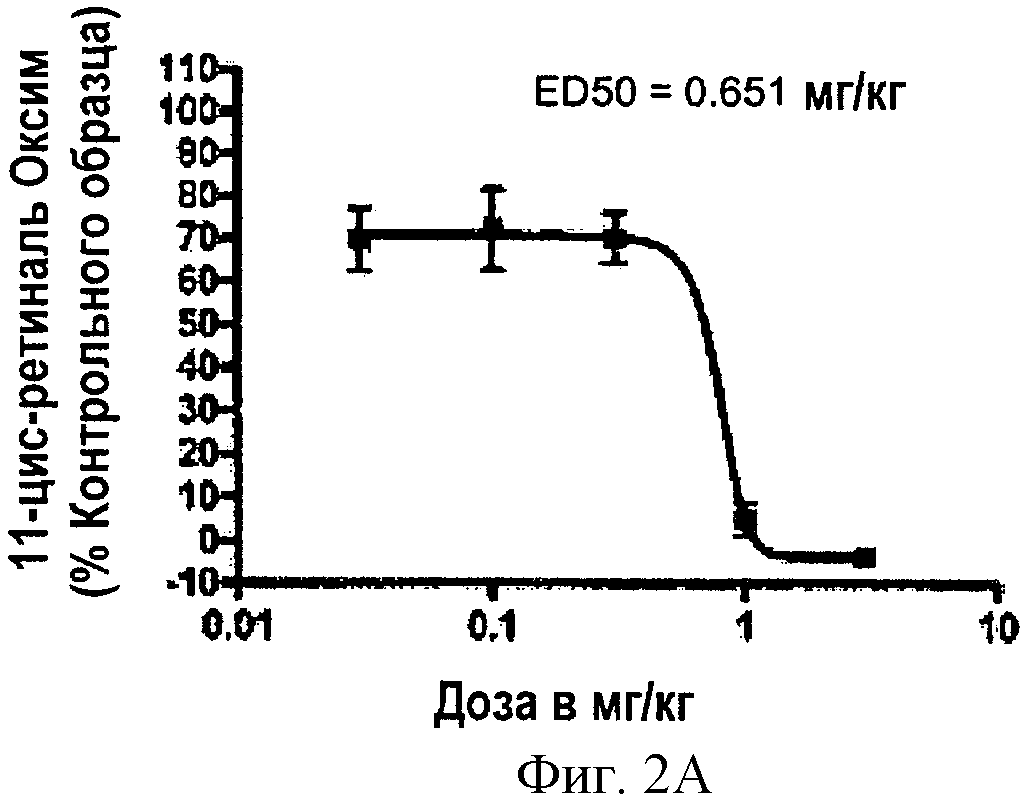
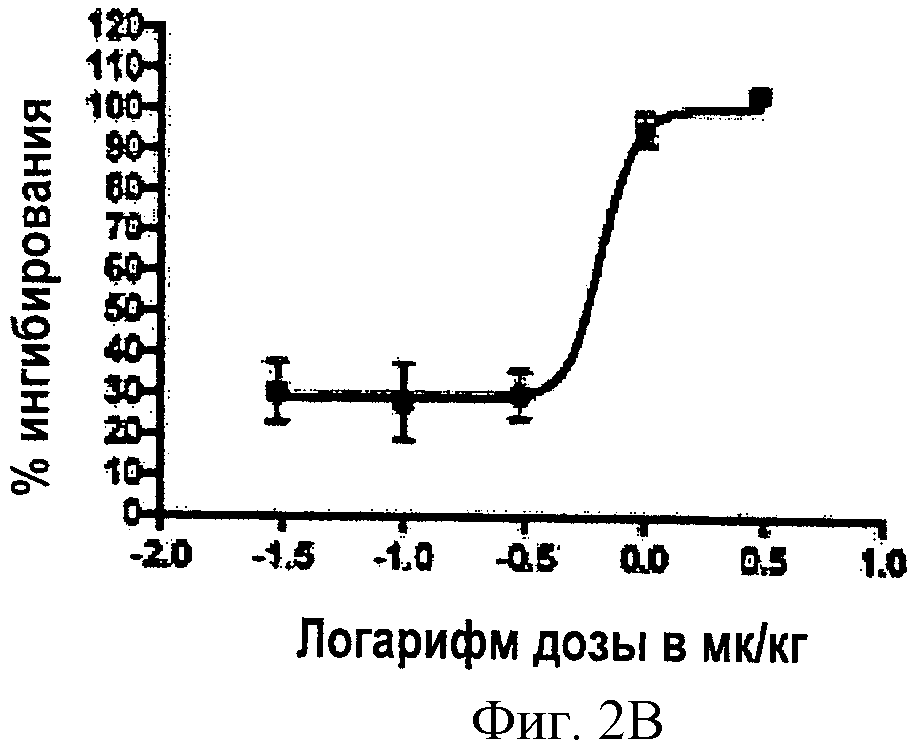
Фигура 2 иллюстрирует зависимость от концентрации ингибирования активности изомеразы соединением Примера 19 (Соединение 19). Фигура 2А показывает зависимое от концентрации ингибирование восстановления 11-цис-ретиналя (оксима). Фигура 2В показывает данные доза-эффект (логарифм дозы, мг/мл), которые приведены в процентах ингибирования активности изомеразы. Ингибирование восстановления было дозозависимым, с величиной ED50 (доза соединения, которое дает 50% ингибирования восстановления 11-цис-ретиналя (оксима)), установленной при 0.651 мг/кг. Пять животных было включено в экспериментальную группу. Планки погрешностей соответствуют стандартной ошибке.
Подробное описание изобретения
Представлено описание аминопроизводных соединений, которые ингибируют стадию изомеризации ретиноидного цикла. Эти соединения и композиции, включающие эти соединения, могут быть эффективными для ингибирования дегенерации ретинальных клеток или повышения выживаемости ретинальных клеток. Описанные здесь соединения, следовательно, являются эффективными в терапии офтальмологических заболеваний и нарушений, включающих ретинальные заболевания или нарушения, такие как возрастная макулярная дегенерация и болезнь Штаргардта.
I. Аминопроизводные соединения
В определенных вариантах обеспечены аминопроизводные соединения, включающие мета-замещенное окончание в азотсодержащей группе. Азотсодержащей группой может быть, например, амин, амид или N-гетероциклил. Связь включает три связывающих атома, включающих, по меньшей мере, два атома углерода и до одного гетероатома, такого как сера, кислород или азот. Эти связывающие атомы образуют комбинацию линейно построенных стабильных химических связей, включающих одинарные, двойные или тройные связи углерод-углерод, углерод-азот, азот-азот, углерод-кислород, углерод-сера и т.п.
Соответственно, в одном варианте представлено соединение Формулы (А) или таутомера, стереоизомера, геометрического изомера или фармацевтически приемлемого сольвата, гидрата, соли, TV-оксида или их пролекарств:

в которой
Z представляет собой связь, -C(R1)(R2)-, -C(R9)(R10)-C(R1)(R2)-, -X-C(R31)(R32)-, -C(R9)(R10)-C(R1)(R2)-C(R36)(R37)- или Х-С(R31)(R32)-C(R1)(R2)-;
Х представляет собой -O-, -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -C(=CH2)-, -C(=N-NR35)- или -C(=N-OR35)-;
G является выбранным из -C(R41)2-C(R41)2-R40, -С(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила или две R41 группы вместе могут формировать оксо;
каждый R42 является независимо выбранным из водорода или алкила;
R1 и R2 каждый, независимо друг от друга, являются выбранными из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, являются выбранными из водорода, С1-С5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, являются выбранными из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R36 и R37 вместе образуют оксо; или дополнительно, R36 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R36 и R1 вместе образуют прямую связь, и R37 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R3 и R4 каждый, независимо друг от друга, являются выбранными из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, являются выбранными из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, СО2R13 или SO2NR24R25; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, являются выбранными из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R9 и R1 вместе образуют прямую связь, и R10 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, являются выбранными из водорода, алкила, карбоциклила, -C(=O)R23, -C(NH)NH2, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый R13, R22 и R23 является независимо выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35 каждый, независимо друг от друга, является водородом или алкилом;
R20 и R21 каждый, независимо друг от друга, являются выбранными из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо друг от друга выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероарилалкила или фторалкила, или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным их водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4; при условии, что G не является незамещенным нормальным алкилом и при условии, что соединением Формулы А не являются:






или

В другом варианте представлено соединение Формулы (А), в которой
Z представляет собой связь, -С(R1)(R2)-, -C(R9)(R10)-C(R1)(R2)-, -Х-C(R31)(R32)-, -C(R9)(R10)-C(R1)(R2)-C(R36)(R37)- или Х-С(R31)(R32)-С(R1)(R2)-;
X является -O-, -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -C(=CH2)-, -C(=N-NR35)- или -C(=N-OR35)-;
R1 и R2 каждый, независимо друг от друга, являются выбранными из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, являются выбранными из водорода, C1-C5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, являются выбранными из водорода, галогена, С1-С5 алкила, фторалкила, -OR6 или NR7R8; или R36 и R37 вместе образуют оксо;
R3 и R4 каждый, независимо друг от друга, являются выбранными из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, CO2R13 или SO2NR24R25; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, являются выбранными из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо;
R11 и R12 каждый, независимо друг от друга, являются выбранными из водорода, алкила, карбоциклила, C(=O)R23, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый R13, R22 и R23 независимо является выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35 являются независимо друг от друга водородом или алкилом;
R20 и R21 каждый, независимо друг от друга, являются выбранными из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 независимо является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
каждый R33 независимо является выбранным из галогено, OR34, алкила или фтоалкила; и n равно 0, 1, 2, 3 или 4.
В другом варианте представлено соединение Формулы (А), имеющее структуру Формулы (В)

в которой,
Z представляет собой -C(R9)(R10)-C(R1)(R2)- или -O-C(R31)(R32)-;
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода или алкила; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R13; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 вместе образуют оксо; или дополнительно, R9 и R10 вместе образуют прямую связь для обеспечения двойной связи, или дополнительно, R9 и R1 вместе образуют прямую связь, и R9 и R1 вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R23; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R13, R22 и R23 является независимо выбранным из алкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, и R34 независимо друг от друга являются водородом или алкилом;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R22; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила.
В другом варианте представлено соединение Формулы (В), в которой
Z представляет собой -C(R9)(R10)-C(R1)(R2)- или -O-C(R31)(R32)-;
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода или алкила; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R13; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, OR19, -NR20R21 или карбоциклила; или R9 и R10 вместе образуют оксо;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R23; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R13, R22 и R23 является независимо выбранным из алкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19 и R34 являются независимо выбранными из водорода или алкила;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R22; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила.
В другом варианте представлено соединение Формулы (В), в которой
G является выбранным из -C(R41)2-C(R41)2-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила, или две R41 группы вместе могут формировать оксо.
В другом варианте представлено соединение Формулы (В), в которой
G является выбранным из -C(R41)2-C(R41)2-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила,
или две R41 группы вместе могут формировать оксо.
В другом варианте представлено соединение Формулы (В), которое имеет структуру Формулы (С)

в которой,
Z представляет собой -C(R9)(R10)-C(R1)(R2)- или -O-C(R31)(R32)-;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероарилалкила или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
R1 и R2 каждый, независимо друг от друга, являются выбранными из водорода, галогена, С1-С5 алкила, фторалкила, -OR6 или NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода или алкила; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R13; или R7 и R8, вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 вместе образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно R9 и R1 вместе образуют прямую связь, и R10 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R23; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R13, R22 и R23 является независимо выбранным из алкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19 и R34 являются независимо водородом или алкилом;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R22; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила.
В другом варианте представлено соединение Формулы (С), в которой
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 вместе образуют оксо.
В другом варианте представлено соединение Формулы (С), которое имеет структуру Формулы (D)

в которой
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R1 и R2 вместе образуют оксо;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода или алкила; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R13; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 вместе образуют оксо;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R23; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый R13, R22 и R23 является независимо выбранным из алкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19 и R34 являются независимо выбранными из водорода или алкила;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R22; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил, и
каждый R24, R25, R26, R27, R28 и R29 независимо является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, C1-C13 алкила, гало или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4; и
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила.
В другом варианте представлено соединение Формулы (D), в которой n равно 0 и каждый из R11 и R12 является водородом. В другом варианте представлено соединение, в котором каждый из R3, R4, R14 и R15 является водородом. В еще другом варианте представлено соединение, в котором
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила или -OR6;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила или -OR19; или R9 и R10 вместе образуют оксо;
R6 и R19 каждый, независимо друг от друга, является водородом или алкилом;
R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл; и
R18 является выбранным из водорода, алкокси или гидрокси.
В другом варианте представлено соединение, в котором R16 и R17, вместе с атомом углерода, к которому они присоединены, образуют циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, и R18 является водородом или гидрокси.
В другом варианте представлено соединение Формулы (D), в которой R11 является водородом и R13 является -C(=O)R23, где R23 представляет собой алкил.
В другом варианте представлено соединение Формулы (D), в которой
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила или -OR6;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила или -OR19; или R9 и R10 вместе образуют оксо;
R6 и R19 каждый, независимо друг от друга, является выбранным из водорода или алкила;
R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил; и
R18 является водородом, гидрокси или алкокси.
В еще другом варианте представлено соединение Формулы (D), в которой n равно 0;
R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют циклопентил, циклогексил или циклогексил; и
R18 является водородом или гидрокси.
В еще другом варианте представлено соединение Формулы (D), в которой
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила или -OR6;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила или -OR19; или R9 и R10 вместе образуют оксо;
R6 и R19 каждый, независимо друг от друга, является выбранным из водорода или алкила;
R16 и R17 независимо являются выбранным из C1-C13 алкила; и
R18 является водородом, гидрокси или алкокси.
В другом варианте представлено соединение Формулы (С), которое имеет структуру Формулы (Е):

в которой,
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода или алкила; или R3 и R4 вместе образуют имино;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R23; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R23 является выбранным из алкила, алкенила, арила, карбоциклила, гетероарила или гетероциклила;
R14 и R15 каждый, независимо друг от друга, является выбранным из водорода или алкила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, С1-C13 алкила, гало или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
R34 является водородом или алкилом; и
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4.
В другом варианте представлено соединение Формулы (Е), в котором n равно 0 и каждый из R11 и R12 является водородом.
В другом варианте представлено соединение Формулы (Е), в котором каждое из R3, R4, R14 и R15 является водородом.
В другом варианте представлено соединение Формулы (Е), в которой
R31 и R32 каждый, независимо друг от друга, является водородом или C1-C5 алкилом;
R16 и R17, вместе с атомом углерода, к которому они присоединены, образуют карбоциклил; и
R18 является водородом, гидрокси или алкокси.
В еще другом варианте представлено соединение Формулы (Е), в которой R16 и R17, вместе с атомом углерода, к которому они присоединены, образуют циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, и R18 представляет собой водород или гидрокси.
В еще другом варианте представлено соединение Формулы (Е), в которой R31 и R32 каждый, независимо друг от друга, является выбранным из водорода или C1-C5 алкила; и R18 является водородом, гидрокси или алкокси.
В еще другом варианте представлено соединение Формулы (Е), в которой R31 и R32 каждый, независимо друг от друга, является водородом или C1-С5 алкилом;
R6 и R19 каждый, независимо друг от друга, является водородом или алкилом;
R16 и R17 каждый, независимо друг от друга, является выбранными из С1-С13 алкила; и
R18 является водородом, гидрокси или алкокси.
В другом варианте представлено соединение Формулы (А), в которой
Z является связью, -X-C(R31)(R32)- или -X-C(R31)(XR32)-C(R1)(R2)-; и
Х является -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -C(=CH2)-, -C(=N-NR35)- или -C(=N-OR35)-.
В еще другом варианте представлено соединение Формулы (А), в которой G является выбранным из -C(R41)2-C(R41)2-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила, или две R41 группы вместе могут формировать оксо.
В другом варианте представлено соединение Формулы (А), которое имеет структуру Формулы (F):

в которой
Х представляет собой -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -С(=O)-, -C(=CH2)-, -C(=N-NR35)- или -C(=N-OR35)-;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода или алкила; или R3 и R4 вместе образуют имино;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила или -C(=O)R23; или R11 и R12, вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R23 является выбранным из алкила, алкенила, арила, карбоциклила, гетероарила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, C1-C13 алкила, гало или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R30, R34 и R35 каждый, независимо является водородом или алкилом;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 независимо является выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4.
В еще другом варианте представлено соединение Формулы (F), в которой n равно 0 и каждый R11 и R12 является водородом.
В еще другом варианте представлено соединение Формулы (F), в которой каждый R3, R4, R14 и R15 является водородом.
В еще другом варианте представлено соединение Формулы (F), в которой
R31 и R32 каждый, независимо друг от друга, является водородом или C1-C5 алкилом;
R16 и R17, вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл; и
R18 является водородом, гидрокси или алкокси.
В еще другом варианте представлено соединение Формулы (F), в которой R16 и R17, вместе с атомом углерода, к которому они присоединены, образуют циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, и R18 является водородом или гидрокси.
В еще другом варианте представлено соединение Формулы (F), в которой R31 и R32, каждый, независимо друг от друга, является выбранным из водорода или C1-C5 алкила; R16 и R17 являются независимо выбранными из C1-C13 алкила; и R18 является водородом, гидрокси или алкокси.
В одном варианте представлено соединение, которое имеет структуру Формулы (I):

в качестве таутомера или смеси таутомеров, или в качестве фармацевтически приемлемой соли, гидрата, сольвата, N-оксида или их пролекарств, в которой:
R1 и R2 каждый, являются одинаковыми или разными и независимо друг от друга являются водородом, галогеном, C1-C5 алкилом, фторалкилом, -OR6, -NR7R8 или R1 и R2 образуют оксо;
R3 и R4 являются одинаковыми или разными и независимо друг от друга являются водородом или алкилом;
R5 является C5-C15 алкилом, аралкилом, гетероциклилалкилом, гетероарилалкилом или карбоциклилалкилом;
R6 является водородом или алкилом;
R7 и R8 являются одинаковыми или разными и каждый независимо представляет собой водород, алкил, карбоциклил или -C(=O)R13; или
R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
Х является -C(R9)(R10)- или -O-;
R9 и R10 являются одинаковыми или разными и независимо друг от друга представляют собой водород, галоген, алкил, фторалкил, -OR6, -NR7R8 или карбоциклил; или R9 и R10 вместе образуют оксо;
R11 и R12 являются одинаковыми или разными и независимо представляют собой водород, алкил или -C(=O)R13; или
R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
R13 является алкилом, алкенилом, арилом, карбоциклилом, гетероарилом или гетероциклилом.
В другом варианте представлено соединение Формулы (I), которое имеет структуру Формулы (Iа):

в виде таутомера или смеси таутомеров, или в виде фармацевтически приемлемой соли, гидрата, сольвата, N-оксида или их пролекарств, в которой:
R1 и R2 каждый, являются одинаковыми или разными, и независимо представляют собой водород, галоген, C1-C5 алкил, фторалкил, -OR6 или -NR7R8; или R1 и R2 образуют оксо;
R3 и R4 каждый, являются одинаковыми или разными, и независимо представляют собой водород или алкил;
R5 является C5-C15 алкилом, аралкилом, гетероциклилалкилом, гетероарилалкилом или карбоциклилалкилом;
R6 является водородом или алкилом;
R7 и R8 каждый, являются одинаковыми или разными, и независимо представляют собой водород, алкил, карбоциклил или -C(=O)R13; или
R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, являются одинаковыми или разными, и независимо представляют собой водород, галоген, алкил, фторалкил, -OR6, -NR7R8 или карбоциклил; или R9 и R10образуют оксо;
R11 и R12 каждый, являются одинаковыми или разными, и независимо представляют собой водород, алкил или -C(=O)R13; или
R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
R13 является алкилом, алкенилом, арилом, карбоциклилом, гетероарилом или гетероциклилом.
В еще другом варианте представлено соединение Формулы (Iа), в которой каждый из R11 и R12 является водородом.
В еще другом варианте представлено соединение Формулы (Ia), в которой каждый из R9 и R10 независимо является водородом, галогеном, алкилом или -OR6, где R6является водородом или алкилом.
В еще другом варианте представлено соединение Формулы (Iа), в которой R5является С5-С9 алкилом, аралкилом или карбоциклилалкилом.
В еще другом варианте представлено соединение Формулы (Iа), в которой
каждый из R1, R2, R3 и R4 является водородом;
каждый из R9 и R10 независимо является водородом или -OR6, где R6 является водородом или алкилом; и
R5 является С5-С9 алкилом.
В еще другом варианте представлено соединение Формулы (Iа), в которой R5является С5-С9 алкилом, замещенным -OR6, где R6 является водородом или алкилом.
В еще другом варианте представлено соединение Формулы (Iа), в которой
каждый из R1, R2, R3 и R4 является водородом;
каждый из R9 и R10 независимо является водородом или -OR6, где R6 является водородом или алкилом; и
R5 является аралкилом.
В еще другом варианте представлено соединение Формулы (Iа), в которой
каждый из R1, R2, R3 и R4 является водородом;
каждый из R9 и R10 независимо является водородом или -OR6, где R6 является водородом или алкилом; и
R5 является карбоциклилалкилом.
В другом варианте представлено соединение Формулы (I), которое имеет структуру Формулы (Ib):

в виде таутомера или смеси таутомеров, или в виде фармацевтически приемлемой соли, гидрата, сольвата, N-оксида или их пролекарств, в которой:
R1 и R2 являются одинаковыми или разными, или независимо представляют собой водород, C1-C5 алкил или фторалкил;
R3 и R4 являются одинаковыми или разными, или независимо представляют собой водород или алкил;
R5 представляет собой C5-C15 алкил, аралкил, гетероциклилалкил, гетероарилалкил или карбоциклилалкил;
R11 и R12 являются одинаковыми или разными, или независимо представляют собой водород, алкил или -C(=O)R13; или
R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и R13 является алкилом, алкенилом, арилом, карбоциклилом, гетероарилом или гетероциклилом.
В другом варианте представлено соединение Формулы (Ib), в которой R11 и R12являются водородом.
В другом варианте представлено соединение Формулы (Ib), в которой R3 и R4являются водородом.
В другом варианте представлено соединение Формулы (Ib), в которой каждый из R, R2, R3 и R4 является водородом, и
R5 является C5-C9 алкилом, карбоциклилалкилом, гетероарилалкилом или гетероциклилалкилом.
В еще другом варианте представлено соединение Формулы (I), выбранное из группы, состоящей из:
3-(3-пентилфенил)пропан-1-амин;
3-(3-гексилфенил)пропан-1-амин;
3-(3-(3,3-диметилбутил)фенил)пропан-1-амин;
3-(3-(октан-4-ил)фенил)пропан-1-амин;
4-(3-(3-аминопропил)фенил)бутан-1-ол;
6-(3-(3-аминопропил)фенил)гексан-1-ол;
3-(3-(6-метоксигексил)фенил)пропан-1-амин;
4-(3-(3-аминопропил)фенетил)гептан-4-ол;
1-(3-(3-аминопропил)фенил)-3-этилпентан-3-ол;
4-(3-(3-аминопропил)фенил)-2-метилбутан-2-ол;
3-(3-(3-аминопропил)фенил)пропан-1-ол;
3-(3-(3-метоксипропил)фенил)пропан-1-амин;
1-(3-(3-аминопропил)фенил)гексан-3-ол;
4-(3-(3-амино-1-гидроксипропил)фенетил)гептан-4-ол;
3-(3-(2,6-диметилфенетил)фенил)пропан-1-амин;
3-(3-фенетилфенил)пропан-1-амин;
3-(3-(3-фенилпропил)фенил)пропан-1-амин;
3-амино-1-(3-(3-фенилпропил)фенил)пропан-1-ол;
3-(3-(2-метилфенетил)фенил)пропан-1-амин;
3-(3-(2-(бифенил-3-ил)этил)фенил)пропан-1-амин;
3-(3-(4-фенилбутил)фенил)пропан-1-амин;
3-(3-(2-(нафтален-2-ил)этил)фенил)пропан-1-амин;
3-(3-(2-циклогексилэтил)фенил)пропан-1-амин;
3-(3-(2-циклопентилэтил)фенил)пропан-1-амин;
3-амино-1-(3-(2-циклопентилэтил)фенил)пропан-1-ол;
1-(3-(3-аминопропил)фенетил)циклогексанол;
1-(3-(3-амино-1-гидроксипропил)фенетил)циклогексанол;
1-(3-(3-аминопропил)фенетил)циклогептанол;
1-(3-(3-амино-1-гидроксипропил)фенетил)циклогептанол;
4-(3-(2-аминоэтокси)фенетил)гептан-4-ол;
1-(3-(2-аминоэтокси)фенетил)циклогексанол;
1-(3-(2-аминоэтокси)фенетил)циклогептанол;
4-(3-(2-аминоэтокси)фенетил)тетрагидро-2Н-тиопиран-4-ол;
6-(3-(2-аминоэтокси)фенил)гексан-1-ол;
2-(3-(3-циклопентилпропил)фенокси)этанамин;
2-(3-(2-(пиридин-3-ил)этил)фенокси)этанамин;
2-(3-(2-(пиридин-2-ил)этил)фенокси)этанамин; и
2-(3-(2-(тиофен-2-ил)этил)фенокси)этанамин.
В другом варианте представлено соединение Формулы (В), в которой
G является выбранным из -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
R42 является выбранным из водорода или алкила.
В другом варианте представлено соединение Формулы (В), в которой
G является выбранным из -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
R42 является выбранным из водорода или алкила.
В другом варианте представлено соединение Формулы (В), в которой
G является выбранным из -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40.
В другом варианте представлено соединение Формулы (В), в которой
G является выбранным из -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40.
В другом варианте представлено соединение Формулы (В), в которой
G является выбранным из -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40.
В другом варианте представлено соединение Формулы (В), в которой
R42 является водородом или C1-С3 алкилом; и
R40 является арилом или гетероарилом.
В другом варианте представлено соединение Формулы (В), в которой
R40 является выбранным из -C(R16)(R17)(R18);
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероарилалкила или фторалкила; и
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила.
В другом варианте представлено соединение Формулы (В), в которой
R40 является выбранным из -C(R16)(R17)(R18);
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероарилалкила или фторалкила; или R16 иR17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила.
В дополнительном варианте представлено соединение Формулы (А), в которой один, или более одного, или все необмениваемые атомы1Н были замещены атомами2H.
В другом варианте представлено соединение Формулы (А), выбранное из группы, состоящей из:






















































































































































































В одном варианте представлена фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение Формулы (А) или таутомер, стереоизомер, геометрический изомер, или фармацевтически приемлемый сольват, гидрат, соль, N-оксид или их пролекарства:

в которой
Z является связью, -C(R1)(R2)-, -C(R9)(R10)-C(R1)(R2)-, -X-C(R31)(R32)-, -C(R9)(R10)-C(R1)(R2)-C(R36)(R37)- или -X-C(R31)(R32)-C(R1)(R2)-;
X представляет собой -O-, -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -C(=CH2)-, -C(=N-NR35)- или -C(=N-OR35)-;
G является выбранным из -C(R41)2-C(R41)2-R40, -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила или две R41 группы вместе могут формировать оксо;
каждый R42 является независимо выбранным из водорода или алкила;
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R36 и R37 вместе образуют оксо; или дополнительно, R36 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R36 и R1 вместе образуют прямую связь, и R36 и R1 вместе образуют прямую связь для обеспечения тройной связи;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, СО2R13 или SO2NR24R25; или R7 и R8 вместе а атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R9 и R1 вместе образуют прямую связь, и R10 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(O)R23, -C(NH)NH2, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12, вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый R13, R22 и R23 независимо является выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35 каждый, независимо является водородом или алкилом;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероариалкила или фторалкила; или R16 и R17 вместе с углеродом, к которому они присоединены, образует карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 является независимо выбранным из водорода, OR34, алкила или фторалкила; или n равно 0, 1, 2, 3 или 4; при условии, что G не является незамещенным нормальным алкилом и при условии, что соединением Формулы А не является:






или

В дополнительном варианте представлено не ретиноидное соединение, которое ингибирует реакцию изомеризации, что приводит к образованию 11-цис-ретинола, при этом указанная реакция изомеризации возникает в ПЭС, и при этом указанное соединение имеет величину ED50, равную 1 мг/кг или менее при введении пациенту. В другом варианте представлено не ретиноидное соединение, в котором величина ED50 измеряется после введения однократной дозы соединения указанному пациенту в течение 2 часов или более. В другом варианте представлено не ретиноидное соединение, при этом не ретиноидным соединением является алкоксильное соединение. В дополнительном варианте представлена фармацевтическая композиция, включающая фармацевтически приемлемый носитель и не ретиноидное соединение, как описано здесь. В дополнительном варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и не ретиноидное соединение, как описано здесь.
В дополнительном варианте представлено соединение, которое ингибирует образование 11-цис-ретинола с величиной IС50, равной примерно 1 мкМ или менее при анализе in vitro, с использованием экстракта клеток, которые экспрессируют RPE65 и LRAT, при этом экстракт, кроме того, включает CRALBP, и при этом соединение остается стабильным в растворе в течение, по меньшей мере, 1 недели при комнатной температуре. В еще другом варианте соединение ингибирует образование 11-цис-ретинола с величиной IC50, равной примерно 0.1 мкМ или менее. В еще другом варианте соединение ингибирует образование 11-цис-ретинола с величиной IC50, равной примерно 0.01 мкМ или менее. В нщн другом варианте соединением, которое ингибирует образование 11-цис-ретинола, является не ретиноидное соединение. В дополнительном варианте представлена фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано здесь. В дополнительном варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано здесь. В дополнительном варианте представлен способ модулирования транспорта хромофора в ретиноидном цикле, включающий введение пациенту соединения, которое ингибирует образование 11-цис-ретинола, как описано здесь.
В дополнительном варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, который включает введение пациенту соединения Формулы (G) или таутомера, стереоизомера, геометрического изомера или фармацевтически приемлемого сольвата, гидрата, соли, N-оксида или их пролекарств:

в которой
Z представляет собой связь, -C(R1)(R2)-, -C(R9)(R10)-C(R1)(R2)-, -X-C(R31)(R32)-, -C(R9)(R10)-C(R1)(R2)-C(R36)(R37)- или -X-C(R31)(R32)-C(R1)(R2)-;
X является -O-, -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -C(=CH2)-, -C(=N-NR35)-, или -C(=N-OR35)-;
G является выбранным из -C(R41)2-C(R41)2-R40, -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18); арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила или две R41 группы вместе могут формировать оксо;
каждый R42 независимо является выбранным из водорода или алкила;
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R36 и R37 вместе образуют оксо; или дополнительно R36 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R36 и R1 вместе образуют прямую связь, и R37 и R2вместе образуют прямую связь для обеспечения тройной связи;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют имино;
R5 представляет собой C5-C15 алкил или карбоциклилалкил;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, CO2R13 или SO2NR24R25; или R7и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R10 и R2 вместе образуют прямую связь, и R9 и R1 вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R23, -C(NH)NH2, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12, вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый R13, R22 и R23 является независимо выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35 каждый, независимо является водородом или алкилом;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероариалкила или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 является независимо выбранным из водорода, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4.
В дополнительном варианте представлен способ модулирования транспорта хромофора в ретиноидном цикле, включающий введение пациенту соединения Формулы (G). В другом варианте представлен способ, в результате которого происходит уменьшение липофусцинового пигмента, накопленного в глазу пациента. В еще другом варианте представлен способ, в результате которого происходит уменьшение липофусцинового пигмента, накопленного в глазу пациента, при этом липофусциновым пигментом является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, в результате которого происходит уменьшение липофусцинового пигмента, накопленного в глазу пациента. В еще другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, в результате которого происходит уменьшение липофусцинового пигмента, накопленного в глазу пациента, при этом липофусциновым пигментом является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В еще другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, при этом офтальмологическим заболеванием или нарушением является возрастная макулярная дегенерация или макулярная дистрофия Штаргардта. В еще другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, при этом офтальмологическое заболевание или нарушение является выбранным из отслоения сетчатки, геморрагической ретинопатии, пигментной дистрофии сетчатки, колбочко-палочковой дистрофии, дистрофии Сорсби, невропатии зрительного нерва, воспалительного заболевания сетчатки, диабетической ретинопатии, диабетической макулопатии, закупорки кровеносного сосуда сетчатки, ретролентальной фиброплазии или ишемически-реперфузионного повреждения, пролиферативной витреоретинопатии, ретинальной дистрофии, врожденной невропатии зрительного нерва, дистрофии Сорсби, увеита, повреждения сетчатки, ретинального нарушения, связанного с болезнью Альцгеймера, ретинального нарушения, связанного с множественным склерозом, ретинального нарушения, связанного с болезнью Паркинсона, ретинального нарушения, связанного с вирусной инфекцией, ретинального нарушения, связанного с сильным воздействием света, миопии и ретинального нарушения, связанного со СПИДом. В еще другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, в результате которого происходит уменьшение липофусцинового пигмента, накопленного в глазу пациента. В еще другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, в результате которого происходит уменьшение липофусцинового пигмента, накопленного в глазу пациента, при этом липофусциновым пигментом является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В другом варианте представлен способ ингибирования темновой адаптации палочковой фоторецепторной клетки сетчатки, включающий контактирование сетчатки с соединением Формулы (G). В другом варианте представлен способ ингибирования темновой адаптации палочковой фоторецепторной клетки сетчатки, включающий контактирование сетчатки с не ретиноидным соединением, как описано здесь. В другом варианте представлен способ ингибирования темновой адаптации палочковой фоторецепторной клетки сетчатки, включающий контактирование сетчатки с соединением, которое ингибирует образование 11-цис-ретинола, как описано здесь.
В другом варианте представлен способ ингибирования регенерации родопсина в палочковой фоторецепторной клетке сетчатки, включающий контактирование сетчатки с соединением Формулы (G). В другом варианте представлен способ ингибирования регенерации родопсина в палочковой фоторецепторной клетке сетчатки, включающий контактирование сетчатки с не ретиноидным соединением, как описано здесь. В другом варианте представлен способ ингибирования регенерации родопсина в палочковой фоторецепторной клетке сетчатки, включающий контактирование сетчатки с соединением, которое ингибирует образование 11-цис-ретинола, как описано здесь.
В другом варианте представлен способ снижения ишемии в глазу пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение Формулы (G).
В дополнительном варианте представлен способ снижения ишемии в глазу пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и не ретиноидное соединение, как описано здесь. В дополнительном варианте представлен способ снижения ишемии в глазу пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано здесь. В еще другом варианте представлен способ снижения ишемии в глазу пациента, при этом фармацевтическая композиция вводится в условиях и времени, достаточных для ингибирования темновой адаптации палочковой фоторецепторной клетки, тем самым приводя к снижению ишемии в глазу.
В дополнительном варианте представлен способ ингибирования неоваскуляризации в сетчатке глаза пациента, включающий введение пациенту фармацевтической композиции, содержащей фармацевтически приемлемый носитель и не ретиноидное соединение, как описано здесь. В дополнительном варианте представлен способ ингибирования неоваскуляризации в сетчатке глаза пациента, включающий введение пациенту фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано здесь. В еще другом варианте представлен способ ингибирования неоваскуляризации в сетчатке глаза пациента, при этом фармацевтическая композиция вводится в условиях и времени, достаточных для ингибирования темновой адаптации палочковой фоторецепторной клетки, что приводит к ингибированию неоваскуляризацию сетчатки.
В дополнительном варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, включающий контактирование сетчатки с соединением Формулы (G). В дополнительном варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, включающий контактирование сетчатки с не ретиноидным соединением, как описано здесь. В дополнительном варианте представлен способ ингибирования дегенерации клетки сетчатки, включающий контактирование сетчатки с соединением, которое ингибирует образование 11-цис-ретинола, как описано здесь.
В другом варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, при этом ретинальной клеткой является нейрональная клетка сетчатки. В другом варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, при этом нейрональной клеткой сетчатки является фоторецепторная клетка.
В другом варианте представлен способ уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение Формулы (G). В дополнительном варианте представлен способ уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, в котором липофусцином является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В дополнительном варианте представлен способ ингибирования уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и не ретиноидное соединение, как описано здесь. В дополнительном варианте представлен способ уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано здесь. В дополнительном варианте представлен способ уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, при этом липофусцином является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В дополнительном варианте представлен способ модулирования мембранного транспорта хлорофоров в ретиноидном цикле, включающий введение пациенту соединения Формулы (G) или таутомера, стереоизомера, геометрического изомера или фармацевтически приемлемого сольвата, гидрата, соли, N-оксида или их пролекарств:

в которой Z является связью, -C(R1)(R2)-, -C(R9)(R10)-C(R1)(R2)-, -Х-С(R31)(R32)-, -С(R9)(R10)-C(R1)(R2)-C(R36)(R37)- или -X-C(R31)(R32)-C(R1)(R2)-;
X является -O-, -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -С(=СН2)-, -C(=N-NR35)-, или -C(=N-OR35)-;
G является выбранным из -С(R41)2-С(R41)2-R40, -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила, или две R41 группы вместе могут формировать оксо;
каждый R42 является независимо выбранным из водорода или алкила;
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-С5 алкила, фторалкила, -OR6 или -NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R36 и R37 вместе образуют оксо; или дополнительно, R36 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R36 и R1 вместе образуют прямую связь, и R37 и R2вместе образуют прямую связь для обеспечения тройной связи;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют имино;
R5 является C5-C15 алкилом или карбоциклилалкилом;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, CO2R13 или SO2NR24R25; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R9 и R1 вместе образуют прямую связь, и R10 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R23, -C(NH)NH2, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12, вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый R13, R22 и R23 является независимо выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35 каждый, независимо является водородом или алкилом;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероариалкила или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 является независимо выбранным из водорода, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4.
В еще другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, включающий введение пациенту соединения Формулы (G), при этом соединение Формулы (G) является выбранным из группы, состоящей из:



























































































































































































В определенных вариантах обеспечены аминопроизводные соединения, содержащие мета-замещенное окончание в азотсодержащей группе. Азотсодержащая группа может быть, например, амином, амидом или N-гетероциклилом. Связь включает три связывающих атома, включающих, по меньшей мере, два атома углерода и до одного гетероатома, например, серу, кислород и азот. Эти связывающие атомы образуют комбинацию линейно построенных стабильных химических связей, включающих одинарные, двойные или тройные углерод-углеродные связи, углерод-азотные связи, азот-азотные связи, связи углерод-кислород, связи углерод-сера и т.п.
Таким образом, соединения могут быть представлены Формулой (I)

в качестве таутомера или смеси таутомеров, или в качестве фармацевтически приемлемой соли, гидрата, сольвата, N-оксида или их пролекарств, в которой:
R1 и R2 каждый являются одинаковыми или разными и независимо друг от друга являются водородом, галогеном, C1-C5 алкилом, фторалкилом, -OR6, -NR7R8 или
R1 и R2 образуют оксо;
R3 и R4 являются одинаковыми или разными и независимо друг от друга являются водородом или алкилом;
R5 является C5-C15 алкилом, аралкилом, гетероциклилалкилом, гетероарилалкилом или карбоциклилалкилом;
R6 является водородом или алкилом;
R7 и R8 являются одинаковыми или разными и каждый независимо представляет собой водород, алкил, карбоциклил или -C(=O)R13; или
R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
Х является -C(R9)(R10)- или -O-;
R9 и R10 являются одинаковыми или разными и независимо друг от друга представляют собой водород, галоген, алкил, фторалкил, -OR6, -NR7R8 или карбоциклил; или
R9 и R10 вместе образуют оксо;
R11 и R12 являются одинаковыми или разными и независимо представляют собой водород, алкил или -C(=O)R13; или
R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
R13 является алкилом, алкенилом, арилом, карбоциклилом, гетероарилом или гетероциклилом.
В определенных вариантах, каждый из R11 и R12 является водородом.
В других вариантах, R11 является водородом и R12 является -C(=O)R13, где R13 является алкилом.
В определенных вариантах, каждый из R3 и R4 является водородом.
В других определенных вариантах, R1 и R2 каждый, независимо друг от друга, является водородом, галогеном, C1-C5 алкилом или -OR6, где R6 является водородом или алкилом.
В других вариантах R9 и R10 каждый, независимо друг от друга, является водородом, галогеном, алкилом или -OR6, где R6 является водородом или алкилом.
В других особых вариантах, каждый из R1, R2, R9 и R10 является независимо водородом или -OR6, где R6 является водородом или алкилом.
В другом особом варианте R9 и R10 вместе образуют оксо.
В других определенных вариантах R5 является С5-С9 алкилом.
В еще других вариантах R5 является аралкилом.
В других вариантах R5 является гетероариалкилом.
В еще других вариантах R5 является гетероциклилалкилом.
В других определенных вариантах R5 является карбоциклилалкилом.
В одном варианте Х является -C(R9)(R10)- и соединение Формулы (I) может быть представлено структурой Формулы (Iа):

в виде таутомера или смеси таутомеров, или в виде фармацевтически приемлемой соли, гидрата, сольвата, N-оксида или их пролекарств, в которой:
R1 и R2 являются одинаковыми или разными, и независимо представляют собой водород, галоген, C1-C5 алкил, фторалкил, -OR6 или -NR7R8; или
R1 и R2 образуют оксо;
R3 и R4 являются одинаковыми или разными, и независимо представляют собой водород или алкил;
R5 является C5-C15 алкилом, аралкилом, гетероциклилалкилом, гетероарилалкилом или карбоциклилалкилом;
R6 является водородом или алкилом;
R7 и R8 является одинаковыми или разными, и независимо представляют собой водород, алкил, карбоциклил или -C(=O)R13; или
R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 являются одинаковыми или разными, и независимо представляют собой водород, галоген, алкил, фторалкил, -OR6, -NR7R8 или карбоциклил; или
R9 и R10 образуют оксо;
R11 и R12 являются одинаковыми или разными, и независимо представляют собой водород, алкил или -C(=O)R13; или
R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
R13 является алкилом, алкенилом, арилом, карбоциклилом, гетероарилом или гетероциклилом.
В определенных вариантах обеспечено соединение, имеющее структуру, представленную Формулой (Iа), в которой каждый из R11 и R12 является водородом.
В других вариантах R11 является водородом и R12 является -с(=O)R13, где R13 является алкилом.
В других вариантах каждый из R3 и R4 является водородом.
В других особых вариантах, каждый из R9 и R10 независимо является водородом, галогеном, алкилом или -OR6, где R6 является водородом или алкилом.
В определенных вариантах R5 является C5-C9 алкилом.
В других определенных вариантах R5 является аралкилом.
В еще других определенных вариантах R5 является карбоциклилалкилом.
В еще других вариантах каждый из R11 и R12 является водородом, каждый из R1, R2, R3 и R4 является водородом, каждый из R9 и R10 независимо является водородом или -OR6, где R6 является водородом или алкилом, и R5 является С5-С9, алкилом.
В определенных особых вариантах R5 является C5-C9 алкилом, замещенным -OR6, где R6 является водородом или алкилом.
Определенные раскрытые здесь соединения имеют структуры, показанные в Таблице 1. Номер примера относится здесь к особому Примеру, который описывает приготовление соединения, имеющего показанную структуру/название.
В еще других вариантах каждый из R11 и R12 является водородом, каждый из R1, R2, R3 and R4 является водородом и каждый из R9 и R10 независимо является водородом или -OR6, где R6 является водородом или алкилом, и R5 является аралкилом.
В определенных особых вариантах алкиленовая часть R5 является этиленом, пропиленом или бутиленом.
В определенных вариантах арильная часть R5 является фенилом, толилом, ксиленилом, бифенилом или нафтилом.
Определенные соединения, раскрытые здесь, имеют структуру, показанную в Таблице 2. Номер примера относится здесь к особому Примеру, который описывает приготовление соединения, имеющего показанную структуру/название.
В еще других вариантах каждый из R11 и R12 является водородом, каждый из каждый из R1, R2, R3 and R4 является водородом и каждый из R9 и R10 независимо является водородом или -OR6, где R6 является водородом или алкилом, и R5 является карбоциклилалкилом. В определенных вариантах карбоциклилалкил может быть к тому же замещенным -OR6, где R6 является водородом или алкилом.
В определенных особых вариантах алкиленовая часть R5 является этиленом, пропиленом или бутиленом.
В определенных вариантах карбоциклильная часть R5 является циклогексилом, циклопентилом или циклогептилом.
Определенные соединения, раскрытые здесь, имеют структуру, показанную в Таблице 3. Номер примера относится здесь к особому Примеру, который описывает приготовление соединения, имеющего показанную структуру/название.
В другом варианте Х представляет собой -0-, и соединение Формулы (I) может быть представлено структурой Формулы (Ib):

в виде таутомера или смеси таутомеров, или в виде фармацевтически приемлемой соли, гидрата, сольвата, N-оксида или их пролекарств, в которой:
R1 и R2 являются одинаковыми или разными, или независимо представляют собой водород, C1-C5 алкил или фторалкил;
R3 и R4 являются одинаковыми или разными, или независимо представляют собой водород или алкил;
R5 представляет собой С5-С15 алкил, аралкил, гетероциклилалкил, гетероарилалкил или карбоциклилалкил;
R11 и R12 являются одинаковыми или разными, или независимо представляют собой водород, алкил или -C(=O)R13; или
R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
R13 является алкилом, алкенилом, арилом, карбоциклилом, гетероарилом или гетероциклилом.
В определенных вариантах соединения, имеющего структуру, представленную Формулой (Ib), каждое из R11 и R12 являются водородом.
В других вариантах R11 является водородом и R12 является -C(=O)R13, где R13 является алкилом.
В других вариантах каждый из R3 и R4 является водородом.
В определенных вариантах R5 является С5-С9 алкилом.
В других определенных вариантах R5 является карбоциклилалкилом.
В определенных других вариантах R5 является гетероарилалкилом.
В еще других определенных вариантах R5 является гетероциклилалкилом.
В других вариантах каждый из R11 и R12 является водородом, каждый из R1, R2, R3 и R4 является водородом, и R5 является C5-C9 алкилом. В определенных вариантах R5 является С5-С9 алкилом, замещенным -OR6, где R6 является водородом или алкилом.
В других вариантах каждый из R11 и R12 является водородом, каждый из R1, R2, R3 и R4 является водородом, и R5 является гетероарилалкилом, при этом алкиленовая часть R5 является этиленом, пропиленом или бутиленом.
В других вариантах каждый из R11 и R12 является водородом, каждый из R1, R2, R3 и R4 является водородом, и R5 является гетероциклилалкилом, при этом алкиленовая часть R5 является этиленом, пропиленом или бутиленом.
В других вариантах каждый из R11 и R12 является водородом, каждый из R1, R2, R3 и R4 является водородом, и R5 является карбоциклилалкилом, при этом алкиленовая часть R5 является этиленом, пропиленом или бутиленом.
Определенные соединения, раскрытые здесь, имеют структуру, показанную в Таблице 4. Номер примера относится здесь к особому Примеру, который описывает приготовление соединения, имеющего показанную структуру/название.
Определенные соединения, раскрытые здесь, имеют структуру, показанную в Таблице 5. Номера примеров относятся здесь к особым Примерам, которые описывают приготовление соединения, имеющего показанную структуру/название.
II. Определения
Использующиеся в описании и прилагаемой формуле формы единственного числа «a», «and» и «the» относятся к форме множественного числа, если в контексте не указано иное. Таким образом, например, ссылка на «соединение» означает множество таких соединений, и ссылка на «клетка» означает одну или более клеток (или множество клеток) и их эквивалентов, известных опытным в данной области специалистам, и т.п. В случае, когда диапазон используется здесь для физических свойств, таких как молекулярный вес или химические свойства, например, химические формулы, все комбинации и подкомбинации диапазонов и их специфических вариантов предполагаются быть включенными. Термин «примерно», когда он относится к числу или числовому диапазону, означает, что упомянутое число или числовой диапазон является приближением в пределах экспериментальной изменчивости (или в пределах статистической экспериментальной ошибки), и таким образом число или числовой диапазон может изменяться в пределах от 1% до 15% от установленного числа или числового диапазона. Термин «включающий» (и родственные термины, такие как «включать» или «включает», или «имеющий» или «включающий») не подразумевает включение в другие определенные варианты, например, вариант любого описанного здесь химического соединения, композиции, способа или процесса, или подобных, и может «состоять из» или «в основном состоять из» описанных элементов.
«Сульфанил» относится к -S- радикалу.
«Сульфинил» относится к -S(=O)- радикалу.
«Сульфонил» относится к -S(=O)2- радикалу.
«Амино» относится к -NH2 радикалу.
«Циано» относится к=CN радикалу.
«Нитро» относится к -NO2 радикалу.
«Окса» относится к -О- радикалу.
«Оксо» относится к -О радикалу.
«Имино» относится к=NH радикалу.
«Тиоксо» относится к=S радикалу.
«Алкил» относится к радикалу с прямой или разветвленной углеводородной цепью, состоящему исключительно из атомов углерода и водорода, не имеющему ненасыщенности, содержащему от одного до пятнадцати углеродных атомов (например, C1-C15 алкил). В определенных вариантах, алкил содержит от одного до тринадцати углеродных атомов (например, С1-С13 алкил). В определенных вариантах, алкил содержит от одного до восьми углеродных атомов (например, C1-C18 алкил). В других вариантах, алкил содержит от пяти до пятнадцати углеродных атомов (например, C5-C15 алкил). В других вариантах, алкил содержит от пяти до восьми углеродных атомов (например, C5-C8 алкил). Алкил присоединен к остальной части молекулы одинарной связью, например, метилом (Me), этилом (Et), n-пропилом, 1-метилэтилом (изопропилом), n-бутилом, n-пентилом, 1,1-диметилэтилом (t-бутилом), 3-метилгексилом, 2-метилгексилом и т.п. Если в описании не указано иное, алкильная группа факультативно является замещенной одним или более из следующих заместителей: гало, циано, нитро, оксо, тиоксо, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa(где t равно 1 или 2) и -S(O)tN(Ra)2 (где t равно 1 или 2), при этом каждый Ra независимо является водородом, алкилом, фторалкилом, карбоциклилом, карбоциклилалкилом, арилом, аралкилом, гетероциклилом, гетероциклилалкилом, гетероарилом или гетероарилалкилом.
«Алкенил» относится к радикальной группе с прямой или разветвленной углеводородной цепью, состоящей исключительно из атомов углерода и водорода, содержащей, по меньшей мере, одну двойную связь, и имеющей от двух до двенадцати углеродных атомов. В определенных вариантах, алкенил содержит от двух до восьми углеродных атомов. В других вариантах, алкенил содержит от двух до четырех углеродных атомов. Алкенил присоединен к остальной части молекулы одинарной связью, например, этенилом (например, винилом), проп-1-енилом (например, аллилом), бут-1-енилом, пент-1-енилом, пента-1,4-диенилом, и т.п. Если в описании не указано иное, алкенильная группа является факультативно замещенной одним или более из следующих заместителей: гало, циано, нитро, оксо, тиоксо, триметилсиланил, -ORa, SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2) и -S(O)tN(Ra)2 (где t равно 1 или 2), при этом каждый R3 независимо является водородом, алкилом, фторалкилом, карбоциклилом, карбоциклилалкилом, арилом, аралкилом, гетероциклилом, гетероциклилалкилом, гетероарилом или гетероарилалкилом.
«Алкинил» относится к радикальной группе с прямой или разветвленной углеводородной цепью, состоящей исключительно из атомов углерода и водорода, содержащей по меньшей мере одну тройную связь, имеющей от двух до двенадцати углеродных атомов. В определенных вариантах, алкинил содержит от двух до восьми углеродных атомов. В других вариантах, алкинил содержит от двух до четырех углеродных атомов. Алкинил присоединен к остальной части молекулы одинарной связью, например, этинилом, пропинилом, бутинилом, пентинилом, гексинилом и т.п. Если в описании не указано иначе, алкинильная группа является факультативно замещенной одним или более из следующих заместителей: гало, циано, нитро, оксо, тиоксо, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)S(O)tRa, (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2) и S(O)tN(Ra)2 (где t равно 1 или 2), при этом каждый Ra независимо является водородом, алкилом, фторалкилом, карбоциклилом, карбоциклилалкилом, арилом, аралкилом, гетероциклилом, гетероциклилалкилом, гетероарилом или гетероарилалкилом.
«Алкилен» или «алкиленовая цепь» относится к прямой или разветвленной бивалентной углеводородной цепи, соединяющей остальную часть молекулы с радикальной группой, состоящей исключительно из углерода и водорода, не имеющей ненасыщенности и содержащей от одного до двенадцати углеродных атомов, например, метилен, этилен, пропилен, n-бутилен, и т.п. Алкиленовая цепь присоединена к остальной части молекулы одинарной связью и к радикальной группе одинарной связью. Местами соединения алкиленовой цепи к остальной части молекулы и к радикальной группе может быть один атом углерода в алкиленовой цепи или любые два атома углерода внутри цепи. Если в описании не указано иное, алкиленовая цепь является факультативно замещенной одним или более из следующих заместителей: гало, циано, нитро, арил, циклоалкил, гетероциклил, гетероарил, оксо, тиоксо, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra-, -C(O)ORa, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2) и -S(O)t(Ra)2 (где t равно 1 или 2), при этом каждый Ra независимо является водородом, алкилом, фторалкилом, карбоциклилом, карбоциклилалкилом, арилом, аралкилом, гетероциклилом, гетероциклилалкилом, гетероарилом или гетероарилалкилом.
«Алкенилен» или «алкениленовая цепь» относится к прямой или разветвленной бивалентной углеводородной цепи, соединяющей оставшуюся часть молекулы с радикальной группой, состоящей исключительно из углерода и водорода, имеющей, по меньшей мере, одну двойную связь и содержащей от двух до двенадцати углеродных атомов, например, этенилен, пропенилен, n-бутенилен, и т.п. Алкениленовая цепь присоединена к остальной части молекулы двойной связью или одинарной связью, и к радикальной группе двойной связью или одинарной связью. Местами соединения алкениленовой цепи к остальной части молекулы и к радикальной группе могут быть один атом углерода или любые два атома углерода внутри цепи. Если в описании не указано иное, алкениленовая цепь является факультативно замещенной одним или более из следующих заместителей: гало, циано, нитро, арил, циклоалкил, гетероциклил, гетероарил, оксо, тиоксо, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tОRa (где t равно 1 или 2) и -S(O)tN(Ra)2 (где t равно 1 или 2), при этом каждый Raнезависимо является водородом, алкилом, фторалкилом, циклоалкилом, циклоалкилалкилом, арилом (факультативно замещенным одной или более гало группой), аралкилом, гетероциклилом, гетероциклилалкилом, гетероарилом или гетероарилалкилом, и при этом каждый из вышеперечисленных заместителей является незамещенным, если не указано иное.
«Арил» относится к радикалу, полученному из ароматической моноциклической или мультициклической углеводородной кольцевой системы путем отщепления атома водорода от кольцевого атома углерода. Ароматическая моноциклическая или мультициклическая углеводородная кольцевая система содержит только водород и от шести до восемнадцати атомов углерода, при этом, по меньшей мере, одно из колец в кольцевой системе является полностью ненасыщенным, т.е. оно содержит циклическую систему делокализованных π-электронов (4n+2) согласно теории Хюккеля. Арильная группа включает, но не ограничивается этим, такие группы, как фенил, фторфенил и нафтил. Если не в описании не указано иное, термин «арил» или префикс «ар-» (такой как в «аралкил») означает включение арильных радикалов, факультативно замещенных одним или более заместителей, независимо выбранных из алкила, алкенила, алкинила гало, фторалкила, циано, нитро, факультативно замещенного арила, факультативно замещенного аралкила, факультативно замещенного аралкенила, факультативно замещенного аралкинила, факультативно замещенного карбоциклила, факультативно замещенного карбоциклилалкила, факультативно замещенного гетероциклила, факультативно замещенного гетероциклилалкила, факультативно замещенного гетероарила, факультативно замещенного гетероарилалкила, -Rb-ORa, -Rb-OC(O)-Ra, -Rb-N(Ra)2, -Rb-C(O)Ra, -Rb-C(O)ORa, -Rb-C(O)N(Ra)2, -Rb-O-Rc-C(O)N(Ra)2, -Rb-N(Ra)C(O)ORa, -Rb-N(Ra)C(O)Ra, -Rb-N(Ra)S(O)tRa (где t равно 1 или 2), -Rb-S(O)tORa(где t равно 1 или 2) и -Rb-S(O)tN(Ra)2 (где t равно 1 или 2), при этом каждый Raнезависимо является водородом, алкилом, фторалкилом, циклоалкилом, циклоалкилалкилом, арилом (факультативно замещенным одной или более гало группой), аралкилом, гетероциклилом, гетероциклилалкилом, гетероарилом или гетероарилалкилом, каждый Rb независимо является прямой связью, или прямой или разветвленной алкиленовой или алкениленовой цепью, и Rc является прямой или разветвленной алкиленовой или алкениленовой цепью, и где каждый из вышеуказанных заместителей является незамещенным, если не указано иное.
«Аралкил» относится к радикалу формулы -Rc-арил, где Rc является алкиленовой цепью, как определено выше, например, бензилом, дифенилметилом и т.п. Алкиленовая часть цепи аралкильного радикала является факультативно замещенной, как описано выше для алкиленовой цепи. Арильная часть аралкильного радикала является факультативно замещенной, как описано выше для арильной группы.
«Аралкенил» относится к радикалу формулы -Rd-арил, где Rd является алкениленовой цепью, как определено выше. Арильная часть аралкенильного радикала является факультативно замещенной, как описано выше для арильной группы. Алкениленовая часть цепи аралкенильного радикала является факультативно замещенной, как определено выше для алкениленовой группы.
«Аралкинил» относится к радикалу формулы -Re-арил, где Re является алкиниленовой цепью, как определено выше. Арильная часть аралкинильного радикала является факультативно замещенной, как описано выше для арильной группы. Алкиниленовая часть цепи аралкинильного радикала является факультативно замещенной, как определено выше для алкиниленовой цепи.
«Карбоциклил» относится к стабильному неароматическому моноциклическому или полициклическому углеводородному радикалу, состоящему исключительно из атомов углерода и водорода, который может включать конденсированные или мостиковые кольцевые системы, содержащие от трех до пятнадцати атомов углерода. В определенных вариантах, карбоциклил содержит от трех до десяти атомов углерода. В других вариантах, карбоциклил содержит от пяти до семи атомов углерода. Карбоциклил присоединен к остальной части молекулы одинарной связью. Карбоциклил может быть насыщенным (т.е. содержать только одинарные С-С связи) или ненасыщенным (т.е. содержать одну или более двойную или тройную связь). Полностью насыщенный карбоциклический радикал также называется «циклоалкил». Примеры моноциклических циклоалкилов включают, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Ненасыщенный карбоциклил также называется «циклоалкенил». Примеры моноциклических циклоалкенилов включают, например, циклопентенил, циклогексенил, циклогептенил и циклооктенил. Полициклические карбоциклические радикалы включают, например, адамантил, норбомил (например, бицикло[2.2.1]гептанил), норборненил, декалинил, 7,7-диметил-бицикло[2.2.1]гептанил, и т.п. Если в описании не указано иное, термин «карбоциклил» означает включение карбоциклических радикалов, которые являются факультативно замещенными одним или более заместителелями, независимо выбранными из алкила, алкенила, алкинила, гало, фторалкила, оксо, тиоксо, циано, нитро, факультативно замещенного арила, факультативно замещенного аралкила, факультативно замещенного аралкенила, факультативно замещенного аралкинила, факультативно замещенного карбоциклила, факультативно замещенного карбоциклилалкила, факультативно замещенного гетероциклила, факультативно замещенного гетероциклилалкила, факультативно замещенного гетероарила, факультативно замещенного гетероарилалкила, -Rb-ORa, -Rb-SRa, -Rb-OC(O)-Ra, -Rb-N(Ra)2, -Rb-C(O)Ra, -Rb-C(O)ORa, -Rb-C(O)N(Ra)2, -Rb-O-Rc-С(O)N(Ra)2, -Rb-N(Ra)C(O)ORa, -Rb-N(Ra)C(O)Ra, -Rb-N(Ra)S(O)tRa (где t равно 1 или 2), -Rb-S(O)tORa (где t равно 1 или 2) и -Rb-S(O)tN(Ra)2 (где t равно 1 или 2), при этом каждый Ra независимо является водородом, алкилом, фторалкилом, циклоалкилом, циклоалкилалкилом, арилом, аралкилом, гетероциклилом, гетероциклилалкилом, гетероарилом или гетероарилалкилом, каждый Rb независимо является прямой связью, или прямой или разветвленной алкиленовой или алкениленовой цепью, и Rc является прямой или разветвленной алкиленовой или алкениленовой цепью, и где каждый из вышеуказанных заместителей является незамещенным, если не указано иначе.
«Карбоциклилалкил» относится к радикалу формулы -Rc-карбоциклил, где Rcявляется алкиленовой цепью, как описано выше. Алкиленовая цепь и карбоциклильный радикал являются факультативно замещенными, как определено выше.
«Гало» или «галоген» относится к бромо-, хлоро-, фторо- или йодо- заместителям. «Фторалкил» относится к алкильному радикалу, как определено выше, которой является замещенным одним или более фтор-радикалами, как определено выше, например, трифторметилом, дифторметилом, 2,2,2-трифторэтилом, 1-фторметил-2-фторэтилом, и т.п. Алкильная часть фторалкильного радикала может быть факультативно замещенной, как определено выше для алкильной группы.
«Гетероциклил» относится к стабильному, 3-18-членному неароматическому циклическому радикалу, который содержит от двух до двенадцати углеродных атомов и от одного до шести гетероатомов, выбранных из азота, кислорода и серы. Если в описании не указано иное, гетероциклильный радикал является моноциклической, бициклической, трициклической или тетрациклической кольцевой системой, которая может содержать конденсированные или мостиковые кольцевые системы. Гетероатомы в гетероциклильном радикале могут быть факультативно окисленными. Один или более атомов азота, в случае их присутствия, являются факультативно кватернизированными. Гетероциклильный радикал является частично или полностью насыщенным. Гетероциклил может быть присоединен к остальной части молекулы любым атомом кольца(ец). Примеры таких гетероциклильных радикалов включают, но не ограничиваются этим, диоксоланил, тиенил[1,3]дитианил, декагидроизоксинолил, имидазолинил, имидазолидинил, изотиазолидинил, изоксазолидинил, морфолинил, октагидроиндолил, октагидроизоиндолил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, оксазолидинил, пиперидинил, пиперазинил, 4-пиперидонил, пирролидинил, пиразолидинил, хинуклидинил, тиазолидинил, тетрагидрофурил, тритианил, тетрагидропиранил, тиоморфолинил, тиаморфолинил, 1-оксо-тиоморфолинил и 1,1-диоксо-тиоморфолинил. Если в описании не указано иное, термин «гетероциклил» означает включение гетероциклильных радикалов, как определено выше, которые являются факультативно замещенными одним или более заместителелями, выбранных из алкила, алкенила, алкинила, гало, фторалкила, оксо, тиоксо, циано, нитро, факультативно замещенного арила, факультативно замещенного аралкила, факультативно замещенного аралкенила, факультативно замещенного аралкинила, факультативно замещенного карбоциклила, факультативно замещенного карбоциклилалкила, факультативно замещенного гетероциклила, факультативно замещенного гетероциклилалкила, факультативно замещенного гетероарила, факультативно замещенного гетероарилалкила, -Rb-ORa, -Rb-SRa, -Rb-OC(O)-Ra, -Rb-N(Ra)2, -Rb-C(O)Ra, -Rb-C(O)ORa, -Rb-C(O)N(Ra)2, -Rb-O-Rc-C(O)N(Ra)2, -Rb-N(Ra)C(O)ORa, -Rb-N(Ra)C(O)Ra, -Rb-N)(Ra)S(O)tRa (где t равно 1 или 2), -Rb-S(O)tORa (где t равно 1 или 2) и Rb-S(O)tN(Ra)2 (где t равно 1 или 2), при этом каждый Ra независимо является водородом, алкилом, фторалкилом, циклоалкилом, циклоалкилалкилом, арилом, аралкилом, гетероциклилом, гетероциклилалкилом, гетероарилом или гетероарилалкилом, каждый Rb независимо является прямой связью или прямой или разветвленной алкиленовой или алкениленовой цепью, и Rc является прямой или разветвленной алкиленовой или алкениленовой цепью, и где каждый из вышеуказанных заместителей является незамещенным, если не указано иное.
«N-гетероциклил» или «N-присоединенный гетероциклил» относится к гетероциклильному радикалу, как определено выше, содержащему, по меньшей мере, один азот, и где местом присоединения гетероциклильного радикала к остальной части молекулы является атом азота в гетероциклильном радикале. N-гетероциклильный радикал является факультативно замещенным, как описано выше для гетероциклильных радикалов. Примеры таких N-гетероциклильных радикалов включают, но не ограничиваются этим, 1-морфолинил, 1-пиперидинил, 1-пиперазинил, 1-пирролидинил, пиразолидинил, имидазолинил и имидазолидинил.
«С-гетероциклил» или «С-присоединенный гетероциклил» относится к гетероциклильному радикалу, как определено выше, который содержит, по меньшей мере, один гетероатом и где местом присоединения гетероциклильного радикала к остальной части молекулы является атом углерода в гетероциклильном радикале. С-гетероциклильный радикал является факультативно замещенным, как описано выше для гетероциклильных радикалов. Примеры таких С-гетероциклильных радикалов включают, но не ограничиваются этим, 2-морфолинил, 2- или 3, или 4-пиперидинил, 2-пиперазинил, 2- или 3-пирролидинил, и т.п.
«Гетероциклилалкил» относится к радикалу формулы -Rc-гетероциклил, где Rc является алкиленовой цепью, как определено выше. Если гетероциклил является азотосодержащим гетероциклилом, гетероциклил является факультативно присоединенным к алкильному радикалу атомом азота. Алкиленовая цепь гетероциклилалкильного радикала является факультативно замещенной, как определено выше для алкиленовой цепи. Гетероциклильная часть гетероциклилалкильного радикала является факультативно замещенной, как определено выше для гетероциклильной группы.
«Гетероарил» относится к радикалу, полученному из от 3-18-членного ароматического кольцевого радикала, который содержит от двух до семнадцати атомов углерода и от одного до шести гетероатомов, выбранных из азота, кислорода и серы. Использующийся здесь гетероарильный радикал может быть моноциклической, бициклической, трициклической или тетрациклической кольцевой системой, в которой, по меньшей мере, одно из колец в кольцевой системе является полностью ненасыщенным, т.е. оно содержит циклическую делокализированную π-электронную систему (4n+2) согласно теории Хуккеля. Гетероарил включает конденсированную или мостиковую кольцевую систему. Гетероатом(ы) в гетероарильном радикале является факультативно окисленными. Один или более атомов азота, в случае присутствия, являются кватернизированными. Гетероарил является присоединенным к остальной части молекулы любым атомом кольца(ец). Примеры гетероарилов включают, но не ограничаваются этим, азепинил, акридинил, бензимидазолил, бензиндолил, 1,3-бензодиоксолил, бензофуранил, бунзооксазолил, бензо[d]тиазолил, бензотиадиазолил, бензо[b][1,4]диоксепинил, бензо[b][1,4]оксазинил, 1,4-бензодиоксанил, бензонафтофуранил, бензоксазолил, бензодиоксолил, бензодиоксинил, бензопиранил, бензопиранонил, бензофуранил, бензофуранонил, бензотиенил (бензотиофенил), бензотиено[3,2-d]пиримидинил, бензотриазолил, бензо[4,6]имидазо[1,2-а]пиридинил, карбазолил, циннолинил, циклопента[d]пиримидинил, 6,7-дигидро-5Н-циклопента [4,5]тиено[2,3-d]пиримидинил, 5,6-дигидробензо[h]хиназолинил, 5,6-дигидробензо[h]циннолинил, 6,7-дигидро-5Н-бензо[6,7]циклогепта[1,2-с]пиридазинил, дибензофуранил, дибензотиофенил, фуранил, фуранонил, фуро[3,2-с]пиридинил, 5,6,7,8,9,10-гексагидроциклоокта[d]пиримидинил, 5,6,7,8,9,10-гeкcaгидpoциклooктa[d]пиpидaзинил, 5,6,7,8,9,10-гексагидроциклоокта[d]пиридинил, изотиазолил, имидазолил, индазолил, индолил, индазолил, изоиндолил, индолинил, изоиндолинил, изохинолил, индолизинил, изоксазолил, 5,8-метано-5,6,7,8-тетрагидрохиназолинил, нафтиридинил, 1,6-нафтиридинонил, оксадиазолил, 2-оксоазепинил, оксазолил, оксиранил, 5,6,6а,7,8,9,10,10а-октагидробензо[h]хиназолинил, 1-фенил-1H-пирролил, феназинил, фенотиазинил, феноксазинил, фталазинил, птеридинил, пуринил, пирролил, пиразолил, пиразоло[3,4-d]пиримидинил, пиридинил, пиpидo[3,2-d]пиpимидинил, пиридо[3,4-d]пиримидинил, пиразинил, пиримидинил, пиридазинил, пирролил, хиназолинил, хиноксалинил, хинолинил, изохинолинил, тетрагидрохинолинил, 5,6,7,8-тетрагидрохиназолинил, 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидинил, 6,7,8,9-тeтpaгидpo-5H-циклoгeптa[4,5]тиeнo[2,3-d]пиpимидинил, 5,6,7,8-тетрагидропиридо[4,5-с]пиридазинил, тиазолил, тиадиазолил, триазолил, тетразолил, триазинил, тиено[2,3-d]пиримидинил, тиено[3,2-d]пиримидинил, тиено[2,3-с]придинил и тиофенил (т.е. тиенил). Если в описании не указано иначе, термин «гетероарил» означает включение гетероарильных радикалов, как определено выше, которые являются факультативно замещенными одним или более заместителем, выбранным из алкила, алкенила, алкинила, гало, фторалкила, галоалкенил, галоалкинила, оксо, тиоксо, циано, нитро, факультативно замещенного арила, факультативно замещенного аралкила, факультативно замещенного аралкенила, факультативно замещенного аралкинила, факультативно замещенного карбоциклила, факультативно замещенного карбоциклилалкила, факультативно замещенного гетероциклила, факультативно замещенного гетероциклилалкила, факультативно замещенного гетероарила, факультативно замещенного гетероарилалкила, -Rb-ORa, -Rb-SRa, -Rb-OC(O)-Ra, -Rb-N(Ra)2, -Rb-C(O)Ra, -Rb-C(O)ORa, -Rb-C(O)N(Ra)2, -Rb-O-Rc-C(O)N(Ra)2, -Rb-N(Ra)C(O)ORa, -Rb-N(Ra)C(O)Ra, -Rb-N(Ra)S(O)tRa (где t равно 1 или 2), -Rb-S(O)tORa (где t равно 1 или 2) и -Rb-S(O)tN(Ra)2 (где t равно 1 или 2), при этом каждый Ra независимо является водородом, алкилом, фторалкилом, циклоалкилом, циклоалкилалкилом, арилом, аралкилом, гетероциклилом, гетероциклилалкилом, гетероарилом или гетероарилалкилом, каждый Rb независимо является прямой связью, или прямой или разветвленной алкиленовой или алкениленовой цепью, и Rc является прямой или разветвленной алкиленовой или алкениленовой цепью, и при этом каждый из вышеуказанных заместителей является незамещенным, если не указано иное.
«N-гетероарил» относится к гетероарильному радикалу, как определено выше, содержащему, по меньшей мере, один азот, и где местом присоединения гетероарильного радикала к остальной части молекулы является атом азота в гетероарильном радикале. N-гетероарильный радикал является факультативно замещенным, как описано выше для гетероарильных радикалов.
«С-гетероарил» относится к гетероарильному радикалу, как определено выше, и где местом присоединения гетероарильного радикала к остальной части молекулы является атом углерода в гетероарильном радикале. С-гетероарильный радикал является факультативно замещенным, как описано выше для гетероарильных радикалов.
«Гетероарилалкил» относится к радикалу формулы -Rc-гетероарил, где Rc является алкиленовой цепью, как определено выше. Если гетероарил является азотосодержащим гетероарилом, гетероарил является факультативно присоединенным атомом азота к алкильному радикалу. Алкиленовая цепь гетероарилалкильного радикала является факультативно замещенной, как определено выше для алкиленовой цепи. Гетероарильная часть гетероарилалкильного радикала является факультативно замещенной, как описано выше для гетероарильной группы.
Соединения или их фармацевтически приемлемые соли могут содержать один или более центров асимметрии и таким образом вызывать рост энантиомеров, диастереомеров и других стереоизомерных форм, которые могут быть определены, в соответствии с абсолютной стереохимией, как (R)- или (S)-, или как (D)- или (L)- для аминокислот. Когда описанные здесь соединения содержат олефиновые двойные связи или другие центры геометрической асимметрии и если не указано иное, предполагается, что соединения включают как Е, так и Z геометрические изомеры (например, цис или транс).
Аналогично, все возможные изомеры, а также их рацемические и факультативно чистые формы, и все таутомерные формы предполагаются быть включенными.
«Стереоизомеры» являются соединениями, которые имеют одинаковую последовательность ковалентных связей и отличаются соответствующим расположением их атомов в пространстве. «Энантиомеры» относятся к двум стереоизомерам, которые являются несовместимым зеркальным изображением друг друга.
Если не указано иное, показанные здесь структуры также означают включение соединений, которые отличаются только присутствием одного или более изотопически обогащенных атомов. Например, соединения, имеющие приведенные структуры, за исключением замещения водорода дейтерием или тритием, или замещения углерода13С- или]14C-обогащенным углеродом, охвачены этим изобретением.
Соединения настоящего изобретения также могут содержать несвойственные пропорции атомных изотопов одного или более атомов, которые образуют такие соединения. Например, соединения могут быть мечены изотопами, такими как дейтерий (2H) тритий (3Н), иод-125 (125I) или углерод-14 (14C). Изотопическое замещение2H,11С,13С,14С,15С,12N,13N,15N,16N,16O,17O,14F,15F,16F,17F,18F,33S,34S,35S,36S,35Cl,37Cl,79Br,81Br,125I является предусмотренным. Все изотопические варианты соединений настоящего изобретения, радиоактивные или не радиоактивные, охвачены настоящим изобретением.
В определенных вариантах раскрытые здесь аминопроизводные соединения содержат некоторые или все атомы1Н, замещенные атомами2H. Способы синтеза аминопроизводных соединений, содержащих дейтерий, известны в данной области техники и включают, но не ограничиваются этим, следующие способы синтеза.
Дейтерированные исходные материалы, такие как кислота i и кислота ii, являются общедоступными и подвергаются описанным здесь синтетическим способам для синтеза аминопроизводных соединений.

Другие дейтерированные исходные материалы также используются в синтезе дейтерий-содержащих аминопроизводных соединений, как показано в неограничивающем примере в приведенной ниже схеме. Большое число дейтерий-содержащих реагентов и элементов структуры являются коммерчески доступными у поставщиков химических препаратов, таких как Aldrich Chemical Co.
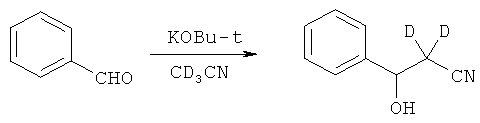
Дейтерий-переносящие реагенты, такие как литий алюминия дейтерид (LiAlD4), используются для переноса дейтерия в восстановительных условиях в субстрат реакции. В приведенных ниже схемах реакций использование LiAlD4 показано только в качестве примера.
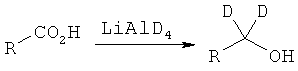
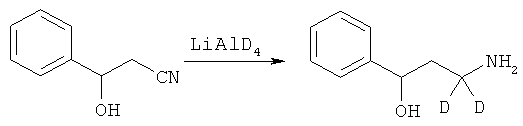
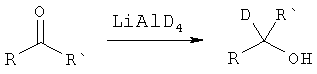
Газ дейтерия и палладиевый катализатор использовали для восстановления ненасыщенных углерод-углеродных связей и для выполнения восстановительного замещения арильных связей углерод-галоген, как показано в качестве примера в приведенных ниже схемах реакций.
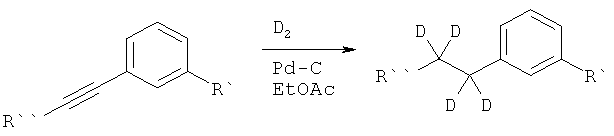


В одном варианте аминопроизводное соединение содержит один атом дейтерия. В другом варианте аминопроизводное соединение содержит два атома дейтерия. В другом варианте аминопроизводное соединение содержит три атома дейтерия. В другом варианте аминопроизводное соединение содержит четыре атома дейтерия. В другом варианте аминопроизводное соединение содержит пять атомов дейтерия. В другом варианте аминопроизводное соединение содержит шесть атомов дейтерия. В другом варианте аминопроизводное соединение является полностью замещенным атомами дейтерия и содержит необмениваемые атомы водорода1Н.
«Таутомер» относится к протонному сдвигу от одного атома молекулы к другому атому той же молекулы. Представленные здесь соединения могут существовать в виде таутомеров. Таутомеры являются соединениями, которые являются взаимопревращаемыми путем миграции атома водорода, которая сопровождается разрывом одинарной связи и установлением двойной связи. В растворах, в которых таутомеризация возможна, будет существовать химическое равновесие таутомеров. Все таутомерные формы раскрытых здесь соединений являются предусмотренными. Точное соотношение таутомеров зависит от нескольких факторов, включающий температуру, растворитель и рН. Некоторые примеры таутомерных взаимных превращений включают:
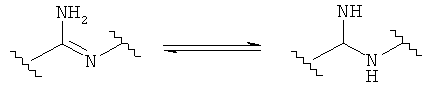


«Факультативно» или «факультативный» означает, что последовательно описанные события или обстоятельства могут или не могут возникнуть, и что описание включает примеры, когда событие или обстоятельство возникает и примеры, в которых не возникает. Например, «факультативно замещенный арил» означает, что арильный радикал может быть или не быть замещенным, и что описание включает как замещенные арильные радикалы, так и арильные радикалы, не имеющие замещения.
«Фармацевтически приемлемая соль» включает как соли присоединения кислоты, так и соли присоединения основания. Фармацевтически приемлемые соли любых описанных здесь соединений алкоксифенил-связанных аминовых производных включают все фармацевтически приемлемые формы солей. Предпочтительными фармацевтически приемлемыми солями описанных здесь соединений являются фармацевтически приемлемые соли присоединения кислоты и фармацевтически приемлемые соли присоединения основания.
«Фармацевтически приемлемые соли присоединения кислоты» относятся к таким солям, которые сохраняют биологическую эффективность и свойства свободных оснований, которые не являются биологически или иначе нежелательными, и которые образованы с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, йодистоводородная кислота, фтороводородная кислота, фосфористая кислота и т.п. Также включенными являются соли, которые образованны с органическими кислотами, такими как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидрокси-алкановые кислоты, алканедионовые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты, и т.д. и включают, например, уксусную кислоту, трифторуксусную кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, р-толуолсульфоновую кислоту, салициловую кислоту и т.п. Таким образом, примеры солей включают сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, нитраты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, иодиды, ацетаты, трифторацетаты, пропионаты, калрилаты, изобутираты, оксалаты, малонаты, сукцинаты, субераты, себацинаты, фумараты, малеаты, манделаты, бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты, фталаты, бензолсульфонаты, толуолсульфонаты, фенилацетаты, цитраты, лактаты, малаты, тартраты, метансульфонаты, и т.п. Также рассматриваются соли аминокислот, такие как аргинаты, глюконаты и галактуронаты (см., например, Berge S.M. et al., "Pharmaceutical Salts," Journal of Pharmaceutical Science, 66:1-19 (1997), который включен здесь в виде ссылки). Соли присоединения кислот основных соединений могут быть приготовлены путем взаимодействия форм свободных оснований с достаточным количеством целевой кислоты для получения соли согласно способам и методикам, с которыми знакомы опытные в данной области специалисты.
«Фармацевтически приемлемые соли присоединения основания» относятся к таким солям, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются биологически или иначе нежелательными. Эти соли являются приготовленными путем добавления неорганического основания или органического основания к свободной кислоте. Фармацевтически приемлемые соли присоединения основания могут быть образованы с металлами или аминами, такими как щелочные и щелочноземельные металлы или органические амины. Соли, полученные из неорганических оснований включают, но не ограничиваются этим, соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п. Соли, полученные из органических оснований, включают, но не ограничиваются этим, соли первичных, вторичных и третичных аминов, замещенные амины, включающие природные замещенные амины, циклические амины и катионные ионообменные смолы, например, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, диэтаноламин, 2-диметиламиноэтанол, 2-диэтиламиноэтанол дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, N-N-дибензилэтилендиамин, хлоропрокаин, гидрабамин, холин, бетаин, этилендиамин, этилендианилин, N-метилглукамин, глюкозамин, метилглукамин, теобромин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминовые смолы и т.п. См. Berge et al., supra.
Если не указано иное, представленные здесь структуры также означают включение соединений, которые различаются только присутствием одного или более изотонически обогащенных атомов. Например, соединения, имеющие настоящие структуры, за исключением замещения водорода дейтерием или тритием, или замещения углерода13С-или14С-обогащенным углеродом, находятся в рамках этого изобретения.
Соединения настоящего изобретения могут также содержать несвойственные пропорции атомных изотопов одного или более атомов, которые образуют такие соединения. Например, соединения могут быть радиомечеными радиоактивными изотопами, такими как, например, тритий (3H), иод-125 (125I) или углерод-14 (14С). Все изотопические вариации соединений настоящего изобретения, радиоактивные или нет, являются охваченными настоящим изобретением.
«Неретиноидное соединение» относится к любому соединению, которое не является ретиноидом. Ретиноид является соединением, которое имеет дитерпеновый скелет, имеющий триметилциклогексениловое кольцо и полиеновую цепь, которая заканчивается в полярной концевой группе. Примеры ретиноидов включают ретиналдегид и полученный имин/гидразид/оксим, ретинол и любой полученный эфир, ретиниламин и любой полученный амид, ретиноидная кислота и любой полученный эфир или амид. Не ретиноидное соединение может включать, хотя не требуется, внутреннюю циклическую группу (например, ароматическую группу). Не ретиноидное соединение может содержать, хотя не обязательно, группу аминового производного.
Использующийся здесь термин «терапия» или «лечение», или «временное облегчение", или "улучшение» являются здесь взаимозаменяемыми. Эти термины относятся к подходу для получения эффекта или требуемых результатов, включающих, но не ограничивающихся этим, терапевтический эффект и/или профилактический эффект. Термин «терапевтический эффект» означает ликвидацию или уменьшение интенсивности основного нарушения, подлежащего лечению. Также, терапевтический эффект достигается ликвидацией или уменьшением интенсивности одного или более физиологических симптомов, связанных с основным нарушением таким образом, что улучшение наблюдается у пациента, без учета того, что пациент может быть все еще поражен основным нарушением. Для профилактического эффекта, композиции могут вводиться пациенту, имеющему риск развития конкретного заболевания или пациенту, сообщившему об одном или более физиологическом симптоме заболевания, даже если диагноз этого заболевания может быть не установлен.
«Пролекарство» означает указание соединения, которое может быть превращено в физиологических условиях или путем сольволиза в биологически активное соединение, описанное здесь. Таким образом, термин «Пролекарство» относится к предшественнику биологически активного соединения, которое является фармацевтически приемлемым. Пролекарство может быть неактивным при введении пациенту, но превращаться in vivo в активное соединение, например, с помощью гидролиза. Соединение пролекарства часто обладает преимуществами по растворимости, поглощению тканями или задержке высвобождения в организме млекопитающего (см., например, Bundgard, H., Design of Prodrugs (1985), pp.7-9, 21-24 (Elsevier, Amsterdam).
Обсуждение пролекарств представлено в Higuchi, Т., et al., "Pro-drugs as Novel Delivery Systems," A.C.S. Symposium Series, Vol.14, and in Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, оба из которых включены здесь полностью в виде ссылки.
Термин «Пролекарство» также означает включение любых ковалентно соединенных носителей, которые высвобождают активное соединение in vivo при введении пролекарства млекопитающему. Пролекарства активного соединения, как описано здесь, могут быть приготовлены с помощью изменения присутствующих в активном соединении функциональных групп таким образом, что модификации расщепляются при обычных манипуляциях или in vivo на родительское активное соединение. Пролекарства включают соединения, в которых гидрокси, амино или меркапто группа является присоединенной к любой группе таким образом, что при введении пролекарства активного соединения млекопитающему происходит расщепление до образования свободной гидрокси, свободной амино или свободной меркапто группы, соответственно. Примеры пролекарств включают, но не ограничиваются этим, ацетатные, формиатные и бензоатные производные спирта или аминовые функциональные группы в активных соединениях и т.п.
Соединения изобретения синтезированы с помощью соответствующей комбинации общеизвестных синтетических способов. Методики, которые являются полезными в синтезировании соединений изобретения являются как очевидными, так и доступными опытным в данной области специалистам.
Ниже приведена иллюстрация общего принципа получения соединений настоящего изобретения, и подробно описаны различные способы, которые являются пригодными для получения соединений изобретения. Однако, не предполагается, что обсуждение определяет или ограничивает диапазон реакций или последовательность реакций, которые являются эффективными для приготовления соединений настоящего изобретения. Соединения этого изобретения могут быть приготовлены способами и методиками, раскрытыми в разделе Примеров ниже, а также известными способами органического синтеза.
Приготовление аминопроизводных соединений
В целом, соединения, которые используются в описанных здесь реакциях, могут быть приготовлены согласно технологиям органического синтеза, которые известны опытным специалистам в данной области, с использованием коммерчески доступных химических препаратов и/или из соединений, описанных в химической литературе. «Коммерчески доступные химические препараты» получены из стандартных коммерческих источников, включая Acros Organics (Pittsburgh PA), Aldrich Chemical (Milwaukee WI, including Sigma Chemical and Fluka), Apin Chemicals Ltd. (Milton Park UK), Avocado Research (Lancashire U.K.), BDH Inc. (Toronto, Canada), Bionet (Cornwall, U.K.), Chemservice Inc. (West Chester PA), Crescent Chemical Co. (Hauppauge NY), Eastman Organic Chemicals, Eastman Kodak Company (Rochester NY), Fisher Scientific Co. (Pittsburgh PA), Fisons Chemicals (Leicestershire UK), Frontier Scientific (Logan UT), ICN Biomedicals, Inc. (Costa Mesa CA), Key Organics (Cornwall U.K.), Lancaster Synthesis (Windham NH), Maybridge Chemical Co. Ltd. (Cornwall U.K.), Parish Chemical Co. (Orem UT), Pfaltz & Bauer, Inc. (Waterbury CN), Polyorganix (Houston TX), Pierce Chemical Co. (Rockford IL), Riedel de Haen AG (Hanover, Germany), Spectrum Quality Product, Inc. (New Brunswick, NJ), TCI America (Portland OR), Trans World Chemicals, Inc. (Rockville MD), and Wako Chemicals USA, Inc. (Richmond VA).
Способы, известные опытным в данной области специалистам, определены с помощью разной справочной литературы и баз данных. Справочная литература и научные труды, которые детализируют синтез реагентов, использующихся для приготовления описанных здесь соединений, или обеспечивают ссылки на статьи, которые описывают процесс приготовления, включают, например, "Synthetic Organic Chemistry", John Wiley & Sons, Inc., New York; S.R.Sandler et al., "Organic Functional Group Preparations," 2nd Ed., Academic Press, New York, 1983; H.O.House, "Modern Synthetic Reactions", 2nd Ed., W.A.Benjamin, Inc. Menlo Park, Calif. 1972; Т.L.Gilchrist, "Heterocyclic Chemistry", 2nd Ed., John Wiley & Sons, New York, 1992; J.March, "Advanced Organic Chemistry: Reactions, Mechanisms and Structure", 4th Ed., Wiley-Interscience, New York, 1992. Дополнительная соответствующая справочная литература и научные труды, которые детализируют синтез реагентов, использующихся для приготовления описанных здесь соединений, или обеспечивают ссылки на статьи, которые описывают приготовление, включают, например, Fuhrhop, J. and Penzlin G. "Organic Synthesis: Concepts, Methods, Starting Materials", второе, пересмотренное и расширенное издание (1994) John Wiley & Sons ISBN: 3-527-29074-5; Hoffman, R.V. "Organic Chemistry, An Intermediate Text" (1996) Oxford University Press, ISBN 0-19-509618-5; Larock, R.C. "Comprehensive Organic Transformations: A Guide to Functional Group Preparations" 2-е издание (1999) Wiley-VCH, ISBN: 0-471-19031-4; March, J. "Advanced Organic Chemistry: Reactions, Mechanisms, and Structure" 4-е издание (1992) John Wiley & Sons, ISBN: 0-471-60180-2; Otera, J. (editor) "Modern Carbonyl Chemistry" (2000) Wiley-VCH, ISBN: 3-527-29871-1; Patai, S. "Patai′s 1992 Guide to the Chemistry of Functional Groups" (1992) Interscience ISBN: 0-471-93022-9; Quin, L.D. et al. "A Guide to Organophosphorus Chemistry" (2000) Wiley-Interscience, ISBN: 0-471-31824-8; Solomons, T. W. G. "Organic Chemistry" 7-е издание (2000) John Wiley & Sons, ISBN: 0-471-19095-0; Stowell, J.C., "Intermediate Organic Chemistry" 2-е издание (1993) Wiley-Interscience, ISBN: 0-471-57456-2; "Industrial Organic Chemicals: Starting Materials and Intermediates: An Ullmann′s Encyclopedia" (1999) John Wiley & Sons, ISBN: 3-527-29645-Х, в 8 томах; "Organic Reactions" (1942-2000) John Wiley & Sons, в 55 томах; и "Chemistry of Functional Groups" John Wiley & Sons, в 73 томах.
Специфические и аналогичные реагенты также могут быть определены с помощью индексов известных химических препаратов, приготовленных Chemical Abstract Service of the American Chemical Society, которые доступны в большинстве публичных и университетских библиотек, а также с помощью баз данных он-лайн (the American Chemical Society, Washington, D.C., возможен контакт для более полной информации). Химические препараты, которые известны, но не имеются в продаже в каталогах, могут быть приготовлены поставщиками на объектах химического синтеза, на которых поставщики стандартных химических препаратов (например тех, которые перечислены выше) обеспечивают обслуживание клиентов. Ссылкой на приготовление и выбор фармацевтических солей соединений алкоксифенил-связанного аминового производного, описанного здесь, является Р.Н.Stahl & С.G.Wermuth "Handbook of Pharmaceutical Salts", Verlag Helvetica Chimica Acta, Zurich, 2002.
Термин «защитная группа» относится к химическим группам, которые блокируют некоторые или все реакционные группы соединения и предотвращают их участие в химических реакциях до тех пор, пока защитная группа не будет удалена, например, звенья, перечисленные и описанные в T.W.Greene, P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd ed. John Wiley & Sons (1999). Преимуществом является использование разных защитных групп таким образом, что каждая (разные) защитная группа может быть удалена разными способами. Защитные группы, которые расщепляются под воздействием разных условий реакции, делают возможным дифференцированное удаление таких защитных групп. Например, защитные группы могут быть удалены кислотой, основанием и гидрогенолизом. Группы, такие как тритил, диметокситритил, ацетал и трет-бутилдиметилсилил являются кислотно-неустойчивыми и могут применяться для защиты карбокси и гирдокси реакционных групп в присутствии аминогрупп, защищенных Cbz группами, которые могут быть удалены гидрогенолизом, и Fmoc группы, которые являются неустойчивыми к основаниям. Карбоксильные кислотные группы могут быть блокированы группами, неустойчивыми к основаниям, например, без ограничения, метилом или этилом, и гидрокси реакционноспособные группы могут быть блокированы группами, неустойчивыми к основаниям, такими как ацетил в присутствии аминов, блокированных группами, неустойчивыми к кислотам, такими как трет-бутилкарбамат или карбаматамы, которые которые являются стабильными как к кислоте, так и к основанию, но могут быть удалены гидролитически.
Карбоновая кислота и гидрокси реакционноспособные группы могут быть также блокированы гидролитически удаляемыми защитными группами, такими как бензильная группа, в то время как аминовые группы могут быть блокированы группами, неустойчивыми к основаниям, например, Fmoc. Реакционноспособные группы карбоновой кислоты могут быть блокированы оксидативно-удаляемыми защитными группами, такими как 2,4-диметоксибензил, в то время как присутствующие аминогруппы могут быть блокированы карбаматами силила, неустойчивыми к фторидам.
Аллильные защитные группы являются эффективными в присутствии кислотных и основных защитных групп, поскольку форма является стабильной и может быть последовательно удалена металлическим или фосфат-ион кислотным катализаторами. Например, аллил-блокированная карбокильная кислота может быть защищена палладий(0)-катализируемой реакцией в присутствии t-бутил карбамата, неустойчивого к кислоте или ацетатаминовыми защитными группами, неустойчивыми к основаниям. Еще другой формой защитных групп является смола, к которой может быть присоединено соединение или промежуточное соединение. До тех пор, пока остаток является присоединенным к смоле, эта функциональная группа является заблокированной и и не может вступать в реакцию. После высвобождения из смолы, функциональная группа способна вступать в реакцию.
Типичные блокирующие защитные группы известны в данной области и включают, но не ограничиваются этим, следующие группы:







В целом, соединения Формулы (I) могут быть приготовлены пошаговым способом, включающим начальное образование ацетилена или олефина, с последующим гидрированием для обеспечения алканильного замещения на фенил. Азотсодержащая группа может присоединяться к фенилу путем формирования и изменения боковой цепи в мета-положении алканила.
1. Формирование алканила
Способы А-С ниже описывают разные подходы к формированию алканила на фенильном кольце.
Более подробно, Способ А иллюстрирует формирование алкана с помощью гидрирования алкина.
Способ В показывает построение промежуточного соединения алкана с помощью гидрирования цис или транс олефина.
Пригодные для гидрирования катализаторы известны опытным специалистам в данной области. Примеры катализаторов включают, например, палладий на угле, гидроксид палладия, платину, оксид платины, никель Ренея, родий, катализатор Уилкинсона (хлор трис(трифенилфосфин)родий) и катализатор Линдлара (Pd-СаСО3-PbO).
Источники водорода, пригодные для восстановления алкинов до алканов путем гидрирования, известны опытным специалистам в данной области. Примеры источника водорода включают, например, газообразный водород, формиат аммония, борогидрид натрия, циклогексен, циклогексадиен и гидразин.
СПОСОБ А

Способ В показывает формирование промежуточного соединения алкана путем гидрирования цис или транс олефина
СПОСОБ В

Алкин (А-1) и олефин (А-3) могут быть приготовлены согласно известным способам в данной области (см., например, Способы C-G).
Способы C-G иллюстрируют формирование боковой цепи алкина или олефина на фениле (указан Ar). Более подробно, Способ С показывает соединение тройной связи с фенилом на основе реакции Соногашира. Обычно, палладиевый(О) катализатор используется в сочетании с основанием для соединения арилгалида с ацетиленовым производным. R′ может быть, например, алкилом, арилом, гетероциклилом, гетероарилом, карбоциклилом или их производными, которые могут далее изменены, как описано здесь.
2. Формирование алканила
СПОСОБ С

Способ D показывает формирование концевого алкина. Обычно, реакцию Соногашира используют для связывания арилгалида с ацетиленовым производным, таким как 2-метил-3-бутин-2-ол. На следующей стадии основание используют для обнаружения концевого алкина. Этот алкин может быть далее изменен в последовательных реакциях типа реакции Соногашира.
СПОСОБ D

Способ Е показывает соединение олефина с фенилом на основе реакции Хека. Обычно, палладиевый(0) катализатор используется в комбинации с основанием для соединения арилгалида с виниловым производным. R′ может быть далее модифицирован, как описано здесь.
СПОСОБ Е
Способ F показывает формирование олефиновой связи на основе реакции Виттинга. Обычно, соль фосфония присоединяется к альдегиду в присутствии пригодного основания, при этом молекула триарилфосфиноксида отщепляется.
СПОСОБ F

Способ G показывает формирование олефиновой связи путем отщепления Н2О в присутствии кислоты.
СПОСОБ G

Дополнительно, прямое алкилирование фенильной группы может быть выполнено, например, путем соединения алкил-бороната с галоидфенилом в присутствии катализатора на основе Pd. Другие способы прямого алкилирования фенильного кольца включают, например, соединение аралкильного или алкильного реактива Гриньяра с фенильным кольцом.
Формирование и модифицирование азотсодержащей боковой цепи
Способы Н-Т ниже описывают разные подходы к формированию боковой цепи и модификациям.
В целом, замещенное соответствующим образом фенильное производное может соединяться с разными типами боковых цепей, которые могут быть далее модифицированы для обеспечения конечных связей и азотсодержащих групп соединений
Формулы (I).
Способ Н показывает арилгалид, соединенный с аллиловым спиртом в присутствии палладиевого(0) катализатора. Одновременно концевая спиртовая группа аллильного спирта была окислена до альдегидной группы, которую далее модифицировали с помощью восстановительного аминирования до амина (-NR11R12).
Способ Н
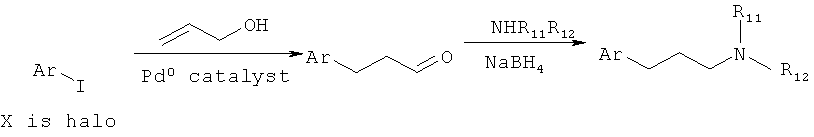
Способ I иллюстрирует альдольную конденсацию между арилальдегидом или арилкетоном и нитрильным реагентом, включающим, по меньшей мере, один α-водород. Полученное в результате конденсации промежуточное соединение может быть далее восстановлено до амина (-NR11R12).
СПОСОБ I

Способ J показывает реакцию ацилирования для формирования связи на основе кетона. Опытному в данной области специалисту будет понятно, что R′ группа может включать функциональные группы, которые могут быть далее модифицированы.
СПОСОБ J

Способ К показывает остаток (R′OH) боковой цепи, присоединенный к арильному производному с помощью атома кислорода в реакции конденсации, в которой молекула Н2O отщепляется. R′ может включать функциональные группы, которые могут быть далее модифицированы для приготовления связей и азотсодержащих групп соединений Формулы (I).
Дополнительно, боковые цепи на основе алкиновых или олефиновых производных могут быть сначала приготовлены согласно Способам C-G, как описано ранее. Производные алкина или олефина могут быть далее гидрированы и модифицированы для обеспечения концевой азотсодержащей группы.
Следующие способы иллюстрируют разные синтетические способы изменения или модифицирования группы боковой цепи путем восстановления, окисления, нуклеофильного или электрофильного замещения, ацилирования и т.п. В результате, может быть синтезирована иная группа связей.
Способ L иллюстрирует процесс аминирования, в котором карбоновая кислота превращается в амин. Обычно, карбоновая кислота (или эфир) может быть сначала восстановлена до исходного спирта, который затем может быть конвертирован в амин с помощью мезилата, галида, азида, фталимида или реакции Мицунобу и т.п. Пригодные восстанавливающие агенты включают, например, борогидрид натрия (NaBH4), цианоборогидрид натрия (NaBH3CN), триацетоксиборогидрид натрия (NаВН(ОСОСН3)3), литий-алюминий гидрид (LiAlH4) и т.п. Как показано, полученный амин может быть далее функционализирован способами, известными опытным в данной области специалистам.
СПОСОБ L

Процесс аминирования, в котором карбоновая кислота сначала превращается в хлорангидрид и галид заменен пригодным аминовым синтоном, показан в Способе М. Полученный амид может быть восстановлен и/или далее функционализирован способами, известным опытным в данной области специалистам.
СПОСОБ М
Дополнительные или альтернативные модификации могут быть произведены согласно способам, показанным ниже.
СПОСОБ N

СПОСОБ О

СПОСОБ Р

СПОСОБ Q
СПОСОБ R

СПОСОБ S

СПОСОБ Т

Схема I иллюстрирует полную синтетическую последовательность приготовления соединения Формулы (I).
Схема I

В схеме I группа боковой цепи сначала строится и защищается амином. Ацетиленовая часть затем формируется посредством соединения с концевым ацетиленом согласно Способу С. Затем снимается защита присоединенного продукта для образования алкина. Алканильная связь образуется с помощью гидрирования алкина (см., например, Способ А). Другие азотсодержащие группы могут быть далее извлечены из концевого амина согласно известным в данной области способам.
Дополнительно к схемам основной реакции и способам, которые обсуждались выше, обеспечены другие примеры схем реакций для иллюстрации способов приготовления любого соединения, имеющего структуру Формулы (I) или ее подструктур, включающих Формулы (Iа) и (Ib).
IV. Лечение офтальмологических заболеваний и нарушений
Описанные здесь аминопроизводные соединения, включающие соединения, которые имеют структуру, представленную Формулой (I) и их подструктур, являются эффективными для лечения офтальмологического заболевания или нарушения путем ингибирования одного или более стадий зрительного цикла.
В дополнительном варианте представлено не ретиноидное соединение, которое ингибирует реакцию изомеризации, что приводит к образованию 11-цис ретинола, при этом указанная реакция изомеризации возникает в ПЭС и при этом указанное соединение имеет величину ED50, равную 1 мг/кг или менее при введении пациенту. В другом варианте представлено не ретиноидное соединение, в котором величина ED50 измерена после введения однократной дозы соединения указанному пациенту в течение 2 часов или более. В другом варианте представлено не ретиноидное соединение, при этом не ретиноидным соединением является алкоксильное соединение. В дополнительном варианте представлена фармацевтически приемлемая композиция, включающая фармацевтически приемлемый носитель и не ретиноидное соединение, как описано здесь. В дополнительном варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, который включает введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и не ретиноидное соединение, как описано здесь.
В дополнительном варианте представлено соединение, которое ингибирует образование 11-цис-ретинола с величиной IС50, равной примерно 1 мкМ или менее при анализе in vitro, используя экстракт клеток, которые экспрессируют RPE65 и LRAT, при этом экстракт кроме того включает CRALBP, и при этом соединение является стабильным в растворе в течение, по меньшей мере, 1 недели при комнатной температуре. В другом варианте, соединение ингибирует образование 11-цис-ретинола при величине IC50 примерно 0.1 мкМ или менее. В другом варианте соединение ингибирует образование 11-цис-ретинола при величине IC50 примерно 0.01 мкМ или менее. В другом варианте соединением, которое ингибирует образование 11-цис-ретинола, является не ретиноидным соединением. В дополнительном варианте представлена фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано здесь. В дополнительном варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, которое включает введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано здесь. В дополнительном варианте представлен способ модулирования транспорта хромофора в ретиноидном цикле который включает введение пациенту соединения, которое ингибирует образование 11-цис-ретинола, как описано здесь.
В дополнительном варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, который включает введение пациенту соединения Формулы (G) или таутомера, стереоизомера, геометрического изомера или фармацевтически приемлемого сольвата, гидрата, соли, N-оксида или их пролекарств:

в которой
Z представляет собой связь, C(R1)(R2)-, -C(R9)(R10)-C(R1)(R2)-, -X-C(R31)(R32)-, -C(R9)(R10)-C(R1)(R2)-C(R36)(R37)- или X-C(R31)(R32)-C(R1)(R2)-;
X представляет собой -O-, -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -C(=CH2)-, -C(=N-NR35)- или -C(=N-OR35)-;
G является выбранным из -C(R41)2-C(R41)2-R40, -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -С(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18) арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила или две R41 группы вместе могут формировать оксо;
каждый R42 является независимо выбранным из водорода или алкила;
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R36 и R37 вместе образуют оксо; или дополнительно, R36 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R36 и R1 вместе образуют прямую связь, и R37 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют имино;
R5 представляет собой C1-C15 алкил или карбоциклилалкил;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, CO2R13 или SO2NR24R25; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R9 и R1 вместе образуют прямую связь, и R10 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R23, -C(NH)NH2, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый из R13, R22 и R23 является независимо друг от друга выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35 каждый является независимо водородом или алкилом;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо друг от друга выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероариалкила или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4.
В дополнительном варианте представлен способ модулирования транспорта хромофора в ретиноидном цикле, который включает введение пациенту соединения Формулы (G). В другом варианте представлен способ, в результате которого происходит уменьшение липофусцинового пигмента, накопленного в глазу пациента. В другом варианте представлен способ, в результате которого происходит уменьшение липофусцинового пигмента, накопленного в глазу пациента, при этом липофусциновым пигментом является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В еще другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, который приводит к уменьшению липофусцинового пигмента, накопленного в глазу пациента. В еще другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, который приводит к уменьшению липофусцинового пигмента, накопленного в глазу пациента, при этом липофусциновым пигментом является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В еще другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, при этом офтальмологическим заболеванием или нарушением является возрастная макулярная дегенерация или макулярная дистрофия Штаргардта. В еще другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, при этом офтальмологическое заболевание или нарушение является выбранным из отслоения сетчатки, геморрагической ретинопатии, пигментной дистрофии сетчатки, палочко-колбочковой дистрофии, дистрофии Сорсби, невропатии зрительного нерва, воспалительного заболевания сетчатки, диабетической ретинопатии, закупорки кровеносного сосуда сетчатки, ретролентальной фиброплазии или ишемически-реперфузионного повреждения сетчатки, пролиферативной витреоретинопатии, дистрофии сетчатки, врожденной невропатии зрительного нерва, увеита, повреждения сетчатки, нарушения сетчатки, связанного с болезнью Альцгеймера, нарушения сетчатки, связанного с рассеянным склерозом, нарушения сетчатки, связанного с болезнью Паркинсона, нарушения сетчатки, связанного с вирусной инфекцией, нарушения сетчатки, связанного с чрезмерным воздействием света, миопии и нарушения сетчатки, связанного со СПИДом. В еще другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано выше, приводящий к уменьшению липофусцинового пигмента, накопленного в глазу у пациента. В еще другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, как описано здесь, приводящий к уменьшению липофусцинового пигмента, накопленного в глазу у пациента, при этом липофусциновым пигментом является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В другом варианте представлен способ ингибирования темновой адаптации палочковой фоторецепторной клетки сетчатки, включающий контактирование сетчатки с соединением Формулы (G). В другом варианте представлен способ ингибирования темновой адаптации палочковой фоторецепторной клетки сетчатки, включающий контактирование сетчатки с не ретиноидным соединением, как описано здесь. В другом варианте представлен способ ингибирования темновой адаптации палочковой фоторецепторной клетки сетчатки, включающий контактирование сетчатки с соединением, которое ингибирует образование 11-цис-ретинола, как описано здесь.
В другом варианте представлен способ ингибирования регенерации родопсина в палочковой фоторецепторной клетке сетчатки, который включает контактирование сетчатки с соединением Формулы (G). В другом варианте представлен способ ингибирования регенерации родопсина в палочковой фоторецепторной клетке сетчатки, который включает контактирование сетчатки с не ретиноидным соединением, как описано здесь. В другом варианте представлен способ ингибирования регенерации родопсина в палочковой фоторецепторной клетке сетчатки, который включает контактирование сетчатки с соединением, которое ингибирует образование 11-цис-ретинола, как описано здесь.
В другом варианте представлен способ снижения ишемии в глазу пациента, который включает введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение Формулы (G).
В дополнительном варианте представлен способ снижения ишемии в глазу пациента, который включает введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и не ретиноидное соединение, как описано здесь. В дополнительном варианте представлен способ снижения ишемии в глазу пациента, который включает введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано выше. В другом варианте представлен способ снижения ишемии в глазу пациента, при этом фармацевтическая композиция вводится в условиях и времени, достаточных для ингибирования темновой адаптации палочковой фоторецепторной клетки, тем самым снижая ишемию в глазу.
В дополнительном варианте представлен способ ингибирования неоваскуляризации в сетчатке глаза у пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и не ретиноидное соединение, как описано здесь. В дополнительном варианте представлен способ ингибирования неоваскуляризации в сетчатке глаза у пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано здесь. В другом варианте представлен способ ингибирования неоваскуляризации в сетчатке глаза у пациента, при этом фармацевтическая композиция вводится в условиях и времени, достаточных для ингибирования темновой адаптации палочковой фоторецепторной клетки, тем самым ингибируя неоваскуляризацию сетчатки.
В дополнительном варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, включающий контактирование сетчатки с соединением Формулы (G). В дополнительном варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, включающий контактирование сетчатки с не ретиноидным соединением, как описано здесь. В дополнительном варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, включающий контактирование сетчатки с соединением, которое ингибирует образование 11-цис-ретинола, как описано здесь.
В еще другом варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, при этом ретинальной клеткой является нейрональная клетка. В другом варианте представлен способ ингибирования дегенерации ретинальной клетки в сетчатке, при этом нейрональной клеткой сетчатки является фоторецепторная клетка.
В другом варианте представлен способ уменьшения липофусцинового пигмента в сетчатке пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение Формулы (G). В дополнительном варианте представлен способ уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, при этом липофусцином является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В дополнительном варианте представлен способ уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и не ретиноидное соединение, как описано здесь. В дополнительном варианте представлен способ уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, включающий введение пациенту фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение, которое ингибирует образование 11-цис-ретинола, как описано выше. В дополнительном варианте представлен способ уменьшения липофусцинового пигмента, накопленного в сетчатке пациента, при этом липофусцином является N-ретинилиден-N-ретинил-этаноламин (А2Е).
В дополнительном варианте представлен способ модулирования транспорта хромофора в ретиноидном цикле, включающий введение пациенту соединения Формулы (G) или таутомера, стереоизомера, геометрического изомера или фармацевтически приемлемого сольвата, гидрата, соли, N-оксида или их пролекарств:

в которой
Z представляет собой связь, -C(R1)(R2)-, -С(R9)(R10)-C(R1)(R2)-, -X-C(R31)(R32)-, -C(R9)(R10)-C(R1)(R2)-C(R36)(R37)- или X-C(R31)(R32)-C(R1)(R2)-;
Х представляет собой -O-, -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -С(=O)-, -С(=СН2)-, -C(=N-NR35)- или -C(=N-OR35)-;
G является выбранным из -C(R41)2-C(R41)2-R40, -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила или две R41 группы вместе могут формировать оксо;
каждый R42 является независимо выбранным из водорода или алкила;
R1 и R2 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, является выбранным из водорода, C1-C5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, является выбранным из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или -NR7R8; или R36 и R37 вместе образуют оксо; или дополнительно, R3 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно R36 и R1 вместе образуют прямую связь, и R37 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R3 и R4 каждый, независимо друг от друга, является выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют имино;
R5 представляет собой C1-C15 алкил или карбоциклилалкил;
R7 и R8 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, CO2R13 или SO2NR24R25; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, является выбранным из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R9 и R1 вместе образуют прямую связь, и R10 и R2вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, -C(=O)R23, -C(NH)NH2, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
каждый R13, R22 и R23 является независимо друг от друга выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35 каждый, является независимо друг от друга водородом или алкилом;
R20 и R21 каждый, независимо друг от друга, является выбранным из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо друг от друга выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
каждый R16 и R17, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероариалкила или фторалкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным из водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4.
В другом варианте представлен способ лечения офтальмологического заболевания или нарушения у пациента, который включает введение пациенту Формулы (G), при этом соединение Формулы (G) является выбранным из группы, состоящей из:



























































































































































































В некоторых вариантах, раскрытые здесь соединения функционируют путем ингибирования или блокирования активности транс-цис изомеразы зрительного цикла Описанные здесь соединения могут ингибировать, блокировать или каким-либо другим образом препятствовать стадии изомеризации в зрительном цикле. В конкретном варианте соединение ингибирует изомеризацию полностью-транс-ретинилового эфира, в определенных вариантах полностью-транс-ретиниловым эфиром является эфир жирной кислоты полностью-транс-ретинола, и соединение ингибирует изомеризацию полностью-транс-ретинола до 11-цис-ретинола. Соединение может связываться или каким-либо другим образом взаимодействовать и ингибировать активность, по меньшей мере, одной изомеразы зрительного цикла, которую здесь и в данной области техники можно назвать ретинальной изомеразой или изомерогидролазой. Соединение может блокировать или ингибировать связывание субстрата полностью-транс-ретинилового эфира с изомеразой. Или же, или дополнительно, соединение может связываться с каталитически активным центром или областью изомеразы, тем самым ингибируя способность энзима катализировать изомеризацию субстрата полностью-транс-ретинилового эфира. На основании новых научных данных полагают, что по меньшей мере одна изомераза, которая катализирует изомеризацию полностью-транс-ретиниловых эфиров, расположена в цитоплазме клеток ПЭС. Как обсуждалось здесь, каждая стадия, энзим, субстрат, промежуточное соединение и продукт зрительного цикла до сих пор являются не изученными (см., например, Moiseyev et al., Proc. Natl. Acad. Sci. USA 102:12413-18 (2004); Chen et al., Invest. Ophthalmol. Vis. Sci. 47:1177-84 (2006); Lamb et al. supra).
Способ определения влияния соединения на изомеразную активность может быть выполнен in vitro, как описано здесь и данной области техники (Stecher et al., J Biol Chem 274:8577-85 (1999); см. также Golczak et al., Proc. Natl. Acad. Sci. USA 102:8162-67 (2005)). Микросомные мембраны пигментного эпителия сетчатки (ПЭС), выделенные у животных (таких как бык, капуцин, например, человек), могут служить в качестве источника изомеразы. Способность соединений алкоксифенил-связанного аминового производного ингибировать изомеразу может быть также определена анализом in vivo мышиной изомеразы. Известно, что кратковременное воздействие на глаз интенсивного света («фотообесцвечивание» зрительного пигмента или просто «обесцвечивание») фотоизомеризует почти весь 11-цис-ретиналь в сетчатке. Восстановление 11-цис-ретиналя после обесцвечивания может быть использовано для оценки активности изомеразы in vivo (см., например, Maeda et al., J. Neurochem 85:944-956 (2003); Van Hooser et al., J Biol Chem 277:19173-82, 2002). При электроретинографическом исследовании запись ЭРГ может производиться, как описано ранее (Haeseleer et al., Nat. Neurosci. 7:1079-87 (2004); Sugitomo et al., J. Toxicol. Sci. 22 Suppl 2:315-25 (1997); Keating et al., Documenta Ophthalmologica 100:77-92 (2000)). See also Deigner et al., Science, 244:968-971 (1989); Gollapalli et al., Biochim Biophys Acta. 1651:93-101 (2003); Parish, et al., Proc. Natl. Acad. Sci. USA 95:14609-13 (1998); Radu, et al., Proc Natl Acad Sci USA 101:5928-33 (2004)). В определенных вариантах, соединения, которые являются эффективными для лечения пациента, имеющего или находящегося в группе риска развития любого из офтальмологических заболеваний или заболеваний сетчатки, или описанных здесь нарушений, имеют уровни IC50 (концентрация соединения, при которой 50% изомеразной активности ингибировано), как измерено в описанных здесь или известных в данной области техники анализах изомеразы, примерно менее чем 1 мкМ; в других вариантах, установленный уровень IC50 составляет примерно менее чем 10 нМ; в других вариантах, установленный уровень IC50 составляет примерно менее чем 50 нМ; в определенных вариантах, установленный уровень IC50 составляет примерно менее чем 100 нМ; в других определенных вариантах, установленный уровень IC50 составляет примерно менее чем 10 мкМ; в других вариантах, установленный уровень IC50 составляет примерно менее чем 50 нМ; в других определенных вариантах, установленный уровень IC50 составляет примерно менее чем 100 нМ или примерно 500 мкМ; в других вариантах, установленный уровень IC50 составляет примерно от 1 мкМ до 10 мкМ; в других вариантах, установленный уровень IC50 составляет примерно от 1 нМ до 10 нМ. Одно или более соединений настоящего изобретения при введении пациенту показывают величину ED50, равную примерно 5 мг/кг или менее, что выявлено ингибированием реакции изомеразы, вызывающей образование 11-цис-ретинола. В некоторых вариантах, соединения настоящего изобретения имеют величину ED50, равную примерно 1 мг/кг при введении пациенту. В других вариантах, соединения настоящего изобретения имеют величину ED50, равную примерно 0.1 мг/кг при введении пациенту. Величины ED50 могут быть измерены примерно через 2 часа, 4 часа, 6 часов, 8 часов или более после введения пациенту соединения или его фармацевтической композиции.
Описанные здесь соединения могут быть эффективными для лечении пациента который имеет офтальмологическое заболевание или нарушение, особенно заболевание или нарушение сетчатки, такое как возрастная макулярная дегенерация или макулярная дистрофия Штаргардта. В одном варианте, описанные здесь соединения могут ингибировать (т.е. предотвращать, уменьшать, замедлять, аброгировать или минимизировать) накопление липофцсциновых пигментов, а также родственных липуфусцину и/или ассоциированных молекул в глазу. В другом варианте, соединения могут ингибировать (т.е. предотвращать, уменьшать, замедлять, ликвидировать или минимизировать) накопление N-ретинилиден-N-ретинилэтаноламина (А2Е) в глазу. Причиной офтальмологического заболевания может быть, по меньшей мере, отчасти, накопление липофусциновых пигментов и/или накопление А2Е в глазу. Соответственно, в определенных вариантах обеспечены способы ингибирования или предотвращения накопления липофусциновых пигментов и/или А2Е в глазу пациента. Эти способы включают введение пациенту композиции, включающей фармацевтически приемлемый или пригодный эксципиент (т.е. фармацевтически приемлемый или пригодный носитель) и аминопроизводное соединение, как описано подробно здесь, включая соединение, имеющее структуру Формулы (I) и их подструктур, а также специфические описанные здесь аминопроизводные соединения.
Накопление липофусциновых пигментов в клетках пигментного эпителия сетчатки (ПЭС) связано с прогрессированием заболеваний сетчатки, что приводит к слепоте, включая возрастную макулярную дегенерацию (De Laey et al., Retina 15:399-406 (1995)). Липофусциновые гранулы являются автофлуоресцирующими лизосомальными остаточными тельцами (также называемыми возрастными пигментами). Важным флуоресцирующим видом липофусцина является А2Е (оранжево-испускающий флуорофор), который является положительно заряженным продуктом конденсации основания Шиффа, образованным полностью-транс-ретинальдегидом с фосфатидилэтаноламином (соотношение 2:1) (см., например, Eldred et al., Nature 361:724-6 (1993); см также Sparrow, Proc. Natl. Acad. Sci. USA 100:4353-54 (2003)). Полагают, что много неусвоенного липофусцинового пигмента образуется в фоторецепторных клетках; осаждение в ПЭС возникает, поскольку ПЭС эндоцитирует мембранозный дебрис, который ежедневно удаляется фоторецепторными клетками. Образование этого соединения не рассматривается как результат катализа любым энзимом, в большей степени образование А2Е происходит в результате спонтанной реакции циклизации. Дополнительно, А2Е имеет бисретиноидную структуру пиридиния, которая, однажды сформировавшись, не может быть энзиматически деградирована. Липофусцин, и таким образом А2Е, накапливаются при старении глаза человека, а также накапливаются при ювенильной форме макулярной дегенерации, называемой заболеванием Штаргардта, и при нескольких других конгенитальных дистрофиях сетчатки.
А2Е может вызывать повреждение сетчатки несколькими разными механизмами. При низких концентрациях, А2Е ингибирует нормальный протеолиз в лизозомах (Holz et al., Invest. Ophthalmol. Vis. Sci. 40:737-43 (1999)). При более высоких значительных концентрациях, А2Е может функционировать как положительно заряженный лизосомотропный детергент, растворяющий клеточные мембраны, и может изменять лизосомальную функцию, высвобождая проапоптотические белки из митохондрии, и в конечном итого убивать клетки ПЭС (см., например, Eldred et al., supra; Sparrow et al., Invest. Ophthalmol. Vis. Sci. 40:2988-95 (1999); Holz et al., supra; Finneman et al., Proc. Natl. Acad. Sci. USA 99:3842-347 (2002); Suter et al., J. Biol. Chem. 275:39625-30 (2000)). А2Е является фототоксичным и инициирует вызванный синим цветом апоптоз в клетках ПЭС (см., например, Sparrow et al., Invest. Ophthalmol. Vis. Sci. 43:1222-27 (2002)). После воздействия синего света происходит образование фотооксидативных продуктов А2Е (например, эпоксидов), которые повреждают клеточные макромолекулы, включая ДНК (Sparrow et al., J. Biol. Chem. 278(20):18207-13 (2003)). А2Е самогенерирует атомарный кислород, который реагирует с А2Е с образованием эпоксидов в месте двойных углерод-углеродных связей (Sparrow et al., supra). Образование активной формы кислорода после фотовозбуждения А2Е вызывает оксидативное повреждение клетки, часто приводящее к гибели клетки. Непрямой способ блокирования образования А2Е с помощью ингибирования биосинтеза ближайшего предшественника А2Е, полностью-транс-ретиналя, было описано (см. Американскую заявку 2003/0032078). Однако, эффективность описанного здесь способа является ограниченной, так как образование полностью-транс ретиналя является важной составляющей зрительного цикла. Другие описанные терапии включают нейтрализацию повреждения, вызванного оксидированными химическими радикалами с помощью миметиков супероксиддисмутазы (см., например, Американскую заявку 2004/0116403) и ингибирования индуцированной А2Е цитохром С-оксидазы в клетках сетчатки отрицательно заряженными фосфолипидами (см., например, Американскую заявку 2003/0050283).
Описанные здесь аминопроизводные соединения могут быть эффективными для предотвращения, уменьшения, ингибирования или снижения накопления (например, отложения) А2Е и А2Е-родственных и/или производных молекул в ПЭС. Без привязки к теории, поскольку ПЭС является важным для сохранения целостности фоторецепторных клеток, предотвращение, снижение или ингибирование повреждения ПЭС может ингибировать дегенерацию (например, усиливать выживаемость или увеличивать, или продлевать жизнеспособность клеток) нейрональных клеток сетчатки, особенно фоторецепторных клеток. Соединения, которые специфично связываются или взаимодействуют с А2Е, А2Е-родственными и/или производными молекулами, или воздействуют на образование или накопление А2Е, могут также понижать, ингибировать, предотвращать или уменьшать один или более токсических эффектов А2Е или А2Е-родственных и/или производных молекул, что приводит к повреждению, потере или нейродегенерации нейрональных клеток сетчатки (включая фоторецепторную клетку), или каким-либо образом уменьшать жизнеспособность нейрональных клеток сетчатки. Такие токсические эффекты включают индуцирование апоптоза, спонтанное образование атомарного кислорода и образование активных форм кислорода; спонтанное образование атомарного кислорода для образования А2Е-эпоксидов, которые индуцируют повреждение ДНК, таким образом повреждая клеточную ДНК и индуцируя повреждение клетки; растворение клеточных мембран; изменение лизосомальной функции; и высвобождение проапоптотических белков из митохондрии.
В других вариантах, описанные здесь соединения могут использоваться для лечения других офтальмологических заболеваний или расстройств, например, глаукомы, колбочко-палочковой дистрофии, отслоения сетчатки, геморрагической или гипертензивной ретинопатии, пигментной дистрофии сетчатки, невропатии зрительного нерва, воспалительного заболевания сетчатки, пролиферативной витреоретинопатии, генетических дистрофий сетчатки, травматического повреждения оптического нерва (например, путем физического повреждения, избыточного воздействия света или лазерного света), врожденной невропатии зрительного нерва, невропатии, вызванной токсическим агентом, или вызванной неблагоприятной побочной реакцией на лекарства, или недостатоком витаминов, дистрофии Сорсби, увеита, нарушения сетчатки, связанного с болезнью Альцгеймера, нарушения сетчатки, связанного с рассеянным склерозом; нарушения сетчатки, связанного с вирусной инфекцией (цитомегаловирус или вирус простого герпеса), нарушения сетчатки, связанного с заболеванием Паркинсона, нарушения сетчатки, связанного с СПИДом, или других форм прогрессирующей атрофии сетчатки или дегенерации. В другом специфическом варианте, заболевание или нарушение возникает в результате механического, химического или вызванного лекарственными препаратами повреждения, теплового поражения, радиационного поражения, светового поражения, лазерного поражения. Соединения изобретения являются эффективными для лечения как врожденной, так и не врожденной дистрофии сетчатки. Эти способы также являются эффективными для предотвращения офтальмологического повреждения, вызванного окружающей средой, например вызванное воздействием света оксидативное повреждение сетчатки, вызванное воздействием лазера повреждение сетчатки, "повреждение, вызванное вспышкой" или "ослепление светом", ошибками в результате неадекватной рефракции, включающие, но не ограничивающиеся этим, миопию (см., например, Quinn GE et al. Nature 1999; 399:113-114; Zadnik К et al. Nature 2000; 404:143-144; Gwiazda J et al. Nature 2000; 404:144), и т.п.
В других вариантах обеспечены способы ингибирования неоваскуляризации (включая, но не ограничиваясь этим, неоваскулярную глаукому) в сетчатке с помощью одного или более аминопроизводных соединений, как описано подробно здесь, включая соединение, имеющее структуру, представленную Формулой (I) и их подструктур, и описанных здесь соединений аминовых соединений. В других определенных вариантах обеспечены способы снижения гипоксии в сетчатке с помощью описанных здесь соединений. Эти способы включают введение пациенту, при необходимости, композицию, включающую фармацевтически приемлемый или пригодный эксципиент (т.е. фармацевтически приемлемый или пригодный носитель) и аминопроизводное соединение, как описано подробно здесь, включая соединение, имеющее структуру Формулы (I) и их подструктур, и описанных здесь специфических аминопроизводных соединений.
Путем объяснения и не привязываясь к какой-либо теории, и как подробно обсуждается здесь далее, адаптированные к темноте палочковые фоторецепторы вызывают очень высокую метаболическую потребность (т.е. расходование энергии (потребление АТФ) и потребление кислорода). Образовавшаяся гипоксия может вызывать и/или обострять дегенерацию сетчатки, которая вероятно будет усиливаться в условиях, когда сосудистая система сетчатки уже нарушена, включая, но не ограничиваясь этим, такие условия, как диабетическая ретинопатия, макулярный отек, диабетическая макулопатия, закупорка кровеносных сосудов сетчатки (которая включает закупорку вен сетчатки и закупорку артерий сетчатки), ретролентальная фиброплазия, ишемически-реперфузионное повреждение, а также влажная форма возрастной макулярной дегенерации (ВМД). Более того, дегенерация сетчатки и гипоксия могут привести к неоваскуляризации, которая в свою очередь может усиливать распространение дегенерации сетчатки. Соединения описанных здесь аминовых производных, которые модулируют зрительный цикл, могут вводиться для предотвращения, ингибирования и/или задержки темновой адаптации палочковых фоторецепторных клеток а следовательно снижать метаболическую потребность, тем самым уменьшая гипоксию и ингибируя неовакуляризацию.
В порядке пояснения, кислород является важным метаболитом для сохранения функции сетчатки у млекопитающих, и гипоксия сетчатки может быть причиной многих заболеваний и нарушений сетчатки, которые в качестве составляющей имеют ишемию. У многих млекопитающих (включая человека) с двойной системой кровоснабжения в сетчатку, насыщение кислородом внутренней сетчатки достигается через внутриретинальную микроциркуляторную часть, которая немного сравнима с хориокапиллярами, которые поставляют кислород в ПЭС и фоторецепторам. Разные системы кровоснабжения создают неравномерное давление кислорода по толщине сетчатки (Cringle et al., Invest. Ophthalmol. Vis. Sci. 43:1922-27 (2002)). Колебание кислорода в слоях сетчатки связано как с различием плотности капилляров, так и с непропорциональным потреблением кислорода разными нейронами сетчатки и глиоцитами.
Локальное давление кислорода может значительно воздействовать на сетчатку и ее микроциркуляторное русло путем регулирования множества вазоактивных агентов, включая, например, васкулярный эндотелиальный фактор роста (VEGP). (См., например, Werdich et al., Exp. Eye Res. 79:623 (2004); Arden et al., Br. J. Ophthalmol. 89:764 (2005)). Полагают, что палочковые фоторецепторы имеют самую высокую метаболическую скорость любой клетки в теле (см., например, Arden et al., supra). Во время темповой адаптации палочковые фоторецепторы восстанавливают высокие уровни цитоплазматического кальция посредством цГМФ-зависимых кальциевых каналов с сопутствующим выталкиванием ионов натрия и воды. Отток натрия из клетки является АФТ-зависимым процессом, при котором нейроны сетчатки потребляют в 5 раз больше кислорода в скотопических условиях (т.е. условиях темновой адаптации) по сравнению с фотопическими условиями (т.е. в условиях световой адаптации). Таким образом, во время характерной темновой адаптации фоторецепторов, высокая метаболическая потребность приводит к значительному локальному снижению уровней кислорода в адаптированной к темноте сетчатке (Ahmed et al. Invest. Ophthalmol. Vis. Sci. 34:516 (1993)).
He привязываясь к какой-либо теории, гипоксия сетчатки может, кроме того, увеличиваться в сетчатке пациентов, которые имеют заболевания или состояния, такие как, например, закупорка центральной ретинальной вены, когда ретинальная сосудистая система уже нарушена. Увеличение гипоксии может повышать предрасположенность к угрозе потери зрения и ретинальной неоваскуляризации. Неоваскуляризация представляет собой формирование новых функциональных сетей микрокапиллярных сосудов с перфузией эритроцитов и является характеристикой дегенеративных изменений сетчатки, включающих, но не ограничивающихся этим, диабетическую ретинопатию, ретролентальную фиброплазию, влажную форму ВМД и закупорку центральной ретинальной вены. Предотвращение или ингибирование темновой адаптации палочковых фоторецепторных клеток, и следовательно уменьшение расходования энергии и потребления кислорода (т.е. снижение метаболической потребности) может ингибировать или замедлять дегенерацию сетчатки, и/или может стимулировать регенерацию ретинальных клеток, включающих палочковые фоторецепторные клетки и пигментные эпителиальные клетки сетчатки, а также уменьшать гипоксию и ингибировать неоваскуляризацию.
Описаны способы ингибирования (т.е. снижения, предотвращения, замедления или торможения развития, биологически или статистически значимым образом) дегенерации ретинальных клеток (включающих ретинальные нейрональные клетки, как описано здесь, и клетки ПЭС) и/или снижения (т.е. предотвращения или замедления, ингибирования, ликвидации, биологически или статистически значимым образом) ретинальной ишемии. Также обеспечены способы ингибирования (т.е. снижения, предотвращения, замедления или торможения, биологически или статистически значимым образом) неоваскуляризацию в глазу, особенно в сетчатке. Такие способы включают контактирование сетчатки, и таким образом, контактирование ретинальных клеток (включающих ретинальные нейрональные клетки, такие как палочковые фоторецепторные клетки, и клетки ПЭС), по меньшей мере, с одним из описанных здесь соединений алкоксифенил аминовых производных, которые ингибируют, по меньшей мере, одну транс-цис изомеразу зрительного цикла (который может включать ингибирование изомеризации полностью-транс-ретинилового эфира), в условиях и времени, достаточных для предотвращения, ингибирования или замедления темновой адаптации палочковой фоторецепторной клетки в сетчатке. Как описано здесь более подробно, в отдельных вариантах соединение, которое контактирует с сетчаткой, взаимодействует с энзимом изомеразой или энзиматическим комплексом в клетке ПЭС и ингибирует, блокирует или каким-либо другим способом препятствует каталитической активности изомеразы. Таким образом, изомеризация полностью-транс-ретинилового эфира является ингибированной или уменьшенной. По меньшей мере одно соединение стренильного производного (или композиция, включающая, по меньшей мере, одно соединение) может вводиться пациенту, у которого развилось или было установлено офтальмологическое заболевание или нарушение, или который находится в группе риска развития офтальмологического заболевания или нарушения, или пациенту, у которого проявился или имеется риск проявления состояния, такого как ретинальная неоваскуляризация или ретинальная ишемия.
В порядке пояснения, зрительный цикл (также называемый ретиноидным циклом) относится к сериям энзима и опосредованным светом превращениям между 11-цис и полностью-транс формами ретинола/ретиналя, которые наблюдаются в фоторецепторных клетках и клетках пигментного эпителия сетчатки (ПЭС) глаза. В фоторецепторных клетках позвоночных фотон света вызывает изомеризацию хромофора 11-цис-ретинилидена в полностью-транс-ретинилиден, связанный со зрительными рецепторами опсинами. Эта фотоизомеризация инициирует конформационные изменения опсина, который в свою очередь инициируют биохимическую цепь реакций, называемых фототрансдукцией (Filipek et al., Annu. Rev. Physiol. 65 851-79 (2003)). После поглощения света и фотоизомеризации 11-цис-ретиналя в полностью-транс ретиналь, регенерация хромофора зрительного пигмента является критической стадией для возвращении фоторецепторов в их темновое состояние. Для регенерации зрительного пигмента требуется, чтобы хромофор был возвращен обратно в 11-цис-конфигурацию (см. в МсВее et al., Prog. Retin. Eye Res. 20:469-52 (2001)). Хромофор высвобождается из опсина и восстанавливается в фоторецепторе с помощью ретинол-дегидрогеназ. Продукт, полностью-транс-ретинол, захватывается прилегающим пигментным эпителием сетчатки (ПЭС) в форме эфиров нерастворимых жирных кислот в субклеточных структурах, известных как ретиносомы (Imanishi et al., J. Cell Biol. 164;373-78 (2004)).
Во время зрительного цикла в палочковых рецепторных клетках, хромофор 11-цис-ретиналь внутри молекулы зрительного пигмента, которая называется родопсином, поглощает фотон света и изомеризуется в полностью-транс конфигурацию, тем самым активируя фототрансдукционный каскад. Родопсин является рецептором, сопряженным с G-белком (GPCR), который состоит из семи трансмембранных спиралей, которые сцеплены внеклеточными и цитоплазмическими петлями. Когда полностью-транс форма ретиноида все еще ковалентно присоединена к молекуле пигментна, пигмент называется метародопсином, который существует в разных формах (например, метародопсин I и метародопсин II). Полностью-транс ретиноид затем подвергают гидролизу и зрительный пигмент находится в форме апопротеина, опсина, который также называется апо-родопсином здесь и в данной области техники. Этот полностью-транс ретиноид переносится или выносится из фоторецепторной клетки и через внеклеточное пространство к клеткам ПЭС, где ретиноид превращается в 11-цис изомер. Полагают, что движение ретиноидов между клетками ПЭС и фоторецепторными клетками выполняется разными шаперонами полипептидов в каждом виде клетки. См. Lamb et al., Progress in Retinal and Eye Research 23:307-80 (2004).
В условиях света родопсин непрерывно переходит через три формы, родопсин, метародопсин и апо-родопсин. Когда большинство зрительного пигмента находится в форме родопсина (т.е. соединенного с 11-цис ретиналем), палочковая фоторецепторная клетка находится в состоянии «темновой адаптации». Когда зрительный пигмент в основном находится в форме метародопсина (т.е. соединен с полностью-транс-ретиналем), состояние фоторецепторной клетки называется «световой адаптацией», и когда зрительный пигмент является апо-родопсином (или опсином) и более не присоединяет хромофор, состояние фоторецепторной клетки называется «родопсин-обедненным». Каждое из трех состояний фоторецепторной клетки имеет разные требования к энергии, и потребляются разные уровни АФТ и кислорода. В состоянии темновой адаптации родопсин не оказывает регулирующего влияния на катионные каналы, которые являются открытыми, что приводит к притоку катионов (Na+/К+ и Са2+). Для сохранения нужного уровня этих катионов в клетке во время темнового состояния, фоторецепторные клетки активно перемещают катионы из клетки посредством АТФ-зависимых насосов. Таким образом, существование этой «текущей темноты» требует большого количества энергии, что приводит к высокой метаболической потребности. В состоянии световой адаптации метародопсин инициирует энзиматический каскадный процесс, что приводит к гидролизу GMP, который, в свою очередь, закрывает катион-специфические каналы в мембране фоторецепторной клетки. В родопсин-обедненном состоянии хромофор гидролизуется из метародопсина для формирования апопротеина, опсина (апо-родопсина), который частично регулирует катионные каналы таким образом, что палочковые фоторецепторные клетки проявляют ослабленный ток по сравнению с фоторецептором в состоянии темновой адаптации, что приводит к умеренной метаболической потребности.
В нормальных световых условиях распространение палочковых фоторецепторов в состоянии темновой адаптации является небольшим, в целом 2% или менее, и клетки находятся главным образом в состоянии световой адаптации или родопсин-обедненном состоянии, что в целом влечет за собой относительно низкую метаболическую потребность по сравнению с клетками в состоянии темновой адаптации. Однако в ночное время относительное распространение фоторецепторов в состоянии темновой адаптации значительно возрастает из-за отсутствия световой адаптации и продолжения действия «темнового» зрительного цикла в клетках ПЭС, которые заменяют палочковые фоторецепторные клетки 11-цис-ретиналем. Этот поворот к темновой адаптации палочкового фоторецептора вызывает увеличение метаболической потребности (т.е. увеличенному АТФ и потреблению кислорода), что в конечном итоге приводит к ретинальной гипоксии и последующему инициированию ангиогенеза. Большинство ишемических инсультов сетчатки, следовательно, возникает в темноте, например, ночью во время сна.
Не привязываясь к какой-либо теории, терапевтическое вмешательство во время «темнового» зрительного цикла может предотвращать ретинальную гипоксию и неоваскуляризацию, которые вызваны высокой метаболической активностью в палочковой фоторецепторной клетке, адаптированной к темноте. С помощью лишь одного примера, изменение «темнового» зрительного цикла путем введения любого из описанных здесь соединений, которое является ингибитором изомеразы, родопсином (т.е. 11-цис ретинальная связь), может быть снижено или обеднено, предотвращая или ингибируя темновую адаптацию палочковых фоторецепторов. Это в свою очередь может уменьшать ретинальную метаболическую потребность, снижая риск ретинальной ишемии и неоваскуляризации в ночное время, и тем самым ингибируя или замедляя ретинальную дегенерацию.
В одном варианте, по меньшей мере, одно из описанных здесь соединений (т.е. соединение, имеющее структуру Формулы (I) и описанные здесь их подструктуры), которое, например, блокирует, снижает, ингибирует или каким-либо другим способом препятствует каталитической активности изомеразы зрительного цикла статистически или биологически значимым образом, может предотвращать, ингибировать или задерживать темновую адаптацию палочковой фоторецепторной клетки, тем самым ингибируя (т.е. снижая, ликвидируя, предотвращая, замедляя развитие или ослабляя статистически или биологически значимым способом) дегенерацию ретинальных клеток (или усиливая выживаемость ретинальных клеток) сетчатки глаза. В другом варианте, соединение аминового производного может предотвращать или ингибировать темновую адаптацию палочковой фоторецепторной клетки, тем самым снижая ишемию (т.е. снижая, предотвращая, ингибируя, замедляя развитие ишемии статистически или биологически значимым образом). В еще другом варианте, любое из описанного здесь алкоксифенил-связанного аминового производного может предотвращать темновую адаптацию фоторецепторной клетки, тем самым ингибируя неоваскуляризацию в сетчатке глаза. Соответственно, здесь обеспечены способы ингибирования клеточной дегенерации сетчатки, ингибирования неоваскуляризации в сетчатке глаза пациента и снижения ишемии в глазу пациента, при этом способы включают введение, по меньшей мере, одного описанного здесь соединения алкоксифенил-связанного аминового производного, в условиях и в момент времени, достаточных для предотвращения, ингибирования или задержки темновой адаптации палочковой фоторецепторной клетки. Эти способы и композиции являются следовательно эффективными для лечения офтальмологического заболевания или нарушения, включая, но не ограничиваясь этим, диабетическую ретинопатию, диабетическую макулопатию, закупорку кровеносного сосуда сетчатки, ретролентальную фиброплазию или ишемически-реперфузионное повреждение сетчатки.
Описанные здесь аминопроизводные соединения (т.е. аминового производного, как подробно описано здесь, включающего соединение, которое имеет структуру Формулы (I) и их подструктур, а также описанные здесь специфические аминовые производные) могут предотвращать (т.е. задерживать, замедлять, ингибировать или уменьшать) восстановление зрительного пигмента хромофора, который может предотвращать или ингибировать, или тормозить образование ретиналов и может увеличивать уровень ретиниловых эфиров, которые нарушают зрительный цикл, ингибируя регенерацию родопсина и которые предотвращают, замедляют, задерживают или ингибируют темновую адаптацию палочковой фоторецепторной клетки. В определенных вариантах, когда темновая адаптация палочковых фоторецепторных клеток предотвращена в присутствии соединения, темновая адаптация является в основном предотвращенной, и число или процент палочковых фоторецепторных клеток, которые являются родопсин-обедненными или адаптированными к свету, увеличивается по сравнению с количеством или процентом клеток, которые являются родопсин-обедненными или адаптированными к свету, в отсутствии агента. Таким образом, в определенных вариантах, когда темновая адаптация палочковых фоторецепторных клеток предотвращена (т.е. в основном предотвращена), только, по меньшей мере, 2% палочковых фоторецепторных клеток являются адаптированными к темноте, аналогично проценту или количеству клеток, которые находятся в состоянии, адаптированном к темноте при нормальных световых условиях. В других определенных вариантах, по меньшей мере, 5-10%, 10-20%, 20-30%, 30-40%, 40-50%, 50-60% или 60-70% палочковых фоторецепторных клеток являются адаптированными к темноте после введения агента. В других вариантах, соединение задерживает темновую адаптацию, и в присутствии соединения темновая адаптация палочковых фоторецепторных клеток может быть задержана на 30 минут, один час, два часа, три часа или четыре часа по сравнению с темновой адаптацией палочковых фоторецепторов в отсутствие соединения. Напротив, когда аминопроизводное соединение вводится таким образом, что соединение эффективно ингибирует изомеризацию субстрата в условиях световой адаптации, соединение вводится таким образом, чтобы минимизировать процент палочковых фоторецепторных клеток, которые являются адаптированными к темноте, например, только 2%, 5%, 10%, 20% или 25% палочковых фоторецепторов являются адаптированными к темноте (см., например, Американскую заявку 2006/0069078; патентную заявку PCT/US2007/002330).
В сетчатке в присутствии, по меньшей мере, одного аминопроизводного соединения, регенерация родопсина в палочковой фоторецепторной клетке может быть ингибирована, или скорость регенерации может быть снижена (например, ингибирована, снижена или уменьшена в статистически или биологически значимой манере), по меньшей мере, частично, путем предотвращения образования ретиналей, снижения уровня ретиналей и/или увеличения уровня ретиниловых эфиров. Для определения уровня регенерации родопсина в палочковой фоторецепторной клетке, уровень регенерации родопсина (который можно назвать первым уровнем) может быть определен перед контактированием соединения и сетчатки (например, до введения агента). Через определенное количество времени, достаточное для взаимодействия соединения с сетчаткой и клетками сетчатки (т.е. после введения соединения), может быть определен уровень регенерации родопсина (который может называться второй уровень). Понижение на втором уровне по сравнению с первым уровнем показывает, что соединение ингибирует регенерацию родопсина. Уровень генерации родопсина может быть определен после каждой дозы или после любого количества доз, и продолжаться во время терапевтического режима для характеристики влияния родопсина на регенерацию родопсина.
В определенных вариантах, пациент, нуждающийся в описанном здесь лечении, может иметь заболевание или нарушение, которое приводит или вызывает ухудшение способности палочковых фоторецепторов регенерировать родопсин в сетчатке. В качестве примера, ингибирование регенерации родопсина (или снижения скорости регенерации родопсина) может быть симптоматическим у пациентов с диабетом. Дополнительно к определению уровня регенерации родопсина у пациента, который имеет диабет, до и после введения описанного здесь аминопроизводного соединения, влияние соединения может также быть охарактеризовано путем сравнения ингибирования регенерации родопсина у первого пациента (или первой группы или множества пациентов), которому вводилось соединение, и второго пациента (или второй группе или множеству пациентов), который имеет диабет, но не получал агент.
В другом варианте обеспечен способ предотвращения или ингибирования темновой адаптации палочковой фоторецепторной клетки (или множетсва палочковых фоторецепторных клеток) в сетчатке, включающий взаимодействие сетчатки и по меньшей мере, одного описанного здесь аминопроизводного соединения, (например, соединения, как описано здесь, включающего соединение, которое имеет структуру Формулы (I) и их субструктур, и описанные здесь специфические аминопроизводные соединения), в условиях и времени, достаточных для того, чтобы произошло взаимодействие между агентом и изомеразой, присутствующей в ретинальной клетке (такой, как клетка ПЭС). Может быть определен первый уровень 11-цис-ретинала в палочковой фоторецепторной клетке в присутствии соединения и произведено сравнение со вторым уровнем 11-цис-ретинала в палочковой фоторецепторной клетке в отсутствие соединения. Предотвращение или ингибирование темновой адаптации палочковой фоторецепторной клетки показывает, когда первый уровень 11-цис-ретинала меньше, чем второй уровень 11-цис-ретинала.
Ингибирование регенерации родопсина может также включать увеличение уровня 11-цис-ретиниловых эфиров, присутствующих в клетке ПЭС в присутствии соединения, по сравнению с уровнем 11-цис-ретиниловых эфиров, присутствующих в клетке ПЭС в отсутствие соединения (например, до введения агента). Для наблюдения и анализа структур ретиносомных структур в ПЭС может использоваться двухфотонный способ построения изображения, чьи структуры, как полагают, содержат ретиниловые эфиры (см., например, Imanishi et al., J. Cell Biol. 164:373-83 (2004), Epub 2004 January 26.). Первый уровень ретиниловых эфиров может быть определен до введения соединения, и второй уровень ретиниловых эфиров может быть определен после введения первой дозы или любой последующей дозы, при этом увеличение во втором уровне по сравнению с первым уровнем показывает, что соединение ингибирует регенерацию родопсина.
Ретиниловые эфиры могут быть проанализированы градиентной ВЭЖХ согласно способам, применяемым на практике в данной области техники (см., например, Mata et al., Neuron 36:69-80 (2002); Trevino et al. J. Exp. Biol. 208:4151-57 (2005)). Для измерения 11-цис и полностью-транс ретиналов, ретиноиды могут быть экстрагированы с помощью формальдегидного способа (см., например, Suzuki et al., Vis. Res. 28:1061-70 (1988); Okajima and Pepperberg, Exp. Eye Res. 65:331-40 (1997)) или путем гидроксиламинового метода (см., например, Groenendijk et al., Biochim. Biophys. Acta. 617:430-38 (1980)) перед анализом изократической ВЭЖХ (см., например, Trevino et al., supra). Ретиноиды могут контролироваться спектрофотометрически (см., например, Maeda et al., J. Neurochem. 85:944-956 (2003); Van Hooser et al., J. Biol. Chem. 277:19173-82 (2002)).
Другой вариант описанных здесь способов лечения офтальмологического заболевания или нарушения, ингибирования дегенерации ретинальной клетки (или усиления выживаемости ретинальной клетки), ингибирования неоваскуляризации и снижения ишемии сетчатки, предотвращения или ингибирования темновой адаптации палочковой фоторецепторной клетки сетчатки включает увеличение уровня апо-родопсина (также называемого опсином) в фоторецепторной клетке. Общий уровень зрительного пигмента приближается к содержанию родопсина и апо-родопсина, и общий уровень сохраняется постоянным. Следовательно, предотвращение, задержка или ингибирование темновой адаптации палочковой фоторецепторной клетки может изменять соотношение апо-родопсина к родопсину. В определенных вариантах, предотвращение, задержка или ингибирование темновой адаптации путем введения описанного здесь аминопроизводного соединения может увеличивать соотношение уровня апо-родопсина к уровню родопсина, по сравнению с соотношением в отсутствие агента (например, до введения агента). Увеличение в соотношении (т.е. статистически или биологически значимое увеличение) апо-родопсина к родопсину показывает, что процент или число палочковых фоторецепторных клеток, которые являются родопсин-обедненными, является увеличенным, и что процент или число палочковых фоторецепторных клеток, которые являются адаптированными к темноте, уменьшается. Соотношение апо-родопсина к родопсину может быть определено в течение курса терапии для контроля влияния агента.
Определение или оценка свойств соединения предотвращать, задерживать или ингибировать темновую адаптацию палочковой фоторецепторной клетки может быть выполнена изучением моделей животных. Уровень родопсина и соотношение апо-родопсина к родопсину может быть определено до введения (которое можно назвать первым уровнем или первым соотношением, соответственно) агента, и затем после введения первой или любой последующей дозы агента (который можно назвать вторым уровнем или вторым отношением, соответственно) для определения и иллюстрации того, что уровень апо-родопсина больше, чем уровень апо-родопсина в сетчатке животных, которые не получали агента. Уровень родопсина в палочковых фоторецепторных клетках может быть установлен согласно способам, которые используются на практике в данной области техники и обеспечены здесь (см., например, Yan et al. J. Biol. Chem. 279:48189-96 (2004)).
Пациентом, которому необходимо такое лечение, может являться человек или низший примат, или другое животное (т.е. ветеринарное использование), у которого развились симптомы офтальмологического заболевания или нарушения, или который находится в группе риска развития офтальмологического заболевания или нарушения. Примеры низших приматов и других животных включают, но не ограничиваются этим сельскохозяйственных животных, домашних животных и животных зоопарка (например, лошадей, коров, буйволов, лам, козлов, кроликов, кошек, собак, шимпанзе, орангутанов, горилл, обезьян, слонов, медведей, крупных кошек и т.п.). Также, здесь обеспечены способы ингибирования (снижения, замедления, предотвращения) дегенерации и усиления выживаемости нейрональных клеток сетчатки (или продления жизнеспособности клетки), включающие введение пациенту композиции, включающей фармацевтически приемлемый носитель и аминопроизводное соединение, описанное подробно здесь, включая соединение, имеющее любую из структур, отраженных в Формуле (I) их подструктур, и представленные здесь специфические аминопроизводные соединения. Нейрональные клетки сетчатки включают фоторецепторные клетки, биполярные клетки, горизонтальные клетки, ганглиоциты и амакриновые клетки. В другом варианте обеспечены способы повышения выживаемости или ингибирования дегенерации зрелых ретинальных клеток, таких как клетка ПЭС или глиальная клетка Мюллера. В других вариантах обеспечены способы предотвращения или ингибирования фоторецепторной дегенерации в глазу пациента. Способ, который предотвращает или ингибирует фоторецепторную дегенерацию, может включать способ восстановления фоторецепторной функции в глазу пациента. Такие способы включают введение пациенту композиции, включающей аминопроизводное соединение, как описано здесь, и фармацевтически приемлемый носитель (т.е., наполнитель или среда). В частности, эти способы включают введение пациенту фармацевтически приемлемого носителя и аминопроизводного соединения, описанного здесь, включающего соединения, имеющие любую из структур Формулы (I)или их подструктур, описанных здесь. Без привязки к теории, описанные здесь соединения могут ингибировать стадию изомеризации ретиноидного цикла (т.е., зрительного цикла) и/или могут замедлять мембранный транспорт хромофора в ретиноидном цикле в глазу.
Офтальмологическое заболевание может возникать, по меньшей мере частично, в результате накопления липофусцинового пигмента(ов) и/или накопления N-ретинилиден-N-ретинилэтаноламина (А2Е) в глазу. Соответственно, в определенных вариантах обеспечены способы ингибирования или предотвращения накопления липофусцинового пигмента (пигментов) и/или (А2Е) в глазу пациента. Эти способы включают введение пациенту композиции, включающей фармацевтически приемлемый носитель и аминопроизводное соединение, как описано здесь подробно, включающее соединение, которое имеет структуру Формулы (I) или их подструктур.
Аминопроизводное соединение может вводиться пациенту, который имеет избыток ретиноида в глазу (например, избыток 11-цис-ретинола или 11-цис-ретиналя), избыток побочных ретиноидных продуктов или промежуточных соединений в рециркуляции полностью-транс-ретиналя или т.п. Описанные здесь способы, и способы которые применяются на практике в данной области техники, могут использоваться для определения изменения уровня одного или более внутренних ретиноидов у пациента (повышенный или пониженный статистически или биологически значимым способом) во время или после введения любого из описанных здесь соединений. Родопсин, который состоит из белка опсина и ретиналя (форма витамина А), расположен в мембране фоторецепторной клетки сетчатки глаза и катализирует только светочувствительную стадию зрения. Хромофор, 11-цис-ретиналь, лежит в кармане белка и является изомеризованным до полностью-транс ретиналя при поглощении света. Изомеризация ретиналя ведет к изменению формы родопсина, который инициирует каскад реакций, вызывающих нервный импульс, который передается в мозг зрительным нервом.
Способы определения внутренних ретиноидных уровней в глазу позвоночного, а также избыток или дефицит таких ретиноидов раскрыты, например, а Американской заявке 2005/0159662 (раскрытие которой включено здесь полностью в виде ссылки). Другие способы определения внутренних ретиноидных уровней у пациента, которые являются эффективными для определения, находятся ли внутренние уровни ретиноидов выше нормального диапазона, включают, например, анализ высокоэффективной жидкостной хроматографией (ВЭЖХ) ретиноидов в биологическом образце пациента. Например, ретиноидные уровни могут быть определены в биологическом образце, которым является образец крови (который включает сыворотку или плазму) пациента. Биологический образец может также включать стекловидную жидкость, внутриглазную жидкость, субретинальную жидкость или слезы.
Например, у пациента может быть получен образец крови и разные ретиноидные соединения и уровни одного или более ретиноидных соединений в образце могут быть разделены и анализированы высокоэффективной жидкостной хроматографией (ВЭЖХ) с нормальными фазами (например, с помощью колонки HP 1100 HPLC и Beckman, Ultrasphere-Si, 4.6 мм × 250 мм с использованием смеси 10% этилацетат/90% гексан при скорости потока 1.4 мл/минуту). Ретиноиды могут быть определены, например, обнаружением при 325 нм с помощью детектора на диодной матрице и программного обеспечения HP Chemstation A.03.03. Избыток ретиноидов может быть определен, например, путем сравнения профилей ретиноидов (т.е., качественного, например, идентификации отдельных соединений, и количественного, например, уровня каждого отдельного соединения) в образце с образцом нормального пациента. Опытные в данной области специалисты знакомы с такими анализами и методами, и легко поймут, что соответствующие контрольные образцы являются включенными.
Использующиеся здесь повышенные или избыточные уровни внутреннего ретиноида, такого как 11-цис-ретинол или 11-цис-ретиналь, относятся к более высоким уровням внутреннего ретиноида, чем те, которые были обнаружены в здоровом глазу здорового позвоночного такого же рода. Введение аминопроизводного соединения понижает или устраняет потребность во внутреннем ретиноиде. В определенных вариантах уровень внутреннего ретиноида можно сравнить до и после введения пациенту одной или более доз аминопроизводного соединения для определения влияния соединения на уровень внутренних ретиноидов у пациента.
В другом варианте, описанные здесь способы лечения офтальмологического заболевания или нарушения, ингибирования неоваскуляризации и снижения ишемии в сетчатке, включают введение, по меньшей мере, одного описанного здесь аминопроизводного соединения, тем самым достигая снижения метаболической потребности, которая включает достижение сокращения АФТ потребления и потребления кислорода в палочковых фоторецепторных клетках. Как описано здесь, потребление АФТ и кислорода в палочковых фоторецепторных клетках, адаптированных к темноте, больше, чем в палочковых фоторецепторных клетках, адаптированных к свету или обедненных родопсином; таким образом, использование соединений в описанных здесь способах может снижать потребление АФТ в палочковых фоторецепторных клетках, которые защищаются, ингибируются или задерживаются от темновой адаптации по сравнению с палочковыми фоторецепторными клетками, которые адаптированы к темноте (такими, как клетки до введения или контакта с соединением, или клетки, которые никогда не подвергались воздействию соединения).
Описанные здесь способы, которые могут предотвратить или ингибировать темновую адаптацию палочковой фоторецепторной клетки, могут следовательно снижать гипоксию в сетчатке (т.е. снижать статистически или биологически значимым способом). Например, уровень гипоксии (первый уровень) может быть определен до начала лечения, т.е., до введения первой дозы соединения (или потребления, как описано здесь, включающего соединение). Уровень гипоксии (например, второй уровень) может быть определен после первой дозы и/или после любой второй, или последующей дозы для контроля или получения характеристик гипоксии во время режима лечения. Уменьшение (снижение) на втором (или любом последующем) уровне гипоксии по сравнению с уровнем гипоксии до начала введения показывает, что соединение и режим лечения предотвращают темновую адаптацию палочковых фоторецепторных клеток и могут использоваться для лечения офтальмологических заболеваний и нарушений. Потребление кислорода, оксигенация сетчатки и/или гипоксия в сетчатке могут быть определены способами, применяющимися на практике в данной области техники. Например, оксигенация сетчатки может определяться измерением флуоресценции флавопротеидов в сетчатке (см., например. Американский патент 4,569,354). Другим примером способа является ретинальная оксиметрия, в которой измеряют насыщение кислородом крови в больших сосудах сетчатки около диска зрительного нерва. Такие способы могут применяться для идентификации и определения объема ретинальной гипоксии до обнаружения изменений в архитектуре ретинального сосуда.
Биологический образец может быть образцом крови (из которого могут быть приготовлены сыворотка или плазма), биоптат, биологическая жидкость (например, стекловидная жидкость, водянистая влага, внутриглазная жидкость, субретинальная жидкость или слезы), эксплантант ткани, органная культура или любая другая ткань, или приготовление клетки от пациента или биологического источника. Образец, кроме того, может относиться к приготовлению ткани или клетки, в которой морфологическая интегральность или физическое состояние было нарушено, например, путем расслоения, диссоциации, солюбилизации, разделения на фракции, гомогенизации, биохимической или химической экстракции, пульверизации, лиофилизации, разрушения ультразвуком или любыми другими способами для производства образца, извлеченного у пациента или биологического источника. Пациент или биологический источник может быть человеком или не относящимся к человеку, культурой эмбриональной клетки (например, ретинальная клеточная культура) или адаптированной в культуре клеточной линией, включая, но не ограничиваясь этим, генно-инженерные клеточные линии, которые могут содержать хромосомно интегрированные или эписомально рекомбинантные последовательности нуклеиновых кислот, иммортализованные или иммортализуемые клеточные линии, клеточные линии соматического клеточного гибрида, дифференцированные или дифференцируемые клеточные линии, трансформированные клеточные линии и т.п. Зрелые ретинальные клетки, включая ретинальные нейрональные клетки, клетки ПЭС и глиальные клетки Мюллера, могут присутствовать или быть изолированными от биологического образца, как описано выше. Например, зрелая ретинальная клетка может быть получена из эмбриональной или длительной клеточной культуры, или может присутствовать или быть изолированной от биологического образца, полученного от пациента (человека или животного).
3. Ретинальные клетки
Сетчатка является тонким слоем нервных тканей, расположенных между стекловидным телом и сосудистой оболочкой глаза. Важными опознавательными точками в сетчатке являются центральная ямка, макула и диск зрительного нерва. Сетчатка является самой толстой около задних секций и становится тоньше около периферии. Макула расположена в задней части сетчатки и содержит центральную ямку и фовеолу.
Фовеола содержит область максимальной конической плотности и, таким образом, придает самую высокую остроту зрения. Фовеола содержится внутри центральной ямки, которая содержится внутри макулы.
Периферическая часть сетчатки увеличивает поле зрения. Периферическая сетчатка распространяется от передней части до ресничного тела и делится на четыре области: около периферии (самая граница), средне-периферийная, дальняя периферийная, и граница между зрительной и слепой частями сетчатки (самая передняя). Граница между зрительной и слепой частями сетчатки обозначает границы сетчатки.
Термин нейрон (или нервная клетка), как понимается в данной области техники и используется здесь, обозначает клетку, которая происходит от нейроэпителиальных клеточных предшественников. Зрелые нейроны (т.е. полностью дифференцированные клетки) проявляют несколько специфических антигенных маркеров. Нейроны могут быть классифицированы функционально на четыре группы; (1) афферентные нейроны (или сенсорные нейроны), которые передают информацию в мозг для сознательного восприятия и моторной координации; (2) моторные нейроны, которые передают команды мускулам и гландам; (3) интернейроны, которые ответственны за локальный канал; и (4) проецирующие нейроны, которые передают информацию из одной области мозга в другую область и следовательно имеют длинные аксоны. Промежуточные нейроны обрабатывают информацию в пределах специфических субобластей мозга и имеют относительно короткие аксоны. Нейроны обычно имеет четыре определенных области: тело клетки (или сома); аксон; дендриты; и пресинаптические окончания. Дендриты служат в качестве первичного ввода информации от других нейрональных клеток. Аксон несет электрические сигналы, которые инициированы в теле клетке к другим нейронам или эффекторному нервному отростку. В пресинаптических окончаниях нейроны передают информацию другой клетке (постсинаптическая клетка), которая может быть другим нейроном, мышечной клеткой или секреторной клеткой.
Сетчатка состоит из нескольких видов нейрональных клеток. Как описано здесь, виды ретинальных нейрональных клеток, которые могут быть выращены in vitro этим способом, включают фоторецепторные клетки, ганглиоциты и промежуточные нейроны, такие как биполярные клетки, горизонтальные клетки и амакриновые клетки. Фоторецепторы являются специальными реагирующими на свет нейрональными клетками и включают два важных класса, палочки и колбочки. Палочки принимают активное участие в скотопическом зрении или зрении в условиях пониженного освещения, тогда как фотопическое или дневное зрение берет начало в колбочках. Много нейродегенеративных заболеваний, таких как ВМД, которые приводят к слепоте, поражают фоторецепторы.
Распространяясь от их клеточных тел, фоторецепторы имеют две морфологически отличные области, внутренние и внешние сегменты. Внешний сегмент лежит дальше от тела фоторецепторной клетки и содержит диски, которые превращают входящую световую энергию в электрические импульсы (фототрансдукция). Внешний сегмент является присоединенным к внутреннему сегменту очень маленькой и укороченной ресничкой. Размер и форма внешних сегментов различается между палочками и колбочками и зависит от положения внутри сетчатки. См. Hogan, "Retina" in Histology of the Human Eye: an Atlas and Text Book (Hogan et al. (eds). WB Saunders; Philadelphia, PA (1971)); Eye and Orbit, 8th Ed., Bron et al., (Chapman and Hall, 1997).
Ганглиоциты являются выходными нейронами, которые передают информацию от промежуточных нейронов сетчатки (включая горизонтальные клетки, биполярные клетки, амакриновые клетки) в мозг. Биполярные клетки названы согласно их морфологии и получают входной сигнал от фоторецепторов, соединяются с амакриновыми клетками и посылают выходной сигнал радиально ганглиоцитам. Амакриновые клетки подвергаются обработке параллельно плоскости сетчатки и имеют обычно ингибирующий выходной сигнал ганглиоцитам. Амакриновые клетки часто подразделятся на нейротрансмиттеры или нейромодуляторы, или пептиды (такие как калретинин или калбиндин) и взаимодействуют друг с другом, с биполярными клетками и с фоторецепторами. Биполярные клетки являются промежуточными нейронами сетчатки, которые названы согласно их морфологии; биполярные клетки получают входной сигнал от фоторецепторов и посылают входной сигнал ганглиоцитам. Горизонтальные клетки модулируют и трансформируют зрительную информацию от большого числа фоторецепторов, и имеют горизонтальную интеграцию (где биполярные клетки передают инфорацию радиально через сетчатку).
Другие ретинальные клетки, которые могут присутствовать в описанных здесь ретинальных клеточных структурах, включают глиальные клетки, такие как глиальные клетки Мюллера, и клетки пигментного эпителия сетчатки (ПЭС). Глиальные клетки окружают тела нервных клеток и аксоны. Глиальные клетки не несут электрических импульсов, но вносят вклад в поддержание нормального функционирования мозга. Глия Мюллера, доминирующий тип глиальной клетки внутри сетчатки, обеспечивает структурную поддержку сетчатки, и является вовлеченной в метаболизм сетчатки (например, вносит вклад в регулирование концентраций ионов, деградацию нейротрансмиттеров и удаляет определенные метаболиты (см., например, Kljavin et al., J. Neurosci. 11:2985 (1991)). Волокна Мюллера (также известные как циркулярные волокна сетчатки) являются поддерживающими нейроглиальными клетками сетчатки, которые проходят по толщине сетчатки от внутренней ограничивающей мембраны к основаниям палочек и колбочков, где они образуют ряд узловых комплексов.
Клетки пигментного эпителия сетчатки (ПЭС) образуют внешний слой сетчатки, отделенный от обогащенной кровеносными сосудами сосудистой оболочки глаза базальной пластинкой. Клетки (ПЭС) являются типом фагоцитарной эпителиальной клетки с некоторыми функциями, подобными макрофагоподобной клетке, которая лежит ниже ретинальных фоторецепторов. Дорсальная поверхность клетки ПЭС тесно примыкает к концам палочковых дисков, и поскольку диски отталкиваются от внешнего сегмента палочек, они являются усвоенными и обработанными клетками ПЭС. Аналогичный процесс возникает с дисками колбочек. Клетки ПЭС также производят, хранят и транспортируют множество факторов, которые вносят вклад в нормальное функционирование и выживаемость фоторецепторов. Другой функцией клеток ПЭС является циркулирование витамина А по мере его движения между фоторецепторами и ПЭС во время световой и темновой адаптации в процессе, известном как зрительный цикл.
Описанный здесь пример анализа in vitro системы длительной клеточной культуры допускает и повышает выживаемость в культуре зрелых ретинальных клеток, включающих ретинальные нейроны, по меньшей мере, в течение 2-4 недель, более 2 месяцев или в течение 6 месяцев. Система клеточной культуры может использоваться для идентификации и описания свойств соединений алкоксифенил-связанного аминового производного, которые являются эффективными в описанных здесь способах для лечения и/или предотвращения офтальмологического заболевания или нарушения, или для предотвращения или ингибирования накопления в глазу липофусцина(ов) и/или А2Е. Ретинальные клетки были изолированы от неэмбриональных, неонкогенных тканей и не были иммортализованы каким-либо способом, например, таким как трансформация или заражение онкогенным вирусом. Система клеточной культуры включает все главные типы ретинальных нейрональных клеток (фоторецепторы, биполярные клетки, горизонтальные клетки, амакриновые клетки и ганглиоциты), а также может включать другие зрелые ретинальные клетки, такие как клетки пигментного эпителия сетчатки и глиальные клетки Мюллера.
Например, образец крови может быть получен от пациента, и разные ретиноидные соединения и уровни одного или более ретиноидного соединения в образце могут быть разделены и анализированы высокоэффективной жидкостной хроматографией (ВЭЖХ) с нормальной фазой (например, с помощью колонки HP 1100 HPLC и Beckman, UltrasphereSi, 4.6 мм × 250 мм с использованием смеси 10% этилацетат/90% гексан при скорости потока 1.4 мл/мин). Ретиноиды могут быть обнаружены, например, детектированием при 325 нм с использованием детектора на диодной матрице и программного обеспечения HP Chemstation A.03.03. Избыток ретиноидов может быть определен, например, путем сравнения профиля ретиноидов (т.е. количественно, например, идентификация специфических соединений, и качественно, например, уровень каждого специфического соединения) в образце с образцом от нормального пациента. Опытным в данной области специалистам, знакомым с такими анализами и технологиями, станет понятно, что соответствующие контрольные образцы являются включенными.
Использующиеся здесь повышенные или избыточные уровни эндогенных ретиноидов, такие как 11-цис-ретинол или 11-цис-ретиналь, относятся к более высоким уровням эндогенных ретиноидов, по сравнению с уровнями, обнаруженными в здоровом глазу молодого позвоночного такого же рода. Введение соединения алкоксифенил-связанного аминового производного снижает или устраняет требования в отношении эндогенного ретиноида.
4. Методы In Vivo и In Vitro для определения терапевтической эффективности соединений
В одном варианте обеспечены способы применения описанных здесь соединений для усиления или пролонгирования ретинальной клеточной выживаемости, включающей выживаемость ретинальных нейрональных клеток и выживаемость клеток ПЭС. Также, здесь обеспечены способы ингибирования или предотвращения дегенерации ретинальной клетки, включающих ретинальную нейрональную клетку (например, фоторецепторную клетку, амакриновую клетку, горизонтальную клетку, биполярную клетку и ганглиоцит) и другие зрелые ретинальные клетки, такие как клетки пигментного эпителия сетчатки и глиальные клетки Мюллера с использованием описанного здесь соединения. Такие способы включают, в определенных вариантах, введение аминопроизводного соединения, как описано здесь. Такое соединение является эффективным для усиления ретинальной клеточной выживаемости, включая выживаемость фоторецепторных клеток и выживаемость клеток пигментного эпителия сетчатки, ингибирования или замедления дегенерации ретинальной клетки и таким образом повышения жизнеспособности ретинальных клеток, в результате чего может происходить замедление или остановка прогрессирования офтальмологического заболевания или нарушения, или ретинального повреждения, которые описаны здесь.
Влияние аминопроизводного соединения на выживаемость ретинальной клетки (и/или дегенерацию ретинальной клетки) может быть определено с помощью использования моделей клеточных культур, моделей животных и других способов, описанных здесь, и применяемых на практике опытными в данной области специалистами. С помощью примера, но не ограничения, такие способы и анализы включают такие, которые включены в Oglivie et al., Exp. Neurol. 161:675-856 (2000);
Американский патент 6,406,840; WO 01/81551; WO 98/12303; Американская заявка 2002/0009713; WO 00/40699; Американский патент 6,117,675; Американский патент 5,736,516; WO 99/29279; WO 01/83714; WO 01/42784; Американский патент 6,183,735; Американский патент 6,090,624; WO 01/09327; Американский патент 5,641,750; Американская заявка 2004/0147019; и Американская заявка 2005/0059148.
Описанные здесь соединения, которые могут быть эффективными для лечения офтальмологического заболевания или нарушения (включая ретинальное заболевание или нарушение), могут ингибировать, блокировать, ослаблять или каким-либо другим способом препятствовать одной или более стадиям зрительного цикла (также называемый здесь и в данной области техники ретиноидным циклом). Без привязки к конкретной теории, аминопроизводное соединение может ингибировать или блокировать стадию изомеризации в зрительном цикле, например, путем ингибирования или блокирования функциональной активности транс-цис-изомеразы зрительного цикла. Описанные здесь соединения могут ингибировать, прямо или непрямо, изомеризацию полностью-транс-ретинола в 11-цис-ретинол. Соединения могут связываться или каким-либо другим способом взаимодействовать, и ингибировать активность, по меньшей мере, одной изомеразы в ретинальной клетке. Любое из описанных здесь соединений может также прямо или непрямо ингибировать или понижать активность изомеразы, которая является вовлеченной в зрительный цикл. Соединение может блокировать или ингибировать способность изомеразы присоединяться к одному или более субстратов, включающих, но не ограничивающихся этим, субстрат полностью-транс-ретинилового эфира или полностью-транс-ретинола. Альтернативно или дополнительно, соединение может присоединяться к каталитическому сайту или области изомеразы, ингибируя тем самым способность энзима катализировать изомеризацию, по меньшей мере, одного субстрата. На основе последних научных данных полагают, что, по меньшей мере, одна изомераза, которая катализирует изомеризацию субстрата во время зрительного цикла, расположена в цитоплазме клеток ПЭС. Как обсуждалось здесь, каждая стадия, энзим, субстрат, промежуточное соединение и продукт зрительного цикла до сих пор не выяснены. Несмотря на то, что полипептид, называемый RPE65, который был обнаружен в связанных с цитоплазмой и мембраной клетках ПЭМ, гипотетически обладает изомеразной активностью (и также относится в данной области техники к обладающему изомергидролазной активностью) (см., например, Moiseyev et al., Proc. Natl. Acad. Sci. USA 102:12413-18 (2004); Chen et al., Invest. Ophthalmol. Vis. Sci. 47:1177-84 (2006)), другие опытные в данной области специалисты полагают, что RPE65 действует в первую очередь как шаперон для полностью-транс-ретиниловых эфиров (see, e.g.. Lamb et al. Supra).
Приведены примеры описанных здесь способов, а также способов, которые применяют на практике опытные в данной области специалисты для определения уровня ферментативной активности изомеразы зрительного цикла в присутствии любого из описанных здесь соединений. Соединение, которое уменьшает активность изомеразы, может быть эффективным для лечения офтальмологического заболевания или нарушения. Таким образом, обеспечены способы обнаружения ингибирования активности изомеразы, включающие контактирование (т.е., смешивание, объединение, или каким-либо другим способом допущение взаимодействия соединения и изомеразы) биологического образца, включающего изомеразу и описанного здесь аминопроизводные соединения, а также последующее определение уровня ферментативной активности изомеразы. Опытному в данной области специалисту следует учесть, что в качестве контроля, уровень активности изомеразы в отсутствие соединения или в присутствии соединения, которое, как известно, не изменяет ферментативную активность изомеразы, можно определить и сравнить с уровнем активности в присутствии соединения. Снижение уровня активности изомеразы в присутствии соединения по сравнению с уровнем активности изомеразы в отсутствии соединения показывает, что соединение может быть эффективным для лечения офтальмологического заболевания или нарушения, такого как возрастная макулярная дистрофия или болезнь Штаргардта. Снижение уровня активности изомеразы в присутствии соединения по сравнению с уровнем активности изомеразы в отсутствие соединения показывает, что соединение может быть также эффективным в описанных здесь способах ингибирования или предотвращения темновой адаптации, ингибирования неоваскуляризации и снижения гипоксии, и таким образом эффективным для лечения офтальмологического заболевания или нарушения, например, диабетической ретинопатии, диабетической макулопатии, закупорки кровеносного сосуда сетчатки, ретролентальной фиброплазии или ишемически-реперфузионного повреждения сетчатки.
Способность описанного здесь аминопроизводного соединения ингибировать или предотвращать темновую адаптацию палочковой фоторецепторной клетки путем ингибирования регенерации родопсина может быть определена с помощью анализов in vitro и/или in vivo моделей животных. В качестве примера, ингибирование регенерации может быть определено в мышиной модели, в которой состояние, подобное диабету, индуцировано химически или мышиной модели, имеющей диабет (см., например, Phipps et al.. Invest. Ophthalmol. Vis. Sci. 47:3187-94 (2006); Ramsey et al., Invest. Ophthalmol. Vis. Sci. 47:5116-24 (2006)). Уровень родопсина (первый уровень) может быть определен (например, спектрофотометрически) в сетчатке животных до введения агента, и произведено сравнение с уровнем родопсина (второй уровень), измеренного в сетчатке животных после введения агента. Снижение на втором уровне родопсина по сравнению с первым уровнем указывает на то, что агент ингибирует регенерацию родопсина. Соответствующие контрольные образцы и план исследования для определения, произошло ли ингибирования регенерации родопсина статистически значимым или биологически значимым образом, могут быть легко определены и выполнены опытным в данной области специалистом.
Способы и методики определения или характеристики воздействия любого из описанных здесь соединений на темновую адаптацию и регенерацию родопсина в палочковых фоторецепторных клетках у млекопитающего, включая человека, могут быть выполнены согласно описанным здесь процедурам и применяться на практике в данной области техники. Например, обнаружение зрительных стимулов после воздействия света (т.е. фотообесцвечивания), в зависимости от времени в темноте, может быть определено до введения первой дозы соединения, и в момент времени после первой дозы и/или любой последующей дозы. Второй способ определения предотвращения или ингибирования темновой адаптации палочковыми фоторецепторными клетками включает измерение амплитуды, по меньшей мере, одного, по меньшей мере двух, по меньшей мере трех, или более компонентов электроретинограммы, которые включают, например, a-волну и b-волну. Смотри, например. Lamb et al., supra; Asi et al., Documenta Ophthalmologica 79:125-39(1992).
Ингибирование регенерации родопсина описанным здесь аминопроизводным соединением включает снижение уровня хромофора, 11-цис-ретиналя, который образуется и присутствует в клетке ПЭС, и последовательное снижение уровня 11-цис-ретиналя, который присутствует в фоторецепторной клетке. Таким образом, соединение, при контакте с сетчаткой в приемлемых условиях и времени, достаточных для предотвращения темновой адаптации палочковой фоторецепторной клетки и для ингибирования регенерации родопсина в палочковой фоторецепторной клетке, влияет на снижение уровня 11-цис-ретиналя в палочковой фоторецепторной клетке (т.е. статистически или биологически значимое снижение). А именно, уровень 11-цис ретиналя в палочковой фоторецепторной клетке является выше до введения соединения, по сравнению с уровнем 11-цис-ретиналя в фоторецепторной клетке после первого и/или любого последующего введения соединения. Первый уровень 11-цис-ретиналя может быть определен до введения соединения, и второй уровень 11-цис-ретинала может быть определен после введения первой или любой последующей дозы для контроля действия соединения. Снижение во втором уровне по сравнению с первым уровнем показывает, что соединение ингибирует регенерацию родопсина и, таким образом, ингибирует или предотвращает темновую адаптацию палочковых фоторецепторных клеток.
Пример способа определения или характеристики способности аминопроизводного соединения снижать ретинальную гипоксию включает измерение уровня ретинальной оксигенации, например, с помощью магнитной резонансной томографии (MRI) для измерения изменений давления кислорода (см., например, Luan et al., Invest. Ophthalmol. Vis. Sci. 47:320-28 (2006)). В данной области техники существуют способы и применяются на практике в установленном порядке для определения или характеристики способности описанных здесь соединений ингибировать дегенерацию ретинальной клетки (см., например, Wenzel et al., Prog. Retin. Eye Res. 24:275-306 (2005)).
Модели животных могут использоваться для характеристики и идентификации соединений, которые могут применяться для лечения ретинальных заболеваний и нарушений. Недавно разработанная модель животного может быть эффективной для оценки терапий для макулярной дегенерации, описанная в Ambati et al. (Nat. Med. 9:1390-97 (2003); Epub 2003 Oct 19). Эта модель животного является одной из нескольких примеров моделей животных, существующих в настоящее время, для оценки соединения или любой молекулы для использования в лечении (включая предотвращение) прогрессирования или развития ретинального заболевания или нарушения. Модели животных, в которых ABCR ген, который кодирует АТФ-связывающий кассетный транспортер, расположенный в ободках фоторецепторных внешних сегментных дисков, может использоваться для оценки воздействия соединения. Мутации в ABCR гене связаны с заболеванием Штаргардта и гетерозиготные мутации в ABCR связаны с ВДМ. Соответственно, животные были генерированы с частичной или полной потерей ABCR функций и могли использоваться для характеристики описанных здесь алкоксифенил-связанных аминовых соединений. (См., например, Mata et al., Invest. Ophthalmol. Sci. 42:1685-90 (2001); Weng et al., Cell 98:13-23 (1999); Mata et al., Proc. Natl. Acad. Sci. USA 97:7154-49 (2000); US 2003/0032078; Американский патент 6,713,300). Другие модели животных включают использование мутантной ELOVL4 трансгенной мыши для определения накопления липофусцина, электрофизиологии и дегенерации фоторецепторов или их предотвращения или ингибирования (см., например, Karan et al., Proc. Natl. Acad. Sci. USA 102:4164-69 (2005)).
Воздействие любого из описанных здесь соединений может быть определено в моделях животных с диабетической ретинопатией, как например, описанное в Luan et al., или может быть определено в нормальной модели животного, в которой животные были адаптированы к свету или темноте в присутствии или в отсутствии любого из описанных здесь соединений. В другом примере способа определения способности агента снижать ретинальную гипоксию производится измерение ретинальной гипоксии с помощью осаждения гидроксипробы (см., например, de Gooyer et al. (Invest. Ophthalmol. Vis. Sci. 47:5553-60 (2006)). Такая методика может выполняться в модели животного с помощью Rho-/Rho- нокаутной мыши (см. de Gooyer et al., supra), при этом, по меньшей мере, одно описанное здесь соединение вводится группе(ам) животных в присутствии и отсутствии, по меньшей мере, одного соединения, или может выполняться у нормального, дикого животного, при этом, по меньшей мере, одно описанное здесь соединение вводится группе(ам) животных в присутствии или отсутствии, по меньшей мере, одного соединения. Другие модели животных включают модели для определения фоторецепторных функций, такие как модели крыс, у которых измеряют электроретинографические (ERG) осцилляторные потенциалы (см., например, Liu et al., Invest. Ophthalmol. Vis. Sci. 47:5447-52 (2006); Akula et al., Invest. Ophthalmol. Vis. Sci. 48:4351-59 (2007); Liu et al., Invest. Ophthalmol. Vis. Sci. 47:2639-47 (2006); Dembinska et al., Invest. Ophthalmol. Vis. Sci. 43:2481-90 (2002); Penn et al., Invest. Ophthalmol. Vis. Sci. 35:3429-35 (1994); Hancock et al., Invest. Ophthalmol. Vis. Sci. 45:1002-1008 (2004)).
Способ определения воздействия соединения на активность изомеразы может выполняться in vitro, как описано здесь и в данной области техники (Stecher et al., J. Biol. Chem. 274:8577-85 (1999); см. также Golczak et al., Proc. Natl. Acad. Sci. USA 102:8162-67 (2005)). Микросомные мембраны пигментного эпителия сетчатки (ПЭС), выделенные у животного (такого как бык, свинья, человек, например), могут служить в качестве источника изомеразы. Способность аминопроизводных соединений ингибировать изомеразу может также определяться анализом in vivo изомеразы у мыши. Известно, что короткое воздействие на глаз интенсивного света («фотообесцвечивание» визуального пигмента или просто «обесцвечивание») фотоизомеризует почти весь 11-цис-ретиналь в сетчатке. Восстановление 11-цис-ретиналя после обесцвечивания может быть использовано для установления активности изомеразы in vivo (см., например, Maeda et al., J. Neurochem. 85;944-956 (2003); Van Hooser et al., J. Biol. Chem. 277:19173-82, 2002). Электроретинографическая (ERG) запись может быть выполнена, как описано выше (Haeseleer et al., Nat. Neurosci. 7:1079-87 (2004); Sugitomo et al., J. Toxicol. Sci. 22 Suppl 2:315-25 (1997); Keating et al., Documenta Ophthalmologica 100:77-92 (2000)). См. также Deigner et al., Science, 244: 968-971 (1989); Gollapalli et al., Biochim. Biophys. Acta 1651: 93-101 (2003); Parish, et al., Proc. Natl. Acad. Sci. USA 95:14609-13 (1998); Radu et al., Proc Natl Acad Sci USA 101: 5928-33 (2004).
Способы клеточной культуры, такие как описанный здесь способ, также являются эффективными для определения воздействия описанного здесь соединения на выживаемость ретинальной нейрональной клетки. Представлено описание здесь и подробное описание в Американской заявке US 2005-0059148 и Американской заявке US 2004-0147019 (которые включены здесь полностью в виде ссылки) моделей клеточной культуры, которые являются эффективными для определения способности аминопроизводного соединения, как описано здесь, усиливать или продливать выживаемость нейрональных клеток, частично ретинальных нейрональных клеток и клеток пигментного эпителия сетчатки (ПЭС), а также ингибировать, предотвращать, замедлять или тормозить дегенерацию глаза, или сетчатки, или ее клеток, или ПЭС, и определять, какие соединения являются эффективными для лечения офтальмологических заболеваний и нарушений.
Модель клеточной культуры включает длительную или продленную культуру зрелых ретинальных клеток, включающих ретинальные нейрональные клетки (например, фоторецепторные клетки, амакриновые клетки, ганглиоциты, горизонтальные клетки и биполярные клетки). Система клеточной культуры и способы производства системы клеточной культуры обеспечивают длительную культуру фоторецепторных клеток. Система клеточной культуры может также включать клетки пигментного эпителия сетчатки (ПЭС) и глиальные клетки Мюллера.
Система ретинальной клеточной культуры может также включать клеточный стрессор. Применение или присутствие стрессора влияет на зрелые ретинальные клетки, включая ретинальные нейрональные клетки, in vitro, таким способом, который является эффективным для изучения патологии заболевания, которое наблюдается при ретинальном заболевании или нарушении. Модель клеточной культуры обеспечивает in vitro систему нейрональной клеточной культуры, которая является эффективной для идентификации и биологического тестирования аминопроизводного соединения, которое является пригодным для лечения неврологических заболеваний или нарушений в целом, а также для лечения дегенеративных заболеваний глаз и мозга в частности. Способность сохранять первичные, in vitro-выращенные клетки из зрелой ретинальной ткани включающей ретинальные нейроны, на протяжении длительного периода в присутствии стрессора, позволяет сделать анализ взаимодействия клетка-клетка, произвести выбор и анализ нейроактивных соединений и материалов, использовать контролируемую систему клеточной культуры для in vitro CNS и офтальмологических тестов, а также для анализа воздействий на отдельные клетки консистентной ретинальной клеточной популяции.
Система клеточной культуры и стрессовая модель ретинальной клетки включает выращенные зрелые ретинальные клетки, ретинальные нейроны и ретинальный клеточный стрессор, которые могут использоваться для скрининга и описания свойств аминопроизводного соединения, которое способно индуцировать или стимулировать регенерацию тканей CNS, поврежденных в результате болезни. Система клеточной культуры обеспечивает культуру зрелых ретинальных клеток, которая является смесью зрелых ретинальных нейрональных клеток и не нейрональных ретинальных клеток. Система клеточной культуры включает все основные типы ретинальных нейрональных клеток (фоторецепторы, биполярные клетки, горизонтальные клетки, амакриновые клетки и ганглиоциты), а также может включать другие зрелые ретинальные клетки, такие как клетки ПЭС и глиальные клетки Мюллера. С помощью включения этих разных типов клеток в in vitro культурную систему, система главным образом собирает «искусственный орган», который является близким к естественному in vivo состоянию сетчатки.
Жизнеспособность одного или более типов зрелых ретинальных клеток, которые выделены (заимствованы) из ретинальной ткани и высеяны на чашку для культуры тканей, может сохраняться в течение продолжительного периода времени, например, от двух недель вплоть до шести месяцев. Жизнеспособность ретинальных клеток может быть определена согласно описанным здесь способам и известным в данной области техники. Ретинальные нейрональные клетки, аналогично нейрональным клеткам в целом, не являются активно делящимися клетками in vivo и, таким образом, клеточное деление ретинальных нейрональных клеток не обязательно будет являться показателем жизнеспособности. Преимуществом системы клеточной культуры является способность выращивать амакриновые клетки, фоторецепторы и связывающие ганглии проекционные нейроны, а также другие зрелые ретинальные клетки в течение продолжительного периода, тем самым обеспечивая возможность определения эффективности описанного здесь аминопроизводного соединения для лечения ретинального заболевания.
Биологическим источником ретинальных клеток или ретинальных тканей может быть млекопитающее (например, человек, низшее млекопитающее, копытное животное, грызун, семейство псовых, свинья, бык или другой источник млекопитающего), птицы или другой род. Могут использоваться ретинальные клетки, включающие ретинальные нейроны, из послеродового низшего примата, послеродовых поросят или послеродовых цыплят, но любая взрослая или послеродовая ретинальная ткань может быть пригодной для использования в этой ретинальной системе клеточной культуры.
В определенных случаях может быть обеспечена система клеточной культуры для надежного продолжительного выживания ретинальных клеток без включения клеток, извлеченных или выделенных или очищенных из не ретинальной ткани. Такая система клеточной культуры включает клетки, отделенные исключительно от сетчатки глаза и, таким образом, является в основном свободной от клеток других типов из других частей или областей глаза, которые отделены от сетчатки, такие как ресничное тело, радужная оболочка, сосудистая оболочка глаза и стекловидное тело. Другие способы клеточной культуры включают добавление не ретинальных клеток, таких как ресничное тело и/или стволовые клетки (которые могут быть или не быть ретинальными стволовыми клетками), и/или дополнительно очищенные глиальные клетки.
In vitro системы ретинальных клеточных культур, описанные здесь, могут служить в качестве физиологических ретинальных моделей, которые могут использоваться для характеристики аспектов физиологии сетчатки. Эта физиологическая ретинальная модель может также использоваться в качестве общей нейробиологической модели. Клеточный стрессор может быть включен в модель системы клеточной культуры. Клеточный стрессор, который, как описано здесь, является ретинальным клеточным стрессором, отрицательно воздействует на жизнеспособность или снижает жизнеспособность одного или более типов разных ретинальных клеток, включая типы ретинальных нейрональных клеток, в системе клеточной культуры. Опытной специалист в данной области быстро оценит и поймет, что ретинальная клетка, как описано здесь, которая проявляет пониженную жизнеспособность, означает, что длительность времени, в течение которого ретинальная клетка выживает в системе клеточной культуры, является сокращенным или уменьшенным (уменьшенная продолжительность жизни), и/или что ретинальные клетки проявляют уменьшающее, ингибирующее или неблагоприятное влияние на биологические или биохимические функции (например, уменьшение или ненормальный метаболизм; инициирование апоптоза; и т.п.) по сравнению с ретинальной клеткой, выращенной в соответствующей контрольной клеточной системе (например, система клеточной культуры, описанная здесь, в отсутствии клеточного стрессора). Пониженная жизнеспособность ретинальной клетки может быть обнаружена смертью клетки-альтерацией или изменением в клеточной структуре или морфологии; индукцией и/или прогрессированием апоптоза; инициированием, усилением и/или ускорением нейродегенерации ретинальных неврональных клеток (или повреждением неврональных клеток).
Способы и методики определения клеточной жизнеспособности подробно описаны здесь и являются такими, с которыми знакомы опытные специалисты. Эти способы и методики определения клеточной жизнеспособности могут быть использованы для контроля здоровья и статуса ретинальных клеток в системе клеточной культуры и для определения способности описанных здесь аминопроизводных соединений изменять (предпочтительно увеличивать, продливать, усиливать, улучшать) жизнеспособность ретинальной клетки или клетки пигментного эпителия сетчатки, или выживаемость ретинальной клетки.
Добавление клеточного стрессора в систему клеточной культуры является эффективным для определения способности аминопроизводного соединения аннулировать, ингибировать, ликвидировать или уменьшать действие стрессора. Система ретинальной клеточной культуры может включать клеточный стрессор, который является химическим (например, А2Е, концентрат сигаретного дыма); биологическим (например, воздействие токсина; бета-амилоид; липополисахариды); или не химическим, таким как физический стрессор, стресс-фактор окружающей среды или механическая сила (например, повышенное давление или воздействие света) (см., например, US 2005-0059148).
Система модели ретинального клеточного стрессора может также включать такой клеточный стрессор, который может быть фактором риска заболевания или нарушения, или который может вносить вклад в развитие или прогрессирование заболевания или нарушения, включая, но не ограничиваясь этим, свет различной длины волны и интенсивности; А2Е; воздействие конденсата сигаретного дыма; оксидативный стресс (например, стресс, который относится к присутствию или воздейтсвию пероксида водорода, нитропруссида, Zn++, или Fe++); повышенного давления (например, атмосферного давления или гидростатического давления), глутамата или антагонистов глутамата (например, N-метил-D-аспартат (NMDA); альфа-амино-3-гидрокси-5-метилизоксазол-4-пропионат (АМРА); каиновая кислота; квискваловая кислота; иботеновая кислота; хинолиновая кислота; аспартат; транс-1-аминоциклопентил-1,3-дикарбокилат (ACPD)); аминокислоты (например., аспартат, L-цистеин; бета-N-метиламин-L-аланин); тяжелые металлы (такие как свинец); разные токсины (например, митохондриальные токсины (например., малонат, 3-нитропропионовая кислота; ротенон, цианид); МРТР (1-метил-4-фенил-1,2,3,6,-тетрагидропиридин), которые метаболизируются до их активного, токсического метаболита МРР+ (1-метил-4-фенилпиридин)); 6-гидроксидопамин; альфа-синуклеин; активаторы протеинкиназы С (например, форболмиристатацетат); биогенные амино стимуляторы (например, первитин, MDMA (3-4 метилендиоксиметамфетамин)); или комбинация одного или более стрессоров. Эффективные ретинальные клеточные стрессоры включают такие, которые имитируют нейродегенеративное заболевание, которое поражает одну или более зрелую ретинальную клетку, описанную здесь. Модель хронического заболевания является особенно важной, потому что большинство нейродегенеративных заболеваний является хроническими. Посредством использования этой in vitro системы клеточной культуры, ранние события в продолжительном развитии процесса заболевания могут быть идентифицированы, потому что расширенный период времени является доступным для клеточного анализа.
Ретинальный клеточный стрессор может изменять (т.е. увеличивать или уменьшать в статистически значимой манере) жизнеспособность ретинальных клеток, например, с помощью изменения выживаемости ретинальных клеток, включающих ретинальные нейрональные клетки и клетки ПЭС, или с помощью изменения нейродегенерации ретинальных нейрональных клеток и/или клеток ПЭС. Предпочтительно, чтобы ретинальный клеточный стрессор оказывал отрицательное воздействие на ретинальную нейрональную клетку или клетку ПЭС таким образом, что выживаемость ретинальной нейрональной клетки или клетки ПЭС уменьшалась или снижалась (т.е. протяженность времени, в течение которого клетки являются жизнеспособными, является уменьшенным в присутствии стрессора) или нейродегенерация клетки (или повреждения нейрональной клетки) является повышенной или увеличенной. Стрессор может поражать только отдельный тип ретинальной клетки в ретинальной клеточной культуре, или стрессор может поражать два, три, четыре или более разных типов клетки. Например, стрессор может изменять жизнеспособность и выживаемость фоторецепторных клеток, но не поражать другие важные типы клеток (например, ганглиоциты, амакриновые клетки, горизонтальные клетки, биполярные клетки, ПЭС и глиальные клетки Мюллера). Стрессоры могут сокращать время выживания ретинальной клетки (in vivo или in vitro), увеличивать скорость или расширять нейродегенерацию ретинальной клетки, или каким-либо другим способом отрицательно воздействовать на жизнеспособность, морфологию, зрелость или продожительность жизни ретинальной клетки.
Воздействие клеточного стрессора (в присутствии и отсутствии соединения алкоксифенил-связанного аминового производного) на жизнеспособность ретинальных клеток в системе клеточной культуры может быть определено для одного или более разных типов ретинальных клеток. Определение жизнеспособности клеток может включать непрерывную оценку структуры и/или функционирование ретинальной клетки с определенными интервалами времени или в определенное время после приготовления культуры ретинальной клетки. Жизнеспособность или длительное выживание одного или более разных типов ретинальных клеток, или одного или более разных типов ретинальных нейрональных клеток, может быть изучено согласно одному или более биохимическому или биологическому параметру, который является показателем пониженной жизнеспособности, такой как апоптоз или заболевание метаболической функции, до наблюдения морфологических или структурных изменений.
Химический, биологический или физический клеточный стрессор может снижать жизнеспособность одного или более типов ретинальных клеток в клеточной структуре, когда стрессор добавляется в клеточную структуру в описанных здесь условиях для сохранения продолжительности клеточной структуры. Или же, одно или более условий культуры может быть установлено таким образом, чтобы воздействие стрессора на ретинальные клетки можно было легко наблюдать. Например, концентрация или процент фатальной бычьей сыворотки может быть снижен или ликвидирован в клеточной культуре, когда клетки подвергаются воздействию конкретного клеточного стрессора (см., например, US 2005-0059148). Или же, ретинальные клетки, выращенные в среде, содержащей сыворотку при определенной концентрации для сохранения клеток, могут быть внезапно подвергнуты воздействию среды, которая не содержит никакого уровня сыворотки.
Ретинальная клеточная культура может быть подвергнута воздействию клеточного стрессора в течение периода времени, которое определено для снижения жизнеспособности одного или более типов ретинальных клеток в системе ретинальной клеточной культуры. Клетки могут быть подвергнуты воздействию клеточного стрессора сразу же после посева ретинальных клеток после изолирования от ретинальной ткани. Или же, ретинальная клеточная культура может быть подвергнута воздействию стрессора после стабилизирования культуры, или в любое время после этого. Когда два или более клеточных стрессора включены в систему ретинальной клеточной культуры, каждый стрессор может быть добавлен в систему клеточной культуры одновременно и в течение такого же периода времени, или может быть добавлен отдельно в разные моменты времени за такой же промежуток времени, или в разные промежутки времени во время выращивания ретинальной клеточной системы. Алкоксифенил-связанное аминовое соединение может быть добавлено до того, как ретинальная клеточная культура будет подергнута воздействию клеточного стрессора, может быть добавлено параллельно с клеточным стрессором или может быть добавлено после воздействия стрессора на ретинальную клеточную культуру.
Фоторецепторы могут быть идентифицированы с помощью антител, которые особым образом присоединяются к фоторецептор-специфическим белкам, таким как опсины, периферины и т.п. Фоторецепторы в клеточной культуре могут быть также идентифицированы как морфологическая популяция иммуноцитохимически меченых клеток с помощью нейронального маркера или могут быть идентифицированы морфологически в изображениях живых культур с увеличенным контрастом. Внешние сегменты могут быть обнаружены морфологически в качестве прикрепления к фоторецепторам.
Ретинальные клетки, включающие фоторецепторы, также могут быть обнаружены с помощью функционального анализа. Например, электрофизиологические способы и методики могут использоваться для измерения отклика фоторецепторов на свет. Фоторецепторы проявляют особую кинетику в количественно оцениваемом иммунном ответе на свет. Чувствительное к кальцию контрастное вещество также может использоваться для обнаружения количественно оцениваемого иммунного ответа на свет внутри культур, содержащих активные фоторецепторы. Для анализа индуцирующих стресс соединений или возможного лечения нервных болезней, ретинальные клеточные культуры могут быть подвергнуты иммуноцитохимии и фоторецепторы и/или другие ретинальные клетки могут быть подсчитаны вручную или с помощью программного обеспечения с использованием фотомикроскопии и технологий изображения. Другой метод иммунологического анализа, известный в данной области техники, (например, ELISA, иммуноблоттинг, проточная цитометрия) также может быть эффективным для идентификации и характеристики ретинальных клеток и ретинальных нервных клеток описанной здесь модели системы клеточной культуры.
Стрессовые модели ретинальной клеточной культуры также могут быть эффективными для идентификации как прямого, так и непрямого фармакологического агента, который воздействует с помощью важного биологически активного компонента, такого как описанное здесь аминопроизводное соединение. Например, добавленный в систему клеточной культуры биологически активный компонент, в присутствии одного или более ретинального клеточного стрессора, может стимулировать один тип клетки таким образом, чтобы усиливать или уменьшать выживаемость других типов клетки. Взаимодействия клетка/клетка и клетка/внутриклеточный компонент могут быть важными в понимании механизма заболевания и действия лекарства. Например, один тип нервной клетки может секретировать трофические факторы, которые воздействуют на рост или выживание другого типа нервной клетки (см., например, WO 99/29279).
В другом варианте, аминопроизводное соединение является включенным в скрининговые анализы, включающие описанную здесь стрессовую модельную систему клеточной культуры для определения, какой и/или до какого уровня или степени соединение увеличивает или продливает жизнеспособность (т.е., увеличивается статистически значимым или биологически значимым образом) множества ретинальных клеток. Опытному в данной области специалисту следует учесть и понять, как описано здесь, что ретинальная клетка, которая проявляет повышенную жизнеспособность, означает, что продолжительность времени, в течение которого ретинальная клетка выживает в системе клеточной культуры, является увеличенным (увеличенная продолжительность жизни), и/или ретинальная клетка сохраняет биологическую или биохимическую функцию (нормальный метаболизм и функцию органеллы; отсутствие апоптоза; и т.п.) по сравнению с ретинальной клеткой, выращенной в соответствующей контрольной клеточной системе (например, система клеточной культуры, описанная здесь, в отсутствие соединения). Увеличенная жизнеспособность ретинальной клетки может быть идентифицирована с помощью отложенной смерти клетки или пониженного числа мертвых или умирающих клеток; сохранения структуры и/или морфологии; отсутствия или задержки инициирования апоптоза; задержки, ингибирования, замедленного прогрессирования, и/или аннулирования нейродегенерации ретинальной нейрональной клетки, или задержки или аннулирования, или предотвращения разрушения нейрональных клеток. Способы и методики определения жизнеспособности ретинальных клеток и, таким образом, проявления повышенной жизнеспособности ретинальных клеток, описаны подробно здесь и известны опытным в данной области специалистам.
В определенных вариантах обеспечен способ определения, увеличивает ли аминопроизводное соединение выживаемость фоторецепторных клеток. Один способ включает контактирование системы ретинальной клеточной культуры, как описано здесь, с аминопроизводным соединением в условиях и за период времени, достаточных для того, чтобы произошло взаимодействие между ретинальными нервными клетками и соединением. Усиленная выживаемость (пролонгированная выживаемость) может быть измерена согласно описанным здесь способам, а также способам, известным в данной области техники, включая обнаружение экспрессии родопсина.
Способность аминопроизводного соединения увеличивать жизнеспособность ретинальных клеток и/или усиливать, развивать или продливать выживаемость клетки (т.е. расширять период времени, в течение которого ретинальные клетки, включая ретинальные нейрональные клетки, являются живыми), и/или ослаблять, ингибировать или препятствовать дегенерации, как прямой или непрямой результат описанного здесь стресса, может быть определена любым из нескольких способов, известных опытным в данной области специалистам. Например, изменения в морфологии клетки в отсутствие или присутствии соединения могут быть определены визуальным наблюдением, таким как метод световой микроскопии, софокусной микроскопии или другим микроскопическим способом, известным в данной области техники. Выживаемость клеток также можно определить, например, подсчетом жизнеспособных и/или нежизнеспособных клеток. Иммунохимические и иммуногистологические методики (такие как окрашивание клеток или поточная цитометрия) могут использоваться для идентификации и оценки цитоскелетной структуры (например, с помощью антител, специфичных для цитоскелетных белков, таких как глиофибриллярный кислый белок, фибронектин, актин, виментин, тубулин и т.п.) или для оценки экспрессии клеточных маркеров, как описано здесь. Влияние аминопроизводного соединения на клеточную целостность, морфологию и/или выживаемость может быть также определена путем измерения фосфорилированного состояния полипептидов нейрональных клеток, например, цитоскелетных полипептидов (см., например, Sharma et al., J. Biol. Chem. 274:9600-06 (1999); Li et al., J. Neurosci. 20:6055-62 (2000)). Клеточное выживание или смерть клетки также могут быть определены согласно описанным здесь способам и способам, известным в данной области техники для измерения апоптоза (например, аннексии V-связывание, фрагментарный анализ ДНК, активация каспазы, маркерный анализ, например, поли(АДФ-рибоза)полимераза(ПАРП), и т.п.).
В живом глазу, например, глазу млекопитающего, формирование А2Е является светозависимым процессом, и его аккумулирование приводит к ряду негативных воздействий в глазу. Это включает дестабилизацию мембран пигментного эпителия сетчатки (ПЭС), повышение чувствительности клеток к повреждению синим светом и замедлению деградации фосфолипидов. Продукты оксидирования А2Е (и А2Е родственных молекул) молекулярным кислородом (оксираны) показали снижение повреждения ДНК в выращенных клетках ПЭС. Все эти факторы приводят к градиентному снижению остроты зрения и в конечном итоге к потере зрения. Если снижение образования ретиналей во время процесса зрительного восприятия было бы возможно, то это снижение приводило бы к пониженным количествам А2Е в глазу. Без привязки к какой-либо теории, пониженное накопление А2Е может уменьшать или задерживать процессы дегенерации в ПЭС и сетчатке, и таким образом замедлять или предотвращать потерю зрения в сухой ВМД и болезни Штаргардта.
В другом варианте обеспечены способы лечения и/или предупреждения дегенеративных заболеваний и нарушений, включающих нейродегенеративные ретинальные заболевания и офтальмологические заболевания, и ретинальные заболевания и нарушения, как описано здесь. Пациентом, нуждающимся в таком лечении, может являться человек или низший примат, или другое животное, у которого развились симптомы дегенеративного ретинального заболевания, или который имеет риск развития дегенеративного ретинального заболевания. Как описано здесь, обеспечен способ лечения (который включает предупреждение или профилактику) офтальмологического заболевания или нарушения путем введения пациенту композиции, включающей фармацевтически приемлемый носитель и аминопроизводное соединение (например, соединения, имеющего структуру Формулы (I) и ее подструктур). Как описано здесь, обеспечен способ увеличения выживаемости нейрональных клеток, таких как ретинальные нейрональные клетки, включающих фоторецепторные клетки, и/или ингибирования дегенерации ретинальных нейрональных клеток путем введения описанных здесь фармацевтических композиций, включающих аминопроизводное соединение.
Увеличенная выживаемость (или пролонгированная или расширенная выживаемость) одного или более типов ретинальных клеток в присутствии аминопроизводного соединения показывает, что соединение может быть эффективным агентом для лечения дегенеративного заболевания, в частности ретинального заболевания или нарушения, включающего нейродегенеративное ретинальное заболевание или нарушение. Клеточное выживание и повышенное клеточное выживание может определяться согласно описанным здесь способам и способам, известным опытным в данной области специалистам, включая анализы жизнеспособности и анализы для обнаружения экспрессии маркерных белков ретинальных клеток. Для определения повышенной выживаемости фоторецепторных клеток может быть обнаружен опсин, например, включающий белок родопсин, который экспрессируется палочками.
В другом варианте, пациент проходит лечение от болезни Штаргардта или макулярной дегенерации Штаргардта. В заболевании Штаргардта, которое связано с мутациями в АВСА4 (также называемом ABCR) транспортере, предполагалось, что аккумулирование полностью-транс-ретиналя отвечает за формирование липофусцинового пигмента, А2Е, который является токсичным по отношению к ретинальным клеткам и вызывает ретинальную дегенерацию и последующую потерю зрения.
В еще одном варианте, пациент проходит лечение от возрастной макулярной дегенерации (ВМД). В разных вариантах, ВМД может быть влажной и сухой формы. При ВМД потеря зрения в первую очередь возникает при осложнении заболевания, вызывая рост кровеносных сосудов под макулой или атрофию макулы. Предполагается, без привязки к какой-либо конкретной теории, что накопление полностью-транс-ретиналя отвечает за формирование липофусцинового пигмента, N-ретинилиден-N-ретинилэтаноламина (А2Е) и А2Е родственных молекул, которые являются токсичными по отношению к ПЭС и ретинальным клеткам, а также вызывают ретинальную дегенерацию и последующую потерю зрения.
Нейродегенеративное ретинальное заболевание или нарушение, для которого описанные здесь соединения и способы могут использоваться для лечения, исцеления, предупреждения, улучшения симптомов, или замедления, ингибирования или остановки прогрессирования, является заболеванием или нарушением, которое приводит или характеризуется потерей ретинальной нейрональной клетки, которая является причиной потери зрения. Такое заболевание или нарушение включает, но не ограничивается этим, возрастную макулярную дегенерацию (включая сухую форму макулярной дегенерации) и макулярную дистрофию Штаргардта.
Возрастная макулярная дистрофия, как описано здесь, является нарушением, которое поражает макулу (центральную область сетчатки) и приводит к снижению и потере центрального зрения. Возрастная макулярная дегенерация возникает обычно у человека в возрасте после 55 лет. Этиология возрастной макулярной дегенерации может включать как воздействие окружающей среды, так и генетические компоненты (см., например, Lyengar et al., Am. J. Hum. Genet. 74:20-39 (2004) (Epub 2003 December 19); Kenealy et al., Mol. Vis. 10:57-61 (2004); Gorin et al., Mol. Vis. 5:29 (1999)). Реже, макулярная дегенерация возникает у молодых людей, включая младенцев, и в целом эти нарушения происходят в результате генетической мутации. Виды подростковой макулярной дегенерации включают заболевание Штаргардта (см., например, Glazer et al., Ophthalmol. Clin. North Am. 15:93-100, viii (2002); Weng et al., Cell 98:13-23 (1999)); коллоидную дистрофию сетчатки Дойна (см., например., Kermani et al., Hum. Genet. 104:77-82 (1999)); дистрофию Сорби, Malattia Levintinese, желтопятнистую абиотрофию сетчатки и аутосомно-доминантную геморрагическую макулярную дистрофию (см. также Seddon et al., Ophthalmology 108:2060-67 (2001); Yates et al., J. Med. Genet. 37:83-7 (2000); Jaakson et al., Hum. Mutat. 22:395-403 (2003)). Географическая атрофия ПЭС является развитой формой не неоваскулярной возрастной макулярной дегенерации сухого типа и связана с атрофией хориокапилляров, ПЭС и сетчатки.
Макулярная дегенерация Штаргардта, рецессивное наследственное заболевание, является наследственным онхоцеркозом у детей. Начальным патологическим дефектом в болезни Штаргардта является также накопление токсических липофусциновых пигментов, таких как А2Е, в клетках пигментного эпителия сетчатки (ПЭС). Это накопление по-видимому отвечает за гибель фоторецепторов и серьезную потерю зрения у пациентов с болезнью Штаргардта. Описанные здесь соединения могут замедлять синтез 11-цис-ретинальдегида (11cRAL или ретиналя), а также регенерацию родопсина путем ингибирования изомеразы в зрительном цикле. Небольшая активация родопсина приводит к высвобождению посностью-транс-ретиналя, который образует первый реагент в А2Е биосинтезе. Лечение аминопроизводным соединением может ингибировать накопление липофусцина, и таким образом задерживает потерю зрения у пациентов с заболеванием Штаргардта и ВМД без токсического воздействия, которое препятствует лечению аминопроизводным соединением. Описанные здесь соединения могут использоваться для эффективного лечения других форм ретинальной или макулярной дегенерации, связанной с накоплением липофусцина.
Введение аминопроизводного соединения пациенту может предотвращать образование липофусцинового пигмента, А2Е (и А2Е родственных молекул), который является токсичным по отношению к ретинальным клеткам и вызывает ретинальную дегенерацию. В определенных вариантах, введение аминопроизводного соединения может уменьшать образование продуктов выделения, например, липофусцинового пигмента, А2Е (и А2Е родственных молекул), улучшать развитие ВМД (например, сухой формы) и заболевания Штаргардта, и снижать или замедлять потерю зрения (например, хориоидальную неоваскуляризацию и/или хориоидальную атрофию). В прежних исследованиях, вместе с 13-цис-ретиноевой кислотой (Аккутан® or Изотретиноин), пациентам вводился лекарственный препарат, который широко использовался для лечения угревой сыпи и в качетсве ингибитора 11-цис-ретинол дегидрогеназы, для предупреждения накопления А2Е в ПЭС. Однако, важным недостатком в этом предложенном лечении является то, что 11-цис-ретиноевая кислота может легко изомеризоваться в полностью-транс-ретиноевую кислоту. Полностью-транс-ретиноевая кислота является очень сильным тератогенным соединением, которое отрицательно воздействует на клеточную пролиферацию и развитие. Ретиноевая кислота также накопляется в печени и может служить фактором, способствующим заболеваниям печени.
В еще других вариантах, аминопроизводное соединение вводится пациенту, такому как человек, с мутацией в АВСА4 транспортере в глазу, аминопроизводное соединение также может назначаться пожилым пациентам. Как используется здесь, пожилым пациентом считается пациент в возрасте, по меньшей мере 45 лет, по меньшей мере 50 или по меньшей мере 60, или по меньшей мере 65 лет. Предполагалось, что в болезни Штаргардта, которое связано с мутациями в АВСА4 транспортере, накопление полностью-транс-ретиналя отвечает за формирование липофусцинового пигмента, 2Е2 (и А2Е родственных молекул), который является токсичным по отношению к ретинальным клеткам, а также вызывает ретинальную дегенерацию и последующую потерю зрения. Без привязки к какой-либо теории, аминопроизводное соединение, описанное здесь, может являться сильным ингибитором изомеразы, вовлеченной в зрительный цикл. Лечение пациентов аминопроизводным соединением, как описано выше, может предупреждать или замедлять образование А2Е (и А2Е родственных молекул) и может иметь защитные свойства для нормального зрения.
В других определенных вариантах, одно или более из описанных здесь соединений может использоваться для лечения других офтальмологических заболеваний или нарушений, например, глаукомы, отслоения сетчатки, гемморагической ретинопатии, пигментной дистрофии сетчатки, вирусного ретинального заболевания, пролиферативной витреоретинопатии, ретинальной дистрофии, наследственной оптической нейропатии, дистрофии Сорби, увеита, повреждения сетчатки, невропатии зрительного нерва, ретинальных нарушений, связанных с внешними нейродегенеративными заболеваниями, такими как болезнь Альцгеймера, множественный склероз, болезнь Паркинсона или другие нейродегенератиные заболевания, которые поражают клетки мозга, ретинальное нарушение, связанное с вирусной инфекцией или другие состояния, такие как СПИД. Ретинальное нарушение также включает легкое повреждение сетчатки, которое относится к повышенному воздействию света (т.е. сильному воздействию света), например, случайное воздействие интенсивного света во время операции; сильное, интенсивное или длительное воздействие солнечного света, такое как пустыня или покрытая снегом местность; во время боя, например, наблюдении огня или взрыва или лазерного устройства и т.п. Ретинальные заболевания могут быть дегенеративной или недегенеративной природы. Неограничивающиеся примеры дегенеративных ретинальных заболевания включает возрастную макулярную дегенерацию и макулярную дистрофию Штаргардта. Примеры недегенеративных ретинальных заболеваний включают, но не ограничиваются этим, гемморагическую ретинопатию, пигментную дистрофию сетчатки, невропатию зрительного нерва, воспалительное заболевание сетчатки, диабетическую ретинопатию, диабетическую макулопатию, ретинальную закупорку кровеносных сосудов, ретролентальную фиброплазию, ишемически-реперфузионное повреждение сетчатки, пролиферативная витреоретинопатия, ретинальная дистрофия, врожденная невропатия зрительного нерва, дистрофия Сорсби, увеит, повреждение сетчатки, нарушение сетчатки, связанное с болезнью Альцгеймера, нарушение сетчатки, связанное со множественным склерозом, нарушение сетчатки, связанное с болезнью Паркинсона, нарушение сетчатки, связанное с вирусной инфекцией, нарушение сетчатки, связанное с сильным воздействием света и нарушение сетчатки, связанное со СПИДом.
В других определенных вариантах, по меньшей мере, одно из описанных здесь соединений может использоваться для лечения, заживления, предотвращения, улучшения симптомов, или замедления, ингибирования или остановки прогрессирования определенных офтальмологических заболеваний и нарушений, включающих, но не ограничивающихся этим, диабетическую ретинопатию, диабетическую макулопатию, диабетическую макулярную опухоль, ретинальную ишемию, ишемически-реперфузионное повреждение сетчатки и закупорка кровеносного сосуда сетчатки (включая закупорку вен и закупорку артерий).
Диабетическая ретинопатия является ведущей причиной слепоты у человека и является осложнением диабета. Диабетическая ретинопатия возникает, когда диабет поражает кровеносные сосуды внутри сетчатки. Не пролиферативная ретинопатия является распространенной, обычно мягкой формой, которая в целом не оказывает влияния на зрение. Отклонения являются ограниченными для сетчатки и зрение ослабляется только если макула является вовлеченной. При отсутствии лечения ретинопатия может прогрессировать в пролиферативную ретинопатию, более серьезную форму диабетической ретинопатии. Пролиферативная ретинопатия возникает, когда новые кровеносные сосуды быстро размножаются внутри и вокруг сетчатки. Вследствие этого может возникнуть кровоизлияние в стекловидное тело, отек сетчатки и/или отслоение сетчатки, приводящие к слепоте.
Другие офтальмологические заболевания и нарушения, которые могут лечить с помощью описанных здесь способов и композиций включают заболевания, нарушения и состояния, которые связаны, ухудшены или вызваны ишемией в сетчатке. Ретинальная ишемия включает ишемию внутренней сетчатки и внешней сетчатки. Ретинальная ишемия может возникать из хориоидальных или ретинальных сосудистых заболеваний, таких как центральная или разветвленная ретнальная закупорка зрения, коллагеноз и тромбоцитопеническая пурпура. Ретинальный васкулит и закупорка наблюдаются при болезни Илза и системной красной волчанке.
Ретинальная ишемия может быть связана с закупоркой кровеносных сосудов сетчатки. В США, как разветвленная, так и центральная закупорка ретинальных вен являются вторым самым распространенным ретинальным заболеванием сосудо после диабетической ретинопатии. Примерно от 7% до 10% пациентов, которые имеют ретинальую закпорку вен в одном глазу в конечном итоге имеют двустороннее заболевание. Потеря поля зрения обычно возникает из-за макулярного отека, ишемии или кровоизлияния в стекловидное тело на фоне неоваскуляризации диска или ретинальной неоваскуляризации, вызванной выделением фактора роста эндотелия сосуда.
Артериолосклероз на месте ретинального артериовенозного перектеста (области, в которых артерии и вены делят общую адвентициальную оболочку) вызывает спазм стенки ретинальной вены проходящей артерией. Спазм приводит к образованию тромбоза и последующей закупорке вены. Блокированная вена может привести к макулярному отеку и кровоизлиянию на фоне разрушения барьера кровь-сетчатка в области, осушенной веной, нарушению циркуляции с турбуленцией в венозном потоке, эндотелиальному повреждению и ишемии. Клинически, области ишемии сетчатки возникают как пушистые белые пятна, которые называются хлопок-шерсть пятна.
Разветвленная закупорка ретинальных вен с аномальной ишемией вызывает резкую потерю центрального и парацентрального поля зрения, в соответствии с расположением вовлеченных ретинальных секторов. Ретинальная неоваскуляризация по причине ишемии может приводить к кровоизлиянию в стекловидное тело и подострой или острой потере зрения.
Два типа центральной ретинальной закупорки вен, ишемической и неишемической, может возникнуть в зависимости от того, присутствует ли широкое распространение ретинальной ишемии. Даже в случае неишемического типа, макула может все еще быть ишемической. Приблизительно 25% центральной ретинальной закупорки вен является ишемической. Диагноз центральной ретинальной закупорки вен может быть обычно поставлен на основании полученных офтальмологических характеристик, включающих ретинальное кровоизлияние во всех секторах, расширенные и скрученные вены и «ватные» пятна на сетчатке. Макулярный отек и фовеальная ишемия могут привести к потере зрения. Внеклеточная жидкость увеличивает тканевое давление, которое может привести к областям с закрытыми капиллярами сетчатки (т.е. очаговому ишемическому ретинальному отбеливанию) или закупорке цилиоретинальной артерии.
Пациенты с закупоркой ишемической центральной ретинальной вены более вероятно имеют неожиданное начало потери зрения и имеют остроту зрения по меньшей мере менее 20/200, родственный афферентный пупиллярный дефект, избыточное внутри рентальное кровоизлияние и обширную нонперфузию на флуоресцентной ангиографии. История природы ишемической закупорки центральной ретинальной вены связана с неблагоприятными исходами: в результате, приблизительно два-три пациента, которые имеют ишемическую закупорку центральной ретинальной вены будут иметь окулярную неоваскуляризацию и один-три будут иметь неоваскулярную глаукому. Последнее состояние является серьезным типом глаукомы, которая может привести к быстрой потере поля зрения и потере зрения, эпителиальному отеку роговой оболочки глаза со вторичной эпителиальной эрозией и предрасположенность к бактериальному кератиту, сильной боли, тошноте и рвоте, и в конечном итоге, фтизису глазного яблока (атропия шара без восприятия света).
Как используется здесь, пациент (или объект) может быть млекопитающим, включая человека, который может иметь или быть пораженным нейродегенеративным заболеванием или состоянием, включая офтальмологическое заболевание или нарушение или который может быть свободным от заболевания, которое поддается обнаружению. Соответственно, лечение может назначаться пациенту, который имеет существующее заболевание или лечение может быть профилактическим, назначаемым пациенту, который имеет риск развития заболевания или состояния. Терапия или лечение относятся к любому признаку успеха в лечении или уменьшению интенсивности повреждения, патологии или состояния, включая любой объективный или субъективный параметр, такой как ослабление; ремиссия; уменьшение симптомов или повреждения, более терпимая патология или состояние для пациента; замедление скорости дегенерации или снижение; ослабление конечной точки дегенерации; или улучшение физического или морального состояния пациента.
Лечение или ослабление симптомов может быть основано на объективных или субъективных параметрах; включении результатов физического обследования. Соответственно, термин «лечение» включает введение соединений или агентов, описанных здесь, для лечения боли, гипералгезии, аллодинии или ноцицептивных событий и для предупреждения или задержки, ослабления или ареста или ингибирования развития симптомов или состояний, связанных с болью, гипералгезией, аллодинией, ноцицептивных событий или других нарушений. Термин «терапевтический эффект» относится к снижению, ликвидировани или предотвращению заболевания, симптомов заболевания или осложнений заболевания у пациента. Лечение также включает восстановление или улучшение функций ретинальных нервных клеток (включая функции фоторецепторов) в живой визуальной системе, например, таких как острота зрения, и тестирование визуального поля зрения и др., которое измеряется периодически (например, еженедельно или ежемесячно). Лечение также включает стабилизирование прогрессирования заболевания (т.е., замедление, минимизирование или остановку прогрессирования офтальмологического заболевания и связанных симптомов) и минимизирование дополнительной дегенерации живой визуальной системы. Лечение также включает профилактику и относится к введению соединения алкоксифенил-связанного аминового производного пациенту для предотвращения дегенерации или дальнейшей дегенерации, ухудшения или дальгейшего ухудшения живой визуальной системы пациента и для предупреждения или ингибирования развития заболевания и/или относящихся к нему симптомов и осложнений.
Разные способы и методики, используемые на практике опытными специалистами в области медицины и офтальмологии для определения и оценки состояния заболевания и/или контроля и вычисления терапевтического режима включают, например, ангиограмму флуоресцеина, фотографию дна, трэкинг зеленым красителем индоцианином хороидальной циркуляторной системы, офтальмоскопию, оптическую когерентную томографию (ОСТ) и тестирование остроты зрения.
Флуоресцеиновая ангиограмма включает впрыскивание красителя флуоресцеина внутривенно и дальнейшее наблюдение протекания краски по мере ее циркулирования через глаз. Внутривенная инъекция зеленого красителя индоцианина также можт применяться для определения, подвергаются ли риску сосуды в глазу, особенно в хориоидальной циркуляторной системе, которая находится сразу же за сетчаткой. Фотография дна может использоваться для изучения оптического нерва, макулы, кровеносных сосудов, сетчатки и стекловидного тела. Микроаневризма является видимым поражением в диабетической ретинопатии, которое может быть определено в цифровых изображениях дна на ранней стадии заболевания (см., например, Американскую заявку 2007/0002275). Офтальмоскоп может использоваться для обследования сетчатки и стекловидного тела. Офтальмоскопия обычно выполняется при расширенных зрачках для лучшего вида внутри глаза. Два типа офтальмосков может использоваться: прямой и непрямой. Прямой офтальмоскоп обычно используется для наблюдения оптического нерва и центральной сетчатки. Периферия, или сетчатка в целом, может наблюдаться с использованием непрямого офтальмоскопа. Оптическая когерентная томография (ОСТ) производит изображения с высоким разрешением, высокой скоростью, неинвазивные, поперечные, тканей тела. ОСТ является неинвазивной и обеспечивает обнаружение микроскопические ранние сигналы разрушения в тканях.
Объект или пациент относится к любому живому или млекопитающему пациенту или пациенту, которому могут быть назначены описанные здесь композиции. Термин «живой» или «млекопитающее» включает человека и низшие приматы, а также подопытные животные, такие как кролики, крысы и мыши и другие животные, такие как домашние животные (такие как кошки, собаки, сошади), фермерские животные и животные зоопарка. Пациенты, которым требуется лечение с использованием описанных здесь способов, могут быть выявлены общепринятыми способам обследования в области медицины, которые используются для определения факторов риска или симптомов, связанных с офтальмологическим заболеванием или состоянием, описанным здесь, или для определения статуса существующего офтальмологического заболевания или состояния у пациента. Эти и другие принятые способы позволяют врачам выбрать пациентов, которым требуется лечение с помощью способов и технологий приготовления лекарственных средств, описанных здесь.
V. Фармацевтические композиции
В определенных вариантах, аминопроизводное соединение может вводиться в виде чистого химического препарата. В других вариантах, соединение аминового производного может быть объединено с фармацевтическим носителем (также называемый здесь как фармацевтически пригодный и приемлемый носитель, наполнитель и т.п., который является нетоксичным, инертным материалом, который не влияет на активность активного инградиента), выбранный на основании выбранного курса введения и стандартной фармацевтической практики, как например, описано в Remington: The Science and Practice of Pharmacy (Gennaro, 21st Ed. Mack Pub. Co., Easton, PA (2005)), раскрытие которой приведено здесь полностью в виде ссылки.
Соответственно, обеспечена фармацевтическая композиция, включающая одно или более аминопроизводных соединений, или стереоизомер, таутомер, пролекарство, фармацевтически приемлемую соль, гидрат, сольват, гидрат кислой соли, N-оксид или его изоморфная кристаллическая форма, соединения, описанного здесь, вместе с одним или более фармацевтически приемлемьм носителем и, дополнительно, другими терапевтическими и/или профилактическими инградиентами. Носитель(и) (или наполнитель(и)) является пригодным или приемлемым, если носитель соответствует другим инградиентам композиции и не вредным для реципиента (т.е. пациента). Фармацевтически приемлемая или пригодная композиция включает офтальмологически пригодную или приемлемую композицию.
В одном варинате обеспечено соединение, включающее фармацевтически приемлемый носитель и соединение Формулы (А) или таутомера, стереоизомера, геометрического изомера или фармацевтически приемлемого сольвата, гидрата, соли, N-оксида или их пролекарств:

в которой,
-C(R1)(R2)-, -C(R9)(R10)-C(R1)(R2)-, -X-C(R31)(R32)-, -C(R9)(R10)-C(R1)(R2)-C(R36)(R37)- или Х-С(R31)(R32)-C(R1)(R2)-;
Х представляет собой -O-, -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -C(=CH2)-, -C(=N-NR35)- или -C(=N-OR35)-;
G является выбранным из -C(R41)2-C(R41)2-R40, -С(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила или две R41 группы вместе могут формировать оксо;
каждый R42 является независимо выбранным из водорода или алкила;
R1 и R2 каждый, независимо друг от друга, являются выбранными из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, являются выбранными из водорода, C1-C5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, являются выбранными из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R36 и R37 вместе образуют оксо; или дополнительно, R36 и R37 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R36 и R1 вместе образуют прямую связь, и R37 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R3 и R4 каждый, независимо друг от друга, являются выбранными из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, являются выбранными из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, СO2R13 или SO2NR24R25; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, являются выбранными из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R9 и R1 вместе образуют прямую связь, и R10 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, являются выбранными из водорода, алкила, карбоциклила, -C(=O)R23, -C(NH)NH2, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12 вместе с атомом азота, к которому они присоедиенены, образуют N-гетероциклил;
каждый R13, R22 и R23 является независимо выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35 каждый, независимо друг от друга, является водородом или алкилом;
R20 и R21 каждый, независимо друг от друга, являются выбранными из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый R24, R25, R26, R27, R28 и R29 является независимо друг от друга выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероарилалкила или фторалкила, или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным их водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4; при условии, что G не является незамещенным нормальным алкилом и при условии, что соединением Формулы А не являются:







Разные варианты, кроме того, обеспечивают фармацевтические композиции, включающие фармацевтически приемлемый эксепиент и соединение любой из Формул
(I):

в которой каждый из R1, R2, R3, R4, R5, R9, R10, R14, R15, R16, R17 и R18 является таким, который определен здесь выше.
В дополнительном варианте представлена фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение Формулы (А) или таутомер, стереоизомер, геометрический изомер или фармацевтически приемлемый сольват, гидрат, соль, N-оксид или их пролекарства:

в которой,
Z представляет собой связь, -C(R1)(R2)-, -C(R9)(R10)-C(R1)(R2)-, -X-C(R31)(R32)-, -C(R9)(R10)-C(R1)(R2)-C(R36)(R37)- или Х-С(R31)(R32)-C(R1)(R2)-;
Х представляет собой -O-, -S-, -S(=O)-, -S(=O)2-, -N(R30)-, -C(=O)-, -C(=CH2)-, -C(=N-NR35)- или -C(=N-OR35)-;
G является выбранным из -C(R41)2-C(R41)2-R40, -С(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40, -C(R42)2-O-R40, -C(R42)2-N(R42)-R40, -C(=O)-N(R42)-R40;
R40 является выбранным из -C(R16)(R17)(R18), арила или гетероарила;
каждый R41 является независимо выбранным из водорода, гидрокси, OR6, алкила или две R41 группы вместе могут формировать оксо;
каждый R42 является независимо выбранным из водорода или алкила;
R1 и R2 каждый, независимо друг от друга, являются выбранными из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R1 и R2 вместе образуют оксо;
R31 и R32 каждый, независимо друг от друга, являются выбранными из водорода, C1-C5 алкила или фторалкила;
R36 и R37 каждый, независимо друг от друга, являются выбранными из водорода, галогена, C1-C5 алкила, фторалкила, -OR6 или NR7R8; или R36 и R37 вместе образуют оксо; или дополнительно, R36 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R36 и R1 вместе образуют прямую связь, и R37 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R3 и R4 каждый, независимо друг от друга, являются выбранными из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или С-присоединенного гетероциклила; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероциклил; или R3 и R4 вместе образуют имино;
R7 и R8 каждый, независимо друг от друга, являются выбранными из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R13, SO2R13, CO2R13 или SO2NR24R25; или R7и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
R9 и R10 каждый, независимо друг от друга, являются выбранными из водорода, галогена, алкила, фторалкила, -OR19, -NR20R21 или карбоциклила; или R9 и R10 образуют оксо; или дополнительно, R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или дополнительно, R9 и R1 вместе образуют прямую связь, и R10 и R2 вместе образуют прямую связь для обеспечения тройной связи;
R11 и R12 каждый, независимо друг от друга, являются выбранными из водорода, алкила, карбоциклила, -C(=O)R23, -C(NH)NH2, SO2R23, CO2R23 или SO2NR28R29; или R11 и R12 вместе с атомом азота, к которому они присоедиенены, образуют N-гетероциклил;
каждый из R13, R22 и R23 является независимо друг от друга выбранным из алкила, гетероалкила, алкенила, арила, аралкила, карбоциклила, гетероарила или гетероциклила;
R6, R19, R30, R34 и R35 каждый, независимо друг от друга, является водородом или алкилом;
R20 и R21 каждый, независимо друг от друга, являются выбранными из водорода, алкила, карбоциклила, гетероциклила, -C(=O)R22, SO2R22, CO2R22 или SO2NR26R27; или R20 и R21 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
каждый из R24, R25, R26, R27, R28 и R29 является независимо друг от друга выбранным из водорода, алкила, алкенила, фторалкила, арила, гетероарила, карбоциклила или гетероциклила;
R16 и R17 каждый, независимо друг от друга, является выбранным из водорода, алкила, гало, арила, гетероарила, аралкила, гетероариалкила или фторалкила, или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют карбоциклил или гетероцикл;
R18 является выбранным их водорода, алкила, алкокси, гидрокси, гало или фторалкила;
каждый R33 является независимо выбранным из галогена, OR34, алкила или фторалкила; и n равно 0, 1, 2, 3 или 4; при условии, что G не является незамещенным нормальным алкилом и при условии, что соединением Формулы А не являются:






or

Разные варианты кроме того обеспечивают фармацевтические композиции, включающие фармацевтически приемлемый носитель и соединение Формулы (I):

в виде таутомера или смеси таутомеров, или в виде фармацевтически приемлемой соли, гидрата, сольвата, N-оксида или их пролекарств, в которой:
R1 и R2 являются одинаковыми или разными и независимо друг от друга представляют собой водород, галоген, C1-C5 алкил, фторалкил, -OR6, -NR7R8 или R1 и R2 образуют оксо;
R3 и R4 являются одинаковыми или разными и независимо друг от друга представляют собой водород или алкил;
R5 представляет собой C5-C15 алкил, аралкил, гетероциклилалкил, гетероарилалкил или карбоциклилалкил;
R6 представляет собой водород или алкил;
R7 и R8 являются одинаковыми или разными и независимо друг от друга представляют собой водород, алкил, карбоциклил или -C(=O)R13; или R7 и R8 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил;
Х представляет собой-С(R9)(R10)- или -O-;
R9 и R10 являются одинаковыми или разными и независимо друг от друга представляют собой водород, галоген, алкил, фторалкил, -OR6, -NR7R8 или карбоциклил; или R9 и R10 образуют оксо;
R11 и R12 являются одинаковыми или разными и независимо друг от друга представляют собой водород, алкил или -C(=O)R13; или
R11 и R12 вместе с атомом азота, к которому они присоединены, образуют N-гетероциклил; и
R13 представляет собой алкил, алкенил, арил, карбоциклил, гетероарил или гетероциклил.
Фармацевтическая композиция (например, для орального введения или введения в виде инъекции, или комбинированная система, или для применения в качестве глазных капель) может быть в виде жидкости или раствора. Жидкая фармацевтическая композиция может включать, например, один или более из следующих компонентов: стерильные растворители, такие как вода для инъекций, солевой раствор, предпочтительно физиологический солевой раствор, раствор Рингера, изотонический хлорид натрия, нелетучее масло, которое может служить в качестве растворителя или питательной взвеси, полиэтиленгликоли, глицерин, пропиленгликоль и другие растворы; антибактериальные агенты; антиоксиданты; хелатообразующие агенты; буферы и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. Препарат для парентерального введения может быть закрыт в ампулах, одноразовых шприцах или флаконах для многократного приема, изготовленных из стекла или пластика. Физиологический солевой раствор широко применяется в качестве наполнителя, и впрыскиваемая фармацевтическая композиция или композиция, которая поставляется в глаз, предпочтительно является стерильной.
По меньшей мере, одно аминопроизводное соединение может вводиться человеку или не относящемуся к человеку позвоночному. В определенных вариантах, соединение является главным образом чистым, поскольку оно содержит примерно менее 5% или менее 1%, или менее 0.1% других органических маленьких молекул, таких как загрязняющие промежуточные соединения или побочные продукты, которые образуются, например, на одной или более стадий метода синтеза. В других вариантах может вводиться комбинация одного или более аминопроизводного соединения.
Аминопроизводное соединение может вводиться пациенту любым пригодным способом, включающим, например, оральный, парентеральный, внутриглазной, внутривенный, внутрибрюшной, внутриназальный (или другими способами доставки в слизистые оболочки, например, носа, гортани и бронхиолы), или путем локального введения в глаз, или с помощью внутриглазного или окологлазного устройства. Режимы локального введения могут включать, например, глазные капли, внутриглазное впрыскивание или окологлазное впрыскивание. Окологлазное впрыскивание обычно включает впрыскивание синтерического ингибитора изомеризации, т.е. аминопроизводного соединения под соединительную оболочку глаза или в пространство Тенона (на нижней стороне волокнистой ткани, лежащей над глазом). Внутриглазное впрыскивание обычно включает впрыскивание аминопроизводного соединения в стекловидное тело. В определенных вариантах, введение является неинвазийным, таким как глазные капли или оральная лекарственная форма или комбинированный источник.
Аминопроизводное соединение может быть приготовлено для введения с помощью фармацевтически приемлемых (пригодных) носителей или наполнителей а также методами, которые принято использовать в данной области техники. Фармацевтически приемлемый или пригодный носитель включает офтальмологически приемлемый или пригодный носитель. Носитель является выбранным в соответствии с растворимостью соединения алкоксифенил-связанного аминового производного. Пригодные офтальмологические композиции включают такие композиции, которые вводятся локально в глаз, такие как глазные капли, впрыскивание и т.п. В случае глазных капель приготовление также дополнительно включает, например, офтальмологически совместимые агенты, такие как изотонизирующие агенты, такие как хлорид натрия, концентрированный глицерин и т.п.; буферные агенты, такие как фосфат натрия, ацетат натрия и подобные; поверхностно-активные соединения, такие как полиоксиэтилен сорбитан моно-олеат (также называемый как Полисорбат 80), полиоксистеарат 40, полиоксиэтиленовое гидрогенизированное касторовое масло и т.п.; стабилизирующие агенты, такие как цитрат натрия, эдентат натрия и т.п.; консерваторы, такие как бензалконий хлорид, парабены и т.п.; и другие компоненты. Консерванты могут использоваться, например, при уровне примерно от 0.001 до 1.0% вес/объем. РН состава обычно находится в диапазоне, допустимом для офтальмологических составов, например, внутри диапазона рН 4-8 или рН 5-7, или рН 6-7, или рН 4-7, или рН 5-8, или рН 6-8, или рН 4-6, или рН 5-6, или рН 7-8.
В дополнительных вариантах, описанные здесь композиции кроме того включают циклодекстрины. Циклодекстрины являются циклическими олигосахаридами, содержащими 6, 7 или 8 глюкопиранозных единиц, называемых α-циклодекстрин, β-циклодекстрин, или γ-циклодекстрин соответственно. Было обнаружено, что циклодекстрины являются отчасти эффективными в фармацевтических композициях. Циклодекстрины имеют гидрофильную внешнюю поверхность, что увеличивает растворимость в воде и гидрофорбную внутреннюю область, которая образует полость. В водной среде гидрофобная часть других молекул часто поступает в гидрофобную полость циклодекстрина для образования соединений включения. Дополнительно, циклодекстрины являются также способными к другим типам несвязывающих взаимодействий с молекулами, которые не находятся внутри гидрофобной полости. Циклодекстрины имеют три свободные гидроксильные группы для каждой глюкопиранозной единицы, или 18 гидроксильных групп на α-циклодекстрине, 21 гидроксильную группу на β-циклодекстрине, и 24 гидроксильную группу на γ-циклодекстрине. Одна или более из этих гидроксильных групп может реагировать с любым числом реагентов для формирования ряда циклодекстриновых производных.
Некоторыми из наиболее известных производных циклодекстрина являются гидроксипропиловые эфиры, сульфонаты и сульфоалкилэфиры.
Ниже показана структура β-циклодекстрина и гидроксипропил-β-циклодекстрина (HPβCD).

Использование циклодекстринов в фармацевтических композициях хорошо известно в данной области, так как циклодекстрины и циклодекстриновые производные часто используются для улучшения растворимости лекарственных препаратов. Во многих случаях соединения включения являются включенными для усиления растворимости; однако другие взаимодействия между циклодекстринами и нерастворимьми соединениями могут также улучшать растворимость. Гидроксипропил--β-циклодекстрин (HPβCD) является коммерчески доступным в виде свободного от пирогена продукта. Это негигроскопичный белый порошок, который легко растворяется в воде. HPpCD является термически стабильным и не разлагается при нейтральном рН.
Раскрыты офтальмологические составы, использующие циклодекстрины. Например, US 5,227,372 раскрывает способы, которые относятся к сохранению офтальмологических агентов в тканях глаза. Американская заявка 2007/0149480 объясняет использование циклодекстринов для приготовления офтальмологических составов маленькой молекулы ингибитора киназы с низкой растворимостью в воде.
Концентрация циклодекстрина, используемая в композициях и в раскрытых здесь способах, может различаться в соответствии с физикохимическими свойствами, фармакокинетическими свойствами, побочным эффектом или нежелательными явлениями, анализами состава или другими факторами, связанными с терапевтически активным агентом или солью, или его пролекарством. Свойства других компонентов в композиции также может быть важным. Таким образом, концентрация или количество циклодекстрина, который используется в соответствии с композицией и способами, раскрытыми здесь, может отличаться. В определенных композициях, концентрация циклодекстрина составляет от 10% до 25%.
Для впрыскивания, соединение аминового производного может быть обеспечено в градиентном солевом растворе для впрыскиваний, в форме впрыскиваемого липосомного раствора, медленно-высвобождаемой полимерной системы и т.п. Внутриглазное и окологлазное впрыскивание известно опытным в данной области специалистами и описано в многочисленных публикациях, включающих, например, Spaeth, Ed., Ophthalmic Surgery: Principles of Practice, W. B. Sanders Co., Philadelphia, Pa., 85-87, 1990.
Для подачи композиции, включающей, по меньшей мере, одно описанное здесь соединение, через слизистую оболочку, которая включает доставку в носовой проход, гортань и дыхательные пути, композиция может быть доставлена в форме аэрозоля. Соединение может быть в форме жидкости или порошка для внутриглазной подачи. Например, композиция может быть доставлена с помощью аэрозольного контейнера под давлением с пригодным распыляющим веществом (например, пропаном, бутаном, изобутеном). Композиция может быть досталвена при помощи поставляющей системы при нормальном давлении, такой как распылитель или аэрозольный аппарат.
Пригодные оральные дозированные формы включают, например, таблетки, пилюли, саше-пакеты или капсулы твердого или мягкого желатина, метилцеллюлозы или другого пригодного материала, легко растворимого в желудочно-кишечном тракте. Могут использоваться пригодные нетоксические твердые носители, которые включают, например, фармацевтические фракции маннитола, лактозы, крахмала, стеарата магния, сахарина натрия, талька, целлюлозы, сахарозы, карбоната магния и т.п. (См., например, Remington: The Science and Practice of Pharmacy (Gennaro, 21st Ed. Mack Pub. Co., Easton, PA (2005)).
Описанные здесь аминопроизводные соединения могут быть приготовлены для длительного или медленного высвобождения. Такие композиции могут в целом быть приготовлены с помощью хорошо известных технологий и вводиться, например, орально, периокулярно, внутрь глаза, ректально или подкожным вживлением или путем имплантации в требуемое целевое место. Составы с длительным высвобождением могут содержать агент, диспергированный в матрице носителя и/или содержаться внутри резервуара, окруженного контролирующей скорость мембраной. Наполнители для использования внутри таких составов являются биосовместимыми и могут также быть биоразлагаемыми; предпочтительно, чтобы состав обеспечивал относительно постоянный уровень высвобождения активного компонента. Количество активного компонента содержащегося внутри состава с длительным высвобождением зависит от места имплантации, скорости и ожидаемой продолжительности высвобождения, и природы состояния, подлежащего лечению или предотвращению.
Системное всасывание лекарственного препарата или композиции, вводимой через глаза, известно опытным в данной области специалистам (см., например, Lee et al., Int. J. Pharm. 233:1-18 (2002)). В одном варианте, аминопроизводное соединение поставляется путем локального глазного способа доставки (см., например, Curr. Drug Metab. 4:213-22 (2003)). Композиция может быть в форме глазной капли, мази или смазки и т.п., такой как водные глазные капли, водные офтальмологические суспензии, не водные глазные капли и не водные офтальмологические суспензии, гели, фотальмологические смазки и т.п. Для приготовления геля, например, может использоваться карбоксивиниловый полимер, метилцеллюлоза, альгинат натрия, гидроксипропилцеллюлоза, этилен малеиновый ангидрид полимер и подобные.
Доза композиции, включающей, по меньшей мере, одно соединение описанного здесь аминопроизводного соединения, может различаться в зависимости от состояния пациента (например, человека), то есть стадии заболевания, общего состояния здоровья, возраста и других факторов, которые опытный в данной области специалист будет использовать для определения дозы. Когда композиция применяется в виде глазных капель, например, от одной до нескольких капель на одну дозу, предпочтительно от 1 до 2 капель (примерно 50 мкл на 1 каплю), композиция может применяться примерно от 1 до 6 раз ежедневно.
Фармацевтические композиции могут вводиться способом, соответствующим подлежащему лечению заболеванию (или предупреждению), как определено опытными в области медицины специалистами. Соответствующая доза и пригодная продолжительность и частота введения будут определяться такими факторами, как состояние пациента, тип и серьезность заболевания пациента, конкретная форма активного компонента и способ введения. В целом, соответствующая доза и лечебный режим обеспечивают композицию(и) в количестве, достаточном для достижения терапевтического и/или профилактического эффекта (например, улучшенный клинический результат, такой как более частая полная или частичная ремиссия, или более длительное свободное от заболевания состояние и/или полное выздоровление или снижение серьезности симптомов). Для профилактического использования доза должна быть достаточной для предупреждения, задержки появления или уменьшения серьезности заболевания, связанного с нейродегенерацией ретинальных нервных клеток и/или дегенерацией других зрелых ретинальных клеток, таких как клетки ПЭС. Оптимальные дозы могут быть определены в целом с помощью экспериментальных моделей и/или клинических испытаний. Оптимальная доза может зависеть от массы тела, веса или объема крови пациента.
Дозы аминопроизводных соединений могут быть подходящим образом выбраны в зависимости от клинического статуса, состояния и возраста пациента, дозированной формы и т.п. В случае глазных капель, аминопроизводное соединение может вводиться, например, от 0.01 мг, 0.1 мг или примерно от 1 мг до 25 мг, до 50 мг, до 90 мг на однократную дозу. Глазные капли могут вводиться один или более раз в день, при необходимости. В случае впрыскиваний, пригодными дозами могут быть, например, примерно 0.0001 мг, примерно 0.001 мг, примерно 0.01 мг или примерно от 0.1 мг до 10 мг, до 25 мг, до 50 мг или до 90 мг аминопроизводного соединения, от одного до семи раз в неделю. В одном варианте, примерно от 1.0 до 30 мг аминопроизводное соединение может вводиться от одного до семи раз в неделю.
Оральные дозы могут обычно изменяться от 1.0 до 1000 мг, от одного до четырех раз или более в день. Примером диапазона доз для орального введения является от 10 до 250 мг от одного до трех раз в неделю. Если композиция является жидким составом, композиция включает, по меньшей мере, 0.1% активного соединения при конкретной массе или весе (например, от 1.0 до 1000 мг) на единицу объема носителя, например, от 2% до 60%.
В определенных вариантах, по меньшей мере, одно соединение описанного здесь аминопроизводного соединения может вводиться в условиях и момент времени, достаточных для ингибирования или предупреждения темновой адаптации палочковых фоторецепторных клеток. В определенных вариантах, соединение вводится пациенту, по меньшей мере, в течение 30 минут (полчаса), 60 минут (один час), 90 минут (1.5 часа), или 120 минут (2 часов) перед сном. В определенных вариантах соединение может вводиться перед сном. В других вариантах, световой стимул может быть заблокирован или удален в течение дня или в нормальных световых условиях путем помещения пациента в среду, в которой удален свет, такую как помещение пациента в темную комнату или путем применения маски на глаза пациенту. Когда световой стимул является удаленным таким образом или другими средствами, известными в данной области техники, агент может вводиться перед сном.
Дозы соединений, которые могут вводиться для предупреждения или ингибирования темновой адаптации палочковой фоторецепторной клетки, могут быть подходящим способом выбраны в зависимости от клинического статуса, состояния и возраста пациента, форма дозы и т.п. В случае с глазными каплями, соединение (или композиция, включающая соединение) может вводиться, например, от 0.01 мг, 0.1 мг или от 1 мг до 25 мг, до 50 мг, до 90 мг на одну дозу. В случае впрыскивания, пригодная доза может составлять примерно 0.0001 мг, 0.001 мг, 0.01 мг или примерно от 0.1 мг до 10 мг, до 25 мг, до 50 мг или до 90 мг соединения, вводимого любое количество дней, от одного до семи дней в неделю, перед сном или перед удалением пациента от всех источников света. В других определенных вариантах, для введения соединения с помощью глазных капель или впрыскивания, доза составляет 1-10 мг (соединение)/кг (вес тела пациента) (т.е., например, 80-800 мг всего на дозу для пациента весом 80 кг). В других вариантах, примерно от 1.0 до 30 мг соединения может вводиться от одного до семи раз в неделю Оральные дозы обычно изменяются в диапазоне примерно от 1.0 до 1000 мг, вводятся любое количество дней, от одного до семи раз в неделю. Например, для орального введения доза составляет примерно от 10 до 800 мг один раз в день перед сном. В других вариантах, композиция доставляется путем внутриглазного введения.
Также обеспечены способы производства соединений и фармацевтических композиций, описанных здесь. Композиция, включающая фармацевтически приемлемый наполнитель или носитель и, по меньшей мере, одно из соединений аминопроизводного соединения, описанного здесь, может быть приготовлена синтезом соединения любым описанным здесь способом или используемым на практике в данной области и последующим приготовлением композиции с фармацевтически приемлемым носителем. Состав композиции будет соответствовать и зависеть от нескольких факторов, включающих, но не ограничивающихся этим, режим поставки, дозу и стабильность соединения.
Другие варианты и применение будут очевидны опытным специалистам с учетом настоящего раскрытия изобретения. Приведенные ниже примеры представлены исключительно для иллюстрации разных вариантов и не подразумевают ограничение изобретения каким-либо образом.
Не смотря на то, что здесь показаны и описаны предпочтительные варианты настоящего изобретения, для опытных в данной области специалистов будет очевидно, что такие варианты приведены только в качестве примера. Многочисленные вариации, изменения и замещения будут возникать для опытных специалистов без отступления от изобретения. Следует понимать, что разные альтернативы вариантам изобретения, описанные здесь, могут использоваться при применении изобретения на практике. Предполагается, что следующие формулы определяют масштаб изобретения и что способы и структуры находятся в рамках этих формул и их эквивалентов.
ПРИМЕРЫ
Если не указано иное, использовали реагенты и растворители, которые получали от коммерческих поставщиков. Безводные растворители и высушенную в печи стеклянную посуду использовали для синтетических превращений, которые в целом считаются чувствительными к влаге и/или кислороду. Флэш колоночную хроматографию и тонкослойную хроматографию (ТСХ) выполняли на силикагеле, если не указано иное. Градиентную флэш колоночную хроматографию выполняли на оборудовании Biotage. Протонный и углеродный ядерный магнитный резонансный спектр получали на спектрометре Varian VnmrS 400 при 400 МГц для протона и 100 МГц для углерода или с использованием спектрометров Bruker AMX 500 или 300 при 500 или 300 МГц для протона и 125 или 75 МГц для углерода, как отмечено выше. Спектр представлен в ррт (δ) и константы взаимодействия J представлены в Герцах (Гц). Для протонного спектра использовали тетраметилсилан в качестве внутреннего стандарта или пик растворителя использовали в качестве базового пика. Для углеродного спектра пик растворителя использовали в качестве базового. Анализ хиральной ВЭЖХ выполняли с использованием колонки Chiralpak IA (4.6 мм × 250 мм, 5 µ) с детектированием диодного излучения. Скорость потока составляла 1 мл/мин.
Способы аналитической ВЭЖХ
Анализ ВЭЖХ был проведен с помощью колонки Hypersil BDS C18 (250×4.6 мм, Phenomenex) с детектированием при 254 нм с использованием стандартной программы градиентного растворителя (Способ 1).
Способы препаративной ВЭЖХ
Препаративную ВЭЖХ проводили с помощью колонки YMC ODA-A (500 мм × 30 мм × 10µ) при температуре окружающей среды с детектированием при 220 нм с помощью вводимого объема 5 мл и стандартной программы градиентных растворителей (Способ 1P или 2Р).
Растворители для приготовления образцов: Метанол, Ацетонитрил, Ацетонитрил: Метанол (1:1).
Растворители для приготовления образцов: Метанол, Ацетонитрил, Ацетонитрил:Метанол (1:1).
ПРИМЕР 1
Приготовление 3-(3-(2,6-диметилфенетил)фенил)пропан-1-амина

3-(3-(2,6-диметилфенетил)фенил)пропан-1-амин был приготовлен согласно способу, показанному на Схеме 1:
Схема 1

Стадия 1: К перемешанному раствору 2,6-диметилбензойной кислоты (1) (10.0 г, 66.6 ммоль) в THF (100 мл) при 0°С по каплям в течение 20 мин добавляли комплекс боран-THF (80 мл 1 М раствора в THF, 80.0 ммоль) и затем реакционную смесь нагревали до комнатной температуры. Через 64 ч реакционную смесь осаждали меделенным добавлением МеОН (70 мл) и полученный раствор концентрировали при пониженном давлении. Остаток суспендировали в EtOAc (300 мл) и отмывали водой и солевым раствором. Органический слой высушивали над Na2SO4 и концентрировали при пониженном давлении для получения спирта 2 в виде белого твердого вещества. Выход (9.10 г, >99%):1Н ЯМР (500 МГц, CDCl3) 7.03-7.13 (m, 3Н), 4.74 (d,J = 5.1 Гц, 2Н), 2.43 (s, 6H), 1.28 (t, J = 5.2 Гц, 1Н); ESI MS m/z 119 [M+H - H2O]+.
Стадия 2: К перемешанному раствору гидробромида трифенилфосфина (22.0 г, 64.0 ммоль) в МеОН (80 мл) добавляли раствор спирта 2 (8.72 г, 64.0 ммоль) в МеОН (70 мл) и реакционную смесь перемешивали при комнатной температуре в течение 48 ч. Реакционную смесь концентрировали при пониженном давлении и остаток растирали со смесью ацетона (20 мл) и диэтилового эфира (50 мл). Осадок собирали вакуумной фильтрацией, промывали диэтиловым эфиром (30 мл) и гексанами (30 мл), и концентрировали при пониженном давлении для получения соли трифенилфосфина 3 в виде белого твердого вещества. Выход (23.0 г, 78%): mp 240-248°С.1H ЯМР (300 МГц, ДМСО-d6) δ 7.51-7.95 (m, 15Н), 7.15 (dt, J = 7.7, 2.6 Гц, 1Н), 6.96 (d, J = 7.7 Гц, 2Н), 4.94 (d, J = 14.6 Гц, 2Н), 1.76 (s, 6H); ESI MS m/z 381 [M-Br]+; ВЭЖХ (Способ 1) 97.0% (AUC), tR=13.78 мин.
Стадия 3: К перемешанной суспензии соли трифенилфосфина 3 (8.76 г, 19.0 ммоль) в THF (60 мл) при -78°С добавляли n-бутиллитий (7.8 мл, 2.5М раствор в гексанах, 19.5 ммоль) и реакционная смесь нагревалась до комнатной температуры. Через 30 мин реакционную смесь снова охлаждали до -78°С, добавляли раствор 3-иодбензальдегида (4.41 г, 19.0 ммоль) в THF (15 мл) и реакционная смесь нагревалась до комнатной температуры. Через 1 ч реакционную смесь осаждали насыщенным водным раствором NH4Cl (50 мл) и экстрагировали EtOAc. Объединенные органические слои концентрировали при пониженном давлении и полученный остаток растворяли в МеОН (70 мл). Раствор МеОН разделяли между гексанами и водой. Объединенные органические слои промывали смесью 70% МеОН-вода (100 мл), высушивали над Na2S04 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией (100% гексаны) для получения транс-алкена 4 (2.12 г, 33%) в виде белого твердого вещества и цис-алкена 5 (1.15 г, 18%) в виде бесцветного масла. 4:1Н ЯМР (500 МГц, CDCl3) 7.84 (s, 1Н), 7.59 (d, J = 7.7 Гц, 1Н), 7.44 (d, J = 7.7 Гц, 1Н), 7.06-7.10 (m, 5H), 6.49 (d, J = 16.6 Гц, 1Н), 2.35 (s, 6H). 5:1H ЯМР (500 МГц, CDCl3) δ 7.44 (d, J = 7.8 Гц, 1Н), 7.37 (s, 1Н), 7.13 (t, J = 7.5 Гц, 1Н), 7.04 (d, J = 7.6 Гц, 2Н), 6.88 (d, J = 7.9 Гц, 1Н), 6.81 (t, J = 7.8 Гц, 1Н), 6.59 (d, J = 12.2 Гц, 1Н), 6.53 (d, J = 12.2 Гц, 1Н), 2.14 (s, 6H).
Стадия 4: В перемешанный раствор транс-алкена 4 (1.86 г, 5.60 ммоль) в DMF (5 мл) добавляли NаНСО3 (1.49 г, 17.7 ммоль), тетрабутиламмоний хлорид (1.58 г, 5.70 ммоль) и аллиловый спирт (0.683 г, 11.8 ммоль). Реакционную колбу продували азотом в течение 10 мин, затем добавляли Pd(OAc)2 (0.029 г, 0.130 ммоль). После дополнительного продувания азотом в течение 10 мин раствор перемешивали в атмосфере азота при комнатной температуре. Через 18 ч раствор разбавляли EtOAc (50 мл) и полученную смесь отмывали водой, 5% водным раствором LiCl и солевым раствором. Органические слои высушивали над MgSO4 и концентрировали при пониженном давлении для получения темного масла. Очистка флэш хроматографией (градиент от 0 до 20% EtOAc-гексаны) обеспечила альдегид 6 в виде бесцветного масла. Выход 1.05 г (71%):1H ЯМР (500 МГц, CDCl3) δ 9.85 (t, J = 1.1 Гц, 1Н), 7.39 (d, J = 7.8 Гц, 1Н), 7.29-7.32 (m, 2H), 7.07-7.12 (m, 5H), 6.57 (d, J = 16.6 Гц, 1Н), 2.99 (t, J = 7.6 Гц, 2H), 2.38-2.84 (m, 2H), 2.37 (s, 6H).
Стадия 5: В раствор альдегида 6 (0.200 г, 0.76 ммоль) в EtOH (15 мл) в атмосфере азота добавляли 10% Pd/C (50% влажности, 0.020 г). Колбу заполняли водородом до 30 PSI и смесь перемешивали в течение 1.5 ч. Реакционную смесь фильтровали через диатомитовую землю, фильтрационный кек промывали EtOH (50 мл) и фильтрат концентрировали при пониженном давлении до желтого остатка. Очистка флэш-хроматографией (градиент от 0 to 20% ЕtOAс-гексаны) позволила получить альдегид 7 в виде желтого масла. Выход (0.100 г, 50%):1Н ЯМР (500 МГц, СDСl3) δ 9.82 (t, J = 1.4 Гц, 1Н), 7.23 (d, J = 7.5 Гц, 1Н), 7.09 (d, J = 7.6 Гц, 1Н), 7.00-7.06 (m, 5H), 2.88-2.95 (m, 4H), 2.71-2.78 (m, 4H), 2.32 (s, 6H).
Стадия 6: К перемешанному раствору альдегида 7 (0.100 г, 0.38 ммоль) в МеОН (5 мл) добавляли 7М NH3 в МеОН (1 мл) и маленькую ложку порошка молекулярного сита. Колбу закрывали и при перемешивании в течение 1.5 ч добавляли NaBH4 (0.022 г, 0.58 ммоль). Раствор перемешивали дополнительно в течение 3 ч, фильтровали над диатомитовой землей, фильтрационный кек споласкивали МеОН (50 мл) и фильтрат концентрировали при пониженном давлении. Очистка полученного остатка флэш хроматографией (5% 7M NH3 в MeOH-CH2Cl2) позволила получить 3-(3-(2,6-диметилфенетил)фенил)пропан-1-амин в виде свободного основания. Выход (0.050 г, 50%). Свободное основание переводили в соль НСl с помощью следующей процедуры: К перемешанному раствору 3-(3-(2,6-диметилфенетил)фенил)пропан-1-амина (0.050 г, 0.17 ммоль) в диэтиловом эфире (2 мл) добавляли 1N HCl в эфире (0.2 мл, 0.2 ммоль). После перемешивания в течение 1 ч твердую фазу собирали фильтрацией и высушивали в вакууме для получения Примера 1 гидрохлорида в виде белого твердого вещества. Выход (0.022 г, 42%): mp 106-108°С;1Н ЯМР (500 МГц, СD3ОD) δ 7.22 (d, J = 7.5 Гц, 1Н), 7.06 (d, J = 7.4 Гц, 2H), 6.99-6.96 (m, 4H), 2.89-2.92 (m, 4H), 2.72-2.75 (m, 2H), 2.67 (t, J = 7.5 Гц, 2H), 2.26 (s, 6H), 1.93 (t, J = 7.7 Гц, 2H);13С ЯМР (75 МГц, CD3OD) δ 143.8, 141.7, 139.3, 127.1, 129.7, 129.6, 129.1, 127.6, 127.0, 126.9; ESI MS m/z 268 [M+Н]+; ВЭЖХ (Способ 1) 98.9% (AUC), tR=11.77 мин. HRMS расчет для C19H25N [M+H]:268.2065, Определено: 268.2064
ПРИМЕР 2
Приготовление 1-(3-(3-аминопропил)фенил)-3-этилпентан-3-ола

1-(3-(3-аминопропил)фенил)-3-этилпентан-3-ол был приготовлен согласно способу, показанному на Схеме 2:
Схема 2
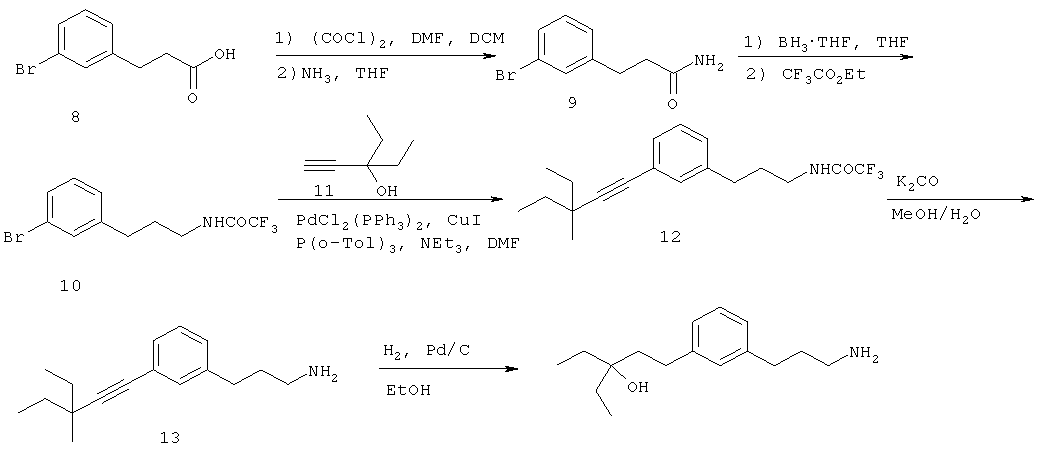
Стадия 1: В перемешанный раствор 3-(3-бромфенил)пропановой кислоты (8) (25.0 г, 109.1 ммоль) в СН2Сl2 (150 мл) добавляли оксалилхлорид (27.7 г, 218.3 ммоль) с последующим DMF (2 капли). Раствор перемешивали при комнатной температуре в течение ночи. Смесь концентрировали при пониженном давлении для получения сырого хлорангидрида, который использовали сразу же на следующей стадии реакции. Стадия 2: Сырой хлорангидрид растворяли в безводном THF (150 мл) и охлаждали в ледяной ванне. Поток газообразного аммиака пропускали через раствор в течение 3-4 минут и смесь нагревали до комнатной температуры, и перемешивали в течение ночи. Смесь концентрировали при пониженном давлении и остаток разделяли между насыщенным водным раствором NаНСО3 и EtOAc. Объединенные органические слои высушивали над Na2SO4 и концентрировали при пониженном давлении для получения амида 9 в виде белого твердого вещества. Выход (23.9 г, 96%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.40 (s, 1H), 7.35 (dt, J = 6.4, 2.4 Гц, 1Н), 7.26 (br s, 1H), 7.18-7.24 (m, 2H), 6.75 (br s, 1H), 2.78 (t, J = 7.6 Гц, 2H), 2.34 (t, J = 7.6 Гц, 2H).
Стадия 3: В ледяной перемешанный раствор амида 9 (23.85 г, 104.6 ммоль) в THF (250 мл) добавляли ВН3-THF (209 мл 1.0 М раствора в THF, 209 ммоль). Раствор нагревали до комнатной температуры и перемешивали в течение 18 ч. Реакцию осаждали медленным добавлением 6N НСl до достижения рН 1. Раствор перемешивали при комнатной температуре в течение 4 ч, затем рН доводили до >10 добавлением 50% водного раствора NaOH. Раствор экстрагировали ЕtOАс и объединенные органические слои отмывали солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении для получения сырого 3-(3-бромфенил)пропан-1-амина, который использовали сразу же в следующей реакции.
Стадия 4: Сырой 3-(3-бромфенил)пропан-1-амин (примерно 104.6 ммоль) перемешивали с этилтрифторацетатом (30 мл) в течение ночи. Смесь концентрировали при пониженном давлении. Очистка флэш хроматографией (20% EtOAc-гексаны) позволила получить трифторацетамид 10. Выход (21.1 г, 62%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1H), 7.43 (s, 1H), 7.36 (dt, J = 7.2, 2.0 Гц, 1H), 7.19-7.25 (m, 2H), 3.16 (q, J = 6.8 Гц, 2H), 2.57 (t, J = 7.6 Гц, 2H), 1.77 (quint, J = 7.2 Гц, 2H).
Стадия 5: В дегазированный раствор N-(3-(3-бромфенил)пропил)-2,2,2-трифторацетамида (10) (0.930 г, 3 ммоль) и 3-этилпент-1-ин-3-ола (11) (0.670 г, 6 ммоль) в триэтиламине (4 мл) и DMF (12 мл) добавляли РdСl2(РРh3)2 (0.053 г, 0.075 ммоль), Р(о-Тоl)3 (0.046 г, 0.15 ммоль) и CuI (0.014 г, 0.075 ммоль). Полученную смесь дегазировали и перемешивали в атмосфере аргона при 90°С в течение 6 ч. Смесь охлаждали до комнатной температуры, затем концентрировали при пониженном давлении, после чего разбавляли ЕtOАс (100 мл) и водой (70 мл). После энергичного встряхивания слои раздели. Органический слой обрабатывали древесным углем, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении. Очистка флэш хроматографией (градиент от 7 до 60% EtOAc-гексаны) позволила получить N-(3-(3-(3-этил-3-гидроксипентил)фенил)пропил)-2,2,2-трифторацетамид (12) в виде желтого масла. Выход (0.663 г, 65%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (s, 1H), 7.17-7.28 (m, 4H), 3.16 (q, J = 7.2 Гц, 2H), 2.56 (t, J = 7.2 Гц, 2H), 1.76 (quint, J = 7.2 Гц, 2H), 1.53-1.67 (m, 4H), 0.97 (t, J = 7.2 Гц, 6Н).
Стадия 6: N-(3-(3-(3-этил-3-гидроксипентил)фенил)пропил)-2,2,2-трифторацетамид (12) (0.660 г, 1.93 ммоль) растворяли в МеОН (15 мл) и добавляли водный раствор К2СО3 (0.42 г/3 мл). Полученную смесь перемешивали при 45°С в течение 4 ч. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении, затем разделяли между ЕtOАс (50 мл) и водой (50 мл). Объединенные органические слои высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент от 80 до 100% (9:1 EtOAc: 7М NH3 в МеОН):гексаны) позволила получить 1-(3-(3-аминопропил)фенил)-3-этилпент-1-ин-3-ола (13) в виде светло-желтого масла. Выход (0.421 г, 89%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.15-7.26 (m, 4H), 5.11 (s, 1H), 2.56 (t, J = 7.6 Гц, 2H), 2.47 (t, J = 5.2 Гц, 2H), 1.55-1.65 (m, 6H), 1.39 (br s, 2H), 0.97 (t, J = 7.6 Гц, 6Н).
Стадия 7: Дегазированный раствор 1-(3-(3-аминопропил)фенил)-3-этилпент-1-ин-3-ола (13) (0.130 г, 0.53 ммоль) в ЕЮН перемешивали с каталитическим количеством 10% Pd/C в атмосфере водорода (атмосферное давление) в течение 16 ч. Фильтрация через 0.45 мкм пленочный фильтр и концентрирование при пониженном давлении позволило получить Пример 2 в виде прозрачного масла. Выход (0.120 г, 91%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.13 (t, J = 7.6 Гц, 1H), 6.93-6.99 (m, 3Н), 3.91 (br s, 1H), 2.45-2.56 (m, 6H), 1.50-1.62 (m, 4H), 1.40 (br s, 2H), 1.38 (q, J = 7.6 Гц, 4H), 0.79 (t, J = 7.6 Гц, 6H)
ПРИМЕР 3
Приготовление 4-(3-(3-аминопропил)фенетил)гептан-4-ола

4-(3-(3-аминопропил)фенетил)гептан-4-ол был приготовлен согласно способу, который использовали в Примере 2.
Стадия 1: В дегазированный раствор N-(3-(3-бромфенил)пропил)-2,2,2-трифторацетамида (10) (2.29 г, 7.4 ммоль) и 4-этинилгептан-4-ола (2.4 г, 18.5 ммоль) в триэтиламине (2 мл) и DMF (18 мл) добавляли PdCl2(PPh3)2 (0.130 г, 0.185 ммоль), Р(о-Тоl)3 (0.113 г, 0.37 ммоль) и CuI (0.070 г, 0.37 ммоль). Полученную смесь дегазировали и перемешивали в атмосфере аргона при 90°С в течение ночи. Смесь охлаждали до комнатной температуры и твердую фазу удаляли фильтрацией через целит. Фильтрат разделяли между диэтиловым эфиром и объединенные органические слои отмывали солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент от 6 до 50% EtOAc-гексаны) позволила получить N-(3-(3-(3-этил-3-гидроксипентил)фенил)пропил)-2,2,2-трифторацетамид (12) в виде янтарного масла. Выход (2.6 г, 95%):1H ЯМР (400 МГц, ДМСО-d6) δ 9.40 (s, 1H), 7.18-7.29 (m, 4H), 3.16 (q, J = 7.2 Гц, 2H), 2.56 (t, J = 7.2 Гц, 2H), 1.76 (quint, J = 7.2 Гц, 2H), 1.53-1.67 (m, 8H), 0.97 (t, J = 7.2 Гц, 6H)
Стадия 2: В раствор 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3-пропилгекс-1-инил)фенил)пропил)ацетамида (2.6 г, 7.0 ммоль) в МеОН (50 мл) добавляли концентрированный водный раствор NH4OH (примерно 25 мл) и раствор перемешивали при комнатной температуре в течение ночи. Еще добавляли концентрированный водный раствор NH4OH (5 мл) и смесь перемешивали в течение ночи. Летучие вещества удаляли концентрированием при пониженном давлении и остаток экстрагировали EtOAc. Органический раствор отмывали водой и солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент от 0 до 20% (20% 7М NН3 в МеОН-ЕtOАс)-ЕtOАс) позволила получить 4-((3-(3-аминопропил)фенил)этинил)гептан-4-ол в виде прозрачного масла. Выход (1.58 г, 83%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.14-7.26 (m, 4H), 5.12 (s, 1H), 2.56 (t, J = 7.2 Гц, 2Н), 2.47 (t obs, J = 7.2 Гц, 2Н), 1.42-1.63 (m, 12H), 0.90 (t, J = 7.2 Гц, 6Н).
Стадия 3: Гидрирование 4-(3-(3-аминопропил)стирил)гептан-4-ола согласно способу, который использовали в Примере 2, за исключением того, что реакцию проводили в течение 2 ч, позволило получить Пример 3 в виде прозрачного масла. Выход (0.2516 г, 50%):1Н ЯМР (400 МГц, СD3ОD) δ 7.15 (t, J = 7.2 Гц, 1H), 6.98-7.02 (m, 3H), 2.55-2.67 (m, 6Н), 1.77 (квинт, J = 7.6 Гц, 2Н), 1.67 (dt, J = 8.0, 4.4 Гц, 2Н), 1.43-1.49 (m, 4H), 1.31-1.42 (m, 4H), 0.93 (t, J = 7.2, 6Н).
ПРИМЕР 4
Приготовление 4-(3-(3-аминопропил)фенил)-2-метилбутан-2-ола

4-(3-(3-аминопропил)фенил)-2-метилбутан-2-ол был приготовлен согласно способу, который использовали в Примере 2.
Стадия 1: Взаимодействие 2-метилбут-3-ин-2-ола с бромидом 10 в THF при 70°С без использования три-о-толилфосфина позволило получить 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3-метилбут-1-инил)фенил)пропил)ацетамид. Выход (0.5 г, 81%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1H), 7.17-7.28 (m, 4H), 3.16 (q, J = 7.2 Гц, 2Н), 2.56 (t, J = 7.2 Гц, 2Н), 1.76 (квинт, J = 7.6 Гц, 2Н), 1.44 (s, 3H), 1.35 (s, 3H)
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3-метилбут-1-инил)фенил)пропил)ацетамида позволило получить 4-(3-(3-аминопропил)фенил)-2-метилбут-3-ин-2-ол. Продукт очищали флэш хроматографией (градиент от 80% до 100% (10% 7 N NH3-MeOH в ЕtOАс)-гексаны) для получения светло-желтого масла. Выход (0.212 г, 62%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.14-7.26 (m, 4Н), 5.41 (br s, 1H), 2.56 (t, J = 7.2 Гц, 2H), 2.47-2.50 (m, 2H), 1.55-1.63 (m, 2H), 1.44 (s, 6H), 1.36 (br s, 2H).
Стадия 3: Гидрирование 4-(3-(3-аминопропил)фенил)-2-метилбут-3-ин-2-ола согласно способу, который использовали в Примере 2, за исключением того, что реакцию проводили в течение 3.5 ч, позволило получить Пример 4. Выход (0.0488 г, 80%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.13 (t, J = 7.6 Гц, 1H), 6.96-6.99 (m, 3Н), 4.19 (br s, 1H), 2.45-2.57 (m, 6H), 1.55-1.62 (m, 4H), 1.48 (br s, 2H), 1.12 (s, 6Н).
ПРИМЕР 5
Приготовление 3-(3-(3-метоксипропил)фенил)пропан-1-амина

3-(3-(3-метоксипропил)фенил)пропан-1-амин был приготовлен согласно способу, который использовали в Примере 4.
Стадия 1: Взаимодействие 3-метоксипроп-1-ена с бромидом 10 позволило получить 2,2,2-трифтор-N-(3-(3-(3-метоксипроп-1-инил)фенил)-пропил)ацетамид в виде светло-желтого масла. Выход (0.193 г, 32%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1H), 7.21-7.31 (m, 4Н), 4.30 (s, 2Н), 3.31 (s, 3Н), 3.16 (q, J = 7.2 Гц, 2 Н), 2.56 (t, J = 7.6 Гц, 2Н), 1.77 (квинт, J = 7.2 Гц, 2Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(3-метоксипроп-1-инил)фенил)-пропил)ацетамида позволило получить 3-(3-(3-метоксипроп-1-инил)фенил)пропан-1-амин в виде прозрачного масла. Выход (0.069 г, 54%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.19-7.28 (m, 4Н), 4.29 (s, 2Н), 3.31 (s, 3Н), 2.57 (t, J = 7.6 Гц, 2Н), 2.48-2.51 (m, 2H), 1.56-1.63 (m, 2H),1.36(brs, 2H)
Стадия 3: Гидрирование 3-(3-(4-метоксибут-1-инил)фенил)пропан-1-амина согласно способу, который использовали для приготовления Примера 4, позволило получить Пример 5. Выход (0.018 г):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.15 (t, J = 7.6 Гц, 1H), 6.94-6.99 (m, 3Н), 3.28 (t, J = 6.4 Гц, 2H), 3.21 (s, 3Н), 2.45-2.57 (m, 6H), 1.71-1.78 (m, 2H), 1.59 (квинт, J = 7.2 Гц, 2H), 1.50 (br s, 2H)
ПРИМЕР 6
Приготовление 3-(3-(3-аминопропил)фенил)пропан-1-ола

3-(3-(3-аминопропил)фенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 4.
Стадия 1: Взаимодействие проп-2-ин-1-ола с бромидом 10 позволило получить 2,2,2-трифтор-N-(3-(3-(3-гидроксипроп-1-инил)фенил)пропил)ацетамид в виде светло-желтого масла. Выход (0.148 г, 26%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.41 (br s, 1H), 7.19-7.29 (m, 4H), 5.28 (t, J = 5.6 Гц, 1H), 4.27 (d, J = 6.4 Гц, 2Н), 3.16 (t, J = 7.2 Гц, 2Н), 2.56 (t, J = 7.6 Гц, 2Н), 1.76 (q, J = 7.6 Гц, 2Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(3-гидроксипроп-1-инил)фенил)пропил)ацетамида позволило получить 3-(3-(3-аминопропил)фенил)проп-2-ин-1-ол в виде прозрачного масла. Выход (0.073 г, 76%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.17-7.27 (m, 4H), 5.28 (br s, 1H), 4.27 (d, J = 3.6 Гц, 2Н), 2.59 (t, J = 7.6 Гц, 2Н), 2.47-2.49 (m, 2Н), 1.52-1.63 (m, 4H).
Стадия 3: Гидрирование 3-(3-(3-аминопропил)фенил)проп-2-ин-1-ола согласно способу, который использовали для приготовления Примера 4, позволило получить Пример 6 в виде прозрачного масла. Выход (0.018 г):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.14 (t, J = 7.6 Гц, 1H), 6.94-6.99 (m, 3H), 4.41 (br s, 1H), 3.38 (t, J = 6.4 Гц, 2Н), 2.45-2.56 (m, 6H), 1.55-1.70 (m, 6H)
ПРИМЕР 7
Приготовление 1-(3-(3-аминопропил)фенетил)циклогексанола

1-(3-(3-аминопропил)фенетил)циклогексанол был приготовлен согласно способу, который использовали в Примере 4, за исключением того, что гидрирование проводили до снятия защиты амина.
Стадия 1: В раствор бромида 10 (2.0 г, 6.45 ммоль) и 1-этинилциклогексанола (1.2 г, 9.67 ммоль) в триэтиламине (40 мл) добавляли CuI (0.0246 г, 0.129 ммоль). Смесь дегазировали аргоном в течение 2-3 мин, затем добавляли PdCl2(PPh3)2 (0.0905 г, 0.129 ммоль). Реакционную смесь дегазировали снова аргоном и затем перемешивали при 70°С в течение ночи в атмосфере аргона. После охлаждения до комнатной температуры, смесь концентрировали при пониженном давлении и суспендировали в смеси ЕtOАс-гексаны (50%, 50 мл). Твердую фазу удаляли фильтрацией и фильтрат концентрировали при пониженном давлении. Очистка флэш хроматографией позволила получить 2,2,2-трифтор-N-(3-(3-((1-гидроксициклогексил)этинил) фенил)пропил)ацетамид в виде прозрачного масла. Выход (1.74 г, 76%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1H), 7.26 (t, J = 7.6 Гц, 1H), 7.17-7.24 (m, 3Н), 5.37 (s, 1H), 3.16 (q, J = 6.8 Гц, 2Н), 2.56 (t, J = 7.2 Гц, 2Н),1.15-1.83 (m, 12H).
Стадия 2: Раствор 2,2,2-трифтор-N-(3-(3-((1-гидроксициклогексил) этинил)фенил)пропил)ацетамида (0.51 г, 1.44 ммоль) в МеОН (15 мл) дегазировали аргоном в течение 2 мин. В этот раствор добавляли 10% Pd/C (0.075 г) и смесь помещали в атмосферу H2 при 40 PSI в смеситель Парра на ночь. Твердую фазу удаляли фильтрацией и фильтрат концентрировали при пониженном давлении для получения сырого продукта в виде прозрачного масла. Это соединение использовании на следующей синтетической стадии без очистки. Выход (0.509 г, 99%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1H), 7.14 (t, J = 7.6 Гц, 1H), 6.95-7.00 (m, 3Н), 3.96 (s, 1H), 3.18 (q, J = 6.8 Гц, 2Н), 2.51-2.57 (m, 4H), 1.72-1.79 (m, 2Н), 1.15-1.59 (m, 12H).
Стадия 3: Снимали защиту 2,2,2-трифтор-N-(3-(3-((1-гидроксициклогексил)этинил)фенил) пропил)ацетамида согласно способу, который использовали в Примере 2, за исключением использования 5 эквивалентов К2СО3 и нагревания реакционной смеси при 55°С в течение 3 ч. Очистка флэш хроматографией (10% 7М NH3 в МеОН-СН2Сl2) позволила получить Пример 7 в виде белого твердого вещества. Выход (0.840 г, 96%);1H ЯМР (400 МГц, ДМСО-d6) δ 7.13 (t, J = 7.2 Гц, 1H), 6.93-6.99 (m, 3Н), 3.96 (br s, 1H), 2.49-2.57 (m, 4H), 1.16-1.63 (m, 18H).
ПРИМЕР 8
Приготовление 1-(3-(3-аминопропил)фенил)гексан-3-ола

1-(3-(3-аминопропил)фенил)гексан-3-ол был приготовлен согласно способу, который использовали в Примере 4.
Стадия 1: Взаимодействие гекс-1-ин-3-ола с бромидом 10 позволило получить 2,2,2-трифтор-N-(3-(3-(3-гидрокигекс-1-инил)фенил)пропил)ацетамид в виде коричневого масла. Выход (0.271 г, 41%).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(3-гидрокигекс-1-инил)фенил)пропил)ацетамида позволило получить 1-(3-(3-аминопропил)фенил)гекс-1-ин-3-ол. Выход (0.086 г, 45%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.16-7.26 (m, 4H), 5.36 (t, J = 5.2 Гц, 1Н), 4.41 (dt, J = 6.4, 5.2 Гц, 1Н), 2.56 (t, J = 7.2 Гц, 2H), 2.47-2.49 (m, 2H), 1.38-1.64 (m, 8H), 0.90 (t, J = 7.2 Гц, 3Н).
Стадия 3: Гидрирование 1-(3-(3-аминопропил)фенил)гекс-1-ин-3-ола согласно способу, который использовали для приготовления Примера 4, позволило получить Пример 8. Выход (0.0296 г):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.13 (t, J = 7.6 Гц, 1Н), 6.92-6.99 (m, 3Н), 4.33 (d, J=5.2 Гц, 1Н), 3.89 (m, 1Н), 2.45-2.67 (m, 6H), 1.23-1.62 (m, 10Н), 0.83(t, J = 7.2 Гц, 3Н).
ПРИМЕР 9
Приготовление 4-(3-(2-аминоэтокси)фенетил)гептан-4-ола

4-(3-(2-аминоэтокси)фенетил)гептан-4-ол был приготовлен согласно способу, показанному на схеме 3:
Схема 3

Стадия 1: В раствор 3-бромфенола (14) (36.38 г, 210.3 моль) в ацетоне (175 мл) добавляли К2СО3 (0.033 г, 237 ммоль) и 2-бромэтанол (20 мл, 283.3 моль). Реакционную смесь нагревали с обратным холодильником в атмосфере аргона в течение 4 дней. После охлаждения до комнатной температуры, смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток растворяли в диэтиловом эфире (150 мл) и раствор отмывали последовательно водой, 10% водным раствором NaOH, 5% водным раствором NaOH, водой и солевым раствором. Раствор высушивали над MgSO4 и концентрировали при пониженном давлении для получения 2-(3-бромфенокси)этанола (15) в виде светло-коричневого масла. Выход (21.07 г, 46%):1Н ЯМР (400 МГц, CDCl3) δ 7.14 (t, J = 7.8 Гц, 1Н), 7.07-7.12 (m, 2H), 6.85 (ddd, J = 7.8, 2.4, 1.3 Гц, 1Н), 4.06 (m, 2H), 3.95 (m, 2H). 2.11 (t, J = 12.3 Гц. 1Н).
Стадия 2: В ледяную смесь 2-(3-бромфенокси)этанола (15) (16.06 г, 74.0 ммоль) и триэтиламина (9.12 г, 90.13 мл) в безводном CH2Cl2 (120 мл) в атмосфере аргона медленно добавляли чистый метансульфонилхлорид (6 мл, 77.2 ммоль). Реакционную смесь перемешивали при 0°С в течение 15 мин. Смесь концентрировали при пониженном давлении и остаток разделяли между EtOAc и водой. Объединенные органические слои отмывали водой и солевым раствором, высушивали над MgSO4 и концентрировали при пониженном давлении для получения 2-(3-бромфенокси)этил метансульфоната (16) в виде коричневатого масла. Продукт использовали без дальнейшей очистки в следующей реакции. Выход (21.32 г, 98%):1H ЯМР (400 МГц, CDCl3) δ 7.16 (t, J = 7.8 Гц, 1Н), 7.11-7.14 (m, 1Н), 7.07 (m, 1Н), 6.39 (ddd, J = 7.6, 2.5, 1.8 Гц, 1Н), 4.56 (m, 2H), 4.22 (m, 2H), 3.08 (s, 3H).
Стадия 3: В раствор мезилата 16 (24.05 г, 81.5 ммоль) в безводном DMF (160 мл) добавляли фталимид калия (15.53 г, 83.8 ммоль) и реакционную смесь перемешивали при 60°С в течение 14 ч. Смесь концентрировали при пониженном давлении и остаток разделяли между смесью гексан-ЕtOАс (7:1) и водой. Образованный осадок собирали фильтрацией, отмывали последовательно водой и гексаном, затем высушивали в вакууме для получения N-(2-(3-бpoмфeнoкcи)этил)фтaлимидa (17) в виде белых легких мелкокристаллических кристаллов (22.05 г). Для сбора второй партии кристаллов, органический слой фильтрата концентрировали при пониженном давлении. Остаток суспендировали в смеси 10% ЕtOАс-гексаны. Раствор отмывали водой и осадок собирали фильтрацией, последовательно отмывали водой, затем гексаном и высушивали в вакууме для получения фталимида 17 (5.65 г). Объединенный выход (21.18 г, 98%).1Н ЯМР (400 МГц, CDCl3) δ 7.86 (m, 2H), 7.73 (m, 2H), 7.03-7.12 (m, 3H), 6.80 (ddd, J = 8.0, 2.5, 1.4 Гц, 1Н), 4.21 (t, J = 6.9 Гц, 2H), 4.10 (t, J = 6.0 Гц, 2H).
Стадия 4: В суспензию фталимида 17 (22.82 г, 65.9 ммоль) в чистом EtOH (200 мл) добавляли гидразин гидрат (6 мл, 123.7 ммоль) и реакционную смесь нагревали с обратным холодильником в атмосфере аргона в течение 1.5 ч. После охлаждения до комнатной температуры смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток заново суспендировали в гексане (100 мл) и твердую фазу удаляли фильтрацией. Фильтрат концентрировали при пониженном давлении. Остаток затем помещали в EtOH и концентрировали при пониженном давлении. Эту процедуру повторяли с толуолом для получения амина 18 в виде густого желтого масла. Выход (10.63 г, 75%):1Н ЯМР (400 МГц, CDCl3) δ 7.06-7.15 (m, 3H), 6.84 (ddd, J = 8.0, 2.5, 1.2 Гц, 1Н), 3.96 (t, J = 5.3 Гц, 2H), 3.07 (t, J = 5.09 Гц, 2H), 1.43 (s, 2H).
Стадия 5: В раствор амина 18 (10.63 г, 49.2 ммоль) в безводном THF (80 мл) добавляли этилтрифторацетат (12 мл, 100.6 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Раствор концентрировали при пониженном давлении и остаток растворяли в смеси 50% EtOAc-гексаны. Раствор фильтровали через слой силикагеля и элюировали смесью 50% ЕtOАс-гексаны. Концентрирование при пониженном давлении позволило получить бромид 19 в виде бледно-желтого масла, которое кристаллизовалось при хранении до бледно-желтого твердого вещества. Выход (13.69 г, 89%):1H ЯМР (400 МГц, СDСl3) δ 7.16 (t, J = 8.0 Гц, 1Н), 7.12-7.14 (m, 1H), 7.05-7.07 (m, 1H), 6.83 (ddd, J = 7.6, 2.5, 1.8 Гц, 1H), 6.75 (br s, 1H), 4.09 (t, J = 4.9 Гц, 2Н), 3.78(dt, J = 5.5 Гц, 2H).
Стадия 6: Бромид 19 взаимодействовал с алкинолом 20 согласно процедуре, описанной в Примере 2, за исключением того, что реакцию проводили в течение 20 ч, для получения алкина 21 в виде желтого масла. Выход (0.89 г, 73%):1H ЯМР (400 МГц, CDCl3) δ 7.22 (t, J = 8.0 Гц, 1H), 7.06 (dt, J = 7.6, 1.0 Гц, 1H), 6.93 (dd, J = 2.5, 1.4 Гц, 1H), 6.85 (ddd, J = 8.4, 2.7, 1.0 Гц, 1H), 6.77 (br s, 1H), 4.09 (t, J = 5.1 Гц, 2Н), 3.78 (dt, J = 5.5 Гц, 2Н), 2.00 (s, 1H), 1.67-1.73 (m, 4H), 1.57-1.61 (m, 4H), 0.98 (t, J = 7.4 Гц, 6Н).
Стадия 7: Снимали защиту алкина 21 согласно процедуре, описанной в Примере 2, за исключением того, что реакцию проводили с 5 эквивалентами К2СО3 при комнатной температуре в течение 7 ч с последующей очисткой флэш хроматографией (элюент 90% EtOAc: (7M NH3 в МеОН) для получения амина 22 трифторацетата в виде кремового твердого вещества. Выход (5 г, 76%).1Н ЯМР (400 МГц, ДМСО-d6) δ 7.23 (t, J = 7.8 Гц, 1H), 6.92-6.93 (m, 1H), 6.90-6.91 (m, 1H), 6.85-6.86 (m, 1H), 5.13 (br s, 1H), 3.89 (t, J = 5.9 Гц, 2Н), 2.83 (t, J = 5.7 Гц, 2Н), 1.42-1.60 (m, 10Н), 0.89 (t, J = 7.2 Гц, 6Н);13С ЯМР (100 МГц, ДМСО-d6) δ 159.28, 130.47, 124.49, 124.26, 117,34, 115.80, 94.78, 83,15, 71.03, 70.26, 44.86, 41.60, 17.96, 15.01. ESI MS m/z 276.39 [М+Н]4, 258.38 [М+Н-H2О]+.
Стадия 8: Гидрирование амина 22 проводили согласно способу, который использовали для приготовления Примера 2. Раствор сырого продукта в смеси 10% MeOH-CH2Cl2 (5 мл) фильтровали через Celite/кварц/песок. Твердую фазу в воронке ополаскивали дополнительным количеством 10% МеОН-СН2Сl2, затем фильтрат концентрировали при пониженном давлении для получения Примера 9 в виде бесцветного масла. Выход (0.201 г, 80%):1Н ЯМР (400 МГц, CDCl3) 5 7.18 (t, J = 8.0 Гц, 1H), 6.72-6.80 (m, 3H), 3.98 (t, J = 5.2 Гц, 2Н), 3.07 (t, J = 5.2 Гц, 2Н), 2.58-2.62 (m, 2Н), 1.70-1.75 (m, 2Н), 1.45-1.50 (m, 7H), 1.32-1.37 (m, 4H), 0.94 (t,J = 6.8 Гц, 6Н).
ПРИМЕР 10
Приготовление 1-(3-(2-аминоэтокси)фенетил)циклогептанола

1-(3-(2-аминоэтокси)фенетил)циклогептанол был приготовлен согласно способу, который использовали в Примере 9:
Стадия 1: Бромид 19 взаимодействовал с 1-этинилциклогептанолом согласно процедуре, описанной в Примере 2, за исключением того, что использовали 1.5 эквивалентов алкина и триэтиламина, и реакционную смесь нагревали в течение 2 ч. После охлаждения реакционной смеси до комнатной температуры смесь разделяли между EtOAc и водой, после чего объединенные органические слои фильтровали через Celite. Фильтрат высушивали над Na2SO4 и обрабатывали активированным углем. После фильтрации раствор концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент от 10 до 50% EtOAc-гексаны) позволила получить 2,2,2-трифтор-N-(2-(3-((1-гидроксициклогептил)этинил)фенокси)этил)ацетамид в виде оранжевого масла. Выход (1.078 г, 60%):1Н ЯМР (400 МГц, СDСl3) δ 7.2 (br s, 1H), 7.18 (t, J = 8.0 Гц, 1H), 7.02 (dt, J = 7.2, 0.8 Гц, 1H), 6.90 (dd, J = 2.4, 1.6 Гц, 1H), 6.81 (ddd, J = 8.4, 2.4, 0.8 Гц, 1H), 4.05 (t, J = 5.2 Гц, 2Н), 3.72 (q, J = 5.3 Гц, 2Н), 2.43 (br s, 1H), 2.05-2.11 (m, 2H), 1.84-1.91 (m, 2Н), 1.53-1.70 (m, 8H).
Стадия 2: В раствор 2,2,2-трифтор-N-(2-(3-((1-гидроксициклогептил)этинил) фенокси)этил)ацетамида (1.07 г, 2.9 ммоль) в МеОН (20 мл) добавляли насыщенный водный раствор К2СО3 (примерно 10 мл). Реакционную смесь энергично перемешивали и нагревали при 50°С в течение 2 ч. После удаления летучих веществ с помощью концентрирования при пониженном давлении, смесь разделяли в EtOAc и воде. Органический слой высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (10% 7М NH3 в МеОН-ЕtOАс) позволила получить 1-((3-(2-аминоэтокси)фенил)этинил)циклогептанол в виде бледно-желтого твердого вещества. (Выход 0.70 г, 88%):1Н ЯМР (400 МГц, CDCl3) δ 7.19 (t, J = 8.0 Гц, 1H), 7.01 (dt, J = 8.0, 0.8 Гц, 1Н), 6.95 (dd, J = 2.8, 1.6 Гц, 1Н), 6.85 (ddd, J = 8.4, 2.4, 1.2 Гц, 1H), 3.97 (t, J = 4.8 Гц, 2Н), 3.07 (br s, 2Н), 2.08-2.13 (m, 2Н), 1.87-1.94 (m, 2Н), 1.59-1.74 (m, HH).
Стадия 3: Гидрирование 1-((3-(2-аминоэтокси)фенил)этинил)циклогептанола согласно способу, который использовали для приготовления примера 2, позволила получить Пример 10 в виде бесцветного масла. Выход (0.186 г, 52%):1Н ЯМР (400 МГц, CDCl3) δ 7.16 (t, J = 8.0 Гц, 1Н), 6.75-6.79 (m, 2H), 6.70 (dd, J = 8.0, 2.0 Гц, 1Н), 3.96 (t, J = 5.2 Гц. 2H), 3.04 (t, J = 4.8 Гц, 2H), 2.63-2.67 (m, 2H), 2.10 (br s, 2H), 1.72-1.76 (m, 2H), 1.67-1.69 (m, 4H), 1.36-1.65 (m, 8H).
ПРИМЕР 11
Приготовление 4-(3-(2-аминоэтокси)фенетил)тетрагидро-2H-тиопиран-4-ола

4-(3-(2-аминоэтокси)фенетил)тетрагидро-2H-тиопиран-4-ол был приготовлен согласно способу, который использовали в Примерах 2 и 9.
Стадия 1: Взаимодействие 4-этинилтетрагидро-2H-тиопиран-4-ола с бромидом 19 проводили согласно способу, который использовали в Примере 2, за исключением того, что реакция протекала в THF при 60°С в течение ночи. Очистка флэш хроматографией (1:2 ЕtOАс:гептан) позволила получить 2,2,2-трифтор-N-(3-(3-((4-гидрокситетрагидро-2H-тиопиран-4-ил)этинил)фенил)пропил)ацетамид в виде бледно-желтого масла. Выход (0.822 г, 72%):1Н ЯМР (400 МГц, CDCl3) δ 7.26 (t, J = 4.5 Гц, 1Н), 7.07 (dt, J = 7.6, 1.2 Гц, 1Н), 6.95 (dd, J = 2.5, 1.4 Гц, 1Н), 6.87 (ddd, J = 8.2, 2.5, 0.8 Гц, 1Н), 4.10 (m, 2H), 3.79 (q, J = 5.5 Гц, 2H), 2.73-2.92 (m, 4H), 2.26-2.31 (m, 2H), 2.01-2.04 (m, 2H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-((4-гидрокситетрагидро-2H-тиопиран-4-ил)этинил)фенил)пропил)ацетамида проводили согласно способу, который использовали для приготовления Примера 9, за исключением того, что использовали 2 эквивалента К2СО3 и реакционную смесь нагревали при 50°С в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь разделяли между EtOAc и водой. Объединенные органические слои отмывали водой и солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (CH2Cl2/EtOH/NH4OH 85:14:1) позволила получить 4-((3-(2-аминоэтокси)фенил)этинил)тетрагидро-2H-тиопиран-4-ол в виде белого аморфного твердого вещества. Выход (0.41 г, б8%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.23-7.28 (m, 1H), 6.93-6.98 (m, 3Н), 5.69 (br s, 1Н), 3.90 (t, J = 5.8 Гц, 2H), 2.83 (t, J = 5.8 Гц, 2H), 2.69 (t, J = 5.6 Гц, 4H), 2.09 (dt, J = 13.0,4.6 Гц, 2H), 1.80 (квинт, J = 6.6 Гц, 2H), 1.60 (br s, 2H).
Стадия 3: Гидрирование 4-((3-(2-аминоэтокси)фенил)этинил)тетрагидро-2Я-тиопиран-4-ола проводили согласно способу, который использовали для приготовления Примера 2, за исключением того, что в качестве растворителя использовали смесь ЕtOАс-МеОН (90%). Пример 11 выделяли в виде бесцветного масла. Выход (0.179 г, 98%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.13 (t, J = 8 Гц, 1Н), 6.34-6.88 (m, 3Н), 4.26 (br s, 1H), 3.86 (t, J = 6.0 Гц, 2H), 2.57-2.88 (m, 4H), 2.53-2.56 (m, 2H), 2.32-2.37 (m, 2H), 1.73-1.78 (m, 2H), 1.42-1.62(m, 6H).
ПРИМЕР 12
Приготовление 1-(3-(2-аминоэтокси)фенетил)циклогексанола

1-(3-(2-аминоэтокси)фенетил)циклогексанол был приготовлен согласно способу, показанному на Схеме 4:
Схема 4

Стадия 1: В ледяной раствор 3-бромфенола (14) (2.0 г, 11.56 ммоль), N-(2-гидроксиэтил)фталимида (2.21 г, 11.6 ммоль) и трифенилфосфина (3.03 г, 11.6 ммоль) в безводном THF (25 мл) медленно добавляли диэтилазодикарбоксилат (2.57 г, 12.7 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. После концентрирования при пониженном давлении добавляли смесь 50% ЕtOAс-гексаны (100 мл) и нагревали до 60°С. После охлаждения до комнатной температуры твердую фазу удаляли фильтрацией и фильтрат концентрировали при пониженном давлении. Очистка флэш хроматографией (10% EtOAc-гексаны) позволила получить бромид 17 в виде белого твердого вещества. Выход (1.92 г, 48%): %):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.82-7.88 (m, 4Н), 7.19 (t, J = 8.4 Гц, 1H), 7.06-7.09 (m, 2H), 6.87-6.90 (m, 1H), 4.22 (t, J = 5.6 Гц, 2Н), 3.93 (t, J = 5.6 Гц, 2Н).
Стадия 2: Взаимодействие бромида 17 с 1-этинилциклогексанолом согласно способу, который использовали в Примере 7 с последующей очисткой флэш хроматографией (20% EtOAc-гексаны) позволила получить соединение 24 в виде бледно-желтого масла. Выход (1.22 г, 57%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.82-7.88 (m, 4Н), 7.21 (t, J = 8.0 Гц, 1H), 6.92 (dt, J = 8.0, 0.8 Гц, 1H), 6.84-6.88 (m, 2Н), 5.38 (br s, 1H), 4.20 (t, J = 5.6 Гц, 2Н), 3.95 (t, J = 5.6 Гц, 2Н), 1.78-1.82 (m, 2Н), 1.59-1.62 (m, 2Н), 1.41-1.53 (m, 4Н), 1.22-1.94 (m, 1H).
Стадия 3: Гидрирование соединения 24 согласно способу, который использовали в Примере 7, позволило получить спирт 25. Выход (0.512 г, колич.):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.81-7.88 (m, 4Н), 7.10 (t, J = 7.6 Гц, 1H), 6.64-6.71 (m, 3H), 4.16 (t, J = 5.6 Гц, 2Н), 3.93 (t, J = 6.8 Гц, 2Н), 3.30 (s, 1H), 2.47-2.53 (m, 4Н), 1.15-1.56 (m, 10Н).
Стадия 4: Снятие защиты спирта 25 выполняли согласно способу, который использовали в Примере 9, за исключением того, что использовали 5 эквивалентов гидразин гидрата и реакцию нагревали при 70°С в течение 4 ч. После охлаждения до комнатной температуры, твердую фазу удаляли фильтрацией и фильтрат концентрировали при пониженном давлении. Очистка флэш хроматографией (10% 7М NH3 in МеОН-СН2Сl2) позволила получить Пример 12. Выход (0.341 г, 68%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.13 (t, J = 8.0 Гц, 1H), 6.73-6.75 (m, 3H), 3.96 (br s, 1H), 3.86 (t, J = 5.6 Гц, 2Н), 2.83 (t, J = 6.0 Гц, 2Н), 2.52-2.56 (m, 2Н), 1.16-1.60 (m, 12H)
ПРИМЕР 13
Приготовление 6-(3-(2-аминоэтокси)фенил)гексан-1-ола

6-(3-(2-аминоэтокси)фенил)гексан-1-ол был приготовлен согласно способу, показанному на Схеме 5:
Схема 5
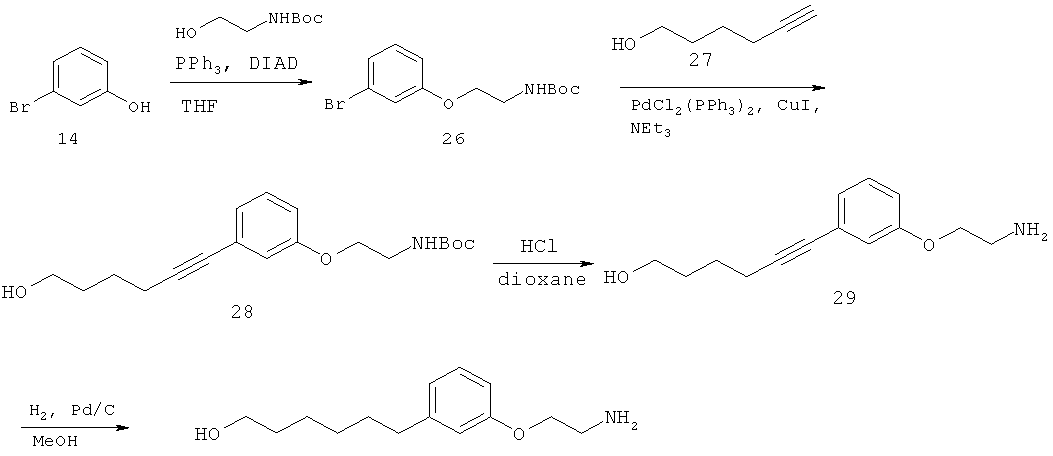
Стадия 1: В раствор 3-бромфенола (14) (5.0 г, 28.9 ммоль) в THF (100 мл) добавляли трет-бутил-2-гидроксиэтилкарбамат (9.3 г, 161 ммоль) и PPh3 (30 г, 115 ммоль). Раствор диизопропилазодикарбоксилата (22.6 мл, 115.6 ммоль) в THF (40 мл) прикалывали при комнатной температуре. Реакционную смесь перемешивали в течение ночи при 50°С. После охлаждения до комнатной температуры смесь концентрировали при пониженном давлении. Остаток растворяли в EtOAc, отмывали солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (6% ЕtOАс-гексаны) обеспечила бромид 26 в виде бесцветного масла. Выход (8.34 г, 91%):1H ЯМР (400 МГц, CDCl3) δ 7.14 (t, J = 8.0 Гц, 1Н), 7.05-7.11 (m, 2H), 6.81-6.84 (m, 1Н), 4.96 (br s, 1Н), 4.00 (t, J = 5.2 Гц, 2H), 3.52 (q, J = 4.8 Гц, 2H), 1.45 (s, 9H).
Стадия 2: В дегазированный раствор (поток пузырьков N2) бромида 26 (0.600 г, 1.89 ммоль) и спирта 27 (0.241 мл, 2.27 ммоль) в Et3N (20 мл) добавляли РdCl2(PPh3)2 (0.040 г, 0.056 ммоль) и CuI (0.011 г, 0.056 ммоль). Смесь нагревали в течение ночи при 70°С. После охлаждения до комнатной температуры смесь концентрировали при пониженном давлении, растворяли в EtOAc и фильтровали. Фильтрат отмывали водой и солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (20% ЕtOАс-гексаны) обеспечила алкин 28 в виде коричневого масла. Выход (0.500 г, 79%):1Н ЯМР (400 МГц, CDCl3) δ 7.17 (t, J = 7.6 Гц, 1Н), 6.99 (d, J = 7.6 Гц, 1Н), 6.91 (s, 1Н), 6.81 (d, J = 8.4 Гц, 1Н), 4.72 (br s, 1Н), 4.00 (t, J = 4.8 Гц, 2Н), 3.72 (m, 2Н), 3.48-3.55 (m, 2Н), 2.46 (d, J = 6.8 Гц, 2Н), 1.66-1.79 (m, 4H), 1.58(s, 1H), 1.45 (s, 9H).
Стадия 3: Алкин 28 (500 мг, 1.52 ммоль) растворяли в смеси HCl-диоксан (12 мл насыщенного раствора) и перемешивали в течение ночи при комнатной температуре. Смесь концентрировали при пониженном давлении, затем очищали препаративной ВЭЖХ с использованием Способа 2Р для получения амина 29 гидрохлорида в виде коричневого твердого вещества. Выход (0.161 г, 40%):1Н ЯМР (400 МГц, ДМСО-d6) δ 8.15 (br s, 3Н), 7.22-7.27 (m, 1H), 6.92-6.97 (m, 3H), 4.14 (t, J = 5.0 Гц, 2Н), 3.40 (t, J = 5.8 Гц, 2Н), 3.14-3.15 (m, 2Н), 2.39 (t, J = 6.6 Гц, 2Н), 1.51-1.53 (m, 4H).
Стадия 4: В перемешанный раствор амина 26 гидрохлорида (0.100 г, 0.42 ммоль) в МеОН добавляли 5% Pd/C (30% масс/масс, 0.023 г) в атмосфере азота. Через смесь пропускали поток пузырьков водорода, после чего перемешивали при 50°С в течение 2 ч в атмосфере водорода. После охлаждения до комнатной температуры твердую фазу удаляли фильтрацией через Celite. Фильтрационный кек ополаскивали дополнительным количеством МеОН и фильтрат концентрировали при пониженном давлении. Пример 13 гидрохлорид изолировали в виде кремового твердого вещества. Выход (0.048 г, 47%):1Н ЯМР (400 МГц, CD3OD) δ 7.18 (t, J = 8.0 Гц, 1H), 6.78-6.83 (m, 3Н), 4.19 (t, J = 5.2 Гц, 2Н), 3.52 (t, J = 6.6 Гц, 2Н), 3.34 (t, J = 5.2 Гц, 2Н), 2.59 (t, J = 7.6 Гц, 2Н), 1.58-1.63 (m, 2Н), 1.43-1.52 (m, 2Н), 1.24-1.42 (m, 4H).
ПРИМЕР 14
Приготовление 2-(3-(3-циклопентилпропил)фенокси)этанамина

2-(3-(3-циклопентилпропил)фенокси)этанамин был приготовлен согласно способу, который использовали в Примере 13.
Стадия 1: Взаимодействие проп-2-инилциклопентана с бромидом 26 и очистка флэш хроматографией (15% EtOAc-гексаны) позволила получить трет-бутил. 2-(3-(3-циклопентилпроп-1-инил)фенокси)этилкарбамат в виде белого твердого вещества. Выход (0.500 г, 77%):1Н ЯМР (400 МГц, CDCl3) δ 6.91-7.21 (m, 3Н), 6.80-6.84 (m, 1H), 4.97 (br s, 1H), 4.00 (t, J = 4.8 Гц, 2Н), 3.52 (q, J = 4.4 Гц, 2Н), 2.40 (d, J = 6.8 Гц, 2Н), 2.07-2.17 (m, 1H), 1.80-1.87 (m, 2Н), 1.48-1.70 (m, 4H), 1.45 (s, 9H), 1.29-1.40 (m, 2Н).
Стадия 2: Снятие защиты трет-бутил 2-(3-(3-циклопентилпроп-1-инил)фенокси)этилкарбамата с использованием НCl в диоксане позволило получить 2-(3-(3-циклопентилпроп-1-инил)фенокси)этанамин в виде белого твердого вещества. Выход (0.160 г, 45%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.20-7.24 (m, 1H), 6.89-6.94 (m, 3H), 4.00 (t, J = 5.0 Гц, 2H), 3.00 (br s, 2H), 3.81 (d, J = 6.8 Гц, 2Н), 2.04 (квинт, J = 7.2, 1H), 1.71-1.78 (m, 2H), 1.44-1.62 (m, 4H), 1.20-1.31 (m, 2H).
Стадия 3: Гидрирование 2-(3-(3-циклопентилпроп-1-инил)фенокси)этанамина согласно способу, который использовали для приготовления Примера 13, позволило получить Пример 14 трифторацетат в виде белого твердого вещества. Выход (0.063 г, 68%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.89 (br s, 3H), 7.18 (t, J = 8.0 Гц, 1H), 6.74-6.79 (m, 3H), 4.09 (t, J = 5.2 Гц, 2H), 3.18 (m, 2H), 2.42-2.53 (m, 2H), 1.62-1.73 (m, 3H), 1.38-1.58 (m, 6H), 1.22-1.28 (m, 2H), 0.92-1.04 (m, 2H).
ПРИМЕР 15
Приготовление 1-(3-(3-амино-1-гидроксипропил)фенетил)циклогексанола

1-(3-(3-амино-1-гидроксипропил)фенетил)циклогексанол был приготовлен согласно способу, показанному на Схеме 6:
Схема 6

Стадия 1: 3-бромбензальдегид взаимодействовал с алкинолом 23 согласно способу, который использовали в Примере 7, за исключением того, что реакционную смесь нагревали в течение 2 ч. После охлаждения реакционной смеси до комнатной температуры ее концентрировали при пониженном давлении и разделяли между EtOAc и водой. Органические слои высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (30% EtOAc-гексаны) позволила получить алкин 31. Выход (3.52 г, 53%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.99 (s, 1H), 7.84-7.90 (m, 2H), 7.68-7.71 (m, 1H), 7.58 (t, J = 7.6 Гц, 1H), 5.50 (s, 1H), 1.19-1.87 (m, 10Н).
Стадия 2: Алкинол 31 гидрировали согласно способу, который использовали в Примере 2, за исключением того, что в качестве растворителя использовали EtOAc и реакцию проводили в течение 3 ч. Очистка флэш хроматографией (20% ЕtOАс-гексаны) позволила получить альдегид 32 в виде бесцветного масла. Выход (2.82 г, 79%):1H ЯМР (400 МГц, ДМСО-d6) δ 9.97 (s, 1H), 7.68-7.71 (m, 2H), 7.52-7.54 (m, 1H), 7.48 (t, J = 7.6 Гц, 1H), 4.03 (s, 1H), 2.68-2.72 (m, 2H), 1.19-1.63 (m, 12H).
Стадия 3: В раствор LDA при -78°С (13.3 мл 2М раствора в смеси гептан/THF/этилбензол, 26.51 ммоль) в безводном THF (50 мл) медленно добавляли ацетонитрил (1.33 мл, 25.31 ммоль) и смесь перемешивали в течение 15 мин. Добавляли раствор альдегида 32 (2.8 г, 12.05 ммоль) в THF (30 мл) через шприц. После медленного нагревания до комнатной температуры реакционную смесь осаждали насыщенным водным раствором NH4Cl (30 мл). Смесь разделяли между EtOAc и водой, органические слои высушивали над Na2SO4 и раствор концентрировали при пониженном давлении. Очистка флэш хроматографией (40% ЕtOАс-гексаны) позволила получить цианогидрин 33 в виде бледно-желтого масла. Выход (2.21 г, 67%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.07-7.24 (m, 4Н), 5.86 (d, J = 4.0 Гц, 1H), 4.83 (q, J = 6.0 Гц, 1H), 3.99 (br s, 1H), 2.74-2.88 (m, 2H), 2.57-2.62 (m, 2H), 1.14-1.61 (m, 12H).
Стадия 4: В ледяной раствор цианогидрина 33 (2.2 г, 8.05 ммоль) в безводном THF (50 мл) медленно через шприц вводили LiAlH4 (10.0 мл 2М раствора в THF, 20 ммоль). При введении происходило выделение осадка и добавляли дополнительное количество THF (100 мл). Реакционная смесь медленно нагревалась до комнатной температуры в течение 2 ч, после чего медленно добавляли твердый Na2SO4·10H2O до тех пор, пока не прекращалось выделение газа. Твердую фазу удаляли фильтрацией, после чего фильтрат высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (10% 7М NH3 в MeOH-CH2Cl2) позволила получить Пример 15 в виде масла, которое затвердевало при стоянии. Выход (1.15 г, 52%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.16 (d, J = 7.6 Гц, 1H), 6.99-7.12 (m, 3H), 4.59-4.62 (m, 1H), 3.98 (br s, 1H), 2.49-2.67 (m, 4H), 1.16-1.63 (m, 17H).
ПРИМЕР 16
Приготовление 1-(3-(3-амино-1-гидроксипропил)фенетил)циклогептанола

1-(3-(3-амино-1-гидроксипропил)фенетил)циклогептанол был приготовлен согласно способу, показанному на Схеме 7.
Схема 7

Стадия 1: В раствор при -50°С t-бутоксида калия (703 мл 1.0 М раствора в THF, 703 ммоль) добавляли ацетонитрил (27.73 г, 675.6 ммоль) через шприц в течение 5 мин. Смесь перемешивали при -50°С в течение 30 мин, затем добавляли раствор 3-бромбензальдегида (22) (100 г, 540.5 ммоль) в THF (50 мл) в течение 5 мин. Смесь перемешивали в течение 30 мин, затем оставляли нагреваться до to 0°С.Реакционную смесь затем осаждали насыщенным водным NH4Cl (250 мл) и слои разделяли. Органические слои отмывали солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении для получения 3-(3-бромфенил)-3-гидроксипропаннитрила (34) в виде бледно-желтого масла. Этот материал использовали на следующей стадии синтеза без дальнейшей очистки. Выход (117.6 г, 95%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.60 (t, J = 1.6 Гц, 1Н), 7.46 (ddd, J = 7.6, 2.0, 1.2 Гц, 1Н), 7.40 (dd, J = 7.6, 2.0 Гц, 1Н), 7.31 (t, J = 7.6 Гц, 1Н), 6.05 (d, J = 4.8 Гц, 1Н), 2.80-2.94 (m, 2H).
Стадия 2: В раствор нитрила 34 (2.15 г, 9.5 ммоль), 1-этинилциклогептанола (35) (2.62 г, 19 ммоль) и Р(t-Bu)3 (0.95 мл 1М раствора в диоксане, 0.95 ммоль) в диизопропиламине (6 мл) и диоксана (30 мл) добавляли РdCl2(РРh3)2 (0.33 г, 0.47 ммоль) и CuI (0.090 г, 0.47 ммоль). Смесь дегазировали (аргон/вакуум), затем нагревали при 45°С в течение ночи. После охлаждения до комнатной температуры смесь концентрировали при пониженном давлении. Очистка флэш хроматографией (от 1:2 до 1:1 ЕtOАс-гексаны) два раза позволила получить алкин 36 в виде бледно-желтого масла. Выход (2.35 г, 87%):1Н ЯМР (400 МГц, CDCl3) δ 7.33-7.46 (m, 4Н), 4.99-5.04 (m, 1H), 3.66-3.74 (m, 1H), 2.72-2.78 (m, 2H), 1.56-2.13 (m, 12H).
Стадия 3: Диол 37 был восстановлен согласно способу, который использовали в Примере 15. Реакционную смесь осаждали NaOH (0.3 мл 50% масса/масса раствором), затем фильтровали и концентрировали при пониженном давлении. Очистка флэш хроматографией (10% МеОН-CH2Сl2, затем от 10% до 20% 7М NH3 в МеОН/СH2Сl2) позволила получить Пример 16 в виде бесцветного масла, которое затвердевало до белого твердого вещества при стоянии. Выход (примерно 0.149 г, 67%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.16 (t, J = 7.6 Гц, 1H), 7.12 (s, 1H), 7.07 (d, J = 7.6 Гц, 1H), 6.99 (t, J = 7.6 Гц, 1H), 4.60 (dd, J = 7.6, 5.6 Гц, 1H), 3.97 (br s, 1H), 3.25 (br s, 2H), 2.56-2.66 (m, 4Н), 1.26-1.64 (m, 16H).
ПРИМЕР 17
Приготовление 3-амино-1-(3-(2-циклопентилэтил)фенил)пропан-1-ола

3-амино-1-(3-(2-циклопентилэтил)фенил)пропан-1-ол был приготовлен согласно способу, показанному на Схеме 8.
Схема 8

Стадия 1: В раствор 3-(3-бромфенил)-3-гидроксипропаннитрила (34) (117.5 г, 519.8 ммоль) в THF (300 мл) в атмосфере аргона добавляли боран-диметилсульфидный комплекс (68 мл; 10.0М в ВН3, 675.7 ммоль) через капельную воронку в течение 30 мин. Реакционную смесь нагревали с обратным холодильником в течение 2.5 ч. После охлаждения до комнатной температуры реакционную смесь осаждали добавлением смеси HCl-MeOH (350 мл 1.25М раствора) в течение 30 мин. Смесь концентрировали при пониженном давлении, затем добавляли воду и устанавливали рН ~12 с помощью 50% водного раствора NaOH. Водную смесь экстрагировали СН2Сl2 и объединенные органические слои высушивали над Na2SO4 и концентрировали при пониженном давлении. Остаток растворяли в смеси 10% МеОН-СН2Сl2 и элюировали через слой кварца смесью 10% MeOH-CH2Cl2, затем смесью 10% 7 М NH3 в МеОН/СН2Сl2 для получения амина 38. Этот материал использовали в последующих синтетических стадиях без дальнейшей очистки. Выход (106 г, 87%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.49 (m, 1Н), 7.37 (dt, J = 7.2, 1.6 Гц, 1Н), 7.23-7.31 (m, 2H), 4.66 (t, J = 6.8 Гц, 1Н), 2.61 (m, 2H), 1.61 (q, J = 6.8 Гц, 2H).
Стадия 2: В раствор амина 38 (5.628 г, 26.0 ммоль) в CH2Cl2 (20 мл) добавляли Et3N (5.43 мл, 39.0 ммоль) и ди-трет-бутил дикарбамат (8.52 г, 39.0 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, после чего концентрировали при пониженном давлении. Остаток растворяли в EtOAc, отмывали солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (13% EtOAc-гексаны) обеспечила получение трет-бутил 3-(3-бромфенил)-3-гидроксипропилкарбамат (39) в виде густого коричневого масла. Выход (4.0 г, 48%):1Н ЯМР (400 МГц, CDCl3) δ 7.53 (s, 1H), 7.39 (d, J = 8.0 Гц, 1H), 7.29 (d, J = 7.6 Гц, 1H), 7.20 (t, J = 7.6 Гц, 1H), 4.87 (br s, 1H), 4.71 (d, J = 6.4 Гц, 1H), 3.64 (br s, 1H), 3.50-3.59 (m, 1H), 3.12-3.19 (m, 1H), 1.77-1.87 (m, 2H), 1.46 (s, 9H).
Стадия 3: Взаимодействие этинилциклопентана (40) с трет-бутил 3-(3-бромфенил)-3-гидроксипропилкарбаматом (39) согласно способу, который использовали в синтезе Примера 13, позволило получить трет-бутил 3-(3-(циклопентилэтинил)фенил)-3-гидроксипропилкарбамат (41) в виде коричневого масла. Выход (0.386 г, 92%).
Стадия 4: Снятие защиты трет-бутил 3-(3-(циклопентилэтинил)фенил)-3-гидроксипропилкарбамата (41) согласно способу, который использовали в Примере 13, и очистка препаративной ВЭЖХ (Способ 1P) позволили получить соединение 42 трифторацетат в виде белого твердого вещества. Выход (0.15 г, 74%):1Н ЯМР (400 МГц, СDСl3) δ 7.17-7.31 (m, 4Н), 4.85 (dd, J = 7.6, 4.0 Гц, 1H), 3.11-3.17 (m, 2H), 2.69 (quint, J = 7.2 Гц, 1H), 1.56-2.02 (m, 10H).
Стадия 5: Соединение 42 трифторацетат гидрировали способом, который использовали в Примере 13, за исключением того, что реакцию проводили в течение ночи при комнатной температуре. Пример 17 трифторацетат изолировали в виде белого тягучего твердого вещества. Выход (0.094 г, 84%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.64 (br s, 3Н), 7.20 (t, J = 7.6 Гц, 1H), 7.03-7.11 (m, 3H), 5.48 (br s, 1H), 4.61 (t, J = 5.6 Гц, 1H), 2.76-2.87 (m, 2H), 2.54 (i, J = 8.0 Гц, 2H), 1.63-1.84 (m, 5H), 1.38-1.58 (m, 6H), 1.02-1.14 (m, 2H).
ПРИМЕР 18
Приготовление 3-амино-1-(3-(3-фенилпропил)фенил)пропан-1-ола
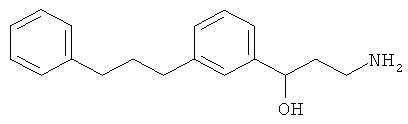
3-амино-1-(3-(3-фенилпропил)фенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 17:
Стадия 1: Связывание проп-2-инилбензола с бромидом 39 позволило получить трет-бутил. 3-гидрокси-3-(3-(3-фенилпроп-1-инил)фенил)пропилкарбамат в виде коричневого масла. Выход (0.404 г, 91%):1Н ЯМР (400 МГц, CDCl3) δ 7.40-7.45 (m, 3H), 7.32-7.36 (m, 3Н), 7.20-7.29 (m, 3Н), 4.87 (br s, 1H), 4.72 (br s, 1H), 3.83 (s, 2H), 3.51-3.54 (m, 1H), 3.35 (br s, 1H), 3.12-3.19 (m, 1H), 1.81-1.84 (m, 2H), 1.45 (s, 9H).
Стадия 2: Снятие защиты трет-бутил 3-гидрокси-3-(3-(3-фенилпроп-1-инил)фенил)пропилкарбамата с последующей очисткой препаративной ВЭЖХ (Способ IP), позволило получить 3-амино-1-(3-(3-фенилпроп-1-инил)фенил)пропан-1-ол трифторацетат в виде белого твердого вещества. Выход (0.114 г, 27%):1H ЯМР (400 МГц, CDCl3) δ 7.92 (br s, 2H), 7.26-7.37 (m, 5H), 7.16-7.23 (m, 4H), 4.79 (dd, J = 8.4, 3.6 Гц, 1Н), 3.75 (s, 2H), 3.02-3.16 (m, 2H), 1.93-1.98 (m, 2H).
Стадия 3: 3-амино-1-(3-(3-фенилпроп-1-инил)фенил)пропан-1-ол трифторацетат гидрировали способом, который использовали в Примере 13, за исключением того, что реакцию проводили в течение 1 ч при 50°С, что позволило получить Пример 18 трифторацетат в виде белого твердого вещества. Выход (33%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.76 (br s, 3Н), 7.24-7.31 (m, 3H), 7.09-7.21 (m, 6H), 5.52 (br s, 1Н), 4.65 (t, J = 5.6 Гц, 1Н), 2.67-2.89 (m, 2H), 2.52-2.64 (m, 4H), 1.78-1.91 (m, 4H).
ПРИМЕР 19
Приготовление 4-(3-(3-амино-1-гидроксипропил)фенетил)гептан-4-ола
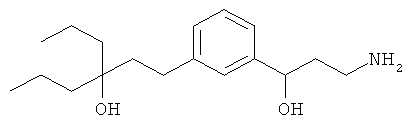
4-(3-(3-амино-1-гидроксипропил)фенетил)гептан-4-ол был приготовлен согласно способу, показанному на Схеме 9:
Схема 9

Стадия 1: В раствор амина 38 (1.70 г, 7.39 ммоль) в EtOH (10 мл) добавляли этилтрифторацетат (10 мл). Смесь перемешивали в течение 4 ч, затем концентрировали при пониженном давлении. Очистка флэш хроматографией (20% EtOAc-гексаны) позволила получить арилбромид 43 в виде прозрачного масла. Выход (0.820 г, 34%): %):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.33 (s, 1H), 7.51 (t, J = 2.0 Гц, 1Н), 7.41 (dt, J = 7.6, 2.0 Гц, 1Н), 7.25-7.32 (m, 2H), 5.46 (d, J = 6.4 Гц, 1H), 4.55-4.60 (m, 1H), 3.20-3.23 (m, 2H), 1.75-1.82 (m, 2H).
Стадия 2: Взаимодействие 4-этилгептан-4-ола (44) с бромидом 43 выполняли согласно способу, который использовали для приготовления Примера 7. Очистка флэш хроматографией (40% EtOAc-гексаны) позволила получить алкин 45 в виде прозрачного масла. Выход (0.520 г, 54%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.35 (m, 1H), 7.29-7.34 (m, 3Н), 7.22-7.26 (m, 1H), 5.39 (d, J = 4.4 Гц, 1H), 5.12 (s, 1H), 4.59 (dt, J = 8.4, 4.8 Гц, 1H), 3.25 (квинт, J = 7.6 Гц, 2H), 1.80 (квинт, J = 8.0 Гц, 2H), 1.44-1.63 (m, 8H), 0.92 (t, J = 7.2 Гц, 6Н).
Стадия 3: Гидрирование алкина 45 проводили согласно способу, который использовали в Примере 2, за исключением того, что растворителем реакции был ЕtOАс и время реакции составляло 2 ч. Спирт 46 изолировали в виде масла и использовали на следующей стадии без очистки. Выход (0.519 г, колич.):1H ЯМР (400 МГц, CDCl3) δ 9.29 (t, J = 5.2 Гц, 1H), 7.16 (t, J = 7.2 Гц, 1H), 7.05-7.09 (m, 2H), 6.99 (d, J = 7.2 Гц, 1H), 5.23 (br s, 1H), 4.50 (t, J = 6.0 Гц, 1H), 3.93 (br s, 1H), 3.20 (q, J = 6.8 Гц, 2H), 2.44 -2.50 (m, 2H), 1.72-1.77 (m, 2H), 1.19-1.33 (m, 10H), 0.82 (t, J = 6.8 Гц, 6Н).
Стадия 4: В раствор спирта 46 (0.510 г, 1.31 ммоль) в 10% Н2O-МеОН (20 мл) добавляли КзСОз (0.905 г, 6.55 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Смесь концентрировали при пониженном давлении, затем разделяли между ЕtOАс и водой. Объединенные органические слои высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (10% 7 M NHs в MeOH/CH2Cl2) позволила получить Пример 19 в виде прозрачного масла. Выход (0.202 г, 53%):1Н ЯМР (400 МГц, CDCl3) δ 7.17 (t, J = 7.2 Гц, 1H), 7.12 (m, 1H), 7.07-7.09 (m, 1H), 6.98-7.00 (m, 1H), 4.59-4.62 (m, 1H), 3.96 (br s, 1H), 2.57-2.66 (m, 2H), 2.48-2.53 (m, 2H),1.53-1.65 (m, 4H), 1.22-1.36 (m, 10Н), 0.84-0.86 (m, 6Н).
ПРИМЕР 20
Приготовление 1-(3-(3-аминопропил)фенетил)циклогептанола
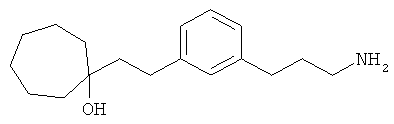
1-(3-(3-аминопропил)фенетил)циклогептанол был приготовлен согласно способу, который использовали для приготовления Примера 7:
Стадия 1: Взаимодействие 1-этинилциклогептанола с бромидом 10 проводили согласно способу, который использовали для приготовления Примера 7. Очистка флэш хроматографией (20% EtOAc-гексаны) позволила получить 2,2,2-трифтор-N-(3-(3-((1-гидроксициклогептил)этинил)фенил)пропил)ацетамид в виде бледно-желтого масла. Выход (1.78 г, 60%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (s, 1Н), 7.26 (t, J = 7.6 Гц, 1Н), 7.17-7.22 (m, 3Н), 5.26 (s, 1Н), 3.16 (q, J = 6.0 Гц, 2Н), 2.56 (t, J = 7.2 Гц, 2Н), 1.91-1.97 (m, 2H), 1.73-1.79 (m, 4H), 1.45-1.63 (m, 8H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-((1-гидроксициклогептил)этинил)фенил)пропил)ацетамида проводили согласно способу, который использовали для приготовления Примера 2, за исключением того, что использовали 5 эквивалентов К2СО3 и реакционную смесь перемешивали при комнатной температуре в течение ночи. Очистка флэш хроматографией (10% 7М NH3 в MeOH/CH2Cl2) позволила получить 2,2,2-трифтор-N-(3-(3-(2-(1-гидроксициклогептил)этил)фенил)пропил)ацетамид в виде прозрачного масла. Выход (0.635 г, 86%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.16-7.32 (m, 4H), 5.13 (s, 1Н), 4.65 (t, J = 6.0 Гц, 1Н), 2.56-2.64 (m, 2Н), 1.44-1.63 (m, 12H), 0.90 (t, J = 7.6 Гц, 6Н).
Стадия 3: Гидроривание 2,2,2-трифтор-N-(3-(3-(2-(1-гидроксициклогептил)этил)фенил)пропил)ацетамида согласно способу, который использовали для приготовления Примера 7, позволило получить Пример 19 в виде бесцветного масла. Выход (0.305 г, 100%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.13 (t, J = 7.2 Гц, 1Н), 6.94-6.98 (m, 3Н), 4.01 (br s, 1Н), 2.47-2.58 (m, 4H), 1.32-1.62 (m, 20H).
ПРИМЕР 21
Приготовление 3-(3-(2-(нафтален-2-ил)этил)фенил)пропан-1-амина

3-(3-(2-(нафтален-2-ил)этил)фенил)пропан-1-амин был приготовлен согласно способу, показанному на Схеме 10
Схема 10

Стадия 1: В дегазированный раствор 3-(3-бромфенил)пропан-1-ола (47) (0.95 г, 4.5 ммоль) и 2-метил-3-бутин-2-ола (48) (1.6 мл, 16 ммоль) в триэтиламине (25 мл) добавляли РdCl2(РРh3)3 (0.095 г, 0.14 ммоль) и CuI (0.027 г, 0.14 ммоль). Полученную смесь дегазировали и перемешивали в атмосфере аргона при 70°С в течение 15 ч. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении и разбавляли EtOAc (50 мл). Следовые количества летучих компонентов удаляли фильтрацией, после чего фильтрат отмывали водой и солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент от 10% до 100% ЕtOАс-гексаны) позволила получить 4-(3-(3-гидроксипропил)фенил)-2-метилбут-3-ин-2-ол (49) в виде светло-количневого масла. Выход (0.78 г, 80%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.18-7.29 (m, 4Н), 5.46 (s, 1H), 4.48 (t, J = 4.0 Гц, 1Н), 3.38 (q, J = 4.0 Гц, 2Н), 2.59 (t, J = 6.0 Гц, 2Н), 2.46 (m, 2H), 1.46 (s, 6H).
Стадия 2: В раствор 4-(3-(3-гидроксипропил)фенил)-2-метилбут-3-ин-2-ола (49) (0.750 г, 3.4 ммоль) в толуоле (50 мл) добавляли порошок КОН (0.390 г, 7 ммоль). Полученную смесь нагревали с обратным холодильником в течение 45 мин. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении до объема 10-15 мл и разделяли между ЕtOАс и водой. Объединенные органические слои отмывали водой и солевым раствором, высушивали над MgSO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (15% EtOAc-гексаны) позволила получить 3-(3-этинилфенил)пропан-1-ол (50) в виде светло-коричневого масла. Выход (0.272 г, 49%).
Стадия 3: В дегазированный раствор спирта 50 (0.5 г, 3.12 ммоль) и 2-бромнафталена (51) (0.54 г, 2.60 ммоль) в Et3N (13 мл) добавляли РdCl2(РРh3)2 (0.055 г, 0.078 ммоль) и CuI (0.015 г, 0.078 ммоль). Реакционную смесь перемешивали в течение ночи при 70°С. После охлаждения до комнатной температуры смесь концентрировали при пониженном давлении. Остаток растворяли в ЕtOАс и твердую фазу отфильтровывали. Фильтрат отмывали водой и солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка фдэш хроматографией (8% ЕtOАс-гексаны) обеспечила получение спирта 52 в виде коричневого масла. Выход (0.40 г, 45%):1Н ЯМР (400 МГц, CDCl3) δ 8.06 (br s, 1H), 7.80-7.83 (m, 2H), 7.58 (dd, J = 8.8, 2.0 Гц, 1H), 7.47-7.51 (m, 2H), 7.41-7.43 (m, 2H), 7.26-7.31 (m, 2H), 7.18 (d, J = 7.6 Гц, 1H), 4.77 (br s, 1H), 4.11 (t, J = 6.4 Гц, 2H), 2.71 (t, J = 7.6 Гц, 2H), 1.99 (квинт, J = 6.8 Гц, 2H).
Стадия 4: В раствор спирта 52 (0.35 г, 1.22 ммоль) в THF (20 мл) добавляли фталимид (0.18 г, 1.28 ммоль) и PPhs (0.40 г, 1.52 ммоль). Реакционную смесь охлаждали до 0°С и прикалывали раствор диизопропилазодикарбоксилата (0.32 г, 1.61 ммоль) в THF (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь концентрировали при пониженном давлении и добавляли 20% EtOAc-гептан. Смесь диспергировали с помощью ультразвука в течение 10 мин, после чего осадок отфильтровывали. Фильтрат концентрировали при пониженном давлении. Очистка флэш хроматографией (10% ЕtOАс-гексаны) позволила получить алкин 53 в виде желтого твердого вещества. Выход (0.40 г, 80%):1H ЯМР (400 МГц, CDCl3) δ 8.44 (d, J = 8.0 Гц, 1H), 7.82-7.88 (m, 4Н), 7.76 (dd, J = 7.2, 1.2 Гц, 1H), 7.70 (dd, J = 5.2, 3.2 Гц, 2H), 7.59-7.64 (m, 1H), 7.52-7.56 (m, 1H), 7.42-7.49 (m, 3Н), 7.29 (d, J = 7.6 Гц, 1H), 7.22 (d, J = 8.0 Гц, 1H), 3.79 (t, J = 7.2 Гц, 2H), 2.73 (t, J = 7.2 Гц, 2H), 2.09 (квинт, J = 7.2 Гц, 2H).
Стадия 5: В раствор алкина 53 (0.40 г, 0.96 ммоль) в ЕtOН (4 мл) добавляли гидразин гидрат (0.17 мл, 2.89 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли диэтиловый эфир и твердую фазу удаляли фильтрацией. Фильтрат концентрировали при пониженном давлении. Очистка препаративной ВЭЖХ с помощью Способа 2Р позволила получить амин 54 в виде белого твердого вещества. Выход (0.12 г, 44%):1Н ЯМР (400 МГц, ДМСО-d6) δ 8.18 (s, 1H), 7.80-7.95 (m, 3Н), 7.69 (br s, 2H), 7.57-7.62 (m, 3H), 7.45-7.49 (m, 2H), 7.40 (t, J = 7.6 Гц, 1H), 7.30 (d, J = 7.6 Гц, 1H), 2.80 (t, J = 7.2 Гц, 2H), 2.69 (t, J = 7.6 Гц, 2H), 1.87 (квинт, J = 7.6 Гц, 2H).
Стадия 6: Гидрирование алкина 54 согласно способу, который использовали в Примере 13, позволило получить Пример 21 трифторацетат в виде белого твердого вещества. Выход (0.019 г, 23%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.81-7.88 (m, 3Н), 7.71 (s, 1H), 7.68 (br s, 2H), 7.42-7.50 (m, 3Н), 7.22 (t, J = 7.4 Гц, 1H), 7.10-7.12 (m, 2H), 7.03 (d, J = 7.6 Гц, 1H), 3.02-3.06 (m, 2H), 2.94-2.98 (m, 2H), 2.78 (t, J = 7.4 Гц, 2H), 2.61 (t, J = 7.6, 2H), 1.81 (квинт, J = 7.6 Гц, 2H).
ПРИМЕР 22
Приготовление 3-(3-фенетилфенил)пропан-1-амина

3-(3-фенетилфенил)пропан-1-амин был приготовлен согласно способу, описанному на Схеме 11.
Схема 11

Стадия 1: Взаимодействие спирта 47 с фталимидом проводили согласно процедуре, описанной в Примере 13, за исключением того, что реакцию проводили при комнатной температуре. Очистка флэш хроматографией (6% EtOAc-гексаны) позволила получить фталимид 55 в виде твердого вещества кремового цвета. Выход (8.6 г, 92%);1H ЯМР (400 МГц, ДМСО-d6) δ 7.81-7.87 (m, 4Н), 7.44 (s, 1Н), 7.31-7.33 (m, 1H), 7.19-7.24 (m, 2H), 3.60 (t, J = 6.8 Гц, 2H), 2.63 (t, J = 7.6 Гц, 2Н), 1.87-1.94 (m, 2H).
Стадия 2: Снятие защиты фталимида 55 проводили согласно способу, который использовали в Примере 21, за исключением того, что реакционную смесь нагревали с обратным холодильником в течение 1.5 ч, что позволило получить амин 56 в виде желтого масла. Это соединение использовали на следующей синтетической стадии без очистки. Выход (5.4 г, 98%).
Стадия 3: Защита амина 56 ди-трет-бутил дикарбонатом согласно способу, который использовали в Примере 17, позволила получить карбамат 57 в виде светло-желтого масла. Карбамат 57 использовали на следующей синтетической стадии без дальнейшей очистки. Выход (6.97 г, 86%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.33 (s, 1H), 7.26-7.34 (m, 1H), 7.08-7.20 (m, 2H), 4.55 (br s, 1H), 3.15 (q, J = 6 Гц, 2Н), 2.61 (t, J = 8.0 Гц, 2Н), 1.79 (квинт, J = 7.6 Гц, 2H), 1.44 (s, 9H).
Стадия 4: Взаимодействие фенилацетилена (58) с бромидом 57 проводили согласно способу, который использовали в Примере 13. Очистка флэш хроматографией (5% EtOAc-гексаны) позволила получить трет-бутил 3-(3-(фенилэтинил)пропилкарбамат (59) в виде коричневого масла. Выход (0.32 г, 50%):1Н ЯМР (400 МГц, CDCl3) δ 7.53 (dd, J = 7.2, 2 Гц, 2Н), 7.42-7.47 (m, 1H), 7.36-7.38 (m, 1H), 7.20-7.26 (m, 2Н), 7.11 (d, J = 8.0 Гц, 1H), 6.98 (t, J = 7.6 Гц, 1H), 6.86 (m, 1H), 4.54 (br s, 1H), 3.14-3.17 (m, 2Н), 2.63 (квинт, J = 7.6 Гц, 2Н), 1.76-1.86 (m, 2Н), 1.38 (s, 9H).
Стадия 5: Снятие защиты трет-бутил 3-(3-(фенилэтинил)пропилкарбамата (59) выполняли согласно процедуре, которую использовали для приготовления Примера 13. Растирание с диэтиловым эфиром позволило получить 3-(3-(фенилэтинил)фенил)пропан-1-амин гидрохлорид (60) в виде грязно-белого твердого вещества. Выход (0.19 г, 73%):1H ЯМР (400 МГц, ДМСО-d6) δ 8.08 (br s, 2Н), 7.55-7.57 (m, 1H), 7.21-7.46 (m, 6H), 7.21-7.30 (m, 2Н), 2.77 (q, J = 7.6 Гц, 2Н), 2.66 (q, J = 7.6 Гц, 2Н), 1.82-1.93 (m, 2Н).
Стадия 6: Гидрирование 3-(3-(фенилэтинил)фенил)пропан-1-амина выполняли согласно способу, который использовали для приготовления Примера 18. Это соединение очищали препаративной ВЭЖХ с помощью Способа 1P для получения Примера 23 трифторацетата в виде твердого вещетсва кремового цвета. Выход (0.080 г, 36%):1H ЯМР (400 МГц, СDСl3) δ 7.87 (br s, 2 Н), 7.24-7.28 (3Н), 7.16-7.20 (m, 3Н), 6.93-7.03 (m, 3H), 2.85-2.87 (m, 5H (выраженное низкое интегрирование)), 2.61 (t, J = 7.6 Гц, 2Н), 1.94 (квинт, J = 7.6 Гц, 2Н);13С ЯМР (300 МГц, CDCl3) δ 142.20, 141.71, 139.72, 128.62, 128.46, 128.44, 128.30, 126.55, 125.88, 125.77, 39.35, 37.84, 37.79, 32.28, 28.90.
ПРИМЕР 23
Приготовление 4-(3-(3-аминопропил)фенил)бутан-1-ола
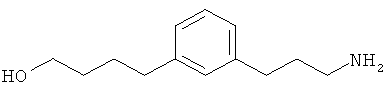
34-(3-(3-аминопропил)фенил)бутан-1-ол был приготовлен согласно способу, который использовали для приготовления Примера 2.
Стадия 1: Взаимодействие бут-3-ин-1-ола с бромидом 10 позволило получить 2,2,2-трифтор-N-(3-(3-(4-гидроксибут-1-инил)фенил)пропил)ацетамид в виде бледно-желтого масла. Выход (0.9 г, 62%):1H ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1H), 7.15-7.26 (m, 4H), 4.86 (br s, 1H), 3.56 (app t, J = 6.8 Гц, 2H), 3.16 (q, J = 6.8 Гц, 2Н), 2.47-2.56 (m, 4H), 1.76 (квинт, J = 7.6 Гц, 2H).
Стади 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(4-гидроксибут-1-инил)фенил)пропил)ацетамида согласно способу, который использовали в Примере 2, за исключением того, что продукт очищали флэш хроматографией (CH2Cl2/EtOH/NH4OH 85:14:1), позволило получить 4-(3-(3-аминопропил)фенил)бут-3-ин-1-ол в виде прозрачного масла. Выход (0.236 г, 65%): %):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.12-7.24 (m, 4H), 3.56 (t, J = 6.9 Гц, 2H), 2.47-2.57 (m, 6H), 1.59 (квинт, J = 6.9 Гц, 2H).
Стадия 3: Гидрирование 4-(3-(3-аминопропил)фенил)бут-3-ин-1-ола согласно способу, который использовали для приготовления примера 18, позволило получить Пример 23 трифторацетат в виде белого твердого вещества. Выход (0.040 г, 56%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.74 (br s, 3Н), 7.20 (t, J = 8.0 Гц, 1H), 7.00-7.06 (m, 3H), 4.37 (m, 1H), 3.27-3.41 (m, 2H), 2.76 (t, J = 7.6 Гц, 2H), 2.45-2.62 (m, 4H), 1.78-1.86 (m, 2H), 1.54-1.61 (m, 2H), 1.39-1.46 (m, 2H).
ПРИМЕР 24
Приготовление 3-(3-(2-циклопентилэтил)фенил)пропан-1-амина

3-(3-(2-циклопентилэтил)фенил)пропан-1-амин был приготовлен согласно способу, который использовали для приготовления Примера 22.
Стадия 1: Взаимодействие этинилциклопентана с бромидом 57 пвыполняли согласно способу, который использовали в Примере 22. Очистка флэш хроматографией (6% EtOAc-гексаны) позволила получить трет-бутил 3-(3-(циклопентилэтинил)пропилкарбамат в виде коричневого масла. Выход (0.70 г, 84%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.06-7.33 (m, 4H), 2.85 (квинт, J = 7.4 Гц, 1H), 2.57-2.66 (m, 2H), 2.62 (t, J = 8.0 Гц, 2H), 1.93-2.01 (m, 2H), 1.82 (квинт, J = 7.6 Гц, 2H), 1.66-1.75 (m, 2H), 1.55-1.64 (m, 4H), 1.45 (m, 9H).
Стадия 2: Снятие защиты трет-бутип 3-(3-(циклопентилэтинил)пропилкарбамата с последующей очисткой препаративной ВЭЖХ (Способ 1P) позволило получить 3-(3-(циклопентилэтинил)фенил)фенил)пропан-1-амин трифторацетат в виде белого твердого вещества. Выход (0.22 г, 30%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.68 (br s, 2H), 7.27 (t, J = 7.6 Гц, 1H), 7.16-7.24 (m, 3Н), 2.85 (квинт, J = 7.6 Гц, 1H), 2.75 (br s, 2H), 2.62 (t, J = 7.2 Гц, 2H), 1.93-2.01 (m, 2H), 1.82 (квинт, J = 7.6 Гц, 2H), 1.67-1.71 (m, 2H), 1.56-1.66 (m, 4H).
Стадия 3: Гидрирование 3-(3-(циклопентилэтинил)фенил)фенил)пропан-1-амина согласно способу, который использовали для приготовления примера 18, позволило получить Пример 24 трифторацетат в виде белого твердого вещества. Выход (80 мг, 79%) :%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.67 (br s, 3Н), 7.20 (t, J = 8.0 Гц, 1Н), 7.00-7.15 (m, 3Н), 2.78 (t, J = 8.4 Гц, 2Н), 2.54-2.62 (m, 4Н), 1.66-1.85 (m, 4H), 1.42-1.64 (m, 7H), 1.18-1.15 (m, 2H).
ПРИМЕР 25
Приготовление 3-(3-(2-циклогексилэтил)фенил)пропан-1-амина

3-(3-(2-циклогексилэтил)фенил)пропан-1-амин был приготовлен согласно способу, который использовали для приготовления Примера 22:
Стадия 1: Взаимодействие этинилциклогексана с бромидом 57 выполняли согласно способу, который использовали в Примере 22. Очистка флэш хроматографией (5% EtOAc-гексаны) позволила получить трет-бутил 3-(3-(циклогексилэтинил) фенил)пропилкарбамат в виде коричневого масла. Выход (0.50 г, 57%).
Стадия 2: Снятие защиты трет-бутил 3-(3-(циклогексилэтинил) фенил)пропилкарбамата с последующей очисткой препаративной ВЭЖХ (Способ 1P) позволило получить 3-(3-(циклогексилэтинил)фенил)пропан-1-амин трифторацетат в виде твердого вещества кремового цвета. Выход (0.21 г, 40%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.67 (br s, 2Н), 7.28 (t, J = 7.6 Гц, 1Н), 7.17-7.24 (m, 3Н), 2.74-2.79 (m, 1Н), 2.64 (t, J = 7.6 Гц, 4H), 1.82 (квинт, J = 7.2 Гц, 4H), 1.67-1.68 (m, 2Н), 1.32-1.52 (m, 6H).
Стадия 3: Гидрирование 3-(3-(циклогексилэтинил)фенил)пропан-1-амина выполняли согласно способу, который использовали для приготовления Примера 18. Очистка препатаривной ВЭЖХ с использованием Способа 1P позволила получить Пример 24 трифторацетат в виде белого твердого вещества. Выход (0.050 г, 33%):1Н ЯМР (400 МГц, СDСl3) δ 7.87 (br s, 3Н), 7.16 (t, J = 7.6 Гц, 1Н), 7.01 (d, J = 7.6 Гц, 1Н), 6.92-6.94 (m, 2Н), 2.87 (m, 2Н), 2.53-2.62 (m, 4H), 1.63-1.76 (m, 5H), 1.43-1.49 (m, 2Н), 1.13-1.29 (m, 6H), 0.87-0.96 (m, 2Н).
ПРИМЕР 26
Приготовление 3-(3-(3-фенилпропил)фенил)пропан-1-амина
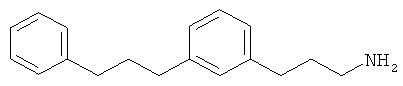
3-(3-(3-фенилпропил)фенил)пропан-1-амин был приготовлен согласно способу, который использовали для приготовления Примера 22.
Стадия 1: Взаимодействие проп-2-инилбензола с бромидом 57 выполняли согласно способу, который использовали в Примере 22. Очистка флэш хроматографией (6% ЕtOАс-гексаны) позволила получить трет-буткл 3-(3-(3-фенилпроп-1-инил)фенил)пропилкарбамат в виде коричневого масла. Выход (0.85 г, 73%):1Н ЯМР (400 МГц, CDCl3) δ 7.41-7.43 (m, 2H), 7.35 (t, J = 8.0 Гц, 2Н), 7.10-7.28 (m, 5Н), 4.52 (br s, 1H), 3.84 (s, 2H), 3.14-3.16 (m, 2H), 2.61 (t, J = 7.6 Гц, 2H), 1.80 (квинт, J = 7.6 Гц, 2H), 1.48 (s, 9H)
Стадия 2: Снятие защиты трет-буткл 3-(3-(3-фенилпроп-1-инил)фенил) пропилкарбамата с последующей очисткой препаративной ВЭЖХ (Способ-001P) позволило получить 3-(3-(3-фенилпроп-1-инил)фенил)пропан-1-амин трифторацетат в виде белого твердого вещества. Выход (0.45 г, 51%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.69 (br s, 2H), 7.35-7.42 (m, 4H), 7.25-7.31 (m, 4H), 7.20-7.22 (m, 1H), 3.89 (s, 2H), 2.76 (t, J = 7.2 Гц, 2H), 2.63 (t, J = 7.6 Гц, 2H), 1.82 (квинт, J = 7.6 Гц, 2H).
Стадия 3: Гидрирование 3-(3-(3-фенилпроп-1-инил)фенил)пропан-1-амина трифторацетата согласно способу, который использовали для приготовления Примера 18, позволила получить Пример 26, который очищали ВЭЖХ с использованием Способа 1P для получения Примера 26 трифторацетата в виде бесцветного масла. Выход (0.180 г, 88%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.69 (br s, 3Н), 7.29 (t, J = 7.2 Гц, 2H), 7.16-7.24 (m, 4H), 7.01-7.05 (m, 3Н), 2.88 (t, J = 8.0 Гц, 2H), 2.56-2.62 (m, 6H), 1.88-1.91 (m, 4H).
ПРИМЕР 27
Приготовление 3-(3-пентифенил)пропан-1-амина

3-(3-пентифенил)пропан-1-амин был приготовлен согласно способу, который использовали для приготовления Примера 22:
Стадия 1: Взаимодействие 1-пент-1-ина с бромидом 57 выполняли согласно способу, который использовали в Примере 22. Очистка флэш хроматографией (5% ЕtOАс-гексаны) позволила получить трет-бутл 3-(3-(пент-1-инил)фенил)пропилкарбамат в виде коричневого масла. Выход (0.35 г, 58%):1Н ЯМР (400 МГц, CDCl3) δ 7.07-7.33 (m, 4H), 4.52 (br s, 1H), 3.14-3.15 (m, 2H), 2.58-2.66 (m, 2H), 2.38 (t, J = 7.2 Гц, 2H), 1.79 (квинт, J = 7.6 Гц, 2H), 1.64 (q, J = 7.2 Гц, 2H), 1.45 (s, 9H), 1.05 (t, J = 6.8 Гц, 3Н).
Стадия 2: Снятие защиты трет-бутил 3-(3-(пент-1-инил)фенил) пропилкарбамата с последующей очисткой препаративной ВЭЖХ (Способ 1P) позволило получить 3-(3-(пент-1-инил)фенил)пропан-1-амин трифторацетат в виде белого твердого вещества. Выход (0.17 г, 32%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.71 (br s, 2Н), 7.28 (t, J = 7.6 Гц, 1Н), 7.17-7.25 (m, 3Н), 2.76 (t, J = 7.2 Гц, 2Н), 2.62 (t, J = 7.2 Гц, 2Н), 2.39 (t, J = 6.8 Гц, 2Н), 1.82 (квинт, J = 7.6 Гц, 2Н), 1.51-1.60 (m, 2Н), 1.00 (t,J = 7.6 Гц, 3Н).
Стадия 3: Гидрирование 3-(3-(пент-1-инил)фенил)пропан-1-амина трифторацетата согласно способу, который использовали для приготовления примера 18, позволило получить Пример 27, который очищали ВЭЖХ для получения Примера 27 трифторацетата в виде твердого вещества кремового цвета. Выход (0.050 г, 20%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.72 (br s, 3Н), 7.20 (t, J = 7.6 Гц, 1Н), 7.00-7.03 (m, 3Н), 2.88 (m, 2Н), 2.60 (t, J = 7.6 Гц, 2Н), 2.46-2.56 (m, 2Н), 1.78-1.85 (m, 2Н), 1.52-1.59 (m, 2Н), 1.22-1.34 (m, 4H), 0.86 (t, J = 7.2 Гц, 3Н).
ПРИМЕР 28
Приготовление 3-(3-гексилфенил)пропан-1-амина
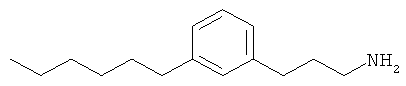
3-(3-гексилфенил)пропан-1-амин был приготовлен согласно способу, который использовали для приготовления Примера 22:
Стадия 1: Взаимодействие гекс-1-ина с бромидом 57 выполняли согласно способу, который использовали в Примере 22. Очистка флэш хроматографией (5% EtOAc-гексаны) позволила получить трет-бутил 3-(3-(гекс-1-инил) фенил)пропилкарбамат в виде коричневого масла. Выход (0.64 г, 64%).
Стадия 2: Снятие защиты трет-бутил 3-(3-(гекс-1-инил)фенил) пропилкарбамата с последующей очисткой препаративной ВЭЖХ (Способ 4Р) позволило получить 3-(3-(гекс-1-инил)фенил)пропан-1-амин гидрохлорид в виде белого твердого вещества. Выход (0.17 г, 33%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.71 (br s, 2Н), 7.28 (t, J = 7.2 Гц, 1Н), 7.17-7.25 (m, 3Н), 2.76 (t, J = 7.6 Гц, 2Н), 2.62 (t, J = 7.2 Гц, 2Н), 2.42 (t, J = 7.0 Гц, 2Н), 1.82 (квинт, J = 7.6 Гц, 2Н), 1.52 (квинт, J = 7.0 Гц, 2Н), 1.44 (квинт, J = 7.0 Гц, 2Н), 0.92 (t, J = 7.6 Гц, 3Н).
Стадия 3: Гидрирование 3-(3-(гекс-1-инил)фенил)пропан-1-амина гидрохлорида согласно способу, который использовали для приготовления Примера 18, позволило получить Пример 28 гидрохлорид в виде бесцветного масла. Выход (0.085 г, 98%): %):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.76 (br s, 3Н), 7.20 (t, J = 7.6 Гц, 1Н), 7.00-7.03 (m, 3Н), 2.78 (t, J = 7.6 Гц, 2H), 2.60 (t, J = 7.6 Гц, 2H), 2.46-2.56 (m, 2H), 1.82 (квинт, J = 7.6 Гц, 2Н), 1.51-1.56 (m, 2H), 1.20-1.30 (m, 6H), 0.85 (t, J = 7.2 Гц, 3Н).
ПРИМЕР 29
Приготовление 3-(3-(3,3-диметилбутил)фенил)пропан-1-амина

3-(3-(3,3-диметилбутил)фенил)пропан-1-амин был приготовлен согласно способу, который использовали для приготовления Примера 22.
Стадия 1: Взаимодействие 3,3-диметилбут-1-ина с бромидом 57 выполняли согласно способу, который использовали в Примере 22. Очистка флэш хроматографией (6% EtOAc-гексаны) позволила получить трет-бутил 3-(3-(3,3-диметилбут-1-инил)фенил)пропилкарбамат в виде коричневого масла. Выход (0.43 г, 54%).
Стадия 2: Снятие защиты трет-бутил 3-(3-(3,3-диметилбут-1-инил) фенил)пропилкарбамата с последующей очисткой препаративной ВЭЖХ (Способ 1P) позволило получить 3-(3-(3,3-диметилбут-1-инил)фенил)пропан-1-амин трифторацетат в виде бледно-желтого твердого вещества. Выход (0.08 г, 18%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.79 (br s, 2H), 7.27 (t, J = 7.6 Гц, 1Н), 7.16-7.22 (m, 3Н), 2.75-2.77 (m, 2H), 2.61 (t, J = 7.6 Гц, 2H), 1.82 (квинт, J = 7.2 Гц, 2H), 1.29 (s, 9H).
Стадия 3: Гидрирование 3-(3-(гекс-1-инил)фенил)пропан-1-амина трифторацетата соглано способу, который использовали для приготовления Примера 18, позволило получить Пример 29 трифторацетат в виде твердого вещества кремового цвета. Выход (0.040 г, 50%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.69 (br s, 3Н), 7.18-7.22 (m, 1Н), 6.99-7.28 (m, 3Н), 2.78 (t, J = 5.2 Гц, 2H), 2.61 (t, J=5.2 Гц, 2H), 2.50-2.55 (m, 2H), 1.79-1.84 (m, 2H), 1.41-1.46 (m,2H), 0.95 (s,9H).
ПРИМЕР 30
Приготовление 6-(3-(3-аминопропил)фенил)гексан-1-ола

6-(3-(3-аминопропил)фенил)гексан-1-ол был приготовлен согласно способу, который использовали для приготовления Примера 22.
Стадия 1: Взаимодействие гекс-5-ин-1-ола с бромидом 57 выполняли согласно способу, который использовали в Примере 22. Очистка флэш хроматографией (30% ЕtOАс-гексаны) позволила получить трет-бутил 3-(3-(6-гидроксигекс-1-инил)фенил)пропилкарбамат в виде белого твердого вещества. Выход (0.350 г, 66%):1Н ЯМР (400 МГц, CDCl3) δ 7.17-7.23 (m, 3Н), 7.07-7.10 (m, 1H), 6.81-6.84 (m, 1H), 4.53 (br s, 1H), 3.72 (q, J = 6.0 Гц, 2H), 3.10-3.18 (m, 2H), 2.60 (t, J = 8.0 Гц, 2Н), 2.46 (t, J = 6.8 Гц, 2H), 1.63-1.83 (m, 6H), 1.44 (s, 9H).
Стадия 2: Снятие защиты трет-бутил 3-(3-(6-гидроксигекс-1-инил)фенил) пропилкарбамата с последующей очисткой препаративной ВЭЖХ с использованием Способа 1P позволило получить 3-(3-(3,3-диметилбут-1-инил)фенил)пропан-1-амин трифторацетат в виде твердого белого вещества. Выход (0.140 г, 34%):1Н ЯМР (400 МГц, СDСl3) δ 7.21 (d, J = 7.6 Гц, 2H), 7.17 (t, J = 7.6 Гц, 1H), 7.07 (dm, J = 7.2 Гц, 1H), 3.68 (t, J = 6.4 Гц, 2H), 2.95 (t, J = 7.6 Гц, 2H), 2.67 (t, J = 7.6, 2H), 2.43 (t, J = 6.4, 2H), 2.06 (квинт, J = 7.6 Гц, 2H), 1.71-1.79 (m, 2H), 1.61-1.68 (m, 2H).
Стадия 3: 6-(3-(3-аминопропил)фенил)гекс-5-ин-1-ол трифторацетат гидрировали согласно процедуре, которую использовали в Примере 18, для получения Примера 30 трифторацетата в виде белого твердого вещества. Выход (33%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.88 (br s, 3Н), 7.20 (t, J = 7.6 Гц, 1H), 6.95-7.20 (m, 3Н), 4.38 (br s, 1H), 3.37 (t, J = 6.0 Гц, 2H), 2.76 (t, J = 7.6 Гц, 2H), 2.59 (t, J = 7.6 Гц, 2H), 2.54 (t, J = 7.2 Гц, 2H), 1.80-1.87 (m, 2H), 1.53-1.58 (m, 2H), 1.38-1.42 (m, 2H), 1.24-1.32 (m, 4H).
ПРИМЕР 31
Приготовление 3-(3-(2-метилфенетил)фенил)пропан-1-амина

3-(3-(2-метилфенетил)фенил)пропан-1-амин был приготовлен согласно способу, показанному на схеме 12:
Схема 12

Стадия 1: Взаимодействие спирта 50 с фталимидом согласно процедуре, описанной в Примере 21, позволило получить алкин 61 в виде желтого твердого вещества. Выход (6.0 г, 76%):1Н ЯМР (400 МГц, CDCl3) δ 7.83 (dd, J = 5.2, 2.8 Гц, 2Н), 7.70 (dd, J = 5.6, 3.2 Гц, 2Н), 7.33 (s, 1H), 7.29-7.24 (m, 1H), 7.16-7.22 (m, 2Н), 3.74 (t, J = 7.2 Гц, 2Н), 3.04 (s, 1H), 2.66 (t, J = 8.0 Гц, 2Н), 2.02 (квинт, J = 7.2 Гц, 2Н).
Стадия 2: В дегазированный раствор алкина 61 (0.6 г, 2.07 ммоль) и 2-иодтолуола (0.543 г, 2.49 ммоль) в триэтиламине (25 мл) добавляли PdCl2(PPh3)2 (0.0435 г, 0.062 ммоль) и CuI (0.0117 г, 0.062 ммоль). Реакционную смесь перемешивали в течение ночи при 70°С. После охлаждения до комнатной температуры смесь концентрировали при пониженном давлении. Остаток растворяли в EtOAc и твердую фазу удаляли фильтрацией. Фильтрат отмывали водой и солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (15% EtOAc-гексаны) обеспечила получение алкина 62 в виде коричневого масла. Выход (0.48 г, 61%):1Н ЯМР (400 МГц, CDCl3) δ 7.83 (dd, J = 5.6, 3.2 Гц, 2Н), 7.76 (dd, J = 5.6, 3.2 Гц, 2Н), 7.48 (d, J = 7.2 Гц, 1H), 7.37 (m, 1H), 7.31-7.32 (m, 1H), 7.15-7.24 (m, 5H), 3.77 (t, J = 7.2 Гц, 2Н), 2.70 (t, J = 7.2 Гц, 2Н), 2.50 (s, 3H), 2.02-2.09 (m, 2Н).
Стадия 3: В алкин 62 (0.48 г, 1.26 ммоль) в ЕtOН (25 мл) добавляли гидразин гидрат (0.23 мл, 3.79 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. В реакционную смесь добавляли диэтиловый эфир. Образовавшуюся твердую фазу: отфильтровывали и фильтрат концентрировали при пониженном давлении. Очистка препаративной ВЭЖХ (Способ 2Р) позволила получить амин 63 в виде бледно-желтого масла. Выход (80 мг, 25%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.24-7.53 (m, 8H), 2.65 (t, J = 8.0 Гц, 2Н), 2.57 (t, J = 6.8 Гц, 2Н), 2.49 (s, 3H), 1.65-1.72 (m, 2H).
Стадия 4: 3-(3-(о-толилэтинил)фенил)пропан-1-амин гидрировали согласно способу, который использовали в Примере 17, для получения Примера 31, который очищали ВЭЖХ для получения Примера 31 трифторацетамида в виде белого полутвердого вещества. Выход (0.021 г, 30%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.66 (br s, 3H), 7.19 (t, J = 7.6 Гц, 1H), 6.99-7.13 (m, 7H), 2.72-2.83 (m, 6H), 2.57 (t, J = 7.6 Гц, 2Н), 2.22 (s, 3H), 1.74-1.81 (m, 2H).
ПРИМЕР 32
Приготовление 3-(3-(2-(бифенил-3-ил)этил)фенил)пропан-1-амина

3-(3-(2-(бифенил-3-ил)этил)фенил)пропан-1-амин был приготовлен согласно который использовали для приготовления Примера 21:
Стадия 1: Взаимодействие спирта 50 с 3-бромбифенилом выполняли согласно способу, описанному в Примере 21, что позволило получить 3-(3-(бифенил-3-илэтинил)фенил)пропан-1-ол. Очистка флэш хроматографией (5% ЕtOАс-гексаны) позволила получить коричневое масло. Выход (0.560 г, б7%):1Н ЯМР (400 МГц, CDCl3) δ 7.78 (br s, 1H), 7.61 (d, J = 7.2 Гц, 2H), 7.56 (d, J = 7.6 Гц, 1H), 7.51 (d, J = 8.0 Гц, 1H), 7.37-7.48 (m, 6H), 7.29 (d, J = 7.6 Гц, 1H), 7.19 (d, J = 7.6 Гц, 1H), 3.70 (dt, J = 6.2, 5.2 Гц, 2H), 2.73 (t, J = 7.6 Гц, 2H), 1.92 (квинт, J = 6.8 Гц, 2H), 1.27 (t, J = 5.2 Гц, 1H).
Стадия 2: Взаимодействие 3-(3-(бифенил-3-илэтинил)фенил)пропан-1-ола с фталимидом выполняли могласно способу, описанному в Примере 21. Очистка флэш хроматографией (6% ЕtOАс-гексаны) позволила получить 2-(3-(3-(бифенил-3-илэтинил)фенил)пропил)изоиндолин-1,3-дион. Выход (0.320 г, 42%):1Н ЯМР (400 МГц, CDCl3) δ 7.84 (dd, J = 5.6, 3.2 Гц, 2H), 7.77 (m, 1H), 7.71 (dd, J = 5.6, 3.2 Гц, 2H), 7.61-7.63(m, 2H), 7.32-7.57 (m, 8H), 7.18-7.25 (m, 2H), 3.77 (t, J = 7.2 Гц, 2Н), 2.70 (t, J = 7.2 Гц, 2Н), 2.02-2.09 (m, 2H).
Стадия 3: Снятие защиты 2-(3-(3-(бифенил-3-илэтинил)фенил)пропил) изоиндолин-1,3-диона согласно способу, описанному в Примере 21, с последующей очисткой препаративной ВЭЖХ (Способ 1P) позволило получить 3-(3-(бифенил-3-илэтинил)фенил)пропан-1-амин трифторацетат в виде белого тягучего твердого вещества. Выход (0.16 г, 52%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.83 (br s, 1H), 7.71-7.15 (m, 3H), 7.67 (br s, 2H), 7.38-7.55 (m, 8H), 7.28-7.30 (m, 1H), 2.77-2.82 (m, 2H), 2.68 (t, J = 7.2 Гц, 2Н), 1.86 (квинт, J = 7.6 Гц, 2H).
Стадия 4: 3-(3-(бифенил-3-илэтинил)фенил)пропан-1-амин трифторацетат гидрировали с помощью способа Примера 13 для получения Примера 32 трифторацетата в виде белого твердого вещества. Выход (0.019 г, 23%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.58-7.60 (m, 2H), 7.40-7.45 (m, 4H), 7.30-7.34 (m, 4H), 7.12-7.20 (m, 2H), 6.96-7.04 (m, 3H), 2.84-2.93 (m, 6H), 2.48-2.53 (m, 2H), 1.52-1.11 (m, 2H).
ПРИМЕР 33
Приготовление 3-(3-(6-метоксигексил)фенил)пропан-1-амина

3-(3-(б-метоксигексил)фенил)пропан-1-амин был приготовлен согласно способу, который использовали для приготовления Примера 22:
Стадия 1: Арилбромид 57 взаимодействовал с 6-метоксигекс-1-ине согласно способу, который использовали для приготовления Примера 13. Очистка флэш хроматографией (10% EtOAc-гексаны) позволила получить трет-бутил 3-(3-(6-метоксигекс-1-инил)фенил)пропилкарбамат в виде коричневого масла. Выход (0.20 г, 36%).
Стадия 2: Снимали защиту трет-бутил 3-(3-(6-метоксигекс-1-инил)фенил)пропилкарбамата согласно способу, который использовали в Примере 13, за исключением того, что в качестве сорастворителя в реакции использовали СН2Сl2 (раствор HCl-диоксана: СН2Сl2 7:5). Очистка препаративной ВЭЖХ (Способ 2Р) позволила получить 3-(3-(6-метоксигекс-1-инил)фенил)пропан-1-амин гидрохлорид в виде грязно-белого твердого вещества. Выход (0.050 г, 30%):1Н ЯМР (400 МГц, CDCl3) δ 8.37 (br s, 3H), 7.10-7.24 (m, 4H), 4.02 (t, J = 6.4 Гц, 2H), 3.78 (s, 3H), 2.98 (t, J = 7.6 Гц, 2H), 2.69 (t, J = 7.6 Гц, 2H), 2.44 (t, J = 7.6 Гц, 2H), 2.04-2.12 (m, 2H), 1.82-1.89 (m, 2H), 1.63-1.73 (m, 2H).
Стадия 3: 3-(3-(6-метоксигексил)фенил)пропан-1-амин гидрохлорид гидрировали с помощью способов в Примере 17 для получения Примера 33 гидрохлорида в виде белого полутвердого вещества. Выход (0.025 г, 82%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.89 (br s, 3Н), 7.16 (t, J = 7.6 Гц, 1H), 6.96-7.01 (m, 3Н), 4.02 (t, J = 6.8 Гц, 2Н), 3.64 (s, 3H), 2.72 (t, J = 7.6 Гц, 2Н), 2.57 (t, J = 7.6 Гц, 2Н), 2.50 (t, J = 7.6 Гц, 2Н), 1.76-1.83 (m, 2Н), 1.48-1.57 (m, 4H), 1.25-1.33 (m, 4H).
ПРИМЕР 34
Приготовление 3-(3-(октан-4-ил)фенил)пропан-1-амина

3-(3-(октан-4-ил)фенил)пропан-1-амин был приготовлен согласно способу, показанному на Схеме 13.
Схема 13
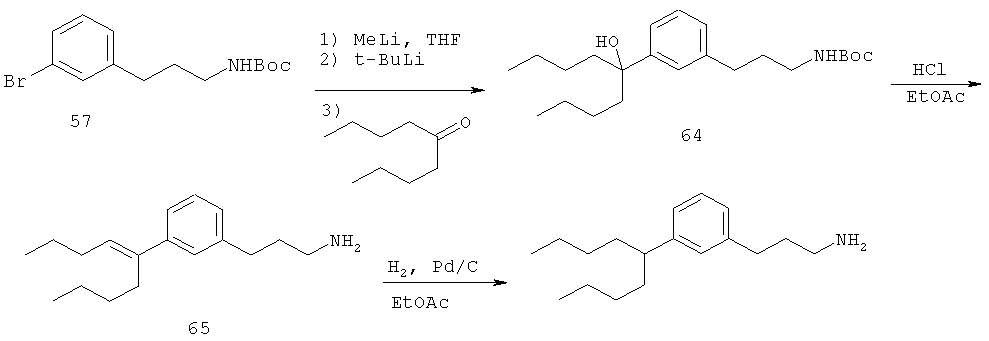
Стадия 1: В раствор соединения 57 при -78°С (0.650 г, 2.07 ммоль, сырой) в безводном THF (20 мл) добавляли MeLi (1.36 мл 1.6 M раствора в диэтиловом эфире, 2.17 ммоль) и смесь перемешивали в течение 10 мин. Добавляли трет-бутиллития (2.5 мл 1.7 М раствора в пентане, 4.24 ммоль) и реакционную смесь перемешивали при -78°С в течение 45 мин. В смесь добавляли 5-нонанон (0.324 г, 2.28 ммоль). После нагрева смеси до комнатной температуры реакцию осаждали добавлением насыщенного водного раствора NH4Cl (15 мл) и устанавливали рН 5 с помощью 1 M HCl. Смесь экстрагировали EtOAc и объединенные органические слои высушивали над Na2SO4 и концентрировали при пониженном давлении для получения спирта 64 в виде масла. Выход (0.090 г, 12%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.14-7.19 (m, 3Н), 6.97 (d, J = 8.0 Гц, 1H), 6.87 (t, J = 4.0 Гц, 1Н), 4.48 (s, 1H), 2.92 (q, J = 8.0 Гц, 2Н), 2.53 (t, J = 8.0 Гц, 2Н), 1.59-1.74 (m, 6H), 1.37 (s, 9H), 1.15-1.23 (m, 6H), 0.84-0.91 (m, 2Н), 0.77 (t, J = 8.0 Гц. 6H).
Стадия 2: Раствор спирта 64 (0.081 г, 0.215 ммоль) в НСl (2 мл 4.2 M раствора в EtOAc, 8.4 ммоль) перемешивали при комнатной температуре в течение ночи. После концентрирования при пониженном давлении получали алкен 65 гидрохлорид в виде масла и использовали без очистки. (Выход 0.066 г, колич.):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.94 (br s, 3Н), 7.11-7.37 (m, 3H), 7.07 (d, J = 8.0 Гц, 1H), 5.63 (t, J = 8.0 Гц, 1H), 2.77-2.80 (m, 2Н), 2.64 (t, J = 8.0 Гц, 2Н), 2.47 (t, J = 8.0 Гц, 2Н), 2.15 (q, J = 8.0 Гц, 2Н), 1.81-1.91 (m, 2Н), 1.44 (q, J = 8.0 Гц, 2Н), 1.17-1.27 (m, 4H), 0.93 (t, J = 8.0 Гц, 3Н), 0.83 (t, J = 8.0 Гц, 3Н).
Стадия 3: Гидрирование соединения 65 выполняли согласно способу, который использовали в Примере 2, за исключением того, что в качестве растворителя использовали EtOAc. Очистка флэш хроматографией (10% 7М NH3 в МеОН-СН2Сl2) позволила получить Пример 34 в виде масла. Выход (0.013 г, 30%):1Н ЯМР (400 МГц, CDCl3) δ 7.21 (t, J = 8.0 Гц, 1H), 6.96-7.03 (m, 3Н), 2.75 (t, J = 8.0 Гц, 2Н), 2.65 (t, J = 8.0 Гц, 2Н), 2.41-2.48 (m, 1H), 1.75-1.84 (m, 2Н), 1.48-1.67 (m, 4H), 1.44 (br s, 2Н), 1.05-1.34 (m, 8Н),0.84(t, J = 8.0 Гц, 6Н).
ПРИМЕР 35
Приготовление 3-(3-(4-фенилбутил)фенил)пропан-1-амина

3-(3-(4-фенилбутил)фенил)пропан-1-амин был приготовлен согласно способу, который использовали в Примере 22.
Стадия 1: Арилбромид 57 взаимодействовал с бут-3-инилбензолом согласно способу, который использовали в Примере 22. Очистка флэш хроматографией (10% EtOAc-гексаны) позволила получить трет-бутил 3-(3-(4-фенилбут-1-инил)фенил)пропилкарбамат в виде коричневого масла. Выход (0.40 г, 82%).
Стадия 2: Снимали защиту трет-бутил 3-(3-(4-фенилбут-1-инил)фенил)пропилкарбамата согласно способу, который использовали в Примере 22 для получения 3-(3-(4-фенилбут-1-инил)фенил)пропан-1-амина гидрохлорида в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 7.74 (br s, 3Н), 7.14-7.28 (m, 9H), 2.82 (t, J = 7.2 Гц, 2Н), 2.71 (t, J = 7.6 Гц, 2Н), 2.67 (t, J = 7.2 Гц, 2Н), 2.58 (t, J = 7.6 Гц, 2Н), 1.78 (квинт, J = 7.6 Гц, 2Н).
Стадия 3: 3-(3-(4-фенилбут-1-инил)фенил)пропан-1-амин гидрохлорид гидрировали согласно способу, который использовали в Примере 17, за исключением того, что время реакции составило 2 ч, для получения Примера 35 гидрохлорида в виде белого твердого вещества. Выход (0.040 г, 49%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.91 (br s, 3H), 7.24 (t, J = 7.6 Гц, 2Н), 7.12-7.19 (m, 4H), 6.98-6.99 (m, 3H), 2.73 (t, J = 7.6, 2H), 2.56-2.59 (m, 6H), 1.77-1.84 (m, 2H), 1.54-1.55 (m, 4H).
ПРИМЕР 36
Приготовление 2-(3-(2-(пиридин-3-ил)этил)фенокси)этанамина

2-(3-(2-(пиридин-3-ил)этил)фенокси)этанамин был приготовлен согласно способу, показанному на схеме 14:
Схема 14
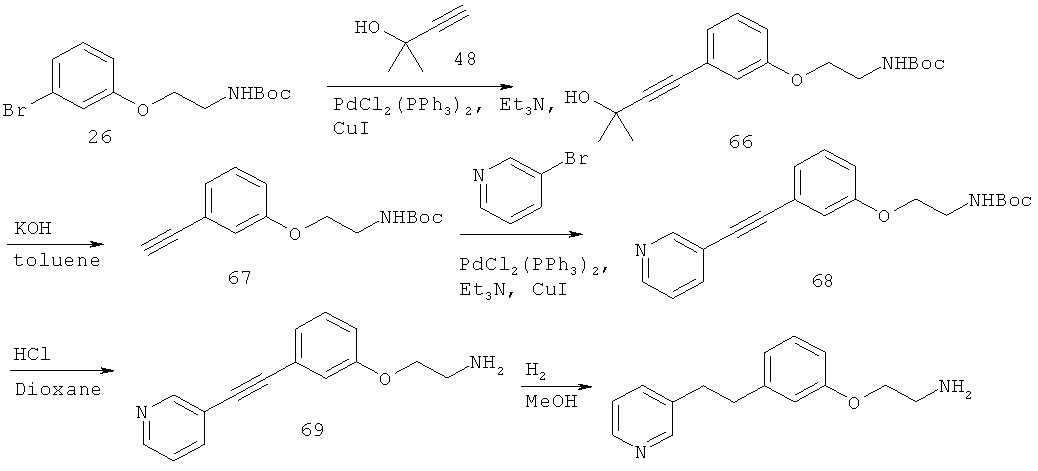
Стадия 1: Взаимодействие бромида 26 с 2-метилбут-3-ин-2-олом (48) согласно способу, который использовали в Примере 13, позволило получить алкин 66 в виде темно-желтого твердого вещества. Выход (0.90 г, 90%):1H ЯМР (400 МГц, СDСl3): δ 7.21 (t, J = 8.0 Гц, 1Н), 7.02 (d, J = 7.6 Гц, 1Н), 6.93-6.95 (m, 1H), 6.85 (ddd, J = 8.4, 2.8, 0.8 Гц, 1 Н), 4.97 (br s, 1Н), 4.01 (t, J = 5.2 Гц, 2H), 3.51-3.52 (m, 2H), 1.62, (s, 6H), 1.56 (s, 9H).
Стадия 2: Обработка алкина 66 КОН согласно способу, который использовали в Примере 21, позволило получить алкин 67 в виде коричневого масла. Выход (0.20 г, 80%):
1Н ЯМР (400 МГц, CDCl3) δ 7.23 (d, J = 8.0 Гц, 1Н), 7.10 (dt, J = 7.6, 1.2 Гц, 1Н), 7.00-7.02 (m, 1Н), 6.90 (ddd, J = 8.4, 2.8, 0.8 Гц, 1Н), 4.97 (br s, 1Н), 4.01 (t, J = 5.2 Гц, 2Н), 3.49-3.54 (m, 2Н), 3.06 (s, 1Н), 1.45 (s, 9H).
Стадия 3: Взаимодействие алкина 67 с 3-бромпиридином согласно способу, который использовали в Примере 13, позволило получить алкин 68 в виде коричневого масла. Выход (0.340 г, 44%):1Н ЯМР (400 МГц, CDCl3) δ 8.76 (d, J = 1.4 Гц, 1Н), 8.55 (dd, J = 4.8, 1.2 Гц, 1Н), 7.81 (dt, J = 8.0, 1.6 Гц, 1Н), 7.29 (t, J = 4.4 Гц, 1Н), 7.28 (s, 1Н), 7.16 (d, J = 8.0 Гц, 1Н), 7.06 (br s, 1Н), 6.92 (dd, J = 8.4, 2.8 Гц, 1Н), 4.05 (t, J = 5.2 Гц, 2Н), 3.54 (q, J = 5.2 Гц, 2Н), 1.46 (s, 9H).
Стадия 4: Снятие защиты алкина 68 с помощью HCl-диоксан согласно способу, который использовали в Примере 13, позволило получить амин 69 гидрохлорид в виде грязно-белого твердого вещества. Выход (0.230 г, 83%):1Н ЯМР (400 МГц, ДМСО-D6) δ 8.78 (br s, 1Н), 8.60 (dd, J = 4.8, 1.6 Гц, 1Н), 8.11 (br s, 3H), 8.02-8.04 (m, 1Н), 7.51 (dd, J = 8.0, 5.2 Гц, 1Н), 7.37 (t, J = 8.0 Гц, 1Н), 7.20 (d, J = 8.0 Гц, 1Н), 7.18 (d, J = 1.6 Гц, 1Н), 7.06 (dd, J = 8.4, 2.4 Гц, 1Н), 4.20 (t, J = 4.8 Гц, 2Н), 3.19 (dd, J = 10.4, 5.6 Гц, 2Н).
Стадия 5: Гидрирование амина 69 гидрохлорида выполняли согласно способу, который использовали в Примере 35. После перемешивания в течение 2 ч твердую фазу удаляли фильтрацией. Фильтрат концентрировали при пониженном давлении и остаток растворяли в концентрированном гидрохлориде аммония. Водный раствор экстрагировали СН2Cl2. Объединенные органические слои концентрирвали при пониженном давлении для получения Примера 36 в виде бесцветного масла. Выход (0.080 г, 39%):1Н ЯМР (400 МГц, ДМСО-d6) δ 8.39 (s, 1Н), 8.36 (d, J = 4.4 Гц, 1Н), 7.61 (d, J = 7.6 Гц, 1Н), 7.26 (dd,J = 7.6, 4.8, 1Н), 7.14 (t, J = 8.0, 1Н), 6.71-6.77 (m, 3H), 3.85 (t, J = 5.6, 2Н), 2.82-2.84 (m, 6H).
ПРИМЕР 37
Приготовление 2-(3-(2-(пиридин-2-ил)этил)фенокси)этанамина

32-(3-(2-(пиридин-2-ил)этил)фенокси)этанамин был приготовлен согласно способу, который использовали в Примере 36:
Стадия 1: Взаимодействие алкина 67 с 2-бромпиридином выполняли согласно способу, который использовали в Примере 13. Очистка флэш хроматографией (20% EtOAc-гексаны) позволила получить трет-бутял 2-(3-(пиридин-2-илэтинил) фенокси)этилкарбамат в виде желтого масла. Выход (0.50 г, 64%):1Н ЯМР (400 МГц, CDCl3): δ 8.63 (d, J = 4.0 Гц, 1Н), 7.69 (dt, J = 7.6, 1.6 Гц, 1Н), 7.53 (d, J = 7.6 Гц, 1Н), 7.24-7.26 (m, 2H), 7.21 (dt, J = 8.0, 1.2 Гц, 1Н), 7.12-7.13 (m, 1Н), 6.93 (ddd, J = 8.0, 2.4, 1.2 Гц, 1Н), 4.98 (br s, 1Н), 4.03 (t, J = 5.2, 2H), 3.54-3.56 (m, 2H), 1.46 (s, 9H).
Стадия 2: Снятие защиты 2-(3-(пиридин-2-илэтинил)фенокси)этилкарбамата с помощью HCl-диоксан согласно способу, который использовали в Примере 13, позволило получить 2-(3-(пиридин-2-илэтинил)фенокси)этанамин гидрохлорид в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 8.61 (dt, J = 5.2, 0.8 Гц, 1Н), 8.20 (br s, 3H), 7.92 (dt, J = 8.0,2.0 Гц, 1Н), 7.69 (d, J = 8.0 Гц, 1Н), 7.47 (ddd, J = 7.6, 5.2, 1.2 Гц, 1Н), 7.39 (t, J = 8.0 Гц, 1Н), 7.22 (d, J = 7.6 Гц, 1Н), 7.19-7.20 (m, 1Н), 7.08 (ddd, J = 8.0, 2.4, 0.8 Гц, 1Н), 4.21 (t, J = 5.2 Гц, 2Н), 3.18 (dt, J = 5.6, 5.2 Гц, 2Н).
Стадия 3: Гидрирование 2-(3-(пиридин-2-илэтинил)фенокси)этанамина гидрохлорида согласно способу, который использовали в Примере 17, за исключением того, что время реакции составило 3 ч, позволила получить Пример 37 гидрохлорид в виде белого твердого вещества. Выход (0.150 г, 73%):1Н ЯМР (400 МГц, ДМСО-d6) δ 8.69 (d, J = 5.2 Гц, 1Н), 8.26 (br s, 4H), 7.75 (d, J = 7.6 Гц, 1Н), 7.69 (t, J = 6.4 Гц, 1Н), 7.20 (t, J = 8.0 Гц, 1Н), 6.91 (s, 1Н), 6.84 (d, J = 7.6, 1Н), 6.80 (dd, J = 8.0,2.0 Гц, 1Н), 4.15 (t, J = 4.8 Гц, 2H), 3.27 (t, J = 8.0 Гц, 2H), 3.17 (d, J = 4.4 Гц, 1Н), 3.15 (d, J = 4.4 Гц, 1Н), 3.03 (t, J = 8.0 Гц, 2Н).
ПРИМЕР 38
Приготовление 2-(3-(2-(тиофен-2-ил)этил)фенокси)этанамина
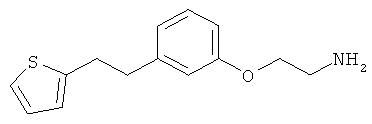
2-(3-(2-(тиофен-2-ил)этил)фенокси)этанамин был приготовлен согласно способу, который использовали в Примере 36:
Стадия 1: Взаимодействие алкина 67 с 2-бромтиофеном выполняли согласно способу, который использовали в Примере 13. Очистка флэш хроматографией (5% EtOAc-гексаны) позволила получить трет-бутил 2-(3-(тиофен-2-илэтинил)фенокси)этилкарбамат в виде коричневого масла. Выход (0.605 г, 57%).1Н ЯМР (400 МГц, СDСl3) δ 7.30 (dd, J = 5.2, 1.2 Гц, 1Н), 7.28-7.29 (m, 1Н), 7.25 (d, J = 8.4 Гц, 1Н), 7.12 (dt, J = 7.6, 1.2 Гц, 1Н). 7.03-7.04 (m, 1Н), 7.02 (dd, J = 5.2, 3.6 Гц, 1Н), 6.89 (ddd, J =8.0, 2.4, 0.8 Гц, 1Н), 4.99 (br s, 1H), 4.04 (t, J = 4.8 Гц, 2Н), 3.55 (dd, J = 10.0, 5.2 Гц, 2Н), 1.46 (s, 9H).
Стадия 2: Снятие защиты трет-бутил 2-(3-(тиофен-2-илэтинил)фенокси)этилкарбамата с помощью HCl-диоксана согласно способу, который использовали в Примере 13, позволило получить 2-(3-(тиофен-2-илэтинил)фенокси)этанамин гидрохлорид в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 8.14 (br s, 3Н), 7.66 (dd, J = 5.2, 1.2 Гц, 1H), 7.40 (dd, J = 3.6, 1.2 Гц, 1H), 7.14 (dd, J = 7.6, 1.2 Гц, 1H), 7.10-7.12 (m, 2Н), 7.03 (ddd, J = 8.4, 2.4, 1.2 Гц, 1Н), 4.19 (t, J = 5.2 Гц, 2Н), 3.17 (t, J = 5.2, 2Н).
Стадия 3: Гидрирование 2-(3-(тиофен-2-илэтинил)фенокси)этанамина гидрохлорида согласно способу, который использовали в Примере 13, позволило получить Пример 38 гидрохлорид в виде белого твердого вещества. Выход (0.15 г, 95%):1Н ЯМР (400 МГц, ДМСО-d6) δ 8.02 (br s, 3Н), 7.27 (dd, J = 5.2, 1.2 Гц, 1H), 7.18 (t, J = 8.0 Гц, 1H), 6.89 (dd, J = 5.2, 3.2 Гц, 1H), 6.81-6.84 (m, 3Н), 6.77 (dd, J = 8.4, 1.6 Гц, 1H), 4.11 (t, J = 5.2 Гц, 2Н), 3.16 (t, J = 5.2 Гц, 2 Н), 3.07 (t, J = 7.6 Гц, 2Н), 2.87 (t, J = 7.6 Гц, 2Н).
ПРИМЕР 39
Приготовление 5-(3-(3-аминопропил)фенетил)нонан-5-ола

5-(3-(3-аминопропил)фенетил)нонан-5-ол был приготовлен согласно способу, который использовали в Примере 2.
Стадия 1: Взаимодействие 3-этинилнонан-5-ола с бромидом 10 позволило получить N-(3-(3-(3-бутил-3-гидроксигепт-1-инил)фенил)пропил)-2,2,2-трифторацетамид в виде коричневого масла. Выход (0.346 г, 22%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1H), 7.14-7.26 (m, 4H), 5.11 (s, 1H), 2.56 (t, J = 7.6 Гц, 2Н), 2.47 (m, 2Н), 1.43-1.62 (m, 14Н),0.88 (1, J = 7.2 Гц, 6Н).
Стадия 2: Снятие защиты N-(3-(3-(3-бутил-3-гидроксигепт-1-инил)фенил) пропил)-2,2,2-трифторацетамида позволило получить 5-((3-(3-аминопропил)фенил) этинил)нонан-5-ол в виде светло-желтого масла. Выход (0.219 г, 84%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.22-7.26 (m, 1H), 7.14-7.17 (m, 3Н), 5.11 (s, 1H), 2.56 (t, J = 7.6 Гц, 2Н), 2.49 (t, J = 6.8 Гц, 2Н), 1.25-1.62 (m, 14H), 0.88 (t, J = 7.2 Гц, 6Н).
Стадия 3: Гидрирование 5-((3-(3-аминопропил)фенил)этинил)нонан-5-ола позволило получить Пример 39 в виде бесцветного масла. Выход (0.133 г, 69%):1Н ЯМР (400 МГц, СDCl3) δ 7.18 (t, J = 8.0 Гц, 1H), 6.97-7.03 (m, 3Н), 2.72 (t, J = 5.2 Гц, 2Н), 2.56-2.65 (m, 4H), 1.68-1.80 (m, 4H), 1.45-1.52 (m, 4H), 1.24-1.38 (m, 11Н), 0.91 (t, J = 6.8 Гц, 6Н). ESI MS m/z 306.7 [M+H]+, 288.6 [M+Н-H2O]+.
ПРИМЕР 40
Приготовление 3-(3-(3-метокси-3-пропилгексил)фенил)пропан-1-амина

3-(3-(3-метокси-3-пропилгексил)фенил)пропан-1-амин был приготовлен согласно способу, который использовали в Примере 2.
Стадия 1: Взаимодействие 4-этинил-4-метоксигептана с бромидом 10 позволило получить 2,2,2-трифтор-N-(3-(3-(3-метокси-3-пропилгекс-1-инил)фенил)пропил)ацетамид в виде светло-желтого масла. Выход (0.596 г, 93%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1Н), 7.18-7.29 (m, 4H), 3.25 (s, 3Н), 3.14-3.20 (m, 2H), 2.56 (t, J = 7.6 Гц, 2Н), 1.73-1.80 (m, 2H), 1.64 (t, J = 8.4 Гц, 4H), 1.34-1.44 (m, 4H), 0.88 (t, J = 7.2 Гц, 6Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(3-метокси-3-пропилгекс-1-инил)фенил)пропил)ацетамида позволило получить 3-(3-(3-метокси-3-пропилгекс-1-инил)фенил)пропан-1-амин в виде прозрачного масла. Выход (0.341 г, 93%);1Н ЯМР (400 МГц, ДМСО-d6) δ 7.27-7.18 (m, 4H), 3.25 (s, 3Н), 2.56 (t, J = 7.6 Гц, 2H), 2.47 (t, J = 6.8 Гц, 2H), 1.56-1.66 (m, 6Н), 1.32-1.44 (m, 6Н), 0.88 (t, J = 7.2 Гц, 6Н).
Стадия 3: Гидрирование 3-(3-(3-метокси-3-пропилгекс-1-инил)фенил)пропан-1-амина позволило получить Пример 40 в виде бесцветного масла. Выход (0.188 г, 71%);1H ЯМР (400 МГц, CDCl3) δ 7.18 (t, J = 8.0 Гц, 1Н), 6.95-7.04 (m, 3Н), 3.16 (s, 3Н), 2.72 (t, J = 7.2 Гц, 2H), 2.62 (t, J = 8.0 Гц, 2H), 2.48-2.55 (m, 2H), 1.64-1.80 (m, 4H), 1.41-1.48 (m, 4H), 1.24-1.35 (m, 4H), 1.20 (br s, 2H), 0.92 (t, J = 7.2 Гц, 6Н). ESI MS m/z 292.5 [M+H]+.
ПРИМЕР 41
Приготовление 1-(3-(3-аминопропил)фенил)-3-метилгексан-3-ола

1-(3-(3-аминопропил)фенил)-3-метилгексан-3-ол был приготовлен согласно способу, который использовали в Примере 2.
Стадия 1: Взаимодействие 3-метилгекс-1-ин-3-ола с бромидом 10 позволило получить 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3-метилгекс-1-инил)фенил)пропил) ацетамид, загрязненный алкиновым димером. Выход (0.699 г, >100%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1Н), 7.25 (dd, J = 8.8, 7.2 Гц, 1Н), 7.17-7.21 (m, 3Н), 5.29 (s, 1Н), 3.17 (q, J = 6.8 Гц, 2Н), 2.56 (t, J = 7.6 Гц, 2Н), 1.76 (квинт, J = 7.2 Гц, 2 Н), 1.48-1.61 (m, 4H), 1.39 (s, 3H), 0.90 (t, J = 7.6 Гц, 3Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3-метилгекс-1-инил)фенил)пропил)ацетамида с последующей очисткой флэш хроматографией (от 72:8:20 до 90:10:0 EtOAc/7 M NH3 в МеОН/гексаны) позволило получить 1-(3-(3-аминопропил)фенил)-3-метилгекс-1-ин-3-ол в виде желтого масла. Выход (0.371 г, 76%, две стадии):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.24 (t, J = 8 Гц, 1Н), 7.14-7.18 (m, 3H), 5.29 (br s, 1Н), 2.56 (t, J = 7.6 Гц, 2Н), 2.47 (t, J = 7.2 Гц, 2 Н), 1.41-1.62 (m, 6H), 1.39 (s, 3Н), 1.34 (br s, 2Н), 0.90 (t, J = 7.6 Гц, 3Н).
Стадия 3: Гидрирование 1-(3-(3-аминопропил)фенил)-3-метилгекс-1-ин-3-ола позволило получить Пример 41 в виде бледно-желтого масла. Выход (0.260 г, 77%);1H ЯМР (400 МГц, СDСl3) δ 7.18 (t, J = 8 Гц, 1Н), 6.97-7.02 (m, 3Н), 2.71 (t, J = 7.2 Гц, 2Н), 2.58-2.66 (m, 4H), 1.70-1.80 (m, 4H), 1.44-1.52 (m, 2Н), 1.35-1.44 (m, 2Н), 1.26-1.35 (br s, 3Н), 1.21 (s, 3Н), 0.93 (t, J = 7.2 Гц, 3Н). ESI MS m/z 250.5 [M+H]+, 232.4 [M+Н-Н2О]+.
ПРИМЕР 42
Приготовление 1-(3-(3-аминопропил)фенил)-3,5-диметилгексан-3-ола

1-(3-(3-аминопропил)фенил)-3,5-диметилгексан-3-ол был приготовлен согласно способу, который использовали в Примере 2 и 3.
Стадия 1: Взаимодействие 3,5-диметилгекс-1-ин-3-ола с бромидом 10 согласно способу, описанному в Примере 3 (за исключением того, что алкинол добавляли после дегазирования), позволило получить 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3,5-диметилгекс-1-инил)фенил)пропил)ацетамид в виде коричневого масла. Выход (0.287 г, 40%):1H ЯМР (400 МГц, ДМСО-d6) δ 9.41 (br s, 1Н), 7.26 (t, J = 7.6 Гц, 1Н), 7.16-7.20 (m, 3Н), 5.25 (s, 1Н), 3.16 (q, J = 6.8 Гц, 2Н), 2.56 (t, J = 7.2 Гц, 2Н), 1.90-1.96 (m, 1Н), 1.76 (квинт, J = 7.6 Гц, 2Н), 1.53 (m, 2Н), 1.42 (s, 3Н), 0.96 (d, J = 6.8 Гц, 6Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3,5-диметилгекс-1-инил)фенил)пропил)ацетамида согласно способу Примера 3, за исключением того, что реакционную смесь перемешивали при комнатной температуре в течение ночи, позволило получить 1-(3-(3-аминопропил)фенил)-3,5-диметилгекс-1-ин-3-ол в виде прозрачного масла. Выход (0.141 г, 72%):1Н ЯМР (400 МГц, ДМСО -d6) δ 7.14-7.27 (m, 4H), 5.25 (s, 1Н), 2.56 (t, J = 7.2 Гц, 2Н), 2.47 (t, J = 6.0 Гц, 2Н), 1.93 (квинт, J = 6.4 Гц, 1Н), 1.60 (q, J = 6.8 Гц, 2Н), 1.54 (t, J = 6.0 Гц, 2Н), 1.42 (s, 3H), 1.35 (br s, 2Н), 0.97 (d, J = 6.4 Гц, 6Н).
Способ 3: Гидрирование 1-(3-(3-аминопропил)фенил)-3,5-диметилгекс-1-ин-3-ола согласно способу Примера 2 с последующей флэш хроматографией (5% (7N NH3/МеОН)/дихлорметан), позволило получить Пример 42 в виде бесцветного масла. Выход (0.048 г, 41%);1Н ЯМР (400 МГц, CDCl3) δ 7.18 (t, J = 8.0 Гц, 1Н), 6.97-7.03 (m, 3Н), 2.71 (t, J = 7.2 Гц, 2H), 2.57-2.68 (m, 4H), 1.70-1.88 (m, 5H), 1.36-1.52 (m, 5H), 1.24 (s, 3Н), 0.97 (dd, J = 6.4, 2.8 Гц, 6Н). ESI MS m/z 264.5 [M+H]+, 246.5 [M+Н-H2O]+.
ПРИМЕР 43
Приготовление 1-(3-(3-аминопропил)фенетил)-2,2,6,6-тетраметилциклогексанола

1-(3-(3-аминопропил)фенетил)-2,2,6,6-тетраметилциклогексанол был приготовлен согласно способу, который использовали в Примерах 2 и 4.
Стадия 1: Взаимодействие 1-этинил-2,2,6,6-тетраметилциклогексанола с бромидом 10 согласно способу, который использовали в Примере 4, позволило получить 2,2,2-трифтор-N-(3-(3-((1-гидрокси-2,2,6,6-тетраметилциклогексил)этинил)фенил)пропил)ацетамид в виде светло-коричневой пены. Выход (0.192 г, 84%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1Н), 7.27 (t, J = 7.6 Гц, 1Н), 7.18-7.23 (m, 3Н), 4.92 (s, 1Н), 3.18 (q, J = 6.8 Гц, 2H), 2.57 (t, J = 7.2 Гц, 2H), 1.76 (квинт, J = 7.6 Гц, 2H), 1.22-1.50 (m, 6Н), 1.14 (s, 6 Н), 1.04 (s, 6Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-((1-гидрокси-2,2,6,6-тетраметилциклогексил)этинил)фенил)пропил)ацетамида выполняли согласно процедуре, описанной в Примере 4, за исключением того, что продукт очищали флэш хроматографией (10% 7 M NH3 в MeOH-EtOAc), что дало возможность получить 1-((3-(3-аминопропил)-фенил)этинил)-2,2,6,6-тетраметилциклогексанол в виде белого твердого вещества. Выход (0.016 г, 73%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.15-7.27 (m, 4H), 4.92 (s, 1Н), 2.57 (t, J = 7.2 Гц, 2H), 2.47 (t, J = 7.2 Гц, 2H), 1.26-1.66 (m, 10Н), 1.14 (s, 6Н), 1.04 (s, 6Н).
Стадия 3: Гидрирование 1-((3-(3-аминопропил)-фенил)этинил)-2,2,6,6-тетраметилциклогексанола согласно способу, который использовали для Примера 2, позволило получить Пример 43 в виде бесцветного масла. Выход (0.075 г, 79%);1Н ЯМР (400 МГц, СDСl3) δ 7.20 (t, J = 8.0 Гц, 1Н), 6.97-7.06 (m, 3Н), 2.60-2.77 (m, 6Н), 1.86-1.92 (m, 2H), 1.73-1.82 (m, 2H), 1.54-1.69 (m, 3Н), 1.49 (br s, 3Н), 1.36-1.44 (m, 1Н), 1.11-1.22 (m, 2H), 1.05 (s, 6Н), 1.01 (s, 6Н). ESI MS m/z 318.7 [M+H]+, 300.7 [M+Н-H2O]+.
ПРИМЕР 44
Приготовление 4-(3-(3-амино-2,2-диметилпропил)фенетил)гептан-4-ола

4-(3-(3-амино-2,2-диметилпропил)фенетил)гептан-4-ол был приготовлен согласно способу, показанному на Схеме 15:
Схема 15
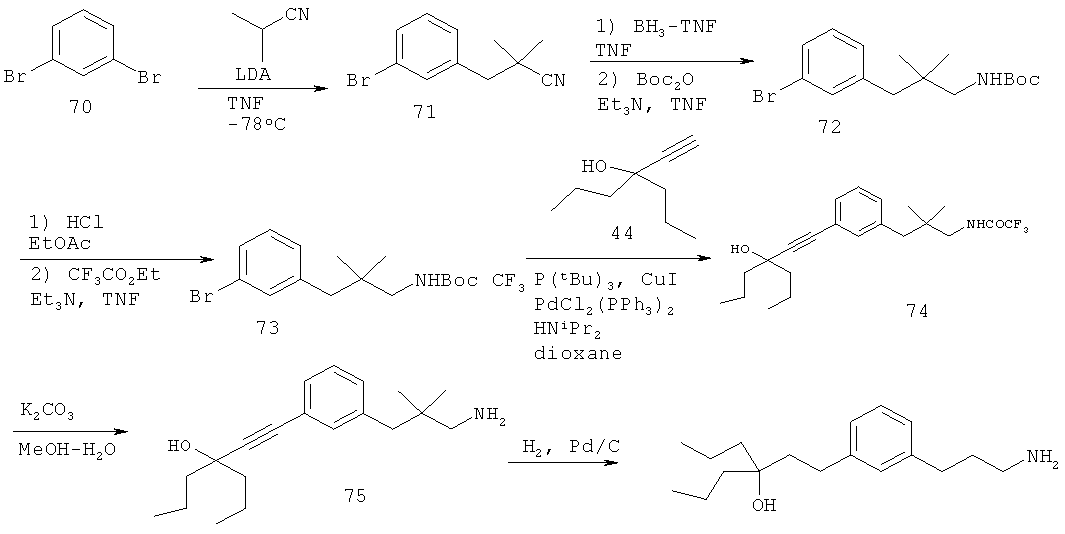
Стадия 1: В высушенную в печи колбу в атмосфере аргона загружали изобутиронитрил (2.15 мл, 24.0 ммоль) и безводный THF (60 мл) и охлаждали до -78°С. Добавляли раствор лития диизопропиламида (12 мл 2.0 М раствора в смеси гептан/THF/этилбензол, 24 ммоль) аликвотами в течение 20 мин, после чего реакционную смесь перемешивали в течение 25 мин. Добавляли 3-бромбензилбромид (70) (3.98 г, 15.92 ммоль) и удаляли холодную ванну. После перемешивания в течение дополнительных 2 ч реакционную смесь осаждали медленным добавлением воды, затем добавляли EtOAc. Водный слой частично насыщали хлоридом натрия. Слои разделяли и водный слой экстрагировали дважды EtOAc. Объединенные органические слои отмывали водой и солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении для получения нитрила 71 в виде оранжевого масла, которое затем отверждалось (4.16 г, колич. выход). Этот материал использовали на следующей стадии синтеза без дальнейшей очистки.1Н ЯМР (400 МГц, CDCl3) δ 7.40-7.45 (m, 2H), 7.20-7.25 (m, 2H), 2.78 (s, 2H), 1.36 (s, 6H).
Стадия 2: В ледяную смесь сырого 3-(3-бромфенил)-2,2-диметилпропаннитрила (71) (3.0 г, 12.6 ммоль) в безводном THF (20 мл) медленно добавляли ВН3-THF (20 мл 1М раствора в THF, 20 ммоль). Реакционную смесь оставляли медленно нагреваться и перемешивали в течение 19 ч. Реакционную смесь осаждали прикапыванием 6М НСl, после чего перемешивали в течение 1.5 ч. Летучие вещества удаляли при пониженном давлении. Водный слой дважды экстрагировали диэтиловым эфиром, затем добавляли ЕtOАс и смесь подщелачивали 5М водным раствором КОН. Слои разделяли и водный слой дважды экстрагировали EtOAc. Объединенные органические слои отмывали солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении для получения 3-(3-бромфенил)-2,2-диметилпропан-1-амина в виде светло-желтого масла (2.3 г). Этот материал использовали на следующей стадии без дальнейшей очистки.1Н ЯМР (400 МГц, CDCl3) δ 7.32-7.35 (m, 1H), 7.30 (t, J=1.7 Гц, 1Н), 7.13 (t, J=7.7 Гц, 1H), 7.06 (dd, J = 7.6,1.2 Гц, 1H), 2.50 (s, 2H), 2.47 (s, 2H), 0.84 (s, 6H).
Стадия 3: Сырой 3-(3-бромфенил)-2,2-диметилпропан-1-амин (2.3 г) растворяли в THF (40 мл). Добавляли ди-трет-бутилдикарбонат (2.3 г, 10.5 ммоль), затем триэтиламин (2.8 мл, 20.1 ммоль) и смесь перемешивали в течение 1.5 ч. Реакционную смесь концентрировали при пониженном давлении и продукт очищали флэш хроматографией (градиент 0-35% EtOAc-гексаны) для получения арилбромида 72 в виде бесцветного масла. Выход (3.3 г, 77%):1Н ЯМР (400 МГц, CDCl3) δ 7.34 (d, J = 7.6 Гц, 1H), 7.27 (t, J = 1.6 Гц, 1H), 7.14 (t, J = 7.7 Гц, 1H), 7.05 (d, J = 7.8 Гц, 1H), 4.58 (br s, 1H), 2.98 (d, J = 6.5 Гц, 2H), 2.48 (s, 2H), 1.45 (s, 9H), 0.85 (s, 6H).
Стадия 4: трет-Буткл 3-(3-бромфенил)2,2-диметилпропилкарбамат (72) (3.2 г, 9.35 ммоль) растворяли в EtOAc (55 мл) и добавляли раствор HCl-EtOAc (~4.2 M, 20 мл, 84 ммоль). Реакционную смесь вентилировали с помощью иглы и перемешивали при комнатной температуре в течение 2.5 ч. Реакционную смесь разбавляли гексанами и твердое белое вещество собирали на воронке из фриттированного стекла. Исходный раствор концентрировали при пониженном давлении, суспендировали смесью ~5-10% EtOAc-гексаны, после чего собирали белое твердое вещество и соединяли с первой партией. Твердую фазу высушивали в вакуумной печи при комнатной температуре в течение ночи для получения чистого 3-(3-бромфенил)-2,2-диметилпропан-1-амина гидрохлорида в виде белого твердого вещества. Выход (1.52 г):1Н ЯМР (400 МГц, CDCl3)δ 8.53 (br s, 2H), 7.37 (dq, J = 1.2 и 8.0 Гц, 1Н), 7.31 (t, J = 1.6 Гц, 1Н), 7.13 (t, J = 7.7 Гц, 1H), 7.08 (dt, J = 8.0, 1.6 Гц, 1Н), 2.83-2.84 (m, 2H), 2.67 (s, 2H), 1.09 (s, 6H).
Стадия 5: 3-(3-бромфенил)-2,2-диметилпропан-1-амин гидрохлорид (1.52 г, 5.45 ммоль) растворяли в безводном THF (50 мл). Медленно добавляли EtsN (1.5 мл, 10.76 ммоль) для получения белой суспензии. Добавляли этилтрифторацетат (2 мл, 16.8 ммоль) и смесь перемешивали при комнатной температуре в течение 15.5 ч. Добавляли дополнительное количество этилтрифторацетата ((~0.75 мл, 6.2 ммоль) и триэтиламин (0.75 мл, 5.4 ммоль), и смесь перемешивали в течение 4 ч. Реакционную смесь концентрировали при пониженном давлении. Продукт помещали в EtOAc, после чего раствор отмывали насыщенным водным раствором NaHCO3 (2X) и солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении для получения N-(3-(3-бромфенил)-2,2-диметилпропил)-2,2,2-трифторацетамида (73) в виде желтого масла. Выход (1.84 г, 58% выход для двух стадий):1Н ЯМР (400 МГц, CDCl3) δ 7.39 (ddd, J = 8.0, 2.0, 0.8 Гц, 1Н), 7.29 (t, J = 1.6 Гц, 1Н), 7.17 (t, J = 7.6 Гц, 1Н), 7.05 (dt, J = 7.6, 1.6 Гц, 1Н), 6.16 (br s, 1Н), 3.24 (d, J = 6.8 Гц, 2H), 2.53 (s, 2H), 0.93 (s, 6H).
Стадия 6: N-(3-(3-бромфенил)-2,2-диметилпропил)-2,2,2-трифторацетамид (73) (0.489 г, 1.45 ммоль) взаимодействовал с 4-этинилгептан-4-олом (44) (0.28 г, 2.0 ммоль) согласно способу, описанному в Примере 16, и продукт очищали флэш хроматографией (градиент от 0 до 50% EtOAc-гексаны) для получения 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3-пропилгекс-1-инил)фенил)-2,2-диметилпропил)ацетамида (74) в виде желтого масла. Выход (0.350 г, 61%):1H ЯМР (400 МГц, CD3OD) δ 7.20-7.25 (m, 3Н), 7.12-7.15 (m, 1Н), 3.19 (s, 2H), 2.54 (s, 2H), 1.58-1.71 (m, 8H), 0.98 (t, J = 7.2 Гц, 6H), 0.85 (s, 6H).
Стадия 7: Снятие защиты 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3-пропилгекс-1-инил)фенил)-2,2-диметилпропил)ацетамида (74) (0.345 г, 0.87 ммоль) выполняли согласно способу, описанному в Примере 2, и продукт очищали флэш хроматографией (от 90 до 100% EtOAc-гексаны, затем 10% 3.5 M NHs в MeOH-EtOAc) для получения алкина 75 в виде масла вместе с восстановленным исходным материалом. Выход (0.0847 г, 32% выход):1H ЯМР (400 МГц, CD3OD) δ 7.19-7.24 (m, 3Н), 7.11-7.13 (m, 1Н), 2.53 (s, 2H), 2.44 (s, 2H), 1.56-1.72 (m, 8H), 0.98 (t, J = 7.2 Гц, 6H), 0.85 (s, 6H).
Стадия 8: Гидрирование алкина 75 согласно способу, который использовали для Примера 2, позволило получить Пример 44 в виде бледно-желтого масла. Выход (0.077 г, 99%):1Н ЯМР (400 МГц, ДМСО-d6) 5 7.11 (t, J = 7.6 Гц, 1Н), 6.95 (d, J = 7.8 Гц, 1Н), 6.88-6.90 (m, 2H), 3.93 (s, 1Н), 2.40 (s, 2H), 2.26 (s, 2H), 1.50-1.55 (m, 2H), 1.43 (br s, 2H), 1.21-1.34 (m, 8H), 0.83 (t, J = 7.0 Гц, 6H), 0.71 (s, 6H). ESI MS m/z 306.4 [M+H]+
ПРИМЕР 45
Приготовление 1-(3-(3-аминопропил)фенил)-3,4-диметилпентан-3-ола
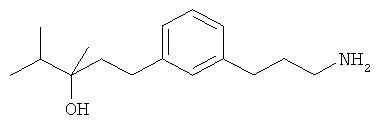
1-(3-(3-аминопропил)фенил)-3,4-диметилпентан-3-ол был приготовлен согласно способу, который использовали в Примере 2.
Стадия 1: Взаимодействие 3,4-диметилпент-1-ин-3-ола с бромидом 10 позволило получить 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3,4-диметилпент-1-инил)фенил)пропил)ацетамид в виде янтарного масла. Выход (0.98 г, 89%):1H ЯМР (400 МГц, CD3OD) δ 7.15-7.25 (m, 4H), 3.27-3.31 (m, 2H), 2.62 (t, J = 7.6 Гц, 2Н), 1.82-1.90 (m, 3Н), 1.50 (s, 3H), 1.09 (d, J = 6.4 Гц, 3Н), 1.05 (d, J = 6.8 Гц, 3Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3,4-диметилпент-1-инил)фенил)пропил)ацетамида позволило получить 1-(3-(3-аминопропил)фенил)-3,4-диметилпент-1-ин-3-ол в виде желтого масла. Выход (0.456 г, 65%):1H ЯМР (400 МГц, CD3OD) δ 7.15-7.25 (m, 4H), 2.60-2.65 (m, 4H), 1.85 (квинт, J = 6.8 Гц, 1Н), 1.72-1.79 (m, 2H), 1.47 (s, 3Н), 1.09 (d, J = 6.8 Гц, 3Н), 1.05 (d, J = 6.8 Гц, 3Н)
Стадия 3: Гидрирование 1-(3-(3-аминопропил)фенил)-3,4-диметилпент-1-ин-3-ола позволило получить Пример 45 в виде бесцветного масла. Выход (0.384 г, 84%):1Н ЯМР (400 МГц, CDCl3) δ 7.18 (t, J = 8.0 Гц, 1Н), 6.97-7.03 (m, 3Н), 2.71 (t, J = 7.2 Гц, 2H), 2.58-2.69 (m, 4H), 1.70-1.82 (m, 5H), 1.50 (br s, 3Н), 1.14 (s, 3Н), 0.93 (dd, J = 12.4, 6.8 Гц, 6Н). ESI MS m/z 250.5 [M+H]+, 232.5 [M+H-H2O]+.
ПРИМЕР 46
Приготовление 4-(3-(3-аминопропил)фенил)-2-фенилбутан-2-ола

4-(3-(3-аминопропил)фенил)-2-фенилбутан-2-ол был приготовлен согласно способу, который использовали в Примерах 2 и 4.
Стадия 1: Взаимодействие 2-фенилбут-3-ин-2-ола с бромидом 10 позволило получить 2,2,2-трифтор-N-(3-(3-(гидрокси-3-фенилбут-1-инил)фенил)пропил)ацетамид в виде желтого масла.1Н ЯМР (400 МГц, ДМСО-d6) δ 9.41 (br s, 1Н), 7.62 (m, 2H), 7.51 (m, 1Н), 7.36 (m, 2H), 7.26 (m, 4H), 6.15 (s, 1Н), 3.16 (m, 2H), 2.57 (m, 2H), 1.78 (m, 2H), 1.69 (s, 3Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(гидрокси-3-фенилбут-1-инил)фенил)пропил)ацетамида позволило получить 4-(3-(3-аминопропил)фенил)-2-фенилбут-3-ин-2-ол в виде желтого масла. Выход (0.122 г, 27% для двух стадий):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.60-7.63 (m, 1Н), 7.33-7.38 (m, 1H), 7.18-7.28 (m, 7H), 6.16 (br s, 1H), 2.57 (m, 2H), 2.51 (m, 2H), 1.69 (s, 3H), 1.56-1.63 (m, 2H), 1.34 (br s, 2H).
Стадия 3: Гидрирование 4-(3-(3-аминопропил)фенил)-2-фенилбут-3-ин-2-ола позволило получить Пример 46 в виде бесцветного масла. Выход (0.073 г, 71%):1Н ЯМР (400 МГц, CDCl3) δ 7.37-7.42 (m, 2H), 7.25-7.31 (m, 2H), 7.14-7.29 (m, 1H), 7.04-7.10 (m, 1H), 6.84-6.91 (m, 3H), 2.60 (t, J = 7.2 Гц, 2H), 2.46-2.57 (m, 3H), 2.29-2.38 (m, 1H), 1.96-2.10 (m, 2H), 1.60-1.80 (m, 5H), 1.51 (s, 3H). ESI MS m/z 284.5 [M+H]+, 266.5 [M+Н-H2O]+.
ПРИМЕР 47
Приготовление 1-(3-(3-аминопропил)фенил)-4-метилпентан-3-ола

1-(3-(3-аминопропил)фенил)-4-метилпентан-3-ол был приготовлен согласно способу, который использовали в Примерах 2 и 4.
Стадия 1: Взаимодействие 4-метилпент-1-ин-3-ола с бромидом 10 позволило получить 2,2,2-трифтор-N-(3-(3-(3-гидрокси-4-метилпент-1-инил)фенил)пропил) ацетамид в виде желтого масла, загрязненного алкиновым димером, который использовали без очистки на следующей стадии.1H ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1H), 7.18-7.29 (m, 4Н), 5.37 (d, J = 5.6 Гц, 1H), 4.20 (t, J = 5.6 Гц, 1H), 3.16 (dt, J = 6.8, 6.0 Гц, 2H), 2.56 (t, J = 7.6 Гц, 2H), 1.70-1.81 (m, 3H), 0.96 (d, J = 6.8 Гц, 3H), 0.94 (d, J = 6.8 Гц, 3H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(3-гидрокси-4-метилпент-1-инил)фенил)пропил)ацетамида позволило получить 1-(3-(3-аминопропил)фенил)-4-метилпент-1-ин-3-ол в виде желтого масла. Выход (10.174 г, 47%, две стадии):1H ЯМР (400 МГц, ДМСО-d6) δ 7.15-7.27 (m, 4Н), 4.29 (d, J = 5.6 Гц, 1H), 2.63 (m, 4Н), 1.88 (m, 1H), 1.76 (m, 2H), 0.96 (d, J = 6.8 Гц, 3H), 0.94 (d, J = 6.4 Гц, 3H).
Стадия 3: Гидрирование 1-(3-(3-аминопропил)фенил)-4-метилпент-1-ин-3-ола позволила получить Пример 47 в виде бесцветного масла. Выход (0.091 г, 58%):1H ЯМР (400 МГц, CDCl3) δ 7.18 (t, J = 8.0 Гц, 1H), 6.97-7.04 (m, 3H), 3.37 (ddd, J = 8.8,4.8, 3.2 Гц, 1H), 2.75-2.85 (m, 1H), 2.71 (t, J = 7.2 Гц, 2H), 2.55-2.65 (m, 3H), 1.71-1.82 (m, 3H), 1.61-1.71 (m, 2H), 1.52 (br s, 3H), 0.90 (dd, J = 1.2, 6.8 Гц, 6Н). ESI MS m/z 236.4 [M+H]+.
ПРИМЕР 48
Приготовление 1-(3-(3-аминопропил)фенетил)циклопентанола

1-(3-(3-аминопропил)фенетил)циклопентанол был приготовлен согласно способу, который использовали в Примерах 2 и 4.
Стадия 1: Взаимодействие 1-этинилциклопентанола с бромидом 10 позволило получить 2,2,2-трифтор-N-(3-(3-((1-гидроксициклопентил)этинил)фенил)пропил) ацетамид в виде желтого масла, которое использовали без очистки на следующей стадии:
1H ЯМР (400 МГц, CD3OD) δ 7.15-7.25 (m, 4H), 3.28 (t, J = 7.2 Гц, 2Н), 2.62 (t, J = 7.2 Гц, 2H), 1.97-2.00 (m, 2Н), 1.73-1.91 (m, 8H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-((1-гидроксициклопентил) этинил)фенил)пропил)ацетамида позволило получить 1-((3-(3-аминопропил)фенил) этинил)циклопентанол в виде желтого масла. Выход (0.478 г, 62% для двух стадий):1H ЯМР (400 МГц, ДМСО-d6) δ 7.14-7.34 (m, 4H), 2.59-2.64 (m, 4H), 1.97-2.00 (m, 4H), 1.71-1.87 (m, 6H).
Стадия 3: Гидрирование 1-((3-(3-аминопропил)фенил)этинил)циклопентанола позволила получить Пример 48 в виде бесцветного масла. Выход (0.261 г, 75%):1Н ЯМР (400 МГц, CDCl3) δ 7.19 (t, J = 8.0 Гц, 1Н), 6.98-7.05 (m, 3Н), 2.69-2.76 (m, 4H), 2.62 (t, J = 7.6 Гц, 2Н), 1.85-1.92 (m, 2Н), 1.79-1.85 (m, 2Н), 1.72-1.79 (m, 2Н), 1.56-1.72 (m, 6H), 1.37 (br s, 3Н). ESI MS m/z 248.5 [M+H]+, 230.4 [M+H-H2O]+.
ПРИМЕР 49
Приготовление 1-(3-(3-аминопропил)фенил)-3,4,4-триметилпентан-3-ола
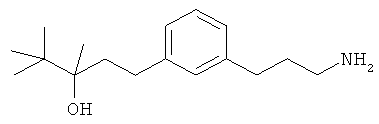
1-(3-(3-аминопропил)фенил)-3,4,4-триметилпентан-3-ол был приготовлен согласно способу, который использовали в Примере 2.
Стадия 1: Взаимодействие 3,4,4-триметилпент-1-ин-3-ола с бромидом 10 в смеси 1:1 DMF и триэтиламина позволило получить 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3,4,4-триметилпент-1-инил)фенил)пропил)ацетамид в виде оранжевого масла. Выход (0.84 г, 73%):1Н ЯМР (400 МГц, СО3ОD) δ 7.15-7.25 (m, 4H), 3.29 (t, J = 7.2 Гц, 2Н), 2.61 (t, J = 8.0 Гц, 2Н), 1.86 (квинт, J = 7.6 Гц, 2Н), 1.49 (s, 3Н), 1.09 (br s, 9H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3,4,4-триметилпент-1-инил)фенил)пропил)ацетамида позволило получить 1-(3-(3-аминопропил)фенил)-3,4,4-триметилпент-1-ин-3-ол в виде желтого масла. Выход (0.493 г, 83%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.15-7.24 (m, 4Н), 2.60-2.65 (m, 4Н), 1.72-1.79 (m, 2H), 1.49 (s, 3H), 1.09 (s, 9H).
Стадия 3: Гидрирование 1-(3-(3-аминопропил)фенил)-3,4,4-триметилпент-1-ин-3-ола позволила получить Пример 49 в виде бесцветного масла. Выход (0.388 г, 82%):1H ЯМР (400 МГц, CDCl3) δ 7.19 (t, J = 8.0 Гц, 1H), 6.98-7.05 (m, 3H), 2.70-2.79 (m, 3H), 2.58-2.68 (m, 3H), 1.67-1.87 (m, 4Н), 1.31 (br s, 3H), 1.21 (s, 3H), 0.94 (s, 9H). ESI MS m/z 264.6 [M+H]+, 246.5 [M+H-H2O]+.
ПРИМЕР 50
Приготовление 1-(3-(2-аминоэтокси)фенил)-3-этилпентан-3-ола

1-(3-(2-аминоэтокси)фенил)-3-этилпентан-3-ол был приготовлен согласно способу, который использовали в Примере 9, за исключением того, что гидрирование выполняли до снятия защиты амина.
Стадия 1: Взаимодействие Соногашира 3-этилпент-1-ин-3-ола с бромидом 19 с последующей флэш хроматографией (градиент 5-50% ЕtOАс/гексаны) позволило получить N-(2-(3-(3-этил-3-гидроксипент-1-инил)фенокси)этил)-2,2,2-трифторацетамид в виде янтарного масла. Выход (2.1 г, 75%).1Н ЯМР (400 МГц, ДМСО-d6) δ 9.58 (m, 1H), 7.24 (t, J = 8.0 Гц, 1H), 6.88-6.96 (m, 3H), 5.12 (s, 1H), 4.08 (t, J = 5.6 Гц, 2H), 3.53 (q, J = 6.4 Гц, 2H), 1.54-1.65 (m, 4Н), 0.96 (t, J = 7.6 Гц, 6Н).
Стадия 2: Гидрирование N-(2-(3-(3-этил-3-гидроксипент-1-инил)фенокси)этил)-2,2,2-трифторацетамида с последующей флэш хроматографией (градиент 5-20% EtoAc/гексаны) позволило получить N-(2-(3-(3-этил-3-гидроксипентил)фенокси)этил)-2,2,2-трифторацетамид в виде бледно-желтого вязкого твердого вещества. Выход (2.06 г, 97%).1Н ЯМР (400 МГц, ДМСО-d6) δ 9.59 (m, 1H), 7.14 (t, J = 7.6 Гц, 1H), 6.68-6.76 (m, 3H), 4.04 (t, J = 5.6 Гц, 2H), 3.91 (s, 1H), 3.53 (q, J = 5.6 Гц, 2H), 2.45-2.50 (m, 2H), 1.49-1.55 (m, 2H), 1.36 (q, J = 7.6 Гц, 4Н), 0.78 (t, J = 7.6 Гц, 6Н).
Стадия 3: Снятие защиты N-(2-(3-(3-этил-3-гидроксипентил)фенокси)этил)-2,2,2-трифторацетамида с последующей флэш хроматографией (10% (7N NН3/МеОН)/дихлорметан) позволило получить Пример 50 в виде желтого масла. Выход (0.557 г, 38%).1Н ЯМР (400 МГц, CDCl3) δ 7.13 (t, J = 7.6 Гц, 1H), 6.64-6.73 (m, 3H), 3.91 (brs, 1H), 3.85 (t, J = 4.8 Гц, 2H), 2.45-2.49 (m, 2H), 1.50-1.56 (m, 2H), 1.43 (brs, 2H), 1.36 (q, J = 7.6 Гц, 4H), 0.78 (t, J = 7.6 Гц, 6Н).
ПРИМЕР 51
Приготовление 1-(3-(2-аминоэтокси)фенил)-3-изопропил-4-метилпентан-3-ола

1-(3-(2-аминоэтокси)фенил)-3-изопропил-4-метилпентан-3-ол был приготовлен согласно способу, который использовали в Примере 9.
Стадия 1: Взаимодействие 3-изопропил-4-метилпент-1-ин-3-ола с бромидом 19 согласно способу, описанному в Примере 9, за исключением того, что реакция протекала в течение 20 ч, позволило получить 2,2,2-трифтор-N-(2-(3-(3-гидрокси-3-изопропил-4-метилпент-1-инил)фенокси)этил)ацетамид в виде масла, которое затвердевало при стоянии. Выход (0.94 г, 46%):1Н ЯМР (400 МГц, СDСl3) δ 7.23 (t, J = 8.0 Гц, 1H), 7.07 (dt, J = 7.6, 1.0 Гц, 1H), 6.95 (dd, J = 2.5, 1.4 Гц, 1H), 6.85 (ddd, J = 8.4,2.7, 1.0 Гц, 1H), 6.70 (br s, 1H), 4.10 (t, J = 5.1 Гц, 2H), 3.79 (dt, J = 5.1 Гц, 2H), 2.04 (m, 2H), 1.80 (s, 1H), 1.09 (d, J = 6.7 Гц, 6Н), 1.05 (d, J = 6.7 Гц, 6Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(2-(3-(3-гидрокси-3-изопропил-4-метилпент-1-инил)фенокси)этил)ацетамида позволило получить 1-(3-(2-аминоэтокси)фенил)-3-изопропил-4-метилпент-1-ин-3-ол в виде белого твердого вещества. Выход (0.529 г, 76%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.24 (t, J = 7.8 Гц, 1H), 6.90-6.95 (m, 2H), 6.87-6.88 (m, 1H), 4.83 (br s, 1H), 3.89 (t, J = 5.7 Гц, 2H), 2.83 (t, J = 5.7 Гц, 2H), 1.86 (m, 2H), 1.47 (br s, 2H), 0.98 (d, J = 6.8 Гц, 6Н), 0.93 (d, J = 6.7 Гц, 6Н).13С ЯМР (100 МГц, ДМСО-d6) δ 159.29, 130.48, 124.58, 124.32, 117.46, 115.72, 92.60, 84.54, 76.74, 71.04, 41.62, 34.95, 18.98, 17.21. ESI MS m/z 276.39 [M+Н]+, 258.37 [M+Н-H2O]+.
Стадия 3: Гидрирование 1-(3-(2-аминоэтокси)фенил)-3-изопропил-4-метилпент-1-ин-3-ола позволило получить Пример 51 в виде бесцветного масла. Выход (0.238 г, 79%):1Н ЯМР (400 МГц, CDCl3) δ 7.17 (t, J = 8.0 Гц, 1H), 6.69-6.80 (m, 3H), 3.96 (t, J = 5.2 Гц, 2H), 3.06 (t, J = 5.2 Гц, 2H), 2.58-2.64 (m, 2H), 1.90-2.02 (m, 2H), 1.74-1.80 (m, 2H), 1.43 (br s, 3H), 0.98 (t, J = 7.2 Гц, 12Н). ESI MS m/z 280.6 [M+H]+, 262.5 [M+H-H2O]+.
ПРИМЕР 52
Приготовление 5-(3-(2-аминоэтокси)фенетил)нонан-5-ола
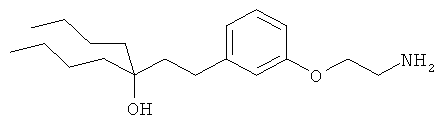
5-(3-(2-аминоэтокси)фенетил)нонан-5-ол был приготовлен согласно способу, который использовали в Примере 9.
Стадия 1: Взаимодействие 5-этинилнонан-5-ола с бромидом 19 позволило получить N-(2-(3-(3-бутил-3-гидроксигепт-1-инил)фенокси)этил)-2,2,2-трифторацетамид.
Выход (1.06 г, 75%):1H ЯМР (400 МГц, CDCl3) δ 7.23 (t, J = 8.0 Гц, 1Н), 7.06 (dt, J = 7.6 and 1.2 Гц, 1Н), 6.94 (dd, J = 2.5, 1.4 Гц, 1Н), 6.86 (ddd, J = 8.4, 2.7, 1.0 Гц, 1Н), 6.72 (br s, 1Н), 4.10 (t, J = 5.3 Гц, 2H), 3.79 (dt, J = 5.3 Гц, 2H), 1.96 (s, 1Н), 1.70-1.75 (m, 4H), 1.50-1.58 (m, 4H), 1.34-1.43 (m, 4H), 0.94 (t, J = 7.2 Гц, 6Н).
Стадия 2: Снятие защиты N-(2-(3-(3-бутил-3-гидроксигепт-1-инил) фенокси)этил)-2,2,2-трифторацетамида позволило получить 5-((3-(2-аминоэтокси) фенил)-этинил)нонан-5-ол в виде бесцветного масла, которое затвердевало при стоянии. Выход (0.695 г, 92%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.24 (t, J = 7.8 Гц, 1Н), 6.92-6.93 (m, 1Н), 6.90-6.91 (m, 1Н), 6.85-6.86 (m, 1Н), 5.13 (br s, 1Н), 3.89 (t, J = 5.7 Гц, 2H), 2.83 (t, J = 5.7 Гц, 2H), 1.52-1.60 (m, 6Н), 1.40-1.49 (m, 4H), 1.25-1.34 (m, 4H), 0.88 (t, J = 7.2 Гц, 6Н).13С ЯМР (100 МГц, ДМСО-d6) δ 159.28, 130.49, 124.50, 124.26, 117.35, 115.76, 94.87, 83.08, 71.03, 70.27, 42.19, 41.60, 26.85, 23.15, 14.74. ESI MS m/z 304.42 [M+H]+, 286.42 [M+Н-H2O]+.
Стадия 3: Гидрирование 5-((3-(2-аминоэтокси)фенил)-этинил)нонан-5-ола позволило получить Пример 52 в виде бесцветного масла. Выход (0.154 г, 73%):1Н ЯМР (400 МГц, CDCl3) δ 7.18 (t, J = 8.0 Гц, 1Н), 6.69-6.81 (m, 3H), 3.97 (t, J = 5.2 Гц, 2H), 3.06 (t, J = 5.2 Гц, 2H), 2.56-2.63 (m, 2H), 1.68-1.75 (m, 2H), 1.44-1.52 (m, 4H), 1.36-1.42 (br s, 3H), 1.24-1.36 (m, 8H), 0.91 (t, J = 6.8 Гц, 6Н). ESI MS m/z 308.6 [M+H]+, 290.6 [M+Н-H2O]+.
ПРИМЕР 53
Приготовление 4-(3-(2-аминоэтокси)фенил)-2-метилбутан-2-ола
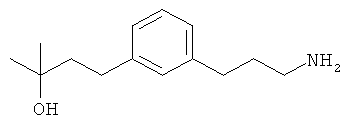
4-(3-(2-аминоэтокси)фенил)-2-метилбутан-2-ол был приготовлен согласно способу, который использовали в Примере 9.
Стадия 1: Взаимодействие 2-метилбут-3-ин-2-ола с бромидом 10 согласно способу, описанному в Примере 9, за исключением того, что реакция протекала в течение 19 ч, позволило получить 2,2,2-трифтор-N-(2-(3-(3-гидрокси-3-метилбут-1-инил)фенокси)этил)ацетамид. Выход (0.667 г, 70%):1Н ЯМР (400 МГц, CDCl3) δ 7.23 (t, J = 7.8 Гц, 1Н), 7.06 (dt, J = 7.6 and 1.2 Гц, 1Н), 6.94 (dd, J = 2.5, 1.4 Гц, 1Н), 6.86 (ddd, J = 8.2, 2.5, 1.0 Гц, 1Н), 6.74 (br s, 1H), 4.09 (t, J = 4.9 Гц, 2Н), 3.80 (dt, J = 5.5 Гц, 2Н), 2.04 (s, 1H), 1.61 (s, 6H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(2-(3-(3-гидрокси-3-метилбут-1-инил)фенокси)этил)ацетамида позволило получить 4-(3-(2-аминоэтокси)фенил)-2-метилбут-3-ин-2-ол в виде белого твердого вещества. Выход (0.240 г, 52%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.23 (t, J = 8.0 Гц, 1H), 6.89-6.93 (m, 2Н), 6.86-6.88 (m, 1H), 5.43 (br s, 1H), 3.89 (t, J = 5.9 Гц, 2Н), 2.83 (t, J = 5.9 Гц, 2Н), 1.45 (br s, 2Н), 1.44 (s, 6H).13C ЯМР (100 МГц, ДМСО-d6) δ 159.27, 130.45, 124.38, 124.20, 117.21, 116.00, 96.57, 80.99, 71.03, 64.27, 41.59, 32.28. ESI MS m/z 220.31 [M+H]+, 202.28 [M+Н-H2O]+; ВЭЖХ (Способ А) tR=2.79 мин.
Стадия 3: Гидрирование 4-(3-(2-аминоэтокси)фенил)-2-метилбут-3-ин-2-ола позволило получить Пример 53 в виде бесцветного масла. Выход (0.143 г, 73%):1Н ЯМР (400 МГц, CDCl3) δ 7.18 (t, J = 8.0 Гц, 1H), 6.70-6.82 (m, 3H), 3.97 (t, J = 5.2 Гц, 2Н), 3.07 (t, J = 5.2 Гц, 2Н), 2.63-2.70 (m, 2Н), 1.74-1.81 (m, 2Н), 1.47 (s, 3H), 1.27 (s, 6H). ESI MS m/z 224.4 [M+H]+, 206.3 [M+H-H2O]+.
ПРИМЕР 54
Приготовление 1-(3-(2-аминоэтокси)фенетил)циклопентанола

31-(3-(2-аминоэтокси)фенетил)циклопентанол был приготовлен согласно способу, который использовали в Примере 9.
Стадия 1: Взаимодействие 1-этинилциклопентанола с бромидом 19 согласно способу, описанному в Примере 9, за исключением того, что реакция протекала в течение 19.5 ч, позволило получить 2,2,2-трифтор-N-(2-(3-((1-гидроксициклопентил)этинил)фенокси)этил)ацетамид в виде коричневого масла. Выход (1.055 г, 92%):1Н ЯМР (400 МГц, CDCl3) δ 7.23 (t, J = 8.0 Гц, 1H), 7.06 (dt, J = 7.6, 1.2 Гц, 1H), 6.95 (dd, J = 2.5, 1.4 Гц, 1H), 6.85 (ddd, J = 8.4, 2.7, 1.0 Гц, 1H), 6.72 (br s, 1H), 4.09 (t, J = 5.3 Гц, 2Н), 3.78 (dt, J = 5.1 Гц, 2Н), 2.00-2.09 (m, 4H), 1.76-1.93 (m, 5H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(2-(3-((1-гидроксициклопентил) этинил)фенокси)этил)ацетамида позволило получить 1-((3-(2-аминоэтокси)фенил) этинил)циклопентанол в виде масла, которое затвердевало при стоянии. Выход (0.502 г, 66%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.23 (t, J = 8.0 Гц, 1H), 6.88-6.94 (m, 3H), 5.28 (br s, 1H), 3.89 (t, J = 5.7 Гц, 2Н), 2.83 (t, J = 5.7 Гц, 2Н), 1.82-1.89 (m, 4H), 1.63-1.74 (m, 4H), 1.48 (br s, 2H).13C ЯМР (100 МГц, ДМСО-d6) δ 159.27, 130.45, 124.50, 124.18, 117.20, 115.93, 95.65, 81.97, 73.44, 71.01, 42.66, 41.58, 23.75. ESI MS m/z 246.33 [M+H]+, 228.30 [M+H-H2O]+; ВЭЖХ (Способ A) tR=4.19 мин.
Стадия 3: Гидрирование 1-((3-(2-аминоэтокси)фенил)этинил)циклопентанола позволило получить Пример 54 в виде бесцветного масла. Выход (0.353 г, 76%):1Н ЯМР (400 МГц, CDCl3) δ 7.16 (t, J = 8.0 Гц, 1Н), 6.68-6.81 (m, 3Н), 3.95 (t, J = 5.2 Гц, 2H), 3.04 (t, J = 5.2 Гц, 2H), 2.72 (m, 2H), 1.86 (m, 2H), 1.72-1.82 (m, 2H), 1.40-1.72 (m, 9H). ESI MS m/z 250.4 [M+H]+, 232.4 [M+H-H2O]+.
ПРИМЕР 55
Приготовление 1-(3-(3-аминопропил)фенил)-3-изопропил-4-метилпентан-3-ола

1-(3-(3-аминопропил)фенил)-3-изопропил-4-метилпентан-3-ол был приготовлен согласно способу, который использовали в Примерах 2 и 13.
Стадия 1: Взаимодействие 3-изопропил-4-метилпент-1-ин-3-ола с бромидом 10 согласно способу, который использовали в Примере 13, позволило получить 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3-изопропил-4-метилпент-1-инил)фенил)пропил) ацетамид в виде бледно-желтого масла. Выход (1.375 г, 66%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1Н), 7.26 (t, J = 7.6 Гц, 1Н), 7.17-7.22 (m, 3Н), 4.81 (s, 1Н), 3.17 (q, J = 6.8 Гц, 2H), 2.56 (t, J = 8.0 Гц, 2H), 1.86 (квинт, J = 6.8 Гц, 2H), 1.76 (квинт, J = 7.6 Гц, 2H), 0.99 (d, J = 6.8 Гц, 6Н), 0.94 (d, J = 6.8 Гц, 6Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3-изопропил-4-метилпент-1-инил)фенил)пропил)ацетамида согласно способу, который использовали в Примере 2, с последующей флэш хроматографией (9:1 CH2Cl2: 7M NH3 в МеОН) позволило получить 1-(3-(3-аминопропил)фенил)-3-изопропил-4-метилпент-1-ин-3-ол в виде прозрачного масла. Выход (0.835 г, 82%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.15-7.26 (m, 4Н), 4.82 (br s, 1Н), 2.56 (t, J = 7.6 Гц, 2H), 2.47-2.52 (m, 2H), 1.86 (квинт, J = 6.8 Гц, 2H), 1.59 (квинт, J = 6.8 Гц, 2H), 1.56 (br.s, 2H), 1.05 (d, J = 6.8 Гц, 6Н), 1.03 (d, J = 6.8 Гц, 6Н).
Стадия 3: Гидрирование 1-(3-(3-аминопропил)фенил)-3-изопропил-4-метилпент-1-ин-3-ола согласно способу, который использовали в Примере 2, позволило получить Пример 55 в виде бесцветного масла. Выход (0.538 г, б8%):1Н ЯМР (400 МГц, CDCl3) δ 7.19 (t, J = 8.0 Гц, 1Н), 6.97-7.60 (m, 3Н), 2.73 (t, J = 7.2 Гц, 2H), 2.58-2.65 (m, 4Н), 1.92-2.04 (m, 2H), 1.72-1.82 (m, 4Н), 1.30-1.40 (br s, 3H), 0.99 (t, J=7.2 Гц, 12Н). ESI MS m/z 278.6 [M+H]+, 260.5 [M+H-H2O]+.
ПРИМЕР 56
Приготовление 4-(3-(3-аминопропил)фенетил)-2,6-диметилгептан-4-ола

4-(3-(3-аминопропил)фенетил)-2,б-диметилгептан-4-ол был приготовлен согласно способу, который использовали в Примере 55.
Стадия 1: Взаимодействие 4-этинил-2,6-диметилгептан-4-ола с бромидом 10 позволило получить 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3-изобутил-5-метилгекс-1-инил)фенил)пропил)ацетамид в виде бледно-желтого масла. Выход (1.25 г, 63%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1Н), 7.14-7.28 (m, 4Н), 5.02 (s, 1H), 3.17 (q, J = 6.8 Гц, 2H), 2.56 (t, J = 7.6 Гц, 2H), 1.93-1.99 (m, 2H), 1.75 (квинт, J = 7.6 Гц, 2H), 1.47-1.56 (m, 4Н), 0.86-0.98 (m, 12Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(3-гидрокси-3-изобутил-5-метилгекс-1-инил)фенил)пропил)ацетамида позволило получить 4-((3-(3-аминопропил)фенил)этинил)-2,6-диметилгептан-4-ол в виде прозрачного масла. Выход (0.73 г, 77%):1Н ЯМР (400 МГц, ДМСО-d6) 7.22-7.26 (m, 1H), 7.12-7.18 (m, 3H), 5.04 (br s, 1H), 2.56 (t, J = 7.2 Гц, 2H), 2.50 (t, J = 6.8 Гц, 2H), 1.91-2.01 (m, 2H), 1.47-1.62 (m, 6Н), 0.98 (m, 6Н), 0.96 (m, 6Н).
Стадия 3: Гидрирование 4-((3-(3-аминопропил)фенил)этинил)-2,6-диметилгептан-4-ола позволила получить Пример 56 в виде бесцветного масла. Выход (0.559 г, 77%):1H ЯМР (400 МГц, CDCl3) δ 7.18 (t, J = 8.0 Гц, 1H), 6.97-7.03 (m, 3H), 2.73 (t, J = 7.2 Гц, 2H), 2.56-2.65 (m, 4Н), 1.72-1.88 (m, 6Н), 1.40-1.48 (m, 7H), 0.98 (dd, J = 6.8, 4.8 Гц, 12Н). ESI MS m/z 306.7 [M+H]+, 288.6 [M+H-H2O]+.
ПРИМЕР 57
Приготовление 5-(3-(3-аминопропил)фенил)пентан-2-ола

5-(3-(3-аминопропил)фенил)пентан-2-ол был приготовлен согласно способу, который использовали в в Примерах 2, 13 и 23.
Стадия 1: Взаимодействие пент-4-ин-2-ола с бромидом 10 согласно способу, который использовали в Примере 13, за исключением того, что реакция протекала при комнатной температуре, позволило получить 2,2,2-трифтор-N-(3-(3-(4-гидроксипент-1-инил)фенил)пропил)ацетамид в виде бледно-желтого масла. Выход (0.95 г, 63%):1H ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br s, 1Н), 7.14-7.26 (m, 4H), 4.80 (s, 1H), 3.81 (q, J = 5.6 Гц, 1H), 3.16 (q, J = 6.8 Гц, 2Н), 2.54 (t, J = 5.6 Гц, 2Н), 2.39 (dd, J = 16.8, 6.8 Гц, 2Н), 1.76 (квинт, J = 7.2 Гц, 2Н), 1.17 (d, J = 5.6 Гц, 3Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-(4-гидроксипент-1-инил)фенил)пропил)ацетамида согласно способу, описанному в Примере 23, позволило получить 5-(3-(3-аминопропил)фенил)пент-4-ин-2-ол в виде прозрачного масла. Выход (0.34 г, 94%):1H ЯМР (400 МГц, CDCl3) δ 7.24-7.25 (m, 1H), 7.23 (t, J = 1.6 Гц, 1H), 7.20 (ddd, J = 7.4, 7.4, 0.6 Гц, 1H), 7.11 (dt, J = 7.2, 1.6 Гц, 1H), 4.04 (dq, J = 12.5, 6.3 Гц, 1Н), 2.72 (t, J = 6.9 Гц, 2Н), 2.51-2.64 (m, 4H), 1.72-1.79 (m, 2Н), 1.65 (br s, 3Н), 1.32 (d, J = 6.3 Гц, 3Н).
Стадия 3: Гидрирование 5-(3-(3-аминопропил)фенил)пент-4-ин-2-ола согласно способу, который использовали в Примере 2, позволило получить Пример 57 в виде бесцветного масла. Выход (0.173 г, 64%):1H ЯМР (400 МГц, CDCl3) δ 7.15-7.22 (m, 1H), 6.97-7.04 (m, 3Н), 3.80 (квинт., J = 6.4 Гц, 1H), 2.72 (t, J = 7.2 Гц, 2Н), 2.55-2.65 (m, 4H), 1.57-1.82 (m, 4H), 1.52 (br s, 3Н), 1.40-1.54 (m, 2Н), 1.17 (d, J = 6.0 Гц, 3Н). ESI MS m/z 222.5 [M+Н]+.
ПРИМЕР 58
Приготовление 3-(3-(2-метоксифенетил)фенил)пропан-1-амина

3-(3-(2-метоксифенетил)фенил)пропан-1-амин был приготовлен согласно способу, который использовали в Примере 22, за исключением того, что гидрирование выполняли до снятия защиты амина.
Стадия 1: Реакцию Соногашира бромида 57 с 2-этиниланизолом выполняли способом, который использовали в Примере 22, за исключением того, что диизопропиламин использовали вместо триэтиламина и реакционную смесь нагревали с обратным холодильником. трет-бутил 3-(3-((2-метоксифенил)этинил) фенил)пропилкарбамат получали в виде желтого масла. Выход (0.42 г, 72%): MS: 366 [М+1]+.
Стадия 2: Восстановление трет-бугил 3-(3-((2-метоксифенил)этинил) фенил)пропилкарбамата позволило получить трет-бутл 3-(3-(2-метоксифенетил)фенил)пропилкарбамат в виде грязно-белого твердого вещества. Выход (0.242 г, 85%): MS: 370[M+1]+.
Стадия 3: Снятие защиты трет-бутил 3-(3-(2-метоксифенетил)фенил)пропилкарбамата позволило получить Пример 58 в виде желтого масла. Выход (0.192 г, 78%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.17-7.23 (m, 2H), 7.11 (d, J = 7.6 Гц, 1Н), 7.0-7.07 (m, 3Н), 6.96 (d, J = 8.4 Гц, 1Н), 6.82-6.86 (m, 1Н), 3.79 (s, 3Н), 2.74-2.84 (m, 6H), 2.62 (t, J = 7.6 Гц, 2H), 1.77-1.86 (m, 2H).13C ЯМР (100 МГц, ДМСО-d6): 157.5, 142.4, 141.2, 130.0, 129.8, 128.8, 128.7, 127.8, 126.5, 126.2, 120.6, 111.1, 55.8, 38.8, 35.9, 32.3, 32.2, 29.2. MS: 270 [М+1]+.
ПРИМЕР 59
Приготовление 6-(3-(3-амино-1-гидроксипропил)фенил)гексан-1-ола

6-(3-(3-амино-1-гидроксипропил)фенил)гексан-1-ол был приготовлен согласно способу, который использовали в Примере 17.
Стадия 1: Взаимодействие гекс-5-ин-1-ола с бромидом 39 позволило получить трет-бутил 3-гидрокси-3-(3-(6-гидроксигекс-1-инил)фенил)пропилкарбамат в виде коричневого масла. Выход (0.405 г, 77%).
Стадия 2: Снятие защиты трет-бутил 3-гидрокси-3-(3-(6-гидроксигекс-1-инил)фенил)пропилкарбамата с последующей очисткой препаративной ВЭЖХ (Способ 2Р) позволило получить 6-(3-(3-амино-1-гидроксипропил)фенил)гекс-5-ин-1-ол гидрохлорид в виде белого твердого вещества. Выход (0.12 г, 32%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.87 (br s, 2H), 7.25-7.35 (m, 4H), 5.51 (br s, 1Н), 4.68 (dd, J = 7.8, 4.4 Гц, 1Н), 4.46 (t, J = 6.4 Гц, 1Н), 3.40-3.44 (m, 2H), 2.77-2.88 (m, 2H), 2.41-2.44 (m,2H), 1.80-1.93 (m, 2H), 1.56-1.62 (m, 4H).
Стадия 3: Гидрирование 6-(3-(3-амино-1-гидроксипропил)фенил)гекс-5-ин-1-ола гидрохдорида согласно способу, который использовали в Примере 13, с последующей очисткой препаративной ВЭЖХ (Способ 1P) позволило получить Пример 59 трифторацетат в виде белого твердого вещества. Выход (21 мг, 14%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.63 (br s, 3Н), 7.23 (t, J = 7.5 Гц, 1Н), 7.12 (s, 1 Н), 7.11 (d, J = 7.5 Гц, 1 Н), 7.06 (d, J = 7.5 Гц, 1Н), 5.49 (br s, 1 Н), 4.63 (t, J = 6.3 Гц, 1Н), 4.31 (t, J = 4.9 Гц, 1Н), 3.35 (dd, J = 11.1, 6.1 Гц, 2H), 2.78-2.90 (m, 2 Н), 2.54 (t, J = 7.7,2H), 1.78-1.84 (m, 2H), 1.50-1.58 (m, 2H), 1.27-1.40 (m, 6H).
ПРИМЕР 60
Приготовление 4-(3-(3-амино-1-гидроксипропил)фенил)бутан-1-ола

4-(3-(3-амино-1-гидроксипропил)фенил)бутан-1-ол был приготовлен согласно способу, который использовали в Примере 19, за исключением того, что снятие защиты амина выполняли перед гидрированием.
Стадия 1: Реакция Соногашира бромида 19 с 3-ин-1-олом позволила получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(4-гидроксибут-1-инил)фенил)пропил)ацетамид в виде коричневого масла. Выход (0.908 г, 90%):1Н ЯМР (400 МГц, CDCl3) δ 7.41 (s, 1H), 7.23-7.36 (m, 3Н), 4.84-4.87 (m, 1H), 3.81 (t, J = 6.4 Гц, 2Н), 3.66-3.69 (m, 1H), 3.39-3.42 (m, 1H), 2.69 (t, J = 6.4 Гц, 2Н), 1.93-1.99 (m, 2Н).
Стадия 2: Смесь 2,2,2-трифтор-N-(3-гидрокси-3-(3-(4-гидроксибут-1-инил)фенил)пропил)ацетамида, карбоната калия (1.6 г, 11.5 ммоль) и воды (3 мл) в МеОН (15 мл) нагревали с обратным холодильником в течение 4 ч. Реакционную смесь концентрировали до сухого состояния при пониженном давлении для получения 4-(3-(3-амино-1-гидроксипропил)фенил)бут-3-ин-1-ола в виде бледно-желтого масла после очистки флэш хроматографией 15% MeOH-NH3 (9.5:0.5)-DCM. Выход (0.38 г, 60%). Это соединение использовали на следующей стадии превращений.
Стадия 3: Раствор 4-(3-(3-амино-1-гидроксипропил)фенил)бут-3-ин-1-ола (5) в 2-PrОН (10 мл) дегазировали и продували азотом. Затем добавляли Pd на С (0.08 г, 10%). Колбу вакуумировали и заполняли водородом. После повторения этой процедуры три раза реакционную смесь перемешивали под баллоном с Нз при комнатной температуре. Примерно через 72 ч смесь фильтровали через Celite и концентрировали при пониженном давлении для получения желтого масла. Сырой продукт очищали флэш хроматографией (градиент 0-15% MeOH-NH3 (9.5:0.5)-DCM) для получения Примера 60 в виде желтого масла. Выход (0.14 г, 37%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.19 (t, J = 7.6, 1H), 7.13 (s, 1H), 7.11 (d, J = 7.6 Гц, 1H), 7.03 (d, J = 7.6 Гц, 1H), 4.60-4.63 (m, 1H), 4.36 (bs, 1H), 3.39 (t, J = 7.6 Гц, 2Н), 2.58-2.68 (m, 2Н), 2.55 (t, J = 7.6 Гц, 2Н), 1.55-1.68 (m, 4H), 1.44-1.46 (m, 2Н).13С ЯМР (100 МГц, ДМСО-d6) δ 146.0, 141.8, 127.7, 126.4, 125.6, 123.0, 71.4, 60.5, 42.4, 38.9, 35.1, 32.1, 27.5. MS: 224 [M+1]+.
ПРИМЕР 61
Приготовление 3-амино-1-(3-(2-метоксифенетил)фенил)пропан-1-ола

3-амино-1-(3-(2-метоксифенетил)фенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Реакция Соногашира бромида 43 с 1-этинил-2-метоксибензолом позволила получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-((2-метоксифенил)этинил)фенил)пропил)ацетамид в виде коричневого масла. Выход (1.12 г, 96%):1Н ЯМР (400 МГц, CDCl3) δ 7.55 (s, 1Н), 7.50 (d, J = 5.6 Гц, 2H), 7.28-7.37 (m, 3H), 6.90-6.96 (m, 2H), 4.84-4.87 (m, 1Н), 3.92 (s, 3H), 3.66-3.69 (m, 1Н), 3.39-3.42 (m, 1Н), 2.32 (bs, 1Н), 1.93-1.99 (m, 2H).
Стадия 2: Восстановление 2,2,2-трифтор-N-(3-гидрокси-3-(3-((2-метоксифенил)этинил)фенил)пропил)ацетамида позволило получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(2-метоксифенетил)фенил)пропил)ацетамид в виде желтого масла. Выход (1.1 г, сырой):1Н ЯМР (400 МГц, CDCl3) δ 7.36 (bs, 1Н), 7.24-7.30 (m, 1Н), 7.13-7.20 (m, 3H), 7.08 (s, 1Н), 7.04 (d, J = 1.6 Гц, 7.2 Гц, 1Н), 6.82-6.87 (m, 2H), 4.83-4.86 (m, 1H), 3.81 (s, 3H), 3.61-3.66 (m, 1Н), 3.36-3.42 (m, 1Н), 2.17 (bs, 1Н), 1.93-1.99 (m, 2H). Это соединение использовали в таком виде для следующего превращения.
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(2-метоксифенетил)фенил)пропил)ацетамида позволило получить темное масло, которое после очистки флэш хроматографией (градиент 0-10% MeOH-NH3 (9.5:0.5)-DCM) позволило получить Пример 61 в виде бледно-зеленого масла. Выход (0.616 г, 75%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.04-7.23 (m, 6H), 6.94 (d, J = 8.0 Гц, 1Н), 6.82 (t, J = 7.2 Гц, 1Н), 4.59 (t, J = 6.4 Гц, 1Н), 3.75 (s, 3H), 2.78 (s, 4H), 2.66-2.73 (m, 2H), 1.70-1.75 (m, 2H).13С ЯМР (100 МГц, ДМСО-d6) δ 157.1, 145.7, 141.6, 129.6, 129.3, 128.0, 127.3, 126.7, 125.5, 123.1, 120.2, 110.6, 70.5, 55.3, 37.6, 35.6, 31.8. MS: 286 [M+1]+.
ПРИМЕР 62
Приготовление 3-(3-(2-(тиофен-2-ил)этил)фенил)пропан-1-амина

3-(3-(2-(тиофен-2-ил)этил)фенил)пропан-1-амин был приготовлен согласно способу, который использовали в Примере 31.
Стадия 1: Алкин 61 взаимодействовал с 2-бромтиофеном и очистка флэш хроматографией (15% ЕtOАс-гексаны) позволила получить 2-(3-(3-(тиофен-2-илэтинил)фенил)пропил)изоиндолин-1,3-дион в виде желтого твердого вещества. Выход (0.490 г, 50%):1Н ЯМР (400 МГц, CDCl3) δ 7.84 (dd, J = 5.6, 3.2 Гц, 2Н), 7.71 (dd, J = 5.2, 3.2 Гц, 2Н), 7.35 (s, 1H), 7.26-7.30 (m, 3H), 7.23 (t, J = 7.6 Гц, 1H), 7.18 (d, J = 7.6 Гц, 1Н), 7.01 (dd, J = 5.2, 3.6 Гц, 1H), 3.76 (t, J = 7.2 Гц, 2Н), 2.69 (t, J = 7.6 Гц, 2Н), 2.05 (квинт., J = 7.6 Гц, 2Н).
Стадия 2: Снимали защиту 2-(3-(3-(тиофен-2-илэтинил)фенил)пропил) изоиндолин-1,3-диона и реакционную смесь разбавляли диэтиловым эфиром и осадок удаляли фильтрацией. Фильтрат концентрировали при пониженном давлении и стадию осаждения диэтиловым эфиром повторяли. Очистка препаративной ВЭЖХ (Способ 1P) позволила получить 3-(3-(тиофен-3-илэтинил)фенил)пропан-1-амин трифторацетат в виде твердого вещества кремового цвета. Выход (0.210 г, 65%):1Н ЯМР (400 МГц, CDCl3) δ 7.94 (br s, 3H), 7.33 (d, J = 7.6 Гц, 1H), 7.25-7.28 (m, 2Н), 7.22 (d, J = 7.6 Гц, 1H), 7.09 (d, J = 7.6 Гц, 1H), 6.99 (dd, J = 5.2, 3.6 Гц, 1H), 2.89 (t, J = 7.2 Гц, 2Н), 2.63 (t, J = 7.6 Гц, 2Н), 1.92-1.99 (m, 2H).
Стадия 3: Гидрирование с последующей очисткой препаративной ВЭЖХ (Способ 1P) позволило получить Пример 62 трифторацетат в виде грязно-белого твердого вещества. Выход (170 mg, 29%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.66 (br s, 3H), 7.28 (d, J = 5.0 Гц, 1H), 7.20 (t, J = 7.5 Гц, 1H), 7.07 (d, J = 7.7 Гц, 1H), 7.06 (s, 1H), 7.01 (d, J = 7.6 Гц, 1H), 6.90 (dd, J = 5.0, 3.4 Гц, 1H), 6.82 (d, J = 3.4 Гц, 1H), 3.08 (t, J = 7.8 Гц, 2Н), 2.88 (t, J = 7.8 Гц, 2Н), 2.71-2.79 (m, 2Н), 2.58 (t, J = 7.7 Гц, 2Н), 1.79 (квинт, J = 7.7 Гц, 2Н).
ПРИМЕР 63
Приготовление 3-амино-1-(3-(4-фенилбутил)фенил)пропан-1-ола

3-амино-1-(3-(4-фенилбутил)фенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 19, за исключением того, что снятие защиты амина выполняли перед гидрированием.
Стадия 1: Взаимодействие арилбромида 43 с бут-3-инилбензолом согласно способу, который использовали в Примере 19, и очистка флэш хроматографией (20% ЕtOАс-гексаны) позволило получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(4-фенилбут-1-инил)фенил)пропил)ацетамид в виде коричневого масла. Выход (0.340 г, 52%):1Н ЯМР (400 МГц, CDCl3) δ 7.28-7.36 (m, 7H), 7.24-7.27 (m, 2Н), 4.84-4.88 (m, 1H), 3.66-3.74 (m, 1Н), 3.41 (ddd, J = 17.6, 8.0, 4.4 Гц, 1Н), 2.93 (t, J = 7.6 Гц, 2Н), 2.70 (t, J = 7.6 Гц, 2Н), 2.27 (d, J = 1.6 Гц, 1Н), 1.90-2.03 (m, 2Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(4-фенилбут-1-инил)фенил)пропил)ацетамида выполняли согласно способу, который использовали в Примере 19, за исключением того, что реакционную смесь нагревали в течение ночи. Очистка препаративной ВЭЖХ (способ 004Р) позволила получить 3-амино-1-(3-(4-фенилбут-1-инил)фенил)пропан-1-ол в виде коричневого твердого вещества. Выход (0.085 г, 33%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.21-7.34 (m, 9H), 4.67 (t, J = 6.0 Гц, 1Н), 2.88 (t, J = 7.2 Гц, 2Н), 2.68-2.74 (m, 4H), 1.68 (q, J = 6.4 Гц, 2Н), 0.86-0.92 (m, 1Н).
Стадия 3: Восстановление 3-амино-1-(3-(4-фенилбутил)фенил)пропан-1-ола (6) в 2-PrОН при комнатной температуре в течение 14 ч позволило получить желтое масло после выделения. Сырой продукт очищали флэш хроматографией (градиент 0-15% MeOH-NH3 (9.5:0.5)-DCM). Затем растворяли в 2-PrОН (10 мл) и перемешивали в течение одного часа с НСl в диоксане (1 мл, 4М). Смесь концентрировали до сухого состояния при пониженном давлении. Очистка флэш хроматографией (градиент 0-15% МеОН-DCM) позволила получить Пример 63 в виде белого полутвердого вещества. Выход (0.13 г, 19%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.20-7.26 (m, 3Н), 7.09-7.15 (m, 5Н), 7.05 (d, J = 7.2 Гц, 1Н), 4.60 (t, J = 7.2 Гц, 1Н), 2.78-2.88 (m, 2Н), 2.55 (m, 4H), 1.78-1.84 (m, 2Н), 1.53-1.55 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 145.3, 142.2, 142.0, 128.3, 128.1, 126.9, 125.6, 125.5, 123.0, 69.7, 36.7, 36.4, 35.0, 34.9, 30.7. MS: 284 [M+1]+
ПРИМЕР 64
Приготовление 2-(3-(4-метилпентил)фенокси)этанамина

2-(3-(4-метилпентил)фенокси)этанамин был приготовлен согласно способу, который использовали в Примере 9, за исключением того, что гидрирование проводили до снятии защиты амина.
Стадия 1: Реакция Соногашира бромида 19 с 4-метил-1-пентином позволила получить 2,2,2-трифтор-N-(2-(3-(4-метилпент-1-инил)фенокси)этил)ацетамид в виде коричневого масла. Выход (0.955 г, 63%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.22-7.27 (m, 1Н), 6.97 (d, J = 7.6 Гц, 1Н), 6.90-6.94 (m, 2Н), 4.10 (t, J = 5.6 Гц, 2Н), 3.53-3.57 (m, 2Н), 2.31 (d, J = 6.4 Гц, 2Н), 1.80-1.90 (m, 1Н), 1.0 (d, J = 6.8 Гц, 6Н).
Стадия 2: Восстановление 2,2,2-трифтор-N-(2-(3-(4-метилпент-1-инил)фенокси)этил)ацетамида позволило получить 2,2,2-трифтор-N-(2-(3-(4-метилпентил)фенокси)этил)ацетамид в виде желтого масла. Выход (0.815 т, 85%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.21-7.25 (m, 1Н), 6.83 (d, J = 7.6 Гц, 1H), 6.70-6.73 (m, 2H), 4.10 (t, J = 5.0 Гц, 2Н), 3.76-3.80 (m, 2H), 2.56 (t, J = 7.8 Гц, 2H), 1.53-1.64 (m, 2H), 1.30-1.38 (m, 3Н), 0.87 (d, J = 6.4 Гц, 6Н).
Стадия 3: Снятие защиты 5-(3-(2-(2,2,2-трифторацетамидо)этокси) фенил)пентанамида позволило получить Пример 64 в виде желтого масла. Выход (0.415 г, 73%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.19-7.23 (m, 1H), 6.77-6.82 (m, 3Н), 4.11 (t, J = 5.2 Гц, 2H), 3.16 (t, J = 5.2 Гц, 2H), 2.53 (t, J = 7.6 Гц, 2H), 1.50-1.60 (m, 3Н), 1.14-1.20 (m, 2H), 0.85 (d, J = 6.8 Гц, 6Н).13С ЯМР (100 МГц, ДМСО-d6) δ 157.9, 144.1, 129.3, 121.2, 114.6, 111.8, 64.6, 38.5, 38.0, 35.4, 28.7, 27.3, 22.5. MS: 222 [M+1]+.
ПРИМЕР 65
Приготовление 2-(3-(3-фенилпроп-1-инил)фенокси)этанамина

2-(3-(3-фенилпроп-1-инил)фенокси)этанамин был приготовлен согласно способу, который использовали в Примере 9.
Стадия 1: Реакция Соногашира бромида 19 с 3-фенил-1-пропином позволила получить 2,2,2-трифтор-N-(2-(3-(3-фенилпроп-1-инил)фенокси)этил)ацетамид в виде коричневого масла. Выход (1.1 г, сырой). Сырой материал использовали непосредственно для дальнейших реаций снятия защиты.
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(2-(3-(3-фенилпроп-1-инил)фенокси)этил)ацетамида позволило получить 2-(3-(3-фенилпроп-1-инил)фенокси)этанамин в виде коричневого масла. Выход (0.74 г, 94%). Сырой материал использовали непосредственно для дальнейшей реакции восстановления.
Стадия 3: Восстановление 2-(3-(3-фенилпроп-1-инил)фенокси)этанамина позволило получить Пример 65 в виде коричневого масла. Выход (0.078 г, 23%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.26-7.30 (m, 2H), 7.17-7.25 (m, 4H), 6.77-6.83 (m, 3Н), 4.09 (t, J = 5.2 Гц, 2H), 3.15 (t, J = 5.2 Гц, 2H), 2.56-2.60 (m, 4H), 1.82-1.90 (m, 2H).13С ЯМР (100 МГц, ДМСО-d6) δ 158.5, 144.1, 142.3, 129.8, 128.8, 128.7, 126.2, 121.7, 115.1, 112.4, 65.2, 39.1, 35.2, 33.0. MS: 256 [M+1]+.
ПРИМЕР 66
Приготовление 4-(3-(2-аминоэтокси)фенил)бутан-1-ола

4-(3-(2-аминоэтокси)фенил)бутан-1-ол был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с бут-3-ин-1-олом позволила получить 2,2,2-трифтор-N-(2-(3-(4-гидроксибут-1-инил)фенокси)этил)ацетамид в виде коричневого масла. Выход (0.9 г, 93%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.21-7.25 (m, 1H), 7.06 (d, J = 7.6 Гц, 1H), 6.94 (bs, 1H), 6.85 (dd, J = 8.4, 2.4 Гц, 1H), 4.09 (t, J = 5.0 Гц, 2Н), 3.76-3.85 (m, 4Н), 2.70(1, J = 6.4 Гц, 2Н)
Стадия 2: Восстановление 2,2,2-трифтор-N-(2-(3-(4-гидроксибут-1-инил)фенокси)этил)ацетамида позволило получить 2,2,2-трифтор-N-(2-(3-(4-гидроксибутил)фенокси)этил)ацетамид в виде желтого масла. Выход (0.42 г, 63%). MS: 304 [M-1].
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(2-(3-(4-гидроксибутил)фенокси) этил)ацетамида позволило получить Пример 66 в виде желтого масла. Выход (0.121 г, 44%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.14-7.18 (m, 1H), 6.71-6.76 (m, 3Н), 3.88 (t, J = 5.8 Гц, 2Н), 3.39 (t, J = 6.6 Гц, 2Н), 2.85 (t, J = 5.8 Гц, 2Н), 2.53 (t, 7 = 6.8 Гц, 2Н), 1.53-1.60 (m, 2Н), 1.38-1.45 (m, 2H).13С ЯМР (100 МГц, ДМСО-d6) δ 159.1, 144.4, 129.6, 121.0, 115.0, 112.0, 70.4, 61.0, 41.4, 35.5, 32.6, 27.8. MS: 210 [M+1].
ПРИМЕР 67
Приготовление 2-(3-фенетилфенокси)этанамина

2-(3-фенетилфенокси)этанамин был приготовлен согласно способу, описанному в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с этинилбензолом позволила получить 2,2,2-тpифтop-N-(2-(3-(фeнилэтинил)фeнoкcи)этил)aцeтaмид в виде коричневого масла. Выход (0.755 г, 70%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.65 (bs, 1H), 7.53-7.57 (m, 2Н), 7.41-7.47 (m, 3Н), 7.34-7.36 (m, 1H), 7.15 (d, J = 7.6 Гц, 1Н), 7.12 (s, 1H), 7.0 (dd, J = 7.6, 2.0 Гц, 1H), 4.14 (t, J = 5.4 Гц, 2Н), 3.55-3.60 (m, 2H).
Стадия 2: Восстановление 2,2,2-трифтор-N-(2-(3-(фенилэтинил)фенокси) этил)ацетамида позволило получить 2,2,2-трифтор-N-(2-(3-фенетилфенокси)этил) ацетамид в виде желтого масла. Выход (0.61 г, 80%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.66 (bs, 1H), 7.15-7.21 (m, 4Н), 7.15-7.20 (m, 2H), 6.80-6.83 (m, 2H), 6.75 (d, J = 7.6 Гц, 1H), 4.06 (t, J = 5.6 Гц, 2H), 3.54-3.60 (m, 2H), 2.81-2.90 (m, 4Н
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(2-(3-фенетилфенокси)этил)ацетамида позволило получить Пример 67 в виде грязно-белого твердого вещества. Выход (0.205 г, 41%):1Н ЯМР (400 MHz, ДМСО-d6) δ 7.14-7.28 (m, 6H), 6.83-6.85 (m, 2H), 6.79 (d, J = 8.4 Гц, 1H), 4.11 (t, J = 5.0 Гц, 2H), 3.18 (t, J = 5.0 Гц, 2H), 2.83-2.87 (m, 4H).13C ЯМР (100 МГц, ДМСО-d6) δ 157.8, 143.2, 141.4, 129.3, 128.3, 128.2, 125.8, 121.3, 114.7, 112.1, 64.6, 38.2, 37.0, 36.9. MS: 242 [M+1]+.
ПРИМЕР 68
Приготовление 2-(3-(4-фенилбутил)фенокси)этанамина

2-(3-(4-фенилбутил)фенокси)этанамин был приготовлен согласно способу, который использовали в Примере 9.
Стадия 1: Реакция Соногашира бромида 19 с бут-3-инил-бензолом позволила получить 2,2,2-трифтор-N-(2-(3-(4-фенилбут-1-инил)фенокси)этил)ацетамид в виде прозрачного масла. Выход (2.8 г, сырой). Сырой материал использовали непосредственно для последующей реакции снятия защиты.
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(2-(3-(4-фенилбут-1-инил)фенокси)этил)ацетамида позволило получить 2-(3-(4-фенилбут-1-инил)фенокси)этанамин в виде желтого масла. Выход (0.700 г, 35%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.29-7.33 (m, 4H), 7.20-7.26 (m, 2H), 6.88-6.93 (m, 2H), 6.84-6.87 (m, 1H), 3.89 (t, J = 5.6, 2H), 2.80-2.88 (m, 4H), 2.69 (t, J = 7.2, 2H).13С ЯМР (100 МГц, ДМСО-d6) δ 158.5, 140.5, 129.7, 128.6, 128.2, 126.2, 124.2, 123.5, 116.6, 114.9, 90.0, 81.1, 70.3, 40.9, 34.3, 20.9. MS: 266 [M+1]+.
Стадия 3: Восстановление 2-(3-(4-фенилбут-1-инил)фенокси)этанамина позволило получить Пример 68 в виде желтого масла. Выход (0.178 г, 89%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.12-7.27 (m, 6H), 6.76-6.80 (m, 3H), 4.09 (t, J = 5.0 Гц, 2H), 3.15 (t, J = 5.0 Гц, 2H), 2.49-2.57 (m, 4H), 1.53-1.58 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 157.9, 143.9, 142.1, 129.3, 128.3, 128.2, 125.6, 121.2, 114.6, 111.8, 64.5, 38.5, 34.9, 30.6, 30.5. MS: 270 [M+1]+.
ПРИМЕР 69
Приготовление 2-(3-(2-метоксифенетил)фенокси)этанамина
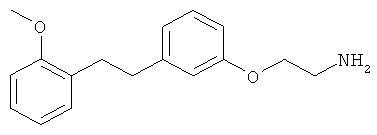
2-(3-(2-метоксифенетил)фенокси)этанамин был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с 2-этиниланизолом позволила получить 2,2,2-трифтор-N-(2-(3-((2-метоксифенил)этинил)фенокси)этил)ацетамид в виде коричневого масла. Выход (0.4 г, 62%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.48 (dd, J = 7.6, 1.6 Гц, 1Н), 7.37-7.42 (m, 1H), 7.31-7.36 (m, 1H), 7.09-7.12 (m, 2H), 7.08 (s, 1H), 6.95-7.01 (m, 2H), 4.13 (t, J = 5.6 Гц, 2H), 3.86 (s, 3Н), 3.55-3.60 (m, 2H).
Стадия 2: Восстановление 2,2,2-трифтор-N-(2-(3-((2-метоксифенил)этинил) фенокси)этил)ацетамида позволило получить 2,2,2-трифтор-N-(2-(3-(2-метоксифенетил)фенокси)этил)ацетамид в виде желтого масла. Выход (0.253 г, 63%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.15-7.20 (m, 2H), 7.12 (d, J = 7.2 Гц, 1H), 6.95 (d, J = 8.4 Гц, 1H), 6.73-6.86 (m, 4H), 4.06 (t, J = 5.6 Гц, 2H), 3.79 (s, 3Н), 3.56 (t, J = 5.4 Гц, 2H), 2.75-2.83 (m, 4H).
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(2-(3-(2-метоксифенетил)фенокси) этил)пцетамида позволило получить Пример 69 в виде желтого масла. Выход (0.122 г, 66%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.16-7.20 (m, 2H), 7.12 (d, J = 7.2 Гц, 1H), 6.95 (d, J = 8.0 Гц, 1H), 6.82-6.86 (m, 1H), 6.74-6.79 (m, 3Н), 3.92 (t, J = 5.6 Гц, 2H), 3.79 (s, 3Н), 2.92 (t, J = 5.6 Гц, 2H), 2.76-2.84 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 158.8, 157.5, 144.0, 130.0, 129.7, 129.6, 127.7, 121.3, 120.6, 115.0, 112.3, 111.1, 68.1, 55.8, 40.6, 35.9, 32.0. MS: 272 [M+1]+.
ПРИМЕР 70
Приготовление (S)-4-(3-(3-амино-1-гидроксипропил)фенетил)гептан-4-ола

(S)-4-(3-(3-амино-1-гидроксипропил)фенетил)гептан-4-ол был приготовлен согласно способу, показанному на Схеме 16.
Схема 16

Стадия 1: В раствор гидроксиамина 38 (37.61 г, 163.4 ммоль) в CH2Cl2 (250 мл) добавляли этилтрифторацетат (28 мл, 209.6 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После чего добавляли Celite (70 г) с последующим хлорхроматом пиридиния (75.65 г, 350.9 ммоль) и СН2Сl2 (200 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, растворитель удаляли при пониженном давлении для получения коричневого твердого вещества, которое переносили на стеклянный фильтр и тщательно отмывали смесью МТВЕ:Гексаны (1:1) Фильтрат концентрировали при пониженном давлении и остаток кристаллизовали из смеси гексаны: EtOAc (95:5) для получения кетона 76 в виде белого твердого вещества. Выход (26.52 г, 50%):1H ЯМР (400 МГц, ДМСО-d6) δ 9.41 (br. t, 1H), 8.06 (t, J = 1.8 Гц, 1H), 7.91-7.95 (m, 1H), 7.80-7.85 (m, 1H), 7.48 (t, J = 8.0 Гц, 1H), 3.50 (q, J = 6.5 Гц, 2Н), 3.30 (t, J = 6.5 Гц, 2Н).
Стадия 2: Взаимодействие 4-этинилгептан-4-ола (44) с бромидом 76 выполняли согласно способу, который использовали для приготовления Примера 2, за исключением того, что реакционную смесь перемешивали при +80°С в течение 3 ч. Очистка флэш хроматографией (градиент от 10% до 70% EtOAc-гексаны) позволила получить алкин 77 в виде темного желтого масла. Выход (3.15 г, колич.).1Н ЯМР (400 МГц, ДМСО-d6) δ 9.40 (br. t, 1H), 7.84-7.92 (m, 2H), 7.58-7.63 (m, 1H), 7.50 (t, J = 7.6 Гц, 1H), 5.19 (s, 1H), 3.51 (q, J = 5.7 Гц, 2H), 3.30 (t, J = 6.7 Гц, 2H), 1.40-1.64 (m, 8H), 0.90 (t, J = 7.2 Гц, 6Н).
Стадия 3: Приготовление (+)-диизопинокамфилрборан ((+)-Iрc2В-Сl) раствора: В ледяной раствор (+)-α-пинена (26.38 г, 193.6 ммоль) в гексане (18 мл) в атмосфере аргона добавляли монохлорборан-метилсульфидный комплекс (9.5 мл, 91.12 ммоль) в течение 5 мин. Смесь перемешивали в течение 5 мин, затем оставляли нагреваться до комнатной температуры. Реакционную смесь нагревали при 30°С в течение 3 ч. Полученный раствор имел концентрацию примерно 1.67 M.
В раствор кетона 77 при 0°С (14.34 г, 37.4 ммоль) и диизопропилэтиламина (6.5 мл, 37.31 ммоль) в безводном THF (60 мл) в атмосфере аргона добавляли раствор (+)-Iрc2В-Сl (55 мл 1.67 М раствора, приготовленного выше, 91.12 ммоль). Реакционную смесь перемешивали при 0°С в течение 5 мин и затем при комнатной температуре в течение 3.5 ч. Реакционную смесь снова охлаждали до 0°С и осторожно добавляли насыщенный водный раствор NaHCO3 (80 мл). Реакционную смесь перемешивали при 0°С в течение 1 ч и затем помещали при -20°С на ночь. Слои разделяли, водный слой экстрагировали МТВЕ, объединенные органические слои отмывали NaHCO3, затем солевым раствором, после чего концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент от 10% до 100% EtOAc-гексаны) позволила получить (S)-алкин 78 в виде желтоватого масла. Выход (10.55 г, 70%).1Н ЯМР (400 МГц, ДМСО-d6) δ 9.32 (br. s, 1H), 7.30-7.33 (m, 1H), 7.26-7.29 (m, 2H), 7.19-7.23 (m, 1H), 5.36 (br. s, 1H), 5.12 (s, 1H), 4.56 (dd, J = 4.7, 7.6 Гц, 1H), 3.15-3.27 (m, 2H), 1.70-1.82 (m, 2H), 1.40-1.61 (m, 8H), 0.91 (t, J = 7.2 Гц, 6H).
Стадия 4. (S)-Алкин 78 гидрировали способом, который использовали в Примере 13, за исключением того, что реакцию проводили при комнатной температуре в течение 2 ч. Очистка флэш хроматографией (градиент от 20% до 80% ЕtOАс-гексаны) позволила получить алкан 79 в виде желтого масла. Выход (5.13 г, 98%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.32 (br. s, 1H), 7.18 (t, J = 7.4 Гц, 1H), 7.06-7.12 (m, 2H), 6.99-7.03 (m, 1H), 5.25 (d, J = 4.3 Гц, 1H), 4.52 (q, J = 4.7 Гц, 1H), 3.95 (s, 1H), 3.23 (q, J = 7.0 Гц, 2H), 2.48-2.53 (m, 2H), 1.72-1.80 (m, 2H), 1.50-1.56 (m, 2H), 1.20-1.36 (m, 8H), 0.84 (t, J = 6.9 Гц, 6Н).
Стадия 5. Снятие защиты трифторацетамида 79 выполняли согласно способу, который использовали для приготовления Примера 9, за исключением того, что использовали 3 эквивалента К2СО3 и реакционную смесь перемешивали при +40°С в течение 4 ч. Очистка флэш хроматографией (градиент от 50% до 100% 20% 7М NH3 в МеОН/ЕtOАс-гексан) позволила получить Пример 70 в виде светло-желтого масла. Выход (3.18 г, 82%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.16 (t, J = 7.6 Гц, 1Н), 7.04-7.12 (m, 2H), 6.96-7.00 (m, 1Н), 4.59 (dd, J = 5.3, 7.4 Гц, 1Н), 3.95 (s, 1Н), 2.54-2.66 (m, 2H), 2.48-2.52 (m, 2H), 1.50-1.64 (m, 4H), 1.20-1.35 (m, 8H), 0.84 (t, J = 7.0 Гц, 6Н). Хиральная ВЭЖХ 95.3% (AUC), tR=22.2 мин.
ПРИМЕР 71
Приготовление (R)-4-(3-(3-амино-1-гидроксипропил)фенетил)гептан-4-ола

(R)-4-(3-(3-амино-1-гидроксипропил)фенетил)гептан-4-ол был приготовлен согласно способу, который использовали в Примере 70.
Стадия 1: Восстановление кетона 77 (-)-Iрc2В-Сl позволило получить (R)-2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгекс-1-инил)фенил)пропил)ацетамид в виде бесцветного масла. Выход (9.53 г, 69%);1Н ЯМР (400 МГц, ДМСО-d6) δ 9.32 (br. s, 1Н), 7.30-7.33 (m, 1Н), 7.26-7.29 (m, 2H), 7.19-7.23 (m, 1Н), 5.36 (br. s, 1Н), 5.12 (s, 1Н), 4.56 (dd, J = 4.7, 7.6 Гц, 1Н), 3.15-3.27 (m, 2H), 1.70-1.82 (m, 2H), 1.40-1.61 (m, 8H), 0.91 (t, J = 7.2 Гц, 6Н).
Стадия 2: Гидрирование (R)-2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгекс-1-инил)фенил)пропил)ацетамида позволила получить (R)-2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропил)ацетамид в виде светло-желтого масла. Выход (4.81 г, 94%).1Н ЯМР (400 МГц, ДМСО-d6) δ 9.32 (br. s, 1Н), 7.18 (t, J = 7.4 Гц, 1Н), 7.06-7.12 (m, 2H), 6.99-7.03 (m, 1Н), 5.25 (d, J = 4.3 Гц, 1Н), 4.52 (q, J = 4.7 Гц, 1Н), 3.95 (s, 1Н), 3.23 (q, J = 7.0 Гц, 2H), 2.48-2.53 (m, 2H), 1.72-1.80 (m, 2H), 1.50-1.56 (m, 2H), 1.20-1.36 (m, 8H), 0.84 (t, J = 6.9 Гц, 6Н).
Стадия 3: Снятие защиты (R)-2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропил)ацетамида позволило получить Пример 71 в виде желтого масла. Выход (2.87 г, 79%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.16 (t, J = 7.6 Гц, 1Н), 7.04-7.12 (m, 2H), 6.96-7.00 (m, 1Н), 4.59 (dd, J = 5.3, 7.4 Гц, 1Н), 3.95 (s, 1Н), 2.54-2.66 (m, 2H), 2.44-2.66 (m, 2H), 1.50-1.64 (m, 4H), 1.20-1.35 (m, 8H), 0.84 (t, J = 7.0 Гц, 6Н). Преп. ВЭЖХ (Способ 2) tR=6.21 мин, 96.5% (AUC); ESI MS m/z 294.51 [М+Н+]+. Хиральная ВЭЖХ 95.1% (AUC), tR=16.6 мин.
ПРИМЕР 72
Приготовление 3-амино-1-(3-(3-метоксипропил)фенил)пропан-1-ола

3-амино-1-(3-(3-метоксипропил)фенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Реакция Соногашира 43 с метилпропаргиловым эфиром позволила получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-метоксипроп-1-инил)фенил)пропил) ацетамид в виде коричневого масла. Выход (0.401 г, 82%):1H ЯМР (400 МГц, CDCl3) δ 7.51 (s, 1H), 7.38-7.44 (m, 1H), 7.31-7.35 (m, 2H), 4.84-4.88 (m, 1H), 4.32 (s, 2H), 3.66-3.69 (m, 1H), 3.44 (s, 3H), 3.39-3.42 (m, 1H), 2.37 (bs, 1H), 1.94-1.99 (m, 2H).
Стадия 2: Восстановление 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-метоксипроп-1-инил)фенил)пропил)ацетамида позволило получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-метоксипропил)фенил)пропил)апетамид в виде желтого масла. Выход (0.298 г, 73%).1Н ЯМР (400 МГц, CDCl3) δ 7.31 (s, 1H), 7.13-7.24 (m, 3H), 4.84-4.88 (m, 1H), 3.66-3.70 (m, 1H), 3.49 (m, 1H), 3.38 (t, J = 6.4 Гц, 2H), 3.34 (s, 3H), 2.69 (t, J = 7.6 Гц, 2H), 1.90-1.95 (m, 2H), 1.86-1.89 (m, 2H).
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-метоксипропил)фенил)пропил)ацетамида позволило получить гель желтого цвета, что после очистки флэш хроматографией (градиент 0-10% MeOH-NH3 (9.5:0.5)-DCM) позволило получить Пример 72 в виде желтого полутвердого вещества. Выход (0.597 г, 82%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.22 (t, J = 7.6 Гц, 1H), 7.13 (s, 1H), 7.11 (d, J = 7.6 Гц, 1H), 7.04 (d, J = 7.6 Гц, 1H), 4.61 (t, J = 6.4 Гц, 1H), 3.29 (t, J = 6.4 Гц, 2H), 3.21 (s, 3H), 2.72-2.77 (m, 2H), 2.58 (t, J = 7.2 Гц, 2H), 1.66-1.79 (m, 4H).13C ЯМР (100 МГц, ДМСО-d6) δ 146.1, 142.0, 128.5, 127.3, 126.0, 123.5, 71.6, 70.8, 58.3, 38.7, 37.7, 32.2, 31.4. MS: 224 [M+1].
ПРИМЕР 73
Приготовление 3-амино-1-(3-гексилфенил)пропан-1-ола

3-амино-1-(3-гексилфенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Реакция Соногашира 43 с 1-гексином позволила получить 2,2,2-трифтор-N-(3-(3-(гекс-1-инил)фенил)-3-гидроксипропил)ацетамид в виде желтого масла. Выход (1.53 г, 76%):1Н ЯМР (400 МГц, CDCl3) δ 7.38 (s, 1H), 7.25-7.34 (m, 3H), 4.88 (m, 1H), 3.65-3.73 (m, 1H), 3.38-3.42 (m, 1H), 2.40 (t, J = 7.2 Гц, 2Н), 2.25 (d, J = 2.0, 1H) 1.93-1.99 (m, 2Н), 1.45-1.61 (m, 4H), 0.94 (t, J = 7.2 Гц, 3Н).
Стадия 2: Раствор 2,2,2-трифтор-N-(3-(3-(гекс-1-инил)фенил)-3-гидроксипропил)ацетамида в EtOAc (20 мл) дегазировали и продували азотом. Затем в него добавляли Pd на С (0.2 г, 10%). Колбу вакуумировали и заполняли водородом. После повторения этой процедуры три раза реакционную смесь перемешивали под баллоном с На в течение 14 ч, после чего эту смесь фильтровали через слой Celite и концентрировали при пониженном давлении для получения 2,2,2-трифтор-N-(3-(3-гексилфенил)-3-гидроксипропил)ацетамида в виде желтого масла. Выход (0.93 г, 75%):1H ЯМР (400 МГц, СDСl3) δ 7.40 (bs, 1H), 7.28-7.31 (m, 2Н), 7.12-7.16 (m, 2Н), 4.86-4.88 (m, 1H), 3.66-3.71 (m, 1H), 3.40-3.43 (m, 1H), 2.58 (t, J = 7.6 Гц, 2Н), 1.96-1.99 (m, 2Н), 1.56-1.60 (m, 4H), 1.30-1.35 (m, 4H), 0.88 (t, J = 6.8 Гц, 3Н).
Стадия 3: Смесь 2,2,2-трифтор-N-(3-(3-гексилфенил)-3-гидроксипропил)ацетамида, карбоната калия (1.55 г, 11.2 ммоль) и воды (4 мл) в 2-PrОН (20 мл) нагревали с обратным холодильником в течение ночи. Реакционную смесь концентрировали до сухого состояния при пониженном давлении для получения желтого масла. Этот сырой продукт растворяли в метаноле (5 мл) и к нему добавляли НСl в диоксане (1 мл, 4М). Смесь перемешивали в течение 30 мин, после чего концентрировали до сухого состояния при пониженном давлении. Очистка флэш хроматографией (градиент 0-10% MeOH-DCM) позволила получить Пример 73 гидрохлорид в виде бледно-желтого полутвердого вещества. Выход (0.174 г, 21%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.67 (bs, 3Н), 7.23 (t, J = 7.2 Гц, 1H), 7.11 (m, 2Н), 7.07 (d, J = 7.2 Гц, 1H), 4.62-4.65 (m, 1H), 2.78-2.87 (m, 2Н), 2.49 (m, 2Н), 1.80-1.84 (m, 2Н), 1.54 (m, 2Н), 1.27 (m, 6H), 0.85 (t, J = 6.8, 3Н).13C ЯМР (100 МГц, ДМСО-d6) δ 145.3, 142.2, 128.1, 126.9, 125.5, 122.9, 69.7, 36.7, 36.4, 35.3, 31.1, 31.0, 28.4, 22.1. MS: 236 [M+1]+.
ПРИМЕР 74
Приготовление 2-(3-(2-циклопропилэтил)фенокси)этанамина

2-(3-(2-циклопропилэтил)фенокси)этанамин был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с циклопропилацетиленом позволила получить N-(2-(3-(2-циклопропилэтинил)фенокси)этил)-2,2,2-трифторацетамид в виде прозрачного масла. Выход (2.0 г, 71%): Сырой материал гидрогенизировали.
Стадия 2: Восстановление N-(2-(3-(2-циклопропилэтинил)фенокси)этил)-2,2,2-трифторацетамида позволило получить N-(2-(3-(2-циклопропилэтил)фенокси)этил)-2,2,2-трифторацетамид в виде желтого масла. Выход (0.205 г, 45%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.70 (bs, 1H), 7.14-7.19 (m, 1H), 6.72-6.80 (m, 3H), 4.06 (t, J = 5.6 Гц, 2Н), 3.53-3.58 (m, 2H), 2.62 (t, J = 7.8 Гц, 2Н), 1.42-1.48 (m, 2Н), 0.62-0.70 (m, 1H), 0.37-0.40 (m, 2Н), 0.02-0.10 (m, 2H). MS: 300[M-1].
Стадия 3: Снятие защиты N-(2-(3-(2-циклопропилэтил)фенокси)этил)-2,2,2-трифторацетамида позволило получить Пример 74 в виде зеленого масла. Выход (0.121 г, 87%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.13-7.19 (m, 1H), 6.71-6.77 (m, 3H), 3.88 (t, J = 5.8 Гц, 2Н), 2.85 (t, J = 5.8 Гц, 2Н), 2.61 (t, J = 7.8 Гц, 2Н), 1.43-1.50 (m, 2Н), 0.64-0.72 (m, 1H), 0.47-0.50 (m, 2Н), 0.02-0.06 (m, 2Н).13С ЯМР (100 МГц, ДМСО-d6) δ 158.6, 143.7, 129.1, 120.5, 114.5, 111.6, 69.8, 40.9, 36.0, 35.4, 10.6, 4.4. MS: 206 [M+1]+.
ПРИМЕР 75
Приготовление 5-(3-(2-аминоэтокси)фенил)пентан-1-ола

5-(3-(2-аминоэтокси)фенил)пентан-1-ол был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Смесь бромида 19 (2.5 г, 8 ммоль), пентин-1-ола (1.34 г, 16 ммоль) в триэтиламине (6 мл, 60 ммоль) и DMF (18 мл) продували азотом в течение 10 минут. После этого добавляли PdCl2(PPh3)2 (0.28 г, 0.4 ммоль), Р(о-То1)3 (0.122 г, 0.4 ммоль) и CuI (0.076 г, 0.4 ммоль), и колбу снова продували азотом, после чего полученную смесь нагревали при 90°С в течение ночи. Смесь погружали в воду, экстрагировали этилацетатом. Органический слой отмывали водой, высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент от 0 до 30% ЕtOАс-гексаны) позволила получить 2,2,2-трифтор-N-(2-(3-(5-гидроксипент-1-инил)фенокси)этил)ацетамид в виде желтого масла. Выход (1.61 г, 63%):1Н ЯМР (400 МГц, СDCl3) δ 7.18-7.24 (m, 1H), 7.03 (d, J = 7.6 Гц, 1H), 6.91 (dd, J = 0.8, 1.2 Гц, 1H), 6.83 (dd, J = 5.6, 2.0 Гц, 1H), 6.76 (bs, 1H), 4.06-4.10 (m, 2Н), 3.76-3.84 (m, 4H), 2.53 (t, J = 7.2 Гц, 2Н), 1.82-1.90 (m, 2Н).
Стадия 2: Восстановление 2,2,2-трифтор-N-(2-(3-(5-гидроксипент-1-инил)фенокси)этил)ацетамида позволило получить 2,2,2-трифтор-N-(2-(3-(5-гидроксипентил)фенокси)этил)ацетамид в виде желтого масла. Выход (0.513 г, 72%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.15-7.20 (m, 1H), 6.72-6.78 (m, 3H), 4.34 (t, J = 5.0 Гц, 2Н), 4.06 (t, J = 5.6 Гц, 2Н), 3.52-3.59 (m, 2Н), 3.37 (t, J = 6.4 Гц, 2Н), 1.51-1.60 (m, 2Н), 1.40-1.47 (m, 2Н), 1.24-1.32 (m, 2Н). MS: 318 [M-1].
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(2-(3-(5-гидроксипентил) фенокси)этил)ацетамида позволило получить Пример 75 в виде желтого масла. Выход (0.175 г, 49%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.14-7.19 (m, 1H), 6.71-6.76 (m, 3H), 3.94 (t, J = 5.6 Гц, 2Н), 3.34 (t, J = 6.6 Гц, 2Н), 2.90 (t, J = 5.6 Гц, 2Н), 2.50 (t, J = 8.0 Гц, 2Н), 1.48-1.56 (m, 2Н), 1.36-1.46 (m, 2Н), 1.22-1.30 (m, 2H).13С ЯМР (100 МГц, ДМСО-d6) δ 158.5, 144.0, 129.2, 120.7, 114.6, 111.6, 68.4, 60.7, 40.3, 35.3, 32.4, 30.8, 25.2. MS: 224 [M+1]+.
ПРИМЕР 76
Приготовление 3-(3-(2-циклопропилэтил)фенил-пропан-1-амина

3-(3-(2-циклопропилэтил)фенил-пропан-1-амин был приготовлен согласно способу, который использовали в Примерах 13 и 22, за исключением того, что гидрирование выполняли перед снятием защиты амина.
Стадия 1: В дегазированный раствор трет-бутил 3-(3-бромфенил) пропилкарбамата (57) (1.0 г, 3.1 ммоль) и циклопропилацетилена (2.9 мл, 3.4 ммоль, 70% раствор в толуоле) в диизопропиламине (4 мл) добавляли PdCl2(PPh3)2 (0.120 г, 0.17 ммоль), три-о-толилфосфин (0.048 г, 0.16 ммоль) и CuI (0.026 г, 0.16 ммоль). Полученную смесь дегазировали и перемешивали в атмосфере азота при 90°С в течение ночи. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток разделяли между водой и этилацетатом. Органический слой высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент 10-40% этилацетат-гексан) позволила получить трет-бутил 3-(3-(циклопропилэтинил)фенил)пропилкарбамат. Выход (0.756 г, 79%). Этот алкин использовали для снятия защиты без дальнейшей очистки.
Стадия 2: Восстановление трет-бутил 3-(3-(циклопропилэтинил) фенил)пропилкарбамата согласно способу, который использовали в Примере 22, позволило получить трет-бутил 3-(3-(2-циклопропилэтил)фенил)пропилкарбамат в виде желтого масла. Выход (0.404 г, 98%): MS: 304 [M+1]+.
Стадия 3: Снятие ВОС защиты трет-бутил 3-(3-(2-циклопропилэтил) фенил)пропилкарбамата согласно способу, который использовали в Примере 13, позволило получить Пример 76 в виде желтого масла. Выход (0.19 г, 90%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.17-7.21 (m, 1H), 6.99-7.04 (m, 3Н), 2.72 (t, J = 7.2 Гц, 2Н), 2.58-2.66 (m, 4Н), 1.75-1.83 (m, 2Н), 1.42-1.48 (m, 2Н), 0.64-0.71 (m, 1H), 0.36-0.41 (m, 2Н), 0.01-0.06 (m, 2Н).13С ЯМР (100 МГц, ДМСО-d6): 142.7, 141.1, 128.8, 128.7, 126.5, 126.0, 38.8, 36.6, 35.8, 32.3, 29.3, 11.1, 4.9. MS: 204 [M+1]
ПРИМЕР 77
Приготовление 2-(3-гексилфенокси)этанамина

2-(3-гексилфенокси)этанамин был приготовлен согласно способу, который использовали в Примере 9.
Стадия 1: Реакция Соногашира бромида 19 с 1-гексином позволила получить 2,2,2-трифтор N-(2-(3-(гекс-1-инил)фенокси)этил)ацетамид в виде прозрачного масла. Выход (1.8 г, 72%):1Н ЯМР (400 МГц, CDCl3) δ 7.19-7.23 (m, 1H), 7.05 (d, J = 7.6 Гц, 1H), 6.84 (s, 1H), 6.80 (dd, J = 8.0,2.4 Гц, 1H), 4.10 (t, J = 5.2 Гц, 2Н), 3.77-3.80 (m, 2Н), 2.40 (t, J = 7.2 Гц, 2Н), 1.53-1.61 (m, 2Н), 1.43-1.50 (m, 2Н), 0.95 (t, J = 7.2 Гц, 3Н).
Стадия 2: Снятие защиты 2,2,2-трифтор N-(2-(3-(гекс-1-инил)фенокси)этил)ацетамида позволило получить 2-(3-(гекс-1-инил)фенокси)этанамин в виде желтого масла. Выход (0.620 г, 90%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.20-7.25 (m, 1H), 6.87-6.93 (m, 3Н), 3.91 (t, J = 5.2 Гц, 2Н), 2.79-2.87 (m, 2Н), 2.38 (t, J = 6.4 Гц, 2Н), 1.42-1.53 (m, 2Н), 1.30-1.40 (m, 2Н), 0.88 (t, J = 7.2 Гц, 3Н).13С ЯМР (100 МГц, ДМСО-d6) δ 158.9, 130.1, 124.8, 124.1, 117.2, 115.3, 90.9, 80.9, 70.3, 41.1, 30.7, 21.9, 18.7, 13.9. ESI MS m/z 218 [M+1]+.
Стадия 3: Восстановление 2-(3-(гекс-1-инил)фенокси)этанамина позовлило получить Пример 77 в виде желтого масла. Выход (0.154 г, 57%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.13-7.18 (m, 1H), 6.70-6.75 (m, 3Н), 3.91 (t, J = 5.6 Гц, 2Н), 2.86 (t, J = 5.6 Гц, 2Н), 1.20-1.28 (m, 6H), 1.52 (t, J = 7 Гц, 2Н), 0.82 (t, J = 6.6 Гц, 3Н).13С ЯМР (100 МГц, ДМСО-d6) δ 159.1, 144.4, 129.6, 121.0, 114.9, 112.0, 69.9, 35.7, 31.6, 31.3, 28.8, 22.5, 14.6. MS: 222 [M+1]+.
ПРИМЕР 78
Приготовление 2-(3-(3-метоксипропил)фенокси)этанамина
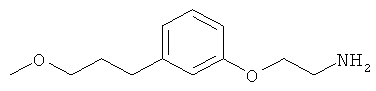
2-(3-(3-метоксипропил)фенокси)этанамин был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с 3-метокси-пропином позволила получить 2,2,2-трифтор-N-(2-(3-(3-метоксипроп-1-инил)фенокси)этил)ацетамид в виде прозрачного масла. Выход (0.51 г, 21%):1Н ЯМР (400 МГц, CDCl3) δ 7.22-7.27 (m, 1H), 7.10 (d, J = 7.6 Гц, 1H), 6.98 (s, 1H), 6.88 (dd, J = 6.8, 1.6 Гц, 1H), 6.71 (bs, 1H), 4.32 (s, 2H), 4.10 (t, J = 5.2 Гц, 2H), 3.77-3.82 (m, 2H), 3.45 (s, 3Н).
Стадия 2: Восстановление 2,2,2-трифтор-N-(2-(3-(3-метоксипроп-1-инил)фенокси)этил)ацетамида позволило получить 2,2,2-трифтор-N-(2-(3-(3-метилпропил)фенокси)этил)ацетамид в виде желтого масла. Выход (0.355 г, 76%).1H ЯМР (400 МГц, ДМСО-d6) δ 7.16-7.22 (m, 1H), 6.74-6.79 (m, 3Н), 4.07 (t, J = 5.6 Гц, 2H), 3.54-3.58 (m, 2H), 3.33 (s, 3Н), 3.28 (t, J = 6.2 Гц, 2H), 2.57 (t, J = 7.8 Гц, 2H), 1.73-1.81 (m, 2H).
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(2-(3-(3-метилпропил)фенокси)этил) ацетамида позволило получить Пример 78 в виде желтого масла. Выход (0.125 г, 52%):1Н ЯМР (400 МГц, ДМСО-d6) δ 8.03 (bs, 2H), 7.20-7.24 (m, 1H), 6.78-6.83 (m, 3Н), 4.14 (t, J = 5.6 Гц, 2H), 2.94 (t, J = 5.6 Гц, 2H), 2.53 (t, J = 7.2 Гц, 2H), 2.05 (t, J = 7.2 Гц, 2H), 1.44-1.54 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 158.4, 144.0, 129.8, 121.7, 115.1, 112.4, 71.6, 64.6, 58.3, 38.8, 32.2, 31.2. MS: 210 [M+1]+.
ПРИМЕР 79
Приготовление 3-амино-1-(3-(3-гидроксипропил)фенил)пропан-1-ола
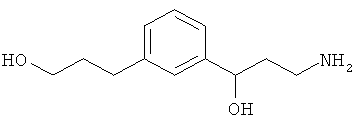
3-амино-1-(3-(3-гидроксипропил)фенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 17, за исключением того, что гидрирование проводили перед снятием защиты амина.
Стадия 1: Реакция Соногашира бромида 39 с пропаргиловым спиртом позволила получить трет-бутил 3-гидрокси-3-(3-(3-гидроксипроп-1-инил)фенил) пропилкарбамат в виде коричневого масла. Выход (0.880 г, 94%):1Н ЯМР (400 МГц, СDСl3) δ 7.45 (s, 1H), 7.28-7.36 (m, 3Н), 4.85-4.87 (bs, 1H), 4.70-4.72 (m, 1H), 4.49 (d, J = 5.2 Гц, 2H), 3.47-3.50 (m, 1H), 3.44 (bs, 1H), 3.12-3.17 (m, 1H), 1.93-1.99 (m, 2H), 1.45 (s, 9H).
Стадия 2: Восстановление трет-бутил 3-гидрокси-3-(3-(3-гидроксипроп-1-инил)фенил)пропилкарбамата позволило получить трет-бутил 3-гидрокси-3-(3-(3-гидроксипропил)фенил)пропилкарбамат в виде желтого масла. Выход (0.731 г, 82%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.20 (t, J = 7.6 Гц, 1Н), 7.13 (s, 1H), 7.11 (d, J = 7.6 Гц, 1Н), 7.04 (d, J = 7.6 Гц, 1Н), 6.77 (t, J = 5.2 Гц, 1Н) 5.15 (d, J = 4.4 Гц, 1Н), 4.51 (m, 1Н), 4.46 (t, J = 4.4 Гц, 1Н), 3.32-3.44 (m, 2H), 2.94-2.98 (m, 2H), 2.58 (t, J = 7.6 Гц, 2H), 1.64-1.73 (m, 4H), 1.45 (s, 9H).
Стадия 3: Снятие защиты трет-бутил 3-гидрокси-3-(3-(3-гидроксипропил)фенил)пропилкарбамата позволило получить гидрохлорид. Сырой продукт подвергали флэш хроматографии (градиент 0-15% MeOH-NH3 (9.5:0.5)-DCM) для получения Примера 79 в виде бледно-желтого полутвердого вещества. Выход (0.364 г, 61%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.20 (t, J = 7.6 Гц, 1Н), 7.10 (s, 1Н), 7.07 (d, J = 7.6 Гц, 1Н), 7.02 (d, J = 7.6 Гц, 1Н), 4.56 (t, J = 6.8 Гц, 1Н), 3.38 (t, J = 6.4 Гц, 2H), 2.62-2.64 (m, 2H), 2.54-2.56 (m, 2H), 1.53-1.72 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 145.7, 142.5, 128.5, 127.4, 126.0, 123.4, 70.1, 60.5, 37.1, 36.8, 34.8, 32.2. MS: 210 [M+1]+.
ПРИМЕР 80
Приготовление 1-(3-(3-амино-1-гидроксипропил)фенил)гексан-3-ола

1-(3-(3-амино-1-гидроксипропил)фенил)гексан-3-ол был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Реакция Соногашира 43 (3 г, 9.2 ммоль) с гекс-1-ин-3-олом позволила получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидроксигекс-1-инил)фенил)пропил)ацетамид в виде желтого масла. Выход (2.31 г, 73%):1Н ЯМР (400 МГц, СDСl3) δ 7.42 (s, 1Н), 7.26-7.38 (m, 3H), 4.86 (m, 1Н), 4.61 (dd, J = 2.0, 5.6 Гц, 1Н), 3.67-3.71 (m, 1Н), 3.37-3.46 (m, 1Н), 2.38 (d, J = 2.0 Гц, 1Н), 1.95-1.99 (m, 2H), 1.75-1.88 (m, 2H), 1.53-1.57 (m, 2H), 0.97 (t, J = 7.2 Гц, 3H).
Стадия 2: Восстановление 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидроксигекс-1-инил)фенил)пропил)ацетамида позволило получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидроксигексил)фенил)пропил)ацетамид в виде желтого масла. Выход (0.911 г, 83%). Это соединение использовали в таком виде на следующей стадии превращения.
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидроксигексил)фенил)пропил)ацетамида и очистка флэш хроматографией (градиент 0-10% МеОН-NH3 (9.5:0.5)-DCM) позволило получить Пример 80 в виде желтого масла (соль НСl не готовили в данном случае). Выход (0.325 г, 49%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.23 (t, J = 7.2 Гц, 1Н), 7.17 (s, 1H), 7.10 (d, J = 7.6 Гц, 1Н), 7.01 (d, J = 7.2 Гц, 1Н), 4.61 (t, J = 6.0 Гц, 1H), 4.39 (bs, 1Н), 2.55-2.70 (m, 4H), 1.53-1.65 (m, 4H), 1.26-1.39 (m, 4H), 0.85 (t, J = 6.4 Гц, 3Н).13С ЯМР (100 МГц, ДМСО-d6) δ 146.4, 142.1, 127.8, 126.4, 125.6, 122.9, 71.3, 68.7, 42.3, 38.9, 31.6,18.4, 14.1. MS: 252 [М+1]+.
ПРИМЕР 81
Приготовление 1-(3-(2-аминоэтокси)фенил)гексан-3-ола

1-(3-(2-аминоэтокси)фенил)гексан-3-ол был приготовлен согласно способу, который использовали в Примере 9.
Стадия 1: Реакция Соногашира бромида 19 с 4-метил-пент-1-ин-3-олом позволила получить 2,2,2-трифтор-N-(2-(3-(3-гидроксигекс-1-инил)фенокси)этил)ацетамид в виде прозрачного масла. Выход (3 г, сырой): Сырой материал использовали непосредственно в последующих реакциях снятия защиты.
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(2-(3-(3-гидроксигекс-1-инил)фенокси)этил)ацетамида позволило получить 1-(3-(2-аминоэтокси)фенил)гекс-1-ин-3-ол в виде желтого масла. Выход (1.858 г, 88%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.23-7.29 (m, 1H), 6.90-6.98 (m, 3Н), 4.42 (t, J = 6.4 Гц, 2H), 3.92 (t, J = 4.8 Гц, 2Н), 2.86 (bs, 2H), 1.56-1.68 (m, 2H), 1.40-1.49 (m, 2H), 0.91 (t, J = 7.6 Гц, 3Н).13С ЯМР (100 МГц, ДМСО-d6) δ 159.0, 130.3, 124.0, 117.1, 115.8, 92.8, 833, 70.4, 61.0, 41.2, 40.1, 18.6, 14.2. ESI MS m/z 234 [М+1]+.
Стадия 3: Восстановление 1-(3-(2-аминоэтокси)фенил)гекс-1-ин-3-ола позволило получить Пример 81 в виде желтого масла. Выход (0.55 г, 68%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.13-7.18 (m, 1H), 6.71-6.76 (m, 3Н), 4.36-4.42 (m, 1H), 3.91 (t, J = 5.6 Гц, 2H), 2.87 (t, J = 5.6 Гц, 2H), 2.62-2.70 (m, 2H), 1.50-1.64 (m, 2H), 1.24-1.40 (m, 4H), 0.85 (s, 3Н).13С ЯМР (100 МГц, ДМСО-d6) δ 158.6, 144.2, 129.2, 120.5, 114.5, 111.5, 69.5, 68.7, 40.8, 39.3, 39.0, 31.6, 18.4, 14.1. MS: 238 [М+1]+
ПРИМЕР 82
Приготовление 3-амино-1-(3-(4-метоксибутил)фенил)пропан-1-ола

3-амино-1-(3-(4-метоксибутил)фенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Реакция Соногашира 43 с 4-метоксибут-1-ином позволила получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(4-метоксибут-1-инил)фенил)пропил)ацетамид в виде коричневого масла. Выход (0.351 г, 81%);1Н ЯМР (400 МГц, CDCl3) δ 7.40 (s, 1H), 7.27-7.37 (m, 3Н), 4.83-4.85 (m, 1H), 3.68-3.71 (m, 1H), 3.63 (t, J = 6.8 Гц, 2Н), 3.39 (s, 3Н), 3.34-3.38 (m, 1H), 2.69 (t, J = 6.8 Гц, 2Н), 2.38 (bs, 1H), 1.91-2.02 (m, 2Н).
Стадия 2: Восстановление 2,2,2-трифтор-N-(3-гидрокси-3-(3-(4-метоксибут-1-инил)фенил)пропил)ацетамида позволило получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(4-метоксибутил)фенил)пропил)ацетамид в виде желтого масла. Выход (0.332 г, 94%): Это соединение использовали в таком виде на следующей стадии превращения. MS: 334 [M+1]+.
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(4-метоксибутил)фенил)пропил)ацетамида с последующей очисткой флэш хроматографией (0-10% (МеОН-NH3 (9.5:0.5))-DCM) позволило получить Пример 82 в виде бледно-зеленого масла. Выход (0.156 г, 61%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.20 (t, J = 7.6 Гц, 1H), 7.11 (s, 1H), 7.09 (d, J = 7.6 Гц, 1H), 7.04 (d, J = 7.6 Гц, 1H), 4.58-4.61 (m, 1H), 3.30 (t, J = 6.4 Гц, 2Н), 3.18 (s, 3Н), 2.61 (t, J = 6.8 Гц, 2Н), 2.58 (t, J = 7.2 Гц, 2Н), 1.63-1.69 (m, 2Н), 1.45-1.56 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 146.6, 142.2, 128.3, 127.0, 126.0, 123.5, 72.2, 71.4, 58.3, 41.4, 38.7, 35.5, 29.1, 28.1. MS: 238 [M+1]+
ПРИМЕР 83
Приготовление (S)-1-(3-(1-аминопропан-2-илокси)фенетил)циклогексанола

(S)-1-(3-(1-аминопропан-2-илокси)фенетил)циклогексанол был приготовлен согласно способу, показанному на Схеме 17.
Схема 17

Стадия 1: Диэтилазодикарбоксилат (17.4 г, 100 ммоль) медленно добавляли в раствор 3-иодфенола (18.5 г, 84 ммоль), спирта 80 (14.73 г, 84 ммоль) и трифенилфосфина (26.2 г, 100 ммоль) в THF (200 мл) при 80°С в атмосфере аргона. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали при комнатной температуре в течение 2 часов, нагревали до 80°С в течение 6 часов, затем концентрировали при пониженном давлении. Остаток растирали с диэтиловым эфиром и полученную твердую фазу удаляли фильтрацией. Фильтрат концентрировали при пониженном давлении и остаток разделяли в этилацетате и 1 N NaOH. Органические слои объединяли, отмывали солевым раствором и концентрировали при пониженном давлении. Остаток очищали флэш хроматографией (градиент 5-20% этилацетат/гексаны) на силикагеле, что позволило получить карбамат 81 в виде загрязненного желтого масла, которое использовали на следующей стадии без дальнейшей очистки. Выход (17.3 г, 54%).
Стадия 2: НСl (12 мл 4.8 М раствора в IPrOH, 56 ммоль) добавляли в раствор карбамата 81 (10 г, 28 ммоль) в этилацетате (25 мл). После перемешивания в течение 1 ч реакционную смесь фильтровали и твердую фазу высушивали при пониженном давлении, что позволило получить гидрохлорид 82 в виде белого твердого вещества, который использовали на следующей стадии без очистки или анализа. Выход (2.9 г, 30%).
Стадия 3: Защита гидрохлорида амина 82 этилтрифторацетатом согласно способу, который использовали в Примере 9, за исключением того, что использовали 1 эквивалент TEA и реакция протекала в дихлорметане, позволило получить трифторамид 83 в виде желтого масла. Выход (3.4 г, колич.).1Н ЯМР (400 МГц, CDCl3) δ 7.29-7.33 (m, 1H), 7.24-7.26 (m, 1H), 6.99 (t, J = 8.0 Гц, 1H), 6.83-6.87 (m, 1H), 6.75 (brs, 1H), 4.45-4.55 (m, 1H), 3.52-3.53 (m, 1H), 3.40-3.50 (m, 1H), 1.29 (d, J = 6.4 Гц, 3Н).
Стадия 4: Смесь трифторамида 83 (500 м г, 1.34 ммоль), 1-этинилциклогексанола (250 мг, 2.01 ммоль), иодида меди (25 мг, 0.13 ммоль), три-о-толилфосфина (40 мг, 0.13 ммоль), TEA (0.279 мл, 2.01 мл) и бис-хлор-трифенилфосфин палладия (91 мг, 0.13 ммоль) в DMF (13 мл) дегазировали, помещали в атмосферу аргона и перемешивали в течение ночи при 90°С. Реакционную смесь фильтровали и фильтрат разделяли в смеси ЕtOАс/вода. Органические слои объединяли и отмывали солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш хроматографией (градиент 10-30% ЕtOАс/гексаны), что позволило получить алкин 84 в виде желтого стеклообразного масла. Выход (0.322 г, 65%):1Н ЯМР (400 МГц, СDСl3) δ 7.21 (t, J = 8.0 Гц, 1H), 7.04-7.08 (m, 1H), 6.94-6.96 (m, 1H), 6.83-6.87 (m, 1H), 6.81 (brs, 1H), 4.48-4.57 (m, 1H), 3.72-3.80 (m, 1H), 3.39-3.49 (m, 1H), 1.85-2.04 (m, 3Н), 1.50-1.80 (m, 8H), 1.29 (d, J = 6.4 Гц, 3Н).
Стадия 5: Снятие защиты алкина 84 согласно способу, который использовали в Примере 2, позволило получить амин 85 в виде желтого масла. Выход (0.200 г, 85%);1Н ЯМР (400 МГц, СDСl3) δ 7.18 (t, J = 8.0 Гц, 1H), 6.96-7.02 (m, 2H), 6.84-6.88 (m, 1H), 4.30-4.38 (m, 1H), 2.87 (d, J = 5.2 Гц, 2H), 1.85-2.02 (m, 2H), 1.50-1.80 (m, 11H), 1.25 (d, J = 6.4 Гц, 3Н). ESI MS m/z 274.3 [m+H]+.
Стадия 6: Гидрирование амина 85 согласно способу, который использовали в Примере 2 с последующей флэш хроматографией (2% (7N NН3/СН3ОH)/CH2Сl2) позволило получить Пример 83 в виде бесцветного масла. Выход (0.045 г, 51%).1Н ЯМР (400 МГц, CDCl3) δ 7.10 (t, J = 8.0 Гц, 1H), 6.64-7.73 (m, 3Н), 4.27 (dddd, J = 6.0 Гц, 1Н), 2.81 (d, J = 2.8 Гц, 2H), 2.59 (m, 2H), 1.67 (m, 2H), 1.30-1.60 (m, 12H), 1.15-1.30 (m, 4H). ESI MS m/z 278.4 [m+Н]+, 260.3 [m+Н-ОН]+.
ПРИМЕР 84 Приготовление 1-(3-(2-аминоэтокси)фенил)-4-метилпентан-3-ола

1-(3-(2-аминоэтокси)фенил)-4-метилпентан-3-ол был приготовлен согласно способу, который использовали в Примере 9.
Стадия 1: Реакция Соногашира бромида 19 с 4-метил-пент-1-ин-3-олом позволила получить 2,2,2-трифтор-N-(2-(3-(3-гидрокси-4-метилпент-1-инил)фенокси)этил)ацетамид в виде желтого масла. Выход (0.51 г, 21%):1Н ЯМР (400 МГц, CDCl3) δ 7.22-7.27 (m, 1H), 7.08-7.12 (d, J = 7.6 Гц, 1H), 6.98 (s, 1H), 6.88 (dd, 1H, J = 6.8 Гц, 1.6, 1H), 6.71 (bs, 1H), 4.32 (s, 2H), 4.09 (t, J = 5.2 Гц, 2Н), 3.77-3.82 (m, 2Н), 1.77-1.83 (m, 1H), 0.94-0.99 (m, 6H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(2-(3-(3-гидрокси-4-метилпент-1-инил)фенокси)этил)ацетамида позволило получить 1-(3-(2-аминоэтокси)фенил)-4-метилпент-1-ин-3-ол в виде желтого масла. Выход (0.160 г, 47%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.22-7.30 (m, 1H), 6.90-7.00 (m, 3Н), 4.21 (d, J = 5.6 Гц, 1H), 3.93 (t, J = 5.2 Гц, 2Н), 2.87 (bs, 2Н), 1.77-1.83 (m, 1H), 0.94-0.99 (m, 6H).13С ЯМР (100 МГц, ДМСО-d6) δ 158.5, 129.8, 123.7, 116.7, 115.2, 91.0, 83.6, 69.9, 66.3, 40.7, 34.3, 18.3, 17.7. ESI MS m/z 234 [M+1]+.
Стадия 2: Раствор 1-(3-(2-аминоэтокси)фенил)-4-метилпент-1-ин-3-ола (0.56 г, 2.4 ммоль) в EtOH (30 мл) дегазировали и продували азотом. В этот раствор добавляли Pd на С (0.05 г, 10%). Колбу вакуумировали и продували три раза водородом. Затем эту суспензию перемешивали при комнатной температуре под баллоном с водородом в течение ночи. Реакционную смесь фильтровали через слой Celite и фильтрационный кек отмывали этанолом. Фильтрат концентрировали для получения Примера 1. Выход (0.38, 66%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.14-7.18 (m, 1H), 6.71-6.76 (m, 3Н), 3.91 (t, J = 5.6 Гц, 2Н), 3.12-3.17 (m, 1H), 2.89 (t, J = 5.6 Гц, 2Н), 2.65-2.73 (m, 1H), 2.46-2.50 (m, 1H), 1.46-1.64 (m, 3Н), 0.8 (t, J = 5.6 Гц, 2Н).13С ЯМР (100 МГц, ДМСО-d6) δ 159.0, 144.8, 129.7, 121.1, 115.0, 112.0, 74.2, 69.6, 41.1, 36.2, 33.7, 32.4, 19.4, 18.0. MS: 238 [M+1]+.
ПРИМЕР 85
Приготовление 3-амино-1-(3-фенетилфенил)пропан-1-ола

3-амино-1-(3-фенетилфенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 79.
Стадия 1: Реакция Соногашира 39 с этинилбензолом позволила получить трет-бутил 3-гидрокси-3-(3-(фенилэтинил)фенил)пропилкарбамат в виде коричневого масла. Выход (0.911 г, 85%):1Н ЯМР (400 МГц, CDCl3) δ 7.51-7.55 (m, 3Н), 7.42-7.44 (m, 1H), 7.30-7.37 (m, 5H), 4.87 (bs, 1H), 4.74-4.76 (m, 1H), 3.46-3.51 (m, 1H), 3.41 (bs, 1H), 3.13-3.19 (m, 1H), 1.79-1.88 (m, 2Н), 1.44 (s, 9H).
Стадия 2: Восстановление трет-бутл 3-гидрокси-3-(3-(фенилэтинил)фенил)пропилкарбамата позволило получить трет-бутцл 3-гадрокси-3-(3-фенетилфенил)пропил карбамат в виде желтого масла. Выход (0.824 г, 91%):1Н ЯМР (400 МГц, СDСl3) δ 7.24-7.29 (m, 3Н), 7.16-7.21 (m, 5H), 7.10 (d, J = 7.2 Гц, 1H), 4.86 (bs, 1H), 4.69-4.73 (m, 1H), 3.46-3.49 (m, 1H), 3.13-3.19 (m, 1H), 3.10 (bs, 1H), 2.91 (s, 4H), 1.80-1.88 (m, 2H), 1.46 (s, 9H).
Стадия 3: Снятие защиты трет-бутил 3-гидрокси-3-(3-фенетилфенил)пропил карбамата позволило получить Пример 85 в виде грязно-белого полутвердого вещества. Выход (0.391 г, 59%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.11-7.29 (m, 9H), 4.64 (t, J = 7.2 Гц, 1H), 2.79-2.86 (m, 6H), 1.79-1.84 (m, 2H).13С ЯМР (100 МГц, ДМСО-d6) δ 145.7, 142.0, 141.8, 128.8, 128.7, 128.5, 127.5, 126.3, 126.0, 123.6, 70.2, 37.7, 37.6, 37.1, 36.8. MS: 256 [M+1]+.
ПРИМЕР 86
Приготовление 5-(3-(3-амино-1-гидроксипропил)фенил)-N,N-диметилпентанамида

5-(3-(3-амино-1-гидроксипропил)фенил)-N,N-диметилпентанамид был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Реакция Соногашира 43 с диметиламидом пент-4-еновой кислоты позволила получить 5-(3-(1-гидрокси-3-(2,2,2-трифторацетамидо)пропил)фенил)-N-N-диметилпент-4-инамид в виде темного желтого масла. Выход (0.33 г, 48%). Это соединение содержало следы исходного материала и использовалось без дальнейшей очистки.
Стадия 2: Восстановление 5-(3-(1-гидрокси-3-(2,2,2-трифторацетамидо)пропил)фенил)-N-N-диметилпент-4-инамида в EtOH позволило получить 5-(3-(1-гидрокси-3-(2,2,2-трифторацетамидо)пропил)фенил)-N-N-диметилпентанамид в виде желтого масла. Выход (0.63 г, 99%):1Н ЯМР (400 МГц, CDCl3) δ 7.62 (bs, 1H), 7.24-7.28 (m, 1H), 7.19 (s, 1H), 7.12 (m, 2H), 4.85 (t, J = 6.8 Гц, 1H), 3.57-3.65 (m, 1H), 3.35-3.44 (m, 1H), 2.99 (s, 3Н), 2.92 (s, 3Н), 2.65 (t, J = 6.8 Гц, 2H), 2.29 (t, J = 6.8 Гц, 2H), 1.98-2.03 (m, 2H), 1.62-1.68 (m, 4H).
Стадия 3: Снятие защиты 5-(3-(1-гидрокси-3-(2,2,2-трифторацетамидо)пропил)фенил)-N-N-диметилпентанамида в системе МеОН-Н2О при комнатной температуре в течение 16 ч позволило получить желтое масло после очистки флэш хроматографией (градиент 0-10% MeOH-NH3 (9.5:0.5)-DCM), что позволило получить Пример 86 в виде бледно-желтого масла. Выход (0.24 г, 54%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.19 (t, J = 7.6 Гц, 1Н), 7.11 (s, 1H), 7.08 (d, J = 7.6 Гц, 1Н), 7.04 (d, J = 7.6 Гц, 1Н), 4.55-4.59 (m, 1Н), 2.91 (s, 3Н), 2.76 (s, 3Н), 2.52-2.59 (m, 4H), 2.26 (t, J = 7.6 Гц, 2Н), 1.61-1.71 (m, 2H), 1.44-1.56 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 171.8, 146.4, 141.7, 127.8, 126.4, 125.5, 123.0, 71.3, 42.1, 36.7, 35.1, 34.7, 32.2, 30.6, 24.3. MS: 279 [M+1]+.
ПРИМЕР 87
Приготовление 5-(3-(3-аминопропил)фенил)пентан-1-ола

5-(3-(3-аминопропил)фенил)пентан-1-ол был приготовлен согласно способу, который использовали в Примере 76.
Стадия 1: реакция Соногашира бромида 57 с 4-пентил-1-олом позволила получить трет-бутил 3-(3-(5-гидроксипент-1-инил)фенил)пропилкарбамат в виде желтого масла. Выход (0.653 г, 59%):1Н ЯМР (400 МГц, СDСl3) δ 7.17-7.23 (m, 3Н), 7.08 (d, J = 7.2 Гц, 1Н), 4.53 (bs, 1Н), 3.83 (t, J = 6.0 Гц, 2H), 3.10-3.18 (m, 2H), 2.60 (t, J = 7.8 Гц, 2H), 2.54 (t, J = 7.0 Гц, 2H), 1.83-1.90 (m, 2H), 1.74-1.82 (m, 2H), 1.44 (s, 9H).
Стадия 2: Восстановление трет-бутил 3-(3-(5-гидроксипент-1-инил)фенил)пропилкарбамата позволило получить трет-бутил 3-(3-(5-гидроксипентил)фенил)пропилкарбамат в виде желтого масла. Выход (0.628 г, 95%):1Н ЯМР (400 МГц, CDCl3) δ 7.16-7.21 (m, 1Н), 6.97-7.02 (m, 3Н), 4.54 (bs, 1Н), 3.71 (t, J = 7.0 Гц, 2H), 3.12-3.17 (m, 2H), 2.58-2.64 (m, 4H), 1.77-1.84 (m, 2H), 1.56-1.67 (m, 4H),1.44 (s, 9H), 1.37-1.42 (m, 2H).
Стадия 3: Снятие ВОС-защиты трет-бутил 3-(3-(5-гидроксипентил)фенил)пропилкарбамата позволило получить Пример 8 в виде коричневого масла. Выход (0.19 г, 43%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.12-7.17 (m, 1Н), 6.94-6.98 (m, 3Н), 3.37 (t, J = 6.4 Гц, 2H), 2.49-2.57 (m, 6H), 1.58-1.65 (m, 2H), 1.50-1.57 (m, 2H), 1.40-1.47 (m, 2H), 1.27-1.33 (m, 2H).13С ЯМР (100 МГц, ДМСО-d6): 142.6, 142.5, 128.8, 128.5, 126.0, 61.1, 41.4, 35.7, 35.2, 33.0, 32.8, 31.4, 25.7. MS: 222 [M+1]+.
ПРИМЕР 88
Приготовление 2-(3-(4-метоксибутил)фенокси)этанамина

2-(3-(4-метоксибутил)фенокси)этанамин был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с 4-метоксибут-1-ине позволила получить 2,2,2-трифтор-N-(2-(3-(4-метоксибут-1-инил)фенокси)этил)ацетамид в виде желтого масла. Выход (0.45 г, 45%): Этот материал использовали непосредственно на следующей стадии снятия защиты.
Стадия 2: Восстановление 2,2,2-трифтор-N-(2-(3-(4-метоксибут-1-инил)фенокси)этил)ацетамида позволило получить 2,2,2-трифтор-N-(2-(3-(4-метоксибутил)фенокси)этил)ацетамид в виде желтого масла. Выход (0.34 г, 75%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.15-7.20 (m, 1Н), 6.71-6.78 (m, 3H), 4.06 (t, J = 5.6 Гц, 2Н), 3.53-3.58 (m, 2Н), 3.31 (t, J = 6.8 Гц, 2Н), 3.20 (s, 3H), 2.54 (t, J = 7.6 Гц, 2Н), 1.54-1.62 (m, 2Н), 1.44-1.52 (m, 2Н). MS: 318 [M-1].
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(2-(3-(4-метоксибутил)фенокси)этил)ацетамида позволило получить Пример 88 в виде желтого масла. Выход (0.18 г, 76%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.15-7.20 (m, 1Н), 6.71-6.78 (m, 3H), 3.93 (t, J = 5.6 Гц, 2Н), 3.31 (t, J = 6.2 Гц, 2Н), 3.20 (s, 3H), 2.93 (t, J = 5.6 Гц, 2Н), 2.54 (t, J = 7.4 Гц, 2Н), 1.52-1.60 (m, 2Н), 1.43-1.50 (m, 2Н).13С ЯМР (100 МГц, ДМСО-d6) δ 159.0, 144.2, 129.7, 121.1, 115.0, 112.1, 72.1, 69.1, 58.3, 40.9, 35.4, 29.1, 27.9. MS: 224 [M+1]+
ПРИМЕР 89
Приготовление 1-(3-(2-аминоэтокси)фенетил)циклооктанола

1-(3-(2-аминоэтокси)фенетил)циклооктанол был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с 1-этинилциклооктанолом позволила получить 2,2,2-трифтор-N-(2-(3-(2-(1-гидроксициклооктил)этинил)фенокси)этил)ацетамид в виде прозрачного масла. Выход (1.3 г, 72%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.22 (d, J = 8.0 Гц, 1Н), 7.07 (d, J = 7.6 Гц, 1Н), 6.91-6.96 (m, 2Н), 4.09-4.13 (m, 2Н), 2.00-2.06 (m, 6H), 1.48-1.72 (m, 11H).
Стадия 2: Восстановление 2,2,2-трифтор-N-(2-(3-((1-гидроксициклооктил)этинил)фенокси)этил)ацетамида позволило получить 2,2,2-трифтор-N-(2-(3-(2-(1-гидроксициклооктил)этил)фенокси)этил)ацетамид в виде желтого масла. Выход (0.36 г, 78%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.14-7.18 (m, 1Н), 6.72-6.78 (m. 3H), 4.06 (t, J = 6.0 Гц, 2Н), 3.42-3.45 (m, 2Н), 2.55-2.59 (m, 2Н), 1.30-1.71 (m, 16H). MS: 386 [M-1].
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(2-(3-(2-(1-гидроксициклооктил) этил)фенокси)этил)ацетамида позволило получить Пример 89 в виде желтого масла. Выход (0.097 г, 37%);1Н ЯМР (400 МГц, ДМСО-d6) δ 7.14-7.18 (m, 1H), 6.70-6.76 (m, 3H), 3.93 (t, J = 5.6 Гц, 2Н), 2.92 (t, J = 5.6 Гц, 2Н), 2.54-2.59 (m, 2H), 1.31-1.70 (m, 16H).13С ЯМР (100 МГц, ДМСО-d6) δ 158.5, 144.9, 129.2, 120.6, 114.5, 111.4, 72.6, 68.6, 43.5, 40.4, 35.6, 29.3, 27.9, 24.6, 22.0. MS: 292 [M+1]+.
ПРИМЕР 90
Приготовление 3-амино-1-(3-(4-метилпентил)фенил)пропан-1-ола
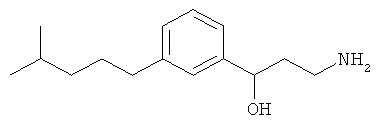
3-амино-1-(3-(4-метилпентил)фенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 63.
Стадия 1: Реакция Соногашира 43 с 4-метил-пент-1-ине позволила получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(4-метилпент-1-инил)фенил)пропил)ацетамид в виде темного коричневого масла. Выход (0.94 г, 94%):1H ЯМР (400 МГц, CDCl3) δ 7.38 (s, 1H), 7.25-7.35 (m, 3H), 4.86 (m, 1H), 3.67-3.72 (m, 1H), 3.38-3.44 (m, 1H), 2.30 (d, J = 6.4 Гц, 2Н), 2.28 (bs, 1H), 1.87-1.99 (m, 3H), 1.05 (d, J = 6.8 Гц, 6Н).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(4-метилпент-1-инил)фенил)пропил)ацетамида позволило получить 3-(3-(3-амино-1-гидроксипропил)фенил)проп-2-ин-1-ол в виде желтого масла. Выход (0.508 г, 76%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.33 (s, 1H), 7.23-7.29 (m, 3H), 5.12 (bs, 2Н), 4.66 (t, J = 6.4 Гц, 1H), 2.68 (t, J = 6.8 Гц, 2Н), 2.32 (d, J = 6.4 Гц, 2Н), 1.82-1.86 (m, 1H), 1.67-1.72 (m, 2Н), 0.95 (d, J = 6.8 Гц, 6Н).1H ЯМР (100 МГц, ДМСО-d6) δ 146.8, 130.0, 128.9, 128.8, 125.7, 123.4, 89.6, 82.1, 70.7, 40.6, 38.3, 28.1, 28.0, 22.3. ESI MS m/z 232 [М+1]+.
Стадия 3: Смесь 3-амино-1-(3-(4-метилпент-1-инил)фенил)пропан-1-ола (0.3 г, 1.3 ммоль) и НСl в диоксане (1 мл, 4 M) в 2-PrОН перемешивали при комнатной температуре в течение 30 мин. Растворитель удаляли при пониженном давлении и таким образом полученный гидрохлорид растворяли в EtOH (10 мл). После продувания колбы азотом добавляли Pd на С (0.040 г, 10%). Колбу вакуумировали и заново заполняли водородом, после чего перемешивали под баллоном с Н2 в течение примерно 14 ч. Реакционную смесь фильтровали через слой Celite и фильтрат выпаривали до сухого состояния при пониженном давлении. Полученный продукт очищали флэш хроматографией (градиент 0-10% MeOH-DCM) для получения Примера 90 гидрохлорида в виде белого твердого вещества. Выход (0.231 г, 65%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.23 (t, J = 7.2 Гц, 1Н), 7.12 (s, 1Н), 7.10 (d, J = 7.6 Гц, 1Н). 7.05 (d, J = 7.6 Гц, 1Н), 4.62 (t, J = 7.6 Гц, 1Н), 2.77-2.89 (m, 2H), 2.50-2.54 (m, 2H), 1.78-1.84 (m, 2H), 1.48-1.57 (m, 3H), 1.13 (m, 2H), 0.83 (d, J = 6.8 Гц, 6Н).13С ЯМР (100 МГц, ДМСО-d6) δ 145.7, 142.6, 128.5, 127.3, 125.9, 123.4, 70.2, 38.5, 37.1, 36.8, 36.0, 29.4, 27.7, 23.0. MS: 236 [M+1]+.
ПРИМЕР 91
Приготовление 5-(3-(3-амино-1-гидроксипропил)фенил)пентан-1-ола

5-(3-(3-амино-1-гидроксипропил)фенил)пентан-1-ол был приготовлен согласно способу, который использовали в Примере 63.
Стадия 1: Реакция Соногашира 43 с пент-4-ин-1-олом позволила получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(5-гидроксипент-1-инил)фенил)пропил)ацетамид в виде коричневого масла. Выход (1.46 г, 69%):1Н ЯМР (400 МГц, CDCl3) δ 7.38 (s, 1Н), 7.22-7.34 (m, 3H), 4.86 (d, J = 8.0 Гц, 1Н), 3.83 (t, J = 5.2 Гц, 2H), 3.65-3.69 (m, 1Н), 3.38-3.42 (m, 1Н), 2.56 (t, J = 7.2 Гц, 2H), 2.38 (bs, 1Н) 1.93-1.99 (m, 2H), 1.83-1.88 (m, 2H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(5-гидроксипент-1-инил)фенил)пропил)ацетамида позволило получить 5-(3-(3-амино-1-гидроксипропил)фенил)пент-4-ин-1-ол в виде желтого масла. Выход (0.64 г, 65%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.32 (s, 1Н), 7.25-7.28 (m, 2H), 7.20-7.22 (m, 1Н) 4.66 (t, J = 6.4 Гц, 1Н), 4.55 (bs, 1Н), 3.52 (t, J = 6.4 Гц, 2H), 2.57-2.66 (m, 2H), 2.44 (t, J = 7.2 Гц, 2H), 1.60-1.70 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 147.2, 129.8, 129.0, 128.7, 125.7, 123.3, 90.6, 81.1, 71.1, 59.9, 41.8, 38.9, 32.0, 15.7; ESI MS m/z 234 [M+1]+.
Стадия 3: Раствор 5-(3-(3-амино-1-гидроксипропил)фенил)пент-4-ин-1-ола в IPA (20 мл) дегазировали и продували азотом. В него добавляли Pd на С (0.2 г, 10%). Колбу вакуумировали и заполняли водородом. После повторения этой процедуры три раза реакционную смесь перемешивали под баллоном с Н2 в течение примерно 14 ч, после чего фильтровали через Celite и концентрировали при пониженном давлении. После очистки флэш хроматографией (градиент 0-10% MeOH-NH3 (9.5:0.5)-DCM) получали Пример 91 в виде желтого масла. Выход (0.208 г, 85%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.23 (t, J = 7.6 Гц, 1Н), 7.10-7.13 (m, 2H), 7.05 (d, J = 7.6 Гц, 1Н), 4.63 (t, J = 6.4 Гц, 1Н), 3.36 (t, J = 6.8 Гц, 2H), 2.72 (t, J = 6.8 Гц, 2H), 2.55 (t, J = 7.6 Гц, 2H), 1.73 (m, 2H), 1.59 (m, 2H), 1.45 (m, 2H), 1.39 (m, 2H).13С ЯМР (100 МГц, ДМСО-d6) δ 145.8, 142.0, 127.9, 126.7, 125.5, 122.9, 70.6, 60.6, 37.7, 35.3, 32.3, 31.0, 25.2. MS: 238 [M+1]+.
ПРИМЕР 92
Приготовление 3-(3-(4-метилпентил)фенил-пропан-1-амина
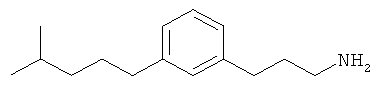
3-(3-(4-метилпентил)фенил-пропан-1-амин был приготовлен согласно способу, который использовали в Примере 76.
Стадия 1: Взаимодействие Соногашира бромида 57 (0.5 г, 1.4 ммоль) с 4-метил-1-пентином (0.2 мл, 2.4 ммоль) позволило получить трет-бутил 3-(4-метилпент-1-инил)фенилкарбамат.Выход (0.35 г, 69%).1Н ЯМР (400 МГц, CDCl3) δ 7.16-7.28 (m, 3Н), 7.07 (d, J = 7.2 Гц, 1Н), 4.50 (bs, 1H), 3.12-3.15 (m, 2H), 2.60 (d, J = 7.6 Гц, 2H), 2.29 (d, J = 6.8 Гц, 2H), 1.84-1.94 (m, 2H), 1.74-1.82 (m, 1H), 1.44 (s, 9H), 1.04 (d, J = 6.8 Гц, 6Н).
Стадия 2: Восстановление трет-бутил 3-(4-метилпент-1-инил)фенил)пропилкарбамата позволило получить трет-бутил 3-(3-(4-метилпентил)фенил)пропилкарбамат в виде желтого масла. Выход (0.309 г, 88%):1H ЯМР (400 МГц, CDCl3) δ 7.17-7.21 (m, 1H), 6.98-7.02 (m, 3Н), 3.12-3.18 (m, 2H), 2.61 (t, J = 7.8 Гц, 2H), 2.55 (t, J = 7.8 Гц, 2H), 1.74-1.83 (m, 2H), 1.51-1.62 (m, 2H), 1.44 (s, 9H), 1.18-1.26 (m, 3Н), 0.87 (d, J = 6.8 Гц, 6Н).
Стадия 3: Снятие ВОС-защиты трет-бутнп 3-(3-(4-метилпентил)фенил)пропилкарбамата позволило получить Пример 92 гидрохлорид в виде грязно-белого твердого вещества. Выход (0.1 г, 53%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.18-7.22 (m, 1H), 7.0-7.03 (m, 3Н), 2.76 (t, J = 7.6 Гц, 2H), 2.61 (t, J = 7.8 Гц, 2H), 2.52 (t, J = 7.6 Гц, 2H), 1.79-1.87 (m, 2H), 1.50-1.59 (m, 3Н), 1.14-1.20 (m, 2H), 0.85 (d, J = 6.8 Гц, 6Н).13С ЯМР (100 МГц, ДМСО-d6): 142.4, 140.7, 128.3, 128.2, 125.9, 125.5, 38.3, 38.1, 35.4, 31.8, 28.8, 28.7, 27.2, 22.5. MS: 220 [M+1]+.
ПРИМЕР 93
Приготовление 5-(3-(2-аминоэтокси)фенил)-N-метилпентанамида

5-(3-(2-аминоэтокси)фенил)-N-метилпентанамид был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с N-метиламидом пент-4-еновой кислоты позволила получить N-метил-5-(3-(2-(2,2,2-трифторацетамидо)этокси)фенил)пент-4-инамид в виде коричневого масла. Выход (0.45 г, 58%):1Н ЯМР (400 МГц, ДМСО-d6) δ 8.02 (bs, 1H), 7.18-7.24 (m, 1H), 7.02 (d, J = 8.0 Гц, 1H), 6.91 (s, 1H), 6.83 (dd, J = 8.0, 2.4 Гц, 1H), 6.76 (bs, 1H), 4.09 (t, J = 5.2 Гц, 2Н), 3.76-3.81 (m, 2Н), 2.85 (d, J = 4.8 Гц, 3Н), 2.76 (t, J = 7.4 Гц, 2Н), 2.47 (t, J = 7.4 Гц, 2Н).
Стадия 2: Восстановление N-метил-5-(3-(2-(2,2,2-трифторацетамидо)этокси) фенил)пент-4-инамида позволило получить N-метил-5-(3-(2-(2,2,2-трифторацетамидо)этокси)фенил)пентанамид в виде желтого масла. Выход (0.22 г, 47%): MS: 345 [М-1]. Этот продукт использовали в таком виде на следующей стадии превращения.
Стадия 3: Снятие защиты N-метил-5-(3-(2-(2,2,2-трифторацетамидо)этокси)фенил)пентанамида позволило получить 5-(3-(2-аминоэтокси)фенил)-N-метилпентанамид. Обработка 5-(3-(2-аминоэтокси)фенил)-N-метилпентанамида НСl в диоксане (4 M) позволила получить Пример 93 гидрохлорид в виде белого твердого вещества. Выход (0.08 г, 44%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.18-7.23 (m, 1H), 6.77-6.81 (m, 3Н), 4.12 (t, J = 4.8 Гц, 2Н), 3.19 (t, J = 4.8 Гц, 2Н), 2.50-2.53 (m, 5H), 2.05 (t, J = 6.8 Гц, 2Н), 1.43-1.52 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 172.4, 157.8, 143.8, 129.3, 121.2, 114.7, 111.8, 64.0, 38.2, 35.1, 34.8, 30.5, 25.4, 24.9. MS: 251 [M+1]+.
ПРИМЕР 94
Приготовление 5-(3-(2-аминоэтокси)фенил)-N,N-диметилпентанамида

5-(3-(2-аминоэтокси)фенил)-N,N-диметилпентанамид был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с N,N-диметиламидом пент-4-еновой кислоты позволила получить N,N-диметил-5-(3-(2-(2,2,2-трифторацетамидо)этокси)фенил)пент-4-инамид в виде коричневого масла. Выход (0.9 г, 50%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.18-7.23 (m, 1H), 7.03 (d, J = 7.2 Гц, 1H), 6.92 (s, 1H), 6.83 (dd, J = 8.4, 2.4 Гц, 1H), 4.09 (t, J = 5.0 Гц, 2Н), 3.76-3.80 (m, 2Н), 2.98 (s, 3Н), 2.96 (s, 3Н), 2.76 (t, J = 7.6 Гц, 2Н), 2.64 (t, J = 7.6 Гц, 2Н).
Стадия 2: Восстановление N,N-диметил-5-(3-(2-(2,2,2-трифторацетамидо) этокси)фенил)пент-4-инамида позволило получить N,N-диметил-5-(3-(2-(2,2,2-трифторацетамидо)этокси)фенил)пентанамид в виде желтого масла. Выход (0.4 г, 88%): MS: 361 [M+1]+. Этот продукт был достаточно чистым для использования его в таком виде на следующей стадии превращения.
Стадия 3: Снятие защиты N,N-диметил-5-(3-(2-(2,2,2-трифторацетамидо) этокси)фенил)пентанамида позволило получить Пример 94 в виде желтого масла. Выход (0.18 г, 61%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.16-7.21 (m, 1Н), 6.74-6.79 (m, 3H), 4.0 (t, J = 5.4 Гц, 2H), 3.02 (t, J = 5.4 Гц, 2H), 2.93 (s, 3H), 2.79 (s, 3H), 2.54 (t, J = 7.2 Гц, 2Н), 2.28 (t, J = 7.4 Гц, 2H), 1.51-1.60 (m, 2H), 1.44-1.50 (m, 2H).13С ЯМР (100 МГц, ДМСО-d6) δ 172.3, 158.7, 144.3, 129.7, 121.4, 115.1, 112.1, 67.6, 37.2, 35.4, 35.2, 32.6, 30.9, 24.7. MS: 265 [M+1]+
ПРИМЕР 95
Приготовление 1-(3-(3-амино-1-гидроксипропил)фенетил)циклооктанола

1-(3-(3-амино-1-гидроксипропил)фенетил)циклооктанол был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Реакция Соногашира 43 с 3-метилгекс-1-ин-3-олом позволила получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-метилгекс-1-инил)фенил)пропил)ацетамид в виде коричневого масла. Выход (0.908 г, 90%):1Н ЯМР (400 МГц, СDСl3) δ 7.37 (s, 1Н), 7.30-7.35 (m, 1Н), 7.26-7.28 (m, 2H), 4.83-4.86 (m, 1Н), 3.66-3.69 (m, 1Н), 3.39-3.42 (m, 1Н), 2.60 (bs, 1Н), 2.11 (bs, 1Н), 1.94-1.99 (m, 2H), 1.69-1.74 (m, 2H), 1.65 (s, 3H), 1.54-1.57 (m, 2H), 0.97 (t, J = 7.2 Гц, 3H).
Стадия 2: Восстановление 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-метилгекс-1-инил)фенил)пропил)ацетамида позволило получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-метилгексил)фенил)пропил)ацетамид в виде желтого масла. Выход (0.99 г, 90%). Это соединение использовали в таком виде на следующей стадии превращения.
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-метилгексил)фенил)пропил)ацетамида позволило получить желтое масло, которое после очистки флэш хроматографией (градиент 0-10% MeOH-NH3 (9.5:0.5)-DCM) дало Пример 95 в виде прозрачного масла. Выход (0.597 г, 82%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.22 (t, J = 7.2 Гц, 1Н), 7.12 (s, 1Н), 7.08 (d, J = 7.2 Гц, 1Н), 7.04 (d, J = 7.2 Гц, 1Н), 4.60 (t, J = 6.4 Гц, 1Н), 2.70-2.73 (m, 2H), 2.55-2.58 (m, 2H), 1.69-1.74 (dd, J = 6.4 Гц, 12.8 Гц, 2H), 1.55-1.58 (m, 2H), 1.17-1.37 (m, 4H), 1.07 (s, 3H), 0.86 (t, J = 7.2 Гц, 3H).13С ЯМР (100 МГц, ДМСО-d6) δ 146.0, 142.8, 128.0, 126.7, 125.4, 122.8, 70.6, 70.5, 44.1, 43.9, 37.7, 30.0, 26.8, 16.8, 14.8. MS: 266 [M+1].
ПРИМЕР 96
Ппиготовление 5-(3-(2-аминоэтокси)фенил)пентанамида

5-(3-(2-аминоэтокси)фенил)пентанамид был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с амидом пент-4-еновой кислоты позволило получить 5-(3-(2-(2,2,2-трифторацетамидо)этокси)фенил)пент-4-инамид в виде прозрачного масла. Выход (0.8 г, 50%):
Стадия 2: Восстановление 5-(3-(2-(2,2,2-трифторацетамидо)этокси)фенил)пент-4-инамида позволило получить 5-(3-(2-(2,2,2-трифторацетамидо)этокси)фенил) пентанамид в виде желтого масла. Выход (0.6 г, 54%): MS: 331 [M-1].
Стадия 3: Снятие защиты 5-(3-(2-(2,2,2-трифторацетамидо)этокси)фенил) пентанамида позволило получить Пример 96 в виде желтого масла. Выход (0.2 г, 47%);1Н ЯМР (400 МГц, ДМСО-d6) δ 7.15-7.20 (m, 1Н), 6.73-6.77 (m, 3Н), 3.96 (t, J = 5.6 Гц, 2Н), 2.94 (t, J = 5.6 Гц, 2Н), 2.53 (t, J = 7.2 Гц, 2Н), 2.05 (t, J = 7.2 Гц, 2Н), 1.44-1.54 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 174.7, 158.5, 144.3, 129.7, 121.6, 115.1, 112.2, 65.5, 39.2, 35.4, 31.0, 25.2. MS: 237 [M+1]+.
ПРИМЕР 97
Приготовление 5-(3-(3-аминопропил)фенил)-N-N-диметилпентанамида

5-(3-(3-аминопропил)фенил)-N-N-диметилпентанамид был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Реакция Соногашира 43 с N-метилпент-4-инамидом позволила получить 5-(3-(1-гидрокси-3-(2,2,2-трифторацетамидо)пропил)фенил)-N-метилпент-4-инамид в виде коричневого масла. Выход (0.661 г, 60%):1H ЯМР (400 МГц, CDCl3) δ 8.0 (bs, 1Н), 7.43-7.48 (m, 1Н), 7.37 (s, 1Н), 7.30 (d, J = 6.8 Гц, 2Н), 5.66 (bs, 1Н), 4.83-4.85 (m, 1Н), 3.63-3.69 (m, 1Н), 3.37-3.44 (m, 1Н), 2.84 (d, J = 4.8 Гц, 3Н), 2.72 (t, J = 7.6 Гц, 2Н), 2.46 (t, J = 7.6 Гц, 2Н), 1.92-2.02 (m, 2Н).
Стадия 2: Восстановление 5-(3-(1-гидрокси-3-(2,2,2-трифторацетамидо) пропил)фенил)-N-метилпент-4-инамида с использованием EtOH в качестве растворителя позволило получить 5-(3-(1-гидрокси-3-(2,2,2-трифторацетамидо)пропил)фенил)-N-метилпентанамид в виде желтого масла. Выход (0.911 мг, 83%).1Н ЯМР (400 МГц, CDCl3) δ 8.0 (bs, 1Н), 7.27 (t, J = 7.2 Гц, 1Н), 7.16 (s, 1H), 7.14 (d, J = 7.6 Гц, 1Н), 7.10 (d, J = 7.6 Гц, 1Н), 5.56 (bs, 1Н), 4.83-4.86 (m, 1Н), 3.54-3.60 (m, 1Н), 3.37-3.44 (m, 1Н), 2.76 (d, J = 4.8 Гц, 3Н), 2.63 (t, J = 7.6 Гц, 2Н), 2.12 (t, J = 7.6 Гц, 2Н), 1.96-2.0 (m, 2H), 1.58-1.67 (m, 4H).
Стадия 3: Снятие защиты 5-(3-(1-гидрокси-3-(2,2,2-трифторацетамидо)пропил)фенил)-N-метилпентанамида в системе МеОН-Н2О при комнатной температуре в течение 16 ч позволило получить желтое масло, которое после очистки флэш хроматографией (градиент 0-10% MeOH-NH3 (9.5:0.5)-DCM) позволило получить Пример 97 в виде желтого полутвердого вещества. Выход (0.325 г, 49%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.19 (t, J = 7.2 Гц, 1Н), 7.13 (s, 1Н), 7.08 (d, J = 7.2 Гц, 1Н), 7.00 (d, J = 7.2 Гц, 1Н), 4.57 (t, J = 6.4 Гц, 1Н), 2.57 (t, J = 7.2 Гц, 2Н), 2.53 (d, J = 4.8 Гц, 3Н), 2.35 (m, 2Н), 2.07 (m, 2Н), 1.70 (m, 2Н), 1.48-1.55 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 172.9, 146.9, 142.1, 128.3, 126.9, 126.2, 123.6, 71.8, 42.7, 35.6, 35.5, 31.2, 25.9, 25.5. MS: 265 [M+1]+.
ПРИМЕР 98
Приготовление 1-(3-(3-амино-1-гидроксипропил)фенетил)циклобутанола
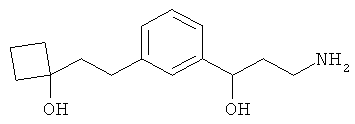
1-(3-(3-амино-1-гидроксипропил)фенетил)циклобутанол был приготовлен согласно способу, который использовали в Примере 79.
Стадия 1: Реакция Соногашира 39 с 1-этинил-циклобутанолом позволила получить трет-бутил 3-гидрокси-3-(3-(2-(1-гидроксициклобутил) этинил) фенил) пропилкарбамат в виде желтого масла. Выход (1.5 г, 70%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.45 (s, 1Н), 7.27-7.34 (m, 3Н), 4.85 (bs, 1Н), 4.71 (m, 1Н), 3.48-3.51 (m, 2Н), 3.14-3.16 (m, 1Н), 2.50-2.52 (m, 2Н), 2.30-2.49 (m, 3Н), 1.80-1.90 (m, 4H), 1.45 (s, 9H).
Стадия 2: Восстановление трет-бутил 3-гидрокси-3-(3-((1-гидроксициклобутил) этинил) фенил) пропилкарбамата в ЕtOН в течение 72 ч позволило получить трет-бутил 3-гидрокси-3-(3-(2-(1-гидроксициклобутил)этил)фенил)пропилкарбамат в виде желтого масла. Выход (0.694 г, 92%):1H ЯМР (400 МГц, CDCl3) δ 7.24-7.26 (m, 2Н), 7.12-7.18 (m, 2Н), 4.73 (bs, 1Н), 4.68-4.75 (m, 1Н), 3.46-3.51 (m, 1Н), 3.13-3.20 (m, 1Н), 2.69-2.72 (m, 2Н), 2.06-2.11 (m, 2Н), 1.96-1.99 (m, 2Н), 1.56-1.93 (m. 4H), 1.45 (s, 9H).
Стадия 3: Смесь трет-бутил 3-гидрокси-3-(3-(2-(1-гидроксициклобутил) этил)фенил)пропилкарбамата и НС1 в диоксане (2 мл, 4М) в этилацетате перемешивали при комнатной температуре в течение 20 ч. Смесь концентрировали до сухого состояния при пониженном давлении. Очистка флэш хроматографией (градиент 0-10% MeOH-DCM) позволила получить Пример 98 гидрохлорид в виде бледно-желтого полутвердого вещества. Выход (0.235 г, 47%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.67-7.71 (bs, 3H), 7.23 (t, J = 7.6, 1H), 7.18 (s, 1H), 7.10 (d, J = 7.6 Гц, 1H), 7.08 (d, J = 7.6 Гц, 1H), 4.93 (bs, 1H), 4.63-4.66 (m, 1H), 2.80-2.85 (m, 2H), 2.50-2.59 (m, 2H), 1.93-1.97 (m, 4H), 1.81-1.85 (m, 2H), 1.71-1.76 (m, 2H), 1.62-1.64 (m, 1H), 1.44-1.49 (m, 1H).13C ЯМР (100 МГц, ДМСО-d6) δ 145.7, 143.2, 128.5, 127.4, 125.9, 123.2, 73.7, 70.2, 42.0, 37.2, 36.9, 36.1, 30.1, 12.3. MS: 250 [М+1]+.
ПРИМЕР 99
Приготовление 2-(3-(2-аминоэтокси)фенетил)циклогексанола

2-(3-(2-аминоэтокси)фенетил)циклогексанол был приготовлен согласно способу, который использовали в Примере 9.
Стадия 1: Взаимодействие Соногашира бромида 19 с 2-этинилциклогексанолом с последующей флэш хроматографией (градиент 5-50% EtOAc/гексаны) позволило получить 2,2,2-трифтор-N-(2-(3-((2-гидроксициклогексил)этинил)фенокси)этил) ацетамид в виде желтого масла. Выход (0.88 г, 31%):1H ЯМР (400 МГц, СDСl3) δ 7.18 (t, J = 8.0 Гц, 1H), 7.01-7.04 (m, 1H), 6.90-6.98 (brs, 1H), 6.91-6.92 (m, 1H), 6.79-6.83 (m, 1H), 4.05-4.07 (m, 2H), 3.74 (app q, J = 5.2 Гц, 2H), 3.48-3.56 (m, 1H), 2.35-2.46 (m, 2H), 2.00-2.08 (m, 1H), 1.64-1.80 (m, 2H), 1.40-1.52 (m, 1H), 1.14-1.40 (m, 4H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(2-(3-((2-гидроксициклогексил) этинил)фенокси)этил)ацетамида с последующей очисткой флэш хроматографией (10% (7N МН3/МеОН)/дихлорметан) позволило получить 2-((3-(2-аминоэтокси)фенил)этинил)циклогексанол в виде белого твердого вещества. Выход (0.29 г, 45%):1Н ЯМР (400 МГц, СDСl3) δ 7.18 (t, J = 7.6 Гц, 1H), 6.98-7.03 (m, 1H), 6.93-6.95 (m, 1H), 6.83-6.86 (m, 1H), 3.96 (t, J = 5.2 Гц, 2H), 3.49-3.57 (m, 1H), 3.08 (brs, 2H), 2.38-2.46 (m, 1H), 2.01-2.10 (m, 2H), 1.55-2.00 (brs, 1H), 1.74-1.82 (m, 2H), 1.65-1.74 (m, 2H), 1.40-1.52 (m, 1H), 1.16-1.40 (m, 3H).
Стадия 3: Гидрирование 2-((3-(2-аминоэтокси)фенил)этинил)циклогексанола с последующей флэш хроматографией (10% (7N NH3/МеОН)/дихлорметан) позволила получить Пример 99 в виде желто-зеленого масла. Выход (0.99 г, 67%):1Н ЯМР (400 МГц, CDCl3) δ 7.17 (t, J = 8.0 Гц, 1Н), 6.75-6.80 (m, 2H), 6.69-6.73 (m, 1H), 3.70 (t, J = 5.2 Гц, 2H), 3.19-3.27 (m, 1H), 3.06 (t, J = 5.2 Гц, 2H), 2.66-2.79 (m, 1H), 2.47-2.56 (m, 1H), 2.05-2.14 (m, 1H), 1.87-1.97 (m, 2H), 1.69-1.77 (m, 1H), 1.61-1.69 (m, 1H), 1.53 (brs, 3H), 1.36-1.46 (m, 1H), 1.11-1.34 (m, 4H), 0.91-1.03 (m, 1H).
ПРИМЕР 100
Приготовление 2-(3-(3-амино-1-гидроксипропил)фенетил)циклогексанола
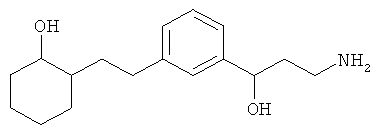
2-(3-(3-амино-1-гидроксипропил)фенетил)циклогексанол был приготовлен согласно способу, который использовали в Примере 63.
Стадия 1: Реакция Соногашира бромида 43 с 2-этинилциклогексанолом с последующей флэш хроматографией (градиент 5-50% EtOAc/гексаны) позволила получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-((2-гидроксициклогексил)этинил)фенил)пропил)ацетамид в виде желтого масла. Выход (1.9 г, 63%):1Н ЯМР (400 МГц, CDCl3) δ 7.39-7.41 (m, 1H), 7.23-7.36 (m, 4H), 4.84 (q, J = 4.0 Гц, 1H), 3.62-3.72 (m, 1H), 3.50-3.57 (m, 1H), 3.34-3.44 (m, 1H), 2.38-2.46 (m 1H), 2.18 (brs, 2H), 1.90-2.1.0 (m, 4H), 1.66-1.84 (m, 2H), 1.40-1.53 (m, 1H), 1.16-1.40 (m, 3H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-((2-гидроксициклогексил)этинил)фенил)пропил)ацетамида с последующей флэш хроматографией (10% (7N NН3/МеОН)/дихлорметан) позволило получить 2-((3-(3-амино-1-гидроксипропил)фенил)этинил)циклогексанол в виде светло-желтого стекловидного твердого вещества. Выход (0.402 г, 29%):1H ЯМР (400 МГц, СDСl3) δ 7.44-7.46 (m, 1H), 7.21-7.31 (m, 3H), 4.92 (dd, J = 8.8, 3.2 Гц, 1H), 3.47-3.56 (m, 1H), 3.05-3.12 (m, 1H), 3.01 (brs, 4H), 2.90-2.99 (m, 1H), 2.37-2.44 (m, 1H), 2.00-2.09 (m, 2H), 1.81-1.90 (m, 1H), 1.64-1.81 (m, 3H), 1.40-1.52 (m, 1H), 1.14-1.40 (m, 3H).
Стадия 3: Гидрирование 2-((3-(3-амино-1-гидроксипропил) фенил)этинил)циклогексанола с последующей флэш хроматографией (10% (7N МН3/МеОН)/дихлорметан) позволило получить Пример 100 в виде желтого масла. Выход (0.153 г, 67%):1Н ЯМР (400 МГц, CDCl3) δ 7.19-7.26 (m, 2H), 7.13-7.17 (m, 1H), 7.05-7.08 (m, 1H), 4.88-4.93 (dd, J = 3.2, 8.8 Гц, 1H), 3.17-3.25 (m, 1H), 3.01-3.10 (m, 1H), 2.88-2.97 (m, 1H), 2.60-2.88 (m, 5H), 2.49-2.58 (m, 1H), 2.05-2.15 (m, 1H), 1.54-1.96 (m, 6H), 1.35-1.47 (m, 1H), 1.10-1.33 (m, 4H), 0.91-1.02 (m, 1H).
ПРИМЕР 101
Приготовление 1-(3-(2-аминоэтокси)фенетил)циклобутанола

1-(3-(2-аминоэтокси)фенетил)циклобутанол был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с 1-этинил-циклобутанолом позволила получить 2,2,2-трифтор-N-(2-(3-(2-(1-гидроксициклобутил)этинил)фенокси) этил)ацетамид в виде коричневого масла. Выход (0.85 г, 39%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.27-7.30 (m, 1H), 6.92-7.03 (m, 3H), 4.09-4.13 (m, 4H), 3.54-3.58 (m, 2H), 2.33-2.37 (m, 2H), 2.16-2.24 (m, 2H), 1.74-1.81 (m, 2H).
Стадия 2: Раствор 2,2,2-трифтор-N-(2-(3-(2-(1-гидроксициклобутил)этинил)фенокси)этил)ацетамида (0.45 г, 1.9 ммоль) в EtOH (20 мл) дегазировали и продували азотом. К нему добавляли Pd на С (0.09 г, 10%) и колбу вакуумировали и заполняли водородом. Полученную реакционную смесь перемешивали при комнатной температуре под баллоном с водородом в течение ночи. После чего фильтровали через слой Celite. Фильтрационный кек отмывали этанолом и фильтрат концентрировали для получения 2,2,2-трифтор-N-(2-(3-(2-(1-гидроксициклобутил)этил)фенокси)этил) ацетамида в виде желтого масла. Выход (0.3 г, 66%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.20-7.25 (m, 1H), 6.87 (d, J = 7.6 Гц, 1H), 6.78 (s, 1H), 6.72 (dd, J = 8.0, 2.4 Гц, 1H), 4.11 (t, J = 5.0 Гц, 2H), 3.76-3.81 (m, 2H), 2.67-2.72 (m, 2H), 2.01-2.14 (m, 4H), 1.92-1.96 (m, 2H), 1.22-1.26 (m, 2H).
Стадия 3: В перемешанный раствор 2,2,2-трифтор-N-(2-(3-(2-(1-гидроксициклобутил)этил) фенокси)этил)ацетамида (0.3 г, 0.9 ммоль) в МеОН-вода (6:0.5) мл добавляли К2СО3 (0.187 г, 1.4 ммоль). Полученную смесь перемешивали в течение ночи, после чего растворитель удаляли при пониженном давлении. Остаток разделяли между DCM и водой, и объединенные органияеские слои отмывали водой с последующей сушкой над Na2SO4. Фильтрат концентрировали при пониженном давлении для получения Примера 101 в виде коричневого масла. Выход (0.12 г, 56%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.17-7.22 (m, 1H), 6.81-6.85 (m, 2H), 6.77 (dd, J = 7.6, 2.0 Гц, 2H), 4.12 (t, J = 5.2 Гц, 2H), 3.18 (t, J = 5.2 Гц, 2H), 2.52-2.60 (m, 2H), 1.91-1.97 (m, 4H), 1.70-1.76 (m, 2H), 1.58-1.66 (m, 1H), 1.40-1.50 (m, 1H).13С ЯМР (100 МГц, ДМСО-d6) δ 158.4, 145.1, 129.8, 121.7, 115.1, 112.2, 73.7, 64.6, 41.8, 38.8, 36.1, 30.1, 12.3. MS: 236 [M+1]+.
ПРИМЕР 102
Приготовление 1-(3-(3-амино-1-гидроксипропил)фенил)-4-метилпентан-3-ола

1-(3-(3-амино-1-гидроксипропил)фенил)-4-метилпентан-3-ол был приготовлен согласно способу, который использовали в Примере 79.
Стадия 1: Реакция Соногашира 39 с 4-метил-пент-1-ин-3-олом позволила получить трет-бутил. 3-гидрокси-3-(3-(3-гидрокси-4-метилпент-1-инил)фенил)пропилкарбамат в виде темного коричневого масла. Выход (1.73 г, 81%):1Н ЯМР (400 МГц, СDСl3) δ 7.44 (s, 1Н), 7.28-7.34 (m, 3Н), 4.86 (bs, 1H), 4.72 (bs, 1H), 4.39 (t, J = 6.0 Гц, 1H), 3.46-3.51 (m, 2H), 3.11-3.19 (m, 1H), 1.78-2.04 (m, 4H), 1.45 (s, 9H), 1.02 (d, J = 7.2 Гц, 3Н), 1.06 (d, J = 7.2 Гц, 3Н).
Стадия 2: Восстановление трет-бутил 3-гидрокси-3-(3-(3-гидрокси-4-метилпент-1-инил)фенил)пропилкарбамата позволило получить трет-бутил 3-гидрокси-3-(3-(3-гидрокси-4-метилпентил)фенил)пропилкарбамат в виде желтого масла. Выход (0.847 г, 91%):1Н ЯМР (400 МГц, CDCl3) δ 7.24-7.28 (m, 1H), 7.22 (s, 1H), 7.18 (d, J = 7.2 Гц, 1H), 7.12 (d, J = 7.2 Гц, 1H), 4.89 (bs, 1H), 4.70-4.72 (m, 1H), 3.46-3.51 (m, 1H), 3.35-3.40 (bs, 1H), 3.15-3.18 (m, 2H), 2.81-2.84 (m, 1H), 2.64-2.67 (m, 1H), 1.80-1.87 (m, 2H), 1.64-1.79 (m, 3Н), 1.45 (s, 9H), 0.92 (d, J = 6.8, 6H).
Стадия 3: Снятие защиты трет-бутил. 3-гидрокси-3-(3-(3-гидрокси-4-метилпентил)фенил)пропилкарбамата позволило получить Пример 102 гидрохлорид в виде бледно-желтого полутвердого сещества. Выход (0.205 г, 30%);1Н ЯМР (400 МГц, ДМСО-d6) δ 7.22 (t, J = 7.6 Гц, 1H), 7.13 (s, 1H), 7.18 (d, J = 7.6 Гц, 1H), 7.12 (d, J = 7.6 Гц, 1H), 4.61 (t, J = 6.8 Гц, 1H), 3.81 (m, 1H) 3.14-3.18 (m, 1H), 2.83-2.90 (m, 2H), 2.77-2.80 (m, 1H), 1.81-1.85 (m, 2H), 1.48-1.61 (m, 3Н), 0.92 (d, J = 6.8 Гц, 6H).13С ЯМР (100 МГц, ДМСО-d6) δ 145.7, 143.0, 128.5, 127.4, 126.0, 125.9, 123.3, 74.3, 70.2, 36.8, 36.4, 33.7, 32.5, 19.4, 18.0. MS: 252 [M+1]+.
ПРИМЕР 103
Приготовление 1-(3-(3-аминопропил)фенетил)циклооктанола

1-(3-(3-аминопропил)фенетил)циклооктанол был приготовлен согласно способу, который использовали в Примере 57, за исключением того, что гидрирование проводили до снятия защиты амина.
Стадия 1: Взаимодействие Соногашира бромида 10 с 1-этинил-циклооктанолом позволило получить 2,2,2-трифтор-N-(3-(3-(2-(1-гидроксициклооктил)этинил)фенил)пропил)ацетамид. Выход (0.344 г, 47%).1Н ЯМР (400 МГц, СDСl3) δ 7.22-7.29 (m, 2H), 7.15-7.19 (m, 1H), 7.11-7.13 (m, 1H), 6.23 (bs, 1H), 3.36-3.42 (m, 2H), 1.48-2.07 (m, 18H).
Стадия 2: Восстановление 2,2,2-трифтор-N-(3-(3-((1-гидроксициклооктил) этинил)фенил)пропил)ацетамида позволило получить 2,2,2-трифтор-N-(3-(3-(2-(1-гидроксициклооктил)этил)фенил)пропил)ацетамид в виде желтого масла. Выход (0.895 г, 98%):1H ЯМР (400 МГц, CDCl3) δ 7.19-7.24 (m, 1H), 7.06 (d, J = 7.2 Гц, 1H), 7.02 (s, 1H), 6.99 (d, J = 7.2 Гц, 1H), 3.36-3.42 (m, 2H), 2.64-2.70 (m, 4H), 1.89-1.96 (m, 2H), 1.32-1.87 (m, 16H).
Стадия 7: Снятие защиты 2,2,2-тpифтop-N-(3-(3-(2-(1-гидpoкcициклooктил)этил)фенил)пропил)ацетамида позволило получить Пример 103 в виде желтого масла. Выход (0.277 г, 42%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.12-7.16 (m, 1H), 6.94-6.98 (m, 3Н), 2.50-2.56 (m, 6H), 1.32-1.70 (m, 18H).13С ЯМР (100 МГц, ДМСО-d6): 143.3, 142.1, 128.2, 128.1, 125.6, 125.4, 72.6, 43.7, 40.9, 35.7, 34.5, 32.5, 29.3, 28.0, 24.7, 22.0. MS: 290 [M+1]
ПРИМЕР 104
Приготовление 5-(3-(3-амино-1-гидроксипропил)фенил)пентанамида
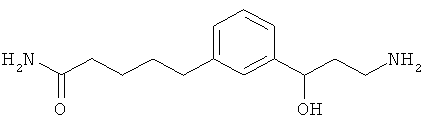
5-(3-(3-амино-1-гидроксипропил)фенил)пентанамид был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Реакция Соногашира 43 с пент-4-инамидом позволила получить 5-(3-(1-гидрокси-3-(2,2,2-трифторацетамидо)пропил)фенил)пент-4-инамид в виде коричневого масла. Выход (0.6 г, 57%). Это соединение использовали в таком виде на следующей стадии превращений. MS: 343 [M+1]+.
Стадия 2: Восстановление 5-(3-(1-гидрокси-3-(2,2,2-трифторацетамидо) пропил)фенил)пент-4-инамида позволило получить 5-(3-(1-гидрокси-3-(2,2,2-трифторацетамидо)пропил)фенил)пентанамид в виде желтого масла. Выход (0.51 г, 83%). Это соединение использовали в таком виде на следующей стадии превращений. MS: 347 [M+1]+.
Стадия 3: Снятие защиты 5-(3-(1-гидрокси-3-(2,2,2-трифторацетамидо)пропил)фенил)пентанамида и последующая очистка флэш хроматографией (градиент 0-10% (MeOH-NH3 (9.5:0.5))-DCM) позволило получить Пример 104 в виде прозрачного масла. Выход (0.125 г, 35%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.23 (t, J = 7.6 Гц, 1Н), 7.12 (s, 1Н), 7.10 (d, J = 7.6 Гц, 1Н), 7.04 (d, J = 7.6 Гц, 1Н), 4.60 (t, J = 6.4 Гц, 1Н), 2.77-2.89 (m, 2H), 2.56 (t, J = 6.8 Гц, 2Н), 2.05 (t, J = 6.8 Гц, 2Н), 1.79-1.85 (m, 2H), 1.48-1.52 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 174.7, 145.7, 142.5, 128.5, 127.4, 125.9, 123.4, 70.3, 37.1, 37.0, 35.5, 35.4, 31.2, 25.2. MS: 251 [M+1]+.
ПРИМЕР 105
Приготовление 3-амино-1-(3-(2-циклооктилэтил)фенил)пропан-1-ола

3-амино-1-(3-(2-циклооктилэтил)фенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 79.
Стадия 1: Реакция Соногашира 39 с этинилциклооктаном позволила получить трет-буткл 3-(3-(2-циклооктилэтинил)фенил)-3-гидроксипропилкарбамат в виде светло-желтого масла. Выход (470 мг, 91%):1H ЯМР (400 МГц, CDCl3) δ 7.39 (s, 1Н), 7.22-7.29 (m, 3Н), 4.86 (bs, 1Н), 4.72 (m, 1Н), 3.23 (bs, 1Н), 3.11-3.19 (m, 1Н), 2.76-2.79 (m, 2H), 1.92-1.96 (m, 2H), 1.74-1.81 (m, 6H), 1.53-1.60 (m, 6H), 1.45 (s, 9H), 1.27 (m, 2H).
Стадия 2: Восстановление трет-бугил 3-(3-(2-циклооктилэтинил)фенил)-3-гидроксипропилкарбамата позволило получить трет-бутил 3-(3-(2-циклооктилэтил)фенил)-3-гидроксипропилкарбамат в виде желтого масла. Выход (0.232 г, 89%):1Н ЯМР (400 МГц, CDCl3) δ 7.22 (t, J = 7.6 Гц, 1Н), 7.18 (s, 1Н), 7.16 (d, J = 7.6 Гц, 1Н), 7.09 (d, J = 7.6 Гц, 1Н), 4.89 (bs, 1Н), 4.72 (m, 1Н), 3.49-3.54 (m, 1Н), 3.13-3.21 (m, 1Н), 3.07 (bs, 1Н), 2.58-2.62 (m, 2H), 1.82-1.87 (m, 2H), 1.63-1.68 (m, 4H), 1.49-1.57 (m, 5H), 1.46-1.48 (m, 3Н), 1.45 (s, 9H), 1.28-1.33 (m, 2H).
Стадия 3: Снятие защиты трет-бутил 3-гидрокси-3-(3-(2-(тетрагидро-2Н-пиран-2-ил)этил)фенил)пропилкарбамата позволило получить полутвердый продукт, который очищали флэш хроматографией (градиент 0-10% MeOH-DCM) для получения Примера 105 гидрохлорида в виде грязно-белого твердого вещества. Выход (0.194 г, 40%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.60 (bs, 1Н), 7.23 (t, J = 7.6 Гц, 1Н), 7.14 (s, 1Н), 7.11 (d, J = 7.6 Гц, 1Н), 7.08 (d, J = 7.6 Гц, 1Н), 4.64 (m, 1Н), 2.81-2.86 (m, 2H), 2.56-2.58 (m, 2H), 1.79-1.83 (m, 2H), 1.54-1.65 (m, 7H), 1.40-1.47 (m, 9H), 1.28-1.33 (m, 2H).13С ЯМР (100 МГц, ДМСО-d6) δ 145.7, 142.9, 128.5, 127.3, 125.9, 123.3, 70.2, 37.2, 36.9, 36.8, 33.7, 32.2, 27.3, 26.3, 25.4. MS: 290 [М+1]+.
ПРИМЕР 106
Приготовление 3-амино-1-(3-(5-метоксипентил)фенил)пропан-1-ола
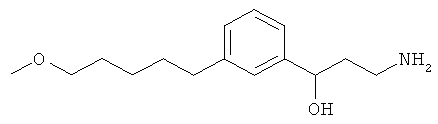
3-амино-1-(3-(5-метоксипентил)фенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 79.
Стадия 1: Реакция Соногашира 39 с 5-метоксипент-1-ине позволила получить трет-бутил 3-гидрокси-3-(3-(5-метоксипент-1-инил)фенил)пропилкарбамат в виде коричневого масла. Выход (0.347 г, 66%):1Н ЯМР (400 МГц, CDCl3) δ 7.39 (s, 1H), 7.27-7.37 (m, 3Н), 4.83-4.85 (bs, 1H), 4.69-4.71 (m, 1H), 3.66-3.71 (m, 1H), 3.52 (t, J = 6.4 Гц, 2Н), 3.48 (m, 1H), 3.36 (s, 3Н), 3.29 (bs, 1H), 2.49 (t, J = 6.4 Hz, 2Н), 1.80-2.02 (m, 4H), 1.45 (s, 9H).
Стадия 2: Восстановление трет-бутил 3-гидрокси-3-(3-(5-метоксипент-1-инил)фенил)пропилкарбамата позволило получить трет-бутил 3-гидрокси-3-(3-(5-метоксипентил)фенил)пропилкарбамат в виде желтого масла. Выход (0.299 г, 88%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.19 (t, J = 7.6 Гц, 1H), 7.09 (s, 1H), 7.07 (d, J = 7.6 Гц, 1H), 7.02 (d, J = 7.6 Гц, 1H), 4.48 (t, J = 6.4 Гц, 1H), 3.27 (t, J = 6.4 Гц, 2Н), 3.16 (s, 3Н), 2.91-2.94 (m, 2Н), 2.50-2.54 (m, 2Н), 1.62-1.67 (m, 2Н), 1.47-1.56 (m, 4H), 1.33 (s, 9H), 1.23-1.28 (m, 2Н).
Стадия 3: Снятие защиты трет-бутил 3-гидрокси-3-(3-(5-метоксипентил)фенил)пропилкарбамата и последующая очистка флэш хроматографией (0-10% MeOH-NH3 (9.5:0.5)-DCM) позволило получить Пример 106 в виде прозрачного масла. Выход (0.178 г, 72%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.20 (t, J = 7.6 Гц, 1H), 7.11 (s, 1H), 7.09 (d, J = 7.6 Гц, 1H), 7.04 (d, J = 7.6 Гц, 1H), 4.58-4.61 (m, 1H), 3.30 (t, J = 6.4 Гц, 2Н), 3.18 (s, 3Н), 2.78-2.87 (m, 2Н), 2.53-2.55 (m, 2Н), 1.79-1.84 (m, 2Н), 1.47-1.57 (m, 4H), 1.23-1.28 (m, 2Н).13C ЯМР (100 МГц, ДМСО-d6) δ 146.4, 141.7, 127.7, 126.4, 125.6, 123.0, 71.8, 71.4, 57.7, 42.5, 38.9, 35.2, 30.8, 28.8, 25.4. MS: 252 [M+1+.
ПРИМЕР 107
Приготовление 2-(3-(5-метоксипентил)фенокси)этанамина

2-(3-(5-метоксипентил)фенокси)этанамин был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с 5-метоксипент-1-ине позволила получить 2,2,2-трифтор-N-(2-(3-(5-мeтoкcипeнт-l-инил)фeнoкcи)этил)aцeтaмид в виде коричневого масла. Выход (0.305 г, 29%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.22-7.27 (m, 1Н), 6.97 (d, J = 7.6 Гц, 1H), 6.90-6.94 (m, 2H), 4.10 (t, J = 5.6 Гц, 2Н), 3.53-3.58 (m, 2H), 3.43 (t, J = 6.4 Гц, 2H), 3.25 (s, 3H), 2.45 (t, J = 7.2 Гц, 2H), 1.72-1.79 (m, 2H).
Стадия 2: Восстановление 2,2,2-трифтор-N-(2-(3-(5-метоксипент-1-инил)фенокси)этил)ацетамида позволило получить 2,2,2-трифтор-N-(2-(3-(5-метоксипентил)фенокси)этил)ацетамид в виде желтого масла. Выход (0.265 г, 87%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.15-7.20 (m, 1H), 6.72-6.78 (m, 3H), 4.06 (t, J = 5.6 Гц, 2H), 3.53-3.58 (m, 2H), 3.30 (t, J = 6.4 Гц, 2H), 3.19 (s, 3H), 2.53 (t, J = 7.2 Гц, 2H), 1.48-1.60 (m, 4H), 1.26-1.32 (m, 2H).
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(2-(3-(5-метоксипентил) фенокси)этил)ацетамида позволило получить Пример 107 в виде желтого масла. Выход (0.115 г, 62%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.14-7.18 (m, 1H), 6.71-6.75 (m, 3H), 3.89 (t, J = 5.8 Гц, 2H), 3.28 (t, J = 6.4 Гц, 2H), 3.20 (s, 3H), 2.87 (t, J = 5.8 Гц, 2H), 2.52 (t, J = 7.2 Гц, 2H), 1.47-1.60 (m, 4H), 1.26-1.32 (m, 2H).13С ЯМР (100 МГц, ДМСО-d6) δ 158.3, 144.4, 129.7, 121.7, 115.1, 112.2, 72.3, 64.5, 58.2, 38.7, 35.6, 31.1, 29.3, 25.8. MS: 238 [M+1]+
ПРИМЕР 108
Приготовление 2-(3-(2-циклооктилэтил)фенокси)этанамина

2-(3-(2-циклооктилэтил)фенокси)этанамина был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с этинилциклооктаном позволила получить N-(2-(3-(циклооктилэтинил)фенокси)этил)-2,2,2-трифторацетамид в виде коричневого масла. Выход (0.505 г, 50%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.21-7.27 (m, 1Н), 6.94 (d, J = 7.2 Гц, 1H), 6.88-6.92 (m, 2H), 4.09 (t, J = 5.4 Гц, 2Н), 3.52-3.57 (m, 2H), 2.79-2.84 (m, 1H), 1.86-1.92 (m, 2H), 1.67-1.76 (m, 4H), 1.47-1.58 (m, 8H).
Стадия 2: Восстановление 2,2,2-трифтор-N-(2-(3-((1-гидроксициклооктил)этинил)фенокси)этил)ацетамида позволило получить 2,2,2-трифтор-N-(2-(3-(2-(1-гидроксициклооктил)этил)фенокси)этил)ацетамид в виде желтого масла. Выход (0.215 г, 70%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.14-7.19 (m, 1H), 6.74-6.78 (m, 3Н), 4.05 (t, J = 5.6 Гц, 2H), 3.53-3.58 (m, 2H), 2.50-2.55 (m, 2H), 1.22-1.68 (m, 17H). MS: 372 [M+1]+.
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(2-(3-(2-(1-гидроксициклооктил)этил)фенокси)этил)ацетамида позволило получить Пример 108 в виде желтого масла. Выход (0.07 г, 45%): %):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.13-7.18 (m, 1H), 6.70-6.75 (m, 3Н), 3.91 (t, J = 5.6 Гц, 2H), 2.87 (t, J = 5.6 Гц, 2H), 2.50-2.54 (m, 2H), 1.22-1.66 (m, 17H).13C ЯМР (100 МГц, ДМСО-d6) δ 158.3, 144.8, 129.8, 121.7, 115.1, 112.3, 64.6, 40.6, 38.8, 36.7, 33.6, 32.2, 27.3, 26.3, 25.4. MS: 276 [M+1]+
ПРИМЕР 109
Приготовление 1-(3-(3-амино-1-гидроксипропил)фенил)-3-метилгексан-3-ола
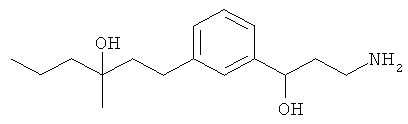
1-(3-(3-амино-1-гидроксипропил)фенил)-3-метилгексан-3-ол был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Реакция Соногашира 43 с 3-метилгекс-1-ин-3-олом позволила получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-метилгекс-1-инил)фенил) пропил)ацетамид в виде коричневого масла. Выход (0.908 г, 90%):1Н ЯМР (400 МГц, CDCl3) δ 7.37 (s, 1H), 7.30-7.35 (m, 1H), 7.26-7.28 (m, 2H), 4.83-4.86 (m, 1H), 3.66-3.69 (m, 1H), 3.39-3.42 (m, 1H), 2.60 (bs, 1H), 2.11 (bs, 1H), 1.94-1.99 (m, 2H), 1.69-1.74 (m, 2H), 1.65 (s, 3Н), 1.54-1.57 (m, 2H), 0.97 (t, J = 7.2 Гц, 3Н).
Стадия 2: Восстановление 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-метилгекс-1-инил)фенил)пропил)ацетамида позволило получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-метилгексил)фенил)пропил)ацетамид в виде желтого масла. Выход (0.99 г, 90%). Это соединение использовали в таком виде для следующего превращения.
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-метилгексил)фенил)пропил)ацетамида позволило получить желтое масло, которое после очистки флэш хроматографией (градиент 0-10% MeOH-NH3 (9.5:0.5)-DCM) позволило получить Пример 109 в виде прозрачного масла. Выход (0.597 г, 82%):1Н ЯМР (400 МГц ДМСО-d6) δ 7.22 (t, J = 7.2 Гц, 1H), 7.12 (s, 1H), 7.08 (d, J = 7.2 Гц, 1Н), 7.04 (d, J = 7.2 Гц, 1H), 4.60 (t, J = 6.4 Гц, 1H), 2.70-2.73 (m, 2H), 2.55-2.58 (m, 2H), 1.69-1.74 (dd, J = 6.4 Гц, 12.8 Гц, 2H), 1.55-1.58 (m, 2H), 1.17-1.37 (m, 4H), 1.07 (s, 3Н), 0.86 (t, J = 7.2 Гц, 3Н).13С ЯМР (100 МГц, ДМСО-d6) δ 146.0, 142.8, 128.0, 126.7, 125.4, 122.8, 70.6, 70.5, 44.1, 43.9, 37.7, 30.0, 26.8, 16.8, 14.8. MS: 266 [M+1].
ПРИМЕР 110
Приготовление 3-амино-1-(3-(2-тетрагидро-2H-пиран-2-ил)этил)фенил)пропан-1-ола

3-амино-1-(3-(2-тетрагидро-2H-пиран-2-ил)этил)фенил)пропан-1-ол был приготовлен согласно способу, который показан на Схеме 18 и который использовали для Примеров 3, 13, 16 и 17.
Схема 18
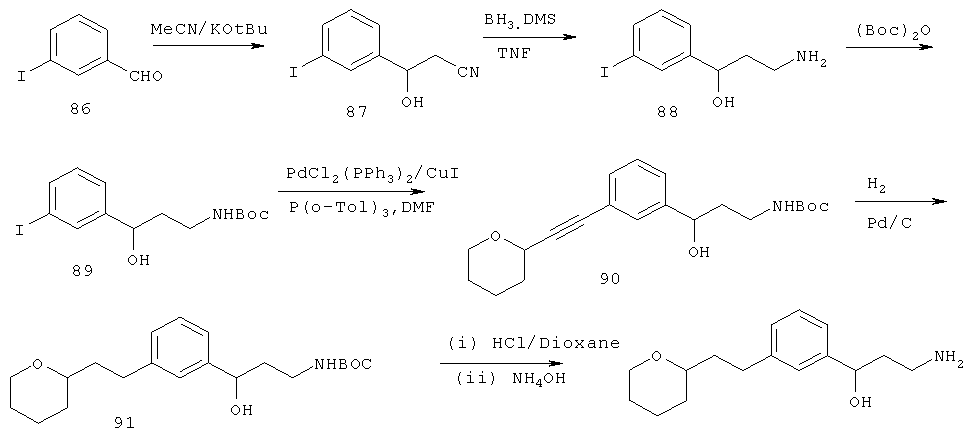
Стадия 1: Добавление ацетонитрила в 3-иодбензальдегид (86) согласно способу, который использовали для Примера 16, позволило получить 3-гидрокси-3-(3-иодфенил)пропаннитрил (87) в виде желтого масла. Выход (2.58 г, 55%):1H ЯМР (400 МГц, CDCl3) δ 7.82 (s, 1H), 7.70 (d, J = 8.0 Гц, 1H), 7.38 (d, J = 8.0 Гц, 1H), 7.14 (t, J = 8.0 Гц, 1H), 5.01 (m, 1H), 2.80 (d, J = 6.4, 2H), 2.40 (bs, 1H).
Стадия 2: Восстановление нитрила 87 согласно способу, который использовали в Примере 17, позволило получить 3-амино-1-(3-иодфенил)пропан-1-ол (88) в виде бледно-желтого масла. Выход (2.63 г, количественный выход). Это соединение использовали в таком виде для следующего превращения.1H ЯМР (400 МГц, CDCl3) δ 7.76 (s, 1H), 7.58 (d, J = 7.6, 1H), 7.33 (d, J = 7.6, 1H), 7.06 (t, J = 8.0, 1H), 4.92 (dd, J = 8.8,2.8 Гц, 1Н), 3.09-3.14 (m, 1H), 2.93-2.99 (m, 1H), 1.81-1.85 (m, 1H), 1.64-1.73 (m, 1H)
Стадия 3: ВОС-защита амина 88, аналогично Примеру 17, позволила получить трет-бутил. 3-гидрокси-3-(3-иодфенил)пропилкарбамат (89) в виде желтого масла. Выход (1.39 г, 40%). Это соединение использовали в таком виде для следующего превращения.1Н ЯМР (400 МГц, CDCl3) δ 7.73 (s, 1H), 7.58 (d, J = 7.6, 1H), 7.33 (d, J = 7.6,1H), 7.07 (t, J = 8.0, 1H), 4.86 (bs, 1H), 4.67 (m, 1H), 3.45-3.51 (m, 2H), 3.11-3.18 (m, 1H), 1.76-1.83 (m, 2H), 1.51 (s, 9H).
Стадия 4: Реакция Соногашира 89 с 2-этинилтетрагидро-2H-пираном согласно способу в Примере 3 позволила получить трет-бутил 3-гидрокси-3-(3-((тетрагидро-2Н-пиран-2-ил)этинил)фенил)пропилкарбамат (90) в виде темного коричневого масла. Выход (1.21 г, 83%):1Н ЯМР (400 МГц, СDСl3) δ 7.45 (s, 1H), 7.27-7.35 (m, 3H), 4.87 (bs, 1H), 4.69-4.71 (m, 1H), 4.49-4.51 (m, 1H), 4.02-4.07 (m, 1H), 3.50-3.52 (m, 1H), 3.56-3.61 (m, 1H), 3.13-3.18 (m, 1H), 1.91-1.93 (m, 2H), 1.74-1.86 (m, 4H), 1.51 (m, 2H), 1.43 (s, 9H).
Стадия 5: Восстановление трет-бутл 3-гидрокси-3-(3-((тетрагидро-2Н-пиран-2-ил)этинил)фенил)пропилкарбамата согласно способу, который использовали для Примера 13, позволило получить трет-бутил 3-гидрокси-3-(3-(2-(тетрагидро-2Н-пиран-2-ил)этил)фенил)пропилкарбамат (91) в виде желтого масла. Выход (0.592 г, сырой).1H ЯМР (400 МГц, CDCl3) δ 7.23 (t, J = 7.2 Гц, 1H), 7.19 (s, 1H), 7.10 (d, J = 7.2 Гц, 1H), 7.02 (d, J = 7.2 Гц, 1H), 4.89 (bs, 1H), 4.64 (t, J = 7.6 Гц, 1H), 3.98-4.0 (m, 1H), 3.38-3.43 (m, 2H), 3.14-3.32 (m, 3H), 2.60-2.76 (m, 2H), 1.80-1.85 (m, 4H), 1.59-1.61 (m, 1H), 1.50-1.53 (m, 2H), 1.45 (s, 9H), 1.20-1.33 (m, 3H).
Стадия 6: Снятие защиты 91 согласно способу, который использовали в Примере 13, позволило получить сырой продукт, который очищали флэш хроматографией (градиент 0-10% MeOH-DCM) для получения Примера 110 гидрохлорида в виде грязно-белого твердого вещества. Выход (0.194 г, 40%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.24 (t, J = 7.2 Гц, 1H), 7.14 (s, 1H), 7.10 (d, J = 7.2 Гц, 1H), 7.07 (d, J = 7.2 Гц, 1H), 4.64 (t, J = 7.6 Гц, 1H), 3.82-3.87 (m, 2H), 3.17-3.21 (m, 2H), 2.76-2.84 (m, 2H), 2.58-2.63 (m, 1H), 1.80-1.84 (m, 2H), 1.54-1.67 (m, 3H), 1.43-1.51 (m, 3H), 1.16 (m, 1H).13С ЯМР (100 МГц, ДМСО-d6) δ 145.8, 142.4, 128.5, 127.3, 125.9, 123.4, 76.6, 70.1, 67.9, 38.4, 37.1, 36.8, 31.9, 31.7, 26.2, 23.5. MS: 264 [M+1]+.
ПРИМЕР 111
Приготовление 5-(3-(3-аминопропил)фенил)-N-метилпентанамида

5-(3-(3-аминопропил)фенил)-N-метилпентанамид был приготовлен согласно способу, который использовали в Примере 76.
Стадия 1: Взаимодействие Соногашира бромида 57 с N-метилпент-4-инамидом позволило получить трет-бутил 3-(3-(5-(метиламино)-5-оксопент-1-инил)фенил)пропилкарбамат. Выход (1.03 г, сырой).1Н ЯМР (400 МГц, CDCl3) δ 7.64-7.70 (m, 1H), 7.48 (d, J = 6.6 Гц, 1H), 7.21 (s, 1H), 7.10 (d, J = 6.4 Гц, 1H), 5.68 (bs, 1H), 4.52 (bs, 1H), 3.10-3.18 (m, 2H), 2.85 (d, J = 6.8 Гц, 3Н), 2.75 (t, J = 7.2 Гц, 2Н), 2.60 (t, J = 7.6 Гц, 2Н), 2.47 (t, J = 7.2 Гц, 2H), 1.75-1.82 (m, 2H), 1.44 (s, 9H).
Стадия 2: Восстановление 5-(3-(3-аминопропил)фенил)-7У-метилпент-4-инамида позволило получить трет-бутил 3-(3-(5-(метиламино)-5-оксопентил)фенил) пропилкарбамат в виде желтого масла. Выход (0.55 г, 88%): MS: 349 [M+1]+.
Стадия 3: Снятие ВОС-защиты wpew-бутил 3-(3-(5-(метиламино)-5-оксопентил)фенил)пропилкарбамата позволило получить 5-(3-(3-aминoпpoпил)фeнил)-N-метилпентанамид гидрохлорид. Продукт изолировали установлением рН конц. аммиаком и экстрагировали DCM. Органический слой отмывали водой, высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент 0-(9.5-0.5) МеОН-NН3)-DCM) позволила получить Пример 111 в виде коричневого масла. Выход (0.107 г, 27%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.13-7.18 (m, 1H), 6.94-6.99 (m, 3Н), 2.48-2.56 (m, 9H), 2.05 (t, J = 6.8 Гц, 2Н), 1.60-1.68 (m, 2Н), 1.42-1.50 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6): 172.8, 142.5, 142.4, 128.8, 128.6, 126.1, 41.2, 35.6, 34.6, 32.9, 31.2, 25.8, 25.4. MS: 249 [M+1]+.
ПРИМЕР 112
Приготовление 5-(3-(3-аминопропил)фенил)пентанамида
5-(3-(3-аминопропил)фенил)пентанамид был приготовлен согласно способу, который использовали в Примере 111.
Стадия 1: Взаимодействие Соногашира бромида 57 с пент-4-инамидом позволило получить трет-бутил 3-(3-(5-амино-5-оксопент-1-инил)фенил) пропилкарбамат. Выход (0.967 г, сырой).1Н ЯМР (400 МГц, CDCl3) δ 7.64-7.70 (m, 1Н), 7.47 (d, J = 6.4 Гц, 1Н), 7.18 (s, 1Н), 7.10 (d, J = 6.4 Гц, 1Н), 5.60-5.80 (m, 2H), 4.53 (bs, 1Н), 3.10-3.18 (m, 2H), 2.75 (d, J = 7.2 Гц, 2H), 2.60 (t, J = 7.6 Гц, 2H), 2.54 (t, J = 7.2 Гц, 2H), 1.76-1.80 (m, 2H), 1.44 (s, 9H).
Стадия 2: Восстановление 5-(3-(3-аминопропил)фенил)пент-4-инамида позволило получить трет-бутил 3-(3-(5-амино-5-оксопентил)фенил)пропилкарбамат в виде желтого масла. Выход (0.310 г, 83%): MS: 335 [M+1]+.
Стадия 3: Снятие ВОС-защиты трет-бутил 3-(3-(5-амино-5-оксопентил)фенил)пропилкарбамата позволило получить Пример 112 в виде грязно-белого твердого вещества. Выход (0.08 г, 38%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.14-7.19 (m, 1Н), 6.97-7.0 (m, 3Н), 2.50-2.60 (m, 6H), 2.05 (t, J = 6.8 Гц, 2H), 1.60-1.70 (m, 2H), 1.43-1.55 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6): 174.2, 142.0, 141.9, 128.3, 128.1, 125.6, 40.7, 34.9, 34.0, 32.4, 30.7, 24.8. MS: 235 [M+1]+.
ПРИМЕР 113
Приготовление 1-(3-(3-амино-1-гидроксипропил)фенил)-3-этилпентан-3-ола

1-(3-(3-амино-1-гидроксипропил)фенил)-3-этилпентан-3-ол был приготовлен согласно способу, который использовали в Примере 63.
Стадия 1: Взаимодействие Соногашира бромида 43 с 3-этилпент-1-ин-3-олом позволило получить N-(3-(3-(3-этил-3-гидроксипент-1-инил)фенил)-3-гидроксипропил) 2,2,2-трифторацетамид. Выход (0.825 г, 77%).1Н ЯМР (400 МГц, CDCl3) δ 7.41 (s, 1Н), 7.28-7.39 (m, 3Н), 4.83-4.87 (m, 1Н), 3.66-3.73 (m, 1Н), 3.37-3.44 (m, 1Н), 1.90-2.02 (m, 2H), 1.70-1.81 (m, 4H), 1.10 (t, J = 7.4 Гц, 6H).
Стадия 2: Снятие защиты N-(3-(3-(3-этил-3-гидроксипент-1-инил)фенил)-3-гидроксипропил)-2,2,2-трифторацетамида позволило получить 1-(3-(3-амино-1-гидроксипропил)фенил)гекс-1-ин-3-ол в виде желтого масла. Выход (0.52 г, 91%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.36 (s, 1Н), 7.29-7.33 (m, 2H), 7.26 (d, J = 6.4 Гц, 1Н), 4.68 (t, J = 4.8 Гц, 1Н), 2.74-2.82 (m, 2H), 1.76-1.82 (m, 2H), 1.60-1.69 (m, 4H), 0.99 (t, J = 7.4 Гц, 6H).13С ЯМР (100 МГц, ДМСО-d6): 146.5, 130.1, 128.9, 126.0, 125.0, 123.0, 100.0, 94.0, 83.3, 75.0, 71.0, 70.2, 34.5, 9.2. ESI MS m/z 262 [M+1]+.
Стадия 3: Восстановление 1-(3-(3-амино-1-гидроксипропил)фенил)-3-этилпент-1-ин-3-ола позволило получить Пример 113 в виде желтого масла. Выход (0.15 г, 49%).1Н ЯМР (400 МГц, ДМСО-d6) δ 7.17-7.21 (m, 1H), 7.14 (s, 1H), 7.07 (d, J = 8.4 Гц, 1Н), 7.02 (d, J = 7.2 Гц, 1H), 4.60-4.64 (m, 1H), 2.58 (t, J = 7.2 Гц, 2H), 2.42-2.50 (m, 2H), 1.60-1.68 (m, 2H), 1.50-1.56 (m, 2H), 1.37 (q, J = 7.6 Гц, 4H), 0.81 (t, J = 7.6 Гц, 6Н).13С ЯМР (100 МГц, ДМСО-d6): 146.5, 142.7, 127.9, 126.4, 125.4, 122.9, 72.4, 71.3, 42.0, 40.1, 38.8, 30.4, 29.6, 7.9. MS: 266 [M+1]+
ПРИМЕР 114
Приготовление 2-(3-(2-(тетрагидро-2H-пиран-2-ил)этил)фенокси)этанамина
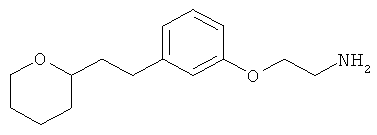
2-(3-(2-(тетрагидро-2H-пиран-2-ил)этил)фенокси)этанамин был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с 2-этинилтетрагидро-2Я-пираном позволила получить 2,2,2-трифтор-N-(2-(3-((тетрагидро-2Я-пиран-2-ил)этинил) фенокси)этил) ацетамид в виде коричневого масла. Выход (0.753 г, 79%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.26-7.32 (m, 1H), 7.05 (d, J = 7.6 Гц, 1H), 6.95-6.98 (m, 2H), 4.50-4.53 (m, 1H), 4.11 (t, J = 5.4 Гц, 2H), 3.83-3.90 (m, 1H), 3.54-3.58 (m, 2H), 3.46-3.53 (m, 1H), 1.78-1.86 (m, 2H). 1.46-1.66 (m, 4H).
Стадия 2: Восстановление 2,2,2-трифтор-N-(2-(3-((тетрагидро-2H-пиран-2-ил)этинил)фенокси)этил)ацетамида позволило получить 2,2,2-трифтор-N-(2-(3-(2-(тетрагидро-2H-пиран-2-ил)этил)фенокси)этил)ацетамид в виде коричневого масла. Выход (0.315 г, 77%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.15-7.20 (m, 1H), 6.72-6.78 (m, 3Н), 4.07 (t, J = 5.6 Гц, 2H), 3.86-3.90 (m, 1H), 3.52-3.58 (m, 2H), 3.26-3.30 (m, 1H), 3.12-3.18 (m, 1H), 2.51-2.68 (m, 2H), 1.52-1.78 (m, 4H), 1.38-1.48 (m, 4H),
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(2-(3-(2-(тетрагидро-2H-пиран-2-ил)этил)фенокси)этил)ацетамида позволило получить Пример 114 в виде желтого масла. Выход (0.141 г, 63%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.19-7.23 (m, 1H), 6.77-6.82 (m, 3Н), 4.10 (t, J = 5.2 Гц, 2H), 3.83-3.86 (m, 1H), 3.24-3.30 (m, 1H), 3.12-3.20 (m, 3Н), 2.50-2.70 (m, 2H), 1.50-1.74 (m, 4H), 1.36-1.46 (m, 3Н), 1.10-1.20 (m, 1H).13С ЯМР (100 МГц, ДМСО-d6) δ 158.4, 144.3, 129.3, 121.6, 115.0, 112.4, 76.6, 67.9, 64.5, 38.7, 38.2, 31.9, 31.6, 26.2, 23.5. MS: 250 [M+1]+.
ПРИМЕР 115
Приготовление 1-(3-(3-амино-1-гидроксипропил)фенетил)циклопентанола

1-(3-(3-амино-1-гидроксипропил)фенетил)циклопентанол был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Реакция Соногашира бромида 43 с 1-этинилциклопентанолом позволила получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-((1-гидроксициклопентил) этинил)фенил)пропил)-ацетамид в виде коричневого масла. Выход (0.55 г, 55%):1Н ЯМР (400 МГц, СDСl3) δ 7.41 (s, 1Н), 7.28-7.35 (m, 3Н), 4.85-4.87 (m, 1H), 3.66-3.70 (m, 1H), 3.38-3.44 (m, 1H), 2.41 (bs, 1H), 1.76-2.08 (m, 10H).
Стадия 2: Восстановление 2,2,2-трифтор-N-(3-гидрокси-3-(3-((1-гидроксициклопентил)этинил)фенил)пропил)-ацетамида позволило получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(2-(1-гидроксициклопентил)этил)фенил)пропил)ацетамид в виде желтого масла. Выход (0.248 г, 62%).1Н ЯМР (400 МГц, CDCl3) δ 7.27-7.31 (m, 1H), 7.20 (s, 1H), 7.14-7.18 (m, 2H), 4.86-4.90 (m, 1H), 3.68-3.73 (m, 1H), 3.38-3.46 (m, 1H), 2.76-2.80 (m, 2H), 2.25 (s, 1H), 1.96-2.02 (m, 3Н), 1.80-1.90 (m, 4H), 1.60-1.72 (m, 5H).
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(2-(1-гидроксициклопентил)этил)фенил)пропил)ацетамида позволило получить Пример 115 в виде желтого масла. Выход (0.12 г, 68%).1H ЯМР (400 МГц, CDCl3) δ 7.20-7.24 (m, 1H), 7.13 (s, 1H), 7.06-7.11 (m, 2H), 4.61 (t, J = 6.4 Гц, 1H), 2.78-2.92 (m, 2H), 2.60-2.65 (m, 2H), 1.80-1.87 (m, 2H), 1.64-1.74 (m, 4H), 1.40-1.60 (m, 6H).13С ЯМР (100 МГц, ДМСО-d6) δ 145.9, 143.4, 128.5, 127.3, 125.8, 123.2, 80.6, 70.6, 44.1, 38.6, 37.4, 31.3, 24.0. MS: 264 [M+1]+
ПРИМЕР 116
Приготовление 3-(3-(3-аминопропил)фенил)-1-фенилпропан-1-ола
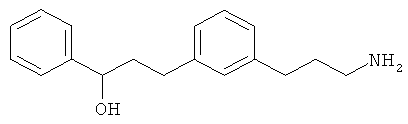
3-(3-(3-аминопропил)фенил)-1-фенилпропан-1-ол был приготовлен согласно способу, который использовали в Примере 103.
Стадия 1: Реакция Соногашира бромида 10 с 1-фенилпроп-1-ин-1-олом позволила получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-фенилпроп-1-инил)фенил)пропил)ацетамид в виде коричневого масла. Выход (0.408 г, 80%). Это соединение использовали в таком виде для следующего превращения.
Стадия 2: Восстановление 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-фенилпроп-1-инил)фенил)пропил)ацетамида позволило получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-фенилпропил)фенил)пропил)ацетамид в виде желтого масла. Выход (0.365 г, 91%). Это соединение использовали в таком виде для следующего превращения.
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-фенилпропил)фенил)пропил)ацетамида и последующая очистка флэш хроматографией (градиент 0-10% MeOH-NH3 (9.5:0.5)-DCM) позволило получить Пример 116 в виде бледно-желтого масла. Выход (0.20 г, 74%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.30-7.33 (m, 4Н), 7.20-7.25 (m, 2H), 7.13 (s, 1H), 7.13 (d, J = 8.0 Гц, 1Н), 7.08 (d, J = 8.0 Гц, 1Н), 5.28 (d, J = 4.4 Гц, 1Н), 4.62 (t, J = 7.2 Гц, 1Н), 4.52-4.63 (m, 1Н), 2.79-2.87 (m, 2H), 2.50-2.59 (m, 2H), 1.79-1.89 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 146.6, 145.7, 142.4, 128.6, 128.5, 127.4, 127.1, 126.2, 125.9, 123.4, 72.2, 70.3, 41.6, 37.1, 32.1. MS: 286 [M+1]+.
ПРИМЕР 117
Приготовление 3-(3-(3-аминопропил)фенил)-2,2-диметилпропил ацетата

3-(3-(3-аминопропил)фенил)-2,2-диметилпропил ацетат был приготовлен согласно способу, показанному на Схеме 19.
Схема 19

Стадия 1: Алкилирование 3-бромбензилбромида (92) этилизобутиратом (93) согласно способу, который использовали в Примере 44 (за исключением того, что использовали насыщенный водный раствор хлорида аммония для осаждения реакции вместо воды), с последующей флэш хроматографией (градиент 0-20% EtOAc/гексаны) позволило получить эфир 94 в виде светло-желтого масла. Выход (2.9 г, 87%):1H ЯМР (400 МГц, CDCl3) δ 7.31-7.35 (m, 1H), 7.27 (t, J = 2.0 Гц, 1Н), 7.11 (t, J = 7.6 Гц, 1Н), 7.01-7.05 (m, 1Н), 4.11 (q, J = 7.2 Гц, 2Н), 2.80 (s, 2Н), 1.23 (t, J = 7.2 Гц, 3Н), 1.67 (s, 6H).
Стадия 2: В перемешивающийся раствор эфира 94 (2.1 г, 7.36 ммоль) в толуоле при 0°С в атмосфере аргона добавляли DIBALH (8.8 мл 1.0 М раствора в THF, 8.8 ммоль). Через 1 ч добавляли вторую аликвоту DIBALH (4.2 мл, 4.2 ммоль). После перемешивания в течение ночи реакцию осаждали насыщенным водным раствором хлорида аммония, разбавляли 1М НСl и экстрагировали этилацетатом. Объединенные органические слои отмывали дополнительным количеством 1М НСl, водой, насыщенным водным раствором бикарбоната натрия и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали, что позволило получить спирт 95 в виде бесцветного масла. Выход (1.84 г, количественно):1Н ЯМР (400 МГц, CDCl3) δ 7.30-7.35 (m, 2Н), 7.13 (t, J = 7.6 Гц, 1Н), 7.06-7.10 (m, 1Н), 3.29 (d, J = 4.8 Гц, 2Н), 2.54 (s, 2Н), 1.38-1.40 m, 1Н), 0.87 (s, 6H).
Стадия 3: Раствор три-1-бутилфосфина (0.13 мл 1М раствора в диоксане, 0.13 ммоль) добавляли в дегазированную смесь бис-хлор-трифенилфосфина палладия (49 мг, 0.07 ммоль), иодида меди (4.9 мг, 0.026 ммоль), ди-изопропиламина (0.31 мл, 2.2 ммоль), спирта 95 (0.422 г, 1.73 ммоль) и трет-бутил-проп-2-инилкарбамата (0.4 г, 2.6 ммоль) в безводном диоксане (20 мл). Реакционную смесь нагревали до 50°С в течение ночи, фильтровали и очищали флэш хроматографией (градиент 4-60% EtOAc/гексаны), что позволило получить алкин 96 в виде желтого масла. Выход (0.162 г, 29%):1Н ЯМР (400 МГц, CDCl3) δ 7.23-7.27 (m, 1Н), 7.17-7.23 (m, 2Н), 7.09-7.13 (m, 1H), 4.74 (brs, 1H), 4.10-4.15 (m, 2Н), 3.29 (s, 2Н), 2.54 (s, 2Н), 1.45 (s, 10H), 0.88 (s, 6H).
Стадия 4: Восстановление алкина 96 согласно способу, который использовали в Примере 2, за исключением того, что в качестве растворителя использовали n-бутанол, с последующей флэш хроматографией (градиент 10-60% этилацетат/гексаны) позволило получить алкан 97 в виде бесцветного масла. Выход (0.1 г, 63%):1Н ЯМР (400 МГц, CDCl3) δ 7.17 (t, J = 7.6 Гц, 1H), 6.95-7.02 (m, 3Н), 4.53 (m, 1H), 3.27 (s, 2Н), 3.05-3.15 (m, 2Н), 2.60 (t, J = 7.2 Гц, 2Н), 2.54 (s, 2Н), 2.08 (s, 1H), 1.57-1.82 (m, 2Н), 1.44 (s, 9H), 0.87 (s, 6H).
Стадия 5: HCl (0.25 мл 6.95 М раствора в этаноле, 1.74 ммоль) добавляли в ратвор спирта 97 в этилацетате (2 мл). Реакционную смесь перемешивали в течение ночи, концентрировали при пониженном давлении и остаток экстрагировали из насыщенного водного раствора бикарбоната натрия этилацетатом. Объединенные органические слои отмывали водой и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш хроматографией (5% (7 N аммиак/метанол)/этилацетат), что позволило получить Пример 117 в виде бесцветного масла. Выход (0.035 г, %):1Н ЯМР (400 МГц, CDCl3) δ 7.16 (t, J = 8.0 Гц, 1H), 6.99-7.04 (m, 1H), 6.89-6.93 (m, 2H), 3.74 (s, 2H), 2.70 (t, J = 7.2 Гц, 2Н), 2.61 (t, J = 8.0 Гц, 2H), 2.54 (s, 2H), 2.09 (s, 3Н), 1.69-1.78 (m, 2H), 1.27 (brs, 2H), 0.89 (s, 6H). ESI MS m/z 264.3 [m+H]+
ПРИМЕР 118
Приготовление 3-(3-(3-аминопропил)фенил)-2,2-диметилпропан-1-ола

3-(3-(3-аминопропил)фенил)-2,2-диметилпропан-1-ол был приготовлен согласно способу, показанному на Схеме 20.
Схема 20
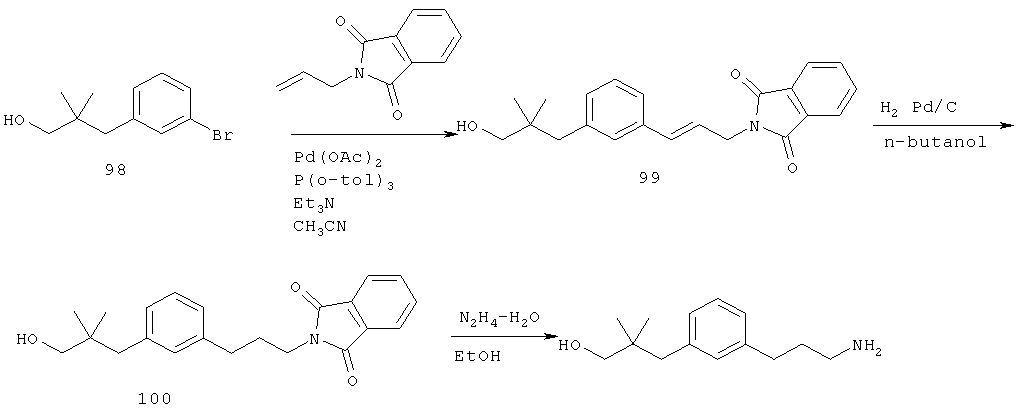
Стадия 1: В раствор арилбромида 98 (0.63 г, 2.6 ммоль) в ацетонитриле (5 мл) добавляли аллилфталимид (0.58 г, 3.1 ммоль), три-о-толилфосфин (0.070 г, 0.26 ммоль) и ацетат палладия (0.036 г, 0.16 ммоль). Смесь вакуумировали и продували аргоном три раза, затем добавляли триэтиламин (0.51 мл, 3.65 ммоль) и процедуру вакуумирования-продувки повторяли три раза. Реакционную смесь нагревали с обратным холодильником в течение ночи, затем разбавляли водным раствором NH4OAc и экстрагировали EtOAc.
Объединенные органические слои отмывали водой, водным раствором NH4OAc, насыщенным водным раствором NaHCO3 и солевым раствором, затем высушивали над MgSO4, фильтровали и концентрировали. Флэш хроматография остатка (градиент 5-60% EtOAc/гексаны) позволила получить спирт 99 в виде белого твердого вещества. Выход (0.58 г, 64%).1Н ЯМР (400 МГц, CDCl3) δ 7.80-7.88 (m, 2H), 7.66-7.72 (m, 2H), 7.10-7.22 (m, 3H), 7.0-7.04 (m, 1H), 6.62 (d, J = 16 Гц, 1Н), 6.18-6.26 (m, 1H), 4.42 (dd, J = 1.6, 6.8 Гц, 2H), 3.27 (s, 2H), 2.52 (s, 2H), 1.59 (brs, 1H), 0.85 (s, 6H).
Стадия 2: Восстановление алкена 99 согласно способу, который использовали в Примере 117, с последующей флэш хроматографией (градиент 20-50% этилацетат/гексаны) позволила получить алкан 100 в виде бесцветного масла.1Н ЯМР (400 МГц, CDCl3) δ 7.79-7.85 (m, 2H), 7.66-7.72 (m, 2H), 7.15 (t, J = 7.6 Гц, 1H), 7.0-7.05 (m, 2H), 6.92-6.96 (m, 1H), 3.72 (t, J = 7.2 Гц, 2H), 3.29 (s, 2H), 2.66 (t, J = 7.2 Гц, 2Н), 2.53 (s, 2H), 1.59-2.05 (m, 2H), 1.54 (s, 1H), 0.87 (s, 6H).
Стадия 3: Снятие защиты алкана 100 согласно способу, который использовали в Примере 9, с последующей флэш хроматографией (градиент 0-10% (7N NН3/МеОН/этилацетат), позволило получить Пример 118 в виде бесцветного масла. Выход (0.068 г, 33%): 7.13-7.18 (m, 1H), 6.94-7.02 (m, 3H), 3.25 (s, 2H), 2.69 (t, J = 6.8 Гц, 2H), 2.61 (t, 7.6 Гц, 2H), 2.53 (s, 2H), 1.89 (brs, 3H), 1.75 (квинт, J = 7.2 Гц, 2H), 0.85 (s, 6H). ESI MS m/z 222.2 [m+H]+.
ПРИМЕР 119
Приготовление 2-(3-(3-аминопропил)фенил)декан-2-ола

2-(3-(3-аминопропил)фенил)декан-2-ол был приготовлен согласно способу, показанному на Схеме 21.
Схема 21
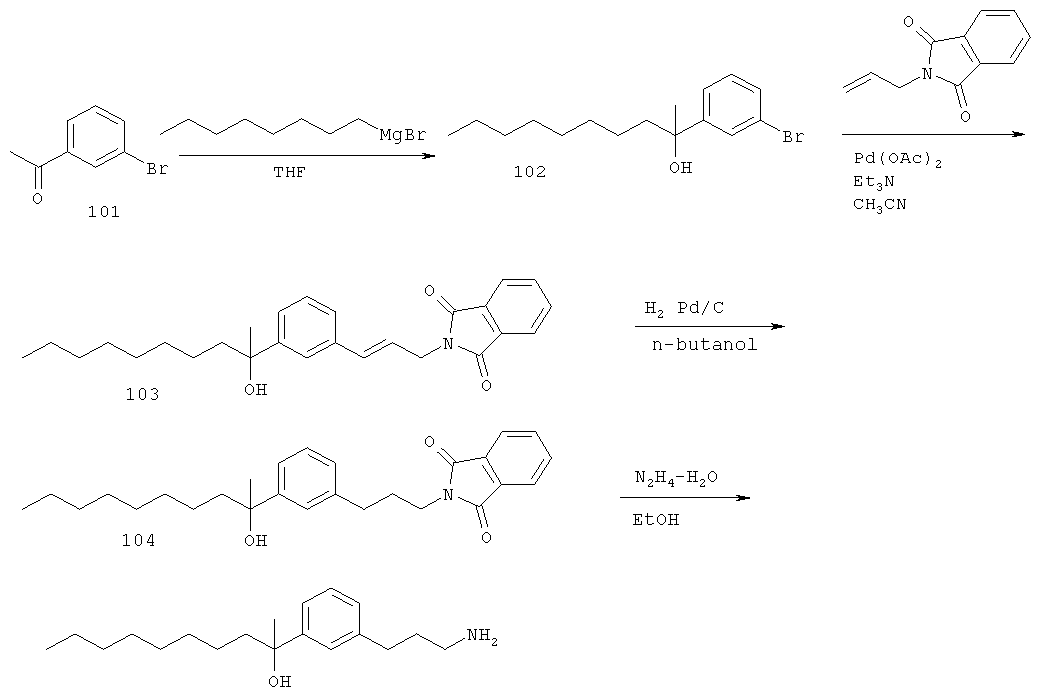
Стадия 1: В раствор 1-(3-бромфенил)этанона (101) (2.0 мл, 15 ммоль) в безводном THF (10 мл) в атмосфере аргона при -78°С добавляли октил-магнийбромид. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Раствор реакционной смеси переливали в насыщенный водный раствор хлорида аммония и перемешивали в течение 20 мин. Водный раствор экстрагировали этилацетатом и объединенные органические слои отмывали водой, насыщенным водным раствором бикарбоната натрия и солевым раствором, высушивали над MgSO4, фильтровали через целит и концентрировали при пониженном давлении. Флэш хроматография остатка позволила получить бензил гидрохлорид 102 в виде бесцветного масла. Выход (2.7 г, 57%):1Н ЯМР (400 МГц, CDCl3) δ 7.59 (t, 2.0 Гц, 1Н), 7.30-7.37 (m, 2H), 7.19 (t, J = 8.0 Гц, 1Н), 1.68-1.82 (m, 2H), 1.64 (brs, 1Н), 1.52 (s, 3Н), 1.18-1.30 (m, 11H), 1.0-1.16 (m, 1Н), 0.85 (1, J = 7.2 Гц, 3Н).
Стадия 2: Связывание Хека бромида 102 с аллилфталимидом согласно способу, который использовали в Примере 118, с последующей хроматографией (градиент 5-40% этилацетат/гексаны) позволило получить алкен 103 в виде желтого масла. Выход (0.67 г, 84%):1Н ЯМР (400 МГц, CDCl3) δ 7.80-7.88 (m, 2H), 7.66-7.74 (m, 2H), 7.39-7.42 (m, 1Н), 7.20-7.28 (m, 3Н), 6.63-6.69 (m, 1Н), 6.26 (dt, J = 6.4, 15.6 Гц, 1Н), 4.44 (dd, 1.2, 6.0 Гц, 2H), 1.70-1.80 (m, 2H), 1.62 (brs, 1H), 1.51 (s, 3Н), 1.30-1.60 (m, 12 Н), 0.84 (t, J = 3.2 Гц, 3Н).
Стадия 3: Восстановление алкена 103 согласно способу, который использовали в Примере 117, с последующей флэш хроматографией (граиден 0-40% этилацетат/гексаны) позволило получить алкан 104 в виде бесцветного масла. Выход (0.43 г, 65%):1Н ЯМР (400 МГц, CDCl3) δ 7.79-7.85 (m, 2H), 7.68-7.72 (m, 2H), 7.16-7.28 (m, 3H), 7.04-7.07 (m, 1H), 3.73 (t, J = 7.2 Гц, 2H), 2.69 (t, J = 8.0 Гц, 2H), 1.99-2.10 (m, 2H), 1.65-1.70 (m, 3Н), 1.52 (s, 3Н), 1.05-1.30 (m, 12), 0.83 (t, J = 7.2 Гц, 3Н).
Стадия 4: Снятие защиты алкана 104 согласно способу, который использовали в Примере 9, с последующей флэш хроматографией (градиент 0-10% (7N МН3/МеОН)/этилацетат) позволило получить Пример 119 в виде бесцветного масла. Выход (0.068 г, 25%):1Н ЯМР (400 МГц, CDCl3) δ 7.21-7.27 (m, 3Н), 7.03-7.07 (m, 1H), 2.74 (t, J = 6.8 Гц, 2H), 2.66 (t, 8.0 Гц, 2H), 1.72-1.83 (m, 4H), 1.53 m, 6H), 1.06-1.30 (m, 12 H), 0.85 (t, J = 7.2 Гц, 3Н). ESI MS m/z 292.4 [m+H]+, 274.4 [m+Н-H2O].
ПРИМЕР 120
Приготовление 2-(3-(3-аминопропил)фенил)гексан-2-ола

2-(3-(3-аминопропил)фенил)гексан-2-ол был приготовлен согласно способу, который использовали в Примере 119.
Стадия 1: Реакция Гриньяра бутил-магнийхлорида с 1-(3-бромфенил)этаноном с последующей флэш хроматографией (градиент 0-25% этилацетат/гексаны) позволило получить 2-(3-бромфенил)гексан-2-ол в виде желтого масла. Выход (0.99 g, 51%):1Н ЯМР (400 МГц, CDCl3) δ 7.59 (t, J = 2.0 Гц, 1H), 7.30-7.37 (m, 2H), 7.19 (t, J = 8.0 Гц, 1Н), 1.70-1.84 (m, 2H), 1.52 (s, 3Н), 1.64 (brs, 1H), 1.18-1.30 (m, 3Н), 1.02-1.14 (m, 1H), 0.84 (1, J = 7.2 Гц, 3Н).
Стадия 2: Реакция Хека 2-(3-бромфенил)гексан-2-ола с аллилфталимидом с последующей хроматографией (градиент 5-30% этилацетат/гексаны) позволило получить (E)-2-(3-(3-(2-гидроксигексан-2-ил)фенил)аллил)изоиндолин-1,3-диона в виде бесцветного масла. Выход (0.46 г, 47%):1Н ЯМР (400 МГц, CDCl3) δ 7.78-7.86 (m, 2H), 7.66-7.72 (m, 2H), 7.40 (s, 1H), 7.18-7.28 (m, 3Н), 6.61-6.68 (m, 1H), 6.24 (dt, J = 6.4, 15.6 Гц, 1H), 4.42 (dd, J = 1.2, 6.4 Гц, 2H), 1.85 (brs, 1H), 1.54-1.56 (m, 2H), 1.50 (s, 3Н), 1.15-1.30 (m, 3Н), 1.00-1.10 (m, 1H), 0.75-0.85 (m, 3H).
Стадия 3: Восстановление (E)-2-(3-(3-(2-гидроксигексан-2-ил)фенил) аллил)изоиндолин-1,3-диона с последующей флэш хроматографией (градиент 0-40% этилацетат/гексаны) позволило получить 2-(3-(3-(2-гидроксигексан-2-ил)фенил)пропил)изоиндолин-1,3-дион в виде бесцветного масла. Выход (0.43 г, 65%):1Н ЯМР (400 МГц, CDCl3) δ 7.80-7.84 (m, 2H), 7.68-7.72 (m, 2h), 7.27 (brs, 1H), 7.16-7.23 (m, 2H), 7.04-7.08 (m, 1H), 3.73 (t, J = 7.2 Гц, 2H), 2.69 (t, J = 8.0 Гц, 2H), 2.03 (quint, J = 7.6 Гц, 2H), 1.54-1.56 (m, 2H), 1.65 (brs, 1H), 1.52 (s, 3H), 1.15-1.30 (m, 3H), 1.10-1.30 (m, 1H), 0.83 (t, J = 7.2 Гц, 3Н).
Стадия 4: Снятие защиты 2-(3-(3-(2-гидроксигексан-2-ил)фенил) пропил)изоиндолин-1,3-диона с последующей флэш хроматографией (градиент 0-10% (7N NH3/МеОН)/этилацетат) позволило получить Пример 120 в виде бесцветного масла. Выход (0.157 г, 90%):1Н ЯМР (400 МГц, CDCl3) δ 7.20-7.27 (m, 3H), 7.03-7.07 (m, 1H), 2.73 (t, J = 7.2 Гц, 2H), 2.66 (t, J = 8.0 Гц, 2H), 1.70-1.84 (m, 4H), 1.53 (s, 3H), 1.42 (brs, 3H), 1.18-1.30 (m, 3H), 1.06-1.16 (m, 1H), 0.84 (t, J = 7.2 Гц, 3H). ESI MS m/z 236.2 [m+Н]+, 218.2 [m+Н-Н2О].
ПРИМЕР 121
Приготовление 1-(3-(3-аминопропил)фенил)-2-метилгексан-2-ола

1-(3-(3-аминопропил)фенил)-2-метилгексан-2-ол был приготовлен согласно способу, который использовали в Примере 119.
Стадия 1: Реакция Гриньяра n-бутилмагний-хлорида с 1-(3-бромфенил)пропан-2-оном с последующей флэш хроматографией (градиент 0-25% этилацетат/гексаны) позволило получить 1-(3-бромфенил)-2-метилгексан-2-ол в виде желтого масла. Выход (0.99 г, 51%):1Н ЯМР (400 МГц, CDCl3) δ 7.35-7.38 (m, 2H), 7.11-7.19 (m, 2H), 2.70 (dd, J = 13.4, 28.8 Гц, 2H), 1.24-1.48 (m, 7H), 1.13 (s, 3H), 0.91 (t, J = 7.2 Гц, 3Н).
Стадия 2: Реакция Хека 1-(3-бромфенил)-2-метилгексан-2-ола с аллилфталимидом с последующей хроматографией (градиент 5-30% этилацетат/гексаны) позволило получить (E)-2-(3-(3-(2-гидрокси-2-метилгексил)фенил)аллил)изоиндолин-1,3-диона в виде белого твердого вещества. Выход (0.55 г, 50%):1Н ЯМР (400 МГц, СDСl3) δ 7.80-7.88 (m, 2H), 7.68-7.74 (m, 2H), 7.16-7.26 (m, 3H), 7.04-7.08 (m, 1H), 6.60-6.66 (m, 1H), 6.24 (dt, J = 6.4, 16 Гц, 1H), 4.43 (dd, J = 1.2, 6.4 Гц, 2Н), 2.69 (dd, J = 13.2, 28 Гц, 2Н), 1.30-1.50 (m, 7H), 1.10 (s, 3H), 0.89 (t, J = 7.2 Гц, 3Н).
Стадия 3: Восстановление (E)-2-(3-(3-(2-гидрокси-2-метилгексил) фенил)аллил)изоиндолин-1,3-диона с последующей флэш хроматографией (градиент 0-40% этилацетат/гексаны) позволило получить 2-(3-(3-(2-гидрокси-2-метилгексил)фенил)пропил)изоиндолин-1,3-диона в виде бесцветного масла. Выход (0.43 г, 65%):1H ЯМР (400 МГц, СDСl3) δ 7.78-7.84 (m, 2H), 7.66-7.72 (m, 2H), 7.16 (t, J = 8.0 Гц, 1H), 7.04-7.08 (m, 2H), 6.95-6.99 (m, 1H), 3.72 (t, J = 7.2 Гц, 2H), 2.62-2.76 (m, 4H), 2.03 (quint, J = 7.6 Гц, 2H), 1.25-1.50 (m, 7H), 1.12 (s, 3H), 0.91 (t, J = 7.2 Гц, 3Н).
Стадия 4: Снятие защиты 2-(3-(3-(2-гидрокси-2-метилгексил)фенил) пропил)изоиндолин-1,3-диона с последующей флэш хроматографией (градиент 0-10% (7N МН3/МеОН)/этилацетат) позволило получить Пример 121 в виде бесцветного масла. Выход (0.144 г, 85%):1H ЯМР (400 МГц, СDСl3) δ 7.18-7.24 (m, 1H), 7.00-7.08 (m, 3H), 2.68-2.78 (m, 4H), 2.60-2.68 (m, 2H), 1.71-1.80 (m, 2H), 1.24-1.50 (m, 9H), 1.12 (s, 3Н), 0.91 (t, J = 7.2 Гц, 3Н). ESI MS m/z 250.3 [m+Н]+, 232.3 [m+Н-Н2О]
ПРИМЕР 122
Приготовление 3-(3-(4-метоксибутил)фенил)пропан-1-амина

33-(3-(4-метоксибутил)фенил)пропан-1-амин был приготовлен согласно способу, который использовали в Примере 76.
Стадия 1: Реакция Соногаширу бромида 57 с 4-метоксибут-1-ине позволило получить трет-бутил 3-(3-(4-метоксибут-1-инил)фенил)пропилкарбамат в виде желтого масла. Выход (0.83 г, 77%):1H ЯМР (400 МГц, СDСl3) δ 7.22-7.25 (m, 2H), 7.16-7.21 (m, 1H), 7.09 (d, J = 7.6 Гц, 1H), 4.51 (bs, 1H), 3.60 (t, J = 7.8 Гц, 2H), 3.41(s, 3Н), 3.10-3.16 (m, 2H), 2.69 (t, J = 7.0 Гц, 2H), 2.59 (t, J = 7.6 Гц, 2H), 1.76-1.84 (m, 2H), 1.44 (s, 9H).
Стадия 2: Восстановление трет-бутил 3-(3-(4-метоксибут-1-инил)фенил)пропилкарбамата позволило получить трет-бутт 3-(3-(4-метоксибутил)фенил)пропилкарбамат в виде желтого масла. Выход (0.81 г, 83%):1Н ЯМР (400 МГц, CDCl3) δ 7.16-7.20 (m, 1H), 6.97-7.02 (m, 3Н), 4.53 (bs, 1H), 3.39 (t, J = 6.4 Гц, 2H), 3.32 (s, 3Н), 3.10-3.17 (m, 2H), 2.58-2.64 (m, 4H), 1.76-1.84 (m, 2H), 1.59-1.70 (m, 4H), 1.44(s, 9H).
Стадия 3: Снятие ВОС-защиты трет-бутил 3-(3-(4-метоксибутил)фенил)пропилкарбамата позволило получить Пример 122 гидрохлорид в виде грязно-белого твердого вещества. Выход (0.615 г, 96%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.16-7.19 (m, 1H), 6.99-7.02 (m, 3Н), 3.29 (t, J = 6.2 Гц, 2H), 3.18 (s, 3Н), 2.76 (t, J = 7.6 Гц, 2Н), 2.58 (t, J = 7.6 Гц, 2Н), 2.54 (t, J = 7.4 Гц, 2Н), 1.77-1.83 (m, 2H), 1.50-1.59 (m, 2H), 1.44-1.49 (m, 2H).13С ЯМР (100 МГц, ДМСО-d6) δ 142.7, 141.3, 128.8, 128.7, 126.4, 126.1, 72.1, 58.3, 38.8, 35.3, 32.3, 29.2, 29.1, 28.1. MS: 222 [M+1]+.
ПРИМЕР 123
Приготовление 3-(3-(2-аминоэтокси)фенил)-1-фенилпропан-1-ола

3-(3-(2-аминоэтокси)фенил)-1-фенилпропан-1-ол был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с 1-фенилпроп-2-ин-1-олом позволила получить 2,2,2-трифтор-N-(2-(3-(3-гидрокси-3-фенилпроп-1-инил)фенокси)этил)ацетамид в виде коричневого масла. Выход (0.55 г, 47%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.61 (d, J = 7.2 Гц, 1Н), 7.30-7.41 (m, 5H), 7.13-7.16 (m, 1H), 7.06 (s, 1H), 6.89 (dd, J = 8.4, 2.4 Гц, 1Н), 5.69 (d, J = 6.0 Гц, 1H), 4.10 (t, J = 5.2 Гц, 2H), 3.77-3.81 (m, 2H), 2.26 (d, J = 6.0 Гц, 1H).
Стадия 2: Восстановление 2,2,2-трифтор-N-(2-(3-(3-гидрокси-3-фенилпроп-1-инил)фенокси)этил)ацетамида позволило получить 2,2,2-трифтор-N-(2-(3-(3-гидрокси-3-фенилпропил)фенокси)этил)ацетамид в виде желтого масла. Выход (0.45 г, 80%). MS: 366 [M-1].
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(2-(3-(3-гидрокси-3-фенилпропил)фенокси)этил)ацетамида позволило получить Пример 123 в виде грязно-белого полутвердого вещества. Выход (0.233 г, 73%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.31-7.35 (m, 4Н), 7.20-7.27 (m, 1H), 7.14-7.19 (m, 1H), 6.71-6.75 (m, 3Н), 5.25 (d, J = 4.4 Гц, 1H), 4.49-4.54 (m, 1H), 3.87 (t, J = 5.8 Гц, 2H), 2.84 (t, J = 5.8 Гц, 2H), 2.50-2.66 (m, 2H), 1.820-1.90 (m, 2H), 1.52-1.60 (m, 2H).13С ЯМР (100 МГц, ДМСО-d6) δ 159.2, 146.6, 144.1, 129.7, 128.5, 127.1, 126.3, 120.9, 114.9, 112.1, 72.1, 70.4, 41.5, 41.4, 40.6, 32.1. MS: 272 [M+1]+
ПРИМЕР 124
Приготовление 3-амино-1-(3-(3-гидрокси-3-фенилпропил)фенил)пропан-1-ола

3-амино-1-(3-(3-гидрокси-3-фенилпропил)фенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Реакция Соногашира 43 с 1-фенилпроп-2-ин-1-олом позволила получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-фенилпроп-1-инил)фенил) пропил)ацетамид в виде коричневого масла. Выход (0.408 г, 80%). Соединение использовали в таком виде для следующего превращения.
Стадия 2: Восстановление 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-фенилпроп-1-инил)фенил)пропил)ацетамида позволило получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-фенилпропил)фенил)пропил)ацетамид в виде желтого масла. Выход (0.365 г, 91%). Соединение использовали в таком виде для следующего превращения.
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-фенилпропил)фенил)пропил)ацетамида и последующая очистка флэш хроматографией (градиент 0-10% MeOH-NH3 (9.5:0.5)-DCM) позволила получить Пример 124 в виде бледно-желтого масла. Выход (0.20 г, 74%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.30-7.33 (m, 4Н), 7.20-7.25 (m, 2H), 7.13 (s, 1H), 7.13 (d, J = 8.0 Гц, 1Н), 7.08 (d, J = 8.0 Гц, 1Н), 5.28 (d, J = 4.4 Гц, 1Н), 4.62 (t, J = 7.2 Гц, 1Н), 4.52-4.63 (m, 1Н), 2.79-2.87 (m, 2H), 2.50-2.59 (m, 2H), 1.79-1.89 (m, 4Н).13С ЯМР (100 МГц, ДМСО-d6) δ 146.6, 145.7, 142.4, 128.6, 128.5, 127.4, 127.1, 126.2, 125.9, 123.4, 72.2, 70.3, 41.6, 37.1, 32.1. MS: 286 [M+1]+.
ПРИМЕР 125
Приготовление 3-(3-(2-аминоэтокси)фенил)пропан-1-ола

3-(3-(2-аминоэтокси)фенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 64.
Стадия 1: Реакция Соногашира бромида 19 с пропаргиловым спиртом позволила получить 2,2,2-трифтор-N-(2-(3-(3-гидроксипроп-1-инил)фенокси) этил)ацетамид в виде коричневого масла. Выход (1.0 г, 43%). Сырой продукт использовали непосредственно на следующей стадии.
Стадия 2: Восстановление 2,2,2-трифтор-N-(2-(3-(3-гидроксипроп-1-инил)фенокси)этил)ацетамида позволило получить 2,2,2-трифтор-N-(2-(3-(3-гидроксипропил) фенокси)этил)ацетамид в виде желтого масла. Выход (0.563 г, 91%). MS: 290 [M-1].
Стадия 3: Снятие защиты 2,2,2-трифтор-N-(2-(3-(3-гидроксипропил) фенокси)этил)ацетамида позволило получить Пример 125 в виде желтого масла. Выход (0.21 г, 56%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.14-7.19 (m, 1Н), 6.72-6.77 (m, 3Н), 3.94 (t, J = 5.6 Гц, 2H), 3.38 (t, J = 6.4 Гц, 2H), 2.91 (t, J = 5.6 Гц, 2H), 2.55 (t, J = 7.8 Гц, 2H), 1.64-1.72 (m, 2H).13С ЯМР (100 МГц, ДМСО-d6) δ 158.5, 143.8, 129.2, 120.7, 114.6, 111.6, 68.3, 60.1, 40.1, 34.2, 31.7. MS: 210 [M+1]+.
ПРИМЕР 126
Приготовление 5-(3-(3-аминопропил)фенил)-N,N-диметилпентанамида

5-(3-(3-аминопропил)фенил)-N,N-диметилпентанамид был приготовлен согласно способу, который использовали в Примере 76.
Стадия 1: Реакция Соногашира бромида 57 с N,N-диметилпент-4-инамидом позволило получить трет-бутил. 3-(3-(5-(метиламино)-5-оксопент-1-инил)фенил) пропилкарбамат. Выход (1.10 г, сырой).
Стадия 2: Восстановление трет-бутил 3-(3-(5-(метиламино)-5-оксопент-1-инил)фенил)пропилкарбамата позволило получить трет-бутил 3-(3-(5-(диметиламино)-5-оксопентил)фенил)пропилкарбамат в виде желтого масла. Выход (0.2 г, 96%):1Н ЯМР (400 МГц, CDCl3) δ 7.15-7.20 (m, 1Н), 6.97-7.01 (m, 3Н), 4.59 (bs, 1H), 3.10-3.17 (m, 2H), 2.98 (s, 3Н), 2.88 (s, 3Н), 2.58-2.64 (m, 4H), 2.32 (t, J = 6.6 Гц, 2H), 1.52-1.78 (m, 6H), 1.44 (s, 9H).
Стадия 3. Снятие ВОС-защиты трет-бутил 3-(3-(5-(диметиламино)-5-оксопентил)фенил)пропилкарбамата позволило получить 5-(3-(3-аминопропил)фенил)-N-N-диметил пентанамид гидрохлорид. Нейтрализация конц. аммиаком с последующей очисткой флэш хроматографией (градиент (0-10%) MeOH:DCM) позволило получить Пример 126 в виде желтого масла. Выход (0.09 г, 66%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.13-7.17 (m, 1H), 6.96-6.99 (m, 3Н), 2.91 (s, 3Н), 2.77 (s, 3Н), 2.50-2.56 (m, 6H), 2.26 (t, J = 7.2 Гц, 2H), 1.60-1.66 (m, 6H), 1.43-1.59 (m, 4H).13С ЯМР (100 МГц, ДМСО-d6) δ 172.7, 142.5, 128.7, 128.6, 126.0, 37.2, 35.4, 35.2, 33.0, 32.6, 31.1, 24.8. MS: 263 [M+1]+.
ПРИМЕР 127
Приготовление 4-(3-(4-аминобутил)фенетил)гептан-4-ола

24-(3-(4-аминобутил)фенетил)гептан-4-ол был приготовлен согласно способу, показанному на Схеме 22.
Схема 22
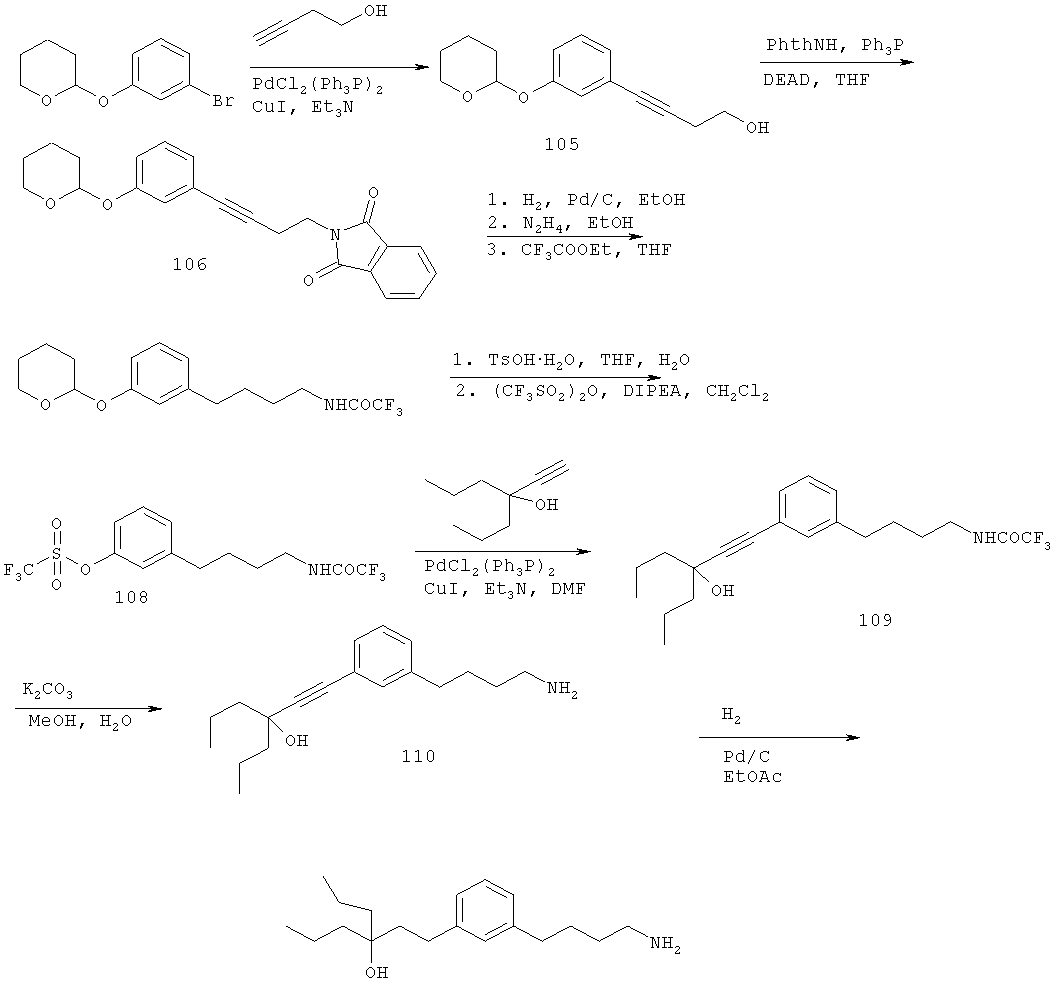
Стадия 1. Реакция Соногашира 3-тетрагидропиранилбромфенола и 3-бутин-1-ола проподили согласно способу, который использовали в Примере 13, за исключением того, что реакционную смесь нагревали при 90°С в течение 18 ч. Очистка флэш хроматографией (градиент от 30% до 100% EtOAc-гексаны) позволила получить спирт 105 в виде оранжевого масла. Выход (2.46 г, 85%);1Н ЯМР (400 МГц, ДМСО-d6) δ 7.22 (t, J = 8.0 Гц, 1Н), 6.93-7.01 (m, 3Н), 5.45 (t, J = 3.2 Гц, 1Н), 4.86 (t, J = 5.6 Гц, 1Н), 3.66-3.75 (m, 1Н), 3.48-3.58 (m, 3Н), 2.51 (t, J = 6.4 Гц, 2Н), 1.64-1.90 (m, 3Н), 1.44-1.64 (m, 3Н).
Стадия 2: Диэтилазодикарбоксилат (1.195 г, 6.86 ммоль) добавляли в атмосфере аргона в перемешанный раствор спирта 105 (39 г, 5.64 ммоль), фталимида (0.90 г, 6.12 ммоль) и трифенилфосфина (1.64 г, 6.25 ммоль) в безводном THF. Реакционную смесь перемешивали при комнатной температуре в течение 20 мин и концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент от 10% до 40% этилацетат/гексаны) позволила получить фталимид 106 в виде бесцветного масла. Выход (1.77 г, 84%):1Н ЯМР (400 МГц, CDCl3) δ 7.82-7.88 (m, 2H), 7.68-7.73 (m, 2H), 7.14 (t, J = 8.0 Гц, 1H), 7.02-7.04 (m, 1H), 6.92-6.97 (m, 2H), 5.36 (t, J = 3.1 Гц, 1Н), 3.95 (t, J = 7.2 Гц, 2H), 3.87 (ddd, J = 3.13, 9.6, 14.5 Гц, 1H), 3.58 (dtd, J = 1.2, 4.1, 11.2 Гц, 1H), 2.80 (t, J = 7.2 Гц, 2H), 1.92-2.05 (m, 1H), 1.78-1.85 (m, 2H), 1.52-1.73 (m, 3H).
Стадия 3: Раствор бутинилфталимида 106 (1.00 г, 2.66 ммоль) в ЕЮН (абс, 50 мл) дегазировали потоком пузырьков аргона в течение 3 мин. В реакционную смесь добавляли палладий на углероде (10%, 0.102 г), после чего дегазировали потоком пузырьков аргона в течение 30 сек и затем применением вакуум/Н2 три раза. Реакционную смесь перемешивали в атмосфере водорода в течение 45 мин и фильтровали. Фильтрат непосредственно использовали на следующей стадии.
Снятие защиты гидразин моногидратом согласно способу, который использовали в Примере 12, за исключением того, что реакционную смесь нагревали при +50°С в течение 16 ч, позволило получить 4-(3-(тетрагидро-2H-пиран-2-илокси)фенил)бут-3-ин-1-амин в виде бесцветного масла, которое использовали на следующей стадии без очистки.
Защита 4-(3-(тетрагидро-2H-пиран-2-илокси)фенил)бут-3-ин-1-амина этилтрифторацетатом согласно способу, который использовали в Примере 19, за исключением того, что реакцию проводили в THF, позволила получить трифторацетамид 107 в виде бесцветного масла. Выход (0.72 г, 78% после трех стадий):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.37 (br.t, 1H), 7.12-7.18 (m, 1H), 6.75-6.83 (m 3H), 5.40 (t, J = 3.2 Гц, 1Н), 3.69-3.77 (m, 1H), 3.47-3.54 (m, 1H), 3.17 (q, J = 6.4 Гц, 2H), 2.52 (t, J = 7.2 Гц, 2Н), 1.63-1.90 (m, 3H), 1.40-1.62 (m, 7H).
Стадия 4: Смесь 107 (0.72 г, 2.08 ммоль) и моногидрата p-толуолсульфоновой кислоты (0.366 г) в THF:H2O (3:1, 20 мл) перемешивали при комнатной температуре в течение 3.5 ч. Реакционную смесь разделяли между водным NаНСО3-солевой раствор и EtOAc. Водный слой экстрагировали EtOAc. Объединенные органические слои отмывали солевым раствором и концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент от 10% до 50% EtOAc-гексаны) позволила получить 2,2,2-трифтор-N-(4-(3-гидроксифенил)бутил)ацетамид в виде бесцветного масла. Выход (0.438 г, 96%).
Раствор трифторметансульфонового ангидрида (0.32 мл, 1.90 ммоль) добавляли в перемешанный раствор 2,2,2-трифтор-N-(4-(3-гидроксифенил)бутил)ацетамида (0.438 г, 1.68 ммоль) и диизопропилэтиламина (0.5 мл, 2.87 ммоль) при 0°С в атмосфере аргона в безводном СН2Сl2. Реакционную смесь перемешивали при 0°С в течение 15 мин и концентрировали при пониженном давлении. Добавляли EtOAc в остаток и смесь отмывали солевым раствором, высушивали над безводным MgSO4, и фильтрат концентрировали при пониженном давлении для получения сырого трифлата 108 в виде светло коричневого масла, которое использовали на следующей стадии без дополнительной очистки. Выход (0.683 г, колич.):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.38 (brt, 1Н), 7.45 (t, J = 8.0 Гц, 1Н), 7.24-7.34 (m, 3H), 3.17 (q, 6.4 Гц, 2Н), 2.64 (t, J = 7.2 Гц, 2H), 1.40-1.60 (m, 4H).
Стадия 5: Реакция Соногашира трифлата 108 с 4-этинилгептан-4-олом согласно способу, который использовали в Примере 2, за исключением того, что реакция протекала в течение 15 ч, после очистки флэш хроматографией (градиент от 5% до 40% EtOAc-гексаны) позволила получить алкинол 109 в виде светло-коричневого масла. Выход (0.327 г, 51%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.38 (brt, 1Н), 7.20-7.34 (m, 1Н), 7.13-7.18 (m, 2H), 5.10 (s, 1Н), 3.17 (q, J = 6.4 Гц, 1Н), 2.54 (t, J = 7.2 Гц, 2H), 1.38-1.62 (m, 12H), 0.88 (t, J = 7.6 Гц, 6Н).
Стадия 6: Снятие защиты трифторацетамида 109 согласно способу, который использовали в Примере 19, за исключением того, что реакционную смесь перемешивали при 50°С в течение 3.5 ч, после очистки флэш хроматографией (10%-100% 7N NН3/МеОН/СН2Сl2-CH2Cl2) позволило получить амин 110 в виде белого твердого вещества. Выход (0.175 г, 71%);1Н ЯМР (400 МГц, CD3OD) δ 7.12-7.24 (m, 4H), 2.46-2.66 (m, 4H), 1.42-1.73 (m, 10Н), 1.43-1.42 (m, 2H), 0.97 (t, J = 7.2 Гц, 6Н);13С ЯМР (100 МГц, СD3OD), δ 142.8, 131.3, 128.8, 128.3, 128.2, 123.6, 91.9, 83.9, 70.9, 44.5, 41.2, 35.2, 32.2, 28.6, 17.6, 13.6; RP-HPLC tR=7.06 мин, 92.5% (AUC); LC-MS m/z=288.25 [M+H]+.
Стадия 7: Раствор алкина 110 (0.0446 г, 0.155 ммоль) в EtOAc (5 мл) дегазировали применением ваккум/аргон 2 раза. Затем в реакционную смесь добавляли Pd/C (10%, 0.0166 г), дегазировали применением вакуум/Н2 2 раза и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Фильтрация с последующей очисткой флэш хроматографией (градиент от 10% до 50% 20% 7N NH3/MeOH/CH2Cl2-СН2Сl2) позволила получить Пример 127 в виде бесцветного масла. Выход (0.0321 г, 71%);1Н ЯМР (400 МГц, CD3OD) δ 7.13 (t, J=7.6 Гц, 1Н), 6.95-7.01 (m, 3H), 2.52-2.67 (m, 6H), 1.58-1.69 (m, 4H), 1.41-1.53 (m, 6Н), 1.30-1.40 (m, 4H), 0.93 (t, J = 7.2 Гц, 6Н); Преп. ВЭЖХ (Способ 2) tR=7.06 мин, 87.4% (AUC); LC-MS m/z=288.25 [M+H]+.
ПРИМЕР 128
Приготовление (1S,2S)-3-амино-1-(3-(2-(1-гидроксициклогексил)этил)фенил)пропан-1,2-диола

(1S,2S)-3-амино-1-(3-(2-(1-гидроксициклогексил)этил)фенил)пропан-1,2-диол был приготовлен согласно способу, показанному на Схеме 23.
Схема 23
Стадия 1: В ледяной раствор 3-бромбензальдегида (30) (3.9 мл, 33.30 ммоль) в безводном дихлорметане (100 мл) добавляли (карбэтоксиметилен)трифенилфосфоран (11.65 г, 33.44 ммоль). Реакционную смесь перемешивали при 0°С в течение 5 мин, затем оставляли нагреваться до комнатной температуры в течение 30 мин и концентрировали при пониженном давлении. Остаток суспендировали в 5% EtOAc/гексаны, перемешивали в течение 10 мин при комнатной температуре и затем фильтровали. Фильтрационный кек отмывали гексанами и фильтрат концентрировали при пониженном давлении. Очистка остатка флэш колоночной хроматографией (силикагель, градиент гексаны-10% ЕtOАс/гексаны) позволила получить аллиловый эфир 111 в виде белого твердого вещества. Выход (7.63 г, 90%).1Н ЯМР (400 МГц, ДМСО-d6) δ 7.95 (t, J = 1.8 Гц, 1Н), 7.70-7.72 (m, 1Н), 7.59 (d, J = 16.4 Гц, 1Н), 7.58 (ddd, J = 1.0, 2.0, 8.0 Гц, 1Н), 7.35 (t, J = 7.8 Гц, 1Н), 6.69 (d, J = 16.0 Гц, 1Н), 4.17 (q, J = 7.2 Гц, 2Н), 1.23 (t, J = 7.0 Гц, 3Н).
Стадия 2: Раствор диизобутил алюминия гидрида (DIBAL-H, 60 мл 1.0 М раствора в CH2Cl2, 60.0 ммоль) добавляли в ледяной раствор эфира 111 (0.63 г, 29.9 ммоль) в диэтиловом эфире (100 мл). Реакционную смесь перемешивали при 0°С в течение 30 мин, после чего добавляли водный раствор NaHSO4 (2M, 42 мл) и полученную смесь перемешивали в течение 1.5 ч при нагревании до комнатной температуры. Добавляли безводный раствор MgSO4 в перемешанную реакционную смесь и через 30 мин смесь фильтровали, после чего фильтрационный кек тщательно отмывали EtOAc. Фильтрат концентрировали при пониженном давлении для получения спирта 112 в виде бесцветного масла. Выход (6.42 г, колич.).1Н ЯМР (400 МГц, ДМСО-d6) δ 7.60 (t, J = 1.8 Гц, 1Н), 7.40 (dt, J = 1.2, 7.6 Гц, 1Н), 7.38 (ddd, J = 1.0, 2.0, 8.0 Гц, 1Н), 7.25 (t, J = 7.6 Гц, 1Н), 6.48-6.54 (m, 1Н), 6.43 (dt, J = 4.3, 16.0 Гц, 1Н), 4.88 (t, J = 5.5 Гц, 1Н), 4.08-4.12 (m, 2Н)
Стадия 3: Уксусный ангидрид (1.2 мл, 12.7 ммоль) добавляли в перемешанный раствор спирта 112 (2.535 г, 11.90 ммоль), Et3N (2.0 мл, 14.3 ммоль) и DMAP (0.141 г, 1.15 ммоль) в безводном СН2Сl2. Реакционную смесь перемешивали при комнатной температуре в течение 30 мин и концентрировали при пониженном давлении. Очистка флэш колоночной хроматографией (силикагель, градиент от 5% до 20% ЕtOАс/гексаны) позволила получить ацетат 113 в виде бесцветного масла. Выход (2.71 г, 89%).1H ЯМР (400 МГц, ДМСО-d6) δ 7.66 (t, J = 1.8 Гц, 1Н), 7.40-7.46 (m, 2Н), 7.27 (t, J = 7.8 Гц, 1Н), 6.58-6.65 (m, 1Н), 6.42 (dt, J = 5.9, 16.0 Гц, 1Н), 4.66 (dd, J = 1.4, 5.9 Гц, 1Н), 2.04 (s, 3Н).
Стадия 4: Смесь аллилацетата 113 (0.71 г, 10.6 ммоль), азида натрия (0.787 г, 12.1 ммоль), воды (20 мл) и THF (50 мл) дегазировали потоком пузырьков аргона в течение 3 мин. Трис-дибензилиденацетонил-бис-палладий-хлорофорный аддукт (0.158 г, 0.17 ммоль) и дифенилфосфиноферрацен (0.1773 г, 0.32 ммоль) добавляли в реакционную смесь. Воздух откачивали применением 3 раза вакуум/аргон и затем реакционную смесь нагревали при 60°С в атмосфере аргона в течение 4 ч. Реакционную смесь концентрировали при пониженном давлении, в остаток добавляли воду и продукт экстрагировали дважды гексанами. Объединенные слои гексанов отмывали насыщенным солевым раствором, высушивали безводным MgS04, фильтровали и фильтрат концентрировали при пониженном давлении. Очистка остатка флэш колоночной хроматографией (силикагель, градиент от 5% до 30% EtOAc/гексаны) позволила получить азид 114 в виде бесцветного масла. Выход (1.90 г, 75%).1Н ЯМР (400 МГц, ДМСО-d6) δ 7.69 (t, J = 1.8 Гц, 1H), 7.42-7.48 (m, 2H), 7.28 (t, J = 7.8 Гц, 1Н), 6.62-6.68 (m, 1H), 6.45 (dt, J = 6.3, 15.8 Гц, 1H), 4.02 (dd, J = 1.2, 6.3 Гц, 1H).
Стадия 5: В круглую колбу с плоским дном емкостью 100 мл помещали Н2O (19 мл) и трет-BuОН. (19 мл) с последующим AD-mix-β (5.61 г). Смесь перемешивали при комнатной температуре в течение 10 мин, после чего добавляли MeSO2NH2 (0.36 г, 3.79 ммоль). Реакционную смесь охлаждали до 0°С, добавляли аллилазид 114 (0.90 г, 3.78 ммоль) и реакционную смесь перемешивали при 0°С в течение 24 ч. Добавляли Na2S2O3 (6.30 г) и смесь перемешивали еще один час, после чего добавляли EtOAc (50 мл) с последующим насыщенным раствором NaCl (50 мл). Слои разделяли и водный слой экстрагировали EtOAc (3×25 мл). Объединенные органические слои отмывали солевым раствором (50 мл), высушивали над безводным MgSO4 и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали флэш колоночной хроматографией (силикагель, градиент от 10% до 90% ЕtOАс/гексаны) для получения азидодиола 115 в виде густого бесцветного масла. Выход (1.02 г, 99%).1Н ЯМР (400 МГц, ДМСО-d6) δ 7.50 (t, J = 1.6 Гц, 1H), 7.40 (ddd, J = 1.2, 2.0, 7.6 Гц, 1H), 7.29-7.33 (m, 1H), 7.25 (t, J = 7.6 Гц, 1H), 5.52 (d, J = 5.1 Гц, 1H), 5.26 (d, J = 5.9 Гц, 1H), 4.51 (t, J = 4.7 Гц, 1H), 3.15 (dd, J = 3.3,12.5 Гц, 1H), 3.02 (dd, J = 8.0,12.7 Гц, 1H).
Стадия 6: Смесь азидодиола 115 (0.826 г, 3.037 ммоль), трифенилфосфина (0.84 г, 3.20 ммоль), THF (10 мл), воды (0.2 мл) и этилтрифторацетата (1 мл) нагревали при 50°С в течение 5 ч и затем концентрировали при пониженном давлении. Очистка остатка флэш колоночной хроматографией (силикагель, градиент от 20% до 90% ЕЮАс/гексаны) позволила получить трифторацетамид 116 в виде белого твердого вещества. Выход (0.73 г, 70%).1Н ЯМР (400 МГц, ДМСО-d6) δ 9.21 (t, J = 5.3 Гц, 1H), 7.52 (t, J = 1.6 Гц, 1H), 7.40 (ddd, J = 1.2, 2.0, 7.8 Гц, 1H), 7.30-7.33 (m, 1H), 7.25 (t, J = 7.6 Гц, 1H), 5.48 (d, J = 5.1 Гц, 1H), 5.00 (d, J = 5.9 Гц, 1H), 4.51 (t, J = 4.7 Гц, 1H), 3.70-3.76 (m, 1H), 3.24 (dt, J = 4.9, 13.3 Гц, 1H), 2.98 (ddd, J = 5.7, 8.8, 13.3 Гц, 1Н).
Стадия 7: Смесь алкена 116 (0.116 г, 0.922 ммоль), бромида 117 (0.242 г, 0.708 ммоль), тетрабутиламмония ацетата (1.19 г) и Pd(OAc)2 (0.029 г, 0.127 ммоль) нагревали в атмосфере аргона при 90°С в течение 5 ч. Воду и солевой раствор добавляли в реакционную смесь, которую экстрагировали три раза EtOAc. Объединенные органические слои отмывали солевым раствором, высушивали над безводным MgS04 и концентрировали при пониженном давлении. Очистка флэш колоночной хроматографией (силикагель, градиент от 20% до 70% ЕtOАс/гексаны) позволила получить алкен 118 в виде белой пены. Выход (0.2128 г, 78%).1Н ЯМР (400 МГц, ДМСО-d6) δ 9.19 (t, J = 5.3 Гц, 1Н), 7.35-7.37 (m, 1H), 7.20-7.26 (m, 2H), 7.13-7.18 (m, 1H), 6.51 (d, J = 16.2 Гц, 1Н), 6.33 (d, J = 16.0 Гц, 1H), 5.33 (d, J = 4.9 Гц, 1H), 4.94 (d, J = 5.7 Гц, 1H), 4.46 (t, J = 4.8 Гц, 1H), 4.41 (s, 1H), 3.70-3.76 (m, 1H), 3.18 (dt, J = 4.5,13.3 Гц, 1H), 2.99 (ddd, J = 6.1, 8.8, 14.3 Гц, 1H), 1.54-1.66 (m, 2H), 1.36-1.54 (m, 7H), 1.18-1.26 (m, 1H).
Стадия 8: Снимали защиту N-((2S,3S)-2,3-дигидрокси-3-(3-((E)-2-(1-гидроксициклогексил)винил)фенил)пропил)-2,2,2-трифторацетамида (118) согласно способу, который использовали в Примере 19, за исключением того, что использовали три эквивалента К2СО3 в смеси МеОН:Н2О (2:1) и реакционную смесь нагревали при 50°С в течение 5 ч. После завершения реакции реакционную смесь концентрировали при пониженном давлении, ресуспендировали в ЕtOАс/ЕtOН и очищали флэш хроматографией с использованием градиента 50% 7N NН3/МеОН в ЕtOАс/гексаны для получения алкена 119 в виде бесцветного масла. Выход (0.118 г, 74%).1Н ЯМР (400 МГц, МеОН-d6) δ 7.42-7.44 (m, 1H), 7.30 (dt, J = 1.6, 7.6 Гц, 1H), 7.27 (t, J = 7.4 Гц, 1H), 7.21 (dt, J = 1.6, 7.2 Гц, 1H), 6.60 (d, J = 16.0 Гц, 1H), 6.36 (d, J = 16.0 Гц, 1H), 4.50 (d, J = 5.9 Гц, 1H), 3.62-2.70 (m, 1H), 2.51-2.58 (m, 2H), 1.66-1.77 (m, 2H), 1.48-1.66 (m, 7H), 1.28-1.40 (m, 1H);13С ЯМР (100 МГц, МеОН-d6) δ 142.3, 137.9, 137.7, 128.3, 126.7, 125.7, 125.6, 124.6, 76.0, 75.8, 71.2, 43.6, 37.5, 25.5, 21.9, 20.9; Преп-ВЭЖХ (Способ 1) tR=4.73 мин, 97% (AUC); ESI MS m/z 292.3 [M+H]+.
Стадия 9: Раствор алкена 119 (0.0612 г, 0.21 ммоль) в ЕtOН (абс, 9 ел) дегазировали применением вак/аргон 2 раза. Затем в реакционную смесь добавляли Pd/C (10%, 0.0139 г), дегазировали применением вак/ Нз два раза и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении для получения Примера 128 в виде бесцветного масла. Выход (0.0454 г, 74%);1Н ЯМР (400 МГц, CD3OD) δ 7.20-7.25 (m, 2H), 7.13-7.17 (m, 1H), 7.09-7.12 (m, 1H), 4.45 (d, J = 6.3 Гц, 1H), 3.64 (q, J = 6.1 Гц, 1H), 2.64-2.69 (m, 2H), 2.52 (d, J = 5.9 Гц, 2H), 1.40-1.73 (m, 12H), 1.26-1.38 (m, 2H); Преп-ВЭЖХ (Способ 2) tR=5.13 мин, 92.2% (AUC); ESI MS m/z=294.46 [М+Н]+.
ПРИМЕР 129
Приготовление (1R,2R)-3-амино-1-(3-(2-(1-гидроксициклогексил)этил)фенил)пропан-1,2-диола

(1R,2R)-3-амино-1-(3-(2-(1-гидроксициклогексил)этил)фенил)пропан-1,2-диол был приготовлен согласно способу, который использовали в Примере 128:
Стадия 1: Дигидроксилирование аллилазида 114 выполняли с использованием AD-mix-α для получения (1R,2R)-3-азидо-1-(3-бромфенил)пропан-1,2-диола. Выход (0.966 г, 96%).1H ЯМР (400 МГц, ДМСО-d6) δ 7.50 (t, J = 1.6 Гц, 1Н), 7.40 (ddd, J = 1.2, 2.0, 7.6 Гц, 1Н), 7.29-7.33 (m, 1Н), 7.25 (t, J = 7.6 Гц, 1Н), 5.52 (d, J = 5.1 Гц, 1Н), 5.26 (d, J = 5.9 Гц, 1Н), 4.51 (t, J = 4.7 Гц, 1Н), 3.15 (dd, J = 3.3, 12.5 Гц, 1Н), 3.02 (dd, J = 8.0, 12.7 Гц, 1Н).
Стадия 2: Восстановление и защита (1R,2R)-3-азидо-1-(3-бромфенил)пропан-1,2-диола позволила получить N-((2R,3R)-3-(3-бромфенил)-2,3-дигидроксипропил)-2,2,2-трифторацетамид в виде белого твердого вещества. Выход 0.66 г, 69%).1H ЯМР (400 МГц, ДМСО-d6) δ 9.21 (t, J = 5.3 Гц, 1Н), 7.52 (t, J = 1.6 Гц, 1Н), 7.40 (ddd, J = 1.2, 2.0, 7.8 Гц, 1Н), 7.30-7.33 (m, 1Н), 7.25 (t, J = 7.6 Гц, 1Н), 5.48 (d, J = 5.1 Гц, 1Н), 5.00 (d, J = 5.9 Гц, 1Н), 4.51 (t, J = 4.7 Гц, 1Н), 3.70-3.76 (m, 1Н), 3.24 (dt, J = 4.9, 13.3 Гц, 1Н), 2.98 (ddd, J = 5.7, 8.8, 13.3 Гц, 1Н).
Стадия 3: Взаимодействие N-((2R,3R)-3-(3-бромфенил)-2,3-дигидроксипропил)-2,2,2-трифторацетамида с олефином 117 позволило получить N-((2R,3R)-2,3-дигидрокси-3-(3-((E)-2-(1-гидроксициклогексил)винил)фенил)пропил)-2,2,2-трифторацетамид в виде коричневатой пены. Выход (0.1958 г, 82%).1H ЯМР (400 МГц, ДМСО-d6) δ 9.19 (t, J = 5.3 Гц, 1Н), 7.35-7.37 (m, 1Н), 7.20-7.26 (m, 2H), 7.13-7.18 (m, 1Н), 6.51 (d, J = 16.2 Гц, 1Н), 6.33 (d, J = 16.0 Гц, 1Н), 5.33 (d, J = 4.9 Гц, 1Н), 4.94 (d, J = 5.7 Гц, 1Н), 4.46 (t, J = 4.8 Гц, 1Н), 4.41 (s, 1Н), 3.70-3.76 (m, 1Н), 3.18 (dt, J = 4.5, 13.3 Гц, 1Н), 2.99 (ddd, J = 6.1, 8.8, 14.3 Гц, 1Н), 1.54-1.66 (m, 2H), 1.36-1.54 (m, 7H), 1.18-1.26 (m, 1H).
Стадия 4: Снятие защиты N-((2R,3R)-2,3-дигидрокси-3-(3-((E)-2-(1-гидроксициклогексил)винил)фенил)пропил)-2,2,2-трифторацетамида позволило получить (1R,2R)-3-амино-1-(3-((E)-2-(1-гидроксициклогексил)винил)фенил)пропан-1,2-диол в виде бесцветного масла. Выход (0.16 г, колич.).1Н ЯМР (400 МГц, МеОН-d4) δ 7.42-7.44 (m, 1Н), 7.30 (dt, J = 1.6, 7.6 Гц, 1Н), 7.27 (t, J = 7.4 Гц, 1Н), 7.21 (dt, J = 1.6, 7.2 Гц, 1Н), 6.60 (d, J = 16.0 Гц, 1Н), 6.36 (d, J = 16.0 Гц, 1Н), 4.50 (d, J = 5.9 Гц, 1Н), 3.62-2.70 (m, 1Н), 2.51-2.58 (m, 2H), 1.66-1.77 (m, 2H), 1.48-1.66 (m, 7H), 1.28-1.40 (m, 1Н).13С ЯМР (100 МГц, MeOH-d4) δ 142.3, 137.9, 137.7, 128.3, 126.7, 125.7, 125.6, 124.6, 76.0, 75.8, 71.2, 43.6, 37.5, 25.5, 21.9, 20.9. ESI MS m/z 292.3 [М+Н]+; ВЭЖХ (Способ 1) 96% (AUC), tR - 4.73 мин.
Способ 5: Гидрирование (1R,2R)-3-амино-1-(3-((E)-2-(1-гидроксициклогексил)винил)фенил)пропан-1,2-диола позволила получить Пример 129 в виде бесцветного масла. Выход (0.0380 г, 77%);1H ЯМР (400 МГц, CD3OD) δ 7.20-7.25 (m, 2H), 7.13-7.17 (m, 1Н), 7.09-7.12 (m, 1Н), 4.45 (d, J = 6.3 Гц, 1Н), 3.64 (q, J = 6.1 Гц, 1Н), 2.64-2.69 (m, 2H), 2.52 (d, J = 5.9 Гц, 2H), 1.40-1.73 (m, 12H), 1.26-1.38 (m, 2H); Преп-ВЭЖХ (Способ 2) tR=5.17 мин, 94.4% (AUC); ESI MS m/z=294.46 [M+H]+.
ПРИМЕР 130
Приготовление (1S,2S)-3-амино-1-(3-(2-(1-гидроксициклогексил)этил)фенил)пропан-1,2-диола

(1S,2S)-3-амино-1-(3-(2-(1-гидроксициклогексил)этил)фенил)пропан-1,2-диол был приготовлен согласно способу, показанному на Схеме 24.
Схема 24
Стадия 1: Свежеприготовленный раствор магнийбромвинила (30.0 мл 1.0 М раствора в THF, 30 ммоль) медленно добавляли в атмосфере аргона в ледяной раствор 3-бромбензальдегида (30) (3.2 мл, 27.3 ммоль) в безводном диэтиловом эфире (50 мл). Реакционную смесь перемешивали при 0°С в течение 20 мин, после чего добавляли водный раствор NH4Cl (25%, 50 мл). Смесь оставляли нагреваться до комнатной температуры, слои разделяли и водный слой экстрагировали гексаном. Объединенные органические слои отмывали солевым раствором, концентрировали при пониженном давлении и очищали флэш колоночной хроматографией (силикагель, градиент от 5% до 300% EtOAc/гексаны) для получения аллилового спирта 120 в виде бесцветного масла. Выход (4.22 г, 73%).1H ЯМР (400 МГц, ДМСО-d6) δ 7.47-7.49 (m, 1H), 7.40 (dt, J = 1.8, 7.4 Гц, 1H), 7.24-7.32 (m, 2H), 5.85-5.94 (m, 1H), 5.61 (d, J = 4.5 Гц, 1H), 5.24 (dt, J = 1.8, 17.0 Гц, 1H), 5.00-5.07 (m, 2H).
Стадия 2: В холодную смесь (-23°С) порошка 4А молекулярного сита (6.4 г) и тетраизопропоксида титана (5.5 мл, 18.8 ммоль) в безводном СН2Сl2 (110 мл) добавляли Диизопропил L-(+)-тартрат (DIPT, 4.7 мл, 22.49 ммоль) в инертной атмосфере. Реакционную смесь перемешивали при -20°С и в течение 5 мин добавляли раствор аллилового спирта 120 (4.0 г, 18.8 ммоль) в безводном СН2Сl2 (80 мл). После перемешивания реакционной смеси при -20°С в течение 30 мин добавляли раствор трет-бутил-гидропероксида (5.0-6.0 М в нонане, 2 мл, примерно 10.0 ммоль). Реакционную смесь перемешивали при -20°С в течение 7.5 ч, выдерживали при - 20°С в течение ночи, перемешивали при - 20°С еще в течение 7 ч и выдерживали при -20°С в течение 43 ч. В реакционную смесь добавляли водный раствор L-винной кислоты (10%, 110 мл), смесь перемешивали в течение 10 мин при комнатной температуре, затем добавляли насыщенный водный раствор Na2SO4 (20 мл). Смесь перемешивали тщательно в течение 1 ч при комнатной температуре, слои разделяли. Водный слой экстрагировали диэтиловым эфиром, затем EtOAc. Объединенные органические слои отмывали солевым раствором, высушивали над безводным NaSO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали флэш колоночной хроматографией (силикагель, градиент от 30% до 70% EtOAc/гексаны) для получения смеси эпоксида 121, DIPT (1:1 молярное соотношение) и непрореагировавшего соединения 120 в виде бесцветного масла. Посторная очистка флэш коночной хроматографией (силикагель, градиент от 5% до 10% ЕtOАс/СН2Сl2 позволила получить смесь эпоксида 121 и DIPT (1:0.85 молярное соотношение) в виде бесцветного масла, которое использовали на следующей стадии без дополнительной очистки. Выход (3.44 г, 85.6%);1H ЯМР (400 МГц, ДМСО-d6) δ 7.54 (t, J = 1.6 Гц, 1Н), 7.45 (ddd, J = 1.2, 2.0, 7.8 Гц, 1Н), 7.34-7.38 (m, 1H), 7.29 (t, J = 7.6 Гц, 1Н), 5.68 (d, J = 4.5 Гц, 1Н), 4.41 (t, J = 4.7 Гц, 1Н), 2.99-3.03 (m, 1Н), 2.69 (ABd, J = 5.5, 3.9 Гц, 1Н), 2.63 (ABd, J = 5.3, 2.7 Гц, 1Н).
Стадия 3: Раствор сырого эпоксида 121 (0.47 г, 0.803 ммоль), гидроксида аммония (25%, 5 мл) и NH3/MeOH (7N, 5 мл) перемешивали в сосуде для реакций под давлением при комнатной температуре в течение 20 ч и затем концентрировали при пониженном давлении. Остаток растворяли в МТВЕ:МеОН (1:1, 10 мл) и добавляли этилтрифторацетат (3.0 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, концентрировали при пониженном давлении и остаток очищали флэш колоночной хроматографией (силикагель, градиент от 30% до 60% EtOAc/гексаны) для получения трифторацетамида 122 в виде бесцветного масла. Выход (0.248 г, 66%);1H ЯМР (400 МГц, ДМСО-d6) δ 9.17 (br. t, 1Н), 7.51 (t, J = 1.8 Гц, 1Н), 7.40 (ddd, J = 1.2, 2.0, 7.9 Гц, 1Н), 7.30-7.33 (m, 1Н), 7.25 (t, J = 7.8 Гц, 1Н), 5.57 (d, J = 4.7 Гц, 1Н), 4.96 (d, J = 6.06 Гц, 1Н), 4.39 (t, J = 5.5 Гц, 1Н), 3.62-3.69 (m, 1Н), 3.38 (dt, J = 4.1, 13.7 Гц, 1Н), 3.05-3.13 (m, 1H).
Стадия 4: Взаимодействие бромида 122 с олефином 117 проводили согласно способу, который использовали в Примере 128, за исключением того, что использовали безводный дегазированный раствор DMF (1 мл) в качестве растворителя реакции, и реакционную смесь нагревали при 90°С в течение 3 ч, затем при 60°С в течение ночи. После добавления воды продукт экстрагировали EtOAc (3 раза) для получения олефина 123 в виде бесцветного масла. Выход (0.194 г, 70%);1Н ЯМР (400 МГц, ДМСО-d6) δ 9.14 (t, J = 5.7 Гц, 1Н), 7.35-7.39 (m, 1H), 7.19-7.25 (m, 2H), 7.13-7.18 (m, 1H), 6.51 (d, J = 16.0 Гц, 1H), 6.34 (d, J = 16.0 Гц, 1H), 5.41 (d, J = 4.5 Гц, 1H), 4.86 (d, J = 6.3 Гц, 1H), 4.39-4.43 (m, 2H), 3.66-3.73 (m, 1H), 3.37 (ddd, J = 3.3, 4.7, 13.3 Гц, 1H), 3.08-3.16 (m, 1H), 1.55-1.67 (m, 2H), 1.37-1.54 (m, 7H), 1.18-1.25 (m, 1H).
Способ 5: Смесь трифторацетамида 123 (0.189 г, 0.488 ммоль), NHs/MeOH (7N, 3.0 мл) и гидроксида аммония (10.0 мл) перемешивали при комнатной температуре в течение 68 ч и концентрировали при пониженном давлении. Остаток очищали флэш хроматографией с использованием граидента от 50% до 100% 7N NH3/MeOH в EtOAc/гексаны для получения сырого амина в виде бесцветного масла. Амин повторно очищали флэш хроматографией с использованием 20% 7N NH3/MeOH в CH2Cl2 для получения алкена 124 в виде бесцветного масла. Выход (0.065 г, 46%);1Н ЯМР (400 МГц, МеОН-d4) δ 7.42-7.45 (m, 1H), 7.22-7.32 (m, 3Н), 6.61 (d, J = 16.2 Гц, 1H), 6.36 (d, J = 16.0 Гц, 1H), 4.58 (d, J = 6.1 Гц, 1H), 3.71-3.76 (m, 1H), 2.92 (dd, J = 3.5, 13.1 Гц, 1H), 2.77 (dd, J = 8.0, 13.1 Гц, 1H), 1.47-1.76 (m, 9H), 1.25-1.40 (m, 1H);13С ЯМР (100 МГц, МеОН-d4) δ 142.7, 137.8, 137.5, 128.1, 126.9, 125.8, 125.4, 124.8, 76.1, 75.7, 71.2, 43.3, 37.5, 25.5, 21.9; Преп-ВЭЖХ (Способ 2) 97% (AUC), tR=5.44 мин; ESI MS m/z 292.5 [M+H]+.
Стадия 6: Гидрирование алкена 124 согласно способу, который использовали в Примере 128, позволило получить Пример 130 в виде бесцветного масла. Выход (0.0513 г, колич);1Н ЯМР (400 МГц, CD3OD) δ 7.19-7.25 (m, 2H), 7.15-7.19 (m, 1H), 7.07-7.11 (m, 1H), 4.52 (d, J = 6.3 Гц, 1H), 3.65 (ddd, J = 3.3, 6.1, 9.6 Гц, 1H), 2.82 (dd, J = 3.5, 13.1 Гц, 1H), 2.63-2.70 (m, 3Н), 1.42-1.74 (m, 12H), 1.26-1.37 (m, 2H);13С ЯМР (100 МГц, МеОН-d4) δ 143.1, 142.3, 128.0, 127.3, 126.8, 124.1, 76.2, 75.5, 70.9, 44.5, 43.2, 37.0, 29.4, 25.9, 22.1, 17.2; Преп-ВЭЖХ (Способ 2) tR=5.30 мин, 92.7% (AUC); ESI MS m/z=294.46 [M+H]+
ПРИМЕР 131
Приготовление (1R,2S)-3-амино-1-(3-(2-(1-гидроксициклогексил)этил)фенил)пропан-1,2-диола

(1R,2S)-3-амино-1-(3-(2-(1-гидроксициклогексил)этил)фенил)пропан-1,2-диол был приготовлен согласно способу, который использовали в Примере 130.
Стадия 1: Эпоксидирование аллилового спирта 120 с использованием диизопропил D-(-)-тартрата позволило получить сырой (R)-(3-бромфенил)((S)-оксиран-2-ил)метанол в виде бесцветного масла. Выход (4.12 г, колич.);1Н ЯМР (400 МГц, ДМСО-d6) δ 7.54 (t, J = 1.6 Гц, 1H), 7.45 (ddd, J = 1.2, 2.0, 7.8 Гц, 1Н), 7.34-7.38 (m, 1H), 7.29 (t, J = 7.6 Гц, 1H), 5.68 (d, J = 4.5 Гц, 1H), 4.41 (t.J = 4.7 Гц, 1H), 2.99-3.03 (m, 1H), 2.69 (ABd, J = 5.5, 3.9 Гц, 1H), 2.63 (ABd, J = 5.3, 2.7 Гц, 1H).
Стадия 3: Открытие эпоксидного кольца и защита амина трифторацетиловой группой позволило получить N-((2S,3R)-3-(3-бромфенил)-2,3-дигидроксипропил)-2,2,2-трифторацетамид в виде бесцветного масла. Выход (0.322 г, 42%);1H ЯМР (400 МГц, ДМСО-d6) δ 9.14 (t, J = 5.7 Гц, 1H), 7.35-7.39 (m, 1H), 7.19-7.25 (m, 2H), 7.13-7.18 (m, 1H), 6.51 (d, J = 16.0 Гц, 1H), 6.34 (d, J = 16.0 Гц, 1H), 5.41 (d, J = 4.5 Гц, 1H), 4.86 (d, J = 6.3 Гц, 1H), 4.39-4.43 (m, 2H), 3.66-3.73 (m, 1H), 3.37 (ddd, J = 3.3, 4.7, 13.3 Гц, 1H), 3.08-3.16 (m, 1H), 1.55-1.67 (m, 2H), 1.37-1.54 (m, 7H), 1.18-1.25 (m, 1H).
Стадия 4: Реакция Хека N-((2S,3R)-3-(3-бромфенил)-2,3-дигидроксипропил)-2,2,2-трифторацетамида с олефином 105 позволило получить N-((2S,3R)-2,3-дигидрокси-3-(3-((E)-2-(1-гидроксициклогексил)винил)фенил)пропил)-2,2,2-трифторацетамид в виде бесцветного масла. Выход (0.266 г, 76%);1Н ЯМР (400 МГц, ДМСО-d6) δ 9.14 (t, J = 5.7 Гц, 1H), 7.35-7.39 (m, 1H), 7.19-7.25 (m, 2H), 7.13-7.18 (m, 1H), 6.51 (d, J = 16.0 Гц, 1H), 6.34 (d, J = 16.0 Гц, 1H), 5.41 (d, J = 4.5 Гц, 1H), 4.86 (d, J = 6.3 Гц, 1H), 4.39-4.43 (m, 2H), 3.66-3.73 (m, 1H), 3.37 (ddd, J = 3.3, 4.7, 13.3 Гц, 1H), 3.08-3.16 (m, 1H), 1.55-1.67 (m, 2H), 1.37-1.54 (m, 7H), 1.18-1.25 (m, 1H).
Стадия 5: Снятие защиты N-((2S,3R)-2,3-дигидрокси-3-(3-((E)-2-(1-гидроксициклогексил)винил)фенил)пропил)-2,2,2-трифторацетамида позволило получить (1R,2S)-3-амино-1-(3-((E)-2-(1-гидроксициклогексил)винил)фенил)пропан-1,2-диол в виде бесцветного масла. Выход (0.104 г, 52%);1H ЯМР (400 МГц, МеОН-d4) δ 7.42-7.45 (m, 1H), 7.22-7.32 (m, 3Н), 6.61 (d, J = 16.2 Гц, 1H), 6.36 (d, J = 16.0 Гц, 1H), 4.58 (d, J = 6.1 Гц, 1H), 3.71-3.76 (m, 1H), 2.92 (dd, J = 3.5, 13.1 Гц, 1H), 2.77 (dd, J = 8.0, 13.1 Гц, 1H), 1.47-1.76 (m, 9H), 1.25-1.40 (m, 1H).
Стадия 6: Гидрирование (1R,2S)-3-амино-1-(3-((E)-2-(1-гидроксициклогексил) винил)фенил)пропан-1,2-диола позволило получить Пример 131 в виде бесцветного масла. Выход (0.0834 г, 96%);1Н ЯМР (400 МГц, СD3ОD) δ 7.19-7.25 (m, 2H), 7.15-7.19 (m, 1H), 7.07-7.11 (m, 1H), 4.52 (d, J = 6.3 Гц, 1H), 3.65 (ddd, J = 3.3, 6.1, 9.6 Гц, 1H), 2.82 (dd, J = 3.5, 13.1 Гц, 1Н), 2.63-2.70 (m, 3Н), 1.42-1.74 (m, 12H), 1.26-1.37 (m, 2H); Преп-ВЭЖХ (Способ 2) tR=5.31 мин, 88.0% (AUC); ESI MS m/z=294.48 [M+H]+
ПРИМЕР 132
Приготовление (R)-3-(3-(3-аминопропил)фенил)-1-фенилпропан-1-ола

(R)-3-(3-(3-аминопропил)фенил)-1-фенилпропан-1-ол был приготовлен согласно способу, который использовали в Примере 2.
Стадия 1: Реакция Соногашира (R)-1-фенилпроп-2-ин-1-ола с N-(3-(3-бромфенил)пропил)-2,2,2-трифторацетамидом позволила получить (S)-2,2,2-трифтор-N-(3-(3-(3-гидрокси-3-фенилпроп-1-инил)фенил)пропил)ацетамид в виде янтарного масла. Выход (0.73 г, 62%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.57-7.59 (m, 2H), 7.17-7.40 (m, 7H), 5.60 (s, 1Н), 3.26-3.29 (m, 2H), 2.62 (t, J = 7.6 Гц, 2H), 1.86 (quint, J = 6.8 Гц, 2H)
Стадия 2: Снятие защиты (S)-2,2,2-трифтор-N-(3-(3-(3-гидрокси-3-фенилпроп-1-инил)фенил)пропил)ацетамида позволило получить (S)-3-(3-(3-аминопропил)фенил)-1-фенилпроп-2-ин-1-ол в виде бледно-желтого масла. Выход (0.239 г, 30%):1Н ЯМР (400 МГц, CD3OD) δ 7.56-7.59 (m, 1Н), 7.16-7.39 (m, 8H), 5.60 (s, 1Н), 2.58-2.62 (m, 4H), 1.69-1.77 (m, 2H).
Стадия 3: Восстановление (S)-3-(3-(3-аминопропил)фенил)-1-фенилпроп-2-ин-1-ола согласно способу, который использовали в Примере 2, с последующей флэш хроматографией (градиент 10-100% (7N NH3/MeOH)/DCM) позволило получить Пример 132 в виде бесцветного масла. Выход (0.103 г, 81%).1Н ЯМР (400 МГц, CDCl3) δ 7.31-7.36 (m, 4H), 7.24-7.30 (m, 1Н), 7.15-7.21 (m, 1Н), 6.97-7.03 (m, 3Н), 4.66 (dd, J = 5.2, 8.0 Гц, 1Н), 2.56-2.76 (m, 6H), 1.96-2.16 (m, 2H), 1.69-1.79 (m, 2H), 1.50-1.70 (brs, 3Н). ESI MS m/z 270.21 [m+H]+, 252.17 [m+Н-OH]+.
ПРИМЕР 133
Приготовление 3-(3-(2-циклогептилэтил)фенил)пропан-1-амина

3-(3-(2-циклогептилэтил)фенил)пропан-1-амин был приготовлен согласно способу, показанному на Схеме 25.
Схема 25

Стадия 1: LAH (180 мл 1М раствора, 176 ммоль) медленно добавляли в раствор кислоты 125 (25 г, 176 ммоль) в безводном THF (500 мл) в атмосфере аргона при 5°С. Реакционную смесь оставляли нагреваться до комнатной температуры, перемешивали в течение 1 ч, снова охлаждали до 5°С, затем осаждали медленным добавлением насыщенного водного раствора Na2SO4. Полученный осадок удаляли фильтрацией, затем фильтрат экстрагировали EtOAc, отмывали водой и солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали для получения спирта 126 в виде бесцветного масла. Выход (21 г, 98%).1Н ЯМР (400 МГц, CDCl3) δ 3.38 (d, J = 6.4 Гц, 2Н), 1.38-1.80 (m, 12H), 1.10-1.20 (m, 2H).
Стадия 2: Раствор спирта 126 (4,5 г, 35 ммоль) в дихлорметане (10 мл) добавляли к перемешивающейся смеси пиридиния хлорхромата (0.4 г, 43.8 ммоль) и целлита (10 г) в дихлорметане (100 мл), после чего реакционную смесь перемешивали в течение 16 ч. Смесь фильтровали через слой силикагеля и слой ополаскивали диэтиловым эфиром. Объединенный фильтрат концентрировали, что позволило получить загрязненный альдегид 127 в виде зеленого масла, которое использовали на следующей стадии без очистки. Выход (4.1 г, 93%).1Н ЯМР (400 МГц, CDCl3) δ 9.58 (d, J = 0.8 Гц, 1Н), 2.28-2.36 (m, 1Н), 1.88-1.95 (m, 2H), 1.40-1.70 (m, 10Н).
Стадия 3: Трихлорацетат натрия добавляли 3 аликвотами в течение 10 мин в перемешанный раствор альдегида 127 (14.9 г, 118 ммоль) и трихлоруксусной кислоты (19.3 г, 177 ммоль) в DMF (150 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, охлаждали в ледяной ванне, затем осаждали и разбавляли водой. Раствор экстрагировали гексанами и отмывали насыщенным водным раствором NH4Cl, водой и солевым раствором. Объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении, что позволило получить загрязненный спирт 128 в виде желтого масла, которое использовали на следующей стадии без очистки. Выход (23.4 г, 80%).1H ЯМР (400 МГц, СDСl3) δ 3.95 (d, J = 2.0 Гц, 1Н), 2.85 (br s, 1Н), 2.20-2.30 (m, 1Н), 1.88-2.08 (m, 1Н), 1.36-1.84 (m, 11H).
Стадия 4: p-Толуолсульфонилхлорид (3.34 г, 17.5 ммоль) добавляли в раствор спирта 128 (4.3 г, 17.5 ммоль), триэтиламина (3.6 мл, 26.3 ммоль) и диазабициклооктана (0.586 г, 5.2 ммоль) в 40 мл дихлорметана и перемешивали при комнатной температуре в течение 90 мин. Реакционную смесь промывали водой (40 мл) и 5N НСl (40 мл). Объединенные водные слои экстрагировали дихлорметаном (40 мл) и объединенные органические слои далее отмывали 2N НСl, водой и солевым раствором, затем высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент 0-10% EtOAc/гексаны) позволила получить сульфонат 129 в виде бледно-желтых кристаллов. Выход (2.65 г, 38%):1Н ЯМР (400 МГц, CDCl3) δ 7.81 (d, J = 8.8 Гц, 2H), 7.32 (d, J = 8 Гц, 2H), 2.43 (s, 3Н), 2.24-2.32 (m, 1H), 1.98-2.06 (s, 1H), 1.78-1.88 (m, 1H), 1.60-1.73 (m, 3Н), 1.28-1.60 (m, 8H).
Стадия 5: Метиллитий (7.0 мл 1.6 M раствора в диэтиловом эфире, 11.25 ммоль) прикалывали в перемешивающийся раствор сульфоната 129 (1 г, 2.5 ммоль) в безводном THF (15 мл) в атмосфере аргона при 5°С. Реакционную смесь оставляли нагреваться до комнатной температуры, перемешивали в течение 16 ч, затем осаждали медленным добавлением насыщенного водного раствора NH4Cl. Смесь экстрагировали гексанами и объединенные органические слои отмывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении, что позволило получить этинилциклогептан (130) в виде желтого масла. Выход (0.270 г, 88%)1H ЯМР (400 МГц CDCl3) δ 2.51 (s, 1H), 1.99 (d, J = 2.8 Гц, 1H), 1.73-1.83 (m, 2H), 1.55-1.70 (m, 4H), 1.35-1.55 (m, 6H).
Стадия 6: Реакция Соногашира этинилциклогептана (130) с N-(3-(3-бромфенил)пропил)-2,2,2-трифторацетамидом согласно способу, который использовали в Примере 2, с последующей флэщ хроматографией (градиент 0-25% EtOAc/гексаны) позволила получить алкин 131 в виде янтарного масла. Выход (0.556 г, 59%):1Н ЯМР (400 МГц, CDCl3) δ 7.16-7.26 (m, 3H), 7.03-7.08 (m, 1H), 6.28 (br s, 1H), 3.36 (dt, J = 6.8, 6.8 Гц, 2H), 2.75-2.83 (m, 1H), 2.63 (t, J = 7.2 Гц, 2Н), 1.85-1.95 (m, 4H), 1.69-1.80 (m, 4Н), 1.48-1.65 (m, 6H).
Стадия 7: Снятие защиты алкина 131 согласно способу, который использовали в Примере 2, с последующей флэш хроматографией (5% (7N NН3/МеОН)/дихлорметан) позволило получить алкин 132 в виде бесцветного масла. Выход (0.226 г, 56%):1Н ЯМР (400 МГц, СDСl3) δ 7.13-7.25 (m, 3H), 7.03-7.08 (m, 1H), 2.74-2.82 (m, 1H), 2.69 (t, J = 7.2 Гц, 2H), 2.59 (t, J = 7.2 Гц, 2H), 1.84-1.94 (m, 2H), 1.68-1.80 (m, 6H), 1.46-1.64 (m, 6H), 1.30 (brs, 2H).
Стадия 8: Восстановление алкина 132 согласно способу, который использовали в Примере 2, с последующей флэш хроматографией (градиент 10-100% (7N NH3/MeOH)/DCM) позволило получить Пример 133 в виде бесцветного масла. Выход (0.081 г, 80%):1Н ЯМР (400 МГц, CD3OD) δ 7.13 (t, J = 7.2 Гц, 1H), 6.92-7.00 (m, 3H), 2.52-2.65 (m, 6H), 1.70-1.80 (m, 4H), 1.60-1.70 (m, 2H), 1.36-1.60 (m, 9H), 1.18-1.28 (m, 2H). ESI MS m/z 260.25 [m+H]+.
ПРИМЕР 134
Приготовление 4-(3-(2-аминоэтилтио)фенетил)гептан-4-ола
4-(3-(2-аминоэтилтио)фенетил)гептан-4-ол был приготовлен согласно способу, показанному на Схеме 26.
Схема 26

Стадия 1: 3-бромбензолтиол (133) (3 г, 15.9 ммоль), 2-бромэтанол (2.4 г, 19.1 ммоль) и К2СО3 (4.4 г, 32 ммоль) соединяли в ацетоне (20 мл) и перемешивали при комнатной температуре в течение 1 ч. Ацетон удаляли при пониженном давлении и остаток эестрагировали из воды этилацетатом. Раствор этилацетата отмывали солевым раствором, высушивали MgSO4, фильтровали и концентрировали при пониженном давлении, что позволило получить спирт 134 в виде желтого масла без очистки. Выход (3.6 г, 97%):1Н ЯМР (400 МГц, CDCl3) δ 7.49 (t, J = 2.0 Гц, 1Н), 7.31 (ddd, J = 0.8, 1.6, 8.0 Hz, 1Н), 7.27 (ddd, J = 0.8, 1.6, 8.0 Гц, 1Н), 7.13 (t, J = 7.6 Гц, 1Н), 3.75 (t, J = 6.4 Гц, 2Н), 3.10 (t, J = 6.4 Гц, 2Н), 2.18 (brs, 1Н).
Стадия 2: Реакция Мицунобу 134 с фталимидом согласно способу, который использовали в Примере 21, с последующей флэш хроматографией (граидент 5-20% этилацетат/гексаны) позволила получить бромид 135 в виде белого твердого вещества. Выход (4.04 г, 72%):1H ЯМР (400 МГц, CDCl3) δ 7.77-7.84 (m, 2Н), 7.66-7.72 (m, 2Н), 7.50 (t, J = 2.0 Гц, 1Н), 7.30 (ddd, J = 0.8, 1.6, 7.6 Гц, 1Н), 7.19 (ddd, J = 0.8, 1.6, 7.6 Гц, 1Н), 7.07 (t, J = 7.6 Гц, 1Н), 3.93 (t, J = 7.2 Гц, 2Н), 3.22 (J = 7.2 Гц, 2Н).
Стадия 3: Снятие защиты бромида 135 согласно способу, который использовали в Примере 9, позволило получить амин 136 в виде желтого масла. Выход (1.56 г, 98%):1Н ЯМР (400 МГц, CDCl3) δ 7.44 (t, J = 2.0 Гц, 1Н), 7.26 (ddd, J = 0.8, 1.6, 7.6 Гц, 1Н), 7.21 (ddd, J = 0.8, 1.6, 7.6 Гц, 1Н), 7.09 (t, J = 8.0 Гц, 1Н), 2.87-3.0 (m, 2Н), 2.82-2.86 (m, 2H), 1.7-2.4 (brs, 2H).
Стадия 4: Амидирование амина 136 соглано способу, который использовали в Примере 2, с последующей флэш хроматографией (градиент 5-20% этилацетат/гексаны) позволило получить трифторамид 137 в виде бесцветного масла. Выход (1.75 г, 80%):1Н ЯМР (400 МГц, СDСl3) δ 7.50 (t, J = 2.0 Гц, 1Н), 7.35 (ddd, J = 0.8, 1.6, 7.6 Гц, 1Н), 7.29 (ddd, J = 0.8, 1.6, 7.6 Гц, 1Н), 7.16 (t, J = 8.0 Гц, 1Н), 6.81 (brs, 1Н), 3.55 (app q, J = 6.4 Гц, 2Н), 3.10 (t, J = 6.4 Гц, 2Н).
Стадия 5: Реакция Соногашира 4-этинилгептан-4-ола с N-(2-(3-бромфенилтио)этил)-2,2,2-трифторацетамидом (137) согласно способу, который использовали в Примере 2, с последующей флэш хроматографией (градиент 5-50% этилацетат/гексаны) позволила получить алкинол 138 в виде окрашенного твердого вещества. Выход (0.22 г, 52%):1Н ЯМР (400 МГц, ДМСО) δ 9.52-9.60 (m, 1Н), 7.26-7.36 (m, 3H), 7.16-7.20 (m, 1Н), 5.11 (s, 1Н), 3.60 (ddd, J = 6.4 Гц, 2Н), 3.11 (t, J = 7.2 Гц, 2Н), 1.52-1.62 (m, 4H), 1.38-1.52 (m, 4H), 0.89 (t, J = 7.2 Гц, 6Н).
Стадия 6: Снятие защиты алкинола 138 согласно способу, который использовали в Примере 2 с последующей флэш хроматографией (градиент 5-50% этилацетат/гексаны) позволило получить амин 139 в виде желтого масла. Выход (0.89 г, 68%):1Н ЯМР (400 МГц, MeOD) δ 7.36-7.38 (m, 1Н), 7.32 (dt, J = 1.6, 7.6 Гц, 1Н), 7.25 (t, J = 7.6 Гц, 1Н), 7.20 (dt, J = 1.6, 7.6 Гц, 1Н), 3.01 (t, J = 6.4 Гц, 2Н), 2.78 (brs, 2Н), 1.62-1.74 (m, 4H), 1.50-1.62 (m, 4H), 0.97 (t, J = 7.2 Гц, 6Н).
Стадия 7: Восстановление амина 139 согласно способу, который использовали в Примере 1, с последующей флэш хроматографией (градиент 10-100% (7N NH3/MeOH)/DCM) позволило получить Пример 134 в виде бесцветного масла. Выход (0.042 г, 75%):1Н ЯМР (400 МГц, CDCl3) 57.16-7.21 (m, 3H), 6.99-7.03 (m, 1Н), 2.99 (t, J = 5.6 Гц, 2Н), 2.91 (brs, 2Н), 2.56-2.62 (m, 2Н), 1.66-1.73 (m, 2Н), 1.40-1.60 (m, 7H), 1.28-1.40 (m, 4H), 0.924 (t, J = 7.2 Гц, 6Н). ESI MS m/z 296.29 [m+H]+, 278.25 [m+Н-OH]+.
ПРИМЕР 135
Приготовление 4-(3-(2-аминоэтилсульфонил)фенетил)гептан-4-ола
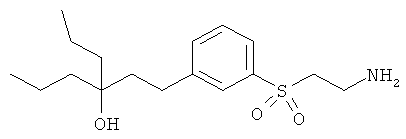
4-(3-(2-аминоэтилсульфонил)фенетил)гептан-4-ол был приготовлен согласно способу, показанному на Схеме 27.
Схема 27

Стадия 1: В раствор бромида 137 (0.6 г, 1.83 ммоль) в этаноле (10 мл) при комнатной температуре добавляли аммония мобибдат тетрагидрат (0.68 г, 0.55 ммоль) (30%) и пероксид водорода (1.9 мл 30% водного раствора, 18.3 ммоль). Реакционную смесь перемешивали в течение ночи, затем осаждали насыщенным водным раствором Na2S2O3 (4 мл). Этанол удаляли в вакууме и остаток экстрагировали из воды этилацетатом. Объединенные органические слои отмывали солевым раствором, высушивали над MgSO4, фильтровали, концентрировали в вакууме и очищали флэш хроматографией (градиент 5-50% этилацетат/гексаны), что позволило получить сульфон 139 в виде белого воскообразного твердого вещества. Выход (0.615 г, 93%):1Н ЯМР (400 МГц, CDCl3) δ 8.05 (t, J = 2.0 Гц, 1Н), 7.81-7.87 (m, 2H), 7.49 (t, J = 8.0 Гц, 1Н), 7.25 (brs, 1H), 3.81-3.88 (m, 2H), 3.33-3.38 (m, 2H).
Стадия 2: Реакция Соногашира 139 с 4-этинилгептан-4-олом согласно способу, который использовали в Примере 2, с последующей флэш хроматографией (градиент 5-50% этилацетат/гексаны) позволила получить алкинол 140 в виде желтого твердого вещества. Выход (0.515 г, 72%):1Н ЯМР (400 МГц, ДМСО) δ 7.93 (m, 1H), 7.80-7.84 (m, 1H), 7.69-7.73 (m, 1H), 7.55 (t, J = 8.0 Гц, 1H), 7.27 (brs, 1H), 3.79-3.86 (m, 2H), 3.31-3.36 (m, 2H), 1.93 (brs, 1H), 1.64-1.78 (m, 4H), 1.51-1.64 (m, 4H), 0.98 (t, J = 7.2 Гц, 6Н).
Стадия 3: Снятие защиты трифторамида 140 согласно способу, который использовали в Примере 2, с последующей флэш хроматографией (градиент 0-10% (7N NH3/МеОН)/дихлорметан) позволило получить алкин 141 в виде желтого масла. Выход (0.21 г, 52%):1Н ЯМР (400 МГц, MeOD) δ 7.90-7.92 (m, 1H), 7.78-7.82 (m, 1H), 7.62-7.64 (m, 1H), 7.48 (t, J = 8.0 Гц, 1H), 3.20-3.25 (m, 2H), 3.07-3.15 (m, 2H), 1.81 (brs, 3H), 1.62-1.75 (m, 4H), 1.50-1.62 (m, 4H), 0.96 (t, J = 7.2 Гц, 6Н).
Стадия 4: Восстановление алкина 141 согласно способу, который использовали в Примере 2, с последующей флэш хроматографией (градиент 0-100% (7N NH3/MeOH)/DCM) позволило получить Пример 135 в виде бесцветного масла. Выход (0.081 г, 80%):1Н ЯМР (400 МГц, CDCl3) δ 7.69-7.74 (m, 2H), 7.44-7.49 (m, 2H), 3.20-3.24 (m, 2H), 3.08-3.13 (m, 2H), 2.69-2.75 (m, 2H), 1.68-1.74 (m, 2H), 1.43-1.52 (m, 7H), 1.26-1.40 (m, 4H), 0.92 (t, 8.0 Гц, 6Н). ESI MS m/z 328.31 [m+H]+, 310.27 [m+Н-ОН]+.
ПРИМЕР 136
Приготовление 4-(3-(2-аминоэтиламино)фенетил)гептан-4-ола

4-(3-(2-аминоэтиламино)фенетил)гептан-4-ол был приготовлен согласно способу, показанному на Схеме 28.
Схема 28
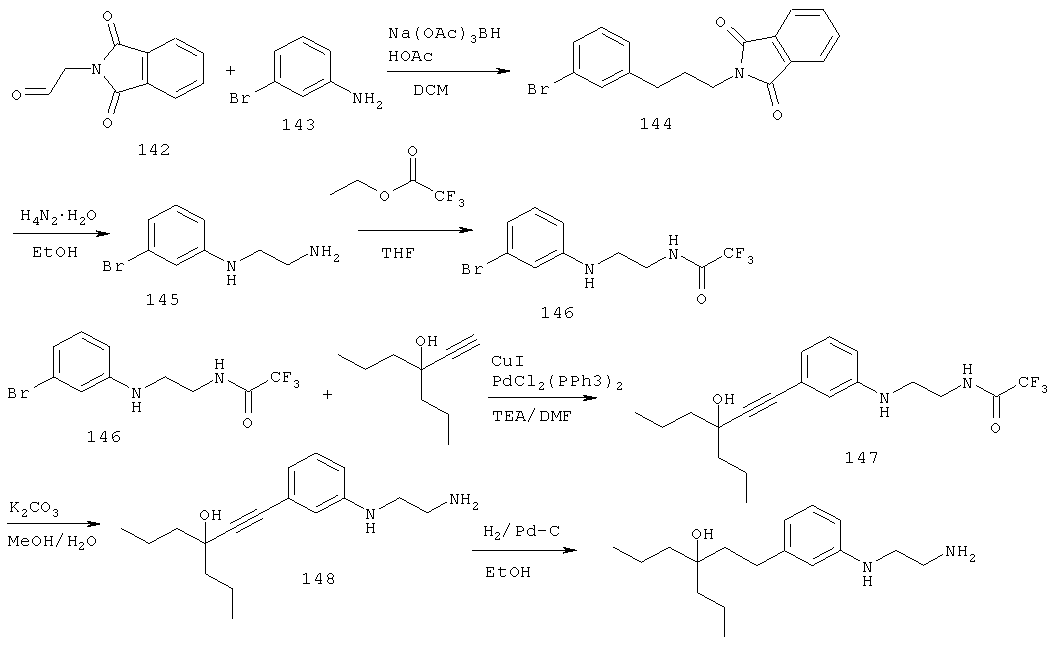
Стадия 1: В перемешанный раствор 2-(1,3-диоксоизоиндолин-2-ил)ацетальдегида (142, 3.0 г, 15.9 ммоль) в СН2Сl2 (1000 мл) добавляли 3-броманилин (143, 2.2 г, 13.0 ммоль), триацетоксиборогидрид натрия (4.2 г, 20 ммоль) и уксусную кислоту (1.2 г, 20 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем отмывали насыщенным раствором хлорида аммония, водой и солевым раствором. Объединенные органические слои высушивали над MgSO4, фильтровали, и концентрировали в вакууме. Очистка флэш хроматографией (градиент 10-40% этилацетат/гексаны) позволила получить бензилбромид 144 в виде желтого масла. Выход (1.7 г, 38%).1H ЯМР (400 МГц, CDCl3) δ 7.80-7.88 (m, 2H), 7.68-7.78 (m, 2H), 6.93-6.99 (m, 1H), 6.72-6.77 (m, 2H), 6.49-6.54 (m, 1H), 4.23 (brs, 1H), 3.95 (t, J = 6.0 Гц, 2Н), 3.39 (t, J = 6.0 Гц, 2H).
Стадия 2: Снятие защиты бензилбромида 144 согласно способу, который использовали в Примере 9, с последующей флэш хроматографией (градиент 0-10% (7N NН3/МеОН)/дихлорметан) позволило получить диамин 145 в виде желтого масла. Выход (0.286 г, 57%).1H ЯМР (400 МГц, CDCl3) δ 6.99 (t, J = 8.0 Гц, 1H), 6.76-6.81 (m, 1H), 6.74 (t, J = 2.0 Гц, 1H), 6.49-6.54 (m, 1H), 4.19 (brs, 1H), 3.13 (t, J = 6.0 Гц, 2H), 2.92 (t, J = 6.0 Гц, 2H), 1.20 (brs, 2H).
Стадия 3: Амидирование диамина 145 согласно способу, который использовали в Примере 2, позволило получить трифторамид 146 в виде желтого воскообразного твердого вещества. Выход (0.462 г, колич.).1Н ЯМР (400 МГц, CDCl3) δ 7.01 (t, J = 8.0 Гц, 1Н), 6.99 (brs, 1H), 6.82-6.86 (m, 1H), 6.74 (t, J = 2.4 Гц, 1Н), 6.50-6.55 (m, 1H), 4.03 (brs, 1H), 3.55 (q, J = 6.0, Гц, 2H), 3.33 (t, J = 6.0 Гц, 2Н).
Стадия 4: Реакция Соногашира 146 с 4-этинилгептан-4-олом согласно способу, который использовали в Примере 2, с последующей флэш хроматографией (5-30% этилацетат/гексаны) позволила получить алкинол 147 в виде оранжевого масла. Выход (0.30 г, 60%).1Н ЯМР (400 МГц, CDCl3) δ 7.54 (brs, 1H), 7.07 (t, J = 8.0 Гц, 1H), 6.75-6.78 (m, 1H), 6.61-6.64 (m, 1H), 6.52-6.56 (m, 1H), 3.51 (q, J = 5.6 Гц, 2H), 3.32 (t, J = 6.0 Гц, 2H), 1.63-1.71 (m, 4H), 1.50-1.63 (m, 4H), 0.95 (t, J = 7.2 Гц, 6Н).
Стадия 5: Снятие защиты алкинола 147 согласно способу, который использовали в Примере 2, с последующей флэш хроматографией (градиент 0-10% (7N NН3/МеОН)/дихлорметан) позволило получить амин 148 в виде желтого воскообразного твердого вещества. Выход (0.14 г, 63%).1Н ЯМР (400 МГц, ДМСО) δ 6.97-7.03 (m, 1H), 6.46-6.54 (m, 3Н), 5.66 (t, J = 5.2 Гц, 1H), 5.07 (s, 1H), 2.94 (q, J = 6.4 Гц, 2H), 2.66 (t, J = 6.4 Гц, 2H), 1.38-1.62 (m, 10 Н), 0.88 (t, J = 7,8 Гц, 6Н).
Стадия 6: Восстановление амина 148 согласно способу, который использовали в Примере 2, с последующей флэш хроматографией (градиент (10-100% (7N NH3/MeOH)/DCM) позволило получить Пример 136 в виде бесцвестного масла. Выход (0.047 г, 84%):1Н ЯМР (400 МГц, CDCl3) δ 7.08 (t, J = 7.6 Гц, 1H), 6.53-6.57 (m, 1H), 6.44-6.49 (m, 2H), 3.18 (t, J = 6.0 Гц, 2H), 2.94 (t, J = 6.0 Гц, 2H), 2.51-2.57 (m, 2H), 1.68-1.74 (m, 2H), 1.42-1.50 (m, 6Н), 1.28-1.40 (m, 6H), 0.93 (t, J = 7.2 Гц, 6Н). ESI MS m/z 279.3 [m+]+, 261.26 [m+Н-ОH]+.
ПРИМЕР 137
Приготовление 3-амино-1-(3-(2-циклогептилэтил)фенил)пропан-1-ола

3-амино-1-(3-(2-циклогептилэтил)фенил)пропан-1-ол был приготовлен согласно способу, который использовали в Примере 2.
Стадия 1: Реакция Сонгашира N-(3-(3-бромфенил)-3-гидроксипропил)-2,2,2-трифторацетамида (43) с этинилциклогептаном с последующей флэш хроматографией (градиент 5-40% EtOAc/гексаны) позволила получить N-(3-(3-(циклогептилэтинил)фенил)-3-гидроксипропил)-2,2,2-трифторацетамид в виде янтарного масла. Выход (0.507 г, 51%):1Н ЯМР (400 МГц, СDСl3) δ 7.42 (br s, 1H), 7.34-7.36 (m, 1H), 7.19-7.33 (m, 3Н), 4.81 (q, J = 4.0 Гц, 1H), 3.48-3.68 (m, 1H), 3.32-3.42 (m, 1H), 2.74-2.82 (m, 1H), 2.48 (br s, 1H), 1.85-2.00 (m, 4H), 1.70-1.80 (m, 4H), 2.46-1.64 (m, 6H).
Стадия 2: Снятие защиты N-(3-(3-(циклогептилэтинил)фенил)-3-гидроксипропил)-2,2,2-трифторацетамида с последующей фоэш хроматографией (5% (7N NН3/МеОН)/дихлорметан) позволило получить 3-амино-1-(3-(2-циклогептилэтинил)фенил)пропан-1-ол в виде желтого масла. Выход (0.173 г, 46%):1H ЯМР (400 МГц, CDCl3) δ 7.40 (s, 1H), 7.18-7.30 (m, 3Н), 4.91 (d, J = 6.8 Гц, 1H), 3.00 (br s, 5H), 2.74-2.82 (m, 1H), 1.80-1.94 (m, 3Н), 1.68-1.80 (m, 5H), 1.44-1.64 (m, 6H).
Стадия 3: Восстановление 3-амино-1-(3-(2-циклогептилэтинил)фенил)пропан-1-ола согласно способу, который использовали в Примере 2, с последующей флэш хроматографией (градиент 10-100% (7N NH3/MeOH)/DCM) позволило получить Пример 137 в виде бесцветного масла. Выход (0.076 г, б9%):1H ЯМР (400 МГц, СDСl3) δ 7.13-7.26 (m, 3Н), 7.03-7.07 (m, 1H), 4.88-4.94 (m, 1H), 3.03-3.10 (m, 1H), 2.88-2.98 (m, 1H), 2.77 (brs, 3Н), 2.55-2.63 (m, 2H), 1.80-1.90 (m, 1H), 1.68-1.80 (m, 3H), 1.58-1.68 (m, 2H), 1.34-1.58 (m, 9H), 1.16-1.27 (m, 2H). ESI MS m/z 276.29 [m+H]+, 258.25 [m+Н-ОН]+.
ПРИМЕР 138
Приготовление (R)-3-амино-1-(3-(4-фенилбутил)фенил)пропан-1-ола

(R)-3-амино-1-(3-(4-фенилбутил)фенил)пропан-1-ол был приготовлен согласно способу, показанному на Схеме 29.
Схема 29

Стадия 1: Хиральное восстановление кетона 76 (-)-Iрc2ВСl согласно способу, который использовали в Примере 70, после очистки флэш хроматографией (градиент) позволило получить (R)-спирт 149 в виде бесцветного масла.1Н ЯМР (400 МГц, CDCl3) δ 7.50 (t, J = 1.6 Гц, 1H), 7.43 (dt, J = 7.2, 2.0 Гц, 1Н), 7.21-7.27 (m, 2H), 4.84 (dt, J = 8.8, 3.2 Гц, 1H), 3.65-3.73 (m, 1H), 3.36-3.43 (m, 1H), 2.47 (dd, J = 2.9, 1.0 Гц, 1H), 1.80-2.00 (m, 2H).
Стадия 2: Реакция Соногашира между (R)-гидроксиарилбромидом 149 и 4-фенилбутином согласно способу, который использовали в Примере 70, за исключением того, что реакционную смесь перемешивали при 70°С в течение 4 ч, и затем при 60°С в течение 17 ч, позволила получить сырой алкин 150 в виде светло желтого масла, которое использовали на следующей стадии без очистки. Выход (0.49 г, 77%).
Стадия 3: Снятие защиты 150 согласно способу, который использовали в Примере 100 (Определение абсолютной стереохимии) позволило получить амин 151 в виде бесцветного масла. Выход (0.195 г, 60%);1Н ЯМР (400 МГц, CD3OD) δ 7.31-7.33 (m, 1H), 7.15-7.29 (m, 8H), 4.67 (dd, J =8.0, 5.3 Гц, 1H), 2.87 (t, J = 7.2 Гц, 2H), 2.64-2.74 (m, 4H), 1.72-1.85 (m, 2H);13С ЯМР (100 МГц, CD3OD) δ 145.6, 140.9, 130.1, 128.8, 128.7, 128.4, 128.2, 126.1, 125.1, 124.1, 89.0, 81.1, 72.0, 71.9, 41.5, 38.4, 35.0, 21.2; RP-HPLC, 96.4% (AUC); LC-MS m/z=280.2 [M+H]+.
Стадия 4: Гидрирование алкина 151 выполняли согласно способу, который использовали в Примере 70, за исключением того, что реакция протекала в течение 16 ч. Реакционную смесь фильтровали и в фильтрат добавляли НСl/ЕtOН (7.4 M, 1 мл). Фильтрат концентрировали при пониженном давлении, растворяли в EtOAc и охлаждали до 0°С. Образованный осадок собирали фильтрацией и высушивали в вакууме для получения Примере 138 гидрохлорида в виде белого твердого вещества. Выход (0.069 г, 75%);1Н ЯМР (400 МГц, CD3OD) δ 7.06-7.26 (m, 9H), 4.78 (dd, J = 5.3, 7.4 Гц, 1Н), 2.97-3.12 (m, 2H), 2.58-2.66 (m, 2H), 1.92-2.01 (m, 2H), 1.58-1.67 (m, 2H); LC-MS (ESI+) 284.42 [M+H]+; Преп-ВЭЖХ (Способ 2): 97.6%, tR=7.00 мин
ПРИМЕР 139
Приготовление (S)-4-(3-(2-амино-1-гидроксиэтил)фенетил)гептан-4-ола

(S)-4-(3-(2-амино-1-гидроксиэтил)фенетил)гептан-4-ол был приготовлен согласно Схеме 30.
Схема 30

Стадия 1: Кетон 152 восстанавливали согласно способу, который использовали в Примере 70 для получения гидроксибромида 153 в виде бесцветного масла. Выход (0.818 г, 80%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.57 (t, J = 1.8 Гц, 1Н), 7.44 (ddd, J = 1.0, 2.0, 7.8 Гц, 1Н), 7.35-7.39 (m, 1Н), 7.28 (t, J = 7.8 Гц, 1Н), 5.90 (d, J = 4.9 Гц, 1Н), 4.80 (dd, J = 4.7, 6.5 Гц, 1Н), 3.66 (ABd, J = 4.5, 6.5 Гц, 1Н), 3.57 (ABd, J = 4.5, 6.5 Гц, 1Н).
Стадия 2: В раствор бромида 153 (0.818 г, 2.92 ммоль) в безводном THF (10 мл) добавляли раствор трет-бутоксида калия (1М, 3.5 ммоль), реакционную смесь перемешивали при комнатной температуре в течение 15 мин, концентрировали при пониженном давлении и остаток обрабатывали водой. Продукт экстрагировали EtOAc, органические слои объединяли, отмывали солевым раствором, водным раствором NH4Cl, высушивали над безводным MgSO4, фильтровали и фильтрат концентрировали при пониженном давлении для получения (S)-2-(3-бромфенил)оксирана (0.486 г), который использовали на следующей стадии без очистки.
(S)-2-(3-бромфенил)оксиран растворяли в растворе 7N NH3/MeOH (5 мл) и в реакционную смесь добавляли водный раствор NH40H (25%, 5 мл), после чего перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь концентрировали при пониженном давлении для получения (S)-2-амино-1-(3-бромфенил)этанола (0.801 г), который использовали на следующей стадии без очистки.
(S)-2-амино-1-(3-бромфенил)этанол растворяли в безводном THF (5 мл) и добавляли этилтрифторацетат (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 мин, концентрировали при пониженном давлении и остаток очищали флэш хроматографией для получения трифторацетамида 154 в виде бесцветного масла. Выход (0.608 г, 67% для 3 стадий):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.45 (br. t, 1H), 7.46-7.49 (m, 1H), 7.40-7.45 (m, 1H), 7.25-7.30 (m, 2H), 5.73 (d, J = 4.7 Гц, 1H), 4.68 (dd, J = 6.7, 11.3 Гц, 1H), 3.47-3.52 (m, 2H).
Стадия 3: Реакция Соногашира бромида 154 с 4-этинилгептан-4-олом согласно способу, который представлен в Примере 70, за исключением того, что P(o-tol) не использовали, позволила получить алкинол 155 в виде коричневого масла. Выход (0.59 г, 82%):1H ЯМР (400 МГц, ДМСО-d6) δ 9.44 (br t, J = 5.5 Гц, 1H), 7.22-7.32 (m, 4H), 5.65 (d, J = 4.7 Гц, 1H), 4.67 (dd, J = 11.7, 6.8 Гц, 1H), 3.25-3.31 (m, 2H), 1.40-1.62 (m, 8H), 0.89 (t, J = 7.0 Гц, 6Н).
Стадия 4: Раствор алкинола 155 (0.59 г, 1.59 ммоль) в NH3/MeOH (7N, 10 мл) и водный раствор NH4OH (25%, 10 мл) перемешивали при комнатной температуре в течение 70 ч и концентрировали при пониженном давлении. Очистка флэш хроматографией (от 0% до 100% 10% 7N NH3/МеОН/СН2Сl2 в СН2Сl2) позволила получить амин 156 в виде бесцветного масла. Выход (0.35 г, 80%);1H ЯМР (400 МГц, CD3OD) δ 7.39-7.41 (m, 1H), 7.26-7.32 (m, 3Н), 4.58 (dd, J = 4.7, 7.6 Гц, 1H), 2.65-2.81 (m, 2H), 1.51-1.73 9 m, 8H), 0.97 (t, J = 7.0 Гц, 6Н); 143.7, 130.3, 128.9, 128.3, 125.8, 123.4, 92.4, 83.7, 74.5, 70.9, 49.0, 44.5, 17.6, 13.6; LC-MS: 276.38 [М+Н]+; Преп-ВЭЖХ tR=6.21 мин, 98% AUC.
Стадия 5: Гидрирование алкина 156 с последующей очисткой флэш хроматографией (граидент (от 10% до 50% 20% 7N NH3/MeOH/CH2Cl2-CH2Cl2) позволила получить Пример 139 в виде бесцветного масла. Выход (0.042 г, 57%);1Н ЯМР (400 МГц, CD3OD) δ 7.23 (t, J = 7.6 Гц, 1H), 7.07-7.21 (m, 3Н), 4.58 (dd, J = 5.1, 7.2 Гц, 1Н), 2.72-2.82 (m, 2H), 2.61 (ddd, J = 4.9, 8.6, 12.7 Гц, 2Н), 1.68 (ddd, J = 4.7, 8.4, 12.5 Гц, 2Н), 1.26-1.50 (m, 8H), 0.93 (t, J = 7.2 Гц, 6Н); LC-MS (ESI+) 280.41 [М+Н]+; Преп-ВЭЖХ (Способ 2): 85.1% (AUC), tR=6.17 мин.
ПРИМЕР 140
Приготовление 4-(5-(3-амино-1-гидроксипропил)-2-фторфенетил)гептан-4-ола
4-(5-(3-амино-1-гидроксипропил)-2-фторфенетил)гептан-4-ол был приготовлен согласно способу, который использовали в Примерах 1, 7, 9, 16 и 17.
Стадия 1: Добавление ацетонитрила в 3-бром-4-фторбензальдегид согласно способу, который использовали в Примере 16, позволило получить 3-(3-бром-4-фторфенил)-3-гидроксипропаннитрил в виде бледно-желтого масла. Выход (4.2 г, 70%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.71 (dd, J = 6.8, 2.0 Гц, 1H), 7.44 (ddd, J = 8.4, 5.2, 2.4 Гц, 1Н), 7.35 (t, J = 8.8 Гц, 1H), 6.08 (bs, 1H), 4.90 (s, 1H), 2.90 (ABd, J = 16.8, 5.2 Гц, 1Н), 2.83 (ABd, J = 16.8, 6.4 Гц, 1Н).
Стадия 2: Восстановление 3-(3-бром-4-фторфенил)-3-гидроксипропаннитрила с помощью ВН3-THF согласно способу, который использовали в Примере 17, с последующей защитой амина этилтрифторацетатом согласно способу, который использовали в Примере 9, позволило получить N-(3-(3-бром-4-фторфенил)-3-гидроксипропил)-2,2,2-трифторацетамид в виде прозрачного масла. Выход (4.3 г, 73%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.31 (bs, 1H), 7.62 (dd, J = 6.8, 2.0 Гц, 1H), 7.37-7.33 (m, 1H), 7.30 (t, J = 8.8 Гц, 1H), 5.48 (d, J = 4.4 Гц, 1H), 4.60-4.56 (m, 1H), 3.28-3.15 (m, 2H), 1.84-1.71 (m, 2H).
Стадия 3: N-(3-(3-бром-4-фторфенил)-3-гидроксипропил)-2,2,2-трифторацетамид взаимодействовал с 4-этинилгептан-4-олом согласно способу, который использвоали в Примере 7, для получения 2,2,2-трифтор-N-(3-(4-фтор-3-(3-гидрокси-3-пропилгекс-1-инил)фенил)-3-гидроксипропил)ацетамида в виде бледно-желтого масла. Выход (1.37 г, 78%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.31 (t, J = 5.0 Гц, 1H), 7.37 (dd, J = 6.8, 2.0 Гц, 1H), 7.34-7.30 (m, 1H), 7.18 (t, J = 9.0 Гц, 1H), 5.41 (d, J = 4.8 Гц, 1H), 5.19 (s, 1H), 4.58-4.54 (m, 1H), 3.28-3.16 (m, 2H), 1.82-1.69 (m, 2H), 1.63-1.41 (m, 8H), 0.89 (t, J = 7.2 Гц, 6Н).
Стадия 4: Снимали защиту 2,2,2-трифтор-N-(3-(4-фтор-3-(3-гидрокси-3-пропилгекс-1-инил)фенил)-3-гидроксипропил)ацетамида согласно способу, который использовали в Примере 9, для получения 4-((5-(3-амино-1-гидроксипропил)-2-фторфенил)этинил)гептан-4-ола в виде бледно-желтого масла. Выход (0.85 г, 82%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.35 (dd, J = 6.8, 2.0 Гц, 1H), 7.31-7.27 (m, 1H), 7.16 (t, J = 9.0 Гц, 1H), 5.19 (bs, 1H), 4.64 (t, J = 6.4 Гц, 1H), 2.64-2.52 (m, 2H), 1.63-1.42 (m, 10Н), 0.89 (t, J = 7.2 Гц, 6Н).
Стадия 5: 4-((5-(3-амино-1-гидроксипропил)-2-фторфенил)этинил)гептан-4-ол (0.107 г, 0.348 ммоль) растворяли в EtOAc (5 мл) и дегазировали потоком аргона. Добавляли 10% Pd/C (10 мг) и помещали в вакуум на 1 мин. Помещали под баллон с H2 и перемешивали в течение 3 ч. Фильтрация катализатора с последующим выпариванием до сухого состояния позволило получить Пример 140 в виде бледно-желтого масла. Выход (0.11 г, 100%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.17 (dd, J = 7.6, 2.0 Гц, 1H), 7.13-7.09 (m, 1H), 7.00 (dd, J = 10.0, 8.4 Гц, 1H), 4.61 (m, 1H), 3.98 (bs, 1H), 2.63-2.56 (m, 2H), 2.54-2.50 (m, 2H), 1.63-1.58 (m, 2H), 1.53-1.49 (m, 2H), 1.35-1.20 (m, 8H), 0.84 (t, J = 7.0 Гц, 6Н).
ПРИМЕР 141
Приготовление (R)-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропил)ацетамида

(R)-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропил)ацетамид был приготовлен согласно способу, представленному ниже.
Пример 71 (0.35 г, 1.19 ммоль) и уксусный ангидрид (0.13 г, 1.25 ммоль) перемешивали в CH2Cl2 в течение ночи при комнатной температуре. Реакционную смесь разделяли между CH2Cl2 и насыщ. NaHCO3. Органический слой высушивали над Na2SO4 и концентрировали при пониженном давлении для получения Примера 141 в виде прозрачного масла. Выход (0.40 г, 100%);1Н ЯМР (400 МГц, ДМСО-d6) δ 7.62 (t, = 5.0 Гц, 1H), 7.17 (t, J = 7.4 Гц, 1H), 7.11 (s, 1H), 7.07 (d, J = 8.0 Гц, 1H), 7.00 (d, J = 7.6 Гц, 1H). 5.14 (d, J = 4.4 Гц, 1H), 4.51-4.47 (m, 1H), 3.95 (s, 1H), 3.07-3.02 (m, 2H), 2.52-2.47 (m, 2H), 1.76 (s, 3H), 1.65 (q, J = 6.8 Гц, 2H), 1.56-1.51 (m, 2H), 1.35-1.21 (m, 8H), 0.84 (t, J = 7.0 Гц, 6Н).
ПРИМЕР 142
Приготовление (R)-2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропил)ацетамида
(R)-2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропил)ацетамид был приготовлен согласно способу, представленному ниже.
Смесь Примера 71 (0.29 г, 0.98 ммоль) и CF3CO2Et (2 мл) в СН2Cl2 перемешивали при комнатной температуре в течение ночи. Концентрирование при пониженном давлении позволило получить Пример 142 в виде прозрачного масла. Выход (0.39 г, 100%);1Н ЯМР (400 МГц, ДМСО-d6) δ 9.32 (t, = 5.2 Гц, 1Н), 7.18 (t, J = 7.6 Гц, 1Н), 7.11 (s, 1H), 7.08 (d, J = 7.6 Гц, 1Н), 7.01 (d, J = 7.6 Гц, 1Н), 5.25 (bs, 1Н), 4.52 (t, J = 6.4 Гц, 1Н), 3.94 (bs, 1Н), 3.22 (q, J = 6.8 Гц, 2Н), 2.52-2.47 (m, 2Н), 1.79-1.73 (m, 2H), 1.56-1.51 (m, 2H), 1.35-1.21 (m, 8H), 0.84 (t, J = 7.0 Гц, 6Н).
ПРИМЕР 143
Приготовление 4-(3-(3-амино-2-гидроксипропил)фенетил)гептан-4-ола
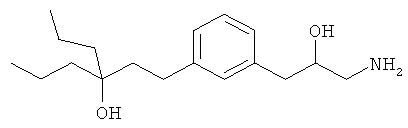
4-(3-(3-амино-2-гидроксипропил)фенетил)гептан-4-ол был приготовлен согласно способу, показанному на Схеме 31.
Схема 31

Стадия 1: В раствор 1-(3-бромфенил)-3-хлорпропан-2-ола (157) (8.49 г, 34.0 ммоль) в безводном DMF (100 мл) в атмосфере N2 добавляли NaN3 (11.05 г, 170.0 ммоль) и NaI (cat., 0.75 г, 5.0 ммоль). Смесь нагревали при 75°С в течение ночи. После охлаждения до комнатной температуры смесь разбавляли эфиром и отмывали водой и солевым раствором. Раствор высушивали над Na2SO4 и концентрировали при пониженном давлении. Продукт высушивали в вакууме при 40°С в течение 2 ч для получения азида 158 в виде желтого масла, которое использовали без очистки. Выход (8.6 г, 98% сырой продукт).
Стадия 2: В раствор азида 158 (8.59 г, 33.28 ммоль) в THF (60 мл) в атмосфере N2 добавляли РРh3 (8.73 г, 33.28 ммоль) и воду (20 мл). Реакционную смесь нагревали при 50°С в течение 24 ч. После охлаждения до комнатной температуры смесь разбавляли солевым раствором и экстрагировали EtOAc. Органический слой высушивали над Na2SO4 и концентрировали при пониженном давлении. Сырой амин растворяли в THF (20 мл) и этилтрифторацетате (20 мл) и перемешивали в течение ночи при комнатной температуре. Выпаривание при пониженном давлении с последующей очисткой флэш хроматографией (5% ЕtOАс/СН2Сl2 позволило получить трифторацетамид 159 в виде белого твердого вещества. Выход (3.72 г, 35%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.33 (t, J = 5.2 Гц, 1Н), 7.42 (d, J = 1.2 Гц, 1Н), 7.38-7.35 (m, 1Н), 7.24-7.20 (m, 2H), 5.00 (d, J = 6.0 Гц, 1Н), 3.83-3.75 (m, 1Н), 3.21-3.07 (m, 2H), 2.70 (dd, J = 13.6 Гц, 4.8, 1Н), 2.55 (dd, J = 14.0, 6.0 Гц, 1Н).
Стадия 3: Взаимодействие бромида 159 с 4-этинилгептан-4-олом согласно процедуре, описанной в Примере 7, позволило получить алкин 160 в виде прозрачного масла. Выход (0.455 г, 59%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.32 (t, J = 5.4 Гц, 1Н), 7.25-7.22 (m, 2H), 7.18-7.16 (m, 2H), 5.11 (s, 1Н), 4.96 (d, J = 5.6 Гц, 1Н), 3.81-3.74 (m, 1Н), 3.21-3.07 (m, 2H), 2.68 (dd, J = 14.0, 4.6 Гц, 1Н), 2.54 (dd, J = 14.0, 7.8 Гц, 1Н), 1.61-1.40 (m, 8Н), 0.89 (t, J = 7.2 Гц, 6Н).
Стадия 4: Снятие защиты трифторацетамида 160 согласно процедуре, описанной в Примере 9, позволило получить амин 161 в виде бледно-желтого масла. Выход (0.273 г, 82%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.24-7.20 (m, 2H), 7.17-7.13 (m, 2H), 5.11 (bs, 1Н). 4.55 (bs, 1Н), 3.51-3.46 (m, 1Н), 2.67 (dd, J = 13.6, 5.2 Гц, 1Н), 2.50 (dd, J = 13.6, 7.6 Гц, 1Н), 2.45 (dd, obs, 1Н), 2.37 (dd, J = 12.8, 6.8 Гц, 1Н), 1.61-1.40 (m, 8H), 0.89 (t, J = 7.6 Гц, 6Н).
Стадия 5: Гидрирование амина 161 согласно способу, который использовали в Примере 140, позволило получить Пример 143 в виде бледно-желтого масла. Выход (0.10 г, 100%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.12 (t, J = 7.4 Гц, 1Н), 6.98-6.94 (m, 3H), 3.94 (bs, 1Н), 3.53-3.47 (m, 1Н), 2.62 (dd, J = 13.6, 5.6 Гц, 1Н), 2.51 (dd, J = 13.2, 7.2 Гц, 1Н), 2.49-2.45 (m, obs., 3H), 2.37 (dd, J = 12.8, 7.2 Гц, 1Н), 1.55-1.51 (m, 2H), 1.35-1.21 (m, 8H), 0.84 (t, J = 7.0 Гц, 6Н).
ПРИМЕР 144
Приготовление 4-(5-(3-амино-1-гидроксипропил)-2-метоксифенетил)гептан-1-ола

4-(5-(3-амино-1-гидроксипропил)-2-метоксифенетил)гептан-1-ол был приготовлен согласно способу, который использовали в Примере 140.
Стадия 1: Добавление ацетонитрила в 3-бром-4-метоксибензальдегид позволило получить 3-(3-бром-4-метоксифенил)-3-гидроксипропаннитрил в виде бледно-оранжевого масла. Выход (10.32 г, 96%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.58 (d, J = 2.0 Гц, 1Н), 7.35 (dd, J = 8.8, 2.0 Гц, 1Н), 7.07 (d, J = 8.8 Гц, 1Н), 5.93 (d, J = 4.4 Гц, 1Н), 4.85-4.81 (m, 1Н). 3.81 (s, 3Н), 2.86 (ABd, J = 16.4, 4.8 Гц, 1Н), 2.79 (ABd, J = 16.8, 6.8 Гц, 1Н).
Стадия 2: Восстановление 3-(3-бром-4-метоксифенил)-3-гидроксипропаннитрила с помощью ВН3-ТНР с последующей защитой амина позволило получить N-(3-(3-бром-4-метоксифенил)-3-гидроксипропил)-2,2,2-трифторацетамид в виде оранжевого масла. Выход (5.76 г, 40%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.31 (bs, 1Н), 7.49 (d, J = 2.0 Гц, 1Н), 7.26 (dd, J = 8.8, 2.0 Гц, 1Н), 7.03 (d, J = 8.8 Гц, 1Н), 5.32 (d, J = 4.8 Гц, 1Н), 4.53-4.49 (m, 1Н), 3.80 (s, 3Н), 3.24-3.15 (m, 2H), 1.79-1.72 (m, 2H).
Стадия 3: N-(3-(3-бром-4-метоксифенил)-3-гидроксипропил)-2,2,2-трифторацетамид взаимодействовал с 4-этинилгептан-4-олом для получения 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгекс-1-инил)-4-метоксифенил) пропил)ацетамида в виде желтого масла. Выход (0.92 г, 55%):1H ЯМР (400 МГц, ДМСО-d6) δ 9.31 (t, J = 5.0 Гц, 1Н), 7.24-7.21 (m, 2H), 6.95 (d, J = 9.2 Гц, 1Н), 5.25 (d, J = 4.8 Гц, 1Н), 5.05 (s, 1Н), 4.51-4.47 (m, 1Н), 3.75 (s, 3Н), 3.24-3.17 (m, 2H), 1.77-1.72 (m, 2H), 1.61-1.42 (m, 8H), 0.89 (t, J = 7.0 Гц, 6Н).
Стадия 4: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгекс-1-инил)-4-метоксифенил)пропил)ацетамида позволило получить 4-((5-(3-амино-1-гидроксипропил)-2-метоксифенил)этинил)гептан-4-ол в виде бледно-желтого масла. Выход (0.53 г, 76%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.22-7.19 (m, 2H), 6.92 (d, J = 8.4 Гц, 1Н), 5.06 (bs, 1Н), 4.58-4.55 (m, 1Н), 3.74 (s, 3Н), 2.63-2.51 (m, 2H), 1.64-1.42 (m, 10Н),0.89(t, J = 7.0 Гц, 6Н).
Стадия 5: Гидрирование 4-((5-(3-амино-1-гидроксипропил)-2-метоксифенил)этинил)гептан-4-ола согласно способу, который использовали в Примере 140, позволило получить Пример 144 в виде бледно-желтого масла. Выход (0.11 г, 100%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.05-7.02 (m, 2H), 6.81 (d, J = 8.0 Гц, 1Н), 4.55-4.52 (m, 1H), 3.84 (bs, 1Н), 3.71 (s, 3Н), 2.64-2.61 (m, 2H), 2.47-2.43 (m, 2H), 1.65-1.53 (m, 2H), 1.50-1.45 (m, 2H), 1.39-1.21 (m, 8H), 0.85 (t, J = 6.8 Гц, 6Н).
ПРИМЕР 145
Приготовление 4-(5-(3-амино-1-гидроксипропил)-2-метилфенетил)гептан-4-ола
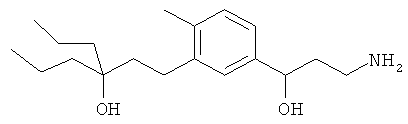
4-(5-(3-амино-1 -гидроксипропил)-2-метилфенетил)гептан-4-ол был приготовлен согласно способу, который использовали в Примере 140.
Стадия 1: Алкилирование 3-бром-4-метилбензальдегида ацетонитрилом позволило получить 3-(3-бром-4-метилфенил)-3-гидроксипропаннитрил в виде бледно-желтого масла. Выход (5.1 г, 94%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.59 (d, J = 1.2 Гц, 1Н), 7.31 (d, J = 8.0 Гц, 1Н), 7.28 (dd, J = 8.0 Гц, 1.2, 1Н), 5.99 (d, J = 4.8 Гц, 1Н), 4.87-4.84 (m, 1Н), 2.88 (ABd, J = 16.8, 4.8 Гц, 1Н), 2.80 (ABd, J = 16.8, 6.8 Гц, 1Н), 2.30 (s, 3Н).
Стадия 2: Восстановление 3-(3-бром-4-метилфенил)-3-гидроксипропаннитрила с помощью ВНз-ТНР с последующей защитой амина позволило получить N-(3-(3-бром-4-метилфенил)-3-гидроксипропил)-2,2,2-трифторацетамид в виде прозрачного масла. Выход (4.12 г, 57%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.31 (bs, 1Н), 7.50 (d, J = 1.6 Гц, 1Н), 7.27 (d, J = 8.4 Гц, 1Н), 7.20 (dd, J = 8.4, 1.6 Гц, 1Н), 5.38 (d, J = 4.4 Гц, 1Н), 4.56-4.52 (m, 1Н), 3.28-3.14 (m, 2H), 2.25 (s, 3Н), 1.83-1.75 (m, 2H).
Стадия 3: N-(3-(3-бром-4-метилфенил)-3-гидроксипропил)-2,2,2-трифторацетамид связывали с 4-этинилгептан-4-олом для получения 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгекс-1-инил)-4-метилфенил)пропил)ацетамида в виде желтого масла. Выход (0.286 г, 28%):1H ЯМР (400 МГц, ДМСО-d6) δ 9.31 (t, J = 5.2 Гц, 1Н), 7.27 (s, 1Н), 7.18 (d, J = 7.6 Гц, 1Н), 7.16 (dd, J = 7.6, 1.8 Гц, 1Н), 5.30 (d, J = 4.8 Гц, 1Н), 5.10 (s, 1Н), 4.54-4.50 (m, 1Н), 3.25-3.14 (m, 2H), 2.30 (s, 3Н), 1.78-1.72 (m, 2H), 1.63-1.36 (m, 8H), 0.89 (t, J = 7.2 Гц, 6Н).
Стадия 4: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгекс-1-инил)-4-метилфенил)пропил)ацетамида позволило получить 4-((5-(3-амино-1-гидроксипропил)-2-метилфенил)этинил)гептан-4-ол в виде бледно-желтого масла. Выход (0.161 г, 76%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.25 (s, 1Н), 7.17-7.12 (m, 2H), 5.11 (bs, 1Н), 4.59 (t, J = 6.4 Гц, 1Н), 2.64-2.52 (m, 2H), 2.30 (s, 3Н), 1.73-1.42 (m, 10Н), 0.89 (t, J = 7.2 Гц, 6Н).
Стадия 5: Гидрирование 4-((5-(3-амино-1-гидроксипропил)-2-метилфенил)этинил)гептан-4-ола позволило получить Пример 145 в виде бледно-желтого масла. Выход (0.11 г, 100%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.02-6.99 (m, 2H), 6.96 (dd, J = 8.0, 1.6 Гц, 1H), 4.57-4.54 (m, 1H), 3.96 (bs, 1H), 2.65-2.54 (m, 2H), 2.50-2.47 (m, obs, 2H), 2.19 (s, 3H), 1.63-1.53 (m, 2H), 1.47-1.43 (m, 2H), 1.37-1.22 (m, 8H), 0.86 (t, J = 7.2 Гц, 6Н).
ПРИМЕР 146
Приготовление 4-(3-(3-амино-1-гидроксипропил)-5-метоксифенетил)гептан-4-ола

4-(3-(3-амино-1-гидроксипропил)-5-метоксифенетил)гептан-4-ол был приготовлен согласно способу, который использовали в Примере 140.
Стадия 1: Алкилирование 3-бром-5-гидроксибензальдегида с помощью ацетонитрила позволило получить 3-(3-бром-5-метоксифенил)-3-гидроксипропаннитрил в виде бледно-желтого масла. Выход (4.1 г, 70%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.16-7.15 (m, 1H), 7.04-7.03 (m, 1H), 6.97-6.96 (m, 1H), 6.04 (d, J = 4.8 Гц, 1H), 4.87-4.83 (m, 1H), 3.74 (s, 3H), 2.89 (ABd, J = 16.4, 5.2 Гц, 1H), 2.81 (ABd, J = 16.8, 6.8 Гц, 1H).
Стадия 2: Восстановление 3-(3-бром-5-метоксифенил)-3-гидроксипропаннитрила с помощью ВН3-THF с последующей защитой амина позволило получить N-(3-(3-бром-5-метоксифенил)-3-гидроксипропил)-2,2,2-трифторацетамид в виде прозрачного масла. Выход (3.9 г, 68%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.30 (bs, 1H), 7.07 (t, J = 1.2 Гц, 1H), 6.98-6.97 (m, 1H), 6.88-6.87 (m, 1H), 5.44 (d, J = 4.8 Гц, 1H), 4.56-4.51 (m, 1H), 3.74 (m, 3H), 3.27-3.15 (m, 2H), 1.96-1.70 (m, 2H).
Стадия 3: Взаимодействие N-(3-(3-бром-5-метоксифенил)-3-гидроксипропил)-2,2,2-трифторацетамида с алкинолом 20 позволило получить 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгекс-1-инил)-5-метоксифенил)пропил)ацетамид в виде бледно-желтого масла. Выход (0.96 г, 66%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.31 (t, J = 4.8 Гц, 1H), 6.91 (s, 1H), 6.86-6.85 (m, 1H), 6.73-6.72 (m, 1H), 5.36 (d, J = 4.8 Гц, 1H), 5.11 (s, 1H), 4.55-4.50 (m, 1H), 3.73 (s, 3H), 3.27-3.16 (m, 2H), 1.81-1.69 (m, 2H), 1.61-1.39 (m, 8Н), 0.89 (t, J = 7.2 Гц, 6Н).
Стадия 4: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(3-(3-гидрокси-3-пропилгекс-1-инил)-5-метоксифенил)пропил)ацетамида позволило получить 4-((3-(3-амино-1-гидроксипропил)-5-метоксифенил)этинил)гептан-4-ол в виде бледно-желтого масла. Выход (0.63 г, 86%:1Н ЯМР (400 МГц, ДМСО-d6) δ 6.89 (s, 1Н), 6.84-6.83 (m, 1H), 6.70-6.69 (m, 1H), 5.12 (bs, 1H), 4.60 (t, J = 6.2 Гц, 1H), 3.72 (s, 3Н), 2.60-2.53 (m, 2H), 1.61-1.39 (m, 10Н), 0.89 (t, J = 7.2 Гц, 6Н).
Стадия 5: Гидрирование 4-((3-(3-амино-1-гидроксипропил)-5-метоксифенил)этинил)гептан-4-ола позволило получить Пример 146 в виде бледно-желтого масла. Выход (0.10 г, 100%):1Н ЯМР (400 МГц, ДМСО-d6) δ 6.81 (s, 1H), 6.65 (s, 1H), 6.54 (s, 1H), 4.56 (t, J = 6.4 Гц, 1H), 3.94 (bs, 1H), 3.69 (s, 3Н), 2.66-2.58 (m, 2H), 2.48-2.44 (m, obs, 2H), 1.60 (q, J = 6.8 Гц, 2H), 1.55-1.51 (m, 2H), 1.34-1.22 (m, 8H), 0.84 (t, J = 7.2 Гц, 6Н).
ПРИМЕР 147
Приготовление 4-(3-(3-амино-1-гидроксипропил)-4-хлорфенетил)гептан-4-ола

4-(3-(3-амино-1-гидроксипропил)-4-хлорфенетил)гептан-4-ол был приготовлен согласно способу, который использовали в Примере 140:
Стадия 1: Алкилирование 5-бром-2-хлорбензальдегида ацетонитрилом позволило получить 3-(5-бром-2-хлорфенил)-3-гидроксипропаннитрил в виде бледно-желтой жидкости. Выход (4.42 г, 75%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.74 (d, J = 2.8 Гц, 1H), 7.53 (dd, J = 8.8, 2.8 Гц, 1H), 7.39 (d, J = 8.8 Гц, 1H), 6.30 (d, J = 4.8 Гц, 1H), 5.13-5.09 (m, 1H), 2.96 (ABd, J = 16.8, 4.8 Гц, 1H), 2.83 (ABd, J = 17.0, 6.0 Гц, 1Н).
Стадия 2: Восстановление 3-(5-бром-2-хлорфенил)-3-гидроксипропаннитрила с помощью ВН3-THF с последующей защитой амина позволило получить N-(3-(5-бром-2-хлорфенил)-3-гидроксипропил)-2,2,2-трифторацетамид в виде оранжевого масла. Выход (2.6 г, 43%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.42 (bs, 1H), 7.67 (d, J = 2.4 Гц, 1H), 7.45 (dd, J = 8.8, 2.4 Гц, 1H), 7.33 (d, J = 8.8 Гц, 1H), 5.64 (d, J = 4.4 Гц, 1H), 3.33-3.29 (m, 2H), 1.96-1.80 (m, 1H), 1.68-1.59 (m. 1H).
Стадия 3: N-(3-(5-бром-2-хлорфенил)-3-гидроксипропил)-2,2,2-трифторацетамид взаимодействовал с 4-этинилгептан-4-олом для получения N-(3-(2-хлор-5-(3-гидрокси-3-пропилгекс-1-инил)фенил)-3-гидроксипропил)-2,2,2-трифторацетамида в виде бледно-желтого масла. Выход (1.03 г, 68%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.42 (t, J = 5.6 Гц, 1H), 7.53 (d, J = 2.0 Гц, 1H), 7.34 (d, J = 8.0 Гц, 1H), 7.23 (dd, J = 8.0 Гц, 2.0, 1H), 5.57 (d, J = 4.0 Гц, 1H), 5.17 (s, 1H), 4.87-4.82 (m, 1H), 3.33-3.28 (m, 2H), 1.87-1.79 (m, 1H), 1.66-1.39 (m, 9H), 0.89 (t, J = 7.2 Гц, 6Н).
Стадия 4: Снимали защиту N-(3-(2-хлор-5-(3-гидрокси-3-пропилгекс-1-инил)фенил)-3-гидроксипропил)-2,2,2-трифторацетамида для получения 4-((3-(3-амино-1-гидроксипропил)-4-хлорфенил)этинил)гептан-4-ола в виде бледно-желтого масла. Выход (0.77 г, 98%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.53 (d, J = 2.4 Гц, 1Н), 7.34 (d, J = 8.0 Гц, 1Н), 7.23 (dd, J J =8.0, 2.4 Гц, 1Н), 5.17 (bs, 1Н), 4.93 (dd, J = 8.8, 2.4 Гц, 1Н), 2.72-2.63 (m, 2H), 1.70-1.62 (m, 1Н), 1.59-1.39 (m, 9H), 0.89 (t, J = 7.2 Гц, 6Н).
Стадия 5: Гидрирование 4-((3-(3-амино-1-гидроксипропил)-4-хлорфенил)этинил)гептан-4-ола согласно способу, который использовали в Примере 140, позволило получить Пример 147 в виде бледно-желтого масла. Выход (0.11 г, 100%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.37 (d, J = 2.4 Гц, 1Н), 7.21 (d, J = 8.0 Гц, 1Н), 7.03 (dd, J = 8.0, 2.4 Гц, 1Н), 4.94-4.91 (m, 1Н), 3.99 (bs, 1Н), 2.72 (t, J = 7.0 Гц, 2H), 2.53-2.49 (m, 2H), 1.74-1.66 (m, 1Н), 1.58-1.49 (m, 3Н), 1.35-1.20 (m, 8H), 0.84 (t, J = 6.8 Гц, 6Н).
ПРИМЕР 148
Приготовление 4-(3-(3-амино-1-гидроксипропил)-4-метилфенетил)гептан-4-ола

4-(3-(3-амино-1-гидроксипропил)-4-метилфенетил)гептан-4-ол был приготовлен согласно способу, который использовали в Примере 140.
Стадия 1: Добавление 5-бром-2-метилбензальдегида в ацетонитрил позволило получить 3-(5-бром-2-метилфенил)-3-гидроксипропаннитрил в виде бледно-желтого масла. Выход (3.33 г, 86%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.61 (d, J = 2.0 Гц, 1Н), 7.35 (dd, J = 8.0, 2.0 Гц, 1Н), 7.09 (d, J = 8.0 Гц, 1Н), 5.96 (d, J = 4.4 Гц, 1Н), 5.04-5.00 (m, 1Н), 2.88 (ABd, J = 16.8, 4.4 Гц, 1Н), 2.77 (ABd, J = 16.8, 6.4 Гц, 1Н), 2.23 (s, 3Н).
Стадия 2: Восстановление 3-(5-бром-2-метилфенил)-3-гидроксипропаннитрила с помощью ВН3-THF с последующей защитой амина позволило получить N-(3-(3-бром-2-метилфенил)-3-гидроксипропил)-2,2,2-трифторацетамид в виде бледно-желтого масла. Выход (3.25 г, 69%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.38 (bs, 1Н), 7.53 (d, J = 2.4 Гц, 1Н), 7.28 (dd, J = 8.0, 2.4 Гц, 1Н), 7.05 (d, J = 8.0 Гц, 1Н), 4.73-4.70 (m, 1Н), 3.36-3.26 (m, 2H), 2.17 (s, 3Н), 1.79-1.71 (m, 1Н), 1.68-1.59 (m, 1Н).
Стадия 3: N-(3-(3-бром-2-метилфенил)-3-гидроксипропил)-2,2,2-трифторацетамид взаимодействовал с 4-этинилгептан-4-олом для получения 2,2,2-трифтор-N-(3-гидрокси-3-(5-(3-гидрокси-3-пропилгекс-1-инил)-2-метилфенил)пропил)ацетамида в виде желтого масла. Выход (1.11 г, 62%):1H ЯМР (400 МГц, ДМСО-d6) δ 9.38 (t, J = 5.2 Гц, 1Н), 7.41 (d, J = 1.6 Гц, 1Н), 7.11 (dd, J = 8.0,1.6 Гц, 1Н), 7.07 (d, J = 8.0 Гц, 1H), 5.26 (d, J = 4.4 Гц, 1Н), 5.08 (s, 1Н), 4.74-4.70 (m, 1Н), 3.35-3.25 (m, 2H), 2.21 (s, 3H), 1.78-1.70 (m, 2H), 1.68-1.40 (m, 8H), 0.89 (t, J = 7.2 Гц, 6Н)
Стадия 4: Снятие защиты 2,2,2-трифтор-N-(3-гидрокси-3-(5-(3-гидрокси-3-пропилгекс-1-инил)-2-метилфенил)пропил)ацетамида позволило получить 4-((3-(3-амино-1-гидроксипропил)-4-метилфенил)этинил)гептан-4-ол в виде бледно-желтого масла. Выход (0.71 г, 85%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.41 (d, J = 1.6 Гц, 1Н), 7.08 (dd, J = 7.6, 1.4 Гц, 1Н), 7.05 (d, J = 7.6 Гц, 1Н), 5.09 (bs, 1Н), 4.83-4.80 (m, 1Н), 2.72-2.61 (m, 2H), 2.23 (s, 3H), 1.61-1.41 (m, 10Н), 0.89 (t, J = 7.0 Гц, 6Н).
Стадия 5: Гидрирование 4-((3-(3-амино-1-гидроксипропил)-4-метилфенил)этинил)гептан-4-ола согласно способу, который использовали в Примере 140, позволило получить Пример 148 в виде бледно-желтого масла. Выход (0.11 г, 100%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.22 (d, J = 1.6 Гц, 1Н), 6.94 (d, J = 7.6 Гц, 1Н), 6.87 (dd, J = 7.6, 1.6 Гц, 1Н), 4.82-4.78 (m, 1Н), 3.94 (bs, 1Н), 2.74-2.64 (m, 2H), 2.47-2.43 (m, obs., 2H), 2.18 (s, 3H), 1.59-1.49 (m, 4H), 1.34-1.22 (m, 8H), 0.84 (t, J = 7.0 Гц, 6Н).
ПРИМЕР 149
Приготовление 1-(3-(3-амино-2-гидроксипропил)фенил)-3-этилпентан-3-ола

1-(3-(3-амино-2-гидроксипропил)фенил)-3-этилпентан-3-ол был приготовлен согласно способу, который использовали в Примере 143.
Стадия 1: Взаимодействие бромида 159 с 3-этилпент-1-ин-3-олом позволило получить N-(3-(3-(3-этил-3-гидроксипент-1-инил)фенил)-2-гидроксипропил)-2,2,2-трифторацетамид в виде прозрачного масла. Выход (0.472 г, 66%):1H ЯМР (400 МГц, ДМСО-d6) δ 9.32 (t, J = 5.6 Гц, 1Н), 7.26-7.22 (m, 2H), 7.20-7.16 (m, 2H), 5.11 (s, 1Н), 4.96 (d, J = 5.6 Гц, 1Н), 3.80-3.74 (m, 1Н), 3.21-3.07 (m, 2H), 2.68 (dd, J = 14.0, 4.8 Гц, 1Н), 2.53 (dd, J = 13.6, 7.6 Гц, 1Н), 1.66-1.52 (m, 4H), 0.96 (t, J = 7.2 Гц, 6Н).
Стадия 2: Снятие защиты N-(3-(3-(3-этил-3-гидроксипент-1-инил)фенил)-2-гидроксипропил)-2,2,2-трифторацетамида позволило получить N-(3-(3-(3-этил-3-гидроксипент-1-инил)фенил)-2-гидроксипропил)-2,2,2-трифторацетамид в виде бледно-желтого масла. Выход (0.232 г, 69%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.24-7.20 (m, 2H), 7.17-7.15 (m, 2H), 5.11 (bs, 1Н), 4.55 (bs, 1Н), 3.51-3.45 (m, 1Н), 2.67 (dd, J = 13.6, 5.2 Гц, 1Н), 2.51 (dd, J = 13.6, 7.6 Гц, 1Н), 2.45 (obs dm, J = 4 4 Гц, 1Н), 2.37 (dd, J = 12.8, 6.8 Гц, 1Н), 1.66-1.52 (m, 4H), 0.96 (t, J = 7.2 Гц, 6Н).
Стадия 3: Гидрирование N-(3-(3-(3-этил-3-гидроксипент-1-инил)фенил)-2-гидроксипропил)-2,2,2-трифторацетамида согласно способу, который использовали в Примере 140, позволило получить Пример 149 в виде бледно-желтого масла. Выход (0.83 г, 100%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.12 (t, J = 7.6 Гц, 1Н), 6.99 (s, 1Н), 6.97-6.95 (m, 2H), 3.91 (bs, 1Н), 3.54-3.47 (m, 1Н), 2.62 (dd, J = 13.6, 5.6 Гц, 1Н), 2.53 (dd, obs, 1Н), 2.48-2.45 (m, obs., 3H), 2.37 (dd, J = 12.8, 7.2 Гц, 1Н), 1.54-1.50 (m, 2H), 1.37 (q, J = 7.6 Гц, 4H), 0.79 (t, J = 7.6 Гц, 6Н).
ПРИМЕР 150
Приготовление 1-(3-(3-амино-2-гидроксипропил)фенетил)циклопентанола
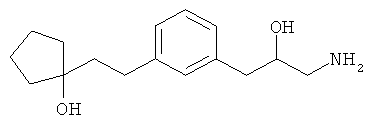
1-(3-(3-амино-2-гидроксипропил)фенетил)циклопентанол был приготовлен согласно способу, который использовали в Примере 149.
Стадия 1: Взаимодействие бромида 159 с 1-этинилциклопентанолом позволило получить 2,2,2-трифтор-N-(2-гидрокси-3-(3-((1-гидроксициклопентил)этинил)фенил) пропил)ацетамид в виде прозрачного масла. Выход (0.441 г, б2%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.32 (t, J = 5.6 Гц, 1Н), 7.26-7.22 (m, 2H), 7.19-7.16 (m, 2H), 5.26 (bs, 1Н), 4.97 (bs, 1Н), 3.78 (bs, 1Н), 3.20-3.06 (m, 2H), 2.67 (dd, J = 14.0, 4.8 Гц, 1Н), 2.53 (dd, J = 13.6, 7.6 Гц, 1Н), 1.91-1.79 (m, 4H), 1.76-1.60 (m, 4H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(2-гидрокси-3-(3-((1-гидроксициклопентил)этинил)фенил)пропил)ацетамида позволило получить 1-((3-(3-амино-2-гидроксипропил)фенил)этинил)циклопентанол в виде бледно-желтого твердого вещества. Выход (0.217 г, 69%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.24-7.20 (m, 2H), 7.17-7.15 (m, 2H), 5.26 (bs, 1Н), 4.55 (bs, 1Н), 3.51-3.45 (m, 1Н), 2.66 (dd, J = 13.6, 5.2 Гц, 1Н), 2.51 (dd, J = 13.6, 8.0 Гц, 1Н), 2.45 (obs dm, J = 4 4 Гц, 1Н), 2.36 (dd, J = 12.8, 6.8 Гц, 1Н), 1.91-1.80 (m, 4H), 1.76-1.60 (m, 4H).
Стадия 3: Гидрирование 1-((3-(3-амино-2-гидроксипропил)фенил)этинил)циклопентанола позволило получить Пример 150 в виде бледно-желтого масла. Выход (0.11 г, 100%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.12 (t, J = 7.4 Гц, 1Н), 7.00 (s, 1Н), 6.97-6.95 (m, 2H), 4.07 (bs, 1Н), 3.57-3.45 (m, 1Н), 2.62-2.58 (m, 3H), 2.52 (dd, J = 13.2, 7.2 Гц, 1Н), 2.49 (dd, obs., 1Н), 2.36 (dd, J = 12.8, 6.8 Гц, 1Н), 1.72-1.67 (m, 4H), 1.57-1.40 (m, 6Н).
ПРИМЕР 151
Приготовление 1-(3-(3-аминопропил)фенил)-2-циклогексилэтанона
1-(3-(3-аминопропил)фенил)-2-циклогексилэтанон был приготовлен согласно способц, показанному на Схеме 32.
Схема 32

Стадия 1: Бромметилциклогексан (5.26 г, 29.7 ммоль) добавляли в атмосфере аргона в Mg стружку (0.72 г, 29.7 ммоль) в безводном THF, содержащем кристаллы I2. Смесь нагревали с обратным холодильником в атмосфере аргона в течение 3 ч, охлаждали до комнатной температуры и через шприц вводили в перемешивающийся раствор 3-бромбензальдегида (30) (5.0 г, 27.0 ммоль) в безводном THF, охлажденном до 0°С. Реакционную смесь перемешивали при комнатной температуре в течение ночи и разделяли между насыщенным раствором NH4Cl и EtOAc. Органический слой высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (10% EtOAc/гексаны) позволила получить спирт 162 в виде прозрачного масла. Выход (2.72 г, 36%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.47 (t, J = 1.6 Гц, 1Н), 7.37 (dt, J = 7.2, 2.0 Гц, 1Н), 7.28-7.21 (m, 2H), 5.17 (d, J = 5.2 Гц, 1Н), 4.59-4.54 (m, 1Н), 1.76 (d, J = 12.8 Гц, 1Н), 1.64-1.56 (m, 4H), 1.49-1.27 (m, 3Н), 1.21-1.06 (m, 3Н), 0.93-0.80 (m, 2H).
Стадия 2: Реакция Хека бромида 162 и трет-бутил проп-2-инилкарбамата согласно способу, который использовали в Примере 154, позволило получить (Е)-алкен 163 в виде прозрачного масла. Выход (0.207 г, 48%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.29 (s, 1Н), 7.24-7.19 (m, 2H), 7.14-7.12 (m, 1H), 7.14 (t, J = 5.6 Гц, 1Н), 6.41 (d, J = 16.0 Гц, 1Н), 6.16 (dt, J = 16.0, 5.6 Гц, 1Н), 5.01 (d, J = 4.4 Гц, 1Н), 4.57-4.53 (m, 1Н), 3.69 (t, J = 5.2 Гц, 2H), 1.74 (d, J = 12.8 Гц, 1Н), 1.66-1.42 (m, 5H), 1.40-1.28 (m, 11Н), 1.21-1.04 (m, 3H), 0.92-0.84 (m, 2H).
Стадия 3: Гидрирование (Е)-алкена 163 согласно способу, который использовали в Примере 2, за исключением того, что реакцию проводили в EtOAc, позволило получить алкан 164 в виде прозрачного масла. Выход (0.197 г, 100%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.17 (t, = 7.2 Гц, 1Н), 7.11-7.06 (m, 2H), 6.99 (d, J = 7.6 Гц, 1Н), 6.82 (t, J = 5.2 Гц, 1Н), 4.96 (d, J = 4.4 Гц, 1Н), 4.55-4.51 (m, 1Н), 2.90 (m, 2H), 2.52-2.46 (m, obs., 2H), 1.74 (d, J = 12.4 Hz, 1Н), 1.66-1.51 (m, 6H), 1.50-1.43 (m, 1H), 1.40-1.27 (m, 11H), 1.21-1.06 (m, 3H), 0.91-0.82 (m, 2H).
Стадия 4: PCC окисление спирта 164 согласно способу, который использовали в Примере 70, позволило получить кетон 165 в виде прозрачного масла. Выход (0.134 г, 74%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.75-7.72 (m, 2H), 7.43 (dt, J = 8.0, 1.6 Гц, 1Н), 7.39 (t, J = 7.6 Гц, 1Н), 6.84 (t, J = 5.2 Гц, 1Н), 2.93-2.88 (m, 2H), 2.84 (d, J = 6.4 Гц, 2H), 2.60 (t, J = 7.6 Гц, 2H), 1.86-1.77 (m, 1Н), 1.70-1.56 (m, 7H), 1.35 (s, 9H), 1.24-1.07 (m, 3H), 1.00-0.91 (m, 2H).
Стадия 5: трет-Бутил 3-(3-(2-циклогексилацетил)фенил)пропилкарбамат (165) (0.124 г, 0.345 ммоль) растворяли в EtOAc и охлаждали в ледяной ванне. Поток пузырьков НС1 пропускали через раствор в течение 2 мин и перемешивали в течении 2 ч при 0°С. Белый осадок собирали фильтрацией, отмывали EtOAc и высушивали в вакууме для получения Примера 153 гидрохлорида в виде белого твердого вещества. Выход (0.7 г, 69%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.95 (br.s, 3H), 7.80-7.77 (m, 2H), 7.48-7.41 (m, 2H), 2.84 (d, J = 6.8 Гц, 2H), 2.77-2.68 (m, 4H), 1.89-1.77 (m, 3H), 1.66-1.56 (m, 5H), 1.25-1.05 (m, 3H), 1.01-0.91 (m, 2H).
ПРИМЕР 152
Приготовление 1-(3-(3-амино-2-гидроксипропил)фенетил)циклогексанола

1-(3-(3-амино-2-гидроксипропил)фенетил)циклогексанол был приготовлен согласно способу, который использовали в Примере 149.
Стадия 1: Взаимодействие бромида 159 с 1-этинилциклогексанолом позволило получить 2,2,2-трифтор-N-(2-гидрокси-3-(3-((1-гидроксициклогексил)этинил)фенил)пропил)ацетамид в виде прозрачного масла. Выход (0.48 г, 65%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.32 (t, J = 5.6 Гц, 1Н), 7.26-7.22 (m, 2H), 7.20-7.16 (m, 2H), 5.37 (s, 1H), 4.97 (d, J = 5.6 Гц, 1H), 3.82-3.75 (m, 1H), 3.21-3.07 (m, 2H), 2.66 (dd, J = 14.0, 4.8 Гц, 1H), 2.55 (dd, J = 13.6, 7.8 Гц, 1H), 1.83-1.79 (m, 2H), 1.63-1.60 (m, 2H), 1.54-1.44 (m, 5H), 1.23-1.18 (m, 1H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(2-гидрокси-3-(3-((1-гидроксициклогексил)этинил)фенил)пропил)ацетамида позволило получить 1-((3-(3-амино-2-гидроксипропил)фенил)этинил)циклогексанол в виде бледно-желтого твердого вещества. Выход (0.227 г, 65%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.25-7.21 (m, 2H), 7.18-7.15 (m, 2H), 5.37 (bs, 1H), 4.59 (bs, 1H), 3.53-3.47 (m, 1H), 2.67 (dd, J = 13.6, 5.2 Гц, 1H), 2.51 (dd, J = 13.6, 7.6 Гц, 1H), 2.48 (obs m, 1H), 2.38 (dd, J = 12.8, 6.8 Гц, 1H), 1.83-1.77 (m, 2H), 1.63-1.60 (m, 2H), 1.54-1.45 (m, 5H), 1.23-1.18 (m, 1H).
Стадия 3: Гидрирование 1-((3-(3-амино-2-гидроксипропил)фенил)этинил) циклогексанола позволило получить Пример 152 в виде бледно-желтого масла. Выход (0.12 г, 100%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.12 (t, J = 7.2 Гц, 1H), 6.99-6.94 (m, 3H), 3.96 (bs, 1H), 3.53-3.47 (m, 1H), 2.61 (dd, J = 13.2, 5.6 Гц, 1H), 2.61-2.46 (m, obs., 4H), 2.37 (dd, J = 12.8, 7.2 Гц, 1H), 1.59-1.51 (m, 4H), 1.48-1.40 (m, 3H), 1.37-1.27 (m, 4H), 1.23-1.15 (m, 1H).
ПРИМЕР 153
Приготовление 2-(3-(3-аминопропил)фенил)-1-циклогексилэтанона

2-(3-(3-аминопропил)фенил)-1-циклогексилэтанон был приготовлен согласно способу, который использовали в Примере 151.
Стадия 1: Реакция Гриньяра между циклогексанкарбальдегидом и 3-бромбензил магния бромидом (0.25М в эфире) позволила получить 2-(3-бромфенил)-1-циклогексилэтанол в виде белого твердого вещества. Выход (1.62 г, 23%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.39 (d, J = 0.8 Гц, 1H), 7.34-7.31 (m, 1H), 7.20-7.17 (m, 2H), 4.37 (d, J = 6.0 Гц, 1H), 3.38-3.32 (m, 1H), 2.69 (dd, J = 13.6, 3.6 Гц, 1H), 2.51-2.45 (dd, obs., 1H), 1.78-1.60 (m, 5H), 1.24-0.94 (m, 6H).
Стадия 2: Реакция Хека 2-(3-бромфенил)-1-циклогексилэтанола и трет-бутал проп-2-инилкарбамата позволила получить (Е)-трет-бутил. 3-(3-(2-циклогексил-2-гидроксиэтил)фенил)аллилкарбамат в виде прозрачного масла. Выход (0.362 г, 45%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.20 (s, 1H), 7.18-7.14 (m. 2H), 7.05-7.03 (m, 2H), 6.38 (d, J = 16.0 Гц, 1H), 6.14 (dt, J = 16.0, 5.8 Гц, 1H), 4.29 (d, J = 6.0 Гц, 1H), 3.68 (t, J = 6.2 Гц, 2H), 2.67 (dd, J = 13.6, 4.4 Гц, 1H), 2.50 (dd, obs., 1H), 1.78-1.57 (m, 5H), 1.37 (s, 9H), 1.21-0.99 (m, 6H).
Стадия 3: Гидрирование (Е)-трет-бутил 3-(3-(2-циклогексил-2-гидроксиэтил)фенил)аллилкарбамата позволило получить трет-бутил 3-(3-(2-циклогексил-2-гидроксиэтил)фенил)пропилкарбамат в виде прозрачного масла. Выход (0.356 г, 100%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.12 (t, J = 7.4, 1H), 6.99-6.94 (m, 3Н), 6.82 (t, J = 5.2 Гц, 1H), 4.26 (d, J = 5.6 Гц, 1H), 3.40-3.34 (m, 1H), 2.89 (q, J = 6.6 Гц, 2H), 2.64 (dd, J = 13.6, 4.4 Гц, 1H), 2.50 (m, obs., 3Н), 1.78-1.58 (m, 7H), 1.35 (s, 9H), 1.19-0.96 (m, 6H).
Стадия 4: РСС окисление трет-бутил 3-(3-(2-циклогексил-2-гидроксиэтил)фенил)пропилкарбамата позволило получить трет-бутил 3-(3-(2-циклогексил-2-оксиэтил)фенил)пропилкарбамат в виде прозрачного масла. Выход (0.254 г, 73%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.17 (t, J = 7.6 Гц, 1H), 7.02 (d, J = 8.0 Гц, 1H), 6.93-6.93 (m, 2H), 6.82 (t, J = 5.2 Гц, 1H), 3.73 (s, 2H), 2.89 (q, J = 6.4 Гц, 2H), 2.51-2.42 (m, obs., 3Н), 1.77-1.74 (m, 2H), 1.67-1.56 (m, 5H), 1.35 (s, 9H), 1.20-1.08 (m, 5H).
Стадия 5: Снятие защиты трет-бутил 3-(3-(2-циклогексил-2-оксиэтил)фенил)пропилкарбамата позволило получить Пример 153 гидрохлорид в виде грязно-белого твердого вещества. Выход (0.162 г, 80%):1H ЯМР (400 МГц, ДМСО-d6) δ 8.04 (br.s, 3Н), 7.20 (t, J = 7.6 Гц, 1H), 7.05 (d, J = 8.0 Гц, 1H), 6.98-6.96 (m, 2H), 3.75 (s, 2H), 2.76-2.69 (m, 2H), 2.59 (t, J = 7.8 Гц, 2H), 2.49-2.43 (m, obs, 1H), 1.85-1.75 (m, 4H), 1.69-1.65 (m, 2H), 1.59-1.56 (m, 1H), 1.27-1.08 (m, 5H).
ПРИМЕР 154
Приготовление 1-(3-(3-амино-1-гидроксипропил)-5-фторфенетил)циклогексанола

1-(3-(3-амино-1-гидроксипропил)-5-фторфенетил)циклогексанол был приготовлен согласно способу, который использовали в Примерах 2, 16, 17, 19 и 118.
Стадия 1: Реакция 3-бром-5-фторбензальдегида с ацетонитрилом согласно способу, описанному в Примере 16, позволила получить 3-бром-5-фторбензальдегид в виде бледно-желтого масла. Выход (2.5 г, 86%):1Н ЯМР (400 МГц, CDCl3) δ 7.34 (t, J = 1.6 Гц, 1Н), 7.23 (dt, J = 8.0, 1.6 Гц, 1Н), 7.08-7.11 (m, 1H), 5.03 (t, J = 6.4 Гц, 1Н), 2.75 (d, J = 6.0 Гц, 2Н).
Стадия 2: Восстановление 3-бром-5-фторбензальдегида с помощью боран-диметилсульфидного комплекса согласно способу, описанному в Примере 17, с последующей защитой этилтрифторацетатом согласно способу, описанному в Примере 19, позволило получить N-(3-(3-бром-5-фторфенил)-3-гидроксипропил)-2,2,2-трифторацетамид в виде светло-желтого масла. Выход (1.0 г, 30%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.30 (t, J = 5.6 Гц, 1Н), 7.34-7.38 (m, 2Н), 7.17 (dt, J = 9.6, 1.6 Гц, 1Н), 5.57 (d, J = 4.4 Гц, 1Н), 4.57-4.62 (m, 1Н), 3.14-3.30 (m, 2Н), 1.70-1.86 (m, 2Н).
Стадия 3: Смесь N-(3-(3-бром-5-фторфенил)-3-гидроксипропил)-2,2,2-трифторацетамида (0.58 г, 1.57 ммоль), 1-винилциклогексанола (0.3 г, 2.38 ммоль) и ацетата палладия (0.03 г, 0.12 ммоль) в тетрабутиламмоний ацетате (1.0 г) и DMF (1 мл) нагревали при 90°С в течение 1 ч. После охлаждения до комнатной температуры реакционную смесь разделяли между водой (40 мл) и этилацетатом (60 мл). Этилацетатную часть высушивали над Na2SO4. Очистка хроматографией (градиент от 40 до 60% ЕtOАс-гексаны) позволила получить (E)-2,2,2-трифтор-N-(3-(3-фтор-5-(2-(1-гидроксициклогексил)винил)фенил)-3-гидроксипропил)ацетамид в виде бесцветного масла. Выход (0.25 г, 54%):1H ЯМР (400 МГц, ДМСО-d6) δ 9.32 (t, J = 5.6 Гц, 1Н), 6.94-7.18 (m, 3H), 6.41-6.53 (m, 2Н), 5.42 (d, J = 4.4 Гц, 1Н), 4.54-4.60 (m, 1Н), 3.18-3.26 (m, 2Н), 1.72-1.86 (m, 2Н), 1.38-1.66 (m, 10Н).
Стадия 4: Снятие защиты (E)-2,2,2-трифтор-N-(3-(3-фтор-5-(2-(1-гидроксициклогексил)винил)фенил)-3-гидроксипропил)ацетамида согласно способу, описанному в Примере 2, позволило получить (E)-1-(3-(3-амино-1-гидроксипропил)-5-фторстирил)циклогексанол в виде бесцветного масла. Выход (0.065 г, 43%):1Н ЯМР (400 МГц, MeOD) δ 7.19 (s, 1Н), 7.00 (dt, J = 9.6, 2.0 Гц, 1Н), 6.94 (dt, J = 9.6, 1.6 Гц, 1Н), 6.58 (d, J = 16.4 Гц, 1Н), 6.39 (d, J = 16.4 Гц, 1Н), 4.72 (t, J = 6.0 Гц, 1Н), 2.70-2.80 (m, 2Н), 1.50-1.88 (m, 10H).
Стадия 5: Гидрирование (E)-1-(3-(3-амино-1-гидроксипропил)-5-фторстирил)циклогексанола согласно способу, описанному в Примере 2, позволило получить Пример 154 в виде бледно-желтого масла, которое растворяли в МеОН и обрабатывали НСl/ЕtOН. Смесь концентрировали при пониженном давлении, остаток ресуспендировали в EtOAc и твердую фазу собирали фильтрацией для получения Примера 154 гидрохлорида в виде белого твердого вещества. Выход (0.05 г, 90%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.88 (bs, 3H), 6.98 (s, 1Н), 6.86-6.93 (m, 2Н), 5.60 (d, J = 4.0 Гц, 1Н), 4.66 (t, J = 4.0 Гц, 1Н), 2.74-2.84 (m, 2H), 2.58-2.62 (m, 2H), 1.72-1.90 (m, 2H), 1.10-1.58 (m, 13H).
ПРИМЕР 155
Приготовление 1-(3-(3-амино-1-гидроксипропил)-2-фторфенетил)циклогексанола

1-(3-(3-амино-1-гидроксипропил)-2-фторфенетил)циклогексанол был приготовлен согласно способу, который использовали в Примере 154.
Стадия 1: Реакция 3-бром-2-фторбензальдегида с ацетонитрилом позволила получить 3-(3-бром-2-фторфенил)-3-гидроксипропаннитрил в виде светло-желтого масла.1Н ЯМР (400 МГц, CDCl3) δ 7.54 (t, J = 7.2 Гц, 2H), 7.11 (td, J = 7.6, 0.4 Гц, 1Н), 5.37 (dd, J = 6.8, 4.4 Гц, 1Н), 2.73-2.91 (m, 2H).
Стадия 2: Восстановление 3-(3-бром-2-фторфенил)-3-гидроксипропаннитрила с помощью боран-диметилсульфидного комплекса позволило получить N-(3-(3-бром-2-фторфенил)-3-гидроксипропил)-2,2,2-трифторацетамид в виде светло-желтого масла. Выход (0.3 г, 44%):1H ЯМР (400 МГц, ДМСО-d6) δ 7.54-7.58 (m, 1Н), 7.45-7.49 (m, 1Н), 7.12-7.17 (m, 1Н), 4.86 (dd, J = 6.8, 4.4 Гц, 1Н), 3.27 (t, J = 7.2 Гц, 2H), 1.73-1.86 (m, 2H).
Способ 3: Взаимодействие N-(3-(3-бром-2-фторфенил)-3-гидроксипропил)-2,2,2-трифторацетамида и 1-винилциклогексанола позволило получить (E)-2,2,2-трифтор-N-(3-(2-фтор-3-(2-(1-гидроксициклогексил)винил)фенил)-3-гидроксипропил)ацетамид в виде бесцветного масла. Выход (0.13 г, 54%):1Н ЯМР (400 МГц, СD3OD) δ 7.42 (td, J = 7.6, 1.2 Гц, 1Н), 7.36 (td, J = 7.2, 1.2 Гц, 1Н), 7.11 (t, J = 8.0 Гц, 1Н), 6.76 (d, J = 16 Гц, 1Н), 6.42 (d, J = 16 Гц, 1Н), 5.02 (dd, J = 6.8, 4.4 Гц, 1Н), 3.41 (t, J = 7.2 Гц, 2H), 1.73-2.00 (m, 2H), 1.50-1.78 (m, 9H), 1.30-1.40 (m. 1H).
Стадия 4: Снятие защиты (E)-2,2,2-трифтор-N-(3-(2-фтор-3-(2-(1-гидроксициклогексил)винил)фенил)-3-гидроксипропил)ацетамида позволило получить (Е)-1-(3-(3-амино-1-гидроксипропил)-2-фторстирил)циклогексанол в виде бесцветного масла. Выход (0.05 г, 561H ЯМР (400 МГц, ДМСО-d6) δ 7.39 (t, J = 6.8 Гц, 1Н), 7.29 (t, J = 6.4 Гц, 1Н), 7.09 (t, J = 7.6 Гц, 1Н), 6.62 (d, J = 16 Гц, 1Н), 6.42 (d, J = 16 Гц, 1Н), 4.88 (t, J = 6.0 Гц, 1Н), 2.57 (t, J = 7.2 Гц, 2H), 1.10-1.68 (m, 12H).
Стадия 5: Гидрирование (Е)-1-(3-(3-амино-1-гидроксипропил)-2-фторстирил)циклогексанола позволило получить Пример 155 гидрохлорид в виде белого твердого вещества. Выход (0.045 г, 85%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.88 (br.s, 3Н), 7.06-7.30 (m, 3Н), 5.5 (br.s, 1H), 4.89-4.92 (m, 2H), 2.78-2.88 (m, 2H), 2.59-2.63 (m, 2H), 1.76-1.96 (m, 2H), 1.12-1.62 (m, 13H).
ПРИМЕР 156
Приготовление 3-(3-(циклогексилтиометил)фенил)проп-2-ин-1-амина

3-(3-(циклогексилтиометил)фенил)проп-2-ин-1-амин был приготовлен согласно способу, представленному ниже.
Стадия 1: Смесь циклогексилмеркаптана (1.09 мл, 8.89 ммоль), 3-бромбензилбромида (2.22 г, 8.882 ммоль) и К2СО3 (2.54 г, 18.38 ммоль) в ацетоне перемешивали в атмосфере аргона при комнатной температуре в течение 4 ч, после чего фильтровали. Фильтрат концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент от 10% до 20% EtOAc-гексаны) позволилоа получить (3-бромбензил)(циклогексил)сульфан в виде бесцветного масла. Выход (2.02 г, 80%):1Н ЯМР (400 МГц, CDCl3) δ 7.48 (t, J = 1.8 Гц, 1H), 7.33-7.37 (m, 1H), 7.22-7.26 (m, 1H), 7.16 (t, J = 7.8 Гц, 1H), 3.68 (s, 2H), (t, J = 3.33, 10.0 Гц, 1H), 1.87-1.96 (m, 2H), 1.69-1.77 (m, 2H), 1.53-1.61 (m, 1H), 1.18-1.38 (m, 5H).
Стадия 2: Реакция Соногашира между (3-бромбензил)(циклогексил)сульфаном и 2,2,2-тpифтop-N-(пpoп-2-инил)aцeтaмидoм согласно способу, который использовали в Примере 139, позволила получить N-(3-(3-(циклогексилтиометил)фенил)проп-2-инил)-2,2,2-трифторацетамид в виде желтого масла. Выход (0.70 г, 35%);1Н ЯМР (400 МГц, ДМСО-d6) δ 10.0 (br t, 1H), 7.24-7.37 (m, 4H), 4.25 (d, J = 5.5 Гц, 2H), 3.72 (s, 2H), 2.48-2.53 (m, 1H), 1.79-1.87 (m, 2H), 1.58-1.65 (m, 2H), 1.45-1.52 (m, 1H), 1.12-1.27 (m, 5H).
Стадия 3: Снятие защиты N-(3-(3-(циклогексилтиометил)фенил)проп-2-инил)-2,2,2-трифторацетамида согласно способу, который использовали в Примере 138 с последующей очисткой флэш хроматографией (градиент от 50% до 100% 7N NН3/МеОН/СН2Сl2-CH2Cl2) позволило получить Пример 156 в виде светло-желтого масла. Выход (0.157 г, 85%);1Н ЯМР (400 МГц, CD3OD) δ 7.35-7.37 (m, 1H), 7.20-7.29 (m, 3Н), 3.70 (s, 2H), 3.58 (s, 2H), 2.46-2.54 (m, 1H), 1.86-1.92 (m, 2H), 1.67-1.75 (m, 2H), 1.53-1.60 (m, 1H), 1.20-1.34 (m, 5H); Преп-ВЭЖХ (Способ 2): 94.7% (AUC), tR=7.08 мин.
ПРИМЕР 157
Приготовление 3-(3-(циклогексилсульфонилметил)фенил)проп-1-ин-1-амина

3-(3-(циклогексилсульфонилметил)фенил)проп-1-ин-1-амин был приготовлен согласно способу, который использовали в Примере 135.
Стадия 1: Окисление N-(3-(3-(циклогексилтиометил)фенил)проп-2-инил)-2,2,2-трифторацетамида согласно способу, который использовали в Примере 135 с последующей очисткой флэш хроматографией (градиент от 20% до 70% EtOAc-гексаны) позволило получить N-(3-(3-(циклогексилсульфонилметил)фенил)проп-2-инил)-2,2,2-трифторацетамид в виде белого твердого вещества. Выход (0.256 г, 86%);1Н ЯМР (400 МГц, ДМСО-d6) δ 10.06 (br. t, J = 5.1 Гц, 1Н), 7.35-7.45 (m, 4H), 4.42 (s, 2H), 4.26 (d, J = 5.5 Гц, 2H), 2.94 (tt, J = 3.3, 15.3 Гц, 1Н), 2.02-2.08 (m, 2H), 1.74-1.82 (m, 2H), 1.56-1.63 (m, 1Н), 1.30-1.42 (m, 2H), 1.07-1.30 (m, 3Н).
Стадия 2: Снятие Вос-защиты N-(3-(3-(циклогексилсульфонилметил) фенил)проп-2-инил)-2,2,2-трифторацетамида согласно способу, который использовали в Примере 138 с последующей очисткой флэш хроматографией (градиент от 10% до 100% 7N NH3/MeOH/CH2Cl2-CH2Cl2) позволило получить Пример 157 в виде белого твердого вещества. Выход (0.166 г, 91%);1Н ЯМР (400 МГц, CD3OD) δ 7.45-7.48 (m, 1Н), 7.40 (dt, J = 1.8, 7.2 Гц, 1Н), 7.37 (dt, J = 1.8, 7.6 Гц, 1Н), 7.33 (t, J = 7.4 Гц, 1Н), 4.33 (s, 2H), 3.59 (s, 2H), 2.93 (tt, J = 3.3, 11.9 Гц, 1Н), 2.10-2.20 (m, 2H), 1.85-1.93 (m, 2H), 1.66-1.73 (m, 1Н), 1.45-1.57 (m, 2H), 1.16-1.37 (m, 3Н); Преп-ВЭЖХ (Способ 2): 99.7% (AUC), tR=5.56 мин
ПРИМЕР 158
Приготовление 3-(3-(циклогексилтиометил)фенил)пропан-1-амина

3-(3-(циклогексилтиометил)фенил)пропан-1-амин был приготовлен согласно способу, который использовали в Примере 135.
Стадия 1: Гидрирование Примера 157 согласно способу, который использовали в Примере 2, с последующей очисткой флэш хроматографией (градиент от 10% до 100% 10% 7N NН3/МеОН/СН2Сl2-CH2Cl2 позволило получить Пример 158 в виде бесцветного масла. Выход (0.0844 г, 91%);1Н ЯМР (400 МГц, CD3OD) δ 7.14-7.20 (m, 2H), 7.09-7.13 (m, 1Н), 7.01-7.07 (m, 1Н), 3.70 (s, 2H), 2.58-2.66 (m, 4H), 2.45-2.57 (m, 1Н), 1.86-1.94 (m, 2Н), 1.67-1.80 (m, 4H), 1.54-1.60 (m, 1H), 1.20-1.33 (m, 5H); Преп-ВЭЖХ (Способ 2): 92.8% (AUC), tR=7.09 мин; LC-MS (ESI+) 264.221 [M+H]+.
ПРИМЕР 159
Приготовление 3-(3-(циклогексилсульфонилметил)фенил)пропан-1-амина

3-(3-(циклогексилсульфонилметил)фенил)пропан-1-амин был приготовлен согласно способу, представленному ниже.
Стадия 1: Гидрирование N-(3-(3-(циклогексилтиометил)фенил)проп-2-инил)-2,2,2-трифторацетамида согласно способу, который использовали в Примере 2 с последующей очисткой флэш хроматографией (градиент от 5% до 20% EtOAc-гексаны) позволило получить N-(3-(3-(циклогексилтиометил)фенил)пропил)-2,2,2-трифторацетамид в виде бесцветного масла. Выход (0.121 г, 72%);1H ЯМР (400 МГц, CDCl3) δ 7.20-7.26 (m, 1H), 7.12-7.17 (m, 2Н), 7.01-7.06 (m, 1H), 6.17 (br.s, 1H), 3.71 (s, 2Н), 3.38 (q, J = 6.9 Гц, 2Н), 2.66 (t, J = 7.4 Гц, 2Н), 2.56 (tt, J = 3.5, 10.4 Гц, 1H), 1.87-1.97 (m, 4H), 1.68-1.77 (m, 2Н), 1.54-1.61 (m, 1H), 1.19-1.38 (m, 5H).
Стадия 2: Окисление N-(3-(3-(циклогексилтиометил)фенил)пропил)-2,2,2-трифторацетамида согласно способу, который использовали в Примере 135, с последующей очисткой флэш хроматографией (градиент от 10% до 40% EtOAc-гексаны) позволило получить N-(3-(3-(циклогексилсульфонилметил)фенил)пропил)-2,2,2-трифторацетамид в виде бесцветного масла, которое затвердевало до белого твердого вещества. Выход (0.112 г, 85%);1Н ЯМР (400 МГц, CDCl3) δ 7.32 (t, J = 7.4 Гц, 1H), 7.17-7.26 (m, 3Н), 6.37 (br.s, 1H), 4.15 (s, 2Н), 3.33 (q, J = 6.7 Гц, 2Н), 2.76 (tt, J = 3.5, 12.1 Гц, 1H), 2.69 (t, J = 7.6 Гц, 2Н), 2.10-2.18 (m, 2Н), 1.87-1.97 (m, 4H), 1.66-1.73 (m, 1H), 1.51-1.63 (m, 2H), 1.18-1.30 (m, 3H).
Снятие защиты N-(3-(3-(циклогексилсульфонилметил)фенил)пропил)-2,2,2-трифторацетамида согласно способу, который использовали в Примере 138, с последующей очисткой флэш хроматографией (градиент от 10% до 100% 7N NН3/МеОН/СН2Сl2-CH2Cl2) позволило получить Пример 159 в виде белого твердого вещества. Выход (0.062 г, 73%);1Н ЯМР (400 МГц, CD3OD) δ 7.21-7.318 (m, 4H), 4.31 (s, 2Н), 2.91 (tt, J = 3.5, 11.9 Гц. 1H), 2.61-2.69 (m, 4H), 2.10-2.18 (m, 2Н), 1.85-1.93 (m, 2Н), 1.73-1.81 (m, 2Н), 1.66-1.73 (m, 1H), 1.44-1.56 (m, 2Н), 1.17-1.36 (m, 3Н);13С ЯМР (100 МГц, CD3OD) δ 142.8, 131.1, 128.65, 128.54, 128.50, 128.08, 59.8, 55.5, 40.8, 34.3, 32.8, 25.2, 25.0, 24.9; Преп-ВЭЖХ (Способ 2): 96.8% (AUC), tR=5.60 мин; LC-MS (ESI+) 296.55 [М+Н]+.
ПРИМЕР 160
Приготовление (E)-3-(3-(циклогексилоксиметил)фенил)проп-2-ен-1-амина

(E)-3-(3-(циклогексилоксиметил)фенил)проп-2-ен-1-амин был приготовлен согласно способу, который использовали в Примерах 2, 9 и 118.
Стадия 1: Реакция 1-бром-3-(бромметил)бензола с циклогексиламином согласно способу, описанному в Примере 9, за исключением того, что в качестве основания использовали карбонат цезия и при 90°С в течение 18 ч получали N-(3-бромбензил)циклогексиламин в виде белого твердого вещества. Выход (0.70 г, 65%):1Н ЯМР (400 МГц, CD3OD) δ 7.53 (t, J = 1.6 Гц, 1H), 7.38-7.41 (m, 1H), 7.29 (d, J = 7.6 Гц, 1Н), 7.23 (t, J = 8.0 Гц, 1H), 3.73 (s, 2H), 2.38-2.46 (m, 1H), 1.92-1.95 (m, 2H), 1.70-1.78 (m, 2H), 1.58-1.66 (m, 1H), 1.06-1.30 (m, 5H).
Стадия 2: Реакция Хека N-(3-бромбензил)циклогексиламина и N-аллил-2,2,2-трифторацетамида согласно способу, описанному в Примере 118, позволила получить (Е)-N-(3-(3-((циклогексиламино)метил)фенил)аллил)-2,2,2-трифторацетамид в виде бесцветного масла. Выход (0.20 г, 22%):1H ЯМР (400 МГц, CD3OD) S 7.55 (s, 1H), 7.48-7.50 (m, 1H), 7.42 (t, J = 7.6 Гц, 1H), 7.35-7.37 (m, 1H), 6.61 (d, J = 16.0 Гц, 1H), 6.32 (dt, J = 16.0, 6.4 Гц, 1H), 4.19 (s, 2H), 4.05 (d, J = 6.4 Гц, 2H), 3.07-3.16 (m, 1H), 2.14-2.22 (m, 2H), 1.66-1.82 (m, 2H), 1.68-1.76 (m, 1H), 1.16-1.50 (m, 5H).
Стадия 3: Снятие защиты (E)-N-(3-(3-((циклогексиламино)метил)фенил)аллил)-2,2,2-трифторацетамида согласно способу, описанному в Примере 2, позволило получить Пример 160 в виде белого твердого вещества. Выход (0.04 г, 23%):1H ЯМР (400 МГц, CD3OD) δ 7.69 (s, 1H), 7.53-7.56 (m, 1H), 7.42-7.48 (m, 2H), 6.84 (d, J = 16.0 Гц, 1H), 6.40 (dt, J = 16.0, 6.8 Гц, 1H), 4.23 (s, 2H), 4.73 (d, J = 6.4 Гц, 2H), 3.08-3.16 (m, 1H), 2.16-2.24 (m, 2H), 1.86-1.94 (m, 2H), 1.68-1.76 (m, 1H), 1.30-1.50 (m, 5H).
ПРИМЕР 161 Приготовление 4-(3-(аминометил)фенетил)гептан-4-ола

4-(3-(аминометил)фенетил)гептан-4-ол был приготовлен согласно способу, представленному ниже.
Стадия 1: N-(3-бромбензил)-2,2,2-трифторацетамид связывали с 4-этинилгептан-4-олом согласно процедуре, описанной в Примере 140, для получения 2,2,2-трифтор-N-(3-(3-гидрокси-3-пропилгекс-1-инил)бензил)ацетамида в виде желтого масла. Выход (0.462 г, 38%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.97 (t, J = 5.6 Гц, 1Н), 7.32 (t, J = 7.8 Гц, 1Н), 7.27-7.22 (m, 3Н), 5.15 (bs, 1Н), 4.35 (d, J = 6.0 Гц, 2Н), 1.60-1.41 (m, 8Н), 0.89 (t, J = 7.2 Гц, 6H).
Стадия 2: Снимали защиту 2,2,2-трифтор-N-(3-(3-гидрокси-3-пропилгекс-1-инил)бензил)ацетамида согласно процедуре в Примере 140 для получения 4-((3-(аминометил)фенил)этинил)гептан-4-ола в виде бледно-желтого масла. Выход (0.254 г, 78%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.33 (s, 1Н), 7.27-7.22 (m, 2Н), 7.18-7.16 (m, 1Н), 5.11 (bs, 1Н), 3.66 (s, 2Н), 1.97 (bs, 2Н), 1.60-1.42 (m, 8Н), 0.89 (t, J = 7.0 Гц, 6H).
Стадия 3: Гидрирование 4-((3-(аминометил)фенил)этинил)гептан-4-ола позволило получить Пример 161 в виде бледно-желтого масла. Выход (0.10 г, 100%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.15 (t, J = 7.6 Гц, 1Н), 7.11 (s, 1Н), 7.07 (d, J = 8.0 Гц, 1Н), 6.97 (d, J = 7.2 Гц, 1Н), 3.94 (bs, 1Н), 3.64 (s, 2Н), 2.51-2.47 (m, obs, 2Н), 1.92 (bs, 2Н), 1.35-1.21 (m, 8Н), 0.85(t, J = 7.0 Гц, 6Н).
ПРИМЕР 162
Приготовление 4-(3-(2-аминоэтил)фенетил)гептан-4-ола

4-(3-(2-аминоэтил)фенетил)гептан-4-ол был приготовлен согласно способу, который использовали в Примере 161.
Стадия 1: Взаимодействие N-(3-бромфенилэтил)-2,2,2-трифторацетамида с 4-этинилгептан-4-олом позволило получить 2,2,2-тpифтop-N-(3-(3-гидpoкcи-3-пpoпилгeкc-1-инил)фенетил)ацетамид в виде желтого масла. Выход (0.902 г, 65%):1H ЯМР (400 МГц, ДМСО-d6) δ 9.43 (t, J = 5.2 Гц, 1Н), 7.25 (t, J = 7.8 Гц, 1Н), 7.20-7.15 (m, 3Н), 5.11 (s, 1Н), 3.41-3.36 (m, 2Н), 2.76 (t, J = 7.0 Гц, 2Н), 1.61-1.40 (m, 8Н), 0.89 (t, J = 7.2 Гц, 6H).
Стадия 2: Снимали защиту 2,2,2-трифтор-N-(3-(3-гидрокси-3-пропилгекс-1-инил)фенетил)ацетамида для получения 4-((3-(2-аминоэтил)фенил)этинил)гептан-4-ола в виде бледно-желтого масла. Выход (0.504 г, 78%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.25-7.21 (m, 1H), 7.17-7.14 (m, 3Н), 5.12 (bs, 1H), 2.74-2.70 (m, 2H), 2.58 (t, J = 7.2 Гц, 2H), 1.60-1.41 (m, 8Н), 1.34 (bs, 2H), 0.89 (t, J = 7.2 Гц, 6Н).
Стадия 3: Гидрирование 4-((3-(2-аминоэтил)фенил)этинил)гептан-4-ола позволило получить Пример 162 в виде бледно-желтого масла. Выход (0.11 г, 100%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.13 (t, J = 7.6 Гц, 1H), 6.96-6.94 (m, 3Н), 3.93 (bs, 1H), 2.73-2.69 (m, 2H), 2.56 (t, J = 7.4 Гц, 2H), 2.50-2.46 (m, obs, 2H), 1.55-1.51 (m, 2H), 1.34-1.20 (m, 8Н), 0.84 (t, J = 7.0 Гц, 6Н).
ПРИМЕР 163
Приготовление 3-(3-аминопропил)-о-циклогексилбензамида

3-(3-аминопропил)-о-циклогексилбензамид был приготовлен согласно способу, который использовали в Примерах 2,19 и 118.
Стадия 1: Раствор 3-бромбензоилхлорида (2.0 г, 9.1 ммоль) в СН2Сl2 добавляли в раствор триэтиламина (1.9 мл, 13.7 ммоль) и циклогексиламина (1,15 мл, 10.0 ммоль) в CH2Cl2 при комнатной температуре при перемешивании. Через 2 ч смесь отмывали НСl (4N), солевым раствором, высушивали над Na2SO4 и концентрировали при пониженном давлении для получения 3-бром-N-циклогексилбензамида в виде белого твердого вещества. Выход (2.43 г, 95%):1Н ЯМР (400 МГц, СD3OD) δ 8.29 (br s, 1H), 7.95 (t, J = 2.0 Гц, 1H), 7.42-7.77 (m, 1H), 7.64-7.67 (m, 1H), 7.36 (t, J = 8.0 Гц, 1H), 3.78-3.84 (m, 1H), 1.92-1.94 (m, 2H), 1.78-1.81 (m, 2H), 1.65-1.69 (m, 1H), 1.16-1.46 (m, 5H).
Стадия 2: Реакция Хека 3-бром-N-циклогексилбензамида и N-аллил-2,2,2-трифторацетамида согласно способу, описанному в Примере 118, позволило получить (E)-N-циклогексил-3-(3-(2,2,2-трифторацетамидо)проп-1-енил)бензамид в виде светло-желтого твердого вещества. Выход (0.50 г, 71%):1H ЯМР (400 МГц, CD3OD) δ 8.18-8.26 (m, 1H), 7.83 (t, J = 1.6 Гц, 1H), 7.65-7.68 (m, 1H), 7.54-7.56 (m, 1H), 7.39(t, J = 7.6 Гц, 1H), 6.62 (d, J = 16.0 Гц, 1H), 6.32 (dt, J = 16.0, 6.4 Гц, 1H), 4.06 (d, J = 5.6 Гц, 2H), 3.80-3.90 (m, 1H), 1.93-1.95 (m, 2H), 1.79-1.82 (m, 2H), 1.66-1.70 (m, 1H), 1.18-1.48 (m, 5H).
Стадия 3: Гидрирование (E)-N-циклогексил-3-(3-(2,2,2-трифторацетамидо)проп-1-енил)бензамида согласно способу, описанному в Примере 154, позволило получить N-циклогексил-3-(3-(2,2,2-трифторацетамидо)пропил)бензамид в виде белого твердого вещества. Выход (0.35 г, 871Н ЯМР (400 МГц, CD3OD) δ 8.08-8.14 (m, 1H), 7.58-7.64 (m, 2Н), 7.34-7.38 (m, 2Н), 7.39 (t, J = 7.6 Гц, 1Н), 3.80-3.90 (m, 1H), 2.70 (t, J = 8.0 Гц, 2Н), 1.86-1.95 (m, 4H), 1.79-1.82 (m, 2Н), 1.66-1.70 (m, 1H), 1.16-1.42 (m, 5H).
Стадия 4: Снятие защиты N-циклогексил-3-(3-(2,2,2-трифторацетамидо)пропил)бензамида согласно способу, описанному в Примере 154, позволило получить Пример 163 гидрохлорид в виде белого твердого вещества. Выход (0.07 г, 25%):1Н ЯМР (400 МГц, CD3OD) δ 7.58-7.66 (m, 2Н), 7.30-7.38 (m, 2Н), 3.78-3.88 (m, 1H), 2.65-2.80 (m, 4H), 1.75-1.95 (m, 6H), 1.66-1.69 (m, 1H), 1.15-1.45 (m, 5H).
ПРИМЕР 164
Приготовление 3-(2-аминоэтокси)-N-циклогексилбензамида

3-(2-аминоэтокси)-N-циклогексилбензамид был приготовлен согласно способу, который использовали в Примерах 9 и 13.
Стадия 1: Взаимодействие метил 3-гидроксибензоата с 2-(трет-бутоксикарбониламино)этил метансульфонатом согласно способу, который использовали в Примере 9, позволило получить метил 3-(2-(трет-бутоксикарбониламино)этокси)бензоат в виде светло-желтого масла. Выход (0.65 г, 84%):1Н ЯМР (400 МГц, CD3OD) δ 7.36 (t, J = 8.0 Гц, 1H), 7.26 (t, J = 8.0 Гц, 1H), 7.16 (ddd, J = 8.4, 2.4, 0.8 Гц, 1Н), 6.99 (ddd, J = 8.0, 2.4, 0.8 Гц, 1H), 4.03 (t, J = 5.6 Гц, 2Н), 3.78 (s, 3H), 1.43 (s, 9H).
Стадия 2: Гидролиз метил 3-(2-(тиреот-бутоксикарбониламино)этокси)бензоата согласно способу, который использовали в Примере 9, за исключением того, что вместо К2СО3 и МеОН использовали LiOH и THF, что позволило получить 3-(2-(трет-бутоксикарбониламино)этокси)бензойную кислоту, которую использовали на следующей стадии реакции без дальнейшей очистки.
Стадия 3: В раствор 3-(2-(трет-бутоксикарбониламино)этокси)бензойной кислоты (0.73 г, 2.98 ммоль), циклогексиламина (0.34 мл, 2.98 ммоль), EDCI (0.7 г, 3.58 ммоль) и НОВТ (0.49 г, 3.58 ммоль) в DMF добавляли DIPEA (1.0 мл, 5.57 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 18 ч, концентрировали и разделяли между этилацетатом и водой. Органический слой высушивали над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент от 30 до 65% ЕtOАс-гексаны) позволила получить трет-бутил 2-(3-(циклогексилкарбамоил)фенокси)этилкарбамат в виде оранжевого масла. Выход (0.20 г, 20%):1H ЯМР (400 МГц, СD3ОD) δ 7.31-7.38 (m, 3H), 7.06-7.09 (m, 1H), 4.04 (t, J = 5.6 Гц, 2Н), 3.78-3.87 (m, 1H), 3.41-3.45 (m, 2H), 1.90-1.98 (m, 2H), 1.78-1.84 (m, 2H), 1.63-1.71 (m, 1H), 1.43 (s, 9H), 1.18-1.38 (m, 5H).
Стадия 4: Снятие защиты трет-бутил 2-(3-(циклогексилкарбамоил)фенокси)этилкарбамата согласно способу, описанному в Примере 151 позволило получить Пример 164 гидрохлорид в виде белого твердого вещества. Выход (0.11 г, 60%):1Н ЯМР (400 МГц, CD3OD) δ 7.36-7.44 (m, 3H), 7.14-7.17 (m, 1H), 4.27 (t, J = 5.2 Гц, 2H), 3.80-3.90 (m, 1H), 3.37 (t, J = 5.2 Гц, 2H), 1.92-1.98 (m, 2H), 1.78-1.86 (m, 2H), 1.65-1.72 (m, 1H), 1.15-1.48 (m, 5H).
ПРИМЕР 165
Приготовление 3-(3-аминопропил)-N-(гептан-4-ил)бензамида

3-(3-аминопропил)-N-(гептан-4-ил)бензамид был приготовлен согласно способу, который использовали в Примере 163:
Стадия 1: Реакция 3-бромбензоилхлорида с гептан-4-амином позволила получить 3-бром-N-(гептан-4-ил)бензамид в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. Выход (2.43 г, 90%).
Стадия 2: Взаимодействие 3-бром-N-(гептан-4-ил)бензамида с -N-аллил-2,2,2-трифторацетамидом позволило получить (E)-N-(гептан-4-ил)-3-(3-(2,2,2-трифторацетамидо)проп-1-енил)бензамид в виде светло-желтого твердого вещества. Выход (0.65 г, 80%):1H ЯМР (400 МГц, СD3ОD) δ 8.09-8.11 (m, 1H), 7.81-7.84 (m, 1H), 7.65-7.68 (m, 1H), 7.54-7.56 (m, 1H), 7.40 (t, J = 1.6 Гц, 1H), 6.63 (d, J = 16.0 Гц, 1H), 6.33 (dt, J = 16.0, 6.4 Гц, 1H), 4.06 (d, J = 6.0 Гц, 2H), 1.50-1.56 (m, 4H), 1.32-1.46 (m, 5H), 0.93 (t, J = 7.2 Гц, 6Н).
Стадия 3: Гидрирование (E)-N-(гептан-4-ил)-3-(3-(2,2,2-трифторацетамидо)проп-1-енил)бензамида позволило получить N-(гептан-4-ил)-3-(3-(2,2,2-трифторацетамидо)пропил)бензамид в виде белого твердого вещества. Выход (0.30 г, 99%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.43 (t, J = 5.6 Гц, 1H), 7.92 (d, J = 8.80 Гц, 1H), 7.60-7.66 (m, 2H), 7.30-7.36 (m, 2H), 3.90-4.0 (m, 1H), 3.16-3.22 (m, 2H), 2.61 (t, J = 8.4 Гц, 2Н), 1.76-1.83 (m, 1H), 1.20-1.48 (m, 8H), 0.84 (t, J = 7.2 Гц, 6Н).
Стадия 4: Снятие защиты N-(гептан-4-ил)-3-(3-(2,2,2-трифторацетамидо)пропил)бензамида позволило получить Пример 165 гидрохлорид в виде белого твердого вещества. Выход (0.18 г, 67%):1Н ЯМР (400 МГц, CD3OD) δ 7.62-7.68 (m, 2H), 7.30-7.40 (m, 2H), 4.05-4.12 (m, 1H), 2.93 (t, J = 8.0 Гц, 2H), 2.78 (t, J = 7.6 Гц, 2H), 1.95-2.05 (m, 2H), 1.50-1.56 (m, 4H), 1.30-1.46 (m, 4H), 0.93 (t, J = 7.6 Гц, 6Н).
ПРИМЕР 166
Приготовление 3-(3-аминопропил)-N-(2,6-диметилфенил)бензамида

3-(3-аминопропил)-N-(2,6-диметилфенил)бензамид был приготовлен согласно способу, показанному на Схеме 33.
Схема 33
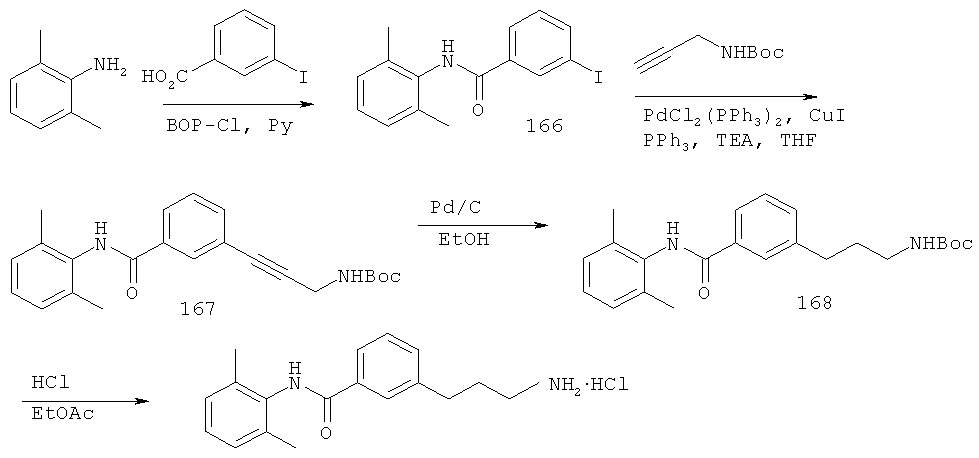
Стадия 1: В раствор 2,6-диметиламина (0.5 мл, 4.0 ммоль) и 3-иодбензойной кислоты (1.0 г, 4.0 ммоль) в безводном пиридине добавляли ВОР-С1 (2.05 г, 8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение двух часов, затем экстрагировали из 1N HCl этилацетатом. Объединенные органические слои отмывали HCl (1N), водой и солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент 10-20% этилацетат/гексаны) позволила получить амид 166 в виде белого твердого вещества. Выход (0.35 г, 25%):1Н ЯМР (400 МГц, ДМСО-d6) δ 8.3 (s, 1H), 7.87-7.92 (m, 2H), 7.10-7.29 (m, 5H), 2.30 (s, 6Н).
Стадия 2: Реакция Соногашира иодида 166 с трет-бутил, проп-2-инилкарбаматом согласно способу, который использовали в Примере 2, за исключением того, что вместо три-толил-о-фосфина использовали трифенилфосфин, с последующей флэш хроматографией (градиент 15-40% этилацетат/гексаны) позволила получить алкин 167 в виде светло-желтого твердого вещества. Выход (0.321 г, 83%):1Н ЯМР (400 МГц, ДМСО-d6) δ 7.96-7.99 (m, 1H), 7.88-7.92 (m, 1H), 7.60-7.65 (m, 1H), 7.48 (t, J = 8.0 Гц, 1Н), 7.33 (brs, 1H), 7.13-7.21 (m, 3Н), 4.58 (brs, 1H), 4.10-4.30 (m, 2H), 2.31 (s, 6H), 1.50 (s, 9H).
Стадия 3: Гидрирование алкина 167 согласно способу, который использовали в Примере 2, с последующей фоэш хроматографией (градиент 10-35% EtOAc/гексаны) позволило получить алкан 168 в виде бесцветного масла. Выход (0.083 г, 69%):1Н ЯМР (400 МГц, ДМСО-d6) δ 8.01 (br.s, 1H), 7.78-7.86 (m, 2H), 7.37-7.47 (m, 2H), 7.10-7.28 (m, 3Н), 4.65 (brs, 1H), 3.16-3.23 (m, 2H), 2.76 (t, J = 8.0 Гц, 2H), 2.31 (s, 6H), 1.87 (quint, J = 8.0 Гц, 2Н), 1.38 (s, 9Н).
Стадия 4: Снятие защиты карбамата 168 согласно способу, который использовали в Примере 34, позволило получить Пример 166 гидрохлорид в виде светлого воскообразного вещества. Выход (0.018 г, 43%):1Н ЯМР (400 МГц, ДМСО-d6) δ 9.80 (s, 1H), 7.85-8.0 (m, 5H), 7.42-7.50 (m, 2H), 7.13 (s, 3Н), 2.78-2.87 (m, 2H), 2.75 (t, J = 8.0 Гц, 2H), 2.19 (s, 6H), 1.91 (квинт, J = 8.0 Гц, 2H). ESI MS m/z 283.3 [m+Н]+
ПРИМЕР 167
Приготовление 4-(3-(1-гидрокси-3-(метиламино)пропил)фенетил)гептан-4-ола

4-(3-(1-гидрокси-3-(метиламино)пропил)фенетил)гептан-4-ол был приготовлен согласно способу в Примере 17 и на Схеме 34.
Схема 34

Стадия 1: Защита 4-(3-(3-амино-1-гидроксипропил)фенетил)гептан-4-ола с помощью (Вос)2O согласно способу, описанному в Примере 17, позволила получить тирет-бутил3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропилкарбамат.
Стадия 2: Восстановление трет-бутил 3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропилкарбамата с помощью ВН3-THF позволило получить Пример 167.
ПРИМЕР 168
Приготовление 1-(3-(3-гидрокси-3-пропилгексил)бензил)гуанидина

1-(3-(3-гидрокси-3-пропилгексил)бензил)гуанидин был приготовлен согласно способу, описанному на Схеме 35.
Схема 35
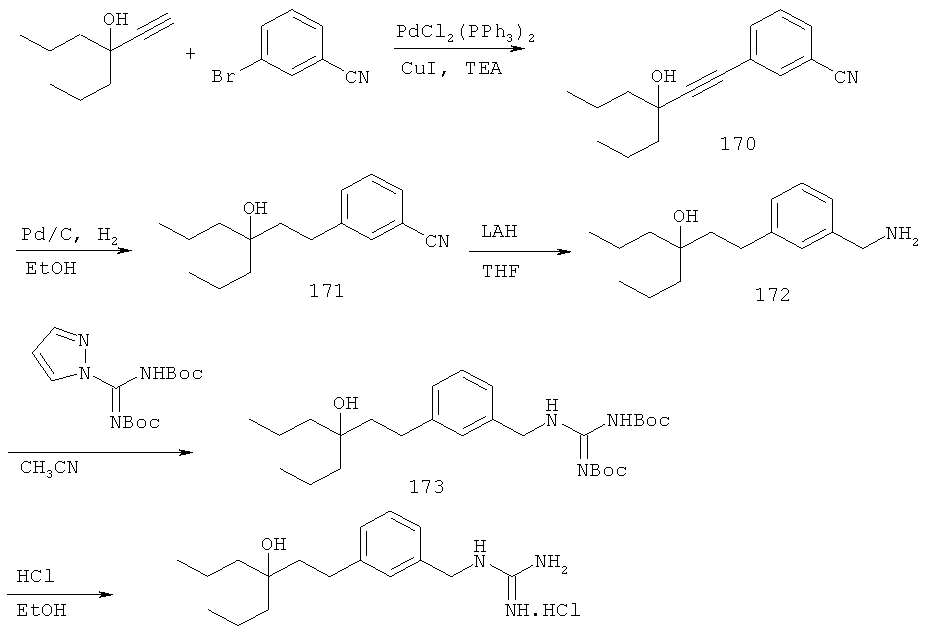
Стадия 1: Взаимодействие 4-этинилгептан-4-ола с 3-бромбензонитрилом согласно способу, описанному в Примере 12, позволило получить 3-(3-гидрокси-3-пропилгекс-1-инил)бензонитрил.
Стадия 2: Гидрирование 3-(3-гидрокси-3-пропилгекс-1-инил)бензонитрила согласно способу, описанному в Примере 12, позволило получить 3-(3-гидрокси-3-пропилгексил)бензонитрил.
Стадия 3: Восстановление 3-(3-гидрокси-3-пропилгексил)бензонитрила согласно способу, описанному в Примере 15, позволило получить 4-(3-(аминометил)фенетил)гептан-4-ол.
Стадия 4: Восстановление 4-(3-(аминометил)фенетил)гептан-4-ола с помощью трет-бутил (1H-пиразол-1-ил)метиленкарбамата в CH3CN позволило получить трет-бутил (трет-бутоксикарбониламино)(3-(3-гидрокси-3-пропилгексил)бензиламино)метиленкарбамат.
Стадия 5: Снятие защиты трет-бутил (трет-бутоксикарбониламино)(3-(3-гидрокси-3-пропилгексил)бензиламино)метиленкарбамата согласно способу, который использовали в Примере 13, позволило получить Пример 168.
ПРИМЕР 169
Приготовление 1-(3-(3-(3-гидрокси-3-пропилгексил)фенил)пропил)гуанидина

1-(3-(3-(3-гидрокси-3-пропилгексил)фенил)пропил)гуанидин был приготовлен согласно способу в Примерах 12, 118 и 168 в Схеме 35.
Схема 35

Стадия 1: Гидрирование (E)-4-(3-(3-аминопроп-1-енил)фенетил)гептан-4-ола согласно способу, описанному в Примере 12, позволило получить 4-(3-(3-аминопропил)фенетил)гептан-4-ол.
Стадия 2: Реакция 4-(3-(3-аминопропил)фенетил)гептан-4-ола с трет-бутил (1H-пиразол-1-ил)метилендикарбаматом согласно способу, описанному в Примере 168, позволила получить трет-бутил (трет-бутоксикарбониламино)(3-(3-(3-гидрокси-3-пропилгексил)фенил)пропиламино)метиленкарбамат.
Стадия 3: Снятие защиты трет-бутил (трет-бутоксикарбониламино)(3-(3-(3-гидрокси-3-пропилгексил)фенил)пропиламино)метиленкарбамата согласно способу, который использовали в Примере 13, позволило получить Пример 169.
ПРИМЕР 170
Приготовление 3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропанимидамида

3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропанимидамид был приготовлен согласно способу, который показан на Схеме 36.
Схема 36

Стадия 1: Взаимодействие 4-этинилгептан-4-ола с 3-(3-бромфенил)-3-гидроксипропаннитрилом согласно способу, описанному в Примере 12, возводило получить 3-гидрокси-3-(3-(3-гидрокси-3-пропилгекс-1-инил)фенил)пропаннитрил в виде светло-желтого масла.
Стадия 2: Гидрирование 3-гидрокси-3-(3-(3-гидрокси-3-пропилгекс-1-инил) фенил)пропаннитрила согласно способу, описанному в Примере 12, позволило получить 3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропаннитрил.
Стадия 3: Через ледяной раствор 3-гидрокси-3-(3-(3-гидрокси-3-пропилгекс-1-илин)фенил) в чистом EtOH пропускали поток пузырьков НСl в течение 4-5 мин. Эту смесь оставляли нагреваться до комнатной температуры и перемешивали. Растворитель удаляли при пониженном давлении. В остаток добавляли чистый EtOH при охлаждении в ледяной ванне и через раствор пропускали поток пузырьков NН3 в течение 2-3 мин. Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 4 ч. Смесь концентрировали при пониженном давлении. В остаток добавляли чистый EtOH при охлаждении в ледяной ванне. Через раствор пропускали поток пузырьков НСl в течение 1 мин и смесь концентрировали при пониженном давлении. Остаток растворяли в H2O и экстрагировали EtOAc. Водный слой выпаривали до сухого состояния и высушивали в высоком вакууме в течение ночи для получения Примера 170.
ПРИМЕР 171 Приготовление 1-амино-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропан-2-она

1-амино-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропан-2-она был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Защита 4-(3-(3-амино-2-гидроксипропил)фенетил)гептан-4-ола (Пример 143) с помощью (Вос)2O согласно способу, описанному в Примере 17, позволила получить трет-бутил 2-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропилкарбамат.
Стадия 2: Окисление трет-бутил 2-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропилкарбамата согласно способу, который использовали в Примере 151, позволило получить трет-буткл 3-(3-(3-гидрокси-3-пропилгексил)фенил)-2-оксопропилкарбамат.
Стадия 3: Снятие защиты трет-бутил 3-(3-(3-гидрокси-3-пропилгексил)фенил)-2-оксопропилкарбамата согласно способу, который использовали в Примере 13, позволило получить Пример 171 гидрохлорид.
ПРИМЕР 172
Приготовление 4-(3-(3-амино-2-фторпропил)фенетил)гептан-4-ола

4-(3-(3-амино-2-фторпропил)фенетил)гептан-4-ол был приготовлен согласно способу, который использовали в Примере 174, за исключением того, что вместо спирта 39 использовали Пример 143.
ПРИМЕР 173
Приготовление 3-амино-1-(3-(3-гидрокси-3-пропилгексил)фенил)пропан-1-она

3-амино-1-(3-(3-гидрокси-3-пропилгексил)фенил)пропан-1-оне был приготовлен согласно способу, который использовали в Примере 19.
Стадия 1: Защита 4-(3-(3-амино-1-гидроксипропил)фенетил)гептан-4-ола с помощью (Вос)2O согласно способу, описанному в Примере 17, позволила получить трет-бутил 3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропилкарбамат.
Стадия 2: Окисление трет-бутил 3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропилкарбамата согласно способу, который использовали в Примере 151, позволило получить трет-бутил 3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропилкарбамат.
Стадия 3: Снятие защиты трет-буткл 3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропилкарбамата согласно способу, который использовали в Примере 13, позволило получить Пример 173 гидрохлорид.
ПРИМЕР 174
Приготовление 4-(3-(3-амино-1-фторпропил)фенетил)гептан-4-ола

4-(3-(3-амино-1-фторпропил)фенетил)гептан-4-ол был приготовлен согласно способу, представленному ниже
Стадия 1: Диэтиламиносернистый трифторид (DAST) добавляли в инертной атмосфере в холодный (-78°С) раствор спирта 39. Реакционную смесь перемешивали при -78°С до тех пор, пока исходный материал не обнаруживали ТСХ. Реакционную смесь разделяли между водой и EtOAc, и водный слой экстрагировали EtOAc. Объединенные органические слои отмывали солевым раствором и высушивали над безводным MgSO4. Очистка флэш хроматографией позволила получить трет-бутил 3-(3-бромфенил)-3-фторпропилкарбамат.
Стадия 2: Реакция Соногашира трет-бутил 3-(3-бромфенил)-3-фторпропилкарбамата и 4-этинилгептан-4-ола согласно способу, описанному в Примере 12, позволила получить трет-бутил 3-фтор-3-(3-(3-гидрокси-3-пропилгекс-1-инил)фенил)пропилкарбамат.
Стадия 3: Гидрирование трет-бутил 3-фтор-3-(3-(3-гидрокси-3-пропилгекс-1-инил)фенил)пропилкарбамата согласно способу, который использовали в Примере 12, позволило получить трет-бутил 3-фтор-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропилкарбамат.
Стадия 4: Снятие защиты трет-бутал 3-фтор-3-(3-(3-гидрокси-3-пропилгексил)фенил)пропилкарбамата согласно способу, который использовали в Примере 13, позволило получить Пример 174.
ПРИМЕР 175
Приготовление 4-(3-(4-аминобутан-2-ил)фенетил)гептан-4-ола

4-(3-(4-аминобутан-2-ил)фенетил)гептан-4-ол был приготовлен согласно способу, который показан на Схеме 37.
Схема 37

Стадия 1: В суспензию метилтрифенилфосфония бромида в THF добавляли KOBu-t (I M в THF, 6.1 ммоль) при комнатной температуре. После перемешивания в течение 30 мин добавляли трет-бутил 3-(3-(3-гидрокси-3-пропилгексил)фенил)-3-оксопропилкарбамат. Полученную смесь перемешивали при комнатной температуре в течение 18 ч. Реакцию осаждали добавлением АсОН. Смесь фильтровали и концентрировали при пониженном давлении. Очистка флэш хроматографией (градиент от 15 до 50% EtOAc-гексаны) позволила получить трет-бутил 3-(3-(3-гидрокси-3-пропилгексил)фенил)бут-3-енилкарбамат.
Стадия 2: Гидрирование трет-бутил 3-(3-(3-гидрокси-3-пропилгексил)фенил) бут-3-енилкарбамата согласно способу, описанному в Примере 12, позволило получить терет-бутил3-(3-(3-гидрокси-3-пропилгексил)фенил)бутилкарбамат.
Стадия 3: Снятие защиты трет-бутил 3-(3-(3-гидрокси-3-пропилгексил)фенил)бутилкарбамата согласно способу, который использовали в Примере 13, позволило получить Пример 175 гидрохлорид.
ПРИМЕР 176
Приготовление 4-(3-(3-амино-1-гидроксипропил)-5-хлорфенетил)гептан-4-ола

4-(3-(3-амино-1-гидроксипропил)-5-хлорфенетил)гептан-4-ол был приготовлен согласно способу, который использовали в Примерах 16, 17 и 19, за исключением того, что 3-бром-5-хлорбензальдегид использовали вместо 3-бромбензальдегида.
ПРИМЕР 177
Приготовление (R)-3-(3-амино-1-гидроксипропил)-N-(гептан-4-ил)бензамида

(R)-3-(3-амино-1-гидроксипропил)-N-(гептан-4-ил)бензамид был приготовлен согласно способу, который использовали в Примерах 71 и 163 с использованием в качестве исходного материала 3-формилбензойной кислоты.
ПРИМЕР 178
Приготовление 4-(3-(3-аминобутил)фенетил)гептан-4-ола

4-(3-(3-аминобутил)фенетил)гептан-4-ол был приготовлен согласно способу, который использовали в Примерах 12 и 180 с использованием вместо аллилтрифторацетамида винилметилкетон.
ПРИМЕР 179
Приготовление (R)-3-(3-амино-1-гидроксипропил)-N-циклогексил-N-метилбензамида

(R)-3-(3-амино-1-гидроксипропил)-N-циклогексил-N-метилбензамид был приготовлен согласно способу, который использовали в Примере 177.
ПРИМЕР 180
Приготовление 1-(3-((1R,2R)-3-амино-1-гидрокси-2-метилпропил)фенетил)циклопентанола

1-(3-((1R,2R)-3-амино-1-гидрокси-2-метилпропил)фенетил)циклопентанол был приготовлен согласно способу, который показан на Схеме 38.
Схема 38

Стадия 1: В смесь (5)-4-бензил-3-пропионилоксазолидин-2-она, безводного MgCl2 (0.104 г, 1.09 ммоль) и 3-бромбензальдегида в EtOAc добавляли Et3N с последующим хлортриметилсиланом. Реакционную смесь перемешивали в атмосфере аргона при комнатной температуре в течение 24 ч и затем фильтровали через слой силикагеля, отмывали EtOAc. Объединенные фильтраты концентрировали при пониженном давлении и остаток очищали флэш хроматографией (градиент от 1 до 30% EtOAc/гексан) для получения (S)-4-бензил-3-((2R,3S)-3-(3-бромфенил)-2-метил-3-(триметилсилилокси)пропаноил)оксазолидин-2-она.
Стадия 2: В раствор (S)-4-бензил-3-((2R,3S)-3-(3-бромфенил)-2-метил-3-(триметилсилилокси)пропаноил)оксазолидин-2-она в безводном THF добавляли раствор LiBH4 в THF в атмосфере аргона. Реакционную смесь перемешивали в течение 18 ч при комнатной температуре и медленно добавляли насыщенный водный раствор NH4Cl с последующим МТВЕ. Смесь перемешивали в течение 15 мин, слои разделяли, органический слой отмывали солевым раствором, высушивали над безводным MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш хроматографией (градиент от 5 до 40% EtOAc/гексан) для получения (2S,3S)-3-(3-бромфенил)-2-метил-3-(триметилсилилокси)пропан-1-ола.
Стадия 3: В холодный (0°С) раствор (2S,3S)-3-(3-бромфенил)-2-метил-3-(триметилсилилокси)пропан-1-ола, фталимида и Рh3Р в безводном THF в атмосфере аргона добавляли раствор диэтилазодикарбоксилата в безводном THF. Реакционную смесь перемешивали в течение 1 часа в атмосфере аргона при нагревании до комнатной температуры и затем растворитель удаляли в вакууме, остаток растворяли в смеси дихлорметан/гексан и очищали флэш хроматографией (градиент от 5 до 30% EtOAc/гексан) для получения to 2-((2S,3S)-3-(3-бромфенил)-2-метил-3-(триметилсилилокси)пропил)изоиндолин-1,3-диона.
Стадия 4: Взаимодействие 2-((2S,3S)-3-(3-бромфенил)-2-метил-3-(триметилсилилокси)пропил)изоиндолин-1,3-диона с 4-этинилгептан-4-олом согласно способу в Примере 12, позволило получить 2-((2S,3S)-3-(3-(3-гидрокси-3-пропилгекс-1-инил)фенил)-2-метил-3-(триметилсилилокси)пропил)изоиндолин-1,3-диона.
Стадия 5: Гидрирование 2-((2S,3S)-3-(3-(3-гидрокси-3-пропилгекс-1-инил)фенил)-2-метил-3-(триметилсилилокси)пропил)изоиндолин-1,3-диона согласно способу, который использовали в Примере 12, позволило получить 2-((2S,3S)-3-(3-(3-гидрокси-3-пропилгексил)фенил)-2-метил-3-(триметилсилилокси)пропил)изоиндолин-1,3-дион.
Стадия 6: В раствор 2-((2S,3S)-3-(3-(3-гидрокси-3-пропилгексил)фенил)-2-метил-3-(триметилсилилокси)пропил)изоиндолин-1,3-диона в ЕtOН добавляли трифторуксусную кислоту. Реакционную смесь перемешивали при комнатной температуре, затем концентрировали при пониженном давлении, заново выпаривали с EtOAc, затем с гексаном для получения 2-((2S,3S)-3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)-2-метилпропил)изоиндолин-1,3-диона.
Стадия 7: Фталимидное расщепление 2-((2S,3S)-3-гидрокси-3-(3-(3-гидрокси-3-пропилгексил)фенил)-2-метилпропил)изоиндолин-1,3-диона выполняли согласно способу, описанному в Примере 9, что позволило получить Пример 180.
ПРИМЕР 181
Приготовление 1-(3-(3-аминопропил)-5-метилфенетил)пиклогексанола

1-(3-(3-аминопропил)-5-метилфенетил)циклогексанол был приготовлен согласно способу, показанному на Схеме 39.
Схема 39

Стадии 1-4: Методика синтеза (E)-1-(3-(3-аминопроп-1-енил)-5-метилфенетил)пиклогексанола аналогична синтезу Примера 183, за исключением того, что 1-бром-3-иод-5-метилбензоли 1-этинилциклогексанол использовали вместо 1-бром-3-иодбензола и 4-этинилгептан-4-ола.
Стадия 5: Гидрирование - (E)-1-(3-(3-аминопроп-1-енил)-5-метилфенетил) циклогексанола согласно способу, описанному в Примере 12, позволило получить Пример 181.
ПРИМЕР 182
Приготовление 1-(3-(3-аминопропил)-4-фторфенетил)пиклогексанола

1-(3-(3-аминопропил)-4-фторфенетил)циклогексанол был приготовлен согласно способу, который использовали в Примере 181.
Стадии 1-4: Методика синтеза (E)-1-(3-(3-аминопроп-1-енил)-4-фторфенетил)циклогексанола аналогична синтезу Примера 181 за исключением того, что 2-бром-1-фтор-4-иодбензол использовали вместо 1-бром-3-иодбензола.
Стадия 5: Гидрирование (E)-1-(3-(3-аминопроп-1-енил)-4-фторфенетил)пиклогексанола согласно способу, описанному в Примере 12, позволило получить Пример 182.
ПРИМЕР 183
Приготовление (Е)-1-(3-(3-аминопроп-1-енил)фенетил)циклогексанола
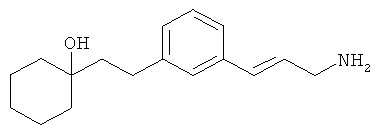
(E)-1-(3-(3-аминопроп-1-енил)фенетил)циклогексанол был приготовлен согласно способу, показанному на Схеме 40.
Схема 40
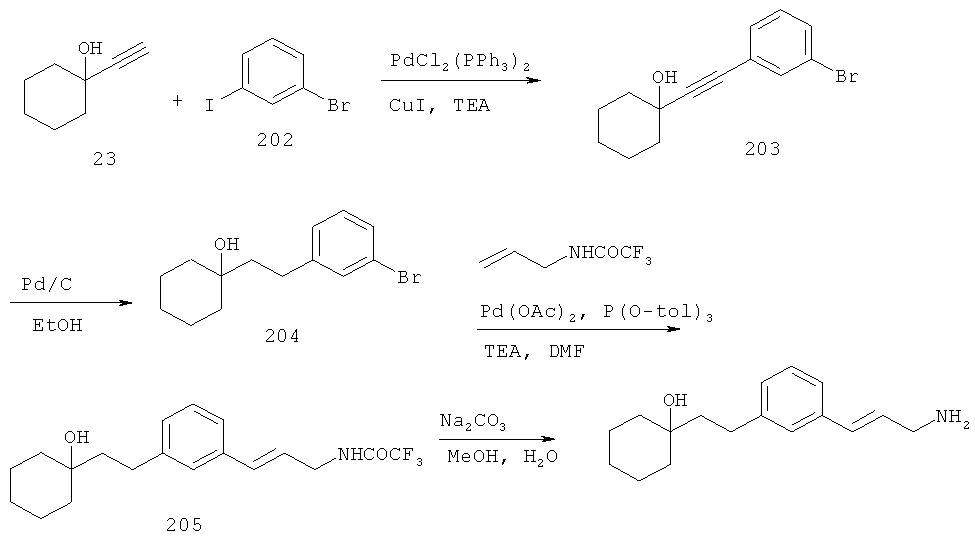
Стадия 1: Взаимодействие циклогексилметанола с 1-бром-3-иодбензолом согласно способу, описанному в Примере 12, позволило получить 1-((3-бромфенил)этинил)циклогексанол в виде светло-желтого масла.
Стадия 2: Гидрирование 1-((3-бромфенил)этинил)циклогексанола согласно способу, описанному в Примере 12, позволило получить 1-(3-бромфенетил)циклогексанол.
Стадия 3: Взаимодействие 1-(3-бромфенетил)циклогексанола с N-аллил-2,2,2-трифторацетамидом согласно способу, описанному в Примере 118, позволило получить (E)-2,2,2-тpифтop-N-(3-(3-(2-(1-гидpoкcициклoгeкcил)фeнил)aллил)aцeтaмид.
Стадия 4: Снятие защиты (E)-2,2,2-трифтор-N-(3-(3-(2-(1-гидроксициклогексил) фенил)аллил)ацетамида согласно способу, описанному в Примере 2, позволило получить Пример 183.
ПРИМЕР 184
Приготовление 1-(3-(3-аминопроп-1-инил)фенетил)пиклогексанола

1-(3-(3-аминопроп-1-инил)фенетил)пиклогексанол был приготовлен согласно способу, который использовали в Примере 12.
Стадия 1: Взаимодействие 1-(3-бромфенетил)циклогексанола с 2-(проп-2-инил)изоиндолин-1,3-дионом согласно способу, описанному в Примере 12, позволило получить 2-(3-(3-(2-(1-гидроксициклогексил)этил)фенил)проп-2-инил)изоиндолин-1,3-дион.
Стадия 2: Снятие защиты 2-(3-(3-(2-(1-гидроксициклогексил)этил)фенил)проп-2-инил)изоиндолин-1,3-диона согласно способу, который описан в Примере 12, позволило получить Пример 184.
ПРИМЕР 185
Приготовление 4-(3-(3-аминопропокси)фенетил)гептан-4-ола
4-(3-(3-аминопропокси)фенетил)гептан-4-ол был приготовлен согласно способу, который использовали в Примере 9.
ПРИМЕР 186
Приготовление 4-(3-((2-аминоэтокси)метил)фенетил)гептан-4-ола

4-(3-((2-аминоэтокси)метил)фенетил)гептан-4-ол был приготовлен согласно способу, показанному на Схеме 41.
Схема 41

Стадия 1: Раствор DIBAL-H в гептане добавляли в инертной атмосфере в охлажденный (-78°С) раствор 2-(3-бромфенил)-1,3-диоксолана в гексанах. Реакционную смесь перемешивали до тех пор, пока исходный материал не обнаруживали ТСХ. Водный раствор НСl (1N) добавляли в реакционную смесь при нагревании до комнатной температуры. Продукт экстрагировали EtOAc. Объединенные органические слои высушивали над безводным MgSO4 и концентрировали при пониженном давлении для получения 2-(3-бромбензилокси)этанола.
Стадия 2: Реакция Мицунобу 2-(3-бромбензилокси)этанола и фталимида согласно способу, который использовали в Примере 134, позволила получить 2-(2-(3-бромбензилокси)этил)изоиндолин-1,3-дион.
Стадия 3: Реакция Соногашира 2-(2-(3-бромбензилокси)этил)изоиндолин-1,3-диона и 4-этинилгептан-4-ола согласно способу, описанному в Примере 12, позволила получить 2-(2-(3-(3-гидрокси-3-пропилгекс-1-инил)бензилокси)этил)изоиндолин-1,3-дион.
Стадия 4: Гидрирование 2-(2-(3-(3-гидрокси-3-пропилгекс-1-инил)бензилокси)этил)изоиндолин-1,3-диона согласно способу, который использовали в Примере 12, позволило получить 2-(2-(3-(3-гидрокси-3-пропилгексил)бензилокси)этил)изоиндолин-1,3-дион.
Стадия 5: Снятие защиты 2-(2-(3-(3-гидрокси-3-пропилгексил)бензилокси) этил)изоиндолин-1,3-диона согласно способу, который использовали в Примере 21, позволило получить Пример 186.
ПРИМЕР 187
Приготовление 2-(3-(3-аминопропил)фенетил)пиклогексанола

2-(3-(3-аминопропил)фенетил)циклогексанол был приготовлен согласно способу, который использовали в Примере 2.
Стадия 1: Реакция Соногашира бромида (10) с 2-этинилциклогексанолом с последующей флэш хроматографией (градиент 5-50% EtOAc/гексаны) позволила получить 2,2,2-трифтор-N-(3-(3-((2-гидроксициклогексил)этинил)фенил)пропил) ацетамид в виде желтого масла. Выход (1.2 г, 43%):1Н ЯМР (400 МГц, CDCl3) δ 7.18-7.28 (m, 3Н), 7.06-7.11 (m, 1H), 6.33 (brs, 1H), 3.48-3.57 (m, 1H), 3.36 (ddd, J = 6.8 Гц, 2H), 2.63 (t, J = 7.2 Гц, 2Н), 2.38-2.46 (m, 1H), 2.32 (brs, 1H), 2.02-2.10 (m, 2H), 1.91 (dddd, J = 7.2 Гц, 2H), 1.74-1.82 (m, 1H), 1.66-1.74 (m, 1H), 1.40-1.52 (m, 1H), 1.16-1.40 (m, 3H).
Стадия 2: Снятие защиты 2,2,2-трифтор-N-(3-(3-((2-гидроксициклогексил)этинил)фенил)пропил)ацетамида с последующей флэш хроматографией (10% (7N NН3/МеОН)/дихлорметан) позволило получить 2-((3-(3-аминопропил)фенил)этинил)циклогексанол в виде оранжевого масла. Выход (0.606 г, 69%):1Н ЯМР (400 МГц, CDCl3) δ 7.16-7.26 (m, 3Н), 7.08-7.12 (m, 1H), 3.48-3.56 (m, 1H), 2.71 (t, J = 7.2 Гц, 2Н), 2.61 (t, J = 7.2 Гц, 2H), 2.38-2.46 (m, 1H), 2.01-2.10 (m, 2H), 1.64-1.82 (m, 7H), 1.40-1.52 (m, 1H), 1.16-1.40 (m, 3H).
Стадия 3: Гидрирование 2-((3-(3-аминопропил)фенил)этинил)циклогексанола с последующей флэш хроматографией (10% (7N NН3/МеОН)/дихлорметан) позволило получить Пример 187 в виде бледно-желтого твердого вещества. (0.265 г, 69%):1Н ЯМР (400 МГц, CDCl3) δ 7.17 (t, J = 7.6 Гц, 1Н), 6.96-7.04 (m, 3H), 3.18 (m, 1H), 2.66-2.76 (m, 3Н), 2.62 (t, J = 7.8 Гц, 2Н), 2.46-2.56 (m, 1H), 2.05-2.15 (m, 1H), 1.88-1.98 (m, 2H), 1.69-1.80 (m, 3H), 1.61-1.69 (m, 1H), 1.34-1.46 (m, 4H), 1.10-1.34 (m, 4H), 0.91-1.03 (m, 1H).
ПРИМЕР 188
Анализ in vitro ингибирования изомеразы
Была определена способность аминопроизводных соединений ингибировать активность изомеразы зрительного цикла.
Реакции ингибирования изомеразы выполняли главным образом как описано (Stecher et al., J. Biol. Chem. 274:8577-85 (1999); see also Golczak et al., Proc. Natl. Acad. Sci. USA 102:8162-67 (2005)). Микросомные мембраны бычего пигментного эпителия сетчатки (ПЭС) являлись источником изомеразы зрительного цикла.
Приготовление микросомных мембран ПЭС.
Экстракты микросомных мембран бычьих ПЭС готовили согласно описанным способам (Golczak et al., Proc. Natl. Acad. Sci. USA 102:8162-67 (2005)) и хранили при -80°С. Сырые микросомные экстракты ПЭС размораживали в ванне с водой при 37°С и затем немедленно помещали на лед. 50 мл сырых микросом ПЭС помещали в тефлоново-стеклянный гомогенизатор емкостью 50 мл (Fisher Scientific, номер по каталогу 0841416М) на лед, приводимый в действие ручным сверлом DeWalt, и гомогенизировали десять раз вверх и вниз на льду при максимальной скорости. Этот процесс повторяли до тех пор, пока сырой микросомный раствор ПЭС не был гомогенизирован. Гомогенат затем центрифугировали (50.2 Ti мотор (Beckman, Fullerton, CA), 13,000 об/мин; 15360 Rcf) в течение 15 минут при 4°С. Надосадочную жидкость собирали и центрифугировали при 42,000 об/мин (160,000 Rcf; 50.2 Ti мотор) в течение 1 ч при 4°С. Надосадочную жидкость удаляли и гранулы суспендировали в 12 мл (конечный объем) холодного 10 мМ буферного раствора MOPS, pH 7.0. Ресуспендированные мембраны ПЭС в аликвотах по 5 мл гомогенизировали в стекло-стекло гомогенизаторе (Fisher Scientific, каталожный номер К885500-0021) до высокой степени гомогенности. Концентрацию белка рассчитывали с помощью количественного биуретового анализа содержания белков ВСА согласно протоколу производителя (Pierce, Rockford, IL). Гомогенизированные препараты ПЭС хранили при -80°С.
Выделение человеческого апо клеточного ретинальдегид-связывающего белка (CRALBP)
Рекомбинантный человеческий апо клеточный ретинальдегид-связывающий белок (CRALBP) клонировали и экспрессировали согласно стандартным молекулярно-биологическим методам (see Crabb et al., Protein Science 7:746-57 (1998); Crabb et al., J. Biol. Chem. 263:18688-92 (1988)). Коротко, полную РНК готовили из конфлюэнтных клеток ARPE19 (American Type Culture Collection, Manassas, VA), кДНК синтезировали с помощью олиго (dT)12-18 праймера и затем ДНК-кодирование CRALBP выполняли двумя последовательными цепными реакциями полимеразы (see Crabb et al., J. Biol. Chem. 263:18688-92 (1988); Intres, et al., J. Biol. Chem. 269:25411-18 (1994); GenBank Accession No. L34219.1). Продукт полимеразной цепной реакции (ПЦР) субклонировали в вектор pTrcHis2-TOPO ТА согласно протоколу производителя (Invitrogen Inc., Carlsbad, CA; каталожный номер К4400-01), и затем последовательность подтверждали согласно стандартным методикам секвенирования нуклеиновой кислоты. Рекомбинантный 6xHis-меченый человеческий CRALBP экспрессировался в химически компетентных клетках Е. coli One Shot TOP 10 (Invitrogen), и рекомбинантный полипептид выделяли из лизатов клеток Е. coli с помощью никель-аффинной хроматографии на никелиевых(Ni) колонках Sepharose XK16-20 для ВЭЖХ (Amersham Bioscience, Pittsburgh, PA; каталожный номер 17-5268-02). Очищенный 6хHis-меченый человеческий CRALBP диализировали против 10 мМ Бис-Трис-Пропана (ВТР) и анализировали методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ). Молекулярный вес рекомбинантного человеческого CRALBP составил примерно 39 kDal.
Анализ изомеразы
Аминопроизводные соединения и контрольные соединения были ресуспендированы в этаноле до 1.0 М. Для проведения анализа изомеразы готовили серию десятикратных разбавлений (10-2, 10-3, 10-4, 10-5, 10-6 М) в этаноле каждого соединения.
Анализ изомеразы выполняли в 10 мМ Бис-Трис-Пропановом (ВТР) буфере, рН 7.5, 0.5% БСА (разбавленном в ВТР буфере), 1 мМ пирофосфате натрия, 20 мкМ полностью-транс ретинола (в этаноле) и 6 мкМ апо-CRALBP. Контрольные соединения (2 мкл) (конечное разведение 1/15 запасов серийного разведения) добавляли в вышеуказанную реакционную смесь, в которую добавляли микросомы ПЭС. Такой же объем этанола добавляли в контрольную реакцию (отсутствие тестируемого соединения). Затем добавляли бычьи микросомы ПЭС (9 млк) (см. выше), и смеси доводили до 37°С для инициирования реакции (общий объем = 150 мкл). Реакции останавливали через 30 мин добавлением метанола (300 мкл). В реакционную смесь с помощью пипетки добавляли гептан (300 мкл). Ретиноид экстрагировали осаждением реакционных смесей с последующим центрифугированием в микроцентрифуге. Верхнюю органическую фазу переносили в ВЭЖХ пробирки и затем анализировали ВЭЖХ с помощью системы Agilent 1100 HPLC с колонкой с нормальной фазой: SILICA (Agilent Technologies, dp 5µ, 4.6 мм Х, 25СМ; скорость потока 1.5 мл/мин; объем впрыскивания 100 мкл). Компоненты растворителя составляли 20% 2% изопропанола в EtOAc и 80% 100% гексана.
Область под А318 нм кривой показала 11-цис ретиноловый пик, который был рассчитан с помощью программного обеспечения Agilent Chemstation и записан вручную. Величины IС50 (концентрация соединения, которая дает 50% ингибирования образования 11-цис-ретинола in vitro) рассчитывали с помощью программного обеспечения GraphPad Prism® 4 Software (Irvine, CA). Все тесты выполняли дважды.
Зависимость от концентрации раскрытых здесь соединений на реакцию изомеризации ретинола также оценивали с помощью рекомбинантной человеческой ферментной системы. В частности, анализ in vitro человеческой изомеразы выполняли главным образом как в Golczak et al. 2005, PNAS 102: 8162-8167, ref. 3). Гомогенат клона клеток НЕК293, экспрессирующий рекомбинантный человеческий RPE65 и LRAT, был источником зрительных энзимов, и экзогенный полностью-транс-ретинол (примерно 20 мкМ) использовали в качестве субстрата. Рекомбинантный человеческий CRALBP (примерно 80 ug/мл) добавляли для усиления образования 11 цис-ретиналя. 200 мкл базовой реакционной смеси Бис-Трис-Фосфатното буфера (10 мМ, рН 7.2) также содержит 0.5% БСА и 1 мМ NaPPi. В этом анализе реакцию проводили при 37°С двумя параллельными опытами в течение одного часа и прекращали добавлением 300 мкл метанола. Количество продукта реакции, 11-цис-ретинола, измеряли анализом ВЭЖХ с последующей экстракцией реакционной смеси гептаном. Записывали Peak Area Units (PAUs), соответствующие 11-цис-ретинолу в ВЭЖХ хроматограммах, и кривые зависимости от концентрации анализировали с помощью GraphPad Prism на величины IС50. Способность многочисленных раскрытых здесь соединений ингибировать реакцию изомеризации оценивали количественно и определяли соответствующие величины IС50. Величины IС50 разных раскрытых здесь соединений, определенных любым из двух вышеуказанных способов, сведены в приведенные ниже Таблицы. Величины IС50 для человеческих и бычьих данных in vitro представлены в Таблицах 6А и 6В.
ПРИМЕР 189
In vitro анализ мышиной изомеразы
Способность аминопроизводных соединений ингибировать изомеразу определяли анализом in vitro изомеразы мыши. Известно, что короткое воздействие на глаз интенсивного света («фотообесцвечивание» зрительного пигмента или просто «обесцвечивание») фотоизомеризует почти весь 11-цис-ретиналь в сетчатке. Восстановление 11-цис-ретиналя после обесцвечивания может использоваться для оценки активности изомеразы in vivo. Замедленное восстановление, как представлено более низкими уровнями оксима 11-цис-ретиналя, является признаком ингибирования реакции изомеризации. Процедуры выполняли главным образом как описано в Golczak et al., Proc. Natl. Acad. Sci. USA 102:8162-67 (2005). See also Deigner et al., Science, 244:968-71 (1989); Gollapalli et al., Biochim Biophys Acta. 1651:93-101 (2003); Parish, et al., Proc. Natl. Acad. Sci. USA, 14609-13 (1998); Radu, et al., Proc Natl Acad Sci USA 101:5928-33 (2004).
Шестинедельному адаптированному к темноте мышиному самцу линии CD-1 (альбинос) зондом орально вводили соединение (0.03-3 мг/кг), растворенное в 100 мкл кукурузного масла, содержащего 10% этанола (5-8 животных на группу). Мышам орально зондом вводили несколько аминопроизводных соединений, описанных здесь. После 1-48 часов пребывания в темноте, мышей подвергали воздействию фотообесцвечивания при 5,000 люкс белого света в течение 10 мин. Мышей оставляли восстанавливаться в течение 2 ч в темноте. Животных затем умерщвляли асфикцией диоксидом углерода. Ретиноиды экстрагировали из глаза, и регенерацию 11-цис-ретиналя оценивали в разные временные интервалы.
Экстракция ретиноида глаза
Все стадии выполняли в темноте при минимальном красном освещении (низкое освещение темной комнаты и мигающее освещение с красным фильтром для точечного освещения в случае необходимости) (см., например, Maeda et al., J. Neurochem 85:944-956, 2003; Van Hooser et al., J Biol Chem 277:19173-82, 2002). После умерщвления мышей, глаза немедленно удаляли и помещали в жидкий азот для хранения.
Глаза помещали в 500 мкл Бис-Трис Пропанового буфера (10 мМ, рН ~7.3) и 20 мкл 0.8 М гидроксиламина (pH ~7.3). Глаза разрезали на маленькие части с помощью ножниц для эрикэктомии и затем тщательно гомогенизировали при скорости 30000 об/мин на механическом гомогенизаторе (Polytron PT 1300 D) в пробирке до тех пор, пока не оставалось видимых тканей. В каждую пробирку добавляли по 500 мкл метанола и 500 мкл гептана. Пробирки закрепляли в вортексе и содержимое тщательно перемешивали в течение 15 мин при комнатной температуре. Органическую фазу отделяли от водной фазы центрифугированием в течение 10 мин при 13К об/мин, 4°С. Из верхнего слоя (органическая фаза) удаляли 240 мкл раствора и переносили в чистый 300 мкл стакан, помещали в виалы ВЭЖХ с помощью стеклянной пипетки, и виалы плотно закрывали.
Образцы анализировали на системе Agilent 1100 HPLC с колонкой с нормальной фазой: КВАРЦ (Beckman Coutlier, dp 5 µm, 4.6 мМ × 250 мМ). Скорость потока составляла 1.5 мл/мин; компонентами растворителя являлись 15% растворителя 1 (1% изопропанола в этилацетате) и 85% растворителя 2 (100% гексаны). Объем загрузки каждого образца составлял 100 мкл; обнаружение при длине волны 360 нм. Область под кривой для оксима 11-цис-ретцналя рассчитывали с помощью программного обеспечения Agilent Chemstation и записывали вручную. Данные получали с помощью программного обеспечения Prizm.
Положительно контролируемых мышей (соединение не вводилось) умерщвляли полностью адаптированными к темноте, и анализировали ретиноиды глаз. Адаптированных к свету (обесцвеченных) контрольных мышей (соединение не вводилось) умерщвляли, ретиноиды изолировали и анализировали сразу же после светолечения. Например, ингибирующая активность изомеразы соединения Примера 3 (Соединение 3) представлена на Фигуре 1. Животным вводили орально зондом 1 мг/кг соединения, затем «фотообесцвечивали» (5000 Люкс белого света в течение 10 минут) через 4,24 и 48 часов после введения дозы и возвращали в темновое состояние для восстановления содержания 11-цис-ретиналя в глазу. Мышей умерщвляли через 2 часа после обесцвечивания, граза рассекали и содержание ретиноида анализировали ВЭЖХ.
Результаты представлены на Фигуре 1.
Изучение in vivo дозо-зависимого ингибирования изомеразы выполняли с использованием нескольких аминопроизводных соединений, описанных здесь. Шестимесячным адаптированным к темноте мышиным самцам линии CD-1 (альбинос) орально через зонд вводили дозу 0.03, 0.1, 0.3, 1 и 3 мг/кг соединения в стерильной воде в качестве раствора и обесцвечивали через 4 ч после дозирования. Мышей оставляли для восстановления в темноте на 2 часа. Животных затем умерщвляли диоксидом углерода. Ретиноиды экстрагировали из глаза и регенерацию 11-цис-ретиналя проводили в разные временные интервалы. Ретиноидный анализ выполняли как описано выше. Мышей, адаптированных к темноте, обрабатывали только носителем, умерщвляли полностью адаптированными к темноте без светолечения и анализировали. Например, дозозависимое ингибирование восстановления 11-цис-ретиналя (оксима) через 4 часа после введения дозы соединения Примера 19 (Соединение 19) представлено на Фигуре 2. Фигура 2А показывает дозо-зависимое ингибирование активности изомеразы и Фигура 2В показывает отклик дозы (логарифм дозы, мг/кг), где данные приведены в соответствие к процентному ингибированию изомеразной активности. Четыре животных были включены в каждую обрабатываемую группу. Планки погрешностей соответствуют стандартной ошибке. Ингибирование восстановления зависело от дозы с величиной ED50 (доза соединения, которая дает 50% ингибирования восстановления 11-цис-ретиналя (оксима)), установленной 0.651 мг/кг. Предполагаемые величина ED50 соединений Примеров 3, 29, 15 и 19 (Соединения 3, 29, 15 и 19) представлены в Таблице 7А.
Таблица 7А представляет in vivo данные ингибирования изомеразы.
Изучение однократной дозы нескольких раскрытых здесь соединений выполняли при оральном введении 1 мг/кг и в некоторых случаях также 5 мг/кг, при обесцвечивании через 4 и 24 часа после введения доз. Эксперименты проводили также на мышиных самцах CD1. Результаты анализировали ВЭЖХ. Результаты % ингибирования представлены в Таблице 7В
ПРИМЕР 190
Приготовление системы ретинальной нейрональной клеточной культуры
Этот пример описывает способы приготовления длительной культуры нейрональных клеток сетчатки. Все соединения и реагенты могут быть получены от Sigma Aldrich Chemical Corporation (St. Louis, МО) или других подходящих производителей.
Ретинальная нейрональная клеточная культура
Глаза свиньи получали от Kapowsin Meats, Inc. (Graham, WA). Глаза энуклеировали, и мышцы и ткани удаляли с орбиты. Глаза разрезали пополам вдоль их экватора, и нейрональную сетчатку рассекали от передней части глаза в забуференном солевом растворе согласно стандартным способам, известным в данной области. Коротко, сетчатка, ресничное тело и стекловидное тело отсекали от передней половины глаза целиком, и сетчатку осторожно отделяли от очищенного стекловидного тела. Каждую сетчатку отщепляли папаином (Worthington Biochemical Corporation, Lakewood, NJ) с последующей инактивацией фетальной бычьей сывороткой (FBS) и добавлением 134 ед. Кунитца/мл ДНКазы. Энзиматически диссоциированные клетки перетирали и собирали центрифугированием, ресуспендировали в смеси модифицированной по способу Дульбекко среды Игла (DMEM) и субстрата Хэма F-12 (Gibco BRL, Invitrogen Life Technologies, Carlsbad, CA), содержащей примерно 25 мкг/мл инсулина, примерно 100 мкг/мл трансферрина, примерно 60 мкМ путресцина, примерно 30 нМ селена, примерно 20 нМ прогестерона, примерно 100 ед/мл пенициллина, примерно 0.05 М Hepes и примерно 10% FBS. Диссоциированные исходные ретинальные клетки помещали на покрытые Поли-D-лизином и Матригелем (BD, Franklin Lakes, NJ) стеклянные покровные стекла, которые помещали в 24-ячеечный культуральный планшет (Falcon Tissue Culture Plates, Fisher Scientific, Pittsburgh, PA). Клетки сохранялись в культуре от 5 дней до одного месяца в 0.5 мл среды (как описано выше, за исключением только 1% FBS) при 37°С и 5% СO2.
Иммуноцитохимический анализ
Нейрональные клетки сетчатки культивировали в течение примерно 1, 3, 6 и 8 недель, и проводили иммуногистохимический анализ клеток в каждый момент времени. Иммуноцитохимический анализ выполняли согласно стандартным методикам, известным в данной области. Палочковые фоторецепторы определяли мечением антителом специфичным в отношении родопсина (мышиные моноклональные антитела, разбавленные примерно 1:500; Chemicon, Temecula, СА). Антитело к нейрофиламенту средней молекулярной массы (поликлональные кроличьи антитела к NFM, разбавленные примерно 1:10,000, Chemicon) использовали для определения ганглиоцитов; антитело к β3-тубулину (моноклональные мышиные антитела G7121, разбавленные примерно 1:1000, Promega, Madison, WI) использовали для общего определения промежуточных нейронов и ганглиоцитов, и антитело к кальбиндину (поликлональные кроличьи антитела к АВ1778, разбавленные примерно 1:250, Chemicon) и калретинину (поликлональные кроличьи антитела АВ5054, разбавленные примерно 1:5000, Chemicon) использовали для определения субпопуляций кальбиндин- и калретинин- экспрессирующих промежуточных нейронов во внутреннем ядерном слое. Коротко, культуры ретинальных клеток фиксировали 4% параформальдегидом (Polysciences, Inc, Warrington, PA) и/или этанолом, ополаскивали в фосфатно-солевом буфере Дюльбекко (DPBS) и инкубировали с исходным антителом в течение примерно 1 ч при 37°С. Затем клетки споласкивали DPBS, инкубировали со вторичным антителом (вторичные антитела, конъюгированные с Alexa 488- или Alexa 568 (Molecular Probes, Eugene, OR)), и споласкивали DPBS. Ядра окрашивали 4′, 6-диамидино-2-фенилиндолом (DAPI, Molecular Probes) и культуры ополаскивали DPBS перед удалением стеклянных покровных стекол и помещением их в среду Fluoromount-G (Southern Biotech, Birmingham, AL) на предметные стекла для наблюдения и анализа.
Выживаемость зрелых нейронов сетчатки в культуре с изменением времени определяли гистохимическими анализами. Фоторецепторные клетки определяли с помощью антитела к родопсину; ганглиоциты идентифицировали с помощью NFM антитела; и амакриновые и горизонтальные клетки определяли окрашиванием антителом, специфичным для калретинина.
Культуры анализировали подсчетом родопсин-меченых фоторецепторов и NFM-меченых ганглиоцитов с помощью микроскопа Olympus IX81 или CZX41 (Olympus, Токио, Япония). Двадцать полей зрения рассчитывали на покровное стекло с помощью 20х линз объектива. Шесть покровных стекол анализировали этим способом для каждого условия в каждом эксперименте. Подсчитывали клетки, которые не подвергали воздействию какого-либо стрессора, и клетки, которые подвергали воздействию стрессора, приводили в соответствие с количеством клеток в контрольном образце. Предполагается, что соединения, представленные в этом описании, улучшают зависимую от дозы и времени выживаемость зрелых нейронов сетчатки.
ПРИМЕР 191
Влияние соединений аминовых производных на выживаемость клеток сетчатки
Этот Пример описывает использование системы зрелой ретинальной клеточной культуры, которая включает клеточный стрессор для определения влияния любого раскрытого здесь аминопроизводного соединения на жизнеспособность ретинальных клеток.
Культуры ретинаьных клеток были приготовлены как описано в Примере 190. В качестве ретинального клеточного стрессора добавляли А2Е. Химический стресс, А2Е, применяли после выращивания клеток примерно в течение 1 недели. А2Е разбавляли в этаноле и добавляли в ретинальные клеточные культуры при концентрации примерно 0,10 мкМ, 20 мкМ, и 40 мкМ. Культуры обрабатывали в течение примерно 24 и 48 часов. А2Е получали от Dr. Koji Nakanishi (Columbia University, New York City, NY) или синтезировали согласно способу Parish et al. (Proc. Natl. Acad. Sci. USA 95:14602-13 (1998)). Затем в культуру добавляли любое раскрытое здесь аминопроизводное соединение. В другие культуры ретинальных клеток любое раскрытое здесь аминопроизводное соединение добавляли до применения стрессора или одновременно с добавлением А2Е в культуру ретинальной клетки. Культуры сохраняли в инкубаторах культур тканей на время действия стрессора при at 37°С и 5% CO2. Клетки затем анализировали иммуноцитохимически, как описано в Примере 190.
Анализ апоптоза
Ретинальные клеточные культуры готовили, как описано в Примере 190, и культивировали в течение 2 недель, после чего подвергали воздействию белого света при примерно 6000 lux в течение 24 часов с последующим 13-часовым периодом отдыха. Устройство было сконструировано для равномерного поступления света определенных длин волн в определенные ячейки 24-ячеечных планшетов. Устройство содержит флуоресцентную лампу белого света (GE P/N FC12T9/CW), соединенную с источником переменного тока. Лампу монтировали внутри стандартного инкубатора для культуры тканей. Воздействие белым светом осуществляли помещением планшетов с клетками непосредственно под флуоресцентную лампу. Уровни CO2 поддерживали примерно 5%, и температуру клеточного планшета поддерживали при 37°С. Температуру контролировали с помощью тонкопленочной термопары. Интенсивности света для всех устройств измеряли и регулировали с помощью люксметра от Extech Instruments Corporation (P/N 401025; Waltham, MA). Любое раскрытое здесь соединение добавляли в ячейки культуральных планшетов до воздействия на клетки белого света, и добавляли в другие ячейки культур после воздействия света. Для оценки апоптоза выполняли терминальное дезоксиуридиновое мечение концов (TUNEL), как описано здесь.
Анализ апоптоза также выполняли после воздействия на ретинальные клетки синего света. Ретинальные клеточные культуры выращивали, как описано в Примере 190. После выращивания клеток в течение примерно 1 недели, применяли воздействие синего света. Синий свет поступал от источника света, изготовленного специально на заказ, состоящего из двух элементов 24 (4×6) синих светодиодов (Sunbrite LED P/N SSP-01TWB7UWB12), разработанных таким образом, что каждый LED был совмещен с отдельной ячейкой 24-ячеечного одноразового планшета. Первый элемент помещали на верхнюю часть 24-ячеечного планшета, заполненного клетками, в то время как второй элемент помещали под планшет с клетками, что позволяло обоим элементам обеспечивать одновременное воздействие света на планшет с клетками. Все устройство помещали внутри стандартного инкубатора для выращивания культур тканей. Уровни СO2 поддерживали примерно 5% и температуру клеточного планшета поддерживали примерно при 37°С. Температуру контролировали с помощью тонкопленочной термопары. Ток в каждый LED контролировали индивидуально с помощью отдельного потенциометра, что способствовало равномерной световой отдаче для всех LED. Клеточные планшеты подвергали воздействию примерно 2000 люкс синего света в течение 2 часов или 48 часов с последующим 14-часовым периодом отдыха. Одно или более раскрытых здесь соединений добавляли в ячейки планшетов с культурами до воздействия на клетки синего света, и добавляли в другие ячейки культур после воздействия синего света. Для оценки апоптоза, TUNEL выполняли как описано здесь.
Для оценки апоптоза, TUNEL выполняли согласно стандартным методикам, применяемым на практике в данной области техники, и согласно инструкциям производителя. Коротко, ретинальные клеточные культуры сначала фиксировали 4% параформальдегидом и затем этанолом, после чего споласкивали в DPBS. Фиксированные клетки инкубировали с энзимом TdT (конечная концентрация 0.2 ед/млк) в реакционном буфере (Fermentas, Hanover, MD), объединенном с Chroma-Tide Alexa 568-5-dUTP (конечная концентрация 0.1 мкМ) (Molecular Probes) в течение примерно 1 ч при 37°С. Культуры ополаскивали DPBS и инкубировали с исходным антителом в течение ночи при 4°С или в течение примерно 1 часа при 37°С. Клетки затем ополаскивали DPBS, инкубировали со вторичными антителами, конъюгированными с Alexa 488 и ополаскивали DPBS. Ядра окрашивали DAPI и культуры ополаскивали DPBS перед удалением покровных стекол и помещением их в среду Fluoromount-G на предметные стекла для наблюдения и анализа.
Культуры анализировали подсчетом TUNEL-меченых ядер с помощью микроскопа Olympus IX81 или CZX41 (Olympus, Токио, Япония). Двадцать полей зрения подсчитывали на каждое предметное стекло с помощью 20х объективных линз. Шесть предметных стекол анализировали этим способом для каждого условия. Подсчитывали клетки, которые не подвергали воздействию тестируемого соединения, и клетки, которые подвергали воздействию антитела, приводили в соответствие с числом клеток в контрольном образце. Данные анализировали с помощью непарного Student f-теста. Предполагается, что соединения этого раскрытия снижают индуцированный А2Е апоптоз и смерть клетки в ретинальных клеточных культурах дозозависимым и зависимым от времени образом.
ПРИМЕР 192
Мышиная модель in vivo, адаптированная к свету
Этот Пример описывает влияние аминопроизводного соединения в мышиной модели in vivo, разрушенной светом.
Воздействие на глаз интенсивного белого света может вызывать фотоповреждение сетчатки. Степень повреждения после обработки светом можно оценить измерением содержания цитоплазматического гистон-ассоциированного-ДНК-фрагмента (моно- и олигонуклеосомы) в глазу (см., например, Wenzel et al., Prog. Retin. Eye Res. 24:275-306 (2005)).
Адаптированным к темноте мышиным самцам линии Balb/c (альбинос, 10/группа) зондом вводили аминопроизводное соединение настоящей заявки в разных дозах (0.01-25 мг/кг) или только носитель. Через шесть часов после введения доз животных подвергали светолечению (8,000 Люкс белого света в течение 1 часа). Мышей умерщвляли через 40 часов после восстановления в темноте и сетчатку отсекали. Анализ ELISA обнаружения гибели клетки выполняли согласно инструкциям производителя (ROCHE APPLIED SCIENCE, Cell Death Detection ELISA plus Kit). Содержание фрагментированной ДНК в сетчатке измеряли для установления ретинально-защитной активности соединений; Предполагается, что эти соединения настоящего раскрытия подавляют или ингибируют фотоповреждение сетчатки.
ПРИМЕР 193
Электроретинографический анализ (ЭРГ)
Этот пример описывает определение влияния аминопроизводного соединения, которое является модулятором зрительного цикла, на величину ЭРГ ответа глаз мышей после орального введения доз соединения животным. Уровень ЭРГ ответа глаз определяли после введения соединения животным (например примерно через 18 и 66 часов после введения).
Три группы девятимесячных мышей (примерно 19-25 г) обоих полов (линия С5 7BL/6, Charles River Laboratories, Wilmington, MA) содержали при комнатной температуре, 72±4°F, и относительной влажности 25%. Животные находились в условиях среды с циклом 12 часов света/темновое окружение, имели свободный доступ к корму и питьевой воде, а также проверялись на общее состояние здоровья до и во время исследования. Вес тела определяли до введения доз. Средний вес образца использовали для установления дозы для всех исследуюемых мышей.
Каждое тестируемое соединение растворяли в контрольном растворителе (ЕtOН) и разбавляли примерно 1:10 (90 мл/900 мл) в соответствующем масле (например, кукурузном масле (Crisco Pure Corn Oil, J.M. Smucker Company, Orrville, ОН)) до требуемой дозы (мг/кг) в требуемом объеме (примерно 0.1 мл/животное). Контрольным носителем являлась смесь этанол:масло (примерно 1:10 (0.9 мл/9 мл). Пример назначений лечения и способов введения животным представлен в Таблице 8.
Животным вводили дозу орально зондом с заданным контрольным растворителем или тестируемыми соединениями во время светового цикла (в примерном интервале от 30 мин до 3 ч 30 мин после начала светового цикла). Объем введенной дозы обычно не превышала 10 мл/кг.
ЭРГ записи производили в адаптированных к темноте и затем (во время курса того же эксперимента) в адаптированных к свету состояниях. Для получения ответа в темновом состоянии животных помещали в темную среду, по меньшей мере, на 1 час до записи, и начинали, по меньшей мере, через 30 минут после начала светового цикла.
Примерно через 18 и 66 часов после введения дозы мышей усыпляли смесью Кетамина и Ксилазина (100 мг/кг и 20 мг/кг, соответственно) и помещали на грелку для поддержания стабильной внутренней температуры во время эксперимента. Зрачки расширяли закапыванием в глаза 5 микролитров мидриатического раствора (тропикамид 0.5%) в записываемый глаз. Монополярный электрод мышиной роговицы (Мауо Corporation, Inazawa, Aichi, Japan) помещали на роговицу и, подкожный электрод с низкопрофильной иглой 12 мм (Grass Telefactor, W Warwick, RI) помещали медиально от глаза. Игольчатый заземляющий электрод помещали в хвост. Совокупность данных получали с помощью Espion E2 (Diagnosys LLC, Littleton, MA) системы регистрации ЭРГ с использованием стимулятора Color Dome Ganzfeld. Полностью адаптированную к темноте функцию интенсивность-ответ определяли отслеживанием воздействия коротких белых вспышек примерно 14 интенсивностей от 0.0001 cd.s/m2 до 333 cd.s/m2. Далее определяли полностью адаптированную к свету функцию интенсивность-ответ отслеживанием коротких белых вспышек примерно 9 интенсивностей от 0.33 cd.s/m2 до 333 cd.s/m2. Анализ полученных откликов проводили в автономном режиме. Определение функции интенсивность-ответ проводили приведением в соответствие сигмоидальной функции к данным (Naka KI, Rushton WA, 1966; Naka K.I, Rushton WA, 1967). Предполагается, что аминопроизводные соединения настоящего раскрытия будут подавлять или ослаблять адаптированные к темноте ЭРГ ответы (измеренные примерно при 0.01 cd.s/m2), и в то же время минимально воздействуя на фотопические, адаптированные к свету Vmax величины при сравнении с контрольными соединениями.
ПРИМЕР 194
Влияние аминопроизводных соединений на снижение липофусциновых флуорофоров
Этот пример описывает тестирование способности аминопроизводного соединения понижать уровень присутствующего бис-ретиноида, N-ретинилиден-N-ретинилэтаноламина (А2Е) и липофусциновых флуорофоров в сетчатке мыши, а также предупреждать образование А2Е и липофусциновых флуорофоров. А2Е является важным флуорофором токсического липофусцина в глазных тканях.
Глаза мутантной мыши линии abca4-null (abca4 -/-) (см., например, Weng et al., Cell 98:13-23 (1999) имеют избыточное накопление флуорофоров липофусцина, такого как А2Е (см., например, Karan et al., Proc. Natl. Acad. Sci. USA 102:4164-69 (2005)). Соединение (примерно 1 мг/кг) или носитель вводили зондом орально ежедневно в течение трех месяцев 2-х месячным мышам линии abca4-/-. Мышей умерщвляли через три месяца лечения. Сетчатки и ПЭС экстрагировали для анализа А2Е.
Аналогичный эксперимент проводили на старых мышах линии balb/c (возраст 10 месяцев). Тестируемых мышей обрабатывали соединением 1 мг/кг/день в течение трех месяцев, и контрольную мышь обрабатывали носителем.
Коротко, при тусклом красном свете, глазные яблоки каждой пары глаз собирали, гомогенизировали в смеси PBS буфера и метанола, после чего А2Е экстрагировали хлороформом. Образцы высушивали и ресуспендировали в смеси вода/ацетонитрил для анализа ВЭЖХ. Количество присутствующего А2Е определяли путем сравнения области под кривой (AUC) А2Е пика образца с концентрация А2Е/AUC кривая для стандарного измерения А2Е при 440 нм.
Предполагается, что уровни А2Е являются пониженными в результате лечения одним или более аминопроизводным соединением, раскрытым здесь.
ПРИМЕР 195
Влияние аминопроизводных соединений на активность ядерных ретиноидных рецепторов
Активность ядерных ретиноидных рецепторов связана с трансдукцией не зрительных физиологических, фармакологических и токсикологических ретиноидных сигналов, которые отрицательно влияют на рост тканей и органов, развитие, дифференциацию и гомостаз.
Влияние одного или более аминопроизводного соединения, раскрытого здесь, и влияние агониста (E-4-[2-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтиленил)-1-пропенил] бензойная кислота) (TTNPB) рецепторов ретиноевой кислоты (RAR), и полностью-транс-ретиноевой кислоты (at-RA), которая служит агонистом RAR и ретиноид-Х-рецептором (RXR), изучали на RAR и RXR рецепторах главным образом как описано Achkar et al. (Proc. Natl. Acad. Sci. USA 93:4879-84 (1996)). Как предполагали, несколько протестированных соединений настоящего раскрытия (Соединения примеров 7, 12, 20 и 16) не оказали значительного влияния на ядерные ретиноидные рецепторы (RAR или RXR). При сравнении, TTNPB и at-RA активировали RXRα, RARα, RARβ и RARγ рецепторы, как предполагалось (Таблица 9). Данные представляют рассчитанные величины ЕС50 (нМ) ±95% Доверительный Интервал ДИ (в скобка) из 7-точечных кривых доза-отклик, рассчитанные с помощью программного обеспечения Graph Pad Prism. Каждую точку определяли три раза.
В случае, когда диапазоны использовали здесь для физических свойств, таких как молекулярный вес или химические свойства, такие как химические формулы, все комбинации и подкоминации диапазонов и их специфических вариантов предполагаются быть включенными.
Разные описанные здесь варианты могут быть объединены для обеспечения дополнительных вариантов. Все Американские патенты, Американские заявки, Американские опубликованные заявки, иностранные патенты, иностранные патентные заявки и не патентные публикации, относящиеся к этой заявке и/или перечисленные в инструкциях по применению, являются полностью включенными здесь в виде ссылки.
Из упомянутого выше следует учесть, что несмотря на то, что определенные варианты были описаны здесь для иллюстрации, могут быть сделаны разные модификации. Опытные в данной области специалисты с помощью общепринятых методик проведения исследований смогут понять или установить много эквивалентов описанных здесь специфических вариантов. Такие эквиваленты являются охваченными следующей формулой. В целом, нижеприведенная формула и использованные термины не ограничивают формулу раскрытыми в описании и формуле определенными вариантами, а включают все возможные варианты наряду с комплексом эквивалентов, к которым такая формула относится. Соответственно, формула изобретения не ограничивается раскрытием.
В то время как здесь были показаны и описаны предпочтительные варианты настоящего изобретения, опытным в данной области специалистам будет очевидно, что такие варианты представлены только в качестве примера. Многочисленные варианты, изменения и замены будут открыты опытным специалистам без отступления от изобретения. Следует понимать, что разные модификации описанных здесь вариантов изобретения могут применяться при осуществлении на практике изобретения. Следует понимать, что нижеприведенная формула определяет масштаб изобретения, и что способы и структуры находятся в пределах этой формулы и их эквивалентов
Реферат
Изобретение относится к новым аминопроизводным структурной формулы (А), обладающим свойствами ингибитора изомеразной активности ретиноидного цикла. В формуле (А) Z представляет собой -С(R)(R)-С(R)(R)- или -X-C(R)(R); Х представляет собой -O-, -S-, -S(=O)-, -S(=O)- или -N(R)-; G выбран из -C(R)-C(R)-R, -C(R)-S-R, -C(R)-SO-R, -C(R)-SO-Rили -C(R)-O-R; Rвыбран из -C(R)(R)(R), Сарила; каждый R, R, R, Rнезависимо выбран из водорода или С-Салкила; каждый Rи Rнезависимо друг от друга выбран из водорода, галогена, С-Салкила или -OR; или Rи Rвместе образуют оксо; каждый R, R, R, R, R, Rпредставляет собой водород; каждый Rи Rнезависимо друг от друга выбран из водорода, галогена, С-Салкила или -OR; или Rи Rобразуют оксо; или возможно Rи Rвместе образуют прямую связь для обеспечения двойной связи; или возможно Rи Rвместе образуют прямую связь и Rи Rвместе образуют прямую связь для обеспечения тройной связи; n равно 0 или 1; значения радикалов R, R, R-R, R, Rприведены в формуле изобретения. Изобретение также относится к фармацевтической композиции, содержащей указанные соединения, к применению соединений для изготовления лекарственного средства для лечения ретинального офтальмологического заболевания, уменьшения липофусцинового пигмента, накопленного в глазу, для ингибирования темновой адаптации палочковой фоторецепторной клетки сетчатки, ингибирования регенерации родопсина в палочковой фоторецепторной клетке сетчатки или ингибирования дегенерации ретинальной клетки в сетчатке. 8 н. и 10 з.п. ф-лы, 2 ил., 17 табл., 195 пр.
Формула

в которой,
Z представляет собой -С(R9)(R10)-С(R1)(R2)- или -X-C(R31)(R32);
Х представляет собой -O-, -S-, -S(=O)-, -S(=O)2- или -N(R30)-;
G выбран из -C(R41)2-C(R41)2-R40, -C(R42)2-S-R40, -C(R42)2-SO-R40, -C(R42)2-SO2-R40или -C(R42)2-O-R40;
R40 выбран из -C(R16)(R17)(R18), С6-10арила;
каждый R41 представляет собой водород;
каждый R42 независимо выбран из водорода или С1-С5алкила;
каждый R1 и R2 независимо друг от друга выбран из водорода, галогена, С1-С5алкила или -OR6; или R1 и R2 вместе образуют оксо;
каждый R31 и R32 представляет собой водород;
каждый R3 и R4 представляет собой водород;
каждый R9 и R10 независимо друг от друга выбран из водорода, галогена, С1-С5алкила или -OR19; или R9 и R10 образуют оксо; или возможно R9 и R1 вместе образуют прямую связь для обеспечения двойной связи; или возможно R9 и R1 вместе образуют прямую связь и R10 и R2 вместе образуют прямую связь для обеспечения тройной связи;
каждый R11 и R12 независимо друг от друга выбран из водорода или -C(=O)R23;
R23 независимо друг от друга выбран из С1-С5алкила или галоген замещенного С1-С5алкила;
каждый R6, R19 и R34 независимо друг от друга представляет собой водород или C1-С5алкил;
R30 представляет собой водород;
каждый R16 и R17 независимо друг от друга выбран из водорода, С1-С5алкила, С6арила или бензила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют С3-С8карбоциклил;
R18 выбран из водорода, С1-С5алкила, С1-С5алкокси или гидрокси;
каждый R33 независимо выбран из галогена, OR34 или С1-С5алкила; и n равно 0 или 1; при условии что G не является незамещенным нормальным алкилом и при условии что соединением Формулы А не являются:



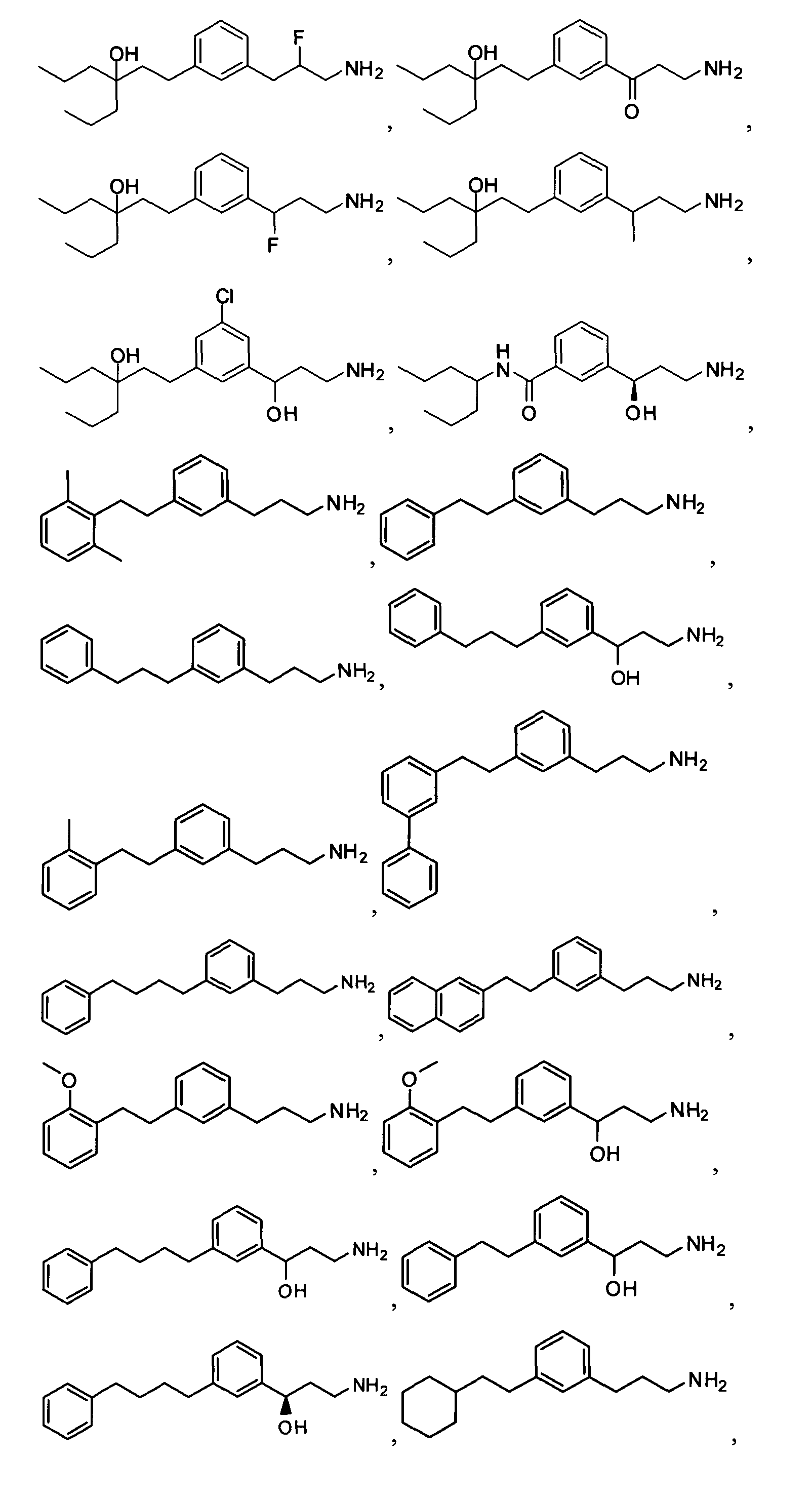


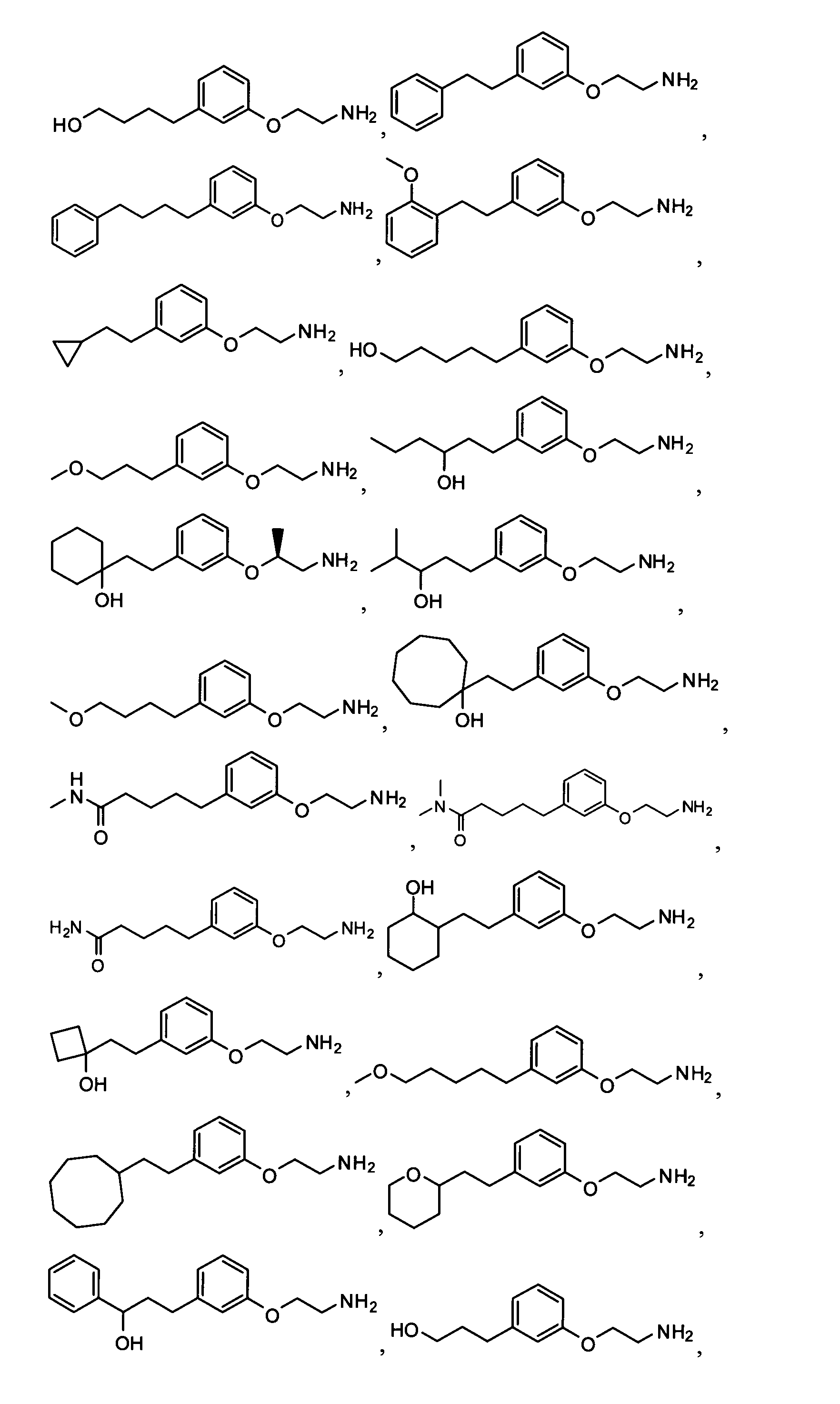

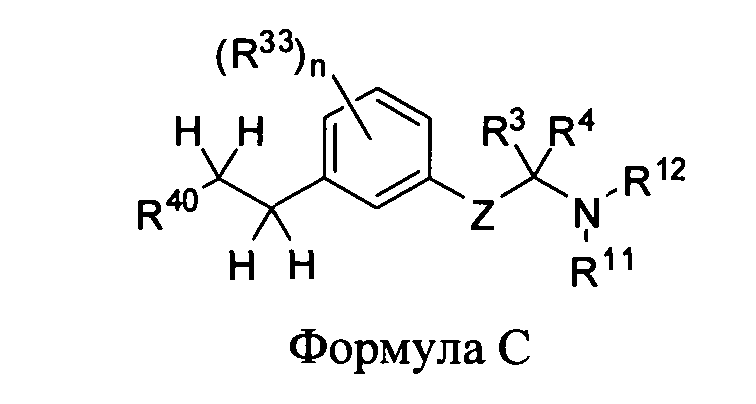
в которой,
Z представляет собой -С(R9)(R10)-С(R1)(R2)- или -O-C(R31)(R32)-;
R40 выбран из -C(R16)(R17)(R18) или С6-С10арила;
каждый R16 и R17 независимо друг от друга выбран из водорода, С1-С5алкила, С6арила или бензила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют С3-С8карбоциклил;
R18 выбран из водорода, С1-С5алкила, С1-С5алкокси или гидрокси.
G выбран из -C(R41)2-C(R41)2-R40;
R40 выбран из -C(R16)(R17)(R18) или С6-С10арила.

в которой
каждый R16 и R17 независимо друг от друга выбран из водорода, C1-C5алкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют С3-С8карбоциклил; и
n обозначает 0;
R18 выбран из водорода, С1-С5алкила, С1-С5алкокси или гидрокси.
R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют С3-С8карбоциклил; и
R18 является водородом, гидрокси или С1-С5алкокси,
при этом возможно в котором:
R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют циклопентил, циклогексил или циклогептил; и
R18 является водородом или гидрокси.

в которой
каждый R16 и R17 независимо друг от друга выбран из водорода или С1-С5алкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют С3-С8карбоциклил;
R18 выбран из водорода, С1-С5алкила, С1-С5алкокси или гидрокси;
R34 является водородом или С1-С5алкилом; и
каждый R33 независимо выбран из галогена, OR34, С1-С5алкила; и n равно 0 или 1.
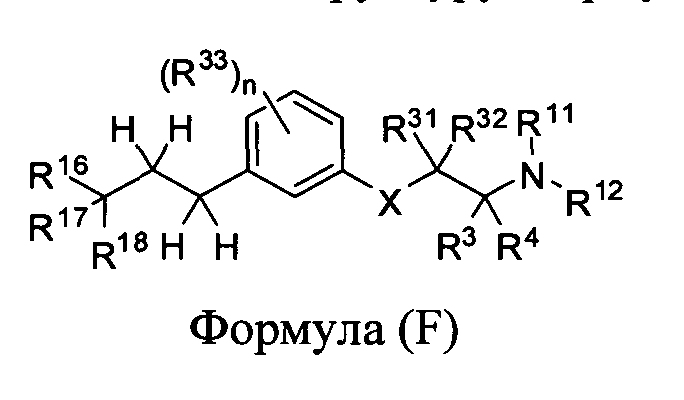
в которой
Х представляет собой -S-, -S(=O)-, -S(=O)2- или -N(R30)-;
каждый R16 и R17 независимо друг от друга выбран из водорода, С1-С5алкила; или R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют С3-С8карбоциклил;
R18 выбран из водорода, С1-С5алкила, С1-С5алкокси или гидрокси;
каждый R33 независимо выбран из галогена, OR34, С1-С5алкила; и n равно 0 или 1.
3-(3-пентилфенил)пропан-1-амин;
3-(3-гексилфенил)пропан-1-амин;
3-(3-(3,3-диметилбутил)фенил)пропан-1-амин;
3-(3-(октан-4-ил)фенил)пропан-1-амин;
4-(3-(3-аминопропил)фенил)бутан-1-ол;
6-(3-(3-аминопропил)фенил)гексан-1-ол;
3-(3-(6-метоксигексил)фенил)пропан-1-амин;
4-(3-(3-аминопропил)фенэтил)гептан-4-ол;
1-(3-(3-аминопропил)фенил)-3-этилпентан-3-ол;
4-(3-(3-аминопропил)фенил)-2-метилбутан-2-ол;
3-(3-(3-аминопропил)фенил)пропан-1-ол;
3-(3-(3-метоксипропил)фенил)пропан-1-амин;
1-(3-(3-аминопропил)фенил)гексан-3-ол;
4-(3-(3-амино-1-гидроксипропил)фенэтил)гептан-4-ол;
3-(3-(2,6-диметилфенэтил)фенил)пропан-1-амин;
3-(3-фенэтилфенил)пропан-1-амин;
3-(3-(3-фенилпропил)фенил)пропан-1-амин;
3-амино-1-(3-(3-фенилпропил)фенил)пропан-1-ол;
3-(3-(2-метилфенэтил)фенил)пропан-1-амин;
3-(3-(2-(бифенил-3-ил)этил)фенил)пропан-1-амин;
3-(3-(4-фенилбутил)фенил)пропан-1-амин;
3-(3-(2-(нафтален-2-ил)этил)фенил)пропан-1-амин;
3-(3-(2-циклогексилэтил)фенил)пропан-1-амин;
3-(3-(2-циклопентилэтил)фенил)пропан-1-амин;
3-амино-1-(3-(2-циклопентилэтил)фенил)пропан-1-ол;
1-(3-(3-аминопропил)фенэтил)циклогексанол;
1-(3-(3-амино-1-гидроксипропил)фенэтил)циклогексанол;
1-(3-(3-аминопропил)фенэтил)циклогептанол;
1-(3-(3-амино-1-гидроксипропил)фенэтил)циклогептанол;
4-(3-(2-аминоэтокси)фенэтил)гептан-4-ол;
1-(3-(2-аминоэтокси)фенэтил)циклогексанол;
1-(3-(2-аминоэтокси)фенэтил)циклогептанол;
4-(3-(2-аминоэтокси)фенэтил)тетрагидро-2Н-тиопиран-4-ол;
6-(3-(2-аминоэтокси)фенил)гексан-1-ол;
2-(3-(3-циклопентилпропил)фенокси)этанамин;
2-(3-(2-(пиридин-3-ил)этил)фенокси)этанамин;
2-(3-(2-(пиридин-2-ил)этил)фенокси)этанамин; и
2-(3-(2-(тиофен-2-ил)этил)фенокси)этанамин.



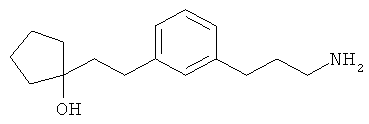


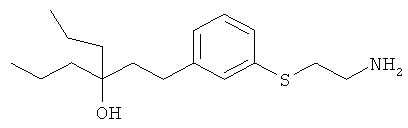

Комментарии