Амины для получения лекарственных средств, предназначенных для предотвращения пролиферации опухолевых клеток - RU2176502C2
Код документа: RU2176502C2
Чертежи





Описание
Настоящее изобретение относится к новому применению соединений, обладающих пригодным сродством к рецепторам, на которых фиксируется цис-N-циклогексил-N-этил-[3-(3-хлор-4-циклогексилфенил)аллил] амин, а также к новым соединениям, обладающим такими же свойствами.
Цис-N-циклогексил-N-этил-[3-(3-хлор-4- циклогексилфенил)аллил] амин, известный под кодовым названием СМ 31747 или SR 31747 и обозначаемый ниже как "SR 31747", описывается в европейском патенте 376850, в котором констатируется его иммуносупрессивная активность.
Обнаружено, что SR 31747 предотвращает пролиферацию раковых клеток и, следовательно, проявляет противоопухолевую активность.
Более того, было обнаружено, что SR 31747 обладает рецепторными участками в этих клетках.
Наконец, было обнаружено, что любой продукт, способный вытеснять меченый тритием SR 31747 из его рецепторов в опухолевых клетках, предотвращает пролиферацию клеток. В частности, установлено, что соединения, способные вытеснять меченый тритием SR 31747 (ниже называется как "3H-SR 31747") из его рецепторных участков, обладают антипролиферативной клеточной активностью.
Таким образом, согласно одному из аспектов настоящее изобретение относится к применению соединений, способных вытеснять меченый тритием цис-N-циклогексил-N-этил-[3-(3-хлор-4- циклогексилфенил)аллил]амин из его рецепторов, для получения фармацевтических композиций, предназначенных для оказания противодействия пролиферации клеток. Способность предусматриваемых для применения согласно настоящему изобретению соединений вытеснять меченый тритием SR 31747 из его рецепторов можно легко определять биохимическим путем с помощью3H-SR 31747 и его фиксации в клетках.
Это определение можно осуществлять при использовании выбранных соответствующим образом опухолевых клеток, предпочтительно среди линий клеток, которые легко пролиферируют in vitro, как, например, клетки миелом человека, рака почки или легкого человека, или еще при использовании клеток рака молочной железы.
В целях возможности осуществления определений в стандартных условиях, позволяющих получать постоянные и воспроизводимые результаты, согласно контексту настоящего изобретения произвольно выбирают линию клеток опухоли молочной железы человека "MCF-7".
Также согласно контексту настоящего изобретения произвольно выбирают3H-SR 31747, в котором тритий фиксирован на виниленовой связи, однако SR 31747 может быть маркирован любым образом, так как метка служит только для того, чтобы следить за вытеснением продукта из его рецепторов.
Определение способности вытеснять3H-SR 31747 из его рецепторов, находящихся в клетках, особенно в случае линии клеток MCF-7, осуществляют путем проведения опытов по общему связыванию и специфическому связыванию.
Согласно настоящему изобретению любой продукт, который, подвергнутый предварительной вышеуказанной операции, способен вытеснять3H-SR 31747 из его рецепторов, может быть использован для получения фармацевтических композиций против пролиферации клеток.
SR 31747, во-первых, способен вытеснять3H-SR 31747 из его рецепторов и обладает высокой ингибирующей активностью в отношении пролиферации клеток.
В частности,
предметом настоящего изобретения является применение соединения, способного вытеснять меченый тритием
цис-N- циклогексил-N-этил-[3-(3-хлор-4-циклогексилфенил)аллил]амин из его рецепторов, выбираемого
из группы, состоящей из:
а) аминов формулы (I)

в которой
R1 означает атом водорода или атом галогена;
R2 означает циклогексил;
R3 означает циклоалкил с 3-6 атомами углерода;
R4 означает атом водорода, алкил с 1-6 атомами углерода или циклоалкил с 3-6 атомами углерода;
А означает группу, выбираемую среди следующих групп: -CO-CH2-, -CH(C1)-CH2-, -CH(OH)-CH2-, -CH2-CH2, -CH=CH-, -C≡C-;
б) фармацевтически приемлемых солей присоединения аминов формулы (I);
в) аминов формулы (II)

в которой
Aa означает группу, выбираемую среди следующих групп:
-CO-CH2-, -CH(OH)-CH2-, -CH=CH-, -C≡C-;
R1a означает водород или галоген;
R2a означает циклогексил;
г) фармацевтически приемлемых солей присоединения кислот аминов формулы II;
д) аминов формулы (III)

в которой
R1b означает атом водорода или атом галогена;
R2b означает циклогексил;
R3b означает атом водорода или алкильную группу с 1-3 атомами углерода;
R4b означает алкильную группу с 1-3 атомами углерода, одинаковую или отличающуюся от алкильной группы в значении радикала R3b;
R3b и R4b, рассматриваемые вместе, могут образовывать вместе с атомом азота, с которым они связаны, 5-7-членную гетероциклическую группу, выбираемую среди пиперидино-, морфолино- и пирролидиногруппы;
Ab означает группу -CH2CH2- или -CH=CH-;
е) фармацевтически приемлемых солей присоединения кислот аминов формулы (III);
ж) аминов формулы (IV)

в которой
Ar1 означает фенильную, нафтильную, замещенную фенильную или замещенную нафтильную группу;
n означает целое число, включая числа от 1 до 4;
RB означает алкильную группу, и в этом случае Aс означает простую связь; и
RA и RC, одинаковые или разные, независимо друг от друга означают атом водорода или группу, выбираемую среди атомов галогена, алкила, замещенного одним или несколькими атомами галогена алкила и алкоксила; или
RB и RC вместе образуют мостик -(CH2)p-, где p означает 0, 1 или 2, и в этом случае RA означает гидроксильную или алкоксильную группу, находящуюся в положении 5 содержащего ее ароматического цикла, или RA означает атом водорода или галогена в любом положении ароматического цикла; или
RB и RC вместе образуют мостик -CH=, и связь, которой он связан с ароматическим циклом, является простой связью, и в этом случае Ас означает метиленовую группу, a RA означает атом водорода, гидроксильную или алкоксильную группу, находящуюся в положении 5 содержащего ее ароматического цикла; или
RB и RC вместе образуют связь и тогда Ас означает группу формулы

причем карбонил связан с кислородом и соседняя связь Ас с содержащим боковую цепь атомом углерода является двойной связью, и в этом случае RA означает атом водорода или гидроксильную или алкоксильную группу;
когда RB означает алкильную группу, каждый из X и Y означает атом водорода или вместе с содержащим их атомом углерода они образуют группу С=O, и RD означает атом водорода или алкильную группу;
когда RB и RC образуют мостик, каждый из X и Y означает атом водорода и RD, который существует только тогда, когда все связи несущего его атома углерода являются простыми связями, означает атом водорода; при условии, что
- термины "алкил" и "алкоксил" означают линейные или разветвленные насыщенные группы с 1-6 атомами углерода;
- термин "замещенный", относящийся к фенильному и нафтильному заместителям, означает, что они могут быть замещены 1-3 группами, выбираемыми среди гидроксила, алкила, замещенного одним или несколькими атомами галогена алкила, алкоксила и галогена;
3) фармацевтически приемлемых солей и сольватов аминов формулы (IV);
и) аминов формулы (V)

в которой
Ar2 и Ar3, одинаковые или разные, независимо друг от друга означают фенильную группу, или нафтил или фенил, замещенный 1-3 группами, выбираемыми среди гидроксила, (C1-C6) - алкила, алкоксила, галогена и алкила, и замещенного одним или несколькими атомами галогена алкила;
каждый из X' и Y' означает атом водорода или вместе они образуют оксогруппу;
RE означает (C1-C6)-алкильную группу;
их изомеров в индивидуальной форме или в виде смеси;
к) фармацевтически приемлемых солей и сольватов аминов формулы (V);
л) аминов формулы (VI)

в которой
R3c означает водород или (С1-С3)-алкил;
R1c и R2c, одинаковые или разные, выбирают среди водорода, гидроксила, (С1 -С3)-алкила, (С1-С3)-алкоксила, галогена и цианогруппы;
V1 и V2 вместе образуют двойную связь, связанную с атомом кислорода или с гидроксиминогруппой N-OH, или они соединены в этилендиоксигруппу - O-CH2-CH2-O-;
Ad означает валентную связь, атом кислорода, метиленовую группу или же этиленовую группу;
m' означает нуль, 1 или 2;
n' означает целое число от 1 до 5;
м) фармацевтически приемлемых солей присоединения кислот аминов формулы (VI);
н) аминов формулы VII

в которой
m'' и n'' означают 1 или 2;
Cy означает (C3-C7) - циклоалкил;
Ar4 означает арил или гетероарил, выбираемый среди фенила, нафтила и тиенила, возможно моно- до тризамещенного галогеном, трифторметилом, (С1-С3)-алкилом, (C1-С3)- алкоксилом;
о) фармацевтически приемлемых солей присоединения кислот аминов формулы (VII);
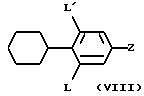
п) аминов формулы (VIII)

в которой
один из L и L' означает водород, а другой выбирают среди водорода, фтора, хлора или нитрогруппы, или каждый из обоих L и L' означает атом хлора;
Z означает:
(i) группу структуры (1)

в которой
G1 означает (С1-C6 )-алкил или (C3-C7)-циклоалкил;
G2 означает (C1-C6)-алкил, (C3-C6) -циклоалкил-(C1-C3)-алкил, (C3-C7)-циклоалкил; фенильный, бензильный, фенетильный радикал, возможно замещенный в бензольной группе радикала галогеном, метоксигруппой или нитрогруппой;
или же G1 и G2 вместе с атомом азота, с которым они связаны, образуют содержащий один атом азота насыщенный, имеющий мостиковую или спиро- структуру, гетероцикл с 5-10 атомами углерода; морфолиногруппу; пиперазиногруппу, незамещенную или замещенную в положении 4 (C1- C4)-алкилом, фенильным, бензильным или фенетильным радикалом, причем бензольная группа может быть замещена галогеном, метоксигруппой или нитрогруппой; группу, выбираемую среди 4-фенил- 1,2,3,6-тетрагидропиридин-1-ильного радикала, 4-фенилпиперидиногруппы, 4-бензилпиперидиногруппы, 4-фенетилпиперидиногруппы, причем фенильная группа вышеуказанных радикалов может быть не замещена или замещена галогеном, метоксигруппой или нитрогруппой;
(ii) группу структуры (2)

в которой
G3 означает водород или гидроксил;
G4 означает водород;
или G3 и G4 вместе образуют одну или две связи так, что вместе с атомами углерода, с которыми они связаны, они образуют виниленовую группу или этиниленовую группу;
G5 означает группу, выбираемую среди фенильного, бензильного, фенетильного радикалов, причем бензольная группа вышеуказанных радикалов может быть не замещена или замещена атомом галогена, метоксигруппой или нитрогруппой;
G6 означает гидроксильную группу или водород;
G6 и G7 означают водород или могут образовывать связь;
или G5 и G6 вместе образуют н- пентиленовую группу;
(iii) группу структуры (3)

в которой
G3 и G4 имеют вышеуказанные значения;
Alk означает (С1-C6)- алкил или (C3 -C6)-алкенил;
G8 означает 1-адамантил, (C3-C7)- циклоалкил, (C3-C7)-циклоалкил-(C1-C3) -алкил или группу, выбираемую среди фенильного, бензильного, 2-фенетильного радикалов, причем бензольная группа вышеуказанных радикалов может быть не замещена или замещена галогеном, метоксигруппой или нитрогруппой;
или Alk и G8, одинаковые или разные, означают (C4-C6)-алкильную группу;
причем G8 не означает (C3-C6) -циклоалкил, когда L означает водород или атом фтора или хлора, L' означает водород и Alk означает (C1-C6) -алкил;
р) фармацевтически приемлемых солей и сольватов аминов формулы (VIII).
Соединения, применение которых заявлено согласно настоящему изобретению, частично описаны в литературе.
В частности, амины формулы (1) и их фармацевтически приемлемые соли описываются в европейском патенте 376850; вышеуказанные амины могут быть получены, как проиллюстрировано в этом документе, и выделены в форме основания, солей и/или сольватов. Амины формулы (II) и их фармацевтически приемлемые соли описываются в европейском патенте 461986; вышеуказанные амины могут быть получены, как проиллюстрировано в этом документе, и выделены в форме основания, солей и/или сольватов. Амины формулы (III) и их фармацевтически приемлемые соли описываются в патенте Франции 2249659; эти амины могут быть получены, как проиллюстрировано в этом документе, и выделены в форме основания, солей и/или сольватов. Амины формулы (IV) и их фармацевтически приемлемые соли описываются в европейском патенте 702010; эти амины могут быть получены, как проиллюстрировано в этом документе, и выделены в форме основания, солей и/или сольватов. Амины формулы (V) и их фармацевтически приемлемые соли описываются в европейском патенте 707004; вышеуказанные амины могут быть получены, как проиллюстрировано в этом документе, и выделены в форме основания, солей и/или сольватов. Амины формулы (VI) и их фармацевтически приемлемые соли описываются в европейском патенте 581677; указанные амины могут быть получены, как проиллюстрировано в этом документе, и выделены в форме основания, солей и/или сольватов. Амины формулы (VII) и их фармацевтически приемлемые соли описываются в международной заявке 95/15948; указанные амины могут быть получены, как проиллюстрировано в этом документе, и выделены в форме основания, солей и/или сольватов.
Соединения групп (n) и (p), представляющие особый интерес, являются новыми и составляют следующий аспект изобретения.
Таким образом, изобретение также относится к новым соединениям, которые вытесняют3H-SR 31747 из его рецепторов и обладают значительными антипролиферативными свойствами, и к содержащим их фармацевтическим композициям.
Более
конкретно, объектом изобретения является амин, выбираемый среди следующих
соединений:
(А) соединение формулы (VIII)
в которой
один из L и L' означает водород, а другой выбирают среди водорода, фтора, хлора или нитрогруппы, или же оба L и L' означают атом хлора;
Z означает:
(i) группу структуры (1)

в которой
G1 означает (C1-C6-алкил или (C3-C7)-циклоалкил;
G2 означает (C1-C6)-алкил, (C3-C6)-циклоалкил-(C1-C3)-алкил, (С3-C7)-циклоалкил; фенильный, бензильный, фенетильный радикал, возможно замещенный в бензольной группе галогеном, метоксигруппой- или нитрогруппой;
или же G1 и G2 вместе с атомом азота, с которым они связаны, образуют содержащий один атом азота насыщенный, имеющий мостиковую или спиро-структуру гетероцикл с 5-10 атомами углерода; морфолиногруппу; пиперазиногруппу, незамещенную или замещенную в положении 4 (C1- C4)-алкилом, фенильным, бензильным или фенетильным радикалом, причем бензольная группа может быть замещена галогеном, метоксигруппой или нитрогруппой; группу, выбираемую среди 4-фенил- 1,2,3,6-тетрагидропиридин-1-ильного радикала, 4-фенилпиперидиногруппы, 4-бензилпиперидиногруппы, 4-фенетилпиперидиногруппы, причем фенильная группа вышеуказанных групп может быть не замещена или замещена галогеном, метоксигруппой или нитрогруппой;
(ii) группу структуры (2)

в которой
G3 означает водород или гидроксил;
G4 означает водород;
или G3 и G4 вместе образуют одну или две связи так, что вместе с атомами углерода, с которыми они связаны, они образуют виниленовую группу или этиниленовую группу;
G5 означает группу, выбираемую среди фенильного, бензильного, фенетильного радикалов, причем бензольная группа вышеуказанных радикалов может быть не замещена или замещена атомом галогена, метоксигруппой или нитрогруппой;
G6 означает гидроксильную группу или водород;
G6 и G7 означают водород или могут образовывать связь;
или же G5 и G6 вместе образуют н- пентиленовую группу;
причем G6 означает гидроксильную группу и G5 и G7 могут образовывать связь только тогда, когда G5 имеет другое значение, чем возможно замещенный бензил или фенетил;
(iii) группу структуры (3)
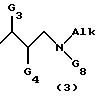
в которой
G3 и G4 имеют вышеуказанные значения;
Alk означает (C1-C6)- алкил или (C3-C6)-алкенил;
G8 означает 1-адамантил, (C3-C7) - циклоалкил, (C3-C7)-циклоалкил-(C1-C3)-алкил или группу, выбираемую среди фенильного, бензильного, 2-фенилэтильного радикалов, причем бензольная группа вышеуказанных радикалов может быть не замещена или замещена галогеном, метоксигруппой или нитрогруппой;
или же Alk и G8, одинаковые или разные, означают (C4-C6)-алкильную группу;
причем G8 не означает (C3-C6) - циклоалкил, когда L означает водород или атом фтора или хлора, L' означает водород и Alk означает (C1-C6)-алкил;
(Б) фармацевтически приемлемые соли и сольваты соединений формулы (VIII).
В этих новых соединениях формулы (VIII) галогеном предпочтительно является хлор или фтор, причем один из L и L' означает водород, а другой является фтором, хлором или нитрогруппой, или же L и L' являются одинаковыми и означают водород или хлор. Эти соединения являются особенно предпочтительными.
Особенно предпочтительными соединениями являются соединения формулы (VIII), в которой Z означает:
(i') группу структуры (1')
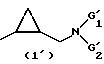
в которой
G'1 означает (С1 -С6)-алкил или (C3-C7) - циклоалкил;
G'2 означает (С1-C6)-алкил, (C3-C7) -циклоалкил-(С1 -C3)-алкил, (C3-C7)-циклоалкил или группу, выбираемую среди фенильного, бензильного, 2-фенилэтильного радикалов, причем бензольная группа вышеуказанных радикалов может быть не замещена или замещена галогеном, метоксигруппой или нитрогруппой;
или же G'1 и G'2 вместе с атомом азота, с которым они связаны, образуют морфолиногруппу, пирролидиногруппу, пиперидиногруппу, гексагидроазепиногруппу или группу, выбираемую среди 4-фенил-1,2,3, 6-тетрагидропиридин-1-ильного радикала, 4- фенилпиперидиногруппы, 4-бензилпиперидиногруппы, 4-фенетилпиперидиногруппы, причем фенильная группа вышеуказанных групп может быть не замещена или замещена галогеном, метоксигруппой или нитрогруппой;
(ii') группу структуры (2')

в которой
G'3 и G'4 означают водород или вместе образуют связь в конфигурации транс или, предпочтительно, цис;
G'6 и G'7 означают водород; и
G'5 означает фенил или бензил;
или же G'5 и G'6 вместе образуют 1,5-пентиленовую группу;
(iii') группу структуры (3')
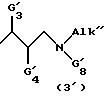
в которой
G'3 и G'4 имеют вышеуказанные значения;
Alk'' означает (C1-C6)-алкил;
G'8 означает 1-адамантильную, фенильную, бензильную или 2-фенилэтильную группу;
или же Alk'' и G'8 являются одинаковыми и каждый означает (C4-C6)-алкильную группу;
и их фармацевтически приемлемые соли и сольваты.
Эти новые соединения формулы (VIII) могут быть получены
способом, заключающимся в том, что:
- либо функциональное производное
циклопропанкарбоновой кислоты формулы (IX)

в которой L и L' имеют вышеуказанные значения, вводят во взаимодействие с амином формулы (X)

в которой G1 и G2 имеют вышеуказанные значения, и затем таким образом полученный амид формулы (XI)

подвергают восстановлению для выделения аминов формулы (VIII), в которой Z означает группу структуры (1), в форме свободных оснований или их фармацевтически приемлемых солей;
- либо соединение формулы (XII)

в которой L и L' имеют вышеуказанные значения, вводят во взаимодействие с формальдегидом и амином, выбираемым среди аминов формул (XIII) и (XIV)


и, в случае необходимости, таким образом полученный продукт формулы (VIII), в которой Z означает группу структуры (2) или (3), где G3 и G4 вместе образуют две связи так, что с атомами углерода, с которыми они связаны, они образуют этиниленовую группу, подвергают гидрированию с помощью двух или одного моля водорода, чтобы выделить соответствующее соединение формулы (VIII), в которой Z означает группу структуры (2) или (3), где соответственно оба G3 и G4 означают атом водорода или вместе с двумя атомами углерода, с которыми они связаны, образуют виниленовую группу; или, в случае необходимости, таким образом полученный продукт формулы (VIII), в которой Z представляет собой группу структуры (2), где G5 означает фенил, G6 означает гидроксил и G7 означает водород, подвергают дегидратации с целью выделения соединения формулы (VIII), в которой Z представляет собой группу структуры (2), где G5 означает фенил и G6 и G7 вместе образуют связь, причем вышеуказанные соединения могут быть выделены в форме свободного основания или одной из их фармацевтически приемлемых солей или одного из их фармацевтически приемлемых сольватов;
- либо ацетофенон формулы (XV)

в которой L и L' имеют вышеуказанные значения, вводят во взаимодействие с формальдегидом и амином вышеуказанной формулы (XIII) или (XIV), затем таким образом полученный продукт формулы (XVI)

в которой L и L' имеют вышеуказанные значения и Z' означает группу структуры (2') или (3')


где Alk'', G'5, G'6, G'7 и G'8 имеют вышеуказанные значения, подвергают реакции восстановления кетогруппы для выделения соответствующего соединения формулы (VIII), в которой Z представляет собой группу структуры (2) или (3), где G3 означает гидроксил и G4 означает водород, после чего, в случае необходимости, таким образом полученный продукт формулы (VIII), в которой Z представляет собой группу структуры (2), где G5 означает фенил, G6 означает гидроксил и G7 означает водород, подвергают дегидратации для выделения соединения формулы (VIII), в которой Z представляет собой группу структуры (2), где G5 означает фенил и G6 и G7 вместе образуют связь; причем вышеуказанные соединения могут быть выделены в форме свободного основания или одной из его фармацевтически приемлемых солей и, в случае необходимости, свободные основания формулы (VIII) превращают в их фармацевтически приемлемые соли.
Взаимодействие функционального производного кислоты формулы (IX) с амином формулы (X) осуществляют по классическим методикам для получения амидов. В качестве функционального производного кислоты формулы (IX) можно использовать любое, обычно применяемое в химии пептидов соединение, как, например, хлорангидрид, ангидрид или смешанный ангидрид, например, с моноэтиловым эфиром карбоновой кислоты (получаемый путем взаимодействия кислоты формулы (IX) с этилхлорформиатом), активированным сложным эфиром или активированным амидом. Когда в качестве функционального производного используют хлорангидрид или ангидрид, может быть предпочтительным работать в присутствии третичного амина, как, например, триэтиламина.
Восстановление соединения формулы (XI) также можно проводить в классических условиях превращения амида в амин, используя в качестве восстановителя гидрид металла, такой как литийалюминийгидрид или боран. Взаимодействие между ацетиленовыми производными формулы (XII) или ацетофенонами формулы (XV) и аминами формул (XIII) и (XIV) в присутствии формальдегида проводят в классических условиях реакции Манниха.
Восстановление соединений формулы (VIII), в которой Z представляет собой одну из групп структуры (2) или (3), где G3 и G4 образуют две связи, осуществляют путем гидрирования с помощью одного моля водорода для получения соединений формулы (VIII) (Z представляет собой группу структуры (2) или (3), где G3 + G4 образуют связь цис-конфигурации) или с помощью двух молей водорода для получения насыщенных соединений.
Восстановление соединения формулы (XVI) для получения соединений формулы (VIII), в которой Z представляет собой одну из групп структуры (2) или (3), где G3 означает гидроксил и G4 означает водород, осуществляют классическими способами. Когда хотят получить гидроксильное соединение со специфической конфигурацией у хирального атома углерода, можно использовать стереоспецифический восстановитель.
Когда гидроксилированное производное затем должно быть дегидратировано для получения соединения формулы (VIII), в которой Z представляет собой одну из групп структуры (2) или (3), где G3 и G4 образуют связь, пространственная конфигурация не играет никакой роли и восстановление соединения формулы (XVI) может быть осуществлено, например, с помощью боргидрида натрия.
Возможную дегидратацию соединения формулы (VIII), в которой Z представляет собой одну из групп структуры (2) или (3), где G3 означает гидроксил и G4 означает водород, осуществляют путем нагревания в присутствии агентов или устройств, которые благоприятствуют удалению и/или улавливанию воды, например, используя насадку Дина-Старка.
Таким образом полученное насыщенное соединение формулы (VIII) имеет транс-конфигурацию. Это соединение в свою очередь может быть гидрировано для получения амина формулы (VIII), в которой Z представляет собой одну из групп структуры (2) или (3), где G3 и G4 означают водород.
Исходные кислоты формулы (IX) и их функциональные производные, так же как амиды формулы (XI), являются новыми продуктами, которые могут быть получены из 4-(4-циклогексил-3,5-L-L'-фенил)-4-оксобутановой кислоты.
Более конкретно, кислоты формулы (IX) получают путем восстановления кетогруппы 4- (4- циклогексил-3, 5-L-L'-фенил)-4-оксобутановой кислоты (где L и L' имеют вышеуказанные значения) для получения 4-(4-циклогексил- 3,5-L-L'-фенил)-4-гидроксибутановой кислоты, которую превращают в ее лактон. Этот последний хлорируют и превращают в сложный эфир 4-хлор-4-(4-циклогексил-3,5-L-L'-фенил) бутановой кислоты, который в свою очередь путем циклизации дает циклопропанкарбоновую кислоту формулы (IX).
4-(4-Циклогексил-3,5-L-L'-фенил)-4- оксобутановые кислоты (где L и L' имеют
вышеуказанные значения) получают следующим образом:
- когда L и L' означают водород, согласно методике
N.P. Buu-Hoi и др. Bull. Soc. Chim. France, 127 (1944);
- когда L означает
водород, а L' означает хлор, согласно методике F. Krausz и др., Arzneim.-Forsh., 24, 1364-1367 (1974); BE 750233;
- когда L означает водород, а L' означает нитрогруппу, согласно методике BE
750233;
- когда L и L' означают хлор, согласно методике F. Krausz и др., Arzneim.-Forsh., 24, 1364-1367
(1974);
- когда L означает водород, а L' означает фтор, путем каталитического
гидрирования 3-(4-циклогексил-3-фтор)бензоилакриловой кислоты, в свою очередь описанной в патенте Японии 75770/71
и патенте ФРГ 2103749.
Таким образом, кислоты формулы (IX) могут быть
получены способом, согласно которому:
- 4-оксобутановую кислоту формулы (XVII)

в которой L и L' имеют вышеуказанные значения, восстанавливают с помощью боргидрида щелочного металла;
- таким образом полученную 4-гидроксибутановую кислоту формулы (XVIII)
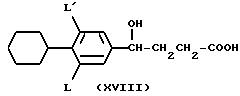
циклизуют путем нагревания при удалении выделяющейся воды;
- таким образом полученный лактон формулы (XIX)

обрабатывают с помощью тионилхлорида, выделяя в (C1-C4) алканоле, сложный эфир формулы (XX)

в которой Alk' означает (C1-C4 )-алкил;
- таким образом полученное соединение формулы (XX) циклизуют путем нагревания в присутствии трет-бутилата калия и выделяют циклопропанкарбоновую кислоту формулы (IX).
Кислоты формулы (IX), их соли, их функциональные производные, особенно хлорангидрид, ангидрид и смешанный ангидрид с моно- (C1-C4) -алкиловым эфиром карбоновой кислоты, а также амиды формулы (XI) являются новыми продуктами, которые составляют следующий аспект настоящего изобретения.
Таким образом, настоящее изобретение также относится к соединению формулы
(XXI)
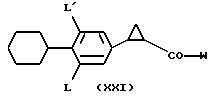
в которой L и L' имеют вышеуказанные значения и W означает гидроксильную группу или группу структуры -NG1G2, где
G1 означает (C1 -C6)-алкил или (C3-C7)-циклоалкил;
G2 означает (C1-C6)-алкил, (C3-C7)-циклоалкил, (С3-С6)-циклоалкил- (C1-С3)-алкил; фенильный, бензильный, фенетильный радикал, возможно замещенный в бензольной группе радикала галогеном, метоксигруппой или нитрогруппой;
или же G1 и G2 вместе с атомом азота, с которым они связаны, образуют содержащий один атом азота насыщенный, имеющий мостиковую или спиро-структуру, гетероцикл с 5-10 атомами углерода; морфолиногруппу, пиперазиногруппу, незамещенную или замещенную в положении 4 (C1-C4)-алкилом, фенильным, бензильным или фенетильным радикалом, причем бензольная группа может быть замещена галогеном, метоксигруппой или нитрогруппой; группу, выбираемую среди 4-фенил-1,2,3,6- тетрагидропиридин-1-ильного радикала, 4- фенилпиперидиногруппы, 4- бензилпиперидиногруппы, 4- фенетилпиперидиногруппы, причем фенильные группы вышеуказанных радикалов могут быть не замещены или замещены галогеном, метоксигруппой или нитрогруппой;
а также к солям щелочных металлов, к солям со вторичными и третичными аминами и к функциональным производным кислоты формулы (XXI), где W означает гидроксильную группу.
Среди солей щелочных металлов соединений формулы (XXI), где W означает гидроксильную группу, особенно предпочтительной является натриевая соль (W = ONa), тогда как среди солей со вторичными или третичными аминами особенно предпочтительными являются соли триметиламина [W = O-N+(CH3)3 ] и триэтиламина [W = O-N+(С2H5)3] . Среди функциональных производных кислоты формулы (XXI), где W означает гидроксильную группу, особенно предпочтительными являются галоидангидриды, в особенности хлорангидрид (W= хлор), ангидрид, смешанные ангидриды с карбоновой или сульфоновой кислотой, в особенности таковые с моно-(C1 -C4)-алкиловым эфиром карбоновой кислоты (W = O-COOAlk', где Alk' означает (С1-С4)-алкил, предпочтительно этил) или с п-толуолсульфокислотой, и особенно предпочтительны активированные сложные эфиры.
Особенно предпочтительны соединения формулы (XXI), в которой галогеном предпочтительно является хлор или фтор, один из L и L' означает водород, а другой означает фтор, хлор или нитрогруппу, или же L и L' являются одинаковыми и означают водород или хлор. Среди этих последних предпочтительными являются такие соединения, в которых, в формуле (XXI), W означает -OH, - ONa, O-N+(C2H5)3, Cl, O-COOAlk' [причем Alk' означает (C1-C4)-алкил] или -NG1 G2. Согласно биохимическим и фармакологическим исследованиям экспозиция соединений согласно изобретению в среде с нормальными клетками в условиях, которые препятствуют пролиферации раковых клеток, показала, что соединения не действуют на такие критерии, как целостность клеточных структур и клеточных функций или сохранение жизнеспособности. Таким образом, эти соединения обладают большой специфичностью по отношению к опухолевым клеткам. Противоопухолевую активность определяли на нескольких линиях человеческих опухолевых клеток in vitro и in vivo у мыши. Все используемые клетки происходят из международной коллекции типовых культур АТСС. Клетки MCF-7 используют для осуществления опытов на связывание.
Мембраны готовят следующим образом: 109 клеток MCF-7 гомогенизируют в течение 10 секунд в аппарате Polytron® в 10 мл буфера Hepes® , pH = 7,4, содержащего: 210 ммоль D-маннита, 70 ммоль сахарозы, 1 ммоль этилендиаминтетрауксусной кислоты, 0,3 ммоль фенилметилсульфонилфторида. Гомогенат центрифугируют при ускорении 650 g в течение 15 минут, затем супернатант отбирают и центрифугируют в течение 1 часа при ускорении 100 000 g. Осадок после центрифугирования вновь суспендируют в буфере Трис-HCI, pH 7,4, до концентрации 1 мг/мл и хранят при температуре -70oC.
Полное
связывание осуществляют в пробирке емкостью 5 мл, в которую вводят:
- 50 мкл
суспензии мембран, содержащей 10-50 мкг протеинов;
- 175 мкл 50 мМ буфера Трис, pH 7,4;
- 25
мкл 20 нМ3H-SR 31747 в 50 мМ буфера Трис, pH 7,4, + 0,1% бычьего
сывороточного альбумина.
Неспецифическое связывание осуществляют путем добавления 25 мкл 10-5 М SR 31747 в описанном выше растворе (конечный объем 250 мкл), затем путем инкубации в течение 30 минут при температуре 25oC. Свободные и связанные фракции разделяют, внося 200 мкл в колонку с 1 мл Sephadex® LH 20, затем подсчитывают радиоактивность в случае первых двух миллилитров, получаемых путем элюирования колонки с помощью 50 мМ буфера Трис, pH 7,4.
Используемые согласно изобретению соединения и новые соединения показывают активности при ИК50 от 10-10 до 10-6 моль.
Из других используемых клеток культивируют, обычно в среде RPMI, к которой добавлено 10% фетальной телячьей сыворотки, следующие линии клеток: миелом человека U266 и RPMI 8226; карциномы почки человека 293; карциномы легкого человека А549; карциномы молочной железы человека MCF-7; MCF-7 лимфоцитарной лейкемии человека.
Противоопухолевую активность определяют колориметрическим методом, используя МТТ { 3-(4, 5- диметилтиазол-2,5-дифенил) тетразолийбромид}, как описывается Mosmann Т., Journ. of Imm. Methods, 65, 55 (1983).
Этот колориметрический количественный анализ позволяет количественно определять противоопухолевую активность раствора, содержащего используемое согласно изобретению соединение.
Согласно используемому протоколу исследования производят посев суспендированных клеток (таких как клетки миелом) по 2,105 клеток/мл на лунку емкостью 1 мл в определенной среде. Посев адгезивных клеток (таких как клетки MCF- 7) производят по 5,104 клеток/мл на лунку емкостью 1 мл в среде RPMI + 0,5% фетальной телячьей сыворотки в течение ночи. На следующий день клеточный покров промывают два раза и заменяют определенной средой. Определенная среда соответствует следующей среде: RPMI + 10 мкг/мл инсулина + 10 мкг/мл человеческого трансферрина.
Для осуществления этого опыта клетки выдерживают в присутствии раствора, содержащего используемое соединение, в течение 5 дней, затем в культуральную среду добавляют МТТ.
Выбираемое время, составляющее 5 дней, соответствует оптимальному времени воздействия. После культивирования в течение 5 дней определяют пролиферацию клеток с помощью вышеописанного теста. Измеряют оптическую плотность при 570 нм. Синее окрашивание появляется в лунках, где клетки еще жизнеспособны. Интенсивность окрашивания пропорциональна количеству живых клеток.
Полученные результаты представлены в таблице А.
Из таблицы следует, что даже низкие концентрации, такие как 1 нмоль - 1 мкмоль, являются достаточными для того, чтобы индуцировать прекращение роста на 50%, и этого воздействия достигают в случае всех исследуемых опухолевых клеток.
Установленный in vitro эффект ингибирования линии клеток MCF-7 изучали in vivo у "голой" мыши путем интраперитонеального введения в дозах от 3 до 100 мг/кг на модели согласно Neri С. и др., Cancer Research, 50, 5892-5897 (1990); и согласно Berebbi M., и др. Oncogene, 505-509 (1990).
Также осуществляют другое исследование, чтобы определить воздействие SR-31747 на рост in vitro и in vivo эпителиальных опухолевых клеток молочной железы и простаты.
Изучение заключается в оценке потенциального противоопухолевого воздействия SR 31747 на рост
разновидности линий
карциноматозных эпителиальных клеток молочной
железы. Исследование осуществляют in vitro на культурах клеток, а также in vivo после инокуляции линий опухолевых клеток
молочной железы атимической "голой" мыши.
Используемыми линиями
клеток являются следующие:
Гормоночувствительная линия клеток MCF-7 происходит от плеврального выделения из
аденокарциномы молочной железы. Антиэстрогенорезистентные клетки MCF-7LY2 получают
из линии клеток MCF-7 путем селективного воздействия (давления) в присутствии антиэстрогена высокого сродства. Линии
клеток MCF-7LCC1 и MCF- 7LCC2 образуются у "голой" мыши после инокуляции клеток
MCF-7. Обе линии клеток являются эстрогенонезависимыми. Клетки MCF-7LCC2 также являются антиэстрогенорезистентными.
Линия клеток MCF-7AZTD5 происходит от линии клеток MCF-7 после стабильной
трансфекции с онкогеном H-ras. Клетки MCF-7AZTD5 in vitro являются антиэстрогенорезистентными. Совокупность этих линий клеток
выдерживают в смеси DMEM (модифицированная по способу Дульбекко среда
Игла) / F 12 (в объемном соотношении 1/1), содержащей 10% неполной фетальной телячьей сыворотки и 16 нг/мл человеческого
инсулина. Линию клеток MCF-7LCC2 культивируют при постоянном присутствии 10-7 моль гидрокситамоксифена. Опухолевые эпителиальные клетки молочной железы MDA-МВ231 являются эстрогенными и
антиэстрогенно-нечувствительными. Их культивируют в среде L 15, дополненной 10%
фетальной телячьей сыворотки, 1% основных аминокислот и 10 мкг/мл человеческого инсулина.
Линии эпителиальных клеток LnCaP, РС3 и DU145 происходят от простатических аденокарцином. Только клетки LnCaP являются чувствительными к гормонам. Все три линии клеток культивируют в среде RPMI, дополненной 10% фетальной телячьей сыворотки.
Все линии клеток выдерживают при температуре 37oС во влажной атмосфере из смеси воздуха с CO2 (в соотношении 95%/5%), за исключением клеток MDA-MB231, которые культивируют в отсутствие CO2. Линии клеток регулярно контролируют на отсутствие микоплазм.
Инокуляцию и обработку животных осуществляют следующим образом.
Используемыми животными являются овариэктомизированные или нет самки атимических "голых" мышей в возрасте четырех недель (R. Janvier). Перед инокуляцией клеток, чувствительных к гормонам, молочной железы (MCF-7, MCF-7AZTD5) животным вводят подкожно 10 мкл 10-5 М этанольного раствора эстрадиола. Обработку возобновляют три раза в течение недели. Один миллион клеток, суспендированных в 100 мкл ЗФР (забуференный фосфатом физиологический раствор/Ca++ инокулируют подкожно в каждое из бедер. На следующий день животным вводят 200 мкл раствора для инъекции (этанол/Твин 80/физиологическая сыворотка в объемном соотношении 1/1/18), содержащего различные реагенты в предварительно определенных концентрациях. Инъекции осуществляют интраперитонеально и возобновляют каждый день.
РЕЗУЛЬТАТЫ
Воздействие in vitro SR 31747 на пролиферацию различных линий опухолевых эпителиальных клеток молочной
железы
Результаты, относящиеся к воздействию SR 31747 на пролиферацию эпителиальных
клеток молочной железы при культивировании, представлены в таблице Б. Активность SR 31747 оценивают в
присутствии различных концентраций сыворотки. В присутствии пониженных концентраций сыворотки
соединение SR 31747 оказывает ингибирующее воздействие на пролиферацию всех испытуемых линий
эпителиальных опухолевых клеток. Повышенные количества сыворотки в культуральных средах частично или
полностью подавляют ингибирующее воздействие SR 31747 на рост клеток.
Для данной концентрации сыворотки способность SR 31747 ингибировать пролиферацию также изменяется в зависимости от используемой линии клеток. В присутствии 0,1% фетальной телячьей сыворотки (FCS), что позволяет одновременно поддерживать минимальной пролиферацию клеток и наблюдать последующее воздействие SR 31747, ИК50, определяемая для чувствительных к гормонам линий клеток MCF-7 (MCF-7, MCF-7AZ, MCF-7 22НТВ), изменяется в пределах от 2•10-9 моль до 7•10-8 моль. Подобные значения ИК50 также получают для клеток MDA-MB231 и MCF-7LCC. Напротив, линии клеток MCF-7AZTD5 и MCF-7LY2 обладают более значительными чувствительностями к ингибирующему воздействию SR 31747, так как определенные ИК50 составляют соответственно 2•10-10 моль и 5•10-12 моль.
Во всех случаях почти полные ингибирования пролиферации клеток, наблюдаемые в присутствии 10-6 моль и иногда 10-7 моль SR 31747, по всей очевидности представляют собой цитотоксические эффекты.
Полученные результаты также показывают, что SR 31747 не способен реверсировать стимулирующее воздействие эстрадиола на чувствительную к гормонам линию клеток MCF-7.
Воздействие in
vivo SR 31747 на частоту и размер опухолей, развивающихся после инокуляции линий эпителиальных
опухолевых клеток молочной железы "голой" мыши:
На фиг. 1 и 2 представлено воздействие SR 31747
на опухоли, развивающиеся у овариэктомизированной "голой" мыши из клеток MDA-MB231.
Каждой мыши вводят в каждое бедро (или 2 точки инокуляции на мышь) 5•106 клеток MDA-MB231. Животных затем обрабатывают ежедневно интраперитонеально, и вводят 500 мкг SR 31747 + 0,003 мкг Е2 (20 мышей). Контрольная партия получает 0,003 мкг Е2 (20 мышей). Количество (в процентах инокулируемых опухолей) и размер развившихся опухолей определяют в различные моменты времени в процессе обработки. По окончании обработки (день 92) животных умерщвляют и взвешивают. Опухоли извлекают и взвешивают.
Фигуры показывают тенденцию SR 31747 уменьшать размер, массу и частоту развивающихся из клеток MDA-MB231 опухолей у овариэктомизированной "голой" мыши. Однако различия на уровне размера и массы опухолей между контрольными группами и группами, которым вводят SR 31747, не являются показательными вследствие большой изменяемости, наблюдаемой в молочной железе каждой группы.
Таким образом in vitro SR 31747 оказывает антипролиферативное воздействие на пролиферацию совокупности изучаемых опухолевых эпителиальных клеток молочной железы. Это воздействие в особенности проявляется в присутствии пониженных концентраций сыворотки и изменяется в зависимости от исследуемых линий клеток. Если, в большинстве случаев, ИК50, измеренные с 0,1% фетальной телячьей "сыворотки, изменяются в пределах от 2•10-9 моль до 2•10-8 моль, то, однако, наблюдают чрезвычайную чувствительность клеток MCF-7LY2 к SR 31747.
Наблюдают общую тенденцию SR 31747 уменьшать одновременно размер, массу и частоту развивающихся из клеток MDA-MB231 опухолей.
Настоящее изобретение также относится к способу получения изображения in vivo опухолей, которое используют в качестве мишени для используемых согласно изобретению радиоактивно меченых, например, с помощью123I,18F,11C,13N, соединений, рецепторов, на которых фиксируется3H-SR 31747. В самом деле, высокая плотность этих рецепторов в опухолевых клетках позволяет сделать вывод, что они могут быть предпочтительно использованы для фиксации радиолигандов, используя методы PET (позитронная эмиссионная томография) и SPECT (одиночных фотонов эмиссионная компьютерная томография).
Следовательно, настоящее изобретение также относится к использованию радиоактивно меченых хорошо известными специалисту изотопами соединений в качестве агента изображения для радиомаркировки.
Кроме того, могут быть использованы другие способы получения изображения, опосредуемые комплексом радиоактивно меченое антитело-антигены.
Такие способы входят, но не являются ограничительными, в метод SPECT или в метод, называемый PET.
Применение соединений согласно изобретению включает также получение лекарственных средств, предназначенных для лечения, которое включает направленную доставку радиоактивно меченых продуктов в качестве высвобождающих излучения веществ поблизости от опухоли или в саму опухоль, используя вышеуказанные соединения для нацеливания радиоактивно меченых продуктов на опухоль или в ее непосредственное окружение, чтобы подвергнуть опухолевые клетки излучениям, эмиттируемым вышеуказанными радиоактивно мечеными продуктами.
Применение соединений согласно изобретению может также включать этап лучевой терапии, где клетки, находящиеся в контакте с соединениями, подвергаются воздействию ионизирующих излучений, включающих, например, гамма-лучи, бета-лучи, рентгеновские лучи или альфа-частицы, которые могут происходить от внешнего источника, как в случае рентгеновских лучей или гамма-лучей, или могут непосредственно вводиться пациенту с помощью радионуклеидов, как описывается, например, в Principles of Radiation Therapy in Cancer, Principles and Practice of Oncology, под ред. Devita V. Т. и др., 4-е издание, J.B. Lippincott Co., Филадельфия, 1993, 15, 248-275.
Эти соединения также можно вводить в сочетании с другими противораковыми действующими началами, хорошо известными специалисту.
Согласно
проиллюстрированным выше биохимическим и фармакологическим исследованиям наилучшую эффективность проявляют следующие соединения:
N-бензил-N-метил[3-(3-хлор-4-циклогексилфенил)пропил]амин;
1-(3-нитро-4-циклогексилфенил)-3-(4-фенилпиперидино) пропан-2-ол;
транс-3-[3-(3-нитро-4-циклогексилфенил)
аллил]-4-фенил-пиперидин;
1-[3-(3-хлор-4-циклогексилфенил)проп-2-инил]-4- фенил-пиперидин;
1-[3-(3-хлор-4-циклогексилфенил) пропил] -4-фенил- 1,2,3,6-тетрагидропиридин;
1-[3-(4-циклогексилфенил)
пропил]-4- фенилпиперидин;
цис-3-[3-(3-хлор-4-циклогексилфенил)аллил]-3-азаспиро [5.5]ундекан;
3-[3-(3-хлор-4-циклогексилфенил)пропил]-3-азаспиро [5.
5]ундекан;
цис-N-адамантан-1-ил-N-этил-[3-(3-хлор- 4-циклогексилфенил)аллил]амин;
4-бензил-1-[3-(3-хлор -4-циклогексилфенил)пропил]пиперидин;
1-(3-хлор-4-циклогексилфенил)-3-(4-фенилпиперидино) пропан-1-ол;
N-циклогексил-N-этил-[3-(4-циклогексилфенил)пропил] амин;
циc-N-этил-N-фeнил-[3-(3-хлор-4-циклогексилфенил)аллил]
амин;
N-фенетил-N-метил-1-[3-(3-хлор-4-циклогексилфенил) пропил]амин;
цис-N-циклогексил-N-этил-[3-(4-циклогексилфенил)аллил] амин;
N-циклогексил-N-этил-[3-(3,
5-дихлор-4- циклогексилфенил)аллил]амин;
транс-N,N-дигексил-[3-(3-хлор-4-циклогексилфенил)аллил] амин;
цис-N-циклогексил-N-этил-[3-(3-хлор-4-циклогексилфенил)аллил]амин;
транс-N-циклогексил-N-этил-[3-(3-хлор-4- циклогексилфенил)аллил] амин;
N-циклогексил-N-этил-[3-(3-хлор-4-циклогексилфенил) пропил]амин,
1-[3-(3-хлор-4-циклогексилфенил)аллил]азепан;
транс-N,N-дициклогексил-3-[(3-хлор-4-циклогексилфенил) аллил]амин;
N-циклогексил-N-этил-[3-(3-хлор-4-циклогексилфенил)проп- 2-инил]амин;
1-(3-хлор-4-циклогексилфенил)-3-(циклогексилэтил-амино) пропан-1-он;
1-(3-хлор-4-циклогексилфенил)-3-(циклогексилэтил-амино) пропан-1-ол;
транс-N,
N-диэтил-[3-(3-хлор-4-циклогексилфенил) аллил]амин;
4-[3-(3-хлор-4-циклогексилфенил)пропил] морфолин;
4-[(3-хлоргексилфенил)бут-2-енил]морфолин;
4-[4-(3-хлор-4-циклогексилфенил) бутил] морфолин
или одна из их фармацевтически приемлемых солей, или один из их фармацевтически приемлемых сольватов.
Соединения, способные вытеснять3H-SR 31747 из его рецепторов, могут быть использованы в терапии всех патологических процессов, которые имеют следствием пролиферацию опухолевых клеток. Эта пролиферация клеток может быть либо чувствительной, либо нечувствительной к гормонам.
Более конкретно, клинические применения, для которых можно предусматривать использование этих соединений, включают заболевания, проистекающие от пролиферации клеток, в особенности такие как глиобластомы, нейробластомы, лимфомы, миеломы, лейкемия, карцинома ободочной кишки; колоноректальная, эпителиальная, гепатическая карциномы; рак легкого, молочной железы, яичников, поджелудочной железы или простаты.
В этих целях соединения, способные вытеснять3H-SR 31747 из его рецепторов, а именно соединения формул (I)-(VIII), так же как их фармацевтически приемлемые соли, могут быть использованы для получения фармацевтических композиций, вводимых перорально, подъязычно, чрескожно или локально. Эти фармацевтические композиции включают по крайней мере один из вышеуказанных продуктов в сочетании с фармацевтически инертным наполнителем.
Более предпочтительно согласно другому из своих аспектов настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве действующего начала соединение формулы (VIII) или одну из его фармацевтически приемлемых солей.
Как органические, так и неорганические кислоты могут быть использованы для получения солей присоединения кислот аминов формулы (VIII), которые нетоксичны и фармацевтически приемлемы, особенно такие, как серная, азотная, фосфорная, соляная, лимонная, уксусная, молочная, винная, памовая, этандисульфоновая, метансульфоновая, янтарная, циклогексилсульфоновая, фумаровая, малеиновая и бензойная кислоты.
В том, что касается введения перорально или подъязычно, в особенности используют простые или дражированные таблетки, желатиновые капсулы с лекарством; гранулы, в известных случаях с замедленным высвобождением лекарственного средства; капли или же липосомы. В том, что касается введения внутривенно, подкожно или внутримышечно, прибегают к использованию стерильных или стерилизуемых растворов, в особенности для венозной перфузии, тогда как для введения чрескожно можно реализовать обычные пластыри. Для локального применения можно использовать кремы или лосьоны, наносимые на кожу.
Фармацевтические композиции согласно настоящему изобретению могут быть получены обычными способами, хорошо известными в области фармацевтической технологии.
Действующее начало может быть включено в эксципиенты, обычно используемые в этих фармацевтических композициях, такие как тальк, гуммиарабик, лактоза, крахмал, стеарат магния, водные или неводные наполнители, жировые вещества животного или растительного происхождения, парафиновые производные, гликоли, различные смачиватели, диспергирующие компоненты, или эмульгаторы, консерванты и т.д.
Фармацевтические композиции согласно изобретению предпочтительно могут содержать соединение формулы (VIII) или одну из его фармацевтически приемлемых солей присоединения в сочетании с одним или несколькими другими известными и обычно используемыми для тех же терапевтических показаний лекарственными средствами.
Количество вводимого в день действующего начала согласно способу настоящего изобретения зависит от особенности терапевтического показания, тяжести излечиваемых болезненных состояний, так же как от массы больного и пути введения.
Для систематического введения общая доза в случае человека обычно изменяется от 1 до 100 мг в день, например составляет 2-50 мг, и более приемлемо составляет 3-40 мг в день.
Разовые дозы для систематического введения обычно включают 3-50 мг (а именно 3, 5, 10, 20, 30, 40 и 50 мг продукта). Эти разовые дозы обычно вводят один или несколько раз в день, предпочтительно 1-3 раза в день.
Для локального применения фармацевтические композиции обычно содержат 0,0001-10% и предпочтительно 0,01-5% действующего начала.
Нижеследующие примеры иллюстрируют изобретение, не ограничивая его объема охраны. В этих примерах температуру плавления определяют в приборе с нагреванием Кофлера.
Получение
ацетиленовых производных для синтеза цис-соединений
Пример приготовления 1
Производное семикарбазона
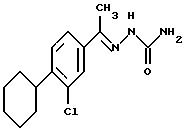
73,6 г (0,66 моль) семикарбазидгидрохлорида и 54,2 г (0,66 моль) ацетата натрия растворяют в 600 мл дистиллированной воды, затем смесь интенсивно перемешивают и при комнатной температуре быстро добавляют раствор 142,1 г (0,6 моль) 3-хлор-4- циклогексилацетофенона в 600 мл этанола. После этого реакционную смесь нагревают при температуре 50oC в течение двух часов, в течение ночи перемешивают при комнатной температуре, потом образовавшиеся кристаллы отфильтровывают под вакуумом, промывают их водой, ацетоном, диэтиловым эфиром, высушивают в вакууме, получая 169,5 г кристаллов белого цвета; выход = 96%.
Пример приготовления 2
2-Xлор-1-циклогексил-4-этинилбензол
Следуют
методике I. Lalezari и др. Angew.
Chem. Internat. Ed. 9, 464 (1970).
Суспензию 26 г (0,234 моль) тонко измельченного оксида селена и 58,7 г (0,2 моль) полученного в примере приготовления 1 семикарбазона в 400 мл ледяной уксусной кислоты сначала нагревают на масляной бане при температуре 60oC в течение 1 часа, затем в течение двух часов при температуре 80oC и получают промежуточный селениодиазол. Затем температуру масляной бани повышают до 150oC и реакционную смесь нагревают в течение 3,5 часов вплоть до прекращения выделения азота, т.е. до полного разложения селениодиазола. Уксусную кислоту после этого удаляют в вакууме, остаток последовательно обрабатывают с помощью 600 мл диэтилового эфира, отфильтровывают, промывают четыре раза водой, один раз водным 5%-ным раствором гидроксида натрия, еще два раза водой, сушат над сульфатом натрия, затем выпаривают в вакууме. Nаслянистый остаток перегоняют под давлением 10-2 мм рт. ст. при температуре 85-100oC, получая 24,8 г бесцветного масла.
Получение кетопроизводных путем реакции Манниха для синтеза гидроксилированных предшественников
транс-соединений
Пример
приготовления 3
1-(3-Нитро-4-циклогексилфенил)-3-(4- фенилпиперидино)пропанон
В 100 мл 1,2-диметоксиэтана растворяют 12,3 г
3-нитро-4-циклогексилацетофенона, 9,85 г 4-фенилпиперидина,
7,5 г параформальдегида и 1,5 мл концентрированной соляной кислоты, затем реакционную смесь при перемешивании в течение 6 часов кипятят с
обратным холодильником. После этого реакционную смесь
выдерживают в течение ночи при комнатной температуре, затем отфильтровывают осадок, который последовательно промывают этилацетатом, затем
диэтиловым эфиром, получая 17 г целевого соединения.
Пример 1
3-[3-(3-Хлор-4-циклогексилфенил)проп-2-инил] -3- азаспиро [5.5]ундекангидрохлорид
4,85 г (0,022 моль)
полученного в примере приготовления 2 соединения и 0,5 г
CuCl2 растворяют в 25 мл 1,2-диметоксиэтана. Затем добавляют по каплям раствор 2,7 г 35%-ного формальдегида и 3,74 г
3-азаспиро[5.5]ундекана в 20 мл 1,2-диметоксиэтана. После добавления
реакционную смесь нагревают при температуре 70oC в течение 30 минут, удаляют растворитель в вакууме, затем
последовательно обрабатывают диэтиловым эфиром, эфирную фазу промывают водным
5%-ным раствором гидроксида натрия, насыщенным раствором хлорида натрия, и сушат над сульфатом магния. Гидрохлорид
кристаллизуют из этилацетата, получая 7,6 г целевого продукта; т. пл. = 241oC.
Пример 2
цис-3-[3-(3-Хлор-4-циклогексилфенил)аллил]
-3- азаспиро[5.5]ундекангидрохлорид
3 г гидрохлорида ацетиленового соединения, полученного согласно
предыдущему примеру 1, обрабатывают водным 10%-ным раствором гидроксида натрия. Полученное
масло после экстракции диэтиловым эфиром промывают насыщенным раствором хлорида натрия, сушат над сульфатом
магния и концентрируют в вакууме. Таким образом полученный остаток вносят в 100 мл
этилацетата с добавленными 5 мл метанола, после чего добавляют 0,2 г Pd/BaSO4 и реакционную смесь
гидрируют при комнатной температуре и атмосферном давлении. Катализатор отфильтровывают
через диоксид кремния, фильтрат концентрируют в вакууме, затем остаточное масло хроматографируют на колонке с
диоксидом кремния, элюируя смесью дихлорметан/метанол в объемном соотношении 98/2.
Концентрирование чистых фракций дает гидрохлорид, который перекристаллизуют из этилацетата; выход = 44%; т. пл. =
238oC.
Примеры 3 и 4
Следуя описанной в примере 1
методике и вводя во взаимодействие 4-циклогексил-3,5-лихлор-1-этинилбензол соответственно с 4-фенилпиперидином и
циклогексилэтиламином в присутствии формальдегида, получают соответственно следующие
соединения:
- 4-фенил-1-[3-(3,5-дихлор-4-циклогексилфенил) проп-2-инил] пиперидингидрохлорид; т. пл. =
250oC (пример 3);
- N-циклогексил-N-этил-3-(3,
5-дихлор-4- циклогексилфенил)проп-2- иниламингидрохлорид (пример 4).
Примеры 5-10
Следуя методике примера 1,
путем взаимодействия 3-хлор-4-циклогексил-1-этинилбензола
соответственно с этилфениламином, 1-адамантилэтиламином, бензилметиламином, (2-фенил- этил) метиламином, 4-бензилпиперидином и
4-гидрокси-4-фенил- пиперидином в присутствии формальдегида получают
соответственно следующие соединения:
- N-этил-N-фенил-3-(3-хлор-4- циклогексилфенил) проп-2-иниламингидрохлорид (пример 5);
- N-(1- адамантил)-N-этил-3-(3-хлор-4-циклогексилфенил)проп-2- иниламингидрохлорид (пример 6);
- N-бензил-N-метил-3-(3-хлор-4-циклогексилфенил)проп-2-иниламингидрохлорид (пример 7);
- N-метил-N-(2-фенилэтил)3-(3-хлор-4-циклогексилфенил) проп-2- иниламингидрохлорид (пример 8);
- 4-бензил-1-[3-(3-хлор-4- циклогексилфенил) проп-2-инил]пиперидингидрохлорид (пример
9); и
- 4-гидрокси-4-фенил-1-[3- (3-хлор-4-циклогексилфенил) проп-2- инил]пиперидингидрохлорид (пример 10).
Примеры 11 и 12
Следуя описанной в примере 1 методике,
путем
взаимодействия 4-циклогексил-1-этинилбензола соответственно с циклогексилэтиламином и 4-фенилпиперидином в присутствии формальдегида получают следующие соединения:
- N-циклогексил-N- этил-3-(4-циклогексилфенил)проп-2-иниламингидрохлорид (пример 11);
- 4-фенил-1-[3-(4-циклогексилфенил)проп-2- инил] пиперидингидрохлорид (пример 12).
Примеры 13-16
Следуя описанной в примере 2 методике, путем гидрирования ацетиленовых производных, полученных согласно примерам 4-6 и 11, получают цис-пропенамины, представленные в таблице
I.
Пример 17
1-(3-Нитро-4-циклогексилфенил)-3-(4-фенилпиперидино)пропанол
13,8 г кетона, полученного согласно примеру приготовления 3, суспендируют в 300 мл
метанола.
Смесь охлаждают до температуры -10oC, затем добавляют 8,42 г боргидрида натрия и реакционную смесь выдерживают при температуре -10oC в течение 10 минут, после чего
оставляют
стоять для повышения температуры до комнатной. Выпавший осадок отфильтровывают и промывают метанолом, получая 9,5 г целевого продукта; т. пл. = 148-150oC.
Пример
18
транс-1-[3-[3-Нитро-4-циклогексилфенил)аллил] ] -4-фенил-пиперидингидрохлорид
10,6 г спирта, полученного согласно примеру 17, и 10,4 г п-толуолсульфокислоты растворяют в 300 мл
ксилола, затем
реакционную смесь кипятят с обратным холодильником в течение 6 часов при перемешивании и при использовании насадки Дина-Старка для сбора выделяющейся воды. Растворитель выпаривают в
вакууме, затем
остаточное масло последовательно обрабатывают этилацетатом, этилацетатную фазу промывают водным 0,5 н. раствором гидроксида натрия, водой, сушат над сульфатом магния и концентрируют в
вакууме до
объема 50 мл растворителя, через который пропускают путем барботирования газообразный хлороводород. Концентрируют в вакууме и осадок промывают диэтиловым эфиром, получая 8 г целевого
гидрохлорида; т.
пл. = 225-233oC.
Пример 19
3-(N-Этил-N-фенил)амино-1-(3-хлор-4- циклогексил)фенил-пропанолгидрохлорид
а) Следуя описанной в примере
приготовления 3
методике, из 3-хлор-4-циклогексилацетофенона путем введения его во взаимодействие с фенилэтиламином получают 1-(3-хлор-4-цикло- гексилфенил)-3-(N-этил-N-фениламино)пропанон.
б) Следуя описанной в примере 17 методике, путем восстановления полученного на стадии (а) кетона с помощью боргидрида натрия получают целевой продукт в виде гидрохлорида; т. пл. = 219oC.
Пример 20
3-[3-(3-Хлор-4-циклогексилфенил)пропил]-3- азаспиро [5.5]ундекангидрохлорид
3 г гидрохлорида ацетиленового соединения, полученного согласно
примеру 1,
обрабатывают водным 10%-ным раствором гидроксида натрия. Полученное масло после экстракции диэтиловым эфиром промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и
концентрируют в
вакууме. Остаточное масло затем вносят в 100 мл этилацетата с добавленными 5 мл метанола, после чего добавляют 0,2 г Pd/BaSO4 и реакционную смесь гидрируют при комнатной
температуре и
атмосферном давлении. Катализатор отфильтровывают через целит, фильтрат концентрируют в вакууме. Полученный остаток обрабатывают минимальным количеством метанола в присутствии 50 мл 2
н. соляной
кислоты, затем последовательно экстрагируют дихлорметаном, экстракт промывают 2 н. раствором соляной кислоты, насыщенным раствором хлорида натрия, сушат над сульфатом магния и
концентрируют в вакууме,
получая 2 г целевого гидрохлорида; т. пл. = 266oC.
Примеры 21-26
Следуя описанной в примере 20 методике, путем гидрирования
соответственно ацетиленовых производных,
полученных согласно примерам 11, 7, 8, 9, 12 и 10, получают соответственно соответствующие насыщенные производные, указанные в таблице II.
Пример 27
1-[3-(3-Хлор-4-циклогексилфенил)пропил] -4- фенил-1,2,3,6-тетрагидропиридингидрохлорид
1 г полученного согласно примеру 26 соединения и 0,51 г п-толуолсульфокислоты
растворяют в 25 мл
ксилола. Реакционную смесь кипятят с обратным холодильником в течение двух часов, затем концентрируют в вакууме. Остаток обрабатывают 10%-ным раствором гидроксида натрия, затем
последовательно
экстрагируют дихлорметаном, промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют в вакууме, получая 0,7 г целевого гидрохлорида; т. пл. =
210o
C.
Пример 28
а) 4-(3-Хлор-4-циклогексилфенил)-4- гидроксибутановая кислота
20 г 4-(3-Хлор-4-циклогексилфенил)-4- оксобутановой кислоты растворяют в
100 мл
тетрагидрофурана, 8,6 мл водного раствора гидроксида натрия и добавляют 100 мл метанола. Реакционную смесь охлаждают до температуры 0-5oC, затем добавляют 3,8 г боргидрида натрия и
смесь
выдерживают в течение ночи при комнатной температуре. Эту реакционную смесь выливают в 8 л воды, затем добавляют 85 мл концентрированной соляной кислоты, получая целевое гидроксилированное
производное.
б) 5-(3-Хлор-4-циклогексилфенил)дигидрофуран-2-он
Полученное согласно стадии (а) соединение растворяют в 300 мл толуола и реакционную смесь кипятят с обратным
холодильником при использовании насадки Дина-Старка для удаления воды. Затем концентрируют растворитель в вакууме, получая целевой лактон; выход = 16 г; т. пл. = 60oC.
в)
Метиловый эфир 4-хлор-4-(3-хлор-4-циклогексилфенил) бутановой кислоты
2,78 г полученного на стадии (б) лактона растворяют в 30 мл бензола, затем добавляют по каплям 2,2 мл тионилхлорида и
реакционную смесь кипятят с обратным холодильником в течение трех часов. После этого эту реакционную смесь вносят в охлажденный раствор газообразного хлороводорода в метаноле и эту смесь перемешивают
в течение ночи при комнатной температуре, затем концентрируют ее в вакууме и получают 3,5 г целевого хлорированного производного.
г)
2-(3-Хлор-4-циклогексилфенил)циклопропанкарбоновая
кислота
3 г полученного согласно стадии (в) сложного эфира растворяют в 10 мл трет-бутанола, затем добавляют 1,5 г трет-бутилата калия и
эту смесь кипятят с обратным холодильником в течение
четырех часов. Потом, после охлаждения, добавляют 50 мл воды и экстрагируют диэтиловым эфиром. Затем, после концентрирования растворителя,
проводят омыление путем растворения остатка в 20 мл этанола и
10 мл воды в присутствии 0,8 г гидроксида калия, после чего эту реакционную смесь кипятят с обратным холодильником в течение двух часов.
После охлаждения раствора добавляют воду, подкисляют путем
добавления 6 н. соляной кислоты и экстрагируют диэтиловым эфиром, сушат и концентрируют в вакууме, получая 1,4 г целевой кислоты.
Примеры 29-32
а) Следуя описанной в примере
28 (а) методике, из 4-(4-циклогексилфенил)-4-оксобутановой кислоты, 4-(4- циклогексил-3,5-дихлорфенил)-4-оксобутановой кислоты,
4-(4- циклогексил-3-фторфенил)-4-оксобутановой кислоты и соответственно
4-(4- циклогексил-3-нитрофенил)-4-оксобутановой кислоты путем восстановления с помощью боргидрида натрия получают следующие
соединения:
- 4-(4-циклогексилфенил)-4-гидроксибутановая кислота
(пример 29 а);
- 4-(4-циклогексил-3,5-дихлорфенил)-4- гидроксибутановая кислота (пример 30 а);
- 4-(4-циклогексил-3- фторфенил)-4-гидроксибутановая кислота (пример 31 а);
и
соответственно
- 4-(4-циклогексил-3-нитрофенил)-4- гидроксибутановая кислота (пример 32 а).
б) Следуя описанной в примере 28 (б) методике, из гидроксибутановых кислот,
полученных согласно вышеприведенным примерам 29 (а) - 32 (а), путем нагревания или кипячения с обратным
холодильником в толуоле при использовании насадки Дина-Старка получают следующие соединения:
- 5-(4- циклогексилфенил)дигидрофуран-2-он (пример 29 б);
- 5-(4-циклогексил-3,
5-дихлорфенил)дигидрофуран-2-он (пример 30 б);
- 5-(4-циклогексил-3-фторфенил)дигидрофуран-2-он
(пример 31 б);
и соответственно
- 5-(4-циклогексил-3-нитрофенил)дигидрофуран-2-он (пример 32 б).
в) Следуя описанной в примере 28 (в) методике, путем взаимодействия
лактонов, полученных согласно вышеприведенным
примерам 29 (б) - 32 (б), с тионилхлоридом, затем с раствором хлороводорода в метаноле получают следующие соединения:
- метил- [4-хлор-4-(4-циклогексилфенил)]бутират (пример 29 в);
- метил-[4- хлор-4-(4-циклогексил-3,5-дихлорфенил)] бутират (пример 30 в);
- метил-[4-хлор-4-(4-циклогексил-3-фторфенил)]бутират (пример 31 в);
и соответственно
- метил-[4-хлор-4-(4-циклогексил-3- нитрофенил)]бутират (пример 32 в).
г)
Следуя описанной в примере 28 (г) методике, путем нагревания полученных согласно вышеприведенным примерам
29(в) - 32 (в) сложных эфиров в трет-бутаноле в присутствии трет-бутилата калия получают
следующие соединения:
- 2-(4-циклогексилфенил)циклопропанкарбоновая кислота (пример 29 г);
- 2-(4-циклогексил-3, 5-дихлорфенил) циклопропанкарбоновая кислота (пример 30 г);
- 2-(4-циклогексил-3- фторфенил) циклопропанкарбоновая кислота (пример 31 г);
и соответственно
- 2-(4-циклогексил-3-нитрофенил) циклопропанкарбоновая кислота (пример 32 г).
Пример 33
а) Хлорангидрид 2-(3-хлор-4- циклогексилфенил)циклопропанкарбоновой кислоты
4 г полученной согласно примеру 28 кислоты и 3,7 мл тионилхлорида растворяют в 50 мл
тетрахлорида углерода. Реакционную смесь кипятят с обратным холодильником в течение трех часов, затем
концентрируют в вакууме, получая 5,9 г целевого хлорангидрида кислоты в виде масла.
б) N-Циклогексил-N-этил-2-(3- хлор-4-циклогексилфенил)циклопропанкарбоксамид
3 г
полученного выше хлорангидрида кислоты растворяют в 50 мл тетрахлорида углерода, затем добавляют
раствор 2,9 г циклогексилэтиламина в 50 мл тетрахлорида углерода и реакционную смесь перемешивают при
комнатной температуре в течение 20 часов. После этого раствор промывают водой вплоть до
нейтрального значения pH. Получают 5,16 г амида в виде масла.
Примеры 34-37
а) Из
циклопропанкарбоновых кислот, полученных, как указано в примерах 29 (г) - 32 (г), путем
взаимодействия с тионилхлоридом согласно описанной в примере 33 (а) методике получают следующие соединения:
- хлорангидрид 2-(4- циклогексилфенил)циклопропанкарбоновой кислоты (пример 34 а);
-хлорангидрид 2-(4-циклогексил-3,5-дихлорфенил) циклопропанкарбоновой кислоты (пример 35 а);
- хлорангидрид 2-(4-циклогексил- 3-фторфенил)циклопропанкарбоновой кислоты (пример 36 а);
и соответственно
- хлорангидрид 2-(4-циклогексил-3- нитрофенил)циклопропанкарбоновой
кислоты (пример 37 а).
б) Следуя описанной в примере 33 (б) методике, путем
взаимодействия хлорангидридов кислот, полученных согласно примерам 34 (a) - 37 (а), как указано выше, с
циклогексилэтиламином получают следующие соединения:
- N-циклогексил-N-этил-2-(4- циклогексилфенил)циклопропанкарбоксамид (пример 34 б);
- N-циклогексил-N-этил-2-(4-циклогексил- 3,
5-дихлорфенил) циклопропанкарбоксамид (пример 35 б);
- N-циклогексил-N-этил-2-(4- циклогексил-3-фторфенил)циклопропанкарбоксамид (пример 36 б);
- N-циклогексил-N-этил-2-(4-циклогексил-3-нитрофенил) циклопропанкарбоксамид (пример 37 б).
Пример 38
[2-(3-Хлор-4- циклогексилфенил)циклопропилметил]циклогексилэтиламингидро
хлорид
5 г полученного согласно примеру 33 амида растворяют в 50 мл диэтилового эфира,
затем добавляют суспензию 0,99 г литий-алюминийгидрида в диэтиловом эфире и реакционную смесь
перемешивают в течение трех часов при комнатной температуре, потом выливают в водный 5%-ный раствор
гидроксида натрия. После этого реакционную смесь экстрагируют диэтиловым эфиром, затем
последовательно декантируют, сушат над сульфатом магния и пропускают путем барботирования газообразный
хлороводород, получая 3,54 г целевого гидрохлорида; т. пл. = 202oC.
Пример 39
а) Следуя описанной в примере приготовления 3 методике, из
3-хлор-4-циклогексилацетофенона путем взаимодействия с ди- н-гексиламином и формальдегидом получают
1-(3-хлор-4- циклогексилфенил)-3-дигексиламинопропанон.
б) Следуя описанной в примере 17 методике, путем восстановления полученного на стадии (а) кетона с помощью боргидрида натрия получают 3-дигексиламино-1-(3-хлор-4-циклогексилфенил)пропанол.
в) Следуя описанной в примере 18 методике, путем дегидратации полученного на стадии (б) спирта получают N-транс-[3-(3-хлор-4- циклогексилфенил)аллил]дигексиламин; т. пл. = 128oC.
Примеры 40-52
Из хлорангидрида 2-(3-хлор-4- циклогексилфенил)циклопропанкарбоновой
кислоты, полученного согласно описанной в примере 33 (а) методике, путем взаимодействия соответственно с
диэтиламином, дигексиламином, (1-адамантил)этиламином, этилфениламином, бензилметиламином,
метил-(2-фенилэтил) амином, морфолином, пиперидином, 4-фенил- 1,2,3,6-тетрагидропиридином, 4-фенилпиперидином,
4- бензилпиперидином, 4-(2-фенилэтил) пиперидином, 3- азаспиро[5.5] ундеканом, и следуя
указаниям примера 33 (б), получают следующие соединения:
- N,
N-диэтил-2-(3-хлор-4- циклогексилфенил)циклопропанкарбоксамид (пример 40);
- N,
N- дигексил-2-(3-хлор-4-циклогексилфенил)циклопропанкарбоксамид (пример 41);
- N-(1-адамантил)-N-этил-2-(3-хлор-4- циклогексилфенил) циклопропанкарбоксамид (пример 42);
- N-этил- N-фенил-2-(3-хлор-4-циклогексилфенил)циклопропанкарбоксамид (пример 43);
- N-бензил-N-метил-2-(3-хлор-4-циклогексилфенил) циклопропанкарбоксамид (пример 44);
- N-метил-N-(2-фенилэтил) -2-(3- хлор-4-циклогексилфенил)циклопропанкарбоксамид (пример 45);
- 4- [2-(3-хлор-4-циклогексилфенил)циклопропил]карбонил-морфолин (пример 46);
- 1-[2-(3-хлор-4-циклогексилфенил)циклопропил] карбонил-пиперидин (пример 47);
- 1-[2-(3-хлор-4- циклогексилфенил)циклопропил]карбонил-4-фенил-1,2,3,6- тетрагидропиридин (пример 48);
- 1-[2-(3-хлор-4- циклогексилфенил)циклопропил]карбонил-4-фенилпиперидин (пример 49);
- 1-[2-(3-хлор-4-циклогексилфенил)циклопропил]карбонил-4- бензилпиперидин (пример 50);
- 1-[2-(3-хлор-4-циклогексилфенил) циклопропил] карбонил-4-(2-фенилэтил)пиперидин (пример 51);
- 3- [2-(3-хлор-4-циклогексилфенил)циклопропил]карбонил-3- азаспиро[5.5] ундекан (пример
52).
Примеры 53-65
Следуя описанной в примере 38 методике, путем
восстановления амидов, полученных согласно примерам 40-52, получают следующие соединения:
- N,
N-диэтил-2-(3-хлор-4- циклогексилфенил)циклопропилметанамин (пример 53);
- N,
N-дигексил-2-(3-хлор-4-циклогексилфенил)циклопропилметанамин (пример 54);
- N-(1-адамантил)-N-этил-2-(3-хлор-4- циклогексилфенил)циклопропилметанамин (пример 55);
- N-этил-N-фенил-2-(3-хлор-4-циклогексилфенил) циклопропилметанамин (пример 56);
- N-бензил-N-метил-2-(3-хлор-4- циклогексилфенил)циклопропилметанамин (пример 57);
- N-метил-N- (2-фенилэтил)-2-(3-хлор-4-циклогексилфенил) циклопропилметанамин (пример 58);
- 4-[2-(3-хлор-4-циклогексилфенил) циклопропил] метилморфолин (пример 59);
- 1-[2-(3-хлор-4- циклогексилфенил) циклопропил]метилпиперидин (пример 60);
- 1-[2-(3-хлор-4-циклогексилфенил) циклопропил] метил-4-фенил-1,2,3,6-тетрагидропиридин (пример 61);
- 1-[2-(3-хлор-4- циклогексилфенил) циклопропил]метил-4-фенил-пиперидин (пример 62);
- 1-[2-(3-хлор-4-циклогексилфенил)циклопропил]метил-4-бензил- пиперидин (пример 63);
- 1-[2-(3-хлор-4-циклогексилфенил) циклопропил] метил-4-(2-фенилэтил)пиперидин (пример 64);
- 3-[2- (3-хлор-4-циклогексилфенил)циклопропил]метил-3- азаспиро[5.5]ундекан (пример 65).
Пример 66
N-Циклогексил-N-этил-2-(3-хлор-4- циклогексилфенил)циклопропанкарбоксамид
а) К раствору 3,4 г (12,2 ммоль) 2-(3-хлор-4-циклогексилфенил) циклопропанкарбоновой
кислоты и 1,25 г (12,3 ммоль)
триэтиламина в 50 мл диоксана, охлажденному до температуры - 5oC, добавляют 1,34 г (12,3 ммоль) этилхлорформиата, выдерживают при этой внутренней температуре в
течение 20 минут при
перемешивании, затем оставляют стоять для повышения температуры до комнатной, отфильтровывают триэтиламингидрохлорид и используют раствор таким образом полученного смешанного
ангидрида
2-(3-хлор-4-циклогексилфенил)циклопропанкарбоновой кислоты с моноэтиловым эфиром карбоновой кислоты.
К таким образом полученному раствору смешанного ангидрида добавляют раствор 1,56 г циклогексилэтиламина в 30 мл тетрагидрофурана и реакционную смесь перемешивают в течение 8 часов при комнатной температуре. Затем раствор промывают водой, сушат его и растворитель выпаривают. Таким образом получают N-циклогексил-N-этил-2-(3-хлор-4-циклогексилфенил) циклопропанкарбоксамид.
Реферат
Изобретение относится к медицине и касается применения цис-N-циклогексил-N-этил-[-3-(3-хлор-4-циклогексилфенил)- аллил]амина, или его фармацевтически приемлемой соли, или сольвата для получения фармкомпозиции для лечения заболеваний, вызванных пролиферацией опухолевых или раковых клеток, а также фармкомпозиции, предназначенной для лечения указанных заболеваний. Указанная композиция обладает повышенной антиопухолевой активностью. 2 с. и 4 з.п. ф-лы, 2 ил., 4 табл.


Комментарии