Применение соединений, связывающихся с лигандами сигма-рецептора, для лечения развития невропатической боли вследствие химиотерапии - RU2537226C2
Код документа: RU2537226C2
Чертежи

Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к применению соединений, связывающихся с сигма-рецептором, для лечения или предупреждения невропатической боли, возникающей в результате химиотерапии.
УРОВЕНЬ ТЕХНИКИ
Лечение состояний боли имеет большое значение в медицине. В настоящее время во всем мире существует необходимость в дополнительной противоболевой терапии. Неотложная потребность в специфичном лечении состояний боли подтверждается в большом количестве научных работ, которые появились в последнее время в области применяемых анальгезирующих средств.
Боль согласно Международной ассоциации по изучению боли (IASP) определяют как «неприятное чувствительное и эмоциональное ощущение, ассоциированное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 210). Хотя боль всегда субъективна, ее причины или синдромы можно классифицировать. Наиболее подходящими подтипами боли, обсуждаемыми в настоящем изобретении, являются невропатическая боль, аллодиния, гипералгезия и особенно периферическая невропатия.
С другой стороны, злокачественная опухоль и ассоциированные с ней способы терапии составляют одну из самых больших проблем здравоохранения во всем мире. Химиотерапия в сочетании или в качестве альтернативы хирургии в большинстве случаев является предпочтительным способом борьбы или оказания помощи пациентам, пораженным карциномами.
Химиотерапию определяют как применение химических веществ для лечения заболевания и согласно настоящему изобретению химиотерапия, главным образом, относится к применению цитотоксических лекарственных средств, называемых химиотерапевтическими средствами, для лечения злокачественной опухоли. Химиотерапия при лечении злокачественной опухоли заключается в персонализированном сочетании эффективных химиотерапевтических средств, предназначенных для замедления быстрого роста злокачественной опухоли, сокращения опухолей, уничтожения злокачественных клеток и предотвращения роста злокачественной опухоли. Химиотерапевтические средства предотвращают репликацию клеток типичным неконтролируемым образом, которым делятся злокачественные клетки.
Периферическая нейротоксичность является клинически важным осложнением химиотерапии злокачественной опухоли. В случае нескольких наиболее эффективных лекарственных средств (например, таксанов, алкалоидов барвинка, цисплатина, бортезомиба, талидомида и ленолидамида) нейротоксичность является ограничивающим дозу фактором и иногда вынуждает прекратить успешную во всем остальном терапию (Polomano and Bennett, 2001; Park et al., 2008). Так как такие лекарственные средства являются предпочтительными для лечения множества гематологических злокачественных новообразований и солидных опухолей, то сотни тысяч пациентов поражаются каждый год. Сенсорные аномалии в результате вызываемой антинеопластическими средствами нейротоксичности находятся в диапазоне от умеренной парестезии или дизестезии у многих пациентов, и у некоторых до хронической периферической невропатии (Quasthoff and Hartung, 2002). Возникновение и тяжесть невропатии зависит от интенсивности однократной дозы, продолжительности лечения, суммарной дозы, предшествующего или одновременного лечения другими невропатическими лекарственными средствами и одновременно существующими состояниями, такими как диабет и злоупотребление алкоголем (Alberts et al., 1995; Postma et al., 1995; Forsyth et al., 1997; Quasthoff and Hartung, 2002). В данной области известно, что невропатическая боль, аллодиния, гипералгезия и особенно периферическая невропатия развиваются в значительном количестве случаев в результате химиотерапии. Существуют очень специфичные симптомы, возникающие в результате нейротоксичности химиотерапевтического лекарственного средства. Лечение таких симптомов является ключевым для сохранения качества жизни страдающих заболеванием пациентов (Mielke et al., 2006; Park et al., 2008; Argyriou et al., 2008). К сожалению, эффективное лечение индуцированной химиотерапией периферической невропатии еще не найдено (Wolf et al., 2008).
Таким образом, целью настоящего изобретения является достижение новой формы лечения невропатической боли, аллодинии, гипералгезии и особенно периферической невропатии, развивающихся вследствие химиотерапии.
Настоящее изобретение неожиданно демонстрирует, что введение соединения, связывающегося с сигма-рецептором, является высокоэффективным для лечения невропатической боли, аллодинии или гипералгезии, развивающихся после химиотерапия. Такое преимущество изобретения является более явным особенно тогда, когда сигма-лиганд является антагонистом сигма-рецептора в форме (нейтрального) антагониста, обратного агониста или частичного антагониста. Еще более неожиданно настоящее изобретение демонстрирует, что совместное введение сигма-лиганда и химиотерапевтического лекарственного средства предотвращает появление боли, часто ассоциированной с химиотерапией.
Настоящее изобретение относится к применению соединения, связывающегося с сигма-рецептором, для получения лекарственного средства для лечения боли, развивающейся вследствие химиотерапии. Настоящее изобретение также относится к применению соединения, связывающегося с сигма-рецептором для получения лекарственного средства для профилактики или лечения боли, развивающейся вследствие химиотерапии. Предпочтительно боль, подвергаемая лечению, представляет собой невропатическую боль, аллодинию или гипералгезию. Более предпочтительно, боль, подвергаемая лечению, представляет собой периферическую невропатическую боль, аллодинию, каузальгию, гипералгезию, гиперестезию, гиперпатию, невралгию, неврит или невропатию.
В одном предпочтительном варианте осуществления изобретения соединение, связывающееся с сигма-рецептором, применяют для профилактики развития боли, развивающейся вследствие химиотерапии.
В другом предпочтительном варианте осуществления изобретения соединение, связывающееся с сигма-рецептором, применяют для лечения боли, развивающейся вследствие химиотерапии.
«Химиотерапия» в используемом в настоящем изобретении смысле определяют как применение химиотерапевтического лекарственного средства для лечения рака, опухолей или злокачественной неоплазии.
«Развивающаяся вследствие химиотерапии» согласно настоящему изобретению определяют как: a) развивающаяся после или вначале химиотерапии и b) следовательно, имеющая место в то же самое время или следующая после применения химиотерапевтического лекарственного средства. Таким образом, симптом, подвергаемый лечению, вероятно, вызван или является следствием токсичности, цитотоксичности или особенно периферической нейротоксичности химиотерапевтического лекарственного средства.
«Химиотерапевтические лекарственные средства» в используемом в настоящем изобретении смысле представляют собой соединения, применяемые в химиотерапии, особенно такие средства, которые нарушают митоз (деление клеток) в результате эффективного целенаправленного воздействия на быстро делящиеся клетки. Так как такие лекарственные средства вызывают повреждение клеток, их называют цитотоксичными. Некоторые лекарственные средства являются причиной того, что клетки подвергаются апоптозу (так называемому «клеточному суициду»). Предпочтительными химиотерапевтическими лекарственными средствами согласно настоящему изобретению являются лекарственные средства, полученные на основе платины, в частности производные платины цисплатин, карбоплатин и оксалиплатин; растительные алкалоиды и терпены (терпеноиды). Другими предпочтительными химиотерапевтическими лекарственными средствами согласно настоящему изобретению являются бортезомиб, талидомид и его производные, особенно ленолидамид.
«Растительные алкалоиды» (и терпеноиды) представляют собой алкалоиды, полученные из растений, которые блокируют деление клеток в результате предотвращения функционирования микротрубочек. Такие микротрубочки необходимы для клеточного деления, и ингибирование также задерживает митоз клеток. Основными примерами растительных алкалоидов являются алкалоиды барвинка и таксаны.
«Алкалоиды барвинка» связываются с конкретными участками на тубулине, ингибируя сборку тубулина в микротрубочки (M-фаза клеточного цикла). Их получают из мадагаскарского барвинка, Catharanthus roseus (ранее известного как Vinca rosea). Алкалоиды барвинка включают винкристин, винбластин, винорелбин и виндезин.
«Таксаны» получают из тиса тихого, Taxus brevifolia. Таксаны повышают стабильность микротрубочек, предотвращая расхождение хромосом во время анафазы. К таксанам относятся паклитаксел и доцетаксел.
Примерами химиотерапевтических лекарственных средств (по их товарным знакам), включая паклитаксел (Taxol®), иресса, гефинтиниб и ксиотакс, являются:
13-цис-ретиноевая кислота, 2-CdA, 2-хлорлезоксиаденозин, 5-фторурацил 5-FU, 6-меркаптопурин, 6-MP, 6-TG 6-тиогуанин, абраксан, аккутан®, актиномицин-D, адриамицин®, адруцил®, агрилин®, Ала-корт®, алдеслейкин, алемтузумаб, ALIMTA, алитретиноин, алкабан-AQ®, алкеран®, полностью трансретиноевая кислота, альфа-интерферон, алтретамин, аметоптерин, амифостин, аминоглутетимид, анагрелид, анандрон®, анастрозол, арабинозилцитозин, Ara-C, аранесп®, аредиа®, аримидекс®, аромазин®, арранон®, трехокись мышьяка, аспрагиназа, ATRA, авастин®, азацитидин, BCG, BCNU, бевацизумаб, бексаротен, BEXXAR®, бикалутамид, BiCNU, бленоксан®, блеомицин, бортезомиб, бусульфан, бусульфекс®, C225, лейковорин кальция, кампат®, камптосар®, камптотецин-11, капецитабин, каракTM, карбоплатин, кармустин, пластинки кармустина, казодекс®, CC-5013, CCNU (o), CDDP (t), CeeNU (t), церубидин (t), цетуксимаб, хлорамбуцил, цисплатин, цитроворум-фактор, кладрибин, кортизон, космеген (t), CPT-11 (o), циклофосфамид, цитадрен (t), цитарабин, цитарабин в липосомной форме, цитосар-U (t), цитоксан®, дакарбазин, дактиномицин, дарбепоэтин альфа, даномицин, даунорубицин, гидрохлорид даунорубицина (t), даунорубифин в липосомной форме, дауноксом (t), декадрон, дельта-кортеф (t), дельтазон (t), денилейкин, дифтитокс, депоцит (t), дексаметазон, ацетат дексаметазона, фосфат дексаметазона натрия, дексазон (t), дексразоксан, DHAD (o), DIC (t), диодекс (t), доцетаксел, доксил (t), доксорубицин, доксорубицин в липосомной форме, дроксиа (t), DTIC, DTIC-Dome (t), дуралон (t), эфудекс (t), элигард (t), элленце (t), элоксатин (t), элспар (t), эмцит (t), эпирубицин, эпоэтин альфа, эрбитукс, эрлотиниб, L-аспарагиназа Erwinia (t), эстрамустин, этиол, этопофос (t), этопозид, этопозид фосфат (t), эулексин (t), эвиста (t), эксеместан, фарестон (t), фаслодекс (t), фемара (R), филграстим, флоксуридин, флудара (t), флударабин, флуороплекс (t), флуороурацил, флуороурацил (крем), флуоксиместерон, флутамид, фолиновая кислота (o), FUDR (t), фулвестрант, G-CSF (t), гефитиниб, гемцитабин, гемтузумаб озогамицин, гемзар (t), гливекTM, глиадел в пластинках (t), GM-CSF (o), гозерелин, колониестимулирующий фактор гранулоцитов (t), колониестимулирующий фактор гранулоцитов и макрофагов (o), галотестин (t), герцептин (t), гексадрол (t), гексален (t), гексаметилмеламин (t), HMM (t), гикамтин (t), гидреа (t), ацетат гидрокорта (t), гидрокортизон, фосфат гидрокортизона натрия, сукцинат гидрокортизона натрия, фосфат гидрокортона (t), гидроксимочевина, ибритумомаб, ибритумомаб тиуксетан, идамицин®, идарубицин ифекс®, IFN-альфа, ифосфамид, IL-11, IL-2, иматиниб мезилат, имидазол карбоксамид, интерферон альфа, интерферон альфа-2b (ПЭГ-конъюгат) (o), интерлейкин-2 (t), интерлейкин-11 (o), интрон A® (интерферон альфа-2b), иресса®, иринотекан, изотретиноин, кидролаза (t), ланакорт (t), L-аспарагиназа (t), LCR (o), леналидомид (ленолидамид), летрозол, лейковорин, лейкеран (t), лейкин (t), лейпролид, лейкокристин (o), лейстатин (t), липосомный Ara-C (t), Liquid Pred (t), ломустин, L-PAM (o), L-сарколизин (o), лупрон (t), лупрон депо (t), матулан (t), максидекс (t), мехлорэтамин, гидрохлорид мехлорэтамина, медралон (t), медрол®, мегейс (t), мегестрол, ацетат мегестрола (o), мелфалан, меркаптопурин, месна, меснекс (t), метотрексат, метотрексат натрия (o), метилпреднизолон, метикортен (t), митомицин, митомицин-C (o), митоксантрон, M-преднизол (t), MTC (o), MTX (o), мустарген (t), мустин, мутамицин (t), милеран (t), милоцел (t), милотарг (t), навелбин (t), неларабин, неосар (t), нейласта (t), неймега (t), нейпоген (t), нексавар®, ниландрон (t), нилутамид, нипент®, азотистый иприт (o), новалдекс (t), новантрон (t), октреотид, ацетат октреотида (o), онкоспар (t), онковин (t), онтак (t), онксал (t), опревелкин, орапред (t), оразон (t), оксалиплатин, паклитаксел, паклитаксел, связанный с белком, памидронат, панретин (t), параплатин (t), педиапред (t), ПЭГ-интерферон, пегаспаргаза, пегфилграстим, ПЭГ-интрон (t), ПЭГ-L-аспарагиназа, пеметрексед, пентостатин, фенилаланиновый иприт (o), платинол (t), платинол-AQ (t), преднизолон, преднизон, прелон (t), прокарбазин, прокрит®, пролейкин (t), имплантат пролифепроспан 20 с кармустином (t), пуринетол (t), ралоксифен, ревлимид®, ревматрекс (t), ритуксан (t), ритуксимаб, роферон-A®, (интерферон альфа-2a) рубекс (t), гидрохлорид рубидомицина (t), сандостатин®, сандостатин LAR (t), сарграмостим, солукортеф (t), солу-медрол (t), сорафениб, STI-571, стрептозоцин, SU11248, сунитиниб, сутент®, тамоксифен, тарцева®, таргретин (t), таксол®), таксотере (t), темодар®, темозоломид, тенипозид, теспа (o), талидомид, таломид®, тера-цис (t), тиогуанин, тиогуанин таблетированный (t), тиофосфамид (o), тиоплекс (t), тиотепа, TICE (R), топосар (t), топотекан, торемифен, тозитумомаб, трастузумаб, третиноин, трексалл (t), трисенокс (t), TSPA (o), VCR (o), велбан (t), велкаде (R), вепезид (t), весаноид (t), виадур (t), видаза (t), винбластин, винбластин сульфат (o), винкасар Pfs (t), винкристин, винорелбин, винорелбин тартрат (o), VLB (o), VM-26 (o), VP-16 (t), вумон (t), кселода®, ксиотакс, заносар (t), зевалинTM, зинекард (t), золадекс®, золедроновая кислота и зомета®.
Другими лекарственными средствами, применяемыми в терапии злокачественных опухолей (главным образом, в качестве химиотерапевтических средств), являются:
(как товарные знаки): алдара, алимта, андрокур, аримидекс, бореа, каеликс, кампто, казодекс, декапептил, элоксатин, эутирокс, фаслодекс, фемара, гемзар, гонапептил, грисетин, герцептин, изоворин, лизодрен, мегефрен, метвикс, навелбин, новалдекс, новантрон, параплатин, прокрин, простакур, супрефакт, тамоксифен фанк, таксол, таксотер, тестекс, элму/пролонгатум, томудекс, утефос, вепезид, кселода, золадекс;
(в виде активных соединений): анастрозол, бикалутамид, бусерелин, капецетабин, цисплатин, карбоплатин, дезоксорубицин, доцетаксел, этопозид, фулвестрант, гемцитабин, госерелин, иринотекан, летрозол, лейпрорелин, мегестрол, митотан, митоксантрон, оксалиплатин, паклитаксел, пеметрексед, ралтитрексед, тамоксифен, тегафур, трипторелин, винкристин, винбластин, винорелбин и виндезин.
Паклитаксел (таксол®) является одним из наиболее эффективных и широко применяемых антинеопластических лекарственных средств для лечения солидных опухолей. Он имеет два опасных побочных эффекта, миелосупрессию и периферическую нейротоксичность. Колониестимулирующий фактор гранулоцитов эффективно противодействует нейтропении у большинства пациентов. Однако не существует приемлемых терапевтических средств для предотвращения или минимизации повреждения нервов, что делает нейротоксичность важным ограничивающим дозу побочным эффектом (Rowinsky et al., 1993a,b; Wasserheit et al., 1996; Gordon et al., 1997; Mielke et al., 2006). Индуцированная паклитакселом нейротоксичность обычно проявляется в виде сенсорной невропатии с наиболее распространенными жалобами на онемение, покалывание, жгучую боль и холодовую аллодинию (Rowinsky et al., 1993a; Chaudhry et al., 1994; Forsyth et al., 1997; Dougherty et al., 2004). Сенсорные симптомы обычно начинаются симметрично в ногах, но иногда появляются одновременно в обеих руках и ногах (Rowinsky et al., 1993a; Quasthoff и Hartung, 2002; Mielke et al., 2006). Клинически значимое количество пациентов с индуцированной паклитакселом невропатией испытывают невропатическую боль. Например, в исследовании 27 пациентов, которых лечили дозами паклитаксела 135, 175 и 250-300 мг/м2, невропатические симптомы имели место у 50, 79 и 100% пациентов, прогрессируя до ограничивающей дозу нейротоксичности у 0, 21 и 71% пациентов, соответственно (Postma et al., 1995).
«Невропатическую боль» определяют согласно IASP как «боль, вызванную или обусловленную первичным повреждением или дисфункцией в нервной системе» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 210). В целях настоящего изобретения указанный термин следует трактовать как синоним «нейрогенной боли», которую определяют согласно IASP как «боль, вызванную или обусловленную первичным повреждением, дисфункцией или преходящим расстройством в периферической или центральной нервной системе». Невропатическая боль согласно настоящему изобретению ограничена невропатической болью в результате химиотерапии, что означает боль, вызванную в результате применения химиотерапевтического средства в химиотерапии. Наиболее вероятной причиной такой боли является нейротоксичность химиотерапевтического средства, и более конкретно, его периферическая нейротоксичность.
Согласно IASP «аллодинию» определяют как «боль вследствие воздействия раздражителя, который обычно не вызывает боли» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 210).
Согласно IASP «периферическую невропатическую боль» определяют как «боль, вызванную или обусловленную первичным повреждением или дисфункцией в периферической нервной системе» и «периферическую нейрогенную боль» определяют как «боль, вызванную или обусловленную первичным повреждением, дисфункцией или преходящим расстройством в периферической нервной системе» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 213).
Согласно IASP «каузалгию» определяют как «синдром длительной жгучей боли, аллодинии и гиперпатии после травматического повреждения нерва, часто в сочетании с вазомоторной и судомоторной дисфункцией и последующими трофическими изменениями» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 210).
Согласно IASP «гипералгезию» определяют как «повышенную реакцию на раздражитель, который обычно вызывает боль» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 211).
Согласно IASP «гиперестезию» определяют как «повышенную чувствительность к раздражениям, за исключением специфических чувств» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 211).
Согласно IASP «гиперпатию» определяют как «болевой синдром, характеризуемый необычно болезненной реакцией на раздражение, особенно повторяющееся раздражение, а также повышенным порогом» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212).
IASP определяет следующие различия между «аллодинией», «гипералгезией» и «гиперпатией» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212):
Согласно IASP «невралгию» определяют как «боль в области иннервации одного или нескольких нервов» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212).
Согласно IASP «неврит» определяют как «воспаление одного или нескольких нервов» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212).
Согласно IASP «невропатию/неврит» определяют как «нарушение функции или патологическое изменение в нерве: в одном нерве - мононевропатия, в нескольких нервах - множественная невропатия, в случае диффузного и двухстороннего поражения - полиневропатия» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212).
Термин «сигма-рецептор/рецепторы», используемый в настоящей заявке, хорошо известен и определен с использованием следующей цитаты: «такой сайт связывания представляет собой типичный белок, отличный от рецепторов опиоидов, NMDA, допаминергических рецепторов и других известных семейств рецепторов нейромедиаторов или гормонов» (G. Ronsisvalle et al. Pure Appl. Chem. 73, 1499-1509 (2001)). Фармакологические данные, основанные на исследованиях связывания лигандов, анатомического распределения и биохимических свойств, выявили, по меньшей мере, два подтипа δ-рецепторов (R. Quiron et al., Trends Pharmacol. Sci. 13, 85-86 (1992); M.L. Leitner, Eur. J. Pharmacol. 259, 65-69 (1994); S.B. Hellewell and W.D. Bowen; Brain Res. 527, 244-253 (1990)) (G. Ronsisvalle et al. Pure Appl. Chem. 73, 1499-1509 (2001)). Белковые последовательности сигма-рецепторов (сигма 1 (δ1) и сигма 2 (δ2)) известны в данной области (например, Prasad, P.D. et al., J. Neurochem. 70 (2), 443-451 (1998)). Они проявляют очень высокую аффинность к различным анальгетикам (например, пентазоцину).
«Соединение/соединения, связывающиеся с сигма-рецептором» или «сигма-лиганд» в используемом в настоящей заявке смысле определяют как соединение, имеющее значение IC50 ≤5000 нМ, более предпочтительно ≤1000 нМ, более предпочтительно ≤500 нМ по отношению к сигма-рецептору. Более предпочтительно значение IC50 составляет ≤250 нМ. Более предпочтительно значение IC50 составляет ≤100 нМ. Более предпочтительно значение IC50 составляет ≤50 нМ. Кроме того, выражение «соединение/соединения, связывающиеся с сигма-рецептором» в используемом в настоящей заявке смысле определяют как соединение, которое дает, по меньшей мере, ≥50% вытеснение при использовании 10 нМ радиолиганда, специфичного к сигма-рецептору (например, предпочтительно [3H]-(+)пентазоцина), при этом сигма-рецептор может относиться к любому подтипу сигма-рецепторов. Предпочтительно указанные соединения связываются с подтипом рецепторов сигма-1. Соединения, связывающиеся с сигма-рецептором, обычно также называемые сигма-лигандами, хорошо известны в данной области. Многие из них входят в объем приведенного выше определения термина «соединение/соединения, связывающиеся с сигма-рецептором». Хотя известно много применений сигма-лигандов, таких как применения в качестве антипсихотических средств, анксиолитиков, антидепрессантов, средств для лечения инсульта, антиэпилептических средств и средств для лечения многих других показаний, включая средства против мигрени и общей боли, в данной области нет упоминаний о таких соединениях как применимых для лечения симптомов боли, развивающейся вследствие химиотерапии.
В таблице 1 перечислены некоторые сигма-лиганды, известные в данной области (например, имеющие IC50 ≤5000 нМ). Некоторые из таких соединений могут связываться с рецептором сигма-1 и/или сигма-2. Такие сигма-лиганды также включают их соответствующие соли, основания и кислоты.
Предпочтительно в указанную выше таблицу также включен восстановленный галоперидол. Восстановленный галоперидол является активным метаболитом галоперидола, который образуется у людей, проявляет высокую аффинность (в низком наномолярном диапазоне) по отношению к рецепторам сигма-1 и вызывает необратимую блокаду рецепторов сигма-1 и у экспериментальных животных, и в клетках человека.
В таблице 2 перечислены некоторые сигма-лиганды, известные в данной области (т.е. имеющие IC50 ≤250 нМ), которые проявляют аффинность к сигма-рецептору более высокую, чем соединения, перечисленные в таблице 1. Некоторые из таких соединений могут связываться с рецептором сигма-1 и/или сигма-2. Такие сигма-лиганды также включают их соответствующие соли основания и кислоты.
Предпочтительно в указанную выше таблицу также включен восстановленный галоперидол. Восстановленный галоперидол является активным метаболитом галоперидола, который образуется у людей, проявляет высокую аффинность (в низком наномолярном диапазоне) по отношению к рецепторам сигма-1 и вызывает необратимую блокаду рецепторов сигма-1 и у экспериментальных животных, и в клетках человека.
Примеры хорошо известных способов получения пролекарства данного действующего соединения известны специалистам в данной области (например, в Krogsgaard-Larsen et al., Textbook of Drugdesign and Discovery, Taylor and Francis (April 2002)).
В настоящей заявке «примерно» означает «приблизительно», и иллюстративно использование термина «примерно» показывает, что дозы, незначительно выходящие за указанные пределы, также могут быть эффективными и безопасными, и такие дозы также входят в объем настоящей формулы изобретения.
Соединения, которые «вводят вместе с соединениями, связывающимися с сигма-рецептором» или «в сочетании с соединениями, связывающимися с сигма-рецептором», можно вводить в виде части одной и той же композиции или можно вводить отдельно в то же самое время или в другое время в одной и той же терапевтической схеме.
В связи с настоящим изобретением «нейтральная форма» относится либо к неионогенной форме, либо к форме с нейтральным результирующим зарядом, например цвиттер-иону в его изоэлектрической точке.
Термин «соль» согласно настоящему изобретению следует понимать как термин, означающий любую форму активного соединения согласно изобретению, в которой данное соединение принимает ионную форму или заряжено, и, если это возможно, также связана с противоионом (катион или анион). Под термином «соль» также следует понимать комплексы активного соединения с другими молекулами и ионами и, в частности, комплексы, которые образованы посредством ионных взаимодействий. Предпочтительные примеры солей включают соли, образованные ионами или молекулами ацетата, монотрифторацетата, сложного ацетатного эфира, цитрата, формиата, пикрата, гидробромида, моногидробромида, моногидрохлорида или гидрохлорида.
Термин «физиологически приемлемая соль» в контексте настоящего изобретения понимают как термин, означающий соль, по меньшей мере, одного из соединений согласно изобретению, которая физиологически переносима человеком и/или млекопитающими.
Термин «сольват» согласно настоящему изобретению следует понимать как термин, означающий любую форму активного соединения согласно изобретению, которое имеет другую молекулу (наиболее вероятно полярный растворитель), связанную с ним в результате нековалентного связывания. Примеры сольватов включают гидраты и алкоголяты, например метанолат.
Термин «лечение» или «лечить» в контексте настоящего описания означает введение соединения или препарата согласно изобретению для предотвращения, ослабления или исключения одного или нескольких симптомов, ассоциированных с невропатической болью, гипералгезией и/или аллодинией.
Кроме того, термины «лечить» или «лечение» согласно нестоящему изобретению включает лечение симптомов невропатической боли, гипералгезии и/или аллодинии, предотвращение или профилактику симптомов невропатической боли, гипералгезии и/или аллодинии, а также предотвращение или профилактику причин симптомов невропатической боли, гипералгезии и/или аллодинии.
Согласно различным вариантам осуществления изобретения соединения, связывающиеся с сигма-рецептором, или фармацевтические композиции, содержащие такие соединения, могут быть введены в стандартной лекарственной форме интестинально, энтерально, парентерально или местно, перорально, подкожно, интраназально, путем ингаляции, посредством всасывания в ротовой полости, внутривенно, внутримышечно, чрескожно, внутрибрюшинно, ректально, внутривагинально, трансдермально, подъязычно, буккально, через слизистую оболочку в ротовой полости. Могут быть введены следующие дозированные формы: таблетки, капсулы, драже, рассасываемые таблетки, пластыри, пастилки, гели, пасты, капли, аэрозоли, пилюли, порошки, водные растворы, суспензии, эмульсии, гранулы, мази, кремы, суппозитории, высушенные вымораживанием инъекционные препараты, инъецируемые композиции, пищевые добавки, питательные батончики и пищевые брикеты, сиропы, напитки, растворы, кордиалы и т.д., которые могут быть в виде препарата для систематического применения, препарата длительного высвобождения, препарата контролируемого высвобождения и различных систем доставки микрогранул, пищевых добавок, питательных батончиков и пищевых брикетов, сиропов, напитков, растворов, кордиалов. В случае таблетки можно использовать различные носители, известные в данной области, например разбавитель и ресорбент, такой как крахмал, декстрин, сульфат кальция, каолин, микрокристаллическая целлюлоза, силикат алюминия и т.д., увлажнитель и вяжущие вещества, такие как вода, глицерин, полиэтиленгликоль, этанол, пропанол, крахмальный клейстер, декстрин, сироп, мед, раствор глюкозы, аравийская камедь, желатин, натрий-карбоксиметилцеллюлоза, шеллак, метилцеллюлоза, фосфат калия, поливинилпирролидон и т.д.; дезинтегрирующее средство, такое как обезвоженный крахмал, альгинат, порошкообразный агар, ламинаран, бикарбонат натрия и лимонная кислота, карбонат кальция, алифатический сложный эфир полиоксиэтиленсорбита, лаурилсульфат натрия, метилцеллюлоза, этилцеллюлоза, лактоза, сахароза, мальтоза, маннит, фруктоза, различные дисахариды и полисахариды и т.д.; средство, подавляющее дезинтеграцию, такое как сахароза, тристеарин, масло какао, гидрогенизированное масло и т.д.; ускоритель всасывания, такой как четвертичная аммониевая соль, лаурилсульфат натрия и т.д.; скользящее вещество, такое как тальк, диоксид кремния, кукурузный крахмал, стеарат, борная кислота, жидкий воск, полиэтилен и т.д. Кроме того, таблетка может быть приготовлена в виде таблетки, покрытой оболочкой, например покрытой сахаром таблетки, покрытой пленкой таблетки, таблетки с кишечнорастворимым покрытием или двухслойной таблетки и многослойной таблетки. А случае пилюли можно использовать различные носители, известные в данной области, например разбавитель и ресорбент, такой как глюкоза, лактоза, крахмал, масло какао, гидрогенизированное растительное масло, поливинилпирролидон, каолин, тальк и т.д.; вяжущие вещества, такие как аравийская камедь, камедь бассора, желатин, этанол, мед, жидкий сахар, рисовый клейстер или мучной клейстер и т.д.; дезинтегрирующие средство, такое как порошкообразный агар, обезвоженный крахмал, альгинат, лаурилсульфат натрия, метилцеллюлоза, этилцеллюлоза. В случае суппозитория можно использовать различные носители, известные в данной области, например полиэтилен, лецитин, масло какао, высшие спирты, сложные эфиры высших спиртов, желатин, полусинтетический глицерид и т.д. В случае капсулы она может быть приготовлена смешиванием указанного соединения, связывающегося с сигма-рецептором, в качестве активного ингредиента с указанными выше носителями с последующим помещением смеси в твердую желатиновую капсулу или мягкую капсулу. Также указанное соединение, связывающееся с сигма-рецептором, можно применять в следующей дозированной форму: микрокапсулы, суспензия в водной фазе, твердая капсула или инъекционный препарат. В случае инъекционного препарата, такого как раствор, эмульсия, высушенный вымораживанием препарат для инъекций и суспензия, можно использовать все разбавители, обычно применяемые в данной области, например воду, этанол, полиэтиленгликоль, пропиленгликоль, оксиэтилированный изостеариловый спирт, полиоксидированный изостеариловый спирт, алифатический сложный эфир полиоксиэтиленсорбита и т.д. Кроме того, чтобы получить изотоничный препарат для инъекции, в такой препарат может быть добавлено соответствующее количество хлорида натрия, глюкозы или глицерина, а также обычный сорастворитель, буфер, средство для корректировки pH и т.д. Кроме того, в фармацевтический препарат при необходимости может быть добавлен краситель, антисептик, отдушка, корригенты, пищевой подсластитель.
В некоторых вариантах осуществления изобретения препарат или фармацевтическая композиция могут содержать активный ингредиент (соединение, связывающееся с сигма-рецептором), а также необязательно, по меньшей мере, одно вспомогательное вещество и/или добавку. В других вариантах осуществления настоящего изобретения препарат или фармацевтическая композиция необязательно может содержать один или несколько дополнительных активных ингредиентов.
В некоторых вариантах осуществления изобретения вспомогательное вещество и/или добавка могут быть специально выбраны из консервантов, эмульгаторов и/или носителей для парентерального применения. Выбор таких вспомогательных веществ и/или добавок и используемые количества зависят от фармацевтической композиции, которую необходимо применять. Примерами являются парентеральные препараты, такие как препараты для внутривенного, подкожного или внутримышечного применения, которые также можно применять другими путями введения.
В некоторых вариантах осуществления изобретения пути введения соединения, связывающегося с сигма-рецептором, включают внутримышечную инъекцию, внутривенную инъекцию, подкожную инъекцию, подъязычное, буккальное введение, через кожу с помощью пластыря, пероральное введение, имплантируемый осмотический насос, коллагеновые имплантаты, аэрозоли или суппозиторий.
В альтернативных вариантах осуществления изобретения соединения, связывающееся с сигма-рецептором, можно вводить по схеме одна, две, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать или более доз в сутки, отдельно или в сочетании с другими лекарственными средствами, в диапазоне периодов времени, включающем без ограничения периоды, составляющие один, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, шестнадцать, восемнадцать, двадцать, двадцать четыре, тридцать или более суток; или в течение периода времени, составляющего один, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, шестнадцать, восемнадцать, двадцать, двадцать четыре, тридцать, тридцать шесть, сорок восемь, шестьдесят, семьдесят два, восемьдесят четыре или более месяцев.
В некоторых вариантах осуществления настоящего изобретения эффективность курса лечения одной, двумя, тремя, четырьмя, пятью или большим количеством доз или в течение одних, двух или трех суток может быть увеличена примерно до пяти, десяти, пятнадцати, двадцати, двадцати пяти или тридцати. В других вариантах осуществления настоящего изобретения дозирование осуществляют только один раз каждый день или один раз каждые два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, шестнадцать, восемнадцать, двадцать, двадцать четыре, тридцать или более дней.
Согласно настоящему описанию доза соединения, связывающегося с сигма-рецептором, зависит от различных факторов, включая природу и тяжесть заболеваний, пол, возраст, массу и индивидуальную реакцию субъекта, конкретное применяемое соединение, путь и частоту введения и т.д. Указанные соединения, связывающиеся с сигма-рецептором, или фармацевтические композиции, содержащие такие соединения, можно вводить в виде однократной или в виде дробных дозированных форм, например от одной до четырех доз в сутки. Специалистам в данной области могут быть легко понятны и осуществлены изменения способов лечения, проиллюстрированных в настоящем описании, которые необходимы или желательны в соответствии с различными терапевтическими потребностями.
В высокопредпочтительном варианте осуществления изобретения невропатическая боль является периферической.
Согласно IASP «периферическую невропатическую боль» определяют как «боль, вызванную или обусловленную первичным повреждением или дисфункцией в периферической нервной системе» и «периферическую нейрогенную боль» определяют как «боль, вызванную или обусловленную первичным повреждением, дисфункцией или преходящим расстройством в периферической нервной системе» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 213).
В другом предпочтительном варианте осуществления настоящего изобретения невропатическая боль представляет собой аллодинию. Согласно IASP «аллодинию» определяют ««боль вследствие воздействия раздражителя, который обычно не вызывает боли» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 210).
В другом предпочтительном варианте осуществления настоящего изобретения невропатическая боль представляет собой каузальгию.
Согласно IASP «каузалгию» определяют как «синдром длительной жгучей боли, аллодинии и гиперпатии после травматического повреждения нерва, часто в сочетании с вазомоторной и судомоторной дисфункцией и последующими трофическими изменениями» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 210).
В другом предпочтительном варианте осуществления настоящего изобретения невропатическая боль представляет собой гипералгезию.
Согласно IASP «гипералгезию» определяют как «повышенную реакцию на раздражитель, который обычно вызывает боль» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 211).
В другом предпочтительном варианте осуществления настоящего изобретения невропатическая боль представляет собой гиперестезию.
Согласно IASP «гиперестезию» определяют как «повышенную чувствительность к раздражениям, за исключением специфических чувств» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 211).
В другом предпочтительном варианте осуществления настоящего изобретения невропатическая боль представляет собой гиперпатию.
Согласно IASP «гиперпатию» определяют как «болевой синдром, характеризуемый необычно болезненной реакцией на раздражение, особенно повторяющееся раздражение, а также повышенным порогом» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212).
IASP определяет следующие различия между «аллодинией», «гипералгезией» и «гиперпатией» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212):
В другом предпочтительном варианте осуществления настоящего изобретения невропатическая боль представляет собой невралгию.
Согласно IASP «невралгию» определяют как «боль в области иннервации одного или нескольких нервов» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212).
В другом предпочтительном варианте осуществления настоящего изобретения невропатическая боль представляет собой неврит.
Согласно IASP «неврит» определяют как «воспаление одного или нескольких нервов» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212).
В другом предпочтительном варианте осуществления настоящего изобретения невропатическая боль представляет собой невропатию/неврит.
Согласно IASP «невропатию» определяют как «нарушение функции или патологическое изменение в нерве: в одном нерве - мононевропатия, в нескольких нервах - множественная невропатия, в случае диффузного и двухстороннего поражения - полиневропатия» (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212).
В другом предпочтительном варианте осуществления настоящего изобретения невропатическая боль представляет собой орофациальную боль.
Другой аспект настоящего изобретения относится к применению соединения, связывающееся с сигма-рецептором, необязательно в форме его рацемата, чистых стереоизомеров, в частности энантиомеров или диастереомеров, или в форме смесей стереоизомеров, в частности энантиомеров или диастереомеров, в любом подходящем соотношении в смеси; в нейтральной форме, в форме кислоты или основания или в форме соли, особенно физиологически приемлемой соли, или в форме сольвата, в частности гидрата, для лечения аллодинии, развивающейся вследствие химиотерапии.
Другой аспект настоящего изобретения относится к применению соединения, связывающееся с сигма-рецептором, необязательно в форме его рацемата, чистых стереоизомеров, в частности энантиомеров или диастереомеров, или в форме смесей стереоизомеров, в частности энантиомеров или диастереомеров, в любом подходящем соотношении в смеси; в нейтральной форме, в форме кислоты или основания или в форме соли, особенно физиологически приемлемой соли, или в форме сольвата, в частности гидрата, для получения лекарственного средства для лечения гипералгезии, развивающейся вследствие химиотерапии.
В высокопредпочтительном варианте осуществления настоящего изобретения, по меньшей мере, одно химиотерапевтическое средство, используемое в химиотерапии, выбрано из производного платины, алкалоида барвинка или таксана. В другом высокопредпочтительном варианте осуществления настоящего изобретения, по меньшей мере, одно химиотерапевтическое средство, используемое в химиотерапии, выбрано из производного платины, алкалоида барвинка, таксана, бортезомиба, талидомида или их производных.
В высокопредпочтительном варианте осуществления настоящего изобретения, по меньшей мере, одно химиотерапевтическое средство, используемое в химиотерапии, выбрано из группы, состоящей из цисплатина, карбоплатина и оксалиплатина; винкристина, винбластина, винорелбина и виндезина; паклитаксела и доцетаксела. В другом высокопредпочтительном варианте осуществления настоящего изобретения, по меньшей мере, одно химиотерапевтическое средство, используемое в химиотерапии, выбрано из группы, состоящей из цисплатина, карбоплатина и оксалиплатина; винкристина, винбластина, винорелбина и виндезина; паклитаксела и доцетаксела; бортезомиба; талидомида и ленолидамида.
Предпочтительно, по меньшей мере, одним химиотерапевтическим средством, используемым в химиотерапии, является цисплатин.
Предпочтительно, по меньшей мере, одним химиотерапевтическим средством, используемым в химиотерапии, является карбоплатин.
Предпочтительно, по меньшей мере, одним химиотерапевтическим средством, используемым в химиотерапии, является оксалиплатин.
Предпочтительно, по меньшей мере, одним химиотерапевтическим средством, используемым в химиотерапии, является винкристин.
Предпочтительно, по меньшей мере, одним химиотерапевтическим средством, используемым в химиотерапии, является винбластин.
Предпочтительно, по меньшей мере, одним химиотерапевтическим средством, используемым в химиотерапии, является винорелбин.
Предпочтительно, по меньшей мере, одним химиотерапевтическим средством, используемым в химиотерапии, является виндезин.
Предпочтительно, по меньшей мере, одним химиотерапевтическим средством, используемым в химиотерапии, является паклитаксел.
Предпочтительно, по меньшей мере, одним химиотерапевтическим средством, используемым в химиотерапии, является доцетаксел.
Предпочтительно, по меньшей мере, одним химиотерапевтическим средством, используемым в химиотерапии, является бортезомиб.
Предпочтительно, по меньшей мере, одним химиотерапевтическим средством, используемым в химиотерапии, является талидомид.
Предпочтительно, по меньшей мере, одним химиотерапевтическим средством, используемым в химиотерапии, является ленолидамид.
Настоящее изобретение также относится к способам лечения пациента или млекопитающего, включая человека, страдающего от невропатической боли, развивающейся вследствие химиотерапии, которые включают в себя применение соединения, связывающегося с сигма-рецептором, необязательно в форме его рацемата, чистых стереоизомеров, в частности энантиомеров или диастереомеров, или в форме смесей стереоизомеров, в частности энантиомеров или диастереомеров, в любом подходящем соотношении; в нейтральной форме, в форме кислоты или основания или в форме соли, особенно физиологически приемлемой соли, или в форме сольвата, в частности гидрата. Предпочтительный способ лечения согласно настоящему изобретению включает в себя применение соединения, связывающегося с сигма-рецептором, выбранного из соединений, перечисленных в таблицах 1 или 2, или упоминаемых в других местах настоящего описания, в случае пациента или млекопитающего, подвергающегося или который вскоре будет подвергнут химиотерапии. Также предпочтительным является случай, если способ лечения включает в себя применение, по меньшей мере, одного химиотерапевтического средства, выбранного из производного платины, алкалоида барвинка или таксана; особенно, если, по меньшей мере, одно химиотерапевтическое средство выбрано из группы, состоящей из цисплатина, карбоплатина и оксалиплатина; винкристина, винбластина, винорелбина и виндезина; и паклитаксела и доцетаксела. Также предпочтительным является случай, если способ лечения включает в себя применение, по меньшей мере, одного химиотерапевтического средства, выбранного из производного платины, алкалоида барвинка, таксана, бортезомиба, талидомида или их производных; особенно если, по меньшей мере, одно химиотерапевтическое средство выбрано из группы, состоящей из цисплатина, карбоплатина и оксалиплатина; винкристина, винбластина, винорелбина и виндезина; паклитаксела и доцетаксела; бортезомиба; талидомида и ленолидамида.
Способ лечения согласно настоящему изобретению также включает совместное введение химиотерапевтического лекарственного средства или лекарственных средств вместе или в сочетании с соединением, связывающимся с сигма-рецептором, по время химиотерапии. Такое совместное введение может быть осуществлено перед, во время или после химиотерапии. Совместное введение также может быть периодическим или непрерывным.
Другим высокопредпочтительным вариантом осуществления изобретения является лечение или профилактика боли, развивающейся вследствие химиотерапии, в котором соединение, связывающееся с сигма-рецептором, сочетают, по меньшей мере, с одним химиотерапевтическим лекарственным средством (B), образуя сочетание с фиксированной дозой активного вещества. Предпочтительно химиотерапевтическое лекарственное средство (B) в сочетании с активным веществом выбрано из производного платины, алкалоида барвинка или таксана, особенно если химиотерапевтическое лекарственное средство (B) выбрано из цисплатина, карбоплатина и оксалиплатина; винкристина, винбластина, винорелбина и виндезина; или паклитаксела и доцетаксела. Также предпочтительно, если химиотерапевтическое лекарственное средство (B) в сочетании с активным веществом выбрано из производного платины, алкалоида барвинка, таксана, бортезомиба, талидомида или его производных; особенно если химиотерапевтическое лекарственное средство (B) выбрано из цисплатина, карбоплатина и оксалиплатина; винкристина, винбластина, винорелбина и виндезина; паклитаксела и доцетаксела; бортезомиба или талидомида и ленолидамида.
Другой альтернативный вариант осуществления настоящего изобретения относится к набору, содержащему соединение, связывающееся с сигма-рецептором, необязательно в форме его рацемата, чистых стереоизомеров, в частности энантиомеров или диастереомеров, или в форме смесей стереоизомеров, в частности энантиомеров или диастереомеров, предпочтительно в любом подходящем соотношении; в нейтральной форме, в форме кислоты или основания или в форме соли, особенно физиологически приемлемой соли, или в форме сольвата, в частности гидрата.
Орофациальная область, лицо и рот, являются участками некоторых наиболее распространенных болей в организме. Эпидемиологические исследования показали высокую распространенность нескольких состояний орофациальной боли, таких как височно-нижнечелюстные расстройства (TMD), синдром жжения полости рта и зубные боли (Dworkin, 2001; Feinman and Newton-John, 2004; LeResche, 2001; Lipton et al., 2001). Многие трудности, которые испытывают клиницисты, пытаясь справиться с состояниями острой и хронической орофациальной боли, обусловлены отсутствием представления и понимания сложных факторов и взаимодействий при таких состояниях, неопределенностями этиологии или патогенеза многих состояний, а также отсутствием информации о сравнительной эффективности анальгетиков в отношении орофациальной боли.
Таким образом, предпочтительным аспектом настоящего изобретения является применение соединения, связывающегося с сигма-рецептором, необязательно в форме его рацемата, чистых стереоизомеров, в частности энантиомеров или диастереомеров, или в форме смесей стереоизомеров, в частности энантиомеров или диастереомеров, в любом подходящем соотношении; в нейтральной форме, в форме кислоты или основания или в форме соли, особенно физиологически приемлемой соли, или в форме сольвата, в частности гидрата, для лечения орофациальной боли, предпочтительно в форме невропатической боли, гипералгезии или аллодинии, более предпочтительно в форме невропатической боли, гипералгезии или аллодинии, развивающейся вследствие химиотерапии.
Все публикации, упоминаемые выше, включены в настоящее описание в виде ссылки в полном объеме.
Хотя указанное выше изобретение описано подробно в целях ясности и понимания, специалисту в данной области при чтении настоящего описания будет понятно, что могут быть осуществлены различные изменения формы и деталей, не выходя за рамки истинного объема изобретения и прилагаемой формулы изобретения.
Следующие далее примеры и чертежи являются только иллюстрациями некоторых вариантов осуществления изобретения, и их никоим образом нельзя рассматривать как ограничивающие изобретение.
ПРИМЕРЫ
Фармакологические эксперименты
Недавно разработаны модели индуцированной паклитакселом вызывающей боли невропатии у мышей и крыс. Такие модели показали, что многократное введение паклитаксела приводило к механической гипералгезии и аллодинии (Authier et al., 2000; Polomano et al., 2001; Dina et al., 2001 и 2004; Smith et al., 2004; Flatters and Bennett, 2004), холодовой аллодинии (Polomano et al., 2001; Smith et al., 2004; Flatters and Bennett, 2004) и в некоторых исследованиях к термической (тепловой) гипералгезии (Polomano et al., 2001; Dina et al., 2001; Flatters and Bennett, 2004); однако в других исследованиях не обнаружено такой термической гипералгезии (Authier et al., 2000; Smith et al., 2004). Тем не менее, индуцированная паклитакселом вызывающая боли невропатия у грызунов представляет собой интересную модель для тестирования эффектов лекарственных средств в случае индуцированной химиотерапией невропатической боли.
Чертежи:
Фиг.1: Протекание индуцированной паклитакселом холодовой аллодинии у мышей во времени. Животных лечили один раз в сутки с 1 по 5 день паклитакселом (2 мг/кг) или его наполнителем внутрибрюшинно. Продолжительность лизания/кусания задней лапы в ацетоновом тесте регистрировали за 3 дня до (PRE) и через несколько дней после первой инъекции паклитаксела или его наполнителя. Каждое животное тестировали только в одной ноцицептивной модели. Каждая точка и вертикальная линия указывают среднее ± S.E.M. значений, полученных, по меньшей мере, для 12 мышей. Статистически значимые различия между значениями в группах, обработанных паклитакселом и наполнителем: * p<0,05; ** p<0,01; и между значениями, полученными за день до обработки и через несколько дней после обработки: # p<0,05; ## p<0,01 (двухфакторный ANOVA для множественных измерений с последующим использованием критерия Ньюмана-Кеулса).
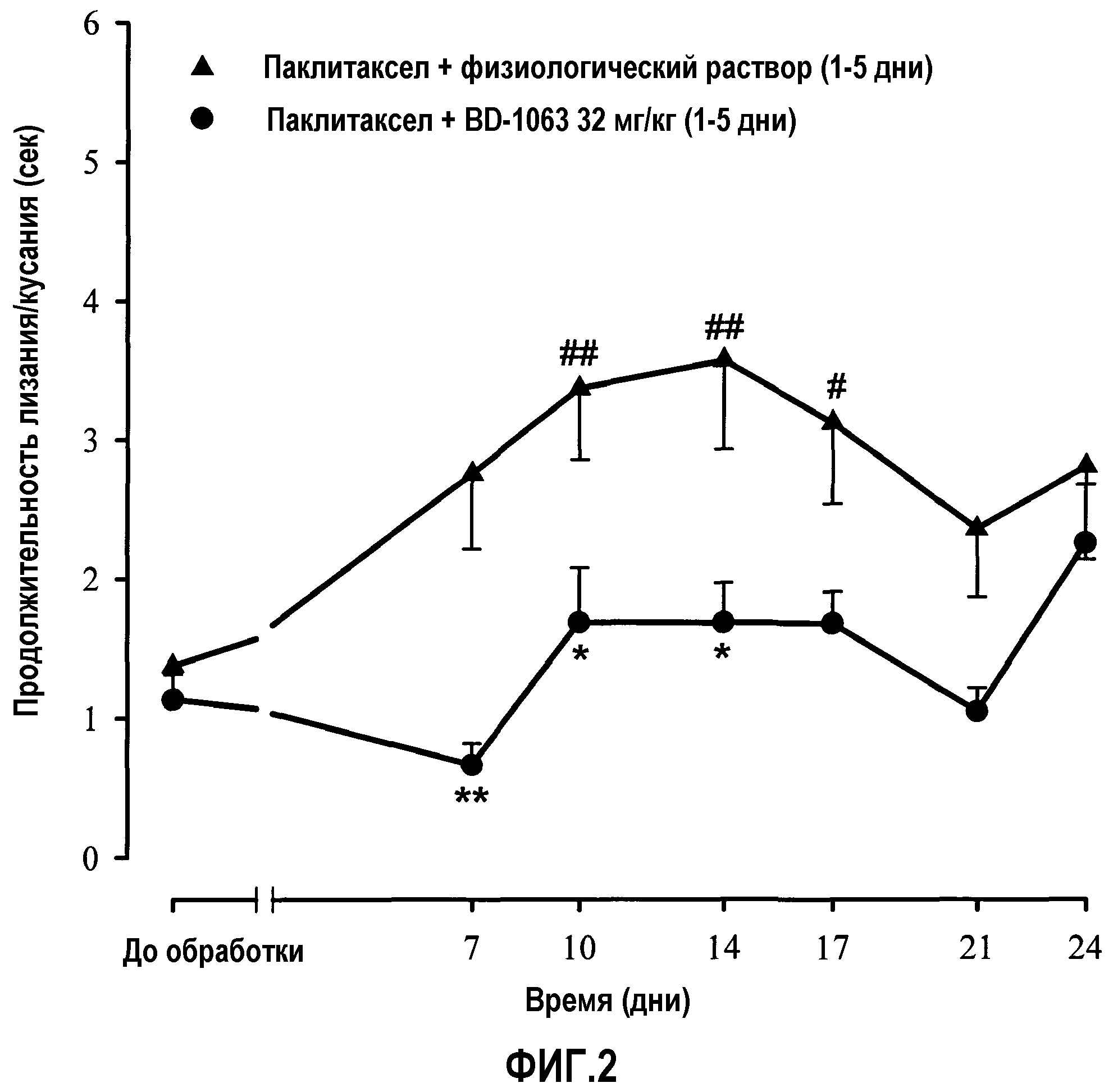
Фиг.2: Временная зависимость влияния совместного введения паклитаксела + BD-1063 (32 мг/кг) или паклитаксела + физиологический раствор на продолжительность лизания/кусания задней лапы в ацетоновом тесте. Мышей обрабатывали один раз в сутки с 1 по 5 день с использованием подкожной инъекции BD-1063 (32 мг/кг) или физиологического раствора за 30 минут до каждой внутрибрюшинной инъекции паклитаксела (2 мг/кг). Оцениваемую реакцию регистрировали у каждого животного за 3 дня до (PRE) и через несколько дней после первой инъекции паклитаксела + BD-1063 или паклитаксела + физиологический раствор. Каждая точка и вертикальная линия указывают среднее ± S.E.M. значений, полученных, по меньшей мере, для 16 животных. Статистически значимые различия по сравнению с паклитакселом + физиологический раствор: * p<0,05, ** p<0,01; и между значениями, полученными за день до обработки и через несколько дней после обработки: # p<0,05, ## p<0,01 (двухфакторный ANOVA для множественных измерений с последующим использованием критерия Ньюмана-Кеулса).
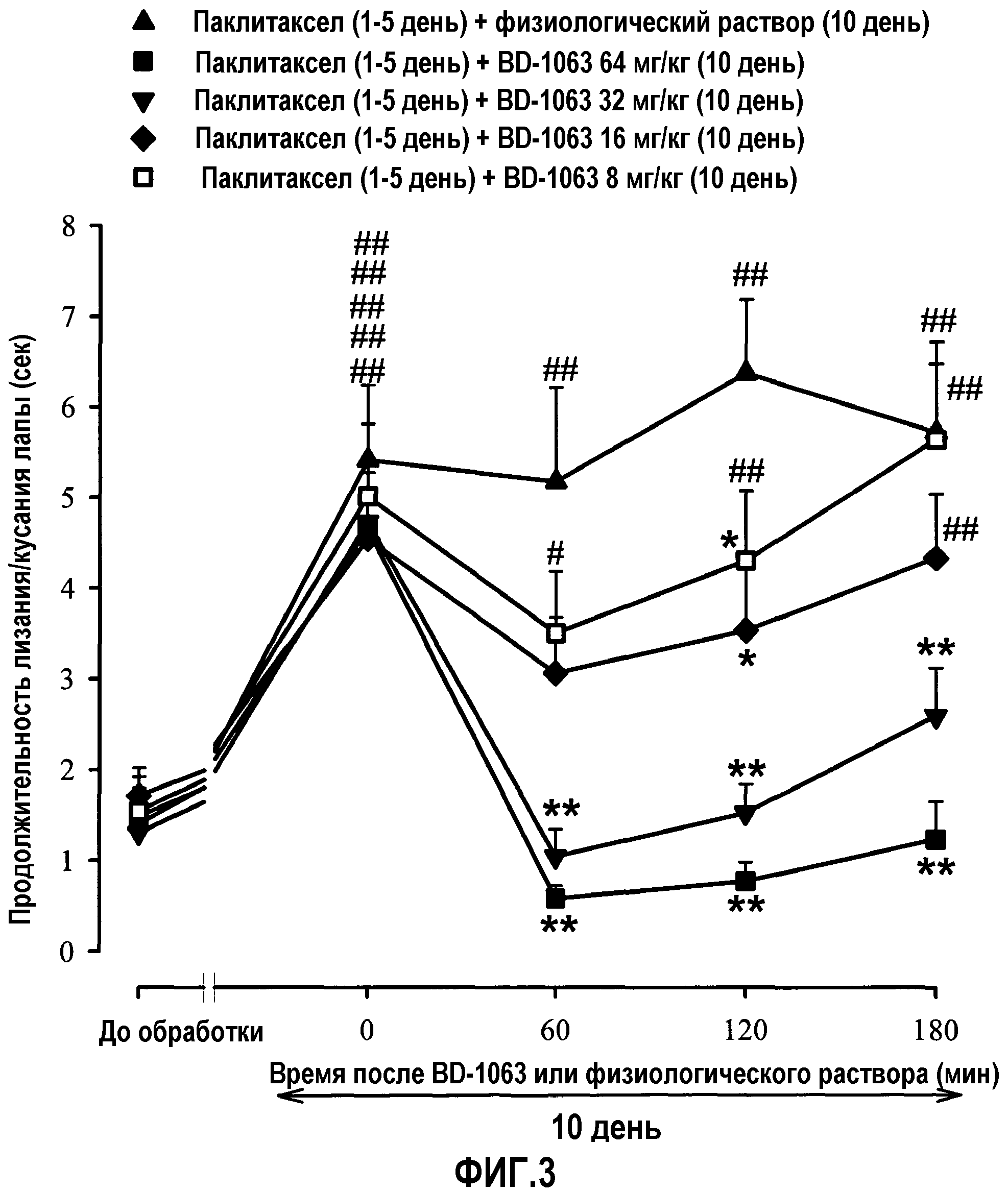
Фиг.3: Влияние однократной обработки несколькими дозами BD-1063 или физиологическим раствором на продолжительность лизания/кусания задней лапы (ацетоновый тест) на 10 день (день максимального эффекта) у мышей, предварительно обработанных паклитакселом. Животных обрабатывали один раз в сутки с 1 по 5 день паклитакселом или его наполнителем внутрибрюшинно, и на 10 день мыши получали однократную инъекцию BD-1063 (8, 16, 32 или 64 мг/кг) или физиологического раствора. Продолжительность лизания/кусания задней лапы регистрировали у каждого животного за 3 дня до (PRE) и через 10 дней после первой инъекции паклитаксела или его наполнителя. В указанный день продолжительность лизания/кусания задней лапы регистрировали непосредственно перед (время 0) и в нескольких временных точках (60, 120 и 180 мин) после инъекции BD-1063 или физиологического раствора. Каждое животное получало либо физиологический раствор, либо одну дозу BD-1063. Каждая точка и вертикальная линия указывают среднее ± S.E.M. значений, полученных, по меньшей мере, для 12 животных. Статистически значимые различия между группами, обработанными BD-1063 и физиологическим раствором в один и тот же день после обработки: * p<0,05; ** p<0,01; и между значениями, полученным в день перед обработкой и на 10 день в разных временных точках после введения лекарственного средства или физиологического раствора: # p<0,05; ## p<0,01 (двухфакторный ANOVA для множественных измерений с последующим использованием критерия Ньюмана-Кеулса).
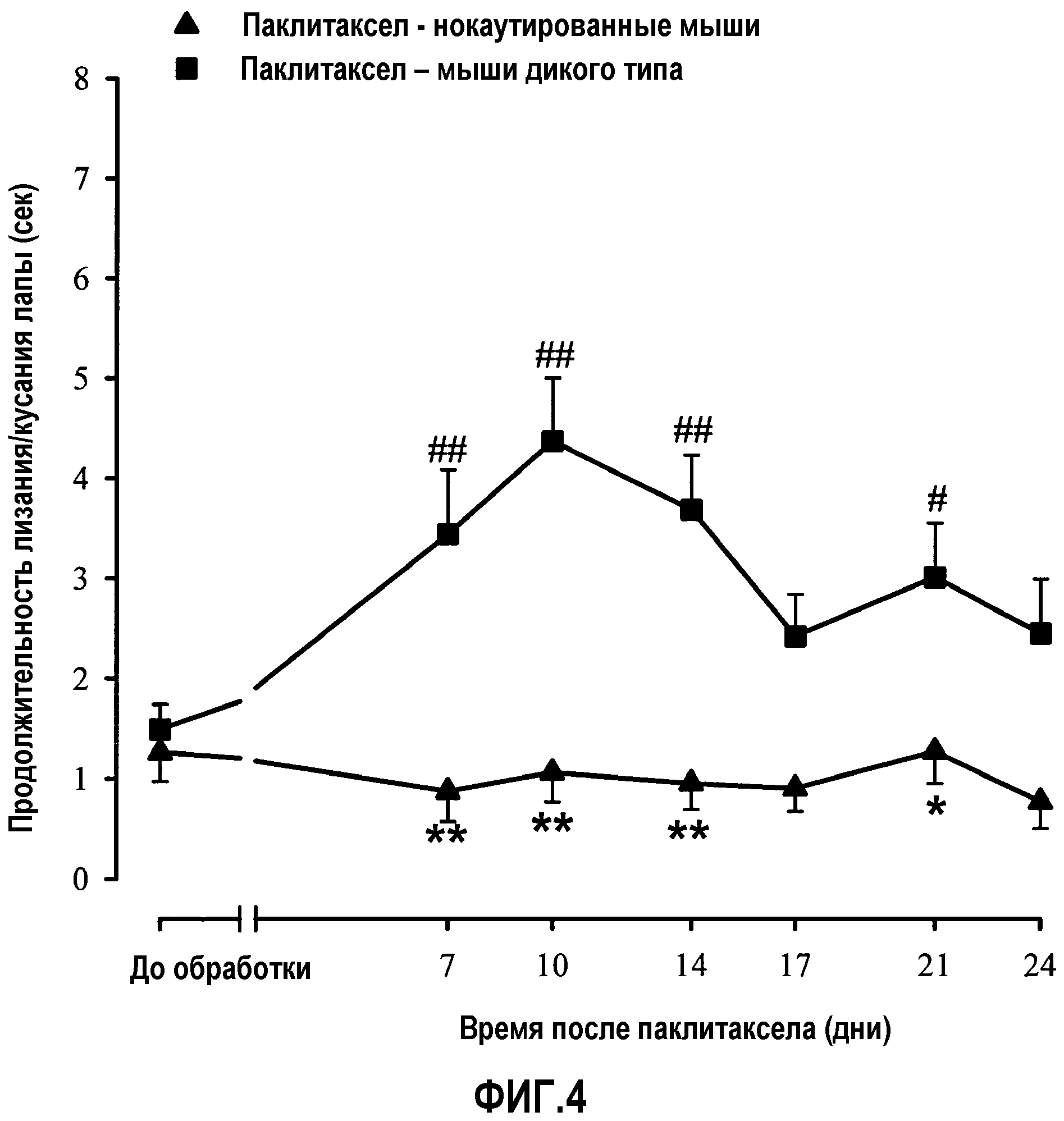
Фиг.4: Протекание индуцированной паклитакселом холодовой аллодинии во времени в следующих группах мышей: одной группе, нокаутированной по рецептору сигма-1, и другой группе мышей дикого типа. Животных обрабатывали один раз в сутки с 1 по 5 день паклитакселом (2 мг/кг) или его наполнителем внутрибрюшинно. Продолжительность лизания/кусания задней лапы в ацетоновом тесте регистрировали за 3 дня до (PRE) и через несколько дней после первой инъекции паклитаксела или его наполнителя. Каждое животное тестировали только в одной ноцицептивной модели. Оказалось, что только у животных дикого типа, обработанных паклитакселом, наблюдается увеличенная продолжительность лизания/кусания задней лапы в ацетоновом тесте. Каждая точка и вертикальная линия указывают среднее ± S.E.M. значений, полученных, по меньшей мере, для 12 мышей. Статистически значимые различия между значениями в группах, обработанных паклитакселом и наполнителем: * p<0,05; ** p<0,01; и между значениями, полученными за день до обработки и через несколько дней после обработки: # p<0,05; ## p<0,01 (двухфакторный ANOVA для множественных измерений с последующим использованием критерия Ньюмана-Кеулса).
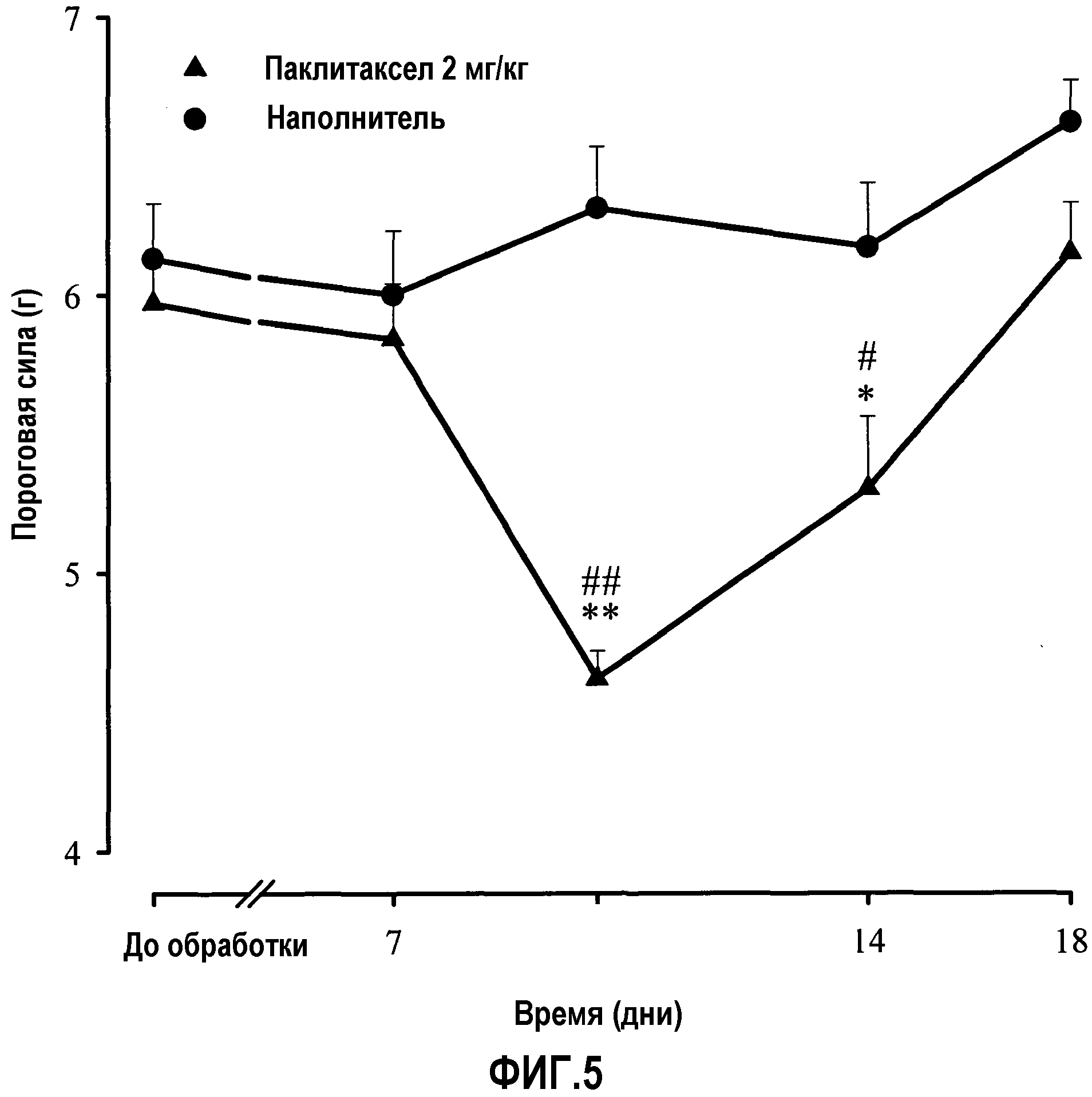
Фиг.5: Протекание индуцированной паклитакселом механической аллодинии у мышей во времени. Животных обрабатывали один раз в сутки с 1 по 5 день паклитакселом (2 мг/кг) или его наполнителем внутрибрюшинно. Пороговую силу в тесте фон Фрея регистрировали за 3 дня до (PRE) и через несколько дней после первой инъекции паклитаксела или его наполнителя. Каждое животное тестировали только в одной ноцицептивной модели. Каждая точка и вертикальная линия указывают среднее ± S.E.M. значений, полученных, по меньшей мере, для 12 мышей. Статистически значимые различия между значениями в группах, обработанных паклитакселом и наполнителем: * p<0,05; ** p<0,01; и между значениями, полученными за день до обработки и через несколько дней после обработки: # p<0,05; ## p<0,01 (двухфакторный ANOVA для множественных измерений с последующим использованием критерия Ньюмана-Кеулса).
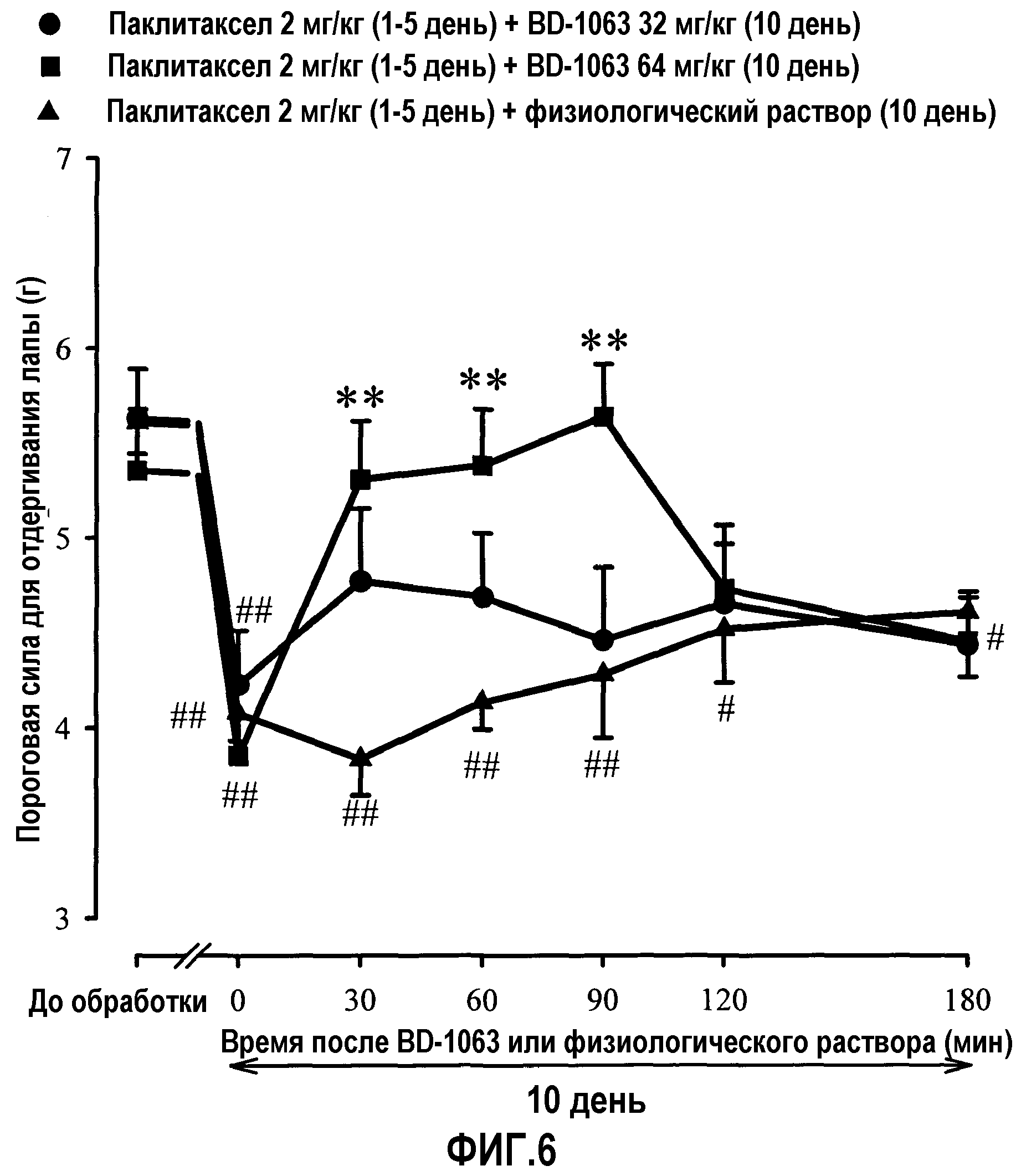
Фиг.6: Влияние однократной обработки несколькими дозами BD-1063 или физиологическим раствором на пороговую силу (тест фон Фрея) индукции отдергивания задней лапы на 10 день (день максимального эффекта) у мышей, предварительно обработанных паклитакселом. Животных обрабатывали один раз в сутки с 1 по 5 день паклитакселом или его наполнителем внутрибрюшинно, и на 10 день мыши получали однократную инъекцию BD-1063 (8, 16, 32 или 64 мг/кг) или физиологический раствор. Пороговую силу регистрировали у каждого животного за 3 дня до (PRE) и через 10 дней после первой инъекции паклитаксела или его наполнителя. В указанный день пороговую силу регистрировали непосредственно перед (время 0) и в нескольких временных точках (60, 120 и 180 мин) после инъекции BD-1063 или физиологического раствора. Каждое животное получало либо физиологический раствор, либо одну дозу BD-1063. Каждая точка и вертикальная линия указывают среднее ± S.E.M. значений, полученных, по меньшей мере, для 12 животных. Статистически значимые различия между группами, обработанными BD-1063 и физиологическим раствором в одной и той же временной точке после обработки: ** p<0,01; и между значениями, полученными в день до обработки и на 10 день в разных временных точках после введения лекарственного средства или физиологического раствора: # p<0,05; ## p<0,01 (двухфакторный ANOVA для множественных измерений с последующим использованием критерия Ньюмана-Кеулса).
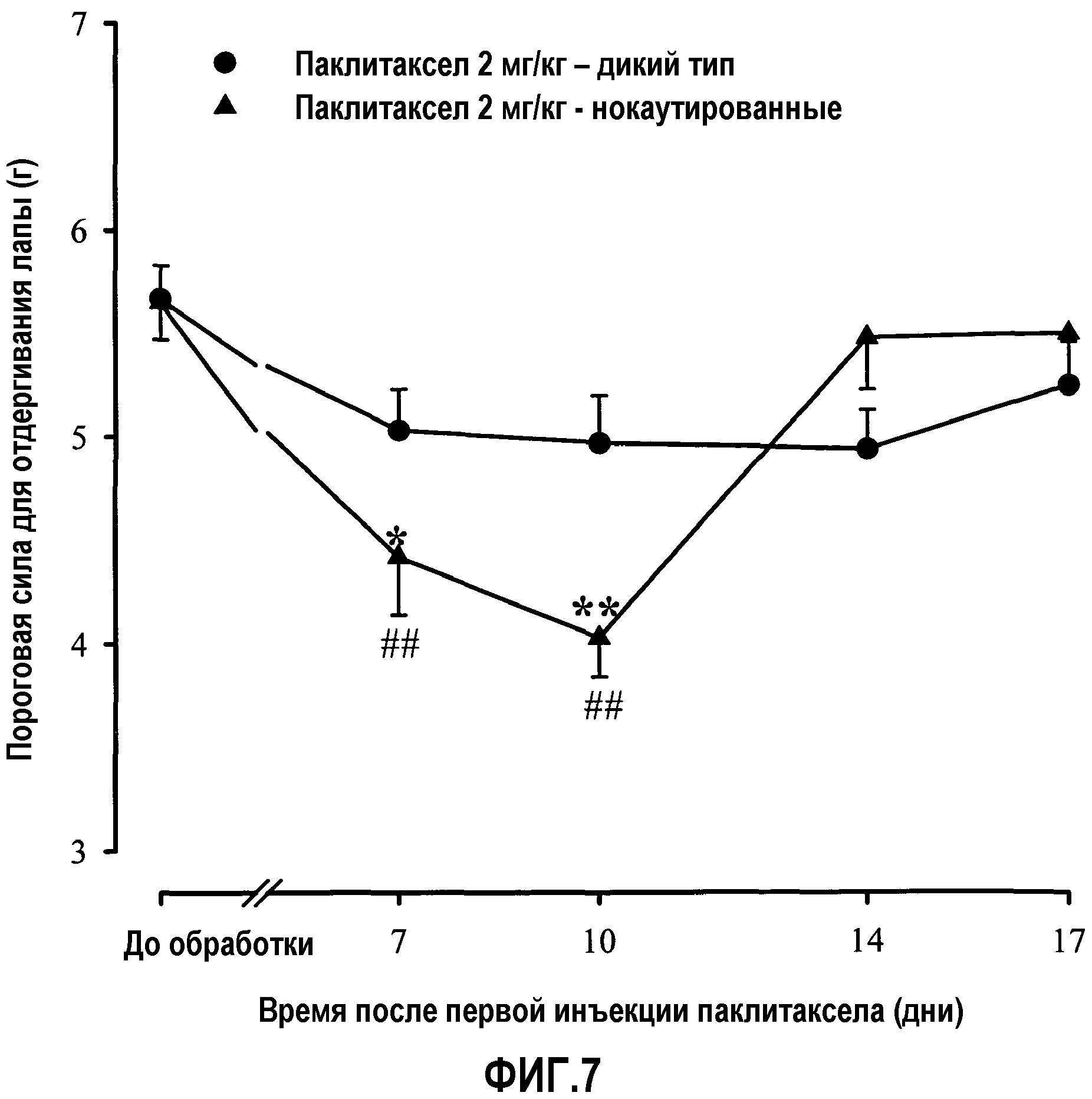
Фиг.7: Протекание индуцированной паклитакселом механической аллодинии во времени в двух группах мышей: одной группе мышей, нокаутированных по рецептору сигма-1, и другой группе мышей дикого типа. Животных обрабатывали один раз в сутки с 1 по 5 день паклитакселом (2 мг/кг) или его наполнителем внутрибрюшинно. Пороговую силу в тесте фон Фрея регистрировали за 3 дня до (PRE) и через несколько дней после первой инъекции паклитаксела или его наполнителя. Каждое животное тестировали только в одной ноцицептивной модели. Оказалось, что только у животных дикого типа, обработанных паклитакселом, наблюдали сниженную пороговую силу в тесте фон Фрея. Каждая точка и вертикальная линия указывают среднее ± S.E.M. значений, полученных, по меньшей мере, для 12 мышей. Статистически значимые различия между значениями в группах, обработанных паклитакселом и наполнителем: * p<0,05; ** p<0,01; и между значениями в день до обработки и в дни после обработки: # p<0,05; ## p<0,01 (двухфакторный ANOVA для множественных измерений с последующим использованием критерия Ньюмана-Кеулса).
Способы
В общем
Эксперименты осуществляли у мышей CD-1 (Charles River, U.S.A.), используя, по меньшей мере, n=10/экспериментальную группу. Индуцированную паклитакселом вызывающую боль периферическую невропатию получали при внутрибрюшинном введении паклитаксела один раз в сутки в течение 5 дней. Контрольные животные получали такой же объем растворителя (смесь этанола и кремофора EL).
Механическую аллодинию оценивали с использованием электронно управляемого волоска фон Фрея (динамический планарный эстезиометр, Ugo Basile, Varese, Italy), как описано ранее (Nieto et al., 2008), и холодовую аллодинию оценивали, используя способ на основе воздействия каплями ацетона (Polomano et al., 2001; Smith et al., 2004).
Хорошо известный антагонист сигма-рецептора BD-1063 инъецировали подкожно либо непосредственно перед каждой инъекцией паклитаксела, чтобы исследовать, влияет ли сигма-антагонист на вызывающую боль периферическую невропатию, или на 10 день (когда заканчивали инъекции паклитаксела и невропатия полностью развивалась), чтобы исследовать, препятствует ли BD-1063 проявлению различных признаков индуцированной паклитакселом невропатической боли. Кроме того, чтобы исследовать влияние рецептора сигма-1 на такой процесс, определяли различие в развитии аллодинии, используя мышей дикого типа и мышей, нокаутированных по рецептору сигма-1.
Конкретное описание
Использовали мышей массой 25-30 г. Перед экспериментом животных содержали группами в клетках со свободным доступом к пище и воде. Клетки находились в помещениях, в которых контролировали температуру и освещение (22±1°C, освещение включали в 08-00 часов и отключали в 20-00 часов, воздух заменяли каждые 20 минут). Тестирование осуществляли во время фазы освещенности (с 9-00 часов до 15-00 часов).
Паклитаксел растворяли в растворителе, состоящем из 50% кремофора EL и 50% абсолютного этанола, получая концентрацию 6 мг/мл. Полученный раствор паклитаксела хранили при -20°C максимум в течение 14 суток и разбавляли в физиологическом растворе (NaCl 0,9%) непосредственно перед введением до конечной концентрации 2 мг/10 мл. Наполнитель для паклитаксела разбавляли во время инъекции физиологическим раствором (NaCl 0,9%) в таком же соотношении, как и раствор паклитаксела.
Паклитаксел (2 мг/кг) вводили внутрибрюшинно (в/б) в объеме 10 мл/кг один раз в сутки в течение пяти следующих друг за другом суток. Следовательно, суммарная доза составляла 10 мг/кг на мышь. В контрольной группе наполнитель паклитаксела вводили по такой же схеме. Такие же схемы инъекции паклитаксела применяли при тестировании групп мышей, нокаутированных по сигма-1, по сравнению с группами мышей дикого типа.
BD-1063 растворяли в физиологическом растворе непосредственно перед введением и применяли в дозах 8, 16, 32 или 64 мг/кг подкожно.
Влияние BD-1063 на индуцированную паклитакселом невропатическую боль исследовали двумя разными путями. Чтобы оценить влияние антагониста сигма-рецептора BD-1063 на развитие индуцированной паклитакселом боли, животным вводили подкожную инъекцию BD-1063 за 30 минут до каждой в/б-инъекции паклитаксела в течение пяти следующих другом за другом суток. Затем тестировали ответ животных на различные ноцицептивные раздражители на протяжении 2-4 недель, в зависимости от теста (см. ниже) без какой-либо дополнительной обработки. Каждое животное тестировали только в одной ноцицептивной модели. Чтобы исследовать влияние BD-1063 на проявление индуцированной паклитакселом боли, однократную инъекцию BD-1063 осуществляли на 10 день, день максимального проявления механической аллодинии или холодовой аллодинии (подробности см. на чертежах). Каждое животное получало только одну дозу BD-1063, и его тестировали только в одной ноцицептивной модели.
Способ оценки холодовой аллодинии. Холодовую аллодинию тестировали, как описано ранее Smith et al., 2004, осторожно прикасаясь к коже на подошвах задних лап пузырьком ацетона, образованным с помощью шприца, соединенного с тонкой полиэтиленовой трубкой. Мышей помещали и давали возможность привыкнуть в течение 30 минут в прозрачных пластиковых камерах (7×7×13 см) с дном, сделанным из проволочной сетки. После периода адаптации ацетон наносили попеременно три раза на каждую лапу с интервалами 30 секунд и регистрировали продолжительность и частоту лизания или кусания. Небольшое зеркало помещали позади камер, чтобы обеспечить четкое наблюдение за лапами. Время, затраченное на лизание или кусание лапы, регистрировали с помощью секундомера и представляли в виде суммарного времени лизания/кусания в шести измерениях. Так как продолжение лизания более 10 секунд в экспериментах было очень редко, то для каждого испытания использовали время отсечения 10 секунд.
Чтобы выяснить протекание во времени индуцированной паклитакселом холодовой аллодинии у контрольных мышей, животных тестировали до введения паклитаксела (значение до обработки, за 3 дня до первой обработки паклитакселом) и в разные дни (7, 10, 14, 17, 21 и 24 день) после первой инъекции паклитаксела или наполнителя.
Такой же способ использовали для сравнения мышей, нокаутированных по сигма-1, с мышами дикого типа, таким образом выясняя протекание во времени индуцированной паклитакселом холодовой аллодинии у контрольных мышей. Соответственно животные (две равных группы нокаутированных мышей и мышей дикого типа тестировали до введения паклитаксела (значение до обработки, за 3 дня до первой обработки паклитакселом) и в разные дни (7, 10, 14, 17, 21 и 24 день) после первой инъекции паклитаксела или наполнителя.
Такой же способ использовали для исследования влияния BD-1063 на развитие холодовой аллодинии, но в данном случае BD-1063 или его наполнитель инъецировали подкожно за 30 минут до каждой из 5 в/б-инъекций паклитаксела. И вновь животных тестировали перед введением паклитаксела/BD-1063 (значение до обработки, за 3 дня до первой обработки паклитакселом/BD-1063) и в разные дни (7, 10, 14, 17, 21 и 24 день) после первой инъекции паклитаксела/BD-1063 или наполнителя. Влияние BD-1063 на проявление индуцированной паклитакселом холодовой аллодинии оценивали на 10 день, так как в этот день наблюдали максимальные аллодинический эффект. Таким образом, на 10 день после периода привыкания к устройству регистрировали латентные периоды исходного уровня, спустя 30 минут подкожно инъецировали BD-1063 или физиологический раствор и снова оценивали латентные периоды отдергивания лапы через 30, 60, 90, 120 и 180 минут после инъекции. Примерно у 33% контрольных животных, обработанных паклитакселем, не наблюдали холодовой аллодинии; следовательно, в данном тесте устанавливали различие между «отвечающими» и «не отвечающими» мышами. «Не отвечающих» мышей легко идентифицировали, так как они затрачивали менее 2 секунд на лизание/кусание лапы, подвергнутой раздражению ацетоном, на 7 и 10 день после введения паклитаксела. «Не отвечающих» животных не использовали для тестирования влияния BD-1063 на проявление холодовой аллодинии, так как у них не было достаточного проявления холодовой аллодинии.
Способ оценки механической аллодинии. Чтобы оценить механическую аллодинию, измеряли пороги отдергивания лапы, используя динамический планарный эстезиометр (Ugo Basile, Italy). В электронном устройстве фон Фрея используется одно негибкое волокно, которое прикладывали, постепенно увеличивая силу (от 0 до 10 г), к подошвенной поверхности задней лапы в течение 20-секундного периода времени. Ноцицептивный сгибательный рефлекс автоматически отключал стимул, и на экране высвечивалось значение порога механического воздействия. В день эксперимента мышей помещали по отдельности в камеры для испытания (9×9×14 см) с дном из проволочной сетки и давали им возможность акклиматизироваться в течение 2 часов. После привыкания каждую мышь тестировали по три раза попеременно на каждой задней лапе.
Чтобы выяснить протекание во времени индуцированной паклитакселом механической аллодинии у контрольных мышей, животных тестировали до введения паклитакселом (значение до обработки; за 3 дня до обработки паклитакселом) и в разные дни (7, 10, 14 и 17 день) после первой инъекции паклитаксела или наполнителя.
Такой же способ использовали для сравнения нокаутированных по сигма-1 мышей с мышами дикого типа, таким образом, выясняя протекание во времени индуцированной паклитакселом механической аллодинии у контрольных мышей. Соответственно животных (две равных группы нокаутированных мышей и мышей дикого типа) тестировали перед введением паклитаксела (значение до обработки, за 3 дня до первой обработки паклитакселом) и в разные дни (7, 10, 14, 17, 21 и 24 день) после первой инъекции паклитаксела или наполнителя.
Такой же способ использовали для тестирования эффекта BD-1063, хорошо известного антагониста сигма-рецептора, на развитие индуцированной паклитакселом механической аллодинии. В данном случае BD-1063 или его наполнитель инъецировали подкожно за 30 минут перед каждой из 5 в/б-инъекций паклитаксела. И снова животных тестировали до введения паклитаксела/BD-1063 (значение до обработки, за 3 дня до первой обработки паклитакселом/BD-1063) и в разные дни (7, 10, 14, 17, 21 и 24 день) после первой инъекции паклитаксела/BD-1063 или наполнителя. Влияние BD-1063 на проявление индуцированной паклитакселом механической аллодинии оценивали на 10 день, так как в этот день наблюдали максимальное изменение порога механического воздействия. Таким образом, на 10 день после периода привыкания к устройству регистрировали латентные периоды исходного уровня, спустя 30 минут подкожно инъецировали BD-1063 или физиологический раствор и снова оценивали латентные периоды отдергивания лапы через 30, 60, 90, 120 и 180 минут после инъекции. У большинства животных (96%), обработанных паклитакселом, наблюдали уменьшение порога механического воздействия; тех животных, у которых не проявлялась механическая аллодиния, не использовали в тестировании влияния BD-1063 на проявление индуцированной паклитакселом механической аллодинии.
Результаты
A) Протекание во времени индуцированной паклитакселом холодовой и механической аллодинии у контрольных мышей. Значения, полученные в день до обработки у обработанных паклитакселем и наполнителем животных, значимо не отличались ни в ацетоновом тесте, ни в тесте фон Фрея. Введение в течение 5 дней наполнителя паклитаксела значимо не модифицировало ответ животных ни в одном из тестов в любой день после обработки по сравнению со значением до обработки.
В ацетоновом тесте (фиг.1) введение паклитаксела (2 мг/кг, в/б) один раз в сутки в течение 5 суток позволяло выявить различия между двумя группами животными, в зависимости от их ответа. У большинства животных (67%), обработанных паклитакселом, значимо (p<0,01) увеличивалось время, затрачиваемое на лизание/кусание лапы, подвергнутой раздражению (фиг.1), и частоты лизания/кусания лапы во все дни после обработки по сравнению со значением в день до обработки. Такие животные представляли собой животных, отвечающих на паклитаксел. С другой стороны, у 33% обработанных паклитакселом животных не наблюдали холодовой аллодинии, и их реакция на ацетон не отличалась от реакции животных, обработанных наполнителем паклитаксела ни по продолжительности (фиг.1), ни по частоте лизания/кусания. Когда сравнивали значения указанных двух переменных, полученные в один и тот же день оценки, между разными группами, наблюдали статистически значимые различия между группой, отвечающей на паклитаксел, и двумя другими группами (не отвечающими на паклитаксел или обработанных наполнителем паклитаксела) для каждого дня оценки после обработки (фиг.1). Индуцированная паклитакселом холодовая аллодиния была максимальной на 10-14 день после первой инъекции антинеопластического средства в отношении обеих регистрируемых переменных (фиг.1); поэтому влияние BD-1063 на проявление холодовой аллодинии оценивали на 10 день.
Введение паклитаксела (2 мг/кг, в/б, в течение 5 суток) индуцировало механическую аллодинию у мышей, так как значимо снижалась пороговая сила для отдергивания лапы в тесте фон Фрея на 10 день по сравнению со значением в день до обработки и значением, полученным в тот же день у животных, обработанных наполнителем паклитаксела (фиг.5). Поэтому влияние BD-1063 на проявление механической аллодинии тестировали на 10 день.
B) Влияние BD-1063 на развитие индуцированной паклитакселом холодовой и механической аллодинии. Значения, полученные до обработки, были сходными в двух экспериментальных группах (паклитаксел + физиологический раствор и паклитаксел + BD-1063) в ацетоновом тесте.
В группе животных, в которой совместно вводили паклитаксел (в/б) и физиологический раствор (п/к) в течение 1-5 дней, наблюдали значимое увеличение продолжительности лизания/кусания лапы (фиг.2) в ацетоновом тесте, которое начиналось на 7 день и достигало максимума на 10-14 день после первой инъекции, как в экспериментах, когда инъецировали только паклитаксел (фиг.1). С другой стороны, в случае животных, которые получали совместную внутрибрюшинную инъекцию BD-1063 в дозе 32 мг/кг вместе с паклитакселом в течение 1-5 дней, выявлены статистически значимые различия в значениях продолжительности лизания/кусания лапы (на протяжении 24 дней после совместного введения), полученных в обеих группах (паклитаксел + физиологический раствор и паклитаксел + BD-1063 (32 мг/кг)), начиная с 7 дня и далее, пока анализировали продолжительность лизания/кусания. Следовательно, совместное введение паклитаксела в/б и BD-1063 (32 мг/кг) ингибировало развитие холодовой аллодинии, индуцированной паклитакселом.
C) Влияние BD-1063 на проявление индуцированной паклитакселом холодовой аллодинии. Продолжительность и частота лизания/кусания лапы на 10 день перед обработкой BD-1063 или физиологическим раствором значимо отличались от таких значений в день до обработки во всех группах обрабатываемых животных. Как и ожидалось, паклитаксел индуцировал холодовую аллодинию через 10 дней после его первой инъекции. Однократная подкожная инъекция физиологического раствора на 10 день не приводила к статистически значимой модификации проявления индуцированной паклитакселом холодовой аллодинии. Острая обработка различными количествами BD-1063 (8, 16, 32 или 64 мг/кг) ингибировала проявление индуцированной паклитакселом холодовой аллодинии. Такое влияние BD-1063 было зависимым от дозы, значимо отличалось от влияния физиологического раствора (фиг.3).
D) Влияние BD-1063 на проявление индуцированной паклитакселом механической аллодинии. Пороговая сила отдергивания лапы на 10 день перед обработкой BD-1063 или физиологическим раствором статистически отличалась от таких значений в день до обработки во всех группах тестированных животных. Как и ожидалось, паклитаксел индуцировал механическую аллодинию через 10 дней после его первой инъекции. Однократная подкожная инъекция физиологического раствора на 10 день не приводила к статистически значимой модификации проявления индуцированной паклитакселом механической аллодинии. Острая обработка различными количествами BD-1063 (32 или 64 мг/кг) ингибировала проявление индуцированной паклитакселом механической аллодинии. Такое влияние BD-1063 зависело от дозы, статистически значимо отличалось от влияния физиологического раствора (фиг.6).
E) Протекание индуцированной паклитакселом холодовой аллодинии во времени при сравнении мышей дикого типа и мышей, нокаутированных по рецептору сигма-1. В ацетоновом тесте (фиг.4) введение паклитаксела (2 мг/кг, в/б) один раз в сутки в течение 5 дней в двух группах животных приводило к разным эффектам. У животных дикого типа индуцированная паклитакселом холодовая аллодиния была максимальной через 10 дней после первой инъекции антинеопластического средства (фиг.4). Напротив, у нокаутированных по рецептору сигма-1 животных индуцированная паклитакселом холодовая аллодиния значимо не проявлялась (фиг.4). Следовательно, индуцированная паклитакселом холодовая аллодиния представляет собой эффект, связанный с рецептором сигма-1.
F) Протекание индуцированной паклитакселом механической аллодинии во времени при сравнении мышей дикого типа и мышей, нокаутированных рецептором сигма-1. В тесте фон Фрея (фиг.7) введение паклитаксела (2 мг/кг, в/б) один раз в сутки в течение 5 дней в двух группах животных приводило к разным эффектам. У животных дикого типа индуцированная паклитакселом механическая аллодиния была максимальной через 10 дней после первой инъекции антинеопластического средства (фиг.7). У нокаутированных по рецептору сигма-1 животных индуцированная паклитакселом механическая аллодиния значимо не проявлялась (фиг.7). Следовательно, индуцированная паклитакселом механическая аллодиния представляет собой эффект, связанный с рецептором сигма-1.
Ссылки
Alberts D.S, Noel J.K. Cisplatin-associated neurotoxicity: can it be prevented? Anticancer Drugs. 1995; 6(3):369-83.
Argyriou A.A, Iconomou G, Kalofonos H.P. Bortezomib-induced peripheral neuropathy in multiple myeloma: a comprehensive review of the literature. Blood 2008; 112(5):1593-9.
Chaudhry V, Rowinsky E.K, Sartorius S.E, Donehower R.C, Cornblath D.R. Peripheral neuropathy from taxol and cisplatin combination chemotherapy: clinical and electrophysiological studies. Ann Neurol. 1994; 35(3):304-11.
Dougherty P.M, Cata J.P, Cordella J.V, Burton A, Weng H.R. Taxol-induced sensory disturbance is characterized by preferential impairment of myelinated fiber function in cancer patients. Pain. 2004; 109(1-2):132-42.
Forsyth P.A, Balmaceda C, Peterson K, Seidman A.D, Brasher P, DeAngelis L.M. Prospective study of paclitaxel-induced peripheral neuropathy with quantitative sensory testing. J Neurooncol. 1997; 35(1):47-53.
Gordon A.N, Stringer C.A, Matthews C.M, Willis D.L, Nemunaitis J. Phase I dose escalation of paclitaxel in patients with advanced ovarian cancer receiving cisplatin: rapid development of neurotoxicity is dose-limiting. J Clin. Oncol. 1997; 15(5):1965-73.
Mielke S, Sparreboom A, Mross K. Peripheral neuropathy: a persisting challenge in paclitaxel-based regimes. Eur J Cancer 2006; 42(1):24-30.
Nieto F.R, Entrena J.M, Cendán C.M, Pozo E.D, Vela J.M, Baeyens J.M. Tetrodotoxin inhibits the development and expression of neuropathic pain induced by paclitaxel in mice. Pain 2008; 137(3):520-31.
Park S.B, Krishnan A.V, Lin C.S, Goldstein D, Friedlander M, Kiernan M.C. Mechanisms underlying chemotherapy-induced neurotoxicity and the potential for neuroprotective strategies. Curr. Med. Chem. 2008; 15(29):3081-94.
Polomano R.C, Bennett G.J. Chemotherapy-evoked painful peripheral neuropathy. Pain Med. 2001; 2(1):8-14.
Postma T.J, Vermorken J.B, Liefting A.J, Pinedo H.M, Heimans J.J. Paclitaxel-induced neuropathy. Ann Oncol. 1995; 6(5):489-94.
Quasthoff S, Hartung H.P. Chemotherapy-induced peripheral neuropathy. J Neurol. 2002; 249(1):9-17.
Rowinsky E.K, Eisenhauer E.A, Chaudhry V, Arbuck S.G, Donehower R.C. Clinical toxicities encountered with paclitaxel (Taxol). Semin Oncol. 1993a; 20 (4 Suppl 3):1-15.
Rowinsky E.K, Chaudhry V, Forastiere A.A, Sartorius S.E, Ettinger D.S, Grochow L.B, Lubejko B.G, Cornblath D.R, Donehower R.C. Phase I and pharmacologic study of paclitaxel and cisplatin with granulocyte colony-stimulating factor: neuromuscular toxicity is dose-limiting. J Clin. Oncol. 1993b; 11(10):2010-20.
Smith S.B, Crager S.E, Mogil J.S. Paclitaxel-induced neuropathic hypersensitivity in mice: responses in 10 inbred mouse strains. Life Sci. 2004; 74(21):2593-604.
Wasserheit С, Frazein A, Oratz R, Sorich J, Downey A, Hochster H, Chachoua A, Wernz J, Zeleniuch-Jacquotte A, Blum R, Speyer J. Phase II trial of paclitaxel and cisplatin in women with advanced breast cancer: an active regimen with limiting neurotoxicity. J Clin. Oncol. 1996; 14(7):1993-9. Erratum in: J Clin. Oncol. 1996 Dec; 14(12):3175.
Wolf S, Barton D, Kottschade L, Grothey A, Loprinzi С Chemotherapy-induced peripheral neuropathy: prevention and treatment strategies. Eur J Cancer 2008; 44(11):1507-15.
Реферат
Изобретение относится к медицине и заключается в применении соединений, являющихся антагонистами сигма-1 рецептора, для лечения или предотвращения невропатической боли, возникающей вследствие химиотерапии препаратами группы таксанов, при этом невропатическая боль представляет собой аллодинию или гипералгезию. 7 з.п. ф-лы, 2 табл., 7 ил.

Комментарии