Способы лечения синдрома дефицита внимания и гиперактивности - RU2556585C2
Код документа: RU2556585C2
Чертежи



Описание
Область техники, к которой относится изобретение
Данное изобретение относится к способу лечения синдрома дефицита внимания и гиперактивности (ADHD). Более конкретно, настоящее изобретение относится к способу применения карбамата одного или в комбинации с другими лекарственными веществами для лечения ADHD.
Уровень техники
ADHD представляет собой хроническую болезнь роста, характеризующуюся проблемами, связанными с наличием внимания, которые приводят к ингибированию несущественных раздражителей и/или к чрезмерному фокусированию на конкретных раздражителях до такой степени, что это мешает продуктивной работе или занятиям в школе. Этим расстройством страдают от 3 до 10% детей и от 1 до 6% взрослых, и 55-66% детей продолжают испытывать проблемы, связанные с ADHD, при наступлении совершеннолетия (Spencer et al., 2002; Daley, 2004). У детей с ADHD существует большой риск стать заядлыми курильщиками и пристраститься к наркотикам. Дети, которые растут с наличием ADHD, могут встретиться с нарушениями при усвоении учебных дисциплин, с социальной дисфункцией и они могут иметь низкую самооценку.
В IV пересмотре в The Diagnostic and Statistical Manual (DSM) (Диагностическом и статистическом справочнике) описаны четыре подтипа такого расстройства: преимущественно гиперактивный/импульсивный тип, когда у пациентов наблюдается шесть или более симптомов гиперактивности/импульсивности и менее шести симптомов отсутствия внимания;
преимущественно невнимательный тип с наличием шести или более симптомов отсутствия внимания и менее шести симптомов гиперактивности/импульсивности;
ADHD в комбинации с шестью или более симптомами гиперактивности/импульсивности и симптомами отсутствия внимания; частичная ремиссия, когда пациент ранее отвечал критериям, но в настоящее время характеризуется несколькими симптомами ухудшения состояния; и ADHD, который не был каким-либо образом охарактеризован, когда не удовлетворяются все критерии и неясно, удовлетворялись ли они ранее (Murphy & Adier, 2004). Трудности с постановкой диагноза, особенно у взрослых пациентов, включают то обстоятельство, что до сих пор не существует диагностического теста для определения ADHD, имеются в наличии сопутствующие заболевания, кроме того, для определения влияния такого состояния (ADHD) на, в, по меньшей мере, две области жизни необходимо мнение клинициста, которое является субъективным, а определение начала заболевания в детстве может быть невозможным. Состояния, которые могут или имитировать симптомы ADHD, или сопутствовать ADHD, включают поведенческое расстройство, оппозиционно-вызывающее расстройство, тяжелое депрессивное расстройство, тревожный невроз, биполярное расстройство, трудности обучения и злоупотребление различными веществами (Spencer et al., 2002; Daley, 2004).
Не существует четко определенной единственной этиологии ADHD. На патофизиологию ADHD могут влиять генетические факторы, дородовые и послеродовые факторы риска и нейробиологический дефицит. Курение и пристрастие к алкоголю увеличивают риск появления ADHD наряду с наличием 75% генетического компонента (Spencer et al., 2002). Сообщалось, что у пациентов с ADHD области мозга, связанные с наличием внимания, включающие префронтальную кору, в которой преобладают рецепторы допамина и норэпинефрина, становятся меньше и менее активными, чем у контрольных пациентов, в этом процессе принимают участие катехоламины, допамин и норэпинефрин (Spencer et al., 2002; Grund et al., 2006; Rader et al., 2009).
Лечение ADHD вначале проводили с помощью стимулирующих лекарственных веществ, включающих метилфенидат, декстроамфетамин, а также смесь стимулирующих веществ первой линии (Rader et al., 2009). Действие таких лекарственных веществ не обязательно длится в течение 24 ч, даже в случае применения составов с пролонгированным высвобождением. Таким образом, стимулирующие вещества нужно принимать 2-3 раза в день, что вызывает затруднения в соблюдении режима терапии (Daughton & Kratochvil, 2009). Однако следует отметить, что режим терапии легче соблюдать при применении препаратов с пролонгированным высвобождением за счет устранения предрассудков, связанных с приемом лекарств в школе, но побочные эффекты продолжают появляться позже в течение дня и имеют склонность быть экстенсивными. Стимулирующие вещества могут привести к злоупотреблению лекарствами, они могут быть неидеальными для сопутствующих заболеваний, включая появление тикового расстройства (Spencer et al., 2002). Кроме того, существует необходимость в мониторинге детей для изучения влияния лечения на рост детей с помощью стимулирующих веществ (Daley, 2004) и изменение кровяного давления и частоты пульса (Daughton & Kratochvil, 2009). Другие побочные эффекты включают уменьшение аппетита, потерю в весе, боль в брюшной полости, головную боль, раздражительность, сердечно-сосудистые осложнения, бессонницу, раздражение кожи и сыпь (Rader et al., 2009).
Лечение с помощью нестимулирующих веществ также было признано эффективным, оно имеет преимущества, состоящие в возможности более длительного применения, меньшем появлении склонности к злоупотреблению лекарственными препаратами и возможности лечения сопутствующих заболеваний, по сравнению со стимулянтами (Daley, 2004). Атомоксетин, который считается препаратом второй линии, имеет высокую селективность по отношению к пресинаптическому переносчику норэпинефрина и ожидается, что его применение при лечении детей и взрослых, больных ADHD, даст длительный терапевтический эффект и будет вызывать меньшую склонность к появлению зависимости от лекарства (Rader et al., 2009; Daughton & Kratochvil, 2009). Однако эффективность применения атомоксетина не достигает уровня эффективности стимулирующих лекарств. Кроме того, эта эффективность начинает проявляться постепенно и есть риск появления суицидальной направленности мышления, заболевания желтухой и возможности взаимодействия с субстратами CYP 2D6.
Лекарства третьей линии включают трициклические антидепрессанты (ТСА), бупропион и альфа-агонисты (Rader et al., 2009). Трициклические антидепрессанты, вызывающие поглощение катехоламина, прописывались для лечения ADHD, но действие ТСА не является селективным, и неблагоприятные эффекты включают появление сухости во рту, изменение кровяного давления, увеличение веса, уменьшение сердечной проводимости и констипацию. Бупропион, антидепрессант с действием агониста допамина и норэпинефрина, оказался более эффективным при лечении ADHD, но при его применении существует огромный риск появления эпилептических припадков несмотря на более высокие дозы, историю более ранних припадков и расстройство пищевого поведения (Daley, 2004). Побочные эффекты от применения клонидина и гуанфацина, являющихся альфа-агонистами, влючают сонливость, головокружение, сухость во рту и ортостатическую гипотонию, но эти лекарства полезны для пациентов с поведенческим расстройством и помогают бороться с бессонницей и потерей аппетита, вызванными применением стимулирующих веществ (Rader et al., 2009). Ингибиторы обратного захвата серотонина также применялись для лечения ADHD, но их эффективность не оказалась обещающей (Spencer et al., 2002).
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ Техническая задача
Таким образом, существует необходимость в разработке способа лечения ADHD, который привел бы к повышению эффективности лечения гиперактивности/импульсивности и симптомов невнимательности при большей податливости пациента лечению и при меньшем проявлении профиля неблагоприятных явлений, включая возникновение зависимости от лекарств. Решение задачи
Данное изобретение направлено на создание способа лечения ADHD, включающего введение терапевтически эффективного количества соединения, имеющего формулу (1) или его фармацевтически приемлемой соли млекопитающему, нуждающемуся в этом:
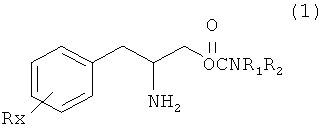
где:
R выбран из группы, состоящей из водорода, низшего алкила, содержащего от 1 до 8 атомов углерода, галогена, выбранного из F, Cl, Br и I, алкоксильной группы, содержащей от 1 до 3 атомов углерода, нитрогруппы, гидроксильной группы, трифторметильной группы и тиоалкоксильной группы, содержащей от 1 до 3 атомов углерода;
x обозначает целое число от 1 до 3, при условии, что R могут быть одинаковыми или разными, когда x равен 2 или 3;
R1 и R2 могут быть одинаковыми или могут отличаться друг от друга и независимо выбраны из группы, состоящей из водорода, низшего алкила, содержащего от 1 до 8 атомов углерода, арила, арилалкила, циклоалкила, содержащего от 3 до 7 атомов углерода;
R1 и R2 вместе могут образовывать 5-7-членное гетероциклическе кольцо, замещенное радикалом, выбранным из группы, состоящей из водорода, алкила и арила, при этом указанный гетероцикл содержит от 1 до 2 атомов азота и 0-1 атом кислорода и атомы азота не связаны непосредственно друг с другом или с атомом кислорода.
Согласно другому варианту данное изобретение предусматривает способ уменьшения симптомов, связанных с ADHD, у субъекта, включающий введение терапевтически эффективного количества соединения, имеющего формулу (1), или его фармацевтически приемлемой соли этому субъекту, нуждающемуся в таком лечении.
Согласно еще одному варианту настоящее изобретение предусматривает способ ослабления или устранения симптомов, связанных с ADHD, у субъекта, включающий стадию введения этому субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения, имеющего формулу (1), или его фармацевтически приемлемой соли.
Согласно дополнительному варианту данное изобретение предусматривает фармацевтическую композицию для лечения ADHD, включающую терапевтически эффективное количество соединения, имеющего формулу (1), или его фармацевтически приемлемой соли.
Согласно другому варианту данное изобретение предусматривает фармацевтическую композицию для уменьшения симптомов, связанных с ADHD, у субъекта, включающий введение терапевтически эффективного количества соединения, имеющего формулу (1), или его фармацевтически приемлемой соли.
Согласно еще одному варианту данное изобретение предусматривает фармацевтическую композицию для ослабления или устранения симптомов, связанных с ADHD, у субъекта, включающий стадию введения этому субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения, имеющего формулу (1), или его фармацевтически приемлемой соли.
Соединение, имеющее структурную формулу (1), представляет собой энантиомер, практически не содержащий других энантиомеров, или смесь энантиомеров, в которой преобладает один из энантиомеров соединения, имеющего структурную формулу (1). Этот один энантиомер преобладает в количестве, составляющем примерно 90% или более и, предпочтительно, примерно 98% или более.
Указанный энантиомер представляет собой (S)-энантиомер, или (L)-энантиомер, имеющий структурную формулу (1a), или (R)-энантиомер, или (D)-энантиомер, имеющий структурную формулу (1b):


Предпочтительно, если Rx, R1 и R2 все были выбраны из водорода и x равнялся 1, что отражают следующие формулы:

или

Варианты данного изобретения включают также способ применения энантиомера структурной формулы (1), практически не содержащего других энантиомеров, то есть энантиомера формулы (1b), или смеси энантиомеров, в которой преобладает энантиомер формулы (1b) (Примечание: в структурной формуле (1b), представленной ниже, аминогруппа, присоединенная к бета-углероду, проектируется на плоскость листа бумаги). Этот энантиомер является правовращающим (D)-энантиомером, который имеет абсолютную конфигурацию (R)).
Преимущества, достигаемые при осуществлении изобретения
Данное изобретение частично основывается на установлении того факта, что фенилалкиламинокарбаматы формулы (1), описанные выше, обладают новыми и уникальными фармакологическими свойствами. Как было показано на примере нескольких животных моделей, эти соединения имеют способность бороться с ADHD и модифицировать симптомы, связанные с наличием ADHD.
Хотя точный механизм действия таких соединений понятен неполностью, известно, что эти соединения не работают по такому механизму, по которому действует большинство других известных лекарств, применяемых для лечения ADHD. По этой причине соединения, имеющие структурную формулу (1), особенно подходят в качестве единственного или дополнительного лекарства для лечения ADHD или для модификации симптомов, связанных с наличием ADHD.
Краткое описание фигур
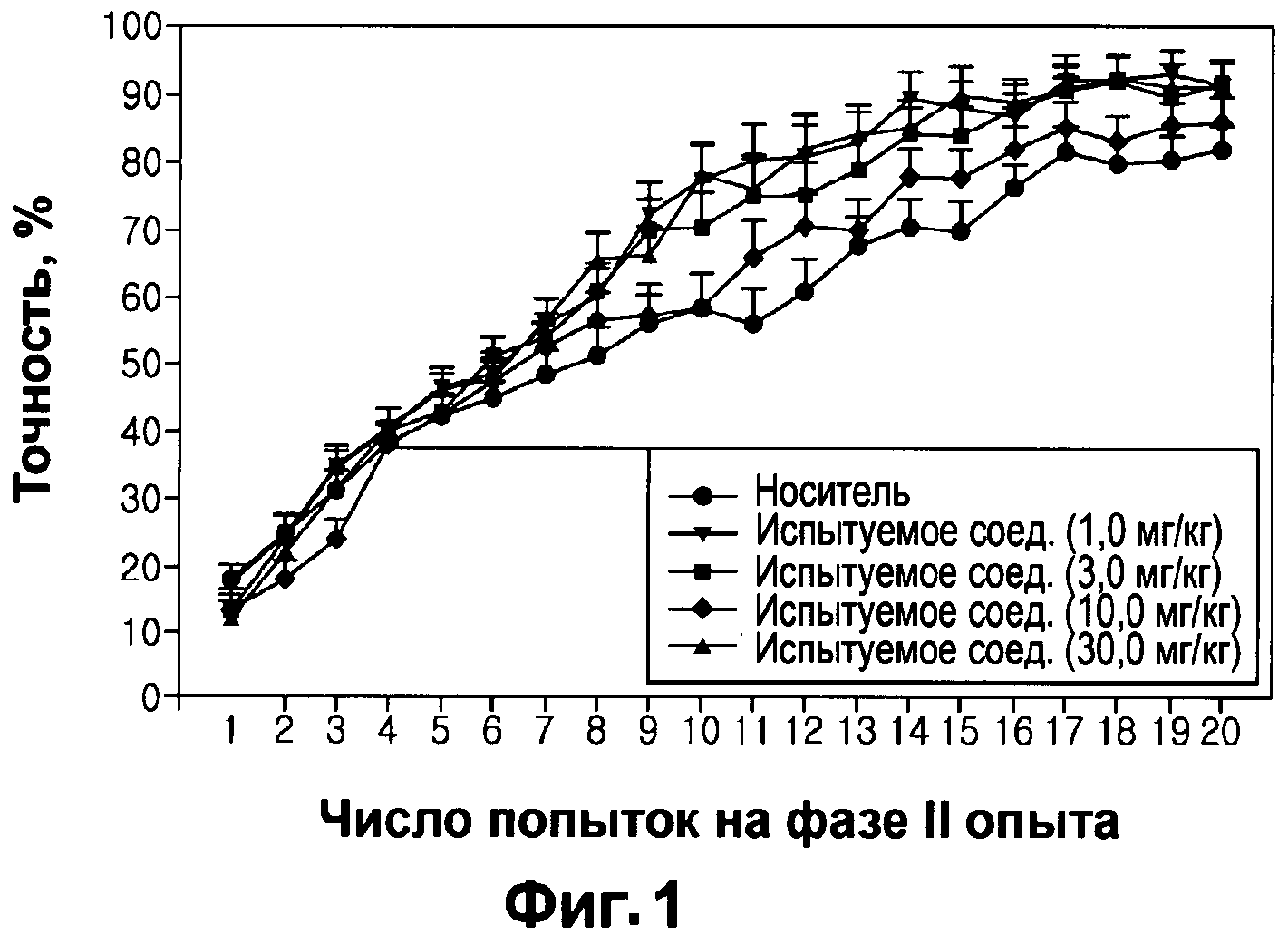
Фигура 1: Влияние испытуемого соединения на величину показателя точности во время проведения стадии II опыта.
Фигура 2: Влияние испытуемого соединения на число попыток, требующихся для достижения критерия показателя точности на стадии II опыта с переменой схемы зрительного различия.
Фигура 3: Влияние испытуемого соединения и амфетамина на двигательную активность.
Фигура 4: Влияние испытуемого соединения и носителя на величину внеклеточной концентрации допамина в полосатом теле мозга у крыс.
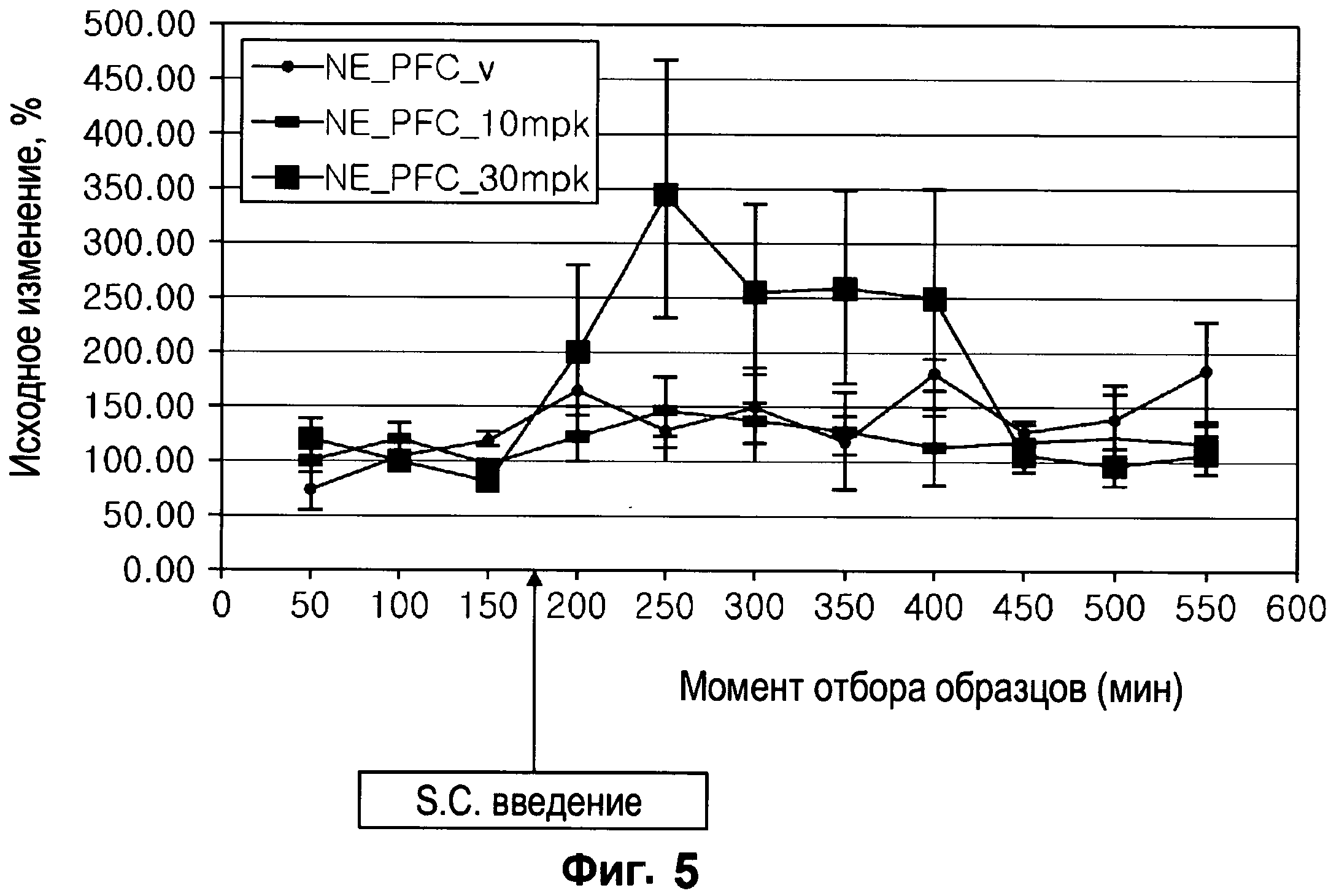
Фигура 5: Влияние испытуемого соединения и носителя на величину внеклеточной концентрации норэпинефрина в префронтальной коре мозга у крыс.
Осуществление изобретения
Указанная выше задача и другие задачи изобретения будут более понятны из следующего ниже описания, прилагаемых рисунков и формулы изобретения.
Данное изобретение направлено на создание способа лечения ADHD, включающего введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения, имеющего структурную формулу (1), или его энантиомеров, диастереомеров, рацематов или их смесей, или его гидратов, сольватов и фармацевтически приемлемых солей и амидов:

где:
R выбран из группы, состоящей из водорода, низшего алкила, содержащего от 1 до 8 атомов углерода, галогена, выбранного из F, Cl, Br и I, алкоксильной группы, содержащей от 1 до 3 атомов углерода, нитрогруппы, гидроксильной группы, трифторметильной группы и тиоалкоксильной группы, содержащей от 1 до 3 атомов углерода;
x обозначает целое число от 1 до 3, при условии, что R могут быть одинаковыми или разными, когда х равен 2 или 3;
R1 и R2 могут быть одинаковыми или могут отличаться друг от друга и независимо выбраны из группы, состоящей из водорода, низшего алкила, содержащего от 1 до 8 атомов углерода, арила, арилалкила, циклоалкила, содержщего от 3 до 7 атомов углерода;
R1 и R2 вместе могут образовывать 5-7-членное гетероциклическе кольцо, замещенное радикалом, выбранным из группы, состоящей из водорода, алкила и арила, при этом указанный гетероцикл содержит от 1 до 2 атомов азота и 0-1 атом кислорода, и атомы азота не связаны непосредственно друг с другом или с атомом кислорода.
Указанный способ включает также применение соединения, выбранного из группы, состоящей из соединений формулы (1a) или формулы (1b) или их энантиомеров, диастереомеров, рацематов или их смесей, или их гидратов, сольватов и фармацевтически приемлемых солей и амидов:


где Rx, R1 и R2 имеют значения, указанные выше.
Описанный способ предпочтительно включает также применение D-энантиомера (или правовращающего энантиомера с абсолютной R-конфигурацией), выбранного из группы, состоящей из соединения, имеющего структурную формулу (1), или смеси его энантиомеров. В соединении со структурной формулой (1) аминогруппа, присоединенная к бета-углероду, проектируется на плоскость листа. Этот энантиомер является правоовращающим (D)-энантиомером, который имеет абсолютную конфигурацию (R).
Предпочтительно, если Rx, R1 и R2 все были выбраны из водорода и x равнялся 1, что отражают следующие формулы:

или

O-карбамоил-(D)-фенилаланинол называется также моногидрохлоридом (R)-(бета-аминофенилпропил)карбамата. В случае смеси энантиомеров, когда в ней преобладает O-карбамоил-(D)-фенилаланинол, предпочтительно, чтобы его содержание составляло около 90% или более и, более предпочтительно, около 98% или более.
Соединения формулы (1) могут быть синтезированы способами, известными специалисту в данной области. Некоторые схемы реакций получения соединений формулы (1) описаны в опубликованных источниках: патенте США №5705640, патенте США №5756817, патенте США №5955499 и патенте США №6140532. Подробное описание этих реакций, а также репрезентативные примеры получения конкретных соединений описаны в опубликованных источниках: патенте США № 5705640, патенте США №5756817, патенте США №5955499 и патенте США №6140532, описание которых полностью включено в данную заявку посредством отсылок.
Соли соединении формулы (1) могут быть получены путем обработки этого соединения кислотой (НХ) в среде подходящего растворителя или способами, хорошо известными специалисту в данной области.
Из структурной формулы (1) ясно видно, что некоторые соединения по изобретению имеют, по меньшей мере, один или возможно более асимметричных атомов углерода. Подразумевается, что данное изобретение охватывает стереохимически чистые изомерные формы соединений, а также их рацематы. Стереохимически чистые изомерные формы могут быть получены при применении известных из уровня техники принципов. Диастереомеры могут быть разделены методами физического разделения, такими как фракционная кристаллизация и хроматография, а энантиомеры могут быть отделены друг от друга путем селективной кристаллизации диастереомерных солей с помощью оптически активных кислот или оснований или путем хиральной хроматографии. Чистые стереоизомеры могут быть также получены синтетическим путем из соответствующих стереохимически чистых исходных материалов или путем применения стереоселективных реакций.
Во время осуществления любого из способов получения соединений по данному изобретению может быть необходимо и/или желательно защитить быстро реагирующие или реакционноспособные группы в любой из молекул. Это может быть достигнуто с помощью общеизвестных защитных групп, таких как описанные в монографиях Protective groups in Organic Chemistry, Ed. J. F.W. McOmie, Plenum Press, 1973; и T.W. Greene & P.G.M. Wuts, Protective groups in Organic Synthesis, Third Edition, John Wiley & Sons, 1999. Защитные группы могут быть удалены на последующей стадии методами, которые известны из уровня техники.
Данное изобретение частично основывается на установлении того, что фенилалкиламинокарбаматы формулы (1), описанные выше, обладают новыми и уникальными фармакологическими свойствами. Как было показано на примере нескольких животных моделей, эти соединения имеют способность бороться с ADHD и модифицировать симптомы, связанные с наличием ADHD.
Хотя точный механизм действия таких соединений понятен неполностью, известно, что эти соединения не работают по такому же механизму, по которому действует большинство других известных лекарств, применяемых для лечения ADHD. По этой причине соединения, имеющие структурную формулу (1), особенно подходят в качестве единственного или дополнительного лекарства для лечения ADHD или для модификации симптомов, связанных с наличием ADHD.
Таким образом, эти соединения могут быть с уверенностью применены в отдельности или в комбинации с другими полезными лекарствами для повышения эффективности лечения и уменьшения проявления побочных эффектов, так как можно использовать меньшие дозы каждого лекарства.
Согласно одному из аспектов данное изобретение относится к способу лечения субъектов, страдающих от ADHD; такой способ включает доставку субъекту терапевтически эффективного количества одного или более карбаматов по данному изобретению или их фармацевтически приемлемых солей и фармацевтически приемлемого носителя, разбавителя или эксципиента.
Согласно другому аспекту настоящее изобретение предусматривает также способ уменьшения проявления, ингибирования или устранения симптомов ADHD, включая гиперактивность/импульсивность и симптомы невнимательности, у субъекта, страдающего от ADHD, который включает введение субъекту эффективного количества карбаматов согласно изобретению для уменьшения проявления, ингибирования или устранения таких симптомов.
Определения
Для удобства ниже разъясняется значение некоторых терминов, используемых в описании, в примерах и в прилагающейся формуле изобретения.
Следует иметь в виду, что данное изобретение не ограничено конкретными описанными способами, протоколами, классами и видами животных и реагентов, так как все они могут меняться. Следует также понимать, что терминология в данной заявке используется только для целей описания конкретного варианта и не ограничивает объем данного изобретения, который ограничивается только представленной формулой изобретения.
Используемый в данной заявке термин "субъект" относится к животному, предпочтительно млекопитающему, и, наиболее предпочтительно, к человеку, и мужчине, и женщине, которые являются объектами лечения, наблюдения или опыта.
Термин "терапевтически эффективное количество", применяемый в данной заявке, означает количество активного соединения или фармацевтического агента, которые вызывают биологическую или медицинскую реакцию в системе тканей животного или человека, который является объектом для исследователя, ветеринара, лечащего врача или другого клинициста, причем эта реакция включает смягчение одного или более признаков или симптомов болезни или расстройства, которые подвергаются лечению.
Термин "профилактически эффективное количество", применяемый в данной заявке, означает количество активного соединения или фармацевтического агента, которое предотвращает или уменьшает риск возникновения биологического или медицинского события в системе тканей животного или человека, который является объектом для исследователя, ветеринара, лечащего врача или другого клинициста.
Термин "фармацевтически приемлемые соли" означает нетоксичные соли соединений, применяемые согласно данному изобретению, которые обычно получают по реакции свободной кислоты с подходящим органическим или неорганическим основанием. Примеры таких солей включают, но без ограничения, ацетат, бензосульфонат, бензоат, бикарбонат, бисульфат, дитартрат, борат, бромид, соль кальция, эдетат кальция, камсилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эсилат, фумарат, глюцептат, глюконат, глутамат, гликолиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, йодид, мизотионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напсилат, нитрат, олеат, оксалат, памоат, пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, соль калия, салицилат, соль натрия, стеарат, основной ацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиоедид, валерат.
Термин "пациент, нуждающийся в лечении", используемый в данной заявке, относится к любому субъекту или пациенту, у которого в настоящее время наблюдается или может развиться любой из перечисленных выше синдромов или расстройств, включая любое расстройство настроения, когда введение одного или более соединений формулы (1) в отдельности или в комбинации с другим терапевтическим вмешательством, включая, но без ограничения, применение другого лекарственного вещества, окажет благоприятное воздействие на клиническое состояние или прогнозируемое состояние пациента.
Термины "лечение" или "излечение", используемые в данной заявке, относятся к любому признаку успеха в профилактике или уменьшении повреждения, патологии или состояния при наличии ADHD и к модификации симптомов ADHD, включая любой объективный или субъективный параметр, такой как ослабление выраженности симптома, ремиссия, уменьшения проявления симптомов или лучшая переносимость повреждения, патологии или состояния пациентом, замедление скорости дегенерации или ухудшения болезни, достижение менее изнуряющего состояния при ухудшении болезни или улучшение физического или умственного самочувствия. Наличие излечения или уменьшение проявления симптомов может быть оценено на основе объективных и субъективных параметров, включая результаты физического осмотра, неврологического осмотра и/или оценку психиатра.
Соответственно, термины "лечение" или "излечение" относятся к введению соединений или агентов по изобретению для лечения любого типа ADHD как у лиц мужского пола, так и у лиц женского пола. В некоторых случаях лечение с помощью соединений по изобретению производится в комбинации с другими соединениями для профилактики, ингибирования или остановки развития ADHD.
Термин "терапевтический эффект", используемый в данной заявке, относится к эффекту ослабления или уменьшения проявления симптомов ADHD.
Термин "терапевтически эффективное количество", используемый в данной заявке, означает количество одного или более соединений по изобретению, которое является достаточным для получения терапевтического эффекта, определение которого приведено выше, у субъекта или пациента, нуждающегося в таком лечении ADHD.
Термины "субъект" или "пациент" в данной заявке применяются как взаимозаменяемые и означают любое млекопитающее, включая, но без ограничения, людей, в том числе человека или субъекта, являющегося пациентом, которому можно вводить композиции по изобретению. Термин "млекопитающее" включает людей, как мужского, так и женского пола, и приматов, не относящихся к человеческому роду, а также экспериментальных животных, таких как кролики, крысы и мыши и другие животные.
Для определения терапевтически и профилактически эффективных доз для фармацевтической композиции по изобретению из уровня техники известны различные методы. Например, для взрослого человека среднего возраста соединение по изобретению можно применять с дневной дозой в интервале от примерно 0,1 мг до 400 мг, обычно по схеме приема 1-2 раза в день. Однако эффективное количество соединения может меняться в зависимости от конкретного применяемого соединения, способа введения, эффективности соединения и степени развития болезни. Кроме того, факторы, связанные с лечением конкретного пациента, включающие возраст пациента, его вес, режим питания и момент введения, могут привести к необходимости регулировки дозы.
Соединение по изобретению можно вводить субъекту любым подходящим способом введения, включая, но без ограничения, внутривенный, оральный, подкожный, внутримышечный, интрадермальный и парентеральный. В зависимости от метода введения соединение формулы (1) может находиться в составе любых форм. Например, формы, подходящие для орального введения, включают твердые составы, такие как пилюли, гелькапы, таблетки, каплеты, капсулы (каждая такая форма может быть с немедленным высвобождением, с синхронным высвобождением и с пролонгированным высвобождением), гранулы, а также порошки. Формы, пригодные для орального введения, включают также жидкие составы, такие как растворы, сиропы, эликсиры, эмульсии и суспензии. Кроме того, формы, которые подходят для парентерального введения, включают стерильные растворы, эмульсии и суспензии.
При приготовлении фармацевтической композиции по изобретению одно или более соединений структурной формулы (1) или соль таких соединений в качестве активного ингредиента тщательно смешивают с фармацевтическим носителем в соответствии с общепринятым способом смешения фармацевтических компонентов. При этом необходимы носители и инертные фармацевтические эксципиенты, которые включают, но без всякого ограничения, связующие, суспендирующие агенты, смазывающие вещества, ароматизаторы, подсластители, консерванты, красители и покрытия. При приготовлении композиций для орального введения можно применять любой из обычных фармацевтических носителей. Например, для жидких оральных препаратов подходящие носители и добавки включают воду, гликоли, масла, спирты, ароматизирующие вещества, консерванты, красители и т.п; для твердых оральных препаратов подходящие носители и добавки включают крахмалы, сахара, разбавители, гранулирующие агенты, смазывающие вещества, связующие, дезинтегранты и т.п.В случае парентеральных форм носители обычно включают стерильную воду, хотя могут быть включены и другие ингредиенты, например, добавки для улучшения растворимости или для сохранности препаратов. Могут быть также приготовлены суспензии для инъекции, в этом случае можно применять соответствующие жидкие носители, суспендирующие агенты и т.п.
Благодаря легкости использования таблетки и капсулы представляют собой самые благоприятные стандартные оральные лекарственные формы, в этом случае, очевидно, применяют твердые фармацевтические носители. Если желательно, таблетки могут содержать покрытие на основе сахара или энтеросолюбильное покрытие, полученное стандартным методом. Можно получать суппозитории, в этом случае в качестве носителя можно применять масло какао. Таблетки и пилюли могут иметь покрытие или же могут быть получены иначе с получением лекарственной формы, имеющей преимущество, состоящее в пролонгированном действии. Например, таблетки или пилюли могут содержать внутренний дозировочный компонент и наружный дозировочный компонент, причем последний бывает в форме оболочки для внутреннего компонента. Эти два компонента могут быть отделены друг от друга энтеросолюбильным слоем, который служит для сопротивления распаду таблетки или пилюли в желудке и дает возможность внутреннему компоненту попасть целым в двенадцатиперстную кишку или обеспечить отсроченное высвобождение. При получении таких энтеросолюбильных слоев или покрытий используемые материалы включают ряд полимерных кислот вместе с такими материалами, как шеллак, цетиловый спирт и ацетат целлюлозы.
Активное лекарство можно также вводить в виде липосомных систем для доставки, таких как небольшие униламеллярные везикулы, большие униламеллярные везикулы и мультиламеллярные везикулы. Липосомы могут быть получены из различных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины.
Активное лекарство может быть также доставлено с помощью моноклональных антител в качестве индивидуальных носителей, с которыми связаны молекулы лекарственного соединения. Активное лекарство может быть также соединено с растворимыми полимерами в качестве целевых носителей лекарства. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, сополимер полигидроксипропилметакриламид-фенол, полигидроксиэтиласпартамид-фенол или полиэтиленоксид-полилизин, замещенный пальмитоильными остатками. Кроме того, активное лекарство может быть также соединено с биоразлагающимися полимерами для достижения контролируемого высвобождения лекарства, например, с полимолочной кислотой, полигликолевой кислотой, сополимерами молочной и гликолевой кислот, поли-ε-капролактоном, полигидроксимасляной кислотой, поли-ортоэфирами, полиацеталями, полидигидропиранами, полицианакрилатами и сшитыми или амфипатическими блок-сополимерами в виде гидрогелей.
Предпочтительно, когда такие композиции находятся в виде стандартных лекарственных форм, таких как таблетки, пилюли, капсулы, порошки, гранулы, стерильные парентеральные растворы или суспензии, дозированные аэрозоли или жидкие спреи, капли, формы в ампулах или в автоинжекторах или суппозитории, для орального, парентерального, интраназальнеого, подъязычного или ректального введения или для введения путем инъекции или вдувания.
Или же композиция может находиться в виде формы, подходящей для введения один раз в неделю или один раз в месяц; например, нерастворимая соль активного соединения может быть адаптирована для получения препарата в виде лекарственного депо для внутримышечной инъекции.
Фармацевтические композиции в стандартной лекарственной форме, например, в таблетке, капсуле, порошке, составе для инъекции, в дозе, помещающейся в чайной ложке, в суппозитории, согласно данному изобретению содержат такое количество активного ингредиента, которое необходимо для доставки эффективной дозы, указанной выше. Например, фармацевтические композиции по изобретению могут содержать в стандартной лекарственной форме от примерно 25 мг до примерно 400 мг активного ингредиента. Предпочтительно, когда количество активного ингредиента находится в пределах от примерно 50 мг до примерно 200 мг.
Согласно некоторым вариантам данного изобретения карбаматные соединении, пригодные для применения при осуществлении данного изобретения, вводятся или в отдельности, или вместе с, по меньшей мере, одним или более другими соединениями или терапевтическими агентами. Согласно этим вариантам предусмотрены способы лечения ADHD у пациента. Такой способ включает стадии: введение пациенту, нуждающемуся в лечении, эффективного количества одного из карбаматных соединений, описанных в данной заявке, в сочетании с эффективным количеством одного или более других соединений или терапевтических агентов.
Следует иметь в виду, что заместители и схема замещения соединений согласно данному изобретению могут быть выбраны специалистом в данной области так, чтобы получались химически стабильные соединения, которые могут быть легко синтезированы способами, известными из уровня техники или описанными в данной заявке.
Данное изобретение включает применение выделенных энантиомеров соединения формулы (1). Согласно одному предпочтительному варианту фармацевтическая композиция, содержащая выделенный S-энантиомер соединения формулы (1), применяется для лечения ADHD у субъекта. Согласно другому также предпочтительному варианту для лечения ADHD у субъекта применяется выделенный R-энантиомер соединения формулы (1).
Данное изобретение включает также применение смеси энантиомерных соединений формулы (1). Согласно одному из вариантов данного изобретения один из энантиомеров будет преобладать. Энантиомер, который преобладает в смеси, является таким энантиомером, который содержится в смеси в количестве, большем, чем любой из других энантиомеров, содержащихся в смеси, например, в количестве, которое превышает 50%. Согласно одному из аспектов один энантиомер преобладает в количестве 90% или 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% или более. Согласно одному предпочтительному варианту энантиомер, который преобладает в композиции, содержащей соединение формулы (1), представляет собой S-энантиомер соединения формулы (1).
Данное изобретение предусматривает способы применения энантиомеров и смесей энантиомеров формулы (1). Карбаматный энантиомер формулы (1) содержит хиральный центр у второго алифатического атома углерода, смежного с фенольным кольцом.
Энантиомер, который выделяется, является энантиомером, который практически не содержит другого энантиомера. Таким образом, выделенный энантиомер представляет собой соединение, которое выделено с помощью способов выделения или получено как уже не содержащее других энантиомеров. Термин "практически не содержит", применяемый в данной заявке, означает, что это соединение получено со значительно большим количеством одного энантиомера. Согласно предпочтительному варианту это соединение включает, по меньшей мере, около 90% по весу предпочтительного энантиомера. Согласно другим вариантам изобретения такое соединение включает, по меньшей мере, около 99% по весу предпочтительного энантиомера. Предпочтительные энантиомеры могут быть выделены из рацемических смесей способом, известным специалисту в данной области, включая жидкостную хроматографию высокого разрешения (ВЭЖХ) и получение и кристаллизацию хиральных солей, или же предпочтительные энантиомеры могут быть получены способами, описанными в данной заявке.
Карбаматные соединения в качестве фармацевтических агентов
Данное изобретение предусматривает рацемические смеси, энантиомерные смеси и выделенные энантиомеры соединения формулы (1) в качестве агентов, применяемых как фармацевтические агенты. Карбаматные соединения получают в качестве фармацевтических веществ для борьбы с ADHD у субъекта.
В общем, карбаматные соединения согласно данному изобретению могут вводиться в составе фармацевтических композиций любым известным из уровня техники методом введения терапевтических лекарств, включая оральный, трансбуккальный, топический, системный методы (например, трансдермальный, интраназальный или в виде суппозитория) или интраперитонеальный метод (например, внутримышечное, подкожное введение или внутривенная инъекция). Введение соединений по изобретению непосредственно в нервную систему может включать, например, интрацеребральный, интравентрикулярный, интрацеребровентрикулярный, интратекальный, интрацистернальный, интраспинальный или периспинальный методы введения путем доставки с помощью интракраниальных или интравертебральных игл или катетеров с накачкой или без нее.
Композиции по изобретению могут быть в виде таблеток, пилюль, капсул, полутвердых форм, порошков, составов с замедленным высвобождением, растворов, суспензий, эмульсий, сиропов, эликсиров, аэрозолей или любых других подходящих форм; они могут включать, по меньшей мере, одно соединение по изобретению в комбинации с по меньшей мере одним фармацевтически приемлемым эксципиентом. Подходящие эксципиенты хорошо известны специалисту в данной области, и описание этих эксципиентов и методов получения композиций можно найти в таких стандартных справочниках, как Alfbnso AR, Remington's Pharmaceutical Sciences, 17thed., Mack publishing Company, Easton PA, 1985, описание этого источника включено в данную заявку полностью посредством отсылки и для всех целей. Подходящие жидкие носители, особенно для растворов для инъекции, включают воду, водный физиологический раствор, водный раствор декстрозы и гликоли.
Карбаматные соединения могут содержаться в водных суспензиях. Водные суспензии по изобретению могут содержать карбаматное соединение в смеси с эксципиентами, которые пригодны для получения водных суспензий. Эти эксципиенты могут включать, например, суспендирующий агент, такой как натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, смола трагаканта и смола акации, и диспергирующие или смачивающие агенты, такие как фосфатиды природного происхождения (например, лецитин), продукт конденсации окиси этилена с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации окиси этилена с длинноцепочечным алифатическим спиртом (например, гептадекаэтилен-оксицетанолом), продукт конденсации окиси этилена с частичным сложным эфиром, полученным из жирной кислоты и гексилового спирта (например, моноолеат полиоксиэтиленсорбитола) или продукт конденсации окиси этилена с частичным сложным эфиром, полученным из жирной кислоты и ангидрида гексита (например, моноолеат полиоксиэтиленсорбитана).
Водная суспензия может также содержать один или более консервантов, таких как этил- или н-пропил-п-гидроксибензоат, один или более красителей, один или более ароматизаторов и один или более подсластителей, таких как сахароза, аспартам или сахарин. Такие составы могут иметь осмолярность.
Масляные суспензии, применяемые при осуществлении способа по изобретению, могут быть получены путем суспендирования карбаматного соединения в среде растительного масла, такого как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в среде минерального масла, такого как жидкий парафин, или в смеси указанных масел. Масляные суспензии могут содержать загуститель, такой как пчелиный воск, твердый парафин или цетиловый спирт.Для получения съедобного орального препарата могут быть добавлены подсластители, такие как глицерин, сорбит или сахароза. Срок хранения этих составов может быть увеличен путем добавления антиоксиданта, такого как аскорбиновая кислота. Пример масла в качестве носителя описан в статье Minto, J. Pharmacol. Exp.Ther., 281:93-102, 1997. Фармацевтические составы по изобретению могут быть получены в виде эмульсий масло-в-воде. Масляная фаза может представлять собой растительное масло или минеральное масло, которые указаны выше, или их смесь.
Подходящие эмульгирующие агенты включают смолы природного происхождения, такие как смола акации или смола трагаканта, фосфатиды природного происхождения, такие как лецитин из соевых бобов, сложные или частичные эфиры, полученные на основе жирных кислот и ангидридов гексита, такие как моноолеат сорбитана, и продукты конденсации этих частичных эфиров с окисью этилена, такие как моноолеат полиоксиэтиленсорбитана. Эмульсия, как и сиропы и эликсиры, может также содержать подсластители и ароматизирующие вещества. Такие составы могут включать средство, уменьшающее раздражение, консервант и краситель.
Для получения аэрозолей, вводимых путем ингаляции, выбирают нужное соединение (а именно, оно должно обладать способностью распыляться), одно или в комбинации с другими подходящими компонентами. Составы аэрозолей помещают в среду приемлемых сжатых пропеллентов, таких как дихлордифторметан, пропан, азот и т.п.
Составы по изобретению, подходящие для парентерального введения, например, при помощи внутрисуставного (например, в колени), внутривенного, внутримышечного, интрадермального, интраперитонеального или подкожного методов, могут представлять собой водные и неводные изотонические стерильные растворы, которые могут содержать антиоксиданты, буферные вещества, бактериостатические агенты и растворенные вещества, которые придают составу изотоничность плазме крови намечаемого пациента, водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты, солюбилизаторы, загустители, стабилизаторы и консерванты. Среди приемлемых носителей и растворителей находятся вода и раствор Рингера, изотонический хлорид натрия.
Кроме того, в качестве растворителя или суспензионной среды обычно используют стерильные нелетучие масла. Для этой цели можно применять любое легкое нелетучее масло, включая синтетические моно- и диглицериды. Далее, при приготовлении составов для инъекции можно использовать жирные кислоты, такие как олеиновая кислота. Получаемые растворы являются стерильными и обычно не содержат нежелательных веществ.
Если соединения обладают достаточной растворимостью, они могут быть растворены непосредственно в обычном физиологическом растворе с применением подходящих органических растворителей или без них.
В водном растворе крахмала или натриевой соли карбоксиметилцеллюлозы или в подходящих маслах, таком как арахисовое, можно приготовить дисперсии тонкоизмельченных соединений. Эти составы могут стерилизоваться обычными хорошо известными методами стерилизации. Эти составы могут содержать вспомогательные фармацевтически приемлемые вещества, которые требуются для условий, близких к физиологическим, такие как буферные агенты, устанавливающие или регулирующие величину рН, агенты, регулирующие тоничность, например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и т.п.
Концентрация карбаматного соединения в этих составах может меняться в значительной степени и выбирается, в основном, в зависимости от объемов жидкостей, вязкости состава, веса субъекта и т.п., в соответствии с выбранным конкретным методом введения и потребностями пациента. При введении на фазе IV состав может быть стерильным препаратом для инъекций, таким как стерильная водная или масляная суспензия для инъекций. Такая суспензия может быть получена в соответствии с известными из уровня техники способами с использованием подходящих диспергирующих или смачивающих агентов. Стерильный препарат для инъекций может быть также в виде стерильного раствора для инъекций или суспензии в нетоксичном разбавителе или растворителе, которые применяются для парентерального введения, например, в виде раствора в 1,3-бутандиоле. Рекомендуемые составы могут находиться в герметичных контейнерах с единичными дозами или с множеством доз, таких как ампулы и флаконы. Растворы и суспензии для инъекции могут быть приготовлены из стерильных порошков, гранул и таблеток, описанных выше. Карбаматное соединение, пригодное для использования в практике данного изобретения, может быть введено, и предпочтительно вводится, перорально. Количество такого соединения по изобретению может меняться в значительной степени в зависимости от вида композиции, величины единичной дозы, вида эксципиентов и других факторов, хорошо известных специалисту. В общем, конечная композиция может содержать, например, от 0,000001% по весу (% вес.) до 50% вес. карбаматного соединения, предпочтительно, от 0,00001% вес. до 25% вес., остальное составляет эксципиент или эксципиенты.
Фармацевтические композиции для орального введения могут быть составлены в рецептуру при помощи фармацевтически приемлемых носителей, хорошо известных специалисту в данной области, применяемых в количествах, подходящих для орального введения. Такие носители дают возможность получать фармацевтические композиции в виде стандартных лекарственных форм, таких как таблетки, пилюли, порошки, драже, капсулы, жидкости, леденцы, гели, сиропы, дисперсии, суспензии и т.д., подходящих для приема внутрь пациентом.
Составы, подходящие для орального введения, могут представлять собой: (а) жидкий раствор, содержащий, например, эффективное количество фармацевтического состава, суспендированного в разбавителях, таких как вода, физиологический раствор или полиэтиленгликоль (PEG) 400; (б) капсулы, саше или таблетки, при этом каждая из этих форм содержит заданное количество активного ингредиента, жидкого, твердого в виде гранул или геля; (в) суспензию в подходящей жидкости и (г) эмульсии.
Фармацевтические препараты для орального введения могут быть получены при применении комбинации соединений по изобретению с твердым эксципиентом, возможного размалывания полученной смеси и ее переработки в гранулы после добавления дополнительных компонентов; если это желательно, получают таблетки или сердцевины для драже. Подходящие твердые эксципиенты представляют собой углеводы или белки и включают, но без ограничения, сахара, в том числе лактозу, сахарозу, манит или сорбит, крахмал из кукурузы, пшеницы, риса, картофеля и других растений; целлюлозу, такую как метилцеллюлоза, гидроксиметилцеллюлоза, гидроксипропилметилцеллюлоза или натриевая соль карбоксиметилцеллюлозы, и смолы, такие как гуммиарабик и смола трагаканта, а также белки, такие как желатин и коллаген.
Если это желательно, могут быть добавлены дезинтегрирующие или солюбилизирующие вещества, такие как сшитый поливинилпирролидон, агар, альгиновая кислота или ее соль, такая как альгинат натрия. Таблетки могут включать один или более компонентов, выбранных из лактозы, сахарозы, маннита, сорбита, фосфатов кальция, кукурузного крахмала, картофельного крахмала, микрокристаллической целлюлозы, желатина, коллоидной двуокиси кремния, талька, стеарата магния, стеариновой кислоты и других эксципиентов, красителей, наполнителей, связующих, разбавителей, буферных агентов, увлажняющих агентов, консервантов, веществ, придающих вкус, красителей, дезинтегрантов и носителей, которые являются фармацевтически совместимыми. Леденцы могут представлять собой смесь активного ингредиента с веществом, придающим вкус, например, с сахарозой, пастилки могут содержать активные ингредиенты в инертной основе, такой как желатин и глицерин, могут быть эмульсии в среде сахарозы или смолы акации, гели и т.п., содержащие в дополнение к активным ингредиентам носители, известные из уровня техники.
Соединения по изобретению могут также применяться в виде суппозиториев для ректального введения лекарства. Эти составы можно получать смешением лекарства с подходящим нераздражающим эксципиентом, который находится в твердом виде при обычной температуре, но становится жидким при ректальной температуре и поэтому расплавляется в прямой кишке с высвобождением лекарства. Такие эксципиенты представляют собой масло какао и полиэтиленгликоли.
Соединения по изобретению могут также вводиться интраназально, интраокулярно, интравагинально и ректальным путем, в том числе с помощью суппозиториев, а также путем вдувания порошков и применения аэрозольных составов (например, стероидных составов, см. Rohatagi, J. Clin. Pharmacji., 35, 1187-1193, 1998; Tjwa, Ann. Allergy Asthma Immunol. 75,107-111,1995.
Соединения по изобретению могут также доставляться трансдермально топическим путем, с помощью аппликаторов, в виде растворов, суспензий, эмульсий, гелей, кремов, мазей, паст, желе, лаков, порошков и аэрозолей.
Вместе с соединением по изобретению можно применять инкапсулирующие материалы, термин "композиция" в данном случае означает, что состав содержит активный ингредиент вместе с инкапсулирующим материалом и другими носителями или без них. Например, соединение по изобретению может быть доставлено в виде микросфер с целью медленного высвобождения активного ингредиента в организме. Согласно одному из вариантов микросферы могут вводиться путем интрадермальной инъекции микросфер, содержащих лекарство (например, мифепристона), (см., например, Gao, Pharm. Res. 12: 857-863,1995); или в виде микросфер для орального введения (см., например, Eyies, J. Pharm. Pharmacol. 49:669-674,1997). И трансдермальный, и интрадермальный способы введения позволяют осуществить непрерывную доставку лекарства в течение нескольких недель или месяцев. Для доставки соединений по изобретению можно также использовать саше.
Согласно другому варианту соединения по изобретению могут быть доставлены с помощью липосом, которые сливаются с клеточной мембраной и происходит их эндоцитоз, то есть к липосоме присоединены лиганды, которые связываются с рецепторами-белками на поверхности клеточной мембраны, приводя к эндоцитозу. За счет применения липосом, особенно таких, на поверхности которых имеются лиганды, специфические по отношению к клеткам-мишеням, или, предпочтительно, липосом, нацеленных на конкретный орган, можно сфокусировать доставку карбаматного соединения в клетки-мишени in vivo (См., например, Al-Muhammed, J. Microencapsul. 13, 293-306, 1996; Chonn, Curr. Opin. Biotechnol. 6, 698-708, 1995; Ostro, Am. Hosp.Pharm. 46, 1576-1587,1989).
Фармацевтические составы по изобретению могут быть получены на основе солей, получаемых из многих кислот, включая, но без ограничения, соляную, серную, уксусную, малеиновую, винную, яблочную, янтарную и другие кислоты. Соли обычно являются более растворимыми в воде и других протонных растворителях, которые можно применять в случае свободных оснований. В других случаях предпочтительный препарат представляет собой лиофилизированный порошок, который может содержать, например, любой из следующих компонентов или все эти компоненты: 1 мМ - 50 мМ гистидина, 0, 5% - 2% сахарозы, 2% -7% маннита, при величине рН в пределах от 4,5 до 5,5, которая достигается путем добавления буферных веществ перед применением состава.
Фармацевтически приемлемые соли относятся к солям, которые приемлемы в фармацевтике и имеют желаемые фармакологические свойства. Такие соли могут быть получены тогда, когда кислые протоны в соединениях способны реагировать с неорганическими или органическими основаниями. Подходящими неорганическими солями являются соли, полученные с помощью щелочных металлов, таких как натрий, калий, магний, кальций и алюминий. Подходящие органические соли включают соли, полученные на основе органических оснований, таких как амины, например, этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и т.п. Фармацевтически приемлемые соли могут также включать соли присоединения к кислотам, образовавшиеся по реакции аминогрупп в родительском соединении с неорганическими кислотами (например, соляной и бромистоводородной кислотами) и с органическими кислотами (например, уксусной кислотой, лимонной кислотой, малеиновой кислотой и алкан- и арен-сульфокислотами, такими как метансульфокислота и бензосульфокислота). Когда в соединении содержатся две кислые группы, фармацевтически приемлемая соль может представлять собой монокислоту-моносоль или дисоль; точно также, когда в соединении содержатся более двух кислых групп, некоторые из них или все могут образовывать соли.
Соединения, указанные в данной заявке, могут быть не в солевой форме или в солевой форме и указание таких соединений означает, что они включают и исходное соединение (не являющееся солью), и их фармацевтически приемлемые соли.
Данное изобретение включает фармацевтически приемлемые соли соединения формулы (1). Может быть более, чем одна приемлемая форма энантиомера соединения формулы (1) и такие формы также охвачены настоящим изобретением.
Фармацевтические композиции по изобретению могут помимо карбаматного соединения содержать, по меньшей мере, один другой терапевтический агент, пригодный для лечения ADHD. Например, карбаматные соединения формулы (1) могут быть в виде физической смеси с другими агентами для лечения ADHD при фиксированных дозах для упрощения их введения.
Способы получения фармацевтических композиций описаны в многочисленных публикациях, таких как Pharmaceutical Dosage Forms: Tablets. Second edition, Revised and Expanded. Volumes 1-3, edited by Lieberman et al.; Pharmaceutical Dosage Forms: Parenteral Medications. Volumes 1-2, edited by Avis et al; и Pharmaceutical Dosage Forms: Dispersed Systems. Volumes 1-2, edited by Lieberman et al; published by Marcel Dekker Inc., описание которых включено в данную заявку посредством отсылок полностью и для всех целей.
Режимы дозирования
Данное изобретение предусматривает способы борьбы с проявлением ADHD у млекопитающего с помощью карбаматных соединений. Количество карбаматного соединения, необходимое для ослабления или лечения ADHD, определяется как терапевтически или фармацевтически эффективная доза. Схема дозирования и эффективные количества, а именно, схема подбора доз и дозирования, будут зависеть от различных факторов, включая стадию развития болезни, физическое состояние пациента, его возраст и т.п. При определении схемы приема для пациента во внимание принимается также способ введения.
Специалист в данной области, пользуясь своими знаниями и данным описанием, способен без недолжного экспериментирования определить терапевтически эффективное количество конкретного замещенного карбамата в практике осуществления данного изобретения (см., например, Lieberman, Pharmaceutical Dosage Forms (Vols. 1-3, 1992); Lloyd, 1999, The Art, Science and Technology of Pharmaceutical Compounding; и Pickar, 1999, Dosage Calculations). Терапевтически эффективная доза также является дозой, при которой терапевтически благоприятные эффекты от применения активного агента перевешивают любое токсическое действие или неблагоприятные побочные эффекты активного агента. Следует также отметить, что для каждого конкретного субъекта определяется конкретная схема приема, которая регулируется со временем в соответствии с необходимостью для пациента и профессиональным суждением специалиста, который осуществляет введение или наблюдает за введением соединений.
С целью лечения композиция или соединение, описанные в данной заявке, могут вводиться субъекту в виде одиночного болюса, путем непрерывной доставки лекарства в течение продолжительного периода времени или по протоколу, предусматривающему повторяющееся введение (например, каждый час или каждый день). Фармацевтические композиции по изобретению могут вводиться, например, один раз или несколько раз ежедневно, три раза в неделю или еженедельно. В соответствии с одним из вариантов данного изобретения фармацевтический состав вводится перорально один или два раза ежедневно.
В контексте данной заявки терапевтическая доза карбаматного соединения может быть повторяющейся без продолжительного периода лечения, что обеспечивает клинически значимые результаты лечения ADHD. Определение эффективных доз в этом контексте основывается обычно на результатах изучения животных моделей с последующим клиническим испытанием на людях, при этом руководствуются определением эффективного дозирования и протоколами введения, что значительно уменьшает появление или серьезность симптомов или состояний у субъекта. В этом отношении подходящие модели могут включать мышиные модели, крысиные модели, свиные модели, модели кошек и приматов, не относящихся к человеческому роду, и других животных, известных для этих целей из уровня техники.
Или же эффективные дозы могут быть определены с помощью in vitro моделей (например, проведения иммунологического и гистопатологического анализов). Когда применяются такие модели, требуются только обычные расчеты и регулировка для определения подходящей концентрации и дозы для введения терапевтически эффективного количества биологического агента (агентов), (то есть количества, которое эффективно при интраназальном, трансдермальном, внутривенном или внутримышечном введения для получения желаемой реакции пациента).
При осуществлении одного из вариантов данного изобретения стандартные лекарственные формы соединений получают для стандартных схем введения. Таким образом, композиция может быть легко разделена на меньшие дозы по указанию врача. Например, стандартные дозы могут быть приготовлены в виде порошков в упаковке, во флаконах или ампулах и, предпочтительно, в виде капсул или таблеток.
Активное соединение, содержащееся в этих стандартных дозированных формах, может быть в количестве, например, от примерно 10 мг до примерно 1 г или более для однократного или многократного ежедневного введения в соответствии с потребностями конкретного пациента. Начиная схему лечения с минимальной дневной дозы равной около одного грамма, определяют концентрацию карбаматных соединений в плазме крови для того, чтобы установить, меньшая или большая доза показана пациенту.
Эффективное количество карбаматных соединений по изобретению может быть введено, например, в виде оральной или парентеральной дозы, составляющей от примерно 0,01 мг/кг до примерно 150 мг/кг. Предпочтительно вводить дозу от примерно 0,1 мг/кг до примерно 25 мг/кг, еще более предпочтительно, от примерно 0,2 мг/кг до примерно 18 мг/кг. Следовательно, терапевтически эффективное количество активного ингредиента, содержащегося в стандартной дозе, может быть равным, например, от примерно 1 мг/день до примерно 7000 мг/день для субъекта, средний вес которого равен 70 кг.
Способы по данному изобретению применяются также с использованием наборов для лечения ADHD. После того, как фармацевтическую композицию, содержащую одно или более карбаматных соединений согласно данному изобретению с возможно добавленными одним или более другими соединениями, представляющими терапевтический интерес, получают в подходящем носителе, она может быть помещена в соответствующий контейнер с этикеткой, указывающей, что она предназначена для лечения ADHD. Дополнительно, другой фармацевтический препарат, включающий, по меньшей мере, один другой терапевтический агент, пригодный для лечения ADHD, может быть также помещен в контейнер, на котором этикетка указывает его назначение для лечения определенной болезни. Такая этикетка может содержать, например, инструкции, касающиеся количества, частоты и способа введения каждого фармацевтического агента.
Хотя настоящее изобретение было описано подробно только в качестве примера для целей ясности его понимания, для специалиста является очевидным, что в объеме прилагающейся формулы изобретения могут быть сделаны некоторые изменения и модификации, подразумеваемые данным изобретением, без лишнего экспериментирования. Следующие ниже примеры приводятся для иллюстрации конкретных аспектов данного изобретения и не ограничивают его.
Лучшее понимание данного изобретения будет достигнуто в свете следующих примеров, которые представлены для иллюстрации, но не предназначены для ограничения настоящего изобретения.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Пример 1
Испытуемое соединение (O-карбамоил-(D)-фенилалатнол), которое вводили внутрибрюшинно (IP), применяли для проведения поведенческого опыта с целью оценки поведения крыс при перемене схемы зрительного различия. Животным, которым вводили 3,0 мг/кг или 30 мг/кг испытуемого соединения или амфетамин, требовалось меньшее количество попыток для достижения уровня критериев поведения, и они имели лучшие баллы по шкале оценки точности по сравнению с крысами, которым вводили носитель. Таким образом, представляется, что испытуемое соединение при его применении в некоторых дозах улучшает поведенческие реакции крыс при проведении этого опыта подобно действию d-амфетамина.
(Методы)
Сорок взрослых самцов крыс Long-Evans (Charles River Laboratories, Wilmington, MA), вес которых в начале опыта был равен примерно 250 г, использовали в качестве субъектов в этом опыте.
Каждую поступающую партию крыс до объединения со всей популяцией изолировали на 5 дн. Крысам давали еще минимум одну неделю на акклиматизацию до начала их обучения.
Испытуемые соединения растворяли в стерильном 0,9%-ном физиологическом растворе с получением концентрации, составлявшей 3,0, 10,0 и 30,0 мг/мл. Референсное соединение, d-амфетамин, также растворяли в стерильном 0,9%-ном физиологическом растворе с получением концентрации, равной 1,0 мг соли амфетамина в мл раствора.
После начала оперантного обучения крыс помещали в индивидуальном порядке. Количество корма было ограничено 12-20 г в день для поддержания веса, равного 85-90% от величины веса крыс, который достигается при свободном доступе к корму (проводилось сравнение с крысами, получавшими корм без ограничения). Крыс никогда не лишали воды, они продолжали набирать вес в течение всего опыта.
После достижения крысами уровня критериев обучения на стадии I обучения их распределяли по группам; группы подбирали по поведенческим признакам (по количеству дней до достижения уровня критериев поведения) на стадии I обучения. Этот опыт проводился по смешанному плану (величины доз x повторяющиеся стадии обучения). Использовали пять уровней дозирования: дозы испытуемого соединения равные 1, 3 и 10 мг/кг, 0,9% физиологический раствор (носитель) и сульфат d-амфетамина с дозой 1,0 мл/кг. Обучение животных проводили в 10 рабочих камерах (Med Associates), которые содержали два выдвигающихся рычага на передней стенке. В камере имелись две стимулирующих лампочки, по одной над каждым рычагом. Контейнеры с пищей помещали между двумя рычагами на передней стенке, нажимаемыми при наличии реакции, о помещении корма сигнализировала лампочка, помещенная на контейнере. Извлечение гранулированного корма фиксировалось фотодатчиком внутри контейнера с кормом. Тусклое освещение в камере обеспечивалось при помощи лампочки, помещенной над центральной частью передней стенки.
Вначале животных обучали нажимать на рычаг для извлечения корма. На этой стадии оба рычага были вдавлены в стенку камеры, и животные получали гранулы весом 45 мг при нажимании на рычаг. Боковое смещение предотвращалось путем выдвигания рычага, как только он нажимался более пяти раз по сравнению с числом нажатий на другой рычаг. Через 3 дня обучения со 100 нажатиями на рычаг крыс перемещали на стадию I обучения. На этой стадии животных учили нажимать на рычаг под зажженной сигнальной лампочкой. Во время каждой попытки одна из сигнальных лампочек (выбранных произвольно) зажигалась на 1 с перед поднятием рычага (предел равнялся 30 с). После вдавливания рычагов в стенку камеры нажатие на ближайший рычаг обеспечивало получение гранулированного корма. Нажатие на дальний рычаг приводило к перерыву, о котором сигнализировало включение лампочки на 5,0 с.После или правильного, или неправильного нажатия на рычаг, или после промаха рычаги выдвигали на меняющийся промежуток времени между циклами (ITI; 5 с+1-1 с). После достижения стабильной реакции крыс (в течение двух последовательных дней коэффициент точности был более 80%) на этой стадии животных начинали обучать при введении лекарств (стадия II обучения).
На стадии II животных делили на пять групп по принципу достижения точности и числу попыток для достижения нормативов. В каждой группе животным вводили от одной до трех доз испытуемого соединения (3,0, 10,0 или 30,0 мг/кг, IP), амфетамин (1,0 мг/кг, IP) или носитель (физиологический раствор) за час до проведения поведенческого эксперимента. На стадии II схема зрительного различия отличалась от схемы различия на стадии I тем, что теперь животных поощряли за нажатие рычага, отдаленного от сигнальной лампочки. Животным вводили лекарства и носитель ежедневно примерно за 60 мин до начала обучения. Обучение продолжалось до тех пор, пока животные в течение двух последовательных дней не достигали 80% точности при новом умении различать раздражители.
Полученные данные анализировали с помощью компьютерной программы SPSS 12.0 для Windows (SPSS Inc., Chicago, IL). Применяли метод анализа ANOVA для смешанного плана с целью обработки данных, характеризующих точность реакции.
Для обработки данных по критериям на стадии II обучения использовали простой метод однофакторного дисперсионного анализа ANOVA. (Результаты)
Точность реакции. Испытуемое соединение приводило к достижению гораздо более лучшего поведения при перемене схемы зрительного различения, что характеризовалось величиной коэффициента точности. Смешанная модель метода анализа ANOVA выявила значительные основные результаты по количеству попыток (F19,665=365,60, р<0,001) и в группах (F4,35=3,08, р=0,028), но более важным является то, что была выявлена значительная группа с эффектом сопряженности (F76,665=1,78, р=0,019). Визуальная оценка графика (см. Фигуру 1) показывает, что носитель и испытуемое соединение с дозой 10,0 мг/кг имели более низкие показатели, чем испытуемое соединение с дозой 3,0 мг/кг или 30,0 мг/кг и амфетамин с дозой 1,0 мг/кг.
Количество попыток на стадии II обучения. Испытуемое соединение обеспечивало лучшее поведение при перемене схемы зрительного различения, о чем свидетельствует количество попыток, потребовавшихся для достижения нормативов (см. Фигуру 2). Метод однофакторного дисперсионного анализа ANOVA выявил влияние на число попыток (F4,35=1,78, р=0,006). Метод парного сравнения (р<0,05) подтвердил, что для животных в группе, которой вводили носитель, потребовалось большее количество попыток для достижения нормативов поведения по сравнению с количеством попыток, потребовавшихся для животных, которым ежедневно вводили 3,0 мг/кг или 30,0 мг/кг испытуемого соединения или 1,0 мг/кг d-амфетамина (см. звездочки на Фигуре 2). Животные, которым вводили 10 мг/кг испытуемого соединения, не отличались от животных, которым вводили носитель, но отличались от животных, получавших дозу испытуемого соединения равную 30 мг/кг и животных, получавших дозу d-амфетамина. На Фигуре 2 значок "*" означает р<0,05 по сравнению с контрольной группой, которой вводили носитель, о чем свидетельствовала величина LSD (наименьшая значимая разность), полученная методом парного сравнения.
ПРИМЕР 2
Испытуемое соединение, вводимое подкожно (SC) с дозами равными 10, 30 и 100 мг/кг, оценивали для определения влияния на спонтанную активность мышей дикого типа и гомозиготных мутантных мышей, "нокаутированных" (КО) по переносчику дофамина (ДАТ-нокаутированных), которые имеют некоторые общие признаки с пациентами, у которых диагностирован ADHD. Испытуемое соединение селективно снижало активность КО мышей и это снижение зависело от дозы, что позволяет предположить, что испытуемое соединение очень эффективно при подавлении гиперактивности ДАТ-нокаутированных мышей.
(Методы)
Самцы и самки мышей дикого типа (WT) и ДАТ-нокаутированных мышей (n=примерно 10 мышей/генотип/агент) после инъекции носителя или испытуемого соединения применяли для изучения спонтанной активности в открытом пространстве в полевых условиях. Мышей помещали в открытое поле на 30 мин и вводили SC носитель (стерильную воду), 2 мг/кг амфетамина или испытуемое соединение в трех концентрациях (10, 30, 100 мг/кг). Все лекарства вводили в объеме 5 мл/кг. Затем животных возвращали в открытое поле еще на 90 мин. Спонтанную активность оценивали на приборе Omnitech Digiscan (Accuscan Instruments, Columbus, ОН). Показатели активности, измеренные с интервалом в 5 мин в течение 2 ч, суммировали. Горизонтальную активность, или двигательную активность, измеряли по общему расстоянию в см, вертикальную активность, или стояние на весу, измеряли по общему числу вертикальных стоек (вставаний на задние лапки), стереотип оценивали по повторяющимся перерывам в вертикальных стойках с интервалами менее, чем в 1 с. При проведении опыта использовали 10 мышей дикого типа (WT) и 10 КО мышей с примерно равным количеством самцов и самок в каждой испытуемой группе. Полученные данные анализировали с помощью Statistical Package для программ Social Sciences (версия 11.0 для Windows; SPSS Science,Chicago, IL). Результаты для каждой зависимой переменной величины анализировали методом анализа вариантности (RMANOVA) эффектов у субъектов (разница между группами во времени) и между субъектами (определение основных эффектов и взаимодействий). Применяли метод парных сравнений с поправкой Бонферрони в качестве апостериорных post- hoc тестов. Параметр р<0,05 считался статистически значимым.
(Результаты)
Исходные данные: Мыши КО проявляли большую степень двигательной активности, характеризовались большим количеством стоек на весу и стереотипической активностью по сравнению с мышами WT.
Лечение лекарствами: Амфетамин с дозой 2 мг/кг приводил к увеличению активности, количества стоек на весу и стереотипической активности у мышей WT и снижал эти показатели у КО мышей по сравнению с животными, которым вводили носитель. Испытуемое соединение снижало активность в зависимости от дозы и применение дозы равной 100 мг/кг подавляло эти виды активности более эффективно по сравнению с амфетамином. Обратите внимание на показатели двигательной активности на Фигуре 3 (пройденное расстояние в см), которая исчезла через 90 мин после инъекции амфетамина (АМРН) и испытуемого соединения. Число стоек на весу и стереотипическое поведение характеризовались похожими результатами.
ПРИМЕР 3
Испытуемое соединение оценивали по способности связывать переносчики дофамина, норэпинефрина и серотонина и по действию на обратный захват дофамина, норэпинефрина и серотонина. Испытуемое соединение характеризовалось слабым связыванием переносчика дофамина и норэпинефрина и слабым действием на обратный захват дофамина и норэпинефрина по сравнению с кокаином.
(Методы)
Неизвестные соединения взвешивали и растворяли в диметилсульфоксиде с получением исходных растворов, содержащих 10 или 100 мМ соединения. Проводили начальное разведение до 50 или 500 мкМ в буфере для анализа связывания и до 1 или 10 мм в буфере для анализа обратного захвата. Последующее разведение производили буфером для анализа, дополненным ДМСО, конечная концентрация составляла 0,1% в ДМСО. Отмеривание пипеткой проводили с помощью роботизированной станции Biomek 2000.
Применяемые величины концентраций испытуемого соединения
Интервал величин концентраций для анализа
Связывание:
hDAT 21,6 нМ-100 мкМ
hSERT 21,6 нМ-100 мкМ
hNET 21,6 нМ-10 мкМ
Обратный захват:
hDAT 31,6 нМ-10 мкМ
hSERT 31,6 нМ-100 мкМ
nNET 31,6 нМ-100 мкМ
Ингибирование связывания радиолиганда [125I]RTI-SS с hDAT, hSERT или hNET в клональных клетках:
Приготовление клеток: Клетки НЕК293, экспрессирующие hDAT, hSERT или hNET, выращивали до достижения 80% конфлюэнтности на чашках Петри с диаметром 150 мм для тканевых культур, они служили источником клеток тканей. Клеточные мембраны готовили следующим образом. Среду сливали с чашки и чашки промывали 10 мл физиологического раствора с фосфатным буфером, не содержащим ионов кальция и магния. Добавляли буфер для лизиса (10 мл; 2 мМ HEPES с 1 мМ ЭДТА). Через 10 мин клетки соскабливали с поверхности чашек, помещали в трубку центрифуги и центрифугировали при 30000 x г в течение 20 мин. Удаляли надосадочную жидкость и полученный осадок снова суспендировали в 12-32 мл раствора 0,32 М сахарозы, применяя датчик Polytron с установкой 7-10 с.Объем для повторного суспендирования зависел от плотности сайтов связывания в клеточной линии и выбирался для отражения связывания в 10% или менее от общей величины радиоактивности. Условия анализа:
Каждая пробирка для анализа содержала 50 мкл препарата мембран (примерно 10-15 мкг белка), 25 мкл низвестного соединения, применяемого для определения неспецифического связывания или буфер (Krebs-HEPES, рН 7,4; 122 мМ NaCl, 2,5 мМ CaCl2, 1,2 мМ MgSO4, 10 мМ паргилин, 100 мкМ трополон, 0,2% глюкозу и 0,02% аскорбиновую кислоту, забуферено 25 мМ HEPES), 25 мкл [125I]RTI-55 (конечная концентрация 40-80 пМ) и дополнительный буфер в количестве, достаточном для получения конечного объема, равного 250 мкл. Мембраны предварительно инкубировали в присутствии неизвестного соединения в течение 10 мин перед добавлением радиолиганда [125I]RTI-55. Пробирки для анализа подвергали инкубированию при температуре 25°С в течение 90 мин. Процесс связывания заканчивали фильтрованием через фильтры GF/C, используя 96-луночный планшет Tomtec. Фильтры промывали в течение 6 с ледяным физиологическим раствором. Сцинтилляционную жидкость добавляли в каждую ячейку и измеряли радиоактивность остатка на фильтре при помощи µ- или β-ридера для планшетов Wallac. Специфическое связывание определяли в виде разницы в связывании, наблюдаемой в присутствии 5 мкМ мазиндола (HEK-hDAT и HEK-hNET) или без него или 5 мкМ имипрамина (HEK-hSERT). Проводили два или три сравнительных эксперимента в двух повторностях. Для анализа данных применяли программу GraphPAD Prism при превращении величин IC50 в величины Ki, используя уравнение Ченга-Прусоффа (Cheng-Prusoff) (Ki=IC50/(1+([RTI-55/Kd RTI-55))). Метод фильтрационного анализа ингибирования обратного захвата [3Н]-нейротрансмиттера в клетках НЕК293, экспрессирующих переносчики рекомбинантного биогенного амина:
Приготовление клеток: Клетки выращивали до достижения конфлюэнтности, как описано выше. Среду удаляли, и клетки дважды промывали физиологическим раствором, содержащим фосфатный буфер (PBS) при комнатной температуре. После добавления буфера Krebs-HEPES планшеты нагревали в водяной бане при температуре 25°С в течение 5 мин. Клетки аккуратно соскабливали и затем растирали в порошок при помощи пипетки. Клетки из многих планшетов объединяли. Один планшет продуцирует достаточное количество клеток для 48 лунок, что требуется для получения данных на двух полных кривых для неизвестных соединений. Условия анализа ингибирования обратного захвата:
Анализ проводили в 96 флаконах объемом 1 мл. Во флаконы добавляли буфер Krebs-HEPES (350 мкл) и неизвестные соединения, применяемые для определения неспецифического обратного захвата, или буфер (50 мкл), и флаконы помещали в водяную баню с температурой 25°С. Специфический обратный захват определяли как разницу в поглощении, наблюдаемом в присутствии 5 мкМ мазиндола (HEK-hDAT и HEK-hNET) или без него или 5 мкМ имипрамина (HEK-hSERT). Добавляли клетки (50 мкл) и проинкубировали их в присутствии неизвестных соединений в течение 10 мин.
Анализ начинали с добавления [3H]дофамина, [3H]серотонина или [3H]норэпинефрина (50 мкл, конечная концентрация была равна 20 нМ). Для окончания обратного захвата через 10 мин применяли фильтрование через фильтры Whatman GF/C, предварительно пропитанные 0,05%-ным полиэтиленимином. Рассчитывали величины IC50, применяя программу GraphPAD Prism для кривых в трехкратном повторе, построенных с использованием 6 величин концентраций лекарства каждая. Проводили две или три независимых расшифровки каждой кривой.
(Результаты)
Испытуемое соединение испытывали на его действие на связывание радиолиганда [125I]RTI-55 с [3H]дофамином и обратный захват [3H]дофамина клетками НЕК, экспрессирующими кДНК для переносчика человеческого дофамина (клетками НЕК-hDAT), его действие на связывание радиолиганда [125I]RTI-55 с серотонином и обратный захват серотонина клетками НЕК, экспрессирующими кДНК для переносчика человеческого серотонина (клетками HEK-hSERT) и его действие на связывание радиолиганда [125I]RTI-55 с [3H]норэпинефрином и обратный захват [3Н]норэпинефрина клетками НЕК, экспрессирующими кДНК для переносчика человеческого норэпинефрина (клетками HEK-hNET). В клетках НЕК-hDAT сродство соединения к сайту связывания было меньше, чем сродство кокаина, стандартного соединения, к тому же сайту (сайтам).
Величина К; для замещения [125I]RTI-55 испытуемым соединением составила 14,200 нМ, а величина К; для замещения [125I]RTI-55 кокаином была равна 236 нМ. При определении обратного захвата испытуемое соединение было менее активно при блокировании обратного захвата [3H]дофамина с величиной IC50 равной 2900 нМ по сравнению с кокаином (IC50=385 нМ). Коэффициент Хилла, отличающийся от единицы, позволил предположить наличие сложных взаимодействий с сайтами связывания иди обратного захвата (Таблица 1).
В клетках HEK-hSERT величина сродство указанного соединения к сайту связывания была ниже, чем величина сродства кокаина, стандартного соединения, к этому же сайту (сайтам). Величина Ki для замещения [125I]RTI-55 испытуемым соединением была равна 815000 нМ, a Ki для замещения [125I]RTI-55 кокаином составляла 361 нМ. При определении степени обратного захвата испытуемое соединение было менее активным при блокировании обратного захвата [3H]серотонина, величина IC50 была равна 100 мкМ, а в случае кокаина величина IC50 составляла 355 нМ (см. Таблицу 2).
В клетках HEK-hNET величина сродство указанного соединения к сайту связывания была ниже, чем величина сродства кокаина, стандартного соединения, к этому же сайту (сайтам). Величина Ki для замещения [125I]RTI-55 испытуемым соединением была равна 3700 нМ, а Ki для замещения [125I]RTI-55 кокаином составляла 505 нМ. При определении степени обратного захвата испытуемое соединение было менее активным при блокировании обратного захвата [3H]норэпинефрина, величина IC50 была равна 4400 нМ, а в случае кокаина величина IC50 составляла 194 нМ (см. Таблицу 3).
Числа отражают стандартную ошибку среднего (SEM) по результатам, по меньшей мере, трех независимых экспериментов, при этом каждый эксперимент проводили дважды (определение связывания) или трижды (определение степени обратного захвата). Когда величины Ki или IC50 для испытуемого соединения были больше 10 мкМ, проводились только два эксперимента и не было указано стандартное отклонение.
ПРИМЕР 4
Для испытуемого соединения определяли его действие на внеклеточную концентрацию моноаминергического нейротрансмиттера, образцы отбирали in vivo путем проведения микродиализа мозга в областях префронтальной коры и полосатого тела мозга у свободно передвигающихся и находящихся в сознании крыс. Введение испытуемого соединения в дозе 30 мг/кг привело к увеличению концентрации дофамина в полосатом теле и концентрации норэпинефрина в префронтовой коре мозга. (Методы)
Диализаты мозга отбирали у самцов крыс Sprague-Dawley, которым постоянно имплантировали микродиализные канюли в перфронтальную кору и в стриатум (полосатое тело) мозга, при этом использовали зонды. Действие различных доз испытуемого соединения (10 мг/кг и 30 мг/кг, вводились подкожно) или носителя (физиологический раствор, 0,9% NaCl) оценивали в трех образцах, отбираемых через 50 мин в начале опыта, и в восьми образцах, отбираемых через 50 мин после введения. Концентрации дофамина, норэпинефрина и серотонина в двух различных областях мозга определяли с помощью метода ВЭЖХ/ECD (ВЭЖХ с электронозахватным детектором) с целью определения любого действия соединения. (Результаты)
Испытуемое соединение в дозе 10 мг/кг не оказывало стойкого влияния на внеклеточные концентрации нейротрансмиттеров ни в одной из исследованных областей мозга. Только в дозе 30 мг/кг испытуемое соединение приводило к увеличению концентрации дофамина в полосатом теле и концентрации норэпинефрина в префронтовой коре мозга с получением довольно переменных величин без заметного влияния на другие исследованные нейротрансмиттеры.
На Фигуре 4 показано влияние испытуемого соединения (10 мг/кг и 30 мг/кг, вводилось подкожно) или носителя (0,9% NaCl) на внеклеточные концентрации дофамина в полосатом теле мозга крыс в трех исходных образцах и 8 отобранных последовательно после введения образцах, а на Фигуре 5 показано влияние испытуемого соединения (10 мг/кг и 30 мг/кг, вводилось подкожно) или носителя (0,9% NaCl) на внеклеточные концентрации норэпинефрина в префронтовой коре мозга крыс в трех исходных образцах и 8 отобранных последовательно после введения образцах.
Показанные на Фигурах 4 и 5 результаты выражены как величины среднего изменения в процентах в сравнении с исходными данными. Стрелка показывает момент времени введения испытуемого соединения. Средние величины (и соответствующие величины SEM) показаны для каждых 50 мин отбора образцов для числа крыс равного 12 в каждой группе (N.B.: индивидуальные данные могут быть основаны на меньшем количестве образцов благодаря случайной потере диализатных образцов).
Процитированные ссылки
Все ссылки, процитированные в данной заявке, включены в данную заявку полностью посредством отсылок для всех целей в той степени, как если бы каждая индивидуальная публикация и отдельный патент или патентная заявка в отдельности были указаны как отсылки полностью для всех целей.
Обсуждение этих ссылок в данной заявке предназначено только для суммирования предположений, сделанных авторами, и нет допущений, что любая ссылка входит в уровень техники. Заявители оставляют за собой право оспаривать точность и значимость этих ссылок.
Данное изобретение не ограничивается конкретными вариантами, описанными в данной заявке, которые предназначены только для иллюстрации отдельных аспектов изобретения. Не выходя за рамки смысла и объема изобретения, можно сделать многие модификации и изменения настоящего изобретения, что является очевидным для специалиста в данной области. Функционально эквивалентные способы и устройства в объеме данного изобретения помимо перечисленных в данной заявке будут также очевидными для специалиста из приведенного выше описания и прилагаемых рисунков. Такие модификации и изменения входят в объем прилагаемой формулы изобретения. Данное изобретение будет ограничено только признаками формулы изобретения вместе с полным объемом эквивалентов, который предусмотрен этой формулой изобретения.
Реферат
Группа изобретений относится к области медицины и предназначена для лечения синдрома дефицита внимания/гиперактивности (ADHD). Способ лечения синдрома дефицита внимания и гиперактивности включает введение терапевтически эффективного количества соединения, имеющего формулу (1), или его фармацевтически приемлемой соли млекопитающему, нуждающемуся в этом:где R, Rи Rобозначают водород и х=1. Также обеспечивается фармацевтическая композиция, включающая соединение, имеющее формулу (1), или его фармацевтически приемлемую соль. Использование группы изобретений обеспечивает эффективное лечение синдрома дефицита внимания/гиперактивности. 2 н. и 11 з.п. ф-лы, 5 ил., 3 табл., 4 пр.
Формула

где: R, R1 и R2 обозначают водород и х=1.



где: R, R1 и R2 обозначают водород и х=1.

Комментарии