Способ лечения ретинопатии при недоношенности и родственных ретинопатических заболеваний - RU2403906C2
Код документа: RU2403906C2
Чертежи







































Описание
Релевантные заявки
Данная заявка заявляет преимущество предварительной заявки на патент США № 60/656122, поданной 24 февраля 2005 г., которая включена путем ссылки.
Заявление о заинтересованности государства
Часть работы, описанной здесь, поддерживалась грантами под номерами EY11254 и EY12598, предоставленными Национальным институтом глаза под эгидой Национальных институтов здоровья. Правительство США имеет некоторые права на данное изобретение.
Область техники, к которой относится изобретение
Данное изобретение относится к способам лечения ретинопатических заболеваний. Конкретнее, данное изобретение относится к способам лечения ретинопатии при недоношенности и родственных ретинопатических заболеваний введением негативных по дифференцировочному антигену гематопоэтических стволовых клеток в глаза млекопитающему, страдающему или имеющему риск развития указанных заболеваний.
Уровень техники
Сосудистые заболевания сетчатки, включающие ретинопатию при диабете, экссудативную возрастную дегенерацию желтого пятна сетчатки (ARMD), ретинопатию при недоношенности (ROP) и окклюзии сосудов, являются основными причинами нарушения зрения и слепоты. Данная группа заболеваний находится в центре интенсивных исследований, проводимых с целью разработки новых способов лечения, которые будут приводить к профилактике или модификации патологической реваскуляризации в глазах. Например, ARMD поражает 12-15 млн американцев в возрасте старше 65 лет и вызывает потерю зрения у 10-15% из них в результате хороидальной (субретинальной) реваскуляризации. Наиболее распространенной причиной потери зрения у американцев старше 65 лет является диабет; в США диабетом страдают 16 млн человек и 40000 тыс. человек страдают от глазных осложнений при данном заболевании, часто возникающих в результате реваскуляризации сетчатки. Несмотря на то что лазерная фотокоагуляция является эффективной для профилактики серьезной потери зрения в подгруппах с высоким риском у пациентов с диабетом, в целом частота развития ретинопатии за 10-летний период остается без изменений. Для пациентов с хороидальной реваскуляризацией за счет ARMD или воспалительных заболеваний глаза, таких как глазной гистоплазмоз, фотокоагуляция, за редким исключением, является не эффективной для предупреждения потери зрения. Несмотря на то что недавно разработанные, нетравматичные виды фотодинамического лечения дают надежду для временного снижения потери зрения у пациентов с ранее не поддающейся лечению хороидальной реваскуляризацией, только у 61,4% пациентов, подвергшихся лечению, имело место улучшение или стабилизация зрения по сравнению с 45,9% в группе пациентов, получавших плацебо.
Возрастная дегенерация желтого пятна сетчатки и ретинопатия при диабете являются основными причинами потери зрения в промышленно развитых странах и в основном в результате аномальной реваскуляризации сетчатки. Поскольку сетчатка состоит из хорошо выраженных слоев нейронов, глии и сосудистых элементов, относительно незначительные нарушения, такие, которые наблюдают при пролиферации сосудов или отеке, могут привести к значительной потере зрительной функции. Наследственные дегенеративные заболевания сетчатки, такие как пигментный ретинит (RP), также связаны с сосудистыми аномалиями, такими как сужение артериол и атрофия сосудов. Несмотря на достигнутый существенный прогресс в идентификации факторов, которые способствуют и подавляют ангиогенез, в настоящее время отсутствует терапия для специфического лечения глазных сосудистых заболеваний.
Наследственные дегенеративные заболевания сетчатки поражают 1 из 3500 человек и характеризуются прогрессирующей ночной слепотой, сужением поля зрения, атрофией зрительного нерва, аттенуацией артериол, изменением проницаемости сосудов и центральной потерей зрения, часто переходящей в полную слепоту (Heckenlively J.R., editor, 1988; Retinitis Pigmentosa, Philadelphia: JB Lippincott Co.). В результате молекулярного генетического анализа данных заболеваний были установлены мутации в более чем 110 различных генах, отвечающих только за относительно небольшой процент заболеваний у людей (Humphries et al., 1992, Science 256: 804-808; Farrar et al. 2002, EMBO J. 21: 857-864). Многие из данных мутаций ассоциированы с ферментными и структурными компонентами фототрансдукционного аппарата, включающего родопсин, сGMP-фосфодиэстеразу, rds-периферин и RPE65. Несмотря на эти наблюдения, по-прежнему отсутствуют эффективные способы лечения для замедления или остановки прогрессирования данных дегенеративных заболеваний сетчатки. Недавние достижения в генной терапии привели к успешному подавлению фенотипов rds (Ali et al., 2000, Nat. Genet. 25: 306-310) и rd (Takahashi et al., 1999, J. Virol. 73: 7812-7816) у мышей и фенотипа RPE65 у собак (Acland et al., 2001, Nat. Genet. 28: 92-95) при доставке трансгена дикого типа к фоторецепторам или в пигментный эпителий сетчатки (RPE) у животных со специфическими мутациями.
Ангиогенез представляет процесс, посредством которого образуются новые сосуды. В ответ на специфические химические сигналы капилляры простираются от уже существующих сосудов, в конечном итоге увеличиваясь в размере, исходя из потребностей организма. Первоначально эндотелиальные клетки, которые выстилают кровеносные сосуды, делятся в направлении, ортогональном по отношению к существующему сосуду, образуя сплошную ветвь. Затем смежные эндотелиальные клетки образуют крупные вакуоли и клетки перегруппировываются таким образом, что вакуоли ориентируют самих себя концом в конец и в конечном итоге образуют полость нового капилляра (образование трубки).
Ангиогенез стимулируется различными состояниями, такими как ответная реакция на рану, и он сопровождает практически любой рост ткани у позвоночных, таких как млекопитающие. Ангиогенез играет роль в развитии некоторых заболеваний, таких как ретинопатия при диабете и некоторые злокачественные опухоли. Для роста опухолей, например, требуется рост кровеносных сосудов для обеспечения кислородом и питательными веществами растущей опухолевой ткани.
Ангиогенез можно остановить или подавить интерференцией химических сигналов, которые стимулируют процесс ангиогенеза. Например, ангиогенные эндотелиальные клетки продуцируют протеазы для расщепления базальной пластинки, которая окружает кровеносные сосуды, «расчищая», таким образом, путь для нового капилляра. Ингибирование данных протеаз или их продукции может привести к предотвращению образования новых сосудов. Аналогично эндотелиальные клетки пролиферируют в ответ на химические сигналы. Особенно важные сигналы пролиферации включают васкулярный эндотелиальный фактор роста (VEGF) и фактор роста фибробластов (FGF) семейства протеинов. Было показано, что VEGF участвует в васкуляризации некоторых опухолей. Интерференция данных процессов передачи сигналов также может подавлять ангиогенез.
Некоторые факторы принимают участие в ангиогенезе. Молекулы кислого и основного факторов роста фибробластов являются митогенами для эндотелиальных клеток и клеток других типов. Васкулярный эндотелиальный фактор роста (VEGF) является высоко избирательным митогеном для эндотелиальных клеток.
В норме у взрослых людей ангионегез является строго регулируемым процессом, и он ограничен заживлением ран и маточными циклами. Ангиогенез «настраивается» на специфические ангиогенные молекулы, такие как кислотный и основной факторы роста (FGF), VEGF, ангиогенин, трансформирующий фактор роста (TGF), фактор-α некроза опухолей (TNF-α) и тромбоцитарный фактор роста (PDGF). Ангиогенез можно подавить ингибирующими молекулами, такими как итерферон-α, тромбоспондин-1, ангиостатин и эндостатин. Существует баланс данных природных стимуляторов и ингибиторов, с помощью которого регулируется находящаяся в норме в состоянии покоя капиллярная сосудистая сеть. Когда данный баланс нарушается, как это имеет место при некоторых заболеваниях, то эндотелиальные клетки капилляров индуцируются для пролиферации, миграции и в конечном итоге дифференциации.
Ангиогенез играет центральную роль в развитии некоторых заболеваний, включая злокачественные опухоли и реваскуляризацию в тканях глаз. Также было показано, что непрерывный рост и метастазирование различных опухолей зависит от прорастания новых кровеносных сосудов хозяина в опухоль в ответ на опухолевые ангиогенные факторы роста. Пролиферация новых кровеносных сосудов в ответ на различные стимулы имеет место в качестве доминирующего фактора при развитии большинства глазных болезней и слепоты, включая пролиферативную ретинопатию при диабете, ARMD, глаукому, интерстициальный кератит и ретинопатию при недоношенности. При данных заболеваниях повреждение тканей может стимулировать высвобождение ангиогенных факторов, приводя к пролиферации капилляров. VEGF играет доминирующую роль в реваскуляризации в радужке и развитии реваскулярных ретинопатий. Несмотря на то что сообщается о наличии четкой корреляции между концентрациями внутри глаза VEGF и развитием ишемической ретинопатической реваскуляризации глаз, вероятно, FGF играет роль. Известно, что кислотный и основной FGF присутствуют в сетчатке взрослого человека в норме, хотя, его детектируемые уровни не всегда коррелируют с реваскуляризацией. В основном это может быть результатом того, что FGF прочно связывается с заряженными компонентами внеклеточного вещества и не всегда может быть легко доступен в свободной диффундируемой форме, которая и детектируется обычными методами в глазных жидкостях.
Конечный общий путь в ангиогенной ответной реакции включает опосредуемый интегрином обмен информацией между пролиферирующими эндотелиальными клетками сосудов и внеклеточным веществом. Данная группа рецепторов адгезии, называемых интегринами, экспрессируется в виде гетеродимеров, имеющих α- и β-субъединицу, во всех клетках. Один такой интегрин, αvβ3, является наиболее «беспорядочным» членом данного семейства и позволяет эндотелиальным клеткам взаимодействовать с широким рядом компонентов внеклеточного матрикса. Антагонисты данного интегрина на основе пептидов и антител подавляют ангиогенез, избирательно индуцируя апоптоз пролиферирующих эндотелиальных клеток сосудов. Существует два цитокин-зависимых пути ангиогенеза, и их можно определить по зависимости от различных интегринов сосудистых клеток, αvβ3 и αvβ5. В частности, ангиогенез, индуцированный основным FGF и VEGF, зависит соответственно от интегрина αvβ3 и αvβ5, поскольку антагонисты на основе антител для каждого интегрина избирательно блокируют данные ангиогенные пути в роговице кроликов и хориоаллантоисной мембраны (САМ) цыплят. Пептидные антагонисты, которые блокируют все αv интегрины, подавляют индуцированный FGF и VEGF ангиогенез. Несмотря на то что в норме кровеносные сосуды глаза у человека не имеют никакого интегрина, αvβ3 и αvβ5 интегрины избирательно располагаются на кровеносных сосудах в тканях пациентов с реваскулярным заболеванием глаз в активной стадии. Несмотря на то что только αvβ3 постоянно присутствует в ткани у пациентов с ARMD, αvβ3и αvβ5 находятся в тканях у пациентов с пролиферативной ретинопатией при диабете. Введенные системно пептидные антагонисты интегринов блокируют формирование кровеносных сосудов на модели васкулогенеза сетчатки на мышах.
Тестирование потенциальных способов лечения реваскулярных заболеваний сетчатки в значительной мере облегчилось после разработки моделей индуцированной кислородом ретинопатии (OIR) на различных видах животных, включая котят, щенков бигль, крыс и мышей. На каждой из этих моделей воздействие гипероксии на новорожденных животных (или чередование гипероксии и гипоксии) приводит к регрессии или задержке развития сосудов сетчатки с последующим аномальным ангиогенезом после их возвращения в среду с нормальным уровнем кислорода. Данные модели отражают события, имеющие место при ретинопатии при недоношенности (ROP), состояния, в котором принимает участие патологическая реваскуляризация, которая может оказывать отрицательное влияние на недоношенных новорожденных.
В течение последней декады мышиная модель OIR стала наиболее распространенной моделью для изучения аномального ангиогенеза, ассоциированного с индуцированными кислородом ретинопатиями. Характер сосудистых аномалий на данной модели несколько отличается от наблюдаемых при ROP; у мышей центральный, задний участок сетчатки становится аваскулярным после воздействия гипероксии, в то время как у человеческих младенцев аваскулярным является периферический участок. Тем не менее, это широко распространенная модель для исследования механизма развития заболевания и разработки потенциального лечения индуцированной гипоксией ретинопатии, и изменения сосудов являются очень последовательными, воспроизводимыми и поддающимися количественной оценке. В последние годы применение данной модели распространилось на общее изучение ишемических вазопатий и близких антиангиогенных вмешательств, и в настоящее время она широко используется при проведении фундаментальных и прикладных исследований.
Исторически сложилось, что общий метод количественной оценки пролиферативной реваскулярной ответной реакции на модели OIR на мышах основан на подсчете количества клеток, ассоциированных с новыми сосудами, выходящими из сетчатки в стекловидное тело («ядра превнутренней пограничной мембраны (ILM)»). Это осуществляется выполнением сагиттальных поперечных срезов, обычно в областях около (но не включая) диска зрительного нерва. Способ является очень трудоемким, длительным по времени и связан с трудностями, включающими необходимость в дифференциации клеток аномальных сосудов от гиалоидальных сосудов в стекловидном теле. За счет того, что, как правило, оцениваются только каждые 30 серийных срезов, то большая часть ткани не подвергается количественной оценке, что потенциально способствует введению большого количества ошибок. Кроме того, поскольку срезы сразу же готовятся из цельных образцов глаза, это исключает оценку одного и того же глаза по другому важному параметру данной модели, а именно степени облитерации сосудов и степени реваскуляризации, которая происходит одновременно с формированием аномальных реваскулярных ветвей. Данный параметр лучше всего оценивается на тотальных препаратах сетчатки.
В течение многих лет полагалось, что популяция стволовых клеток существует в кровотоке и костном мозге нормального взрослого человека. Различные субпопуляции данных клеток могут претерпевать дифференцировку в гематопоэтические позитивные по дифференцировочному антигену (Lin+) и негативные по дифференцировочному антигену (Lin-) клетки. Кроме того, недавно было показано, что популяция негативных по дифференцировочному антигену гематопоэтических стволовых клеток (HSC) содержит эндотелиальные клетки-предшественники (ЕРС), способные формировать кровеносные сосуды в условиях in vitro и in vivo (смотри Asahara et al., 1997, Science 275: 964-7). Данные клетки могут принимать участие в нормальном и патологическом ангиогенезе в постнатальном периоде развития (смотри Lyden et al., 2001, Nat. Med. 7, 1194-201; Kalka et al. 2000, Proc. Natl. Acad. Sci. USA 97: 3422-7; и Kocher et al. 2001, Nat. Med. 7, 430-6), а также дифференцироваться в различные типы клеток, не относящихся к эндотелиальным клеткам, включая гепатоциты (смотри Lagasse et al. 2000, Nat. Med. 6: 1229-34), микроглию (смотри Priller et al. 2002 Nat. Med. 7, 1356-61), кардиомициты (смотри Orlic et al., 2001, Proc. Natl. Acad. Sci. USA 98: 10344-9) и эпителий (смотри Lyden et al. 2001, Natl. Med. 7: 1194-1201). Несмотря на то что данные клетки использовались на нескольких экспериментальных моделях ангиогенеза, механизм направленности ЕРС на новую сосудистую сеть остается неизвестным и не была установлена стратегия, с помощью которой можно было бы эффективно повышать количество клеток, которые вносят свой вклад в конкретную сосудистую сеть.
В настоящее время гематопоэтические стволовые клетки из костного мозга являются единственным типом стволовых клеток, обычно используемым для терапевтических применений. Клетки HSC костного мозга применялись в течение 40 лет в трансплантатах. В настоящее время с помощью усовершенствованных способов сбора очищенных стволовых клеток можно проводить исследования с целью разработки лекарственных препаратов для лечения лейкемии, лимфомы и наследственных заболеваний крови. Клинические применения стволовых клеток у людей испытывались для лечения диабета и злокачественных опухолей почек на поздних стадиях на ограниченном количестве пациентов.
Сущность изобретения
Настоящее изобретение относится к способу лечения ретинопатии при недоношенности (ROP) и родственных ретинопатических заболеваний. Способ включает введение в сетчатку млекопитающего, страдающего или имеющего риск развития ретинопатии при недоношенности или родственного ретинопатического заболевания, количества клеток из вазотрофической популяции негативных по дифференцировочному антигену гематопоэтических стволовых клеток, эффективного для стимуляции лечебной физиологической реваскуляризации в поврежденных участках сетчатки и ослабления повреждения сетчатки, вызванного заболеванием. Предпочтительно млекопитающее является человеком. В одном предпочтительном варианте осуществления популяция негативных по дифференцировочному антигену гематопоэтических стволовых клеток представляет популяцию негативных по дифференцировочному антигену гематопоэтических стволовых клеток, содержащую гематопоэтические стволовые клетки и эндотелиальные клетки-предшественники (т.е. Lin-HSC). В другом предпочтительном варианте осуществления популяция негативных по дифференцировочному антигену гематопоэтических стволовых клеток представляет популяцию выделенных миелоподобных клеток костного мозга (MLBM), в которой большинство клеток является негативными по дифференцировочному антигену и экспрессирует антиген CD44, а также антиген CD11b. В качестве альтернативы для лечения новорожденных младенцев подходящую популяцию негативных по дифференцировочному антигену гематопоэтических стволовых клеток можно выделить из крови вены пупочного канатика.
Предпочтительно клетки, вводимые млекопитающему, являются аутологичными по отношению к конкретному млекопитающему, которое подвергается лечению. Предпочтительно клетки вводят посредством внутриглазной инъекции. В предпочтительном варианте осуществления клетки вводят млекопитающему, страдающему ретинопатией при недоношенности (ROP), такому как человеческий младенец на ранних стадиях развития заболевания. В другом предпочтительном варианте осуществления клетки вводят млекопитающему, имеющему риск развития ROP или близкого ретинопатического заболевания, в качестве профилактического средства в начале развития симптомов заболевания до воздействия гипероксии на новорожденного.
Результаты, полученные на модели ROP индуцированной кислородом ретинопатии (OIR), свидетельствуют о том, что настоящий способ лечения способствует заживлению и восстановлению сосудов в сетчатке млекопитающего, которое страдает ретинопатией. Кроме того, способ способствует восстановлению зрительных нейронов за счет нейротрофического действия клеток. Преимущественно клетки из популяции негативных по дифференцировочному антигену гематопоэтических стволовых клеток по изобретению включаются в сосудистую сеть сетчатки и дифференцируются в эндотелиальные клетки, одновременно включаясь в нейронную сеть и тем самым, ослабляя дегенерацию нейронов, таких как колбочки сетчатки. Популяции выделенных негативных по дифференцировочному антигену гематопоэтических стволовых клеток включают клетки, которые избирательно направлены на активированные астроциты сетчатки при интравитреальном введении в глаза и которые стабильно включаются в новую сосудистую и нейронную сеть глаза.
В еще одном предпочтительном варианте осуществления клетки из популяций негативных по дифференцировочному антигену гематопоэтических стволовых клеток трансфицируют терапевтически пригодным геном. Например, клетки можно трансфицировать полинуклеотидами, которые операбильно кодируют нейротрофические вещества и тому подобное, которые обладают избирательным действием на новую сосудистую сеть и дополнительно способствуют лечебной реваскуляризации и развитию нейронов посредством опосредуемой клетками генной терапии.
Конкретным преимуществом лечения глаз способами по настоящему изобретению является вазотрофический и нейротрофический эффект спасения, наблюдаемый в глазах после интравитреального введения клеток из популяций негативных по дифференцировочному антигену гематопоэтических стволовых клеток. Нейроны и фоторецепторы сетчатки, в частности колбочки, сохраняются и можно достичь некоторого улучшения зрительной функции в глазах, обработанных популяциями клеток по изобретению.
Предпочтительно сетчатка с патологией для лечения способом по изобретению включает активированные астроциты. Это можно осуществить ранней обработкой глаза популяцией негативных по дифференцировочному антигену гематопоэтических стволовых клеток, когда имеется ассоциированный глиоз, или применением лазера для стимуляции местной пролиферации активированных астроцитов.
Краткое описание фигур
На фигурах:
Фиг.1 представляет схематичные изображения развивающейся сетчатки у мышей. (А) Развитие первичного сплетения. (В) Вторая фаза формирования сосудов сетчатки. GCL, слой клеток ганглия; IPL, слой внутреннего сплетения; INL, внутренний ядерный слой; ОPL, слой внешнего сплетения; ОNL, внешний ядерный слой; RPE, пигментный эпителий сетчатки; ON, зрительный нерв; Р, периферическая область. Панель (С) отражает характеристику с использованием проточной цитометрии разделенных клеток, производных костного мозга, Lin+ HSC и Lin- HSC. Верхний ряд: точечный график распределения клеток, не меченных антителами, в которых R1 представляет оцениваемую количественно область позитивного окрашивания РЕ; R2 представляет GFP-позитивную область; средний ряд: клетки Lin- HSC (С57В/6) и нижний ряд: Lin+ HSC (С57В/6), каждую линию клеток метили РЕ-конъюгированными антителами против Sca-1, c-kit, Flk-1/KDR, CD31. Данные с Tie-2 получали на мышах Tie-2-GFP. Проценты указывают процент положительно-меченых клеток из популяции Lin- HSC и Lin+ HSC в целом.
Фиг.2 показывает результаты подсадки клеток Lin- HSC в развивающуюся сетчатку у мыши. (а) На 4 сутки после интравитреальной инъекции (Р6) клетки еGFP+Lin- HSC прикрепляются и дифференцируются в сетчатке. (b) Клетки Lin- HSC (мыши В6.129S7-Gtrosa26, окрашены антителами β-gal) прижились над сосудистой сетью, окрашенной антителами против коллагена IV (звездочки указывают наклон сосудистой сети). (с) Большая часть клеток Lin+ HSC (еGFP+) на четвертые сутки после инъекции (Р6) была не способна к дифференцировке. (d) Брыжеечные еGFP+ мышиных ЕС на четвертые сутки после инъекции (Р6). (е) Клетки Lin- HSC (еGFP+), введенные в глаза взрослым мышам. (f) Хоминг и дифференцировка клеток еGFP+Lin- HSC (стрелки) при малом увеличении вдоль уже имеющейся астроцитной матрицы у трансгенных мышей GFAP-GFP. (g) Ассоциация клеток Lin- (еGFP) и лежащих под ними астроцитов (стрелки) при большем увеличении. (h) Трансгенные контрольные мыши GFAP-GFP без инъекции. (i) На 4 сутки после инъекции (Р6), клетки еGFP+Lin- HSC мигрируют и подвергаются дифференцировке в области будущего глубокого сплетения. На левой фигуре показана активность Lin- HSC в тотальном препарате сетчатки; на правой фигуре показано расположение клеток Lin- HSC (стрелки) в сетчатке (верхняя часть - стекловидное тело, нижняя - склера). (j) Двойное мечение антителами против α-CD31-PE и α-GFP-alexa 488. Через 7 суток после инъекции введенные клетки Lin- HSC (еGFP, красный цвет) включались в сосудистую сеть (CD31). Кончики стрелок указывают на зоны включения. (k) Клетки еGFP+Lin- HSC образуют сосуды на 14 сутки после введения (Р17). (l и m) Внутрикардиальная инъекция родамина-декстрана указывает, что сосуды являются интактными и функциональными в обоих первичном (l) и глубоком сплетениях (m).
Фиг.3 показывает, что клетки еGFP+Lin- HSC подвергаются хомингу в зону глиоза (на что указывают экспрессирующие GFAP астроциты, левый снимок), индуцированного лазерным (а) и механическим (b) воздействием во взрослой сетчатке (звездочки показывают место повреждения). На правых снимках при большом увеличении показана тесная ассоциация клеток Lin- HSC и астроцитов. Масштаб=20 мкМ.
Фиг.4 показывает спасение под действием клеток Lin- HSC сосудистой сети мышиной, подвергающейся дегенерации сетчатки. (а-d) Образцы сетчатки на 27 сутки после введения (Р33) при окрашивании коллагеном IV; (а) и (b) отсутствие различий в образцах клетчатки после введении клеток Lin+ HSC (мыши Balb/c) в сосудистой сети по сравнению с нормальными мышами FVB; (с) и (d) в образцах сетчатки после введения Lin- HSC (мыши Balb/c) имеет место богато развитая сосудистая сеть, аналогичная мышам дикого типа; (а) и (с) замороженные срезы тотального препарата сетчатки (верхняя часть - стекловидное тело, нижняя - склера) при окрашивании DAPI; (b) и (d) глубокое сплетение тотального образца сетчатки; (е) график в столбцах, показывающий увеличение сосудистой сети глубокого сосудистого сплетения, образованного после введения клеток Lin- HSC в сетчатку (n=6). Степень глубокой васкуляризации сетчатки оценивали количественно по определению общей длины сосудов на каждом снимке. Проводили сравнение средней общей длины сосудов/большое увеличение (в микронах) для образцов сетчатки, обработанных клетками Lin- HSC, Lin+ HSC и контрольными образцами. (f) Сравнение длины глубокого сосудистого сплетения после введения клеток Lin- HSC (R, правый глаз) или Lin+ HSC (L, левый глаз) у мышей rd/rd. Представлены результаты по 6 отдельным мышам (каждый цвет представляет отдельную мышь). (g) и (h) Клетки Lin- HSC также (мыши Balb/c) спасали сосудистую сеть у мышей rd/rd при введении в глаза на Р15. Показаны промежуточное и глубокое сосудистое сплетение в образцах сетчатки после инъекции клеток Lin- HSC (g) и Lin+HSC (h) (через один месяц после введения).
Фиг.5 представляет микрофотографии ткани мышиной сетчатки: (а) глубокий слой тотального препарата сетчатки (мыши rd/rd) на 5 сутки после введения (Р11) с видимыми клетками еGFP+Lin- HSC (серым цветом). (b) и (c) Сосудистая сеть сетчатки на Р60 у Tie-2-GFP (мыши rd/rd), которым ввели клетки Balb/c Lin- HSC (b) или Lin+ HSC (с) на Р6. Видны только эндогенные эндотелиальные клетки (окрашенные GFP) на левых панелях (b) и (с). Средние панели (b) и (с), окрашенные антителами против CD31; стрелки указывают сосуды, окрашенные CD31, но не GFP, правые панели (b) и (с) показывают окрашивание обоими GFP и CD31. (d) Окрашивание α-SMA сетчатки после введения Lin- HSC (левая панель) и контрольной сетчатки (правая панель).
Фиг.6 показывает, что трансфицированные T2-TrpRS клетки Lin- HSC подавляют развитие сосудистой сети сетчатки у мышей. (а) Схематичное представление человеческих TrpRS, T2-TrpRS и Т2- TrpRS с сигнальной последовательностью Igk на аминоконце. (b) Сетчатки после введения трансфицированных T2-TrpRS клеток Lin- HSC экспрессируют белок T2-TrpRS в условиях in vivo. (1) Рекомбинантный T2-TrpRS, продуцированный E. coli; (2) рекомбинантный T2-TrpRS, продуцированный E. coli; (3) рекомбинантный T2-TrpRS, продуцированный E. coli; (4) контрольная сетчатка; (5) сетчатка после введения Lin- HSC + pSecTag2A (только вектор); (6) сетчатка после введения Lin- HSC + pKLe135 (Igk-T2-TrpRS в pSecTag). (а) Эндогенный TrpRS. (b) Рекомбинантный TrpRS. (с) Т2-TrpRS в сетчатке после введения Lin- HSC. (c-f) Показательные первичное (поверхностное) и вторичное (глубокое) сплетения в обработанной сетчатке на 7 сутки после введения. (с) и (d) Нормальное развитие глаза после обработки клетками Lin- HSC, трансфицированными пустой плазмидой. (е) и (f) В большинстве глаз, обработанных трансфицированными T2-TrpRS клетками Lin- HSC, наблюдалось подавление глубокого сплетения. (с) и (е) Первичное (поверхностное) сплетение. (d) и (f) Вторичное (глубокое) сплетение. Слабая линия сосудов, показанная на (f), представляет «протечку крови» сосудов первичной сети на (е).
Фиг.7 показывает последовательность ДНК, кодирующей меченный His6 Т2-TrpRS, SEQ ID NO: 1.
Фиг.8 показывает аминокислотную последовательность меченного His6 Т2-TrpRS, SEQ ID NO: 2.
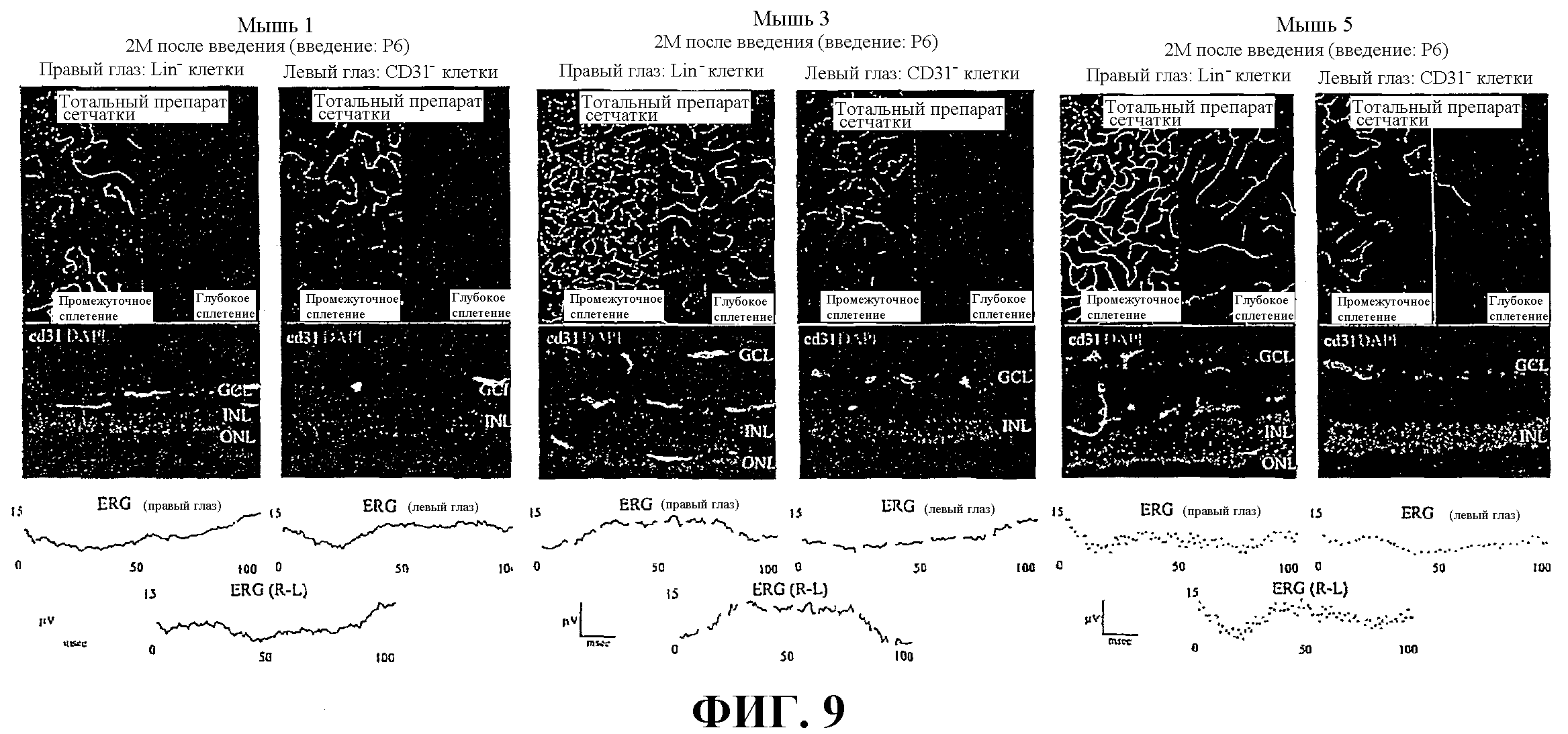
Фиг.9 показывает микрофотографии и электроретинограммы (ERG) сетчатки от мышей, которым вводили в глаза клетки Lin- HSC и Lin+ HSC (контрольные).
Фиг.10 представляет статистические графики зависимости, показывающие корреляцию между спасением нейронов (ось Y) и спасением сосудов (ось X) для обоих промежуточного (Int.) и глубокого слоев глаз мыши rd/rd, обработанных Lin- HSC.
Фиг.11 представляет статистические графики зависимости, показывающие отсутствие корреляции между спасением нейронов (ось Y) и спасением сосудов (ось X) для глаз мышей rd/rd, обработанных Lin+HSC.
Фиг.12 представляет график в столбцах длины сосудов (ось Y) в произвольных относительных единицах для глаз у мышей rd/rd, обработанных Lin- HSC (темные колонки) и не обработанных (светлые колонки) у мышей rd/rd через 1 месяц (1М), 2 месяца (2М) и 6 месяцев (6М) после введения.
Фиг.13 представляет графики в столбцах количества ядер во внешнем слое нейронов (ONR) у мышей rd/rd через 1 месяц (1М), 2 месяца (2М) и 6 месяцев (6М) после введения и показывает достоверное увеличение количества ядер в глазах, обработанных Lin- HSC (темные колонки) по сравнению с контрольными глазами, обработанными Lin+ HSC (светлые колонки).
Фиг.14 представляет графики зависимости количества ядер во внешнем слое нейронов (ONR) у мышей rd/rd при сравнении правого глаза (R, обработанного клетками Lin- HSC) с левым глазом (L, обработанным клетками Lin+ HSC) на периоды времени (после введения) через 1 месяц (1М), 2 месяца (2М) и 6 месяцев; каждая линия представляет график сравнения глаз для отдельной мыши.
Фиг.15 представляет изменения сосудистой сети и нейронов в сетчатке у мышей rd1/rd1 (CH3/HeJ, левые панели) или у мышей дикого типа (C57BL/6, правые панели). Показана сосудистая сеть промежуточного (верхние панели) или глубокого (средние панели) сосудистых сплетений в тотальном препарате сетчатки (красный цвет: коллаген IV, зеленый цвет: CD31) и срезах (красный цвет: DAPI, зеленый цвет: CD31, нижние панели) одних и тех же образцов сетчатки (Р: в день после рождения). GCL: слой клеток ганглия, INL: внутренний ядерный слой, ОNL: внешний ядерный слой.
Фиг.16 показывает, что введение клеток Lin- HSC элиминирует дегенерацию нейронов у мышей rd1/rd1. (А, В и С) Сосудистая сеть сетчатки промежуточного (Int.) или глубокого сплетения и срезы глаза после введения Lin- HSC (правые панели) и противоположного контрольного глаза с введением клеток (CD31-) (левые панели) на Р30 (А), Р60 (В) и Р180 (С). (D) Среднее значение общей длины сосудистой сети (+ или - стандартная ошибка средней) в образцах сетчатки после введения клеток Lin- HSC или контрольных клеток (CD31-) на Р30 (слева, n=10), на Р60 (в середине, n=10) и на Р180 (справа, n=6). Данные по промежуточному (Int.) и глубокому сосудистому сплетениям приведены отдельно (ось Y: относительная длина сосудистой сети). (Е) Среднее количество ядер клеток в ONL на Р30 (слева, n=10), на Р60 (в середине, n=10) и на Р180 (справа, n=6) при обработке сетчатки контрольными клетками (CD31-) или клетками Lin- HSC (ось Y: относительное количество ядер клеток в ONL). (F) Линейные корреляции между длиной сосудистой сети (ось X) и количеством ядер клеток в ONL (ось Y) на Р30 (слева), на Р60 (в середине) и на Р180 (справа) в сетчатке после введения Lin- HSC и в сетчатке, обработанной контрольными клетками.
Фиг.17 показывает, что функция сетчатки спасается при введении клеток Lin- HSC. Использовали электроретинографические исследования (ERG) для оценки функции сетчатки после введения клеток Lin- HSC и контрольных клеток (CD31-). (А и В) Показательные случаи спасенной и не спасенной сетчатки через 2 месяца после введения. Представлен срез сетчатки правого глаза, обработанного клетками Lin- HSC (А), и левого глаза, обработанного контрольными клетками (CD31-) (В), у одного и того же животного (зеленый цвет: окрашенная CD31 сосудистая сеть; красный цвет: окрашенные DAPI ядра). (С) Результаты ERG, полученные у одного и того же животного, представлены на (А) и (В).
Фиг.18 показывает, что популяция клеток человеческого костного мозга может спасать дегенерирующую сетчатку у мышей rd1 (А-С). Спасение также наблюдали на другой модели дегенерации сетчатки у мышей rd10 (D-K). (А) Человеческие клетки Lin- HSC (hLin- HSC), меченные зеленой краской, могут подвергаться дифференцировке в сосудистые клетки сетчатки после интравитреальной инъекции мышам C3SnSmn.CB17-Prkdc SCID. (В и С) Сосудистая сеть сетчатки (левые панели, сверху: промежуточное сплетение, внизу: глубокое сплетение) и нейроны (правая панель) в глазу после обработки клетками hLin- HSC (В) и в противоположном контрольном глазу (С) через 1,5 месяца после инъекции. (D-K) Спасение у мышей rd10 введением клеток Lin- HSC (обработка на Р6). Представлены показательные образцы сетчатки на Р21 (D: Lin- HSC, Н: контрольные клетки), на Р30 (Е: Lin- HSC, I: контрольные клетки), на Р60 (F: Lin- HSC, J: контрольные клетки), на Р105 (G: Lin- HSC, K: контрольные клетки) (обработанные и контрольные глаза от одного и того же животного на каждую временную точку). Сосудистую сеть сетчатки (верхний снимок на каждой панели представляет промежуточное сплетение; средний снимок на каждой панели представляет глубокое сплетение) окрашивали CD31 (зеленый цвет) и коллагеном IV (красный цвет). Нижний снимок на каждой панели представляет поперечный срез того же образца сетчатки (красный цвет: DAPI, зеленый цвет: CD31).
Фиг.19 показывает, что продукция кристаллина αА подвергается положительной регуляции в спасенных клетках внешнего ядерного слоя после введения клеток Lin- HSC, но не в противоположном глазу, обработанном контрольными клетками. Левая панель; контрольный IgG в спасенной сетчатке, средняя панель; кристаллин αА в спасенной сетчатке, правая панель; кристаллин αА в не спасенной сетчатке.
Фиг.20 включает таблицы генов, которые подвергаются положительной регуляции у мышей в сетчатке, обработанной клетками Lin- HSC по настоящему изобретению. (А) Гены, экспрессия которых повышается в 3 раза у мышей в сетчатке после обработки мышиными клетками Lin- HSC. (В) Гены кристаллина, которые подвергаются положительной регуляции у мышей в сетчатке после обработки мышиными клетками Lin- HSC. (С) Гены, экспрессия которых повышается в 2 раза у мышей в сетчатке после обработки человеческими клетками Lin- HSC. (D) Гены нейротрофических факторов или факторов роста, экспрессия которых подвергается положительной регуляции у мышей в сетчатке, обработанной человеческими клетками Lin- HSC.
Фиг.21 показывает распределение поверхностных антигенов CD31 и интегрина α6 в популяциях позитивных на CD33 (CD133+) и негативных на CD33 (CD133-) человеческих клеток Lin- HSC. На левых панелях приведены графики рассеивания, полученные проточной цитометрией. Центральные и правые панели представляют гистограммы, показывающие уровень экспрессии специфических антител в популяции клеток. Ось Y представляет количество эпизодов, и ось Х представляет интенсивность сигнала. Окрашенная гистограмма со сдвигом вправо от контрольной гистограммы (линия) представляет увеличение сигнала флуоресценции и экспрессии антител по сравнению с фоновым уровнем.
Фиг.22 показывает постнатальное развитие сетчатки у мышей С57/В16 дикого типа при нормальном уровне кислорода (нормоксия) в постнатальном периоде от Р0 до Р30.
Фиг.23 показывает модель индуцированной кислородом ретинопатии на мышах С57/В16 при высоких концентрациях кислорода (гипероксия; 75% кислорода) в период между Р7 и Р12 с последующей нормоксией в период Р12-Р17.
Фиг.24 показывает спасение сосудов при обработке популяциями Lin- HSC на модели индуцированной кислородом ретинопатии (OIR).
Фиг.25 показывает, что спасенные фоторецепторы во внешнем ядерном слое (ONL) у мышей rd1 после интравитреального введения клеток Lin- HSC преимущественно представляют колбочки. Небольшой процент фоторецепторов в сетчатке у мышей дикого типа (верхняя панель) представлял колбочки по данным оценки экспрессии красного/зеленого опсина колбочек (А), в то время как большинство клеток ONL были позитивными на специфический для палочек родопсин (В). Сосудистая сеть аутофлуоресцировала с неиммунной сывороткой (С), но ядерные слои были полностью негативны по окрашиванию на специфические для палочек или колбочек опсины. В образцах сетчатки у мышей rd/rd (нижние панели) имел место уменьшенный внутренний ядерный слой и практически полностью атрофированный ONL, при том, что оба давали отрицательную реакцию на опсин колбочек (D) и палочек (G). Контрольные обработанные CD31-HSC глаза были идентичны сетчатке мышей rd/rd без обработки, без какого-либо окрашивания на опсин колбочек (Е) и палочек (Н). В противоположных глазах, обработанных Lin-HSC, наблюдали заметно уменьшенный, но четко присутствующий ONL, который преимущественно состоял из колбочек по данным положительной иммунореактивности на красный/зеленый опсин колбочек (F). Также наблюдали присутствие небольшого количества палочек (I).
Фиг.26 показывает графики рассеивания по данным проточной цитометрии по характеристике популяций негативных по дифференцировочному антигену и позитивных по дифференцировочному антигену стволовых клеток (соответственно графики вверху слева и внизу слева), показывающие проценты клеток, экспрессирующих антиген CD44 (точки красным цветом), а также графики популяций негативных на CD31 и позитивных на CD31 клеток (соответственно графики вверху справа и внизу справа), показывающие проценты клеток, экспрессирующих антиген CD31 (точки красным цветом).
Фиг.27 показывает графики рассеивания по данным проточной цитометрии по характеристике популяции негативных по дифференцировочному антигену клеток, экспрессирующих высокий уровень антигена CD44 (группа графиков слева), и субпопуляции клеток костного мозга, которые не экспрессируют высокий уровень антигена CD44 (группа графиков справа), демонстрирующих относительные проценты клеток, экспрессирующих другие поверхностные клеточные антигены.
Фиг.28 показывает микрофотографии сетчатки от мышей после интравитреального введения клеток из предпочтительной популяции выделенных клеток MLBM (левая панель) по сравнению с сетчаткой от мышей после интравитреального введения клеток CD44lo.
Фиг.29 показывает микрофотографии сетчатки глаз от мышей после введения клеток из популяции клеток MLBM (CD44hi) и клеток CD44lo.
Фиг.30 представляет графики, показывающие лечебное действие популяции клеток MLBM в отношении ослабления патогенного ангиогенеза и стимуляции лечебной физиологической реваскуляризации в сетчатке у мышей на модели индуцированной кислородом ретинопатии при недоношенности. На верхнем графике приводится сравнение площади преретинальной реваскулярной ветви для контрольной сетчатки (первая колонка), сетчатки, обработанной клетками CD44lo (средняя колонка), и сетчатки, обработанной клетками из клеточной популяции MLBM (правая колонка). На нижнем графике приводится сравнение площади облитерирующего сосудистого участка для контрольной сетчатки (первая колонка), сетчатки, обработанной клетками CD44lo (средняя колонка), и сетчатки, обработанной клетками из клеточной популяции MLBM (правая колонка).
Фиг.31 представляет микрофотографии, показывающие, что после включения клеток из клеточной популяции клеток MLBM в сосудистую сеть сетчатки клетки экспрессируют васкулярный эндотелиальный фактор роста (VEGF), о чем свидетельствует зеленое окрашивание клеток в нижней части снимка.
Фиг.32 представляет микрофотографии, показывающие, что клетки из клеточной популяции CD11b+ MLBM по изобретению избирательно направлены на сосудистую сеть сетчатки.
Фиг.33 представляет микрофотографии, показывающие, что клетки костного мозга CD44- CD11b- по изобретению не направлены избирательно на сосудистую сеть сетчатки.
Фиг.34 показывает аминокислотную последовательность Т2-фрагмента TrpRS (SEQ ID NO: 3) и его варианта Т2-TrpRS-GD (SEQ ID NO: 4).
Фиг.35 показывает аминокислотную последовательность мини-TrpRS (SEQ ID NO: 5).
Фиг.36 показывает аминокислотную последовательность Т1-TrpRS (SEQ ID NO: 6).
Подробное описание предпочтительных вариантов осуществления изобретения
Костный мозг содержит гематопоэтические стволовые клетки, которые способны к развитию в различные типы клеток крови, например, В-клетки, Т-клетки, гранулоциты, тромбоциты и эритроциты. Поверхностные дифференцировочные антигены представляют группу клеточных поверхностных белков, которые являются маркерами линий дифференцировки зрелых клеток крови, включающих CD2, CD3, CD11, CD11а, Мас-1 (CD11b:CD18), CD14, CD16, CD19, CD24, CD33, CD36, CD38, CD45, CD45RA, мышиный Ly-6G, мышиный ТER-119, CD56, CD64, CD68, CD86 (В7.2), CD66b, человеческий лейкоцитарный антиген DR (HLA-DR) и CD235а (гликофорин А). Выделенные гематопоэтические стволовые клетки, которые не экспрессируют высокие уровни «дифференцировочного поверхностного антигена» (Lin) на их клеточных поверхностях, относятся здесь к «негативным по дифференцировочному антигену» или «Lin-» гематопоэтическим стволовым клеткам, т.е. Lin- HSC. Как правило, человеческие гематопоэтические стволовые клетки экспрессируют другие поверхностные антигены, такие как CD31, CD34, CD117 (c-kit) и/или CD133. Обычно мышиные гематопоэтические стволовые клетки экспрессируют другие поверхностные антигены, такие как CD34, CD117 (c-kit), Thy-1 и/или Sca-1.
Клетки костного мозга включают субпопуляцию клеток, которая экспрессирует антиген CD44 (т.е. рецептор гиалуроновой кислоты) и CD11b (интегрин αМ). Из костного мозга можно выделить миелоподобную популяцию клеток костного мозга, обогащенную экспрессирующими CD44 и CD11b клетками, обработкой клеток костного мозга антителами против CD44 (анти-CD44-антителами) и/или антителами против CD11b (анти-CD11b-антителами) и затем отбором клеток, которые вступают в иммунную реакцию с антителами. Затем антитела можно удалить из клеток способами, которые хорошо известны в данной области. Клетки можно отобрать, например, при использовании проточной цитометрии с применением антител, связанных с или нанесенных на шарики с последующим фильтрованием или при постановке других методов отделения, которые хорошо известны в данной области. Большинство отобранных клеток представляют собой негативные по дифференцировочному антигену и экспрессирующие оба антигена CD44 и CD11b, независимо от того, какие используются антитела при выделении.
Как правило, стволовые клетки идентифицируют по распределению антигенов на поверхности клеток (подробное обсуждение смотри в Stem Cells: Scientific Progress and Future Directions, сообщение, подготовленное National Institutes of Health, Office of Science Policy, June 2001, Appendix E: Stem Cell Markers, этот источник включен здесь для сведения в полном объеме). Примерно 75% негативных по дифференцировочному антигену гематопоэтических стволовых клеток, выделенных из костного мозга, также являются позитивными на CD44. В предпочтительном варианте осуществления большинство клеток из клеточной популяции MLBM являются негативными по дифференцировочному антигену гематопоэтическими стволовыми клетками (т.е. CD44+Lin-HSC).
В том смысле, в котором оно используется здесь и в прилагаемой формуле изобретения, выражение «взрослый» по отношению к костному мозгу и клеткам костного мозга включает костный мозг, выделенный в постнатальном периоде, т.е. от молодых и взрослых индивидуумов, в противоположность эмбрионам. Следовательно, термин «взрослое млекопитающее» относится к молодым (в постнатальном периоде) и полностью зрелым млекопитающим, в противоположность эмбрионам или индивидуумам в пренатальном периоде развития.
Популяции клеток Lin- HSC, содержащие эндотелиальные клетки-предшественники (ЕРС), являются особенно подходящими для способов по настоящему изобретению. Выделенные популяции клеток Lin- HSC предпочтительно содержат клетки млекопитающих, среди которых, по меньшей мере, примерно 20% клеток экспрессируют поверхностный антиген CD31, который обычно присутствует на эндотелиальных клетках. В другом варианте осуществления, по меньшей мере, примерно 50% клеток экспрессирует CD31, более предпочтительно, по меньшей мере, примерно 65%, наиболее предпочтительно, по меньшей мере, примерно 75%. Предпочтительно, по меньшей мере, примерно 50% клеток в популяциях Lin- HSC по настоящему изобретению предпочтительно экспрессирует антиген интегрин α6.
В одной предпочтительной популяции мышиных клеток Lin- HSC, по меньшей мере, примерно 50% клеток экспрессирует антиген CD31 и, по меньшей мере, примерно 50% клеток экспрессирует антиген CD117 (c-kit). Предпочтительно, по меньшей мере, примерно 75% клеток Lin- HSC экспрессирует поверхностный антиген CD31, более предпочтительно примерно 81% клеток. В другом предпочтительном варианте осуществления на мышах, по меньшей мере, примерно 65% клеток экспрессирует поверхностный антиген CD117, более предпочтительно 70% клеток. Особенно предпочтительным вариантом осуществления настоящего изобретения является популяция клеток Lin HSC, в которой примерно от 50% до 85% клеток экспрессирует поверхностный антиген CD31 и примерно от 70% до 75% клеток экспрессирует поверхностный антиген CD117.
В предпочтительной популяции человеческих клеток Lin- HSC клетки являются негативными на CD31 и, по меньшей мере, примерно 50% клеток экспрессирует поверхностный антиген CD31 и, по меньшей мере, примерно 50% клеток экспрессирует антиген интегрин α6. Еще одним предпочтительным вариантом осуществления является популяция человеческих клеток Lin- HSC, в которой клетки являются позитивными на CD133, в которой, по меньшей мере, примерно 30% клеток экспрессирует поверхностный антиген CD31 и, по меньшей мере, примерно 30% клеток экспрессирует антиген интегрин α6.
Популяции выделенных клеток Lin- HSC по настоящему изобретению избирательно направлены на астроциты, и они включаются в новую сосудистую сеть сетчатки при интравитреальном введении в глаза млекопитающих, таких как мышь или человек, от которых выделены клетки.
Популяции выделенных клеток MLBM также направлены на астроциты, и они включаются в новую сосудистую сеть сетчатки при интравитреальном введении в глаза млекопитающих, таких как мышь или человек, от которых выделены клетки.
Популяции выделенных клеток MLBM включают клетки, которые дифференцируются в эндотелиальные клетки и образуют сосудистые структуры в сетчатке. В частности, популяции клеток MLBM являются пригодными для лечения реваскулярных и сосудистых дегенеративных заболеваний сетчатки и для восстановления поврежденных сосудов сетчатки. Популяции клеток MLBM также способствуют спасению нейронов в сетчатке и индуцируют положительную регуляцию антиапоптозных генов. Популяции клеток MLBM по изобретению, в частности, пригодны для лечения аномалий сетчатки глаза у новорожденных млекопитающих, таких как млекопитающие, страдающие индуцированной кислородом ретинопатии или ретинопатии при недоношенности.
В качестве альтернативы для лечения новорожденных младенцев вазотрофическую популяцию негативных по дифференцировочному антигену гематопоэтических стволовых клеток, выделенную из крови вены пупочного канатика, можно использовать вместо популяций стволовых клеток, полученных из костного мозга.
Настоящее изобретение относится к способу лечения ретинопатии при недоношенности и близких заболеваний, таких как индуцированная кислородом ретинопатия у млекопитающих. Способ включает введение в сетчатку млекопитающего, страдающего или имеющего риск развития ретинопатии при недоношенности или близкого ретинопатического заболевания, количества клеток из вазотрофической популяции негативных по дифференцировочному антигену гематопоэтических стволовых клеток, эффективного для обеспечения лечебной физиологической реваскуляризации в поврежденных участках сетчатки. Предпочтительно млекопитающее является человеком.
В одном предпочтительном варианте осуществления популяция негативных по дифференцировочному антигену гематопоэтических стволовых клеток представляет популяцию клеток Lin- HSC, содержащую эндотелиальные клетки-предшественники, описанные выше, например популяцию клеток костного мозга. В другом предпочтительном варианте осуществления популяция негативных по дифференцировочному антигену гематопоэтических стволовых клеток представляет популяцию выделенных миелоподобных клеток, полученных из костного мозга (MLBM), в которой большинство клеток являются негативными по дифференцировочному антигену и экспрессируют антиген CD44, а также антиген CD11b. Предпочтительно клетки, которые вводят млекопитающему, являются аутологичными для конкретного млекопитающего, которое подвергается лечению. Предпочтительно клетки вводят посредством внутриглазной инъекции. В предпочтительном варианте осуществления клетки вводят млекопитающему, страдающему ретинопатией при недоношенности (ROP), такому как человеческий младенец, на ранних стадиях заболевания. В другом предпочтительном варианте осуществления клетки вводят млекопитающему с риском развития ROP или близкого ретинопатического заболевания, в качестве профилактического средства до воздействия гипероксии или до начала развития симптомов заболевания.
Количество клеток из популяции негативных по дифференцировочному антигену гематопоэтических стволовых клеток, вводимых в глаза, является достаточным для купирования развития заболевания глаз. Например, количество вводимых клеток может быть эффективным для восстановления повреждения сетчатки глаза, стабилизации новой сосудистой сети сетчатки, созревания новой сосудистой сети сетчатки и профилактики или остановки сосудистых истечений и сосудистых кровоизлияний.
Клетки из популяции негативных по дифференцировочному антигену гематопоэтических стволовых клеток по настоящему изобретению можно трансфицировать терапевтически пригодными генами, такими как гены, кодирующие антиангиогенные белки, для применения в опосредованной клетками генной терапии глаз и гены, кодирующие нейротрофические вещества для повышения эффекта спасения нейронов.
Трансфицированные клетки могут включать любой ген, который является терапевтически пригодным для лечения заболеваний сетчатки. В одном предпочтительном варианте осуществления трансфицированные клетки включают ген, операбельно кодирующий антиангиогенный пептид, включая белки или фрагменты белков, такие как антиангиогенные (т.е. ангиостатические) фрагменты TrpRS, например, Т1- и Т2-фрагменты TrpRS, которые подробно описаны в совместной, одновременно рассматриваемой заявке на патент США No 10/080839, раскрытие которой включено здесь посредством ссылки. Трансфицированные клетки, кодирующие антиангиогенный пептид по настоящему изобретению, являются пригодными для лечения заболеваний сетчатки, включающих аномальное развитие сосудов, таких как диабетическая ретинопатия и подобные заболевания. Предпочтительно популяциями клеток являются таковые из человеческих клеток.
В другом предпочтительном варианте осуществления трансфицированные клетки включают ген, операбельно кодирующий нейротрофическое вещество, такое как фактор роста нервов, нейротрофин-3, нейротрофин-4, нейротрофин-5, цилиарный нейротрофический фактор, эпителиальный нейротрофический фактор пигментного эпителия сетчатки, инсулиноподобный фактор роста, глиальный нейротрофический фактор, нейротрофический фактор ткани мозга и тому подобное. Такие нейротрофические клетки являются пригодными для обеспечения спасения нейронов при нейрональных дегенеративных заболеваниях сетчатки, таких как глаукома и пигментный ретинит, при лечении повреждений нервов сетчатки и тому подобное. Сообщалось об имплантатах, включающих цилиарный нейротрофический фактор в качестве средства для лечения пигментного ретинита (смотри Kirby et al., 2001, Mol. Ther. 3(2): 241-8; Farrar et al., 2002, EMBO Journal 21: 857-854). Сообщалось, что нейротрофический фактор ткани мозга модулирует ассоциированный с генами рост в поврежденном ганглии сетчатки (смотри Fournier et al., 1997, J. Neurosci. Res. 47: 561-572). Имеются сообщения о том, что нейротрофический фактор, полученный из глиальных клеток, замедляет дегенерацию фоторецепторов при пигментном ретините (смотри McGee et al., 2001, Mol. Ther. 4(6): 622-9).
Предпочтительно, по меньшей мере, 1×105 клеток из популяции негативных по дифференцировочному антигену гематопоэтических стволовых клеток вводят посредством интравитреальной инъекции в глаза млекопитающего, страдающего дегенеративным заболеванием сетчатки. Количество клеток для введения может зависеть от тяжести дегенерации клетчатки, возраста млекопитающего и других факторов, которые будут легко очевидны любому специалисту в области лечения заболеваний сетчатки. Клетки из популяции негативных по дифференцировочному антигену гематопоэтических стволовых клеток можно вводить в одной дозе или несколькими дозами в течение периода времени, как это определит врач, занимающийся лечением.
Данные, полученные на OIR модели ROP, указывают, что особым преимуществом лечения с использованием способов по настоящему изобретению является эффект вазотрофического и нейротрофического спасения, наблюдаемый в глазах после интравитреальной обработки популяциями негативных по дифференцировочному антигену гематопоэтических стволовых клеток. Нейроны и фоторецепторы сетчатки, в частности колбочки, сохраняются, и может иметь место некоторое поддержание зрительной функции глаз, обработанных клетками из популяций негативных по дифференцировочному антигену гематопоэтических стволовых клеток по изобретению. Лечение ингибиторами ангиогенеза не приводит к блокированию терапевтического действия популяций негативных гематопоэтических стволовых клеток. Наблюдали присутствие клеток, подобных макрофагам, что ассоциировалось со спасенными кровеносными сосудами, на основании чего можно предположить о наличии возможной связи между иммунными клетками и негативными по дифференцировочному антигену клетками костного мозга в отношении вазотрофической активности негативных по дифференцировочному антигену клеток. Однако введение антител против CD18 в период с Р7 по Р17 в целях снижения выхода макрофагов из кровеносных сосудов не приводит к блокированию спасательного эффекта негативных по дифференцировочному антигену гематопоэтических стволовых клеток.
В еще одном предпочтительном варианте осуществления клетки вводят до начала развития заболевания или на его ранних стадиях для защиты сетчатки от повреждения, которое иначе будет иметь место, если глаз остается без обработки. Подобное профилактическое лечение является особенно желательным в тех случаях, когда известно, что млекопитающее, подвергающееся лечению, имеет риск развития ретинопатии при недоношенности, индуцированной кислородом ретинопатии или других ретинопатических заболеваний. Профилактическое лечение является особенно эффективным в настоящих способах, поскольку присутствие популяций негативных по дифференцировочному антигену клеток в глазу будет реально приводить к ослаблению тяжести повреждения сосудов в сетчатке и может остановить заболевание до того, как будет иметь место повреждение, в противоположность просто обеспечения восстановления после повреждения сетчатки. Например, на модели OIR было установлено, что мыши после введения Lin- HSC в период на Р3 и Р7, до воздействия гипероксии в меньшей степени подвергаются повреждению сетчатки и выздоравливают быстрее по сравнению с мышами, которым клетки вводили после воздействия гипероксии. Кроме того, у мышей, которые подверглись обработке во время воздействия гипероксии, также наблюдали более быстрое выздоровление.
Развитие сосудов сетчатки у мышей
Модель глазного ангиогенеза. Глаза мышей являются принятой моделью для проведения исследований, касающихся развития сосудов сетчатки у млекопитающих, например, развития сосудов сетчатки у человека. В период развития сосудистой сети у мышей имеет место развитие кровеносных сосудов сетчатки, стимулированное ишемией, в тесной ассоциации с астроцитами. Данные глиальные элементы мигрируют в третьем триместре развития плода человека или грызунов в неонатальном периоде в сетчатку из диска зрительного нерва, наряду со слоем клеток ганглия, и распространяются радиально. По мере развития сосудистой сети сетчатки эндотелиальные клетки используют уже образовавшуюся матрицу из астроцитов для определения характера распределения сосудов сетчатки (смотри Фиг.1 (А и В)). На Фиг.1 (А и В) представлены схематичные изображения развивающейся мышиной сетчатки. Панель (А) показывает развитие первичного сплетения (темные линии вверху слева на изображении), наложенные на матрицу из астроцитов (светлые линии), в то время как (В) показывает вторую фазу формирования сосудов сетчатки. На Фиг.1 GCL означает слой клеток ганглия; IPL означает слой внутреннего сплетения; INL означает внутренний ядерный слой; ОPL означает слой внешнего сплетения; ОNL означает внешний ядерный слой; RPE означает пигментный эпителий сетчатки; ОN означает зрительный нерв и Р означает периферические области.
При рождении сосудистая сеть сетчатки практически отсутствует. На 14 сутки постнатального периода (Р14) в сетчатке развиваются сложные первичный (поверхностный) и вторичный (глубокий) сосудистые слои, что совпадает с началом прозрения. Первоначально спицеподобные периферические сосуды формируются радиально по существующей сети астроцитов к периферии, постепенно становясь связанными между собой при формировании капиллярных сплетений. Данные сосуды растут в виде монослоя внутри нервного волокна на Р10 (Фиг.1 (А)). На Р7-Р8 коллатеральные ветви начинают распространяться от данного первичного сплетения и проникают в сетчатку к внешнему плексиформному слою, где они образуют вторичное или глубокое сплетение сетчатки. На период Р21 вся сеть подвергается существенной перестройке и образуется третичное или промежуточное сплетение на внутренней поверхности внутреннего ядерного слоя (Фиг.1 (В)).
Модель ангиогенеза сетчатки у новорожденных мышей является подходящей для исследования роли HSC в период глазного ангиогенеза по нескольким причинам. На данной физиологически адекватной модели существует крупная матрица из астроцитов до появления эндогенных кровеносных сосудов, что позволяет оценить их роль для клетка-клеточной направленности во время процесса формирования новой сосудистой сети. Кроме того, известно, что данный согласованный и воспроизводимый процесс формирования сосудов в сетчатке в неонатальном периоде индуцируется гипоксией, и в данном отношении он имеет аналогии со многими заболеваниями сетчатки, в развитии которых играет роль ишемия.
Обогащение эндотелиальными клетками-предшественниками (ЕРС) из костного мозга
Несмотря на то что экспрессия клеточных поверхностных маркеров уже широко исследовалась на популяции ЕРС, обнаруживаемой в препаратах HSC, маркеры, с помощью которых можно было бы однозначно идентифицировать ЕРС, еще слабо определены. Для обогащения ЕРС выделяли гематопоэтические позитивные на дифференцировочный маркер клетки (Lin+), т.е. В-лимфоциты (CD45), Т-лимфоциты (CD3), гранулоциты (Ly-6G), моноциты (CD11) и эритроциты (TER-119), из мононуклеарных клеток костного мозга мышей. Антиген Sca-1 использовали для дополнительного обогащения ЕРС. При сравнительном анализе результатов, полученных после интравитреального введения одинаковых количеств клеток Lin- Sca-1+ или клеток Lin-, различия между двумя группами отсутствовали. Фактически, только когда вводили клетки Lin- Sca-1-, наблюдали существенно более сильное включение в развивающиеся кровеносные сосуды.
Популяции Lin- HSC обогащают ЕРС, основываясь на функциональных тестах. Кроме того, популяции Lin+ HSC в функциональном отношении ведут себя совершенно иначе по сравнению с популяциями клеток Lin- HSC. Также оценивались эпитопы, обычно применяемые для идентификации ЕРС для каждой фракции (на основе результатов исследований по характеристике в условиях in vitro, о которых сообщалось ранее). Несмотря на то что ни один их данных маркеров не был исключительно ассоциирован с фракцией Lin-, уровень всех был повышен в пределах примерно от 70% до 1800% во фракции Lin- HSC по сравнению с фракцией Lin+ HSC (Фиг.1 (С)). На Фиг.1 панель (С) представлены данные по характеристике с использованием проточной цитометрии выделенных из костного мозга клеток Lin+ HSC и Lin- HSC. В верхнем ряду панели (С) представлен точечный график распределения гематопоэтических стволовых клеток, не меченных антителами. R1 определяет поддающуюся количественной оценке площадь с положительным окрашиванием на РЕ; R2 указывает на положительное окрашивание GFP. Точечные графики для Lin- HSC приведены в среднем ряду, и графики для Lin+ HSC представлены в нижнем ряду. Клетки С57В/6 метили РЕ-конъюгированными антителами против Sca-1, c-kit, Flk-1/KDR, CD31. Данные с Tie-2 получали на мышах Tie-2-GFP. Проценты в углах точечных графиков указывают процент положительно-меченых клеток из популяции Lin- HSC и Lin+ HSC в целом. Интересно отметить, что использованные маркеры, такие как Flk-1/KDR, Tie-2 и Sca-1, экспрессировались слабо и, таким образом, не использовались для дальнейшего фракционирования.
Клетки Lin- HSC можно выделить (а) выделением костного мозга от взрослого млекопитающего; (b) выделением множества моноцитов из костного мозга; (с) мечением моноцитов панелью конъюгированных с биотином антител против одного или более дифференцировочных поверхностных антигенов, предпочтительно дифференцировочных поверхностных антигенов, выбранных из группы, состоящей из CD2, CD3, CD4, CD11, CD11а, Мас-1, CD14, CD16, CD19, CD24, CD33, CD36, CD38, CD45, Ly-6G (мышиного), ТER-119 (мышиного), CD45RA, CD56, CD64, CD68, CD86(В7.2), CD66b, человеческого лейкоцитарного антигена DR (HLA-DR) и CD235а (гликофорина А); d) удалением моноцитов, которые являются позитивными на один или более из указанных поверхностных антигенов, из множества моноцитов; и (е) выделением из них популяции негативных по дифференцировочному антигену гематопоэтических стволовых клеток.
В тех случаях когда клетки Lin- HSC выделяют из костного мозга взрослого человека, то предпочтительно моноциты метят панелью конъюгированных с биотином антител против дифференцированных поверхностных антигенов CD2, CD3, CD4, CD11а, Мас-1, CD14, CD16, CD19, CD33, CD38, CD45RA, CD64, CD68, CD86(В7.2) и CD235а. Когда Lin- HSC выделяют из костного мозга взрослой мыши, то предпочтительно моноциты метят конъюгированной с биотином панелью антител против поверхностных антигенов CD3, CD11, CD45, Lyc-6G и TER-119.
Введенные интравитреально клетки Lin- HSC содержат ЕРС, которые направлены на астроциты и включаются в развивающуюся сосудистую сеть сетчатки
Для определения того, насколько введенные интравитреально клетки Lin- HSC могут быть направлены на определенные типы клеток сетчатки, используют матрицу из астроцитов и принимают участие в ангиогенезе сетчатки, примерно 105 клеток из композиции Lin- HSC по настоящему изобретению или клеток Lin+ HSC (контроль, примерно 105 клеток), выделенных из костного мозга взрослых мышей (трансгенных GFP или LacZ), вводили мышам в глаза на 2 сутки после рождения (Р2). Через 4 суток после введения (Р6) много клеток из композиции Lin- HSC по настоящему изобретению, полученные от трансгенных мышей GFP или LacZ, адгезировали к сетчатке и приобретали характерную удлиненную форму эндотелиальных клеток (Фиг.2 (а)). На Фиг.2 показана подсадка клеток Lin- HSC в развивающуюся сетчатку мыши. Как показано на Фиг.2, панель (а) на 4 сутки после интравитреального введения (Р6) инъецированные клетки eGFP+ Lin- HSC прикреплялись и подвергались дифференцировке на сетчатке.
Во многих участках сетчатки экспрессирующие GFP клетки располагались таким образом, что они «прилаживались» к лежащим внизу астроцитам и напоминали кровеносные сосуды. Данные флуоресцирующие клетки наблюдали поверх эндогенной, развивающейся сосудистой сети (Фиг.2 (b)). В противоположность только небольшое количество клеток Lin+ HSC (Фиг.2 (с)) или брыжеечных эндотелиальных клеток от взрослой мыши (Фиг.2 (d)) прикреплялось к поверхности сетчатки. Для определения того, насколько клетки из введенной популяции Lin- HSC также могут прикрепляться к сетчатке с уже развившимися сосудами, композицию Lin- HSC вводили в глаза взрослым мышам. Интересно отметить, что не наблюдали прикрепления клеток к сетчатке или включения в уже развившиеся, нормальные кровеносные сосуды сетчатки (Фиг.2 (е)). Это указывает на то, что композиции Lin- HSC по настоящему изобретению не приводят к разрыву развившейся, нормальной сосудистой сети и не вызывают аномальной васкуляризации в нормально развившейся сетчатке.
Для определения взаимосвязи между введенными композициями Lin- HSC и астроцитами сетчатки использовали трансгенных мышей, которые экспрессируют глиальный фибриллярный кислый белок (GFAP, маркер астроцитов) и регулируемый промотором зеленый флуоресцентный белок (GFP). Исследование образцов сетчатки от данных трансгенных мышей GFAP-GFP, которым ввели клетки Lin- HSC от трансгенных мышей eGFP, показало наличие совместной локализации введенных eGFP ЕРС и уже имеющихся астроцитов (Фиг.2 (f-h), стрелки). Наблюдали, что клетки eGFP+Lin- HSC «прилаживаются» к лежащей внизу сети астроцитов (стрелки, Фиг.2 (g)). В результате исследования глаз было установлено, что введенные, меченые клетки прикреплялись только к астроцитам; у мышей в сетчатке на период развития Р6, когда периферическая область сетчатки еще не имеет эндогенных сосудов, наблюдали, что введенные клетки прикреплялись к астроцитам в этих еще без сосудистой сети областях. С удивлением было установлено, что введенные, меченые клетки локализуются в более глубоких слоях сетчатки в точном местонахождении, где будут развиваться нормальные сосуды сетчатки (Фиг.2 (i), стрелки).
Для определения того, насколько введенные клетки Lin- HSC стабильно включаются в развивающуюся сосудистую сеть сетчатки, исследовали сосуды сетчатки на несколько временных точек. На ранней стадии Р9 (через 7 суток после введения) клетки Lin- HSC включались в структуры CD31+(Фиг.2 (j)). На период Р16 (14 суток после введения) клетки уже интенсивно включались в подобные сосудам структуры в сетчатке (Фиг.2 (k)). Когда родамин-декстран вводили непосредственно в сосуды (для идентификации функциональных кровеносных сосудов сетчатки) перед убоем животных, то большая часть клеток Lin- HSC совпадала с основными сосудами (Фиг.2 (l)). Наблюдали два типа распределения меченых клеток: (1) при одном типе, т.е. клетки выстраивались вдоль сосудов между немечеными эндотелиальными клетками и (2) другой тип показывал, что сосуды полностью состояли из меченых клеток. Введенные клетки также включались в сосуды глубокого сосудистого сплетения (Фиг.2 (m)). Несмотря на имеющееся сообщение о случайном включении клеток ЕРС из Lin- HSC в новую сосудистую сеть, данное сообщение о том, что сосудистая сеть полностью состоит из данных клеток, является первым. Эти данные свидетельствуют о том, что популяция клеток Lin- HSC, полученная из костного мозга, при интравитреальном введении может эффективно включаться в любой слой формирующегося сосудистого сплетения сетчатки.
Гистологическое исследование тканей, не относящихся к сетчатке (например, мозга, печени, сердца, легких, костного мозга), не выявило присутствия каких-либо позитивных на GFP клеток при исследовании в период на 5 или 10 сутки после интравитреального введения. Эти данные указывают на то, что эта субпопуляция клеток во фракции Lin- HSC избирательно направлена на астроциты и что она стабильно включается в развивающуюся сосудистую сеть сетчатки. Поскольку данные клетки имеют многие свойства эндотелиальных клеток (ассоциация с астроцитами сетчатки, удлиненная форма, стабильное включение в новые сосуды и их отсутствие в бессосудистых участках), то данные клетки представляют ЕРС, присутствующие в популяции Lin- HSC. Астроциты, на которые они направлены, представляют тот же тип, наблюдаемый при многих индуцированных гипоксией ретинопатиях. Хорошо известно, что глиальные клетки являются известным компонентом новых сосудистых ветвей пучков, наблюдаемых при DR и других формах повреждения сетчатки. В условиях реактивного глиоза и индуцированной ишемией реваскуляризации активированные астроциты пролиферируют, продуцируют цитокины и индуцируют положительную регуляцию GFAP, наподобие тому, что наблюдается во время формирования сосудистой матрицы в сетчатке новорожденных у многих видов млекопитающих, включая людей.
Для выяснения того, направлены ли популяции Lin- HSC на активированные астроциты в глазах взрослых мышей, так же как это происходит в глазах новорожденных, клетки Lin- HSC вводили в глаза взрослых мышей с сетчаткой, поврежденной фотокоагуляцией (Фиг.3 (а)) или кончиком иглы (Фиг.3 (b)). На обеих моделях популяция клеток с сильным окрашиванием на GFAP локализовалась только около места повреждения (Фиг.3 (а и b)). Клетки из введенных композиций Lin- HSC локализовались около места повреждения и оставались специфически связанными с GFAP-позитивными астроцитами (Фиг.3 (а и b)). В этих местах также наблюдали, что клетки Lin- HSC мигрировали в более глубокий слой сетчатки на уровне, сходном с таковым, наблюдаемом во время формирования глубокой сосудистой сети в неонатальном периоде. В неповрежденных участках сетчатки клетки Lin- HSC отсутствовали, что аналогично тому, что наблюдается при введении Lin- HSC в нормальную, не поврежденную сетчатку у взрослых мышей (Фиг.2 (е)). Эти данные указывают на то, что композиции Lin- HSC могут быть избирательно направлены на активированные глиальные клетки в поврежденной сетчатке взрослых мышей с глиозом, а также в сетчатке новорожденных, претерпевающей васкуляризацию.
Введенные интравитреально клетки Lin- HSC могут спасти и стабилизировать дегенерирующую сосудистую сеть
Поскольку введенные интравитреально композиции клеток Lin- HSC направлены на астроциты, и они включаются в нормальную сосудистую сеть сетчатки, то данные клетки могут также стабилизировать претерпевающую дегенеративные изменения сосудистую сеть при ишемических и дегенеративных заболеваниях сетчатки, ассоциированных с глиозом и дегенерацией сосудов. Мыши rd/rd являются моделью дегенерации сетчатки, у которых имеет место выраженная дегенерация фоторецепторов и сосудистых слоев сетчатки через 1 месяц после рождения. Сосудистая сеть сетчатки у данных мышей развивается нормально до Р16, когда на данный период времени более глубокое сосудистое сплетение подвергается регрессии; у большинства мышей глубокое и промежуточное сплетения практически полностью дегенерируют к Р30.
Для определения того, насколько клетки Lin- HSC могут спасать регрессирующие сосуды, клетки Lin+ или Lin- HSC (от мышей Balb/c) вводили мышам rd/rd интравитреально на Р6. На Р33 после введения клеток Lin+сосуды наиболее глубокого слоя сетчатки практически полностью отсутствовали (Фиг.4 (а и b)). В противоположность большая часть образцов сетчатки после введения Lin- HSC на Р33 имела почти нормальную сосудистую сеть с тремя параллельными, хорошо сформированными сосудистыми слоями (Фиг.4 (а и d)). Количественная оценка данного эффекта показала, что средняя длина сосудов в глубоком сосудистом сплетении в глазах мышей rd/rd, обработанных Lin- HSC, была почти в три раза выше по сравнению с таковой в необработанных или обработанных Lin+ глазах (Фиг.4 (е)). С удивлением было установлено, что введение композиции Lin- HSC из костного мозга взрослых мышей rd/rd (FVB/N) также приводило к спасению дегенерирующей сосудистой сети в сетчатке новорожденных мышей rd/rd (Фиг.4 (f)). Дегенерацию сосудистой сети в глазах мышей rd/rd наблюдали на 2-3 неделю после рождения. Введение клеток Lin- HSC на более поздний срок Р15 также приводило к частичной стабилизации дегенерирующей сосудистой сети у мышей rd/rd, по меньшей мере, в течение 1 месяца (Фиг.4 (g и h)).
Композиция Lin- HSC, введенная мышам rd/rd меньшего возраста (например, на Р2), также включалась в развивающуюся поверхностную сосудистую сеть. На Р11 наблюдали, что данные клетки мигрируют к месту глубокого сосудистого сплетения и образуют тип, характерный наблюдаемому во внешнем сосудистом слое сетчатки у мышей дикого типа (Фиг.5 (а)). Для более четкого описания того, как клетки из композиций Lin- HSC включаются в и стабилизируют дегенерирующую сосудистую сеть сетчатки у мышей rd/rd, композицию Lin- HSC, полученную от мышей Balb/c, вводили в глаза мышам Tie-2-GFP FVB. Мыши FVB имеют генотип мышей rd/rd и поскольку они экспрессируют гибридный белок Tie-2-GFP, то все эндогенные кровеносные сосуды флуоресцируют.
Когда не меченые клетки из композиции Lin- HSC вводят в глаза новорожденным мышам Tie-2-GFP FVB и затем они включаются в развивающуюся сосудистую сеть, то должны быть не меченые «бреши» в эндогенных, меченных Tie-2-GFP сосудах, которые соответствуют включенным, введенным, не меченым клеткам Lin- HSC. В результате последующего окрашивания другим сосудистым маркером (например, СD31) сосуд вырисовывается целиком, что позволяет определить, являются ли не эндогенные, эндотелиальные клетки частью сосудистой сети. Через 2 месяца после инъекции в сетчатке глаза наблюдали присутствие СD31-позитивных, Tie-2-GFP-негативных сосудов после введения композиции Lin- HSC (Фиг.5 (b)). Интересно отметить, что большинство спасенных сосудов содержало позитивные на Tie-2-GFP клетки (Фиг.5 (с)). Распределение перицитов, по данным окрашивания на актин гладкой мускулатуры, не подверглось изменению после введения Lin- HSC, независимо имело ли место спасение сосуда (Фиг.5 (d)). Эти данные четко демонстрируют, что введенные интравитреально клетки Lin- HSC мигрируют в сетчатку, принимают участие в формировании новых кровеносных сосудов сетчатки и стабилизируют эндогенную дегенерирующую сосудистую сеть у мышей с генетическим дефектом.
Подавление ангиогенеза в сетчатке трансфицированными клетками из Lin- HSC
В развитии большинства сосудистых заболеваний сетчатки в большей степени принимает участие аномальная пролиферация сосудов, чем дегенерация. Трансгенные клетки, направленные на астроциты, можно использовать для доставки антиангиогенного белка и подавления ангиогенеза. Клетки из композиций Lin- HSC трансфицировали Т2-триптофанил-тРНК-синтетазой (Т2-TrpRS). Т2-TrpRS представляет собой фрагмент TrpRS с молекулярной массой 43 кДа, который эффективно ингибирует ангиогенез в сетчатке (Фиг.6 (а) и Фиг.34). На Р12 сетчатка глаз, в которую вводили клетки Lin- HSC, трансфицированные контрольной плазмидой (без гена Т2-TrpRS) на Р2, имели нормальные первичное (Фиг.6 (с)) и вторичное (Фиг. (d)) сосудистые сплетения сетчатки. При инъецировании на Р2 композиции трансфицированных Т2-TrpRS клеток Lin- HSC по настоящему изобретению и оценке результатов введения через 10 суток оказалось, что первичная сосудистая сеть имела существенные аномалии (Фиг.6 (е)) и формирование глубокой сосудистой сети сетчатки было практически полностью подавлено (Фиг.6 (f)). Несколько сосудов, наблюдаемых в данных глазах, было заметно ослаблено с наличием крупных «брешей» между сосудами. Данные по степени подавления под действием секретирующих Т2-TrpRS клеток Lin- HSC подробно представлены в таблице 1.
Т2-TrpRS продуцируется и секретируется клетками в композиции в условиях in vitro и после введения данных трансфицированных клеток в стекловидное тело в сетчатке детектировали наличие фрагмента Т2-TrpRS с молекулярной массой 30 кДа (Фиг.6 (b)). Данный фрагмент массой 30 кДа избирательно наблюдали только в сетчатке, обработанной трансфицированными клетками Lin- HSC, и это снижение кажущейся молекулярной массы по сравнению с рекомбинантным или синтезированным в условиях in vitro белком может быть результатом процессинга или деградации Т2-TrpRS в условиях in vivo. Эти данные указывают на то, что композиции Lin- HSC можно использовать для доставки функционально активных генов, таких как гены, экспрессирующие ангиостатические молекулы, в сосудистую сеть сетчатки посредством направленной доставки к активированным астроцитам. Несмотря на возможность того, что наблюдаемый ангиостатический эффект является результатом опосредованной клетками активности, это кажется маловероятным, поскольку глаза, обработанные идентичными, но не трансфицированными Т2 клетками Lin- HSC, имели в сетчатке нормальную сосудистую сеть.
Введенные интравитреально популяции клеток Lin- HSC локализуются близко к астроцитам сетчатки, включаются в сосуды и могут быть пригодными для лечения многих заболеваний сетчатки. Несмотря на то что введенные композиции HSC прикрепляются к матрице из астроцитов, небольшие количества мигрируют глубоко в сетчатку, проникая в области, где затем будет развиваться глубокая сосудистая сеть. Даже несмотря на то что в данной зоне не наблюдали присутствия GFAP-позитивных астроцитов до 42 суток после рождения, это не исключает возможность того, что GFAP-негативные глиальные клетки уже присутствуют для обеспечения сигнала для локализации Lin- HSC. В предыдущих исследованиях было показано, что многие заболевания ассоциируются с реактивным глиозом. В частности, при DR глиальные клетки и их внеклеточное вещество ассоциированы с патологическим ангиогенезом.
Поскольку клетки композиций Lin- HSC специфически прикрепляются к GFAP-экспрессирующим глиальным клеткам, независимо от типа повреждения, композиции Lin- HSC по настоящему изобретению можно использовать для их направления в преангиогенные участки поражения в сетчатке. Например, при ишемических ретинопатиях, таких как диабет, реваскуляризация возникает в ответ на гипоксию. При направлении композиций Lin- HSC к месту патологической реваскуляризации развитие новой сосудистой сети можно стабилизировать, предупреждая возникновение аномалий в новой сосудистой сети, таких как кровоизлияние или отек (причины потери зрения при DR), и может потенциально ослабить гипоксию, которая первоначально стимулировала реваскуляризацию. Аномальные кровеносные сосуды можно восстановить до нормального состояния. Кроме того, ангиостатические белки, такие как T2-TrpRS (SEQ ID NO: 3 на Фиг.34), T2-TrpRS-GD (SEQ ID NO: 4 на Фиг.34), мини-TrpRS (SEQ ID NO: 5 на Фиг.35) и T1-TrpRS (SEQ ID NO: 6 на Фиг.36), можно доставить в места патологического ангиогенеза при использовании трансфицированных композиций Lin- HSC и индуцированной лазером активации астроцитов. Предпочтительные ангиостатические фрагменты TrpRS включают T2-TrpRS и T2-TrpRS-GD. Поскольку лазерную фотокоагуляцию обычно используют в клинической офтальмологии, то данный подход имеет применение для лечения многих заболеваний клетчатки. Несмотря на применение опосредуемых клетками подходов при лечении злокачественных опухолей, их использование в отношении глазных болезней является более преимущественным, поскольку посредством внутриглазной инъекции возможно доставить большие количества клеток непосредственно в место заболевания.
Нейротрофическое и вазотрофическое спасение под действием клеток Lin- HSC
МАСS использовали для выделения Lin-HSC из костного мозга мышей с усиленным зеленым флуоресцентным белком (eGFP), C3H (rd/rd), FVB (rd/rd), как было описано выше. Содержащие ЕРС Lin-HSC от данных мышей вводили интравитреально на Р6 в глаза мышам C3H и FVB. Образцы сетчатки отбирали на различные временные точки (1 месяц, 2 месяца и 6 месяцев) после введения. Сосудистую сеть анализировали сканированием с использованием лазерного конфокального микроскопа после окрашивания антителами против CD31 и проведением гистологических исследований сетчатки после окрашивания ядер DAPI. Также использовали анализ экспрессии микросовокупности генов мРНК из сетчатки в различные временные точки для идентификации генов, потенциально принимающих участие в этом действии.
В глазах мышей rd/rd была обнаружена выраженная дегенерация нейросенсоров сетчатки и сосудистой сети сетчатки на Р21. В глазах мышей rd/rd, обработанных клетками Lin-HSC, на Р6 имела место нормальная сосудистая сеть сетчатки в течение 6 месяцев; оба глубокий и промежуточный слоя были существенно более развиты по сравнению с контролем на те же временные точки (1М, 2М и 6М) (смотри Фиг.12). Кроме того, наблюдали, что образцы сетчатки после обработки Lin-HSC были также толще (на период 1М в 1,2 раза; на период 2М в 1,3 раза; на период 6М в 1,4 раза) и имели большее количество клеток во внешнем ядерном слое (на период 1М в 2,2 раза; на период 2М в 3,7 раза; на период 6М в 5,7 раза) по сравнению с глазами, обработанными клетками Lin+HSC, использованными в качестве контроля. Широкомасштабный геномный анализ «спасенных» сетчаток (например, при использовании Lin-HSC) по сравнению с контрольными образцами сетчатки (без обработки или обработанных клетками, не относящимися к Lin-) показал достоверную положительную регуляцию генов, кодирующих sHSC (небольшие белки теплового шока) и специфических факторов роста, которая коррелировала со спасением сосудов и нейронов, включая гены, кодирующие белки, представленные на Фиг.20, панели А и В.
Полученные из костного мозга популяции Lin-HSC существенно и воспроизводимо индуцировали сохранение нормальной сосудистой сети и значительно увеличивали слои фоторецепторов и других нейронных клеток у мышей rd/rd. Данный нейротрофический спасательный эффект коррелировал с достоверной положительной регуляцией небольших белков теплового шока и факторов роста и способствовал пониманию сущности терапевтических подходов к лечению известных, не поддающихся в настоящее время лечению дегенеративных заболеваний сетчатки.
Сетчатка у мышей rd1/rd1 проявляет выраженную дегенерацию сосудов и нейронов
Постнатальное развитие сосудов и нейронов в сетчатке у мышей в норме хорошо описано и аналогично изменениям, наблюдаемым в третьем триместре развития человеческого эмбриона (Dorrell et al., 2002, Invest. Ophtalmon. Vis. Sci. 43: 3500-3510). Мыши, гомозиготные в отношении гена rd1, разделяют многие характерные свойства дегенерации сетчатки у человека (Frasson et al., 1999, Natl. Med. 5: 1183-1187), и у них имеется быстрая потеря фоторецепторов (PR), которая сопровождается тяжелой атрофией сосудов, в результате мутации гена, кодирующего cGMP-фосфодиэстеразу PR (Bowes et al., 1990, Nature 347: 677-680). Для исследования сосудистой сети во время развития сетчатки и ее последующей дегенерации использовали антитела против коллагена IV (CIV), белка внеклеточного вещества (ЕСМ) зрелой сосудистой сети и CD31 (PECAM-1), маркера эндотелиальных клеток (Фиг.15). Сетчатка мышей rd1/rd1 (C3H/HeJ) развивалась нормально до примерно 8 суток после рождения (Р), когда началась дегенерация содержащего фоторецепторы внешнего ядерного слоя (ONL). ONL быстро дегенерировал и клетки погибали апоптозом, так что к Р20 остался только единичный слой ядер. В результате двойного окрашивания общего препарата сетчатки антителами против CIV и CD31 были выявлены детали дегенерации сосудов у мышей rd1/rd1, аналогичные описанным другими исследователями (Blanks et al., 1986, J. Comp. Neurol. 254: 543-553). Оказалось, что первичный и глубокий сосудистые слои развивались нормально до Р12, после чего имела место быстрая потеря эндотелиальных клеток по результатам отсутствия окрашивания на CD31. Позитивные на CD31 эндотелиальные клетки находились в нормальном распределении до Р12, но после этого быстро исчезали. Интересно отметить, что положительное окрашивание на CIV оставалось на протяжении всего периода наблюдений, на основании чего можно предположить, что сосуды и связанные ЕСМ образуются нормально, но остается только матрикс после Р13, поскольку на данный период развития CD31-позитивные клетки отсутствовали (Фиг.15, средние панели). Промежуточное сосудистое сплетение также подвергалось дегенерации после Р21, но она прогрессировала медленнее по сравнению с глубоким сплетением (Фиг.15, верхняя панель). Сосудистые и нейронные слои сетчатки нормальных мышей представлены для сравнения с мышами rd1/rd1 (правые панели, Фиг.15).
Нейрозащитное действие полученных из костного мозга клеток Lin- HSC у мышей rd1/rd1
Введенные интравитреально клетки Lin-HSC включаются в эндогенную сосудистую сеть сетчатки во всех трех сосудистых сплетениях и предупреждают дегенерацию сосудов. Интересно отметить, что введенные клетки никогда практически не обнаруживают во внешнем ядерном слое. Данные клетки либо включаются в образующиеся сосуды сетчатки, либо их можно обнаружить очень близко к данным сосудам. Мышиные клетки Lin-HSC (от мышей C3H/HeJ) вводили интравитреально в глаза мышам C3H/HeJ (rd1/rd1) на Р6, непосредственно перед началом дегенерации. К Р30 глаза после введения контрольных клеток (CD31-) проявляли характерный для мышей rd1/rd1 фенотип, т.е. в каждой обследованной сетчатке наблюдали практически полную дегенерацию глубокого сосудистого сплетения и ONL. В глазах с введением клеток Lin-HSC промежуточное и глубокое сосудистое сплетения сохраняли нормальный внешний вид. С удивлением можно было отметить, что достоверно больше клеток наблюдали во внутреннем ядерном слое (INL) и ОNL в глазах после введения Lin-HSC по сравнению с глазами, обработанными контрольными клетками (Фиг.16 (А)). Спасательный эффект клеток Lin-HSC можно было наблюдать через 2 месяца (Фиг.16 (В)) и даже на протяжении такого длительного периода времени, как 6 месяцев после инъекции (Фиг.16 (С)). Различия в сосудистой сети промежуточного и глубокого сплетений в глазах после введение Lin-HSC, а также содержащих нейроны INL и ОNL, были достоверными на все временные точки при сравнении спасенных и не спасенных глаз (Фиг.16 (В и С)). Данный эффект анализировали количественно по определению общей длины сосудистой сети (Фиг.16 (D)) и количества DAPI-позитивных ядер клеток в ОNL (Фиг.16 (Е)). Применили анализ простой линейной регрессии для обработки данных на все временные точки.
Наблюдали наличие статистически достоверной корреляции между спасением сосудов и спасением нейронов (например, в отношении толщины ОNL) на Р30 (р<0,024) и Р60 (р<0,034) в глазах после обработки Lin-HSC (Фиг.16 (F)). Корреляция оставалась высокой, хотя, и уже статистически недостоверной (р<0,14) на Р180 при сравнении образцов сетчатки после введения Lin-HSC с сетчаткой, обработанной контрольными клетками (Фиг.16 (F)). В противоположность для сетчатки после введения контрольных клеток не было установлено статистически значимой корреляции между сохранением сосудистой сети и ОNL на любую временную точку (Фиг.16 (F)). Эти данные показывают, что интравитреальное введение клеток Lin-HSC приводит к одновременному спасению сосудов сетчатки и нейронов сетчатки у мышей rd1/rd1. Не наблюдали локализации введенных клеток в ОNL или любом ином месте, чем внутри, или в тесной близости к кровеносным сосудам сетчатки.
Функциональное спасение сетчатки введением Lin-HSC у мышей rd/rd
Снимали электроретинограммы (ERG) у мышей через 2 месяца после введения контрольных клеток или мышиных Lin-HSC (Фиг.17). Проводили иммуногистохимический и микроскопический анализ с каждым глазом после записи ERG для подтверждения того, что имело место спасение сосудов и нейронов. Показательные записи ERG на обработанных, спасенных и контрольных, не спасенных глазах показали, что в спасенных глазах цифровой вычтенный сигнал (обработанные минус необработанные глаза) давал четко детектируемый сигнал с амплитудой порядка 8-10 микровольт (Фиг.17). Четко сигналы от обоих глаз были в сильной степени аномальными. Однако постоянные и детектируемые ERG регистрировали от обработанных клетками Lin-HSC глаз. Во всех случаях ERG от контрольного глаза не детектировалась. Несмотря на то что амплитуды сигналов для спасенных глаз были значительно ниже по сравнению с нормой, сигналы постоянно воспроизводились в тех случаях, когда спасение было подтверждено гистологически, и они были того порядка, о котором сообщалось в других исследованиях по спасению сетчатки на основе генов. В целом эти данные свидетельствуют о некоторой степени функционального спасения в глазах, обработанных клетками Lin-HSC.
Спасенные клетки сетчатки у мышей rd/rd преимущественно представляют колбочки
Спасенные и не спасенные сетчатки анализировали иммуногистохимически с антителами, специфическими на опсин палочек или колбочек. Одни и те же образцы глаз, которые использовали для записи ERG, результаты которой приведены на Фиг.17, анализировали на наличие опсина палочек и колбочек. В сетчатке мышей дикого типа менее, чем примерно 5% имеющихся фоторецепторов представляют собой колбочки (Soucy et al., 1998, Neuron 21: 481-493), и результаты иммуногистохимического анализа, полученные с красным/зеленым опсином колбочек, как представлено на Фиг.25 (А), или родопсином палочек, как представлено на Фиг.25 (В), согласовывались с данным процентом клеток-колбочек. Когда сетчатку мышей дикого типа окрашивали неиммунной сывороткой IgG, то не наблюдали окрашивания нейросенсоров сетчатки иной, чем аутофлуоресценция кровеносных сосудов (Фиг.25 (С)). Через 2 месяца после рождения сетчатка у мышей rd/rd без обработки имела существенно атрофичный внешний ядерный слой, который не показывал какого-либо окрашивания антителами против красного/зеленого опсина колбочек (Фиг.25) (D)) или родопсина палочек (Фиг.25 (G)). При введении в глаза контрольных клеток CD31-HSC сетчатка также не окрашивалась положительно на присутствие опсина колбочек (Фиг.25 (Е)) или родопсина палочек (Фиг.25 (Н)). Напротив, в противоположных глазах, обработанных клетками Lin-HSC, имели место примерно от 3 до примерно 8 рядов ядер в сохраненном внешнем ядерном слое; большая часть данных клеток была положительной на опсин колбочек (Фиг.25 (F)) с примерно 1-3% положительными клетками на опсин палочек (Фиг.25 (I)). Примечательно, что это почти противоположно тому, что обычно наблюдается в сетчатке у мышей в норме, где преобладают палочки. Эти данные свидетельствуют о том, что введение клеток Lin-HSC сохраняет колбочки в течение длительного периода времени, в течение которого они бы обязательно подвергались дегенерации.
Клетки Lin-HSC из костного мозга человека (hBM) также спасают дегенерирующую сетчатку
Клетки Lin-HSC, выделенные из костного мозга человека, ведут себя аналогично мышиным Lin-HSC. Отбирали костный мозг у людей-доноров и истощали клетки Lin+HSC с получением популяции человеческих клеток Lin-HSC (hLin-HSC). Данные клетки метили ex vivo флуоресцентной меткой и вводили в глаза мышам C3SnSmn. CB17-Prkdc SCID. Введенные клетки hLin-HSC мигрировали и направлялись в места ангиогенеза в сетчатке таким же образом, как это наблюдали при введении мышиных Lin-HSC (Фиг.18 (А)). Помимо направленного движения к сосудам человеческие клетки Lin-HSC также обеспечивали высокий спасающий эффект в отношении слоев сосудистых клеток и нейронов у мышей rd1/rd1 (Фиг.18 (В и С)). Данное наблюдение подтверждает факт наличия клеток в человеческом костном мозге, которые направлены к сосудистой сети и могут предупредить дегенерацию сетчатки.
Клетки Lin-HSC обладают вазо- и нейротрофическим действием на мышах rd10/rd10
Несмотря на то что мыши rd1/rd1 являются наиболее широко применяемой и наилучшим образом охарактеризованной моделью дегенерации сетчатки (Chang et al., 2002, Vision Res. 42: 517-525), дегенерация протекает очень быстро и в этом отношении она отличается от обычного, более медленного по времени течения данного заболевания у человека. У данного штамма дегенерация клеток фоторецепторов начинается примерно на Р8, период времени, когда сосудистая сеть сетчатки по-прежнему быстро увеличивается (Фиг.15). Последующая дегенерация глубокой сосудистой сети сетчатки начинается несмотря на то, что формирование промежуточного сплетения по-прежнему продолжается и, таким образом, сетчатка у мышей rd1/rd1 никогда полностью не развивается в отличии от того, что наблюдают у большинства людей при данном заболевании. Модель на мышах rd10, у которых дегенерация протекает медленнее и в большей мере напоминает дегенеративное состояние сетчатки у человека, использовали для исследования опосредуемого Lin-HSC спасения сосудов. У мышей rd10 дегенерация клеток фоторецепторов начинается примерно на Р21, и затем очень быстро происходит дегенерация сосудов.
Поскольку в норме развитие нейросенсоров сетчатки в основном завершается к Р21, то начало деградации наблюдают после завершения дифференцировки клеток сетчатки и в этом отношении она в большей степени аналогична дегенеративным изменениям сетчатки, наблюдаемым у человека, по сравнению с моделью на мышах rd1/rd1. Клетки Lin-HSC или контрольные клетки от мышей rd10 вводили в глаза на Р6 и в различные временные точки оценивали состояние сетчатки. На Р21 образцы сетчатки из глаз, обработанных как Lin-HSC, так и контрольными клетками, были в норме при полном развитии всех сосудистых слоев и нормальном развитии INL и ONL (Фиг.18 (D и H)). Примерно на Р21 начиналась дегенерация сетчатки, и она прогрессировала с возрастом. К Р30 в сетчатке, обработанной контрольными клетками, имела место выраженная дегенерация сосудов и нейронов (Фиг.18 (I)), в то время как в сетчатке после введения клеток Lin-HSC сохранялись нормальные сосудистые слои и фоторецепторные клетки (Фиг.18 (Е)). Различие между спасенными и не спасенными глазами было более выражено на более поздних периодах времени (Фиг.18 (F и G)) до (Фиг.18 (J и K)). В контрольных обработанных глазах очень четко наблюдали прогрессирование дегенерации сосудов при иммунногистохимическом окрашивании на CD31 и коллаген IV (Фиг. 18 (I) и (K)). В глазах, обработанных контрольными клетками, практически полностью отсутствовало положительное окрашивание CD31, в то время как коллаген IV-позитивные «участки» оставались видимыми, указывая на то, что в данном случае в большей мере имеет регрессия сосудов, а не частичное формирование сосудов. В противоположность в глазах после обработки клетками Lin-HSC были сосуды с положительным окрашиванием на CD31 и коллаген IV, что было очень близко к нормальным глазам у мышей дикого типа (сравни Фиг.18 (F) и (I)).
Анализ экспрессии генов в сетчатке мышей rd/rd после обработки клетками Lin-HSC
Провели широкомасштабные геномные исследования (анализ микросовокупностей) для анализа спасенных и не спасенных образцов сетчатки для идентификации умозрительных медиаторов нейротрофического спасения. Сравнивали экспрессию генов сетчатки у мышей rd1/rd1, обработанной клетками Lin-HSC, с сетчатками без обработки, а также сетчатками, в которые вводили контрольные клетки (CD31-). Данные сравнения проводили в трех параллелях. Для констатации наличия различий необходимо было, чтобы экспрессия генов была, по меньшей мере, в 2 раза выше по сравнению с фоновыми уровнями во всех трех параллельных пробах. Гены, которые подвергались положительной регуляции в 3 раза в образцах сетчатки с введением клеток Lin-HSC по сравнению с вариантом опыта с введением в сетчатку контрольных клеток и без их введения у мышей rd/rd, приведены на Фиг.20, панели А и В. Рассчитывали значения коэффициентов вариации (COV) для экспрессированных генов делением стандартного отклонения на среднее значение уровня экспрессии для репликата каждой мРНК. Кроме того, определяли корреляцию между уровнями экспрессии и «шумовой» дисперсии при сопоставлении среднего значения и стандартного отклонения (SD). Получали корреляцию между уровнем экспрессии гена и стандартным отклонением для каждого гена, что позволило установить фоновые уровни и надежный порог уровня экспрессии. В целом, данные находились в допустимых пределах (Tu et al., 2002, Proc. Natl. Acad. Sci. USA 99: 14031-14036). Для генов, которые по отдельности обсуждаются ниже, были характерны уровни экспрессии, превышающие данные критические уровни экспрессии. Также определяли парные значения «t-теста». В каждом случае р-значения являются статистически значимыми (около или ниже 0,05), что указывает на наличие аналогий между репликатами и возможными достоверными различиями между разными опытными группами. Многие из подвергшихся достоверной положительной регуляции генов, включая MAD и Ying Yang-1 (YY-1) (Austen et al., 1997, Curr. Top. Microbiol. Immunol. 224: 123-130), кодируют белки с функциями, включающими защиту клеток от апоптоза. Ряд генов кристаллина, которые имеют гомологию последовательностей и функции, аналогичные к известным белкам теплового шока, включая защиту клеток от стресса, подвергались положительной регуляции при обработке Lin-HSC. Экспрессия α-кристаллина локализуется в ONL по данным иммуногистохимического анализа (Фиг.19). На Фиг.19 показано, что экспрессия кристаллина αA подвергалась положительной регуляции в спасенном внешнем ядерном слое клеток после обработки Lin-HSC, но не в противоположных глазах, обработанных контрольными клетками. Левая панель показывает окрашивание IgG (контроль) в спасенной сетчатке. На средней панели показано присутствие кристаллина αА в спасенной сетчатке. Правая панель показывает кристаллин αА в не спасенной сетчатке.
Матричную РНК из сетчатки мышей rd1/rd1, подвергшейся спасению под действием человеческих клеток Lin-HSC, гибридизовали с человеческими специфическими чипсами микросовокупностей Affymetrix U133A. После анализа в сильных условиях установили наличие генов, экспрессия мРНК которых была специфической для человека, выше фонового уровня и достоверно выше в образцах сетчатки, спасенной под действием человеческих клеток Lin-HSC, по сравнению с сетчатками, спасенными мышиными клетками Lin-HSC, и сетчатками после введения контрольных человеческих клеток без наблюдаемого эффекта спасения (Фиг.20, панель С). В биоинформационном тесте с микросовокупностями была обнаружена молекула адгезии к клеткам, CD6, экспрессированная на поверхности примитивных и только что дифференцированных CD34+ гематопоэтических стволовых клеток, и интерферон α 13, другой ген, экспрессированный гематопоэтическими стволовыми клетками, при валидации протокола исследований. Кроме того, несколько факторов роста и нейротрофических факторов экспрессировалось на уровне выше фонового в спасенных образцах сетчатки после обработки человеческими клетками Lin-HSC (Фиг.20, панель D).
Маркеры коммитированных гематопоэтических клеток использовали для отрицательного отбора популяции клеток Lin-HSC из костного мозга, содержащих ЕРС. Несмотря на то что субпопуляция полученных из костного мозга клеток Lin-HSC, которая может служить в качестве ЕРС, не охарактеризована с помощью обычно применяемых клеточных поверхностных маркеров, поведение данных клеток в развивающейся и/или поврежденной сосудистой сети сетчатки полностью отличается от наблюдаемого для популяций клеток Lin+или эндотелиальных клеток у взрослых. Данные клетки избирательно направляются в места ангиогенеза в сетчатке и принимают участие в формировании основных кровеносных сосудов.
Наследственные дегенеративные заболевания сетчатки часто сопровождаются потерей сосудистой сети сетчатки. Для эффективного лечения таких заболеваний требуется восстановление функции, а также поддержание сложной архитектоники ткани. Несмотря на то что в недавно проведенных нескольких исследованиях была изучена опосредованная клетками доставка трофических факторов или самих стволовых клеток, возможно, необходима некая их комбинация. Например, применение факторов роста в терапии для лечения дегенеративного заболевания сетчатки приводит к неконтролируемому чрезмерному росту кровеносных сосудов, результатом чего является серьезное нарушение нормальной архитектоники ткани сетчатки. Применение нейронных или стволовых клеток сетчатки для лечения дегенеративного заболевания сетчатки может восстановить функцию нейронов, но для функциональной сосудистой сети также будет необходимо восстановление функциональной целостности сетчатки. Включение клеток из популяции Lin-HSC в сосуды сетчатки мышей rd/rd приводит к стабилизации дегенеративной сосудистой сети без нарушения структуры сетчатки. Данный спасательный эффект также наблюдали, когда клетки вводили мышам rd/rd на Р15. Поскольку дегенерация сосудов начинается у мышей rd/rd на Р16, то данное наблюдением обосновывает терапевтическое «окно» для эффективного лечения клетками Lin-HSC. После внутриглазного введения клеток Lin-HSC сохраняются нейроны и фоторецепторы сетчатки и поддерживается зрительная функция глаз.
Клетки Lin-HSC из косного мозга взрослых проявляют выраженное вазо- и нейротрофическое действие при интравитреальном введении мышам с дегенеративным заболеванием сетчатки. Данный спасающий эффект сохраняется на протяжении 6 месяцев после обработки и он наиболее эффективен в том случае, когда клетки Lin-HSC вводят до развития полной дегенерации (до 16 суток после рождения мышей, когда, как правило, полная дегенерация у них происходит к 30 суткам после рождения). Данное спасательное действие установлено на двух моделях дегенерации сетчатки на мышах, и примечательно, что его можно обеспечить с помощью полученных из костного мозга взрослого человека клетками HSC, когда реципиент является грызуном с иммунодефицитом и дегенерацией сетчатки (например, мышами SCID) или когда донор является мышью с дегенерацией сетчатки. Несмотря на то что в нескольких предыдущих работах сообщалось о частичном фенотипическом спасении у мышей или собак с дегенерацией сетчатки после спасения гена, опосредованного вирусом, геном дикого типа (Ali et al., 2000, Nat. Genet. 25: 306-310; Takahashi et al., 1999, J. Virol. 73: 7812-7816; Acland et al. 2001, Nat. Genet. 28: 92-95), настоящее изобретение представляет собой впервые описанное опосредуемое клетками терапевтическое действие, достигаемое спасением сосудов. Таким образом, потенциальная применимость такого подхода для лечения группы заболеваний (например, пигментного ретинита) при наличии более чем 100 известных мутаций является более практичным по сравнению с созданием препаратов на основе индивидуальных генов для лечения каждой известной мутации.
Точная молекулярная основа нейротрофического спасательного действия остается не известной, но оно наблюдается только, когда имеется сопутствующая стабилизация/спасение сосудов. Присутствие введенных стволовых клеток, само по себе, недостаточно для воспроизведения нейротропического спасения и явное отсутствие нейронов, производных стволовых клеток, во внешнем ядерном слое означает возможность того, что введенные клетки трансформируются в фоторецепторы. Данные, полученные при анализе экспрессии микросовокупностей генов, показывают наличие достоверной положительной регуляции генов, о которых известно, что они обладают антиапоптозным эффектом. Поскольку в сетчатке, подвергшейся дегенерации, гибель большей части нейронов происходит посредством апоптоза, то такая защита может иметь высокий терапевтический эффект в пролонгировании «жизни» фоторецепторов и других нейронов, имеющих важное значение для зрительной функции при данных заболеваниях. C-myc является фактором транскрипции, который принимает участие в апоптозе посредством положительной регуляции по ходу цепи различных факторов, индуцирующих апоптоз. Экспрессию C-myc можно повысить в 4,5 раза у мышей rd/rd по сравнению с животными дикого типа, и этот факт указывает на потенциальное участие в дегенерации фоторецепторов у мышей rd/rd. Известно, что Mad1 и YY-1, два гена, подвергающиеся достоверной положительной регуляции в защищенных клетками Lin-HSC образцах сетчатки (Фиг.20, панель А), ингибируют активность c-myc, подавляя тем самым индуцированный апоптоз. Также было показано, что сверхэкспрессия Mad1 подавляет индуцированную Fas активацию каспазы-8, другого ключевого компонента апоптозного пути. Положительная регуляция данных двух молекул может играть роль в защите сетчатки от дегенерации сосудов и нейронов предупреждением инициации апоптоза, который в норме приводит к дегенерации у мышей rd/rd.
Другая группа генов, которые в значительной степени подвергаются положительной регуляции в сетчатке после обработки клетками Lin-HSC, включает члены семейства кристаллина (Фиг.20, панель В). Близкие к белкам теплового шока и другим индуцированным стрессом белкам, кристаллины могут активироваться под влиянием стресса сетчатки и обеспечивать защитное действие от апоптоза. Аномально низкая экспрессия кристаллина αА коррелирует с потерей фоторецепторов на модели дистрофии сетчатки на крысах, и результаты недавнего анализа белков сетчатки у мышей rd/rd показали индукцию положительной регуляции в отношении кристаллина в ответ на дегенерацию сетчатки. Основываясь на данных, полученных заявителями по микросовокупности генов в спасенной ЕРС сетчатке у мышей rd/rd, можно прийти к выводу, что положительная регуляция кристаллинов играет ключевую роль в опосредованной ЕРС нейропротекции сетчатки.
Вероятно, что гены, такие как с-myc, Mad1 и Yx-1 и кристаллинов, представляют собой медиаторы отрицательной регуляции спасения нейронов. Нейротрофические средства могут регулировать экспрессию антиапоптозных генов, хотя анализ микросовокупностей генов, проведенный заявителями, в сетчатке, спасенной мышиными стволовыми клетками, не показал индукции повышенных уровней известных нейротрофических факторов. Однако с другой стороны анализ эффекта спасения, опосредованного стволовыми клетками, полученными из человеческого костного мозга, с человеческими специфическими чипсами, показал наличие небольшого, но достоверного повышения экспрессии генов многих факторов роста.
Гены, подвергшиеся положительной регуляции, включают несколько членов семейства факторов роста фибробластов и отоферлин. Мутации гена отоферлина связаны с генетическими нарушениями, приводящими к глухоте за счет нейропатии слухового нерва. Возможно, что продукция отоферлина под действием введенных клеток Lin-HSC также вносит свой вклад в предупреждение нейропатии сетчатки. Исторически сложилось такое мнение, что изменения сосудов, наблюдаемые у пациентов и животных с дегенерацией сетчатки, являются вторичными по отношению к сниженным метаболическим потребностям, поскольку фоторецепторы погибают. Настоящие данные указывают, что, по меньшей мере, у мышей при наследственной дегенерации сетчатки сохранение нормальной сосудистой сети также помогает сохранить компоненты внешнего ядерного слоя. Недавние сообщения, имеющиеся в литературе, подтверждают концепцию о том, что тканеспецифическая сосудистая сеть имеет трофические эффекты, которые протекают помимо просто обеспечения сосудистого «питания». Например, эндотелиальные клетки печени можно стимулировать на продукцию, после активации VEGFR1, факторов роста, имеющих ключевое значение для регенерации и поддержания функции гепатоцитов, перед возможной угрозой повреждения печени (LeCouter et al., 2003, Science 299: 890-893).
Имеются сообщения об аналогичных показательных взаимодействиях между сосудистыми эндотелиальными клетками и смежными клетками паренхимы печени, которые принимают участие в органогенезе печени до образования функциональных кровеносных сосудов. Эндогенная сосудистая сеть сетчатки у индивидуумов с дегенерацией сетчатки может не способствовать столь драматически спасению, но если эта сосудистая сеть поддерживается клетками-предшественниками эндотелиальных клеток из популяций гематопоэтических стволовых клеток костного мозга, то они могут сделать сосудистую сеть более устойчивой к дегенерации и одновременно способствовать выживанию нейронов, а также сосудов сетчатки. У людей с дегенерацией сетчатки замедление начала полной дегенерации сетчатки может обеспечить годы дополнительного зрения. У животных после обработки клетками Lin-HSC имеется достоверное сохранение ERG, что может быть достаточным для сохранения зрения.
В клинике существует широко распространенное мнение, что может иметь место значительная потеря фоторецепторов и других нейронов при сохранении при этом функционального зрения. На этой точке преодолевается критический порог и зрение теряется. Поскольку почти все наследственные дегенеративные заболевания сетчатки у человека имеют ранее, но медленное, начало развития, то можно установить наличие дегенерации сетчатки у индивидуума и подвергнуть его лечению интравитреально введением трансплантата из аутологичных стволовых клеток костного мозга по изобретению для задержки развития дегенерации сетчатки и сопутствующей потери зрения. Для повышения направленности и включения стволовых клеток по изобретению является желательным наличие активированных астроцитов (Otani et al., 2002, Nat. Med. 8: 1004-1010); это можно осуществить при раннем начале лечения, когда имеется ассоциированный глиоз, или использованием лазера для стимуляции местной пролиферации активированных астроцитов. Необязательно можно использовать трансфекцию ex vivo стволовых клеток одним или более нейротрофическими веществами до внутриглазного введения для повышения эффекта спасения. Данный подход можно использовать для лечения других дегенеративных нейрональных нарушений зрения, таких как глаукома, для которых характерна дегенерация ганглиональных клеток сетчатки.
Популяции клеток Lin-HSC из костного мозга взрослых содержат популяцию ЕРС, которая может способствовать ангиогенезу направленным движением к реактивным астроцитам и включением в развившуюся матрицу без нарушения структуры сетчатки. Клетки Lin-HSC также обеспечивают длительный нейротрофический эффект спасения в глазах с дегенерацией сетчатки. Кроме того, композиции генетически модифицированных аутологичных клеток Lin-HSC, содержащих ЕРС, можно трансплантировать в глаза с ишемией или аномальной сосудистой сетью, и они могут стабильно включаться в новые сосуды и слои нейронов и постоянно доставлять терапевтические молекулы местно на протяжении длительного периода времени. Такая местная доставка генов, экспрессирующих фармакологические вещества в физиологически значимых концентрациях, представляет собой новый подход для терапии не поддающихся в настоящее время лечению глазных болезней.
Фоторецепторы в сетчатке нормальных мышей, например, преимущественно представляют собой палочки, но внешний ядерный слой, обнаруживаемый после спасения клетками Lin-HSC по изобретению, содержит в основном колбочки. Большинство наследственных дегенеративных заболеваний сетчатки у человека развивается в результате первичных, специфических для палочек аномалий, и полагают, что потеря колбочек является вторичной по отношению к дисфункции палочек, которая, вероятно, относится к потере некоторых трофических факторов, экспрессируемых палочками.
ПРИМЕРЫ
Пример 1. Выделение и обогащение клеток; получение популяций мышиных клеток Lin- HSC А и В
Общая методика. Все опыты в условиях in vivo проводили согласно NIH Guide for Care and Use of Laboratory Animals и на все опыты было получено разрешение The Scripps Research Institute (TSRI, La Jolla, CA) Animal Care and Use Committee. Клетки костного мозга выделяли у взрослых мышей B6.129S7-Gtrosa26, Tie-2GFP, ACTbEGFP, FVB/NJ (мыши rd/rd) или Balb/cBYJ (The Jackson Laboratory, ME).
Затем отделяли моноциты в градиенте плотности с использованием градиента полисахарозы HISTOPAQUE® (Sigma, St. Louis, MO) и метили панелью конъюгированных с биотином антител против дифференцировочных антигенов (против CD45, CD3, Ly-6G, CD11, TER-119, Pharmingen, San Diego, СА) для отбора клеток Lin- у мышей. Позитивные на дифференцировочные антигены клетки (Lin+) отделяли и удаляли от клеток Lin-HSC с использованием разделительного магнитного устройства (клеточный сортер AUTOMACSTM, Miltenyi Biotech, Auburn, CA). Полученную популяцию клеток Lin-HSC, содержащую предшественники эндотелиальных клеток, дополнительно характеризовали с использованием проточного цитометра FACSTM Calibur (Becton Dickinson, Franklin Lakes, NJ) с помощью следующих антител: РЕ-конъюгированных против Sca-l, c-kit, KDR и CD31 (Pharmingen, San Diego СА). Клетки костного мозга мышей Tie-2-GFP использовали для характеристики Tie-2.
Для сбора эндотелиальных клеток у взрослых мышей ткань брыжейки хирургическим путем извлекали у мышей ACTbEGFP и помещали в коллагеназу (Worthington, Lakewood, NJ) для расщепления ткани с последующим фильтрованием с использованием фильтра с размером пор 45 мкм. Проточную жидкость собирали и инкубировали со средой для роста эндотелия (Clonetics, San Diego, CA). Характеристики эндотелиальных клеток подтверждали по морфологическому виду, напоминающему булыжник, при окрашивании моноклональными антителами против CD31 (Pharmingen) и исследованием культур на образование трубкообразных структур в матриксе MATRIGELTM (Becton Dickinson, Franklin Lakes, NJ).
Популяция мышиных клеток Lin-HSC А. Клетки костного мозга выделяли у мышей ACTbEGFP согласно обшей методике, описанной выше. Клетки Lin-HSC охарактеризовали проточной цитометрией FACS на присутствие маркеров поверхностных клеточных антигенов CD31, c-kit, Sca-l, Flk-l и Tie-2. Результаты приведены на Фиг.1 (С). Примерно 81% клеток Lin-HSC имело маркер CD31, примерно 70,5% клеток Lin-HSC имело маркер c-kit, примерно 4% клеток Lin-HSC имело маркер Sca-l, примерно 2,2% клеток Lin-HSC имело маркер Flk-l и примерно 0,9% клеток Lin-HSC имело маркер Tie-2. В противоположность клетки Lin+HSC, выделенные из этих же клеток костного мозга, имели совершенно другой профиль клеточных маркеров (т.е. CD31: 37,4%; c-kit: 20%; Sca-l: 2,8%; Flk-1: 0,05%).
Популяция мышиных клеток Lin-HSC В. Клетки костного мозга выделяли у мышей Balb/c, ACTbEGFP и С3Н согласно общей методике, описанной выше. Клетки Lin-HSC анализировали на присутствие клеточных поверхностных маркеров (Sca-l, Flk-l/KDR, c-kit (CD117), Cd34, CD31 и различных интегринов: α1, α2, α3, α4, α5, α6, αL, αM, αV, αX, αIIb, β1, β2, β3, β4, β5и β7). Результаты приведены в таблице 2.
Пример 2. Интравитреальное введение клеток на мышиной модели
На веках у мышей с помощью тонкой бритвы проводили бороздку для обнажения глазного яблока на Р2-Р6. Затем популяцию негативных по дифференцировочному антигену клеток Lin-HSCА по настоящему изобретению (примерно 105 клеток примерно в 0,5-1 мкл клеточной культуральной среды) вводили интравитреально с использованием шприца с иглой номер 33 (Hamilton, Reno, NV).
Пример 3. Трансфекция ЕРС
Мышиные клетки Lin-HSC (популяция А) трансфицировали ДНК (SЕQ ID NO: 1, Фиг.7), кодирующей Т2-фрагмент TrpRS (SЕQ ID NO: 3), также с включением метки His6 с использованием реагента для трансфекции FuGENETM6 (Roche, Indianopolis, IN) согласно протоколу изготовителя. Клетки Lin-HSC (примерно 106 клеток на мл) суспендировали в среде opti-MEM® (Invitrogen, Carlsbad, CA), содержащей фактор стволовых клеток (PeproTech, Rocky Hill, NJ). Затем вносили смесь ДНК (примерно 1 мкг) и реагента FuGENE (примерно 3 мкл) и реакционные смеси инкубировали при температуре примерно 37°С в течение примерно 18 ч. После инкубации клетки отмывали и собирали. Частота трансфекции данной системы составляла примерно 17% по данным анализа FACS. Продукцию Т2-TrpRS подтверждали вестерн-блоттингом. Аминокислотная последовательность His6-меченного Т2-TrpRS представлена в виде SЕQ ID NO: 2 на Фиг.8.
Пример 4. Иммуногистохимический и конфокальный микроскопический анализ
На различные временные точки отбирали образцы сетчатки у мышей и использовали для приготовления общего препарата или приготовления замороженных срезов. Для приготовления тотальных препаратов образцы сетчатки фиксировали в 4% параформальдегиде и блокировали в 50% телячьей эмбриональной сыворотке (FBS) и 20% нормальной козьей сыворотке в течение 1 ч при комнатной температуре. Образцы сетчаток обрабатывали первичными антителами и детектировали с использованием вторичных антител. Использованными первичными анатителами были: антитела против коллагена IV (Chemicon, Temecula, CA), анти-β-gal-антитела (Promega, Madison, WI), анти-GFAP-антитела (Dako Cytomation, Carpenteria, CA), антитела против α-актина гладкой мускулатуры (α-SMA, Dako Cytomation). Вторичными использованными антителами были таковые конъюгированные с флуоресцентными маркерами Alexa 488 или 594 (Molecular Probes, Eugene, OR). Снимки получали с использованием конфокального микроскопа MRC 1024 (Bio-Rad, Hercules, CA). Трехмерные снимки делали с использованием программного обеспечения LASERSHARP® (Bio-Rad) для исследования трех различных слоев при развитии сосудов в тотальном препарате сетчатки. Различия в пиксель-итенсивности GFP между мышами с усиленным GFP (eGFP) и мышами GFAP/wtGFP, различаемые конфокальной микроскопией, использовали для получения 3-мерных снимков.
Пример 5. Количественный анализ ангиогенеза в сетчатке у мышей в условиях in vivo
Для анализа Т2-TrpRS восстанавливали первичное и глубокое сплетения по трехмерным снимкам сетчатки мышей. Первичное сплетение подразделяли на две группы: с нормальным развитием или нарушенным развитием сосудов. Степени ингибирования развития глубоких сосудов истолковывали, основываясь на проценте ингибирования развития сосудов, включая следующие показатели: полное ингибирование формирования глубокого сплетения обозначали как «полное», нормальное развитие сосудов (включая менее чем 25% ингибирование) обозначали как «нормальное» и остальное обозначали как «частичное». Для данных по спасению сетчатки у мышей rd/rd исследовали четыре отдельных зоны глубокого сплетения в каждом тотальном препарате сетчатки с использованием 10× лупы. Высчитывали общую длину сосудистой сети для каждого снимка, суммировали и сравнивали между группами. Для получения более точной информации клетки Lin-HSC вводили в один глаз и клетки Lin+HSC - в другой глаз одной и той же мыши. Образцы контрольной сетчатки брали у мышей из того же помета.
Пример 6. Модели поражения сетчатки у взрослых мышей
Модели с поражением сетчатки лазером или разрезом проводили соответственно с использованием диодного лазера (150 мВ, 1 сек, 50 мм) или механической пунктурой сетчатки инъекционной иглой 27 номера. Через 5 суток после повреждения вводили клетки интравитреально. Через 5 суток отбирали образцы глаз.
Пример 7. Нейротрофическое спасение регенерации сетчатки
Негативные по дифференцировочному антигену гематопоэтические стволовые клетки (Lin-HSC) из костного мозга взрослых мышей обладают вазотрофическим и нейротрофическим эффектом спасения на модели дегенерации сетчатки на мышах. В правый глаз 10-дневных мышей вводили интравитреально примерно 105 клеток Lin-HSC по настоящему изобретению в объеме 0,5 мкл и результаты обработки оценивали через 2 месяца в отношении присутствия сосудистой сети и количества нейрональных ядерных слоев. В левый глаз той же мыши вводили примерно такое же количество клеток Lin+HSC в качестве контроля и исследовали аналогично. Как следует из данных фиг. 9, в глазах, обработанных клетками Lin-HSC, сосудистая сеть сетчатки была практически нормальной, внутренний ядерный слой был близок к норме и внешний ядерный слой (ONL) имел примерно от 3 до 4 слоев ядер. Напротив, в противоположном глазу, обработанном клетками Lin+HSC, имел место заметно атрофированный средний сосудистый слой в сетчатке; был полностью атрофированным внешний сосудистый слой; внутренний ядерный слой был заметно атрофичным и внешний ядерный слой практически отсутствовал. Это было сильно выражено у мыши 3 и мыши 5. У мыши 1 отсутствовал эффект спасения, и это было характерно примерно для 15% обработанных мышей.
При оценке зрительной функции по данным электроретинограмм (ERG) восстановление положительной ERG наблюдали при одновременном детектировании спасения сосудов и нейронов (мыши 3 и 5). Позитивные ERG отсутствовали, когда отсутствовал эффект спасения сосудов и нейронов (мышь 1). Наличие данной корреляции между вазотрофическим и нейротрофическим спасением в глазах мышей rd/rd под действием клеток Lin-HSC по настоящему изобретению показано на графике анализа регрессии на Фиг.10. Наблюдали наличие корреляции между восстановлением нейронов (ось Y) и сосудов (ось X) для промежуточной сосудистой сети (r=0,45) и глубокой сосудистой сети (r=0,67).
На Фиг.11 показано отсутствие какой-либо статистически достоверной корреляции между спасением сосудов и нейронов под действием клеток Lin+HSC. Спасение сосудов оценивали количественно, и данные представлены на Фиг.12. Данные для мышей через 1 месяц (1М), 2 месяца (2М) и 6 месяцев (6М) после введения клеток, приведенные на Фиг.12, показывают, что длина сосудов была достоверно выше в глазах, обработанных клетками Lin-HSC по настоящему изобретению (темные колонки) по сравнению с длиной сосудов в глазах, не подвергшихся обработке, у той же мыши (светлые колонки), особенно через 1 месяц и 2 месяца после введения. Количественно оценивали нейротрофический эффект спасения по определению количества ядер во внутреннем и внешнем ядерных слоях примерно через 2 месяца после введения клеток Lin-HSC или Lin+HSC. Результаты приведены на фиг. 13 и 14.
Пример 8. Популяция человеческих клеток Lin-HSC
Клетки костного мозга выделяли от здоровых добровольцев согласно общей методике, представленной выше. Затем отделяли моноциты в градиенте плотности с использованием градиента полисахарозы HISTOPAQUE® (Sigma, St. Louis, MO). Для выделения популяции клеток Lin-HSC из мононуклерных клеток костного мозга человека использовали следующую панель конъюгированных с биотином антител против дифференцировочных антигенов с использованием разделительного магнитного устройства (клеточный сортер AUTOMACSTM, Miltenyi Biotech, Auburn, CA): СD2, СD3, СD4, СD11a, Mac-1, СD14, СD16, СD19, СD33, СD38, СD45RA, СD64, СD68, СD86, СD2a35 (Pharmingen).
Затем популяцию человеческих клеток Lin-HSC разделяли на две субпопуляции на основе наличия или отсутствия экспрессии СD133. Клетки метили конъюгированными с биотином антителами против СD133 и разделяли на две субпопуляции позитивных на СD133 и негативных на СD133 клеток.
Пример 9. Интравитреальное введение человеческих и мышиных клеток на мышиной модели дегенерации сетчатки
Мышей штаммов C3H/HeJ, C3SnSmn.CB17-Prkdc SCID и rd10 использовали в качестве модели дегенерации клетчатки. Мыши C3H/HeJ и C3SnSmn.CB17-Prkdc SCID (The Jackson Laboratory, Maine) были гомозиготными по мутации на дегенерацию сетчатки 1 (rd1), мутации, которая вызывает раннее начало тяжелой дегенерации сетчатки. Мутация локализуется в экзоне 7 гена Pde6b, кодирующего β-субъединицу cGMP-фосфодиэстеразы фоторецепторов-палочек. Мутация данного гена имеет место у людей с аутосомальным рецессивным пигментозным ретинитом (RP). Мыши C3SnSmn.CB17-Prkdc SCID являются также гомозиготными по спонтанной мутации, вызывающей тяжелый комбинированный иммунодефицит (Prkdc SCID), и их использовали для опытов по трансплантации человеческих клеток. Дегенерацию сетчатки у мышей rd10 вызывают мутацией в экзоне 13 гена Pde6b. Мыши также являются подходящей клинической моделью RP с более поздним началом и более слабой дегенерацией сетчатки по сравнению с мышами rd1/rd1. Все манипуляции проводили согласно NIH Guide for Care and Use of Laboratory Animals и на все опыты было получено разрешение The Scripps Research Institute Animal Care and Use Committee.
На веках у мышей с помощью тонкой бритвы проводили бороздку для обнажения глазного яблока на Р2-Р6. Затем популяцию А негативных по дифференцировочному антигену мышиных или человеческих клеток Lin-HSC (примерно 105 клеток примерно в 0,5-1 мкл клеточной культуральной среды) вводили мышам в глаза интравитреально с использованием шприца с иглой номер 33 (Hamilton, Reno, NV). Для визуализации введенных человеческих клеток клетки метили краской (Cell traker green CMFDA, Molecular Probes) перед введением.
В различные периоды времени отбирали образцы сетчатки и фиксировали в 4% параформальдегиде (PFA) и метаноле с последующим блокированием в смеси 50% FBS/20% NGS в течение одного часа при комнатной температуре. Для окрашивания сосудистой сети сетчатки образцы сетчатки инкубировали с антителами против CD31 (Pharmingen) и против коллагена IV (Chemicon) с последующей обработкой конъюгированными с Alexa 488 или 594 вторичными антителами (Molecular Probes, Eugene, OR). Образцы сетчатки помещали на плоскость с помощью четырех радиальных релаксирующих насечек для получения тотального препарата. Снимки сосудистой сети в промежуточном или глубоком сплетениях сетчатки (смотри Dorrell et al., 2002, Invest. Ophthalmol. Vis. Sci. 43: 3500-3510) получали с использованием конфокального микроскопа Radiance MP2100 и программного обеспечения LASERSHARP® (Bio-Rad, Hercules, California). Для количественной оценки сосудистой сети произвольно выбирали четыре независимых поля (900 мкм × 900 мкм) от среднего участка промежуточного или глубокого сосудистого слоя и определяли общую длину сосудистой сети с использованием анализирующего программного обеспечения LASERPRIX® (Bio-Rad). Для дальнейшего анализа использовали значения общих длин данных четырех полей в одном и том же сплетении.
Плоский препарат сетчатки вновь заливали для приготовления замороженных срезов. Образцы сетчатки помещали на ночь в 4% PFA с последующей инкубацией в 20% сахарозе. Образцы сетчатки заливали в соединение, обеспечивающее оптимальную температуру для приготовления срезов (OCT: Tissue-Tec; Sakura Fine Tech, Torrance, CA). Срезы, полученные на криостате (10 мкм), подвергали повторной гидратации в PBS, содержащем краску DAPI на ядра (Sigma-Aldrich, St. Louis, Missouri). Для конфокальной микроскопии отбирали поля зрения с меченными DAPI ядрами в трех различных участках (шириной 280 мкм, произвольный отбор проб) на одном срезе, который содержал переднюю часть зрительного нерва и полную периферическую область сетчатки. Подсчитывали количество ядер в ONL в трех независимых полях зрения на одном срезе и суммировали для анализа. Анализ простой линейной регрессии проводили для исследования взаимосвязи между длиной сосудистой сети в глубоком сплетении и количеством ядер в ONL.
После адаптации в темноте в течение ночи мышам проводили анестезию внутрибрюшинным введением кетамина в дозе 15 мкг/г и ксилазина в дозе 7 мкг/г. Электроретинограммы (ERG) снимали с поверхности роговицы каждого глаза после внесения сосудорасширяющего средства (1% раствор атропина сульфата) при использовании золотой электродной петли для роговицы вместе с ротовым референс-электродом и заземляющим хвостовым электродом. Стимуляцию проводили с использованием устройства Grass Photic Stimulator (PS33 Plus, Grass Instruments, Quincy, MA), прикрепленного к внешней стороне колпака Ganzfeld с высокой отражающей способностью. Фиксировали ответные реакции палочек на коротковолновые вспышки света (Wratten 47A; λмакс=470 нм) в пределах интенсивности до максимально возможной для световой стимуляции (0,668 cвечей-сек/м2). Ответные сигналы усиливали (усилитель СР511 АС, Grass Instruments), преобразовывали в цифровые значения (PCI-1200, National Instruments, Austin, TX) и анализировали на компьютере. Каждая мышь служила и в качестве собственного внутреннего контроля при записи ERG, т.е. с обработанного и не обработанного глаза. Среднее выводили по 100 кривым для наиболее слабых сигналов. Средние реакции глаз, не подвергшихся обработке, в цифрах вычитали из данных по реакции обработанного глаза и эту разницу в сигнале использовали в качестве показателя функционального спасения.
Анализ микросовокупностей генов использовали для оценки экспрессии генов, на которые направлено действие клеток Lin- HSC. Мышам rd/rd на Р6 вводили либо клетки Lin- HSC, либо CD31-НSС. Образцы сетчатки от данных мышей извлекали на 40 сутки после введения в не содержащую РНК-азу среду (на этот период времени после введения становится очевидным эффект спасения сосудистой сети и фоторецепторов сетчатки). Каждый квадрат из каждого образца сетчатки исследовали на приготовленном тотальном препарате для гарантии того, что обеспечивалось направленная доставка клеток Lin- HSC, а также их защитное действие в отношении сосудистой сети и нейронов. Выделяли РНК из образцов сетчатки с результативной обработкой согласно протоколу TRIzol (Life Technologies, Rockville, MD) с использованием фенольного/хлороформного метода выделения РНК. РНК гибридизовали с чипсами Affymetrix Mu74Av2 и экспрессию генов анализировали с использованием программного обеспечения GENESPRING® (Silicon Genetics, Redwood City, CA). Выделенные человеческие или мышиные HSC вводили интравитреально мышам на Р6. На Р45 извлекали образцы сетчатки и разделяли на группы: 1) мышиные сетчатки, спасенные введением человеческих клеток HSC, 2) мышиные сетчатки, не спасенные введением человеческих клеток HSC, и 3) мышиные сетчатки, спасенные введением мышиных клеток HSC для выделения РНК и гибридизации с человеческими, специфическими чипсами U133F Affymetrix. Программное обеспечение GENESPRING® использовали для идентификации генов с экспрессией выше фонового уровня и с более высокой экспрессией в спасенных сетчатках под действием человеческих клеток HSC. Затем индивидуально анализировали профили экспрессии пары с зондом и сравнивали с моделью обычных опытов с микросовокупностями человеческих U133А с использованием dChip для установления специфической для человеческих образцов гибридизации и элиминации ложных положительных результатов за счет перекрестной межвидовой гибридизации.
На Фиг.21 приведены данные проточной цитометрии по сравнению экспрессии антигенов CD31 и интегрина альфа 6 на человеческих CD133-позитивных (CD133+) и CD133-негативных (CD133-) клетках, входящих в популяции Lin- HSC по настоящему изобретению. На левых панелях представлены графики рассеивания с использованием проточной цитометрии. Центральные и правые панели представляют гистограммы, показывающие уровень экспрессии специфических антител в популяции клеток. Ось Y представляет количество эпизодов, и ось Х представляет интенсивность сигнала. Нарисованные гистограммы представляют контрольные антитела изотипа IgG, показывающие неспецифическое фоновое окрашивание. Заштрихованные гистограммы показывают уровень экспрессии специфических антител в клеточной популяции. Заштрихованные гистограммы, сдвинутые вправо от нарисованной (контрольной) гистограммы, показывают повышенный сигнал флуоресценции и экспрессию антител выше фонового уровня. При сравнении положения пиков на заштрихованных гистограммах для двух клеточных популяций, обнаруживается различие в экспрессии белка на клетках. Например, CD31 экспрессировался на уровне выше фонового на CD133+ и CD133- клетках по изобретению; однако было отмечено больше клеток, экспрессирующих более низкие концентрации CD31 в популяции клеток CD133+по сравнению с популяцией клеток CD133-. На основе этих данных становится очевидным, что экспрессия CD31 варьирует между двумя популяциями и что экспрессия альфа 6 интегрина в основном характерна для клеток в популяции Lin-, и, таким образом, она может служить в качестве маркера клеток, обладающих вазо- и нейротрофической функцией спасения.
Когда субпопуляцию CD133-позитивных и CD133-негативных клеток Lin- HSC вводили интравитреально в глаза новорожденным мышам SCID, то наиболее высокую степень включения в развивающуюся сосудистую сеть наблюдали для субпопуляции CD133-негативных клеток, которые экспрессировали поверхностные антигены как CD31, так и интегрин α6 (Фиг.21, внизу). Оказалось, что субпопуляция CD133-позитивных клеток, которые не экспрессировали CD31 или интегрин α6 (Фиг.21, вверху), направляется в места периферической индуцированной ишемией реваскуляризации, но не при введении в глаза, в которых протекает ангиогенез.
Спасенные и не спасенные сетчатки исследовали иммуногистохимическим анализом с использованием антител, специфических на опсин палочек и колбочек. В одних и тех же глазах, использованных для записи ERG, результаты которых приведены на Фиг.17, определяли опсин палочек и колбочек. В сетчатке мышей дикого типа менее чем 5% фоторецепторов представляют собой колбочки (Sourcy et al., 1998, Neuron 21: 481-493) и результаты иммуногистохимического окрашивания, полученные с красным/зеленым опсином колбочек, как показано на Фиг.25 (А), или родопсином палочек, как показано на Фиг.25 (В), что согласуется с данным процентом клеток-колбочек. Антитела, специфические на родопсин палочек (rho4D2), были предоставлены Dr. Robert Molday из University of British Columbia, и их использовали, как описано ранее (Hicks et al., 1986, Exp. Eye Res. 42: 55-71). Кроличьи антитела, специфические на красный/зеленый опсин колбочек, получали от Chemicon (AB5405) и использовали согласно инструкциям изготовителя.
Пример 10. Интравитреальное введение мышиных клеток на моделях индуцированной кислородом дегенерации сетчатки на мышах
Новорожденных мышей дикого типа C57B16 подвергали воздействию гипероксии (в атмосфере с 75% кислорода) на Р7 и Р12 сутки после рождения в качестве модели индуцированной кислородом дегенерации сетчатки (OIR). На Фиг.22 показано нормальное развитие сосудов в постнатальном периоде у мышей C57B16 в период с Р0 до Р30. На Р0 сутки можно наблюдать пышное развитие только поверхностных сосудов вокруг диска зрительного нерва. В течение последующих нескольких суток первичная поверхностная сосудистая сеть распространяется к периферии, достигая дальних периферических участков на Р10. В период между Р7 и Р12 развивается вторичное (глубокое) сплетение сетчатки. На Р17 имеется хорошо развитая поверхностная и глубокая сеть сосудов (Фиг.22, вставки). В последующие сутки происходит перестройка наряду с развитием третичного (промежуточного) слоя сосудов до развития взрослой структуры примерно на Р21.
В противоположность на модели OIR, описанной здесь, после воздействия 75% кислорода в период Р7-Р12 нормальная последовательность событий серьезно нарушается (Фиг.23). Популяцию клеток Lin- HSC от взрослых мышей вводили интравитреально на Р3 в глаза мышей, которые затем подвергались OIR, в другой глаз вводили PBS или CD31-негативные клетки в качестве контроля. На Фиг.24 показано, что популяции клеток Lin- HSC могут подавлять дегенеративное действие высоких концентраций кислорода в развивающейся сетчатке у мышей. В глазах, подвергшихся обработке, на Р17 наблюдали полностью развившуюся поверхностную и глубокую сосудистую сеть сетчатки, в то время как в контрольных глазах имело место большое количество аваскулярных участков, практически без глубоких сосудов (Фиг.24). Было исследовано примерно 100 образцов глаз от мышей, представляющих модель OIR. Нормальную васкуляризацию наблюдали в 58% обработанных популяциями клеток Lin- HSC глаз по сравнению с 12% контрольных глаз, обработанных CD31-клетками, и 3% контрольных глаз, обработанных PBS.
Пример 11. Выделение миелоподобных клеток костного мозга из костного мозга мышей при отборе по CD44
Клетки костного мозга выделяли от взрослых мышей (The Jackson Laboratory, ME). Цельный костный мозг обрабатывали мышиными антителами против CD44 и использовали проточную цитометрию для выделения экспрессирующих CD44 клеток из костного мозга. Клетки отделяли от антител и хранили в растворе буфера для будущего применения. Также выделяли популяцию клеток, которые не экспрессируют в значительной степени CD44 (CD44loBM).
Пример 12. Выделение миелоподобных клеток костного мозга из костного мозга мышей при отборе по CD44
Клетки костного мозга также подвергали положительному отбору с использованием антител против CD11b вместо CD44, как описано в примере 11. Выделяли популяцию миелоподобных клеток костного мозга, которые были CD44hi и CD11b+ клетками, обладающими аналогичными характеристиками в отношении активности с популяцией CD44hi, выделенной в примере 11 с использованием CD44. Также выделяли популяцию CD44lo CD11b-, которая, как было установлено, не является активной.
Пример 13. Характеристика популяций клеток MLBM
Несмотря на то что роль CD44 в данном контексте не ясна, возможно, что данный рецептор опосредует выживаемость клеток, миграцию клеток и/или дифференцировку клеток в богатом гиалуроновой кислотой стекловидном теле после введения клеток в глаза. В не фракционированном костном мозге мышей присутствовали различные популяции клеток CD44hi (т.е. MLBM) и CD44lo. Популяция клеток MLBM представляет на 76% популяцию Lin-, использованную в предшествующих примерах, в то время как примерно только 37% и 4% соответственно популяции клеток Lin+и CD31-/CD34-/CD11b- из костного мозга экспрессировали CD44 (Фиг.26). Следовательно, имеется высокая корреляция между экспрессией CD44 и вазотрофическим и нейротрофическим эффектами, наблюдаемыми для данных трех популяций, т.е. клетки Lin-были наиболее эффективными, в то время как клетки CD31-/CD34-/CD11b-были соответственно наименее эффективными. При использовании панели специфических антител против дифференцировочных антигенов было установлено, что большая часть клеток CD44hi обладает выраженными характеристиками, свойственными для миелоидных клеток (Фиг.27). Аналогично почти все клетки костного мозга CD44hi также были CD11b+(Фиг.27).
Положительно отобранные клетки MLBM с использованием антител против CD11b, описанные в примере 12, (CD44hi CD11b+) давали результаты по активности, аналогичные полученным с клетками MLBM, выделенными при использовании отбора с помощью антител против CD44 в опытах с направленным действием на сосуды.
Характеристики клеточных поверхностных антигенов популяции клеток MLBM из примера 12 или клеток CD44lo CD11b+, выделенных в примере 12, приведены в таблице 3 ниже. В таблице 3 более высокое значение со знаком (+) указывает на относительно более высокую экспрессию антигена. Знак минус (-) указывает на отсутствие детектируемой экспрессии.
Пример 14. Вазотрофический и нейротрофический эффекты популяции клеток MLBM
Популяция клеток MLBM из примера 11 сохраняла свойства клеток Lin- в отношении направленного движения к сосудам и проявления вазо- и нейротрофического эффектов, несмотря на то, что клетки CD44loВМ проявляли низкую активность или отсутствие активности. Способность к направленному движению к сосудам была продемонстрирована при введении клеток из клеточной популяции GFP+ MLBM мышам интравитреально на 7 сутки после рождения (Р7) и анализе образцов сетчатки на Р14. После мечения кровеносных сосудов изолектином GS наблюдали, что клетки GFP+ направляются к сосудистой сети сетчатки и занимают околососудистую локализацию без признаков включения. Данные события были общим явлением при использовании MLBM, были весьма редкими или вовсе отсутствовали в глазах, обработанных клетками CD44loВМ (Фиг.28).
Вазо- и нейротрофическую активность популяции клеток MLBM из примера 11 оценивали с использованием модели дегенерации сетчатки на мышах, как описано выше для клеток Lin- HSC. У мышей rd1/rd1 наблюдали характерные признаки дегенеративного заболевания сетчатки, включая гибель фоторецепторов и атрофию глубокой сосудистой сети сетчатки. Как описано выше, клетки костного мозга Lin- HSC сохраняли глубокую сосудистую сеть сетчатки и частично спасали фоторецепторы. Популяция клеток MLBM осуществляли ту же функцию (Фиг.29).
Модель индуцированной кислородом ретинопатии имеет общие черты с ретинопатией при недоношенности. Патология, связанная с данной моделью, достоверно ослабляется при обработке глаз клетками из клеточной популяции MLBM. Эффекты клеток из клеточной популяции MLBM на данной модели были аналогичными наблюдаемым с использованием клеток Lin- HSC, описанных выше. В глазах после обработки клетками из клеточной популяции MLBM было установлено достоверное снижение двух параметров, использованных для количественной оценки степени патологии на данной модели: наличие зоны облитерации сосудов и ветвящийся реваскулярный участок. В противоположность в глазах, обработанных клетками CD44loВМ, не было обнаружено улучшения состояния глаз по сравнению с глазами после обработки контрольным растворителем (Фиг.30).
В дополнении к направленному движению к сосудистой сети клетки из клеточной популяции MLBM подвергаются дифференцировке в подобные макрофагам (F4/80+) клетки, проникают в сетчатку и занимают положение, противоположное пигментному эпителию сетчатки (RPE). Подобная локализация способствует наблюдаемому спасению сосудов и фоторецепторов клеток из клеточной популяции MLBM. Кроме того, при локализации в месте, близком к RPE, клетки из клеточной популяции MLBM продуцируют васкулярный эндотелиальный фактор роста (VEGF), что показано при введении клеток из клеточной популяции MLBM, полученных от мышей VEGF-GFP, у которых зеленый флуоресцентный белок (GFP) экспрессируется только при активации VEGF (Фиг.31). Таким образом, оказалось, что клетки из клеточной популяции MLBM находятся в состоянии «активированных» VEGF. Оказалось, что введенные клетки из клеточной популяции MLBM вызывают рекрутмент эндогенных клеток того же типа, поскольку в области RPE наблюдали присутствие GFP+ (введенных) и GFP- (эндогенных) клеток. Данную локализацию наблюдали у мышей дикого типа во время нормального развития сосудов сетчатки, в спасенной сетчатке у мышей rd1/rd1 и на модели индуцированной кислородом ретинопатии.
Аналогичные результаты по направленному движению к сосудам были получены для популяции клеток MLBM из примера 12. На Фиг.32 показано, что на Р20 клетки CD44hi CD11b+из примера 12 (зеленый цвет) специфически направлены к сосудистой сети (красный цвет) при введении на Р2 также, как и популяция с высоким содержанием CD44 из примера 11. На Фиг.33 показано, что клетки CD44lo CD11b- из примера 12 не обладают специфической направленностью на сосудистую сеть.
Популяция клеток MLBM по настоящему изобретению обеспечивает эффективный и надежный способ лечение ишемической ретинопатии и подобных глазных заболеваний. Клетки легко выделяются из аутологичного костного мозга, что снижает до минимума, таким образом, потенциальную возможность проявления иммуногенности, часто наблюдаемой при опосредуемых клетками видах лечения. Длительное (до 6 месяцев) наблюдение выявило только случайное образование розеток и гистологическое сохранение нейронов сетчатки в глазах после введения негативных по дифференцировочному антигену клеток. Кроме того, популяцию клеток MLBM по изобретению можно трансфицировать подходящими генами для доставки функциональных генов в сетчатку.
Можно осуществить многочисленные вариации и модификации вариантов осуществления, описанных выше, не отступая от сущности и объема новых признаков изобретения. Не предполагается и не подразумевается сведения изобретения к конкретным вариантам осуществления, описанным здесь.
Реферат
Изобретение относится к медицине, а именно к офтальмологии, и может быть использовано при лечении ретинопатии при недоношенности или родственных ретинопатических заболеваний. Для этого в сетчатку вводят эффективное количество клеток из популяции негативных по дифференцировочному антигену гематопоэтических стволовых клеток. При этом популяция таких стволовых клеток представляет собой популяцию выделенных миелоподобных клеток костного мозга, в которой большая часть клеток является негативной по дифференцировочному антигену и экспрессирует антиген CD44 и антиген CD11b. Способ позволяет обеспечить физиологическую реваскуляризацию в поврежденных участках сетчатки и ослабить уже вызванные заболеванием повреждения сетчатки за счет эксперессии антигенов, обладающих высокой вазотрофической активностью. 15 з.п. ф-лы, 3 табл., 36 ил.

Комментарии