Новое лечение роговицы с применением ламинина - RU2718062C2
Код документа: RU2718062C2
Чертежи













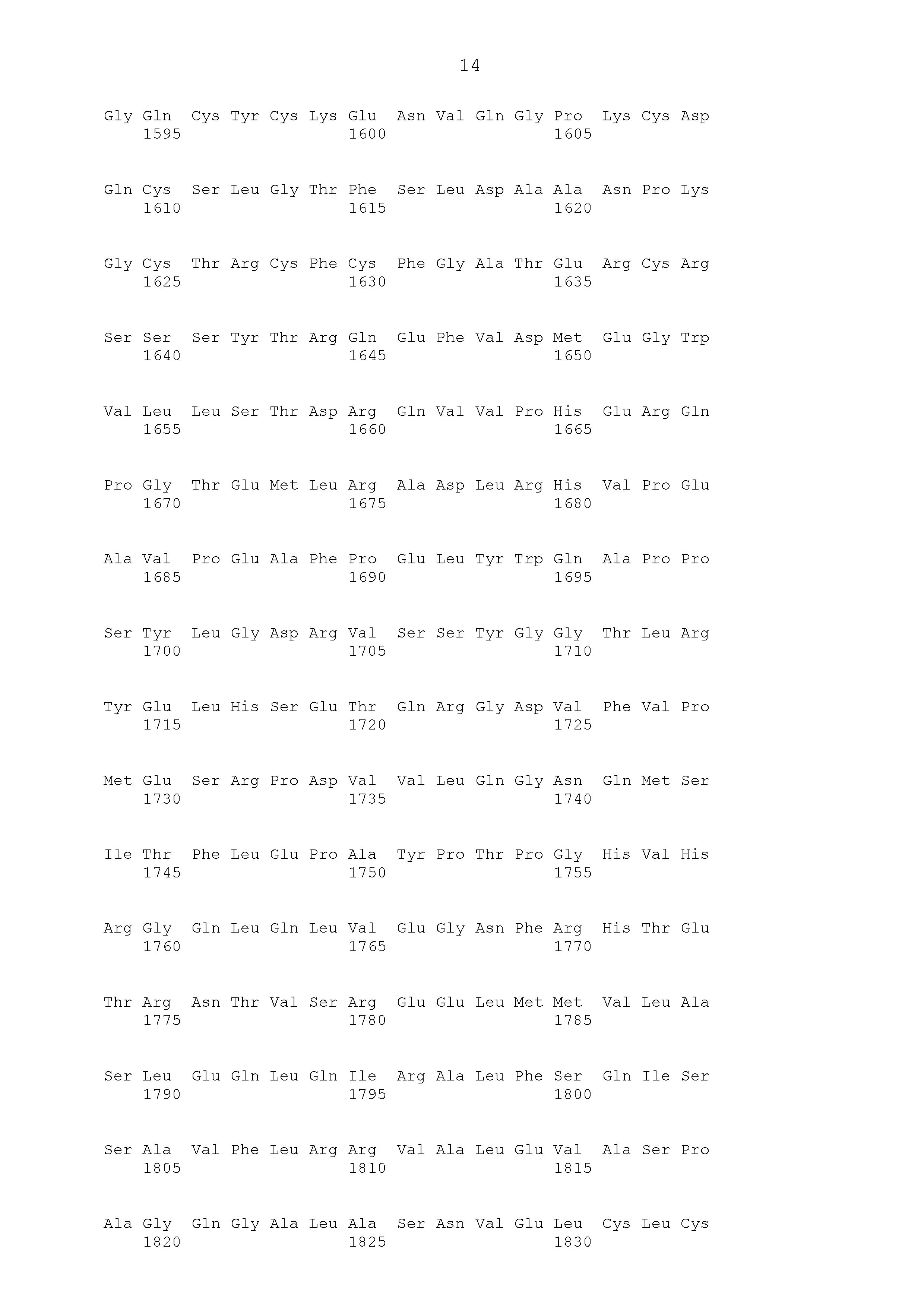



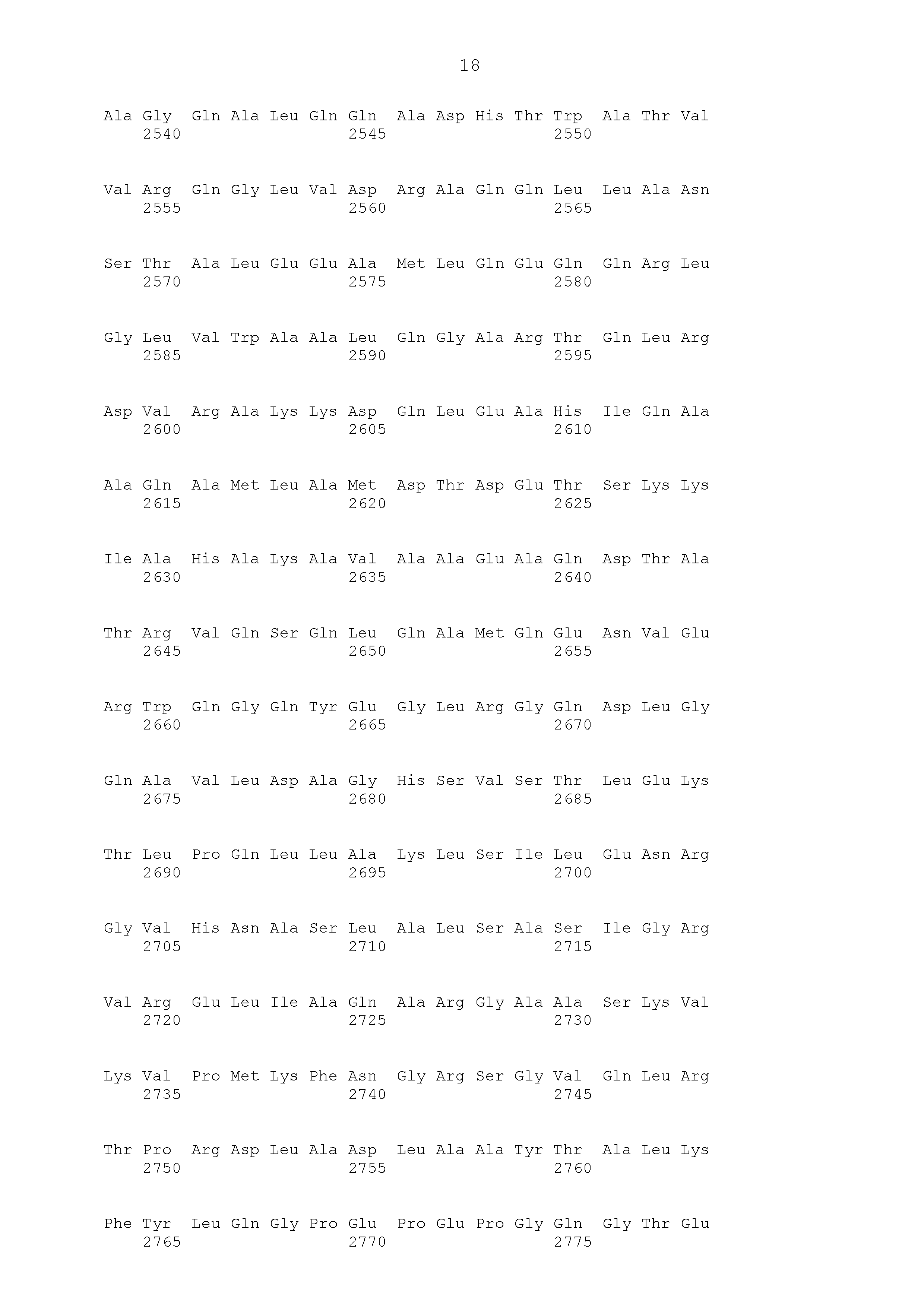




































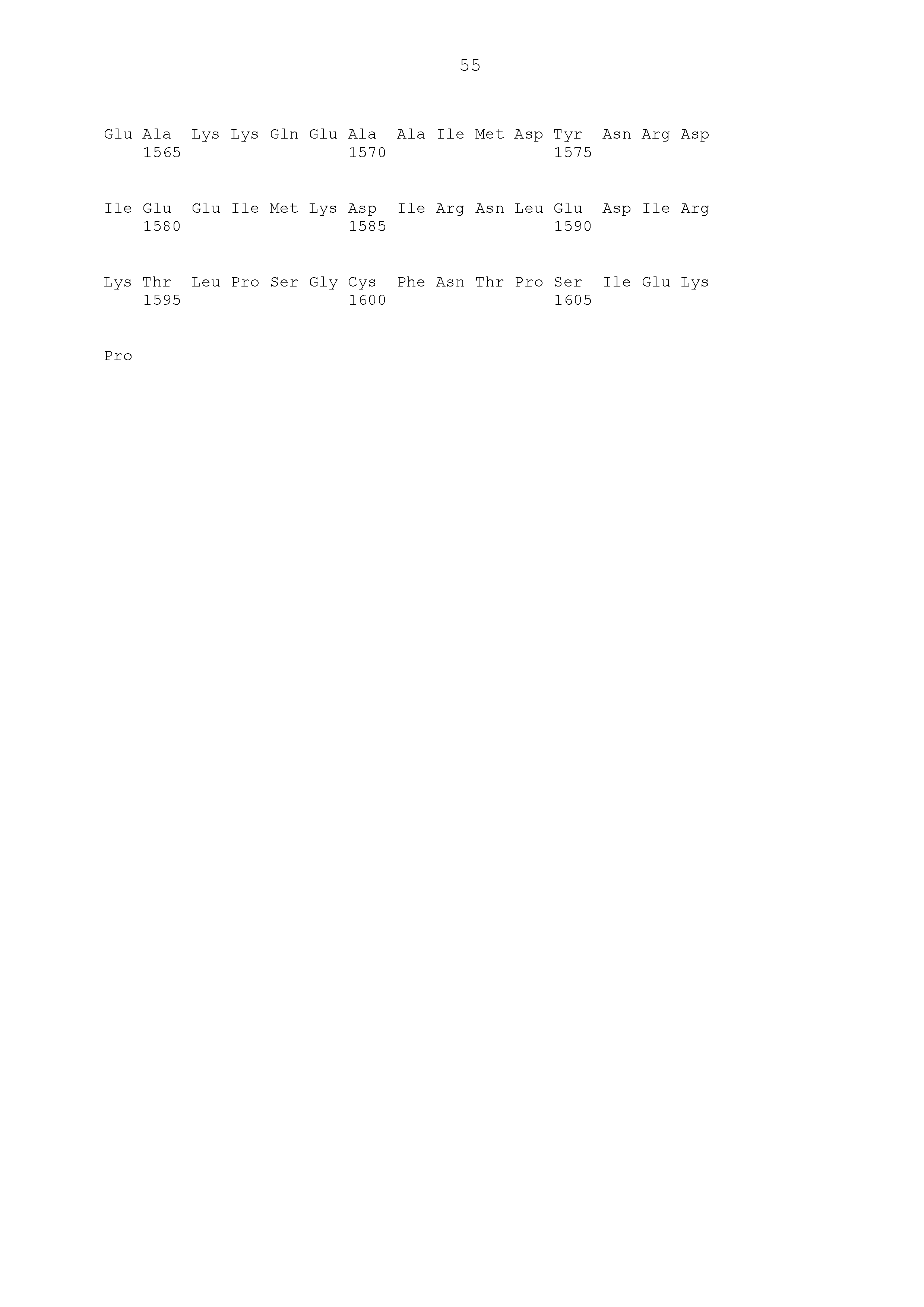


Описание
[Область техники, к которой относится изобретение]
[0001]
Настоящее изобретение относится к новой терапии с применением ламинина. Более конкретно, настоящее изобретение направлено на офтальмологическую терапию с применением ламинина и еще более конкретно направлено на терапию и профилактику эндотелия роговицы.
[Уровень техники]
[0002]
Эндотелиальные клетки роговицы человека присутствуют при плотности приблизительно 3000 клеток на мм2 с момента рождения. Эндотелиальные клетки роговицы человека не имеют способности к регенерации при их повреждении. Таким образом, считается, что эндотелиальные клетки роговицы сложно культивировать. Поскольку культивирование и пролиферацию в настоящее время сложно применять в методиках трансплантации, лечение и хирургия эндотелия роговицы практически невозможны. Недостаток донорской роговицы ощущается в Японии, где число пациентов, ожидающих пересадки роговицы, составляет приблизительно 2600, тогда как количество трансплантаций роговицы, проводимых в Японии, составляет приблизительно 1700 ежегодно.
[0003]
Патентные источники 1 и 2 известны в отношении взаимосвязи между ламининами и офтальмологией.
[Список цитируемых источников]
[Патентные источники]
[0004]
[PTL 1] Японская, выложенная для общего доступа патентная публикация национальной фазы PCT 2004-500012
[PTL 2] Японская, выложенная для общего доступа патентная публикация национальной фазы PCT 2003-532647
[Сущность изобретения]
[Решение задачи]
[0005]
Авторы изобретения обнаружили, что определенные ламинины могут применяться в офтальмологической терапии, в особенности терапии эндотелия роговицы, на которой основано настоящее изобретение. Таким образом, в настоящем изобретении репрезентативно предложено следующее.
(1) Терапевтическое или профилактическое средство для заболевания, нарушения или состояния эндотелия роговицы, включающее по меньшей мере одно средство, выбранное из группы, состоящей из ламининов и их фрагментов.
(2) Терапевтическое или профилактическое средство по п.1, где ламинины включают последовательность RGD.
(3) Терапевтическое или профилактическое средство по п.1 или 2, где ламинины включают α5-цепь и/или γ1-цепь.
(4) Терапевтическое или профилактическое средство по любому из пп.1-3, где ламинины включают ламинин 511 (α5β1γ1) и ламинин 521 (α5β2γ1).
(5) Терапевтическое или профилактическое средство по любому из пп.1-4, где фрагменты обладают способностью к клеточной адгезии эндотелиальной клетки роговицы.
(6) Терапевтическое или профилактическое средство по любому из пп.1-5, где средством является ламинин 511, ламинин 521 или фрагмент ламинина 511-E8.
(7) Терапевтическое или профилактическое средство по любому из пп.1-6, где эндотелий роговицы происходит от примата.
(8) Терапевтическое или профилактическое средство по любому из пп.1-7, где заболевание, нарушение или состояние эндотелия роговицы выбрано из группы, состоящей из эндотелиальной дистрофии роговицы Фукса, эндотелиита роговицы, травмы и нарушений и состояний вследствие глазной хирургической операции.
(9) Терапевтическое или профилактическое средство по любому из пп.1-8, где заболевание, нарушение или состояние эндотелия роговицы выбрано из группы, состоящей из светобоязни, нечеткого зрения, нарушения зрения, офтальмалгии, эпифоры, гиперемии, боли, буллезной кератопатии, дискомфорта в глазу, пониженного контраста, ослепления светом, отека стромы роговицы, буллезной кератопатии и помутнения роговицы.
(10) Терапевтическое или профилактическое средство по любому из пп.1-9, где эндотелий роговицы включает эндотелиальный слой роговицы, Десцеметову оболочку или и то, и другое.
(11) Терапевтическое или профилактическое средство по любому из пп.1-10, где в эндотелии роговицы Десцеметова оболочка находится в отделенном состоянии.
(12) Терапевтическое или профилактическое средство по любому из пп.1-11, дополнительно включающее эндотелиальную клетку роговицы.
(13) Терапевтическое или профилактическое средство по любому из пп.1-11, дополнительно включающее ингибитор ROCK.
(14) Терапевтическое или профилактическое средство по любому из пп.1-11, дополнительно включающее эндотелиальную клетку роговицы и ингибитор ROCK.
(15) Терапевтическое или профилактическое средство по п.13 или 14, где ингибитор ROCK выбран из группы, состоящей из Y-27632 ((R)-(+)-транс-(4-пиридил)-4-(1-аминоэтил)-циклогексан-карбоксамида дигидрохлорида моногидрата) и его фармацевтически приемлемой соли.
(16) Терапевтическое или профилактическое средство по любому из пп.1-15, где средство вводится в глаз и, таким образом, контактирует с тканью в глазу.
(17) Терапевтическое или профилактическое средство по любому из пп.1-16, где средство присутствует в концентрации приблизительно 21 нМ или больше.
(18) Терапевтическое или профилактическое средство по любому из пп.1-17, где дополнительно вводят эндотелиальную клетку роговицы.
(19) Терапевтическое или профилактическое средство по любому из пп.1-18, где средство предоставляют в смеси с эндотелиальной клеткой роговицы, и по меньшей мере одно средство, выбранное из группы, состоящей из ламининов и их фрагментов, вводится в глаз и, таким образом, контактирует с тканью в глазу.
(20) Терапевтическое или профилактическое средство по любому из пп.1-19, дополнительно включающее ингибитор ROCK.
(21) Терапевтическое или профилактическое средство по любому из пп.1-20, где ингибитор ROCK выбран из группы, состоящей из Y-27632 ((R)-(+)-транс-(4-пиридил)-4-(1-аминоэтил)-циклогексанкарбоксамида дигидрохлорида моногидрата) и его фармацевтически приемлемой соли.
(22) Терапевтическое или профилактическое средство по любому из пп.1-21, где средство, смешанное с эндотелиальной клеткой роговицы, составляет приблизительно 2,1 нМ или больше, и вводимое средство составляет приблизительно 21 нМ или больше.
(23) По меньшей мере одно средство, выбранное из группы, состоящей из ламининов и их фрагментов, для применения в терапии или профилактике заболевания, нарушения или состояния эндотелия роговицы.
(24) Средство по п.23, дополнительно включающее признак, описанный в одном или более пп.2-22.
(25) Способ терапии или профилактики заболевания, нарушения или состояния эндотелия роговицы, включающий введение эффективного количества по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, субъекту, нуждающемуся в терапии или профилактике.
(26) Способ по п.25, дополнительно включающий признак, описанный в одном или более пп.2-11.
(27) Способ по п.26 или 26, дополнительно включающий введение эндотелиальной клетки роговицы субъекту.
(28) Способ по любому из пп.25-27, дополнительно включающий введение ингибитора ROCK субъекту.
(29) Способ по п.28, где ингибитор ROCK выбран из группы, состоящей из Y-27632 ((R)-(+)-транс-(4-пиридил)-4-(1-аминоэтил)-циклогексанкарбоксамида дигидрохлорида моногидрата) и его фармацевтически приемлемой соли.
(30) Способ по любому из пп.25-29, дополнительно включающий введение эндотелиальной клетки роговицы и ингибитора ROCK субъекту.
(31) Способ по любому из пп.25-30, где средство вводится в глаз субъекта и, таким образом, контактирует с тканью в глазу.
(32) Способ по любому из пп.25-31, где средство присутствует в концентрации приблизительно 21 нМ или больше.
(33) Способ по любому из пп.25-32, дополнительно включающий введение эндотелиальной клетки роговицы отдельно от средства.
(34) Способ по любому из пп.25-33, где средство предоставляют в смеси с эндотелиальной клеткой роговицы, и по меньшей мере одно средство, выбранное из группы, состоящей из ламининов и их фрагментов, вводится в глаз и, таким образом, контактирует с тканью в глазу.
(35) Способ по любому из пп.25-34, дополнительно включающий введение ингибитора ROCK отдельно от средства.
(36) Способ по любому из пп.25-35, где ингибитор ROCK выбран из группы, состоящей из Y-27632 ((R)-(+)-транс-(4-пиридил)-4-(1-аминоэтил)-циклогексанкарбоксамида дигидрохлорида моногидрата) и его фармацевтически приемлемой соли.
(37) Способ по любому из пп.25-32, где средство, смешанное с эндотелиальной клеткой роговицы, составляет приблизительно 2,1 нМ или больше, и вводимое средство составляет приблизительно 21 нМ или больше.
(38) Применение по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, в производстве лекарственного средства для терапии или профилактики заболевания, нарушения или состояния эндотелия роговицы.
(39) Применение по п.38, дополнительно включающее признак по одному или более пп.2-22.
(40) Применение по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, для терапии или профилактики заболевания, нарушения или состояния эндотелия роговицы.
(41) Применение по п.40, дополнительно включающее признак, описанный в одном или более пп.2-22.
[0006]
Необходимо понимать, что один или более вышеуказанных признаков могут быть также представлены в качестве комбинации в дополнение к прямо показанным комбинациям в настоящем изобретении. Дополнительные варианты осуществления и преимущества настоящего изобретения будут ясны тем специалистам, которые ознакомились и надлежащим образом оценили следующее подробное описание.
[Полезные эффекты изобретения]
[0007]
В настоящем изобретении предложены новые офтальмологические терапии, в особенности новые терапии эндотелиальными клетками роговицы (в особенности, человеческими эндотелиальными клетками роговицы). В частности, настоящее изобретение может приводить к почти полному излечению буллезной кератопатии. В предпочтительном варианте осуществления происходит заживление Десцеметовой оболочки. Такой эффект является значимым эффектом, который не мог быть достигнут стандартными методами.
[Краткое описание чертежей]
[0008]
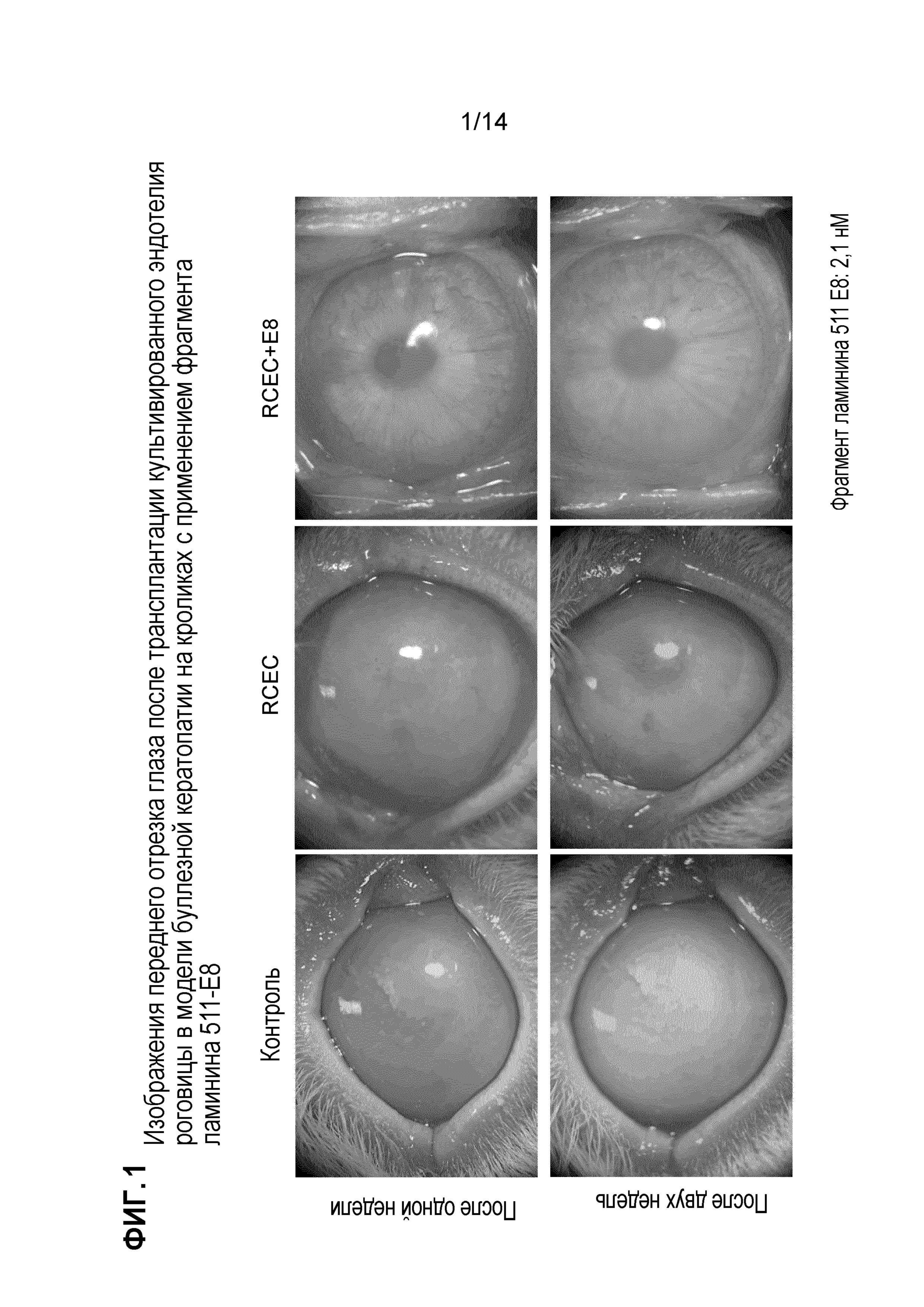
[Фигура 1] На Фигуре 1 показаны изображения переднего отрезка глаза после трансплантации культивированного эндотелия роговицы в модели буллезной кератопатии на кролике с применением фрагмента ламинина 511-E8. Показаны изображения переднего отрезка глаза, слева направо, Контроля: передний отрезок глаза с механически соскобленными эндотелиальными клетками роговицы кролика в качестве контроля, RCEC: передний отрезок глаза полученной модели, в которой культивированные эндотелиальные клетки роговицы кролика вводили в переднюю камеру глаза и выдерживали в положении лежа на животе в течение трех часов, и RCEC+E8: передний отрезок глаза полученной модели, в которой культивированные эндотелиальные клетки роговицы кролика вводили в переднюю камеру глаза с DMEM, содержащей фрагменты ламинина 511-E8, доведенные до концентрации 2,1 нМ, и выдерживали в положении лежа на животе в течение трех часов. В верхнем ряду показаны изображения после одной недели, и в нижнем ряду показаны изображения после двух недель.
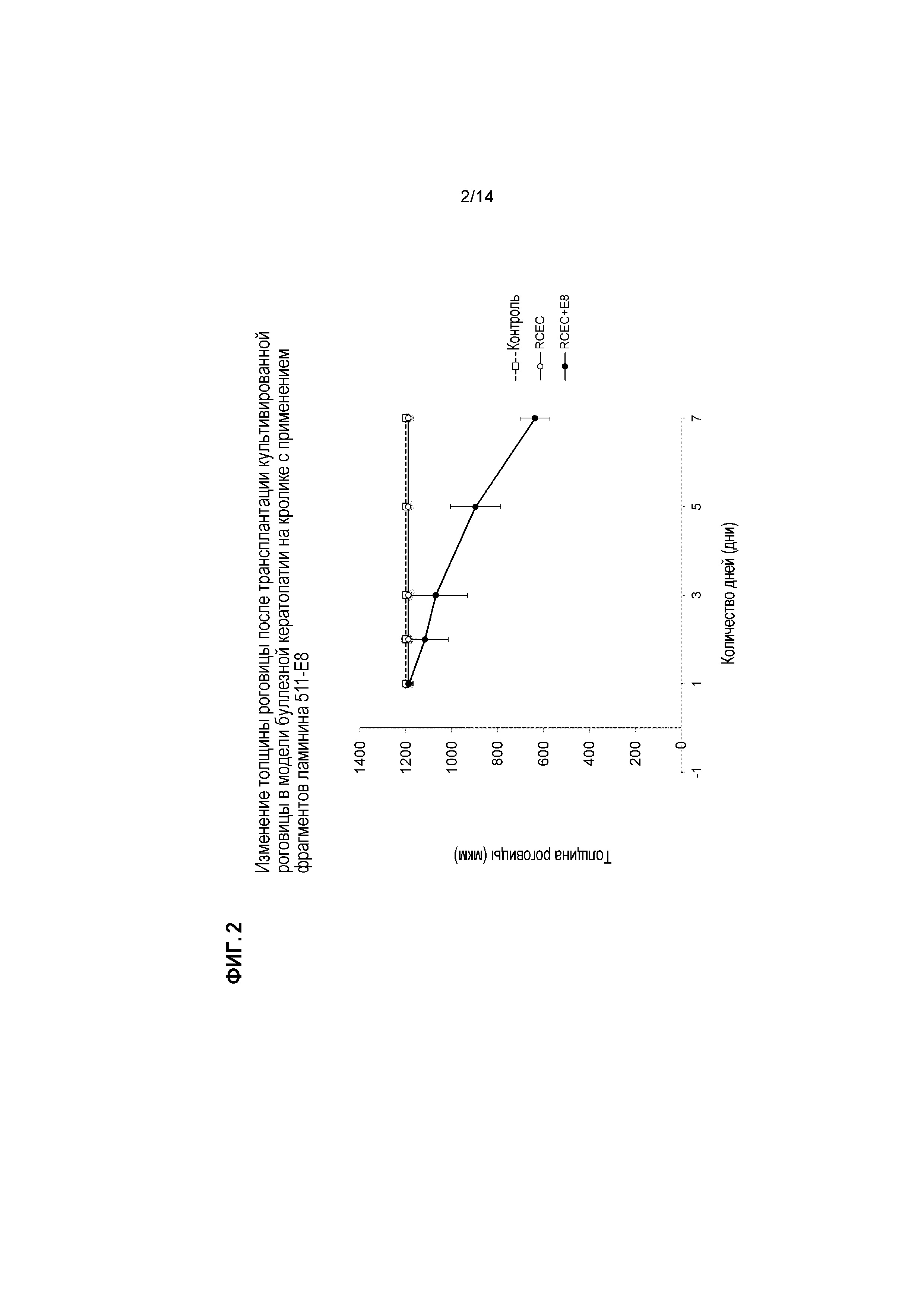
[Фигура 2] На Фигуре 2 показано изменение толщины роговицы после пересадки культивированной роговицы в модели буллезной кератопатии на кролике с применением фрагментов ламинина 511-E8. По оси Y указана толщина роговицы (мкм), измеренная с помощью ультразвукового пахиметра. По оси X указано число дней после лечения. Планка указывает стандартную ошибку.
[Фигура 3] На Фигуре 3 показаны результаты гистологического исследования после трансплантации культивированного эндотелия роговицы с применением фрагмента ламинина 511-E8. На Фигуре 3 показано окрашивание, слева направо, антителами против Na+/K+-АТФазы, антителами против ZO-1, антителами против N-кадгерина и фаллоидином.
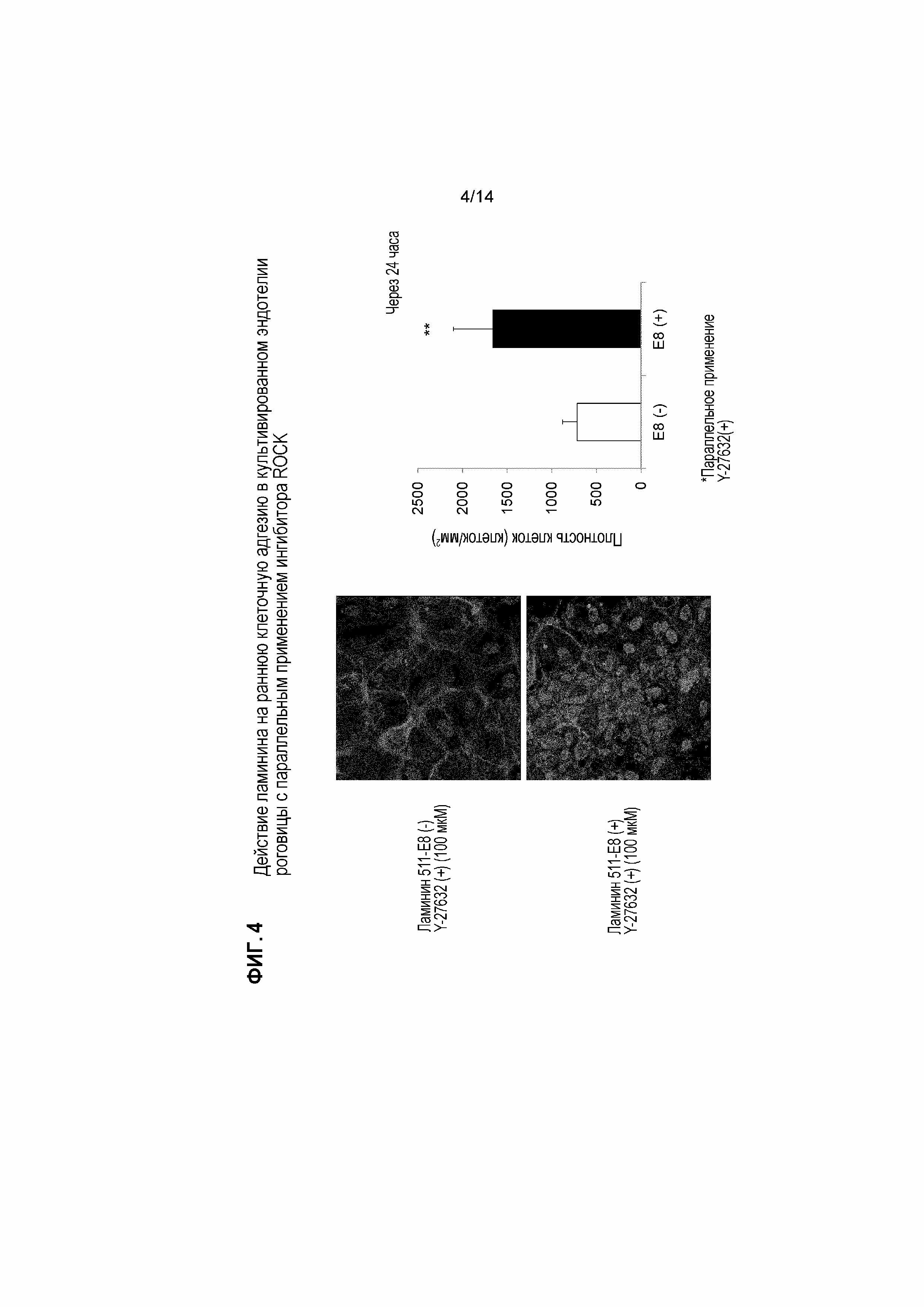
[Фигура 4] На Фигуре 4 показаны результаты исследования трансплантации культивированного эндотелия роговицы в модели буллезной кератопатии на кроликах с параллельным применением ламинина и ингибитора ROCK. Модель буллезной кератопатии была создана в результате механического отделения эндотелия роговицы у кролика. Адгезию введенных клеток к субстрату через 24 часа сравнивали у индивидов, которым вводили культивированные эндотелиальные клетки роговицы кролика с ингибитором ROCK Y-27632 (+) (100 мкМ) в переднюю камеру глаза, и индивидов, которым вводили клетки, фрагменты ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ). С левой стороны показаны изображения окрашивания фаллоидином и DAPI. В верхнем ряду показан результат без фрагмента ламинина 511-E8 и с Y-27632 (+) (100 мкМ), и в нижнем ряду показан результат с фрагментами ламинина 511-E8 и Y-27632 (+) (100 мкМ). Окрашивание фаллоидином демонстрирует, что больше клеток закрепилось у индивида, которому ввели клетки с фрагментами ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ). С правой стороны показан график с данными по плотности клеток. На оси Y указана плотность клеток (клеток/мм2). Плотность прикрепившихся клеток была значительно выше у индивида, которому вводили клетки с фрагментами ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ).
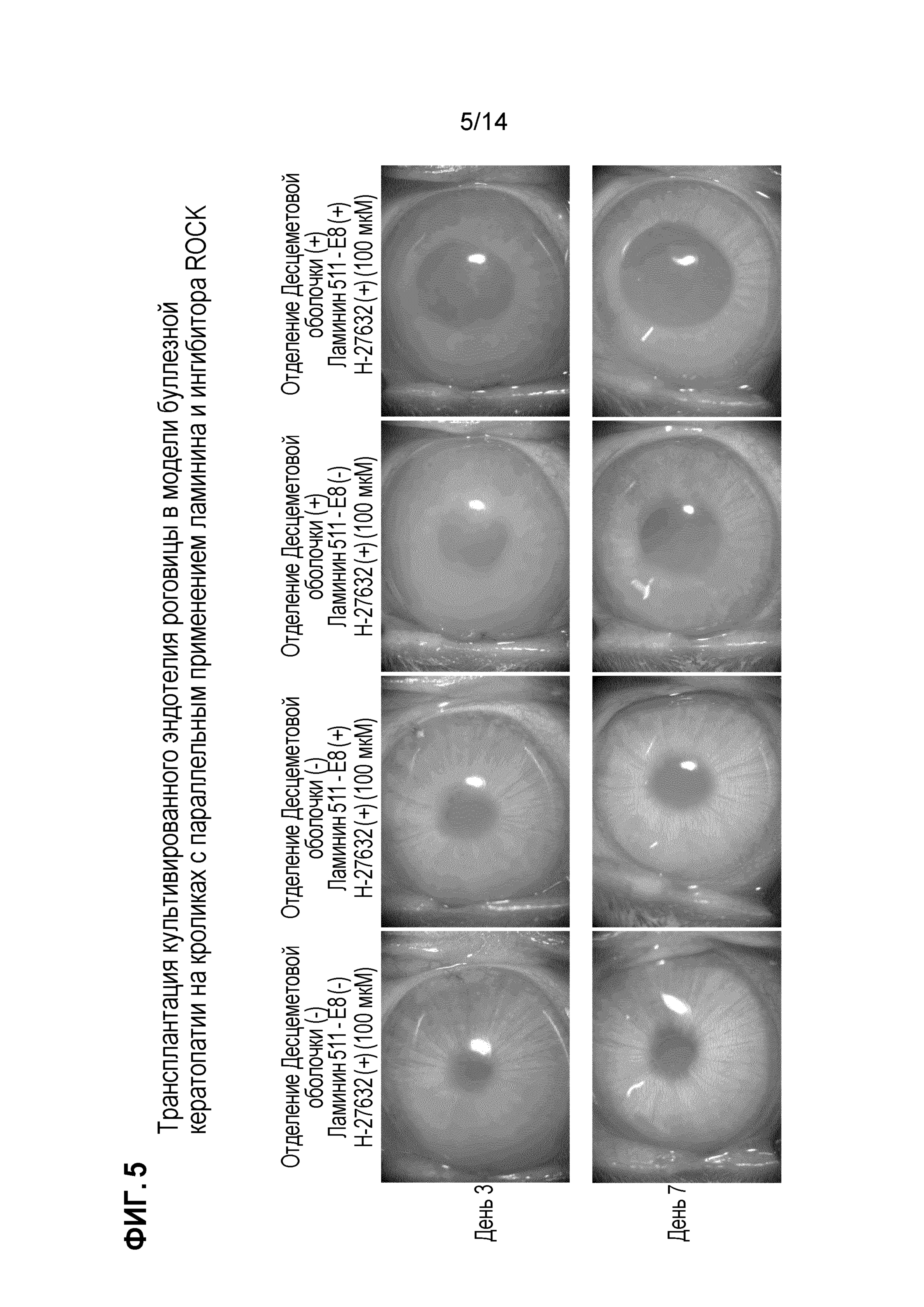
[Фигура 5] На Фигуре 5 показаны изображения переднего отрезка глаза после трансплантации культивированного эндотелия роговицы в модели буллезной кератопатии на кроликах. Показаны изображения переднего отрезка глаза, слева направа, индивида, у которого отделяли эндотелиальные клетки роговицы, но не Десцеметову оболочку, и вводили культивированные эндотелиальные клетки роговицы с Y-27632 (+) (100 мкМ), индивида, у которого отделяли эндотелиальные клетки роговицы, но не Десцеметову оболочку, и вводили клетки с фрагментами ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ), индивида в модели буллезной кератопатии, у которого отделяли Десцеметову оболочку и вводили клетки с Y-27632 (+) (100 мкМ), и индивида в модели буллезной кератопатии, у которого отделяли Десцеметову оболочку и вводили клетки с фрагментами ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ). В верхнем ряду показаны результаты Дня 3 и в нижнем ряду показаны результаты Дня 7.
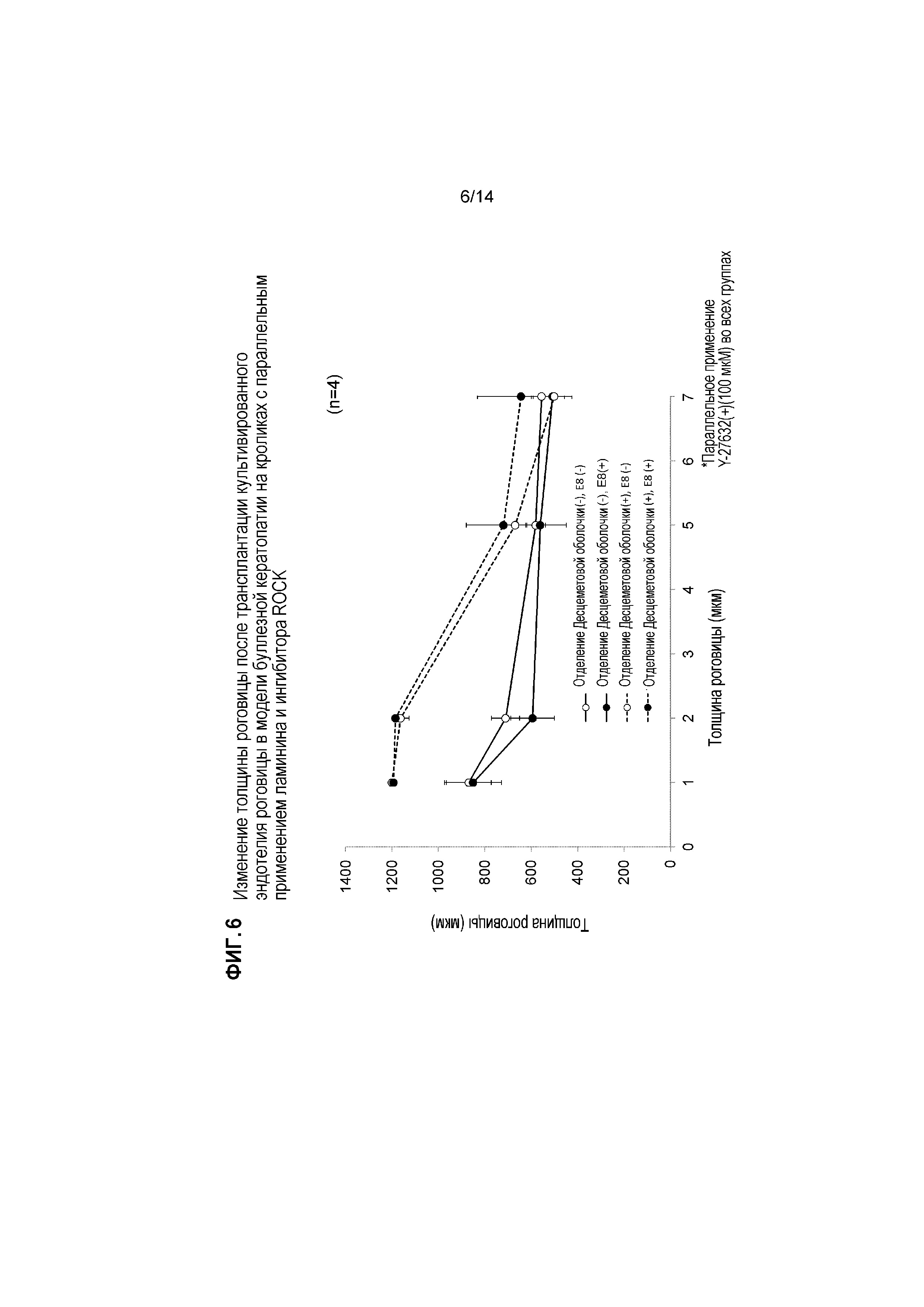
[Фигура 6] На Фигуре 6 показана толщина роговицы (мкм) четырех групп, показанных на Фигуре 5, после трансплантации культивированного эндотелия роговицы. На оси X указано число дней после лечения. Сплошные линии указывают на отсутствие отделения Десцеметовой оболочки, и пунктирные указывают на отделение Десцеметовой оболочки. Каждый закрашенный кружок указывает на присутствие фрагментов ламинина 511-E8, и незакрашенные кружки указывают на отсутствие фрагмента ламинина 511-E8. Уменьшение толщины роговицы было сильнее задержано при отделении Десцеметовой оболочки по сравнению со случаями без отделения.
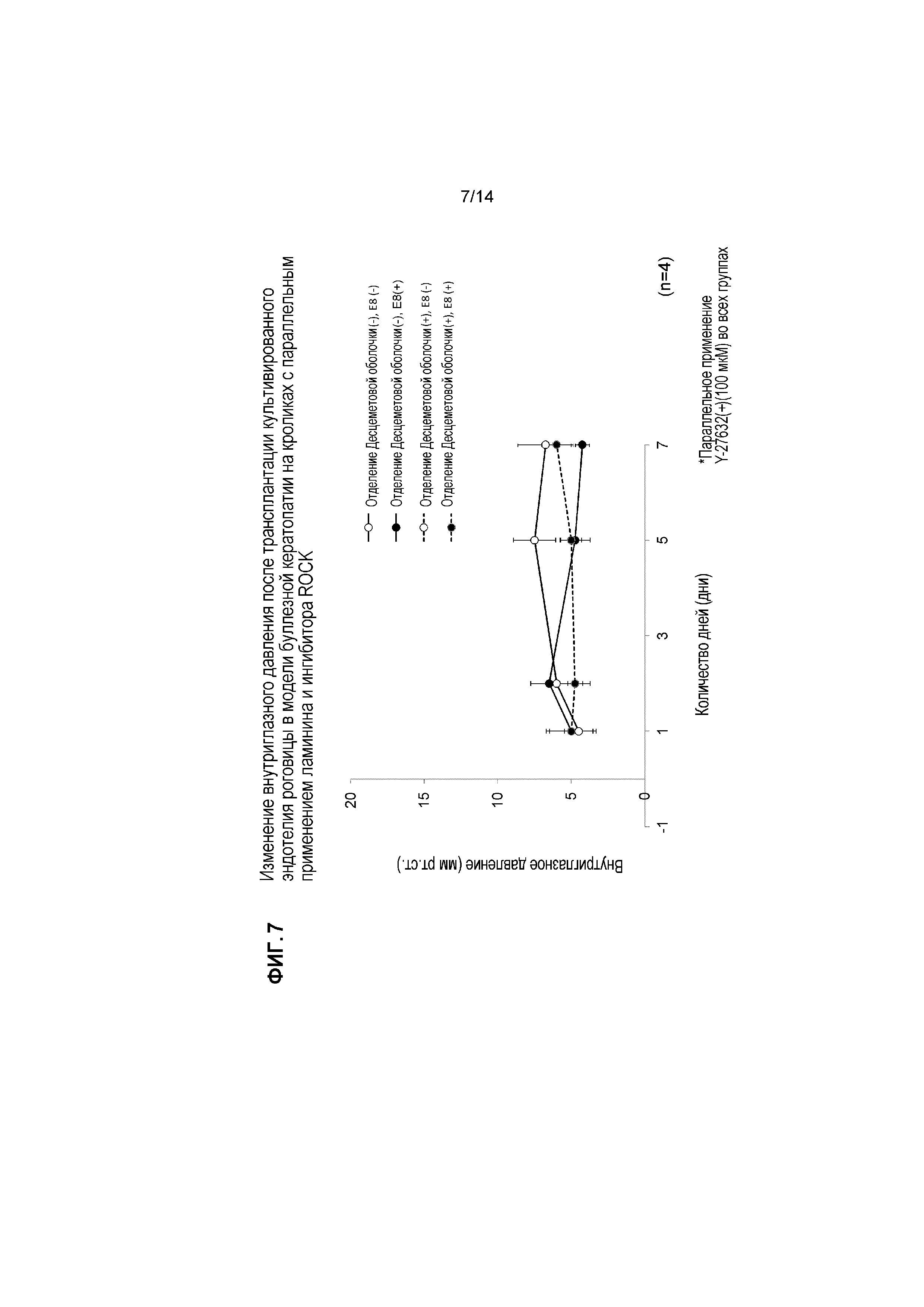
[Фигура 7] На Фигуре 7 показано внутриглазное давление (мм рт.ст.) в четырех группах, показанных на Фигуре 5, после трансплантации культивированного эндотелия роговицы. На оси X указано число дней после лечения. Сплошные линии указывают отсутствие отделения Десцеметовой оболочки, и пунктирные линии указывают на присутствие отделения Десцеметовой оболочки. Каждый закрашенный кружок указывает на присутствие фрагментов ламинина 511-E8, и незакрашенные кружки указывают на отсутствие фрагмента ламинина 511-E8. Повышение внутриглазного давления, которое считают осложнением в результате трансплантации клеток, не наблюдали ни в одной группе.
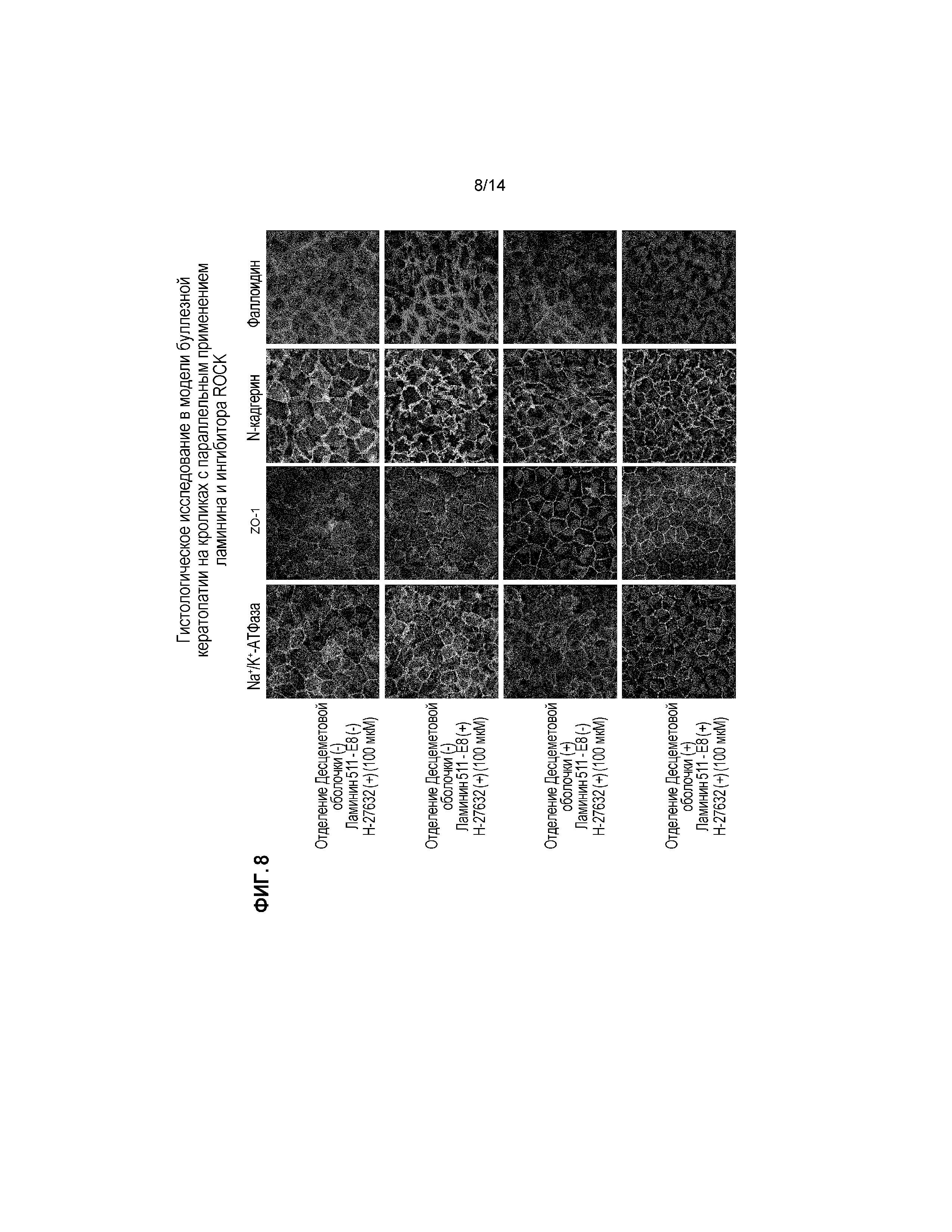
[Фигура 8] На Фигуре 8 показано гистологическое исследование четырех групп, показанных на Фигуре 6, через 14 дней после трансплантации культивированного эндотелия роговицы. На Фигуре 8 показано окрашивание, слева направо, антителами против Na+/K+-АТФазы, антителами против ZO-1, антителами против N-кадгерина и фаллоидином. На Фигуре 8 показаны изображения окрашивания, с верхнего ряда, у индивидов, у которых отделяли эндотелиальные клетки роговицы, но не отделяли Десцеметову оболочку, и вводили культивированные эндотелиальные клетки роговицы с Y-27632 (+) (100 мкМ), у индивидов, у которых отделяли эндотелиальные клетки роговицы, но не отделяли Десцеметову оболочку, и вводили клетки с фрагментами ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ), у индивидов в модели буллезной кератопатии, у которых отделяли Десцеметову оболочку и вводили клетки с Y-27632 (+) (100 мкМ), и у индивидов в модели буллезной кератопатии, у которых отделяли Десцеметову оболочку и вводили клетки с фрагментами ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ).
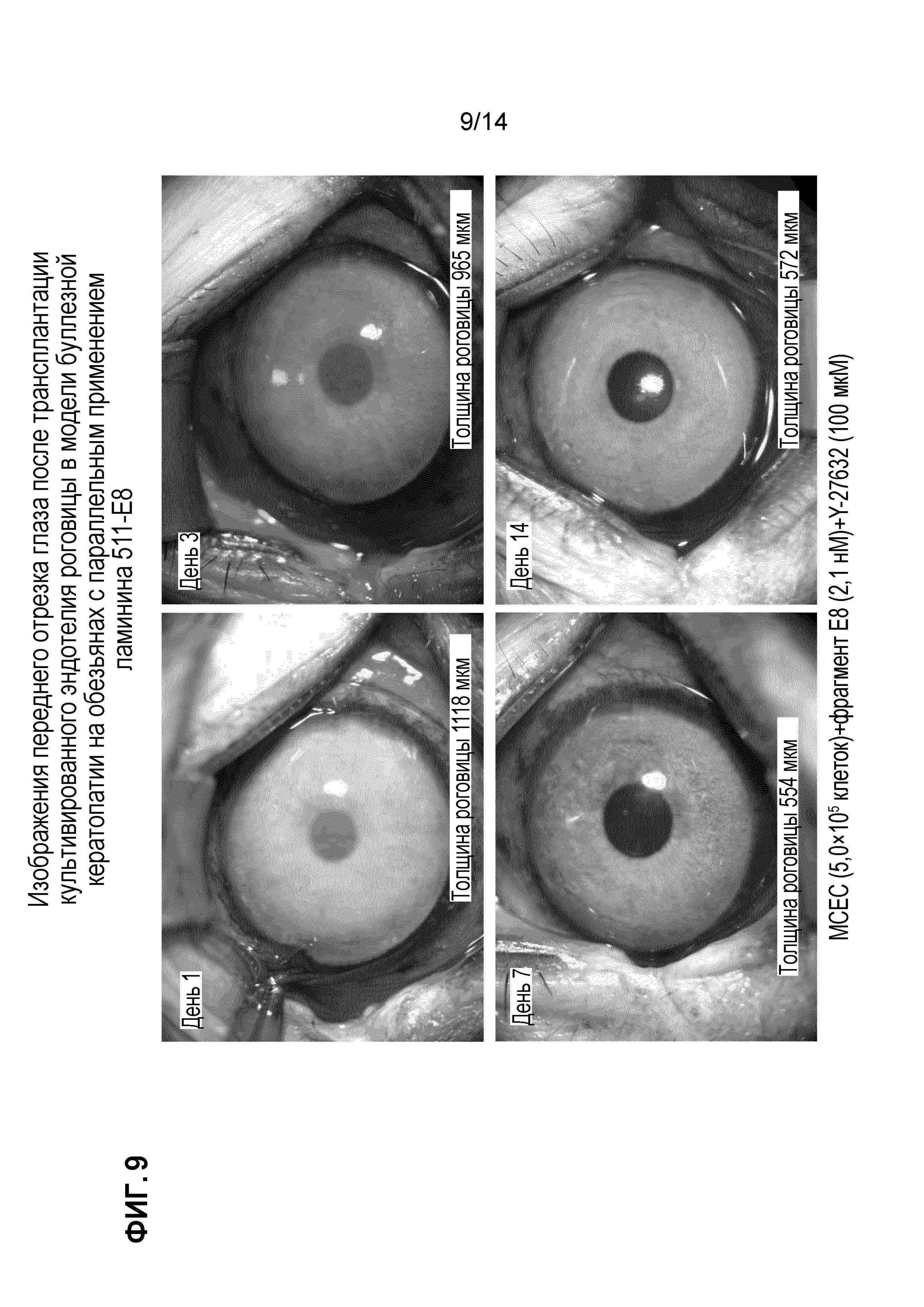
[Фигура 9] На Фигуре 9 показаны изображения переднего отрезка глаза после трансплантации культивированного эндотелия роговицы в модели буллезной кератопатии на обезьянах, подвергнутых параллельному применению фрагментов ламинина 511-E8. В модели на яванских макаках с механически соскобленными эндотелиальными клетками роговицы вводили культивированные эндотелиальные клетки роговицы яванского макака в переднюю камеру глаза и выдерживали в положении лежа на животе в течение трех часов. На левом верхнем изображении показан результат в День 1, на правом верхнем изображении показан результат в День 3, на левом нижнем изображении показан результат в День 7, и справа снизу показан результат в День 14.
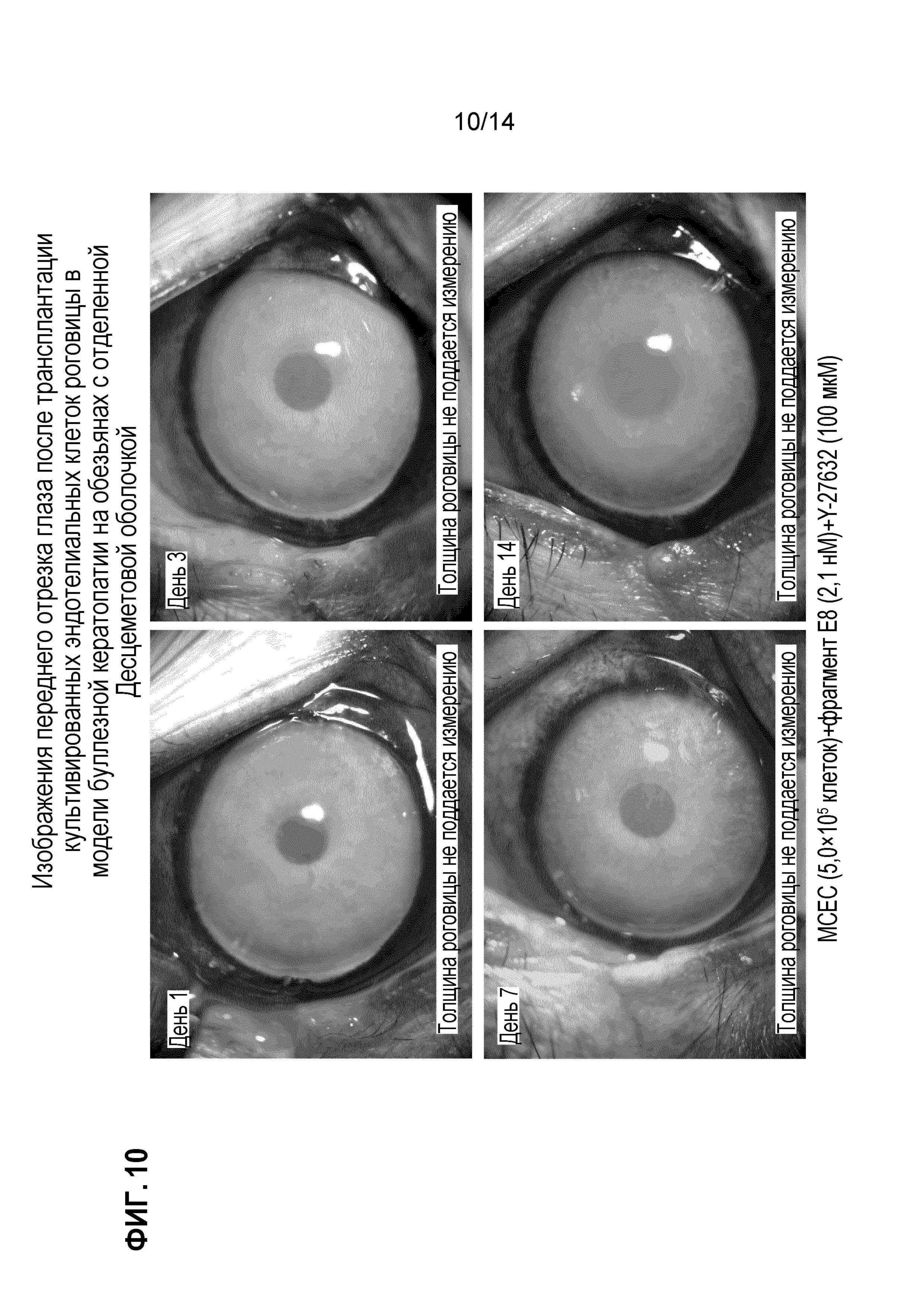
[Фигура 10] На Фигуре 10 показаны изображения переднего отрезка глаза после отделения Десцеметовой оболочки и трансплантации культивированных эндотелиальных клеток роговицы параллельно с фрагментами ламинина 511-E8 в модели буллезной кератопатии на обезьянах. В модели на яванских макаках с механически выскобленными эндотелиальными клетками роговицы после отделения Десцеметовой оболочки вводили культивированные эндотелиальные клетки роговицы яванского макака в переднюю камеру глаза и выдерживали в положении лежа на животе в течение трех часов. На левом верхнем изображении показан результат в День 1, на правом верхнем изображении показан результат в День 3, на левом нижнем изображении показан результат в День 7 и справа снизу показан результат в День 14.
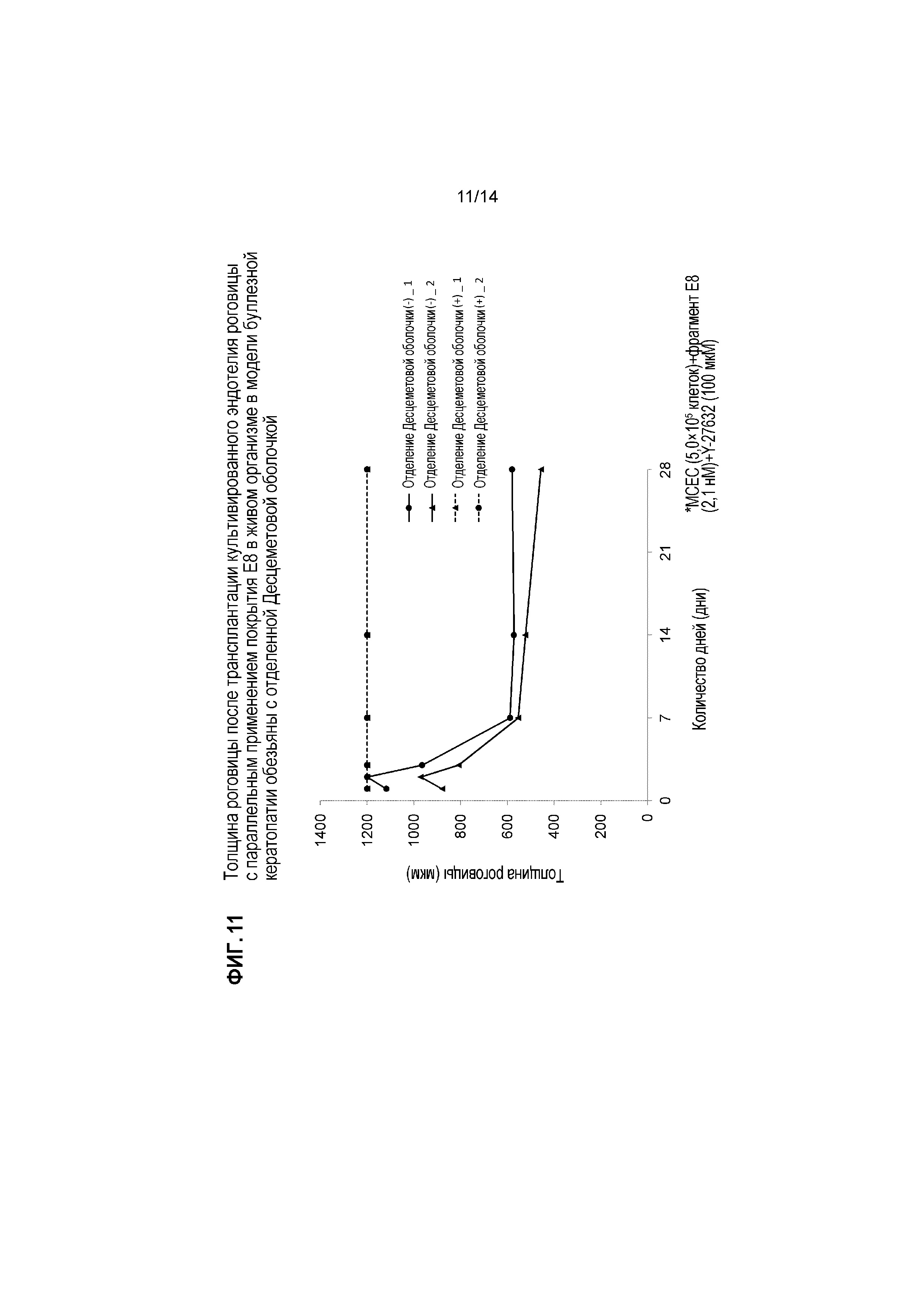
[Фигура 11] На Фигуре 11 показана толщина роговицы после трансплантации культивированного эндотелия роговицы в модели буллезной кератопатии обезьяны с параллельным применением фрагментов ламинина 511-E8. Показана толщина роговицы (мкм) индивидов с и без отделения Десцеметовой оболочки. На оси X указано число дней после лечения, и на оси Y указана толщина роговицы (мкм). Сплошные линии указывают пример без отделения Десцеметовой оболочки, и пунктирные линии указывают индивидов с отделением Десцеметовой оболочки. Закрашенные кружки и треугольники обозначают индивидуальные различия. Уменьшения толщины роговицы не наблюдали в обоих примерах с отделением Десцеметовой оболочки.
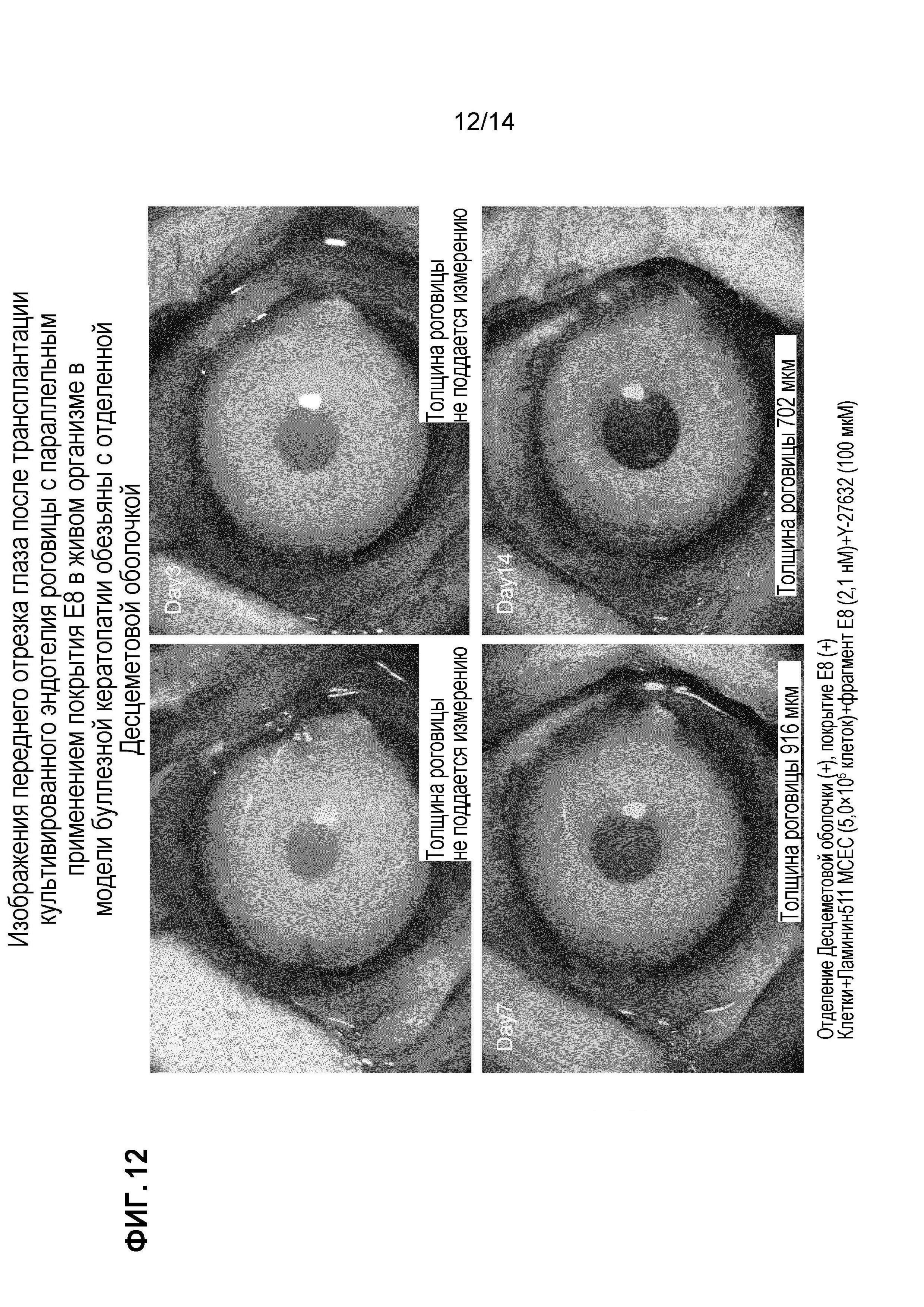
[Фигура 12] На Фигуре 12 показаны изображения переднего отрезка глаза после отделения Десцеметовой оболочки в модели буллезной кератопатии на обезьянах, введения фрагментов ламинина 511-E8 в переднюю камеру глаза при концентрации 21 нМ и выдерживания модели в течение одного часа для покрытия стромы роговицы, обнаженной при отделении Десцеметовой оболочки у живого организма, с последующей трансплантацией культивированных эндотелиальных клеток роговицы параллельно с фрагментами ламинина 511-E8. На левом верхнем изображении показан результат в День 1, на правом верхнем изображении показан результат в День 3, на левом нижнем изображении показан результат в День 7, и справа снизу показан результат в День 14.
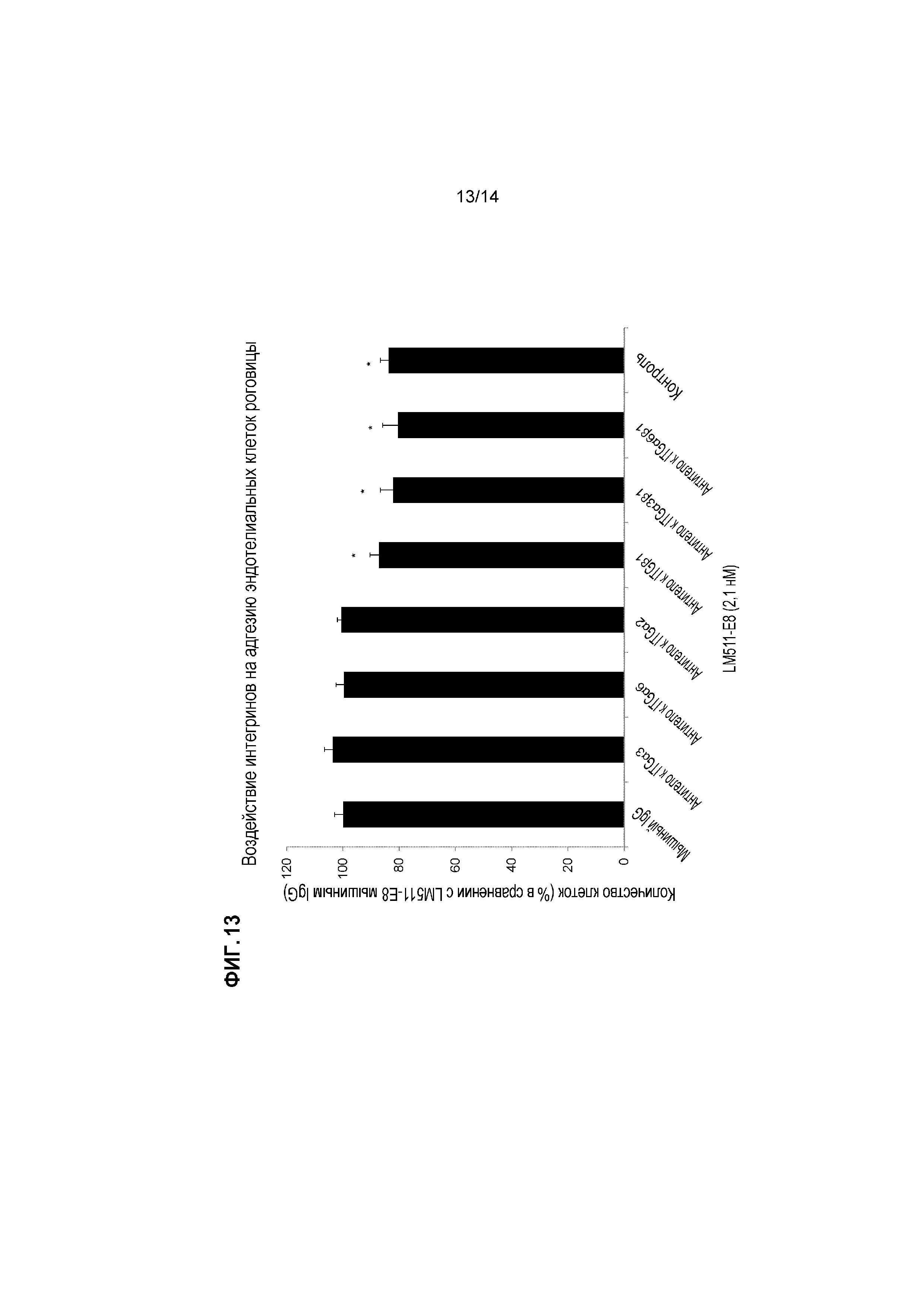
[Фигура 13] На Фигуре 13 показано воздействие интегринов на адгезию эндотелиальных клеток роговицы. Фрагменты ламинина 511-E8 добавляли так, чтобы конечная концентрация составляла 2,1 нМ, и сеяли эндотелиальные клетки роговицы. Показано количество прикрепившихся клеток через 24 часа (показано отношение к мышиному IgG) при посеве после добавления, слева направо, в следующем порядке, мышиный IgG, антитело против интегрина α3, антитело против интегрина α6, антитело против интегрина α2, антитело против интегрина β1, антитело против интегрина α3β1 и антитело против интегрина α6β1. В конце справа показан контроль, к которому добавляли только мышиный IgG для посева, без добавления фрагмента ламинина 511-E8.
[Фигура 14] На Фигуре 14 показано, что активация белков, ассоциированных с клеточной адгезией, опосредована интегрином. Группа без фрагментов ламинина 511-E8 подготовлена в качестве контроля, в конце слева. Группы, в которых добавляли фрагменты ламинина 511-E8, чтобы конечная концентрация составляла 2,1 нМ, подготовлены во втором столбце слева и после него. Результаты Вестерн-блоттинга показаны во втором столбце слева и после него для случаев добавления, в следующем порядке, мышиный IgG, антитела против интегрина α3, антитела против интегрина α6, антитела против интегрина α2, антитела против интегрина β1, антитела против интегрина α3β1 и антитела против интегрина α6β1 для посева. С верхнего ряда, показаны p-FAK, FAK, p-паксиллин и фоновая GAPDH. Числовые значения в каждой полосе указывают относительное значение интенсивности полосы, определенной количественно, принимая ламинин 511-E8 на левом конце за 1.
[Описание вариантов осуществления]
[0009]
Далее описано настоящее изобретение. По всему тексту описания выражение в форме единственного числа следует понимать как включающее соответствующее понятие в форме множественного числа, если прямо не отмечено иное. Таким образом, артикли в форме единственного числа (например, "a", "an", "the" и т.п. в случае английского языка) следует также понимать как включающие соответствующие понятия в форме множественного числа, если прямо не отмечено иное. Кроме того, следует понимать, что термины, используемые в настоящем описании, используются в значении, которое обычно используется в данной области, если прямо не отмечено иное. Таким образом, если не определено иное, все терминологии и научно-технические термины, которые используются в настоящем описании, имеют такое же значение, как и термины, обычно известные специалистам в области техники, к которой относится настоящее изобретение. В случае противоречия настоящее описание (включая определения) имеет преимущественную силу.
[0010]
(Определения)
При использовании в настоящем описании "эндотелиальная клетка роговицы" используется в значении, которое обычно используется в данной области техники. Роговица является одной из слоистых тканей, формирующих глаз. Роговица прозрачная и находится в части, ближайшей к внешней среде. У людей, как известно, роговица состоит из пяти слоев, т.е. эпителия роговицы, Боуменовой мембраны, собственной пластинки или стромы роговицы (Lamina propria), Десцеметовой оболочки (базальной мембраны эндотелия роговицы) и эндотелия роговицы, в порядке от наружной поверхности (поверхности тела). Если прямо не отмечено иное, части кроме эпителия и эндотелия можно в совокупности именовать "стромой роговицы", которые называют так же в настоящей заявке. При использовании в настоящем описании "HCEC" (эндотелиальная клетка роговицы человека) является сокращенным обозначением человеческих эндотелиальных клеток роговицы. Эндотелиальная клетка роговицы кролика сокращенно обозначена как "RCEC", и эндотелиальная клетка роговицы обезьяны сокращенно обозначена как "MCEC". Следует понимать, что природные клетки, а также клетки, дифференцированные из стволовых клеток, такие как дифференцированные клетки, индуцированные из ИПСК и т.п., могут применяться в качестве эндотелиальных клеток роговицы, используемых в настоящем изобретении.
[0011]
При использовании в настоящем описании "выделенный" относится к состоянию, в котором вещество, которое в природе сопровождает объект в нормальных условиях, по меньшей мере, уменьшено, и предпочтительно к состоянию, в котором объект по существу не содержит такого вещества. Таким образом, выделенные клетки, ткань и т.п. относятся к клеткам, ткани и т.п., которые по существу не содержат других веществ, которые сопровождают их (например, других клеток, белков, нуклеиновых кислот и т.п.) в естественной среде.
[0012]
<Ламинин>
При использовании в настоящем описании "ламинин" являеся белком, входящим в состав базальной мембраны внеклеточного матрикса. Ламинины способствуют многоклеточности/формированию ткани и их поддержанию, клеточной адгезии, миграции клеток и росту клеток и имеют тесную связь с раковыми клетками. Считается, что ламинин экспрессируется на ранней стадии (двухклеточной стадии) бластогенеза. Ламинин представляет собой гетеротример, состоящий из одной α-цепи, одной β-цепи и одной γ-цепи. Для обозначения ламининов известна номенклатура в порядке открытия (ламинин 1, ламинин 2 и т.д.). Однако соответствие с субъединицами не рассматривается, поэтому в настоящей заявке применяется более новый способ обозначения, в котором название субкласса α, β или γ (трехзначное число, первая цифра указывает α, вторая цифра указывает β и последняя цифра указывает γ) описано вместе. В случае α1, β1 и γ1 такой ламинин называют ламинином 111. У ламининов были обнаружены пять типов α-цепей, 3 типа β-цепей и три типа γ-цепей. Таким образом, теоретическое максимальное количество комбинаций составляет 5×3×3=45, поэтому возможны 45 типов молекул ламинина. Однако считается, что не все комбинации существуют в природе. Каждая субъединица, например, называется LAMA1, LAMA2, LAMA3, LAMA4 или LAMA5 для α-цепи, LAMB1, LAMB2, или LAMB3 для β-цепи и LAMC1, LAMC2 или LAMC3 для γ-цепи. Белки ламинины, используемые в настоящеом изобретении, могут быть природными белками ламининами или белками с модифицированной формой, в которых один или несколько аминокислотных остатков изменены с сохранением их биологической активности, в особенности активности, стимулиирующей клеточную адгезию. Кроме того, белки ламинины в настоящем изобретении не ограничены в отношении происхождения, способа их получения и т.п., при условии, что белок ламинин обладает описанными в настоящей заявке признаками. Таким образом, белки ламинины, применяемые в настоящем изобретении, могут быть любыми из природных белков, белков, экспрессированных с рекомбинантной ДНК с помощью метода генной инженерии, или химически синтезированных белков. Происхождение белков ламининов, применяемых в настоящем изобретении, специально не ограничено, но предпочтительно они получены от человека. При культивировании клетки человека в целях получения медицинского материала, предпочтительно, но не является ограничением, применение ламинина, полученного от человека, чтобы избежать применения материала, полученного из другого животного.
[0013]
Известны связывающие молекулы ламинина. α1β1, α2β1, α2β2, α3β1, α6β1, α6β4, α7β1, α9β1, αvβ3, αvβ5 и αvβ8 являются интегринами, известными как рецептор ламинина.
[0014]
В следующей таблице описаны репрезентативные ламинины и представлено соответствующее поъяснение.
[0015]
[Таблица 1]
[0016]
При использовании в настоящем описании "α1-цепь" (LAMA1) является субъединицей белка ламинина молекулы клеточной адгезии во внеклеточном матриксе и называется LAMA1, LAMA, S-LAM-альфа и т.п. Для LAMA1 человека последовательности гена и белка зарегистрированы под регистрационными номерами NCBI NM_005559 и NP_005550, соответственно. OMIM идентифицирован регистрационным номером 150320. При использовании в рамках настоящей заявки следует понимать, что "α1-цепь" или "LAMA1" означает не только белок, имеющий аминокислотную последовательность, представленную под определенным номером последовательности или регистрационным номером (или нуклеиновую кислоту, кодирующую белок), но также и функционально активное производное, функционально активный фрагмент или их гомолог, или мутант, кодируемый нуклеиновой кислотой, которая гибридизуется с нуклеиновой кислотой, кодирующей белок, при условии высокой или низкой строгости.
[0017]
При использовании в настоящем описании "α2-цепь" (LAMA2) является субъединицей белка ламинина молекулы клеточной адгезии во внеклеточном матриксе и называется LAMA2, LAMM и т.п. Для LAMA2 человека последовательности гена и белка зарегистрированы под регистрационными номерами NCBI NM_000426 и NP_000417, соответственно. OMIM идентифицирован регистрационным номером 156225. При использовании в рамках настоящей заявки следует понимать, что "α2-цепь" или "LAMA2" означает не только белок, имеющий аминокислотную последовательность, представленную под определенным номером последовательности или регистрационным номером (или нуклеиновую кислоту, кодирующую белок), но также и функционально активное производное, функционально активный фрагмент или их гомолог, или мутант, кодируемый нуклеиновой кислотой, которая гибридизуется с нуклеиновой кислотой, кодирующей белок, при условии высокой или низкой строгости.
[0018]
При использовании в настоящем описании "α3-цепь" (LAMA3) является субъединицей белка ламинина молекулы клеточной адгезии во внеклеточном матриксе и называется LAMA3, BM600, E170, LAMNA, LOCS, lama3a и т.п. Для LAMA3 человека последовательности гена и белка зарегистрированы под регистрационными номерами NCBI NM_000227 и NP_000218, соответственно. OMIM идентифицирован регистрационным номером 600805. При использовании в рамках настоящей заявки следует понимать, что "α3-цепь" или "LAMA3" означает не только белок, имеющий аминокислотную последовательность, представленную под определенным номером последовательности или регистрационным номером (или нуклеиновую кислоту, кодирующую белок), но также и функционально активное производное, функционально активный фрагмент или их гомолог, или мутант, кодируемый нуклеиновой кислотой, которая гибридизуется с нуклеиновой кислотой, кодирующей белок, при условии высокой или низкой строгости.
[0019]
При использовании в настоящем описании "α4-цепь" (LAMA4) является субъединицей белка ламинина молекулы клеточной адгезии во внеклеточном матриксе и называется LAMA4, LAMA3, LAMA4*-1, CMD1JJ и т.п. Для LAMA4 человека последовательности гена и белка зарегистрированы под регистрационными номерами NCBI NM_001105206 и NP_001098676, соответственно. OMIM идентифицирован регистрационным номером 600133. При использовании в рамках настоящей заявки следует понимать, что "α4-цепь" или "LAMA4" означает не только белок, имеющий аминокислотную последовательность, представленную под определенным номером последовательности или регистрационным номером (или нуклеиновую кислоту, кодирующую белок), но также и функционально активное производное, функционально активный фрагмент или их гомолог, или мутант, кодируемый нуклеиновой кислотой, которая гибридизуется с нуклеиновой кислотой, кодирующей белок, при условии высокой или низкой строгости.
[0020]
При использовании в настоящем описании "α5-цепь" (LAMA5) является субъединицей белка ламинина молекулы клеточной адгезии во внеклеточном матриксе и называется LAMA5, KIAA1907 и т.п. Для LAMA5 человека последовательности гена и белка зарегистрированы под регистрационными номерами NCBI NM_005560 и NP_005551, соответственно. OMIM идентифицирован регистрационным номером 601033. При использовании в рамках настоящей заявки следует понимать, что "α5-цепь" или "LAMA5" означает не только белок, имеющий аминокислотную последовательность, представленную под определенным номером последовательности или регистрационным номером (или нуклеиновую кислоту, кодирующую белок), но также и функционально активное производное, функционально активный фрагмент или их гомолог, или мутант, кодируемый нуклеиновой кислотой, которая гибридизуется с нуклеиновой кислотой, кодирующей белок, при условии высокой или низкой строгости.
[0021]
При использовании в настоящем описании "β1-цепь" (LAMB1) является субъединицей белка ламинина молекулы клеточной адгезии во внеклеточном матриксе и называется LAMB1, CLM, LIS5 и т.п. Для LAMB1 человека последовательности гена и белка зарегистрированы под регистрационными номерами NCBI NM_002291 и NP_002282, соответственно. OMIM идентифицирован регистрационным номером 150240. При использовании в рамках настоящей заявки следует понимать, что "β1-цепь" или "LAMB1" означает не только белок, имеющий аминокислотную последовательность, представленную под определенным номером последовательности или регистрационным номером (или нуклеиновую кислоту, кодирующую белок), но также и функционально активное производное, функционально активный фрагмент или их гомолог, или мутант, кодируемый нуклеиновой кислотой, которая гибридизуется с нуклеиновой кислотой, кодирующей белок, при условии высокой или низкой строгости.
[0022]
При использовании в настоящем описании "β2-цепь" (LAMB2) (ламинин S) является субъединицей белка ламинина молекулы клеточной адгезии во внеклеточном матриксе и называется LAMB2, LAMS, NPHS5 и т.п. Для LAMB2 человека последовательности гена и белка зарегистрированы под регистрационными номерами NCBI NM_002292 и NP_002283, соответственно. OMIM идентифицирован регистрационным номером 150325. При использовании в рамках настоящей заявки следует понимать, что "β2-цепь" или "LAMB2" означает не только белок, имеющий аминокислотную последовательность, представленную под определенным номером последовательности или регистрационным номером (или нуклеиновую кислоту, кодирующую белок), но также и функционально активное производное, функционально активный фрагмент или их гомолог, или мутант, кодируемый нуклеиновой кислотой, которая гибридизуется с нуклеиновой кислотой, кодирующей белок, при условии высокой или низкой строгости.
[0023]
При использовании в настоящем описании "β3-цепь" (LAMB3) является субъединицей белка ламинина молекулы клеточной адгезии во внеклеточном матриксе и называется LAMB3, BM600-125KDA, LAM5, LAMNB1 и т.п. Для LAMB3 человека последовательности гена и белка зарегистрированы под регистрационными номерами NCBI NM_000228 и NP_000219, соответственно. OMIM идентифицирован регистрационным номером 150310. При использовании в рамках настоящей заявки следует понимать, что "β3-цепь" или "LAMB3" означает не только белок, имеющий аминокислотную последовательность, представленную под определенным номером последовательности или регистрационным номером (или нуклеиновую кислоту, кодирующую белок), но также и функционально активное производное, функционально активный фрагмент или их гомолог, или мутант, кодируемый нуклеиновой кислотой, которая гибридизуется с нуклеиновой кислотой, кодирующей белок, при условии высокой или низкой строгости.
[0024]
При использовании в настоящем описании "γ1-цепь" (LAMC1) является субъединицей белка ламинина молекулы клеточной адгезии во внеклеточном матриксе и называется LAMC1, LAMB2 и т.п. Для LAMC1 человека последовательности гена и белка зарегистрированы под регистрационными номерами NCBI NM_002293 и NP_002284, соответственно. OMIM идентифицирован регистрационным номером 150290. При использовании в рамках настоящей заявки следует понимать, что "γ1-цепь" или "LAMC1" означает не только белок, имеющий аминокислотную последовательность, представленную под определенным номером последовательности или регистрационным номером (или нуклеиновую кислоту, кодирующую белок), но также и функционально активное производное, функционально активный фрагмент или их гомолог, или мутант, кодируемый нуклеиновой кислотой, которая гибридизуется с нуклеиновой кислотой, кодирующей белок, при условии высокой или низкой строгости.
[0025]
При использовании в настоящем описании "γ2-цепь" (LAMC2) является субъединицей белка ламинина молекулы клеточной адгезии во внеклеточном матриксе и называется LAMC2, B2T, BM600, CSF, EBR2, EBR2A, LAMB2T, LAMNB2 и т.п. Для LAMC2 человека последовательности гена и белка зарегистрированы под регистрационными номерами NCBI NM_005562 и NP_005553, соответственно. OMIM идентифицирован регистрационным номером 150292. При использовании в рамках настоящей заявки следует понимать, что "γ2-цепь" или "LAMC2" означает не только белок, имеющий аминокислотную последовательность, представленную под определенным номером последовательности или регистрационным номером (или нуклеиновую кислоту, кодирующую белок), но также и функционально активное производное, функционально активный фрагмент или их гомолог, или мутант, кодируемый нуклеиновой кислотой, которая гибридизуется с нуклеиновой кислотой, кодирующей белок, при условии высокой или низкой строгости.
[0026]
При использовании в настоящем описании "γ3-цепь" (LAMC3) является субъединицей белка ламинина молекулы клеточной адгезии во внеклеточном матриксе и называется LAMC3, OCCM и т.п. Для LAMC3 человека последовательности гена и белка зарегистрированы под регистрационными номерами NCBI NM_006059 и NP_006050, соответственно. OMIM идентифицирован регистрационным номером 604349. При использовании в рамках настоящей заявки следует понимать, что "γ3-цепь" или "LAMC3" означает не только белок, имеющий аминокислотную последовательность, представленную под определенным номером последовательности или регистрационным номером (или нуклеиновую кислоту, кодирующую белок), но также и функционально активное производное, функционально активный фрагмент или их гомолог, или мутант, кодируемый нуклеиновой кислотой, которая гибридизуется с нуклеиновой кислотой, кодирующей белок, при условии высокой или низкой строгости.
[0027]
При использовании в настоящем описании "ламинин, экспрессируемый в эндотелиальных клетках роговицы" относится к типу ламинина с геном, который экспрессируется в нормальном состоянии или предпочтительно значительно экспрессируется на уровне белка, в эндотелиальных клетках роговицы. Было подтверждено, что экспрессируются α5, β1, β2 и γ1, с помощью анализа, представленного в настоящей заявке (Фигура 2 в WO 2015/080297). Таким образом, экспрессируются, по меньшей мере, ламинин 511 и ламинин 521. В Dev. Dyn.218, 213-234, 2000 и J.Biol. Chem. 277 (15), 12741-12748, 2002 представлено подробное описание ламинина 511. Таким образом, содержание, раскрытое в указанных документах, включено в настоящую заявку посредством отсылки. В случае ламинина 511 и т.п. можно использовать те, которые доступны на рынке. Например, рекомбинантные белки ламинин 511 и ламинин 521 доступны на рынке и могут быть получены от BioLamina AB.
[0028]
При использовании в настоящем описании "экспрессия" гена, полинуклеотида, полипептида и т.п. относится к гену и т.п., подвергаемому некоторому воздействию in vivo, с переходом в другую форму. Предпочтительно экспрессия относится к гену, полинуклеотиду и т.п., транскрибируемому и транслируемому с переходом в форму полипептида, однако транскрипция, приводящая к мРНК, также может быть одной из форм экспрессии. Более предпочтительно такая форма полипептида может подвергаться посттрансляционному процессингу (указана в настоящей заявке как производное). Например, уровень экспрессии каждой цепи ламинина может быть определен с помощью любого метода. В частности, уровень экспрессии каждой цепи ламинина может быть установлен при оценке количества мРНК каждой цепи ламинина, количества белка каждой цепи ламинина или биологической активности белка каждой цепи ламинина. Количество мРНК или белка каждой цепи ламинина могут быть определены с помощью способа, описанного в настоящей заявке.
[0029]
При использовании в настоящем описании "функциональный эквивалент" относится к чему-либо, что обладает такой же функцией, представляющей интерес, но другой структурой по сравнению с исходным объектом. Таким образом, следует понимать, что "ламинин или каждая цепь ламинина, или их функциональный эквивалент" или "группа, состоящая из ламинина, каждой цепи ламинина и их функционального эквивалента" охватывают сам ламинин или каждую цепь ламинина, а также фрагменты, мутанты или варианты ламинина или каждой цепи ламинина (например, вариант аминокислотной последовательности и т.п.), обладающие одним или более из способности к клеточной адгезии, регуляции дифференцировки и/или вызывающей рост активности в отношении клетки глаза и т.п., а также вещества, которые могут превращаться в сам ламинин или каждую цепь ламинина, или фрагмент, мутант или вариант ламинина, или каждую цепь ламинина в момент действия (включая, например, нуклеиновые кислоты, кодирующие сам ламинин или каждую цепь ламинина, или фрагмент, мутант или вариант ламинина, или каждую цепь ламинина, векторы и клетки, включающие такую нуклеиновую кислоту, и т.п.). Типичные примеры "ламинина или каждой цепи ламинина, или их функционального эквивалента" или "группы, состоящей из ламинина, каждой цепи ламинина и их функционального эквивалента" включают по меньшей мере одно средство, выбранное из группы, состоящей из ламининов и их фрагментов. В настоящем изобретении подразумевается, что функциональный эквивалент ламинина или каждой цепи ламинина может применяться таким же образом, как ламинин или каждая цепь ламинина без их какого-либо конкретного упоминания.
[0030]
При использовании в настоящем описании "фрагмент" относится к полипептиду или полинуклеотиду с длиной последовательности от 1 до n-1 по отношению к полноразмерному полипептиду или полинуклеотиду (с длиной n). Длина фрагмента может быть соответственно изменена в соответствии с задачей. В случае полипептида примеры нижнего предела его длины включают 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 40, 50 и более аминокислот. Длины, представленные целым числом, которое прямо не перечислено в настоящем описании (например, 11 и т.п.), также могут быть подходящими в качестве нижнего предела. В случае полинуклеотида примеры нижнего предела его длины включают 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 40, 50, 75, 100 и более нуклеотидов. Длины, представленные целым числом, которое прямо не перечислено в настоящем описании (например, 11 и т.п.), также могут быть подходящими в качестве нижнего предела. В настоящей заявке подразумевается, что сами фрагменты такой цепи ламинина, в случае действия в качестве фактора своей активности, например, стимуляции роста или поддержания, включены в объем настоящего изобретения. Согласно настоящему изобретению термин "активность" при использовании в настоящем описании относится к функции молекулы в самом широком значении. Активность обычно охватывает, без ограничения, биологическую функцию, биохимическую функцию, физическую функцию и химическую функцию молекулы. Примеры активности включают ферментативную активность, способность взаимодействовать с другой молекулой, способность активировать, вызывать, стабилизировать, ингибировать, подавлять или нарушать функцию другой молекулы, стабильность и способность к локализации в определенном положении в клетке. В соответствующих случаях термин также направлен на функцию белкового комплекса в самом широком смысле. При использовании в настоящем описании "биологическая функция", в отношении гена или нуклеиновой кислоты или полипептида, связанного с ними, относится к определенной функции, которую ген, нуклеиновая кислота или полипептид могут выполнять в живом организме. Соответствующие примеры включают, без ограничения, продукцию специфического антитела, ферментативную активность, придание устойчивости и т.п. При использовании в настоящем описании биологическая функция может проявляться "биологической активностью". При использовании в настоящем описании "биологическая активность" относится к активности, которую некоторое средство (например, полинуклеотид, белок и т.п.) может иметь в живом организме, включая активность, проявляющую множество функций (например, активность активации транскрипции), таких как активность активации или дезактивации молекулы при взаимодействии с другой молекулой. Когда два средства взаимодействуют, их биологическая активность может рассматриваться как связь между двумя указанными молекулами и биологическое изменение, возникающее в результате этого, например, две молекулы связываются, когда преципитация одной из молекул антителом приводит к копреципитации другой молекулы. Таким образом, один способ определения включает наблюдение такой копреципитации. В случае, когда средство является, например, ферментом, его биологическая активность включает его ферментативную активность. Другой пример включает связывание лиганда с соответствующим рецептором, когда средством является лиганд. Такая биологическая активность может быть измерена с помощью методики, известной в уровне техники. Таким образом, "активность" относится к различным измеряемым индикаторам, которые указывают или обнаруживают связь (прямо или опосредованно), или влияют на реакцию (т.е. оказывают измеряемое воздействие в ответ на некоторый контакт или стимуляцию). Соответствующие примеры включают аффинность соединения, которое непосредственно связывается с полипептидом или полинуклеотидом настоящего изобретения, количество белков до или после некоторого контакта или стимуляции и измерение другой подобной функции.
[0031]
"Функционально активный" при использовании в настоящем описании относится к полипептиду, фрагменту или производному, обладающему структурной функцией, регулирующей функцией или биохимической функцией белка, такой как биологическая активность, в соответствии с вариантом осуществления, связанным с полипептидом, фрагментом или производным изобретения.
[0032]
При использовании в настоящем описании "фрагмент" ламинина относится к любому фрагменту ламинина. В отношении средства, применяемого в настоящем изобретении, следует понимать, что может использоваться не только полноразмерный ламинин, но также и фрагмент ламинина, при условии, что фрагмент обладает функцией полноразмерного ламинина, в особенности способностью к клеточной адгезии эндотелиальной клетки. Таким образом, фрагмент ламинина, используемый в настоящем изобретении, обычно обладает по меньшей мере одной функцией ламинина. Такая функция, в частности, может охватывать способность к клеточной адгезии эндотелиальной клетки.
[0033]
Последовательность ламинина, который, как установили, экспрессируется в эндотелиальных клетках роговицы, будет описана в настоящем изобретении. Следует понимать, что указанные ламинины являются предпочтительными репрезентативными примерами настоящего изобретения, при этом настоящее изобретение не ограничивается такими определенными субтипами ламинина.
[0034]
Типичная нуклеотидная последовательность α5-цепи ламинина может быть:
(a) полинуклеотидом, последовательность оснований которого представлена в SEQ ID NO: 1, или последовательностью его фрагмента;
(b) полинуклеотидом, кодирующим полипептид, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2, или его фрагментом;
(c) полинуклеотидом, кодирующим вариант полипептида или его фрагмент, имеющий одну или более аминокислот с мутацией, выбранной из группы, состоящей из замены, добавления и делеции в аминокислотной последовательности, представленной в SEQ ID NO: 2, где вариант полипептида обладает биологической активностью;
(d) полинуклеотидом, который является аллельным или сплайс-мутантом последовательности оснований, представленной в SEQ ID NO: 1, или его фрагментом;
(e) полинуклеотидом, кодирующим видовой гомолог полипептида, состоящего из аминокислотной последовательности, представленной в SEQ ID NO: 2, или его фрагментом;
(f) полинуклеотидом, кодирующим полипептид, обладающий биологической активностью и гибридизующийся с полинуклеотидом согласно одному из (a)-(e) при строгих условиях; или
(g) полинуклеотидом, кодирующим полипептид, обладающий биологической активностью, и состоящим из последовательности оснований с идентичностью по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% с полинуклеотидом согласно одному из (a)-(e) или его комплементарной последовательностью. В этом отношении биологическая активность, как правило, относится к активности α5-цепи ламинина. Можно сделать отсылку на Doi M et al., J.Biol.Chem. 277(15), 12741-12748, 2002 и патент США 6,933,273 по поводу α5-цепей.
[0035]
Аминокислотная последовательность α5-цепи ламинина может быть:
(a) полипептидом, состоящим из аминокислотной последовательности, представленной в SEQ ID NO: 2, или его фрагментом;
(b) полипептидом, обладающим биологической активностью и содержащим одну или более аминокислот с мутацией, выбранной из группы, состоящей из замены, добавления и делеции в аминокислотной последовательности, представленной в SEQ ID NO: 2;
(c) полипептидом, кодируемым аллельным или сплайс-мутантом последовательности оснований, представленной в SEQ ID NO: 1;
(d) полипептидом, который является видовым гомологом аминокислотной последовательности, представленной в SEQ ID NO: 2; или
(e) полипептидом, обладающим биологической активностью и имеющим аминокислотную последовательность с идентичностью по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% с полипептидом согласно одному из (a)-(d). В этом отношении биологическая активность, как правило, относится к активности α5-цепи ламинина. Можно сделать отсылку на Doi M et al., J.Biol.Chem. 277(15), 12741-12748, 2002 и патент США 6,933,273 по поводу α5-цепей.
[0036]
Типичная нуклеотидная последовательность β1-цепи ламинина может быть:
(a) полинуклеотидом, последовательность оснований которого представлена в SEQ ID NO: 3, или последовательностью его фрагмента;
(b) полинуклеотидом, кодирующим полипептид, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 4, или его фрагментом;
(c) полинуклеотидом, кодирующим вариант полипептида или его фрагмент, содержащий одну или более аминокислот с мутацией, выбранной из группы, состоящей из замены, добавления и делеции в аминокислотной последовательности, представленной в SEQ ID NO: 4, где вариант полипептида обладает биологической активностью;
(d) полинуклеотидом, который является аллельным или сплайс-мутантом последовательности оснований, представленной в SEQ ID NO: 3, или его фрагментом;
(e) полинуклеотидом, кодирующим видовой гомолог полипептида, состоящего из аминокислотной последовательности, представленной в SEQ ID NO: 4, или его фрагментом;
(f) полинуклеотидом, кодирующим полипептид, обладающий биологической активностью и гибридизующийся с полинуклеотидом согласно одному из (a)-(e) в строгих условиях; или
(g) полинуклеотидом, кодирующим полипептид, обладающий биологической активностью, и состоящим из последовательности оснований с идентичностью по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% с полинуклеотидом согласно одному (a)-(e) или его комплементарной последовательностью. В этом отношении биологическая активность, как правило, относится к активности β1-цепи ламинина. Можно сделать отсылку на Pillarainen et al., J.Biol.Chem.262 (22), 10454-10462, 1987 и патент США 6,933,273 по поводу β1-цепей.
[0037]
Аминокислотная последовательность β1-цепи ламинина может быть:
(a) полипептидом, состоящим из аминокислотной последовательности, представленной в SEQ ID NO: 4, или его фрагментом;
(b) полипептидом, обладающим биологической активностью и содержащим одну или более аминокислот с мутацией, выбранной из группы, состоящей из замены, добавления и делеции в аминокислотной последовательности, представленной в SEQ ID NO: 4;
(c) полипептидом, кодируемым аллельным или сплайс-мутантом последовательности оснований, представленной в SEQ ID NO: 3;
(d) полипептидом, который является видовым гомологом аминокислотной последовательности, представленной в SEQ ID NO: 4; или
(e) полипептидом, обладающим биологической активностью и имеющим аминокислотную последовательность с идентичностью по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% с полипептидом согласно одному из (a)-(d). В этом отношении биологическая активность, как правило, относится к активности β1-цепи ламинина. Можно сделать отсылку на Pillarainen et al., J.Biol.Chem.262 (22), 10454-10462, 1987 и патент США 6,933,273 по поводу β1-цепей.
[0038]
Типичная нуклеотидная последовательность β2-цепи ламинина может быть:
(a) полинуклеотидом, последовательность оснований которого представлена в SEQ ID NO: 5, или последовательностью его фрагмента;
(b) полинуклеотидом, кодирующим полипептид, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 6, или его фрагментом;
(c) полинуклеотидом, кодирующим вариант полипептида или его фрагмент, содержащий одну или более аминокислот с мутацией, выбранной из группы, состоящей из замены, добавления и делеции в аминокислотной последовательности, представленной в SEQ ID NO: 6, где вариант полипептида обладает биологической активностью;
(d) полинуклеотидом, который является аллельным или сплайс-мутантом последовательности оснований, представленной в SEQ ID NO: 5, или его фрагментом;
(e) полинуклеотидом, кодирующим видовой гомолог полипептида, состоящего из аминокислотной последовательности, представленной в SEQ ID NO: 6, или его фрагментом;
(f) полинуклеотидом, кодирующим полипептид, обладающий биологической активностью и гибридизующийся с полинуклеотидом согласно одному из (a)-(e) в строгих условиях; или
(g) полинуклеотидом, кодирующим полипептид, обладающий биологической активностью, и состоящим из последовательности оснований с идентичностью по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% с полинуклеотидом согласно одному из (a)-(e) или его комплементарной последовательностью. В этом отношении биологическая активность, как правило, относится к активности β2-цепи ламинина. Можно сделать отсылку на Wewer UM et al., Genomics. Nov 15, 1994; 24(2): 243-52, 1987 и патент США 6,933,273 по поводу β2-цепей.
[0039]
Аминокислотная последовательность β2-цепи ламинина может быть:
(a) полипептидом, состоящим из аминокислотной последовательности, представленной в SEQ ID NO: 6, или его фрагментом;
(b) полипептидом, обладающим биологической активностью и содержащим одну или более аминокислот с мутацией, выбранной из группы, состоящей из замены, добавления и делеции в аминокислотной последовательности, представленной в SEQ ID NO: 6;
(c) полипептидом, кодируемым аллельным или сплайс-мутантом последовательности оснований, представленной в SEQ ID NO: 5;
(d) полипептидом, который является видовым гомологом аминокислотной последовательности, представленной в SEQ ID NO: 6; или
(e) полипептидом, обладающим биологической активностью и имеющим аминокислотную последовательность с идентичностью по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% с полипептидом согласно одному из (a)-(d). В этом отношении биологическая активность, как правило, относится к активности β2-цепи ламинина. Можно сделать отсылку на Wewer UM et al., Genomics. Nov 15, 1994; 24(2): 243-52, 1987 и патент США 6,933,273 по поводу β2-цепей.
[0040]
Типичная нуклеотидная последовательность γ1-цепи ламинина может быть:
(a) полинуклеотидом, последовательность оснований которого представлена в SEQ ID NO: 7, или последовательностью его фрагмента;
(b) полинуклеотидом, кодирующим полипептид, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 8 или его фрагментом;
(c) полинуклеотидом, кодирующим вариант полипептида или его фрагмент, содержащий одну или более аминокислот с мутацией, выбранной из группы, состоящей из замены, добавления и делеции в аминокислотной последовательности, представленной в SEQ ID NO: 8, где вариант полипептида обладает биологической активностью;
(d) полинуклеотидом, который является аллельным или сплайс-мутантом последовательности оснований, представленной в SEQ ID NO: 7, или его фрагментом;
(e) полинуклеотидом, кодирующим видовой гомолог полипептида, состоящего из аминокислотной последовательности, представленной в SEQ ID NO: 8, или его фрагментом;
(f) полинуклеотидом, кодирующим полипептид, обладающий биологической активностью и гибридизующийся с полинуклеотидом согласно одному из (a)-(e) в строгих условиях; или
(g) полинуклеотидом, кодирующим полипептид, обладающий биологической активностью, и состоящим из последовательности оснований с идентичностью по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% с полинуклеотидом согласно одному из (a)-(e) или его комплементарной последовательностью. В этом отношении биологическая активность, как правило, относится к активности γ1-цепи ламинина. Можно сделать отсылку на Pillarainen et al., J.Biol.Chem.263 (14), 6751-6758, 1988 и патент США 6,933,273 по поводу γ1-цепей.
[0041]
Аминокислотная последовательность γ1-цепи ламинина может быть:
(a) полипептидом, состоящим из аминокислотной последовательности, представленной в SEQ ID NO: 8, или его фрагментом;
(b) полипептидом, обладающим биологической активностью и содержащим одну или более аминокислот с мутацией, выбранной из группы, состоящей из замены, добавления и делеции в аминокислотной последовательности, представленной в SEQ ID NO: 8;
(c) полипептидом, кодируемым аллельным или сплайс-мутантом последовательности оснований, представленной в SEQ ID NO: 7;
(d) полипептидом, который является видовым гомологом аминокислотной последовательности, представленной в SEQ ID NO: 8; или
(e) полипептидом, обладающим биологической активностью и имеющим аминокислотную последовательность с идентичностью по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% с полипептидом согласно одному из (a)-(d). В этом отношении биологическая активность, как правило, относится к активности γ1-цепи ламинина. Можно сделать отсылку на Pillarainen et al., J.Biol.Chem.263 (14), 6751-6758, 1988 и патент США 6,933,273 по поводу γ1-цепей.
[0042]
При использовании в настоящем описании "белок", "полипептид", "олигопептид" и "пептид" попеременно используются в одном и том же значении и относятся к полимеру из аминокислот любой длины. Такой полимер может быть линейной цепью, разветвленной цепью или циклической цепью. Аминокислоты могут быть природными, неприродными или измененными аминокислотами. Этот термин может также охватывать аминокислоты, собранные в комплекс из множества полипептидных цепей. Данный термин также охватывает природно или искусственно измененные полимеры аминокислот. Примеры такого изменения включают образование дисульфидной связи, гликозилирование, липидирование, ацетилирование, фосфорилирование и любую другую операцию или изменение (например, конъюгирование с меткой). Это определение также охватывает, например, полипептиды, включающие один или несколько аналогов аминокислот (например, включающие неприродные аминокислоты и т.п.), пептидоподобные комплексы (например, пептоид) и другие изменения, известные в уровне техники. В отношении белка изобретения (например, каждой цепи ламинина), ДНК, кодирующая каждый представляющий интерес ген цепи, может быть включена в подходящий вектор и введена в эукариотическую или прокариотическую клетку при использовании вектора экспрессии, который может экспрессироваться в соответствующем организме-хозяине, при этом соответствующие цепи экспрессируются с получением нужного белка. Клетки-хозяева, которые могут применяться для экспрессии ламинина, специально не ограничены. Соответствующие примеры включают прокариотические клетки-хозяева, такие как E. coli и Bacillus subtilis, и эукариотические клетки-хозяева, такие как дрожжи, грибы, клетки насекомых, растения и растительные клетки, а также клетки млекопитающих. Векторы, сконструированные для экспрессии представляющей интерес цепи ламинина и т.п., могут быть введены в вышеуказанные клетки-хозяева с помощью трансформации, трансфекции, конъюгирования, слияния протопластов, электропорации, технологии генной пушки, осаждения фосфатом кальция, агробактериального метода, прямой микроинъекции и т.п. Клетки, содержащие вектор, выращивают в подходящей питательной среде с целью продукции цепи ламинина и т.п., применяемой в настоящем изобретении, после чего цепь ламинина очищают из клеток или среды культивирования с получением цепи ламинина и т.п. Очистка может быть выполнена при помощи эксклюзионной хроматографии, ВЭЖХ, ионообменной хроматографии, иммуноафинной хроматографии и т.п.
[0043]
При использовании в настоящем описании "аминокислота" может быть природной или неприродной, при условии достижения цели настоящего изобретения.
[0044]
При использовании в настоящем описании "полинуклеотид", "олигонуклеотид" и "нуклеиновая кислота" попеременно используются в одном и том же значении и относятся к полимеру из нуклеотидов любой длины. Данные термины также охватывают "производное олигонуклеотида" и "производное полинуклеотида". "Производное олигонуклеотида" и "производное полинуклеотида" попеременно используются и относятся к олигонуклеотиду или полинуклеотиду, который включает производное нуклеотида или олигонуклеотида, или полинуклеотида со связью между нуклеотидами, которая отличается от природных связей. Определенные примеры таких олигонуклеотидов включают: 2'-O-метил-рибонуклеотид; производные олигонуклеотидов с фосфодиэфирной связью в олигонуклеотиде, превращенной в фосфоротиоатную связь; производные олигонуклеотидов с фосфодиэфирной связью в олигонуклеотиде, превращенной в N3'-P5'-фосфорамидатную связь; производные олигонуклеотидов с рибозой и фосфодиэфирной связью в олигонуклеотиде, превращенными в связь пептид-нуклеиновой кислоты; производные олигонуклеотидов с заменой урацила в олигонуклеотиде C-5 пропинил-урацилом; производные олигонуклеотидов с заменой урацила в олигонуклеотиде C-5 тиазол-урацилом; производные олигонуклеотидов с заменой цитозина в олигонуклеотиде C-5 пропинил-цитозином; производные олигонуклеотидов с заменой цитозина в олигонуклеотиде феноксазин-модифицированным цитозином; производные олигонуклеотидов с заменой рибозы в ДНК 2'-O-пропилрибозой; производные олигонуклеотидов с заменой рибозы в олигонуклеотиде 2'-метоксиэтоксирибозой и т.п. Если не отмечено иное, преполагается, что определенные последовательности нуклеиновых кислот охватывают последовательности, которые представлены прямо, а также их консервативно измененные варианты (например, замены вырожденных кодонов) и комплементарные последовательности. В частности, замена вырожденных кодонов может быть достигнута при получении последовательности, в которой третье положение одного или нескольких выбранных (или всех) кодонов заменено смешанным основанием и/или остатком дезоксиинозина (Batzer et al., Nucleic Acid Res.19: 5081 (1991); Ohtsuka et al., J. Biol. Chem. 260: 2605-2608 (1985); Rossolini et al., Mol. Cell. Probes 8: 91-98 (1994)). При использовании в настоящем описании "нуклеиновая кислота" попеременно используется с геном, кДНК, мРНК, олигонуклеотидом и полинуклеотидом. При использовании в настоящем описании "нуклеотид" может быть природным или неприродным.
[0045]
При использовании в настоящем описании "ген" относится к средству, который определяет генетический признак. Как правило, ген упорядочен в данном порядке на хромосоме. Ген, который определяет первичную структуру белка, называется структурным геном, а ген, который влияет на его экспрессию, называется регуляторным геном. В настоящем описании "ген" может относиться к "полинуклеотиду", "олигонуклеотиду" и "нуклеиновой кислоте".
[0046]
Аминокислоты могут быть указаны в настоящем описании либо с использованием своего общеизвестного трехбуквенного кода, либо своего однобуквенного кода, рекомендуемого Комиссией по биохимической номенклатуре IUPAC-IUB. Аналогичным образом, нуклеотиды могут быть указаны с использованием своего общеизвестного однобуквенного кода. Подобие, идентичность и гомологию аминокислотной последовательности и последовательности оснований сравнивают при вычислении с использованием параметра по умолчанию с помощью инструмента анализа последовательностей, BLAST. Например, идентичность может быть определена при использовании BLAST 2.2.26 (доступен с 30 октября 2011 года) NCBI. В настоящем описании значения идентичности обычно относятся к значению, полученному при выравнивании с параметрами по умолчанию при использовании вышеуказанного BLAST. Так или иначе, в случае получения более высокого значения при изменении параметра, значением идентичности считается наиболее высокое значение. При оценке идентичности во множестве областей, значением идентичности считается наиболее высокое значение из них. Подобие является значением, вычисленным с учетом подобной аминокислоты в дополнение к идентичности.
[0047]
При использовании в настоящем описании "полинуклеотид, который гибридизуется в строгих условиях" относится к известным условиям, обычно используемым в данной области. Следует понимать, что ламинины, кодируемые "полинуклеотидом, который гибридизуется в строгих условиях" с последовательностями нуклеиновых кислот каждого прямо раскрытого ламинина, могут также применяться в качестве ламининов, используемых в настоящем изобретении. Такой полинуклеотид может быть получен при использовании гибридизации колонии, гибридизации бляшки, саузерн-блот гибридизации и т.п. с полинуклеотидом, выбранным из полинуклеотидов настоящего изобретения, используемым в качестве зонда. В частности, это относится к полинуклеотиду, который может быть идентифицирован с помощью гибридизации при 65°C в присутствии 0,7-1,0 М NaCl, при использовании фильтра, на котором иммобилизована полученная из колонии или бляшки ДНК, с последующей промывкой фильтра при условии 65°C в SSC (натрий цитратно-солевом) растворе в 0,1-2-кратной концентрации (где в состав раствора SSC однократной концентрации входит 150 мМ хлорида натрия и 15 мМ цитрата натрия). Гибридизация может быть выполнена согласно методам, описанным в экспериментальных документах, таких как Molecular Cloning 2nd ed., Current Protocols in Molecular Biology, Supplement 1-38, DNA Cloning 1: Core Techniques, A Practical Approach, Second Edition, Oxford University Press (1995). В этом отношении последовательности, включающие только A последовательность или T последовательность, предпочтительно исключают из последовательностей, которые гибридизуются в строгих условиях. Таким образом, полипептиды (например, ламинины), применяемые в настоящем изобретении, также охватывают полипептиды, кодируемые молекулой нуклеиновой кислоты, которая гибридизуется в строгих условиях с молекулой нуклеиновой кислоты, кодирующей полипептид, прямо описанный в настоящем изобретении. Такие условия низкой строгости включают: выполнение гибридизации в течение 18-20 часов при 40°C в буфере, содержащем 35% формамида, 5×SSC, 50 мМ Трис-HCl (pH 7,5), 5 мМ ЭДТА, 0,02% ПВП, 0,02% BSA, 100 мкг/мл денатурированной ДНК спермы лосося и 10% (вес/объем) сульфата декстрана; промывку 1-5 часов при 55°C в буфере, состоящем из 2×SSC, 25 мМ Трис-HCl (pH 7,4), 5 мМ ЭДТА и 0,1% ДСН; и промывку в течение 1,5 часов при 60°C в буфере, состоящем из 2×SSC, 25 мМ Трис-HCl (pH 7,4), 5 мМ ЭДТА и 0,1% ДСН.
[0048]
Функциональные эквиваленты с одной или более аминокислотными вставками, заменами или делециями, или добавлениями к одному или обоим концам в аминокислотной последовательности могут применяться в качестве функциональных эквивалентов изобретения. В настоящем описании "одна или более аминокислотных вставок, замен или делеций, или добавлений к одному или обоим концам в аминокислотной последовательности" означают, что сделано изменение с множеством аминокислотных замен и т.п., которые могли произойти естественным образом с помощью известного технического способа, такого как сайт-направленный мутагенез, или в результате природной мутации.
[0049]
Измененные аминокислотные последовательности каждой цепи ламинина и т.п., применяемые в настоящем изобретении, могут быть последовательностями, например, с приблизительно 1-30, предпочтительно приблизительно 1-20, более предпочтительно приблизительно 1-9, еще более предпочтительно приблизительно 1-5, наиболее предпочтительно приблизительно 1-2 аминокислотными вставками, заменами или делециями, или добавлениями к одному или обоим концам. Измененные аминокислотные последовательности могут быть аминокислотными последовательностями, содержащими одну или более (предпочтительно 1 или несколько, или 1, 2, 3 или 4) консервативных замен в аминокислотной последовательности каждой цепи ламинина и т.п. В настоящем описании "консервативная замена" означает замену одного или более аминокислотных остатков другими химически подобными аминокислотными остатками, что по существу не изменяет функций белка. Соответствующие примеры включают замены данного гидрофобного остатка другим гидрофобным остатком, замены данного полярного остатка другим полярным остатком, имеющим такой же электрический заряд. Функционально подобные аминокислоты, которые могут использоваться для такой замены, известны в уровне техники для каждой аминокислоты. Определенные примеры неполярных (гидрофобных) аминокислот включают аланин, валин, изолейцин, лейцин, пролин, триптофан, фенилаланин, метионин и т.п. Определенные примеры полярных (нейтральных) аминокислот включают глицин, серин, треонин, тирозин, глутамин, аспарагин, цистеин и т.п. Определенные примеры (основных) аминокислот, имеющих положительный электрический заряд, включают аргинин, гистидин, лизин и т.п. Кроме того, примеры (кислотных) аминокислот, имеющих отрицательный электрический заряд, включают аспарагиновую кислоту, глутаминовую кислоту и т.п.
[0050]
"Средство" при использовании в настоящем описании, в широком смысле, может быть любым веществом или другими элементами (например, светом, излучением, теплом, электричеством и другими формами энергии) при условии, что может быть достигнута предполагаемая цель. Примеры такого средства включают, без ограничения, белки, полипептиды, олигопептиды, пептиды, полинуклеотиды, олигонуклеотиды, нуклеотиды, нуклеиновые кислоты (в том числе, например, молекулы ДНК, такие как кДНК и геномную ДНК, и молекулы РНК, такие как мРНК), полисахариды, олигосахариды, липиды, органические малые молекулы (например, гормоны, лиганды, передающие информацию вещества, органические малые молекулы, молекулы, синтезируемые с использованием комбинаторной химии, малые молекулы, которые могут применяться в качестве лекарственного средства (например, низкомолекулярные лиганды и т.п.)), и комплексные молекулы на их основе. Типичные примеры средства, специфического в отношении полинуклеотида, включают, без ограничения, полинуклеотиды, обладающие комплементарностью с определенной гомологией последовательности (например, 70% или большей идентичностью последовательности) с последовательностью полинуклеотида, полипептиды, такие как фактор транскрипции, который связывается с промоторной областью, и т.п. Типичные примеры средства, специфического в отношении полипептида, включают, без ограничения, антитела, специфично направленные на полипептид, или их производное или аналог (например, одноцепочечные антитела), специфические лиганды или рецепторы в случае, когда полипептид является рецептором или лигандом, субстраты в случае, когда полипептид является ферментом, и т.п.
[0051]
При использовании в настоящем описании "нормальная клеточная функция" клетки относится к функции, которой клетка обладает по своей природе, при указании определенной клетки, например, при указании эндотелиальных клеток роговицы. В случае эндотелиальных клеток роговицы примеры такой функции включают, без ограничения, способность к адаптации при пересадке роговицы, ZO-1 и Na+/K+-АТФазу (Matsubara M, Tanishima T: Wound-healing of the corneal endothelium in the monkey: a morphometric study, Jpn J Ophthalmol 1982, 26: 264-273; Matsubara M, Tanishima T: Wound-healing of corneal endothelium in monkey: an autoradiographic study, Jpn J Ophthalmol 1983, 27: 444-450; Van Horn DL, Hyndiuk RA: Endothelial wound repair in primate cornea, Exp Eye Res 1975, 21: 113-124 и Van Horn DL, Sendele DD, Seideman S, Buco PJ: Regenerative capacity of the corneal endothelium in rabbit and cat, Invest Ophthalmol Vis Sci 1977, 16: 597-613) и т.п.
[0052]
ZO-1 и Na+/K+-АТФаза могут быть оценены при наблюдении экспрессии гена на уровне нуклеиновой кислоты, например, с помощью ОТ-ПЦР или иммунологических способов. Подтверждение экспрессии Na+/K+-АТФаза и ZO-1 и/или функции на том же уровне, как у нормальных клеток, позволяет получить подтверждение того, обладают ли представляющие интерес клетки нормальной функцией.
[0053]
В случае способности к адаптации при пересадке роговицы, обычно могут проводить тесты трансплантации культивируемых клеток путем механического соскабливания эндотелия роговицы в качестве модели буллезной кератопатии на подопытных животных, таких как кролики. Впрочем, поскольку эндотелиальные клетки роговицы кроликов растут in vivo, нельзя отрицать возможность естественного заживления вследствие роста собственных эндотелиальных клеток роговицы (Matsubara M, et al., Jpn J Ophthalmol 1982, 26: 264-273; Matsubara M, et al., Jpn J Ophthalmol 1983, 27: 444-450; Van Horn DL, et al., Exp Eye Res 1975, 21: 113-124 и Van Horn DL, et al., Invest Ophthalmol Vis Sci 1977, 16: 597-613). Таким образом, для более точной оценки способности к адаптации при трансплантации, предпочтительно оценивать приживление у приматов. При оценке способности к адаптации при трансплантации людям, способность к адаптации оценивают у приматов, таких как яванские макаки, по меньшей мере через один месяц, предпочтительно по меньшей мере два месяца, более предпочтительно по меньшей мере три месяца, еще более предпочтительно по меньшей мере шесть месяцев и еще более предпочтительно, например, по меньшей мере двенадцать месяцев. Подтверждение способности к адаптации при трансплантации у приматов, таких как обезьяны, является важным, особенно в случае применения на людях.
[0054]
(Общие методики)
Молекулярные биологические методы, биохимические методы и микробиологические методы, используемые в настоящей заявке, являются известными и стандартными методами в данной области, которые описаны, например, в Sambrook J. et al. (1989). Molecular Cloning: A Laboratory Manual, Cold Spring Harbor and its 3rd Ed. (2001); Ausubel, F. M. (1987). Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience; Ausubel, F. M. (1989). Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience; Innis, M. A. (1990). PCR Protocols: A Guide to Methods and Applications, Academic Press; Ausubel, F. M. (1992). Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Greene Pub. Associates; Ausubel, F. M. (1995). Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Greene Pub. Associates; Innis, M. A. et al. (1995). PCR Strategies, Academic Press; Ausubel, F. M. (1999). Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Wiley, and annual updates; Sninsky, J. J. et al. (1999). PCR Applications: Protocols for Functional Genomics, Academic Press, Gait, M. J. (1985). Oligonucleotide Synthesis: A Practical Approach, IRL Press; Gait, M. J. (1990). Oligonucleotide Synthesis: A Practical Approach, IRL Press; Eckstein, F. (1991). Oligonucleotides and Analogues: A Practical Approach, IRL Press; Adams, R. L. et al. (1992). The Biochemistry of the Nucleic Acids, Chapman & Hall; Shabarova, Z. et al. (1994). Advanced Organic Chemistry of Nucleic Acids, Weinheim; Blackburn, G. M. et al. (1996). Nucleic Acids in Chemistry and Biology, Oxford University Press; Hermanson, G. T. (I996). Bioconjugate Techniques, Academic Press, Bessatsu Jikken Igaku [Experimental Medicine, Supplemental Volume], Idenshi Donyu Oyobi Hatsugen Kaiseki Jikken Ho [Experimental Methods for Transgenesis & Expression Analysis], Yodosha, 1997 и т.п. По эндотелиальным клеткам роговицы известны обзоры Nancy Joyce et al. {Joyce, 2004 #161} {Joyce, 2003 #7}. Поскольку длительное культивирование и субкультивирование приводит к фибробласто-подобной трансформации, как обсуждается выше, в настоящее время проводится исследование эффективных способов культивирования. Соответствующие части (которые могут быть полным документом) вышеуказанных документов включены в настоящую заявку посредством отсылки.
[0055]
(Предпочтительные варианты осуществления)
Далее описаны предпочтительные варианты осуществления. Следует понимать, что варианты осуществления являются примерами настоящего изобретения, при этом объем настоящего изобретения не должен ограничиваться такими предпочтительными вариантами осуществления. Также необходимо понимать, что специалисты в данной области могут с легкостью внести изменения или модификации в рамках настоящего изобретения, обратившись к следующим предпочтительным вариантам осуществления. Кроме того, следует понимать, что любые варианты осуществления могут быть комбинированы.
[0056]
<Терапия или профилактика>
В одном аспекте настоящего изобретения предложено терапевтическое или профилактическое средство для заболевания, нарушения или состояния роговицы, например, эндотелия роговицы, включающее по меньшей мере одно средство, выбранное из группы, состоящей из ламининов и их фрагментов. В данном аспекте настоящего изобретения также предложено по меньшей мере одно средство, выбранное из группы, состоящей из ламининов и их фрагментов, для применения в терапии или профилактике заболевания, нарушения или состояния эндотелия роговицы. В данном аспекте настоящего изобретения в качестве альтернативы предложен способ терапии или профилактики заболевания, нарушения или состояния эндотелия роговицы, включающий введение эффективного количества по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, субъекту, нуждающемуся в терапии или профилактике. В данном аспекте следует понимать, что терапевтический или профилактический эффект в отношении роговицы может быть аналогичным образом достигнут для эндотелия роговицы, а также эпителия и т.п.
[0057]
В определенном варианте осуществления настоящего изобретения предложено терапевтическое или профилактическое средство для заболевания, нарушения или состояния эндотелия роговицы, включающее по меньшей мере одно средство, выбранное из группы, состоящей из ламининов и их фрагментов.
[0058]
В одном варианте осуществления средство или ламинин, применяемые в настоящем изобретении, включают последовательность RGD. Не желая быть связанными с какой-либо теорией, последовательность RGD считается связанной с клеточной адгезией. Следует понимать, что ламинин с выраженной способностью к клеточной адгезии может применяться для терапии или профилактики заболевания, нарушения или состояния эндотелия роговицы или для его улучшения.
[0059]
В другом варианте осуществления средство или ламинин, применяемые в настоящем изобретении, включают α5-цепь. Не желая быть связанными с какой-либо теорией, это вызвано тем, что типы ламинина, включающие α5-цепь, как продемонстрировано результатами, показанными в Примерах и т.п., были способны к терапии или профилактике заболевания, нарушения или состояния эндотелия роговицы или его улучшению, при этом β- и γ-цепи, как предполагают, обладают определенной степенью гибкости при условии присутствия α5-цепи.
[0060]
В другом варианте осуществления средство или ламинин, применяемые в настоящем изобретении, включают γ1-цепь. Не желая быть связанными с какой-либо теорией, это вызвано тем, что типы ламинина, включающие γ1-цепь, как продемонстрировано результатами, показанными в Примерах и т.п., были способны к терапии или профилактике заболевания, нарушения или состояния эндотелия роговицы или его улучшению, при этом α- и β-цепи, как предполагают, обладают определенной степенью гибкости при условии присутствия γ1-цепи.
[0061]
В еще одном варианте осуществления средство или ламинин, применяемые в настоящем изобретении, включают α5-цепь и/или γ1-цепь. Не желая быть связанными с какой-либо теорией, это вызвано тем, что типы ламинина, включающие α5-цепь и/или γ1-цепь, как продемонстрировано результатами, показанными в Примерах и т.п., были способны к терапии или профилактике заболевания, нарушения, или состояния эндотелия роговицы или его улучшению, при этом продемонстрировано действие ламинина 511 и ламинина 521 таким образом, что β, как показано, обладает определенной степенью гибкости при условии, что определена α5-цепь и/или γ1-цепь.
[0062]
В одном предпочтительном варианте осуществления ламинин включает ламинин 511 и ламинин 521. Таким образом, средство согласно изобретению может быть ламинином 511, ламинином 521 или их фрагментом в данном варианте осуществления. Любой фрагмент может применяться в качестве фрагмента ламинина 511 или ламинина 521 согласно изобретению при условии, что фрагмент способен к терапии или профилактике заболевания, нарушения или состояния эндотелия роговицы или его улучшению. Примеры таких фрагментов включают, без ограничения, фрагмент ламинина 511-E8 и фрагмент ламинина 521 (SEQ ID NO: 9 и 10 (последовательность нуклеиновой кислоты и аминокислотная последовательность) и SEQ ID NO: 11 и 12 (последовательность нуклеиновой кислоты и аминокислотная последовательность), соответственно) (см. Taniguchi Y, Ido H, Sanzen N, Hayashi M, Sato-Nishiuchi R, Futaki S, Sekiguchi K. The C-terminal region of laminin beta chains modulates the integrin binding affinities of laminins. J Biol Chem. 284: 7820-7831, 2009; доступно в Nippi. Inc.). Фрагмент ламинина 511-E8 и фрагмент ламинина 521 являются фрагментами, получаемыми при обработке эластазой, и состоят из трех LG доменов (LG1-LG3) в C-концевой области α-цепи и части суперспирального домена гетеротримера. Фрагмент E8 рассматривается как соответствующий интегрин-связывающему участку молекулы гетеротримера, в котором α-цепь, β-цепь и γ-цепь ламинина собираются при посредстве суперспирального домена друг с другом. Таким образом, фрагмент полноразмерного ламинина, в котором по существу сохранен интегрин-связывающий участок, может применяться в качестве предпочтительного фрагмента. Следует понимать, что такой фрагмент может быть создан при подходящем изменении на основе информации о фрагментах ламинина 511-E8 и ламинина 521.
[0063]
В этом отношении фрагмент E8 человеческого ламинина α5β1γ1 (в настоящем описании также называемый "человеческим ламинином 511-E8") означает фрагмент человеческого ламинина α5β1γ1 (в дальнейшем также называемый "человеческим ламинином 511"), соответствующий фрагменту E8 мышиного ламинина α1β1γ1 (в дальнейшем также называемому "мышиным ламинином 111-E8"). При использовании в настоящем описании термин "фрагмент ламинина 511-E8" также обозначен как "Фрагмент ламинина 511-E8", "Ламинин 511 E8" или "Ламинин 511-E8". Фрагмент E8 ламинина был идентифицирован как фрагмент с сильной активностью клеточной адгезии из фрагментов, которые могут быть получены при расщеплении мышиного ламинина α1β1γ1 (в дальнейшем называемого "мышиным ламинином 111") эластазой (Edgar D., Timpl R., Thoenen H. The heparin-binding domain of lamininis responsible for its effects on neurite outgrowth and neuronal survival. EMBOJ., 3: 1463-1468, 1984., Goodman SL., Deutzmann R., von der Mark K. Two distinct cell-binding domains in laminin can independently promote nonneuronal cell adhesion and spreading. J. Cell Biol., 105: 589-598, 1987). В отношении человеческого ламинина 511 и человеческого ламинина 332, предполагается присутствие фрагмента, соответствующего мышиному ламинину 111-E8, после расщепления эластазой. Фрагмент человеческого ламинина 511-E8, применяемый в настоящем изобретении, должен быть лишь фрагментом человеческого ламинина 511 с такой же активностью клеточной адгезии, структурой и приближенной молекулярной массой, как мышиный ламинин 111-E8, и не должен быть продуктом расщепления эластазой человеческого ламинина 511. Способ производства фрагмента человеческого ламинина 511-E8 специально не ограничен. Примеры такого способа включают способ расщепления полноразмерного человеческого ламинина 511 протеолитическим ферментом, таким как эластаза, с целью фракционирования и очистки представляющего интерес фрагмента, способ производства в виде рекомбинантного белка и т.п. Производство в виде рекомбинантного белка предпочтителен с точки зрения объема производства, постоянства качества, стоимости производства и т.п. Рекомбинантный фрагмент человеческого ламинина 511-E8 может быть произведен при соответствующем применении известного метода генной инженерии. Способ производства рекомбинантного фрагмента человеческого ламинина 511-E8 можно осуществлять, например, при получении ДНК, кодирующей белок каждой α-цепи, β-цепи и γ-цепи фрагмента человеческого ламинина 511-E8, встраивании каждой полученной ДНК в вектор экспрессии, экспрессии полученных трех типов векторов экспрессии с помощью котрансфекции в подходящей клетке-хозяине и очистке белка, образующего тример, с помощью известного метода (например, см. Hiroyuki Ido, et al, "The requirement of the glutamic acid residue at the third position from the carboxyl termini of the laminin γ chains in integrin binding by laminins" The Journal of Biological Chemistry, 282, 11144-11154, 2007). В заявке на патент Японии 2011-78370 может быть указан определенный способ производства. Подобные фрагменты также могут быть получены при использовании человеческого ламинина 521. Это называют фрагментом ламинина 521-E8. Следует понимать, что такой фрагмент может быть получен так же, как фрагмент ламинина 511-E8, и может сохранять такую же активность, как фрагмент ламинина 511-E8. В настоящем изобретении подразумевается, что фрагмент E8 может быть аналогичным образом изготовлен для любого ламинина, содержащего α5-цепь и/или γ1-цепь. Также следует понимать, что такой фрагмент E8 может применяться аналогично полноразмерному ламинину в настоящем изобретении.
[0064]
В предпочтительном варианте осуществления ламинин включает ламинин 511 (α5β1γ1) и ламинин 521 (α5β2γ1), или средство является ламинином 511, ламинином 521, фрагментом ламинина 511-E8 или фрагментом ламинина 521-E8.
[0065]
В другом варианте осуществления фрагмент, применяемый в настоящем изобретении, обладает способностью к клеточной адгезии клетки роговицы (эндотелиальной клетки роговицы).
[0066]
В одном варианте осуществления концентрация применяемого средства (например, ламинина или его фрагмента) может быть любой концентрацией (также называемой эффективной концентрацией или терапевтически эффективной концентрацией в случае терапии, или профилактически эффективной концентрацией в случае профилактики) при условии наличия терапевтического или профилактического действия. Соответствующие примеры включают, без ограничения, приблизительно 0,1 нМ или больше, приблизительно 0,2 нМ или больше, приблизительно 0,3 нМ или больше, приблизительно 0,4 нМ или больше, приблизительно 0,5 нМ или больше, приблизительно 0,6 нМ или больше, приблизительно 0,7 нМ или больше, приблизительно 0,8 нМ или больше, приблизительно 0,9 нМ или больше, приблизительно 1 нМ или больше, приблизительно 2 нМ или больше, приблизительно 2,1 нМ или больше, приблизительно 3 нМ или больше, приблизительно 4 нМ или больше, приблизительно 5 нМ или больше, приблизительно 6 нМ или больше, приблизительно 7 нМ или больше, приблизительно 8 нМ или больше, приблизительно 9 нМ или больше, приблизительно 10 нМ или больше, приблизительно 15 нМ или больше, приблизительно 20 нМ или больше, приблизительно 21 нМ или больше, приблизительно 25 нМ или больше, приблизительно 30 нМ или больше, приблизительно 40 нМ или больше, приблизительно 50 нМ или больше, приблизительно 60 нМ или больше, приблизительно 70 нМ или больше, приблизительно 80 нМ или больше, приблизительно 90 нМ или больше, приблизительно 100 нМ или больше и т.п.
[0067]
В одном варианте осуществления участок, являющийся целью настоящего изобретения, включает эндотелий роговицы. Таким образом, заболевания, нарушения или состояния, являющиеся целью настоящего изобретения, включают, без ограничения, заболевание, нарушение или состояние эндотелия роговицы, являющиеся целью настоящего изобретения.
[0068]
В одном варианте осуществления участок глаза происходит от примата. В другом варианте осуществления участок глаза происходит от человека.
[0069]
В одном варианте осуществления глазная клетка происходит от примата. В другом варианте осуществления глазная клетка происходит от человека.
[0070]
В одном варианте осуществления эндотелий роговицы происходит от примата. В другом варианте осуществления эндотелий роговицы происходит от человека.
[0071]
В одном варианте осуществления клетка эндотелия роговицы происходит от примата. В другом варианте осуществления клетка эндотелия роговицы происходит от человека. Не желая быть связанными с какой-либо теорией, поскольку терапевтическое или профилактическое действие с применением ламинина в модели эндотелия роговицы в Примерах настоящего описания продемонстрировано не только на кроликах, но также и на приматах, специалистам в данной области будет очевидно, что аналогичное терапевтическое или профилактическое действие достигается у любого млекопитающего.
[0072]
Примеры заболеваний, нарушений или состояний эндотелия роговицы, являющихся целью настоящего изобретения, включают заболевания, которые требуют трансплантации эндотелия роговицы, такие как буллезную кератопатию, отек роговицы, бельмо роговицы, в особенности буллезную кератопатию, вызванную нарушением эндотелия роговицы вследствие дистрофии роговицы, травмы или глазной операции. Трансплантат может использоваться при их терапии. Примеры причины такой буллезной кератопатии, нарушения эндотелия роговицы и т.п. включают хирургическую операцию, а также эндотелиальную дистрофию роговицы Фукса, травму, псевдоэксфолиативный синдром, эндотелиит роговицы и т.п.
[0073]
В другом варианте осуществления примеры заболевания, нарушения или состояния эндотелия роговицы включают светобоязнь, нечеткое зрение, нарушение зрения, офтальмалгию, эпифору, гиперемию, боль, буллезную кератопатию, дискомфорт в глазу, пониженный контраст, ослепление светом, отек стромы роговицы, буллезную кератопатию и помутнение роговицы и т.п.
[0074]
Примеры субъектов терапии или профилактики заболевания, нарушения или состояния эндотелия роговицы согласно изобретению включают млекопитающих (например, людей, мышей, крыс, хомяков, кроликов, кошек, собак, коров, овец, обезьян и т.п.) и предпочтительно являются приматами (например, людьми).
[0075]
В одном варианте осуществления эндотелий роговицы, являющийся целью настоящего изобретения, включает эндотелиальный слой роговицы, Десцеметову оболочку или и то, и другое.
[0076]
В предпочтительном варианте осуществления эндотелий роговицы, являющийся целью настоящего изобретения, включает Десцеметову оболочку. Эндотелий роговицы, являющийся целью настоящего изобретения, включает эндотелий роговицы с Десцеметовой оболочкой в отделенном состоянии. Способ согласно изобретению, как обнаружили, был способен к лечению Десцеметовой оболочки в отделенном состоянии, полное удаление которой было сложным в случае стандартных методик. Способ изобретения может быть также понят как качественное улучшение с этой точки зрения.
[0077]
<Комбинированная терапия>
В другом аспекте настоящего изобретения предложено терапевтическое или профилактическое средство для заболевания, нарушения или состояния эндотелия роговицы, с применением по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов и эндотелиальной клетки роговицы. В этом отношении средство и эндотелиальная клетка роговицы изобретения могут применяться в виде смеси или применяться независимо. Таким образом, в данном аспекте настоящего изобретения предложен способ терапии или профилактики заболевания, нарушения или состояния эндотелия роговицы, включающий введение эффективного количества по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, субъекту, нуждающемуся в терапии или профилактике, и введение субъекту эндотелиальной клетки роговицы и/или ингибитора ROCK. Следует понимать, что средство (ламинин, его фрагмент и т.п.), эндотелиальная клетка роговицы, ингибитор ROCK и т.п., применяемые в способе настоящего изобретения данного аспекта, могут применяться в любой форме, раскрытой в настоящей заявке.
[0078]
Не желая быть связанными с какой-либо теорией, помутнение в роговице было устранено, толщина роговицы была уменьшена и маркеры указывали, что функция возвратилась к нормальным показателям, как продемонстрировано в Примерах, в результате применения эндотелиальной клетки роговицы и по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, в самой терапии. Кроме того, был достигнут терапевтический результат, который был ранее недосягаемым. Более того, время, требуемое для терапии, отличается тем, что оно значительно меньше, чем было продемонстрировано в случаях, когда значимый эффект проявлялся за два - три дня и достигал почти полного восстановления за одну неделю.
[0079]
В другом аспекте настоящего изобретения предложено терапевтическое или профилактическое средство для заболевания, нарушения или состояния эндотелия роговицы, с применением по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов и ингибитора ROCK (этот термин является синонимом "ингибитора Rho-киназы"). В этом отношении средство и ингибитор ROCK изобретения могут применяться в качестве смеси или применяться независимо. Следует понимать, что средство (ламинин, его фрагмент и т.п.), применяемое в способе изобретения данного аспекта, может применяться в любой форме, описанной в настоящей заявке.
[0080]
В настоящем изобретении "Rho-киназа" относится к серин/треониновой киназе, которая активируется при активации Rho. Соответствующие примеры включают ROKα (ROCK-II: Leung, T. et al., J.Biol.Chem., 270, 29051-29054, 1995), p160ROCK (ROKβ, ROCK-I: Ishizaki, T. et al., The EMBO J., 15(8), 1885-1893, 1996) и другие белки, обладающие активностью серин/треониновой киназы.
[0081]
Примеры ингибиторов ROCK включают соединения, раскрытые в следующих документах: патент США 4678783, патент Японии 3421217, Международная публикация WO 95/28387, Международная публикация WO 99/20620, Международная публикация WO 99/61403, Международная публикация WO 02/076976, Международная публикация WO 02/076977, Международная публикация WO 2002/083175, Международная публикация WO 02/100833, Международная публикация WO 03/059913, Международная публикация WO 03/062227, Международная публикация WO 2004/009555, Международная публикация WO 2004/022541, Международная публикация WO 2004/108724, Международная публикация WO 2005/003101, Международная публикация WO 2005/039564, Международная публикация WO 2005/034866, Международная публикация WO 2005/037197, Международная публикация WO 2005/037198, Международная Публикация WO 2005/035501, Международная публикация WO 2005/035503, Международная публикация WO 2005/035506, Международная публикация WO 2005/080394, Международная публикация WO 2005/103050, Международная публикация WO 2006/057270, Международная публикация WO 2007/026664 и т.п. Такие соединения могут быть получены способами, описанными в соответствующих документах, где раскрыты такие соединения. Определенные примеры соединений включают 1-(5-изохинолинсульфонил)гомопиперазин или его соль (например, фасудил (1-(5-изохинолинсульфонил)-гомопиперазин)), (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарба-моил)циклогексан ((R)-(+)-транс-(4-пиридил)-4-(1-аминоэтил)-циклогексанкарбоксамид) или его соль (например, Y-27632 ((R)-(+)-транс-(4-пиридил)-4-(1-аминоэтил)-циклогексан-карбоксамида дегидрохлорида моногидрат) и т.п.) и т.п. В случае указанных соединений также можно соответственно использовать доступный на рынке продукт (Wako Pure Chemical Industries, Ltd, Asahi Kasei Pharma Corporation и т.п.).
[0082]
В предпочтительном варианте осуществления примеры ингибитора ROCK (ингибитора Rho-киназы), применяемого в настоящем изобретении, включают, без ограничения, Y-27632 ((R)-(+)-транс-(4-пиридил)-4-(1-аминоэтил)-циклогексанкарбоксамида дегидрохлорида моногидрат) и т.п.
[0083]
Любая эндотелиальная клетка роговицы может применяться в качестве "эндотелиальной клетки роговицы", применяемой в настоящей заявке. Эндотелиальная клетка роговицы может быть выделеной или культивированной. Эндотелиальные клетки роговицы могут быть клетками, культивированными с помощью стандартного способа культивирования с методикой, разработанной авторами изобретения, или культивированными с помощью других методов. Например, могут применяться эндотелиальные клетки роговицы, культивированные с помощью метода, описанного в WO 2013/100208. Например, ингибитор фибриллизации может постоянно присутствовать во время культивирования эндотелиальных клеток роговицы, тогда как стимулятор адгезии может присутствовать в течение некоторого периода (например, 24-72 часа или 48 часов и т.п.), затем его удаляют на некоторое время, и затем он присутствует в течение некоторого периода (например, 24-72 часа или 48 часов и т.п.; этот период может каждый раз изменяться или оставаться таким же). В альтернативе эти способы культивирования могут необязательно являться способом, в котором не применяются стимуляторы адгезии. Например, следующие три типа являются соответствующими примерами.
[0084]
(Способ культивирования 1)
Y-27632 (например, доступный от WAKO, номер по каталогу: 253-00513), который является ингибитором ROCK, стимулирующим адгезию, добавляют на 48 часов с конечной концентрацией 10 мкмоль/л во время первичного культивирования и субкультивирования.
[0085]
(Способ культивирования 2)
Ингибитор ROCK Y-27632 постоянно добавляют во время культивирования с конечной концентрацией 10 мкмоль/л.
[0086]
(Способ культивирования 3)
Клетки культивируют в минимальной среде с добавкой SB431542 (например, доступной от Merck Millipore, Billerica, MA) (1 мкмоль/л) и SB203580 (1 мкмоль/л), без добавления Y-27632.
[0087]
Питательная среда, которая будет использоваться, может быть компонентом среды, который продавался и использовался, или компонентом, разработанным отдельно для эндотелия роговицы. Примеры такого компонента среды включают, без ограничения, OptiMEM, DMEM, M199, MEM и т.п. (которые доступны от INVITROGEN и т.п.). Типичные примеры включают, в случае людей, среду OPTI-MEM I с пониженным расходом добавляемой сыворотки, жидкую (номер по каталогу INVITROGEN: 31985-070)+8% FBS (BIOWEST, номер по каталогу: S1820-500)+200 мг/мл CaCl2•2H2O (номер по каталогу SIGMA: C7902-500G)+0,08% хондроитина сульфата (номер по каталогу SIGMA: C9819-5G)+20 мкг/мл аскорбиновой кислоты (номер по каталогу SIGMA: A4544-25G)+50 мкг/мл гентамицина (номер по каталогу INVITROGEN: 15710-064)+5 нг/мл EGF (номер по каталогу INVITROGEN: PHG0311), акклиматизированной для питающих клеток 3T3 в качестве минимальной среды, и SB431542 (1 мкмоль/л) и SB203580 (1 мкмоль/л).
[0088]
<1> Сбор и культивирование эндотелиальных клеток роговицы в пробирке
Эндотелиальные клетки роговицы получали из роговицы самого реципиента или подходящего донора при использовании стандартного метода. С учетом условий трансплантации в настоящем изобретении, могут быть подготовлены эндотелиальные клетки роговицы, полученные из организмов одного вида. Например, Десцеметову оболочку и слой эндотелиальных клеток ткани роговицы отделяли от стромы роговицы и затем переносили в чашку для культивирования и обрабатывали Диспазой или чем-либо подобным. В результате эндотелиальные клетки роговицы отделялись от Десцеметовой оболочки. Эндотелиальные клетки роговицы, остающиеся на Десцеметовой оболочке, могут быть сняты с помощью пипетки и т.п. После удаления Десцеметовой оболочки эндотелиальные клетки роговицы культивировали в культуральной жидкости (например, описанной в WO 2013/100208). В качестве культуры или культуральной жидкости может использоваться, например, следующее: FBS (эмбриональная бычья сыворотка) (например, BIOWEST, номер по каталогу: S1820-500), b-FGF (основной фактор роста фибробластов) (например, INVITROGEN, номер по каталогу: 13256-029), и антибиотическое вещество, такое как пенициллин или стрептомицин, может быть соответственно добавлено к коммерчески доступной DMEM (модифицированной по Дульбекко среде Игла) (например, INVITROGEN, номер по каталогу: 12320 и т.п.), с последующим добавлением компонентов нормализатора культуры, показанного в WO 2013/100208. Нанесение средства изобретения при культивировании способствует адгезии эндотелиальных клеток роговицы на поверхности емкости для культивирования, что приводит к превосходному росту. При культивировании с добавлением ламинина в культуральную жидкость предпочтительно использовать чашку для культивирования с поверхностью, покрытой коллагеном I типа, коллагеном IV типа, фибронектином, ламинином или внеклеточным матриксом бычьих эндотелиальных клеток роговицы и т.п. В альтернативе можно использовать стандартную емкость для культивирования, которая обработана коммерческим средством для нанесения покрытия, таким как FNC coating mix® (50 мл (AES-0407), ATHENA, номер по каталогу: 0407). Температурные условия для культивирования эндотелиальных клеток роговицы специально не ограничены при условии сохранения роста эндотелиальных клеток роговицы. Например, температура составляет от приблизительно 25°C до приблизительно 45°C и предпочтительно от приблизительно 30°C до приблизительно 40°C с учетом эффективности роста, и более предпочтительно приблизительно 37°C. Способ культивирования проводят в среде с концентрацией CO2 приблизительно 5-10% при увлажнении, в стандартном термостате для культивирования клеток.
[0089]
<2> Субкультивирование
После роста эндотелиальных клеток роговицы, подвергнутых культивированию, клетки можно субкультивировать. Предпочтительно субкультивирование проводят при субконфлюэнтности или конфлюэнтности. Субкультивирование может быть выполнено следующим образом. Сначала клетки обрабатывают трипсином-ЭДТА или чем-либо подобным, при этом клетки отделяются от поверхности емкости для культивирования. Затем клетки собирают. Нормализатор культуры или среду изобретения добавляют к собранным клеткам с получением суспензии клеток. Предпочтительно подвергнуть клетки центрифугированию во время или после сбора клеток. Центрифугирование позволяет получить суспензию клеток высокой плотности. Предпочтительная плотность клеток составляет приблизительно 1-2×106 клеток/мл. Примеры условий центрифугирования включают, без ограничения, от 500 об/мин (30 g) до 1000 об/мин (70 g) в течение 1-10 минут.
[0090]
Суспензию клеток сеют в емкость для культивирования и подвергают культивированию так же, как при получении вышеуказанной первичной культуры. Хотя фактор разведения после субкультивирования изменяется в зависимости от состояния клеток, он составляет приблизительно от 1:2 до 1:4 и предпочтительно составляет 1:3. Субкультивирование может быть проведено при условиях культивирования, аналогичных условиям при получении вышеуказанной первичной культуры. Время инкубирования изменяется в зависимости от состояния используемых клеток и т.п. Соответствующие примеры включают 7-30 дней. Вышеуказанное субкультивирование можно проводить много раз по мере необходимости. При использовании ингибитора ROCK или подобного клеточная адгезия в начальный период культивирования может быть повышена, что приводит к более короткому периоду культивирования.
[0091]
<Очистка эндотелиальных клеток роговицы высокой плотности при использовании центрифугирования в градиенте плотности>
В одном варианте осуществления клетки могут применяться в настоящем изобретении после очистки эндотелиальных клеток роговицы высокой плотности при использовании центрифугирования в градиенте плотности. Способ такой очистки, как правило, является следующим. Культивированные человеческие эндотелиальные клетки роговицы, смесь клеток низкой плотности и клеток высокой плотности, могут быть подвергнуты центрифугированию в градиенте плотности в течение 15 минут при 800×g при использовании подходящего средства (например, OptiPrep™). Клетки, содержащиеся в осадках и супернатанте, могут быть собраны, и подходящее количество каждой из клеток (например, 420 клеток/мм2) сеют и культивируют как группу осадков и группу супернатантов, соответственно. Морфологию исследуют с помощью фазово-контрастного микроскопа через 30 дней с целью анализа экспрессии маркера, ассоциированного с функцией эндотелия роговицы, с помощью иммуноокрашивания и измерения плотности клеток/площади клеток. Культивированные клетки после центрифугирования демонстрируют монослойную полигональную морфологию клетки и в группе осадков, и в группе супернатантов. Получали клетки, демонстрирующие экспрессию Na+/K+-АТФазы и ZO-1. Кроме того, группа осадков обычно имеет значительно более высокую плотность клеток. Срединное значение (интерквартильный диапазон) площади клеток обычно ниже в группе осадков с меньшей дисперсией. Таким образом, подразумевается, что клетки высокой плотности могут быть очищены с помощью центрифугирования в градиенте плотности и применены в настоящем изобретении.
[0092]
<Покрытие>
В одном варианте осуществления настоящего изобретения предложено терапевтическое или профилактическое средство для заболевания, нарушения или состояния эндотелия роговицы, включающее по меньшей мере одно средство, выбранное из группы, состоящей из ламининов и их фрагментов, где средство вводится в глаз и, таким образом, контактирует с тканью в глазу. Таким образом, в данном аспекте настоящего изобретения также предложен способ терапии или профилактики заболевания, нарушения или состояния эндотелия роговицы, включающий введение эффективного количества по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, субъекту, нуждающемуся в терапии или профилактике, где средство вводят в глаз субъекта, и, таким образом, оно контактирует с тканью в глазу. Следует понимать, что средство (ламинин, его фрагмент и т.п.), применяемое в способе изобретения в данном аспекте, может применяться в любой форме, раскрытой в настоящей заявке. В этом отношении подразумевается, что средство вводится в глаз и, таким образом, контактирует с тканью в глазу, что приводит к формированию покрытия (также называемого в настоящей заявке ламининовым покрытием) по меньшей мере из одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, в глазу, способствующего заживлению роговицы.
[0093]
В одном варианте осуществления концентрация средства, используемого при нанесении покрытия, может быть любой концентрацией при условии наличия терапевтического или профилактического действия (также называемой эффективной концентрацией; также называемой эффективной покрывающей концентрацией в случае покрытия). Соответствующие примеры включают, без ограничения, приблизительно 0,1 нМ или больше, приблизительно 0,2 нМ или больше, приблизительно 0,3 нМ или больше, приблизительно 0,4 нМ или больше, приблизительно 0,5 нМ или больше, приблизительно 0,6 нМ или больше, приблизительно 0,7 нМ или больше, приблизительно 0,8 нМ или больше, приблизительно 0,9 нМ или больше, приблизительно 1 нМ или больше, приблизительно 2 нМ или больше, приблизительно 2,1 нМ или больше, приблизительно 3 нМ или больше, приблизительно 4 нМ или больше, приблизительно 5 нМ или больше, приблизительно 6 нМ или больше, приблизительно 7 нМ или больше, приблизительно 8 нМ или больше, приблизительно 9 нМ или больше, приблизительно 10 нМ или больше, приблизительно 15 нМ или больше, приблизительно 20 нМ или больше, приблизительно 21 нМ или больше, приблизительно 25 нМ или больше, приблизительно 30 нМ или больше, приблизительно 40 нМ или больше, приблизительно 50 нМ или больше, приблизительно 60 нМ или больше, приблизительно 70 нМ или больше, приблизительно 80 нМ или больше, приблизительно 90 нМ или больше, приблизительно 100 нМ или больше и т.п.
[0094]
В одном предпочтительном варианте осуществления клетки роговицы, такие как эндотелиальные клетки роговицы, могут быть также введены после, одновременно или до введения средства около эндотелия роговицы, которое, таким образом, контактирует с клетками или тканью, составляющими эндотелий роговицы. Таким образом, эндотелиальные клетки роговицы могут быть введены независимо от средства в настоящем изобретении. Время введения клетки роговицы, такой как эндотелиальная клетка роговицы, предпочтительно выбирают после или одновременно с инъекцией средства в глаз и его контакта с тканью в глазу (покрытие), и более предпочтительно после введения средства в глаз, которое, таким образом, контактирует с тканью в глазу. Было установлено, что приживлению клетки роговицы, такой как эндотелиальная клетка роговицы, введенной таким образом на ткань эндотелия роговицы, способствует присутствие покрытия, значительно усиливающего терапевтическое действие.
[0095]
В другом аспекте настоящего изобретения предложено терапевтическое или профилактическое средство для заболевания, нарушения или состояния эндотелия роговицы, включающее смесь по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, и клетки роговицы, такой как эндотелиальная клетка роговицы, где по меньшей мере одно средство, выбранное из группы, состоящей из ламининов и их фрагментов, которое отличается по меньшей мере от одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, вводится в глаз и, таким образом, контактирует с тканью в глазу, предпочтительно с частью ткани, подвергаемой терапии или профилактике (например, эндотелия роговицы и т.п.). Таким образом, в данном аспекте настоящего изобретения предложен способ терапии или профилактики заболевания, нарушения или состояния эндотелия роговицы, включающий введение эффективного количества по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, субъекту, нуждающемуся в терапии или профилактике, где средство предоставляют в смеси с эндотелиальной клеткой роговицы, и по меньшей мере одно средство, выбранное из группы, состоящей из ламининов и их фрагментов, вводится в глаз и, таким образом, контактирует с тканью в глазу. В данном аспекте вышеуказанная смесь может быть введена до, одновременно или после введения по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, в глаз, и, таким образом, оно контактирует с тканью в глазу (покрытие). Время введения смеси предпочтительно выбирают после или одновременно с инъекцией средства в глаз и контакта с тканью в глазу, и более предпочтительно после введения средства в глаз, которое, таким образом, контактирует с тканью в глазу. Не желая быть связанными с какой-либо теорией, подразумевается, что такое покрытие обеспечивает среду, которая способствует образованию смеси вышеуказанного средства и клетки роговицы, такой как эндотелиальная клетка роговицы, что способствует, таким образом, заживлению роговицы. Следует понимать, что клетка роговицы, такая как эндотелиальная клетка роговицы, может применяться в любой форме, описанной в настоящей заявке, или любой известной форме.
[0096]
В предпочтительном варианте осуществления терапевтическое или профилактическое средство изобретения, в форме покрытия, дополнительно включает ингибитор ROCK. Ингибитор ROCK и средство могут быть введены одновременно, последовательно или независимо.
[0097]
Ингибитор ROCK может быть в любой форме, отдельно описанной в настоящей заявке, и предпочтительно является Y-27632 ((R)-(+)-транс-(4-пиридил)-4-(1-аминоэтил)-циклогексанкарбоксамида дигидрохлорида моногидратом) и т.п.
[0098]
В одном варианте осуществления в настоящем изобретении средство, смешанное с клеткой роговицы, такой как эндотелиальная клетка роговицы, составляет приблизительно 2,1 нМ или больше, и вводимое средство составляет приблизительно 21 нМ или больше.
(Применение)
[0099]
В другом аспекте настоящего изобретения предложено применение по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, в производстве лекарственного средства для терапии или профилактики заболевания, нарушения или состояния эндотелия роговицы. В альтернативе в данном аспекте настоящего изобретения предложено применение по меньшей мере одного средства, выбранного из группы, состоящей из ламининов и их фрагментов, для терапии или профилактики заболевания, нарушения или состояния эндотелия роговицы. Следует понимать, что средство (ламинин, его фрагмент и т.п.), применяемое в применении изобретения, может применяться в любой форме, описанной в настоящей заявке.
[0100]
Литературные источники, такие как научная литература, патенты и заявки на патенты, цитируемые в настоящем документе, включены посредством отсылки в той же степени, как если бы каждый документ был полностью прямо описан. При использовании в настоящем описании "или" используется, когда могут использоваться "по меньшей мере один или несколько" объектов, перечисленных в предложении. В случае явного описания этого как "в диапазоне из двух значений" в настоящей заявке, два значения также включены в диапазон. Описание "приблизтельно" при использовании в настоящей заявке указывает, если прямо не отмечено иное, на числовое значение, округленное до ближайшего действительного числа, или, в случае определенного значения, соответствующее значение±10%.
[0101]
Как описано выше, настоящее изобретение было раскрыто с представлением предпочтительных вариантов осуществления для облегчения понимания. Настоящее изобретение пояснено далее на основе Примеров. Вышеуказанное пояснение и следующие Примеры представлены не для ограничения настоящего изобретения, но для единственной цели иллюстрации. Таким образом, объем настоящего изобретения не ограничивается вариантами осуществления и Примерами, прямо описанными в настоящей заявке, а ограничивается только объемом формулы изобретения.
[Примеры]
[0102]
Далее раскрыты Примеры настоящего изобретения. Биологические образцы и т.п., в соответствующих случаях, обрабатывали в соответствии со стандартами, определенными Министерством здравоохранения, труда и социального обеспечения, Министерством образования, культуры, спорта, науки и технологии и т.п.
[0103]
(Экспериментальный метод: получение культивированной эндотелиальной клетки роговицы)
(Метод)* (Культивируемый)
Эндотелиальные клетки роговицы кролика (RCEC, источник клеток и способ культивирования): В случае эндотелиальных клеток роговицы кролика, используемых в следующем эксперименте, Десцеметову оболочку, включающую слой эндотелиальных клеток, отделяли от ткани роговицы и помещали в р-р 1,2 Ед/мл Диспазы I [(Sanko Pure Chemical) номер по каталогу: GD81060], растворенной в DMEM (Gibco-Invitrogen), и инокулировали при 37°C. Через один час эндотелиальные клетки роговицы отделяли, собирали с Десцеметовой оболочки с помощью пипетки и центрифугировали в течение 5 минут при 1000 об/мин для удаления супернатанта. Добавляли культуральную среду и смешивали с осажденными эндотелиальными клетками роговицы. Весь их объем сеяли на 6-луночный планшет, покрытый смесью FNC Coating Mix. Использовали среду DMEM (номер по каталогу: 12320; Gibco-Invitrogen) с добавкой 10% FBS, 50 мкг/мл гентамицина (номер по каталогу: 15710-064; Invitrogen), 10 мкг/мл Y-27632 (номер по каталогу: 6880005, Calbiochem, La Jolla, CA) и 2 нг/мл основного фактора роста фибробластов (номер по каталогу: 13256-029; bFGF; Invitrogen). Как и в случае обезьян, ранее описанные линии [Koizumi N et al., Exp Eye Res., 2012; 95: 60-67; Koizumi N et al., Invest Ophthalmol Vis Sci.. 2007; 48: 4519-4526; Okumura N et al., Am J Pathol. 2012; 181: 268-277] использовали для культивирования эндотелиальных клеток роговицы (CEC) кролика.
[0104]
Среду меняли каждые два дня. Субкультивирование проводили при 50% конфлюэнтности. Способ субкультивирования включал промывку клеток PBS без Ca2+Mg2+ (PBS-; Nissui Pharmaceutical Co., Ltd., Tokyo, Japan), добавление TrypLE™ Select (номер по каталогу: 12563; Invitrogen) и инкубирование в течение 5 минут при 37°C. После отделения и сбора клеток с планшета и центрифугирования в течение 5 минут при 1000 об/мин, добавляли культуральную среду с получением суспензии клеток. Клетки сеяли при плотности 1:2 на чашку, покрытую FNC Coating Mix.
[0105]
Их использовали в качестве культивированных эндотелиальных клеток роговицы.
[0106]
(Статистический анализ)
Статистически значимое различие (p-значение) по средним значениям при сравнении двух образцов определяли при использовании t-критерия Стьюдента. Статистически значимые различия при сравнении наборов множества образцов анализировали при использовании критерия множественного сравнения Даннетта. Значения, показанные на графике, представляют собой среднее±SE.
[0107]
(Пример 1: Эксперимент по трансплантации культивированного эндотелия роговицы в модели буллезной кератопатии на кроликах с применением фрагмента ламинина 511-E8)
В этом Примере фрагмент ламинина 511-E8 использовали в качестве ламинина, и модель буллезной кератопатии на кроликах использовали в качестве патологической модели для трансплантации культивированного эндотелия роговицы.
[0108]
(Материалы и методы)
(Используемые реактивы и т.д.)
В данном Примере использовали следующие реактивы и т.п.
*Культивированные эндотелиальные клетки роговицы кролика (также сокращенно обозначенные RCEC; подготовленные, как раскрыто выше)
*Фрагмент ламинина 511 E8 (Nippi. Inc., 382-02413)
*Модель буллезной кератопатии на кроликах (полученная, как описано ниже в (Способе трансплантации))
*Другое указано в экспериментальном методе
(Способ трансплантации)
Эксперимент, показанный на Фигуре 1, проводили следующим образом.
[0109]
Эндотелий роговицы кролика отделяли механически при использовании силиконовой иглы 20 калибра (мягкая коническая игла; Inami & Co., Ltd., Tokyo, Japan) для получения модели буллезной кератопатии. Контрольной группой являлась созданная модель, в которой не вводили клетки. В группе RCEC вводили культивированные эндотелиальные клетки роговицы кролика в переднюю камеру глаза полученной модели и выдерживали в положении лежа на животе в течение трех часов. Кроме того, в группе RCEC+E8 культивированные эндотелиальные клетки роговицы кролика вводили вместе с DMEM, содержащей фрагменты ламинина 511-E8, доведенные до концентрации 2,1 нМ, в переднюю камеру глаза полученной модели и выдерживали в положении лежа на животе в течение трех часов.
[0110]
(Измерение толщины роговицы)
Эксперимент по измерению, показанный на Фигуре 2, проводили следующим образом.
[0111]
Толщину роговицы индивида, полученную на Фигуре 1, измеряли последовательно с помощью ультразвукового пахиметра (SP 2000; Tomey, Nagoya, Japan). В случае невозможности измерения использовали значение 1200 мкм, которое является верхним предельным значением, поддающимся измерению.
[0112]
(Гистологическое исследование)
Гистологическое исследование на Фигуре 3 проводили следующим образом. При исследовании проверяли нормальную функцию с помощью иммуноокрашивания при использовании Na+/K+-АТФазы и ZO-1. Это служит для исследования функций эндотелиальных клеток роговицы, насосной функции и барьерной функции. Na+/K+-АТФаза и ZO-1 указывают на норму функций эндотелиальной клетки роговицы, насосной функции и барьерной функции, соответственно. Метод заключается в следующем.
[0113]
(Способ наблюдения клеток (гистологический анализ), такой как окрашивание)
Клетки наблюдали с помощью фазово-контрастного микроскопа. После иммобилизации клеток, ZO-1 и Na+/K+-АТФазу использовали в качестве связанных с функцией маркеров и применяли иммуноокрашивание для наблюдения с помощью флуоресцентного микроскопа. Для исследования окрашивания ткани ткань роговицы, извлеченную у кролика, фиксировали 4% формальдегидом в течение 10 минут при комнатной температуре (КТ) и инкубировали в течение 30 минут с 1% бычьим сывороточным альбумином (BSA). Чтобы определить фенотип регенерированной эндотелиальной ткани роговицы проводили иммуногистохимический анализ на ассоциированный с адгезионным контактом белок ZO-1 и ассоциированный с насосной функцией белок Na+/K+-АТФазу. ZO-1 и Na+/K+-АТФазу использовали в качестве маркеров, связанных с функциями клеток. ZO-1 и Na+/K+-АТФазу окрашивали при использовании разведения 1:200 поликлональных антител к ZO-1 (Zymed Laboratories, Inc., South San Francisco, CA) и моноклональных антител к Na+/K+-АТФазе (Upstate Biotec, Inc., Lake Placid, NY). В качестве вторичного антитела использовали разведение 1:2000 метки Alexa Fluor®488 (Life Technologies Corp., Carlsbad, CA). Ядро клеток затем окрашивали DAPI (Vector Laboratories, Inc., Burlingame, CA). Морфологию клеток дополнительно окрашивали Alexa Fluor®488-конъюгированным фаллоидином в разведении 1:400 (Life Technologies Corp., Carlsbad, CA). Затем микропрепарат наблюдали под флуоресцентным микроскопом (TCS SP2 AOBS; Leica Microsystems, Welzlar, Germany).
[0114]
(Результаты)
Результаты показаны на Фигурах 1-3. На Фигуре 1 показаны изображения переднего отрезка глаза после трансплантации культивированного эндотелия роговицы в модели буллезной кератопатии на кроликах с применением фрагмента ламинина 511-E8. Показаны изображения переднего отрезка глаза, слева направо, Контроля: контроль с механически соскобленными эндотелиальными клетками роговицы кролика, RCEC: полученная модель с введением культивированных эндотелиальных клеток роговицы кролика в переднюю камеру глаза и выдерживанием в положении лежа на животе в течение трех часов и RCEC+E8: полученная модель с введением культивированных эндотелиальных клеток роговицы кролика в переднюю камеру глаза с DMEM, содержащей фрагменты ламинина 511-E8, доведенные до концентрации 2,1 нМ, и выдерживанием в положении лежа на животе в течение трех часов. В верхнем ряду показаны изображения после одной недели, и в нижнем ряду показаны изображения после двух недель. Роговица была мутной в контрольной группе и группе RCEC, но прозрачной и восстановленной в группе RCEC+E8, что демонстрирует то, что роговица является прозрачной и восстановленной при введении клеток с ламинином.
[0115]
На Фигуре 2 показано изменение толщины роговицы после трансплантации культивированной роговицы в модели буллезной кератопатии на кроликах с применением фрагмента ламинина 511-E8. Как показано, толщина роговицы начинает значительно уменьшаться после введения. При измерении толщины роговицы с помощью ультразвукового пахиметра, роговица оставалась утолщенной, с толщиной приблизительно 1200 мкм или больше (предел измерения) в контрольной и RCEC группах, но в группе RCEC+E8 толщина роговицы уменьшалась в среднем до 637 мкм в день 7. Это понятно, так как трансплантация клеток с ламинином вызывает восстановление эндотелия роговицы и насосной и барьерной функции.
[0116]
На Фигуре 3 показаны результаты гистологического исследования после трансплантации культивированной роговицы с применением фрагмента ламинина 511-E8. Как показано на Фигуре, экспрессировался продукт гена, который экспрессируется в нормальных эндотелиальных клетках роговицы. В частности, экспрессировались Na+/K+-АТФаза, указывающая на насосную функцию, и ZO-1, указывающий на плотные контакты (барьерная функция). Кроме того, было продемонстрировано, что нормально экспрессировался N-кадгерин, указывающий на адгезионное соединение. Также при окрашивании фаллоидином было продемонстрировано, что клетки имели монослойную полигональную морфологию, которая соответствовала нормальным клеткам. На основании вышеизложенного было показано, что клетки восстанавливали нормальные функции.
[0117]
Исходя из результатов, очевидно, что введение ламинина или его фрагмента с эндотелиальной клеткой роговицы может обеспечить значимое излечение заболевания или нарушения эндотелия роговицы и восстановление нормальных функций.
[0118]
(Пример 2: Эксперимент по трансплантации культивированного эндотелия роговицы в модели буллезной кератопатии на кроликах с параллельным применением ламинина и ингибитора ROCK)
Ранее сообщали, что клеточной адгезии с субстратом способствует введение культивированных эндотелиальных клеток роговицы в переднюю камеру глаза с ингибитором ROCK. В этом отношении исследовали эффект от параллельного применения ламинина и ингибитора ROCK.
[0119]
(Материалы и методы)
(Используемый реактив и т.д.)
В этом Примере использовали следующие реактивы и т.п.
*Культивированные эндотелиальные клетки роговицы кролика (RCEC; полученные, как раскрыто выше)
*Фрагмент ламинина 511 E8 (такой же, как в Примере 1; Nippi. Inc., 382-02413)
*Y-27632 ((R)-(+)-транс-(4-пиридил)-4-(1-аминоэтил)цикло-гексанкарбоксамида дигидрохлорида моногидрат) (номер по каталогу: 6880005, Calbiochem, La Jolla, CA)
*Модель буллезной кератопатии на кроликах (такая же, как в Примере 1; способ получения описан в разделе (Способ трансплантации))
*Другое указано в экспериментальном методе
(Способ трансплантации)
Эксперимент, показанный на Фигуре 4, проводили следующим образом.
[0120]
Эндотелий роговицы кролика отделяли механически для получения модели буллезной кератопатии. Адгезию введенных клеток на субстрате через 24 часа сравнивали у индивидов, которым вводили культивированные эндотелиальные клетки роговицы кролика вместе с ингибитором ROCK Y-27632 (+) (100 мкМ) в переднюю камеру глаза, и у индивидов, которым вводили клетки вместе с фрагментами ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ). Кролика усыпляли через 24 часа. Ткань роговицы извлекали и подвергали окрашиванию фаллоидином для оценки морфологии и количества прикрепившихся клеток.
[0121]
Эксперименты по измерению, показанные на Фигурах 5-8, проводили следующим образом.
[0122]
(Способ трансплантации)
Анализы проводили на 4 группах из 4 кроликов, т.е. в группе, в которой вводили культивированные эндотелиальные клетки роговицы вместе с Y-27632 (+) (100 мкМ) после отделения эндотелиальных клеток роговицы, без отделения Десцеметовой оболочки, в группе, в которой вводили клетки вместе с фрагментами ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ) после отделения эндотелиальных клеток роговицы, без отделения Десцеметовой оболочки, в группе, в которой в модели буллезной кератопатии с отделенной Десцеметовой оболочкой вводили клетки вместе с Y-27632 (100 мкМ), и в группе, в которой в модели буллезной кератопатии с отделенной Десцеметовой оболочкой вводили клетки вместе с фрагментами ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ).
[0123]
(Измерение толщины роговицы и внутриглазного давления)
Толщину роговицы измеряли с помощью ультразвукового пахиметра (SP 2000; Tomey, Nagoya, Japan). В случае невозможности измерения использовали значение 1200 мкм, которое является верхним предельным значением, поддающимся измерению. Кроме того, внутриглазное давление измеряли с помощью Tonovet (M. E. Technica, Tokyo).
[0124]
(Гистологическое исследование)
Гистологическое исследование, показанное на Фигуре 8, проводили так же, как в Примере 1.
[0125]
(Результаты)
На Фигуре 4 показаны результаты клеточной адгезии на субстрате при трансплантации культивированного эндотелия роговицы в модели буллезной кератопатии на кроликах с параллельным применением ламинина и ингибитора ROCK, через 24 часа. Окрашивание фаллоидином продемонстрировало, что большее количество клеток прикрепилось у индивидов, которым вводили клетки вместе с фрагментами ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ). Плотность прикрепившихся клеток также была выше у индивидов, которым вводили клетки вместе с фрагментами ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ) (в среднем 717,3 клеток/мм2 в отсутствие ламинина, с увеличением до 1662,8 клеток/мм2 в присутствии ламинина). Это понятно, так как ламинин также вызывал клеточную адгезию у живого организма в случае параллельного применения ламинина с ингибитором ROCK.
[0126]
На Фигуре 5 показаны изображения переднего отрезка глаза для 4 групп, которые являются, слева направо, группой, в которой вводили культивированные эндотелиальные клетки роговицы вместе с Y-27632 (+) (100 мкМ) после отделения эндотелиальных клеток роговицы, без отделения Десцеметовой оболочки, группой, в которой вводили клетки вместе с фрагментами ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ) после отделения эндотелиальных клеток роговицы, без отделения Десцеметовой оболочки, группой, в которой в модели буллезной кератопатии с отделенной Десцеметовой оболочкой вводили клетки вместе с Y-27632 (100 мкМ), и группой, в которой в модели буллезной кератопатии с отделенной Десцеметовой оболочкой вводили клетки вместе с фрагментами ламинина 511-E8 (2,1 нМ) и Y-27632 (+) (100 мкМ).
[0127]
Фигуры 6 и 7 представляют собой графики, на которых показана толщина роговицы и внутриглазное давление, соответственно. Уменьшение толщины роговицы было задержано при отделении Десцеметовой оболочки по сравнению со случаем без отделения, но, в конечном счете, толщина роговицы уменьшилась в обоих случаях. Внутриглазное давление в течение периода наблюдения находилось в пределах нормальных значений.
[0128]
На Фигуре 8 показано гистологическое исследование после трансплантации культивированного эндотелия роговицы с применением фрагмента ламинина 511-E8. Было продемонстрировано, как показано на фигуре, что Na+/K+-АТФаза (насосная функция) и ZO-1 (барьерная функция) экспрессировались, и N-кадгерин также нормально экспрессировался во всех группах. Окрашивание фаллоидином в группе с добавлением фрагмента ламинина 511-E8 продемонстрировало, что клетки имели нормальную монослойную полигональную морфологию, которая соответствует нормальной ткани. Кроме того, насосная функция и плотный контакт нормально экспрессировались в группе с добавлением фрагмента ламинина 511-E8, тогда как адгезионное соединение также было нормальным, демонстрируя нормальную морфологию. Таким образом, было показано, что клетки в группе с добавлением фрагмента ламинина 511-E8 восстанавливали нормальные функции.
[0129]
Исходя из результатов, очевидно, что ламинин или его фрагмент можно применять с ингибитором ROCK и вводить с эндотелиальными клетками роговицы со значимым излечением заболевания или нарушения эндотелия роговицы, а также улучшением функции, что восстанавливает нормальные функции.
[0130]
(Пример 3: Пример модели буллезной кератопатии на обезьяне)
На следующем этапе модель буллезной кератопатии на обезьянах использовали в качестве примера приматов для аналогичного исследования эффекта от параллельного применения ламинина, ингибитора ROCK и трансплантации эндотелиальных клеток роговицы.
[0131]
(Материалы и методы)
(Используемые реактивы и т.д.)
В этом Примере использовали следующие реактивы и т.п.
*Культивированные эндотелиальные клетки роговицы обезьяны (полученные так же, как в способе культивирования клеток кролика, который снова описан ниже)
*Фрагмент ламинина 511 E8 (такой же, как в Примере 1; Nippi. Inc., 382-02413)
*Y-27632 ((R)-(+)-транс-(4-пиридил)-4-(1-аминоэтил)цикло-гексанкарбоксамида дигидрохлорида моногидрат) (такой же, как в Примере 2; номер по каталогу: 6880005, Calbiochem, La Jolla, CA)
*Модель буллезной кератопатии на обезьянах (полученная, как описано ниже в (Способе трансплантации))
(Способ культивирования)
Эндотелиальные клетки роговицы обезьяны (MCEC) можно получать и культивировать следующим образом. В частности, Десцеметову оболочку, включающую слой эндотелиальных клеток, отделяли от ткани роговицы и помещали в р-р 1,2 Ед/мл Диспазы I [(Sanko Pure Chemical) номер по каталогу: GD81060], растворенной в DMEM (Gibco-Invitrogen), и инокулировали при 37°C. Через один час эндотелиальные клетки роговицы отделяли, собирали с Десцеметовой оболочки с помощью пипетки и центрифугировали в течение 5 минут при 1000 об/мин для удаления супернатанта. Добавляли культуральную среду и смешивали с осажденными эндотелиальными клетками роговицы. Весь их объем сеяли на 6-луночный планшет, покрытый смесью FNC Coating Mix. Использовали среду DMEM (номер по каталогу: 12320; Gibco-Invitrogen) с добавкой 10% FBS, 50 мкг/мл гентамицина (номер по каталогу: 15710-064; Invitrogen), 10 мкг/мл Y-27632 (номер по каталогу: 6880005, Calbiochem, La Jolla, CA) и 2 нг/мл основного фактора роста фибробластов (номер по каталогу: 13256-029; bFGF; Invitrogen). Как и в случае обезьян, ранее описанные линии [Tan DT et al., Lancet., 2012; 379: 1749-1761; Koizumi N et al., Exp Eye Res., 2012; 95: 60-67; Koizumi N et al., Invest Ophthalmol Vis Sci.2007; 48: 4519-4526; Okumura N et al., Am J Pathol. 2012; 181: 268-277] использовали для культивирования эндотелиальных клеток роговицы (CEC) кролика.
[0132]
Среду меняли каждые два дня. Субкультивирование проводили при 50-80% конфлюэнтности. Способ субкультивирования включал промывку клеток PBS без Ca2+Mg2+ (PBS-; Nissui Pharmaceutical Co., Ltd., Tokyo, Japan), добавление TrypLE™ Select (номер по каталогу: 12563; Invitrogen) и инкубирование в течение 5 минут при 37°C. После отделения и сбора клеток с планшета и центрифугирования в течение 5 минут при 1000 об/мин, добавляли культуральную среду с получением суспензии клеток. Клетки сеяли при плотности 1:2 на чашку, покрытую FNC Coating Mix.
[0133]
(Способ трансплантации)
Эндотелий роговицы яванского макака отделяли механически при использовании силиконовой иглы 20 калибра (мягкая коническая игла; Inami & Co., Ltd., Tokyo, Japan) для получения модели буллезной кератопатии. На Фигуре 9 5,0×105 культивированных эндотелиальных клеток роговицы обезьяны вводили с DMEM, содержащей фрагменты ламинина 511-E8, доведенные до концентрации 2,1 нМ, в переднюю камеру глаза в модели буллезной кератопатии, которую выдерживали в положении лежа на животе в течение трех часов. На Фигуре 10 отделяли Десцеметову оболочку в полученной модели буллезной кератопатии и аналогично вводили 5,0×105 культивированных эндотелиальных клеток роговицы обезьяны с DMEM, содержащей фрагменты ламинина 511-E8, доведенные до концентрации 2,1 нМ, в переднюю камеру глаза в модели буллезной кератопатии, которую выдерживали в положении лежа на животе в течение трех часов.
[0134]
(Измерение толщины роговицы)
Толщину роговицы измеряли с помощью ультразвукового пахиметра (SP 2000; Tomey, Nagoya, Japan). В случае невозможности измерения использовали значение 1200 мкм, которое является верхним предельным значением, поддающимся измерению.
[0135]
(Результаты)
Результаты показаны на Фигурах 9-10. На Фигуре 9 показаны изображения переднего отрезка глаза после трансплантации культивированного эндотелия роговицы в модели буллезной кератопатии на обезьянах, подвергнутой параллельному применению фрагментов ламинина 511-E8. Было установлено, что ламинин или его фрагмент согласно изобретению могут излечивать буллезную кератопатию при введении с эндотелиальными клетками роговицы с ингибитором ROCK в моделях на приматах, у которых существенно ограничен рост эндотелия роговицы в живом организме. Между тем на Фигуре 10 показаны изображения переднего отрезка глаза после отделения Десцеметовой оболочки и трансплантации культивированных эндотелиальных клеток роговицы параллельно с фрагментами ламинина 511-E8 в модели буллезной кератопатии на обезьянах. Роговица не была прозрачной или восстановленной в модели, в которой эндотелиальные клетки роговицы яванского макака была соскоблены механически. Тогда как роговица была прозрачной и восстановленной в модели буллезной кератопатии на кроликах, терапевтического действия в модели на яванских макаках не наблюдали. Это предполагает возможность, что эндотелий роговицы не восстанавливается в зависимости от вида животного, поскольку адгезия пересаженных клеток к роговице уменьшается при отделении Десцеметовой оболочки. На Фигуре 11 показано изменение толщины роговицы у индивидов, подвергнутых трансплантации без отделения Десцеметовой оболочки, и у индивидов, подвергнутых трансплантации с отделением Десцеметовой оболочки, в виде графика. Толщина роговицы не уменьшалась в группе с отделением Десцеметовой оболочки, тогда как она уменьшалась без отделения Десцеметовой оболочки.
[0136]
(Пример 4: Пример терапии с покрытием ламинина у субъекта с отделенной Десцеметовой оболочкой)
На следующем этапе подтверждали улучшение эффекта от параллельного применения ламинина, ингибитора ROCK и трансплантации эндотелиальных клеток роговицы при отдельном покрытии стромы на задней стороне роговицы, обнаженной при отделении Десцеметовой оболочки, ламинином с целью подтверждения этого.
[0137]
(Материалы и методы)
(Используемые реактивы и т.д.)
В этом Примере использовали следующие реактивы и т.п.
*Культивированные эндотелиальные клетки роговицы обезьяны (полученные так же, как в Примере 3)
*Фрагмент ламинина 511-E8 (такой же, как в Примере 1; Nippi. Inc., 382-02413)
*Y-27632 ((R)-(+)-транс-(4-пиридил)-4-(1-аминоэтил)цикло-гексанкарбоксамида дигидрохлорида моногидрат) (такой же, как в Примере 2; номер по каталогу: 6880005, Calbiochem, La Jolla, CA)
(Способ)
Эндотелий роговицы яванского макака отделяли механически при использовании силиконовой иглы 20 калибра (мягкая коническая игла; Inami & Co., Ltd., Tokyo, Japan) для получения модели буллезной кератопатии. Десцеметову оболочку отделяли в полученной модели буллезной кератопатии. Фрагменты ламинина 511-E8 вводили в переднюю камеру глаза в модели буллезной кератопатии при концентрации 21 нМ и модель оставляли на один час. Строму роговицы, обнаженную в результате отделения Десцеметовой оболочки, покрывали, таким образом, у живого организма. Затем 5,0×105 культивированных эндотелиальных клеток роговицы обезьяны вводили с DMEM, содержащей фрагменты ламинина 511-E8, доведенные до концентрации 2,1 нМ, в переднюю камеру глаза модели буллезной кератопатии, которую выдерживали в положении лежа на животе в течение трех часов, как в Примере 3.
[0138]
(Результаты)
Результаты показаны на Фигуре 12. Как показано на Фигуре 12, отделение Десцеметовой оболочки, сопровождаемое введением фрагментов ламинина 511-E8 в переднюю камеру глаза в концентрации 21 нМ с покрытием стромы роговицы приводило к тому, что роговица становилась прозрачной и восстанавливалась, что не было достигнуто без покрытия (Фигура 10). Это демонстрирует, что введение ламинина с суспензией клеток может способствовать не только клеточной адгезии, но также и приживлению клеток у живого организма, с его применением в качестве средства для нанесения покрытия у живого организма.
[0139]
(Пример 5: Воздействие интегрина на адгезию эндотелиальной клетки роговицы)
В данном Примере исследовали воздействие различных интегринов на адгезию эндотелиальных клеток роговицы.
[0140]
(Материалы и методы)
(Используемые реактивы и т.д.)
В этом Примере использовали следующие реактивы и т.п.
*Контроль относится к группе без фрагментов ламинина 511-E8.
*Мышиный IgG (DAKO, X0931)
*Антитело к интегрину α3 (Millipore, MAB1952Z-20)
*Антитело к интегрину α6 (Millipore, MAB1378-20)
*Антитело к интегрину α2 (Millipore, MAB1950Z-20)
*Антитело к интегрину β1 (R&D Systems, MAB17781)
*В качестве антител против интегрина α3β1 и против интегрина α6β1 использовали комбинацию вышеуказанных антител.
*Фрагмент ламинина 511-E8 (такой же, как в Примерах выше)
(Способ)
Среду полностью удаляли из чашки для культивирования, в которой культивировали человеческие эндотелиальные клетки роговицы. Клетки два раза промывали PBS (-). После промывки добавляли фосфатный буфер и инкубировали смесь в течение 5 минут при 37°C (5% CO2). Затем PBS (-) удаляли и добавляли TrypLE™ Select (10×) (Life Technologies, A12177-01). Смесь инкубировали в течение 10 минут при 37°C (5% CO2). Затем добавляли Opti-MEMI (Life Technologies, 31985-070) для сбора клеток. После сбора клеток клетки центрифугировали в течение 3 минут при 1200 об/мин с получением суспензии клеток в OPTI-MEM I. В это время группу без фрагмента ламинина 511-E8 подготавливали в качестве контроля, а также группу с добавкой фрагментов ламинина 511-E8 до конечной концентрации 2,1 нМ. В это же время мышиный IgG и интегрин-нейтрализирующее антитело добавляли к группе с добавлением фрагмента ламинина 511-E8, доведя конечную концентрацию до 2 мкг/мл. После доведения концентрации, клетки сеяли на 96-луночный планшет в количестве 5000 клеток/лунка и инкубировали в течение 24 часов при 37°C (5% CO2). Через 24 часа после посева среду полностью удаляли и клетки два раза промывали PBS (-). После промывки добавляли среду и CellTiter-Glo Luminescent Cell Viability Assay (Promega Corporation, Madison, WI) в соотношении 1:1. Смесь встряхивали в темноте в течение 2 минут и затем оставляли стоять на 10 минут. После этого проводили измерения. 24ч, *p<0,01, критерий Даннета, n=6.
(Результаты)
Результаты показаны на Фигуре 13. Как показано, добавление фрагментов ламинина 511-E8 в среду при посеве способствовало адгезии эндотелиальных клеток роговицы для контроля, но при этом клеточная адгезия была подавлена до того же уровня, как в контроле, нейтрализующими антителами к интегрину β1.
[0141]
(Пример 6: Отношение между активацией белка, ассоциированного с клеточной адгезией, и интегрином)
На следующем этапе в данном Примере продемонстрировали, что активация ассоциированного с клеточной адгезией белка опосредована интегрином.
[0142]
(Материалы и методы)
(Реактивы и т.д.)
По существу использовали такие же условия, как в Примере 5.
*Мышиный IgG (такой же, как в Примере 5)
*Антитело к интегрину α3 (такое же, как в Примере 5)
*Антитело к интегрину α6 (такое же, как в Примере 5)
*Антитело к интегрину α2 (такое же, как в Примере 5)
*Антитело к интегрину β1 (такое же, как в Примере 5)
*Антитело к интегрину α3β1 (такое же, как в Примере 5)
*Антитело к интегрину α6β1 (такое же, как в Примере 5)
(Способ)
Среду полностью удаляли из чашки для культивирования, в которой культивировали человеческие эндотелиальные клетки роговицы. Клетки два раза промывали PBS (-). После промывки добавляли фосфатный буфер и инкубировали смесь в течение 5 минут при 37°C (5% CO2). Затем PBS (-) удаляли и добавляли TrypLE™ Select (10×) (Life Technologies, A12177-01). Смесь инкубировали в течение 10 минут при 37°C (5% CO2). Затем добавляли Opti-MEMI (Life Technologies, 31985-070) для сбора клеток. После сбора клеток клетки центрифугировали в течение 3 минут при 1200 об/мин с получением суспензии клеток в OPTI-MEM I. В это время группу без фрагмента ламинина 511-E8 подготавливали в качестве контроля, а также группу с добавкой фрагментов ламинина 511-E8 до конечной концентрации 2,1 нМ. В это же время мышиный IgG и интегрин-нейтрализирующее антитело добавляли к группе с добавлением фрагмента ламинина 511-E8, доведя конечную концентрацию до 2 мкг/мл. После доведения концентрации, клетки сеяли на 12-луночный планшет в количестве 1×105 клеток/лунка и собирали белки через три часа после посева. Вестерн-блоттинг использовали для обнаружения Phospho-FAK (Cell Signaling TECHNOLOGY, 8556S), FAK (Cell Signaling TECHNOLOGY, 3285S) и p-Паксиллина (Cell Signaling TECHNOLOGY, 2541S). Фактор разведения для каждого антитела составил 1:1000. Денситометрию проводили с количественной оценкой при помощи Image J
[0143]
(Результаты)
Результаты показаны на Фигуре 14. Как показано, p-FAK активировался фрагментами ламинина 511-E8 через три часа после посева, но подвергался супрессии до такого же уровня, как в контроле, при воздействии нейтрализирующих антител к интегрину β1. p-Паксиллин также активировался фрагментами ламинина 511-E8, но подвергался супрессии до такого же уровня, как в контроле, при воздействии нейтрализирующих антител к интегрину β1. С учетом вышеизложенного следует понимать, что E8 способствует клеточной адгезии при активации ассоциированного с адгезией белка посредством интегрина.
[0144]
С учетом Примеров 5 и 6, более раннюю клеточную адгезию в отношении клеток без фрагментов наблюдали при добавлении фрагментов ламинина 511-E8. Количество прикрепившихся клеток через 24 часа значительно увеличилось до 137,3±2,8% (p<0,01). Кроме того, активность клеточной адгезии при воздействии фрагментов ламинина 511-E8 была подавлена нейтрализирующими антителами к интегрину α3β1 и α6β1, при этом активность была на том же уровне, как у клеток без фрагмента ламинина 511-E8 (p<0,01). Фосфорилирование FAK было вызвано фрагментами ламинина 511-E8, но подавлено интегрин-нейтрализирующим антителом. Таким образом, следует понимать, что ламинин 511 связывается с интегрином и вызывает фосфорилирование FAK, вызывая адгезию эндотелиальных клеток роговицы к субстрату. Поэтому следует понимать, что ламинины, такие как фрагменты ламинина 511-E8, могут применяться в трансплантации эндотелиальных клеток роговицы.
[0145]
(Пример 7: Пример композиции: композиция смеси ламинина-клеток)
В данном Примере терапевтический раствор, содержащий средство изобретения, изготавливали следующим образом, как Пример композиции.
[0146]
Следующий раствор приготавливали стандартным методом.
Ламинин 511, ламинин 521 и/или их фрагмент (0,75 мкг/см2)
Конечная концентрация составляет 2,1 нМ
Культивированные эндотелиальные клетки роговицы
(подходящее количество клеток, приготовленных согласно Примеру 1 и т.п.)
Подходящий буфер
подходящее количество
Общее количество
100 мл
[0147]
(Пример 8: Пример композиции: композиция для нанесения ламинина)
В данном Примере раствор для нанесения покрытия, включающий средство изобретения, изготавливали следующим образом, как Пример композиции.
[0148]
Раствор для нанесения покрытия приготавливали, как показано ниже, стандартным методом.
Ламинин 511, ламинин 521 и/или их фрагмент (0,75 мкг/см2)
Конечная концентрация составляет 21 нМ
Подходящий буфер
подходящее количество
Общее количество
100 мл
Каждый компонент может быть получен, как описано в Примерах 1-4.
[0149]
Как описано выше, настоящее изобретение было проиллюстрировано с использованием предпочтительных вариантов осуществления настоящего изобретения. Впрочем, следует понимать, что объем настоящего изобретения нужно оценивать лишь в соответствии с объемом формулы изобретения. Подразумевается, что патенты, заявки на патенты и источники, цитируемые в настоящем документе, включены посредством отсылки, как если бы их содержание было прямо описано в настоящем документе. Настоящая заявка испрашивает приоритет заявки на патент Японии 2014-222947, поданной 31 октября 2014 года, все содержание которой включено в настоящую заявку посредством отсылки.
[Промышленная применимость]
[0150]
В настоящем изобретении предложена новая офтальмологическая терапия, в особенности новая терапия эндотелиальными клетками роговицы (в особенности, человеческими эндотелиальными клетками роговицы). В частности, настоящее изобретение может приводить к почти полному излечению буллезной кератопатии, таким образом, настоящее изобретение особенно применимо в фармацевтической промышленности.
[Список последовательностей в форме произвольного текста]
[0151]
SEQ ID NO: 1: последовательность нуклеиновой кислоты α5-цепи ламинина (NM_005560)
SEQ ID NO: 2: аминокислотная последовательность α5-цепи ламинина (NP_005551)
SEQ ID NO: 3: последовательность нуклеиновой кислоты β1-цепи ламинина (NM_002291)
SEQ ID NO: 4: аминокислотная последовательность β1-цепи ламинина (NP_002282)
SEQ ID NO: 5: последовательность нуклеиновой кислоты β2-цепи ламинина (NM_002292)
SEQ ID NO: 6: аминокислотная последовательность β2-цепи ламинина (NP_002283)
SEQ ID NO: 7: последовательность нуклеиновой кислоты γ1-цепи ламинина (NM_002293)
SEQ ID NO: 8: аминокислотная последовательность γ1-цепи ламинина (NP_002284)
Реферат
Изобретение относится к медицине и касается терапевтического или профилактического средства для заболевания, нарушения или состояния эндотелия роговицы, включающего по меньшей мере одно средство, выбранное из группы, состоящей из ламининов и их функциональных фрагментов, где ламинины включают α5-цепь и γ1-цепь и заболевание представляет собой буллезную кератопатию, где функциональные фрагменты обладают способностью к клеточной адгезии эндотелиальной клетки роговицы. Изобретение обеспечивает лечение и профилактику буллезной кератопатии. 19 з.п. ф-лы, 14 ил., 1 табл., 8 пр.

Комментарии