Способ культивирования микроводоросли chlorella vulgaris - RU2769152C1
Код документа: RU2769152C1
Чертежи

Описание
Изобретение относится к области биотехнологии, в частности к способам искусственного культивирования микроводоросли вида Chlorella vulgaris.
Микроводоросль Chlorella vulgaris широко применяется как в медицине, так и в животноводстве в качестве биологически активной кормовой добавки, а также в пищевой промышленности. На основе микроводоросли Chlorella возможно создание биосорбентов для очистки воды, а также микроводоросль может быть источником биотоплива.
Известен способ (патент РФ №2508398, опубл. 27.02.2014, МПК C12N 1/12, С12Р 7/64, C12R 1/89), в котором культивирование штамма микроводоросли Chlorella vulgaris Al 123 проводят в лабораторных условиях при температуре 25°С на среде ВВМ рН 6.8 в лимитированных по азоту условиях в течение 7 дней, в объеме среды 200 мл в колбах на 500 мл, при непрерывном барботировании суспензии стерильным воздухом со скоростью 200 мл/мин, при освещенности 120 Вт/м2 с фотопериодом 16 ч. Недостатком данного способа является низкий прирост биомассы.
Известен способ культивирования микроводоросли Chlorella, который предусматривает культивирование микроводоросли на жидкой питательной среде в условиях перемешивания и освещения при воздействии импульсного низкочастотного электромагнитного поля с магнитной индукцией 2000 Гс при частоте импульсов 10 Гц и длительностью 10 мкс (авт. св. №1711734, опубл. 15.02.1992, МПК A01G 33/00, C12N 13/00). К недостаткам данного способа можно отнести низкую производительность и высокую энергозатратность.
Известен способ искусственного культивирования микроводорослей и установка для его осуществления (патент РФ №2175013, опубл. 10.06.2001, МПК C12N 1/12, A01G 33/00. Культивирование микроводорослей осуществляется путем фотосинтеза при воздействии на них радиолюминесцентного излучения и тепла, возбуждаемого проникающими ядерными излучениями, при этом спектр радиолюминесцентного излучения может быть выбран резонансно совпадающим со спектром действия фотосинтеза. Искусственным источником энергии служит источник проникающих ядерных изучений, источником люминесцентного оптического излучения - радиолюминофор, тепло генерируется в среде источника ядерных излучений. В качестве источника ядерных излучений используется ядерный реактор, в том числе, реактор-размножитель с уран-ториевым циклом в виде решетки из ядерных радиолюминесцентных ламп, которые со всех сторон окружены светоприемными кюветами с суспензией культивируемых микроводорослей. Недостатками способа являются высокие энергозатраты, использование ядерного излучения, применение дорогостоящего компонента, являющегося прекурсором, радиолюминофора.
Наиболее близким аналогом является способ искусственного культивирования микроводорослей и установка для его осуществления (патент РФ №2668162, опубл. 26.09.2018, МПК C12N 1/12, A01G 33/00, С12М 1/02. С12М 1/36. Способ включает культивирование суспензии микроводоросли в фотобиореакторе, в котором суспензию микроводоросли перемешивают в течение 13-17 минут с частотой вращения 500 об/мин через каждые 120 минут. При этом культивирование осуществляют также барботирующего устройства с расходом 1,2-1,8 л/мин при температуре 26-30°С, непрерывном воздействии инфракрасного излучения 10900-11300 Лк и при поверхностной освещенности 2200-2800 Лк с фотопериодом 12 часов. Недостатком способа по прототипу является трудоемкость культивирования.
Технической задачей заявляемого изобретения является разработка высокопроизводительного, экологически чистого, безопасного способа с использованием нетрудоемких операций и минимально энергозатратной компактной установки для искусственного культивирования микроводорослей вида Chlorella vulgaris в лабораторных условиях.
Технический результат - увеличение прироста биомассы и сохранение требуемого качества, при минимальных сроках и энергетических затратах, а также простоте и доступности способа.
Технический результат достигается за счет культивирования суспензии микроводоросли Chlorella vulgaris в фотобиореакторе с клинообразным дном, при:
интенсивности освещения 5000 Л к;
перемешивании и аэрации суспензии с помошью аквариумной помпы;
оптимизации питательной среды - использование питательной среды Тамия с 0,01% АСДФ-2;
подаче углекислого газа с интенсивностью 0,05 л/мин.
Новые существенные признаки:
1. Для культивирования микроводоросли Chlorella vulgaris изготовлены фотобиореакторы с прямоугольным поперечным сечением, расстоянием между большими боковыми стенками 10 см и клинообразным дном, у которых углы между вертикальной стенкой и нисходящей частью дна, между нисходящей и восходящей частями дна и восходящей и вертикальной стенкой равны 120°; при этом длина рабочей вертикальной стенки, сопряженной с нисходящей частью дна, равна L, проекция нисходящей части дна на горизонтальное основание фотобиореактора равна 2/3 L, а проекция восходящей части дна на горизонтальное основание основание равна 1/3 L (фиг.). Экспериментально определено, что данная форма фотобиореактора обеспечивает более легкое перемешивание суспензии микроводорослей и снижает их осаждаемость. Для освещения были использованы люминесцентные лампы, спектр которых благоприятно воздействует на рост микроводорослей. Расстояние между большими стенками обеспечивает толщину столба суспензии микроводоросли 10 см, превышение которой ухудшает его проницаемость для светового потока и, соответственно, рост и развитие микроводорослей.
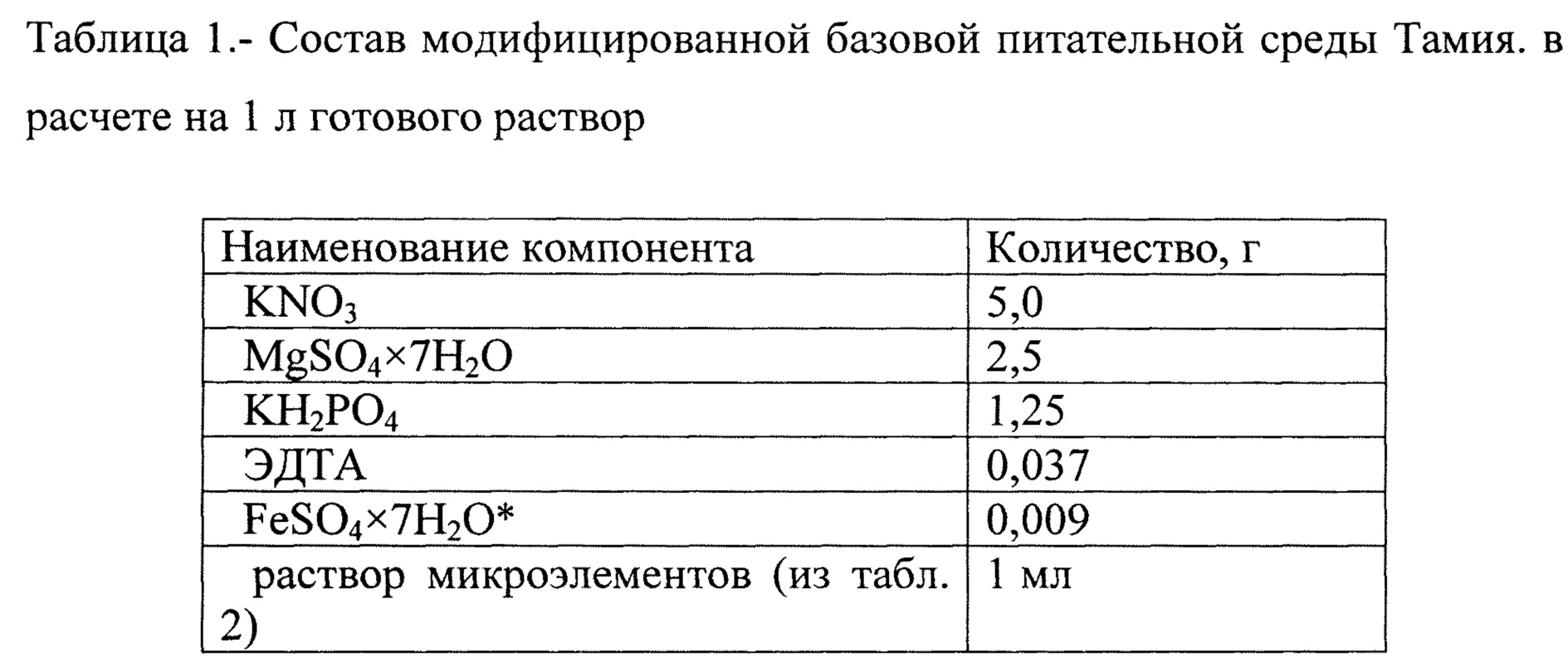
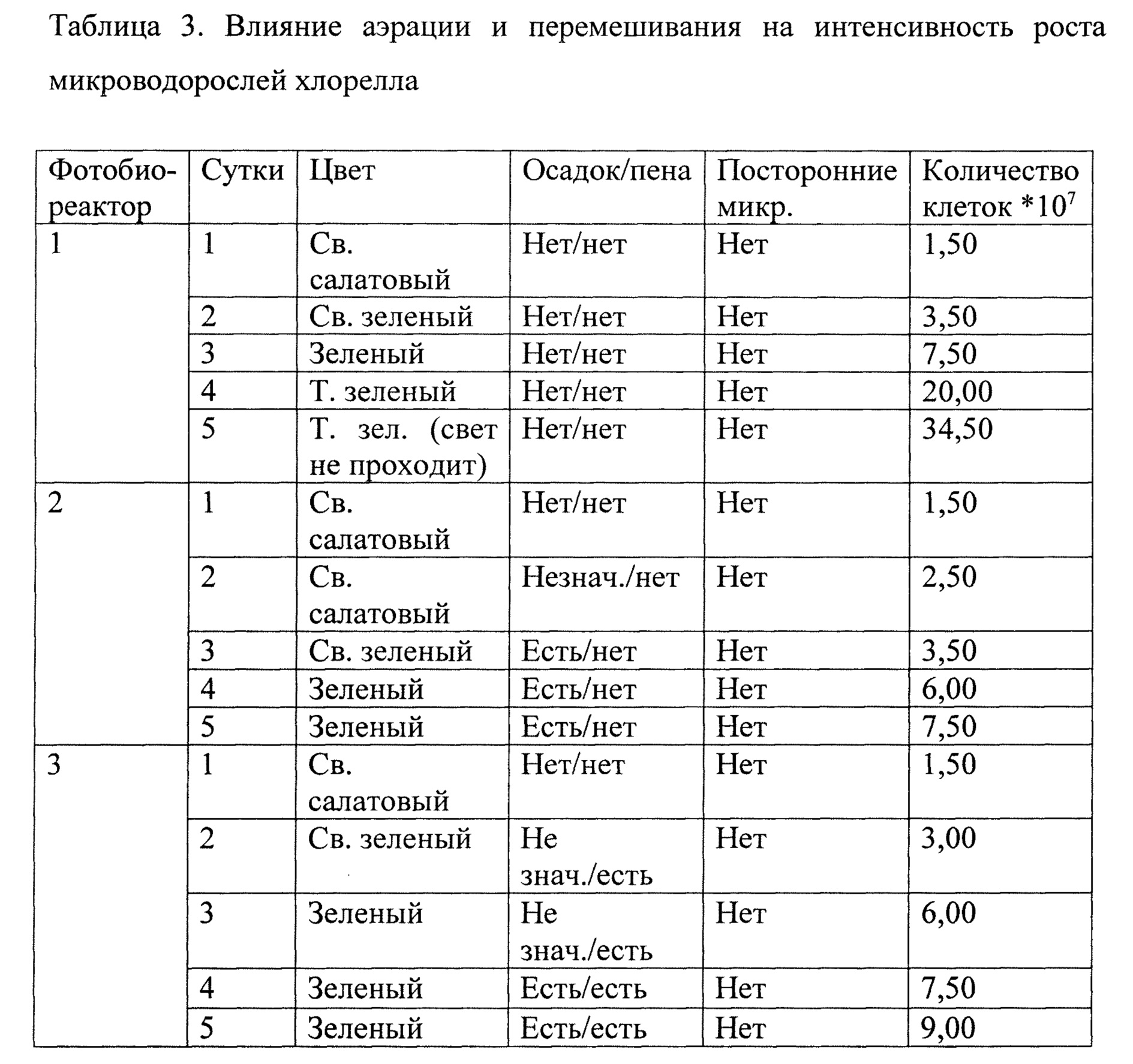
2. В лабораторных исследованиях определялось влияние трех различных вариантов перемешивания и аэрации на скорость роста микроводорослей Chlorella, при остальных равных факторах: базовая питательная среда Тамия, состав которой указан в таблицах 1 и 2, освещение 5000 Лк, температура 30°С. В первом фотобиореакторе перемешивание осуществлялось с помощью аквариумной помпы и аэрацией компрессором. Во втором фотобиоракторе перемешивание осуществлялось путем аэрации через стеклянную трубку с распылителем на конце (мелкие пузырьки воздуха увлекают за собой жидкость и благодаря форме фотобиореактора обеспечивается ее круговое вертикальное перемешивание). В третьем фотобиореакторе перемешивание осуществлялось по тому же принципу, что и во втором, только на конце стеклянной трубки отсутствовал распылитель, что обеспечивало активное перемешивание, но за счет крупного размера пузырей воздуха аэрация была менее эффективной. Результаты исследования приведены в таблице 3.
Как видно из таблицы 3, для максимальной интенсивности роста микроводорослей наиболее эффективен вариант аэрации и перемешивания аквариумной помпой и компрессором, где на 5-е сутки количество клеток в 1 мл суспензии составляло 34,50*107, по сравнении с вариантом 2 - 7,5*107 и вариантом 3 - 9,00*107
3. Оптимизация питательной среды. Определялось влияние различных вариантов питательной среды на скорость роста микроводорослей Chlorella, при остальных равных факторах (перемешивание и аэрация с помощью аквариумной помпы и компрессора, освещение люминесцентными лампами 5000 Лк, температура 30°С).
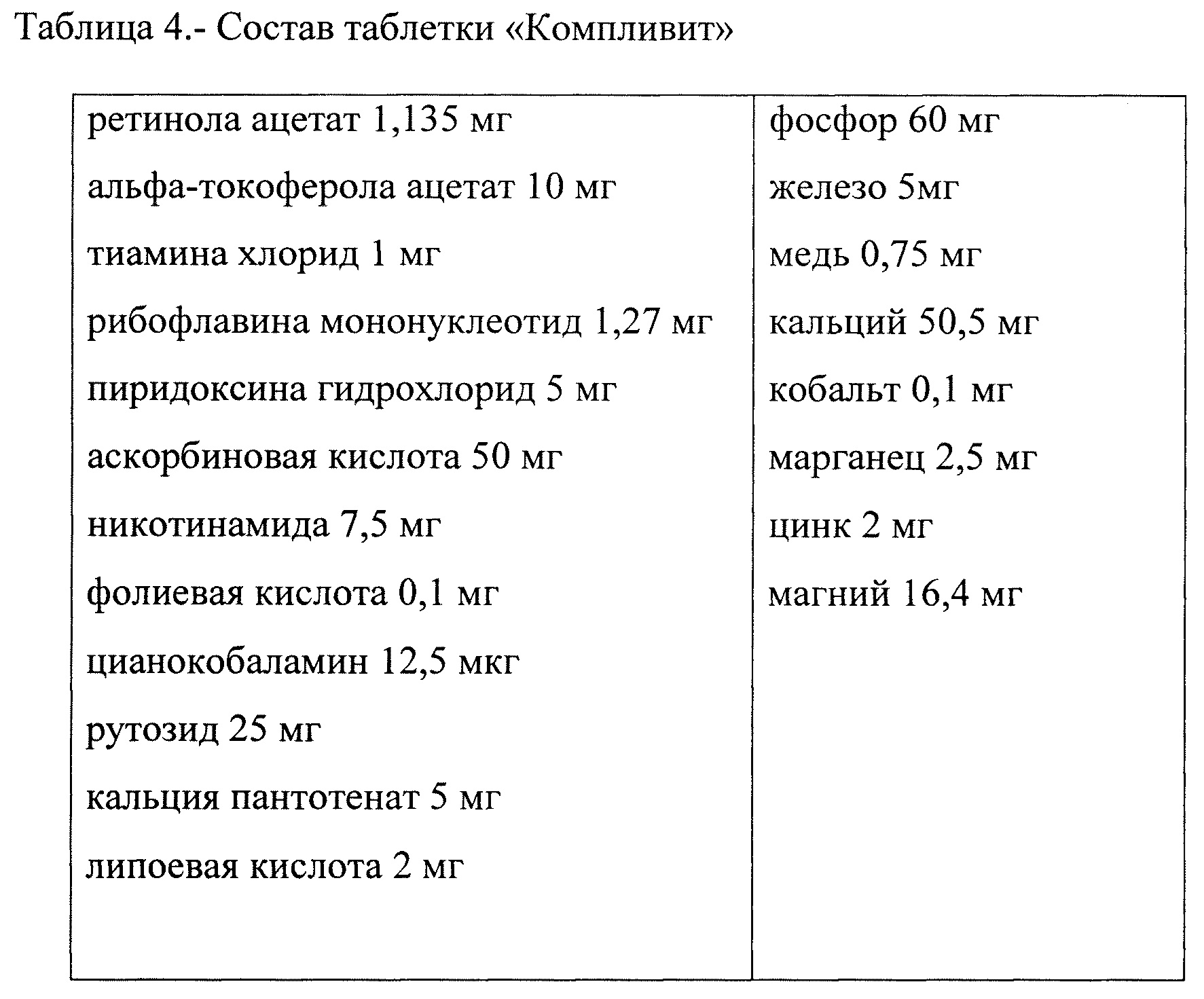
В первом фотобиореакторе использовалась питательная среда Тамия. (базовый вариант, указанный в паспорте Chlorella vulgaris штамма С-1, таблицы 1, 2). Во втором фотобиореакторе водоросли выращивались в дистиллированной воде. В третьем фотобиореакторе использовалась среда на основе витаминно-минерального комплекса «Компливит» (табл. 4).
Для использования витаминно-минерального комплекса «Компливит» в качестве питательной среды, сначала готовили концентрированный раствор из расчета одна таблетка на 1 л дистиллированной воды. Затем полученный раствор биологически активных веществ смешивали с дистиллированной водой из расчета 1 мл раствора на 1 л воды, получая нужный объем питательной среды.
В четвертом фотобиореакторе использовалась питательная среда Тамия (базовый вариант) с добавлением 0,01% АСДФ-2.
Низкомолекулярные компоненты данной фракции по своей структуре родственны продуктам клеточного обмена, что облегчает их вовлечение в метаболический процесс. Добавление АСД Ф-2 в среду Тамия обосновывали тем, что вторая фракция имеет в своем составе низшие карбоновые кислоты, их аммонийные соли, амиды и холиновые эфиры, разнообразные производные аммиака и солей аммония, холина, метилмеркаптана и других веществ с SH-группами. Компоненты АСД Ф-2 способны оказать ростстимулирующее действие, обогатить питательную среду азотом, корректировать рН. Антисептическое действие АСД Ф-2, обусловленное высоким рН, не окажет губительного действия на микроводоросли в силу высокого разведения и значительной толерантности микроводоросли Chlorella к щелочной среде.
Из таблицы 5 видно, что выше скорость роста была в третьем (среда на основе витаминно-минерального комплекса «Компливит») и четвертом фотобиореакторах (питательная среда Тамия с добавлением 0,01% АСД Ф-2).
Во втором и первом фотобиореакторах результаты до 4 дня были сравнимы между собой, на пятый день в дистиллированной воде интенсивность роста микроводоросли значительно снизилась, что обусловлено недостатком питательных веществ.
4. Известно, что количество углекислоты в процессе культивирования микроводорослей является одним из лимитирующих факторов.
С целью повышения интенсивности роста и качества биомассы в лабораторных условиях было включено в технологию выращивания микроводоросли Chlorella vulgaris обогащение суспензии углекислым газом. Были проведены исследования влияния количества углекислого газа на интенсивность роста микроводоросли при остальных равных факторах (перемешивание и аэрация с помощью аквариумной помпы и компрессора, освещение люминесцентными лампами 5000 Лк, температура 30°С, базовая питательная среда Тамия с добавлением 0,01% АСДФ-2).
С помощью стеклянной трубки с распылителем на конце, погруженным в самую нижнюю точку фотобиореактора, осуществляли подачу CO2 в трех вариантах:
в первом фотобиореакторе 0,05 л/мин;
во втором фотобиореакторе 0,1 л/мин;
в третьем фотобиореакторе 0,5 л/мин;
Критерии оценки были такие же, как и в предыдущем эксперименте: Результаты исследования приведены в таблице 6.
Из таблицы 6 видно, что существенной разницы между первым и вторым вариантом не наблюдается. В третьем варианте интенсивность роста с третьего дня отсутствовала, а цвет изменился с зеленого на бело-желтый, что свидетельствует о гибели клеток из-за избыточного количества углекислоты.
Таким образом, первый вариант с минимальным количеством углекислого газа, 0,05 л/мин является оптимальный при данной технологии выращивания.
Пример осуществления способа.
Перед началом культивирования 5-литровый фотобиореактор дезинфицируют 10% NaOH, промывают дистиллированной водой, устанавливают аквариумную помпу и трубку с распылителем для подачи CO2, заполняют готовой питательной средой Тамия с добавлением 0,01% АСД Ф-2 в объеме 4,75 л, комнатной температуры, после чего добавляют 250 мл инокулята микроводоросли Chlorella vulgaris плотностью 3×108 клеток/мл. Освещение производят люминесцентными лампами, располагая фотобиореакторы на таком расстоянии от ламп, чтобы обеспечить осввещенность в 5000 Лк. Подачу углекислого газа устанавливают в объеме 0,05 л/мин. Температура суспензии поднимается и поддерживается на уровне 30°С за счет теплового излучения люминесцентных ламп.
В процессе культивирования на третьи сутки плотность суспензии составит 4,1×108 клеток/мл, на пятые сутки 4,5×108. Клетки микроводоросли крупные, не слипшиеся, недеформированные, суспензия насыщенного зеленого цвета, что свидетельствует о высоком качестве биомассы. В это время производится отбор готовой суспензии микроводорослей в объеме 4,75 л с замещением равным объемом питательной среды, и процесс культивирования продолжается. Данный способ позволяет проводить до 5 циклов непрерывного культивирования микроводорослей Chlorella vulgaris, после чего производится чистка и дезинфекция фотобиореактора.
Готовая суспензия является ценным биологическим сырьем и может использоваться в чистом виде или как компонент биологически активных добавок в питании человека и кормлении сельскохозяйственных животных. Хранить готовую суспензию необходимо при температуре 15°С и без доступа прямых солнечных лучей.

Вспомогательные вещества: тальк, крахмал картофельный, лимонная кислота, повидон низкомолекулярный (поливинилпирролидон), кальция октадеканоат (кальция стеарат), сахароза (сахар); гипролоза (гидроксипропилцеллюлоза), макрогол (полиэтиленоксид), повидон низкомолекулярный (поливилпирролидон), титана диоксид (Е-171), тальк, аспартам.


Реферат
Изобретение относится к области биотехнологии, в частности к способам искусственного культивирования микроводоросли вида Chlorella vulgaris. Способ культивирования микроводоросли Chlorella vulgaris включает выращивание микроводоросли в фотобиореакторе на питательной среде с аэрацией и перемешиванием слоев при искусственном освещении. Микроводоросли выращивают в фотобиореакторе с клинообразным дном, на питательной среде Тамия с добавлением 0,01% АСД Ф-2, при постоянной аэрации и перемешивании суспензии с помощью аквариумной помпы и компрессора с одновременной подачей углекислого газа 0,05 л/мин, при температуре 30°С и непрерывном освещении люминесцентными лампами 5000 Лк. Фотобиореактор для выращивания микроводорослей имеет прямоугольное поперечное сечение, расстояние между большими стенками равно 10 см. Клинообразное дно имеет восходящую и нисходящую части, угол между которыми, а также углы между каждой частью и прилегающей вертикальной стенкой, равны 120° Длина рабочей вертикальной стенки, сопряженной с нисходящей частью дна, равна L, проекция нисходящей части дна на горизонтальное основание равна 2/3 L, а проекция восходящей части дна на горизонтальное основание равна 1/3 L. Такое строение дна улучшает перемешивание суспензии микроводорослей. Технический результат - увеличение прироста биомассы и сохранение требуемого качества при минимальных сроках и энергетических затратах, а также простота и доступность способа. 1 з.п. ф-лы, 1 ил., 6 табл.
Формула
Документы, цитированные в отчёте о поиске
Способ культивирования микроводоросли chlorella
