Бензофеноны как ингибиторы il-1бета и tnf-альфа, фармацевтическая композиция и способ лечения - RU2270194C2
Код документа: RU2270194C2
Описание
Настоящее изобретение относится к новому классу соединений, включающему производные гетероариламинобензофенона, которые обладают противовоспалительным действием, к фармацевтическим композициям, содержащим эти соединения, и к их применению для лечения и профилактики воспалительных заболеваний.
Ряд аминобензофенонов (например, 4-(2-амино-4-нитрофениламино)бензофенон) был описан ранее (Hussein, F.A. et al., Iraqi J.Sci., 22, 54-66 (1981)). Однако в этой публикации отсутствует описание какого-либо возможного терапевтического использования таких соединений. В WO 98/32730 описаны аминобензофеноновые ингибиторы секреции интерлейкина 1β (IL-1β) и альфа-фактора некроза опухоли (TNF-α) in vitro и показана возможность использования этих соединений для лечения воспалительных заболеваний, в патогенезе которых участвуют провоспалительные цитокины, например астмы, ревматоидного артрита, псориаза, контактного дерматита и атопического дерматита. Кроме того, соединения, описанные в WO 98/32730, были протестированы in vivo на их противовоспалительные свойства в мышиной модели хронического кожного воспаления, индуцированного 12-О-тетрадеканоилфорбол-13-ацетатом (ТРА) (De Young, L.M. et al., Agents Actions 26, 335-341 (1989); Carlson, R.P. et al., Agents Actions 17, 197-204 (1985); Alford J.G. et al., Agents Action 37, (1992); Stanley, P.L. et al., Skin Pharmacol. 4, 262-271 (1991)). В этой модели хронического кожного воспаления указанные соединения имели такую же эффективность, как и стандартное соединение гидрокортизон.
Задачей настоящего изобретения является получение других фармакологически активных производных бензофенона, которые структурно отличаются от соединений, описанных в WO 98/32730.
Было неожиданно обнаружено, что новые производные бензофенона являются сильными ингибиторами секреции интерлейкина 1β (IL-1β) и альфа-фактора некроза опухоли (TNF-α) in vitro, что позволяет их использовать для лечения и/или предупреждения воспалительных заболеваний и других состояний, патогенез которых обусловлен секрецией и регуляцией цитокинов или, более конкретно, интерлейкина 1β (IL-1β) и альфа-фактора некроза опухоли (TNF-α ). Ингибирование или негативная регуляция цитокинов, возможно, обусловлена ингибированием киназ МАР, а более конкретно киназы р38 МАР, белка, активируемого стрессом, который является важным элементом при передаче сигнала, приводящей к продуцированию провоспалительных цитокинов.
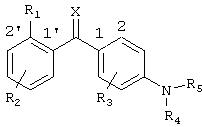
В соответствии с этим, настоящее изобретение относится к соединению общей формулы I
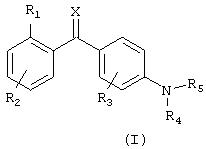
где R1 выбран из группы, состоящей из галогена, галогеналкила, гидрокси, гидроксиалкила, гидроксиалкилокси, меркапто, циано, карбокси, нитро, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, гетероциклоалкила, арила, гетероарила, аралкила, алкиларила, алкокси, аралкокси, алкилтио, алкоксикарбонила, алкилкарбонилокси, алкоксикарбонилокси, алкилсульфонилокси, алкилоксисульфонила, алкилкарбониламино, аминокарбоаминоалкила, аминосульфонила, алкилсульфониламино, алканоила, алкилкарбонила, -NR9R10 или -CONR9R10, где R9 и R10 являются одинаковыми или различными и независимо представляют водород, алкил или арил;
R2 представляет один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, галогена, галогеналкила, гидрокси, гидроксиалкила, гидроксиалкилокси, меркапто, циано, карбокси, нитро, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, гетероциклоалкила, арила, гетероарила, аралкила, алкиларила, алкокси, аралкокси, алкилтио, алкоксикарбонила, алкилкарбонилокси, алкоксикарбонилокси, алкилсульфонилокси, алкилоксисульфонила, алкилкарбониламино, аминокарбоаминоалкила, аминосульфонила, алкилсульфониламино, алканоила, алкилкарбонила, -NR9R10 или -CONR9R10, где R9 и R10 являются одинаковыми или различными и независимо представляют водород, алкил или арил;
R3 представляет один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, галогена, галогеналкила, гидрокси, гидроксиалкила, меркапто, циано, нитро, алкила, алкенила, алкинила, циклоалкила, арила, аралкила, алкиларила, алкокси, аралкокси, алкилтио, алкоксикарбонила, алкилкарбониламино, алкилкарбонилокси, алкоксикарбонилокси, алкилкарбонила, -NR9R10 или -CONR9R10, где R9 и R10 являются одинаковыми или различными и независимо представляют водород, алкил или арил;
R4 представляет водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, карбокси или арил;
R5 представляет гетероароматическую моно- или бициклическую систему, содержащую 1-4 гетероатома, за исключением триазина, где указанная циклическая система необязательно замещена водородом, галогеном, галогеналкилом, гидрокси, гидроксиалкилом, гидроксиалкилокси, меркапто, циано, карбокси, нитро, алкилом, алкенилом, алкинилом, циклоалкилом, циклоалкенилом, гетероциклоалкилом, арилом, гетероарилом, аралкилом, алкиларилом, алкокси, аралкокси, алкилтио, алкоксикарбонилом, алкилкарбонилокси, алкоксикарбонилокси, алкилсульфонилокси, алкилоксисульфонилом, алкилкарбониламино, аминокарбоаминоалкилом, аминосульфонилом, алкилсульфониламино, алканоилом, алкилкарбонилом, -NR9R10 или -CONR9R10, где R9 и R10 являются одинаковыми или различными, и независимо представляют водород, алкил или арил;
Х представляет кислород, серу, N-ОН или NR11, где R11 представляет водород или алкил;
или к его фармацевтически приемлемым солям, гидратам, сольватам или сложным эфирам, а также к N-оксидам, где атом N у R5 является окисленным.
Определения
В настоящем изобретении, термин "алкил" означает одновалентный радикал, образующийся из прямого или разветвленного алкана в результате удаления атома водорода от любого атома углерода. Алкильная цепь обычно содержит 1-10 атомов углерода, а в частности, 1-6 атомов углерода. Этот термин также включает подклассы нормального алкила (н-алкила), вторичного и третичного алкила, такого как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил и изогексил.
Термин "галогеналкил" означает определенный выше алкильный радикал, замещенный одним или несколькими атомами галогена, такими как хлор, фтор, бром или йод.
Термин "гидроксиалкил" означает определенный выше алкильный радикал, замещенный одной или несколькими гидроксигруппами.
Термин "алкокси" означает радикал формулы OR', где R' представляет определенный выше алкил, например метокси, этокси, пропокси, бутокси и т.п.
Термин "гидроксиалкокси" означает определенную выше алкоксигруппу, замещенную одной или несколькими гидроксигруппами.
Термин "алкенил" означает моно-, ди-, три- тетра- или пентаненасыщенный алкановый радикал, обычно содержащий 2-10 атомов углерода, а в частности 2-6 атомов углерода, например, этенил, пропенил, бутенил, пентенил или гексенил. Термин "алкинил" означает алкановый радикал, содержащий 1-5 тройных связей С-С, где алкановая цепь обычно содержит 2-10 атомов углерода, а в частности 2-6 атомов углерода, такой как этинил, пропинил, бутинил, пентинил или гексинил.
Термин "алкоксикарбонил" означает радикал формулы -COOR', где R' представляет определенный выше алкил, такой как метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил и т.п.
Термин "циклоалкил" означает насыщенный циклоалкановый радикал, обычно содержащий 3-10 атомов углерода, а в частности 3-8 атомов углерода, например, циклопропил, циклобутил, циклопентил или циклогексил. Термин "циклоалкенил" означает моно-, ди-, три- или тетраненасыщенные циклоалкановые радикалы, например, циклопропенил, циклобутенил, циклопентенил или циклогексенил. Термин "гетероциклоалкил" означает определенный выше циклоалкановый радикал, содержащий один или несколько гетероатомов, выбранных из О, N или S.
Термин "арил" означает радикалы карбоциклических ароматических колец, а в частности, 5- или 6-членных колец, необязательно, конденсированных бициклических колец, например, фенил или нафтил. Термин "гетероарил" означает радикалы гетероциклических ароматических колец, а в частности, 5- или 6-членных колец с 1-4 гетероатомами, выбранными из O, S и N, или необязательно конденсированных бициклических колец с 1-4 гетероатомами, например, пиридил, хинолил, изохинолил, индолил, тетразолил, тиазолил, имидазолил, пиразолил, оксазолил, изоксазолил, тиенил, пиразинил, изотиазолил, бензимидазолил и бензофуранил.
Термин "алкилкарбонилокси" означает радикал формулы R'-COO-, где R' представляет алкил, определенный выше. Термин "алкоксикарбонилокси" означает радикал формулы R'O-COO, где R' представляет алкил, определенный выше. Термин "алкилсульфонилокси" означает радикал формулы R'-(SO2)-O-, где R' представляет алкил, определенный выше. Термин "алкилсульфонил" означает радикал формулы R'O-(SO2)-, где R' представляет алкил, определенный выше.
Термин "аралкил" означает ароматическое кольцо с определенной выше алкильной боковой цепью, например, бензил. Термин "алкиларил" означает определенный выше алкильный радикал, содержащий ароматическую боковую цепь.
Термин "галоген" означает фтор, хлор, бром или йод.
Термин "алкилтио" означает радикал формулы -SR, где R представляет определенный выше алкил и включает метилтио, этилтио, н-пропилтио и 2-пропилтио.
Термин "алкиламино" означает радикал формулы -NHR или -NR2, где R представляет определенный выше алкил, имеющий 1-6 атомов углерода, и включает, например, метиламино, диметиламино, ди-(н-пропил)амино и н-бутил(этил)амино.
Термин "карбамоил" означает группу -OCONH2, -OCONHR и -OCONRR', где R и R' представляет алкил, определенный выше.
Термин "фармацевтически приемлемая соль" означает соли щелочных или щелочноземельных металлов, например соли натрия, калия, магния или кальция, а также соли серебра и соли, образованные подходящими органическими или неорганическими кислотами, такими как хлористоводородная, бромистоводородная, иодистоводородная, серная, азотная, фосфорная, уксусная, молочная, малеиновая, фталевая, лимонная, пропионовая, бензойная, глутаровая, глюконовая, метансульфоновая, салициловая, янтарная, винная, толуолсульфоновая, сульфаминовая или фумаровая кислоты.
Термин "фармацевтически приемлемые сложные эфиры" означает легко гидролизуемые сложные эфиры, такие как алканоилоксиалкиловый, аралканоилоксиалкиловый, ароилоксиалкиловый, например, ацетоксиметиловый, пивалоилоксиметиловый, бензоилоксиметиловый сложные эфиры и соответствующие 1'-оксиэтиловые производные, или алкоксикарбонилоксиалкиловые сложные эфиры, например, метоксикарбонилоксиметиловые сложные эфиры и этоксикарбонилоксиметиловые сложные эфиры и соответствующие 1'-оксиэтиловые производные, или лактониловые сложные эфиры, например, фталидиловые сложные эфиры или диалкиламиноалкиловые сложные эфиры, например, диметиламиноэтиловые сложные эфиры. Легко гидролизуемыми сложными эфирами являются in vivo-гидролизуемые сложные эфиры соединений формулы I. Такие сложные эфиры могут быть получены стандартными методами, известными специалистам, например, методом, описанным в патенте Великобритании №1490852, который вводится в настоящее изобретение в качестве ссылки.
"Киназа р38 МАР" представляет собой активируемую стрессом протеинкиназу, существующую в различных изоформах (р38α, р38β, р38β2, р38γ и р38δ). Киназа р38 МАР активируется различными стимуляторами, включая тепловой, химический, осмотический, рН- и окислительный стресс, удаление фактора роста, высокое или низкое содержание глюкозы и ультрафиолетовое излучение. р38 также стимулируется агентами, которые опосредуют начальный физиологический ответ на повреждение, инфекцию и воспаление, такими как липополисахариды (ЛПС) и провоспалительные цитокины IL-1β, TNF-α, FasL, CD40L и TGF-β. Подобно другим киназам МАР, р38 фосфорилируется киназами, включая МКК3, МЕК6 и МКК6, на треонине и тирозине в активирующей петле (Thr-Хаа-Tyr), расположенной возле АТР и сайта связывания с субстратом. В свою очередь, р38 фосфорилирует и активирует сериновые-треониновые протеинкиназы: киназу-2 МАРКАР, киназу-3 МАРКАР, киназу-5 МАРКАР, MNK-1 и MSK-1. Было установлено, что активация р38 регулирует биосинтез цитокинов в клетках многих типов, либо непосредственно путем фосфорилирования и активации факторов транскрипции, участвующих в экспрессии цитокинов, либо опосредованно путем фосфорилирования MSK-1, которая, при ее активации, активирует фактор транскрипции CREB. Было также показано, что некоторые пиридинил-имидазолы, например SB203580, которые ингибируют продуцирование IL-1β и TNF-α из ЛПС-обработанных моноцитов человека, являются ингибиторами киназы р38. Поэтому был сделан вывод, что для разработки противовоспалительных соединений, р38 представляет особый интерес как возможная мишень для этих соединений (см. J.C. Lee et al., Immunopharmacology 47, 2000, pp.185-201 и приводимые в них ссылки; P.R. Young, "Specific Inhibitors of p38 MAP kinase", Signaling Network and Cell Cycle Control: The Molecular Basis of Cancer and Other Diseases, J.S. Gutkind (Ed.), Humana Press, Inc., Totowa, N.J. и приводимые в них ссылки).
Предпочтительные варианты осуществления изобретения
В соединениях формулы I:
R1 предпочтительно представляет заместитель, выбранный из группы, состоящей из галогена, гидрокси, меркапто, трифторметила, амино, (С1-С6)алкила, (С2-С6)алкенила, (С1-С6)алкокси, (С1-С6)алкилтио, (С1-С6)алкиламино, (С1-С6 )алкоксикарбонила, циано, -CONH2, фенила и нитро, а в частности, фтора, хлора, брома, гидрокси, трифторметила, амино, (С1-С3)алкила, (С2-С3 )алкенила, (С1-С3)алкокси, (С1-С3)алкоксикарбонила, циано или -CONH2;
R2 представляет один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, галогена, гидрокси, меркапто, трифторметила, амино, (С1-С6)алкила, (С2-С6)алкенила, (С1-С6)алкокси, (С1-С6)алкилтио, (С1-С6)алкиламино, (С1-С6)алкоксикарбонила, циано, -CONH2, фенила и нитро, а в частности, водорода, фтора, хлора, брома, гидрокси, трифторметила, амино, (С1-С3)алкила, (С2-С3)алкенила, (С1-С3)алкокси, (С1-С3)алкоксикарбонила, циано или -CONH2;
R3 представляет один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, галогена, гидрокси, меркапто, трифторметила, амино, (С1-С6)алкила, (С2-С6)алкенила, (С1-С6)алкокси, (С1-С6)алкилтио, (С1-С6)алкиламино, (С1-С6)алкоксикарбонила, циано, -CONH2, фенила и нитро, а в частности, водорода, фтора, хлора, брома, гидрокси, трифторметила, амино, (С1-С3)алкила, (С2-С3)алкенила и (С1-С3)алкокси;
R4 представляет водород, (С1-С6)алкил, (С2-С6)алкенил или (С3-С6)циклоалкил или циклоалкенил, а в частности, водород, (С1-С4 )алкил или (С2-С4)алкенил;
Х представляет кислород или NH;
В моно- или бициклических гетероароматических системах, представленных R5, гетероатом(ы) может быть выбран из N, S или О. Каждое кольцо предпочтительно содержит 5 или 6 атомов. Примерами подходящих гетероароматических циклических систем являются циклические системы, выбранные из группы, состоящей из пиридила, пиразинила, пиримидинила, хинолила, изохинолила, хиназолинила, пиридазинила, фталазинила, пуринила, хиноксалила, аллопуринила, бензофуранила, изобензофуранила, бензимидазолила, бензоксазолила, бензотиенила, изобензотиенила, бензотиазолила, бензоизотиазолила, бензотриазолила, индолизинила, изоиндолила, индолила, индазолила, триазолила, оксазолила, тиадиазолила, тиенила, фурила, пирролила, имидазолила, пиразолила, тиазолила, изотиазолила или изоксазолила.
R5 предпочтительно выбран из гетероароматических циклических систем, содержащих 1 или 2 атома азота, например, колец, имеющих структуры:


Циклические системы R5 могут быть, но необязательно, окислены до соответствующих N-оксидов, примеры которых представлены ниже для изохинолиновой циклической системы:
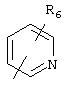

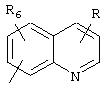
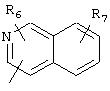

R6 и R7 представляют один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, галогена, гидрокси, меркапто, трифторметила, циано, карбокси, карбамоила, амино, нитро, (С1-С10)алкила, (С2-С10)алкенила, (С3-С8)циклоалкила или циклоалкенила, (С1 -С10)алкокси, (С1-С10)-алкилтио, (С1-С10)алкоксикарбонила и фенила. В частности, R6 и R7 представляет один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, фтора, хлора, брома, гидрокси, трифторметила, амино, (С1-С6)алкила, (С2-С6 )алкенила, (С1-С6)алкокси, (С1-С6)алкоксикарбонила, циано, карбокси и -CONH2; и

R8 представляет водород, (С1-С6)алкил, (С2-С6)алкенил или (С3-С6)циклоалкил или -циклоалкенил.
В соединениях формулы I, более предпочтительно:
R1 представляет заместитель, выбранный из группы, состоящей из фтора, хлора, брома, гидрокси, метила и метокси;
R2 представляет один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, фтора, хлора, брома, гидрокси, трифторметила, метила, этила и метокси;
R3 представляет один или несколько одинаковых или различных заместителей, выбранных из водорода, фтора, хлора, брома, гидрокси, метила и метокси;
R4 представляет водород, метил или этил;
R5 выбран из группы, состоящей из замещенных или незамещенных 3-пиридильного, 2-пиридильного, 3-хинолильного, 4-изохинолильного, 4-индолильного, 5-индолильного, 6-индолильного и 7-индолильного радикалов и соответствующих N-оксидов;
R6 и R7 представляет один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, фтора, хлора, брома, гидрокси, метила, метокси, циано и карбокси;
R8 представляет водород, (С1-С4)алкил, (С2-С6)алкенил, такой как аллил; а более предпочтительно, R8 представляет водород, метил, этил, аллил, пропил или трет-бутил; и/или
Х представляет кислород.
Фенильная группа R1, R2, R3, R6 и R7 может быть, но не обязательно, замещена, например, гидрокси, амино, нитро, циано или галогеном, а предпочтительно, фтором или хлором.
Конкретными соединениями настоящего изобретения являются
2-хлор-2'-метил-4-(4-пиридиламино)бензофенон (соединение 101),
2-хлор-2'-метил-4-(2-пиридиламино)бензофенон (соединение 102),
2-хлор-2'-метил-4-(5-нитро-2-пиридиламино)бензофенон (Соединение 103),
4-(6-амино-5-нитро-2-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 104),
6-хлор-2-(3-хлор-4-(2-метилбензоил)фениламино)изоникотиновая кислота (соединение 105),
4-(6-карбонитрил-2-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 106),
2-хлор-2'-метил-4-(3-пиридиламино)бензофенон (соединение 107),
2-хлор-4-(5,6-диамино-2-пиридиламино)-2'-метилбензофенон (соединение 108),
2-хлор-2'-метил-4-(3-нитро-2-пиридиламино)бензофенон (соединение 109),
4-(3-амино-2-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 110),
4-(5-амино-2-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 111),
2-хлор-4-(4-изохинолиламино)-2'-метилбензофенон (соединение 114),
трет-бутил-5-(3-хлор-4-(2-метилбензоил)фениламино)никотиноат (соединение 115),
2-хлор-2'-метил-4-(4-метил-3-пиридиламино)бензофенон (соединение 116),
2-хлор-2'-метил-4-(6-метил-3-пиридиламино)бензофенон (соединение 117),
4-(5-бром-3-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 118),
4-(5-карбонитрил-3-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 119),
4-(3-бром-2-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 120),
2-хлор-2'-метил-4-(8-хинолиламино)бензофенон
(соединение 121),
2-хлор-4-(6-этокси-3-пиридиламино)-2'-метилбензофенон (соединение 122),
4-(4-бром-1-изохинолиламино)-2-хлор-2'-метилбензофенон (соединение 123),
2-хлор-2'-метил-4-(2-метил-5-трифторметил-3-пиридиламино) бензофенон (соединение 124),
2-хлор-2'-метил-4-(3-хинолиламино)бензофенон (соединение 125),
2-хлор-4-(4-этокси-3-пиридиламино)-2'-метилбензофенон (соединение 126),
2-хлор-4-(2-этокси-3-пиридиламино)-2'-метилбензофенон (соединение 127),
2-хлор-2'-метил-4-(2-метил-6-хинолиламино)бензофенон (соединение 129),
2-хлор-4-(7-хлор-4-хинолиламино)-2'-метилбензофенон (соединение 130),
2-хлор-2'-метил-4-(2-хинолиламино)бензофенон (соединение 131),
2-хлор-2'-метил-4-(4-хинолиламино)бензофенон (соединение 132),
2-хлор-2'-метил-4-(1-метил-7-индолиламино)бензофенон (соединение 133),
2-хлор-2'-метил-4-(1-метил-5-индолиламино)бензофенон (соединение 134),
2-хлор-2',5'-диметил-4-(4-метил-3-пиридиламино)бензофенон (соединение 135),
2-хлор-2', 5'-диметил-4-(4-изохинолиламино)бензофенон (соединение 136),
2-хлор-4-(4-изохинолиламино)-2',4',5'-триметилбензофенон (соединение 137),
2, 3'-дихлор-2'-метил-4-(4-метил-3-пиридиламино)бензофенон (соединение 138),
2-фтор-2'-метил-4-(4-метил-3-пиридиламино)бензофенон (соединение 139),
2, 4'-дихлор-2'-метил-4-(4-метил-3-пиридиламино)бензофенон (соединение 140),
2-хлор-4'-фтор-4-(4-изохинолиламино)-2'-метилбензофенон (соединение 141),
4'-н-бутил-2-хлор-4-(4-изохинолиламино)-2'-метилбензофенон (соединение 142),
2-хлор-4-(5-изохинолиламино)-2'-метилбензофенон (соединение 143),
2-хлор-4-(4-изохинолиламино)-4'-метокси-2'-метилбензофенон (соединение 144),
2-фтор-4-(4-изохинолиламино)-4'-метокси-2'-метилбензофенон (соединение 145),
2, 4'-дихлор-2'-метил-4-(1-метил-7-индолиламино)бензофенон (соединение 146),
2-хлор-4-(1-метил-7-индолиламино)-2',4',5'-триметилбензофенон (соединение 147),
2-хлор-2', 5'-диметил-4-(1-метил-7-индолиламино)бензофенон (соединение 148),
2-хлор-4-(3-этокси-4-изохинолиламино)-2'-метилбензофенон (соединение 149),
2-хлор-4-(1-этокси-4-изохинолиламино)-2'-метилбензофенон (соединение 150),
4-(2-бензоксазолиламино)-2-хлор-2'-метилбензофенон (соединение 151),
4-(1-метил-2-бензимидазолиламино)-2-хлор-2'-метилбензофенон (соединение 152),
4-(2-бензотиазолиламино)-2-хлор-2'-метилбензофенон (соединение 153),
2-хлор-2'-метил-4-(2-пиримидиламино)бензофенон (соединение 154),
2-хлор-2'-метил-4-(7-метил-пурин-6-иламино)бензофенон
(соединение 155),
2-хлор-2'-метил-4-(2-метил-5-бензотиазолиламино)бензофенон (соединение 156),
2-хлор-2'-метил-4-(пиразин-2-иламино)бензофенон (соединение 157),
2-хлор-2'-метил-4-(5-пиримидиламино)бензофенон (соединение 158),
2-хлор-2'-метил-4-(5-нитро-2-тиазолиламино)бензофенон (соединение 159),
2-хлор-2'-метил-4-((4-метил-3-нитро-(1,2,4-триазол-5-иламино))бензофенон (соединение 160),
и их N-оксиды, где атом азота гетероциклического заместителя R5 является специфически окисленным.
Более предпочтительными соединениями являются:
2-хлор-2'-метил-4-(3-пиридиламино)бензофенон (соединение 107),
4-(3-амино-2-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 110),
2-хлор-4-(4-изохинолиламино)-2'-метилбензофенон (соединение 114),
2-хлор-2'-метил-4-(4-метил-3-пиридиламино)бензофенон (соединение 116),
2-хлор-2'-метил-4-(6-метил-3-пиридиламино)бензофенон (соединение 117),
4-(5-бром-3-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 118),
2-хлор-2'-метил-4-(8-хинолиламино)бензофенон (соединение 121),
2-хлор-4-(6-этокси-3-пиридиламино)-2'-метилбензофенон
(соединение 122),
2-хлор-2'-метил-4-(3-хинолиламино)бензофенон (соединение 125),
2-хлор-4-(4-этокси-3-пиридиламино)-2'-метилбензофенон (соединение 126),
2-хлор-2'-метил-4-(1-метил-7-индолиламино)бензофенон (соединение 133),
2-хлор-2'-метил-4-(1-метил-5-индолиламино)бензофенон (соединение 134),
2-хлор-2',5'-диметил-4-(4-метил-3-пиридиламино)бензофенон (соединение 135),
2-хлор-2', 5'-диметил-4-(4-изохинолиламино)бензофенон (соединение 136),
2-хлор-4-(4-изохинолиламино)-2',4',5'-триметилбензофенон (соединение 137),
2-фтор-2'-метил-4-(4-метил-3-пиридиламино)бензофенон (соединение 139),
2,4'-дихлор-2'-метил-4-(4-метил-3-пиридиламино)бензофенон (соединение 140),
2-хлор-4'-фтор-4-(4-изохинолиламино)-2'-метилбензофенон (соединение 141),
2-хлор-4-(5-изохинолиламино)-2'-метилбензофенон (соединение 143),
2-хлор-4-(4-изохинолиламино)-4'-метокси-2'-метилбензофенон (соединение 144),
2-фтор-4-(4-изохинолиламино)-4'-метокси-2'-метилбензофенон (соединение 145),
2-хлор-4-(3-этокси-4-изохинолиламино)-2'-метилбензофенон
(соединение 149),
2-хлор-4-(1-этокси-4-изохинолиламино)-2'-метилбензофенон (соединение 150),
и N-оксиды:
2-хлор-2'-метил-4((2-пиридил-N-оксид)амино)бензофенон (соединение 112),
2-хлор-2'-метил-4((3-пиридил-N-оксид)амино)бензофенон (соединение 113),
2-хлор-4((4-изохинолил-N-оксид)амино)-2'-метилбензофенон (соединение 128).
Также, в основном, предпочтительными являются соединения формулы Ia, где Х=S и где R1, R2, R3, R4, R5, R6, R7 и R8 определены выше, и соединения формулы Ib, где Х=N-OH и где R1, R2, R3, R4, R5, R6, R7 и R8 определены выше.


Конкретными соединениями формулы Ia являются:
2-хлор-2'-метил-4-(4-пиридиламино)тиобензофенон,
2-хлор-2'-метил-4-(2-пиридиламино)тиобензофенон,
2-хлор-2'-метил-4-(5-нитро-2-пиридиламино)тиобензофенон,
4-(6-амино-5-нитро-2-пиридиламино)-2-хлор-2'-метил(тиобензофенон),
6-хлор-2-(3-хлор-4-(2-метилбензоил)фениламино)изоникотиновая кислота,
4-(6-карбонитрил-2-пиридиламино)-2-хлор-2'-метил(тиобензофенон),
2-хлор-2'-метил-4-(3-пиридиламино)тиобензофенон,
2-хлор-4-(5, 6-диамино-2-пиридиламино)-2'-метил(тиобензофенон),
2-хлор-2'-метил-4-(3-нитро-2-пиридиламино)тиобензофенон,
4-(3-амино-2-пиридиламино)-2-хлор-2'-метил(тиобензофенон),
4-(5-амино-2-пиридиламино)-2-хлор-2'-метил(тиобензофенон),
2-хлор-4-(4-изохинолиламино)-2'-метил(тиобензофенон),
трет-бутил-5-(3-хлор-4-(2-метилбензоил)фениламино)никотиноат,
2-хлор-2'-метил-4-(4-метил-3-пиридиламино)тиобензофенон,
2-хлор-2'-метил-4-(6-метил-3-пиридиламино)тиобензофенон,
4-(5-бром-3-пиридиламино)-2-хлор-2'-метил(тиобензофенон),
4-(5-карбонитрил-3-пиридиламино)-2-хлор-2'-метил (тиобензофенон),
4-(3-бром-2-пиридиламино)-2-хлор-2'-метил(тиобензофенон),
2-хлор-2'-метил-4-(8-хинолиламино)тиобензофенон,
2-хлор-4-(6-этокси-3-пиридиламино)-2'-метил(тиобензофенон),
4-(4-бром-1-изохинолиламино)-2-хлор-2'-метил(тиобензофенон),
2-хлор-2'-метил-4-(2-метил-5-трифторметил-3-пиридиламино)тиобензофенон,
2-хлор-2'-метил-4-(3-хинолиламино)тиобензофенон,
2-хлор-4-(4-этокси-3-пиридиламино)-2'-метил(тиобензофенон),
2-хлор-4-(2-этокси-3-пиридиламино)-2'-метил(тиобензофенон),
2-хлор-2'-метил-4-(2-метил-6-хинолиламино)тиобензофенон,
2-хлор-2'-метил-4-(2-хинолиламино)тиобензофенон,
2-хлор-4-(7-хлор-4-хинолиламино)-2'-метил(тиобензофенон),
2-хлор-2'-метил-4-(4-хинолиламино)тиобензофенон,
2-хлор-2'-метил-4-(1-метил-7-индолиламино)тиобензофенон,
2-хлор-2'-метил-4-(1-метил-5-индолиламино)тиобензофенон,
2-хлор-2',5'-диметил-4-(4-метил-3-пиридиламино)тиобензофенон,
2-хлор-2', 5'-диметил-4-(4-изохинолиламино)тиобензофенон,
2-хлор-4-(4-изохинолиламино)-2',4',5'-триметил(тиобензофенон),
2, 3'-дихлор-2'-метил-4-(4-метил-3-пиридиламино)тиобензофенон,
2-фтор-2'-метил-4-(4-метил-3-пиридиламино)тиобензофенон,
2, 4'-дихлор-2'-метил-4-(4-метил-3-пиридиламино)тиобензофенон,
2-хлор-4'-фтор-4-(4-изохинолиламино)-2'-метил(тиобензофенон),
4'-н-бутил-2-хлор-4-(4-изохинолиламино)-2'-метил (тиобензофенон),
2-хлор-4-(5-изохинолиламино)-2'-метил(тиобензофенон),
2-хлор-4-(4-изохинолиламино)-4'-метокси-2'-метил (тиобензофенон),
2-фтор-4-(4-изохинолиламино)-4'-метокси-2'-метил (тиобензофенон),
2,4'-дихлор-2'-метил-4-(1-метил-7-индолиламино)тиобензофенон,
2-хлор-4-(1-метил-7-индолиламино)-2',4',5'-триметил (тиобензофенон),
2-хлор-2',5'-диметил-4-(1-метил-7-индолиламино)тиобензофенон,
2-хлор-4-(3-этокси-4-изохинолиламино)-2'-метил(тиобензофенон),
2-хлор-4-(1-этокси-4-изохинолиламино)-2'-метил(тиобензофенон),
4-(2-бензоксазолиламино)-2-хлор-2'-метил(тиобензофенон),
4-(1-метил-2-бензимидазолиламино)-2-хлор-2'-метил (тиобензофенон),
4-(2-бензотиазолиламино)-2-хлор-2'-метил(тиобензофенон),
2-хлор-2'-метил-4-(2-пиримидиламино)тиобензофенон,
2-хлор-2'-метил-4-(7-метил-пурин-6-иламино)тиобензофенон,
2-хлор-2'-метил-4-(2-метил-5-бензотиазолиламино)тиобензофенон,
2-хлор-2'-метил-4-(пиразин-2-иламино)тиобензофенон,
2-хлор-2'-метил-4-(5-пиримидиламино)тиобензофенон
и их соли, образованные фармацевтически приемлемыми кислотами, гидраты и сольваты.
Конкретными соединениями формулы Ib являются:
оксим 2-хлор-2'-метил-4-(4-пиридиламино)бензофенона,
оксим 2-хлор-2'-метил-4-(2-пиридиламино)бензофенона,
оксим 2-хлор-2'-метил-4-(5-нитро-2-пиридиламино)бензофенона,
оксим 4-(6-амино-5-нитро-2-пиридиламино)-2-хлор-2'-метилбензофенона,
6-хлор-2-((3-хлор-4-((гидроксиимино)(2-метилфенил)метил)) фениламино)изоникотиновая кислота,
оксим 4-(6-карбонитрил-2-пиридиламино)-2-хлор-2'-метилбензофенона,
оксим 2-хлор-2'-метил-4-(3-пиридиламино)бензофенона,
оксим 2-хлор-4-(5,6-диамино-2-пиридиламино)-2'-метилбензофенона,
оксим 2-хлор-2'-метил-4-(3-нитро-2-пиридиламино)бензофенона,
оксим 4-(3-амино-2-пиридиламино)-2-хлор-2'-метилбензофенона,
оксим 4-(5-амино-2-пиридиламино)-2-хлор-2'-метилбензофенона,
оксим 2-хлор-4-(4-изохинолиламино)-2'-метилбензофенона,
трет-бутил-5-((3-хлор-4-((гидроксиимино)(2-метилфенил)метил))фениламино)никотиноат,
оксим 2-хлор-2'-метил-4-(4-метил-3-пиридиламино)бензофенона,
оксим 2-хлор-2'-метил-4-(6-метил-3-пиридиламино)бензофенона,
оксим 4-(5-бром-3-пиридиламино)-2-хлор-2'-метилбензофенона,
оксим 4-(5-карбонитрил-3-пиридиламино)-2-хлор-2'-метилбензофенона,
оксим 4-(3-бром-2-пиридиламино)-2-хлор-2'-метилбензофенона,
оксим 2-хлор-2'-метил-4-(8-хинолиламино)тиобензофенона,
оксим 2-хлор-4-(6-этокси-3-пиридиламино)-2'-метилбензофенона,
оксим 4-(4-бром-1-изохинолиламино)-2-хлор-2'-метилбензофенона,
оксим 2-хлор-2'-метил-4-(2-метил-5-трифторметил-3-пиридиламино)бензофенона,
оксим 2-хлор-2'-метил-4-(3-хинолиламино)бензофенона,
оксим 2-хлор-4-(4-этокси-3-пиридиламино)-2'-метилбензофенона,
оксим 2-хлор-4-(2-этокси-3-пиридиламино)-2'-метилбензофенона,
оксим 2-хлор-2'-метил-4-(2-метил-6-хинолиламино)бензофенона,
оксим 2-хлор-2'-метил-4-(2-хинолиламино)бензофенона,
оксим 2-хлор-4-(7-хлор-4-хинолиламино)-2'-метилбензофенона,
оксим 2-хлор-2'-метил-4-(4-хинолиламино)бензофенона,
оксим 2-хлор-2'-метил-4-(1-метил-7-индолиламино)бензофенона,
оксим 2-хлор-2'-метил-4-(1-метил-5-индолиламино)бензофенона,
оксим 2-хлор-2', 5'-диметил-4-(4-метил-3-пиридиламино) бензофенона,
оксим 2-хлор-2',5'-диметил-4-(4-изохинолиламино)бензофенона,
оксим 2-хлор-4-(4-изохинолиламино)-2',4', 5'-триметилбензофенона,
оксим 2,3'-дихлор-2'-метил-4-(4-метил-3-пиридиламино) бензофенона,
оксим 2-фтор-2'-метил-4-(4-метил-3-пиридиламино)бензофенона,
оксим 2,4'-дихлор-2'-метил-4-(4-метил-3-пиридиламино) бензофенона,
оксим 2-хлор-4'-фтор-4-(4-изохинолиламино)-2'-метилбензофенона,
оксим 4'-н-бутил-2-хлор-4-(4-изохинолиламино)-2'-метилбензофенона,
оксим 2-хлор-4-(5-изохинолиламино)-2'-метилбензофенона,
оксим 2-хлор-4-(4-изохинолиламино)-4'-метокси-2'-метилбензофенона,
оксим 2-фтор-4-(4-изохинолиламино)-4'-метокси-2'-метилбензофенона,
оксим 2, 4'-дихлор-2'-метил-4-(1-метил-7-индолиламино) бензофенона,
оксим 2-хлор-4-(1-метил-7-индолиламино)-2',4',5'-триметилбензофенона,
оксим 2-хлор-2', 5'-диметил-4-(1-метил-7-индолиламино) бензофенона,
оксим 2-хлор-4-(3-этокси-4-изохинолиламино)-2'-метилбензофенона,
оксим 2-хлор-4-(1-этокси-4-изохинолиламино)-2'-метилбензофенона,
оксим 4-(2-бензоксазолиламино)-2-хлор-2'-метилобензофенона,
оксим 4-(1-метил-2-бензимидазолиламино)-2-хлор-2'-метилбензофенона,
оксим 4-(2-бензотиазолиламино)-2-хлор-2'-метилбензофенона,
оксим 2-хлор-2'-метил-4-(2-пиримидиламино)бензофенона,
оксим 2-хлор-2'-метил-4-(7-метил-пурин-6-иламино)бензофенона,
оксим 2-хлор-2'-метил-4-(2-метил-5-бензотиазолиламино) бензофенона,
оксим 2-хлор-2'-метил-4-(пиразин-2-иламино)бензофенона,
оксим 2-хлор-2'-метил-4-(5-пиримидиламино)бензофенона,
и их соли, образованные фармацевтически приемлемыми кислотами, гидраты и сольваты.
Соединения общей формулы Ic

где R1, R2, R4, R5, R6, R7, R8 и Х определены выше, а R3 представляет (С1-С3)алкил, фтор, хлор, бром, метокси и гидрокси, и их соли, образованные с фармацевтически приемлемыми кислотами, гидраты и сольваты являются наиболее предпочтительными.
В формуле Ic, R1 предпочтительно представляет метил или галоген, а более предпочтительно, F или Cl; R2 представляет один или несколько заместителей, предпочтительно, водород, галоген, (С1-С3)алкил, метокси или этокси, а R3 представляет метил, метокси или хлор.
Фармакологические методы
Для исследования эффективности соединения настоящего изобретения in vitro, ингибирование секреции IL-1β и TNF-α измеряли в соответствии с нижеследующей процедурой:
Продуцирование цитокинов оценивали в средах мононуклеарных клеток периферической крови, стимулированных липополисахаридом (ЛПС). Мононуклеарные клетки выделяли из периферической крови человека путем фракционирования в Lymphoprep® (Nycomed, Norway) и суспендировали в среде RPMI 1640 (среда для культивирования), содержащей фетальную телячью сыворотку (FCS, 2%) в концентрации 5Ч105 клеток/мл. Эти клетки инкубировали в 24-луночных планшетах для культивирования ткани в 1 мл-аликвотах. Тестируемые соединения растворяли в диметилсульфоксиде (ДМСО, 10 мМ) и разводили указанной средой. В эти клетки в течение 30 минут добавляли соединения, а затем добавляли ЛПС (конечная концентрация 1 мг/мл). Планшеты инкубировали в течение 18 часов и концентрацию IL-1β и TNF-α в среде определяли с помощью твердофазного иммуноферментного анализа. Затем вычисляли средние ингибирующие концентрации (IC50) указанных соединений. Результаты представлены в Таблице 1.
Кроме того, было обнаружено, что соединения настоящего изобретения обладают аналогичными активностями ингибирования секреции супероксида PMN (полиморфоядерного нейтрофила), что также указывает на возможность их использования в качестве противовоспалительных лекарственных средств. Эти соединения были протестированы в соответствии с нижеследующей процедурой.
Полиморфоядерные гранулоциты человека (PMN) выделяли из человеческой крови путем осаждения декстраном, фракционирования в аппарате Lymphoprep® и гипотонического лизиса примесных эритроцитов.
Образование супероксид-аниона определяли как восстановление феррицитохрома С, ингибируемое супероксиддисмутазой (Madhu, S.B. et al., Inflammation, 16, 241 (1992)). Клетки суспендировали в сбалансированном солевом растворе Хэнкса и инкубировали с тестируемыми соединениями в течение 10 минут при 37°С. Клетки примировали путем добавления TNF-α (конечная концентрация 3 нг/мл) в течение 10 минут, а затем в течение 3 минут добавляли феррицитохром С (конечная концентрация 750 мкг/мл), альбумин бычьей сыворотки (BSA, конечная концентрация 1 мг/мл) и формил-метионил-лейцил-фенилаланин (fMLP, конечная концентрация 10-7 М). Клетки охлаждали на льду и центрифугировали. Оптические плотности не содержащего клеток супернатанта измеряли в спектрофотометре. Затем вычисляли среднюю ингибирующую концентрацию (IC50) указанных соединений. Полученные результаты вместе с log Р тестируемых соединений представлены в таблице 1.
Эти результаты показали, что соединения настоящего изобретения способны ингибировать продуцирование IL-1β, TNF-α и PMN-супероксида и обнаруживают фармакологическую активность, сравнимую с активностью эталонного соединения, что позволяет использовать указанные соединения для лечения воспалительных заболеваний. Более низкие величины log Р соединений настоящего изобретения соответствуют более низкой липофильности, что свидетельствует о том, что указанные соединения обладают лучшей биологической доступностью по сравнению с эталонным соединением.
Анализ на киназу р38 МАР
Культивирование клеток
Клетки COS-1 (фибробласт-подобные клетки, полученные из почек африканской зеленой мартышки и содержащие Т-антиген дикого типа под контролем промотора SV40), получали из АТСС (АТСС №CRL-1650) и культивировали в культуральной среде (DMEM без фенолового красного, 10% FCS, 2 мМ L-глутамина, 100 ед. пенициллина и 100 мкг стрептомицина/мл) при 37°С в атмосфере с 5% CO2. Эти клетки пересевали два раза в неделю при трипсинизации (0,25% трипсин, 1мМ EDTA в PBS) и разделяли на две части в отношении 1:10. Среду меняли через день или на каждый третий день. Клеточную линию регулярно тестировали с использованием серии ПЦР-праймеров микоплазмы (Stratagene), и было обнаружено, что она не содержит микоплазмы. Среды для культивирования тканей, FCS, L-глутамин и пенициллин и стрептомицин получали от Bribco BRL, Gaithersburg, MD, USA.
Кратковременная экспрессия клеток COS-1
На первый день, клетки COS-1 высевали в 143 см2-чашках Петри с плотностью 2х104 клеток/см2 в культуральной среде. На 2-й день, клетки ко-трансфецировали 5 мкг (всего) экспериментальной плазмидной ДНК, экспрессирующей FLAG-p38α и FLAG-МКК6(ЕЕ). Плазмиды вводили в клетки COS-1 в бессывороточной среде с использованием DOTAPТМ (Boehringer-Mannhiem, Mannhiem, Germany). Плазмидную ДНК получали и очищали с использованием набора, не содержащего эндотоксина, QIAGEN, Maxiprep-500 (Hilden, Germany). Для этого ДНК и DOTAPТМ смешивали точно 15 минут при 37°С в CO2-инкубаторе. Затем смесь для трансфекции переносили в 15 мл пробирку (Falcon) и в эту смесь добавляли среду для трансфекции (DMEM с L-глутамином и пенициллином/стрептомицином, но без сыворотки), а затем полученную смесь добавляли к клеточному монослою. После 4-часового инкубирования с DOTAPТМ и с плазмидами, среду, содержащую двойное количество сыворотки, добавляли к клеткам до конечной концентрации сыворотки 10%. Затем эти клетки инкубировали 24 часа и подвергали реакции с киназой.
Иммунопреципитация
После 24-часового инкубирования, реакцию прекращали путем помещения чашки Петри в ледяную баню. Среду отсасывали, и клеточный монослой один раз промывали в охлажденном на льду PBS (137 мМ NaCl, 1,5 мМ КН2РО4, 2,7 мМ KCl, 8,1 мМ Na2НРО4·2H2O), а затем солюбилизировали в течение 10 минут в 1,5 мл буфера для лизиса (50 мМ HEPES, рН 7,5, 150 мМ NaCl, 10 мМ EDTA, 10 мМ Na4Р2О7, 100 мМ NaF, 2 мМ Na3VO4, 1% тритон Х-100, 500 мкМ Pefabloc, 10 мкг/мл лейпептина, 10 мкг/мл апротинина). Клеточный монослой соскабливали резиновой палочкой, и переносили в пробирку Эппендорфа. Солюбилизированные клетки осветляли путем центрифугирования при 10000 Ч g в течение 10 минут при 4°С. Супернатант переносили в 50 мкл предварительно промытых сефарозных сфер с G-белком в HNT-буфере (30 мМ HEPES, рН 7,5, 30 мМ NaCl, 0,1% тритон Х-100) и инкубировали с 2 мкг/образец моноклонального антитела против FLAGТМ М2 (вырабатываемого против FLAG-эпитопа, -NH2-Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys-СООН) в течение 1 часа при комнатной температуре. Моноклональное антитело против FLAG М2 получали от фирмы Sigma (кат.№F-3165). Приблизительно 60 мкг белка осветленного клеточного лизата добавляли к предварительно адсорбированным антителам против FLAGТМ на сефарозных сферах с G-белком и инкубировали в течение 90 минут при 4°С в миксере для проб крови. После иммунопреципитации сефарозные сферы дважды промывали в буфере для лизиса и дважды промывали в буфере для киназной реакции (25 мМ HEPES, рН 7,5, 10 мМ ацетата магния, 50 мкМ АТР).
Инкубирование соединений с очищенной киназой р38α
Предварительно промытое иммунопреципитированное антитело против FLAG-p38, адсорбированное на сефарозных сферах с G-белком, два раза промывали в 1 Ч киназном буфере (25 мМ HEPES, рН 7,5, 10 мМ ацетата магния, 50 мкМ АТР), и супернатант отсасывали. Эти соединения разводили в 1 х киназном буфере в соответствующей концентрации. Указанные соединения добавляли к промытому преципитированному и активированному FLAG-p38, адсорбированному на сефарозных сферах с G-белком, в течение 30 минут при 30°С в объеме 100 мкл. Через каждые 10 минут по пробиркам Эппендорфа постукивали для того, чтобы убедиться, что сферы и соединения находятся в растворе. После инкубирования в течение 30 минут, сферы центрифугировали и супернатант отсасывали.
Реакция киназы р38α МАР
Киназную реакцию инициировали путем добавления 1 мкг субстрата GST-ATF-2 (Santa Cruz, LaJolla, CA, USA, cat. no. sc-4114) вместе с 2 мкКи γ-32Р-АТР в 1 х киназном буфере на образец. Реакционную смесь оставляли на 30 мин при 30°С для прохождения реакции, после чего реакцию прекращали добавлением 40 мкл 2 х буфера для ДСН-образца. Образцы кипятили, центрифугировали и подвергали электрофорезу в 15%-ПААГ с ДСН. Осушенный ДСН-ПААГ-гель экспонировали с использованием экрана фосфолюминофора и радиоактивные полосы PHAS-1 количественно оценивали c помощью фосфолюминофора STORM860 (Molecular Dynamics, Sunnyvale, CA, USA) с использованием программного обеспечения ImageQuaNT.
Ингибирование соединением 114 в этом анализе показано ниже в таблице 2:
Эталонное соединение SB 203580 широко используется как эталонное соединение для ингибирования киназы р38α МАР. Это соединение имеется в продаже под названием Calbiochem (Calbiochem-Novabiochem LaJolla, CA, USA).
Полученные результаты показали, что соединения настоящего изобретения являются сильными ингибиторами киназы р38α МАР, обладающими фармакологической активностью, сравнимой с активностью эталонного соединения, а поэтому они могут быть использованы для лечения воспалительных заболеваний.
Для исследования соединений настоящего изобретения in vivo может быть использована мышиная модель хронического кожного воспаления, индуцированного 12-О-тетрадеканоилфорбол-13-ацетатом (ТРА) (De Young, L.M. et al., Agents Actions 26, 335-341 (1989); Carlson, R.P. et al., Agents Actions 17, 197-204 (1985); Alford J.G. et al., Agents Action 37, (1992); Stanley, P.L. et al., Skin Pharmacol. 4, 262-271 (1991)), см. описание метода в работе WO 98/32730, которая вводится в настоящее описание посредством ссылки. Эти результаты показали, что соединения настоящего изобретения обладают такой же эффективностью, что и известные стандартные соединения, например, гидрокортизон, который, как известно, имеет побочные эффекты, но в отличие от него, соединения настоящего изобретения обладают хорошей переносимостью и являются нетоксичными. Некоторые члены класса, к которому относятся соединения настоящего изобретения, обнаруживают очень низкую абсорбцию, что делает их особенно ценными для использования в лечении различных кожных болезней. В основном, они могут быть введены, например, перорально, внутривенно, интраназально, местно или чрезкожно.
Способы получения соединения формулы I
Соединения настоящего изобретения могут быть получены различными способами, хорошо известными специалистам в области органического синтеза. Соединения настоящего изобретения могут быть синтезированы нижеописанными способами, а также способами, известными специалистам в области органического синтеза, или их вариантами, выбранными самим специалистом. Предпочтительными методами являются, но не ограничиваются ими, методы, описанные ниже.
Новые соединения формулы I, Ia и Ib могут быть получены в соответствии с реакциями и методами, описанными в данном разделе. Реакции осуществляют в растворителях, подходящих для используемых реагентов и материалов, и эти реакции являются подходящими для эффективных превращений. Кроме того, следует отметить, что в описанных ниже методах синтеза, все предлагаемые реакционные условия, включая растворитель, атмосферу реакции, температуру реакции, продолжительность процесса и процедур обработки выбирают как стандартные условия для данной реакции, и этот выбор может быть легко осуществлен самим специалистом. Для каждого специалиста в области органического синтеза очевидно, что функциональные группы, присутствующие на различных частях полученной молекулы, должны быть совместимыми с предлагаемыми реагентами и реакциями. Не все соединения формулы I, относящиеся к данному классу, могут быть совместимыми с определенными реакционными условиями, необходимыми для осуществления некоторых описанных методов. Такие ограничения в отношении заместителей, совместимых с данными реакционными условиями, могут быть легко определены самим специалистом, и в этом случае могут быть использованы альтернативные методы.
В настоящем описании были использованы нижеследующие сокращения: BINAP=рацемический или нерацемический 2,2'-бис (дифенилфосфино)-1, 1'-бинафтил, CDCl3=дейтерохлороформ, ДМФ=N,N-диметилформамид, ДМСО-d6= гексадейтеродиметилсульфоксид, ДМСО=диметилсульфоксид, EtOAc=экспрессирующий вектор этилацетат, Et2О=диэтиловый эфир, Pd2(dba)3=трис(дибензилиденацетон)дипалладий(0), mCPBA=мета-хлорбензойная кислота, МеОН=метанол, NaOt-Bu=трет-бутоксид натрия, KOt-Bu=трет-бутоксид калия, ТГФ=тетрагидрофуран, ТСХ=тонкослойная хроматография.

L: F, Cl, Br, I или OSO2CF3
Y: Cl, Br, I, OSO2R'
FGI: взаимопревращение функциональных групп
Соединения настоящего изобретения могут быть получены способом, предусматривающим сочетание амина формулы III с бромидом, иодидом, фторидом, хлоридом или трифлатом формулы II, как показано на схеме 1, где R1, R2, R3, R4, R5 и Х определены в общей формуле I, за исключением того, что, перед проведением реакции сочетания, любой заместитель или функциональная группа, которые являются потенциально реакционноспособными в указанной реакции сочетания, сами могут быть защищены, а затем удалены.
Указанную реакцию сочетания осуществляют любыми методами образования дифениламинов, известными каждому специалисту в области органического синтеза.
Предпочтительным методом является метод катализируемого палладием аминирования, который предусматривает взаимодействие амина с гетероарилгалогенидом (или с гетероарилтрифлатом) в присутствии основания, подходящего источника Pd и подходящего фосфинового лиганда в инертном растворителе. (Работы: Wolfe, J.P.; Wagaw, S.; Buchwald, S.L.; J.Am. Chem. Soc. (1996), 118, 7215-16; Wagaw, S.; Buchwald, S.L.; J.Org. Chem., (1996), 61, 7240-41; Wolfe, J.P.; Buchwald, S.L.; Tetrahedron Lett., (1997), 38, 6359-62; Hong Y. et al., Tetrahedron Lett. (1997), 38, 5607-10).
Палладиевые соединения, используемые в данном способе, не имеют конкретных ограничений, и характерными примерами таких соединений являются: ацетат палладия(II), хлорид палладия(II), бромид палладия(II), дихлорбис(трифенилфосфин)палладий(II), тетракис(трифенилфосфин)палладий(0), трис(дибензилиденацетон)дипалладий(0). Предпочтительным лигандом являются, но не ограничиваются ими, рацемический или нерацемический 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (обозначаемый далее BINAP), три-о-толилфосфин, три-трет-бутилфосфин, 1,1'-бис(дифенилфосфино)ферроцен, бис[(2-дифенилфосфино)фенил]эфир (DPEphos), 2-дициклогексилфосфанил-2'-диметиламинобифенил, 2-(ди-трет-бутилфосфино)бифенил и 9,9-диметил-4, 6-бис(дифенилфосфино)ксантин (Xantphos). Количество палладия и лиганда, используемых в этом способе, обычно составляет в пределах от 0,1 до 10 моль%, в расчете на количество используемого ароматического галогенида (или трифлата).
Было показано, что наилучшими основаниями в этом способе являются, в частности, NaOt-Bu и карбонат цезия (Cs2CO3), но могут быть также использованы и другие основания.
Реакцию обычно осуществляют при повышенной температуре (80-120°С) в инертных растворителях, таких как 1,4-диоксан, толуол, бензол и тетрагидрофуран, в инертной атмосфере, такой как аргон или азот.
Реакция сочетания может быть также осуществлена путем нуклеофильного замещения гетероарилгалогена амином либо в присутствии основания в полярном апротонном растворителе, либо без растворителя. Предпочтительным основанием является KOt-Bu или NaH, но также могут быть использованы и другие основания. Предпочтительным растворителем является диметилсульфоксид, но могут быть также использованы и другие растворители, такие как ДМФ. Указанную реакцию проводят при повышенной температуре (120-150° С) в течение 12-24 ч.
Соединения настоящего изобретения, в которых R4 не является водородом, могут быть получены способом, предусматривающим взаимодействие амина формулы I (R4=Н) с алкилирующим агентом, как показано на схеме 1, где R1, R2, R3, R5 и Х определены в общей формуле I, за исключением того, что любой заместитель или функциональная группа, которые являются потенциально реакционноспособными в указанной реакции взаимодействия, сами могут быть защищены перед проведением реакции, а затем удалены.
Типичными алкилирующими агентами общей формулы R-Y являются, но не ограничиваются ими, иодиды (Y=I), бромиды (Y=Br), хлориды (Y=Cl) и сульфонаты (Y=OSO2R', где R' представляет метил, трифторметил или 4-метилфенил).
В некоторых случаях соединения настоящего изобретения могут быть получены путем простого взаимопревращения функциональных групп (FGI), которое представляет собой стандартный способ, известный каждому специалисту в области органического синтеза, где функциональную группу в соединениях общей формулы I превращают в другую функциональную группу в одну или несколько стадий синтеза с получением нового соединения общей формулы I. Примерами таких способов являются, но не ограничиваются ими, гидролиз сложного эфира с образованием кислоты в основных условиях; снятие защиты у метилового эфира с образованием фенола путем обработки, например, трибромидом бора (BBr3); каталитическое гидрирование олефина с образованием насыщенного углеводорода и восстановления нитрогруппы до амина.
Соединения настоящего изобретения общей формулы I, где Х=S, могут быть получены из кетона (общей формулы I, С=О) способом FGI с использованием одного из множества тиокарбонилирующих реагентов, известных каждому специалисту в области органического синтеза. Примерами таких тиокарбонилирующих реагентов являются, но не ограничиваются ими, пентасульфид фосфора (Р4S10) или реагент Лавессона (2,4-бис(4-метоксифенил)-1,3,2,4-дитиафосфетан-2,4-дисульфид) или т.п. Соединения настоящего изобретения общей формулы I, где Х=N-ОН, могут быть получены из кетона (общей формулы I, С=О) путем обработки гидроксиламином или его защищенным производным с последующим снятием защиты в подходящем растворителе, например, в пиридине или в метаноле.
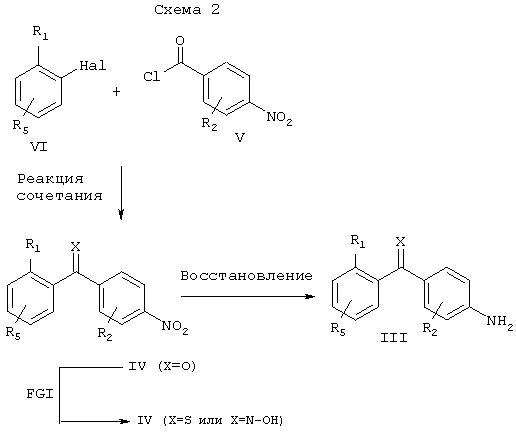
Соединения настоящего изобретения общей формулы III могут быть получены несколькими методами, известными специалистам в области органического синтеза. Одна из используемых последовательностей реакций показана на схеме 2. Ключевой стадией является взаимодействие бромида (или иодида) общей формулы VI с хлорангидридом общей формулы V с образованием бензофенона общей формулы IV. Это соединение IV может быть затем восстановлено до соответствующего амина общей формулы III путем обработки стандартными восстановителями. Примерами таких как восстановителей являются, но не ограничиваются ими, дигидрат хлорида олова; водород; формиат аммония, или гидрат гидразина и каталитическое количество палладия на угле. Указанную реакцию сочетания осуществляют путем превращения бромида (VI) в реакционноспособное металлорганическое промежуточное соединение, например, путем обработки бутиллитием с получением литиевого производного, или путем обработки магнием с получением магниевого производного. Реакционную способность этого промежуточного соединения затем модулируют путем переметаллирования с образованием, например, цинка, путем обработки ZnCl2, ZnBr2 или ZnI2. Это цинкорганическое соединение затем подвергают взаимодействию с хлорангидридом общей формулы V в присутствии комплекса палладия(0) в каталитическом количестве. Примерами таких катализаторов являются, но не ограничиваются ими, тетракис(трифенилфосфин)палладий(0), тетракис(трифениларсин) палладий(0), дихлорбис(трифенилфосфин)палладий (II) или бензилхлорбис(трифенилфосфин)палладий (II).
Как показано на схеме 2, соединения общей формулы IV (Х=О) могут быть превращены способом FGI в соединение общей формулы IV (Х=S или Х=N-ОН), как описано выше. Это описание лишь иллюстрирует универсальность указанного метода синтеза и описанная в общих чертах последовательность реакций является лишь одной из возможных стратегий синтеза соединений настоящего изобретения. То есть, в некоторых случаях может оказаться более предпочтительным использовать другую последовательность вышеописанных реакций. Описанная последовательность реакций не должна рассматриваться как ограничение способа получения соединений настоящего изобретения общей формулы I и изменение последовательности реакций является очевидной альтернативой для каждого специалиста в области органического синтеза.
Фармацевтические композиции
В другом своем аспекте, настоящее изобретение относится к фармацевтической композиции, содержащей в качестве активного компонента соединение формулы I, Ia, Ib или Ic вместе с фармацевтически приемлемым наполнителем или носителем. Термин "фармацевтически приемлемый" относится к наполнителю или носителю, включенному в композицию, который является совместимым с другими ингредиентами и не является токсичным или не обладает каким-либо нежелательным воздействием на пациента, которому вводится данная композиция.
Фармацевтические композиции могут быть изготовлены в виде разовой лекарственной формы, такой как таблетки, пилюли, капсулы, порошки, гранулы, эликсиры, сиропы, эмульсии, ампулы, суппозитории или парентеральные растворы или суспензии для орального, парентерального, офтальмического, чрезкожного, внутрисуставного, местного, пульмонального, назального, буккального или ректального введения или для введения другими способами, подходящими для данной композиции противовоспалительных соединений в соответствии с общепринятой практикой, описанной в Remington: The Science and Practice of Pharmacy. 19th Ed., Mack Publishing Company, 1995. Термин "разовая лекарственная форма" означает унифицированную, то есть разовую дозу, которая может быть введена пациенту, и которая может быть легко обработана и упакована, оставаясь, при этом, физически и химически стабильной лекарственной формой, включающей либо один активный компонент, либо его смесь с твердыми или жидкими фармацевтическими наполнителями или носителями. В композиции настоящего изобретения, активный компонент может присутствовать в количестве примерно 0,1-100% по массе композиции.
Для орального введения в форме таблетки или капсулы, соединение формулы I может быть соответствующим образом объединено с оральным нетоксическим фармацевтически приемлемым носителем, таким как этанол, глицерин, вода или т.п. При необходимости к смеси могут быть добавлены подходящие связывающие агенты, замасливатели, дезинтегрирующие агенты, отдушки и красители. Подходящими связывающими агентами являются, например, лактоза, глюкоза, крахмал, желатин, аравийская камедь, трагакантовая камедь, альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Замасливателями являются, например, олеат натрия, стеарат натрия, стерат магния, бензоат натрия, ацетат натрия, хлорид натрия или т.п. Дезинтегрирующими агентами являются, например, крахмал, метилцеллюлоза, агар, бентонит, ксантановая камедь или т.п.
Для получения твердых композиций, таких как таблетки, активное соединение формулы I смешивают с одним или несколькими наполнителями, такими как наполнители, описанные выше, и с другими фармацевтическими разбавителями, такими как вода, для разведения предварительно полученной твердой композиции, содержащей гомогенную смесь соединений формулы I. Термин "гомогенный" означает, что соединение формулы I равномерно распределяется по всей композиции так, чтобы эта композиция могла быть легко разделена на равные эффективные разовые лекарственные формы, такие как таблетки или капсулы. Затем предварительно полученная композиция может быть разделена на разовые лекарственные формы, содержащие примерно от 0,05 до 1000 мг, а в частности, примерно от 0,1 до 500 мг активного соединения настоящего изобретения.
Жидкими композициями для орального или парентерального введения соединений настоящего изобретения являются, например, водные растворы, сиропы, водные или масляные суспензии или эмульсии на основе пищевых масел, таких как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло. Подходящими диспергирующими или суспендирующими агентами для водных суспензий являются синтетические или природные камеди, такие как трагакантовая камедь, альгинат, аравийская камедь, декстран, натрий-содержащая карбоксиметилцеллюлоза, желатин, метилцеллюлоза или поливинилпирролидон.
Для парентерального введения, например, для внутримышечного, внутрибрюшинного, подкожного или внутривенного введения или вливания, фармацевтическая композиция предпочтительно содержит соединение формулы I, растворенное или солюбилизированное в подходящем фармацевтически приемлемом растворителе. Для парентерального введения, композиция настоящего изобретения может включать стерильный водный или безводный растворитель, а в частности, воду, изотонический физиологический раствор, изотонический раствор глюкозы, буферный раствор или другой растворитель, обычно используемый для парентерального введения терапевтически активных веществ, а в частности, антипролиферирующих агентов. Указанная композиция может быть стерилизована, например, путем фильтрации через удерживающий бактерии фильтр, добавления к указанной композиции стерилизующего агента, облучения композиции или нагревания этой композиции. Альтернативно, соединение настоящего изобретения может быть получено в виде стерильного твердого препарата, например, лиофилизованного порошка, который растворяют в стерильном растворителе непосредственно перед использованием.
Композиция, предназначенная для парентерального введения, может дополнительно включать стандартные добавки, такие как стабилизаторы, буферы или консерванты, например антиоксиданты, такие как метилгидроксибензоат или т.п.
Композиции для ректального введения могут быть получены в форме суппозиториев, содержащих активный ингредиент и носитель, такой как масло какао, или в форме клизмы.
Композиции, подходящие для внутрисуставного введения, могут быть получены в форме стерильного водного препарата, содержащего активный ингредиент, который может иметь микрокристаллическую форму, например форму водной микрокристаллической суспензии. Для внутрисуставного и офтальмического введения могут быть также использованы липосомные препараты или системы биологически разлагаемых полимеров, включающие активный ингредиент.
Композициями, подходящими для местного применения, включая закапывание в глаза, являются жидкие или полужидкие препараты, такие как мази, лосьоны, гели, аппликаторы, эмульсии типа "масло в воде" или "вода в масле", такие как кремы, мази или пасты; либо растворы или суспензии, такие как капли. Для местного применения, активный компонент предпочтительно составляет 1%-20% по массе композиции, однако он может составлять вплоть до 50 мас.%.
Композициями, подходящими для введения через нос или через щечный карман или для ингаляции, являются порошки, самораспыляющиеся композиции и композиции в виде спреев, такие как аэрозоли или аэрозольные ингаляторы. Композиции, подходящие для интраназального и трансбуккального введения могут содержать 0,1-20 мас.%, например, примерно 2 мас.% активного ингредиента.
Композиция может, кроме того, содержать один или несколько других активных компонентов, обычно используемых для лечения различных воспалительных заболеваний и состояний. Примерами таких дополнительных активных компонентов могут быть компоненты, выбранные из группы, состоящей из глюкокортикоидов, витамина D и аналогов витамина D, антигистаминов, антагонистов фактора активации тромбоцитов (ФАТ), антихолинергических агентов, метилксантинов, β-адренергических агентов, ингибиторов СОХ-2, салицилатов, инфометацина, флуфенамата, напроксена, тимегадина, солей золота, пеницилламина, агентов, снижающих уровень холестерина в сыворотке, ретиноидов, солей цинка и салицилазосульфапиридина.
В другом своем аспекте, настоящее изобретение относится к использованию соединений формулы I для получения лекарственного средства для лечения или профилактики воспалительных заболеваний или состояний. В еще одном своем аспекте, настоящее изобретение относится к способу лечения воспалительных заболеваний или состояний, предусматривающему введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы I.
Подходящая доза соединений настоящего изобретения зависит inter alia от конкретного соединения, выбранного для лечения, от способа введения, возраста и состояния пациента, тяжести заболевания, подвергаемого лечению и других факторов, хорошо известных практикующему врачу. Соединение настоящего изобретения может быть введено орально или парентерально в соответствии с различными схемами введения доз, например, ежедневно или раз в неделю. В основном, разовую дозу вводят в количестве от 0,01 до 400 мг/кг массы тела, например, от 0,1 до 100 мг/кг массы тела. Указанное соединение может быть введено в виде болюса (то есть полной суточной дозы, вводимой один раз) или в виде дробных доз, вводимых два или несколько раз в день.
Воспалительными заболеваниями или состояниями, которые могут быть подвергнуты лечению соединениями настоящего изобретения, являются воспалительные заболевания, где модуляция экспрессии и секреции цитокинов может быть опосредована киназами МАР, такими как киназа р38 МАР, описанная выше. Примерами воспалительных заболеваний или состояний, которые, очевидно, опосредуются киназой р38 МАР, являются заболевания или состояния, выбранные из группы, состоящей из астмы, аллергии, артрита, включая ревматоидный артрит, остеоартрит и спондилоартрит, подагры, атеросклероза, воспалительных кишечных заболеваний, болезни Крона, пролиферативных и воспалительных кожных болезней, таких как псориаз, атопический дерматит и акне, увеита, сепсиса, септического шока, ассоциированных со СПИД'ом заболеваний и остеопороза.
Указанное лечение может также предусматривать введение одного или нескольких других противовоспалительных активных компонентов, таких как глюкокортикоиды, витамин D и аналоги витамина D, антигистамины, антагонисты фактора активации тромбоцитов (ФАТ), антихолинергические агенты, метилксантины, β-адренергические агенты, ингибиторы СОХ-2, салицилаты, инфометацин, флуфенамат, напроксен, тимегадин, соли золота, пеницилламин, агенты, снижающие уровень холестерина в сыворотке, ретиноиды, соли цинка и салицилазосульфапиридин.
Настоящее изобретение дополнительно проиллюстрировано нижеследующими общими процедурами, препаративными примерами и примерами, которые никоим образом не ограничивают заявленного объема изобретения.
ПРИМЕРЫ
Общие процедуры, препаративные примеры и примеры
Конкретные примеры соединений формулы I представлены в Таблице 3. Все температуры плавления являются нескорректированными. Для1Н- и13С-спектров ядерного магнитного резонанса (ЯМР) (300 МГц, для1Н), величины химических сдвигов (δ)(в м.д.) измерены, если это не оговорено особо, в растворах дейтерохлороформа и гексадейтеродиметилсульфоксида по отношению к внутреннему эталону - тетраметилсилану (δ 0,00) или хлороформу (1Н-ЯМР δ 7,25,13С ЯМР δ 76,81). Величины для мультиплета (м), определенные в конечном счете как дублет (д), триплет (т) или квартет (кв.), приводятся приблизительно в средней точке, если не указан диапазон. Сигнал может быть также определен как синглет (с) или широкий синглет (шир.). При этом были использованы безводные органические растворители. Термин "хроматография" означает колоночную хроматографию с использованием флеш-техники, проводимую на силикагеле.
Нумерация в таблице 3 соответствует нумерации в нижеприведенных формулах, R6 и R7 являются такими, как они были определены в общей формуле I.
Общая процедура 1
В результате взаимодействия соединений общей формулы II с соединениями общей формулы III получают соединения общей формулы I или их защищенное производное.
В сосуде с завинчивающейся крышкой амин (1,0 экв.) общей формулы III растворяют в 1,4-диоксане или в толуоле и добавляют галогенид (1,0-1,1 экв.) общей формулы II. Сосуд продувают аргоном, добавляют основание (Cs2 CO3 или NaOt-Bu, 1,4 экв.), Pd2(dba)3 (0,02 экв.) и BINAP (0,04 экв.), снова продувают аргоном и закрывают. Полученную суспензию интенсивно встряхивают при комнатной температуре а течение пяти минут, а затем при 100°С-110°С в течение 4-20 ч или до тех пор, пока не исчезнет галогенид II, на что указывает ТСХ. Реакционную смесь оставляют для охлаждения до комнатной температуры. Реакционную смесь выливают в смесь EtOAc и воды. Органическую фазу отделяют, а водную фазу три раза экстрагируют EtOAc. Объединенные органические фазы промывают водой и насыщенным водным NaCl, сушат (MgSO4) фильтруют и концентрируют в вакууме. Остаток очищают с помощью хроматографии и/или путем кристаллизации с получением продукта реакции сочетания общей формулы I или его защищенного производного.
Общая процедура 2
Взаимодействие соединений общей формулы II с соединениями общей формулы III с образованием соединений общей формулы I или их защищенного производного.
Амин общей формулы (III)(1 экв.) растворяют в ДМСО (0,1-0,2М) и добавляют гетероарилхлорид или гетероарилфторид (1 экв.) общей формулы (II). Трет-бутоксид калия, 2 экв. или 3 экв., если соединение II является гидрохлоридом, растворяют в ДМСО (0,2-0,4М), и раствор по каплям добавляют к реакционной смеси. Реакционную смесь перемешивают в атмосфере аргона при 120-150°С в течение 12-24 ч. Реакционную смесь выливают в воду и три раза экстрагируют EtOAc. Объединенные органические фазы промывают насыщенным водным NaCl, сушат (MgSO4), фильтруют и концентрируют в вакууме, и неочищенный продукт очищают флеш-хроматографией с получением продукта реакции сочетания общей формулы I или его защищенного производного.
Общая процедура 3
Взаимодействие соединений общей формулы VI с соединениями общей формулы V с образованием соединений общей формулы IV или их защищенного производного.
Бромид (80 ммоль) общей формулы VI растворяют в сухом ТГФ (65 мл) и охлаждают при перемешивании до -78°С в атмосфере аргона. Затем по каплям добавляют н-бутиллитий (80 ммоль, 1,6 М раствор в гексане), поддерживая внутреннюю температуру ниже -65°С, и полученную смесь перемешивают еще 15 минут. Затем по каплям добавляют ТГФ-раствор ZnCl2 (100 ммоль, 1,0 М) и реакционную смесь оставляют для нагревания до комнатной температуры. Через 2 ч реакционную смесь охлаждают до 0°С и добавляют тетракис(трифенилфосфин)палладий(0) (4,0 ммоль), а затем по каплям добавляют хлорангидрид (84 ммоль) общей формулы V в ТГФ. Реакционную смесь оставляют для нагревания до 20°С и перемешивают примерно 16 ч. Полученный желтый раствор фильтруют и фильтрат выливают в смесь EtOAc/вода 1:1, встряхивают и разделяют. Водную фазу экстрагируют еще двумя порциями EtOAc. Органические фазы объединяют, сушат (MgSO4), фильтруют и концентрируют в вакууме с получением неочищенного продукта. Последующую очистку проводят с помощью флеш-хроматографии и/или кристаллизации с получением целевого соединения IV или его защищенного производного.
Общая процедура 4
Восстановление соединений общей формулы IV дигидратом хлорида олова с получением соединений общей формулы III или их защищенного производного.
Смесь соединения общей формулы IV (5 ммоль) и дигидрата хлорида олова (5,64 г, 25 ммоль) в абсолютном этаноле (50 мл) нагревают до 70°С в атмосфере аргона. Через 1 ч, или когда исчезнет исходный материал, на что указывает ТСХ, раствор оставляют для охлаждения до комнатной температуры, а затем выливают в воду со льдом. рН делают щелочным путем добавления насыщенного гидроксида натрия (50 мл), а затем раствор экстрагируют этилацетатом (3Ч100 мл). Органическую фазу сушат (MgSO4), фильтруют и выпаривают с получением неочищенного продукта. Затем неочищенный продукт очищают либо путем кристаллизации, либо с помощью флеш-хроматографии с получением целевого соединения или его защищенного производного.
Общая процедура 5
Окисление соединения общей формулы I кислотой mCPBA с получением соответствующих N-оксидов
Соединение общей формулы I (1 экв.) растворяют в СН2Cl2, добавляют mCPBA (1,2 экв.) и реакционную смесь перемешивают при комнатной температуре в течение 1-3 ч. Затем добавляют Na2S2O5 (1,5 экв.) и суспензию перемешивают и фильтруют. К фильтрату добавляют К2CO3 (3 экв.) и перемешивают в течение 0,5-1 ч. Затем добавляют MgSO4, суспензию фильтруют и фильтрат концентрируют в вакууме. Очистку проводят флеш-хроматографией и/или кристаллизацией.
Препаративный пример 1
2-Хлор-4-нитро-2'-метилбензофенон (соединение 1)
Общая процедура: 3
Исходное соединение VI: 2-бромтолуол
Исходное соединение V: 2-хлор-4-нитро-бензоилхлорид
Очистка: Хроматография с использованием смеси EtOAc/пентан, 1:9, в качестве элюента
13C ЯМР (CDCl3): δ 195,1, 148,9, 145,5, 140,6, 135,0, 133,1, 132,7, 132,4, 131,9, 130,0, 125,9, 125,4, 121,9, 21,5
Препаративный пример 2
4-Амино-2-хлор-2'-метилбензофенон (соединение 2)
Общая процедура: 4
Исходное соединение IV: 2-хлор-4-нитро-2'-метилбензофенон (соединение 1)
Очистка: Хроматография с использованием смеси EtOAc/пентан, 1:9, а затем 1:4 в качестве элюента
13C ЯМР (CDCl3): δ 196,7, 150,5, 139,5, 137,6, 135,1 133,9, 131,2, 130,7, 129,5, 127,5, 125,3, 116,0, 112,2, 20,3
Препаративный пример 3
2-Хлор-4-метокси-2'-метил-4-нитробензофенон (соединение 3)
Общая процедура: 3
Исходное соединение VI: 2-бром-5-метокситолуол
Исходное соединение V: 2-хлор-4-нитро-бензоилхлорид
Очистка: Кристаллизация из смеси МеОН/циклогексан, 10:1
13C ЯМР (CDCl3): δ 193,3, 163,3, 148,6, 146,3, 144,3 135,5, 132,4, 129,6, 127,5, 125,3, 121,9, 118,1, 110,9, 55,4, 22,4
Препаративный пример 4
4-Амино-2-хлор-4'-метокси-2'-метилбензофенон (соединение 4)
Общая процедура: 4
Исходное соединение IV: 2-хлор-4'-метокси-2'-метил-4-нитробензофенон (соединение 3)
Очистка: Фильтрация через короткую колонку с силикагелем
13C ЯМР (CDCl3): δ 195, 7, 161,7, 149,6, 141,6, 134,2 133,3, 132,8, 131,4, 129,1, 117,0, 115,8, 112,4, 110,3, 55,3, 21,3
Препаративный пример 5
2,4'-Дихлор-2'-метил-4-нитробензофенон (соединение 5)
Общая процедура: 3
Исходное соединение VI: 2-бром-5-хлортолуол
Исходное соединение V: 2-хлор-4-нитро-бензоилхлорид
Очистка: Хроматография с использованием смеси EtOAc/пентан, 1:15, а затем 1:10, в качестве элюента
13C ЯМР (CDCl3): δ 194,1, 149,0, 145,0, 142,6, 139,4 133, 5, 133,1, 132,7, 132,5, 130,1, 126,1, 125,5, 122,0, 21,4
Препаративный пример 6
4-Амино-2,4'-дихлор-2'-метилбензофенон (соединение 6)
Общая процедура: 4
Исходное соединение IV: 2,4'-дихлор-2'-метил-4-нитробензофенон (соединение 5)
13C ЯМР (CDCl3): δ 195,4, 150,5, 139,8, 137,9, 136,5 135,1, 133,7, 131,2, 130,9, 127,5, 125,6, 115,9, 112,3, 20,2
Препаративный пример 7
2-Хлор-4-фтор-2'-метил-4-нитробензофенон (соединение 7)
Общая процедура: 3
Исходное соединение VI: 2-бром-5-фтортолуол
Исходное соединение V: 2-хлор-4-нитро-бензоилхлорид
Очистка: Хроматография с использованием смеси EtOAc/пентан, 1:20, в качестве элюента
13C ЯМР (CDCl3): δ 193,7, 165,1, 148,9, 145,3, 144,6 134,7, 132,6, 131,4, 129,9, 125,5, 122,0, 119,5, 113,0, 21,8
Препаративный пример 8
4-Амино-2-хлор-4'-фтор-2'-метилбензофенон (соединение 8)
Общая процедура: 4
Исходное соединение IV: 2-хлор-4'-фтор-2'-метил-4-нитробензофенон (соединение 7)
Очистка: Фильтрация через короткую колонку с силикагелем
13C ЯМР (CDCl3): δ 195,4, 163,9, 150,3, 141,5, 135,5 134,9, 133,5, 132,2, 128,0, 118,1, 115,9, 112,4, 112,3, 20,6
Препаративный пример 9
2-Фтор-4-нитро-2'-метилбензофенон (соединение 9)
Общая процедура: 3
Исходное соединение VI: 2-бромтолуол
Исходное соединение V: 2-фтор-4-нитро-бензоилхлорид
Очистка: Кристаллизация из смеси МеОН/циклогексан, 6:1
13C ЯМР (CDCl3): δ 193,1, 159,9, 150,3, 139,3, 136,4 133,8, 132,6, 132,1, 131,7, 130,8, 125,8, 119,4, 112,4, 21,0
Препаративный пример 10
4-Амино-2-фтор-2'-метилбензофенон (соединение 10)
Общая процедура: 4
Исходное соединение IV: 2-фтор-4-нитро-2'-метилбензофенон (соединение 9)
Очистка: Фильтрация через короткую колонку с силикагелем
13C ЯМР (CDCl3): δ 194,3, 163,8, 153,0, 140,7, 136,1 134,0, 130,8, 129,9, 127,9, 125,3, 116,8, 110,1, 101,3, 19,8
Препаративный пример 11
2-Хлор-2',5'-диметил-4-нитробензофенон (соединение 11)
Общая процедура: 3
Исходное соединение VI: 2-бром-1,4-диметилбензол
Исходное соединение V: 2-хлор-4-нитро-бензоилхлорид
Очистка: Фильтрация через короткую колонку с силикагелем
13C ЯМР (CDCl3): δ 195,3, 148,9, 145,6, 137,4, 135,5 135,0, 133,9, 132,8, 132,3, 132,2, 130,0, 125,5, 121,9, 21,1, 20,8
Препаративный пример 12
4-Амино-2-хлор-2',5'-диметилбензофенон (соединение 12)
Общая процедура: 4
Исходное соединение IV: 2-хлор-2', 5'-диметил-4-нитробензофенон (соединение 11)
Очистка: Фильтрация через короткую колонку с силикагелем
13C ЯМР (CDCl3): δ 196,8, 150,2, 139, 3, 135,1, 134,9 134,5, 133,8, 131,4, 131,1, 130,0, 128,0, 116,0, 112,2, 20,8, 19,9
Препаративный пример 13
2,3'-Дихлор-2'-метил-4-нитробензофенон (соединение 13)
Общая процедура: 3
Исходное соединение VI: 2-бром-3-хлортолуол
Исходное соединение V: 2-хлор-4-нитро-бензоилхлорид
Очистка: Кристаллизация из смеси МеОН/циклогексан, 9:1
13C ЯМР (CDCl3): δ 194,6, 149,2, 144,5, 138,2, 137,3 137,0, 133,5, 133,2, 130,7, 129,0, 126,5, 125,7, 122,0, 17,3
Препаративный пример 14
4-Амино-2,3'-дихлор-2'-метилбензофенон (соединение 14)
Общая процедура: 4
Исходное соединение IV: 2, 3'-дихлор-2'-метил-4-нитробензофенон (соединение 13)
Очистка: Фильтрация через короткую колонку с силикагелем
13C ЯМР (CDCl3): δ 195,3, 150, 9, 142,4, 135,8, 135,8 134,8, 134,6, 131,0, 126,8, 126,7, 126,4, 116,2, 112,2, 17,1
Препаративный пример 15
2-Фтор-4'-метокси-2'-метил-4-нитробензофенон (соединение 15)
Общая процедура: 3
Исходное соединение VI: 2-бром-5-метокситолуол
Исходное соединение V: 2-фтор-4-нитро-бензоилхлорид
Очистка: Перекристаллизация из смеси МеОН/циклогексан/СН2Cl2,
13C ЯМР (CDCl3): δ 191,3, 163,1, 159,3, 143,6, 135,0 134,8, 131,2, 128,5, 119,4, 117,8, 112,2, 110,8, 55,5, 22,1
Препаративный пример 16
4-Амино-2-фтор-4'-метокси-2'-метилбензофенон (соединение 16)
Общая процедура: 4
Исходное соединение IV: 2-фтор-4'-метокси-2'-метил-4-нитробензофенон (соединение 15)
Очистка: Фильтрация через короткую колонку с силикагелем
13C ЯМР (CDCl3): δ 193,4, 163,1, 161,2, 152,2, 140,1, 133,7, 132,6, 131,7, 117,8, 116,6, 110,3, 110,1, 101,3, 55,3, 20,7
Препаративный пример 17
2-Хлор-4-нитро-2',4',5'-триметилбензофенон (соединение 17)
Общая процедура: 3
Исходное соединение VI: 2-бром-1,2,4-триметилбензол
Исходное соединение V: 5-хлор-4-нитро-бензоилхлорид
Очистка: Перекристаллизация из EtOAc
ЕО 01720-000 (CDCl3)
13C ЯМР (CDCl3): δ 194,8, 148,7, 146,1, 143,0, 138,3, 134,1, 134,0, 133,4, 132,6, 132,5, 129,8, 125,4, 121,9, 21,2, 19,9, 19,2
Препаративный пример 18
4-Амино-2-хлор-2',4',5'-триметилбензофенон (соединение 18)
Общая процедура: 4
Исходное соединение IV: 2-хлор-4-нитро-2',4',5'-триметилбензофенон (соединение 17)
Очистка: Фильтрация через короткую колонку с силикагелем
13C ЯМР (CDCl3): δ 196,6, 149,9, 140,0, 136,6, 135,5, 134,7, 133,4, 132,7, 131,4, 128,5, 115,9, 112,2, 20,0, 19,7, 19,1
Препаративный пример 19
4'-н-Бутил-2-хлор-2'-метил-4-нитробензофенон (соединение 19)
Общая процедура: 3
Исходное соединение VI: 4'-н-бутил-2-метилиодбензол
Исходное соединение V: 2-хлор-4-нитро-бензоилхлорид
Очистка: Хроматография, элюент EtOAc:петролейный эфир, 1:15
13 C ЯМР (CDCl3): δ 194,6, 149,2, 148,7, 146,0, 141,1 132,7, 132,7, 132,6, 132,3, 129,8, 125,9, 125,3, 121,8, 35,7, 33,1, 22,4, 21,8, 13,9
Препаративный пример 20
4-Амино-4'-н-бутил-2-хлор-2'-метилбензофенон (соединение 20)
Общая процедура: 4
Исходное соединение IV: 4'-н-бутил-2-хлор-2'-метил-4-нитробензофенон (соединение 19)
Очистка: Фильтрация через короткую колонку с силикагелем
13C ЯМР (CDCl3): δ 196,5, 150,0, 146,3, 138,3, 136,5 134,7, 133,4, 131,5, 130,4, 128,4, 125,3, 115,9, 112,2, 35,6, 33,3, 22,4, 20,6, 13,9
Пример 1
2-Хлор-2'-метил-4-(4-пиридиламино)бензофенон (соединение 101)
Общая процедура: 2
Исходное соединение II: гидрохлорид 4-хлорпиридина (0,30 г, 2,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,49 г, 2, 0 ммоль)
Растворитель: ДМСО (15 мл)
Основание: t-BuOK (0,67 г, 6,0 ммоль) в ДМСО (10 мл)
Время реакции: 22 ч
Температура реакции: 150°С
Очистка: Хроматография с использованием смеси EtOAc:МеОН, 15:1
Продукт: соединение 101, 0,20 г масла.
1Н ЯМР (CDCl3): δ 8,39 (д, 1Н), 7,43 (д, 1Н), 7,40-7,20 (м, 5Н), 7,08 (дд, 1Н), 6,97 (д, 3Н), 2,50 (с, 3Н)
Пример 2
2-Хлор-2'-метил-4-(2-пиридиламино)бензофенон (соединение 102)
Общая процедура: 2
Исходное соединение II: 2-хлор-пиридин (0,19 мл, 2,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,49 г, 2,0 ммоль)
Растворитель: ДМСО (15 мл)
Основание: t-BuOK (0,45 г, 4,0 ммоль) в ДМСО (10 мл)
Время реакции: 22 ч
Температура реакции: 150°С
Очистка: Хроматография с использованием смеси EtOAc:петролейный эфир, 1:5
Продукт: соединение 102, 0,21 г масла.
1Н ЯМР (CDCl3): δ 8,28 (д, 1Н), 7,65 (д, 1Н), 7,58 (т, 1Н), 7,41 (д, 1Н), 7,40-7,25 (м, 4Н), 7,19 (т, 1Н), 6,95 (с, 1Н), 6,86 (м, 2Н), 2,47 (с, 3Н)
Пример 3
2-Хлор-2'-метил-4-(5-нитро-2-пиридиламино)бензофенон (соединение 103)
Общая процедура: 2
Исходное соединение II: 2-хлор-5-нитро-пиридин (0,32 г, 2,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,49 г, 2,0 ммоль)
Растворитель: ДМСО (10 мл)
Основание: t-BuOK (0,45 г, 4,0 ммоль) в ДМСО (20 мл)
Время реакции: 18 ч
Температура реакции: 150°С
Очистка: Хроматография с использованием смеси EtOAc:петролейный эфир, 2:7-1:3
Продукт: соединение 103, 0,09 г кристаллического соединения.
13С ЯМР (ацетон d-6): δ 196,7, 159,4, 146,2, 144,2, 139,2, 139,0, 138,8, 138,8, 133,6, 133,5, 132,4, 132,4, 132,3, 131,0, 126,5, 121,0, 118,3, 112,1, 20,8
Пример 4
4-(6-Амино-5-нитро-2-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 104)
Общая процедура: 2
Исходное соединение II: 2-амино-6-хлор-3-нитропиридин (0,69 г, 4,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,98 г, 4,0 ммоль)
Растворитель: ДМСО (15 мл)
Основание: t-BuOK (0,90 г, 8,0 ммоль) в ДМСО (25 мл)
Время реакции: 48 ч
Температура реакции: 150°С
Очистка: Хроматография с использованием смеси СН2Cl2:EtOAc, 50:1-30:1
Продукт: соединение 104, 0,58 г кристаллического соединения.
13С ЯМР (ДМСО): δ 195,9, 157,7, 154,7, 143,5, 138,0, 137,4, 135,7, 131,9, 131,8, 131,5, 131,4, 129,9, 125,8, 119,9, 119,5, 117,5, 103,2, 20,2
Пример 5
6-Хлор-2-(3-хлор-4-(2-метилбензоил)фениламино)изоникотиновая кислота (соединение 105)
Общая процедура: 2
Исходное соединение II: 2,6-дихлор-4-цианопиридин (0,70 г, 4,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,98 г, 4,0 ммоль)
Растворитель: ДМСО (15 мл)
Основание: t-BuOK (0,90 г, 8,0 ммоль) в ДМСО (25 мл)
Время реакции: 48 ч
Температура реакции: 150°С
Очистка: Хроматография с использованием смеси EtOAc:МеОН, 5:1
Продукт: соединение 105, 0,52 г масла, цианозаместитель был гидролизован в процессе реакции или обработки.
13С ЯМР (ДМСО): δ 195,7, 166,6, 154,8, 150,5, 147,2, 145,0, 138,4, 137,0, 132,3, 132,1, 131,2, 131,1, 129,5, 129,4, 125,7, 118,0, 115,6, 114,8, 111,3, 20,0
Пример 6
4-(6-Карбонитрил-2-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 106)
Общая процедура: 2
Исходное соединение II: 2-хлор-3-циано-пиридин (0,28 г, 2,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,49 г, 2,0 ммоль)
Растворитель: ДМСО (10 мл)
Основание: t-BuOK (0,45 г, 4,0 ммоль) в ДМСО (20 мл)
Время реакции: 18 ч
Температура реакции: 150°С
Очистка: Хроматография с использованием смеси EtOAc:петролейный эфир, 1:1-1:0
Продукт: соединение 106, 0,07 г кристаллического соединения.
13С ЯМР (CDCl3): δ 195,9, 155,5, 144,3, 142,9, 142,1, 140,3, 140,0, 136,0, 133,2, 132,6, 132,1, 131,8, 131,1, 128,8, 125,7, 125,3, 115,7, 105,7, 102,4, 21,3
Пример 7
2-Хлор-2'-метил-4-(3-пиридиламино)бензофенон (соединение 107)
Общая процедура: 1
Исходное соединение II: 3-хлор-пиридин (1,18 мл, 12,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (2, 95 г, 12,0 ммоль)
Растворитель: толуол (60 мл)
Основание: t-BuONa
Время реакции: 45 ч
Температура реакции: 110°С
Очистка: Хроматография с использованием смеси СН2Cl2:ацетона, 4:1
Продукт: соединение 107, 2,05 г кристаллического соединения.
13С ЯМР (CDCl3): δ 196,5, 146,8, 144,4, 142,7, 138,7, 138,1, 134,9, 133,3, 131,4, 131,1, 130,4, 129,9, 127,1, 125,4, 124,0, 117,0, 113,4, 20,5
Пример 8
2-Хлор-4-(5,6-диамино-2-пиридиламино)-2'-метилбензофенон (соединение 108)
Соединение 104 (0,38 г, 1,0 ммоль) растворяют в EtOH (10 мл) и в ДМФ (10 мл). Затем добавляют SnCl2 ·H2O (1,12 г, 5,0 ммоль) и раствор перемешивают при 90°С в течение 20 ч. Реакционную смесь выливают в воду со льдом (100 мл), добавляют 2 н. NaOH (50 мл) и водную фазу экстрагируют EtOAc (50 мл) и Et2О (2×50 мл). Объединенные органические фазы промывают насыщенным водным NaCl (50 мл), сушат (Na2SO4), фильтруют и концентрируют в вакууме. Остаток очищают с помощью флеш-хроматографии, EtOAc:петролейный эфир, 2:1 - 1:0.
Продукт: соединение 108, 0,05 г масла
13С ЯМР (ДМСО): δ 196,7, 148,9, 146,2, 145,6, 139,2, 137,9, 134,6, 133,1, 131,2, 130,8, 129,7, 129,2, 126,7, 125,4, 122,5, 117,4, 114,0, 102,1, 20,4
Пример 9
2-Хлор-2'-метил-4-(3-нитро-2-пиридиламино)бензофенон (Соединение 109)
2-Хлор-3-нитро-пиридин (0,32 г, 2,0 ммоль) и 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,49 г, 2,0 ммоль) тщательно смешивают. Реакционную смесь нагревают при 100°С в течение 0,5 ч, а затем при 160°С в течение 0,5 ч. Реакционную смесь охлаждают до комнатной температуры и растворяют в насыщенном водном NaHCO3 (10 мл) и EtOAc (30 мл). Фазы разделяют и органическую фазу промывают насыщенным водным NaHCO3 (10 мл), сушат (MgSO4), фильтруют и концентрируют в вакууме. Очистку проводят с помощью флеш-хроматографии с использованием смеси EtOAc:петролейный эфир, 1:7. Продукт: соединение 109, 0,26 г кристаллического соединения, которое было перекристаллизовано из Et2О.
13С ЯМР (CDCl3): δ 196,6, 154,8, 149,2, 141,4, 138,9, 137,9, 135,6, 134,2, 133,4, 131,6, 131,6, 131,5, 130,6, 129,4, 125,5, 122,5, 119,0, 115,3, 20,9
Пример 10
4-(3-Амино-2-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 110)
Соединение 109 (0,15 г, 0,4 ммоль) суспендируют в EtOH (10 мл) и SnCl2·H2O (0,46 г, 2,0 ммоль). Реакционную смесь перемешивают при 70°С в течение 1 ч, после чего выливают в воду со льдом (50 мл). Затем добавляют 2 н. NaOH (50 мл) и водную фазу экстрагируют EtOAc (3×20 мл). Объединенные органические фазы сушат (MgSO4), фильтруют и концентрируют в вакууме. Очистку проводят флеш-хроматографией с использованием смеси EtOAc:петролейный эфир, 2:3.
Продукт: соединение 110, 0,12 г масла.
13С ЯМР (CDCl3): δ 196,9, 145,3, 143,9, 139,2, 138,9, 138,1, 134,2, 132,7, 131,7, 131,3, 131,0, 130,3, 130,0, 125,4, 124,6, 118,8, 118,5, 114,9, 20,5
Пример 11
4-(5-Амино-2-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 111)
Соединение 103 (0,07 г, 0,19 ммоль) суспендируют в EtOH (5 мл) и SnCl2

Продукт: соединение 111, 0,038 г масла.
13С ЯМР (CDCl3): δ 196,7, 146,3, 146,0, 139,1, 137,9, 137,6, 135,1, 134,6, 133,1, 131,3, 130,9, 129,8, 129,6, 125,5, 125,4, 117,3, 113,9, 112,7, 20,5
Пример 12
2-Хлор-2'-метил-4-((2-пиридил-N-оксид)амино)бензофенон (соединение 112)
Общая процедура: 5
Исходное соединение I: соединение 102 (0,16 г, 0,5 ммоль)
Время реакции: 1 ч
Очистка хроматографией с использованием смеси EtOAc:МеОН, 8:1
Продукт: соединение 112, 0,098 г кристаллического соединения, которое может быть перекристаллизовано из МеОН
13С ЯМР (ДМСО): δ 195,8, 146,0, 142,8, 137,7, 137,5, 132,2, 132,0, 131,8, 131,6, 131,4, 130,0, 127,0, 125,8, 121,0, 117, 7, 116,1, 109,8, 20,2
Пример 13
2-Хлор-2'-метил-4-((3-пиридил-N-оксид)амино)бензофенон (соединение 113)
Общая процедура: 5
Исходное соединение I: соединение 107 (0,18 г, 0,54 ммоль)
Время реакции: 2 ч
Очистка хроматографией с использованием смеси EtOAc:МеОН, 7:1
Продукт: соединение 113, 0,12 г кристаллического соединения,
13С ЯМР (CD3OD): δ 198,5, 146,6, 143,7, 139,7, 139,4, 135,4, 134,0, 133,2, 133,0, 132,7, 132,6, 131,2, 130,4, 128, 1, 126,8, 120,0, 119,6, 116,5, 20,8
Пример 14
2-Хлор-4-(4-изохинолиламино)-2'-метилбензофенон
(соединение 114)
Общая процедура: 1
Исходное соединение II: 4-бромо-изохинолин (0,42 г, 2,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,49 г, 2,0 ммоль)
Растворитель: 1,4-диоксан (6 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 100°С
Очистка: Хроматография с использованием смеси СН2Cl2:ацетона, 10:1
Продукт: соединение 114, 0,64 г аморфного соединения.
13С ЯМР (CDCl3): δ 196,6, 150,1, 149,3, 139,0, 138,6, 137,9, 135,1, 133,5, 132,1, 131,3, 131,1, 130,9, 130,8, 129,7, 129,3, 129,3, 128,2, 127,9, 125,4, 121,6, 116,3, 112,6, 20,5
Пример 15
трет-Бутил-5-(3-хлор-4-(2-метилбензоил)фениламино)никотиноат (соединение 115)
5-Бромникотиновую кислоту (4,7 г, 23 ммоль) добавляют к 7 мл конденсированного изобутилена в СН2 Cl2 (15 мл), а затем добавляют конц. H2SO4 (0,75 мл). Реакционную смесь перемешивают в сосуде с завинчивающейся крышкой в течение 24 часов при комнатной температуре, а затем выливают в насыщенный водный NaHCO3 (100 мл). Водную фазу экстрагируют EtOAc (100 мл), органическую фазу промывают NaHCO3, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией с использованием смеси EtOAc:петролейный эфир, 1:10 в качестве элюента.
Продукт: трет-бутил-5-бромникотиноат, кристаллическое соединение
13С ЯМР (CDCl3): δ 163,06, 154,02, 148,85, 139,38, 129,10, 120,48, 82,82, 28,12
Общая процедура 1:
Исходное соединение II: трет-бутил-5-бромникотиноат (0,12 г, 0,45 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,13 г, 0,53 ммоль)
Растворитель: толуол (3 мл)
Основание: t-BuONa
Время реакции: 12 ч
Температура реакции: 100°С
Очистка: Хроматография с использованием смеси EtOAc:петролейный эфир, 1:2
Продукт: соединение 115, 0,035 г масла.
13С ЯМР (CDCl3): δ 196,7, 164,1, 146,1, 145,1, 144, 8, 138,5, 138,2, 137,4, 134,8, 133,2, 131,5, 131,3, 131,0, 130,1, 128,4, 126,9, 125,5, 117,7, 113,7, 82,5, 28,1, 20,6
Пример 16
2-Хлор-2'-метил-4-(4-метил-3-пиридиламино)бензофенон (соединение 116)
Общая процедура: 1
Исходное соединение II: 3-бром-4-метилпиридин (0,172 г, 1,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 110°С
Очистка: Хроматография с использованием смеси EtOAc:петролейный эфир, 1:3-1:1
Продукт: соединение 116, 0,08 г масла.
13С ЯМР (CDCl3): δ 196,5, 148,5, 146,5, 146,1, 142,1, 139,0, 138,0, 135,4, 135,1, 135,5, 131,3, 131,0, 129,8, 129,3, 125,9, 125,4, 116,0, 112,3, 20,5, 17,5
Пример 17
2-Хлор-2'-метил-4-(6-метил-3-пиридиламино)бензофенон (соединение 117)
Общая процедура: 1
Исходное соединение II: 5-бром-2-метилпиридин (0,172 г, 1,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 110°С
Очистка: Хроматография с использованием смеси EtOAc:петролейный эфир, 1:4-1:2
Продукт: соединение 117, 0,15 г масла.
1Н ЯМР (CDCl3): δ 8,37 (д, 1Н), 7,45 (дд, 1Н), 7,4-7,15 (м, 6Н), 6,93 (д, 1Н), 6,78 (дд, 1Н), 6,29 (с, 1Н), 2,54 (с, 3Н), 2,44 (с, 3Н)
Пример 18
4-(5-Бром-3-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 118)
Общая процедура: 1
Исходное соединение II: 3,5-дибром-пиридин (0,237 г, 1,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 5 ч
Температура реакции: 110°С
Очистка: Хроматография с использованием смеси ацетон:СН2Cl2, 1:10
Продукт: соединение 118, 0,05 г масла.
13 С ЯМР (CDCl3): δ 196,6, 145,4, 144,7, 139,9, 138,6, 138,4, 138,3, 134,8, 133,0, 131,6, 131,6, 131,4, 130,2, 128,3, 125,5, 120,8, 118,1, 114,3, 20,7
Пример 19
4-(5-Карбонитрил-3-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 119)
Общая процедура: 1
Исходное соединение II: 5-бромникотинонитрил (0,22 г, 1,2 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: толуол (5 мл)
Основание: Cs2CO3
Время реакции: 18 ч
Температура реакции: 100°С
Очистка: Хроматография с использованием смеси EtOAc:петролейный эфир, 1:2
Продукт: соединение 119, 0,11 г масла.
13С ЯМР (ДМСО): δ 195,6, 145,8, 144,5, 144,5, 138,4, 138,1, 137,1, 133,0, 131,3, 131,3, 129,8, 129,5, 126,6, 125,8, 117,3, 116,9, 114,2, 109,3, 20,1
Пример 20
4-(3-Бром-2-пиридиламино)-2-хлор-2'-метилбензофенон (соединение 120)
Общая процедура: 1
Исходное соединение II: 3-бром-2-хлор-пиридин (0,23 г, 1,2 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 100°С
Очистка: Обращенно-фазовая ВЭЖХ (0,1% TFA в H2O):(0,1% TFA в 90% СН3CN + 10% H2O), 1:1-0:1
Продукт: соединение 120.
13С ЯМР (CDCl3): δ 196,7, 150,8, 146,5, 143,3, 140,6, 138,5, 133,8, 132,1, 131,5, 131,3, 130,3, 125,4, 119,9, 117,2, 116,4, 107,0, 20,7
Пример 21
2-Хлор-2'-метил-4-(8-хинолиламино)бензофенон (соединение 121)
Общая процедура: 1
Исходное соединение II: 8-бром-хинолин (0,16 мл, 1,25 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,28 г, 1,14 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 100°С
Очистка: Флеш-хроматография с использованием смеси Et2О:петролейный эфир, 1:3
Продукт: соединение 121, 0,28 г кристаллического соединения, которое было перекристаллизовано из Et2О.
13С ЯМР (CDCl3): δ 196,5, 147,9, 145,9, 139,0, 138,9, 138,1, 137, 7, 136,4, 134,7, 133,1, 131,4, 131,0, 130,6, 129,9, 128,8, 127,0, 125,4, 121,9, 119,1, 118,7, 115,3, 110,7, 20,6
Пример 22
2-Хлор-4-(6-этокси-3-пиридиламино)-2'-метилбензофенон (соединение 122)
Общая процедура: 1
Исходное соединение II: 5-бром-2-этокси-пиридин (0,24 г, 1,2 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 100°С
Очистка: Обращенно-фазовая ВЭЖХ
Продукт: соединение 122
1Н ЯМР (CDCl3): δ 8,09 (д, 1Н), 7,54 (дд, 1Н), 7,40-7,20 (м, 5Н), 6,80 (м, 2Н), 6,66 (дд, 1Н), 4,35 (кв, 2Н), 2,43 (с, 3Н), 1,42 (т, 3Н)
Пример 23
4-(4-Бром-1-изохинолиламино)-2-хлор-2'-метилбензофенон (соединение 123)
Общая процедура: 1
Исходное соединение II: 4-бром-1-хлоризохинолин (0,14 г, 0,5 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,13 г, 0,56 ммоль)
Растворитель: 1,4-диоксан (3 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 100°С
Очистка: Обращенно-фазовая ВЭЖХ
Продукт: соединение 123.
1Н ЯМР (CDCl3): δ 8,24 (с, 1Н), 8,18 (д, 1Н), 8,00 (д, 1Н), 7,85 (т, 1Н), 7,77 (д, 1Н), 7,65 (т, 1Н), 7,45-7,35 (м, 4Н), 7,28 (д, 1Н), 7,20 (т, 1н), 2,52 (с, 3Н)
Пример 24
2-Хлор-2'-метил-4-(2-метил-5-трифторметил-3-пиридиламино)бензофенон (соединение 124)
Общая процедура: 1, без Pd2(dba)3 и BINAP
Исходное соединение II: 3-хлор-2-метил-5-(трифторметил)пиридин (0,20 г, 1,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Катализатор: Pd(Р(циклогексил)3)2Cl2 (30 мг, 0,04 ммоль)
Время реакции: 18 ч
Температура реакции: 110°С
Очистка: Обращенно-фазовая ВЭЖХ
Продукт: соединение 124
13С ЯМР (CDCl3): δ 196,4, 152,6, 144,5, 138,8, 137,9, 137,5, 137,2, 134,8, 133,0, 132,9, 131,7, 130,4, 125,6, 123,8, 119,4, 115,4, 20,8, 19,5
Пример 25
2-Хлор-2'-метил-4-(3-хинолиламино)бензофенон (соединение 125)
Общая процедура: 1
Исходное соединение II: 3-бром-хинолин (0,23 г, 1,1 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 100°С
Очистка флеш-хроматографией с использованием смеси EtOAc:петролейный эфир, 2:3
Продукт: соединение 125, 0,23 г аморфного соединения.
13С ЯМР (CDCl3): δ 196,5, 146,6, 146,1, 144,9, 138,7, 138,2, 135,0, 134,2, 133,3, 131,4, 131,2, 130,7, 130,0, 129,2, 128,4, 128,0, 127,5, 126,9, 125,5, 122,4, 117,2, 113,6, 20,6
Пример 26
2-Хлор-4-(4-этокси-3-пиридиламино)-2'-метилбензофенон (соединение 126)
Общая процедура: 1
Исходное соединение II: 3-бром-4-этоксипиридин (0,22 г, 1,1 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (6 мл)
Основание: t-BuONa
Время реакции: 7 ч
Температура реакции: 100°С
Очистка флеш-хроматографией с использованием смеси EtOAc:петролейный эфир, 1:3-1:0, а затем обращенно-фазовой ВЭЖХ
Продукт: соединение 126, масло.
13С ЯМР (CDCl3): δ 196,3, 158,5, 142,6, 138,9, 137,5, 136,5, 134,3, 134,1, 132,5, 131,9, 131,8, 131,6, 130,7, 126,8, 125,7, 120,8, 116,8, 107,7, 66,9, 20,9, 14,2
Пример 27
2-Хлор-4-(2-этокси-3-пиридиламино)-2'-метилбензофенон (соединение 127)
Общая процедура: 1
Исходное соединение II: 3-бром-2-этоксипиридин (0,22 г, 1,1 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (6 мл)
Основание: t-BuONa
Время реакции: 3 ч
Температура реакции: 100°С
Очистка флеш-хроматографией с использованием смеси EtOAc:петролейный эфир, 1:5
Продукт: соединение 127, 0,20 г масла.
13С ЯМР (CDCl3): δ 196,4, 154,1, 145,9, 138,8, 138,7, 138,2, 134,8, 133,1, 131,4, 131,1, 130,5, 129,9, 125, 4, 125,2, 122,8, 117,8, 116,6, 114,3, 62,2, 20,5, 14,7
Пример 28
2-Хлор-4-((4-изохинолил-N-оксид)амино)-2'-метилбензофенон (соединение 128)
Общая процедура: 5
Исходное соединение I: соединение 114 (0,37 г, 1,0 ммоль)
Время реакции: 2 ч
Очистка хроматографией с использованием смеси EtOAc:МеОН, 8:1,
Продукт: соединение 128, 0,22 г кристаллического соединения.
13С ЯМР (ДМСО): δ 195,5, 147,5, 138,3, 137,0, 136,0, 132,9, 131,2, 131,2, 130,9, 129,9, 129,7, 129,5, 127,9, 125,7, 125,3, 123,4, 122,1, 117,7, 114,6, 20,0
Пример 29
2-Хлор-2'-метил-4-(2-метил-6-хинолиламино)бензофенон (соединение 129)
Общая процедура: 1
Исходное соединение II: 6-бромхиналдин (0,24 мл, 1,1 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (6 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 100°С
Очистка флеш-хроматографией с использованием смеси EtOAc:петролейный эфир, 1:1
Продукт: соединение 129, 0,27 г масла.
13С ЯМР (CDCl3): δ 196,6, 157, 7, 147,3, 144,9, 139,0, 138,0, 137,9, 135,2, 135,0, 133,4, 131,3, 131,0, 130,2, 129,9, 129,8, 127,3, 125,4, 124,6, 122,7, 117,1, 115,2, 113,5, 25,1, 20,5
Пример 30
2-Хлор-4-(7-хлор-4-хинолиламино)-2'-метилбензофенон (соединение 130)
4,7-Дихлорхинолин (0,20 г, 1,0 ммоль) растворяют в изо-PrOH (10 мл) и добавляют 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,27 г, 1,1 ммоль). Реакционную смесь перемешивают при кипячении с обратным холодильником в течение 2 ч, а затем выливают в насыщенный водный NaHCO3 (30 мл). Водную фазу экстрагируют EtOAc (3х30 мл), объединенные органические фазы промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и концентрируют в вакууме. Очистку проводят флеш-хроматографией с использованием смеси EtOAc:петролейный эфир, 1:3-1:1.
Продукт: соединение 130, 0,28 г кристаллического соединения.
13С ЯМР (ДМСО): δ 195,67, 152,08, 149,58, 145,60, 145,01, 137,84, 137,39, 134,19, 132,34, 132,26, 131,50, 131,39, 129,82, 127,78, 125,76, 125,65, 124,51, 120,52, 119,25, 117,52, 105,38, 20,13
Пример 31
2-Хлор-2'-метил-4-(2-хинолиламино)бензофенон (соединение 131)
2-Хлорхинолин (0,16 г, 1,0 ммоль) растворяют в изо-PrOH (10 мл) и добавляют 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,27 г, 1,1 ммоль). Реакционную смесь перемешивают при кипячении с обратным холодильником в течение 18 ч, реакционную смесь обрабатывают как описано в методе синтеза соединения 130. Очистку проводят флеш-хроматографией с использованием смеси EtOAc:петролейный эфир, 1:4.
Продукт: соединение 131, 0,24 г масла.
13С ЯМР (CDCl3): δ 196,9, 152,6, 147,1, 144,1, 138,6, 138,4, 138,1, 134,0, 132,4, 131,6, 131,4, 131,2, 130,2, 130,1, 127,4, 127,3, 125,5, 124,5, 124,1, 119,8, 116,1, 112,9, 20,7
Пример 32
2-Хлор-2'-метил-4-(4-хинолиламино)бензофенон (соединение 132)
4-Хлорхинолин (0,16 г, 1,0 ммоль) растворяют в изо-PrOH (10 мл) и добавляют 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,27 г, 1,1 ммоль). Реакционную смесь перемешивают при кипячении с обратным холодильником в течение 18 ч, а затем выливают в насыщенный водный NaHCO3 (30 мл). Водную фазу экстрагируют EtOAc (3х30 мл), объединенные органические фазы промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и концентрируют в вакууме. Очистку проводят флеш-хроматографией с использованием смеси EtOAc:петролейный эфир, 1:3-1:1.
Продукт: соединение 132, 0,16 г аморфного соединения.
13С ЯМР (CDCl3): δ 196,58, 150, 79, 149,37, 145,25, 144,37, 138,74, 137,98, 134,30, 133,22, 132,51, 131,67, 131,61, 130,45, 130,28, 129,84, 126,10, 125,54, 121,10, 120,75, 120,07, 117,54, 105,43, 20,80
Пример 33
2-Хлор-2'-метил-4-(1-метил-7-индолиламино)бензофенон (соединение 133)
7-Броминдол (0,37 г, 1,9 ммоль) растворяют в сухом ДМФ. Затем добавляют К2СО3 (0,52 г, 3,8 ммоль) и метилиодид (0,13 мл, 2,08 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 дней, после чего добавляют H2O (20 мл), водную фазу экстрагируют Et2О (3х20 мл), объединенные органические фазы промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают хроматографией с использованием смеси EtOAc:петролейный эфир, 1:20, в качестве элюента, в результате чего получают 7-бром-1-метилиндол в виде кристаллического соединения.
13С ЯМР (CDCl3): δ 133,07, 131,75, 126,54, 120,46, 120,34, 103,89, 101,18, 36,84
Получение соединения 133:
Общая процедура: 1
Исходное соединение II: 7-бром-1-метилиндол (0,23 г, 1,1 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (6 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 100°С
Очистка хроматография с использованием смеси EtOAc:петролейный эфир, 1:3
Продукт: соединение 133, 0,23 г аморфного соединения.
13С ЯМР (CDCl3): δ 196,55, 151,82, 139,37, 137,71, 135,36, 133,85, 132,97, 131,62, 131,19, 131,05, 130,68, 129,50, 127,92, 125,30, 123,76, 121,83, 120,53, 120,19, 115,06, 111,34, 101,50, 35,49, 20,35
Пример 34
2-Хлор-2'-метил-4-(1-метил-5-индолиламино)бензофенон (соединение 134)
5-Бром-1-метилиндол получают из 5-броминдола как описано для получения 7-бром-1-метилиндола из 7-броминдола. Очистку проводят хроматографией с использованием смеси EtOAc:петролейный эфир, 1:10.
13С ЯМР (CDCl3): δ 135,37, 130,12, 129,94, 124,30, 123,27, 112,66, 110, 63, 100,53, 32,96
Получение соединения 134:
Общая процедура: 1
Исходное соединение II: 5-бром-1-метилиндол (0,23 г, 1,1 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (6 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 100°С
Очистка: хроматография с использованием смеси EtOAc:петролейный эфир, 1:3
Продукт: соединение 134, 0,12 г кристаллического соединения.
13С ЯМР (CDCl3): δ 7,45 (д, 1Н), 7,36-7,18 (м, 6Н), 7,08 (д, 1Н), 7,06 (дд, 1Н), 6,82 (д, 1Н), 6,66 (дд, 1Н), 6,45 (дд, 1Н), 6, 01 (с, 1Н), 3,80 (с, 3Н), 2,41 (с, 3Н)
Пример 35
2-Хлор-2',5'-диметил-4-(4-метил-3-пиридиламино)бензофенон (соединение 135)
Общая процедура 1
Исходное соединение II: 3-бром-4-метилпиридин (0,092 г, 0,5 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'5'-диметилбензофенон (0,134 г, 0,5 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси СН2Cl2:ацетон, 9:1
Продукт: соединение 135, 0,078 г масла.
13С ЯМР (CDCl3): δ 196,7, 148,4, 146, 5, 146,0, 142,1, 138,9, 135,5, 135,1, 134,9, 134,8, 133,5, 131,7, 131,2, 130,1, 129,4, 125,9, 116,0, 112,3, 20,8, 19,9, 17,5
Пример 36
2-Хлор-2', 5'-диметил-4-(4-изохинолиламино)бензофенон (соединение 136)
Общая процедура: 1
Исходное соединение II: 4-бромизохинолин (0,103 г, 0,49 ммоль)
Исходное соединение III: 4-амино-2-хлор-2',5'-диметилбензофенон (0,131 г, 0,5 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 4 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:1
Продукт: соединение 136, 0,18 г кристаллического соединения.
13С ЯМР (CDCl3): δ 196,8, 150,1, 149,2, 139,0, 138,6, 135,1, 134,9, 134,8, 133,5, 132,1, 131,7, 131,2, 131,1, 130,8, 130,1, 129,4, 129,3, 128,2, 127,9, 121,6, 116,4, 112,6, 20,8, 20,0
Пример 37
2-Хлор-4-(4-изохинолиламино)-2',4',5'-триметилбензофенон (соединение 137)
Общая процедура: 1
Исходное соединение II: 4-бромизохинолин (0,103 г, 0,49 ммоль)
Исходное соединение III: 4-амино-2-хлор-2',4',5'-триметилбензофенон (0,148 г, 0,5 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси СН2Cl2:ацетон, 9:1
Продукт: соединение 137, 0,16 г кристаллического соединения.
13С ЯМР (CDCl3): δ 196,6, 149,9, 148,9, 140,3, 138,3, 136,2, 135,8, 134,6, 133,5, 133,0, 132,8, 132,0, 131,5, 131,3, 130,7, 130,0, 129,3, 128,1, 127,8, 121,6, 116,4, 112,7, 20,1, 19,7, 19, 1
Пример 38
2,3'-Дихлор-2'-метил-4-(4-метил-3-пиридиламино)бензофенон (соединение 138)
Общая процедура: 1
Исходное соединение II: 3-бром-4-метилпиридин (0,095 г, 0,5 ммоль)
Исходное соединение III: 4-амино-2,3'-дихлор-2'-метилбензофенон (0,144 г, 0,5 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси СН2 Cl2:ацетон, 9:1
Продукт: соединение 138, 0,09 г масла.
13С ЯМР (CDCl3): δ 195,3, 149,2, 146,8, 146,4, 142,5, 142,0, 135,9, 135,8, 135,1, 134,9, 134,3, 131,2, 127,9, 126,9, 126,4, 126,0, 116,0, 112,1, 17,5, 17,1
Пример 39
2-Фтор-2'-метил-4-(4-метил-3-пиридиламино)бензофенон (соединение 139)
Общая процедура: 1
Исходное соединение II: 3-бром-4-метилпиридин (0,092 г, 0,5 ммоль)
Исходное соединение III: 4-амино-2-фтор-2'-метилбензофенон (0,120 г, 0,5 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:1
Продукт: соединение 139, 0,02 г масла.
13С ЯМР (CDCl3): δ 194,3, 163, 7, 151,3, 146,8, 146,6, 142,8, 140,3, 136,3, 135,2, 134,0, 130,9, 130,2, 128,1, 126,0, 125,3, 117,9, 109,9, 101,1, 19,9, 17,4
Пример 40
2, 4'-Дихлор-2'-метил-4-(4-метил-3-пиридиламино)бензофенон (соединение 140)
Общая процедура: 1
Исходное соединение II: 3-бром-4-метилпиридин (0,086 г, 0,5 ммоль)
Исходное соединение III: 4-амино-2,3'-дихлор-2'-метилбензофенон (0,132 г, 0,47 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси СН2Cl2:ацетон, 9:1
Продукт: соединение 140, 0,12 г масла.
13С ЯМР (CDCl3): δ 195,4, 148,7, 146,7, 146,2, 142,2, 140,1, 137,4, 136,8, 135,3, 135,2, 133,4, 131,3, 131,1, 128,9, 125,9, 125,6, 115,8, 112,4, 20,4, 17,5
Пример 41
2-Хлор-4'-фтор-4-(4-изохинолиламино)-2'-метилбензофенон (соединение 141)
Общая процедура: 1
Исходное соединение II: 4-бромизохинолин (0,104 г, 0,5 ммоль)
Исходное соединение III: 4-амино-2-хлор-4'-фтор-2'-метилбензофенон (0,140 г, 0,53 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси СН2Cl2:ацетон, 9:1
Продукт: соединение 141, 0,13 г кристаллического соединения.
13С ЯМР (CDCl3): δ 195,4, 164,0, 150,3, 149,3, 141,8, 138,7, 135,0, 134,9, 133,1, 132,4, 132,4, 131,0, 130,8, 129,4, 129,3, 128,2, 127,9, 121,6, 118,2, 116,2, 112,7, 112,3, 20,8
Пример 42
4'-н-Бутил-2-хлор-4-(4-изохинолиламино)-2'-метилбензофенон (соединение 142)
Общая процедура: 1
Исходное соединение II: 4-бромизохинолин (0,104 г, 0,5 ммоль)
Исходное соединение III: 4-амино-2'-н-бутил-2-хлор-2'-метилбензофенон (0,150 г, 0,5 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси СН2Cl2:ацетон, 9:1
Продукт: соединение 142, 0,17 г масла.
13С ЯМР (CDCl3): δ 196,4, 150,0, 148,8, 146,7, 138,6, 138,5, 136,0, 134,7, 133,0, 132,1, 131,7, 131,2, 130, 8, 130,7, 130,1, 129,3, 128,2, 127,9, 125,4, 121,6, 116,3, 112,7, 35,6, 33,3, 22,4, 20,8, 13,9
Пример 43
2-Хлор-4-(5-изохинолиламино)-2'-метилбензофенон
(соединение 143)
Общая процедура: 1
Исходное соединение II: 5-бромизохинолин (0,104 г, 0,5 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (0,122 г, 0,5 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси СН2Cl2:ацетон, 9:1
Продукт: соединение 143, 0,16 г масла.
13С ЯМР (CDCl3): δ 196,6, 153,0, 148,7, 143,4, 138,9, 138,0, 135,5, 135,0, 133,5, 131,6, 131,3, 131,0, 129,8, 129,5, 127,4, 125,4, 124,8, 123,8, 116,6, 115,1, 113,0, 20,5
Пример 44
2-Хлор-4-(4-изохинолиламино)-4'-метокси-2'-метилбензофенон (соединение 144)
Общая процедура: 1
Исходное соединение II: 4-бромизохинолин (0,104 г, 0,5 ммоль)
Исходное соединение III: 4-амино-2-хлор-4'-метокси-2'-метилбензофенон (0,136 г, 0,5 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси СН2 Cl2:ацетон, 9:1
Продукт: соединение 144, 0,19 г кристаллического соединения.
13С ЯМР (CDCl3): δ 195,5, 161,9, 149,9, 148,5, 142, 0, 138,3, 134,2, 133,7, 132,4, 132,0, 131,4, 130,9, 130,7, 129,3, 128,2, 127,8, 121,6, 117,1, 116,3, 112,9, 110,4, 55,3, 21,5
Пример 45
2-Фтор-4-(4-изохинолиламино)-4'-метокси-2'-метилбензофенон (соединение 145)
Общая процедура: 1
Исходное соединение II: 4-бромизохинолин (0,103 г, 0,5 ммоль)
Исходное соединение III: 4-амино-2-фтор-4'-метокси-2'-метилбензофенон (0,130 г, 0,5 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:1, а затем перекристаллизация из EtOAc
Продукт: соединение 145, 0,07 г кристаллического соединения.
1Н ЯМР (ДМСО-D6): δ 9,18 (с, 1Н), 9,13 (с, 1Н), 8,54 (с, 1Н), 8,20 (д, 1Н), 8,03 (д, 1Н), 7,83 (т, 1Н), 7,75 (т, 1Н), 7,42 (т, 1Н), 7,30 (д, 1Н), 6,87 (д, 1Н), 6,81 (дд, 1Н), 6,77 (дд, 1Н), 6,58 (дд, 1Н), 3,80 (с, 3Н), 2,34 (с, 3Н)
Пример 46
2,4'-Дихлор-2'-метил-4-(1-метил-7-индолиламино)бензофенон (соединение 146)
Общая процедура: 1
Исходное соединение II: 7-бром-1-метилиндол (0,115 г, 0,55 ммоль), полученный как описано в примере 33
Исходное соединение III: 4-амино-2,4'-дихлор-2'-метилбензофенон (0,140 г, 0,5 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:3
Продукт: соединение 146, 0,08 г кристаллического соединения.
13С ЯМР (CDCl3): δ 195,5, 152,1, 139,8, 137,8, 136,5, 135,4, 133,8, 132,9, 131,6, 131,2, 131,1, 130,8, 127,5, 125,5, 123,6, 121,8, 120,6, 120,2, 115,0, 111,4, 101,5, 35,5, 20,2
Пример 47
2-Хлор-4-(1-метил-7-индолиламино)-2',4', 5'-триметилбензофенон (соединение 147)
Общая процедура: 1
Исходное соединение II: 7-бром-1-метилиндол (0,115 г, 0,55 ммоль), полученный как описано в примере 33
Исходное соединение III: 4-амино-2-хлор-2',4',5'-триметилбензофенон (0,137 г, 0,5 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:3
Продукт: соединение 147, 0,097 г кристаллического соединения.
13С ЯМР (CDCl3): δ 196,6, 151,5, 140,0, 136,6, 135,5, 135,0, 133,5, 133,4, 133,0, 132,7, 131,6, 131,3, 131,0, 128, 6, 124,0, 121,8, 120,4, 120,2, 115,0, 111,3, 101,5, 35,5, 20,0, 19,7, 19,1
Пример 48
2-Хлор-2',5'-диметил-4-(1-метил-7-индолиламино)бензофенон (соединение 148)
Общая процедура: 1
Исходное соединение II: 7-бром-1-метилиндол (0,115 г, 0,55 ммоль), полученный как описано в примере 33
Исходное соединение III: 4-амино-2-хлор-2',5'-диметилбензофенон (0,148 г, 0,5 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:3
Продукт: соединение 148, 0,30 г кристаллического соединения.
1Н ЯМР (CDCl3): δ 7,56 (д, 1Н), 7,28 (д, 1Н), 7,17-7,02 (м, 4Н), 6,98 (д, 1Н), 6,95 (д, 1Н), 6,61 (д, 1Н), 6,50 (д, 1Н), 6,42 (дд, 1Н), 5,93 (с, шир, 1Н), 3,81 (с, 3Н), 2,32 (с, 3Н), 2,27 (с, 3Н)
Пример 49
2-Хлор-4-(3-этокси-4-изохинолиламино)-2'-метилбензофенон (соединение 149)
Общая процедура: 1
Исходное соединение II: 4-бром-3-этоксиизохинолин (0,097 г, 0,39 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,095 г, 0,39 ммоль)
Растворитель: 1,4-диоксан (3 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:3
Продукт: соединение 149, 0,11 г кристаллического соединения.
13С ЯМР (CDCl3): δ 196,6, 155,1, 149,9, 147,4, 139,3, 137,8, 134,8, 133,3, 131,2, 130,7, 130,5, 129,6, 128,7, 128,1, 125,6, 125,3, 124,5, 121,9, 116,2, 113,9, 112,4, 62,7, 20,4, 15,0
Пример 50
2-Хлор-4-(1-этокси-4-изохинолиламино)-2'-метилбензофенон (соединение 150)
Общая процедура: 1
Исходное соединение II: 4-бром-1-этоксиизохинолин (0,097 г, 0,39 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,095 г, 0,39 ммоль)
Растворитель: 1, 4-диоксан (3 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:3
Продукт: соединение 150, 0,11 г кристаллического соединения.
13С ЯМР (CDCl3): δ 196,5, 159,7, 151,2, 139,4, 138,5, 137,7, 135,5, 135,3, 133,8, 131,2, 131,0, 130,7, 129,5, 128,0, 127,1, 125,3, 125,0, 124,6, 121,8, 120,3, 115,1, 111,4, 62,4, 20,4, 14,6
Пример 51
4-(2-Бензоксазолиламино)-2-хлор-2'-метилбензофенон
(соединение 151)
Общая процедура: 1
Исходное соединение II: 2-хлорбензоксазол (0,35 мл, 3,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,49 г, 2,0 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:4
Продукт: соединение 151, 0,17 г кристаллического соединения.
13С ЯМР (CDCl3): δ 196,9, 157,3, 147,8, 141,4, 141,3, 138,7, 138,0, 134,0, 133,1, 132,2, 131,6, 130,6, 125,5, 124,7, 124,5, 122,6, 119,3, 117,4, 115,7, 109,5, 20,8
Пример 52
4-(1-Метил-2-бензимидазолиламино)-2-хлор-2'-метилбензофенон (соединение 152)
Общая процедура: 1
Исходное соединение II: 2-хлор-1-метилбензоимидазол (0,33 г, 2,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,49 г, 2,0 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 24 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:2
Продукт: соединение 152, 0,27 г кристаллического соединения.
13С ЯМР (CDCl3): δ 196,0, 147,0, 140,4, 139,0, 137,1, 135,4, 133,9, 132,0, 131,8, 130,9, 129,8, 125,6, 125,4, 124,6, 121,1, 117,6, 113,7, 110,1, 31,3, 20,9
Пример 53
4-(2-Бензотиазолиламино)-2-хлор-2'-метилбензофенон
(соединение 153)
Общая процедура: 1
Исходное соединение II: 2-хлорбензотиазол (0,26 мл, 2,0 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,49 г, 2,0 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 20 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси ацетон:СН2Cl2, 1:100
Продукт: соединение 153, 0,24 г кристаллического соединения.
13С ЯМР (CDCl3): δ 196,9, 161,5, 151,1, 143,1, 138,7, 138,0, 134,1, 133,1, 132,3, 131,6, 130,5, 130,3, 126,5, 125,5, 123,4, 121,0, 120,3, 119,6, 116,0, 20,8
Пример 54
2-Хлор-2'-метил-4-(2-пиримидиламино)бензофенон
(соединение 154)
Общая процедура: 1
Исходное соединение II: 2-бромпиримидин (0,18 г, 1,1 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси ацетон:СН2Cl2, 2:100
Продукт: соединение 154, 0,14 г кристаллического соединения.
13С ЯМР (CDCl3): δ 196,8, 159,4, 158,1, 143,0, 138,4, 133,9, 132,1, 132,0, 131,5, 131,3, 130,3, 125,4, 119,8, 116,2, 113,8, 20,7
Пример 55
2-Хлор-2'-метил-4-(7-метил-пурин-6-иламино)бензофенон (соединение 155)
Общая процедура: 1
Исходное соединение II: 6-бром-7-метилпурин (0,18 г, 0,84 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,19 г, 0,77 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:3 -> 1:1, а затем перекристаллизация из Et2О
Продукт: соединение 155, 0,06 г кристаллического соединения.
13С ЯМР (CDCl3): δ 196,7, 152,7, 151,4, 150,4, 142,3, 141,8, 138,7, 138,2 133,7 133,1, 131,9, 131,6, 131,4, 130,5, 125,5, 120, 7, 120,6, 117,1, 30,0, 20,8
Пример 56
2-Хлор-2'-метил-4-(2-метил-5-бензотиазолиламино)бензофенон (соединение 156)
Общая процедура: 1
Исходное соединение II: 5-бром-2-метилбензотиазол (0,25 г, 1,1 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (6 мл)
Основание: t-BuONa
Время реакции: 18 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:3 -> 1:2
Продукт: соединение 156, 0,21 г масла.
13С ЯМР (CDCl3): δ 196,5, 168,7, 154,6, 147,8, 139,1, 138,8, 138,0, 135,1, 133,4, 131,3, 130,9, 130,8, 129,8, 129,5, 125,4, 122,2, 119,3, 116,5, 114,3, 113,0, 20,5, 20,2
Пример 57
2-Хлор-2'-метил-4-(пиразин-2-иламино)бензофенон
(соединение 157)
Общая процедура: 1
Исходное соединение II: 2-иодпиразин (0,23 г, 1,1 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (6 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:1, а затем очиска с помощью ОФ-ВЭЖХ
Продукт: соединение 157, масло.
13С ЯМР (CDCl3): δ 196,8, 151,0, 143,2, 141,6, 138,6, 138,3, 136,3, 134,5, 134,0, 132,4, 132,2, 131,6, 131,4, 130,4, 125,5, 119,7, 116,1, 20,7
Пример 58
2-Хлор-2'-метил-4-(5-пиримидиламино)бензофенон
(соединение 158)
Общая процедура: 1
Исходное соединение II: 5-бромпиримидин (0,18 г, 1,1 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0, 25 г, 1,0 ммоль)
Растворитель: 1,4-диоксан (5 мл)
Основание: t-BuONa
Время реакции: 6 ч
Температура реакции: 100°С
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:1 -> 1:0 а затем очистка с помощью ОФ-ВЭЖХ
Продукт: соединение 158, масло.
13С ЯМР (CDCl3): δ 196,3, 153,3, 148,0, 145,0, 138,6, 138,2, 134,9, 133,0, 132,2, 131,6, 131,5, 130,2, 125,5, 117,7, 114,2, 20,7
Пример 59
2-Хлор-2'-метил-4-(5-нитро-2-тиазолиламино)бензофенон (соединение 159)
4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,246 г, 1,0 ммоль), 2-бром-5-нитротиазол (0,209 г, 1,0 ммоль) и N,N-диизопропилэтиламин (0,18 мл, 1,0 ммоль) смешивают в 4 мл сосуде с завинчивающейся крышкой и выдержмвают при 60°С в течение 18 ч. Реакционную смесь распределяют между EtOAc и водой, органическую фазу промывают H2O (3х10 мл) и насыщенным раствором соли (10 мл), сушат (MgSO4) и выпаривают в вакууме. Неочищенный продукт очищают флеш-хроматографией с использованием смеси EtOAc:СН2Cl2, 1:50, в качестве элюента.
Продукт: соединение 159, 0,12 г кристаллического соединения.
13С ЯМР (ДМСО-D-6): δ 195,8, 166,5, 145,2, 142,1, 138,6, 137,8, 137,4, 133,1, 131,9, 131,8, 131,6, 130,3, 125,9, 119,3, 117,0, 54,9, 20,3
Пример 60
2-Хлор-2'-метил-4-((4-метил-3-нитро-(1,2,4-триазол-5-иламино))бензофенон (соединение 160)
Получение 5-бром-4-метил-3-нитро-1,2,4-триазола:
5-бром-3-нитро-1,2, 4-триазол (0,78 г, 4,0 ммоль) растворяют в ДМФ (20 мл). Затем добавляют К2СО3 (1,11 г, 8,0 ммоль) и СН3I (0,28 мл, 4,4 ммоль) и смесь перемешивают при комнатной температуре в течение 18 ч. Затем добавляют H2O и водную фазу три раза экстрагируют Et2О. Объединенные органические фазы промывают насыщенным раствором соли, сушат (MgSO4), выпаривают и неочищенный продукт очищают флеш-хроматографией с использованием смеси EtOAc:петролейный эфир, 1:1, в качестве элюента.
Продукт: 2-бром-1-метил-5-нитро-1,2, 4-триазол, 0,44 г
13С-ЯМР (CDCl3) δ: 131,3, 80,6, 38,0.
Получение соединения 160
Общая процедура: 1
Исходное соединение II: 5-бром-4-метил-3-нитро-1,2,4-триазол (0,22 г, 1,1 ммоль)
Исходное соединение III: 4-амино-2-хлор-2'-метилбензофенон (соединение 2) (0,24 г, 1,0 ммоль)
Растворитель: толуол (5 мл)
Основание: Cs2CO3
Время реакции: 18 ч
Температура реакции: 100°С
Через 18 часов добавляют дополнительную порцию BINAP (24 мг) и Pd2(dba)3 (17 мг), и реакционную смесь встряхивают еще в течение 24 ч при 100°С.
Обработку проводят как описано в общей процедуре 1.
Очистка: флеш-хроматография с использованием смеси EtOAc:петролейный эфир, 1:1, а затем обращенно-фазовая ВЭЖХ
Продукт: соединение 160, масло.
13С ЯМР (ДМСО-D-6): δ 195,8, 158,3, 151,0, 142,8, 137,8, 137,4, 131,9, 131,6, 131,4, 131,4, 129,9, 125,8, 117,9, 115,6, 35,6, 20,1
Пример 61
Таблетка, содержащая соединение 116
Активное вещество, лактозу и крахмал смешивают до гомогенного состояния в подходящем миксере и увляжняют 5-процентным водным раствором метилцеллюлозы, 15 спз. Смешивание продолжали до тех пор, пока не образовывались гранулы. Если это необходимо, мокрую гранулированную смесь пропускали через подходящее сито и сушили в подходящей сушилке, например в сушилке с кипящим слоем или в сушильной печи, до тех пор, пока содержание воды не составляло менее чем 1%. Осушенные гранулы пропускали через 1 мм сито и смешивали до гомогенного состояния с найтрийсодержащей карбоксиметилцеллюлозой. Затем добавляли стеарат магния, смесь размешивали в течение небольшого периода времени. Из этой гранулированной смеси на соответствующей таблетирующей машине были получены таблетки массой 200 мг.
Пример 62
Композиция для инъекций, содержащая соединение 116
Активное вещество растворяли в этаноле (10%), а затем добавляли воду для инъекций, которой придавали изотоничность хлоридом натрия, до 100%. Этой смесью заполняли ампулы и стерилизовали.
Пример 63
Композиция в виде крема, содержащая соединение 116
Соединение 116 (10 г) растворяли в октилдодецилмиристате (250 г) с получением части А. Метилпарабен (1 г) и пропилпарабен (0,2 г) растворяли в феноксиэтаноле (6 г) и смешивали с 0,025 М фосфатным буфером рН 7,5 (632,8 г) с получением части В. Цетостеариловый спирт (50 г) и ARLACEL 165® (50 г) расплавляли в сосуде при 70-80°С. Затем добавляли часть А и нагревали до 60-70°С. Водную фазу также нагревали до 60-70°С и медленно добавляли к расплавленной масляной фазе при перемешивании при высокой скорости. Гомогенизированные компоненты охлаждали до комнатной температуры.
Реферат
Изобретение относится к новым производным бензофенона общей формулы (I) или их фармацевтически приемлемым солям и N-оксидам, т.е соединениям, где атом азота у гетероциклического заместителя может быть окисленным. Соединения обладают свойствами ингибитора интерлейкина (IL-1β) или альфа-фактора некроза опухоли (TNF-α) и могут быть использованы для лечения воспалительных заболеваний и состояний. В соединении общей формулы (I)

R1 представляет C1-C6алкил, R2 представляет один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, галогена, C1-C6алкила, C1-C6алкокси, R3представляет один заместитель в орто-положении, выбранный из группы, состоящей из водорода, галогена, R4 представляет водород,
R5 представляет азотсодержащую гетероароматическую моно- или бициклическую систему, содержащую 1-4 гетероатома, выбранных из N, S или O, где каждое кольцо 5 или 6 атомов в кольце, кроме триазина, причем указанная моно- или бициклическая система необязательно замещена водородом, галогеном, галогеналкилом, циано, карбокси, нитро, C1-C6алкилом, C1-C6алкокси, C1-C6алкоксикарбонилом, -NR9 R10, где R9 и R10 представляют водород; Х представляет кислород. Изобретение также относится к фармацевтической композиции и к способу лечения и профилактики. 2 н. и 17 з.п. ф-лы, 3 табл.
Формула
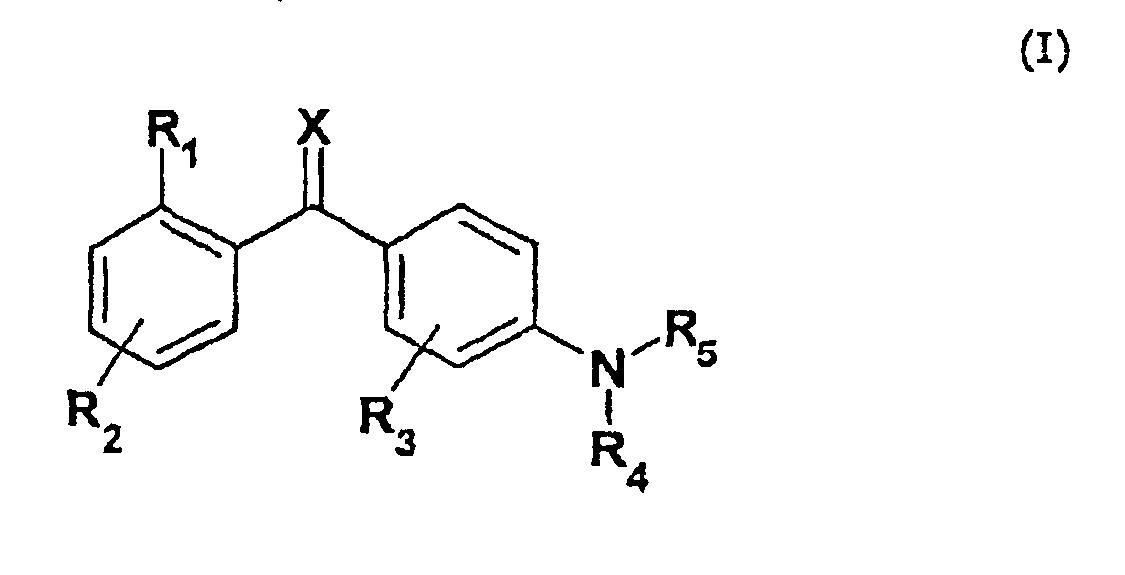


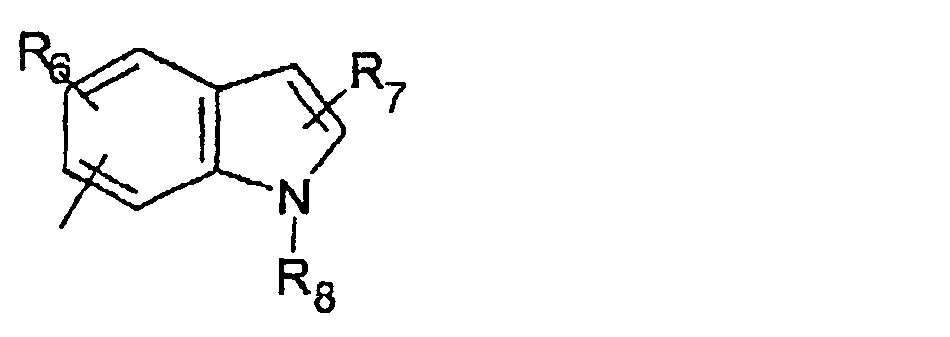
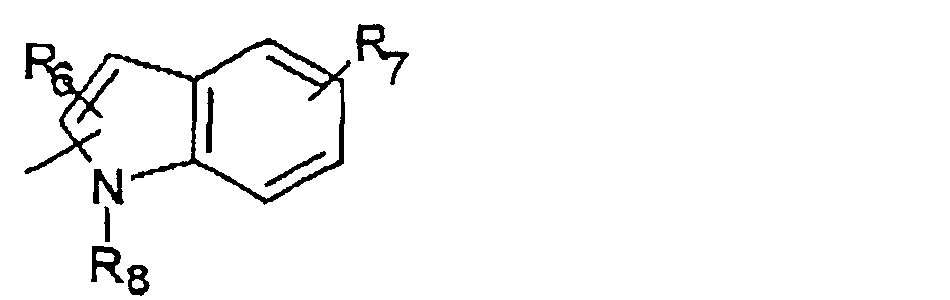




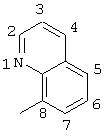

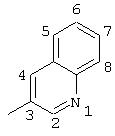

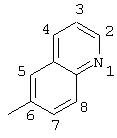
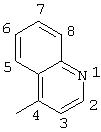
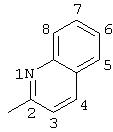

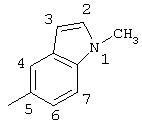
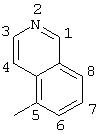

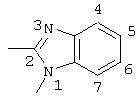


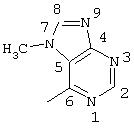

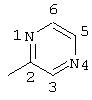
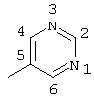
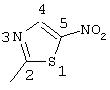


Комментарии