Лечение воспалительных заболеваний - RU2440110C2
Код документа: RU2440110C2
Чертежи



Описание
Предшествующий уровень техники
В настоящей заявке заявлен приоритет предварительной патентной заявки США серийный №60/838222, поданной 17 августа 2006, полное описание которой специфически включено в настоящее описание в виде ссылки. Настоящее изобретение было осуществлено при правительственной поддержке, с грантом номер NS049014-02, Национального института Здоровья. Правительство имеет определенные права на изобретение.
А. Область изобретения
Настоящее изобретение в целом относится к области воспалительных заболеваний периферической нервной системы. Точнее, оно касается способов лечения воспалительных заболеваний периферической нервной системы путем модуляции активности рецептора сфингозин-1-фосфата.
В. Область техники
Периферическая нервная система (ПНС (PNS)) является обычной мишенью иммунного поражения. Хроническую воспалительную демиелинизирующую полинейропатию (CIDP) иногда считают аналогом рассеянного склероза (MS), который поражает центральную нервную систему, в ПНС, из-за сходства между двумя заболеваниями в отношении течения заболевания (рецидивирующее против прогрессирующего), наличия демиелинизации и различной степени потери аксонов и иммуно-опосредованной патофизиологии. Воспалительные инфильтраты в нервах при CIDP состоят преимущественно из Т-клеток и макрофагов, и предполагается, что вероятной причиной повреждения ткани при CIDP является реакция против миелиновых антигенов, опосредованная Т-клетками. Доступное лечение CIDP, такое как внутривенное введение гамма-глобулина, плазмаферез и стероиды, является эффективным у двух третей пациентов, но связаны с осложнениями или невозможностью получения продолжительной ремиссии (Ropper, 2003). Следовательно, существует насущная необходимость в разработке новых терапевтических способов и средств, которые могут быть использованы отдельно или в комбинации с существующими вариантами лечения.
Сущность изобретения
Настоящее изобретение обеспечивает лечение воспалительных заболеваний и аутоиммунных заболеваний. В одном варианте осуществления настоящее изобретение обеспечивает способ лечения пациента с аутоиммунным заболеванием периферической нервной системы, включающий в себя введение пациенту эффективного количества модулятора рецептора сфингозин-1-фосфата. В другом варианте осуществления настоящее изобретение обеспечивает способ облегчения симптомов аутоиммунного заболевания периферической нервной системы у пациента, включающий введение пациенту эффективного количества модулятора рецептора сфингозин-1-фосфата. В следующем варианте осуществления настоящее изобретение обеспечивает способ продления времени между рецидивами аутоиммунного заболевания периферической нервной системы у пациента, включающий введение пациенту эффективного количества модулятора рецептора сфингозин-1-фосфата.
В другом варианте осуществления настоящее изобретение обеспечивает способ лечения пациента с аутоиммунным заболеванием мышц, включающий введение пациенту эффективного количества модулятора рецептора сфингозин-1-фосфата, при лечении аутоиммунного заболевания периферической нервной системы. В другом варианте осуществления настоящее изобретение обеспечивает способ облегчения симптомов аутоиммунного заболевания мышц у пациента, включающий введение пациенту эффективного количества модулятора рецептора сфингозин-1-фосфата. В другом варианте осуществления настоящее изобретение обеспечивает способ продления времени между рецидивами аутоиммунного заболевания мышц у пациента, включающий введение пациенту эффективного количества модулятора рецептора сфингозин-1-фосфата.
В другом варианте осуществления настоящее изобретение обеспечивает способ лечения пациента с аутоиммунным заболеванием нервно-мышечных синапсов, включающий введение пациенту эффективного количества модулятора рецептора сфингозин-1-фосфата, при лечении аутоиммунного заболевания нервно-мышечных синапсов. В другом варианте осуществления настоящее изобретение обеспечивает способ облегчения симптомов аутоиммунного заболевания нервно-мышечных синапсов у пациента, включающий введение пациенту эффективного количества модулятора рецептора сфингозин-1-фосфата. В дополнительном варианте осуществления настоящее изобретение обеспечивает способ продления времени между рецидивами аутоиммунного заболевания нервно-мышечных синапсов у пациента, включающий введение пациенту эффективного количества модулятора рецептора сфингозин-1-фосфата.
В одном варианте осуществления изобретения модулятор рецептора сфингозин-1-фосфата используют для лечения заболевания периферической нервной системы. В определенных аспектах заболеванием периферической нервной системы является синдром Гийена-Барре (GBS), хроническая воспалительная демиелинизирующая полинейропатия (CIDP), нейропатия, опосредованная антителами, или васкулитная нейропатия. В некоторых вариантах осуществления изобретения модулятор рецептора сфингозин-1-фосфата используют для лечения аутоиммунных состояний, поражающих мышцы (например, миозит) или нервно-мышечные синапсы (например, миастения).
Симптомы воспалительных или аутоиммунных заболеваний периферической нервной системы включают, например, покалывание или онемение (обычно начинающееся в пальцах ног и рук), слабость в руках, слабость в ногах, потерю глубоких сухожильных рефлексов (арефлексия), слабость и патологические ощущения. Симптомы воспалительных или аутоиммунных заболеваний мышц включают, например, мышечную слабость, атрофию мышц, боль в мышцах, общую слабость и дисфагию (затруднение глотания). Симптомы воспалительных или аутоиммунных расстройств нервно-мышечных синапсов включают, например, мышечную слабость, асимметричный птоз (нависание одного или обоих век), диплопию (двоение в глазах) из-за слабости мышц, которые контролируют движение глаз, нестабильную или утиную походку, слабость в руках, кистях, пальцах рук, ногах и шее, изменение выражения лица, дисфагию (затруднение глотания), одышку и дизартрию (нарушение речи). Один или более из этих симптомов могут быть облегчены способами по настоящему изобретению. Под фразой «облегчение симптомов воспалительного заболевания периферической нервной системы» подразумевают, что симптом становится менее тяжелым или более переносимым.
В определенных аспектах изобретения модулятор рецептора сфингозин-1-фосфата представляет собой FTY720, FTY720-P, AAL®, AFD(R) или SEW2871. В некоторых аспектах изобретения модулятор рецептора сфингозин-1-фосфата представляет собой ингибитор рецептора сфингозин-1-фосфата. В других аспектах изобретения модулятор рецептора сфингозин-1-фосфата представляет собой агонист рецептора сфингозин-1-фосфата. Рецептором сфингозин-1-фосфата может быть, например, рецептор S1P1, S1P2, S1P3, S1P4 или S1P5.
Модулятор рецептора сфингозин-1-фосфата может быть введен пациенту до развития симптомов аутоиммунного заболевания периферической нервной системы или он может быть введен пациенту после развития симптомов аутоиммунного заболевания периферической нервной системы. В определенных аспектах изобретения модулятор рецептора сфингозин-1-фосфата вводят пациенту во время ремиссии симптомов аутоиммунного заболевания периферической нервной системы. В определенных вариантах осуществления изобретения модулятор рецептора сфингозин-1-фосфата вводят пациенту и перед, и после развития симптомов аутоиммунного заболевания. Модулятор рецептора сфингозин-1-фосфата можно вводить любым путем, известным в области техники. В определенных вариантах осуществления изобретения модулятор рецептора сфингозин-1-фосфата вводят перорально или путем инъекции. Для перорального введения модулятор рецептора сфингозин-1-фосфата может быть представлен в любой фармацевтической композиции, подходящей для перорального введения, такой как жидкость, капсула или таблетка. Для инъекции модулятор рецептора сфингозин-1-фосфата может быть представлен в любой фармацевтической композиции, подходящей для инъекции, такой как жидкость для шприца. Инъекция может быть, например, внутривенной, внутриартериальной, внутримышечной или подкожной.
В определенных аспектах изобретения модулятор рецептора сфингозин-1-фосфата вводят один раз в день, два раза в день или три раза в день. В некоторых вариантах осуществления изобретения модулятор рецептора сфингозин-1-фосфата вводят почти каждые 4 часа, 6 часов, 8 часов, 12 часов, 24 часа, 48 часов или 72 часа. В определенных аспектах изобретения суточная дозировка модулятора рецептора сфингозин-1-фосфата, вводимая пациенту человеку, составляет между около 0,1 до 20 мг, от 0,5 до 10 мг, от 0,5 до 5 мг, от 1 до 5 мг, от 1,25 до 5 мг, от 1,5 до 3 мг, от 0,1 до 1 мг, или в любом диапазоне, попадающем в эти рамки. В некоторых аспектах изобретения модулятор рецептора сфингозин-1-фосфата вводят через день, через два дня, каждый четвертый день, каждый пятый день, еженедельно или один раз в месяц. Практикующий врач, ответственный за введение композиции по настоящему изобретению, может определить соответствующую дозировку, путь введения и частоту введения путем оценки физических и физиологических факторов пациента, таких как масса тела, пол, тяжесть состояния и предшествующие или сопутствующие терапевтические вмешательства.
Также предусмотрено, что модулятор рецептора сфингозин-1-фосфата можно вводить в комбинации со вторым терапевтическим средством. Например, модулятор рецептора сфингозин-1-фосфата может вводиться в комбинации с иммунодепрессантом (например, циклоспорин А, циклоспорин G, FK-506, ABT-281, ASM981, рапамицин, 40-О-(2-гидрокси)этилрапамацин, кортикостероиды, циклофосфамид, азатиоприн, метотрексат, лефлуномид, мизорибин, микофенолат мофетил или 15-дезоксиспергуалин), стероидом (например, преднизон или гидрокортизон), иммуноглобулином или интерфероном 1 типа. Модулятор рецептора сфингозин-1-фосфата и второе средство могут вводиться одновременно или последовательно. Когда модулятор рецептора сфингозин-1-фосфата и второе средство вводят одновременно, они могут быть рецептированы в одной композиции или в отдельных композициях.
Предусматривается, что любой способ или композиция, описанные в настоящем описании, могут быть осуществлены с учетом любого другого способа или композиции, описанных в настоящем описании.
Применение термина «или» в формуле изобретения используется для обозначения «и/или», если особым образом не указано отношение только к альтернативам или альтернативы являются обоюдно включающими, когда описание поддерживает определение, которое относится к единственным альтернативам и «и/или».
В настоящей заявке термин «около» используют для обозначения, что значение включает стандартное отклонение ошибки для устройства или метода, используемых для определения значения.
Следуя установленному патентному закону, слова «a» и «an» при использовании в сочетании со словом «включающий» в формуле изобретения или спецификации, обозначает один или более, если не указано иначе.
Другие задачи, характеристики и преимущества настоящего изобретения станут очевидны из следующего подробного описания. Однако необходимо понимать, что подробное описание и специфические примеры, указывая на специфические варианты осуществления изобретения, даны только в качестве иллюстрации, тогда как из настоящего подробного описания специалисту в области техники очевидны различные изменения и модификации в сущности и объеме изобретения.
Краткое описание чертежей
Следующие чертежи являются частью настоящей спецификации и включены для дополнительной демонстрации определенных аспектов настоящего изобретения. Изобретение может быть лучше понято со ссылками на один или более из указанных чертежей в сочетании с подробным описанием специфических вариантов осуществления изобретения, представленных в настоящем описании.
Фиг.1. Химические структуры FTY720 и связанных соединений. На фиг.1 представлены химические структуры сфингозина, сфингозин-1-фосфата, FTY720, FTY720-P, AAL(R), AFD(R) и SEW2871.
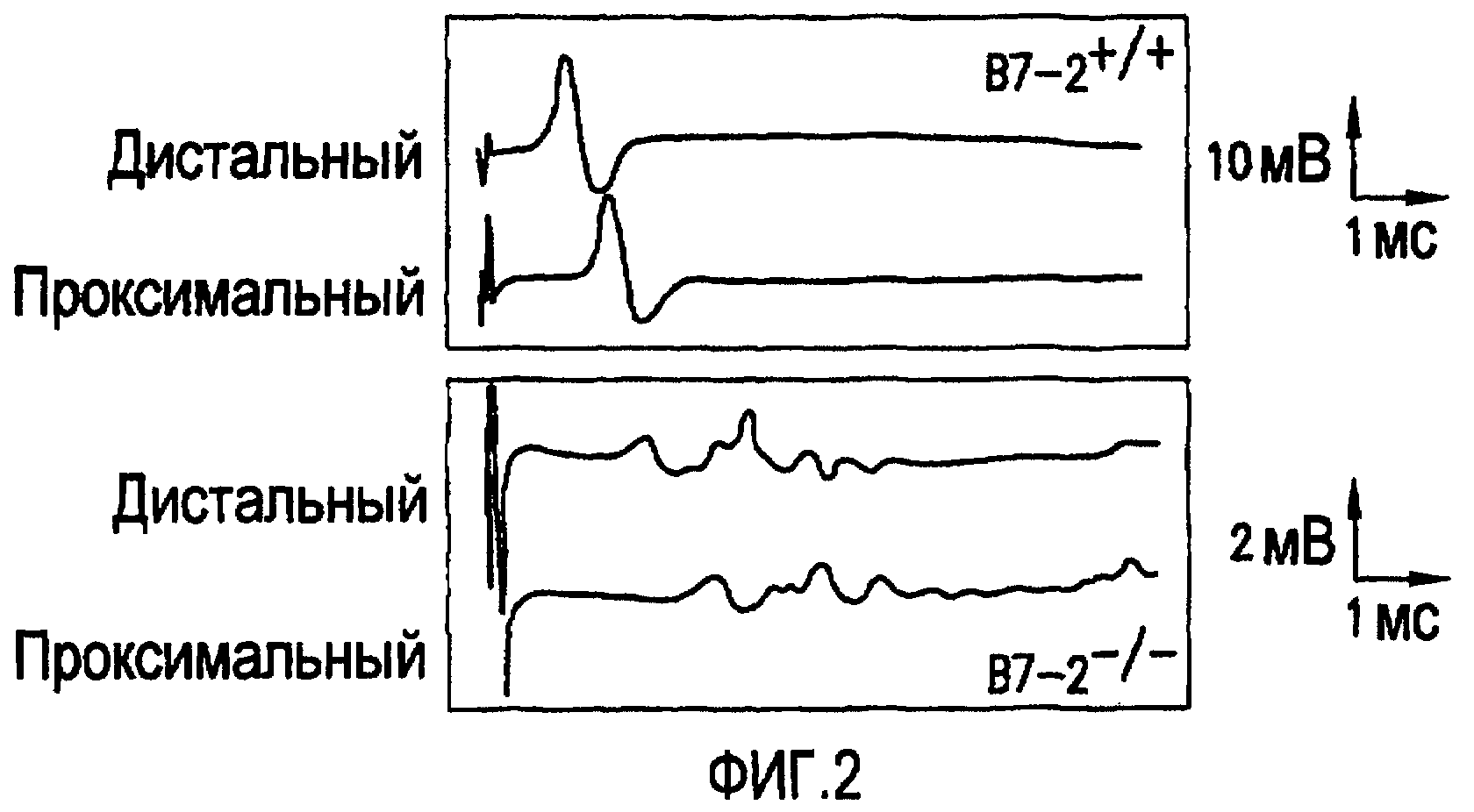
Фиг.2. Комбинированные мышечные потенциалы действия (СМАР). На фиг.2 представлены примеры СМАР при стимуляции седалищного нерва у мышей дикого типа и В7-2-/- NOD.
Фиг.3. Препараты разделенных волокон седалищного нерва. В препаратах разделенных волокон были показаны сегментирующая демиелинизация и укорочение участков нервного волокна между перехватами Ранвье с нерегулярной толщиной миелиновых капсул у мышей В7-2-/- NOD по сравнению с мышами NOD дикого типа. Перехваты Ранвье указаны стрелками.
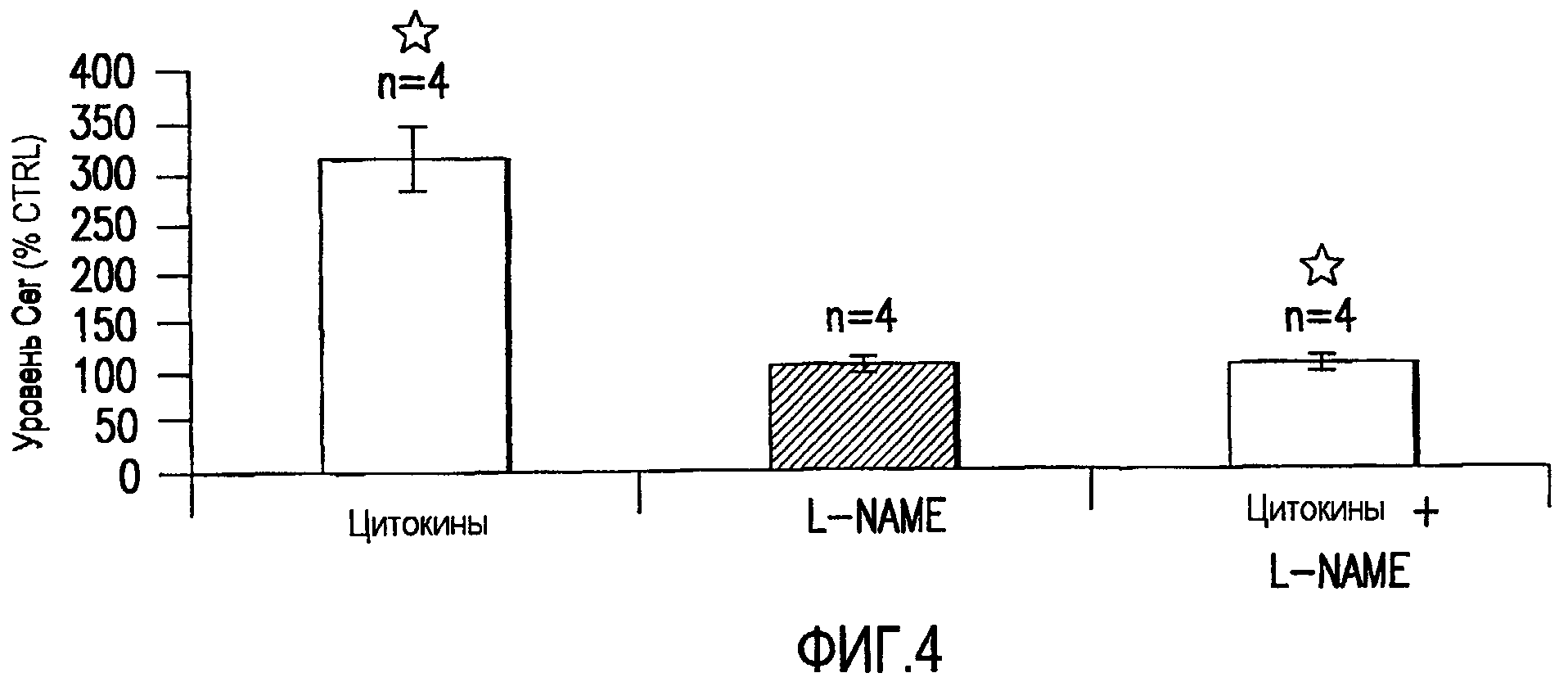
Фиг.4. Накопление церамида в Шванновских клетках (SC), индуцированное цитокинами. TNF-α и IFN-γ действуют синергично, снижая выживаемость клеток посредством индукции NOS и накопления церамида в бессмертных SC. На фиг.4 показан уровень церамида в виде процентного отношения контроля в SC, индуцированный TNF-α (100 г/мл) + IFN-γ (200 ЕД/мл), L-NAME (ингибитор NOS) или TNF-α (100 г/мл) + IFN-γ (200 ЕД/мл) + L-NAME. Индукция цитокинами происходила в течение 24 часов. Звездочка (*) показывает р<0,0001.
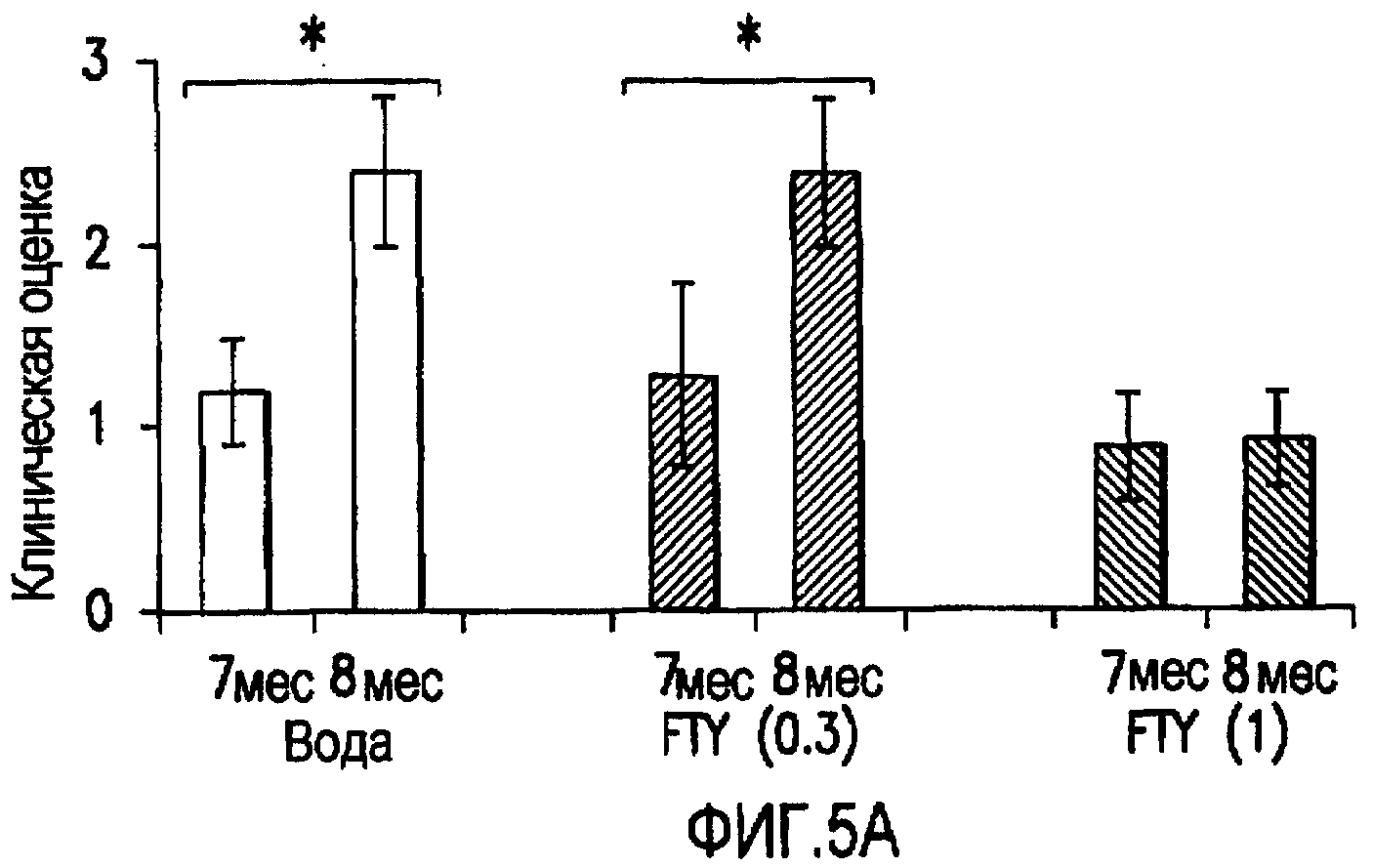
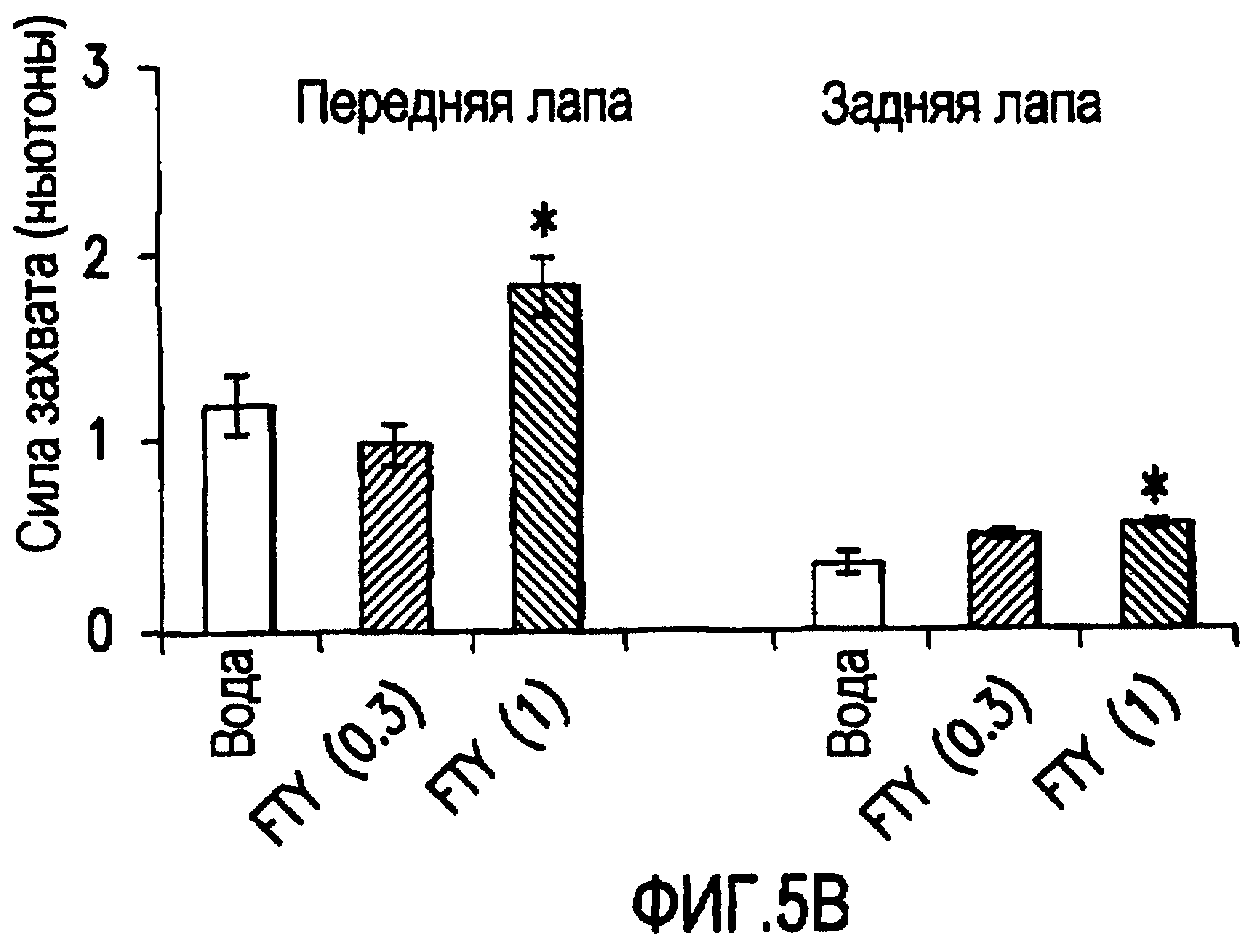
Фиг.5А и 5В. Эффект FTY720 на клинические показатели и силу захвата у мышей NOD, дефицитных по В7-2. Животных делили на 3 группы: (1) вода (n=11); (2) FTY720 0,3 мг/кг (n=5) и (3) FTY720 1,0 мг/кг (n=10). Ежедневное лечение начинали в возрасте 7 месяцев и продолжали в течение 4 недель. На фиг.5А показаны клинические показатели мышей NOD, дефицитных по В7-2, в 7 месяцев (перед лечением) и 8 месяцев (после лечения) для мышей, которым вводили носитель (воду), FTY720 в дозе 0,3 мг/кг или FTY720 в дозе 1,0 мг/кг. Звездочка (*) указывает p<0,0007. Наоборот, клинические показатели мышей, получавших лечение FTY720 (1 мг/кг), не ухудшились. В конце 4-недельного лечения измеряли силу захвата задней лапы и передней лапы с помощью измерителя силы захвата (Columbus Instruments). На фиг.5В показаны результаты измерений силы захвата задней и передней лапы для мышей, которым вводили носитель (воду), FTY720 в дозе 0,3 мг/кг или FTY720 в дозе 1,0 мг/кг. Звездочка (*) указывает p<0,01. Планки погрешности представляют собой SEM.
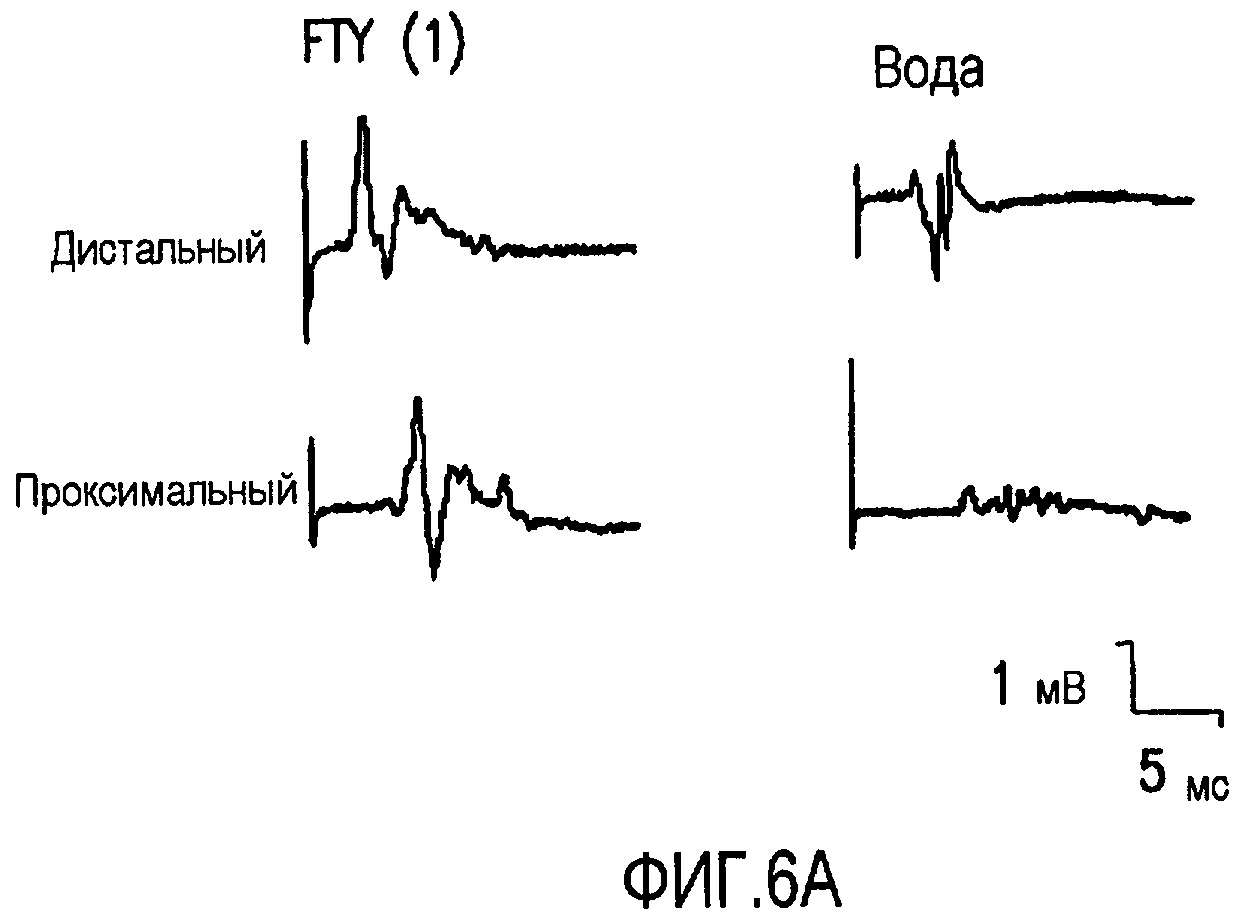
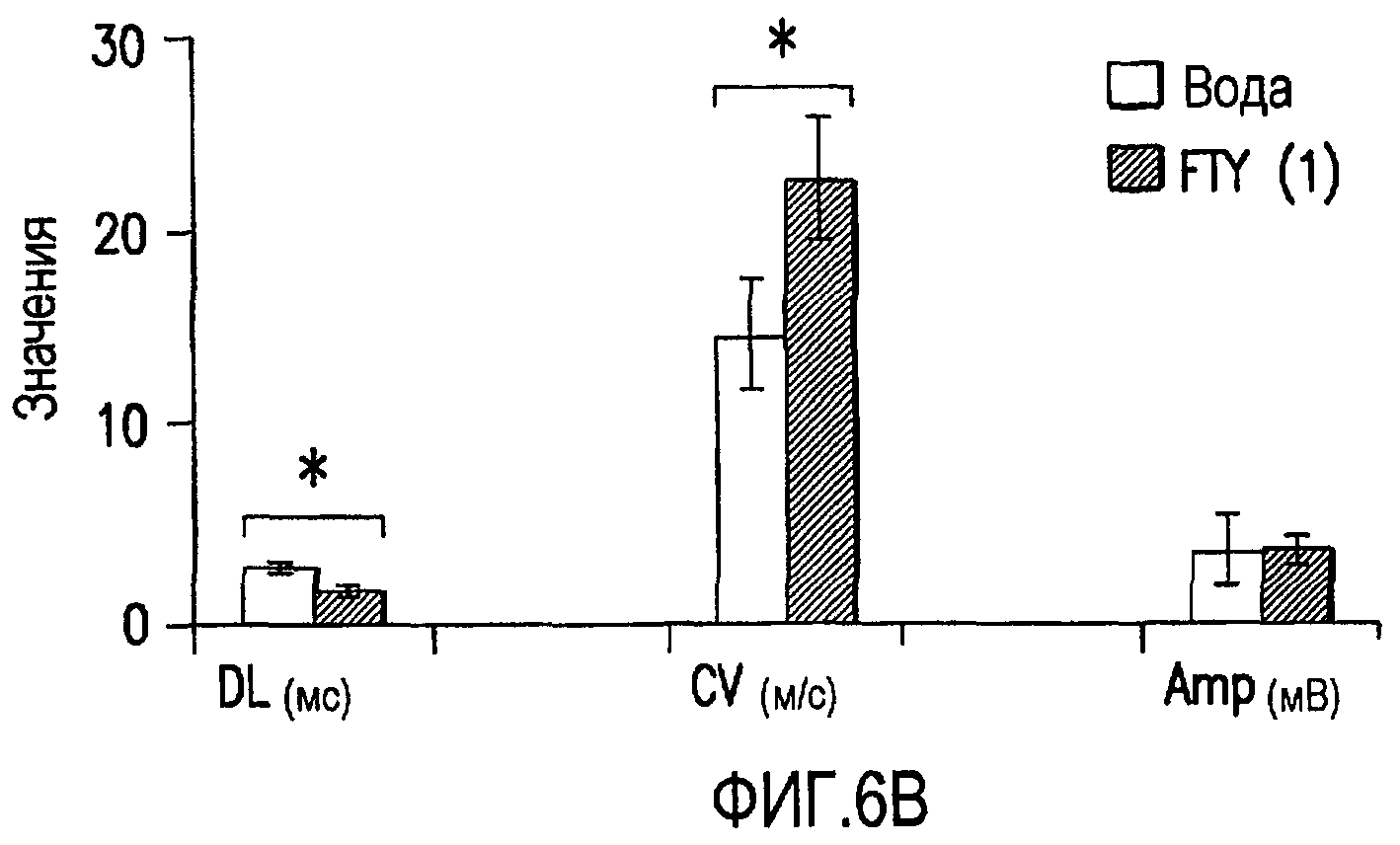
Фиг.6А и 6В. Эффект FTY720 на дистальную задержку, скорость проведения и амплитуду седалищных комбинированных мышечных потенциалов действия у мышей NOD, дефицитных по В7-2. Для оценки функции седалищного нерва у мышей, получавших FTY720 в дозе 1,0 мг/кг или носитель (вода), проводили электрофизиологические исследования. Оценивали дистальную задержку (DL), скорость проведения (CV) и комбинированные мышечные потенциалы действия седалищного нерва (СМАР). Настоящий чертеж иллюстрирует, что у мышей, получавших FTY720 в дозе 1,0 мг/кг, продемонстрировано улучшение DL и CV по сравнению с мышами, получавшими носитель, но не продемонстрировано улучшение амплитуды СМАР седалищного нерва. На фиг.6А даны примеры седалищных СМАР. На фиг.6В показано резюме данных, полученных по 12 нервам мышей, получавших носитель, и 14 нервам мышей, получавших FTY720 в дозе 1,0 мг/кг. Звездочка (*) показывает р<0,02; двойная звездочка (**) показывает р<0,01.
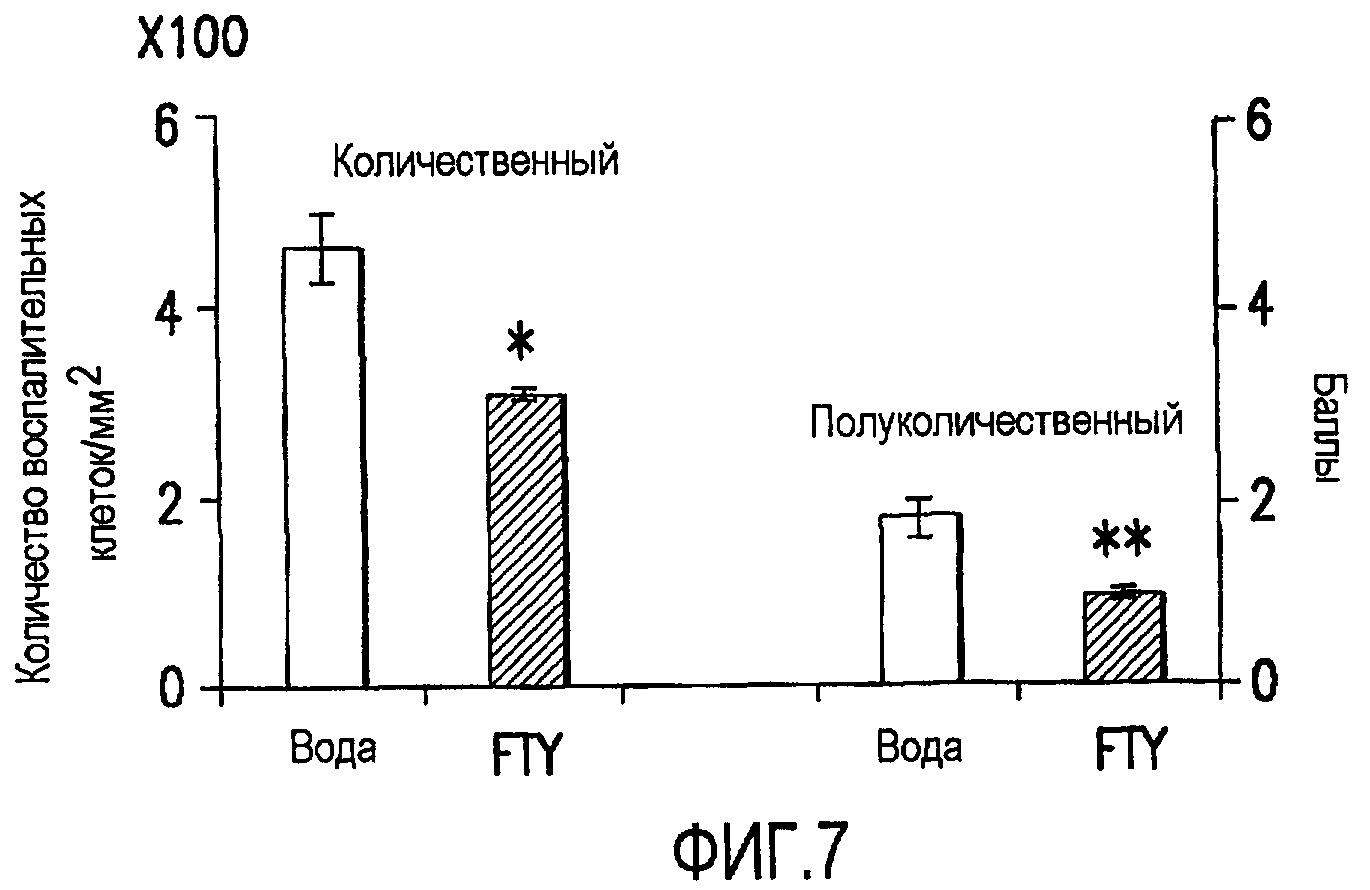
Фиг.7. Эффект FTY720 на инфильтрацию воспалительными клетками в сечениях седалищных нервов у мышей NOD, дефицитных по В7-2. У мышей NOD, дефицитных по В7-2, получавших носитель (вода, n=6) или FTY720 в дозе 1,0 мг/кг (n=7), проводили гистологическое исследование. Инфильтрацию воспалительными клетками измеряли количественным методом и полуколичественным методом. Настоящий чертеж демонстрирует, что инфильтрация воспалительными клетками снижалась в сечениях седалищных нервов от мышей, получавших FTY720, по сравнению с таковой у мышей, получавших носитель. Звездочка (*) показывает р<0,02; двойная звездочка (**) показывает р<0,003.
Фиг.8. Эффект FTY720 на демиелинизацию и потерю миелиновых волокон у мышей NOD, дефицитных по В7-2. Анализировали Epon сечения от мышей NOD, дефицитных по В7-2, получавших носитель (вода, n=6) или FTY 720 в дозе 1,0 мг/кг (n=7). Потерю миелиновых волокон оценивали количественным методом и демиелинизацию оценивали полуколичественным методом. На настоящем чертеже продемонстрировано, что демиелинизация и потеря миелиновых волокон снижалась у мышей, получавших FTY720, по сравнению с мышами, получавшими носитель. Звездочка (*) показывает р<0,015.
ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
А. ПАТОГЕНЕЗ ХРОНИЧЕСКОЙ ВОСПАЛИТЕЛЬНОЙ ДЕМИЕЛИНИЗИРУЮЩЕЙ ПОЛИНЕЙРОПАТИИ
Хроническая воспалительная демиелинизирующая полинейропатия (CIDP) представляет собой воспалительное заболевание периферической нервной системы (ПНС). Течение заболевания может быть рецидивирующим или прогрессирующим и характеризуется наличием фокальной демиелинизации, различной степени потери аксонов и иммуно-опосредованной патофизиологией. Воспалительные инфильтраты в нервах при CIDP состоят преимущественно из Т-клеток и макрофагов, предполагая, что вероятной причиной повреждения тканей при CIDP является опосредованная Т-клетками реакция против антигенов миелина. Однако антигенные мишени нарушенного Т-клеточного ответа остаются неизвестными. Существующее лечение для CIDP включает кортикостероиды, такие как преднизон, которые могут быть использованы отдельно или в комбинации с иммунодепрессантными лекарственными средствами; плазмаферез; и внутривенное введение иммуноглобулина. Физиотерапия может улучшить мышечную силу, функцию и подвижность и минимизировать сокращение мышц и сухожилий и деформацию суставов.
Полная активация Т-клеток требует передачи сигнала посредством совместно стимулирующих молекул, В7-1 и В7-2, в добавление к антиген-специфичному сигналу посредством Т-клеточных рецепторов. Презентация антигена в присутствии В7-1 вызывает дифференцировку Т-клеток в фенотип Th1 с экспрессией интерлейкина-2, IFN-γ и TNF-α, тогда как презентация в ассоциации с В7-2 индуцирует фенотип Th-2 с преимущественной экспрессией IL-4 (Karandikar et al., 1998; Kuchroo et al., 1995). Согласуясь с вышеуказанным представлением, в нервах при CIDP существует преимущественная стимуляция В7-1 (Kiefer et al., 2000). Исследования на мышах, нокаутированных по CD28, выявили, что CD28 требуется для развития экспериментального аллергического неврита (EAN), модели синдрома Гийена-Барре (GBS) на животных (Zhu et al., 2001b). У мышей NOD диабет может быть предотвращен лечением анти-В7-2 антителом или устранением экспрессии В7-2, но такие манипуляции вызывают спонтанную аутоиммунную полинейропатию (SAP), которая имитирует CIDP клинически, гистологически и электрофизиологически (Salomon et al., 2001). Прогрессирующее течение в такой модели отличается от EAN, которое обычно является монофазным со спонтанным выздоровлением только с несколькими исключениями. При EAN животных иммунизировали периферическим миелином или очищенными белками миелина, такими как Р0, Р2, РМР22 или MAG (Constantinescu et al., 1996; Kim et al., 1994; Stoll et al., 1993; Zhu et al., 2001b).
Активированные лимфоциты мигрируют через гематонервный барьер (BNB), который обусловлен взаимодействиями между молекулами на лимфоцитах и адгезии молекул на эндотелиальных клетках. Поскольку существует обширная мононуклеарная инфильтрация, повреждение периферических нервов и демиелинизация могут возникать в результате множества механизмов. Помимо выработки цитотоксических соединений и цитокинов, таких как TNF-α, макрофаги могут проникать через внешне интактные миелиновые капсулы и отслаивать миелин с поверхности аксонов (Prineas and McLeod, 1976). Th1 цитокины, такие как TNF-α и IFN-γ действуют синергично, снижая выживаемость Шванновских клеток (SC) посредством индукции iNOS и накопления церамида (Nagano et al., 2001). Другие обнаружили, что такие цитокины ингибируют пролиферацию SC и подавляют экспрессию миелин-ассоциированного гликопротеина (Chandross et al., 1996; Schneider-Schaulies et al., 1991).
Шванновские клетки играют многофункциональную роль в воспалительных нейропатиях, действуя как антиген-представляющие клетки, мишени иммунной атаки, а также как источник нейротрофических факторов. Указанные клетки экспрессируют рецепторы S1P2 и S1P3; последние стимулируются активатором аденилатциклазы форсколином (Bermingham et al., 2001; Weiner et al., 2001). Средства, которые повышают цАМФ, защищают от EAN и снижают восприимчивость SC к цитокин-индуцированной клеточной смерти (Kim et al., 1994; Nagano et al., 2001). Защитный эффект может быть опосредован частично путем регуляции экспрессии рецепторов S1P на SC, и сигнальный путь сфинголипидов может играть важную роль в выживаемости и дифференцировке SC. Факторы, ведущие к терминации по сравнению с персистированием иммунного ответа, полностью неясны. Шванновские клетки, экспрессирующие FasL, могут участвовать в элиминации аутореактивных Т-клеток (Wohlleben et al., 2000). Ремиссия обычно ассоциирована с повышенной продукцией IL-4, IL-10 и TGF-β.
В. СИГНАЛЬНЫЙ ПУТЬ СФИНГОЛИПИДОВ В ЛИМФОЦИТАХ И ГЛИАЛЬНЫХ КЛЕТКАХ
Во множестве типов клеток было показано, что факторы роста и цитокины модулируют активность ферментов, вовлеченных в регуляцию так называемого реостата церамид/S1P, критической детерминанты клеточного исхода (Cuvillier et al., 1996; Spiegel and Milstein, 2003). Провоспалительные цитокины, такие как TNF-α и интерлейкин-1, активируют сфингомиелиназу, но не церамидазу, что приводит к накоплению церамида, тогда как PDGF и FGF стимулируют церамидазу помимо сфингомиелиназы, приводя к снижению церамида и увеличению сфингозина, который затем может быть преобразован в сфингозин-1-фосфат (S1P) (Coroneos et al., 1995).
Известно, что активированные тромбоциты, моноциты и тучные клетки секретируют S1P, давая мкМ концентрации в плазме (Murata et al., 2000; Spiegel and Milstein, 1995). Следовательно, S1P может потенциально действовать или как внутриклеточный мессенджер, или в качестве внеклеточного лиганда для рецепторов S1P1-S1P5, связанных с G-белками (ранее называемых Edg1, Edg5, Edg3, Edg6 и Edg8, соответственно). Рецепторы S1P связаны со множеством G белков. Например, S1P1 связывается с Gi/o и другими членами семейства Gi, но не с Gs, Gq, G12 или G13. Активация S1P1 стимулирует фосфорилирование митоген-активированных протеинкиназ (МАРК), ингибирует аденилатциклазу и активирует фосфолипазу С, приводя к пролиферативному или миграционному ответу (Windh et al., 1999; Zondag et al., 1998). В эндотелиальных клетках, где впервые были идентифицированы гены S1P1 и S1P3, S1P стимулирует синтез ДНК и миграцию клеток и обеспечивает целостность эндотелиального барьера (Liu et al., 2001; Schaphorst et al., 2003). Рецепторы S1P экспрессируются множеством типов клеток, но преимущественные подтипы рецепторов отличаются от одного клеточного типа к другому, хотя с небольшим перекрыванием.
Из рецепторов S1P, экспрессируемых Т-лимфоцитами, преобладают рецепторы S1P1 и S1P4, но их экспрессия подавляется TCR-зависимой активацией. S1P в низких концентрациях (≤0,1 мкМ) вызывает хемотаксис Т-клеток, тогда как высокие концентрации являются ингибирующими (Graeler et al., 2002). Начальные исследования в трансфицированных клетках выявили, что рецептор S1P1 является передатчиком S1P-индуцированного хемотаксиса, но последующие исследования выявили, что повышенная экспрессия S1P4 в Т-клетках Jurkat достаточна для индукции подвижности клеток в отсутствие экзогенного S1P (Graler et al., 2003). Исследования in vitro выявили, что S1P ингибирует пролиферацию поликлональных Т-клеток, но не существует согласия относительно его эффекта на секрецию цитокинов. S1P усиливает секрецию IL-2 и IFN-γ человеческими Т-клетками, тогда как он снижает секрецию IFN-γ и IL-4 мышиными Т-клетками CD4+, не влияя на IL-2 (Dorsam et al., 2003; Jin et al., 2003). Помимо лимфоцитов мышиные макрофаги и дендритные клетки также экспрессируют рецепторы S1P (S1P1, S1P2, S1P3 и S1P5). Обработка зрелых дендритных клеток S1P ассоциирована с возникновением Th2 иммунного ответа (Idzko et al., 2002; Lee et al., 2002). Следовательно, основной результат действия S1P на поляризацию иммунного ответа (Th1 vs Th2) in vivo остается неясным.
Рецепторы S1P экспрессируются в глиальных клетках. Было показано, что экзогенный S1P активирует ERK каскад и модулирует Ca2+ сигналы в олигодендроцитах (OLG) (Hida et al., 1998). S1P индуцирует экспрессию факторов роста, таких как нейротрофический фактор, полученный из клеточной линии глиальных клеток, в астроцитах (Sato et al., 1999; Yamagata et al., 2003). Клетки линии OLG экспрессируют преимущественно S1P1, S1P5 и возможно S1P2, тогда как Шванновские клетки экспрессируют рецепторы S1P2 и S1P3 (Bermingham et al., 2001; Im et al., 2000; McGiffert and Chun, 2002; Terai et al., 2003; Weiner et al., 2001). Было показано, что лизофосфатидовая кислота, которая действует на другие рецепторы Edg, обеспечивает выживаемость и дифференцировку SC, а также регулирует их морфологию и адгезию (Li et al., 2003; Weiner et al., 2001).
С. МОДУЛЯТОРЫ РЕЦЕПТОРОВ СФИНГОЗИН-1-ФОСФАТА
Рецепторы сфингозин-1-фосфата (S1P) вовлечены в регуляцию направленной миграции лимфоцитов. Рецепторы S1P экспрессируются в нескольких типах клеток, вовлеченных в патогенез воспалительных заболеваний периферической нервной системы, таких как глиальные клетки, макрофаги, эндотелиальные клетки и Шванновские клетки. Настоящее изобретение обеспечивает способы для лечения воспалительных заболеваний, таких как воспалительные заболевания периферической нервной системы, путем модуляции активности рецептора S1P.
FTY720 (2-амино-2-[2-(4-октилфенил)этил]-1,3-пропандиол) является иммуномодулирующим средством, который показал себя эффективным в моделях трансплантации. Он действует путем изолирования лимфоцитов в лимфоидных органах с сопутствующей лимфопенией периферической крови и снижением миграции Т-клеток в ткани-мишени (Chiba et al., 1998; Pinschewer et al., 2000; Xie et al., 2003). FTY720 обладает структурным сходством со сфингозином, что предполагает, что он действует через рецепторы S1P (Brinkmann et al., 2002; Suzuki et al., 1996). Тогда как FTY720 сам по себе не обладает Т-клеточной хемотаксической активностью, его фосфорилированная форма (FTY720-P) является сильным агонистом рецепторов S1P за исключением S1P2, что определяли анализом связывания [γ35-S]GTPγS на трансфицированных клетках, экспрессирующих отдельные рецепторы S1P (Brinkmann et al., 2002; Mandala et al., 2002). FTY720 широко преобразуется в FTY720-P in vivo (Brinkmann et al., 2002).
Подавление или инактивация экспрессии S1P1 FTY720 или его фосфорилированной формой обеспечивает объяснение изоляции лимфоцитов, сходного с таковым, наблюдаемым у голых мышей S1P1 (Matloubian et al., 2004). Другой предложенной моделью является та, что FTY720 блокирует выход лимфоцитов посредством активности агониста S1P1 (Brinkmann et al., 2002; Mandala et al., 2002). В концентрациях >3 мкМ FTY720 вызывает апоптоз лимфоцитов (Matsuda et al., 1998; Oyama et al., 1998). Было показано, что FTY720 является эффективным при экспериментальном аллергическом энцефаломиелите (ЕАЕ), когда лечение начинают в день иммунизации бычьим спинным мозгом или MBP (Brinkmann et al., 2002; Fujino et al., 2003). В настоящее время FTY720 исследуют в отношении лечения рассеянного склероза (MS), воспалительного и нейродегенеративного заболевания центральной нервной системы (ЦНС) («FTY720, a novel once-daily oral medication, shows promising results in treatment of multiple sclerosis" Novartis Media Release, [online], обнаруженная в сети интернет по адресу novartispharma.at/download/presse/international/FTY720%20-%20ENGLISH%20-%20FINAL.pdf., опубликованное 28 июня 2006 г.). Однако успешный исход при заболеваниях ЦНС не всегда переходит в успешный результат при расстройствах ПНС. Например, интерферон-β (IFN-β) является эффективным в снижении частоты обострений MS, но его место в лечении CIDP и других воспалительных нейропатий остается противоречивым. Об улучшении у пациентов с CIDP, получающих IFN-β, сообщали в 2 из 4 исследований (Choudhary et al., 1995; Vallat et al., 2003; Kuntzer et al., 1999; Hadden et al., 1999).
AAL(R) является хиральным метиловым аналогом FTY720 и AFD(R) является фосфатным эфиром AAL(R) (Kiuchi et al., 2000). AFD(R) действует как агонист к четырем рецепторам SIP (S1P1, S1P3, S1P4 и S1P5) (Brinkmann et al., 2002). В недавнее время было продемонстрировано, что AAL(R) индуцирует быстрое фенотипическое изменение в медуллярных тимоцитах, приводя к подавлению CD69 в течение 2 часов (Rosen et al., 2003). SEW2871 действует как агонист S1P1. Эти результаты показывают, что FTY720 и связанные соединения оказывают плейотропное действие на иммунную систему. Структуры сфингозина, сфингозин-1-фосфата, FTY720, FTY720-P, AAL(R), AFD(R) и SEW2871 представлены на фиг.1.
D. ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Фармацевтические композиции по настоящему изобретению включают эффективное количество одного или более модуляторов активности рецептора S1P, растворенного или диспергированного в фармацевтически приемлемом носителе. Фразы «фармацевтически или фармакологически приемлемый» относятся к молекулярной сущности и композициям, которые не дают нежелательной, аллергической или другой нежелательной реакции при введении при необходимости животному, например человеку. Получение фармацевтической композиции, которая содержит, по меньшей мере, один модулятор активности рецептора S1P, известно специалисту в области техники в свете настоящего описания и что проиллюстрировано в «Remington: The Science and Practice of Pharmacy” 21st Edition 2005, включенном в настоящее описание в виде ссылки. Более того, понимают, что для введения человеку препараты должны соответствовать стандартам стерильности, пирогенности, общей безопасности и чистоты, как требуется FDA Office of Biological Standards.
Как используется в настоящем описании, “фармацевтически приемлемый носитель» включает любой и все растворители, дисперсионные среды, антиоксиданты, соли, оболочки, поверхностно-активные вещества, консерванты (например, метил- или пропил-п-гидроксибензоат, сорбиновая кислота, антибактериальные средства, противогрибковые средства), изотонические агенты, замедлители растворения (например, парафин), абсорбенты (например, каолиновая глина, бентонитовая глина), стабилизаторы лекарственных средств (например, лаурилсульфат натрия), гели, вяжущие вещества (например, сироп, гуммиарабик, желатин, сорбит, трагакант, поливинилпирролидон, карбоксиметилцеллюлоза, альгинаты), вспомогательные вещества (например, лактоза, молочный сахар, полиэтиленгликоль), разрыхляющие агенты (например, агар-агар, крахмал, лактоза, фосфат кальция, карбонат кальция, альгиновая кислота, сорбит, глицин), увлажняющие агенты (например, цетиловый спирт, моностеарат глицерина), смазывающие агенты, ускорители абсорбции (например, четверичные соли аммония), съедобные масла (например, миндальное масло, кокосовое мало, масляные эфиры пропиленгликоля), подслащающие агенты, ароматизирующие агенты, красители, наполнители (например, крахмал, лактоза, сахароза, глюкоза, маннит, кремниевая кислота), таблетирующие смазывающие агенты (например, стеарат магния, крахмал, глюкоза, лактоза, рисовая мука, мел), носители для ингаляции (например, углеводородистые пропелленты), буферные агенты или такие подобные материалы и их комбинации, как известно обычному специалисту в области техники (см., например, «Remington: The Science and Practice of Pharmacy” 21st Edition 2005). За исключением тех случаев, когда обычный носитель несовместим с активным ингредиентом, предусматривается его применение в терапевтической или фармацевтической композиции.
В любом случае композиция может включать различные антиоксиданты для замедления окисления одного или более компонентов. Примеры антиоксидантов включают аскорбиновую кислоту, гидрохлорид цистеина, сульфит натрия, бисульфит натрия, метабисульфит натрия, аскорбилпальмитат, бутилированный гидрокситолуол, бутилированный гидроксианизол, лецитин, пропилгаллат и токоферол. Соответственно предотвращение действия микроорганизмов может быть осуществлено консервантами, например, различными антибактериальными и противогрибковыми агентами, включая, но не ограничиваясь, парабены (например, метилпарабены, пропилпарабены), хлорбутанол, фенол, сорбиновую кислоту, тимеросал или их комбинации.
Фармацевтически приемлемые соли кислот включают аддитивные соли кислот, например, таковые, образуемые со свободными аминогруппами белковоподобных композиций, или образуемые с неорганическими кислотами, такими как, например, соляная, бромистоводородная или фосфорная; или такими органическими кислотами, как уксусная, щавелевая, виннокаменная, бензойная, молочная, фосфорная, лимонная, малеиновая, фумаровая, янтарная, напсиловая, клавулановая, стеариновая или миндальная кислота. Соли, образованные со свободными карбоксильными группами, также могут быть получены из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция, магния или железа; или таких органических оснований как изопропиламин, триметиламин, гистидин или прокаин.
В вариантах осуществления изобретения, где композиции находятся в жидкой форме, носитель может быть растворителем или дисперсионной средой, включающей, но не ограничивающейся, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и др.), липиды (например, триглицериды, растительные масла, липосомы) и их комбинации. Соответствующая текучесть может поддерживаться, например, путем использования оболочки, например, в виде лецитина; путем поддержания требуемого размера частиц путем диспергирования в носителях, таких как, например, жидкий полиол или липиды; путем использования поверхностно-активных веществ, таких как, например, гидроксипропилцеллюлоза; или комбинаций таких методов. Во множестве случаев предпочтительно включать изотонические агенты, такие как, например, сахара, хлорид натрия или их комбинации.
Настоящее изобретение может быть введено любым подходящим способом, известным обычному специалисту в области техники (см., например, «Remington: The Science and Practice of Pharmacy” 21st Edition 2005). Пути введения фармацевтической композиции включают, например, пероральный, внутрикожный, подкожный, местный, путем инъекции, инфузии, непрерывной инфузии, местной перфузии, погружения непосредственно целевых клеток, посредством катетера, посредством лаважа или путем комбинации вышеуказанного.
Модуляторы активности рецептора S1P при введении перорально могут быть в форме таблеток, капсул, саше, флаконов, порошков, гранул, пастилок, восстанавливаемых порошков или жидких препаратов. Стерильные инъекционные растворы получают включением активных соединений в требуемом количестве в соответствующий растворитель с различными другими ингредиентами, перечисленными выше, как требуется, с последующей стерилизацией фильтрованием. Обычно дисперсии получают включением различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и/или другие ингредиенты. В случае стерильных порошков для получения стерильных инъекционных растворов, суспензий или эмульсий предпочтительными методами получения являются сушка в вакууме или методики лиофилизации, которые дают порошок активного ингредиента плюс любого дополнительного желательного ингредиента из его стерильной предварительно отфильтрованной жидкой среды. Жидкая среда должна быть, если необходимо, соответствующим образом забуферена, и жидкий разбавитель сначала сделан изотоничным перед инъекцией с помощью достаточного количества солевого раствора или глюкозы. Также предусматривается получение высококонцентрированных композиций для непосредственной инъекции, когда в качестве растворителя предусматривается применение ДМСО для получения чрезвычайно быстрого проникновения, доставки высоких концентраций активных агентов в небольшую область.
Точная дозировка композиции по настоящему изобретению, вводимая пациенту, может быть определена физическими и физиологическими факторами, такими как масса тела, пол, тяжесть состояния, тип заболевания, подвергаемого лечению, предшествующих или сопутствующих терапевтических вмешательств, первичной болезни пациента, времени введения, скорости экскреции определенного соединения и пути введения. Практикующий врач, ответственный за введение, в любом случае определяет концентрацию активного ингредиента(ов) в композиции и соответствующей доз(ы) для отдельного пациента.
В определенных вариантах осуществления изобретения длительное всасывание инъекционной композиции может быть получено путем использования композиций средств, замедляющих всасывание, таких как, например, моностеарат алюминия, желатин или их комбинации.
Е. ПРИМЕРЫ
Следующие примеры включены для демонстрации предпочтительных вариантов осуществления изобретения. Специалист в области техники должен принимать во внимание, что методики, описанные в указанных далее примерах, представляют собой методики, обнаруженные авторами для соответствующего осуществления изобретения, и, следовательно, могут рассматриваться как составляющие предпочтительные варианты его осуществления. Однако специалист в области техники должен, в свете настоящего описания, понимать, что в специфических вариантах осуществления, которые описаны, может быть сделано множество изменений, и все еще получены такие же или подобные результаты без отклонения от сущности и объема изобретения.
ПРИМЕР 1
Спонтанная аутоиммунная полинейропатия (SAP) у мышей NOD, дефицитных по В7.2
В процессе изучения роли совместных стимулирующих сигналов у мышей NOD было обнаружено, что устранение экспрессии В7-2 предотвращает развитие гипергликемии у таких мышей. Однако у таких мышей в возрасте 24 недели развивался симметричный парез задних лап (Salomon et al., 2001). Исследования проводимости нервов, проводимые на седалищных нервах in vivo, выявили удлинение дистального времени запаздывания, существенное замедление скорости проведения и разброс комбинированных мышечных потенциалов действия (СМАР), как показано на фиг.2. Дистальное двигательное время запаздывания составило 1,1±0,1 мс (n=8) у NOD дт (wt) и 2,7±0,4 мс у мышей NOD B7.2-/- (p<0,005). Скорость проведения составила 50,5±3,8 м/с у NOD дт (wt) и 17,9±3,2 м/с у мышей NOD B7.2-/- (p<0,00001). Амплитуда СМАР составила 10,8±1,5 мВ у NOD дт (wt) и 3,0±0,6 мВ у мышей NOD B7.2-/- (p<0,005). Частичный блок проведения, определяемый как 30% снижение амплитуды при проксимальной по сравнению с дистальной стимуляцией, наблюдали у некоторых, не у всех, животных, вероятно, связанный с ограниченным количеством изученных нервов. Такие электрофизиологические находки являются классическими для демиелинизирующего процесса с сопутствующей потерей аксонов.
При гистологическом исследовании выявили наличие воспалительных инфильтратов в дорсальных корешковых ганглиях (DRG) и седалищных нервах, но не в ЦНС мышей NOD B7.2-/-. Обнаруживалось значительное уменьшение большого диаметра аксонов и утоньшение миелинизации волокон на сечениях седалищных нервов. На исследуемых препаратах волокон были показаны сегментарная демиелинизация и укороченные междоузлия с неравномерной толщиной миелиновых оболочек, согласующиеся с текущим восстановлением миелина (фиг.3). Такое возникновение некоторой ремиелинизации указывает на потенциальную обратимость процесса. Спонтанную аутоиммунную полинейропатию (SAP) индуцировали у мышей NOD-SCOD CD4+ Т-клетками, выделенными у пораженных животных, но не в исследованиях пассивного переноса с использованием сыворотки от пораженных животных. Такие исследования продемонстрировали, что мыши NOD, дефицитные по В7-2, составляют первую модель спонтанной аутоиммунной нейропатии, сходной с человеческим заболеванием CIDP; и аутоиммуно-предрасположенные пациенты имеют иммунную дисфункцию, которая может проявляться в виде отдельных заболеваний, в зависимости от совместно стимулирующей среды.
ПРИМЕР 2
Синергический эффект провоспалительных цитокинов на совместные культуры SC и дорсальных корешковых ганглиев (DRG)-SC
TNF-α и IFN-γ (меченые как цитокины) действовали синергически, снижая выживаемость клеток посредством индукции NOS и накопления церамида в бессмертных SC-клетках (фиг.4) (Nagano et al., 2001). Ни один цитокин отдельно не вызывал клеточной смерти. Такие цитокины также оказывали синергическое ингибирующее действие на миелинизацию в неонатальных совместных культурах DRG-SC, что было очевидно через 3 дня обработки. Не наблюдали эффекта на миелинизацию при использовании IFN-γ в дозе 50-300 ЕД/мл или низких концентраций TNF-α (10 нг/мл). Хотя умеренное ингибирующее действие наблюдали при 100 нг/мл TNF-α. Индуцированная цитокинами клеточная смерть, поражающая SC и нейроны, наблюдалась в совместных культурах, обрабатываемых в течение 7 дней.
ПРИМЕР 3
Влияние FTY720 на тяжесть SAP у мышей NOD, дефицитных по В7-2
Было показано, что FTY720 ингибирует эмиграцию лимфоцитов из лимфоидных органов, и было показано, что его фосфорилированная форма является сильным агонистом четырех рецепторов S1P (Brinkmann et al., 2002; Graler and Goetzl, 2004; Matloubian et al., 2004). Последние исследования предполагают, что эффект таких лекарственных средств in vivo может быть опосредован подавлением рецепторов S1P FTY720 или его фосфорилированной формой (Brinkmann et al., 2002; Graler and Goetzl, 2004; Matloubian et al., 2004). Главным следствием таких агентов является изоляция лимфоцитов во вторичных лимфоидных органах, хотя при более высоких концентрациях наблюдали апоптоз (Brinkmann et al., 2002; Mandala et al., 2002; Nagahara et al., 2000). Пероральное введение FTY720 предотвращало ЕАЕ при введении в момент иммунизации (Brinkmann et al., 2002; Fujino et al., 2003). Однако ранее было неясно, является ли FTY720 или его хиральный аналог (AAL(R)) эффективным при введении после развития заболевания.
Ввиду сходства с CIDP мыши NOD, дефицитные по В7-2, дают уникальную возможность изучать агенты, которые могут останавливать прогрессирование заболевания или ускорение выздоровления при аутоиммунных нейропатиях. В этой модели спонтанной аутоиммунной нейропатии развитие симптомов возникает между 24 и 28 неделями. При отсутствии лечения состояние мышей ухудшалось до развития у них тетрапареза через 32 недели.
Использовали самок мышей NOD, дефицитных по В7-2, так как они были более подвержены развитию SAP, чем их сверстники самцы (Salomon et al., выше). В начале исследования мыши имели возраст 7 месяцев. Животным давали FTY720 (водный раствор) в дозировке 0,3 мг/кг или 1 мг/кг или отдельно носитель через пероральный зонд один раз в день в течение 1 месяца. Концентрации выбирали на основании исследований доза-ответ в отношении уменьшения периферических лимфоцитов, и данных исследований ЕАЕ у крыс (Brinkmann et al., 2002; Fujino et al., 2003).
Для определения эффекта FTY720 на клинические показатели и силу захвата мышей NOD, дефицитных по В7-2, проводили и качественные, и количественные исследования ослепленным лабораторным персоналом. Для качественной оценки использовали номинальную шкалу (с 0 как норма и 5 как смерть), описанную другими исследователями (Zhu et al., 2001a). Для количественной оценки измеряли силу задних и передних лап с помощью измерителя силы захвата (Columbus Instruments). У животных, получавших лечение в течение 1 месяца 1 мг/кг FTY720 (n=10), качественно проявлялась меньшая слабость и количественно большая сила захвата при сравнении с животными, получавшими носитель (n=11), или животными, получавшими только 0,3 мг/кг FTY720 (n=5) (фиг.5А и 5В). Различия в клинических показателях оценки между мышами, получавшими воду, через 7 месяцев и через 8 месяцев, были статистически значимыми со значением р менее чем 0,0007 (фиг.5А). Аналогично различия в клинических показателях между мышами, получавшими 0,3 мг/кг FTY720, в 7 месяцев и в 8 месяцев были статистически значимыми со значением р менее чем 0,03. В противоположность мышам, получавшим носитель, и мышам, получавшим 0,3 мг/кг FTY720, клинические показатели мышей, получавших 1,0 мг/кг FTY720, не увеличились между месяцем 7 и месяцем 8. Подобные результаты наблюдали при количественной оценке силы передних лап и задних лап. У мышей, получавших 1,0 мг/кг FTY720, проявлялось увеличение силы захвата по сравнению с мышами, получавшими носитель или 0,3 мг/кг FTY720 (фиг.5В). Полученные результаты показывают, что FTY720 может быть полезным даже при введении после развития симптомов.
Эффективность FTY720 также мониторировали путем индукции лимфопении периферической крови. Количество лимфоцитов периферической крови снижалось до 50-60% у особей, получавших носитель посредством FTY720 (0,3 мг/кг) (n=4) и на 25-30% FTY720 (1 мг/кг) (n=3).
В подгруппе исследуемых животных проводили электрофизиологические исследования для оценки эффекта FTY720 на функцию седалищного нерва in vivo. У мышей, получавших 1,0 мг/кг FTY720, было продемонстрировано улучшение дистального времени задержки (DL) и скорости проведения (Cv) по сравнению с мышами, получавшими воду, но не было продемонстрировано улучшения амплитуды седалищных комбинированных мышечных потенциалов действия (СМАР) (см. Таблицу). Подобным образом фиг.6 иллюстрирует, что лечение FTY720 улучшало DL и CV (фиг.6В, показывающая резюме результатов из экспериментов, проводимых на 12 нервах от 6 мышей, получавших воду, и 14 нервах от 7 мышей, получавших FTY720), но не амплитуду седалищных CMAP (фиг.6А).
Для дальнейшей оценки эффекта FTY720 у NOD мышей, дефицитных по В7-2, проводили гистологическое исследование для оценки инфильтрации воспалительными клетками. С использованием и количественного, и полуколичественного метода у мышей, получавших 1,0 мг/кг FTY720 (n=7), проявлялось снижение инфильтрации воспалительными клетками по сравнению с мышами, получавшими воду (n=6) (фиг.7). Такие наблюдаемые различия были статистически значимыми со значением р менее чем 0,02 при сравнении мышей, получавших воду, с мышами, получавшими FTY720, с использованием количественного метода и значением р менее чем 0,003 при проведении сравнения с использованием полуколичественного метода. Для количественного метода области тканей измеряли анализом изображения, и количество воспалительных клеток подсчитывали при ×20 увеличении. Результаты усреднены и выражены как клетки на мм2 сечения ткани. Для полуколичественного метода воспаление ранжировали как: 1 - несколько разбросанных мононуклеарных воспалительных клеток часто субпериневрально; 2 - перивенулярное скопление мононуклеарных воспалительных клеток (один или два фокуса); 3 - обширные мультифокальные перивенулярные скопления лейкоцитов и распространенное эндоневральное воспаление.
Лечение FTY720 также предотвращало демиелинизацию и потерю миелиновых волокон. Получали сечения Epon от мышей, получавших носитель (n=6), и мышей, получавших 1,0 мг/кг FTY720 (n=7). У мышей, получавших FTY720, выявлялось снижение процента потери миелиновых волокон и увеличение демиелинизации (фиг.8). Полученные различия статистически отличались со значением р менее чем 0,015. процент потери миелиновых волокон на Epon сечениях оценивал заслепленный наблюдатель с использованием координатной сетки. Демиелинизацию оценивали, как указано далее: 1 - отдельные демиелинизированные аксоны периваскулярно или рассеянно; 2 - множество фокусов периваскулярной демиелинизации; 3 - обширная демиелинизация, периваскулярная и сливающаяся.
ПРИМЕР 4
Исследование эффекта FTY720 на проницаемость гемато-нервного барьера
Дополнительные эксперименты позволяют определить, могут ли FTY720 и связанные соединения, такие как агонист S1P1 SEW2871, уменьшать нарушение гемато-нервного барьера (BNB) при введении после развития заболевания. Для изучения эффекта FTY720 на проницаемость BNB мышам NOD, дефицитным по В7-2, вводили внутривенно синий Эванса (ЕВА) за 1 час перед умерщвлением. Мышей, получавших носитель, сравнивали с мышами на 1-й день лечения FTY720 и на 3-й день лечения FTY720. С использованием DIC визуализации продольных сечений седалищного нерва получали софокусные изображения ЕВА с применением сходных условий (например, такой же линзы, лазерной энергии, размера стенопеического отверстия и др.). Если неплотность EBA в нервных тканях уменьшалась при помощи FTY720, такой результат показывал, что терапевтический эффект FTY720 опосредован, по меньшей мере, частично уменьшением нарушения BNB. Отрицательные результаты (т.е. отсутствие эффекта на способность ЕВА пересекать BNB) предполагают, что способность FTY720 снижать воспалительную инфильтрацию в сечениях седалищных нервов у SAP мышей возникает скорее в результате снижения миграции лимфоцитов в органы-мишени, чем преимущественного действия на рецепторы S1P1 и/или S1P3, экспрессируемые эндотелиальными клетками.
Дополнительные эксперименты также позволяют определять, изменяется ли в этой модели на мышах с помощью FTY720 и связанных соединений иммунореактивность спленоцитов в отношении предполагаемых антигенов. Спленоциты выделяют от SAP мышей, получавших носитель, FTY720 и FTY720-связанные соединения. Пролиферацию спленоцитов отслеживают по включению тимидина (например, исследование3Н-тимидина). Также оценивают продукцию цитокинов в ответ на пептид белка Р0 (180-199) (10-20 мкг/мл), пептид белка Р2 (57-81) (10-20 мкг/мл), очищенный миелин ПНС (100 мкг/мл) и лизат SC (100 мкг/мл). Снижение пролиферации спленоцитов и продукции цитокинов показывает, что активация Т-клеток уменьшается в ответ на FTY720 и связанные соединения. Этот результат показывает, что такие соединения могут действовать как на ранней (примирование), так и на поздней (эффекторной) фазах заболевания.
ПРИМЕР 5
Исследование роли рецепторов S1P в Шванновских клетках (SC)
Очищенные SC из седалищных нервов новорожденных крыс обрабатывали TNF-α (100 нг/мл) + IFN-γ (200 ЕД/мл) в течение 48-72 часов в бессывороточных условиях с или без FTY720-P (0,01-1- мкМ). Указанные дозировки TNF-α и IFN-γ основаны на предыдущих исследованиях (Nagano et al., 2001). Для определения, может ли FTY720-P снижать смертность SC, оценивали уровень апоптоза клеток после окрашивания ядер йодидом пропидия и исследования с трипаном синим. Если FTY720-P снижает смертность SC, для определения, который из подтипов рецепторов S1P опосредует этот эффект, используют методы siRNA. Такой подход также может быть использован для определения, могут ли агонисты S1P, иные чем FTY720-P, такие как S1P или SEW2871, ингибировать смертность SC.
В случае, если FTY720-P или другие агонисты рецептора S1P ингибируют смертность SC, будут проведены дополнительные эксперименты для оценки эффекта FTY720-P и другого агониста рецептора S1P на фосфорилирование ERK1/2 и Akt, которые являются сигнальными молекулами, связанными с выживаемостью и пролиферацией клеток. При отсутствии наблюдения эффекта в исследованиях выживаемости, пролиферации и фосфорилирования такой результат может означать, что рецепторы S1P не являются критическими для выживания, дифференцировки или миелинизации SC. Положительные результаты из вышеуказанных исследований покажут, что рецепторы S1P могут служить в качестве потенциальных мишеней для глиопротективных агентов.
Все композиции и способы, описанные и заявленные в настоящем описании, могут быть сделаны и осуществлены в свете настоящего описания без ненужных экспериментов. Тогда как композиции и способы по настоящему изобретению описаны в свете предпочтительных вариантов осуществления изобретения, специалисту в области техники очевидно, что к композициям и методам и в стадиях или в последовательности стадий способов, описанных в настоящем описании, могут быть применены вариации без отклонения от концепции, сущности и объема изобретения. В частности, очевидно, что определенные агенты, которые являются и химически и физиологически связанными, могут быть заменены на агенты, описанные в настоящем описании, при этом можно ожидать таких же или подобных результатов. Все такие подобные замены и модификации, очевидные специалисту в области техники, рассматриваются как находящиеся в сущности, объеме и концепции изобретения, что определено приложенной формулой изобретения.
ССЫЛКИ
Следующие ссылки, в той мере, в которой они обеспечивают примерные детали процедур, или другие, дополнительно к указанным в настоящем описании, специфически включены в настоящее описание в виде ссылки.
Bermingham et al, J. Neurosci. Res., 63:516-524, 2001.
Brinkmann et al, J. Biol. Chem., 277:21453-21457, 2002.
Chandross et al, Molec. Cell Neurosci., 7:479-500, 1996.
Chiba el al, J. Immunol., 160:5037-5044, 1998.
Choudhary et al, J. Neurol, 242:252-253, 1995.
Constantinescu et al, J. Neurol. Sci., 143: 14-18, 1996.
Coroneos et al, J. Biol. Chem., 270:23305-23309, 1995.
Cuvillier et al. Nature, 381:800-803, 1996.
Dorsam et al, J. Immunol, 171:3500-3507, 2003.
Fujino et al, J. Pharmacol Exp. Then, 305:70-77, 2003.
Graeler et al, J. Immunol, 169:4084-4087, 2002.
Graler et al, J. Cell Biochem., 89:507-519, 2003.
Graler and Goetzl, FASEB J., 16: 1874-1878, 2004.
Hadden et al, Neurology, 53:57-61, 1999.
Hida et al, J. Neurosci., 18:8712-8719, 1998.
Idzko et al, FASEB J., 16:625-627, 2002.
Jin et al, Blood, 101:4909-4915, 2003.
Karandikar et al., J. Neuroimmunol, 89: 10-18, 1998.
Kiefer et al, J. Neurol. Neurosurg. Psychiat., 69:362-368, 2000.
Kim et al, J. Neuroimmunol, 51: 177-183, 1994.
Kiuchi et al, J. Med. Chem., 43:2946-2961, 2000.
Kuchroo et al, Cell, 80:707-718, 1995.
Kuntzer et al, Neurology, 53:1364-1365, 1999.
Lee et al, Biochim. Biophys. Acta, 1582:175-177, 2002.
Li et al, J. Biol Chem., 278:9585-9591, 2003.
Liu et al, Am. J. Respir. Cell Mol. Biol., 24:711-719, 2001.
Mandala et al., Science, 296:346-349, 2002.
Matloubian et al., Nature, 427:355-360, 2004.
Matsuda et al., Transplant Proc, 30:2355-2357, 1998.
McGiffert and Chun, FEBS Lett., 531(1): 103-108, 2002.
Murata et al., Biochem. J., 352(3):809-815, 2000.
Nagahara et al, Immunopharmacology, 48:75-85, 2000.
Nagano et al., J. Neurochem., 77:1486-1495, 2001.
Novartis Media Release, "FTY720, a novel once-daily oral medication, shows promising results in treatment of multiple sclerosis," [online] retrieved from http://www.novartispharma.at/download/presse/international/FTY720%20-%20ENGLISH%20-%20FINAL.pdf.
Oyama et al, Jpn. J. Pharmacol., 76:377-385, 1998.
Pinschewer et al., J. Immunol., 164:5761-5770, 2000.
Prineas and McLeod, J. Neurol. Sci, 27:427-458, 1976.
Remington's Science and Practice of Pharmacy, 21st Ed., Mack Printing Company, 2005.
Ropper, Neurol., 60:S16-S22, 2003.
Rosen et al, Proc. Natl. Acad. Sci. USA, 100: 10907-10912, 2003.
Salomon et al, J. Exp. Med., 194:677-684, 2001.
Sato et al, Brain Res. Mol. Brain Res., 74:182-189, 1999.
Schaphorst et al, Am. J. Physiol. Lung Cell Mol. Physiol, 285:258-267, 2003.
Schneider-Schaulies et al., Neuron., 7:995-1005, 1991.
Spiegel and Milstien, J Membr. Biol, 146:225-237, 1995.
Spiegel and Milstien, Molec. Cell Biol, 4:397-40, 2003.
Stoll et al, J. Neuroimmunol, 45: 175-182, 1993.
Suzuki et al. Transplant Proc, 28: 1375-1376, 1996.
Terai et al, Neurosci., 116: 1053-1062, 2003.
Vallat et al. Neurology, 60:S23-28, 2003.
Weiner et al, J. Neurosci., 21: 7069-7078, 2001.
Windh et al., J. Biological Chem., 274:27351-27358, 1999.
Wohlleben et al, Glia, 30:373-381, 2000.
Xie et al, J. Immunol, 170:3662-3670, 2003.
Yamagata et al., Glia, 41:199-206, 2003.
Zhu et al., Exp. Neurol., 169:472-478, 2001a.
Zhu et al., J. Neuroimmunol., 114: 114-121, 2001b.
Zondag et al., Biochem. J., 330(2):605-609, 1998.
Реферат
Изобретение относится к медицине и касается способов лечения, облегчения симптомов и удлинения интервала между рецидивами аутоиммунных заболеваний периферической нервной системы, в частности синдрома Гийена-Барре (GBS), хронической воспалительной демиелинизирующей полинейропатии (CIDP), нейропатии при васкулите. Пациенту вводят эффективное количество агониста рецептора сфингозин-1-фосфата, в частности FTY720, FTY720-P, AAL(R), AFD(R) или SEW2871. Изобретение обеспечивает расширение арсенала способов лечения аутоиммунных заболеваний периферической нервной системы. 3 н. и 17 з.п. ф-лы, 10 ил., 1 табл.

Комментарии