Фармацевтическая композиция на основе n1,n4-бис-(бута-1,3-диенил)бутан-1,4-диамина и способы ее применения - RU2448693C2
Код документа: RU2448693C2
Чертежи

















Описание
Ссылка на родственную заявку
Заявленная формула изобретения имеет приоритет по патентной заявке США №60/797,142, поданной 3 мая 2006, которая представлена здесь посредством ссылки в полном объеме.
Уровень техники
Прогрессирующий метастатический гормоно-рефрактерный рак предстательной железы является второй основной причиной смертности от рака среди мужчин, проживающих в США. Было определено, что в 2006 году свыше 27000 американцев умрет от метастатического рака простаты. В настоящее время, большинство хемиотерапевтических агентов, применяемых в клиниках, имеют ограничения для лечения заболевания. Таким образом, существует большая потребность в новых терапевтических агентах для лечения метастатического рака простаты.
Во время первичной диагностики, у большинства пациентов с раком простаты имеются андроген-зависимые опухоли, которые быстро регрессируют после хирургического вмешательства, облучения и терапии, направленной на устранение влияния андрогенов. Однако рак репидивирует через несколько лет у значительного процента таких пациентов. Рецидив проявляется в форме прогрессирующего метастатического гормоно-рефрактерного заболевания. В настоящее время, не существует эффективной терапии для лечения или профилактики данного заболевания, в особенности в прогрессирующей стадии. В этой связи, существует большая неотложная потребность в разработке лекарственных средств для подавления рецидива и прогрессирования рака простаты.
Существует теория, что оксидативный стресс в ткани предстательной железы является главным фактором возникновения и прогрессирования рака простаты. Следовательно, дополнительно существует срочная необходимость для обнаружения и разработки лекарственных средств, которые терапевтически снижают оксидативный стресс.
Опубликованные эпидемиологические и биохимические случаи вызывают предположения, что оксидативный стресс в ткани простаты является одним из основных факторов возникновения и прогрессирования рака предстательной железы и что антиоксиданты способны снижать канцерогенез предстательной железы. Также известно, что андроген является одним из основных стимуляторов ROS (активных форм кислорода) в нормальных и злокачественных клетках простаты. (См. Wilding, G., Endocrine Control of Prostate Cancer, Cancer Surveys, 23:43-62 (1995)). Также известно, что в катаболическом пути полиаминов, рециркуляция фермента ацетилполиаминоксидазы ("АРАО") представляет основной источник продукции ROS. (См. Cohen, S.S., A Guide to the Polyamines, Oxford Univ. Press, Oxford UK: 296-319 (1998); Schwartz, В et al., A New Model for Disruption of the Oraithine Decarboxylase Gene, SPE1, in Saccharomyces Cerevisiae Exhibits Growth Arrest and Genetic Instability at the MAT Locus, Biochem J., Nov 15:312 (Pt.1):83-90 (1995); Schipper RG et al., Antitumor Activity of the Polyamine Analog N(I)5N(I1)-diethyhiorspermine Against Human Prostate Carcinoma Cells, The Prostate, 44(4):313-21 (2000); Casero, RA et al. The Role of Polyamine Catabolism in Anti-tumour Drug Response, Biochem. Soc. Trans., Apr: 31(2):361-5 (2003); На, НС et al. The Role of Polyamine Catabolism in Polyamine Analogue-Induced Programmed Cell Death, Proc. Natl. Acad. Sci. USA, 94(21): 11557-62 (1997); и. Bey, P et al., N-2,3-Butadienyl-1,4-butanediamine Derivatives: Potent Irreversible Inactivators of Mammalian Polyamine Oxidase, J.Med.Chem, 28(1):1-2 (1985)).
Раскрытие изобретения
Один аспект изобретения представляет способ снижения концентрации активных форм кислорода в простате мужчины, включающий стадии или действия по введению терапевтического количества N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина или его фармацевтически приемлемой соли или сольвата.
В примерном воплощении вышеуказанного способа, терапевтическое количество представляет собой количество, достаточное для снижения концентрации одной или более активных форм кислорода в простате, по меньшей мере, на 50% по сравнению с концентрациями активных форм кислорода у контрольного мужчины, не получающего лечение.
В примерном воплощении вышеуказанного способа, способ дополнительно содержит стадию или действие определения сниженной концентрации активных форм кислорода путем измерения отношения показателя флуоресценции окисленного гидроэтидина к показателю флуоресценции ДНК ex vivo.
В другом примерном воплощении вышеуказанного способа, способ дополнительно включает стадию или действие по определению сниженной концентрации активных форм кислорода путем измерения ех vivo соотношения уровня флуоресценции окисленного 2′,7′-дихлордигидрофлуоресцеин диацетата к уровню флуоресценции ДНК.
В другом примерном воплощении вышеуказанного способа, способ дополнительно включает стадию или действие по определению снижения концентрации активных форм кислорода путем измерения ex vivo соотношения уровня флуоресценции окисленного гидроэтидина к уровню флуоресценции ДНК.
В другом примерном воплощении любых вышеуказанных способов, активными формами кислорода являются один или более, выбранные из перекиси водорода, супероксида, гидроксильного радикала и оксида азота, где "супероксид" представляет собой молекулу кислорода с одним дополнительным электроном. Например, молекула супероксида может быть ROS, образованной в клеточной митохондрии.
Другой аспект изобретения представляет способ ингибирования ацетилполиаминоксидазы в простате мужчины, включающий стадию или действие по введению человеку терапевтического количества N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина или его соли или сольвата. В примерном воплощении, ацетилполиаминоксидаза ингибируется, по меньшей мере, на 50% по сравнению с мужчиной, не получающим лечение.
Другой аспект изобретения представляет способ профилактического лечения рака простаты у мужчин, включающий стадию или действие по введению терапевтического количества N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина или его фармацевтически приемлемой соли или сольвата.
В примерном воплощении вышеуказанного способа, терапевтическое количество представляет количество, достаточное для предотвращения или снижения возникновения и/или рецидивирования рака простаты по сравнению с взятым в качестве контроля мужчиной, не получающим лечение, с или без ранее диагностированным раком простаты.
Другой аспект изобретения представляет способ лечения рака простаты мужчины, включающий стадию или действие по введению терапевтического количества N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина или его фармацевтически приемлемой соли или сольвата.
В примерном воплощении вышеуказанного способа, терапевтическое количество представляет собой количество, достаточное для остановки или снижения прогрессирования, заболеваемости и/или смертности вследствие рака простаты.
В примерном воплощении любых вышеуказанных способов, солью является ацетат, бензолсульфонат, бензоат, бикарбонат, битартрат, бромид, кальция эдетат, камсилат, карбонат, хлорид, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эсилат, фумарат, глюцептат, глюконат, глутамат, глюколлиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изотионат, лактат, лактобионат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напсилат, нитрат, памоат, пантотенат, фосфат, дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, сульфат, таннат, тартрат, теоклат или триэтиодид.
В другом примерном воплощении любых вышеуказанных способов, солью является дигидрохлоридная соль.
В другом примерном воплощении любых вышеуказанных способов, терапевтическое количество составляет в пределе около 1-100 мг/кгмассы тела, и терапевтическое количество дозируется для приема от двух раз в неделю до одного раза в день.
В другом примерном воплощении любых вышеуказанных способов, терапевтическое количество составляет в пределе около 10-40 мг/кгмассы тела, и терапевтическое количество дозируется для еженедельного приема.
В другом примерном воплощении любых вышеуказанных способов, терапевтическое количество составляет приблизительно 25 мг/кгмассы тела, и терапевтическое количество дозируется для приема дважды в неделю.
Другой аспект изобретения представляет пероральную фармацевтическую композицию, содержащую терапевтически эффективное количество активного фармацевтического ингредиента, содержащего N,N′-бис(2,3-бутадиенил)-1,4-бутандиамин или его фармацевтически приемлемую соль или сольват, и один или более фармацевтически пригодных частей, выбранных из группы, состоящей из носителя, наполнителя, растворителя, добавки, среды для лекарственного средства, стабилизатора, инертного разбавителя, связующего вещества, разлагающего агента и связующего вещества.
В примерном воплощении пероральной фармацевтической композиции, соль представляет собой ацетат, бензолсульфонат, бензоат, бикарбонат, битартрат, бромид, кальция эдетат, камсилат, карбонат, хлорид, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эсилат, фумарат, глюцептат, глюконат, глутамат, гликолиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изотионат, лактат, лактобионат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напсилат, нитрат, памоат, пантотенат, фосфат, дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, сульфат, таннат, тартрат, теоклат или триэтиодид.
В примерном воплощении пероральной фармацевтической композиции, композиция представлена в форме непокрытой оболочкой таблетки, покрытой оболочкой таблетки, твердой желатиновой капсулы, мягкой желатиновой капсулы, порошка, капсулы, пеллеты, раствора, суспензии, эликсира или эмульсии.
Другой аспект изобретения представляет способ определения оксидативного стресса в ткани человека, содержащий стадию или действие по измерению ex vivo отношения уровня флуоресценции окисленного 2′,7′-дихлордигидрофлуоресцеин диацетата к уровню флуоресценции ДНК.
Другой аспект изобретения представляет способ определения оксидативного стресса в ткани человека, содержащий стадию или действие по измерению ех vivo отношения уровня флуоресценции окисленного гидроэтидина к уровню флуоресценции ДНК.
Другой аспект изобретения представляет способ определения оксидативного стресса в ткани простаты мужчины, содержащий стадию или действие по измерению отношения уровня флуоресценции окисленного 2′,7′-дихлордигидрофлуоресцеин диацетата к уровню флуоресценции DNA in vivo.
В примерном воплощении вышеуказанных способов, ткань человека представляет собой ткань предстательной железы мужчины, полученной при биопсии опухоли.
В другом примерном воплощении вышеуказанных способов, ткань человека получена путем биопсии опухоли из другого органа, кроме предстательной железы.
Другой аспект изобретения представляет способ лечения рака в простате самца-собаки, содержащий стадию или действие по введению собаке терапевтического количества N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина или его фармацевтически приемлемой соли или сольвата.
Другой аспект изобретения представляет способ снижения концентрации активных форм кислорода в ткани человека, содержащий стадию или действие по введению человеку терапевтического количества N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина его фармацевтически приемлемой соли или сольвата.
В примерном воплощении вышеуказанного способа, терапевтическое количество представляет собой количество, достаточное для снижения концентрации одной или более активных форм кислорода в простате, по меньшей мере, на 50% по сравнению с концентрацией активных форм кислорода в необработанной ткани человека.
В примерном воплощении вышеуказанного способа, активные формы кислорода представляют собой один или более соединения, выбранные из перекиси водорода, супероксида, гидроксильного радикала и оксида азота.
Другой аспект изобретения представляет набор реагентов для измерения концентрации активных форм кислорода ех vivo или in vivo в клетке млекопитающих, органе или биоптате, содержащий первый компонент, содержащий краситель гидроэтидин, и, второй компонент, содержащий краситель для ДНК живых клеток.
В примерном воплощении вышеуказанного набора реагентов, краситель для ДНК живых клеток содержит:
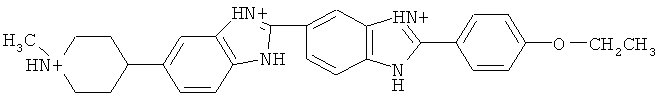
Другой аспект изобретения представляет способ применения вышеуказанного набора для измерения ex vivo концентрации активных форм кислорода в ткани, полученной из клеток млекопитающих, органов и биоптатов, содержащий стадии или действия, включающие окрашивание первой ткани красителем гидроэтидин с получением первого числа единиц флуоресценции, окрашивание второй ткани красителем для ДНК живых клеток с получением второго числа единиц флуоресценции, и приведение первого числа единиц флуоресценции ко второму числу единиц флуоресценции для расчета концентрации активных форм кислорода.
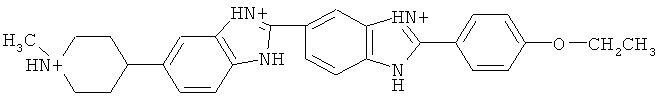
В примерном воплощении вышеуказанного способа, ДНК живых клеток содержит:

Другой аспект изобретения представляет набор реагентов для измерения концентрации активных форм кислорода ех vivo или in vivo в клетке млекопитающего, органе или биоптате, содержащий первый компонент, содержащий краситель 2′,7′-дихлордигидрофлуоресцеина диацетат, и второй компонент, содержащий а краситель для ДНК живых клеток.
В примерном воплощении вышеуказанного набора реагентов, ДНК живых клеток содержит:

Другой аспект изобретения представляет способ применения вышеуказанного набора реагентов для измерения ex vivo концентрации активных форм кислорода в ткани, полученной из клеток млекопитающего, органов или биоптатов, включающий стадии или действия, обеспечивающие окрашивание первой ткани красителем 2',7'-дихлордигидрофлуоресцеина диацетатом с получением первого числа единиц флуоресценции, окрашивание второй ткани красителем для ДНК живых клеток с получением второго числа единиц флуоресценции, и приведение первого числа единиц флуоресценции ко второму числу единиц флуоресценции для расчета концентрации активных форм кислорода.
В примерном воплощении вышеуказанного способа, ДНК живых клеток содержит:
Краткое описание чертежей
Фиг.1 представляет схематическую иллюстрацию метаболизма полиамина в зависимости от андрогена, индуцирующего введение SSAT в клетки простаты, обуславливая окисление полиамина и продукцию ROS.
Фиг.2 представляет теоретическую схематичную иллюстрацию соединения N,N′-бис(2,3-бутадиенил)-1,4-бутандиамин непосредственного изобретения, действующего как ингибитор ацетилполиаминоксидазы (АРАО) и блокирующего андроген, вызывающий продукцию ROS в клетках простаты.
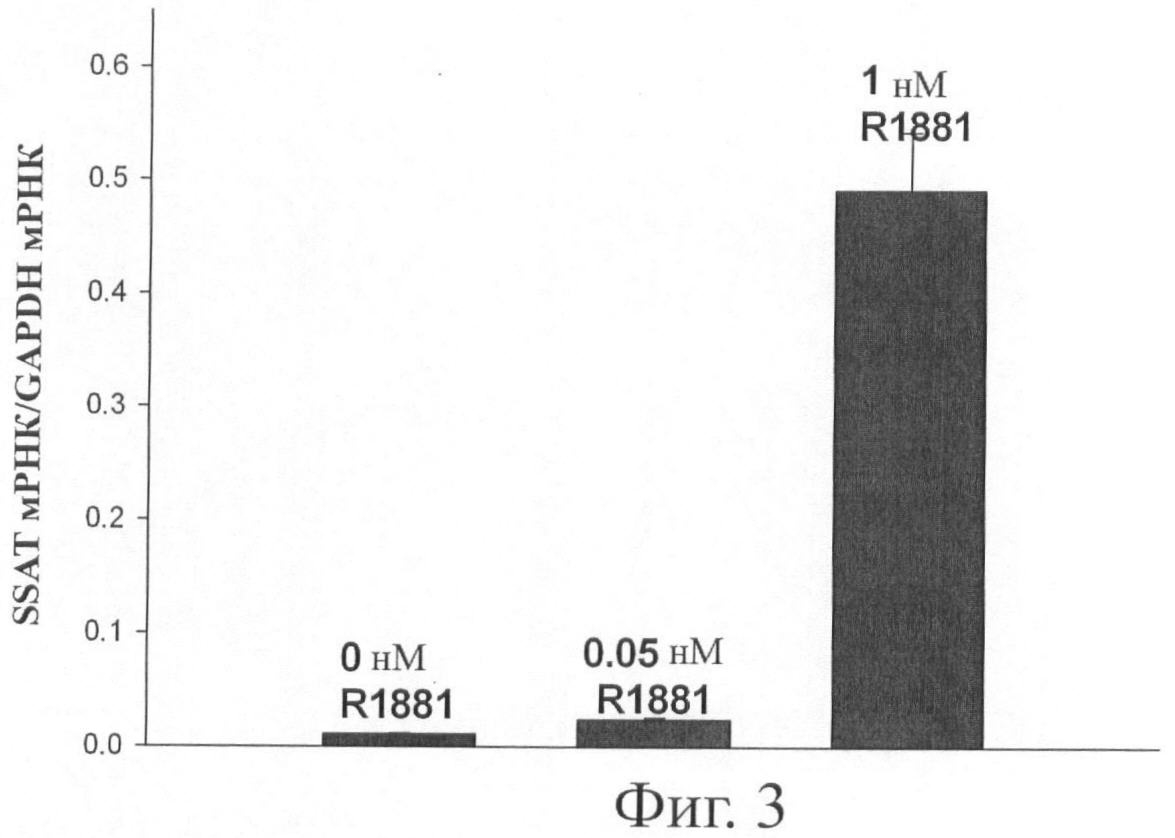
Фиг.3 представляет графическую иллюстрацию, показывающую диаграмму количественного определения уровня мРНК SSAT путем qRT-PCR, приведенного к уровням мРНК глицеральдегид-3-фосфо-дегидрогеназы в необработанных клетках рака простаты человека и клетках, обработанных 0,05 нМ или 1,0 тМ R1881 в течение 96 часов, где данные QRT-PCR показывают, что обработка 1 нМ R1881 (синтетический аналог андрогена) повышает уровни мРНК SSAT в клетках LNCaP.
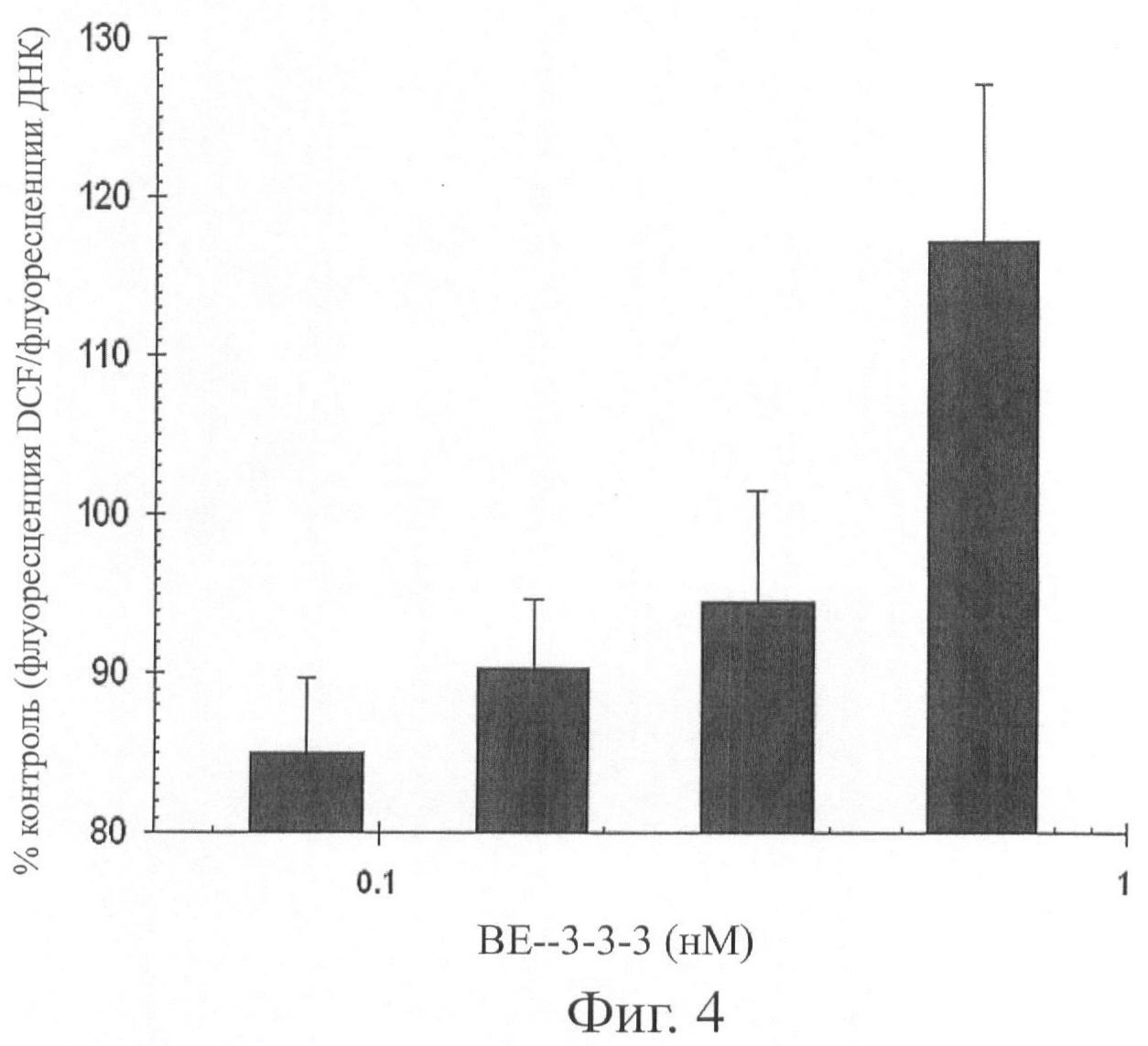
Фиг.4 представляет графическую иллюстрацию, показывающую диаграмму флуоресценции DCF/ флуоресценции ДНК в клетках LNCaP при 72 часовой обработке с повышением концентрации неандрогенного соединения бисетил норспермин ("ВЕ-3-3-3") в клетках рака простаты человека DU-145, где данные приведены к проценту необработанных клеток в качестве контроля и где ВЕ-3-3-3 (известный индуктор SSAT) повышает оксидативный стресс в клетках DU-145.
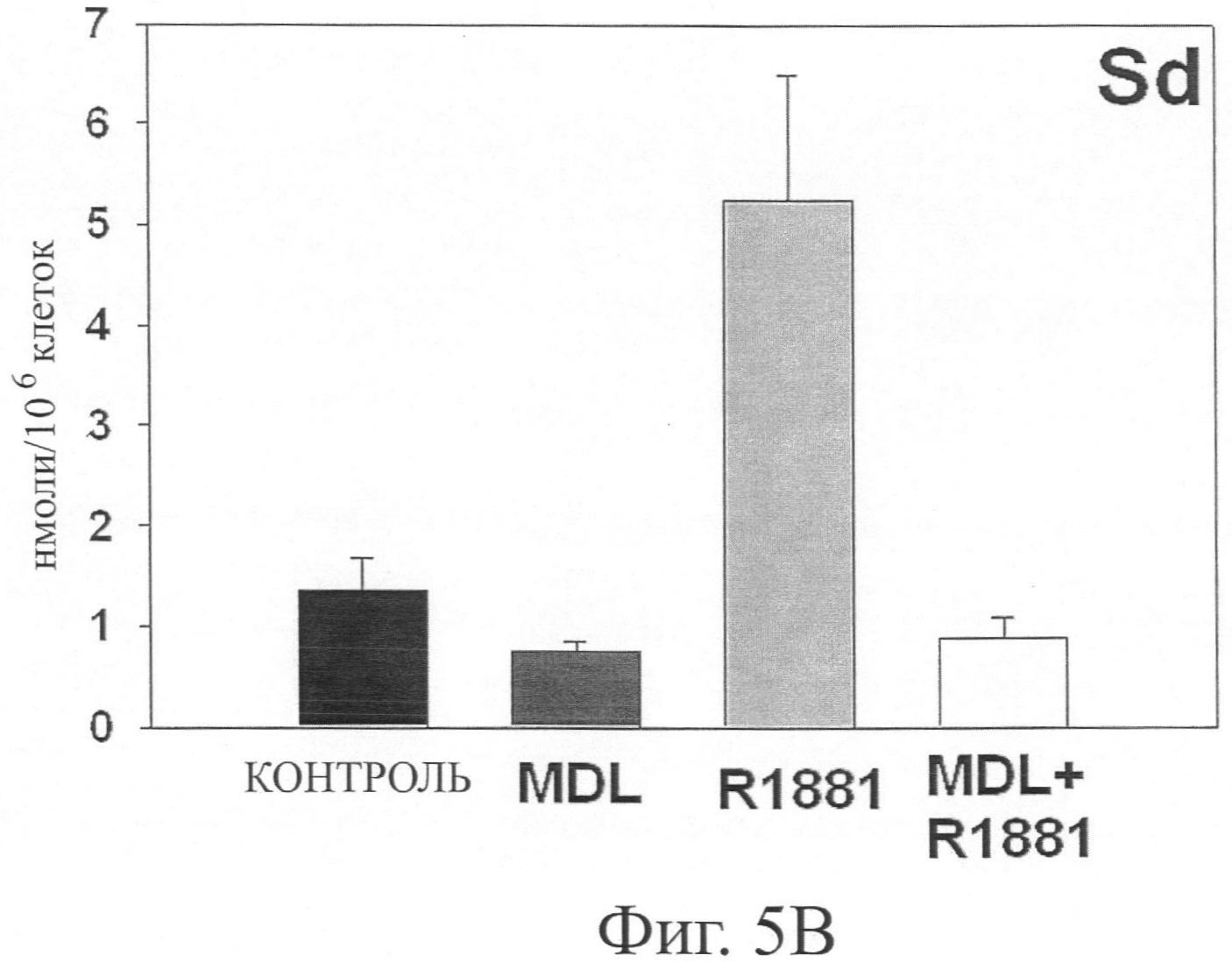
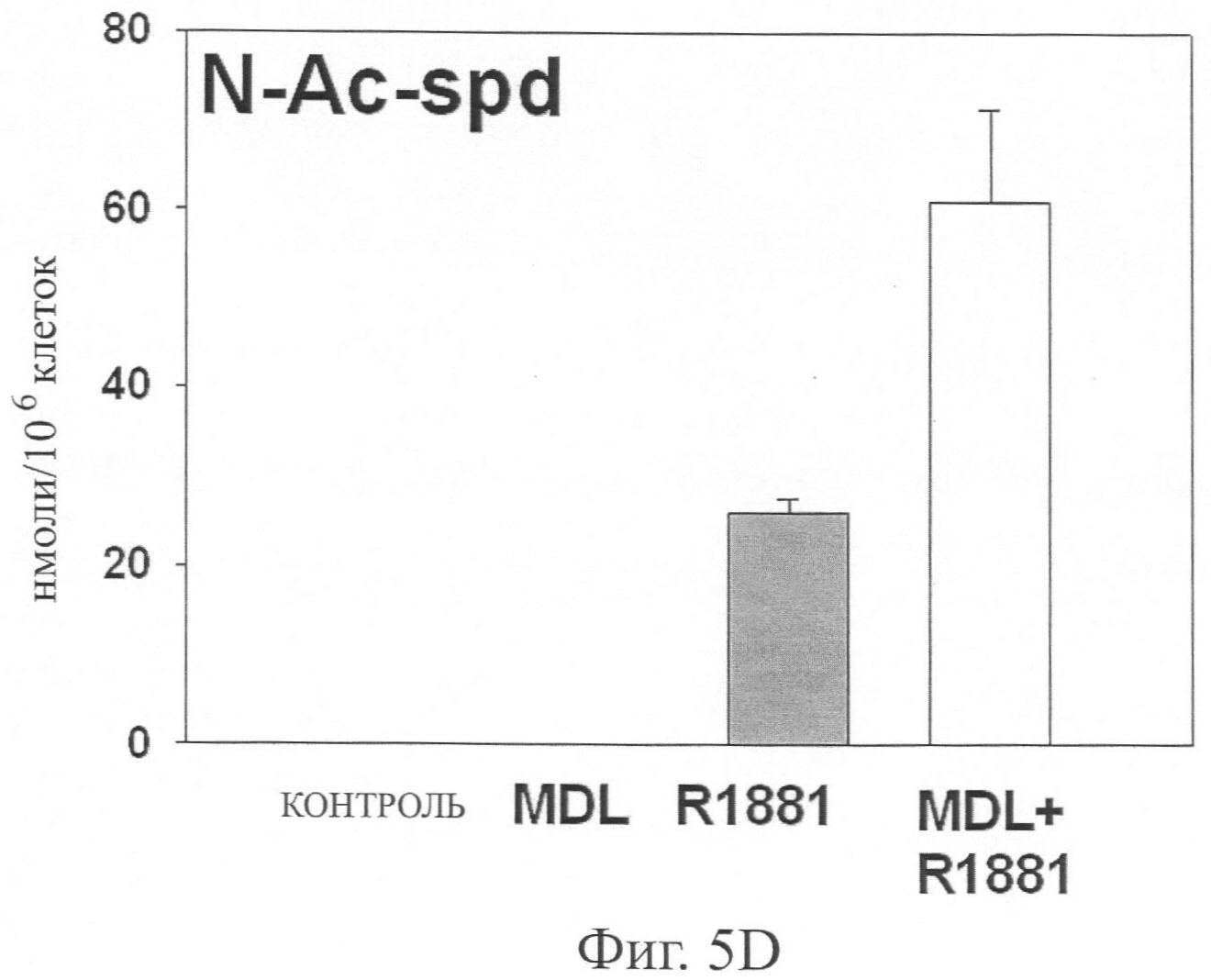
Фиг.5А-5Е представляют графические чертежи, показывающие диаграммы уровней путресцина (Pu), спермидина (Sd), spermine (Sm), N-ацетил спермидина (N-Ac-Sd) и N-ацетил спермина (N-Ac-Sm) в клетках простаты человека LNCaP, обработанных 25 мкг N,N′-бис(2,3-бутадиенил)-1,4-бутандиамином в течение 120 часов, и с и без обработки 1 нМ R1881 в течение 96 часов, и клетках, предварительно обработанных в течение 24 часов 25 мкМ N,N′-бис(2,3-бутадиенил)-1,4-бутандиамином с последующей обработкой 1 нМ R1881 в течение 96 часов, где уровни полиамина выражаются в нмоль/10-6 клеток и определялись с помощью способа ВЭЖХ (см. Kabra, PM et al., Solid-Phase Extraction and Determination of Dansyl Derivatives of Unconjugated and Acetylated Polyamines by Reverse-Phase Liquid Chromatography: Improved Separation Systems for Polyamines in Cerebrospinal Fluid, Urine and Tissue, J.Chromatogr., 1986; 380(1):19-32) при использовании коммерчески доступных стандартов, и где данные показывают уровни полиамина и ацетил полиамина в клетках LNCaP, обработанных 1 нМ R1881 ± 25 мкМ MDL 72,527.
Фиг.6 представляет графическую иллюстрацию, показывающую диаграмму флуоресценции DCF/флуоресценции ДНК в клетках LNCaP, выраженных как процент контрольных необработанных клеток, обработанных увеличивающейся концентрацией R1881, где данные показывают, что предварительная обработка с MDL 72,527 эффективно блокирует андроген, индуцирующий продукцию ROS в клетках LNCaP.
Фиг.7A-7D включают картины срезов предстательной железы 20-недельной мыши линии TRAMPxFVB Fl (Hybrid Mouse Prostatic Lumens), инъецированной 8 мг/кгмассы тела гидроэтидина (HEt) внутривенно за один час до умерщвления (где TRAMP является обозначением трансгенной аденокарциномы на мышиной модели рака простаты), при этом Фиг.7А демонстрирует типичную картину фазово-контрастной мироскопии среза простаты животных, получившим только наполнитель, при этом Фиг.7В демонстрирует картину флуоресцентной микроскопии среза простаты, показанного на Фиг.7А, при этом Фиг.7С демонстрирует типичную картину фазово-контрастной мироскопии среза простаты животных, умерщвленных через 2 недели после 6-кратного введения им 25 мг/кгмассы тела N,N′-бис(2,3-бутадиенил)-1,4-бутандиаминового соединения, при этом Фиг.7D демонстрирует HEt картину флуоресцентной микроскопии среза простаты, показанного на Фиг.7С, при этом все картины были получены при 20х увеличении с помощью Olympus(TM) BH-2 флуоресцентного микроскопа при использовании фильтров с 480 нм возбуждением/600 нм излучением, объединенных с цифровой камерой Sony DSC-V3, установленной на F2,8 и 30 сек, при этом картины иллюстрируют снижение оксидативного стресса вследствие применения лекарственного средства и при этом меньшая флуоресценция HEt показывает меньший оксидативный стресс у мышей, получившим MDL 72,527.
Фиг.8 представляет графическую иллюстрацию диаграммы, показывающей процент выживших животных в зависимости от возраста самцов-мышей TRAMP, при этом животные получали 25 мг/кгмассы тела N,N′-бис(2,3-бутадиенил)-1,4-бутандиаминового соединения или физиологический раствор в качестве контроля внутрибрюшинно дважды в неделю (при неделях, помеченных "tx") и отслеживали выживаемость, при этом выживаемость определялась по времени до эфтаназии, обусловленной опухолевой массой, и при этом данные демонстрируют повышение общей выживаемости вследствие лечения с MDL 72,527 у мышей TRAMP.
Фиг.9 показывает графическую иллюстрацию диаграммы, демонстрирующей зависимость массы тела животного (г) от возраста животного (недели) для мышей TRAMPxFVB, получавшим 25 мг/кгмассы тела MDL 72,527 или физиологический раствор в качестве контроля два раза в неделю (при неделях, отмеченных "tx"), при этом данные показывают, что MDL 72,527 не обладает материальным токсическим эффектом, что определено по изменениям массы тела мышей TRAMPxFVB.
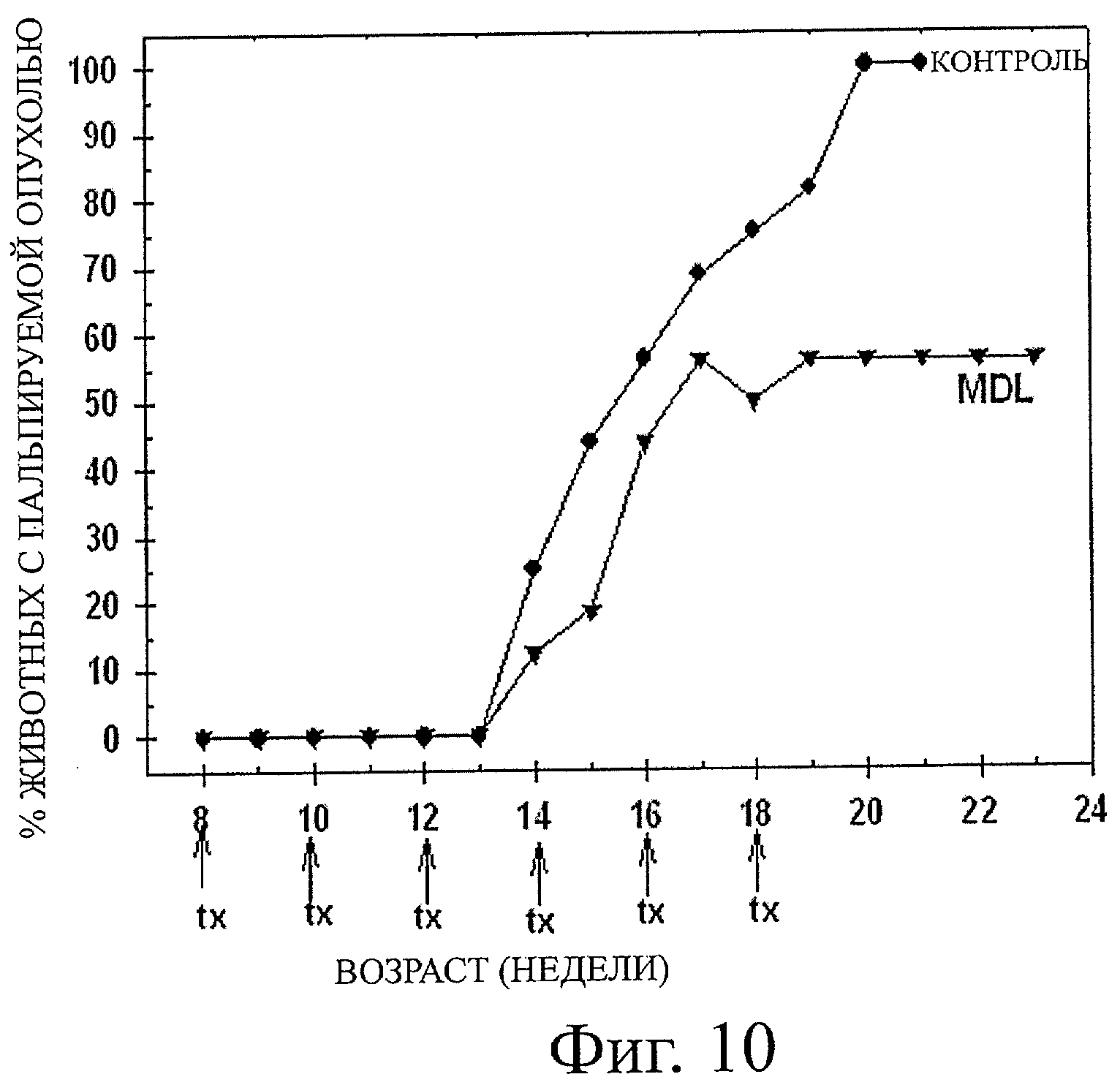
Фиг.10 показывает графическую иллюстрацию диаграммы, демонстрирующей процент животных с четкой пальпируемой опухолью в зависимости от возраста животного (недель), при этом мыши TRAMPxFVB получали 25 мг/кгмассы тела N,N′-бис(2,3-бутадиенил)-1,4-бутандиаминового соединения каждые две недели (при "tx"), и при этом данные демонстрируют, что лечение с MDL 72,527 задерживает развитие опухоли у мышей TRAMPxFVB.
Фиг.11 показывает графическую иллюстрацию диаграммы, демонстрирующей процент выживших животных в зависимости от возраста (недель) самцов-мышей TRAMPxFVB, при этом животные получали 25 мг/кгмассы тела N,N′-бис(2,3-бутадиенил)-1,4-бутандиаминового соединения или физиологический раствор в качестве контроля внутрибрюшинно дважды в неделю (при неделях, помеченных "tx") и отслеживали выживаемость, при этом выживаемость определялась по времени до эфтаназии, обусловленной опухолевой массой, и при этом данные демонстрируют повышение общей выживаемости вследствие лечения с MDL 72,527 у мышей TRAMPxFVB.
Фиг.12 демонстрирует анализ Western blot, показывающий, что применение соединения N,N′-бис(2,3-бутадиенил)-1,4-бутандиамин, вызывающего блокировку андрогенного действия у мышей TRAMPxFVB, не было связано с супрессирующим эффектом андрогенного рецептора ("AR").
Фиг.13 демонстрирует диаграмму флуоресценции DCF/флуоресценции ДНК, представляющую уровни ROS в клонах клеток LNCaP, трансфицированных одним вектором или вектором, экспрессирующим siRNA против SSAT (si22), при этом клетки не были обработаны или обрабатывались 1 нМ R1881 в течение 96 ч, при этом все данные сопоставлялись с таковыми для необработанных клеток, трансфицированных одним вектором, при этом 1 нМ R1881, вызывающий продукцию ROS, значительно снижался в клоновых клетках LNCaP с отключенным SSAT (si22), и при этом данные показывают, что окисление полиамина является источником ROS в РСа.
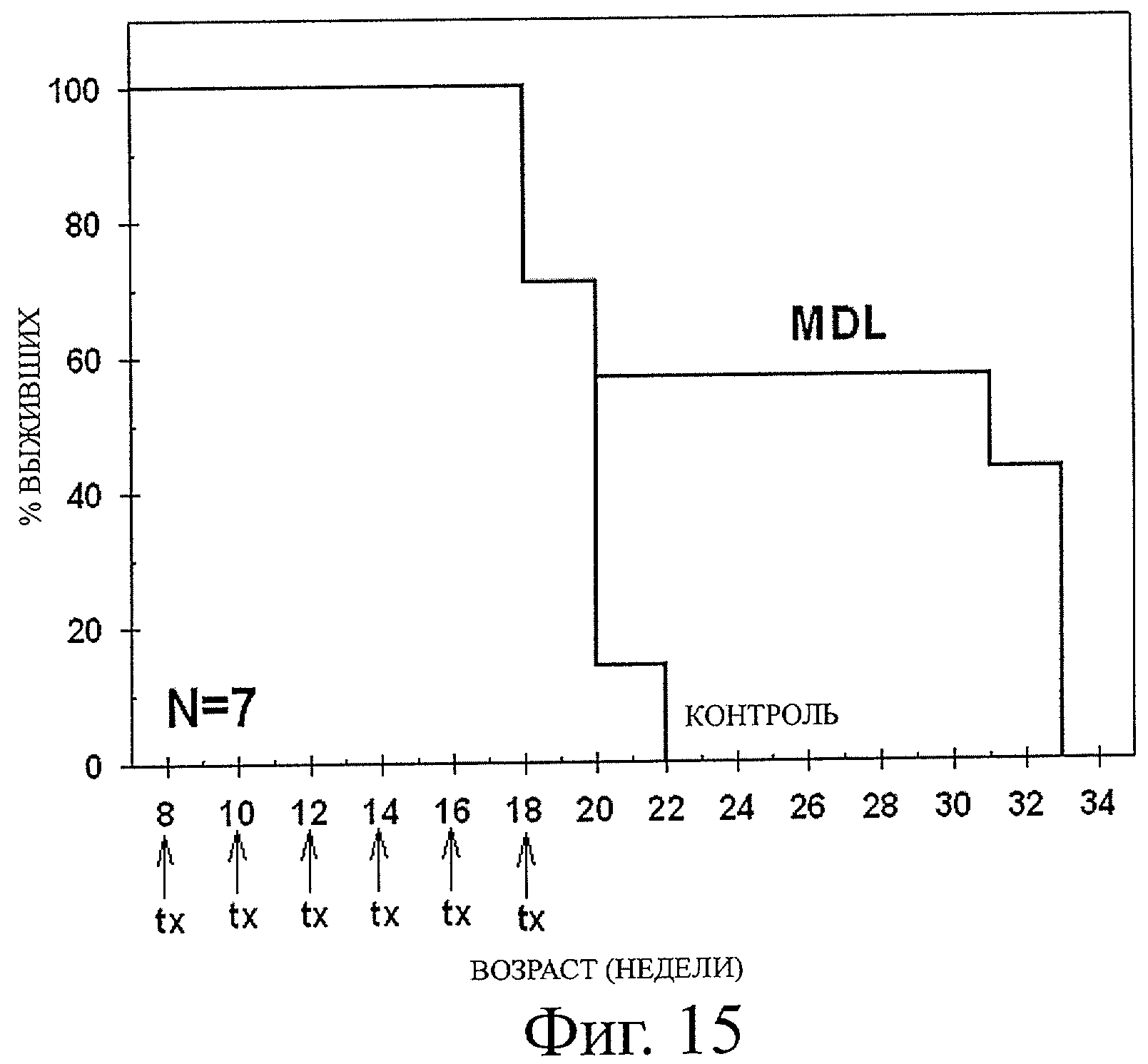
Фиг.14 и 15 показывают кривые выживаемости Каплан-Майера, демонстрирующие процент выживаемости в зависимости от возраста мышей самцов TRAMP на Фиг.14 и TR-AMPxFVB на Фиг.15, при этом животные получали либо 25 мг/кгмассы тела MDL 72,527 либо физиологический раствор в качестве контроля путем внутрибрюшинного введения два раза в день по неделям, отмеченным линиями, и отслеживали выживаемость, при этом выживаемость определяли по времени до эфтаназии, обусловленной опухолевой массой, при этом (как показано на Фиг.14) MDL 72,527, который вводили один раз в две недели на курс из трех введений, увеличивал общую выживаемость TRAMP животных, и при этом (как показано на Фиг.15) MDL 72,527, который вводили один раз в две недели на курс из 6 введений, повышал общую выживаемость TRAMPxFVB мышей.
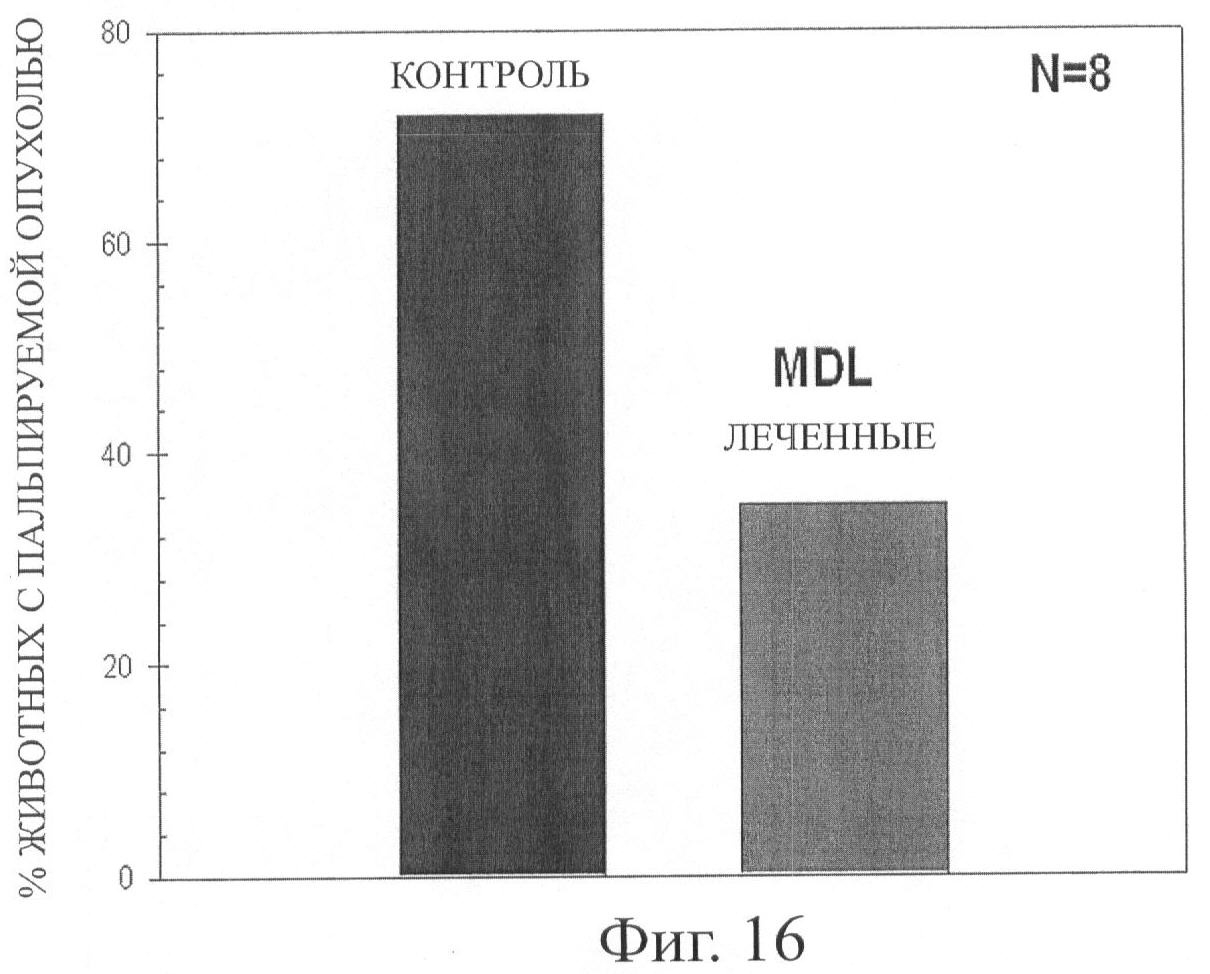
Фиг.16 демонстрирует диаграмму двадцати недельных животных с пальпируемой опухолью перед тем, как 8 животных были умерщвлены для проведения микроскопического определения наличия простатической интраэпителиальной неоплазии (Prostatic Intraepithelial Neoplasm, PIN) или карциномы в ткани простаты с помощью анатомо-патологического исследования, при этом показано время развития опухоли у мышей TRAMPxFVB, получавшим лечение с MDL 72,527 в дозе 25 мг/кгмассы тела один раз каждые две недели.
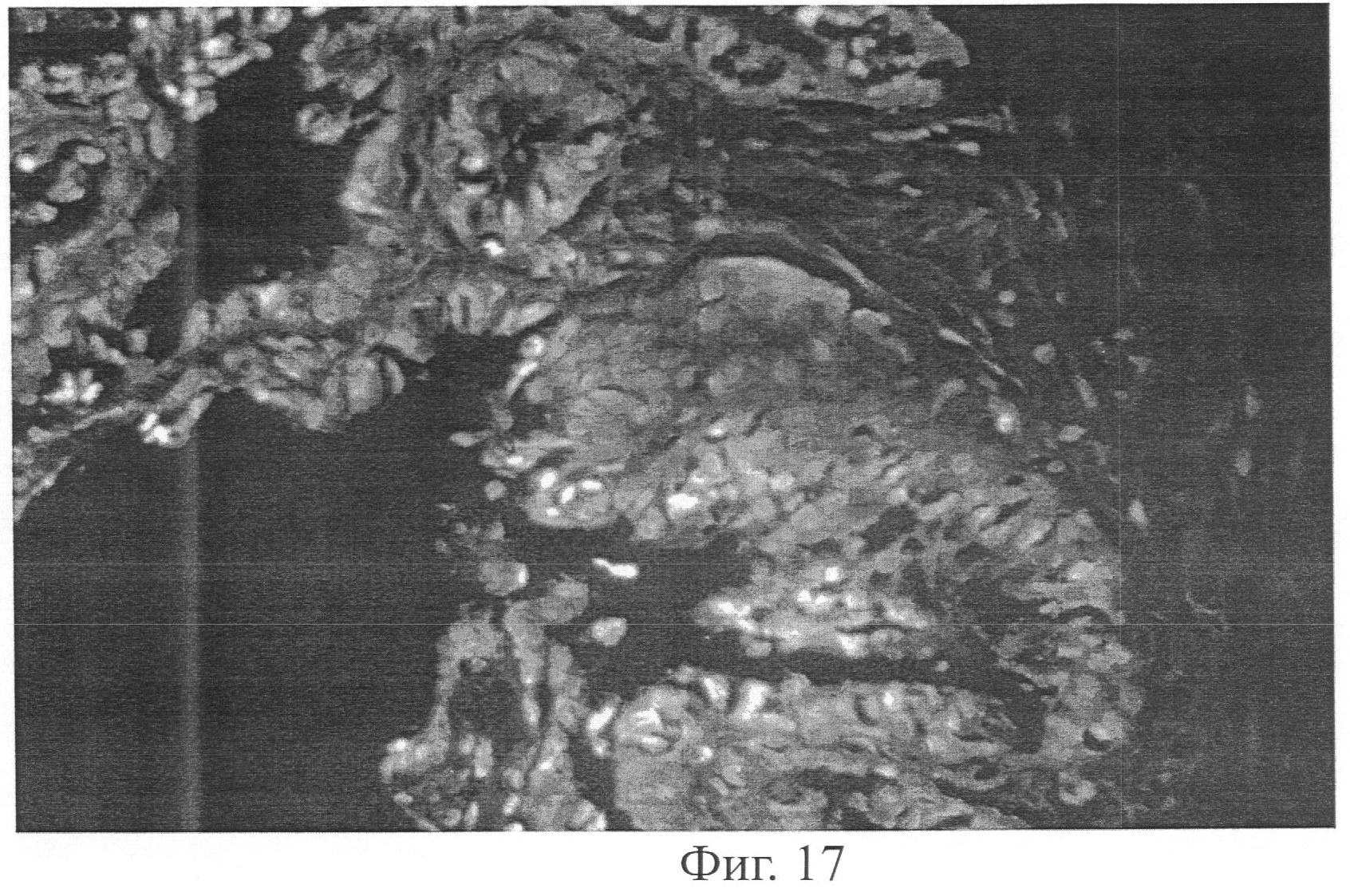
Фиг.17 демонстрирует картину удаленной хирургическим путем ткани простаты человека от нелеченных мужчин, разрезанной на толщину 4-5 мм и инкубированной в растворе HEt (8 мг/мл) в течение 60 мин при 37°С перед обработкой ткани (парафиновая блокировка и изготовление микротомных срезов для флуоресцентной микрографии), при этом картины получены при 20х увеличении при длине волны возбуждения 480 нм/излучения 595 нм, после лечения, которое включено.
Фиг.18 демонстрирует картину аналогичной части простаты человека, использующейся на Фиг.17, при этом окрашивание HEt демонстрирует разницу между эпителиальными клетками и стромальными клетками, и при этом данные показывают высокий оксидативный стресс только в эпителиальных клетках простаты.
Фиг.19 демонстрирует рассматриваемый способ приготовления N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина.
Осуществление изобретения
Изобретение относится к N1,N4-бис(бута-1,3-диенил)бутан-1,4-диамин дигидрохлориду (также относится к MDL 72,527 и N,N′-ди-2,3-бутадиенил-1,4-бутандиамина дигидрохлориду), или его солям или сольватам, его применению в качестве антиоксиданата, его применению для профилактики и/или лечения рака простаты у мужчин, и его применению для снижения концентрации активных форм кислорода в ткани предстательной железы человека или в любой ткани организма, и способам приготовления его соединения. Другие способы включают ингибирование ацетилполиаминоксидазы в ткани простаты человека или другой ткани организма, содержащие введение терапевтического количества N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина или его соли или сольвата человеку, и способ определения оксидативного стресса в ткани простаты человека или другой ткани организма человека или животного, содержащий измерение отношения уровня флуоресценции окисленного 2′,7′-дихлордигидрофлуоресцеин диацетата к уровню флуоресценции ДНК и флуоресценции красителя гидроэтидина ex vivo или in vivo. Изобретение может использоваться ex vivo или in vivo на любом млекопитающем, таком как человек или собака.
Настоящее изобретение включает химиотерапевтические агенты, которые специфично снижают оксидативный стресс в ткани простаты, тем самым предотвращая и/или останавливая прогрессирование рака простаты, в частности у пациентов, входящих в группу высокого риска. Было установлено, что активные формы кислорода ("ROS") продуцируются в предстательной железе в относительно высоких уровнях по сравнению с другими органами. ROS включают, но не ограничиваются, перекись водорода, супероксид, гидроксильный радикал и азотную кислоту.
Без ограничения какой-либо теорией, полагается, что применение соединения N,N′-бис(2>3-бутадиенил)-1,4-бутандиамина ингибирует проявления ацетилполиаминоксидазы ("АРАО") и полиаминоксидазы (РАО) посредством специфичного биохимического пути для оксидативного стресса, вызванного андрогенами (т.е. продукцию ROS), и тем самым направляя антиоксидантную терапию к ткани предстательной железы. Дополнительно полагается, что введение рассматриваемого соединения N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина не приводит к побочному материальному эффекту на андроген-сигнальном пути. Структура N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина показана ниже.
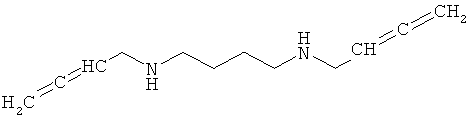
Предпочтительно, свободная форма, соль или сольват N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина вводится человеку или другому млекопитающему. Форма соли или сольвата может быть любой фармацевтически пригодной солью или сольватом. Предпочтительно, фармацевтически пригодная соль представляет собой N,N′-бис(2,3-бутадиенил)-1,4-бутандиамин·2HCl. Предпочтительно, фармацевтически пригодный сольват представляет собой N,N′-бис(2,3-бутадиенил)-1,4-бутандиамин·2HCl, растворенный в фармачевтически пригодном растворителе, таком как полярный растворитель, предпочтительно в воде.
[00064] В этой связи, применение рассматриваемого соединения N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина успешно задерживает развитие опухоли простаты и повышает показатель общей выживаемости на популярной модели предклинической трансгенной аденокарциномы мышиной простаты ("TRAMP"). (см. Garcia, GE et al., 2-Methoxyestradiol Inhibits Prostate Tumor Development in Transgenic Adenocarcinoma of Mouse Prostate: Role of Tumor Necrosis Factor-α-Simulated Gene 6, Clin Cancer Res 12(3) (lFeb2006). Модель TRAMP спонтанно развивает рак простаты и умирает от болезни. Введение рассматриваемого соединения N5N′-бис(2,3-бутадиенил)-1,4-бутандиамина значительно снижает оксидативный стресс в культивированных, андрогензависимых опухолевых клеточных линиях человека и в предраковых очагах повреждения на животном TRAMP in vivo. Рассматриваемое соединение N,N-бис(2,3-бутадиенил)-1,4-бутандиамин может также применяться как адъювантная терапия для профилактики рецидивов у пациентов, ранее проходящим лечение от первичной опухоли простаты.
Было отмечено, что ROS продуцируются в предстательной железе при более высоких уровнях, чем в других органах. ROS изменяет гены, связанные с ростом и апоптозом, либо посредством направленных мутагенных эффектов на ДНК, либо посредством изменения экспрессии генов. Высокие уровни ROS в ткани простаты могут играть роль в обоих инициации и прогрессировании рака простаты. ROS могут вызывать перекисное окисление липидов, изменять активность тиол-зависимых ферментов или разрушать ДНК.
Низкие уровни ROS, воздействующие как мутагены, индуцируя опухолевые или окислительно-восстановительные изменения благодаря продукции ROS, играют ключевую роль в специфичных путях сигнальной трансдукции. Рационы питания с высоким содержанием жиров повышают перекисное окисление липидов (тем самым продуцируя ROS), что приводит к относительно более высокой частоте заболевания раком простаты в индустриальных странах по сравнению с развивающимися государствами. Опубликованные данные подтверждают снижение частоты рака простаты, если рационы питания включают пищевые антиоксиданты, такие как β-каротин, β-ликопин, витамин Е и силен, которые снижают клеточные уровни ROS.
Недавно, экспериментальные и клинические данные непосредственно связывали повышенный оксидативный стресс с ускоренным развитием опухолей простаты. Иммуногистохимия используется для измерения оксидативного стресса, вызывающего оксидативные изменения оснований ДНК в депо парафиновых блоков злокачественных и нормальных тканях предстательной железы, удаленных хирургическим путем. Ткани злокачественной и метастатической опухоли простаты человека показывают более высокие уровни ROS, вызывающие изменения протеинов и оснований ДНК, по сравнению с нормальной тканью предстательной железы. Иммуногистохимия также показывает, что оксидативное разрушение ДНК и протеина значительно выше в предраковых очагах повреждения в простате TRAMP по сравнению с прилежащей нормальной тканью простаты.
Андроген был идентифицирован как натуральный агент, который вызывает оксидативный стресс в ткани простаты. Краситель гидроэтидин флуоресцирует при окислении посредством ROS. Наличие высокого оксидативного стресса в ксенотрансплантатах опухоли человека LNCaP наблюдалось у бестимусных мышей самцов in vivo. Такой повышенный уровень оксидативного стресса у мышей опухоленосителей снижался за 72 часа после оперативной кастрации, при которой удаляется природный источник андрогена.
Точные молекулярные механизмы, относящиеся к продукции ROS, вызванной андрогенами, в ткани простаты неизвестны. Другие пути, приводящие к повышенному образованию ROS в клетках СаР были указаны как: экспрессия нуклеарных факторов транскрипции (таких как фактор транскрипции, индуцируемый гипоксией ("HIF-1α"), NF-κВ, АР-I, и др.); и подавление экспрессии глутатион S-трансфераз, что приводит к снижению уровней общего глутатиона-восстановителя. Предполагаемые пути могут не быть взаимоисключающими.
Спермидин и спермин представляют собой полиамины, при этом предшественник диаминпутресцина представляет органический катион, присутствующий в клетках млекопитающих. Такие полиамины являются незаменимыми для клеточного роста и пролиферации. Сперма здоровых мужчин содержит большое количество спермина (примерно 3 мМ), образующегося главным образом во время простатической секреции.
Как показано на фиг.1, катаболизм полиамина запускается посредством действия спермидин/спермин N-ацетилтрансферазы ("SSAT"), которая продуцирует N-ацетилполиамины. N-ацетилполиамины окисляются за счет конститутивного фермента АРАО. АРАО использует FAD, который доводится до FADH2 в течение окисления ацетилполиаминов. FADH2 восстанавливается обратно до FAD, регенерируя активный фермент АРАО через продукцию Н2О2 (т.е. ROS). Повышенная экспрессия полиаминных катаболических ферментов (через индукцию специфичных факторов транскрипции и снижение общего клеточного глутатиона) может повышать клеточный оксидативный стресс благодаря катаболизму полиамина.
Как показано на фиг.1, SSAT представляет собой лимитирующий скорость реакции фермент, включенный в путь катаболизма полиамина. Ацетилполиамины, продуцирующиеся за счет SSAT, функционируют как субстрат для окисления АРАО сопутствуют продукции ROS. Новейшие ДНК микрочип и данные qRT-PCR полагают, что андроген индуцирует 30-50-кратную сверхэкспрессию гена SSAT в андроген-зависимых раковых клетках простаты человека LNCaP.
Хорошо известно из уровня техники, что андроген, при физиологических концентрациях, вызывает продукцию ROS в андроген зависимых раковых клетках простаты. Способ окисления 2′,7′-дихлордигидрофлуоресцеин диацетата (DCF) был использован для измерения отношения флуоресценции окисленного DCF: флуоресценции ДНК, который представляет известное измерение уровней ROS в клеточных линиях простаты. Данные и результаты показаны в таблице 1.
F(5)=5% фетальной бычьей сыворотки
F1/C4=1% фетальной бычьей сыворотки +4% сыворотка, обработанная углем (обедненная андрогеном)
Раковые клетки простаты человека LNCaP выращивали в среде, обедненной андрогеном, содержащей 1% FBS и 4% FBS, абсорбированного углем, (F1/C4) и в присутствии или отсутствии 1 нМ аналога синтетического андрогена R1881 с или без предварительного лечения 15 мкМ антиоксиданта о-токоферола (витамин Е). Уровни ROS LNCaP and DU-145 раковых клеток простаты человека показаны как подвергающиеся лечению с ВЕ-3-3-3, который является известным индуцирующим агентом SSAT, с или без лечения с 25 мкМ MDL 72,527.
Данные в таблице 1 показывают, что уровни ROS во всех раковых клеточных линиях простаты относительно выше чем таковые уровни, наблюдаемые в нормальных простатических эпителиальных клетках. Данные в таблице 1 также показывают, что клетки LNCaP имеют относительно больше ROS чем клетки DU-145; что аналог андрогена R1881 в концентрации 1 нМ, которые сопоставимы с физиологическими уровнями андрогена, повышают уровень ROS в клетках LNCaP; что сублетальная доза ВЕ-3-3-3 (1 мкМ) повышает уровни ROS в обеих клеточных линиях; и что возрастание уровня ROS изменяется/снижается/предотвращается за счет и предварительного лечения витамином Е и/или MDL 72,527.
Как схематически показано на фиг.1, необычно высокие уровни полиамина в клетках простаты и высокая индукция SSAT могут вызывать сильное повышение уровней ROS. Анализ генной экспрессии с помощью микрочипа ДНК в контрольных необработанных клетках LNCaP и клетках, обработанных 1нМ аналогом андрогена R1881 в течение 96 часов, осуществлялся дважды с помощью Affymetrix Genechip Arrays. В обоих экспериментах, SSAT четко идентифицировался как высоко сверхэкспрессирующийся в обработанных R1881 клетках LNCaP по сравнению с необработанными контрольными клетками. Среди списка генов, которые сверхэкспрессируются (более чем 10-кратно по сравнению с контролем), только SSAT являлся ферментом, связанным с ROS-образующим путем.
Данные, полученные при использовании ДНК микрочипа и qRT-PCR, показаны на фиг.3. Каждая точка на графике означает среднюю величину показателей из шести идентично-обработанных лунок, повторенных дважды в трех разах. Данные qRT-PCR показывают 50-кратное повышение генной экспрессии SSAT в обработанных R1881 с LNCaP клетках по сравнению с необработанными контрольными клетками. Это дополнительно указывает на то, что SSAT сверх-экспрессируется только в клетках, обработанных 1 нМ R1881 (который показывает оксидативный стресс), но не в клетках, обработанных 0,05 нМ R1881, где не наблюдается повышения оксидативного стресса. Таким образом, может быть постулировано, что андроген-вызванная генная экспрессия SSAT является значимым источником продукции клеточных ROS в андрген-зависимых раковых клетках простаты.
Фиг.4 демонстрирует роль SSAT в продукции клеточных ROS при использовании бисэтилнорспермина (ВЕ-3-3-3). ВЕ-3-3-3 известен тем, что он индуцирует ферментативную активность SSAT в различных клеточных линиях, включая андроген-зависимые LNCaP и андроген-независимые DU-145 простатические раковые клетки. DU-145 клетки обрабатывали с повышением концентраций ВЕ-3-3-3 в течение 72 часов. Оксидативный стресс измеряли при использовании 96-луночных планшет, на основании способа окисления с красителем 2′7′-дихлорфлуоресцеин диацетат. Каждая точка графика означает среднюю величину показателей из шести идентично-обработанных лунок, повторенных дважды в трех разах. Данные демонстрируют, что ВЕ-3-3-3 (при нетоксичной дозировке, 1 нМ) эффективно блокирует R1881-индуцированную продукцию ROS. Данные также показывают, что ингибирование полиаминоксидазы, используя MDL 72,527, значительно снижает клеточные уровни ROS в андроген-зависимых простатических раковых клетках, и что MDL 72,527 является эффективным антиоксидантом, который специфично блокирует андроген-вызванную продукцию ROS в андроген-зависимых простатических раковых клетках человека.
Фиг.5А-5Е показывают эффект предварительной обработки клеток LNCaP (с или без обработки с R1881) соединением N,N′-бис(2,3-бутадиенил)-1,4-бутандиамин на уровни полиамина и ацетил полиамина. Способ количественного подсчета на основе ВЭЖХ был использован для определения уровней полиамина и ацетил полиамина в клетках LNCaP, обработанных 1 нМ R1881 ± 25 мкМ MDL 72,527. Каждая точка на графике представляет 2 определения клеточных пеллет из 3 независимых экспериментов. Фиг.5А-5Е показывают, что обработка с R1881 (при конечной концентрации 1 нМ в течение 96 часов) значительно повышает уровни путресцина и спермидина, снижает уровень спермина и повышает уровни N-ацетилспермидина и N-ацетилспермина.
Можно сообщить, что Фиг.5А-5Е поддерживают вывод, что обработка R1881 повышает уровни мРНК SSAT, при этом повышая ферментативную активность SSAT. В R1881 клетках, предварительная обработка рассматриваемым соединением N,N′-бис(2,3-бутадиенил)-1,4-бутандиамин почти полностью блокирует вызванное повышение уровней путресцина и спермидина (связанные с 1 нМ R1881), и это вызывает значительное повышение уровней N-ацетилспермидина и N-ацетилспермина без значимого изменения уровня спермина. Наблюдалось незначительное небольшое повышение уровня N-Ac-спермина в клетках, обработанных рассматриваемым соединением N,N′-бис(2,3-бутадиенил)-1,4-бутандиамином. Также было отмечено, что клетки, обработанные MDL 72,527 при 25 мкМ значимо и эффективно блокируют активность АРАО. Наблюдаемое большое увеличение уровней ацетил полиамина также предполагает, что введение MDL 72,527 не имеет материального эффекта на генную экспрессию SSAT и/или ферментативную активность в андроген-обработанных клетках.
Показанное на фиг.6 представляет данные, демонстрирующие, что предварительное введение 25 мкМ MDL 72,527 эффективно блокирует андроген-вызванную продукцию ROS в клетках LNCaP. Уровни ROS в клетках LNCaP были индуцированы посредством повышения концентрации R1881 в течение 96 часов с и без предварительной обработки с MDL 72,527. Результаты определялись с использованием способов окисления DCF. Каждая точка графика означает среднюю величину показателей из шести идентично-обработанных лунок, повторенных дважды в трех разах. Данные, относящиеся к уровням ROS клеток, предварительно обработанных соединением N,N'-бис(2,3-бутадиенил)-1,4-бутандиамин, приводились в зависимости от эффектов применения одного MDL 72,527. Данные на фиг.6 полагают, что предварительная обработка с помощью MDL 72,527 (>1 нМ) эффективно блокирует R1881-индуцированную продукцию ROS. Данные также полагают, что ингибирование полиаминоксидазы с использованием MDL 72,527 значительно снижает клеточные уровни ROS в андроген-зависимых простатических раковых клетках, и что MDL 72,527 является эффективным антиоксидантом, который специфично блокирует андроген-индуцированную продукцию ROS в андроген-зависимых простатических раковых клетках человека.
Фиг.7A-7D показывают, что применение соединения N,N′-бис(2,3-бутадиенил)-1,4-бутандиамин снижает оксидативный стресс в ткани простаты у TRAMPxFVB животных in vivo. Способ применения окисления с красителем гидроэтидин (HEt) было стандартизировано для наблюдения оксидативного стресса в простатических опухолях in vivo. HEt окисляет 2-гидрокси этидий специфично посредством ROS(41). 2-Гидрокси этидий флуоресцирует при длине волны возбуждения 488 нм и длине волны излучения 595 нм. Краситель HEt может быть безопасно введен животным по меньшей мере за 1 час до умерщвления. Двадцати-недельные животные TRAMPxFVB были инъецированы HEt (8 мг/кгмассы тела) за 1 час до умерщвления. После умерщвления, предстательные железы собирали, фиксировали в формалине и заливали парафином. Парафиновые блоки разрезали на микротомные срезы и ткани депарафинировали, наблюдали с помощью флуоресцентной микроскопии и анализировали при использовании цифрового изображения. Снимки представлены на фиг.7A-7D.
Фиг.7А демонстрирует сделанную с помощью фазово-контрастной микроскопии картину среза простаты от животных, получавшим только носитель. Фиг.7В демонстрирует картину флуоресцентной микроскопии среза простаты, показанного на Фиг.7А. Фиг.7С демонстрирует сделанную с помощью фазово-контрастной микроскопии картину среза простаты животных, умерщвленных через 2 недели после 6 введений им MDL 72,527 в дозировке 25 мг/кгмассы тела. Фиг.7D демонстрирует HEt картину флуоресцентной микроскопии среза простаты, показанного на фиг.7С. Картины, показанные на фиг.7A-7D, были получены при 20х увеличении с помощью Olympus(TM) ВН-2 флуоресцентного микроскопа при использовании фильтров с длиной волны возбуждения 480 нм / излучения 600 нм, объединенных с цифровой камерой Sony DSC-V3, установленной на F2,8 и 30 сек вспышку.
Высокая флуоресценция (благодаря окислению HEt) главным образом наблюдалась в простатическом просвете, в частности по краям инвазивных клеток, где начинается образование простатической интраэпителиальной неоплазии (PIN). Напротив, не обнаруживалось окисление красителя в простатических тканях мышей TRAMP, получавшим MDL 72,527 (см. фиг.7D), что подтверждается последующим окрашиванием Н&Е. Данные, показанные на фиг.7A-7D, полагают, что соединение N,N′-бис(2,3-бутадиенил)-1,4-бутандиамин значительно подавляет оксидативный стресс in vivo в просвете простаты TRAMP мышей, где начинает формироваться PIN, что дополнительно предполагает, что полиаминное окисление является значимьм фактором для оксидативного стресса в культивированных клетках простаты человека и просвете простаты животных TRAMP in vivo.
Способ окисления DCFH 96-луночные культуры или свежеиссеченные животные или ткани человека анализировали на предмет оценки уровней ROS в интактных клетках при использовании красителя 2′,7′-дихлорфлуоресцеин диацетата (DCF) (Molecular Probes, Inc., Eugene, OR). Иссеченные ткани или клеточные культуры промывали 200 мкл буфера Кребса-Рингера (116 мМ NaCl, 4,2 мМ KCl, 2,5 мМ CaCl2, 1,6 мМ NaH2PO4, 1,2 мМ MgSO4, 22 мМ NaHCO3, и 11 мМ D-глюкозы), предварительно нагревали до 37°С, инкубировали при 37°С в 100 мкл буфера Кребса-Рингера, содержащего 10 мг/мл (конечная концентрация) красителя DCF в течение 45 минут. Каждый 96-луночный культуральный планшет сканировали на планшетном сканере CytoFluor 2350(TM) (Applied Biosystems, Foster City, CA) при длине волны возбуждения 485 нм/излучения 530 нм. Каждый образец ткани анализировали.
Анализ с использованием гидроэтидина. Краситель гидроэтидин растворяли в DMSO (100 мг/мл) и разводили в изотоническом физиологическом растворе до 1 мг/мл перед инъецированием. Краситель либо вводили внутрибрюшинно мыши через хвостовую вену за 1 час до умервщления (in vivo), либо свежеиссеченные ткани человека или животного промывали в изотоническом PBS и выдерживали в 8 мг/мл растворе красителя в буфера Кребса-Рингера, предварительно нагретого до 37°С в течение 60 минут при 37°С (ех vivo) перед процессом. Для анализа in vivo, животных подвергали эфтаназии и обескровливали перед сбором опухоли или других тканей. Ткани после обработки заливали в парафиновые блоки. Из микротомных срезов блоков готовили слайды и определяли флуоресценцию при длине волны возбуждения 488 нм/длине волны излучения 595 нм.
Анализ ДНК. Пятьдесят мкл буфера Кребса-Рингера (40 мкг/мл), содержащий краситель Hoechst 33342, который содержит
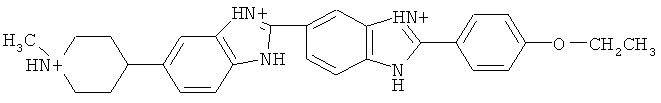
добавляли в каждую лунку за 45 минут и к каждой ткани за 60 минут перед измерениями флуоресценции. ДНК флуоресценцию определяли при длине волны возбуждения 360 нм/излучения 460 нм. Все DCF или гидроэтидиновую флуоресценции приводили к ДНК флуоресценции для правильного расчета оксидативного стресса.
BD Bioimager. Все показатели флуоресценции определялись при использовании автоматизированной, с общим фокусом, в режиме реального времени, одноклеточной кинетической и с конечной точкой системы BD Pathway Bioimager (BD Biosciences (Laguna Hills, CA).
Данные, показанные на фиг.8, показывают, что применение соединения N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина повышает показатель общей выживаемости ("OS") мышей TRAMP. Обследовали TRAMP мышей, у которых спонтанно образовывались опухоли простаты на 20-22 неделе и большинство из которых умерли от опухолевой массы на 30-32 неделе. TRAMPxFVB мышей, у которых начались образовываться опухоли простаты на 12-14 неделе жизни и большинство из которых умерли от опухолевой массы на 20-22 неделе жизни, также тестировали (данные показаны на фиг.9-11). Как показано на фиг.9, использовали дозу 25 мг/кгмассы тела MDL 72,527, которая хорошо переносилась (т.е. не наблюдалось очевидных признаков токсичности, ненормального поведения или потери массы тела). Доза свыше 20 мг/кгмассы тела требовалась для полного подавления ацетилполиаминоксидазы мыши.
В исследовании животных TRAMP, соединение N,N′-бис(2,3-бутадиенил)-1,4-бутандиамин вводили на 22 неделе, при этом некоторые животные начали показывать пальпируемые опухоли. Животным (по 5 в каждой группе) инъецировали 3 раза по 25 мг/кгмассы тела MDL 72,527 внутрибрюшинно два раза в неделю. OS показано на фиг.8, что полагает значительное повышение выживаемости по сравнению с животными, принимающими носитель.
В данном исследовании при использовании TRAMPxFVB мышей, 8 животных составляли группу, получавших лечение MDL 72,527, и 8 мышей входили в группу, получавших носитель. Поскольку у этих животных развитие опухоли простаты началось в более раннем возрасте, чем у TRAMP животных, то лечение началось в 8 недельном возрасте. Лечение включало 6 инъекций MDL 72,527 в дозе 25 мг/кгмассы тела внутрибрюшинно два раза в неделю. Результаты показаны на фиг.11, что предполагает значительное увеличение OS для животных, получавшим MDL 72,527, по сравнению с контрольной группой, принимавших носитель. Более 60% TRAMPxFVB мышей, получавших MDL 72,527, жили, по меньшей мере, 8 недель после окончания курса терапии, и, по меньшей мере, 6 недель после смерти животных из контрольной группы, получавших носитель. Данные на фиг.8 и 9 показывают, что различные виды TRAMP животных воспроизводимо показывают более 60% выживаемость, преимущественно животные получающие MDL 72,527, по сравнению с мышами, получавшими носитель.
Данные, показанные на фиг.10, показывают, что применение соединения N,N′-бис(2,3-бутадиенил)-1,4-бутандиамин задерживает время развития опухоли у мышей TRAMPxFVB. Признаки развития пальпируемой опухоли простаты мониторировали два раза в неделю. На 11 недели (29 недельные животные) после введения MDL 72,527 (в дозе 25 мг/кгмассы тела, вводимой один раз в две недели) было остановлено, более 40% леченных мышей не проявляли признаков пальпируемой опухоли в простате или в другой части тела.
Данные, показанные на фиг.1-18, демонстрируют, что соединение N,N′-бис(2,3-бутадиенил)-1,4-бутандиамин эффективно блокирует андроген-вызванный оксидативный стресс в раковых клетках простаты человека и в предстательной железе TRAMP животных. Данные также показывают, что MDL 72,527 задерживает время развития опухоли у TRAMP животных, что приводит к статистически значимому увеличению OS.
Другой аспект изобретения представляет усовершенствованный синтез получения N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина. MDL 72,527 является потенциальным, необратимым ингибитором полиаминоксидазы млекопитающих и он ингибирует Kj при 0,9 мМ против полиаминоксидазы печени свиней. Известный синтез MDL включает преобразование N-Boc-защищенного пропаргиламина в соответствующий (бис)аллен, с последующим соединением 2 эквивалентов защищенного аллена с 1,4-дииодобутаном. Снятие защитных групп с результирующего N-Boc-защищенного (бис)аллена приводит к получению MDL 72,527. Известный синтез является проблематичным в том, что электрофильная природа алленовой группы приводит к получению побочных продуктов в течение алкилирования дииодида. Общий выход невыгодно низок.
Предлагаемый способ приготовления N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина имеет преимущественно высокий выход продукта. Этот способ избегает также получения не желаемых побочных продуктов. Способ приведен на фиг.19.
Коммерчески доступный путресцина 1 (бис)-N-Boc защищен от получения соединения 2 (85,2% выход). Соединение 2 используется для алкилирования 2 эквивалентов пропаргилбромида в присутствии гидрида натрия, продуцирующего соединение 3 (59,5% выход). Выходы в этой трансформации дополнительно повышаются за счет применения смеси диметилформамида ("DMF") и тетрагидрофурана ("THF") в соотношении 1:5. Группы пропаргила в соединении 3 преобразовываются в соответствующие аллены в присутствии CuBr, формальдегида и диизопропиламина с выходом промежуточного соединения 4 (38,7% выход). Соединение 4 дезащищается в присутствии HCl с выходом желаемой нужной молекулы MDL 72,527 (белое твердое вещество, 65,8% выход).
Способ ВЭЖХ количественного определения MDL, натуральных полиаминов и их производных в клеточных экстрактах, а также у людей и животных, является стандартным. Следовательно, фармакокинетика и фармакодинамика MDL 72,527 могут быть определены.
Соли соединения N,N′-бис(2,3-бутадиенил)-1,4-бутандиамин могут быть фармацевтически пригодными (т.е. фармацевтически приемлемыми) солями, включая, но не ограниваясь, соли, полученные посредством добавления кислоты, образующиеся путем смешивания раствора соединения MDL с раствором фармацевтически пригодной кислоты. Фармацевтически пригодная кислота может быть соляной кислотой, метансульфоновой кислотой, фумаровой кислотой, малеиновой кислотой, янтарной кислотой, уксусной кислотой, бензойной кислотой, щавелевой кислотой, лимонной кислотой, винной кислотой, карбоновой кислотой или фосфорной кислотой. Различные фармацевтически приемлемые соли хорошо известны из уровня техники и могут использоваться с N,N′-бис(2,3-бутадиенил)-1,4-бутандиамином, такие как те, которые описаны в Berge SM et al., "Pharmaceutical Salts." J.Pharm. Sd. 66:1-19 (1977) и Haynes DA et al., "Occurrence of pharmaceutically acceptable anions and cations in the Cambridge Structural Database," J.Pharm. Sd. 94:2111-2120 (2005), которые здесь приведены посредством ссылки. Например, перечень FDA-одобренных коммерчески доступных солей включают ацетат, бензолсульфонат, бензоат, бикарбонат, битартрат, бромид, кальция эдетат, камсилат, карбонат, хлорид, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эсилат, фумарата, глюцептат, глюконат, глутамат, гликолиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изотионат, лактат, лактобионат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напсилат, нитрат, памоат, пантотенат, фосфат, дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, сульфат, таннат, тартрат, теоклат или триэтиодид.
Соединение N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина (или его соль или сольват) может применяться как пероральная лекарственная форма, такая как непокрытые оболочкой таблетки, покрытые оболочкой таблетки, твердые желатиновые капсулы, мягкие желатиновые капсулы, порошки, капсулы, пеллеты, растворы, суспензии, эликсиры или эмульсии. Пероральная лекарственная форма может применяться в соответствии с дозировочным режимом для достижения приемлемого терапевтического эффекта. Пероральная лекарственная форма определяется также фармацевтической композицией, содержащей фармацевтически активный ингредиент (API) и различные фармацевтически пригодные/приемлемые носители (водные, безводные, растворы, суспензии или эмульсии), наполнители, растворители, добавки, носители, стабилизаторы, инертные разбавители, связывающие вещества (см., камедь, кукурузный крахмал, желатин), разлагающие агенты (см., кукурузный крахмал, картофельный крахмал, альгиновая кислота), смазки (см., стеариновая кислота, стеарат магния) и подобные.
Например, фармацевтически приемлемый водный носитель включает, но не ограничивается, камеди, крахмалы, сахара, лактозу, сахарозу, целлюлозные материалы, воду, спиртовые/водные смеси, фосфатный буфер (0,01-0,01 М, или более предпочтительно 0,05 М) и 0,9% физиологический раствор. Неводные растворители включают, но не ограничиваются, пропиленгликоль, полиэтиленгликоль, растительные масла (см., оливковое масло, этилолеат и подобные). Различные фармацевтически приемлемые USP одобренные наполнители могут также использоваться, включая, но не ограничиваясь, альбумин, желатин, детергенты (см., Tween 20, Tween 80, Pluronic F68, соли желчных кислот и подобные), солюбилизирующие агенты (см., глицерин, полиэтиленглицерин и подобные), антиоксиданты (см.., аскорбиновая кислота, натрия метабисульфат и подобные), консерванты (см., тимеросал, бензиловый спирт, парабен и подобные), жирные кислоты, воски, полоксамеры, полоксамины, увеличивающие объем субстанции или модификаторы тоничности (см., лактоза, маннитол и подобные), полимеры для ковалентного связывания или образования комплексов с ионами металлов, полиакриловой кислотой, полигаиколевой кислотой, гидрогелевыми агентами, липосомами, микроэмульсионными агентами, мицельными агентами, миламеларными агентами, мультиламилярными везикулами, эритроцитарными агентами или сферопластическими агентами.
Реферат
Заявленная группа изобретений относится к области медицины. Заявлены способ лечения и профилактического лечения рака простаты у мужчин и способ лечения рака простаты самцов собак, включающие введение в виде монотерапии терапевтического количества N,N′-бис(2,3-бутадиенил)-1,4-бутандиамина или его фармацевтически приемлемой соли или сольвата. Терапевтическое количество находится в интервале около 1-100 мг/кгмассы тела и дозируется в диапазоне от двух раз в неделю до одного раза в сутки. Заявленная группа изобретений имеет высокую терапевтическую эффективность. 3 н. и 12 з.п ф-лы, 26 ил., 1 табл.
Формула
Документы, цитированные в отчёте о поиске
Способ терапевтического лечения доброкачественной гиперплазии простаты или рака простаты млекопитающего

Комментарии