Антинеоплазические соединения и фармацевтические композиции на их основе - RU2404987C2
Код документа: RU2404987C2
Чертежи

Описание
Область техники, к которой относится изобретение
Данное изобретение относится к области молекулярной фармакологии, особенно связанной с онкологией и более определенно - с химическими соединениями, полученными с помощью молекулярного моделирования виртуального скрининга, имеющими явное цитотоксическое действие и противоопухолевый эффект, основанный на их способности к блокирования фосфороакцепторного участка на субстратах казеин-киназы 2 прямым или косвенным взаимодействием.
Уровень техники
Казеин-киназа 2 (СК2) является ферментом серина/треонина, вовлеченным в прирост клеточной пролиферации, являющийся основным ядром внутриклеточной локализации в течение злокачественного трансформационного процесса (Tawfic S., Yu S., Wang H., и др. (2001) протеин-киназный СК2 импульс в неоплазии Histol. Histopathol. 16:573-582). Более того, некоторые ключевые вирусные белки для патогенеза вируса иммунодефицита человека (ВИЧ) и вируса гепатита С (HCV) описываются как субстраты СК2 (Meggio F., Marin O., и др. (2001) Mol. Cell. Biochem. 227:145-151; Franck N., Le Seyec J., и др. (2005). Белок вируса гепатита С NS2 фосфорилируется белком киназы СК2 и образуются антитела для разрушения до протеасомы. J Virol. 79:2700-2008).
Данные других мировых групп также подтверждали существование повышенных уровней СК2 в различных солидных опухолях эпителиального происхождения в пределах, колеблющихся от 3 до 7 раз выше, чем в отношении нормальной ткани (Tawfic S., Yu S., и др. (2001) протеин-киназный СК2 импульс в неоплазии. Histol. Histopathol. 16:573-582; Faust R.A., Gapany M., и др. (1996). Повышенная активность протеин-киназы СК2 в хроматине опухолей головы и шеи: связь со злокачественной трансформацией. Cancer Letters 101:31-35), помимо того, именно фосфорилирующая активность фермента СК2, являющегося очень важным явлением в злокачественной трансформации клеток, составляет сильный маркер в опухолевом развитии (Seldin D.C., Leder P. (1995) казеин-киназа IIά трансген-индуцированной мышиной липомы: относительно тейлероиоза у крупного рогатого скота. Science 267:894-897), повышенная экспрессия СК2, с другой стороны, приводит к онкогенезу клеток молочной железы из-за повышения уровня регуляции передачи сигнала каскада Wnt/бета-катенина (Landesman-Bollag E., Romien-Mourez R. и др. (2001) протеин-киназа СК2 в онкогенезе молочной железы. Oncogene 20:3247-3257). Последние исследования позволяют предполагать, что СК2 играет существенную роль в некоторых других процессах, похожих на ремодуляцию хроматина (Barz T., Ackenmann K. и др. (2003) экспрессионные скрининги всего генома показывают глобальную роль протеин-киназы СК2 в ремодуляции хроматина. J Cell Sci. 116:1563-1577), и регуляции выживаемости клетки (Unger G.M., Davis A.T., Slaton J.W., Ahmed K. (2004) протеин-киназа СК2 как регулятор клеточной выживаемости: использование для терапии рака. Curr Cancer Drug Targets, 4:77-84). Первостепенно важными для понимания процесса развития рака являются данные, доказывающие, что опосредованное фосфорилирование СК2 является очень сильным импульсом для клеточной выживаемости, следовательно, рассматривая этот фермент как антиапоптозный медиатор для клеточной физиологии (Ahmed K., Gerber D.A., Cochet C. (2002). Связь выживаемости клеточной группы: выявленная роль протеин-киназы СК2. Trends Cell Biol, 12:226-229; Torres J., Rodriguez J. и др. (2003) фосфориляционно регулируемое расщепление опухолевого супрессора PTEN с помощью каспазы-3: использование для контроля протеиновой стабильности и PTEN-белковых взаимодействий. J Biol. Chem., 278:30652-60).
На основе вышеупомянутых данных опосредованное фосфорилирование СК2 подтверждается как биохимическое явление, подходящее для использования в качестве потенциальной мишени для терапевтического воздействия на рак, превращая все потенциальные ингибиторы подобного явления в будущих кандидатах для лечения подобного состояния. Несколько современных мировых исследовательских групп развивают различные стратегии для ингибирования опосредованного фосфорилирования СК2 двумя экспериментальными подходами: а) прямое ингибирование СК2 фермента или b) блокирование фосфорилированного участка поблизости от кислотного домена, описанного как общий для всех субстратов СК2.
Для обоих подходов авторы в состоянии продемонстрировать концепцию, при которой ингибирование явления опосредованного фосфорилирования СК2 приводит к индукции апоптоза в опухолевых клетках, которая предполагает экспериментальное подтверждение СК2 в качестве очень многообещающей мишени в открытии лекарств для лечения рака.
Например, прямой ингибитор фермента, такой как 4,5,6,7-тетрабромтриазол (ТBB), испытываемый как сильнодействующий апоптозный и каспаза-зависимый деградационный индуктор в клетках Jurkat в микромолярной концентрационной области (Ruzzene M., Penzo D., Pinna L. (2002) ингибитор протеин-киназы СК2 4,5,6,7-тетрабромбензотриазол (ТBB) индуцирует апоптоз и каспаза-зависимую деградацию клеточно-специфического протеина 1 (HS1) гематопоэтического происхождения в клетках Jurkat. Biochem J., 364:41-47). Также, с помощью ингибирования экспрессии фермента CK2 при использовании антисмысловых олигонуклеотидов, in vitro апоптотический эффект и противоопухолевое действие были продемонстрированы на экспериментальной модели рака на мышах (Guo C, Yu S. и др. (2001) потенциальная роль ядерной матрикс-ассоциированной протеин-киназы CK2 в защите против апоптоза, обусловленного действием лекарственных средств в раковых клетках. J Biol. Chem., 276:5992-5999; Slaton J.W. и др. (2004). Индукция апоптоза с помощью антисмыслового СК2 в человеческой ксенотрансплантантной модели рака предстательной железы. Mol. Cancer Res. 2:712-721).
Другие соединения, такие как производные антрахинона, флавоноиды и галогенированные азобензилимидазолы, описываются как ингибиторы места связывания СК2 аденозин тринитрофосфата (АТФ) (Sarno S. и др. (2002) к рациональному моделированию протеин-киназных казеин-киназы 2 ингибиторов. Pharmocol. Therapeutics 93:159-168) и 5-оксо-5,6-дигидроиндол(1,2-а)хиназолин-7-ил уксусная кислота (IQA) представляется как избирательный ингибитор СК2, используя высокую пропускную способность скрининга (Vangrevelinghe E. и др. (2003) биохимическое и трехмерно-структурное изучение специфического ингибирования протеин-киназы СК2 [5-оксо-5,6-дигидроиндол-(1,2-а)хиназолин-7-ил]уксусной кислотой (IQA). J. Med. Chem. 46:2556-2662).
Вышеупомянутые соединения проявляют свой активный ингибирующий эффект СК2 в микромолярной области для ингибиторной концентрации 50 (IC50), но при этом не сообщается о каких-либо свидетельствах противоопухолевого действия в экспериментальных моделях рака.
Другим известным подходом для ингибирования опосредованного СК2 фосфорилирования является блокирование сайта фосфорилирования в кислотном домене, найденном на субстрате фермента, как это описано в патентной заявке WO 03/054002 и работе Perea S.E. и др. (2004). Противоопухолевый эффект нового проапоптотического пептида, уменьшающего фосфорилирование протеин-киназой СК2. Авторы Cancer Res. 64:7127-7129 предлагают использовать семейства циклических пептидов для блокирования фосфорилирования СК2 на субстратном участке in vitro и показывающую опухолевую клеточную цитотоксичность и противоопухолевый эффект на доклинических раковых моделях. Однако описанные в этой публикации пептиды имеют ограничение, не дающее возможности per se (в чистом виде) проникать в клетки, следовательно, требующие внедренный в мембрану пептид, сращенный с ними.
В общих чертах, при сравнении с небольшими молекулами, использование пептидов имеет недостатки из-за пониженной in vivo стабильности в циркуляции, деградации, очень затрудняющие разработку рецептуры для перорального применения, и они не легко доставляются внутрь клеток (Ludger Wess, Изогеника: Улучшенные пептиды, Biocentury 25 октября, 2004).
Другими проблемами пептидов, широко описанными в литературе, являются быстрая потеря своего иммуногенного потенциала и их стоимость на терапевтическую дозу, которая, как известно, обычно выше по сравнению с непептидными препаратами.
Сущность изобретения
Принимая во внимание потенциальные ограничения для использования вышеупомянутых циклических пептидов в качестве потенциальных терапевтических агентов, данное изобретение описывает химические молекулы, способные к ингибированию опосредованного СК2 фосфорилирования прямым или косвенным взаимодействием с фосфороакцепторным участком на субстрате, и выявляет цитотоксический и противоопухолевый эффект на животной модели рака.
Таким образом, описанные химические соединения имеют четко определенную химическую структуру, позволяющую им выполнять одно или несколько из следующих действий:
А: связывание соединений с доменом фосфорилирования или его окружением на СК2 субстрате, блокируя, прямым или косвенным образом, связывание фермента с субстратом.
В: связывания соединений с доменом фосфорилирования на СК2 субстрате, допуская связывание фермента СК2, но блокируя, прямым или косвенным образом, переход фосфатной группы к фосфороакцептору серина.
С: связывание соединений с субстратным белком СК2, вызывая конформационные изменения в домене фосфорилирования, его окружении или их обоих, таким образом, что при этом имеет место блокирование, прямое или косвенное, связывания СК2 или переход фосфатной группы к фосфороакцептору серина.
Поэтому эти соединения, главным образом, характеризуются своей способностью к ингибированию биохимического процесса фосфорилирования, опосредованного СК2.
В детальном понимании данное изобретение относится к химическим молекулам, характеризующимся специфической химической структурой, определяемой присутствием в любой части молекулы некоторых химических элементов, связанных последовательным образом с предписанной электронной гибридизацией и сгруппированных в следующие пять структурных групп:
I. N-[C(sp2)]1,2,3-N
II. N-[C(sp2)]1,2,-[C(sp3)]1,2,3-N
III. N-[C(sp3)]1,2,3-N
IV. N-C(sp2)-[C(sp3)]1,2-C(sp2)-N
V. N-C(sp3)-[C(sp2)]1,2-C(sp3)-N
Некоторые соединения, принадлежащие к подобным структурным классам, показаны ниже:







Вышеупомянутые молекулы были описаны для заявленной функции с помощью всестороннего молекулярного моделирования общего типичного участка фосфорилирования, четко определенного для этого фермента (Meggio F., Pinna L.A. (2003) Тысяча и один субстрат протеин-киназы СК2. The FASEB J. 17:349-368), проверка их достоверности с помощью молекулярного связывания с ферментом СК2 и дальнейший анализ с помощью обширного молекулярного скрининга разнообразных химических баз данных проводились в нашей лаборатории с приблизительным количеством в один миллион двести тысяч соединений.
Изобретение также включает любой гомологический вариант описанных соединений. Определяя в качестве гомологического варианта любую молекулу подобной или иной химической природы среди описанных здесь соединений, но с химической структурой, позволяющей достигать таких же эффектов наряду с эффектом ингибирования опосредованного СК2 фосфорилирования.
По-другому, но предпочтительнее для реализации изобретения, фармацевтическая композиция включает одно или более химических соединений и/или их фармацевтически приемлемые соли, одни или вместе с другими фармацевтически приемлемыми носителями и добавками. Также частью данного изобретения является использование описанных химических соединений для получения лекарственных средств для ингибирования пролиферации опухолевых клеток in vitrо, in vivo или в ассоциированных с телом системах для лечения в живых организмах рака и/или других состояний, в которых фермент СК2 может играть патологическую роль.
Описанные химические молекулы характеризовались своей способностью ингибировать фосфорилирование минимальной аминокислотной последовательности S/T-X-X-E/D, где Х является некоторой аминокислотой, предпочтительно отличной от лизина и аргинина, и, кроме того, других белков, не имеющих подобной типичной последовательности, связанной с этим типом соединений, и обладающих способностью ингибировать опосредованное СК2 фосфорилирование.
Для характеристики химических соединений, описанных в данном изобретении, авторами проводилось всестороннее молекулярное моделирование типичного фосфорилированного участка, четко определенного для этого фермента (Meggio F., Pinna L.A. (2003) тысяча и один субстрат протеин-киназы СК2. The FASEB J. 17:349-368), проверка их достоверности с помощью молекулярного связывания с ферментом СК2 и дальнейший анализ с помощью обширного молекулярного скрининга разнообразных химических баз данных проводились в нашей лаборатории с приблизительным количеством в один миллион двести тысяч соединений.
Все соединения с рассчитанными значениями энергии связи выше средней отбирались как положительные в первом раунде и представлялись на рассмотрение во втором раунде скрининга с более ограниченными значениями отбора, и в дальнейшем анализировались, чтобы выявить структурные закономерности, причем химические структуры соединений, отобранных во втором раунде скрининга, были оптимизированы для достижения наиболее высоких из возможных значений расчетной энергии связи. Результирующие соединения были синтезированы, очищены с помощью высокоэффективной жидкостной хроматографии, проанализированы с помощью инфракрасной спектроскопии, масс-спектрометрии и ядерного магнитного резонанса и окончательно оценены по своей эффективности in vitro и in vivo. В соответствии с данным исследованием описанные химические соединения являются в равной степени эффективными по своей способности ингибировать явление опосредованного фосфорилирования СК2.
Химические соединения, описанные в этом изобретении, вызывают цитотоксичность в человеческих раковых клетках способом, зависящим от дозы, без помощи любого другого проникающего в клетку агента. Подобное утверждение согласуется с предыдущими данными, показывающими, что химические молекулы способны транспортироваться клеточным аппаратом и достигать своих мишеней внутри клеток (Meggio F., Pagano M.A. и др.(2004) ингибирование протеин-киназы СК2 с помощью конденсированных полифенольных производных. In vitro и in vivo изучение. Biochemestry. 43:12931-12936).
Подобно этому, нахождение значений IC50 представляет очень большой интерес для in vitro изучений цитотоксичности в наномолярной области. Эти результаты показывают повышенную цитотоксическую активность описанных соединений относительно ранее упомянутых циклических пептидов, которые ингибируют домена фосфорилирования СК2. В соответствии с in vitro результатами, химические соединения этого изобретения имеют сильный противоопухолевый эффект и при местном, и при системном применении. Объективно было подтверждено, что химические соединения по этому изобретению оказывают противоопухолевый эффект при такой низкой дозировке, как 0,5 и 2 мг/кг, представляя от 10- до 20-кратного уменьшения дозировки по сравнению с предварительно описанными циклическими пептидами.
Краткое описание чертежей
Чертеж: Противоопухолевый эффект химических соединений на модели человеческого рака, имплантированного мышам.
Подробное описание отдельных вариантов осуществления
Примеры
Данное изобретение объясняется с помощью следующих примеров:
Пример 1
Отбор соединений с помощью виртуального молекулярного моделирования виртуального скрининга
Используя вычислительную модель, обнаруженную с помощью всестороннего виртуального скрининга, некоторое количество соединений было отобрано на основании высокого значения расчетной энергии связи рецептор-лигандного комплекса (Таблица 1). Это приблизительное значение энергии рассчитывается с учетом всестороннего анализа конформаций и нескольких энергетических компонентов, используя разработанную вычислительную программу.
Пример 2
Действие описанных химических соединений на фосфорилирование типичного СК2 субстрата
Исследование состоит в проведении in vitro реакции фосфорилирования, используя в качестве субстрата онкопротеина Е7 из вируса папилломы человека типа 16 (VHP-16), экспресированного в E. сoli как пептидилированная глутатион S-трансфераза (GST). Результирующий E7-GST затем очищается с помощью глутатион-сефарозной (Pharmacia) аффинной хроматографии. Перед ферментативной реакцией E7-GST был преинкубирован один час при температуре 37°С с различными концентрациями химических соединений. Реакция проводится в смеси, состоящей из 50 мкл Трис:HCl 25 мM буфера c рН 7,5, 1 мклCi32P-γATФ, 100 мкM ATФ, 40 мкл содержащего E7-GST полимера, 0,2 М NaCl, 10 мM MgCl и одной единицы фермента СК2 (Promega), позволяющей ей продолжаться 40 минут при 37°С. После реакции полимер отмывается три раза с 0,5 мл реакционного буфера и окончательно уровень фосфорилирования E7-GST анализируется в 10% полиакриламидном гелевом электрофорезе (PAGE). Визуализация фосфорилированного протеина производится с помощью воздействия рентгенолучевых чувствительных пленок, для высушивания PAGE геля, и определение количества проводилось с помощью денситометрического анализа пленок.
Значения IC50 рассчитывались, используя для каждой кривую дозировка-эффект. Значения IC50 рассматриваются как ингибиторная концентрация, повреждающая 50% ферментной активности. Параллельно проводили сравнительный контрольный эксперимент, изучая при таких же условиях циклический пептид Р15, представленный выше как ингибитор участка фосфорилирования субстрата СК2.
Результаты таблицы 2 показывают, что химические соединения, описанные здесь, являются эффективными ингибиторами для типичного субстрата СК2, как следует из значений IC50. Поразительным фактом, как видно, является высочайшая ингибиторная способность химических соединений по сравнению с ранее представленными циклическими пептидами, активными только в микромолярной области.
Пример 3
Действие описанных химических соединений на фосфорилирование типичного участка СК2
Исследование состоит в проведении in vitro реакции фосфорилирования, используя в качестве субстрата секвеназы RRREEETEEE, широко распространенной как оптимизированный типичный фосфорилированный домен субстратов СК2.
Перед ферментативной реакцией субстратный пептид был преинкубирован один час при температуре 37°С при различных концентрациях химических соединений. Реакция проводится в смеси, состоящей из 50 мкл Трис:HCl 25 мM буфера c рН 7,5, 1 мклCi32P - γATФ, 100 мкM ATФ, 40 мкл содержащего E7-GST полимера, 0,2 М NaCl, 10 мM MgCl и одной единицы фермента СК2 (Promega), позволяющей ей продолжаться 10 минут при 37°С. После реакции 5 мкл реакционной смеси наносилось на бумажный фильтр Whatmann PE-81 и отмывалось четыре раза 10 мM H3PO4, в конце ассоциированная радиоактивность бумаги была измерена и значения числа импульсов в минуту для каждого образца были прямо коррелированы с ферментативной активностью СК2.
Значения IC50 рассчитывались, используя для каждой кривую дозировка-эффект. Значения IC50 рассматриваются как ингибиторная концентрация, повреждающая 50% ферментной активности. В параллельный контрольный эксперимент включили для сравнения исследование при таких же условиях циклического пептида Р15, представленного выше как ингибитор фосфорилированного участка субстрата СК2.
Результаты таблицы 3 показывают, что химические соединения, описанные здесь, являются эффективными ингибиторами для типичного субстрата СК2, как следует из значений IC50. Поразительным фактом, как видно, является высочайшая ингибиторная способность химических соединений по сравнению с ранее представленными циклическими пептидами, активными только в микромолярной области.
Пример 4
Действие описанных здесь химических соединений на человеческие опухолевые клетки
Н-125 клетки из человеческой немелкоклеточной легочной карциномы были нанесены на 96-луночные планшеты (Costar) до плотности 2×104 клеток/мл в среде Dulbecco (DMEM) (Gibco) и обеспечены фетальной телячьей сывороткой (Gibco). 24 часа спустя описанные здесь химические соединения были добавлены к культуральной среде в области между 0,5 и 100 нМ, инкубируя смесь 72 часа при 37°С в 5% СО2, в конце было добавлено 20 мкл 1,90 мг/мл MTS раствора. Планшеты были сохранены один дополнительный час при таких же инкубационных условиях и были сняты показания спектральной поглощательной способности при 492 нм. Результаты оценивались как процентный рост по отношению к контролям без каких-нибудь соединений, и значения IC50 рассчитывались, используя для каждой кривую дозировка-эффект. Значения IC50 рассматриваются как ингибиторная концентрация, повреждающая 50% ферментной активности. В параллельный контрольный эксперимент включили для сравнения исследование при таких же условиях циклического пептида Р15, представленного выше как ингибитор фосфорилированного участка субстрата СК2.
Результаты таблицы 4 показывают, что химические соединения, описанные здесь, имеют сильный in vitro цитотоксический эффект на культивируемых человеческих опухолевых клетках, как следует из значений IC50. Поразительным фактом, как видно, является высочайшая ингибиторная способность химических соединений по сравнению с ранее представленными циклическими пептидами, активными только в микромолярной области.
Пример 5
Противоопухолевой эффект химических соединений по изобретению на модели человеческого рака, имплантированного голой мыши
В этом исследовании были использованы самки бесшерстных мышей BalbC в возрасте от 6 до 8 недель. Для прививания опухоли на этой модели 5000000 клеток Н-125, суспендированных в 250 мкл PBS, были введены в спинную область животных. Как только опухоли были пальпируемы в приблизительном объеме 50 мм3, выполнялось прямое ежедневное введение соединений С32425, С33426 и С33427 в течение 5 дней. Как показано на фиг.1, введение химических соединений имело следствием значительный противоопухолевый ответ. Подобные результаты показывают, что химические соединения, ингибирующие опосредованное фосфорилирование СК2, имеют возможность вызывать противоопухолевый ответ в соответствующей модели для экспериментальной онкологии.
Реферат
Данное изобретение относится к фармацевтической композиции, включающей одно или более соединений, выбранных из группы, приведенной в формуле изобретения, и имеющих явное цитотоксическое действие и противоопухолевый эффект, основанный на их способности к блокированию фосфороакцепторного участка на субстратах казеин-киназы 2 прямым или косвенным взаимодействием, а также к применению соединений для приготовления лекарственных средств, ингибирующих пролиферацию опухолевых клеток. 2 н.п. ф-лы, 1 ил., 4 табл.
Формула
(1Z)-3,5,5-триметилциклогекс-2-ен-1-он семикарбазон,
N-(4-амино-2,6-дигидроксипиримидин-5-ил)-N'-изопропилтио мочевина,
N-бутил-N'-(2-фурилметил)мочевина,
3-({[(2-карбоксиэтил)амино]карбонил}амино)пропановая кислота,
1-(2-хлорэтил)-3-(цианометил)мочевина,
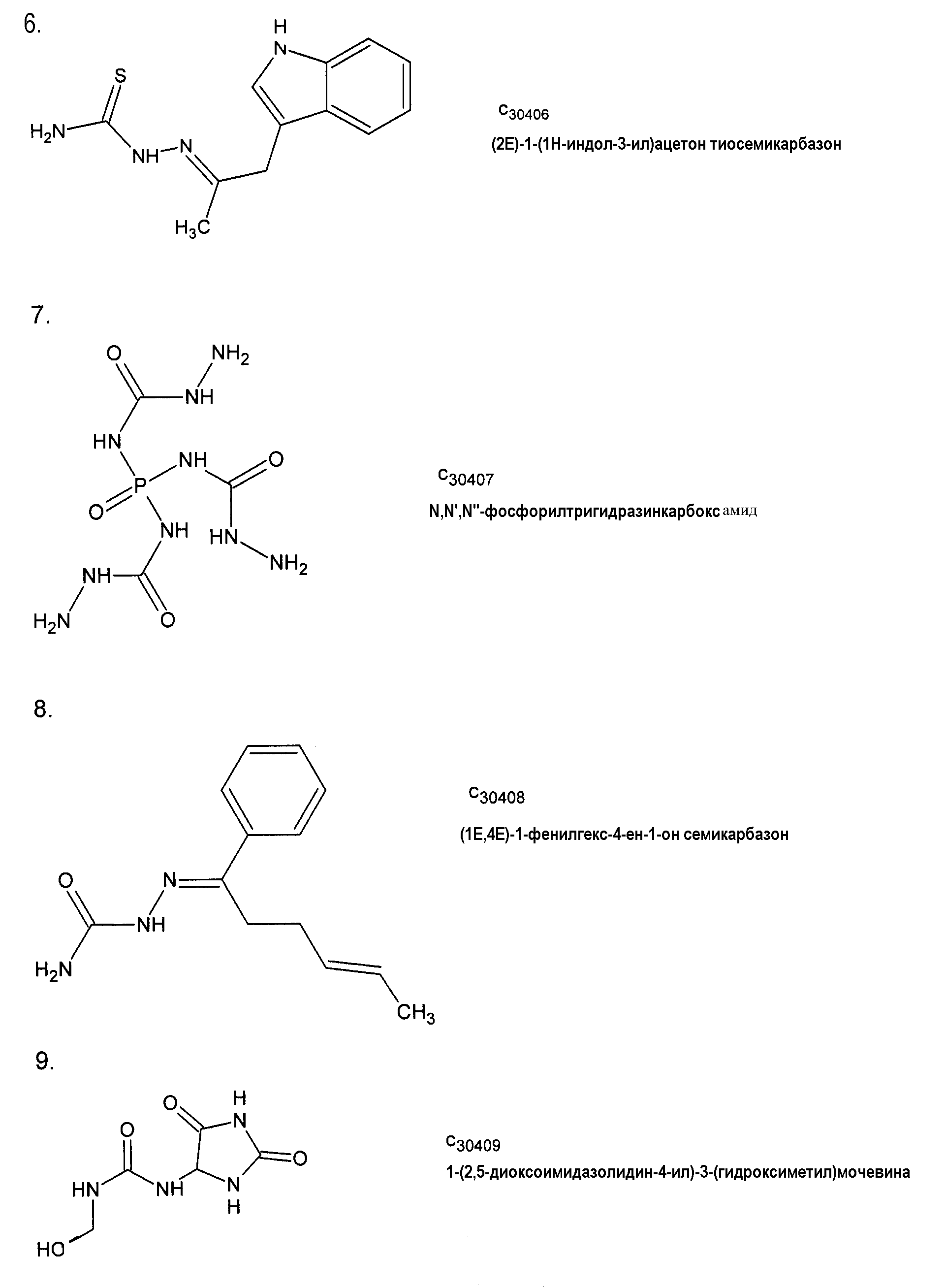
(2Е)-1-(1Н-индол-3-ил)ацетонтиосемикарбазон,
(1Е,4Е)-1-фенилгекс-4-ен-1-он семикарбазон,
1-(2,5-диоксоимидазолидин-4-ил)-3-(гидроксиметил)-мочевина,
N-(3,5-дихлорфенил)-4,6-бис(трихлорметил)-1,3,5-триазин-2-амин,
1-трет-бутил-3-(2-хлорэтил)мочевина,
1-(2-хлорэтил)-3-(1-метил-1-фенилэтил)мочевина,
1-(2-хлорэтил)-3-[1,1-диметил-2-(метилсульфонил)-этил]мочевина,
3-амино-N-бензил-2-(формиламино)-3-иминопропанамид,
(2Z)-1-феноксиацетонтиосемикарбазон,
{[({[(аминоацетил)амино]ацетил}амино)ацетил]амино}-уксусная кислота,
[({[(бензилокси)карбонил]амино}ацетил)(метил)амино]-уксусная кислота,
({[(2-бромпропаноил)амино]ацетил}амино)уксусная кислота,
(1Е,1'Е)-2,2'-(2,4-диоксопиримидин-1,3(2Н,4Н)диил)диацетальдегид дитиосемикарбазон,
({[(3-аминопропаноил)амино]ацетил}амино)уксусная кислота,
2-{[4-фтор-3-(трифторметил)фенил]амино}ацетогидразид,
2-[(3-йодфенил)амино]ацетогидразид,
N-(2,3-дигидроксипропил)-2-(2-нитро-lH-имидазол-1-ил)пропанамид,
N-({[(аминоацетил)амино]ацетил}норвалин,
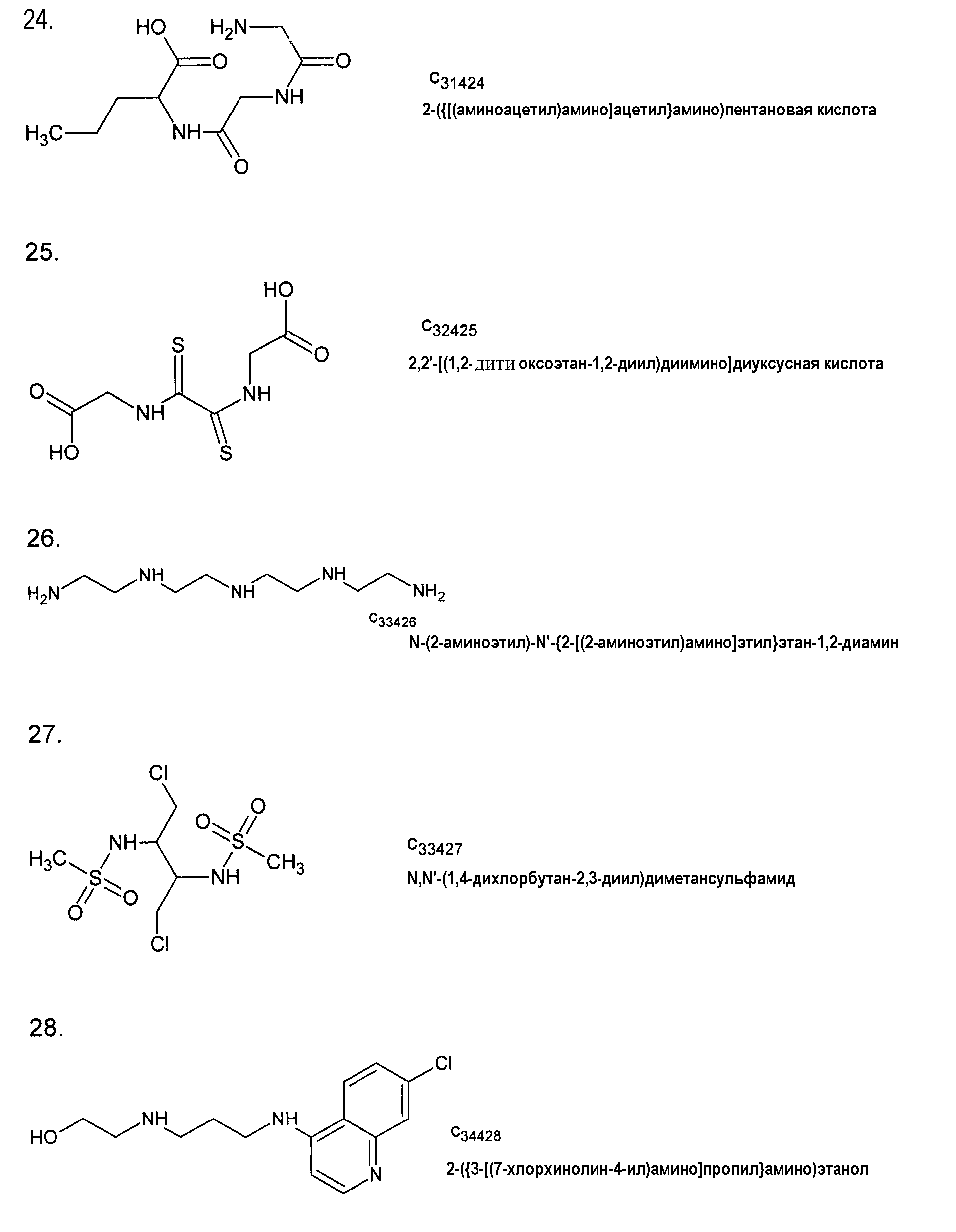
2,2'-[(1,2-дитиооксоэтан-1,2-диил)диимино]диуксусная кислота,
N-(2-аминоэтил)-N'-{2-[(2-аминоэтил)амино]этил}этан-1,2-диамин,
N,N'-(1,4-дихлорбутан-2,3-диил)диметансульфонамид,
2-({3-[(7-хлорхинолин-4-ил)амино]пропил}амино)этанол,
(2,4-дигидроксипиримидин-5-ил)сульфаминовая кислота,
1-(2,5-диоксоимидазолидин-4-ил)-N-[3-(трифторметил)фенил]метансульфонамид,
N'-(2-гидроксиэтил)изоникотингидразид,
2-[(2,4-дихлорбензил)тио]-6-гидроксипиримидин-4-карбоновая кислота,
3-амино-N-бензилпропанамид,
2-гидроксисукциногидразид,
2-амино-4-{[(бензилокси)карбонил]амино}-4-оксобутановая кислота,
2-{[циано(фенил)метил]амино}бензамид,
S-(2-имино-2-{[2-(1-метил-1Н-бензимидазол-2-ил)этил]амино}этил)кислый тиосульфат,
2-амино-6-[(2-гидроксипропил)амино]-5-нитропиримидин-4-ол,
3-[2-амино-6-(метилтио)-9Н-пурин-9-ил]-5-(гидроксиметил)циклопентан-1,2-диол,
этил 2-(2-гидразино-2-оксоэтил)-1Н-пиррол-3-карбоксилат.
(1Z)-3,5,5-триметилциклогекс-2-ен-1-он семикарбазон,
N-(4-амино-2,6-дигидроксипиримидин-5-ил)-N'-изопропилтиомочевина,
N-бутил-N'-(2-фурилметил)мочевина,
3-({[(2-карбоксиэтил)амино]карбонил}амино)пропановая кислота,
1-(2-хлорэтил)-3-(цианометил)мочевина,
(2Е)-1-(1Н-индол-3-ил)ацетонтиосемикарбазон,
(1Е,4Е)-1-фенилгекс-4-ен-1-он семикарбазон,
1-(2,5-диоксоимидазолидин-4-ил)-3-(гидроксиметил)-мочевина,
N-(3,5-дихлорфенил)-4,6-бис(трихлорметил)-1,3,5-триазин-2-амин,
1-трет-бутил-3-(2-хлорэтил)мочевина,
1-(2-хлорэтил)-3-(1-метил-1-фенилэтил)мочевина,
1-(2-хлорэтил)-3-[1,1-диметил-2-(метилсульфонил)-этил]мочевина,
3-амино-N-бензил-2-(формиламино)-3-иминопропанамид,
(2Z)-1-феноксиацетонтиосемикарбазон,
{[({[(аминоацетил)амино]ацетил}амино)ацетил]амино}-уксусная кислота,
[({[(бензилокси)карбонил]амино}ацетил)(метил)амино]-уксусная кислота,
({[(2-бромпропаноил)амино]ацетил}амино)уксусная кислота,
(1Е,1'Е)-2,2'-(2,4-диоксопиримидин-1,3(2Н,4Н)диил)диацетальдегид дитиосемикарбазон,
({[(3-аминопропаноил)амино]ацетил}амино)уксусная кислота,
2-{[4-фтор-3-(трифторметил)фенил]амино}ацетогидразид,
2-[(3-йодфенил)амино]ацетогидразид,
N(2,3-дигидроксипропил)-2-(2-нитро-1Н-имидазол-1-ил)пропанамид,
N-({[(аминоацетил)амино]ацетил}норвалин,
2,2'-[(1,2-дитиооксоэтан-1,2-диил)диимино]диуксусная кислота,
N-(2-аминоэтил)-N'-{2-[(2-аминоэтил)амино]этил}этан-1,2-диамин,
N,N'-(1,4-дихлорбутан-2,3-диил)диметансульфонамид,
2-({3-[(7-хлорхинолин-4-ил)амино]пропил}амино)этанол,
(2,4-дигидроксипиримидин-5-ил)сульфаминовая кислота,
1-(2,5-диоксоимидазолидин-4-ил)-N-[3-(трифторметил)фенил]метансульфонамид,
N'-(2-гидроксиэтил)изоникотингидразид,
2-[(2,4-дихлорбензил)тио]-6-гидроксипиримидин-4-карбоновая кислота,
3-амино-N-бензилпропанамид,
2-гидроксисукциногидразид,
2-амино-4-{[(бензилокси)карбонил]амино}-4-оксобутановая кислота,
2-{[циано(фенил)метил]амино}бензамид,
S-(2-имино-2-{[2-(1-метил-1Н-бензимидазол-2-ил)этил]амино}этил)кислый тиосульфат,
2-амино-6-[(2-гидроксипропил)амино]-5-нитропиримидин-4-ол,
3-[2-амино-6-(метилтио)-9Н-пурин-9-ил]-5-(гидроксиметил)циклопентан-1,2-диол,
этил 2-(2-гидразино-2-оксоэтил)-1Н-пиррол-3-карбоксилат
и фармацевтически приемлемые носители.

Комментарии