Средство, обладающее гиполипидемическим, гепатозащитным и антиоксидантным действием - RU2636817C2
Код документа: RU2636817C2
Чертежи
Описание
Изобретение относится к медицине и фармации, к области создания средства растительного происхождения, которое может быть использовано для профилактики и лечения широкого спектра заболеваний. Предложенный порошок лекарственных и пищевых растений и условным названием «Атерофит» обладает выраженным гиполипидемическим, гепатозащитным и антиоксидантным действием и представляет собой однородный порошок на основе 23-компонентной растительной композиции. Сущность изобретения состоит в том, что в качестве гиполипидемического, гепатозащитного и антиоксидантного средства предложено применение порошка лекарственных и пищевых растений следующего состава: плоды шиповника и кардамона, корнеплод свеклы столовой, слоевище лишайника исландского, корни солодки и шлемника байкальского, трава пустырника, шишки хмеля, плоды миробалана, боярышника и яблони ягодной, столбик с рыльцами кукурузы, корневища имбиря и бадана, семян льна и мускатного ореха, листья ортосифона тычиночного и мяты перечной, порошки глюконата кальция и камфоры, цветки ромашки и календулы, кора коричника настоящего, взятые в определенном соотношении. Указанное средство может быть использовано как в виде порошка, так и в форме капсул.
Порошок «Атерофит» позволяет повысить биологическую ценность благодаря сбалансированному оптимальному составу лекарственных и пищевых растений. За счет многокомпонентности указанное средство проявляет широкий спектр фармакологической активности: противовоспалительный, адаптогенный, седативный, антиоксидантный, гиполипидемический, мембраностабилизирующий, иммуномодулирующий, гипотензивный, диуретический, желчегонный, гепатозащитный, антиагрегантный и антистрессорный. Порошок «Атерофит» может применяться в комплексной терапии и профилактике ишемической болезни сердца (ИБС), гипертонической болезни, сахарного диабета, ожирения различной степени, при нарушениях липидного и углеводного обмена, для профилактики атеросклеротических изменений в кровеносных сосудах, а также в гериатрической практике.
Гиперлипидемия считается одним из ведущих факторов риска развития различных заболеваний, связанных с атеросклерозом. Сегодня атеросклероз входит в число наиболее широко распространенных заболеваний [30]. В частности, атеросклеротические поражения сосудов являются одной из основных причин заболеваний сердечно-сосудистой системы. В настоящее время наблюдается «омоложение» их среди населения трудоспособного возраста [3]. В развитии атеросклероза ведущую роль отводят нарушению липидного обмена, индукции свободнорадикального окисления липидов, дисфункции эндотелия, повышенному тромбогенному потенциалу плазмы. Атеросклероз характеризуется утолщением или уплотнением стенок артерий, скоплением и отложением в сосудах липопротеидов низкой плотности и других веществ с развитием атеросклеротических бляшек. Формирование атеросклеротических бляшек ограничивает приток крови и кислорода к органам и тканям и провоцирует развитие, прежде всего, заболеваний сердечно-сосудистой системы: стенокардии, инфаркта миокарда, сердечной недостаточности. В подавляющем большинстве случаев недостаток кровоснабжения различных органов является следствием ишемической болезни. Кроме ишемической болезни сердца атеросклероз приводит к поражениям сосудов мозга, которые ведут к инсульту. Чаще всего это бывает при сочетании атеросклероза сосудов мозга с гипертонической болезнью. В результате атеросклероза также происходят нарушения периферического кровообращения, тяжелым следствием которого является гангрена конечностей. Избыток калоригенных продуктов в рационе питания, гиподинамия, стресс, повышенное потребление поваренной соли, дефицит антиоксидантов и другие факторы провоцируют усиление свободнорадикального окисления биомакромолекул, в частности липидов, что является одной из главных причин прогрессирования атеросклероза, ведущим фактором формирования его осложнений [32].
Медикаментозная коррекция предполагает: торможение всасывания экзогенного холестерина и реабсорбции эндогенного холестерина; угнетение синтеза эндогенного холестерина, триацилглицеридов и повышение их утилизации в организме; ускорение метаболизма и выведение холестерина и триацилглицеридов; применение гепатопротекторов, желчегонных средств; предупреждение и устранение повреждений сосудов: антиоксиданты, ангиопротекторы и антиагреганты синтетического и природного происхождений.
Известны синтетические гиполипидемические препараты, снижающие уровень липидов в крови на 17-40%. К ним относятся фибраты, препараты никотиновой кислоты и современные препараты из группы статинов (ловастатин, симвастатин, провастатин и др.). Недостатком этих препаратов являются побочные эффекты при длительном применении: так, фибраты вызывают калькулезный холецистит, препараты никотиновой кислоты - дистрофию печени, статины - поражение печени, мышц. Известны также фитопрепараты полиспонин и трибуспонин, обладающие слабой гиполипидемической активностью. Кроме побочного действия, указанные препараты не обладают гепатопротекторной активностью, в то время как атеросклероз, связанный с повышенным содержанием в крови холестерина и триацилглицеридов, часто сопровождается нарушениями функции печени. В последнее время арсенал фитосредств, обладающих гепатопротекторным действием, существенно расширился. Широко применяются ЛИВ-52, эссенциале и силимарин. Недостатком является то, что эти препараты импортируются.
Препараты, снижающие уровень липидов, должны отвечать следующим требованиям: быть нетоксичными, усиливать адаптивные реакции, поддерживать иммуногенез, снижать интенсивность свободнорадикального окисления липидов в тканях и органах, нивелировать в тканях и органах, нивелировать возрастные изменения и др. [12].
Как известно, наряду с химическими лекарственными средствами, для снижения уровня холестерина применяют лекарственные растения. На основе растений созданы лечебно-профилактические средства, в той или иной степени снижающие уровни холестерина в крови и регулирующих липидный обмен. Известны лекарственные средства (ЛС) для лечения и профилактики указанных заболеваний, однако большинство фитопрепаратов получают путем экстрагирования суммы биологически активных веществ (БАВ) из лекарственного растительного сырья (ЛРС). Общим недостатком экстракционных лекарственных средств является то, что истощение растительного сырья в процессе производства по существующим технологиям на фармацевтических предприятиях происходит на 50-60%, в результате чего более 40% БАВ теряется в составе отработанного шрота [11].
Одним из путей комплексной переработки растительного сырья является использование лекарственных средств на основе измельченного порошка. Лекарственное растительное сырье в виде измельченного порошка в течение многих веков используется в тибетской медицине и медицине Китая. Создание таких лекарственных средств является одним из перспективных направлений в развитии фармацевтического производства, так как позволяет максимально использовать весь комплекс БАВ, рационально использовать растительные ресурсы. На основе традиционной прописи «Камфора-25» при анализе тибетских рецептурных справочников [14, 29, 34] оптимизирован состав средства «Атерофит». Выбор был обусловлен данными об использовании порошка «Камфора-25» тибетскими лекарями в качестве «омолаживающего» средства. Растительная композиция порошка подобрана на основе изучения данных литературы о химическом составе растений, об использовании их в народной, тибетской и научной медицине, фармакологических свойствах, официнальности и состояния их сырьевой базы.
Задачей изобретения является расширение ассортимента и области применения лечебно-профилактических средств, отличающихся безвредностью и возможностью его длительного применения без осложнений при многих патологиях на основе растительного сырья.
Технический результат - получение нового средства на растительной основе, обладающего гиполипидемическим, гепатозащитным и антиоксидантным действием.
Поставленная задача решается тем, что предложено лечебно-профилактическое средство для нормализации холестеринового обмена, профилактики и лечения атеросклероза на основе лекарственных и пищевых растений при следующем соотношении компонентов, в мас. %:
Исходным сырьем для получения порошка «Атерофит» служат указанные лекарственные и пищевые растения.
Плоды шиповника - Fructus Rozae. Шиповник майский (ш. коричный) - Rosa majalis Herrm. (R. Cinnamomea L.), шиповник иглистый - Rosa acicularis Lindl., шиповник даурский - Rosa davurica Pall., шиповник собачий - Rosa canina L. и др. видов, сем. розоцветных - Rosaceae. ГФ XI изд., вып.2, ст.38.
Мякоть плодов содержат кислоту аскорбиновую (витамин С): (0,2-1%) - у низковитаминных видов и до (4-5%) - у высоковитаминных; каротиноиды (β-каротин и др.) (до 10 мг %); токоферолы (вит. Е); рибофлавин (вит. B2), филлохинон (вит. K); флавоноиды (рутин, кверцетин, изокверцетин, кемпферол); катехины; лейкоантоцианидины; антоцианы; гидролизуемые и конденсированные дубильные вещества; органические кислоты (лимонная и яблочная 2-4%); жирное масло, пектиновые вещества (до 14%), сахара (до 24%), около 0,9% свободных аминокислот (в основном аспарагиновой); соли калия (23 мг %), натрия (5 мг %), кальция (26 мг %), магния (8 мг %), фосфора (8 мг %), железа (11,5 мг %). Препараты из плодов шиповника обладают широкой фармакологической активностью. Витамин С принимает непосредственное участие во многих окислительно-восстановительных процессах, в метаболизме аминокислот, углеводов, жиров, активации ряда ферментов, способствует регенерации тканей, регулирует свертываемость крови, проницаемость сосудов, участвует в синтезе коллагена, стероидных гормонов, повышает устойчивость и защитные реакции организма к инфекциям и другим неблагоприятным факторам внешней среды, стимулирует кроветворный аппарат, усиливает фагоцитарную способность лейкоцитов; повышает умственную и физическую работоспособность, активирует основной обмен. Экспериментально доказано противоатеросклеротическое действие аскорбиновой кислоты, что проявляется снижением уровня холестерина и общих липидов в крови, ингибированием отложения атероматозных масс в стенках сосудов. В механизме противоатеросклеротического действия шиповника участвуют не только аскорбиновая кислота, но и ряд других веществ, регулирующих проницаемость сосудистой стенки (рутин), действующих как антиоксиданты (токоферолы, витамин А), а также ПНЖК и другие вещества. Желчегонный эффект препаратов шиповника (одним из стимуляторов которого считают соли магния, присутствующие в шиповнике в значительных количествах) также способствует удалению из организма холестерина и его предшественников. Наличием в шиповнике магния объясняют снижение напряжения сосудистых стенок, улучшение функции печени. Ионы магния также подавляют процессы образования щавелевой кислоты, в их присутствии увеличивается растворимость оксалатов кальция, активируется фибринолиз, что препятствует образованию камней и сгустков крови в мочевой системе. Плоды шиповника обладают противовоспалительным, желчегонным и мочегонным действием [1, 4,16,17, 22].
Корнеплоды свеклы. Свекла столовая (с.обыкновенная) - Beta vulgaris L. сем. Маревые. ГОСТ Р 52622-2006. Овощи сушеные. Общие технические условия. В свекле содержатся антоцианы, клетчатка, пектин, большое количество витаминов, мг: аскорбиновая кислота (10%), В1 (тиамин) (0,04%), B2 (рибофлавин) (0,20%), Р, РР (ниацин, никотиновая кислота) (1,2%), Е, β-каротин (0,04%); углеводов (59,6%), органические кислоты, аминокислоты, минеральные вещества, сапонины, связывающие холестерин в кишечнике; бетанин, бетаин, которые способствуют ускорению роста и участвуют в образовании холина, улучшающего функцию печени и предохраняющего ее от жирового перерождения, бетацианины ингибируют процессы пролиферации раковых клеток, препятствуя возникновению злокачественных опухолей, а пектиновые вещества подавляют деятельность гнилостных кишечных бактерий и способствуют образованию в организме гликогена. Свекла - источник органического кальция и калия, так необходимых для поддержания кислотно-щелочного баланса крови; богата йодом (необходим для щитовидной железы, памяти и работоспособности). По количеству железа и цинка она не имеет себе равных. В свекле содержится кобальт, от которого зависит синтез витамина В12, а также фолиевая кислота (вит. В9), которые участвуют в обмене и синтезе некоторых аминокислот, нуклеиновых кислот, стимулируют кроветворную функцию костного мозга и способствуют лучшему усвоению витамина В12. Тиамин повышает эластичность кровеносных сосудов, предупреждает склеротические повреждения сосудов и внутреннее кровоизлияние, препятствует образованию опухолей, нормализует функцию нервной системы, мышц и сердца. Рибофлавин регулирует процессы обмена в роговице, хрусталике и сетчатке глаза, обеспечивает световое и цветовое зрение. Разновидности витамина РР - никотиновая кислота и никотинамид - для синтеза половых гормонов, а также кортизона, тироксина и инсулина. Пиродоксин, синтезируя в печени фермент трансаминазу, участвующую в обмене аминокислот, обеспечивает усвоение белков и жиров; играет важную роль в азотистом обмене и деятельности иммунной системы [2, 6, 15, 21].
Плоды кардамона - Fructus Cardamom. Кардамон настоящий - Elettaria cardamomum White et Maton, сем. имбирных - Zingiberaceae. ГОСТ 29052-91 «Пряности. Кардамон». Технические условия. Содержится: эфирное масло (3-8% - лимонен, терпинеол, борнеол, цинеол), жирное масло (10%), сахар, крахмал, клетчатка, азотистые и безазотистые вещества. Используют для улучшения пищеварения, при головной боли, в качестве почечного и ветрогонного средства [20,31]. Лечит все болезни почек, вызванные «холодом» и «Ветром», «хороший» - для почек [34].
Слоевище цетрарии исландской - Thallus Lichenis islandici. Мох исландский - Cetraria islandica L., сем. пармелиевых - Parmeliaceae. ГОСТ 13727-68. «Слоевище лишайника цетрарии исландской». Найдены полисахариды (30-70% от массы сухого сырья). Основным углеводом цетрарии является лихенин - из класса β-глюканов (природные иммунокорректоры), изолихенан, галактоманнан. Они повышают эффективность медикаментозного лечения нарушений обмена веществ и снижают токсичность используемых препаратов. Полисахариды цетрарии исландской обладают антигипоксическими свойствами, относятся к интерферонстимуляторам и адаптогенам. В сочетании с микроэлементами полисахарид представляет собой ценное иммуномодулирующее средство для лиц, страдающих аутоиммунными заболеваниями. Наибольшую ценность в цетрарии исландской представляют лишайниковые кислоты, особенно усниновая кислота, обладающая антибиотическим действием; горькое вещество цетрарии (цетраровая кислота - 2-3%); фолиевую и аскорбиновую, лихестериновую, протолихестериновую, фумарпротоцетраровую кислоты; камеди; минеральные соли (1-2%); витамин В12. Оказывает ранозаживляющее и антимикробное действие, а также обладает мягчительными и обволакивающими свойствами. Рекомендуется для лечения заболеваний органов пищеварения и дыхания. Используют при гастритах, энтероколитах, при хронических бронхитах, трахеитах, а также как общеукрепляющее средство при потере аппетита и истощающих болезнях. Антигипотоксическое, обволакивающее, отхаркивающее, адаптогенное, иммуномодулирующее, бактериостатическое, бактерицидное, средство [1, 9, 16, 24].
Корень солодки - Radix Glycyrrhizae. Солодка голая (с.уральская) - Glycyrrhiza glabra L. (G. uralensis Fisch.), сем. - Fabaceae. ГФ X, ст.573; ФСП 42-0273-1781-01. ГОСТ 22839-88E «Корни и корневища солодки». В подземных органах обнаружены: тритерпеновый сапонин - глицирризин (до 23%), представляющий собой кальциево-калиевую соль кислоты глицирризиновой, агликоном (сапогенином или генином), которой является кислота глицирретиновая (глицирретовая), а углеводная часть глицирризина представлена двумя молекулами кислоты глюкуроновой, присоединяющимися к сапогенину у С3. Приторно-сладкий вкус лакричного корня обусловлен именно присутствием глицирризиновой кислоты, соли которой слаще сахара в 50-100 раз. Среди 27 разнообразных флавоноидов наиболее важны флавонол и халкон, а также их изоформы - ликуразид, кемпферол, ликвиритозид, ликвиритин, изоликвиритин, уралозид и др.; полисахариды (крахмал до 34%), пектиновые вещества - (4-6%); дубильные вещества (до 14%); кумарины (до 2,6%); органические кислоты (до 4,6%); горькие вещества - 2,4%; стероиды (β-ситостерин, эстриол). Солодка обладает гипогликемическим, антисекреторным, противовоспалительным, иммунокорригирующим, противовирусным, противоязвенным свойствами, также обнаружены адаптогенные свойства. Препараты из корня солодки обладают спазмолитическим действием, расслабляют гладкую мускулатуру, снижают секрецию пищеварительных желез и действуют как общеукрепляющее, отхаркивающее, обволакивающее, моче- и желчегонное средство. Солодка оказывает смягчающее действие при кашле, оказывает анибактериальное и антитоксическое действие, способствует нормальному функционированию желудка, стимулирует перистальтику желудочно-кишечного тракта, укрепляет естественные защитные силы организма. Кислота глицирризиновая проявляет противовирусное действие. Благодаря наличию сапонинов способствует снижению уровня холестерина в крови, препятствует атеросклеротическим изменениям стенок сосудов, эффективно снижает артериальное давление, оказывает противоопухолевое действие, способствует повышению иммунитета [1, 4, 16, 17, 22].
Корни шлемника байкальского - Radices Scutellariae baicalensis. Шлемник байкальский - Scutellaria baicalensis Georgi., сем. яснотковых - Lamiaceae. ФС 42-453-91; ГОСТ 6077-80. В подземных органах содержатся флавоноиды (до 10% - байкалин, скутеллярин, вагонин), гидролизующиеся на глюкуроновую кислоту и агликоны - байкалеин и скутелляреин, ороксилин и др.; дубильные вещества (до 2,5%); эфирное масло, смолы. Обладает гипотензивным, седативным, противоаллергическим, ноотропным действием [1, 16, 17, 22].
Трава пустырника - Herba Leonuri. Пустырник сердечный - Leonurus cardiaca L. (П. пятилопастной - L. quinquelobatus Gilib.), сем. яснотковых - Lamiaceae. ГФ XI изд., вып. 2, ст.54. В траве пустырника содержатся флавоноидные гликозиды (рутин, гиперозид, кверцетин, квинквелозид, космосиин, кверцитрин, кверцимеритрин); дубильные вещества (до 2,5%); иридоиды (аюгол, аюгозид и галиридозид); сахара, эфирные масла, каротин; горькие гликозиды со стероидным скелетом и азотистые основания (холин, стахидрин); провитамин А и витамин С. Пустырник имеет высокую терапевтическую эффективность, обладает седативными свойствами - оказывает гипотензивное и кардиотоническое действия. Применяется у больных, страдающим кардиосклерозом, гипертонической болезнью, стенокардией, миокардитом, кардионеврозом. Препараты пустырника применяют при повышенной нервной возбудимости; психастении и неврастении, сопровождающихся бессонницей, чувством напряженности и повышенной реактивности, а также при вегето-сосудистой дистонии и неврозах; при функциональных расстройствах центральной и вегетативной нервной системы, особенно в предклимактерическом и климактерическом периодах, а также при кардиосклерозе, гипертонической болезни, стенокардии, миокардите и кардионеврозе. По характеру действия препараты пустырника близки к препаратам валерианы, седативный эффект от применения препаратов травы пустырника выше, чем при использовании препаратов из корней и корневищ валерианы [1, 4, 16, 17, 22].
Шишки хмеля - Strobili Lupuli. Хмель обыкновенный - Humulus lupulus L., сем. коноплевых - Cannabaceae. ГОСТ 21946-76. Шишки хмеля содержат 0,3-1,8% эфирного масла. В его составе 224 компонента, относящихся к моно- и сесквитерпеноидам. Главные компоненты эфирного масла - мирцен, кариофиллен, гумулен и фарнезен. Найдены эфиры, спирты, органические кислоты, кетоны алифатического ряда. Содержатся в соплодиях горечи (11-21%), которые по международной номенклатуре принято называть «общими смолами». Они состоят из а- и b-кислот (гумулон, когумулон, лупулон, колупулон и др.). Определены фенольные соединения: флавоноиды, производные кверцетина и кемпферола (изокверцитрин, рутин, астрагалин, кверцитрин, кемпферитрин, мирицитрин и др.); кумарины; антоцианидины (цианидин и дельфинидин); катехины: (+)-катехин, (-)-эпикатехин и их полимеры; фенольные кислоты (хлорогеновая и ее производные, галловая, протокатеховая, кофейная, феруловая и др.). В сырье обнаружены витамины группы В, аскорбиновая кислота, токоферолы, эстрогенные гормоны. Шишки хмеля имеют широкий спектр фармакологической активности; обладают противовоспалительным, диуретическим, антимикробным, успокоительным, болеутоляющим, гепатопротекторным, желчегонным, противоязвенным, спазмолитическим, противовирусным гипосенсибилизирующим и нейротропным действием. Используют при заболеваниях желудочно-кишечного тракта как улучшающее пищеварение и как болеутоляющее; как седативное, снотворное средство [1, 16, 17, 22].
Плоды миробалана - Fructus Myrobalanae. Миробалан хебула - Terminalia chebula Retz., сем. - Combretaceae. ГОСТ 29053-91. «Пряности. Миробалан.» Миробаланы - одно из сильнейших омолаживающих средств в Восточной медицине. Регулируют содержание сахара в крови, улучшают усвоение пищи, обостряют зрение, повышают память, способствуют очищению кишечника от шлаков. Регулируют функцию толстой кишки и, в зависимости от дозы, устраняют как запоры, так и понос.Используют при слабости и тканевой недостаточности у пожилых лиц, ослабленных хроническими болезнями, переутомлением и нервным истощением. Плоды обладают противовоспалительным, антиоксидантнтным, бактерицидным, общеукрепляющим свойствами, полезны при истощении, ранах и болезнях глаз [31]. Плоды полезны для печени и при жаре (лимфы) [34].
Плоды боярышника - Fructus Crataegi. Боярышник кроваво-красный (б. даурский) - Crataegus sanguinea Pall. (с.dahurica Koehne et Schneid.), сем. розоцветных - Rosaceae. ГФ XI, вып.2, ст.32. В плодах содержатся: флавоноиды (гиперозид, кверцетин, кверцитрин, витексин, ацетилвитексин, пиннатифидин,); витамин С (до 38,3 мг %); каротин (0,5 мг %); редуцирующие сахара (до 5%); фенолкарбоновые кислоты (кофейная, хлорогеновая); тритерпеноиды (кратегусовая, урсоловая, олеаноловая кислоты); дубильные вещества; амины (холин, ацетилхолин); каротиноиды. Препараты боярышника тонизируют сердечную мышцу, одновременно уменьшая ее возбудимость, регулируют ритм сердца, предупреждая и устраняя аритмию, улучшают коронарное и мозговое кровообращение. Регулируют тонус сосудистой системы, нормализуя артериальное давление, оказывают седативное действие, снижают возбудимость нервной системы, улучшают сон и общее состояние организма. Применяют при функциональных расстройствах сердечной деятельности, сердечной недостаточности, стенокардии, ангионеврозах, мерцательной аритмии, парксизмальной тахикардии, при атеросклерозе, гипертонической болезни. Оказывает влияние на эластичность сосудистой стенки (артериол и капилляров). В связи с этим они используются для улучшения снабжения кислородом миокарда и нейронов головного мозга. Препараты боярышника оказывают влияние на липидный обмен, а также обладают выраженным антиатеросклеротическим действием, усиливают желчеотделение, снижают уровень холестерина в крови [1, 4, 16, 17, 22].
Плоды яблони ягодной. Яблоня ягодная (сибирская) - Malus baccata (L.), (Яблоня Палласова - Malus pallasiana Juz.), Яблоня домашняя - Malus domestica Borkh. сем. розоцветных - Rosaceae. Плоды содержат эфирное масло, сахара, пектиновые вещества, клетчатку, витамин B1, В2 РР, А, С и Р-активные вещества (катехины, лейкоантоцианы, флавоновые гликозиды и др.), каротин, органические кислоты (яблочная и лимонная), дубильные вещества, минеральные элементы (Na, K, Fe, Са, Mn). Необходимо отметить, что по наличию биологически активных веществ, плоды дикорастущих яблонь превосходят даже большинство культурных сортов. Их используют и как диетическое и лечебное средство. Яблоки полезны лицам страдающим сердечно-сосудистыми заболеваниями, подагрой, хроническими запорами, атеросклерозом, ревматизмом, со склонностью к образованию почечных и мочевых камней. Яблоки способствуют нормализации деятельности желудочно-кишечного тракта и пищеварительной системы, а также применяются для повышения аппетита. Они снижают уровень холестерина в крови из-за содержания пектина и соответствующих волокон; применяют при авитаминозе, малокровии, при подагре и хроническом ревматизме; препятствуют образованию мочевой кислоты. Плоды яблони считаются хорошим диетическим средством при нарушении обмена веществ, ожирении, а в свежем виде - для профилактики атеросклероза. Сок яблок укрепляет сердечно-сосудистую систему, поскольку в нем много кроветворных элементов. [5, 8, 27, 33].
Столбики с рыльцами кукурузы (кукурузные рыльца) - Styli cum stigmatis Zeae maydis. Кукуруза обыкновенная (маис) - Zea mays L., сем. мятликовых - Poaceae. ГФ XI, вып. 2, ст.82. Кукурузные рыльца содержат: жирное масло (до 2,5%), эфирное масло (до 0,12%), каротиноиды, смолистые вещества (до 2,7%), горькие гликозиды (1,15%), сапонины (до 3,18%), витамины B1, В2, В6, В12, D, Е, K, С, инозит, стероиды: ситостерин, стигмастерин, слизи (до 3,8%), флавоноиды, макро- и микроэлементы. Препараты кукурузных рылец обладают выраженным желчегонным свойством, увеличивают секрецию желчи, уменьшают ее вязкость, повышают мочеотделение; обладают также гипогликемическими свойствами. Назначают при холангитах, гепатитах и холециститах, энтероколитах, а также при отеках, связанных с заболеваниями сердечнососудистой системы и болезнями почек. Применяют для лечения и профилактики атеросклероза, используют при гиповитаминозах [1, 4, 16, 17, 22].
Корневища имбиря - Rhizomata Zingiberis. Имбирь настоящий (и. аптечный) - Zingiber officinale, сем. имбирных - Zingiberaceae. ГОСТ 29046-91 «Пряности. Имбирь». В корневищах имбиря содержится: эфирного масла (до 3%), главной составной частью которого являются сесквитерпены - α- и β-цингиберены (до 70%), обладающие характерным имбирным запахом. Кроме того, в эфирном масле содержатся терпеноиды: линалоол, гераниол, бизаболен, цинеол, цитраль, фарнезел, борнеол. Жгучий вкус корневища обусловлен смолистой частью, известной под названием «гингероль», который является смесью разных цингеролов (гингеролов) (5-8%). Обнаружены липиды (6-8%), аминокислоты, витамины (никотиновая, вит. А), до 50% крахмала, клетчатка. Используют при плохом аппетите и расстройстве пищеварения (с тошнотой и рвотой), метеоризме, хроническом энтерите. Имбирь понижает артериальное давление и уровень холестерина в крови. Обладает противовоспалительным, ветрогонным, спазмолитическим, болеутоляющим действием. Порошок имбиря считается одним из лучших противотрахоматозных средств. Как седативное и антиспастическое, общеукрепляющее средство [17, 20, 22, 31].
Семена льна - Semina Lini. Лен посевной (л. обыкновенный) - Linum usitatissimum L., сем. льновых - Linaceae. ГФ XI, вып. 2, ст.79. Семена всех разновидностей льна содержат (30-48%) жирного масла, в состав которого входят кислоты: линолевая (15-20%), линоленовая (50-65%), олеиновая (10-20%), пальмитиновая (6-7%), стеариновая (2-4%). А также находятся: слизь (5-12%), диетическая клетчатка (28%), протеин (21%), углеводы (6% - сахара, лигнин, гемицеллюлоза), фенолокислоты (сиреневая, кумаровая), органические кислоты, каротин, 4% золы, макро- и микроэлементы. Семена льна в качестве обволакивающего и смягчающего средства применяют в виде слизи при заболеваниях кишечника, а также как противоядие при отравлении кислотами, щелочами, солями тяжелых металлов. Льняное масло применяют как легкое слабительное при спастическом запоре, наружно как ранозаживляющее при ожогах, лучевых поражениях и для приготовления мазей. Обладают противовоспалительным, слабительным и обволакивающим действием. Линетол, входящий в состав масла, оказывает противосклеротический эффект, снижает уровень холестерина, оказывает болеутоляющее действие и ускоряет регенерацию пораженных тканей. Семена льна являются источником незаменимых (эссенциальных) ненасыщенных жирных кислот (омега 3). Используют семена льна для снижения уровня холестерина в крови, предотвращений заболеваний сердечно-сосудистой и иммунной систем, снижения риска возникновения новообразований [1, 4, 16, 17, 22].
Листья ортосифона тычиночного - Folia Orthosiphonis Staminei. Ортосифон тычиночный (почечный чай) - Orthosiphon Stamineus Benth., сем. яснотковых - Lamiaceae. ГФ XI, вып. 2, ст. 21. Надземная часть растения содержит (1,64-3,63%) тритерпеновых сапонинов. Агликон главного из них (1-сапофонина) - урсоловая кислота, относящаяся к производным 1-амирина. Кроме того, почечный чай содержит многоатомный спирт - мезоинозит (0,35-0,016%), флавоноиды (3,84-2,39%), дубильные вещества (5,07-4,78%), эфирное масло (0,2-0,6%), жирное масло (до 2,7%), липиды (7,76-6,41%), органические кислоты (3,26-5,0%), в том числе винная (до 1,5%), лимонная, розмариновая. Почечный чай применяют при острых и хронических заболеваниях почек, сопровождающихся отеками и образованием мочевых камней, при циститах и уретритах, подагре, сахарном диабете, желчнокаменной болезни и холециститах, а также при различных заболеваниях сердечно-сосудистой системы. Препараты почечного чая обладают мочегонным свойством, при этом с мочой из организма выводятся хлориды, мочевина, мочевая кислота. Кроме того, почечный чай обладает спазмолитическим действием и повышает секреторную активность слизистой оболочки желудка и содержание свободной хлористоводородной кислоты в желудочном соке [1, 4, 16, 17, 22].
Кальция глюконат - Calcii gluconas. ГФ X, ст.121. Белый зернистый или кристаллический порошок без запаха и вкуса. Источник ионов кальция; антиаллергическое средство. Карбонаты кальция - Е170. Группа: пищевая добавка. Для здоровья человека карбонаты кальция играют не последнюю роль - они принимают участие в процессах свертывания крови. Помимо этого, данное вещество способно стабилизировать кровяное давление и существенно регулировать многие внутренние процессы, а также предназначенны для лечения и профилактики остеопороза, рахита и кариеса. Кальций - макроэлемент, участвующий в формировании костной ткани, процессе свертывания крови, необходим для поддержания стабильной сердечной деятельности, осуществления процессов передачи нервных импульсов [18].
Корневища бадана - Rhizomata Bergeniae. Бадан толстолистный - Bergenia crassifblia L., сем. камнеломковых - Saxifragaceae. ГФ XI, вып. 2, ст.70. Корневища бадана толстолистного содержат главным образом дубильные вещества пирогаллоловой группы (5-28%); изокумарины (бергенин 5%); катехины (0,3-1,16%); фенолкарбоновые кислоты и их производные (галловая кислота 0,22%); флобафены (3,6%), арбутин (9-33,3%), глюкозу (7%), сахарозу (2%), крахмал (40%), декстрин (8,5%), щавелевокислый кальций (4%), смолистые вещества (1%), эфирное масло. Препараты бадана обладают противовоспалительным, вяжущим, кровоостанавливающим и бактерицидным свойствами. Укрепляют стенки капилляров, понижают артериальное давление. Применяют при заболеваниях желудочно-кишечного тракта (колитах и энтероколитах неинфекционной природы), в гинекологической практике при обильных менструациях и кровотечениях после аборта. А также при фибромиоме матки. В стоматологической практике применяют при хронических воспалительных процессах в полости рта [1, 4, 16, 17, 22].
Листья мяты перечной - Folia Menthae piperitae. Мята перечная - Mentha piperita L., сем. яснотковых - Lamiaceae. ГФ XI изд., вып. 2, ст.18.
Листья мяты содержат не менее 2% эфирного масла, состоящего из терпенового спирта, ментола и его эфиров (изовалериановой и уксусной кислот). Также содержит изомеры: ментон, α-пинен, лимонен, цинеол, дипентол, β-фелландрен и другие терпеноиды; флавоноиды, дубильные вещества, каротин, бетаин, гесперидин, органические кислоты, витамины С, А, микроэлементы. Галеновые вытяжки из травы обладают успокаивающими, спазмолитическими, болеутоляющими, желчегонными антисептическими свойствами, а также оказывают рефлекторное коронарорасширяющее действие. За счет местного раздражающего эффекта и стимулирующего влияния на периферические нейрорецепторы кожи и слизистых оболочек мята усиливает капиллярное кровообращение и перистальтику кишечника. Препараты из листьев мяты усиливают секрецию пищеварительных желез, улучшают аппетит, повышают желчеотделение, оказывают спазмолитическое действие, снижая тонус гладкой мускулатуры кишечника, желче- и мочевыводящих путей. Бактерицидные свойства мяты распространяются на все виды патогенных бактерий желудочно-кишечного тракта, способствует отделению желчи. В качестве желчегонного средства их рекомендуют при холецистите, холангите, желчнокаменной болезни и гепатитах. При воспалительных заболеваниях верхних дыхательных путей (фарингит, ларингит, трахеит, риниты). Ментол широко используют как легкое рефлекторное сосудорасширяющее средство при стенокардии и болезнях, связанных со спазмами сосудов головного мозга, а также применяют как легкие седативные препараты при повышенной возбудимости, бессоннице и различных невротических состояниях [1, 4, 16, 17, 22].
Цветки ромашки - Flores Chamomillae. Ромашка аптечная - Chamomilla recutita L., сем. астровых - Asteraceae. ГФ XI, вып. 2, ст.7.
Соцветия ромашки аптечной содержат (0,2-0,8%) эфирного масла, основные действующие вещества которого - сесквитерпеновые лактоны (хамазулен), а также сесквитерпеновые углеводороды (фармазен и кадинен); сесквитерпеновые спирты (бизаболол, бизабололоксид, кетоспирт); флавоноиды, кумарины, ситостерин, холин, полисахариды, каротин, горькие вещества, витамин С, изовалериановую и органические кислоты, слизи.
Благодаря такому составу препараты ромашки оказывают желчегонное, спазмолитическое, противовоспалительное, антисептическое, седативное, местноанестезирующее действие, повышают секрецию пищеварительных желез, уменьшают процессы брожения, снимают спазмы кишечника. Обладают стимулирующим влиянием на дыхательную функцию, расширяя сосуды головного мозга. Используют в качестве противовоспалительного, антисептического и обезболивающего средства при заболеваниях полости рта (стоматиты, гингивиты), тонзиллитах и ангине. Назначают при острых и хронических гастритах и язвенной болезни желудка, при колитах и энтероколитах. При заболеваниях печени и желчных путей препараты ромашки снимают спазм желчных протоков, усиливают желчеотделение, уменьшают воспалительные явления, а также при кардиосклерозе, гипертонической болезни, стенокардии, миокардите и кардионеврозе. Применяют при повышенной возбудимости, психастении и неврастении, сопровождающейся бессонницей, чувством напряженности и повышенной реактивности, а также при вегетососудистой дистонии и неврозах, функциональных расстройствах центральной и вегетативной нервной системы [1, 4, 16, 17, 22].
Цветки ноготков - Flores calendulae. Ноготки лекарственные (Календула лекарственная) - Calendula officinalis L., сем. астровых -Asteraceae. ГФ XI изд., вып. 2, ст.5. Цветочные корзинки содержат (до 3%) каротиноиды (вилоксантин, α- и β-каротины, ликопин, лютеин, неоликопин, рубиксантин, флавохром, флавоксантин); флавоноиды (0,33-0,88%): (изорамнетин-3-глюкозид„ рутин, нарциссин, кверцитрин); тритерпеновые сапонины: календулозиды А, В, С, Д1, Д2 и F; небольшое количество кумаринов (скополетин, умбеллиферон и эскулетин); смолы (до 3,4%); слизи (до 4%); дубильные вещества (до 6,4%); эфирные масла (до 0,024%); фенольные кислоты (коричная, о-кумаровая, синапиновая, хинная, ванилиновая, феруловая) и органические кислоты (яблочная до 6,8%), аскорбиновую, пентадециловую и следы салициловой. Лекарственные средства из календулы обладают противовоспалительным,
ранозаживляющим, антисептическим, седативным, мягким гипотензивным действием. Применяются как гепатопротекторное средство при гепатите, холецистите; воспалительных заболеваниях слизистых оболочек полости рта (парадонтозе, стоматите), при лечении незаживающих ран и язв, пролежней и ожогов, отморожений, конъюктивитов, как успокаивающее при бессоннице, при сердечно-сосудистых заболеваниях [1, 4, 16, 17, 22].
Семена мускатного ореха - Semen Myristicae. Мускатное дерево - Myristica fragrans Houtt., сем. Myristicaceae. ГОСТ 29048-91 «Пряности. Мускатный орех». Содержит эфирного масла (10%), жирного масла (до 40%), углеводы, клетчатка. Применяют как ветрогонное, при поносах, желудочных и кишечных коликах. Эфирное масло назначают как стимулирующее и тонизирующее средство [31]. Лечит болезни от расстройства «Ветра» и болезни сердца [34]. Используют в производстве ликеров, горьких настоек и вин. Употребляют как пряность для приготовления соусов, фарша, а также хлебобулочных изделий [20].
Камфора - Camphora. ГФ X, ст.128. Бесцветный кристаллический порошок, с сильным характерным запахом и пряным горьковатым охлаждающим вкусом. Синтетическое вещество. Улучшает легочный кровоток и альвеолярную вентиляцию; тонизирует дыхательный и сосудодвигательный центры; улучшает функцию миокарда, усиливает обменные процессы и чувствительность миокарда к влиянию симпатических нервов; ингибирует агрегацию тромбоцитов, расширяет коронарные артерии. Стимулятор центральной нервной системы; кардиотоническое средство.
Камфору используют в медицине и ароматерапии. Применяют правовращающую натуральную d-камфору, добываемую из камфорного дерева, или полусинтетическую, левовращающую L-камфору, получаемую из пихтового масла. Рацемическую камфору используют только для наружного применения. В начале XX века считали, что терапевтическое действие оказывает только натуральная (правовращающая) d-камфора, затем было доказано, что синтетические продукты - левовращающая и рацемическая камфора не имеют существенного различия с действием натуральной формы. Все три формы оказывают положительное влияние на альвеолярную вентиляцию, улучшают легочный кровоток и функцию миокарда. Фармакологи рассматривают камфору как важный представитель аналептических средств. Тонизирует дыхательный центр, стимулирует сосудодвигательный центр. Оказывает также непосредственное действие на сердечную мышцу, усиливая обменные процессы в ней и повышая ее чувствительность к влиянию симпатических нервов. Способствует отделению мокроты. Возможно, что камфора ингибирует агрегацию тромбоцитов, в связи с чем она рекомендована к применению для улучшения микроциркуляции. Возбуждая чувствительные нервные окончания кожи, рефлекторно улучшает трофику органов и тканей. При парентеральном введении - аналептическое, кардиотоническое, вазоконстрикторное и отхаркивающее действие. При наружном применении оказывает противовоспалительное, противомикробное, местнораздражающее, анальгезирующее действие. Противозудное действие камфоры, возможно, связано с тем, что она, как и ментол, избирательно активирует холодовые рецепторы. Камфора почти нерастворима в воде (1:840), но легко растворяется в этиловом спирте (1:1), этиловом эфире, хлороформе, жирных и эфирных маслах. Сохраняют в хорошо укупоренных банках в прохладном месте [10].
Кора коричника настоящего - Cortex Cmnamomi veri. Коричник настоящий - Cinnamomum verum J. Presl., сем. лавровых - Lauraceae. ГОСТ 29049-91 «Пряности. Корица». Кора содержит (до 2%) эфирного масла, в состав которого входит альдегид кислоты коричной (65-75%), фелландрена и эвгенола (около 10%), цинеол; дубильные вещества, смола, слизь, крахмал, кальция оксалат. Оказывает губительное действие на туберкулезную палочку и вирусы; активен в отношении различных грамположительных и грамотрицательных бактерий. Применяют как спазмолитическое, тонизирующее, противорвотное, антисептическое средство [11]. Используют как пряность, улучшает пищеварение [20, 31].
Предложенный порошок «Атерофит» получают следующим образом.
Пример 1. Крупные корни и корневища, а также корнеплоды очищают от механических примесей, промывают проточной водой и предварительно сушат на воздухе, затем измельчают на небольшие кусочки размером в 1-3 мм. Далее необходимое количество растительного сырья каждого компонента (в граммах) отвешивают и досушивают под вакуумом 550-600 мм рт.ст. при температуре 45-50°C до остаточной влажности 5%. После операции взвешивания и сушки смешивают все компоненты (кроме порошков камфоры и глюконата кальция) и измельчают в мельнице. Затем просеивают материал через сито с отверстиями диаметром 0,25 мм. Оставшийся непросеянный материал снова измельчают и осуществляют повторное просеивание и так до тех пор, пока весь материал не будет измельчен и просеян, затем добавляют к нему порошкообразную минеральную добавку и хорошо перемешивают в смесителе. В расплавленную камфору добавляют порциями полученную смесь компонентов, постоянно ее перемешивая. Далее готовый порошок фасуют в банки из стекла темного цвета по 100, 200, 500 г, укупоривают и хранят в сухом, прохладном месте.
«Атерофит» представляет собой однородный порошок зеленовато-бурого цвета с красноватым оттенком со специфическим ароматным запахом, с горьковатым и слегка вяжущим вкусом.
На основании фитохимического анализа порошка «Атерофит» установлено наличие фенольных соединений: К 1 мл фильтрата прибавляют 3 мл спирта 96% и 1 мл 2% спиртового раствора алюминия хлорида; раствор окрашивается в зеленовато-желтый цвет (флавоноиды). К 1 мл фильтрата прибавляют несколько мг порошка металлического магния и 2-3 капли концентрированной хлористоводородной кислоты; раствор окрашивается в красно-малиновый цвет (флавоноиды). К 3 мл фильтрата прибавляют 3 капли 1% спиртового раствора железа окисного хлорида; появляется черно-синее окрашивание и осадок (дубильные вещества).
К 3 мл фильтрата прибавляют 2 мл 0,1% водного раствора нингидрина; при нагревании образуется сине-фиолетовое окрашивание раствора (аминокислоты).
Органических кислот. Методом хроматографии на бумаге FN-12 в системе растворителей: бутанол-муравьиная кислота-вода (18:2:5) после обработки 0,05% водным раствором бромфенолового синего в водных извлечениях на хроматограммах обнаруживают желтые пятна на уровне свидетелей: винная кислота - Rf=0,31; лимонная кислота - Rf=0,46; яблочная кислота - Rf=0,66; янтарная кислота - Rf=0,84.
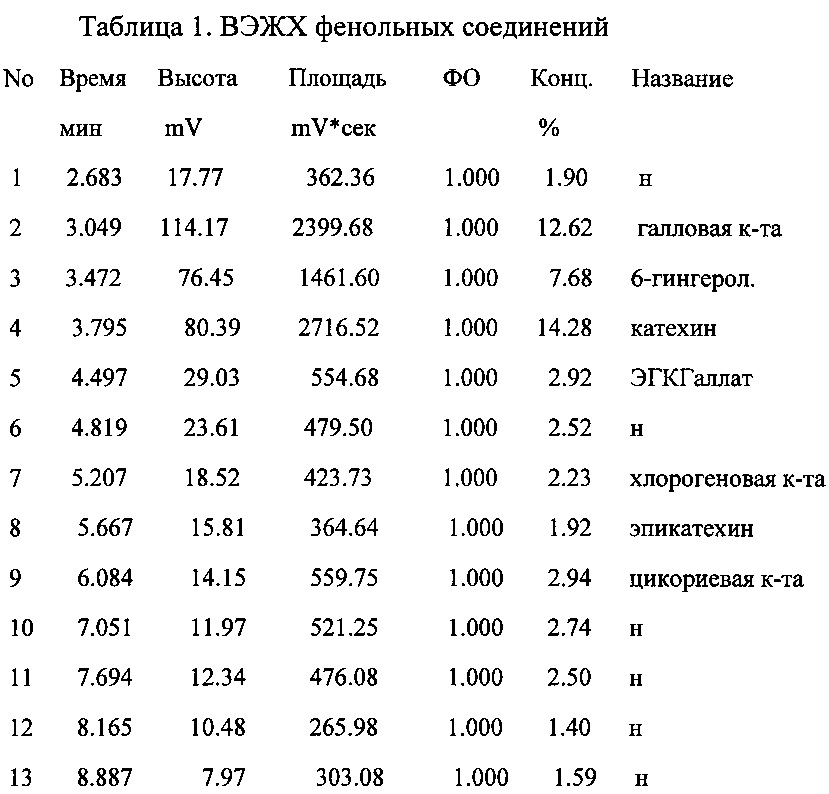
Фенольных соединений. Проводили на высокоэффективном жидкостном хроматографе фирмы «GILSTON», модель 305, ФРАНЦИЯ; инжектор ручной, модель RHEODYNE 7125 USA с последующей компьютерной обработкой результатов исследования с помощью программы Мультихром для «Windows». В качестве неподвижной фазы была использована металлическая колонка размером 4,6×250 мм Kromasil С 18, размер частиц 5 микрон. В качестве подвижной фазы метанол-вода-фосфорная кислота концентрированная, в соотношении 400:600:5. Анализ проводили при комнатной температуре. Скорость подачи элюента 0,8 мл/мин. Продолжительность анализа 60 мин. Детектирование проводилось с помощью УФ-детектора «GILSTON» UV/VIS модель 151, при длине волны 254 нм (табл. 1).
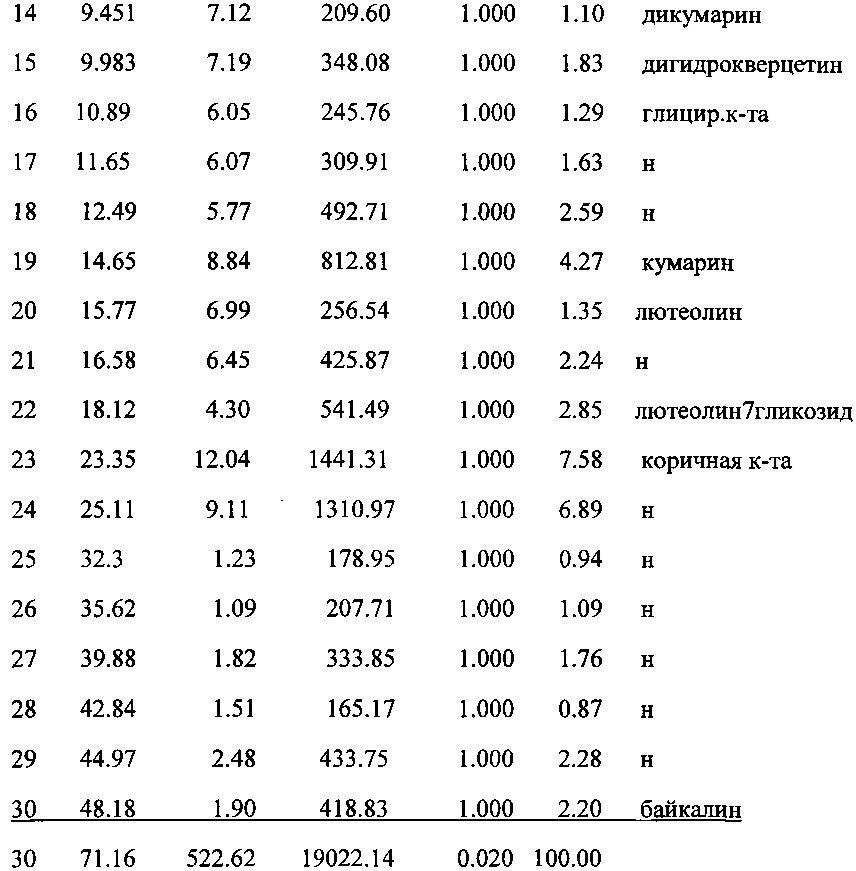
Определение аминокислот проводили на аминокислотном анализаторе марки ААА-339 (Чехия) (табл. 2, 3).


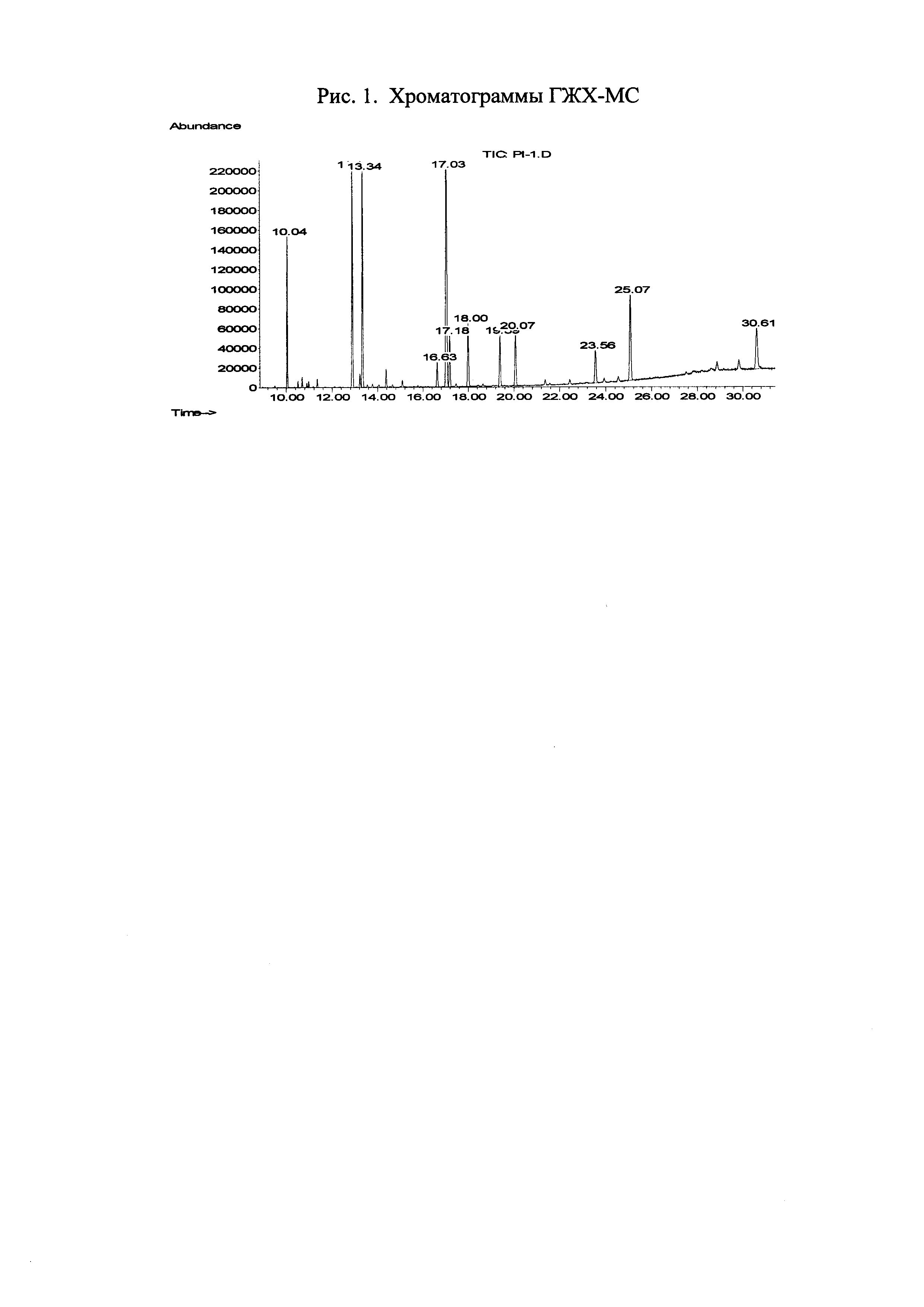
Определение эфирного масла. Эфирное масло выделяли методом перегонки с водяным паром в течение 4 часов (ГФ XI, вып. 1. С.290, метод 1). Полученное масло было исследовано методом хромато-масс-спектрометрии на газовом хроматографе Agilent 6890 с квадрупольным масс-спектрометром (MSD 5973N) в качестве детектора. Объем пробы - 1 мкл раствора с разделением потока 20:1. Качественный анализ основан на сравнении времен удерживания и полных масс-спектров по библиотеке хромато-масс-спектрометрических данных летучих веществ растительного происхождения. Процентное содержание компонентов эфирных масел вычисляли по площадям газо-хроматографических пиков без корректирующих коэффициентов (табл. 4).
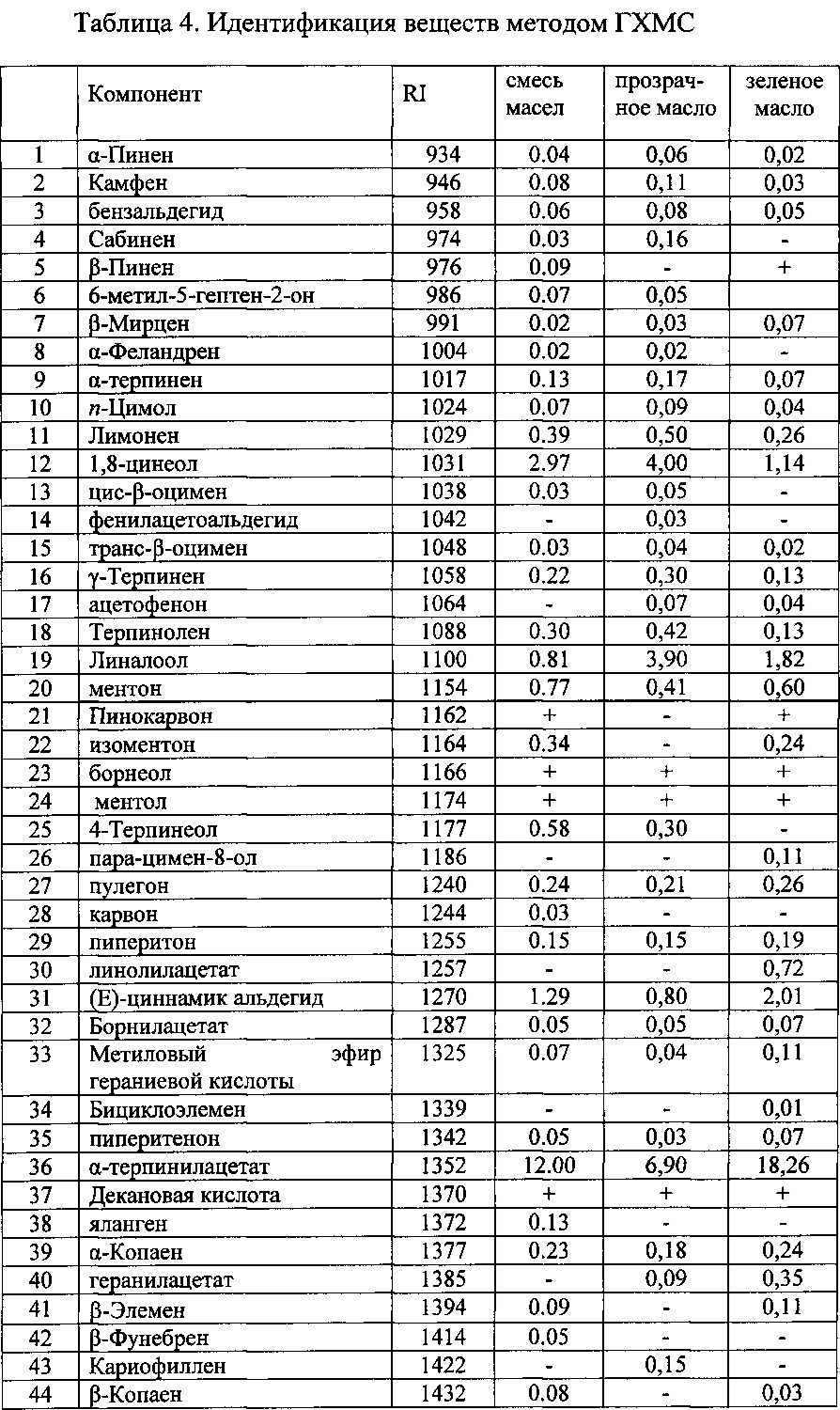
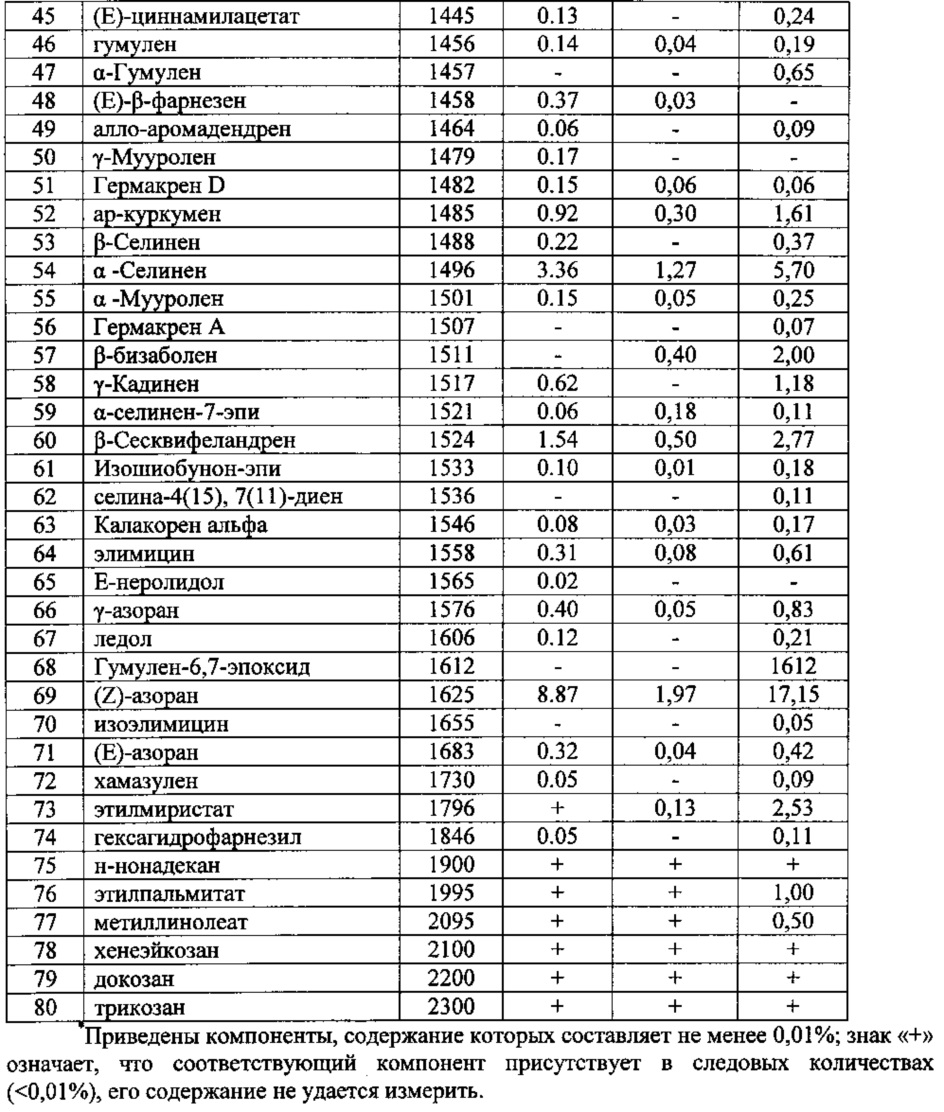
Определение метиловых эфиров жирных кислот в липидной фракции методом ГХМС. Анализ метиловых эфиров проводили методом газо-хромато-масс-спектрометрии на газовом хроматографе Hewlett-Packard 6890 с квадрупольным масс-спектрометрическим детектором HP 5973. Использовалась кварцевая колонка CP-Wax (неполярная фаза - полиэтиленгликоль) с внутренним диаметром 0,20 мм. Толщина пленки неподвижной фазы составляет 0,25 мкм. В качестве подвижной фазы использовали гелий марки «А». Качественный анализ основан на сравнении времен удерживания полных масс-спектров соответствующих чистых компонентов, представленных в машинном каталоге, стандартных смесей GLC-68D (Nu-Chek-Prep; Elysian, Minnesota, USA) (рис. 1, табл. 5).
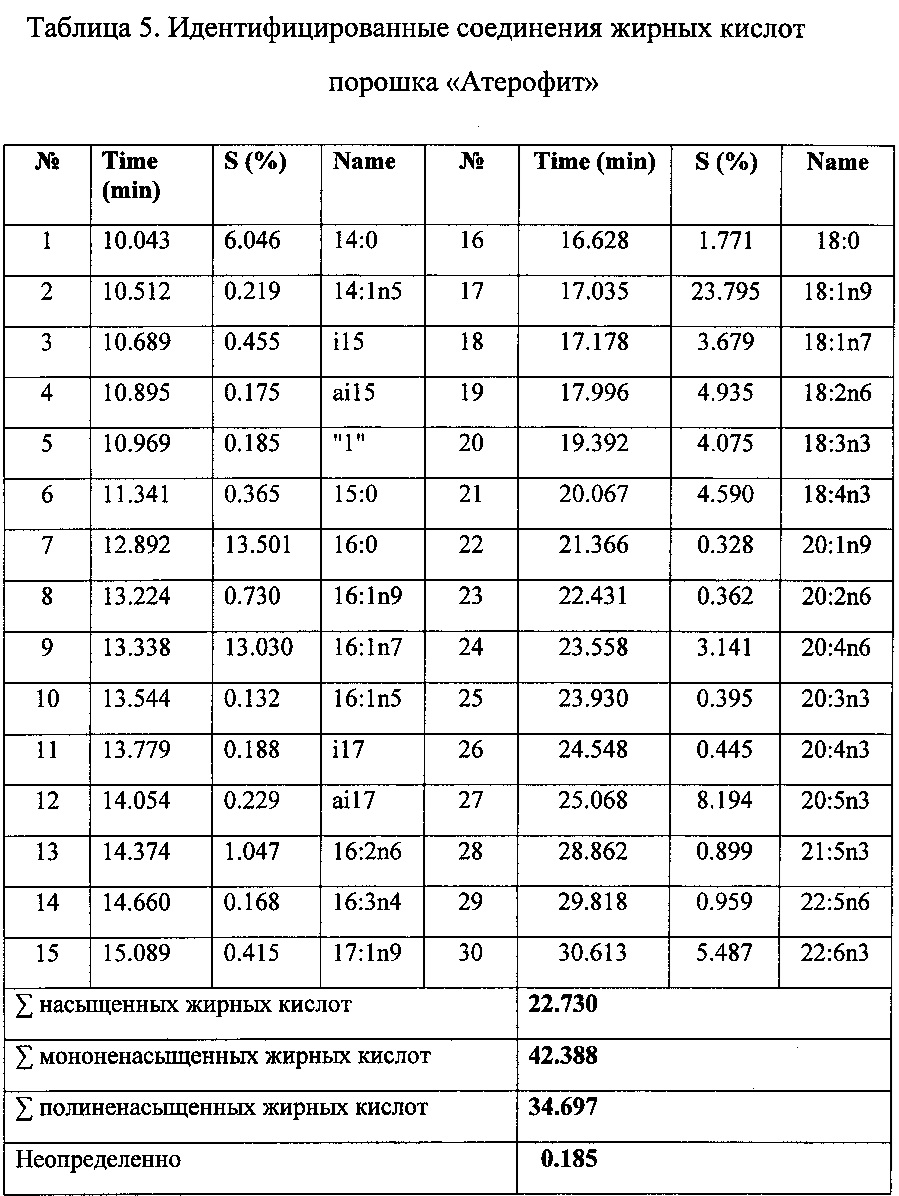
Методом ГХМС определено содержание около 30 высокомолекулярных жирных кислот. Как видно из полученных данных, в «Атерофит» входят незаменимые жирные кислоты такие как: линолевая (18:2n6), леноленовая (18:3n3), арахидоновая (20:4n6), эйкозапентаеновая (20:5n3) и докозагексаеновая (22:6n3) кислоты.
Определено количественное содержание основных БАВ в порошке «Атерофит»: флавоноидов - 4,14%; аминокислот - 1,68%; аскорбиновой кислоты - 0,87%; органических кислот - 1,72%; дубильных веществ - 5,9%; полисахаридов - 4,39%.
Другая, более современная, лекарственная форма выполнения заявляемого средства - желатиновые капсулы, содержащие порошок заявляемого состава.
Дозированные лекарственные формы (капсулы) отличаются высокой стабильностью, необходимой биодоступностью, удобны в применении пациентами, обладают одновременно корригированием и локализацией действия лекарственных препаратов в заданной области. Кроме того, они не требуют применения специальных технологий и аппаратуры. Одной из наиболее ответственных стадий при производстве капсул, является их наполнение. Необходимо учитывать тот факт, что капсульные машины работают по принципу полного засыпания объема капсулы, поэтому следует вводить наполнители для заполнения всего объема капсулы [7]. При разработке состава и технологии капсулированной формы основное внимание уделялось установлению соотношений лекарственных веществ, выбору вспомогательных веществ и стабильности средства.
Фармакологическое изучение порошка и капсул проведено в лаборатории экспериментальной фармакологии ИОЭБ СО РАН (зав. лаб.-д.м.н., профессор Николаев СМ.). Были установлены экспериментально-терапевтические дозы порошка «Атерофит» в капсуле. При разработке состава капсул учитывалось, что содержание их в одной капсуле должно соответствовать разовой дозе (500 мг). Исходя из анализа технических характеристик твердых желатиновых капсул, удобства по применению и имеющегося оборудования использовали капсулы №0. С целью оптимизации технологии приготовления капсул, учитывая увеличение массы капсулируемой смеси, в дальнейших исследованиях использовали
Для получения капсул смешивают порошок «Атерофит» и вспомогательные вещества при следующем соотношении компонентов, в граммах на капсулу:
Пример 2. Для получения лекарственного средства в форме капсул, заявленный состав берут в следующем количестве, в граммах на 100 г смеси: порошок «Атерофит» - 86,207 г; лактоза - 10,345 г; сахар-рафинад - 3,448 г. Смесь лактозы с сахар-рафинадом смешивают с 1/3 частью (28,735 г) порошка «Атерофит», при постоянном перемешивании добавляют оставшуюся часть порошка - тщательно перемешивают и увлажняют 29,3 89 г 5% раствора крахмального. Для равномерного распределения клейстера крахмального, его добавляют порциями. Увлажненную массу протирают (или продавливают) через сито с отверстиями диаметром 1 мм и сушат при температуре 50-60°C до остаточной влажности не более 3%, затем просеивают через сито и опудривают гранулированную массу порошка (гранулят) 0,497 г аэросила. Далее гранулят подают на полуавтоматическую капсульницу «Фетон» для первичного наполнения капсул. Для более полного (вторичного) наполнения капсул производят уплотнение (подпрессовку) гранулята в ней. Получают 346 готовых капсул. По 20 штук каждой серии отбирают на анализ по показателям: средняя масса содержимого капсул и отклонения от нее, распадаемость, качественное и количественное содержание действующих веществ.
Содержимое капсулы представляет собой гранулят коричневато-бордового цвета с ароматным запахом и слегка горьковатого вкуса. Полученный продукт - лекарственное средство проявляет гиполипидемическую, гепатозащитную и антиоксидантную активность и рекомендуется для комплексной терапии и профилактики нормализации холестеринового обмена и лечения атеросклероза.
Капсулы содержат различные группы биологически активных веществ, что и в исходной композиции, и стандартизованы по содержанию основных БАВ - флавоноидов и аминокислот. Разработана методика количественного определения суммы флавоноидов в пересчете на байкалин-стандарт в капсуле с применением метода прямой спектрофотометрии.
Методика 1. Аналитическую пробу содержимого 20 капсул тщательно перемешивают. Около 0,5000 г (точная навеска) аналитической пробы помещают в коническую колбу вместимостью 200 мл с резиновой пробкой, приливают 100 мл спирта 70%, взвешивают с погрешностью ±0,01 г и экстрагируют на магнитной мешалке без нагревания или на «вибрационном встряхивателе» в течение 1 часа. После экстракции колбу взвешивают и доводят до первоначальной массы спиртом 70%. Содержимое колбы фильтруют через бумажный фильтр, отбрасывая первые 10 мл фильтрата (раствор А). 1 мл раствора А помещают в мерную колбу вместимостью 25 мл и доводят объем раствора спиртом 70% до метки (раствор Б). Через 30 минут измеряют оптическую плотность раствора Б на спектрофотометре при длине волны 278 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют спирт 70%. Параллельно в тех же условиях измеряют оптическую плотность РСО байкалина (раствор Б). Содержание суммы флавоноидов в пересчете на байкалин-стандарт в капсуле в граммах (X) вычисляют по формуле:
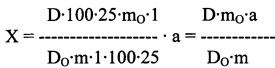
где D - оптическая плотность испытуемого раствора;
DO - оптическая плотность раствора РСО байкалина;
m - масса навески содержимого капсулы в граммах;
mO - масса РСО байкалина в граммах;
а - средняя масса содержимого капсулы в граммах. Метрологические характеристики методики представлены в таблице 6.

Относительная ошибка единичного определения с 95% вероятностью не превышает 4%. Содержание суммы флавоноидов в пересчете на байкалин должно быть от 7,796 мг до 9,528 мг, считая на среднюю массу содержимого одной капсулы.
Количественное определение свободных аминокислот в капсуле хроматоспектрофотометрическим методом.
Методика 2. Аналитическую пробу содержимого 20 капсул тщательно перемешивают. Около 1,0000 г (точная навеска) аналитической пробы помещают в коническую колбу вместимостью 200 мл с резиновой пробкой, приливают 100 мл спирта 30%, взвешивают с погрешностью ±0,01 г и экстрагируют на магнитной мешалке без нагревания или на «вибрационном встряхивателе» в течение 1 часа. После экстракции колбу взвешивают и доводят до первоначальной массы спиртом 30%. Содержимое колбы фильтруют через бумажный фильтр, отбрасывая первые 10 мл фильтрата (раствор А). В 2 пробирки вместимостью по 50 мл, помещают по 5 мл 0,1% спиртового раствора нингидрина, по 1 мл 0,25% раствора натрия карбоната;
3 мл раствора А прибавляют в 1 пробирку, во 2 - 1 мл 0,05% спиртового раствора глутаминовой кислоты и 2 мл воды очищенной. Пробирки нагревают на кипящей водяной бане в течение 15 мин, затем охлаждают под струей холодной воды. Содержимое пробирок количественно переносят в мерные колбы вместимостью по 25 мл, доводят объемы растворов спиртом 30% до метки, перемешивают. Измеряют оптическую плотность растворов на спектрофотометре при длине волны 567 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют спирт 30%.
Содержание суммы свободных аминокислот в пересчете на кислоту глутаминовую в капсуле в граммах (X) вычисляют по формуле:
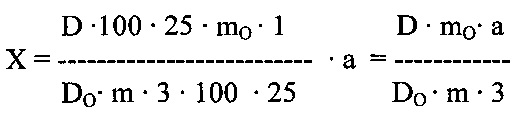
где: D - оптическая плотность испытуемого раствора;
DO - оптическая плотность раствора РСО кислоты глутаминовой;
m - масса навески содержимого капсулы в граммах;
mO - масса РСО кислоты глутаминовой в граммах;
а - средняя масса содержимого капсулы в граммах. Метрологические характеристики методики представлены в таблице 7.
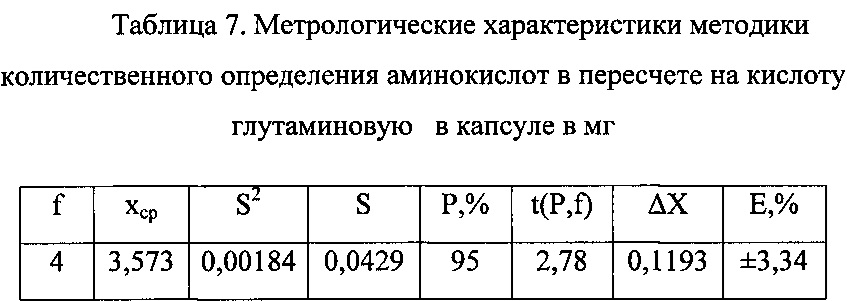
Относительная ошибка единичного определения с 95% вероятностью не превышает 4%. Содержание суммы аминокислот в пересчете на кислоту глутаминовую должно быть от 3,216 мг до 3,930 мг считая на среднюю массу содержимого одной капсулы.
Оценку качества предложенных капсул проводят по следующим показателям: средняя масса содержимого капсул, отклонение от средней массы содержимого капсул, распадаемость, количественное содержание и качественный состав флавоноидов и аминокислот (табл. 8).
Положительный эффект заключается в том, что лекарственное средство имеет высокую биологическую доступность, химическую и микробиологическую стабильность в течение срока годности - 2 года, возможность точного подбора дозы, простоту производственного процесса, а также портативность и удобство применения.
Гиполипидемическое, гепатозащитное и антиоксидантное действие лекарственного растительного средства «Атерофит»
Гиполипидемическое действие средства «Атерофит» при назначении атерогенной диеты крысам
Эксперименты выполнены на 50 белых крысах линии Wistar обоего пола с исходной массой 150-170 г. Экспериментальные исследования проводили в соответствии с Правилами Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 2002). Дизайн экспериментов одобрен этической комиссией Института общей и экспериментальной биологии СО РАН (протокол №151 от 13.02.2013).
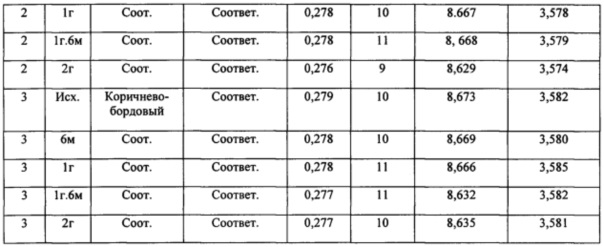
Экспериментальную гиперлипидемию вызывали у крыс путем назначения атерогенной диеты в течение 8 недель. Крысы ежедневно внутрижелудочно получали холестерин в дозе 0,1 г/100 г массы, 1 мл/100 г массы 3,5%-ной жирности молоко и 30000 ЕД/100 г витамина D2. «Атерофит» вводили ежедневно внутрижелудочно в форме водной взвеси в дозе 500 мг/кг в объеме 10 мл/кг на протяжении всего эксперимента (56 дней). Контрольная группа животных получала воду очищенную в аналогичных условиях в эквиобъемном количестве. Исследования проводили через 8 недель от начала эксперимента. При исследовании гиполипидемической активности лекарственного растительного средства «Атерофит» в сыворотке крови определяли содержание общего холестерина (ОХС), триацилглицеридов (ТГ), фракции β-липопротеидов (β-ЛП), холестерина липопротеидов высокой плотности (ХСЛПВП), холестерина липопротеидов низкой плотности (ХСЛПНП), холестерина липопротеидов очень низкой плотности (ХСЛПОНП), рассчитывали индекс атерогенности (ИА) и отношение ХСЛПНП к ХСЛПВП. Были использованы унифицированные лабораторные методы исследования с помощью диагностических биохимических наборов фирм «Ншпап», «OlvexDiagnosticum», «Roche», «Вектор Бест». Активность катал азы в сыворотке крови определяли спектрофотометрическим методом [13]. Концентрацию малонового диальдегида определяли по методу свободнорадикального окисления липидсодержащих компонентов крови [28]. Полученные в ходе экспериментов данные статистически обработаны с применением пакета прикладных программ «Ехе12003». Различия принимали значимыми с помощью критерия t - Стъюдента при вероятности 95% (Р≤0,05) [25]. Как следует из приведенной таблицы 9, назначение атерогенной диеты крысам сопровождается резким нарушением липидного обмена и спектра липопротеидов сыворотки крови. Так, у животных контрольной группы при назначении холестерина в смеси с молоком и витамином D2, содержание общего холестерина повышается на 40%, триацилглицеридов - в 2,2 раза, общих липидов сыворотки крови - на 15%, β-липопротеидов - в 2,2 раза. Наряду с этим, изменяется соотношение основных липопротеидов сыворотки крови: ХСЛПНП возрастает более чем в 5 раз, ХСЛПОНП - в 2,2 раза, индекс атерогенности - в 3,9 раза, отношение ХСЛПНП к ХСЛПВП - в 7,7 раза. Вместе с тем, содержание антиатерогенных липопротеидов (ХСЛПВП) снижается на 30%.
При курсовом назначении испытуемого средства «Атерофит» в крови лабораторных животных содержание общего холестерина снижается на 25%, триацилглицеридов - в 3,5 раза, общих липидов - на 26%, β-липопротеидов - в 3,1 раза. Также нормализуется соотношение отдельных липопротеидов:
содержание ХСЛПНП снижается на 50%, ХСЛПОНП - в 3,5 раза, индекс атерогенности - на 60%, соотношение наиболее атерогенных липопротеидов к антиатерогенным липопротеидам - в 2,5 раза. Содержание ХСЛПВП повышается на 24%. В более выраженной степени гиполипидемическое действие испытуемое средство оказывает в отношении содержания наиболее атерогенных липопротеидов - ХСЛПНП. Также указанное средство в заметной степени снижает содержание общих липидов и общего холестерина в сыворотке крови.
При назначении лабораторным животным атерогенной диеты содержание МДА в сыворотке крови возрастает в 2 раза по сравнению с данными у интактных животных, а активность каталазы снижается на 54%. Курсовое введение «Атерофит» крысам с экспериментальной гиперлипидемией сопровождается снижением уровней МДА на 34%, а активность каталазы сыворотки крови возрастает на 73% по сравнению с показателями в контроле.
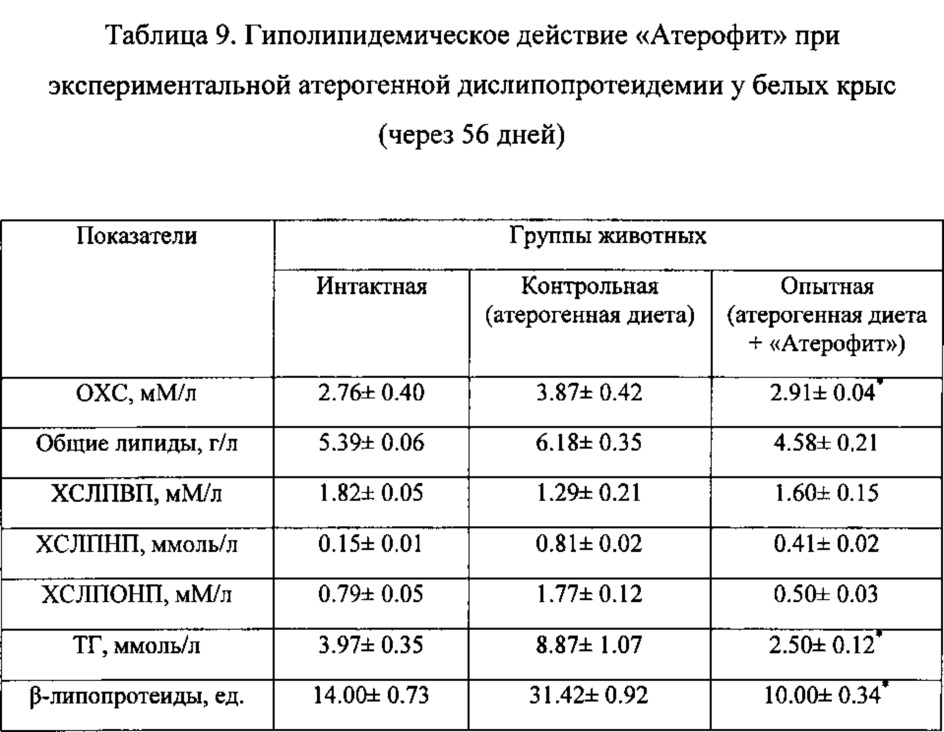

Таким образом, средство «Атерофит» при экспериментальной дислипопротеидемии, вызванной холестериновой диетой (атерогенная диета), обладает выраженным гипохолестеринемическим и гиполипидемическим действием, в значительной степени снижает содержание в крови наиболее атерогенных липопротеидов и триацилглицеридов и индекс атерогенности сыворотки крови. Вместе тем, «Атерофит» способствует повышению концентрации в крови липопротеидов высокой плотности, которые обладают антиатерогенной активностью. Наряду с этим, указанное средство повышает антиокислительный потенциал организма и препятствует избыточному накоплению продуктов переокисления фосфолипидов мембран в тканях и органах.
Фармакотерпевтическая эффективность средства «Атерофит» при повреждении печени крыс этанолом
Эксперименты выполнены на 54 белых крысах линии Wistar обоего пола массой 160-210 г. Животные находились в стандартных условиях содержания в виварии Института общей и экспериментальной биологии СО РАН на обычном для указанного вида животных рационе при свободном доступе к воде и пище. Эксперименты проводили в соответствии с требованиями Всемирного общества защиты животных (WSPA) и Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 2002). Повреждение печени крыс этанолом вызывали внутрижелудочным введением 40% водного раствора этилового спирта в объеме 7 мл/кг в течение 14 дней, 1 раз в сутки. Животным вводили средство «Атерофит» в экспериментально-терапевтической дозе 500 мг/кг в объеме 10 мл/кг 1 раз в сутки на протяжении всего эксперимента. В качестве контроля служили крысы, которым вводили воду очищенную в аналогичных условиях в соответствующих объемах. Исследования проводили через 7 и 14 сутки от начала эксперимента. Концентрацию ТБК-активных продуктов в гомогенате печени определяли спектрофотометрическим методом [26]. Активность индикаторных ферментов цитолитического и холестатического синдромов: аланинаминотрансферазы (АлТ) и аспартатаминотрансферазы (АсТ), щелочной фосфатазы (ЩФ), а также концентрацию β-липопротеидов, общего, прямого и непрямого билирубина, холестерина, общего белка в сыворотке крови определяли с использованием стандартных наборов реактивов ЗАО «Вектор-Бест» (Новосибирск).
Желчеобразовательную и желчевыделительную функцию печени оценивали по скорости секреции и общему количеству выделенной желчи, в которой определяли содержание основных ее ингредиентов: желчных кислот, билирубина и холестерина [23]. Полученные в ходе экспериментов данные статистически обработаны с применением пакета прикладных программ «Биостат 2006».
При курсовом введении крысам «Атерофит» наблюдали торможение процессов ПОЛ: содержание МДА в гомогенате печени крыс снижалось на 7, 14 сутки на 38 и 35% соответственно по сравнению с данными в контроле. Наряду с этим, в гораздо меньшей степени проявлялись признаки развития синдромов цитолиза и холестаза. В частности, происходило снижение активности трансаминаз, щелочной фосфатазы, содержания билирубина и холестерина в сыворотке крови по сравнению с показателями у крыс, получавших этанол и воду (табл. 10).
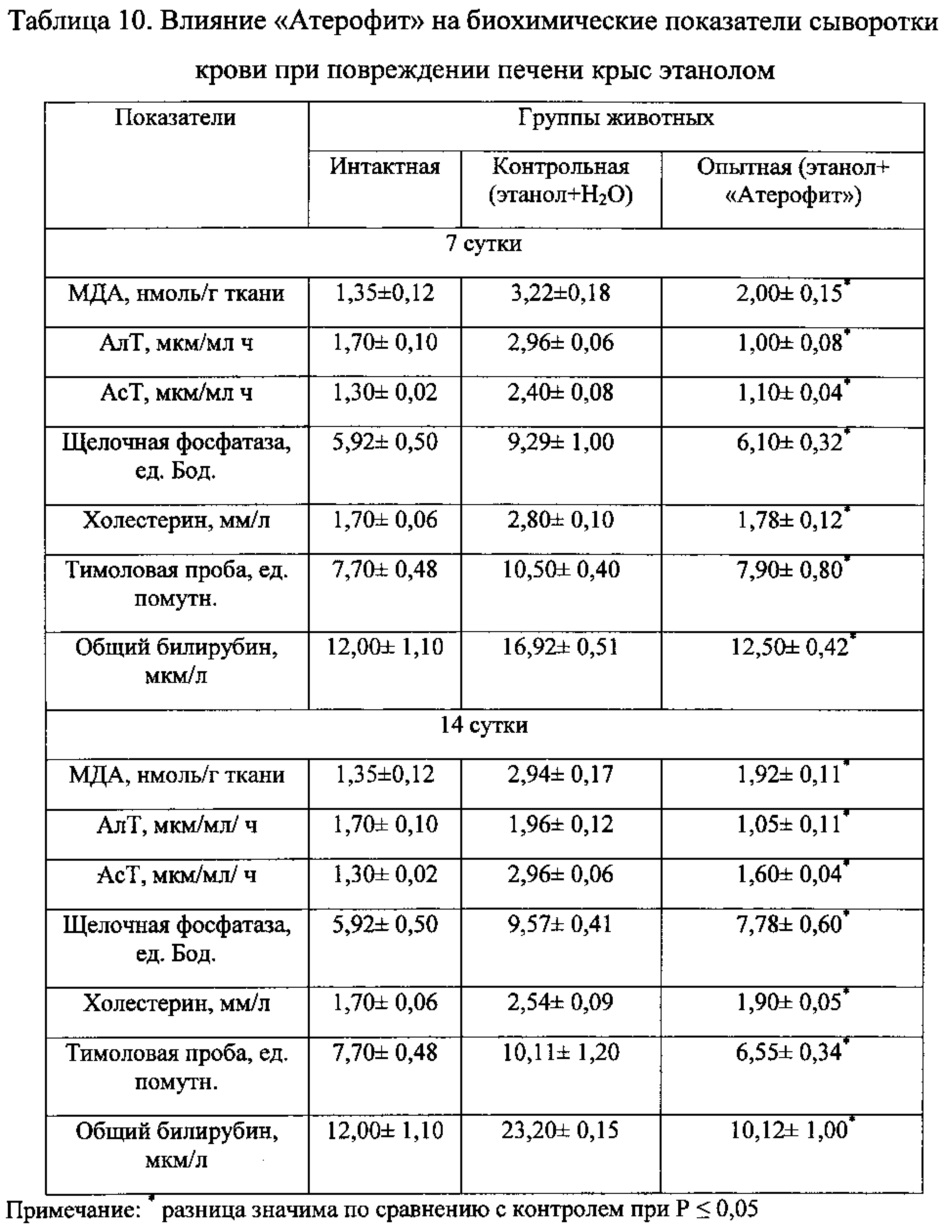
Введение крысам «Атерофит» сопровождалось умеренным повышением скорости секреции желчи. Наиболее выраженное воздействие «Атерофит» оказывал на содержание основных ингредиентов желчи у крыс с повреждением печени этанолом. В частности, через 7 суток концентрация желчных кислот, билирубина и холестерина в желчи под влиянием указанного фитосредства повышались в 1,7 раза, на 55 и 33% соответственно по сравнению с контролем (табл. 11, 12).
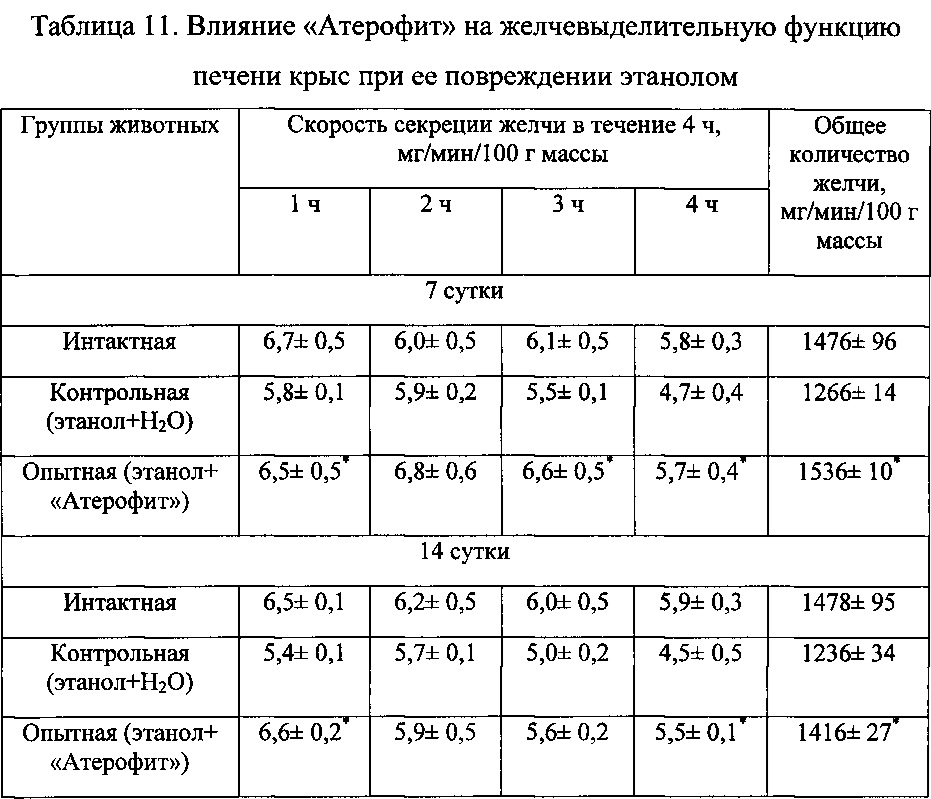
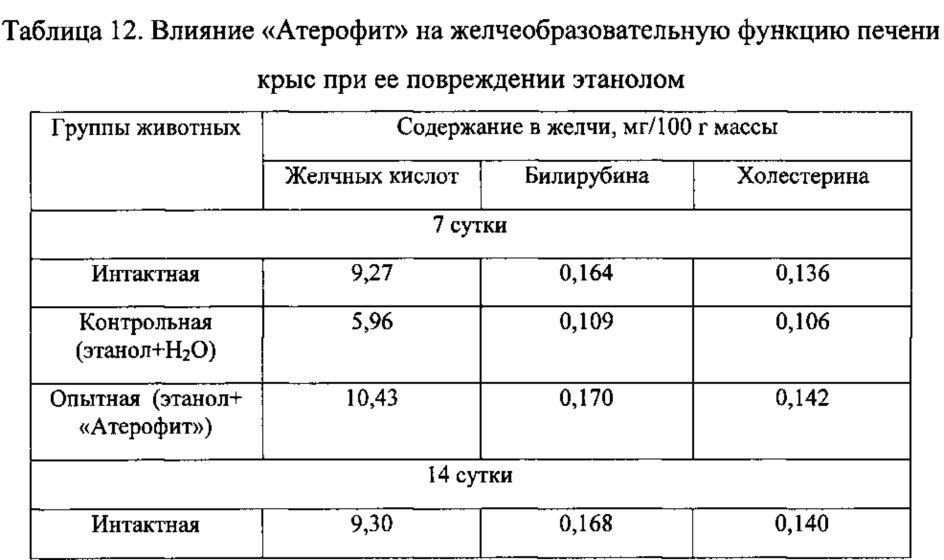
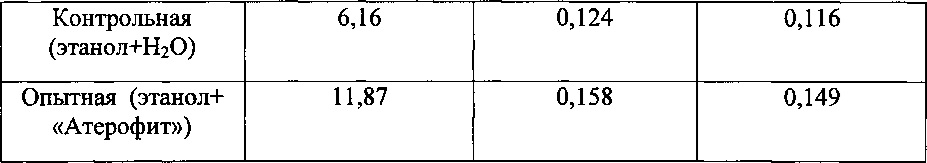
Таким образом, лекарственное средство «Атерофит» при повреждении печени крыс этанолом снижает уровень содержания продуктов перекисного окисления липидов в печени и предупреждает развитие синдромов цитолиза и холестаза. Отличительной особенностью является то, что указанное средство оказывает выраженное влияние на синтез желчных кислот в печени и способствует их ускоренному выведению с желчью.
Определение антиоксидантной активности средства «Атерофит». Антирадикальная активность по отношению к супероксидным радикалам. Связывание супероксидных радикалов (ССР) определяли по методу Chen с соавторами, в котором продукция О2 осуществлялась в неэнзиматической системе феназинметосульфат - НАДФ с последующей спектрофотометрической регистрацией количества окисленного тетразолия нитросинего. В качестве препаратов сравнения использовали рутин и кверцетин (Sigma) [35]. Полученные данные приведены в таблице 13.
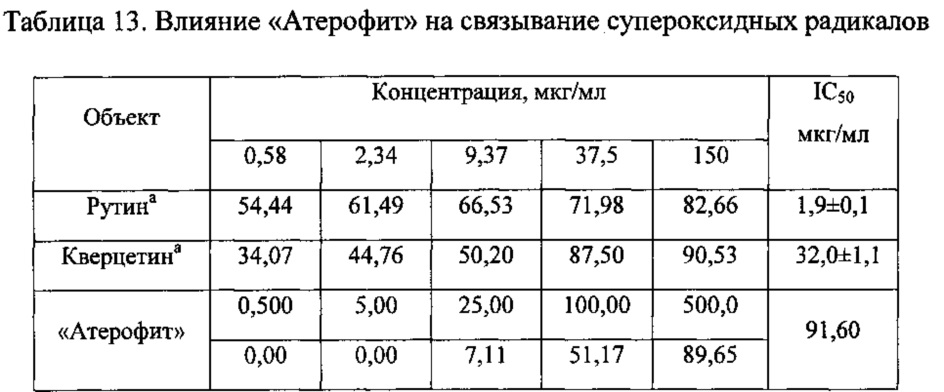
Как следует из данных приведенных в таблице 13, уровень связывания супероксидных радикалов увеличивается при повышении концентрации исследуемого фитосредства в инкубационной среде. При этом «Атерофит» обладает выраженной активностью в отношении связывания молекул О2•- (IC50=91,6 мкг/мл).
Антирадикальная активность «Атерофит» в отношении связывания молекул оксида азота (NO)
Связывание NO(CNO) определяли по методу Goyindarajan со соавторами, заключающийся в связывании веществом (препаратом) NO нитропруссида натрия с последующей спектрофотометрической регистрацией остаточного содержания NO реактивом Грисса [36].
Полученные результаты подвергали логарифмированию по концентрационной шкале с последующим регрессионным анализом и определением величины 50% связывания NO (IC50). В качестве препаратов сравнения использовали рутин (Sigma) и кверцетин (Sigma) [36]. Полученные данные приведены в таблице 14.
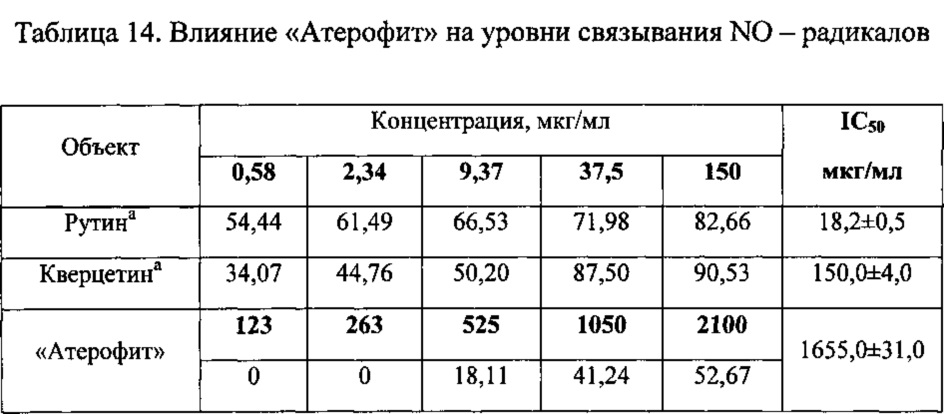
Как следует из данных, приведенных в таблице 14, исследуемое фитосредство обладает антирадикальной активностью по отношению к NO-радикалам. Показано, что «Атерофит» обладает умеренной активностью в отношении связывания NO-радикалов (IC50=1,65 мг/мл).
Антирадикальная активность «Атерофит» в отношении связывания DPPH-радикала
Использование 2,2-diphenyl-l-picrylhydrazyl (DPPH) радикала в определении антирадикальной активности является безсубстратным методом. В присутствии донора водорода 2,2-diphenyl-1-picrylhydrazyl восстанавливается с утратой специфической окраски.
Изучение DPPH-теста проводилось спектрофотометрическим методом со спиртовым раствором радикала DPPH при длине волны 520 нм. В результате статических испытаний измерения были проведены через 30 мин и построены кривые зависимости процентного ингибирования радикалов DPPH от концентрации исследуемых средств. В качестве препарата сравнения использовали Ионол (Sigma) [37].
Одним из основных показателей, характеризующих антирадикальную активность по методу DPPH, является IC50 - концентрация исследуемого фитосредетва, при которой наблюдается 50%-е ингибирование радикалов DPPH (табл. 15).
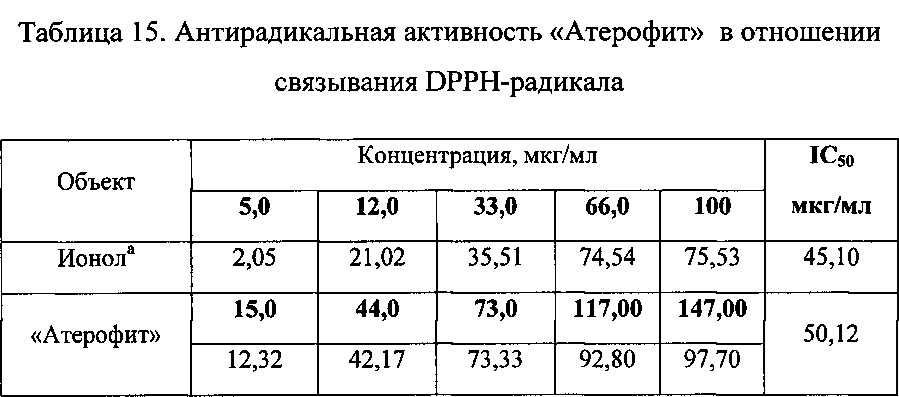
Как следует из данных, приведенных в таблице 15, исследуемое средство «Атерофит» обладает выраженной антирадикальной активностью по отношению к DPPH-радикалам (IC50=50,12 мкг/мл), сопоставимой с таковой препарата сравнения - ионола (IC50=45,10 мкг/мл).
С увеличением концентрации исследуемого средства антирадикальная активность возрастает.
Определение Fe2+ - хелатирующей активности «Атерофит» в модельной системе
Исследование проведено с использованием метода, основанного на способности исследуемого вещества связывать ионы железа (Fe2+) [19].
Fe2+-хелатирующую активность испытуемого средства выражали в процентах по отношению к контролю, значения которого принимали за 100%. Полученные данные приведены в таблице 16.
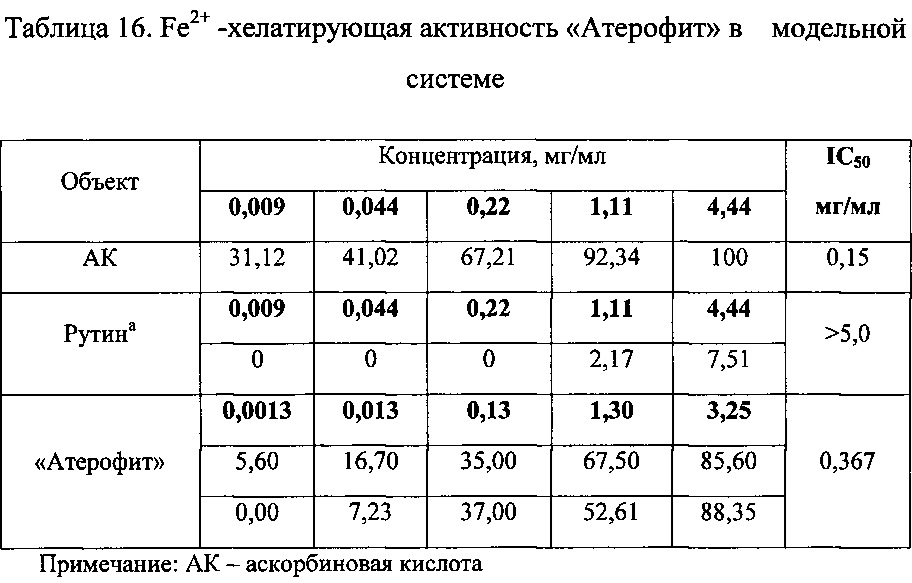
В результате проведенных исследований установлено, что лекарственное растительное средство «Атерофит» обладает выраженной хелатирующей активностью в отношении металла переменной валентности Fe2+ (IC50=0,367 мг/мл), превосходящей таковую веществ сравнения. Для препарата сравнения (аскорбиновой кислоты) данный показатель составил 0,15 мг/мл (IC50=15).
Источники информации:
1. Атлас лекарственных растений России. Всероссийский научно-исследовательский институт лекарственных и ароматических растений (ВИЛАР). - Москва, 2006. - 345 с.
2. Бетацианины корнеплодов красной столовой свеклы. Саенко И.И., Тарасенко О.В., Дейнека В.Е., Дейнека Л.А.- Научные ведомости. Серия. Естественные науки. - 2012, №3 (122), вып. 18. Стр. 195-200.
3. Гальцев Ю.И. Социально-гигиеническое исследование особенностей смертности населения трудоспособного возраста в крупном регионе Сибири: дисс. на соиск. уч. степени кан. мед. наук. Новосибирск, 2013.-147 с.
4. Государственная фармакопея СССР XI изд., вып.2. - Общие методы анализа. Лекарственное растительное сырье. - М., Медицина. - 1990. - 398 с.
5. Даргаева Т.Д., Николаева Г.Г. и др. Исследования яблони ягодной, произрастающей в Бурятии. // Изучение препаратов природного и синтетического происхождения. Ч. 2. - Томск: Изд. Томского университета, 1978.
6. Дубровин И. Все об обычной свекле. Свекла - «Кубышка полезных веществ». - М., 2000. - Изд-во Эксмо-Пресс. Глава IV. Целительные свойства свеклы.
7. Дудкин Р.В. Технология получения капсулированной формы фитопрепарата «Секрет молодости» для геронтологической практики: дисс.… канд. фарм. наук. - Москва, 2006.- 192 с.
8. Иванова Е.В., Сорокопудов В.Н., Сорокопудова О.А. Качество плодов видов рода MALUS (L.) MILL. При интродукции в условиях Белгородской области // Современные проблемы науки и образования. - Раздел. Биологические науки. - 2014. - №4.
9. Исландский мох как перспективный источник пищевого сырья.
С.В. Брюхова, М.Б. Данилов. - Молодые ученые Сибири: Материалы Всероссийской молодежной научно-технической конференции. - Улан-Удэ: Изд-во ВСТГУ, 2008. - С.175-176.
10. Камфора. http://dic.academic.ru/dic.nsf/meditem/780.
https://health.mail.ru/drug/camphor/#pharmacologic influence.
11. Каухова И.Е. Новая методика получения растительных препаратов. // Фармация.-2006. - №1. - С.37-39.
12. Климов А.Н., Никульчева Н.Г. Липиды, липопротеиды и атеросклероз. - Санкт-Петербург: Питер. 1995. - 264 с.
13. Королюк М.А., Иванова Л.И., Майорова И.Г. Методы определения активности каталазы // Лабор. дело. - 1988. - №1. - С.16-19.
14. «Кунпан-Дудзи». Рецептурный справочник тибетской медицины. М. - 2008. - №290. С.62.
15. Кургузова К.С. Комплексное использование столовой свеклы в специализированных продуктах питания для профилактики железодефицитной анемии и оценка их потребительских свойств: автореф. дисс. … канд. тех. наук. - Краснодар, 2013. - 21 с.
16. Лекарственные растения Сибири / Минаева В.Г.- 5-е изд. перераб. и доп. -Новосибирск: Наука. Сиб. отделение, 1991. - 431 с.
17. Лекарственное сырье растительного и животного происхождения. Фармакогнозия: уч. пособие / под ред. Г.П. Яковлева. - СПб.: СпецЛит. Санкт-Петербург, 2006. - 845 с.
18. Медицинский вестник, http://mymedlife.ru/content/kaltsiya-karbonat.
19. Олейников Д.Н., Зилфикаров И.Н., Торопова А.А, Ибрагимов Т.А. Химический состав сока каллизии душистой (Callisia fragranswood) и его антиоксидантная активность (invitro). // Химия растительного сырья. - 2008. - №4. - С.95-100.
20. Пищевые растения в тибетской медицине / Т.А. Асеева, Ц.А. Найдакова. - 3-е изд., исправ. и доп. - Новосибирск: Наука. Сиб. отд., 1991. - 129 с.
21. Покровский Б. Свекла вместо лекарств. Лечение свеклой. - М.: ООО «АСС-Центр», ООО «ТехКомпани», 4-е изд., 2010. - 96 с.
22. Почему растения лечат / М.Я. Ловкова, A.M. Рабинович, С.М. Пономарева, Г.Н. Бузук, СМ. Соколова. - М.: Наука, 1990. - 256 с.
23. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - М., 2005. - 832 с.
24. Сафонова М.Ю., Саканян Е.И., Лесиовская Е.Е. Cetraria islandica (L) Ach. Химический состав и перспективы применения в медицине // Растительные ресурсы. - 1999. - Т. 35. - №. - С.106-115.
25. Сергиенко В.И., Бондарева И.Б. Математическая статистика в клинических исследованиях. - М., 2001. - 256 с.
26. Стальная И.Д., Гаришвили М.Д. Метод определения малонового диальдегида с помощью тиобарбитуровой кислоты / Современные методы в биохимии. - М., 1977. - С.66-68.
27. Телятьев В.В. Полезные растения Центральной Сибири.- Иркутск: Восточно-Сибирское книжное изд-во, 1985. - Стр. 138; 274-275.
28. Темирбулатов Р.А., Селезнев Е.И. Метод повышения интенсивности свободнорадикального окисления липидсодержащих компонентов крови и его диагностическое значение // Лаб. дело. - 1981. - №4. - С.209-211.
29. Тибетская рецептура в традиционной монгольской медицине. Э.Г. Базарон, С.М. Баторова. - Изд-во БНЦ СО РАН. - Улан-Удэ, 2002. - 163 с.
30. Томпсон Г. Р. Руководство по гиперлипидемии. MSD. 1991. 255 с.
31. Тропические и субтропические лекарственные растения / Д.А. Муравьева, А.Ф. Гаммерман. - М., Медицина, 1974. - 231 с.
32. Чазов Е.И., Климов А.Н. «Дислипопротеидемия и ишемическая болезнь сердца». - М., 1980.
33. Чехирова Г.В., Асеева Т.А. Яблоня ягодная (Malus baccata (L.) Borkh) как заменитель тибетского растительного сырья эмблики лекарственной (Emblica officinalis Gaertn) // Тибетская медицина Бурятии - достояние России: Тезисы конференции, посвященной 10-летию Центра восточной медицины МЗ Республики Бурятия. - Улан-Удэ, 2000. - С.45-47.
34. «Чжуд-Ши». Канон тибетской медицины. Перевод с тибетского Д.Б. Дашиева. - М.: Изд-во «Восточная литература» РАН. - 2001.- 766 с.
35. Chen A.-S., Taguchi T., Sakai K., Kikuchi K., Wang M.-W., Miwal. Antioxidantactiviti esofchitibioseandchititriose // ological&PharmaceuticalBulletin. - 2003. - V. 26. - P. 1326-1330.
36. Govindarajan R., Rastogi S., Vijayakumar M. Studies on the antioxidant activities of Desmodium gagenticum // Biological & Pharmaceutical Bulletin. - 2003. - V. 26. - P. 1424-1427.
37. Seyoum A., Asres K., El-Fiky F.K. Structure-radicals cavenging relation shipsof flavonoids // Phytochemistry. - 2006. - Vol.67. - N 18. - P. 2058-2070.
Реферат
Изобретение относится к области медицины и фармакологии, в частности к области средств растительного происхождения с широким спектром фармакологического действия, и раскрывает средство, обладающее гиполипидемическим, гепатозащитным и антиоксидантным действием. Средство характеризуется тем, что оно содержит порошок лекарственных и пищевых растений, а также кальция глюконат и камфору при определенном соотношении компонентов. Указанное средство может быть использовано как в виде порошка, так и в форме капсул. Средство и капсулы на его основе могут быть использованы в комплексной терапии и профилактике атеросклероза, ишемической болезни сердца (ИБС), гипертонической болезни, сахарного диабета, ожирения различной степени, при нарушениях липидного и углеводного обмена, а также в гериатрической практике. 16 табл., 1 ил., 2 пр.

Комментарии