Фармацевтическая композиция и ее применение - RU2786387C2
Код документа: RU2786387C2
Чертежи

Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области медицины, в частности к фармацевтической композиции и ее применению.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Сердечная недостаточность, которая для краткости называется «HF», относится к ситуации, в которой венозный отток не может осуществляться из сердца полностью вследствие нарушений систолической функции и/или диастолической функции сердца, что приводит к застою крови в венозной системе и недостаточной перфузии крови в артериальной системе и впоследствии приводит к синдрому нарушения сердечного кровообращения, который проявляется в виде застоя крови в легких и застоя крови в полой вене. Сердечная недостаточность является конечной стадией развития заболевания сердца, а не отдельным заболеванием. Сердечная недостаточность чаще всего начинается с левожелудочковой недостаточности, а именно в первую очередь проявляется в виде застоя крови в легких.
Сердечную недостаточность можно разделить на систолическую сердечную недостаточность и диастолическую сердечную недостаточность в соответствии с различием во фракции выброса левого желудочка (LVEF). Эпидемиологические исследования показали, что от 40% до 71% пациентов с хронической сердечной недостаточностью характеризуются диастолической сердечной недостаточностью (DHF), которая встречается главным образом у пожилых людей, женщин и людей с высоким кровяным давлением и/или сахарным диабетом.
В Руководстве по сердечной недостаточности, опубликованном в 2008 году Европейским кардиологическим обществом (ESC), DHF называется сердечной недостаточностью с сохраненной фракцией выброса левого желудочка (HF-PEF). В течение длительного времени в клинической работе больше внимания уделяли левожелудочковой систолической сердечной недостаточности. Пациенты с сердечной недостаточностью с нормальной фракцией выброса левого желудочка составляют приблизительно 50% от общего числа пациентов с сердечной недостаточностью. Прогноз при сердечной недостаточности с нормальной фракцией выброса левого желудочка не лучше, чем при систолической сердечной недостаточности, и частота внезапной смерти от нее является высокой.
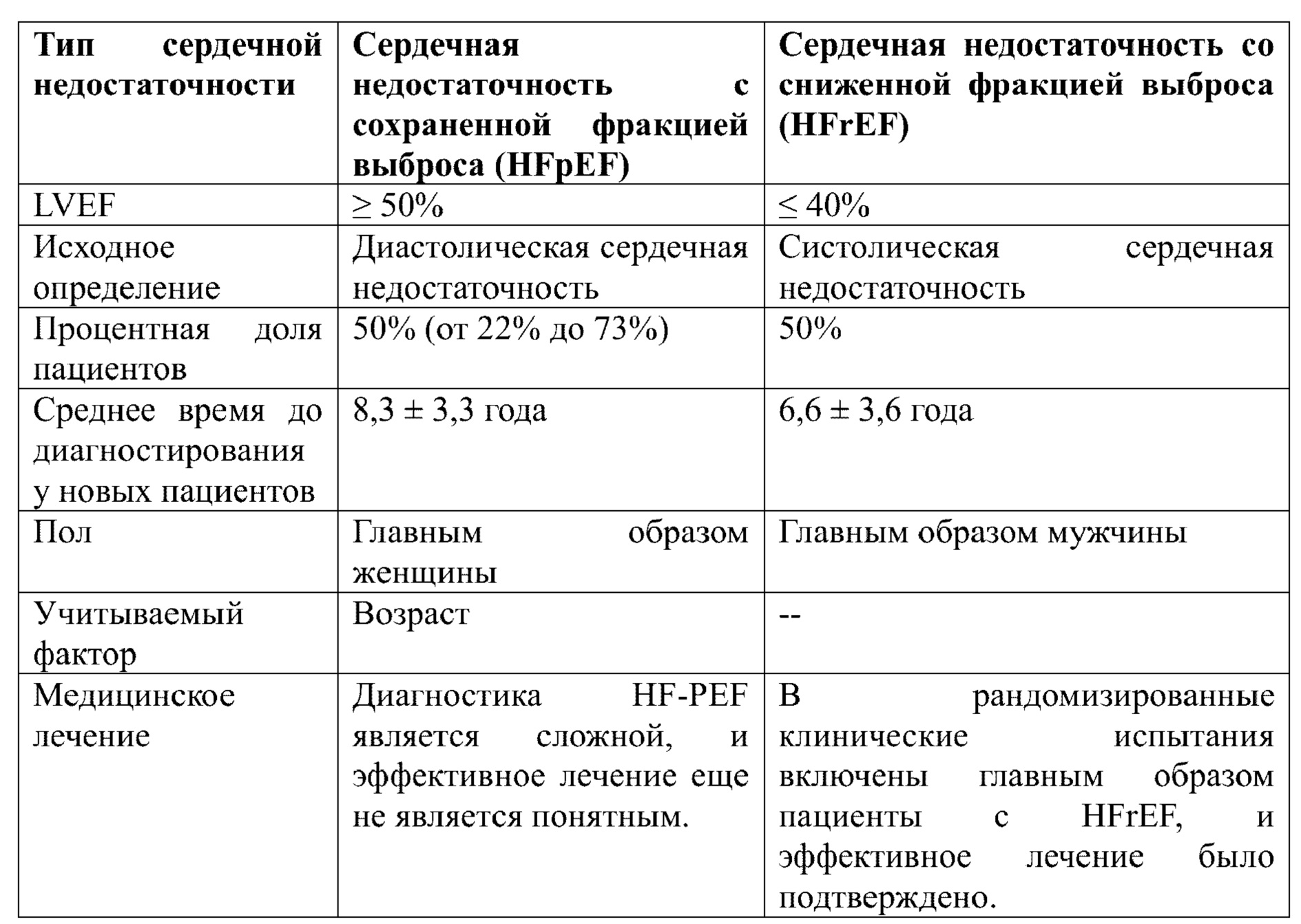
Сердечная недостаточность с сохраненной фракцией выброса левого желудочка вызвана нарушением способности к активному расслаблению желудочков во время диастолы и нарушением наполнения левого желудочка во время диастолы в результате увеличения жесткости миокарда, и частота встречаемости сердечной недостаточности этого типа растет в последние годы. Поскольку сердечная недостаточность с сохраненной фракцией выброса левого желудочка часто встречается клинически при ранней сердечной недостаточности и раньше, чем сократительная дисфункция, она замедляет течение и прогрессирование HF-PEF и может уменьшать выраженность боли у пациента и снижать финансовое бремя пациента.
Современные виды лечения HF-PEF включают активный контроль кровяного давления, коррекцию фибрилляции предсердий, контроль желудочкового ритма при фибрилляции предсердий и применение диуретиков, ACEI, β-адреноблокаторов для устранения гипертрофии левого желудочка и улучшения диастолической функции. Тем не менее, в клинической практике, у некоторых пациентов эффекты после вышеуказанных видов лечения по-прежнему являются неудовлетворительными, что приводит к значительному снижению качества жизни.
Производные фенолокислот в качестве лекарственных средств традиционной китайской медицины широко распространены в лекарственных растениях, например, жимолости (Lonicera japonica Thunb.), корне Rubus craiaegifolius (Rosaceae), одуванчике и Erigeron breviscapinus (Compositae), Salvia officinalis (Labiatae), Canarium bengalense (Burseraceae), а также Angelica sinensis (Umbelliferae) и корневище Ligusticum chuanxiong и т.д. Все больше внимания уделялось видам фармакологической активности, которые были обнаружены у производных фенолокислот в этих растениях, например, захвату свободных радикалов, противовоспалительной, противовирусной, иммунорегуляторной, антикоагулянтной и противоопухолевой активности и т.д.
Обычно производные фенолокислот подразделяются на следующие категории: фенолокислоты на основе бензойной кислоты, например, из Dioscorea bulbifera L. и одуванчика; фенолокислоты на основе коричной кислоты, например, феруловая кислота, главный биологически активный компонент в водорастворимом экстракте Angelica sinensis, корневища Ligusticum chuanxiong и одуванчика; литоспермовая кислота, выделенная из Salvia miltiorrhiza Bunge (сем. Labiatae); фенолокислоты на основе фенилуксусной кислоты, например, пара-гидроксифенилуксусная кислота, обнаруживаемая в одуванчике и плодах Forsythia suspensa.
Таншинон, также известный как общий таншинон, является бактериостатическим жирорастворимым фенантрахиноном, экстрагируемым из даншена, лекарственного средства традиционной китайской медицины (корня Salvia miltiorrhiza Bunge, семейство Labiatae). Было идентифицировано более 10 соединений, в том числе таншинон I, таншинон IIА, таншинон IIВ, криптотаншинон и изокриптотаншинон и т.д. При этом подтверждено, что 5 соединений - криптотаншинон, дигидротаншинон II, гидрокситаншинон, метилтаншинат и таншинон IIВ - обладают антибактериальным эффектом, а также противовоспалительным эффектом и эффектом понижения температуры. Натриевая соль сульфоната таншинона IIА - продукт сульфирования таншинона IIА - является водорастворимой, и клинически доказано, что она обладает значительным эффектом при лечении стенокардии и незначительными побочными эффектами. Из нее было разработано новое лекарственное средство для лечения ишемической болезни сердца (CHD). У общего таншинона было обнаружено множество эффектов антибактериального действия, уменьшения воспаления, активизации кровообращения для рассеивания застоя крови и содействия заживлению ран, и после его длительного введения значительные побочные эффекты не наблюдались.
Сапонин представляет собой глюкозид, который содержит тритерпеновые или спиростановые агликоны и распространен главным образом в наземных высших растениях. Основные активные компоненты различных китайских трав, таких как женьшень, ширококолокольчик и володушка, включают сапонин. Сапонин обладает биологической активностью противоракового действия, ингибирования пролиферации опухолевых клеток, индуцирования апоптоза, влияния на передачу сигнала в раковых клетках и ингибирования ангиогенеза в опухоли и метастазирования опухолевых клеток. Кроме того, сапонин обладает эффектами снижения уровня сахара в крови и уровня липидов в крови, противовирусным и иммунорегуляторным действием, что становится очень популярным предметом исследований в нашей стране и за рубежом.
Флавоноиды, изначально относящиеся к классу соединений на основе 2-фенилхромона, теперь обычно относятся к классу химических веществ с двумя бензольными кольцами, соединенными друг с другом посредством трехуглеродной цепи между ними. Основные природные флавоноиды можно классифицировать в зависимости от степени окисления трехуглеродной цепи между кольцом А и кольцом В, положения присоединения кольца В и от того, образует ли трехуглеродная цепь кольцо, и других характеристик. Флавоноиды представляют собой класс вторичных метаболитов растений и обладают различными видами биологической активности, такими как антиоксидантная, антиангиогенная, противовоспалительная, противовирусная активность, активность снижения уровня сахара в крови и уровня липидов в крови, противоостеопоротическая активность. Они широко распространены в овощах, фруктах и других растениях. Исследования показали, что при потреблении рациона, богатого флавоноидами, снижается риск рака ободочной кишки, рака предстательной железы, рака молочной железы и других видов рака.
Эфирные масла как лекарственные средства традиционной китайской медицины получают главным образом из ароматических лекарственных средств традиционной китайской медицины. Это общий термин для класса компонентов, подобных эфирным маслам, которые не смешиваются с водой и могут быть получены путем паровой дистилляции. Эфирные масла широко представлены в растениях, и можно сказать, что практически все пахучие растения содержат эфирные масла в различных количествах. Растения с более высоким содержанием эфирных масел включают главным образом: Compositae, Rutaceae, Lauraceae, Labiatae, Umbelliferae, Myrtaceae, Ericaceae, Gramineae, Zingiberaceae, Leguminosae, Rosaceae, Magnoliaceae, Liliaceae, Cupressaceae и т.д.
Эфирные масла состоят главным образом из терпеноидов и ароматических соединений и их кислородсодержащих производных, таких как спирты, альдегиды, кетоны, фенолы, эфиры, лактоны и т.д. Кроме того, также включены азотсодержащие и серосодержащие соединения. Эфирные масла представляют собой бесцветную или светло-желтую прозрачную маслянистую жидкость, которая может улетучиваться при комнатной температуре, и обладают противовоспалительными, противоаллергическими, противомикробными, антимутационными, противораковыми, антигельминтными эффектами, эффектами ингибирования ферментов и эффектами в отношении центральной нервной системы, дыхательной системы и т.д.
В предшествующем уровне техники нет сообщений о лекарственном препарате с комбинацией сальвианоловых кислот, таншинонов, сапонинов, флавоноидов и эфирных масел. Также нет сообщений о том, что эти компоненты, объединенные в определенном соотношении, можно применять для лечения сердечной недостаточности.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
С целью решения вышеуказанных технических проблем в настоящем изобретении предусмотрена фармацевтическая композиция.
В настоящем изобретении также предусмотрено применение фармацевтической композиции при лечении сердечной недостаточности.
Цель настоящего изобретения достигается посредством следующих технических решений.
В настоящей заявке предусмотрена фармацевтическая композиция, содержащая следующие компоненты:
В настоящей заявке дополнительно предусмотрена фармацевтическая композиция, содержащая следующие компоненты:
Кроме того, в настоящей заявке предусмотрена фармацевтическая композиция, содержащая следующие компоненты:
В вышеуказанных фармацевтических композициях фенолокислоты включают вещества в следующих массовых частях: даншенсу (т.е. сальвиановая кислота А): протокатеховый альдегид: сальвианоловая кислота Т: сальвианоловая кислота U: сальвианоловая кислота D: сальвианоловая кислота G: розмариновая кислота: литоспермовая кислота: сальвианоловая кислота В: сальвианоловая кислота А: изосальвианоловая кислота С=(3,0-11,0): (0,06-0,15): (0,2-0,55): (0,2-0,55): (0,4-1,3): (0,02-0,05): (0,3-0,8): (0,05-0,40): (0,10-0,40): (0,07-0,12): (0,015-0,04).
В вышеуказанных фармацевтических композициях флавоноиды включают вещества в следующих массовых частях: каликозин-7-глюкозид: ононин: каликозин: формононетин=(0,6-1,8): (0,3-0,7): (0,03-0,18): (0,03-0,65).
В вышеуказанных фармацевтических композициях таншиноны включают вещества в следующих массовых частях: дигидротаншинон I: криптотаншинон: таншинон I: таншинон IIА=(0,001-0,03): (0,005-0,04): (0,002-0,025): (0,004-0,03).
В вышеуказанных фармацевтических композициях сапонины включают вещества в следующих массовых частях: нотогинзенозид R1: гинзенозид Rg1: гинзенозид Rb1: астрагалозид: гинзенозид Rd=(1,8-3,5): (2,5-5,4): (1,3-5,0): (0,30-0,60): (0,4-0,6).
В вышеуказанных фармацевтических композициях эфирные масла включают вещества в следующих массовых частях: транс-неролидол: оксид неролидола = (25-38): (55-76). При этом оксид неролидола содержит
(3R,6S,7R)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ол,
(3R,6R,7S)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ол,
(3S,6R,7S)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ол и
(3S,6S,7R)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ол в массовых частях, составляющих (3-6): (4-7): (25-33): (23-30).
В фармацевтической композиции по настоящему изобретению фенолокислоты (даншенсу, протокатеховый альдегид, сальвианоловая кислота Т, сальвианоловая кислота U, сальвианоловая кислота D, сальвианоловая кислота G, розмариновая кислота, литоспермовая кислота, сальвианоловая кислота В, сальвианоловая кислота А, изосальвианоловая кислота С), таншиноны (дигидротаншинон I, криптотаншинон, таншинон I, таншинон IIА), сапонины (нотогинзенозид R1, гинзенозид Rg1, гинзенозид Rb1, астрагалозид, гинзенозид Rd), флавоноиды (каликозин-7-глюкозид, ононин, каликозин, формононетин) могут быть получены согласно предшествующему уровню техники, получены путем экстракции и тонкой очистки или получены коммерческим путем. Эфирное масло транс-неролидол относится к предшествующему уровню техники. (3R,6S,7R)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ол, (3R,6R,7S)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ол, (3S,6R,7S)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен- 7-ол, (3S,6S,7R)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ол также относятся к предшествующему уровню техники, как, например, «Тао Y, Wang Y. Bioactive sesquiterpenes isolated from the essential oil of Dalbergia odorifera T. Chen[J]. Fitoterapia, 2010, 81(5): 393-399».
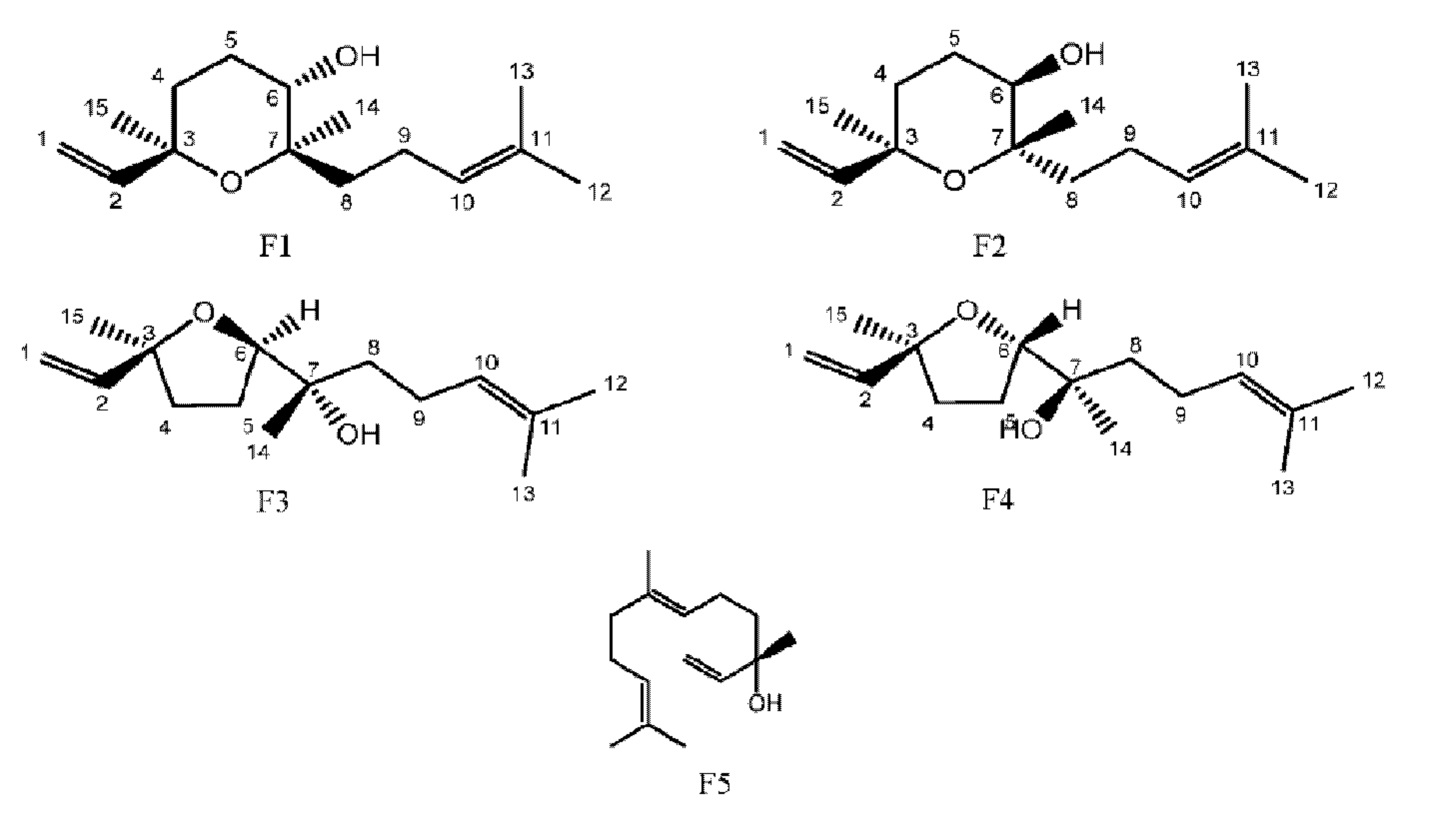
F1: отн-(3R,6S,7R)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ол
F2: отн-(3R,6R,7S)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ол
F3: отн-(3S,6R,7S)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ол
F4: отн-(3S,6S,7R)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ол
F5: транс-неролидол
В одном варианте осуществления настоящего изобретения в настоящем изобретении дополнительно предусмотрен фармацевтический препарат, содержащий фармацевтическую композицию по настоящему изобретению. В предпочтительном варианте осуществления фармацевтическая композиция в качестве активных ингредиентов составляет 0,1-99,9 масс. % фармацевтического препарата, а остальное представляет собой фармацевтически приемлемый(приемлемые) носитель(носители). В другом варианте осуществления настоящего изобретения фармацевтическая композиция получена в виде стандартной лекарственной формы, и указанная стандартная лекарственная форма относится к отдельному препарату, например, каждой таблетке из таблеток, каждой капсуле из капсул, каждой бутыли с растворами для перорального применения и каждому пакету с гранулами и т.д.
Препарат пригоден для перорального, парентерального (в том числе для подкожного, например, в инъекционной форме или в виде таблеток резервуарного типа; внутрикожного; интратекального; внутримышечного, например, в лекарственной форме резервуарного типа; а также внутривенного введения и т.д.), ректального и местного (например, сублингвального) введения. Однако наиболее подходящий путь введения зависит от состояния пациентов.
В контексте настоящего изобретения используемые фармацевтические носители представляют собой различные виды органических или неорганических носителей, которые можно вводить в комбинации с фармацевтической композицией, например, вспомогательные вещества, смазывающие вещества, связывающие вещества, разрыхлители и средства для нанесения покрытия, используемые для твердых препаратов; или фармацевтические добавки, например, красящие вещества и подсластители. Указанные носители выбраны из сахарного спирта, например, маннита, сорбита, ксилита; аминокислоты, например, гидрохлорида цистеина, метионина, глицина; витамина С; динатриевой соли EDTA, кальций-динатриевой соли EDTA; неорганических солей, например, карбоната, ацетата, фосфата одновалентного щелочного металла или их водных растворов; хлорида натрия, хлорида калия, пиросульфита натрия, бисульфита натрия, тиосульфата натрия; карбоната кальция, бикарбоната кальция; стеарата, например, стеарата кальция, стеарата магния; неорганических кислот, например, хлористоводородной кислоты, уксусной кислоты, серной кислоты, фосфорной кислоты; солей органических кислот, например, лактата натрия; олигосахарида, полисахарида, целлюлозы и их производных, например, мальтозы, глюкозы, фруктозы, декстрана, сахарозы, лактозы, циклодекстрина (такого как β-циклодекстрин), крахмала; производных кремния; альгината; желатина; поливинилпирролидона; глицерина; агара; поверхностно-активных веществ, например, Tween-80; полиэтиленгликоля; фосфолипидных материалов; каолина; тальковой пудры и т.д.
Фармацевтический препарат по настоящему изобретению может быть представлен в любых фармацевтически приемлемых лекарственных формах, включая таблетки, такие как таблетки, покрытые сахарной оболочкой, таблетки, покрытые пленочной оболочкой, и таблетка, покрытая энтеросолюбильной оболочкой; капсулы, такие как твердые капсулы и мягкие капсулы; растворы для перорального применения; защечные таблетки; гранулы; быстрорастворимые порошки; пилюли; порошки; пасты; драже; суспензии; пудры; растворы; инъекционные формы; суппозитории; пасты, такие как мази, твердые пасты; кремы; спреи; капли и пластыри. Препараты по настоящему изобретению предпочтительно представлены в следующих лекарственных формах: лекарственные формы для перорального применения, такие как капсулы, таблетки, растворы для перорального применения, гранулы, пилюли, порошки, драже и пасты и т.д.; и инъекционные формы, такие как порошки для приготовления раствора для инъекций, жидкости для инъекций, инфузионные формы и т.д. Препараты по настоящему изобретению наиболее предпочтительно представляют собой таблетки.
Препараты с лекарственными формами для перорального применения могут содержать широко используемые вспомогательные вещества, связывающие вещества, объемообразующие средства, разбавители, средства для прессования таблеток, смазывающие вещества, разрыхлители, красящие вещества, ароматизирующие средства и смачивающие средства. При необходимости на таблетки можно наносить покрытие.
Подходящие иллюстративные объемообразующие средства включают целлюлозу, маннит, лактозу и другие аналогичные объемообразующие средства.
Предпочтительные примеры вспомогательных веществ включают лактозу, D-маннит, D-сорбит, крахмал, например, α-крахмал, декстрин, кристаллическую целлюлозу, гидроксипропилцеллюлозу с низкой степенью замещения, натрий-карбоксиметилцеллюлозу, аравийскую камедь, амилопектин, легкую безводную кремниевую кислоту, синтетический силикат алюминия и алюмосиликат магния и т.д.
Предпочтительные примеры смазывающих веществ включают стеарат магния, стеарат кальция, тальковую пудру, силикагель и додецилсульфат натрия и т.д.
Предпочтительные примеры связующих веществ включают α-крахмал, сахарозу, желатин, аравийскую камедь, метилцеллюлозу карбоксиметилцеллюлозу, натрий-карбоксиметилцеллюлозу, кристаллическую целлюлозу, сахар, D-маннит, трегалозу, декстрин, амилопектин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и пирролидон.
Предпочтительные примеры разрыхлителей включают лактозу, сахар, крахмал, карбоксиметилцеллюлозу, кальций-карбоксиметилцеллюлозу, алкиламид натрия, карбоксиметилкрахмал натрия, легкую безводную кремниевую кислоту, гидроксипропилцеллюлозу с низкой степенью замещения, крахмал, поливинилпирролидон и крахмалгликолят натрия и т.д.
Предпочтительные примеры средств для нанесения покрытия включают гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, этилцеллюлозу, карбоксиметилцеллюлозу и поливиниловый спирт и т.д.
Предпочтительные примеры красящих веществ включают водорастворимые пищевые тартразиновые красители (пищевой краситель, такой как пищевой красный №2 и №3, пищевой желтый №4 и №5, пищевой синий №1 и №2); нерастворимые в воде лакообразующие красители (такие как алюминиевая соль вышеуказанных водорастворимых пищевых тартразиновых красителей) и природные красители (такие как β-каротин, хлорофилл и колькотар) и т.д.
Предпочтительные примеры подсластителей включают сахаринат натрия, глицирретиновую кислоту, аспартам и стевиозид и т.д.
Обычно способ получения таблеток включает прессование или формование фармацевтической композиции по настоящему изобретению с использованием одной или более фармацевтически приемлемых сред-носителей.
Фармацевтическую композицию по настоящему изобретению можно также составить в виде жидких препаратов для перорального применения, например, водорастворимых или маслорастворимых суспензий, растворов, эмульсий, сиропов и т.д. Фармацевтическая композиция по настоящему изобретению также может представлять собой сухой продукт, который перед использованием повторно смешивают с водой или другими подходящими носителями. Этот вид жидких препаратов может содержать традиционные добавки, в том числе суспендирующие средства, такие как сорбитовый сироп, метилцеллюлоза, глюкоза/сироп, желатин, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза, гелеобразный стеарат алюминия или гидрогенизированный пищевой жир; эмульгаторы, такие как лецитин, сорбитанмоноолеат или аравийская камедь; неводные носители, которые могут включать пищевое масло, такое как миндальное масло, фракционированное кокосовое масло, масляные сложные эфиры, пропиленгликоль или этанол; и консерванты, такие как метилпарабен, нипазол и сорбиновая кислота. При необходимости могут быть включены традиционные душистые вещества или красящие вещества.
Препараты для парентерального введения включают в себя водные и неводные стерильные инъекционные формы, где эти препараты могут содержать антиоксиданты, буферные средства, бактериостатические средства и изотонические средства и т.д.; и препараты для парентерального введения могут включать в себя водные и неводные стерильные суспензии, где эти препараты могут содержать суспендирующие средства и загустители. Препараты можно хранить в однодозовых или многодозовых сосудах, таких как герметичные ампулы и флаконы, и можно выдерживать в условиях сублимационной сушки (лиофилизации), при этом перед использованием к ним необходимо добавлять только стерильные жидкие носители, например, воду для инъекций.
Препараты для ректального введения могут представлять собой суппозитории, содержащие традиционные основы для суппозиториев, например, масло какао, стеариновую кислоту или другие глицериды или этиленгликоль.
Препараты для перорального местного введения, например, препараты для трансбуккального или сублингвального введения, включают в себя троше, в которых активный ингредиент заключен в ароматизированную основу, такую как сахароза и аравийская камедь; и пастилки, в которых активный ингредиент заключен в основу, такую как желатин и глицерин или сахароза и аравийская камедь.
Фармацевтическая композиция по настоящему изобретению также может быть составлена в виде препаратов резервуарного типа, и такой препарат пролонгированного действия можно вводить путем имплантации (такой как подкожная или внутримышечная имплантация) или внутримышечной инъекции. Следовательно, фармацевтическую композицию по настоящему изобретению можно получить с использованием подходящих полимеров или гидрофобных материалов (например, эмульсий в приемлемом масле) или ионообменных смол или получить в виде слаборастворимого производного, например, слаборастворимой соли.
В настоящем изобретении также описано применение фармацевтической композиции по настоящему изобретению при получении лекарственного препарата для лечения ишемической болезни сердца.
В настоящем изобретении также описано применение фармацевтической композиции по настоящему изобретению при получении лекарственного препарата для улучшения состояния при повреждении миокарда, особенно при повреждении миокарда, вызванного сердечной недостаточностью.
В настоящем изобретении также описано применение фармацевтической композиции по настоящему изобретению при получении лекарственного препарата для лечения или предупреждения сердечной недостаточности, где сердечная недостаточность предпочтительно представляет собой сердечную недостаточность со сниженной фракцией выброса и/или сердечную недостаточность с сохраненной фракцией выброса.
Фармацевтическая композиция по настоящему изобретению может ингибировать миокардиальный фиброз и/или апоптоз миокардиальных клеток и/или воспалительную реакцию после развития сердечной недостаточности.
В настоящем изобретении описан способ улучшения состояния при повреждении миокарда, включающий введение эффективного количества фармацевтической композиции по настоящему изобретению субъекту, у которого имеется повреждение миокарда или риск его наличия, где повреждение миокарда предпочтительно представляет собой повреждение миокарда, вызванное сердечной недостаточностью.
В настоящем изобретении описана вышеуказанная фармацевтическая композиция по настоящему изобретению для улучшения состояния при повреждении миокарда, где повреждение миокарда предпочтительно представляет собой повреждение миокарда, вызванное сердечной недостаточностью.
В настоящем изобретении описан способ лечения или предупреждения сердечной недостаточности, включающий введение эффективного количества фармацевтической композиции по настоящему изобретению субъекту, у которого имеется сердечная недостаточность или риск ее наличия, где сердечная недостаточность предпочтительно представляет собой сердечную недостаточность со сниженной фракцией выброса и сердечную недостаточность с сохраненной фракцией выброса.
В настоящем изобретении также описана вышеуказанная фармацевтическая композиция по настоящему изобретению для лечения или предупреждения сердечной недостаточности, где сердечная недостаточность предпочтительно представляет собой сердечную недостаточность со сниженной фракцией выброса и сердечную недостаточность с сохраненной фракцией выброса.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой иллюстративное изображение, полученное в ходе ультразвукового исследования в М-режиме при измерении в день 28, на котором представлены эффекты в каждой экспериментальной группе крыс с сердечной недостаточностью, индуцированной LAD, в отношении функции левого желудочка, измеренной с помощью эхокардиограммы.
Фиг. 2 представляет собой иллюстративное изображение окрашивания с помощью НЕ (увеличение 400×), где ядра были помечены синим цветом с помощью DAPI.
Фиг. 3 представляет собой иллюстративную микрофотографию окрашивания методом TUNEL (увеличение 400×), где апоптотические ядра были помечены зеленым цветом.
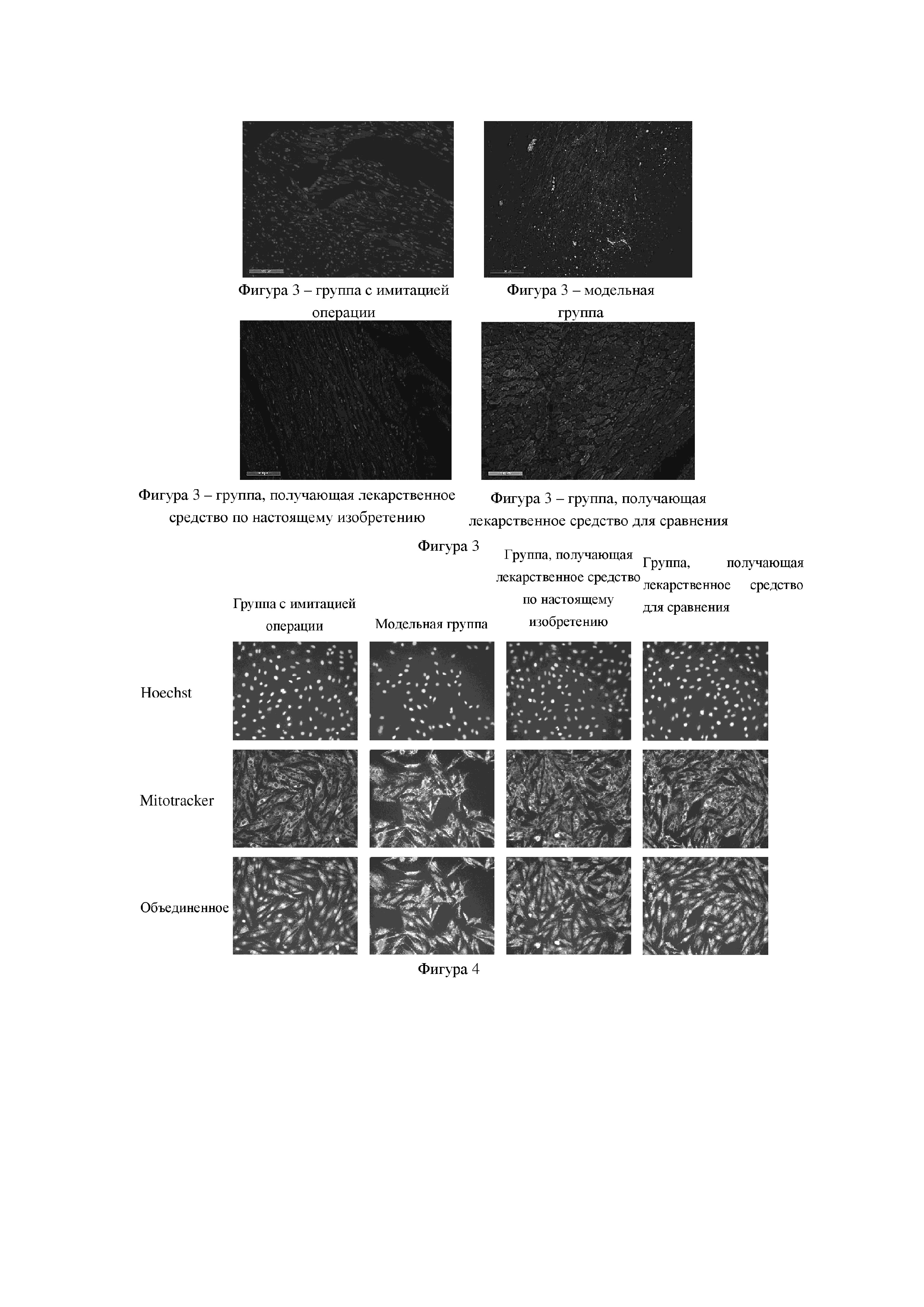
На фиг. 4 представлены защитные эффекты в каждой экспериментальной группе в отношении количества ядер и биологической функции митохондрий при повреждении миокардиальных клеток Н9с2, индуцированном гипоксией. Флуоресцентные красители используют для высокоинформативной визуализации клеток Н9с2 в отношении количества ядер и качества митохондрий. Ядра окрашены синим цветом после трансфекции с использованием флуоресцентного красителя Hoechst; митохондрии окрашены красным цветом после трансфекции с использованием флуоресцентного красителя MitoTracker; «Объединенное» представляет изображение, полученное после слияния этих двух изображений.
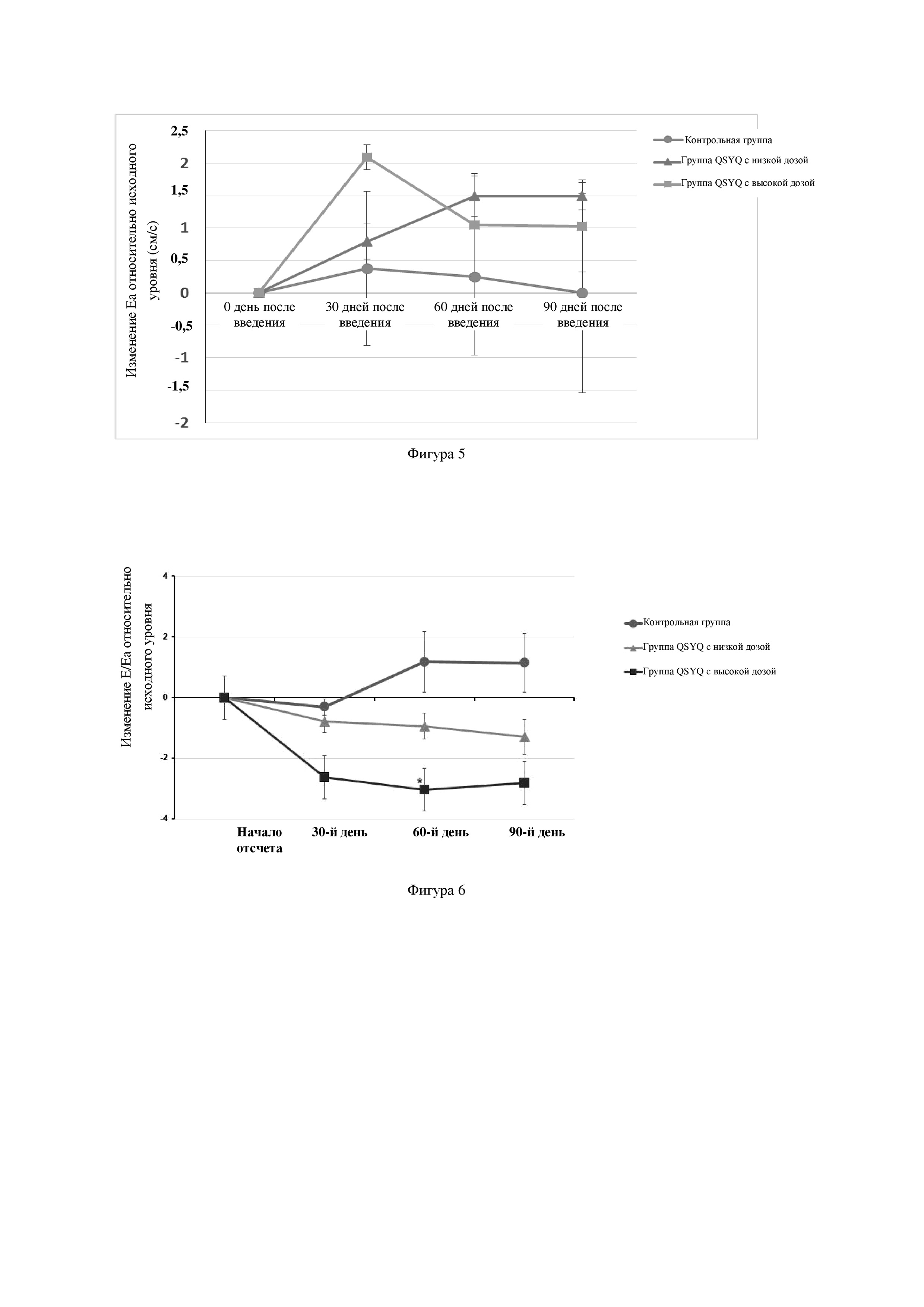
На фиг. 5 представлено изменение пиковой скорости движения фиброзного кольца митрального клапана в ранней диастоле (ΔЕа) в каждой группе в ходе введения лекарственного средства по настоящему изобретению.
На фиг. 6 представлена степень изменения значения Е/Еа диастолической функции (ΔЕ/Еа) в каждой группе в ходе введения лекарственного средства по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Конкретные варианты осуществления настоящего изобретения будут описаны подробно ниже со ссылкой на графические материалы, но следует понимать, что объем правовой охраны настоящего изобретения не ограничен конкретными вариантами осуществления.
Если в явной форме не указано иное, во всем описании и формуле изобретения термин «включающий» или его варианты, такие как «содержащий» и т.п., следует понимать как включающий в себя указанные элементы или компоненты и не исключающий другие элементы или компоненты.
Примеры
Пример 1
16 г фенолокислот, 3,5 г флавоноидов, 0,2 г таншинонов и 16 г сапонинов равномерно перемешивали и затем равномерно перемешивали с 16 г эфирных масел с получением фармацевтической композиции.
Фармацевтическая композиция содержит 11,55 г даншенсу, 0,15 г протокатехового альдегида, 0,6 г сальвианоловой кислоты Т, 0,6 г сальвианоловой кислоты U, 1,3 г сальвианоловой кислоты D, 0,05 г сальвианоловой кислоты Q 0,8 г розмариновой кислоты, 0,4 г литоспермовой кислоты, 0,4 г сальвианоловой кислоты В, 0,12 г сальвианоловой кислоты А, 0,04 г изосальвианоловой кислоты С, 2,1 г каликозин-7-глюкозида, 0,8 г ононина, 0,2 г каликозина, 0,78 г формононетина, 0,048 г дигидротаншинона I, 0,064 г криптотаншинона, 0,04 г таншинона I, 0,048 г таншинона IIА, 3 г нотогинзенозида R1, 4,6 г гинзенозида Rg1, 4,3 г гинзенозида Rb1, 0,52 г астрагалозида, 0,52 г гинзенозида Rd, 5,3 г транс-неролидола, 0,84 г (3R,6S,7R)-3,7,11-тpимeтил-3,7-эпoкcи-1,10-дoдeкaдиeн-6-oлa, 0,98 г (3R,6R,7S)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ола, 4,63 г (3S,6R,7S)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ола, 4,21 г (3S,6S,7R)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ола.
Пример 2
15,36 г фенолокислот, 3,33 г флавоноидов, 0,13 г таншинонов и 18,6 г сапонинов равномерно перемешивали и затем равномерно перемешивали с 16 г эфирных масел с получением фармацевтической композиции.
Фармацевтическая композиция содержит 11 г даншенсу, 0,15 г протокатехового альдегида, 0,55 г сальвианоловой кислоты Т, 0,55 г сальвианоловой кислоты U, 1,3 г сальвианоловой кислоты D, 0,05 г сальвианоловой кислоты G, 0,8 г розмариновой кислоты, 0,4 г литоспермовой кислоты, 0,4 г сальвианоловой кислоты В, 0,12 г сальвианоловой кислоты А, 0,04 г изосальвианоловой кислоты С, 1,8 г каликозин-7-глюкозида, 0,7 г ононина, 0,18 г каликозина, 0,65 г формононетина, 0,03 г дигидротаншинона I, 0,04 г криптотаншинона, 0,025 г таншинона I, 0,03 г таншинона IIА, 3,5 г нотогинзенозида R1, 5,4 г гинзенозида Rg1, 5 г гинзенозида Rb1, 0,6 г астрагалозида, 0,6 г гинзенозида Rd, 5,3 г транс-неролидола, 0,84 г (3R,6S,7R)-3,7,11-тpимeтил-3,7-эпoкcи-1,10-дoдeкaдиeн-6-oлa, 0,98 г (3R,6R,7S)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ола, 4,63 г (3S,6R,7S)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ола, 4,21 г (3S,6S,7R)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ола.
Пример 3
4,42 г фенолокислот, 0,96 г флавоноидов, 0,012 г таншинонов и 6,3 г сапонинов равномерно перемешивали и затем равномерно перемешивали с 15 г эфирных масел с получением фармацевтической композиции.
Фармацевтическая композиция содержит 3 г даншенсу, 0,06 г протокатехового альдегида, 0,2 г сальвианоловой кислоты Т, 0,2 г сальвианоловой кислоты U, 0,4 г сальвианоловой кислоты D, 0,02 г сальвианоловой кислоты G, 0,3 г розмариновой кислоты, 0,05 г литоспермовой кислоты, 0,1 г сальвианоловой кислоты В, 0,07 г сальвианоловой кислоты А, 0,015 г изосальвианоловой кислоты С, 0,6 г каликозин-7-глюкозида, 0,3 г ононина, 0,03 г каликозина, 0,03 г формононетина, 0,001 г дигидротаншинона I, 0,005 г криптотаншинона, 0,002 г таншинона I, 0,004 г таншинона IIА, 1,8 г нотогинзенозида R1, 2,5 г гинзенозида Rg1, 1,3 г гинзенозида Rb1, 0,3 г астрагалозида, 0,4 г гинзенозида Rd, 6,8 г транс-неролидола, 0,82 г (3R,6S,7R)-3,7,11-тpимeтил-3,7-эпoкcи-1,10-дoдeкaдиeн-6-oлa, 1,09 г (3R,6R,7S)-3,7,11-тpимeтил-3,7-эпoкcи-1,10-дoдeкaдиeн-6-oлa, 6,82 г (3S,6R,7S)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ола, 6,27 г (3S,6S,7R)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ола.
Пример 4
18 г фенолокислот, 4 г флавоноидов, 0,3 г таншинонов и 18 г сапонинов равномерно перемешивали и затем равномерно перемешивали с 16 г эфирных масел с получением фармацевтической композиции.
В фармацевтической композиции фенолокислоты включают вещества в следующих массовых частях: даншенсу: протокатеховый альдегид: сальвианоловая кислота Т: сальвианоловая кислота U: сальвианоловая кислота D: сальвианоловая кислота G: розмариновая кислота: литоспермовая кислота: сальвианоловая кислота В: сальвианоловая кислота А: изосальвианоловая кислота С=11: 0,15: 0,55: 0,55: 1,3: 0,05: 0,8: 0,40: 0,40: 0,12: 0,04; флавоноиды включают вещества в следующих массовых частях: каликозин-7-глюкозид: ононин: каликозин: формононетин=1,8: 0,7: 0,18: 0,65; таншиноны включают вещества в следующих массовых частях: дигидротаншинон I: криптотаншинон: таншинон I: таншинон IIА=0,03: 0,04: 0,025: 0,03. Сапонины включают вещества в следующих массовых частях: нотогинзенозид R1: гинзенозид Rg1: гинзенозид Rb1: астрагалозид: гинзенозид Rd=3,5: 5,4: 5,0: 0,60: 0,6. Эфирные масла включают вещества в следующих массовых частях: транс-неролидол: (3R,6S,7R)-3,7,11-тpимeтил-3,7-эпoкcи-1,10-дoдeкaдиeн-6-oл: (3R,6R,7S)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ол: (3S,6R,7S)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ол: (3S,6S,7R)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ол=38: 6: 7: 33: 30.
Пример 5
18 г фенолокислот, 4 г флавоноидов, 0,3 г таншинонов и 18 г сапонинов равномерно перемешивали и затем равномерно перемешивали с 17 г эфирных масел с получением фармацевтической композиции.
В фармацевтической композиции фенолокислоты включают вещества в следующих массовых частях: даншенсу: протокатеховый альдегид: сальвианоловая кислота Т: сальвианоловая кислота U: сальвианоловая кислота D: сальвианоловая кислота G: розмариновая кислота: литоспермовая кислота: сальвианоловая кислота В: сальвианоловая кислота А: изосальвианоловая кислота С=3: 0,06: 0,2: 0,02: 0,4:0,02: 0,3: 0,05: 0,1: 0,07: 0,015; флавоноиды включают вещества в следующих массовых частях: каликозин-7-глюкозид: ононин: каликозин: формононетин=0,6: 0,3: 0,03: 0,03; таншиноны включают вещества в следующих массовых частях: дигидротаншинон I: криптотаншинон: таншинон I: таншинон IIА=0,001: 0,005: 0,002: 0,004. Сапонины включают вещества в следующих массовых частях: нотогинзенозид R1: гинзенозид Rg1: гинзенозид Rb1: астрагалозид: гинзенозид Rd=1,8: 25: 1,3: 0,3: 0,4. Эфирные масла включают вещества в следующих массовых частях: транс-неролидол: (3R,6S,7R)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ол: (3R,6R,7S)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ол: (3S,6R,7S)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ол: (3S,6S,7R)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ол=25: 3: 4: 25: 23.
Пример 6
20 г фенолокислот, 5 г флавоноидов, 0,5 г таншинонов и 20 г сапонинов равномерно перемешивали и затем равномерно перемешивали с 18 г эфирных масел с получением фармацевтической композиции.
В фармацевтической композиции фенолокислоты включают вещества в следующих массовых частях: даншенсу: протокатеховый альдегид: сальвианоловая кислота Т: сальвианоловая кислота U: сальвианоловая кислота D: сальвианоловая кислота G: розмариновая кислота: литоспермовая кислота: сальвианоловая кислота В: сальвианоловая кислота А: изосальвианоловая кислота С=11: 0,15: 0,55: 0,55: 1,3: 0,05: 0,8: 0,40: 0,40: 0,12: 0,04; флавоноиды включают вещества в следующих массовых частях: каликозин-7-глюкозид: ононин: каликозин: формононетин=1,8: 0,7: 0,18: 0,65; таншиноны включают вещества в следующих массовых частях: дигидротаншинон I: криптотаншинон: таншинон I: таншинон IIА=0,03: 0,04: 0,025: 0,03. Сапонины включают вещества в следующих массовых частях: нотогинзенозид R1: гинзенозид Rg1: гинзенозид Rb1: астрагалозид: гинзенозид Rd=3,5: 5,4: 5,0: 0,60: 0,6. Эфирные масла включают вещества в следующих массовых частях: транс-неролидол: (3R,6S,7R)-3,7,11-тpимeтил-3,7-эпoкcи-1,10-дoдeкaдиeн-6-oл: (3R,6R,7S)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ол: (3S,6R,7S)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ол: (3S,6S,7R)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ол=38: 6: 7: 33: 30.
Пример 7
2 г фенолокислот, 0,5 г флавоноидов, 0,005 г таншинонов и 5 г сапонинов равномерно перемешивали и затем равномерно перемешивали с 10 г эфирных масел с получением фармацевтической композиции.
В фармацевтической композиции фенолокислоты включают вещества в следующих массовых частях: даншенсу: протокатеховый альдегид: сальвианоловая кислота Т: сальвианоловая кислота U: сальвианоловая кислота D: сальвианоловая кислота G: розмариновая кислота: литоспермовая кислота: сальвианоловая кислота В: сальвианоловая кислота А: изосальвианоловая кислота С=3: 0,06: 0,2: 0,02: 0,4: 0,02: 0,3: 0,05: 0,1: 0,07: 0,015; флавоноиды включают вещества в следующих массовых частях: каликозин-7-глюкозид: ононин: каликозин: формононетин=0,6: 0,3: 0,03: 0,03; таншиноны включают вещества в следующем массовом соотношении: дигидротаншинон I: криптотаншинон: таншинон I: таншинон IIА=0,001: 0,005: 0,002: 0,004. Сапонины включают вещества в следующих массовых частях: нотогинзенозид R1: гинзенозид Rg1: гинзенозид Rb1: астрагалозид: гинзенозид Rd=1,8: 25: 1,3: 0,3: 0,4. Эфирные масла включают вещества в следующих массовых частях: транс-неролидол: (3R,6S,7R)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ол: (3R,6R,7S)-3,7,11-триметил-3,7-эпокси-1,10-додекадиен-6-ол: (3S,6R,7S)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ол: (3S,6S,7R)-3,7,11-триметил-3,6-эпокси-1,10-додекадиен-7-ол=25: 3: 4: 25: 23.
Пример 8
Брали 0,5 г фармацевтической композиции из примера 1 и 10,5 г PEG-6000, равномерно перемешивали, плавили путем нагревания и затем переносили в капельный резервуар. Жидкость по каплям добавляли в жидкий парафин при 6~8°С, чтобы получить 400 капельных пилюль после удаления оставшегося парафина.
Пример 9
Брали 0,5 г фармацевтической композиции из примера 2, 4,5 г глюкозы, 0,9 г тиосульфата натрия и 1 мл дистиллированной воды, равномерно перемешивали, лиофилизировали и загружали по отдельности в 500 флаконов с получением порошков для приготовления раствора для инъекций.
Пример 10
Брали 0,5 г фармацевтической композиции из примера 2, 5,5 г маннита, 0,9 г эдетата кальция-динатрия и 2 мл дистиллированной воды, равномерно перемешивали, лиофилизировали и загружали по отдельности в 300 флаконов с получением порошков для приготовления раствора для инъекций.
Пример 11
Брали 0,5 г фармацевтической композиции из примера 2, 50 г крахмала и 50 г сахарозы, равномерно перемешивали, гранулировали и прессовали с получением таблеток.
Пример 12
Брали 0,5 г фармацевтической композиции из примера 2, 50 г крахмала и 50 г сахарозы, равномерно перемешивали, гранулировали и загружали в оболочки капсул с получением капсул.
Тестовые примеры
Благоприятные эффекты настоящего изобретения проиллюстрированы посредством следующих тестовых примеров.
Тестовый пример 1. Сердечная недостаточность со сниженной фракцией выброса
1. Животная модель и способ введения
1.1 Экспериментальные животные
Все животные были одобрены Управлением Центра лабораторных животных Тяньцзиньского университета традиционной китайской медицины (TCM-LAEC2017003). Самцов крыс SD чистой линии массой 200±20 г отбирали и кормили при температуре 22-25°С и влажности 40-70%. Крысам обеспечивали освещение днем и ночью во время кормления, их регулярно кормили стандартным гранулированным кормом, снабжали стерилизованной питьевой водой и подвергали тестированию после одной недели адаптивного кормления в экспериментальной среде.
1.2 Экспериментальные лекарственные средства
Группа лекарственного средства по настоящему изобретению: фармацевтическая композиция из примера 2 (QSYQ-1), 169 г.
Группа лекарственного средства для сравнения: фармацевтическая композиция из примера 2 без эфирных масел (QSYQ-2), 169 г.
1.3 Экспериментальные способы
Крысы голодали в течение 12 часов до хирургического вмешательства за исключением свободного доступа к воде. Показатели массы крыс записывали, и крыс анестезировали с помощью 5% хлоральгидрата (6 мл/кг) путем внутрибрюшинной инъекции. После введения крыс в состояние анестезии (приблизительно 2-5 минут, болевые реакции не имели место при зажимании пальцев крыс руками) осуществляли следующие операции.
Предгрудинную оперируемую область стерилизовали с помощью йодофора в спирте, и между третьим и четвертым ребрами в левой половине грудной клетки крысы делали разрез длиной примерно 5 мм. Мышечные слои резко разделяли, и вскрывали грудную полость между третьим и четвертым ребрами с помощью гемостатических щипцов, и разрез растягивали с помощью растягивающего крючка для обнажения грудной полости. В поле зрения стереомикроскопа определяли положение сердца, и перикард осторожно разрывали для определения положения передней нисходящей ветви левой коронарной артерии (в месте соединения артериального конуса и ушка левого предсердия). Лигирование осуществляли с использованием шелковой нити калибра 5-0 с иглой на расстоянии 2-3 мм ниже точки начала коронарной артерии в основании ушка левого предсердия. После лигирования невооруженным глазом было видно, что соответствующая область на поверхности сердца из ярко-красной становилась бледной, и в области снабжения кровеносными сосудами появлялся цианоз миокарда; частота сердечных сокращений у крысы значительно увеличивалась, и дыхание было быстрым со сниженной интенсивностью сердцебиения. Растягивающий крючок ослабляли, и оставшуюся в грудной полости жидкость отсасывали ватным тампоном. Газ из грудной полости выдавливали, и на мышцы и кожу быстро накладывали швы с помощью нити калибра 3-0. Крысу после хирургического вмешательства помещали на электрическое одеяло. После того, как у крысы возобновлялось самостоятельное дыхание, интубационную трубку вынимали из трахеи, и после хирургического вмешательства крысе вводили пенициллин. При этом в группе с имитацией операции только продевали нить под передней нисходящей ветвью коронарной артерией без лигирования, а остальная часть лечения была такой же, как указано выше.
До момента времени 12-13 дней после моделирования крыс соответствующим образом подвергали эхокардиографии для оценивания того, являлось ли моделирование успешным. Крыс, для которых моделирование было успешным, произвольным образом разделяли на четыре группы, а именно модельную группу, группу с имитацией операции (т.е. группу холостого контроля в клеточном эксперименте), группу, получающую фармацевтическую композицию по настоящему изобретению, и группу, получающую лекарственное средство для сравнения по настоящему изобретению, соответственно. В группе, получающей фармацевтическую композицию по настоящему изобретению, крысам, начиная с момента времени 14 дней после хирургического вмешательства, ежедневно вводили через желудочный зонд QSYQ-1 в клинически эквивалентной дозе 100 мг/кг в течение 14 дней из расчета по клинической ежедневной дозе для людей. В группе, получающей лекарственное средство для сравнения (QSYQ-2), крысам, начиная с момента времени 14 дней после хирургического вмешательства, ежедневно вводили через желудочный зонд лекарственное средство в клинически эквивалентной дозе 100 мг/кг в течение 14 дней из расчета по клинической ежедневной дозе для людей.
2. Сбор образцов
Образец крови: после гемодинамического теста кровь брали из брюшного отдела аорты крысы, а затем пробирку с кровью помечали у ее горловины, помещали на водяную баню при 37°С на 30 минут и центрифугировали при 3000 об/мин. в течение 15 минут. Отбирали сыворотку крови, разделяли по пробиркам с кожухом объемом 1,5 мл и хранили при -80°С для дальнейшего использования.
Образец сердца: его сбор осуществляли после взятия крови из брюшного отдела аорты. Сердце вырезали после забора крови, дважды прополаскивали 4% раствором параформальдегида, помещали в раствор формалина для фиксации и хранили для дальнейшего использования.
3. Оценивание животной модели
Ультразвуковое оценивание: эхо кардиографическое оценивание крыс осуществляли через 14 дней после хирургического вмешательства, и моделирование сердечной недостаточности идентифицировали как успешное, если значение EF находилось в пределах диапазона 38-50%. Для выявления уровней TNF-α, IL-6 и IL1-β в образцах сыворотки крови использовали твердофазный иммуноферментный «сэндвич»-анализ с двумя антителами (ELISA). Для выявления СК, СК-МВ и LDH применяли автоматический биохимический анализатор.
Образцы сердца обезвоживали, заливали и нарезали на срезы, и срезы окрашивали посредством окрашивания с помощью НЕ и флуоресцентного окрашивания методом TUNEL.
4. Статистический анализ
Экспериментальные данные подвергали статистической обработке с помощью программного обеспечения SPSS22.0, и результаты эксперимента выражали как среднее значение ± стандартное отклонение (
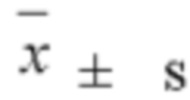
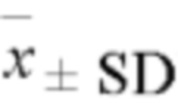
5. Результаты
5.1 Эффекты в каждой группе лечения в отношении сердечной функции крыс
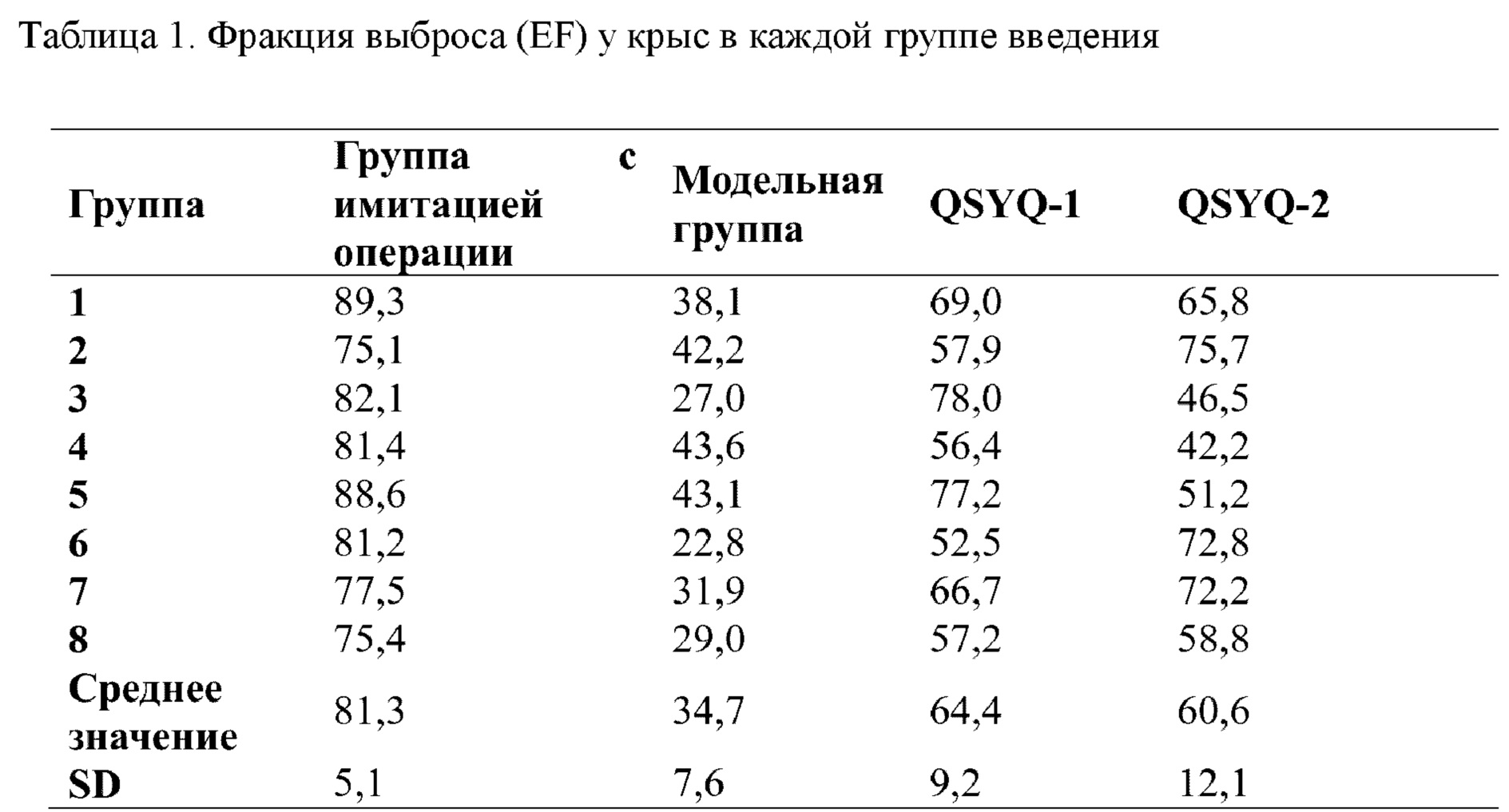
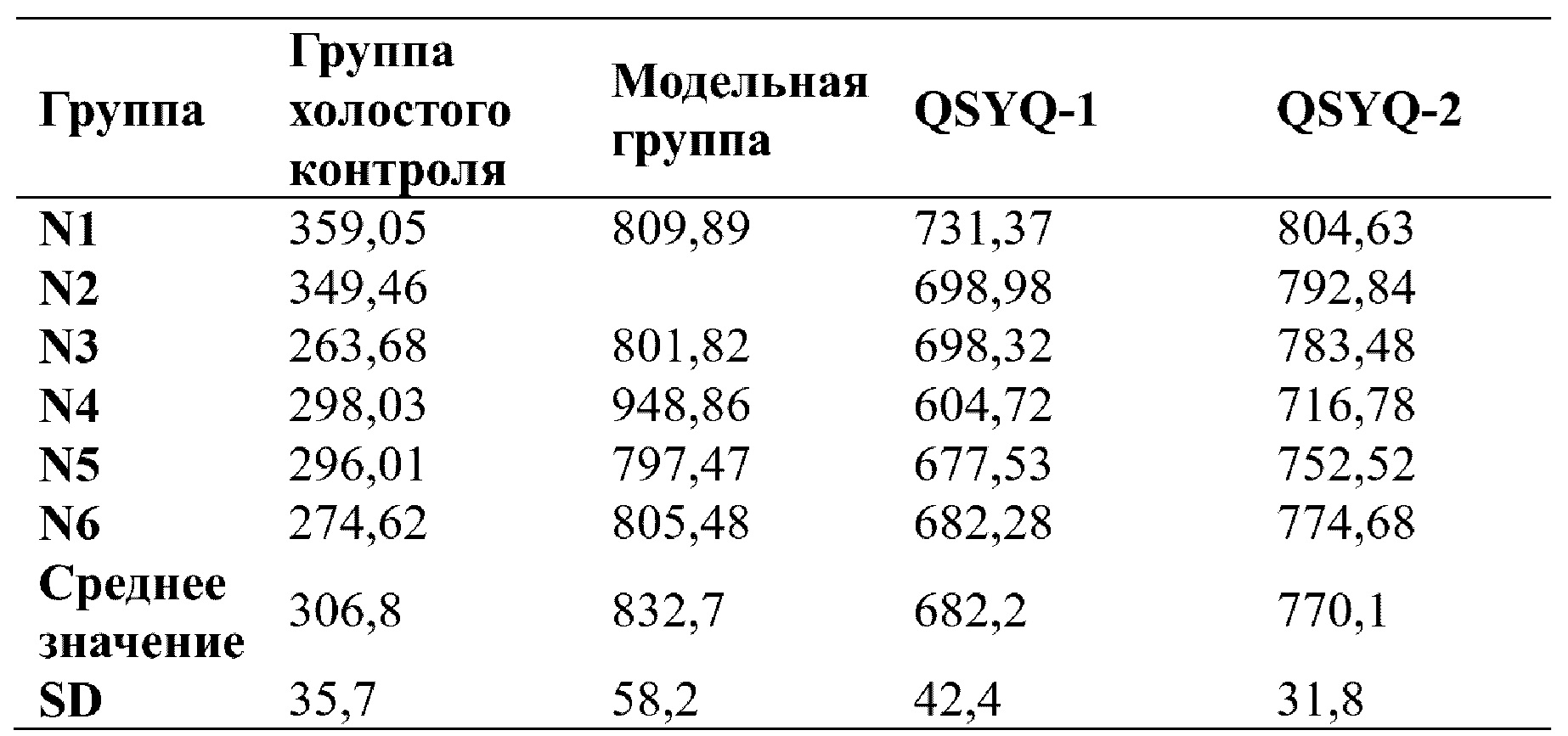
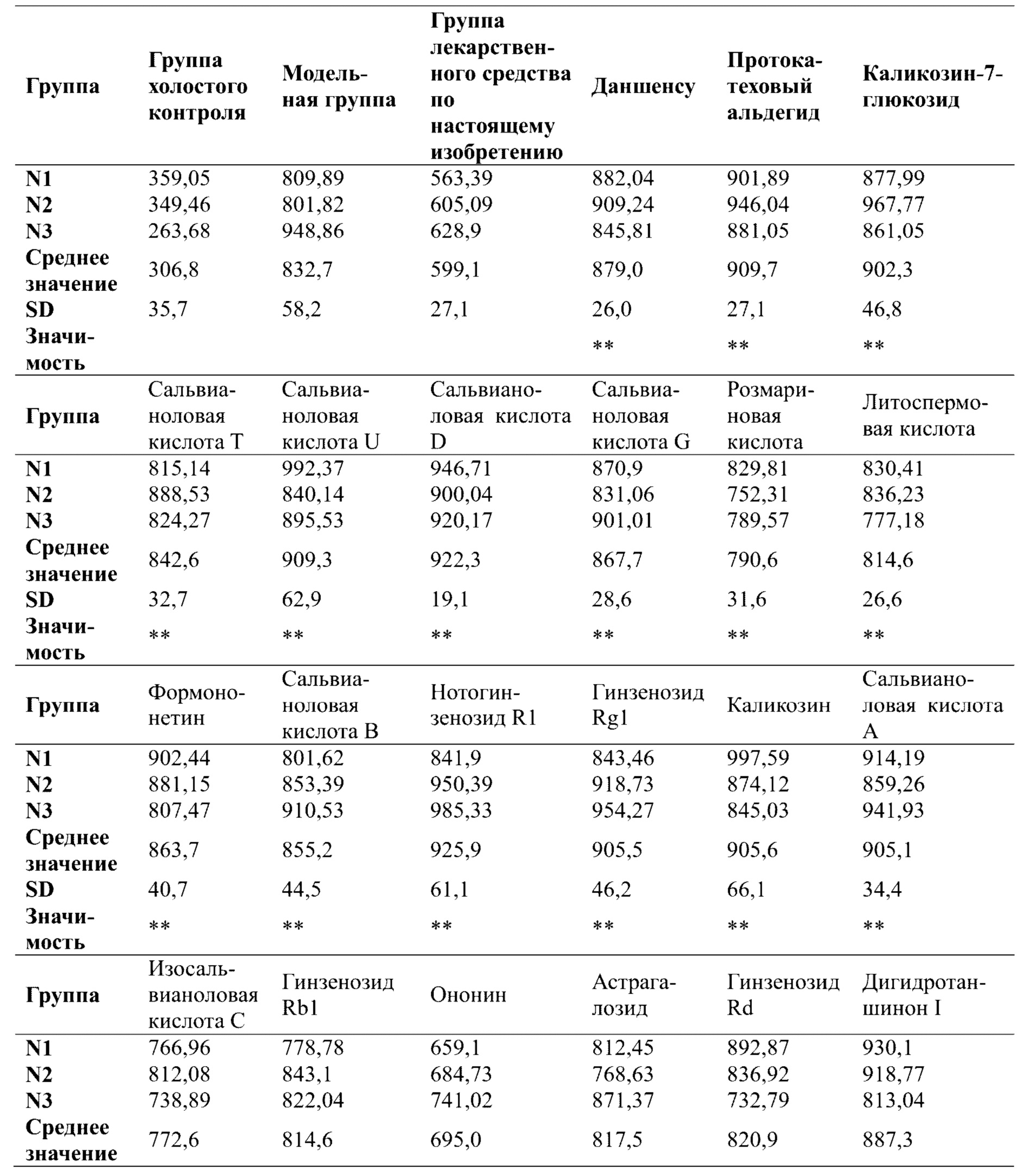
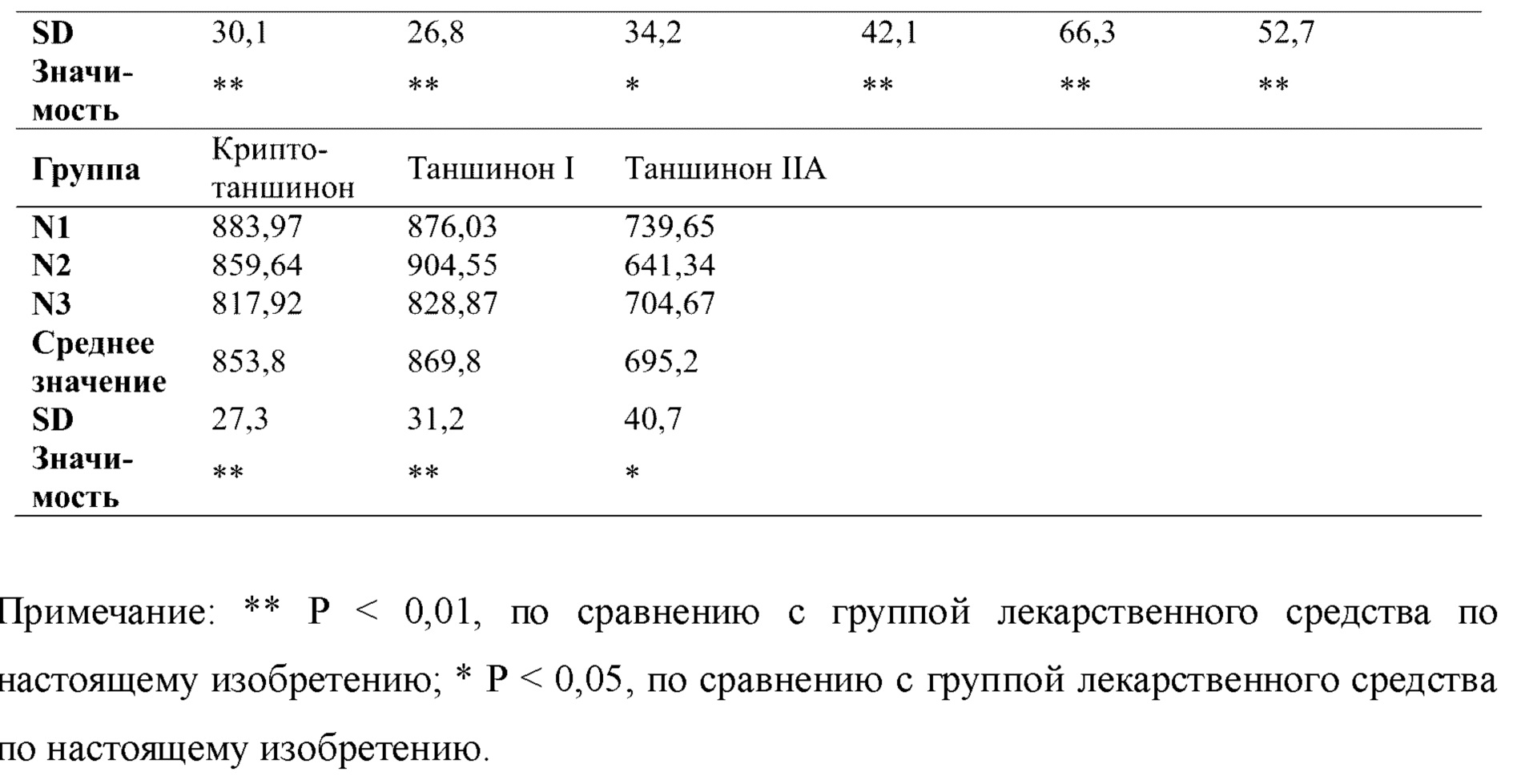
Результаты ультразвукового оценивания в М-режиме показали, что по сравнению с группой нормального контроля полость желудочка в модельной группе постепенно расширялась, и движение стенок левого желудочка ослаблялось, и сократительная способность уменьшалась. Однако после введения QSYQ-1 и QSYQ-2 как степень расширения, так и сократительная способность полости желудочка улучшались, как показано на фигуре 1 (иллюстративное изображение, полученное в ходе ультразвукового исследования в М-режиме). После моделирования лигирования передней нисходящей ветви левой коронарной артерии фракция выброса, фракция укорочения и балл изменения площади левого желудочка у крыс значительно снижались по сравнению с таковыми в группе нормального контроля (т.е. в группе с имитацией операции). После лечения с помощью каждой группы лекарственного средства скорость непрерывного уменьшения фракции выброса левого желудочка крыс в группах введения была ограничена по сравнению с таковой в модельной группе, и различия были статистически значимыми. Изменение фракции укорочения левого желудочка соответствовало фракции выброса левого желудочка, и разница в значении FS по сравнению с таковым в модельной группе была статистически значимой. В каждой экспериментальной группе (QSYQ-1 и QSYQ-2) наблюдались защитные эффекты в отношении сердечной функции крыс с сердечной недостаточностью, индуцированной LAD. Данные о фракции выброса (EF) и фракции сокращения (FS) измеряли, начиная со дня 28, см. таблицы 1 и 2. Как EF, так и FS для QSYQ-1 были выше, чем таковые для QSYQ-2, что указывает на то, что эфирные масла в композиции по настоящему изобретению обладали эффектами содействия всасыванию композиций на основе сальвианоловых кислот, сапонинов, флавоноидов и таншинонов и синергическим образом демонстрировали защитные функции в отношении сердечной функции у пациентов с сердечной недостаточностью.
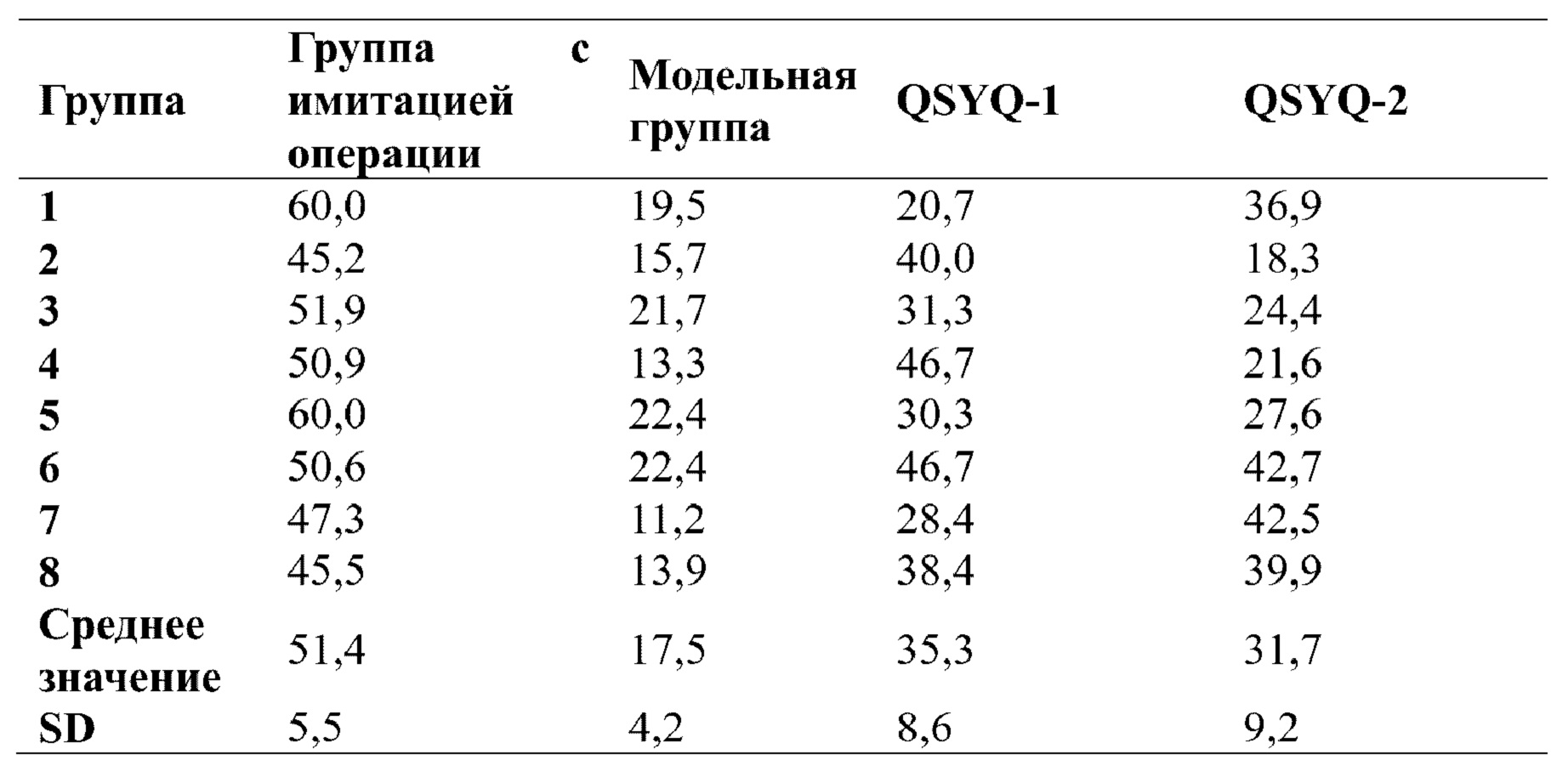
5.2 Результаты исследования миокардиальных ферментативных индикаторов
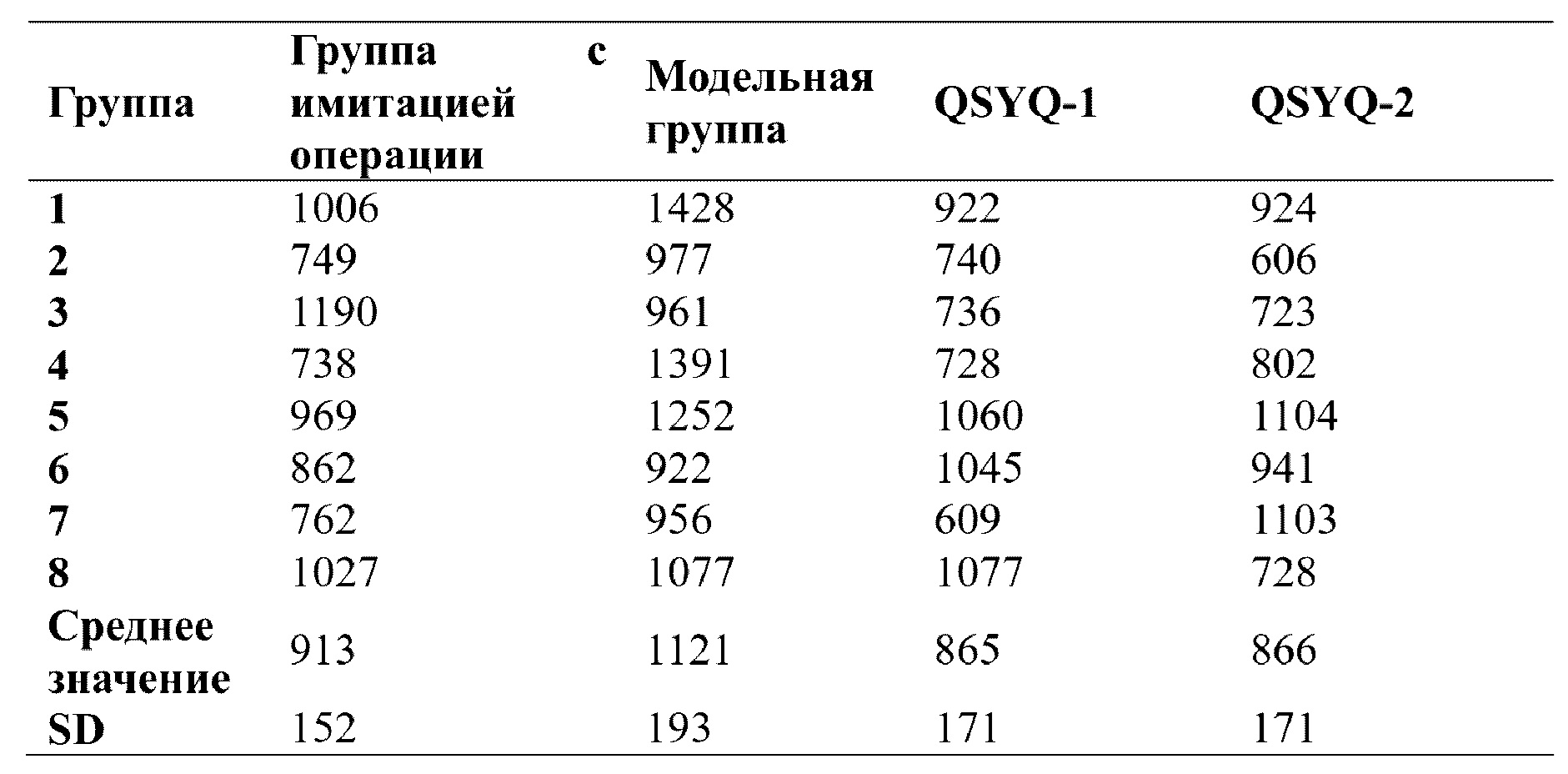
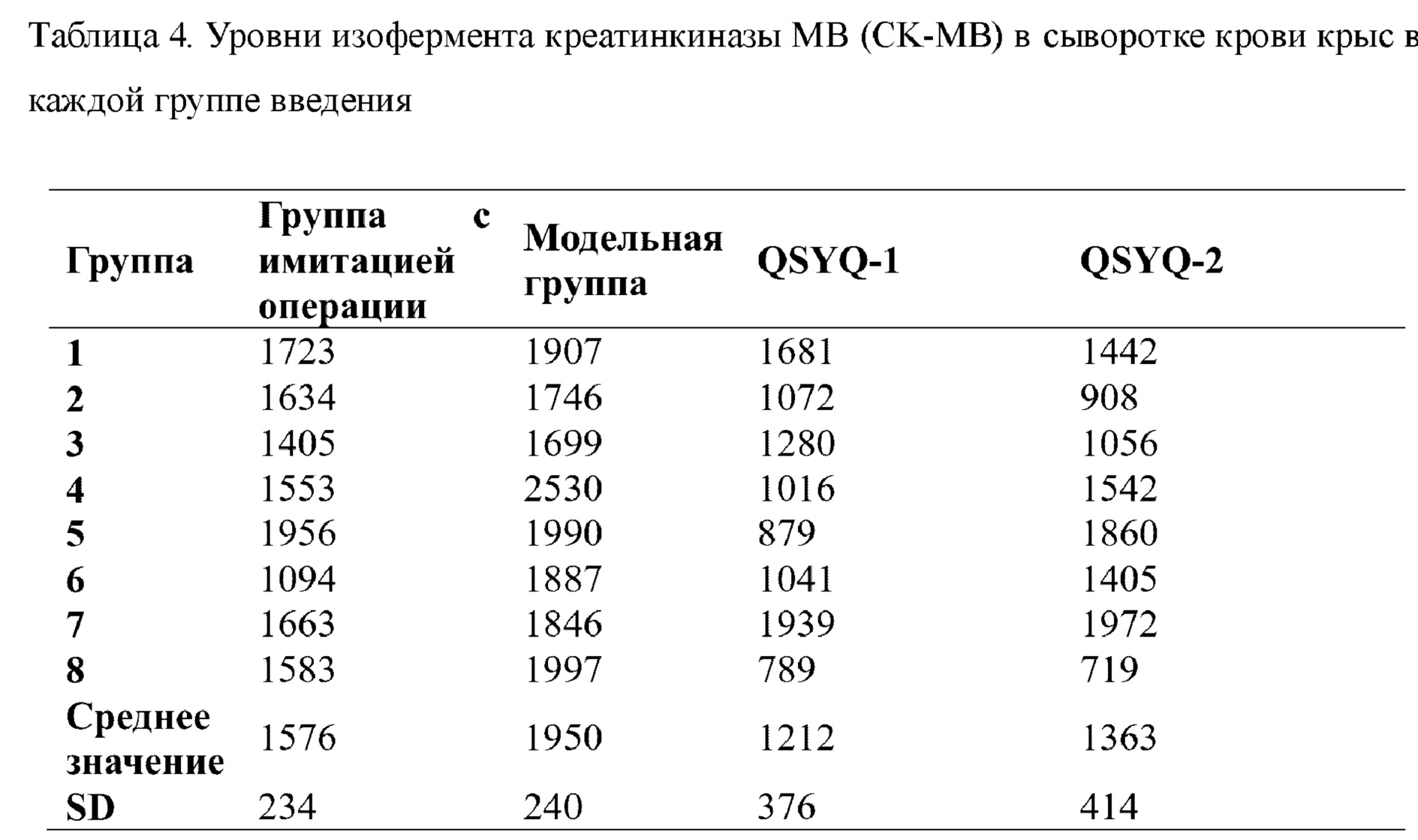
В каждой экспериментальной группе (QSYQ-1 и QSYQ-2) проводили исследование эффектов в отношении высвобождения миокардиальных ферментов и гистологических характеристик миокарда у крыс с сердечной недостаточностью, индуцированной LAD. Все из уровней СК, LDH и СК-МВ в сыворотке крови крыс в группах введения (т.е. QSYQ-1 и QSYQ-2) были снижены по сравнению с таковыми в модельной группе, что указывает на то, что в группах введения имел место эффект снижения уровней миокардиальных ферментов. Что касается уровня креатинкиназы (СК), то для QSYQ-1 и QSYQ-2 результаты были сходными, тогда как эффекты снижения уровня изофермента креатинкиназы MB (СК-МВ) и уровня лактатдегидрогеназы (LDH) для QSYQ-1 превосходили таковые для QSYQ-2. Можно видеть, что эфирные масла в группе лекарственного средства по настоящему изобретению обладают синергическим эффектом. См. таблицы 3, 4 и 5.
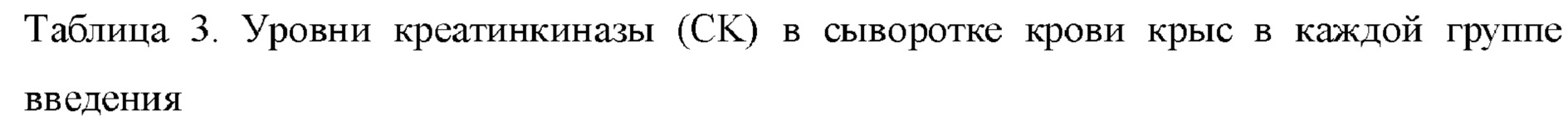
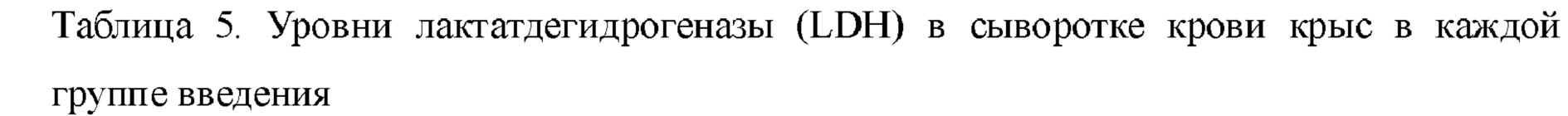
5.3 Результаты патологического исследования
Результаты окрашивания с помощью НЕ показаны на фигуре 2, представляющей собой иллюстративное изображение окрашивания с помощью НЕ (увеличение 400×), где ядра были помечены синим цветом с помощью DAPI. По сравнению с группой нормального контроля с имитацией операции модельная группа характеризовалась значительно повышенной инфильтрацией лейкоцитов и отчетливо наблюдаемым разрывом миокардиальных волокон. В каждой группе введения терапевтического лекарственного средства и группе введения прединтервенционного лекарственного средства можно значительно снизить степень повреждения миокарда.
Результаты окрашивания методом TUNEL показаны на фигуре 3, представляющей собой иллюстративную микрофотографию окрашивания методом TUNEL (увеличение 400×), где апоптотические ядра клеток были помечены зеленым цветом, что демонстрирует, что лигирование передней нисходящей ветви левой коронарной артерии может вызвать повреждение кардиомиоцитов у крыс. Как видно на фигуре 2, после окрашивания можно наблюдать отчетливые меченные флуоресцеином апоптотические тельца, и скорость апоптоза в миокардиальных клетках значительно увеличилась по сравнению с таковой в группе нормального контроля с имитацией операции.
Таким образом, исследования в указанных выше пунктах 5.1-5.3 показали, что в крысиной модели сердечной недостаточности с лигированием передней нисходящей ветви левой коронарной артерии движение передней стенки левого желудочка существенно уменьшалось, и значительно снижалась сократительная способность миокарда, что указывает на то, что в модельной группе наблюдалось значительное снижение сердечной функции по сравнению с группой с имитацией операции. QSYQ-1 может значительно уменьшать выраженность изменений в левом желудочке, значительно замедлять непрерывное уменьшение значений EF и FS, вызванное повреждением сердца у крыс, индуцированным лигированием передней нисходящей ветви левой коронарной артерии, поддерживать сократительную способность миокарда и обеспечивать кровоснабжение сердца. Результаты эксперимента по исследованию миокардиальных ферментов показали, что после введения лекарственного средства уровни СК, СК-МВ и LDH у модельных крыс снижались. Возможно, вследствие слишком длительного времени моделирования резкое повышение уровней этих ферментов после повреждения миокарда будет постепенно восстанавливаться со временем. Для QSYQ-1 также продемонстрирован эффект снижения уровней миокардиальных ферментов, что указывает на то, что можно достигнуть определенного эффекта защиты сердца после введения лекарственного средства. Кроме того, результаты окрашивания с помощью НЕ и методом TUNEL показали, что после введения лекарственного средства воспалительная реакция, миокардиальный фиброз и апоптоз миокардиальных клеток и т п. у модельных крыс после развития сердечной недостаточности можно ингибировать, благодаря чему достигается эффект защиты миокардиальных клеток.
Тестовый пример 2. Культивирование клеток и оценивание активности
1. Экспериментальные лекарственные средства: группа лекарственного средства по настоящему изобретению (QSYQ-1) и группа лекарственного средства для сравнения (QSYQ-2) являются такими же, как в тестовом примере 1.
Каждая из групп активных ингредиентов в отдельности содержала одно из следующего: даншенсу, протокатеховый альдегид, сальвианоловую кислоту Т, сальвианоловую кислоту U, сальвианоловую кислоту D, сальвианоловую кислоту Q розмариновую кислоту, литоспермовую кислоту, сальвианоловую кислоту В, сальвианоловую кислоту А, изосальвианоловую кислоту С, каликозин-7-глюкозид, ононин, каликозин, формононетин, дигидротаншинон I, криптотаншинон, таншинон I, таншинон IIА, нотогинзенозид R1, гинзенозид Rg1, гинзенозид Rb1, астрагалозид, гинзенозид Rd.
Масса каждой группы составляла 160 г.
2. Экспериментальные способы: QSYQ-1 и QSYQ-2 и каждую группу активного ингредиента подвергали ультразвуковому растворению, и с помощью DMSO из них получали 0,4 мг/мл исходного раствора. При осуществлении оценивания активности in vitro вышеуказанные группы соответствующим образом разбавляли одинаковым количеством экспериментальной среды.
Клетки собирали в логарифмической фазе роста и добавляли в 96-луночный культуральный планшет с черным прозрачным дном при концентрации 5000 клеток на лунку и объеме 100 мкл на лунку. Клетки инкубировали в инкубаторе с 5% СO2 при 37°С в течение 24 часов. Затем тестируемые группы соответствующим образом добавляли к экспериментальным группам, инкубировали в течение 24 часов и затем помещали в гипоксическую камеру, через которую пропускали смешанный газ, состоящий из 95% азота и 5% CO2, при скорости потока 15 л/мин в течение 10 минут, и инкубировали в течение еще 8 часов после индуцирования гипоксического повреждения при 37°С. Модельную группу инкубировали только в течение 8 часов в условиях гипоксии, а группу холостого контроля инкубировали в нормальных условиях.
Операция мечения клеточным флуоресцентным зондом заключалась в следующем: маточный раствор флуоресцентного зонда Hoechst 33342 разбавляли в 1000 раз в основной среде DMEM; затем маточный раствор MitoTracker Deep Red FM разбавляли в 10000 раз в культуральной среде, содержащей Hoechst 33342, с тем чтобы он служил в качестве «смешанного» красителя. Среду в культуральном планшете сливали и заменяли «коктейльным» красителем в количестве 50 мкл на лунку, и инкубировали в инкубаторе вдали от света в течение 30 минут. Планшет извлекали из места инкубирования вдали от света и промывали с помощью DMEM (с высоким содержанием глюкозы) 3 раза в течение 5 минут каждый раз. Затем осуществляли визуализацию живых клеток.
Операция визуализации живых клеток с помощью HCS заключалась в следующем: для визуализации ядер, меченных с помощью Hoechst 33342, выбирали длину волны возбуждающего света 360-400 нм и длину волны испускаемого света 410-480 нм; для визуализации митохондрий, меченных с помощью Mito Tracker Deep Red FM, выбирали длину волны возбуждающего света 620-640 нм и длину волны испускаемого света 650-760 нм. Для анализа визуализации с помощью HCS и считывания показателей интенсивности флуоресценции ядра/цитоплазмы применяли программное обеспечение Harmony 3.0. В системе HCS-скрининга объединены функции автоматической визуализации с помощью флуоресцентной микроскопии и может осуществляться высокопроизводительный многоиндексный анализ. Для осуществления вторичного анализа изображений и данных и управления ими, а также для построения кривой функциональной зависимости от дозы применяли высокоэффективную систему управления изображениями и данными и их анализа Columbus.
Статистический способ: такой же, как в тестовом примере 1.
3. Результаты эксперимента: в модели повреждения кардиомиоцитов, индуцированного гипоксией, на фигуре 4 и в таблице 6 количество ядер живых клеток значительно снижалось по сравнению с таковым в группе холостого контроля, тогда как при предварительном введении QSYQ-1 в экспериментальных группах демонстрировался в значительной степени отчетливо наблюдаемый защитный эффект, который превосходил эффект группы лекарственного средства для сравнения без эфирных масел (QSYQ-2). В таблице 7 показаны результаты исследования защитного эффекта отдельных компонентов в лекарственном средстве по настоящему изобретению в отношении количества ядер при повреждении миокардиальных клеток Н9с2, индуцированном гипоксией. Все из фенолокислот, флавоноидов, сапонинов, таншинонов в группе лекарственного средства по настоящему изобретению оказывали определенный защитный эффект в отношении количества кардиомиоцитов, но эффект каждого компонента уступал защитному эффекту фармацевтической композиции по настоящему изобретению при повреждении миокардиальных клеток, что указывает на то, что группа лекарственного средства по настоящему изобретению может демонстрировать синергический эффект после объединения этих различных компонентов.
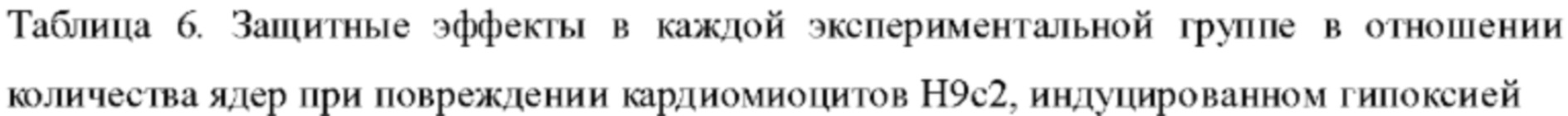

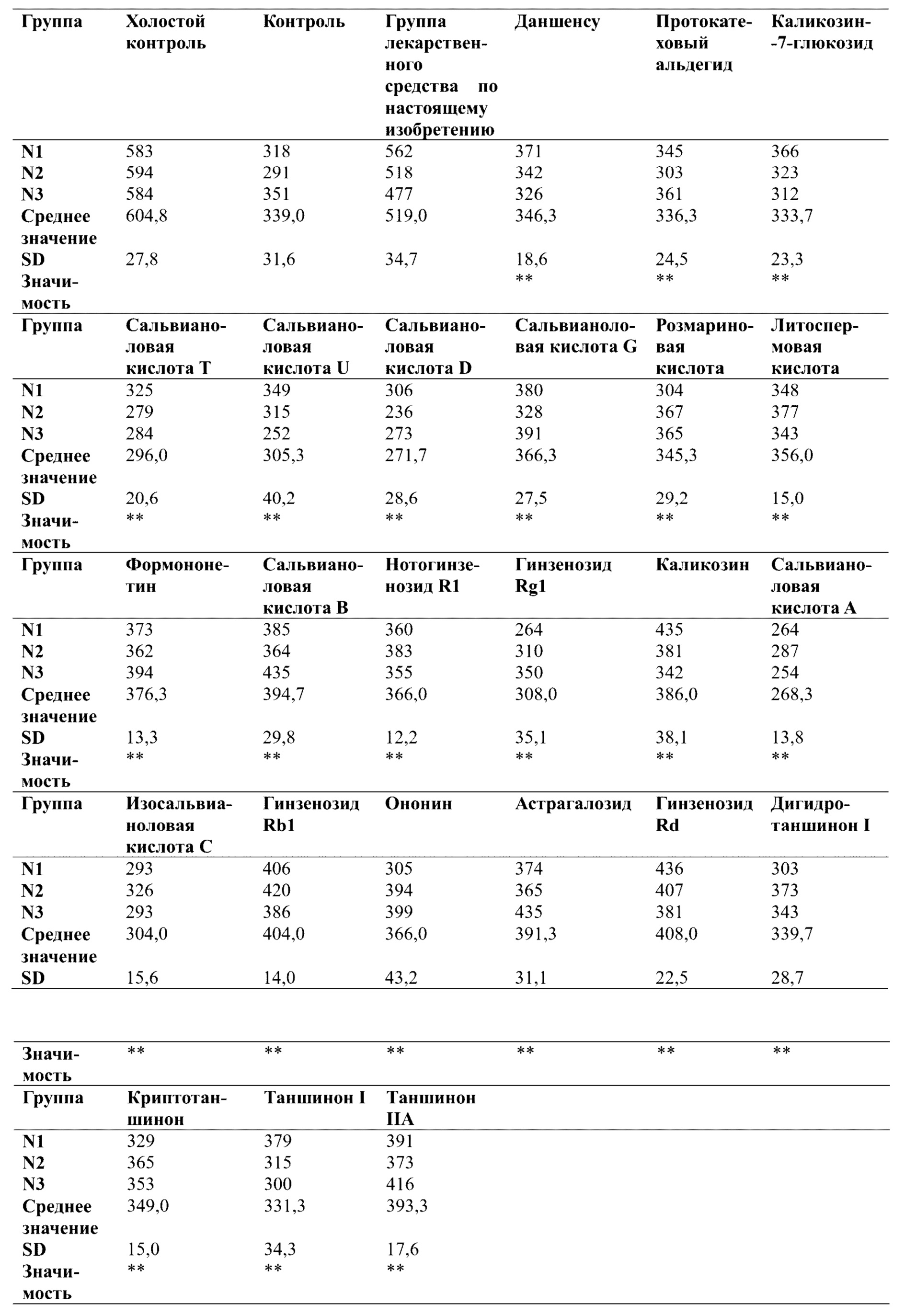

Что касается качества митохондрий, то по сравнению с группой холостого контроля, с учетом появления недостатка снабжения кислородом после гипоксического повреждения миокарда и компенсаторной регуляции внутриклеточных сенсоров кислорода для улучшения способности к использованию кислорода, модельная группа на фигуре 4 и в таблице 8 характеризовалась значительно повышенным качеством митохондрий. При этом после предварительного введения QSYQ-1 в экспериментальной группе демонстрировался весьма значительный защитный эффект, который превосходил эффект группы лекарственного средства для сравнения без эфирных масел (QSYQ-2). В таблице 9 показаны защитные эффекты группы лекарственного средства по настоящему изобретению и ее отдельных компонентов в отношении функции митохондрий при повреждении кардиомиоцитов Н9с2, индуцированном гипоксией. Результаты показали, что все из фенолокислот, флавоноидов, сапонинов, таншинонов в группе лекарственного средства по настоящему изобретению оказывали определенный защитный эффект в отношении функции митохондрий миокардиальных клеток, но эффект каждого компонента уступал защитному эффекту фармацевтической композиции по настоящему изобретению в отношении функции митохондрий после повреждения миокарда, что указывает на то, что группа лекарственного средства по настоящему изобретению может демонстрировать синергический эффект после объединения этих различных компонентов.


4. Заключение: оценки активности в таблицах 6-9 показали, что QSYQ-1 обладал значительно более высокой активностью, чем фармацевтическая композиция, состоящая из 24 компонентов (т.е. QSYQ-2), и каждый отдельный компонент, и между фармацевтическими компонентами по настоящему изобретению наблюдался синергический эффект.
Тестовый пример 3. Сердечная недостаточность с сохраненной фракцией выброса
Исследование эффективности непрерывного введения фармацевтической композиции по настоящему изобретению в течение 90 дней у макаков-резусов со спонтанной хронической сердечной недостаточностью
1. Цели исследования
Цель исследования заключалась в оценивании эффективности непрерывного введения фармацевтической композиции по настоящему изобретению в течение 90 дней в клинически эквивалентной дозе и наблюдение спонтанной хронической сердечной недостаточности (классы II-IV NYHA, HfpEF) у макаков-резусов (среднего возраста/старшего возраста). Основными фармакодинамическими индикаторами являлись эхокардиографические индикаторы для анализа структуры сердца и изменений сократительной и диастолической функций до и после введения.
2. Экспериментальные материалы и способы
2.1 Экспериментальные материалы
2.1.1 Экспериментальные животные
Вид животного: макак-резус
Уровень: обычный уровень. Перед тестом назначали карантин, в том числе физикальное обследование, два теста на наличие Mycobacterium tuberculosis и тесты на наличие паразитов, сальмонеллы, шигеллы и вируса герпеса В.
Идентификация животных: на шею надевали ошейник с номерным знаком из нержавеющей стали с выгравированными арабскими цифрами, и на груди делали татуировку.
(1) Критерии включения
Самцы в возрасте 12-23 лет (эквивалентно взрослым людям в возрасте от 40 до 70 лет).
Масса тела: 9-13 кг.
Класс II - класс IV NYHA; при этом у половины животных в каждой группе имелась HFpEF.
HFpEF (с умеренным или более существенным повреждением): е'<8 или Е/е'>10 (в соответствии с клиническими диагностическими критериями).
(2) Критерии исключения
Гипертензия 2 и 3 степени (SBP>140 мм рт. ст., DBP>90 мм рт. ст.).
Животные с тяжелой дисфункцией печени и почек, анемией, лейкоцитозом, тромбоцитопенией, нарушением электролитного баланса и аномальными колебаниями массы тела.
Животные с отчетливо наблюдаемыми клиническими аномальными симптомами или заболеваниями эндокринной системы, иммунной системы, системы свертывания крови и мочеполового тракта.
Любые другие заболевания в анамнезе, которые могут повлиять на оценку эффективности лекарственного средства.
2.1.2 Тестируемые вещества
Лекарственное средство по настоящему изобретению (пример 1, QSYQ) предоставлялось от Tasly Pharmaceutical Group Co., Ltd. Для удобства введения лекарственное средство смешивали с PEG в определенном соотношении с получением препарата в форме капельной пилюли для экспериментов с животными с номером партии 20180215.
2.2 Экспериментальные группы и введение
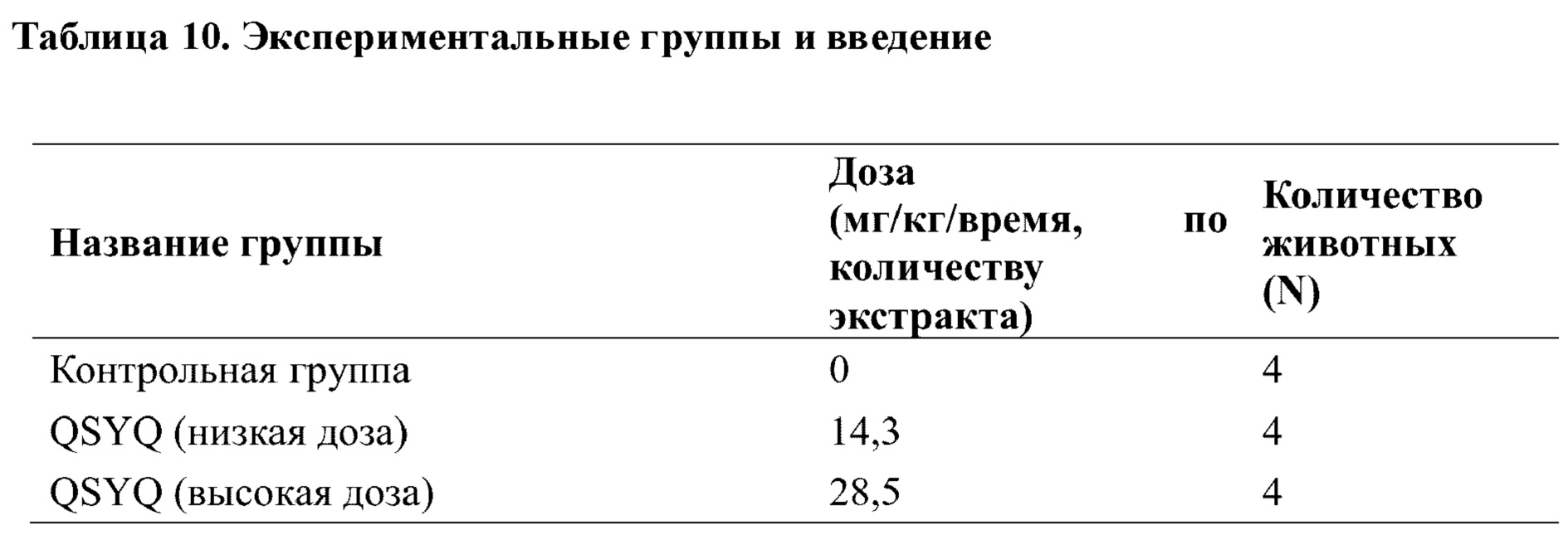
В тесте проводили разделение на 3 группы: контрольная группа, QSYQ (низкая доза), QSYQ (высокая доза), с 4 животными в каждой группе.
Путь введения: введение через носопищеводный зонд один раз в день.
Расчет дозы: дозу для следующей недели рассчитывали, исходя из массы тела, определяемой каждый раз при взвешивании.
Время введения: от 08: 00 до 10: 00, ежедневное введение.
Подробнее см. таблицу 10 ниже.
2.3 Индикаторы выявления
Первичные фармакодинамические индикаторы: сердечную функцию у обезьян с сердечной недостаточностью измеряли до введения, а также в 30-й, 60-й и 90-й дни после введения. Левожелудочковый комплекс в продольном осевом сечении левого желудочка латерально от грудины брали для измерения конечно-систолического и конечно-диастолического диаметров левого желудочка и расчета конечно-диастолического объема левого желудочка (LVEDV), конечно-систолического объема левого желудочка (LVESV), ударного объема (SV), значения Еа, значения Е/Еа и других параметров для того, чтобы оценить эффекты фармацевтической композиции по настоящему изобретению в отношении сократительной и диастолической функции у обезьян с сердечной недостаточностью.
Вторичные фармакодинамические индикаторы: соответствующие изменения кровяного давления у обезьян до введения, а также в 30-й, 60-й и 90-й дни после введения.
Регулярные наблюдения: ежедневно во время введения у животных наблюдали такие характеристики, как величина активности, потребление корма и масса тела.
3. Статистические способы
Все данные представляли собой данные измерений и выражались как среднее значение ± стандартное отклонение (
4. Результаты эксперимента
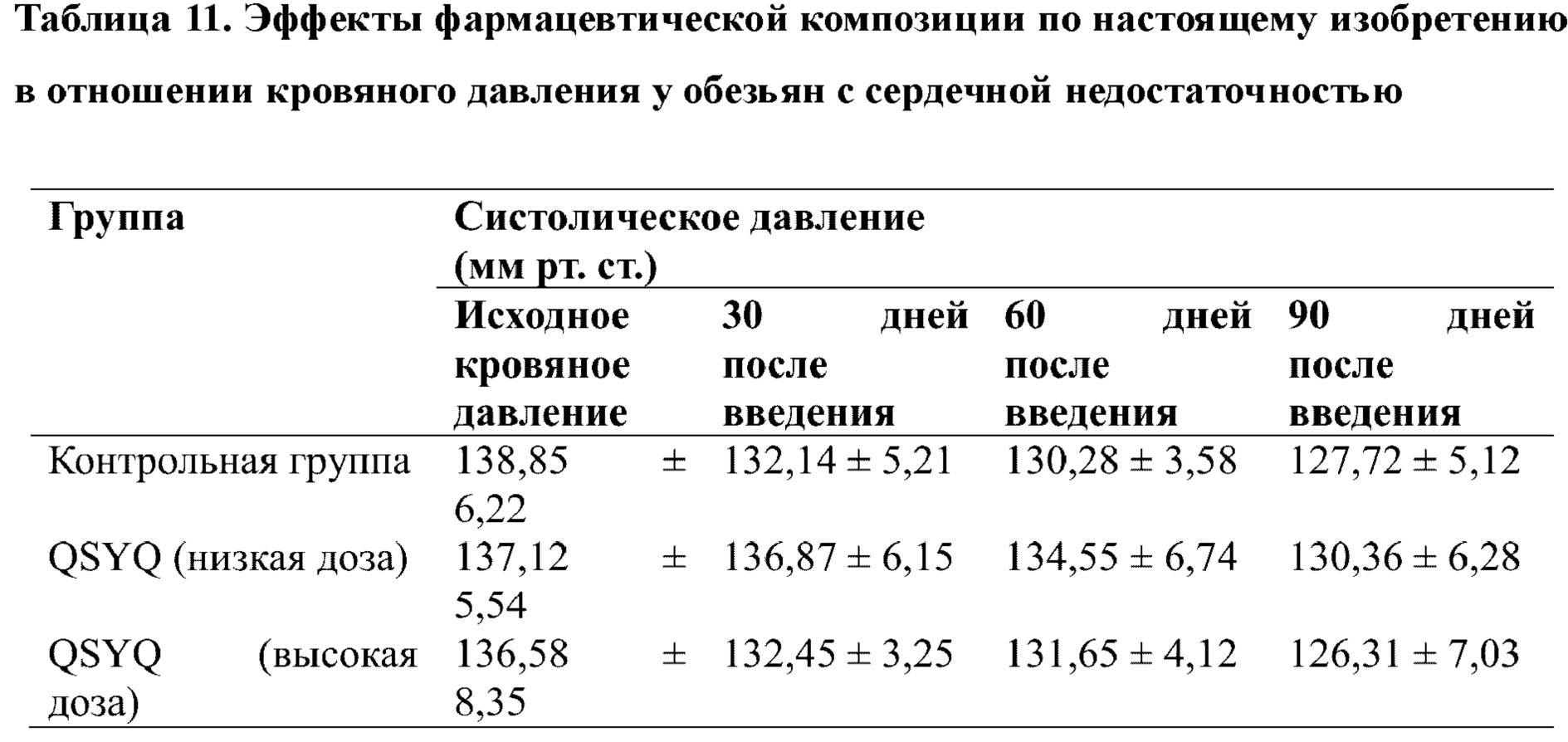
1) Эффекты в отношении кровяного давления у макаков-резусов со спонтанной хронической сердечной недостаточностью
Результаты исследования показали, что фармацевтическая композиция по настоящему изобретению оказывала определенный эффект улучшения в отношении систолического давления у обезьян с сердечной недостаточностью, и антигипертензивная эффективность являлась зависимой от дозы. Результаты показаны в таблице 11.
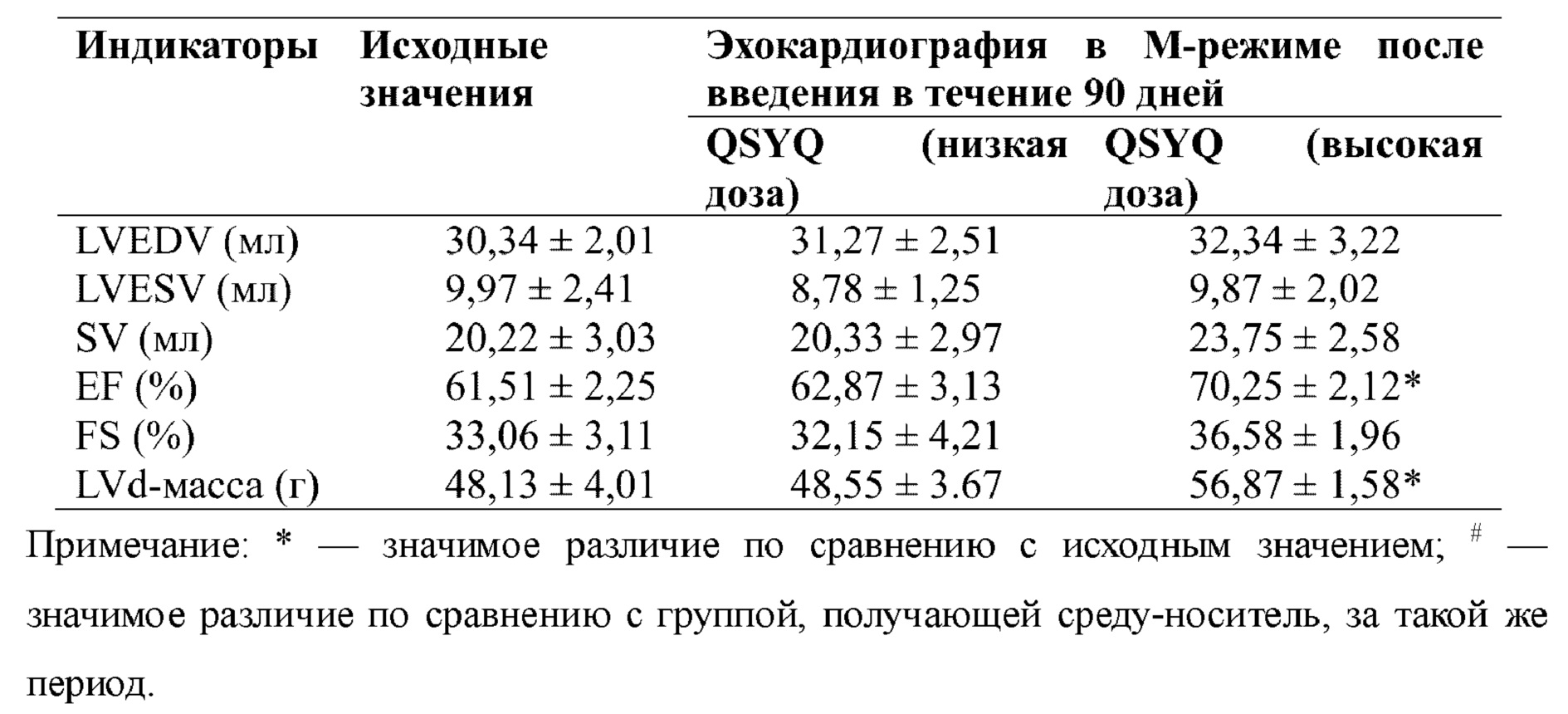
2) Эффекты в отношении сердечной функции у макаков-резусов со спонтанной хронической сердечной недостаточностью
Результаты исследования показали, что фармацевтическая композиция по настоящему изобретению характеризовалась статистически значимым различием во фракции выброса левого желудочка у обезьян с сердечной недостаточностью по сравнению с группой, получающей среду-носитель, что указывает на то, что фармацевтическая композиция по настоящему изобретению оказывала определенный эффект в отношении сократимости левого желудочка у обезьян с сердечной недостаточностью и может в определенной степени улучшать функцию левых отделов сердца у обезьян с сердечной недостаточностью. Результаты показаны в таблице 12.
Кроме того, как Еа, так и Е/Еа являются широко используемыми параметрами для выявления диастолической функции и чувствительными индикаторами для оценивания диастолической функции левого желудочка сердца, и значение Е/Еа, составляющее приблизительно 9, у обезьян является оптимальным. В исследовании было обнаружено, что как изменение пиковой скорости движения фиброзного кольца митрального клапана в ранней диастоле (ΔЕа), так и изменение Е/Еа (ΔЕ/Еа) в группе введения улучшались в большей степени, чем в модельной группе (см. фигуры 5 и 6).

3) Ежедневное наблюдение
Во время введения экспериментальных животные наблюдали ежедневно. Было обнаружено, что животные в контрольной группе характеризовались меньшей активностью и часто характеризовались наличием диспноэ, ухудшением физического состояния, слабостью и меньшим потреблением корма после проявления активности. Животные в группе, которой вводили фармацевтическую композицию по настоящему изобретению (QSYQ), характеризовались более высокой средней дневной активностью, чем животные в контрольной группе, являлись оживленными и активными, имея хорошую физическую силу, и одышка и другие симптомы были редкими, а потребление корма животными было нормальным.
5. Заключение
Непрерывное введение фармацевтической композиции по настоящему изобретению в течение 90 дней может приводить к увеличению фракции выброса у модельной обезьяны, характеризующейся сердечной недостаточностью с сохраненной фракцией выброса, улучшению ее сократительной функции, а также оказывать определенный эффект улучшения в отношении ее диастолической функции.
Вышеприведенные описания конкретных иллюстративных вариантов осуществления настоящего изобретения были представлены в целях описания и иллюстрации. Эти описания не предназначены для ограничения настоящего изобретения раскрытыми точными формами, и, очевидно, можно осуществлять множество видоизменений и модификаций в свете вышеприведенных идей. Иллюстративные варианты осуществления выбраны и описаны с целью пояснения определенных принципов настоящего изобретения и их практического применения, что таким образом позволяет специалисту в данной области создавать и использовать различные иллюстративные варианты осуществления настоящего изобретения, а также их различные альтернативы и модификации. Предполагается, что объем настоящего изобретения определяется прилагаемой к данному документу формулой изобретения и ее эквивалентами.
Реферат
Группа изобретений относится к фармацевтической промышленности, а именно к композиции для лечения или предупреждения повреждения миокарда или сердечной недостаточности. Фармацевтическая композиция для лечения или предупреждения повреждения миокарда или сердечной недостаточности, содержащая следующие компоненты: фенолокислоты 2-20 частей по массе; флавоноиды 0,5-5 частей по массе; таншиноны 0,005-0,5 части по массе; сапонины 5-20 частей по массе; эфирные масла 10-18 частей по массе; где фенолокислоты включают даншенсу, протокатеховый альдегид, сальвианоловую кислоту T, сальвианоловую кислоту U, сальвианоловую кислоту D, сальвианоловую кислоту G, розмариновую кислоту, литоспермовую кислоту, сальвианоловую кислоту B, сальвианоловую кислоту A, изосальвианоловую кислоту C; флавоноиды включают каликозин-7-глюкозид, ононин, каликозин, формононетин; таншиноны включают дигидротаншинон I, криптотаншинон, таншинон I, таншинон IIA; сапонины включают нотогинзенозид R1, гинзенозид Rg1, гинзенозид Rb1, астрагалозид, гинзенозид Rd; и эфирные масла включают транс-неролидол, оксид неролидола. Применение вышеописанной фармацевтической композиции для получения лекарственного препарата для улучшения состояния при повреждении миокарда или лекарственного препарата для лечения или предупреждения сердечной недостаточности. Фармацевтический препарат для лечения или предупреждения повреждения миокарда или сердечной недостаточности, содержащий вышеописанную фармацевтическую композицию, где фармацевтическая композиция составляет 0,1~99,9 масс. % фармацевтического препарата, а остальное представляет собой фармацевтически приемлемый(приемлемые) носитель(носители). Способ лечения или предупреждения повреждения миокарда или сердечной недостаточности, включающий введение эффективного количества вышеописанных фармацевтической композиции или фармацевтического препарата субъекту, у которого имеется повреждение миокарда и/или сердечная недостаточность или риск их наличия. Вышеописанные композиция и препарат обладают синергетической активностью в отношении лечения или предупреждения повреждения миокарда или сердечной недостаточности. 4 н. и 22 з.п. ф-лы, 6 ил., 12 табл., 3 пр.

Комментарии