Способ лечения болезни паркинсона - RU2677278C2
Код документа: RU2677278C2
Чертежи


Описание
ОБЛАСТЬ ТЕХНИКИ
[0001] В настоящем изобретении предложен способ лечения неврологических или двигательных расстройств, таких как болезнь Паркинсона, путем парентерального введения леводопы и карбидопы и сопутствующего перорального введения ингибитора катехол-О-метилтрансферазы (КОМТ), такого как энтакапон или толкапон.
УРОВЕНЬ ТЕХНИКИ
[0002] Болезнь Паркинсона представляет собой дегенеративное состояние, характеризующееся сниженной концентрацией нейромедиатора дофамина в головном мозге. Леводопа (L-дофа или L-3,4-дигидроксифенилаланин) является непосредственным метаболическим предшественником дофамина, который, в отличие от дофамина, способен проникать через гематоэнцефалический барьер, и наиболее часто используется для восстановления концентрации дофамина в головном мозге. В течение последних 40 лет леводопа остается наиболее эффективным средством для лечения болезни Паркинсона.
[0003] Тем не менее, леводопа имеет малый период полувыведения из плазмы, что даже при наилучшем уровне ухода за пациентом, возможном в настоящее время, приводит к пульсирующей дофаминергической стимуляции. Поэтому долгосрочное лечение осложняется двигательной неустойчивостью и дискинезией, которые могут быть причиной значительного нарушения здоровья для некоторых пациентов. Стратегия лечения, способная в идеале обеспечить доставку леводопы/дофамина в головной мозг более непрерывным и физиологическим образом, обеспечила бы преимущества стандартного применения леводопы при снижении двигательных осложнений и является остро востребованной пациентами, страдающими болезнью Паркинсона и другими неврологическими или двигательными расстройствами (Olanow, Mov. Dis., 2008, 23 (Suppl. 3), S613-S622). Были разработаны составы для перорального введения леводопы с замедленным высвобождением, но было показано, что подобные препараты в лучшем случае продемонстрировали не большую эффективность, чем стандартные таблетки. Также предпринимались попытки непрерывного введения леводопы путем интрадуоденального введения или инфузии с применением портативных насосов или пластырей. Подобные способы лечения, особенно интрадуоденальный, являются крайне инвазивными и неудобными.
[0004] Метаболическое преобразование леводопы в дофамин катализируется ферментом декарбоксилазой ароматических L-аминокислот, повсеместно присутствующим ферментом с особо высокими концентрациями в слизистой оболочке кишечника, печени, головном мозге и капиллярах головного мозга. Ввиду внемозгового метаболизма леводопы требуется вводить большие дозы леводопы, что приводит к высокой внемозговой концентрации дофамина, вызывающей нежелательные побочные эффекты у некоторых пациентов. По этой причине леводопу обычно вводят с сопутствующим пероральным введением ингибитора дофадекарбоксилазы, таким как карбидопа или бенсеразид, что на 60-80% снижает дозу леводопы, необходимую для достижения клинического ответа, и, таким образом, предотвращает некоторые из ее побочных эффектов путем ингибирования преобразования леводопы в дофамин вне головного мозга.
[0005] Дополнительные внемозговые метаболические пути леводопы включают преобразование посредством моноаминоксидазы (МАО) или катехол-О-метилтрансферазы (КОМТ), которая превращает леводопу в 3-метокси-4-гидроксил-L-фенилаланин (3-О-метилдопа, 3-ОМД), метаболит, конкурирующий с леводопой при прохождении через гематоэнцефалический барьер. Таким образом, ингибирование МАО, например, моклобемидом, разагилином, селегинином или сафинамидом, или ингибирование КОМТ, например, энтакапоном или толкапоном, повышает эффективность леводопы. Энтакапон демонстрирует короткое двухфазное выведение, с периодом полувыведения в β-фазе примерно от 0,4 до примерно 0,7 часов и периодом полувыведения в γ-фазе примерно 2,4 часа, и по этой причине обычно его вводят от шести до восьми раз в день. Толкапон связывается с каталическим центром КОМТ как в периферической, так и в центральной нервной системах, с
[0006] Эффективность ингибиторов метаболических путей леводопы, при сопутствующем введении с леводопой, в отношении повышения уровня последней в крови хорошо освещена, и были предложены различные составы леводопы с такими ингибиторами. Например, доступные в настоящий момент лекарственные средства для перорального применения включают СИНЕМЕТ (SINEMET®) и таблетки СИНЕМЕТ CR (SINEMET® CR) с замедленным высвобождением, включающие леводопу и карбидопу, а также таблетки МАДОПАР (MADOPAR®), содержащие леводопу и бенсеразид. Дополнительные составы леводопы и карбидопы для подкожного, предпочтительно непрерывного, введения, предложены в публикациях международных заявок WO 2010/134074 и WO 2012/066538, содержание которых полностью включено в настоящее описание посредством ссылки, как если бы оно было полностью приведено в настоящем описании.
[0007] Другим лекарственным средством для перорального применения являются таблетки СТАЛЕВО (STALEVO®), содержащие леводопу, карбидопу и энтакапон, и составы с этими ингредиентами, например, для подкожного введения, раскрыты в вышеприведенной WO 2012/066538, где также раскрыто пероральное введение СИНЕМЕТ (SINEMET®) и сопутствующее непрерывное подкожное введение либо энтакапона, либо энтакапона и карбидопы.
[0008] В источнике Nyholm et al. (European Journal of Neurology, 2012, 19, 820-826) показали, что пероральное введение 200 мг энтакапона и сопутствующая внутрикишечная инфузия леводопы и карбидопы в дозировке, равной 80% от оптимизированной для пациента дозы, позволяет поддерживать уровень леводопы в крови, по существу аналогичный достигаемому при приеме оптимизированной дозы леводопы и карбидопы без энтакапона. Иными словами, Nyholm с соавторами показали, что пероральное введение энтакапона позволяет снизить первичную дозировку вводимых леводопы и карбидопы на 20% при сохранении желаемого уровня леводопы в крови.
[0009] Тем не менее, различные известные составы не обеспечивают оптимального лечения болезни Паркинсона ввиду остающегося относительно высоким уровня побочных эффектов и колебаний уровня леводопы в крови. Таким образом, существует постоянная острая потребность в способах лечения двигательных расстройств, таких как болезнь Паркинсона, которые могли бы обеспечить постоянный уровень леводопы в крови у пациентов, что привело бы к постоянной дофаминэнергической стимуляции головного мозга, и в то же время ограничить побочные эффекты, вызываемые высокой периферической концентрацией леводопы, возникающей при введении леводопы в высоких дозах.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0010] В одном аспекте согласно настоящему изобретению предложен способ лечения болезни Паркинсона у нуждающегося в этом индивида, включающий парентеральное введение фармацевтической композиции, содержащей карбидопу и леводопу или их фармацевтически приемлемые соли, указанному индивиду; и пероральное введение ингибитора катехол-О-метилтрансферазы (КОМТ), такого как энтакапон или толкапон.
[0011] В другом аспекте настоящее изобретение относится к карбидопе или ее фармацевтически приемлемой соли, леводопе или ее фармацевтически приемлемой соли и ингибитора КОМТ для применения в комбинации для лечения болезни Паркинсона, причем карбидопа и леводопа (или их соли) приготовлены в виде единой композиции для парентерального введения, а указанный ингибитор приготовлен в виде композиции для перорального введения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0012] На фиг. 1А-1В показано влияние карбидопы на стабильность леводопы in vitro и ex vivo: 1А. Раствор 6% масс. леводопы и аргинина с различными концентрациями (2, 1,5, 1, 0,5%) карбидопы или без карбидопы испытывали на физическую стабильность in vitro. Результаты показывают, что карбидопа предотвращает образование темно-желтой окраски в присутствии воздуха дозозависимым образом (маленькие флаконы справа), а в отсутствие воздуха (с N2 в свободном пространстве над содержимым флакона) 0,5% карбидопы было достаточно для предотвращения образования этой окраски (большие флаконы слева на фигуре). 1В. Раствор 7% масс. леводопы и аргинина с или без 2% масс. карбидопы непрерывно вводили в подкожную ткань образца свежей полнослойной шкуры свиньи размером 5×5 см. Справа изображен эффект ингибирования окисления при использовании состава леводопы, который включает карбидопу.
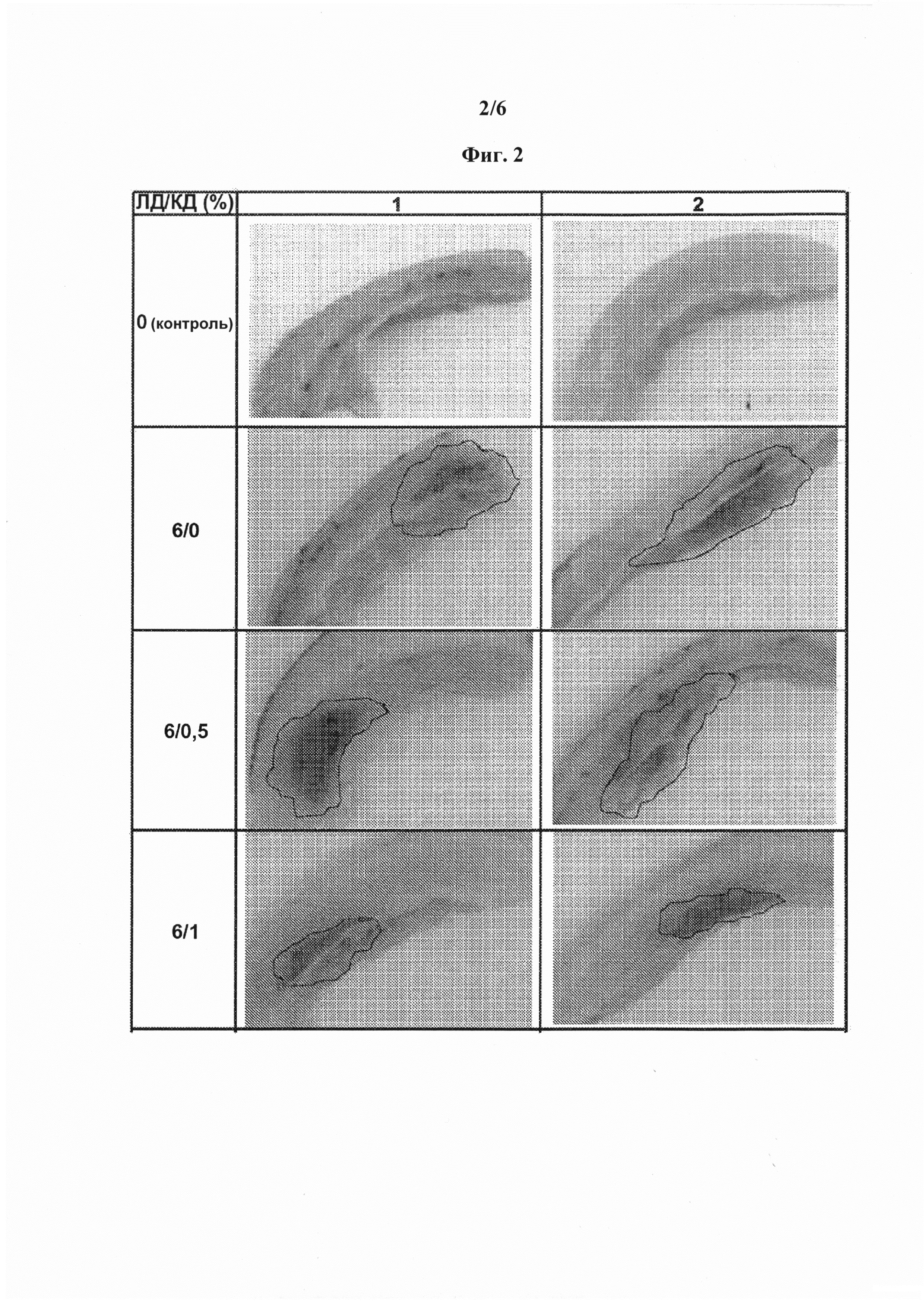
[0013] На фиг. 2 показано, что присутствие 1% карбидопы в растворе леводопы снижает тяжесть и распространение вызванной леводопой местной подкожной токсичности у свиньи.
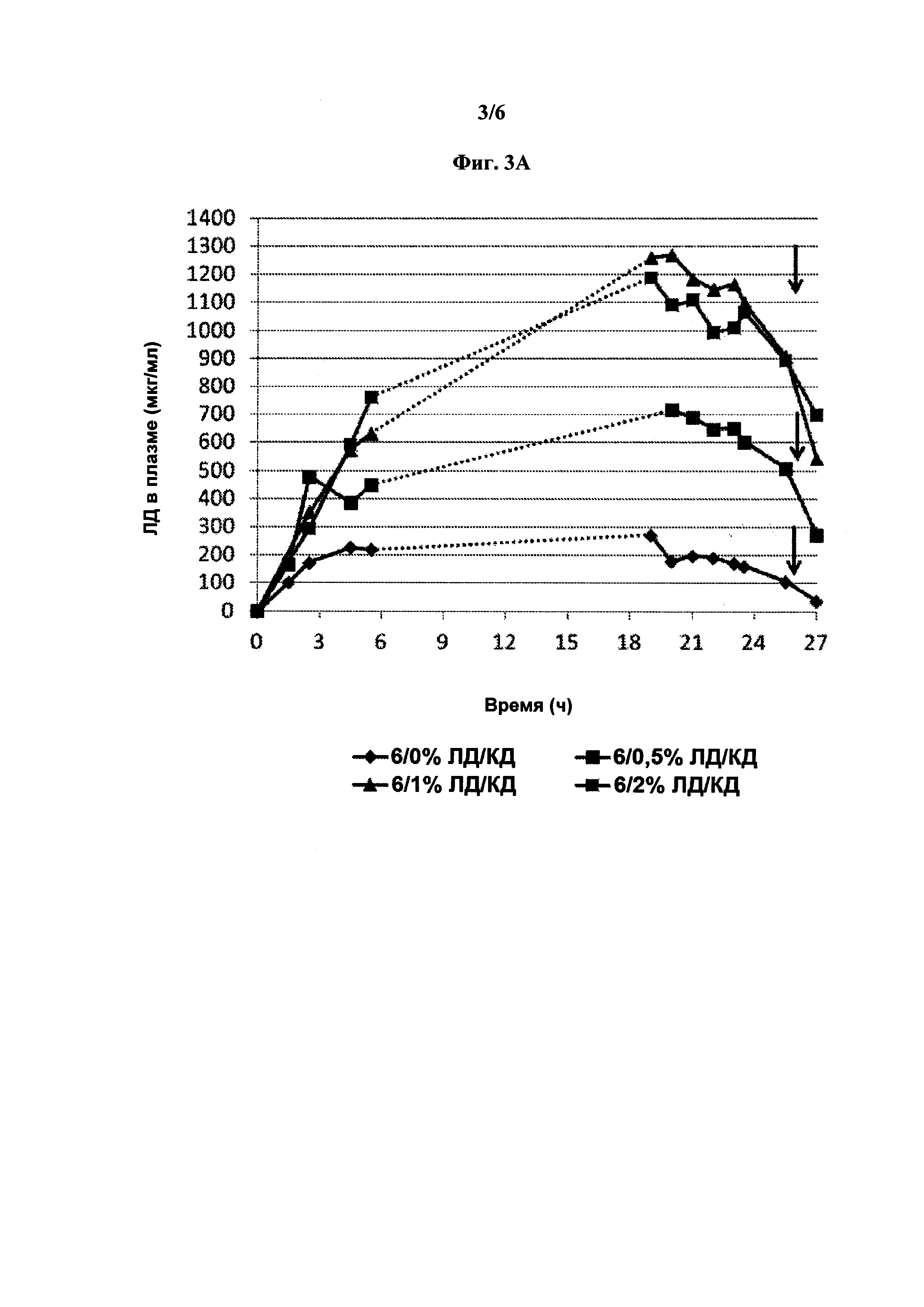
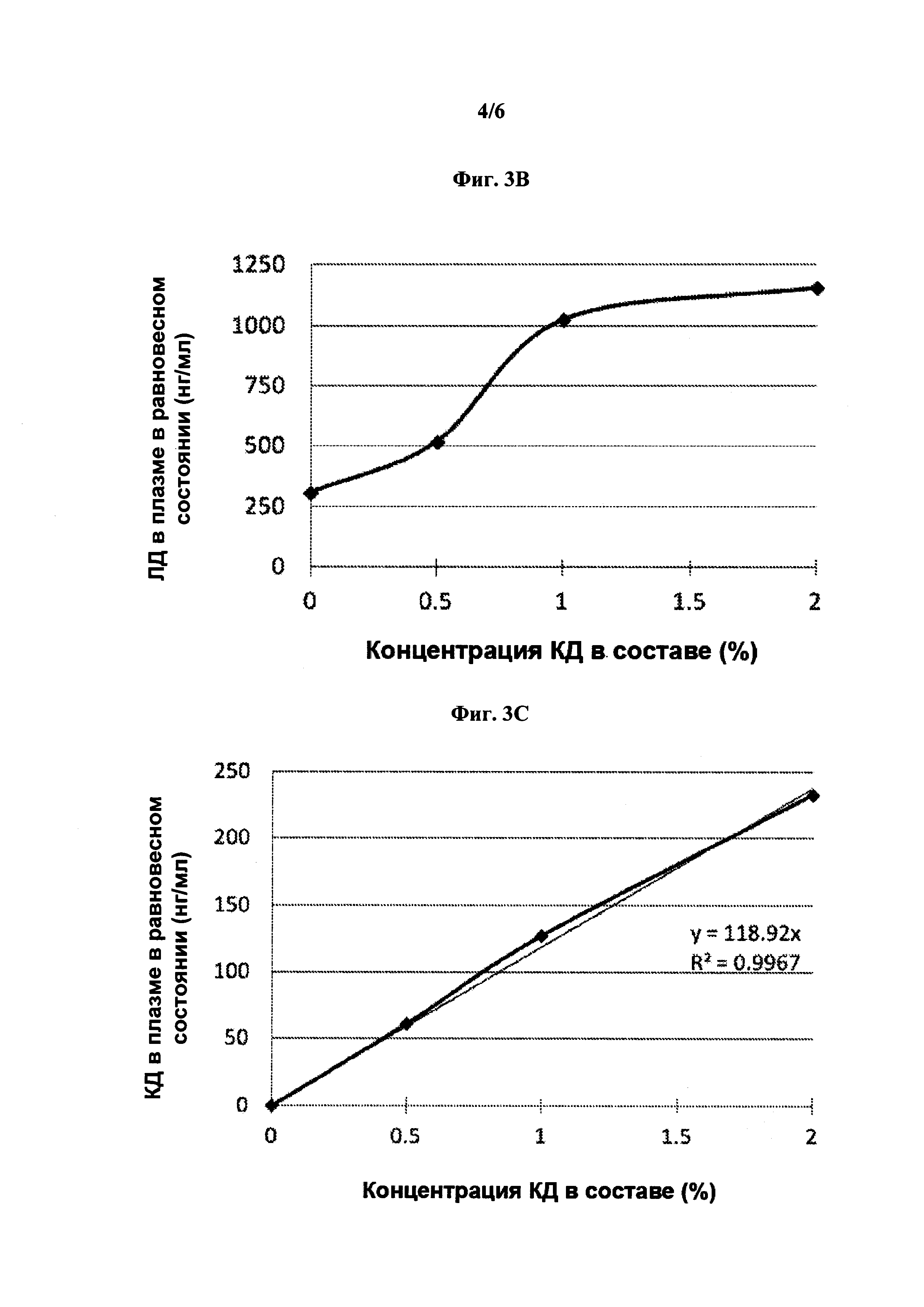
[0014] На фиг. 3А-3С показано влияние карбидопы на фармакокинетику леводопы в эксперименте на свинье. 3А: концентрация леводопы в плазме после непрерывного подкожного введения 6% леводопы с различными количествами карбидопы. 3В: Корреляция между концентрациями леводопы в равновесном состоянии в плазме, достигнутыми после непрерывного подкожного введения составов леводопы/карбидопы и концентрацией карбидопы в составе. 3С: Корреляция между концентрациями леводопы в равновесном состоянии в плазме после непрерывного подкожного введения составов леводопы/карбидопы и концентрацией карбидопы в составе.
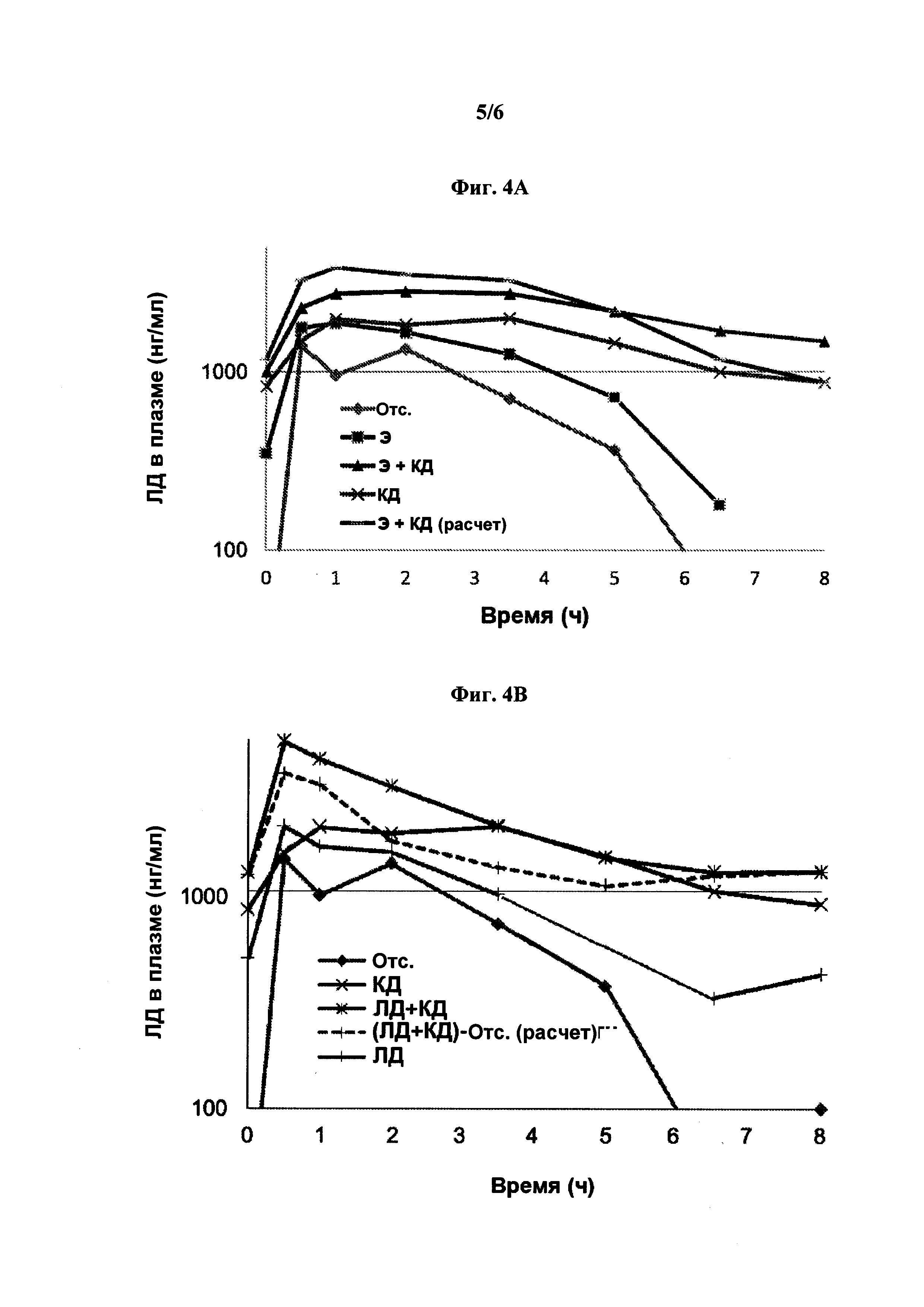
[0015] На фиг. 4А-4В показано влияние непрерывного подкожного (SC) введения энтакапона (Э) и/или карбидопы (КД) (40 мг/24 ч) на концентрацию в плазме леводопы (ЛД, нг/мл) после перорального введения Синемета (100/25 леводопа/карбидопа) свиням (4А); и влияние непрерывного SC введения КД (40 мг/24 ч) и/или ЛД (140 мг/24 ч) на концентрацию ЛД в плазме после перорального введения Синемета свиням (4В).
[0016] На фиг. 5 показано влияние карбидопы на местную подкожную токсичность леводопы после 24 ч непрерывного подкожного введения, в дозе 0,16 мл/ч у свиней.
[0017] На фиг. 6 показано влияние перорального введения энтакапона (200 мг каждые 2 ч) на концентрацию в плазме леводопы (ЛД), карбидопы (КД) и 3-О-метилдопы (3-OMD) при непрерывном подкожном (SC) введении леводопы (360 мг/24 ч) и карбидопы (90 мг/24 ч) людям-добровольцам.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0018] Как указано выше, сопутствующее введение леводопы и активного агента, способного ингибировать путь метаболизма леводопы, хорошо известно, и одним из коммерчески доступных лекарственных средств для лечения болезни Паркинсона является СТАЛЕВО (STALEVO®), где указанное лекарственное средство содержит комбинацию леводопы, карбидопы и энтакапона. Тем не менее, несмотря на преимущества, ассоциируемые с совместным пероральным введением указанных трех компонентов, данный конкретный способ введения обладает рядом недостатков, поскольку пероральное введение приводит к колебаниям уровня леводопы в крови; кроме того, энтакапон, при его присутствии в одном растворе с карбидопой, например, после растворения таблетки в желудочно-кишечном тракте, снижает биологическую доступность карбидопы. Это четко указано в источнике Ahtila et al. (Clin Neuropharmacol., 1995, 18(1), 46-57), где продемонстрировано, что высокие дозы энтакапона (400 мг и 800 мг) при сопутствующем пероральном введении с леводопой и карбидопой снижают общее количество карбидопы в крови, но не оказывают влияния на время достижения максимальной концентрации (Tmax) карбидопы. Ahtila с соавторами также показали, что максимальное увеличение общего количества леводопы, вызванное добавлением энтакапона к перорально вводимым леводопе и карбидопе, составило примерно 33% (после введения дозы энтакапона 400 мг).
[0019] Вышесказанное позволяет предположить, что возможно получить предпочтительный эффект от введения карбидопы отдельно от энтакапона, то есть используя либо различные способы введения, либо вводя их в два различных места в теле пациента. Действительно, как уже показано авторами настоящего изобретения и описано WO 2012/066538, пероральное введение Синемета (Sinemet®) (леводопа/карбидопа, 100/25 мг) и сопутствующее подкожное введение либо энтакапона, либо комбинации энтакапона и карбидопы (приготовленных в виде различных композиций) приводит к повышению уровня леводопы в крови. Как конкретно показано, энтакапон и карбидопа при непрерывном подкожном введении совместно с Синеметом оказывают синергическое воздействие на фармакокинетику леводопы в плазме.
[0020] Согласно другому подходу, описанному в вышеуказанном источнике Nyholm et al., энтакапон вводят перорально, в то время как комбинацию леводопы и карбидопы вводят сопутствующим образом путем внутрикишечной инфузии, и, как показано, пероральное введение энтакапона позволяет уменьшить исходную дозу вводимой леводопы и карбидопы на 20% при сохранении желаемого уровня леводопы в крови. Согласно Nyholm et al., описанный способ введения может позволить увеличить уровень леводопы на 33%.
[0021] В соответствии с настоящим изобретением обнаружено, что непрерывное подкожное введение композиции, содержащей как леводопу, так и карбидопу, и сопутствующее пероральное введение ингибитора катехол-О-метилтрансферазы, в частности энтакапона, пациентам с болезнью Паркинсона неожиданно повышает уровень леводопы в крови более чем на 40%, в частности от примерно 420 нг/мл до примерно 620 нг/мл, при поддержании постоянного уровня леводопы в крови без значительных колебаний, и, таким образом, позволяет значительно снизить исходную дозу леводопы, вводимую пациентам с болезнью Паркинсона, и, следовательно, снизить побочные эффекты данного лекарственного средства. Более того, приведенные в настоящем описании экспериментальные данные показывают, что введение единой композиции, содержащей леводопу и карбидопу, обладает дополнительными преимуществами по сравнению с раздельным введением ввиду снижения локальных побочных эффектов, вызываемых леводопой при введении совместно с карбидопой.
[0022] Эти результаты демонстрируют, что пероральное введение ингибитора КОМТ с сопутствующим парентеральным, например подкожным, введением, в частности непрерывным парентеральным введением, леводопы и ингибитора дофа-декарбоксилазы, такого как карбидопа, позволяет достичь уровня леводопы в крови, значительно более высокого чем в любом из известных аналогов, в которых применяют другие режимы введения. Это позволяет предположить, что представленный в настоящем описании режим введения позволяет максимально использовать ингибирующий потенциал обоих ингибиторов.
[0023] В настоящем изобретении, таким образом, предложена стратегия лечения неврологического или двигательного расстройства, такого как болезнь Паркинсона, включающая парентеральное (например, непрерывное) введение комбинации леводопы и ингибитора дофа-декарбоксилазы, или фармацевтически приемлемых солей указанных агентов, с сопутствующим пероральным введением ингибитора КОМТ. Такая стратегия позволяет обеспечить высокий уровень леводопы в плазме, обеспечивающий по существу непрерывную стимуляцию дофаминэргической системы головного мозга, и может позволить снизить частоту перорального приема ингибиторов КОМТ с 5-8 раз в день до 2-3 раз в день и/или снизить ежедневную дозировку леводопы и/или ингибитора КОМТ.
[0024] Неврологическое расстройство представляет собой расстройство нервной системы организма. Термин "двигательное расстройство" в контексте настоящего описания обозначает состояние нервной системы, вызывающее аномальные контролируемые или неконтролируемые движения или замедленные, ограниченные движения.
[0025] Неврологические или двигательные расстройства, которые подлежат лечению с примененением предложенной в настоящем описании стратегии лечения, включают, но не ограничивается ими: болезнь Паркинсона, вторичный паркинсонизм, синдром беспокойных ног, болезнь Хантингтона, синдром Шая-Дрейджера и дистонию, в также различные состояния, вызванные повреждением мозга, такие как, без ограничения ими, отравление монооксидом углерода или марганцем. В одном из вариантов реализации неврологическое заболевание, подлежащее лечению согласно данной стратегии, представляет собой болезнь Паркинсона.
[0026] Термин "ингибитор дофа-декарбоксилазы" в контексте настоящего описания обозначает агент, способный ингибировать периферический метаболизм леводопы с образованием дофамина посредством декарбоксилазы ароматических L-аминокислот, такой как карбидопа и бенсеразид. В конкретном варианте реализации в качестве ингибитора дофа-декарбоксилазы, используемого в соответствии с описанной стратегией лечения, применяют карбидопу или ее фармацевтически приемлемую соль.
[0027] Термин "ингибитор катехол-О-метилтрансферазы (КОМТ)" в контексте настоящего описания обозначает агент, способный ингибировать деградацию леводопы до 3-О-метилдопы (3-ОМД) под действием катехол-О-метилтрансферазы и, таким образом, продлевать период полувыведения леводопы из кровотока. Примеры ингибиторов КОМТ включают, но не ограничиваются ими: энтакапон, обладающий только периферической активностью, а также толкапон и нитекапон, обладающие активностью как в периферической, так и в центральной нервной системе. Предпочтительными для введения в соответствии с предложенной в настоящем описании стратегией лечения ингибиторы КОМТ являются энтакапон и толкапон. Доза вводимого ингибитора КОМТ определяется таким образом, чтобы обеспечить по существу непрерывное ингибирование активности КОМТ при введении, таким образом увеличивая время полувыведения введенной леводопы и значительно снижая колебания уровня леводопы в плазме, с тем чтобы избежать низких остаточных уровней леводопы в плазме.
[0028] В соответствии с предложенной в данном описании стратегией лечения, комбинация леводопы и ингибитора дофадекарбоксилазы, например карбидопы, вводимая парентерально получающему лечение индивиду, может быть приготовлена в виде двух отдельных фармацевтических композиций (далее "композиции для парентерального введения"), причем одна из указанных композиций содержит леводопу или ее фармацевтически приемлемую соль, а другая содержит указанный ингибитор дофа-декарбоксилазы или его фармацевтически приемлемую соль; или приготовлена в виде единой фармацевтической композиции, содержащей оба активных компонента (далее "композиция для парентерального введения"). В конкретном варианте реализации комбинация леводопы и ингибитора дофа-декарбоксилазы приготовлена в виде единой фармацевтической композиции, которую вводят парентерально получающему лечение индивиду, а ингибитор КОМТ, например энтакапон или толкапон, приготовлен в виде фармацевтической композиции, вводимой указанном индивиду перорально (далее "композиция для перорального введения").
[0029] Термин "фармацевтическая композиция" в настоящем описании обозначает композицию, содержащую по меньшей мере один активный компонент, указанный в настоящем описании, приготовленный совместно с одним или более фармацевтически приемлемыми носителями или фармацевтически приемлемыми вспомогательными веществами. Термины "фармацевтически приемлемый носитель" и "фармацевтически приемлемое вспомогательное вещество" в контексте настоящего описания обозначают любые и все растворители, дисперсионные среды, консерванты, антиоксиданты, покрытия, изотонические и абсорбирующие замедлители высвобождения и т.п., совместимые с фармацевтическим способом введения. Применение таких средств и агентов для фармацевтически активных веществ хорошо известно специалистам. Композиции также могут включать другие активные компоненты, обеспечивающие поддерживающие, дополнительные или усиленные терапевтические функции. Термин "фармацевтически или фармакологически приемлемый" включает молекулы и композиции, не вызывающие вредной, аллергической или иной неблагоприятной реакции при введении животному или человеку соответствующим образом. Для введения людям препараты должны соответствовать стандартам стерильности, апирогенности, безопасности и чистоты согласно требованиям, например, Отдела биологических стандартов Управления по контролю пищевых продуктов и лекарственных средств США (FDA).
[0030] В одном аспекте согласно настоящему изобретению, таким образом, предложен способ лечения неврологического или двигательного расстройства, такого как болезнь Паркинсона, у нуждающегося в этом индивида, включающий парентеральное введение указанному индивиду фармацевтической композиции, содержащей карбидопу и леводопу или их фармацевтически приемлемые соли и пероральное введение указанному индивиду ингибитора катехол-О-метилтрансферазы (КОМТ). В альтернативном способе карбидопу и леводопу или их фармацевтически приемлемые соли вводят парентерально в виде двух отдельных фармацевтических композиций, причем одна из этих композиций содержит карбидопу или ее фармацевтически приемлемую соль, а другая содержит леводопу или ее фармацевтически приемлемую соль.
[0031] Композиция для парентерального введения может быть введена любым парентеральным путем, например подкожно, чрескожно, внутрикожно, внутривенно, внутримышечно, эндотрахеально, интраназально, интратекально, внутрижелудочно или интрадуоденально, в одном или более мест на теле индивида. В конкретных вариантах реализации парентеральную композицию вводят по существу непрерывно, например вводят указанному индивиду по существу непрерывным образом подкожно, чрескожно, внутрикожно, внутрижелудочно или интрадуоденально. Непрерывное введение композиции для парентерального введения может быть обеспечено путем применения, например, инфузионного насоса или кожного пластыря, а именно устройства, подходящего для чрескожного или подкожного введения композиции для парентерального введения, то есть Способного обеспечивать доставку указанной композиции сквозь кожу или слизистую оболочку в кровоток пациента. Кожные пластыри, пригодные для применения согласно способу в соответствии с настоящим изобретением, могут иметь один или более участков, содержащих вводимую парентеральную композицию или композиции, и описаны, например, в вышеуказанной публикации WO 2012/066538.
[0032] Массовое отношение леводопы к ингибитору дофа-декарбоксилазы, например карбидопе, которые вводят в соответствии со способом согласно настоящему изобретению, может быть любым, которое достаточно для обеспечения при сопутствующем введении ингибитора КОМТ поддержания терапевтических уровней леводопы в плазме, вне зависимости от того, приготовлены ли указанные леводопа и ингибитор дофа-декарбоксилазы в виде единой композиции для парентерального введения или в виде двух отдельных композиций для парентерального введения. В конкретных вариантах реализации массовое отношение леводопа: карбидопа может находиться в диапазоне от примерно 20:1 до примерно 1:1.
[0033] В некоторых вариантах реализации композиция для парентерального введения дополнительно содержит аргинин. В соответствии с такими вариантами реализации композиция для парентерального введения содержит карбидопу и леводопу в общем мольном соотношении с аргинином от примерно 1:2 до примерно 1:3,5. Как указано ранее авторами настоящего изобретения и раскрыто в WO 2010/134074 и WO 2012/066538, такие композиции являются гораздо более стабильными, чем композиции без использования аргинина или композиции, в которых вместо аргинина использованы отличные от аргинина основные аминокислоты, например лизин или гистидин.
[0034] В некоторых конкретных таких вариантах реализации композиция для парентерального введения в соответствии со способом согласно настоящему изобретению содержит: (i) аргинин, от примерно 0,1% до примерно 2% масс. карбидопы и от примерно 4% до примерно 8% масс. леводопы; или (ii) аргинин, от примерно 0,6% до примерно 1,5% масс. карбидопы и примерно 6% масс. леводопы. Такие композиции могут быть введены со скоростью от примерно 0,1 до примерно 1000 мкл/ч/место; или в объеме от примерно 2 до примерно 10 мл/24 ч/место, например, от примерно 4 до примерно 6 мл/24 ч/место; или в дозировке от примерно 80 до примерно 800 мг леводопы/день и от примерно 20 до примерно 200 мг карбидопы/день; или со скоростью от примерно 240 до примерно 360 мг леводопы и от примерно 60 до примерно 90 мг карбидопы/день/место. Более конкретно, такие композиции для парентерального введения вводят подкожно, чрескожно, внутрикожно, внутривенно, внутримышечно, эндотрахеально, интраназально или интратекально.
[0035] В других таких конкретных вариантах реализации композиция для парентерального введения содержит (i) аргинин, от примерно 1% до примерно 4% масс. карбидопы и от примерно 6% до примерно 16% масс. леводопы; или (ii) аргинин, от примерно 1,5% до примерно 2,5% масс. карбидопы и примерно 12% масс. леводопы. Такие композиции могут быть введены со скоростью от примерно 0,2 до примерно 2000 мкл/ч/место; или в объеме от примерно 10 до примерно 24 мл/24 ч/место, например, от примерно 12 до примерно 16 мл/24 ч/место; или в дозировке от примерно 600 до примерно 4000 мг леводопы/день и от примерно 60 до примерно 500 мг карбидопы/день; или со скоростью от примерно 800 до примерно 1600 мг леводопы и от примерно 200 до примерно 400 мг карбидопы/день/место. Более конкретно, такие композиции для парентерального введения вводят внутрижелудочно или интрадуоденально.
[0036] В некоторых конкретных вариантах реализации композиция для парентерального введения в соответствии со способом согласно настоящему изобретению содержит аргинин, леводопу и карбидопу, причем композиция для парентерального введения характеризуется мольным отношением леводопа: аргинин, выбранным из значений от примерно 1:1,5 до примерно 1:2,5, соответственно, и рН от примерно 8,5 до примерно 10, то есть примерно 8,5, 8,6, 8,7, 8,8, 8,9, 9,0, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9 или 10, при 25°C. Такие композиции могут содержать, например, от примерно 1% до примерно 20% масс. или более карбидопы, предпочтительно по меньшей мере примерно 1%, 2%, 4% или 6% масс. карбидопы; или по меньшей мере примерно 1%, предпочтительно примерно 2%, 3%, 4%, 5% или 6% масс. леводопы. Кроме того, такие композиции могут дополнительно содержать фармацевтически приемлемое вспомогательное вещество, такое как N-метилпирролидон, поливинилпирролидон, пропиленгликоль или их комбинацию, и кроме этого может дополнительно содержать воду. В конкретных вариантах реализации такие композиции для парентерального введения имеют рН от примерно 8,5 до примерно 9,8 при 25°C.
[0037] В некоторых конкретных вариантах реализации композиция для парентерального введения в соответствии со способом согласно настоящему изобретению содержит аргинин, карбидопу, по меньшей мере примерно 4% масс. леводопы и, необязательно, меглюмин, причем указанная композиция для парентерального введения имеет рН от примерно 9,1 до примерно 9,8, то есть примерно 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7 или 9,8, при 25°C. Такие композиции могут иметь мольное отношение активных компонентов, то есть карбидопы и леводопы к аргинину от примерно 1:1,8 до примерно 1:3,5 или от примерно 1:2,2 до примерно 1:2,5. В частности, такие композиции содержат от примерно 4% до примерно 12% или от примерно 5% до примерно 30%, масс. леводопы, и/или от примерно 1% до примерно 6% или от примерно 1% до примерно 2% масс. карбидопы.
[0038] В некоторых вариантах реализации, композиция для парентерального введения содержит аргинин, карбидопу, по меньшей мере примерно 4% масс. леводопы, согласно вышеприведенному определению, и дополнительно содержит меглюмин. В некоторых конкретных таких композициях мольное отношение активных компонентов к аргинину составляет от примерно 1:1,1 до примерно 1:1,9, и/или мольное отношение активных компонентов к меглюмину составляет от примерно 1:0,3 до примерно 1:1,2, от примерно 1:0,3 до примерно 1:1,5, от примерно 1:0,4 до примерно 1:1,1. К другим таким конкретным композициям относятся композиции, содержащие от примерно 2,0% до примерно 11% масс. меглюмина и/или от примерно 10% до примерно 35% масс. аргинина.
[0039] В более конкретных вариантах реализации композиция для парентерального введения содержит аргинин, карбидопу, по меньшей мере примерно 4% масс. леводопы и, необязательно, меглюмин, согласно любому из вышеприведенных вариантов реализации, и дополнительно содержит по меньшей мере один агент, способный ингибировать образование продуктов окисления, например аскорбиновую кислоту или ее фармацевтически приемлемую соль, такую как аскорбат натрия, аскорбат кальция, аскорбат калия, аскорбилпальмитат или аскорбилстеарат, L-цистеин, N-ацетилцистеин (NAC), глутатион (GSH), Na2-EDTA, Na2-EDTA-Ca, или комбинацию перечисленных веществ.
[0040] В соответствии с настоящим изобретением композиции для парентерального введения, содержащие аргинин, карбидопу, по меньшей мере примерно 4% масс. леводопы и, необязательно, меглумин, согласно любому из вышеприведенных вариантов реализации, могут дополнительно содержать бисульфит натрия.
[0041] В некоторых конкретных вариантах реализации композиция для парентерального введения в соответствии со способом согласно настоящему изобретению содержит примерно 6% масс. леводопы, от примерно 0,6% до примерно 1,4% масс. карбидопы, от примерно 15% до примерно 16% масс. аргинина и примерно 0,5% масс. аскорбиновой кислоты; композиция может дополнительно содержать примерно 0,4% масс. L-цистеина и/или примерно 0,5% масс. NAC и имеет рН от примерно 9,4 до примерно 9,6.
[0042] В других конкретных вариантах реализации парентеральная композиция в соответствии со способом согласно настоящему изобретению содержит от примерно 12% до примерно 15% масс. леводопы, от примерно 1,2% до примерно 4% масс. карбидопы, от примерно 32% до примерно 42% масс. либо аргинина, либо меглумина; и от примерно 1,0% до примерно 1,3% масс. аскорбата натрия; композиция может дополнительно содержать от примерно 0,1% до примерно 0,5% масс. L-цистеина, и/или NAC, и/или цистеина-HCl; и имеет рН от примерно 9,6 до примерно 9,8.
[0043] В соответствии с настоящим изобретением парентеральную композицию, имеющую любой из составов, описанных выше, вводят при сопутствующем введении композиции для перорального введения, содержащей ингибитор КОМТ. Ингибитор КОМТ может быть введен в дозировке, например, от примерно 10 до примерно 1600 мг в день, от примерно 50 до примерно 400 мг в день, от примерно 100 до примерно 600 мг в день, от примерно 400 до примерно 1200 мг в день, от примерно 1000 до примерно 1400 мг в день или от примерно 1200 мг до примерно 1600 мг в день. Композиция для перорального введения может быть введена 1, 2, 3, 4 или 5 раз в день. В некоторых вариантах реализации ингибитор КОМТ вводят с меньшей частотой, чем рекомендуется в настоящее время, например два-три раза в день, или в меньшей суточной дозе.
[0044] В некоторых вариантах реализации композиция для перорального введения содержит энтакапон, и указанную композицию вводят одновременно с парентеральной композицией в дозе от примерно 200 мг до примерно 600 мг, например примерно 200, 250, 300, 350, 400, 450, 500, 550 или 600 мг, два или три раза в день. В более конкретных таких вариантах реализации пероральную композицию вводят в дозе от примерно 350 до примерно 450 мг, например примерно 400 мг, дважды в день.
[0045] В других вариантах реализации композиция для перорального введения содержит толкапон, и указанную композицию вводят при сопутствующем введении композиции для парентерального введения в дозе от примерно 50 мг до примерно 200 мг, например примерно 50, 75, 100, 125, 150, 175 или 200 мг, один, два или три раза в день. Более конкретно, пероральную композицию вводят в дозе от 75 до примерно 125 мг, например примерно 100 мг, дважды в день.
[0046] Композиции для перорального введения ингибитора КОМТ могут быть представлены в любой подходящей форме. Например, композиция для перорального введения может быть приготовлена в виде пилюли, твердой или мягкой капсулы, таблетки, пастилок (troches), таблеток для рассасывания (lozenges), водных или масляных суспензий, растворимых порошков или гранул, эмульсий, сиропов или эликсиров. Пероральный состав может содержать, например, от примерно 200 мг до примерно 600 мг, от примерно 50 мг до примерно 200 мг, или 100 мг, ингибитора КОМТ на дозу. В некоторых случаях пероральный состав может представлять собой состав с контролируемым высвобождением, т.е. он может быть приготовлен для обеспечения контролируемого (замедленного, продленного или пролонгированного) или отложенного высвобождения ингибитора КОМТ.
[0047] Различные фармацевтические композиции, используемые в соответствии со способом согласно настоящему изобретению, могут быть приготовлены согласно стандартным методикам, например, как описано в источнике Remington: The Science and Practice of Pharmacy, 19th Ed., 1995. Композиции могут быть приготовлены, например, путем равномерного и тщательного приведения активного компонента/компонентов в ассоциацию с жидким носителем, мелкодисперсным твердым носителем, или ими обоими, и затем, при необходимости, придания продукту формы с получением желаемого состава. Композиции могут быть представлены в жидкой, твердой или полутвердой форме и могут дополнительно содержать фармацевтически приемлемые наполнители, носители, растворители или адъюванты, а также иные инертные ингредиенты и вспомогательные вещества. В одном варианте реализации фармацевтическая композиция согласно настоящему изобретению приготовлена в виде наночастиц.
[0048] Используемые композиции для парентерального введения могут быть приготовлены путем смешивания леводопы и ингибитора дофа-декарбоксилазы, например карбидопы, необязательно вместе с аргинином, и/или меглумином, и/или одним или более антиоксидантами, в вышеописанных количествах с получением порошкообразной смеси. Может быть добавлена вода с получением суспензии. Суспензия может быть нагрета, например до примерно 60-90°C, более конкретно до примерно 72±5°C, например, путем добавления предварительно нагретой воды и/или помещения смеси на горячую (например, 72±5°C) водяную баню на достаточный период времени, например примерно 3 минуты, примерно 5 минут, примерно 10 минут или более, с получением раствора, с необязательным перемешиванием, и охлаждения раствора с получением композиции. Пространство контейнера над содержимым может быть наполнено N2. Например, смесь может быть извлечена из водяной бани и охлаждена до комнатной температуры (КТ), и антиоксидант может быть добавлен в атмосфере N2 с последующим перемешиванием. Приготовление по вышеописанному способу, например, при котором леводопу, карбидопу и аргинин смешивают сначала как порошки, а затем получают суспензию в воде с последующим нагреванием, может обеспечить
[0049] Композиции для парентерального введения могут быть стерилизованы, например с использованием 0,2 мкм фильтров, таких как фильтры с мембранами из нейлона или поливинилидендифторида (PVDF). В некоторых вариантах реализации композиции содержат меньше нежелательных побочных продуктов, например токсических побочных продуктов или загрязнителей, например гидразина, в случае если карбидопа и леводопа присутствуют одновременно и в случае приготовления с применением определенных антиоксидантов, например аскорбиновой кислоты и ее солей, а не с другими, например с бисульфитом натрия. В других вариантах реализации композиции содержат меньше нежелательных побочных продуктов в случае если добавляют предварительно нагретую воду, как указано выше, по сравнению с составами, приготовленными без добавления предварительно нагретой воды. В других вариантах реализации леводопа и/или карбидопа могут не растворяться, если не применять методику приготовления, описанную выше. Вышеописанные способы приготовления могут обеспечить получение более стабильных составов, чем составы, приготовленные без добавления горячей воды или нагрева.
[0050] Композиции для перорального введения ингибитора КОМТ могут быть приготовлены в соответствии с любым из известных в данной области техники способов приготовления фармацевтических композиций и могут дополнительно включать один или более ингредиентов, выбранных из числа подсластителей, вкусовых агентов, красителей и консервантов для обеспечения фармацевтически привлекательных и приятных препаратов. Таблетки содержат активный компонент, то есть ингибитор КОМТ, в смеси с нетоксичными фармацевтически приемлемыми вспомогательными веществами, подходящими для изготовления таблеток. Эти вспомогательные вещества могут представлять собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактозу, фосфат кальция или фосфат натрия; гранулирующие и диспергирующие агенты, например кукурузный крахмал или альгининовую кислоту; связующие агенты, например крахмал, желатин или гуммиарабик; и смазывающие агенты, например, стеарат магния, стеаровую кислоту или тальк. Таблетки могут быть либо без покрытия, либо на них может быть нанесено покрытие с применением известных методик для обеспечения отсроченного разложения и всасывания в желудочно-кишечном тракте и таким образом обеспечивая замедленное действие в течение более длительного периода. Например, может быть использован обеспечивающий задержку по времени материал, такой как глицерилмоностеарат или глицерилдистеарат. Также на таблетки может быть нанесено покрытие с применением методик, описанных в патентах США №4256108, 4166452 и 4265874 с получением осмотических лечебных таблеток с контролируемым высвобождением. Композиции для перорального введения также могут быть представлены в форме эмульсии "масло в воде".
[0051] Композиции для перорального введения могут быть приготовлены для обеспечения либо немедленного, либо контролируемого высвобождения ингибитора СОМТ. Подобные композиции с контролируемым высвобождением могут быть приготовлены в виде либо матрицы с контролируемым высвобождением, например в виде матричных таблеток с контролируемым высвобождением, в которых высвобождение растворимого действующего вещества контролируется путем наличия диффузии активного вещества сквозь гель, образовавшийся после набухания гидрофильного полимера, вступившего в контакт с растворяющей жидкостью (in vitro) или желудочно-кишечным соком (in vivo). Описано много полимеров, способных формировать такой гель, например производные целлюлозы, в частности просте эфиры целлюлозы, такие как гидроксипропилцеллюлоза, гидроксиметилцеллюлоза, метилцеллюлоза или метилгидроксипропилцеллюлоза, и среди различных коммерческих сортов указанных простых эфиров имеются сорта, демонстрирующие достаточно высокую вязкость. В других вариантах реализации композиция включает активный компонент, приготовленный для контролируемого высвобождения, в виде микрокапсулированной лекарственной формы, в которой мелкие капли ингибитора КОМТ окружены покрытием или мембраной с образованием частиц размером порядка от нескольких микрометров до нескольких миллиметров.
[0052] Другие рассматриваемые составы включают депо-системы, основой которых являются биоразлагаемые полимеры, для которых происходит медленное высвобождение активного компонента по мере разложения полимера. Наиболее распространенный класс биоразлагаемых полимеров - гидролитически лабильные поли(сложные эфиры), приготовленные из молочной кислоты, гликолевой кислоты или комбинации этих двух молекул. Полимеры, полученные из этих индивидуальных мономеров, включают поли(D,L-лактид) (PLA), поли(гликолид) (PGA), и сополимер поли(D,L-лактид-со-гликолид) (PLG).
[0053] Стратегия лечения, раскрытая в настоящем описании, направлена на повышение периода полувыведения введенной леводопы и существенное снижение колебаний уровней леводопы в плазме путем совместного введения леводопы и ингибитора дофа-декарбоксилазы, такого как карбидопа, и по существу непрерывного ингибирования активности КОМТ с обеспечением таким образом у получающего лечение индивида постоянного уровня леводопы в плазме, что приведет к постоянной дофаминергической стимуляции головного мозга, и в то же время снижением побочных эффектов, вызываемых высокими уровнями леводопы в плазме при введении леводопы в высоких дозах. Предполагамое введение леводопы, ингибитора дофа-декарбоксилазы и ингибитора КОМТ в соответствии со способом согласно настоящему изобретению, как правило, может быть проведено в течение определенного периода времени, например дней, недель, месяцев и даже лет, в зависимости от состояния пациента и в соответствии с указаниями лечащего врача.
[0054] В другом аспекте данное изобретение относится к ингибитору дофа-декарбоксилазы или его фармацевтически приемлемой соли, леводопе или ее фармацевтически приемлемой соли и ингибитору КОМТ, например энтакапону или толкапону, для применения в комбинации при лечении неврологического или двигательного расстройства, причем ингибитор дофа-декарбоксилазы и леводопа, или их указанные фармацевтически приемлемые соли приготовлены, по отдельности или как комбинация, в виде композиции для парентерального введения (композиций), а указанный ингибитор КОМТ приготовлен в виде композиции для перорального введения.
[0055] В конкретном таком аспекте изобретение относится к карбидопе, леводопе и ингибитору КОМТ, более конкретно энтакапону или толкапону, для применения в виде комбинации при лечении болезни Паркинсона, причем карбидопа и леводопа приготовлены в виде единой парентеральной композиции согласно вышеприведенному описанию, а указанный ингибитор КОМТ приготовлен в виде композиции для перорального введения согласно вышеприведенному описанию.
[0056] В некоторых вариантах реализации композиция для парентерального введения приготовлена в виде подкожной, чрескожной, внутрикожной, внутривенной, внутримышечной, эндотрахеальной, интраназальной, интратекальной, внутрижелудочной или интрадуоденальной композиции. Отдельные такие композиции для парентерального введения подходят для по существу непрерывного введения.
[0057] Также согласно настоящему изобретению предусмотрен набор, содержащий: (i) парентеральную композицию согласно вышеприведенному описанию, то есть фармацевтическую композицию, приготовленную для парентерального, например чрескожного, внутрикожного или подкожного введения, предпочтительно непрерывного парентерального введения, причем указанная композиция для парентерального введения содержит ингибитор дофа-декарбоксилазы, например карбидопу, и леводопу, или их фармацевтически приемлемые соли, например их меглуминовые или аригининовые соли; (ii) пероральную композицию согласно вышеприведенному описанию, то есть фармацевтическую композицию, приготовленную для перорального введения, причем указанная композиция для перорального введения содержит ингибитор КОМТ, например энтакапон и толкапон; и (iii) инструкции по сопутствующему введению указанных фармацевтических композиций для лечения неврологического или двигательного расстройства, такого как болезнь Паркинсона.
[0058] Композиция для парентерального введения, включенная в состав вышеописанного набора может быть приготовлена в виде жидкости или лиофилизированного порошка, который может быть восстанавлен с получением жидкого состава, или может быть частью кожного пластыря, и/или может быть приготовлена для непрерывного введения любым из подходящих парентеральных путей, таких как, чрескожный, внутривенный, подкожный, внутрикожный, внутримышечный, внутрижелудочный или интрадуоденальный. Композиция для перорального введения, включенная в набор, может быть приготовлена либо для немедленного, либо для контролируемого высвобождения ингибитора КОМТ, как описано выше, и может быть выполнена в любой из вышеописанных форм.
[0059] В некоторых вариантах реализации либо парентеральная, либо композиция для перорального введения, включенная в состав описываемого набора, может быть представлена в контейнере(-ах), например, в предварительно наполненном картридже(-ах), подходящих для применения пациентом или врачом. Например, в настоящем изобретении предложен набор, содержащий предварительно наполненный картридж, содержащий парентеральную жидкую композицию, содержащую карбидопу, леводопу и аргинин; и пероральную композицию, например, одну или более таблеток или пилюль ингибитора КОМТ, например энтакапона или толкапона; и, необязательно, инструкции по применению.
[0060] Описанное в общем виде изобретение будет более наглядно разъяснено посредством ссылки на следующие примеры, включенные в настоящее описание исключительно с целью иллюстрации некоторых аспектов и вариантов реализации настоящего изобретения, и не предназначенные для ограничения изобретения каким-либо образом.
ПРИМЕРЫ
Пример 1. Приготовление растворов/состава для подкожного введения
[0061] А. Раствор/состав с 2% карбидопы готовили путем добавления предварительно нагретого 0,1% раствора бисульфита натрия к карбидопе. [ASSIA Ltd.]. Добавляли аргинин (Merck) до достижения окончательного мольного отношения 1:1,2 КД (карбидопа) : Арг (аргинин). Смесь перемешивали при 60°C до полного растворения. Нагревание прекращали, и смеси позволяли остыть до комнатной температуры; рН 8,5. Раствор фильтровали, используя стерильную мембрану 0,22 мкм из PVDF.
[0062] В. Раствор/состав с 10% толкапона готовили следующим образом: раствор, содержащий 10% толкапона, готовили путем добавления соответствующего количества Н2О к толкапону (Synfine Research), медленно добавляя аргинин при перемешивании до достижения окончательного мольного отношения 1:1. Смесь размешивали до полного растворения. После охлаждения рН раствора составил 7,8.
[0063] С. Раствор, содержащий 10% энтакапона, готовили путем добавления соответствующего количества Н2О к энтакапону (Suven Life Sciences), перемешивания при 30-35°C и медленного добавления аргинина до достижения окончательного мольного отношения 1:1. Смесь перемешивали до полного растворения. После охлаждения рН раствора составил 6,9, рН менее концентрированных растворов (6%) составил 7,8. После приготовления такой раствор энтакапона может быть разбавлен до состава с концентрацией 2%, 3% или 4% по массе.
[0064] Энтакапон не растворялся (в концентрациях >1%) с другими аминокислотами, такими как гистидин и глутаминовая кислота или в буферах при различных значениях рН.
[0065] D. Раствор 7% леводопы/2% карбидопы готовили путем добавления предварительно нагретого 0,1% раствора бисульфита натрия к аргинину. Добавляли леводопу до достижения окончательного мольного отношения 1:2 ЛД : Арг. Смесь перемешивают при 75-80°C до полного растворения. После охлаждения до 60°C, карбидопу и аргинин добавляли до достижения окончательного мольного отношения 1:1,2 КД (карбидопа) : Арг (аргинин). Смесь перемешивали при 60°C до полного растворения. После охлаждения к раствору добавляли еще примерно 12,5% аргинина. рН раствора составил примерно 9,2.
[0066] Е. Раствор леводопы 7% масс. готовили путем добавления предварительно нагретого 0,1% раствора бисульфита натрия к аргинину. Добавляли леводопу до достижения окончательного мольного отношения 1:2 ЛД : Арг. Смесь размешивают при 75-80°C до полного растворения. После охлаждения рН раствора составил примерно 9,4.
[0067] F. Раствор энтакапона или толкапона 2% или 4% готовили путем растворения энтакапона или толкапона в растворе, содержащем 1 эквивалент меглумина (мольное соотношение энтакапон/толкапон : меглумин составляло 1:1) при рН 8,23.
Пример 2. Методика приготовления составов
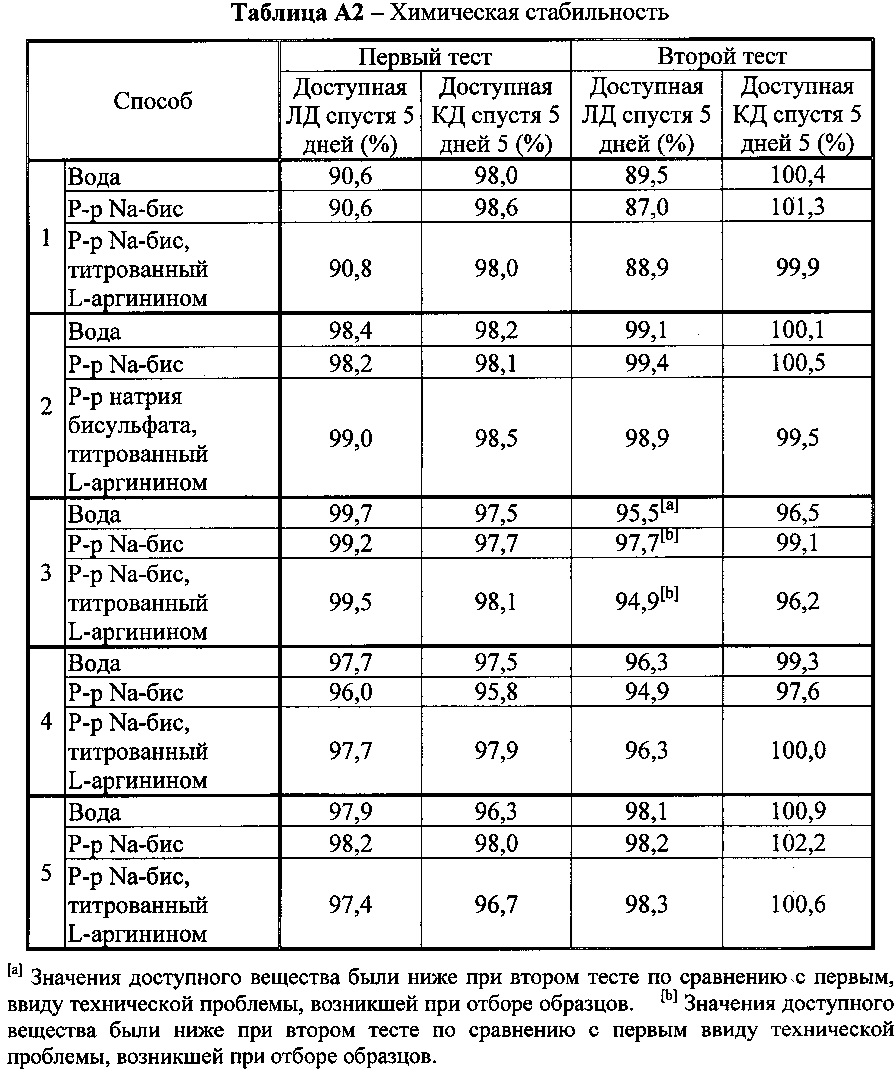
[0068] Составы леводопы (ЛД) и карбидопы (КД) могут быть приготовлены следующим образом. Тем не менее, как показано в таблице А, способ приготовления оказывает существенное влияние на химическую и физическую стабильность полученной композиции.
[0069] Способ 1 (раствор L-Арг). L-Арг и Na-бис (бисульфат натрия) растворяли в воде. Раствор добавляли к порошкам ЛД и КД. Смесь нагревали при перемешивании в течение 13 минут при 75°C до полного растворения. Раствор ЛД/КД выдерживали при комнатной температуре в течение 10 минут для охлаждения.
[0070] Способ 2 (все порошки вместе). Все порошки (ЛД, КД и L-Apг) взвешивали, и добавляли воду с Na-бис. Суспензию нагревали при перемешивании в течение 13 минут при 75°C до полного растворения. Раствор ЛД/КД выдерживали при комнатной температуре в течение 10 минут для охлаждения.
[0071] Способ 3 (аналогично 2, но без предварительного нагревания Na-бис). Все порошки (ЛД, КД и L-Арг) взвешивали, и добавляли воду. Суспензию нагревали при перемешивании в течение 13 минут при 75°C до полного растворения. Раствор ЛД/КД выдерживали при комнатной температуре в течение 10 минут для охлаждения.
[0072] Способ 4 (приготовление по стадиям). ЛД и соответствующее количество L-Арг взвешивали; добавляли воду и раствор Na-бис. Суспензию нагревали в течение 7 минут при 75°C до полного растворения, после чего выдерживали 7 минут при комнатной температуре. КД и соответствующее количество L-Арг взвешивали и добавляли к раствору ЛД/Арг при 60°C до полного растворения. В конце добавляли дополнительный L-Арг.
[0073] Способ 5 (аналогичен 4, но без предварительного нагревания Na-бис). ЛД и соответствующее количество L-Арг взвешивали; добавляли воду. Суспензию нагревали при перемешивании в течение 13 минут при 75°C до полного растворения. КД и соответствующее количество L-Арг взвешивали и добавляли к раствору ЛД/Арг при 60°C до полного растворения. В конце добавляли оставшийся L-Арг.
[0074] После охлаждения все составы согласно всем способам разделяли на 3 флакона, и в каждый флакон добавляли воду, раствор Na-бис или раствор Na-бис-Арг. Оценивали физическую и химическую стабильность. Результаты представлены в таблицах А1 и А2.
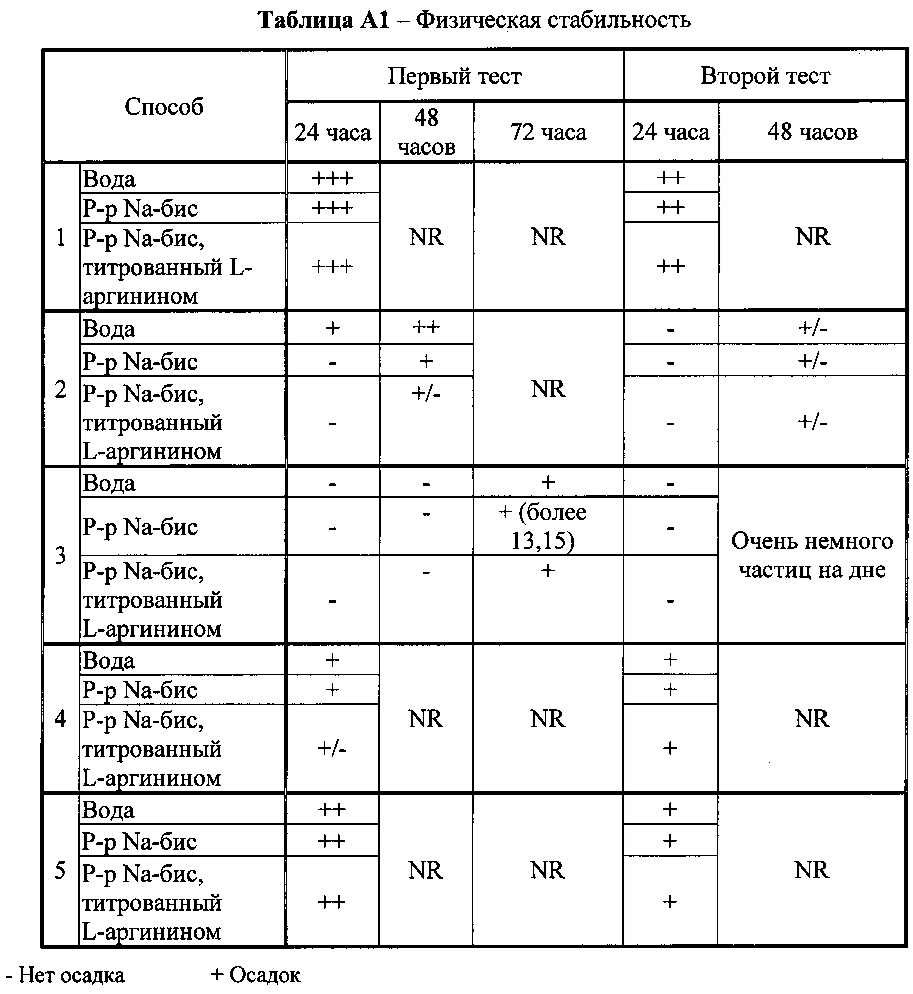
[0075] Составы исследовали с помощью ВЭЖХ-анализа в конце приготовления и спустя 5 дней при комнатной температуре. Восстановление спустя 5 дней при комнатной температуре рассчитывали и сравнивали с Т=0.
[0076] Результаты, приведенные в таблицах А1 и А2, явно демонстрируют, что способ приготовления состава оказывает значительное влияние на его физическую и химическую стабильность. Состав, приготовленный согласно способу 3, демонстрирует значительно большую стабильность.
Пример 3. Влияние аргинина на долгосрочную стабильность композиций леводопы и леводопы/карбидопы
[0077] Жидкие составы, содержащие леводопу, карбидопу и аргинин, готовили в соответствии с методикой, описанной в примере 2, и проводили сравнительные исследования составов с различными концентрациями аргинина, и/или аминосахара (например, меглумина), и/или сахара (например, декстрозы), и/или щелочи (NaOH), или иной основной аминокислоты (например лизина, гистидина). Результаты приведены в таблице В.
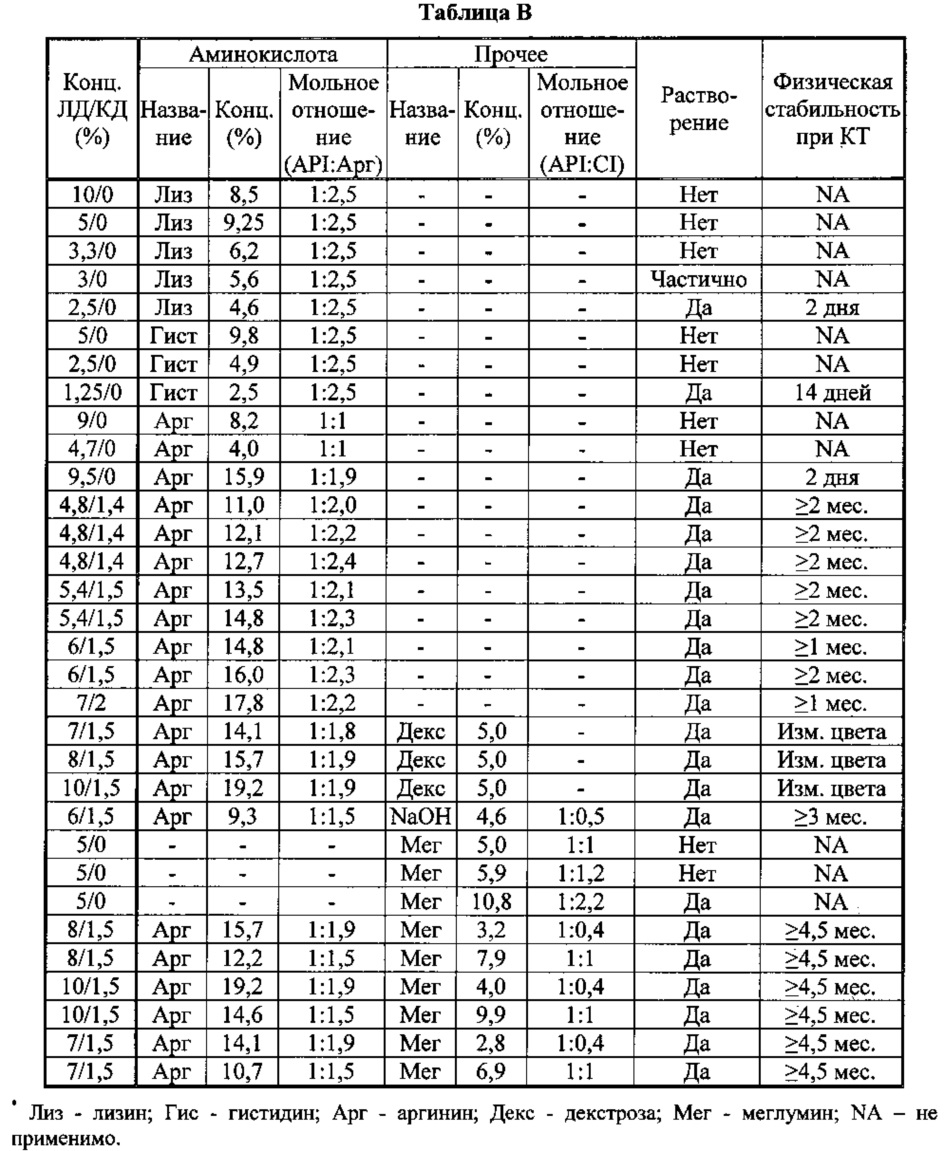
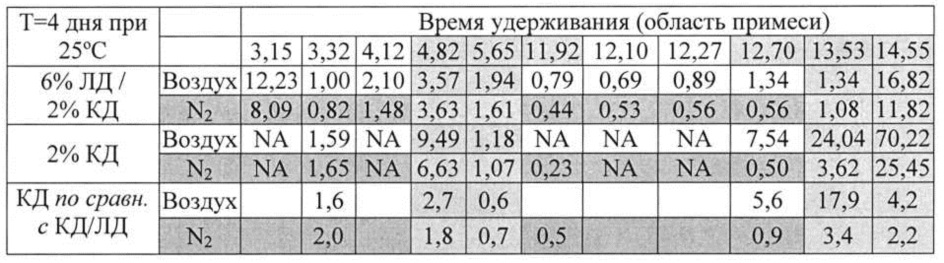
[0078] В таблице В показано, что аргинин образует стабильные растворы с высокими концентрациями леводопы и карбидопы (>2,5%) при мольных отношениях <1:2,5, в то время с другими основными аминокислотами ЛД в указанных условиях даже не растворяется. При мольных отношениях ЛД/КД к аргинину 1:<2 растворы не обладают долговременной стабильностью, если не добавлен меглумин или другой противоион, и меглумин может быть использован для снижения мольного отношения к ЛД/КД.
[0079] Жидкие составы готовили путем взвешивания всех порошков (ЛД, КД и L-Apг) и добавления воды, предварительно нагретой до 73±3°C. Суспензию помещали на водяную баню при 73±3°C и перемешивали в течение 10 минут до полного растворения. Раствор ЛД/КД выдерживали при комнатной температуре 10 минут для охлаждения. После этого добавляли аскорбиновую кислоту. Растворы разливали по стеклянным флаконам и хранили при +25°C и -20°C в течение указанного периода времени. Перед проведением анализов замороженные флаконы выдерживали при комнатной температуре до полного оттаивания. После этого составы перемешивали и подвергали анализам на стабильность.
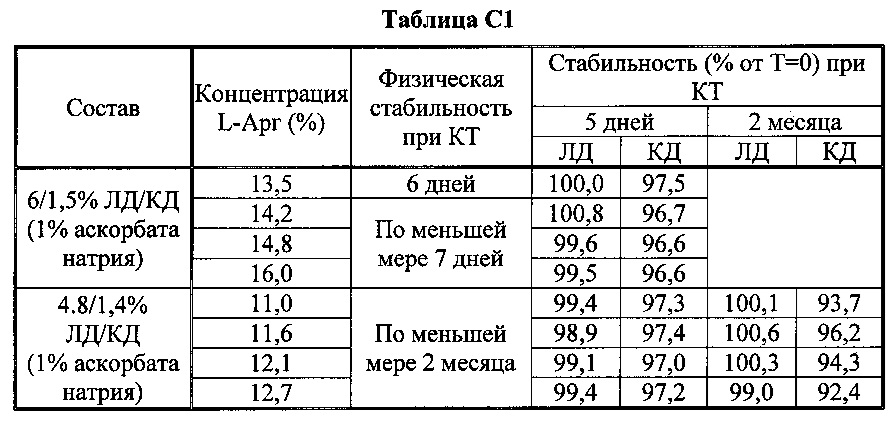
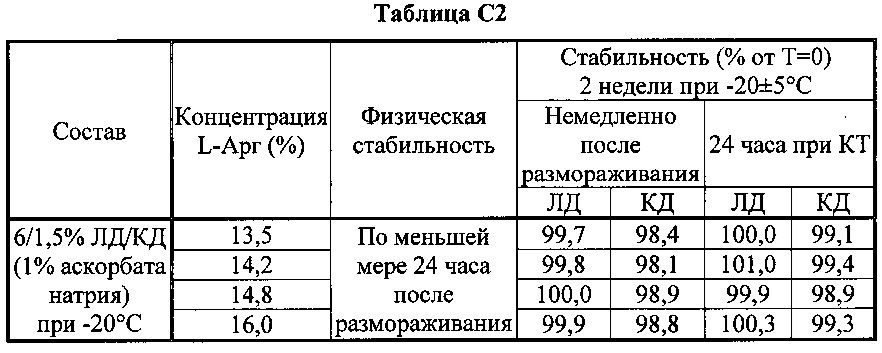
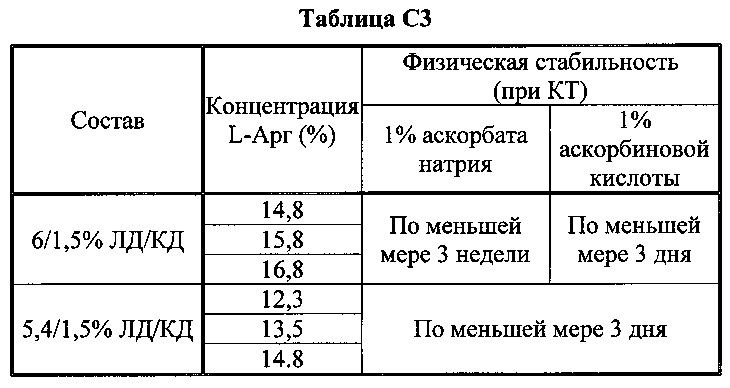
[0080] В таблицах С1-С6 показан эффект L-Арг на физическую и химическую долгосрочную стабильность при +25°C и при -20°C. В частности, в таблицах показано, что существует корреляция между мольным отношением аргинина к ЛД/КД и стабильностью, причем в общем композиции с большим количеством аргинина имеют более длительную стабильность: растворы с ЛД/КД : аргинин (при мольном отношении 1:≥2.1) стабильны по меньшей мере 1 месяц при комнатной температуре и при -20±5°C. Эти растворы стабильны даже при очень высоких концентрациях твердого вещества (общее содержание >45%).
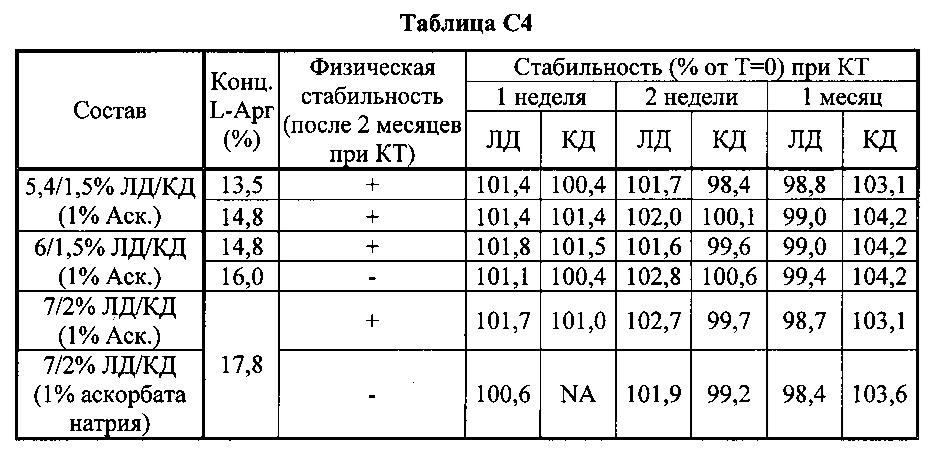

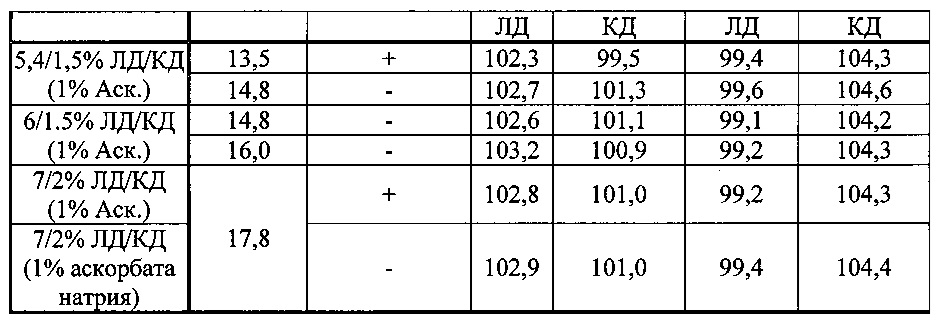

[0081] Составы, содержащие 6/1,5% и 5,4/1,5% ЛД/КД и различные концентрации L-аргинина титровали уксусной кислотой (100%) или молочной кислотой (85%) для изучения влияния рН и концентрации L-аргинина на физическую стабильность растворов (таблица D).
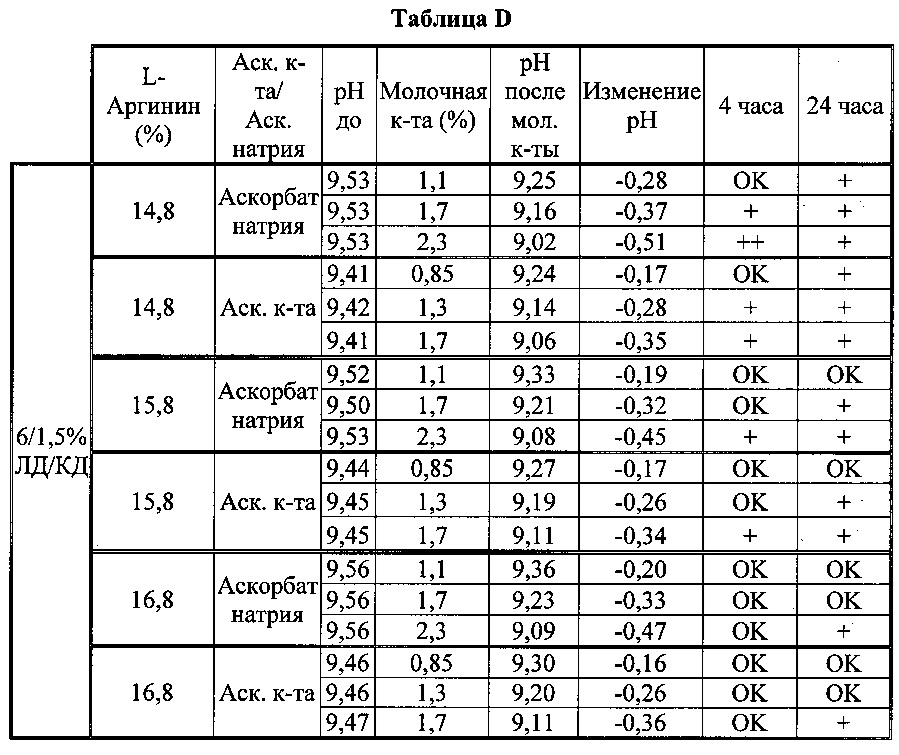
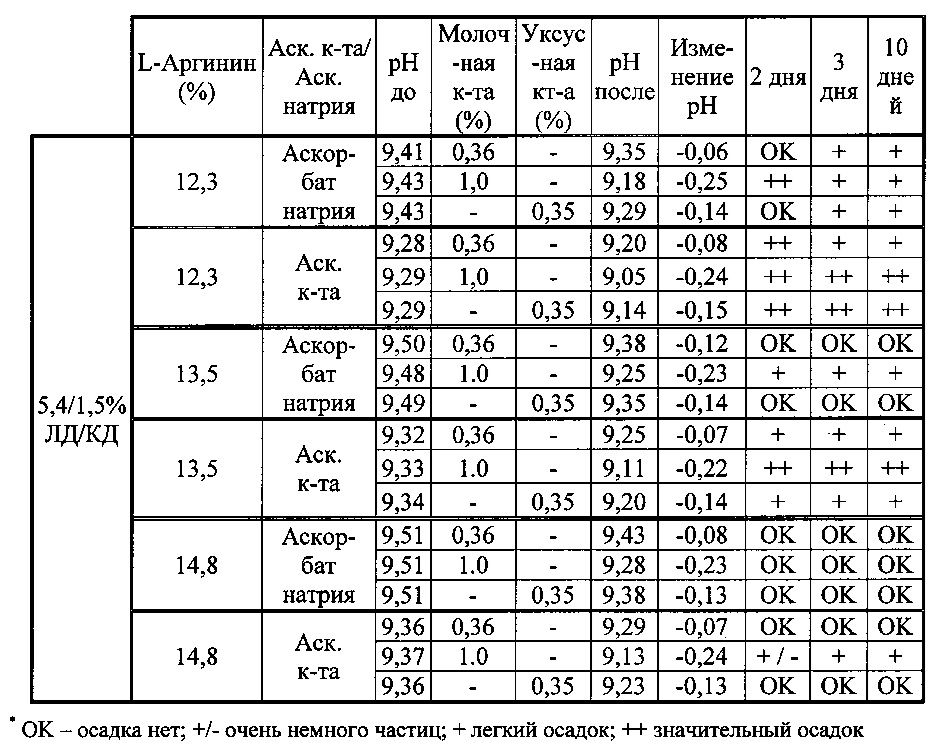
[0082] В таблице D показано, что аскорбиновая кислота снижает рН на 0,1-0,15 единиц по сравнению с аскорбатом натрия, и что другие органические кислоты могут еще больше снижать рН составов. Однако при этом результаты тестирования физической стабильности указывают, что составы в общем нестабильны при рН <9,15±0,5. Составы с аскорбатом натрия оказались более стабильными, чем составы с аскорбиновой кислотой при данной концентрации L-аргинина. Таким образом можно предположить, что избыток кислоты может вызывать выпадение осадка в отсутствии соответствующего количества L-аргинина.
[0083] В таблице Е показана химическая и физическая стабильность спустя 3 недели после получения состава 6/1,5/14,8% ЛД/КД/Арг, использованного для тестирования стабильности, результаты которого приведены в таблице D.

Пример 4: Стабильность составов леводопы с карбидопой in-vitro и ex-vivo
[0084] Исследовали влияние карбидопы на составы леводопы. Составы леводопы (ЛД) готовили с 0, 0,5, 1, 1,5 и 2% масс. карбидопы (КД) и постоянной концентрацией аргинина. Проводили оценку физической и химической стабильности. Результаты приведены в таблице F.
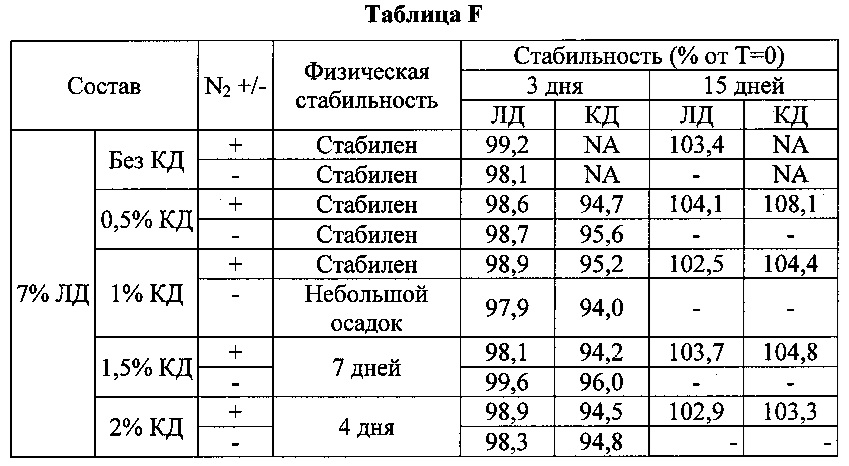
[0085] Результаты экспериментов, представленные на фиг. 1А, показывают, что карбидопа предотвращает образование темно-желтой окраски в присутствии воздуха дозозависимым образом. В отсутствии воздуха (с N2 над составом) 0,5% КД было достаточно для подавления образования этой окраски. Выдвинуто предположение, что КД ингибирует окисление ЛД in vitro. Результаты экспериментов, представленные в таблице F, показывают, что карбидопа не оказывает значительного влияния на химическую стабильность леводопы. Данные результаты также показывают, что отношение количества аргинина к общему количеству активных ингредиентов важно для предотвращения образования осадка, то есть физическая стабильность состава зависит от относительной концентрации аргинина.
[0086] В дополнительном эксперименте составы с ЛД готовили с 0, 0,5, 1 и 2% КД и соответствующими концентрациями аргинина. Проводили оценку физической и химической стабильности. Результаты приведены в таблице G.
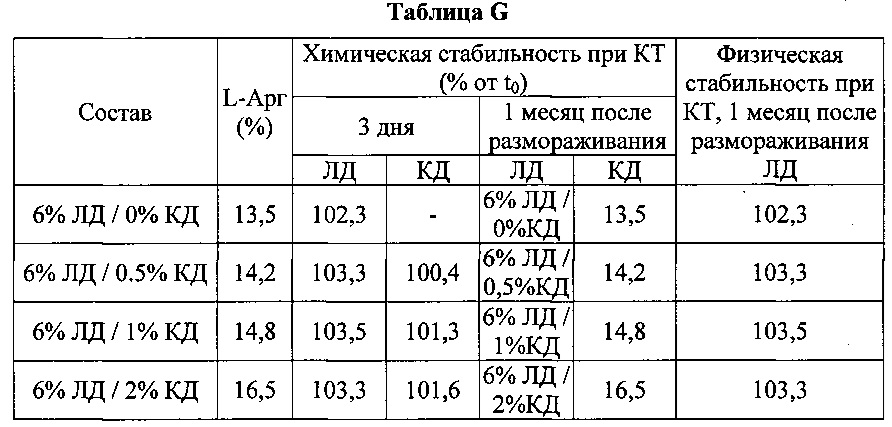
[0087] В присутствии достаточных концентраций L-аргинина все составы ex-vivo были стабильны по меньшей мере месяц при комнатной температуре после размораживания, как показано в таблице G.
[0088] Влияние карбидопы на стабильность составов леводопы показано на фиг. 1. Раствор 7% ЛД/аргинин с 2% КД или без нее непрерывно вводили со скоростью 0,08 мл/ч × 18 ч при 37°C в образец свежей свиной шкуры полной толщины размером 5×5 см. Справа на фиг. 1 показано отсутствие образования черных побочных продуктов, позволяющее предположить, что КД ингибирует окисления ЛД ex vivo и может также ингибировать образование о-хинонов и меланина.
Пример 5. Стабильность составов карбидопы с леводопой
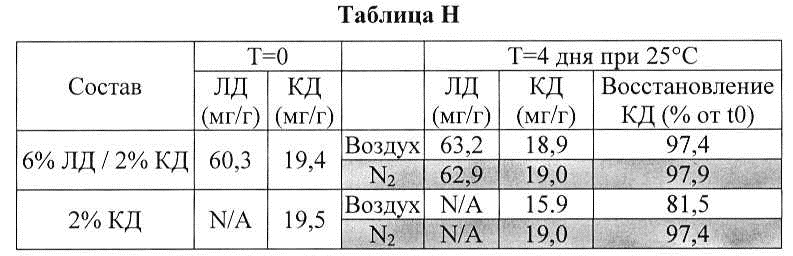
[0089] Проводили исследование влияния леводопы на стабильность карбидопы. Результаты приведены в таблице Н.
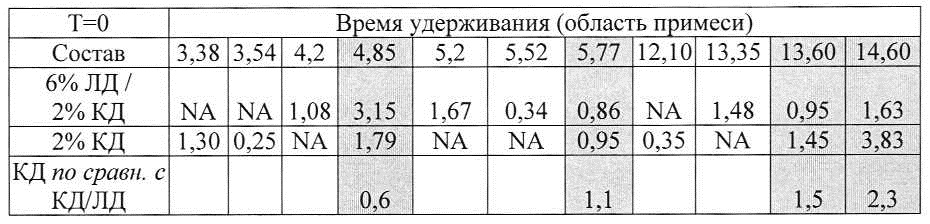
[0090] В таблице Н показано, что карбидопа была менее чувствительна к окислению и разложению и была более стабильна в присутствии леводопы: область примесей при времени удерживания (R.T.) 4,82, 5,65, 12,7, 13,53 и 14,55 была значительно увеличена в аэробных условиях при отсутствии ЛД, а область примесей при R.T. 4,82 и 13,53 была увеличена даже в отсутствие кислорода. Можно предположить, что ЛД может защищать КД от разложения.
Пример 6. Токсичность и фармакокинетика составов леводопы с карбидопой
[0091] Проводили исследование влияния карбидопы на местную токсичность леводопы на свиньях: растворы, содержащие 6% ЛД и 0, 0,5 или 1% КД с соответствующим количеством аргинина (13,5, 14,2 или 14,8%, соответственно), вводили свиньям непрерывно подкожно со скоростью 0,16 мл/ч в течение 24 ч. Каждый состав вводили двум свиньям. Образцы кожи отбирали спустя 8±1 дней. На фиг. 2 показано, что присутствие 1% карбидопы снижает тяжесть и степень обусловленной леводопой токсичности in-vivo.
[0092] Проводили исследование влияния карбидопы на фармакокинетику леводопы и карбидопы. Растворы, содержащие 6% ЛД и 0, 0,5, 1 или 2% КД и соответствующее количество аргинина (13,5, 14,2, 14,8 или 16.5%, соответственно) вводили свиньям непрерывно подкожно со скоростью 0,16 мл/ч в течение 24 ч. На фиг. 3 показано, что КД оказывает значительное влияние на фармакокинетику ЛД. Это влияние было дозозависимым и линейным в пределах от ±0,3 до ±1,2% КД.
Пример 7. Уровни леводопы в плазме после подкожного введения
[0093] Цель данного эксперимента состояла в определении уровней ЛД (леводопы) в плазме после непрерывного подкожного введения карбидопы, леводопы или энтакапона и их комбинаций с пероральным введением ЛД/КД свиньям.
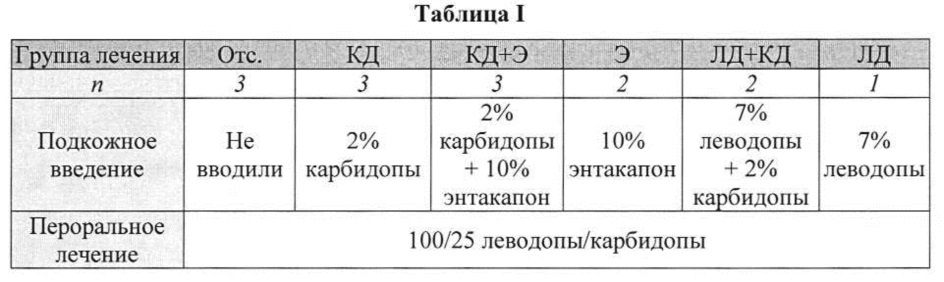
[0094] Самкам свиней породы ландрас и крупная белая массой 22 кг вводили, начиная с дня 1, в 15:00 согласно таблице I перорально ЛД/КД 100/25 и соответствующие тестовые составы, содержащие карбидопу, леводопу или энтакапон и их комбинации, приготовленные с аргинином, как описано выше, вводили непрерывно подкожно при помощи кожного пластыря (Омнипод (Omnipod®)) со скоростью 0,08 мл/ч.
[0095] В таблице I приведен протокол лечения для каждой из групп. Составы готовили согласно примерам 1 и 2.
[0096] Образцы крови отбирали после введения 3ей пероральной дозы в заданные моменты времени, и анализировали уровни леводопы, карбидопы и 3-OMD методом высокоэффективной жидкостной хроматографии с электрохимическим детектированием (ВЭЖХ-ЭХД).
[0097] На фиг. 4 представлены средние концентрации леводопы в плазме после перорального введения Синемета (перорально 100/25 ЛД/КД) при непрерывном подкожном введении энтакапона (200 мг/24 ч) ± КД (40 мг/24 ч), в виде двух отдельных композиций (фиг. 4А); или ЛД (140 мг/24 ч) ± КД (40 мг/24 ч) свиньям (фиг. 4В) (все составы для подкожного введения включали аргинин, как указано выше).
[0098] Результаты показывают, что существует синергический эффект между энтакапоном (200 мг/24 ч) и КД (40 мг/24 ч) в отношении фармакокинетики леводопы в плазме (нг/мл) при совместном непрерывном подкожном введении по сравнению с расчетной фармакокинетикой ЛД в плазме, полученной сложением концентраций ЛД после непрерывного подкожного введения КД и энтакапона по отдельности (фиг. 1А и таблица 2, С по сравнению с B+D). Результаты также показывают, что существует аддитивный эффект между леводопой (140 г/24 ч) и карбидопой (40 мг/24 ч) в отношении фармакокинетики леводопы в плазме (нг/мл) при непрерывном подкожном введении по сравнению с расчетной фармакокинетикой леводопы в плазме, полученной при сложении концентраций ЛД в плазме после непрерывного подкожного введения КД и ЛД по отдельности. (фиг. 1В и таблица 2, Е по сравнению с D+F). Кроме того, данные результаты позволяют предположить, что непрерывное подкожное введение ЛД и КД может быть достаточным для поддержания постоянной и непрерывной концентрации леводопы в плазме даже при отсутствии перорального введения ЛД/КД (фиг. 4В пунктирная линия и таблица J ‘Е минус А’). В таблице J приводятся концентрации леводопы в плазме спустя 6½ и 8 ч после перорального введения ЛД/КД.

[0099] На фиг. 5 показаны биопсии тканей из места введения комбинированного состава леводопа-карбидопа-аргинин и состава леводопа/аргинина. Видимого раздражения или повреждения тканей в случае с составом леводопа-карбидопа с аргинином не наблюдается. В месте введения состава леводопы-аргинина, по-видимому, имеется некоторое почернение тканей. Не ограничиваясь конкретной теорией, можно предположить, что присутствие карбидопы и аргинина в составе с леводопой (аргинином) защищает местные ткани от локального повреждения леводопой путем предотвращения окисления леводопы до раздражающих побочных продуктов, и что карбидопа является мощным антиоксидантом.
Пример 8. Дополнительные примеры составов карбидопы и леводопы/карбидопы
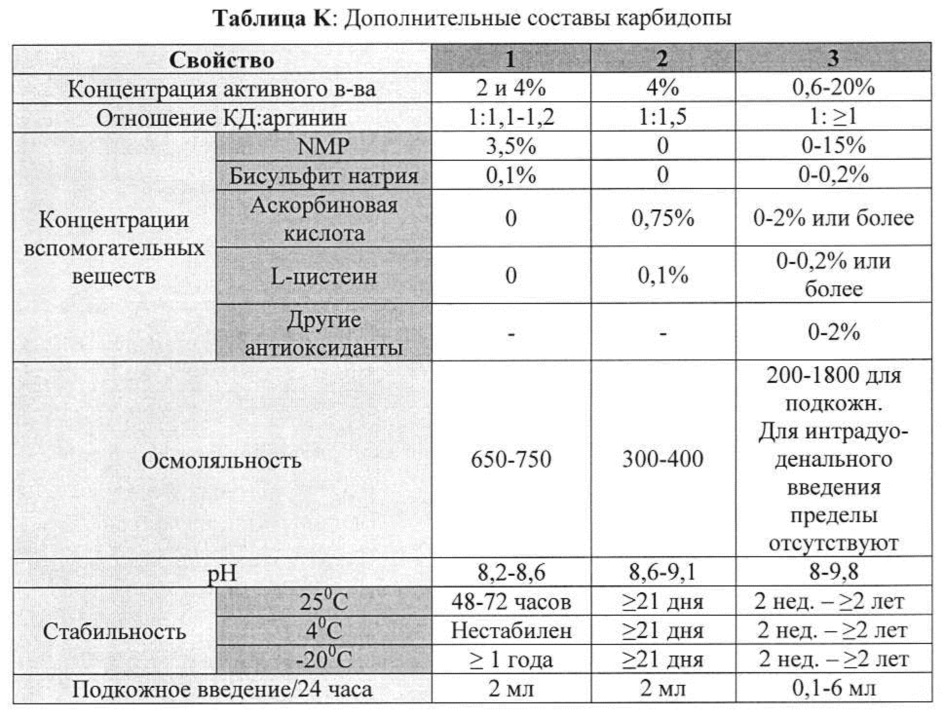
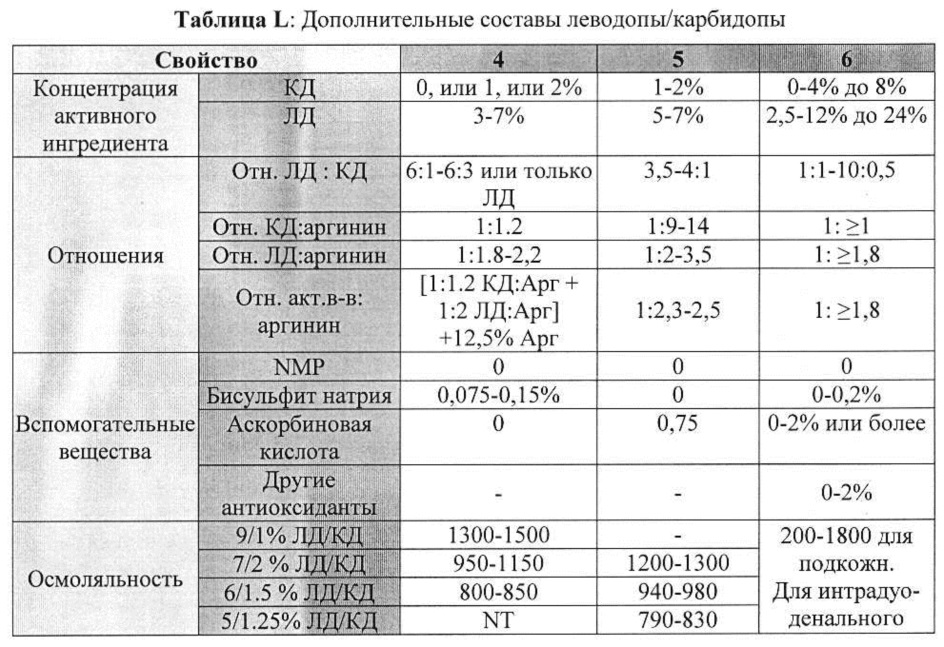
[00100] В таблицах K и L приведены дополнительные неограничивающие примеры составов, содержащих карбидопу и леводопу/карбидопу.
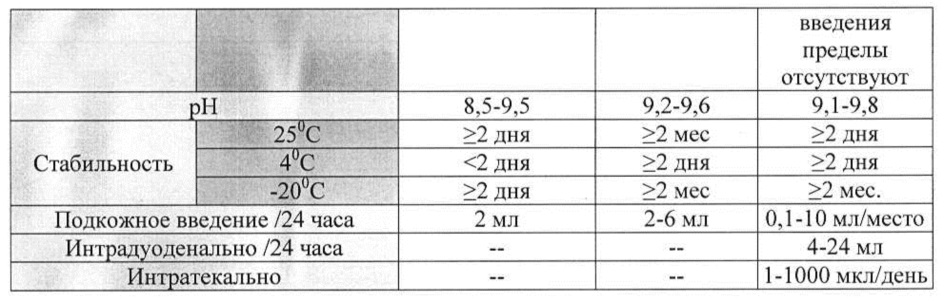
Пример 9. Уровни леводопы, карбидопы и 3-О-метилдопы в плазме после непрерывного подкожного введения карбидопы и леводопы и перорального введения энтакапона
[00101] Цель данного эксперимента состояла в определении уровней леводопы (ЛД), карбидопы (КД) и 3-О-метилдопы (3-OMD) в плазме после непрерывного подкожного введения карбидопы и леводопы, и перорального введения энтакапона людям-добровольцам.
[00102] В одном и том же центре было проведено двойное слепое рандомизированное плацебо-контролируемое исследование на шести добровольцах-мужчинах европеоидной расы в возрасте от 18 до 40 лет. ЛД (6%)/КД (1,5%) вводили со скоростью 240 мкл/ч, что соответствует 360 мг ЛД и 90 мг КД за 24 часа. Энтакапон (200 мг) вводили перорально каждые 2 часа, начиная с 15ого часа после начала инфузии ЛД/КД. Концентрации ЛД, КД и 3-OMD в плазме измеряли в заданные моменты времени.
[00103] Как показано на фиг. 6, полученные результаты демонстрируют, что пероральное введение энтакапона повышало концентрации ЛД в плазме, достигаемые при непрерывном подкожном введении ЛД/КД, на 50% в течение 9 часов после начала введения энтакапона. Концентрации ЛД в плазме не достигала равновесия ко времени прекращения эксперимента (через 24 часа после начала инфузии ЛД/КД и через 9 часов после начала приема энтакапона. Концентрации 3-OMD в плазме были значительно снижены. Эти результаты позволяют предположить, что вместо введения 200 мг энтакапона 6-8 раз в день, что обычно делается при пероральном введении ЛД/КД, можно вводить 400 мг энтакапона, например, два или три раза в день.
ЭКВИВАЛЕНТЫ
[00104] Несмотря на рассмотрение конкретных вариантов реализации, вышеприведенное описание является иллюстративным и неограничивающим. После ознакомления с настоящим описанием специалистам в данной области техники будет очевидно множество вариантов настоящего изобретения. Полный объем настоящего изобретения должен определяться в соответствии с формулой изобретения, учитывая полный объем его эквивалентов, и описанием, а также подобными вариациями.
[00105] Если не указано иное, все числовые значения, выражающие количества ингредиентов, условия реакций и т.п., использованные в описании и формуле изобретения, следует понимать как изменяемые во всех случаях посредством термина "примерно". Следует отметить, что в случаях, когда в описании и формуле изобретения приведены конкретные значения, если не указано иное, термин "примерно" означает допустимый диапазон ошибки, например, до 5% или 10%, который должен быть предусмотрен для конкретного значения.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[00106] Полное содержание всех патентов, опубликованных патентных заявок, веб-сайтов и других цитируемых в настоящем описании источников включено в настоящую заявку посредством ссылки.
Реферат
Группа изобретений касается лечения болезни Паркинсона. Предложены: 1) способ лечения болезни Паркинсона у нуждающегося в этом индивида, включающий введение указанному индивиду парентеральной композиции, содержащей карбидопу и леводопу, при этом указанная парентеральная композиция приготовлена для подкожного введения и ее вводят по существу непрерывно, и пероральной композиции, содержащей энтакапон, при этом указанная пероральная композиция содержит примерно 400, 450, 500, 550 или 600 мг энтакапона и ее вводят два или три раза в день; и 2) соответствующее применение комбинации карбидопы, энтакапона и леводопы. Технический результат состоит в значительном (с 420 до 620 нг/мл) повышении уровня леводопы в крови пациентов без значительных его колебаний. 2 н. и 19 з.п. ф-лы, 6 ил., 18 табл., 9 пр.

Комментарии