Пролекарства карбидопа и l-dopa и их применение для лечения болезни паркинсона - RU2743347C2
Код документа: RU2743347C2
Чертежи





















Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее описание относится к (a) пролекарствам карбидопа, (b) пролекарствам L-dopa, (c) фармацевтическим комбинациям и композициям, содержащим пролекарство карбидопа и/или пролекарство L-dopa, и (d) способам лечения болезни Паркинсона и ассоциированных состояний, включающим в себя введение пролекарства карбидопа и пролекарства L-dopa субъекту с болезнью Паркинсона.
УРОВЕНЬ ТЕХНИКИ ДЛЯ ИЗОБРЕТЕНИЯ
[0002] Болезнь Паркинсона представляет собой хроническое и прогрессирующее нейродегенеративное состояние, харакетризующееся уменьшенными уровнями в головном мозге нейромедиатора дофамина (т.е., 3,4-дигидроксифенэтиламина). Введение L-dopa (т.е., L-3,4-дигидроксифенилаланина) в настоящее время является наиболееэффективной терапией для лечения пациента с болезнью Паркинсона. L-dopa, который, в отличие от дофамина, может пересекать гематоэнцефалический барьер, ферментативно превращается в головном мозге в дофамин, что приводит к увеличенным уровням дофамина:

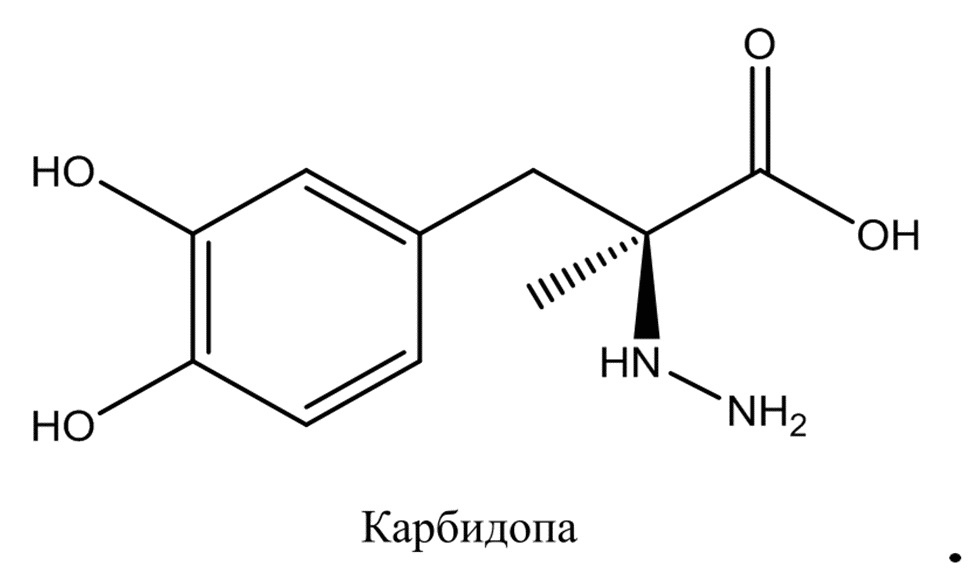
[0003] Превращение L-dopa в дофамин катализирует декарбоксилаза ароматических L-аминокислот, повсеместно распространенный фермент, способствующий центральному, а также периферическому метаболизму L-dopa до дофамина. Из-за периферического метаболизма L-dopa, относительно большая доза L-dopa необходима для достижения терапевтически эффективных уровней дофамина в головном мозге. Введение таких больших доз L-dopa приводит к увеличенным уровням периферического дофамина, что может вызывать тошноту у некоторых пациентов. Для преодоления этих проблем, L-dopa, как правило вводят с ингибитором периферической декарбоксилазы ароматических L-аминокислот, таким как карбидопа (т.е., (2S)-3-(3,4-дигидроксифенил)-2-гидразино-2-метилпропионовая кислота):
Совместное введение карбидопа с L-dopa ингибирует периферический метаболизм L-dopa до дофамина, что значительно уменьшает дозу L-dopa, необходимую для терапевтически эффективного ответа, и уменьшает ассоциированные побочные эффекты.
[0004] Однако, даже когда L-dopa и карбидопа вводят совместно, является сложным постоянно поддерживать желательные уровни дофамина в головном мозге из-за относительно короткого время полужизни L-dopa в плазме. Кроме того, переносимость многими пациентами изменчивости уровней дофамина в головном мозге уменьшается с прогрессированием заболевания. Одним из способов, эффективных для уменьшения изменчивости уровней дофамина, является непрерывная доставка в кишечник регулируемой дозы геля L-dopa/карбидопа, известного по его коммерческому наименованию, DuoDopa® в Европе и Duopa® в Соединенных Штатах Америки. DuoDopa®/Duopa® представляет собой суспензию моногидрата L-dopa/карбидопа (соотношение моногидрата L-dopa к карбидопа 4:1) в водном геле (карбоксиметилцеллюлозе натрия), обладающую вязкостью, позволяющей однородное распределение тонко измельченных частиц вещества. Гель доставляют в проксимальный отдел тонкого кишечника через еюностомальный зонд, вставленный через участок чрескожной эндоскопической гастростомии. DuoDopa®/Duopa® упаковывают в кассетные резервуары для лекарственных средств и вводят непрерывно посредством управляемого программным обеспечением насоса для амбулаторной инфузии. Хотя L-dopa и карбидопа совместно вводят для лечения болезни Паркинсона в течение нескольких десятилетий, соответствующая с точки зрения фармакокинетики система доставки, не требующая вставки в кишечник, не является коммерчески доступной.
[0005] Основной проблемой для разработки менее инвазивных или иным образом улучшенных способов введения L-dopa и карбидопа является растворимость этих соединений. Каждое из них обладает низкой растворимостью в воде в диапазоне pH, необходимом для инфузии. Стабильные, более концентрированные, и/или менее вязкие составы, содержащие L-dopa и/или карбидопа (или соединения, способные к биопревращению in vivo в L-dopa и/или карбидопа), являются желательными. Такие составы могут обеспечивать преимущества по сравнению с существующей инфузионной терапией, включая: (a) уменьшение объема и улучшение перекачиваемости состава, подлежащего доставке пациенту, что позволяет также уменьшение размера и массы устройства для доставки; (b) увеличение срока хранения состава посредством уменьшения деградации и улучшения стабильности состава; и/или (c) обеспечение большей гибкости для пациентов для управления их лечением посредством уменьшения или исключения требований хранения состава в холодильнике (например, более длительные периоды времени для манипуляции с составом вне холодильника). Такие стабильные, более концентрированные и/или менее вязкие составы можно также применять в менее инвазивных способах введения (например, подкожной инфузии).
[0006] Соответственно, существует постоянная необходимость в улучшенных композициях и способах, которые могут обеспечивать непрерывные и постоянные уровни дофамина в головном мозге для эффективного лечения двигательных расстройств, таких как болезнь Паркинсона. Настоящее описание относится к таким улучшенным композициям и способам.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] В одном аспекте настоящее описание относится к соединению, соответствующему по структуре формуле (I):

или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[0008] В другом аспекте настоящее описание относится к соединению, соответствующему по структуре формуле (II):

или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[0009] В другом аспекте настоящее описание относится к фармацевтической комбинации, содержащей первое соединение, соответствующее по структуре формуле (I), или его фармацевтически приемлемую соль, и второе соединение, соответствующее по структуре формуле (II), или его фармацевтически приемлемую соль.
[0010] В другом аспекте настоящее описание относится к фармацевтической композиции, содержащей первое соединение, соответствующее по структуре формуле (I), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В определенных аспектах, фармацевтическая композиция может дополнительно содержать второе соединение, соответствующее по структуре формуле (II), или его фармацевтически приемлемую соль.6
[0011] В другом аспекте настоящее описание относится к способу лечения болезни Паркинсона или ассоциированного состояния у пациента, включающему в себя введение пациенту терапевтически эффективного количества фармацевтической комбинации, содержащей первое соединение, соответствующее по структуре формуле (I), или его фармацевтически приемлемую соль, и второе соединение, соответствующее по структуре формуле (II), или его фармацевтически приемлемую соль. В конкретных аспектах, способ включает в себя введение первого соединения, соответствующего по структуре формуле (I), или его фармацевтически приемлемой соли, и второго соединения, соответствующего по структуре формуле (II), в одной фармацевтической композиции или в отдельных фармацевтических композициях.
[0012] Дополнительные преимущества по настоящему описанию буду очевидны специалисту в данной области из прочтения этой патентной заявки. Варианты осуществления описания, описанные в следующих разделах, предназначены для иллюстрации изобретения, и их не следует рассматривать как сужающие объем изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0013] Фигура 1 представляет собой график растворимости 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа при pH 7,4, и растворимость L-dopa и карбидопа.
[0014] Фигура 2 представляет собой график высвобождения гидразина из раствора 4ʹ-монофосфата L-dopa и 4ʹ-фосфата карбидопа в соотношении 4:1 при различных уровнях pH.
[0015] Фигура 3 представляет собой график, сравнивающий высвобождение гидразина между Duopa® и раствором 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа в соотношении 4:1.
[0016] Фигура 4 представляет собой профиль зависимости время-концентрация для уровней L-dopa в крови крыс после введения комбинации 3ʹ,4ʹ-дифосфата L-dopa и 3ʹ,4ʹ-дифосфата карбидопа в различных соотношениях доз.
[0017] Фигура 5 представляет собой профиль зависимости время-концентрация уровней карбидопа в крови крыс после введения комбинации 3ʹ,4ʹ-дифосфата L-dopa и 3ʹ,4ʹ-дифосфата карбидопа в различных соотношениях доз
[0018] Фигура 6 представляет собой график уровней в крови в состоянии равновесия L-dopa и карбидопа у крыс после введения комбинации 3ʹ,4ʹ-дифосфата L-dopa и 3ʹ,4ʹ-дифосфата карбидопа в различных соотношениях доз.
[0019] Фигура 7 представляет собой профиль зависимости время-концентрация для уровней L-dopa в крови и уровней 4ʹ-монофосфата L-dopa в крови у крыс после введения комбинации 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа в соотношении 4:1.
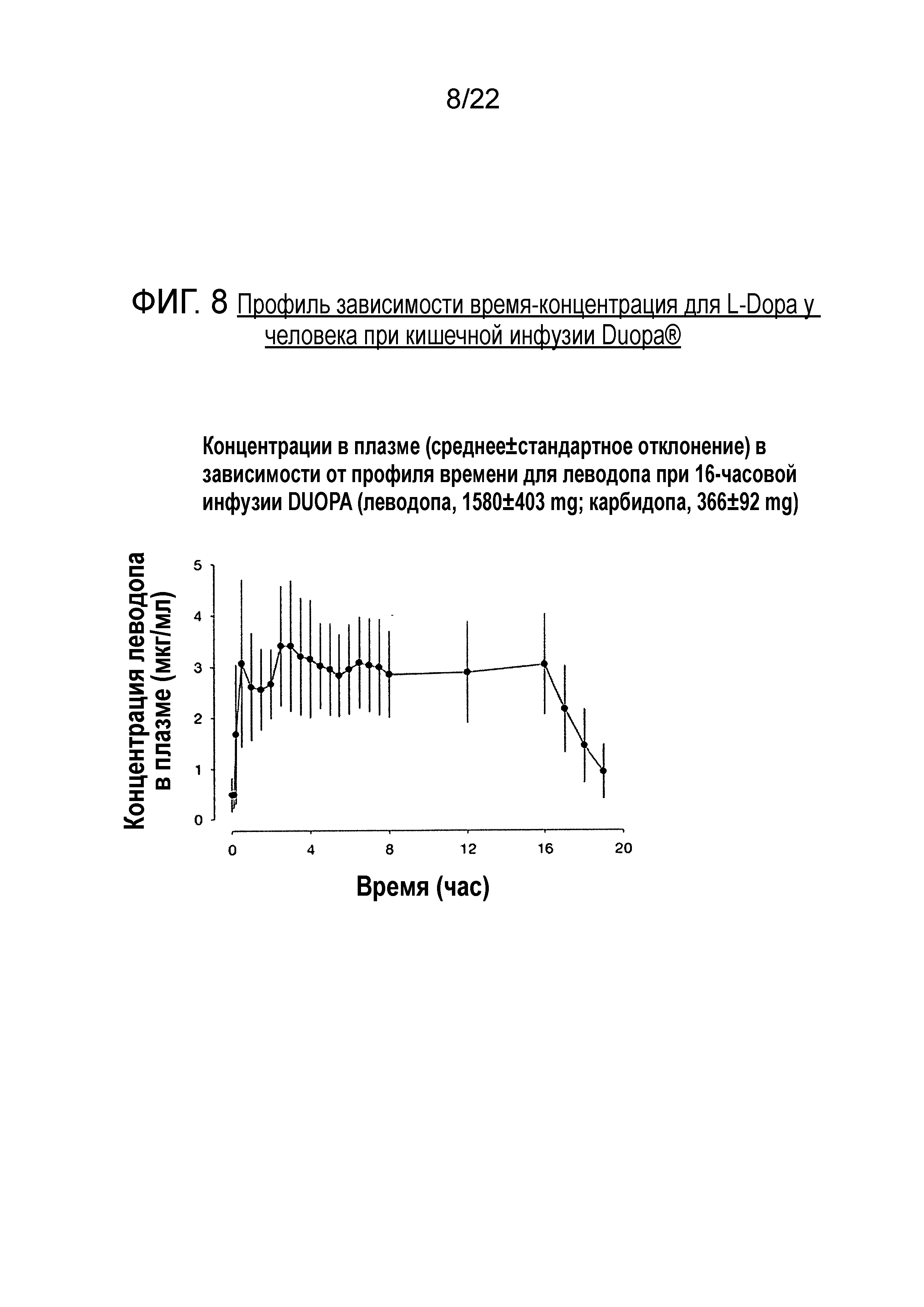
[0020] Фигура 8 представляет собой профиль зависимости время-концентрация для уровней L-dopa в крови у человека после введения Duopa®.
[0021] Фигура 9 представляет собой профиль зависимости время-концентрация для уровней карбидопа в крови и уровней 4ʹ-монофосфата карбидопа в крови у крыс после введения комбинации 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа в соотношении 4:1.
[0022] Фигура 10 представляет собой профиль зависимости время-концентрация для уровней L-dopa в крови у минисвиней после введения комбинации 3ʹ,4ʹ-дифосфата L-dopa и 3ʹ,4ʹ-дифосфата карбидопа в различных соотношениях доз.
[0023] Фигура 11 представляет собой профиль зависимости время-концентрация для уровней L-dopa в крови и уровней 4ʹ-монофосфата L-dopa в крови у минисвиней после введения комбинации 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа в соотношении 15:1.
[0024] Фигура 12 представляет собой профиль зависимости время-концентрация для уровней карбидопа в крови и уровней 4ʹ-монофосфата карбидопа в крови у минисвиней после введения комбинации 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа в соотношении 15:1
[0025] Фигура 13 представляет собой паттерн порошковой рентгенодифракции ангидрата 4ʹ-монофосфата L-dopa (i).
[0026] Фигура 14 представляет собой паттерн порошковой рентгенодифракции ангидрата 4ʹ-монофосфата L-dopa (ii).
[0027] Фигура 15 представляет собой паттерн порошковой рентгенодифракции 3ʹ-монофосфата L-dopa.
[0028] Фигура 16 представляет собой паттерн порошковой рентгенодифракции тригидрата 3ʹ,4ʹ-дифосфата L-dopa.
[0029] Фигура 17 представляет собой паттерн порошковой рентгенодифракции тригидрата 4ʹ-монофосфата карбидопа.
[0030] Фигура 18 представляет собой паттерн порошковой рентгенодифракции дигидрата 4ʹ-монофосфата карбидопа.
[0031] Фигура 19 представляет собой паттерн порошковой рентгенодифракции дегидрата 4ʹ-монофосфата карбидопа.
[0032] Фигура 20 представляет собой паттерн порошковой рентгенодифракции 3ʹ-монофосфата карбидопа (i).
[0033] Фигура 21 представляет собой паттерн порошковой рентгенодифракции 3ʹ-монофосфата карбидопа (ii).
[0034] Фигура 22 представляет собой паттерн порошковой рентгенодифракции натриевой соли 3ʹ,4ʹ-дифосфата карбидопа.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0035] В этом письменном описании использованы примеры, чтобы описать изобретение, включая наилучший способ, а также, чтобы позволить специалисту в данной области осуществление изобретения, включая получение и использование любых описанных пролекарств фосфатов карбидопа или фармацевтических композиций, и осуществления любых из описанных способов или процессов. Патентоспособный объем изобретения определен посредством формулы изобретения и может включать в себя другие примеры, встречающиеся специалистам в данной области. Такие другие примеры предназначены для включения в объем формулы изобретения, если они обладают элементами, не отличающимися от буквальных формулировок, или если они включают в себя эквивалентные элементы.
I. Определения
[0036] Заголовки разделов, как применяют в этом разделе и полном описании, не предназначены, чтобы являться ограничивающими.
[0037] Когда перечислен числовой диапазон, каждое промежуточное число внутри диапазона явно предусмотрено с такой же степенью точности. Например, в случае диапазона от 6 до 9, числа 7 и 8 предусмотрены в дополнение к 6 и 9, и в случае диапазона от 6,0 до 7,0, числа 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 и 7,0 явно предусмотрены. Подобным образом, все перечисленные соотношения также включают в себя все подсоотношения, попадающие в более широкое соотношение.
[0038] Неконкретизированные формы единственного числа включают в себя ссылки на множественное число, если из контекста явно не следует иначе.
[0039] Термин «и/или», как применяют в такой фразе, как «A и/или B», в настоящем документе предназначен для включения «A и B», «A или B», «A» и «B».
[0040] Термин «приблизительно» в общем относится к диапазону чисел, которые специалист в данной области может считать эквивалентными указанному значению (т.е., обладающими такой же функцией или приводящими к такому же результату). Во многих случаях, термин «приблизительно» может включать в себя числа, округленные до ближайшей значащей цифры.
[0041] Если контекст не требует иного, термины «содержать», «содержит» и «содержащий» используют на основании и с ясным пониманием того, что их следует интерпретировать включительно, а не исключительно, и того, что авторы настоящего изобретения подразумевают такую интерпретацию каждого из этих слов в толковании этого патента, включая формулу изобретения ниже.
[0042] Термины «улучшать» и «улучшение» обладают их общепринятым и обычным значением для специалиста в области фармацевтики или медицины, и конкретно включают в себя облегчение эффектов болезни Паркинсона, или снижение или уменьшение побочного эффекта болезни Паркинсона.
[0043] Термин «пациент» включает в себя млекопитающих и человека, особенно человека.
[0044] Термин «фармацевтически приемлемый носитель» или «фармацевтически приемлемый наполнитель» относится к всем без исключения растворителям, диспергирующим средам, консервантам, антиоксидантам, покрытиям, изотоническим и замедляющим абсорбцию средствам, и т.п., совместимыми с фармацевтическим введением.
[0045] Термин «фармацевтически приемлемая соль» относится к соли соединения, которая является фармацевтически приемлемой и которая обладает желательной фармакологической активностью исходного соединения. Такие соли включают в себя: (1) кислотно-аддитивные соли, сформированные с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; или сформированные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, виннокаменная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2,2,2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, третичная бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и т.п.; и (2) соли, сформированные, когда протон кислоты, присутствующий в исходном соединении, либо заменен на ион металла, например, ион щелочного металла, ион щелочноземельного металла или ион алюминия; либо скоординирован с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин, дициклогексиламин и т.п.
[0046] Термины «уменьшать» и «уменьшение» обладают их общепринятым и обычным значением для специалиста в области фармацевтики или медицины и конкретно включают в себя сокращение или уменьшение количества случаев, продолжительности или интенсивности побочных эффектов болезни Паркинсона, таких как дискинезии или галлюцинации.
[0047] Термин «терапевтически эффективное количество» обозначает количество соединения, которое, при введении пациенту, страдающему от болезни Паркинсона или ассоциированного состояния, или чувствительному к ним, либо отдельно, либо в комбинации с дополнительными способами терапии, обеспечивает эффект лечения болезни Паркинсона или ассоциированного состояния. «Терапевтически эффективное количество» может меняться, например, в зависимости от соединения, подвергаемого лечению состояния и его тяжести, и возраста и массы пациента, подлежащего лечению.
[0048] Термины «лечить» и «лечение» обладают их общепринятым и обычным значением для специалиста в области фармацевтики или медицины и конкретно включают в себя улучшение качества жизни или уменьшение симптомов или побочных эффектов болезни Паркинсона.
II. Пролекарства карбидопа и L-Dopa
[0049] Как отмечено ранее, присущая L-dopa и карбидопа низкая растворимость в воде при физиологически приемлемом pH для инфузии представляет собой значительную техническую проблему для разработки улучшенных фармацевтических композиций и способов лечения. Такие проблемы включают в себя, например, сложности в достижении подходящего объема дозирования и стабильности состава в рамках требуемых ограничений pH. Эти проблемы дополнительно осложняются требованием того, чтобы фармацевтические композиции и способы лечения обеспечивали фармакокинетически пригодный и фармакокинетически соответствующий контроль уровней дофамина в головном мозге пациента.
[0050] Предшествующие подходы к получению пролекарства потерпели неудачу по ряду причин из-за этих технических проблем (включая недостаточную химическую стабильность, недостаточную растворимость, проблемы с биопревращением in vivo, и т.п.), и никаких пролекарств L-dopa или пролекарств карбидопа для инфузии не было успешно запущено в серийное производство. Однако, пролекарства, фармацевтические комбинации и композиции, и способы лечения по настоящему описанию преодолевают эти проблемы. Их можно использовать для лечения пациентов, страдающих болезнью Паркинсона и ассоциированными состояниями, и они не всегда требуют инвазивного хирургического вмешательства. В различных вариантах осуществления по настоящему описанию, композиции включают в себя пролекарства L-dopa и карбидопа, которые превращаются в L-dopa и карбидопа in vivo, что позволяет доставку посредством способов непрерывного введения, включая внутрижелудочное, внутримышечное, внутривенное и подкожное введение. Эти новые пролекарства, комбинации, композиции и способы по настоящему описанию представляют собой усовершенствование в лечении болезни Паркинсона и других родственных состояний.
A. Пролекарства карбидопа
[0051] В одном варианте осуществления таким образом, настоящее описание относится к соединению, соответствующему по структуре формуле (I):
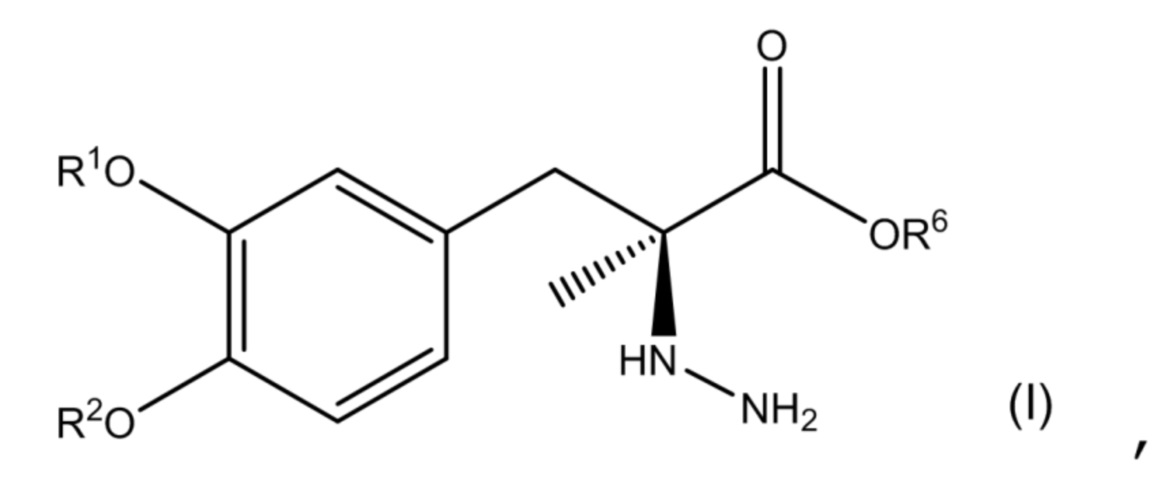
или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2. В одном аспекте соединение соответствует по структуре формуле (I). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (I).
[0052] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и -P(O)(OH)2; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2. В одном аспекте соединение соответствует по структуре формуле (I). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (I).
[0053] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I-a):
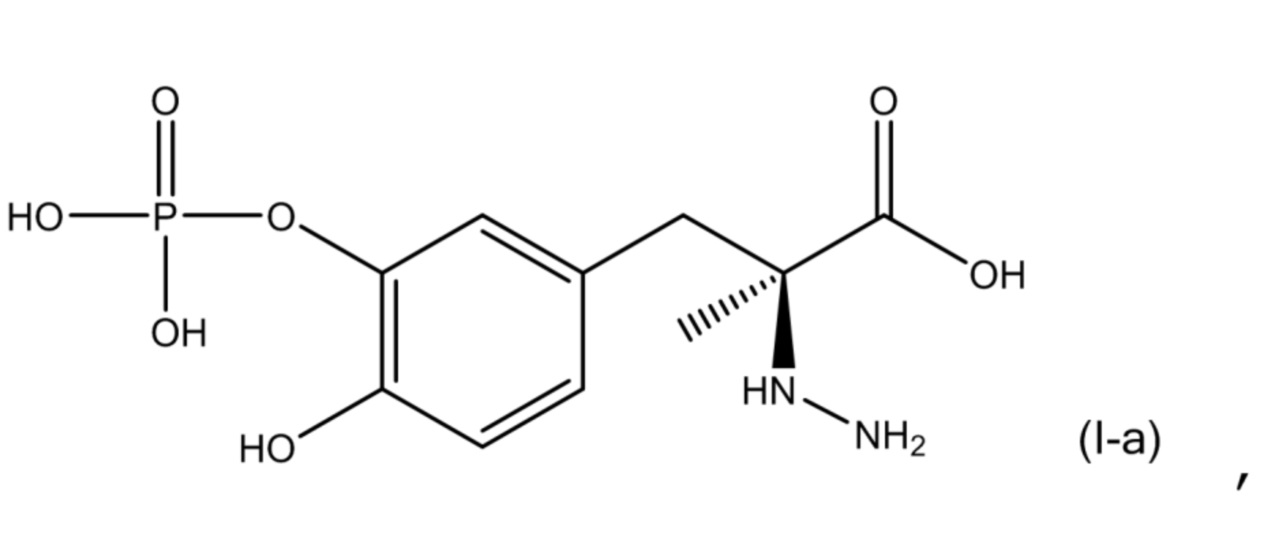
или его фармацевтически приемлемой соли. В одном аспекте соединение соответствует по структуре формуле (I-a). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (I-a).
[0054] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I-b):

или его фармацевтически приемлемой соли. В одном аспекте соединение соответствует по структуре формуле (I-b). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (I-b).
[0055] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I-c):

или его фармацевтически приемлемой соли. В одном аспекте соединение соответствует по структуре формуле (I-c). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (I-c).
[0056] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и -R5-O-P(O)(OH)2; где R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой-R5-O-P(O)(OH)2.
[0057] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и -R5-O-P(O)(OH)2; где R5представляет собой метил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -R5-O-P(O)(OH)2.
[0058] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и -R5-O-P(O)(OH)2; где R5представляет собой этил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -R5-O-P(O)(OH)2.
[0059] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и -R5-O-P(O)(OH)2; где R5представляет собой пропил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -R5-O-P(O)(OH)2.
[0060] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и -R5-O-P(O)(OH)2; где R5представляет собой бутил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -R5-O-P(O)(OH)2.
[0061] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C2-алкил; R6представляет собой водород; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[0062] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо представляет собой водород или -R5-O-P(O)(OH)2; R5представляет собой C1-C2-алкил; R6представляет собой водород; и при этом один из R1 и R2 представляет собой -R5-O-P(O)(OH)2.
[0063] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I-d):

или его фармацевтически приемлемой соли. В одном аспекте соединение соответствует по структуре формуле (I-d). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (I-d).
[0064] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I-e):

[0065] или его фармацевтически приемлемой соли. В одном аспекте соединение соответствует по структуре формуле (I-e). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (I-e).
[0066] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и -P(O)(OH)2; R6представляет собой водородили C1-C4-алкил;и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2.
[0067] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и -P(O)(OH)2; R6представляет собой метил;и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2.
[0068] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и -P(O)(OH)2; R6представляет собой этил;и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2.
[0069] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и -P(O)(OH)2; R6представляет собой пропил;и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2.
[0070] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и -P(O)(OH)2; R6представляет собойбутил;и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2.
[0071] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I), или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо представляет собой водород, -P(O)(OH)2или -R5-O-P(O)(OH)2; R5представляет собой C1-C2-алкил; R6представляет собой C1-C2-алкил; и при этом один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[0072] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (I-f):

[0073] или его фармацевтически приемлемой соли. В одном аспекте соединение соответствует по структуре формуле (I-f). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (I-f).
B. Пролекарства L-Dopa
[0074] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II):
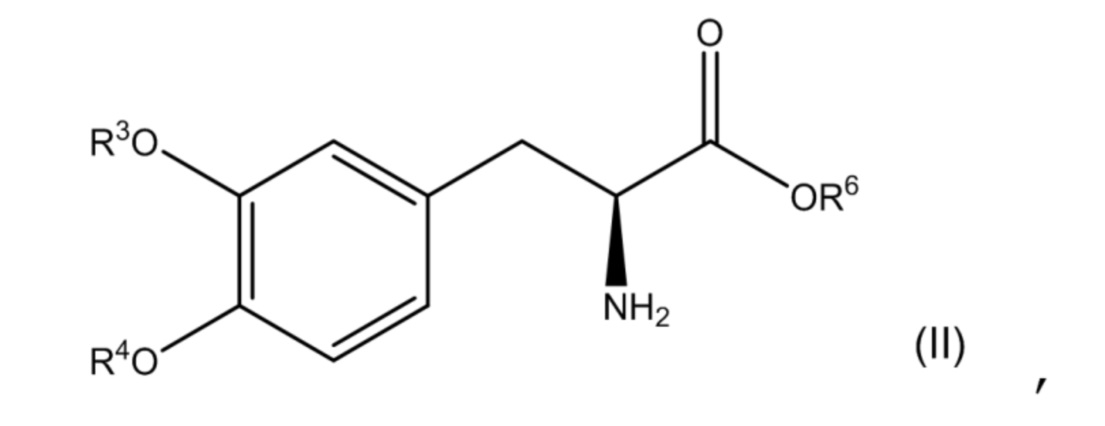
или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2. В одном аспекте соединение соответствует по структуре формуле (II). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (II).
[0075] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II), или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода и -P(O)(OH)2; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2. В одном аспекте соединение соответствует по структуре формуле (II). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (II).
[0076] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II-a):

или его фармацевтически приемлемой соли. В одном аспекте соединение соответствует по структуре формуле (II-a). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (II-a).
[0077] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II-b):

или его фармацевтически приемлемой соли. В одном аспекте соединение соответствует по структуре формуле (II-b). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (II-b).
[0078] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II-c):

или его фармацевтически приемлемой соли. В одном аспекте соединение соответствует по структуре формуле (II-c). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (II-c).
[0079] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II), или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода и -R5-O-P(O)(OH)2; где R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой-R5-O-P(O)(OH)2.
[0080] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II), где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода и -R5-O-P(O)(OH)2; где R5представляет собой метил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -R5-O-P(O)(OH)2.
[0081] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II), где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода и -R5-O-P(O)(OH)2; где R5представляет собой этил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -R5-O-P(O)(OH)2.
[0082] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II), где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода и -R5-O-P(O)(OH)2; где R5представляет собой пропил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -R5-O-P(O)(OH)2.
[0083] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II), где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода и -R5-O-P(O)(OH)2; где R5представляет собой бутил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -R5-O-P(O)(OH)2.
[0084] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II-d):

или его фармацевтически приемлемой соли. В одном аспекте соединение соответствует по структуре формуле (II-d). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (II-d).
[0085] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II-e):

или его фармацевтически приемлемой соли. В одном аспекте соединение соответствует по структуре формуле (II-e). В другом аспекте соединение представляет собой фармацевтически приемлемую соль соединения, соответствующего по структуре формуле (II-e).
[0086] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II), или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода и -P(O)(OH)2; R6представляет собой водородили C1-C4-алкил;и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2.
[0087] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II), или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода и -P(O)(OH)2; R6представляет собой метил;и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2.
[0088] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II), или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода и -P(O)(OH)2; R6представляет собой этил;и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2.
[0089] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II), или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода и -P(O)(OH)2; R6представляет собой пропил;и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2.
[0090] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II), или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода и -P(O)(OH)2; R6представляет собойбутил;и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2.
[0091] В другом варианте осуществления настоящее описание относится к соединению, соответствующему по структуре формуле (II), или его фармацевтически приемлемой соли, где R3 представляет собой водород; R4 представляет собой -P(O)(OH)2; и R6представляет собой метил.
III. Промежуточные соединения
[0092] Новые способы синтеза, описанные в настоящем документе для получения фосфатов L-dopa и фосфатов карбидопа, привели к получению следующих новых промежуточных соединений:



[0093] Как применяют в настоящем документе, «Bn» относится к бензильной группе, и «Cbz» относится к карбоксибензильной группе.
IV. Фармацевтические комбинации/композиции
[0094] Настоящее описание относится также к фармацевтическим комбинациям и композициям, содержащим пролекарство карбидопа и/или пролекарство L-dopa.
[0095] В некоторых вариантах осуществления фармацевтические композиции содержат пролекарство карбидопа. В других вариантах осуществления фармацевтические композиции содержат пролекарство L-dopa. В других вариантах осуществления, фармацевтические композиции содержат как пролекарство карбидопа, так и пролекарство L-dopa.
[0096] Пролекарства карбидопа и L-dopa, описанные в настоящем документе (и их фармацевтически приемлемые соли), можно составлять в одной и той же фармацевтической композиции или можно представлять в отдельных фармацевтических композициях. Например, фармацевтическая комбинация, описанная в настоящем документе, может содержать пролекарство карбидопа в первой фармацевтической композиции и пролекарство L-dopa в отдельной, второй фармацевтической композиции. Альтернативно, фармацевтическая комбинация может содержать пролекарство карбидопа и пролекарство L-dopa в одной и той же фармацевтической композиции.
A. Первое соединение и второе соединение
[0097] В одном варианте осуществления фармацевтическая композиция содержит первое соединение, соответствующее по структуре формуле (I):

или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель; где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2. В одном аспекте композиция содержит первое соединение, соответствующее по структуре формуле (I). В другом аспекте композиция содержит фармацевтически приемлемую соль первого соединения, соответствующего по структуре формуле (I).
[0098] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, соответствующее по структуре формуле (I-a), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В одном аспекте композиция содержит первое соединение, соответствующее по структуре формуле (I-a). В другом аспекте композиция содержит фармацевтически приемлемую соль первого соединения, соответствующего по структуре формуле (I-a).
[0099] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, соответствующее по структуре формуле (I-b), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В одном аспекте композиция содержит первое соединение, соответствующее по структуре формуле (I-b). В другом аспекте композиция содержит фармацевтически приемлемую соль первого соединения, соответствующего по структуре формуле (I-b).
[0100] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, соответствующее по структуре формуле (I-c), или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель. В одном аспекте композиция содержит первое соединение, соответствующее по структуре формуле (I-c). В другом аспекте композиция содержит фармацевтически приемлемую соль первого соединения, соответствующего по структуре формуле (I-c).
[0101] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, соответствующее по структуре формуле (I-d), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В одном аспекте композиция содержит первое соединение, соответствующее по структуре формуле (I-d). В другом аспекте композиция содержит фармацевтически приемлемую соль первого соединения, соответствующего по структуре формуле (I-d).
[0102] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, соответствующее по структуре формуле (I-e), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В одном аспекте композиция содержит первое соединение, соответствующее по структуре формуле (I-e). В другом аспекте композиция содержит фармацевтически приемлемую соль первого соединения, соответствующего по структуре формуле (I-e).
[0103] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, соответствующее по структуре формуле (I-f), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В одном аспекте композиция содержит первое соединение, соответствующее по структуре формуле (I-f). В другом аспекте композиция содержит фармацевтически приемлемую соль первого соединения, соответствующего по структуре формуле (I-f).
[0104] В одном варианте осуществления фармацевтическая композиция содержит второе соединение, соответствующее по структуре формуле (II):
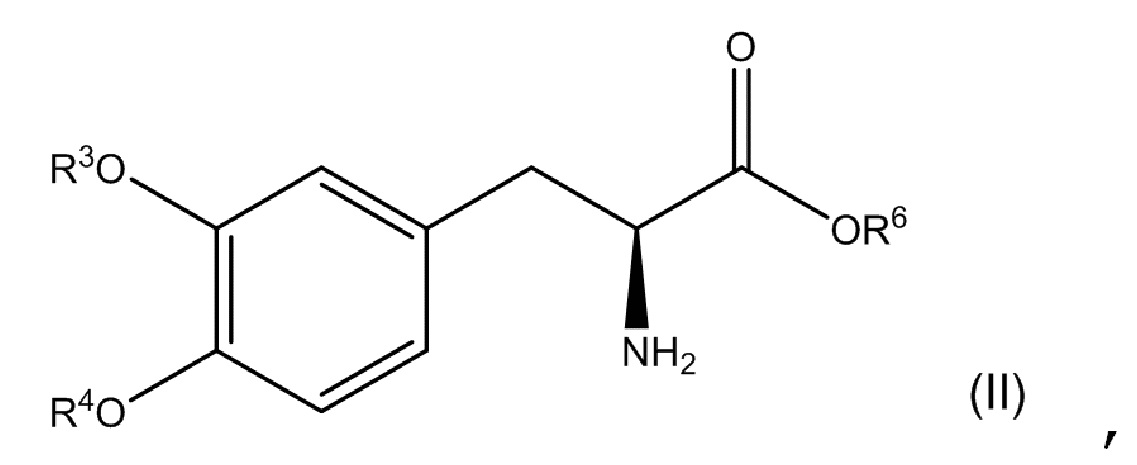
или его фармацевтически приемлемую соль, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2. В одном аспекте композиция содержит второе соединение, соответствующее по структуре формуле (II). В другом аспекте композиция содержит фармацевтически приемлемую соль первого соединения, соответствующего по структуре формуле (II).
[0105] В другом варианте осуществления фармацевтическая композиция содержит второе соединение, соответствующее по структуре формуле (II-a), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В одном аспекте композиция содержит второе соединение, соответствующее по структуре формуле (II-a). В другом аспекте композиция содержит фармацевтически приемлемую соль второго соединения, соответствующего по структуре формуле (II-a).
[0106] В другом варианте осуществления фармацевтическая композиция содержит второе соединение, соответствующее по структуре формуле (II-b), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В одном аспекте композиция содержит второе соединение, соответствующее по структуре формуле (II-b). В другом аспекте композиция содержит фармацевтически приемлемую соль второго соединения, соответствующего по структуре формуле (II-b).
[0107] В другом варианте осуществления фармацевтическая композиция содержит второе соединение, соответствующее по структуре формуле (II-c), или его фармацевтически приемлемую соли и фармацевтически приемлемый носитель. В одном аспекте композиция содержит второе соединение, соответствующее по структуре формуле (II-c). В другом аспекте композиция содержит фармацевтически приемлемую соль второго соединения, соответствующего по структуре формуле (II-c).
[0108] В другом варианте осуществления фармацевтическая композиция содержит второе соединение, соответствующее по структуре формуле (II-d), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В одном аспекте композиция содержит второе соединение, соответствующее по структуре формуле (II-d). В другом аспекте композиция содержит фармацевтически приемлемую соль второго соединения, соответствующего по структуре формуле (II-d).
[0109] В другом варианте осуществления фармацевтическая композиция содержит второе соединение, соответствующее по структуре формуле (II-e), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В одном аспекте композиция содержит второе соединение, соответствующее по структуре формуле (II-e). В другом аспекте композиция содержит фармацевтически приемлемую соль второго соединения, соответствующего по структуре формуле (II-e).
[0110] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I):

или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2; и
второе соединение соответствует по структуре соединению формулы (II):

или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[0111] Композиция может независимо содержать первое соединение и второе соединение либо как свободную форму соединения, либо как фармацевтически приемлемую соль соединения. В одном аспекте композиция содержит свободную форму первого соединения. В другом аспекте композиция содержит фармацевтически приемлемую соль первого соединения. В другом аспекте композиция содержит свободную форму второго соединения. В другом аспекте композиция содержит фармацевтически приемлемую соль второго соединения. В другом аспекте композиция содержит свободную форму первого соединения и свободную форму второго соединения. В другом аспекте композиция содержит фармацевтически приемлемую соль первого соединения и фармацевтически приемлемую соль второго соединения.
[0112] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-a) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II):

или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[0113] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-b) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II):

или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[0114] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-c) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II):

или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[0115] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-d) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II):

или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[0116] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-e) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II):

или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[0117] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-f) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II):

или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[0118] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I):

или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2; и
второе соединение соответствует по структуре соединению формулы (II-a) или его фармацевтически приемлемой соли.
[0119] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I):

или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2; и
второе соединение соответствует по структуре соединению формулы (II-b) или его фармацевтически приемлемой соли.
[0120] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I):

или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2; и
второе соединение соответствует по структуре соединению формулы (II-c) или его фармацевтически приемлемой соли.
[0121] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I):

или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2; и
второе соединение соответствует по структуре соединению формулы (II-d) или его фармацевтически приемлемой соли.
[0122] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I):

или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2; и
второе соединение соответствует по структуре соединению формулы (II-e) или его фармацевтически приемлемой соли.
[0123] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-a):или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-a) или его фармацевтически приемлемой соли.
[0124] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-b) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-a) или его фармацевтически приемлемой соли.
[0125] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-c) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-a) или его фармацевтически приемлемой соли.
[0126] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-d) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-a) или его фармацевтически приемлемой соли.
[0127] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-e) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-a) или его фармацевтически приемлемой соли.
[0128] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-f) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-a) или его фармацевтически приемлемой соли.
[0129] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-a) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-b) или его фармацевтически приемлемой соли.
[0130] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-b) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-b) или его фармацевтически приемлемой соли.
[0131] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-c) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-b) или его фармацевтически приемлемой соли.
[0132] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-d) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-b) или его фармацевтически приемлемой соли.
[0133] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-e) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-b) или его фармацевтически приемлемой соли.
[0134] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-f) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-b) или его фармацевтически приемлемой соли.
[0135] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-a) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-c) или его фармацевтически приемлемой соли.
[0136] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-b) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-c) или его фармацевтически приемлемой соли.
[0137] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-c) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-c) или его фармацевтически приемлемой соли.
[0138] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-d) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-c) или его фармацевтически приемлемой соли.
[0139] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-e) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-c) или его фармацевтически приемлемой соли.
[0140] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-f) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-c) или его фармацевтически приемлемой соли.
[0141] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-a) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-d) или его фармацевтически приемлемой соли.
[0142] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-b) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-d) или его фармацевтически приемлемой соли.
[0143] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-c) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-d) или его фармацевтически приемлемой соли.
[0144] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-d) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-d) или его фармацевтически приемлемой соли.
[0145] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-e) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-d) или его фармацевтически приемлемой соли.
[0146] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-f) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-d) или его фармацевтически приемлемой соли.
[0147] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-a) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-e) или его фармацевтически приемлемой соли.
[0148] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-b) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-e) или его фармацевтически приемлемой соли.
[0149] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-c) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-e) или его фармацевтически приемлемой соли.
[0150] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-d) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-e) или его фармацевтически приемлемой соли.
[0151] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-e) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-e) или его фармацевтически приемлемой соли.
[0152] В другом варианте осуществления фармацевтическая композиция содержит первое соединение, второе соединение и фармацевтически приемлемый носитель, где:
первое соединение соответствует по структуре соединению формулы (I-f) или его фармацевтически приемлемой соли; и
второе соединение соответствует по структуре соединению формулы (II-e) или его фармацевтически приемлемой соли.
[0153] Фармацевтические композиции по настоящему описанию, содержащие как первое соединение, так и второе соединение, как правило, содержат первое соединение и второе соединение в массовом отношении от приблизительно 1:1 до приблизительно 1:50. В одном аспекте массовое отношение составляет от приблизительно 1:2 до приблизительно 1:15. В другом аспекте массовое отношение составляет от приблизительно 1:4 до приблизительно 1:10. В другом аспекте массовое отношение составляет приблизительно 1:4. В другом аспекте массовое отношение составляет приблизительно 1:7,5. В другом аспекте массовое отношение составляет приблизительно 1:10.
B. Дополнительные наполнители
[0154] Фармацевтические композиции по настоящему описанию необязательно содержат один или несколько дополнительных фармацевтически приемлемых наполнителей. Термин «наполнитель» относится к любому веществу, не являющемуся собственно лекарственным средством, используемому в качестве носителя или переносчика для доставки лекарственного средства субъекту или добавляемому к фармацевтической композиции для улучшения ее свойств для манипуляций или хранения, или чтобы позволять или облегчать формирование композиций единичной дозы.
[0155] Наполнители включают в себя, например, антиоксиданты, средства для регуляции pH и осмолярности, консерванты, загустители, красители, забуферивающие средства, бактериостатики и стабилизаторы. Данный наполнитель, если присутствует, как правило, присутствует в количестве от приблизительно 0,001% до приблизительно 95%, от приблизительно 0,01% до приблизительно 80%, от приблизительно 0,02% до приблизительно 25% или от приблизительно 0,3% до приблизительно 10% по массе.
[0156] В одном варианте осуществления фармацевтические композиции, необязательно, содержат антиоксидант. Подходящие антиоксиданты для применения в фармацевтических композициях включают в себя, например, бутилированный гидрокситолуол, бутилированный гидроксианизол, метабисульфит калия и т.п.
[0157] В одном варианте осуществления фармацевтические композиции, необязательно, содержат забуферивающее средство. Забуферивающие средства включают в себя средства, уменьшающие изменения pH. Подходящие классы забуферивающих средств для применения в различных вариантах осуществления настоящего изобретения содержат соль металла группы IA, включая, например, соль бикарбонат металла группы IA, соль карбонат металла группы IA, забуферивающее средство на основе щелочного или щелочноземельного металла, забуферивающее средство на основе алюминия, забуферивающее средство на основе кальция, забуферивающее средство на основе натрия или забуферивающее средство на основе магния. Подходящие забуферивающие средства дополнительно включают в себя карбонаты, фосфаты, бикарбонаты, цитраты, бораты, ацетаты, фталаты, тартратя, сукцинаты любого из указанного выше, например, фосфат, цитрат, борат, ацетат, бикарбонат и карбонат натрия или калия.
C. Лекарственные формы
Твердая композиция
[0158] В одном варианте осуществления фармацевтическая композиция представляет собой твердую композицию.
[0159] В другом варианте осуществления фармацевтическая композиция представляет собой твердую композицию, подходящую для перорального введения. Первое и второе соединение могут присутствовать в форме независимых, отдельных твердых лекарственных форм или могут быть объединены в одной и той же твердой лекарственной форме. Подходящие твердые лекарственные формы включают в себя капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах, первое и/или второе соединение можно смешивать по меньшей мере с одним инертным, фармацевтически приемлемым наполнителем или носителем, таким как цитрат натрия или фосфат дикальция и/или с a) наполнителями или расширителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота; b) связующими веществами, такими как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик; c) увлажнителями, такими как глицерин; d) дезинтегрирующими средствами, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, конкретные силикаты и карбонат натрия; e) замедляющими растворение средствами, такими как парафин; f) ускорителями всасывания, такими как соединения четвертичного аммония; g) увлажняющими средствами, такими как цетиловый спирт и глицеринмоностеарат; h) абсорбентами, такими как каолин и бентонитовая глина, и i) смазывающими средствами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль, лекарственная форма может также содержать забуферивающие средства.
[0160] Твердые композиции сходного типа также можно применять в качестве наполнителей в желатиновых капсулах с мягким или твердым наполнением с использованием таких носителей, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п.
[0161] Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул можно получать с покрытиями и оболочками, такими как растворяющиеся в кишечнике покрытия и другие покрытия, хорошо известными в области получения фармацевтических составов. Они могут, необязательно, содержать средства, снижающие прозрачность, а также могут представлять собой такие композиции, что они высвобождают активный ингредиент(ы) исключительно или предпочтительно, в конкретной части кишечного тракта, необязательно, замедленным образом. Примеры композиций для погружения, которые можно использовать, включают в себя полимерные вещества и воска.
[0162] Первое и/или второе соединения могут также находиться в микроинкапсулированной форме (раздельно или вместе), по необходимости, с одним или несколькими из указанных выше носителей.
Жидкая композиция
[0163] В одном варианте осуществления фармацевтическая композиция представляет собой жидкую композицию. В одном аспекте композиция содержит воду и является подходящей для инфузии.
[0164] В другом варианте осуществления фармацевтическая композиция представляет собой жидкую композицию, которая является подходящей для внутрижелудочного введения, введения в кишечник (например, введения в двенадцатиперстную кишку, в тощую кишку), интраназального, подкожного, внутримышечного или внутривенного введения. В одном аспекте композиция является подходящей для внутрижелудочного введения. В другом аспекте композиция является подходящей для подкожного введения. В другом аспекте композиция является подходящей для внутримышечного введения. В другом аспекте композиция является подходящей для внутривенного введения. В другом аспекте композиция является подходящей для введения в кишечник. В другом аспекте композиция является подходящей для введения в двенадцатиперстную кишку. В другом аспекте композиция является подходящим для введения в тощую кишку. В другом аспекте композиция является подходящей для интраназального введения.
[0165] В другом варианте осуществления фармацевтическая композиция представляет собой водную фармацевтическую композицию, обладающую концентрацией пролекарства L-dopa по меньшей мере приблизительно 5 мг/мл. В одном аспекте концентрация пролекарства L-dopa составляет по меньшей мере приблизительно 10 мг/мл. В другом аспекте концентрация пролекарства L-dopa составляет по меньшей мере приблизительно 20 мг/мл. В другом аспекте концентрация пролекарства L-dopa составляет по меньшей мере приблизительно 30 мг/мл. В другом аспекте концентрация пролекарства L-dopa составляет по меньшей мере приблизительно 50 мг/мл. В другом аспекте концентрация пролекарства L-dopa составляет по меньшей мере приблизительно 100 мг/мл. В другом аспекте концентрация пролекарства L-dopa составляет по меньшей мере приблизительно 150 мг/ мл. В другом аспекте концентрация пролекарства L-dopa составляет по меньшей мере приблизительно 200 мг/мл. В другом аспекте концентрация пролекарства L-dopa составляет по меньшей мере приблизительно 250 мг/мл. В другом аспекте концентрация пролекарства L-dopa составляет по меньшей мере приблизительно 300 мг/мл. В другом аспекте концентрация пролекарства L-dopa составляет по меньшей мере приблизительно 350 мг/мл. В другом аспекте концентрация пролекарства L-dopa составляет по меньшей мере приблизительно 400 мг/мл. В частности, вышеуказанные концентрации пролекарства L-dopa могут представлять собой концентрации пролекарства фосфата L-dopa, более конкретно, концентрации пролекарства 3ʹ-монофосфата L-dopa, пролекарства 4ʹ-монофосфата L-dopa и/или пролекарства 3ʹ,4ʹ-дифосфата L-dopa.
[0166] В другом варианте осуществления фармацевтическая композиция представляет собой водную фармацевтическую композицию, обладающую концентрацией пролекарства карбидопа по меньшей мере приблизительно 5 мг/мл. В одном аспекте концентрация пролекарства карбидопа составляет по меньшей мере приблизительно 10 мг/мл. В другом аспекте концентрация пролекарства карбидопа составляет по меньшей мере приблизительно 20 мг/мл. В другом аспекте концентрация пролекарства карбидопа составляет по меньшей мере приблизительно 30 мг/мл. В другом аспекте концентрация пролекарства карбидопа составляет по меньшей мере приблизительно 50 мг/мл. В другом аспекте концентрация пролекарства карбидопа составляет по меньшей мере приблизительно 100 мг/мл. В другом аспекте концентрация пролекарства карбидопа составляет по меньшей мере приблизительно 150 мг/ мл. В другом аспекте концентрация пролекарства карбидопа составляет по меньшей мере приблизительно 200 мг/мл. В частности, вышеуказанные концентрации пролекарства карбидопа могут представлять собой концентрации пролекарства фосфата карбидопа, более конкретно, концентрации пролекарства 3ʹ-монофосфата карбидопа, пролекарства 4ʹ-монофосфата карбидопа и/или пролекарства 3ʹ,4ʹ-дифосфата карбидопа.
D. Уровень pH
[0167] В одном варианте осуществления фармацевтические композиции могут обладать pH ≥ ~2,0, ≥ ~2,5, ≥ ~3,0, ≥ ~3,5, ≥ ~4,0, ≥ ~4,5, ≥ ~5,0, ≥ ~5,5, ≥ ~6,0, ≥ ~6,2, ≥ ~6,4, ≥ ~6,5, ≥ ~6,6, ≥ ~6,8, ≥ ~7,0, ≥ ~7,1, ≥ ~7,2, ≥ ~7,3, ≥ ~7,4, ≥ ~7,5, ≥ ~7,6, ≥ ~7,7, ≥ ~7,8, ≥ ~7,9, ≥ ~8,0, ≥ ~8,2, ≥ ~8,4, ≥ ~8,6, ≥ ~8,8, или ≥ ~9,0. В частности, pH составляет ≥ ~7,4. Описанные в явной форме диапазоны включают в себя комбинации любых из вышеперечисленных значений, например, ~2,0 - ~7,5, ~6,0 - ~9,0, ~6,4 - ~7,7, ~7,0 - ~7,9, ~7,3 - ~8,2 и т.д. В одном из аспектов pH составляет от приблизительно 2 до приблизительно 8. В одном аспекте pH составляет от приблизительно 2,0 до приблизительно 7,5. В другом аспекте pH составляет от приблизительно 3,0 до приблизительно 7,5. В другом аспекте pH составляет от приблизительно 4,0 до приблизительно 7,5. В другом аспекте pH составляет от приблизительно 5,0 до приблизительно 7,5. В другом аспекте pH составляет от приблизительно 6,0 до приблизительно 7,5.
E. Стабильность
[0168] В другом варианте осуществления первое соединение (например, пролекарства фосфаты) и второе соединение (например, пролекарства фосфаты) в фармацевтических композициях преимущественно могут оставаться стабильными в жидких композициях (например, водных растворах) при описанных выше pH в течение ≥ ~24 часов, ≥ ~36 часов, ≥ ~48 часов, ≥ ~60 часов, ≥ ~72 часов, ≥ ~84 часов, ≥ ~96 часов, ≥ ~108 часов, ≥ ~120 часов, ≥ ~132 часов, ≥ ~136 часов, ≥ ~144 часов, ≥ ~156 часов, ≥ ~168 часов или ≥ ~180 часов. В частности, фармацевтические композиции могут оставаться стабильными в водных растворах в течение ≥ ~24 часов при pH ~6 - ~8. Описанные в явной форме диапазоны включают в себя комбинации любых из вышеперечисленных значений, например, от ~24 часов до ~180 часов, от ~24 часов до ~168 часов, от ~36 часов до ~72 часов и т.д. Такая увеличенная стабильность является важной для жидких композиций из фармацевтических композиций, поскольку, как правило, жидкие композиции хранят перед введением (например, внутрижелудочным, подкожным введением, введением в тощую кишку, интраназальным, внутримышечным и/или внутривенным введением), и таким образом, первое соединение и второе соединение должны оставаться стабильными и не должны значительно деградировать в ходе хранения.
F. Растворимость
[0169] В другом варианте осуществления первое соединение (например, пролекарства фосфаты) и второе соединение (например, пролекарства фосфаты) в фармацевтических композициях неожиданно обладают увеличенной растворимостью в жидких композициях (например, водных растворах). Например, первое соединение и/или второе соединение могут обладать растворимостью при pH приблизительно ~5 - ~8, или более конкретно, при приблизительно нейтральном pH от приблизительно 6,9 до приблизительно 7,5, ≥ ~90 мг/мл, ≥ ~100 мг/мл, ≥ ~110 мг/мл, ≥ ~120 мг/мл, ≥ ~130 мг/мл, ≥ ~140 мг/мл, ≥ ~150 мг/мл, ≥ ~160 мг/мл, ≥ ~170 мг/мл, ≥ ~180 мг/мл, ≥ ~190 мг/мл, ≥ ~200 мг/мл, ≥ ~210 мг/мл, ≥ ~220 мг/мл, ≥ ~230 мг/мл, ≥ ~240 мг/мл, ≥ ~250 мг/мл, ≥ ~260 мг/мл, ≥ ~270 мг/мл, ≥ ~280 мг/мл, ≥ ~290 мг/мл, ≥ ~300 мг/мл, ≥ ~310 мг/мл, ≥ ~320 мг/мл, ≥ ~330 мг/мл, ≥ ~340 мг/мл, ≥ ~350 мг/мл, ≥ ~360 мг/мл, ≥ ~370 мг/мл, ≥ ~380 мг/мл, ≥ ~390 мг/мл, ≥ ~400 мг/мл, ≥ ~410 мг/мл, ≥ ~420 мг/мл, ≥ ~430 мг/мл, ≥ ~440 мг/мл, ≥ ~450 мг/мл, ≥ ~460 мг/мл, ≥ ~470 мг/мл, ≥ ~480 мг/мл, ≥ ~490 мг/мл или ≥ ~500 мг/мл. Описанные в явной форме диапазоны включают в себя комбинации любых из вышеперечисленных значений, например, от ~90 мг/мл до ~500 мг/мл, от ~100 мг/мл до ~300 мг/мл, от ~200 мг/мл до ~500 мг/мл и т.д. В частности, первое соединение обладает растворимостью при нейтральном pH, например, приблизительно 7,4, ≥ ~160 мг/мл, в частности, ≥ ~200 мг/мл. В частности, второе соединение обладает растворимостью при нейтральном pH, например, приблизительно 7,4, ≥ ~370 мг/мл, в частности, ≥ ~400 мг/мл. Эта увеличенная растворимость позволяет более высокие концентрации первого соединения и/или второго соединения в фармацевтической композиции, что приводит к более эффективным и более высоким системным уровням первого соединения и/или второго соединения после введения пациенту.
G. Высвобождение гидразина
[0170] Первое соединение (например, пролекарства фосфаты) и/или второе соединение (например, пролекарства фосфаты) могут высвобождать некоторые количества гидразина, который является канцерогеном. Таким образом, является важным уменьшение высвобождения гидразина из фармацевтических композиций. Неожиданно обнаружено, что фармацевтические композиции, описанные в настоящем документе, при pH ~5 - ~8 (например, 7,4) высвобождают гидразин в количествах ≤ ~60 м.д./час, ≤ ~55 м.д./час, ≤ ~50 м.д./час, ≤ ~45 м.д./час, ≤ ~40 м.д./час, ≤ ~35 м.д./час, ≤ ~30 м.д./час, ≤ ~25 м.д./час, ≤ ~20 м.д./час, ≤ ~15 м.д./час, ≤ ~10 м.д./час, ≤ ~5 м.д./час, ≤ ~4 м.д./час, ≤ ~3 м.д./час, ≤ ~2 м.д./час, ≤ ~1 м.д./час или ≤ ~0,5 м.д./час. Описанные в явной форме диапазоны включают в себя комбинации любых из вышеперечисленных значений, например, от ~0,5 до ~60 м.д./час, от ~1 м.д./час до ~40 м.д./час, от ~1 м.д./час до ~10 м.д./час, от ~ 2 м.д./час до ~4 м.д./час и т.д. В частности, фармацевтические композиции высвобождают менее чем ~1 м.д./час гидразина.
H. Готовность к применению
[0171] В других вариантах осуществления, настоящее описание относится к готовым к применению ампуле или картриджу, или контейнеру, или корпусу, подходящим для содержания жидкого состава фармацевтической лекарственной формы. Такое содержание может выполнять функцию содержания жидкого состава, содержащего одно или несколько пролекарств карбидопа и/или одно или несколько пролекарств L-dopa. Флаконы могут также служить для хранения порошокообразных форм пролекарств(а) карбидопа и/или пролекарств(а) L-dopa, так что флакон может представлять собой готовый к применению формат, где при разведении водным носителем получают в результате готовую для отбора или загрузки форму для инъекции пациенту.
I. Фармацевтические комбинации
[0172] Как указано выше, фармацевтическая комбинация, содержащая первое соединение и второе соединение, также описана в настоящем документе. Первое соединение или его фармацевтически приемлемая соль и второе соединение или его фармацевтически приемлемая соль могут оба присутствовать в одной фармацевтической композиции или могут оба присутствовать в отдельных фармацевтических композициях. В случае разделения их можно вводить совместно, как более полно обсуждают в настоящем документе.
[0173] Таким образом, в одном варианте осуществления фармацевтическая комбинация, содержащая первое соединение, соответствующее по структуре соединению формулы (I):

или его фармацевтически приемлемую соль, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил;и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2; и
второе соединение, соответствующее по структуре соединению формулы (II):

или его фармацевтически приемлемую соль, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2, представлена в настоящем документе.
V. Способы лечения
[0174] Настоящее описание, кроме того, относится к способам лечения болезни Паркинсона и ассоциированных состояний, включающих в себя введение эффективного количества пролекарства карбидопа и пролекарства L-dopa пациенту.
[0175] В некоторых вариантах осуществления способы лечения болезни Паркинсона и ассоциированных состояний включают в себя обеспечение терапии спасения для лечения болезни Паркинсона и ассоциированных состояний. Термин «терапия спасения», как применяют в настоящем документе, представляет собой любую интенсивную и периодическую терапию, которую можно использовать для лечения неожиданного повторного появления моторных симптомов (например, неожиданного периода «выключения» или «изнашивания конца дозы» и непредсказуемых периодов «включения/выключения»). Пациенты с инвалидизирующими двигательными затруднениями могут проходить циклы между периодами «выключения», которые определяют как периоды плохой подвижности, заторможенности и скованности, и периодами «включения», которые определяют как периоды хорошего контроля двигательной системы без вызывающей трудности дискинезии.
[0176] В некоторых вариантах осуществления пролекарство фосфат карбидопа и пролекарство L-dopa вводят пациенту в форме фармацевтической композиции, содержащей оба пролекарства. В других вариантах осуществления пролекарство карбидопа и пролекарство L-dopa вводят пациенту раздельно.
A. Первое соединение и второе соединение, и их сочетания
[0177] В одном варианте осуществления настоящее описание относится к способу лечения состояния у субъекта (например, пациента) нуждающегося в таком лечении, где способ включает в себя введение пациенту фармацевтической комбинации, содержащей первое соединение и второе соединение, где:
первое соединение соответствует по структуре соединению формулы (I):

или его фармацевтически приемлемой соли, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5 представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2;
второе соединение соответствует по структуре соединению формулы (II):

или его фармацевтически приемлемой соли, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; где R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[0178] В одном варианте осуществления первое соединение и второе соединение вводят в количествах, которые вместе обеспечивают терапевтический эффект для субъекта (например, пациента).
[0179] В одном варианте осуществления первое соединение соответствует по структуре формуле (I-a), и второе соединение соответствует по структуре формуле (II-a).
[0180] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-b), и второе соединение соответствует по структуре формуле (II-a).
[0181] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-c), и второе соединение соответствует по структуре формуле (II-a).
[0182] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-d), и второе соединение соответствует по структуре формуле (II-a).
[0183] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-e), и второе соединение соответствует по структуре формуле (II-a).
[0184] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-f), и второе соединение соответствует по структуре формуле (II-a).
[0185] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-a), и второе соединение соответствует по структуре формуле (II-b).
[0186] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-b), и второе соединение соответствует по структуре формуле (II-b).
[0187] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-c), и второе соединение соответствует по структуре формуле (II-b).
[0188] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-d), и второе соединение соответствует по структуре формуле (II-b).
[0189] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-e), и второе соединение соответствует по структуре формуле (II-b).
[0190] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-f), и второе соединение соответствует по структуре формуле (II-b).
[0191] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-a), и второе соединение соответствует по структуре формуле (II-c).
[0192] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-b), и второе соединение соответствует по структуре формуле (II-c).
[0193] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-c), и второе соединение соответствует по структуре формуле (II-c).
[0194] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-d), и второе соединение соответствует по структуре формуле (II-c).
[0195] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-e), и второе соединение соответствует по структуре формуле (II-c).
[0196] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-f), и второе соединение соответствует по структуре формуле (II-c).
[0197] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-a), и второе соединение соответствует по структуре формуле (II-d).
[0198] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-b), и второе соединение соответствует по структуре формуле (II-d).
[0199] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-c), и второе соединение соответствует по структуре формуле (II-d).
[0200] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-d), и второе соединение соответствует по структуре формуле (II-d).
[0201] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-e) и второе соединение соответствует по структуре формуле (II-d).
[0202] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-f), и второе соединение соответствует по структуре формуле (II-d).
[0203] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-a), и второе соединение соответствует по структуре формуле (II-e).
[0204] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-b), и второе соединение соответствует по структуре формуле (II-e).
[0205] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-c), и второе соединение соответствует по структуре формуле (II-e).
[0206] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-d), и второе соединение соответствует по структуре формуле (II-e).
[0207] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-e), и второе соединение соответствует по структуре формуле (II-e).
[0208] В другом варианте осуществления первое соединение соответствует по структуре формуле (I-f), и второе соединение соответствует по структуре формуле (II-e).
B. Состояния, подвергаемые лечению
[209] В одном варианте осуществления состояние, подвергаемое лечению посредством введения первого соединения и второго соединения, представляет собой болезнь Паркинсона.
[210] В другом варианте осуществления состояние, подвергаемое лечению посредством введения первого соединения и второго соединения, представляет собой нарушение сна у пациента с болезнью Паркинсона (т.е., способ уменьшения нарушения сна у пациента с болезнью Паркинсона).
[211] В другом варианте осуществления состояние, подвергаемое лечению посредством введения первого соединения и второго соединения, представляет собой нарушенную двигательную активность у пациента с болезнью Паркинсона (т.е., способ улучшения двигательной активности у пациента с болезнью Паркинсона).
[212] В другом варианте осуществления состояние, подвергаемое лечению посредством введения первого соединения и второго соединения, представляет собой ночную недееспособность у пациента с болезнью Паркинсона (т.е., способ уменьшения количества случаев ночной недееспособности у пациента с болезнью Паркинсона).
[213] В другом варианте осуществления первое соединение и второе соединение вводят для лечения моторных флуктуаций у пациента с болезнью Паркинсона.
[214] В другом варианте осуществления первое соединение и второе соединение вводят для лечения дискинезии у пациента с болезнью Паркинсона.
[215] В другом варианте осуществления первое соединение и второе соединение вводят для задержки начала моторных флуктуаций у пациента с болезнью Паркинсона.
[216] В другом варианте осуществления первое соединение и второе соединение вводят для задержки начала дискинезии у пациента с болезнью Паркинсона.
C. Введение фармацевтической композиции
[217] В одном варианте осуществления настоящее описание относится к способу лечения состояния, нуждающегося в лечении, где способ включает в себя введение субъекту (например, пациенту) терапевтически эффективного количества фармацевтической композиции по настоящему описанию.
[218] В одном варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-a), и второе соединение, соответствующее по структуре формуле (II-a).
[219] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-b), и второе соединение, соответствующее по структуре формуле (II-a).
[220] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-c), и второе соединение, соответствующее по структуре формуле (II-a).
[221] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-d), и второе соединение, соответствующее по структуре формуле (II-a).
[222] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-e), и второе соединение, соответствующее по структуре формуле (II-a).
[223] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-f), и второе соединение, соответствующее по структуре формуле (II-a).
[224] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-a), и второе соединение, соответствующее по структуре формуле (II-b).
[225] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-b), и второе соединение, соответствующее по структуре формуле (II-b).
[226] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-c), и второе соединение, соответствующее по структуре формуле (II-b).
[227] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-d), и второе соединение, соответствующее по структуре формуле (II-b).
[228] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-e), и второе соединение, соответствующее по структуре формуле (II-b).
[229] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-f), и второе соединение, соответствующее по структуре формуле (II-b).
[230] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-a), и второе соединение, соответствующее по структуре формуле (II-c).
[231] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-b), и второе соединение, соответствующее по структуре формуле (II-c).
[232] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-c), и второе соединение, соответствующее по структуре формуле (II-c).
[233] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-d), и второе соединение, соответствующее по структуре формуле (II-c).
[234] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-e), и второе соединение, соответствующее по структуре формуле (II-c).
[235] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-f), и второе соединение, соответствующее по структуре формуле (II-c).
[236] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-a), и второе соединение, соответствующее по структуре формуле (II-d).
[237] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-b), и второе соединение, соответствующее по структуре формуле (II-d).
[238] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-c), и второе соединение, соответствующее по структуре формуле (II-d).
[239] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-d), и второе соединение, соответствующее по структуре формуле (II-d).
[240] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-e), и второе соединение, соответствующее по структуре формуле (II-d).
[241] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-f), и второе соединение, соответствующее по структуре формуле (II-d).
[242] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-a), и второе соединение, соответствующее по структуре формуле (II-e).
[243] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-b), и второе соединение, соответствующее по структуре формуле (II-e).
[244] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-c), и второе соединение, соответствующее по структуре формуле (II-e).
[245] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-d), и второе соединение, соответствующее по структуре формуле (II-e).
[246] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-e), и второе соединение, соответствующее по структуре формуле (II-e).
[247] В другом варианте осуществления вводимая композиция содержит первое соединение, соответствующее по структуре формуле (I-f), и второе соединение, соответствующее по структуре формуле (II-e).
D. Состояния, подвергаемые лечению
[248] В одном варианте осуществления состояние, подвергаемое лечению посредством введения фармацевтической композиции, представляет собой болезнь Паркинсона.
[249] В другом варианте осуществления состояние, подвергаемое лечению посредством введения фармацевтической композиции, представляет собой нарушение сна у пациента с болезнью Паркинсона (т.е., способ уменьшения нарушения сна у пациента с болезнью Паркинсона).
[250] В другом варианте осуществления состояние, подвергаемое лечению посредством введения фармацевтической композиции, представляет собой нарушенную двигательную активность у пациента с болезнью Паркинсона (т.е., способ улучшения двигательной активности у пациента с болезнью Паркинсона).
[251] В другом варианте осуществления фармацевтическую композицию вводят для лечения моторных флуктуаций у пациента с болезнью Паркинсона.
[252] В другом варианте осуществления фармацевтическую композицию вводят для лечения дискинезии у пациента с болезнью Паркинсона.
[253] В другом варианте осуществления фармацевтическую композиция вводят для задержки начала моторных флуктуаций у пациента с болезнью Паркинсона.
[254] В другом варианте осуществления фармацевтическую композицию вводят для задержки начала дискинезии у пациента с болезнью Паркинсона.
[255] В другом варианте осуществления состояние, подвергаемое лечению посредством введения фармацевтической композиции, представляет собой ночную недееспособность у пациента с болезнью Паркинсона (т.е., способ уменьшения количества случаев ночной недееспособности у пациента с болезнью Паркинсона).
E. Массовые отношения и способы введения
[256] Как правило, массовое отношение первого соединения (например, пролекарств фосфатов) и второго соединения (например, пролекарств фосфатов), вводимых пациенту (либо раздельно, либо вместе в одной фармацевтической композиции), составляет от приблизительно 1:1 до приблизительно 1:50. В одном аспекте массовое отношение составляет от приблизительно 1:2 до приблизительно 1:15. В другом аспекте массовое отношение составляет от приблизительно 1:4 до приблизительно 1:10. В другом аспекте массовое отношение составляет приблизительно 1:4. В другом аспекте массовое отношение составляет приблизительно 1:7,5. В другом аспекте массовое отношение составляет приблизительно 1:10.
[257] В одном варианте осуществления первое соединение (например, пролекарства фосфаты) и второе соединение (например, пролекарства фосфаты) вводят пациенту в форме твердой композиции (или твердых композиций). В одном аспекте композиция является подходящей для перорального введения.
[258] В одном варианте осуществления первое соединение (например, пролекарства фосфаты) и второе соединение (например, пролекарства фосфаты) вводят пациенту в форме жидкой композиции (или жидких композиций). В одном аспекте композиция содержит воду и является подходящей для инфузии.
[259] В другом варианте осуществления первое соединение (например, пролекарства фосфаты) и второе соединение (например, пролекарства фосфаты) вводят пациенту в форме жидкой композиции (либо раздельно, либо в одной и той же фармацевтической композиции), которая является подходящей для внутрижелудочного, подкожного, интраназального, внутримышечного или внутривенного введения. В одном аспекте жидкая композиция(композиции) является подходящей для внутрижелудочного введения. В другом аспекте жидкая композиция(композиции) является подходящей для подкожного введения. В другом аспекте жидкая композиция(композиции) является подходящей для внутримышечного введения. В другом аспекте жидкая композиция(композиции) является подходящей для внутривенного введения. В другом аспекте жидкая композиция(композиции) является подходящей для интраназального введения.
[260] В другом варианте осуществления первое соединение (например, пролекарства фосфаты) и второе соединение (например, пролекарства фосфаты) вводят посредством введения в кишечник (например, в тощую кишку, в двенадцатиперстную кишку) (либо раздельно, либо в одной и той же фармацевтической композиции). Их можно вводить (или «вводить посредством инфузии») непосредственно в кишечник, например, в двенадцатиперстную кишку или в тощую кишку, посредством постоянного зонда, вставленного посредством чрескожной эндоскопической гастростомии, например, с помощью внешнего трансабдоминального зонда и внутреннего кишечного зонда. В одном аспекте первое соединение (например, пролекарства фосфаты) и второе соединение (например, пролекарства фосфаты) вводят посредством зонда, вставленного посредством гастроеюностомии под рентгенологическим контролем. В другом аспекте первое соединение (например, пролекарства фосфаты) и второе соединение (например, пролекарства фосфаты) вводят посредством временного назодуоденального зонда, который сначала вставляют пациенту, чтобы определить, отвечает ли пациент благоприятным образом на способ лечения, перед вставкой постоянного зонда.
[261] В некоторых вариантах осуществления, где первое соединение (например, пролекарства фосфаты) и второе соединение (например, пролекарства фосфаты) вводят посредством введения в кишечник, введение можно проводить с использованием переносного насоса, такого как насос, продаваемый под торговым наименованием CADD-Legacy Duodopa.RTM. pump®. Конкретно, кассету, пакет или флакон, содержащие первое соединение (например, пролекарства фосфаты) и второе соединение (например, пролекарства фосфаты), можно присоединять к насосу для получения системы доставки. Затем систему доставки присоединяют к назодуоденальному зонду, трансабдоминальному порту, дуоденальному зонду или еюнальному зонду для введения в кишечник.
[262] В одном варианте осуществления способ включает в себя введение первого соединения (например, пролекарств фосфатов) и второго соединения (например, пролекарств фосфатов) (либо вместе, либо раздельно) пациенту по существу непрерывно в течение периода по меньшей мере приблизительно 12 часов. В дополнительных аспектах, первое соединение (например, пролекарства фосфаты) и второе соединение (например, пролекарства фосфаты) вводят по существу непрерывно в течение периода по меньшей мере приблизительно 16 часов, по меньшей мере приблизительно 24 часов, приблизительно 2 суток, приблизительно 3 суток, приблизительно 4 суток, приблизительно 5 суток, приблизительно 6 суток, приблизительно одной недели, или дольше. В частности, первое соединение (например, пролекарства фосфаты) и второе соединение (например, пролекарства фосфаты) можно вводить подкожно по существу непрерывно в течение периода по меньшей мере приблизительно 16 часов.
F. Дозирование и концентрации в плазме
[263] В одном варианте осуществления дозы первого соединения (например, пролекарств фосфатов) и второго соединения (например, пролекарств фосфатов), вводимые пациенту, корректируют для оптимизации клинического ответа, достигаемого у субъекта (например, пациента), что означает максимизацию функционального периода включения в течение суток посредством минимизации количества и продолжительности периодов выключения (т.е., брадикинезии) и минимизации периода включения с инвалидизирующей дискинезией.
[264] В одном варианте осуществления ежесуточная доза пролекарства L-dopa (т.е., второго соединения), вводимая пациенту способами по настоящему описанию, может составлять, например, от приблизительно 20 до приблизительно 1000000 мг, от приблизительно 20 до приблизительно 100000 мг, от приблизительно 20 до приблизительно 10000 мг, от приблизительно 20 до приблизительно 5000 мг, от приблизительно 20 мг до приблизительно 4000 мг, от приблизительно 20 мг до приблизительно 3000 мг, от приблизительно 20 мг до приблизительно 2000 мг, или от приблизительно 20 мг до приблизительно 1000 мг в сутки. В частности, пролекарство фосфат L-dopa, более конкретно, пролекарство 3ʹ-монофосфат L-dopa, пролекарство 4ʹ-монофосфат L-dopa и/или пролекарство 3ʹ,4ʹ-дифосфат L-dopa вводят в вышеуказанных ежесуточных дозах.
[265] В одном варианте осуществления ежесуточная доза пролекарства карбидопа (т.е., первого соединения), вводимая пациенту способами по настоящему описанию, может составлять, например, от 0 мг до приблизительно 2500 мг, от 0 мг до приблизительно 1250 мг, от 0 мг до приблизительно 1000 мг, от 0 мг до приблизительно 750 мг, от 0 мг до приблизительно 625 мг, от 0 мг до приблизительно 500 мг, от 0 мг до приблизительно 375 мг, от 0 мг до приблизительно 250 мг, или от 5 мг до приблизительно 125 мг в сутки. В частности, пролекарство фосфат карбидопа, более конкретно, пролекарство 3ʹ-монофосфат карбидопа, пролекарство 4ʹ-монофосфат карбидопа и/или пролекарство 3ʹ,4ʹ-дифосфат карбидопа вводят в вышеуказанных ежесуточных дозах.
[266] В некоторых вариантах осуществления количество первого соединения и количество второго соединения вводят таким образом, что в комбинации они являются достаточными для достижения уровня L-dopa в плазме пациента по меньшей мере приблизительно 100 нг/мл. В одном аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 200 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 300 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 400 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 500 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 600 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 700 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 800 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 900 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 1000 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 1500 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 2000 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 3000 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 4000 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 5000 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 6,000 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 7000 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 8000 нг/мл. В другом аспекте уровень L-dopa в плазме составляет по меньшей мере приблизительно 9000 нг/мл. В частности, первое соединение может представлять собой пролекарство фосфат карбидопа, более конкретно, пролекарство 3ʹ-монофосфат карбидопа, пролекарство 4ʹ-монофосфат карбидопа и/или пролекарство 3ʹ,4ʹ-дифосфат карбидопа. В частности, второе соединение может представлять собой пролекарство фосфат L-dopa, более конкретно, пролекарство 3ʹ-монофосфат L-dopa, пролекарство 4ʹ-монофосфат L-dopa и/или пролекарство 3ʹ,4ʹ-дифосфат L-dopa.
[267] В некоторых вариантах осуществления количество первого соединения и количество второго соединения вводят таким образом, что в комбинации они являются достаточными для достижения уровня L-dopa в плазме от приблизительно 10 нг/мл до приблизительно 9000 нг/мл. В одном аспекте уровень L-dopa в плазме составляет от приблизительно 10 нг/мл до приблизительно 8000 нг/мл В другом аспекте уровень L-dopa в плазме составляет от приблизительно 25 нг/мл до приблизительно 6000 нг/мл. В другом аспекте уровень L-dopa в плазме составляет от приблизительно 50 нг/мл до приблизительно 4000 нг/мл. В другом аспекте уровень L-dopa в плазме составляет от приблизительно 100 нг/мл до приблизительно 2000 нг/мл. В другом аспекте уровень L-dopa в плазме составляет от приблизительно 25 нг/мл до приблизительно 1,200 нг/мл. В другом аспекте уровень L-dopa в плазме составляет от приблизительно 10 нг/мл до приблизительно 500 нг/мл. В другом аспекте уровень L-dopa в плазме составляет от приблизительно 25 нг/мл до приблизительно 500 нг/мл. В частности, первое соединение может представлять собой пролекарство фосфат карбидопа, более конкретно, пролекарство 3ʹ-монофосфат карбидопа, пролекарство 4ʹ-монофосфат карбидопа и/или пролекарство 3ʹ,4ʹ-дифосфат карбидопа. В частности, второе соединение может представлять собой пролекарство фосфат L-dopa, более конкретно, пролекарство 3ʹ-монофосфат L-dopa, пролекарство 4ʹ-монофосфат L-dopa и/или пролекарство 3ʹ,4ʹ-дифосфат L-dopa.
[268] В некоторых вариантах осуществления описанные выше диапазоны концентраций L-dopa можно поддерживать в течение по меньшей мере приблизительно 1-часового интервала, 2-часового интервала, 3-часового интервала, 4-часового интервала, 5-часового интервала, 6-часового интервала, 7-часового интервала, an 8-часового интервала, 9-часового интервала, 10-часового интервала, 11-часового интервала, 12-часового интервала, 13-часового интервала, 14-часового интервала, 15-часового интервала, 16-часового интервала, 17-часового интервала, an 18-часового интервала, 19-часового интервала, 20-часового интервала, 21-часового интервала, 22-часового интервала, 23-часового интервала или 24-часового интервала.
G. Уровни в плазме крови пролекарства фосфата L-Dopa и пролекарства фосфата карбидопа.
[269] Обнаружено, что в некоторых вариантах осуществления после введения первого соединения и второго соединения, неожиданная концентрация второго соединения, т.е., пролекарства фосфата L-dopa, остается в плазме крови и не превращается в L-dopa. Кроме того, может присутствовать неожиданная концентрация первого соединения, т.е., пролекарства фосфата карбидопа, которая остается в плазме крови и не превращается в карбидопа. Неожиданно, пролекарство фосфат L-dopa и/или пролекарство фосфат карбидопа может оставаться в плазме крови в течение полной продолжительности непрерывной инфузии первого соединения и/или второго соединения.
[270] Таким образом, в некоторых вариантах осуществления введение первого и второго соединения приводит к уровню пролекарства фосфата L-dopa в плазме от приблизительно 0 нг/мл до приблизительно 3600 нг/мл, от приблизительно 1 нг/мл до приблизительно 3600 нг/мл, или от приблизительно 10 нг/мл до приблизительно 3600 нг/мл. В одном аспекте уровень пролекарства фосфата L-dopa в плазме составляет от приблизительно 10 нг/мл до приблизительно 3200 нг/мл. В другом аспекте уровень пролекарства фосфата L-dopa в плазме составляет от приблизительно 25 нг/мл до приблизительно 2800 нг/мл. В другом аспекте уровень пролекарства фосфата L-dopa в плазме составляет от приблизительно 50 нг/мл до приблизительно 2400 нг/мл. В другом аспекте уровень пролекарства фосфата L-dopa в плазме составляет от приблизительно 10 нг/мл до приблизительно 2000 нг/мл. В другом аспекте уровень пролекарства фосфата L-dopa в плазме составляет от приблизительно 25 нг/мл до приблизительно 1600 нг/мл. В другом аспекте уровень пролекарства фосфата L-dopa в плазме составляет от приблизительно 25 нг/мл до приблизительно 1200 нг/мл. В другом аспекте уровень пролекарства фосфата L-dopa в плазме составляет от приблизительно 10 нг/мл до приблизительно 800 нг/мл. В другом аспекте уровень пролекарства фосфата L-dopa в плазме составляет от приблизительно 10 нг/мл до приблизительно 400 нг/мл. В другом аспекте уровень пролекарства фосфата L-dopa в плазме составляет от приблизительно 10 нг/мл до приблизительно 200 нг/мл. В другом аспекте уровень пролекарства фосфата L-dopa в плазме составляет от приблизительно 10 нг/мл до приблизительно 100 нг/мл.
[271] В некоторых вариантах осуществления введение первого и второго соединения приводит к уровню пролекарства фосфата карбидопа в плазме от приблизительно 0 нг/мл до приблизительно 600 нг/мл, от приблизительно 1 нг/мл до приблизительно 600 нг/мл или от приблизительно 10 нг/мл до 600 нг/мл. В одном аспекте уровень пролекарства фосфата карбидопа в плазме составляет от приблизительно 10 нг/мл до приблизительно 500 нг/мл. В другом аспекте уровень пролекарства фосфата карбидопа в плазме составляет от приблизительно 10 нг/мл до приблизительно 400 нг/мл. В другом аспекте уровень пролекарства фосфата карбидопа в плазме составляет от приблизительно 10 нг/мл до приблизительно 300 нг/мл. В другом аспекте уровень пролекарства фосфата карбидопа в плазме составляет от приблизительно 10 нг/мл до приблизительно 200 нг/мл. В другом аспекте уровень пролекарства фосфата карбидопа в плазме составляет от приблизительно 10 нг/мл до приблизительно 100 нг/мл. В другом аспекте уровень пролекарства фосфата карбидопа в плазме составляет от приблизительно 25 нг/мл до приблизительно 600 нг/мл. В другом аспекте уровень пролекарства фосфата карбидопа в плазме составляет от приблизительно 25 нг/мл до приблизительно 500 нг/мл. В другом аспекте уровень пролекарства фосфата карбидопа в плазме составляет от приблизительно 25 нг/мл до приблизительно 400 нг/мл. В другом аспекте уровень пролекарства фосфата карбидопа в плазме составляет от приблизительно 25 нг/мл до приблизительно 300 нг/мл. В другом аспекте уровень пролекарства фосфата карбидопа в плазме составляет от приблизительно 25 нг/мл до приблизительно 200 нг/мл. В другом аспекте уровень пролекарства фосфата карбидопа в плазме составляет от приблизительно 25 нг/мл до приблизительно 100 нг/мл.
[272] Диапазоны концентраций пролекарства фосфата L-dopa и/или диапазоны концентраций пролекарства фосфата карбидопа в плазме можно поддерживать в течение по меньшей мере приблизительно 1-часового интервала, 2-часового интервала, 3-часового интервала, 4-часового интервала, 5-часового интервала, 6-часового интервала, 7-часового интервала, 8-часового интервала, 9-часового интервала, 10-часового интервала, 11-часового интервала, 12-часового интервала, 13-часового интервала, 14-часового интервала, 15-часового интервала, 16-часового интервала, 17-часового интервала, 18-часового интервала, 19-часового интервала, 20-часового интервала, 21-часового интервала, 22-часового интервала, 23-часового интервала или 24-часового интервала. Кроме того, диапазоны концентрации пролекарства фосфата L-dopa и/или диапазоны концентрации пролекарства фосфата карбидопа можно поддерживать в указанных выше интервалах на протяжении последовательных суток, например, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток и т.д. Без связи с теорией, это может способствовать непрерывному введению первого и второго соединения (либо вместе, либо раздельно).
[273] В некоторых вариантах осуществления количество первого соединения и количество второго соединения вводят таким образом, что они являются достаточными для поддержания уровня карбидопа в плазме менее чем приблизительно 2500 нг/мл. В одном аспекте уровень карбидопа в плазме составляет менее чем приблизительно 2000 нг/мл. В другом аспекте уровень карбидопа в плазме составляет менее чем приблизительно 1500 нг/мл. В другом аспекте уровень карбидопа в плазме составляет менее чем приблизительно 1000 нг/мл. В другом аспекте уровень карбидопа в плазме составляет менее чем приблизительно 500 нг/мл. В другом аспекте уровень карбидопа в плазме составляет менее чем приблизительно 250 нг/мл. В другом аспекте уровень карбидопа в плазме составляет менее чем приблизительно 100 нг/мл. В другом аспекте уровень карбидопа в плазме составляет менее чем приблизительно 50 нг/мл. В другом аспекте уровень карбидопа в плазме составляет менее чем приблизительно 25 нг/мл.
[274] В некоторых вариантах осуществления описанные выше диапазоны концентраций карбидопа в плазме поддерживают в течение по меньшей мере приблизительно: 1-часового интервала, 2-часового интервала, 3-часового интервала, 4-часового интервала, 5-часового интервала, 6-часового интервала, 7-часового интервала, an 8-часового интервала, 9-часового интервала, 10-часового интервала, 11-часового интервала, 12-часового интервала, 13-часового интервала, 14-часового интервала, 15-часового интервала, 16-часового интервала, 17-часового интервала, 18-часового интервала, 19-часового интервала, 20-часового интервала, 21-часового интервала, 22-часового интервала, 23-часового интервала или 24-часового интервала.
H. Нагрузка фосфора
[275] В некоторых вариантах осуществления количество первого соединения и количество второго соединения можно вводить субъекту и достигать нагрузки фосфора менее чем приблизительно 2000 мг/сутки, или менее чем приблизительно 2500 мг/сутки или менее чем приблизительно 3000 мг/сутки. Значение 3000 мг/сутки принято за максимальное переносимое потребление. См. DRI, рекомендуемое потребление с пищей, для кальция, фосфора, витамина D и фторида на www.nap.edu/ctalog/5776. В следующих вариантах осуществления введение терапевтических концентраций первого и второго соединения субъекту приводит к общей нагрузке фосфора от приблизительно 350 мг/сутки до приблизительно 550 мг/сутки, или от приблизительно 400 мг/сутки до приблизительно 500 мг/сутки, или от приблизительно 400 мг/сутки до приблизительно 450 мг/сутки, или приблизительно 427 мг/сутки. Среднее потребление фосфора с пищей в популяции США составляет приблизительно 1500 мг/сутки. См. Ervin R.B., et al. 2004. Dietary intake of selected minerals for the United States population: 1999-2000. Adv Data. Apr 27;(341):1-5. Таким образом, суммарное количество фосфора после введения первого и второго соединения может составлять от приблизительно 1850 мг/сутки до приблизительно 2000 мг/сутки или от приблизительно 1900 мг/сутки до приблизительно 1950 мг/сутки или приблизительно 1927 мг/сутки, что значительно меньше, чем принятое максимальное переносимое потребление 3000 мг/сутки.
VI. Совместное введение и/или дополнительная терапия
[276] Способы лечения по настоящему описанию, необязательно, могут дополнительно включать в себя введение одного или нескольких лекарственных средств для лечения болезни Паркинсона (например, средства против болезни Паркинсона) в дополнение к пролекарству L-dopa и пролекарству карбидопа. В одном варианте осуществления дополнительное лекарственное средство(средства) выбраны из группы, состоящей из ингибиторов декарбоксилазы, отличных от карбидопа (например, бенсеразида), ингибиторов катехол-O-метилтрансферазы («COMT») (например, энтакапона и толкапона) и ингибиторов моноаминоксидазы A («MAO-A») или моноаминоксидазы B («MAO-B») (например, моклобемида, разагалина, селегилина и сафинамида). В одном аспекте дополнительное лекарственное средство(средства) выбрано из группы, состоящей из ингибиторов декарбоксилазы, отличных от карбидопа. В другом аспекте дополнительное лекарственное средство(средства) выбрано из группы, состоящей из ингибиторов COMT, таких как энтакапон. В другом аспекте дополнительное лекарственное средство(средства) выбрано из группы, состоящей из ингибиторов MAO-A. В другом аспекте дополнительное лекарственное средство(средства) выбрано из группы, состоящей из ингибиторов MAO-B.
[277] Дополнительные лекарственные средства и первое и второе соединение можно вводить вместе или раздельно; и по существу одновременно или последовательно по отношению друг к другу. Кроме того, дополнительные лекарственные средства и первое и второе соединение могут находиться в отдельных лекарственных формах, которые могут являться одинаковыми или различными. Например, энтакапон можно использовать в качестве вспомогательного лекарственного средства, и его можно вводить перорально, и первое и второе соединение, обсуждаемые в настоящем документе, можно вводить подкожно (раздельно или вместе в одной и той же фармацевтической композиции). Кроме того, лекарственные средства и первое и второе соединение можно, необязательно, упаковывать совместно, например, в одном контейнере или во множестве контейнеров внутри одной внешней упаковки или предоставлять совместно в отдельных упаковках («совместное представление»).
[278] Подобным образом, фармацевтические композиции по настоящему описанию, необязательно, могут дополнительно содержать одно или несколько дополнительных лекарственных средств для лечения болезни Паркинсона, как описано выше.
VII. Наборы
[279] Настоящее описание относится также к наборам, содержащим одну или несколько фармацевтических лекарственных форм, содержащим пролекарство фосфат карбидопа; наборам, содержащим одну или несколько фармацевтических лекарственных форм, содержащих пролекарство фосфат L-dopa; и наборам, содержащим одну или несколько фармацевтических лекарственных форм, содержащим как пролекарство фосфат карбидопа, так и пролекарство фосфат L-dopa. Набор, необязательно, может содержать одно или несколько из дополнительных лекарственных средства и/или инструкций, например, инструкций для использования набора для лечения пациента, страдающего болезнью Паркинсона и ассоциированным состоянием.
[280] В одном варианте осуществления набор содержит первую фармацевтическую лекарственную форму, где первая фармацевтическая лекарственная форма содержит первое соединение, соответствующее по структуре формуле (I), или его фармацевтически приемлемую соль. В одном аспекте набор содержит вторую фармацевтическую лекарственную форму, содержащую второе соединение, соответствующее по структуре формуле (II), или его фармацевтически приемлемую соль. В другом аспекте первая фармацевтическая лекарственная форма дополнительно содержит второе соединение, соответствующее по структуре формуле (II), или его фармацевтически приемлемую соль. В другом аспекте первая фармацевтическая лекарственная форма и, когда это применимо, вторая фармацевтическая лекарственная форма представляют собой жидкие фармацевтические лекарственные формы.
[281] Поскольку дофамин представляет собой ахиральное соединение, различные варианты осуществления, обсуждаемые выше, потенциально можно адаптировать для использования с пролекарством фосфатом D-dopa или рацематом пролекарства фосфата D-dopa и пролекарства фосфата L-dopa вместо пролекарства фосфата L-dopa.
VIII. Полиморфы пролекарства L-Dopa и карбидопа
[282] Конкретные кристаллические формы пролекарств L-dopa и пролекарств карбидопа, описанных выше, также идентифицированы и описаны в настоящем документе. Более конкретно, такие кристаллические формы представляют собой ангидрат 4ʹ-монофосфата L-dopa (i), ангидрат 4ʹ-монофосфата L-dopa (ii), 3ʹ-монофосфат L-dopa, тригидрат 3ʹ,4ʹ-дифосфата L-dopa, тригидрат 4ʹ-монофосфата карбидопа, дигидрат 4ʹ-монофосфата карбидопа, дегидрат 4ʹ-монофосфата карбидопа, 3ʹ-монофосфат карбидопа (i), 3ʹ-монофосфат карбидопа (ii) и 3ʹ,4ʹ-дифосфат карбидопа.
A. Полиморфы пролекарства L-Dopa
[283] Кристаллический твердый ангидрат 4ʹ-монофосфата L-dopa (i) можно идентифицировать по характерным пикам в его паттерне порошковой рентгенодифракции (фигура 13). Специалист в области аналитической химии способен легко идентифицировать твердый ангидрат 4ʹ-монофосфата L-dopa (i) посредством всего лишь одного характерного пика в его паттерне порошковой рентгенодифракции. Таким образом, в одном или нескольких вариантах осуществления, представлен кристаллический ангидрат 4ʹ-монофосфата L-dopa (i), для которого показано по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14 или 15 характерных пиков в паттерне порошковой рентгенодифракции при значениях два тета 10,261±0,20, 12,053±0,20, 13,759±0,20, 14,932±0,20, 16,147±0,20, 16,718±0,20, 17,34±0,20, 19,254±0,20, 20,654±0,20, 22,078±0,20, 23,599±0,20, 24,198±0,20, 25,898±0,20, 26,338±0,20 и 27,117±0,20. Кристаллографические параметры элементарной ячейки ангидрата 4ʹ-монофосфата L-dopa (i) также получены и определены как: a составляет 7,0508 Å, b составляет 10,6253 Å, c составляет 14,7588 Å, с получением объема ячейки 1105,68 Å3, где каждый из a, b, и c представляет собой репрезентативное измерение кристаллической решетки.
[284] Кристаллический твердый ангидрат 4ʹ-монофосфата L-dopa (ii) можно идентифицировать по характерным пикам в его паттерне порошковой рентгенодифракции (фигура 14). Специалист в области аналитической химии способен легко идентифицировать твердый ангидрат 4ʹ-монофосфат L-dopa (ii) посредством всего лишь одного характерного пика в его паттерне порошковой рентгенодифракции. Таким образом, в одном или нескольких вариантах осуществления, представлен кристаллический ангидрат 4ʹ-монофосфата L-dopa (ii), для которого показано по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14 или 15 характерных пиков в паттерне порошковой рентгенодифракции при значениях два тета 8,468±0,20, 10,234±0,20, 11,821±0,20, 13,084±0,20, 13,503±0,20, 15,48±0,20, 15,848±0,20, 16,513±0,20, 18,447±0,20, 19,346±0,20, 20,239±0,20, 21,139±0,20, 24,221±0,20, 24,865±0,20, 25,647±0,20.
[285] Кристаллический твердый 3ʹ-монофосфат L-dopa можно идентифицировать по характерным пикам в его паттерне порошковой рентгенодифракции (фигура 15). Специалист в области аналитической химии способен легко идентифицировать твердый 3ʹ-монофосфат L-dopa посредством всего лишь одного характерного пика в его паттерне порошковой рентгенодифракции. Таким образом, в одном или нескольких вариантах осуществления, представлен кристаллический 3ʹ-монофосфат L-dopa, для которого показано по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14 или 15 характерных пиков в паттерне порошковой рентгенодифракции при значениях два тета 8,662±0,20, 11,286±0,20, 15,079±0,20, 15,678±0,20, 16,786±0,20, 17,288±0,20, 18,438±0,20, 19,682±0,20, 20,946±0,20, 22,188±0,20, 22,671±0,20, 23,088±0,20, 24,144±0,20, 24,744±0,20 и 25,383±0,20.
[286] Кристаллический твердый тригидрат 3ʹ,4ʹ-дифосфата L-dopa можно идентифицировать по характерным пикам в его паттерне порошковой рентгенодифракции (фигура 16). Специалист в области аналитической химии способен легко идентифицировать твердый тригидрат 3ʹ,4ʹ-дифосфат L-dopa посредством всего лишь одного характерного пика в его паттерне порошковой рентгенодифракции. Таким образом, в одном или нескольких вариантах осуществления, представлен кристаллический тригидрат 3ʹ,4ʹ-дифосфата L-dopa, для которого показано по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14 или 15 характерных пиков в паттерне порошковой рентгенодифракции при значениях два тета 7,118±0,20, 10,342±0,20, 11,355±0,20, 12,161±0,20, 14,201±0,20, 17,36±0,20, 17,632±0,20, 19,196±0,20, 19,444±0,20, 20,83±0,20, 21,504±0,20, 22,491±0,20, 23,085±0,20, 24,487±0,20 и 25,11±0,20.
B. Полиморфы пролекарства карбидопа
[287] Кристаллический твердый тригидрат 4ʹ-монофосфата карбидопа можно идентифицировать по характерным пикам в его паттерне порошковой рентгенодифракции (фигура 17). Специалист в области аналитической химии способен легко идентифицировать твердый тригидрат 4ʹ-монофосфата карбидопа посредством всего лишь одного характерного пика в его паттерне порошковой рентгенодифракции. Таким образом, в одном или нескольких вариантах осуществления, представлен кристаллический тригидрат 4ʹ-монофосфата карбидопа, для которого показано по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14 или 15 характерных пиков в паттерне порошковой рентгенодифракции при значениях два тета 7,484±0,20, 10,05±0,20, 11,971±0,20, 13,085±0,20, 14,923±0,20, 16,095±0,20, 16,85±0,20, 17,359±0,20, 17,635±0,20, 19,269±0,20, 19,544±0,20, 21,842±0,20, 22,578±0,20, 22,921±0,20 и 23,822±0,20. Кристаллографические параметры элементарной ячейки тригидрата 4ʹ-монофосфата карбидопа также получены и определены как: a составляет 7,0226 Å, b составляет 9,4565 Å, c составляет 23,615 Å, с получением объема ячейки 1568,25 Å3, где каждый из a, b, и c представляет собой репрезентативное измерение кристаллической решетки.
[288] Твердый кристаллический дигидрат 4ʹ-монофосфата карбидопа можно идентифицировать по характерным пикам в его паттерне порошковой рентгенодифракции (фигура 18). Специалист в области аналитической химии способен легко идентифицировать твердый дигидрат 4ʹ-монофосфата карбидопа посредством всего лишь одного характерного пика в его паттерне порошковой рентгенодифракции. Таким образом, в одном или нескольких вариантах осуществления, представлен кристаллический дигидрат 4ʹ-монофосфата карбидопа, для которого показано по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14 или 15 характерных пиков в паттерне порошковой рентгенодифракции при значениях два тета 7,925±0,20, 10,28±0,20, 12,344±0,20, 15,002±0,20, 15,841±0,20, 16,158±0,20, 17,565±0,20, 18,506±0,20, 19,058±0,20, 19,473±0,20, 19,702±0,20, 20,188±0,20, 20,668±0,20, 22,37±0,20 и 24,167±0,20.
[289] Кристаллический твердый дегидрат 4ʹ-монофосфата карбидопа можно идентифицировать по характерным пикам в его паттерне порошковой рентгенодифракции (фигура 19). Специалист в области аналитической химии способен легко идентифицировать твердый 4ʹ-монофосфат карбидопа дегидрат посредством всего лишь одного характерного пика в его паттерне порошковой рентгенодифракции. Таким образом, в одном или нескольких вариантах осуществления, представлен кристаллический дегидрат 4ʹ-монофосфата карбидопа, для которого показано по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, или по меньшей мере 10 характерных пиков в паттерне порошковой рентгенодифракции при значениях два тета 9,492±0,20, 10,528±0,20, 15,356±0,20, 15,907±0,20, 16,165±0,20, 17,933±0,20, 18,737±0,20, 19,429±0,20, 21,176±0,20 и 22,626±0,20.
[290] Кристаллический твердый 3ʹ-монофосфат карбидопа (i) можно идентифицировать по характерным пикам в его паттерне порошковой рентгенодифракции (фигура 20). Специалист в области аналитической химии способен легко идентифицировать твердый 3ʹ-монофосфат карбидопа (i) посредством всего лишь одного характерного пика в его паттерне порошковой рентгенодифракции. Таким образом, в одном или нескольких вариантах осуществления, представлен кристаллический 3ʹ-монофосфат карбидопа (i), для которого показано по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10 характерных пиков в паттерне порошковой рентгенодифракции при значениях два тета 9,171±0,20, 13,539±0,20, 14,23±0,20, 15,589±0,20, 15,979±0,20, 18,394±0,20, 18,832±0,20, 19,315±0,20, 22,143±0,20 и 22,81±0,20.
[291] Кристаллический твердый 3ʹ-монофосфат карбидопа (ii) можно идентифицировать по характерным пикам в его паттерне порошковой рентгенодифракции (фигура 21). Специалист в области аналитической химии способен легко идентифицировать твердый 3ʹ-монофосфат карбидопа (ii) посредством всего лишь одного характерного пика в его паттерне порошковой рентгенодифракции. Таким образом, в одном или нескольких вариантах осуществления, представлен кристаллический 3ʹ-монофосфат карбидопа (ii), для которого показано по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, или по меньшей мере 10 характерных пиков в паттерне порошковой рентгенодифракции при значениях два тета 4,433±0,20, 8,917±0,20, 9,654±0,20, 13,192±0,20, 15,288±0,20, 15,747±0,20, 17,886±0,20, 19,291±0,20, 20,554±0,20 и 21,797.
[292] Кристаллическую твердую натриевую соль 3ʹ,4ʹ-дифосфата карбидопа можно идентифицировать по характерным пикам в ее паттерне порошковой рентгенодифракции (фигура 22). Специалист в области аналитической химии способен легко идентифицировать твердую натриевую соль 3ʹ,4ʹ-дифосфата карбидопа посредством всего лишь одного характерного пика в ее паттерне порошковой рентгенодифракции. Таким образом, в одном или нескольких вариантах осуществления, представлена кристаллическая натриевая соль 3ʹ,4ʹ-дифосфата карбидопа, для которой показано по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14 или 15 характерных пиков в паттерне порошковой рентгенодифракции при значениях два тета 5,852±0,20, 6,861±0,20, 7,338±0,20, 11,159±0,20, 11,729±0,20, 12,953±0,20, 13,714±0,20, 14,381±0,20, 14,686±0,20, 15,479±0,20, 16,676±0,20, 17,179±0,20, 17,592±0,20, 18,861±0,20 и 20,305±0,20.
[293] Предусмотрены также композиции и комбинации, содержащие описанные выше полиморфы L-dopa и карбидопа. Таким образом, в одном или нескольких вариантах осуществления, представлены фармацевтические композиции и комбинации, содержащие описанные выше полиморфы L-dopa и карбидопа, а также способы лечения болезни Паркинсона посредством введения таких фармацевтических композиций и комбинаций. В частности, представлены способы лечения болезни Паркинсона посредством введения фармацевтической композиции, содержащей один или несколько полиморфов L-dopa и карбидопа, идентифицированных по характерным пикам в паттернах порошковой рентгенодифракции из любой из фигур 13-22.
[294] Анализ порошковой рентгенодифракции (PXRD) образцов проводили следующим образом. Образцы для анализа рентгенодифракции получали посредством распределения образца тонким слоем на держателе образца и осторожного выравнивания образца с помощью предметного стекла микроскопа. Например, образец можно измельчать до тонкого порошка с помощью ступки с пестиком, или с помощью стеклянных предметных стекол микроскопа в случае ограниченных количеств образцов. Образцы анализировали в одной из трех конфигураций: с круговым держателем для объемных образцов, с кварцевой пластиной с нулевым фоном или с горячей пластиной (с установкой, аналогичной установке пластины с нулевым фоном).
[295] Паттерны дифракции получали с использованием дифрактометра Inel G3000, оборудованного германиевым монохроматором для падающего луча для получения излучения Cu-Kα1. Рентгеновский излучатель запускали при напряжении 40 кВ и токе 30 мА. Inel G3000 оборудован позиционно-чувствительным детектором, монитрорирующим одновременно все дифракционные данные. Детектор калибровали посредством регистрации ослабленного прямого луча в течение семи секунд с интервалами в 1 градус в диапазоне два тета 90 градусов. Калибровку проверяли относительно положения линии кремния в эталонном стандарте (NIST 640c). Образцы помещали в алюминиевый держатель образца и выравнивали с помощью предметного стекла.
[296] Альтернативно, порошковую рентгенодифракцию можно проводить с использованием дифрактометра Rigaku Miniflex (30 кВ и 15 мА; источник рентгеновского излучения: Cu; диапазон: два тета 2,00-40,00°; скорость сканирования: 1-5 градусов/минуту) или дифрактометра Scintag X1 или X2 (с рентгеновской трубкой 2 кВ с нормальным диапазоном фокусировки с твердотельным германиевым детектором, охлаждаемым либо жидким азотом, либо элементом Пельтье; 45 кВ и 40 мА; источник рентгеновского излучения: Cu; диапазон: два тета 2,00-40,00°; скорость сканирования: 1-5 градусов/минуту).
[297] Положения характерных пиков паттерна порошковой рентгенодифракции приведены в отношении угловых положений (два тета) при допустимом отклонении±0,20°. Отклонение±0,10° предназначено для использования при сравнении двух паттернов порошковой рентгенодифракции. На практике, если пик паттерна дифракции из одного паттерна относят к диапазону угловых положений (два тета), которые представляют собой измеренное положение пика±0,20°, и пик паттерна дифракции из другого паттерна относят к диапазону угловых положений (два тета), которые представляют собой измеренное положение пика±0,20°, и если эти диапазоны положения пиков перекрываются, тогда считают, что эти два пика имеют одно и то же угловое положение (два тета). Например, если определено, что пик паттерна дифракции из одного паттерна имеет положение пика 5,20°, для целей сравнения допустимое отклонение позволяет отнести пик к положению в диапазоне 5,00°-5,40°. Если определено, что пик для сравнения в другом паттерне дифракции имеет положение пика 5,35°,и допустимое отклонение позволяет отнести пик к положению в диапазоне 5,15° - 5,55°, тогда считают, что эти два сравниваемых пика имеют одно и то же угловое положение (два тета), поскольку существует перекрывание между двумя диапазонами положений пика.
[298] Анализ рентгенодифракции монокристаллов образцов проводили следующим образом. Образцы для анализа рентгенодифракции получали посредством фиксации избранных монокристаллов на стеклянных иглах с помощью эпоксидного адгезива. Данные рентгенодифракции получали с использованием системы Bruker SMART с площадным детектором APEX (50 кВ и 40 мА; источник рентгеновских лучей: Mo). Данные собирали при -100°C.
IX. Примеры
[299] Следующие неограничивающие примеры представлены для дополнительной иллюстрации настоящего описания. Сокращения, используемые в примерах ниже, включают в себя следующие:
«DBU» обозначает 1,8-диазабицикло[5,4,0]-ундец-7-ен.
«DCM» обозначает дихлорметан.
«ЭДТА» обозначает этилендиаминтетрауксусную кислоту.
«FCC» обозначает флэш-хроматографию на колонке.
«HPLC» обозначает высокоэффективную жидкостную хроматографию
«IPA» обозначает изопропанол.
«LC-MS» обозначает жидкостную хроматографию-масс-спектрометрию.
«m-CPBA» обозначает мета-хлорпероксибензойную кислоту.
«MTBE» обозначает метил-трет-бутиловый эфир.
«pa» обозначает площадь пика.
«THF» обозначает тетрагидрофуран.
«TLC» обозначает тонкослойную хроматографию.
«t1/2» обозначает биологическое время полужизни, т.е., время, необходимое для того, чтобы половина количества лекарственного средства или другого вещества, введенного в живой организм, подвергалась метаболизму или уничтожению посредством нормальных биологических процессов.
Пример 1: Синтез монофосфатов L-Dopa
[300] 3ʹ-монофосфат L-dopa и 4ʹ-монофосфат L-dopa получали, как показано на схеме 1 ниже:
Схема 1

[301] Конкретно, 3ʹ-монофосфат L-dopa и 4ʹ-монофосфат L-dopa получали, как описано в стадиях 1-5B ниже.
Стадия 1
[302] Раствор гидроксида натрия (40 г, 1,0 моль) в воде (300 мл) добавляли по каплям к суспензии соединения 1 (100 г, 0,5 моль) в воде (300 мл) в течение периода 20 минут при 0°C. Бензилхлорформиат (103,9 г, 0,6 моль) в диоксане (400 мл) добавляли по каплям к суспензии в течение периода 30 минут при 0°C и затем реакционную массу перемешивали при комнатной температуре в течение 16 часов. Завершение реакции мониторировали посредством TLC. После полного расхода исходного материала, реакционную массу подщелачивали до pH=10 с использованием 10% гидроксида натрия (200 мл) и экстрагировали с использованием MTBE (500 мл). Органический слой отделяли и отбрасывали. Водный слой подкисляли до pH=2 с использованием 6 Н HCl (150 мл) и экстрагировали с использованием MTBE (500 мл X 2). Объединенный органический слой промывали водой (500 мл), насыщенным раствором хлорида натрия (500 мл), высушивали над сульфатом натрия и концентрировали в вакууме при 45°C - 50°C с получением неочищенного соединения 2 в форме вязкой жидкости (120 г, 72%).
Стадия 2
[303] Карбонат цезия (123 г, 0,37 моль) добавляли в две партии раствора соединения 2 (250 г, 0,75 моль) в диметилформамиде (2 л) при 0° C. Бензилбромид (90,3 мл, 0,75 моль) добавляли по каплям в эту смесь в течение периода 30 минут при 0°C и затем реакционную массу перемешивали при комнатной температуре в течение 16 часов. Завершение реакции мониторировали посредством TLC. После полного расхода исходного материала, реакционную массу разводили водой (5 л) и экстрагировали с использованием MTBE (1 л X 2). Объединенный органический слой промывали водой (1 л), насыщенным раствором хлорида натрия (0,5 л), высушивали над сульфатом натрия и концентрировали в вакууме при 45°C - 50°C с получением неочищенного соединения 4 в форме вязкой жидкости (250 г).
Стадия 3
[304] Карбонат цезия (698,5 г, 2,14 моль) добавляли в четыре партии раствора соединения 3 (900 г, 2,14 моль) в диметилформамиде (7,2 л) при 0° C. Бензилбромид (512 мл, 4,28 моль) добавляли по каплям в эту смесь в течение периода один час при 0°C и затем реакционную массу перемешивали при комнатной температуре в течение 16 часов. Завершение реакции мониторировали посредством TLC. После полного расхода исходного материала, реакционную массу разводили водой (15 л) и экстрагировали с использованием MTBE (3 L X 2). Объединенный органический слой промывали водой (3 л), насыщенным раствором хлорида натрия (1,5 л), высушивали над сульфатом натрия и концентрировали в вакууме при 45°C - 50°C с получением неочищенного продукта в форме вязкой жидкости (1 кг).
[305] Полученный неочищенный продукт смешивали с неочищенным продуктом из предыдущих партий (всего 1,6 кг) и неоднократно очищали посредством флэш-хроматографии на колонке с силикагелем (230-400 меш) с использованием 10-20% этилацетата в петролейном эфире с получением соединений 4a (270 г) и 4b (255 г).
Стадия 4A
[306] Трет-бутоксид калия (65,6 г, 0,58 моль) добавляли в четыре партии раствора соединения4a (200 г, 0,39 моль) в тетрагидрофуране (2,0 л) при 0°C. 10% масс./масс. раствор дибензилфосфорилхлорида в толуоле (2,31 кг, 0,78 моль) добавляли по каплям в эту смесь в течение периода 30 минут при 0°C и затем реакционную массу перемешивали при комнатной температуре в течение 2 часов. Завершение реакции мониторировали посредством тонкослойной хроматографии. После полного расхода исходного материала, реакционную массу охлаждали до 0°C - 5°C и реакцию останавливали водой (1,0 л). Органический слой отделяли, и водный слой экстрагировали толуолом (500 мл). Объединенный органический слой промывали водой (1 л), насыщенным раствором NaCl (500 мл), высушивали над сульфатом натрия и концентрировали в вакууме при 45°C - 50°C. Полученный неочищенный продукт очищали хроматографией на колонке с силикагелем (230-400 меш) с использованием 30%-40% этилацетата в петролейном эфире с получением соединения5a в форме вязкой жидкости (185 г, 61,6%).
Стадия 4B
[307] Трет-бутоксид калия (68,9 г, 0,61 моль) добавляли в четыре партии раствора соединения4b (210 г, 0,41 моль) в тетрагидрофуране (2,2 л) при 0°C. 10% масс./масс. раствор дибензилфосфорилхлорида в толуоле (2,43 кг, 0,82 моль) добавляли по каплям в эту смесь в течение периода 30 минут при 0°C. После полного добавления, реакционную массу перемешивали при комнатной температуре в течение 2 часов. Завершение реакции мониторировали посредством тонкослойной хроматографии. После завершения реакции, реакционную массу охлаждали до 0°C - 5°C и реакцию останавливали водой (1,0 л). Органический слой отделяли, и водный слой экстрагировали толуол (500 мл). Объединенный органический слой промывали водой (1 л), насыщенным раствором NaCl (500 мл), высушивали над сульфатом натрия и концентрировали в вакууме при 45°C - 50°C. Неочищенный продукт, полученный из этой партии, смешивали с неочищенным продуктом (45 г) из другой партии и очищали хроматографией на колонке с силикагелем (230-400 меш) с использованием 30%-40% этилацетата в петролейном эфире с получением соединения5b в форме вязкой жидкости (250 г, 65%).
Стадия 5A
[308] 10% Pd/C (30 г, 50% влажности) добавляли к раствору соединения5a (100 г, 0,13 моль) в этаноле и воде (1 л, 4:1) в атмосфере азота. Реакционную колбу откачивали и продували газообразным водородом три раза, и затем гидрогенизировали под давлением 4 кг/см2 (приблизительно 4 атмосферы) в течение 16 часов. После завершения реакции, воду (500 мл) добавляли в реакционную смесь и катализатор удаляли фильтрацией через фильтрующую прокладку из целлюлозы K100 (диаметр 520 мм). Фильтрат концентрировали под пониженным давлением. Полученный неочищенный продукт перемешивали с этанолом (60 мл), фильтровали и высушивали под вакуумом с получением (S-2-амино-3-(3-гидрокси-4-(фосфоноокси)фенил)-пропионовой кислоты; L-dopa (4-фосфат) (17 г, 47%) в форме грязно-белого твердого вещества.1H ЯМР (300 МГц, D2O) δ 7,1 (д, J=8,1 Гц, 1H), 6,7 (с, 1H), 6,68 (д, J=8,1 Гц, 1H), 4,1 (к, J=5,1 Гц, 1H), 3,15 (дд, J=14,7 Гц, 4,5 Гц, 1H ), 3,0-2,93 (м, 1H); MS (LCMS) m/z 278 [M+H]+.
Стадия 5B
[309] 10% Pd/C (30 г, 50% влажности) добавляли к раствору соединения5b (100 г, 0,13 моль) в этаноле и воде (1 л, 4:1) в атмосфере азота. Реакционную колбу откачивали и продували газообразным водородом три раза, и затем гидрогенизировали под давлением 4 кг/см2 (приблизительно 4 атмосферы) в течение 16 часов. После завершения реакции, воду (500 мл) добавляли в реакционную смесь, и катализатор удаляли фильтрацией через фильтрующую прокладку из целлюлозы K100 (диаметр 520 мм). Фильтрат концентрировали под пониженным давлением. Полученный неочищенный продукт перемешивали с этанолом (60 мл), фильтровали и высушивали под вакуумом с получением (S-2-амино-3-(4-гидрокси-3-(фосфоноокси)фенил)-пропионовой кислоты; L-dopa (3-фосфат) (21 г, 58,5%) в форме грязно-белого твердого вещества.1H ЯМР (300 МГц, D2O) δ 7,06 (с, 1H), 6,85 (с, 2H), 4,08 (к, J=4,8 Гц, 1H), 3,16 (дд, J=14,7 Гц, 5,1 Гц, 1H ), 3,0-2,92 (м, 1H); MS (LCMS) m/z 278 [M+H]+.
Пример 2: Синтез дифосфата L-Dopa
[310] 3ʹ,4ʹ-дифосфат L-dopa получали, как показано на схеме 2 ниже:
Схема 2

[311] Конкретно, 3ʹ,4ʹ-дифосфат L-dopa получали, как описано в стадиях 6 и 7 ниже.
Стадия 6
[312] Карбонат цезия (484 г, 1,48 моль) добавляли в две партии раствора соединения3 (250 г, 0,59 моль) в диметилформамиде (2,5 л) при 0°C. Раствор 10% масс./масс. дибензилфосфорилхлорида в толуоле (3,52 кг, 1,18 моль) добавляли по каплям в эту смесь в течение периода один час при 0°C и затем реакционную массу перемешивали при комнатной температуре в течение 2 часов. Завершение реакции мониторировали посредством TLC. После полного расхода исходного материала, реакционную массу охлаждали до 0°C - 5°C и реакцию останавливали водой (5 л). Органический слой отделяли, и водный слой экстрагировали толуолом (1 л). Объединенный органический слой промывали водой (1 л), насыщенным раствором хлорида натрия (0,5 л), высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме при 45°C - 50°C. Подученный неочищенный продукт очищали хроматографией на колонке с силикагелем (230-400 меш) с использованием 10%-15% этилацетата в петролейном эфире с получением соединения6 в форме липкой жидкости (240 г) промежуточной чистоты.
Стадия 7
[313] 10% Pd/C (20 г, 50% влажности) добавляли к раствору соединения 6 (50 г, 0,05 моль) в THF (500 мл) в атмосфере азота. Реакционную колбу откачивали и продували газообразным водородом три раза и затем гидрогенизировали под давлением 6 кг в течение 8 часов. После завершения реакции, воду (250 мл) добавляли в реакционную смесь и катализатор удаляли фильтрацией через фильтрующую прокладку из целлюлозы K100 (диаметр 520 мм). Фильтрат концентрировали под пониженным давлением. Полученный неочищенный продукт перемешивали с этанолом (30 мл), фильтровали и высушивали под вакуумом с получением L-dopa (3,4-фосфат) (12,8 г, 64%, чистоту корректировали) в форме грязно-белого твердого вещества.1H ЯМР (300 МГц, D2O) δ 7,21 (д, J=8,4 Гц, 1H), 7,16 (с, 1H), 6,95 (д, J=7,8 Гц, 1H), 4,23 (к, J=2,7 Гц, 1H ), 3,24 (дд, J=15 Гц, 4,8 Гц, 1H ), 3,08-3,01 (м, 1 H); MS (LCMS) m/z 358 [M+H]+.
Пример 3: Синтез монофосфатов карбидопа
[314] 3ʹ-фосфат карбидопа и 4ʹ-фосфат карбидопа получали, как показано на схеме 3 ниже:
Схема 3

[315] Конкретно, 3ʹ-фосфат карбидопа и 4ʹ-фосфат карбидопа получали, как описано в стадии 1 ниже.
Стадия 1
[316] Густую смесь пентоксида фосфора (2,325 г, 16,38 ммоль) и фосфорной кислоты (85% в воде, 1,79 мл, 26,2 ммоль) нагревали до 100°C в течение 15 минут, получая прозрачный раствор. Раствор снова охлаждали до 50°C, и добавляли моногидрат карбидопа (0,400 г, 1,64 ммоль). Через 3 часа раствор охлаждали до комнатной температуры, перемешивали в течение 14 часов, и затем нагревали до 35°C. Через 24 часа раствор охлаждали до комнатной температуры и перемешивали в течение 60 часов. Добавляли воду (2 мл, экзотермический нагрев 50°C), раствор перемешивали в течение 5 минут, и затем анализировали посредством HPLC (колонка Agilent Poroshell 120 EC-C18 # 693975-902 4,6×150 мм, 1 мл/минуту 0,1% в воде H3PO4/CH3CN, 3 минуты 97:3, 4 минуты градиент до 70:30, 2 минуты градиент до 0:100, выдержка 1 минута, детекция при 220 нм), показав: карбидопа (6,7 минут): 2,6 pa%, фосфат 1 (5,1 минут): 38,2 pa%, фосфат 2 (5,7 минут): 37,7 pa%, дифосфат (2,3 минут): 5,9 pa%. Водный раствор разводили водой (5X), затем очищали посредством препаративной HPLC (колонка Kromasil Phenyl 3 см ID x 25 см, 5 микрон, 30 мл/минуту 0,1% муравьиная кислота/CH3CN, 10 минут 97:3, 5 минут градиент до 93:7, 0,5 минут градиент до 100:0, детекция при 277 нм). Очищенные фракции разделенных монофосфатов объединяли, концентрировали каждую в роторном испарителе (температура бани 35°C) до 10 мл, затем лиофилизировали, получая 4ʹ-фосфат карбидопа 1 (152 мг, выход 30%) и 3ʹ-фосфат карбидопа 2 (137 мг, выход 27%) в форме белых аморфных порошков. 3ʹ-монофосфат карбидопа:1H ЯМР (400 МГц, оксид дейтерия) δ 7,20 (дд, J=8,2, 1,2 Гц, 1H), 6,84 (д, J=2,1 Гц, 1H), 6,77 (дд, J=8,3, 2,2 Гц, 1H), 3,19 (д, J=14,2 Гц, 1H), 2,99 (д, J=14,2 Гц, 1H), 1,52 (с, 3H); MS (ESI) m/z 307 [M+H]+. 4ʹ-монофосфат карбидопа: 1H ЯМР (400 МГц, оксид дейтерия) δ 7,14 (т, J=1,4 Гц, 1H), 7,01-6,83 (м, 2H), 3,19 (д, J=14,3 Гц, 1H), 3,00 (д, J=14,4 Гц, 1H), 1,52 (с, 3H); MS (ESI) m/z 307 [M+H]+.
Пример 4a: Синтез дифосфата карбидопа
[317] 3ʹ,4ʹ-дифосфат карбидопа получали, как показано на схеме 4a ниже:
Схема 4a

[318] Конкретно, 3ʹ,4ʹ-дифосфат карбидопа получали, как описано в стадиях 1-4 ниже.
Стадия 1
[319] Взвесь моногидрата карбидопа (20,0 г, 82 ммоль), бикарбонат натрия (7,57 г, 90 ммоль), воду (200 мл), и THF (100 мл) охлаждали до 5°C - 10°C, и добавляли N-(бензилоксикарбонилокси)сукцинимид (20,4 г, 82 ммоль). Смесь нагревали до температуры окружающей среды, и она становилась почти гомогенным раствором через 5 часов, когда по LC-MS показывали почти полную реакцию. Раствор разводили MTBE (100 мл), слои разделяли, и органический слой экстрагировали с использованием насыщенного водного NaHCO3 (100 мл). Водные слои подкисляли с помощью 2 Н HCl (160 мл), и кислый водный слой экстрагировали с использованием MTBE (2×100 мл). В ходе второй обратной экстракции, небольшое количество продукта начинало преципитировать. Объединенные органические слои промывали рассолом (20 мл), и оставшееся твердое вещество смывали с делительной воронки с помощью MTBE (20 мл). Полученную смесь концентрировали до суммарной массы 43 г, и добавляли 10% THF/MTBE (60 мл). Смесь являлась слишком густой для перемешивания, так что добавляли дополнительный MTBE (от 60 мл до 6 объемов 5% THF/MTBE). Полученную белую взвесь затем нагревали до 50°C. Взвесь охлаждали до температуры окружающей среды в течение одного часа и затем перемешивали в течение 14 часов. Белое твердое вещество фильтровали, промывали с использованием 5% THF/MTBE (20 мл), и высушивали в вакуумной печи (50°C), получая соединение (S)-2-(2-((бензилокси)карбонил)-гидразинил)-3-(3,4-дигидроксифенил)-2-метилпропионовой кислоты с THF (4:3) (31,1 г, 71,9 ммоль, выход 91%) в виде белого твердого вещества.1H ЯМР (400 МГц, DMSO-d6) δ 8,66 (д, J=9,0 Гц, 2H), 8,18 (ушир. с, 1H), 7,49-7,17 (м, 5H), 6,59 (дд, J=5,0, 3,0 Гц, 2H), 6,44 (дд, J=8,0, 2,0 Гц, 1H), 5,04 (с, 2H), 2,73 (д, J=13,4 Гц, 1H), 2,59 (д, J=13,3 Гц, 1H), 1,07 (с, 3H); MS (ESI) m/z 361 [M+H]+.
Стадия 2
[320] Раствор гидразона бензофенона (20,0 г, 102 ммоль) в DCM (100 мл) охлаждали до < 0°C, и добавляли иод (0,052 г, 0,204 ммоль) и 1,1,3,3-тетраметилгуанидин (25,6 мл, 204 ммоль). m-CPBA (30,5 г, 132 ммоль) добавляли по порциям между -10°C и 0°C в течение 5 минут (экзотермический нагрев, баня из сухого льда/ацетона для контроля). Смесь перемешивали между 0°C и 12°C в течение 15 минут и затем промывали с использованием воды (3×200 мл). Полученную смесь сушили (Na2SO4), концентрировали до суммарного объема 76 мл, и смывали в 125 мл колбу Эрленмейера с использованием дополнительных 16 мл DCM, с получением приблизительно 1 M темно-пурпурного раствора (диазометилен)дибензола. В отдельной колбе, взвесь соединения (S)-2-(2-((бензилокси)карбонил)гидразинил)-3-(3,4-дигидроксифенил)-2-метилпропионовой кислоты с тетрагидрофураном (4:3) (30,7 г, 74,0 ммоль) в IPA (300 мл) охлаждали до менее 10°C и добавляли раствор (диазометилен)дибензола (78 мл, 78 ммоль). Полученную смесь нагревали до комнатной температуры и по LC-MS показали a остановку реакции через 30 минут. Добавляли дополнительный дифенилдиазометан (0,2 экв., 14 мл) и перемешивание продолжали при комнатной температуре. Через 35 минут, добавляли оставшийся раствор дифенилдиазометана (9 мл). Через 2 часа 20 минут, пурпурная окраска сохранялась, и по LC-MS показали, что реакция завершилась. Реакционную смесь концентрировали до приблизительно 60 мл и добавляли 20% CH3CN в воде (300 мл). Смесь промывали циклогексаном (10×300 мл), добавляли этилацетат (450 мл), и смесь промывали насыщенным водным NaHCO3 (150 мл) и рассолом (60 мл). Смесь сушили (Na2SO4) и концентрировали, получая (S)-бензил 2-(1-(бензгидрилокси)-3-(3,4-дигидроксифенил)-2-метил-1-оксопропан-2-ил)гидразин-карбоксилат (39,4 г, 74,8 ммоль, выход >99%).1H ЯМР (400 МГц, DMSO-d6) δ 8,65 (ушир. с, 2H), 8,19 (ушир. с, 1H), 7,43-7,20 (м, 15H), 6,70 (с, 1H), 6,55 (д, J=2,0 Гц, 1H), 6,45 (д, J=8,0 Гц, 1H), 6,20 (дд, J=7,9, 2,0 Гц, 1H), 4,95 (д, J=3,4 Гц, 2H), 2,81 (д, J=13,6 Гц, 1H), 2,67 (д, J=13,7 Гц, 1H), 1,17 (д, J=3,1 Гц, 3H); MS (ESI) m/z 549 [M+Na]+.
Стадия 3
[321] Раствор (S)-бензил-2-(1-(бензгидрилокси)-3-(3,4-дигидроксифенил)-2-метил-1-оксопропан-2-ил)гидразинкарбоксилата (39,4 г, 74,8 ммоль) и CH3CN (394 мл) охлаждали до менее чем 0°C, и добавляли DBU (27,1 мл, 180 ммоль) и тетрабензилпирофосфат (89 г, 165 ммоль) при менее, чем 0°C. Через 40 минут добавляли воду (400 мл), получая двухфазный раствор. Слои разделяли, нижний (желтый масляный) слой промывали (приблизительно 100 мл) холодными 1:1 CH3CN/водой (2×100 мл), затем разводили этилацетатом (400 мл) и промывали с использованием рассола (80 мл). Смесь сушили (Na2SO4) и концентрировали. FCC (50-100% MTBE/гептаны) получали (S)-бензил-2-(1-(бензгидрилокси)-3-(3,4-бис((бис(бензилокси)фосфорил)окси)фенил)-2-метил-1-оксопропан-2-ил)гидразин-карбоксилат (67,2 г, 64,2 ммоль, выход 86%) в форме прозрачного масла.1H ЯМР (400 МГц, DMSO-d6) δ 7,45-7,16 (м, 35H), 7,06 (д, J=8,6 Гц, 1H), 6,88 (дд, J=8,7, 2,0 Гц, 1H), 6,71 (с, 1H), 5,12 (ддт, J=9,9, 7,0, 3,9 Гц, 10H), 4,99-4,80 (м, 2H), 2,95-2,76 (м, 2H), 1,11 (д, J=1,8 Гц, 3H); MS (ESI) m/z 1069 [M+Na]+.
Стадия 4
[322] Раствор (S)-бензил-2-(1-(бензгидрилокси)-3-(3,4-бис((бис(бензилокси)-фосфорил)окси)фенил)-2-метил-1-оксопропан-2-ил)гидразинкарбоксилата (60,6 г, 57,9 ммоль) в THF (550 мл) добавляли к 5% Pd/C (влажный JM#9) (12,1 г, 56,9 ммоль) в 2 л сосуд для реакций под давлением из нержавеющей стали. Смесь встряхивали при 60 фунтов на кв. дюйм (414 кПа) водорода при 22°C в течение 2 часов. Исходная температура составляла 12,4°C (раствор сохраняли в холодильнике), и Tмакс составляла 31,6°C. Затем добавляли воду (деионизированную, 275 мл), и гидрогенизацию продолжали в течение следующих 17 часов. Смесь фильтровали через нейлоновую мембрану с использованием 100 мл промывки 1:1 THF-водой. Смесь разводили MTBE (100 мл) и слои разделяли. Водный слой промывали MTBE (3×100 мл), затем концентрировали в роторном испарителе (температура бани 35°C) до суммарной массы 100 г, и лиофилизировали в течение 3 суток до белого стеклообразного вещества. Аморфное твердое вещество разламывали и лиофилизировали в течение одних суток для удаления следов дополнительной воды, получая дифосфат карбидопа (22,3 г, >99%), все еще содержащий 10-15 масс.% воды по титрованию способом Карла Фишера (скорректированный выход 85%).1H ЯМР (500 МГц, DMSO-d6) δ 7,15 (д, J=8,3 Гц, 1H), 7,11 (с, 1H), 6,89 (дд, J=8,1, 2,1 Гц, 1H), 3,00-2,82 (м, 2H), 1,31 (с, 3H); MS (ESI) m/z 387 [M+H]+. По HPLC (колонка Agilent Poroshell 120 EC-C18 # 693975-902 4,6×150 мм, 1 мл/минуту 0,1% aq H3PO4/CH3CN, 3 минуты 97,5:2,5, 4 минуты градиент до 70:30, 2 минуты градиент до 0:100, выдержка 1 минута, детекция при 220 нм), материал обладал чистотой 96,4% (% площади пика при 220 нм; время удержания дифосфата=2,37 минут).
Пример 4b: Синтез дифосфата карбидопа
[323] 3ʹ,4ʹ-дифосфат карбидопа получали, как показано на схеме 4b ниже:
Схема 4b

[324] Конкретно, 3ʹ,4ʹ-дифосфат карбидопа получали, как описано в стадиях 1-4 ниже.
Стадия 1
[325] К суспензии S(-)-карбидопа (25 г, 92 ммоль) в воде (76 мл) добавляли раствор гидроксида натрия (7,24 г, 183 моль) в воде (76 мл) по каплям в течение периода 20 минут при <5°C. После добавления основания, смесь перемешивали в течение 15 минут или пока реакционная смесь не становилась раствором. К этому раствору добавляли бензилхлорформиат (18,67 г, 110 ммоль) в THF (101 мл) по каплям в течение периода 30 минут при <10°C и затем реакционной смеси позволяли нагреться до комнатной температуры. Реакционную смесь перемешивали при 25°C в течение 1 час. Через 1 час добавляли дополнительные 0,2 экв. бензилхлорформиата (3,74 г, 3,12 мл), и реакционную смесь перемешивали 1,5 час при 25°C. Через 1,5 час реакционную смесь (pH=5,75) подщелачивали до pH=9 с использованием 10% гидроксида натрия и экстрагировали с использованием MTBE (3×150 мл). Органический слой отделяли и отбрасывали. Водный слой (pH=8,6) подкисляли до pH=2,75 с использованием 6 Н HCl и экстрагировали с использованием MTBE (3x 150 мл). Объединенные органические слои промывали насыщенным раствором хлорида натрия (150 мл), высушивали над сульфатом магния и частично (75%) концентрировали в вакууме. К раствору добавляли 250 мл THF и снова частично (75%) концентрировали в вакууме. К желтому раствору добавляли 250 мл MTBE и концентрировали до 50% по объему. Полученную белую взвесь охлаждали до 0°C, фильтровали и твердое вещество промывали с использованием холодного MTBE с получением 32,31 г (белое твердое вещество) соединения 1 (содержание 84,5% масс./масс., 95,6% pa, PAY 83%).
Стадия 2
[326] Карбонат цезия (2,3 г, 7,08 ммоль) добавляли к раствору соединения 2 (5,0 г, 11,79 ммоль) в DMF (50 мл) при 2°C. Смесь перемешивали в течение 10 мин. К этой смеси добавляли бензил бромид (2,0 г, 11,79 ммоль, 1,4 мл) по каплям в течение периода 10 минут при 2°C. После добавления, реакционную смесь перемешивали при 25°C в течение 64 час. Через 64 час, реакционную смесь разводили водой (150 мл) и экстрагировали с использованием MTBE (3x 150 мл). Объединенные органические слои промывали водой (50 мл), рассолом (50 мл), высушивали (MgSO4), фильтровали и концентрировали с получением 5,36 г соединений 2 и 3 с выходом 88%. Соединение 2: MS (ESI) m/z 451 [M+H]+, соединение 3, MS (ESI) m/z 541 [M+H]+.
Стадия 3
[327] К раствору соединений 2 и 3 (9,8 г, 21,75 ммоль) в ACN (100 мл) добавляли тетрабензилпирофосфат (29,9 г, 54,4 ммоль) при -14°C. DBU (8,61 мл, 56,6 ммоль) добавляли в реакционную смесь при -7°C по каплям. Затем реакционную смесь перемешивали при <0°C в течение 30 мин. Через 30 мин, реакционной смеси позволяли нагреться до комнатной температуры. Через 1 час реакцию в реакционной смеси останавливали водой (300 мл), экстрагировали с использованием MTBE (2x 150 мл), промывали водой (150 мл), рассолом (150 мл), высушивали (MgSO4), фильтровали и концентрировали с получением 24,69 г соединений 4 и 5 с выходом 92%. Соединение 4, MS (ESI) m/z 972 [M+H]+.
Стадия 4
[328] Тетрагидрофуран (10,00 мл) добавляли к соединениям 4 и 5 (1,026 г, 0,980 ммоль) и 5% Pd/C (50% влажности JM#9) (0,199 г, 1,870 ммоль, масса в сухом состоянии 0,10 г) в системе Barnstead 20 мл со стеклянным вкладышем. Смесь перемешивали при 80 фунтов на кв. дюйм (552 кПа) водорода при 25°C в течение 1,5 час. Добавляли воду (5,00 мл), и смесь гидрогенизировали в течение следующих 1,5 час. Затем через 1,5 час, смесь фильтровали через полипропиленовую мембрану, добавляли 2,5 мл MTBE, смесь встряхивали в делительной воронке, и нижний водный слой спускали. Водный раствор промывали дважды с использованием 2,5 мл MTBE, получая значительное уменьшение объема (THF и толуол переходили в MTBE). Бесцветный водный раствор (водный слой) лиофилизировали в течение 3 суток, получая 385 мг желательного продукта (93,9% pa) соединение 6.
Пример 5: Альтернативный синтез 4ʹ-монофосфата L-Dopa
[329] 4ʹ-монофосфат L-Dopa получали, как показано на схеме 5 ниже:
Схема 5

[330] Конкретно, 4ʹ-монофосфат L-Dopa получали, как описано в стадиях 1-5 ниже.
Стадия 1
[331] К раствору 3-(бензилокси)-4-гидроксибензальдегида, соединения 1, (10,0 г, 43,8 ммоль) в ацетонитриле (100 мл) добавляли дифосфат тетрабензила (TBPP) (24,8 г, 46,0 ммоль) при 25°C. Реакционную смесь охлаждали до 4°C и добавляли DBU (7,67 г, 50,4 ммоль) в реакционную смесь. После добавления, реакционной смеси позволяли нагреться до комнатной температуры и перемешивали при комнатной температуре (~20-25°C) в течение 60 мин. Затем реакцию в реакционной смеси останавливали водой (400 мл) и экстрагировали с использованием MTBE (3x 100 мл). Органический слой промывали насыщенным раствором бикарбоната натрия (150 мл), водой (150 мл), насыщенным раствором хлорида натрия (150 мл) и концентрировали с получением соединения 2 (20,7 г, чистота 96,5%, выход 93%).1H ЯМР (400 МГц, DMSO-d6) δ 9,92 (с, 1H), 7,67 (дд, J=1,8, 0,9 Гц, 1H), 7,54 (дд, J=8,1, 1,8 Гц, 1H), 7,48-7,39 (м, 3H), 7,35-7,22 (м, 13H), 5,22 (с, 2H), 5,09 (дд, J=8,2, 2,1 Гц, 4H).
Стадия 2
[332] К раствору триметилового сложного эфира (+/-)-бензилоксикарбонил-альфа-фосфоноглицина (31,1 г, 94 ммоль) и дибензил-(2-(бензилокси)-4-формилфенил)-фосфата, соединения 2, (44,3 г, чистота 94%, 85 ммоль) в 443 мл DCM при 2°C добавляли 1,1,3,3-тетраметилгуанидин (TMG) (11,78 г, 102 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. На следующие сутки реакционную смесь промывали с использованием 3×222 мл воды и концентрировали с получением 68,9 г соединения 3. Затем Соединение 3 суспендировали с 40,5 г силикагеля 60 в 689 мл этилацетата в течение 1 час и фильтровали. Фильтрат концентрировали с получением 73,4 г соединения 3 в форме масла. Затем соединение 3 преципитировали при 4°C и суспендировали в 350 мл MTBE при 4°C в течение 1час. Затем взвесь фильтровали и твердое вещество промывали с использованием холодного MTBE. Твердое вещество сушили в вакуумной печи при 40°C в течение ночи с получением 50,4 г соединения 3 (чистота 99,6%, выход 85%).1H ЯМР (400 МГц, DMSO-d6) δ 7,60 (т, J=1,4 Гц, 1H), 7,44-7,18 (м, 23H), 5,10 (qd, J=5,9, 2,6 Гц, 8H), 3,72 (с, 3H).
Стадия 3
[333] В реактор 2,0 галлона (7,8 л) загружали соединение 3, метил-3-(3-(бензилокси)-4-((бис(бензилокси)фосфорил)окси)фенил)-2-(((бензилокси)карбонил)амино)акрилат (446,31 г, 521 ммоль) в 3,6 л THF. Этот раствор барботировали N2 в течение 30 минут. В другой реактор Into another 2,0 галлона (7,8 л) загружали тетрафторборат 1,2-бис[(2S,5S)-2,5-диэтилфосфолано]бензол(1,5-циклооктадиен)родий (I) (3,44 г, 5,21 ммоль) и продували N2 10 раз, затем барботировали N2 в течение 30 минут. Затем раствор исходного материала переносили в этот реактор с использованием давления N2. Трубопроводы продували H2, затем реактор продували H2 три раза. Реакционную смесь перемешивали при 35°C при 100 фунтов на кв. дюйм (689 кПа) H2. Через 20 час, по HPLC показали соединение 4, с 99% э.и. Затем реакционный раствор переносили в 12 л экстрактор и добавляли 3,6 л этилацетата. Раствор промывали 2x 3,7 л 5% масс. цистеина/8% бикарбоната натрия, затем 3,6 л 5% масс. водн. NaCl. Органический слой отделяли и перемешивали с 43,4 г активированного углерода ENO-PC при комнатной температуре под N2 в течение ночи. Смесь фильтровали, и фильтрат концентрировали с получением соединения 4 (420,1 г, (масло), чистота 88% масс./масс., выход 100%, хиральная чистота: 99% э.и. Неочищенный продукт (S)-метил 3-(3-(бензилокси)-4-((бис(бензилокси)фосфорил)окси)фенил)-2-(((бензилокси)карбонил)амино)пропаноат, соединение 4, использовали, как есть, на следующей стадии.1H ЯМР (400 МГц, DMSO-d6) δ 7,85 (д, J=8,1 Гц, 1H), 7,46-7,16 (м, 21H), 7,09 (дд, J=8,2, 1,4 Гц, 1H), 6,81 (дд, J=8,2, 1,9 Гц, 1H), 5,09-4,98 (м, 8H), 4,31 (ддд, J=10,2, 8,1, 5,0 Гц, 1H), 3,63 (с, 3H), 3,08-2,78 (м, 2H).
Стадия 4
[334] В 150-мл гидрогенизатор Парра добавляли 10% масс. на основании сухого вещества 5% Pd/C (1,33 г, катализатор содержит 63,6% H2O). В реактор загружали 2,9% масс. водного раствора бикарбоната натрия (20,7 г). Соединение 4 (5,70 г, содержание 85%) растворяли в THF (48,5 мл, 10 мл/г субстрата) и затем переносили в реактор. В реакторе создавали давление аргона 60 фунтов на кв. дюйм (414 кПа) и спускали давление до 10 фунтов на кв. дюйм (69 кПа); проводили продувку аргоном под давлением всего 6 раз. Подобным образом, проводили продувку реактора под давлением водородом 3 раза (заполняли до 50 фунтов на кв. дюйм (345 кПа), спускали до 5 фунтов на кв. дюйм (34 кПа)). Заполняли реактор до 50 фунтов на кв. дюйм (345 кПа) H2 и перемешивали при 750 об./мин при 25°C в течение по меньшей мере 2 час. После завершения реакции, фильтровали двухфазный раствор для удаления катализатора. Промывали реактор и отфильтрованный осадок водой (4,1 мл, 2 мл/г относительно теоретического выходя продукта). Двухфазную реакционную смесь разводили с использованием 16 мл MTBE. Водный слой удаляли и промывали с использованием 16 мл MTBE. Затем водный слой переносили в 250-мл колбу и добавляли количество 6 M водн. HCl, достаточное для доведения pH до 1,8. Раствор интенсивно перемешивали, затем добавляли iPrOH (73 мл), чтобы довести конечный состав растворителя композиция до 3:1 iPrOH/вода. Взвесь перемешивали в течение ночи. Взвесь после кристаллизации фильтровали, и влажный осадок твердого вещества промывали с использованием iPrOH. Белое твердое вещество сушили в вакуумной печи при 50°C с получением соединения 5 (1,72 г, кристаллическое твердое вещество, выход 85%). 1H ЯМР (400 МГц, оксид дейтерия) δ 7,25 (дт, J=8,3, 1,1 Гц, 1H), 6,87 (т, J=1,5 Гц, 1H), 6,80 (дд, J=8,3, 2,2 Гц, 1H), 4,41 (ддд, J=7,9, 5,4, 0,7 Гц, 1H), 3,87 (д, J=0,7 Гц, 3H), 3,36-3,08 (м, 2H).
Стадия 5
[335] К раствору соединения 5, (S)-метил 2-амино-3-(3-гидрокси-4-(фосфоноокси)фенил)пропаноат, (10,0 г, 34,3 ммоль) в 40 мл воды при 15-20°C добавляли 22,89 мл (4,0 экв.) 6 Н NaOH. Когда pH достигал 7-8, раствор пропускали через фильтр для осветления. После осветления, продолжали доведение pH. После добавления основания, реакционную смесь перемешивали при 25°Cв течение 60 мин (pH=12,06). Через 60 мин реакционную смесь подкисляли с использованием 4,0 экв. 6 Н HCl (137 ммоль, 22,89 мл). Конечный pH доводили до 1,8. Через 10 мин реакционная смесь становилась мутной, и добавляли 200 мл IPA. Взвесь перемешивали в течение 30 мин и твердое вещество фильтровали и промывали с использованием IPA. Твердое вещество сушили в вакуумной печи при 40°C в течение ночи с получением соединения 6, (S)-2-амино-3-(3-гидрокси-4-(фосфоноокси)фенил)пропионовой кислоты (7,85 г, чистота 99%, выход 87%, 99,6% э.и.).1H ЯМР (400 МГц, оксид дейтерия) δ 7,24 (дд, J=8,3, 1,3 Гц, 1H), 6,91 (д, J=2,1 Гц, 1H), 6,83 (дд, J=8,3, 2,2 Гц, 1H), 4,25 (дд, J=8,0, 5,2 Гц, 1H), 3,35-3,05 (м, 2H).
Пример 6: Альтернативный синтез 4ʹ-монофосфата L-Dopa
[336] 4ʹ-монофосфат L-Dopa получали, как показано ниже:

Стадия 1
[337] Раствор 2-(бензилокси)фенола (63,7 мл, 364 ммоль) в MeOH (1050 мл) охлаждали до -10°C и добавляли иодид натрия (54,5 г, 364 ммоль) и гидроксид натрия (382 мл, 764 ммоль) (NaOH в течение 5 мин, температура до 10°C и темный раствор при добавлении NaOH). Снова охлаждали до < 5°C и добавляли гипохлорит натрия (247 мл, 400 ммоль) по каплям, сохраняя температуру < 5oC. Через 10 мин, удаляли 500 мл MeOH посредством ротационного выпаривания, затем добавляли MTBE (730 мл) и 2 Н HCl (909 мл, 1818 ммоль), промывали с использованием 1 Н Na2S2O3 (130 мл x 3; светлее с каждым разом) и рассола (64 мл), высушивали (Na2SO4), концентрировали и промывали циклогексаном (100 мл) до неочищенного желтого твердого вещества. Добавляли циклогексан (130 мл), нагревали до 55°C (желтый раствор), затем медленно охлаждали, проводили затравку кристаллизации при 45°C (~ 50 мг, раствор) и 40°C (~ 50 мг, образовывалась взвесь). Продолжали охлаждение до комнатной температуры (~20-25°C) и интенсивно перемешивали в течение ночи. Фильтровали, промывая с использованием циклогексана (64 мл), получали материал сбора 1 (69,93 г, 59%, очень чистый по 1H ЯМР, немного грязно-белое твердое вещество). Концентрировали исходный раствор до ~70 мл, проводили затравку кристаллизации, выдерживали 1 час, и липкий темный материал преципитировал вместе с продуктом. Добавляли MTBE (7 мл), обрабатывали ультразвуком (способствует уменьшению окрашивания), перемешивали 20 мин и фильтровали. Промывали с использованием 10% MTBE/циклогексана (32 мл), получали материал сбора 2 (4,65 г, небольшое количество некоторых загрязнений по 1H ЯМР). Всего, выделили 2-(бензилокси)-4-иодфенол (74,6 г, 229 ммоль, выход 62,9%).1H ЯМР (501 МГц, DMSO-d6) δ 9,33 (с, 1H), 7,49-7,42 (м, 2H), 7,42-7,35 (м, 2H), 7,35-7,29 (м, 1H), 7,24 (д, J=2,0 Гц, 1H), 7,09 (дд, J=8,3, 2,1 Гц, 1H), 6,64 (д, J=8,3 Гц, 1H), 5,09 (с, 2H).
Стадия 2
[338] Раствор (S)-бензил 2-(((бензилокси)карбонил)амино)-3-гидроксипропаноата (150 г, 455 ммоль) в DMF (750 мл) охлаждали до 0°C и добавляли иодид метилтрифеноксифосфония (247 г, 547 ммоль) (без экзотермического нагрева). Через 20 мин между 5 и -5oC, реакция завершалась по LC-MS. Через 30 мин, добавляли бикарбонат натрия (19,13 г, 228 ммоль) и MTBE (750 мл, температура до 8°C), затем осторожно добавляли воду (750 мл, небольшое выделение CO2 в ранний период добавления), сохраняя температуру < 20°C. Смывали в делительную воронку с использованием дополнительной воды (750 мл, всего 1,5 л, 10 объемов) и MTBE (750 мл, всего 1,5 л, 10 объемов), водн. pH ~ 8. Разделяли слои, промывали органический слой рассолом (300 мл) и проверяли слои по LC-MS. Высушивали (Na2SO4), концентрировали до минимального объема (суммарная масса 401 г), и добавляли MeOH (3,0 л, желтый раствор). Добавляли воду (1,5 л) в течение 30 мин, проводили затравку кристаллизации с использованием ранее выделенного кристаллического материала (0,1% масс., 150 мг) после чего добавляли 2 объема, 300 мл воды (без растворения). Постепенно образовывалась взвесь, затем быстро густела, после чего добавляли 650 мл воды. После перемешивания при температуре окружающей среды в течение 30 мин, фильтровали белую взвесь, промывали с использованием 2:1 MeOH/воды (300 мл для промывки взвеси, 300 мл для промывки вытеснением) и оставляли на стеклообразной фритте под вакуумом на 12 час. Добавляли MeOH (2,25 л, 15 объемов) к влажному отфильтрованному осадку, интенсивно перемешивали в течение 30 мин для разрыхления взвеси, затем добавляли воду (1,125 л) в течение 30 мин, перемешивали дополнительные 15 мин и фильтровали, промывали с использованием 2:1 MeOH/воды (300 мл для промывки вытеснением). Высушивали белое твердое вещество в вакуумной печи при 50°C до постоянной массы, получая (R)-бензил 2-(((бензилокси)карбонил)амино)-3-иодпропаноат (173 г, 394 ммоль, выход 86%). Титрованием Kf показали 253 м.д. воды.1H ЯМР (400 МГц, DMSO-d6) δ 7,96 (д, J=8,3 Гц, 1H), 7,44-7,14 (м, 10H), 5,10 (д, J=33,8 Гц, 4H), 4,38 (тд, J=8,7, 4,6 Гц, 1H), 3,55 (дд, J=10,3, 4,6 Гц, 1H), 3,37 (т, J=9,7 Гц, 1H). MS (ESI) m/z 457 [M+NH4]+.
Стадия 3
[339] Взвесь цинка (47,0 г, 719 ммоль) и DMF (325 мл) перемешивали в 2 л 3-горлой круглодонной колбе с магнитной мешалкой. Серую взвесь охлаждали до 16°C в ледяной бане и добавляли иод (7,60 г, 29,9 ммоль) (супернатант от желтого до бесцветного с экзотермическим нагревом от 16 до 27°C). Снова охлаждали до 10°C и добавляли (R)-бензил 2-(((бензилокси)карбонил)амино)-3-иодпропаноат (105 г, 240 ммоль) порционно в течение 10 мин при < 25oC. После дополнительных 10 мин между 20 и 25°C, по LCMS показали полное включение цинка (остановка реакции в аликвоте 2Н HCl). Добавляли Pd2(dba)3 (0,457 г, 0,499 ммоль), 2-дициклогексилфосфино-2ʹ,6ʹ-диметоксибифенил (0,410 г, 0,998 ммоль), и 2-(бензилокси)-4-иодфенол (65,1 г, 200 ммоль) в одной порции (без экзотермического нагрева) и перемешивали при комнатной температуре (старт=2:30). Через 1 час наблюдали экзотермический нагрев до 27°C, поэтому снова охлаждали в водяной бане комнатной температуры до 20-25°C и перемешивали в течение ночи. Через 15 час 40 мин, по LC-MS показали полную реакцию без примесей. Добавляли MTBE (650 мл) и силикагель (65 г), перемешивали 15 мин и фильтровали серую взвесь, промывая серое твердое вещество с использованием MTBE (325+130 мл). Промывали желтый фильтрат насыщ. водн. NH4Cl (325 мл, температура доходила до 27°C с выделением небольшого количества H2, при pH ~5-6) и рассолом (130 мл), высушивали (Na2SO4), концентрировали и подвергали FCC (колонка 800 г, 50-100% DCM/гептаны, затем до 10% MTBE/DCM; разделяя только неполярные сильно окрашенные примеси и основной материал, улучшая посредством HPLC от 91 pa% до 93 pa%) с получением (S)-бензил 3-(3-(бензилокси)-4-гидроксифенил)-2-(((бензилокси)карбонил)амино)пропаноата (106 г, 207 ммоль, выход 104%) в форме светло-коричневого масла. По1H ЯМР показана дополнительная масса преимущественно сложного эфира Bn-CBz-аланина из-за протонирования избыточного алкилцинка в процессе обработки. Использовали без дополнительной очистки на следующей стадии, принимая количественный выход.1H ЯМР (501 МГц, DMSO-d6) δ 8,86 (с, 1H), 7,80 (д, J=8,0 Гц, 1H), 7,47-7,41 (м, 2H), 7,41-7,08 (м, 13H), 6,94 (д, J=2,0 Гц, 1H), 6,70 (д, J=8,0 Гц, 1H), 6,63 (дд, J=8,0, 1,9 Гц, 1H), 5,15-4,93 (м, 6H), 4,27 (ддд, J=9,7, 7,9, 5,5 Гц, 1H), 2,93 (дд, J=13,8, 5,5 Гц, 1H), 2,78 (дд, J=13,8, 9,8 Гц, 1H). MS (ESI) m/z 512 [M+H]+.
Стадия 4
[340] Раствор (S)-бензил 3-(3-(бензилокси)-4-гидроксифенил)-2-(((бензилокси)карбонил)амино)пропаноата (102 г, 200 ммоль) в ACN (510 мл) перемешивали при комнатной температуре и добавляли тетрабензилпирофосфат (118 г, 220 ммоль). Охлаждали в ледяной бане и добавляли DBU (45,2 мл, 300 ммоль) в течение 10 мин, сохраняя температуру между 20 и 25°C. Через 30 мин, по LC-MS показали полную реакцию. Добавляли MTBE (1,0 л) и воду (510 мл), разделяли слои (очень небольшая потеря водн. слоя по LCMS), и промывали органический слой рассолом (3×200 мл). Высушивали (Na2SO4), концентрировали и подвергали FCC (разделяли на две порции; каждую очищали на 800 г колонки с использованием градиентной элюции 25-75% MTBE/гептанами, затем объединяли) с получением (S)-бензил-3-(3-(бензилокси)-4-((бис(бензилокси)фосфорил)окси)фенил)-2-(((бензилокси)карбонил)амино)пропаноата (132 г, 171 ммоль, выход 86%) в форме янтарного масла.1H ЯМР (400 МГц, DMSO-d6) δ 7,87 (д, J=8,1 Гц, 1H), 7,43-7,17 (м, 26H), 7,07 (дд, J=8,2, 1,3 Гц, 1H), 6,79 (дд, J=8,3, 1,9 Гц, 1H), 5,14-4,91 (м, 10H), 4,38 (ддд, J=10,0, 8,0, 5,2 Гц, 1H), 3,05 (дд, J=13,8, 5,2 Гц, 1H), 2,88 (дд, J=13,8, 10,1 Гц, 1H). MS (ESI) m/z 789 [M+NH4]+.
Получение 4ʹ-монофосфата леводопа завершали, как на стадии 5a из примера 1.
Пример 7: Альтернативный синтез 4ʹ-монофосфата карбидопа
[341] 4ʹ-монофосфат карбидопа получали, как показано на схеме 7 ниже:
Схема 7

[342] Конкретно, 4ʹ-монофосфат карбидопа получали, как описано в стадиях 1-5 ниже.
Стадия 1
[343] В 500 мл трехгорлую круглодонную колбу загружали соединение 1 (25,04 г, 90 ммоль), трис(дибензилиденацетон)палладий (1,23 г, 1,343 ммоль), тетрафторборат три-трет-бутилфосфония (0,875 г, 3,02 ммоль) и якорь магнитной мешалки. Термопару, обратный холодильник и пробку помещали в три горла колбы. Колбу продували азотом в течение 1 час. В это время, во вторую колбу загружали диоксан (200,0 мл), 2-метилпроп-2-ен-1-ол (8,30 мл, 99 ммоль) и N-циклогексил-N-метилциклогексанамин (30,0 мл, 140 ммоль), и эту колбу барботировали азотом в течение 1 час. Затем раствор диоксана переносили через канюлю в колбу, содержащую соединение 1, палладий и лиганд. Реакционную смесь нагревали до 100°C в течение 1 час. Через это время, реакционную смесь охлаждали до 35°C и разводили этилацетатом (250 мл) и 1,0 M HCl (250 мл). Двухфазную смесь перемешивали в течение 10 мин и разделяли фазы. Органический раствор удаляли из реактора, и водную фазу возвращали. Этилацетат (150 мл) добавляли к водному материалу, и смесь перемешивали в течение 10 мин. Водный слой спускали из реакционной смеси, и исходный этилацетат возвращали в реактор. Эту объединенную смесь промывали (2×10 мин при перемешивании) с использованием смеси 5% N-ацетилцистеина/8% бикарбоната натрия. После отделения водных отходов после каждой промывки, желтый органический раствор фильтровали через диатомитовую землю целит®. Титрованием способом Карла Фишера органической реакционной смеси показали, что содержание воды составляло 3,3% масс. Желтый органический раствор возвращали в реактор и перемешивали при добавлении бисульфита натрия (18,67 г, 179 ммоль). Реакционную смесь нагревали до 40°C в течение 13 час. Через это время, преципитат фильтровали и твердое вещество промывали этилацетатом (3×100 мл) с получением белого твердого вещества с выходом 64,2%. Определили, что содержание материала составляет 60,0% по Q-ЯМР спектроскопии. 1H ЯМР (400 МГц, D2O, 1:1 диастереомеры): δ м.д. 7,48-7,36 (м, 5H), 6,92 (м, 1H), 6,86 (дд, J=8,0, 4,0 Гц, 1H), 6,76 (дд, J=8,0, 4,0 Гц, 1H), 5,21-5,19 (м, 2H), 4,27-4,25 (м, 1H), 3,10-3,05 (м, 0,5H), 2,68-2,63 (м, 0,5 H), 2,52-2,49 (м, 0,5H), 2,38-2,16 (м, 1,5H), 0,94 (д, J=8,0 Гц, 1,5H), 0,84 (д, J=8,0 Гц, 1,5 H).
Стадия 2a
[344] В 500-мл 3-горлую круглодонную колбу с присоединенными термопарой и верхней мешалкой загружали соединение 3 (15,05 г, 63,3% масс./масс., 23,2 моль), бикарбонат натрия (16,97 г, 202 ммоль), воду (155 мл) и этилацетат (140 мл). Полученную двухфазную суспензию интенсивно перемешивали при 25°C. После полного расхода исходного материала, реакционную смесь переносили в делительную воронку, и слои разделяли. Органический слой промывали рассолом (75 мл). Органический слой сушили над сульфатом натрия, и концентрировали в вакууме с получением соединения 2 в виде белого твердого вещества (6,22 г, 62,9%). 1H ЯМР (400 МГц, CDCl3): δ м.д. 9,68 (д, J=2,0 Гц, 1H), 7,46-7,32 (м, 5H), 6,86 (д, J=8,0 Гц, 1H), 6,73 (д, J=1,6 Гц, 1H), 6,68 (дд, J=8,0, 1,6 Гц, 1H), 5,58 (с, 1H), 5,08 (с, 2H), 2,98 (дд, J=13,6, 6,0 Гц, 1H), 2,65-2,56 (м, 1H), 2,53 (дд, J=13,6, 8,0 Гц, 1H), 1,05 (д, J=6,8 Гц, 3H).
Стадия 2b
[345] В 250-мл 3-горлую колбу с присоединенными термопарой и верхней мешалкой добавляли соединение 2 (6,29 г, 23,22 ммоль), затем ацетонитрил (63 мл). Затем тетрабензилпирофосфат (13,54 г, 24,38 ммоль) добавляли при 25°C. Реакционную смесь охлаждали до 2,1°C в ледяной бане, и DBU (4,55 мл, 30,2 ммоль) добавляли в реакционную смесь по каплям и полученный раствор перемешивали при 2°C. После полного расхода исходного материала, реакционную массу разводили водой (65 мл) и экстрагировали с использованием MTBE (130 мл). Объединенный органический слой промывали водой (65 мл), 5% раствором хлорида натрия (30 мл), высушивали над сульфатом натрия, и концентрировали в вакууме с получением неочищенного соединения 4 в виде желтого масла (11,38 г, 92,4%). 1H ЯМР (400 МГц, CDCl3): δ м.д. 9,75 (д, J=1,2 Гц, 1H), 7,46-7,42 (м, 2H), 7,36-7,23 (м, 13H), 7,17 (дд, J=8,0, 1,2 Гц, 1H), 6,81 (дд, J=2,0, 1,2 Гц, 1H), 6,72 (дд, J=8,0, 2,0 Гц, 1H), 5,11 (с, 2H), 5,10 (с, 2H), 5,07 (с, 2H), 3,05 (дд, J=13,6, 5,6, Гц, 1H), 2,69-2,59 (м, 1H), 2,56 (дд, J=13,6, 8,0 Гц, 1H), 1,09 (д, J=7,2 Гц, 3H).
Стадия 3
[346] В 500-мл 3-горлую круглодонную колбу с присоединенной термопарой добавляли (R)-5-(пирролидин-2-ил)-1H-тетразол (0,15 г, 1,07 ммоль) и ацетонитрил (40 мл). Затем добавляли TFA (0,084 мл, 1,07 ммоль), затем (E)-дибензилдиазен-1,2-дикарбоксилат (8,25 г, 27,7 ммоль). Затем раствор соединения 4 (11,4 г, 21,49 ммоль) в ацетонитриле (70 мл) добавляли через канюлю. Полученный раствор перемешивали при 25°C. После полного расхода исходного материала, реакционную смесь разводили ацетонитрилом (88 мл) и водой (58 мл) добавляли для преципитации продукта. Полученную взвесь перемешивали в течение ночи при 25°C и затем фильтровали и промывали с использованием 28% масс. воды в ацетонитриле (30 мл) с получением соединения 5 (8,9 г, выход 50%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ м.д. 9,72 (с, 1H), 7,42-7,17 (м, 25H), 7,09-7,05 (м, 1H), 6,67-6,34 (м, 2H), 5,80 (ушир. с, 1H), 5,30-4,80 (м, 10H), 3,39-3,21 (м, 1H), 2,92-2,77 (м, 1H), 1,14-1,00 (ушир. с, 3H).
Стадия 4
[347] 100 мл трехгорлую круглодонной колбу оборудовали термопарой и загружали соединение 5 (5,10 г, 6,15 ммоль), ацетонитрил (50,0 мл) и диметилсульфоксид (DMSO) (1,00 мл, 14,1 ммоль). Белую суспензию перемешивали и получали 2,0 мл водного раствора моногидрата дигидрофосфата натрия (1,78 г, 12,90 ммоль) и добавляли в реакционную смесь. После этого добавления, 2,0 мл водного раствора хлорита натрия (2,88 г (80% масс.), 25,5 ммоль) добавляли по каплям в течение 90 с. Мутная реакционная смесь становилась светло-желтой и более темно-желтой и становилась более прозрачной по мере прохождения реакции. Через 90 мин, реакцию останавливали с использованием 6,0 мл водного раствора сульфита натрия (1,60 г, 12,7 ммоль). Реакционную смесь перемешивали в течение 20 мин после добавления сульфита. После этого времени, реакционную смесь выливали в делительную воронку, и круглодонную колбу промывали с использованием 50 мл изопропилацетата и 50 мл воды. Водный и органический слои разделяли. Органический слой промывали с использованием 50 мл воды. Эмульсия формировалась при перемешивании слоев. В это время, затем добавляли 20 мл рассола, и фазы разделяли после исчезновения эмульсии. Дополнительные 50 мл изопропилацетата добавляли в реакционную смесь, и колбу помещали в роторный испаритель пока реакционная смесь не начинала выглядеть мутной. Суммарный объем реакционной смеси после дистилляции составлял ~10 мл. Реакционную колбу помещали в холодильник при 4°C на 16 час. Через это время, образованное белое твердое вещество собирали, промывали с использованием 20 мл изопропилацетата и высушивали в вакууме с получением 75,0% выходом соединения 6. 1H ЯМР (400 МГц, CDCl3): δ м.д. 7,58-7,14 (м, 26H), 7,01-6,84 (м, 1H), 6,41-6,29 (м, 1H), 5,46-4,64 (м, 10H), 3,80-3,49 (м, 1H), 3,02-2,94 (м, 1H), 1,19 (ушир. с, 3 H).
Стадия 5
[348] В реактор Парра 1 галлон (3,8 л) загружали 5% масс. на основании массы в сухом состоянии 5% Pd/C (63,6% H2O, 15,0 г), воду (182 мл) и 5% масс. водного бикарбоната натрия (215 мл). К водной взвеси катализатора добавляли раствор в THF (1090 мл) соединения 6 (109 г, содержание 85%). Реактор собирали и создавали инертную атмосферу с использованием азота, с последующей продувкой водородом (4 продувки под давлением × 30 фунтов на кв. дюйм (207 кПа)). Затем в реакторе снова создавали давление 30 фунтов на кв. дюйм (207 кПа) с использованием водорода. Реактор интенсивно перемешивали при 25°C в течение по меньшей мере 1 час. После получения полного реакционного превращения, водород спускали и в реакторе создавали инертную атмосферу с использованием азота. Затем двухфазную реакционную смесь фильтровали для удаления катализатора, с последующей промывкой водой (93 мл). Двухфазную реакционную смесь разводили с использованием MTBE (370 мл). Смесь перемешивали в течение 15 мин, затем позволяли оседать в течение 10 мин (следует отметить, что продукт содержится в водном слое). Разделяли слои и промывали водный слой с использованием MTBE (370 мл), как описано выше.
[349] С использованием достаточного количества 6 M водной HCl, раствор подкисляли до pH 1,9. Проводили затравку кристаллизации водного раствора с использованием 0,1% масс. соединения 7 для индукции образования центров кристаллизации. Добавляли изопропанол (1326 мл) к взвеси после затравки кристаллизации и перемешивали в течение по меньшей мере 5 час при температуре окружающей среды. Взвесь фильтровали для сбора продукта, рециркулируя жидкости в качестве промывки при необходимости. Промывали влажный осадок твердых веществ изопропанолом (370 мл). Твердые вещества-продукты высушивали на воздухе на воронке в течение 2 час. Выделяли 38,5 г соединения 7 в форме тригидрата (выход с поправкой на содержание 97,2%). 1H ЯМР (400 МГц, D2O): δ м.д. 7,21 (д, J=8,0 Гц), 6,87 (д, J=2,0 Гц, 1H ), 6,77 (дд, J=8,0, 2,0 Гц, 1H), 3,19 (д, J=16,0 Гц, 1H), 3,00 (д, J=16,0 Гц, 1H), 1,54 (с, 3H).
Пример 8: Синтез 3ʹ-фоноксиметилового сложного эфира L-Dopa
[350] 3ʹ-фоноксиметиловый сложный эфир L-dopa получали, как показано на схеме 8 ниже:
Схема 8

[351] Конкретно, 3ʹ-фоноксиметиловый сложный эфир L-dopa получали, как описано в стадиях 1-6 ниже.
Стадия 1
[352] К раствору 4-(бензилокси)-4-гидроксибензальдегида, соединения 1, (10,0 г, 43,8 ммоль) в ацетонитриле (133 мл) добавляли ди-трет-бутил(хлорметил)фосфат (12,53 г, 46,0 ммоль) при 25°C. Реакционную смесь охлаждали до 4°C и добавляли DBU (7,67 г, 50,4 ммоль). После добавления, реакционной смеси позволяли нагреться до комнатной температуры (~20-25°C) и затем нагревали до 50°C в течение 39 час. Через 22 час реакционную смесь охлаждали до комнатной температуры и останавливали реакцию водой (400 мл) и экстрагировали с использованием MTBE (3×100 мл). Органический слой промывали насыщенным раствором бикарбоната натрия (150 мл), водой (150 мл), насыщенным раствором хлорида натрия (150 мл) и концентрировали с получением соединения 2 (19,48 г, чистота 49%, выход 50%. Неочищенный продукт пропускали через колонку с силикагелем с использованием градиента этилацетата-гексана с получением 8,08 г соединения 2 (чистота 94%, выход 40%.1H ЯМР (400 МГц, DMSO-d6) δ 9,85 (с, 1H), 7,66 (дд, J=8,3, 1,9 Гц, 1H), 7,63 (д, J=2,0 Гц, 1H), 7,49-7,44 (м, 2H), 7,43-7,32 (м, 4H), 5,65 (д, J=12,0 Гц, 2H), 5,25 (с, 2H), 1,36 (д, J=0,6 Гц, 18H).
Стадия 2
[353] К раствору триметилового сложного эфира (+/-)-бензилоксикарбонил-альфа-фосфоноглицина (5,35 г, 16,14 ммоль) и 2-(бензилокси)-5-формилфенокси)метил-ди-трет-бутилфосфата, соединения 2, (6,78 г, 14,67 ммоль) в 70 мл DCM при 0°C добавляли 1,1,3,3-тетраметилгуанидин (TMG) (2,0 г, 17,60 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи. На следующие сутки реакционную смесь промывали с использованием 3×35 мл воды и концентрировали с получением 13,11 г неочищенного продукта. Затем неочищенный продукт очищали хроматографией на колонке с силикагелем с использованием градиента этилацетата-гексана с получением 7,34 г соединения 3 (чистота 81%, выход 62%.1H ЯМР (400 МГц, DMSO-d6) δ 7,50-7,28 (м, 13H), 7,21 (с, 1H), 7,16 (с, 1H), 5,59 (д, J=11,9 Гц, 2H), 5,18 (с, 2H), 5,09 (д, J=12,1 Гц, 2H), 3,69 (с, 3H), 1,35 (д, J=0,5 Гц, 18H).
Стадия 3
[354] В 120 мл реактор Парра загружали метил-3-(4-(бензилокси)-3-(((ди-трет-бутоксифосфорил)окси)метокси)фенил)-2-(((бензилокси)карбонил)амино)акрилат, соединение 3, (7,34 г, 9,07 ммоль) и тетрафторборат 1,2-бис[(2S,5S)-2,5-диэтилфосфолано]бензол(1,5-циклооктадиен)родия (I) (0,060 г, 0,091 ммоль), и тетрагидрофуран (59,5 мл). Смесь продували H2 и реакционную смесь перемешивали при 35°C при 100 фунтов на кв. дюйм (689 кПа) H2 в течение 20 час. Через 20 час, реакционную смесь концентрировали и очищали хроматографией на колонке с силикагелем с использованием градиента этилацетата-гексана с получением 5,44 г соединения 4 (чистота 76%, выход 69%, 98% э.и.).1H ЯМР (400 МГц, DMSO-d6) δ 7,80 (д, J=8,0 Гц, 1H), 7,48-7,25 (м, 10H), 7,04 (д, J=2,1 Гц, 1H), 7,01 (д, J=8,4 Гц, 1H), 6,89 (дд, J=8,3, 2,1 Гц, 1H), 5,55 (дд, J=11,6, 1,6 Гц, 2H), 5,08 (с, 2H), 4,99 (д, J=2,7 Гц, 2H), 4,22 (ддд, J=9,8, 7,9, 5,2 Гц, 1H), ), 3,62 (с, 3H), 3,03-2,67 (м, 2H), 1,37 (д, J=1,2 Гц, 18H).
Стадия 4
[355] В 50 мл реактор Парра загружали 5% Pd/C (JM #9) (0,418 г, 2,311 ммоль). (S)-метил 3-(4-(бензилокси)-3-(((ди-трет-бутоксифосфорил)окси)метокси)фенил)-2-(((бензилокси)карбонил)амино)пропаноат, соединение 4, (2,0 г, 2,311 ммоль) растворяли в тетрагидрофуране (15,2 мл). Этот раствор загружали в реактор и продували аргоном, затем H2. Реакционную смесь перемешивали при 50 фунтов на кв. дюйм (345 кПа) H2 при комнатной температуре в течение 1 час. Через 1 час, катализатор отфильтровывали и промывали с использованием THF. Раствор концентрировали и очищали хроматографией на колонке с силикагелем с использованием этилацетата-метанола с получением 1,04 г соединения 4, (чистота 95%, выход 98%).1H ЯМР (400 МГц, DMSO-d6) δ 9,13 (с, 1H), 6,88 (д, J=1,9 Гц, 1H), 6,74 (д, J=8,1 Гц, 1H), 6,71 (д, J=2,0 Гц, 1H), 5,50 (д, J=11,4 Гц, 2H), 3,58 (с, 3H), 3,49 (т, J=6,6 Гц, 1H), 2,81-2,58 (м, 2H), 1,70 (с, 2H), 1,39 (д, J=0,6 Гц, 18H).
Стадия 5
[356] К (S)-метил 2-амино-3-(3-(((ди-трет-бутоксифосфорил)окси)метокси)-4-гидроксифенил)пропаноату, соединению 5, (1,04 г, 2,34 ммоль) в 10 мл DCM при 5°Cдобавляли 876 мкл (5,0 экв.) трифторуксусной кислоты по каплям. Реакционную смесь перемешивали при 25°C до завершения реакции. Через 60 мин, исходный материал был израсходован и продукт прилипал к слою DCM. Продукт, соединение 6, экстрагировали из слоя DCM с использованием 3 мл воды. Затем водный слой брали, как есть, для следующей стадии. LC/MS [M+1]=322,1
Стадия 6
[357] К (S)-метил 2-амино-3-(4-гидрокси-3-((фосфоноокси)метокси)фенил)пропаноату, соединению 6, (752 мг, 2,341 ммоль) в 4 мл воды при 5°C добавляли 2,62 мл 6 Н NaOH по каплям в течение 5 мин до pH=12,5. Реакционную смесь перемешивали при 25°C до завершения реакции. Через 60 мин реакционную смесь подкисляли с использованием 6 Н HCl до pH=1,9. К этому раствору добавляли IPA пока продукт не преципитировал при поддержании pH 1,9. Продукт, соединение 7, фильтровали и промывали с использованием IPA с получением 630 мг, с чистотой 90%.1H ЯМР (400 МГц, оксид дейтерия) δ 7,17 (д, J=1,8 Гц, 1H), 6,99-6,96 (м, 1H), 6,94 (дд, J=8,3, 1,8 Гц, 1H), 5,57 (д, J=12,6 Гц, 2H), 4,16 (дд, J=7,9, 5,1 Гц, 1H), 3,33-3,05 (м, 2H).
Пример 9: Синтез 4ʹ-фоноксиметилового сложного эфира L-Dopa
[358] 4ʹ-фоноксиметиловый сложный эфир L-dopa получали, как показано на схеме 9 ниже:
Схема 9

[359] Конкретно, 4ʹ-фоноксиметиловый сложный эфир L-dopa получали, как описано в стадиях 1-6 ниже.
Стадия 1
[360] К раствору 3-(бензилокси)-4-гидроксибензальдегида, соединения 1, (10,0 г, 43,8 ммоль) в ацетонитриле (133 мл) добавляли ди-трет-бутил(хлорметил)фосфат (12,53 г, 46,0 ммоль) при 25°C. Реакционную смесь охлаждали до 4°C и добавляли DBU (7,67 г, 50,4 ммоль). После добавления, реакционной смеси позволяли нагреться до комнатной температуры (~20-25°C) и затем нагревали до 50°C в течение 22 час. Через 22 час реакционную смесь охлаждали до комнатной температуры и реакцию останавливали водой (400 мл) и экстрагировали с использованием MTBE (3×100 мл). Органический слой промывали насыщенным раствором бикарбоната натрия (150 мл), водой (150 мл), насыщенным раствором хлорида натрия (150 мл) и концентрировали с получением соединения 2 (20,0 г, чистота 70%, выход 73%). Неочищенный продукт пропускали через колонку с силикагелем с использованием градиента этилацетата-гексана с получением 8,77 г соединения 2 (чистота 91%, выход 41%.1H ЯМР (400 МГц, DMSO-d6) δ 9,87 (с, 1H), 7,59 (д, J=7,0 Гц, 2H), 7,49-7,45 (м, 2H), 7,43-7,31 (м, 4H), 5,72 (д, J=12,7 Гц, 2H), 5,20 (с, 2H), 1,37 (д, J=0,6 Гц, 18H).
Стадия 2
[361] К раствору триметилового сложного эфира (+/-)-бензилоксикарбонил-альфа-фосфоноглицина (5,51 г, 16,64 ммоль) и (2-(бензилокси)-4-формилфенокси)метил-ди-трет-бутилфосфата, соединения 2, (7,49 г, 15,13 ммоль) в 75 мл DCM при 0°C добавляли 1,1,3,3-тетраметилгуанидин (2,09 г, 18,16 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи. На следующие сутки реакционную смесь промывали с использованием 3×35 мл воды и концентрировали с получением 13,11 г неочищенного продукта. Затем неочищенный продукт очищали хроматографией на колонке с силикагелем с использованием градиента этилацетата-гексана с получением 8,37 г соединения 3 (чистота 85%, выход 72%).1H ЯМР (400 МГц, DMSO-d6) δ 7,54 (д, J=2,0 Гц, 1H), 7,50-7,21 (м, 13H), 7,16 (д, J=8,5 Гц, 1H), 5,63 (д, J=12,1 Гц, 2H), 5,09 (д, J=19,1 Гц, 4H), 3,71 (с, 3H), 1,37 (д, J=0,5 Гц, 18H).
Стадия 3
[362] В 120 мл реактор Парра загружали метил-3-(3-(бензилокси)-4-(((ди-трет-бутоксифосфорил)окси)метокси)фенил)-2-(((бензилокси)карбонил)амино)акрилат (8,37 г, 10,85 ммоль) и тетрафторборат 1,2-бис[(2S,5S)-2,5-диэтилфосфолано]бензол(1,5-циклооктадиен)родия (I) (0,072 г, 0,109 ммоль), и тетрагидрофуран (70,5 мл). Смесь продували H2 и реакционную смесь перемешивали при 35°C при 100 фунтов на кв. дюйм (689 кПа) H2 в течение 20 час. Через 20 час реакционную смесь концентрировали и очищали хроматографией на колонке с силикагелем с использованием градиента этилацетата-гексана с получением 6,34 г соединения 4 (чистота 78%, выход 69%, 97% э.и.).1H ЯМР (400 МГц, DMSO-d6) δ 7,80 (д, J=8,1 Гц, 1H), 7,54-7,22 (м, 10H), 7,12-6,97 (м, 2H), 6,80 (дд, J=8,2, 2,0 Гц, 1H), 5,54 (д, J=11,3 Гц, 2H), 5,13-4,90 (м, 4H), 4,25 (ддд, J=10,1, 8,1, 5,0 Гц, 1H), 3,62 (с, 3H), 3,04-2,73 (м, 2H), 1,35 (д, J=0,5 Гц, 18H).
Стадия 4
[363] В 50 мл реактор Парра загружали 5% Pd/C (JM #9) (0,429 г, 2,372 ммоль). (S)-метил 3-(3-(бензилокси)-4-(((ди-трет-бутоксифосфорил)окси)метокси)фенил)-2-(((бензилокси)карбонил)амино)пропаноат, соединение 4, (2,0 г, 2,372 ммоль) растворяли в тетрагидрофуране (THF) (15,6 мл). Этот раствор загружали в реактор и продували аргоном, затем H2. Реакционную смесь перемешивали при 50 фунтов на кв. дюйм (345 кПа) H2 при комнатной температуре в течение 1 час. Через 1 час катализатор отфильтровывали и промывали с использованием THF. Раствор концентрировали и очищали хроматографией на колонке с силикагелем с использованием этилацетата-метанола с получением 1,08 г соединения 4, (чистота 94%, выход 99%).1H ЯМР (400 МГц, DMSO-d6) δ 9,20 (с, 1H), 6,95 (д, J=8,2 Гц, 1H), 6,66 (д, J=2,1 Гц, 1H), 6,54 (дд, J=8,2, 2,1 Гц, 1H), 5,49 (д, J=11,3 Гц, 2H), 3,57 (с, 3H), 3,50 (т, J=6,6 Гц, 1H), 2,79-2,59 (м, 2H), 1,72 (2, 2H), 1,38 (д, J=0,5 Гц, 18H).
Стадия 5
[364] К (S)-метил 2-амино-3-(4-(((ди-трет-бутоксифосфорил)окси)метокси)-3-гидроксифенил)пропаноату, соединению 5, (1,08 г, 2,34 ммоль) в 11 мл DCM при 5°C добавляли 901 мкл (5,0 экв.) трифторуксусной кислоты по каплям. Реакционную смесь перемешивали при 25°C до завершения реакции. Через 60 мин исходный материал был израсходован и продукт прилипал к слою DCM. Продукт, соединение 6, экстрагировали из слоя DCM с использованием 3 мл воды. Затем водный слой брали, как есть, для следующей стадии. LC/MS [M+1]=322,1
Стадия 6
[365] К (S)-метил 2-амино-3-(3-гидрокси-4-((фосфоноокси)метокси)фенил)пропаноату, соединению 6, (752 мг, 2,341 ммоль) в 3 мл воды при 5°C добавляли 6 Н NaOH по каплям в течение 5 мин при pH=12,5. Реакционную смесь перемешивали при 25°C до завершения реакции. Через 60 мин реакционную смесь подкисляли с использованием 6 Н HCL до pH=1,9. К этому раствору добавляли IPA до преципитации продукта при поддержании pH 1,9. Продукт, соединение 7, фильтровали и промывали с использованием IPA с получением 850 мг, с чистотой 88%.1H ЯМР (400 МГц, оксид дейтерия) δ 7,09 (дд, J=8,2, 0,7 Гц, 1H), 6,76 (д, J=2,1 Гц, 1H), 6,73 (дт, J=8,3, 1,3 Гц, 1H), 5,43 (дд, J=12,6, 0,7 Гц, 2H), 4,08-3,97 (м, 1H), 3,21-2,89 (м, 2H).
Пример 10: Синтез 3ʹ-фоноксиметилового сложного эфира карбидопа и 4ʹ-фоноксиметилового сложного эфира карбидопа
[366] 3ʹ-фоноксиметиловый сложный эфир карбидопа и 4ʹ-фоноксиметиловый сложный эфир карбидопа получали, как показано на схеме 10 ниже:
Схема 10
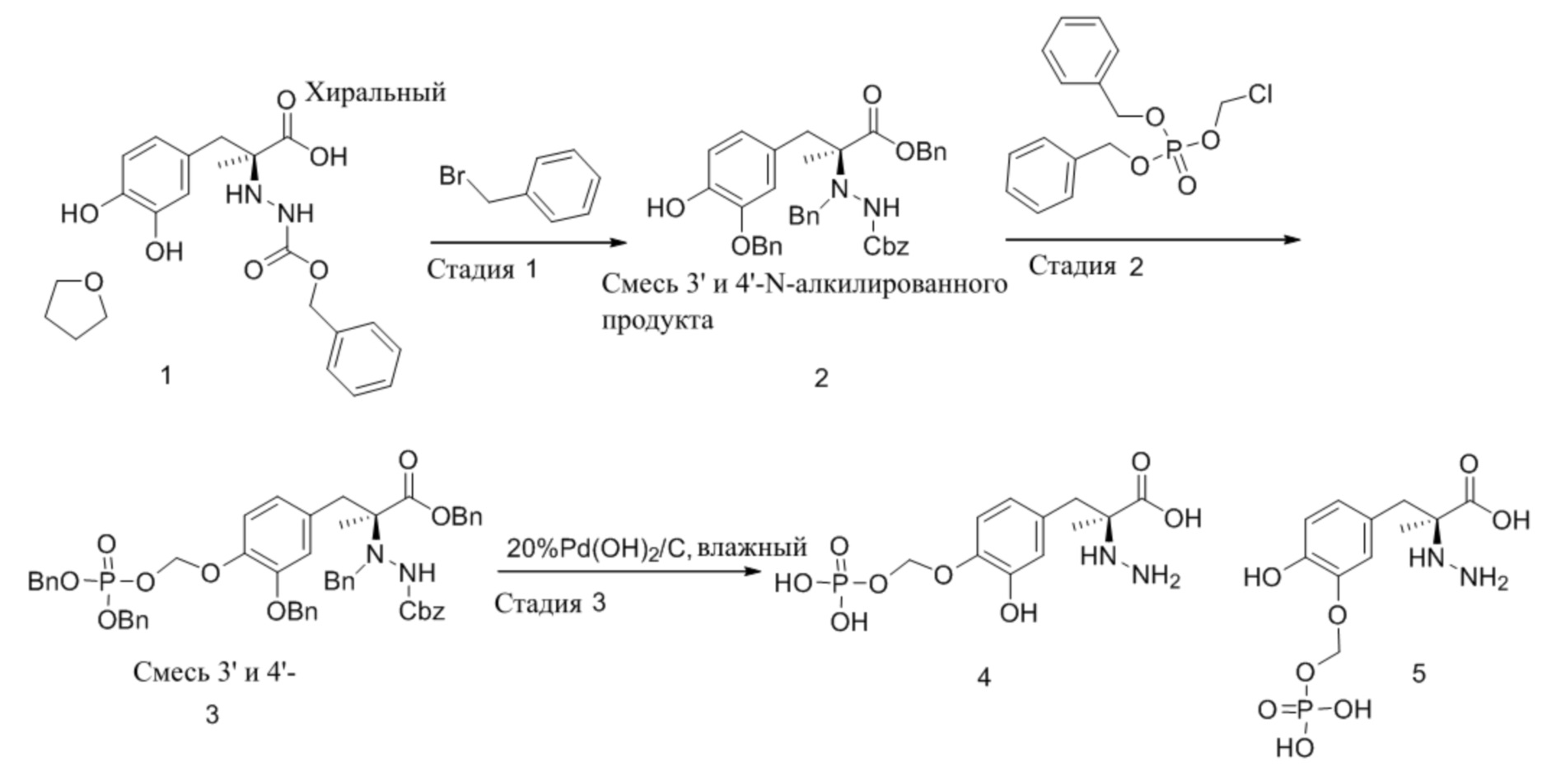
[367] Конкретно, 3ʹ-фоноксиметиловый сложный эфир карбидопа и 4ʹ-фоноксиметиловый сложный эфир карбидопа получали, как описано в стадиях 1-3 ниже.
Стадия 1 - Получение (S)-бензил-2-бензил-2-(1-(бензилокси)-3-(3-(бензилокси)-4-гидроксифенил)-2-метил-1-оксопропан-2-ил)гидразинкарбоксилата (смесь 3ʹ и 4ʹ) (соединения 2)
[368] В 500 мл круглодонную колбу добавляли соединение (S)-2-(2-((бензилокси)карбонил)гидразинил)-3-(3,4-дигидроксифенил)-2-метилпропионовой кислоты с тетрагидрофураном (1:1), соединение 1, (10 г, 84% масс., 19,42 ммоль) и 100 мл DMF. Добавляли карбонат цезия (11,39 г, 35 ммоль), и смесь перемешивали при комнатной температуре в течение 15 минут. Смесь охлаждали в ледяной бане. Бензилбромид (7,38 мл, 62,2 ммоль) добавляли порционно. Смесь перемешивали в ледяной бане в течение ночи. Взвесь фильтровали, и осадок промывали метил-т-бутиловым эфиром. Фильтрат смешивали с водой, и слои разделяли. Водный слой экстрагировали с использованием метил-т-бутилового эфира. Объединенные органические слои промывали рассолом, высушивали над безводным сульфатом натрия и концентрировали. Неочищенный материал очищали флэш-хроматографией с использованием колонки с 220 г силикагеля (0-30% этилацетат в гептанах) с получением соединения 2 в форме бесцветного густого масла (1,20 г, 9,8%).
[369] MS (ESI+) 631,1
Стадия 2 - Получение (S)-бензил-2-бензил-2-(1-(бензилокси)-3-(3-(бензилокси)-4-(((бис(бензилокси)фосфорил)окси)метокси)фенил)-2-метил-1-оксопропан-2-ил)гидразинкарбоксилата (смеси 3ʹ и 4ʹ) (соединения 3)
[370] В 100 мл круглодонную колбу добавляли дибензил(хлорметил)фосфат (1,632 г, 4,99 ммоль), (S)-бензил 2-бензил-2-(1-(бензилокси)-3-(3-(бензилокси)-4-гидроксифенил)-2-метил-1-оксопропан-2-ил)гидразинкарбоксилат, соединение 2, (2,1 г, 3,33 ммоль) и 25 мл ацетонитрила. Смесь охлаждали в ледяной бане. Добавляли 1,8-диазабицикло[5,4,0}ундец-7-ен (0,745 мл, 4,99 ммоль), и смесь перемешивали в ледяной бане в течение 30 минут, затем при комнатной температуре в течение ночи. Воду добавляли в реакционную смесь, и смесь экстрагировали с использованием этилацетата дважды. Объединенные органические слои промывали с использованием воды и рассола, высушивали над безводным сульфатом натрия и концентрировали. Неочищенный материал очищали сначала посредством флэш-хроматографии с использованием колонки с 120 г силикагеля (0-50% этилацетат в гептанах), затем посредством RP-HPLC (60-100% ацетонитрил в 0,1% TFA/воде на колонке Phenonemex C18 5u) с получением соединения 3 в виде бесцветного масла (247 мг, 8%).
[371] LC/MS (APCI+) m/z= 921,2(M+H)
Стадия 3 - Получение (S)-2-гидразинил-3-(3-гидрокси-4-((фосфоноокси)метокси)фенил)-2-метилпропионовой кислоты (Соединение 4) и (S)-2-гидразинил-3-(4-гидрокси-3-((фосфоноокси)метокси)фенил)-2-метилпропионовой кислоты (соединения 5)
[372] (S)-бензил 2-бензил-2-(1-(бензилокси)-3-(3-(бензилокси)-4-(((бис(бензилокси)фосфорил)окси)метокси)фенил)-2-метил-1-оксопропан-2-ил)гидразинкарбоксилат, соединение 3, (240 мг, 0,261 ммоль), 10 мл тетрагидрофурана и 5 мл воды добавляли к 20% Pd(OH)2/C, влажному (50 мг, 0,036 ммоль) в 50 мл сосуде для реакций под давлением. Смесь перемешивали в течение 1 час при 50 фунтов на кв. дюйм (345 кПа) и комнатной температуре. Реакционную смесь фильтровали. Фильтрат смешивали с водой, экстрагировали с использованием метил-т-бутилового эфира дважды. Водную фазу сушили посредством лиофилизатора. концентрат очищали посредством RP-HPLC (0-10% 0,1% муравьиной кислоты/в ацетонитриле в 0,1% муравьиной кислоты/в воде на колонке Kromacil Phenyl 3,0 см IDx25 см, 5u). Разделяли два изомера. Собранные фракции объединяли соответственно и высушивали посредством лиофилизатора с получением соединения 4 и соединения 5, каждого в форме рыхлого белого твердого вещества.
[373] Соединение 4(16,5 мг, 16,1%):1H ЯМР (501 МГц, DMSO-d6) δ 6,94 (д, J=8,1 Гц, 1H), 6,62 (д, J=2,1 Гц, 1H), 6,54 (дд, J=8,1, 2,1 Гц, 1H), 5,28 (д, J=14,6 Гц, 2H), 2,86 (д, J=13,6 Гц, 1H), 2,78 (д, J=13,6 Гц, 1H), 1,26 (с, 3H). MS (ESI+) 337,0
[374] Соединение 5 (30,9 мг, 30,2%):1H ЯМР (400 МГц, DMSO-d6) δ 7,00 (с, 1H), 6,68 (м, 2H), 5,32 (м, 2H), 2,91-2,77 (м, 2H), 1,26 (с, 3H). MS (ESI+) 337,0
Пример 11: Синтез метилового сложного эфира 4ʹ-монофосфата карбидопа
[375] Метиловый сложный эфир 4ʹ-монофосфата карбидопа получали, как показано на схеме 11 ниже:
Схема 11

Стадия 1
[376] В 100 мл круглодонную колбу загружали (S)-3-(3-(бензилокси)-4-((бис(бензилокси)фосфорил)окси)фенил)-2-(1,2-бис((бензилокси)карбонил)гидразинил)-2-метилпропионовую кислоту (3,03 г, 3,59 ммоль) (1), DCC (0,889 г, 4,31 ммоль), 25 мл метанола и якорь магнитной мешалки. К этой перемешиваемой смеси 4-(диметиламино)пиридин (88 мг, 0,720 ммоль) добавляли в одной порции, и реакционную смесь перемешивали в течение дополнительных 48 час. Через это время, растворитель удаляли в роторном испарителе, оставляя светло-желтый осадок. Осадок суспендировали в ацетонитриле (40 мл) и перемешивали при 5°C в течение 2 час. Затем суспензию фильтровали через слой силикагеля, элюировали с использованием 400 мл ацетонитрила. Удалением ацетонитрила в роторном испарителе получали 94% выход бледно-желтого масла, которое использовали непосредственно на следующей стадии. LC/MS [M+H]: 859,40.
Стадия 2
[377] В 150-мл реактор Парра загружали 5% Pd/C (0,794 мг, 3,36 ммоль). Катализатор суспендировали в воде (4,83 мл) и 5% масс. водн. бикарбонате натрия (5,61 мл, 3,36 ммоль). К этой взвеси добавляли раствор в тетрагидрофуране (29 мл) (S)-дибензил-1-(3-(3-(бензилокси)-4-((бис(бензилокси)фосфорил)окси)фенил)-1-метокси-2-метил-1-оксопропан-2-ил)гидразин-1,2-дикарбоксилата (2,89 г, 3,36 ммоль) (2). Реактор герметично закрывали и продували аргоном (4×40 фунтов на кв. дюйм (276 кПа)), затем H2 (4×50 фунтов на кв. дюйм (345 кПа)). Затем в реакторе снова создавали давление 50 фунтов на кв. дюйм (345 кПа) H2 и перемешивали при температуре окружающей среды в течение 60 мин. Через это время, двухфазную реакционную смесь фильтровали через диатомитовую землю целит®, с использованием воды (2,2 мл) для смывания и фильтрации остатков в реакторе. Двухфазную смесь разводили с использованием MTBE (8 мл), перемешивали в течение 5 мин и выливали в делительную воронку. Водный слой отделяли и промывали с использованием DCM (3×30 мл). Водный слой собирали и высушивали в лиофилизаторе с получением 68% выхода соединения 3 в форме грязно-белого твердого вещества.1H ЯМР (400 МГц, D2O): δ 1,46 (с, 3H), 2,92 (д, J=12 Гц, 1H), 3,05 (д, J=12 Гц, 1H), 3,79 (с, 3H), 6,65-6,72 (м, 2H), 7,11 (д, J=8,0 Гц, 1H).
Пример 12: Исследования стабильности пролекарства фосфата
1-суточные исследования стабильности
[378] Пролекарства фосфаты L-dopa и пролекарства фосфаты карбидопа оценивали в исследовании стабильности. Водные растворы пролекарств (80 мкг/мл) мониторировали в диапазоне значений pH при хранении в условиях окружающей среды - одни сутки, чтобы показать возможность реализации дозирования в ходе инфузии. В таблице 12-A ниже приведены результаты этого исследования, подтверждающие, что пролекарства обладают хорошей стабильностью при комнатной температуре в течение периода одни сутки.
Таблица 12-A: Исследование стабильности (пролекарства)
[379] Кроме того, раствор с комбинацией дифосфатов каждого соединения (3ʹ,4ʹ-дифосфата L-dopa при 35 мг/мл и 3ʹ,4ʹ-дифосфата карбидопа при 8,7 мг/мл) мониторировали в течение одних суток при комнатной температуре. Этот образец продували азотом для удаления кислорода. В таблице 12-B ниже приведены результаты этого исследования, подтверждающие хорошую стабильность комбинированного раствора при комнатной температуре с продувкой азотом в течение периода одни сутки.
Таблица 12-B: Исследование стабильности (комбинация дифосфатов)
7- суточное исследование стабильности
[380] Кроме того, раствор с комбинацией 4ʹ-монофосфата L-dopa при 200 мг/мл и 4ʹ-монофосфата карбидопа при 50 мг/мл мониторировали в течение 7 суток при комнатной температуре. Эти образцы получали с продувкой и без продувки азотом для удаления кислорода. В таблице 12-C ниже приведены результаты этого исследования, подтверждающие хорошую стабильность комбинированного раствора при комнатной температуре в течение 7 суток.
Таблица 12-C: Исследование стабильности (комбинация 4ʹ-монофосфатов)
Пример 13: Исследования растворимости пролекарств фосфатов
[381] Пролекарства фосфаты L-dopa и пролекарства фосфаты карбидопа оценивали в исследовании растворимости. Уровни растворимости пролекарств фосфатов в воде в условиях окружающей среды определяли посредством визуальной оценки. В таблице 13-A приведены результаты исследования, включая измеренные значения для L-dopa и карбидопа.
Таблица 13-A: Исследование растворимости
[382] На фигуре 1 показана увеличенная растворимость 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа по сравнению с L-dopa и карбидопа.
Пример 14: Исследования высвобождения гидразина
[383] Растворы с комбинацией 4ʹ-монофосфата L-dopa при 50 мг/мл и 4ʹ-монофосфата карбидопа при 12,5 мг/мл мониторировали по высвобождению гидразина в течение 7 суток. Эти растворы получали с pH 5 - pH 8, с продувкой азотом для удаления кислорода и хранили при комнатной температуре. Обнаружили, что присутствовало сильное уменьшение высвобождение гидразина при pH приблизительно 7,4, как показано на фигуре 2. Количество гидразина, высвобожденного из Duopa®, также определяли с целью сравнения. Как показано на фигуре 3, раствор с соотношением 4:1 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа при pH приблизительно 7,4 неожиданно обладал намного более низким высвобождением гидразина по сравнению с Duopa®.
Пример 15: Исследования биопревращения in vitro
[384] Биопревращение in vitro пролекарств фосфатов L-dopa в L-dopa и пролекарств фосфатов в карбидопа оценивали в нескольких исследованиях. Кратко, пролекарства фосфаты L-dopa и карбидопа (2,5 мкг/мл) инкубировали с гомогенатами или фракциями тканей от крыс, минисвиней или человека, включая кровь, гомогенат кожи (3 мг/мл), микросомы печени (1 мг/мл), фракцию S9 печени (1 мг/мл), фракцию S9 почки (1 мг/мл) и фракции S9 кишечника (1 мг/мл). Реакционные смеси инкубировали при 37°C в течение 5-6 временных точек в пределах 1-2 часов. В конце каждой временной точки, реакцию в реакционных смесях останавливали посредством 2-3 объемов 5% трихлоруксусной кислоты в воде. После остановки, смеси центрифугировали при 3000 об/мин в течение 20 минут, и супернатанты анализировали посредством LC-MS для количественного определения пролекарства, L-dopa или карбидопа. Биопревращение in vitro оценивали посредством мониторирования как зависимого от времени истощения пролекарства, так и формирования соответствующего L-dopa или карбидопа.
[385] В таблице 15-A ниже приведены результаты исследования для крови. В крови, все четыре пролекарства монофосфата быстро подвергались дефосфорилированию у крысы, минисвиньи и человека, с соответствующим зависимым от времени образованием L-dopa или карбидопа. Как правило, t1/2 является наиболее коротким у минисвиньи, затем у крысы и затем у человека. Пролекарства дифосфаты карбидопа и L-dopa также быстро подвергались дефосфорилированию в крови крысы с t1/2 53 минуты и 6 минут, соответственно, с соответствующим образованием L-dopa или карбидопа. Дефосфорилирование пролекарства дифосфата L-dopa проходило медленнее в крови человека и минисвиньи с t1/2 138 минут и 125 минут, соответственно. Соответствующее зависимое от времени образование L-dopa наблюдали при инкубациях крови минисвиньи и человека. Однако, пролекарство дифосфат карбидопа не подвергалось дефосфорилированию в крови минисвиньи и человека. Не наблюдали образования карбидопа при инкубациях крови.
Таблица 15-A: Исследование биопревращения in vitro (кровь)
[386] В таблице 15-B ниже приведены результаты исследования для гомогенатов кожи. В гомогенатах кожи, четыре пролекарства монофосфата медленно подвергались дефосфорилированию с t1/2 в диапазоне от 114 минут до 992 минут, с соответствующим образованием L-dopa или карбидопа. Два пролекарства дифосфата являлись стабильными в гомогенатах кожи крысы, минисвиньи и человека. Не наблюдали образования L-dopa или карбидопа при инкубациях.
Таблица 15-B: Исследование биопревращения in vitro (гомогенаты кожи)
[387] В микросомах печени человека, четыре пролекарства (пролекарства 3ʹ-фосфат и дифосфат L-dopa, и пролекарства 4ʹ- фосфат и дифосфат карбидопа) являлись стабильными без наблюдаемого образования L-dopa или карбидопа.
[388] В фракциях S9 печени крысы, минисвиньи и человека, четыре пролекарства (пролекарства 4ʹ-фосфат и дифосфат L-dopa, и пролекарства 4ʹ-фосфат и дифосфат карбидопа) являлись стабильными без наблюдаемого образования L-dopa или карбидопа.
[389] В фракциях S9 почки крысы и человека, четыре пролекарства (пролекарства 4ʹ-фосфат и дифосфат L-dopa, и пролекарства 4ʹ-фосфат и дифосфат карбидопа) являлись стабильными без наблюдаемого образования L-dopa или карбидопа.
[390] В таблице 14-C ниже приведены результаты исследования фракций S9 кишечника. В фракциях S9 кишечника крысы и человека, четыре пролекарства (пролекарства 4ʹ-фосфат и дифосфат L-dopa, и пролекарства 4ʹ-фосфат и дифосфат карбидопа) быстро подвергались дефосфорилированию. t1/2, по-видимому, являлось более коротким в S9 кишечника человека, чем в S9 кишечника крысы. Соответствующее зависимое от времени образование L-dopa или карбидопа наблюдали при инкубациях пролекарств с фракциями S9 кишечника крысы или человека. Результаты позволяют предполагать значительную активность фосфатазы в кишечнике крысы и человека.
Таблица 15-C: Исследование биопревращения in vitro (фракции S9 кишечника)
Пример 16: Фармакокинетические исследования у крыс
[391] Превращение in vivo пролекарства фосфата L-dopa в L-dopa и пролекарства фосфата карбидопа в карбидопа оценивали в фармакокинетическом исследовании на крысах, в котором пролекарство вводили крысам внутривенно или подкожно. Для сравнения, проводили фармакокинетическое исследование на крысах с использованием L-dopa и карбидопа, для помощи в оценке превращения пролекарств in vivo. Дизайн исследования и измеренные уровни L-dopa и карбидопа обобщены в таблицах 16-A и 16-B, соответственно. Кратко, в группах из трех самцов крыс Sprague-Dawley вводили (1) L-dopa и карбидопа в водном растворе, или (2) индивидуальное пролекарство в водном растворе внутривенно или подкожно. Образцы крови собирали для множества временных точек в течение 24 часов в пробирки для сбора, содержащие NaAsO4, ЭДТА и аскорбиновую кислоту. Плазму отделяли от крови и подвергали преципитации белка с использованием 2-3 объемов 5% трихлоруксусной кислоты в воде, с последующим центрифугированием. Супернатанты подвергали анализу LC-MS для количественного определения пролекарства, L-dopa или карбидопа.
Таблица 16-A: Уровни in vitro у крыс (L-Dopa)
Таблица 16-B: Уровни in vitro у крыс (карбидопа)
[392] Посредством сравнения уровней in vivo L-dopa или карбидопа, полученных после введения пролекарств, с уровнями, полученными после введения L-dopa или карбидопа отдельно, оценили, что превращение in vivo пролекарств в соответствующие L-dopa или карбидопа превышает 66%.
Пример 17: Исследование соотношения дифосфата L-Dopa/дифосфата карбидопа
[393] Эффект различных соотношений доз дифосфата карбидопа и дифосфата L-dopa на уровни L-dopa в состоянии равновесия оценивали в фармакокинетическом исследовании у крыс. В этом исследовании, крысам проводили 16-часовую подкожную инфузию комбинации дифосфата L-dopa (фиксированной дозы) и дифосфата карбидопа (различных доз) вместе в водном растворе. Кратко, в группах из трех самцов крыс Sprague-Dawley вводили комбинацию дифосфата L-dopa и дифосфата карбидопа в различных соотношениях доз. В таблице 17-A представлено обобщение дизайна исследования. Крысам сначала вводили подкожные болюсные дозы в течение одной минуты при объеме дозы 1 мл/кг. Через 1,5 часов, дозы вводили посредством непрерывной инфузии в течение следующих 14,5 часов при объеме дозы 10 мл/кг. Образцы крови собирали через 0,25, 0,5, 1, 6, 16 и 20 часов после болюсной дозы. Образцы крови обрабатывали таким же способом, как описано в примере 16. Отдельные аликвоты образцов крови собирали для измерения количества гидразина.
Таблица 17-A: Дизайн исследования для исследования соотношений пролекарств у крыс
[394] Уровни как L-dopa, так и карбидопа хорошо сохранялись на протяжении периода непрерывной инфузии между 1 час и 16 час в каждой группе дозирования. На фигуре 4 представлен профиль зависимости время-концентрация для уровней L-dopa в крови после введения комбинации пролекарств дифосфатов в различных соотношениях. На фигуре 5 представлен профиль зависимости время-концентрация для уровней карбидопа в крови после введения комбинации пролекарств дифосфатов в различных соотношениях.
[395] В таблице 17-B ниже приведены измеренные уровни в крови в состоянии равновесия L-dopa («LD») и карбидопа («CD»). На фигуре 6 те же данные представлены графически. Соотношение дифосфата L-dopa и фосфата карбидопа оказывало значительный эффект на уровень в состоянии равновесия L-dopa. Например, после введения дифосфата L-dopa отдельно, средняя концентрация L-dopa в плазме через 6 часов (C6час) составляла 0,164 мкг/мл. Когда комбинацию дифосфата L-dopa и дифосфата карбидопа вводили в соотношении доз 50:1, средняя концентрация L-dopa в плазме через 6 часов (C6час) увеличивалась до 0,55 мкг/мл. Когда комбинацию дифосфата L-dopa и дифосфата карбидопа вводили в соотношении доз 1:1, средняя концентрация L-dopa в плазме через 6 часов (C6час) дополнительно увеличивалась до 1,47 мкг/мл. Во всех группах, уровни гидразина были ниже предела количественного определения (0,5 нг/мл).
Таблица 17-B: Уровни в состоянии равновесия L-Dopa и карбидопа (различные соотношения пролекарств)
Пример 18: Фармакокинетические исследования 4ʹ-монофосфата L-Dopa/4ʹ-монофосфата карбидопа у крыс
[396] Эффект соотношения 4:1 4ʹ-монофосфата L-dopa и 4ʹ-фосфата карбидопа на уровни в состоянии равновесия L-dopa оценивали в фармакокинетическом исследовании у крыс.
16-часовая подкожная инфузия
[397] В этом исследовании, комбинацию 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа вместе в водном растворе в соотношении доз 4:1 сначала вводили крысам посредством подкожного болюса в дозе 60/14 мг/кг в течение 1 мин. Через 1,5 часа, комбинацию дозировали снова посредством непрерывной инфузии в дозе 300/71 мг/кг в течение следующих 14,5 часов. Образцы крови собирали через 1, 0,25, 1, 6, 16 и 24 часов после дозирования. Образцы крови обрабатывали таким же способом, как описано в примере 15. Отдельные аликвоты образцов крови собирали для измерения количества гидразина. На фигуре 7 представлен профиль зависимости время-концентрация уровней в крови L-dopa и 4ʹ-монофосфата L-dopa после введения комбинации пролекарств 4ʹ-монофосфатов в соотношении 4:1. Как показано на фигуре 7, непрерывная подкожная инфузия 4:1 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа обеспечивала высокие системные уровни L-dopa (например, ~10 мкг/мл), что соответствует и/или превышает уровни в плазме (например, ~3 мкг/мл), достигнутые с использованием Duopa®, как показано на фигуре 8. Концентрация в состоянии равновесия ~1 мкг/мл сохранялась на протяжении периода инфузии карбидопа. Уровни оставшихся 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа составляли ~22% и ~8% от уровней леводопа и карбидопа, соответственно. Дозы являлись хорошо переносимыми для крыс, и гидразина не детектировали в образцах плазмы крыс. На фигуре 9 представлен профиль зависимости время-концентрация для уровней карбидопа и 4ʹ-монофосфата карбидопа в крови после введения комбинации пролекарств 4ʹ-монофосфатов в соотношении 4:1.
24-часовая подкожная инфузия в течение 7 суток
[398] В этом исследовании, крысам проводили 24-часовую подкожную инфузию комбинации 4ʹ-монофосфата L-dopa (LD) и 4ʹ-монофосфата карбидопа (CD) вместе в водном растворе в соотношении доз 4:1 в течение 7 суток. В таблице 18-A ниже приведена измеренная концентрация леводопа в состоянии равновесия при различных количествах 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа в соотношении 4:1.
Таблица 18-A: Уровни концентрации L-Dopa в состоянии равновесия
Пример 19: Фармакокинетические исследования дифосфата L-Dopa и дифосфата карбидопа у минисвиней
[399] Превращение in vivo дифосфата карбидопа в карбидопа оценивали в фармакокинетическом исследовании у минисвиней, в котором пролекарство вводили в водном растворе подкожно в группе из трех минисвиней. Для сравнения, проводили также фармакокинетическое исследование с использованием карбидопа для помощи в оценке превращения пролекарств карбидопа. В таблице 19-A приведены измеренные уровни карбидопа. Оцененное превращение in vivo дифосфата карбидопа в карбидопа составляло приблизительно 100%, на основании уровней карбидопа.
Таблица 19-A: Уровни карбидопа in vivo у минисвиней
[400] Эффект различных соотношений доз дифосфата карбидопа и дифосфата L-dopa на уровни L-dopa в состоянии равновесия оценивали в фармакокинетическом исследовании у минисвиней. В этом исследовании, минисвиньям проводили 16-часовую подкожную инфузию комбинации дифосфата L-dopa и дифосфата карбидопа вместе в водном растворе при указанном соотношении доз. Период отмывки следовал после каждого соотношения доз. Дизайн исследования обобщен в таблице 19-B ниже и являлся сходным с дизайном описанного ранее исследования у крыс, за исключением того, что в нем не присутствовало начальных подкожных болюсных доз. Образцы крови собирали через 1, 2, 4, 6, 8, 10, 14, 16 и 24 часов после дозирования. Образцы крови обрабатывали таким же способом, как описано в примере 12. Отдельные аликвоты образцов крови собирали для измерения количества дофамина.
Таблица 19-B: Дизайн исследования для исследования соотношений пролекарств у минисвиней
[401] На фигуре 10 представлен профиль зависимости время-концентрация для уровней L-dopa в крови после введения комбинации пролекарств дифосфатов в различных соотношениях. Дофамина не детектировали в образцах плазмы крови минисвиней.
Пример 20: Фармакокинетические исследования 15:1 4ʹ-монофосфата L-Dopa/4ʹ-монофосфата карбидопа у минисвиней
[402] Эффект соотношения 15:1 4ʹ-монофосфата L-dopa и 4ʹ-фосфата карбидопа на уровни L-dopa в состоянии равновесия оценивали в фармакокинетическом исследовании у минисвиней.
[403] В этом исследовании, минисвиньям проводили 16-часовую подкожную инфузию комбинации 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа вместе в водном растворе при соотношении доз 15:1 без начальной болюсной дозы. Дозы составляли 48/3,2 мг/кг для 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа, соответственно. Образцы крови собирали через 1, 3, 6, 8, 10, 14, и 24 часов после дозирования. Образцы крови обрабатывали таким же способом, как описано в примере 12. Отдельные аликвоты образцов крови собирали для измерения количества гидразина. В Таблице 20-A представлено обобщение измеренных уровней 4ʹ-монофосфата L-dopa и L-dopa у минисвиней.
Таблица 20-A
Cмакс [нг/мл]; Tмакс [час]; AUC0-t [нг*час/мл];
[404] На фигуре 11 представлен профиль зависимости время-концентрация для уровней L-dopa и 4ʹ-монофосфата L-dopa в крови после введения комбинации пролекарств 4ʹ-монофосфатов в соотношении 15:1. Как показано на фигуре 11, непрерывная подкожная инфузия 15:1 4ʹ-монофосфата L-dopa и 4ʹ-фосфата карбидопа обеспечивала высокие системные уровни L-dopa (например, ~5,5 мкг/мл), что соответствует и/или превышает уровни в плазме (например, ~3 мкг/мл), достигнутые с использованием Duopa®, как показано на фигуре 8. Концентрация леводопа в плазме увеличивалась с течением времени и приближалась к состоянию равновесия через ~10 часов после дозирования. Достигали концентрации леводопа в плазме в состоянии равновесия ~5,5 мкг/мл. Уровень оставшегося 4ʹ-монофосфата L-dopa составлял ~10% от уровня леводопа. Концентрация карбидопа в плазме достигала состояния равновесия через ~3 часа после дозирования с концентрацией в состоянии равновесия ~0,2 мкг/мл. Уровень оставшегося 4ʹ-монофосфата карбидопа составлял ~22% от уровня карбидопа. Дозы являлись хорошо переносимыми для минисвиней, и гидразина не детектировали в образцах плазмы минисвиней. На фигуре 12 представлен профиль зависимости время-концентрация для уровней карбидопа и 4ʹ-монофосфата карбидопа в крови после введения комбинации пролекарств 4ʹ-монофосфатов в соотношении 15:1.
Пример 21: Фармакокинетические исследования 4ʹ-монофосфата L-Dopa и 4ʹ-монофосфата карбидопа у собак
[405] В этом исследовании, собакам проводили 24-часовую подкожную инфузию комбинации 4ʹ-монофосфата L-dopa (LD) и 4ʹ-монофосфата карбидопа (CD) вместе в водном растворе в соотношении доз 4:1. В таблице 21-A ниже приведена измеренная концентрация леводопа (L-dopa) в состоянии равновесия при различных количествах 4ʹ-монофосфата L-dopa и 4ʹ-монофосфата карбидопа в соотношении 4:1. Не присутствовало смертности, и все собаки выжили до окончания исследования. Лекарственные средства 4ʹ-монофосфат (LD) и 4ʹ-монофосфат карбидопа (CD) являлись хорошо переносимыми. Относящиеся к предмету исследования клинические признаки при 400/100 мг/кг состояли из рвоты у обеих собак, возникшей рано на протяжении интервала дозирования. Данные о клинической патологии для пролекарств 4ʹ-монофосфатов леводопа и карбидопа состояли в умеренно увеличенном количестве нейтрофилов и моноцитов при 400/100 мг/кг; умеренно уменьшенном количестве триглицеридов для животных после введения >200/50 мг/кг; умеренно увеличенном количестве билирубина у животных после введения >200/50 мг/кг; увеличенной специфической плотности мочи при всех дозах; минимально увеличенных соотношении фосфора к креатинину и фракционной экскреции фосфора при 400/100 мг/кг. Заключения: Введение 4ʹ-монофосфата L-dopa (LD) и 4ʹ-монофосфата карбидопа (CD) в дозах вплоть до 400/100 мг/кг не приводило к обнаружению неблагоприятных событий. Это приводило к концентрации леводопа 18,3 мкг/мл и к концентрации карбидопа 2,88 мкг/мл.
Таблица 21-A: Уровни концентрации L-Dopa в состоянии равновесия
Пример 22: Нагрузка фосфора
[406] Когда крысам вводили композицию пролекарств дифосфата L-dopa/дифосфата карбидопа (т.е., композицию дифосфатов), присутствовало увеличение количества фосфата в сыворотке при дозах ≥300/75 мг/кг/сутки. Этого повышения уровня фосфата в сыворотке не происходило у крыс после введения композиции 4ʹ-монофосфата L-dopa/4ʹ-монофосфата карбидопа (т.е., композиции монофосфатов) в дозах вплоть до 750/187,5 мг/кг/сутки.
Пример 23: Безопасность и переносимость
[407] Исследовали местное раздражение и боль в участке инъекции.
[408] МЕСТНАЯ ПЕРЕНОСИМОСТЬ:
[409] Боль при инъекции оценивали у кроликов с использованием внутривенной, околовенозной и подкожной болюсной инъекции дифосфата LD/CD в концентрациях 200/50 мг/мл. Немедленно после инъекции и через 24 часа наблюдения не присутствовало показателей боли в участке инъекции или местного раздражения тканей. Не присутствовало неблагоприятных клинических признаков или данных микроскопии, являющихся показателями местной непереносимости у крыс после введения SC болюсной дозы дифосфата LD при концентрации вплоть до 125 мг/мл или у минисвиней после подкожной инфузии дифосфата LD/CD в течение 24 часов при 200/50 мг/мл.
[410] В исследованиях SC инфузии в течение 7 суток у крыс не присутствовало показателей раздражения или непереносимости в участке инфузии для дифосфатов LD/CD или монофосфатов LD/CD при инфузии 41/10 и 75/18,75 мг/мл, соответственно, в течение 18 или 24 часов/сутки, соответственно. При проведении подкожной инфузии монофосфата LD/CD (200/50 мг/мл) собакам в течение 24 часов не присутствовало очевидных видимых показателей раздражения в участке инъекции. Суммарные данные поддерживают низкий риск боли при инъекции или местного раздражения тканей при инфузии в один и тот же участок в течение 24 часов.
[411] ТОКСИЧНОСТЬ ДЛЯ ГРЫЗУНОВ:
[412] Проводили исследование токсичности при IV инфузии в течение 7 суток с использованием пролекарств дифосфатов L-Dopa и карбидопа вместе в водном растворе. Крысам Sprague-Dawley (n=5/пол/группу) вводили дозы 80/20, 240/60 или 720/180 мг/кг в течение 18 часов в сутки в течение 7 последовательных суток. Несмотря на то, что для самцов крыс в группе 720/180 мг/кг показано увеличение уровня фосфора в сыворотке, не наблюдали отличных от потери массы тела и уменьшения потребления пищи неблагоприятных клинических признаков, данных клинической патологии или гистологической патологии. Доза пролекарств дифосфата L-Dopa и дифосфата карбидопа 720/180 мг/кг приводила к концентрации леводопа в плазме 15,2 мкг/мл.
[413] Проводили также исследование токсичности SC инфузии в течение 7 суток с использованием пролекарств дифосфатов L-Dopa и карбидопа вместе в водном растворе. Крысам Sprague-Dawley (n=5/пол/группу) вводили дозы 100/25, 300/75 или 750/187,5 мг/кг в течение 18 часов в сутки в течение 7 последовательных суток. Несмотря на то, что для самцов крыс в группе 300/75 и для самцов и самок крыс в группе 750/187,5 мг/кг показано увеличение уровня фосфора в сыворотке, не наблюдали отличных от потери массы тела и уменьшения потребления пищи неблагоприятных клинических признаков, данных клинической патологии или гистологической патологии. Доза 750/187,5 мг/кг приводила к концентрации леводопа в плазме концентрация 19,6 мкг/мл.
[414] Проводили также исследование токсичности SC инфузии в течение 7 суток с использованием смешанных монофосфатов L-Dopa и карбидопа вместе в водном растворе. Самцам крыс Sprague-Dawley (n=4 или 5/группу) вводили дозы 100/25, 300/75 или 750/187,5 мг/кг в течение 24 часов в сутки в течение 7 последовательных суток. Для крыс в группе 750/187,5 мг/кг показаны клинические признаки, включающие в себя агрессивное поведение и увеличенную активность. Эти обнаружения являлись выраженными достаточно для того, чтобы влиять на установку и проходимость SC катетера, и для того, чтобы удалить некоторых животных до завершения полного расписания дозирования. Средние массы тела по окончании исследования в группах 300/75 мг/кг являлись уменьшенными на -18% относительно начала дозирования на сутки 1. Не присутствовало значительных эффектов на уровень фосфата в сыворотке или моче и данных неблагоприятной клинической патологии или гистологической патологии. Концентрация леводопа в плазме составляла 9,4 мкг/мл в группе 300/75 мг/кг.
Пример 24: Прогнозирование уровней в состоянии равновесия L-dopa и 4ʹ-монофосфата L-dopa, карбидопа и 4ʹ-монофосфата карбидопа, так же как ежесуточной нагрузки фосфора для человека.
[415] Ключевые факторы для прогнозирования у человека включают в себя:
1) линейную фармакокинетику у человека;
2) коэффициенты биопревращения пролекарств у человека оценивают по средним коэффициентам биопревращения, наблюдаемым в доклинических исследованиях на животных (0,9 для 4ʹ-монофосфата L-dopa и 0,7 для 4ʹ-монофосфата карбидопа);
3) высокую биодоступность (F) пролекарств монофосфатов после подкожного (SC) дозирования (0,75 для 4ʹ-монофосфата L-dopa и 0,65 для 4ʹ-монофосфата карбидопа);
4) высвобождение фосфата из пролекарства является полным после SC дозирования. Проектные параметры PK для пролекарства монофосфата и активных лекарственных средств показаны в таблице 24-A.
Таблица 24-A. Проектные параметры PK у человека для пролекарств монофосфатов и активных лекарственных средств
CLp, выведение из плазмы; SC: подкожное; F: биодоступность
[416] С использованием значений точечной оценки, при стимуляции непрерывной SC инфузии 150/38 мг/час (4ʹ-монофосфат L-dopa/4ʹ-монофосфат карбидопа) получили концентрацию в состоянии равновесия (Csc) леводопа 3000 нг/мл, с нагрузкой фосфора 427 мг/сутки, как показано в таблице 24-B.
Таблица 24-B. Точечная оценка параметров PK 4ʹ-монофосфата L-dopa, леводопа, 4ʹ-монофосфата карбидопа и карбидопа.
[417] Можно достигать растворимости в воде 4ʹ-монофосфата L-dopa, настолько высокой, как > 300 мг/мл. Из одного 20-мл флакона раствора для дозирования в сутки можно доставлять > 6000 мг в сутки 4ʹ-монофосфата L-dopa, что может обеспечивать Css леводопа > 5 мкг/мл, принимая линейную фармакокинетику у человека.
Пример 25: Получение кристаллического тригидрата карбидопа-4ʹ-монофосфата
[418] 95 мг образца аморфного карбидопа-4ʹ-монофосфата взвешивали в 8 мл флакон и растворяли в 200 мкл воды. 500 мкл изопропилового спирта добавляли после растворения твердого вещества. Раствор становился мутным после добавления изопропанола. Мутную суспензию перемешивали с использованием якоря магнитной мешалки при комнатной температуре в течение 15 мин. Затем добавляли 200 мкл IPA. Взвесь перемешивали в течение часа и затем фильтровали. Влажный отфильтрованный осадок промывали с использованием 1 мл IPA. Твердое вещество высушивали на воздухе в течение ночи и затем анализировали посредством порошковой рентгенодифракции (PXRD) на следующие сутки. Паттерн PXRD для кристаллического тригидрата карбидопа-4ʹ-монофосфата показан на фигуре 17.
Пример 26a: Получение кристаллического дигидрата карбидопа-4ʹ-монофосфата
[419] 420 мг тригидрата карбидопа-4ʹ-монофосфата взвешивали в 20 мл флакон. 8,4 мл н-бутанола добавляли в флакон, и содержимое перемешивали в течение ночи при 30°C с использованием якоря магнитной мешалки. Образец влажного отфильтрованного осадка выделяли и анализировали посредством PXRD. Паттерн PXRD для кристаллического дигидрата карбидопа-4ʹ-монофосфата показан на фигуре 18.
Пример 26b: Получение кристаллического дигидрата карбидопа-4ʹ-монофосфата
[420] 103 мг аморфного карбидопа-4ʹ-монофосфата взвешивали в 4 мл флакон. Добавляли 200 мкл воды. После полного растворения твердых веществ, добавляли 500 мкл изопропилового спирта, и раствор перемешивали при комнатной температуре с использованием якоря магнитной мешалки. Через 30 мин твердые вещества наблюдали в флаконе. В этой точке добавляли 200 мкл IPA, и взвесь перемешивали в течение еще 30 мин. Затем твердые вещества выделяли и анализировали паттерн PXRD влажного отфильтрованного осадка. Паттерн PXRD влажного отфильтрованного осадка соответствовал паттерну PXRD, показанному на фигуре 18.
Пример 27: Получение кристаллического дегидрата карбидопа-4ʹ-монофосфата
[421] Приблизительно 10 мг тригидрата карбидопа-4ʹ-монофосфата загружали в тарированную алюминиевую чашу DVS Advantage (Surface Measurement Systems Ltd, Alperton, United Kingdom). Образец подвергали воздействию следующих условий влажности при 25°C: относительная влажность (RH) 30-0-90-0-30% с интервалами RH 10%. Для каждой стадии, критерий dm/dt (изменение массы в зависимости от времени) составлял 0,001% за 5 минут и минимальное время dm/dt - 30 минут, и максимальное dm/dt - 120 минут. Скорость потока азота в ходе анализа составляла 200 см3/мин. Образец после DVS сохраняли при 30% RH до анализа PXRD. Паттерн PXRD для кристаллического дегидрата карбидопа-4ʹ-монофосфата показан на фигуре 19.
Пример 28: Получение кристаллического L-Dopa-3ʹ-монофосфата
[422] Кристаллический L-dopa-3ʹ-монофосфат получали в соответствии с примером 1 (стадии 1, 2, 3, 4b, 5b), описанным выше. Паттерн PXRD для кристаллического L-dopa-3ʹ-монофосфата показан на фигуре 15.
Пример 29: Получение кристаллического ангидрата (i) L-Dopa-4ʹ-монофосфата
[423] Кристаллический ангидрат (i) L-dopa-4ʹ-монофосфата получали в соответствии с примером 5, описанным выше. Паттерн PXRD для кристаллического ангидрата (i) L-dopa-4ʹ-монофосфата показан на фигуре 13.
Пример 30: Получение кристаллического ангидрата (ii) L-Dopa-4ʹ-монофосфата
[424] 204 мг ангидрата (i) L-dopa-4ʹ-монофосфата взвешивали в 4-мл флакон. Добавляли 1 мл диметилсульфоксида и 1 мл воды. Полученную взвесь перемешивали при 24°C. Затем твердое вещество фильтровали, высушивали на воздухе и анализировали посредством PXRD. Паттерн PXRD для кристаллического ангидрата (ii) L-dopa-4ʹ-монофосфата показан на фигуре 14.
Пример 31: Получение кристаллического Карбидопа-3ʹ-монофосфата (i)
[425] 100 мг аморфного карбидопа-3ʹ-монофосфата взвешивали в 4 мл флакон. Добавляли 300 мкл воды. После растворения твердого вещества, добавляли 600 мкл изопропанола. Полученный прозрачный раствор перемешивали с использованием якоря магнитной мешалки при комнатной температуре в течение ночи, пока твердые вещества не выпадали из раствора. Добавляли 300 мкл изопропанола и суспензию перемешивали в течение 15 мин. Затем суспензию фильтровали, и полученное твердое вещество сушили в вакуумной печи при комнатной температуре. Высушенное твердое вещество анализировали посредством PXRD. Паттерн PXRD для кристаллического карбидопа-3ʹ-монофосфата (i) показан на фигуре 20.
Пример 32: Получение кристаллического карбидопа-3ʹ-монофосфата (ii)
[426] 25 мг карбидопа-3ʹ-монофосфата (i) взвешивали в 2 мл флакон. 100 мкл воды добавляли для растворения твердого вещества. Флакон помещали в устройство Crystal 16 (Avantium Technologies, Amsterdam, Netherlands) и подвергали следующему циклу нагревания/охлаждения при перемешивании с использованием якоря магнитной мешалки: линейное изменение при 10°C/час до 50°C, выдержка в течение 4 час, линейное изменение при 20°C/час до -15°C, выдержка в течение 4 час, линейное изменение при 10°C/час до 50°C, выдержка в течение 4 час, линейное изменение до -15°C при 10°C/час, выдержка в течение 4 час, линейное изменение до 50°C при 10°C/час, выдержка в течение 4 час, линейное изменение до -15°C при 5°C/час, выдержка в течение 4 час, линейное изменение до 25°C при 10°C/час и выдержка до анализа PXRD. Затем твердое вещество фильтровали, и влажный отфильтрованный осадок анализировали посредством PXRD. Паттерн PXRD для кристаллического карбидопа-3ʹ-монофосфата (ii) показан на фигуре 21.
Пример 33: Получение кристаллической натриевой соли карбидопа-3ʹ,4ʹ-дифосфата
[427] 46 мг аморфного 3ʹ,4ʹ-дифосфата карбидопа и 5,6 мг гранул гидроксида натрия растворяли в 500 мкл диметилсульфоксида и 200 мкл воды. Добавляли 400 мг IPA. Затем раствор нагревали до 35°C, и затем позволяли остыть до комнатной температуры. Раствор перемешивали с использованием якоря магнитной мешалки до преципитации игольчатых кристаллов. Затем твердое вещество отфильтровывали и анализировали посредством PXRD. Паттерн PXRD для кристаллической натриевой соли карбидопа-3ʹ,4ʹ-дифосфата показан на фигуре 22.
Пример 34: Получение кристаллического тригидрата L-Dopa-3ʹ,4ʹ-дифосфата
[428] 62,1 мг аморфного L-dopa 3ʹ,4ʹ-дифосфата взвешивали в 2 мл флакон. 200 мкл воды добавляли для растворения твердого вещества. Флакон помещали в устройство Crystal 16 (Avantium Technologies, Amsterdam, Netherlands) и подвергали следующему циклу нагревания/охлаждения при перемешивании с использованием якоря магнитной мешалки: линейное изменение при 10°C/час до 50°C, выдержка в течение 4 час, линейное изменение при 20°C/час до -15°C, выдержка в течение 4 час, линейное изменение при 10°C/час до 50°C, выдержка в течение 4 час, линейное изменение до -15°C при 10°C/час, выдержка в течение 4 час, линейное изменение до 50°C при 10°C/час, выдержка в течение 4 час, линейное изменение до -15°C при 5°C/час, выдержка в течение 4час, линейное изменение до 25°C при 10°C/час и выдержка до анализа PXRD. Затем твердое вещество фильтровали, и влажный отфильтрованный осадок анализировали посредством PXRD. Паттерн PXRD для кристаллического тригидрата L-dopa-3ʹ,4ʹ-дифосфата показан на фигуре 16.
[429] Альтернативно, этилацетат, изопропанол, воду-насыщенный этилацетат, метилэтилкетон, ацетон, тетрагидрофуран, толуол, 2-метил-THF, дихлорметан, трет-трибутиламин, изобутилацетат, 1,4-диоксан также можно использовать в качестве растворителей для кристаллизации тригидрата L-dopa-3ʹ,4ʹ-дифосфата. Можно использовать также следующие смеси растворителей в соотношении 1:1 по объему: ацетон/вода, изопропилацетат/гептан.
X. Дополнительные варианты осуществления
[430] Вариант осуществления 1. Фармацевтическая комбинация, содержащая первое соединение, соответствующее по структуре формуле (I):

или его фармацевтически приемлемую соль, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил;и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2; и
второе соединение, соответствующее по структуре формуле (II):

или его фармацевтически приемлемую соль, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[431] Вариант осуществления 2. Фармацевтическая комбинация из варианта осуществления 1, где первое соединение представляет собой

[432] Вариант осуществления 3. Фармацевтическая комбинация из варианта осуществления 1 или 2, где второе соединение представляет собой

[433] Вариант осуществления 4. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где первое соединение или его фармацевтически приемлемая соль и второе соединение или его фармацевтически приемлемая соль присутствуют в отдельных фармацевтических композициях, или оба присутствуют в одной и той же фармацевтической композиции.
[434] Вариант осуществления 5. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где массовое отношение первого соединения или его фармацевтически приемлемой соли к второму соединению или его фармацевтически приемлемой соли составляет от приблизительно 1:1 до приблизительно 1:50, предпочтительно, от приблизительно 1:2 до приблизительно 1:15, предпочтительно, от приблизительно 1:4 до приблизительно 1:10 и более предпочтительно, приблизительно 1:4.
[435] Вариант осуществления 6. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где первое соединение или его фармацевтически приемлемая соль обладает растворимостью по меньшей мере приблизительно 200 мг/мл в водном растворе при приблизительно нейтральном pH, и второе соединение или его фармацевтически приемлемая соль обладает растворимостью по меньшей мере приблизительно 400 мг/мл в водном растворе при приблизительно нейтральном pH.
[436] Вариант осуществления 7. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где комбинация представляет собой водную комбинацию, подходящую для внутрижелудочного, подкожного, внутримышечного введения, введения в тощую кишку, перорального, интраназального или внутривенного введения.
[437] Вариант осуществления 8. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где комбинация представляет собой водную комбинацию, подходящую для подкожного введения.
[438] Вариант осуществления 9. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-a):

или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-a):

или его фармацевтически приемлемую соль.
[439] Вариант осуществления 10. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-b):

или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-a):
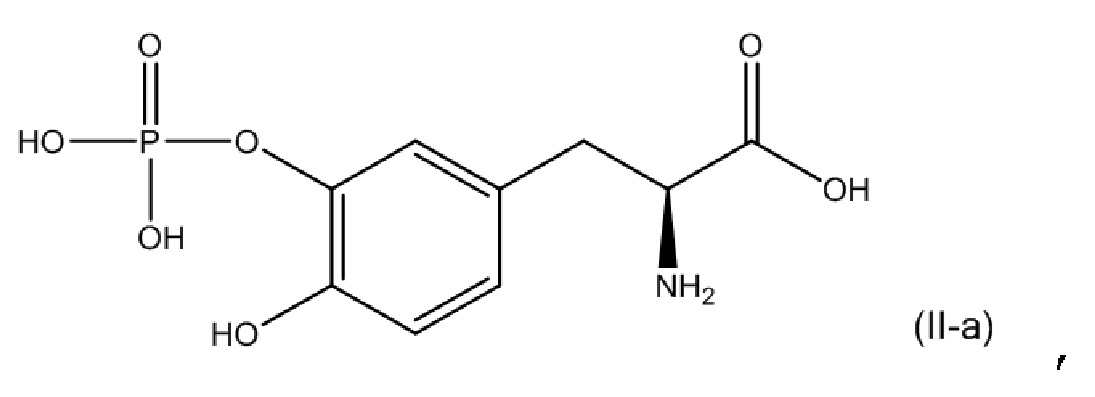
или его фармацевтически приемлемую соль.
[440] Вариант осуществления 11. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-c)

или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-a):

или его фармацевтически приемлемую соль.
[441] Вариант осуществления 12. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-a):

или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-b):

или его фармацевтически приемлемую соль.
[442] Вариант осуществления 13. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-b):
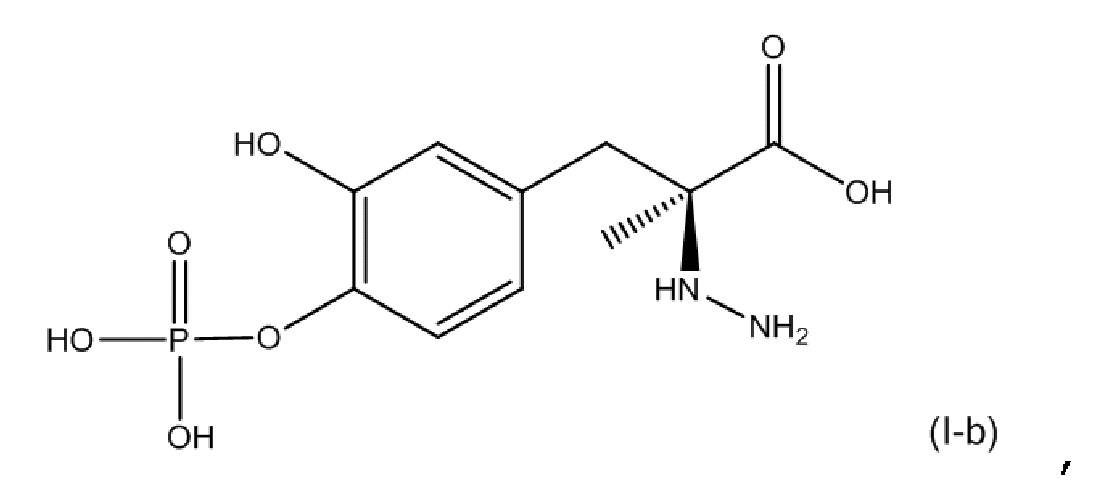
или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-b):

или a его фармацевтически приемлемую соль.
[443] Вариант осуществления 14. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-c):

или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-b):

или его фармацевтически приемлемую соль.
[444] Вариант осуществления 15. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-a):

или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-c):

или a его фармацевтически приемлемую соль.
[445] Вариант осуществления 15. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-b):
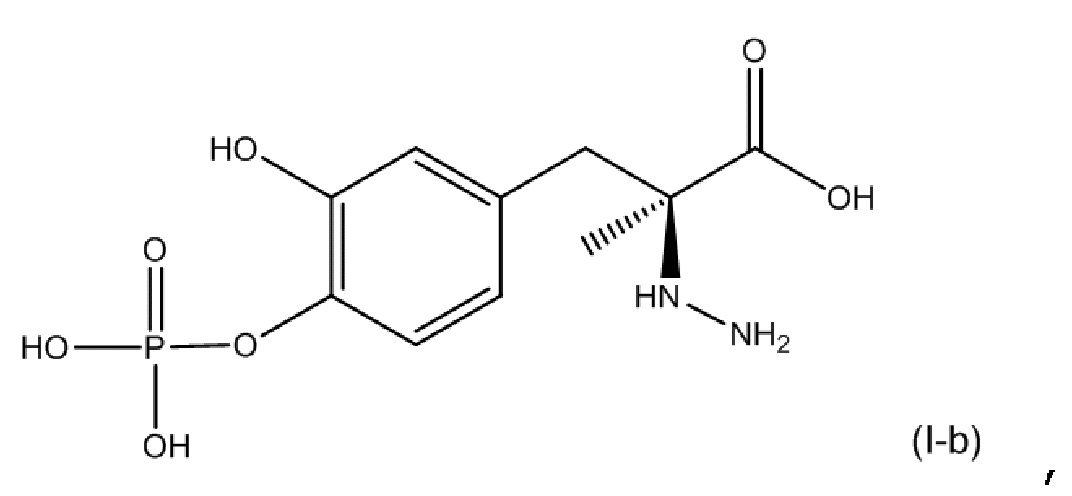
или его фармацевтически приемлемую соль; и второе соединение представляет собой a соединение, соответствующее по структуре формуле (II-c):

или его фармацевтически приемлемую соль.
[446] Вариант осуществления 17. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-c):

или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-c):

или его фармацевтически приемлемую соль.
[447] Вариант осуществления 18. Способ лечения болезни Паркинсона у нуждающегося в этом субъекта и/или способ обеспечения терапии спасения для субъекта, страдающего болезнью Паркинсона, где способ включает в себя введение субъекту терапевтически эффективного количества фармацевтической комбинации по любому из предшествующих вариантов осуществления.
[448] Вариант осуществления 19. Способ из варианта осуществления 18, где первое соединение и второе соединение вводят субъекту в отдельных фармацевтических композициях, или первое соединение и второе соединение вводят субъекту в одной и той же фармацевтической композиции, содержащей первое соединение и второе соединение.
[449] Вариант осуществления 20. Способ из варианта осуществления 18 или 19, где способ включает в себя внутрижелудочное, подкожное введение, введение в тощую кишку, пероральное, интраназальное, внутримышечное или внутривенное введение первого соединения и второго соединения.
[450] Вариант осуществления 21. Способ по любому из вариантов осуществления 18-20, где способ включает в себя подкожное введение первого соединения и второго соединения.
[451] Вариант осуществления 22. Способ по любому из вариантов осуществления 18-21, где способ включает в себя по существу непрерывное введение первого соединения и второго соединения в течение периода по меньшей мере приблизительно 12 часов.
[452] Вариант осуществления 23. Способ по любому из вариантов осуществления 18-22, где массовое отношение вводимого первого соединения и вводимого второго соединения составляет от приблизительно 1:1 до приблизительно 1:50.
[453] Вариант осуществления 24. Способ по любому из вариантов осуществления 18-23, где массовое отношение вводимого первого соединения и вводимого второго соединения составляет от приблизительно 1:2 до приблизительно 1:15.
[454] Вариант осуществления 25. Способ по любому из вариантов осуществления 18-24, где массовое отношение вводимого первого соединения и вводимого второго соединения составляет от приблизительно 1:4 до приблизительно 1:10.
[455] Вариант осуществления 26. Способ по любому из вариантов осуществления 18-25, где массовое отношение вводимого первого соединения и вводимого второго соединения составляет приблизительно 1:4.
[456] Вариант осуществления 27. Способ по любому из вариантов осуществления 18-26, где массовое отношение вводимого первого соединения и вводимого второго соединения составляет приблизительно 1:7,5.
[457] Вариант осуществления 28. Способ по любому из вариантов осуществления 18-27, где массовое отношение вводимого первого соединения и вводимого второго соединения составляет приблизительно 1:10.
[458] Вариант осуществления 29. Способ по любому из вариантов осуществления 18-28, где первое соединение выбрано из группы, состоящей из

и второе соединение выбрано из группы, состоящей из

[459] Вариант осуществления 30. Способ по любому из вариантов осуществления 18-29, дополнительно включающий в себя введение субъекту другого средства против болезни Паркинсона.
[460] Вариант осуществления 31. Способ по любому из вариантов осуществления 18-30, где фармацевтическая комбинация представляет собой водную комбинацию.
[461] Вариант осуществления 32. Способ из варианта осуществления 31, где водную фармацевтическую комбинацию вводят посредством внутрижелудочного, подкожного, внутримышечного, интраназального введения, введения в тощую кишку, перорального или внутривенного введения.
[462] Вариант осуществления 33. Способ из вариантов осуществления 31 или 32, где водную фармацевтическую комбинацию вводят посредством подкожного введения.
[463] Вариант осуществления 34. Соединение, соответствующее по структуре формуле (I):

или его фармацевтически приемлемая соль, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил;и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[464] Вариант осуществления 35. Соединение или фармацевтически приемлемая соль из варианта осуществления 34, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2, и -R5-O-P(O)(OH)2; R5представляет собой C1-C2-алкил; R6представляет собой водород; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[465] Вариант осуществления 36. Соединение или фармацевтически приемлемая соль из варианта осуществления 34 или 35, где каждый из R1 и R2 независимо представляет собой водород или -P(O)(OH)2; R6представляет собой водород; и один из R1 и R2 представляет собой -P(O)(OH)2.
[466] Вариант осуществления 37. Соединение или фармацевтически приемлемая соль из варианта осуществления 34 или 35, где каждый из R1 и R2 независимо представляет собой водород или -R5-O-P(O)(OH)2; R5представляет собой C1-C2-алкил; R6представляет собой водород; и при этом один из R1 и R2 представляет собой -R5-O-P(O)(OH)2.
[467] Вариант осуществления 38. Соединение или фармацевтически приемлемая соль из варианта осуществления 34, где каждый из R1 и R2 независимо представляет собой водород, -P(O)(OH)2или -R5-O-P(O)(OH)2; R5представляет собой C1-C2-алкил; R6представляет собой C1-C2-алкил; и при этом один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[468] Вариант осуществления 39. Соединение или соль по любому из вариантов осуществления 34-36, где соединение соответствует по структуре формуле (I-a):
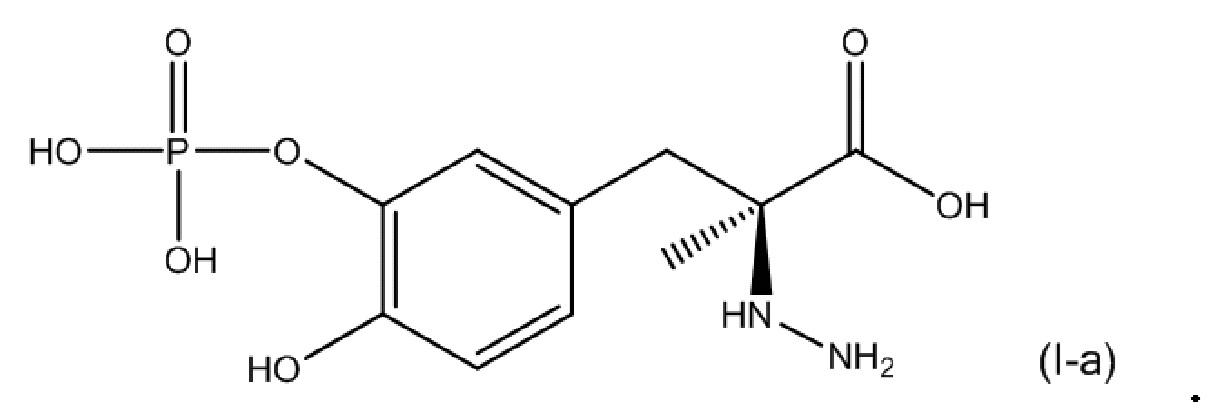
[469] Вариант осуществления 40. Соединение или соль по любому из вариантов осуществления 34-36, где соединение соответствует по структуре формуле (I-b):
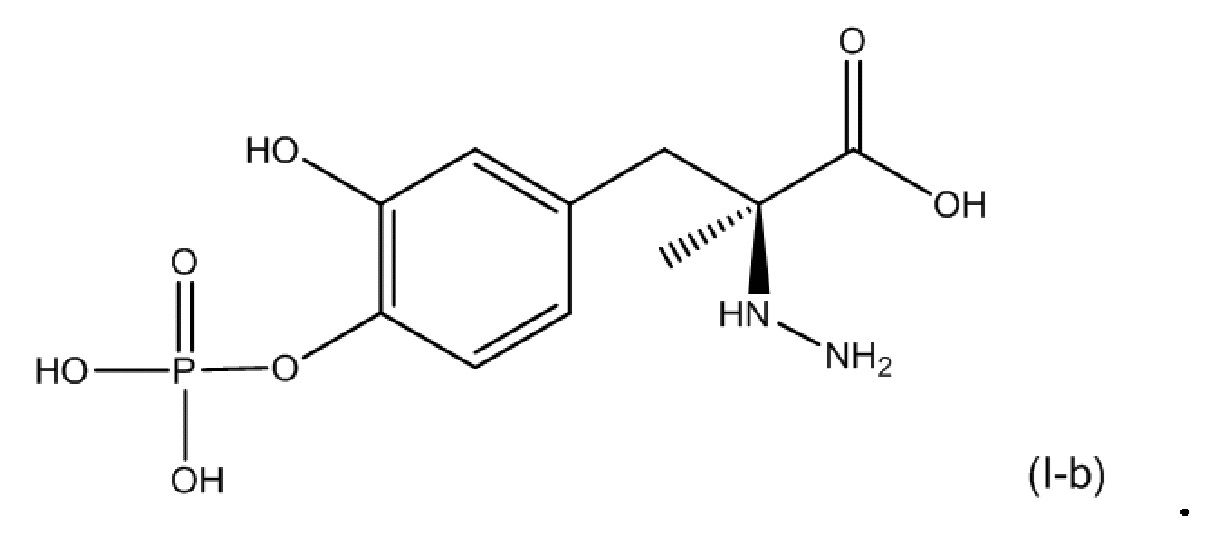
[470] Вариант осуществления 41. Соединение или соль по любому из вариантов осуществления 34-36, где соединение соответствует по структуре формуле (I-c):

[471] Вариант осуществления 42. Соединение или соль по любому из вариантов осуществления 34, 35 или 37, где соединение соответствует по структуре формуле (I-d):

[472] Вариант осуществления 43. Соединение или соль по любому из вариантов осуществления 34, 35 или 37, где соединение соответствует по структуре формуле (I-e):

[473] Вариант осуществления 44. Соединение или соль по любому из вариантов осуществления 34 или 38, где соединение соответствует по структуре формуле (I-f):

[474] Вариант осуществления 45. Соединение, соответствующее по структуре формуле (II):

или его фармацевтически приемлемая соль, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[475] Вариант осуществления 46. Соединение или соль из варианта осуществления 45, где каждый из R3 и R4 независимо представляет собой водород или -R5-O-P(O)(OH)2; R5представляет собой C1-C2-алкил; R6представляет собой водород; и при этом один из R3 и R4 представляет собой-R5-O-P(O)(OH)2.
[476] Вариант осуществления 47. Соединение или соль из варианта осуществления 45 или 46, где соединение соответствует по структуре формуле (II-d):

[477] Вариант осуществления 48. Соединение или соль из варианта осуществления 45 или 46, где соединение соответствует по структуре формуле (II-e):

[478] Вариант осуществления 49. Фармацевтическая композиция, содержащая первое соединение, соответствующее по структуре формуле (I):

или его фармацевтически приемлемую соль, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2, и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил;и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2; и фармацевтически приемлемый носитель.
[479] Вариант осуществления 50. Фармацевтическая композиция из варианта осуществления 49, где первое соединение соответствует по структуре формуле (I-a):

[480] Вариант осуществления 51. Фармацевтическая композиция из варианта осуществления 49, где первое соединение соответствует по структуре формуле (I-b):
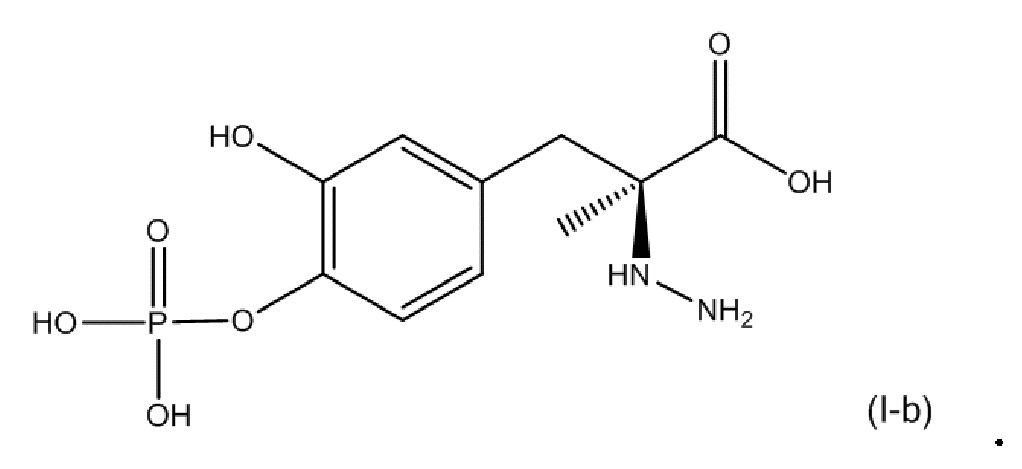
[481] Вариант осуществления 52. Фармацевтическая композиция из варианта осуществления 49, где первое соединение соответствует по структуре формуле (I-c):

[482] Вариант осуществления 53. Фармацевтическая композиция по любому из вариантов осуществления 49-52, где композиция дополнительно содержит второе соединение, соответствующее по структуре формуле (II):

или его фармацевтически приемлемую соль, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
[483] Вариант осуществления 54. Фармацевтическая композиция из варианта осуществления 53, где второе соединение соответствует по структуре формуле (II-a):

[484] Вариант осуществления 55. Фармацевтическая композиция из варианта осуществления 53, где второе соединение соответствует по структуре формуле (II-b):

[485] Вариант осуществления 56. Фармацевтическая композиция из варианта осуществления 53, где второе соединение соответствует по структуре формуле (II-c):
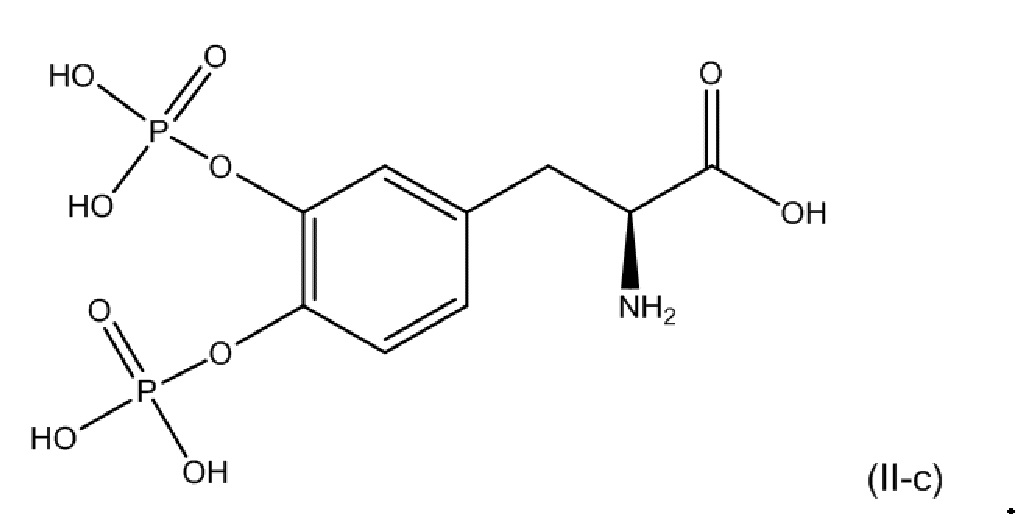
[486] Вариант осуществления 57. Фармацевтическая композиция по любому из вариантов осуществления 37-44, где массовое отношение первого соединения и второго соединения составляет от приблизительно 1:1 до приблизительно 1:50, предпочтительно, от приблизительно 1:2 до приблизительно 1:15, даже более предпочтительно, от приблизительно 1:4 до приблизительно 1:10.
[487] Вариант осуществления 58. Фармацевтическая композиция по любому из вариантов осуществления 49-57, где массовое отношение первого соединения и второго соединения составляет приблизительно 1:4.
[488] Вариант осуществления 59. Фармацевтическая композиция по любому из вариантов осуществления 49-57, где массовое отношение первого соединения и второго соединения составляет приблизительно 1:7,5.
[489] Вариант осуществления 60. Фармацевтическая композиция по любому из вариантов осуществления 49-57, где массовое отношение первого соединения и второго соединения составляет приблизительно 1:10.
[490] Вариант осуществления 61. Фармацевтическая композиция по любому из вариантов осуществления 49-60, где композиция дополнительно содержит воду и является подходящей для инфузии.
[491] Вариант осуществления 62. Набор, содержащий фармацевтическую комбинацию по любому из вариантов осуществления 1-17.
[492] Вариант осуществления 63. Набор, содержащий фармацевтическую композицию по любому из вариантов осуществления 49-62.
[493] Вариант осуществления 64. Соединение, выбранное из группы, состоящей из



[494] Вариант осуществления 65. Кристаллический полиморф 4ʹ-монофосфата L-dopa, идентифицированный посредством порошковой рентгенодифракции где кристаллический полиморф представляет собой:
кристаллический ангидрат 4ʹ-монофосфата L-dopa (i), для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 10,261±0,20, 12,053±0,20, 13,759±0,20, 14,932±0,20, 16,147±0,20, 16,718±0,20, 17,34±0,20, 19,254±0,20, 20,654±0,20, 22,078±0,20, 23,599±0,20, 24,198±0,20, 25,898±0,20, 26,338±0,20 и 27,117±0,20; или
кристаллический ангидрат 4ʹ-монофосфата L-dopa (ii), для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 8,468±0,20, 10,234±0,20, 11,821±0,20, 13,084±0,20, 13,503±0,20, 15,48±0,20, 15,848±0,20, 16,513±0,20, 18,447±0,20, 19,346±0,20, 20,239±0,20, 21,139±0,20, 24,221±0,20, 24,865±0,20, 25,647±0,20.
[495] Вариант осуществления 66. Кристаллический 3ʹ-монофосфат L-dopa, для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 8,662±0,20, 11,286±0,20, 15,079±0,20, 15,678±0,20, 16,786±0,20, 17,288±0,20, 18,438±0,20, 19,682±0,20, 20,946±0,20, 22,188±0,20, 22,671±0,20, 23,088±0,20, 24,144±0,20, 24,744±0,20 и 25,383±0,20.
[496] Вариант осуществления 67. Кристаллический тригидрат 3ʹ4-дифосфата L-dopa, для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 7,118±0,20, 10,342±0,20, 11,355±0,20, 12,161±0,20, 14,201±0,20, 17,36±0,20, 17,632±0,20, 19,196±0,20, 19,444±0,20, 20,83±0,20, 21,504±0,20, 22,491±0,20, 23,085±0,20, 24,487±0,20 и 25,11±0,20.
[497] Вариант осуществления 68. Кристаллический полиморф 4ʹ-монофосфатаа карбидопа, идентифицированный посредством порошковой рентгенодифракции, где кристаллический полиморф представляет собой:
кристаллический тригидрат 4ʹ-монофосфата карбидопа, для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 7,484±0,20, 10,05±0,20, 11,971±0,20, 13,085±0,20, 14,923±0,20, 16,095±0,20, 16,85±0,20, 17,359±0,20, 17,635±0,20, 19,269±0,20, 19,544±0,20, 21,842±0,20, 22,578±0,20, 22,921±0,20 и 23,822±0,20;
кристаллический дигидрат 4ʹ-монофосфата карбидопа, для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 7,925±0,20, 10,28±0,20, 12,344±0,20, 15,002±0,20, 15,841±0,20, 16,158±0,20, 17,565±0,20, 18,506±0,20, 19,058±0,20, 19,473±0,20, 19,702±0,20, 20,188±0,20, 20,668±0,20, 22,37±0,20 и 24,167±0,20; или
кристаллический дегидрат 4ʹ-монофосфата карбидопа, для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 9,492±0,20, 10,528±0,20, 15,356±0,20, 15,907±0,20, 16,165±0,20, 17,933±0,20, 18,737±0,20, 19,429±0,20, 21,176±0,20 и 22,626±0,20.
[498] Вариант осуществления 69. Кристаллический полиморф 3ʹ-монофосфата карбидопа, идентифицированный посредством порошковой рентгенодифракции, где кристаллический полиморф представляет собой:
кристаллический 3ʹ-монофосфат карбидопа (i), для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 9,171±0,20, 13,539±0,20, 14,23±0,20, 15,589±0,20, 15,979±0,20, 18,394±0,20, 18,832±0,20, 19,315±0,20, 22,143±0,20 и 22,81±0,20; или
кристаллический 3ʹ-монофосфат карбидопа (ii), для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 4,433±0,20, 8,917±0,20, 9,654±0,20, 13,192±0,20, 15,288±0,20, 15,747±0,20, 17,886±0,20, 19,291±0,20, 20,554±0,20 и 21,797.
[499] Вариант осуществления 70. Кристаллическая натриевая соль 3ʹ4-дифосфата карбидопа, для которой показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 5,852±0,20, 6,861±0,20, 7,338±0,20, 11,159±0,20, 11,729±0,20, 12,953±0,20, 13,714±0,20, 14,381±0,20, 14,686±0,20, 15,479±0,20, 16,676±0,20, 17,179±0,20, 17,592±0,20, 18,861±0,20 и 20,305±0,20.
[500] Понятно, что предшествующее подробное описание и сопутствующие примеры являются просто иллюстративными, и их не следует принимать как ограничения объема изобретения, который определяется единственно пунктами прилагаемой формулы изобретения и их эквивалентами.
[501] Различные изменения и модификации описанных вариантов осуществления очевидны специалистам в данной области. Такие изменения и модификации, включая, без ограничения, изменения и модификации, относящиеся к химическим структурам, заместителям, производным, промежуточным соединениям, синтезу, композициям, составам или способам применения по изобретению, можно получать без отклонения от его содержания и объема.
Реферат
Изобретение относится к фармацевтической композиции для лечения болезни Паркинсона, содержащей терапевтически эффективное количество первого соединения, соответствующего по структуре формуле (I), или его фармацевтически приемлемой соли, и терапевтически эффективное количество второго соединения, соответствующего по структуре формуле (II), или его фармацевтически приемлемой соли. В формуле (I) каждый из R1и R2независимо выбран из группы, состоящей из водорода, -P(O)(OH)2и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R1и R2представляет собой -P(O)(OH)2или -R5-O-P(O)(OH)2. В формуле (II) каждый из R3и R4независимо выбран из группы, состоящей из водорода, -P(O)(OH)2и -R5-O-P(O)(OH)2; R5представляет собой C1-C4-алкил; R6представляет собой водородили C1-C4-алкил; и при этом по меньшей мере один из R3и R4представляет собой -P(O)(OH)2или -R5-O-P(O)(OH)2. Изобретение относится также к фармацевтической композиции, содержащей конкретные соединения формул (I) и (II), способу лечения болезни Паркинсона и соединению, соответствующему по структуре формуле (I). 4 н. и 10 з.п. ф-лы, 22 ил., 18 табл., 34 пр.
Формула

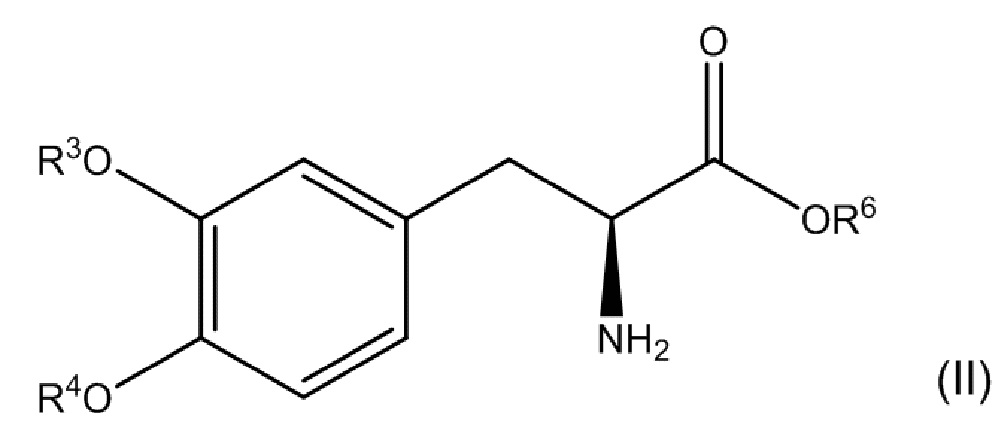





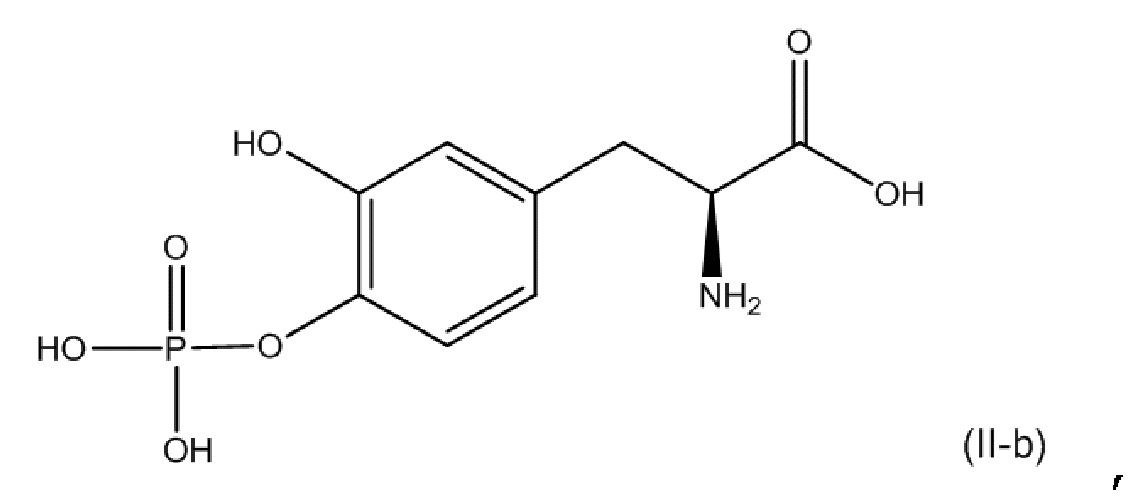




Документы, цитированные в отчёте о поиске
Фармацевтические композиции энтакапона, леводопы и карбидопы с улучшенной биодоступностью
Продолжительное 24-часовое введение в кишечник леводопа/карбидопа
Мезилатное пролекарство леводопы, его композиции и применение
Пролекарства леводопа, композиции на их основе и их применения

Комментарии