Способ получения препарата для реализации воспроизводительных качеств коров и продуктивного потенциала телят - RU2622765C2
Код документа: RU2622765C2
Описание
Изобретение относится к области биотехнологии и ветеринарной медицины, а именно к способам получения препаратов для активизации неспецифической резистентности организма крупного рогатого скота.
Известен способ получения биологически активного препарата из дрожжей (SU 1808331 A1, A61K 35/72, 15.04.93) в виде очищенного полисахаридного комплекса, обладающего иммуностимулирующей активностью. Иммобилизация полисахаридов дрожжевых клеток в агаровом геле (ТУ 10.07.236-91 на производство препарата «Достим») или в 10-14% водно-солевом растворе поливинилпирролидона (RU 2137480 C1, A61K 31/79, 35/72, 20.09.99) повышает иммуностимулирующую активность препаратов.
Наиболее близким аналогом (прототипом) по решаемой задаче является способ получения препарата для повышения неспецифической резистентности и иммуногенеза организма животных (ПС-2), включающий смешивание 0,2-0,3% суспензии агара и концентрата очищенного полисахаридного комплекса дрожжевых клеток. К полученной смеси при постоянном перемешивании добавляют (-)2,3,5,6-тетрагидро-6-фенилимидазо-[2,1-b]-тиазола гидрохлорид и формалин, объем доводят дистиллированной водой до 100 мас. ч. Препарат обладает иммуностимулирующей активностью (RU 2332214 C1, A61K 31/429, 31/115, A61K 36/06, A61K 36/02, A61P 37/04, 27.08.2008).
К недостаткам препарата можно отнести отсутствие антибактериальной активности к возбудителям болезней животных.
Изобретение направлено на получение препарата для активизации неспецифической резистентности организма крупного рогатого скота, расширяющего ассортимент средств как для повышения активности клеточных и гуморальных звеньев неспецифической резистентности и специфического иммуногенеза организма, так и для повышения антибактериальной активности против возбудителей болезней сельскохозяйственных животных.
Технический результат заключается в смешивании 90 мас. ч. 0,2-0,3% суспензии агара и 2,5 мас. ч. концентрата очищенного полисахаридного комплекса дрожжевых клеток. К полученной смеси при постоянном перемешивании добавляют 3,5 мас. ч. производного бензимидазола (-)2,3,5,6-тетра-гидро-6-фенилимидазо-[2,1-b]-тиазола гидрохлорид, 5,0 млн. ЕД антибиотика амикацина -(S)-0-3-амино-3-дезокси-альфа-D-глюкопиранозил-(1-6)-0-[6-амино-6-дезокси-альфа-D-глюкопиранозил-(1-4)-N1-(4-амино-2-гидрокси-1-оксобутил)-2-дезокси-D-стрептамин (в виде сульфата) и 0,2 мас. ч. формалина, объем доводят дистиллированной водой до 100 мас. ч. Полученный препарат разливают во флаконы по 50-100 мл, после стерилизации используют для активизации неспецифической резистентности организма крупного рогатого скота.
Отличие заявляемого решения от известного аналога заключается в том, что при введении антибиотика амикацина совместно с полисахаридным комплексом и (-)2,3,5,6-тетрагидро-6-фенилимидазо-[2,1-b]-тиазола гидрохлоридом усиливается их действие как на факторы неспецифической резистентности и иммуногенеза, так и активируется фагоцитоз и усиливается бактерицидная активность против возбудителей болезней крупного рогатого скота.
Для осуществления способа использовали следующие вещества:
1) агар микробиологический ГОСТ 17206;
2) концентрат очищенного полисахаридного комплекса дрожжей SU 1808331;
3) (-)2,3,5,6-тетрагидро-6-фенилимидазо-[2.1-b]-тиазола гидрохлорид ТУ 9333-024;
4) амикацин: порошок д/пригот. р-ра д/в/в и в/м введения ЛСР-006572/09;
5) формалин ГОСТ 1625;
6) вода дистиллированная ГОСТ 6709.
Способ осуществляется следующим образом.
Пример 1. 90 мас. ч. 0,2% суспензии агара смешивали 2,5 мас. ч. концентрата очищенного полисахаридного комплекса дрожжей. К полученной смеси при постоянном перемешивании добавляли 3,5 мас. ч. (-)2,3,5,6-тетрагидро-6-фенилимидазо-[2,1-b]-тиазола гидрохлорид, 5,0 млн. ЕД антибиотика амикацина и 0,2 мас. ч. формалина, объем доводили дистиллированной водой до 100 мас. ч. Полученный препарат после стерилизации использовали для активизации неспецифической резистентности организма крупного рогатого скота.
Пример 2. 90 мас. ч. 0,3% суспензии агара смешивали 2,5 мас. ч. концентрата очищенного полисахаридного комплекса дрожжей. К полученной смеси при постоянном перемешивании добавляли 3,5 мас. ч. (-)2,3,5,6-тетрагидро-6-фенилимидазо-[2,1-b]-тиазола гидрохлорид, 5,0 млн. ЕД антибиотика амикацина и 0,2 мас. ч. формалина, объем доводили дистиллированной водой до 100 мас. ч. Полученный препарат после стерилизации использовали для активизации неспецифической резистентности организма крупного рогатого скота.
Пример 3. Объектами исследований были стельные (последние 45 суток до отела) и новотельные (первые 3-5 суток после отела) коровы черно-пестрой породы. В научно-хозяйственном опыте были подобраны три группы сухостойных коров (контрольная, 1-я, 2-я и 3-я опытные) по принципу пар-аналогов с учетом клинико-физиологического состояния, возраста и живой массы по 10 животных в каждой группе.
Коровам 1-й опытной группы внутримышечно инъецировали ПС-2 (прототип) в дозе 10 мл за 45-40, 25-20 и 15-10 суток до отела, 2-й опытной группы - препарат по изобретению (пример 1), 3-й опытной группы - препарат по изобретению (пример 2) в указанной дозе и сроки (опытные варианты), четвертая группа была контрольной.
Показатели неспецифической резистентности коров определяли за 35-30, 15-10 и 10-5 суток до отела, а также на 3-5 сутки после отела. Результаты исследований приведены в табл. 1.
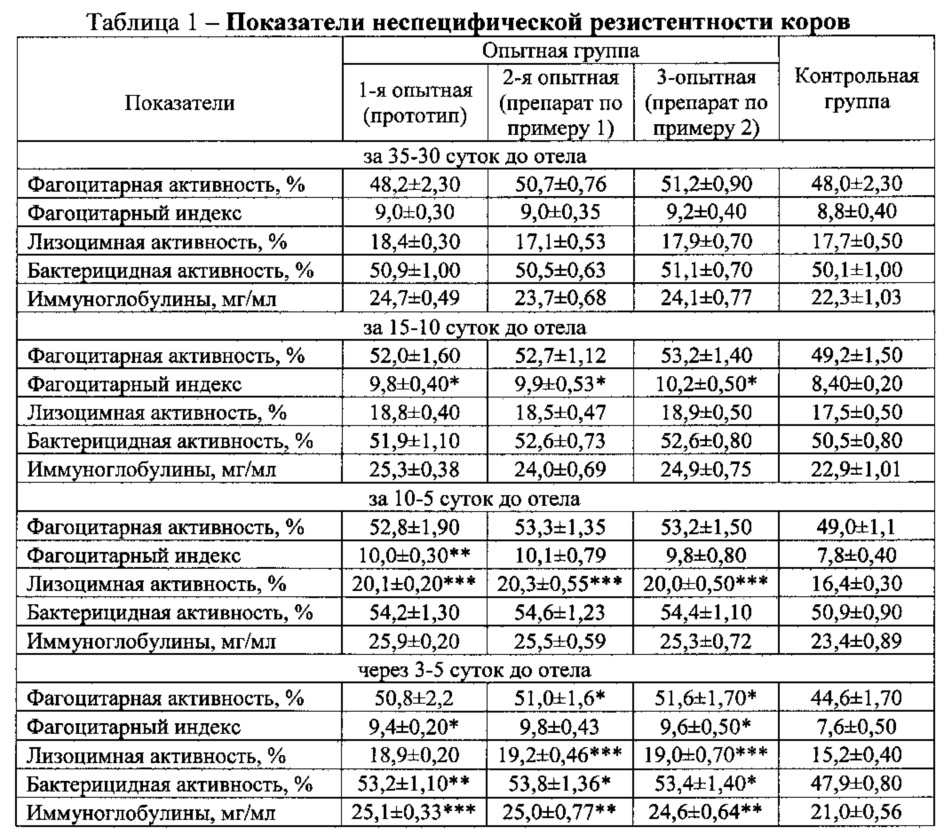
Установлено, что предлагаемый препарат по примерам 1 и 2 улучшает показатели неспецифической резистентности организма за 15-10 суток до отела: фагоцитарную активность - на 3,5 и 4,0%, фагоцитарный индекс - на 17,8 и 21,4%, лизоцимную активность - на 1,0 и 1,4%, бактерицидную активность - на 2,1 и 2,1%, уровень иммуноглобулинов - на 4,8 и 8,7%; за 10-5 суток до отела - на 4,3 и 4,2%, 29,4 и 25,6%, 3,9 и 3,6%, 3,7 и 3,5%, 8,9 и 8,1%; через 3-5 суток после отела - на 6,4 и 7,0%, 28,9 и 26,3%, 4,0 и 3,8%, 5,9 и 5,5%, 19,0 и 17,1% (P<0,05-0,001).
Пример 4. Подобраны четыре группы глубокостельных коров по принципу пар-аналогов с учетом физиологического состояния, возраста, живой массы по 10 животных в каждой группе. Коровам 1-й опытной группы за 45-40, 25-20 и 15-10 суток до отела внутримышечно инъецировали препарат ПС-2 (прототип) в дозе 10 мл. Коровам 2-й опытной группы в те же сроки до отела внутримышечно вводили комплексный препарат по примеру 1 в дозе 10 мл. Коровам 3-й опытной группы в те же сроки до отела внутримышечно вводили препарат по примеру 2 в дозе 10 мл. Коровам контрольной группы препараты не использовали.
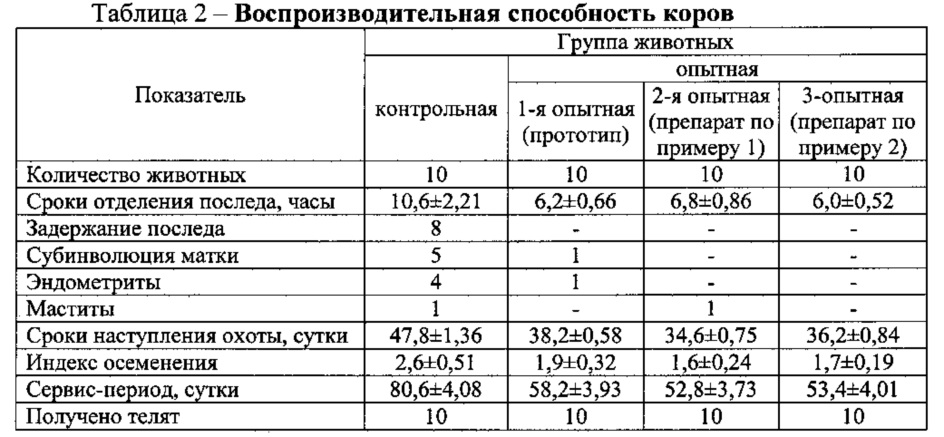
Под влиянием препаратов у коров уменьшались гинекологические болезни (субинволюция матки, эндометриты и маститы) на 80-90%, повысилась воспроизводительная функция: сократились сроки прихода в первую охоту на 9,6-13,2 сут, сократился индекс осеменения на 0,7-1,0 и продолжительность сервис-периода на 22,4-27,8 сут. При этом отмечено, что используемые комплексные препараты оказывают более эффективное действие на воспроизводительные способности животных, чем прототип.
У телят, родившихся от вышеуказанных коров, снизились болезни желудочно-кишечного тракта и респираторных органов на 30-40%, сократилась продолжительность болезней на 3,0-6,0 сут (P<0,05-0,001). При этом применение предлагаемых способов повышает сохранность телят на 20%.
Пример 5. Испытание препарата для изучения профилактической и терапевтической эффективности и реализации биологического потенциала организма проводили на телятах, подобранных по принципу пар-аналогов, в возрасте 1-3 суток. Были сформированы четыре группы животных по 5 голов в каждой. Первой группе телят вводили препарат ПС-2 (прототип) в дозе 0,1 мл/кг массы, второй группе - препарат по изобретению (пример 1) в дозе 0,1 мл/кг массы, третьей группе - препарат по изобретению (пример 2) в дозе 0,1 мл/кг массы (опытные варианты). Четвертая группа была контрольной. Изучали заболеваемость и сохранность телят в течение 180 суток. Результаты этих исследований приведены в табл. 3.
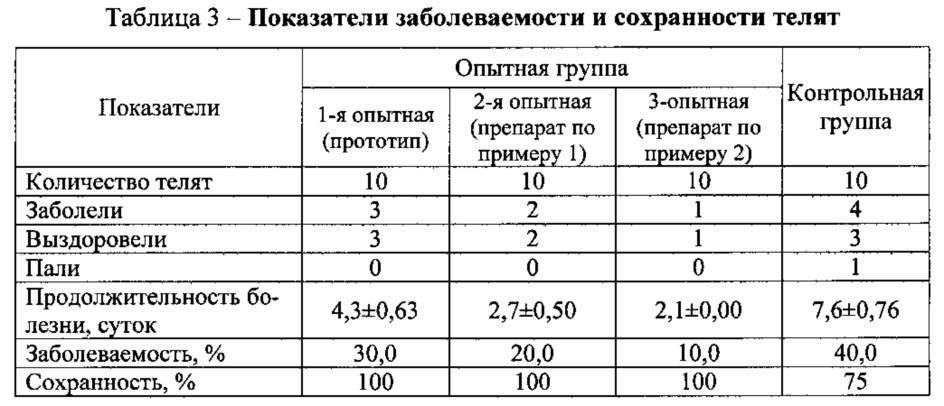
Установлено, что в контрольной группе заболело 4 теленка или 40,0%, из них 1 теленок пал и 3 выздоровели. Вначале у телят регистрировались признаки острого воспаления кишечного тракта (диарея), проявляющиеся поносом, переходящие в токсическую диспепсию с признаками обезвоживания. Продолжительность болезни составила 7,6±0,76 суток. Осложнения в течение болезни у телят происходят в результате снижения защитных свойств организма, при котором усиливается активность условно патогенной микрофлоры и болезнь переходит в токсическую форму с признаками обезвоживания и эшерихиоза.
Заболеваемость телят в 1-й, 2-й и 3-й опытных группах составила 30, 20 и 10% соответственно, что в 1,3, 2,0, и 4,0 раза меньше, чем в контроле. Болезнь у них протекала признаками угнетения, незначительными расстройствами пищеварения. При лечении предложенными способами телята выздоравливали в течение 2-5 суток. Сохранность телят в опытных группах составила 100%. Дополнительное включение антибиотика амикацина в состав препарата обезвреживает возможных возбудителей болезней телят, что проявляется повышением профилактической и лечебной эффективности предлагаемого способа.
Показатели прироста живой массы телят представлены в табл. 4.
Из этой таблицы видно, что живая масса телят контрольной, 1-й (прототип), 2-й (препарат по примеру 1) и 3-й (препарат по примеру 2) опытных групп в 1-е сутки после рождения не имела существенной разницы и в среднем составила 31,0±1,10 кг, 30,8±0,66 кг, 31,4±0,87 кг и 31,6±0,93 кг соответственно (P>0,05). В последующие сроки исследований живая масса оказалась выше у животных опытных групп, выращенных на фоне внутримышечной инъекции препаратов по примерам 1 и 2. Если к завершению периода выращивания (180 суток) животные 2-й и 3-й опытных групп превосходили по указанному показателю роста сверстников 1-й опытной группы (прототип) соответственно на 4,6 и 7,0 кг, то к концу периода доращивания (360 суток) - на 13,8 и 17,0 кг, а при снятии с откорма (540 суток) - на 19,4 и 24,2 кг (P<0,001). При снятии с откорма живая масса молодняка 2-й (препарат по примеру 1) и 3-й (препарат по примеру 2) опытных групп оказалась выше на 21,4 и 26,2 кг (P<0,001), чем в контроле.
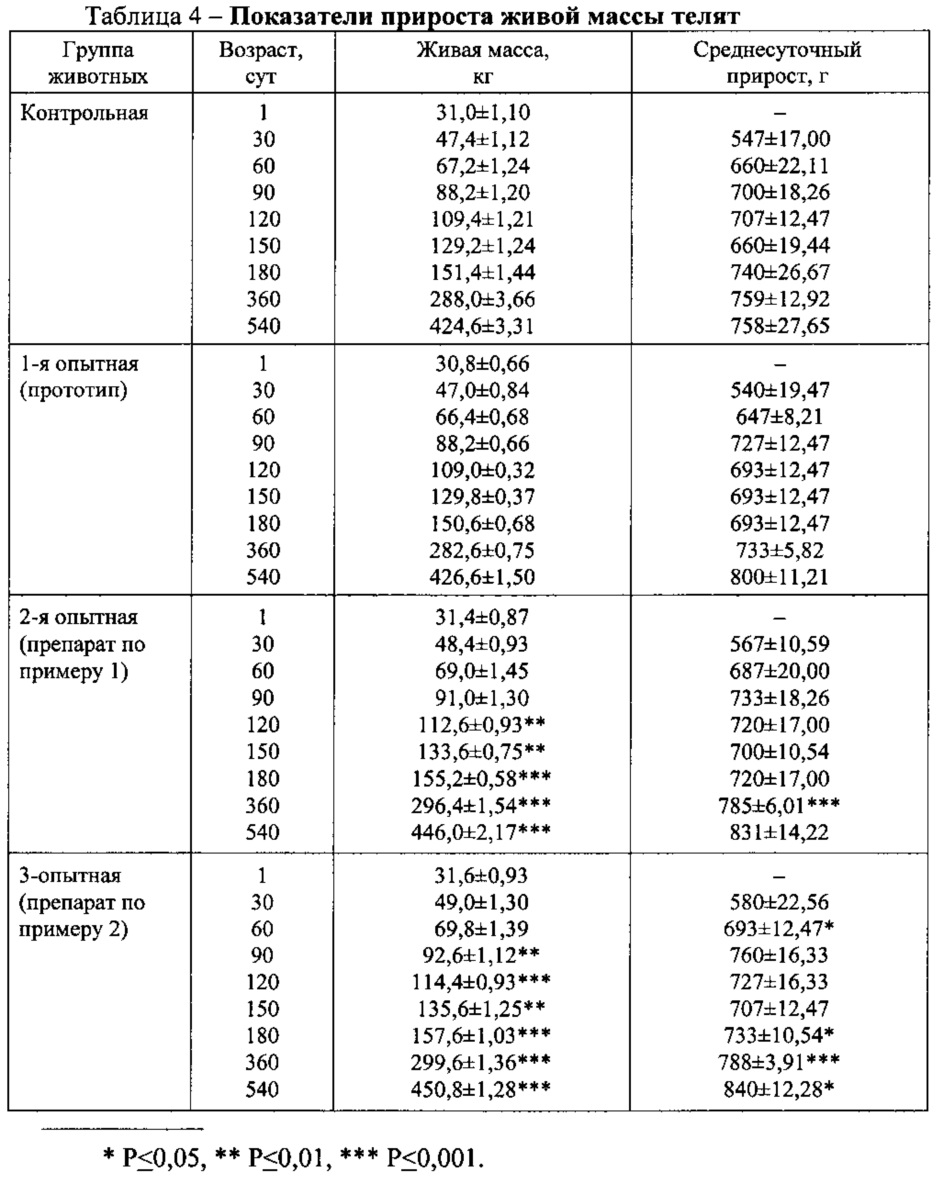
Подобная закономерность прослеживалась и в динамике среднесуточного прироста живой массы подопытных животных.
Таким образом, под влиянием разработанного препарата на основе полисахаридного комплекса дрожжевых клеток и антибиотика амикацина у крупного рогатого скота активизируются клеточные и гуморальные факторы неспецифической резистентности организма, как следствие предупреждаются гинекологические заболевания коров в родовой и послеродовой периоды и повышается воспроизводительная функция, а у телят снижаются количество и продолжительность респираторных заболеваний и желудочно-кишечного тракта, ускоряются рост и развитие.
Реферат
Изобретение относится к области ветеринарии и предназначено для активизации неспецифической резистентности организма крупного рогатого скота. Смешивают 90 мас. ч. 0,2-0,3% суспензии агара с 2,5 мас. ч. концентрата очищенного полисахаридного комплекса. К полученной смеси при постоянном перемешивании добавляют 3,5 мас. ч. (-)2,3,5,6-тетрагидро-6-фенилимидазо-[2,1-b]-тиазол гидрохлорид, 5,0 млн ЕД антибиотика амикацина и 0,2 мас. ч. формалина, объем доводят до 100 мас. ч. Изобретение высокоэффективно для активизации неспецифической резистентности организма крупного рогатого скота. 4 табл., 5 пр.
