Способ получения препарата для реализации биологического потенциала сельскохозяйственных животных - RU2622981C2
Код документа: RU2622981C2
Описание
Изобретение относится к области биотехнологии и ветеринарной медицины, а именно к способам получения препаратов для повышения неспецифической резистентности организма свиней.
Известен способ получения биологически активного препарата из дрожжей (SU 1808331 A1 A61K 35/72, 15.04.93) в виде очищенного полисахаридного комплекса, обладающий иммуностимулирующей активностью. Иммобилизация полисахаридов дрожжевых клеток в агаровом геле (ТУ 10.07.236-91 на производство препарата «Достим») или в 10-14% водно-солевом растворе поливинилпирролидона (RU 2137480 C1 A61K 31/79, 35/72, 20.09.99) повышает иммуностимулирующую активность препаратов.
Наиболее близким аналогом (прототипом) по решаемой задаче является способ получения препарата для повышения неспецифической резистентности и иммуногенеза организма животных (ПС-2), включающий смешивание 0,2-0,3% суспензии агара и концентрата очищенного полисахаридного комплекса дрожжевых клеток. К полученной смеси при постоянном перемешивании добавляют (-)2,3,5,6-тетрагидро-6-фенилимидазо-[2,1-b]-тиазола гидрохлорид и формалин, объем доводят дистиллированной водой до 100 мас. ч. Препарат обладает иммуностимулирующей активностью (RU 2332214 C1 A61K 31/429, 31/115, A61K 36/06, A61K 36/02, A61P 37/04, 27.08.2008).
К недостаткам препарата можно отнести отсутствие антибактериальной активности к возбудителям болезней животных.
Изобретение направлено на получение препарата для повышения неспецифической резистентности организма свиней, расширяющих ассортимент средств как для повышения активности клеточных и гуморальных звеньев неспецифической резистентности и специфического иммуногенеза организма, так и для повышения антибактериальной активности против возбудителей болезней сельскохозяйственных животных.
Технический результат заключается в смешивании 90 мас. ч. 0,2-0,3% суспензии агара и 2,5 мас. ч. концентрата очищенного полисахаридного комплекса дрожжевых клеток. К полученной смеси при постоянном перемешивании добавляют 3,5 мас. ч. производного бензимидазола (-)2,3,5,6-тетра-гидро-6-фенилимидазо-[2,1-b]-тиазола гидрохлорида, 5,0 млн. ЕД цефалоспо-ринового антибиотика I поколения -цефазолина-(6R-транс)-3-[[5-Метил-1,3,4-тиадиазол-2-ил)-тио]метил]-8-оксо-7-[(1Н-тетразол-1-илацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновая кислота (в виде натриевой соли) и 0,2 мас. ч. формалина, объем доводят дистиллированной водой до 100 мас. ч. Полученный препарат разливают во флаконы по 50-100 мл, после стерилизации используют для повышения неспецифической резистентности организма свиней.
Отличие заявляемого решения от известного аналога заключается в том, что при введении антибиотика цефазолина совместно с полисахаридным комплексом и (-)2,3,5,6-тетрагидро-6-фенилимидазо-[2,1-b]-тиазола гидрохлоридом усиливается их действие как на факторы неспецифической резистентности и иммуногенеза, так и активируется фагоцитоз и повышается бактерицидная активность против возбудителей болезней свиней.
Для осуществления способа использовали следующие вещества:
1) агар микробиологический ГОСТ 17206;
2) концентрат очищенного полисахаридного комплекса дрожжей SU 1808331;
3) (-)2,3,5,6-тетрагидро-6-фенилимидазо-[2.1-b]-тиазола гидрохлорид ТУ 9333-024;
4) цефазолин - цефалоспориновый антибиотик I поколения, порошок д/пригот.р-ра д/в/м введения - Р №003079/01.
5) формалин ГОСТ 1625;
6) вода дистиллированная ГОСТ 6709.
Способ осуществляется следующим образом.
Пример 1. 90 мас. ч. 0,2% суспензии агара смешивали 2,5 мас. ч. концентрата очищенного полисахаридного комплекса дрожжей. К полученной смеси при постоянном перемешивании добавляли 3,5 мас. ч. (-)2,3,5,6-тетрагидро-6-фенилимидазо-[2,1-b]-тиазола гидрохлорида, 5,0 млн. ЕД антибиотика цефазолина и 0,2 мас. ч. формалина, объем доводили дистиллированной водой до 100 мас. ч. Полученный препарат после стерилизации использовали для повышения неспецифической резистентности организма свиней.
Пример 2. 90 мас. ч. 0,3% суспензии агара смешивали 2,5 мас. ч. концентрата очищенного полисахаридного комплекса дрожжей. К полученной смеси при постоянном перемешивании добавляли 3,5 мас. ч. (-)2,3,5,6-тетрагидро-6-фенилимидазо-[2,1-b]-тиазола гидрохлорида, 5,0 млн. ЕД антибиотика цефазолина и 0,2 мас. ч. формалина, объем доводили дистиллированной водой до 100 мас. ч. Полученный препарат после стерилизации использовали для повышения неспецифической резистентности организма свиней.
Пример 3. Объектами исследований служили супоросные (последние 30 суток до опороса) свиноматки крупной белой породы. В научно-хозяйственном опыте были подобраны четыре группы супоросных свиноматок (контрольная, 1-я, 2-я и 3-я опытные) по принципу пар-аналогов с учетом клинико-физиологического состояния, возраста и живой массы по 10 животных в каждой группе.
Свиноматкам 1-й опытной группы внутримышечно инъецировали ПС-2 (прототип) в дозе 8 мл за 30, 20 и 10 суток до опороса, 2-й опытной группы - препарат по изобретению (пример 1), 3-й опытной группы - препарат по изобретению (пример 2) в указанной дозе и сроки (опытные варианты), четвертая группа была контрольной.
Показатели неспецифической резистентности свиноматок определяли за 25, 15 и 5 суток до опороса, а также на 5 сутки после опороса. Результаты исследований приведены в табл. 1.
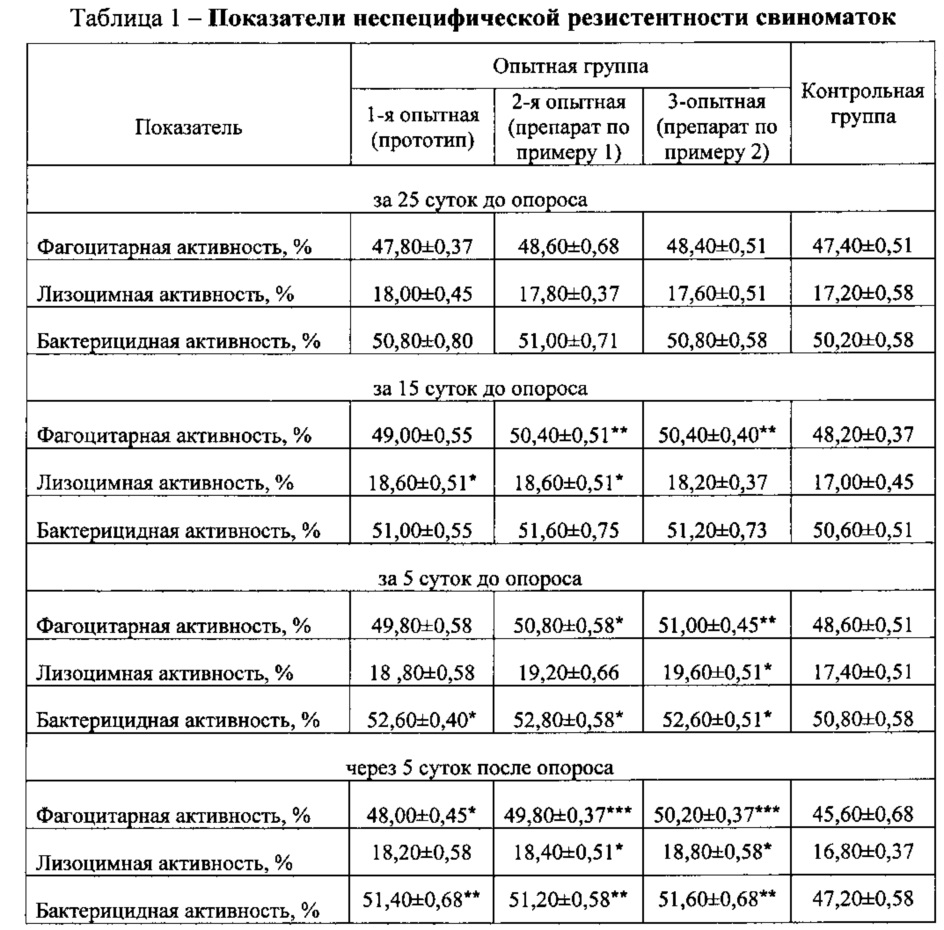
Установлено, что предлагаемый препарат по примерам 1 и 2 улучшает гематологические показатели неспецифической резистентности организма свиноматок за 15 суток до опороса: фагоцитарную активность - на 2,2%, лизоцимную активность - на 1,6 и 1,2%, бактерицидную активность - на 1,0 и 0,6%, за 5 суток до опороса - на 2,2 и 2,4%, 1,8 и 2,2%, 2,0 и 1,8%, через 5 суток после опороса - на 4,2 и 4,6%, 1,6 и 2,0%, 4,0 и 4,4% (P<0,05-0,001).
Результаты исследований репродуктивных качеств свиноматок представлены в табл. 2.
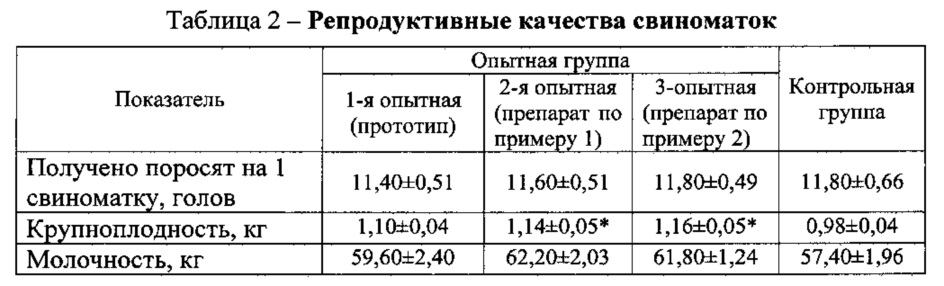
Апробированный препарат по примерам 1 и 2 повышает крупноплодность на 16 и 18%, молочность свиноматок на 4,8 и 4,4 кг соответственно.
Пример 4. Испытание препарата для изучения профилактической эффективности и реализации биологического потенциала животных проводили на поросятах, подобранных по принципу пар-аналогов в 1 -суточном возрасте. Были сформированы четыре группы животных по 10 голов в каждой. Первой группе поросят вводили препарат ПС-2 (прототип) в дозе 0,1 мл/кг массы, второй группе - препарат по изобретению (пример 1) в дозе 0,1 мл/кг массы, третьей группе - препарат по изобретению (пример 2) в дозе 0,1 мл/кг массы (опытные варианты). Четвертая группа была контрольной.
Результаты исследований заболеваемости и сохранности поросят приведены в табл. 3.
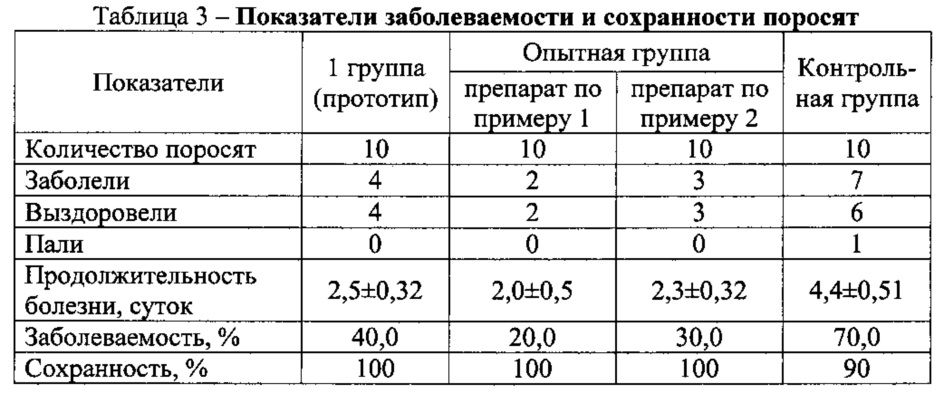
Установлено, что в контрольной группе заболело 7 поросят или 70,0%, из них 1 поросенок пал и 6 выздоровели. У поросят регистрировались признаки острого воспаления кишечного тракта (диарея). Продолжительность болезни составила 4,4±0,51 суток. Возникновение болезни у поросят происходило в результате снижения защитных свойств организма, при котором усиливается активность условно патогенной микрофлоры, что приводит к повышению риска развития заболевания, в частности эшерихиоза.
Заболеваемость поросят в 1-й, 2-й и 3-й опытных группах составила 40, 20 и 30% соответственно, что в 1,75, 3,50, и 2,33 раза меньше, чем в контроле.
Болезнь у них также протекала с признаками воспаления кишечного тракта (диарея), но степень проявления клинических признаков и продолжительность болезней была меньше в 1,76, 2,20 и 1,19 раза, чем в контроле. Сохранность поросят в опытных группах составила 100%.
Динамика показателей неспецифической резистентности организма поросят представлена в табл. 4.
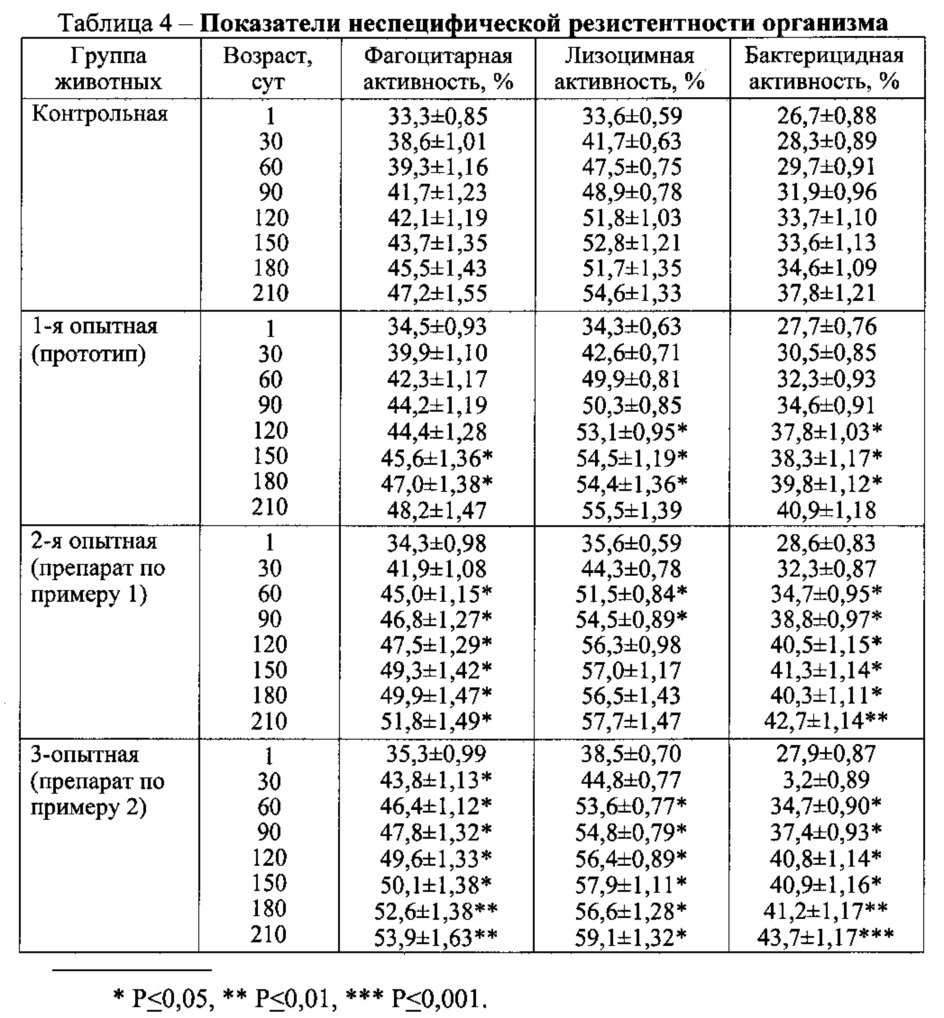
Из представленного материала следует, что фагоцитарная активность лейкоцитов увеличивалась по мере взросления поросят. Более выраженная клеточная реакция наблюдалась у молодняка 2-й опытной группы после инъекции препарата по примеру 1 при изучении ее в 60-, 90-, 120-, 150-, 180- и 210-суточном возрасте по сравнению с соответствующими данными контрольной группы животных соответственно на 5,7%; 5,1, 5,4, 5,6, 4,4 и на 4,6% (P<0,05). Достоверная разница между величинами 3-й опытной и контрольной групп установлена через 30, 60, 90, 120, 150, 180 и 210 суток после инъекции препарата по примеру 2 на 5,2%, 7,1, 6,1, 7,5, 6,4, 7,1 и на 6,7% (P<0,05-0,01).
Состояние гуморального звена неспецифической резистентности организма наиболее полно характеризует лизоцимная активность плазмы и бактерицидная активность сыворотки крови. Установлено, что у молодняка опытных групп, выращенных с применением разработанного препарата по примерам 1 и 2, указанные гуморальные факторы иммунной системы были выше, чем в контроле на 4,0-5,6% и 4,5-6,1% и на 4,9-7,7% и 5,0-7,3% (P<0,05-0,01) соответственно.
Показатели прироста живой массы поросят представлены в табл. 5.
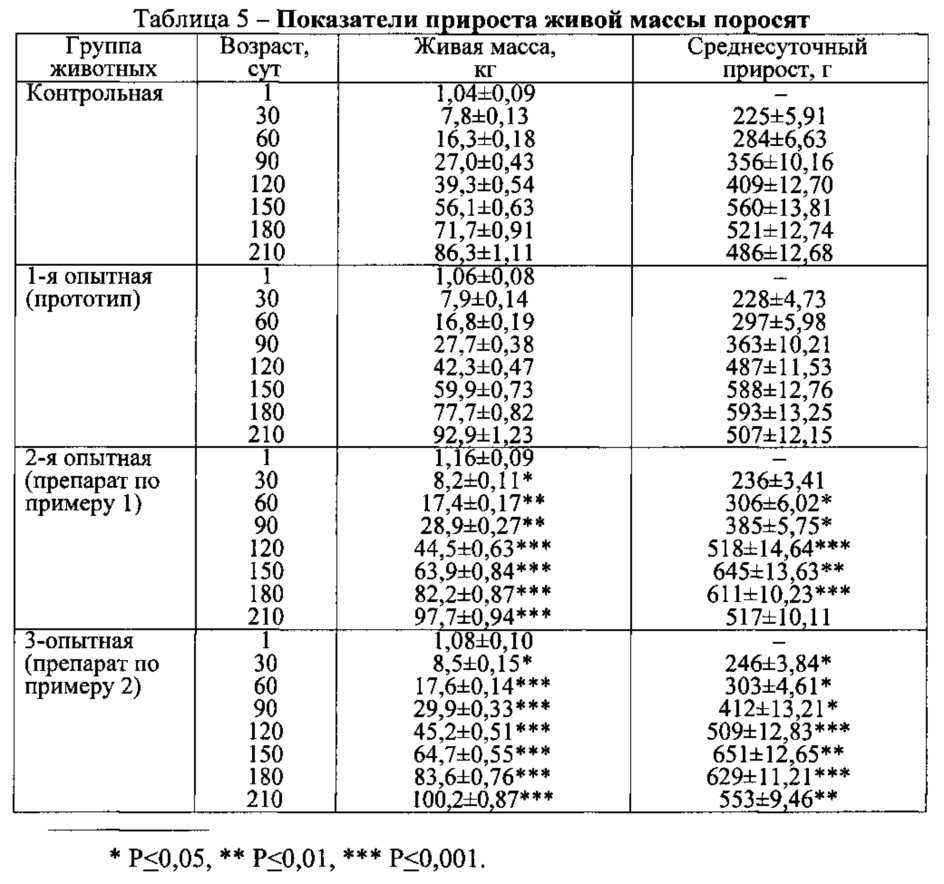
Из представленной таблицы видно, что живая масса поросят контрольной, 1-й (прототип), 2-й (препарат по примеру 1) и 3-й (препарат по примеру 2) опытных групп в 1-е сутки после рождения не имела существенной разницы и в среднем составила 1,04±0,09 кг, 1,06±0,08 кг, 1,16±0,09 кг и 1,08±0,10 кг соответственно (P>0,05). В последующие сроки исследований живая масса оказалась выше у животных опытных групп, выращенных на фоне внутримышечной инъекции препарата по примерам 1 и 2. Установлено, что животные 2-й и 3-й опытных групп превосходили по живой массе сверстников контрольной группы: в 30-суточном возрасте на 0,4 и 0,7 кг, в 60-суточном - 1,1 и 1,2 кг, 90-суточном - 1,9 и 2,9 кг, 120-суточном - 5,2 и 5,9 кг, 150-суточном - 7,8 и 8,6 кг, 180-суточном - 10,5 и 11,9 кг, в 210-суточном возрасте - на 11,4 и 13,9 кг соответственно (P<0,05-0,001). Аналогичная закономерность установлена и в динамике среднесуточного прироста живой массы подопытных животных.
Таким образом, под влиянием разработанного препарата на основе полисахаридного комплекса дрожжевых клеток и антибиотика цефазолина активизируются клеточные и гуморальные факторы неспецифической резистентности организма свиней и, как следствие, улучшаются репродуктивные качества свиноматок, а у поросят снижаются количество и продолжительность заболеваний органов пищеварения, активизируются рост и развитие.
Реферат
Изобретение относится к области ветеринарии и предназначено для повышения неспецифической резистентности организма свиней. Смешивают 90 мас.ч. 0,2-0,3% суспензии агара и 2,5 мас.ч. концентрата очищенного полисахаридного комплекса дрожжевых клеток. К полученной смеси при постоянном перемешивании добавляют 3,5 мас.ч. производного бензимидазола (-)2,3,5,6-тетрагидро-6-фенилимидазо-[2,1-b]-тиазола гидрохлорида, 5,0 млн ЕД цефалоспоринового антибиотика I поколения - цефазолина, и 0,2 мас.ч. формалина, объем доводят до 100 мас.ч. Заявленное изобретение высокоэффективно для для повышения неспецифической резистентности организма свиней. 5 табл., 4 пр.

Комментарии