Лечение грибковой инфекции противогрибковыми препаратами из группы полиенов или ингибиторов β-глюкансинтазы в комбинации с анти-hsp90-антителами - RU2262952C2
Код документа: RU2262952C2
Описание
Настоящее изобретение относится к новым композициям и препаратам, которые являются эффективными противогрибковыми агентами, и новому антителу, которое можно включать в композиции и препараты.
Грибковые инфекции являются важной причиной смертности пациентов в отделении интенсивной терапии и чаще всего у иммунологически «скомпрометированных» и ослабленных пациентов (Gold J.W.M., 1984, Am. J. Med. 76: 458-463; Klein, R.S. et al., 1984, N. Engl. J. Med. 311: 354-357; Burnie J.P., 1997, Current Anaesthesia & Critical Care 8: 180-183). Наличие и устойчивость грибковых инфекций могут быть отнесены за счет избирательного воздействия противогрибковых препаратов широкого спектра действия, часто длительного пребывания пациентов в таких условиях, как отделение интенсивной терапии, проблем при диагностике инфекций и отсутствия эффективности противогрибковых агентов, используемых при лечении. Несмотря на то что строгий гигиенический контроль может привести к некоторой профилактике грибковых инфекций в больнице или другой среде, вспышки инфекций остаются серьезной проблемой и нуждаются в обращении к ним.
Системные грибковые инфекции, такие как инвазивный кандидоз и инвазивный аспергиллез, могут вызываться различными грибковыми патогенами, например вирулентными видами Candida, С. albicans, С. tropicalis и С. krusei, и менее вирулентными видами С. parapsilosis и Torulopsis glabrata (последний в некоторых источниках относят к Candida glabrata). Несмотря на то что С. albicans ранее представлял наиболее распространенный изолят грибков, получаемый из отделений интенсивной терапии, в недавних исследованиях было показано, что С. tropicalis, С. glabrata, С. parapsilosis и С. krusei в настоящее время составляют примерно половину таких изолятов (Pfaller М.А. et al., 1998, J. Clin. Microbiol. 36: 1886-1889; Pavese P. et al., 1999, Pathol. Biol. 46: 579-583). Возрастание видов, не относящихся к albicans, означает появление видов Candida, устойчивых к обычной противогрибковой терапии (Walsh T.J. et al., New Eng. J. Med. 340: 764-771).
Обнаружение и диагностика грибкового патогена, ответственного за инфекцию, являются критическими для последующей терапии, поскольку противогрибковые агенты могут быть более эффективными против определенных штаммов. В GB2240979 и ЕР0406029 (здесь полностью включены для сведения) раскрыты грибковый стрессовый белок и антитело к нему, которые можно использовать в чувствительном и высокоспецифичнсм тесте для обнаружения грибковых патогенов.
Традиционно С. albicans, С. tropicalis и С. parapsilosis лечат противогрибковым препаратом амфотерицином В, считающимся «золотым стандартом» системной противогрибковой терапии (Burnie J.P., 1997, выше). К сожалению, амфотерицин В сам по себе является высокотоксичным, и его применение ограничивается в результате проявления побочных эффектов, включая озноб, лихорадку, миалгию или тромбофлебит. Другие противогрибковые агенты включают азоловые препараты для перорального введения (миконазол, кетоконазол, итраконазол, флуконазол) и 5-фторцитозин. Однако такие виды грибков, как С. karusei и Т. glabrata, являются резистентными к флуконазолу, и часто эти виды присутствуют у пациентов, которым данный препарат вводили в профилактических целях. Кроме того, сообщалось о резистентных к флуконазолу штаммах С. albicans (Opportunistic Pathogens, 1997, 1: 27-31). Таким образом, несмотря на недавние достижения, сделанные в области лечебных препаратов таких, как флуконазол, итраконазол и системные липосомальные варианты амфотерицина В (Burnie J.P., 1997, выше), остается актуальной потребность в эффективных лекарственных препаратах для лечения грибковых инфекций.
Настоящее изобретение направлено на вышеуказанную потребность в новой композиции, которая представляет значительное усовершенствование по сравнению с противогрибковыми агентами предшествующего уровня для лечения грибковых инфекций у человека и животных, и также нового антитела, которое можно включить в композицию. Композиция по настоящему изобретению включает антитело, которое может связываться с одним или более эпитопом грибкового стрессового белка, в комбинации с известными противогрибковыми препаратами. Заявители с удивлением обнаружили, что эффективность противогрибковых препаратов против грибковых инфекций значительно повышается, что дает возможность проводить лечение в более низких дозах или осуществлять более эффективное лечение в той же дозе, позволяя снизить проявление нежелательных побочных эффектов. Кроме того, композиция по настоящему изобретению позволяет эффективно лечить грибковые инфекции, которые в своей основе резистентны к противогрибковому агенту, использованному в композиции.
По настоящему изобретению обеспечивается применение композиции, включающей антитело или его антигенсвязывающий фрагмент, специфические к одному или более эпитопов грибкового стрессового белка, и противогрибковый агент, включающий по меньшей мере один из группы, состоящей из полиенового противогрибкового агента и эхинокандинового противогрибкового агента, в способе производства лекарственного препарата для лечения грибковых инфекций, где грибок, вызывающий указанную грибковую инфекцию, является резистентным к указанному противогрибковому агенту per se.
Дополнительно по настоящему изобретению обеспечивается комбинированный препарат для одновременного, раздельного или последовательного применения при лечении грибковых инфекций, включающий антитело или его антигенсвязывающий фрагмент, специфические к одному или более эпитопов грибкового стрессового белка, и противогрибковый агент, включающий по меньшей мере один из группы, состоящей из полиенового противогрибкового агента и эхинокандинового противогрибкового агента, где грибок, вызывающий указанную грибковую инфекцию, является резистентным к указанному противогрибковому агенту per se.
Антитело может быть специфическим к белку теплового шока представителей родов Candida или Torulopsis (обычно рода Candida или Torulopsis считаются синонимами). В частности, антитело может быть специфическим к белку теплового шока, включающему hsp90 из Candida albicans, как описано в GB 2240979 и ЕР 0406029.
Антитело или его антигенсвязывающий фрагмент могут быть специфическими к эпитопу, включающему последовательность SEQ ID NO:1.
Антитела, их производство и применение хорошо известны и раскрыты, например, у Harlow Е. и Lane D., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1999.
Антитела можно получать с использованием стандартных способов, известных в данной области. Примеры антител включают (но не ограничиваются) поликлокальные, моноклональные, химерные, одноцепочечные, Fab-фрагменты, фрагменты, полученные экспрессией Fab-библиотеки, и антигенсвязывающие фрагменты антител.
Антитела могут быть продуцированы рядом хозяев, например овцами, кроликами, крысами, мышами, людьми и другими. Их можно иммунизировать введением белка теплового шока из рода Candida, например hsp90 из С. albicans или его любыми фрагментами или олигопептидами, которые обладают иммуногенными свойствами. В зависимости от вида хозяина можно использовать различные адъюванты для усиления иммунологического ответа. Такие адъюванты включают, но не ограничиваются, адъювант Фрейнда, минеральные гели, такие как гидроокись алюминия, и поверхностно-активные вещества такие, как лизолецитин, плуроновые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин и динитрофенол. Среди адъювантов, используемых у людей, BCG (Bacille Calmette-Guerin) и Corynebacterium parvum являются особенно пригодными.
Моноклональные антитела к белку теплового шока из рода Candida, например hsp90 из С. albicans, или его любому фрагменту или олигопептиду можно получить с использованием любого способа, который обеспечивает продукцию антител стабильными клеточными линиями в культуре. Они включают, но не ограничиваются, гибридомный метод, метод с человеческой В-клеточной гибридомой и EBV-гибридомный метод (Koehler et al., 1975, Nature, 256: 495-497; Kosbor et al., 1983; Immunol. Today 4: 72; Cote et al., 1983, PNAS USA, 80: 2026-2030; Cole et al., 1985, Monoclonal Antibodies and Cancer Therapy, Alan R. Liss Inc., New York, pp.77-96).
Кроме того, можно использовать методы, разработанные для получения «химерных антител», сплайсинг генов мышиных антител в гены человеческих антител с получением молекулы с соответствующей антигенной специфичностью и биологической активностью (Morrison et al., 1984, PNAS USA, 81: 6851-6855; Neuberger et al., Nature, 312: 604-608; Takeda et al., 1985, Nature, 314: 452-454). Альтернативно можно адаптировать способы, описанные для получения антител с одной цепью, с использованием известных в данной области методов для получения антител с одной цепью, специфической к белку теплового шока из Candida. Можно получить антитела с близкой специфичностью, но другого идиотипического состава, перестановкой цепи из рандомизированных комбинаторных библиотек иммуноглобулинов (Burton D.R., PNAS USA, 88: 11120-11123).
Можно также получить антитела за счет индуцирования образования их in vivo в популяции лимфоцитов или скринингом библиотек рекомбинантных иммуноглобулинов или с использованием реагентов с высокоспецифическим связыванием (Orlandi et al., 1989, PNAS USA, 86: 3833-3837; Winter G. et al., 1991, Nature, 349: 293-299).
Можно также приготовить антигенсвязывающие фрагменты, например, F(ab')2-фрагменты, которые можно получить расщеплением пепсином молекулы антитела, и Fab-фрагменты, которые можно получить восстановлением дисульфидных мостиков F(ab')2-фрагментов. Альтернативно можно сконструировать библиотеки экспрессируемых последовательностей Fab для быстрой и простой идентификации моноклональных Fab-фрагментов с желаемой специфичностью (Huse et al., 1989, Science, 256: 1275-1281).
Для скрининга, с целью идентификации антител, обладающих желаемой специфичностью, можно использовать различные иммуноанализы. В данной области хорошо известны многочисленные методики для конкурентного связывания и радиоиммуноанализа с использованием поликлональных или моноклональных антител с установленной специфичностью. Такие иммуноанализы обычно включают регистрацию образования комплекса белка теплового шока из рода Candida, например hsp90 из С. albicans, или его любого фрагмента или олигопептида, с его специфическим антителом. Можно использовать двухстадийный иммуноанализ с моноклональными антителами с использованием моноклональных антител, специфических к двум не взаимодействующим эпитопам белка теплового шока, но также можно использовать метод конкурентного связывания (Maddox et al., 1983, J. Exp. Med., 158: 1211-1216).
Антитело может включать последовательность SEQ ID NO:2.
Полиеновый противогрибковый агент может включать, например, амфотерицин В, производное амфотерицина В или нистатин. Производные амфотерицина В включают такие композиции, как АмБисом (Ambisom) (например, поставляемый, NexStar Pharmaceuticals, Cambridge, Великобритания), липидный комплекс амфотерицина-В (абельцет (Abelcet)), коллоидную дисперсию амфотерицина-В (амфоцил (Amphocil)) и эмульсию внутрилипидного амфотерицина В (Burnie J.P., 1997, выше). Амфотерицин В можно применять в комбинации с другим противогрибковым агентом, таким как 5-фторцитозином (Burnie J.P., 1997, выше).
Эхинокандиновым противогрибковым агентом может быть, например, анидулафунгин (Anidulafungin) (LY303366; Eli Lilly & Co., Indianapolis, США). Эхинокандины представляют собой циклические липопептиды, которые ингибируют синтез β-1,3-глюкана в грибках (Redding J.A. et al., 1998, Antimicrob. Agents Chemo. Ther. 42(3): 1187-1194).
Грибковыми инфекциями, которые можно лечить композицией или комбинированным препаратом, могут быть мукоромикоз, бластомикоз, кокцидиоидомикоз или паракокцидиоидомикоз, или если возбудителем грибковой инфекции являлись Candida, Cryptococcus, Histoplasma, Aspergillus или Torulopsis. Термин «кокцидиоидомикоз» также относится к «кокцидиомикозу» и термин «паракокцидиоидомикоз» представляет синоним «паракокцидомикоза».
Грибковая инфекция может быть резистентной к противогрибковому агенту per se, т.е. грибковыми инфекциями, которые по своей природе не поддаются лечению специфическими агентами, поскольку специфический противогрибковый агент не эффективен при традиционном применении его одного.
Также представляется композиция или комбинированный препарат, как здесь описано, для применения в способе лечения грибковых инфекций человека или животного.
Также представляется способ производства лекарственного препарата для лечения грибковых инфекций человека или животного, отличающийся тем, что применяется композиция или комбинированный препарат, описанные в настоящей заявке. Способы производства лекарственных препаратов хорошо известны. Например, лекарственный препарат может дополнительно включать фармацевтически приемлемый носитель, разбавитель или наполнитель (Remington's Pharmaceutical Sciences and US Pharmacopoeia, 1984, Mack Publishing Company, Easton, PA, США).
Также представляется применение композиции или комбинированного препарата, описанное в настоящей заявке, в способе производства лекарственного препарата для лечения грибковых инфекций. Грибковая инфекция может быть резистентной к противогрибковому агенту per se.
Также представляется способ лечения грибковых инфекций у человека или животного, включающий введение композиции или комбинированного препарата по настоящей заявке пациенту в случае необходимости. Точную дозу (т.е. фармацевтически приемлемую дозу) композиции или комбинированного препарата, которую следует вводить пациенту, может легко определить специалист в данной области, например, при использовании простых опытов «доза - ответная реакция». Композицию или комбинированный препарат можно вводить перорально.
Кроме того, настоящее изобретение представляет набор, включающий антитело или его антигенсвязывающий фрагмент, специфические к одному или более эпитопов грибкового стрессового белка, и противогрибковый агент, включающий любой один из группы, состоящей из полиенового противогрибкового агента или эхинокандинового противогрибкового агента, для применения при лечении грибковых инфекций. Набор можно использовать для лечения грибковых инфекций, где грибок, вызывающий грибковую инфекцию, является резистентным к противогрибковому агенту per se.
Антитело по изобретению может иметь диагностическое применение. Так, для диагностического применения антитело можно использовать для обнаружения того, присутствует ли стрессовый белок в организме хозяина, для подтверждения того, что у хозяина имеется определенная грибковая инфекция, например мукоромикоз, бластомикоз, кокцидиоидомикоз или паракокцидиоидомикоз, или инфекция, вызываемая Candida, Cryptococcus, Histoplasma, Aspergiilus или Torulopsis, или, например, при диагностике грибковых абсцессов, особенно печеночного кандидоза и/или для мониторинга результатов лечения таких инфекций. Диагностические способы данного типа образуют дополнительный аспект изобретения, и обычно при их постановке могут использоваться стандартные методики, например иммунологические методы, такие как твердофазный иммуноферментный анализ, радиоиммуноанализ, метод латекс-агглютинации или анализ методом иммуноблоттинга.
Антитело по изобретению можно пометить детектируемой меткой или можно конъюгировать с молекулой-эффектором, например с лекарственным препаратом, например с противогрибковым агентом, таким как амфотерицин В или фторцитозин, или с токсином, таким как рицин, или с ферментом, с использованием обычных способов, и изобретение распространяется на такие меченые антитела или конъюгаты антител.
Также настоящее изобретение представляет применение антитела или антигенсвязывающего фрагмента по настоящему изобретению при получении диагностикума для диагносцирования одной или более грибковых инфекций. Диагностикум может представляться в наборе. Набор может содержать инструкции для применения при диагностике одной или более грибковых инфекций. Также по настоящему изобретению представляется диагностический набор, описанный здесь.
Если желательно, то можно использовать смеси антител для диагностики или лечения, например смеси двух или более антител, распознающих различные эпитопы грибкового стрессового белка по изобретению, и/или смеси антител различного класса, например смеси атител IgG и IgM, распознающих один и тот же или различный эпитоп(ы) по изобретению.
Содержание каждого из источников, обсуждаемых здесь, включая цитированные источники, полностью включено здесь для сведения.
Настоящее изобретение будет дополнительно понятно из последующего описания, которое покажет только в качестве примера конкретные воплощения композиции и экспериментирование с ней.
Экспериментальный раздел
В описанных ниже опытах исследовалось противогрибковое действие антитела против антигена hsp90 из Candida albicans, использованного в комбинации с противогрибковыми препаратами, такими как амфотерицин В или флуконазол. Результаты показывают, что в некоторых случаях комбинация антитела и противогрибкового агента приводит к повышенному противогрибковому действию по сравнению с каждым одним из соединений. Удивительно высокий синергитический эффект показан для амфотерицина В в комбинации с анти-Candida albicans hsp90-антителом против различных распространенных проблемных грибковых патогенов. Данный синергитический эффект обладает важным значением для лечения грибковых инфекций в клинике. В предварительных клинических исследованиях с участием четырех пациентов, страдающих от инфекций, вызванных Candida, была показана эффективность настоящего изобретения для людей.
Материалы и методы
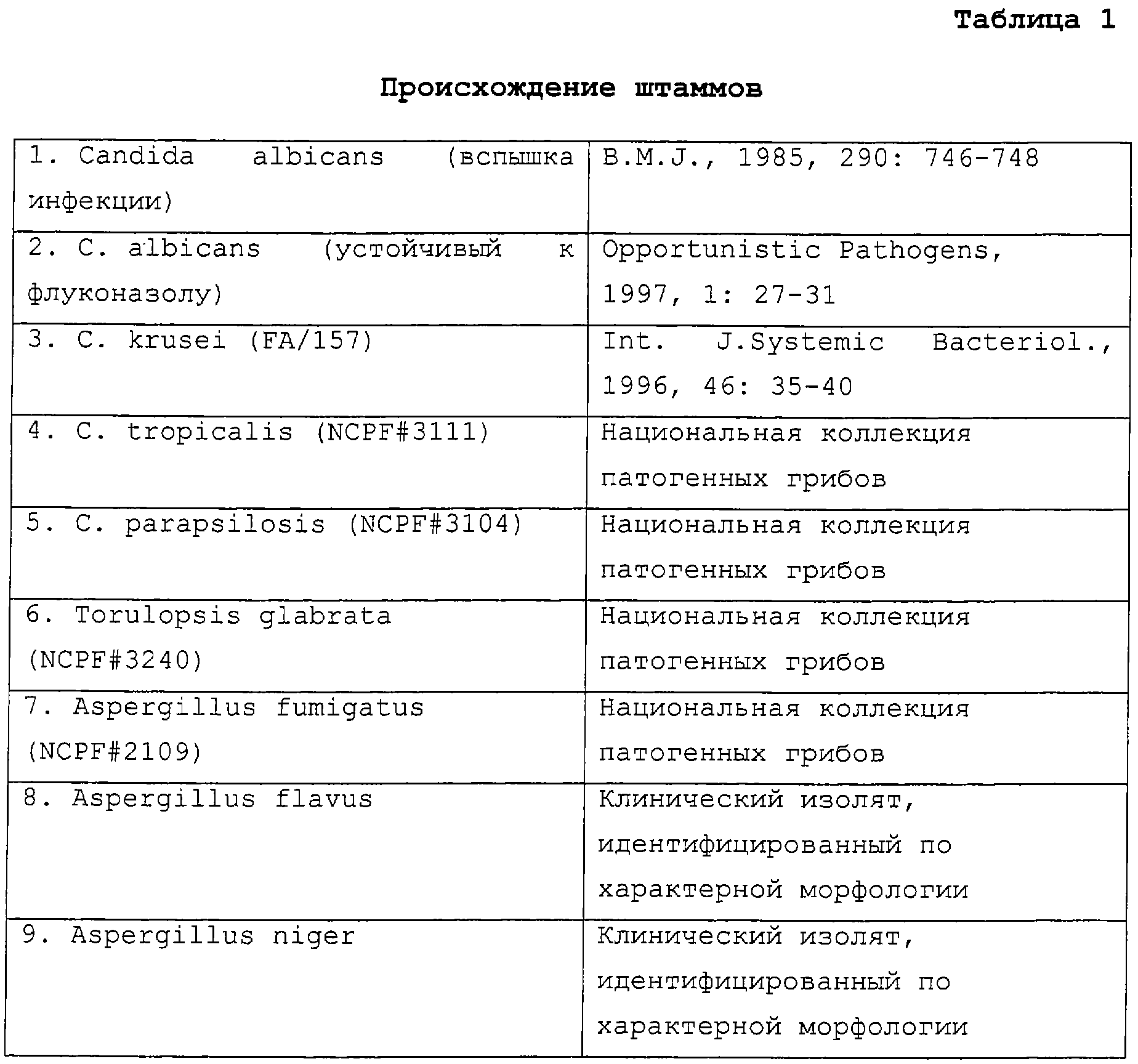
Штаммы:
Использованные штаммы дрожжей, не относящиеся к Aspergillus (таблица 1), высевали на декстрозный агар Сабуро (Oxoid, Basingstoke, Великобритания) и инкубировали при 37°С в течение 24 ч. Штаммы идентифицировали с использованием системы API 20C (BioMerieux, Marcy L'Etoile, Франция). Если было необходимо, проводили микроскопические исследования морфологии на агаре с кукурузной мукой для подтверждения идентификации.
Изоляты Aspergillus spp (таблица 1) росли на декстрозном агаре Сабуро (Oxoid, Basingstoke, Великобритания) при 35°С в течение 24 ч.
Инокулят:
Для штаммов, не относящихся к Aspergillus, готовили суспензии из отдельных колоний (диаметр ≥ 1 мм) в 5 мл стерильного 0,85% физиологического раствора с плотностью 1×104 клеток/мл, что устанавливали при подсчете на сетке гемоцитометра. Для штаммов Aspergillus смотри ниже.
Противогрибковые агенты:
Амфотерицин В от Sigma (Poole, Dorset) закупали в виде лиофилизованного порошка для внутривенного введения (фунгизон). Флуконазол от Pfizer поставлялся в виде раствора для внутривенного введения (дифлукан). Амфотерицин В растворяли в диметилсульфоксиде с получением концентрации 1,2 мг/мл, а флуконазол растворяли в 0,85% физиологическом растворе также с получением концентрации 1,2 мг/мл. Маточные растворы хранили до использования при -70°С. Абельцет (липосомальный амфотерицин В) изготовлялся Bristol-Meyers Squib (США), и готовился согласно указаниям изготовителя для использования его в клинических исследованиях.
Антитело:
Последовательность ДНК предшествующего антитела, специфического в отношении эпитопа hsp90 из Candida albicans, раскрытого в GB 2240979 и ЕР 0406029, генетически модифицировали оптимизацией кодона для экспрессии в Escherichia coli (Operon Technologies Inc., Alameda, CA, США) и вставляли в экспрессирующий вектор Е.coli. Аминокислотная последовательность анти-hsp90-антитела по настоящему изобретению включает последовательность SEQ ID NO:2 (включает домены тяжелой цепи, легкой цепи и спейсер). Антитело по настоящему изобретению распознает эпитоп, включающий последовательность SEQ ID NO:1.
Анти-hsр90-антитело экспрессировали в хозяине Escherichia coli и затем очищали аффинной хроматографией и в обменной колонке с имидазолом до чистоты 95%. Использовали стандартные методики молекулярной биологии (смотри, например, Harlow & Lane, выше; Sambrook J. et al., 1989, Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York; Sambrook J. & Russell D., 2001, Molecular Cloning: A Laboratory Manual, 3rd Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor).
Композиции микограба (Mycograb) (RTM) готовили следующим образом: ампулу, содержащую 10 мг чистого анти-hsp90-антитела, 150 мг мочевины фармацевтической чистоты (Ph Eur) и 174 мг L-аргинина (Ph Eur), восстанавливали в 5 мл воды.
Среда для анализа:
Бульон RPMI готовили из бульонной среды RPMI 1640 (Sigma R7880) с добавлением 0,3 г глутамина на литр, забуферивали за счет 34,6 г морфолинпропансульфоновой кислоты (MOPS) на литр и рН доводили до 7,0.
Тест микроразведения в бульоне:
Готовили двукратные разведения (от 40 до 0,024 мг/мл для амфотерицина В и от 400 до 0,4 мг/мл для флуконазола) в бульоне RPMI, начиная с двух маточных растворов. 100 мл суспензии инокулята, разбавленного 1 к 10 (эквивалентно 1×103 КОЕ), вносили в планшеты для микротитрования. К этому добавляли 50 мкл противогрибкового препарата и затем 50 мкл антитела. Антитело было либо без разведения (0,4 мг/мл), либо разведенным до 1/10 или 1/100. Когда антитело отсутствовало, объем до 50 мкл доводили RPMI. Общий объем в каждой лунке составлял 200 мкл. Конечными концентрациями антитела в опытах были: 100 мкг/мл (без разведения), 10 мкг/мл («антитело в разведении 1/10») или 1 мкл/мл («антитело в разведении 1/100»).
Планшеты инкубировали при 37°С в течение ночи и минимальную ингибирующую концентрацию (MIC) определяли по самой низкой концентрации, ингибирующей рост.
Проводили подсчет колоний в лунках, в которых имелось видимое на глаз торможение роста дрожжей. Данные представлены в виде колониеобразующих единиц на мл бульона (КОЕ/мл).
Опыты с Aspergillus:
Готовили изоляты Aspergillus fumigatus, Aspergillus flavus и Aspergillus niger на среде RPMI 1640. Суспензии готовили с получением конечного инокулята 2×104 конидий на мл и их разливали в аликвотах объемом 100 мкл в плоскодонные планшеты для микротитрования. Готовили серии двойных разведений амфотерицина В в пределах от 250 мкг/мл до 0,75 мкг/мл и разливали в соответствующие лунки. Микограб вносили в каждую лунку с конечной концентрацией 100 мкг/мл в приготовленном буфере. Готовили также контрольные серии для каждого изолята, который включал только приготовленный буфер. Затем планшеты инкубировали при 35°С (200 об/мин) в течение 48 ч и для каждого изолята определяли значения MIC по отсутствию или присутствию роста в лунках.
Синергия на животных:
Тридцати мышам CD1 (каждая массой 25 г) вводили 100 мкл штамма С. albicans, выделенного при вспышке инфекции (эквивалентно 1,5×107 КОЕ), и через 2 ч мышей распределяли на три группы и им вводили:
(A) группа 1-100 мкл 10 мМ раствора ацетата аммония (ААТ; рН 9) с последующим введением 100 мкл амфотерицина В, что эквивалентно 0,6 мг/кг в 5% (мас./об.) растворе глюкозы;
(B) группа 2-100 мкл 10 мМ раствора ААТ (рН 9), содержащего 500 мкг анти-hsр90-антитела с последующим введением 100 мкл амфотерицина В, что эквивалентно 0,6 мг/кг в 5% (мас./об.) растворе глюкозы; и
(С) группа 3-100 мкл 10 мМ раствора ААТ (рН 9), содержащего 50 мкг анти-hsр90-антитела, с последующим введением 100 мкл амфотерицина В, что эквивалентно 0,6 мг/кг в 5% (мас./об.) растворе глюкозы.
Животных умерщвляли через 48 ч и проводили подсчет дрожжей на чашках со средой Сабуро в ткани печени, селезенки и почек.
Клинические исследования:
Открытое исследование по безопасности и фармакокинетике анти-пзр90-антитела (в виде микограба, смотри выше), с охватом четырех пациентов, страдающих инфекциями, вызванными Candida, проводили в Центральном госпитале Манчестера (Central Manchester Health Care Trust Hospital) и госпитале Витеншейва, (Wythenshawe), оба в Манчестере, Великобритания. Пациентов обследовали на признаки сепсиса вызванного Candida, включая:
положительные культуры С. albicans из многочисленных мест или внутренних областей; высокую или прыгающую температуру (пирексию); высокую частоту пульса (тахикардию) и высокое число лейкоцитов («WBC»).
После обычного лечения абельцетом (липосомальным амфотерицином В) и/или флуконазолом, пациентам дополнительно вводили различные дозы микограба, включая необязательную тестовую дозу (0,1 мг/кг) и терапевтическую дозу(ы) 1 мг/кг. За пациентами вели наблюдение на наличие клинических и лабораторных признаков инфекции (тестированные лабораторные показатели включали биохимию крови, гематологию и факторы свертывания крови) и определяли концентрации микограба в сыворотке крови и моче.
Результаты
Данные опытов in vitro, в которых исследовалось действие сочетания анти-Candida albicans hsр90-антитела («антитело») и противогрибковых агентов представлены в таблицах 2-18. Результаты опытов на животных приведены в таблице 19.
Опыты in vitro
Композиции, включающие антитело и флуконазол:
В таблице 2 приведены значения минимальных ингибирующих концентраций (MIC) флуконазола для испытуемых грибковых патогенов с или без присутствия анти-С. albicans hsp90-антитела в различных разведениях, что оценивали тестом микроразведения в бульоне. В присутствии антитела без разведения или антитела, разведенного в 10 раз, MIC для штамма, выделенного при вспышке инфекции, снижалось в четыре раза (от 1,56 мкг/мл до 0,39 мкг/мл флуконазола), в то время как 100-кратное разведение антитела приводило к двукратному снижению MIC флуконазола.
Незначительное уменьшение MIC флуконазола наблюдали для резистентного к флуконазолу штамма С. albicans и С. krusei в присутствии антитела без разведения. Однако при разведении 1/10 и 1/100 антитело не оказывало воздействия на значения MIC флуконазола для данных штаммов по сравнению с вариантом без антитела.
Для остальных штаммов грибков, т.е. С. tropicalis, С. parapsilosis и Т. glabrata, анти-С. albicans hsp90-антитело не оказывало заметного эффекта на значения MIC флуконазола.
Были проведены дополнительные опыты, в которых количественно определяли число клеточных колоний, выживших при различных концентрациях флуконазола с различными разведениями анти-С. albicans hsр90-антитела, для каждого из штаммов грибков, данные приведены в таблице 2.
При исследованных концентрациях флуконазола выживаемость С. albicans (штамм, выделенный при вспышке инфекции) не снижалась при добавлении антитела без разведения или антитела, разведенного в 100 раз (таблица 3).
Для резистентного к флуконазолу штамма С. albicans наблюдали двукратное снижение выживаемости колоний при концентрации флуконазола 12,5 мкг/мл в присутствии антитела без разведения (таблица 4). Незначительное снижение выживаемости данного штамма отмечено при более низких концентрациях флуконазола в присутствии антитела без разведения, но никакого эффекта не было замечено при разведении антитела 1/100.
Неразведенное или разведенное антитело не оказывало достоверного антигрибкового эффекта на С. krusei при тестированных концентрациях флуконазола (таблица 5).
Для С. tropicalis не наблюдали заметного воздействия на выживаемость для каждой из испытанных концентраций флуконазола в присутствии или отсутствии антитела (таблица 6).
В таблице 7 показано, что присутствие или отсутствие антитела не оказывало влияния на выживаемость колоний Т. glabrata при каждой из тестированных концентраций флуконазола.
Присутствие или отсутствие антитела не оказывало заметного эффекта на выживаемость колоний С. parapsilosis при концентрациях флуконазола, указанных в таблице 8.
Композиции с антителом и амфотерицином В:
В таблице 9 показаны минимальные ингибирующие концентрации (MIC) амфотерицина В против грибковых патогенов в присутствии и при отсутствии анти-С. albicans hsр90-антитела при различных разведениях, что оценивали в тесте микроразведения в бульоне.
В противоположность данным, полученным с флуконазолом (смотри таблицы 2-8, выше), во всех случаях тестирования штаммов имело место по меньшей мере четырехкратное снижение MIC амфотерицина В, когда добавляли неразведенное антитело в бульон при инкубации (таблица 9). Кроме того, во всех случаях при исследованиях штаммов имело место по меньшей мере двукратное уменьшение MIC амфотерицина В при добавлении в бульон при инкубации антитела, разведенного в 100 раз (конечная концентрация антитела: 1 мкг/мл).
Наибольший эффект композиции, включающей антитело и амфотерицин В, на снижение MIC амфотерицина В наблюдали на устойчивом к флуконазолу штамме С. albicans. Антитело без разведения приводило к десятикратному уменьшению MIC амфотерицина В, и даже при 100-кратном разведении антитела MIC амфотерицина В снижалось примерно на 25% (таблица 9).
Были проведены детальные опыты, в которых количественно определяли число колоний клеток, выживших при различных концентрациях амфотерицина В с различными разведениями анти-С. albicans hsр90-антитела для каждого из штаммов грибков, данные приведены в таблице 9.
В таблице 10 представлены данные по выживаемости штамма С. albicans, выделенного при вспышке инфекции, инкубированного с амфотерицином В в присутствии и отсутствие антитела. Имело место выраженное снижение (по меньшей мере в 10 раз) числа выживших колоний под воздействием антитела при всех тестированных концентрациях амфотерицина. Например, при концентрации 0,078 мкг/мл амфотерицина В выживаемость С. albicans (выделенного при вспышке инфекции) составляла 0,2% в присутствии антитела, разведенного в 100 раз, по сравнению с выживаемостью штамма без антитела. Ингибирующее действие антитела, разведенного в 100 раз, при концентрации 0,078 мкг/мл амфотерицина В было эквивалентно выживаемости данного штамма при концентрации 0,156 мкг/мл амфотерицина В (без антитела). Следовательно, даже очень разведенное антитело способно снижать количество амфотерицина В, необходимого для достижения степени специфической гибели у данного штамма.
В таблице 11 представлены данные по выживаемости колоний С. albicans (штамма, устойчивого к флуконазолу) при различных концентрациях амфотерицина В и при различных разведениях антитела. Не было отмечено заметного воздействия антитела или амфотерицина В при более низких концентрациях противогрибкового агента. Однако при концентрациях амфотерицина В, приближающихся к MIC противогрибкового агента (смотри таблицу 9, выше) наблюдали, что антитело при 100-кратном разведении приводило к 0,1% выживанию данного штамма по сравнению с антителом.
Данные по выживаемости колоний С. krusei в присутствии амфотерицина В и различных количеств антитела приведены в таблице 12. Становится очевидным, что антитело является очень эффективным против данного штамма при более высоких испытанных концентрациях амфотерицина В. Даже при 100-кратном разведении число колоний С. krusei, обнаруженных в присутствии 0,312 мкг/мл амфотерицина В, составляло 0, 01% от выживших без антитела.
Можно было отметить, что при всех тестированных концентрациях амфотерицина В (в пределах 0,019-0,156 мкг/мл) антитело было эффективным в снижении выживаемости колоний штамма С. tropicalis (таблица 13). Действие усиливалось при более высоких концентрациях антитела и амфотерицина В.
В таблице 14 показана выживаемость Т. glabrata в присутствии различных концентраций амфотерицина В и антитела. Наблюдали, что антитело было очень эффективным в ингибировании роста Т. glabrata при всех тестированных концентрациях амфотерицина В. Например, при 100-кратном разведении антитела рост данного штамма ингибировался на 99,2% при концентрации амфотерицина В 0,009 мкг/мл, на 99,99% при концентрации амфотерицина В 0,019 мкг/мл и на 99,91% при концентрации амфотерицина В 0,039 мкг/мл.
Данные по выживаемости грибкового штамма С. parapsilosis при различных концентрациях антитела и амфотерицина В представлены в таблице 15. Наблюдали, что антитело без разведения приводило к снижению выживаемости данного штамма при всех испытанных концентрациях амфотерицина В. При более низких концентрациях антитела действие было менее выраженным, чем для других исследованных штаммов.
Композиции с антителом без противогрибкового агента:
В последующем опыте оценивали действие одного анти-С. albicans hsр90-антитела в различных концентрациях (без противогрибкового агента) на различные штаммы грибков (использованных в таблицах 2-15, выше). Результаты, представленные в таблице 16, показывают, что для большинства использованных штаммов само по себе антитело не оказывало действия на их выживаемость. Однако наблюдали некоторое снижение выживаемости, которое можно отнести за счет одного антитела, у штаммов Т. glabrata, С. tropicalis и С. parapsilosis.
Опыты с Aspergillus spp:
MIC амфотерицина В для Aspergillus fumigatus равнялось 2,5 мкг/мл. При добавлении микограба значение MIC сдвинулось к 0,125 мкг/мл (двукратное снижение). MIC амфотерицина В для Aspergillus flavus равнялось 2,5 мкг/мл. При добавлении 100 мкг/мл микограба значение MIC сдвинулось к 0,125 мкг/мл (двукратное снижение). MIC амфотерицина В для Aspergillus niger равнялось 2,5 мкг/мл. При добавлении 100 мкг/мл микограба значение MIC сдвинулось к 0,125 мкг/мл (двукратное снижение).
Краткое заключение по результатам опытов in vitro
Результаты, представленные в таблицах 2-16, показывают, что несмотря на то что анти-С. albicans hsp90-антитело само по себе способно ингибировать рост некоторых штаммов грибков, удивительно высокий уровень противогрибковой активности против всех исследованных штаммов наблюдали, когда антитело использовали в комбинации с амфотерицином В. Данное удивительное взаимодействие между антителом и амфотерицином В не наблюдается с другими противогрибковыми исследованными агентами: флуконазол в комбинации с антителом не приводил к достоверному и потенциально полезному эффекту.
Используя уменьшающий критерий четырехкратного различия в улучшении значения MIC, данные в таблице 2 показывают, что флуконазол в сочетании с неразведенным антителом (конечная концентрация 100 мкг/мл) или антителом в 10-кратном разведении (конечная концентрация 10 мкг/мл) был эффективен только против штамма С. albicans, выделенного при вспышке инфекции. Однако с использованием того же критерия из таблицы 9 становится очевидным, что амфотерицин В в сочетании с неразведенным антителом или антителом в 10-кратном разведении был эффективен против всех тестируемых штаммов грибков. Следовательно, можно придти к выводу, что имеется сильная синергия между амфотерицином В и анти-С. albicans hsp90-антителом, что определяли по улучшению значений MIC.
Для опытов, в которых количественно определяли число грибковых колоний при различных обработках противогрибковым препаратом и антителом (смотри таблицы 3-8 и 10-15, выше), можно использовать другой критерий отбора, который определяется через двойное log снижение (100-кратное) выживаемости колоний при оценке потенциально полезных комбинаций обработок.
Краткое обобщение результатов для флуконазола в комбинации с анти-С. albicans hsр90-антителом представлено в таблице 17. Здесь показана наименьшая использованная концентрация флуконазола, приводящая к желаемому эффекту (или наибольшая концентрация, использованная в опыте) наряду с указанием критерия отбора для по меньшей мере 100-кратного снижения выживаемости грибков. Результаты показывают, что только устойчивый к флуконазолу штамм С. albicans, при комбинации с флуконазолом и неразбавленным антителом давал достоверный эффект.
Обобщение результатов для амфотерицина В в комбинации с анти-С. albicans hsр90-антителом представлено в таблице 18. Становится очевидным, что критерий отбора (100-кратное снижение роста грибковых колоний) удовлетворяется с антителом без разведения для всех исследованных штаммов грибков при 10-кратном разведении антитела для С. albicans (штамм, выделенный при вспышке инфекции, и устойчивый к флуконазолу штамм), С. krusei и Т. glabrata, и при 100-кратном разведении антитела для С. albicans (штамм, выделенный при вспышке инфекции) и Т. glabrata.
Заслуживает внимания то, что синергию между амфотерицином В и антителом наблюдали не только против чувствительных к флуконазолу штаммов С. albicans, но также устойчивых к флуконазолу штаммов С. albicans и дрожжей, таких как Candida krusei и Т. glabrata, которые по своей природе резистентны к флуконазолу.
Результаты по Aspergillus spp. показывают, что имелась синергия между амфотерицином В и микограбом in vitro против наиболее распространенных Aspergillus spp.
(2) Опыты на животных
Мышей, зараженных штаммом Candida albicans, выделенным при вспышке инфекции, обрабатывали только амфотерицином В (группа 1), амфотерицином В и 500 мкг анти-hsр90-антитела (группа 2) и амфотерицином В и 50 мкг анти-hsр90-антитела (группа 3). Данные по числу дрожжевых колоний, выделенных из различных тканей мышей через 48 ч, представлены в таблице 19. Результаты показывают, что у животных, обработанных амфотерицином В и 500 мкг антитела (группа 2), было достоверное снижение (по меньшей мере на порядок) числа дрожжевых колоний по сравнению с животными, обработанными только амфотерицином В (группа 1). Также было показано, что у животных, обработанных амфотерицином В и 50 мкг антитела (группа 3), было пониженное число дрожжевых колоний по сравнению с животными, обработанными только амфотерицином В (группа 1). Следовательно, данные in vivo совпадают с данными in vitro и подтверждают наличие синергии между анти-hsр90-антителом и противогрибковым агентом амфотерицином В при лечении грибковых инфекций.
(3) Клинические исследования:
Четырех пациентов с признаками, свидетельствующими о наличии инфекции Candida, и которые не поддавались обычному лечению противогрибковыми препаратами, подвергали комбинированному лечению противогрибковыми препаратами и анти-hsр90-антителами в виде микограба (смотри выше), и проводилось наблюдение за их состоянием.
Пациенту 1 был поставлен первичный диагноз - острый панкреатит и в постоперационном периоде у него развился респираторный дистресс-синдром взрослых (ARDS), для купирования которого потребовалась вентиляция легких. С. albicans выделяли при посеве in vitro из многочисленных мест, включая ложе поджелудочной железы. У пациента было очень высокое число лейкоцитов (WBC) (78,4), хотя оно в значительной мере колебалось и могло быть вызвано не только одним сепсисом. Лечение абельцетом начинали в дозе 3 мг/кг.
Через пять суток после начала лечения абельцетом пациенту 1 дополнительно ввели первую тестовую дозу микограба 0,1 мг/кг (сутки 1). На третьи сутки пациенту ввели клиническую дозу микограба 1 мг/кг. В связи с рядом показателей, например ухудшением числа тромбоцитов, которое было низким по меньшей мере в течение четырех суток, на сутки 3 введение абельцета и микограба прекратили после введения микограба в клинической дозе. Однако через шесть суток (сутки 9) у пациента 1 вновь выделяли С. albicans из асцитной жидкости и ему назначили флуконазол (400 мг). На следующие сутки (сутки 10) пациенту ввели заключительные две клинические дозы микограба, 1 мг/кг на дозу.
Несмотря на то что пациент 1 получал абельцет в течение семи суток, прежде чем пациент получил клиническую дозу микограба на сутки 3, у него по-прежнему выделяли С. albicans из места трахеостомии, и у пациента была тахикардия. Комбинированное лечение абельцетом и микограбом на сутки 3 приводило к тому, что в течение пяти суток С. albicans не выделяли. Во время лечения микограбом не наблюдали связанных с микограбом изменений в биохимии крови, гематологии и факторах свертывания крови. Лечение последующего рецидива флуконазолом и микограбом (две дозы на сутки 10) было менее успешным, как ожидалось бы на основании результатов по синергии in vitro (смотри, например, таблицы 2 и 17), но в конечном итоге пациент излечился от кандидоза.
Концентрации микограба в сыворотке крови у пациента 1 через различные интервалы времени после введения микограба представлены в таблице 20. Опытная доза на сутки 1 не давала определяемые концентрации в сыворотке крови. Дозы 1,0 мг/кг на сутки 3 и сутки 10 приводили к детектируемым концентрациям в сыворотке крови, и данные уровни были сопоставимы с таковыми, при которых в условиях in vitro была показана синергия с амфотерицином В (смотри таблицы 9 и 18). После второй дозы на сутки 10 концентрации микограба в сыворотке крови повысились, что указывает на некоторое его накопление в тканях после первой дозы. Микограб обнаруживали в моче при дозах 1,0 мг/кг (данные не представлены).
Пациенту 2 был поставлен диагноз сужение тонкого отдела кишечника за счет спаек, и у него развился ARDS, для купирования которого потребовалась вентиляция легких. С. albicans выделяли после посева in vitro из многочисленных мест, включая асцитную жидкость, при этом инфекция была связана с флюктуирующей температурой (35,8-38,2°С), повышенным WBC (11,4) и периодической тахикардией (110). Пациенту начали вводить абельцет в дозе 3 мг/кг.
Через четверо суток после начала лечения абельцетом у пациента 2 по-прежнему сохранялась флюктуирующая температура, повышенное WBC и периодическая тахикардия. Пациенту вводили микограб в тестовой дозе 0,1 мг/кг (сутки 1). На следующие сутки пациенту вводили клиническую дозу микограба 1 мг/кг (сутки 2). Последнюю дозу абельцета также вводили на сутки 2 ввиду окончания 5-дневного курса лечения. Через двое суток (сутки 4) пациент получал две заключительные клинические дозы микограба.
Пациент хорошо переносил микограб. Клиническая доза микограба на сутки 2 привела к снижению и стабилизации температуры (от 38,2 до 36,7°С на сутки 2 после введения клинической дозы, оставаясь на уровне 36,7-37,4° С до суток 3) и падению WBC (от 11,9 до 9,6). На сутки 4 пациент выглядел клинически лучше, и С. albicans не выделяли из асцитной жидкости, культур крови или мочи. Во время лечения не наблюдали связанных с микограбом изменений в биохимии крови, гематологии и факторах свертывания крови. Последующее выздоровление осложнилось бактериальным сепсисом, но он поддавался лечению антибиотиками, и у пациента наступило полное выздоровление.
Концентрации микограба в сыворотке крови у пациента 2 через различные интервалы времени после введения микограба представлены в таблице 21. Тестовая доза на сутки 1 не давала определяемые концентрации в сыворотке крови. Доза 1,0 мг/кг на сутки 2 приводила к детектируемым концентрациям в сыворотке крови, и данные уровни были сопоставимы с таковыми, при которых в условиях in vitro была показана синергия с амфотерицином В (смотри таблицы 9 и 18). Микограб обнаруживали в моче при дозах 1,0 мг/кг (данные не представлены).
У пациента 3 был панкреатит в течение шести недель, который привел к необходимости проведения 80% панкреатэктомии. У пациента имелись умеренно повышенные значения LFT (печеночные функциональные пробы), возможно, за счет алкогольной зависимости, и он был носителем MRSA (устойчивого к метициллину Staphylococcus aureus). С. albicans выделяли из многочисленных мест, поэтому пациенту внутривенно вводили флуконазол. Через двенадцать суток после отсутствия положительной реакции на флуконазол лечение пациента изменили на 300 мг абельцета. Через трое суток у пациента по-прежнему сохранялась повышенная температура (38,5°С), и С. albicans по-прежнему выделяли из многочисленных мест (дренаж из брюшинной полости и трубка для гастроскопии), и, следовательно, ему ввели клиническую дозу (1 мг/кг) микограба (сутки 1) в дополнение к абельцету.
В тот день, когда вводили микограб, у пациента 3 был септический шок, вызванный грамотрицательными бактериями (высокая температура 39,5°С, низкое кровяное давление), возможно, в результате Pseudomonas aeruginosa, которые затем выделили из дренажа поджелудочной железы, хотя, у него также выделяли Enterococcus faecalis из культур крови. В результате этого случая микограб больше не вводили. Затем пациент положительно реагировал на лечение антибиотиками (ванкомицином и цефтазидимом).
За счет бактериальных осложнений было трудно оценивать влияние одной дозы микограба у пациента 3. Однако отмечалось, что у него не выделяли С. albicans (например, при помощи трубки для гастроскопии и из дренажа раны) в течение 48 ч после введения дозы, и у него не повышалась температура на сутки 2 и сутки 3. Не наблюдали связанных с микограбом изменений в лабораторных показателях (биохимии крови, гематологии и факторах свертывания крови). На сутки 4 у пациента был рецидив выделения С. albicans, несмотря на то, что он по-прежнему находился на абельцете, но затем наступило полное выздоровление.
Концентрации микограба в сыворотке крови у пациента 3 через различные интервалы времени после введения микограба представлены в таблице 22. Однократная доза 1,0 мг/кг на сутки 1 приводила к детектируемым концентрациям в сыворотке крови, и данные уровни были сопоставимы с таковыми, при которых в условиях in vitro была показана синергия с амфотерицином В (смотри таблицы 9 и 18). Микограб также обнаруживался в моче после дозы 1,0 мг/кг (данные не представлены).
Пациенту 4 был поставлен диагноз эмпиема, вызванная С. albicans, хотя первоначально пациент был доставлен в ITU (отделение интенсивной терапии) с абсцессом легкого, вызванного Streptococcus milleri (выделен из культур крови). С. albicans выделяли из двух образцов при лаваже бронхов (правое и левое легкое) и через трое и четверо суток из образцов жидкости из эмпиемы. На следующие сутки начинали лечение абельцетом (5 мг/кг). Через 5 суток после начала лечения абельцетом отмечали некоторое клиническое ухудшение и на следующее утро (сутки 1) оно было связано с высоким WBC (15,7), и вновь выделяли С. albicans из жидкости межреберного дренажа.
Микограб (1 мг/кг дважды в день) вводили пациенту 4 в 8.30 утра и 8.30 вечера на сутки 1. За исключением временного повышения температуры в ночь суток 1, клинически состояние пациента улучшилось. С. albicans не выделяли из образцов жидкости из эмпиемы, культивированных на сутки 1, и пациенту постепенно становилось лучше.
Пациент 4 хорошо переносил микограб. Не отмечали связанных с микограбом изменений лабораторных показателей (биохимии крови, гематологии и факторов свертывания крови). Хотя, у пациента выделяли С. albicans из дренажа грудной полости через шесть суток после начала лечения абельцетом, и WBC было высоким (15,7) непосредственно перед введением первой дозы микограба, затем состояние пациента постепенно улучшалось, и у него не выделяли С. albicans.
Концентрации микограба у пациента 4 через различные интервалы времени после введения микограба представлены в таблице 23. Дозы 1,0 мг/кг, введенные на сутки 1, давали определяемые концентрации в сыворотке крови, которые были сопоставимы с таковыми, при которых в условиях in vitro была показана синергия с амфотерицином В (смотри таблицы 9 и 18). После второй дозы на сутки 1 концентрации микограба в сыворотке крови повышались, что указывало на некоторое его накопление в тканях после первой дозы. Микограб обнаруживали в моче при дозах 1,0 мг/кг (данные не представлены).
Выводы
Представленные данные четко показывают, что имеется удивительный синергизм между анти-hsр90-антителом и противогрибковым агентом амфотерицином В, который демонстрирует повышенную противогрибковую активность против широкого ряда патологически значимых штаммов грибков. Данные результаты позволяют применять новые, высокоэффективные композиции для лечения грибковых инфекций у человека и животных, и также новое антитело, которое может быть включено в композицию. Настоящее изобретение позволяет либо проводить лечение при более низких дозах, либо осуществлять более эффективное лечение с теми же дозами, тем самым снижая проявление нежелательных побочных эффектов.
Клиническое значение настоящего изобретения включает: (i) получение синергитической комбинации амфотерицина В и анти-hsр90-антитела при лечении распространенной дрожжевой инфекции, которое должно стать лечением выбора. Это приведет к снижению смертности и заболеваемости в результате данных инфекций. Результаты предварительных клинических исследований, представленные здесь, подтверждают эффективность настоящего изобретения по сравнению с существующими методами лечения; (ii) амфотерицин В является токсичным, в частности нефротоксичным препаратом. Синергия, обеспеченная настоящим изобретением, означает, что амфотерицин В может быть использован в меньшей дозе при одновременном сохранении эффективности и снижении токсичности и (iii) снижающее токсичность действие анти-hsр90-антитела обеспечит клиническую эффективность амфотерицина В в случаях высоких доз и дополнительно внести вклад в улучшенный клинический результат.


Реферат
Изобретение относится к области терапии грибковых заболеваний. Сущность изобретения составляет противогрибковая композиция, включающая антитело или антигенсвязывающий фрагмент, специфический к эпитопу грибкового белка теплового шока, и противогрибковый агент, выбранный из полиенового и эхинокандинового противогрибкового агента, для лечения грибковых инфекций, где грибок является резистентным к указанному агенту per se. Другим объектом изобретения является набор для лечения грибковых инфекций. Технический результат - расширение арсенала противогрибковых средств. 2 н. и 9 з.п. ф-лы, 23 табл.

Комментарии