Терапевтическая композиция и лекарственная форма на её основе - RU2629314C2
Код документа: RU2629314C2
Описание
Группа изобретений относится к области фармакологии и медицины.
Предлагаемая композиция и создаваемые на ее основе лекарственные формы предназначены для предупреждения и лечения болезней движения. Кроме того, они могут быть использованы для лечения симптомов болезни Меньера (далее болезнь Меньера), а также лечения вестибулярных синдромов, иногда возникающих после операций на среднем ухе.
Болезнями движения принято называть группу болезней (укачивание, морская болезнь, воздушная болезнь, космическая болезнь и пр.), характеризующихся такими симптомами как головокружение, тошнота, рвота. Эти симптомы иногда возникают у человека во время движения при несовпадении результатов анализа ситуации визуальной, вестибулярной и соматосенсорной системами. Неподвижный человек, чьи зрительные восприятия вызывают сенсорный конфликт с другими сигналами ЦНС, также может испытывать симптомы болезни движения (например, при просмотре фильмов, и, особенно, во время работы оператора, находящегося под действием вестибулярных раздражителей). [Brandt Т. et al. Vertigo and Dizziness … Springer, 2005, p. 129-131; Яснецов B.B. и др. Нейрохимические и фармакотерапевтические аспекты болезни движения. М., 1993, с. 98-100].
Профилактика болезней движения заключается в заблаговременном приеме лекарственных веществ (ЛВ), устраняющих или облегчающих проявление симптомов болезни.
Первыми ЛВ, использованными для профилактики и облегчения симптомов укачивания, были холиноблокаторы, снижающие тонус парасимпатических отделов вегетативной нервной системы. И хотя сейчас представление о причинах, вызывающих состояние укачивания, стали более сложными, перефирические м-холиноблокаторы (атропин, скополамин, гиосциамин) продолжают использовать, а последний является эталонным ЛВ при испытаниях новых препаратов [Яснецов В.В. и др., с. 100-107].
Наиболее употребительными ЛВ при терапии болезней движения являются антигистаминные препараты (прометазин, циннаризин, дименгидринат, циклизин, фенирамин, прометазин, бетагистин под различными торговыми названиями) [Яснецов В.В. и др, с. 116-121]. Направленный поиск противоукачивающих средств среди новых соединений с антигистаминной активностью продолжается [RU 2010130175; RU 2008137941; US 4668681; NZ 584942].
В патенте РФ 2208453 описан «Способ увеличения резистентности организма к укачиванию». Способ предусматривает парентеральное введение окисленного глутатиона или фармацевтических композиций на его основе за 1-24 ч перед укачивающим воздействием. При этом доза окисленного глутатиона составляет 0,1-10 мг на 1 кг массы организма.
Известно использование отечественного препарата пирроксана (адреноблокатор) для повышения устойчивости операторов к действию вестибулярных нагрузок. Прием 30 мг пирроксана за 40 мин. до начала действия вестибулярных нагрузок приводит к значительному улучшению показателей выполнения операторских заданий, но это улучшение сопоставимо с действием эталонного димедрола (антигистаминный препарат, принятый в дозе 100 мг за 40 минут до испытаний). При этом пирроксан уменьшает преимущественно соматические проявления укачивания (головокружение, нистагм) и меньше влияет на вегетативные проявления (тошнота, рвота, жар). [П.Д. Шабанов. Эксперим. и клинич. фармакол. 2005, т. 68, №3, с. 50-55].
Возможны два способа расширения списка препаратов, предназначенных для предупреждения и лечения болезней движения. Одним из них является направленный синтез новых индивидуальных соединений и их скрининг. Другой подход заключается в создании эффективной комбинации существующих препаратов. В рамках именно этой концепции создана заявляемая композиция.
В патенте РФ 2183118 описан «Способ профилактики вестибуловегетативных расстройств у человека в условиях воздействий, вызывающих укачивание». Способ включает пероральное введение нейролептика до начала воздействия разнонаправленных линейных, угловых, прецессионных и кориолисовых ускорений, и одновременно с нейролептиком вводят ингибитор синтеза простагландинов и этимизол в минимальных терапевтических дозах.
Сочетание некоторых м-холинолитиков с α-, β-адреностимуляторами или со стимуляторами дофаминовых рецепторов [Яснецов В.В. и др, с. 132-133]; [US 5039528] также порой проявляет противоукачивающий эффект.
Сочетание некоторых антиконвульсантов с противокашлевыми опиоидами позволяет снизить дозу антиконвульсанта для достижения сходного лечебного действия при симптомах болезней движения [US 5234929].
Известен патент US 6140324, описывающий композицию для лечения болезней движения, содержащую комбинацию трех групп веществ. В состав композиции входят:
- пять известных ЛВ из группы антигистаминов в дозе от 0,5 мг до 50 мг/сутки,
- скополамин в дозе от 0,05 мг до 1 мг/сутки, относящийся к группе м-холинолитиков
- и новый тахикинин-антагонист в дозе от 5 мкг до 5000 мкг/сутки, принадлежащий к группе нейрокинин 1-антагонистов, эффективных противорвотных препаратов, используемых обычно при химиотерапии опухолей.
Концептуально описанное в патенте US 6140324 решение наиболее близко к заявляемой композиции, в связи с чем оно принято в качестве прототипа. Недостатком данного решения является использование в составе композиции новосинтезированного вещества, требующего продолжительного и дорогостоящего исследования.
Целью настоящего изобретения является создание новой эффективной композиции, предназначенной для профилактики и лечения болезней движения. Решаемой технической задачей является создание такой эффективной композиции, которая была бы основана на известных лекарственных средствах и не требовала дорогостоящих фармакологических испытаний.
Обозначенная цель является актуальной. Необходимость в лекарствах для профилактики и лечения болезней движения год от года ширится в связи с ростом мобильности населения и возрастающим числом людей, работающих операторами.
Поставленную задачу решает композиция, в состав которой входят:
- примерно от 70,0% до примерно 84,0% 1-(2,3-дигидро-1,4-бензодиоксин-6-ил)-3-(3-фенилпирролидин-1-ил)пропан-1-она гидрохлорида (пирроксана) или иной его соли,
- примерно от 7,0% до примерно 8,4% 10-[3-(4-метилпиперазин-1-ил)пропил]-2-(трифторметил)фенокситиазина дигидрохлорида (трифтазина) или иной его соли, - примерно от 14,0% до примерно 16,6% 1,1-дифенил-4-пиперидин-1-илбут-2-ин-1-ол гидрохлорида (диферидина) или иной его соли.
Процесс подбора компонентов и соотношения их масс включал множество экспериментальных исследований и основывался на следующих известных характеристиках отобранных для композиции лекарственных форм.
Пирроксан (1-(2,3-дигидро-1,4-бензодиоксин-6-ил)-3-(3-фенилпирролидин-1-ил)пропан-1-он гидрохлорид) (ВФС 42-1066, ФС 42-1992-99, ГРЛС 69/812/7; CAS# 33025-33-1) относится к группе неселективных α-адреноблокаторов и используется при лечении дизенцефальной патологии симпатико-адреналинового типа (оказывает гипотензивное, седативное, противозудное действие), в том числе при профилактике перевозбуждения вестибулярного аппарата.
Трифтазин (ГФ X, стат. 700, CAS## 117-89-5, 605-75-4, 440-17-5) относится к группе нейролептиков, обладает активным антипсихотическим действием, по механизму - блокатор дофаминовых рецепторов. Также обладает противорвотной активностью.
Диферидин (CAS# 972-04-3; Разрешение Минздрава СССР Пр-4 от 23.02.1973 и Фармкомитета Минздрава СССР Пр-18 от 02.07.1976) является центральным м- и н-холинолитиком и подавляет активность перефирических м-холинореактивных систем, оказывает и прямое гипотензивное действие на стенки сосудов [М.А. Разумова. К фармакологии аминоспиртов ацетиленового ряда. Ж. фарм. и токсикол., 1965, №2, с. 153-158]. Как и у других производных ацетиленовых аминоспиртов, он рекомендован для лечения болезни Паркинсона из-за сочетания невысокой токсичности и большой широты фармакологического действия.
Экспериментальная проверка применимости заявляемой композиции для профилактики и лечения болезней движения подтвердила ее эффективность.
Наличие в составе композиции неселективного α-адреноблокатора, подавляющего избыточный тонус симпатической нервной системы, в сочетании с нейролептиком, снижающим эмоциональную возбужденность, возникшую вследствие возбужденности вестибулярных центров, и с м- и н-холиноблокатором, подавляющим избыточный тонус парасимпатического отдела вегетативной нервной системы, дало положительный результат.
Оптимальное соотношение масс входящих в композицию компонентов определено опытным путем. В предпочтительном варианте реализации заявляемой композиции массовое соотношение компонентов пирроксан : трифтазин : диферидин составляет 10:1:2.
Осуществление группы изобретений можно выполнить различными путями. Так при изготовлении заявляемой композиции в ее состав может быть включен 10-[3-(4-метилпиперазин-1-ил)пропил]-2-(трифторметил)фенокситиазин дигидрохлорид (трифтазин, CAS# 440-17-5) или иная его соль, например дималеат (CAS# 605-75-4) или сульфоксид (CAS# 1549-88-8).
Аналогичная возможность варьирования существует и для фармацевтически допустимых солей пирроксана и диферидина.
Заявленная композиция может быть самостоятельной лекарственной формой, но на ее основе могут быть выполнены и различные известные и разрешенные лекарственные формы, обеспечивающие системное действие ЛВ при энтеральном и парентеральном путях введения композиции в организм.
Так для перорального использования лекарственная форма композиции может быть выполнена твердой, например, в виде гранул (сфероидов), порошков, таблеток или капсул. Также для перорального использования лекарственная форма может быть жидкой в виде раствора, суспензии, эмульсии или сиропа. Сублингвальное введение композиции могут обеспечить жевательные лекарственные резинки и пластинки.
Для парентерального использования лекарственная форма, основанная на заявляемой композиции, может быть выполнена в виде раствора, эмульсии, включая эмульсии с липосомным носителем и накожные трансдермальные формы. Возможен вариант изготовления на основе заявленной композиции и мягких лекарственных форм: мази, пластинок и пластырей.
Лекарственная форма, выполненная на основе вышеуказанной композиции, может содержать, кроме действующих терапевтических средств, взятых в вышеуказанном соотношении, также известные вспомогательные вещества и наполнители. Для получения любой из названных лекарственных форм заявляемой композиции могут быть использованы все известные дополнительные ингредиенты (наполнители, носители, эмульгаторы, стабилизаторы, пролонгаторы действия, корригенты, адгезивы и пленкообразователи).
Любая из вышеназванных лекарственных форм, содержащая вышеуказанную композицию, может быть изготовлена комбинацией описанных технологий и приемов, разрешенные Государственной Фармакопеей РФ 12 2010 года, Государственной Фармакопеей СССР 11 1987 года и Европейской Фармакопеей 7.0 2011 года.
Примеры
ПРИМЕР 1 - использование заявляемой композиции для предупреждения моделированной болезни движения.
Испытания проводились в два этапа. На первом предварительном этапе из общего числа испытуемых добровольцев отбирались те лица, которые проявили чувствительность к укачиванию.
Для моделирования болезни движения было использовано раскачивание испытуемых добровольцев на модернизированных качелях Хилова [К.Л. Хилов. Вестник советской оториноларингологии. 1933. №4; с. 213] с автоматическим регулированием амплитуды и частоты раскачивания.
В экспериментах использовали следующие условия создания вестибулярных раздражений: частота 15 мин-1, размах - 12 м, подъем стола качелей – 1 м. Раскачивание человека на двухбрусковых качелях, когда стол качелей остается горизонтальным, приводит к ритмичному воздействию на человека вертикальных линейных ускорений, раздражающих отолитовый отдел вестибулярного аппарата. Длительное раскачивание приводит к аккумуляции отолитовых раздражений, которая сопровождается такими симптомами укачивания как головокружение, тяжесть в голове, повышенное слюноотделение, тошнота. Раскачивание испытуемых продолжалось до появления у них первых необычных ощущений. Этот промежуток времени (в минутах) и служил количественным показателем вестибулярной устойчивости.
Далее в опытах с испытанием препаратов участвовали лишь лица, проявившие чувствительность к укачиванию в предварительных испытаниях. Для устранения фактора тренированности промежуток времени между отборочным опытом и опытом с приемом препарата превышал 20 дней.
Сущность второго этапа испытаний состояла в следующем.
Были изготовлены три группы внешне одинаковых желатиновых капсул. В одни капсулы помещали заявляемую композицию, изготовленную в виде порошка; доза заявляемой композиции содержала 10 мг пирроксана, 2 мг диферидина и 1 мг трифтазина. В другие капсулы помещали эталонное вещество - известное противоукачивающее средство аэрон (ФС 42-771-86); доза содержала 0,2 мг скополамина и 0,8 мг гиосциамина (наивысшая разрешенная разовая доза). В третьей группе капсул находилось индифферентное вещество (плацебо).
Испытания проводили методом двойного слепого исследования (ни испытуемый, ни экспериментатор не знали о содержимом принятой за 60 минут до начала раскачивания капсулы).
В Таблице 1 сопоставлены результаты контрольного опыта (прием плацебо) с приемом эталонного противоукачивающего средства и приемом заявляемой композиции.
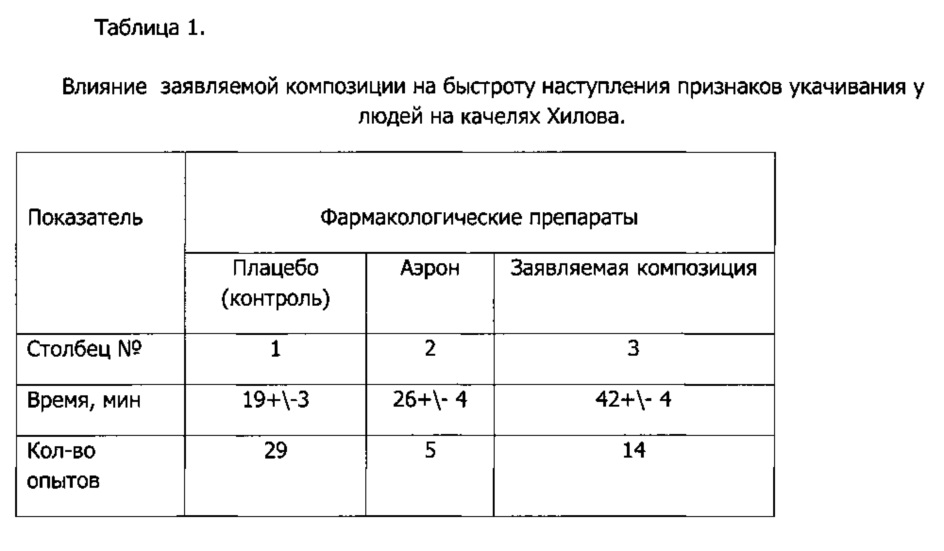
Из результатов, приведенных в Таблице 1, видно, что аэрон оказал незначительное положительное влияние на устойчивость людей к укачиванию в условиях данного эксперимента. В то же время прием заявляемой композиции достоверно более, чем в два раза увеличивал продолжительность переносимых кумулятивных вестибулярных раздражений. Данный результат (42 минуты, столбец 3 Таблицы 1) в 1,6 раза лучше, чем результат, достигаемый приемом эталонного аэрона (столбец 2 Таблицы 1) и в 2,2 раза лучше приема плацебо.
ПРИМЕР 2 - использование композиции для лечения морской болезни.
Заявляемая композиция прошла испытания в условиях длительного укачивания (морского плавания) на добровольцах, испытывающих все симптомы морской болезни, вызванной килевой качкой на 5-6 бальном волнении (Таблица 2). Испытуемые получали заявляемую композицию (в форме пероральных таблеток, содержащих 10 мг пирроксана, 2 мг диферидина и 1 мг трифтазина) один раз в сутки. Большинство из них (66%) ощущали облегчение состояния в течение 6-8 часов после приема, затем симптомы болезни возобновлялись. Семь человек (22%), не почувствовавших действия композиции, составляли группу с сильнейшими симптомами морской болезни, у которых многократно повторяющаяся рвота препятствовала всасыванию композиции перорального применения.
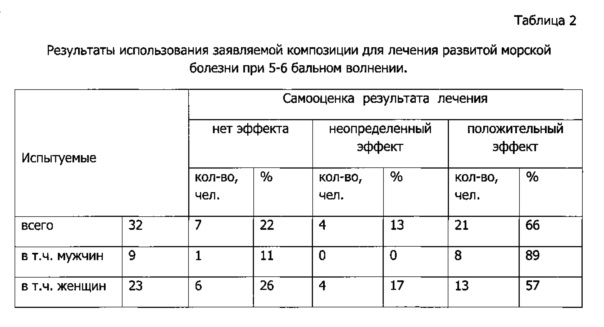
Таким образом, заявляемая композиция оказывала противоукачивающее действие, по величине сходное с приемом 1 мг м-холиноблокатора скополамина (индекс защиты 63%) [Яснецов В.В. и др., с. 100] или 50 мг антигистаминного димедрола (индекс защиты 62%) [Яснецов В.В. и др., с. 117]. Достигнутый индекс защиты соответствует группе эффективных средств для лечения болезней движения.
ПРИМЕР 3 - использование заявляемой композиции для предупреждения воздушной болезни
Заявляемая композиция (в форме таблеток, содержащих 10 мг пирроксана, 2 мг диферидина и 1 мг трифтазина) была испытана в условиях кратковременного укачивания на пассажирах легкомоторных самолетов, на которых укачивание развивается наиболее часто и в наиболее выраженной форме. Испытания проводили на добровольцах, в состав которых входили люди, обычно подверженные воздушной болезни и получавшие разовую дозу заявляемой композиции за 30-40 минут до начала полета. Контрольную группу составляли пассажиры, нечувствительные к болезням движения или не желавшие участвовать в испытаниях. Контролем служили наблюдения немедицинского работника, ориентировавшегося по таким внешним признакам болезни, как холодный пот, бледность, жалобы, рвота (Таблица 3).
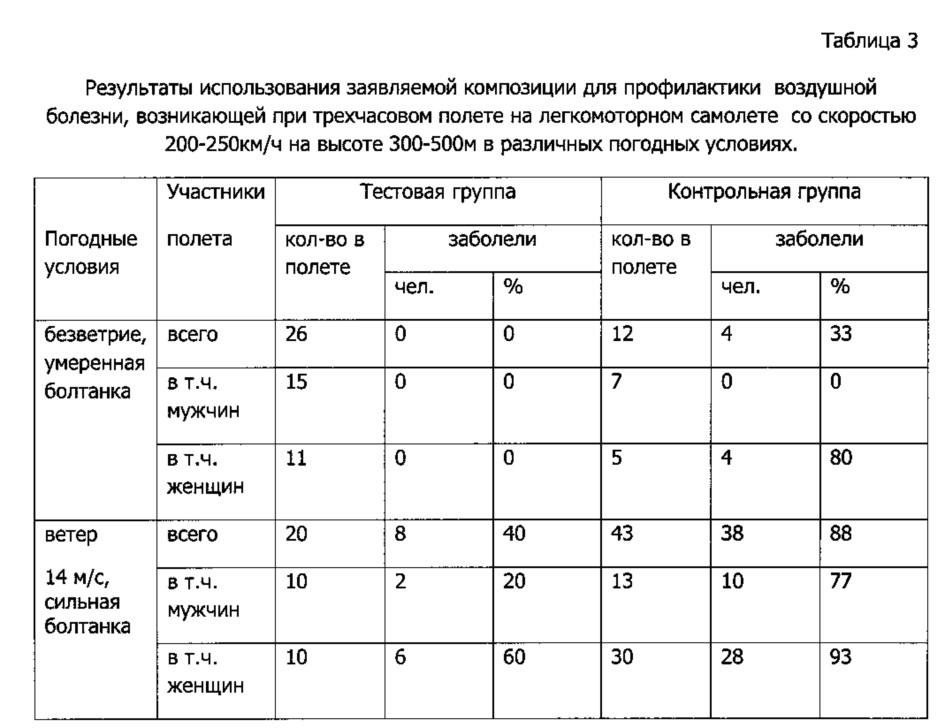
Из данных Таблицы 3 следует вывод об отчетливо-сильном профилактическом действии заявляемой композиции, особенно очевидном при умеренной нагрузке на вестибулярный аппарат.
ПРИМЕР 4 - использование композиции для предупреждения морской болезни в условиях длительного плавания.
Заявляемая композиция прошла испытания в условиях длительного тридцатидневного плавания при ежесуточном волнении моря не ниже четырехбального. Тридцать четыре испытуемых (младший плавсостав) ежедневно получали разовую дозу заявляемой композиции (в форме таблеток, содержащих 10 мг пирроксана, 2 мг диферидина и 1 мг трифтазина) и исполняли свои служебные обязанности. Их самочувствие фиксировали методом самооценки и объективной оценки (наличие тошноты и рвоты).
У 31 одного человека (91%) зафиксировано положительное действие заявляемой композиции (отсутствие вегетативных признаков укачивания). Побочные отрицательные эффекты обнаружены не были. Не были выявлены и такие побочные эффекты как сонливость, головная боль и чувство усталости, обычные при приеме известных противоукачивающих средств - скополамина, димедрола и циклизина.
ПРИМЕР 5 - влияние качественного состава композиции на результаты профилактики моделированной болезни движения.
Моделирование болезней движения проводили на качелях Хилова в условиях, описанных в примере 1.
Были изготовлены пять групп внешне одинаковых желатиновых капсул. В одни капсулы помещали заявляемую композицию, изготовленную в виде порошка; доза заявляемой композиции содержала 10 мг пирроксана, 2 мг диферидина и 1 мг трифтазина. Во вторую группу капсул помещали одно из мажорных веществ, входящих в заявляемую композицию, α-адреноблокатор пирроксан (ФС 42-0870), рекомендованного для купирования укачивания в дозе 15-30 мг [М.Д. Машковский. Лекарственные средства.- Изд. 15-е, 2005. - С. 5259]. Использованная доза пирроксана составляла 10 мг (как и в заявляемой композиции). В третьей группе капсул находилось известное противоукачивающее средство - педифен (ФС 2008-06-066 ФСП 42-0008-3931-03, ГРЛС Р N002888/01), относящийся к группе центральных н-холинолитиков в дозе 100 мг. В четвертую группу капсул помещали М-композицию (моделирующую состав заявляемой композиции). М-композиция содержала, как и заявляемая, дифферидин и трифтазин, но вместо пирроксана - педифен в фармацевтически эффективной дозе. Таким образом, четвертая группа капсул с М-композицией содержала 100 мг педифена, 2 мг диферидина и 1 мг трифтазина. В пятую группу капсул помещали индифферентное вещество - крахмал (плацебо).
Испытания проводили методом двойного слепого исследования (ни испытуемый, ни экспериментатор не знали о содержимом принятой за 60 минут до начала раскачивания капсулы).
Результаты экспериментов и сопоставления представлены в Таблице 4.
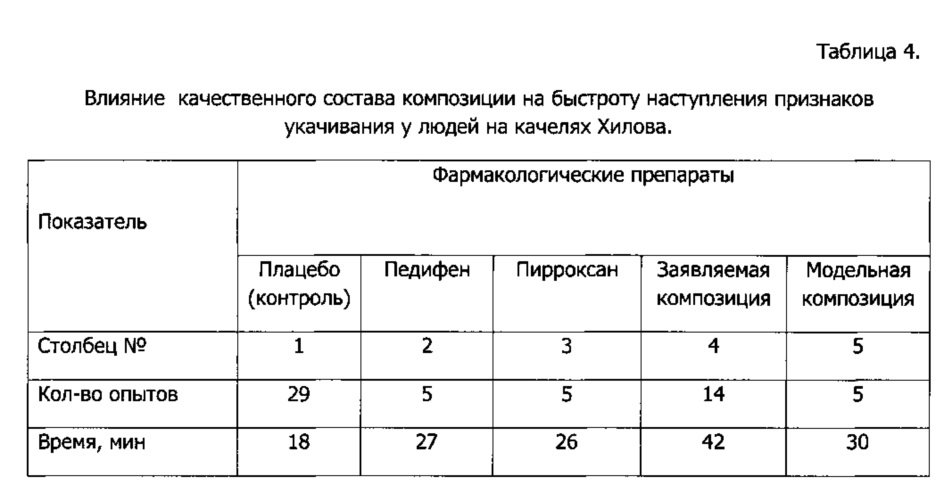
Из результатов, приведенных в Таблице 4, видно, что педифен и пирроксан оказали незначительное влияние на устойчивость людей к укачиванию в условиях данного эксперимента (столбцы 2 и 3 Таблицы 4) - устойчивость, по сравнению с плацебо, возросла на 44-48%. В то же время прием заявляемой композиции достоверно более, чем в два раза увеличивал продолжительность переносимых кумулятивных вестибулярных раздражений (столбец 4 Таблицы 4) - устойчивость возросла на 133%. Модельная композиция (столбец 5 Таблицы 4), содержащая педифен, трифтазин и диферидин, хотя и проявила 66%-ное увеличение продолжительности переносимых вестибулярных раздражений (что лучше чем индивидуальный показатель одного из ее компонентов - педифена (столбец 2 Таблицы 4), все же значительно отстает от характеристики заявляемой композиции (столбец 4 Таблицы 4).
Следовательно, именно сочетание трех компонентов заявляемой композиции - пирроксана, трифтазина и диферидина, взятых в соотношении 10:1:2 обеспечивает высокие противоукачивающие ее свойства.
Таким образом, заявляемая композиция обеспечивает решение поставленной задачи. Создано новое эффективное средство профилактики и лечения болезней движения. Преимущество заявляемой композиции по сравнению с известной композицией - прототипом очевидно. Заявляемая композиция основана на комбинации известных лекарственных средствах и не требует дорогостоящих фармакологических испытаний. При этом также как и композиция - прототип (патент США US 6140324) заявляемая композиция обеспечивает возможность ее использования не только для лечения болезней движения, но и для лечения болезни Меньера и, кроме того, и для лечения некоторых вестибулярных синдромов, иногда возникающих после операций на среднем ухе.
Ниже приведены примеры экспериментальных исследований, подтверждающие возможность использования композиции для лечения вестибулярных симптомов болезни Меньера и вестибулярных синдромов операций на среднем ухе.
ПРИМЕР 6 - использование заявляемой композиции для лечения симптомов болезни Меньера
Композицию в форме таблеток перорально получали 20 больных, поступивших в клинику в стадии обострения болезни Меньера (головная боль, шум и распирание головы, холодный пот, головокружение). Члены группы испытуемых страдали болезнью Меньера от 2 до 7 лет, и их приступы обычно положительно купировались вдыханием чистого кислорода, а вдыхание карбогена (смесь 95% кислорода и 5% углекислоты) приводило к ухудшению состояния. Действие препарата оценивали как сами больные, так и объективно - по регистрации двухминутной стабилограммы (приборной регистрации частоты и амплитуды колебаний тела больного, стоящего в позе Ромберга). Стабилограммы записывали через 30, 45, 60, 75 и 90 минут после приема композиции и усреднялись. Результаты представлены в Таблице 5.
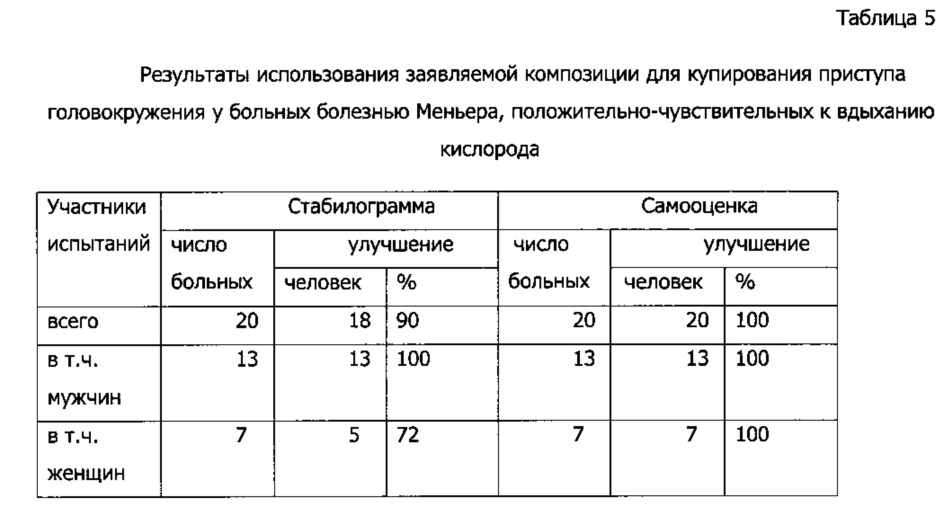
В день приема заявляемой композиции возобновление приступов болезни Меньера не наблюдалось; а у двух больных из этой группы (10%) приступы головокружения не возобновлялись в течение нескольких месяцев после разового приема заявляемой композиции.
Влияния на артериальное давление у принимавших композицию больных не выявлено.
ПРИМЕР 7 - использование заявляемой композиции для лечения вестибулярных осложнений после стапедопластических операций.
Одним из частых осложнений после хирургического лечения отосклероза является возникновение вестибулярных расстройств. На 6 добровольцах, имеющих подобные осложнения, была испытана заявляемая композиция. Композицию в форме капсул принимали перорально в ближайшие сроки после операции (1-5 суток) или однократно (разовая доза составляла до трех капсул) или в течение нескольких дней. В этом случае максимальная суточная доза составляет 6 капсул, то есть 60 мг пирроксана, 12 мг диферидина и 6 мг трифтазина. Лечебный эффект развивался во всех случаях примерно через 60 минут после приема композиции.
В 4 случаях (67% испытуемых) однократный прием либо 1-2 капсул (двое больных) либо 3 капсул (двое больных) привел к исчезновению тошноты, головокружения и нистагма. В двух случаях разовый прием одной или трех капсул избавил пациентов от рвоты, тошноты, головокружения, однако легкий нистагм сохранился, что потребовало продолжения приема композиции до 3-7 дней (до полного исчезновения нистагма) в той же дозировке.
Во всех случаях не были выявлены побочные действия препарата, а именно изменение артериального давления.
ПРИМЕР 8 - использование композиции для лечения послеоперационных осложнений хирургического лечения гнойного эпитимпанита.
Одним из частых осложнений после хирургического лечения гнойного эпитимпанита является возникновение вестибулярных расстройств. С целью симптоматического лечения больных с подобными осложнениями на 2 добровольцах была испытана заявляемая композиция. Композицию (в таблетированной форме, 1 доза содержала 10 мг пирроксана, 2 мг диферидина и 1 мг трифтазина) принимали перорально в ближайшие сроки после операции (4-7 суток) однократно, по 1 таблетке. Дальнейший прием не требовался из-за исчезновения всех вестибулярно-соматических симптомов. Лечебный эффект развивался во всех случаях примерно через 60 минут после приема композиции.
Влияния действия композиции на показатели артериального давления не выявлено.
Таким образом, доказаны применимость и эффективность заявленной композиции при различных реализациях ее лекарственных форм как для профилактики и лечения болезней движения, так и для лечения вестибулярных расстройств при болезни Меньера и вестибулярных синдромов после слухоулучшающих операций.
Реферат
Группа изобретений включает новую терапевтическую композицию и лекарственную форму, содержащую упомянутую композицию. Композиция предназначена для предупреждения и лечения болезней движения, для лечения вестибулярных симптомов болезни Меньера и вестибулярных синдромов после операций на среднем ухе. Композиция содержит пирроксан, трифтазин и диферидин в массовом соотношении 10:1:2. Лекарственная форма может иметь различные реализации, в частности лекарственная форма может быть выполнена с возможностью перорального, буккального, трансдермального и/или парентерального использования. 2 н. и 2 з.п. ф-лы, 8 пр., 5 табл.

Комментарии