Противовирусное соединение множественного действия, его состав и способ лечения вирусных заболеваний - RU2597150C2
Код документа: RU2597150C2
Чертежи




Описание
Данное изобретение описывает соединение и фармацевтическую композицию модифицированной РНК для лечения вирусных заболеваний, которые, в частности, вызываются вирусами семейств Orthomyxoviridae, Paramyxovirus, Hepatitis, семейства Herpesviridae, энтеровирусами и аденовирусами. Кроме того, модифицированная дрожжевая РНК способна ингибировать размножение вирусов гриппа, вируса гепатита С, генитального герпеса, вируса иммунодефицита человека, вируса Коксаки В. Данное изобретение также описывает терапевтические методы улучшения или предупреждения вирусных заболеваний.
ТЕХНИЧЕСКИЙ УРОВЕНЬ
Быстро развивающаяся устойчивость вирусов к противовирусным препаратам требует создания новых лекарств с универсальным механизмом действия, а также новых препаратов, действующих на недавно открытые мишени. Поскольку вирусные заболевания часто связаны с несколькими видами вирусов, создание новых противовирусных препаратов с различными механизмами действия против многих вирусов имеет особое значение для существенного улучшения результатов лечения.
Молекулы РНК могут иметь широкий спектр конформаций и выполнять большое количество клеточных функций за счет образования структур, позволяющих им иметь конкретные РНК-РНК, РНК-ДНК или РНК-белковые взаимодействия. Успехи в изучении этих различных РНК взаимодействий позволили разработать ряд технологий, позволяющих создать новые методы лечения различных заболеваний. В настоящее время известен ряд новых, химически синтезированных терапевтических РНК, которым уделяется наибольшее внимание. Это, в первую очередь, так называемые ингибиторы генов, ингибиторы белков и иммуностимулирующие РНК (Bruce A. Sullenger & Eli Gilboa, Emerging clinical applications of RNA, Nature, 2002, 418, July 11, pp. 252-258).
К ингибиторам генов, например, можно отнести комплементарные РНК, которые специфически распознают целевые транскрипты путем формирования с ними пар оснований в соответствии с их последовательностями. Они имеют и другое название - антисенс РНК. Формирование с ними дуплекса РНК приводит к деградации РНК-мишени, и в результате, к ингибированию ее трансляции. Были сделаны открытия, показавшие, что некоторые РНК могут быть катализаторами гидролиза РНК, что в свою очередь, привело к развитию нового класса терапевтических РНК, так называемых транс-расщепляющих (trans-cleaving) рибозимов. Такая привязка рибозимов к субстрату РНК через взаимодействие спаренных оснований, расщепляет связанные РНК-мишени, освобождая продукты расщепления. (Guerrier-Takada, С, Gardiner, К., Marsh, Т., Расе, N. & Altaian, S, The RNA moiety of ribonuclease P is the catalytic subunit of the enzyme, Cell, 1983, 35, pp. 849-857). Были проведены несколько клинических испытаний I и II фазы с использованием транс-расщепляющих рибозимов у небольшого количества больных с инфекционными заболеваниями. (Wong-Staal, F., Poeschla, ЕМ & Looney, DJ, A controlled, Phase 1 clinical trial to evaluate the safety and effects in HIV-1 infected humans of autologous lymphocytes transduced with a ribozyme that cleaves HIV-1 RNA, Hum. Gene Ther. 1998, 9, pp. 2407-2425) К сожалению, эти клинические исследования показали, что данный метод не дает долговременного эффекта (Bruce A. Sullenger & Eli Gilboa, Emerging clinical applications of RNA, Nature, 2002, 418, July 11 pp. 252-258) К критическим факторам, определяющим успех испытаний указанных синтетических рибозимов, относится способность обеспечить эффективную доставку рибозимов в соответствующие клетки in vivo, а также уровень и продолжительность торможения целевого гена, который должен замедлять развитие болезни. Для выздоровления пациентов с хроническими заболеваниями, такими как рак, ВИЧ-инфекция и гепатит С, нужны устойчивые к расщеплению рибозимы, с высоким уровнем торможения целевых транскриптов. На практике это трудно достичь, особенно когда мишенью является многокопийная вирусная РНК с высоким уровнем экспрессии.
К ингибиторам белков относятся химически синтезированные РНК, которые могут образовывать сложные структуры, вступающие в молекулярное взаимодействие с белками и поддерживающие с ними стабильные комплексы. (Daley DTA, Luscombe NM, Berman HMand Thornton JM, Protein-RNA interactions: a structural analysis. Nucleic Acids Research, 29, 4, pp. 943-954. Для отбора таких биологически активных РНК, представляющих собой олигонуклеотиды длиной 15-35 нуклеотидов, недавно был разработан ряд технологических решений. Такие олигонуклеотиды могут специфически связываться с белковыми мишенями (AD Keefe, S. Pai, A. Ellington, Aptamers as therapeutics, Nature Review, 2010, 9, pp. 537-550)
Прежде всего были разработаны технологии химического синтеза олигонуклеотидов, которые с высокой аффинностью связываются с белковыми мишенями и включают широкий круг белков, в том числе цитокины, протеазы, киназы, рецепторы на поверхности клеток и молекулы клеточных адгезии. В настоящее время разрабатываются химически синтезированные олигонуклеотиды, способные системно вводиться в организм. В первую очередь это мишени крови, такие как тромбин, фактор IXa и фактор Виллебранда, или мишени на поверхности клеток, такие как рецептор эпидермального фактора роста (EGFR).
Химически синтезированные олигонуклеотиды могут использоваться для терапевтических целей и в настоящее время проходят клинические испытания для лечения заболеваний глаз, гематологических заболеваний и для лечения рака (Keefe AD, Schaub RG, Aptamers as candidate therapeutics for cardiovascular indications, Curr. Opin. Pharmacol. 2008 Apr., 8 (2), pp. 147-52, Epub Jan 28, 2008; Barbas AS, Mi J., Clary BM, White RR, Aptamer applications for targeted cancer therapy, Future Oncol., 2010, Jul, 6 (7), pp. 1117-26)
Большинство химически синтезированных олигонуклеотидов в организме подвергаются опосредованной нуклеазами (ферментами сыворотки крови) деградации, почечной фильтрации, поглощению печенью, селезенкой и другими тканями. Поэтому олигонуклеотиды, не защищеные модифицированными нуклеотидами, имеют период полураспада в крови не более чем 2 минуты. При помощи достаточно трудоемкого процесса можно специфически модифицировать нуклеотиды, входящие в состав химически синтезированных олигонуклеотидов, и провести их защиту на 3′-конце, что повысит устойчивость нуклеаз сыворотки крови (Floege J. et al., Novel approach to specific growth factor inhibition in vivo antagonism of platelet-derived growth factor in glomerulonephritis by aptamers, American Journal of Pathology, 1999, 154, pp. 169-179; Beigelman, L. et al., Synthesis and biological activities of a phosphorodithioate analog of 2′, 5′-oligoadenylate, Nucleic Acids Res., 1995, 23, pp. 3989-3994). Данная стратегия увеличит полураспад таких олигонуклеотидов в сыворотке крови в десятки раз. Для снижения почечной фильтрации их коньюгируют с полимерам типа PEG с высокой молекулярной массой, что предотвращает утечку препарата путем почечной фильтрации. Неконъюгированные олигонуклеотиды выводятся из системы кровообращения мыши с периодом полураспада 5-10 минут, в то время как 40 кДа PEG-конъюгаты могут иметь полураспад в кровообращении не менее 1 день. (Burmeister, РЕ et al., Direct in vitro selection of a2′-O-methyl aptamer to VEGF. Chem. Biol., 2005, 12, pp. 25-33).
Сейчас существует несколько химически синтезированных олигорибонуклеотидов, которые уже прошли клинические испытания и находятся в процессе рассмотрения. В декабре 2004 года US FDA одобрило первый химически синтезированный олигонуклеотид Pegaptanib для терапевтического использования, который в настоящее время продается Pfizer и Eyetech как Macugen. Это 27 членный олигорибонуклеотид, вводящийся интравитреально инъекциями в глаз один раз в 6 недель с целью улучшения утраченной остроты зрения при возрастной макулярной дегенерации (ВМД) (Chakravarthy, U. et al., Year 2 efficacy results of 2 randomized controlled clinical trials of pegaptanibfor neovascular age-related macular degeneration, Ophthalmology, 2006, 113, e1-e25).
На II фазе клинических испытаний находится REG1, 34-членный олигонуклеотид, являющийся специфическим ингибитором фактора свертывания IXa. Он обеспечивает быстрое начало антикоагуляции in vivo после введения и быстро возвращается к исходному уровню после введения антидота RB007. (Chan MY et al., Phase 1b randomized study of antidote-controlled modulation of Factor IXa activity in patients with stable coronary artery disease circulation, 2008, 117, pp. 2865-2874). На первой фазе клинических испытаний находится ARC 1905, являющийся 39-членным олигонуклеотидом, который используется совместно с vEGF-специфичниим фрагментом антитела Ранибизумаб для AMD заболевания (Biesecker G, et al., Derivation of RNA aptamer inhibitors of human complement C5, Immunopharmacology, 1999, 42, 1-3,, pp. 219-230).
Тотальные РНК, особенно выделенные из дрожжей, уже длительное время используются как терапевтические препараты. (Zemskov V.M, Lidak М., Zemskov А.М, Mikstays U.Ya., Small RNA. Preparation, hydrolysis and its application in medicine, Riga, Zanatne, 1985, p. 191) Однако в данном случае используется натриевая соль дрожжевой РНК, которая является недостаточно очищенной, имеет высокую гетерогенность по молекулярному весу (в ней присутствует весь спектр нуклеотидных соединений от динуклеотидов в малых транспортных РНК) и обладает только иммуномодулирующими свойствами (Zemskov AM, Perederiy VG, Zemskov VM, Bychkova NG, Immunocorrective nucleic acid drugs and their clinical application, Kiev, Healthy, 1994, p. 232).
Известны использования дрожжевой рибонуклеиновой кислоты для заживления ран. (Kulkarni et al., Ribonucleotide preparations and uses thereof - US Patent No. 5712256, Jan. 27, 1988). Однако в данном случае используются продукты гидролиза РНК, а не сама РНК, как определенная последовательность, или конфигурация за счет ее вторичной структуры.
Для лечения воспаления и связанных с воспалением заболеваний была предложена высокоочищенная, гомогенная по молекулярному весу дрожжевая РНК. (Tkachuk Z., Compound, composition and method for the treatment of inflammatory and inflammatory-related disorders, US Patent No. 6737271, May 18, 2004). На основе этой субстанции был создан препарат нуклеинат, успешно прошедший II фазу клинических испытаний и успешно продвигающийся на фармрынке Украины в течение последних семи лет. Нуклеинат зарекомендовал себя как иммуномодулятор и противовоспалительный препарат для лечения острых и хронических воспалений легких, почек и других воспалительных процессов. Однако высокоочищенная дрожжевая РНК не обладает специфической противовирусной активностью. Нуклеиновые кислоты, в частности РНК, до сих пор не использовались как специфические противовирусные препараты с множественным действием против многих вирусных заболеваний.
Вирусы гриппа. Вирус гриппа относится к семейству ортомиксовирусов (лат. Orthomyxoviridae) и включает три серотипа А, В, С. Вирусы серотипов А и В составляют один род, а серотип С - другой. Каждый серотип имеет свою антигенную характеристику, определяемую нуклеопротеинами (NP) и матричными (М) белковыми антигенами. Вирусы гриппа типа А широко распространены в природе и поражают как людей, так и некоторых млекопитающих и птиц. Вирусы гриппа типа В выделяются только у человека, типа С - у людей и свиней. Возбудители гриппа типа А и В ответственны за ежегодные эпидемии. Серотип А включает подтипы, которые различаются по характеристике своего гемагглютинина (Н) и нейраминидазы (N). Для вирусов серотипа А (реже В) характерна частая смена антигенной структуры при пребывании их в естественных условиях. Антитела, вырабатываемые в ответ на гемагглютинин, составляют основу иммунитета против определенного подтипа возбудителя гриппа. В настоящее время известно 15 подтипов гемагглютинина (НА) и 10 подтипов нейраминидазы (NA) вирусов гриппа типа А, циркулирующих среди позвоночных. По данным вирусологических, иммунологических и серологических исследований, эпидемии и пандемии, начиная с 1889 года, были вызваны вирусами, имеющими в своем составе гемагглютинин H1, Н2 или НЗ и нейраминидазу N1 или N2. Эти возбудители объединены в три подтипа вируса гриппа А человека, A (H1N1), A (H2N2) и A (H3N2), в появлении которых на эпидемиологической орбите наблюдается определенная цикличность. Вирусы паразитируют в эпителии слизистых оболочек носоглотки и верхних дыхательных путей и обладают сильным токсином, поражающим кровеносные сосуды и капилляры.
Во время эпидемии вирус гриппа атакует большое количество людей, что отрицательно влияет на экономику страны. Поэтому поиск и использование химиотерапевтических препаратов, способных блокировать размножение вируса, является очень важным. До недавнего времени эффективность химиопрофилактики гриппа, а также других вирусных заболеваний была очень низкой. Первое сообщение о противовирусном действии 1-амино-адамантана сделал в 1963 году Джексон и соавторы. (Jackson GG, Muldon RL, Akers LW, Serological evidence for prevention of influenza infection in volunteers by anti-influenzal drug amantadine hydrochloride, in Antimicrobial agents and chemotherapy, S. 1., Acad. Press, New York, 1964, pp. 703-707). В 1964 году Дивайс и соавторы опубликовали результаты экспериментов (Davies WL, Grunert RR, De Somer P. et al., Antiviral activity of I-adamantanamine (amantadine), Science, 1964, 144, pp. 862-863), и с тех пор ремантадин стал основным препаратом, который широко используется для профилактики и лечения гриппа.
В 1970 году была открыта кристаллическая структура вирусной нейраминидазы гриппа А и В типов и доказано, что ингибирование нейраминидазной компоненты вируса гриппа задерживает размножение вируса. (Miller W.Е., Mechanisms of action and pharmacology chemical agents, in Antiviral agents and viral diseases of man, Ed. By GJ Gallasso et al., Raven Press, New York, 1979, pp. 77-149; Hay den FG, Osterhaus AD, Treanor JJ et al., Efficacy and safety of the neur-aminidase inhibitor zanamivir in the treatment of influenza virus infections, in GG 167 Influenza Study Group, N. Engl. J. Med., 1997, 337, 13, pp. 874-880). Это позволило создать препараты осельтамивир и занамивир, блокирующие активность нейраминидазы А и В типов вируса гриппа. Эти препараты защищают от заражения клетки эпителия дыхательных путей и предотвращают распространение вируса в организме. Осельтамивир и занамивир показали высокую профилактическую и лечебную эффективность с уменьшением в среднем на 2-3 дня периода лечения и облегчением протекания болезни (Monto AS, Fleming DM, Henry D. et al., Efficacy and safety of the neuraminidase inhibitor zanamivir in the treatment of influenza A and В virus infections, J. Infect. Diseases, 1999, 180, 2, pp. 254-261; Iozzo M., Efficacy and tolerability of the neuraminidase inhibitor Zanamivir, J. Acad. Phys. Assistants, 2001, 2, 2, pp. 186-188; Hoyden FG, Treanor JJ, Fritz RS et al., Use of oral neuraminidase inhibitor Osettamivir in experimental human influenza, J. Amer. Med. Assoc., 1999, 282, 13, pp. 48-50).
Эпидемии гриппа и острых респираторных вирусных инфекций сопровождаются высоким уровнем смертности и серьезными осложнениями в уязвимых группах населения. В группу риска входят люди с хроническими заболеваниями, особенно сердечно-сосудистыми (Davis MM, Taubert K., Benin AL et al., Influenza vaccination as secondary prevention for cardiovascular disease: a science advisory from the American Heart Association, Amer. College of Cardiology, Circulation, 2006, 114, pp. 1549-1553). Существует убедительное доказательство того, что острые респираторные вирусные инфекции и грипп вызывают приступы сердца. Было убедительно доказано, что препараты против вирусных инфекций является эффективным методом для снижения риска сердечных приступов у людей с сердечно-сосудистыми заболеваниями. (Warren-Gash С, Smeeth L., Hayviard AC, Influenza as a trigger for acute myocardial infarction or death from cardiovascular disease: a systematic review, Lancet Infect. Dis., 2009, 9, pp. 601-610).
Эпидемии гриппа и ОРВИ сопровождаются частой смертностью и опасными осложнениями среди уязвимых групп людей. К подверженным риску, относятся люди с хроническими патологиями, особенно такими, как сердечно-сосудистые заболевания. (Davis MM, Taubert К., Benin AL et al., Influenza vaccination as secondary prevention for cardiovascular disease: a science advisory from the American Heart Association, American College of Cardiology, Circulation, 2006, 114, pp. 1549-1553). Тем не менее, связь между заражением ОРВИ и гриппом и острым инфарктом миокарда долго оставалась неясной. В то же время, различные авторы сообщают о сезонности моделей сердечно-сосудистой смертности, напоминающих модели циркуляции ОРВИ и гриппа (Ailing DW, Blackwelder WC, Stuart-Harris CH, A study of excess mortality during influenza epidemics in the United States, 1968-1976, Am. Epidemiol., 1981, 113, Pp. 30-33; Collins SD, Excess mortality from causes other than influenza and pneumonia during influenza epidemics, Public Health Rep., 1932, 47, Pp. 2159-2179; Eickhoff T., Sherman I, Serfling R., Observations on excess mortality associated with epidemic influenza, JAMA, 1961, 176, PP. 776-782; Housworth J., Langmuir AD, Excess mortality from epidemic influenza, 1957-1966, Am.J. Epidemiol., 1974, 100, Pp. 40-48). Клинические оценки состояния пациентов с гриппом указывают на конечные системные последствия, такие как высокая температура, мышечные боли и усталость, часто сопровождающиеся проявлениями ишемии миокарда (Greaves K., Oxford JS, Price CP, Clarke GH, Crake Т., The prevalence of myocarditis and skeletal muscle injury during acute viral infection in adults: measurement of cardiac troponins I and T in 152 patients with acute influenza infection, Arch. Intern. Med. 2003 163, pp. 165-168; Ison MG, Campbell V., Rembold C, Dent J., Hayden FG, Cardiac findings during uncomplicated acute influenza in ambulatory adults, Clin. Infect. Dis., 2005, 40, PP. 415-422; Paul BK, Clinical observations of influenza, with special reference to its effects and cardiac functional efficiency, Indian Med. J., 1963, 57, PP. 251-283; Verel D., Warrack AJ, Potter CW, Ward С., Rickards DF, Observations on the A2 England influenza epidemic: a clinicopathological study, Am. Heart J., 1976, 92, pp. 290-96).
Эти результаты привели к выводу, что грипп может играть роль острого воспалительного стимула, вызывающего сердечно-сосудистые расстройства. С целью прогнозирования риска сосудистых заболеваний у людей, в качестве важного компонента стали использовать маркеры системного воспаления и воспалительной активации клеток. Известно, что вирус гриппа сильно влияет на воспалительные, коагуляционные и метаболические пути (Madjid М., Aboshady L, Awan I., Iitovsky S., Casscells SW, Influenza and cardiovascular disease: is there a causal relationship, Tex. Heart Inst. J., 2004, 31, Pp. 4-13), что может привести к дестабилизации атеросклеротических бляшек и, таким образом, к частичной окклюзии или полной обтурации коронарных сосудов, являющейся основной причиной острого инфаркта миокарда (White HD, Chew DP, Acute myocardial infarction, Lancet, 2008, 372, pp. 570-584) Кроме того, грипп может выступать в качестве острого воспалительного и прокоагуляторного стимула быстрых изменений в эндотелии (Housworth J., Langmuir AD, Excess mortality from epidemic influenza, 1957-1966, Am.J. Epidemiol. 1974, 100, Pp. 40-48; Madjid M., Awan I.., AH M, Frazier L., Casscells W, Influenza and atherosclerosis: vaccination for cardiovascular disease prevention, Expert Opin. Bid. Ther., 2005, 5, Pp. 91-96). Хорошо известны сердечные осложнения такие, как миокардит, перикардит, вызванные заболеванием гриппом, хотя пока что роль гриппа в характере триггерно-спускового механизма острого инфаркта миокарда четко не доказана. В то же время в конкретной литературе появилось много фактов того, что грипп (в том числе заболевания гриппом, и острые респираторные инфекции) может ускорить смертность от острого инфаркта миокарда или сосудистой смерти. Многочисленные исследования, проведенные в различных условиях с использованием различных методов, показывают, что существует тесная связь между гриппом и острым инфарктом миокарда. В то же время существует не так много клинических исследований, изучающих возможность снижения риска сердечно-сосудистых осложнений с помощью противовирусных препаратов и кардиопротекторное действие последних на пациентов с гриппом и ОРВИ. Только в двух небольших рандомизированных исследованиях было оценено положительное действие вакцинации против гриппа для профилактики сердечных приступов у пациентов с сердечно-сосудистыми заболеваниями. Было показано, что вакцинация против гриппа приводит к значительной защите от сосудистой смерти. Полученные оценки представленных моделей рандомизированных последствий показывают защитный эффект вакцинации. Авторы считают, что следует поощрять вакцинацию против гриппа, особенно у людей с сердечно-сосудистыми заболеваниями, которые часто оппозиционно относятся к вакцинации. (Warren-Gash С, Smeeth L, Hayviard AC. Influenza as a trigger for acute myocardial infarction or death from cardiovascular disease: a systematic review, Lancet Infect. Dis., 2009, 9, Pp. 601-610).
Таким образом, существуют многочисленные доказательства того, что грипп может спровоцировать развитие острого инфаркта миокарда, повышение сосудистой смертности, и использование антивирусных препаратов может быть эффективным способом снижения случаев сердечных приступов у пациентов с сердечно-сосудистыми заболеваниями.
Вирусы гепатита. Согласно определению Всемирной организации здравоохранения / ВОЗ /, гепатит - это воспаление печени, которое в большинстве случаев вызывается вирусной инфекцией. Существует пять основных вирусов гепатита - А, В, С, D и Е.
Гепатит А - острая инфекционная болезнь с преимущественным поражением пищеварительного тракта, особенно печени. Гепатит А вызывается вирусом гепатита А, который попадает в организм с пищей или водою. Источником инфекции является больной. Болезнь очень опасна, потому приводит к гибели печеночных клеток и нарушения всех функций печени.
Гепатит В - болезнь, вызываемая вирусом гепатита В (HBV) и поражающая печень, что приводит к ее воспалению. Ежегодно от осложнений гепатита В на Земле умирает около 600 тысяч человек. HBV передается от инфицированного к здоровому человеку при контакте или с кровью и другими жидкостями организма - семьям, а также влагалищной жидкостью и слюной. Пути распространения гепатита В идентичны вирусу иммунодефицита человека (ВИЧ), но инфекционность HBV в 50-100 раз выше. В отличие от ВИЧ, HBV может жить вне организма менее 7 дней.
Гепатит D. Вызывается вирусом гепатита D (или дельта-вирусом) и характеризуется острым развитием с массивными повреждениями клеток печени. Дельта-вирус не в состоянии развиваться сам по себе, поэтому для репликации и экспрессии он требует наличие вируса гепатита В. Пути передачи гепатита D аналогичны гепатиту В и гепатиту С. Его инкубационный период составляет от 3 до 7 недель. Клинические проявления гепатита D аналогичны гепатиту В. Вакцинация против гепатита В также предотвращает появление гепатита D.
Гепатит Е. Провоцирует симптомы, похожие на гепатит А. Пути передачи гепатита Е также аналогичны гепатиту А. Гепатит Е распространяется через загрязненную воду или пищу, также может передаваться через кровь. Чаще всего он встречается в Центральной Азии и в африканских странах.
Известны вирусы гепатита F и G, которые идентифицированы недавно и недостаточно изучены.
Гепатит С - вирусное заболевание с парентеральным механизмом заражения, которое чаще всего протекает в виде посттрансфузионного гепатита. Вирус был открыт в 1989 году в крови больных гепатитом, у которых была обнаружена вирусная РНК, характерная для флави-вирусов. Вирусный гепатит С вызывается РНК-вирусом с размером вириона 30-60 нм и принадлежит к семейству Flaviviridae.
На данный момент различают 11 основных генотипов вируса гепатита С: 1a, 1b, 1c, 2a, 2b, 2c, 3a, 3b, 4a, 4b, 4c, 4d, 4e, 5a, 6a, 7a, 7b, 8a, 8b, 9a, 10a, 11a.
Вирусные частицы HCV имеют оболочку, содержатся в крови в подпороговых количествах и ассоциированы с липопротеинами низкой плотности.
Источником инфекции являются больные с активным гепатитом С и латентные больные - носители вируса. HCV-инфекция является инфекцией с парентеральным механизмом заражения - через инфицированную кровь и ее компоненты. В настоящее время стандартом лечения вирусного гепатита С, принятым рядом стран, является комбинированная противовирусная терапия (ПВТ) препаратами интерферона альфа и рибавирина. Согласно этому стандарту ПВТ показана пациентам с постоянно повышенными уровнями АЛТ в сыворотке крови при определении РНК вируса гепатита С и наличии выраженных гистологических изменений в печени больного. Длительность терапии может составлять от 12 до 72 недель, в зависимости от генотипа вируса гепатита С. Ответы на лечение, связаны во многом с индивидуальными особенностями пациента, определяемыми его геномом. Критерием эффективности лечения в настоящее время является стойкая биохимическая ремиссия (нормализация уровня АЛТ в течение длительного времени после ПВТ) и отсутствие виремии (неопределенный уровень РНК через 6 месяцев и более после завершения лечения).
Вирусный гепатит С является глобальной проблемой здравоохранения. Возбудителем гепатита С является РНК-содержащий вирус, передающийся парентеральным путем и вызывающий у человека как острый, так и хронический гепатит, в 60-80% случаев приводящий к циррозу или раку печени. По данным ВОЗ около 1% населения планеты инфицировано вирусом гепатита С (HCV). Источником инфекции является человек, и в 100% случаев вирус определяется в крови больного.
Вирус гепатита С называют «тихим (ласковым) убийцей». В 70% случаев заболевание протекает в скрытой форме. Независимо от степени тяжести в 50-80% случаев гепатит С принимает хроническую форму с последующим развитием цирроза, карциномы, а также поражает нервные клетки, вызывая тяжелые последствия. Вирус отнесен к роду Hepatitis С like-viruses семьи Flaviviridae (Alter YJ, To or not to C: these are questions, Blood, 1995, 85, pp. 1681-1695; National Institutes of Health Consensus Development Conference Panel Statement: Management of Hepatitis C, Hepatology, 1997, 26, pp. 2-10 содержит РНК положительной полярности (Lindsay KL, Therapy of hepatitis С overview, Hepatology, 1997, 26, pp. 715-775), который характеризуется высокой степенью неоднородности (Yohko KS, Hiroshi Y., In vitro systems for the detection of hepatitis С virus infection, Viral Hepatitis Rev., 1995, 1, pp. 59-65; National Institutes of Health Consensus Development Conference Panel Statement: Management of Hepatitis C, Hepatology, 1997, 26 pp. 2-10). Препараты альфа-интерферона (ИФН) (реаферон, роферон А, интрон А и др..) остаются базовыми для лечения ВГС-инфекции (EASL International Consensus Conference on Hepatitis С. Consensus Statement. Paris, J. Hepatol., 1999, 30, pp. 976-995), однако достоверный противовирусный эффект (отсутствие РНК ВГС в сыворотке крови в течение 6 месяцев после лечения) наблюдается только в 8-12% пациентов, леченных альфа ИФН (Lindsay KL, Therapy of hepatitis С∧ overview, Hepatology, 1997, 26, pp. 715-775). Таким образом, в настоящее время остается актуальным поиск альтернативных путей терапии ВГС-инфекции.
Весьма перспективной группой препаратов для лечения вирусных инфекций, в том числе и ВГС, могут стать индукторы ИФН, которые представляют разнообразную группу высоко и низкомолекулярных природных и синтетических соединений, объединенных способностью вызывать образование ИФН. Индукторы ИФН имеют характерную антивирусную, антитуморогенную и иммунологическую активность (Ershov FY, Anti-virus Pharmaceuticals, Moscow., 1998, p. 240).
Вакцина против гепатита С в настоящее время не разработана, нет и препаратов, которые бы эффективно подавляли репликацию вируса в организме. Трудности в разработке профилактических и лечебных препаратов в отношении гепатита С заключаются в безрезультативности многих попыток получить экспериментальные модели инфекции для проведения скрининговых исследований с целью определения препаратов, способных эффективно лечить гепатит С.
Вирусы герпеса. Герпес (лат. герпесвирусов) - это большая семья ДНК вирусов, вызывающих различные заболевания не только у человека и других млекопитающих, но и птиц, рептилий, амфибий, рыб. Вирусами герпеса заражено большинство населения нашей планеты (Baltimore D. The strategy of RNA viruses, Harvey Lect., 1974, 70 Series, pp. 57-74). Герпетическая инфекция является классическим представителем латентного инфекционного процесса. Установлено, что более 70% из тех, кто впервые столкнулся с вирусом простого герпеса (ВПГ), в дальнейшем переносили рецидивы инфекции несмотря на высокий уровень противогерпетических антител.
Герпетические инфекции - это группа антропонозных инфекционных заболеваний, вызываемых вирусами герпеса человека (ВГЧ), течение которых происходит в виде HHangapaHTHbix, субклинических и клинически манифестных форм (Liesegang Т., Herpes simplex, Cornea, 1999, Vol. 18, No. 6, p. 739).
Герпес (от греч. Herpes - ползучий) - одна из наиболее распространенных и плохо контролируемых инфекций человека. В организме с нормальной иммунной системой герпетические вирусы могут циркулировать бессимптомно, но у людей с иммуносупрессией они вызывают тяжелые заболевания с летальным исходом. У человека выделено 8 типов вирусов герпеса, представленных ДНК-содержащими вирусами с очень похожей морфологией, что не позволяет различать их при электронной микроскопии (Herpesviruses, in: Baron′s Medical Microbiology, Baron S et al., Eds., 4th.; U. of Texas Medical Branch, 1996; Medical Microbiology, 5th Ed., Elsevier Mosby, 2005).
Попадая в организм человека, ВПГ пожизненно приживается в нем, периодически вызывая рецидивы разнообразной тяжести. ВГЧ находятся в латентном состоянии в паравертебральных сенсорных ганглиях в виде L-PREP-частиц. Типичным представителем ВГЧ является вирус простого герпеса 1-го типа ВПГ-1, или ВГЧ-1, который вызывает орофациальный герпес.
Близким к нему по морфологическим, антигенным и физико-химическим свойствам является вирус герпеса человека 2-го типа (ВГТГ-2, или ВГЧ-2), который вызывает генитальный герпес (ГГ). ГГ - это один из случаев герпетической инфекции, относящийся к наиболее распространенным заболеваниям, передающимся половым путем, которые отличаются от других заболеваний этой группы пожизненным носительством возбудителя в организме человека (латенции). Это обстоятельство обусловливает высокую частоту возникновения болезни, которой присущи частые рецидивы.
Возникновение ГГ часто связывают с ВПГ-2. К такому выводу приводят данные по частоте выявления антител к этому серотипу вируса при эпидемиологических исследованиях. Раньше считали, что ВПГ-1 чаще идентифицируется при поражении кожи лица, верхних конечностей, туловища. Сейчас установлено, что ГГ может быть вызван ВПГ-1. При этом генитальная инфекция, вызванная ВПГ-1, рецидивирует сравнительно редко, чаще рецидивы возникают у больных с высокими титрами антител к ВПГ-2. Методом гибридизации ДНК ВПГ и ДНК из тканей, полученных при операциях рака шейки матки и злокачественных патологий цервикального канала, установлена роль этого вируса в возникновении рака шейки матки.
Вирус герпеса человека 3-го типа (ВГЧ-3) вызывает два самостоятельных заболевания - ветряную оспу и опоясывающий лишай. Вирус герпеса человека 4-го типа (ВГЧ-4), или вирус Эпштейна-Барра, - это этиологический фактор инфекционного мононуклеоза, лимфомы Беркитта, назофарингиальной карциномы, волосистой лейкоплакии языка. Вирус герпеса человека 5 типа (ВГЧ-5) приводит к цитомегаловирусной инфекции и, наконец, вирус герпеса человека 6-го типа (ВГЧ-6), как установлено последнее время, вызывает внезапную экзантему у детей раннего возраста и синдром хронической усталости у взрослых. В современной литературе содержатся данные, которые косвенно указывают на возможное участие ВГЧ-6 в развитии лимфогрануломатоза, злокачественной В-клеточной лимфомы, саркоидоза, синдрома Шегрена, болезни Крона, аутоиммунного тиреоидита, а также инфекционного мононуклеоза, не связанного с вирусом Эпштейна-Бара. Выявлена причастность этого вируса к развитию острых гепатитов у взрослых и детей, включая гепатиты с фульминантным течением и быстрым летальным исходом. В 1990 г.открыли ВГЧ-7 и ВГЧ-8, значения которых в патологии до сих пор мало изучены. ВГЧ-7 ассоциируется с лимфопролиферативными заболеваниями и синдромом хронической усталости, а ВГЧ-8 - с саркомой Капоши.
Лечение герпетической инфекции остается до сих пор сложной проблемой. Длительный хронический процесс приводит к негативной иммунной перестройке организма. Наблюдается развитие повторной иммунной недостаточности, угнетение реакций клеточного иммунитета, снижение неспецифической защиты организма, выражающееся в пониженной способности лейкоцитов синтезировать α- и γ-интерфероны (ИФН), гипоимуноглобулинемии, сенсибилизации к вирусным антигенам (Herpesviruses, in Baron′s Medical Microbiology, Baron S et al., Eds.; 4th U. of Texas Medical Branch, 1996; Medical Microbiology, 5th Ed., Elsevier Mosby, 2005)
Сегодня антигерпетики составляют около 80% имеющихся антивирусных препаратов, что опять же доказывает актуальность проблемы. Большинство из них - это аномальные нуклеозиды. Возникает вопрос - почему при таком огромном количестве и разнообразии лекарственных средств герпетические заболевания все еще плохо контролируются. В последнее время возросло количество сообщений об устойчивости ВПГ против многих антигерпетичних препаратов на основе аномальных нуклеозидов. Механизм их действия сочетает в себе как ингибирование ферментов, участвующих в репликации вируса (тимидинкиназы, ДНК-полимеразы), так и индукцию синтеза интерферона. Отсюда и вопрос - почему несмотря на значительное количество и разнообразие противовирусных препаратов герпетическая инфекция по-прежнему плохо поддается лечению. Последние отчеты показывают, что устойчивость ВПГ к противогерпетическим аномальным нуклеозидам возрастает в течение последних лет. Поэтому наиболее перспективным является путь создания антивирусных препаратов, влияющих на первые стадии репродукции вирусов - адсорбцию и слияние вирусов с клеткой. Новые антивирусные препараты моделируются как лиганды имитации или имитаторы рецепторов, конкурентно замещают природные компоненты при взаимодействии с клеткой хозяина.
Вирус иммунодефицита человека. Синдром приобретенного иммунодефицита (СПИД) впервые был зафиксирован в США в 1983 году. В течение двух месяцев больной умер. В настоящее время около 14000 новых случаев инфицирования происходят ежедневно. Возбудителем является вирус, имеющий вид спиральки в треугольной сердцевине. Он носит название ВИЧ (вирус иммунодефицита человека) и имеет три типа: ВИЧ 1 и ВИЧ 2, которые очень распространенны в Западной Европе, и ВИЧ 3, из-за которого страдают преимущественно американцы и африканцы. Вирус поражает Т - лимфоциты, служащие для его размножения, и макрофаги, которые разносят его по организму.
Сам по себе СПИД не является смертельной болезнью, но функционирование его вируса в организме влияет на иммунную систему так, что даже простой насморк может привести к смерти человека. ВИЧ разрушает Т-лимфоциты, и это приводит к потере организмом защитных реакций, в результате чего активизируется так называемая условно-патогенная флора организма и резко повышается вероятность смертельных воспалений, поражений нервной системы, развития онкологических заболеваний.
Источником инфекции является непосредственный носитель ВИЧ. Заражение возможно только при половом контакте с инфицированным или при кровообмене с ним. Если ВИЧ-инфицированная женщина рожает ребенка, то по последним исследованиям, этот ребенок вовсе не обязательно должен быть носителем вируса.
Антиретровирусная терапия позволяет снизить риск передачи вируса от матери к ребенку всего лишь до 6 процентов. (Sepkowitz KA. «AIDS - the first 20 years». N. Engl. J. Med. 2001, 344 (23):1764-72. Divisions of HIV / AIDS Prevention HIV and Its Transmission. Centers for Disease Control & Prevention, 2003).
Первый антиретровирусный препарат, известный как азидотимидин, был синтезирован в 1964 году, а в 1987 году он был одобрен для лечения ВИЧ-инфекции и с тех пор широко используется в практике (Balzarini J., Naesens L., Aquaro S., Knispel T, Perno C.-R, De Clercq E., Meier C: Intracellular Metabolism of CycloSaligenyl 3′-Azido-2′-3′-dideoxythymidine Monophosphate, a Prodrug of 3′-Azido-2′-3′-dideoxythymidine (Zidovudine). Molecular Pharmacology 1999; 56: pp. 1354-1361).
В середине 90-х стали доступны первые ингибиторы протеаз, в том числе саквинавир, ритонавир и индинавир. Их использование позволило снизить смертность с 38 до 22 процентов (Cameron DW, Heath-Chiozzi М, Danner S, Cohen С, Kravcik S, Maurath C, Sun E, Henry D, Rode R, Potthoff A, Leonard J.Randomised placebo-controlled trial of ritonavir in advanced HIV-1 disease. The Advanced HIV Disease Ritonavir Study Group. Lancet. 1998; 351 (9102):543-9).
В 1996 году был предложен первый ненуклеозидный ингибитор обратной транскриптазы - невирапин - и еще один ингибитор протеазы - нелфинавир. В Европе использование новых препаратов позволило снизить связанные со СПИДом заболевания с 30,7% до 2,5% (Harrington М, Carpenter СС. Hit HIV-1 hard, but only when necessary. Lancet. 2000 Jun 17; 355 (9221):2147-52).
Однако несмотря на большое количество довольно дорогих антиретровирусных препаратов для этого вируса тоже существует проблема устойчивости к предложенным препаратам. Поэтому поиск новых препаратов, способных инактивировать много белков ВИЧ, не прекращается, а в последнее время еще усиливается. Особенно острая потребность заключается в препаратах, способных не только ингибировать репродукцию ВИЧ, но и одновременно подавлять репликацию других вирусов, например вирусов гепатита, которые часто сопровождают заболевания СПИДом.
Энтеровирусы - вирусы семейства Picornaviridae. Они включают 67 патогенных для человека серотипов: 3 типа вирусов полиомиелита, 23 типа вирусов Коксаки А, 6 типов вирусов Коксаки В, и др. Название энтеровирусов связано с их репродукцией в ЖКТ, однако энтерит они вызывают редко. Энтеровирусы человека содержат одноцепочечную РНК, кодирующую полипротеин, который расщепляется на 11 различных белков. РНК окружена икосаедричним капсидом, содержащим 4 вирусных белка (VP1-VP4). VP1 - основная мишень нейтрализующих антител. Энтеровирусы распространены повсеместно.
Вирус Коксаки вызывает у человека различные заболевания, чаще всего - бактериальный менингит и миалгии. Эти заболевания протекают в пищеварительном тракте, как и все заболевания, вызванные энтеровирусами. Различаются типы А и В. Тип А включает в себя около 24 вирусов-возбудителей таких заболеваний как герпетическая ангина, бактериальный менингит, перикардит, общие лихорадочные инфекции и т.п. Тип В вызывает болезнь Борнхольма (плевродиния, миалгия). Клинические симптомы вирусов А и В четко отличаются друг от друга. Тип В 4 действует на центральную и периферическую нервные системы, при этом могут наблюдаться головные боли, боли в затылке и в груди.
Потребность в новых противовирусных препаратах.
В настоящее время существует необходимость разработки новых противовирусных препаратов с различными механизмами действия против различных вирусных заболеваний. Эти препараты должны вмешиваться в механизмы, ответственные за проникновение вирусов в клетку-хозяина и их высвобождение из нее. Возможность создания препаратов, способных подавлять многих представителей семейства вирусов, была основана на открытиях Чарльза Джейнвей и его последователей (Janeway Jr., СА, Approaching the asymptote? Evolution and revolution in immunology, Cold Spring Harbor Symposia on Quantitative Biology, 1989, 54, 1, pp. 1-13).
Во-первых, было показано, что все живые организмы имеют врожденный иммунитет. Этот врожденный иммунитет существует на генетическом уровне и обеспечивает способность организма к борьбе с чужими микроорганизмами, трансплантатами, токсинами, опухолевыми клетками, и клетками, инфицированными вирусами. Система врожденного иммунитета включается с появления первого возбудителя и реагирует на некоторые классы антигенов, специфичных для возбудителя организмов.
Во-вторых, клетки врожденного иммунитета обладают так называемыми Toll-подобными рецепторами, (TLR), которые признают эти классы антигенов и активируют врожденный иммунитет.
В-третьих, TLR являются специфическими для определенного класса инфекций, то есть способны распознавать определенный тип чужих молекул, например РНК вируса, а не вообще нуклеиновые кислоты. Люди имеют больше десяти TLR-ов, каждый из которых специализируется на определенном классе патогенов. Один признает РНК вирусных инфекций, другой - полисахариды бактерий, третий - белки одноклеточных паразитов, и т.д.
Рецепторы находятся на клетках различных типов, включая клетки кожи и эпителия. В случае опознания вируса фактор инфицированной клетки с помощью TLR может отключить синтез вирусных белков, чтобы начать запрограммированную гибель зараженной клетки (апоптоз). Иммунные клетки, обнаружившие вирус, могут распространять сигналы для экспрессии цитокинов, факторов, вызывающих воспаление, а также могут выделять антивирусные факторы, такие как интерферон.
Техническим результатом заявленного изобретения является создание способа профилактики и лечения вирусных инфекций при помощи нового лекарственного препарата с универсальным комплексным механизмом действия в отношении существующих вирусов, новых недавно выявленных вирусов, и в отношении вирусных заболеваний, вызванных несколькими различными вирусами, а также раскрытие способа его получения.
Достижение технического результата обеспечивается тем, что способ профилактики и/или лечения вирусных инфекций включает введение пациенту в количестве, достаточном для профилактики и/или лечения, композиции из высокоочищенного экстракта дрожжевой РНК, которая имеет не менее 75% по массе фрагментов 25±10 нуклеотидов, с чистотой предпочтительно, по меньшей мере, 99%, в сочетании с маннитом в пропорции от 2:1 до 3:1 по весу, где экстракт дрожжевой РНК был предварительно нагрет с маннитом, при этом экстракт дрожжевой РНК составляет не менее 50% от веса композиции.
При этом сама композиция для профилактики и/или лечения вирусных инфекций включает высокоочищенный экстракт дрожжевой РНК, имеющий по массе не менее 75% фрагментов 25±10 нуклеотидов, с чистотой предпочтительно, по меньшей мере, 99%, при этом экстракт дрожжевой РНК предварительно нагрет с маннитом и находится с ним в пропорции от 2:1 до 3:1 по весу, причем экстракт дрожжевой РНК составляет не менее 50% от веса композиции.
В соответствии со следующим аспектом изобретения вышеуказанную композицию получают путем нагревания высокоочищенного экстракта дрожжевой РНК с маннитом при температуре в диапазоне 40-70°С, при этом экстракт дрожжевой РНК содержит по массе не менее 75% фрагментов 25±10 нуклеотидов, с чистотой предпочтительно, по меньшей мере, 99%, и находится с маннитом в пропорции от 2:1 до 3:1 по весу, причем экстракт дрожжевой РНК составляет не менее 50% от веса композиции.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Поскольку к этому времени большинство противовирусных препаратов действовали только на один фактор инфекции, вирусы очень быстро начинали проявлять устойчивость к этим препаратам.
Изобретение предлагает композицию и способ лечения, которые обеспечивают множественное действие препарата на несколько этапов развития вирусов. Такое многоэтапное и устойчивое противовирусное действие препарата исключает быструю выработку вирусом устойчивости к таким препаратам.
Поскольку целый ряд вирусных заболеваний сопровождается действием нескольких вирусов и требует применения в клинике многих противовирусных препаратов, данное изобретение предлагает препарат, который способен противостоять одновременно нескольким вирусам. Например, при ОРВИ больные часто встречаются с комплексной инфекцией вирусов гриппа и парагриппа, а применение предложенного препарата, позволяет успешно противостоять указанным вирусам одновременно. Подобная картина отмечается при заболевании СПИД-ом, где часто вместе с вирусом ВИЧ обнаруживают вирусы гепатита.
Ранее предложенные лекарственные препараты на основе рибонуклеиновых кислот являются химически синтезированными соединениями, они достаточно дороги и с точки зрения технологии их использования не пригодны для лечения массовых вирусных заболеваний. Изобретение предлагает препарат, созданный на основе дешевой естественной субстанции - дрожжевой рибонуклеиновой кислоты, который можно использовать в массовом порядке в виде капсул, таблеток и других доступных лекарственных форм.
Такие вирусные инфекции как СПИД, гепатит С и другие, требуют длительного комплексного лечения антибиотиками и другими противовирусными препаратами, часто обладающими высокой токсичностью и влиянием на психическую и нервную деятельность пациентов. Предлагаемое изобретение - это препарат, который является нетоксичным и не имеет побочных последствий при длительном комплексном лечении.
В то же время в данном изобретении показано, что РНК соединения, похожие по своей конформации на РНК вируса, способны активировать иммунную систему и действовать в качестве антибиотиков в отношении различных вирусов, вызывающих у людей тяжелые заболевания, такие как пандемия гриппа, гепатита С, генитального герпеса и СПИД. Высокоочищенная дрожжевая РНК, подвергшаяся термообработке, должна, соответственно, улучшать противовирусные свойства. Как описано ниже, было выполнено комплексное изучение препаратов, содержащих дрожжевую рибонуклеиновую кислоту (РНК) в различных, in vitro и in vivo моделях. Указанные модели соответствуют определенным типам вирус-индуцированных заболеваний. Действие РНК-содержащих препаратов было сравнимо с действием лекарств, одобренных в настоящее время для противовирусной терапии.
1. Модели гриппозной инфекции in vitro и in vivo.
Антигриппозную активность препарата in vitro определяли на перевиваемой культуре клеток MDCK (клетки почки собаки) со сплошным слоем в соответствии с рекомендациями (Preclinical drug research: guidelines. - Kyiv, 2001. - С. 371-396). Антигриппозную активность препарата in vivo изучали на модели гриппозной пневмонии у мышей по профилактической и лечебной схемам.
Было показано, что РНК-препараты могут быть применены для лечения гриппа. В конкретном варианте, максимально переносимая концентрация (МПК) составляет 5000 мкг/мл, минимально активная концентрация (МАК) составляет 31 мкг/мл, а химиотерапевтический индекс (ХТИ) составляет 161.
Эффективная доза композиции экстракта РНК и сахара, когда сахаром является, например, маннит (РНК-М), рассчитана in vitro в пределах 1.25-10 мг/мл в профилактических целях и 0,6-10 мг/мл для лечения. Высокая антигриппозная активность препарата была продемонстрирована для профилактического лечения мышей при внутрибрюшинном и внутривенном введении в дозах от 15 до 150 мг/кг. В случае интраназального введения, например, эффективная доза была в десять раз выше. Было установлено, что антигриппозное действие РНК-М связано с угнетением нейраминидазы и гемагглютинина вируса гриппа. Кроме того, соединение экстракта РНК - сахар является пролонгированным индуктором альфа-интерферона in vivo. В дальнейшем дозу введения рассчитывали по количеству РНК в составе.
Таким образом, на моделях in vitro та in vivo, использовавшихся для оценки противогриппозного действия препаратов показано, что соединение, полученное из дрожжевой РНК, характеризуется мощной противовирусной активностью. Поскольку РНК-М обладает антинейраминидазным и гемагглютинин угнетающим действием, этот препарат может рассматриваться как обладающий специфической антигриппозной активностью.
2. In vitro и in vivo модели вирусов гепатита.
Вместе с тем, в данном изобретении против вируса гепатита С (HCV) была продемонстрирована активность производных соединений дрожжевой РНК на экспериментальной модели суспензионной культуры клеток МТ-4, инфицированных HCV, и на новой модели продуцирующей культуры клеток трансфицированных кДНК HCV (МТ-4 - HCV кДНК модель), а также на суррогатной тест-модели вируса гепатита С с вирусом бычьей диареи (BVDV).
Было установлено, что препарат РНК-М достаточно эффективен против вируса гепатита С, в частности HCV человека.
Результаты исследования эффективности препарата, содержащего экстракт очищенной РНК, например, выделенный из дрожжей, в сочетании с сахаром, например маннитом, на модели культуры МТ-4, инфицированной HCV показали, что в лучшем варианте использования препарата на основе РНК МПК составляет 50 мг/мл, МАК составляет 0,25 мг/мл, а химиотерапевтический индекс равен 200.
Результаты исследований антивирусной активности препарата, содержащего по существу очищенный экстракт РНК, например, выделенный из дрожжей, в сочетании с сахаром, например с маннитом, на модели MDVK-BVDV показывают, что в концентрации менее около 1 мг/мл, препарат подавляет размножение вирусов на 2,0 Lg ID50, а в концентрации не менее 0,5 мг/мл - соответственно на 3,0 Lg ID50.
Таким образом, препарат РНК-М может быть классифицирован как высокоэффективный антивирусный препарат, способный ингибировать репликацию HCV человека.
Результаты эксперимента также показали, что экстракт очищенной РНК, например, из дрожжей, в сочетании с сахаром, например маннитом, полезно использовать в терапии пациентов с гепатитом. В частности, была подтверждена высокая эффективность лечения пациентов с гепатитом С, включающая улучшение состояния пациентов, стабилизацию биохимических показателей, снижение количества копий вируса в образцах выделенных в сыворотке крови больных. Препарат хорошо переносился, побочных эффектов не было зарегистрировано.
3. In vivo модели вирусов герпеса.
Изучение in vivo профилактической и терапевтической активности РНК-М было произведено на клеточной линии из почки кролика (RK13). Изучение in vivo противогерпетической активности РНК-М было проведено на модели мышиного герпетического менингоэнцефалита, вызванного вирусом простого герпеса (ВПГ-1), а также на модели инфекции генитального герпеса морских свинок, инфицированных ВПГ-2. Цитологический анализ был произведен в чувствительных к герпесу клетках гассерова ганглия невриномы крыс
Установлено, что РНК-препарат обладает мощным противогерпетическим действием.
В частности, препарат, содержащий экстракт очищенной РНК, например, из дрожжей, в сочетании с сахаром, например с маннитом, оказался активным противогерпетическим агентом. В лучшем варианте, его вирус-ингибирующая активность in vitro, лежит в пределах от 60 до 1000 мкг/мл, его МАК составляет 60 мкг/мл, МПК составляет 5000 мкг/мл, а химиотерапевтический индекс составляет 83,3.
Эффективность препарата in vitro, содержащего очищенный экстракт РНК, например, из дрожжей, в сочетании с сахаром, например маннитом, при профилактической и лечебной схемах введения, находится в широком диапазоне концентраций от 0,6 до 10 мг/мл. Препарат в профилактической дозе 0,1 мг/мл и в лечебной дозе 1 мг/мл не оказывает отрицательное влияние на митотический индекс и на количество патологических митозов.
В частности, на модели герпетического менингоэнцефалита при внутрибрюшинном введении 0,5 мг/кг соединения РНК-маннитол (РНК-М) по лечебной схеме введения индекс эффективности составляет 41.2. В частности, очень эффективным является использование мази РНК-М при местном применении на модели генитального герпеса. При профилактической (в дозах от 0,1 мг/мл) и при лечебной (в дозе 1,0 мг/мл) схемах введения РНК-М, индекс терапевтической активности (ИТА) составляет соответственно 100% и 73,2%. При проведении опытов на животных оказалось, что РНК-М превосходит действие Virolex®, который использовался как референтный препарат.
Результаты, полученные на моделях in vitro и in vivo, использовавшихся для отбора противогерпетических препаратов, позволяют сделать вывод, что комбинация экстракта очищенной РНК, например, из дрожжей, вместе с маннитом, обладает мощным противогерпетическим действием. Было продемонстрировано, что она эффективна при лечении вирусного герпетического заболевания, в частности при лечении герпеса половых органов.
4. In vivo модели вирусов СПИДа. В данном изобретении показано, что экстракт очищенной РНК, например, из дрожжей, в сочетании с маннитом, эффективно ингибирует репликацию ВИЧ. В частности, была продемонстрирована эффективность РНК-М в лечении ВИЧ-инфицированных пациентов и, как следствие действия, снижение уровня вирусной нагрузки и увеличение количества CD4+ Т-лимфоцитов.
5. In vivo модели энтеровирусов. В данном изобретении показано, что экстракт очищенной РНК, например, из дрожжей, в сочетании с маннитом, является высокоактивным противовирусным средством, с высоким антиэнтеровирусным действием.
6. Состав и введения препарата. Как правило, введение соединения очищенной РНК после температурной обработки с маннитом для профилактического действия может быть в дозе не меньшей 0,1 мг/кг/день, и для лечения - около 10 мг/кг/день, по крайней мере, с одним фармацевтическим транспортным средством, например с приемлемым носителем, наполнителем и растворителем. Далее дозу введения препарата рассчитывают по количеству РНК в составе. Для профилактики гриппа при внутрибрюшинном или внутривенном введении лучше применять препарат в концентрации от примерно 1,5 до примерно 10 мг/кг/сут, а при интраназальном введении, лучше, по меньшей мере, 2,5 мг/кг/день, или еще лучше - менее 25 мг/кг/сут.
Для лечения гриппа при внутрибрюшинном или внутривенном введении, лучше применять препарат в дозах от около 1,5 до около 25 мг/кг/сут, а при интраназальном введении, предпочтительно, от около 2,5 до около 25 мг/кг/день и около 50 мг/кг/сут.
Лучшая эффективная доза для подавления гемагглютинации - около 1 мг/мл, еще лучше - по меньшей мере, около 10 мг/мл.
Лучшая эффективная доза для подавления размножения вируса гепатита С в культуре клетками, по меньшей мере, 0,25 мг/мл, еще лучше менее 0,5 мг/мл.
Для профилактических и лечебных схем введения при лечении герпетического заболевания агента эффективная доза находится в широком диапазоне концентраций от 0,6 до 10 мг/мл.
Эффективная доза для профилактических и лечебных схем введения препарата находится в широком диапазоне концентраций от 0,1 до 10 мг/мл соединения экстракта очищенной РНК из дрожжей с маннитом. В частности, в профилактических дозах она находится в диапазоне от 0, 1 до 1,0 мг/мл, и в лечебных дозах - от 1,0 мг/мл до 10 мг/мл. Профилактическая доза 0,1 мг/мл и лечебная доза 1 мг/мл не влияют неблагоприятно на митотический индекс, и на количество патологических митозов. Примерная эффективная доза составляет 5-10 мг РНК на 1 кг веса пациента в день.
Продолжительность лечения антивирусными РНК-М преимущественно составляет от 7 дней при ОРВИ, около 3-5 месяцев - для вирусов герпеса и до 1,5 лет и более - для вируса гепатита С.
Краткое описание рисунков.
Рисунки 1-10 являются графиками измерения динамики средних значений субъективных жалоб и объективных симптомов заболевания: (1) высокая температура тела, (2) головная боль (3) катаральные признаки, (4) общая слабость, (5) боль в суставах, (6), миалгия, (7), зуд и жжение в носу, (8), утомляемость (9) лихорадка, и (10) боль в горле.
Рисунки 11-14 является сравнительными диаграммами, показывающими соответствие между исследовательской и контрольной группами больных подгруппы, зараженных различными вирусами, соответственно, (11) вирус гриппа А, (12) вирус гриппа В, (13) вирус парагриппа, а также (14) аденовирус, согласно основным переменным (I) время нормализации температуры, (II) время прохождения головной боли, (III) время ощущения общей слабости.
На рисунке 15 показаны результаты электрофореза для малых РНК в 15% ПААГ, содержащих DS-Na и 7М мочевины, пре: E.Coli тРНК (полоса-1, сектор-а), 25-членный олигорибонуклеотид (полоса-1, сектор-б) высокоочищенную дрожжевую РНК (полоса-2), натриевую соль дрожжевой РНК (полоса-3).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Пример 1. Пример метода для получения противовирусных РНК
Пример 1.1 Выделение, очистка и анализ РНК.
Поскольку препарат на основе РНК содержит экстракт высокоочищенной РНК, например дрожжевой РНК, для выделения и очистки РНК могут быть с успехом использованы два вида дрожжей Saccharomyces cerevisiae и Candida utilis. В соответствии с изобретением также могут быть использованы препараты промышленных дрожжевых РНК, выделенные из этих двух видов дрожжей. Может быть также использована РНК, выделенная и полученная из других источников, если она отвечает требованиям противовирусной эффективности, как указано в описании к данному изобретению.
Наилучшими являются соответствующие критерии по молекулярной массе и чистоте выделенной РНК. По молекулярной массе, желательно, чтобы РНК состояла главным образом из фрагментов с 25±10 нуклеотидов, что соответствует диапазону молекулярной массы от 4200 до 9800. Например, экстракт РНК содержит не менее 75% от веса олигонуклеотидов с молекулярной массой от 4200 до 9800, более предпочтительно - не менее 90% от массы фрагментов, имеющих от 20 до 25 нуклеотидов из общего экстракта дрожжевой РНК. Преимущественно, доля по отношению к вышеуказанным диапазонам количества нуклеотидов или диапазонам молекулярных масс, или обоих, должна быть, по крайней мере, 95%, еще более предпочтительно - до 100%. В примере - по крайней мере, 99%. Преимущественно должно соблюдаться одно или несколько следующих условий: молекулярная масса - около 7000, содержание азота - выше 14%, содержание фосфора превышает 8,5%, содержание ДНК составляет менее 1%, отрицательное содержание белка, согласно биуретовому тесту. Например, очищенный экстракт РНК содержит более 14,5% от массы азота и более 8,5% от массы фосфора. Экстракт очищенной РНК, преимущественно, практически не содержит белков, ДНК и нуклеотидов, например, по крайней мере, 95% по весу, с чистотой предпочтительно, по меньшей мере, 99%. Молекулярная масса может быть определена с помощью электрофоретического исследования малых РНК в 15% полиакриламидном геле (ПААГ), содержащем DS-Na и 7М мочевину (Mette MF, Autsatz W., van der Winden J., Matzke MA, Matzke AJM. Transcriptional silencig and promoter methylation triggered by double-stranded // EMBO J. - 2000. - 19. - P. 5194-5201). Например, Электрофоретическое исследование экстракта дрожжевой РНК показало существенные различия молекулярной массы (рис. 15).
Как видно на рисунке 15, в соответствии с молекулярной массой маркеров tRNA Е. Coli и 25 членного олигорибонуклеотида, высокоочищенная дрожжевая РНК содержится в качестве однородной полосы в зоне, соответствующей 25-нуклеотидам, в то время как натриевая соль дрожжевой РНК перемещается как гетерогенная полоса, начиная с маркера tRNA с молекулярной массой 19000 на протяжении всего пути до полосы 25 членов олигонуклеотида с молекулярной массой 7000. Это указывает на высокую степень очистки дрожжевой РНК, вполне однородной в соответствии с молекулярной массой и содержит главным образом 25±10 нуклеотидов.
Метод очистки общей РНК дрожжей может быть использован, как описано в полном объеме в патенте США №6737271, содержание которого включено в качестве ссылки (Tkachuk Z., Compound, composition and method for the treatment of inflammatory and inflammatory-related disorders. US Patent No. 6737271, May 18, 2004).
Для получения готовой РНК-композиции для терапевтических или профилактических целей экстракт очищенной РНК может быть модифицирован. В композиции РНК - содержащего препарата, согласно изобретению в качестве противовирусного средства используется очищенный экстракт РНК в готовом к использованию составе в количестве по весу, по крайней мере, около 50%, преимущественно - около от 60 до 80%, более предпочтительно - около от 65% до 75%, еще более предпочтительно - около 70%.
Согласно изобретению готовый к использованию состав содержит экстракт РНК и маннит, в соотношении, преимущественно, от 1,5:1 до 3,5:1 по весу, более предпочтительно, от примерно 2:1 до примерно 3:1, более предпочтительно - около 2,5:1. Таким образом, взятая в качестве примера РНК-М, имеет маннит в пропорции РНК: маннит 2,5:1. То есть этот препарат содержит не менее 70% РНК. Вместо маннита или в дополнение к манниту могут быть использованы другие виды сахара, например, лактоза для РНК-Л, используемая как общее количество сахара в описанной выше пропорции.
Относительно примера РНК-аргинин (и/или лизин, гистидин, спермин, спермидин, гуанидин), доли экстракта РНК и щелочной органического соединения в данном препарате составляет преимущественно около от 1:1 до 2:1 по весу, более предпочтительно - от 2.5:2 к 3.5:2, еще более предпочтительно - около 3:2. Таким образом, взятая в качестве примера РНК-А, имеет пропорцию РНК: аргинин - 3:2. Другие щелочные аминокислоты лизина и гистидина, а также спермин, спермидина и гуанидина могут быть использованы в тех же пропорциях.
В соответствии со следующим аспектом изобретения композицию из экстракта РНК и маннита получают путем нагревания экстракта РНК с, по крайней мере, с маннитом.
Температура нагрева находится в диапазоне от около 40 до около 70°С и преимущественно - от около 50 до 70°С, более предпочтительно - от около 55 до около 65°С, например, близко к 60°С.
Таким образом, в качестве примера для получения композиции на основе РНК-М, готовится смесь дрожжевой РНК: маннит в пропорции 2,5:1, которую растворяют в воде, подогревают до температуры 60-65°С и выдерживают в течение 10 минут. Затем раствор охлаждают до комнатной температуры и высушивают в вакууме. Высушенная композиция используется для исследования противовирусных свойств, как описано ниже.
Как дополнительные вещества в композиции могут быть использованы различные сахара, такие как маннит или лактоза, щелочные аминокислоты, такие как аргинин, лизин, гистидин и алифатические полиамиды, такие как гуанидин, спермин и спермидин. Например, экстракт РНК-А обрабатывают щелочной аминокислотой, такой как аргинин.
В готовом для использования соединении могут использоваться различные фармакологические приемлемые наполнители, носители и растворители.
Пример 1.2. Модификация и отбор РПК с противовирусной активностью.
Известно, что большинство противогриппозных препаратов, такие как Tamiflu и другие, действуют только против нейраминидазной активности и не подавляют рецепторы гемагглютинина. Поэтому было решено, прежде всего, провести отбор препаратов с антигемаглютининовою активностью. Реакция гемагглютинации была проведена параллельно с 1% куриными эритроцитами или 0,75% эритроцитами морской свинки согласно общепринятой методологии (Руководство по лабораторной диагностике вирусных заболеваний и риккетсий, Москва, Медицина, 1965, стр. 136.) Антигемаглютининовую активность высокоочищенной дрожжевой РНК, ее аргининовых и натриевой солей, изучали в концентрации 1% и 3%. Как показали результаты эксперимента, представленью в таблице 1.2.1. ниже, дрожжевая РНК и ее натриевая соль не обладают антигемаглютининовой активностью, в то время как аргининовая соль дрожжевой РНК, особенно в концентрации 1%, имеет существенную антигемаглютининовую активность.


На втором этапе мы изучали комплексные препараты дрожжевой РНК и сахаров, таких как маннит (М) и лактоза (Л), которые часто используются в производстве лекарственных препаратов в качестве дополнительных веществ. Для приготовления конечной композиции дрожжевой РНК и маннита, мы изучали влияние температуры на их растворы путем определения их антигемаглютининовой активности. Водный раствор дрожжевой РНК и маннита готовили в весовых соотношениях 2,5:1, которые затем выдерживали 10 мин соответственно при 50, 60, 70, 80 и 90°С, а также при комнатной температуре. Затем растворы РНК и маннита охлаждали до комнатной температуры, высушивали и изучали влияние полученного препарата РНК-М в концентрации 0,5 мг/мл на гемаглютининовую активность вируса гриппа AFM 1/47 H1N1. В качестве контроля использовались выходные растворы дрожжевой РНК и маннита. Результаты опыта представлены в таблице 1.2.2. ниже.
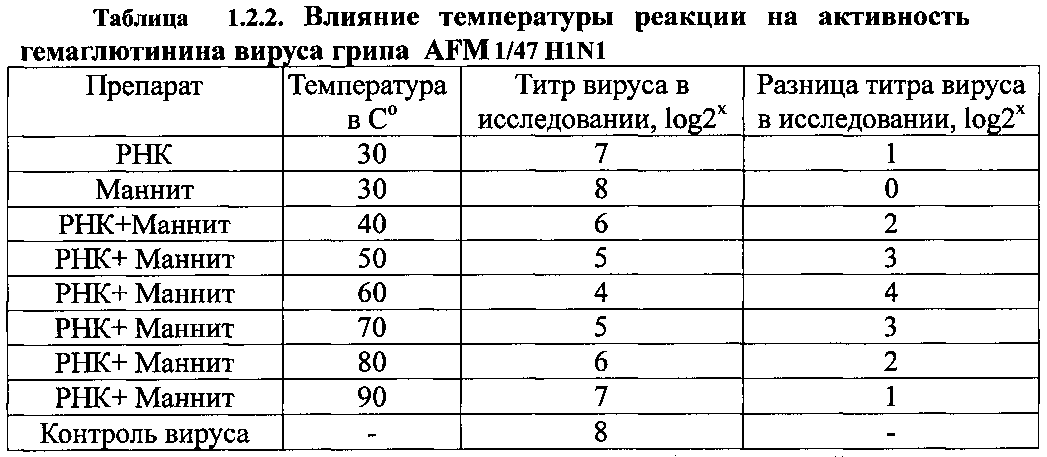
Как показали результаты эксперимента, комбинированный препарат РНК-М, полученный путем нагревания при 60±10°С, существенно снижает активность гемагглютинина вируса гриппа. Лучшая антигемаглютининовая активность была продемонстрирована при нагревании раствора РНК и маннита при 60°С. Далее мы исследовали противовирусную активность препаратов, полученных при оптимальной температуре, которые мы обозначили как РНК-М. Мы предположили, что другие сахара в сочетании с дрожжевой РНК также будут стимулировать его антигемаглютининовую активность. Был проведен сравнительный анализ антигемаглютининовой активности препарата дрожжевой РНК с использованием сахара лактозы (РНК-Л), приготовленного при температуре 60°С, как описано выше, для получения РНК-М. Результаты сравнительного анализа представлены в таблице 1.2.3. ниже.

Как видно из результатов опыта, высшую антигемаглютининовую активность вируса гриппа AFM 1/47 H1N1 проявляет препарат дрожжевой РНК, который подвергали температурной обработке в смеси с маннитом. Одновременно мы изучили антигемаглютининовую активность других полирибонуклеотидов. Как видно из результатов опыта, представленных в таблице 1.2.4, только препарат PolyI проявлял выразительную антигемаглютининовую активность вируса гриппа AFM 1/47 H1N1.

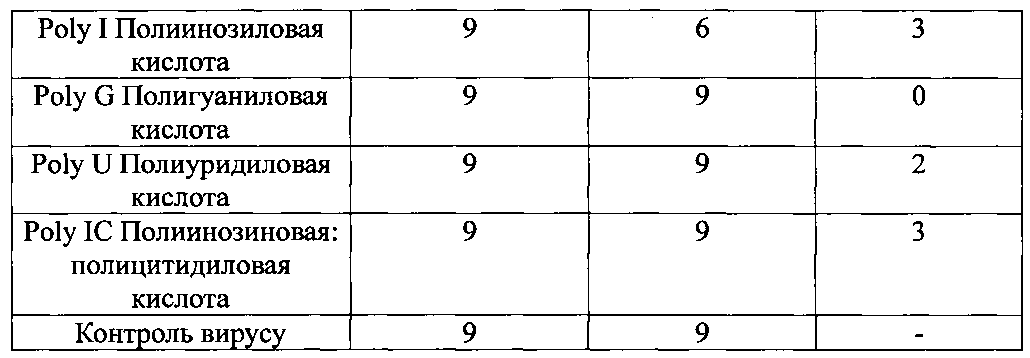
Соединения Poly, С, I, G, и PolyIC были получены в Научно-производственном объединении «Вектор», Бердянск.
Как видно выше из таблицы 1.2.4., препараты полирибонуклеотидов имеют низкую антигемаглютининовую активность. Только двухцепочечная полиинозиловая и полицитидиловая кислоты и одноцепная полиинозиловая кислота показали значительную антигемаглютининовую активность, но она была ниже, чем РНК-М.
Поскольку полученная при температуре 55-65°С РНК-М показала максимальную антигемаглютининовую активность, она была использована для дальнейшего исследования противовирусной активности в моделях in vitro и in vivo.
Пример 2. Итог экспериментальных моделей и результаты
Пример 2.1. Модели вирусов гриппа.
Пример 2.1.1. Модель вируса гриппа in vitro.
Препараты. Исследуемый препарат РНК-М, Тамифлю (Tamiflu-Oseltamivir) фирмы "Rochen" (75 мг в капсуле). Poly I: Poly С - эталонный индуктор интерферона (ИФН) фирмы "Calbiochem". Нейраминидаза - препарат нейраминидазы с Astrobacter ureafacHeris 1 unit Calbiochem.
Вирусы. Вирус гриппа в опытах in vitro: A/FM/1/47 (H1N1), инфекционный титр в MDCK -3,0-7,0 lg ID50 Вирус гриппа в опытах in vivo: A/FM/1/47 (H1N1), адаптирован к легким белых мышей, который прошел 15 пассажей на мышах, инфекционный титр - 4,01 lg ID50, 100% летальность животных наблюдалась в течение 5 суток. Вирус везикулярного стоматита, штамм Индиана, полученный из музея вирусов Института вирусологии им. Д.И. Ивановского РАМН (Москва). Инфекционный титр в культуре тканей L41 составлял 4,0-5,0 lg CTD50.
Клеточные культуры. MDCK - перевиваемых культур клеток почки собаки, среда для культивирования: RPMI-1640+10% фетальной сыворотки крупного рогатого скота+антибиотики. L41 - лимфобластоидные клетки человека. ОН-1 - лимфобластоидные клетки мыши.
Определение МПК и МАК. По МПК считали наибольшую дозу препарата, которая не вызывала дегенерации клеток, а МАК представляет собой минимальное количество препарата, тормозящее развитие вирусоспецифического цитопатогенного действия (ЦПД) на 50%. ХТИ препарата относительно вируса гриппа определяли путем установления соотношения МПК в МАК. Отсутствие ЦПД в опыте при наличии его в контроле вируса, а также разница инфекционного титра в опыте по сравнению с контролем вируса гриппа, позволили рассчитать МАК препарата.
Антигриппозную активность препарата РНК-М in vitro определяли на перевиваемых культурах клеток MDCK (клетки почки собаки) со сплошным слоем. Антигриппозную активность РНК-М in vivo изучали на модели гриппозной пневмонии у мышей по профилактической и лечебной схемам. Неинбредным мышам внутрибрюшинно, внутривенно или интраназально вводили раствор препарата РНК-М за 24 ч до интраназального инфицирования вирусом гриппа, адаптированного к легочной ткани мышей в дозе 10 LD50 (профилактическая схема) и через 24 ч после заражения вирусом гриппа (лечебная схема). Одновременно ставили контроль вируса гриппа для профилактической и лечебной схемы опытов. Эффективность действия препарата оценивали по индексу эффективности ингибирования летальности и инфекционного титра вируса гриппа в легочной ткани мышей [12].
Антигриппозную активность препарата РНК-М in vitro изучали на перевиваемых культурах клеток MDCK (клетки почки собаки) со сплошным слоем. Рассчитанная нами МПК РНК-М равна 5000 мкг/мл, МАК - 31 мкг/мл, а ХТИ препарата составляет 161. Показатели МПК, МАК и ХТИ позволяют отнести препарат РНК-М к высокоактивным противовирусным лекарствам.
При проведении испытаний антигриппозной активности препарата РНК-М in vitro исследовали его профилактическое и лечебное действие.
Согласно представленным ниже результатам в таблице 2.1.1. при применении профилактической схемы введения РНК-М был эффективен в дозах 1,25-10 мг/мл, при лечебной схеме - в дозах 0,6-10 мг/мл.
Таблица 2.1.1. Противогрипозное действие препарата РНК-М in vitro

Пример 2.1.2. Модель вируса гриппа H1N1 и H5N2 in vitro.
Вирусы и клетки. Клетки MDCK культивировали в 96-луночных ч: планшетах (Costar, USA) до состояния монослоя в среде MEM с добавлением 100 мкг/мл гентамицина, 5% сыворотки КРС для среды роста: клеток, 1 мкг/мл трипсина для среды поддержки и культивирования вируса. Штаммы вирусов гриппа A/California/7/09 (H1N1) v и А/mallard/Pennsylvania/10218/84 (H5N2) были получены из коллекции вирусов Института гриппа РАМН (Санкт-Петербург, РФ) и пассированы в алантоисной полости 10-12-дневных куриных эмбрионов в течение 48 часов при 37°С.
Определение цитотоксичности препарата. Для определения рабочих концентраций РНК-М была предварительно изучена его токсичность относительно клеток MDCK. С этой целью двукратные разведения препарата (5,0-0,16 мг/мл) были добавлены к клеткам и инкубированы в течение 48 часов. Затем клетки были промыты 2 раза по 5 минут фосфатно-солевым буфером. Число живых клеток оценивали с помощью микротетразолиевого теста (МТТ), характеризующего интенсивность митохондриального дыхания живых клеток. С этой целью в ямки планшетов было добавлено по 100 мкл раствора 3-(4,5-диметилтиазолил-2) 2,5 дифенилтетразолия бромида (ICN Biochemicals Inc., Aurora, Ohio) с концентрацией (5 мг/мл) в физиологическом растворе. Клетки инкубировали при 37°С в атмосфере 5% СО2 в течение 2 часов и промывали в течение 5 минут фосфатно-солевым буфером. Осадок растворяли в 100 мкл ДМСО на лунку, после чего оптическую плотность в лунках планшетов измеряли на многофункциональном ридере Victor 1420 (PerkinElmer, Finland) при длине волны 535 нм. По результатам теста для каждого продукта определяли 50% цитотоксическую дозу (CTD50), т.е. концентрацию препарата, вызывающая гибель 50% клеток в культуре.
Оценка противовирусного действия препарата.
Заражение культуры клеток вирусом проводили через час после контакта с препаратом РНК-М. В ямки планшетов с культурой клеток MDCK вносили препарат в соответствующей концентрации и заражали культуру серийным десятикратным разведением вируса от 10-1 до 10-7. После заражения вирусом клетки инкубировали в термостате при 37°С в течение 48 часов. Контролем была культура клеток, зараженная (положительный контроль) и не зараженная вирусом культура интактных клеток, в которую вместо раствора препаратов вносили поддерживающую среду (отрицательный контроль). Учет результатов проводили после 48 часов инкубации. Для определения инфекционного титра вируса культуральную жидкость переносили в лунки планшета для иммунологических реакций, после чего добавляли равный объем 1% куриных эритроцитов. О наличии вируса судили по реакции гемагглютинации (ГА) в контрольных и опытных лунках. За титр вируса по реакции гемагглютинации принимали величину, обратную десятичному логарифму, которая при наибольшем разведении исходного вируса, вызывает положительную реакцию. О противовирусной активности соединений судили по снижению инфекционного титра вируса по сравнению с контролем. На основании полученных данных, рассчитывали 50% эффективную дозу (ED50), т.е. концентрацию соединения, снижающую продукцию вируса вдвое по сравнению с контролем, а также индекс селективности, являющийся отношением CTD50 к ED50 и характеризующий избирательность ингибирующего действия в отношении вируса к незараженным клеткам (Mosmann Т., Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays, J. Immunol. Methods, 1983, 65, pp. 55-63)
Результаты исследования показали, что цитотоксическая доза РНК-М составляет более 5000 мкг/мл. В случаях гриппа A/California/7/09 (H1N1) эффективная доза (ED50) РНК-М составила 500 мкг/мл, а его индекс селективности >10. В случае вируса птичьего гриппа A/mallard/Pennsylvania/ 10218/84 (H5N2), препарат был эффективен при более высоких концентрациях (ED50=1519 мкг/мл), а его избирательность индекса селективности >3.
Пример 2.1.3. В Модель вируса гриппа и n vivo.
Антигриппозную активность РНК-М in vivo изучали на модели гриппозной пневмонии у мышей по профилактической и лечебной схемам. Неинбредным мышам внутрибрюшинно, внутривенно или интраназально вводили раствор препарата РНК-М за 24 ч до интраназального инфицирования вирусом гриппа, адаптированного к легочной ткани мышей в дозе 10 LD50 (профилактическая схема) и через 24 ч после заражения вирусом гриппа (лечебная схема). Одновременно контролировали вирус гриппа по профилактической и лечебной схемам опытов. Эффективность действия препарата оценивали по индексу эффективности ингибирования летальности и инфекционному титру вируса гриппа в легочной ткани мышей.
Определение интерфероногенного действия препарата проводили по общепринятой методике подавления ЦПД вируса везикулярного стоматита в культуре клеток ОН-1
Определение нейраминидазной активности проводили по методу D. Aminoff (Amminoff D., Methods for the quantitative estimation of N-acetyl-neuraminic acid and their application to hydrolysates of sialomucoids, Biochem. J., 1961, 81, pp. 384-392). Реакцию гемагглютинации ставили параллельно с 1% куриными эритроцитами или 0,75% эритроцитами морской свинки. Инфекционный титр вируса гриппа определяли по наличию гемагглютинина вируса гриппа. (Guide to laboratory diagnosis of viral and ricketsia diseases, Moscow Medecine, 1965, p. 136).
Исследование антигриппозной активности PHK-M in vivo проводили при различных способах введения препарата по профилактической, и по лечебной схемам, как показано в таблице 2.1.2. ниже.


Обнаружено, что при профилактическом внутрибрюшинном и внутривенном введении РНК-М, эффективными являлись дозы 15, 50, 150 мг/кг, а при интраназальном введении эффективная доза препарата была значительно выше - 1000 мг/кг. При лечебной схеме введения препарата эффективным было внутрибрюшное и интраназальное введение РНК-М при более низких дозах - 25 мг/кг (IE=60,0) и 50 мг/кг (IE=60,0).
При изучении механизма действия препарата РНК-М определяли нейраминидазную, гемаглютининовую и интерфероногенную активность.
Исследование влияния РНК-М на гемаглютининовую активность вируса гриппа A/FM/1/47 (H1N1) проводили, используя дозы 1,0, 3,0; 10,0 30,0; мг/мл. Согласно результатам исследований, РНК-М в дозах 1,0, 3,0; 10,0 30,0; мг/мл статистически достоверно (в 4 раза) уменьшает гемаглютининовую активность гемагглютинина вируса гриппа: при контроле титра вируса 64±9,6 в указанных дозах титр равен 16±2.4.
Нейраминидазную активность препарата РНК-М изучали на примере нейраминидазы вируса гриппа и раствора препарата РНК-М в дозах 30,0; 10,0 3,0, 1,0 мг/мл (контакт препарата происходил в течение 1 и 18 ч). Результаты эксперимента представлены в таблице 2.1.3. В результате проведенных исследований выявлено, что при действии препарата в дозах 30,0 и 10 мг/мл в течение 1 ч ингибирование нейраминидазной активности вируса гриппа было полным, на 100%, а в дозах 3 и 1 мг/мл - на 50%. При более длительном контакте (18 ч) полная ингибиция нейраминидазной активности вируса гриппа отмечалась при действии препарата в дозах 3,0; 10,0 30,0; мг/мл и на 50% - в дозе 1 мг/мл.

Таким образом, препарат РНК-М в дозах 1,0; 3,0; 10,0 и 30,0 мг/мл инактивирует активность нейраминидазы вируса гриппа на 10 и 50%, в дозах 1,0; 10,0 и 30,0 мг/мл, что статистически достоверно уменьшает его гемаглютининовую активность.
Изучение индукции ИФН препаратом РНК-М в эксперименте in vivo проводили на мышах, которым препарат вводили внутрибрюшинно в дозе 50 мг/кг. Через 1, 2, 3. 6 суток определяли наличие ИФН в сыворотке крови животных по общей методике подавления ЦПД вируса везикулярного стоматита в перевиваемых клетках мышей ОН-1 (лимфобластоидные клетки мышей).
Динамика индукции ИФН препаратом РНК-М в организме мышей состояла в том, что максимальная активность ИФН регистрировалась в первые сутки, а затем активность ИФН снижалась вдвое и на таком уровне определялась через 6 суток (2.1.4.). Маркер кислотостойкости ИФН свидетельствует о том, что индуцированной РНК-М ИФН является альфа-ИФН.

Анализируя полученные результаты, необходимо отметить, что механизм антигриппозного действия препарата РНК-М осуществляется за счет влияния на активность нейраминидазы и гемагглютинина и индукции альфа-ИФН.
Пример 2.1.4. Лечение гриппа и ОРВИ у людей.
Данное клиническое исследование проводилось как открытое, рандомизированное, сравнительное, параллельное. В исследование были включены 170 пациентов. Все пациенты, которые принимали участие в исследовании, с целью уменьшения систематической погрешности, связанной с отбором, с помощью процедуры простой рандомизации были разделены на основную (85 пациентов) и контрольную (85 пациентов) группы. В исследовании принимали участие мужчины и женщины в возрасте от 18 до 70 лет с диагнозом ОРВИ или грипп. Основными критериями включения были: наличие вируса, (положительный результат иммунофлюоресцентного теста) температура тела >38°С, сопровождаемая лихорадкой и болевым синдромом, наличие субъективных жалоб (слабость, миалгия, головная боль, першение в горле и/или боль в горле, кашель). В качестве противовирусного препарата для сравнения с РНК-М (основная группа) применяли Тамифлю (контрольная группа). Кроме того, пациенты обеих групп получали стандартную терапию согласно протоколу для нозологии. Препарат РНК-М назначали перорально по 0,5 г 3 раза в сутки в течение 5-7 дней, затем - до 14 суток включительно по 0.25 г два раза в сутки. Препарат Тамифлю принимали согласно инструкции.
Анализ эффективности терапии в каждой группе выполняли по главным для этого исследования показателям, включающим время, в течение которого исчезали головная боль, общая слабость, катаральные явления (кашель) и нормализовалась температура тела (менее 37°С). Вспомогательными показателями в этом исследовании были: лихорадка, боль в горле, боль в суставах, миалгия, утомляемость, наличие выделений из носа, зуд и жжение в носу, катаральные явления (кашель, ринит и др.), выраженность которых оценивалась по вербальной аналоговой шкале (0-3 балла).
Дизайн исследования включал иммунологическое обследование, проводимое с помощью моноклоновых антител. Диагноз грипп и ОРВИ был подтвержден с помощью иммунофлуоресцентного экспресс-метода (МИД) и серологического анализа (HIR). Вирус гриппа А был обнаружен у 32,94% пациентов, вирус гриппа В - у 8,24% больных, вирус парагриппа - в 41,18% случаев, аденовирусная инфекция - у 8,24% больных, дыхательная синцитиальная инфекция - в 9, 41%. Вирус гриппа идентифицировали путем выявления РНК Influenza virus А, РНК Influenza virus В. При положительном результате гриппа А образцы повторно исследовали на Influenza virus A/H1N1. Дополнительный анализ методом ПНР на вирус гриппа A/H1/N1 был сделан на амплификаторе Rotor-Gene 6000.
Статистические методы.
Математическую обработку данных проводили с помощью встроенных средств статистического анализа электронных таблиц Microsoft Excel и пакета прикладных программ SPSS 13.1. Для анализа использовали методы описательной статистики (для количественных переменных исчислялись показатели - n, среднее арифметическое, медиана, стандартное отклонение, минимум и максимум, а для категориальных переменных - частота и доля в процентах), графические методы, методы интервального оценивания (оценка 95% ДИ для средних арифметических или медиан в зависимости от согласованности данных, анализировались, с нормальным распределением), методы двухфакторной ДА по смешанной модели с последующим применением анализа простых контрастов. Критерий Манна-Уитни или критерий Стьюдента для независимых выборок (в зависимости от нормальности распределения данных) применялся для оценки существенности различий между двумя группами, критерий знаковых рангов Уилкоксона или критерий Стьюдента для парных данных применялись для сравнения показателей до и после лечения. Для анализа согласованности распределения данных с нормальным распределением применялся критерий Шапиро-Уилки. Доверительные интервалы для разности медиан были построены с помощью метода Ходжеса-Лемана. Уровнями значимости был взят 0,01 для критерия Шапиро-Уилки и 0,05 для других критериев.
Анализ эффективности по показателям симптоматики заболевания.
Выраженность показателей симптоматики заболевания измерялась по ВАШ (вербальной аналоговой шкале), имевшей следующие упорядоченные категории, которые приравнивались к количеству баллов: 0 баллов - нет признака, 1 балл - симптоматика слабо выражена, 2 балла - умеренно выраженная симптоматика, 3 балла - симптоматика сильно выражена.
Графически динамика средних арифметических значений показателей субъективных жалоб и объективных симптомов заболевания приведена на рис. 1-рис. 10.
Уменьшение выраженности симптоматики заболевания (повышение температуры тела, лихорадка, головная боль, боль в горле, боль в суставах, миалгия, зуд и жжение в носу, утомляемость, общая слабость и катаральные явления) в основной группе по сравнению с исходным состоянием (день 0) было статистически существенным, начиная с четвертого дня (день 4).
На рис. 1 - 4 графически представлена динамика основной симптоматики заболевания: повышение температуры тела, головная боль, катаральные явления и общая слабость. Представленные на указанных рисунках кривые становятся похожими, а различия между группами в отношении: день i - день 0, статистически существенными во всех этих показателях начиная с 4-го дня. Это свидетельствует о том, что уменьшение выраженности этих показателей в основной группе существенно больше уже на 4-й день по сравнению с контрольной группой. Это уменьшение продолжает оставаться существенным у показателя "повышение температуры тела" к 14 дню (рис. 1), у показателя "головная боль" - к 10 дню (рис. 2), у показателя «катаральные явления» к 6 дню (рис. 3), а также на 21 день, а у показателя "общая слабость" (рис. 4) это уменьшение продолжает оставаться существенным до 6-го дня. Такой результат означает, что уменьшение выраженности главных показателей в основной группе наступает существенно раньше (на 4-й день), чем в контрольной, и эта разница в двух показателей продолжает оставаться существенно большей до 14-го и 21-го дней включительно. Полученные результаты свидетельствуют о том, что уменьшение выраженности указанных показателей в основной группе существенно больше и происходило раньше по сравнению с контрольной группой, и это уменьшение, в основном на два - три дня, продолжает оставаться существенным до завершения лечения.
Основываясь на данных, представленных графически на рис. 1-рис. 10, можно констатировать, что наблюдается тенденция более быстрого уменьшения выраженности показателей симптоматики в основной группе по сравнению с контрольной.
Для оценки существенности уменьшения выраженности показателей симптоматики заболевания в каждой из групп было проведено ДА по смешанным моделям: зависимая переменная - показатель симптоматики, анализируемый фактор "время" - фиксированный (уровни: день 0, день 2, день 4, день 6, день 8, день 10, день 14 и день 21), фактор "пациенты" - случайный. Для тех зависимых переменных, для которых не выполнялись предпосылки ДА (нормальность распределения остатков), было выполнено ДА на рангах.
Согласно результатам ДА, эффект фактора «время» является существенным, что свидетельствует о положительном влиянии лечения на уменьшение выраженности симптоматики заболевания как в основной так и в контрольной группах.
Анализ эффективности лечения в подгруппах зараженных различными вирусами.
Дополнительно был проведен сравнительный анализ между основной и контрольной группами в подгруппах пациентов, зараженных различными вирусами, по следующим критериям:
- Время, за которое нормализовалась температура;
- Время, за которое исчезла головная боль;
- Время, за которое исчезла слабость.
Так как данные, которые анализируются, не согласовывались с нормальным законом распределения, то в качестве меры центральной тенденции для всех показателей была взята медиана, значение которой приведено на сравнительных диаграммах (рис. 11 - рис. 14). Проведенные с помощью критерия Манна-Уитни сравнения соответствующих подгрупп основной и контрольной групп позволили констатировать, что существуют статистически существенные различия между основной и контрольной группой по главным переменными эффективности и сделать вывод, что наблюдается тенденция к меньшим средним значениям указанных показателей в основной группе по сравнению с контрольной.
Таким образом, можно утверждать, что эффективность терапии в основной группе, включавшей РНК-М выше, чем эффективность только стандартной терапии по указанным переменными (время, за которое нормализовалась температура, время, за которое исчезла головная боль, время, за которое исчезла общая слабость).
Результаты проведенного нами исследования показывают, что независимо от зараженности больных, составляющих более 80%, вирусом гриппа, или парагриппа, препарат РНК-М существенно сокращает время, в течение которого исчезают основные проявления ОРВИ.
Пример 2.2. Модели Вируса гепатита С
Исследование активности новых препаратов против вируса гепатита С (ВГС) требует наличия экспериментальной модели. Многочисленные попытки создания модели гепатита С долгое время не давали желаемых результатов, поскольку уровни репликации ВГС в системах in vitro были низкими и регистрировались только методом ПНР (Deryabin PG, Isaev EI, Vyazov SO et al., Vopr.vyrusol, 1997, 6 pp. 251-253) Стандартными моделями, использовавшимися авторами, являются клетки МТ-4, клетки Daudi, а также клетки Hela, трансформированной рекомбинантной плазмиды (PBK-CMC-HCV - репликон), содержащие структурные гены ВГС и трансферованые клетки человеческой гепатомы - Huh-7 с люцеферазной репортерной конструкцией pGL3 (Helbig KJ, George J., Beard MR, A novel I-TAC promoter polymorphic variant is functional in the presence of replicating HCV genotype, J. Clin. Virol., 2005, 32, 2, pp. 137-143) Недавно осуществлено успешное выделение ВГС из сыворотки крови людей, инфицированных цитопатогенным вариантом ВГС, способным накапливаться в высоких титрах в культурах клеток различного происхождения, послужило основой для проведения исследований по поиску новых чувствительных клеточных культур для культивирования вируса гепатита С (Deriabin PG, Lvov DK, Isaeva EI, Biological properties of citopathogenic hepatitis С variants, 21st International Congress of Virology, Sydney, 1999, 13, p. 2).
Для выделения и культивирования вируса гепатита С в экспериментальных моделях авторы использовали перевиваемые культуры клеток аденокарциномы надпочечника человека - SW-13 перевиваемые культуры клеток лимфобластоидного происхождения - МТ-4, первичные культуры клеток ГМС (клетки головного мозга новорожденных мышей) (Helbig KJ, George J., Beard MR, A novel I-TAC promoter polymorphic variant is functional in the presence of replicating HCV genotype., J. Clin. Virol., 2005, 32, 2, pp. 137-143).
Идентификацию цитопатогенного эффекта вируса, проводили на пермиссивных к репродукции флавивирусов культурах: перевиваемой линии клеток почки эмбриона свиньи - КНЕС, перевиваемой линии тестикул свиньи - ПТС, ВНК-2, Vero, НАК. Полученный вирус характеризовался высокими инфекционными и антигенными свойствами и эффективно нейтрализовался ВГС-специфическими антителами.
С помощью реакций нейтрализации, торможения гемагглютинации специфическими антителами, иммуноферментного метода, иммунофлуоресценции и реакции диффузной преципитации в агаре проведена идентификация цитопатогенного ВГС. РНК этого варианта вируса идентифицированного как геном ВГС в ОТ-ПЦР с использованием праймеров 5′-NTR, в области генома ВГС, кодирующего нуклеокапсидный белок, а также методом секвенирования фрагмента генома ВГС, кодирующего область нуклеокапсидного белка ВГС. Авторы (Venison LV, Sobolev BN, Tissue tropism of hepatitis virus C, Viral hepatitis: Prospects and achievements, 1999, 12, pp. 11-17; Deriabin PG, Lvov DK, Isaeva EI, Biological properties of citopathogenic hepatitis С variants, 21st International Congress of Virology, Sydney, 1999, 13, p. 2) представили доказательства выделения вируса гепатита С и моделирования продуктивной и персистентной инфекции in vitro. Однако вирус гепатита С, выделенный авторами, еще не зарегистрирован в Международной коллекции и не является стандартным.
Пример 2.2.1. Модель суспензионной культуры МТ-4, инфицированной вирусом гепатита С.
В опытах использовали перевиваемую суспензионную культуру клеток МТ-4 лимфобластоидного происхождения, которую культивировали на питательной среде RPMI-1640 с 10% раствором фетальной сыворотки и антибиотиками. В качестве источника ВГС использовали неразведенную сыворотку крови больных гепатитом С, которая содержит РНК ВГС с различной вирусной нагрузкой, как показано в таблице 2.2.1.

Известно, что расщепление структурных белков HCV осуществляется клеточными пептидазами и вирусной протеазой, поэтому для успешного культивирования вируса гепатита С в исследуемых культурах использовали метод предварительной обработки клеток ТРСК-трипсином XIII типа из поджелудочной железы теленка, (Sigma США). Для этого монослой отмывали трижды в 6 мл среды D-MEM, содержащей 2 мкл/мл ТРСК-трипсина. Обработанные трипсином клетки иннокулировали неразведенной стерильной сывороткой крови от инфицированных ВГС больных в объеме 0,2 мл. Через 30 мин контакта монослой клеток дважды промывали, с целью удаления не адсорбированного вируса, и заливали питательной средой RPMI-1640 с 2% фетальной сыворотки и антибиотиками. Инфицированные таким образом клетки инкубировали при 36,5°С в течение 7 суток.
На 5 сутки в культуре клеток проводили тестирование вируса методом ПЦР с использованием набора АмплиСенс (Boom RC, Sol JA, Salimans МММ, Jansen CL, Wertheim-van Dillen PME, van der Noordaa J., Rapid and simple methods for purification of nucleic acids, Journal of Clinical Microbiology, 1990, 28, 3, pp. 495-503) с модификациями (Carter MJ and Milton ID, An inexpensive and simple method for DNA purification on silica particles, Nucleic Acids Research, 1993, 21, p. 1044). Для получения количественной оценки вирусной нагрузки, использовали метод титрования амплифицированной ДНК. Инфекционный титр вируса гепатита С определяли на пятые сутки инфицированием культур МТ-4 десятикратным разведением вируса гепатита С.
Инфицирование культур клеток МТ-4 осуществляли ВГС-содержащими сыворотками крови человека. Методом ГЩР в культурах клеток определяли вирус гепатита С на пятые сутки культивирования. В зависимости от версии сыворотки, вирусная нагрузка составляла от 1 до 10 и 100000 на г/экв. В инфицированных клетках МТ-4 вирус гепатита С определялся с высокой нагрузкой, то есть эффективность выделения вируса была высокой. Стабильность культивирования в культуре клеток МТ-4 доказана определением репродукции ВГС в последовательных пассажах.
Определение инфекционного титра культивируемых вирусов осуществляли с помощью ПЦР и по ЦПД вируса в культуре клеток.
Инфекционный титр вируса отвечал 5,5 lgID50. Анти-ВГС инактивированная сыворотка полностью нейтрализовала инфекционность вируса, выраженную в РНК-ВГС к титру 1:640. Контроль ВГС составлял - 100 тыс. - 1 млн. г/экв.
Антивирусную гепатит С-активность препарата РНК-М начали изучать с определения химиотерапевтического индекса (ХТИ) РНК-М по отношению к вирусу гепатита С путем установления соотношения максимально переносимой концентрации (МПК препарата РНК-М отвечала 1000,0 мкг/мл), и минимально активной концентрации (МАК), которая представляет собой минимальное количество препарата, которое ингибирует вирусную нагрузку гепатита С на 50%.
Для определения МАК вируса в дозе 100 ТЦД50/0,1 мл вносили в культуру клеток МТ-4 и инкубировали в течение 1 часа при 37°С. После адсорбции вируса на клетках остатки удаляли, а клетки отмывали питательной средой RPMI-1640, после чего в поддерживающую среду (RPMI-1640 и 2% фетальной сыворотки) вносили РНК-М в концентрациях от 1,25 до 10 мкг/мл. Показатель репродукции вируса в геном-эквиваленте на клетку определяли методом ПЦР. Результаты представлены в таблице 2.2.2. ниже.


Было показано, что эффективность подавления РНК-М репродукции ВГС по данным ПЦР зависит от концентрации препарата и нарастает от 50 до 100% для соответствующих доз от 2,5 до 5,0 мкг/мл.
Результаты исследования РНК-М показали, что максимально переносимая концентрация составляет 50 мг/мл, минимально активная концентрация составляет 0,25 мг/мл, а химиотерапевтический индекс составил 200. Согласно этим показателям, препарат РНК-М можно отнести к высокоактивным антивирусным лекарствам в отношении гепатита С.
Пример 2.2.2. Модель продуцирующей культуры клеток трансфицированных к ДНК вируса гепатита С.
Эксперименты проводили на линии клеток МТ-4 - перевиваемой суспензионной культуры клеток лимфобластоидного происхождения. В качестве источника, содержащей ВГС, использовали неразведенную плазму крови больных гепатитом С, содержащую РНК ВГС с различной вирусной нагрузкой.
Для получения продуцирующих ВГС культур клеток выделяли РНК ВГС. В пробирки, содержащие по 450 мкл лизирующего раствора и 5 мкл внутреннего контрольного образца (СКВ), добавляли по 100 мкл проб (сыворотки или плазмы больных вирусным гепатитом С). В каждую пробирку отдельным наконечником вносили по 25 мкл ресуспендированного сорбента. Сорбцию проводили при комнатной температуре в течении 5 мин. Ресуспендировали на вортексе. Дальше пробирки центрифугировали для осаждения сорбента при 10000 об/мин в течение 30 сек на микроцентрифуге «Eppendorf». Супернатант отсасывали при помощи вакуума. К осадку добавляли 400 мкл раствора для отмывки 1. Затем перемешивали на вортексе до полного ресуспендирования сорбента и центрифугировали 3 сек при 10000 об/мин. Супернатант отсасывали при помощи вакуума. Осадок промывали дважды раствором отмывки 3 (по 500 мкл), с 70% этанолом. Сорбент ресуспендировали и осаждали при 10000 об/мин. Супернатант отсасывали при помощи вакуума. Последнюю отмывку, аналогично предыдущей, проводили в ацетоне (400 мкл) и полностью отбирали супернатант из каждой пробирки. Осадок подсушивали в термостате «Биоком» (Россия) при температуре 60°С в течение 10 мин. Элюции РНК проводили в 50 мкл деионизованной воды, без РНКаз и инкубировали в термостате при 60°С 3 мин. В супернатанте была очищена РНК. Эти пробы были готовы к реакции обратной транскрипции и ПЦР.
Реакцию обратной транскрипции РНК проводили в соответствии с рекомендациями фирмы производителя при помощи комплекта реагентов «Реверта-L» (ФГУН «ЦНИИЭ» Роспотребнадзора, Москва), который предназначен для получения кДНК на матрице РНК, возбудителей инфекционных болезней, для последующего анализа методом ПЦР. Материалом для опытов служил раствор РНК, выделенный с использованием комплекта реагентов «РИБО-сорб» (ФГУН «ЦНИИЭ» Роспотребнадзора, Москва). Реакционная смесь состояла из лиофилизированного DTT, 125 мкл RT-mix и 6 мкл ревертазы (MMLV). К 10 мкл готовой реакционной смеси добавляли 10 мкл РНК-пробы. Обратную транскрипцию проводили при 37°С 30 мин., в результате чего получили кДНК.
Трансфекцию суспензионных культур МТ-4 проводили кальций-фосфатным методом (Deryabin PG, Lvov DK, Isaeva EI, Biological properties of cytopathogenic hepatitis variants, 21st International Congress of Virology, Sydney, 1999, 13, p. 2). Для этого изотонический раствор, с буфером HEPES, фосфатом и ДНК смешивали с хлористым кальцием, при этом образовался осадок из частиц фосфата кальция и ДНК. Суспензию добавляли к культуре клеток, которая поглощала ее частички.
Готовили растворы А - HEPES - pH 7,1 - 300 мкл и В - 2 М CaCl2 - 300 мкл. Для приготовления раствора В к 36 мкл CaCl2 добавляли 20 мкг кДНК HCV и добавляли дистиллированную воду до 300 мкл. Затем раствор А по каплям добавляли к раствору В, продували воздухом и выдерживали 30 мин при комнатной температуре до образования осадка. Полученный осадок по каплям добавляли в культуру клеток МТ-4. Культуры трансфицированных кДНК ВГС инкубировали при температуре 34°С в термостате с подачей 5% CO2. Тестирование вируса в культуре клеток МТ-4 проводили методом ПЦР на 2-м пассаже на 9-е сутки культивирования и 5-том пассаже на 17-е сутки культивирования.
После 30 суток культивирования культуры продуцирующих клеток МТ-4, трансфицированных вирусом гепатита С, замораживали в жидком азоте. За 24 ч до замораживания клеточной линии, питательную среду (RPMI-1640+10% фетальной сыворотки) заменили поддерживающей средой (RPMI-1640+2% фетальной сыворотки). Клетки ресуспендировали в питательной среде, подсчитывали в камере Горяева и определяли их жизнеспособность (при помощи 1% раствора трипанового синего). Клетки замораживали, если их жизнеспособность превышала 90%, для чего их концентрировали путем центрифугирования. Для замораживания использовали диметилсульфоксид (ДМСО), который вносили в предварительно охлажденную клеточную смесь. Затем клетки переносили в жидкий азот. Через 1 месяц продуцирующие МТ трансфицированных ВГС культуры размораживали и культивировали в термостате при температуре 36,60°C с подачей 5% СО2.
Изучение противовирусной активности препарата РНК-М на модели продуцирующей культуры клеток трансфицированных кДНК вируса гепатита С.
Дальнейшее изучение противовирусной активности препарата РНК-М проводили на модели продуцирующей культуры клеток трансфицированных кДНК вируса гепатита С.Известно, что вирус гепатита С слишком плохо размножается в культурах клеток, чтобы образовать там высокую первичную концентрацию вируса. Поэтому для экспериментального изучения таких препаратов дополнительно применяют «суррогатные» вирусы (Dugound D., Fenn J., Siu R. et. Al., In vitro characterization of Celgosivir, a clinical stage compound for the treatment of HCV infections, Med. Virol., 2003, 71, pp. 391-398). Суррогатные вирусы являются заменителями вирусов, способных размножаться в достаточном количестве в культурах клеток. В качестве суррогатного вируса HCV используют бычий вирус вирусной диареи (BVDV), который является тест-моделью вируса гепатита С (Dugound D., Siu R., Fenn J. et. Al., Synergistic inhibition of flaviridae virus by Celgosivir in combination with Ribavirin or interferon-a, Hepatology, 2002, 36, pp. 1259-1265).
В ходе проведенных исследований нами было получены продуцирующие культуры клеток МТ-4 трансфицированные кДНК ВГС, которые давали продукцию вируса гепатита С, стабильную как к замораживанию трансфицированных клеток МТ-4, так и после размораживания.
Культуру клеток МТ-4-кДНК, содержащую соответственно вирусы ВГС (вирусная нагрузка, в пересчете к РНК вируса гепатита С в продуцирующей культуре МТ-4-кДНК равняется 12320 г/экв) и BVDV (инфекционный титр BVDV в контроле был 7,0 lg ID50,), обрабатывали препаратом РНК-М в концентрациях 10 и 5 мкг/мл. Противовирусную активность оценивали по инфекционным титрам ВГС в ПЦР и в lg ID50. Результаты изучения противовирусной активности препарата РНК-М на модели продуцирующей культуры клеток трансфицированных кДНК вируса гепатита С и BVDV, свидетельствуют, что при концентрации 10 мкг/мл препарат ингибирует репродукцию вирусов на 2,0 lg ID50, а в концентрации 5 мкг/мл - соответственно на 3,0 lg ID50.
Таким образом, препарат РНК-М в дозах 5 мкг/мл и 10 мкг/мл ингибировал репродукцию вируса во всех исследуемых системах: ВГС суррогатного вируса бычьей вирусной диареи, культивируемого вируса и продуцирующей культуры МТ-4-кДНК вируса гепатита С.
Пример 2.2.3. Лечение гепатита С в организме человека
Лечение пациентов с гепатитом С "золотым стандартом" в комплексной терапии - ПЭГ-интерфероном и рибавирином дает только 60% эффективности, и такое лечение является очень дорогим. Изучали эффективность РНК-М в комплексном лечении больных с гепатитом С на стадии репликации вируса в группе из 6 человек (методом ПЦР подтверждено наличие РНК ВГС в 1 мл сыворотки крови). Препараты были назначены по следующей схеме: в 1-й месяц давали по 3 капсулы РНК-М и по 5 капсул Рибарина "Parmastart" Украина (рибавирин) в день, а во 2-й месяц - 2 капсулы РНК-М и 5 капсул Рибарина в день.
В течение 2 месяцев после начала лечения у всех пациентов был отмечен ранний вирусологический ответ. В начале лечения количество РНК вируса гепатита С в крови пациентов колебалось от 1.72×106 до 3.8×106 копий/мл в 1 мл сыворотки крови (в среднем - 2,99×106). После лечения пациентов количественное определение РНК вируса гепатита С в плазме крови показало снижение количества вируса в 1.6-3.5 раза (в среднем в 2,7 раза), в диапазоне от 5.6×105 до 2.3×106 копий/мл РНК вируса гепатита С (в среднем 1.28×106).
Таким образом, была подтверждена высокая эффективность РНК-М лечения пациентов с гепатитом С. Улучшались самочувствие пациентов, стабилизировались биохимические показатели, снижалось количество копий вируса в сыворотке крови. РНК-М хорошо переносилась организмом пациента, побочные эффекты не были зарегистрированы.
Пример 2.3. Модели вируса герпеса
Пример 2.3.1. In vitro модели вирусов герпеса
Препараты. РНК-М, который назначали в дозе от 0,1 мг до 1 г на кг массы тела. Виролекс назначали согласно инструкции (KRKA, Словения), Poly I - Poly C эталонный индуктор IFN фирмы "Calbichem".
Вирусы и клеточные культуры. Вирус простого герпеса (ВПГ-1): использовали лиофилизированный вирус 1-го антигенного типа, штамм VC, полученный из музея вирусов Института вирусологии им. Д.И. Ивановського РАМН. Цитопатическое действие инфекционного титра (ЦПД) в культуре клеток RK-13 составляло 5,0-5,5 lg ТЦД50/0,1 мл, при внутримозговом заражении белых мышей - 4,0-4,5 lg LD50/0,03 мл. Вирус простого герпеса ВПГ-2, штамм ВН, поддерживали серийными пассажами в культуре клеток RK-13. Инфекционный титр по ЦПД в культуре клеток составлял 5,5-6,0 lg ТЦД50/0,1 мл. До начала экспериментальных исследований вирус хранили при -70°С.
Использовали культуру клеток с невриномы гасерового узла крысы (НГУК-1), индуцированную трансплацентарным введением этиленнитрозоурины. Перевиваемые культуры клеток почки кролика (RK-13) получены из коллекции музея клеток CDC (Атланта, США). Перевиваемые культуры культивировали при 37°С с подачей 5%; CO2 в питательной среде, состоящей из RPMI-1640, 10% фетальной сыворотки теленка и антибиотиков.
Определение максимально переносимой концентрации. МПК препаратов изучали с использованием клеток RK-13 и MDCK. В опытах применяли не менее десяти рядов лунок в плашках с культурой клеток для каждого разведения препарата в питательной среде. Плашки с культурами клеток инкубировали при 37°C с подачей 5% CO2 в течение 5 суток. Ежедневно исследовательские и контрольные культуры исследовали с целью установления наличия или отсутствия ЦПД. Степень ЦПД определяли по изменению морфологии клеток (округление, сморщивание клеток, отторжения от поверхности лунок продегенерированих клеток) по 4-плюсовой системе. По МПК препарата подсчитывали его наибольшее количество, которое бы не вызвало дегенерацию клеток.
Оценка химиотерапевтического индекса. ХТИ препарата по ВПГ-1 определяли путем установления соотношения МПК в МАК, представляющее собой минимальное количество препарата, способное тормозить развитие вирусспецифического ЦПД на 50%. Для определения МАК тест-вируса в дозе 100 ТЦД50/0,1 мл вносили в культуру клеток RK-13 и MDCK и инкубировали в течение 1 ч при 37°С. После адсорбции вируса на клетках его удаляли и клетки отмывали питательной средой, затем в ее поддерживающую среду (RPMI-1640+2% фетальной сыворотки) вносили препарат РНК-М в концентрациях от 60 до 1000 мкг/мл. Отсутствие ЦПД в опыте при наличии его в контроле вируса, а также разница инфекционного титра в опыте по сравнению с контролем вируса герпеса позволили рассчитать МАК препарата.
Цитологический анализ. Цитологический анализ проводили в клетках НГУК, чувствительных к ВПГ после фиксации клеток, выращивали на покровных стеклах в жидкости Шабадаш (состоящей из азотнокислой меди в этиловом спирте и нейтрального формалина в соотношении 9: 1) в течение 30 мин. Окраску проводили гематоксилин-эозином по общепринятой методике. Митотический индекс определяли путем вычисления 3000-10000 клеток и выражали в промилле (%), т.е. число митозов на 1000 клеток. Одновременно определяли наличие патологических форм митозов. Исследование цитологических препаратов проводили в микроскопе Standard 20 Zeiss с объективом x100 и x40 и окуляром x10.
Рассчитанная МПК РНК-М на культуре клеток RK-13 составляет 5000 мкг/мл. Ингибирующая активность препарата lg ID50>2 находится в диапазоне концентраций от 60 до 1000 мкг/мл, его МАК составляет 60 мкг/мл, ХТИ=83,3. В соответствии с методическими рекомендациями (Guidelines Pre-clinical drug research, Kyiv, 2001, pp. 371-396), считается, что вещество (или препарат) имеет антивирусную активность, если уровень репродукции вируса снижается на lg ID50=2 и более. Это позволяет отнести РНК-М к высокоактивным антивирусным препаратам.
Профилактическое и лечебное действие препарата РНК-М in vitro изучали на культуре клеток RK-13. Использовали ВПГ-1, штамм VC, инфекционный титр 4,0 lg ТЦД50 и ВПГ-2, штамм ВН, инфекционный титр 4,0-5,0 lg ТЦД50. Для изучения профилактического действия препарата, его вносили в культуру в различных разведениях в течение 24 ч до инфицирования вирусом, а при исследовании лечебного действия - через 24 ч после инфицирования. Культуру инкубировали в термостате с подачей CO2 в течение 5 суток, ежедневно контролируя с помощью микроскопа и отмечая репродукцию вируса по ЦПД на клетки RK-13 по сравнению с контрольными культурами, где монослой не поддавался никаким воздействиям. Морфологически ЦПД ВПГ на клетки проявляется в образовании симпластов или округлых клеток в сочетании с появлением гигантских многоядерных клеток.
Через 5 суток собирали культуральную среду из лунок плашек и в каждой ее пробе изучали инфекционный титр для профилактического и лечебного действия препарата. Результаты репликации ВПГ-1 и ВПГ-2 приведены в таблице 2.3.1. ниже

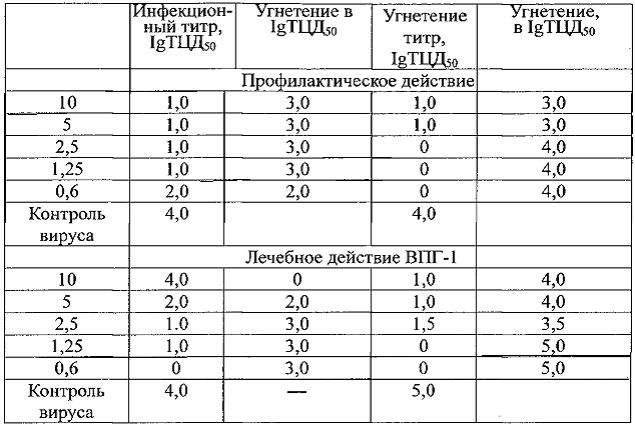
Анализ полученных результатов по определению репродукции ВПГ-1 и ВПГ-2 (таблицы 2.3.1) свидетельствует о том, что РНК-М имеет высокую противогерпетическую активность в широком диапазоне концентраций - от 0,6 до 10 мг/мл, как при профилактической, так и при лечебном схемах введения препарата в культуру клеток ВК-13.
В клетках НГУК, зараженных вирусом герпеса и обработанных РНК-М, изучали митотический режим при профилактической и лечебной схемах введения препарата в концентрации 0,1 и 1 мг/мл. Данные приведены ниже в таблице 2.3.2.


Как видно из таблицы 2.3.2., при профилактической схеме введения РНК-М в концентрации 0,1 мг/мл предотвращал изменение митотического режима клеток. Показатели митотической активности в опытных и в контрольных группах (интактные клетки) почти не отличались. То же самое регистрировалось и по показателям патологических форм митозов. Итак, в культуре клеток НГУК, зараженных ВПГ, препарат РНК-М в дозе 0,1 мг/мл при профилактическом действии и в дозах 0,1 и 1 мг/мл при лечебном действии не производил негативного влияния на уровень митотического индекса и количество патологических форм митоза.
Пример 2.3.2. In vivo модель вирусов герпеса.
Животные. В исследовании использовали белых неинбредных мышей массой 14-18 г, содержавшихся в стандартных условиях вивария и морских свинок (самцов) массой 250-300 г.
Антигерпетическое действие РНК-М по ВПГ-1 изучали на модели герпетического менингоэнцефалита. Животных заражали вирусом герпеса путем введения внутрь мозга в объеме 0,03 мл вирусной суспензии. Инфекционную активность вируса герпеса определяли по уровню летальности животных. Данная модель удобна для оценки выраженности симптоматики, которая отмечается 100% воспроизведением и не требует дополнительных контролей. Развитие клинических симптомов начиналось на 5-6-е сутки с момента инфицирования и достигало максимума на 13 - 14-е сутки, далее отмечалось уменьшение выраженности симптоматики с последующим клиническим выздоровлением выживших животных. Наличие острой герпетической инфекции подтверждалось с помощью иммунофлюоресценции. Так, наиболее интенсивное свечение наблюдалось в тканях головного мозга (особенно в стволовых отделах) через 6-7 суток с момента инфицирования, что соответствует моменту возникновения клинических признаков заболевания. Летальность животных, инфицированных ВПГ, составила 100%.
Антигерпетическую активность РНК-М по ВПГ-2 изучали на модели генитальной герпетической инфекции морских свинок, воспроизводимой путем заражения последних жидкостью, которая содержала вирус, с инфекционным титром 5,0-5,5 lg ТЦД50/мл по методике, предложенной Маренниковой (Marennikova SS, Matsevich GR, Chekunova EV et al., The development and use of new experimental models of different forms of herpes infection, Vopr. virusol., 1986, 1, pp. 59-65). Жидкость, содержащую вирус, наносили на предварительно скарифицированную кожу пениса. Скарификацию проводили с помощью хирургического ланцета после того, как животных анестезировали эфиром. Размер поверхности скарификации равен 4-7 мм2. Жидкость, содержащую вирус, наносили с помощью пипетки сразу после скарификации (с последующим втиранием). Клинические симптомы экспериментального герпеса гениталий регистрировали ежесуточно перед проведением лечения и наблюдали в течение всего периода болезни. Критериями оценки тяжести инфекционного процесса были поверхность и степень специфических поражений, наличие отека, гиперемии, орхит. Максимальная выраженность каждого признака составила 4 балла. Наблюдение за животными проводили в течение 21 суток. Каждая исследуемая группа состояла из трех животных.
Препарат наносили на скарифицированную и зараженную поверхность 1 раз в сутки в течение 5 суток. В качестве референс-препарата использовали мазь Виролекс фирмы КРКА (Словения), которую наносили, как и исследуемый препарат, в виде аппликаций на поверхность раны ежесуточно в течение 5 суток. Лечение препаратом РНК-М и Виролекс начинали через 2 ч после инфицирования.
Антигерпетическую активность РНК-М в экспериментах in vivo изучали на модели герпесвирусного менингоэнцефалита на белых беспородных мышах. Препараты РНК-М в дозах 0,5 и 5 мг/мл и виролекс в дозе 10 мг/кг вводили по 0,2 мл внутрибрюшинно через 24 ч после заражения вирусом герпеса. Показано, что в дозе 0,5 мг/кг РНК-М имел высокую лечебную эффективность и индекс его эффективности при этом составлял 41,2, то есть был почти на уровне стандартного препарата виролекс (50,0). Антивирусную активность РНК-М исследовали также на модели генитального герпеса у морских свинок. Лечение препаратом РНК-М проводили в дозах 0,1 и 1 мг/кг массы до и после инфицирования вирусом герпеса, для контроля использовали виролекс. Всего в опыте было задействовано шесть групп животных: животные, которых заражали только вирусом герпеса; животные, которых заражали вирусом герпеса и лечили Виролекс; животные, которых заражали вирусом герпеса и лечили аппликациями препарата РНК-М в дозе 1,0 мг/кг массы; животные, которых заражали вирусом герпеса и лечили РНК-М в концентрации 0,1 мг/кг массы; животные, которых обрабатывали РНК-М в дозе 1,0 мг/кг массы и заражали вирусом герпеса; животные, которых обрабатывали РНК-М в дозе 0,1 мг/кг массы и заражали вирусом герпеса.
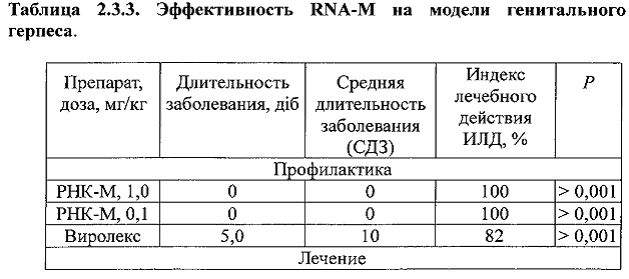

Результаты исследования, представленные в Таблице 2.3.3, показали, что при профилактическом действии препарата в дозах 0,1 и 1,0 мг/кг массы животного средняя интенсивность выраженности заболевания (СИВЗ) равна нулю, а индекс лечебного действия составляет 100, тогда как аналогичные показатели для Виролекс были значительно ниже (табл.3). Эффективность лечения животных РНК-М после заражения вирусом также оказалась значительно выше, чем при применении стандартного препарата виролекс: показатель СДЗ для РНК-М составлял 14 для Виролекс - 22.0, а ИЛД - 73.2 и 56,0% соответственно.
2.3.3. Лечение пациентов с вирусом герпеса.
Ведущая роль в лечении герпеса вирусных заболеваний принадлежит химиотерапевтическим препаратам, содержащим анормальные нуклеозиды (ацикловир и его производные), которые путем конкурентного подавления вирусной ДНК-полимеразы ингибируют синтез вирусной ДНК и репликацию вируса. Однако эти препараты являются токсичными, особенно при длительном использовании, а в некоторых случаях они мало эффективны из-за развития устойчивости к герпес-вирусам.
Поэтому в работе использовали препарат РНК-М для оценки эффективности лечения пациентов с генитальным герпесом. Для исследования были отобраны пациенты с генитальным герпесом. Репликации вируса герпеса 1 и 2 типа диагностировали с помощью полимеразной цепной реакции, которую проводили с тампонов, полученных из влагалища или со скребка из уретры.
У всех пациентов были зарегистрированы высокие концентрации (+++) ДНК-копии ВПГ 1 и 2 типа. Терапия препаратом РНК-М была назначена пациентам в дозе 0,5 г 3 раза в день после еды. В качестве контрольной группы были использованы пациенты с аналогичными результатами ПЦР, которые лечились "Placebo". Через месяц после лечения все пациенты были обследованы еще раз. В группе лечения РНК-М полимеразная цепная реакция у 83,3% пациентов была отрицательной и только в 16,7% обследований пациенты показали наличие ДНК возбудителя в низких концентрациях (+). В контрольной группе 71,4% пациентов имели положительный результат наличия возбудителя при обследовании методом ПЦР.
Эти результаты подтверждают эффективность и целесообразность использования РНК-М при лечении генитального герпеса.
Пример 2.4. Модели ВИЧ
Пример 2.4.1. Модель репродукции ВИЧ.
Вирус иммунодефицита человека (ВИЧ) (эталонный штамм BUI-1RF) - в виде продуцирующей культуры МТ4/ВИЧ LBK - Т-лейкоциты человека - продуцента вируса иммунодефицита I типа, полученного из музея вирусов Института вирусологии им. Д.И. Ивановского. Вирус хранился при -70°С. Источником ВИЧ была культуральная среда клеток МТ4/ВИЧ LBK. Предварительно было определено, что инфицированность этих клеток достигала практически 100% по данным непрямой иммунофлюоресценции с моноклональными антителами к антигену р-24 ВИЧ-1. Тождество вируса, продуцируемого клетками МТ4/ВИЧ LBK, с ВИЧ-1 было подтверждено в реакции нейтрализации.
Культура клеток. Лимфобластоидные клетки МТ-4, получены из банка клеток Института экспериментальной патологии, онкологии и радиобиологии НАН Украины. Питательная среда состояла из 88% среды RPMI 1640 ("Sigma") с добавлением 10% инактивированной прогреванием фетальной сыворотки теленка ("Sigma") и антибиотиков. Клетки выращивали в пластиковых флаконах ("Nunc") объемом 50 мл при 37°С и 5% CO2. Каждые 3-4 дня живые клетки подсчитывали с помощью трипанового синего и рассеивали в начальной концентрации 2,5×105 клеток на 1 мл.
Исследование анти-ВИЧ действия препарата РНК-М.
Использовали традиционную модель первично инфицированных вирусом иммунодефицита человека суспензионных клеток МТ-4. Инфицирование клеток МТ-4 штаммом ВИЧ-1 проводили путем добавления вируса к клеточной суспензии в концентрации 4-5×105 кл/мл множественностью заражения (100 ID30/лунку). Ингибирующий эффект препаратов оценивали иммуноферментным методом на 5 сутки культивирования по количеству вирусного антигена. Инфекционный титр ВИЧ-1 определяли следующим образом: десятикратные разведения тестируемой среды вносили в полистироловые планшеты, в лунках которых находились культивируемые клетки МТ-4. Инфицированные клетки культивировали при 37°С в течение 5 суток в атмосфере 5% CO2. Затем с каждой лунки отбирали культуральную жидкость и определяли наличие антигена р24 методом ИФА с помощью тест-системы "Genetic Systems™ HIV-1 Ag EIA" (BioRad). Инфекционный титр ВИЧ был равен 4,0-6,5 lg ID50.
Изучение анти-ВИЧ активности РНК-М in vitro.
ВИЧ культивировали в суспензии культуры МТ-4 и в культуре невриномы гасерианових ганглий крысы (НГГК). Характеристики ВИЧ1 представлены в таблице 2.4.1. ниже.


Исследования проводились с препаратом РНК-М в культуре клеток МТ-4 по методу (Tkachuk Z.YU., Rybalko SL, Semernikova LI, Tkachuk VV, Zavelevich MP, Tkachuk LV, Myhaylopulo I., Matsuka H. KH., Action of 2′, 5′-tryolihoadenilate and its epoxy-derivative on reproduction of human immunodeficiency virus and reverse transcriptase activity of retroviruses, Biopolymers and cells, 1999, 15, 4, pp. 314-319). В первом варианте препарат вносили за 24 часа до инфицирования вирусом (профилактическая схема), в другом - через 24 часа после инфицирования вирусом (лечебная схема). В каждую пробу вносили вирус иммунодефицита человека, культивировали его в течение 5 суток, затем в каждой пробе определяли инфекционный титр вируса. Препарат оставался в среде в течение всего цикла исследования. В качестве эталонного препарата использовали Ретровир в разведении 0,25. Показано, что препараты РНК-М и РНК-А значительно подавляют размножение ВИЧ на 1,9 lg ID50 при представленных схемах введения препаратов. Препарат Ретровир имел подобный результат. Результаты этого исследования свидетельствуют о высокой противовирусной активности РНК-М и РНК-А при терапевтической схеме введения препаратов. Было обнаружено, что они значительно превосходят действие Ретровира. Это позволило отнести РНК-М и РНК-А к эффективным препаратам, способным подавлять репродукцию ВИЧ.
Пример 2.4.2. Лечение СПИДа у больных пациентов
Тактика лечения пациентов с ВИЧ-инфекцией заключается в регулярном лабораторном контроле CD4+ Т-лимфоцитов и вирусной нагрузки. В том случае, когда количество CD4+ Т-лимфоцитов становится меньше 350 клеток в 1 мкл крови и вирусная нагрузка превышает 100000 копий РНК ВИЧ в 1 мл крови, нужно применять антиретровирусную терапию (APT). У ВИЧ-инфицированных пациентов были изучены эффективность применения РНК-М для восстановления количества CD4+ Т-лимфоцитов и снижение уровня вирусной нагрузки.
Три группы людей с разной вирусной нагрузкой и количеством CD4+ Т-лимфоцитов, которые находились на 1 и 2 клинических стадиях, получали РНК-М внутрь по 0,75 г в день в течение 2 месяцев. Из-за отсутствия показаний они не получали специфического APT. У больных после одного и двух месяцев лечения определяли уровень CD4+ Т-лимфоцитов и вирусную нагрузку. После первого месяца применения РНК-М вирусная нагрузка в группах был снижена в 1,7, 1,9 и 12,7 раз, по сравнению с первичными данными до лечения. Во всех трех группах абсолютное количество CD4+ Т-лимфоцитов выросло в среднем на 285 клеток в 1 мкл крови (350, 351 и 154 клеток/мкл). Общее количество лимфоцитов в периферической крови выросло в среднем на 579,67 клеток в 1 мкл крови. После 2-х месяцев лечения спад вирусной нагрузки в первой группе был 13000 до 1190 копий РНК ВИЧ в 1 мл крови (в 10,9 раза). Для пациентов второй группы вирусная нагрузка ВИЧ была уменьшена с 1780 до 151 копий РНК в 1 мл крови. Для пациентов третьей группы вирусная нагрузка снизилась в 3,3 раза. В течение первого и второго месяца использования РНК-М не были обнаружены изменения показателей биохимического анализа крови (трансаминаз, билирубина, альбумина, мочевины, креатинина, холестерина и т.д.). Таким образом, употребление препарата РНК-М в дозе 0,75 мг в день для ВИЧ-инфицированных лиц приводит к снижению уровня вирусной нагрузки ВИЧ-инфекции и увеличению количества CD4+ Т-лимфоцитов.
Пример 2.5. Модели энтеровирусной инфекции.
Культура клеток - Нер-2 - перевиваемая культура клеток карциномы гортани человека. Питательная среда - Игла+10% эмбриональной сыворотки, при 37°С в атмосфере с 5% CO2. Использовали вирус Коксаки В, инфекционный титр вируса составлял 4 lgE ID50
Максимально переносимая концентрация (МПК), или CD50, препаратов РНК-М и РНК-А равна 5 мг/мл. МПК препарата для клеток считали такую его наибольшую концентрацию, в которой вещество уменьшает жизнеспособность клеток на 50%. Химиотерапевтический индекс препаратов (ХТИ) РНК-М и РНК-А по отношению к вирусу Коксаки В определяли путем установления соотношения МПК к минимально активной концентрации (МАК), которая представляет собой минимальное количество препарата, подавляющего развитие вирусспецифического ЦПД на 50%. Для определения МАК тест-вирус в инфицируемой дозе вносили в культуру клеток Нер-2 и инкубировали при 37°С в атмосфере 5% CO2 в течение 1 часа. После адсорбции вируса на клетках его удаляли и клетки трижды отмывали, внося в каждую лунку по 0,4 мл раствора Хэнкса и сливая его. После этого в каждую лунку вносили по 0,2 мл среды поддержки с различными концентрациями препаратов. На каждую концентрацию препарата использовали 3 лунки. В качестве контроля использовали инфицированные клетки, которые инкубировали в среде поддержки без добавления препаратов. Инкубировали клетки при 37°С в атмосфере 5% CO2 в течение 48 часов. Отсутствие ЦПД в опытах при наличии его в контролях позволило определить МАК препаратов. Препарат считают проявляющим активность при снижении уровня репродукции вируса на 2,0 lg и больше.
Итак, МАК препарата РНК-А соответствует >500 мкг/мл, а МАК препарата РНК-М - 125 мкг/мл. Результаты определения химиотерапевтического индекса препаратов в отношении вируса Коксаки В показали, что для РНК-М он равен 40, а для РНК-А - соответственно 10. Таким образом, показатели МПК, МАК и ХТИ исследуемых препаратов позволяют отнести препарат РНК-М к активным антивирусным препаратам, а РНК-А - к малоактивным антиентеровирусным препаратам.
Реферат
Предложенная группа изобретений относится к области медицины. Предложен способ профилактики и/или лечения вирусных инфекций, включающий введение пациенту композиции. Предложена композиция из высокоочищенного экстракта дрожжевой РНК, имеющей по массе не менее 75% фрагментов 25±10 нуклеотидов, с чистотой предпочтительно, по меньшей мере, 99%, в сочетании с маннитом в пропорции по весу от 2:1 до 3:1, где экстракт дрожжевой РНК был предварительно нагрет с маннитом, при этом экстракт дрожжевой РНК составляет не менее 50% от веса композиции. Предложен способ приготовления этой композиции. Предложенная группа изобретений обеспечивает новое противовирусное средство пролонгированного действия. 3 н. и 25 з.п. ф-лы, 15 ил., 14 табл., 2 пр.
Формула
Документы, цитированные в отчёте о поиске
Стабилизированная вакцинная композиция для стимулирования иммунного ответа и способ ее получения

Комментарии