Производные индена в качестве фармацевтических средств - RU2381209C2
Код документа: RU2381209C2
Описание
Область техники
Настоящее изобретение касается производных индена, способов применения производных и содержащих указанные производные фармацевтических композиций.
Уровень техники
Нормальная воспалительная реакция представляет собой существенно локализованную реакцию “организма” на внедряющиеся микроорганизмы или повреждение ткани с вовлечением клеток иммунной системы. Воспалительная реакция позволяет организму специфически распознавать и устранять вторгающийся организм и/или восстанавливать нарушенную ткань. Классические признаки воспаления включают покраснение (эритему), набухание (отек), боль и повышенное выделение тепла (пирему) на участке повреждения. Многие острые изменения на участке воспаления прямо или опосредованно связаны с характерным для данной реакции массовым притоком лейкоцитов (например, нейтрофилов, эозинофилов, лимфоцитов, моноцитов). Лейкоцитарная инфильтрация и аккумуляция в тканях приводит к активации лейкоцитов и последующему высвобождению медиаторов воспаления, таких как, например, LTB4, простагландины, TNF-α, IL-1β, IL-8, IL-5, IL-6, гистамин, протеазы и активные формы кислорода.
Обычное воспаление является строго регулируемым процессом, жестко контролируемым на нескольких уровнях для каждого типа клеток, вовлеченных в реакцию. Например, экспрессия провоспалительного цитокина TNF-α контролируется на уровне экспрессии генов, трансляции, посттрансляционной модификации и высвобождения зрелой формы из клеточной мембраны. Провоспалительные реакции обычно противодействуют по эндогенным противовоспалительным механизмам, таким как генерация IL-10 или IL-4. Особенность обычной воспалительной реакции состоит в том, что указанная реакция является временной по природе, с последующей фазой разрешения, возвращающей состояние кожи к прежнему состоянию. Считается, что фаза разрешения включает повышающую регуляцию противовоспалительных механизмов, таких как IL-10, а также понижающую регуляцию провоспалительных процессов.
Воспалительное заболевание наблюдается, когда инициируется воспалительная реакция, которая является неадекватной и/или не разрешается нормальным образом, а скорее сохраняется и приводит к хроническому воспалительному состоянию. Заболевание может также включать нарушение клеточного иммунного ответа, что приводит к распознаванию белков организма-хозяина (антигенов) как чужеродных. Здесь воспалительная реакция становится неправильной по отношению к питающим тканям с клетками-эффекторами, направленными на специфические органы или ткани, что часто приводит к необратимому нарушению. Аспект распознавания “своего” при аутоиммунном заболевании часто отражается клональной экспансией субпопуляций T-клеток, характеризующихся специфическим субтипом рецептора T-клетки (TCR) в болезненном состоянии. Часто воспалительное заболевание также характеризуется дисбалансом в уровнях субпопуляций T-хелпера (Th) (т.е., Th1-клеток против Th2-клеток). Воспалительное заболевание может быть системным (например, волчанка) или локализованным на отдельных участках или органах (например, астма) и оказывает влияние на громадное количество людей, представляя тяжелое экономическое бремя для общества. Примерами некоторых наиболее общих и проблемных воспалительных заболеваний являются астма, рассеянный склероз, ревматоидный артрит, воспалительная болезнь кишечника, псориаз и атопический дерматит.
Терапевтические подходы, направленные на излечивание воспалительных заболеваний, обычно делятся на две категории: (a) отрицательная негативная модуляция процессов, подвергающихся повышающей регуляции в болезненном состоянии, или (b) повышающая регуляция противовоспалительных путей в пораженных клетках или тканях. Большинство используемых в настоящее время в клинике лечебных схем относится к первой категории. Некоторые примеры таких схем включают кортикостероиды и нестероидные противовоспалительные лекарственные средства (NSAIDs).
Выяснены многие тканевые, клеточные и биохимические процессы, являющиеся нарушенными при воспалительном заболевании, что позволило создать экспериментальные модели или осуществить биологические испытания, имитирующие болезненное состояние. Эти испытания и модели дают возможность скрининга и отбора соединений, характеризующихся достаточной вероятностью терапевтической эффективности в отношении рассматриваемого воспалительного заболевания. Несмотря на применение таких моделей для многих воспалительных заболеваний не были найдены эффективные лекарственные средства. Существует значительная потребность в терапевтических средствах, эффективно останавливающих или обращающих прогрессирование болезни при болезненных состояниях или патологиях, таких как астма, хроническое обструктивное заболевание легких, рассеянный склероз, псориаз и воспалительная болезнь кишечника.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соединения по настоящему изобретению полезны в качестве противовоспалительных средств.
Таким образом, один из аспектов настоящего изобретения касается соединений формулы (I):

где
кольцо A, C или D независимо является полностью насыщенным, частично насыщенным или полностью ненасыщенным;
каждый из C1, C4, C11, C12, C15 и C16 независимо замещен двумя группами, независимо выбираемыми из группы, включающей водород, алкил, -R8-OR7 или -R8-N(R7)2, при условии, что C4 не может быть замещен двумя метильными группами;
каждый из C9 и C14 независимо замещен водородом, алкилом, -R8-OR7 или
-R8-N(R7)2;
R1 означает -OR7 или -N(R7)2;
каждый из R2 и R3 независимо выбирают из группы, включающей -R8-OR7, -R8-OC(O)R9, -R10-N(R7)2, -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, алкил, алкенил, необязательно замещенный аралкил, необязательно замещенный аралкенил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарилалкил, необязательно замещенный гетероарилалкенил и необязательно замещенный гетероарилалкенил;
каждый из R4a и R4b независимо выбирают из группы, включающей водород, алкил, алкенил или алкинил;
либо R4a означает водород, алкил, алкенил или алкинил и R4b означает прямую связь с углеродом в положении C16;
либо R4a и R4b вместе образуют алкилиден или галогеналкилиден;
R5 означает алкил или R5 означает прямую связь с углеродом в положении C14;
R6 означает водород, -R8-OR7 или -R8-N(R7)2;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, алкил, необязательно замещенный циклоалкил, необязательно замещенный циклоалкилалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарил и необязательно замещенный гетероарилалкил;
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную алкиленовую цепь и линейную или разветвленную алкениленовую цепь; и
каждый R9 независимо выбирают из группы, включающей водород, алкил, арил и аралкил;
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную алкиленовую и линейную или разветвленную алкениленовую цепь;
в виде отдельного стереоизомера, смеси стереоизомеров или рацемической смеси стереоизомеров;
или фармацевтически приемлемая соль, сольват или пролекарство указанного соединения, в изолированном виде или в виде смеси.
Согласно другому аспекту изобретение касается соединений формулы (II):

где
кольцо A, C или D независимо является полностью насыщенным, частично насыщенным или полностью ненасыщенным;
каждый из C1, C2, C4, C11, C12, C15 и C16 независимо замещен
(a) одной из следующих групп: =O, =C(R14)2, =C=C(R14)2, -[C(R14)2]n- (где n равно 2-6) и -O-[C(R14)2]m-O- (где m равно 1-6); или
(b) двумя из следующих независимо выбираемых групп: -R14, -OR15 и -N(R16)2;
C3 замещен двумя из следующих независимо выбираемых групп: -R14, -OR15 и
-N(R16)2;
каждый из C5, C8, C9, С10, С13, C14 и C17 необязательно независимо замещен одной из следующих групп: -R14, -OR15 и -N(R16)2;
каждый из R11 и R12 независимо выбирают из группы, включающей водород, галоген, =О, -OR15, -N(R16)2 и C1-30-органическую группу;
R13 означает -R14, -OR15, -N(R16)2, =C(R14)2, =C=C(R14)2, -[C(R14)2]n- (где n равно 2-5) или -O-[C(R14)2]m-O- (где m равно 1-5);
каждый R14 независимо выбирают из группы, включающей водород, галоген и
C1-30-органическую группу, где две геминальных R14 группы могут образовывать кольцо вместе с углеродом, к которому присоединены;
каждый R15 независимо выбирают из группы, включающей водород, кислород-защитную группу, так что -OR15 означает защищенную гидроксигруппу, инициатор уходящей группы, так что -OR15 означает уходящую группу, и C1-30-органическую группу, которая может, необязательно, содержать, по меньшей мере, один гетероатом, выбираемый из группы, включающей бор, галоген, азот, кислород, фосфор, кремний и серу, где вицинальные -OR15 группы вместе с углеродами, к которым присоединены, могут образовывать циклическую структуру, которая защищает вицинальные гидроксигруппы, и где геминальные -OR15 группы вместе с углеродом, к которому присоединены, могут образовывать циклическую структуру, которая защищает карбонильную группу;
каждый R16 независимо выбирают из группы, включающей водород, -OR17, кислород (так что образуется нитро- или оксим-группа) и C1-30-органическую группу, которая может, необязательно, содержать, по меньшей мере, один гетероатом, выбираемый из группы, включающей бор, галоген, азот, кислород, фосфор, кремний и серу; либо
две R16 группы вместе с азотом, к которому присоединены, образуют гетероциклическое кольцо; и
каждый R17 независимо выбирают из водорода и C1-30-гидрокарбила; в виде отдельного стереоизомера, смеси стереоизомеров или рацемической смеси стереоизомеров;
или фармацевтически приемлемая соль, сольват или пролекарство указанного соединения, в изолированном виде или в виде смеси;
при условии, однако, что
(1) C4 не может быть замещен двумя метильными группами
(2) R13 не может означать =O или 6-метилгепт-2-ил;
(3) когда C17 замещен водородом, R13 не может означать -OH или -OC(O)R, где R означает метил, этил, фенил или циклогексил;
(4) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и гидрокси, каждый из C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает =O и R12 означает -CH2C(O)H, R13 не может означать -С(СН3)НСН2СН2С(О)ОСН3 или -С(СН3)НСН2СН2С(СН2СН3)НС(СН3)2Н;
(5) когда каждый из C1, C2, C4, C11, C12 и C15 замещен двумя водородами, C16 замещен водородом и гидрокси, каждый из C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, C3 замещен водородом и гидрокси, R11 означает =O и R12 означает -CH2C(O)ОH или -CH2C(O)OCH3, R13 не может означать -С(СН3)НNHСН2СН2N(СН3)2, -С(СН3)НСН2СН2С(СН2СН3)НС(СН3)2Н или -C(CH3)H-R (где R означает 5-метилпиперидин-2-ил);
(6) когда каждый из C1, C2, C11, C12 и C15 замещен двумя водородами, C3 замещен водородом и гидрокси, C4 замещен двумя водородами или C4 связан двойной связью с C3, каждый из C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает =O и R12 означает -CH2CN, R13 не может означать -C(O)OCH3;
(7) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и гидрокси, каждый из C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает =O и R12 означает =CHC(O)H, R13 не может означать -С(СН3)НСНСНС(СН3)НС(СН3)2Н;
(8) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и гидрокси, каждый из C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает =O и R12 означает -CH2CH3, R13 не может означать -C(CH3)HOC(O)CH3;
(9) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и гидрокси, каждый из C5, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает гидрокси и R12 означает =CHCH2OH, R13 не может означать -С(СН3)НСН2СН2С(СН2СН3)НС(СН3)2Н или -С(СН3)НСНСНС(СН3)НС(СН3)2Н, -С(СН3)НСН2СН2С(СН2)С(СН3)2Н или -С(СН3)НСНС[СН2С(СН3)2Н]H;
(10) когда каждый из C1, C2, C4, C11, C12 и C15 замещен двумя водородами, C3 замещен водородом и гидрокси, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, C16 замещен двумя водородами или одним водородом и гидрокси, R11 означает гидрокси и R12 означает -CH2CH2OH, R13 не может означать -С(СН3)НСН2СН2С(СН2СН3)НС(СН3)2Н, -С(СН3)НСН2ОН, -СН2ОН или -С(СН3)Н-R (где R означает 5-метилпиперидин-2-ил);
(11) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и гидрокси, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает гидрокси и R12 означает -CH2СН3, R13 не может означать -С(СН3)НСН2С(СН3)НС(СН3)2Н или -С(ОН)НСН3;
(12) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и гидрокси, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает гидрокси и R12 означает -CHСН2, R13 не может означать -С(ОН)НСН3;
(13) когда каждый из C1, C4, C11, C12, C15 и C16 замещен двумя водородами, C2 замещен водородом и гидрокси, C3 замещен водородом и гидрокси, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает -C(O)OH и R13 означает -С(СН3)НС(ОН)НС(ОН)НС(СН2СН3)НС(СН3)2Н, R12 не может означать -CH2SH или -CH2SSCH2R (где R означает водород или C1-30- органическую группу);
(14) когда каждый из C1, C4, C11, C12, C15 и C16 замещен двумя водородами, C2 замещен двумя водородами или водородом и гидрокси, C3 замещен водородом и гидрокси, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает -C(O)OH или -CH2OH и R12 означает -CH2OH, R13 не может означать -СН2ОН, -С(СН3)НС(ОН)НС(ОН)НС(СН3)НС(СН3)2Н или -С(СН3)НС(ОН)НС(ОН)НС(СН2СН3)НС(СН3)2Н;
(15) когда каждый из C1, C2, C11, C12 и C15 замещен двумя водородами, C3 замещен водородом и гидрокси, C4 замещен водородом и метилом или двумя водородами, каждый из C5 и C9 замещен водородом, каждый из C8 и C14 замещен водородом или каждый замещен метилом, каждый из C10 и C13 замещен метилом, C16 замещен водородом и -OC(O)CH3, R11 означает -C(O)H и R12 означает -C(O)H, R13 не может означать =С[С(О)ОН]СН2СН2СНС(СН3)2 или -С(СН3)НСН2СН2С(О)ОСН3;
(16) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и гидрокси, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, C12 замещен водородом и гидрокси, R11 означает -CH2C(O)OH или -CH2C(O)OCH3 и R12 означает -NH2 или -N(CH3)3, R13 не может означать -С(СН3)НСН2СН2С(О)ОСН3 или -С(СН3)НСН2СН2С(О)ОН;
(17) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и гидрокси, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает -NH2 или -N(CH3)3 и R12 означает -CH2C(O)OH или -CH2C(O)OCH3, R13 не может означать -С(СН3)НСН2СН2С(О)ОСН3 или -С(СН3)НСН2СН2С(О)ОН;
(18) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и гидрокси, каждый из C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает =NNHC(NH)NH2 и R12 означает -CH2CH2C(O)OH, R13 не может означать -C(CH3)NNHC(NH)NH2;
(19a) когда каждый из C1, C2, C4, C11 и C12 замещен двумя водородами, C3 замещен =O, каждый из C8, C14 и C17 замещен водородом, C9 замещен водородом или гидрокси, каждый из C10 и C13 замещен метилом, C15 замещен двумя водородами или C15 замещен водородом и связан двойной связью с C16, C16 замещен водородом или гидрокси и связан двойной связью с C15, или C16 замещен =CH2OH, R11 означает =О и R12 означает =CHC(O)OH, R13 не может означать -C(CH3)HC(O)CH2C(CH3)HC(CH3)2H;
(19b) когда каждый из C1, C2, C4, C11 и C12 замещен двумя водородами, C3 замещен =O, C8 и C14 связаны друг с другом двойной связью, C9 замещен гидрокси, каждый из C10 и C13 замещен метилом, C15 замещен водородом и связан двойной связью с C16, C16 замещен метокси и связан двойной связью с C15, C17 замещен водородом, R11 означает =О и R12 означает -CH2C(O)OCH3, R13 не может означать -C(CH3)HC(O)CH2C(CH3)HC(CH3)2H;
(20) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен =O, каждый из C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает =О и R12 означает -CH2CN, R13 не может означать C(O)NHR (где R означает 5-трифторметил-2-трет-бутилфенил) или -C(O)OCH3;
(21) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен =O, каждый из C8, C9, C14 и C17 замещен водородом, C10 замещен метилом или -CH2OC(O)H, C13 замещен метилом, R11 означает =О и R12 означает -CH2CH3 или -CH2I, R13 не может означать -C(O)OCH3;
(22) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен =O, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает -C(O)OH и R12 означает -C(O)OH, R13 не может означать -C(CH3)HCH2CH2C(O)OH или -C(CH3)HCH2CH2CH3;
(23) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен =O, каждый из C5, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает -CN и R12 означает =О, R13 не может означать -C(CH3)HCHCHC(CH3)HC(CH3)2H;
(24) когда каждый из C1, C2, C4, C12 и C15 замещен двумя водородами, C3 замещен водородом и -OC(O)CH3, C8, C9, каждый из C8, C9 и C14 замещен водородом, C11 замещен двумя водородами, водородом и гидрокси или водородом и -OC(O)CH3, C16 замещен двумя водородами или =CH2, C17 замещен водородом, гидрокси или -OC(O)CH3, каждый из C10 и C13 замещен метилом, R11 означает =О, и R12 означает -CH2C(O)OH, R13 не может означать -CH3, -CH2CH3, -C(O)CH3, циклопентанон, -C(CH3)HOC(O)R (где R означает фенил), -C(CH3)HCH2CH2C(O)OCH3, -C(O)CH2OC(O)CH3 или -C(CH3)HCH2CH2C(CH2CH3)HC(CH3)2H;
(25) когда каждый из C1, C2, C4, C11, C12 и C16 замещен двумя водородами, C3 замещен водородом и -OC(O)CH3, каждый из C8 и C9 замещен водородом, каждый из C10 и C13 замещен метилом, C14 замещен метилом или -OC(О)CH3, C15 замещен двумя водородами или =О, C17 замещен водородом или OC(O)CH3, R11 означает =О и R12 означает -CH2C(O)H, R13 не может означать -C(O)OCH3, -C(O)CH3 или -CH3;
(26) когда каждый из C1, C2, C4, C11, C12 и C15 замещен двумя водородами, C3 замещен водородом и -OC(O)CH3, каждый из C8, C9 и C14 замещен водородом, каждый из C10 и C13 замещен метилом, C16 замещен двумя водородами или образует двойную связь с C17, R11 означает =О и R12 означает -CH2CN, R13 не может означать -C(O)CH3;
(27) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и -OC(O)CH3, каждый из C8, C9, C14 и C17 замещен водородом, C10 замещен водородом или -CH2C(O)OH, C13 замещен метилом, R11 означает =О и R12 означает -CH2I или -CH2C(O)OCH3, R13 не может означать -O(O)CH3;
(28) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и -OC(O)CH3, каждый из C8, C9, C14 и C17 замещен водородом, C10 замещен водородом или -CH2C(O)OH, C13 замещен метилом, R11 означает =О и R12 означает -CH2I, -CHCH2, -CCH, -C(O)OCH3 или -CH2OCH3, R13 не может означать -C(CH3)HOC(O)CH3;
(29) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и -OC(O)CH3, каждый из C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает =О и R12 означает -CH2NCO, -CH2C(O)N3 или -C(O)OH, R13 не может означать -C(CH3)HCH2CH2C(CH2CH3)HC(CH3)2H;
(30) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и -OC(O)CH3, каждый из C8, C9 и C14 замещен водородом, каждый из C10 и C13 замещен метилом, C17 замещен -OC(O)CH3, R11 означает =О и R12 означает -CH2CHNNHR (где R означает 2,4-динитрофенил), R13 не может означать -CH3;
(31) когда каждый из C1, C4, C11, C12, C15 и C16 замещен двумя водородами, C2 замещен водородом и -OC(O)CH3, C3 замещен водородом и -OC(O)CH3, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает -C(O)OH и R12 означает -C(O)H, R13 не может означать -С(CH3)HCH2CH2CH2CH3;
(32) когда каждый из C1, C4, C11, C12, C15 и C16 замещен двумя водородами, C2 замещен водородом и -OC(O)CH3, C3 замещен водородом и -OC(O)CH3, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает -C(O)OH или -C(O)OCH3 и R12 означает -C(O)H, -CH2SSCH2R (где R означает водород или С1-30- органическую группу), -CH2OS(O)2CH3 или -CH2OH, R13 не может означать -С(CH3)HC[OC(O)CH3]HC[OC(O)CH3]HC(CH2CH3)HC(CH3)2H;
(33) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и -OC(O)CH3, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает -C(O)OH и R12 означает -C(O)OH, R13 не может означать -C(CH3)HCH2CH2C(O)OH;
(34) когда каждый из C1, C2, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и -OC(O)CH3, C4 замещен водородом и метилом, каждый из C5, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает -CH2C(O)H и R12 означает =O, R13 не может означать -C(CH3)HCH2CH2C(O)C(CH3)2H;
(35) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и -OC(O)CH3, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 и R12 оба означают -CHNOCH3 или -CHNOCH2CH3, R13 не может означать -C(CH3)HCH2CH2C(O)OCH3;
(36) когда каждый из C1, C2, C4, C11, C12 и C15 замещен двумя водородами, C3 замещен водородом и -OC(O)CH3, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, C16 замещен водородом и -OC(O)CH3, R11 означает -OC(O)CH3 и R12 означает -CH2CH2OC(O)CH3, R13 не может означать -C(CH3)HR (где R означает 5-метил-1-ацетилпиперидин-2-ил);
(37) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и триизопропилсилилокси, каждый из C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает =О и R12 означает
-CH2C(O)OH, -CH2C(O)H, -CH2CH2N3, -CH2CH2OH, -CH2CH2OS(O)2CH3 или -CH2C(O)N3, R13 не может означать -C(O)N(CH2CH3)2;
(38) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и триизопропилсилилокси, каждый из C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает =О и R12 означает
-CH2C(O)OH, -CH2C(O)H или -CH2C(O)Cl, R13 не может означать -C(O)OCH3;
(39) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и триизопропилсилилокси, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом и R11 и R12 оба означают -CHNOCH3, R13 не может означать -C(CH3)HCH2CH2C(O)OCH3;
(40) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и -OC(O)R (где R означает 4-нитрофенил или 3,5-динитрофенил), каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает -OH и R12 означает -CH2CH2OC(O)R (где R означает 4-нитрофенил или 3,5-динитрофенил), R13 не может означать -C(CH3)HCH2OC(O)R (где R означает 4-нитрофенил или 3,5-динитрофенил) или -C(CH3)HCH2CH2C(CH2CH3)HC(CH3)2H;
(41) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и -OCH2OCH3, каждый из C5, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает -CN и R12 означает -OH или =O,
R13 не может означать -C(CH3)HCHCHC(CH3)HC(CH3)2H;
(42) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и -OCH2OCH3, каждый из C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает =O и R12 означает -CH2C(O)OH,
R13 не может означать -OCH2CH2CH3;
(43) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен =NNHR (где R означает 2,4-динитрофенил), каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом и R11 и R12 оба означают -C(O)OH, R13 не может означать -C(CH3)HCH2CH2C(O)OH;
(44) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и -OCH2R (где R означает фенил), каждый из C5, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает -CH2C(O)H и R12 означает =O, R13 не может означать -C(CH3)HCH2CH2C(CH3)HC(CH3)2H;
(45) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и -CH3, каждый из C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает =O и R12 означает -C(O)OH, R13 не может означать -OC(CH3)3; и
(46) когда каждый из C1, C2, C4, C11, C12, C15 и C16 замещен двумя водородами, C3 замещен водородом и -OC(CH3)3, каждый из C5, C8, C9, C14 и C17 замещен водородом, каждый из C10 и C13 замещен метилом, R11 означает гидрокси и R12 означает -CH2OH, R13 не может означать -OC(CH3)3.
Согласно другому аспекту изобретение касается фармацевтических композиций, содержащих фармацевтически приемлемый наполнитель и соединение формулы (I) или соединение формулы (II), как указано выше.
Согласно еще одному аспекту изобретение представляет способ лечения воспалительного состояния или заболевания у млекопитающего, указанный способ включает введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы (I) или соединения формулы (II), как указано выше.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение касается фармацевтических композиций и способов, полезных для лечения и/или предотвращения различных болезненных состояний. Например, по одному из аспектов настоящее изобретение касается способа лечения воспаления у млекопитающего, предпочтительно у человека. Способ включает введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения по изобретению или фармацевтически приемлемой соли указанного соединения, или эффективного количества фармацевтической композиции, содержащей соединение по изобретению или фармацевтически приемлемую соль указанного соединения.
Прежде чем изложить изобретение более подробно, приведем некоторые используемые здесь понятия с соответствующими определениями, а также некоторые используемые условные обозначения.
Определение терминов
Как использовано здесь, формы единственного числа включают объекты во множественном числе, если это не противоречит контексту. Например, "соединение" означает одно или более таких соединений, тогда как "фермент" включает конкретный фермент, а также другие члены семейства и соответствующие им эквиваленты, известные специалистам в данной области. Как использовано в описании и приложенных пунктах, если не указано особо, приведенные ниже термины имеют следующие значения.
"Алкил" означает линейный или разветвленный углеводородный радикал, состоящий исключительно из атомов углерода и водорода, не имеющий ненасыщенности и содержащий от одного до семи атомов углерода, который соединен с остатком молекулы простой связью, например метил, этил, н-пропил, 1-метилэтил (изопропил), н-бутил, н-пентил, 1,1-диметилэтил (трет-бутил) и т.п.
"Алкенил" означает линейный или разветвленный углеводородный радикал, состоящий исключительно из атомов углерода и водорода, имеющий, по меньшей мере, одну двойную связь и содержащий от двух до семи атомов углерода, который соединен с остатком молекулы простой связью, например этенил, проп-1-енил, бут-1-енил, пент-1-енил, пента-1,4-диенил и т.п.
"Алкинил" означает линейный или разветвленный углеводородный радикал, состоящий исключительно из атомов углерода и водорода, имеющий, по меньшей мере, одну тройную связь и содержащий от двух до семи атомов углерода, который соединен с остатком молекулы простой связью, например этинил, проп-2-инил, бут-2-инил, пент-2-инил, пента-1,4-диинил и т.п.
"Арил" означает ароматическую моноциклическую или полициклическую углеводородную систему циклов, состоящую исключительно из водорода и углерода и содержащую от 6 до 19 атомов углерода, где циклическая система может быть частично или полностью ненасыщенной. Арильные группы включают, но не в порядке ограничения, такие группы, как флуоренил, фенил и нафтил. Если не оговорено в описании особо, подразумевается, что термин "арил" или приставка "ар-" (такая, как в "аралкил") включает арильные радикалы, необязательно замещенные одним или более заместителями, выбираемыми из группы, включающей алкил, алкенил, галоген, галогеналкил, галогеналкенил, циано, нитро, арил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, -R8-OR7, -R8-N(R7)2, -R8-C(O)R7, -R8-C(O)OR7, -R8-C(O)N(R7)2, -R8-N(R9)C(O)OR9, -R8-N(R9)C(O)R9, -R8-N(R9)(S(O)tR9) (где t принимает значения от 1 до 2), -R8-S(O)POR9 (где p принимает значения от 1 до 2), -R8-S(O)tR9 (где t принимает значения от 0 до 2) и -R8-S(O)PN(R9)2 (где p принимает значения от 1 до 2), где каждый из R7, R8 и R9 принимает значения, указанные выше в разделе “сущность изобретения”.
"Аралкил" означает радикал формулы -RaRb, где Ra означает вышеуказанный алкильный радикал и Rb означает один или более вышеуказанных арильных радикалов, например, бензил, дифенилметил и т.п. Арильные радикалы необязательно могут быть замещены, как указано выше.
"Аралкенил" означает радикал формулы -RcRb, где Rc означает вышеуказанный алкенильный радикал и Rb означает один или более вышеуказанных арильных радикалов, которые, необязательно, могут быть замещены, как указано выше.
"Алкилен" и "алкиленовая цепь" означают линейную или разветвленную двухвалентную углеводородную цепь, соединяющую остаток молекулы с радикальной группой, состоящую исключительно из углерода и водорода, не имеющую ненасыщенности и содержащую от одного до семи атомов углерода, например метилен, этилен, пропилен, н-бутилен и т.п. Алкиленовая цепь может быть соединена с остатком молекулы и с радикальной группой посредством двух любых углеродов в цепи.
"Алкенилен" и "алкениленовая цепь" означают линейную или разветвленную двухвалентную углеводородную цепь, соединяющую остаток молекулы с радикальной группой, состоящую исключительно из углерода и водорода, имеющую, по меньшей мере, одну двойную связь и содержащую от двух до семи атомов углерода, например этенилен, пропенилен, н-бутенилен и т.п. Алкениленовая цепь соединена с остатком молекулы посредством простой связи и с радикальной группой посредством двойной связи или простой связи. Точками присоединения алкениленовой цепи к остатку молекулы и к радикальной группе могут служить два любых углерода в цепи.
"Алкилиден" означает линейную или разветвленную углеводородную радикальную группу, состоящую исключительно из углерода и водорода, имеющую, по меньшей мере, одну двойную связь и содержащую от одного до семи атомов углерода, которая соединена с остатком молекулы посредством двойной связи, например метилен, этилиден, пропилиден, н-бутилиден и т.п.
"Циклоалкил" означает стабильный моноциклический или бициклический углеводородный радикал, состоящий исключительно из атомов углерода и водорода, содержащий от трех до десяти атомов углерода, который является насыщенным и соединен с остатком молекулы посредством простой связи, например циклопропил, циклобутил, циклопентил, циклогексил, декалинил и т.п. Если не оговорено в описании особо, подразумевается, что термин "циклоалкил" включает циклоалкильные радикалы, необязательно замещенные одним или более заместителями, независимо выбираемыми из группы, включающей алкил, алкенил, галоген, галогеналкил, галогеналкенил, циано, нитро, арил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, -R8-OR7, -R8-N(R7)2, -R8-C(O)R7, -R8-C(O)OR7, -R8-C(O)N(R7)2, -R8-N(R9)C(O)OR9, -R8-N(R9)C(O)R9, -R8-N(R9)(S(O)tR9) (где t принимает значения от 1 до 2), -R8-S(O)POR9 (где p принимает значения от 1 до 2), -R8-S(O)tR9 (где t принимает значения от 0 до 2) и -R8-S(O)PN(R9)2 (где p принимает значения от 1 до 2), где каждый из R7, R8 и R9 принимает значения, указанные выше в разделе “сущность изобретения”.
"Циклоалкилалкил" означает радикал формулы -RaRd, где Ra означает вышеуказанный алкильный радикал и Rd означает вышеуказанный циклоалкильный радикал. Алкильный радикал и циклоалкильный радикал, необязательно, могут быть замещены, как указано выше.
"Галоген" означает бром, хлор, фтор или йод.
"Галогеналкил" означает вышеуказанный алкильный радикал, который замещен одним или более галогеновыми радикалами, например трифторметил, дифторметил, трихлорметил, 2,2,2-трифторэтил, 1-фторметил-2-фторэтил, 3-бром-2-фторпропил, 1-бромметил-2-бромэтил и т.п.
"Галогеналкенил" означает вышеуказанный алкенильный радикал, который замещен одним или более галогеновыми радикалами, например 2-бромэтенил, 3-бромпроп-1-енил и т.п.
"Галогеналкилиден" означает вышеуказанный алкилиденовый радикал, который замещен одним или более галогеновыми радикалами, например дифторметилен, дихлорметилен и т.п.
"Гетероциклил" означает стабильный 3-18-членный неароматический циклический радикал, состоящий из атомов углерода и одного-пяти гетероатомов, выбираемых из группы, включающей азот, кислород и серу. В контексте настоящего изобретения гетероциклильный радикал может означать моноциклическую, бициклическую, трициклическую или тетрациклическую систему циклов, которая может включать конденсированные и содержащие мостиковую связь циклические системы; и атомы азота, углерода или серы в гетероциклильном радикале могут быть, необязательно, окисленными; атом азота может быть, необязательно, четвертичным и гетероциклильный радикал может быть частично или полностью насыщенным. Примеры таких гетероциклильных радикалов включают, но не в порядке ограничения, диоксоланил, декагидроизохинолил, имидазолинил, имидазолидинил, изотиазолидинил, изоксазолидинил, морфолинил, октагидроиндолил, октагидроизоиндолил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, оксазолидинил, пиперидинил, пиперазинил, 4-пиперидонил, пирролидинил, пиразолидинил, тиазолидинил, тетрагидрофурил, тритианил, тетрагидропиранил, тиаморфолинил, тиаморфолинилсульфоксид и тиаморфолинилсульфон. Если в описании не оговорено особо, подразумевается, что термин "гетероциклил" включает вышеуказанные гетероциклильные радикалы, которые, необязательно, замещены одним или более заместителями, выбираемыми из группы, включающей алкил, алкенил, галоген, галогеналкил, галогеналкенил, циано, нитро, арил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, -R8-OR7, -R8-N(R7)2, -R8-C(O)R7, -R8-C(O)OR7, -R8-C(O)N(R7)2, -R8-N(R9)C(O)OR9, -R8-N(R9)C(O)R9, -R8-N(R9)(S(O)tR9) (где t принимает значения от 1 до 2), -R8-S(O)POR9 (где p принимает значения от 1 до 2), -R8-S(O)tR9 (где t принимает значения от 0 до 2) и -R8-S(O)PN(R9)2 (где p принимает значения от 1 до 2), где каждый из R7, R8 и R9 принимает значения, указанные выше в разделе “сущность изобретения”.
"Гетероциклилалкил" означает радикал формулы -RaRe, где Ra означает вышеуказанный алкильный радикал и Re означает вышеуказанный гетероциклильный радикал, и если гетероциклил означает азотсодержащий гетероциклил, гетероциклил может быть соединен с алкильным радикалом по атому азота. Гетероциклильный радикал, необязательно, может быть замещен, как указано выше.
"Гетероарил" означает 3-18-членный ароматический циклический радикал, состоящий из атомов углерода и одного-пяти гетероатомов, выбираемых из группы, включающей азот, кислород и серу. В контексте настоящего изобретения, гетероциклильный радикал может означать моноциклическую, бициклическую, трициклическую или тетрациклическую систему циклов, которая может включать конденсированные и содержащие мостиковую связь циклические системы; и атомы азота, углерода или серы в гетероциклильном радикале могут быть, необязательно, окисленными; атом азота может быть, необязательно, четвертичным. Примеры включают, но не в порядке ограничения, азепинил, акридинил, бензимидазолил, бензтиазолил, бензиндолил, бензoтиадиазолил, бензoнафтофуранил, бензоксазолил, бензoдиоксолил, бензoдиоксинил, бензoпиранил, бензoпиранонил, бензoфуранил, бензoфуранонил, бензoтиенил (бензoтиофенил), бензoтриазолил, бензo[4,6]имидазо[1,2-a]пиридинил, карбазолил, циннолинил, дибензoфуранил, фуранил, фуранонил, изотиазолил, имидазолил, индолил, индазолил, изоиндолил, индолинил, изоиндолинил, индолизинил, изоксазолил, нафтиридинил, оксадиазолил, 2-оксоазепинил, оксазолил, оксиранил, феназинил, фенотиазинил, феноксазинил, фталазинил, птеридинил, пуринил, пирролил, пиразолил, пиридинил, пиразинил, пиримидинил, пиридазинил, хиназолинил, хиноксалинил, хинолинил, хинуклидинил, изохинолинил, тиазолил, тиадиазолил, триазолил, тетразолил, триазинил и тиофенил. Если в описании не оговорено особо, подразумевается, что термин "гетероарил" включает вышеуказанные гетероарильные радикалы, которые, необязательно, замещены одним или более заместителями, выбираемыми из группы, включающей алкил, алкенил, галоген, галогеналкил, галогеналкенил, циано, нитро, арил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, -R8-OR7, -R8-N(R7)2, -R8-C(O)R7, -R8-C(O)OR7, -R8-C(O)N(R7)2, -R8-N(R9)C(O)OR9, -R8-N(R9)C(O)R9, -R8-N(R9)(S(O)tR9) (где t принимает значения от 1 до 2), -R8-S(O)POR9 (где p принимает значения от 1 до 2), -R8-S(O)tR9 (где t принимает значения от 0 до 2) и -R8-S(O)PN(R9)2 (где p принимает значения от 1 до 2), где каждый из R7, R8 и R9 принимает значения, указанные выше в разделе “сущность изобретения”.
"Гетероарилалкил" означает радикал формулы -RaRf, где Ra означает вышеуказанный алкильный радикал и Rf означает вышеуказанный гетероарильный радикал. Гетероарильный радикал, необязательно, может быть замещен, как указано выше.
"Гетероарилалкенил" означает радикал формулы -RbRf, где Rb означает вышеуказанный алкенильный радикал и Rf означает вышеуказанный гетероарильный радикал. Гетероарильный радикал, необязательно, может быть замещен, как указано выше.
Как использовано здесь, соединения, определяемые как "коммерчески доступные" могут быть получены из стандартных коммерческих источников, включающих Acros Organics (Pittsburgh PA), Aldrich Chemical (Milwaukee Wl; включая Sigma Chemical and Fluka), American Tissue Culture Collection (ATCC, Rockville, MD), Apin Chemicals Ltd. (Milton Park UK), Avocado Research (Lancashire U.K.), BDH Inc. (Toronto, Canada), Bionet (Cornwall, U.K.), Chemservice Inc. (West Chester PA), Crescent Chemical Co. (Hauppauge NY), Eastman Organic Chemicals, Eastman Kodak Company (Rochester NY), EM Industries, Inc. (Hawthorne, NY; World Wide Web), Fisher Scientific Co. (Pittsburgh PA), Fisher Scientific Co. (Hampton, NH), Fisons Chemicals (Leicestershire UK), Frontier Scientific (Logan UT), ICN Biomedicals, Inc. (Costa Mesa CA), Key Organics (Cornwall U.K.), Lancaster Synthesis (Windham NH; www.lancaster.co.uk), Maybridge Chemical Co. Ltd. (Cornwall U.K.), Parish Chemical Co. (Orem UT), Pfaltz & Bauer, Inc. (Waterbury CN), Polyorganix (Houston TX), Pierce Chemical Co. (Rockford IL), Praxair (Vancouver, B.C.), Riedel de Haen AG (Hannover, Germany), Spectrum Quality Product, Inc. (New Brunswick, NJ), Steraloids Inc. (Newport, RI), TCI America (Portland OR), Trans World Chemicals, Inc. (Rockville MD) и Wako Chemicals USA, Inc. (Richmond VA).
Как использовано здесь, "подходящие условия" для осуществления стадии синтеза, точно указаны здесь или могут быть приведены путем ссылки на публикации, касающиеся способов, используемых в синтетической органической химии. Вышеуказанные справочники и монографии, подробно описывающие синтез реагентов, используемых в получении соединений по настоящему изобретению, также приводят условия осуществления стадии синтеза, отвечающей настоящему изобретению.
Как использовано здесь, "способы, известные специалисту в данной области" могут быть установлены с помощью различных справочников и базы данных. Подходящие справочники и монографии, подробно описывающие синтез реагентов, используемых в получении соединений по настоящему изобретению, или дающие ссылки на статьи, описывающие получение, включают, например, "Synthetic Organic Chemistry", John Wiley & Sons, Inc., New York; S. R. Sandler et al., "Organic Functional Group Preparations," Ed., Academic Press, New York, 1983; H. O. House, "Modern Synthetic Reactions", Ed., W. A. Benjamin, Inc. Menlo Park, Calif. 1972; T. L. Gilchrist, "Heterocyclic Chemistry", 2 nd Ed., John Wiley & Sons, New York, 1992; J. March, "Advanced Organic Chemistry: Reactions, Mechanisms and Structure", 4th Ed., Wiley-lnterscience, New York, 1992.
Специфические и аналогичные реагенты могут также быть найдены по индексам известных химических препаратов, получаемых Chemical Abstract Service of the American Chemical Society, доступным в большинстве публичных и университетских библиотек, а также по интерактивной базе данных (the American Chemical Society, Washington, D.C., возможны контакты для уточнения деталей). Химические реагенты, известные, но не доступные из коммерческих каталогов, могут быть изготовлены на заказ специализирующимися на химическом синтезе фирмами, где многие фирмы-поставщики стандартной химической продукции (например, перечисленные выше) оказывают сервисные услуги по синтезу на заказ. Рекомендации по получению и выбору фармацевтических солей по настоящему изобретению приведены в P. H. Stahl & C. G. Wermuth "Handbook of Pharmaceutical Salts", Verlag Helvetica Chimica Acta, Zurich, 2002.
Как использовано здесь, термин C1-30-органическая группа означает стабильную группировку атомов, состоящую, по меньшей мере, из одного и не более чем максимальное число углеродов, указанное в интервале, обычно не более 30 атомов углерода, и любого числа неуглеродных атомов.
C1-30-органическая группа может представлять собой насыщенный или ненасыщенный гидрокарбильный радикал. Насыщенный гидрокарбильный радикал определяется согласно настоящему изобретению как любой радикал, состоящий только из углерода и водорода, где исключительно простые связи используются для соединения атомов углерода. Таким образом, любая стабильная группировка атомов углерода и водорода, содержащая, по меньшей мере, один атом углерода, входит в рамки понятия насыщенного углеводородного радикала по настоящему изобретению. Некоторая специальная терминология, которая может быть использована для обозначения специфической группировки из атомов углерода, обсуждается ниже.
Атомы углерода могут образовывать указанную здесь алкильную группу. Атомы углерода могут образовывать указанную здесь циклоалкильную группу. Дополнительными группами, входящими в рамки указанного понятия "циклоалкил" являются указанные ниже полициклоалкильные группы.
Полициклоалкильная группа представляет собой группировку атомов углерода, где, по меньшей мере, один атом углерода входит в состав, по меньшей мере, двух раздельно идентифицируемых циклов. Полициклоалкильная группа может содержать мостиковую связь между двумя атомами углерода, где характерными примерами служат бицикло[1.1.0]бутил, бицикло[3.2.1]октил, бицикло[5.2.0]нонил, трицикло[2.2.1.01]гептил, норборнил и пинанил. Полициклоалкильная группа может содержать одну или более конденсированных циклических систем, где характерными примерами служат декалинил (радикал декалина) и пергидроантраценил. Полициклоалкильная группа может содержать спиросвязь, где отдельный атом является единственным общим членом двух циклов. Характерными примерами служат спиро[3.4]октил, спиро[3.3]гептил и спиро[4.5]децил.
Кроме того, насыщенный гидрокарбильный радикал может представлять собой любую комбинацию двух или более вышеуказанных групп, т.е. любую комбинацию алкильной и циклоалкильной групп. Таким образом, C1-30-органическая группа может представлять собой алкильную группу (например, метильную) с циклоалкильным (например, циклогексильным) заместителем, так что C1-30-органическая группа означает циклогексилметильную группу. В качестве другого примера, C1-30-органическая группа может представлять собой циклоалкильную группу (например, циклооктильную) с двумя алкильными заместителями (например, метильным и этильным заместителем), так что C1-30-органическая группа означает метилэтилциклооктильную группу. В качестве заключительного примера, C1-30-органическая группа может представлять собой циклоалкильную группу с алкильным заместителем, где алкильный заместитель замещен полициклоалкильным заместителем.
Как указано выше, C1-30-органическая группа может означать ненасыщенный гидрокарбильный радикал. Такая C1-30-органическая группа определяется, как имеющая такую углеродную группировку, как упомянута выше для насыщенных гидрокарбильных радикалов, дополнительно отличающуюся тем, что, по меньшей мере, одна связь между любыми двумя атомами углерода не относится к простой связи. Алкильная группа, содержащая, по меньшей мере, одну двойную связь, называется здесь алкенильной группой. Алкильная группа, содержащая, по меньшей мере, одну тройную связь, называется здесь алкинильной группой.
Подобным образом, циклоалкильная группа может содержать одну или более двойных или тройных связей и входить в рамки понятия насыщенного гидрокарбильного радикала по изобретению. Циклоалкенил и циклоалкинил являются общими названиями, отвечающими группам, имеющим один цикл на углеродной основе с одной двойной или тройной связью в цикле соответственно. Циклоалкадиенильные группы означают циклоалкильные группы с двумя двойными связями, содержащимися в циклической структуре. Двойная связь может быть экзоциклической по отношению к циклу, например, углеродный атом цикла может быть связан с =CH2 группой (т.е. метилиденовая группа) или высшим гомологом.
Цикл может быть ненасыщенным, вплоть до ароматического, и все еще входить в рамки понятия ненасыщенного гидрокарбильного радикала. Таким образом, арильная группа, как определена здесь, входит в рамки понятия гидрокарбильных групп. Поскольку комбинация, включающая вышеуказанную группу, также входит в рамки понятия ненасыщенного гидрокарбильного радикала, аралкил (C1-30-органическая группа представляет собой алкильную группу с, по меньшей мере, одним арильным заместителем, например бензил) и алкиларил (C1-30-органическая группа представляет собой арильный цикл с, по меньшей мере, одним алкильным заместителем, например толил) группы входят в рамки понятия C1-30-органическая группа. C6-арилы являются предпочтительным компонентом органических групп по изобретению.
Также в рамки понятия C1-30-органической группы входят те органические группы, которые содержат один или более гетероатомов. Гетероатомы по изобретению означают любой атом, отличный от углерода и водорода. Предпочтительный класс гетероатомов составляют встречающиеся в природе атомы (отличные от углерода и водорода). Другой предпочтительный класс составляют неметаллы (отличные от углерода и водорода). Еще один предпочтительный класс включает бор, азот, кислород, фосфор, серу, селен и галоген (например, фтор, хлор, бром и йод, при этом фтор и хлор предпочтительны). Еще один предпочтительный класс включает азот, кислород, серу и галоген. Еще один предпочтительный класс включает азот, кислород и серу. Предпочтительным гетероатомом является кислород. Также предпочтительным гетероатомом является азот.
Например, C1-30-органическая группа может означать вышеуказанный гидрокарбильный радикал с, по меньшей мере, одним заместителем, содержащим, по меньшей мере, один гетероатом. Другими словами, C1-30-органическая группа может означать вышеуказанный гидрокарбильный радикал, где, по меньшей мере, один атом водорода замещен гетероатомом. Например, если гетероатом означает кислород, заместитель может представлять собой карбонильную группу, т.е. два водорода на одном атоме углерода замещены кислородом, что приводит к образованию либо кетоновой, либо альдегидной группы. Альтернативно, один водород может быть замещен атомом кислорода, что образует гидрокси, алкокси, арилокси, аралкилокси, алкиларилокси (где алкокси, арилокси, аралкилокси, алкиларилокси носят общее название гидрокарбилокси), гетероарилокси, -OC(O)R, кеталь, ацеталь, гемикеталь, гемиацеталь, эпокси и -OSO3M. Гетероатом может представлять собой галоген. Гетероатом может означать азот, где азот является составной частью амино-(-NH2, -NHR, -N(R)2), алкиламидо-, ариламидо-, арилалкиламидо-, алкилариламидо-, нитро-, -N(R)SO3M или аминокарбониламидной группы. Гетероатом может означать серу, где сера является составной частью тиольной, тиокарбонильной, -SO3M, сульфонильной, сульфонамидной или сульфонгидразидной группы. Гетероатом может являться составной частью углеродсодержащего заместителя, такого как формил, циано, -C(O)OH, -C(O)OR, -C(O)OM, -C(O)R, -C(O)N(R)2, карбамат, карбогидразид и карбогидроксамовая кислота.
В приведенных выше иллюстративных примерах содержащих гетероатом заместителей, R означает остаток C1-30-органической группы и M означает протон или ион металла. Предпочтительные ионы металлов в комбинации с противоионом образуют физиологически толерантные соли. Предпочтительный металл, из которого может быть образован ион металла, включает щелочной металл [например, литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs)], щелочноземельный металл (например, магний (Mg), кальций (Ca) и стронций (Sr)], либо марганец (Mn), железо (Fe), цинк (Zn) или серебро (Ag). Щелочной металл или щелочноземельный металл составляют предпочтительные M группы. Натрий, калий, магний и кальций образуют предпочтительные M группы. Натрий и калий образуют предпочтительные M группы.
Другой класс C1-30-органических групп по изобретению составляют вышеуказанные гидрокарбильные радикалы, где углеродный атом в гидрокарбиле замещен, по меньшей мере, одним гетероатомом. Одним из примеров таких органических групп служат вышеуказанные гетероциклилы. По другому примеру такие органические группы содержат гетероатом, образующий мостиковую связь между (a) радикалом, с которым связана органическая группа, и (b) остатком органической группы. Примеры включают алкокси-, арилокси-, аралкокси- и алкиларилокси-радикалы, которые носят здесь общее название гидрокарбилокси-радикалов или групп. Таким образом, -OR является примером C1-30-органической группы по изобретению (где R означает остаток C1-30-органической группы). Другим примером служит -NHR (где R означает остаток
C1-30-органической группы). Другие примеры включают -R8-OR7 и -R8-N(R7)2, где R7 и R8 принимают значения, указанные выше в разделе “сущность изобретения”, и R10 означает химическую связь либо линейный или разветвленный алкилен, или алкенилен.
Хотя C1-30-органическая группа может содержать до 30 атомов углерода, предпочтительные органические группы по изобретению содержат приблизительно менее 30 атомов углерода, например до 25 атомов углерода, более предпочтительно до 20 атомов углерода. Органическая группа может содержать приблизительно до 15 атомов углерода, либо до 12 или 10 атомов углерода. Предпочтительная категория органических групп содержат приблизительно до 8 или 6 атомов углерода.
Подразумевается, что термин "пролекарство" означает соединение, которое может быть превращено в физиологических условиях или в результате сольволиза в биологически активное соединение по изобретению. Таким образом, термин "пролекарство" означает фармацевтически приемлемый метаболический предшественник соединения по изобретению. Пролекарство может быть неактивным во время введения нуждающемуся в таком лечении пациенту, но преврашается in vivo в активное соединение по изобретению. Пролекарства обычно быстро преобразуются in vivo, давая исходное соединение по изобретению, например, в результате гидролиза в крови. Пролекарственное соединение часто обеспечивает преимущества в растворимости, тканевой совместимости или замедленном высвобождении в организме млекопитающего (см., Bundgard, H., Design of Prodrugs (1985), pp. 7-9, 21-24 (Elsevier, Amsterdam).
Обзор пролекарств приведен в Higuchi, T., et. аl., "Pro-drugs as Novel Delivery Systems," A.C.S. Symposium Series, Vol. 14, и в Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, содержание которых включено здесь в качестве ссылки.
Подразумевается также, что термин "пролекарство" включает любые ковалентно связанные носители, высвобождающие активное соединение по изобретению in vivo при введении такого пролекарства млекопитающему. Пролекарства соединения по изобретению могут быть получены модификацией существующих в соединении по изобретению функциональных групп, осуществляемой таким образом, что модификации отщепляются либо в результате общепринятых операций, либо in vivo, с образованием исходного соединения по изобретению. Пролекарства включают соединения по изобретению, где гидрокси-, амино- или меркапто-группа химически связана с любой группой, которая, при введении пролекарства соединения по изобретению млекопитающему отщепляется, образуя свободную гидрокси-, свободную амино- или свободную меркапто-группу соответственно. Примеры пролекарств включают, но не в порядке ограничения, ацетатные, формиатные и бензоатные производные спиртовых или амино-функциональных групп в соединениях по изобретению и т.п.
Подразумевается, что термины "стабильное соединение" и "стабильная структура" означают соединение, достаточно устойчивое, чтобы выдерживать выделение из реакционной смеси до пригодной степени чистоты и формулирование в эффективное терапевтическое средство.
"Млекопитающее" включает людей и домашних животных, таких как кошки, собаки, свиньи, крупный рогатый скот, овцы, козы, лошади, кролики и т.п.
"Необязательный" или "необязательно" означает, что последовательно описанный исход событий может иметь место, а может не иметь, и что описание включает случаи, когда указанное событие или условие происходит, и случаи, когда не происходит. Например, "необязательно замещенный арил" означает, что арильный радикал может быть, а может не быть замещенным, и что описание включает как замещенный арильный радикал, так и арильный радикал без замещения.
"Кислород-защитная группа" означает радикал, который защищает и сохраняет гидроксигруппу во время последовательных химических превращений. Такие группы включают, но не в порядке ограничения, триалкилсилил или диарилалкилсилил (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), тетрагидропиранил, бензил и т.п. Защитные группы могут быть введены или удалены согласно стандартным методикам, хорошо известным специалистам в данной области, и как указано в данном описании. Применение защитных групп, в частности кислород-защитной группы, описано подробно в Green, T.W. and P.G.M. Wutz, Protective Groups in Organic Synthesis (1991), 2 nd Ed., Wiley-Interscience.
"Инициатор уходящей группы" означает радикал, который вместе с кислородом, к которому присоединен указанный радикал, образует уходящую группу, легко удаляемую из остатка молекулы под действием соответствующего нуклеофила. Гидрокси-радикал не является легко удаляемой группой и поэтому должен быть превращен в группу, которая отщепляется. Один из способов состоит в присоединении протона к гидрокси-радикалу (с целью получения более кислотной уходящей группы). Другой состоит в превращении гидрокси в реакционноспособный сложный эфир, чаще всего в эфир сульфокислоты. Часто используют такие сульфокислотные эфирные группы, как тозилат, брозилат, нозилат и мезилат. Другие уходящие группы включают ионы оксония, алкилперхлораты, эфиры аммониоалкансульфокислот, алкилфторсульфонаты и фторированные соединения - трифлаты и нонафлаты.
"Фармацевтически приемлемый носитель, разбавитель или наполнитель" включает, не в порядке ограничения, любое вспомогательное вещество, носитель, наполнитель, скользящее вещество, подсластитель, разбавитель, консервант, краситель/пигмент, интенсификатор вкуса и аромата, поверхностно-активное вещество, увлажняющее средство, диспергирующее средство, суспендирующее средство, стабилизатор, изотоническое средство, растворитель или эмульгатор, утвержденные Управлением по контролю за продуктами и лекарствами Соединенных Штатов в качестве пригодных для употребления людьми или домашними животными.
"Фармацевтически приемлемая соль" включает как кислотно-, так и основно-аддитивные соли.
Термин "фармацевтически приемлемая кислотно-аддитивная соль" означает те соли, которые сохраняют биологическую эффективность и свойства свободных оснований, не являются биологически или иным образом неприемлемыми и образованы с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и органическими кислотами, такими как уксусная кислота, 2,2-дихлоруксусная кислота, адипиновая кислота, альгиновая кислота, аскорбиновая кислота, аспарагиновая кислота, бензолсульфоновая кислота, бензойная кислота, 4-ацетамидобензойная кислота, камфорная кислота, камфор-10-сульфоновая кислота, каприновая кислота, капроновая кислота, каприловая кислота, угольная кислота, коричная кислота, лимонная кислота, цикламовая кислота, додецилсерная кислота, этан-1,2-дисульфоновая кислота, этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, муравьиная кислота, фумаровая кислота, галактаровая кислота, гентизиновая кислота, глюкогептоновая кислота, глюконовая кислота, глюкуроновая кислота, глутаминовая кислота, глутаровая кислота, 2-оксоглутаровая кислота, глицерофосфорная кислота, гликолевая кислота, гиппуровая кислота, изомасляная кислота, молочная кислота, лактобионовая кислота, лауриновая кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфоновая кислота, слизевая кислота, нафталин-1,5-дисульфоновая кислота, нафталин-2-сульфоновая кислота, 1-гидрокси-2-нафтойная кислота, никотиновая кислота, олеиновая кислота, оротовая кислота, щавелевая кислота, пальмитиновая кислота, памовая кислота, пропионовая кислота, пироглутаминовая кислота, пировиноградная кислота, салициловая кислота, 4-аминосалициловая кислота, себациновая кислота, стеариновая кислота, янтарная кислота, винная кислота, тиоциановая кислота, п-толуолсульфоновая кислота, трифторуксусная кислота, ундециленовая кислота и т.п.
"Фармацевтически приемлемая основно-аддитивная соль" означает те соли, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются биологически или иным образом неприемлемыми. Эти соли получают путем присоединения неорганического основания или органического основания к свободной кислоте. Соли, образованные с неорганическими основаниями, включают, но не в порядке ограничения, соли натрия, калий, литий, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п. Предпочтительными неорганическими солями являются соли аммония, натрия, калия, кальция и магния. Соли, образованные с органическими основаниями, включают, но не в порядке ограничения, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основных ионообменных смол, таких как аммиак, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, диэтаноламин, этаноламин, деанол, 2-диметиламиноэтанол, 2-диэтиламиноэтанол, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаиновые смолы, бенетамин, бензатин, этилендиамин, глюкозамин, метилглюкамин, теoбром, триэтаноламин, трометамин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиамин и т.п. В особенности предпочтительными органическими основаниями являются изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин.
"Терапевтически эффективное количество" означает такое количество соединения по изобретению, которое при введении млекопитающему, предпочтительно человеку, является достаточным для эффективного лечения, как указано ниже, воспалительного заболевания у млекопитающего. Количество соединения по изобретению, составляющее "терапевтически эффективное количество", изменяется в зависимости от соединения, состояния и тяжести указанного состояния, и возраста излечиваемого млекопитающего, но может быть установлено по стандартной методике специалистом в данной области, с учетом личного опыта и данного описания.
"Лечение", как использовано здесь, охватывает излечивание рассматриваемого заболевания или состояния у подверженного рассматриваемому заболеванию или нарушению млекопитающего, предпочтительно человека, и включает
(i) предотвращение возникновения заболевания или состояния у млекопитающего, в частности, когда такое млекопитающее предрасположено к состоянию, но диагноз наличия указанного состояния не установлен;
(ii) сдерживание заболевания или состояния, т.е. приостановку развития; или
(iii) снятие указанного заболевания или состояния, т.е. обеспечение регрессии болезни или состояния.
Соединения по изобретению содержат центральные ядра из трех колец, обозначенные здесь A, C и D, как приведено ниже:

Углеродные атомы центральных ядер нумеруются как указано выше. В данном описании атом углерода в положении 1 центральных ядер обозначен C1 и так далее.
В соединениях по изобретению, если не оговорено особо, каждое из колец A, C и D является, независимо, полностью насыщенным, частично насыщенным или полностью ненасыщенным. То есть атомы водорода, соединенные с любым из атомов углерода в положениях 1-5 и 8-17, могут быть опущены, на основании чего может быть сделан вывод о ненасыщенности внутри колец A, C и D. Например, когда атомы углерода под номерами 5, 8, 9, 10, 13 и 14 указаны как замещенные одним водородом, и также указано, что каждое из колец A, C и D, независимо, является полностью насыщенным, частично насыщенным или полностью ненасыщенным, то один или более любых атомов водорода, соединенных с атомами углеродов под номерами 5, 8, 9 и 14, могут быть опущены, что свидетельствует о ненасыщенности атома углерода.
Соединения по изобретению или фармацевтически приемлемые соли указанных соединений могут содержать один или более асимметричных центров и могут, таким образом, образовывать энантиомеры, диастереомеры и другие стереоизомерные формы, которые могут быть обозначены в терминах абсолютной стереохимии, как (R)- или (S)-, или как (D)- или (L)- для аминокислот. Подразумевается, что настоящее изобретение включает все такие возможные изомеры, а также соответствующие рацемические и оптически чистые формы. Оптически активные (+) и (-), (R)- и (S)- или (D)- и (L)-изомеры могут быть получены путем применения хиральных синтонов или хиральных реагентов, либо выделением по общепринятым методикам, таким как ЖХВР с обращенной фазой. Когда указанные здесь соединения содержат олефиновые двойные связи или другие центры геометрической асимметрии, если не оговорено особо, это означает, что соединения включают как E, так и Z геометрические изомеры. Подобным образом, подразумевается также, что включены все таутомерные формы.
Используемая здесь номенклатура для соединений по изобретению является видоизмененной формой номенклатурной системы ИЮПАК, по которой соединения называются как производные от индена. Нумерация местоположения различных заместителей инденового цикла в названиях соединений по изобретению основана на стандартной системе нумерации местоположения для инденовых циклов. Кроме того, конфигурация заместителей указана в названиях соединений как "α", если заместитель расположен ниже плоскости инденового цикла, и "β", если заместитель расположен выше плоскости инденового цикла. Например, соединение формулы (Ia) (отражающее нумерацию атомов углерода:

где каждый из C1, C4, C11, C12, C15 и C16 независимо замещен двумя водородами; каждый из C9 и C14 независимо замещен водородом; R1 означает β-гидрокси; R2 означает β-(2-гидроксиэтил); R3 означает α-гидрокси; R4a и R4b вместе образуют метилен; R5 означает β-метил и R6 означает водород, т.е. соединение следующей формулы:

которое носит здесь название 5-(1β-метил-4β-гидрокси-2β-(2-гидроксиэтил)циклогексил)-4α-гидрокси-7αβ-метил-1-метиленоктагидроинден.
Соединения по изобретению могут, и, как правило, это выполняется, существовать в виде твердых соединений, включая кристаллические твердые вещества, которые могут быть кристаллизованы из общепринятых растворителей, таких как этанол, N,N-диметилформамид, вода или т.п., либо из смесей указанных растворителей. Процесс кристаллизации может, в зависимости от условий кристаллизации, приводить к различным полиморфным структурам. В большинстве случаев более термодинамически устойчивый полиморф целесообразен для производства в промышленном масштабе стероидного соединения по изобретению и является предпочтительной формой соединения.
Часто кристаллизация дает сольват соединения по изобретению. Как использовано здесь, термин "сольват" означает агрегат, который включает одно или более соединений по изобретению и одну или более молекул растворителя. Растворителем может быть вода, в этом случае сольват представляет собой гидрат. Альтернативно, растворитель может являться органическим растворителем. Таким образом, соединения по настоящему изобретению могут существовать в виде гидрата, включая моногидрат, дигидрат, гемигидрат, сесквигидрат, тригидрат, тетрагидрат и т.п., а также в виде соответствующих сольватных форм. Соединение по изобретению может представлять собой истинные сольваты, тогда как в других случаях, соединение по изобретению может просто удерживать добавочное количество воды или растворителя, или смеси воды и растворителя.
Как использовано здесь, "фармацевтически приемлемый сольват" означает сольват, который сохраняет биологическую эффективность и свойства биологически активных соединений по изобретению. Примеры фармацевтически приемлемых сольватов включают, но не в порядке ограничения, воду, изопропанол, этанол, метанол, ДМСО, EtOAc, уксусную кислоту и этаноламин. Квалифицированному специалисту в данной области понятно, что сольватированные формы равноценны несольватированным формам и входят в рамки объема настоящего изобретения. Sykes, P. A., Guidebook to Mechanism in Organic Chemistry, 6th Ed (1986, John Wiley & Sons, N.Y.) служит примером ссылки, где описаны сольваты.
B. Фармацевтические композиции
Настоящее изобретение касается фармацевтической композиции или композиции для применения в ветеринарии (здесь далее имеющей общее название фармацевтическая композиция), содержащей вышеуказанное соединение по изобретению в смеси с фармацевтически приемлемым носителем. Изобретение также касается композиции, предпочтительно фармацевтической композиции, содержащей эффективное количество вышеуказанного соединения совместно с фармацевтически приемлемым носителем.
Фармацевтические композиции по настоящему изобретению могут быть представлены в форме, позволяющей введение композиции пациенту. Например, композиция может быть в форме твердого вещества, жидкого или газообразного (аэрозоль). Характерные способы введения включают, но не в порядке ограничения, пероральное, местное, парентеральное, сублингвальное, ректальное, вагинальное, окулярное и интраназальное. Термин парентеральное, как использован здесь, включает подкожные впрыскивания, внутривенное, внутримышечное, подложечное впрыскивание или инфузионные приемы. Фармацевтическую композицию по изобретению составляют таким образом, чтобы обеспечить биологическую доступность содержащегося в указанной композиции активного ингредиента при введении композиции пациенту. Вводимые пациенту композиции имеют форму одной или более стандартных доз, где, например, таблетка может представлять собой единичную стандартную дозу, а контейнер для аэрозольной формы соединения по изобретению может содержать некоторое количество стандартных доз.
Вещества, используемые для получения фармацевтических композиций, должны быть фармацевтически чистыми и нетоксичными в используемых количествах. Для специалиста в данной области очевидно, что оптимальная дозировка активного ингредиента (ингредиентов) в фармацевтической композиции зависит от ряда факторов. Соответствующие факторы включают, но не в порядке ограничения, тип субъекта (например, человек), конкретную форму активного ингредиента, способ введения и используемую композицию.
В общем случае фармацевтическая композиция включает соединение, причем имеется в виду одно или более вышеуказанных активных соединений по изобретению в смеси с одним или более носителями. Носитель (носители) могут быть, в частности, такими, что композиции существуют, например, в форме таблеток или порошка. Носитель (носители) может быть жидким, при этом композиции существуют, например, в форме сиропа для перорального приема или впрыскиваемой жидкости. Кроме того, носитель (носители) может быть газообразным, что обеспечивает аэрозольную композицию, полезную, например, для введения путем ингаляции.
Когда предназначена для перорального введения, композиция предпочтительно существует либо в твердой, либо в жидкой форме, где полутвердая, полужидкая, суспензионная и гелевая формы входят в число форм, рассматриваемых здесь либо как твердые, либо как жидкие.
В качестве твердой композиции для перорального введения композиция может быть формулирована в форме порошка, гранулы, прессованной таблетки, пилюли, капсулы, жевательной резинки, облатки или т.п. Такая твердая композиция обычно должна содержать один или более инертных разбавителей или пригодных в пищу носителей. Вдобавок возможно присутствие одного или более следующих вспомогательных веществ: связующих веществ, таких как карбоксиметилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза или желатин; наполнителей, таких как крахмал, лактоза или декстрины, дезинтегрирующих средств, таких как альгиновая кислота, альгинат натрия, Primogel, кукурузный крахмал и т.п.; смазывающих веществ, таких как стеарат магния или Sterotex; скользящих веществ, таких как коллоидный диоксид кремния; подсластителей, таких как сахароза или сахарин, корригента, такого как мята перечная, метилсалицилат или апельсиновый экстракт, и красителя.
Когда композиция представлена в форме капсулы, например желатиновой капсулы, указанная композиция может содержать, в дополнение к веществам вышеуказанного типа, жидкий носитель, такой как полиэтиленгликоль, циклодекстрин или жирное масло.
Композиция может быть представлена в форме жидкости, например эликсира, сиропа, раствора, эмульсии или суспензии. В качестве двух примеров, жидкость может быть предназначена для перорального введения или для доставки путем инъекции. Если предполагается пероральное введение, предпочтительная композиция содержит, в дополнение к рассматриваемым соединениям, один или более подсластителей, консервантов, красителей/пигментов и интенсификаторов вкуса и аромата. В композицию, предназначенную для введения путем инъекции, могут быть включены, в количестве один или более, поверхностно-активное вещество, консервант, увлажняющее средство, диспергирующее средство, суспендирующее средство, буфер, стабилизатор и изотоническое средство.
Жидкие фармацевтические композиции по изобретению, независимо, будь то растворы, суспензии или иная подобная форма, могут включать одно или более следующих вспомогательных веществ: стерильные разбавители, такие как вода для инъекции, солевой раствор, предпочтительно физиологический раствор, раствор Рингера, изотонический хлорид натрия, нелетучие масла, такие как синтетические моно- или диглицериды, которые могут служить в качестве растворителя или суспендирующей среды, полиэтиленгликоли, глицерин, циклодекстрин, пропиленгликоль или другие растворители; бактерицидные средства, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты и средства для регулирования тоничности, такие как хлорид натрия или декстроза. Препарат для парентерального введения может быть заключен в ампулы, шприцы одноразового применения или содержащие многократные дозы склянки, изготовленные из стекла или пластика.
Предпочтительным вспомогательным веществом является физиологический раствор. Фармацевтическая композиция для впрыскивания преимущественно является стерильной.
Жидкая композиция, предназначенная либо для парентерально, либо для перорального введения, должна содержать такое количество соединения по изобретению, которое позволяет обеспечить приемлемую дозу. Обычно это количество соответствует, по меньшей мере, 0,01% соединения по изобретению в композиции. Предпочтительные для перорального применения композиции содержат от 4% до 50% активного соединения по изобретению. Предпочтительные композиции и препараты по настоящему изобретению получают таким образом, чтобы парентеральная стандартная дозировка содержала от 0,01 до 2 мас.% активного соединения.
Фармацевтическая композиция может быть предназначена для местного применения, в этом случае удобно включать носитель, составляющий основу раствора, эмульсии, мази или геля. Основа, например, может содержать одно или более следующих веществ: петролатум, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавители, такие как вода и спирт, и эмульгаторы и стабилизаторы. В фармацевтической композиции для местного применения могут присутствовать загустители. Если предназначена для трансдермального применения, композиция может включать трансдермальный пластырь или устройство для ионтофореза. Составы для местного применения могут содержать соединение по формуле изобретения в концентрации приблизительно от 0,01 % до 10 мас./об.% (масса на единицу объема).
Композиция может быть предназначена для ректального применения, в форме, например, суппозитория, который плавится в прямой кишке и высвобождает лекарственное средство.
Композиция для ректального применения может содержать масляную основу в качестве подходящего нераздражающего наполнителя. Такие основы включают, не в порядке ограничения, ланолин, масло какао и полиэтиленгликоль.
Композиция может включать различные вещества, модифицирующие физическую форму твердой или жидкой стандартной лекарственной единицы. Например, композиция может включать вещества, образующие вокруг активных ингредиентов изолирующую оболочку.
Материалы, образующие изолирующую оболочку, обычно являются инертными и могут быть выбраны, например, из группы, включающей сахар, шеллак и другие средства, образующие энтеросолюбильные покрытия. Альтернативно, активные ингредиенты могут быть заключены в желатиновую капсулу.
Композиция в твердой или жидкой форме может включать агент, связывающий активный компонент(ы) и тем самым способствующий доставке активных компонентов. Подходящие агенты, которые могут выступать в этом качестве, включают моноклональное и поликлональное антитело, белок или липосому.
Фармацевтическая композиция по настоящему изобретению может состоять из газообразных лекарственных доз, например, указанная композиция может быть представлена в форме аэрозоля. Термин аэрозоль используется для обозначения ряда систем, начиная с систем коллоидного характера и кончая системами, включающими аэрозольные упаковки. Доставка может осуществляться посредством сжиженного или сжатого газа, или с помощью системы пульверизатора, дозирующего активные ингредиенты. Аэрозоли соединений по изобретению могут выпускаться в однофазной, двухфазной или трехфазной системах, обеспечивающих доставку активного ингредиента (ингредиентов). Доставка аэрозоля подразумевает наличие необходимого контейнера, активаторов, клапанов, вспомогательных отсеков, распределителей и т.п., вместе образующих набор. Предпочтительные аэрозоли могут быть установлены специалистом в данной области без излишнего эксперимента.
Независимо от того, в какой форме находится, твердой, жидкой или газообразной, фармацевтическая композиция по настоящему изобретению может содержать одно или более известных фармакологических средств, применяемых в терапии воспаления (включающего астму, аллергию, ревматоидный артрит, рассеянный склероз и т.д.), аутоиммунные заболевания (включающие диабет и красную волчанку) и пролиферативные нарушения (злокачественные новообразования).
Фармацевтические композиции могут быть получены по методикам, хорошо известным в области фармации.
Композиция, предназначенная для применения путем инъекции, может быть получена объединением соединения по изобретению с водой в целях получения раствора. Может быть добавлено поверхностно-активное вещество, что облегчает образование гомогенного раствора или суспензии. Поверхностно-активные вещества представляют собой соединения, которые нековалентно взаимодействуют с соединением по изобретению, способствуя растворению или образованию гомогенной суспензии активного соединения в водной системе доставки.
С. Способы применения
Соединения по изобретению или фармацевтические композиции, содержащие одно или более указанных соединений и фармацевтически приемлемый носитель, разбавитель или наполнитель, могут быть использованы в способах лечения или предотвращения воспалительного состояния или заболевания у пациента, где способ включает введение нуждающемуся в таком лечении пациенту некоторого количества соединения или композиции по настоящему изобретению, где количество является эффективным для лечения или предотвращения воспалительного состояния или заболевания у пациента.
Воспалительное состояние или заболевание может включать острое или хроническое воспаление костей и/или хрящей суставов; воспалительное состояние или заболевание может означать артрит, выбираемый из группы, включающей ревматоидный артрит, подагрический артрит или ювенильный ревматоидный артрит; воспалительное состояние может означать аутоиммунное состояние или заболевание; воспалительное состояние или заболевание может включать воспаление центральной нервной системы (например, где заболеванием центральной нервной системы является рассеянный склероз или где заболеванием центральной нервной системы является болезнь Альцгеймера); воспалительное состояние или заболевание может означать заболевание красной волчанкой; воспалительное состояние или заболевание может означать воспалительную болезнь кишечника (например, болезнь Крона или неспецифический язвенный колит); воспалительное состояние или заболевание может означать воспалительное кожное заболевание (например, псориаз или дерматит); воспалительное состояние или заболевание может означать реакцию трансплантат против хозяина; воспалительное состояние или заболевание может быть сосудистым (например, васкулит); воспалительное состояние или заболевание может означать атеросклеротическую болезнь; воспалительное состояние или заболевание может включать респираторное воспаление (например, респираторным заболеванием является астма или где респираторным заболеванием является хроническое обструктивное заболевание легких; или где респираторным заболеванием является эмфизема); воспалительное состояние или заболевание может означать легочный саркоидоз; воспалительное состояние или заболевание может означать глазное воспаление или аллергию; воспалительное состояние или заболевание может означать аллергический ринит; воспалительное состояние или заболевание может быть связано с инфильтрацией лейкоцитами; воспалительное состояние или заболевание может быть связано с отеком; состояние или заболевание может быть связано с ишемическим реперфузионным нарушением; состояние или заболевание может быть связано с повышенными уровнями воспалительных цитокинов (например, где воспалительный цитокин означает IL-1 или где воспалительный цитокин означает IL-2, или где воспалительный цитокин означает IL-3, или где воспалительный цитокин означает интерлейкин (IL)-4, или где воспалительный цитокин означает IL-5, или где воспалительный цитокин означает IL-6, или где воспалительный цитокин означает IL-8, или где воспалительный цитокин означает IL-9, или где воспалительный цитокин означает IL-10, или где воспалительный цитокин означает IL-12, или где воспалительный цитокин означает IL-13, или где воспалительный цитокин означает IL-18, или где воспалительный цитокин означает TNF-α, или где воспалительный цитокин означает TGF-β, или где воспалительный цитокин означает GM-CSF, или где воспалительный цитокин означает IFN-γ, или где воспалительный цитокин означает LTB4, или где воспалительный цитокин является членом семейства цистеиниллейкотриенов, или где воспалительный цитокин регулируется активацией нормальных T-клеток, экспрессированных и секретированных (RANTES), или где воспалительный цитокин означает эотаксин-1, 2 или 3, или где воспалительный цитокин означает воспалительный белок макрофага (MIP)-1a, или где воспалительный цитокин означает моноцитарный хемотактический белок-1, 2, 3 или 4); состояние или заболевание может быть связано с измененными уровнями воспалительных факторов адгезии (например, когда фактором адгезии является иммуноглобулин, таким как фактор адгезии сосудистых клеток (VCAM-1 или 2) или фактор межклеточной адгезии (ICAM-1 или 2); когда фактором адгезии является интегрин, таким как самый поздний антиген-4 (VLA-4) или Mac-1; когда фактором адгезии является селектин, такой как e-селектин).
Кроме того, настоящее изобретение касается способа лечения или предотвращения заболевания или состояния у пациента, где заболевание или состояние связано с патологическими состояниями, вовлекающими инфильтрацию лейкоцитами, способ включает введение нуждающемуся в таком лечении пациенту некоторого количества соединения или композиции по настоящему изобретению, где количество является эффективным для лечения или предотвращения заболевания или состояния, вызванного патологическими состояниями, вовлекающими инфильтрацию лейкоцитами.
Далее настоящее изобретение касается способа лечения или предотвращения артрита у пациента, включающего введение нуждающемуся в таком лечении пациенту некоторого количества соединения или композиции по настоящему изобретению, где количество является эффективным для лечения или предотвращения артрита у пациента.
Далее настоящее изобретение касается способа лечения или предотвращения воспалительной болезни кишечника у пациента, включающего введение нуждающемуся в таком лечении пациенту некоторого количества соединения или композиции по настоящему изобретению, где количество является эффективным для лечения или предотвращения воспалительной болезни кишечника у пациента.
Далее настоящее изобретение касается способа лечения или предотвращения воспалительной болезни кишечника у пациента, включающего введение нуждающемуся в таком лечении пациенту некоторого количества соединения или композиции по настоящему изобретению, где количество является эффективным для лечения или предотвращения псориаза у пациента.
Далее настоящее изобретение касается способа лечения или предотвращения атеросклероза у пациента, включающего введение нуждающемуся в таком лечении пациенту некоторого количества соединения или композиции по настоящему изобретению, где количество является эффективным для лечения или предотвращения атеросклероза у пациента.
Согласно способу по настоящему изобретению соединение по изобретению или фармацевтическая композиция, содержащая одно или более соединений по изобретению и фармацевтически приемлемый носитель, разбавитель или наполнитель, может, хотя не обязательно, достигать одного или более следующих желательных результатов у пациента, которому вводится вышеуказанное соединение по изобретению или композиция, содержащая одно из этих соединений и фармацевтически приемлемый носитель, разбавитель или наполнитель:
1. Ингибирование инфильтрации лейкоцитов (например, нейтрофилов, макрофагов и т.д.);
2. Ингибирование активации лейкоцитов;
3. Изменение соотношения лимфоцитов (например, клеток TH1 против TH2);
4. Ингибирование хемотаксиса лейкоцитов;
5. Ингибирование продуцирования и/или высвобождения TNF-α;
6. Ингибирование продуцирования и/или высвобождения хемокина (например, эотаксина и т.д.);
7. Ингибирование продуцирования, высвобождения и/или функции фактора адгезии (например, VCAM, VLA-4 и т.д.);
8. Ингибирование отека;
9. Ингибирование продуцирования и/или высвобождения цитокина интерлейкина (например, IL-1, IL-2, IL-3, IL-4, IL-5, IL6, IL-8, IL-9, IL10, IL-12, IL-13, IL-18);
10. Ингибирование высвобождения медиаторов воспаления (например, лейкотриенов, триптазы, аденозина и т.д.);
11. Ингибирование симптомов артрита;
12. Ингибирование симптомов воспалительной болезни кишечника;
13. Ингибирование симптомов псориаза;
14. Ингибирование симптомов атеросклероза.
Описанные здесь соединения по изобретению или фармацевтические композиции, содержащие одно или более указанных соединений и фармацевтически приемлемый носитель, разбавитель или наполнитель, могут быть использованы в способе лечения или предотвращения пролиферативного нарушения у пациента, где способ включает введение нуждающемуся в такой терапии пациенту некоторого количества соединения или композиции по настоящему изобретению, где количество является эффективным для лечения или предотвращения пролиферативного нарушения у пациента.
Как использовано здесь, пролиферативные нарушения включают, но не в порядке ограничения, все виды лейкоза и солидные опухоли, подверженные дифференцировке или апоптозу при прерывании соответствующего клеточного цикла.
Таким образом, способ по изобретению может быть использован для лечения воспаления, включая как острое, так и хроническое воспаление, а также некоторых пролиферативных нарушений (злокачественных новообразований). Как использовано здесь, воспаление включает, но не в порядке ограничения, артрит (где указанный термин охватывает свыше 100 видов болезней, включающих ревматоидный артрит, псориатический артрит, анкилозирующий спондилит, остеоартрит, подагру и синовит), воспаления головного мозга (включая рассеянный склероз, болезнь Альцгеймера, умственное расстройство при СПИДе, удар, энцефалит, травму и болезнь Крейтцфельда-Якоба), воспалительную болезнь кишечника (включая болезнь Крона и неспецифический язвенный колит), синдром раздраженной толстой кишки, ишемическое реперфузионное нарушение, включающее инфаркт миокарда, саркоидоз, псориаз, реакцию трансплантата ткани/органа против хозяина, системную красную волчанку, ювенильный диабет типа I, васкулит, артеросклероз, кардиомиопатию, аутоиммунный миокардит, атопический дерматит, астму, аллергию, аллергический ринит и хроническое обструктивное заболевание легких (включая эмфизему и бронхит).
Способ по изобретению предусматривает введение терапевтически эффективного количества соединения по изобретению, включая соответствующие соли, композиции и пр. Как использовано здесь, фактическое количество, охватываемое термином "терапевтически эффективное количество" зависит от способа введения, типа излечиваемого теплокровного и физических характеристик конкретного рассматриваемого теплокровного. Эти факторы и влияние указанных факторов на определение такого количества хорошо известны специалистам в области медицины. Указанное количество и способ введения могут быть специально подобраны для достижения оптимальной эффективности в зависимости от таких факторов, как масса, диета, конкурентная лекарственная терапия и другие факторы, известные специалистам в области медицины.
Терапевтически эффективное количество соединения или фармацевтической композиции по настоящему изобретению должно быть достаточным для лечения воспаления или пролиферативных заболеваний у теплокровного, такого как человек. Способы введения терапевтически эффективных количеств противовоспалительных средств хорошо известны в данной области и включают введение ингаляционной, пероральной или парентеральной форм. Такие лекарственные формы включают, но не в порядке ограничения, парентеральные растворы, таблетки, капсулы, имплантаты замедленного высвобождения и системы трансдермальной доставки; либо ингаляционные лекарственные системы, использующие ингаляторы с сухим порошком или ингаляционные устройства, содержащие многократные дозы под давлением.
Величину дозировки и частоту введения выбирают таким образом, чтобы создать терапевтически эффективный уровень средства, не оказывающий вредного воздействия. Указанный уровень обычно соответствует интервалу доз приблизительно от 0,001 до 100 мг/кг/день и, как правило, приблизительно от 0,01 до 10 мг/кг/день, при пероральном или внутривенном введении. Кроме того, обычно, приблизительно от 0,0001 до 10 мг/кг/день при интраназальном введении или путем ингаляции.
D. Предпочтительные варианты осуществления изобретения
Из числа соединений формулы (I), приведенной выше в разделе “сущность изобретения”, предпочтительную группу соединений составляют соединения формулы (Ia):

где
кольцо A, C или D независимо является полностью насыщенным или частично насыщенным;
каждый из C1, C4, C11, C12, C15 и C16 независимо замещен двумя водородами;
каждый из C9 и C14 независимо замещен водородом;
R1 означает -OR7 или -N(R7)2;
каждый из R2 и R3 независимо выбирают из группы, включающей -R8-OR7, -R8-OC(O)R9, -R10-N(R7)2, -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, алкил, алкенил, необязательно замещенный аралкил, необязательно замещенный аралкенил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарилалкил, необязательно замещенный гетероарилалкенил и необязательно замещенный гетероарилалкенил;
каждый из R4a и R4b независимо выбирают из группы, включающей водород, алкил, алкенил или алкинил;
либо R4a означает водород, алкил, алкенил или алкинил и R4b означает прямую связь с углеродом в положении C16;
либо R4a и R4b вместе образуют алкилиден или галогеналкилиден;
R5 означает алкил или R5 означает прямую связь с углеродом в положении C14;
R6 означает водород, -R8-OR7 или -R8-N(R7)2;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, алкил, необязательно замещенный циклоалкил, необязательно замещенный циклоалкилалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарил и необязательно замещенный гетероарилалкил;
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную алкиленовую цепь и линейную или разветвленную алкениленовую цепь; и
каждый R9 независимо выбирают из группы, включающей водород, алкил, арил и аралкил;
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную алкиленовую и линейную или разветвленную алкениленовую цепь.
Из этой группы соединений одной из предпочтительных подгрупп соединений является подгруппа, где
R1 означает -OR7;
каждый из R2 и R3 независимо выбирают из группы, включающей -R8-OR7, -R8-OC(O)R9, -R10-N(R7)2, -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, алкил, алкенил, необязательно замещенный аралкил, необязательно замещенный аралкенил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарилалкил, необязательно замещенный гетероарилалкенил и необязательно замещенный гетероарилалкенил;
каждый из R4a и R4b независимо выбирают из группы, включающей водород, алкил, алкенил или алкинил;
либо R4a означает водород, алкил, алкенил или алкинил и R4b означает прямую связь с углеродом в положении C16;
либо R4a и R4b вместе образуют алкилиден или галогеналкилиден;
R5 означает алкил или R5 означает прямую связь с углеродом в положении C14;
R6 означает водород, -R8-OR7 или -R8-N(R7)2;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, алкил, необязательно замещенный циклоалкил, необязательно замещенный циклоалкилалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарил и необязательно замещенный гетероарилалкил;
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную алкиленовую цепь и линейную или разветвленную алкениленовую цепь; и
каждый R9 независимо выбирают из группы, включающей водород, алкил, арил и аралкил;
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную алкиленовую и линейную или разветвленную алкениленовую цепь.
Из указанной подгруппы соединений одним из предпочтительных классов соединений является тот класс, где
R1 означает -OR7;
R2 означает -R8-OR7;
R3 выбирают из группы, включающей -R8-OR7, -R8-OC(O)R9, -R10-N(R7)2, -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, алкил, алкенил, необязательно замещенный аралкил, необязательно замещенный аралкенил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарилалкил, необязательно замещенный гетероарилалкенил и необязательно замещенный гетероарилалкенил;
каждый из R4a и R4b независимо выбирают из группы, включающей водород, алкил, алкенил или алкинил;
либо R4a означает водород, алкил, алкенил или алкинил и R4b означает прямую связь с углеродом в положении C16;
либо R4a и R4b вместе образуют алкилиден или галогеналкилиден;
R5 означает алкил или R5 означает прямую связь с углеродом в положении C14;
R6 означает водород, -R8-OR7 или -R8-N(R7)2;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, алкил, необязательно замещенный циклоалкил, необязательно замещенный циклоалкилалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарил и необязательно замещенный гетероарилалкил;
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную алкиленовую цепь и линейную или разветвленную алкениленовую цепь; и
каждый R9 независимо выбирают из группы, включающей водород, алкил, арил и аралкил;
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную алкиленовую и линейную или разветвленную алкениленовую цепь.
Из этого класса соединений одним из предпочтительных подклассов соединений является тот подкласс, где
R1 означает -OR7;
R2 означает -R8-OR7;
R3 означает -R8-OR7;
каждый из R4a и R4b независимо выбирают из группы, включающей водород, алкил, алкенил или алкинил;
либо R4a означает водород, алкил, алкенил или алкинил и R4b означает прямую связь с углеродом в положении C16;
либо R4a и R4b вместе образуют алкилиден или галогеналкилиден;
R5 означает алкил;
R6 означает водород;
каждый R7 независимо выбирают из группы, включающей водород, алкил, замещенный арил или необязательно замещенный аралкил; и
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную алкиленовую цепь и линейную или разветвленную алкениленовую цепь.
Из указанного класса соединений другим предпочтительным подклассом соединений является тот подкласс, где
R1 означает -OR7;
R2 означает -R8-OR7;
R3 означает -R10-N(R7)2;
каждый из R4a и R4b независимо выбирают из группы, включающей водород, алкил, алкенил или алкинил;
либо R4a означает водород, алкил, алкенил или алкинил и R4b означает прямую связь с углеродом в положении C16;
либо R4a и R4b вместе образуют алкилиден или галогеналкилиден;
R5 означает алкил или R5 означает прямую связь с углеродом в положении C14;
R6 означает водород, -R8-OR7 или -R8-N(R7)2;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, алкил, необязательно замещенный циклоалкил, необязательно замещенный циклоалкилалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарил и необязательно замещенный гетероарилалкил;
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную алкиленовую цепь и линейную или разветвленную алкениленовую цепь; и
каждый R9 независимо выбирают из группы, включающей водород, алкил, арил и аралкил;
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную алкиленовую и линейную или разветвленную алкениленовую цепь.
Из вышеуказанной предпочтительной подгруппы другим предпочтительным классом соединений является тот класс, где
R1 означает -OR7;
R2 означает -R10-N(R7)2;
R3 выбирают из группы, включающей -R8-OR7, -R8-OC(O)R9, -R10-N(R7)2, -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, алкил, алкенил, необязательно замещенный аралкил, необязательно замещенный аралкенил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарилалкил, необязательно замещенный гетероарилалкенил и необязательно замещенный гетероарилалкенил;
каждый из R4a и R4b независимо выбирают из группы, включающей водород, алкил, алкенил или алкинил;
либо R4a означает водород, алкил, алкенил или алкинил и R4b означает прямую связь с углеродом в положении C16;
либо R4a и R4b вместе образуют алкилиден или галогеналкилиден;
R5 означает алкил или R5 означает прямую связь с углеродом в положении C14;
R6 означает водород, -R8-OR7 или -R8-N(R7)2;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, алкил, необязательно замещенный циклоалкил, необязательно замещенный циклоалкилалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарил и необязательно замещенный гетероарилалкил;
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную алкиленовую цепь и линейную или разветвленную алкениленовую цепь; и
каждый R9 независимо выбирают из группы, включающей водород, алкил, арил и аралкил;
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную алкиленовую и линейную или разветвленную алкениленовую цепь.
Из этого предпочтительного класса соединений одним из предпочтительных подклассов соединений является тот подкласс, где
R1 означает -OR7;
R2 означает -R10-N(R7)2;
R3 означает -R8-OR7;
каждый из R4a и R4b независимо выбирают из группы, включающей водород, алкил, алкенил или алкинил;
либо R4a означает водород, алкил, алкенил или алкинил и R4b означает прямую связь с углеродом в положении C16;
либо R4a и R4b вместе образуют алкилиден или галогеналкилиден;
R5 означает алкил или R5 означает прямую связь с углеродом в положении C14;
R6 означает водород, -R8-OR7 или -R8-N(R7)2;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, алкил, необязательно замещенный циклоалкил, необязательно замещенный циклоалкилалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарил и необязательно замещенный гетероарилалкил;
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную алкиленовую цепь и линейную или разветвленную алкениленовую цепь; и
каждый R9 независимо выбирают из группы, включающей водород, алкил, арил и аралкил;
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную алкиленовую и линейную или разветвленную алкениленовую цепь.
Из указанного предпочтительного класса соединений другим предпочтительным подклассом соединений является тот подкласс, где
R1 означает -OR7;
R2 означает -R10-N(R7)2;
R3 означает -R10-N(R7)2;
каждый из R4a и R4b независимо выбирают из группы, включающей водород, алкил, алкенил или алкинил;
либо R4a означает водород, алкил, алкенил или алкинил и R4b означает прямую связь с углеродом в положении C16;
либо R4a и R4b вместе образуют алкилиден или галогеналкилиден;
R5 означает алкил или R5 означает прямую связь с углеродом в положении C14;
R6 означает водород, -R8-OR7 или -R8-N(R7)2;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, алкил, необязательно замещенный циклоалкил, необязательно замещенный циклоалкилалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарил и необязательно замещенный гетероарилалкил;
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную алкиленовую цепь и линейную или разветвленную алкениленовую цепь; и
каждый R9 независимо выбирают из группы, включающей водород, алкил, арил и аралкил;
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную алкиленовую и линейную или разветвленную алкениленовую цепь.
Из группы соединений, указанной выше первой, другой предпочтительной подгруппой соединений является та подгруппа, где
R1 означает -N(R7)2;
каждый из R2 и R3 независимо выбирают из группы, включающей -R8-OR7, -R8-OC(O)R9, -R10-N(R7)2, -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, алкил, алкенил, необязательно замещенный аралкил, необязательно замещенный аралкенил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарилалкил, необязательно замещенный гетероарилалкенил и необязательно замещенный гетероарилалкенил;
каждый из R4a и R4b независимо выбирают из группы, включающей водород, алкил, алкенил или алкинил;
либо R4a означает водород, алкил, алкенил или алкинил и R4b означает прямую связь с углеродом в положении C16;
либо R4a и R4b вместе образуют алкилиден или галогеналкилиден;
R5 означает алкил или R5 означает прямую связь с углеродом в положении C14;
R6 означает водород, -R8-OR7 или -R8-N(R7)2;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, алкил, необязательно замещенный циклоалкил, необязательно замещенный циклоалкилалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарил и необязательно замещенный гетероарилалкил;
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную алкиленовую цепь и линейную или разветвленную алкениленовую цепь; и
каждый R9 независимо выбирают из группы, включающей водород, алкил, арил и аралкил;
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную алкиленовую и линейную или разветвленную алкениленовую цепь.
Из предпочтительного класса соединений, указанного выше первым, другим предпочтительным подклассом соединений является тот подкласс, где
R1 означает -OR7;
R2 означает -R8-OR7;
R3 означает -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2;
каждый из R4a и R4b независимо выбирают из группы, включающей водород, алкил, алкенил или алкинил;
либо R4a означает водород, алкил, алкенил или алкинил и R4b означает прямую связь с углеродом в положении C16;
либо R4a и R4b вместе образуют алкилиден или галогеналкилиден;
R5 означает алкил или R5 означает прямую связь с углеродом в положении C14;
R6 означает водород, -R8-OR7 или -R8-N(R7)2;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, алкил, необязательно замещенный циклоалкил, необязательно замещенный циклоалкилалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарил и необязательно замещенный гетероарилалкил;
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную алкиленовую цепь и линейную или разветвленную алкениленовую цепь; и
каждый R9 независимо выбирают из группы, включающей водород, алкил, арил и аралкил;
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную алкиленовую и линейную или разветвленную алкениленовую цепь.
Из предпочтительной подгруппы соединений, указанной выше первой, другим предпочтительным классом соединений является тот класс, где
R1 означает -OR7;
R2 выбирают из группы, включающей -R8-OC(O)R9, -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, алкил, алкенил, необязательно замещенный аралкил, необязательно замещенный аралкенил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарилалкил, необязательно замещенный гетероарилалкенил и необязательно замещенный гетероарилалкенил;
R3 означает -R8-OR7 или -R8-OC(O)R9;
каждый из R4a и R4b независимо выбирают из группы, включающей водород, алкил, алкенил или алкинил;
либо R4a означает водород, алкил, алкенил или алкинил и R4b означает прямую связь с углеродом в положении C16;
либо R4a и R4b вместе образуют алкилиден или галогеналкилиден;
R5 означает алкил или R5 означает прямую связь с углеродом в положении C14;
R6 означает водород, -R8-OR7 или -R8-N(R7)2;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, алкил, необязательно замещенный циклоалкил, необязательно замещенный циклоалкилалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарил и необязательно замещенный гетероарилалкил;
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную алкиленовую цепь и линейную или разветвленную алкениленовую цепь; и
каждый R9 независимо выбирают из группы, включающей водород, алкил, арил и аралкил;
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную алкиленовую и линейную или разветвленную алкениленовую цепь.
Из предпочтительного класса соединений, указанного выше первым, другим предпочтительным подклассом соединений является тот подкласс, где
R1 означает -OR7;
R2 означает -R8-OR7;
R3 означает гетероциклилалкил, необязательно замещенный гетероарилалкил, необязательно замещенный гетероарилалкенил или необязательно замещенный гетероарилалкенил;
каждый из R4a и R4b независимо выбирают из группы, включающей водород, алкил, алкенил или алкинил;
либо R4a означает водород, алкил, алкенил или алкинил и R4b означает прямую связь с углеродом в положении C16;
либо R4a и R4b вместе образуют алкилиден или галогеналкилиден;
R5 означает алкил или R5 означает прямую связь с углеродом в положении C14;
R6 означает водород, -R8-OR7 или -R8-N(R7)2;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, алкил, необязательно замещенный циклоалкил, необязательно замещенный циклоалкилалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероциклилалкил, необязательно замещенный гетероарил и необязательно замещенный гетероарилалкил;
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную алкиленовую цепь и линейную или разветвленную алкениленовую цепь; и
каждый R9 независимо выбирают из группы, включающей водород, алкил, арил и аралкил;
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную алкиленовую и линейную или разветвленную алкениленовую цепь.
Из приведенных выше предпочтительных групп соединений наиболее предпочтительными соединениями по изобретению являются те соединения, которые описаны ниже в разделе “примеры синтезов". Из приведенных выше предпочтительных групп соединений наиболее предпочтительные варианты выбора значений R1, R2, R3, R4a, R4b, R5, R6, R7, R8, R9 и R10 могут быть выявлены при рассмотрении соединений, описанных ниже в разделе “примеры синтезов". Например, наиболее предпочтительным вариантом выбора значений R4a и R4b является вариант, когда оба заместителя вместе образуют метиленовую или этилиденовую группу. Например, предпочтительным вариантом выбора значения R1 является -R8-OR7, где R8 означает прямую связь и R7 означает водород. Например, предпочтительным вариантом выбора значения R5 является метил. Например, предпочтительным вариантом выбора значения R6 является водород. Подобные предпочтительные варианты осуществления сразу видны из последующего описания и приложенных пунктов.
Из способов лечения воспалительного состояния или заболевания у млекопитающего посредством введения соединения по изобретению, как указано выше в разделе “сущность изобретения”, предпочтительным является способ введения соединения формулы (Ia). Кроме того, предпочтительным является способ, где воспалительное состояние или заболевание выбирают из следующей группы, включающей артрит (включая ревматоидный артрит, псориатический артрит, анкилозирующий спондилит, остеоартрит, подагру и синовит), воспаления головного мозга (включая рассеянный склероз, болезнь Альцгеймера, умственное расстройство при СПИДе, удар, энцефалит, травму и болезнь Крейтцфельда-Якоба), воспалительную болезнь кишечника (включая болезнь Крона и неспецифический язвенный колит), синдром раздраженной толстой кишки, ишемическое реперфузионное нарушение (включая инфаркт миокарда) саркоидоз, псориаз, реакцию трансплантата ткани/органа против хозяина, системную красную волчанку, ювенильный диабет типа I, васкулит, артеросклероз, кардиомиопатию, аутоиммунный миокардит, атопический дерматит, астму, аллергию, аллергический ринит и хроническое обструктивное заболевание легких (включая эмфизему и бронхит).
E. Получение соединений по изобретению
Соединения по изобретению могут быть получены способами с использованием стадий, известных специалистам в данной области, либо аналогичных таким стадиям.
Общие способы осуществления взаимодействий на стероидах могут быть найдены в "Steroid Reactions", C. Djerassi, Ed. Holden Day, San Francisco, Calif., 1963 и приведенных там ссылках. Общие синтетические способы могут быть взяты из "Comprehensive Organic Transformations", R.C. Larock, VCH Publishers, New York, N.Y., 1989 и приведенных там ссылок. Дополнительными литературными ссылками, полезными для синтеза соединений по изобретению, являются следующие: T. Reichstein; C.H. Meystre, Helv. Chim. Act, 1932, 22, 728; H. Westmijze; H. Kleyn; P. Vermeer; L.A. van Dijck, Tet. Lett. 1980, 21, 2665; K. Prezewowsky; R Wiechert, пат. США № 3682983; P. Kaspar; H. Witzel, J. Steroid Biochem. 1985, 23, 259; W.G. Dauben; T. Brookhart, J. Am. Chem. Soc. 1981, 103, 237; A.J. Manson et al., J. Med. Chem. 1963, 6, 1; R.O. Clinton et al, J. Am. Chem. Soc. 1961, 83, 1478; M.S. Ahmad; L.A. Khan, Acta. Chim. Acad. Sci. Hung. 1981, 106, 111.
В частности, соединения по изобретению могут быть получены по следующим схемам или реакционным схемам, приведенным в разделе “примеры синтезов”. Само собой разумеется, что другие соединения по изобретению могут быть получены аналогичным способом, как описано ниже, либо способами, известными квалифицированному специалисту в данной области. Очевидно, что хотя последующие “примеры синтезов” направлены на получение определенного заместителя на конкретном атоме углерода в соединениях, специалист в данной области, основываясь на приведенных здесь указаниях и с учетом общеизвестной информации данной области, может получить подобные заместители на других углеродных атомах соединений.
Согласно приведенной ниже схеме A кетоны соединения 1 или соединения, аналогичные указанному, могут быть подвергнуты алкилированию с помощью ряда алкилирующих групп, что дает соединения по изобретению, имеющие, но не в порядке ограничения, алкильное, циклоалкильное, арильное и гетероарильное замещение. Алкилирование 17-кетона 1 под действием аниона ацетилена приводит к образованию 17α-этинил-17β-гидроксил-промежуточного соединения 2.
Обращение стереохимии C17-заместителей может быть осуществлено первоначальным получением метилсульфоната с последующей обработкой нитратом серебра(I) в тетрагидрофуране (ТГФ) и воде. Дегидратация соединения 2 с применением POCl3 в 2,4-лутидине дает соединение 3. Обработка с помощью тетрабутиламмонийфторида приводит к удалению трет-бутилдиметилсилильных групп, с образованием соединения 4.
Схема А

i)KCCH; ii) 2,4-лутидин iii) Bu4NF
Согласно приведенной ниже схеме B соединения по изобретению, имеющие алленовую функциональность, могут быть получены из промежуточных соединений, аналогичных соединению 2. Характерным примером служит взаимодействие соединения 2 с LiAlH4 и AlCl3 в ТГФ, приводящее к аллену 5. Обработка тетрабутиламмонийфторидом удаляет трет-бутилдиметилсилильные группы, что приводит к образованию соединения 6.
Схема В

Согласно приведенной ниже схеме С соединения по изобретению, имеющие алкинильную функциональность, могут быть получены из промежуточных алленовых соединений. Иллюстративным примером служит обработка соединений 5 н-BuLi в ТГФ, дающая 17β-этинильное соединение 7. Обработка тетрабутиламмонийфторидом удаляет трет-бутилдиметилсилильные группы, что приводит к образованию соединения 8.
Схема С

Согласно приведенной ниже схеме D соединения по изобретению, имеющие алкенильную функциональность, могут быть получены из промежуточных алкиновых соединений. Иллюстративным примером служит контролируемое гидрирование соединения 7 с использованием Pd-CaCO3 в качестве катализатора, приводящее к образованию алкена 9. Обработка тетрабутиламмонийфторидом удаляет трет-бутилдиметилсилильные группы, что приводит к образованию соединения 10.
Схема D

Соединение 1 может быть использовано во множестве реакций олефинирования, включая реакции по типу Виттига, приводящие к соединениям по изобретению, содержащим экзоциклический олефин. Например, как иллюстрируется приведенной ниже схемой E, соединение 1 может быть обработано этилтрифенилфосфонийбромидом и трет-бутилатом калия, что дает соединение 11, содержащее R1=метил и R2=водород. Обработка тетрабутиламмонийфторидом удаляет трет-бутилдиметилсилильные группы, что приводит к образованию соединения 12.
По аналогии с синтезом, представленным следующей схемой E, кетоны, такие как соединение 1, могут быть подвергнуты взаимодействию с другими реагентами типа Виттига, такими как, но не в порядке ограничения, метил-, пропил-, бутил-, пентил- или гексилтрифенилфосфонийбромид, что приводит к образованию соединений по изобретению, аналогичных соединению 12, содержащему R2=водород и R1=водород, этил, пропил, бутил или пентил.
Схема Е

Соединения по изобретению могут содержать экзоциклические двойные связи E- и/или Z-геометрии. Например, как иллюстративно представлено на следующей схеме F, Z-олефин 11 в циклогексане может быть обработан УФ-светом в присутствии дифенилдисульфида, что приводит к изомеризации до E-олефина 13. Обработка тетрабутиламмонийфторидом удаляет трет-бутилдиметилсилильные группы, что приводит к образованию соединения 14.
Схема F

Множество соединений по изобретению, содержащих функционализированные боковые цепи, может быть получено применением способов, таких как промотируемые кислотами Льюиса сочетания с альдегидами и акцепторами Михаэля. Например, как иллюстрируется следующей схемой G, соединение 11 может быть подвергнуто взаимодействию с метилпропиолатом в присутствии диэтилалюминийхлорида, что приводит к образованию соединения 15. Двойные связи могут быть подвергнуты гидрированию с использованием катализатора, такого как платина, что дает соединение 16. Обработка тетрабутиламмонийфторидом удаляет трет-бутилдиметилсилильные группы, что приводит к образованию соединения 17.
Схема G

Следующие специфические примеры приведены в качестве руководства, способствующего практическому осуществлению изобретения, и не рассматриваются как ограничивающие рамки объема изобретения и приложенных пунктов.
Если не оговорено особо, флэш-хроматография и колоночная хроматография, используемые в следующих примерах, могут быть выполнены с применением силикагеля Merck 60 (230-400 меш). Флэш-хроматография может быть выполнена по методике, приведенной в "Purification of Laboratory Chemicals", 3rd. edition, Butterworth-Heinemann Ltd., Oxford (1988), Eds. D. D. Perrin and W. L. F. Armarego, page 23. Колоночная хроматография означает способ, где скорость протекания элюента через насадочный материал определяется гравитацией. Во всех случаях флэш-хроматография и радиальная хроматография могут быть взаимозаменяемыми. Радиальная хроматография может быть выполнена с использованием силикагеля на Chromatotron Model № 7924T (Harrison Research, Palo Alto, California). Если не оговорено особо, регистрируемые значения Rf получают методом тонкослойной хроматографии, используя силикагель 60 F254 (Merck KGaA, 64271, Darmstadt, Germany). Насыщенный раствор соли означает насыщенный раствор хлорида натрия.
Также, если не оговорено особо, химические реагенты и реактивы поставляются стандартными химическими фирмами-поставщиками, такими как Aldrich (Milwaukee, WI; www.aldrich.sial.com); EM Industries, Inc. (Hawthorne, NY); Fisher Scientific Co. (Hampton, NH) и Lancaster Synthesis, Inc. (Windham, NH). Газообразные вещества поставляет Praxair (Vancouver, B.C.). Клеточные линии, если не оговорено особо, получают из открытой продажи или коммерческих источников, например American Tissue Culture Collection (ATCC, Rockville, MD).
ПРИМЕРЫ СИНТЕЗОВ
ПРИМЕР 1
Соединение 25, характерное соединение по изобретению, может быть получено согласно реакционной схеме 1. Любое число соединений, родственных соединению 25, может быть получено использованием аналогичной методики. Исходное соединение 18 может быть получено по методикам, кратко изложенным в патенте США 6046185.
Реакционная схема 1

В общих чертах, гидрирование соединения 18, с применением Pd на угле в качестве катализитора, дает соединение 19. Окисление по Байеру-Виллагеру с использованием 3-хлорпероксибензойной кислоты (MCPBA) в CHCl3 дает лактоновое соединение 20. Восстановление лактона литийалюмогидридом в ТГФ дает диоловое соединение 21. Взаимодействие соединения 21 с трет-бутилдифенилсилилхлоридом (TBDPSCl) и имидазолом в ДМФА защищает первичный гидроксил в соединении 22. Обработка 80% уксусной кислотой удаляет кеталь и трет-бутилдиметилсилильную (TBS) группу, что дает соединение 23. Олефинирование соединения 23 с использованием метилтрифенилфосфонийбромида и KOtBu в ТГФ дает метилиденовое соединение 24. Обработка при нагревании до температуры кипения с обратным холодильником раствора Bu4NF в ТГФ удаляет TBDPS-группу, что дает соединение 25.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 19
Раствор соединения 18 (2,03 г, 4,41 ммоль) в EtOAc (135 мл) обрабатывают в течение ночи водородом (давление баллона) в присутствии каталитического количества Pd на угле. Катализатор удаляют фильтрованием, и раствор концентрируют досуха. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc/CH2Cl2, 8:1:1), получая соединение 19 (1,79 г, 88%) в виде белого твердого вещества.
Синтез соединения 20
Смесь соединения 19 (2,38 г, 5,14 ммоль) и MCPBA (3,11 г, 10,3 ммоль) в хлороформе (26 мл) нагревают до температуры кипения с обратным холодильником в течение 4 часов. После охлаждения до температуры окружающей среды реакционную смесь разбавляют EtOAc (25 мл), промывают насыщенным Na2SO3 (2×20 мл), насыщенным NaHCO3 (2×20 мл) и насыщенным раствором соли (2×20 мл), затем сушат над безводным MgSO4 и концентрируют досуха. Сырое соединение 20 (2,43 г, белое твердое вещество) используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 21
К раствору соединения 20 (1,00 г, 2,09 ммоль) в ТГФ при 0°C добавляют LiAlH4 (21 мл 1M раствора в ТГФ, 2,09 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение одного часа, затем медленно добавляют насыщенный раствор соли (5 мл). Раствор экстрагируют с помощью CH2Cl2 (2×15 мл), затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (EtOAc), получая соединение 21 (0,786 г, 78%) в виде белого твердого вещества.
Синтез соединения 22
Раствор соединения 21 (0,93 г, 1,93 ммоль), TBDPSCl (1,1 мл, 4,4 ммоль) и имидазола (0,57 г, 8,5 ммоль) в сухом ДМФА (10 мл) перемешивают в течение ночи. Реакционную смесь разбавляют EtOAc (50 мл) и промывают насыщенным раствором соли (2×20 мл), затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 3:1), получая соединение 22 (1,22 г, 66%) в виде белого твердого вещества.
Синтез соединения 23
Смесь соединения 22 (1,00 г, 1,39 ммоль) и 80% уксусной кислоты (20 мл)) перемешивают при 50°C в течение 2 часов, затем разбавляют толуолом (30 мл) и концентрируют. Сырое соединение 23 используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 24
Смесь KOtBu (0,487 г, 4,12 ммоль) и MePPh3Br (1,47 г, 4,12 ммоль) в ТГФ (6 мл) перемешивают при температуре окружающей среды в течение 1 часа в атмосфере аргона, после чего добавляют соединение 23 (0,773 г, 1,37 ммоль) в ТГФ (6 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи, затем разбавляют EtOAc (40 мл) и промывают насыщенным раствором соли (2×30 мл), после чего сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 1:1), получая соединение 24 (0,606 г, 79%) в виде белого твердого вещества.
Синтез соединения 25
Раствор соединения 24 (0,15 г, 0,267 ммоль) и Bu4NF (0,4 мл 1,0M раствора в ТГФ) в ТГФ (5 мл) нагревают до температуры кипения с обратным холодильником в атмосфере аргона в течение 2 часов. Растворитель выпаривают при пониженном давлении и остаток очищают хроматографией на силикагеле (MeOH/EtOAc, 2:98), получая соединение 25 (0,073 г, 82%) в виде белого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мM NH4OAc в смеси 3:7 воды и MeCN) 287,10; C20H31O.
ПРИМЕР 2
Соединение 29, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 2. Любое количество соединений, родственных соединению 29, может быть получено с применением подобной методики. Исходное соединение 20 может быть получено согласно методикам, приведенным выше в примере 1.
Реакционная схема 2

В общих чертах, обработка лактонового соединения 20 с помощью MeLi в ТГФ дает соединение лактола 26. Окисление по Байеру-Виллагеру с использованием MCPBA в CHCl3 дает соединение 27. Обработка 80% уксусной кислотой удаляет кеталь и TBS-группу, что дает соединение 28. Восстановление соединения 28 с использованием метилтрифенилфосфонийбромида и KOtBu в ТГФ вводит метилиденовую группу и удаляет ацильную группу, что дает соединение 29.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 26
К раствору соединения 20 (2,0 г, 4,18 ммоль) при 0°C в сухом ТГФ (12 мл) добавляют по каплям MeLi (8,95 мл 1,4M раствора в диэтиловом эфире). Реакционную смесь перемешивают в течение 2 часов, затем выливают на лед и экстрагируют EtOAc (3×100 мл). Объединенный органический слой промывают насыщенным раствором соли (2×50 мл), затем сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 8:2), получая соединение 26 (1,49 г, 72%) в виде белого твердого вещества.
Синтез соединения 27
К раствору соединения 26 (1,49 г, 3,00 ммоль) в хлороформе добавляют MCPBA (1,8 г, 6,00 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 20 часов, затем разбавляют EtOAc (200 мл). Раствор промывают последовательно 5% раствором NaHSO3 (2×100 мл), насыщенным раствором K2CO3 (2×50 мл) и насыщенным раствором соли (2×50 мл), после чего сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 9:1), получая соединение 27 (1,3 г, 85%) в виде белого твердого вещества.
Синтез соединения 28
Смесь соединения 27 (400 мг, 0,783 ммоль) и 80% уксусной кислоты (5 мл) перемешивают при 50°C в течение 5 часов, затем разбавляют толуолом (50 мл) и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/ацетон, 1:1), получая соединение 28 (322 мг, 86%) в виде белого твердого вещества.
Синтез соединения 29
Смесь KOtBu (286 мг, 2,55 ммоль) и MePPh3Br (911 мг, 2,55 ммоль) в ТГФ (2 мл) перемешивают при температуре окружающей среды в течение 1 часа в атмосфере аргона, затем добавляют соединение 28 (300 мг, 0,85 ммоль) в ТГФ (2 мл). Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 4 часов, затем охлаждают до температуры окружающей среды и разбавляют водой (5 мл). Раствор экстрагируют EtOAc (3×50 мл) и промывают насыщенным раствором соли (2×20 мл), после чего сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 2:8), получая соединение 29 (144 мг, 55%) в виде белого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 273,01; C19H29O.
ПРИМЕР 3
Соединение 38, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 3. Любое количество соединений, родственных соединению 38, может быть получено с применением подобной методики. Исходное соединение 30 может быть получено согласно методикам, кратко изложенным в патенте США 6046185.
Реакционная схема 3

В общих чертах, дигидроксилирование соединения 30 с применением тетраоксида осмия в пиридине дает соединение 31. Окислительное расщепление диола с использованием тетраацетата свинца в CH2Cl2 дает соединение 32. Селективное восстановление альдегидной группы с использованием LiBEt3H в ТГФ дает соединение 33. Взаимодействие соединения 33 с TBDPSCl и имидазолом в ДМФА защищает свободную гидроксильную группу, давая соединение 34. Восстановление литийалюмогидридом кетоновой группы дает соединение 35. Обработка 80% уксусной кислотой удаляет кеталь, что дает соединение 36. Олефинирование с использованием метилтрифенилфосфонийбромида и KOtBu в ТГФ дает метилиденовое соединение 37. Обработка при нагревании до температуры кипения с обратным холодильником раствора Bu4NF в ТГФ удаляет TBDPS-группу, что дает соединение 38.
Далее приведены характерные примеры соединений, полученных, как указано выше.
Синтез соединения 31
К раствору соединения 30 (0,45 г, 0,89 ммоль) в пиридине (2,5 мл) добавляют OsO4 (0,25 г, 0,98 ммоль). Реакционную смесь перемешивают при 90°C в течение ночи, затем добавляют раствор Na2S2O3 (0,5 г) в смеси воды (8 мл) и пиридина. Реакционную смесь перемешивают в течение 20 минут, после чего экстрагируют CH2Cl2 (2×20 мл) и промывают насыщенным раствором соли (30 мл), затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 4:1), получая соединение 31 (0,249 г, 58%) в виде белого твердого вещества.
Синтез соединения 32
К раствору соединения 31 (0,52 г, 1,08 ммоль) в CH2Cl2 добавляют Pb(OAc)4 (0,527 г, 1,19 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 10 минут в атмосфере аргона. Осадок удаляют фильтрованием и растворитель выпаривают при пониженном давлении. Остаток фильтруют через слой силикагеля (смесь гексан/EtOAc, 1:1), получая соединение 32 (0,482 г, 58%) в виде белого твердого вещества.
Синтез соединения 33
К раствору соединения 32 (0,562 г, 1,17 ммоль) в ТГФ при 0°C добавляют LiBEt3H (1,29 мл 1М раствора в ТГФ). Реакционную смесь перемешивают при температуре окружающей среды в течение 40 минут в атмосфере аргона, затем охлаждают на ледяной бане и медленно добавляют NaOH (1,29 мл, 1M) и H2O2 (0,2 мл, 30%). Полученный раствор перемешивают при 0°C еще 5 минут. Раствор экстрагируют с помощью CH2Cl2 (2×15 мл) и экстракты сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 75:25-40:60), получая соединение 33 (256 мг, 46%) в виде белого твердого вещества.
Синтез соединения 34
Раствор соединения 33 (0,185 г, 0,385 ммоль), TBDPSCl (0,175 мл, 0,673 ммоль) и имидазола (0,09 г, 1,161 ммоль) в сухом ДМФА (4 мл) перемешивают в течение ночи. Реакционную смесь разбавляют толуолом (30 мл) и промывают насыщенным раствором соли (2×15 мл), затем сушат над MgSO4, фильтруют и концентрируют. Сырое соединение 34 используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 35
К раствору соединения 34 (сырой продукт, 0,104 ммоль) в ТГФ при 0°C добавляют LiAlH4 (0,1 мл 1М раствора в ТГФ) в атмосфере аргона. Реакционную смесь перемешивают при 0°C в течение 1 часа, затем медленно добавляют насыщенный раствор соли (5 мл). Раствор экстрагируют с помощью CH2Cl2 (2×15 мл), затем экстракты сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 2:3), получая соединение 35 (39 мг, 51% с двух стадий) в виде белого твердого вещества.
Синтез соединения 36
Смесь соединения 35 (120 мг, 0,197 ммоль) и 80% уксусной кислоты (1,5 мл) перемешивают при температуре окружающей среды в течение ночи, затем разбавляют толуолом (10 мл) и концентрируют. Сырое соединение 36 используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 37
Смесь KOtBu (60 мг, 0,54 ммоль) и MePPh3Br (194 мг, 0,54 ммоль) в ТГФ (0,9 мл) перемешивают при температуре окружающей среды в течение 1 часа в атмосфере аргона, затем добавляют соединение 36 (97 мг, 0,17 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 3 часов, затем разбавляют EtOAc (80 мл) и промывают насыщенным раствором соли (2×30 мл), после чего сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 2:3), получая соединение 37 (63 мг, 65%) в виде белого твердого вещества.
Синтез соединения 38
Раствор соединения 37 (59 мг, 0,105 ммоль) и н-Bu4NF (0,16 мл 1,0M раствора в ТГФ) в ТГФ (0,35 мл) нагревают до температуры кипения с обратным холодильником в атмосфере аргона в течение 2 часов. Растворитель выпаривают при пониженном давлении и остаток очищают хроматографией на силикагеле (смесь MeOH/EtOAc, 2:98),
получая соединение 38 (38 мг) в виде белого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 286,93; C20H31O.
ПРИМЕР 4
Соединение 45, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 4. Любое количество соединений, родственных соединению 45, может быть получено с применением подобной методики. Исходное соединение 18 может быть получено согласно методикам, кратко изложенным в патенте США 6046185.
Реакционная схема 4

В общих чертах, окислительное раскрытие цикла соединения 18 с применением периодата натрия и каталитического количества оксида рутения дает соединение 39. Взаимодействие с литийалюмогидридом в ТГФ дает соединение 40. Окислительное расщепление диола с применением тетраацетата свинца в CH2Cl2 дает соединение 41. Обработка с помощью MeLi в ТГФ дает лактоловое соединение 42. Окисление по Байеру-Виллагеру с использованием MCPBA в CHCl3 дает соединение 43. Обработка 80% уксусной кислотой удаляет кеталь и TBS-группу, что дает соединение 44. Взаимодействие соединения 44 с метилтрифенилфосфонийбромидом и KOtBu в ТГФ вводит метилиденовую группу, и последующая обработка с помощью K2CO3 в кипящем метаноле удаляет ацильную группу, что приводит к образованию соединения 45.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 39
К раствору NaIO4 (13,96 г, 65,2 ммоль) и RuO2·H2O (87 мг, 0,66 ммоль) в воде (120 мл) добавляют CCl4 (80 мл) и ацетон (100 мл). Затем медленно добавляют соединение 18 (сырой продукт, 0,81 ммоль) в смеси CCl4 (40 мл) и ацетона (60 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 3 часов. Раствор экстрагируют с помощью CH2Cl2 (2×200 мл) и объединенный органический слой промывают насыщенным раствором соли (200 мл), затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc/MeOH, 70:25:5), получая соединение 39 (3,41 г, 37%) в виде белого твердого вещества.
Синтез соединения 40
К раствору соединения 39 (0,509 г, 1,00 ммоль) в ТГФ медленно добавляют LiAlH4 (3 мл 1M раствора в ТГФ). Реакционную смесь перемешивают в течение 2 часов, затем медленно добавляют насыщенный NaHCO3 (5 мл). Раствор экстрагируют с помощью CH2Cl2 (2×20 мл) и экстракты сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь MeOH/EtOAc, 5:95), получая соединение 40 (0,16 г, 32%) в виде белого стеклообразного твердого вещества.
Синтез соединения 41
К раствору соединения 40 (0,16 г, 0,32 ммоль) с CH2Cl2 добавляют Pb(OAc)4 (0,156 г, 0,35 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 10 минут в атмосфере аргона. Осадок удаляют фильтрованием и растворитель выпаривают при пониженном давлении. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 9:1), получая соединение 41 (0,113 г, 87%) в виде белого стеклообразного твердого вещества.
Синтез соединения 42
К раствору соединения 41 (0,20 г, 0,43 ммоль) в ТГФ (3 мл) при 0°C добавляют MeLi (1,5 мл 1,4M раствора в диэтиловом эфире) в атмосфере аргона. Реакционную смесь перемешивают при температуре окружающей среды в течение 2 часов, затем гасят насыщенным NH4Cl (15 мл) и экстрагируют EtOAc (2×15 мл), после чего сушат над MgSO4, фильтруют и концентрируют. Сырое соединение 42 используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 43
Смесь соединения 42 (сырой продукт, 0,43 ммоль) и MCPBA (0,26 г, 57-86%, 1,51 ммоль) в хлороформе (3 мл) перемешивают при температуре окружающей среды в течение 1 дня. Реакционную смесь разбавляют EtOAc (15 мл) и промывают последовательно насыщенным Na2SO3 (20 мл), насыщенным NaHCO3 (20 мл) и насыщенным раствором соли (20 мл), затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 4:1), получая соединение 43 (66 мг, 31% от двух стадий) в виде белого твердого вещества.
Синтез соединения 44
Смесь соединения 43 (0,40 г, 0,81 ммоль) и 80% уксусной кислоты (5 мл) перемешивают при 50°C в течение 2 часов, затем разбавляют толуолом (20 мл) и концентрируют. Сырое соединение 44 используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 45
Смесь KOtBu (0,45 г, 4,05 ммоль) и MePPh3Br (1,45 г, 4,05 ммоль) в ТГФ (10 мл) перемешивают при температуре окружающей среды в течение 1 часа в атмосфере аргона, затем добавляют соединение 44 (сырой продукт, 0,81 ммоль) в ТГФ (5 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи, затем разбавляют CH2Cl2 (50 мл) и промывают насыщенным раствором соли (2×30 мл), после чего сушат над MgSO4, фильтруют и концентрируют. Сырой продукт нагревают до температуры кипения с обратным холодильником в присутствии K2CO3 (0,34 г, 2,42 ммоль) в ТГФ (5 мл) в течение 3 часов. Растворитель удаляют и остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc/MeOH, 5:5:0,5), получая соединение 45 (0,13 г, 55% от двух стадий) в виде белого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мM NH4OAс в смеси 3:7 воды и MeCN) 317,00; C18H30NaО3.
ПРИМЕР 5
Соединение 51, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 5. Исходное соединение 46 может быть получено согласно методикам, кратко изложенным в патенте США 6046185. Любое количество соединений, родственных соединению 51, может быть получено с применением подобной методики.
Реакционная схема 5

В общих чертах, взаимодействие соединения 46 с периодатом натрия в ТГФ окислительно расщепляет диол, что дает соединение 47. Взаимодействие альдегидных групп с боргидридом натрия дает соединение 48. Обработка 80% уксусной кислотой удаляет кеталь и TBS-группу, что дает соединение 49. Взаимодействие с TBSCl и имидазолом в ДМФА защищает гидроксилы, что приводит к образованию соединения 1. Олефинирование с использованием метилтрифенилфосфонийбромида и KOtBu в ТГФ дает соединение 50. Обработка 80% уксусной кислотой и впоследствии кипящим раствором Bu4NF в ТГФ удаляет TBS-группы, что дает соединение 51.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 47
Раствор соединения 46 (450 мг, 0,94 ммоль), NaIO4 (240 мг, 1,12 ммоль), воды (2 мл) и ТГФ (4 мл) перемешивают в течение ночи при температуре окружающей среды. Реакционную смесь разбавляют EtOAc и промывают насыщенным раствором соли, после чего сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь EtOAc/гексан, 15:85), получая соединение 47 (140 мг, 31%) в виде белого твердого вещества.
Синтез соединения 48
Раствор соединения 47 (1,32 г, 2,76 ммоль), NaBH4 (229 мг, 6,06 ммоль), MeOH (17 мл) и CH2Cl2 (3 мл) перемешивают при 0°C в течение 4 часов, затем при температуре окружающей среды в течение ночи. Растворители выпаривают при пониженном давлении, и остаток разбавляют EtOAc и промывают насыщенным раствором соли. EtOAc-слой сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (смесь EtOAc/гексан, 2:3), что дает соединение 48 (0,35 г, 26%) в виде белого твердого вещества.
Синтез соединения 49
Смесь соединения 48 (350 мг, 0,72 ммоль) и 80% уксусной кислоты (20 мл) перемешивают в течение ночи при температуре окружающей среды. Растворители выпаривают при пониженном давлении, и остаточный растворитель удаляют совместной перегонкой с толуолом, получая соединение 49 (250 мг, 100%) в виде желтого твердого вещества.
Синтез соединения 1
Раствор соединения 49 (очищенное, 0,72 ммоль), TBSCl (382 мг, 2,54 ммоль), имидазола (346 мг, 5,08 ммоль) в сухом ДМФА (15 мл) перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь разбавляют EtOAc (100 мл), промывают водой, затем сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь EtOAc/гексан, 5:95), что дает соединение 1 (374 мг, 78%).
Синтез соединения 50
Смесь KOtBu (191 мг, 1,7 ммоль) и MePPh3Br (600 мг, 1,7 ммоль) в ТГФ (1,5 мл) перемешивают при температуре окружающей среды в течение 1 часа в атмосфере аргона, затем добавляют соединение 1 (374 мг, 0,56 ммоль) в ТГФ (1,5 мл). Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 3 часов, затем разбавляют водой (3 мл) и экстрагируют EtOAc (30 мл). EtOAc-слой промывают водой (10 мл) и насыщенным раствором соли (10 мл), затем сушат над Na2SO4, фильтруют и концентрируют. Остаток пропускают через силикагель (EtOAc/гексан, 1:99), получая соединение 50 (354 мг, 95%) в виде желтого масла.
Синтез соединения 51
Смесь соединения 50 (350 мг, 0,53 ммоль) и 80% уксусной кислоты (10 мл) нагревают до 50°C в течение 6 часов. Растворители выпаривают при пониженном давлении, и остаточный растворитель удаляют совместной перегонкой с толуолом. Остаток все еще содержит некоторое количество TBS-защищенного продукта, поэтому остаток поглощают ТГФ (1 мл) и Bu4NF (2,5 мл 1,0M раствора в ТГФ), и полученный раствор нагревают до температуры кипения с обратным холодильником в течение 3,5 часов. Реакционную смесь разбавляют EtOAc и промывают водой и насыщенным раствором соли, затем сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (EtOAc), получая соединение 51 (119 мг, 70%) в виде светло-желтого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 305,16; C20H32O2, 287,19; C20H30О.
ПРИМЕР 6
Соединение 59, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 6. Любое количество соединений, родственных соединению 59, может быть получено с применением подобной методики. Исходное соединение 27 может быть получено согласно методикам, описанным выше в примере 2.
Реакционная схема 6

В общих чертах, взаимодействие соединения 27 с уксусным ангидридом и DMAP в пиридине дает соединение 52. Обработка 80% уксусной кислотой удаляет кеталь и TBS-группу, что дает соединение 53. Взаимодействие с метилтрифенилфосфонийбромидом и KOtBu в толуоле вводит метилиденовую группу и отщепляет ацильную группу от первичного гидроксила, что приводит к образованию соединения 54. Обработка TBSCl, DMAP и Et3N в ДМФА селективно защищает первичный гидроксил, давая соединение 55. Свободный гидроксил в соединении 55 превращают в бромидное соединение 56, используя бром, трифенилфосфин и Et3N в ТГФ. Азидное замещение брома при использовании азида натрия в NMP дает соединение 57. Взаимодействие с литийалюмогидридом в ТГФ восстанавливает азид и отщепляет ацильную группу, что дает соединение 58. Обработка 80% уксусной кислотой удаляет TBS-группу и приводит к образованию соли с ацетатом аммония, что дает соединение 59.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 52
Раствор соединения 27 (3,08 г, 5,87 ммоль), уксусного ангидрида (1,12 мл, 11,7 ммоль) и DMAP (50 мг, 0,41 ммоль) в пиридине (25 мл) перемешивают в течение ночи. Затем реакционную смесь гасят насыщенным раствором соли (80 мл) и экстрагируют EtOAc (200 мл). EtOAc-слой промывают насыщенным раствором соли (2×60 мл), затем сушат (MgSO4), фильтруют и концентрируют. Сырое соединение 52 используют непосредственно на следующей стадии.
Синтез соединения 53
Смесь соединения 52 (сырой продукт, 5,87 ммоль) и 80% уксусной кислоты (40 мл) перемешивают при 50°C в течение 1 часа, затем перегоняют с толуолом (3×50 мл) и концентрируют. Сырое соединение 53 используют непосредственно на следующей стадии.
Синтез соединения 54
Смесь KOtBu (2,02 г, 18,0 ммоль) и MePPh3Br (6,43 г, 18,0 ммоль) в толуоле (45 мл) перемешивают при температуре окружающей среды в течение 1 часа в атмосфере аргона, затем добавляют соединение 53 (сырой продукт, 5,87 ммоль) в толуоле (10 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи, затем разбавляют насыщенным раствором NH4Cl (100 мл) и экстрагируют EtOAc (100 мл). EtOAc-слой промывают насыщенным раствором соли (80 мл), затем сушат (MgSO4), фильтруют и концентрируют. Остаток пропускают через силикагель (смесь гексан/ацетон, 7:3), получая очищенное соединение 54.
Синтез соединения 55
Раствор соединения 54 (очищенное, 2,85 ммоль), TBSCl (490 мг, 3,25 ммоль), DMAP (58 мг, 0,47 ммоль) и Et3N (600 мкл, 4,3 ммоль) в сухом ДМФА (6 мл) перемешивают в течение 5 часов. Реакционную смесь разбавляют толуолом (80 мл), промывают насыщенным раствором NaHCO3 и насыщенным раствором соли, затем сушат (MgSO4), фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле, получая соединение 55 (480 мг, 45%).
Синтез соединения 56
Бром (80 мкл, 1,6 ммоль) добавляют к раствору Ph3P (407 мг, 1,6 ммоль) в ТГФ (5 мл) при температуре окружающей среды. Спустя 5 минут добавляют Et3N (290 мкл, 2,1 ммоль) с последующим добавлением раствора соединения 55 (480 мг, 1,03 ммоль) в ТГФ (5 мл). Через 1,5 часа реакционную смесь разбавляют EtOAc (100 мл) и промывают водой и насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией (смесь гексан/EtOAc, 95:5), получая соединение 56 (510 мг, 94%).
Синтез соединения 57
Раствор соединения 56 (510 мг, 0,97 ммоль), NaN3 (200 мг, 3,1 ммоль) и NMP (8 мл) нагревают до 55°C в течение 4 часов. Реакционную смесь разбавляют толуолом (100 мл) и EtOAc (30 мл) и промывают водой и насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией (смесь гексан/EtOAc, 98:2), получая соединение 57 (197 мг, 41%).
Синтез соединения 58
К раствору соединения 57 (197 мг, 0,40 ммоль) в ТГФ при температуре окружающей среды добавляют LiAlH4 (1 мл 1,0M раствора в диэтиловом эфире). Реакционную смесь перемешивают при температуре окружающей среды в течение 2,5 часов, затем добавляют Na2SO4·10H2O. Раствор фильтруют и твердый продукт промывают MeOH и CH2Cl2. Фильтрат концентрируют и остаток очищают хроматографией на силикагеле (смесь CHCl3/MeOH/Et3N, 90:8:2), получая соединение 58 (144 мг, 78%).
Синтез соединения 59
Смесь соединения 58 (114 мг, 0,27 ммоль) и 80% уксусной кислоты (7 мл) перемешивают в течение ночи при температуре окружающей среды. Раствор разбавляют толуолом (3×50 мл) и концентрируют, получая соединение 59 (58 мг, 59%) в виде желтого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 307,92; C19H34NO2.
ПРИМЕР 7
Соединения 67 и 68, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 7. Любое количество соединений, родственных соединениям 67 и 68, может быть получено с применением подобной методики. Исходное соединение 21 может быть получено согласно методикам, описанным выше в примере 1.
Реакционная схема 7
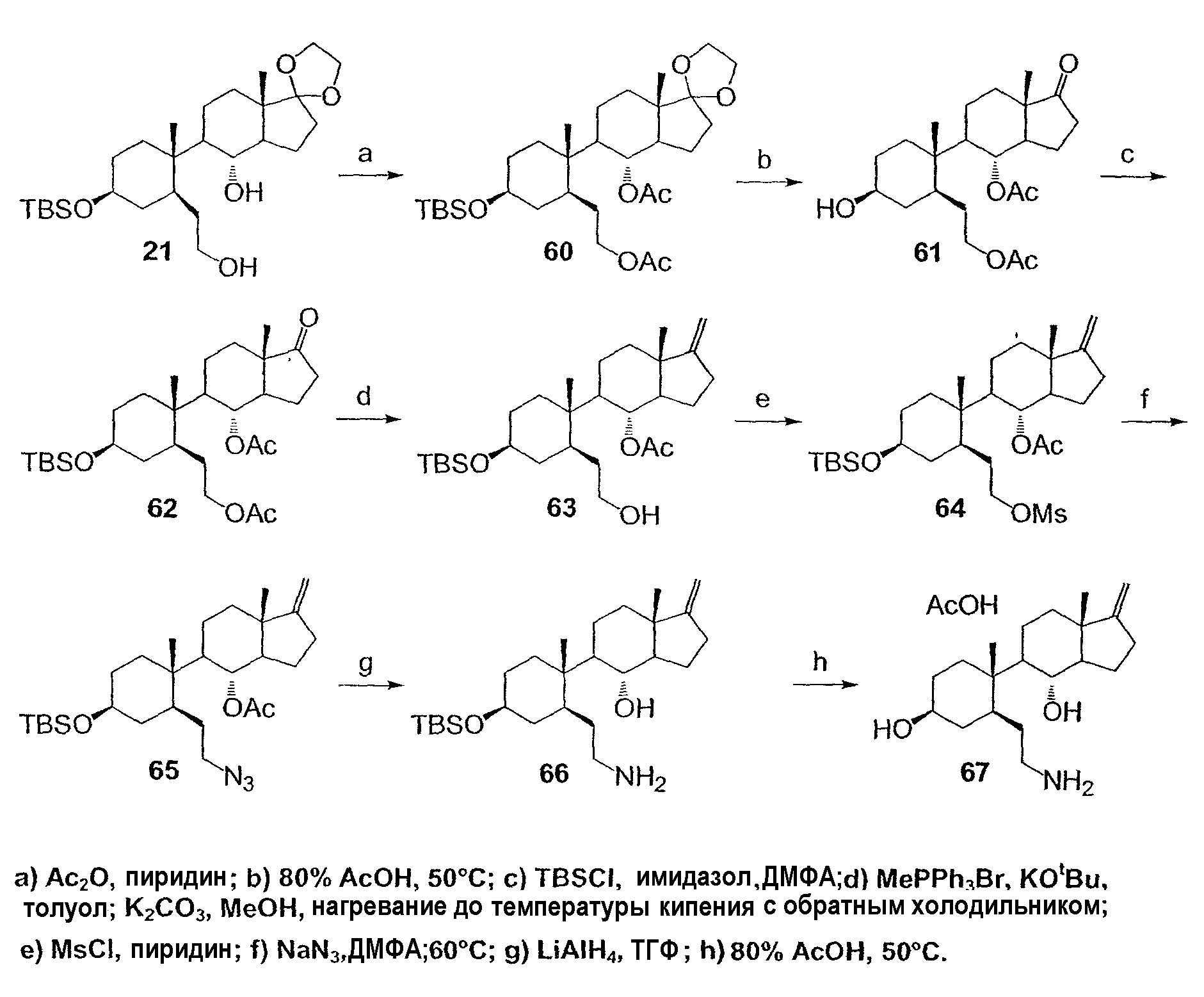
В общих чертах, обработка соединения 21 уксусным ангидридом в пиридине (в целях защиты свободных гидроксилов) дает соединение 60. Обработка 80% уксусной кислотой удаляет кеталь и TBS-группу, что дает соединение 61. Обработка TBSCl и имидазолом в ДМФА защищает свободный гидроксил в соединении 62. Олефинирование соединения 62 с использованием метилтрифенилфосфонийбромида и KOtBu в толуоле вводит метилиденовую группу. В некоторых случаях условия олефинирования приводят к отщеплению ацетата от первичного гидроксила, что приводит к образованию соединения, такого как 63. Первичный ацетат может быть селективно гидролизован осуществлением взаимодействия с K2CO3 в кипящем метаноле. Свободный гидроксил в соединении 63 превращают в мезилатное соединение 64, используя MsCl и пиридин. Азидирование с использованием азида натрия в ДМФА дает азидосоединение 65. Восстановление азида литийалюмогидридом в ТГФ дает аминосоединение 66. Обработка 80% уксусной кислотой удаляет TBS-группу и приводит к образованию соли с ацетатом аммония, что дает соединение 67.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 60
К раствору соединения 21 (0,686 г, 1,42 ммоль) в пиридине (5 мл) добавляют уксусный ангидрид (0,94 мл, 9,94 ммоль) и реакционную смесь перемешивают при 50°C в течение ночи. Раствор разбавляют с помощью EtOAc (25 мл) и промывают насыщенным раствором соли (2×20 мл), затем сушат над MgSO4, фильтруют и концентрируют. Сырое соединение 60 используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 61
Смесь соединения 60 (сырой продукт, 1,42 ммоль) и 80% уксусной кислоты (15 мл) перемешивают при 50°C в течение 2 часов, затем разбавляют толуол (2×20 мл) и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 1:2), получая соединение 61 (0,479 г, 87%) в виде белого твердого вещества.
Синтез соединения 62
Раствор соединения 61 (0,971 г, 2,38 ммоль), TBSCl (0,716 г, 4,75 ммоль) и имидазола (0,647 г, 9,51 ммоль) в сухом ДМФА (10 мл) перемешивают в течение 3 часов. Реакционную смесь разбавляют толуолом (50 мл) и промывают насыщенным раствором соли (2×20 мл), затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 4:1), получая соединение 62 (1,218 г, 98%) в виде вязкого светло-желтого масла.
Синтез соединения 63
Смесь KOtBu (5,00 г, 42,3 ммоль) и MePPh3Br (15,1 г, 42,3 ммоль) в толуоле (100 мл) перемешивают при температуре окружающей среды в течение 1 часа в атмосфере аргона, затем добавляют раствор соединения 62 (сырой продукт, 14,1 ммоль) в 100 мл толуола. Реакционную смесь перемешивают в течение ночи при температуре окружающей среды, затем гасят насыщенным раствором NaHCO3 (75 мл) и водой (75 мл). Раствор дополнительно разбавляют 100 мл воды и экстрагируют EtOAc (4×100 мл). Объединенный раствор экстрактов промывают насыщенным раствором соли (2×100 мл), затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 100:0, затем 9:1, затем 4:1), получая диацетатное соединение (4,5 г, 62%) в виде желтого масла и соединение 63 (1,8 г, 27%) в виде желтого масла. Раствор диацетатного соединения (4,5 г, 8,6 ммоль), K2CO3 (4,78 г, 34,6 ммоль) и метанол (100 мл) нагревают до температуры кипения с обратным холодильником в атмосфере аргона. Спустя 75 минут реакционную смесь охлаждают до температуры окружающей среды и фильтруют через целит, элюируя CH2Cl2. Фильтрат концентрируют и растворяют в EtOAc (250 мл), затем промывают водой и сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 100:0, затем 19:1, затем 9:1), получая соединение 63 (3,2 г, 47%) в виде желтой пены.
Синтез соединения 64
К раствору соединения 63 (3,17 г, 6,62 ммоль) в пиридине (50 мл) и CH2Cl2 (0,5 мл) добавляют метансульфонилхлорид (1,02 мл, 13,2 ммоль) и реакционную смесь перемешивают в атмосфере аргона при температуре окружающей среды в течение 3 часов. Реакционную смесь гасят насыщенным раствором NaHCO3 (60 мл) и экстрагируют EtOAc (3×80 мл). Объединенный раствор экстрактов промывают водой и насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Остаток концентрируют из толуола, получая сырое соединение 64, которое используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 65
Раствор соединения 64 (сырой продукт, 6,62 ммоль) и NaN3 (646 мг, 9,93 ммоль) в ДМФА (40 мл) нагревают в атмосфере аргона при 60°C в течение ночи. После охлаждения реакционную смесь разбавляют водой (100 мл) и экстрагируют диэтиловым эфиром (4×100 мл). Объединенный раствор экстрактов промывают водой и насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 100:0, затем 98:2, затем 95:5), получая соединение 65 (2,56 г, 77% от 2 стадий) в виде желтого масла.
Синтез соединения 66
Раствор LiAlH4 (3,85 мл 1,0M раствора в ТГФ) добавляют к раствору соединения 65 (647 мг, 1,28 ммоль) в ТГФ (15 мл) в атмосфере аргона. Спустя 3 часа реакционную смесь гасят Na2SO4·10H2O и разбавляют ТГФ (10 мл). Спустя 30 минут раствор фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь CH2Cl2/MeОH/Et3N, 100:0:0, затем 95:5:0, затем 90:10:0, затем 95:5:2), получая соединение 66 (324 мг, 58%) в виде бесцветного масла.
Синтез соединения 67
Раствор соединения 66 (320 мг, 0,734 ммоль) и 80% уксусной кислоты (25 мл) нагревают до 50°C в течение 3 часов. Остаток очищают хроматографией на силикагеле с обращенной фазой (H2O, затем смесь H2O/MeОH/AcOH 50:50:2). Концентрация из смеси MeOH/MeCN дает соединение 67 (244 мг, 87%) в виде белого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 322,12; C20H36NO2.
Синтез соединения 68
Используя методики, описанные для синтеза соединения 67, за исключением олефинирования с помощью EtPPh3Br, соединение 68 (75 мг) получают в виде белого твердого вещества с выходом 22%, исходя из соединения 62. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAC в смеси 3:7 воды и MeCN) 336,16; C21H38NO2.
ПРИМЕР 8
Соединения 77-81, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 8. Исходные соединения, такие как 69, могут быть получены согласно методикам, кратко изложенным в патенте США 6046185. Любое количество соединений, родственных соединениям 77-81, может быть получено с применением подобной методики.
Реакционная схема 8

a) AC2O, DMAP, пиридин; b) 80% AcOH; c) NaBH4, MeOH, ТГФ; e) AC2O, DMAP, пиридин, g) NaN3, ДМФА: h) LiAlH4, ТГФ; i) 80% AcOH; j) HCl, вода, MeOH, 65°C.
В общих чертах, взаимодействие соединения 69 с уксусным ангидридом и DMAP в пиридине дает соединение 70. Обработка 80% уксусной кислотой удаляет ацетонидную группу, что дает соединение 71. Взаимодействие с периодатом натрия в ТГФ окислительно расщепляет диол, давая соединение 72. Восстановление альдегидных групп боргидридом натрия дает соединение 73. Взаимодействие с уксусным ангидридом и DMAP в пиридине селективно защищает один из первичных гидроксилов, давая соединение 74. Свободный гидроксил превращают в мезилатное соединение 75, используя MsCl и пиридин. Взаимодействие с азидом натрия в ДМФА дает азидосоединение 76. Взаимодействие с литийалюмогидридом в ТГФ восстанавливает азид и удаляет ацильные группы, что приводит к образованию соединения 77. Обработка 80% уксусной кислотой приводит к образованию соединения 78 в виде соли с ацетатом аммония. Взаимодействие соединения, такого как 78 с HCl в воде и MeOH, способствует перемещению 18-метильной группы к C17 с образованием соединения, такого как 79. Осторожная обработка соединения 77 с помощью HCl в MeCN и воде приводит к образованию соли соединения 77 с хлоридом аммония (т.е. соединения 80).
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 70
Раствор соединения 69 (6,9 г, 19,1 ммоль), уксусного ангидрида (3,62 мл, 38,3 ммоль) и DMAP (0,23 г, 1,9 ммоль) в пиридине (50 мл) перемешивают в течение 4,5 часов. Реакционную смесь разбавляют холодной водой (150 мл), экстрагируют EtOAc (600 мл) и промывают насыщенным раствором соли (2×200 мл), затем сушат над MgSO4, фильтруют и концентрируют. Сырое соединение 70 используют непосредственно на следующей стадии.
Синтез соединения 71
Смесь соединения 70 (сырой продукт, 19,1 ммоль) и 80% уксусной кислоты (50 мл) перемешивают при 40°C в течение 2 часов. Раствор концентрируют, получая сырое соединение 71, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 72
Раствор соединения 71 (сырой продукт, 19,1 ммоль), NaIO4 (8,19 г, 38,3 ммоль), воды (53 мл) и ТГФ (106 мл) перемешивают при температуре окружающей среды в течение 3,5 часов. Реакционную смесь разбавляют CH2Cl2 и промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют, получая сырое соединение 72, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 73
Раствор соединения 72 (сырой продукт, 19,1 ммоль), NaBH4 (1,45 г, 38,3 ммоль), ТГФ (120 мл) и MeOH (40 мл) перемешивают при 0°C в течение 10 минут, затем при температуре окружающей среды в течение 1 часа. Смесь охлаждают льдом и медленно добавляют 80% уксусную кислоту (62 мл). Раствор перемешивают при температуре окружающей среды в течение 10 минут, затем разбавляют с помощью EtOAc (400 мл) и после этого промывают насыщенным раствором соли. EtOAc-слой сушат над MgSO4, фильтруют и концентрируют, получая сырое соединение 73, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 74
Раствор соединения 73 (сырой продукт, 19,1 ммоль), уксусного ангидрида (2,1 мл, 22,0 ммоль) и DMAP (230 мг, 1,9 ммоль) в пиридине (65 мл) перемешивают при температуре окружающей среды в течение 1,5 часов. Реакционную смесь разбавляют EtOAc (400 мл) и промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc 5:1, затем 4:1, затем 7:3), получая соединение 74 (4,9 г, 63%).
Синтез соединения 75
К раствору соединения 74 (4,9 г, 12,1 ммоль) в пиридине (40 мл) добавляют метансульфонилхлорид (1,68 мл, 21,7 ммоль) и реакционную смесь перемешивают при температуре окружающей среды в течение 2 часов. Раствор разбавляют EtOAc (400 мл) и промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют, получая сырое соединение 75, которое используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 76
Смесь соединения 75 (сырой продукт, 12,1 ммоль) и NaN3 (1,57 г, 24,1 ммоль) в ДМФА (100 мл) нагревают в атмосфере аргона при 60°C в течение ночи. После охлаждения реакционную смесь разбавляют толуолом (400 мл) и промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 8:2), получая соединение 76 (4,8 г, 92% от 2 стадий).
Синтез соединения 77
Раствор LiAlH4 (44,5 мл 1,0M раствора в Et2O) добавляют к охлажденному льдом раствору соединения 76 (4,8 г, 11,1 ммоль) в ТГФ (111 мл). Спустя 10 минут растворение продолжают при температуре окружающей среды в течение еще 4 часов. Реакционную смесь охлаждают льдом и гасят Na2SO4·10H2O. Спустя 15 минут раствор разбавляют EtOAc (100 мл), перемешивают еще 20 минут при температуре окружающей среды, затем фильтруют. Фильтрат промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют, получая соединение 77 (3,8 г, количественно) в виде белого твердого вещества.
Синтез соединения 78
Раствор соединения 77 (1,00 г, 2,93 ммоль) и 80% уксусной кислоты (15 мл) нагревают до 40°C в течение 1 часа, затем концентрируют. Остаточный растворитель удаляют совместной перегонкой с толуолом. Остаток порошкуют в диэтиловом эфире и фильтруют, получая соединение 78 (923 мг, 83%) в виде белого твердого вещества. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 321,95; C20H36NО2.
Синтез соединения 79
Раствор соединения 78 (600 мг, 1,57 ммоль), концентрированной HCl (5 капель), воды (1 мл) и MeOH (9 мл) нагревают до 65°C в течение 5 дней, затем концентрируют. Остаток порошкуют в MeCN и фильтруют, получая соединение 79 (504 мг, 90%) в виде белого твердого вещества. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 322,2; C20H36N02.
Синтез соединения 80
К суспензии соединения 77 (0,1 г, 0,3 ммоль) в MeCN (2 мл) добавляют HCl (337 мкл 1,0M раствора в Et2O). Спустя 15 минут раствор фильтруют, получая соль соединения 77 с хлоридом аммония, т.е. соединение 80 (76 мг, 72%) в виде белого порошка.
Синтез соединения 81
Используя методики, приведенные для синтеза соединения 80, соединение 81 (0,646 г) получают в виде белого порошка с выходом 37%, исходя из этилиденового соединения, аналогичного соединению 69. Стадия образования соли отличается тем, что соединение выделяют путем совместной перегонки остаточного кислотного раствора, используя MeOH: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 335,89; C21H38NO2.
ПРИМЕР 9
Соединения 88 и 89, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 9. Любое количество соединений, родственных соединениям 88-89, может быть получено с применением подобной методики. Исходное соединение 73 также может быть получено согласно методикам, приведенным выше в примере 8.
Реакционная схема 9

В общих чертах, взаимодействие соединения 73 с TBSCl и имидазолом в ДМФА дает соединение 83. Взаимодействие с уксусным ангидридом и DMAP в пиридине защищает оставшийся свободный гидроксил, давая соединение 84. Взаимодействие с тетрабутиламмонийфторидом удаляет TBS-группу, что приводит к образованию соединения 85. Свободный гидроксил превращают в мезилатное соединение 86, используя MsCl и пиридин. Взаимодействие с азидом натрия в ДМФА дает азидосоединение 87. Взаимодействие с литийалюмогидридом в ТГФ восстанавливает азид и удаляет ацильные группы, давая соединение 88. Обработка 80% уксусной кислотой приводит к образованию соли с ацетатом аммония, что дает соединение 89.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 83
Раствор соединения 73 (2,9 г, 7,92 ммоль), TBSCl (1,32 г, 8,76 ммоль), имидазола (813 мг, 11,9 ммоль) и ДМФА (20 мл) перемешивают при температуре окружающей среды в течение 1,5 часов. Раствор разбавляют водой (50 мл) и экстрагируют толуолом (100 мл). Толуольный слой промывают насыщенным раствором соли (40 мл), затем сушат над MgSO4, фильтруют и концентрируют, получая сырое соединение 83, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 84
Раствор соединения 83 (сырой продукт, 7,96 ммоль), уксусного ангидрида (2,25 мл, 23,9 ммоль) и DMAP (100 мг, 0,82 ммоль) в пиридине (25 мл) перемешивают при температуре окружающей среды в течение 1 часа. Реакционную смесь разбавляют EtOAc и промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Сырое соединение 84 используют на следующей стадии без дополнительной очистки.
Синтез соединения 85
Раствор соединения 84 (сырой продукт г, 7,96 ммоль), Bu4NF (12 мл 1,0M раствора в ТГФ) и ТГФ перемешивают при температуре окружающей среды в течение 2 часов и при 40°C в течение 30 минут. Реакционную смесь фильтруют через силикагель и концентрируют. Остаток очищают хроматографией на силикагеле (смесь EtOAc/гексан 3:7), получая соединение 85 (2,06 г, 64%).
Синтез соединения 86
К раствору соединения 85 (1,06 г, 2,61 ммоль) в пиридине (12 мл) добавляют метансульфонилхлорид (400 мкл, 5,16 ммоль) и реакционную смесь перемешивают при температуре окружающей среды в течение 2 часов. Реакционную смесь гасят водой и экстрагируют EtOAc. Раствор промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют, получая сырое соединение 86, которое используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 87
Смесь соединения 86 (сырой продукт, 2,61 ммоль) и NaN3(1,0 г, 15 ммоль) в ДМФА (15 мл) нагревают в атмосфере аргона при 95°C в течение ночи. После охлаждения реакционную смесь разбавляют толуолом и промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле, получая соединение 87 (575 мг, 89%).
Синтез соединения 88
Раствор LiAlH4 (3,2 мл 1,0M раствора в ТГФ) добавляют к охлажденному льдом раствору соединения 87 (274 мг, 0,635 ммоль) в ТГФ (3 мл). Спустя 10 минут растворение продолжают при температуре окружающей среды в течение еще 3 часов. Реакционную смесь охлаждают льдом и гасят Na2SO4·10H2O. Спустя 15 минут раствор фильтруют, и фильтрат промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Очистка методом хроматографии на силикагеле (смесь EtOAc/MeOH/H2O/NH4OH 7:2:1:0,15, затем 7:2:1:0,2, затем 7:2:1:0,3), что дает соединение 88 (135 мг, 66%).
Синтез соединения 89
Раствор соединения 88 (135 мг, 0,42 ммоль) и 80% уксусной кислоты (3 мл) нагревают до 40°C в течение 30 минут, затем концентрируют. Остаточный растворитель удаляют совместной перегонкой с метанолом, получая соединение 89 (158 мг, 99%) в виде светло-желтой пены. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 322,11; C20H36NО2.
ПРИМЕР 10
Соединения 100 и 101, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 10. Любое количество соединений, родственных соединениям 100 и 101, может быть получено с применением подобной методики. Исходное соединение 60 также может быть получено согласно методикам, приведенным выше в примере 7.
Реакционная схема 10

В общих чертах, селективный гидролиз первичного ацетата в соединении 60 с применением K2CO3 дает соединение 90. Осуществление взаимодействия по свободному гидроксилу с применением MsCl и пиридина дает мезилатное соединение 91. Замещение мезилата на фенилселенид дает соединение 92. Окислительное элиминирование с использованием пероксида водорода дает олефиновое соединение 93. Осмилирование дает дигидроксилированное соединение 94, которое затем подвергают окислительному расщеплению под действием тетраацетата свинца, что дает соединение 95. Восстановление боргидридом натрия дает спиртовое соединение 96. Азидирование с использованием диизопропилазодикарбоксилата (DIAD), дифенилфосфорилазида (DPPA) и PPh3 в ТГФ дает азидосоединение 97. Взаимодействие с литийалюмогидридом в ТГФ восстанавливает азид и удаляет ацильную группу, что дает соединение 98. Обработка с помощью HCl удаляет как TBS-группу, так и циклический кеталь, что приводит к образованию соединения 99. Олефинирование с помощью метилтрифенилфосфонийбромида и KOtBu в ТГФ дает соединение 100. Обработка уксусной кислотой приводит к образованию соли с ацетатом аммония, что дает соединение 101.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 90
Смесь соединения 60 (12,7 г, 22,4 ммоль), K2CO3, (9,38 г, 67,2 ммоль), MeOH (250 мл) и воды (94 мл) перемешивают при 55°C в течение 2 часов, охлаждают до температуры окружающей среды, затем концентрируют. Остаток растворяют в EtOAc, дважды промывают насыщенным раствором NaHCO3, затем дважды насыщенным раствором соли, сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc), получая соединение 90 (10,16 г, 86%) в виде белой пены.
Синтез соединения 91
К раствору соединения 90 (10,14 г, 19,3 ммоль) в пиридине (50 мл) при 0°C добавляют метансульфонилхлорид (2,69 мл, 34,8 ммоль). Смесь перемешивают при 0°C в течение 10 минут, затем при температуре окружающей среды в течение 2 часов. Смесь разбавляют с помощью EtOAc (200 мл) и промывают водой (2×50 мл). Осуществляют обратную экстракцию объединенных водных порций с помощью EtOAc (50 мл). Объединенные органические слои промывают насыщенным раствором соли (2×50 мл), сушат над безводным MgSO4 и концентрируют. Остаток растворяют в толуоле и концентрируют, получая соединение 91 (11,3 г, 97%) в виде белой пены, которое используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 92
К перемешиваемой смеси дифенилдиселенида (7,04 г, 22,1 ммоль) и EtOH (100 мл) при 0°C добавляют порциями, за период 7 минут, NaBH4 (1,69 г, 44,2 ммоль), затем, спустя 5 минут, смеси дают нагреться до температуры окружающей среды и перемешивают еще один час. Полученный раствор добавляют через канюлю к суспензии соединения 91 в EtOH (175 мл), споласкивая EtOH (25 мл). Смесь перемешивают при 50°C в течение 35 минут. Смесь охлаждают, добавляют воду (70 мл), и смесь концентрируют. Остаток растворяют в EtOAc (400 мл) и промывают водой (100 мл), затем насыщенным раствором соли (100 мл). Осуществляют обратную экстракцию объединенных промывных вод с помощью EtOAc (3×75 мл). Объединенные органические слои промывают насыщенным раствором соли (2×100 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc), получая соединение 92 (10,6 г, 87%) в виде желтой пены.
Синтез соединения 93
Смесь соединения 92 (10,2 г, 15,4 ммоль) и 30% раствора H2O2 в ТГФ (4500 мл) перемешивают при температуре окружающей среды в течение 50 минут, затем при 65°C в течение 40 минут. После охлаждения смесь разбавляют с помощью EtOAc (500 мл) и промывают насыщенным раствором соли (200 мл), затем насыщенным раствором NaHCO3 (200 мл). Осуществляют обратную экстракцию объединенных водных порций с помощью EtOAc (2×100 мл). Объединенные органические порции промывают насыщенным раствором соли (2×200 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 3:1; EtOAc), получая соединение 93 (5,86 г, 75%) в виде белой пены.
Синтез соединения 94
К раствору соединения 93 (4,81 г, 9,49 ммоль) в ТГФ (90 мл),tBuOH (30 мл) и воды (9 мл) добавляют NMO (1,72 г, 14,2 ммоль) и OsO4 (3,0 мл 4% раствора в воде, 0,47 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи, затем добавляют раствор Na2S2O3·5H2O (1,75 г) в воде (30 мл). Смесь перемешивают в течение 30 минут, затем разбавляют насыщенным раствором соли (350 мл) и экстрагируют CH2Cl2 (200 мл, 2×125 мл, 75 мл). Объединенные органические слои промывают насыщенным раствором соли (2×150 мл), сушат над безводным MgSO4 и концентрируют, получая соединение 94 (5,70 г) в виде светло-коричневой пены, которое используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 95
К раствору соединения 94 (5,70 г) в CH2Cl2 (100 мл) добавляют Pb(OAc)4 (4,43 г, 9,49 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 35 минут, затем фильтруют через слой диоксида кремния и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 9:1, 4:1), получая соединение 95 (4,21 г, 85% из расчета на INT1660) в виде белой пены.
Синтез соединения 96
К перемешиваемому раствору соединения 95 (300 мг, 0,59 ммоль) в смеси MeOH/ТГФ (2 мл/7 мл) при 0°C добавляют NaBH4 (45 мг, 1,2 ммоль). После 5 мин при 0°C смесь перемешивают при температуре окружающей среды, добавляют дополнительное количество NaBH4 (89 мг, 2,4 ммоль), порциями, за 4 часа. Смесь охлаждают до 0°C и реакцию гасят водой (1 мл). Смесь разбавляют с помощью EtOAc (200 мл), дважды промывают насыщенным раствором соли, сушат и концентрируют. Остаток очищают колоночной хроматографией (смесь гексан/EtOAc, 6:4), получая соединение 96 с выходом 82%.
Синтез соединения 97
Используя способы, описанные ниже в методике способа В, по примеру 12, для синтеза соединения 116, соединение 97 получают из соединения 96. Сырое соединение 97 очищают колоночной хроматографией (смесь гексан/EtOAc, 8:2) и используют на следующей стадии без дополнительной очистки.
Синтез соединения 98
К перемешиваемому раствору очищенного соединения 97 (0,59 ммоль) в ТГФ (20 мл) при 0°C добавляют по каплям 1M LAH в ТГФ (5,8 мл, 5,8 ммоль). После 25 мин при 0°C смесь перемешивают при температуре окружающей среды в течение 3 часов. Смесь вновь охлаждают до 0°C и добавляют порциями твердый Na2SO4·10H2O (1,86 г, 5,8 ммоль). Смесь перемешивают при 0°C в течение 5 мин и затем при температуре окружающей среды еще 20 мин, после чего фильтруют через целит. Фильтрат концентрируют, и остаток очищают колоночной хроматографией (смесь EtOAc/MeOH/Et3N, 9:1:0,5), получая соединение 98 (150 мг, 59% в расчете на соединение 96) в виде прозрачной смолы.
Синтез соединения 99
Смесь соединения 98 (150 мг, 0,32 ммоль) и 80% HOAc (5 мл) перемешивают при 40°C в течение 7 часов. Растворители удаляют методом ротационного выпаривания и сушат в вакууме. Сырое соединение 99 используют на следующей стадии без дополнительной очистки.
Синтез соединения 100
Смесь MePPh3Br (1,26 г, 3,5 ммоль) и KOtBu (395 мг, 3,5 ммоль) в ТГФ (15 мл) перемешивают при температуре окружающей среды в течение 2 часов и затем добавляют к смеси полученного ранее соединения 99 в ТГФ (5 мл) и ДМФА (1 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 2 дней и затем гасят насыщенным NH4Cl (0,25 мл). Смесь разбавляют с помощью EtOAc (20 мл) и MeOH (5 мл) и фильтруют через целит. Фильтрат концентрируют, и остаток очищают колоночной хроматографией (смесь EtOAc/MeOH/вода/Et3N, 6:3:0,5:0,5), получая соединение 100 (47 мг, 47% в расчете на соединение 98).
Синтез соединения 101
Раствор соединения 100 (47 мг, 0,15 ммоль) в 80% HOAc перемешивают при температуре окружающей среды в течение нескольких минут, и затем растворители удаляют методом ротационного выпаривания. Остаток выпаривают несколько раз совместно с MeOH. Остаток растворяют в небольшом количестве MeOH и обрабатывают небольшим количеством ацетонитрила. Продукт отделяют осаждением и супернатант удаляют с помощью пипетки. Полученный твердый продукт сушат в вакууме, получая соединение 101 (35 мг, 62%) в виде светлого порошка: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 308,06; C19H34NO2.
ПРИМЕР 11
Соединения 107-108, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 11. Любое количество соединений, родственных соединениям 107-108, может быть получено с применением подобной методики. Исходное соединение 33 также может быть получено согласно методикам, приведенным выше в примере 3.
Реакционная схема 11

a) MsCl, пиридин; b) NaN3, ДМФА, 40°C; c) NaBH4, MeOH, ТГФ; d) PPh3, H2O, ТГФ, 40°C; e) 2 N HCl, ТГФ; f) MePPh3Br, KOtBu, ТГФ, ДМФА; g) 80% AcOH.
В общих чертах, осуществление взаимодействия по свободному гидроксилу с применением MsCl и пиридина дает мезилатное соединение 102. Замещение мезилата на азид с использованием азида натрия в ДМФА дает соединение 103. Боргидридом натрия селективно восстанавливают карбонил, получая соединение 104. Восстановление азида с использованием PPh3 и воды в ТГФ дает соединение 105. Обработка с помощью HCl удаляет TBS-группу и циклический кеталь, что приводит к образованию соединения 106. Олефинирование с помощью MePPh3Br и KOtBu в ТГФ дает соединение 107. Обработка уксусной кислотой приводит к образованию соли с ацетатом аммония, что дает соединение 108.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 102
К раствору соединения 33 (15,0 г, 31,2 ммоль) в пиридине (100 мл) при 0°C добавляют метансульфонилхлорид (4,35 мл, 56,2 ммоль). Реакционную смесь перемешивают при 0°C в течение 10 минут, затем при температуре окружающей среды в течение 4 часов. Смесь разбавляют с помощью EtOAc (400 мл), промывают водой (2×100 мл) и затем насыщенным раствором соли (2×100 мл), после чего сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 3:1, 1:1), что дает соединение 102 (12,8 г, 78%) в виде белой пены.
Синтез соединения 103
Смесь соединения 102 (0,800 г, 1,43 ммоль) и NaN3 (0,190 г, 2,89 ммоль) в сухом ДМФА (15 мл) перемешивают при 50°C в течение 3 часов, затем при 40°C в течение ночи. После охлаждения до температуры окружающей среды смесь разбавляют водой (80 мл) и экстрагируют Et2O (3×30 мл). Органическую часть промывают насыщенным раствором соли (2×20 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (гексан; смесь гексан/EtOAc, 19:1, 9:1, 4:1), что дает соединение 103 (0,476 г, 66%) в виде желтого масла.
Синтез соединения 104
К перемешиваемому раствору соединения 103 (0,473 г, 0,935 ммоль) в ТГФ (15 мл) и MeOH (5 мл) при 0°C добавляют NaBH4 (0,286 г, 7,48 ммоль), порциями, за период 5 минут. Образовавшуюся смесь перемешивают при 0°C в течение 10 минут, затем при температуре окружающей среды в течение ночи. Реакционную смесь гасят водой (50 мл), затем экстрагируют EtOAc (30 мл, 2×20 мл). Органические экстракты промывают насыщенным раствором соли (2×20 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 9:1, 4:1), что дает соединение 104 (0,349 г, 73%) в виде белой пены.
Синтез соединения 105
Смесь соединения 104 (0,346 г, 0,681 ммоль), PPh3 (0,542 г, 2,04 ммоль), воды (1 мл) и ТГФ (20 мл) перемешивают при 40°C в течение ночи и затем концентрируют. Остаток очищают хроматографией на силикагеле (смесь CH2Cl2/MeOH, 19:1; смесь CH2Cl2/MeОH/Et3N, 9:1:0,2), получая соединение 105 (0,336 г, количественно) в виде бесцветной стеклообразной массы.
Синтез соединения 106
Смесь соединения 105 (0,050 г, 0,10 ммоль) и 2н. HCl (1 мл, 2 ммоль) в ТГФ (3 мл) перемешивают при температуре окружающей среды в течение 2 часов, затем концентрируют. К раствору остатка в CH2Cl2/MeOH (1:1,8 мл) добавляют крупнопористый полистирол-связанный карбонат (0,105 г, 0,300 ммоль) и смесь перемешивают при температуре окружающей среды в течение 3 часов. Смесь фильтруют, споласкивая смесью CH2Cl2/MeOH (1:1, 3×5 мл) и фильтрат концентрируют, получая соединение 106 (0,032 г, 94%) в виде бесцветного масла.
Синтез соединения 107
Смесь KOtBu (0,339 г, 2,87 ммоль) и MePPh3Br (1,02 г, 2,87 ммоль) в ТГФ (12 мл) перемешивают при температуре окружающей среды в течение 2,5 часов, затем добавляют раствор соединения 106 (0,116 г, 0,359 ммоль) в ТГФ (6 мл) и ДМФА (2 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи, затем гасят насыщенным раствором NH4Cl (4 мл), разбавляют с помощью MeOH (10 мл), фильтруют и фильтрат концентрируют. Остаток промывают EtOAc (3×10 мл) и MeOH (2×10 мл). Объединенные промывные воды концентрируют. Остаток очищают хроматографией на силикагеле (смесь EtOAc/MeOH; смесь EtOAc/MeOH/H2O/Et3N), получая соединение 107 (0,024 г, 21%) в виде бесцветной стеклообразной массы.
Синтез соединения 108
Смесь соединения 107 (0,035 г, 0,11 ммоль) и 80% уксусной кислоты (5 мл) перемешивают при температуре окружающей среды в течение 45 минут, затем концентрируют. Остаток растворяют в MeOH и концентрируют трижды. Осаждение из смеси ACN/MeOH дает соединение 108 (0,036 г, 86%) в виде желтого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 322,24; С20Н36NO2.
ПРИМЕР 12
Соединения 119-120, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 12. Любое количество соединений, родственных соединениям 119-120, может быть получено с применением подобной методики. Исходное соединение 102 может быть получено согласно методикам, приведенным выше в примере 11.
Реакционная схема 12

В общих чертах, замещение мезилата на фенилселенид дает соединение 109. Окислительное элиминирование с использованием пероксида водорода дает олефиновое соединение 110. Восстановление боргидридом натрия дает спиртовое соединение 111. Взаимодействие с уксусным ангидридом и DMAP в пиридине дает соединение 112. Озонирование дает альдегидное соединение 113. Восстановление боргидридом натрия дает соединение 114. Осуществление взаимодействия по свободному гидроксилу с использованием MsCl и пиридина дает мезилатное соединение 115. Азидное замещение мезилата с использованием азида натрия в ДМФА дает соединение 116. Взаимодействие с литийалюмогидридом в ТГФ восстанавливает азид и удаляет как ацильную группу, так и TBS-группу, что дает соединение 117. Обработка с помощью HCl удаляет циклический кеталь, приводя к образованию соединения 118. Олефинирование с использованием MePPh3Br и KOtBu в ТГФ дает соединение 119. Обработка уксусной кислотой приводит к образованию соли с ацетатом аммония, что дает соединение 120.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 109
К перемешиваемой смеси дифенилдиселенида (7,25 г, 22,8 ммоль) и EtOH (100 мл) при 0°C добавляют порциями NaBH4 (1,74 г, 45,5 ммоль), спустя 5 минут смеси дают нагреться до температуры окружающей среды и перемешивают в течение еще одного часа. Полученный раствор добавляют через канюлю к суспензии соединения 102 в EtOH (175 мл), споласкивая с помощью EtOH (25 мл). Смесь перемешивают при температуре окружающей среды в течение 30 минут, затем при 50°C в течение 45 минут. Смесь охлаждают, добавляют воду (80 мл) и смесь концентрируют. Остаток растворяют в EtOAc (500 мл) и промывают насыщенным раствором соли (2×100 мл). Осуществляют обратную экстракцию объединенных промывных вод с помощью EtOAc (200 мл), и EtOAc-часть промывают насыщенным раствором соли (2×50 мл). Объединенные органические экстракты сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 9:1), получая соединение 109 (8,9 г, 75%) в виде светло-желтого твердого вещества.
Синтез соединения 110
Смесь соединения 109 (0,907 г, 1,46 ммоль) и 30% раствора H2O2 в ТГФ (60 мл) перемешивают при температуре окружающей среды в течение 1 часа, затем при 65°C в течение 1 часа. После охлаждения смесь разбавляют с помощью EtOAc (60 мл) и промывают насыщенным раствором соли (30 мл), затем насыщенным раствором NaHCO3 (40 мл). Осуществляют обратную экстракцию объединенных водных порций с помощью EtOAc (2×20 мл). Объединенные органические порции промывают насыщенным раствором соли (2×40 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (гексан; смесь гексан/EtOAc, 7:1), получая соединение 110 (0,447 г, 66%) в виде белого твердого вещества.
Синтез соединения 111
К перемешиваемому раствору соединения 110 (3,82 г, 8,26 ммоль) в ТГФ (75 мл) и MeOH (25 мл) при 0°C добавляют NaBH4 (1,06 г, 27,7 ммоль), порциями, за 20 минут. Полученную смесь перемешивают при 0°C в течение 10 минут, затем при температуре окружающей среды в течение ночи. Реакционную смесь охлаждают до 0°C и гасят водой (200 мл), затем экстрагируют EtOAc (3×100 мл). Органические экстракты промывают насыщенным раствором соли (2×100 мл), сушат над безводным MgSO4 и концентрируют, получая соединение 111 (3,76 г, 98%) в виде белой пены.
Синтез соединения 112
К раствору соединения 111 (5,36 г, 11,5 ммоль) и DMAP (0,282 г, 2,31 ммоль) в пиридине (85 мл) добавляют уксусный ангидрид (10,9 мл, 115 ммоль). Полученную смесь перемешивают при 50°C в течение ночи, затем охлаждают до температуры окружающей среды, разбавляют с помощью EtOAc (350 мл) и промывают водой (120 мл). Осуществляют обратную экстракцию водной части с помощью EtOAc (2×50 мл). Объединенные органические слои промывают насыщенным раствором соли (2×125 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 9:1), получая соединение 112 (5,37 г, 92%) в виде белой пены.
Синтез соединения 113
Раствор соединения 112 (4,84 г, 9,55 ммоль) в CH2Cl2 (75 мл) и MeOH (25 мл) обрабатывают озоном при -78°C в течение 3,5 часов. Барботируют азот при -78°C в течение 10 минут, после чего добавляют диметилсульфид (12 мл, 164 ммоль), и смесь перемешивают при -78°C в течение 10 минут, затем при температуре окружающей среды в течение 2 часов. Смесь концентрируют, после чего остаток растворяют в EtOAc (200 мл), промывают водой (2×50 мл) и затем насыщенным раствором соли (2×50 мл), сушат над безводным MgSO4 и концентрируют, получая соединение 113 (4,59 г, 94%) в виде белой пены.
Синтез соединения 114
К перемешиваемому раствору соединения 113 (300 мг, 0,59 ммоль) в смеси MeOH/ТГФ (2 мл/7 мл) при 0°C добавляют NaBH4 (64 мг, 1,7 ммоль). После 15 мин при 0°C смесь перемешивают при температуре окружающей среды в течение 1 часа и затем добавляют дополнительное количество NaBH4 (20 мг, 0,53 ммоль). Смесь перемешивают еще 50 мин, после чего охлаждают до 0°C и реакцию гасят водой (5 мл). Смесь разбавляют с помощью EtOAc (200 мл), дважды промывают насыщенным раствором соли, сушат и концентрируют, получая сырое соединение 114 (299 мг, 99%). Продукт используют на следующей стадии без дополнительной очистки.
Синтез соединения 115
К перемешиваемому раствору соединения 114 (103 мг, 0,2 ммоль) в пиридине при 0°C добавляют по каплям MsCl (0,1 мл, 0,9 ммоль). Полученную смесь перемешивают при температуре окружающей среды в течение 8 часов, затем разбавляют с помощью EtOAc (200 мл), промывают насыщенным раствором соли, сушат и концентрируют, получая сырое соединение 115, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 116
Способ A
Смесь полученного ранее соединения 115 и NaN3 (46 мг, 0,7 ммоль) в ДМФА (1,6 мл) перемешивают при 60°C в течение ночи. Реакционную смесь разбавляют толуолом (150 мл) и промывают насыщенным раствором соли. Промывные воды объединяют и экстрагируют толуолом. Органические экстракты объединяют и промывают насыщенным раствором соли, сушат и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (смесь гексан/EtOAc, 9:1), получая соединение 116 (45 мг, 43% из расчета на INT1861), в виде прозрачной смолы.
Способ В
К перемешиваемому раствору соединения 114 (293 мг, 0,57 ммоль) в ТГФ (6 мл) при 0°C добавляют Ph3P (329 мг, 1,25 ммоль), DIAD (0,25 мл, 1,27 ммоль) и DPPA (0,27 мл, 1,25 ммоль). После 10 мин при 0°C смесь перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь гасят водой (20 мл) и экстрагируют EtOAc. EtOAc-экстракты объединяют и промывают насыщенным NaHCO3, насыщенным раствором соли, сушат и концентрируют. Остаток очищают колоночной хроматографией (смесь гексан/EtOAc, 9:1), получая соединение 116 (275 мг, 89%) в виде прозрачной смолы.
Синтез соединения 117
К перемешиваемому раствору соединения 116 (128 мг, 0,24 ммоль) в ТГФ (5 мл) при 0°C добавляют по каплям 1M LAH в ТГФ (0,95 мл, 0,95 ммоль). После 10 мин при 0°C смесь перемешивают при температуре окружающей среды в течение 4,5 часов. Смесь вновь охлаждают до 0°C и добавляют порциями твердый Na2SO4·10H2O (308 мг, 0,95 ммоль). Смесь перемешивают при 0°C в течение 10 мин и затем при температуре окружающей среды в течение еще 20 мин, после чего фильтруют через целит. Фильтрат разбавляют с помощью EtOAc (200 мл), промывают насыщенным раствором соли, сушат (Na2SO4) и концентрируют. Остаток очищают колоночной хроматографией (смесь EtOAc/MeOH/вода/Et3N, 7:2:0,5:0,5), получая соединение 117 (45 мг, 53%).
Синтез соединения 118
Смесь соединения 117 (45 мг, 0,13 ммоль) и 2н. HCl (1 мл) в ТГФ (3 мл) перемешивают при температуре окружающей среды в течение ночи. Растворитель удаляют методом ротационного выпаривания и остаток очищают колоночной хроматографией (смесь EtOAc/MeOH/вода/Et3N, 7:2:0,5:0,5), получая соединение 118 (50 мг, с примесью следов Et3N).
Синтез соединения 119
Смесь MePPh3Br (457 мг, 1,28 ммоль) и KOtBu (144 мг, 1,28 ммоль) в ТГФ (6 мл) перемешивают при температуре окружающей среды в течение 1 часа 40 мин и затем добавляют к смеси соединения 118 (50 мг, 0,16 ммоль) в ТГФ (3 мл) и ДМФА (1 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи и затем гасят насыщенным NH4Cl (2 мл). После перемешивания в течение нескольких минут смесь концентрируют методом ротационного выпаривания. Остаточную пастообразную массу многократно экстрагируют EtOAc и фильтруют. Фильтраты объединяют и концентрируют. Остаток очищают колоночной хроматографией (смесь EtOAc/MeOH/вода/Et3N, 7:2:0,5:0,5), получая соединение 119 (24 мг, 63% в расчете на соединение 117).
Синтез соединения 120
К перемешиваемому раствору соединения 119 (43 мг) в MeOH (~2 мл) добавляют 80% HOAc (0,5 мл) и затем смесь концентрируют досуха. Остаток повторно растворяют в небольшом количестве MeOH и обрабатывают небольшим количеством ацетонитрила. Смесь концентрируют вновь и полученный осадок сушат в вакууме, получая соединение 120 (53 мг, 100%) в виде светлого порошка: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мM NH4OAc в смеси 3:7 воды и MeCN) 308,11; C19H34NO2.
ПРИМЕР 13
Соединения 132-133, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 13. Любое количество соединений, родственных соединениям 132-133, может быть получено с применением подобной методики. Исходное соединение 121 получают согласно методикам, приведенным в патенте США 6046185.
Реакционная схема 13

В общих чертах, олефинирование с использованием (EtO)2P(O)CHF2 и литийдиизопропиламида (LDA) в ТГФ дает соединение 122. Тетрабутиламмонийфторид в ТГФ удаляет TBS-группу, что дает соединение 123. Взаимодействие с уксусным ангидридом в пиридине дает соединение 124. Обработка 80% уксусной кислотой удаляет ацетонидную группу, что приводит к образованию соединения 125. Окисление с помощью NaIO4 дает диальдегидное соединение 126. Восстановление боргидридом натрия дает соединение 127. Взаимодействие с уксусным ангидридом в пиридине дает соединение 128. Осуществление взаимодействия по свободному гидроксилу с применением MsCl и пиридина дает мезилатное соединение 129. Азидное замещение мезилата с использованием азида натрия в ДМФА дает соединение 130. Восстановление азида с применением PPh3 и воды в ТГФ дает соединение 131. Метанолиз ацетатов дает соединение 132. Обработка с помощью HCl приводит к образованию солевого соединения 133.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 122
Свежеприготовленный LDA (3,4 мл, 2,4 ммоль) добавляют к находящемуся при -78°C раствору F2CHPO(OEt)2 (0,40 мл, 2,5 ммоль) в сухом ТГФ (3 мл) в атмосфере аргона. Спустя 20 минут добавляют раствор соединения 121 (0,30 г, 0,63 ммоль) в сухом ТГФ. Взаимодействие осуществляют в течение 1 часа, затем медленно нагревают до температуры окружающей среды за период времени 2 часа и, наконец, нагревают до 60°C в течение 3 часов. Реакционную смесь охлаждают до температуры окружающей среды, затем гасят 0,5 мл воды. Раствор разбавляют с помощью EtOAc и промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (смесь 4% EtOAc/гексан), получая соединение 122 (0,145 г, 45%) в виде белого твердого вещества.
Синтез соединения 123
Раствор соединения 122 (0,65 г, 1,3 ммоль), Bu4NF (2,7 мл 1M раствора в ТГФ) и ТГФ (10 мл) нагревают до 50°C в течение 3 часов. Реакционную смесь концентрируют и остаток очищают колоночной хроматографией на силикагеле (смесь 30% EtOAc/гексан), получая соединение 123 (0,54 г, количественно).
Синтез соединения 124
Раствор соединения 123 (0,54 г, 1,3 ммоль), уксусного ангидрида (0,24 мл, 2,5 ммоль) и пиридина (5 мл) перемешивают при температуре окружающей среды в течение 3 дней. Раствор разбавляют EtOAc, промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Сырое соединение 124 используют на следующей стадии без дополнительной очистки.
Синтез соединения 125
Раствор соединения 124 (сырой продукт, 1,3 ммоль) и 80% уксусной кислоты (10 мл) нагревают до 50°C в течение 2 часов. Реакционную смесь концентрируют при пониженном давлении и остаточные растворители удаляют совместной перегонкой с толуолом. Сырое соединение 125 используют на следующей стадии без дополнительной очистки.
Синтез соединения 126
Раствор NaIO4 (0,54 г, 2,5 ммоль) и воду (4 мл) добавляют к раствору соединения 125 (сырой продукт, 1,3 ммоль) и ТГФ (10 мл). Спустя 3 часа раствор разбавляют CH2Cl2 и промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Сырое соединение 126 используют на следующей стадии без дополнительной очистки.
Синтез соединения 127
Боргидрид натрия (48 мг, 1,3 ммоль) добавляют к раствору соединения 126 (сырой продукт, 1,3 ммоль), ТГФ (6 мл) и MeOH (2 мл). Спустя 3 часа реакционную смесь гасят водой (15 мл) и раствор экстрагируют, используя 2×15 мл EtOAc. Объединенные экстракты сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (смесь 30% EtOAc/гексан), получая соединение 127 (0,38 г, 75%) в виде белого твердого вещества.
Синтез соединения 128
Раствор соединения 127 (0,38 г, 0,95 ммоль), уксусного ангидрида (0,09 мл, 1 ммоль) и пиридина (5 мл) перемешивают в течение ночи при температуре окружающей среды. Реакционную смесь разбавляют водой и экстрагируют 2×15 мл EtOAc. Объединенные экстракты сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле, получая соединение 128 (0,32 г, 76%) в виде белого твердого вещества.
Синтез соединения 129
Раствор соединения 128 (0,32 г, 0,72 ммоль), MsCl (0,11 мл, 1,4 ммоль) и пиридина (5 мл) перемешивают при температуре окружающей среды в течение 3 часов. Реакционную смесь гасят водой и экстрагируют EtOAc (2×25 мл). Объединенные экстракты промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Сырое соединение 129 используют на следующей стадии без дополнительной очистки.
Синтез соединения 130
Раствор соединения 129 (сырой продукт, 0,72 ммоль), NaN3 (0,83 г, 3,6 ммоль) и ДМФА (5 мл) нагревают в течение ночи до 55°C. Реакционную смесь охлаждают до температуры окружающей среды и разбавляют водой (10 мл), затем экстрагируют толуолом. Толуольный раствор сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (смесь 20% EtOAc/гексан), получая соединение 130 (0,30 г, 89%) в виде белой пены.
Синтез соединения 131
Раствор соединения 130 (0,13 г, 0,28 ммоль), PPh3 (0,15 г, 0,56 ммоль), ТГФ (3 мл) и воды (0,3 мл) перемешивают в атмосфере аргона в течение 3 дней. Реакционную смесь концентрируют, и остаток очищают колоночной хроматографией на силикагеле (смесь EtOAc/MeOH/Et3N 9:1:0,5), получая соединение 131 (98 мг, 79%) в виде белого твердого вещества.
Синтез соединения 132
Раствор соединения 131 (0,28 г, 0,65 ммоль), NaOMe (0,5 мл 25% раствора в MeOH) и MeOH (5 мл) перемешивают при температуре окружающей среды в течение 3 часов. Реакционную смесь концентрируют и остаток очищают колоночной хроматографией (смесь EtOAc/MeOH/NH4OH 9:1:0,6), получая соединение 132 (0,21 г, 89%) в виде белого твердого вещества.
Синтез соединения 133
Раствор соединения 132 (0,24 г, 0,68 ммоль), HCl (1,36 мл 1M раствора в Et2O) и MeOH (3 мл) перемешивают при температуре окружающей среды в течение 30 минут. Реакционную смесь концентрируют и остаток порошкуют в EtOAc (5 мл). Полученное белое твердое вещество фильтруют и сушат в течение ночи при высоком вакууме и температуре 56°C, получая соединение 133 (0,21 г, 78%): ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAс в смеси 3:7 воды и MeCN) 358,14; C20H34F2NО2.
ПРИМЕР 14
Соединение 143, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 14. Любое количество соединений, родственных соединению 143, может быть получено с применением подобной методики. Исходное соединение 121 получают согласно методикам, приведенным в патенте США 6046185.
Реакционная схема 14

В общих чертах, олефинирование с использованием (EtO)2P(O)CCl3 и LDA в ТГФ дает соединение 134. Обработка 80% уксусной кислотой удаляет как TBS-группу, так и ацетонидную группу, что приводит к образованию соединения 135. Обработка TBSCl и имидазолом в ДМФА селективно защищает один гидроксил, что дает соединение 136. Окисление с помощью NaIO4 дает диальдегидное соединение 137. Восстановление боргидридом натрия дает соединение 138. Обработка TBSCl и имидазолом в ДМФА селективно защищает один гидроксил, что дает соединение 139. Осуществление взаимодействия по свободному гидроксилу с применением MsCl и пиридина дает мезилатное соединение 140. Азидное замещение мезилата с использованием азида натрия в ДМФА дает соединение 141. Восстановление азида с применением PPh3 и воды в ТГФ дает соединение 142. Обработка с помощью HCl удаляет TBS-группы и приводит к образованию солевого соединения 143.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 134
CCl3P(O)(OEt)2 (1,12 мл, 6 ммоль) добавляют к находящемуся при -78°C раствору свежеприготовленного LDA (6 ммоль) в сухом ТГФ (20 мл) в атмосфере аргона. Спустя 5 минут добавляют соединение 121 (954 мг, 2 ммоль). Взаимодействие продолжается в течение 1 часа, затем реакционную смесь медленно нагревают до температуры окружающей среды за 2 часа и, наконец, перемешивают при температуре окружающей среды в течение ночи. Реакцию гасят 0,5 мл воды. Раствор разбавляют EtOAc и промывают водой, затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (смесь 3% EtOAc/гексан), получая соединение 134 (109 мг, 10%) в виде светло-желтой пены.
Синтез соединения 135
Раствор соединения 134 (288 мг, 0,53 ммоль) в 2 мл ТГФ и 80% уксусной кислоты (8 мл) нагревают до 50°C в течение 2 часов. Реакционную смесь концентрируют при пониженном давлении и остаточные растворители удаляют совместной перегонкой с толуолом. Сырое соединение 135 используют на следующей стадии без дополнительной очистки.
Синтез соединения 136
Раствор соединения 135 (сырой продукт, 0,53 ммоль) в ДМФА (3 мл), имидазола (108 мг, 1,6 ммоль) и TBSCl (160 мг, 1,1 ммоль) перемешивают при температуре окружающей среды в течение 2 часов. Реакционную смесь разбавляют 50 мл воды и экстрагируют 100 мл EtOAc. Экстракты сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле, получая соединение 136 (243 мг, 91%) в виде светло-желтой пены.
Синтез соединения 137
Раствор NaIO4 (205 мг, 0,96 ммоль) и воды (2 мл) добавляют к раствору соединения 136 (243 мг, 0,48 ммоль) и ТГФ (6 мл). Спустя 3 часа раствор разбавляют с помощью CH2Cl2 и промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Сырое соединение 137 используют на следующей стадии без дополнительной очистки.
Синтез соединения 138
Боргидрид натрия (36 мг, 0,96 ммоль) добавляют к раствору соединения 137 (сырой продукт, 0,48 ммоль), ТГФ (3 мл) и MeOH (1 мл). Спустя 3 часа реакцию гасят водой (30 мл) и раствор экстрагируют, используя 2×50 мл EtOAc. Объединенные экстракты сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (смесь 30% EtOAc/гексан), получая соединение 138 (201 мг, 83%) в виде светло-желтого масла.
Синтез соединения 139
Раствор соединения 138 (201 мг, 0,4 ммоль), имидазола (136 мг, 2 ммоль), TBSCl (110 мг, 0,73 ммоль) и ДМФА (3 мл) перемешивают в течение 1 часа при температуре окружающей среды. Реакционную смесь разбавляют 30 мл воды и экстрагируют 2×40 мл EtOAc. Объединенные экстракты сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле, получая соединение 139 (230 мг, 93%) в виде светло-желтого масла.
Синтез соединения 140
Раствор соединения 139 (216 мг, 0,35 ммоль), MsCl (0,14 мл, 1,8 ммоль) и пиридина (3,5 мл) перемешивают при температуре окружающей среды в течение 2 часов. Реакционную смесь гасят 30 мл воды и экстрагируют EtOAc (2×40 мл). Объединенные экстракты промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Сырое соединение 140 используют на следующей стадии без дополнительной очистки.
Синтез соединения 141
Раствор соединения 140 (сырой продукт, 0,35 ммоль), NaN3 (178 мг, 2,7 ммоль) и ДМФА (3 мл) нагревают в течение ночи при 55°C. Реакционную смесь охлаждают до температуры окружающей среды, разбавляют водой (30 мл), затем экстрагируют толуолом. Толуольный раствор сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (смесь 5% EtOAc/гексан), получая соединение 141 (202 мг, 89%) в виде светло-желтого масла.
Синтез соединения 142
Раствор соединения 141 (202 мг, 0,31 ммоль), PPh3 (320 мг, 1,2 ммоль), ТГФ (4 мл) и воды (0,3 мл) перемешивают в атмосфере аргона в течение ночи, затем нагревают до 50°C в течение 4 часов. Реакционную смесь концентрируют, остаток очищают 2 г ионообменной смолы SCX (6 объемов MeOH, 3 объема смеси 5% аммиак/MeOH), получая соединение 142 в виде светло-желтой пены (во время этого процесса частично утрачивается TBS-группа).
Синтез соединения 143
Раствор соединения 142 (сырой продукт, 0,31 ммоль), HCl (1 мл 1M раствора в Et2O), ТГФ (3 мл) и воды (0,5 мл) перемешивают при температуре окружающей среды в течение 2 часов. Реакционную смесь выдерживают при 4°C в течение 1 часа. Полученное белое твердое вещество фильтруют и промывают EtOAc, затем сушат в течение ночи при высоком вакууме и температуре 56°C, получая соединение 143 (122 мг, 92%): ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 390,06; C20H34Cl2NO2.
ПРИМЕР 15
Соединения 157-158, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 15. Исходное соединение 144 может быть получено согласно методикам, кратко изложенным в патенте США 6046185. Любое количество соединений, родственных соединениям 157-158, может быть получено с применением подобной методики.
Реакционная схема 15

a) TBSCl, имидазол, ДМФА; b) BH3·ТГФ, H2O2, ТГФ; c) n-Pr4N(RuO4), NMO, 4Å молекулярные сита, CH2Cl2; d) MePPh3Br, KOtBu, ТГФ; e) n-Bu4NF, ТГФ; f) Ac2O, DMAP, пиридин; g) 80% AcOH; h) NalO4, ТГФ, H2O; i) NaBH4, MeOH, ТГФ; j) Ac2O, DMAP, пиридин; k) MsCl, пиридин; l) NaN3, ДМФА; m) LiAlH4, ТГФ; n) 80% AcOH.
В общих чертах, взаимодействие соединения 144 с TBSCl и имидазолом в ДМФА дает соединение 145. Гидроборирование с помощью комплекса боран-тетрагидрофуран в ТГФ, с последующим окислением под действием NaOH и H2O2 превращает соединение 145 во вторичное спиртовое соединение 146. Окисление каталитическим количеством тетра-н-пропиламмонийперрутената (TPAP) и NMO в CH2Cl2 дает соединение 147. Олефинирование с помощью MePPh3Br и KOtBu в ТГФ дает алкен 148. Тетрабутиламмонийфторид удаляет TBS-группу, давая соединение 149. Взаимодействие с уксусным ангидридом в пиридине дает соединение 150. Обработка 80% уксусной кислотой удаляет ацетонидную группу, давая соединение 151. Окисление с помощью NaIO4 дает диальдегидное соединение 152. Восстановление боргидридом натрия дает соединение 153. Взаимодействие с уксусным ангидридом в пиридине селективно защищает один гидроксил, давая соединение 154. Осуществление взаимодействия по свободному гидроксилу с применением MsCl и пиридина дает мезилатное соединение 155. Азидное замещение мезилата с использованием азида натрия в ДМФА дает соединение 156. Взаимодействие с литийалюмогидридом в ТГФ восстанавливает азид и удаляет ацетаты, давая соединение 157. Обработка 80% уксусной кислотой приводит к образованию аммонийацетатного солевого соединения 158.
Синтез соединения 145
Раствор соединения 144 (10,0 г, 26,7 моль), TBSCl (6,22 г, 40,1 ммоль) и имидазола (3,67 г, 53,4 ммоль) в сухом ДМФА (178 мл) перемешивают при температуре окружающей среды в течение 2,5 часов. Реакционную смесь разбавляют водой (250 мл) и экстрагируют толуол (3×250 мл). Объединенные толуольные экстракты промывают насыщенным раствором соли (250 мл), сушат над MgSO4, фильтруют и концентрируют. Сырое соединение 145 (12,5 г, 96%) используют на следующей стадии без дополнительной очистки.
Синтез соединения 146
К раствору соединения 145 (12,5 г, 25,6 ммоль) в сухом ТГФ (150 мл) добавляют комплекс боран-тетрагидрофуран (46 мл 1,0M раствора в ТГФ), и реакционную смесь перемешивают при температуре окружающей среды в течение 1 часа. Медленно добавляют 10% водный NaOH (180 мл). Смесь охлаждают льдом и медленно добавляют 30% водный раствор H2O2 (120 мл). Смесь перемешивают при температуре окружающей среды в течение 1 часа и затем экстрагируют EtOAc (3×250 мл). Объединенные EtOAc-экстракты промывают 10% водным Na2S2O3 (200 мл), насыщенным раствором соли (200 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь CH2Cl2/EtOAc, 95:5, затем 85:15 и смесь гексан/EtOAc, 90:10, затем 85:15), получая соединение 146 (10,7 г, 83%) в виде белого твердого вещества.
Синтез соединения 147
К смеси соединения 146 (8,50 г, 16,8 ммоль), NMO (2,23 г, 18,5 ммоль), 4 Å молекулярных сит (5,3 г) в CH2Cl2 (85 мл) добавляют TPAP (152 мг, 0,42 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 1 часа, затем фильтруют через силикагель, наполненный в воронку из пористого стекла (элюируют смесью гексан/EtOAc, 1:1) и концентрируют досуха. Сырой продукт 147 используют на следующей стадии без дополнительной очистки.
Синтез соединения 148
Смесь KOtBu (5,69 г, 48,1 ммоль) и MePPh3Br (17,2 г, 48,1 ммоль) в ТГФ (160 мл) перемешивают при температуре окружающей среды в течение одного часа в атмосфере аргона, затем добавляют соединение 147 (8,10 г, 16,1 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 4 часов, разбавляют насыщенным раствором соли (150 мл), экстрагируют EtOAc (3×200 мл). Объединенные EtOAc экстракты промывают насыщенным раствором соли (200 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 96:4, затем 10:1, затем 4:1), получая соединение 148 (6,3 г, 79%) в виде белой пены.
Синтез соединения 149
Раствор соединения 148 (6,3 г, 12,5 ммоль) и н-Bu4NF (18,8 мл 1,0M раствора в ТГФ) в ТГФ (125 мл) нагревают до температуры кипения с обратным холодильником в атмосфере аргона в течение 1 часа. Растворитель выпаривают при пониженном давлении, и остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 2:1 затем 1:1), получая соединение 149 (4,8 г, 99%) в виде белого твердого вещества.
Синтез соединения 150
Раствор соединения 149 (4,8 г, 12,4 ммоль), уксусного ангидрида (2,3 мл, 24,7 ммоль) и DMAP (151 мг, 1,24 ммоль) в пиридине (60 мл) перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь разбавляют EtOAc (300 мл) и промывают насыщенным раствором соли (2×100 мл). EtOAc-слой сушат над MgSO4, фильтруют и концентрируют. Сырое соединение 150 используют непосредственно на следующей стадии.
Синтез соединения 151
Смесь соединения 150 (сырой продукт, 12,4 ммоль) и 80% уксусной кислоты (90 мл) перемешивают при 40°C в течение 1 часа. Раствор концентрируют, получая соединение 151, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 152
Раствор соединения 151 (2,20 г, 5,63 ммоль), NaIO4 (2,43 г, 11,3 ммоль), воды (23 мл) и ТГФ (46 мл) перемешивают при температуре окружающей среды в течение 3 часов. Реакционную смесь разбавляют CH2Cl2 (200 мл) и промывают насыщенным раствором соли (3×75 мл). CH2Cl2-слой сушат над MgSO4, фильтруют и концентрируют, получая соединение 152, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 153
Раствор соединения 152 (сырой продукт, 5,63 ммоль), NaBH4 (538 мг, 14,1 ммоль), ТГФ (36 мл) и MeOH (12 мл) перемешивают при 0°C в течение 10 минут, затем при температуре окружающей среды в течение 2 часов. Смесь охлаждают льдом и медленно добавляют 80% уксусную кислоту (23 мл). Раствор перемешивают при температуре окружающей среды в течение 10 минут, затем разбавляют с помощью EtOAc (200 мл) и промывают насыщенным раствором соли (3×75 мл). EtOAc-слой сушат над MgSO4, фильтруют и концентрируют, получая сырое соединение 153, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 154
Раствор соединения 153 (сырой продукт, 5,63 ммоль), уксусного ангидрида (0,58 мл, 6,20 ммоль) и DMAP (69 мг, 0,56 ммоль) в пиридине (22 мл) перемешивают при температуре окружающей среды в течение 1,5 часов. Реакционную смесь разбавляют EtOAc (200 мл) и промывают насыщенным раствором соли (3×75 мл). EtOAc-слой сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 5:1, затем 4:1, затем 7:3), получая соединение 154 (1,6 г, 65% от 5 стадий).
Синтез соединения 155
К раствору соединения 154 (1,60 г, 3,68 ммоль) в пиридине (15 мл) добавляют метансульфонилхлорид (0,600 мл, 7,37 ммоль), и реакционную смесь перемешивают при температуре окружающей среды в течение 4 часов. Раствор разбавляют с помощью EtOAc (200 мл) и промывают насыщенным раствором соли (3×70 мл), затем сушат над MgSO4, фильтруют и концентрируют, получая сырое соединение 155, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 156
Смесь соединения 155 (сырой продукт, 3,68 ммоль) и NaN3 (479 мг, 7,36 ммоль) в ДМФА (25 мл) нагревают в атмосфере аргона при 60°C в течение ночи. После охлаждения реакционную смесь разбавляют толуолом (300 мл) и промывают насыщенным раствором соли (3×75 мл), затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 9:1, затем 8:2), получая соединение 156 (1,6 г, 95% от 2 стадий) в виде белой пены.
Синтез соединения 157
Раствор LiAlH4 (13,9 мл 1,0M раствора в ТГФ) добавляют к охлаждаемому льдом раствору соединения 156 (1,60 г, 13,9 ммоль) в ТГФ (35 мл) и перемешивают в течение 15 минут. Перемешивание продолжают при температуре окружающей среды в течение 3 часов. Реакционную смесь охлаждают льдом, гасят Na2SO4·10H2O и перемешивают в течение 10 минут. После чего смесь перемешивают еще дополнительно в течение 30 минут при температуре окружающей среды, разбавляют с помощью EtOAc и затем фильтруют. Фильтрат промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь EtOAc/MeOH/H2O/Et3N, 70:20:10:0, затем 70:20:10:3), получая соединение 157 (0,8 г, 66%) в виде белого твердого вещества.
Синтез соединения 158
Раствор соединения 157 (0,800 г, 2,29 ммоль) и 80% уксусной кислоты (20 мл) нагревают до 40°C в течение 1 часа и затем концентрируют. Остаточный растворитель удаляют совместной перегонкой с ацетонитрилом. Остаток порошкуют в диэтиловом эфире и фильтруют, получая соединение 158 (700 мг, 75%) в виде белого твердого вещества. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 350,12; C22H40NO2.
ПРИМЕР 16
Соединение 163, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 16. Любое количество соединений, родственных соединению 163, может быть получено с применением подобной методики. Исходное соединение 21 может быть получено согласно методикам, описанным выше в примере 1.
Реакционная схема 16

а) 80% АсОН, 55°С; b) TBSCI, имидазол, ДМФА; с) TsNHNH2, толуол, нагревание до температуры кипения с обратным холодильником; d) LDA, ТГФ; e) 80% AcOH.
В общих чертах, обработка 80% уксусной кислотой удаляет TBS-группу, давая соединение 159. Взаимодействие с TBSCl и имидазолом в ДМФА дает соединение 160. Взаимодействие с тозилгидразином в толуоле дает соединение 161. Взаимодействие с LDA дает продукт элиминирования, соединение 162. Обработка 80% уксусной кислотой удаляет TBS-группы, что приводит к образованию соединения 163.
Синтез соединения 159
Смесь соединения 21 (1,19 г, 2,46 ммоль) и 80% уксусной кислоты (20 мл) перемешивают при 55°C в течение 3 часов, затем концентрируют. Остаток растворяют в толуоле и концентрируют трижды. Остаток очищают хроматографией на силикагеле (смесь EtOAc/MeOH, 49:1), получая соединение 159 (0,747 г, 93%) в виде белой пены.
Синтез соединения 160
Смесь соединения 159 (0,747 г, 2,30 ммоль), TBSCl (2,08 г, 13,8 ммоль) и имидазола (1,88 г, 27,6 ммоль) в сухом ДМФА (12 мл) перемешивают при температуре окружающей среды в течение 3 часов, затем разбавляют водой (50 мл) и экстрагируют EtOAc (3×50 мл). Объединенные органические слои промывают насыщенным раствором соли (2×30 мл), сушат над безводным Na2SO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 7:3), получая соединение 160 (1,11 г, 93%) в виде белой пены.
Синтез соединения 161
Смесь соединения 160 (0,500 г, 0,904 ммоль) и TsNHNH2 (0,236 г, 1,27 ммоль) в толуоле (20 мл) нагревают до температуры кипения с обратным холодильником в течение 1 часа, затем перемешивают при температуре окружающей среды в течение ночи, после чего нагревают до температуры кипения с обратным холодильником в течение еще одного часа.
После охлаждения смесь концентрируют. К остатку добавляют CH2Cl2 и смесь охлаждают льдом. Осадок отделяют фильтрованием, промывая охлажденным CH2Cl2, затем сушат, получая соединение 161 (0,588 г, 90%) в виде белого твердого вещества.
Синтез соединения 162
Раствор LDA получают добавлениемnBuLi (2 мл 2,5M раствора в гексане, 5,0 ммоль) к растворуiPr2NH (0,77 мл, 5,5 ммоль) в ТГФ (4,23 мл) при 0°C, затем перемешивают раствор при 0°C в течение 30 минут. К раствору соединения 161 (0,550 г, 0,763 ммоль) в ТГФ (4 мл) при температуре окружающей среды добавляют раствор LDA (6,4 мл 0,71M раствора, 4,6 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Смесь разбавляют насыщенным раствором соли (50 мл) и экстрагируют EtOAc (3×50 мл). Объединенные органические слои промывают насыщенным раствором соли (2×30 мл), сушат над безводным Na2SО4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 19:1, 9:1), получая соединение 162 (0.062 г, 15%) в виде желтого геля.
Синтез соединения 163
Смесь соединения 162 (0,062 г, 0,11 ммоль) и 80% уксусной кислоты (2 мл) перемешивают при температуре окружающей среды в течение 3 часов и затем концентрируют. Остаток растворяют в толуоле и концентрируют. Остаток очищают хроматографией на силикагеле (EtOAc/MeOH, 19:1), получая соединение 163 (0,022 г, 65%) в виде светло-желтого твердого вещества.
ПРИМЕР 17
Соединение 178, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 17. Любое количество соединений, родственных соединению 178, может быть получено с применением подобной методики. Исходное соединение 164 может быть получено согласно методикам, кратко изложенным в патенте США 6046185.
Реакционная схема 17

a) MsCl, пиридин; b) LiBr, DBU, ДМФА, 150°C; c) NMO, OsO4, H2O, tBuOH, ТГФ; d) MePPh3Br, KOtBu, ТГФ; e) Ac2O, DMAP, пиридин; f) 80% AcOH; g) NalO4, H2O, ТГФ; h) NaBH4, MeOH, ТГФ; i) TBSCl, имидазол, ДМФА; j) MsCl, пиридин; k) NaN3, ДМФА, 40°C; l) K2CO3, H2O, MeOH; m) PPh3, H2O, THF, 40°C; n) 80% AcOH.
В общих чертах, осуществление взаимодействия по свободному гидроксилу с применением MsCl и пиридина дает мезилатное соединение 165. Обработка с помощью LiBr и DBU в ДМФА дает соединение 166 в качестве продукта элиминирования. Осмилирование дает соединение 167. Олефинирование с использованием MePPh3Br и KOtBu в ТГФ дает соединение 168. Взаимодействие с уксусным ангидридом и DMAP в пиридине дает соединение 169. Обработка 80% уксусной кислотой удаляет ацетонидную группу, давая соединение 170. Окисление с помощью NaIO4 дает диальдегидное соединение 171. Восстановление боргидридом натрия дает соединение 172. Обработка TBSCl и имидазолом в ДМФА селективно защищает один гидроксил, что дает соединение 173. Осуществление взаимодействия по свободному гидроксилу с применением MsCl и пиридина дает мезилатное соединение 174. Азидное замещение мезилата с использованием азида натрия в ДМФА дает соединение 175. Основной гидролиз ацетатов дает соединение 176. Восстановление азида с использованием PPh3 и воды в ТГФ дает соединение 177. Обработка 80% уксусной кислотой удаляет TBS-группу и приводит к образованию солевого соединения 178.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 165
К раствору соединения 164 (4,00 г, 11,03 ммоль) в пиридине (20 мл) добавляют MsCl (1,28 мл, 16,55 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение одного часа в атмосфере аргона, затем разбавляют с помощью EtOAc (100 мл), промывают насыщенным раствором соли (2×50 мл), сушат над безводным MgSO4 и концентрируют досуха. Сырое полученное соединение 165 используют для следующего взаимодействия без дополнительной очистки.
Синтез соединения 166
Смесь сырого соединения 165 (2,00 г, 4,54 ммоль), литийбромида (0,59 г, 6,81 ммоль) и DBU (2 мл, 13,62 ммоль) в сухом ДМФА (50 мл) нагревают до 150°C в течение 1,5 часов. После охлаждения к реакционной смеси добавляют толуол (120 мл) и воду (60 мл). Слои разделяют и водную фазу экстрагируют толуолом (80 мл). Объединенный толуольный раствор промывают насыщенным раствором соли (100 мл), сушат над безводным MgSO4 и концентрируют досуха. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 9/1), получая очищенное соединение 166 (1,09 г, 70%) в виде белого твердого вещества.
Синтез соединения 167
К раствору соединения 166 (1,00 г, 2,90 ммоль) в смеси ТГФ (15 мл) и трет-BuOH (5 мл) добавляют воду (2,5 мл), с последующим добавлением NMO (0,60 мл, 50% в H2O) и OsO4 (0,89 мл, 4% в H2O). Реакционную смесь перемешивают при температуре окружающей среды в течение 3 часов, затем добавляют раствор Na2S2O3 (0,5 г) в воде (15 мл). Реакционную смесь перемешивают в течение 20 минут, затем экстрагируют CH2Cl2 (2×30 мл), промывают насыщенным раствором соли (50 мл), сушат над безводным MgSO4 и концентрируют досуха. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 1:1), получая соединение 167 (0,65 г, 60%) в виде белого твердого вещества.
Синтез соединения 168
Смесь KOtBu (2,88 г, 32,9 ммоль) и MePPh3Br (11,8 г, 32,9 ммоль) в ТГФ (40 мл) перемешивают при температуре окружающей среды в течение 1 часа, затем добавляют соединение 167 (4,15 г, 11,0 ммоль) в ТГФ (10 мл) и смесь перемешивают при температуре окружающей среды в течение ночи. Добавляют насыщенный раствор NaHCO3 (50 мл) и смесь перемешивают в течение 15 минут, затем разбавляют водой (50 мл) и экстрагируют EtOAc (4×50 мл). Объединенные органические слои промывают насыщенным раствором соли (2×60 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc/MeOH, 1:1:0,02), получая смесь, содержащую соединение 168 (6,29 г) в виде светло-коричневой пены.
Синтез соединения 169
К раствору смеси, содержащей соединение 168 (6,29 г, 11,0 ммоль) и DMAP (0,128 г, 1,05 ммоль) в пиридине (40 мл) добавляют уксусный ангидрид (4,15 мл, 44,0 ммоль). Смесь перемешивают при температуре окружающей среды в течение ночи, затем разбавляют с помощью EtOAc (100 мл), промывают насыщенным раствором NaHCO3 (50 мл), водой (50 мл) и насыщенным раствором соли (2×50 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 1:3), получая соединение 169 (4,12 г, 81% из расчета на INT395) в виде белой пены.
Синтез соединения 170
Смесь соединения 169 (1,97 г, 4,28 ммоль) и 80% уксусной кислоты (15 мл) перемешивают при температуре окружающей среды в течение 3 часов и затем концентрируют. Остаток очищают хроматографией на силикагеле, получая соединение 170 (1,35 г, 75%) в виде желтой пены.
Синтез соединения 171
Смесь соединения 170 (1,29 г, 3,07 ммоль) и NaIO4 (1,32 г, 6,13 ммоль) в ТГФ (20 мл) и воде (10 мл) перемешивают при температуре окружающей среды. Спустя 1,5 часа добавляют еще 0,20 г (0,92 ммоль) NaIO4. По прошествии 3 часов общего реакционного времени смесь разбавляют водой (20 мл) и экстрагируют CH2Cl2 (60 мл). Органическую часть промывают насыщенным раствором соли (30 мл), сушат над безводным MgSO4 и концентрируют, получая сырое соединение 171, которое используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 172
К раствору сырого соединения 171 (3,07 ммоль) в ТГФ (15 мл) и MeOH (5 мл) при 0°C добавляют NaBH4 (0,232 г, 6,14 ммоль). Затем смесь перемешивают при 0°C в течение 15 минут, после чего при температуре окружающей среды в течение 1,5 часов. Смесь охлаждают до 0°C и медленно добавляют 80% уксусную кислоту (10 мл). Смесь перемешивают при температуре окружающей среды в течение 10 минут, затем разбавляют с помощью EtOAc (80 мл) и промывают насыщенным раствором соли (2×30 мл). Органическую часть сушат над безводным MgSO4 и концентрируют, получая соединение 172 (1,23 г, 95% в расчете на соединение 170) в виде светло-желтой пены.
Синтез соединения 173
Смесь соединения 172 (1,23 г, 2,91 ммоль), имидазола (0,600 г, 8,73 ммоль) и TBSCl (0,585 г, 3,76 ммоль) в ДМФА (15 мл) перемешивают при температуре окружающей среды в течение 35 минут, затем разбавляют водой (140 мл) и экстрагируют Et2O (4×50 мл). Объединенные органические слои промывают насыщенным раствором соли (2×50 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (гексан; смесь гексан/EtOAc, 9:1, 4:1, 3:1), получая соединение 173 (0,992 г, 64%) в виде белой пены.
Синтез соединения 174
К раствору соединения 173 (0,990 г, 1,84 ммоль) в пиридине (10 мл) добавляют метансульфонилхлорид (0,257 мл, 3,32 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 1,5 часов, после чего разбавляют EtOAc (50 мл), промывают водой (20 мл), затем насыщенным раствором соли (20 мл), сушат над безводным MgSO4 и концентрируют, получая сырое соединение 174 (1,17 г, белая пена), которое используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 175
Смесь сырого соединения 174 (1,84 ммоль) и NaN3 (0,242 г, 3,68 ммоль) в сухом ДМФА (15 мл) перемешивают при 40°C в течение ночи. После охлаждения до температуры окружающей среды смесь разбавляют водой (150 мл) и экстрагируют Et2O (4×50 мл). Объединенные органические слои промывают насыщенным раствором соли (2×50 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (гексан; смесь гексан/EtOAc, 9:1, 4:1), получая соединение 175 (0,708 г, 69% в расчете на соединение 173) в виде белой пены.
Синтез соединения 176
Смесь соединения 175 (0,397 г, 0,645 ммоль), K2CO3 (0,446 г, 3,23 ммоль), воды (5 мл) и MeOH (15 мл) перемешивают при температуре окружающей среды в течение 4 часов, затем разбавляют водой (100 мл) и экстрагируют CH2Cl2 (3×50 мл). Объединенные органические слои промывают насыщенным раствором соли (2×50 мл), сушат над безводным MgSO4 и концентрируют, получая соединение 176 (0,284 г, 92%) в виде белого твердого вещества, которое используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 177
Смесь соединения 176 (0,284 г, 0,594 ммоль), трифенилфосфина (0,472 г, 1,78 ммоль), воды (1 мл) и ТГФ (15 мл) перемешивают при 40°C в течение ночи и затем концентрируют. Остаток очищают хроматографией на силикагеле (CH2Cl2; CH2Cl2/Me0H, 19:1, 12:1; CH2Cl2/MeОH/Et3N, 9:1:0,3), получая соединение 177 (0,241 г, 90%) в виде белого твердого вещества.
Синтез соединения 178
Смесь соединения 177 (0,234 г, 0,518 ммоль) и 80% уксусной кислоты (20 мл) перемешивают при температуре окружающей среды в течение ночи и затем концентрируют. Остаток трижды растворяют в MeOH и концентрируют. Осаждение из смеси ACN/MeOH (20 мл) дает соединение 178 (0,223 г, количественно) в виде белого твердого вещества. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 338,26; C20H36NO3.
ПРИМЕР 18
Соединения 182-185, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 18. Любое количество соединений, родственных соединениям 182-185, может быть получено с применением подобной методики. Исходное соединение 95 получают согласно методикам, описанным выше в примере 10.
Реакционная схема 18

a) KOtBu, Me2NCH2CH2PPh3Br, ТГФ; b) LAH, ТГФ; c) 80% AcOH; d) MePPh3Br, KOtBu, ТГФ; e) 80% AcOH.
В общих чертах, олефинирование с использованием Me2NCH2CH2PPh3Br и KOtBu в ТГФ дает соединение 179. Восстановление литийалюмогидридом удаляет ацильную группу, что приводит к образованию соединения 180. Обработка 80% уксусной кислотой удаляет группу циклического кеталя, что дает соединение 181. Олефинирование с использованием MePPh3Br и KOtBu в ТГФ дает соединение 182. Обработка 80% уксусной кислотой приводит к образованию солевого соединения 183.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 179
Смесь KOtBu (101 мг, 0,9 ммоль) и (2-диметиламиноэтил)трифенилфосфонийбромида (373 мг, 0,9 ммоль) в ТГФ (10 мл) перемешивают при температуре окружающей среды в течение 1 часа 20 мин. Добавляют раствор соединения 95 (154 мг, 0,3 ммоль) в ТГФ (5 мл), и смесь перемешивают при температуре окружающей среды в течение ночи. Добавляют насыщенный NH4Cl (1 мл), и смесь разбавляют с помощью EtOAc (100 мл), промывают насыщенным NaHCO3, насыщенным раствором соли, сушат и концентрируют. Сырой продукт очищают колоночной хроматографией (смесь EtOAc/MeOH, 9:1), получая соединение 179 (118 мг, 69%).
Синтез соединения 180
К перемешиваемому раствору соединения 179 (118 мг, 0,21 ммоль) в ТГФ (10,5 мл) при 0°C добавляют по каплям 1M LAH в ТГФ (0,63 мл, 0,63 ммоль). После 30 мин при 0°C, смесь перемешивают при температуре окружающей среды в течение 3 часов. Смесь вновь охлаждают до 0°C и добавляют порциями твердый Na2SO4·10H2O (203 мг, 0,63 ммоль). После 5 мин при 0°C смесь перемешивают при температуре окружающей среды в течение 45 мин и затем фильтруют через целит, и промывают EtOAc. Фильтрат концентрируют, и полученное таким образом сырое соединение 180 используют на следующей стадии без дополнительной очистки.
Синтез соединения 181
Раствор полученного ранее сырого соединения 180 в 80% HOAc (5 мл) перемешивают при 40°C в течение 7 часов 20 мин. Растворители удаляют методом ротационного выпаривания и остаток очищают колоночной хроматографией (смесь EtOAc/MeOH/вода/Et3N, 7:2:0,5:0,5), получая соединение 181 (73 мг, 96% в расчете на соединение 179).
Синтез соединения 182
Смесь Ph3PMeBr (357 мг, 1,0 ммоль) и KOtBu (112 мг, 1,0 ммоль) в ТГФ (5 мл) перемешивают при температуре окружающей среды в течение 1 часа 20 мин. Добавляют раствор соединения 181 (73 мг, 0,2 ммоль) в ТГФ (3 мл), и смесь перемешивают при температуре окружающей среды в течение ночи. Реакцию гасят насыщенным NH4Cl (0,5 мл), и смесь разбавляют с помощью EtOAc (150 мл), промывают насыщенным NaHCO3, насыщенным раствором соли, сушат и концентрируют. Остаток очищают колоночной хроматографией (смесь EtOAc/MeOH/вода/Et3N, 7:2:0,5:0,5, затем EtOAc/MeOH/Et3N, 7,5:2:0,5), получая соединение 182 (57 мг, 79%).
Синтез соединения 183
Раствор соединения 182 (57 мг, 0,16 ммоль) в 80% HOAc (1 мл) перемешивают при 40°C в течение нескольких минут и затем растворители удаляют методом ротационного выпаривания и остаток сушат в вакууме. Продукт растворяют в небольшом количестве MeOH и обрабатывают небольшим количеством диэтилового эфира. Соль отделяют осаждением и сушат в вакууме, получая соединение 183 (68 мг, колич.) в виде светлого порошка. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 362,09; C23H40NО2.
Синтез соединения 184
Используя методики, описанные для синтеза соединения 183, за исключением олефинирования (4-хлорбензил)трифенилфосфонийхлоридом, получают соединение 184 (34 мг) с выходом 51%, исходя из соединения 95. Другие значительные исключения состоят в использовании HCl в MeOH в целях воздействия на стадию десилилирование/декетализация (при получении промежуточного соединения, аналогичного соединению 181) и включении последующей стадии гидрирования по двойной связи. Промежуточное соединение, аналогичное соединению 181, обрабатывают каталитическим количеством 10% Pd на угле в ТГФ и MeOH в атмосфере H2. Катализатор отделяют фильтрованием, и фильтрат концентрируют. Сырое промежуточное соединение обрабатывают 80% HOAc, получая ацетатную соль соединения 184: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAс в смеси 3:7 воды и MeCN) 434,68; C26H41ClNO2.
Синтез соединения 185
Стадия 1: синтез (3-пиридилметил)трифенилфосфонийхлорида
К перемешиваемому раствору 3-(хлорметил)пиридингидрохлорида (5,17 г, 31,5 ммоль) в воде (8 мл) добавляют порциями K2CO3 (4,34 г, 31,5 ммоль). Полученную смесь трижды экстрагируют диэтиловым эфиром. Экстракты объединяют и дважды промывают насыщенным раствором соли, сушат и концентрируют. Остаток (3,25 г, 25,5 ммоль) растворяют в ксилоле (30 мл) и добавляют Ph3P (6,70 г, 25,5 ммоль). Смесь нагревают до 133-134°C в течение ночи и затем охлаждают до температуры окружающей среды. Твердый продукт фильтруют, промывают толуолом и сушат в вакууме, получая (3-пиридилметил)трифенилфосфонийхлорид (5,86 г, 48%) в виде розоватого твердого вещества.
Стадия 2: синтез соединения 185
Используя методику, описанную выше для синтеза соединения 184, за исключением замены на (3-пиридилметил)трифенилфосфонийхлорид, соединение 185 (19 мг) получают с выходом 20%, исходя из соединения 95. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 водя и MeCN) 384,15; C25H38NO2.
ПРИМЕР 19
Соединение 189, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 19. Любое количество соединений, родственных соединению 189, может быть получено с применением подобной методики. Исходное соединение 93 может быть получено согласно методикам, описанным выше в примере 10.
Реакционная схема 19

В общих чертах, каталитическое гидрирование двойной связи дает соединение 186. Восстановление литийалюмогидридом удаляет ацильную группу, давая соединение 187. Обработка 80% уксусной кислотой удаляет как TBS-группу, так и группу циклического кеталя, давая соединение 188. Олефинирование с использованием MePPh3Br и KOtBu в ТГФ дает соединение 189.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 186
Смесь соединения 93 (98 мг, 0,19 ммоль), 10% Pd/C (10 мг) в EtOH (4 мл) перемешивают в атмосфере H2 (1 атм) в течение ночи. Катализатор удаляют фильтрованием, и фильтрат концентрируют. Сырое соединение 186 (98 мг) используют на следующей стадии без дополнительной очистки.
Синтез соединения 187
К перемешиваемому раствору соединения 186 (98 мг, 0,19 ммоль) в ТГФ (9 мл) при 0°C добавляют по каплям 1M LAH в ТГФ (0,86 мл, 0,86 ммоль). После 5 мин при 0°C смесь перемешивают при температуре окружающей среды в течение 6 часов. Смесь вновь охлаждают до 0°C и добавляют порциями Na2SO4·10H2O (275 мг, 0,86 ммоль). После 5 мин при 0°C смесь перемешивают при температуре окружающей среды в течение 1 часа и затем фильтруют через целит. Фильтрат концентрируют, и сырой продукт очищают колоночной хроматографией (смесь гексан/EtOAc, 1:1), получая соединение 187.
Синтез соединения 188
Раствор полученного ранее соединения 187 в 80% HOAc (5 мл) перемешивают при 40°C в течение 7,5 часов. Растворители удаляют методом ротационного выпаривания, и остаток очищают колоночной хроматографией (EtOAc/гексан, 8:2, затем 9:1), получая соединение 188 (35 мг, 59% в расчете на соединение 186).
Синтез соединения 189
Смесь Ph3PMeBr (196 мг, 0,55 ммоль) и KOtBu (62 мг, 0,54 ммоль) в ТГФ (5 мл) перемешивают при температуре окружающей среды в течение 1,5 часов. Добавляют раствор соединения 188 (35 мг, 0,11 ммоль) в ТГФ (2 мл), и смесь перемешивают при температуре окружающей среды в течение ночи. Реакцию гасят насыщенным NH4Cl (1 мл), и смесь разбавляют с помощью EtOAc (150 мл), промывают насыщенным раствором соли, сушат и концентрируют. Остаток очищают колоночной хроматографией (смесь EtOAc/гексан, 7:3), получая соединение 189 (37 мг, колич.). ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 324,74; C20H38NO2.
ПРИМЕР 20
Соединение 192, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 20. Любое количество соединений, родственных соединению 192, может быть получено с применением подобной методики.
Реакционная схема 20

В общих чертах, катализируемое палладием сочетание олефина 93 с арилгалогенидом 4-BrC6H4OEt дает соединение 190. Обработка 80% уксусной кислотой удаляет как TBS-группу, так и группу циклического кеталя, давая соединение 191. Олефинирование с использованием MePPh3Br и KOtBu в ТГФ дает соединение 192.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 190
Смесь соединения 93 (100 мг, 0,2 ммоль), 4-бромфенетола (0,04 мл, 0,28 ммоль), три(ортотолил)фосфина (12 мг, 0,04 ммоль), Pd(OAc)2 (2,3 мг, 0,01 ммоль), Et3N (0,06 мл) в ацетонитриле (2 мл) нагревают до 80°C в течение ночи. Растворители удаляют и остаток очищают колоночной хроматографией (смесь гексан/EtOAc, 9:1, затем 85:15), получая соединение 190 (61 мг, 49%).
Синтез соединения 191
Раствор соединения 190 в 80% HOAc (5 мл) перемешивают при 40°C в течение 7,5 часов. Растворители удаляют методом ротационного выпаривания, и остаток очищают колоночной хроматографией (EtOAc/гексан, 8:2), получая соединение 191 (27 мг, 60%).
Синтез соединения 192
Смесь Ph3PMeBr (114 мг, 0,32 ммоль) и KOtBu (36 мг, 0,32 ммоль) в ТГФ (3 мл) перемешивают при температуре окружающей среды в течение 1,5 часов. Добавляют раствор соединения 191 (27 мг, 0,064 ммоль) в ТГФ (1 мл) и смесь перемешивают при температуре окружающей среды в течение ночи. Реакцию гасят насыщенным NH4Cl (1 мл) и смесь разбавляют с помощью EtOAc (150 мл), промывают насыщенным раствором соли, сушат и концентрируют. Остаток очищают колоночной хроматографией (смесь EtOAc/гексан, 1:1), получая соединение 192 (13 мг, 43%). ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAс в 3:7 воды и MeCN) 484,69; C30H46NО4.
ПРИМЕР 21
Соединения 195-201, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 21. Любое количество соединений, родственных соединениям 195-201, может быть получено с применением подобной методики. Исходное соединение 85 может быть получено согласно методикам, приведенным выше в примере 9.
Реакционная схема 21

В общих чертах, катализируемое TPAP окисление свободного спирта дает соединение 193. Олефинирование с использованием (2-пиридилметил)трифенилфосфонийхлорида и KOtBu в ТГФ дает соединение 194. Восстановление литийалюмогидридом удаляет ацильные группы, что дает соединение 195.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 193
К раствору соединения 85 (11,6 г, 28,4 ммоль) в CH2Cl2 (100 мл) при 0°C добавляют TPAP (1,50 г, 4,26 ммоль) и NMO (9,98 г, 85,2 ммоль). Смесь перемешивают при 0°C в течение 10 минут, затем при температуре окружающей среды в течение 3 часов. Смесь концентрируют досуха, и остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 3:2, 1:1; EtOAc), получая соединение 193 (8,61 г, 75%) в виде белого твердого вещества.
Синтез соединения 194
Стадия 1. Синтез (2-пиридилметил)трифенилфосфонийхлорида
К перемешиваемому раствору 2-(хлорметил)пиридингидрохлорида (8,0 г, 48,8 ммоль) в воде (20 мл) добавляют порциями K2CO3 (6,74 г, 48,7 ммоль). Полученную смесь экстрагируют четыре раза диэтиловым эфиром. Экстракты объединяют и промывают дважды насыщенным раствором соли, сушат и концентрируют. Остаток (5,78 г, 45,3 ммоль) растворяют в 1,4-диоксане (19 мл) и добавляют Ph3P (11,89 г, 45,3 ммоль). Смесь нагревают до 110°C в течение ночи и затем охлаждают до температуры окружающей среды. Твердый продукт фильтруют, промывают диэтиловым эфиром и сушат в вакууме, получая (2-пиридилметил)трифенилфосфонийхлорид (15,78 г, 83%) в виде светлого твердого вещества.
Стадия 2. Синтез соединения 194
Смесь KOtBu (132 мг, 1,2 ммоль) и (2-пиридилметил)трифенилфосфонийхлорида (460 мг, 1,2 ммоль) в ТГФ (15 мл) перемешивают при температуре окружающей среды в течение 1,5 часов. Добавляют раствор соединения 193 (195 мг, 0,48 ммоль) в ТГФ (5 мл) и смесь перемешивают при температуре окружающей среды в течение ночи. Добавляют насыщенный NH4Cl (1 мл) и смесь разбавляют с помощью EtOAc (150 мл), промывают насыщенным раствором соли, сушат и концентрируют. Сырой продукт очищают колоночной хроматографией (смесь EtOAc/гексан, 1:1), получая соединение 194 (207 мг, 90%).
Синтез соединения 195
К перемешиваемому раствору соединения 194 (207 мг, 0,43 ммоль) в ТГФ (15 мл) при 0°C добавляют по каплям 1M LAH в ТГФ (1,9 мл, 1,9 ммоль). После 5 мин при 0°C смесь перемешивают при температуре окружающей среды в течение 6 часов. Реакционную смесь вновь охлаждают до 0°C и добавляют порциями Na2SO4·10H2O
(623 мг, 1,9 ммоль). После 5 мин при 0°C смесь перемешивают при температуре окружающей среды в течение 1 часа и затем фильтруют через целит и промывают EtOAc. Фильтрат и промывные воды объединяют и концентрируют. Остаток очищают колоночной хроматографией (смесь EtOAc/MeOH, 95:5), получая соединение 195 (135 мг, 79%): ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 396,43; C26H38NO2.
Синтез соединения 196
Используя методики, описанные для синтеза соединения 195, за исключением олефинирования (3-пиридилметил)трифенилфосфонийхлоридом, получают соединение 196 (90 мг) с выходом 61%, исходя из соединения 193: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAC в смеси 3:7 воды и MeCN) 396,17; C26H38NO2.
Синтез соединения 197
Используя методики, описанные для синтеза соединения 195, за исключением олефинирования гексилтрифенилфосфонийбромидом, получают соединение 197 (Z-изомер, 124 мг) с выходом 85%, исходя из соединения 193: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 405,86; C26H48NO2.
Синтез соединений 198 и 201
Используя методики, описанные для синтеза соединения 195, за исключением олефинирования (3-бензилоксипропил)трифенилфосфонийбромидом, соединение 198 (Z-изомер, 114 мг, 68%) и соединение 201, продукт дебензилирования (Z-изомер, 10 мг, 7%), получают, исходя из соединения 193. Соединение 198: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 452,57; C30H44O3. Соединение 201: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 363,15; C23H39O3.
Синтез соединения 199
Используя методики, описанные для синтеза соединения 195, за исключением олефинирования (2-диметиламиноэтил)трифенилфосфонийбромидом и получения соли с помощью уксусной кислоты, соединение 199 (Z-изомер, 93 мг) получают с выходом 57%, исходя из соединения 193: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 376,06; C24H42NO2.
Синтез соединения 200
Используя методики, описанные для синтеза соединения 195, за исключением олефинирования (4-хлорбензил)трифенилфосфонийхлоридом, соединение 200 (118 мг) получают с выходом 74%, исходя из соединения 193.
ПРИМЕР 22
Соединение 203, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 22. Любое количество соединений, родственных соединению 203, может быть получено с применением подобной методики. Исходное соединение 193 может быть получено согласно методикам, приведенным выше в примере 21.
Реакционная схема 22
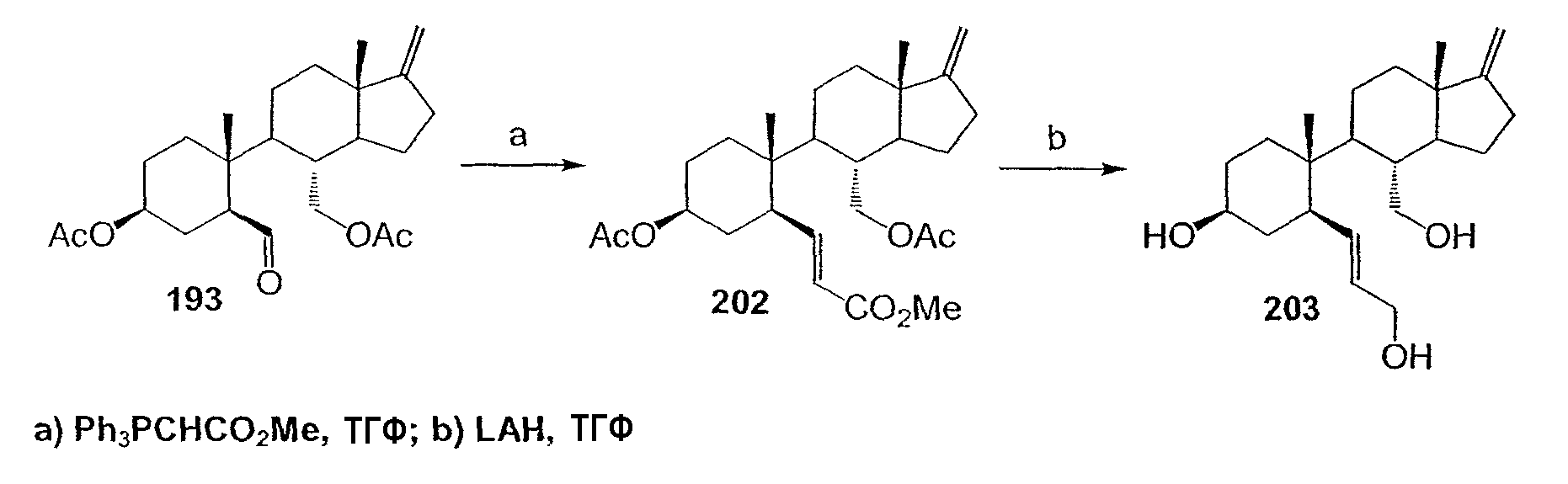
В общих чертах, олефинирование с использованием метил(трифенилфосфоранилиден)ацетата в ТГФ дает соединение 202. Восстановление литийалюмогидридом сложноэфирных групп дает соединение 203.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 202
Смесь соединения 193 (300 мг, 0,74 ммоль) и метил(трифенилфосфоранилиден)ацетата (742 мг, 2,2 ммоль) в ТГФ (30 мл) перемешивают при 67°C в течение ночи и затем при 80°C в течение одного дня. Растворитель удаляют и остаток очищают колоночной хроматографией (смесь гексан/EtOAc, 8:2), получая соединение 202 (328 мг, 96%).
Синтез соединения 203
К перемешиваемому раствору соединения 202 (179 мг, 0,39 ммоль) в ТГФ (15 мл) при 0°C добавляют по каплям 1M LAH в ТГФ (2,2 мл, 2,2 ммоль). После 5 мин при 0°C, смесь перемешивают при температуре окружающей среды в течение 6 часов 10 мин. Реакционную смесь вновь охлаждают до 0°C и добавляют порциями Na2SO4·10H2O (715 мг, 2,2 ммоль). После 5 мин при 0°C смесь перемешивают при температуре окружающей среды в течение 1 часа и затем фильтруют через целит и промывают EtOAc. Фильтрат и промывные воды объединяют и концентрируют. Остаток очищают колоночной хроматографией (смесь EtOAc/MeOH, 95:5), получая соединение 203 (66 мг, 49%): ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 331,06; C22H35O2.
ПРИМЕР 23
Соединения 210-212 могут быть получены согласно следующей реакционной схеме 23. Любое количество соединений, родственных соединениям 210-212, может быть получено с применением подобной методики. Исходное соединение 90 может быть получено согласно методикам, приведенным выше в примере 10.
Реакционная схема 23

a) NMO, TPAP, CH2Cl2; b) (4-хлорбензил)трифенилфосфонийхлорид, KOtBu, ТГФ; с) LiAlH4, ТГФ; d) 80% AcOH, MeOH, ТГФ, 40°C; e) MePPh3Br, KOtBu, ТГФ.
В общих чертах, катализируемое TPAP окисление свободного спирта дает соединение 205. Олефинирование с использованием (4-хлорбензил)трифенилфосфонийхлорида и KOtBu в ТГФ дает соединение 206 и Е-изомерное соединение 207. Восстановление литийалюмогидридом удаляет ацильную группу, что дает соединение 208. Обработка 80% уксусной кислотой удаляет TBS-группу и группу циклического кеталя, что дает соединение 209. Олефинирование с использованием MePPh3Br и KOtBu в ТГФ дает соединение 210.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 205
К раствору соединения 204 (8,60 г, 16,4 ммоль) в CH2Cl2 (100 мл) при 0°C добавляют TPAP (0,86 г, 2,5 ммоль) и NMO (5,76 г, 49,2 ммоль). Смесь перемешивают при 0°C в течение 5 минут, затем при температуре окружающей среды. Спустя 3 часа добавляют еще TPAP (0,29 г, 0,83 ммоль) и NMO (1,92 г, 16,4 ммоль) и продолжают перемешивание. После суммарного реакционного времени 5,5 часов смесь концентрируют досуха. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 49:1, 19:1, 9:1, 4:1), получая соединение 205 (5,13 г, 60%) в виде белого твердого вещества.
Синтез соединений 206 и 207
Смесь KOtBu (0,136, 1,15 ммоль) и (4-хлорбензил)трифенилфосфонийхлорида (0,496 г, 1,15 ммоль) в ТГФ (10 мл) перемешивают при температуре окружающей среды в течение 1 часа, затем добавляют раствор соединения 205 (0,20 г, 0,38 ммоль) в ТГФ (5 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи, затем гасят насыщенным раствором NH4Cl (1 мл), разбавляют с помощью EtOAc (150 мл), промывают насыщенным раствором соли (2×25 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc), получая соединение 206 (0,093 г, 39%) в виде бесцветной стеклянной массы и соединение 207 (0,126 г, 53%) в виде бесцветной стеклянной массы.
Синтез соединения 208
К раствору соединения 206 (0,15 ммоль) в ТГФ (10 мл) добавляют LiAlH4 (0,59 мл 1M раствора в ТГФ, 0,59 ммоль). Смесь перемешивают при температуре окружающей среды в течение ночи, затем гасят Na2SO4·10H2O и перемешивают в течение 30 минут. Смесь фильтруют, споласкивая EtOAc, и концентрируют досуха, получая сырое соединение 208 (0,089 г, бесцветная стеклянная масса), которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 209
Сырое соединение 208 (0,15 ммоль) растворяют в 80% уксусной кислоте (10 мл) с ТГФ (1 мл) и MeOH (1 мл) и перемешивают при 40°C в течение 4,5 часов, затем при температуре окружающей среды в течение ночи. Смесь концентрируют, получая сырое соединение 209 (0,074 г) в виде бесцветной стеклянной массы, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 210
Смесь KOtBu (0,122 г, 1,03 ммоль) и MePPh3Br (0,368 г, 1,03 ммоль) в ТГФ (5 мл) перемешивают при температуре окружающей среды в течение 1 часа, затем добавляют раствор соединения 209 (0,074 г, 0,17 ммоль) в ТГФ (5 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи, затем гасят насыщенным раствором NH4Cl (1 мл), разбавляют с помощью EtOAc (100 мл), промывают насыщенным раствором соли (2×20 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 3:1, 1:1), получая соединение 210 (0,035 г, 21% в расчете на соединение 205) в виде белого твердого вещества, после концентрации из CH2Cl2. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мM NH4OAc в смеси 3:7 воды и MeCN) 411,14; C27H36ClO.
Синтез соединения 211
Используя методику, описанную для синтеза соединения 208, соединение 207 (0,126 г, 0,200 ммоль) подвергают взаимодействию с LiAlH4 (0,80 мл 1M раствора в ТГФ, 0,80 ммоль), получая спиртовое промежуточное (0,121 г, бесцветная стеклянная масса). Используя методику, описанную для синтеза соединения 209, спиртовое промежуточное соединение (0,20 ммоль) превращают в кетоновое промежуточное соединение (0,104 г, бесцветная стеклянная масса). Используя методику, описанную для синтеза соединения 210, за тем исключением, что применяют другую систему растворителей при хроматографии на силикагеле (смесь гексан/EtOAc, 4:1, 7:3, 3:2, 1:1), кетоновое промежуточное соединение (0,20 ммоль) превращают в алкен. Концентрация из CH2Cl2 дает соединение 211 (0,058 г, 36% в расчете на соединение 205) в виде светло-желтого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 411,09; C27H36ClO.
Синтез соединения 212
Используя методику, описанную для синтеза соединения 206, за тем исключением, что применяют другую систему растворителей при хроматографии на силикагеле (смесь EtOAc/MeOH, 9:1; EtOAc/MeOH/Et3N, 9:0,75:0,25), соединение 205 (0,20 г, 0,38 ммоль) подвергают взаимодействию с (2-диметиламиноэтил)трифенилфосфонийбромидом (0,485 г, 1,15 ммоль), получая аминовое промежуточное соединение (0,204 г, 93%, желтое масло). Используя методику, описанную для синтеза соединения 208, за тем исключением, что спустя 2,5 часа добавляют еще 0,76 мл раствора LiAlH4 (1M в ТГФ, 0,76 ммоль) и суммарное время реакции составляет 5,5 часов, аминовое промежуточное соединение (0,35 ммоль) подвергают взаимодействию с LiAlH4 (0,76 мл 1M раствора в ТГФ, 0,76 ммоль), получая спиртовое промежуточное соединение (0,203 г, бесцветная стеклянная масса). Используя методику, описанную для синтеза соединения 209, за тем исключением, что ТГФ и MeOH не добавляют и реакционную смесь не нагревают, спиртовое промежуточное соединение (0,35 ммоль) превращают в кетоновое промежуточное соединение в виде соли с уксусной кислотой (0,189 г, бесцветная стеклянная масса). Используя методику, описанную для синтеза соединения 210, за тем исключением, что используют 0,331 г (2,80 ммоль) KOtBu, 1,00 г (2,80 ммоль) MePPh3Br и 15 мл ТГФ, и после гашения реакционную смесь концентрируют, затем очищая хроматографией на силикагеле (смесь EtOAc/MeOH, 9:1; EtOAc/MeOH/Et3N, 9:0,9:0,1, 9:0,75:0,25), кетоновое промежуточное соединение (0,35 ммоль) превращают в алкен. Смесь алкена, 80% AcOH (1 мл) и MeOH (5 мл) концентрируют методом ротационного выпаривания. Осаждение из Et2O дает соединение 212 (0,072 г, 43% в расчете на соединение 205) в виде белого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 375,98; C24H42NO2.
ПРИМЕР 24
Соединения 219-222, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 24. Любое количество соединений, родственных соединениям 219-222, может быть получено с применением подобной методики. Исходное соединение 35 может быть получено согласно методикам, приведенным выше в примере 3.
Реакционная схема 24

а) Ас2О, DMAP, пиридин; b) HCl, H2O, ТГФ, 60-65°C; с) MePPh3Br, KOtBu, ТГФ; d) TBAF, ТГФ, 70°C; e) NMO, TPAP, CH2Cl2; f) (2-диметиламиноэтил)трифенилфосфонийбромид, KOtBu, ТГФ; g) LiAlH4, ТГФ; h) 80% AcOH, MeOH.
В общих чертах, взаимодействие с уксусным ангидридом и DMAP в пиридине дает соединение 213. Обработка HCl и водой в ТГФ удаляет группу циклического кеталя, что дает соединение 214. Олефинирование с использованием MePPh3Br и KOtBu в ТГФ дает соединение 215. Тетрабутиламмонийфторид удаляет трет-бутилдифенилсилильную группу, что приводит к образованию соединения 216. Катализируемое TPAP окисление свободного спирта дает соединение 217. Олефинирование с использованием (2-диметиламиноэтил)трифенилфосфонийбромида и KOtBu в ТГФ дает соединение 218. Восстановление литийалюмогидридом удаляет ацильные группы, что дает соединение 219. Обработка 80% уксусной кислотой приводит к образованию солевого соединения 220.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 213
К раствору соединения 35 (67 ммоль) в пиридине (150 мл) при 0°C добавляют DMAP (1,0 г, 8,2 ммоль) и уксусный ангидрид (12,7 мл, 134 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 2 часов. Реакцию гасят водой и реакционную смесь разбавляют с помощью EtOAc, затем концентрируют досуха, получая сырое соединение 213, которое используют для последующего взаимодействия без дополнительной очистки.
Синтез соединения 214
Смесь соединения 213 (67 ммоль), HCl (20 мл), воды (50 мл) и ТГФ (150 мл) перемешивают при 60-65°C в течение 2 часов, затем охлаждают до температуры окружающей среды. С помощью K2CO3 величину pH смеси доводят до pH=7,0-8,0, затем добавляют воду и CH2Cl2. Смесь сушат над безводным MgSO4 и концентрируют. Осаждение из EtOAc дает сырую смесь, содержащую соединение 214 (белое твердое вещество), которую используют на следующей стадии без дополнительной очистки.
Синтез соединения 215
Смесь KOtBu (9,43 г, 83,9 ммоль) и MePPh3Br (30,0 г, 83,9 ммоль) в ТГФ (200 мл) перемешивают при температуре окружающей среды, затем добавляют сырое соединение 214 (67 ммоль) и смесь перемешивают при температуре окружающей среды еще 2 часа. Реакцию гасят охлажденной водой и реакционную смесь экстрагируют EtOAc. Органическую часть концентрируют досуха, затем остаток обрабатывают смесью гексан/EtOAc (4:1), фильтруют, и фильтрат концентрируют досуха. Остаток растворяют в пиридине и добавляют уксусный ангидрид. Смесь перемешивают при температуре окружающей среды в течение 2 часов, затем гасят водой и экстрагируют EtOAc. Органическую часть концентрируют досуха, получая сырое соединение 215, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 216
Смесь сырого соединения 215 (67 ммоль) и TBAF (30 мл 1M раствора в ТГФ, 30 ммоль) в ТГФ (80 мл) перемешивают при температуре окружающей среды в течение 2 часов, затем при 70°C в течение 1 часа. Смесь концентрируют, и остаток очищают хроматографией на силикагеле, получая соединение 216 (6,12 г, 22% в расчете на соединение 35) в виде белого твердого вещества.
Синтез соединения 217
К раствору соединения 216 (6,0 г, 15 ммоль) в CH2Cl2 (50 мл) добавляют TPAP (0,052 г, 0,15 ммоль) и NMO (4,4 г, 38 ммоль). Смесь перемешивают при температуре окружающей среды. Спустя 2 часа добавляют дополнительное количество TPAP (0,052 г, 0,15 ммоль) и продолжают перемешивание. После 3 часов суммарного реакционного времени смесь концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 9:1), получая соединение 217 (2,9 г, 48%) в виде белого твердого вещества.
Синтез соединения 218
Смесь KOtBu (0,157, 1,33 ммоль) и (2-диметиламиноэтил)трифенилфосфонийбромида (0,563 г, 1,33 ммоль) в ТГФ (10 мл) перемешивают при температуре окружающей среды в течение 1 часа, затем добавляют раствор соединения 217 (0,20 г, 0,49 ммоль) в ТГФ (5 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи, затем гасят насыщенным раствором NH4Cl (1 мл), разбавляют с помощью EtOAc (150 мл), промывают насыщенным раствором соли (2×25 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь EtOAc/MeOH, 9:1; EtOAc/MeOH/Et3N, 9:0,75:0,25), получая соединение 218 (0,197, 88%) в виде белой пены.
Синтез соединения 219
К раствору соединения 218 (0,197 г, 0,428 ммоль) в ТГФ (10 мл) добавляют LiAlH4 (0,98 мл 1M раствора в ТГФ, 0,98 ммоль). Смесь перемешивают при температуре окружающей среды в течение 4 часов, затем гасят Na2SO4·10H2O и перемешивают в течение 30 минут. Смесь фильтруют, споласкивая EtOAc, и концентрируют досуха. Остаток очищают хроматографией на силикагеле (смесь EtОAc/MeOH, 9:1; смесь EtOAc/MeOH/Et3N, 9:0,75:0,25, 9:0,5:0,5), получая соединение 219 в виде белого твердого вещества, которое используют для последующего взаимодействия.
Синтез соединения 220
Смесь соединения 219, 80% AcOH (1 мл) и MeOH (5 мл) концентрируют методом ротационного выпаривания. Концентрация из CH2Cl2 дает соединение 220 (0,154 г, 72% в расчете на соединение 217) в виде белой пены: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 375,96; C24H42NO2.
Синтез соединений 221 и 222
Используя методику, описанную для синтеза соединения 218, за тем исключением, что другую систему растворителей используют при хроматографии на силикагеле (смесь гексан/EtOAc, 3:1, 3:2), соединение 217 (0,20 г, 0,49 ммоль) подвергают взаимодействию с (3-пиридилметил)трифенилфосфонийхлоридом (0,519 г, 1,33 ммоль), получая смесь алкеновых промежуточных соединений (0,195 г, бесцветная стеклянная масса). Используя методику, описанную для синтеза соединения 219, за тем исключением, что реакционное время составляет 3 часа и другие системы растворителей используют при хроматографии на силикагеле (смесь EtOAc/MeOH и
CH2Cl2/ацетон), смесь алкеновых промежуточных соединений (0,41 ммоль) подвергают взаимодействию с LiAlH4 (0,81 мл 1M раствора в ТГФ, 0,81 ммоль), получая соединение 221 (Z-изомер) (0,037 г, 19% в расчете на соединение 217) в виде белой пены, после концентрации из CH2Cl2, и соединение 222 (E-изомер) (0,047 г, 24% в расчете на соединение 217) в виде белого твердого вещества, после осаждения из Et2O. Соединение 221: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 395,98; C26H38NO2. Соединение 222: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мM NH4OAc в смеси 3:7 воды и MeCN) 395,96; C26H38NO2.
ПРИМЕР 25
Соединение 225, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 25. Любое количество соединений, родственных соединению 225, может быть получено с применением подобной методики. Исходное соединение 76 может быть получено согласно методикам, представленным выше реакционной схемой 8.
Реакционная схема 25

В общих чертах, взаимодействие соединения 76 с трифенилфосфином и водой в ТГФ восстанавливает азидную группу, что дает соединение 223. Аминогруппу превращают в сульфонамидное соединение 224, используя MsCl и триэтиламин в CH2Cl2. Обработка карбонатом калия в метаноле и воде дает соединение 225.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 223
Раствор соединения 76 (6,00 г, 13,9 ммоль), PPh3 (5,85 г, 22,3 ммоль), воды (3,72 мл, 206 ммоль) и ТГФ (100 мл) нагревают в течение ночи до 40°C. Реакционную смесь концентрируют, и остаток очищают хроматографией на силикагеле (смесь EtOAc/MeOH/Et3N 90:10, затем 90:10:3), получая соединение 223 (4,59 г, 81%) в виде белой пены.
Синтез соединения 224
Раствор соединения 223 (250 мг, 0,616 ммоль), MsCl (72 мкл, 0,92 ммоль), Et3N (258 мкл, 1,84 ммоль) и CH2Cl2 перемешивают при температуре окружающей среды в атмосфере аргона в течение 1,5 часов. Реакцию гасят насыщенным раствором NaHCO3 (3 мл) и водой (2 мл). Раствор дополнительно разбавляют водой (5 мл) и экстрагируют 100 мл EtOAc. EtOAc-раствор промывают водой и насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc 3:1, затем 1:1), получая соединение 224 (310 мг, количественно) в виде белой пены.
Синтез соединения 225
Раствор соединения 224 (223 мг, 0,46 ммоль), K2CO3 (255 мг, 1,84 ммоль), воды (3 мл) и метанола (6 мл) нагревают до температуры кипения с обратным холодильником в течение 2 часов. Реакционную смесь концентрируют, затем растворяют в воде и CH2Cl2 и экстрагируют CH2Cl2 (240 мл). CH2Cl2-раствор промывают водой и насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют.
Остаток очищают хроматографией на силикагеле (смесь CH2Cl2/MeOH 100:0, затем 19:1, затем 9:1). Остаток от очищенных фракций концентрируют из минимального количества MeOH и ацетонитрила (5 мл), получая соединение 225 (132 мг, 72%) в виде белого порошка: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 381,90; C21H35NO3S, 363,85; C21H33NO2S.
ПРИМЕР 26
Соединение 227, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 26. Любое количество соединений, родственных соединению 227, может быть получено с применением подобной методики. Исходное соединение 77 может быть получено согласно методикам, описанным выше в примере 8.
Реакционная схема 26

В общих чертах, взаимодействие соединения 77 с уксусным ангидридом и DMAP в пиридине приводит к ацилированию гидроксила и аминогрупп, что дает соединение 226. Селективное восстановление ацетатов литийалюмогидридом дает соединение 227.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 226
Раствор соединения 77 (208 мг, 0,647 ммоль), уксусного ангидрида (214 мкл, 2,27 ммоль), DMAP (17 мг) и пиридина (5 мл) перемешивают в течение ночи при температуре окружающей среды. Реакцию гасят насыщенным раствором соли и реакционную смесь экстрагируют EtOAc. EtOAc-раствор промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Остаточный растворитель удаляют совместной перегонкой с толуолом. Остаток очищают хроматографией на силикагеле (EtOAc), получая соединение 226 (235 мг, 81%).
Синтез соединения 227
Раствор LiAlH4 (1,57 мл 1,0M раствора в ТГФ) добавляют к охлажденному льдом раствору соединения 226 (235 мг, 0,525 ммоль) в ТГФ (10 мл). Спустя 10 минут растворение продолжают при температуре окружающей среды в течение еще 2 часов. Реакцию гасят Na2SO4·10H2O. Спустя 1 час добавляют MgSO4 и раствор фильтруют и концентрируют. Полученное кристаллическое твердое вещество порошкуют, последовательно растирая с Et2O, CH2Cl2, EtOAc и MeOH, что дает соединение 227 (128 мг, 67%) в виде белого твердого порошка. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 386,48; C22H37NNaO3.
ПРИМЕР 27
Соединения 229 и 231-233, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 27. Любое количество соединений, родственных соединениям 229 и 231-233, может быть получено с применением подобной методики. Исходное соединение 223 может быть получено согласно методикам, описанным выше в примере 25.
Реакционная схема 27

В общих чертах, взаимодействие аминосоединения, такого как соединение 223, с бензоилхлоридом дает амидное соединение 230. Восстановление амида и ацетатов литийалюмогидридом дает соединение 231. Обработка 80% уксусной кислотой приводит к образованию солевого соединения 232.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 230
Раствор соединения 223 (405 мг, 1,00 ммоль), бензоилхлорида (0,17 мл, 1,46 ммоль), DMAP (15 мг), пиридина (4 мл) и CH2Cl2 (6 мл) перемешивают в течение 2 часов при температуре окружающей среды. Реакционную смесь разбавляют с помощью EtOAc (250 мл) и промывают насыщенным раствором NaHCO3 и насыщенным раствором соли, затем сушат над NaSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь EtOAc/гексан 45:55), получая соединение 230 (490 мг, 96%) в виде бесцветного сиропа.
Синтез соединения 231
Раствор LiAlH4 (6×4,8 мл 1,0M раствора в ТГФ) добавляют за 3 дня к раствору соединения 230 (490 мг, 0,96 ммоль) в ТГФ (20 мл) при нагревании до кипения с обратным холодильником в атмосфере аргона. Реакционную смесь охлаждают льдом и гасят Na2SO4·10H2O. Спустя 20 минут раствор фильтруют и концентрируют. Остаток очищают хроматографией (смесь EtOAc/MeOH 95:5), получая соединение 231 (395 мг, 39%) в виде кристаллического твердого вещества.
Синтез соединения 232
Раствор соединения 231 (150 мг, 0,36 ммоль) и 80% AcOH нагревают до 40°C в течение 10 минут. Раствор концентрируют, получая соединение 232 (162 мг, 94%) в виде белой пены. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 412,16; C27H42NO2.
Синтез соединения 233
Используя методики, описанные для синтеза соединения 232, за исключением замены на циклопропанкарбонилхлорид, соединение 233 (231 мг) получают в виде белого твердого вещества с выходом 67%, исходя из соединения 223: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 376,35; C24H42NO2.
Синтез соединения 229
Используя методики, описанные для синтеза соединения 232, соединение 229 (549 мг) получают в виде стеклообразного твердого вещества с выходом 36%, исходя из соединения 226. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мM NH4OAс в смеси 3:7 воды и MeCN) 350,63; C22H40NO2.
ПРИМЕР 28
Соединения 235-236, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 28. Любое количество соединений, родственных соединениям 235-236, может быть получено с применением подобной методики. Исходное соединение 223 может быть получено согласно методикам, описанным выше в примере 25.
Реакционная схема 28
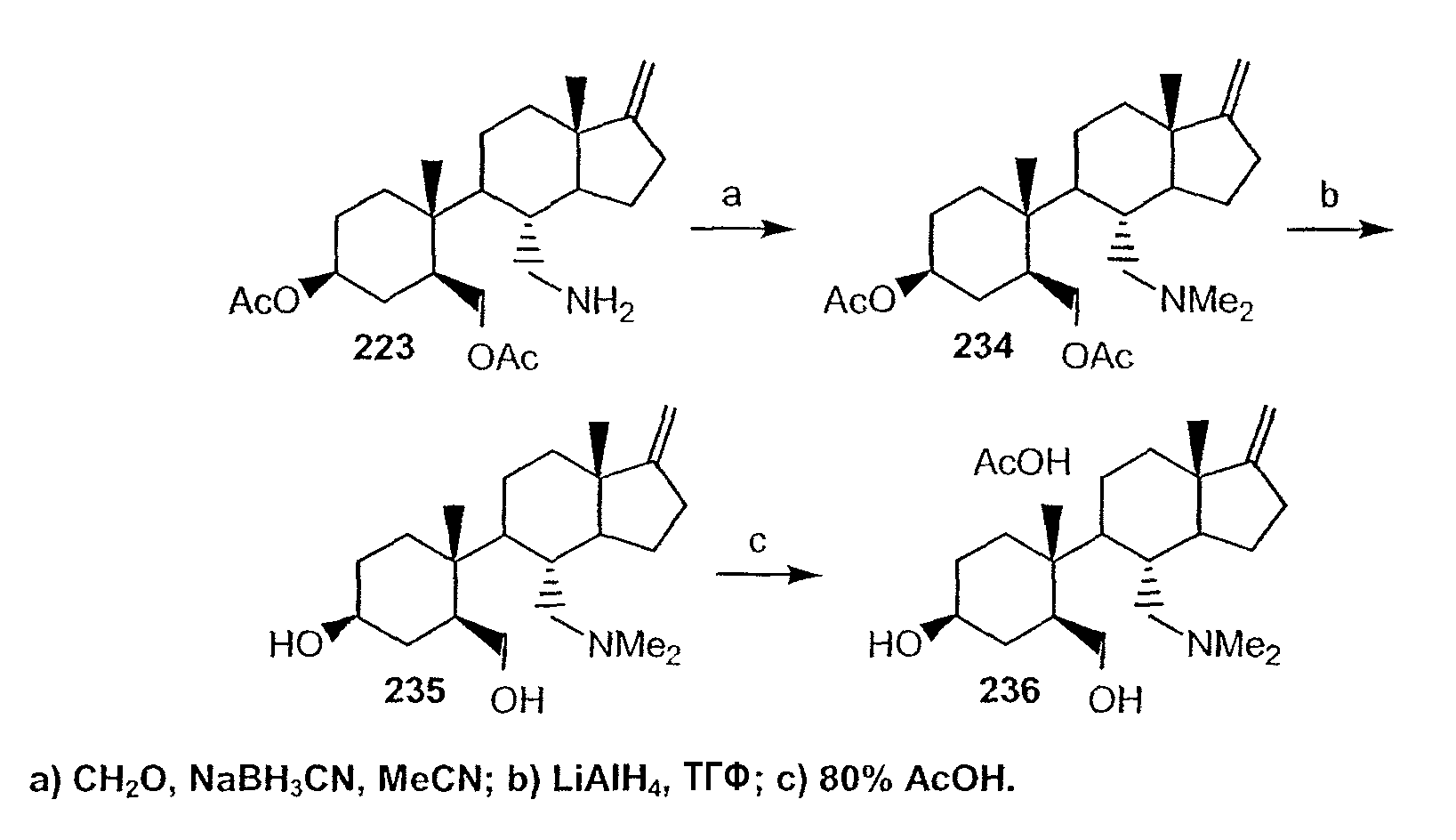
В общих чертах, взаимодействие аминосоединения, такого как соединение 223, с альдегидом, таким как формальдегид, и восстанавливающим агентом, таким как
NaBH3CN, дает третичное аминосоединение, такое как соединение 234. Восстанавливающий агент, такой как литийалюмогидрид, используют для восстановления защищенных сложным эфиром гидроксилов, получая соединение 235. Обработка 80% уксусной кислотой приводит к образованию аммонийацетатного солевого соединения 236.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 234
NaBH3CN (2×25 мг, 0,8 ммоль) добавляют за период 25 минут к имеющему температуру окружающей среды раствору соединения 223 (99 мг, 0,24 ммоль), 37% CH2O в воде (0,1 мл) и ацетонитрила (2 мл). Спустя 15 минут pH раствора доводят до pH 7, добавляя по каплям 80% уксусную кислоту. Спустя 1 час реакционную смесь разбавляют EtOAc (150 мл) и промывают насыщенным раствором NaHCO3 и насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь EtOAc/MeOH 95:5), получая соединение 234 (104 мг, 98%).
Синтез соединения 235
Раствор LiAlH4 (5,5 мл 1,0M раствора в ТГФ) добавляют к охлажденному льдом раствору соединения 234 (492 мг, 1,1 ммоль) в ТГФ (15 мл) в атмосфере аргона. Спустя 25 минут охлаждающую баню убирают и взаимодействие продолжают осуществлять в течение 4 часов при температуре окружающей среды. Реакционную смесь охлаждают льдом и реакцию гасят Na2SO4·10H2O. После 10 минут при температуре окружающей среды, раствор фильтруют, споласкивая с помощью EtOAc, и фильтрат промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь EtOAc/MeOH/H2O 16:3:1), получая соединение 235 (294 мг, 74%) в виде кристаллического твердого вещества.
Синтез соединения 236
Раствор соединения 235 (287 мг, 0,82 ммоль) и 80% AcOH (10 мл) перемешивают при 40°C в течение 10 минут, затем концентрируют. Повторная концентрация из минимального количества метанола в ацетонитриле дает соединение 236 (287 мг, 85%) в виде белого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 350,69; C22H40NO2.
ПРИМЕР 29
Соединения 240-241, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 29. Любое количество соединений, родственных соединениям 240-241, может быть получено с применением подобной методики. Исходное соединение 223 может быть получено согласно методикам, приведенным выше в примере 25.
Реакционная схема 29

В общих чертах, аминосоединение может быть превращено в сульфонамид, такой как путем осуществления взаимодействия соединения 223 с сульфонилхлоридом, таким как 2-нитробензолсульфонилхлорид, что дает соединение 237. Азот сульфонамида в соединении, таком как 237, может затем быть подвергнут алкилированию с помощью электрофила, такого как метилиодид, что дает аминосоединение, такое как 238. Сульфонамид может быть расщеплен путем осуществления взаимодействия с нуклеофилом, таким как анион тиофенолята, что дает соединение 239. Ацетаты могут быть удалены путем основного гидролиза, что дает соединение 240. Обработка 80% уксусной кислотой приводит к образованию аммонийацетатного солевого соединения 241.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 237
2-Нитробензолсульфонилхлорид (194 мг, 0,88 ммоль) добавляют к охлажденному льдом раствору соединения 223 (296 мг, 0,73 ммоль), Et3N (180 мкл, 1,3 ммоль) и CH2Cl2 (5 мл) в атмосфере аргона. Спустя 30 минут охлаждающую баню убирают и взаимодействие продолжают осуществлять в течение 1 часа при температуре окружающей среды. Реакционную смесь разбавляют EtOAc и промывают насыщенным раствором NaHCO3 и насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют, получая соединение 237 (433 мг, 100%) в виде светло-желтого твердого вещества.
Синтез соединения 238
MeI (60 мкл и 2×30 мкл 1,9 ммоль) добавляют за 7 часов к раствору соединения 237 (431 мг, 0,73 ммоль), K2CO3 (232 мг, 1,7 ммоль) и ДМФА (3 мл) в атмосфере аргона. После перемешивания в течение ночи при температуре окружающей среды реакционную смесь разбавляют с помощью EtOAc и промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют, получая сырое соединение 238, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 239
Раствор соединения 238 (сырой продукт, 0,73 ммоль), PhSH (225 мкл, 2,19 ммоль), CsCO3 (714 мг, 2,19 ммоль) и ацетонитрила (6 мл) нагревают до 55°C в атмосфере аргона в течение 1,5 часов. Реакционную смесь при температуре окружающей среды разбавляют с помощью EtOAc и промывают насыщенным раствором соли, затем сушат MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь EtOAc/гексан 1:1, затем EtOAc/MeOH/Et3N 90:10:2), получая соединение 239 (268 мг, 88%) в виде светло-желтого масла.
Синтез соединения 240
Раствор соединения 239 (268 мг, 0,639 ммоль), 10% KOH в воде (1 мл) и MeOH (5 мл) нагревают до 55°C в течение 4 часов. Реакционную смесь при температуре окружающей среды разбавляют с помощью EtOAc (80 мл) и промывают насыщенным раствором соли, затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (смесь EtOAc/MeOH/H2O/NН4OH 80:15:5:1,5, затем 70:20:10:2), получая соединение 240 (182 мг, 85%) в виде белой пены.
Синтез соединения 241
Раствор соединения 240 (182 мг, 0,542 ммоль) и 80% AcOH нагревают до 40°C в течение 15 минут, затем концентрируют. Остаточный растворитель удаляют совместной перегонкой с метанолом, получая соединение 241 (210 мг, 98%) в виде светло-желтой пены. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мM NH4OAc в смеси 3:7 воды и MeCN) 336,08; C21H38NO2.
ПРИМЕР 30
Соединение 242, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 30. Любое количество соединений, родственных соединениям 242, может быть получено с применением подобной методики. Исходное соединение 77 может быть получено согласно методикам, приведенным выше в примере 8.
Реакционная схема 30

а) пиразол-1-карбоксамидингидрохлорид
В общих чертах, взаимодействие аминосоединения, такого как 77, с пиразол-1-карбоксамидингидрохлоридом и диизопропилэтиламином (DIEA) в метаноле дает соединение 242.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 242
Раствор соединения 77 (106 мг, 0,33 ммоль), пиразол-1-карбоксамидингидрохлорида (51 мг, 0,35 ммоль), DIEA (61 мкл, 0,35 ммоль) и MeOH (165 мкл) перемешивают при температуре окружающей среды в атмосфере аргона в течение 3 дней. Суспензию растирают с Et2O, декантируя растворитель, что дает белый порошок.
Затем твердое вещество перекристаллизовывают из 3 мл смеси EtOAc/MeOH/Et2O, получая соединение 242 (64 мг, 48%) в виде белого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 364,06; C21H38N3O2.
ПРИМЕР 31
Соединения 243-250, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 31. Любое количество соединений, родственных соединениям 243-250, может быть получено с применением подобной методики. Исходное соединение 77 может быть получено согласно методикам, приведенным выше в примере 8.
Реакционная схема 31

а) Ме2СНСНО, NaB(OAc)3H, 4Å молекулярные сита, 1,2-дихлорэтан; b) 80% AcOH.
В общих чертах, восстановительное аминирование аминосоединения, такого как соединение 77, с помощью кетона или альдегида, такого как изобутиральдегид, дает амин, такой как соединение 243. Обработка 80% уксусной кислотой дает солевое соединение 244.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 243
К перемешиваемой смеси соединения 77 (100 мг, 0,31 ммоль) в 1,2-дихлорэтане (5 мл) и EtOH (1 мл) добавляют изобутиральдегид (0,14 мл, 1,5 ммоль), 4Å молекулярные сита (100 мг) и NaB(OAc)3H (197 мг, 0,93 ммоль). Смесь перемешивают при температуре окружающей среды в течение трех дней и затем фильтруют через целит и промывают EtOAc. Фильтрат и промывные воды объединяют и концентрируют. Остаток очищают колоночной хроматографией (смесь EtOAc/MeOH, 9:1, затем 8:2), что дает соединение 243 (79 мг, 67%).
Синтез соединения 244
Раствор соединения 243 (79 мг) в 80% HOAc (2 мл) перемешивают при 40°C в течение нескольких и затем концентрируют методом ротационного выпаривания. Остаток несколько раз подвергают совместной перегонке с MeOH и сушат в вакууме. Продукт растворяют в небольшом количестве MeOH и обрабатывают небольшим количеством ацетонитрила. Растворители удаляют и продукт сушат в вакууме, получая соединение 244 (91 мг, 99%): ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 378,21; C24H44NO2.
Синтез соединения 245
Используя методики, описанные для синтеза соединения 244, за исключением замены на 1-метил-4-пиперидон, соединение 245 (183 мг) получают с количественным выходом, исходя из соединения 77: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAс в смеси 3:7 воды и MeCN) 419,21; C26H47N2O2.
Синтез соединения 246
Используя методики, описанные для синтеза соединения 244, за исключением замены на 3-нитробензальдегид, соединение 246 (58 мг) получают с 35% выходом, исходя из соединения 77: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 457,22; C27H41N2O4.
Синтез соединения 247
Используя методики, описанные для синтеза соединения 244, за исключением замены на пиперонал, соединение 247 (161 мг) получают с 99% выходом, исходя из соединение 77: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc
в смеси 3:7 воды и MeCN) 456,12; C28H42NO4.
Синтез соединения 248
Используя методики, описанные для синтеза соединения 244, за исключением замены на пиррол-2-карбоксальдегид, соединение 248 (131 мг) получают с 91% выходом, исходя из соединения 77: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc
в смеси 3:7 воды и MeCN) 401,15; C25H41N2O2.
Синтез соединения 249
Используя методики, описанные для синтеза соединения 244, за исключением замены на 2-фуральдегид, соединение 249 (88 мг) получают с 61% выходом, исходя из соединения 77: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 402,23; C25H40NO3.
Синтез соединения 250
Используя методики, описанные для синтеза соединения 244, за исключением замены на 3-пиридинкарбоксальдегид, соединение 250 (59 мг) получают с 40% выходом, исходя из соединения 77: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 413,22; C26H41N2O2.
ПРИМЕР 32
Соединения 252-261, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 32. Любое количество соединений, родственных соединениям 252-261, может быть получено с применением подобной методики. Исходное соединение 193 может быть получено согласно методикам, приведенным выше в примере 9.
Реакционная схема 32

a) пирролидин, NaB(OAc)3H, 4Å молекулярные сита, 1,2-дихлорэтан; b) LAH, ТГФ; c) 80% AcOH.
В общих чертах, восстановительное аминирование кетонового или альдегидного соединения, такого как соединение 193, с помощью амина, такого как пирролидин, дает амин, такой как соединение 251. Восстановление литийалюмогидридом удаляет ацильные группы, что приводит к образованию соединения 252. Обработка 80% уксусной кислотой дает солевое соединение 253.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 251
К перемешиваемому раствору соединения 193 (150 мг, 0,37 ммоль) в 1,2-дихлорэтане (7,5 мл) добавляют пирролидин (0,18 мл, 2,2 ммоль), 4Å молекулярные сита (150 мг) и NaB(OAc)3H (314 мг, 1,5 ммоль). Смесь перемешивают при температуре окружающей среды в течение трех дней и затем фильтруют через целит и промывают EtOAc. Фильтрат и промывные воды объединяют и концентрируют. Остаток очищают колоночной хроматографией (смесь EtOAc/MeOH/Et3N, 8:2:0,5), получая соединение 251 (155 мг, 91%).
Синтез соединения 252
К перемешиваемому раствору соединения 251 (155 мг, 0,34 ммоль) в ТГФ (15 мл) при 0°C добавляют по каплям 1M LAH в ТГФ (1,7 мл, 1,7 ммоль). После 5 мин при 0°C смесь перемешивают при температуре окружающей среды в течение 5 часов 40 мин. Реакционную смесь вновь охлаждают до 0°C, добавляют порциями твердый Na2SO4.10H2O (536 мг, 1,7 ммоль). После 5 мин при 0°C смесь перемешивают при температуре окружающей среды в течение 1 часа и затем фильтруют через целит и промывают EtOAc. Фильтрат и промывные воды объединяют и концентрируют. Остаток очищают колоночной хроматографией (смесь EtOAc/MeOH/вода/Et3N, 8:1:0,5:0,5), получая соединение 252 (121 мг, 92%).
Синтез соединения 253
Раствор соединения 252 (121 мг) в 80% HOAc (2 мл) перемешивают при 40°C в течение нескольких минут и затем концентрируют методом ротационного выпаривания. Остаток подвергают совместной перегонке с MeOH, несколько раз, и сушат в вакууме. Продукт растворяют в небольшом количестве MeOH и обрабатывают небольшим количеством ацетонитрила. Растворители удаляют и продукт сушат в вакууме, получая соединение 253 (147 мг, колич.): ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 376,24; C24H42NO2.
Синтез соединения 254
Используя методики, описанные для синтеза соединения 253, за исключением замены на этаноламин, соединение 254 (84 мг) получают с 51% выходом, исходя из соединения 193: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 366,13; C22H40NO3.
Синтез соединения 255
Используя методики, описанные для синтеза соединения 253, за исключением замены на N,N-диметилэтилендиамин, соединение 255 (38 мг) получают с 20% выходом, исходя из соединения 193: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 393,11; C26H49N2O4.
Синтез соединения 256
Используя методики, описанные для синтеза соединения 253, за исключением замены на циклогексиламин, соединение 256 (154 мг) получают с 87% выходом, исходя из соединения 193: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 404,28; C26H46NO2.
Синтез соединения 257
Используя методики, описанные для синтеза соединения 253, за исключением замены на 3-(аминометил)пиридин, соединение 257 (122 мг) получают с 65% выходом, исходя из соединения 193: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 413,15; C26H41N2O2.
Синтез соединения 258
Используя методики, описанные для синтеза соединения 253, за исключением замены на фурфуриламин, соединение 258 (83 мг) получают с 47% выходом, исходя из соединения 193: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 402,20; C25H40NO3.
Синтез соединения 259
Используя методики, описанные для синтеза соединения 253, за исключением замены на 3-фторанилин и отсутствия стадии солеобразования, соединение 259 (86 мг) получают с 57% выходом, исходя из соединения 193: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 416,08; C26H39FNO2.
Синтез соединения 260
Используя методики, описанные для синтеза соединения 259, за исключением замены на 3-аминопиридин, соединение 260 (42 мг) получают с 28% выходом, исходя из соединения 193: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 399,20; C25H39N2O2.
Синтез соединения 261
Используя методики, описанные для синтеза соединения 259, за исключением замены на м-толуидин, соединение 261 (91 мг) получают с 60% выходом, исходя из соединения 193: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 412,20; C27H42NO2.
ПРИМЕР 33
Соединение 270, характерное соединение по изобретению, может быть получено согласно следующей реакционной схеме 33. Любое количество соединений, родственных соединению 270, может быть получено с применением подобной методики. Исходное соединение 262 может быть получено согласно методикам, приведенным в патенте США 6046185.
Реакционная схема 33

a) TBSCl, имидазол, DMAP, ДМФА, ТГФ; b) NalO4, H2O, ТГФ; c) NaBH4, MeOH, ТГФ; d) Ac2O, DMAP, пиридин; e) MsCl, пиридин; f) NaH, имидазол, ДМФА; g) LAH, ТГФ; h) HOAc.
В общих чертах, обработка TBSCI и имидазолом в ДМФА селективно защищает один гидроксил, что дает соединение 263. Окисление с помощью NaIO4 дает диальдегидное соединение 264. Восстановление с использованием натрийборгидрида дает соединение 265. Взаимодействие с уксусным ангидридом и DMAP в пиридине селективно защищает один гидроксил, что дает соединение 266. Осуществление взаимодействия по свободному гидроксилу с использованием MsCl и пиридина дает мезилатное соединение 267. Замещение мезилата анионом имидазола в ДМФА дает соединение 268. Удаление ацильной группы с помощью литийалюмогидрида дает соединение 269. Обработка 80% уксусной кислотой удаляет TBS-группу, что дает соединение 270.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 263
К раствору сырого соединения 262 (86,3 ммоль) в ДМФА (90 мл) и ТГФ (150 мл), охлаждаемому на бане с холодной водой, добавляют DMAP (0,50 г, 4,1 ммоль), имидазол (11,8 г, 173 ммоль) и TBSCl (15,6 г, 104 ммоль). Смесь перемешивают при температуре окружающей среды в течение 2,5 часов, затем охлаждают на бане с холодной водой. Добавляют воду (100 мл) и EtOAc (100 мл). Слои разделяют и осуществляют обратную экстракцию водной части с помощью EtOAc (50 мл). Объединенные органические слои промывают насыщенным раствором соли (2×250 мл), сушат над безводным MgSO4 и концентрируют досуха, получая соединение 263 (38,0 г, количественно) в виде белой пены.
Синтез соединения 264
К раствору соединения 263 (38,0 г, 86,3 ммоль) в ТГФ (250 мл), охлаждаемому на бане с холодной водой, добавляют суспензию NaIO4 (36,9 г, 173 ммоль) в воде (120 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 1,5 часов, затем добавляют воду (150 мл) и EtOAc (150 мл). Слои разделяют и осуществляют обратную экстракцию водной части с помощью EtOAc (100 мл). Объединенные органические слои промывают насыщенным раствором соли (200 мл), сушат над безводным MgSO4 и концентрируют досуха, получая сырое соединение 264, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 265
К раствору сырого соединения 264 (86,3 ммоль) в ТГФ (125 мл) и MeOH (125 мл) при 0°C добавляют порциями NaBH4 (6,53 г, 173 ммоль). Смесь перемешивают при 0°C в течение 15 минут, затем при температуре окружающей среды в течение 1 часа. Смесь охлаждают на бане с холодной водой и гасят 80% уксусной кислотой, доводя до pH=7,0. Добавляют воду (100 мл) и EtOAc (150 мл). Слои разделяют и осуществляют обратную экстракцию водной части с помощью EtOAc (100 мл). Объединенные органические слои промывают насыщенным раствором соли (200 мл), сушат над безводным MgSO4 и концентрируют досуха. Остаток перемешивают с гексаном (150 мл) в течение 2 часов, затем осадок отделяют фильтрованием, споласкивая гексаном (2×25 мл). Твердый продукт сушат, получая соединение 265 (19,8 г, 52% в расчете на соединение 263) в виде белого твердого вещества.
Синтез соединения 266
К раствору соединения 265 (17,0 г, 38,9 ммоль) в CH2Cl2 (25 мл) и пиридине (50 мл), охлаждаемому на бане с холодной водой, добавляют DMAP (0,50 г, 4,1 ммоль), затем, по каплям, уксусный ангидрид (4,0 мл, 43 ммоль). Смесь перемешивают при температуре окружающей среды в течение 1,5 часов. Добавляют насыщенный раствор соли (120 мл) и EtOAc (250 мл). Слои разделяют и осуществляют обратную экстракцию водной части с помощью EtOAc (100 мл). Объединенные органические слои промывают насыщенным раствором соли (2×150 мл), сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 49:1, 19:1, 9:1, 4:1), получая соединение 266 (11,0 г, 59%) в виде белого твердого вещества.
Синтез соединения 267
К перемешиваемому раствору соединения 266 (2,4 г, 5,0 ммоль) в пиридине (20 мл) добавляют по каплям MsCl (0,39 мл, 5,0 ммоль). Полученную смесь перемешивают при температуре окружающей среды в течение 5 часов. Смесь разбавляют с помощью EtOAc (300 мл), промывают насыщенным раствором соли и промывные воды объединяют и экстрагируют EtOAc. Органические экстракты объединяют и промывают насыщенным раствором соли, сушат и концентрируют, получая соединение 267 (2,8 г, 100%) в виде светлого твердого вещества.
Синтез соединения 268
К перемешиваемому раствору имидазола (66 мг, 0,97 ммоль) в ДМФА (6 мл) при температуре окружающей среды добавляют NaH (39 мг, 60% в минеральном масле, 0,97 ммоль). После перемешивания в течение 1 часа при температуре окружающей среды смесь становится прозрачной, и тогда добавляют в виде твердого вещества соединение 267 (200 мг, 0,36 ммоль). Смесь перемешивают при 60°C в течение 3 часов 45 мин и затем оставляют при температуре окружающей среды на ночь. Смесь разбавляют с помощью толуола (200 мл), промывают насыщенным раствором соли, сушат и концентрируют. Сырое соединение 268 используют на следующей стадии без дополнительной очистки.
Синтез соединения 269
К перемешиваемому раствору соединения 268 (0,36 ммоль) в ТГФ (15 мл) при 0°C добавляют по каплям 1M LAH в ТГФ (0,57 мл, 0,57 ммоль). После 5 минут при 0°C смесь перемешивают при температуре окружающей среды в течение 5 часов. реакционную смесь вновь охлаждают до 0°C и добавляют порциями твердый Na2SO4.10H2O (184 мг, 0,57 ммоль). После 5 минут при 0°C смесь перемешивают при температуре окружающей среды в течение 1 часа, и затем фильтруют через целит, и промывают EtOAc. Фильтрат и промывные воды объединяют и концентрируют. Сырое соединение 269 используют на следующей стадии без дополнительной очистки.
Синтез соединения 270
Раствор сырого соединения 269 (0,36 ммоль) в 80% HOAc (4 мл) перемешивают при 40°C в течение 6,5 часов. Растворители удаляют и остаток очищают колоночной хроматографией (смесь EtOAc/MeOH/Et3N, 8:1,5:0,5), получая соединение 270 (110 мг, 82% в расчете на соединение 267). ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 372,87; C23H37N2O2.
ПРИМЕР 34
Соединения 276-277, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 34. Любое количество соединений, родственных соединениям 276-277, может быть получено с применением подобной методики. Исходное соединение 267 может быть получено согласно методикам, приведенным выше в примере 33.
Реакционная схема 34

a) NaN3, ДМФА; b) K2CO3, MeOH, H2O; c) NMO, TPAP, CH2Cl2; d) циклопентиламин, NaB(OAc)3H, 4Å молекулярные сита, 1,2-дихлорэтан; e) LAH, ТГФ; f) 80% AcOH; g) 80% AcOH.
В общих чертах, азидное замещение мезилата с помощью NaNO3 в ДМФА дает соединение 271. Основной гидролиз ацетата дает соединение 272. Катализируемое TPAP окисление гидроксильной группы дает соединение 273. Восстановительное аминирование с помощью циклопентиламина дает соединение 274. Восстановление азида литийалюмогидридом дает соединение 275. Обработка 80% уксусной кислотой удаляет TBS-группу, что дает соединение 276. После очистки на колонке дополнительная обработка 80% уксусной кислотой дает солевое соединение 277.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 271
Смесь соединения 267 (1,8 г, 3,2 ммоль) и NaN3 (420 мг, 6,5 ммоль) в ДМФА (26 мл) перемешивают при 60°C в течение ночи. Смесь охлаждают до температуры окружающей среды и разбавляют с помощью толуола (300 мл), промывают насыщенным раствором соли, сушат и концентрируют, получая соединение 271 (1,56 г, 95%).
Синтез соединения 272
Смесь соединения 271 (1,35 г, 2,68 ммоль), K2CO3 (2,9 г, 21 ммоль) в смеси MeOH/ТГФ/вода (50 мл/50 мл/39 мл) перемешивают при температуре окружающей среды в течение ночи. Большую часть растворителей удаляют методом ротационного выпаривания и остаток разбавляют водой (250 мл) и экстрагируют EtOAc. EtOAc-экстракты объединяют и промывают насыщенным раствором соли, сушат и концентрируют. Сырой продукт очищают колоночной хроматографией (смесь гексан/EtOAc, 85:15), получая соединение 272 (856 мг) с выходом 69%.
Синтез соединения 273
К перемешиваемому раствору соединения 272 (892 мг, 1,93 ммоль) в CH2Cl2 (35 мл) добавляют NMO (333 мг, 2,84 ммоль) и TPAP (57 мг, 0,16 ммоль). Смесь перемешивают при температуре окружающей среды в течение 2 часов 15 мин и затем растворитель удаляют методом ротационного выпаривания. Остаток очищают колоночной хроматографией (смесь гексан/EtOAc, 9:1), получая соединение 273 (769 мг) с выходом 87%.
Синтез соединения 274
К перемешиваемому раствору соединения 273 (170 мг, 0,37 ммоль) в 1,2-дихлорэтане (8 мл) добавляют циклопентиламин (0,18 мл, 1,8 ммоль), 4Å молекулярные сита (170 мг) и NaB(OAc)3H (331 мг, 1,56 ммоль). Смесь перемешивают при температуре окружающей среды в течение 28 часов и затем фильтруют через целит и промывают EtOAc. Фильтрат и промывные воды объединяют и концентрируют. Остаток фильтруют через колонку с диоксидом кремния, используя смесь EtOAc/MeOH (9:1), и сырое соединение 274 используют на следующей стадии без дополнительной очистки.
Синтез соединения 275
К перемешиваемому раствору соединения 274 (0,37 ммоль) в ТГФ (15 мл) при 0°C добавляют по каплям 1M LAH в ТГФ (1,9 мл, 1,9 ммоль). После 5 мин при 0°C смесь перемешивают при температуре окружающей среды в течение 5,5 часов. Реакционную смесь вновь охлаждают до 0°C и добавляют порциями Na2SO4.10H2O (596 мг, 1,9 ммоль). После 5 мин при 0°C смесь перемешивают при температуре окружающей среды в течение 1 часа и затем фильтруют через целит и промывают EtOAc. Фильтрат и промывные воды объединяют и концентрируют. Сырое соединение 275 используют на следующей стадии без дополнительной очистки.
Синтез соединения 276
Раствор сырого соединения 275 (0,37 ммоль) в 80% HOAc (5 мл) перемешивают при 40°C в течение 7,5 часов. Растворители удаляют и остаток очищают колоночной хроматографией (смесь EtOAc/MeOH/вода/Et3N, 6,5:2,5:0,5:0,5), получая соединение 276 (74 мг, 52% в расчете на соединение 273).
Синтез соединения 277
Раствор соединения 276 (74 мг) в 80% HOAc (0,5 мл) перемешивают при температуре окружающей среды в течение нескольких минут, и затем растворители удаляют методом ротационного выпаривания. Остаток несколько раз выпаривают совместно с MeOH и сушат в вакууме. Продукт растворяют в небольшом количестве MeOH и обрабатывают небольшим количеством ацетонитрила. Растворители удаляют и продукт сушат в вакууме, получая соединение 277 (90 мг, 93%) в виде не совсем белого порошка: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 388,98; C25H45N2O.
ПРИМЕР 35
Соединения 282-306, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 35. Любое количество соединений, родственных соединениям 282-306, может быть получено с применением подобной методики. Исходное соединение 113 может быть получено согласно методикам, приведенным выше в примере 12.
Реакционная схема 35

a) изобутиламин, NaB(OAc)3H, 4Å МС, DCE; b) LiAIH4, ТГФ; c) 80% AcOH, 40°C; d) MePPh3Br, KOtBu, ТГФ; e) 80% AcOH.
В общих чертах, восстановительное аминирование кетонового или альдегидного соединения, такого как соединение 113, с помощью амина, такого как изобутиламин, дает амин, такой как соединение 278. Восстановление литийалюмогидридом удаляет ацильную группу, что дает соединение 279. Обработка 80% уксусной кислотой удаляет как TBS-группу, так и группу циклического кеталя, что дает соединение 280. Олефинирование с использованием MePPh3Br и KOtBu в ТГФ дает соединение 281. Обработка 80% уксусной кислотой приводит к образованию солевого соединения 282.
Далее приведены характерные примеры соединений, полученных как указано выше.
Синтез соединения 278
Смесь соединения 113 (0,18 г, 0,35 ммоль), изобутиламин (0,18 мл, 1,8 ммоль) и 4Å молекулярных сит (0,15 г) в DCE (5 мл) перемешивают при температуре окружающей среды в течение 1 часа. Добавляют NaB(OAc)3H (0,395 г, 1,77 ммоль) и смесь перемешивают при температуре окружающей среды в течение 5 дней. Реакционную смесь разбавляют с помощью MeOH и фильтруют через слой целита, споласкивая EtOAc. Фильтрат промывают насыщенным раствором NaHCO3, затем дважды насыщенным раствором соли, сушат над безводным MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле, получая смесь соединения 278 и имин соединения 278 (0,240 г) в виде светло-желтого масла, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 279
К раствору смеси соединения 278 и соответствующего имина (0,33 ммоль) в ТГФ (10 мл) добавляют LiAlH4 (0,99 мл 1M раствора в ТГФ, 0,99 ммоль). Смесь перемешивают при температуре окружающей среды в течение ночи, затем гасят Na2SO4·10H2O и перемешивают в течение 30 минут. Смесь фильтруют, споласкивая EtOAc, и концентрируют досуха, получая сырое соединение 279 (0,137 г) в виде бесцветной стеклянной массы, которое используют на следующей стадии без дополнительной очистки.
Синтез соединения 280
Сырое соединение 279 (0,33 ммоль) растворяют в 80% уксусной кислоте (7 мл) и перемешивают при 40°C в течение ночи, затем концентрируют. Остаток частично очищают хроматографией на силикагеле, получая соединение 280 (0,083 г) в виде бесцветной стеклянной массы.
Синтез соединения 281
Смесь KOtBu (0,184 г, 1,56 ммоль) и MePPh3Br (0,557 г, 1,56 ммоль) в ТГФ (6 мл) перемешивают при температуре окружающей среды в течение 1,5 часов, затем добавляют раствор соединения 281 (0,083 г, 0,20 ммоль) в ТГФ (4 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи, затем гасят насыщенным раствором NH4Cl и концентрируют. Остаток частично очищают хроматографией на силикагеле, получая соединение 281, которое используют для последующего взаимодействия.
Синтез соединения 282
Смесь соединения 281 (0,2 ммоль), 80% AcOH и MeOH концентрируют методом ротационного выпаривания. Остаток растворяют в воде и промывают CH2Cl2 (5×5 мл), затем концентрируют. Осаждение из гексана дает соединение 282 (0,042 г, 28% из расчета на соединение 113) в виде белого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 364,22; C23H42NO2.
Синтез соединения 283
Применяя методику, описанную для синтеза соединения 278, за тем исключением, что используют 0,329 г (1,47 ммоль) NaB(OAc)3H и реакционное время составляет 4 дня, соединение 113 (0,25 г, 0,49 ммоль) подвергают взаимодействию с 3-(аминометил)пиридином (0,25 мл, 2,5 ммоль), получая иминовое промежуточное соединение (0,225 г, 77%, белая пена). Используя методику, описанную для синтеза соединения 279, за тем исключением, что реакционное время составляет 5 часов, иминовое промежуточное соединение (0,376 ммоль) подвергают взаимодействию с LiAlH4 (1,50 мл 1M раствора в Et2O, 1,50 ммоль), получая сырое спиртовое промежуточное соединение с отщепленной TBS-группой (0,162 г, желтая пена). Применяя методику, описанную для синтеза соединения 280, за тем исключением, что используют 20 мл 80% AcOH и восстановление осуществляют при температуре окружающей среды, сырую смесь, содержащую спиртовое промежуточное соединение, (0,376 ммоль) превращают в кетоновое промежуточное соединение (0,095 г, бесцветная стеклянная масса). Применяя методику, описанную для синтеза соединения 281, за тем исключением, что используют 0,163 г (1,38 ммоль) KOtBu и 0,492 г (1,38 ммоль) MePPh3Br и после гашения реакционную смесь фильтруют через целит, кетоновое промежуточное соединение (0,23 ммоль) превращают в алкен. Осаждение из Et2O дает соединение 283 (0,014 г, 7% из расчета на соединение 113) в виде белого твердого вещества. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 397,75; C25H38N2O2.
Синтез соединения 284
Используя методику, описанную для синтеза соединения 278, соединение 113 (0,18 г, 0,35 ммоль) подвергают взаимодействию с этаноламином (0,11 мл, 1,8 ммоль), получая аминовое промежуточное соединение (0,053 г, 27%, желтое масло). Используя методику, описанную для синтеза соединения 279, аминовое промежуточное соединение (0,096 ммоль) подвергают взаимодействию с LiAlH4 (0,19 мл 1M раствора в ТГФ, 0,19 ммоль), получая спиртовое промежуточное соединение с некоторым TBS-отщеплением (0,040 г, бесцветная стеклянная масса). Применяя методику, описанную для синтеза соединения 280, за тем исключением, что используют 6 мл 80% уксусной кислоты и остаток не подвергают очистке, сырую смесь, содержащую спиртовое промежуточное соединение, превращают в кетоновое промежуточное соединение в виде уксуснокислой соли (0,041 г, бесцветная стеклянная масса). Используя методику, описанную для синтеза соединения 281, кетоновое промежуточное соединение (0,096 ммоль) превращают в сырой алкен. Используя методику, описанную для синтеза соединения 282, за тем исключением, что остаток не промывают CH2Cl2, сырой алкен превращают в уксуснокислую соль. Осаждение из смеси гексан/CH2Cl2 дает соединение 284 (0,015 г, 10% из расчета на соединение 113) в виде желтого твердого вещества. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 352,12; C21H38NO3.
Синтез соединения 285
Применяя методику, описанную для синтеза соединения 278, за тем исключением, что используют 0,20 г 4Å молекулярных сит, взаимодействие начинают осуществлять с 0,395 г (1,77 ммоль) NaB(OAc)3H, затем, спустя 2 дня, добавляют еще 0,263 г (1,18 ммоль) NaB(OAc)3H, и суммарное реакционное время составляет 6 дней, соединение 113 (0,30 г, 0,59 ммоль) подвергают взаимодействию с фурфуриламином (0,27 мл, 3,0 ммоль), получая смесь аминового и иминового промежуточных соединений (0,283 г, белая пена). Используя методику, описанную для синтеза соединения 279, за тем исключением, что реакционное время составляет 5 часов, смесь промежуточных соединений амин/имин (0,48 ммоль) подвергают взаимодействию с LiAlH4 (1,44 мл 1M раствора в Et2O, 1,44 ммоль), получая сырое спиртовое промежуточное соединение с большей частью отщепленных TBS-групп (0,248 г, желтое масло). Применяя методику, описанную для синтеза соединения 280, за тем исключением, что используют 20 мл 80% AcОH, взаимодействие осуществляют при температуре окружающей среды, и остаток после осаждения растворяют в ТГФ (6 мл) и обрабатывают 2н. HCl (2 мл) при температуре окружающей среды в течение ночи, и затем концентрируют, сырую смесь, содержащую спиртовое промежуточное соединение (0,481 ммоль), превращают в кетоновое промежуточное соединение в виде HCl-соли (0,146 г, желтое масло). Применяя методику, описанную для синтеза соединения 281, за тем исключением, что используют 0,236 г (2,00 ммоль) KOtBu и 0,715 г (2,00 ммоль) MePPh3Br, добавляют ДМФА (0,5 мл) и после гашения реакционную смесь фильтруют через целит, кетоновое промежуточное соединение (0,33 ммоль) превращают в сырой алкен. Используя методику, описанную для синтеза соединения 282, сырой алкен превращают в уксуснокислую соль. Осаждение из Et2O дает соединение 285 (0,013 г, 14% из расчета на соединение 113) в виде светло-коричневого твердого вещества. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 388,16; C24H38NO3.
Синтез соединения 286
Используя методику, описанную для синтеза соединения 278, за тем исключением, что остаток не подвергают очистке, осуществляют взаимодействие соединения 113 (0,18 г, 0,35 ммоль) с N,N-диметилэтилендиамином (0,20 мл, 1,8 ммоль), получая смесь аминового и иминового промежуточных соединений (0,192 г, бесцветное масло). Используя методику, описанную для синтеза соединения 279, смесь промежуточных соединений амин/имин (0,33 ммоль) подвергают взаимодействию с LiAlH4 (0,99 мл 1M раствора в ТГФ, 0,99 ммоль), получая сырое спиртовое промежуточное соединение (0,137 г, бесцветная стеклянная масса). Используя методику, описанную для синтеза соединения 280, за тем исключением, что остаток не подвергают очистке, сырое спиртовое промежуточное соединение превращают в кетоновое промежуточное соединение в виде уксуснокислой соли (0,147 г, бесцветная стеклянная масса). Используя методику, описанную для синтеза соединения 281, кетоновое промежуточное соединение (0,33 ммоль) превращают в сырой алкен. Используя методику, описанную для синтеза соединения 282, за тем исключением, что остаток не промывают CH2Cl2, сырой алкен превращают в уксуснокислую соль. Концентрация из CH2Cl2 дает соединение 286 (0,072 г, 47% из расчета на соединение 113) в виде светло-желтого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 379,03; C23H43N2O2.
Синтез соединения 287
Используя методику, описанную для синтеза соединения 278, соединение 113 (0,18 г, 0,35 ммоль) подвергают взаимодействию с 2-(1-циклогексенил)этиламином (0,25 мл, 1,8 ммоль), получая аминовое промежуточное соединение (0,165 г, 77%, желтое масло). Используя методику, описанную для синтеза соединения 279, аминовое промежуточное соединение (0,27 ммоль) подвергают взаимодействию с LiAlH4 (0,53 мл 1M раствора в ТГФ, 0,53 ммоль), получая сырое спиртовое промежуточное соединение (0,132 г, бесцветная стеклянная масса). Применяя методику, описанную для синтеза соединения 280, за тем исключением, что используют 8 мл 80% уксусной кислоты, сырое спиртовое промежуточное соединение превращают в кетоновое промежуточное соединение в виде уксуснокислой соли (0,108 г, бесцветная стеклянная масса). Используя методику, описанную для синтеза соединения 281, кетоновое промежуточное соединение (0,23 ммоль) превращают в сырой алкен. Используя методику, описанную для синтеза соединения 282, за тем исключением, что остаток промывают с помощью Et2O (4×5 мл) вместо CH2Cl2, сырой алкен превращают в уксуснокислую соль. Осаждение из смеси гексан/CH2Cl2 дает соединение 287 (0,051 г, 31% из расчета на соединение 113) в виде белого твердого вещества: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAс в смеси 3:7 воды и MeCN) 416,26; C27H46NO2.
Синтез соединения 288
Используя методику, описанную для синтеза соединения 278, за тем исключением, что остаток не подвергают очистке, осуществляют взаимодействие соединения 113 (0,18 г, 0,35 ммоль) с 4-(2-аминоэтил)морфолин (0,23 мл, 1,8 ммоль), получая аминовое промежуточное соединение (0,205 г, 94%, бесцветное масло). Используя методику, описанную для синтеза соединения 279, аминовое промежуточное соединение (0,33 ммоль) подвергают взаимодействию с LiAlH4 (0,66 мл 1M раствора в ТГФ, 0,66 ммоль), получая сырое спиртовое промежуточное соединение (0,150 г, бесцветная стеклянная масса). Применяя методику, описанную для синтеза соединения 280, за тем исключением, что используют 8 мл 80% уксусной кислоты и остаток не подвергают очистке, сырое спиртовое промежуточное соединение превращают в кетоновое промежуточное соединение в виде уксуснокислой соли (0,203 г, коричневое масло). Используя методику, описанную для синтеза соединения 281, кетоновое промежуточное соединение (0,33 ммоль) превращают в сырой алкен. Используя методику, описанную для синтеза соединения 282, за тем исключением, что остаток очищают хроматографией на силикагеле после промывки, сырой алкен превращают в уксуснокислую соль. Осаждение из Et2O дает соединение 288 (0,108 г, 64% из расчета на соединение 113) в виде не совсем белого твердого вещества. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 421,16; C25H45N2O3.
Синтез соединения 289
Применяя методику, описанную для синтеза соединения 278, за тем исключением, что используют 0,125 г 4Å молекулярных сит, взаимодействие начинают осуществлять с 0,329 г (1,47 ммоль) NaB(OAc)3H, затем, спустя 2 дня, добавляют еще 0,219 г (0,982 ммоль) NaB(OAc)3H, и суммарное реакционное время составляет 6 дней, соединение 113 (0,25 г, 0,49 ммоль) подвергают взаимодействию с м-толуидином (0,27 мл, 2,5 ммоль), получая аминовое промежуточное соединение (0,240 г, желтое масло). Используя методику, описанную для синтеза соединения 279, за тем исключением, что реакционное время составляет 5 часов, аминовое промежуточное соединение (0,400 ммоль) подвергают взаимодействию с LiAlH4 (0,80 мл 1M раствора в Et2O, 0,80 ммоль), получая сырое спиртовое промежуточное соединение с, большей частью, отщепленными TBS-группами (0,224 г, желтое масло). Применяя методику, описанную для синтеза соединения 280, за тем исключением, что используют 20 мл 80% AcOH и взаимодействие осуществляют при температуре окружающей среды, сырую смесь, содержащую спиртовое промежуточное соединение, (0,400 ммоль) превращают в кетоновое промежуточное соединение (0,135 г, светло-коричневое твердое вещество). Используя методику, описанную для синтеза соединения 281, за тем исключением, что используют 0,238 г (2,01 ммоль) KOtBu и 0,719 г (2,01 ммоль) MePPh3Br и после гашения реакционную смесь фильтруют через целит, кетоновое промежуточное соединение (0,34 ммоль) превращают в алкен. Концентрация из CH2Cl2 дает соединение 289 (0,095 г, 49% из расчета на соединение 113) в виде желтой пены.
Синтез соединения 290
Применяя методику, описанную для синтеза соединения 278, за тем исключением, что используют 0,10 г 4Å молекулярных сит и 6 мл DCE, взаимодействие начинают осуществлять с 0,165 г (0,740 ммоль) NaB(OAc)3H, затем, спустя 8 часов, добавляют еще 0,083 г (0,37 ммоль) NaB(OAc)3H, и суммарное реакционное время составляет 2 дня, соединение 113 (0,197 г, 0,387 ммоль) подвергают взаимодействию с бензиламином (0,21 мл, 1,9 ммоль), получая аминовое промежуточное соединение (0,171 г, 73%, бесцветная смола). Применяя методику, описанную для синтеза соединения 279, за тем исключением, что используют 6 мл ТГФ и реакционное время составляет 5 часов, аминовое промежуточное соединение (0,28 ммоль) подвергают взаимодействию с LiAlH4 (0,56 мл 1M раствора в ТГФ, 0,56 ммоль), получая сырое спиртовое промежуточное соединение с, большей частью, отщепленными TBS-группами (0,132 г, бесцветная смола). Применяя методику, описанную для синтеза соединения 280, за тем исключением, что спирт обрабатывают 2н. HCl (2 мл) в ТГФ (6 мл) вместо 80% уксусной кислоты и взаимодействие осуществляют при температуре окружающей среды, сырую смесь, содержащую спиртовое промежуточное соединение, (0,28 ммоль) превращают в кетоновое промежуточное соединение (0,095 г, бесцветная стеклообразная масса). Используя методику, описанную для синтеза соединения 281, за тем исключением, что используют 0,162 г (1,44 ммоль) KOtBu, 0,514 г (1,44 ммоль) MePPh3Br и 13 мл ТГФ, и после гашения реакционную смесь разбавляют EtOAc (20 мл) и MeOH (10 мл), затем фильтруют через целит, кетоновое промежуточное соединение (0,24 ммоль) превращают в алкен. Осаждение из ACN дает соединение 290 (0,063 г, 41% из расчета на соединение 113) в виде белого твердого вещества. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAC в смеси 3:7 воды и MeCN) 382,06; C25H36NO2.
Синтез соединения 291
Используя методики, описанные для синтеза соединения 282, за исключением замены на 3-фторбензиламин, соединение 291 (0,039 г) получают в виде желтого твердого вещества с 23% выходом, исходя из соединения 95: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAC в смеси 3:7 воды и MeCN) 416,21; C26H39FNO2.
Синтез соединения 292
Используя методики, описанные для синтеза соединения 282, за исключением замены на морфолин, соединение 292 (0,089 г) получают в виде светло-розового твердого вещества с 58% выходом, исходя из соединения 95. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 378,12; C23H40NО3.
Синтез соединения 293
Используя методики, описанные для синтеза соединения 282, за исключением замены на 3,4-(метилендиокси)анилин, соединение 293 (0,068 г) получают в виде белого твердого вещества с 45% выходом, исходя из соединения 95. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAC в смеси 3:7 воды и MeCN) 428,37; C26H38NO4.
Синтез соединения 294
Используя методики, описанные для синтеза соединения 282, за исключением замены на изобутиламин, соединение 294 (0,111 г) получают в виде оранжевого твердого вещества с 75% выходом, исходя из соединения 95. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 364,12; C23H42NO2.
Синтез соединения 295
Используя методики, описанные для синтеза соединения 282, за исключением замены на циклогексиламин, соединение 295 (0,029 г) получают в виде оранжевого твердого вещества с 18% выходом, исходя из соединения 95. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAC в смеси 3:7 воды и MeCN) 390,12; C25H42NO2.
Синтез соединения 296
Используя методики, описанные для синтеза соединения 282, за исключением замены на N-метиланилин, соединение 296 (0,040 г) получают в виде оранжевого твердого вещества с 28% выходом, исходя из соединения 95. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 397,86; C26H40NO2.
Синтез соединения 297
Применяя методику, описанную для синтеза соединения 278, за тем исключением, что используют 0,20 г 4Å молекулярных сит и 7 мл DCE, смесь перемешивают в течение 1 часа перед добавлением NaB(OAc)3H, реакционное время составляет 3 дня, и остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 1:1; смесь EtOAc/MeOH, 9:1), соединение 95 (0,25 г, 0,49 ммоль) подвергают взаимодействию с 3-(аминометил)пиридином (0,25 мл, 2,5 ммоль), получая аминовое промежуточное соединение (0,266 г, 90%, бесцветная стеклянная масса). Используя методику, описанную для синтеза соединения 279, за тем исключением, что реакционное время составляет 1 ночь, аминовое промежуточное соединение (0,44 ммоль) подвергают взаимодействию с LiAlH4 (0,98 мл 1M раствора в Et2O, 0,98 ммоль), получая спиртовое промежуточное соединение (0,255 г, желтая пена). Применяя методику, описанную для синтеза соединения 280, за тем исключением, что используют 20 мл 80% AcOH, взаимодействие осуществляют при температуре окружающей среды в течение 4 дней и остаточный продукт очищают хроматографией на силикагеле (смесь EtOAc/MeOH/H2O/Et3N, 9:1:0,25:0,25), спиртовое промежуточное соединение (0,46 ммоль) превращают в кетоновое промежуточное соединение в виде свободного амина (0,039 г, светло-коричневое твердое вещество). Используя методику, описанную для синтеза соединения 281, за тем исключением, что используют 0,069 г (0,58 ммоль) KOtBu, 0,209 г, (0,585 ммоль) MePPH3Br и 7 мл ТГФ, реакционную смесь перемешивают в течение 1 часа, после чего добавляют раствор кетонового промежуточного соединения, и реакционное время составляет 2 дня, кетоновое промежуточное соединение (0,097 ммоль) превращают в сырой алкен. Используя методику, описанную для синтеза соединения 282, за тем исключением, что остаток не очищают хроматографией, сырой алкен превращают в соединение 297 (0,011 г, 5% из расчета на INT1703) в виде желтой стеклообразной массы. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 399,16; C25H39N2O2.
Синтез соединения 298
Применяя методику, описанную для синтеза соединения 278, за тем исключением, что используют 0,20 г 4Å молекулярных сит и 7 мл DCE, смесь перемешивают в течение 1 часа, после чего добавляют NaB(OAc)3H, реакционное время составляет 3 дня, и остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 3:2, 1:1), соединение 95 (0,25 г, 0,49 ммоль) подвергают взаимодействию с фурфуриламином (0,23 мл, 2,5 ммоль), что дает аминовое промежуточное соединение (0,269 г, 93%, желтая пена). Используя методику, описанную для синтеза соединения 279, за тем исключением, что аминовое промежуточное соединение (0,46 ммоль) подвергают взаимодействию с LiAlH4 (0,98 мл 1M раствора в Et2O, 0,98 ммоль) в течение ночи, затем дополнительно добавляют 1,96 мл раствора LiAlH4 (1M в Et2О, 1,96 ммоль), после чего осуществляют дальнейшее взаимодействие в течение ночи, получают спиртовое промежуточное соединение (0,228 г, белая пена). Применяя методику, описанную для синтеза соединения 280, за тем исключением, что используют 20 мл 80% AcОH и взаимодействие осуществляют при температуре окружающей среды в течение 3 дней, спиртовое промежуточное соединение (0,42 ммоль) превращают в кетоновое промежуточное соединение в виде уксуснокислой соли (0,229 г, желтое стеклянная масса). Используя методику, описанную для синтеза соединения 281, за тем исключением, что добавляют 0,2 мл ДМФА, кетоновое промежуточное соединение (0,42 ммоль) превращают в сырой алкен. Используя методику, описанную для синтеза соединения 282, сырой алкен превращают в уксуснокислую соль. Осаждение из Et2O дает соединение 298 (0,088 г, 40% из расчета на соединение 95) в виде оранжевого твердого вещества. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 388,05; C24H38NO3.
Синтез соединения 299
Применяя методику, описанную для синтеза соединения 278, за тем исключением, что используют 0,20 г 4Å молекулярных сит и 7 мл DCE, смесь перемешивают в течение 1 часа, после чего добавляют NaB(OAc)3H, реакционное время составляет 3 дня, и остаток очищают хроматографией на силикагеле (EtOAc; смесь EtOAc/MeOH/Et3N, 9:1:0,3), соединение 95 (0,25 г, 0,49 ммоль) подвергают взаимодействию с этаноламином (0,15 мл, 2,5 ммоль), получая аминовое промежуточное соединение (0,274 г, количественно, желтая пена). Используя методику, описанную для синтеза соединения 279, аминовое промежуточное соединение (0,49 ммоль) подвергают взаимодействию с LiAlH4 (0,98 мл 1M раствора в Et2O, 0,98 ммоль) в течение ночи, затем дополнительно добавляют 0,98 мл раствора LiAlH4 (1M в Et2О, 0,98 ммоль), после чего осуществляют дальнейшее взаимодействие в течение ночи, получают спиртовое промежуточное соединение (0,224 г, бесцветная стеклянная масса). Применяя методику, описанную для синтеза соединения 280, за тем исключением, что используют 20 мл 80% AcОH и взаимодействие осуществляют при температуре окружающей среды в течение 3 дней, спиртовое промежуточное соединение (0,44 ммоль) превращают в кетоновое промежуточное соединение в виде уксуснокислой соли (0,216 г, бесцветная стеклянная масса). Используя методику, описанную для синтеза соединения 281, за тем исключением, что добавляют 0,5 мл ДМФА, кетоновое промежуточное соединение (0,44 ммоль) превращают в сырой алкен. Используя методику, описанную для синтеза соединения 282, за тем исключением, что остаток не подвергают очистке хроматографией, сырой алкен превращают в уксуснокислую соль. Концентрация из
CH2Cl2 дает соединение 299 (0,041 г, 20% из расчета на соединение 95) в виде желтого твердого вещества. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 352,06; C21H38NO3.
Синтез соединения 300
Применяя методику, описанную для синтеза соединения 278, за тем исключением, что используют 0,10 г 4Å молекулярных сит, реакционное время составляет 2,5 дня и остаток очищают хроматографией на силикагеле (смесь гексан/EtOAc, 8:2), соединение 95 (0,10 г, 0,20 ммоль) подвергают взаимодействию с м-толуидином (0,10 мл, 0,93 ммоль), получая аминовое промежуточное соединение (0,091 г, 77%, желтоватая смола). Применяя методику, описанную для синтеза соединения 279, за тем исключением, что используют 8 мл ТГФ, раствор LiAlH4 добавляют при 0°C и смесь перемешивают при 0°C в течение 20 минут, после чего перемешивают при температуре окружающей среды, и реакционное время составляет 3,5 часа, аминовое промежуточное соединение (0,15 ммоль) подвергают взаимодействию с LiAlH4 (0,45 мл 1M раствора в ТГФ, 0,45 ммоль), получая сырое спиртовое промежуточное соединение. Применяя методику, описанную для синтеза соединения 280, за тем исключением, что используют 4 мл 80% AcОH и взаимодействие осуществляют в течение 5 часов, сырое спиртовое промежуточное соединение (0,15 ммоль) превращают в сырое кетоновое промежуточное соединение. Применяя методику, описанную для синтеза соединения 281, за тем исключением, что используют 7 мл ТГФ и 0,5 мл ДМФА, и после гашения смесь разбавляют с помощью EtOAc (20 мл) и MeOH (5 мл), и затем фильтруют через целит, кетоновое промежуточное соединение (0,15 ммоль) превращают в алкен (0,021 г, прозрачная смола). Используя методику, описанную для синтеза соединения 282, за тем исключением, что остаток не подвергают очистке хроматографией, алкен превращают в уксуснокислую соль. Осаждение из смеси ACN/MeOH дает соединение 300 (0,020 г, 21% из расчета на соединение 95) в виде желтой пены.
Синтез соединения 301
Применяя методику, описанную для синтеза соединения 278, за тем исключением, что используют 0,10 г 4Å молекулярных сит, реакционное время составляет 2,5 дня и остаток очищают хроматографией на силикагеле (смесь EtOAc/MeOH, 9:1), соединение 95 (0,10 г, 0,20 ммоль) подвергают взаимодействию с пирролидином (0,10 мл, 1,2 ммоль), получая аминовое промежуточное соединение (0,090 г, 82%, прозрачная смола). Применяя методику, описанную для синтеза соединения 279, за тем исключением, что используют 8 мл ТГФ, раствор LiAlH4 добавляют при 0°C, смесь перемешивают при 0°C в течение 20 минут с последующим перемешиванием при температуре окружающей среды, и реакционное время составляет 3,5 часа, аминовое промежуточное соединение (0,16 ммоль) подвергают взаимодействию с LiAlH4 (0,45 мл 1M раствора в ТГФ, 0,45 ммоль), получая сырое спиртовое промежуточное соединение. Применяя методику, описанную для синтеза соединения 280, за тем исключением, что используют 4 мл 80% AcOH и реакционное время составляет 5 часов, сырое спиртовое промежуточное соединение (0,16 ммоль) превращают в сырое кетоновое промежуточное соединение. Применяя методику, описанную для синтеза соединения 281, за тем исключением, что используют 7 мл ТГФ и 0,5 мл ДМФА и после гашения смесь разбавляют с помощью EtOAc (20 мл) и MeOH (5 мл), затем фильтруют через целит, кетоновое промежуточное соединение (0,16 ммоль) превращают в алкен (0,029 г, смола). Используя методику, описанную для синтеза соединения 282, за тем исключением, что остаток не очищают хроматографией, алкен превращают в уксуснокислотную соль. Осаждение из смеси ACN/MeOH дает соединение 301 (0,038 г, 42% из расчета на INT1703) в виде не совсем белой пены. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 362,18; C23H40NO2.
Синтез соединения 302
Используя методики, описанные для синтеза соединения 282, за исключением замены на N,N-диметилэтилендиамин, соединение 302 (0,067 г) получают в виде оранжевого твердого вещества с 39% выходом, исходя из соединения 205: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 393,03; C24H45N2O2.
Синтез соединения 303
Используя методики, описанные для синтеза соединения 282, за исключением замены на 3,4-(метилендиокси)анилин, соединение 303 (0,055 г) получают в виде оранжевого твердого вещества с 33% выходом, исходя из соединения 205: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 441,95; C27H40NO4.
Синтез соединения 304
Используя методики, описанные для синтеза соединения 282, за исключением замены на циклогексиламин, соединение 304 (0,022 г) получают в виде светло-желтого твердого вещества с 12% выходом, исходя из соединения 205: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 404,05; C26H46NO2.
Синтез соединения 305
Применяя методики, описанные для синтеза соединения 282, за исключением замены на 3-трифторметиланилин, соединение 305 (0,096 г) получают в виде белого твердого вещества с 54% выходом, исходя из соединения 205: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAc в смеси 3:7 воды и MeCN) 465,45; C27H38F3NO2.
Синтез соединения 306
Используя методики, описанные для синтеза соединения 282, за исключением замены на изобутиламин, соединение 306 (0,035 г) получают в виде белого твердого вещества с 21% выходом, исходя из соединения 205: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAс в смеси 3:7 воды и MeCN) 378,08; C24H44NO2.
ПРИМЕР 36
Соединения 308-310, характерные соединения по изобретению, могут быть получены согласно следующей реакционной схеме 36. Любое количество соединений, родственных соединениям 308-310, может быть получено с применением подобной методики. Исходное соединение 217 может быть получено согласно методике, приведенной выше в примере 24.
Реакционная схема 36

a) пирролидин, NaB(OAc)3H, 4Å МС, DCE; b) LiAlH4, ТГФ; c) 80% AcOH, MeOH.
В общих чертах, восстановительное аминирование соединения 217 дает соединение 307. Восстанавливающий агент, такой как литийалюмогидрид, используют для восстановления защищенных сложным эфиром гидроксилов, получая соединение 305. Обработка 80% уксусной кислотой дает аммонийацетатную соль соединения 309.
Синтез соединения 307
Смесь соединения 217 (0,20 г, 0,49 ммоль), пирролидина (0,18 мл, 2,2 ммоль) и 4Å молекулярных сит (0,20 г) в DCE (5 мл) перемешивают при температуре окружающей среды в течение 30 минут. Добавляют NaB(OAc)3H (0,297 г, 1,33 ммоль), споласкивая с помощью DCE (2 мл), и смесь перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь разбавляют MeOH (3 мл) и фильтруют через слой целита, споласкивая с помощью EtOAc (25 мл). Фильтрат промывают насыщенным раствором NaHCO3 (10 мл), затем насыщенным раствором соли (2×5 мл), сушат над безводным MgSO4 и концентрируют, получая соединение 307 (0,235 г, количественно) в виде бесцветной стеклянной массы, которую используют на следующей стадии без дополнительной очистки.
Синтез соединения 308
К раствору соединения 307 (0,49 ммоль) в ТГФ (10 мл) добавляют LiAlH4 (0,88 мл 1M раствора в ТГФ, 0,88 ммоль). Смесь перемешивают при температуре окружающей среды в течение ночи, затем гасят Na2SО4·10H2O и перемешивают в течение 1 часа. Смесь фильтруют, споласкивая с помощью EtOAc, и концентрируют досуха. Остаток очищают хроматографией на силикагеле (смесь EtOAc/MeOH, 9:1; смесь EtOAc/MeOH/Et3N, 9:0,75:0,25), получая соединение 308 в виде белого твердого вещества, которое используют для последующего взаимодействия.
Синтез соединения 309
Смесь соединения 308, 80% AcOH (1 мл) и MeOH (5 мл) концентрируют методом ротационного выпаривания. Концентрация из CH2Cl2 дает соединение 309 (0,168 г, 79% из расчета на INT5) в виде белой пены: ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAс в смеси 3:7 воды и MeCN) 375,95; C24H42NO2.
Синтез соединения 310
Используя методики, описанные для синтеза соединения 309, за исключением замены на м-толуидин, соединение 310 (0,20 г) получают в виде желтой пены с 69% выходом, исходя из соединения 217. ЖХ/МС (прямое впрыскивание, электрораспыление +ve, 10 мМ NH4OAC в смеси 3:7 воды и MeCN) 412,01; C27H42NO2.
Следующие соединения по изобретению получают согласно приведенным выше примерам.
Соединение 25; 5-(1β-метил-4β-гидрокси-2β-(2-гидроксиэтил)циклогексил)-4α-гидрокси-7aβ-метил-1-метиленоктагидроинден;
Соединение 29; 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден;
Соединение 38; 5-(1β-метил-2β,4β-дигидроксициклогексил)-
4α-(2-гидроксиэтил)-7aβ-метил-1-метиленоктагидроинден;
Соединение 45; 5-(1β-метил-2β,4β-дигидроксициклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден;
Соединение 51; 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-
4α-гидроксиметил-7aβ-метил-1-метиленоктагидроинден;
Соединение 59; соль 5-(1β-метил-4β-амино-2β-гидроксиметилциклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 67; соль 5-(1β-метил-4β-гидрокси-2β-(2-аминоэтил)циклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 68; соль 5-(1β-метил-4β-гидрокси-2β-(2-аминоэтил)циклогексил)-
4α-гидрокси-7aβ-метил-1-этилиденоктагидроинден-ацетат аммония;
Соединение 77; 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-аминометил-7aβ-метил-1-метиленоктагидроинден;
Соединение 78; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-
4α-аминометил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 79; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-
4α-аминометил-1,1-диметил-2,3,4,5,6,7-гексагидро-1H-инден-хлорид аммония;
Соединение 80; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-аминометил-7aβ-метил-1-метиленоктагидроинден-хлорид аммония;
Соединение 81; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-
4α-аминометил-7aβ-метил-1-этилиденоктагидроинден-хлорид аммония;
Соединение 88; 5-(1β-метил-4β-гидрокси-2β-аминометилциклогексил)-
4α-гидроксиметил-7aβ-метил-1-метиленоктагидроинден;
Соединение 89; соль 5-(1β-метил-4β-гидрокси-2β-аминометилциклогексил)-
4α-гидроксиметил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 100; 5-(1β-метил-4β-гидрокси-2β-аминометилциклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден;
Соединение 101; соль 5-(1β-метил-4β-гидрокси-2β-аминометилциклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 107; 5-(1β-метил-2β,4β-дигидроксициклогексил)-
4α-(2-аминоэтил)-7aβ-метил-1-метиленоктагидроинден;
Соединение 108; соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-
4α-(2-аминоэтил)-7αβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 119; 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-аминометил-7aβ-метил-1-метиленоктагидроинден;
Соединение 120; соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-
4α-аминометил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 132; 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-
4α-аминометил-7aβ-метил-1-дифторметиленоктагидроинден;
Соединение 133; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-
4α-аминометил-7aβ-метил-1-дифторметиленоктагидроинден-хлорид аммония;
Соединение 143; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-
4α-аминометил-7aβ-метил-1-дихлорметиленоктагидроинден-хлорид аммония;
Соединение 157; 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-
4α-аминометил-7aβ-метил-1β-(пропен-2-ил)октагидроинден;
Соединение 158; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-
4α-аминометил-7aβ-метил-1β-(пропен-2-ил)октагидроинден-ацетат аммония;
Соединение 163; 5-(1β-метил-4β-гидрокси-2β-(2-гидроксиэтил)циклогексил)-4α-гидрокси-7aβ-метил-3a,4,5,6,7,7a-гексагидро-3H-инден;
Соединение 178; соль 5-(1β-метил-4α,5α-дигидрокси-2β-гидроксиметилциклогексил)-
4α-аминометил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 182; 5-(1β-метил-4β-гидрокси-2β-(3-диметиламинопроп-1-енил)циклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден;
Соединение 183; соль 5-(1β-метил-4β-гидрокси-2β-(3-диметиламинопроп-1-енил)циклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 184; соль 5-(1β-метил-4β-гидрокси-2β-(2-(4-хлорфенил)этил)циклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 185; соль 5-(1β-метил-4β-гидрокси-2β-(2-пиридин-3-илэтил)циклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 189; 5-(1β-метил-4β-гидрокси-2β-этилциклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден;
Соединение 192; 5-(1β-метил-4β-гидрокси-2β-(2-(4-этоксифенил)эт-1-ен-1-ил)циклогексил)-
α-ацетокси-7aβ-метил-1-метиленоктагидроинден;
Соединение 195; 5-(1β-метил-4β-гидрокси-2β-(2-(пиридин-2-ил)эт-1-ен-1-ил)циклогексил)-
4α-гидроксиметил-7aβ-метил-1-метиленоктагидроинден;
Соединение 196; 5-(1β-метил-4β-гидрокси-2β-(2-(пиридин-3-ил)эт-1-ен-1-ил)циклогексил)-
4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
Соединение 197; 5-(1β-метил-4β-гидрокси-2β-(гепт-1-ен-1-ил)циклогексил)-
4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
Соединение 198; 5-(1β-метил-4β-гидрокси-2β-(4-бензилоксибут-1-ен-1-ил)циклогексил)-
4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
Соединение 199; соль 5-(1β-метил-4β-гидрокси-2β-(3-диметиламинопроп-1-ен-1-ил)циклогексил)-
4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 200; 5-(1β-метил-4β-гидрокси-2β-(2-(4-хлорфенил)этенил)циклогексил)-
4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
Соединение 201; 5-(1β-метил-4β-гидрокси-2β-(4-гидроксибут-1-ен-1-ил)циклогексил)-
4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
Соединение 203; 5-(1β-метил-4β-гидрокси-2β-(3-гидроксипроп-1-ен-1-ил)циклогексил)-
4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
Соединение 210; 5-(1β-метил-4β-гидрокси-2β-(3-(4-хлорфенил)проп-2Z-ен-1-ил)циклогексил)-
4α-гидрокси-7аβ-метил-1-метиленоктагидроинден;
Соединение 211; 5-(1β-метил-4β-гидрокси-2β-(3-(4-хлорфенил)проп-2Е-ен-1-ил)циклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден;
Соединение 212; 5-(1β-метил-4β-гидрокси-2β-(4-диметиламинолбут-1-ен-1-ил)циклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден;
Соединение 219; 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(4-диметиламинобут-
2Z-ен-1-ил)-7aβ-метил-1-метиленоктагидроинден;
Соединение 220; соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(4-диметиламинобут-
2Z-ен-1-ил)-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 221; 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-
(3-пиридин-3-илпроп-2Z-ен-1-ил)-7aβ-метил-1-метиленоктагидроинден;
Соединение 222; 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-
(3-пиридин-3-илпроп-2E-ен-1-ил)-7aβ-метил-1-метиленоктагидроинден;
Соединение 225; 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(метилсульфонил)
аминометил-7aβ-метил-1-метиленоктагидроинден;
Соединение 227; 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(ацетил)аминометил-7aβ-метил-1-метиленоктагидроинден;
Соединение 229; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-
(этил)аминометил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 231; 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-
(бензил)аминометил-7aβ-метил-1-метиленоктагидроинден;
Соединение 232; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-
(бензил)аминометил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 233; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(циклопропилметил)
аминометил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 235; 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-
4α-(диметил)аминометил-7aβ-метил-1-метиленоктагидроинден;
Соединение 236; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-
(диметил)аминометил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 240; 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-
(метил)аминометил-7aβ-метил-1-метиленоктагидроинден;
Соединение 241; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-
(метил)аминометил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 242; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-
(гуанидино)метил-7aβ-метил-1-метиленоктагидроинден-хлорид аммония;
Соединение 243; 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-
(2-метилпропил)аминометил-7аβ-метил-1-метиленоктагидроинден;
Соединение 244; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил) -4α-(2-метилпропил) аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 245; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)
-4α-(1-метилпиперидин-4-ил)аминометил-7аβ-метил-1-метиленоктагидроинден-диацетат аммония;
Соединение 246; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)
-4α-(3-нитробензил)аминометил-7aβ-мeтил-1-мeтилeнoктaгидpoиндeн-aцeтaт аммония;
Соединение 247; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)
-4α-(пиперонил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 248; соль 5-(1β-метил-4(3-гидрокси-2(3-гидроксиметилциклогексил)
-4α-(пиррол-2-илметил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 249; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)
-4α-(фурфурил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 250; соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)
-4α-(пиридин-3-илметил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 252; 5-(1β-метил-4β-гидрокси-2β-(пирролидин-1-ил)метилциклогексил)
-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
Соединение 253; соль 5-(1β-метил-4β-гидрокси-2β-(пирролидин-1-ил)метилциклогексил)
-4α-гидроксиметил-7aβ-метил-метиленоктагидроинден-ацетат аммония;
Соединение 254; соль 5-(1β-метил-4β-гидрокси-2β-(2-гидроксиэтил)аминометилциклогексил)
-4α-гидроксиметил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 255; соль 5-(1β-метил-4β-гидрокси-2β-(2-диметиламиноэтил)аминометилциклогексил)
-4α-гидроксиметил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 256; соль 5-(1β-метил-4β-гидрокси-2β-(циклогексил)аминометилциклогексил)
-4α-гидроксиметил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 257; соль 5-(1β-метил-4β-гидрокси-2β-(пиридин-3-илметил)аминометилциклогексил)
-4α-гидроксиметил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 258; соль 5-(1β-метил-4β-гидрокси-2β-(фурфурил)аминометилциклогексил)
-4α-гидроксиметил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 259; 5-(1β-метил-4β-гидрокси-2β-(3-фторфенил)аминометилциклогексил
-4α-гидроксиметил-7aβ-метил-1-метиленоктагидроинден;
Соединение 260; 5-(1β-метил-4β-гидрокси-2β-(пиридин-3-ил)аминометилциклогексил)
-4α-гидроксиметил-7aβ-метил-1-метиленоктагидроинден;
Соединение 261; 5-(1β-метил-4β-гидрокси-2β-(3-метилфенил)аминометилциклогексил)
-4α-гидроксиметил-7aβ-метил-1-метиленоктагидроинден;
Соединение 270; 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)
-4α-(имидазол-1-ил)метил-7aβ-метил-1-метиленоктагидроинден;
Соединение 276; 5-(1β-метил-4β-гидрокси-2β-(циклопентил)аминометилциклогексил)
-4α-аминометил-7aβ-метил-1-метиленоктагидроинден;
Соединение 277; соль 5-(1β-метил-4β-гидрокси-2β-(циклопентил)аминометилциклогексил)
-4α-аминометил-7aβ-метил-1-метиленоктагидроинден-диацетат аммония;
Соединение 282; соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-метилпропил)аминометил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 283; 5-(1β-метил-2β,4β-дигидроксициклогексил)-
4α-(пиридин-3-илметил)аминометил-7aβ-метил-1-метиленоктагидроинден;
Соединение 284; соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-
(2-гидроксиэтил)аминометил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 285; соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-
(фурфурил)аминометил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 286; соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-диметиламиноэтил)
аминометил-7aβ-метилметиленоктагидроинден-ацетат аммония;
Соединение 287; соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-циклогекс-1-ен-1-
илэтил)аминометил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 288; соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-морфолин-4-илэтил)
аминометил-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 289; 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(3-метилфенил)
аминометил-7aβ-метил-1-метиленоктагидроинден;
Соединение 290; 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-
(бензил)аминометил-7aβ-метил-1-метиленоктагидроинден;
Соединение 291; соль 5-(1β-метил-4β-гидрокси-2β-(3-фторбензил)аминометилциклогексил)-4α
-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 292; соль 5-(1β-метил-4β-гидрокси-2β-(морфолин-4-ил)
метилциклогексил)-4α-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 293; 5-(1β-метил-4β-гидрокси-2β-(1,3-бензoдиоксол-5-ил)аминометилциклогексил)-4α-гидрокси-7aβ-метил-1-метиленоктагидроинден;
Соединение 294; соль 5-(1β-метил-4β-гидрокси-2β-(2-метилпропил)аминометилциклогексил)-4α-
гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 295; соль 5-(1β-метил-4β-гидрокси-2β-(циклогексил)аминометилциклогексил)-4α-
гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 296; 5-(1β-метил-4β-гидрокси-2β-(N-фенил-N-метиламино)метилциклогексил)-4α-
гидрокси-7aβ-метил-1-метиленоктагидроинден;
Соединение 297; соль 5-(1β-метил-4β-гидрокси-2β-(пиридин-3-илметил)аминометилциклогексил)-4α-
гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 298; соль 5-(1β-метил-4β-гидрокси-2β-(фурфурил)аминометилциклогексил)-4α-
гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 299; соль 5-(1β-метил-4β-гидрокси-2β-(2-гидроксиэтил)аминометилциклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 300; соль 5-(1β-метил-4β-гидрокси-2β-(3-метилфенил)аминометилциклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 301; соль 5-(1β-метил-4β-гидрокси-2β-(пирролидин-1-ил)метилциклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 302; соль 5-(1β-метил-4β-гидрокси-2β-(2-(2-диметиламиноэтил)аминоэтил)циклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 303; 5-(1β-метил-4β-гидрокси-2β-(2-(1,3-бензoдиоксол-5-ил)аминоэтил)циклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден;
Соединение 304; соль 5-(1β-метил-4β-гидрокси-2β-(2-(циклогексил)аминоэтил)циклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 305; 5-(1β-метил-4β-гидрокси-2β-(2-(3-трифторметилфенил)аминоэтил)циклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден;
Соединение 306; соль 5-(1β-метил-4β-гидрокси-2β-(2-(2-метилпропил)аминоэтил)циклогексил)-
4α-гидрокси-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 308; 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-
(2-пирролидин-1-илэтил)-7aβ-метил-1-метиленоктагидроинден;
Соединение 309; соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-
(2-пирролидин-1-илэтил)-7aβ-метил-1-метиленоктагидроинден-ацетат аммония;
Соединение 310; 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-
(2-(3-метилфенил)аминоэтил)-7aβ-метил-1-метиленоктагидроинден.
Все соединения по изобретению, полученные как указано выше, существующие в форме свободного основания или кислоты, могут быть превращены в соответствующие фармацевтически приемлемые соли путем обработки подходящими неорганическим или органическим основанием или неорганической или органической кислотой. Соли соединений, полученные как указано выше, могут быть превращены в соответствующую форму свободного основания или кислоты с применением стандартных методик.
ПРИМЕРЫ ПРИМЕНЕНИЯ
ПРИМЕР A
Влияние соединений на отек уха в модели на мышах TH1 гиперчувствительности замедленного типа, вызванной химическим гаптеном.
Модели гиперчувствительности замедленного типа представляют собой T-клеточно-зависимые ответные реакции. Используемый тип химического гаптена может искажать T-клеточную реакцию, главным образом, в направлении TH1- или TH2-поляризации. Оксазолон и динитрохлорбензол (DNCB) индуцируют TH1-доминантный иммунный ответ.
Мышей сенсибилизируют в день 0 нанесением на поверхность кожи обритого живота 100 мкл 3% раствора оксазолона в 95% этаноле. Эту процедуру повторяют в день 1. Спустя шесть дней после сенсибилизации (т.е. в день 5) мышам вводят провокационную пробу путем местной аппликации, нанося 25 мкл 0,8% раствора оксазолона в 95% этаноле на обе стороны правых ушей и 25 мкл 95% этанола на левые уши. На день 6 (спустя 24 часа после заражения) мышей забивают, удаляют оба уха и сразу же заготавливают стандартные тканевые диски из каждого уха, используя корковый бор. Следует обратить внимание на то, чтобы образцы ткани отбирались из одной и той же ушной зоны. Сразу же измеряют массу тканей ушных дисков. Испытуемые соединения вводят перорально при дозе 5 мг/кг один раз в день в течение 7 дней (от дня 0 до дня 6), вводя последнюю дозу за 2 часа до забивания.
Альтернативно, мышей сенсибилизируют в день 0 путем нанесения на поверхность кожи обритого живота 50 мкл 1% раствора динитрохлорбензола (DNCB) в смеси ацетон:оливковое масло при соотношении 4:1. Эту процедуру повторяют в день 5. Начиная с одиннадцатого дня после первичной сенсибилизации мышам вводят провокационную пробу, 3 раза (в дни 10, 11 и 12), путем местной аппликации, нанося 25 мкл 0,5% DNCB, растворенного в смеси ацетон:оливковое масло при соотношении 4:1, на обе стороны правых ушей и 25 мкл растворителя на левые уши. Спустя двадцать четыре часа после стимуляции мышей забивают, как указано выше. Испытуемые соединения вводят перорально при дозе 10 мг/кг один раз в день в течение 5 дней (от дня 8 до дня 12), вводя последнюю дозу за 2 часа до заражения.
Отек уха выражают через прирост массы уха и рассчитывают, вычитая массу левого уха (заражение растворителем) из массы правого уха (заражение химическим гаптеном). Процент подавления отека уха лекарственными средствами рассчитывают, используя следующее уравнение: 100-((лекарственный отек/средний контрольный отек)·100).
Соединения по изобретению могут быть оценены данным испытанием в целях выявления способности к ингибированию вызванного оксазолоном и DNCB кожного воспаления.
ПРИМЕР В
Влияние соединений в отек уха в модели на мышах TH2 гиперчувствительности замедленного типа, вызванной флуоресцеинизотиоцианатом.
Мышей сенсибилизируют в день 0 нанесением на поверхность кожи обритого живота 50 мкл 0,5% раствора флуоресцеинизотиоцианата (FITC) в смеси 1:1 ацетона и дибутилфталата. Эту процедуру повторяют в день 7. Спустя четырнадцать дней после сенсибилизации (т.е. на день 13) мышам вводят провокационную пробу путем местной аппликации, нанося 25 мкл 0,5% FITC, растворенного в смеси 1:1 ацетона и дибутилфталата, на обе стороны правых ушей и 25 мкл раствора из смеси 1:1 ацетона и дибутилфталата на левые уши. На день 14 (спустя 24 часа после заражения) мышей забивают, удаляют оба уха и сразу же заготавливают стандартные тканевые диски из каждого уха, используя корковый бор. Следует обратить внимание на то, чтобы образцы ткани отбирались из одной и той же ушной зоны. Сразу же измеряют массу тканей ушных дисков. Испытуемые соединения (5-10 мг/кг) или растворитель вводят перорально один раз в день в течение 3 дней (от дня 11 до дня 13) за 2 часа до заражения.
Отек уха выражают через прирост массы уха и рассчитывают, вычитая массу левого уха (заражение растворителем) из массы правого уха (заражение FITC). Процент подавления отека уха лекарственными средствами рассчитывают, используя следующее уравнение: 100-((лекарственный отек/средний контрольный отек)·100).
Показано, что соединения по изобретению, при оценке согласно данному испытанию, ингибируют FITC-индуцированное кожное воспаление при дозах менее 20 мг/кг.
ПРИМЕР С
Действие соединений на LPS-индуцированный перитонит у мышей
Мышам вводят лекарственное средство (5 мг/кг) или растворитель перорально каждый день в течение четырех дней, вводя последнюю дозу за 2 часа до заражения. На день 4 мышей стимулируют либо физиологическим раствором, либо липополисахаридом (LPS), растворенным в физиологическом растворе (4 мг/кг) посредством интраперитонеальной инъекции. На 24 ч или 48 ч после стимуляция, животных анестезируют и применяют эвтаназию путем трансторакального сердечного обескровливания. Перитонеальную полость промывают охлажденным льдом EDTA-содержащим забуференным фосфатом физиологическим раствором (PBS). Перитонеальную промывную жидкость центрифугируют и удаляют супернатант. Осадок в пробирке ресуспендируют в PBS при 4°C. Цитоспиновые образцы получают и окрашивают для ручной дифференциации и перечисления типов клеток. Кроме того, ресуспендированную промывную жидкость анализируют на абсолютное количество клеток и клеточные дифференциалы с помощью гематологического анализатора CellDyn 3700SC (Abbott Laboratories Inc.).
Показано, что соединения по изобретению, при оценке согласно данному испытанию, ингибируют LPS-индуцированное перитонеальное воспаление при дозах менее 20 мг/кг.
ПРИМЕР D
Влияние соединений на разрушение хрящей у мышей
Данную модель используют для изучения влияния новых соединений на разрушение хрящей, индуцируемое естественной воспалительной реакцией, вызываемой имплантацией чужеродного тела. Активность в данной модели может свидетельствовать об активности против артрита.
Зифоидный грудинный хрящ оперативно удаляют у крыс, забитых с помощью CO2, промывают гибитаном и споласкивают стерильным, забуференным фосфатом физиологическим раствором. Из грудины извлекают диски диаметром 4 см с помощью щипцов для биопсии кожи из нержавеющей стали, № 4, и разрезают пополам. Каждую половинку перед имплантацией взвешивают и заворачивают в предварительно взвешенную, влажную, стерильную вату. Кусочек хряща, завернутого в вату, вживляют подкожно в каждую дорсолатеральную поверхность анестезированным самкам CD/1-мышей (возраст 6-8 недель) через разрез в 1 см вдоль дорсальной срединной линии (день 0). Мышам вводят испытуемые образцы пероральным способом на дни 3-17. На день 18 мышей забивают, извлекают вату и хрящ, и хрящ отделят от ваты. Взвешивают как хрящ, так и вату и рассчитывают разницу между массами до и после имплантации. Вату промывают 1 мл буфера, получают цитоспиновые продукты и окрашивают для дифференциации и перечисления типов клеток. Кроме того, ресуспендированную промывную жидкость анализируют на абсолютное количество клеток и клеточные дифференциалы с помощью гематологического анализатора CellDyn 3700SC (Abbott Laboratories Inc.).
Осуществляют ферментацию хряща в течение ночи в растворе папаина и цистеингидрохлорида при 65°C, анализируют содержание остающегося в хряще глюкозаминглюкана спектрофотометрическим методом и рассчитывают как %GAG/мг разложившегося хряща (приведенный к массе хряща до имплантации).
Соединения по изобретению могут быть оценены данным испытанием в целях выявления способности к ингибированию разрушения хрящей.
ПРИМЕР E
Влияние соединений на индуцированный раздражителем отек уха у мышей
Ряд мышей однозначно идентифицируют, нанося метку с помощью несмываемого маркера на хвост. Мышам вводят перорально 15 мг/кг испытуемого соединения в 100 мкл 45% β-циклодекстрина в физиологическом растворе. Мышей анестезируют на короткое время с помощью 2% галотана, и 2 мкг форбол-12-миристат-13-ацетата (PMA) в 25 мкл ацетона наносят на внутреннюю и внешнюю стороны левого уха мышей. Ацетон наносят таким же образом на правое ухо мышей, что служит в качестве контроля с растворителем. Контрольных животных подвергают такой же обработке, но без испытуемого соединения. Спустя 3 часа мышей забивают путем сворачивания шеи, и стандартного размера пробы берут на биопсию из каждого уха и взвешивают с точностью до 1/10 мг. Данные анализируют с учетом разницы между каждым левым ухом и правым ухом и затем рассчитывают % ингибирования отека по формуле (((среднее Rx/среднее для раздражителя))×100)-100.
Соединения по изобретению могут быть оценены данным испытанием в целях выявления способности к ингибированию PMA-индуцированного кожного отека.
ПРИМЕР F
Влияние соединений на цитокин-индуцированную трансэндотелиальную миграцию лейкоцитов
Испытание с помощью проточной камеры дает возможность исследования in vitro влияния испытуемых соединений на адгезию лейкоцитов в отношении эндотелия человека. Используя параллельный проточный камерный планшет осуществляют перфузию крови человека с физиологическими скоростями через воспаленный монослой HUVEC.
Монослои HUVEC получают при 3 пассаже в чашку Петри на 35 мм, покрытую 2% желатином и 5 мг/мл фибронектином. Спустя 3 дня конфлюэнтные монослои обрабатывают 25 мкг/мл TNF-α в течение 4 часов. Добавляют испытуемое соединение, при необходимости, при соответствующих инкубационных временах (10 мин или 4 ч). Кровь забирают у здорового взрослого человека, набирают в пробирки с вакуумом, содержащие гепарин натрия, и хранят при 37°C. Кровь обрабатывают испытуемым соединением при различных концентрациях в течение 10 мин при 37°C. Затем осуществляют перфузию цельной крови через проточную камеру в течение 2 мин при усилии сдвига 10 дин/см2. После чего монослои промывают HBSS при 37°C приблизительно в течение 6 мин при 10 дин/см2. Вначале промывочного периода производят видеозапись слоев на магнитную ленту. Во время последних 5 мин промывочного периода, подвижные, прилипающие и трансмигрировавшие лейкоциты подсчитывают вручную, при объективе микроскопа 20X, в пределах двух полей зрения, каждую минуту. Адгезивные лейкоциты определяются как остающиеся неподвижными в течение, по меньшей мере, 10 секунд. Данные для каждой минуты усредняют и выражают через процент ингибирования по отношению к обработанной растворителем TNF-α-стимулированной пробе. Эффективность лекарственных препаратов сравнивают с золотостандартной контрольной пробой, полученной обработкой монослоя HUVEC с помощью антитела против E-селектина человека (10 мкг/мл) и крови с антителом крыс против CD18 человека (20 мкг/мл), тем и другим в течение 10 мин при 37°C.
Показано, что соединения по изобретению, при оценке согласно данному испытанию, ингибируют TNF-α-индуцированную миграцию лейкоцитов при концентрациях менее 20 мкМ.
ПРИМЕР G
Влияние соединений на аллерген-индуцированное воспаление легких у крыс
Способность соединения ингибировать аллерген-индуцированную аккумуляцию клеток зоны воспаления, таких как эозинофилы и нейтрофилы, в промывной жидкости, полученной от сенсибилизированных животных, свидетельствует об активности соединения против астмы. В особенности такая модель системы полезна в оценке действия испытуемого соединения при лечении ответной реакции в поздней фазе астмы, когда совершенно очевидны воспаление легких и вторая фаза бронхоконстрикции, и при аллергии, в частности, когда поражена респираторная система. Испытание проводят следующим образом.
Самцов крыс Brown Norway сенсибилизируют овальбумином путем однократной интраперитонеальной инъекции 1 мг овальбумина, адсорбированного на 100 мг Al(OH)3 (квасцы), в 1 мл стерильного физиологического раствора (крысам группы контрольного физиологического раствора вводят только стерильный физиологический раствор) на день 1, и оставляют сенсибилизировать до дня 21. Испытуемые соединения вводят перорально каждый день в течение трех дней перед стимуляцией (дни 19, 20, 21) и в один день после стимуляции (день 22), вводя третью дозу за 2 часа до стимуляции, а дозу четвертого дня через 24 часа после стимуляции (объем=300 мкл/доза). Крысам вводят провокационную пробу в виде 5% овальбумина в физиологическом растворе, обрабатывая из распылителя Devillbis'a в течение 5 мин на день 21.
Через сорок восемь часов после стимуляции животных забивают путем передозировки интраперитонеально-вводимого пентобарбитола натрия и проводят лаваж легких с помощью 2×7 мл охлажденного забуференного фосфатом физиологического раствора. Извлеченную промывную жидкость помещают на лед. Бронхоальвеолярную промывную жидкость центрифугируют и удаляют супернатант. Осадок в пробирке ресуспендируют в забуференным фосфатом физиологическом растворе при 4°C. Цитоспиновые образцы получают и окрашивают для дифференциации и перечисления типов клеток. Показано, что соединения по изобретению ингибируют аллерген-индуцированное воспаление легких при дозах менее 20 мг/кг.
ПРИМЕР H
Влияние соединений на аллерген-индуцированную бронхоконстрикцию у мышей
Модель гиперреактивных дыхательных путей крыс (AHR) Buxco, хорошо описанная многочисленными исследователями, имитирует сильное сужение дыхательных путей в ответ на аэрозольные стимуляции, характеризующее сенсибилизированных животных по сравнению с несенсибилизированными животными. К системе Buxco применяют способ, называемый общая плетизмография, по которому количественно определяют вызванные дыханием изменения давления в камере, используя корреляцию между повышенной резистентностью дыхательных путей и повышенным соотношением время выдоха/дыхательная пауза, для расчета степени сужения дыхательных путей (Penh). После сенсибилизации аллергеном и ингаляционной стимуляции дыхательных путей Penh возрастает по сравнению с мнимосенсибилизированными, мнимозараженными животными. Таким образом, эффективность потенциального противовоспалительного средства может быть установлена путем оценки влияния указанного средства на овальбумин-индуцируемые AHR.
Самок мышей Balb/c сенсибилизируют на день 1 и 14 путем и.п. инъекции 100 мкл стерильного физиологического раствора, содержащего 20 мкг овальбумина и 2,25 мг Al(OH)3. Мнимосенсибилизированным мышам вводят только 100 мкл стерильного физиологического раствора. Испытуемые соединения (5 мг/кг) вводят перорально путем принудительного кормления через зонд в течение пяти последовательных дней, за два дня до стимуляции (дни 26 и 27) и в течение трех дней стимуляции овальбумином (дни 28, 29 и 30, за 2 часа до стимуляции). Мышам вводят провокационную пробу путем опрыскивания аэрозолем овальбумина (5% в физиологическом растворе) в течение 20 мин на дни 28, 29 и 30. На день 31 мышей помещают в камеры для общей плетизмографии системы Buxco и измеряют реактивность дыхательных путей в отношении стимуляции аэрозольным PBS и метахолином (MCh; 0,78, 1,56, 3,125, 6,25, 12,5, 25, 50 мг/мл), выражаемую через Penh.
Показано, что соединения по изобретению, при оценке согласно данному испытанию, ингибируют аллерген-индуцированную гиперреактивность дыхательных путей при дозах менее 20 мг/кг.
ПРИМЕР I
Действие соединений на LPS-индуцированное острое воспаление легких у крыс.
Крысам вводят лекарственное средство (1-20 мг/кг) или растворитель перорально каждый день за четыре дня до заражения. На день 4 крыс стимулируют либо физиологическим раствором, либо LPS, растворенным в физиологическом растворе (2 мг/кг), посредством интраперитонеальной инстилляции. Животных забивают путем передозировки интраперитонеально-вводимого пентобарбитола натрия спустя 3 часа после стимуляции и проводят лаваж легких с помощью 14 мл забуференного фосфатом физиологического раствора (PBS). Легочную промывную жидкость центрифугируют при 300 g в течение 3 мин, и удаляют супернатант. Осадок в пробирке ресуспендируют в 1-3 мл PBS при 4°C в зависимости от размера осадка и числа суммарных лейкоцитов. Объем конечной клеточной суспензии, содержащий приблизительно 240000 клеток, добавляют к соответствующему объему PBS при 4°C, получая конечный объем, равный 220 мкл, и конечную концентрацию 1×106 клетки/мл (конечная цитоспиновая суспензия). Пробу в 100 мкл (100000 клеток) помещают на цитоцентрифугу и вращают в течение 4 мин при 55 g. Получают два микроскопических препарата на промывную пробу, закрепляют и окрашивают в DifQuik. Кроме того, ресуспендированную промывную жидкость анализируют на абсолютное количество клеток и клеточные дифференциалы с помощью гематологического анализатора CellDyn 3700SC (Abbott Laboratories Inc.).
Показано, что соединения по изобретению, при оценке согласно данному испытанию, ингибируют LPS-индуцированное воспаление легких при дозах менее 20 мг/кг.
ПРИМЕР J
Действие соединений на LPS-индуцированное острое воспаление легких у мышей
Крысам вводят лекарственное средство (1-20 мг/кг) или растворитель перорально каждый день за четыре дня до заражения. На день 4 крыс стимулируют либо физиологическим раствором, либо LPS, растворенным в физиологическом растворе, (0,15 мг/кг) посредством интратрахеальной инстилляции. Животных забивают путем передозировки интраперитонеально-вводимого пентобарбитола натрия спустя 6 часов после стимуляции. После торакотомии проводят лаваж легких с помощью 3×0,75 мл PBS. Бронхоальвеолярную промывную жидкость центрифугируют, и удаляют супернатант. Осадок в пробирке ресуспендируют в PBS при 4°C. Цитоспиновые продукты получают и окрашивают для дифференциации и перечисления типов клеток. Кроме того, ресуспендированную промывную жидкость анализируют на абсолютное количество клеток и клеточные дифференциалы с помощью гематологического анализатора CellDyn 3700SC (Abbott Laboratories Inc.).
Показано, что соединения по изобретению могут быть оценены данным испытанием в целях выявления способности к ингибированию LPS-индуцированного воспаления легких.
ПРИМЕР К
Влияние соединений на синтез простагландина E2
Простагландин E2 (PGE2) является первичным продуктом метаболизма арахидоновой кислоты (AA). Подобно большинству эйкозаноидов PGE2 не существует заранее в клеточных резервуарах. Синтез PGE2 катализируется циклооксигеназой-2 (COX-2), индуцируемым ферментом, активируемым воспалительными стимулами, цитокинами и митогенами. Активация COX-2 приводит к повышенному продуцированию PGE2. Сообщается о наличии повышенных концентраций PGE2 при хронических воспалительных состояниях, таких как ревматоидный артрит и астма. Ингибирование синтеза COX-2 и PGE2 является основной целью терапии будущего, направленной на лечение воспалительных артропатий.
Эндотелиальные клетки пупочной вены человека (HUVEC-C) выращивают до слияния в покрытых желатином чашках Петри в присутствии эндотелиальной питательной среды (EGM-2). При испытании EGM-2 заменяют на среду RPMI-1640, содержащую 2% сыворотку плода теленка (FBS). HUVEC-Cs инкубируют с соединениями в течение 1 часа перед стимуляцией с помощью IL-1β в течение 24 часов. Экзогенный AA добавляют за период 15 минут и определяют концентрацию PGE2 в супернатантах клеточных культур методом конкурентного иммуноферментного анализа (EIA).
Соединения растворяют при концентрации 20 мМ в ДМСО и исследуют аналитическим методом при 5 и 1 мкл с конечной концентрацией в ДМСО 0,05%. Используют трипликаты аналитических проб. Контролями, включенными в каждый эксперимент, являются интактные клетки, обработанные IL-1β клетки, обработанные NS-398/IL-1β клетки и стандартная кривая известных концентраций PGE2. NS-398 является селективным ингибитором COX-2. Концентрацию PGE2 рассчитывают, используя соответствующее программное обеспечение для log-логит-преобразования кривой и соотнося данные с концентрацией PGE2 на стандартной кривой.
Процент ингибирования рассчитывают следующим образом: % I=100-[PGE2]C/[PGE2]Co×100, где [PGE2]C означает концентрацию PGE2 в смеси соединение/обработанные IL-1β пробы и [PGE2]Co означает концентрацию PGE2 в обработанной IL-1β пробе.
Показано, что соединения по изобретению ингибируют синтез PGE2 при концентрациях менее 10 мг/кг.
Все вышеперечисленные патенты США, опубликованные патентные заявки США, патентные заявки США, иностранные патенты, иностранные патентные заявки и непатентные публикации, упомянутые в данном описании и/или перечисленные в инструкции по применению, полностью включены здесь в качестве ссылки.
Из вышесказанного следует, что, хотя конкретные варианты осуществления изобретения описаны здесь в целях иллюстрации, могут быть выполнены различные модификации, не выходящие за рамки сущности и объема изобретения. Следовательно, изобретение не ограничивается ничем, кроме приложенных пунктов.
Реферат
Настоящее изобретение относится к соединениям формулы (I) в виде отдельного стереоизомера, смеси стереоизомеров или рацемической смеси стереоизомеров и их фармацевтически приемлемым солям. Соединения настоящего изобретения обладают противовоспалительной активностью. В формуле (I) ! ! кольцо А, С или D независимо является полностью или частично насыщенным; каждый из С1, С4, С11, С12, С15 и С16 независимо замещен двумя атомами водорода; каждый из С9 и С14 независимо замещен атомом водорода; R1 означает -OR7 или -N(R7)2. Значения остальных радикалов указаны в формуле изобретения. Изобретение также относится к фармацевтической композиции, обладающей противовоспалительной активностью и содержащей эффективное количество соединения изобретения, и к применению соединений для получения лекарственного средства, обладающего противовоспалительной активностью. 3 н. и 20 з.п. ф-лы.
Формула

где кольцо А, С или D независимо является полностью или частично насыщенным;
каждый из C1, C4, С11, С12, С15 и С16 независимо замещен двумя атомами водорода;
каждый из С9 и С14 независимо замещен атомом водорода;
R1 означает -OR7 или -N(R7)2;
каждый из R2 и R3 независимо выбирают из группы, включающей: -R8-OR7, -R8-OC(O)R9, -R10-N(R7)2, -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, C1-С6алкил, С2-С6алкенил, C1-С6алкил-фенил, замещенный галогеном, С2-С6алкенил-фенил,
замещенный -R8-OR7 или галогеном, С1-С6алкил-(5-6-членный насыщенный гетероциклил с 1 или 2 гетероатомами, выбранными из О или N), С1-С6алкил-(5-6-членный гетероарил с 1 или 2 атомами N в качестве гетероатомов) и С2-С6алкенил-(6-членный гетероарил с одним атомом N в качестве гетероатома);
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С16;
либо R4a и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил, или R5 означает прямую связь с углеродом в положении С14;
R6 означает водород или -R8-OR7;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, C1-С6алкил, С3-С7циклоалкил, частично насыщенный или насыщенный C1-С6алкил-С3-С6циклоалкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-C1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2, С1-С6алкил-(6-членный гетероциклил с 1 или 2 гетероатомами, выбранными из О и N, необязательно замещенный C1-С6алкилом), 6-членный гетероарил с 1 атомом азота в качестве гетероатома и C1-С6алкил-(5-6-членный гетероарил с 1 гетероатомом, выбранным из О и N), 9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов и С1-С6алкил-(9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов);
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь;
каждый R9 независимо выбирают из водорода и C1-С6алкила; и
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную C1-С6алкиленовую и линейную или разветвленную С2-С6алкениленовую цепь;
в виде отдельного стереоизомера, смеси стереоизомеров или рацемической смеси стереоизомеров;
или фармацевтически приемлемая соль указанного соединения.
R1 означает -OR7;
каждый из R2 и R3 независимо выбирают из группы, включающей -R8-OR7, -R8-OC(O)R9, -R10-N(R7)2, -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, C1-С6алкил, С2-С6алкенил, C1-С6алкил-фенил, замещенный галогеном, С2-С6алкенил-фенил,
замещенный -R8-OR7 или галогеном, С1-С6алкил-(5-6-членный насыщенный гетероциклил с 1 или 2 гетероатомами, выбранными из О или N), С1-С6алкил-(5-6-членный гетероарил с 1 или 2 атомами N в качестве гетероатомов) и С2-С6алкенил-(6-членный гетероарил с одним атомом N в качестве гетероатома);
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С16;
либо R4а и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил, или R5 означает прямую связь с углеродом в положении С14;
R6 означает водород или -R8-OR7;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, C1-С6алкил, С3-С7циклоалкил, частично насыщенный или насыщенный C1-С6алкил-С3-С6циклоалкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-C1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2, С1-С6алкил-(6-членный гетероциклил с 1 или 2 гетероатомами, выбранными из О и N, необязательно замещенный C1-С6алкилом), 6-членный гетероарил с 1 атомом азота в качестве гетероатома и C1-С6алкил-(5-6-членный гетероарил с 1 гетероатомом, выбранным из О и N), 9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов и С1-С6алкил-(9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов);
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь;
каждый R9 независимо выбирают из водорода и C1-С6алкила; и
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную C1-С6алкиленовую и линейную или разветвленную С2-С6алкениленовую цепь.
R1 означает -OR7;
R2 означает R8-OR7;
R3 независимо выбирают из группы, включающей -R8-OR7, -R8-OC(O)R9, -R10-N(R7)2, R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, C1-С6алкил, C2-С6алкенил, C1-С6алкил-фенил, замещенный галогеном, С2-С6алкенил-фенил, замещенный -R8-OR7или галогеном, С1-С6алкил-(5-6-членный насыщенный гетероциклил с 1 или 2 гетероатомами, выбранными из О или N), С1-С6алкил-(5-6-членный гетероарил с 1 или 2 атомами N в качестве гетероатомов) и С2-С6алкенил-(6-членный гетероарил с одним атомом N в качестве гетероатома);
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С 16;
либо R4a и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил, или R5 означает прямую связь с углеродом в положении С14;
R6 означает водород или -R8-OR7;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, C1-С6алкил, С3-С7циклоалкил, частично насыщенный или насыщенный C1-С6алкил-С3-С6циклоалкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-C1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2, С1-С6алкил-(6-членный гетероциклил с 1 или 2 гетероатомами, выбранными из О и N, необязательно замещенный C1-С6алкилом), 6-членный гетероарил с 1 атомом азота в качестве гетероатома и C1-С6алкил-(5-6-членный гетероарил с 1 гетероатомом, выбранным из О и N), 9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов и С1-С6алкил-(9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов);
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь;
каждый R9 независимо выбирают из водорода и C1-С6алкила; и
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную C1-С6алкиленовую и линейную или разветвленную С2-С6алкениленовую цепь.
R1 означает -OR7;
R2 означает -R8-OR7;
R3 означает -R8-OR7;
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С 16;
либо R4a и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил;
R6 означает водород;
каждый R7 независимо выбирают из группы, включающей водород, C1-С6алкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-С1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2; и
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь.
5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-(2-гидроксиэтил)пиклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-гидроксиэтил)-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-(2-гидроксиэтил)циклогексил)-4α-гидрокси-7аβ-метил-3а,4,5,6,7,7а-гексагидро-3Н-инден;
5-(1β-метил-4β-гидрокси-2β-(4-бензилоксибут-1-ен-1-ил)циклогексил)-4α-гидроксиметил-7β-метил-1-метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-(4-гидроксибут-1-ен-1-ил)пиклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден и
5-(1β-метил-4β-гидрокси-2β-(3-гидроксипроп-1-ен-1-ил)циклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден.
R1 означает -OR7;
R2 означает -R8-OR7;
R3 означает -R10-N(R7)2;
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С16;
либо R4a и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил, или R5 означает прямую связь с углеродом в положении С14;
R6 означает водород или -R8-OR7;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, C1-С6алкил, С3-С7циклоалкил, частично насыщенный или насыщенный C1-С6алкил-С3-С6циклоалкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-C1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2, С1-С6алкил-(6-членный гетероциклил с 1 или 2 гетероатомами, выбранными из О и N, необязательно замещенный C1-С6алкилом), 6-членный гетероарил с 1 атомом азота в качестве гетероатома и C1-С6алкил-(5-6-членный гетероарил с 1 гетероатомом, выбранным из О и N), 9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов и С1-С6алкил-(9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов);
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь;
каждый R9 независимо выбирают из водорода и C1-С6алкила; и
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную C1-С6алкиленовую и линейную или разветвленную С2-С6алкениленовую цепь.
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-аминометил-7аβ-метил-1-этилиденоктагидроинден-хлорид аммония;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-аминометил-7аβ-метил-1-метиленоктагидроинден-хлорид аммония;
5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-аминоэтил)-7аβ-метил-1-метиленоктагидроинден;
соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-аминоэтил)-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-аминометил-7аβ-метил-1-метиленоктагидроинден;
соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-аминометил-7аβ-метил-1-дифторметиленоктагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-аминометил-7аβ-метил-1-дифторметиленоктагидроинден-хлорид аммония;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-аминометил-7аβ-метил-1-дихлорметиленоктагидроинден-хлорид аммония;
5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-аминометил-7аβ-метил-1β-(пропен-2-ил)октагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-аминометил-7аβ-метил-1β-(пропен-2-ил)октагидроинден-ацетат аммония;
соль 5-(1β-метил-4α,5α-дигидрокси-2β-гидроксиметилциклогексил)-4α-аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(4-диметиламинобут-2Z-ен-1-ил)-7аβ-метил-1-метиленоктагидроинден;
соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(4-диметиламинобут-2Z-ен-1-ил)-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(этил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(бензил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(циклопропилметил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(диметил)аминометил-7аβ-метил-1 -метиленоктагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(диметил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(метил)аминометил-7аβ-метил-1-метиленоктагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(метил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(2-метилпропил)аминометил-7аβ-метил-1 -метиленоктагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(2-метилпропил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(1-метилпиперидин-4-ил)аминометил-7аβ-метил-1-метиленоктагидроинден-диацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(3-нитробензил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(пиперонил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(пиррол-2-илметил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(фурфурил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(пиридин-3-илметил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-метилпропил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(пиридин-3-илметил)аминометил-7аβ-метил-1-метиленоктагидроинден;
соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-гидроксиэтил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(фурфурил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-диметиламиноэтил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-циклогекс-1-ен-1-илэтил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-морфолин-4-илэтил)аминометил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(3-метилфенил)аминометил-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(бензил)аминометил-7аβ-метил-1-метиленоктагидроинден и
5-(1β-метил-2β,4β-дигидроксипиклогексил)-4α-(2-(3-метилфенил)аминоэтил)-7аβ-метил-1-метиленоктагидроинден.
R1 означает -OR7;
R2 означает -R10-N(R7)2;
R3 независимо выбирают из группы, включающей -R8-OR7, -R8-OC(O)R9, -R10-N(R7)2, R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, C1-С6алкил, C2-
С6алкенил, C1-С6алкил-фенил, замещенный галогеном, С2-С6алкенил-фенил, замещенный -R8-OR7 или галогеном, С1-С6алкил-(5-6-членный насыщенный гетероциклил с 1 или 2 гетероатомами, выбранными из О или N), С1-С6алкил-(5-6-членный гетероарил с 1 или 2 атомами N в качестве гетероатомов) и С2-С6алкенил-(6-членный гетероарил с одним атомом N в качестве гетероатома);
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С16;
либо R4a и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил, или R5 означает прямую связь с углеродом в положении С14;
R6 означает водород или -R8-OR7;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, C1-С6алкил, С3-С7циклоалкил, частично насыщенный или насыщенный C1-С6алкил-С3-С6циклоалкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-C1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2, С1-С6алкил-(6-членный гетероциклил с 1 или 2 гетероатомами, выбранными из О и N, необязательно замещенный C1-С6алкилом), 6-членный гетероарил с 1 атомом азота в качестве гетероатома и C1-С6алкил-(5-6-членный гетероарил с 1 гетероатомом, выбранным из О и N), 9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов и С1-С6алкил-(9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов);
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь;
каждый R9 независимо выбирают из водорода и C1-С6алкила; и
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную C1-С6алкиленовую и линейную или разветвленную С2-С6алкениленовую цепь.
R1 означает -OR7;
R2 означает -R10-N(R7)2;
R3 означает -R8-OR7;
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С16;
либо R4a и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил, или R5 означает прямую связь с углеродом в положении С14;
R6 означает водород или -R8-OR7;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, C1-С6алкил, С3-С7циклоалкил, частично насыщенный или насыщенный C1-С6алкил-С3-С6циклоалкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-C1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2, С1-С6алкил-(6-членный гетероциклил с 1 или 2 гетероатомами, выбранными из О и N, необязательно замещенный C1-С6алкилом), 6-членный гетероарил с 1 атомом азота в качестве гетероатома и C1-С6алкил-(5-6-членный гетероарил с 1 гетероатомом, выбранным из О и N), 9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов и С1-С6алкил-(9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов);
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь;
каждый R9 независимо выбирают из водорода и C1-С6алкила; и
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную C1-С6алкиленовую и линейную или разветвленную С2-С6алкениленовую цепь.
соль 5-(1β-метил-4β-гидрокси-2β-(2-аминоэтил)циклогексил)-4α-гидрокси-7аβ-метил-1 -метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-(2-аминоэтил)циклогексил)-4α-гидрокси-7аβ-метил-1-этилиденоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-аминометилциклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-аминометилциклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-аминометилциклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-аминометилциклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-(3-диметиламинопроп-1-енил)циклогексил)-4α-гидрокси-7аβ-метил-1 -метиленоктагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-(3-диметиламинопроп-1-енил)циклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-(3-диметиламинопроп-1-ен-1-ил)циклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-(4-диметиламинолбут-1-ен-1-ил)циклогексил)-4α-гидрокси-7аβ-метил-1 -метиленоктагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-(2-гидроксиэтил)аминометилциклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-(2-диметиламиноэтил)аминометилциклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидркси-2β-(циклогексил)аминометилциклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-(пиридин-3-илметил)аминометилциклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-(фурфурил)аминометилциклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-(3-фторфенил)аминометилциклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-(пиридин-3-ил)аминометилциклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-(3-метилфенил)аминометилциклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-(3-фторбензил)аминометилциклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-(1,3-бензодиоксол-5-ил)аминометилциклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-(2-метилпропил)аминометилциклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-(циклогексил)аминометилциклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-(N-фенил-N-метиламино)метилциклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-(пиридин-3-илметил)аминометилциклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-(фурфурил)аминометилциклогексил)-4α-гидрокси-7аβ-
метил-1-метиленоктагидроинлен-ацетат амония;
соль 5-(1β-метил-4β-гидрокси-2β-(2-гидроксиэтил)аминометилциклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-(3-метилфенил)аминометилциклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-(2-(2-диметиламиноэтил)аминоэтил)циклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-(2-(1,3-бензодиоксол-5-ил)аминоэтил)циклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-(2-(циклогексил)аминоэтил)циклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-(2-(3-трифторметилфенил)аминоэтил)циклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден и
соль 5-(1β-метил-4β-гидрокси-2β-(2-(2-метилпропил)аминоэтил)циклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония.
R1 означает -OR7;
R2 означает -R10-N(R7)2;
R3 означает -R10-N(R7)2;
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С16;
либо R4a и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил, или R5 означает прямую связь с углеродом в положении С14;
R6 означает водород или -R8-OR7;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, C1-С6алкил, С3-С7циклоалкил, частично насыщенный или насыщенный C1-С6алкил-С3-С6циклоалкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-C1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2, C1-C6алкил-(6-членный гетероциклил с 1 или 2 гетероатомами, выбранными из О и N, необязательно замещенный C1-С6алкилом), 6-членный гетероарил с 1 атомом азота в качестве гетероатома и C1-С6алкил-(5-6-членный гетероарил с 1 гетероатомом, выбранным из О и N), 9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов и С1-С6алкил-(9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов);
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь;
каждый R9 независимо выбирают из водорода и C1-С6алкила; и
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную C1-С6алкиленовую и линейную или разветвленную С2-С6алкениленовую цепь.
5-(1β-метил-4β-гидрокси-2β-(циклопентил)аминометилциклогексил)-4α-аминометил-7аβ-метил-1-метиленоктагидроинден и
соль 5-(1β-метил-4β-гидрокси-2β-(циклопентил)аминометилциклогексил)-4α-аминометил-7аβ-метил-1-метиленоктагидроинден-диацетат аммония.
R1 означает -N(R7)2;
каждый из R2 и R3 независимо выбирают из группы, включающей R8-OR7, -R8-OC(O)R9, -R10-N(R7)2, R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, C1-С6алкил, С2-С6алкенил, C1-С6алкил-фенил, замещенный галогеном, С2-С6алкенил-фенил,
замещенный -R8-OR7 или галогеном, С1-С6алкил-(5-6-членный насыщенный гетероциклил с 1 или 2 гетероатомами, выбранными из О или N), С1-С6алкил-(5-6-членный гетероарил с 1 или 2 атомами N в качестве гетероатомов) и С2-С6алкенил-(6-членный гетероарил с одним атомом N в качестве гетероатома);
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С16;
либо R4a и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил, или R5 означает прямую связь с углеродом в положении С14;
R6 означает водород или-R8-OR7;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, C1-С6алкил, С3-С7циклоалкил, частично насыщенный или насыщенный C1-С6алкил-С3-С6циклоалкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-C1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2, С1-С6алкил-(6-членный гетероциклил с 1 или 2 гетероатомами, выбранными из О и N, необязательно замещенный C1-С6алкилом), 6-членный гетероарил с 1 атомом азота в качестве гетероатома и C1-С6алкил-(5-6-членный гетероарил с 1 гетероатомом, выбранным из О и N), 9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов и С1-С6алкил-(9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов);
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь;
каждый R9 независимо выбирают из водорода и C1-С6алкила; и
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную C1-С6алкиленовую и линейную или разветвленную С2-С6алкениленовую цепь.
R1 означает -OR7;
R2 означает -R8-OR7;
R3 означает -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), R10-N(R9)C(NR9)N(R9)2;
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С16;
либо R4a и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил, или R5 означает прямую связь с углеродом в положении С14;
R6 означает водород или -R8-OR7;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, C1-С6алкил, С3-С7циклоалкил, частично насыщенный или насыщенный C1-С6алкил-С3-С6циклоалкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-C1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2, С1-С6алкил-(6-членный гетероциклил с 1 или 2 гетероатомами, выбранными из О и N, необязательно замещенный C1-С6алкилом), 6-членный гетероарил с 1 атомом азота в качестве гетероатома и C1-С6алкил-(5-6-членный гетероарил с 1 гетероатомом, выбранным из О и N), 9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов и С1-С6алкил-(9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов);
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь;
каждый R9 независимо выбирают из водорода и C1-С6алкила; и
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную C1-С6алкиленовую и линейную или разветвленную С2-С6алкениленовую цепь.
5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(метилсульфонил)аминометил-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(ацетил)аминометил-7аβ-метил-1-метиленоктагидроинден и
соль 5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(гуанидино)метил-7аβ-метил-1-метиленоктагидроинден-хлорид аммония.
R1 означает -OR7;
R2 выбирают из группы, включающей -R8-OC(O)R9, -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9(где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, C1-С6алкил, С2-С6алкенил, C1-С6алкил-фенил, замещенный галогеном, С2-С6алкенил-фенил, замещенный -R8-OR7 или галогеном, С1-С6алкил-(5-6-членный насыщенный гетероциклил с 1 или 2 гетероатомами, выбранными из О или N), C1-С6алкил-(5-6-членный гетероарил с 1 или 2 атомами N в качестве гетероатомов) и С2-С6алкенил-(6-членный гетероарил с одним атомом N в качестве гетероатома);
R3 означает -R8-OR7 или -R8-OC(O)R9;
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С16;
либо R4a и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил, или R5 означает прямую связь с углеродом в положении С14;
R6 означает водород или -R8-OR7;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, C1-С6алкил, С3-С7циклоалкил, частично насыщенный или насыщенный C1-С6алкил-С3-С6циклоалкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-C1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2, С1-С6алкил-(6-членный гетероциклил с 1 или 2 гетероатомами, выбранными из О и N, необязательно замещенный C1-С6алкилом), 6-членный гетероарил с 1 атомом азота в качестве гетероатома и C1-С6алкил-(5-6-членный гетероарил с 1 гетероатомом, выбранным из О и N), 9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов и С1-С6алкил-(9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов);
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь;
каждый R9 независимо выбирают из водорода и C1-С6алкила; и
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную C1-С6алкиленовую и линейную или разветвленную С2-С6алкениленовую цепь.
соль 5-(1β-метил-4β-гидрокси-2β-(пирролидин-1-ил)метилциклогексил)-4α-гидрокси-7аβ-метил- 1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-(2-(4-хлорфенил)этил)циклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
соль 5-(1β-метил-4β-гидрокси-2β-(2-пиридин-3-илэтил)циклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония;
5-(1β-метил-4β-гидрокси-2β-этилциклогексил)-4α-гидрокси-7аβ-метил-1 -метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-(2-(4-этоксифенил)эт-1-ен-1-ил)циклогексил)-4α-ацетокси-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-(2-(пиридин-2-ил)эт-1-ен-1-ил)циклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-(2-(пиридин-3-ил)эт-1-ен-1-ил)циклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-(гепт-1-ен-1-ил)пиклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-(2-(4-хлорфенил)этенил)циклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-(3-(4-хлорфенил)проп-2Z-ен-1-ил)циклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-4β-гидрокси-2β-(3-(4-хлорфенил)проп-2Е-ен-1-ил)пиклогексил)-4α-гидрокси-7aβ-метил-1-метиленоктагидроинден;
соль 5-(1β-метил-4β-гидрокси-2β-(пирролидин-1-ил)метилциклогексил)-4α-гидроксиметил-7аβ-метил-1-метиленоктагидроинден-ацетат аммония и
соль 5-(1β-метил-4β-гидрокси-2β-(морфолин-4-ил)метилциклогексил)-4α-гидрокси-7аβ-метил-1-метиленоктагидроинден-ацетат аммония.
R1 означает -OR7;
R2 означает -R8-OR7;
R3 означает С1-С6алкил-(5-6-членный насыщенный гетероциклил с 1 или 2 гетероатомами, выбранными из О или N), С1-С6алкил-(5-6-членный гетероарил с 1 или 2 атомами N в качестве гетероатомов) и С2-С6алкенил-(6-членный гетероарил с одним атомом N в качестве гетероатома);
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С 16;
либо R4a и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил, или R5 означает прямую связь с углеродом в положении С14;
R6 означает водород или -R8-OR7;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, C1-С6алкил, С3-С7циклоалкил, частично насыщенный или насыщенный C1-С6алкил-С3-С6циклоалкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-C1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2, С1-С6алкил-(6-членный гетероциклил с 1 или 2 гетероатомами, выбранными из О и N, необязательно замещенный C1-С6алкилом), 6-членный гетероарил с 1 атомом азота в качестве гетероатома и C1-С6алкил-(5-6-членный гетероарил с 1 гетероатомом, выбранным из О и N), 9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов и С1-С6алкил-(9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов);
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь;
каждый R9 независимо выбирают из водорода и C1-С6алкила; и
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную C1-С6алкиленовую и линейную или разветвленную С2-С6алкениленовую цепь.
5-(1β-метил-4β-гидрокси-2β-гидроксиметилциклогексил)-4α-(имидазол-1-ил)метил-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(3-пиридин-3-илпроп-2Z-ен-1-ил)-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(3-пиридин-3-илпроп-2Е-ен-1-ил)-7аβ-метил-1-метиленоктагидроинден;
5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-пирролидин-1-илэтил)-7аβ-метил-1-метиленоктагидроинден и
соль 5-(1β-метил-2β,4β-дигидроксициклогексил)-4α-(2-пирролидин-1-илэтил)-7аβ-метил-1 -метиленоктагидроинден-ацетат аммония.

где кольцо А, С или D независимо является полностью или частично насыщенным;
каждый из C1, C4, С11, С12, С15 и С16 независимо замещен двумя атомами водорода;
каждый из С9 и С14 независимо замещен атомом водорода;
R1 означает -OR7 или -N(R7)2;
каждый из R2 и R3 независимо выбирают из группы, включающей -R8-OR7, -R8-OC(O)R9, -R10-N(R7)2, -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, C1-С6алкил, С2-С6алкенил, C1-С6алкил-фенил, замещенный галогеном, С2-С6алкенил-фенил, замещенный -R8-OR7 или галогеном, С1-С6алкил-(5-6-членный насыщенный гетероциклил с 1 или 2 гетероатомами, выбранными из О или N), С1-С6алкил-(5-6-членный гетероарил с 1 или 2 атомами N в качестве гетероатомов) и С2-С6алкенил-(6-членный гетероарил с одним атомом N в качестве гетероатома);
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С16;
либо R4a и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил, или R5 означает прямую связь с углеродом в положении С14;
R6 означает водород или -R8-OR7;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, C1-С6алкил, С3-С7циклоалкил, частично насыщенный или насыщенный C1-С6алкил-С3-С6циклоалкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-C1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2, С1-С6алкил-(6-членный гетероциклил с 1 или 2 гетероатомами, выбранными из О и N, необязательно замещенный C1-С6алкилом), 6-членный гетероарил с 1 атомом азота в качестве гетероатома и C1-С6алкил-(5-6-членный гетероарил с 1 гетероатомом, выбранным из О и N), 9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов и С1-С6алкил-(9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов);
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь;
каждый R9 независимо выбирают из водорода и C1-С6алкила; и
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную C1-С6алкиленовую и линейную или разветвленную С2-С6алкениленовую цепь;
в виде отдельного стереоизомера, смеси стереоизомеров или рацемической смеси стереоизомеров;
или фармацевтически приемлемую соль указанного соединения.

где кольцо А, С или D независимо является полностью или частично насыщенным;
каждый из C1, C4, С11, С12, С15 и С16 независимо замещен двумя атомами водорода;
каждый из С9 и С14 независимо замещен атомом водорода;
R1 означает -OR7 или -N(R7)2;
каждый из R2 и R3 независимо выбирают из группы, включающей -R8-OR7, -R8-OC(O)R9, -R10-N(R7)2, -R10-N(R9)C(O)R9, -R10-N(R9)S(O)tR9 (где t равно 1 или 2), -R10-N(R9)C(NR9)N(R9)2, C1-С6алкил, С2-С6алкенил, C1-С6алкил-фенил, замещенный галогеном, С2-С6алкенил-фенил, замещенный -R8-OR7 или галогеном, С1-С6алкил-(5-6-членный насыщенный гетероциклил с 1 или 2 гетероатомами, выбранными из О или N), С1-С6алкил-(5-6-членный гетероарил с 1 или 2 атомами N в качестве гетероатомов) и С2-С6алкенил-(6-членный гетероарил с одним атомом N в качестве гетероатома);
каждый из R4a и R4b независимо выбирают из водорода и С2-С6алкенила;
либо R4a означает водород, и R4b означает прямую связь с углеродом в положении С16;
либо R4a и R4b вместе образуют C1-С6алкилиден или галоген-С1-С6алкилиден;
R5 означает C1-С6алкил, или R5 означает прямую связь с углеродом в положении С14;
R6 означает водород или -R8-OR7;
каждый R7 независимо выбирают из группы, включающей водород, -R10-OR9, -R10-N(R9)2, C1-С6алкил, С3-С7циклоалкил, частично насыщенный или насыщенный C1-С6алкил-С3-С6циклоалкил, фенил, необязательно замещенный C1-С6алкилом, галогеном или галоген-C1-С6алкилом, C1-С6алкил-фенил, необязательно замещенный галогеном или NO2, С1-С6алкил-(6-членный гетероциклил с 1 или 2 гетероатомами, выбранными из О и N, необязательно замещенный C1-С6алкилом), 6-членный гетероарил с 1 атомом азота в качестве гетероатома и C1-С6алкил-(5-6-членный гетероарил с 1 гетероатомом, выбранным из О и N), 9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов и С1-С6алкил-(9-членный гетероарил с 2 атомами кислорода в качестве гетероатомов);
каждый R8 независимо выбирают из группы, включающей прямую связь, линейную или разветвленную C1-С6алкиленовую цепь и линейную или разветвленную С2-С6алкениленовую цепь;
каждый R9 независимо выбирают из водорода и C1-С6алкила; и
каждый R10 независимо выбирают из группы, включающей линейную или разветвленную C1-С6алкиленовую и линейную или разветвленную С2-С6алкениленовую цепь;
в виде отдельного стереоизомера, смеси стереоизомеров или рацемической смеси стереоизомеров;
или фармацевтически приемлемой соли указанного соединения
для получения лекарственного средства, обладающего противовоспалительной активностью.
Документы, цитированные в отчёте о поиске
Аналоги витамина d3, способ их получения и фармацевтический препарат
Патенты аналоги
Indene derivatives as pharmaceutical agents
Indene derivatives as pharmaceutical agents
Indene derivatives as pharmaceutical agents
ПРОИЗВОДНЫЕ ИНДЕНА В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ
Indene derivatives as pharmaceutical agents
Indene derivatives as pharmaceutical agents
Indene derivatives as pharmaceutical agents
INDENE DERIVATIVES AS PHARMACEUTICAL AGENTS
Indene derivatives as pharmaceutical agents
INDENE DERIVATIVES AS PHARMACEUTICAL AGENTS
INDENE DERIVATIVES AS PHARMACEUTICAL AGENTS
Indene derivatives as pharmaceutical agents
INDENE DERIVATIVES AS PHARMACEUTICAL AGENTS

Комментарии