Лекарственное средство от отравлений - RU2465893C2
Код документа: RU2465893C2
Чертежи




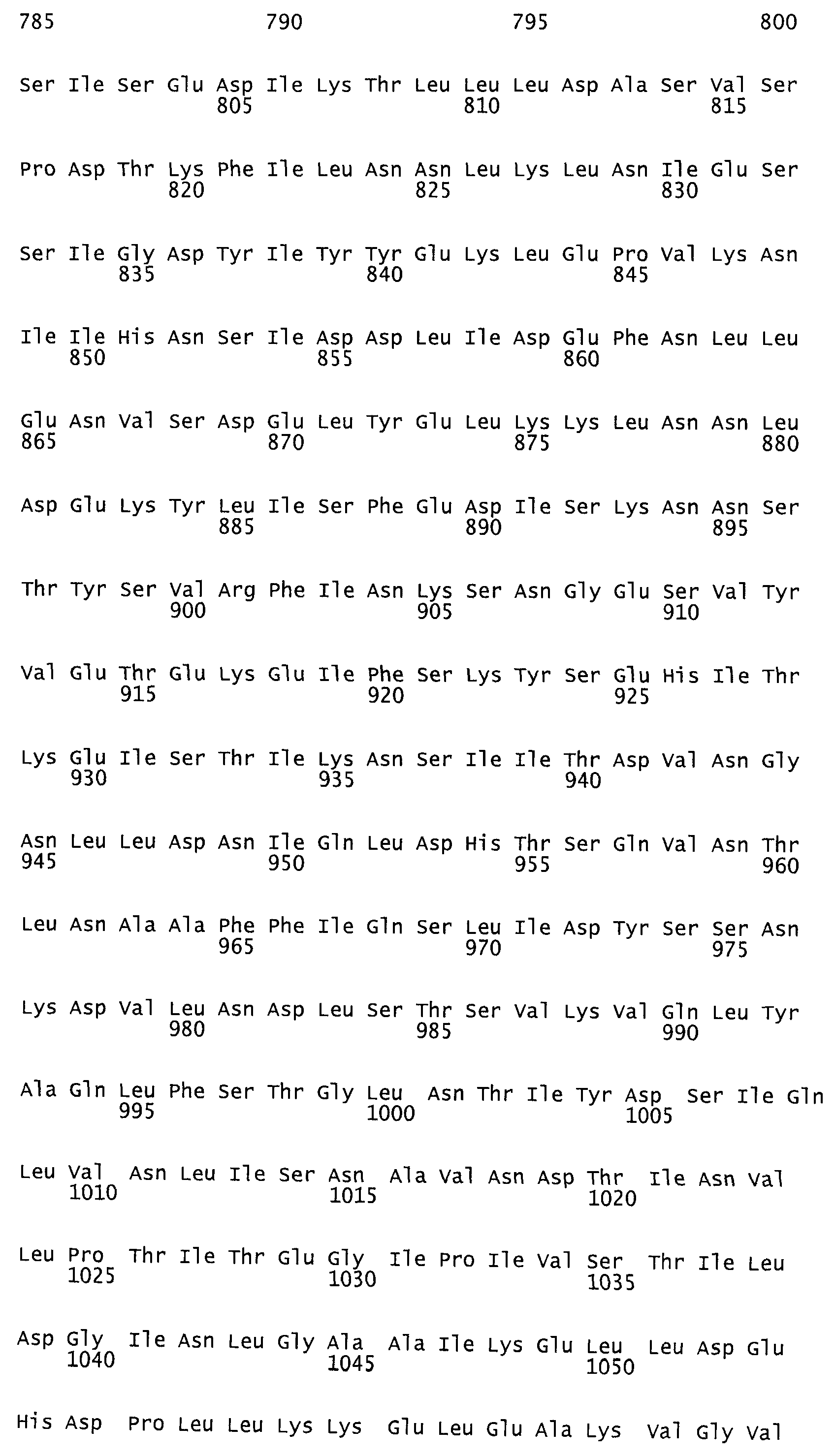

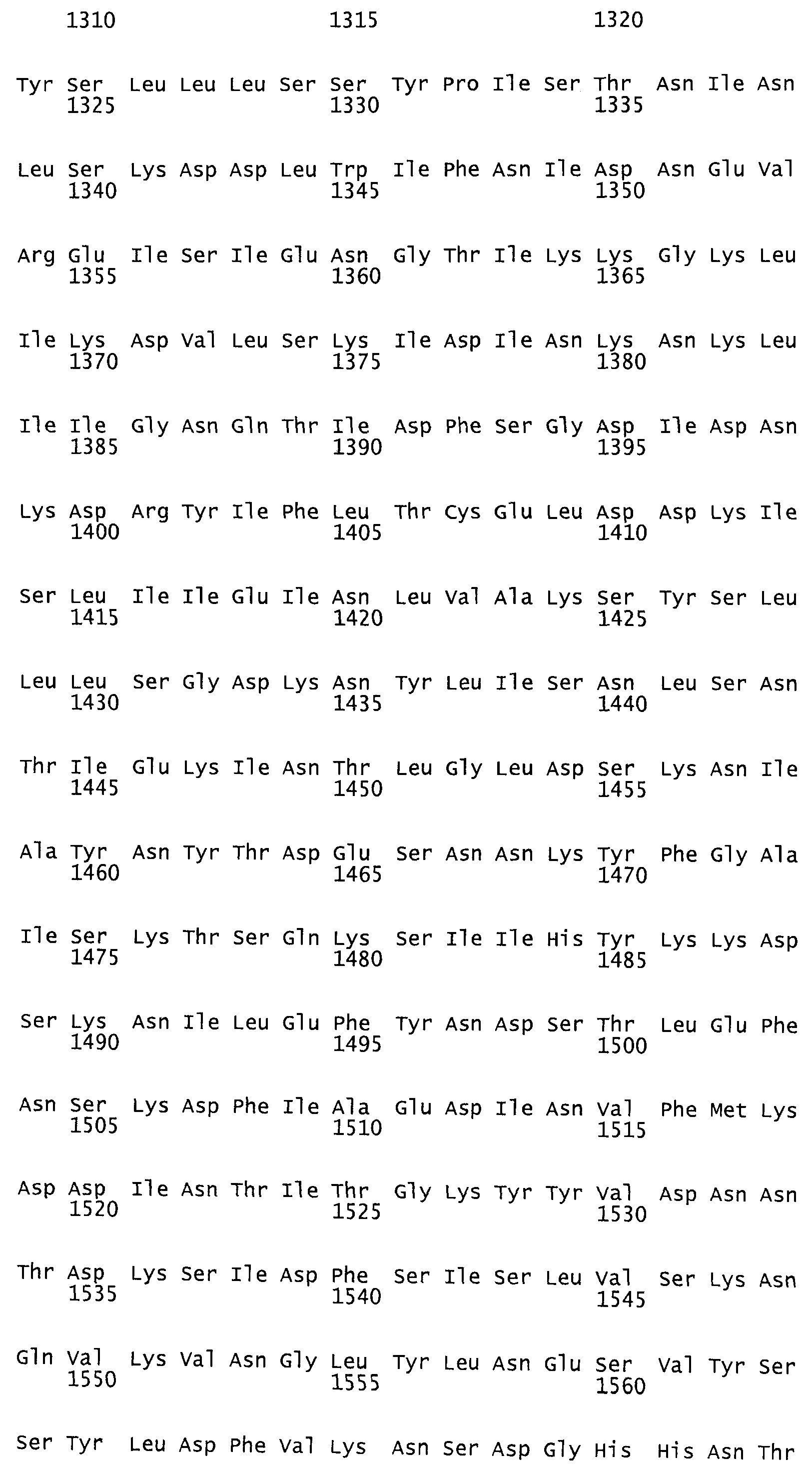


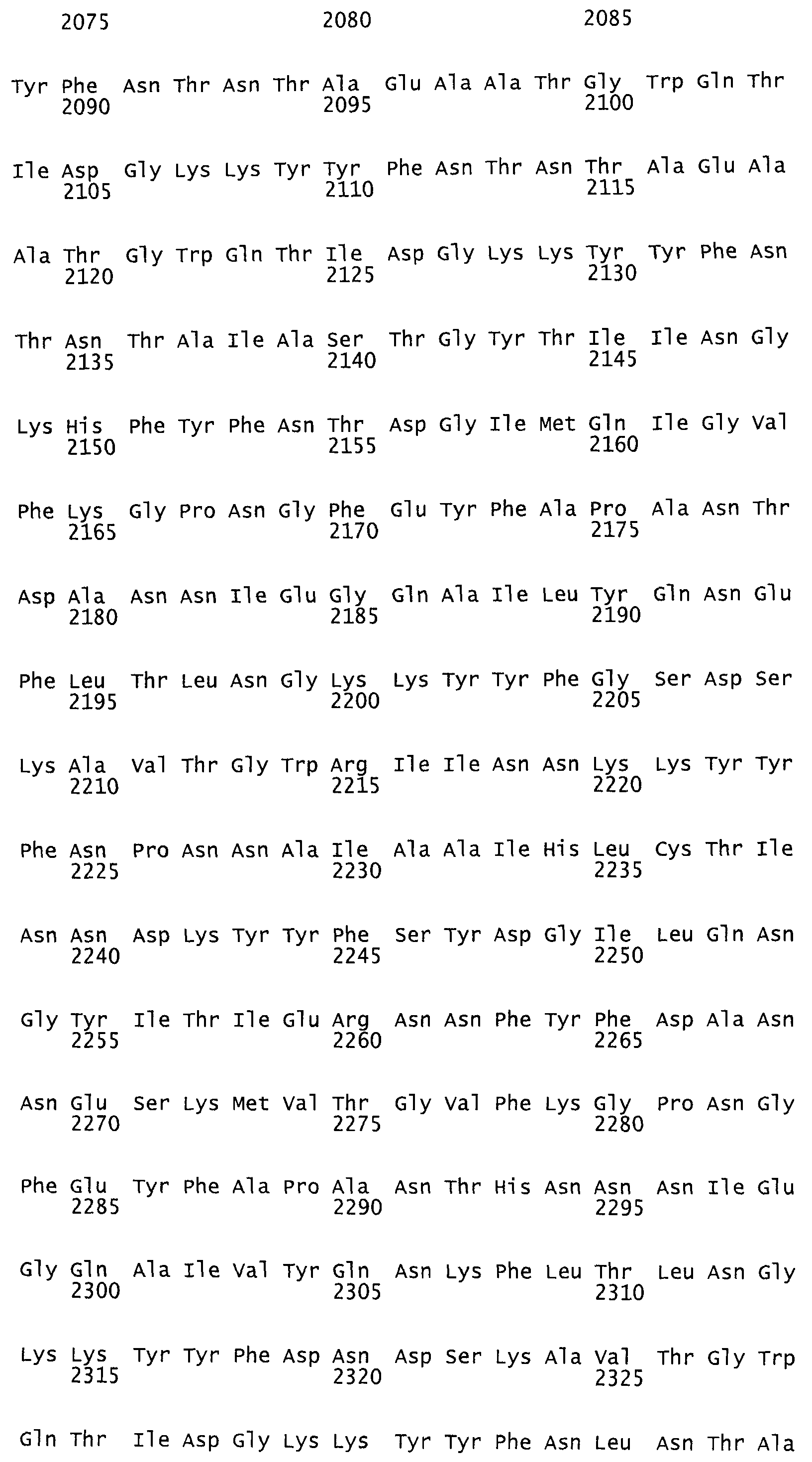










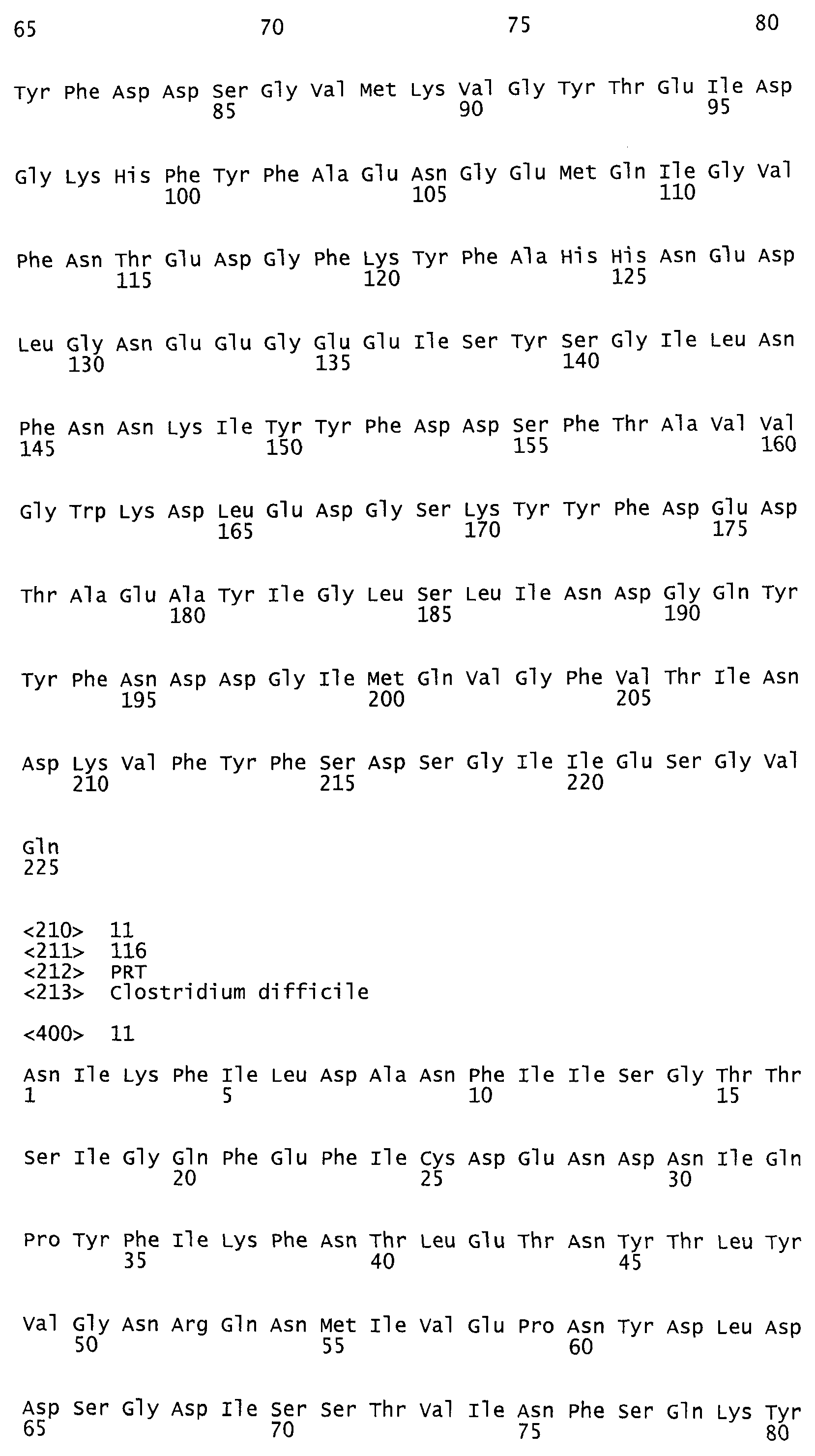




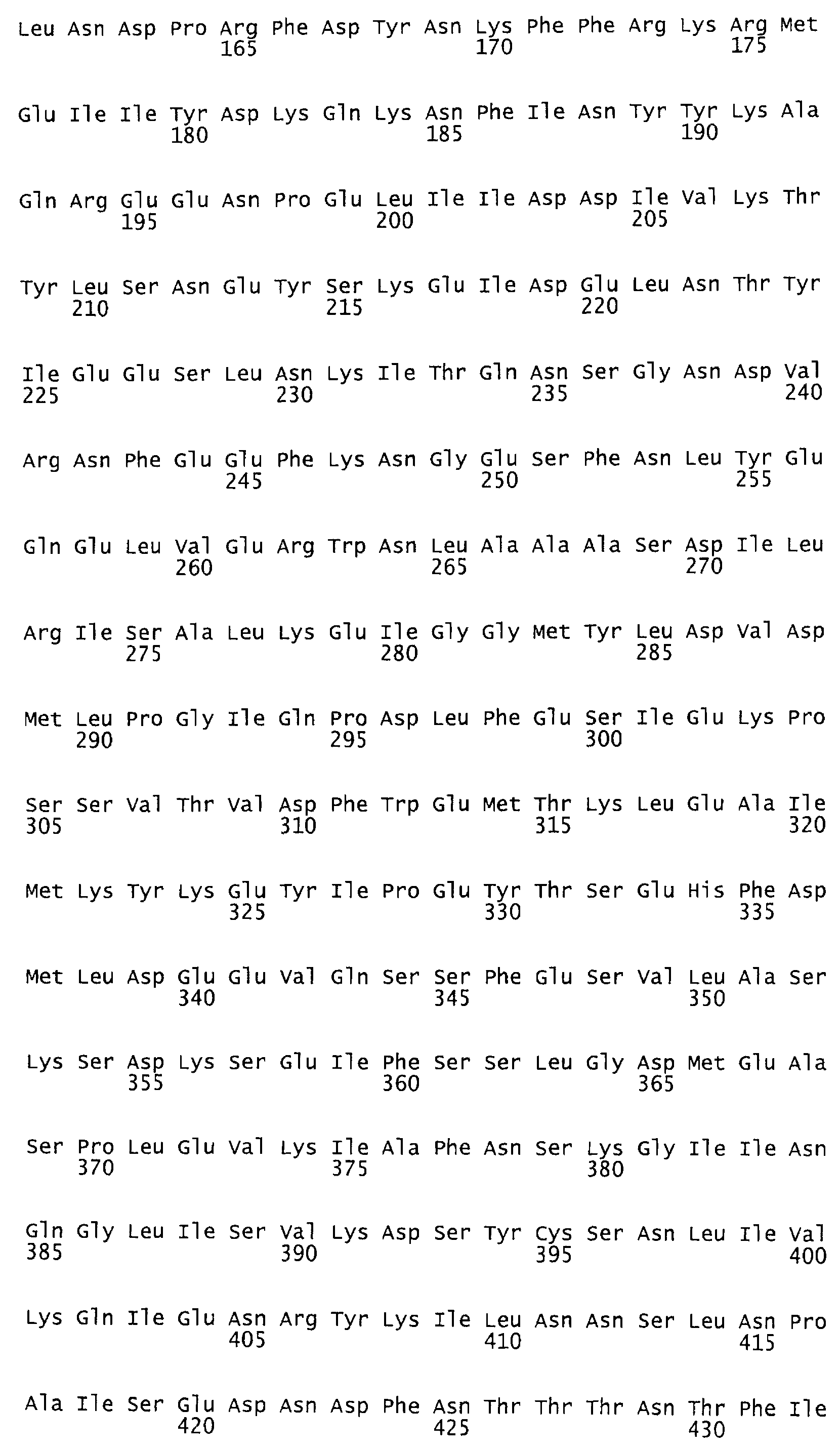
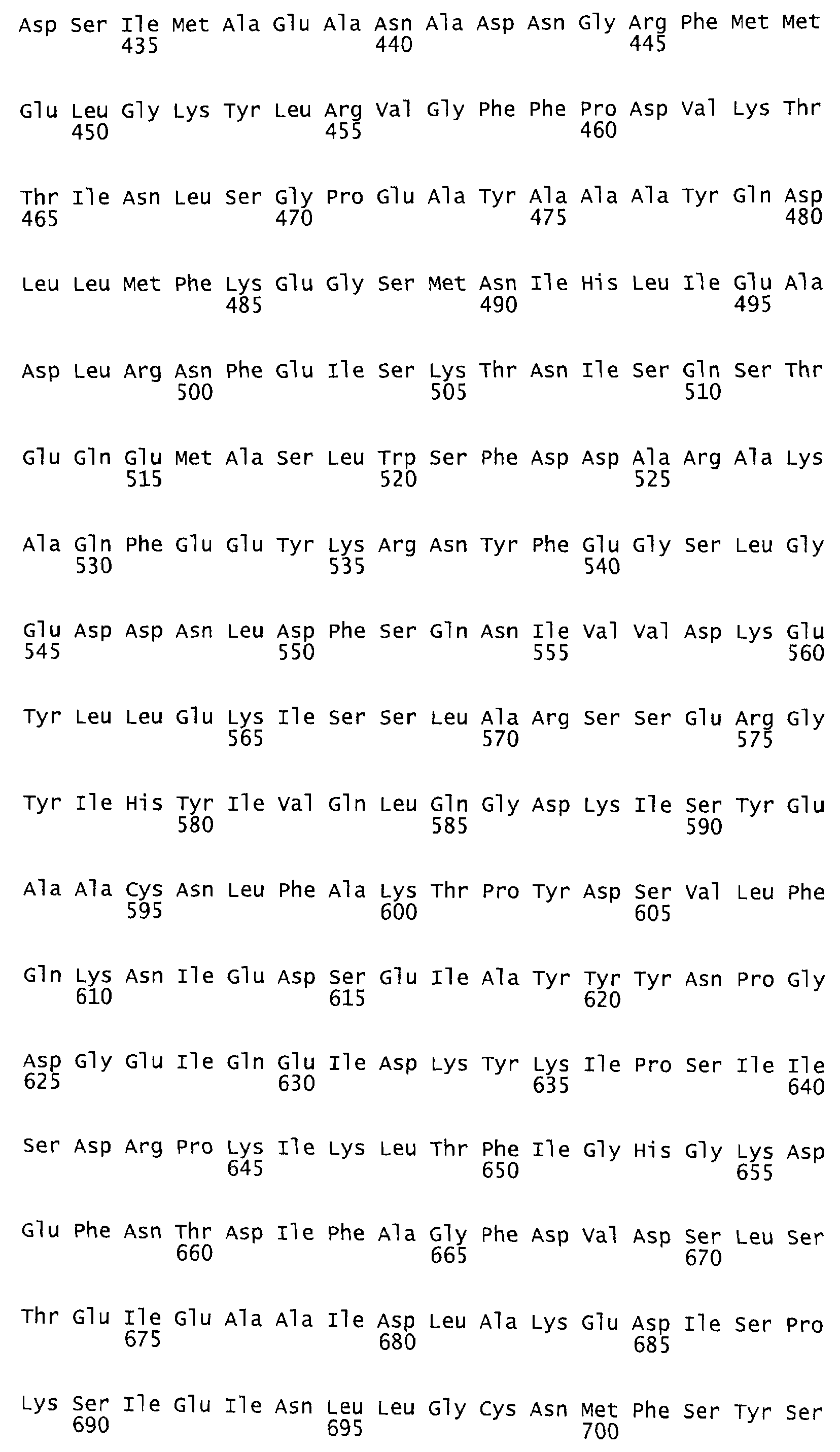































Описание
Область техники, к которой относится изобретение
Изобретение относится к лекарственному средству для предупреждения или ослабления отравления большими клостридиальными цитотоксинами (LCT), в частности токсинами А, В (TcdA, TcdB) Clostridium difficile, летальным токсином (TcsL) Clostridium sordellii и α-токсином (Tcnα) Clostridium novyi.
Уровень техники
Токсин Clostridium difficile представляет собой грамположительный микроорганизм, развивающийся в строго анаэробных условиях и образующий споры, идентифицированный лишь в конце 70-х годов в качестве этиологического фактора ассоциированной с антибиотиками диареи и псевдомембранного колита. С 90-х годов Clostridium difficile считается наиболее значительным больничным инфекционным началом в развитых странах. Следствием постоянно возрастающего применения антибиотиков широкого спектра явился неуклонный рост инциденции вызванных Clostridium difficile инфекций прежде всего у больных в стационарных условиях лечения.
За ассоциированные с Clostridium difficile заболеваниями ответственны экзотоксины А (TcdA) и В (TcdB), продуцируемые Clostridium difficile. Существуют разные штаммы с разной вирулентностью и выработкой токсинов. Приблизительно четверть всех штаммов токсины не вырабатывают. Образующие токсины штаммы почти всегда продуцируют указанные оба вида токсина. TcdA представляет собой энтеротоксин, который вследствие цитотоксического повреждения энтероцитов повышает проницаемость слизистой оболочки кишечника, вызывая тем самым диарею. TcdB является цитотоксином, нарушающим перенос электролита и вызывающим потерю жидкости и функциональные нарушения в работе кишечника. Токсины TcdA и TcdB относятся к группе так называемых больших клостридиальных цитотоксинов (LCT) и состоят соответственно из пептидной цепи с тремя функциональными доменами, а именно С-терминального домена, ответственного за прикрепление токсина к мембране клетки хозяина, гидрофобного среднего домена, (совместно) ответственного за процесс транслокации через клеточные мембраны, и N-терминального домена, выполняющего функцию гликозилтрансферазы и придающего молекуле токсическую активность.
И хотя в механизме проникания токсинов в клетку хозяина еще не все ясно, однако фактом является то, что после своего прикрепления к рецептору клетки хозяина посредством эндоцитоза токсины поступают в эту клетку и что для проявления своей токсичности N-терминальные каталитические домены отщепляются и перемещаются в цитозоль клетки хозяина. Здесь каталитический домен специфически гликозилирует ГТФазы подсемейства Rho (Rho, Rac и Cdc42), которые в свою очередь участвуют во множестве каскадов для трансдукции сигналов, и блокирует таким образом процессы трансдукции сигналов, что в конечном итоге ведет к распаду цитоскелета и гибели клетки.
Поэтому в уровне техники до настоящего времени исходили из того, что клеточная протеаза катализирует отщепление каталитического N-терминального домена пептидных цепей токсинов TcdA и TcdB, а также других «больших клостридиальных цитотоксинов» (LCT) (Rupnik и др., 2005, и Pfeiffer и др., 2003). Однако соответствующего подтверждения не представлено.
Раскрытие изобретения
В ходе исследований, которые легли в основу настоящего изобретения, неожиданно было установлено, что расщепление TcdA и TcdB представляет собой автокаталитический процесс, инициируемый инозитолфосфатом (IP) и что, следовательно, токсины Clostridium difficile наряду с их каталитической функцией гликозилтрансферазы выполняют еще функцию протеазы для саморасщепления или автокаталитического расщепления.
Такая функция протеазы идентифицирована как аспартат-протеаза. Каталитическим центром функции протеазы идентифицирована протеиновая область, содержащая аминокислотную последовательность в аминокислотном положении от AS 1653 до AS 1678 токсина TcdB согласно последовательности №P18177 (SwissProt/TrEMBL). Мотив DXG (Rao и др., 1998), характерный для аспартат-протеазы, находится в аминокислотном положении 1665. В качестве места связывания была идентифицирована протеиновая область, содержащая аминокислотную последовательность в положении от AS 1517 до AS 2142 протеина токсина TcdB согласно последовательности №Р18177 (SwissProt/TrEMBL). Такая аминокислотная последовательность представляет собой мотив инозин-5-монофосфат-дегидрогеназы, состоящий из двух участков: AS 1517 - AS 1593 и AS 1918 - AS 2142, разделенных протеиновым участком длиной 325 аминокислот без гомологии последовательностей.
При лечении больных, инфицированных Clostridium difficile, сначала отменяют, насколько это возможно, антибиотик, явившийся причиной инфекции. Последующее лечение проводится исключительно симптоматично. При продолжительном или тяжелом протекании болезни, а также в том случае, когда отмена соответствующего антибиотика не представляется возможной по другим причинам, для лечения назначается метрондиазол или ванкомицин.
Недостатки практикуемой антимикробной терапии многообразны. Решающее значение при этом имеет, прежде всего, то обстоятельство, что болезнь, спровоцированная антибиотиками при лечении другой инфекции, не поддается эффективной антимикробной терапии. Это объясняется тем, что токсин Clostridium difficile в кишечнике здорового человека встречается относительно редко и не может развиться в нормальной флоре кишечника. В случае нарушения нормальной флоры кишечника в ходе лечения антибиотиками Clostridium difficile может развиться и эффективно заселить кишечник. Применение антибиотиков против Clostridium difficile снова ведет к разрушению флоры кишечника и служит причиной, препятствующей восстановлению здоровой флоры этого кишечника. Этим объясняется также большое количество ремиссий, наблюдаемых по окончании антимикробной терапии. Дополнительным недостатком принятой терапии является появление в последнее время возрастающего количества мультирезистентных штаммов Clostridium difficile. Это угрожает тем, что этот до настоящего времени единственный способ лечения заболеваний, инфицированных Clostridium difficile, становится бесполезным и количество смертельных случаев, вызванных Clostridium difficile, возрастает. Кроме того, необходимые для лечения вызванной Clostridium difficile инфекции антибиотики, являются очень дорогими и применяются обычно лишь в обоснованных случаях в качестве резервных.
Поэтому существует острая потребность в медикаментах, пригодных для подавления (предупреждения, устранения, облегчения) вызванных токсинами Clostridium difficile инфекций с исключением риска развития резистентности клостридиев или же других бактерий, а также без повреждения естественной бактериальной флоры у соответствующих пациентов, в частности флоры кишечника.
Задачей настоящего изобретения является создание такого медикамента.
Решение этой задачи заключается в создании лекарственного средства упомянутого выше типа, характеризующегося тем, что оно содержит в качестве активного вещества, по меньшей мере, один эффектор, а именно ингибитор или активатор автокаталитической активности протеазы больших клостридиальных цитотоксинов (LCT), в частности автокаталитической активности протеазы токсина A (TcdA) Clostridium difficile, и/или токсина В (TcdB) Clostridium difficile, и/или летального токсина (TesL) Clostridium sordellii, и/или α-токсина (Tcnα) Clostridium novyi.
В качестве эффекторов автокаталитической активности протеазы цитотоксинов LCT ниже обозначены активаторы и ингибиторы автокаталитической активности протеазы цитотоксинов LCT.
Если активным веществом или эффектором выступает ингибитор, то его антитоксическое действие обусловлено тем, что он снижает активность протеазы неповрежденного токсина, в частности токсина TcdB, или TcdA, или TesL, или Tenα, и тем самым предупреждает отщепление цитотоксически эффективного фрагмента с функцией глюкозилтрансферазы (в случае TcdB и TcdA им является фрагмент 63 кДа).
Пригодными для применения ингибиторами являются химические вещества, ингибирующие активность протеазы токсинов.
Понятие «химическое вещество» включает в себя, здесь и далее, как неорганические, так и органические соединения, ионы и пептиды или протеины.
Предпочтительными ингибиторами служат такие химические вещества, которые необратимо ингибируют активность протеазы. Примером может служить вещество 1,2-эпокси-3-(р-нитрофенокси)-пропан (EPNP). Это вещество вступает в необратимую реакцию с остатками аспартата в каталитическом центре протеаз и таким образом ингибирует протеолитическое действие. Другие ингибиторы протеазы известны среднему специалисту и могут быть им легко идентифицированы с помощью известных методов (компьютерное моделирование, высокоэффективная рентгеноскопия). Например, для проведения «высокоэффективной рентгеноскопии» может быть синтезирован пептид, последовательность аминокислот которого соответствует последовательности места расщепления протеазы цитотоксинов LCT. В результате соединения этого пептида, например, с красителем АМС (7-амино,4-метил-кумарином) с помощью известных специалисту методов может быть создан зонд. Затем для проведения «высокоэффективной рентгеноскопии» маркированный зонд соединяют с токсином и веществами-кандидатами. Если зонд расщепляется, то это ведет к изменениям спектра флуоресценции. Такие изменения легко регистрируются хорошо известными специалисту методами (детекторами флуоресценции). Смеси, в которых не наблюдается изменения спектра флюоресценции, содержат, следовательно, потенциальные ингибиторы протеазы. В качестве примера следует описать еще один способ идентификации веществ, влияющих на повышение автокаталитической активности протеазы цитотоксинов LCT. Для этого могут применяться голотоксин или соответствующие фрагменты токсина, которые связаны, например, с красителем, флуоресценция которого затухает в нерасщепленном токсине или его фрагменте. В результате автокаталитического расщепления токсина или его фрагментов исключается эффект затухания. Как уже указывалось, изменения в спектре флуоресценции могут легко регистрироваться.
Особо пригодными ингибиторами, т.е. эффекторами с ингибирующей функцией, являются химические вещества, в частности протеины, из них, прежде всего, антитела, снижающие автокаталитическую активность протеазы цитотоксинов LCT и взаимодействующие с активным центром протеазы.
Выражение «взаимодействовать» означает в данном контексте любой тип взаимодействия между цитотоксинами LCT и химическим веществом, в частности протеином, и включает в себя, в частности, ковалентные связи, как, например, дисульфидные связи, и нековалентные связи, как, например, силы Ван-дер-Вальса, гидрофобные или электростатические взаимодействия, а также связи в виде водородных мостиков.
Предпочтительными являются при этом протеины, из них, прежде всего, антитела, взаимодействующие с протеиновой областью токсина TcdB от AS 1500 до AS 1800, в частности от AS 1653 до AS 1678, и, прежде всего, с мотивом DXG в положении 1665, согласно аминокислотной последовательности токсина TcdB, №Р18177 (SwissProt/TrEMBL), или же с эквивалентными или гомологичными протеиновыми областями токсина TcdA, или TcsL, или Tcnα. При этих эквивалентных или гомологичных протеиновых областях речь идет в случае с TcdA об участке аминокислотной последовательности от AS 1651 до AS 1675 согласно аминокислотной последовательности токсина TcdA, №Р16154 (SwissProt/TrEMBL) с мотивом DXG в аминокислотном положении AS 1662, в случае же с токсином TcsL - об участке аминокислотной последовательности от AS 1654 до AS 1679 согласно аминокислотной последовательности токсина TcsL, №Q46342 (SwissProt/TrEMBL) с мотивом DXG в аминокислотном положении AS 1666 и в случае с токсином Tcnα - об участке аминокислотной последовательности от AS 1641 до AS 1665 согласно аминокислотной последовательности токсина Tcnα №46149 (SwissProt/TrEMBL).
Другими пригодными к применению ингибиторами (эффекторами с ингибирующей функцией) служат химические вещества, в частности протеины, из них, прежде всего, антитела, которые снижают автокаталитическую активность протеазы цитотоксинов LCT, при этом они ингибируют взаимодействие между инозитолфосфатом и токсином. Поскольку связь с IP исключена, то не происходит протеолитического расщепления токсинов.
При этом предпочтительными являются протеины, из них, прежде всего, антитела, взаимодействующие с протеиновой областью токсина TcdB от AS 1400 до AS 2300, в частности от AS 1517 до AS 2142 и, прежде всего, от AS 1517 до AS 1593 или от AS 1918 до AS 2142, соответственно аминокислотной последовательности токсина TcdB №P18177 (SwissProt/TrEMBL), или же с эквивалентными или гомологичными протеиновыми областями токсинов TcdA, или TcsL, или Tcnα.
Столь же успешно могут быть генерированы антитела или другие протеины, которые не взаимодействуют непосредственно с местом связывания инозитолфосфата, в частности с указанными выше протеиновыми областями, а направлены в сторону смежных областей, стерически препятствуют связи с IP, предотвращая тем самым протеолитическое расщепление токсинов. Кроме того, могут быть генерированы антитела и другие протеины, которые непосредственно не взаимодействуют с мотивом DXG функции протеазы цитотоксинов LCT, а препятствуют протеолитическому расщеплению за счет связи на смежных участках протеина.
Пригодными ингибиторами (эффекторами с ингибирующей функцией) служат также структурные аналоги инозитолфосфата (IP), в частности инозитолгексафосфата (IP6), которые вместо IP и, в частности, IP6 могут занимать места реакционного связывания цитотоксинов LCT, в частности токсина TcdA, и/или TcdB, и/или TcsL, и/или Tcnα, однако они не обладают инициаторной функцией, присущей IP или IP6. Такие структурные аналоги являются, следовательно, антагонистами по отношению к агонистам IP (в частности, IP6) и вызывают состязательное снижение активности протеазы цитотоксина LCT, в частности токсина TcdA, и/или TcdB, и/или TcsL, и/или Tcnα. Пригодные для применения структурные аналоги известны среднему специалисту и могут быть легко идентифицированы хорошо известными специалисту способами испытания (соответствующие примеры приведены выше).
Пригодными ингибиторами служат, кроме того, замедлители инозитолфосфата (синонимы: замедлитель инозитолфосфата и ингибитор инозитолфосфата), т.е. такие замедлители, которые связывают или модифицируют инозитолфосфат и, в частности, инозитолгексафосфат таким образом, что они теряют свою способность к инициированию активности протеазы цитотоксинов LCT, в частности токсина TcdA, и/или TcdB, и/или TcsL, и/или Tcnα. Примером таких веществ могут служить двухвалентные ионы, такие как Са2+, образующие вместе с IP6 нерастворимые комплексы. Подобные вещества специалисту известны или могут быть легко идентифицированы известными ему способами испытания (примеры приведены выше).
Другими пригодными ингибиторами (эффекторами с ингибирующей функцией) являются химические вещества, подавляющие образование инозитолфосфатов в просвете кишки пациентов (млекопитающих, в частности людей) или в соматических клетках пациентов (млекопитающих, в частности людей) или разрушающие уже имеющийся инозитолфосфат и препятствующие таким образом протеолитическому расщеплению цитотоксинов LCT при внедрении в цитоплазму. Предпочтительными примерами такого вещества служат литий, VPA (Valproic acid) или CBZ (карбамазепин).
Пригодными активаторами, т.е. эффекторами с функцией активатора, являются химические вещества, повышающие активность протеазы токсинов. Антитоксическое действие активатора основано на том, что он инициирует активность протеазы неповрежденного токсина, в частности токсина TcdA, и/или TcdB, и/или TcsL, и/или Tcnα, еще до того, как токсин присоединится к клетке хозяина так, чтобы расщепленный фрагмент мог бы проникнуть внутрь клетки (цитозол). Следовательно, активатор вызывает отщепление цитотоксически эффективного фрагмента с функцией глюкозилтрансферазы (в случае с TcdB и TcdA им является фрагмент 63 кДа) вне клетки хозяина. После этого цитотоксически эффективный фрагмент не может более попасть внутрь клетки и проявить в ней свое цитотоксическое действие.
Особенно пригодным активатором (эффектором с функцией активатора) является изолированный инозитолфосфат (IP) (в отличие от цитозолического), преимущественно инозитолгексафосфат (IP6). Медикамент с таким активным началом обладает тем преимуществом, что присутствующий в кишечнике пациента цитотоксин LCT, в частности токсин TcdA, и/или TcdB, и/или TcsL, и/или Tcnα, под действием медикаментозно введенного IP претерпит расщепление уже в кишечнике, т.е. еще до того, как он соединится с клетками кишечника или другими соматическими клетками и произведет токсическое действие.
Столь же успешно может применяться в качестве активатора (эффектора с функцией активатора) вещество, повышающее аналогично IP6 автокаталитическую активность протеазы цитотоксина LCT, в частности токсина TcdA, и/или TcdB, и/или TcsL, и/или Tcnα.
Такие вещества специалисту известны и могут быть легко идентифицированы известными методами. Дополнительно пригодны для этого также модифицированные варианты описанных выше «высокоэффективных способов анализа» (High-Troughput-Assays). При этом объединяют токсин и потенциальные вещества-активаторы и в последующем исследуют на изменения спектра флуоресценции. Смеси, в которых произошли большие изменения в течение короткого времени, содержат пригодные активаторы (эффекторы с функцией активатора).
Согласно изобретению каталитические центры функции протеазы цитотоксинов LCT могут также использоваться в качестве целенаправленно назначаемых антигенов (вакцин) для образования иммунитета к токсинам. Поэтому объектом настоящего изобретения является также лекарственное средство для предупреждения или ослабления отравления цитотоксинами LCT, отличающееся тем, что оно может назначаться в качестве вакцины и что оно содержит аминокислотную последовательность каталитического центра токсина TcdA, и/или TcdB, и/или TcsL, и/или Tcnα полностью или фрагментарно в виде антигенного активного вещества (веществ). Антигенное вещество (вещества) выбирается предпочтительно из группы следующих протеиновых фрагментов:
- мотив DXG в положении 1665 аминокислотной последовательности токсина TcdB, №Р18177 (SwissProt/TrEMBL),
- положения от AS 1653 до AS 1678 аминокислотной последовательности токсина TcdB, №Р18177 (SwissProt/TrEMBL),
- положения от AS 1500 до AS 1800 аминокислотной последовательности токсина TcdB, №Р18177 (SwissProt/TrEMBL),
- мотив DXG в положении 1662 аминокислотной последовательности токсина TcdA, №Р16154 (SwissProt/TrEMBL),
- положения от AS 1651 до AS 1675 аминокислотной последовательности токсина TcdA, №Р16154 (SwissProt/TrEMBL),
- мотив DXG в положении 1666 аминокислотной последовательности токсина TcsL, №Q46342 (SwissProt/TrEMBL),
- положения от AS 1654 до AS 1679 аминокислотной последовательности токсина TcsL, №Q46342 (SwissPro/TrEMBL),
- положения от AS 1641 до AS 1665 аминокислотной последовательности токсина Tcnα, №Q46149 (SwissPro/TrEMBL).
Ниже изобретение подробнее поясняется с помощью примеров выполнения и фигур. При этом изображено на:
фиг.1 - расщепление голотоксина TcdB10463 (270 кДа) на домены транслокации/лиганды (207 кДа) и N-терминальные каталитические домены (63 кДа) посредством электрофореза в ПААГ в присутствии додецилсульфата натрия, произведенное с помощью:
a) смеси, состоящей из маркированного посредством Су3 токсина TcdB10463 и экстракта клеток свиной селезенки (пример 1А);
b) смеси, состоящей из маркированного посредством Су3 токсина TcdB10463 и не содержащего протеин экстракта клеток свиной селезенки (пример 1 В);
c) смеси, состоящей из маркированного посредством Су3 токсина TcdB10463 и инозитолфосфата;
d) смеси, состоящей из не маркированного токсина TcdB10463 и инозитолфосфата;
e) смеси, состоящей из не маркированного (очищенного посредством аффинной хроматографии) токсина TcdB10463 и инозитолфосфата;
a-е: соответственно сразу после инкубации при комнатной температуре в течение 1 часа;
фиг.2 - электрофорез смеси в ПААГ в присутствии додецилсульфата натрия, состоящей из токсина TcdB10463 и/или IP6, после или без предварительной обработки токсина с помощью EPNP;
След 1: TcdB10463 после предварительной обработки с помощью EPNP без применения IP6, на участке 63 кДа полоса не выявлена;
След 2: TcdB10463 после предварительной обработки с помощью EPNP и после инкубации совместно с IP6, типичная полоса 63 кДа выражена слабо;
След 3: TcdB10463 без предварительной обработки с помощью EPNP и после инкубации совместно с IP6, в зоне молекулярного веса 63 кДа прослеживается четко выраженная полоса;
След 4: TcdB10463 без предварительной обработки с помощью ENPN и без применения IP6, на участке 63 кДа полоса не выявлена;
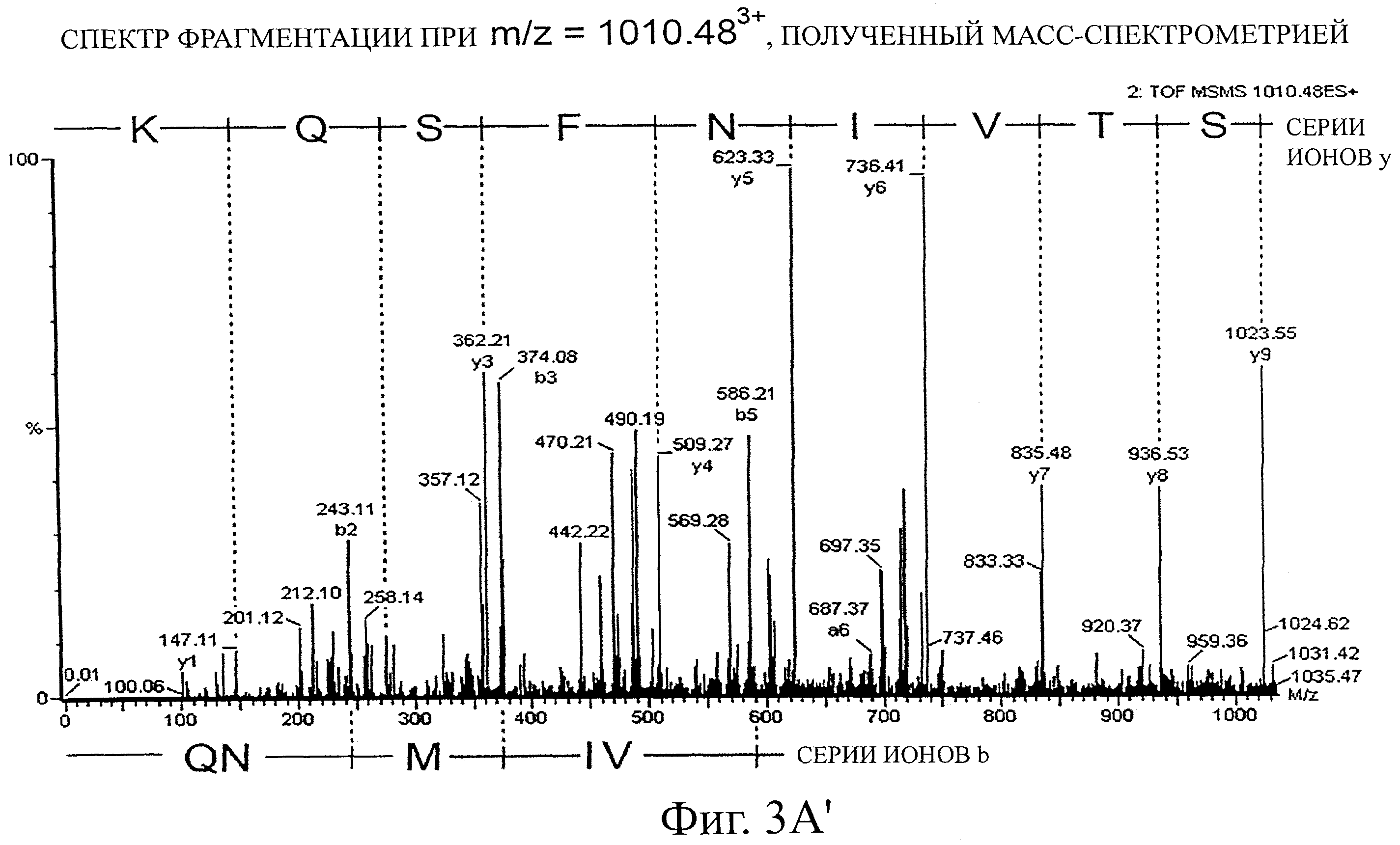
фиг.3 - МС-анализ методом ESI-ЖХ-МС после триптического переваривания нативного (а) и модифицированного с помощью ENPN (b) протеина токсина TcdB. МС-сканирование (крупное изображение) и спектры фрагментации (вставка).
Все способы, указанные в приводимых ниже примерах, специалисту известны и описаны, например, у Ausubel и др. (2003).
Пример 1. Подтверждение автокаталитической активности протеазы токсина TcdB
Токсин В Clostridium difficile (270 кДа) контрольного штамма VPII0463, обозначаемый ниже для краткости как TcdB10463, подвергли сначала флуоресцирующей маркировке с помощью Су3. Для этого 200-400 мкг TcdB10463 (tgcBIOMICS, г.Майнц, ФРГ) маркировали красителем Су3 в соответствии с указаниями изготовителя (Amersham Bioscience), при этом токсин вместе с растворенным в диметилформамиде красителем инкубировали в течение часа при 4°C. Несвязанный краситель удалили затем с помощью вытеснительной хроматографии (Size Exclusion Chromatography = SEC), причем 10 ммолей Трис-HCl при pH 8,5 служили буферным раствором. Молекулярное соотношение между красителем и TcdB10463, маркированным с помощью Су3, составило 0,8-1,6. Маркированный токсин TcdB10463 был разделен на аликвотные части и хранился при -80°C до следующего случая применения.
(А) Для проведения известного в уровне техники «анализа расщеплением in vitro» (in-vitro-cleavage-assay) (см., в частности, Rupnik и др., (2005), на эту публикацию будут приводиться ссылки) аликвотная часть размороженного до комнатной температуры токсина TcdB10463, маркированного с помощью Су3, инкубировали в течение 1 часа при комнатной температуре с применением экстракта клеток свиной селезенки.
Этот экстракт клеток свиной селезенки приготовили следующим образом. Свежую свиную селезенку поместили в фосфатный буфер (PBS) и размельчили для получения суспензии из отдельных клеток. Добавкой буфера с низким содержанием соли, а именно 150 ммолей NF4Cl, 1 ммоля KHCO3 и 0,1 ммоля этилендиаминтетрауксусной кислоты, pH 7,6, лизировали имевшиеся эритроциты и тем самым удалили их. Затем клетки селезенки промыли дважды в 10 ммолях Трис-HCl, pH 8,5, и сразу подвергли глубокой заморозке при -80°C. Для получения необходимого экстракта клеток одну аликвотную часть замороженных клеток селезенки разморозили в одной аликвотной части из 10 ммолей Трис-HCl, pH 8,5, и суспендировали, затем полученную суспензию подвергли ультразвуковой обработке. Полученный лизат центрифугировали в течение 1 часа при 200000g и 4°С и надосадочную часть использовали в экспериментах.
В конце фазы инкубации смесь из токсина TcdB104, маркированного с помощью Су3, и экстракта клеток свиной селезенки подвергли электрофорезу в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) для сепарации и определения фрагментов токсина TcdB, образовавшихся во время инкубации. Результат такого электрофореза представлен на фиг.1а. Как и ожидалось, были получены два известных и характерных фрагмента 63 кДа и 207 кДа токсина В Clostridium difficile, в данном случае TcdB10463.
Для отрицательного контроля служили аликвотные части токсина TcdB10463 без примеси экстракта клеток селезенки (см. фиг.1 "-").
(В) В одновременно проводившемся опыте экстракт клеток селезенки, описанный в разделе (А), перед инкубацией вместе с токсином TcdB10463, маркированным с помощью Су3, очистили от протеина. Для этого аликвотную часть полученного согласно (А) экстракта клеток свиной селезенки подвергли после ультразвуковой обработки шестикратной экстракции фенол-хлороформом, которую проводили следующим образом. Экстракт клеток свиной селезенки смешали с фенол-хлороформ-изоамиловым спиртом (25/24/1) в объемном соотношении 1:1. Полученную смесь центрифугировали в течение 10 минут при 1700g и 4°C. Самый верхний водный слой декантировали в чистую емкость центрифуги и пятикратно повторили центрифугирование и декантацию. С целью удаления остатков фенола в заключение провели экстракцию хлороформом. Аликвотные части полученной таким образом водной и не содержавшей протеин фракции экстракта клеток селезенки разбавили в объемном соотношении 1:30 (30), 1:100 (100) или 1:300 (300) посредством 10 ммолей Трис-HCl, pH 8,5, и, как описано в разделе (А), смешали с аликвотными частями размороженного до комнатной температуры токсина TcdB10463, маркированного с помощью Су3, и инкубировали в течение 1 часа при комнатной температуре. В конце инкубационной фазы полученные смеси подвергли электрофорезу в ПААГ в присутствии додецилсульфата натрия для отделения и определения образовавшихся во время инкубации фрагментов токсина ТсdВ10463. Результат такого электрофореза наглядно представлен с помощью геля Doc EQ System Image Readers (BIO-RAD, г.Мюнхен, ФРГ) и показан на фиг.1, b. Для всех испытательных смесей были получены характерные фрагменты токсина TcdB10463: 63 кДа и 207 кДа. Это показывает, что водная, не содержащая протеин фракция экстракта клеток селезенки по-прежнему обладает или обладала способностью расщеплять токсин TcdB10463 на его оба характерных фрагмента.
В одновременно проводившемся опыте описанный в (А) экстракт клеток селезенки подвергли тепловой обработке (96°C, 30 минут) до того, как его инкубировали, как описано в разделе (А) вместе с токсином TcdB10463; маркированным Су3, и не подвергли электрофорезу в ПААГ в присутствии додецилсульфата натрия. Результат этого электрофореза приведен на фиг.1, b. Снова были получены два характерных фрагмента токсина TcdB10463: 67 кДа и 207 кДа. Результат свидетельствует о том, что индуцированный теплом экстракт клеток селезенки по-прежнему обладал способностью расщеплять токсин TcdB10463 на два характерных фрагмента.
(С) В ходе последующей серии опытов маркированный с помощью Су3 и не маркированный токсин TcdB10463 инкубировали отдельно (т.е. без примешивания экстракта клеток селезенки) с применением разных инозитолфосфатов в течение 1 часа при комнатной температуре и затем соответствующие смеси подвергли электрофорезу в ПААГ в присутствии додецилсульфата натрия. Результат этих исследований приведен в таблице 1 и на фигурах 1, с-е. Неожиданно получили данные, согласно которым протеолитическое расщепление токсина TcdB10463 инициируется уже одним химическим веществом, таким как инозитолфосфат, и, следовательно, при таком протеолитическом расщеплении происходит автокаталитический процесс с участием протеина токсина.
В таблице 1 можно видеть, что ряд инозитолфосфатов способен инициировать автокаталитическое расщепление токсина TcdB10463. Из испытанных инозитолфосфатов максимальной активностью по расщеплению обладал инозитолгексафосфат (IP6), что означает, что IP6 обладает наибольшей активностью инициатора (см. также фигуры 1, с-е).
Структурные аналоги или другие родственные инозитолфосфатам вещества, обладающие активностью инициатора, хорошо известны специалисту и могут быть легко определены известными методами (например, компьютерным моделированием). Также могут быть применены, например, описанные выше «высокоэффективные способы анализа» (High-Troughput-assays).
Испытания IP6 при его разных концентрациях в опыте по инкубации с применением токсина TcdB10463 (см. фиг.1, с, d) показали, что для расщепления маркированного флуоресцирующим веществом токсина В достаточной является концентрация IP 10 мкмолей (фиг.1, c), в то время как для расщепления не маркированного токсина В (что наглядно выявлено при электрофорезе в ПААГ в присутствии додецилсульфата натрия путем окраски цинковым пигментом (Zinc Stain and Destain Kit, Biorad, Hercules, США)) достаточными были еще меньшие концентрации, составившие до 1 мкмоля (фиг.1, d).
Аналогичные эксперименты проводились также с токсинами TcdA10463, TcsL Clostridium sordellii и Tcnα. При этом обнаружилось, что инозитолфосфаты активировали автокаталитическое расщепление исследовавшихся токсинов семейства LCT.
(D) Для исключения загрязнения токсина TcdB10463 протеазами, использованного в опытах и выделенного из надосадочной культуры токсина TcdB10463 Clostridium difficile, был проведен контрольный опыт с применением специально очищенного токсина TcdB10463. Очистка токсина TcdB10463 проводилась посредством аффинной хроматографии с использованием моноклонального антитела 2CV (DSM АСС 2321) следующим образом. 7 мг специфического для токсина TcdB моноклонального антитела 2CV (очищенная от протеина надосадочная часть не содержащей сыворотку гибридомной культуры) поместили в колонку HiTrap NHS Sepharose (стандартная, выпускаемая фирмой GE Healthcare, г.Фрайбург, ФРГ). Размещение и элюирование производились в соответствии с указаниями изготовителя. В готовую колонку поместили около 4 мг токсина TcdB10463 и удалили не связанные протеины трехразовой промывкой 50 ммолями Трис-HCl, pH 7.0 и 125 ммолями NaCl. Элюирование производилось в один прием с применением 0,1 моля триэтаноламин-соляной кислоты, pH 11. Токсин элюировали в виде трех фракций по 4 мл при концентрации от 450 до 185 мкг/мл. Элюированный токсин сразу нейтрализовали 1 молью Трис-HCl, pH 7,5, при объемном соотношении 1:10, что стало возможным благодаря тому, что этот нейтрализующий раствор уже до начала элюирования находился в пробирках для улавливания фракций. Затем проверили на отсутствие загрязняющих протеинов посредством электрофореза в ПААГ в присутствии додецилсульфата натрия и последующей окраски цинковым пигментом (см. фиг.1, е "-").
Контрольный опыт состоял из инкубации очищенного описанным способом не маркированного токсина TcdB10463 вместе с IP6, последующего электрофореза в ПААГ в присутствии додецилсульфата натрия и определения токсина или его фрагментов с помощью окраски цинковым пигментом. Результат этого опыта представлен на фиг.1, е, он свидетельствует о полном расщеплении голотоксина на два известных фрагмента 63 кДа и 207 кДа.
Пример 2. Инактивация токсина TcdB-10463 посредством инкубации с ингибитором протеазы
Как описано в примере 1 (D), токсин TcdВ10463 очистили с помощью аффинной хроматографии с применением моноклонального антитела 2CV и затем предварительно обрабатывали в течение 60 минут при комнатной температуре либо (i) ингибитором протеазы EPNP (10 ммолей 1,2-эпокси-3-(р-нитрофенокси)-пропана), либо (ii) - в качестве контроля - буфером (50 ммолей N-2-гидроксиэтилпиперазин-N'-2-гидроксипропансульфоновой кислоты, 1 моль NaCl, 1 ммоль этилендиаминтетрауксусной кислоты, pH 8,0). Затем, аналогично примеру 1 (А), провели анализ на расщепление in vitro. Испытуемые смеси применялись в объеме 10 мкл и содержали соответственно 50-100 нг не маркированного токсина TcdB10463, 100 мкмолей IP6 и 10 ммолей Трис-HCl, pH 8,5. Эти испытуемые смеси подвергли после инкубации (1 ч при комнатной температуре) электрофорезу в ПААГ в присутствии додецилсульфата натрия (10%) и затем токсины и их фрагменты проявили посредством окраски цинковым пигментом.
На фиг.2 представлен результат данного эксперимента. Инкубация токсина TcdB10463 с применением одного IP6 (след 3) вызвала появление отчетливо прослеживаемой полосы в зоне молекулярного веса 63 кДа. Если токсин предварительно обрабатывается с помощью EPNP (след 2), то типичная полоса 63 кДа выражена слабо. Такие результаты свидетельствуют о том, что при добавке ингибитора протеазы EPNP почти полностью подавляется протеолитическая активность (протеазы) токсина TcdB10463.
Предварительно обработанный с помощью EPNP токсин дополнительно исследовали в опыте с яичником китайского хомячка (СНО) по Moos и др., (2000), на его остаточную активность (цитотоксическое действие).
Опыт СНО проводили следующим образом. На микротитрованную планшетку с 96 лунками высеяли клетки яичники китайского хомячка (5000 клеток на лунку) и в течение 16 часов инкубировали в стандартизированных условиях (5% CO2, 37°C, DMEM F12 (DMEM: модифицированная по способу Дульбекко среда Игла) с добавкой 2 ммолей L-глютамина, 5% FCS). Затем после последовательного разбавления токсинов в среде роста примешали к клеткам. Испытывали стадии разбавления от 100 до 10-8. Клетки инкубировали в течение 3 часов в стандартизированных условиях. Затем под микроскопом определяли долю округлых клеток, для чего фотографировали несколько представительных вырезов лунки и подсчитывали клетки вытянутой и закругленной форм (см. также Moos и др., Meth Enzymol. 2000, 325: 114-125. Здесь специально делается ссылка на эту публикацию).
Результаты испытания СНО показали, что токсин TcdB10463, предварительно обработанный посредством EPNP, обладает существенно меньшей цитотоксической активностью по сравнению с таким же необработанным токсином (см. табл.2). Поскольку ингибирующее действие EPNP основано, как известно, на том, что EPNP вступает в ковалентное взаимодействие с каталитическими остатками аспартата и вызывает этим необратимую инактивацию протеазы (Salto и др., 1994), то результаты данного опыта свидетельствуют о том, что подавление активности токсина TcdB10463 вызвано подавлением активности протеазы в молекуле этого токсина.
Описанный эксперимент с применением EPNP доказывает, что токсическое действие TcdB10463 и других токсинов LCT значительно снижается в результате предварительной обработки токсинов соответствующим ингибитором протеазы.
EPNP представляет собой модельное вещество для ковалентного ингибитора токсинов LCT. Другие сопоставимые, ковалентно действующие или состязательно подавляющие ингибиторы среднему специалисту известны или же они могут быть определены известными методами, например уже описанным «высокоэффективным методом анализа».
Пример 3. Инактивация цитотоксического действия токсина TcdB10463 путем внеклеточной активации протеазы с помощью IP6
Токсин TcdB10463 инкубировали, как это описано в примере 1 (С), с применением 100 мкмолей IP6. После инкубации отделили меньший фрагмент 63 кДа протеина токсина, отщепившийся вследствие активности протеазы, при этом исходную смесь очистили с помощью пробирок Microcon (Millipore, величина исключения: 100 кДа). Этот фрагмент 63 кДа токсина TcdB10463 исследовали, как описано в примере 2, испытанием СНО по Moos и др. (2000), на округлость клеток. При этом неразбавленный и разбавленный на нескольких стадиях протеин добавили к клеткам.
В этом опыте было установлено, что фрагмент 63 кДа, обладавший функцией глюкозилтрансферазы в токсине TcdB10463, в данных условиях самостоятельно не мог вызвать цитотоксическое действие. Как в разбавленном, так и в неразбавленном виде не отмечена округлость клеток (вследствие глюконизации специфических ГТФаз подсемейства Rho, результирующей отсюда блокировки процессов трансдукции сигналов и, как следствие, распада цитоскелета). Данные результаты, согласно которым генерированный посредством автокатализа фрагмент токсина оказался инактивным внеклеточно, подтверждает результаты авторов Pfeifer и др. (2003) и Rupnik и др. (2005), которые показали, что отщепленный каталитический домен токсина TcdB10463 не поступает в эукариотные клетки и поэтому остается инактивным в клеточной среде. (В то время как в этих работах автокаталитическая активность токсинов LCT очевидно исключается (Pfeiffer и др., 2003) или же сообщается о клеточной протеазе, активирующей токсины LCT (Rupnik и др., 2005), результаты опытов, проводившихся в связи с настоящим изобретением, впервые показали, что N-терминальный фрагмент токсина отщепляется автокаталитически).
Следовательно, цитотоксическое действие токсина TcdB10463 и других токсинов LCT может быть предупреждено за счет того, что протеолитическое расщепление токсинов может быть индуцировано еще до проникания токсинов в клетки.
Пример 4. Определение активного центра протеазы токсина TcdB10463
Токсин TcdB10463; инактивированный посредством EPNP (см. пример 2) и не подвергшийся обработке, был разделен с помощью геля додецила сульфата натрия и проявлен цинковым пигментом. Затем были вырезаны соответствующие протеинам полосы и разделены на мелкие части. Их обесцветили и просушили, затем восстановили в 2 ммолях дихлордифенилтрихлорэтана и алкилировали 20 ммолями ацетамида йода. После промывки и повторной сушки гелевых фрагментов их подвергли перевариванию трипзином в течение ночи при 37°C. Образовавшиеся пептиды разделили жидкостной хроматографией высокого разрешения (NaniAcquity ultraperformance Liquid Chromatography, Waters, Milford, США). Для этого 2 мкл проб нанесли на колонку с обратной фазой (NaniEase ВЕН С18 (75 мкм × 10 см) Waters, Milford, США) в 2%-ный буфер В с подвижной фазой (0,1% муравьиной кислоты в ацетонитриле). Подвижная фаза буфера А содержала 0,1% муравьиной кислоты в H2O. Затем фрагменты элюировали с колонки при градиенте 3 - 40% мобильной фазы буфера В (90 минут при 300 нл/мин).
Затем элюированные фрагменты исследовали под масс-спектрометром. Для этого применили масс-спектрометр Q-Tof Premier фирмы Waters. Прибор калибровали раствором, содержавшим [глю-1]-фибриногенпептид (500 фмолей/мкл при 300 нл/мин), с применением контрольного распылителя ф. NanoLockSpray (Waters). При анализе результатов использовалось программное обеспечение MassLnyx4.1 (Waters).
Анализ результатов показал, что не обработанный токсин TcdB отличается от обработанного с помощью EPNP токсина только триптическим фрагментом (фиг.3). Этот фрагмент содержит аминокислоты от AS 1653 до AS 1678 протеина токсина TcdB согласно аминокислотной последовательности №P18177 (SwissProt/TrEMBL) с мотивом DXG в положении 1665, характерным для протеаз аспартата.
Сравнение аминокислотной последовательности от AS 1653 до AS 1678 каталитического центра токсина TcdB10463 с соответствующими каталитическими центрами и протеиновыми областями токсинов TcdA, TcsL и Tcnα показало, что область обладает высокой степенью консервации (см. табл.3).
Поэтому специалист может генерировать с помощью известных методов антитела или другие протеины, которые специфично взаимодействуют с активным центром домена протеазы токсинов и тем самым препятствуют, например, автокаталитическому расщеплению токсинов LCT. Столь же успешно могут быть генерированы антитела или протеины, которые непосредственно не блокируют активный центр, а только направлены в сторону соседних областей и тем самым стерически препятствуют автопротеолитическому расщеплению токсина.
Пример 5. Ингибирование действия токсина TcdB с помощью антител в результате иммунизации инактивированным токсином TcdB
Для защиты от цитотоксических эффектов токсина TcdB были приготовлены следующие препараты с содержанием токсина TcdB, которые применили при иммунизации кроликов:
препарат А: TcdB, инактивированный формалином
препарат В: TcdB, инактивированный с помощью EPNP (см. пример 2)
препарат С: фрагмент TcdB AS 1601-1716 (мотив DSG)
препарат D: фрагмент TcdB AS 1508-1601 (часть мотива, связывающего инозин)
препарат Е: фрагмент TcdB AS 1508-2157
(Мотив DSG и целиком мотив, связывающий инозин).
Фрагменты токсина TcdB были выделены известными специалисту методами из плазмида рЕТ-19 (Novagen) и очищены с помощью пришитой гис-метки. После этого гис-метку отщепили в результате переваривания энтерокиназой. Чистоту протеина проверили гелем додецилсульфата натрия (данные не приведены).
Сначала кроликов подвергли с применением антигена основной иммунизации, затем нескольким реиммунизациям. Из их крови были получены поликлональные антисыворотки. С целью проверки их нейтрализующего действия поликлональной антисывороткой предварительно обработали сначала токсин TcdB (стадия разбавления 1:100) и инкубировали в течение 1 часа при комнатной температуре. Затем проверили нейтрализующее действие антисывороток посредством испытания СНО, как описано в примере 2. Мерой нейтрализующего действия сывороток служила продолжительность защиты клеток от цитотоксического действия токсина TcdB.
У кроликов, иммунизированных препаратом А, титр антител был низким (см. табл.4), кроме того, сыворотка этих кроликов не действовала нейтрализующе. Такие результаты соответствуют известным специалисту показателям, полученным в опытах по иммунизации токсинами, расщепленными муравьиной кислотой. Животные, иммунизированные препаратом В, хотя и имели заметный титр (разведение до 1:1500), однако и эта антисыворотка не обладала нейтрализующим эффектом при испытании СНО (табл.4).
Кролики, иммунизированные препаратами C-E, также имели титр антител, кроме того их поликлональные сыворотки проявили при испытании СНО заметное нейтрализующее действие (табл.4). Поликлональная сыворотка, полученная в результате иммунизации посредством препарата Е, обладала наилучшими нейтрализующими свойствами.
Сыворотки, приготовленные в результате отдельной иммунизации препаратами С и D, показали меньшее нейтрализующее действие.
Успех, достигнутый иммунизацией с применением фрагмента D, содержавшего часть связывающей инозитол области, доказывает, что данный участок токсинов LCT представляет собой важную для активации токсинов область. Связывание IP6 на этом участке токсина ведет к повышению автокаталитической активности протеазы и, следовательно, активации токсинов LCT.
Нейтрализующее действие расположенной вокруг мотива DSG области доказывает, что антитела, направленные в сторону активного центра протеазы, способны ингибировать протеолитическую активность. С помощью таких антител может быть обеспечена защита от токсических действий токсинов LCT также in vitro.
При иммунизации препаратом Е совместно применялись только оба фрагмента успешных препаратов С и D. Успешная иммунизация с применением обоих фрагментов токсина TcdB основана на том, что у животных были индуцированы как антитела, направленные против активной зоны протеазы, так и антитела, присоединяющиеся к области, связывающей инозитолфосфат. Таким образом, действие антисыворотки объясняется тем, что впервые удалось индуцировать специфические антитела, которые целенаправленно угнетают активность токсина.
Для естественного введения токсинов LCT в целевые клетки важно автокаталитическое расщепление токсинов, так как только таким образом в целевых клетках может быть высвобожден N-терминальный фрагмент, вызывающий собственно токсическую активность. Связывание специфических антител на участке вокруг мотива DSG протеазы аспартата и места связывания инозитолфосфата предупреждает автокаталитическое расщепление токсинов. Следовательно, у пациентов может быть выработана эффективная иммунизация против токсинов LCT применением фрагментов токсинов, необходимых для автокаталитического расщепления токсинов LCT.
ЛИТЕРАТУРА:
Ausubel, F.M. et al.: "Current Protocols in Molecular Biology" (2003), John Wiley and Sons. Inc.
Rupnik et al. (2005) "Characterization of the cleavage site and function of resulting cleavage fragments after limited proteolysis of Clostridium difficile toxin B (TcdB) by host cells." Mikrobiol 151, 199-208.
Moos et al. (2000) "Purification and evaluation of large clostridial cytotoxins that inhibit small GTPases of Rho and Ras subfamilies" Meth Enzymol. 325: 114-125.
Pfeifer et al. (2003) "Cellular Uptake of Clostridium difficile toxins B" J. Biol. Chem. 278: 44535-41.
Rao et al. (1998) "Molecular and biotechnological aspects of microbial proteases" Microbiol. Mol. Biol. Rev. 62: 597-635.
Salto et al. (1994) "In vitro characterization of nonpeptide irreversible inhibitors of HIV proteases", J. Biol. Chem. 269: 10691-8.
Tang (1971) "Specific and irreversible inactivation of pepsin by substrate-like Epoxides", J. Biol. Chem. 246: 4510-17.
Реферат
Группа изобретений относится к лекарственным средствам для предупреждения или ослабления отравления большими клостридиальными цитотоксинами (LCT), в частности токсинами А и В (TcdA, TcdB) Clostridium difficile, отличается тем, что содержит в качестве активного вещества, по меньшей мере, один эффектор, а именно ингибитор или активатор автокаталитической активности протеазы цитотоксинов LCT. Группа изобретений обеспечивает эффективное подавление инфекций, вызванных токсинами Clostridium difficile. 2 н. и 18 з.п. ф-лы, 6 ил., 4 табл., 5 пр.
Формула
(1) пригодно для назначения в качестве вакцины и
(2) в качестве антигенного активного вещества
(a) содержит тот фрагмент протеина токсина TcdB аминокислотной последовательности SEQ ID No: 14 в списке последовательностей, который включает в себя, по меньшей мере, один мотив DXG в положении 1665, предпочтительно аминокислотную последовательность в положениях от АМК 1653 до АМК 1678, более предпочтительно аминокислотную последовательность от АМК 1500 до АМК 1800,
(b) и/или содержит тот фрагмент протеина токсина TcdA аминокислотной последовательности SEQ ID No: 3 в списке последовательностей, который включает в себя, по меньшей мере, один мотив DXG в положении 1662, предпочтительно аминокислотную последовательность в положениях от АМК 1651 до АМК 1675.
(c) и/или содержит тот фрагмент протеина токсина TcsL его аминокислотной последовательности SEQ ID No: 19 в списке последовательностей, который включает в себя, по меньшей мере, один мотив DXG в положении 1666, предпочтительно аминокислотную последовательность в ее положениях от АМК 1654 до АМК 1679,
(d) и/или содержит тот фрагмент протеина токсина Tsnα его аминокислотной последовательности SEQ ID No: 16 в списке последовательностей, который включает в себя, по меньшей мере, одну аминокислотную последовательность в ее положениях от АМК 1641 до АМК 1665.

Комментарии