Пептидные макроциклы против acinetobacter baumannii - RU2729609C2
Код документа: RU2729609C2
Описание
Введение
В настоящем изобретении предложены соединения, которые проявляют активность против Acinetobacter baumannii, их получение, содержащие их фармацевтические композиции и их применение в качестве лекарственных средств для лечения заблеваний и инфекций, вызванных Acinetobacter baumannii.
В частности, настоящее изобретение относится к соединениям формулы (I)

где X1-X8 и R1-R8 являются такими, как здесь описано, и его фармацевтически приемлемым солям.
Уровень техники
Acinetobacter baumannii является грамотрицательной, аэробной, неферментирующей бактерией, признанной в течение последних десятилетий в качестве возвращающегося патогена с очень ограниченными вариантами лечения.
A. baumannii рассматривается центрами US Centers for Disease Control and Prevention в качестве серьезной угрозы и относится к так называемым 'ESKAPE' патогенам (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa иEnterobacter species & E. coli) которые в настоящее время вызывают большинство нозокомиальных инфекций и эффективно “избегают” активности противомикробных агентов.
A. baumannii чаще всего встречается в отделениях интенсивной терапии и хирургических отделениях, где широкое использование антибиотиков включило устойчивость ко всем известным антимикробным препаратам и где эти бактерии вызывают инфекции, которые включают бактериемию, пневмонию, менингит, инфекцию мочевых путей и раневую инфекцию.
A. baumannii обладает исключительной способностью к росту и приобретению резистентных детерминант и демонстрирует сопротивление к окружающей среде, которое позволяет выжить и распространяться в нозокомиальной обстановке, что делает этот организм частым источником вспышек инфекции и эндемического, связанного с здоровьем патогена.
Из-за увеличения устойчивости антибиотиков к большинству, если не всем имеющимся терапевтическим вариантам, инфекции мультирезистентного (MDR) A. baumanniii, особенно те, которые вызваны устойчивым к карбапенему A. baumannii, чрезвычайно трудно или даже невозможно лечить при высокой смертности, также как увеличении заболеваемости и продолжительности пребывания в отделении интенсивной терапии.
Acinetobacter baumannii был определен и по-прежнему остается «ярким примером несоответствия между неудовлетворенными медицинскими потребностями и текущими антимикробными исследованиемиями и разработкой дорожной карты в соответствии с Целевой группой по антимикробной доступности (AATF), Общества инфекционных заболеваний Америки (IDSA). Таким образом, существует высокий спрос и потребность в идентификации соединений, подходящих для лечения заболеваний и инфекций, вызванных Acinetobacter baumannii.
В настоящем изобретеним предложен новый химиотип (пептидныме макроциклы), который проявляет активность против как восприимчивых к лекарственным средствам, а также резистентных к лекарственным средствам штаммов Acinetobacter baumannii. Молекулы регулярно тестировались против чувствительных к лекарственным средствам штаммов A. baumannii (ATCC19606 и ATCC 17978) и, кроме того, над группой из десяти клинических изолятов. Некоторые типичные молекулы были выбраны для профилирования in vivo. Как фармакокинетический профиль, так и эффективность в модели септицемии мышей указывают на большой потенциал для дальнейшего развития составного класса.
Подробное описание изобретения
Если не указано иное, все технические и научные термины, используемые здесь, имеют то же значение, которое обычно понимается специалистом в данной области техники, к которому относится настоящее изобретение. Хотя способы и материалы, подобные или эквивалентные описанным здесь, могут быть использованы на практике или испытаниях по изобретению, подходящие способы и материалы описаны ниже.
Все публикации, патентные заявки, патенты и другие ссылки, упомянутые здесь, включены в качестве ссылки в полном объеме.
Номенклатура, используемая в настоящей Заявке, основана на систематической номенклатуре IUPAC, если не указано иное.
AutoNom 2000 (автоматическая номенклатура) для ISIS/Draw использовалась для генерации химических названий по IUPAC.
Любая открытая валентность, возникающая на атомах углерода, кислорода, серы или азота в структурах, указанных здесь, указывает на присутствие водорода, если не указано иное.
Термин «остаток» относится к атому или группе химически связанных атомов, которые присоединены к другому атому или молекуле одной или несколькими химическими связями, тем самым образуя часть молекулы. Например, переменные R1, R2 и R3 формулы (I) относятся к остаткам, которые присоединены к основной структуре формулы (I) ковалентной связью.
При указании количества заместителей термин «один или несколько» относится к диапазону от одного заместителя до максимально возможного числа замещений, то есть замену одного водорода вплоть до замещения всех атомов водорода заместителями.
Термин «возможно» или «необязательно» означает, что описанное впоследствии событие или обстоятельство может присуствовать, но не обязательно, и что описание включает случаи, когда присуствует событие или обстоятельство, и случаи, в которых оно отсутствует.
Термин «заместитель» обозначает атом или группу атомов, заменяющих атом водорода на исходной молекуле.
Термин «замещенный» означает, что указанная группа имеет один или несколько заместителей. Если какая-либо группа может нести множество заместителей и имеется множество возможных заместителей, то заместители независимо представляют собой выбранные и не обязательно должны быть одинаковыми. Термин «незамещенный» означает, что указанная группа не имеет заместителей. Термин «возможно замещенный» означает, что указанная группа является незамещенной или замещена одним или несколькими заместителями, независимо выбранными из группы возможных заместителей. При указании количества заместителей термин «один или несколько» означает от одного заместителя до максимально возможного количества замещения, то есть замену одного водорода вплоть до замены всех атомов водорода на заместители.
Термин «соединение (я) по настоящему изобретению» и «соединение (и) изобретения» относится к соединениям, раскрытым здесь, и их стереоизомерам, таутомерам, сольватам и солям (например, их фармацевтически приемлемым солям).
Когда соединения по изобретению являются твердыми веществами, специалистам в данной области техники понятно, что эти соединения и их сольваты и соли могут существовать в различных твердых формах, особенно в разных кристаллических формах, все из которых предназначены для охвата настоящего изобретения и заданных формул.
Термин, «структурно родственные вещества» означает вещества, которые имеют общую или основную структуру вещества, обладающего биологической активностью, такого как обычный фармакофор или ольфактофор. Однако такие структурно связанные вещества могут отличаться друг от друга, однако, в их заместителях.
Термин «фармацевтически приемлемые эфиры» обозначает производные соединений по настоящему изобретению, в которых карбоксигруппа превращена в эфир, где карбоксигруппа означает -C(O)O-. Метил-, этил-, метоксиметил-, метилтиометил- и пивалоилоксиметиловые эфиры являются примерами таких подходящих эфиров. Термин «фармацевтически приемлемые эфиры», кроме того, охватывает производные соединений по настоящему изобретению, в которых гидроксильные группы были превращены в соответствующие эфиры неорганическими или органическими кислотами, такими как азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота или п-толуолсульфоновая кислота и которые являются нетоксичными для живых организмов.
Термин "фармацевтически приемлемые соли" обозначает соли, которые не являются биологически или иным образом нежелательными. Фармацевтически приемлемые соли включают кислотно-аддитивные соли а также основно-аддитивные соли.
Термин "фармацевтически приемлемая кислотно-аддитивная соль" означает те фармацевтически приемлемые соли, которые образованы с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, угольная кислота, фосфорная кислота, и органическими кислотами, выбранными из алифатических, циклоалифатических, ароматических, аралифатических, гетероциклических, карбоновых и сульфоновых органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, глюконовая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малеиновая кислота, малеиновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, аспарагиновая кислота, аскорбиновая кислота, глутаминовая кислота, антраниловая кислота, бензойная кислота, коричная кислота, миндальная кислота, эмбоновая кислота, фенилуксусная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота и салициловая кислота.
Термин "фармацевтически приемлемые основно-аддитивная соль" означает те фармацевтически приемлемые соли, которые образованы с органическим или неорганическим основанием. Примеры приемлемых неорганических оснований, включают соли натрия, калия, аммония, кальция, магния, железа, цинка, меди, марганца и алюминия. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основных ионообменных смол, таких как изопропиламин-, триметиламин-, диэтиламин-, триэтиламин-, трипропиламин-, этаноламин-, 2-диэтиламиноэтанол-, триметамин-, дициклогексиламин-, лизин-, аргинин-, гистидин-, кофеин-, прокаин-, гидрабамин-, холин-, бетаин-, этилендиамин-, глюкозамин-, метилглюкамин-, теобромин-, пурин-, пиперазин-, пиперидин-, N-этилпиперидин-, и полиаминовые смолы.
Стереохимические определения и условные обозначения, используемые здесь, как правило, соответствуют S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; and Eliel, E. and Wilen, S., “Stereochemistry of Organic Compounds”, John Wiley & Sons, Inc., New York, 1994. При описании оптически активного соединения префиксы D и L или R и S, используются для обозначения абсолютной конфигурации молекулы относительно ее хирального центра (ов). Заместители, присоединенные к рассматриваемому хиральному центру ранжируются в соответствии с Sequence Rule of Cahn, Ingold и Prelog. (Cahn et al. Angew. Chem. Inter. Edit. 1966, 5, 385; errata 511). Префиксы D и L или (+) и (-) используются для обозначения знака вращения плоскости поляризованного света соединением, причем (-) или L обозначает, что соединение является левовращающим. Соединение с префиксом (+) или D является правовращающим.
Термины “гало”, “галоген”, и “галид” используются в настоящем изобретении взаимозаменяемо и обозначают фтор, хлор, бром, или йод. Конкретными примерами галогена являются фтор и хлор.
Термин "алкил" означает одновалентную линейную или разветвленную насыщенную углеводородную группу, содержащую от 1 до 12 атомов углерода. В частных воплощениях алкил обладает от 1 до 7 атомами углерода, и в более конкретных воплощениях от 1 до 4 атомами углерода. Примеры алкила включают метил, этил, пропил, изопропил, н-бутил, изо-бутил, втор-бутил или трет-бутил. Конкретными примерами алкила являются метил, этил, изопропил, н-бутил, втор-бутил и трет-бутил, наиболее предпочтительно метил и этил.
Термин “алкокси” обозначает группу формулы -O-R', где R' представляет собой алкильную группу. Примеры алкокси остатков включают метокси, этокси, изопропокси, и трет-бутокси. Конкретным примером алкокси является метокси.
Термин "галоалкил" означает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы заменен одинаковыми или различными атомами галогена, в частности атомами фтора. Примеры галогеналкила включают монофтор-, дифтор- или трифторметил, -этил или -пропил, например 3,3,3-трифторпропил, 2-фторфенил, 2,2,2-трифторэтил, фторметил, или трифторметил Термин "пергалоалкил" означает алкильную группу, в которой все атомы водорода алкильной группы заменены одинаковыми или разными атомами галогена. Конкретный пример галоалкила представляет собой трифторметил.
Термин «галоалкокси» обозначает алкоксигруппу, где по крайней мере один из атомов водорода алкоксигруппы заменен одинаковыми или разными атомами галогена, в частности атомами фтора. Примеры галоалкокси включают монофтор-, дифтор- или трифторметокси, -этокси или -пропокси, например 3,3,3-трифторпропокси, 2-фторэтокси, 2,2,2-трифторэтокси, фторметокси или трифторметокси. Термин "пергалоалкокси" обозначает алкоксигруппу, где все атомы водорода алкоксигруппы заменены одинаковыми или разными атомами галогена.
Термин "гидроксиалкил" обозначает алкильную группу, где по крайней мере один из атомов водорода алкильной группы заменен гидроксильной группой. Примеры гидроксиалкилов включают гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 1- (гидроксиметил) -2-метилпропил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил, 2,3-дигидроксипропил, 2-гидрокси- 1-гидроксиметилэтил, 2,3-дигидроксибутил, 3,4-дигидроксибутил или 2- (гидроксиметил) -3-гидроксипропил.
Термин “бициклическая кольцевая система” обозначает два кольца, которые конденсированы друг с другом посредством общей одинарной или двойной связи (аннелированная бициклическая система), через последовательность из трех или более общих атомов (мостиковоые бициклические кольцевые системы) или через один общий атом (спиробициклическая кольцевая система). Бициклические системы могут быть насыщенными, частично ненасыщенными, ненасыщенными или ароматическими. Бициклические кольцевые системы могут содержать гетероатомы, выбранные из N, O и S.
Термин "циклоалкил" означает одновалентную насыщенную моноциклическую или бициклическую углеводородную группу из от 3 до 10 атомов углерода в кольце. В частных воплощениях циклоалкил означает одновалентную насыщенную моноциклическую углеводородную группу из от 3 до 8 кольцевых атомов углерода. Бициклическая означает - состоящий из двух насыщенных карбоциклов, имеющих один или более общих атомов углерода. В частности, циклоалкильные группы представляют собой моноциклические. Примеры моноциклических циклоалкилов включают циклопропил, циклобутанил, циклопентил, циклогексил или циклогептил. Примерами бициклических циклоалкилов являются бицикло[2.2.1]гептанил или бицикло[2.2.2]октанил. Конкретным примером циклоалкила является циклопропил.
Термин "гетероциклоалкил" обозначает одновалентную насыщенную или частично ненасыщенную моно-, би- или трициклическую кольцевую систему, содержащую от 3 до 9 кольцевых атомов, включающих один, два или три кольцевых гетероатома, выбранных из N, О и S, а остальные кольцевые атомы являются углеродом. В частных воплощениях гетероциклоалкил представляет собой одновалентную насыщенную моноциклическую кольцевую систему из 4-7 кольцевых атомов, содержащую один, два или три кольцевых гетероатома, выбранных из N, О и S, а остальные кольцевые атомы являются углеродом. Примерами моноциклических насыщенных гетероциклоалкилов являются азиридинил, оксиранил, азетидинил, оксетанил, пирролидинил, тетрагидрофуранил, тетрагидро-тиенил, пиразолидинил, имидазолидинил, оксазолидинил, изоксазолидинил, тиазолидинил, пиперидинил, тетрагидропиранил, тетрагидротиопиранил, пиперазинил, морфолинил, 1,1-диоксо-тиоморфолин-4-ил, азепанил, диазепанила, гомопиперазинил или оксазепанил. Примерами бициклических насыщенных гетероциклоалкилов являются 8-аза-бицикло[3.2.1]октил, хинуклидинил, 8-окса-3-аза-бицикло[3.2.1]октил, 9-азабицикло[3.3.1]нонил, 3-окса-9-азабицикло[3.3.1]нонил, или 3-тиа-9-азабицикло[3.3.1]нонил.. Конеретными примерами частично ненасыщенных гетероциклоалкилов являются дигидрофурил, имидазолинил, дигидро-оксазолил, тетрагидро-пиридинил или дигидропиранил. Кокнертными примерами насыщеных гетероциклоалкилов являются пирролидинил, пиперидинил, пиперазинил, морфолинил и 2-окса-5-аза-бицикло[2.2.1]шептил. Конкертными примерами насыщеных гетероциклоалкилов являются дигидропиранил и дигидроиндолил.
Термин “ароматический” означает обычную идею ароматичности, как это определено в литературе, например в IUPAC - Compendium of Chemical Terminology, 2nd, A. D. McNaught & A. Wilkinson (Eds). Blackwell Scientific Publications, Oxford (1997).
Термин “арил” обозначает моновалентную ароматическую карбоциклическую моно- или бициклическую кольцевую систему, содержащую 6-10 кольцевых атомомв углерода. Примеры арильных остатков включают фенил и нафтил, наиболее предпочтительно фенил. Конкретным арилом, замещенным арилом, является бифенил.
Термин “гетероарил”, самостоятельно или в комбинации, обозначает моновалентную ароматическую гетероциклическую моно- или бициклическую кольцевую системы из 5 - 12 кольцевых атомов, содержащую 1, 2, 3 или 4 гетероатома, выбранных из N, O и S, оставшиеся кольцевые атомы являются углеродом. Примеры гетероарильной группы включают пирролил, фуранил, тиенил, имидазолил, оксазолил, тиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридинил, пиразинил, пиразолил, пиридинил, пиридазинил, пиримидинил, триазинил, азепинил, диазепинил, изоксазолил, бензофуранил, изотиазолил, бензотиенил, индолил, изоиндолил, изобензофуранил, бензимидазолил, бензоксазолил, бензоизоксазолил, бензотиазол, бензоизотиазолил, бензооксиазолил, бензотиадиазолил, бензотриазолил, пуринил, хинолинил, изохинолинил, хиназолинил или хиноксалинил. Конкретными примерами гетероарила являются имидазолил, пиразолил, пирролил, изоксазолил, пиридинил, пиразинил, пиридазинил, пиримидинил, иедолил и хинолил. Более предпочтительными примерами гетероарилов являются пиридинил и индолил.
Термин "защитная группа" обозначает группу, которая селективно блокирует реакционноспособный участок в многофункциональном соединении таким образом, что химическая реакция может быть проведена селективно в другом незащищенном реакционноспособном участке, в значении обычно связанным с ним в синтетической химии. Защитные группы могут быть удалены на соответствующей стадии. Типичные защитные группы представляют собой амино-защитные группы, карбокси-защитные группы или гидрокси-защитные группы
Термин “аминозащитная группа” обозначает группу, предназначенную для защиты аминогруппы и включает бензил, бензилоксикарбонил (карбобензилокси, CBZ), Fmoc (9-флуоренилметоксикарбонил), п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил, трет-бутоксикарбонил (BOC), и трифторацетил. Дополнительные примеры этих групп можно найти в T. W. Greene and P. G. M. Wuts, “Protective Groups in Organic Synthesis”, 2nd ed., John Wiley & Sons, Inc., New York, NY, 1991, chapter 7; E. Haslam, “Protective Groups in Organic Chemistry”, J. G. W. McOmie, Ed., Plenum Press, New York, NY, 1973, Chapter 5, and T.W. Greene, “Protective Groups in Organic Synthesis”, John Wiley and Sons, New York, NY, 1981. Термин “защищенная аминогруппа” относится к аминогруппе, замещенной аминозащитными группами.
Термин “карбокси-защитная группа” обозначает группу, предназначенную для защиты карбокси группы и включает эфирные группы и гетероциклоалкильные группы. Примеры таких эфирных групп включают замещенные арилалкиловые эфиры, включая эфиры с замещенными бензилами, например 4-нитробензил, 4-метоксибензил, 3,4-диметоксибензил, 2,4-диметоксибензил, 2,4,6-триметоксибензил, 2,4,6-триметилбензил, пентаметилбензил, 3,4-метилендиоксибензил, бензгидрил, 4,4'-диметоксибензгидрил, 2,2',4,4'-тетраметоксибензгидрил, эфиры алкилов или замещеных алкилов, такие как метил, этил, трет-бутил, аллил или трет-амил, трифенилметил (тритил), 4-метокситритил, 4,4'-диметокситритил, 4,4',4 "-триметокситритил, 2-фенилпроп-2-ил, тиоэфиры, такие как трет-бутиловый тиоэфир, силильные эфиры, такие как триметилсилиловый, трет-бутилдиэтилсилиловый эфиры, фенацил, 2,2,2-трихлорэтил, бета-(триметилсилил)этил, бета-(ди(н-бутил)метилсилил)этил, п-толуолсульфонилэтил, 4-нитробензилсульфонилэтил, аллил, циннамил, 1- (триметилсилилметил)проп-1-ен-3-ил и подобные остатки. Другими примерами карбокси-защитных групп являются гетероциклильные группы, такие как 1,3-оксазолинил. Дополнительные примеры этих групп можно найти в T. W. Greene and P. G. M. Wuts, “Protective Groups in Organic Synthesis”, 2nd ed., John Wiley & Sons, Inc., New York, N.Y., 1991, chapter 5; E. Haslam, “Protective Groups in Organic Chemistry”, J. G. W. McOmie, Ed., Plenum Press, New York, N.Y., 1973, Chapter 5, and T.W. Greene, “Protective Groups in Organic Synthesis”, John Wiley and Sons, New York, NY, 1981, Chapter 5. Термин “защищенная карбоксигруппа” обозначает карбоксигруппу, замещенную карбокси-защитной группой.
Термин “гидрокси-защитая группа” обозначает группу, предназначенную для защиты гидроксигруппы и включает эфирные и эфиробразующие группы, в частности тетрагидропиранилокси, бензоил, ацетокси, карбамоилокси, бензил, и силилэфирные (например, TBS, TBDPS) группы. Дополнительные примеры этих групп можно найти в T. W. Greene and P. G. M. Wuts, “Protective Groups in Organic Synthesis”, 2nd ed., John Wiley & Sons, Inc., New York, NY, 1991, chapters 2-3; E. Haslam, “Protective Groups in Organic Chemistry”, J. G. W. McOmie, Ed., Plenum Press, New York, NY, 1973, Chapter 5, and T.W. Greene, “Protective Groups in Organic Synthesis”, John Wiley and Sons, New York, NY, 1981. Термин “защищенная гидроксигруппа” относится к гидроксигруппе, замещенной гидроксизащитной группой.
Термин «депротекция » или «снятие защиты» означает процесс, при котором защитную группу удаляют после завершения селективной реакции. Реагенты депротекции включают кислоты, основания или водород, в частности карбонаты калия или натрия, гидроксид лития в спиртовых растворах, цинк в метаноле, уксусную кислоту, трифторуксусную кислоту, палладиевые катализаторы или трибромид бора.
Термин «активный фармацевтический ингредиент» (или «API») обозначает соединение или молекулу в фармацевтической композиции, которая имеет конкретную биологическую активность.
Терминс «фармацевтическая композиция» и «фармацевтический препарат » (или «состав») взаимозаменяемы и обозначают смесь или раствор, содержащий терапевтически эффективное количество активного фармацевтического ингредиента, вместе с фармацевтически приемлемыми эксципиентами, которые вводят млекопитающему, например человеку, который в этом нуждается.
Термин «фармацевтически приемлемый» обозначает свойство соединения, которое полезно при получении фармацевтической композиции, которая обычно безопасна, не токсична и не является биологически или нежелательной и приемлема как для ветеринарного, так и для фармацевтического применения у человека.
Термины «фармацевтически приемлемый эксципиент», «фармацевтически приемлемый носитель» и «терапевтически инертный эксципиент» могут быть взаимозаменяемыми и обозначать любой фармацевтически приемлемый ингредиент в фармацевтической композиции, не имеющей терапевтической активности и нетоксичной для субъекта, которому вводится, такой как дезинтеграторы, связующие вещества, наполнители, растворители, буферы, средства для тоничности, стабилизаторы, антиоксиданты, поверхностно-активные вещества, носители, разбавители или смазывающие вещества, используемые для приготовления фармацевтических продуктов.
Термин «терапевтически эффективное количество» обозначает количество соединения или молекулы настоящего изобретения, которое при введении субъекту (i) лечит или предотвращает конкретное заболевание, состояние или расстройство, (ii) ослабляет, улучшает или устраняет один или несколько симптомов конкретного заболевания, состояния или расстройства или (iii) предотвращает или задерживает начало одного или нескольких симптомов конкретного заболевания, состояния или расстройства, описанных здесь. Терапевтически эффективное количество будет варьироваться в зависимости от соединения, состояния заболевания, которое лечится, тяжести лечившегося заболевания, возраста и относительного здоровья субъекта, пути и формы введения, заключения лечащего врача или ветеринарного врача, и других факторов.
Термин «лечение» или «лечить» болезненного состояния включает в себя ингибирование состояния болезни, то есть остановку развития болезненного состояния или его клинических симптомов, или облегчение состояния болезни, т. е. вызывание временной или постоянной регрессии состояния болезни или её клинических симптомов.
Термин «предотвращение» или «профилактика» состояния болезни означает, что клинические симптомы состояния болезни не развиваются у субъекта, который может быть подвергнут воздействию или предрасположен к состоянию заболевания, но еще не испытывает или не проявляет симптомов состояния заболевания.
Термин «аминокислота» как здесь используется обозначает органическую молекулу, обладающую аминогруппой, расположенную в а-положении по отношению к карбоксильной группе. Примеры аминокислот включают аргинин, глицин, орнитин, лизин, гистидин, глутаминовую кислоту, аспарагиновую кислоту, изолейцин, лейцин, аланин, феналаланин, тирозин, триптофан, метионин, серин, пролин. Используемая аминокислота является необязательно в каждом случае L-формой.
Подробно, настоящее изобретение относится к соединению формулы (I)

где:
X1 представляет собой C-L1-R11 или N,
X2 представляет собой C-L2-R12 или N,
X3 представляет собой C-L3-R13 или N,
X4 представляет собой C-L4-R14 или N, при условии, что не более чем три из X1, X2, X3 и X4 представляют собой N;
X5 представляет собой C-L5-R15 или N,
X6 представляет собой C-L6-R16 или N,
X7 представляет собой C-L7 R17 или N,
X8 представляет собой C-L8-R18 или N, при условии, что не более чем три из X5, X6, X7 и X8 представляют собой N;
R1 представляет собой -(CH2)m-гетероарил или -(CH2)m-гетероциклоалкил, где гетероарил возможно замещен одним или более галогеном, циано, C1-7-алкилом, C1-7-галоалкилом, C3-7-циклоалкилом или C1-7-алкокси;
R2, R4 и R6 каждый независимо выбран из водорода, C1-7-алкила, C1-7-галоалкила, и C3-7-циклоалкила;
R3 представляет собой -C1-7-алкил, -(CH2)n-NR20R21, -(CH2)n-C(O)NR20R21 или -(CH2)n-O-(CH2)q-NR20R21;
R5 представляет собой водород, C1-7-алкил, гидрокси-C1-7-алкил, -(CH2)o-NR22R23, -(CH2)o-C(O)-NR22R23, -(CH2)o-O-(CH2)q-NR20R21, -(CH2)o-NH-C(NH)-NR22R23, -(CH2)o-NH-C(O)-NR22R23, -(CH2)o-NH-C(O)-OR26, -(CH2)o-C3-7-циклоалкил, -(CH2)o-гетероциклоалкил, -(CH2)o-гетероарил, -(CH2)o-арил, где циклоалкил, гетероциклоалкил, гетероарил и арил возможно замещены галогеном, циано, C1-7-алкилом, C1-7-галоалкилом, C1-7-алкокси или арилом;
R5' представляет собой водород или C1-7-алкил;
R7 и R8 каждый независимо выбран из водорода, C1-7-алкила, C1-7-галоалкила, C3-7-циклоалкила и C1-7-алкокси;
R11, R12, R13, R14, R15 и R16 каждый независимо выбран из водорода, галогена, циано, C1-7-алкила, C1-7-галоалкила, -NR24R25, C1-7-алкил-NR24R25, гидрокси, C1-7-алкокси, гало-C1-7-алкокси, -B(OH)2, бензилокси-пропинила (-C≡C-CH2-O-бензил), C3-7-циклоалкила, гетероциклоалкила, арила и гетероарила,
где гетероарил возможно замещен одним C1-7-галоалкилом или C1-7-алкокси;
R17 представляет собой водород, галоген, циано, C1-7-алкил, C1-7-галоалкил, -NR24R25, C1-7-алкил-NR24R25, гидрокси, C1-7-алкокси, гало-C1-7-алкокси, B(OH)2, бензилокси-проп-1-инил, C3-7-циклоалкил, гетероциклоалкил, арил и гетероарил,
где гетероциклоалкил возможно замещен одним -NR24R25,
где арил и гетероарил возможно замещены одним, двумя или тремя заместителями, выбранными из группы: галоген, циано, C1-7-алкил, C1-7-галоалкил, C1-7-гидроксиалкил, гидрокси, C1-7-алкокси, -NR24R25, -SO2-C1-7-алкил, -SO2-NR24R25, гетероциклоалкил и гетероциклоалкил, замещенный C1-7-алкилом;
R18 представляет собой водород, галоген, циано, C1-7-алкил, C1-7-галоалкил, гидрокси, C1-7-гидроксиалкил, C1-7-алкокси, C1-7-галоалкокси, -NR24R25, C1-7-алкил-NR24R25, C3-7-циклоалкил, гетероциклоалкил, арил и гетероарил,
где арил и гетероарил возможно замещены одним, двумя или тремя заместителями, выбранными из группы: галоген, циано, C1-7-алкил, C1-7-галоалкил, гидрокси, C1-7-алкокси, -NR24R25, C1-7-алкил-NR24R25, -CO-NH-(CH2)r-NR24R25, -CO-NH-(CH2)r-OH, -CO-NH-(CH2)r-гетероциклоалкил, -CO-OH, -O-C1-7-гидроксиалкил, -O-(CH2)r-CO-OH, -SO2-C1-7-алкил, -SO2-NR24R25, гетероциклоалкил, -O-гетероциклоалкил и гетероциклоалкил, замещенный C1-7-алкилом;
R21 и R23 каждый независимо выбран из водорода и C1-7-алкила;
R24 и R25 каждый независимо выбран из водорода, C1-7-алкила, C1-7-галоалкила, C1-7-гидроксиалкила, и C3-7-циклоалкила;
R26 представляет собой водород, C1-7-алкил или бензил;
L1, L2, L3, L4, L5, L6, L7 и L8 каждый независимо выбран из одинарной связи, -C(O)-, -SO2-,
-(CH2)p-, -CH=CH- и -C≡C-;
m представляет собой 1, 2, 3, или 4;
n представляет собой 1, 2, 3, или 4;
o представляет собой 0, 1, 2, 3, или 4;
p представляет собой 1, 2, 3, или 4;
q представляет собой 1, 2, 3, или 4;
r представляет собой 1, 2, 3, или 4;
или его фармацевтически приемлемым солям.
Конкретными воплощениями настоящего изобретения являются соединения формулы (I) или его фармацевтически приемлемым солям.
Кроме того, необходимо понимать, что каждое воплощение, относящееся к конкретным значениям X1-X8, R1-R23, m, n или o, как здесь раскрыто, может быть комбинировано с любым другим воплощением, относящимся к другомй значению X1-X8, R1-R23, m, n или o, как здесь раскрыто.
Кокнретное воплощение настоящего изобретения относится к соединению формулы (I')

где:
X1 представляет собой C-L1-R11 или N,
X2 представляет собой C-L2-R12 или N,
X3 представляет собой C-L3-R13 или N,
X4 представляет собой C-L4-R14 или N, при условии, что не более чем три из X1, X2, X3 и X4 представляют собой N;
X5 представляет собой C-L5-R15 или N,
X6 представляет собой C-L6-R16 или N,
X7 представляет собой C-L7 R17 или N,
X8 представляет собой C-L8-R18 или N, при условии, что не более чем три из X5, X6, X7 и X8 представляют собой N;
R1 представляет собой -(CH2)m-гетероарил, где гетероарил возможно замещен одним или более галогеном, циано, C1-7-алкилом, C1-7-галоалкилом, C3-7-циклоалкилом или C1-7-алкокси;
R2, R4 и R6 каждый независимо выбран из водорода, C1-7-алкила, C1-7-галоалкила и C3-7-циклоалкила;
R3 представляет собой -(CH2)n-NR20R21;
R5 представляет собой C1-7-алкил, гидрокси-C1-7-алкил, -(CH2)o-NR22R23, -(CH2)o-C(O)-NR22R23, -(CH2)o-NH-C(O)-NR22R23, -(CH2)o-C3-7-циклоалкил, -(CH2)o-гетероциклоалкил, -(CH2)o-гетероарил, -(CH2)o-арил, где циклоалкил, гетероциклоалкил, гетероарил и арил возможно замещены галогеном, циано, C1-7-алкилом, C1-7-галоалкилом или C1-7-алкокси;
R7 и R8 каждый независимо выбран из водорода, C1-7-алкила, C1-7-галоалкила, C3-7-циклоалкила и C1-7-алкокси;
R11, R12, R13, R14, R15, R16, R17 и R18 каждый независимо выбран из водорода, галогена, циано, C1-7-алкила, C1-7-галоалкила, -NR24R25, гидрокси, C1-7-алкокси, гало-C1-7-алкокси, C3-7-циклоалкила, гетероциклоалкила, арила и гетероарила;
R20 и R22 каждый независимо выбран из водорода, C1-7-алкила, C1-7-галоалкила, C3-7-циклоалкила и -C(=NH)-NH2;
R21 и R23 каждый независимо выбран из водорода и C1-7-алкила;
R24 и R25 каждый независимо выбран из водорода, C1-7-алкила, C1-7-галоалкила, и C3-7-циклоалкила;
L1, L2, L3, L4, L5, L6, L7 и L8 каждый независимо выбран из одинарной связи, -C(O)-, -SO2-,
-(CH2)p-, -CH=CH- and -C≡C-;
m, n, o и p каждый независимо выбран из 1, 2, 3 и 4;
или его фармацевтически приемлемым солям.
Конкретное воплощение настоящего изобретения относится к соединению формулы (I) или (I') где:
X1 представляет собой CR11 или N,
X2 представляет собой CR12 или N,
X3 представляет собой CR13 или N,
X4 представляет собой CR14 или N, при условии, что не более чем два из X1, X2, X3 и X4 представляют собой N;
X5 представляет собой CR15 или N,
X6 представляет собой CR16 или N,
X7 представляет собой CR17 или N,
X8 представляет собой CR18 или N, при условии, что не более чем два из X5, X6, X7 и X8 представляют собой N;
R1 представляет собой -(CH2)m-гетероарил или -(CH2)m- гетероциклоалкил; где гетероарил возможно замещен одним или более галогеном, циано, C1-7-алкилом, C1-7-галоалкилом, C3-7-циклоалкилом или C1-7-алкокси; и где гетероциклоалкил является частично ненасыщенным;
R2, R4 и R6 каждый независимо выбран из водорода, C1-7-алкила, C1-7-галоалкила, и C3-7-циклоалкила;
R3 представляет собой -C1-7-алкил, -(CH2)n-NR20R21, -(CH2)n-C(O)NR20R21 или -(CH2)n-O-(CH2)q-NR20R21;
R5 представляет собой водород, C1-7-алкил, гидрокси-C1-7-алкил, -(CH2)o-NR22R23, -(CH2)o-C(O)-NR22R23, -(CH2)o-O-(CH2)q-NR20R21, -(CH2)o-NH-C(NH)-NR22R23, -(CH2)o-NH-C(O)-NR22R23, -(CH2)o-NH-C(O)-OR26, -(CH2)o-гетероциклоалкил, -(CH2)o-гетероарил, -(CH2)o-арил, где циклоалкил, гетероциклоалкил, гетероарил и арил возможно замещены галогеном, циано, C1-7-алкилом, C1-7-галоалкилом, C1-7-алкокси или арилом;
R7 и R8 каждый независимо выбран из водорода, C1-7-алкила, C1-7-галоалкила, C3-7-циклоалкила и C1-7-алкокси;
R11, R12, R13, R14, R15 и R16 каждый независимо выбран из водорода, галогена, циано, C1-7-алкила, C1-7-галоалкила, -NR24R25, C1-7-алкил-NR24R25, гидрокси, C1-7-алкокси, гало-C1-7-алкокси, -B(OH)2, бензилокси-пропинила, C3-7-циклоалкила, гетероциклоалкила, арила и гетероарила,
где гетероарил возможно замещен одним C1-7-галоалкилом или C1-7-алкокси;
R17 представляет собой водород, галоген, циано, C1-7-алкил, C1-7-галоалкил, -NR24R25, C1-7-алкил-NR24R25, гидрокси, C1-7-алкокси, гало-C1-7-алкокси, -B(OH)2, бензилокси-пропинил, C3-7-циклоалкил, гетероциклоалкил, арил и гетероарил,
где гетероциклоалкил возможно замещен одним -NR24R25,
где арил и гетероарил возможно замещены одним, двумя или тремя заместителями, выбранными из группы: галоген, циано, C1-7-алкил, C1-7-галоалкил, C1-7-гидроксиалкил, гидрокси, C1-7-алкокси, -NR24R25, -SO2-C1-7-алкил, -SO2-NR24R25, гетероциклоалкил и гетероциклоалкил, замещенный C1-7-алкилом;
R18 представляет собой водород, галоген, циано, C1-7-алкил, C1-7-галоалкил, гидрокси, C1-7-гидроксиалкил, C1-7-алкокси, C1-7-галоалкокси, -NR24R25, C1-7-алкил-NR24R25, C3-7-циклоалкил, гетероциклоалкил, арил и гетероарил,
где арил и гетероарил возможно замещены одним, двумя или тремя заместителями, выбранными из группы: галоген, циано, C1-7-алкил C1-7-галоалкил, гидрокси, C1-7-алкокси, -NR24R25, C1-7-алкил-NR24R25, -CO-NH-(CH2)r-NR24R25, -CO-NH-(CH2)r-OH, -CO-NH-(CH2)r-гетероциклоалкил, -CO-OH, -O-C1-7-гидроксиалкил, -O-(CH2)r-CO-OH, -SO2-C1-7-алкил, -SO2-NR24R25, гетероциклоалкил, -O-гетероциклоалкил и гетероциклоалкил, замещенный C1-7-алкилом;
R20 и R22 каждый независимо выбран из водорода, C1-7-алкила, C1-7-галоалкила, C3-7-циклоалкила и -C(=NH)-NH2;
R21 и R23 каждый независимо выбран из водорода и C1-7-алкила;
R24 и R25 каждый независимо выбран из водорода, C1-7-алкила, C1-7-галоалкила, C1-7-гидроксиалкила, и C3-7-циклоалкила;
R26 представляет собой водород, C1-7-алкил или бензил;
m, n, o, p, q и r каждый независимо выбран из 1, 2, 3 и 4;
или его фармацевтически приемлемым солям.
Конкретное воплощение настоящего изобретения относится к соединению формулы (Ia)

где
X1-X8, и R2-R8 являются такими, как определено здесь;
R9 представляет собой водород, галоген, циано, C1-7-алкил, C1-7-галоалкил, C1-7-алкокси, C1-7-галоалкокси и C3-7-циклоалкил;
R10 представляет собой водород, C1-7-алкил, C1-7-галоалкил, или C3-7-циклоалкила;
R19 представляет собой водород, галоген, циано, C1-7-алкил, C1-7-галоалкил, C1-7-алкокси, C1-7-галоалкокси и C3-7-циклоалкила;
или его фармацевтически приемлемым солям.
Конкретное воплощение настоящего изобретения относится к соединению формулы (Ib)

где X1, X4, R2 , R15, R17, R18 и R9 являются такими, как определено здесь, а Y представляет собой -CH2- или -CO-; или его фармацевтически приемлемым солям.
Конкретное воплощение настоящего изобретения относится к соединению формулы (Ic)

где X1, X4, R2 , R15, R17, R18 и R9 являются такими, как определено здесь, а Y представляет собой -CH2- или -CO-; или его фармацевтически приемлемым солям.
В частном воплощении настоящего изобретения X1 представляет собой N или CR11; в частности N, CH или C-галоген; более конкретно N, CH оили CF; наиболее предпочтительно CH.
В частном воплощении настоящего изобретения X2 представляет собой N или CR12; в частности N, CH, C-гало, C-CH2-NH2, C-арил или C-гетероарил; в частности N, CH, CF, CBr, C-CH2-NH2, C-фенил или C-пиридинил; более конкретно CH или CF; наиболее предпочтительно CH.
В частном воплощении настоящего изобретения X3 представляет собой N или CR13; в частности N, CH, C-галоген или C-арил; более конкретно N, CH, CBr, C-фенил; наиболее предпочтительно CH.
В частном воплощении настоящего изобретения X4 представляет собой N или CR14, в частнсоти N или CH, наиболее предпочтительно CH.
В частном воплощении настоящего изобретения X5 представляет собой N или CR15; в частности N, CH, C-гало, C-C1-7-алкил, C-C1-7-галоалкил, C-гетероциклоалкил, C-арил, C-гетероарил, C-гетероарил, замещенный одним C1-7-галоалкилом, или C-гетероарил, замещенный одним C1-7-алкокси; более конкретно N, CH, CF, CCl, CCH3, CF3, C-морфолинил, C-фенил, C-пиридинил, C-пиридинил, замещенный CF3, или C-пиридинил, замещенный метокси; еще более конкретно CH, CCl, CCH3 или CCF3; наиболее предпочтительно CH или CCl.
В частном воплощении настоящего изобретения X6 представляет собой N или CR16; в частности CH, C-гало, C-C1-7-алкил, C-C1-7-галоалкил, C-арил или C-гетероциклоалкил; более конкретно N, CH, CF, CCl, CCH3, CCF3, C-фенил или C-морфолинил; наиболее предпочтительно CH.
В частном воплощении настоящего изобретения X6 представляет собой N.
В частном воплощении настоящего изобретения X7 представляет собой N или CR17.
В частном воплощении настоящего изобретения X7 представляет собой N, CH, C-гало, C-циано, C-C1-7-алкил, C-C1-7-галоалкил, C-NH2, C-C1-7-алкокси, C-B(OH)2, C-C≡C-CH2-O-CH2-арил, C-арил, C-гетероарил, или C-гетероциклоалкил; где арил возможно замещен одним заместителем, выбранным из галогена, циано, SO2-C1-7-алкила и SO2-NH2;где гетероарил возможно замещен одним или двумя заместителями, выбранными из галогена, циано, C1-7-алкила, NH2, гидрокси, C1-7-алкокси, SO2-C1-7-алкила, гетероциклоалкила и C1-7-алкил-гетероциклоалкила; и где гетероциклоалкил возможно замещен одним NH2.
В частном воплощении настоящего изобретения X7 представляет собой N, CH, CF, Cl, CBr, C-циано, C-метил, C-этил, C-изопропил, C-трет-бутил, CCF3, CNH2, C-метокси, C-B(OH)2, C-C≡C-CH2-O-CH2-фенил, C-фенил, C-гетероарил, или C-гетероциклоалкил;
где фенил возможно замещен одним заместителем, выбранным из галогена, циано, SO2-C1-7-алкил и SO2-NH2;
где гетероарил выбран из группы: имидазолил, пиразолил, пирролил, изоксазолил, пиридинил, пиразинил, пиридазинил и пиримидинил и где гетероарил возможно замещен одним или двумя заместителями, выбранными из галогена, циано, C1-7-алкила, NH2, гидрокси, C1-7-алкокси, SO2-C1-7-алкила, гетероциклоалкила и C1-7-алкил-гетероциклоалкила; и
где гетероциклоалкил представляет собой пирролидинил возможно замещенный одним NH2, морфолинил 2-окса-5-аза-бицикло[2.2.1]гептил, и 3,6-дигидро-2H-пиранил.
В частном воплощении настоящего изобретения X7 представляет собой CH, C-гало, C-C1-7-галоалкил или C-C1-7-алкокси.
В частном воплощении настоящего изобретения X7 представляет собой CH, CCl, CCF3 или C-метокси.
В частном воплощении настоящего изобретения X8 представляет собой N или CR18.
В частном воплощении настоящего изобретения X8 представляет собой N, CH, C-гало, C-C1-7-галоалкил, C-ди-C1-7-алкиламино, C-арил, C-гетероарил, или C-гетероциклоалкил; где арил возможно замещен одним заместителем, выбранным из C1-7-алкил-NH2, -CO-NH-(CH2)2-N(CH3)2, -CO-NH-(CH2)2-OH, -CO-NH-(CH2)2-гетероциклоалкила, -CO-OH, -O-C1-7-гидроксиалкила, -O-CH2-CO-OH, -SO2-C1-7-алкила, -SO2-NH2, -SO2-NH(CH2CH2OH), гетероциклоалкила, и -O-гетероциклоалкила; и где гетероарил возможно замещен одним заместителем, выбранным из галогена, C1-7-алкила, NH2 и гидрокси.
В частном воплощении настоящего изобретения X8 представляет собой N, CH, CF, CCl, CBr, CCF3, CN(CH3)2, C-фенил, C-пиридинил, или C-морфолинил; где фенил возможно замещен одним заместителем, выбранным из -CH2-NH2, -CH2-CH2-NH2, -CO-NH-(CH2)2-N(CH3)2, -CO-NH-(CH2)2-OH, -CO-NH-(CH2)2-морфолинила, -CO-OH, -O-(2,3-дигидрокси-пропокси), -O-CH2-CO-OH, -SO2-CH3, -SO2-NH2, -SO2-NH(CH2CH2OH), пиперидинила, пиперазинила и -O-пиперидинила; и где пиридинил возможно замещен одним заместителем, выбранным из фтора, метила, NH2 и гидрокси.
В частном воплощении настоящего изобретения X8 представляет собой CH, C-гало, C-C1-7-галоалкил, C-арил или C-гетероарил; где арил возможно замещен одним заместителем, выбранным из -CO-OH, -O-CH2-CO-OH, -SO2-C1-7-алкила, -SO2-NH2 и -SO2-NH(CH2CH2OH); и где гетероарил возможно замещен одним заместителем, выбранным из NH2 и гидрокси.
В частном воплощении настоящего изобретения X8 представляет собой CH, CCl, CCF3, C-фенил или C-пиридинил; где фенил возможно замещен одним заместителем, выбранным из-CO-OH, -O-CH2-CO-OH, -SO2-CH3и -SO2-NH2; и где пиридинил возможно замещен одним заместителем, выбранным из NH2 и гидрокси.
В частном воплощении настоящего изобретения R1 представляет собой -(CH2)m-гетероарил или -(CH2)m- гетероциклоалкил, где гетероарил является моноциклическим или бициклическим, в частности бициклическим, и возможно замещен одним или более галогеном, циано, C1-7-алкилом, C1-7-галоалкилом, C3-7-циклоалкилом или C1-7-алкокси; и где гетероциклоалкил является частично ненасыщенным.
В частном воплощении настоящего изобретения R1 представляет собой -(CH2)m-индолил, -(CH2)m-хинолил, или -(CH2)m-дигидроиндолил, где индолил, хинолил и дигидроиндолил возможно замещены одним или более галогеном или C1-7-алкилом.
В частном воплощении настоящего изобретения R1 представляет собой индолилметил, возможно замещенный одним или двумя заместителями, выбранными из фтора, хлора и метила или R1 представляет собой 2,3-дигидро-индолметил или R1 представляет собой хинолилметил.
В частном воплощении настоящего изобретения R1 представляет собой 1H-индол-3-илметил, 1-метил-1H-индол-3-илметил, 2-метил-1H-индол-3-илметил, 5-фтор-1H-индол-3-илметил, 5-хлор-1H-индол-3-илметил, 6-хлор-1H-индол-3-илметил, 6-хлор-1-метил-1H-индол-3-илметил, хинолин-2-илметил или 2,3-дигидро-1H-индол-3-илметил.
В частном воплощении настоящего изобретения R1 представляет собой 1H-индол-3-илметил или 2-метил-1H-индол-3-илметил.
В частном воплощении настоящего изобретения R2 представляет собой водород или C1-7-алкил, более конкретно водород, метил или этил; наиболее предпочтительно метил или этил.
В частном воплощении настоящего изобретения R3 представляет собой бутил, амино-пропил, амино-бутил, метиламино-бутил, пропионамид или амино-этоксиметил.
В частном воплощении настоящего изобретения R3 представляет собой бутил, 3-амино-пропил, 4-амино-бутил, 4-метиламино-бутил, пропионамид or 2-амино-этоксиметил.
В частном воплощении настоящего изобретения R3 представляет собой 3-амино-пропил или 4-амино-бутил; наиболее предпочтительно 4-амино-бутил.
В частном воплощении настоящего изобретения R4 представляет собой водород.
В частном воплощении настоящего изобретения R5 представляет собой водород, C1-7-алкил, гидрокси-C1-7-алкил, -(CH2)o-NR22R23, -(CH2)o-C(O)-NR22R23, -(CH2)o-O-(CH2)q-NR20R21, -(CH2)o-NH-C(NH)-NR22R23, -(CH2)o-NH-C(O)-NR22R23, -(CH2)o-NH-C(O)-OR26, -(CH2)o-гетероциклоалкил, -(CH2)o-гетероарил, -(CH2)o-арил, где гетероциклоалкил, гетероарил и арил возможно замещены галогеном, циано, C1-7-алкилом, C1-7-галоалкилом, C1-7-алкокси или арилом.
В частном воплощении настоящего изобретения R5 представляет собой водород, метил, изопропил, изобутил, гидрокси-метил, гидрокси-этил, гидрокси-пропил, амино-пропил, амино-бутил, метиламино-бутил, ацетамид, пропионамид, N-метил-пропионамид, амино-этоксиметил, уреил-метил, гуанидил-метил, бензилкарбокси-амино-пропил, пиперидинил, пиридинил-метил, метилимидазолил-метил, бифенил-метил или нафталенил-метил.
В частном воплощении настоящего изобретения R5 представляет собой -(CH2)o-NR22R23 или -(CH2)o-C(O)-NR22R23.
В частном воплощении настоящего изобретения R5 представляет собой 3-амино-пропил или пропионамид.
В частном воплощении настоящего изобретения R5' представляет собой водород или метил, наиболее предпочтительно водород.
В частном воплощении настоящего изобретения R6 представляет собой водород или метил, наиболее предпочтительно водород.
В частном воплощении настоящего изобретения R7 представляет собой водород или метил, наиболее предпочтительно водород.
В частном воплощении настоящего изобретения R8 представляет собой водород или C1-7-алкил; более конкретно водород или метил; наиболее предпочтительно водород.
В частном воплощении настоящего изобретения R9 представляет собой водород или C1-7-алкил; более конкретно водород или метил; наиболее предпочтительно водород.
В частном воплощении настоящего изобретения R10 представляет собой водород или C1-7-алкил; более конкретно водород или метил; наиболее предпочтительно водород.
В частном воплощении настоящего изобретения R11 представляет собой водород или галоген; более конкретно водород или фтор; наиболее предпочтительно водород.
В частном воплощении настоящего изобретения R12 представляет собой водород, галоген, C1-7-алкил-NR24R25, арил или гетероарил; более конкретно водород, фтор, бром, аминометил, фенил или пиридинил; наиболее предпочтительно водород.
В частном воплощении настоящего изобретения R13 представляет собой водород, галоген или арил; более конкретно водород, бром или фенил; наиболее предпочтительно водород.
В частном воплощении настоящего изобретения R14 представляет собой водород.
В частном воплощении настоящего изобретения R15 представляет собой водород, галоген, C1-7-алкил, гало-C1-7-алкил, гетероциклоалкил, арил или гетероарил, где гетероарил возможно замещен одним C1-7-галоалкилом или C1-7-алкокси.
В частном воплощении настоящего изобретения R15 представляет собой водород, фтор, хлор, метил, CF3, морфолинил, фенил или пиридинил, где пиридинил возможно замещен CF3 или метокси.
В частном воплощении настоящего изобретения R15 представляет собой водород,
В частном воплощении настоящего изобретения R16 представляет собой водород, галоген, C1-7-алкил, гало-C1-7-алкил, гетероциклоалкил или арил.
В частном воплощении настоящего изобретения R16 представляет собой водород, фтор, хлор, бром, метил, CF3, морфолинил или фенил.
В частном воплощении настоящего изобретения R16 представляет собой водород,
В частном воплощении настоящего изобретения R17 представляет собой водород, галоген, циано, C1-7-алкил, C1-7-галоалкил, -NR24R25, C1-7-алкил-NR24R25, гидрокси, C1-7-алкокси, -B(OH)2, бензилокси-пропинил, гетероциклоалкил, арил или гетероарил, где гетероциклоалкил возможно замещен одним амино, где арил возможно замещен одним галогеном, циано, -SO2-C1-7-алкилом, или -SO2-NR24R25, и где гетероарил возможно замещен одним или двумя заместителями, выбранными из группы: галоген, циано, C1-7-алкил, C1-7-гидроксиалкил, гидрокси, C1-7-алкокси, -NR24R25, -SO2-C1-7-алкил, гетероциклоалкил и гетероциклоалкил, замещенный C1-7-алкил.
В частном воплощении настоящего изобретения R17 представляет собой водород, фтор, хлор, бром, циано, метил, этил, изопропил, трет-бутил, CF3, амино, метокси, B(OH)2, бензилокси-пропинил, пирролидинил, амино-пирролидинил, морфолинил, 2-окса-5-аза-бицикло[2.2.1]гепт-5-ил, дигидропиранил, фенил, хлор-фенил, циано-фенил, метилсульфонил-фенил, аминосульфонил-фенил, имидазолил, метил-имидазолил, метил-пиразолил, диметил-пиразолил, пирролил, диметил-изоксазолил, пиридинил, фтор-пиридинил, дифтор-пиридинил, хлор-пиридинил, циано-пиридинил, метил-пиридинил, амино-пиридинил, диметиламино-пиридинил, гидрокси-пиридинил, метокси-пиридинил, метилсульфонил-пиридинил, морфолинил-пиридинил, метилпиперазинил-пиридинил, пиразинил, пиридазинил, или пиримидинил.
В частном воплощении настоящего изобретения R17 представляет собой водород, галоген, C1-7-галоалкил, или C1-7-алкокси.
В частном воплощении настоящего изобретения R17 представляет собой водород, хлор, CF3, или метокси.
В частном воплощении настоящего изобретения R18 представляет собой водород, галоген, C1-7-галоалкил, -NR24R25, гетероциклоалкил, арил или гетероарил,
где арил возможно замещен одним заместителем, выбранным из группы: C1-7-алкил-NR24R25, -CO-NH-(CH2)r-NR24R25, -CO-NH-(CH2)r-OH, -CO-NH-(CH2)r-гетероциклоалкил, -CO-OH, -O-C1-7-гидроксиалкил, -O-(CH2)r-CO-OH, -SO2-C1-7-алкил, -SO2-NR24R25, гетероциклоалкил, и -O-гетероциклоалкил,
и где гетероарил возможно замещен одним заместителем, выбранным из галогена, C1-7-алкила, амино и гидркси.
В частном воплощении настоящего изобретения R18 представляет собой водород, фтор, хлор, бром, CF3, диметиламино, морфолинил, фенил или пиридинил,
где фенил возможно замещен одним заместителем, выбранным из группы: амино-метил, амино-этил, -CO-NH-(CH2)2-N(CH3)2, -CO-NH-(CH2)2-OH, -CO-NH-(CH2)2-морфолинил, -CO-OH, 2,3-дигидрокси-пропокси, -O-CH2-CO-OH, -SO2-метил, -SO2-NH2, -SO2-NH(гидроксиэтил), пиперидинил, пиперазинила и пиперидинилокси,
и где гетероарил возможно замещен одним заместителем, выбранным из фтора, метила, амино и гидрокси.
В частном воплощении настоящего изобретения R18 представляет собой водород, хлор, CF3, фенил или пиридинил,
где фенил возможно замещен одним заместителем, выбранным из группы: -CO-OH, -O-CH2-CO-OH, -SO2-метил, -SO2-NH2, и -SO2-NH(гидроксиэтил),
и где гетероарил возможно замещен одним заместителем, выбранным из амино и и гидрокси.
В частном воплощении настоящего изобретения R19 представляет собой водород или галоген, более конкретно водород или хлор; наиболее предпочтительно водород.
В частном воплощении настоящего изобретения R20 представляет собой водород или метил, в частности водород.
В частном воплощении настоящего изобретения R21 представляет собой водород.
В частном воплощении настоящего изобретения R22 представляет собой водород, C1-7-алкил и -C(=NH)-NH2; более конкретно водород, метил или -C(=NH)-NH2; наиболее предпочтительно водород.
В частном воплощении настоящего изобретения R23 представляет собой водород.
В частном воплощении настоящего изобретения R24 представляет собой водород.
В частном воплощении настоящего изобретения R25 представляет собой водород.
В частном воплощении настоящего изобретения R26 представляет собой водород, метил или бензил.
В частном воплощении настоящего изобретения m представляет собой 1.
В частном воплощении настоящего изобретения n представляет собой 1, 3 или 4, в частности 4.
В частном воплощении настоящего изобретения o представляет собой 0, 1, 3 или 4, в частности 3.
В частном воплощении настоящего изобретения p представляет собой 1, 2, 3 или 4.
В частном воплощении настоящего изобретения q представляет собой 2.
В частном воплощении настоящего изобретения r представляет собой 1 или 2, в частности 2.
Конкретное воплощение настоящего изобретения относится к соединению формулы (I), (I'), (Ia), (Ib) или (Ic), где:
X1 представляет собой CR11;
X2 представляет собой CR12;
X3 представляет собой CR13;
X4 представляет собой N;
X5 представляет собой CR15;
X6 представляет собой CR16 или X6 представляет собой N;
R1 представляет собой -(CH2)m-индолил, где индолил возможно замещен одним или более галогеном или C1-7-алкилом;
R2 представляет собой водород или C1-7-алкил;
R3 представляет собой 3-амино-пропил или 4-амино-бутил;
R4 представляет собой водород;
R5 представляет собой -(CH2)o-NR22R23 или пиперидинил;
R6 представляет собой водород;
R7 представляет собой водород;
R8 представляет собой водород или C1-7-алкил;
R9 представляет собой водород или C1-7-алкил;
R10 представляет собой водород или C1-7-алкил;
R11 представляет собой водород или галоген;
R12 представляет собой водород или галоген;
R13 представляет собой водород;
R14 представляет собой водород;
R15 представляет собой водород, галоген, C1-7-алкил или гало-C1-7-алкил;
R16 представляет собой водород, галоген, C1-7-алкил или гало-C1-7-алкил;
R17 представляет собой водород, галоген, C1-7-алкил, гало-C1-7-алкил, C1-7-алкокси или арил;
R18 представляет собой водород, галоген или гало-C1-7-алкил;
R19 представляет собой водород или галоген;
R20 представляет собой водород;
R21 представляет собой водород;
R22 представляет собой водород, C1-7-алкил и -C(=NH)-NH2;
R23 представляет собой водород;
m представляет собой 1;
n представляет собой 3 или 4; и
o представляет собой 1, 3 или 4;
или его фармацевтически приемлемым солям.
Конкретное воплощение настоящего изобретения относится к соединению формулы (Ia), где
X1 представляет собой CH или C-галоген;
X2 представляет собой CH или C-галоген;
X3 представляет собой CH;
X4 представляет собой CH или N;
X5 представляет собой CH, C-гало, C-C1-7-алкил или C-C1-7-галоалкил;
X6 представляет собой N, CH, C-гало, C-C1-7-алкил или C-C1-7-галоалкил;
X7 представляет собой CH, C-гало, C-C1-7-алкил, C-C1-7-галоалкил, C-C1-7-алкокси или C-арил;
X8 представляет собой CH, C-галоген или C-C1-7-галоалкил;
R1 представляет собой индолилметил, возможно замещенный одним или двумя заместителями, выбранными из хлора и метила;
R2 представляет собой водород или C1-7-алкил;
R3 представляет собой 3-амино-пропил или 4-амино-бутил;
R4 представляет собой водород;
R5 представляет собой 3-амино-пропил, 4-метиламино-бутил, гуанидинил-метил или пиперидинил;
R6 представляет собой водород;
R7 представляет собой водород;
R8 представляет собой водород или C1-7-алкил;
R9 представляет собой водород или C1-7-алкил;
R10 представляет собой водород или C1-7-алкил;
R19 представляет собой водород или галоген;
или его фармацевтически приемлемым солям.
Конкретные соединения формулы (I), (I'), (Ia), (Ib) или (Ic) настоящего изобретения являются теми, которые выбраны из группы, состоящей из:
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15,18-бис-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-12-(1H-индол-3-илметил)-13-метил-18-пиперидин-4-ил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
N-[(11S,14S,17S)-14-(4-амино-бутил)-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-илметил]-гуанидин;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-5-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-6-метокси-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-4,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-5,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-6,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-4-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-5-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-6-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(6-хлор-1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(6-хлор-1-метил-1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-13-метил-12-(1-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-12-(6-хлор-1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-12-(6-хлор-1-метил-1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(9S,12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-12-(1H-индол-3-илметил)-9,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6,7-дихлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-7-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,7-дихлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-7-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-6-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-7-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,6-дихлор-23-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,7-дифтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-12-(1H-индол-3-илметил)-13-метил-4-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-13-метил-12-(2-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-22-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-16-метил-25-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,23-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дифтор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-6,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,6-дихлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-13-этил-12-(1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-13-этил-12-(1H-индол-3-илметил)-6-метокси-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-13-этил-12-(1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-13-этил-12-(1H-индол-3-илметил)-4-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-18-(4-метиламино-бутил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-6-метокси-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-6-метокси-4,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-16,25-диметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-хлор-22-фтор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-22-фтор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-12-(1H-индол-3-илметил)-4,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-23-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-13-метил-12-(2-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,13-диметил-12-(2-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,6-дихлор-13-метил-12-(2-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(9S,12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-9,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-23-метокси-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-2-тиа-5,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-23-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-23-фтор-12-(1H-индол-3-илметил)-4,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-этил-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22-хлор-17-(1H-индол-3-илметил)-16-метил-25-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-6-фенил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-трет-бутил-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-метокси-13-метил-12-(2-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-6-изопропил-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-22-фтор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-этил-17-(1H-индол-3-илметил)-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-16-этил-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-этил-17-(1H-индол-3-илметил)-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-16-этил-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-этил-17-(1H-индол-3-илметил)-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21, 23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-бромо-16-этил-17-(1H-индол-3-илметил)-25-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-11-(3-метил-3H-имидазол-4-илметил)-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-11-пиридин-3-илметил-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-16-метил-23-фенил-25-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-бромо-17-(1H-индол-3-илметил)-16-метил-25-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-бромо-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22-бромо-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-16-метил-23,25-бис-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-морфолин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-11,16-диметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-11-изопропил-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-11-гидроксиметил-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-трифторметил-2-тиа-4,7,10,13,16,19-гексааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,7,10,13,16,19-гексааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пиридин-3-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15, 18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пиридин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-11-изобутил-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-23-(2-метокси-пиридин-4-ил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11-ил]-пропионамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-7,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-(2-метил-пиридин-4-ил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-11-((S)-1-гидрокси-этил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-11,11,16-триметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-11-нафтален-2-илметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-(6-амино-пиридин-3-ил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,7,10,13,16,19-гексааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-7,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-трифторметил-2-тиа-7,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-5,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-11-нафтален-1-илметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-[2-(4-метил-пиперазин-1-ил)-пиридин-4-ил]-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
{(7S,10S,13S)-10-(4-аминобутил)-7-(3-аминопропил)-20-хлор-13-[(1H-индол-3-ил)метил]-12-метил-8,11,14-триоксо-5,6,7,8,9,10,11,12,13,14,15,16-додекагидропиридо[2,3-b][1,5,8,11,14]бензотиатетраазациклогептадецин-18-ил}бороновая кислота;
(12S,15S,18S)-15-(3-амино-пропил)-18-бифенил-4-илметил-12-(1H-индол-3-илметил)-19-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(2-амино-этоксиметил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-11,14-бис-(2-амино-этоксиметил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(2-амино-этоксиметил)-11-(3-амино-пропил)- -25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-22,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11-ил]-пропионамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-5,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-трифторметил-2-тиа-5,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11R,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-24-фенил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-24-фенил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11R,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-24-фенил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
2-[(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-ацетамид;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-6-фенил-4-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-фенил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пирролидин-1-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(5-фтор-1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-хинолин-2-илметил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(12S,15S,18S)-15,18-бис-(3-амино-пропил)-4,6-дихлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-23-(2-метокси-пиридин-4-ил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23 гексаен-11-ил]-пропионамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(5-хлор-1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(2,3-дигидро-1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-морфолин-4-ил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропионамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(3,6-дигидро-2H-пиран-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
{3-[(11S,14S,17S)-14-(4-амино-бутил)-22,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропиарбаминовой кислоты бензиловый эфир;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-6-фенил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-6-(2-хлор-фенил)-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-6-пиридин-3-ил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-6-пиридин-4-ил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-6-(1-метил-1H-пиразол-3-ил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-(2-метил-пиридин-4-ил)-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропионамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пиразин-2-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-морфолин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пиридазин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-фенил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пиридин-2-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15-18-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-бромо-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-1,4-дихлор-9-метил-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион;
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-3-хлор-9-метил-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-6-(1-метил-1H-имидазол-4-ил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-23-фенил-25-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11-ил]-пропионамид;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-20-хлор-12-метил-18-(трифторметил)-6,7,9,10,12,13,15,16-октагидробензо[b]пиридо[3,4-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-20-хлор-12-метил-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:3',4'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-1-хлор-9-метил-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[3,4-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-18-хлор-12-метил-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:4',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
3-[(11S,14S,17S)-14-(3-амино-пропил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропионамид;
3-[(11S,14S,17S)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-23-фенил-25-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-14-ил]-пропионамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-(2-морфолин-4-ил-пиридин-4-ил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-23-пиридин-2-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил] -пропионамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(2-хлор-пиридин-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(6-гидрокси-пиридин-3-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23- гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(6-диметиламино-пиридин-3-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-12-метил-18-(2-метилпиридин-4-ил)-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:4',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-5-бромо-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-23-(3,5-диметил-изоксазол-4-ил)-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропионамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-23-(2-метил-пиридин-4-ил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(2-метокси-пиридин-4-ил)-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-23-(4-метансульфонил-фенил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-23-(5-метансульфонил-пиридин-3-ил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-(3-амино-пирролидин-1-ил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(3,5-диметил-1H-пиразол-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-5-фенил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(2-фтор-пиридин-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-12-метил-18-(6-метилпиридин-3-ил)-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:4',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-3-хлор-9-метил-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[3,2-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион;
[(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-илметил]-мочевина;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-23-пиридин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(2-хлор-пиридин-4-ил)-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(2-фтор-пиридин-4-ил)-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4, 6,21,23-гексаен-12,15,18-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-23-фенил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропионамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-23-карбонитрил;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(3,5-диметил-изоксазол-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-(2-окса-5-аза-бицикло[2.2.1]гепт-5-ил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-(3-бензилокси-проп-1-инил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-4-хлор-9-метил-1-фенил-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-пиридин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-пиридин-3-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-9-метил-2-морфолино-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[3,2-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион;
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-9-метил-4-морфолино-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[3,4-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион;
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-4-хлор-9-метил-1-(пиридин-3-ил)-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион;
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-4-хлор-9-метил-1-(пиридин-4-ил)-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион;
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-4-хлор-1-(2-метоксипиридин-4-ил)-9-метил-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-18-бромо-12-метил-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:2',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-4-хлор-9-метил-1-(2-(трифторметил)пиридин-4-ил)-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(5-метансульфонил-пиридин-3-ил)-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-22-пиридин-3-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-4-хлор-9-метил-1-морфолино-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-22-пиридин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(7S,10S,13S)-10-(4-аминобутил)-7-(3-аминопропил)-20-хлор-6,7,9,10,12,13,15,16-октагидро-12-метил-13-[(2-метил-1H-индол-3-ил)метил]-18-[2-(4-метил-1-пиперазинил)-4-пиридинил]пиридо[2,3-b][1,5,8,11,14]бензотиатетраазациклогептадецин-8,11,14(5H)-трион;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-12-метил-18-морфолино-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:4',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-18-(2-метоксипиридин-4-ил)-12-метил-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:4',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-23-бромо-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-23-фенил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-23-пиридин-3-ил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(2,6-дифтор-пиридин-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3(8),4,6,22,24-гексаен-12,15,18-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-N-метил-пропионамид;
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-23-ил]-бензонитрил;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-(2-метил-пиридин-4-ил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пиримидин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-23-ил]-бензолсульфонамид;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-12-метил-18-(2-метилпиридин-4-ил)-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:2',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
(12S,15S,18S)-15-(4-амино-бутил)-23-(4-аминометил-фенил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-18-(2-метоксипиридин-4-ил)-12-метил-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:2',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-12-метил-18-морфолино-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:2',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-24-бромо-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-24-фенил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-22-пиридин-3-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропионамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-22-(2-фтор-пиридин-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-(2-амино-пиридин-4-ил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-22-ил]-бензолсульфонамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-22-(4-метансульфонил-фенил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-3-фтор-12-метил-6,7,9,10,12,13,15,16-октагидробензо[b]пиридо[3,2-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-имидазол-1-ил-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22-(6-амино-пиридин-3-ил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-23-ил]-пиридин-2-карбонитрил;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-22-(6-гидрокси-пиридин-3-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-22-(2-фтор-пиридин-4-ил)-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11-ил]-пропионамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-(1H-пиррол-3-ил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-23-карбонитрил;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(4-метансульфонил-фенил)-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-23-ил]-бензолсульфонамид;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-3-бромо-12-метил-6,7,9,10,12,13,15,16-октагидробензо[b]пиридо[3,2-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-17-(диметиламино)-12-метил-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:3',4'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-12-метил-17-(пиридин-3-ил)-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:3',4'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион;
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-22-ил]-бензойная кислота;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-22-[4-(2,3-дигидрокси-пропокси)-фенил]-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
{4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-22-ил]-фенокси}-уксусная кислота;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-[4-(пиперидин-4-илокси)-фенил]-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6, 21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-22-(4-аминометил-фенил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-22-[3-(2-амино-этил)-фенил]-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-(4-пиперазин-1-ил-фенил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,2-гексаен-12,15,18-трион;
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-22-ил]-N-(2-гидрокси-этил)-бензолсульфонамид;
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-22-ил]-N-(2-гидрокси-этил)-бензамид;
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен--22-ил]-N-(2-диметиламино-этил)-бензамид;
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-22-ил]-N-(2-морфолин-4-ил-этил)-бензамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-(4-пиперидин-4-ил-фенил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-11-(3-амино-пропил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-14-(4-метиламино-бутил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-11-(3-гидрокси-пропил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-11-(3-амино-пропил)-14-бутил-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
и их фармацевтически приемлемые соли.
Более конкретные соединения формулы (I), (I'), (Ia), (Ib) или (Ic) настоящего изобретения являются теми, которые выбраны из группы, состоящей из:
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-6-метокси-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-4,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,6-дихлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-13-этил-12-(1H-индол-3-илметил)-6-метокси-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-13-этил-12-(1H-индол-3-илметил)-4-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,6-дихлор-13-метил-12-(2-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22-хлор-17-(1H-индол-3-илметил)-16-метил-25-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-этил-17-(1H-индол-3-илметил)-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-16-этил-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-этил-17-(1H-индол-3-илметил)-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-16-этил-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-трифторметил-2-тиа-4,7,10,13,16,19-гексааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,7,10,13,16,19-гексааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11-ил]-пропионамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-пиридин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-пиридин-3-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-22-пиридин-3-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-22-пиридин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-22-пиридин-3-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропионамид;
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-22-ил]-бензолсульфонамид;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-22-(4-метансульфонил-фенил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22-(6-амино-пиридин-3-ил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-22-(6-гидрокси-пиридин-3-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион;
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-22-ил]-бензойная кислота;
{4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-22-ил]-фенокси}-уксусная кислота;
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-22-ил]-N-(2-гидрокси-этил)-бензолсульфонамид;
и их фармацевтически приемлемые соли.
Наиболее предпочтительные соединения формулы (I), (I'), (Ia), (Ib) или (Ic) настоящего изобретения являются теми, которые выбраны из группы, состоящей из:
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-6-метокси-4,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-16-этил-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-этил-17-(1H-индол-3-илметил)-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-16-этил-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион; и их фармацевтически приемлемые соли.
Дополнительные конкретные соединения формулы (I), (I'), (Ia), (Ib) или (Ic) настоящего изобретения являются теми, которые выбраны из группы, состоящей из:
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-6-метокси-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-4,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,6-дихлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-13-этил-12-(1H-индол-3-илметил)-6-метокси-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-13-этил-12-(1H-индол-3-илметил)-4-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,6-дихлор-13-метил-12-(2-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22-хлор-17-(1H-индол-3-илметил)-16-метил-25-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-этил-17-(1H-индол-3-илметил)-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-16-этил-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-этил-17-(1H-индол-3-илметил)-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-16-этил-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион;
и их фармацевтически приемлемые соли.
Способ получения
Соединения формулы (I), (I'), (Ia), (Ib) или (Ic) и его фармацевтически приемлемые соли как определено выше могут быть получены в соовтетсвии со стандартными методиками, известными из уровня техники.
1. Общий синтез линкера
Линкерное промежуточное соединение формулы (III) может быть получено в соответствии с обычными способами, известными из уровня техники, в частности в соответствии со способами, как описано в примерах (например, PG=Fmoc).

2. Общий синтез трипептида
Трипептид формулы (IV) может быть получен в соовтетствии с обычными способами, известными в уровне техники.
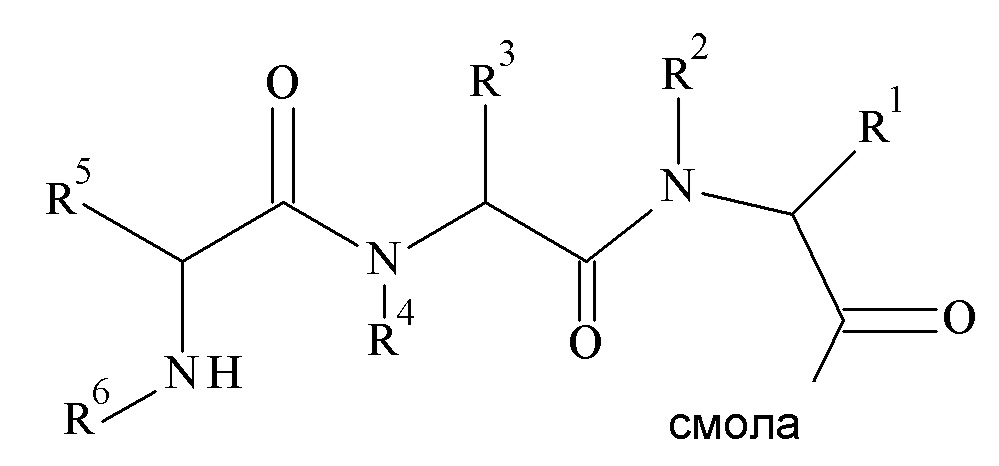
Последовательность трипептида может быть, например, синтезирована с помощью тверодфазного пептидного синтеза, известного из увроня техники (SPPS) (например, Fmoc-химия) следующим образом:
a) Смолу (например, 2-Cl-тритиловая смола) в качестве твердой подложки загружают сначала N-защищенной аминокислотой и основанием Хунига (N,N-диизопропилэтиламин или DIPEA) с последующим отщеплением защитных групп.
b) Вторая N-защищенная аминокислота связывается со связывающим реагентом и основанием Хунига с последующим отщеплением защитной группы (наприемр, Fmoc).
c) Третья N-защищенная аминокислота связывается со связывающим реагентом и основанием Хунига с последующим отщеплением защитной группы.
В случае, когда присуствуют N-метилированные аминокислоты в соединении формулы (IV), алкилирование может быть проведено на твердой фазе. После подходящей стадии SPPS, терминальный амин защищают на первой стадии, например набуханием смолы в тетрагидрофуране (ТГФ) и добавлением основания Хунига и 2-нитробензол-1-1сульфонилхлорида (Nbs). На второй стадии, метил-4-нитробензолсульфонат вместе с 7-метил-1,5,7-триазабицикло[4.4.0]дец-5-еном может быть добавлен к смоле в диметилфуране (ДМФ). Для удаления 2-нитробензол-1-1сульфонамидной защитной группы 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) можно добавить к смоле в ДМФ с последующим добавлением меркаптоэтанола.
В частном воплощении твердая подложка представляет собой 2-хлортрихлоридную смолу.
В частном воплощении N-защищенные аминокислоты защищены с помощью 9-флуоренилметоксикарбонила (Fmoc).
В частном воплощении смолу нагружают на стадии a) с помощью 0.1-1.0 экв. первой аминокислоты и избытка основания Хунига в дихлорметане (ДХМ).
В частном воплощении смолу тщательно промывают после реакции связывания на стадии a) диметилформамидом (ДМФ) и дихлорметаном (ДХМ).
В частном воплощении Fmoc защитную группу отщепляют на стадии a) с помощью смеси 50% пиперидина ДХМ/ДМФ (1:1).
В частном воплощении, смолу тщательно промывают после депротекции на стадии a) с помощью ДМФ, ДХМ и метанола (MeOH) с последующей сушкой под вакуумом и взвешиванием.
В частном воплощении, связывающий реагент на стадии b) представляет собой реагент Мукаямы (2-хлор-1-метилпиридиния йодид).
В частном воплощении, вторая аминокислота на стадии b) связвается с 4 экв. реагента Мукаямы в качестве связывающего реагента и 6 экв основания Хунига в ДМФ/ДХМ (1:1).
В частном воплощении, смолу тщательно промывают после реакции связывания на стадии b) диметилформамидом (ДМФ) и дихлорметаном (ДХМ).
В частном воплощении, Fmoc защитную группу отщепляют на стадии b) с помощью смеси 50% пиперидина в ДХМ/ДМФ (1:1).
В частном воплощении, смолу тщательно промывают после депротекции на стадии b) с помощью ДМФ и ДХМ с последующей сушкой под вакуумом и взвешиванием.
В частном воплощении, связывающий реагент на стадии c) представляет собой HATU (1-[бис(диметил-амино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиния 3-оксидгексафторфосфат).
В частном воплощении, третья аминокислота на стадии c) связвается с 4 экв. реагента Мукаямы в качестве связывающего реагента и 6 экв основания Хунига в ДМФ/ДХМ (1:1).
В частном воплощении, смолу тщательно промывают после реакции связывания на стадии c) диметилформамидом (ДМФ) и дихлорметаном (ДХМ).
В частном воплощении, Fmoc защитную группу отщепляют на стадии c) с помощью смеси 20% пиперидина в ДМФ.
В частном воплощении, смолу тщательно промывают после депротекции на стадии c) с помощью ДМФ и ДХМ с последующей сушкой под вакуумом и взвешиванием.
3. Общий синтез для связывания трипептида с линкером
Соединение формулы (I) может быть получено с использованием в качестве исходного вещества соединений формулы (III) и формулы (IV) в соовтетствии со Схемой 1.
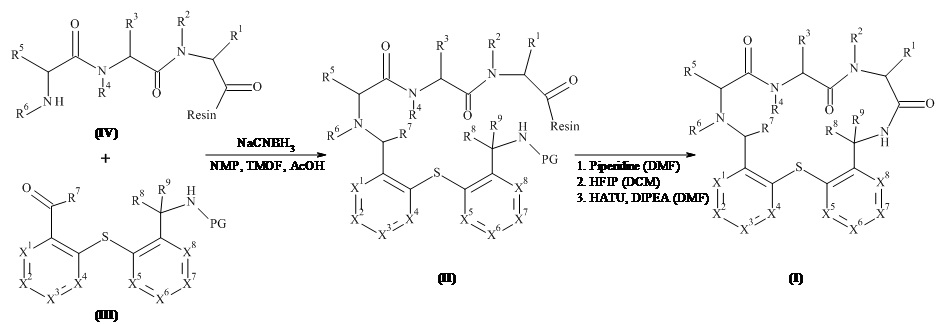
Схема 1.
Линкерный альдегид или кетон формулы (III) растворяют в смеси N-метил-2-пирролидона (NMP), триметилортоформиата (TMOF) и уксусной кислоты (AcOH) и смолу, содержащую трипептид формулы (IV) добавили к раствору. После взбалтывания смеси, цианоборогидрид натрия (NaCNBH3) добавили с получением соединения формулы (II).
После реакции Борка, защитную группу (PG) на линкере отщепляют, например с помощью смеси 20% пиперидина в ДМФ. Смолу на трипептиде можно отщепить, например, посредством добавления 20% гексафторизопропанола (HFIP) в ДХМ и фильтрованием. Соединение формулы (I) в заключение получают в результате циклизации расщепленного соединения формулы (II) с использованием HATU и оснвоания Хунига с последующей общей депротекцией оставшихся защищенных аминогрупп.
Конкретное воплощение настоящего изобретения относится к способу получения соединения формулы (I), содержащему следующие стадии:
a) взаимодействие соединения формулы (III) с соединением формулы (IV) с использованием цианоборогидрида (NaCNBH3) с получением соединения формулы (II);

b) отщепление защитной группы (PG) и смолы от соединения формулы (II);
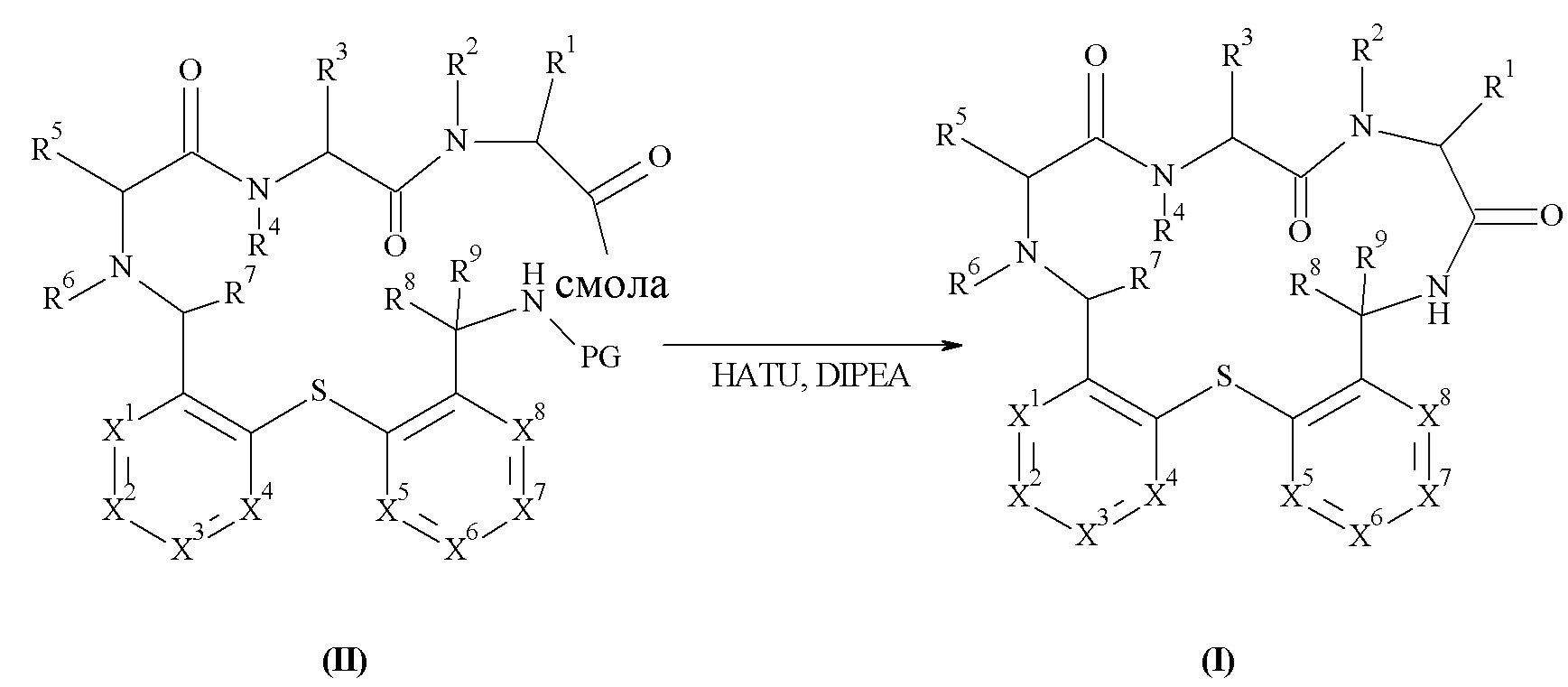
c) с последующей циклизацией отщепленного соединения формулы (II) с использованием HATU и основания Хунига.
В частном воплощении, трипептид формулы (IV) промывают с помощью ДХМ перед добавлением в линкерный альдегид или кетон формулы (III).
В частном воплощении, растворитель линкерного альдегида формулы (III) состоит из смеси N-метил-2-пирролидона (NMP), триметилортоформиата (TMOF) и уксусной кислоты (AcOH).
В частном воплощении, реакционную смесь промывают после реакции Борка с помощью ДМФ, ДХМ, MeOH/ДХМ и/или ДМФ.
В частном воплощении, циклизацию депротектированного и отщепленного соединения формулы (II) проводят с использованием HATU и DIPEA в ДМФ.
В частном воплощении, общею BOC-депротекцию проводят посредством обработки ТФУ в растворителе, в частности ДХМ, при КТ.
Фармацевтические композиции
В другом воплощении настоящего изобретения предложены фармацевтические композиции или лекарственные средства, содержащие соединения по изобретению и терапевтически инертный носитель, разбавитель или фармацевтически приемлемый эксципиент, а также способы применения соединений по изобретению для получения таких композиций и лекарственных средств.
Композиции изготавливают, дозируют и вводят в соответствии с надлежащей медицинской практикой. Факторы для рассмотрения в этом контексте включают конкретное заболевание, которое лечат, конкретное млекопитающее, подвергаемое лечению, клиническое состояние пациента, причину расстройства, место доставки агента, способ введения, режим введения и другие факторы, известные врачам.
Соединения по изобретению можно вводить любым подходящим способом, включая пероральный, топикальный (включая буккальный и подъязычный), ректальный, вагинальный, трансдермальный, парентеральный, подкожный, интраперитонеальный, внутрилегочный, внутрикожный, интратекальный и эпидуральный и интраназальный, и, при желании для местного лечения, внутриочагового введения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение.
Соединения настоящего изобретения могут быть введены в любой удобной форме, например в форме таблеток, порошков, капсул, растворов, дисперсий, суспензий, сиропов, аэрозолей, свечей, гелей, эмульсий, пластырей и т.д. Такие композиции могут содержать компоненты, подходящие для фармацевтических препаратов, например, разбавители, носители, модификаторы рН, консерванты, растворители, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты, антиоксиданты и дополнительные активные агенты. Они также могут содержать другие терапевтически ценные вещества.
Обычные композиции готовят путем смешивания соединения по настоящему изобретению и носителя или эксципиента. Подходящие носители и эксципиенты хорошо известны специалистам в данной области техники и подробно описаны в, например, Ansel H.C. и соавт, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems (2004) Lippincott, Williams & Wilkins, Philadelphia; Gennaro A.R. и соавт, Remington: The Science and Practice of Pharmacy (2000) Lippincott, Williams & Wilkins, Philadelphia; and Rowe R.C, Handbook of Pharmaceutical Excipients (2005) Pharmaceutical Press, Chicago. Композиции могут также включать один или более буферов, стабилизирующих агентов, поверхностно-активных веществ, увлажняющих агентов, любрикантов, эмульгаторов, суспендирующих агентов, консервантов, антиоксидантов, светозащитные агенты, скользящие вещества, технологические добавки, красители, подсластители, парфюмерные агенты, отдушки, растворители и другие известные добавки, чтобы обеспечить элегантную презентацию препарата (например, соединения по настоящему изобретению или его фармацевтической композиции) или помощь в производстве фармацевтического продукта (например, лекарственного препарата).
Доза, в которой могут быть введены соединения по изобретению может варьироваться в широких пределах и, конечно, соответствовать индивидуальным требованиям в каждом конкретном случае. В общем, в случае приема внутрь суточная доза от 0,01 до 1000 мг соединения общей формулы (I) на человека должна быть соответствующей, хотя верхний предел также может быть превышен в случае необходимости.
Примером подходящей пероральной лекарственной формы является таблетка, содержащая от 100 мг до 500 мг соединения по изобретению с от 30 до 90 мг безводной лактозы, от 5 до 40 мг натрия кроскармеллозы, от 5 до 30 мг поливинилпирролидона (ПВП) K30 и от 1 до 10 мг магния стеарата. Порошкообразные ингредиенты сначала смешивают вместе, а затем смешивают с раствором PVP. Полученная композиция может быть высушена, гранулирована, смешана со стеаратом магния и спрессована в форме таблеток с использованием обычного оборудования.
Пример аэрозольной композиции может быть получен путем растворения соединения, например, от 10 до 100 мг, по изобретению в соответствующем буферном растворе, например, фосфатном буфере, добавив вспомогательное вещество, например, соль, такую как хлорид натрия, если это необходимо. Раствор может быть отфильтрован, например, используя фильтр 0,2 мкм, для удаления примесей и загрязнений..
Применения
Как описано выше, соедиения формулы (I), (I'), (Ia), (Ib) или (Ic) и их фармацевтически приемлемые соли проявляют ценные фармакологические свойства для лечения или предотвращения инфекций и соответствующих заболеваний, в частности бактериемии, пневмонии, менингита, инфекции мочевых путей и раневых инфекций, вызванных патогенами, в частности бактериями, более конкретно видами Acinetobacter, наиболее предпочтительно Acinetobacter baumannii.
Соедиения формулы (I), (I'), (Ia), (Ib) или (Ic) и их фармацевтически приемлемые соли обладают активностью в качестве антибиотиков, в частности в качестве антибиотиков против видов Acinetobacter, более конкретно в качестве антибиотиков против Acinetobacter baumannii, наиболее предпочтительно в качестве патоген-специфичных антибиотиков против Acinetobacter baumannii.
Соедиения формулы (I), (I'), (Ia), (Ib) или (Ic) и их фармацевтически приемлемые соли могут быть использованы в качестве антибиотиков, например, в качестве антибактериальных фармацевтических ингредиентов, подходящих для лечения или предотвращения бактериальных инфекций, в частности для лечения или предотвращения бактериальных инфекций, вызванных видами Acinetobacter, более конкретно для лечения или предотвращения бактериальных инфекций, вызванных Acinetobacter baumannii.
Соединения настоящего изобретения могут быть использованы, самостоятельно или в комбинации с другими лекарствами, для лечения или предотвращения инфекций и соответствующих заболеваний, в частности бактериемии, пневмонии, менингита, инфекции мочевых путей и раневых инфекций, вызванных патогенами, в частности бактериями, более конкретно вызванных видами Acinetobacter, наиболее предпочтительно Acinetobacter baumannii.
Конкретное воплощение настоящего изобретения относится к фармацевтическим композициям, содержащим соединения формулы (I), (I'), (Ia), (Ib) или (Ic) как определено выше или их фармацевтически приемлемые соли, как определено выше, и один или более фармацевтически приемлемых эксципиентов.
Конкретное воплощение настоящего изобретения к фармацевтическим композициям, содержащим соединения формулы (I), (I'), (Ia), (Ib) или (Ic) или их фармацевтически приемлемые соли, как определено выш,е и один или более фармацевтически приемлемых эксципиентов для лечения или предотвращения инфекций и соответствующих заболеваний, в частности бактериемии, пневмонии, менингита, инфекции мочевых путей и раневых инфекций, вызванных патогенами, в частности бактериями, более конкретно вызванных видами Acinetobacter, наиболее предпочтительно Acinetobacter baumannii.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), (I'), (Ia), (Ib) или (Ic) или их фармацевтически приемлемым солям, как определено выше, для применения в качестве терапевтически активных веществ, особенно для применения в качестве терапевтически активных веществ для лечения или предотвращения инфекций и соответствующих заболеваний, в частности бактериемии, пневмонии, менингита, инфекции мочевых путей и раневых инфекций, вызванных патогенами, в частности бактериями, более конкретно вызванных видами Acinetobacter, наиболее предпочтительно Acinetobacter baumannii.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), (I'), (Ia), (Ib) или (Ic) или их фармацевтически приемлемым солям, как определено выше, для применения при лечении или предотвращении инфекций и соответствующих заболеваний, в частности бактериемии, пневмонии, менингита, инфекции мочевых путей и раневых инфекций, вызванных патогенами, в частности бактериями, более конкретно вызванных видами Acinetobacter, наиболее предпочтительно Acinetobacter baumannii.
Конкретное воплощение настоящего изобретения относится к способу лечения или предотвращения инфекций и соответствующих заболеваний, в частности бактериемии, пневмонии, менингита, инфекции мочевых путей и раневых инфекций, вызванных патогенами, в частности бактериями, более конкретно вызванных видами Acinetobacter, наиболее предпочтительно Acinetobacter baumannii, который включает введение соединений формулы (I), (I'), (Ia), (Ib) или (Ic) или их фармацевтически приемлемых солей, как определено выше, субъекту.
Конкретное воплощение настоящего изобретения относится к применению соединений формулы (I), (I'), (Ia), (Ib) или (Ic) или их фармацевтически приемлемым солям, как определено выше, для лечения или предотвращения инфекций и соответствующих заболеваний, в частности бактериемии, пневмонии, менингита, инфекции мочевых путей и раневых инфекций, вызванных патогенами, в частности бактериями, более конкретно вызванных видами Acinetobacter, наиболее предпочтительно Acinetobacter baumannii.
Конкретное воплощение настоящего изобретения относится к применению соединений формулы (I), (I'), (Ia), (Ib) или (Ic) или их фармацевтически приемлемым солям, как определено выше, для получения лекарственных средств для лечения или предотвращения инфекций и соответствующих заболеваний, в частности бактериемии, пневмонии, менингита, инфекции мочевых путей и раневых инфекций, вызванных патогенами, в частности бактериями, более конкретно вызванных видами Acinetobacter, наиболее предпочтительно Acinetobacter baumannii. Такие лекарственные средства содержат соединения формулы (I), (I'), (Ia), (Ib) или (Ic) или их фармацевтически приемлемые соли, как определено выше.
Примеры
Настоящее изобретение будет более полно понятным со ссылкой на следующие примеры. Однако, они не должны трактоваться как ограничивающие объем настоящего изобретения.
Используемые аббревиатуры
Agp: 2-амино-3-гуанидин-пропионовая кислота
Boc: трет-бутилоксикарбонил
ДХМ: дихлорметан
DIPEA: N,N-диизопропиламин
ДМФ: N,N-диметилформамид
EA: этилацетат
EtOAc: этилацетат
EtOH: этанол
Fmoc: 9-флуоренилметоксикарбонил
Fmoc-OSu: N-(9-флуоренилметоксикарбонилокси)сукцинимид
HATU: O-(7-азабензотриазол-1-ил)-N,N,N′,N′-тетраметилурониягексафторфосфат
HFIP: Гексафторизопропанол
HOBt: Гидрокси-бензотриазол
LAH: алюмогидрид лития
Lys: лизин
MeCN: ацетонитрил
Реагент Мукаямы: 2-хлор-1-метил-пиридиния йодид
MTBD: 7-метил-1,5,7-триазабицикло[4.4.0]дец-5-ен
NMP: N-метилпирролидон
Orn: орнитин
Pd2(dba)3: Трис(дибензилиденацетон)дипалладий(0)
ТГФ: тетрагидрофуран
ТСХ: тонкослойная хроматография
TMOF: триметилортоформиат
Trp: триптофан
p-TSA: п-толуолсульфоновая кислота
HMPA: гексаметилфосфорамид
Промежуточное соединение 1
9H-флуорен-9-илметил N-[[3-хлор-2-(2-формилфенил)сульфанил-фенил]метил]карбамат
К суспензии 3-хлор-2-фтор-бензальдегида (2.8 г, 16.64 ммоль) и K2CO3 (4.5 г, 33.29 ммоль) в ДМФ (15 мл) добавили 2-меркапто-бензойной кислоты метиловый эфир (7.9 г, 49.93 ммоль) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и экстрагировали (3 x 100 мл) этилацетатом. Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством колоночной хроматографии на силикагеле (20 % этилацетат и гексан) с получением метил 2-(2-хлор-6-формил-фенил)сульфанилбензоата (4.4 г, 86.17%) в виде белого осадка. LC-MS: 307.2 [M+H]+.
К раствору метил 2-(2-хлор-6-формил-фенил)сульфанилбензоата (4.4 г, 14.37 ммоль) и трет-бутил сульфинамида (2.61 г, 21.56 ммоль) в ТГФ (50 мл) добавили тетраэтоксид титана (4.92 г, 21.56 ммоль) и реакционную смесь нагревали до 80°C в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (3 x 100 мл). Объединенные органические слои высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством колоночной хроматографии на силикагеле (20 % этилацетат и гексан) с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-хлор-фенил]сульфанилбензоата (4.2 г, 71.25%) в виде коричневого осадка. LC-MS: = 409.8 [M+H]+.
К охлажденному на льду раствору метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-хлор-фенил]сульфанилбензоата (4.2 г, 10.26 ммоль) в ТГФ (50 мл) добавили LAH (1.1 г, 37.95 ммоль) по порциям и реакционную смесь перемешивали в течение 1 ч при этой температуре. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водным раствором сульфата натрия (50 мл) и экстрагировали этилацетатом (3 x 100 мл). Объединенные органические слои высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили тритурированием с гексаном с последующим пентаном с получением N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (3.7 г, 94.06 %) в виде коричневого осадка. LC-MS: 383.8 [M+H].
К раствору N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (3.7 г, 9.64 ммоль) в ДХМ (100 мл) добавили Периодинан Десса-Мартина (1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3(1H)-он) (12.26 г, 28.90 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и экстрагировали с помощью ДХМ (3 x 100 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили посредством колоночной хроматографии на силикагеле (этилацетат) с получением N-[[3-хлор-2-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (0.7 г, 19.02 %) в виде белого осадка. LC-MS: 381.8 [M+H]+.
К охлажденному на льду раствору N-[[3-хлор-2-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (0.800 г, 2.09 ммоль) в диоксане (10 мл) добавили 4M HCl в диоксане (0.9 мл) и получившуюся реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. Летучие компоненты удалили при пониженном давлении с получением 2-[2-(аминометил)-6-хлор-фенил]сульфанилбензальдегида (0.660 г, количественный) в виде серо-белого осадка. LC-MS: 278.0 [M+H]+.
К раствору 2-[2-(аминометил)-6-хлор-фенил]сульфанилбензальдегида (0.660 г, 2.09 ммоль) в 5% водном NaHCO3 (6 мл) добавили Fmoc-OSu (0.754 г, 2.24 ммоль) в CH3CN (20 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили этилацетатом и промыли водой с последующим солевым раствором. Органический слой высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (5-7% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-[[3-хлор-2-(2-формилфенил)сульфанил-фенил]метил]карбамата (0.460 г, 44%) в виде серо-белого осадка. LC-MS: 500.3 [M+H]
1H-NMR: (400 MHz, DMSO-d6): δ 4.22-4.19 (1H, m), 4.33-4.29 (4H, m), 6.47 (1H, d, J = 8.00 Hz), 7.37-7.28 (4H, m), 7.47-7.40 (3H, m), 7.57 (1H, t, J = 7.8 Hz), 7.64 (1H, d, J = 7.6 Hz), 7.68 (2H, d, J = 7.4 Hz), 7.90-7.81 (3H, m), 8.00 (1H, d, J = 7.5 Hz), 10.20 (1H, s).
Промежуточное соединение 2
9H-флуорен-9-илметил N-[[4-хлор-2-(2-формилфенил)сульфанил-фенил]метил]карбамат
Промежуточное соединение 2 получили по аналогии с Промежуточным соединением 1 с использованием в качестве исходного вещества соответствующим образом замещенный бензальдегид.
1H-NMR: (400 MHz, DMSO-d6) δ 4.20-4.22 (m; 3H); 4.32 (2H; d; J = 6.8 Hz); 7.6 (1H; d; J = 7.6 Hz); 7.31-7.36 (m; 4H); 7.40 (3H; t; J = 7.4 Hz); 7.46 (1H; br s); 7.54 (2H; t; J = 8.4 Hz); 7.69 (2H; d; J = 7.6 Hz); 7.82-7.84 (m; 1H); 7.90 (2H; d; J = 7.2 Hz); 7.99 (1H; d; J = 7.2 Hz); 10.21 (1H; s).
Промежуточное соединение 3
9H-флуорен-9-илметил N-[[5-хлор-2-(2-формилфенил)сульфанил-фенил]метил]карбамат
Промежуточное соединение 3 получили по аналогии с Промежуточным соединением 1 с использованием в качестве исходного вещества соответствующим образом замещенный бензальдегид.
1H-NMR: (400 MHz, DMSO-d6) δ 4.23-4.25 (m; 3H); 4.32 (2H; d; J = 6.8 Hz); 6.7 (1H; d; J = 8.0 Hz); 7.31 (2H; t; J = 7.4 Hz); 7.39-7.43 (4H; m); 7.44-7.54 (2H; m); 7.70 (2H; d; J = 7.6 Hz); 7.82-7.84 (m; 2H); 7.98 (2H; d; J = 7.2 Hz); 10.20 (1H; s).
Промежуточное соединение 4
9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанилфенил]метил]карбамат

Промежуточное соединение 4 получили соовтетственно из коммерчески доступного [2-[2-(аминометил)фенил]сульфанилфенил]метанола.
1H NMR (600 MHz, CHCl3-d6) δ ppm 4.15 - 4.22 (m, 1 H) 4.38 (d, J=6.9 Hz, 2 H) 4.48 (d, J=6.3 Hz, 2 H) 5.12 - 5.20 (m, 1 H) 6.77 (d, J=7.8 Hz, 1 H) 7.17 - 7.25 (m, 1 H) 7.27 - 7.58 (m, 12 H) 7.76 (d, J=7.6 Hz, 2 H) 7.86 (d, J=7.6 Hz, 1 H) 10.13 - 10.40 (m, 1 H).
Промежуточное соединение 5
9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-5-метокси-фенил]метил]карбамат

Суспензию Na2S.H2O (2.43 г, 31.16 ммоль) и MgSO4 (7.79 г, 64.93 ммоль) в NMP (80 мл) нагревали до 80°C в течение 30 мин в атмосфере N2. В получившуюся реакционную смесь добавили 2-фтор-5-метокси-бензальдегид (4.0 г, 25.97 ммоль) по каплям при этой же температуре и нагревали до 80°C в течение 1 ч. Затем реакционную смесь охладили до 0°C, уксусный ангидрид (3.42 мл, 36.36 ммоль) добавили по каплям и перемешивание продолжили в течение 1 ч. Реакционную смесь разделили между водой и этилацетатом, органический слой отделили , высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью флеш-хроматографии (30% этилацетат в гексане) с получением S-(2-формил-4-метокси-фенил) этантиоата (2.5 г, 45%) в виде вязкого масла. LC-MS: 210.9 (M+H).
К перемешанному раствору S-(2-формил-4-метокси-фенил) этантиоата (2.5 г, 11.90 ммоль) в безводном ТГФ (70 мл) добавили трет-бутилсульфинамид (1.44 г, 11.90 ммоль) с последующим этоксидом титана (IV) (2.49 мл, 11.90 ммоль). Получившуюся реакционную смесь нагревали до 60°C в течение 1 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. Затем реакционную смесь влили в воду (50 мл), отфильтровали через целит и промыли этилацетатом. Органический слой разделили, промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью колоночной флеш-хроматографии (25% этилацетат в гексане) с получением S-[2-[(E)-трет-бутилсульфинил-иминометил]-4-метокси-фенил] этантиоата (1.56 г, 42%) в виде красноватого масла. LC-MS: 313.7 (M+H).
Раствор S-[2-[(E)-трет-бутилсульфинилиминометил]-4-метокси-фенил] этантиоата (1.9 г, 6.07 ммоль) в ТГФ/EtOH (4:1; 50 мл) дегазировали аргоном в течение 10 мин и NaBH4 (1.61 г, 42.5 ммоль) добавили порциями при 0°C. Реакционную смесь перемешивали в течение 1 ч. Реакционную смесь затем погасили смесью ацетон/этанол (1:1; дегазированная аргоном) и перемешивали в течение 1 ч при комнатной температуре. Летучие компоненты эвапорировали при пониженном давлении и высвободили в атмосфере аргона с получением N-[(5-метокси-2-сульфанил-фенил)метил]-2-метил-пропан-2-сульфинамида (1.65 г, неочищенный) в виде желтого осадка, который использовали как есть на следующей стадии без дополнительной очистки.LC-MS: 273.9 (M+H).
К раствору N-[(5-метокси-2-сульфанил-фенил)метил]-2-метил-пропан-2-сульфинамида (1.6 г, 2.05 ммоль) в ДМФ (40 мл, дегазированный аргоном перед добавлением в течение приблизительно 10 мин) добавили K2CO3 (1.61 г, 11.72 ммоль) и 2-фторбензальдегид (0.93 мл, 8.79 ммоль) последовательно и реакционную смесь перемешивали при 70°C в течение 5 ч. Затем реакционную смесь разбавили этилацетатом, промыли водой с последующим солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили с помощью колоночной флеш-хроматографии (50% EtOAc в гексане) с получением N-[[2-(2-формилфенил)сульфанил-5-метокси-фенил]метил]-2-метил-пропан-2-сульфинамида (0.64 г, 24.3% за две стадии) в виде серо-белого осадка. LC-MS: 378.1 (M+H).
К охлажденному на льду раствору N-[[2-(2-формилфенил)сульфанил-5-метокси-фенил]метил]-2-метил-пропан-2-сульфинамида (0.64 г, 1.69 ммоль) в диоксане (3 мл) добавили 4M HCl в диоксане (10 мл) и реакционную смесь оставили перемешиваться при комнатной температуре в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. Летучие компоненты эвапорировали при пониженном давлении с получением 2-[2-(аминометил)-4-метокси-фенил]сульфанилбензальдегида (0.52 г, 99%) в виде серо-белого осадка. LC-MS: 274.1 (M+H).
К охлажденной на льду суспензии 2-[2-(аминометил)-4-метокси-фенил]сульфанилбензальдегида (0.52 г,1.68 ммоль) в ацетонитриле (20 мл) и 5% водном растворе NaHCO3 (2 мл) добавили Fmoc-OSu (0.57 г, 1.68 ммоль) в CH3CN (20 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили этилацетатом (50 мл) и органический слой отделили . Органический слой промыли водой с последующим солевым раствором и высушили над безводным сульфатом натрия. Органический слой сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (10% EtOAc в гексане) с получением 9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-5-метокси-фенил]метил]карбамата (0.50 г, 60%) в виде серо-белого осадка. LC-MS: 496.4 (M+H).
1H-NMR: (400 MHz, CDCl3): δ 3.84 (3H, s), 4.15 (1H, t, J = 7.00 Hz), 4.34 (2H, d, J = 7.1 Hz), 4.41 (2H, d, J = 6.4 Hz), 5.16 (1H, t, J = 5.8 Hz), 6.65 (1H, d, J = 8.0 Hz), 6.90 (1H, dd, J = 8.5, 2.6 Hz), 7.11 (1H, d, J = 2.5 Hz), 7.31-7.17 (4H, m), 7.39-7.36 (2H, m), 7.53-7.47 (3H, m), 7.74 (2H, d, J = 7.5 Hz), 7.81 (1H, d, J = 7.6 Hz), 10.27 (1H, s).
Промежуточное соединение 6
9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-3-метил-фенил]метил]карбамат

Суспензию Na2S. 9H2O (4.79 г, 61.41 ммоль) и MgSO4 (10.87 г, 90.31 ммоль) в NMP (100 мл) перемешивали при 80°C в течение периода 30 мин в атмосфере аргона. В получившуюся реакционную смесь добавили раствор 2-фтор-3-метилбензальдегида (5 г, 36.12 ммоль) в NMP (25 мл) по каплям при 80°C и перемешивание продолжили в течение 30 мин при 80°C. Затем реакционную смесь охладили в ванне со льдом. В получившуюся реакционную смесь добавили уксусный ангидрид (6 мл) по каплям и реакционную смесь перемешивали в течение 30 мин. Прогресс реакции контролировали с помощью ТСХ. Затем реакционную смесь разделили между водой и этилацетатом; органический слой отделили , высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили посредством флеш-хроматографии (25% этилацетат в гексане) с получением S-(2-формил-6-метил-фенил) этантиоата (3.2 г, 45.64%) в виде коричневого осадка. LC-MS: 194.25 (M+H).
К раствору S-(2-формил-6-метил-фенил) этантиоата (3.2 г, 16.47 ммоль) в безводном ТГФ (100 мл) добавили 2-метилпропан-2-сульфинамид (1.99 г, 16.47 ммоль) и тетраэтоксид титана (3.76 г, 16.474 ммоль) последовательно. Получившуюся реакционную смесь перемешивали в течение периода 2 ч в атмосфере аргона при 60°C. Затем реакционную смесь охладили до комнатной температуры, влили в воду со льдом и отфильтровали через небольшой слой целита. Фильтрат экстрагировали этилацетатом (100 мл x 2) и объединенный органический слой промыли солевым раствором (100 мл x 2), высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (10-20% этилацетат в гексане) с получением S-[2-[(E)-трет-бутилсульфинилиминометил]-6-метил-фенил] этантиоата (2.9 г, 59.30%) в виде вязкого масла. LC-MS: 297.44 (M+H).
Раствор S-[2-[(E)-трет-бутилсульфинилиминометил]-6-метил-фенил] этантиоата (2.7 г, 9.091 ммоль) в ТГФ-этаноле (4:1; 75 мл) дегазировали аргоном в течение 15 мин и затем борогидрид натрия (2.75 г, 72.727ммоль) добавили по порциям при 0°C. Получившуюся реакционную смесь перемешивали в течение 30 мин при 0°C и 30 мин при комнатной температуре. Затем реакционную смесь погасили смесью ацетон/этанол (1:1; 30 мл) (дегазированный аргоном) и перемешивали в течение 1 часа при 0°C. Летучие компоненты эвапорировали при пониженном давлении и высвободили в атмосфере аргона с получением 2-метил-N-[(3-метил-2-сульфанил-фенил)метил]пропан-2-сульфинамида (неочищенный) в виде желтого осадка. Это соединение использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 257.41(M+H).
К раствору 2-метил-N-[(3-метил-2-сульфанил-фенил)метил]пропан-2-сульфинамида (2.31 г, 8.98 ммоль) в ДМФ (80 мл) (дегазированный аргоном перед добавлением в течение 10 мин) добавили карбонат калия (2.48 г, 17.947 ммоль) и 2-фторбензальдегид (3.34 г, 26.92 ммоль) и реакционную смесь нагревали до 70°C в течение 5 ч. Затем реакционную смесь разбавили этилацетатом (50 мл), промыли водой (50 мл) с последующим солевым раствором (50 мл x 2), высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством силикагелевой (100-200 меш) колоночной хроматографии (3% метанол в ДХМ) с получением N-[[2-(2-формилфенил)сульфанил-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.0 г, 25% за две стадии) в виде вязкого коричневого масла. LC-MS: 361.53 (M+H).
К охлажденному на льду раствору N-[[2-(2-формилфенил)сульфанил-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (0.950 г, 2.63 ммоль) в диоксане (10 мл) добавили 4M HCl в диоксане (0.95 мл) и получившуюся реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. Летучие компоненты эвапорировали при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром и высушили с получением 2-[2-(аминометил)-6-метил-фенил]сульфанилбензальдегида (0.670 г, 87.10 %) в виде белого осадка. Это соединение использовали как есть на следующей стадии без дополнительной очистки.LC-MS: 257.36 (M+H).
К перемешанной суспензии 2-[2-(аминометил)-6-метил-фенил]сульфанилбензальдегида (0.670 г, 2.607 ммоль) в 5% бикарбонате натрия (5 мл) добавили раствор Fmoc-OSU ( 0.879 г, 2.607 ммоль) в ацетонитриле (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь затем разбавили этилацетатом (50 мл) и промыли солевым раствором (50 мл), высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (25% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-3-метил-фенил]метил]карбамата (0.48 г, 44.12%) в виде белого осадка. LC-MS: 479.60 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 2.29 (3H, s), 4.20 (1H, t, J = 6.7 Hz), 4.26 (2H, d, J = 6.00 Hz), 4.30 (2H, t, J = 6.8 Hz), 6.45 (1H, d, J = 8.00 Hz), 7.21 (1H, d, J = 7.56 Hz), 7.35-7.29 (4H, m), 7.48-7.38 (4H, m), 7.69 (2H, d, J = 7.52 Hz), 7.78 (1H, t, J = 6.00 Hz), 7.89 (2H, d, J = 7.5 Hz), 7.97 (1H, d, J = 6.2 Hz), 10.22 (1H, s).
Промежуточное соединение 7
9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-4-метил-фенил]метил]карбамат

Суспензию сульфида натрия (4.8 г, 78.04 ммоль) и MgSO4 (10.8 г, 90.48 ммоль) в NMP (100 мл) перемешивали при 80°C в течение периода 30 мин в атмосфере аргона. В получившуюся реакционную смесь добавили раствор 2-фтор-4-метилбензальдегида (5 г, 36.19 ммоль) в NMP (25 мл) по каплям при 80°C и перемешивание продолжили в течение 30 мин при 80°C. Затем реакционную смесь охладили в ванне со льдом. В получившуюся реакционную смесь добавили уксусный ангидрид (5.1 мл, 54.29 ммоль) по каплям и реакционную смесь перемешивали в течение 30 мин. Прогресс реакции контролировали с помощью ТСХ. Затем реакционную смесь разделили между водой (150 мл) и этилацетатом (150 мл), органический слой отделили , высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили с помощью хроматографии на системе Combiflash (30% этилацетат в гексане) с получением S-(2-формил-5-метил-фенил) этантиоата (4.8 г, 68%) в виде вишневого осадка. LC-MS: 195.0 (M+H).
К раствору S-(2-формил-5-метил-фенил) этантиоата (4.8 г, 24.71 ммоль) в безводном ТГФ (100 мл) добавили 2-метилпропан-2-сульфинамид (2.9 г, 24.71 ммоль) с последующим тетраэтоксидом титана (5.6 г, 24.71 ммоль) и получившуюся реакционную смесь перемешивали в течение периода 30 мин в атмосфере аргона при 60°C. Затем реакционную смесь охладили до комнатной температуры, влили в воду со льдом и отфильтровали через небольшой слой целита. Фильтрат экстрагировали этилацетатом (100 мл x 2), промыли солевым раствором (100 мл x 2), высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью хроматографии на системе Combiflash (10-20% этилацетат в гексане) с получением S-[2-[(E)-трет-бутилсульфинилиминометил]-5-метил-фенил] этантиоата (4.5 г, 61%) в виде бледно-оранжевого осадка. LC-MS: 313.6 (M+H).
Раствор S-[2-[(E)-трет-бутилсульфинилиминометил]-5-метил-фенил] этантиоата (1.5 г, 4.78 ммоль) в ТГФ-этаноле (4:1; 40 мл) дегазировали аргоном в течение 15 мин и затем борогидрид натрия (1.4 г, 38.28 ммоль) добавили по порциям при 0°C и реакционную смесь перемешивали в течение 30 мин при 0°C и 30 мин при комнатной температуре. Затем реакционную смесь погасили смесью ацетон/этанол (1:1; 30 мл) (дегазированный аргоном) и перемешивание продолжили в течение 1 ч при 0°C. Летучие компоненты эвапорировали при пониженном давлении и высвободили в атмосфере аргона с получением 2-метил-N-[(4-метил-2-сульфанил-фенил)метил]пропан-2-сульфинамида в виде желтого осадка. Это соединение использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 258 (M+H).
К раствору 2-метил-N-[(4-метил-2-сульфанил-фенил)метил]пропан-2-сульфинамида (3 г, неочищенный) в ДМФ (60 мл) (дегазированный аргоном перед добавлением в течение приблизительно 10 мин) добавили карбонат калия (1.2 г, 9.32 ммоль) и 2-фторбензальдегид (1.7 г, 13.98 ммоль) и реакционную смесь нагревали до 70°C в течение 5 ч. Затем реакционную смесь разбавили этилацетатом (50 мл), промыли водой (50 мл) с последующим солевым раствором (50 мл x 2), высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством силикагелевой (100-200 меш) колоночной хроматографии (5% метанол в ДХМ) с получением N-[[2-(2-формилфенил)сульфанил-4-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (0.6 г, 16% за две стадии) в виде бесцветной жидкости.LC-MS: 362.1 (M+H).
К охлажденному на льду раствору N-[[2-(2-формилфенил)сульфанил-4-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (0.8 г, 2.216 ммоль) в диоксане (10 мл) добавили 4M HCl в диоксане (0.8 мл) и получившуюся реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. Летучие компоненты эвапорировали при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром и высушили с получением 2-(2-этил-5-метил-фенил)сульфанилбензальдегида (0.56 г, 98%) в виде бледно-желтого осадка. Это соединение использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 258.0 (M+H).
К перемешанной суспензии 2-(2-этил-5-метил-фенил)сульфанилбензальдегида (0.56 г, 2.17 ммоль) в 5% бикарбонате натрия (5 мл) добавили раствор Fmoc-OSU (0.73 г, 2.18 ммоль) в ацетонитриле (2 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Затем реакционную смесь разбавили этилацетатом (50 мл) и промыли солевым раствором (50 мл). Органический слой высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили с помощью хроматографии на системе Combiflash (30% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-4-метил-фенил]метил]карбамата (0.51 г, 56%) в виде серо-белого осадка. LC-MS: 480.5 (M+H).
1H-NMR: (400 MHz, CDCl3): δ 2.33 (3H, s), 4.16 (1H, t, J = 7.0 Hz), 4.35 (2H, d, J = 7.0 Hz), 4.41 (2H, d, J = 6.0 Hz), 5.12 (1H, br t, J = 5.3 Hz), 6.75 (1H, d, J = 7.7 Hz), 7.33-7.23 (5H, m), 7.42-7.35 (4H, m), 7.52 (2H, d, J = 7.6 Hz), 7.74 (2H, d, J = 7.5 Hz), 7.84 (1H, d, J = 7.6 Hz), 10.29 (1H, s).
Промежуточное соединение 8
9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-5-метил-фенил]метил]карбамат

Суспензию Na2S.H2O (4.79 г, 61.41 ммоль) и MgSO4 (10.87 г, 90.31 ммоль) в NMP (100 мл) перемешивали при 80°C в течение периода 30 мин в атмосфере аргона. В получившуюся реакционную смесь добавили раствор 2-фтор-5-метилбензальдегида (5 г, 36.12 ммоль) в NMP (25 мл) по каплям при 80°C и перемешивание продолжили в течение 30 мин при 80°C. Затем реакционную смесь постепенно охладили в ванне со льдом. В получившуюся реакционную смесь добавили уксусный ангидрид (6 мл) по каплям и реакционную смесь перемешивали в течение 30 мин. Прогресс реакции контролировали с помощью ТСХ. Затем реакционную смесь разделили между водой и этилацетатом, органический слой отделили , высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (30% этилацетат в гексане) с получением S-(2-формил-4-метил-фенил) этантиоата (3.3 г, 47%) в виде коричневого осадка.LC-MS: 194.25 (M+H).
К перемешанному раствору S-(2-формил-4-метил-фенил) этантиоата (3.3 г, 17.01 ммоль) в безводном ТГФ (100 мл) добавили трет-бутилсульфинамид (2.06 г, 17.01 ммоль) с последующим тетраэтоксидом титана (3.88 г, 17.01 ммоль) и получившуюся реакционную смесь перемешивали в течение периода 2 ч в атмосфере аргона при 60°C. Затем реакционную смесь влили в воду со льдом и отфильтровали через небольшой слой целита. Фильтрат экстрагировали этилацетатом (100 мл x 2), промыли солевым раствором (100 мл x 2), высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью хроматографии на системе Combiflash (10-20% этилацетат в гексане) с получением S-[2-[(E)-трет-бутилсульфинилиминометил]-4-метил-фенил] этантиоата (3.0 г, 59.40%) в виде вязкого масла. LC-MS: 297.44 (M+H).
Раствор тоиуксусной кислоты S-[2-[(E)-трет-бутилсульфинилиминометил]-4-метил-фенил] этантиоата (2.0 г, 6.73 ммоль) в ТГФ-этаноле (4:1; 75 мл) дегазировали аргоном в течение 15 мин и затем борогидрид натрия (2.03 г, 53.87 ммоль) добавили по порциям при 0°C и реакционную смесь перемешивали в течение 30 мин при 0°C и 30 мин при комнатной температуре. Реакционную смесь затем погасили смесью ацетон/этанол (1:1; 30 мл) (дегазированный аргоном) и перемешивали в течение 1 ч при 0°C. Летучие компоненты эвапорировали при пониженном давлении и высвободили в атмосфере аргона с получением 2-метил-N-[(5-метил-2-сульфанил-фенил)метил]пропан-2-сульфинамида (неочищенный) в виде желтого осадка. Это соединение использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 257.41(M+H).
К раствору 2-метил-N-[(5-метил-2-сульфанил-фенил)метил]пропан-2-сульфинамида (1.73 г, 6.7 ммоль) в ДМФ (80 мл) (дегазированный аргоном перед добавлением в течение приблизительно 10 мин) добавили карбонат калия (1.86 г, 13.463 ммоль) и 2-фторбензальдегид (2.50 г, 20.194 ммоль) последовательно и реакционную смесь нагревали до 70°C в течение 5 ч. Прогресс реакции контролировали с помощью ТСХ. Затем реакционную смесь разбавили этилацетатом (50 мл), промыли водой (50 мл) с последующим солевым раствором (50 мл x 2), высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством силикагелевой (100-200 меш) хроматографии (3% метанол в ДХМ) с получением N-[[2-(2-формилфенил)сульфанил-5-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (0.840 г, 21% за две стадии) в виде коричневого вязкого масла.LC-MS: 361.5 (M+H).
К раствору N-[[2-(2-формилфенил)сульфанил-5-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (0.840 г, 3.26 ммоль) в диоксане (10 мл) добавили 4M HCl в диоксане (0.87 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. Летучие компоненты эвапорировали при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром и высушили с получением 2-(2-этил-4-метил-фенил)сульфанилбензальдегида (0.600 г, 88.10%) в виде белого осадка. Это соединение использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 257.36 (M+H).
К перемешанной суспензии 2-(2-этил-4-метил-фенил)сульфанилбензальдегида гидрохлорида (0.600 г, 2.33 ммоль) в 5% бикарбонате натрия (5 мл) добавили Fmoc-OSU ( 0.787 г, 2.334 ммоль) в ацетонитриле (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Затем реакционную смесь разбавили этилацетатом (50 мл) с последующим солевым раствором (50 мл), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (25% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-5-метил-фенил]метил]карбамата (0.5 г, 51%) в виде серо-белого осадка. LC-MS: 480.1 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 2.36 (3H, s), 4.23-4.21 (3H, br m), 4.30-4.28 (2H, br m), 6.64 (1H, d, J = 8.0 Hz), 7.24-7.20 (2H, m), 7.37-7.30 (3H, m), 7.47-7.38 (4H, m), 7.70 (2H, d, J = 7.4 Hz), 7.81 (1H, t, J = 5.7 Hz), 7.90 (2H, d, J = 7.5 Hz), 7.95 (1H, d, J = 7.6 Hz), 10.20 (1H, s).
Промежуточное соединение 9
9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-3-(трифторметил)фенил]метил]карбамат

К раствору 2-фтор-3-трифторметил-бензальдегида (2.0 г, 10.41 ммоль) в ДМФ (4 мл) добавили K2CO3 (2.8 г, 20.82 ммоль) с последующим 2-меркапто-бензойной кислоты метиловым эфиром (2.62 г, 15.61 ммоль) и реакционную смесь перемешивали в течение 6 ч при комнатной температуре. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (30 мл) и экстрагировали этилацетатом (70 мл). Органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-[2-формил-6-(трифторметил)фенил]сульфанилбензоата (3.0 г, 84.67%) в виде серо-белого осадка. LC-MS: 341.0 (M+H).
К раствору метил 2-[2-формил-6-(трифторметил)фенил]сульфанилбензоата (3 г, 8.81 ммоль) в безводном ТГФ (50 мл) добавили трет-бутилсульфинамид (1.6 г, 13.22 ммоль) с последующим этоксидом титана (IV) (3.49 мл, 16.6 ммоль) и реакционную смесь нагревали до 80°C в течение 1 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (30 мл) и экстрагировали этилацетатом (70 мл). Органический слой отделили, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-метил-фенил]сульфанилбензоата (3.8 г, 97.19%) в виде бледно-желтого вязкого масла. LC-MS: 443.8 (M+H).
К охлажденной на льду суспензии LAH (0.977 г, 25.73 ммоль) в ТГФ (30 мл) добавили метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-метил-фенил]сульфанилбензоат (3.8 г, 8.57 ммоль) в ТГФ (30 мл) и реакционную смесь перемешивали в течение 2 ч при 0°C. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили насыщенным раствором сульфата натрия (3 мл) и отфильтровали через целит. Остаток промыли этилацетатом (80 мл) и фильтрат сконцентрировали с получением N-[[2-[2-(гидроксиметил)фенил]сульфанил-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.6 г, 72.6%) в виде серо-белого осадка. LC-MS: 418.1 (M+H).
К охлажденному на льду раствору N-[[2-[2-(гидроксиметил)фенил]сульфанил-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.6 г , 6.235 ммоль) в ДХМ (100 мл) добавили периодинан Десса-Мартина (7.931 г, 18.70 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь влили в насыщенный раствор бикарбоната натрия и экстрагировали с помощью ДХМ (3 x 100 мл). Объединенный органический слой промыли тиосульфатом натрия, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили хроматографией на системе Combiflash (этилацетат) с получением N-[[2-(2-формилфенил)сульфанил-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.2 г, 46%) в виде серо-белого осадка. LC-MS: 415.9 (M+H).
К охлажденному на льду раствору N-[[2-(2-формилфенил)сульфанил-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.2 г, 2.88 ммоль) в диоксане (12 мл) добавили 4M HCl в диоксане (1.2 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты эвапорировали при пониженном давлении с получением 2-[2-(аминометил)-6-метил-фенил]сульфанилбензальдегида (0.88 г, 97.87 %) в виде желтого осадка. LC-MS: 311.9 (M+H).
К охлажденной на льду суспензии 2-[2-(аминометил)-6-метил-фенил]сульфанилбензальдегида (0.88 г, 2.82 ммоль) в ацетонитриле (15 мл) и 5% водном растворе NaHCO3 (8 мл) добавили раствор Fmoc-OSu (0.953 г, 2.82 ммоль) в CH3CN (15 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили этилацетатом (50 мл) и органический слой отделили . Органический слой промыли водой с последующим солевым раствором и высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили посредством флеш-хроматографии (5-7% EtOAc в гексане) с получением 9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-3-метил-фенил]метил]карбамата (1.1 г, 82%) в виде белого осадка. LC-MS: 533.9 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.20 (3H, br), 4.33 (2H, d, J = 6.6 Hz), 6.36 (1H, d, J = 7.9 Hz), 7.44-7.31 (6H, m), 7.61 (1H, d, J = 7.4 Hz), 7.68 (2H, d, J = 7.4 Hz), 7.86-7.76 (2H, m), 7.92-7.88 (3H, m), 8.01 (1H, d, J = 7.4 Hz), 10.17 (1H, s).
Промежуточное соединение 10
9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-4-(трифторметил)фенил]метил]карбамат

К раствору 2-фтор-4-трифторметил-бензальдегида (2.0 г, 10.41ммоль) в ДМФ (4 мл) добавили K2CO3 (2.8 г, 20.82 ммоль) с последующим 2-меркапто-бензойной кислоты метиловым эфиром (2.62 г, 15.61 ммоль) и реакционную смесь перемешивали в течение 6 ч при комнатной температуре. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (30 мл) и экстрагировали этилацетатом (70 мл). Органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-[2-формил-5-(трифторметил)фенил]сульфанилбензоата (3.0 г, 84.67 %) в виде серо-белого осадка. LC-MS: 341.1 (M+H).
К раствору метил 2-[2-формил-5-(трифторметил)фенил]сульфанилбензоата (3 г, 8.81 ммоль) в безводном ТГФ (50 мл) добавили трет-бутилсульфинамид (1.6 г, 13.22 ммоль) с последующим этоксидом титана (IV) (2.77 г, 13.22 ммоль) и реакционную смесь нагревали до 80°C в течение 1 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (30 мл) и экстрагировали этилацетатом (70 мл). Органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-5-(трифторметил)фенил]сульфанилбензоата (3.8 г, 97.19%) в виде бледно-желтого вязкого масла. LC-MS: 443.9 (M+H).
К охлажденной на льду суспензии LAH (0.977 г, 25.73 ммоль) в ТГФ (30 мл) добавили метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-5-(трифторметил)фенил]сульфанилбензоат (3.8 г, 8.57 ммоль) в ТГФ (30 мл) и реакционную смесь перемешивали в течение 2ч при 0°C. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили насыщенным раствором сульфата натрия (3 мл) и отфильтровали через целит. Остаток промыли этилацетатом (80 мл) и фильтрат сконцентрировали с получением N-[[2-[2-(гидроксиметил)фенил]сульфанил-4-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (3.5 г, 99%) в виде желтого масла. LC-MS: 418.1 (M+H).
К охлажденному на льду раствору N-[[2-[2-(гидроксиметил)фенил]сульфанил-4-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (3.5 г , 8.39 ммоль) в ДХМ (100 мл) добавили периодинан Десса-Мартина (10.67 г, 25.18 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь влили в насыщенный раствор бикарбоната натрия и экстрагировали с помощью ДХМ (3 x 100 мл). Объединенный органический слой промыли тиосульфатом натрия, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили хроматографией на системе Combiflash (этилацетат) с получением N-[[2-(2-формилфенил)сульфанил-4-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.7 г, 48.75%) в виде вязкого желтого масла. LC-MS: 415.9 (M+H).
К охлажденному на льду раствору N-[[2-(2-формилфенил)сульфанил-4-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.7 г, 4.091 ммоль) в диоксане (17 мл) добавили 4M HCl в диоксане (1.7 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты эвапорировали при пониженном давлении с получением 2-[2-(аминометил)-5-(трифторметил)фенил]сульфанилбензальдегида (1.1 г, 86%) в виде серо-белого осадка. LC-MS: 311.9 (M+H).
К охлажденной на льду суспензии 2-[2-(аминометил)-5-(трифторметил)фенил]сульфанилбензальдегида (1.1 г, 3.53 ммоль) в ацетонитриле (15 мл) и 5% водном растворе NaHCO3 (8 мл) добавили раствор Fmoc-OSu (1.19 г, 3.53 ммоль) в CH3CN (15 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили этилацетатом (50 мл) и органический слой отделили . Органический слой промыли водой с последующим солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили посредством флеш-хроматографии (5-7% EtOAc в гексане) с получением 9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-4-метил-фенил]метил]карбамата (0.530 г, 31%) в виде серо-белого осадка. LC-MS: 534.2 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.22 (1H, t, J = 6.7 Hz), 4.29 (2H, d, J = 5.7 Hz), 4.35 (2H, d, J = 6.7 Hz), 6.76 (1H, d, J = 7.9 Hz), 7.35-7.31 (2H, m), 7.46-7.40 (3H, m), 7.52 (1H, d, J = 7.2 Hz), 7.56 (1H, d, J = 7.8 Hz), 7.69 (2H, d, J = 7.4 Hz), 7.91-7.85 (3H, m), 7.73 (1H, s)., 7.94 (1H, t, J = 8.00 Hz), 8.00 (1H, d, J = 7.4 Hz), 10.22 (1H, s).
Промежуточное соединение 11
9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-5-(трифторметил)фенил]метил]карбамат

К раствору 2-фтор-5-трифторметил-бензальдегида (2.0 г, 10.41ммоль) в ДМФ (4 мл) добавили K2CO3 (2.8 г, 20.82 ммоль) с последующим 2-меркапто-бензойной кислоты метиловым эфиром (2.67 г, 15.61 ммоль) и реакционную смесь перемешивали в течение 4 ч при комнатной температуре. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (3 x 100 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-[2-формил-4-(трифторметил)фенил]сульфанилбензоата (3.5 г, 98.78%) в виде серо-белого осадка. LC-MS: 340.7 (M+H).
К раствору метил 2-[2-формил-4-(трифторметил)фенил]сульфанилбензоата (3.5 г, 16.6 ммоль) в безводном ТГФ (20 мл) добавили трет-бутилсульфинамид (2.01 г, 16.6 ммоль) с последующим этоксидом титана (IV) (3.49 мл, 16.6 ммоль) и реакционную смесь нагревали до 80°C в течение 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (50 мл), отфильтровали через целит и промыли этилацетатом. Органический слой отделили, промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4-(трифторметил)фенил]сульфанилбензоата (4.0 г, 54.11%) в виде серо-белого осадка. LC-MS: 444.0 (M+H).
К охлажденной на льду суспензии LAH (1.02 г, 27.0 ммоль) в ТГФ (60 мл) добавили метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4-(трифторметил)фенил]сульфанилбензоат (4.0 г, 9.02 ммоль) в ТГФ (40 мл) и реакционную смесь перемешивали в течение 30 мин при 0°C. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили насыщенным раствором сульфата натрия (5 мл) и отфильтровали через целит. Остаток промыли этилацетатом (3 x 50 мл) и фильтрат сконцентрировали с получением N-[[2-[2-(гидроксиметил)фенил]сульфанил-5-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (3.0 г, 79.58 %) в виде серо-белого осадка. LC-MS: 418 (M+H).
К охлажденному на льду раствору N-[[2-[2-(гидроксиметил)фенил]сульфанил-5-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (3.0 г, 7.1 ммоль) в ДХМ (100 мл) добавили периодинан Десса-Мартина (9.1 г, 21.5 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь влили в насыщенный раствор бикарбоната натрия и экстрагировали с помощью ДХМ (3 x 100 мл). Объединенный органический слой промыли тиосульфатом натрия, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили с использованием флеш-хроматографии (этилацетат) с получением N-[[2-(2-формилфенил)сульфанил-5-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.7 г, 56.87%) в виде серо-белого осадка. LC-MS: 415.7 (M+H).
К охлажденному на льду раствору N-[[2-(2-формилфенил)сульфанил-5-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.7 г, 4.09 ммоль) в диоксане (20 мл) добавили 4M HCl в диоксане (1.7 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты эвапорировали при пониженном давлении с получением 2-[2-(аминометил)-4-(трифторметил)фенил]сульфанилбензальдегида (1.1 г, 86.36%) в виде серо-белого осадка. LC-MS: 312.1 (M+H).
К суспензии 2-[2-(аминометил)-4-(трифторметил)фенил]сульфанилбензальдегида (1.0 г, 3.53 ммоль) в 5% водном растворе NaHCO3 (8 мл) добавили Fmoc-OSu (1.19 г, 3.53 ммоль) в CH3CN (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили этилацетатом (50 мл) и органический слой отделили . Органический слой промыли водой с последующим солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили посредством флеш-хроматографии (30% EtOAc в гексане) с получением 9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-5-(трифторметил)фенил]метил]карбамата (0.410 г, 26.79%) в виде серо-белого осадка. LC-MS: 533.9 (M+H).
1H-NMR: (400 MHz, CDCl3): δ 4.19 (1H, t, J = 6.7 Hz), 4.41 (2H, d, J = 6.9 Hz), 4.53 (2H, d, J = 6.2 Hz), 5.22 (1H, br), 6.93 (1H, d, J = 7.6 Hz), 7.31-7.27 (1H, m), 7.47-7.33 (6H, m), 7.56-7.51 (3H, m), 7.76-7.74 (3H, m), 7.91 (1H, d, J = 8.5 Hz), 10.29 (1H, s).
Промежуточное соединение 12
9H-флуорен-9-илметил N-[(1S)-1-[5-хлор-2-(2-формилфенил)сульфанил-фенил]этил]карбамат
Раствор 1-(5-хлор-2-фторфенил)этан-1-она (2.0 г,11.588ммоль), (2-сульфанилфенил)метанола (1.625 г, 11.588ммоль), 63% водн. NaOH(0.7мл) и HMPA(5мл) нагрели до 100°C в течение 5 ч. Реакционную смесь разбавили водой и экстрагировали EtOAc. Объединенные органические слои промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 20%EtOAc в гексане с получением 1-[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этанона (2.67 г, 78%) в виде бесцветной вязкой жидкости.
К перемешанному раствору 1-[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этанона (1.0 г,3.425 ммоль) в ТГФ(7мл) добавили (S) 2-метил 2-пропана сульфинамид (415 мг, 3.425 ммоль) и Ti(OEt)4 (3.59 мл, 17.123 ммоль) и нагревали до 70°C в течение 48 ч. Реакционную смесь погасили солевым раствором и экстрагировали этилацетатом. Отделенный органический слой высушили над сульфатом натрия и сконцентрировали под вакуумом с получением N-[(1S)-1-[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этил]-2-метил-пропан-2-сульфинамида (1.0 г, неочищенный) в виде вязкой жидкости.
К перемешанному раствору N-[(1S)-1-[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этил]-2-метил-пропан-2-сульфинамида (2.5 г, 6.925 ммоль) в ТГФ (30 мл) добавили L-селектрид (лития три-втор-бутил(гидридо)борат) (10 мл) при -78°C и перемешивали в этих условиях в течение 2 ч. Затем реакционную смесь погасили насыщенным раствором NH4Cl и экстрагировали этилацетатом, высушили над Na2SO4 и сконцентрировали под вакуумом с получением неочищенного соединения, которое очистили на обычной колонке с силикагелем (30% EtOAc-гексан) с получением N-[(1S)-1-[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этил]-2-метил-пропан-2-сульфинамида (1.9 г, 68%) в виде серо-белого вязкого осадка. MS, установленная: 398.2 (M+H).
К перемешанному раствору N-[(1S)-1-[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этил]-2-метил-пропан-2-сульфинамида (1.0 г, 2.513 ммоль) в MeOH(10мл), добавили 4M HCl/диоксан(5мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении с получением [2-[2-[(1S)-1-аминоэтил]-4-хлор-фенил]сульфанилфенил]метанола (900 мг, неочищенный) в виде бесцветной жидкости. MS, установленная: 294.1 (M+H).
К перемешанной суспензии [2-[2-[(1S)-1-аминоэтил]-4-хлор-фенил]сульфанилфенил]метанола (900мг, 2.727 ммоль) в 5% NaHCO3(20мл) добавили Fmoc OSU( 919.636 мг, 2.727 ммоль) в CH3CN(20 мл) при 25°C и реакционную массу перемешивали при 25°C в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение затем очистили на обычной колонке с силикагелем (20% этилацетат-гексан) с получением 9H-флуорен-9-илметил N-[(1R)-1-[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этил]карбамата в виде вязкого осадка (800 мг, 56%). MS, установленная: 516.3 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[(1R)-1-[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этил]карбамата (540мг, 1.046 ммоль) в ДХМ/ТГФ(1:1, 24мл) добавили MnO2(1.819 г, 20.928 ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита, фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-20% EA/гексан с получением 9H-флуорен-9-илметил N-[(1S)-1-[5-хлор-2-(2-формилфенил)сульфанил-фенил]этил]карбамата (300мг, 55%) в виде светло-желтого осадка.
1H-NMR: (400 MHz, DMSO-d6) δ 1.26 (3H; d; J = 6.92 Hz); 4.21-4.23 (2H; m); 5.08-5.12 (1H; m); 6.83 (1H; d; J = 7.8 Hz); 7.31-7.33 (2H; m); 7.39-7.40 (4H; m); 7.45-7.46 (m; 2H); 7.66-7.69 (3H; m); 7.90 (2H; d; J = 7.4 Hz); 7.96 (1H; d; J =7.4 Hz); 8.03 (1H; d; J = 7.36 Hz); 10.21 (1H; s).
Промежуточное соединение 13
9H-флуорен-9-илметил N-[[3,6-дихлор-2-(2-формилфенил)сульфанил-фенил]метил]карбамат

К охлажденной на льду суспензии 3,6-дихлор-2-фтор-бензальдегида (3 г, 15.54 ммоль) и K2CO3 в ДМФ (10 мл) добавили 2-меркапто-бензойной кислоты метиловый эфир и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь влили в воду и экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения, которое тритурировали с гексаном с получением метил 2-(3,6-дихлор-2-формил-фенил)сульфанилбензоата (4.5 г, 85%) в виде серо-белого осадка.
К перемешанному раствору 2-(3,6-дихлор-2-формил-фенил)сульфанилбензоата (4.5 г, 13.19 ммоль) в безводном ТГФ (100 мл) добавили трет-бутилсульфинамид (2.39 г, 19.79 ммоль) с последующим этоксидом титана (IV) (4.51 мл, 19.79 ммоль) и реакционную смесь нагревали до 60°C в течение 1 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь влили в воду (200 мл), отфильтровали через целит и промыли этилацетатом (200 мл). Органический слой отделили, промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое тритурировали с гексаном с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3,6-дихлор-фенил]сульфанилбензоата (5.6 г, 96%) в виде белого осадка.
К охлажденной на льду суспензии LAH (1.43 г, 37.95 ммоль) в ТГФ (50 мл) добавили метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3,6-дихлор-фенил]сульфанилбензоат (5.6 г, 12.61 ммоль) в ТГФ (50 мл) и реакционную смесь перемешивали в течение 30 мин. Затем реакционную смесь погасили насыщенным раствором сульфата натрия (15 мл) и отфильтровали через целит. Фильтрат сконцентрировали с получением неочищенного соединения, которое тритурировали с гексаном с получением N-[[3,6-дихлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 96%) в виде серо-белого осадка. LC-MS: 418.0 (M+H).
К охлажденному на льду раствору N-[[3,6-дихлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (4.2 г, 10.76 ммоль) в ДХМ (100 мл) добавили периодинан Десса-Мартина (6.84 г, 16.14 ммоль) и реакционную смесь перемешивали при комнатной ттемпературе в течение ночи. Затем реакционную смесь влили в насыщенный раствор бикарбоната натрия и экстрагировали с помощью ДХМ (100 мл x 3). Объединенный органический слой промыли раствором тиосульфата натрия, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили с помощью колоночной флеш-хроматографии (10% EtOAc в гексане) с получением N-[[3,6-дихлор-2-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.6 г, 36%) в виде вязкого осадка, который использовали как есть на следующей стадии без дополнительной очистки. MS, расчитанная: 415 MS, полученная 416.0 (M+H).
К охлажденному на льду раствору N-[[3,6-дихлор-2-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.6 г, 3.84 ммоль) в диоксане (12 мл) добавили 4M HCl в диоксане (4 мл) и реакционную смесь перемешивали при комнатной ттемпературе в течение 6 ч. Летучие компоненты эвапорировали при пониженном давлении с получением 2-[2-(аминометил)-3,6-дихлор-фенил]сульфанилбензальдегида (1.1 г, 92%) в виде бледно-желтого осадка. LC-MS: 311.9(M+H).
К охлажденной на льду суспензии 2-[2-(аминометил)-3,6-дихлор-фенил]сульфанилбензальдегида (1.1 г, 3.52 ммоль) в ацетонитриле (25 мл) добавили 5% водный раствор NaHCO3 (10 мл) с последующим раствором Fmoc-OSu (1.18 г, 3.52 ммоль) в CH3CN (15 мл) и реакционную смесь перемешивали при комнатной ттемпературе в течение 4 ч. Затем реакционную смесь разбавили этилацетатом (80 мл) и водой (50 мл). Органический слой отделили, промыли солевым раствором и высушили над безводным сульфатом натрия. Органический слой сконцентрировали при пониженном давлении и полученное таким образом неочищенное соединение очистили с помощью флеш-хроматографии (20% EtOAc в гексане) с получением 9H-флуорен-9-илметил N-[[3,6-дихлор-2-(2-формилфенил)сульфанил-фенил]метил]карбамата (0.83 г, 44%) в виде белого осадка. LC-MS: 534.2 (M+H).
1H-NMR: (400 MHz, CDCl3): δ 4.10 (1H, t, J = 7.2 Hz), 4.26 (2H, d, J = 7.1 Hz), 4.80 (2H, d, J = 6.0 Hz), 5.10 (1H, br), 6.53 (1H, d, J = 7.6 Hz), 7.31-7.27 (4H, m), 7.37 (2H, t, J = 7.4 Hz), 7.52-7.46 (4H, m), 7.73 (2H, d, J = 7.5 Hz), 7.84 (1H, d, J = 6.2 Hz), 10.28 (1H, s).
Промежуточное соединение 14
9H-флуорен-9-илметил N-[[2,3-дихлор-6-(2-формилфенил)сульфанил-фенил]метил]карбамат

К охлажденной на льду суспензии 2,3-дихлор-6-фтор-бензальдегида (3 г, 15.54 ммоль) и K2CO3 (4.29 г, 31.08 ммоль) в ДМФ(10 мл) добавили 2-меркапто-бензойной кислоты метиловый эфир (2.12 мл, 15.54 ммоль) и реакционную смесь перемешивали в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь влили в воду и экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью колоночной флеш-хроматографии (10% EtOAc в гексане) с получением метил 2-(3,4-дихлор-2-формил-фенил)сульфанилбензоата (3 г, 57%) в виде серо-белого осадка.
К раствору метил 2-(3,4-дихлор-2-формил-фенил)сульфанилбензоата (3 г, 8.79 ммоль) в безводном ТГФ (100 мл) добавили трет-бутилсульфинамид (1.60 г, 13.19 ммоль) и этоксид титана (IV) (3 мл, 13.19 ммоль) последовательно и получившуюся реакционную смесь нагрели до 60°C в течение 1 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь влили в воду (100 мл), отфильровали через целит и слой целита промыли этилацетатом. Органический слой отделили и промыли солевым раствором. Органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое тритурировали с гексаном с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3,4-дихлор-фенил]сульфанилбензоата (3.8 г, 92%) в виде серо-белого осадка.
К охлажденной на льду суспензии LAH (0.97 г, 25.67 ммоль) в ТГФ (40 мл) добавили метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3,4-дихлор-фенил]сульфанилбензоат (3.8 г, 8.56 ммоль) в ТГФ (30 мл) и реакционную смесь перемешивали в течение 30 мин. Затем реакционную смесь погасили насыщенным раствором сульфата натрия (5 мл), отфильтровали через целит и слой целита промыли этилацетатом (3 x 50 мл). Фильтрат сконцентрировали и полученное таким образом неочищенное соединение тритурировали с гексаном с получением N-[[2,3-дихлор-6-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.5 г, 70%) в виде серо-белого осадка. LC-MS: 417.8 (M+H).
К охлажденному на льду раствору N-[[2,3-дихлор-6-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.5 г, 5.98 ммоль) в ДХМ (100 мл) добавили периодинан Десса-Мартина (3.80 г, 8.97 ммоль) и получившуюся реакционную смесь перемешивали при комнатной ттемпературе в течение 1 ч. После заверешения реакции реакционную смесь влили в насыщенный раствор бикарбоната натрия и экстрагировали с помощью ДХМ (100 мл x 3). Объединенный органический слой промыли раствором тиосульфата натрия и высушили над безводным сульфатом натрия. Органический слой сконцентрировали при пониженном давлении и полученное таким образом неочищенное соединение очистили с помощью колоночной флеш-хроматографии (10% EtOAc в гексане) с получением N-[[2,3-дихлор-6-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.7 г, 69%) в виде серо-белого осадка. LC-MS: 416.0 (M+H).
К охлажденному на льду раствору N-[[2,3-дихлор-6-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.7 г, 4.08 ммоль) в диоксане (25 мл) добавили 4M HCl в диоксане (10 мл) и получившуюся реакционную смесь оставили перемешиваться при комнатной ттемпературе в течение 6 ч. Летучие компоненты эвапорировали при пониженном давлении с получением неочищенного соединения, которое тритурировали с диэтиловым эфиром с получением 2-[2-(аминометил)-3,4-дихлор-фенил]сульфанилбензальдегида (1.27 г, 99%) в виде белого осадка. LC-MS: 311.9 (M+H).
К охлажденной на льду суспензии 2-[2-(аминометил)-3,4-дихлор-фенил]сульфанилбензальдегида (1.3 г, 4.16 ммоль) в ацетонитриле (40 мл) добавили 5% водный раствор NaHCO3 (10 мл) с последующим раствором Fmoc-OSu (1.40 г, 4.16 ммоль) в CH3CN (15 мл) и реакционную смесь перемешивали при комнатной ттемпературе в течение 3 ч. Затем реакционную смесь разбавили этилацетатом (100 мл) и водой (100 мл). Органический слой отделили и промыли солевым раствором. Органический слой высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили с помощью колоночной флеш-хроматографии (20% EtOAc в гексане) с получением 9H-флуорен-9-илметил N-[[2,3-дихлор-6-(2-формилфенил)сульфанил-фенил]метил]карбамата (0.610 г, 28%) в виде белого осадка. LC-MS: 534.1 (M+H).
1H-NMR: (400 MHz, CDCl3): δ 4.17-4.15 (1H, m), 4.22-4.21 (2H, m), 4.50 (2H, d, J = 4.4 Hz), 6.89 (1H, d, J = 7.8 Hz), 7.30 (2H, t, J = 7.4 Hz), 7.42-7.38 (4H, m), 7.51 (2H, t, J = 7.5 Hz), 7.70-7.64 (3H, m), 7.88 (2H, d, J = 7.6 Hz), 7.97 (1H, d, J = 7.8 Hz), 10.19 (1H, s).
Промежуточное соединение 15
9H-флуорен-9-илметил N-[[2-хлор-6-(2-формилфенил)сульфанил-фенил]метил]карбамат

К охлажденной на льду суспензии 2-хлор-6-фтор-бензальдегида (3 г, 18.92 ммоль) и K2CO3 в ДМФ (10 мл) добавили 2-меркапто-бензойной кислоты метиловый эфир (2.6 мл, 18.92 ммоль) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь влили в воду и экстрагировали этилацетатом (3 x 50 мл). Объединенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью колоночной флеш-хроматографии (10% EtOAc в гексане) с получением метил 2-(3-хлор-2-формил-фенил)сульфанилбензоата (3.4 г, 59%) в виде белого осадка.
К перемешанному раствору метил 2-(3-хлор-2-формил-фенил)сульфанилбензоата (3.4 г, 11.11 ммоль) в безводном ТГФ (100 мл) добавили трет-бутилсульфинамид (2.01 г, 16.66 ммоль) с последующим этоксидом титана (IV) (3.8 мл, 16.66 ммоль). Получившуюся реакционную смесь нагрели до 60°C в течение 1 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь влили в воду (150 мл) и отфильтровали через целит, промыли этилацетатом (150 мл). Органический слой отделили, промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое тритурировали с гексаном с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3-хлор-фенил]сульфанилбензоата (4.4 г, 97%) в виде серо-белого осадка.
К охлажденной на льду суспензии LAH (1.05 г, 27.87 ммоль) в ТГФ (30 мл) добавили метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3-хлор-фенил]сульфанилбензоат (3.8 г, 9.29 ммоль) в ТГФ (40 мл) и реакционную смесь перемешивали при комнатной температуре в течение 0.5 ч. Затем реакционную смесь погасили насыщенным сульфатом натрия (10 мл), отфильтровали через целит и промыли этилацетатом (3 x 75 мл). Фильтрат сконцентрировали с получением неочищенного соединения, которое тритурировали с гексаном с получением N-[[2-хлор-6-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (3.2 г, 90%) в виде белого осадка. LC-MS: 384.0 (M+H).
К охлажденному на льду раствору N-[[2-хлор-6-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (3.2 г, 8.35 ммоль) в ДХМ (100 мл) добавили периодинан Десса-Мартина (5.31 г, 12.53 ммоль) и реакционную смесь перемешивали при комнатной ттемпературе в течение 1 ч. После заверешения реакции реакционную смесь влили в насыщенный раствор бикарбоната натрия и экстрагировали с помощью ДХМ (100 мл x 3). Объединенный органический слой промыли раствором тиосульфата натрия, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили с помощью колоночной флеш-хроматографии (10% EtOAc в гексане) с получением N-[[2-хлор-6-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.1 г, 66%) в виде серо-белого осадка. LC-MS: 382.1 (M+H).
К охлажденному на льду раствору N-[[2-хлор-6-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.1 г, 5.51 ммоль) в диоксане (30 мл) добавили 4M в HCl в диоксане (10 мл) и реакционную смесь оставили перемешиваться при комнатной температуре в течение 6 ч. Летучие компоненты эвапорировали при пониженном давлении с получением 2-[2-(аминометил)-3-хлор-фенил]сульфанилбензальдегида (1.5 г, 98%) в виде белого осадка, который использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 277.9 (M+H).
К охлажденной на льду суспензии 2-[2-(аминометил)-3-хлор-фенил]сульфанилбензальдегида (1.5 г, 4.90 ммоль) в ацетонитриле (40 мл) добавили 5% водный раствор NaHCO3 (15 мл) с последующим раствором Fmoc-OSu (1.65 г, 4.90 ммоль) in CH3CN (10 мл) и реакционную смесь перемешивали при комнатной ттемпературе в течение 4 ч. Затем реакционную смесь разбавили этилацетатом (100 мл) и водой (50 мл). Органический слой отделили и промыли солевым раствором. Органический слой высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью хроматографии на системе Combiflash (20% EtOAc в гексане) с получением 9H-флуорен-9-илметил N-[[2-хлор-6-(2-формилфенил)сульфанил-фенил]метил]карбамата (0.93 г, 39%) в виде белого осадка. LC-MS: 499.9 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.20-4.14 (3H, m), 4.47 (2H, d, J = 4.4 Hz), 6.86 (1H, d, J = 7.9 Hz), 7.32-7.28 (2H, m), 7.43-7.36 (5H, m), 7.53-7.49 (1H, m), 7.62-7.59 (2H, m), 7.68 (2H, d, J = 7.4 Hz), 7.87 (2H, d, J = 7.5 Hz), 7.96 (1H, d, J = 6.6 Hz), 10.20 (1H, s).
Промежуточное соединение 16
9H-флуорен-9-илметил N-[[3-хлор-2-(2-формилфенил)сульфанил-6-(трифторметил)-фенил]метил]карбамат

К перемешанному раствору метил 2-меркапто-бензойной кислоты метилового эфира (2 г, 11.89 ммоль) и 2,3-дихлор-6-(трифторметил)бензальдегида (2.89 г, 11.889ммоль) в ДМФ ( 20мл) добавили K2CO3 (1.64 г, 11.89 ммоль) и реакционную массу перемешивали при 25°C в течение 30 мин. Реакционную смесь разбавили этилацетатом и промыли водой. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-5% этилацетата в гексане с получением метил 2-[6-хлор-2-формил-3-(трифторметил)фенил]сульфанилбензоата (2.3 г, 51%) в виде белого осадка. MS, установленная: 375 (M+H).
К перемешанному раствору метил 2-[6-хлор-2-формил-3-(трифторметил)фенил]сульфанил-бензоата (4.5 г, 12.007ммоль) в ТГФ (50мл) добавили 2-метилпропан-2-сульфинамид (1.45 г, 12.0 ммоль), Ti(OEt)4 (12.68мл, 60.04 ммоль) и реакционную массу нагревали до 70°C в течение 16 ч. Реакционную массу погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через слой целита, промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением этил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-хлор-3-(трифторметил)фенил]сульфанилбензоата (5.8 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 491.8 (M+H).
К перемешанному раствору этил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-хлор-3-(трифторметил)фенил]сульфанилбензоата (5.8 г, 15.185ммоль) в ТГФ (60мл) добавили LiBH4 (3.2 г, 151.85 ммоль) и реакционную массу нагревали до 50°C в течение 4 ч. Реакционную смесь погасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-40% этилацетата в гексане с получением N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-6-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (3.7 г, 69%, 2 стадии) в виде серо-белого осадка. MS, установленная: 452.2 (M+H).
К перемешанному раствору N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-6-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (3.7 г, 8.18ммоль) в MeOH(40мл) добавили 4M HCl в диоксане(20мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении с получением [2-[2-(аминометил)-6-хлор-3-(трифторметил)фенил]сульфанилфенил]метанола (3.6 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 347.8 (M+H).
К перемешанной суспензии [2-[2-(аминометил)-6-хлор-3-(трифторметил)фенил]сульфанилфенил]метанола (3.6 г, 9.368 ммоль) в 5% NaHCO3(35мл) добавили Fmoc OSU( 3.1 г, 9.368ммоль) в CH3CN(35мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-6-(трифторметил)фенил]метил]карбамата (2.96 г, 63%, 2 стадии) в виде серо-белого осадка. MS, установленная: 569.9 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-6-(трифторметил)фенил]метил]карбамата (2.9 г, 5.087ммоль) в ДХМ/ТГФ(1:1, 60мл) добавили MnO2 (8.84 г, 101.749 ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита, фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-20% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3-хлор-2-(2-формилфенил)сульфанил-6-(трифторметил)фенил]метил]карбамата (2 г, 69%) в виде серо-белого осадка. MS, установленная: 567.9 (M+H).
1H-NMR: (400 MHz, DMSO-d6) δ 4.01-4.03 (1H; m); 4.22-4.28 (2H; m); 4.41 (2H; d; J = 5.6 Hz); 6.53 (1H; d; J = 7.76 Hz); 7.30 (2H; t; J = 7.4 Hz); 7.42 (3H; t; J = 7.4 Hz); 7.49-7.51 (1H; m); 7.67 (2H; d; J = 7.36 Hz); 7.74 (1H; br s); 7.89 (2H; d; J = 7.8 Hz); 7.99-8.03 (2H; m); 8.07 (1H; s); 10.20 (1H; s).
Промежуточное соединение 17
9H-флуорен-9-илметил N-[[3,6-дифтор-2-(2-формилфенил)сульфанил-фенил]метил]карбамат
К перемешанному раствору метил 2-меркапто-бензойной кислоты метилового эфира (1.37 г, 8.153ммоль) и 2-хлор-3,6-дифторбензальдегида (1.43 г, 8.153ммоль) в ДМФ ( 12мл) добавили K2CO3(1.12 г, 8.153ммоль) и реакционную массу перемешивали при 25°C в течение 30 мин. Реакционную смесь разбавили этилацетатом и промыли водой. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-2% этилацетата в гексане с получением метил 2-(3,6-дифтор-2-формил-фенил)сульфанилбензоата (1 г, 40%) в виде желтого осадка. MS, установленная: 309.3 (M+H).
К перемешанному раствору метил 2-(3,6-дифтор-2-формил-фенил)сульфанилбензоата (1.7 г, 5.519ммоль) в ТГФ ( 20мл) добавили 2-метилпропан-2-сульфинамида (0.669 г, 5.519ммоль), Ti(OEt)4(5.786мл, 27.597ммоль) и реакционную массу нагревали до 70°C в течение 4 ч. Реакционную массу погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через слой целита, промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением этил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3,6-дифтор-фенил]сульфанилбензоата (2.4 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 425.7 (M+H).
К перемешанному раствору этил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3,6-дифтор-фенил]сульфанилбензоата (2.4 г, 5.647ммоль) в ТГФ (30мл) добавили LiBH4 (1.23 г, 56.471ммоль) и реакционную массу нагревали до 70°C в течение 2 ч. Реакционную смесь погасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-50% этилацетата в гексане с получением N-[[3,6-дифтор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.6 г, 75%, 2 стадии) в виде серо-белого осадка. MS, установленная: 385.9 (M+H).
К перемешанному раствору N-[[3,6-дифтор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.6 г, 3.855ммоль) в MeOH(25мл), добавили 4M HCl в диоксане(12мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении с получением [2-[2-(аминометил)-3,6-дифтор-фенил]сульфанилфенил]метанола (1.6 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 281.9 (M+H).
К перемешанной суспензии [2-[2-(аминометил)-3,6-дифтор-фенил]сульфанилфенил]метанола (1.6 г, 5.112 ммоль) в 5% NaHCO3(20мл) добавили Fmoc OSU( 1.724 г, 5.112 ммоль) в CH3CN(20 мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 3 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3,6-дифтор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]карбамата (2 г, 95%, 2 стадии) в виде серо-белого осадка. MS, установленная: 503.9 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[[3,6-дифтор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]карбамата (2 г, 3.976ммоль) в ДХМ/ТГФ(1:1, 50мл) добавили MnO2 (6.913 г, 79.523 ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита, фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-12% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3,6-дифтор-2-(2-формилфенил)сульфанил-фенил]метил]карбамата (1 г, 50%) в виде серо-белого осадка. MS, установленная: 502.1 (M+H).
1H-NMR: (400 MHz, DMSO-d6) δ 4.12-4.14 (3H; m); 4.40 (2H; d; J = 3.68 Hz); 6.70 (1H; d; J = 7.76 Hz); 7.20-7.31 (2H; m); 7.33-7.45 (4H; m); 7.49-7.53 (1H; m); 7.64 (2H; d; J = 7.44 Hz); 7.69 (1H; m); 7.82 (2H; d; J = 7.52 Hz); 7.99 (1H; d; J = 7.4 Hz); 10.19 (1H; s).
Промежуточное соединение 18
9H-флуорен-9-илметил N-[[2-(2-фтор-6-формил-фенил)сульфанилфенил]метил]карбамат

К охлажденной на льду суспензии 2,3-дифтор-бензальдегида (4.0 г, 28.16 ммоль) и K2CO3 (7.77 г, 56.33 ммоль) в ДМФ (15 мл) добавили 2-меркапто-бензойной кислоты метиловый эфир (4.7 г, 28.16 ммоль) и реакционную смесь перемешивали в течение 1 ч при 0°C. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (2 x 100 мл). Объединенные органические слои высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое тритурировали с гексаном с получением метил 2-(2-фтор-6-формил-фенил)сульфанилбензоата (5.5 г, 67%) в виде серо-белого осадка. ЖХМС: 290.9 (M+H).
К раствору метил 2-(2-фтор-6-формил-фенил)сульфанилбензоата (т.е. 3d) (3 г, 10.34 ммоль) в толуоле (50 мл) добавили этиленгликоль (1.2 мл, 20.68 ммоль) и p-TSA (0.19 г, 1.03 ммоль) и реакционную смесь нагрели до 140°C с использованием насадки Дина-Старка в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. Затем реакционную смесь влили в насыщенный раствор бикарбоната натрия и экстрагировали этилацетатом (2 x 50 мл). Объединенный органический слой высушили над безводным сульфатом натрия, отфильтровали и сконцентрировали с получением метил 2-[2-(1,3-диоксолан-2-ил)-6-фтор-фенил]сульфанилбензоата (3 г, 86%), который использовали как есть на следующей стадии без очистки. LC-MS: 334.7(M+H).
К охлажденной на льду суспензии LAH (1.19 г, 31.43 ммоль) в ТГФ (40 мл) добавили раствор метил 2-[2-(1,3-диоксолан-2-ил)-6-фтор-фенил]сульфанилбензоата (3.5 г, 10.47 ммоль) в ТГФ (40 мл) и реакционную смесь перемешивали в течение 30 мин. Затем реакционную смесь погасили насыщенным раствором сульфата натрия (20 мл), перемешивали в течение 30 мин и отфильтровали через целит, промыли этилацетатом (3 x 100 мл). Фильтрат сконцентрировали с получением [2-[2-(1,3-диоксолан-2-ил)-6-фтор-фенил]сульфанилфенил]метанола (3 г, 93%) в виде вязкого масла. LC-MS: 324 (M+NH4).
К охлажденному на льду раствору [2-[2-(1,3-диоксолан-2-ил)-6-фтор-фенил]сульфанилфенил]метанола (3 г, 9.80 ммоль) в ДХМ (50 мл) добавили Et3N (4.08 мл, 29.41 ммоль) и метансульфонилхлорид (1.13 г, 14.70 ммоль) и получившуюся реакционную смесь перемешивали в течение 30 мин. Затем реакционную смесь разбавили водой (100 мл) и экстрагировали с помощью ДХМ (50 мл). Органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением [2-[2-(1,3-диоксолан-2-ил)-6-фтор-фенил]сульфанилфенил]метилметансульфоната (3.5 г, 93%) в виде бледно-желтой жидкости, которую использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 384.9(M+H).
К раствору [2-[2-(1,3-диоксолан-2-ил)-6-фтор-фенил]сульфанилфенил]метилметансульфоната (3.5 г, 9.11 ммоль) в ТГФ (40 мл) добавили жидкий аммоний (15 мл) при -78°C. Затем реакционную смесь постепенно нагрели до 55°C в течение 4 ч. Летучие компоненты удалили при пониженном давлении с получением [2-[2-(1,3-диоксолан-2-ил)-6-фтор-фенил]сульфанилфенил]метанамина (2.5 г, 94%) в виде вязкого масла. ЖХМС: 305.8(M+H).
К охлажденной на льду суспензии [2-[2-(1,3-диоксолан-2-ил)-6-фтор-фенил]сульфанилфенил]метанамина (2.5 г, 8.19 ммоль) в ацетонитриле (60 мл) добавили 5% водный NaHCO3 (5 мл) с последующим раствором Fmoc-OSu (2.76 г, 8.19 ммоль) в CH3CN (40 мл) и реакционную смесь перемешивали при комнатной ттемпературе в течение 4 ч. Её затем разбавили этилацетатом (200 мл) и водой (200 мл). Органический слой отделили, промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (20% EtOAc в гексане) с получением 9H-флуорен-9-илметил N-[[2-[2-(1,3-диоксолан-2-ил)-6-фтор-фенил]сульфанилфенил]метил]карбамата (1.5 г, 39%) в виде белого осадка. LC-MS: 527.6 (M+H).
К охлажденному на льду раствору 9H-флуорен-9-илметил N-[[2-[2-(1,3-диоксолан-2-ил)-6-фтор-фенил]сульфанилфенил]метил]карбамата (1.5 г, 2.84 ммоль) в ацетоне (50 мл) добавили раствор конц. HCl (8 мл) и реакционную смесь перемешивали при КТ в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты удалили при пониженном давлении и неочищенную реакционную смесь растворили в растворе бикарбоната натрия. Водн. слой экстрагировали этилацетатом, высушили над безводным сульфатом натрия, отфильтровали и сконцентрировали с получением неочищенного соединения, которое дополнительно очистили с помощью колоночной флеш-хроматографии (20% EtOAc в гексане) с получением 9H-флуорен-9-илметил N-[[2-(2-фтор-6-формил-фенил)сульфанилфенил]метил]карбамата (1.0 г, 72%) в виде белого осадка. LC-MS: 483.9 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.26-4.23 (1H, m), 4.38-4.35 (4H, m), 6.86 (1H, d, J = 7.7 Hz), 7.19-7.14 (1H, m), 7.23-7.22 (2H, m), 7.33 (2H, t, J = 7.3 Hz), 7.42 (2H, t, J = 7.3 Hz), 7.79-7.64 (5H, m), 7.93-7.88 (3H, m), 10.44 (1H, s).
Промежуточное соединение 19
9H-флуорен-9-илметил N-[[3-фтор-2-(2-формилфенил)сульфанил-фенил]метил]карбамат

К охлажденной на льду суспензии 2,3-дифтор-бензальдегида (4.7 г, 28.16 ммоль) и K2CO3 (7.77 г, 56.33 ммоль) в ДМФ (15 мл) добавили 2-меркапто-бензойной кислоты метиловый эфир (4 г, 28.16 ммоль) и реакционную смесь перемешивали в течение 1 ч при 0°C. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (2 x 100 мл). Объединенные органические слои высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое тритурировали с гексаном с получением метил 2-(2-фтор-6-формил-фенил)сульфанилбензоата (5.5 г, 67%) в виде серо-белого осадка. ЖХМС: 290.9(M+H).
К раствору метил 2-(2-фтор-6-формил-фенил)сульфанилбензоата (3 г, 10.34 ммоль) в безводном ТГФ (50 мл) в атмосфере аргона при комнатной температуре добавили трет-бутилсульфинамид (1.87 г, 15.51ммоль) с последующим этоксидом титана (IV) (3.53 г, 15.51 ммоль) и реакционную смесь нагревали до 70°C в течение 3 ч. После заверешения реакции реакционную смесь охладили до комнатной температуры, влили в воду (10 мл) и отфильтровали через слой целита. Слой целита промыли этилацетатом (100 мл). Органический слой отделили, промыли водой (100 мл) и высушили над безводным сульфатом натрия. Органический слой сконцентрировали при пониженном давлении с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-фтор-фенил]сульфанилбензоата (2.5 г, 61%) в виде желтого осадка. ЖХМС: 393.8 (M+H).
К охлажденной на льду суспензии LAH (0.72 г, 19.04 ммоль) в ТГФ (30 мл) добавили метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-фтор-фенил]сульфанилбензоат (2.5 г, 6.36 ммоль) в ТГФ (40 мл) и реакционную смесь перемешивали при этой температуре в течение 30 мин. Затем реакционную смесь погасили насыщенным раствором сульфата натрия (15 мл) и отфильтровали через целит. Фильтрат сконцентрировали с получением N-[[3-фтор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.2 г, 94%) в виде серо-белого осадка. ЖХМС: 367.8(M+H).
К охлажденному на льду раствору N-[[3-фтор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.2 г, 5.99 ммоль) в ДХМ (100 мл) добавили периодинан Десса-Мартина (3.81 г, 8.99 ммоль) и реакционную смесь перемешивали при КТ в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили NaHCO3 (100 мл) и экстрагировали с помощью ДХМ (2 x 100 мл). Объединенный органический слой промыли насыщенным раствором тиосульфата натрия, высушили над безводным сульфатом натрия, отфильтровали и сконцентрировали с получением неочищенного соединения, которое очистили с помощью колоночной флеш-хроматографии (50% EtOAc в гексане) с получением N-[[3-фтор-2-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.8 г, 82%) в виде белого осадка. ЖХМС: 365.8 (M+H).
К охлажденному на льду раствору N-[[3-фтор-2-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.8 г, 2.88 ммоль) в диоксане (40 мл) добавили HCl в диоксане (20 мл, 4M) и реакционную смесь перемешивали при КТ в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. Летучие компоненты удалили при пониженном давлении и неочищенное соединение тритурировали диэтиловым эфиром с последующим высушиванием при пониженном давлении с получением 2-[2-(аминометил)-6-фтор-фенил]сульфанилбензальдегида (1 г, 88%) в виде белого осадка. ЖХМС: 261.7(M+H).
К перемешанной суспензии 2-[2-(аминометил)-6-фтор-фенил]сульфанилбензальдегида (1.0 г, 3.83 ммоль) в ацетонитриле (50 мл) и 5% водной добавили раствор Fmoc-OSu (1.29 г, 3.83 ммоль) в ацетонитриле (30 мл) и реакционную смесь перемешивали при комнатной ттемпературе в течение 4 ч. Затем её разбавили этилацетатом (200 мл) и водой (200 мл). Органический слой отделили, промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (10% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-[[3-фтор-2-(2-формилфенил)сульфанил-фенил]метил]карбамата (0.65 г, 22% за две стадии) в виде белого осадка. ЖХМС: 484.0 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.21 (1H, t, J = 6.6 Hz), 4.33-4.28 (4H, m), 6.60 (1H, d, J = 8.0), 7.23 (1H, d, J = 7.7 Hz), 7.48-7.30 (7H, m), 7.64-7.58 (1H, m), 7.68 (2H, d, J = 7.4 Hz), 7.90-7.85 (3H, m), 8.00 (1H, d, J = 6.9 Hz), 10.19 (1H, s).
Промежуточное соединение 20
9H-флуорен-9-илметил N-[[5-хлор-2-(2-формилфенил)сульфанил-3-(трифторметил)фенил]метил]карбамат

К суспензии 5-хлор-2-фтор-3-трифторметил-бензальдегида (1.5 г, 6.62 ммоль) и K2CO3 (1.8 г, 13.24 ммоль) в ДМФ (15 мл) добавили 2-меркапто-бензойной кислоты метиловый эфир (1.1 г, 6.62 ммоль) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (3 x 250 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством силикагелевой (100-200 меш) колоночной хроматографии (20 % этилацетат и гексан) с получением метил 2-[4-хлор-2-формил-6-(трифторметил)фенил]сульфанилбензоата (2.3 г, 93%) в виде коричневого осадка.
К раствору метил 2-[4-хлор-2-формил-6-(трифторметил)фенил]сульфанилбензоата (2.6 г, 6.95 ммоль) и трет-бутил сульфинамида (1.8 г, 15.29 ммоль) в ТГФ (50 мл) добавили тетраэтоксид титана (3.48 г,15.29 ммоль) и реакционную смесь нагрели до 60°C в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (3 x 100 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали с получением неочищенного соединения, которое очистили посредством силикагелевой (100-200 меш) колоночной хроматографии (30 % этилацетат и гексан) с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4-хлор-6-(трифторметил)фенил]сульфанилбензоата (1.9 г, 57%) в виде коричневого осадка. LC-MS: 477.9 (M+H).
К охлажденной на льду суспензии LAH (0.45 г, 11.95 ммоль) в ТГФ (20 мл) добавили раствор метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4-хлор-6-(трифторметил)фенил]сульфанилбензоата (1.9 г, 3.98 ммоль) в ТГФ (30 мл) и реакционную смесь перемешивали в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили водным раствором сульфата натрия (50 мл) и экстрагировали этилацетатом (3 x 100 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое промыли гексаном с последующим пентаном с получением N-[[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-3-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.6 г, 89%) в виде серо-белого осадка. LC-MS: 452.0(M+H).
К суспензии N-[[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-3-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.6 г, 3.54 ммоль) в ДХМ (50 мл) добавили периодинан Десса-Мартина (3.7 г, 8.86 ммоль) и реакционную смесь перемешивали при КТ в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и экстрагировали с помощью ДХМ (3 x 100 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством силикагелевой (100-200 меш) колоночной хроматографии (этилацетат) и сконцентрировали при пониженном давлении с получением N-[[5-хлор-2-(2-формилфенил)сульфанил-3-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (0.900 г, 56%) в виде белого осадка. LC-MS: 449.7(M+H).
К охлажденному на льду раствору N-[[5-хлор-2-(2-формилфенил)сульфанил-3-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (0.9 г, 0.0020 моль) в 1,4 диоксане (20 мл) добавили 4M HCl в диоксане (4 мл) и реакционную смесь перемешивали при комнатной ттемпературе в течение 2 ч. Летучие компоненты удалили при пониженном давлении с получением 2-[2-(аминометил)-4-хлор-6-(трифторметил)фенил]сульфанилбензальдегида (0.65 г, 94%) в виде серо-белого осадка. LC-MS: 346.0 (M+H).
К раствору N-[[5-хлор-2-(2-формилфенил)сульфанил-3-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (0.9 г, 0.0020 моль) в 5% водном растворе NaHCO3 (12 мл) добавили Fmoc-OSu (0.558 г, 0.0020 моль) в CH3CN (50 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Затем реакционную смесь разбавили этилацетатом и промыли водой с последующим солевым раствором. Органический слой отделили, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии с получением 9H-флуорен-9-илметил N-[[5-хлор-2-(2-формилфенил)сульфанил-3-(трифторметил)фенил]метил]карбамата (0.435 г, 32%) в виде серо-белого осадка. LC-MS: 568.0 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.23-4.20 (3H, m), 4.32-4.30 (2H, m), 6.43 (1H, d, J = 8.0 Hz), 7.34-7.30 (2H, m), 7.44-7.37 (4H, m), 7.67 (2H, d, J = 7.4 Hz), 7.70 (1H, br s), 7.89 (3H, d, J = 7.5 Hz), 8.03-8.00 (2H, m), 10.15 (1H, s).
Промежуточное соединение 21
9H-флуорен-9-илметил N-[[3-хлор-2-(2-формилфенил)сульфанил-5-(трифторметил)фенил]метил]карбамат

Суспензию 3-хлор-2-фтор-5-трифторметил-бензальдегида (2.5 г, 11.06 ммоль) и K2CO3 (3.0 г, 22.12 ммоль) в ДМФ (15 мл) добавили в 2-меркапто-бензойной кислоты метиловый эфир (1.8 г, 11.06 ммоль) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (3 x 250 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством колоночной хроматографии на силикагеле (100-200 меш) с использованием 20 % этилацетата и гексана в качестве элюента с получением метил 2-[2-хлор-6-формил-4-(трифторметил)фенил]сульфанилбензоата (3.5 г, 85%) в виде коричневого осадка.
К суспензии метил 2-[2-хлор-6-формил-4-(трифторметил)фенил]сульфанилбензоата (3.5 г, 9.36 ммоль) и трет-бутил сульфинамида (1.6 г, 14.03 ммоль) в ТГФ (50 мл) добавили тетраэтоксид титана (3.2 г, 14.03 ммоль) и реакционную смесь нагрели до 60°C в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (3 x 100 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством силикагелевой (100-200 меш) колоночной хроматографии (30 % этилацетат и гексан) с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-хлор-4-(трифторметил)фенил]сульфанилбензоата (4 г, 89%) в виде коричневого осадка. LC-MS: 477.9 (M+H).
К охлажденной на льду суспензии LAH (0.955 г, 25.15 ммоль) в ТГФ (25 мл) добавили раствор 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-хлор-4-(трифторметил)фенил]сульфанилбензоата (4 г, 8.38 ммоль) в ТГФ (25 мл) и реакционную смесь перемешивали в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водным раствором сульфата натрия (100 мл) и экстрагировали этилацетатом (3 x 250 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили промывкой гексаном с последующим пентаном с получением N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-5-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (3.9 г, 95%) в виде коричневого осадка. LC-MS: 452.1(M+H).
К раствору N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-5-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (3.9 г, 8.64 ммоль) в ДХМ (100 мл) добавили периодинан Десса-Мартина (9.17 г, 21.62 ммоль) и реакционную смесь перемешивали при КТ в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили раствором NaHCO3 (100 мл) и экстрагировали с помощью ДХМ (3 x 100 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством силикагелевой (100-200 меш) колоночной хроматографии (этилацетат) с получением N-[[3-хлор-2-(2-формилфенил)сульфанил-5-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (2 г, 51%) в виде белого осадка. LC-MS: 449.7(M+H).
К охлажденному на льду раствору N-[[3-хлор-2-(2-формилфенил)сульфанил-5-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (2 г, 4.45 ммоль) в 1, 4 диоксане (50 мл) добавили 4M HCl в диоксане (4 мл) и получившуюся реакционную смесь перемешивали при комнатной ттемпературе в течение 2 ч. Летучие компоненты эвапорировали при пониженном давлении с получением 2-[2-(аминометил)-6-хлор-4-(трифторметил)фенил]сульфанилбензальдегида (1.5 г, 98%) в виде серо-белого осадка. LC-MS: 346.1(M+H).
К раствору 2-[2-(аминометил)-6-хлор-4-(трифторметил)фенил]сульфанилбензальдегида (2 г, 5.24 ммоль) в 5% водном растворе NaHCO3 (12 мл) добавили Fmoc-OSu (1.42 г, 4.19 ммоль) в CH3CN (50 мл) и реакционную смесь перемешивали при комнатной ттемпературе в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили этилацетатом и промыли водой с последующим солевым раствором. Объединенный органический слой высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии с получением 9H-флуорен-9-илметил N-[[3-хлор-2-(2-формилфенил)сульфанил-5-(трифторметил)фенил]метил]карбамата (0.700 г, 34%) в виде серо-белого осадка. LC-MS: 568.1(M+H).
1H-NMR: (400 MHz, CDCl3): δ 4.15 (1H, t, J = 6.9 Hz), 4.37 (2H, d, J = 6.9 Hz), 4.55 (2H, d, J = 6.4 Hz), 5.29-5.26 (1H, br), 6.52 (1H, d, J = 7.0 Hz), 7.29-7.27 (2H, m), 7.34-7.30 (2H, m), 7.41-7.36 (2H, m), 7.51 (2H, d, J = 7.4 Hz), 7.76-7.73 (4H, m), 7.87-7.85 (1H, m), 10.25 (1H, s).
Промежуточное соединение 22
9H-флуорен-9-илметил N-[[3-хлор-6-фтор-2-(2-формилфенил)сульфанил-фенил]метил]карбамат
К раствору 2,3-дихлор-6-фторбензальдегида (1.0 г,5.208 ммоль) в ДМФ(7.0 мл) добавили K2CO3 (720 мг,5.208 ммоль) и метил 2-сульфанилбензоат (876 мг ,5.208 ммоль) и перемешивали при 25°C в течение 30 мин. Реакционную смесь разбавили водой и экстрагировали EtOAc. Объединенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением соединения, которое очистили с помощью обычной колонки с силикагелем с использованием 0-2% этилацетата в гексане с получением метил 2-(6-хлор-3-фтор-2-формил-фенил)сульфанилбензоата (354мг, 21%) в виде желтого осадка.
К перемешанному раствору метил 2-(6-хлор-3-фтор-2-формил-фенил)сульфанилбензоата (1.7 г,5.247 ммоль) в ТГФ(25 мл) добавили 2-метил 2-пропансульфинамид (0.636 г, 5.247 ммоль) и Ti(OEt)4 (5.5 мл, 26.235 ммоль) и реакционную смесь нагревали до 70°C в течение 4 ч. Реакционную смесь погасили солевым раствором и экстрагировали этилацетатом, высушили над сульфатом натрия и сконцентрировали под вакуумом с получением этил 2-({6-хлор-3-фтор-2-[(1Z)-[(2-метилпропан-2-сульфинил)имино]метил]фенил}сульфаниля)бензоата (2.2 г, неочищенный) в виде желтой жидкости. MW, найденная: 442.3 (M+H).
К перемешанному раствору этил 2-({6-хлор-3-фтор-2-[(1Z)-[(2-метилпропан-2-сульфинил)имино]метил]фенил}сульфанил)бензоата (2.4 г, 5.442 ммоль) в ТГФ (25мл) добавили LiBH4 (1.185 г, 54.422 ммоль) при 0°C и реакционную массу нагрели до 70°C в течение 4 ч. Растворитель эвапорировали и реакционную смесь погасили с помощью NH4Cl и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-50% этилацетата в гексане с получением N-[[3-хлор-6-фтор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.4 г, 64%) в виде серо-белого осадка. MS, установленная: 402.2 (M+H).
К перемешанному раствору N-[[3-хлор-6-фтор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.4 г, 3.373 ммоль) в MeOH(25 мл), добавили 4M HCl в диоксане (12 мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении с получением [2-[2-(аминометил)-6-хлор-3-фтор-фенил]сульфанилфенил]метанола (1.4 г, неочищенный) в виде белого осадка. MS, установленная: 298.2 (M+H).
К перемешанной суспензии [2-[2-(аминометил)-6-хлор-3-фтор-фенил]сульфанилфенил]метанола (1.4 г, 4.714 ммоль) в 5% NaHCO3(20 мл) добавили Fmoc OSU( 1.589 г, 4.714 ммоль) в CH3CN(20 мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 3 ч. Затем реакционную смесь разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-50% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3-хлор-6-фтор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]карбамата (1.6 г, 88%, 2 стадии) в виде серо-белого осадка. MS, установленная: 520 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[[3-хлор-6-фтор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]карбамата (1.6 г, 3.083 ммоль) в ДХМ/ТГФ(1:1, 50 мл) добавили MnO2(5.36 г, 61.657 ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита, фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-13% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3-хлор-6-фтор-2-(2-формилфенил)сульфанил-фенил]метил]карбамата (1.0 г, 63%) в виде серо-белого осадка. MS, установленная: 517.8 (M+H).
1H-NMR: (400 MHz, DMSO-d6) δ 4.12-4.14 (3H; m); 4.40 (2H; br s); 6.55 (1H; d; J = 7.92 Hz); 7.28-7.31 (2H; m); 7.33-7.45 (4H; m); 7.51 (1H; t; J = 8.96 Hz); 7.62 (2H; d; J = 7.44 Hz); 7.70-7.72 (1H; m); 7.82 (2H; d; J = 7.52 Hz); 7.99 (1H; d; J = 7.4 Hz); 10.19 (1H; s)
Промежуточное соединение 23
9H-флуорен-9-илметил N-[[2-[(3-формил-2-пиридил)сульфанил]-3-(трифторметил)фенил]метил]карбамат

К охлажденному на льду раствору 2-фтор-3-трифторметил-бензальдегида (3.2 г, 20.87 ммоль) в ДМФ (30 мл) добавили по порциям гидрид натрия (1.663 г, 9.16 ммоль) и реакционную смесь перемешивали в течение 30 мин. В получившуюся реакционную смесь добавили раствор 2-меркапто-никотиновой кислоты метилового эфира (2.2 г, 13.87 ммоль) в ДМФ (10 мл) по каплям и реакционную смесь нагревали до 90°C в течение 9 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь охладили при 0°C и добавили карбонат калия (3.83 г, 27.742 ммоль) с последующим метилйодидом (5.90 г, 27.74 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. После заверешения реакции реакционную смесь разбавили ледяной водой (100 мл) и экстрагировали этилацетатом (3 x 100 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили посредством флеш-хроматографии (30% EtOAc в гексане) с получением метил 2-[2-формил-6-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (1.3 г, 33%) в виде серо-белого осадка. LC-MS: 341.7 (M+H).
К раствору полученного метил 2-[2-формил-6-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (1.3 г, 3.81 ммоль) в безводном ТГФ (50 мл) добавили трет-бутилсульфинамид (2.31 г, 19.06 ммоль) с последующим этоксидом титана (IV) (4.34 г, 19.06 ммоль) и реакционную смесь нагрели до 60°C в течение 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (50 мл), отфильтровали через целит и промыли этилацетатом. Органический слой отделили, промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (30% EtOAc в гексане) с получением метил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-6-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (1.3 г, 77%) в виде серо-белого осадка. LC-MS: 444.9 (M+H).
К охлажденной на льду суспензии LAH (0.277 г, 7.32 ммоль) в ТГФ (50 мл) добавили 2-[2-[(Z)-трет-бутилсульфинилиминометил]-6-(трифторметил)фенил]сульфанилпиридин-3-карбоксилат (1.3 г, 2.93 ммоль) в ТГФ (30 мл) и реакционную смесь перемешивали в течение 30 мин при 0°C. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили насыщенным сульфатом натрия (5 мл) и отфильтровали через целит. Остаток промыли этилацетатом (3 x 50 мл) и фильтрат сконцентрировали с получением N-[[2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-3-(трифторметил)фенил]метилен]-2-метил-пропан-2-сульфинамида (1.1 г, 90%) в виде вязкой массы. LC-MS: 418.7 (M+H).
К охлажденному на льду раствору N-[[2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-3-(трифторметил)фенил]метилен]-2-метил-пропан-2-сульфинамида (1.1 г, 2.63 ммоль) в ДХМ (100 мл) добавили периодинан Десса-Мартина (1.45 г, 3.421 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь влили в насыщенный раствор бикарбоната натрия и экстрагировали с помощью ДХМ (3 x 100 мл). Объединенный органический слой промыли тиосульфатом натрия, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили с помощью флеш-хроматографии (30% EtOAc в гексане) с получением N-[[2-[(3-формил-2-пиридил)сульфанил]-3-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (0.750 г, 69%) в виде серо-белого осадка. LC-MS: 416.9 (M+H).
К охлажденному на льду раствору N-[[2-[(3-формил-2-пиридил)сульфанил]-3-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (0.750 г, 1.80 ммоль) в диоксане (20 мл) добавили 4M HCl в диоксане (1.0 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты эвапорировали при пониженном давлении с получением 2-[2-(аминометил)-6-(трифторметил)фенил]сульфанилпиридин-3-карбальдегида (0.620 г, 100%) в виде серо-белого осадка. LC-MS: 313.0 (M+H).
К суспензии 2-[2-(аминометил)-6-(трифторметил)фенил]сульфанилпиридин-3-карбальдегида (0.620 г, 1.9808 ммоль) в 5% водном растворе NaHCO3 (5 мл) добавили Fmoc-OSu (0.534 г, 1.5846ммоль) в CH3CN (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили этилацетатом (50 мл) и органический слой отделили . Органический слой промыли водой с последующим солевым раствором и высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили посредством флеш-хроматографии (30% EtOAc в гексане) с получением 9H-флуорен-9-илметил N-[[2-[(3-формил-2-пиридил)сульфанил]-3-(трифторметил)фенил]метил]карбамата (0.635 г, 60%) в виде белого осадка. LC-MS: 534.8 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.21 (3H, m), 4.34 (2H, d, J = 8.8 Hz), 7.44-7.29 (5H, m), 7.58 (1H, d, J = 7.6 Hz), 7.72-7.67 (3H, m), 7.83-7.81 (2H, m), 7.89 (2H, d, J = 7.5 Hz), 8.40-8.36 (2H, m), 10.18 (1H, s).
Промежуточное соединение 24
9H-флуорен-9-илметил N-[[5-хлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат

К охлажденному на льду раствору 5-хлор-2-фтор-бензальдегида (5.14 г, 33.10 ммоль) в ДМФ (80 мл) добавили по порциям гидрид натрия (1.52 г, 66.20 ммоль) и реакционную смесь перемешивали в течение 30 мин. В получившуюся реакционную смесь добавили 2-меркапто-никотиновой кислоты метиловый эфир (3.5 г, 22.06 ммоль) в ДМФ (20 мл) и реакционную смесь нагревали при 90°C в течение 9 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь охладили при 0°C и добавили карбонат калия (6.1 г, 44.14 ммоль) и метилйодид (9.39 г, 66.20 ммоль). Затем реакционную смесь перемешивали при комнатной температуре в течение 16 ч. После заверешения реакции реакционную смесь разбавили ледяной водой (100 мл) и экстрагировали этилацетатом (3 x 100 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили посредством флеш-хроматографии (30% EtOAc в гексане) с получением метил 2-(4-хлор-2-формил-фенил)сульфанилпиридин-3-карбоксилата (2.5 г, 37%) в виде вязкого масла. LC-MS: 308.0 (M+H).
К раствору метил 2-(4-хлор-2-формил-фенил)сульфанилпиридин-3-карбоксилата (2.5 г, 8.14 ммоль) в безводном ТГФ (50 мл) добавили трет-бутилсульфинамид (4.93 г, 40.72 ммоль) с последующим этоксидом титана (IV) (9.28 г, 40.72 ммоль) и реакционную смесь нагрели до 60°C в течение 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (50 мл), отфильтровали через целит и промыли этилацетатом. Органический слой отделили, промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (30% EtOAc в гексане) с получением метил 2-[4-хлор-2-[(Z)-трифторметилсульфинилиминометил]фенил]сульфанилпиридин-3-карбоксилата (1.5 г, 45%) в виде серо-белого осадка. LC-MS: 411.1 (M+H).
К охлажденной на льду суспензии LAH (0.277 г, 7.32 ммоль) в ТГФ (50 мл) добавили неочищенный метил 2-[4-хлор-2-[(Z)-трифторметилсульфинилиминометил]фенил]сульфанилпиридин-3-карбоксилат (1.5 г, 4.39 ммоль) в ТГФ (70 мл) и реакционную смесь перемешивали в течение 30 мин при 0°C. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили насыщенным раствором сульфата натрия (5 мл) и отфильтровали через целит. Остаток промыли этилацетатом (3 x 50 мл) и фильтрат сконцентрировали с получением N-[[5-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]-1,1,1-трифтор-метансульфинамида (1.1 г, 65%) в виде серо-белого осадка. LC-MS: 385.0 (M+H).
К охлажденному на льду раствору N-[[5-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]-1,1,1-трифтор-метансульфинамида (1.1 г, 2.86 ммоль) в ДХМ (100 мл) добавили периодинан Десса-Мартина (1.57 г, 3.72 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь влили в насыщенный раствор бикарбоната натрия и экстрагировали с помощью ДХМ (3 x 100 мл). Объединенные органические слои промыли тиосульфатом натрия, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного N-[[5-хлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]-1,1,1-трифтор-метансульфинамида (0.750 г, 68%) в виде серо-белого осадка. LC-MS: 382.7 (M+H).
К охлажденному на льду раствору N-[[5-хлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]-1,1,1-трифтор-метансульфинамида (0.750 г, 1.96 ммоль) в диоксане (20 мл) добавили 4M HCl в диоксане (1.0 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты эвапорировали при пониженном давлении с получением солянокислой соли 2-[2-(аминометил)-4-хлор-фенил]сульфанилпиридин-3-карбальдегида (0.650 г, 66%) в виде вязкой массы. LC-MS: 279.1(M+H).
К суспензии 2-[2-(аминометил)-4-хлор-фенил]сульфанилпиридин-3-карбальдегида (0.650 г, 2.34 ммоль) в 5% водном растворе NaHCO3 (5 мл) добавили Fmoc-OSu (0.788 г, 2.34 ммоль) в CH3CN (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили этилацетатом (50 мл) и органический слой отделили. Органический слой промыли водой с последующим солевым раствором и высушили над безводным сульфатом натрия. Органический слой сконцентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили посредством флеш-хроматографии (30% EtOAc в гексане) с получением 9H-флуорен-9-илметил N-[[5-хлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамата (0.390 г, 36%) в виде белого осадка. LC-MS: 501.0 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.24-4.18 (3H, m), 4.30 (2H, d, J = 6.9 Hz), 7.43-7.31 (7H, m), 7.54 (1H, d, J = 7.9 Hz), 7.69 (2H, d, J = 7.4 Hz), 7.90-7.84 (3H, m), 8.34 (1H, dd, J = 7.6, 1.7 Hz), 8.44 (1H, dd, J = 4.7, 1.7 Hz), 10.18 (1H, s).
Промежуточное соединение 25
9H-флуорен-9-илметил N-[[2-хлор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат

К раствору 2-хлор-6-фтор-бензальдегида (2.0 г, 12.89 ммоль) в этаноле (80 мл, продутый аргоном) добавили этоксид натрия (2.19 г, 32.22 ммоль) и 2-меркапто-никотиновую кислоту (2.04 г, 12.89 ммоль) при комнатной температуре. Реакционную смесь нагревали до кипения в течение 4 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты удалили при пониженном давлении с получением 2-(3-хлор-2-формил-фенил)сульфанилпиридин-3-карбоновой кислоты (6 г, неочищенный) в виде коричневого осадка, который использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 294.1 (M+H).
К охлажденному на льду раствору 2-(3-хлор-2-формил-фенил)сульфанилпиридин-3-карбоновой кислоты (6.0 г, неочищенный) в ДМФ (25 мл) в атмосфере аргона добавили K2CO3 (2.827 г, 20.46 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 мин. В получившуюся реакционную смесь добавили MeI (1.27 мл, 20.46 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Затем реакционную смесь разбавили водой (100 мл) и водную фазу экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили с помощью флеш-хроматографии (10% этилацетат в гексане) с получением метил 2-(3-хлор-2-формил-фенил)сульфанилпиридин-3-карбоксилата (1.6 г, 40% за две стадии) в виде желтого осадка. LC-MS: 307.7(M+H).
К перемешанному раствору метил 2-(3-хлор-2-формил-фенил)сульфанилпиридин-3-карбоксилата (1.6 г, 5.20 ммоль) в безводном ТГФ (100 мл) в атмосфере аргона добавили этоксид титана (IV) (2.96 г, 13.00 ммоль) с последующим трет-бутилсульфинамидом (1.57 г, 13.00 ммоль) и получившуюся реакционную смесь нагревали до 60°C в течение 4ч. Затем реакционную смесь охладили до комнатной температуры, влили в воду (100 мл) и отфильтровали через слой целита. Слой целита промыли этилацетатом. Органический слой отделили и водный слой экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (25% этилацетат в гексане) с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3-хлор-фенил]сульфанилпиридин-3-карбоксилата (1.8 г, 84%) в виде вязкого масла. LC-MS: 410.6 (M+H). По данным1H-NMR, это соединения представляет собой смесь этилового и метилового эфира. MS, установленная: 424.9(M+H).
К охлажденному на льду раствору метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3-хлор-фенил]сульфанилпиридин-3-карбоксилата (1.8 г, 4.38 ммоль) в ТГФ (50 мл) в атмосфере аргона добавили LAH (0.416 г, 10.95 ммоль) по порциям и реакционную смесь перемешивали при 0°C в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили этилацетатом и насыщенным раствором сульфата натрия. Затем реакционную смесь отфильтровали через целит и промыли EtOAc. Фильтрат сконцентрировали с получением N-[[2-хлор-6-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (1.6 г, 95%) в виде серо-белого осадка. LC-MS: 384.9 (M+H).
К охлажденному на льду раствору N-[[2-хлор-6-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (1.6 г, 4.15 ммоль) в ДХМ (50 мл) добавили периодинан Десса Мартина (2.227 г, 5.40 ммоль) по порциям и реакционную смесь перемешивали при комнатной температуре в течение 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили с помощью ДХМ (50 мл) и насыщенного раствора бикарбоната натрия (50 мл). Органический слой отделили и водный слой экстрагировали с помощью ДХМ (50 мл x 2). Объединенный органический слой промыли раствором тиосульфата натрия с последующим солевым раствором. Летучие компоненты удалили при пониженном давлении с получением N-[[2-фтор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (1.6 г) в виде вязкого масла. LC-MS: 382.9 (M+H).
К охлажденному на льду раствору N-[[2-фтор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, неочищенный) в диоксане (20 мл) добавили 4M HCl в диоксане (30 мл) и реакционную смесь перемешивали при комнатной температуре в течение периода 2 ч. Прогресс реакции контролировали с помощью ЖХМС. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром (30 мл x 2) и хорошо высушили с получением 2-[2-(аминометил)-3-хлор-фенил]сульфанилпиридин-3-карбальдегида (2.0 г, неочищенный) в виде желтого осадка. LC-MS: 279.1 (M+H).
К перемешанной суспензии неочищенного 2-[2-(аминометил)-3-хлор-фенил]сульфанилпиридин-3-карбальдегида (2.0 г, неочищенный) в 5% растворе бикарбоната натрия и ацетонитриле (30 мл, 1:1) добавили Fmoc-OSu (1.08 г, 3.21 ммоль) в ацетонитриле (15 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты удалили при пониженном давлении и неочищенную реакционную смесь разбавили водой (50 мл). Водную фазу экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой промыли солевым раствором (50 мл x 1), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (30% этилацетат в гексане) с получением необходимого соединения, которое дополнительно промыли этилацетатом (5 мл) и высушили с получением 9H-флуорен-9-илметил N-[[2-хлор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамата (0.515 г, 20% за две стадии) в виде белого осадка. LC-MS: 500.9 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.19-4.15 (3H, m), 4.36 (2H, d, J = 4.6 Hz), 7.30 (2H, t, J = 7.4 Hz), 7.42-7.34 (4H, m), 7.47 (1H, t, J = 4.5 Hz), 7.53 (1H, d, J = 7.0 Hz), 7.61 (1H, d, J = 7.9 Hz), 7.67 (2H, s, J = 7.4 Hz), 7.88 (2H, d, J = 7.5 Hz), 8.33 (1H, dd, J = 7.6, 1.7 Hz), 8.44 (1H, dd, J = 4.7, 1.7 Hz), 10.18 (1H, s).
Промежуточное соединение 26
9H-флуорен-9-илметил N-[[3,5-дихлор-2-(4-фтор-2-формил-фенил)сульфанил-фенил]метил]карбамат

К перемешанному раствору 5-фтор-2-меркапто-бензойной кислоты (1 г, 5.808 ммоль) в ТГФ(20мл), добавили 2,2,2-трихлорацетамидной кислоты трет-бутиловый эфир (3.6мл, 20.328ммоль) с последующим медленным добавлением BF3.OEt2 (0.615мл, 5.808ммоль) при 0°C и перемешивали при 25°C в течение 2 ч. После завершения реакции реакционную смесь погасили водой и экстрагировали этилацетатом. Объединенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью обычной колонки с силикагелем с использованием 2% этилацетата в гексане с получением трет-бутил 5-фтор-2-сульфанил-бензоата (620мг,47%) в виде бесцветной жидкости.
К перемешанному раствору трет-бутил 5-фтор-2-сульфанил-бензоата (600мг, 2.628ммоль) в ДМФ (10мл) добавили 2,3,5-трихлор-бензальдегид (660мг, 3.154ммоль), Cs2CO3 (2.13 г, 6.571ммоль) и реакционную смесь нагревали 60°C в течение 3 ч. После завершения реакции реакционную смесь погасили водой и экстрагировали этилацетатом. Объединенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью обычной колонки с силикагелем с использованием 2% этилацетат в гексане с получением трет-бутил 2-(2,4-дихлор-6-формил-фенил)сульфанил-5-фтор-бензоата (660мг, 62%) в виде бесцветной жидкости.
К перемешанному раствору 2-(2,4-дихлор-6-формил-фенил)сульфанил-5-фтор-бензоата (900мг, 2.243ммоль) в ТГФ(20мл) добавили 2-метил 2-пропансульфйонамид (271мг, 2.243ммоль) и Ti(OEt)4 (2.3мл, 11.214ммоль) и нагревали до 70°C в течение 16 ч. Реакционную смесь погасили солевым раствором и экстрагировали этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением трет-бутил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4,6-дихлор-фенил]сульфанил-5-фтор-бензоата (1 г, неочищенный) в виде желтой жидкости. MS, установленная: 504.1 (M+H).
К перемешанному раствору трет-бутил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4,6-дихлор-фенил]сульфанил-5-фтор-бензоата (1 г, 1.982ммоль) в ТГФ(20мл) добавили LiBH4(215мг, 9.911ммоль) и реакционную массу нагревали до 50°C в течение 4 ч. Реакционную массу погасили насыщенным хлоридом аммония и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением N-[[3,5-дихлор-2-[4-фтор-2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.2 г, неочищенный) в виде серо-белого осадка. MS, установленная: 435.7 (M+H).
К перемешанному раствору N-[[3,5-дихлор-2-[4-фтор-2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.2 г, 2.75ммоль) в MeOH(20мл), добавили 4M HCl/диоксан(10мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении с получением [2-[2-(аминометил)-4,6-дихлор-фенил]сульфанил-5-фтор-фенил]метанола (1 г, неочищенный) в виде серо-белого осадка. MS, установленная: 332 (M+H).
К перемешанной суспензии [2-[2-(аминометил)-4,6-дихлор-фенил]сульфанил-5-фтор-фенил]метанола (1 г, 2.712ммоль) в 5% NaHCO3 (20мл) добавили Fmoc OSU (914мг, 2.712ммоль) в CH3CN(20мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3,5-дихлор-2-[4-фтор-2-(гидроксиметил)фенил]сульфанил-фенил]метил]карбамата (800мг, 64%, 4 стадии) в виде серо-белого осадка. MS, установленная: 554 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[[3,5-дихлор-2-[4-фтор-2-(гидроксиметил)фенил]сульфанил-фенил]метил]карбамата (800мг, 1.661ммоль) в ДХМ/ТГФ (1:1, 20мл) добавили MnO2 (2.88 г, 33.221ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную смесь отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-20% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3,5-дихлор-2-(4-фтор-2-формил-фенил)сульфанил-фенил]метил]карбамата (700мг, 76%) в виде серо-белого осадка. MS, установленная: 552.3 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.17-4.12 (3H, m), 4.35 (2H, d, J = 5.1 Hz), 7.45-7.28 (6H, m), 7.67-7.60 (4H, m), 7.88 (2H, d, J = 7.5 Hz), 8.35 (1H, dd, J = 7.6, 1.8 Hz), 8.41 (1H, dd, J = 4.8, 1.8 Hz), 10.19 (1H, s).
Промежуточное соединение 27 и Промежуточное соединение 28
9H-флуорен-9-илметил N-[[3-хлор-6-фтор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат

и 9H-флуорен-9-илметил N-[[3-хлор-2-фтор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат

К раствору 3-хлор-2,6-дифтор-бензальдегида (2.0 г, 12.88 ммоль) в этаноле (80 мл, продутый аргоном) добавили этоксид натрия (2.192 г, 32.21 ммоль) и 2-меркапто-никотиновую кислоту (2.26 г, 12.88 ммоль) при комнатной температуре и реакционную смесь нагревали до кипения в течение 4 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты удалили при пониженном давлении с получением смеси 2-(6-хлор-3-фтор-2-формил-фенил)сульфанилпиридин-3-карбоновой кислоты и 2-(4-хлор-3-фтор-2-формил-фенил)сульфанилпиридин-3-карбоновой кислоты (6 г, неочищенный) в виде коричневого осадка, который использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 312.1 (M+H).
К охлажденному на льду раствору вышеупомянутой смеси (6.0 г, неочищенный) в ДМФ (25 мл) в атмосфере аргона добавили K2CO3 (2.66 г, 19.24 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 мин. В получившуюся реакционную смесь добавили MeI (1.198 мл, 19.248 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Затем реакционную смесь разбавили водой (100 мл) и водную фазу экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (10% этилацетат в гексане) с получением смеси метил 2-(4-хлор-3-фтор-2-формил-фенил)сульфанилпиридин-3-карбоксилата и метил 2-(4-хлор-3-фтор-2-формил-фенил)сульфанилпиридин-3-карбоксилата (2.3 г, 57% за две стадии) в виде желтого осадка. LC-MS: 325.7(M+H).
К перемешанному раствору вышеупомянутой смеси (2.3 г, 7.06 ммоль) в безводном ТГФ (100 мл) в атмосфере аргона добавили этоксид титана (IV) (4.027 г, 17.65 ммоль) с последующим трет-бутилсульфинамидом (2.139 г,17.65 ммоль) и получившуюся реакционную смесь перемешивали при комнатной температуре в течение 1 ч и нагревали до 60°C в течение 4 ч. Затем реакционную смесь охладили до комнатной температуры, влили в воду (100 мл) и отфильтровали через слой целита. Слой целита промыли этилацетатом. Органический слой отделили и водный слой экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (25% этилацетат в гексане) с получением смеси метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4-хлор-3-фтор-фенил]сульфанилпиридин-3-карбоксилата и метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4-хлор-3-фтор-фенил]сульфанилпиридин-3-карбоксилата (1.9 г, 63%) в виде вязкого масла. LC-MS: 428.6 (M+H).
К охлажденному на льду раствору вышеупомянутой смеси (1.9 г, 4.43 ммоль) в ТГФ (50 мл) в атмосфере аргона добавили LAH (0.42 г, 11.07 ммоль) по порциям и реакционную смесь перемешивали при 0°C в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили этилацетатом и насыщенным раствором сульфата натрия. Затем реакционную смесь отфильтровали через целит и промыли EtOAc. Фильтрат сконцентрировали с получением смеси N-[[3-хлор-2-фтор-6-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида и N-[[3-хлор-2-фтор-6-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (1.6 г, 90%) в виде серо-белого осадка. LC-MS: 402.9 (M+H).
К охлажденному на льду раствору вышеупомянутой смеси (1.6 г, 3.97 ммоль) в ДХМ (50 мл) добавили периодинан Десса-Мартина (2.128 г, 5.162 ммоль) по порциям и реакционную смесь перемешивали при комнатной температуре в течение 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили с помощью ДХМ (50 мл) и насыщенного раствора бикарбоната натрия (50 мл). Органический слой отделили и водный слой экстрагировали с помощью ДХМ (50 мл x 2). Объединенный органический слой промыли тиосульфатом натрия с последующим солевым раствором. Летучие компоненты удалили при пониженном давлении с получением смеси N-[[2-фтор-6-[(3-формил-2-пиридил)сульфанил]-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида и N-[[3-хлор-2-фтор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (1.6 г, колич.) в виде вязкого масла. LC-MS: 400.8 (M+H).
К охлажденному на льду раствору вышеупомянутой смеси (2.0 г, неочищенный) в диоксане (20 мл) добавили 4M HCl в диоксане (30 мл) и реакционную смесь перемешивали при комнатной температуре в течение периода 2 ч. Прохождение реакции контролировали с помощью ЖХМС. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром (30 мл x 2) и высушили с получением смеси 2-[2-(аминометил)-4-хлор-3-фтор-фенил]сульфанилпиридин-3-карбальдегида и 2-[2-(аминометил)-4-хлор-3-фтор-фенил]сульфанилпиридин-3-карбальдегида (2.0 г, неочищенный) в виде желтого осадка. LC-MS: 297.1 (M+H).
К перемешанной суспензии вышеуказанной смеси (2.0 г, неочищенный) в 5% растворе бикарбоната натрия и ацетонитриле (30 мл, 1:1) добавили Fmoc-OSu (1.422 г, 4.21 ммоль) в ацетонитриле (15 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты удалили при пониженном давлении и неочищенную реакционную смесь разбавили водой (50 мл). Водную фазу экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой промыли солевым раствором (50 мл x 1), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (20% этилацетат в гексане) с получением смеси двух изомеров 1.6 г. Смесь изомеров очистили с помощью препаративной ВЭЖХ с получением 9H-флуорен-9-илметил N-[[3-хлор-2-фтор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамата (0.910 г, 35% за две стадии) в виде белого осадка и 9H-флуорен-9-илметил N-[[3-хлор-2-фтор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамата (0.210 г, 8% за две стадии) в виде белого осадка. LC-MS: 518.9 (M+H). and LC-MS: 519.0 (M+H).
1H-NMR 9H-флуорен-9-илметил N-[[3-хлор-2-фтор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат: (400 MHz, DMSO-d6): δ 4.17-4.12 (3H, m), 4.35 (2H, d, J = 5.1 Hz), 7.45-7.28 (6H, m), 7.67-7.60 (4H, m), 7.88 (2H, d, J = 7.5 Hz), 8.35 (1H, dd, J = 7.6, 1.8 Hz), 8.41 (1H, dd, J = 4.8, 1.8 Hz), 10.19 (1H, s).
1H-NMR 9H-флуорен-9-илметил N-[[3-хлор-2-фтор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат: (400 MHz, DMSO-d6): δ 4.18-4.13 (3H, m), 4.27 (2H, d, J = 4.2 Hz), 7.30 (2H, t, J = 7.4 Hz), 7.42-7.34 (4H, m), 7.66-7.60 (4H, m), 7.9 (2H, d, J = 7.5 Hz), 8.34 (1H, dd, J = 7.6, 1.8 Hz), 8.44 (1H, dd, J = 4.8, 1.8 Hz), 10.18 (1H, s).
Промежуточное соединение 29
9H-флуорен-9-илметил N-[[2,3-дихлор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат

К охлажденному на льду раствору 2,3-дихлор-6-фтор-бензальдегида (2 г, 12.88 ммоль) в этаноле (20 мл) добавили этоксид натрия (2.1 г, 32.22 ммоль) и 2-меркапто-никотиновую кислоту (2.7 г, 14.17 ммоль) последовательно и реакционную смесь нагревали до 90°C в течение 5 ч. Прогресс реакции контролировали с помощью ТСХ. Летучие компоненты удалили при пониженном давлении с получением 2-(3,4-дихлор-2-формил-фенил)сульфанилпиридин-3-карбоновой кислоты (6.8 г, неочищенный) в виде бледно-желтого осадка, который использовали как есть на следующей стадии без дополнительной очистки.
К охлажденному на льду раствору 2-(3,4-дихлор-2-формил-фенил)сульфанилпиридин-3-карбоновой кислоты (4.2 г, неочищенный) в ДМФ (30 мл) добавили карбонат калия (4.4 г, 32.10 ммоль) и метилйодид (2.3 мл, 38.52 ммоль) последовательно и реакционную смесь перемешивали при комнатной температуре в течение 15 ч. Прогресс реакции контролировали с помощью ТСХ. Затем реакционную смесь разбавили водой (50 мл) и водную фазу экстрагировали этилацетатом (50 мл x 2). Объединенный органический слой промыли солевым раствором (50 мл x 2), высушили над безводным сульфатом натрия и растворитель выпарили при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии с получением метил 2-(3,4-дихлор-2-формил-фенил)сульфанилпиридин-3-карбоксилата (2.5 г, 56% за две стадии) в виде бледно-желтого осадка.
К перемешанному раствору метил 2-(3,4-дихлор-2-формил-фенил)сульфанилпиридин-3-карбоксилата (2.5 г, 7.30 ммоль) в безводном ТГФ (40 мл) добавили 2-метилпропан-2-сульфинамида (1.7 г, 14.61 ммоль) и тетраэтоксид титана (3.33 г, 14.61 ммоль). Получившуюся реакционную смесь нагрели до 60°C в течение периода 1 ч в атмосфере аргона. Затем реакционную смесь охладили до комнатной температуры, влили в воду со льдом и отфильтровали через небольшой слой целита. Фильтрат экстрагировали этилацетатом (100 мл x 2), промыли солевым раствором (100 мл x 2), высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (градиент 10-20% этилацетат в гексане) с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3,4-дихлор-фенил]сульфанилпиридин-3-карбоксилата (1.9 г, 58%) в виде бледно-оранжевого осадка. LC-MS: 444.6 (M+H).
К охлажденному на льду раствору метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3,4-дихлор-фенил]сульфанилпиридин-3-карбоксилата (2.2 г, 4.93 ммоль) в ТГФ (30 мл) в атмосфере аргона добавили LAH (0.375 г, 9.879 ммоль) по порциям и реакционную смесь перемешивали при комнатной температуре в течение 45 мин. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили насыщенным раствором хлорида аммония (~5 мл), отфильтровали через слой целита и промыли его этилацетатом. Фильтрат сконцентрировали с получением N-[[2,3-дихлор-6-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 96%) в виде серо-белого осадка. LC-MS: 418.6 (M+H).
К охлажденному на льду раствору N-[[2,3-дихлор-6-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (2.1 г, 5.01 ммоль) в ДХМ (20 мл) добавили периодинан Десса-Мартина (2.7 г, 6.51 ммоль) по порциям и реакционную смесь перемешивали при комнатной температуре в течение периода 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. Получившуюся реакционную смесь разбавили диэтиловым эфиром (25 мл) и влили в насыщенный раствор бикарбоната натрия (30 мл), содержащего тиосульфат натрия (4 г) и перемешивали до тех пор, пока не наблюдались два разных слоя. Органический слой отделили и водную фазу экстрагировали этилацетатом (50 мл x 2). Объединенный органический слой промыли насыщенным водным раствором бикарбоната натрия (50 мл x 2) с последующим солевым раствором (25 мл x 2). Органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением N-[[2,3-дихлор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 95%) в виде бледно-желтого осадка, который использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 416.7 (M+H).
К раствору N-[[2,3-дихлор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 4.79 ммоль) в диоксане (10 мл) медленно добавили 4M HCl в диоксане (2.0 мл) и получившуюся реакционную смесь перемешивали при комнатной ттемпературе в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром и высушили с получением 2-[2-(аминометил)-3,4-дихлор-фенил]сульфанилпиридин-3-карбальдегида (1.6 г, неочищенный) в виде бледно-желтого осадка. Это соединение использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 313.1 (M+H).
К перемешанной суспензии 2-[2-(аминометил)-3,4-дихлор-фенил]сульфанилпиридин-3-карбальдегида (1.6 г, неочищенный) в 5% бикарбонате натрия (15 мл) добавили Fmoc-OSU (1.8 г, 5.62 ммоль) в ацетонитриле (2 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Затем реакционную смесь разбавили этилацетатом (50 мл) и промыли солевым раствором (50 мл x 1), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью хроматографии на системе Combiflash (30% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-[[2,3-дихлор-6-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамата (1.0 г, 40% за две стадии) в виде серо-белого осадка. LC-MS: 534.9 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.33-4.13 (3H, m), 4.39 (2H, d, J = 4.5 Hz), 7.30 (2H, t, J = 7.4 Hz), 7.42-7.35 (3H, m), 7.55-7.53 (2H, m), 7.69-7.66 (3H, m), 7.88 (2H, d, J = 7.5 Hz), 8.34 (1H, dd, J = 7.6, 1.4 Hz), 8.45 (1H, dd, J = 4.8, 1.7 Hz), 10.17 (1H, s).
Промежуточное соединение 30
9H-флуорен-9-илметил N-[[3,6-дихлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат
К охлажденному на льду раствору 3,6-дихлор-2-фтор-бензальдегида (2 г, 12.88 ммоль) в этаноле (30 мл) добавили этоксид натрия (2.1 г, 32.22 ммоль) и 2-меркапто-никотиновую кислоту (2.7 г, 14.17 ммоль) последовательно и реакционную смесь нагревали до 90°C в течение 5 ч. Прогресс реакции контролировали с помощью ТСХ. Летучие компоненты удалили при пониженном давлении с получением 2-(3,6-дихлор-2-формил-фенил)сульфанилпиридин-3-карбоновой кислоты (6.8 г, неочищенный) в виде бледно-желтого осадка, который использовали как есть на следующей стадии без дополнительной очистки.
К раствору 2-(3,6-дихлор-2-формил-фенил)сульфанилпиридин-3-карбоновой кислоты (4.2 г, неочищенный) в ДМФ (30 мл) добавили карбонат калия (4.42 г, 31.99 ммоль) и метилйодид (2.3 мл, 38.39 ммоль) последовательно и реакционную смесь перемешивали при комнатной температуре в течение 15 ч. Прогресс реакции контролировали с помощью ТСХ. Затем реакционную смесь разбавили водой (50 мл) и экстрагировали этилацетатом (50 мл x 2). Объединенные органические слои промыли солевым раствором (50 мл x 2), высушили над безводным сульфатом натрия и растворитель выпарили при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии с получением метил 2-(3,6-дихлор-2-формил-фенил)сульфанилпиридин-3-карбоксилата (2.6 г, 60% за две стадии) в виде бледно-желтого масла.
К перемешанному раствору метил 2-(3,6-дихлор-2-формил-фенил)сульфанилпиридин-3-карбоксилата (2.6 г, 7.598 ммоль) в безводном ТГФ (40 мл) добавили 2-метилпропан-2-сульфинамид (1.8 г, 15.19 ммоль) и тетраэтоксид титана (3.4 г, 15.19 ммоль). Получившуюся реакционную смесь нагрели до 60°C в течение 1 ч в атмосфере аргона. Затем реакционную смесь снова охладили до комнатной температуры, влили в воду со льдом и отфильтровали через небольшой слой целита. Фильтрат экстрагировали этилацетатом (100 мл x 2), промыли солевым раствором (100 мл x 2), высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (градиент 10-20% этилацетат в гексане) с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3,6-дихлор-фенил]сульфанилпиридин-3-карбоксилата (2 г, 59%) в виде бледно-оранжевого осадка. LC-MS: 444.9 (M+H).
К охлажденному на льду раствору метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3,6-дихлор-фенил]сульфанилпиридин-3-карбоксилата (2.2 г, 4.93 ммоль) в ТГФ (40 мл) в атмосфере аргона добавили LAH (0.37 г, 9.87 ммоль) по порциям и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили насыщенным раствором хлорида аммония (~5 мл), отфильтровали через слой целита и слой промыли EtOAc. Фильтрат сконцентрировали с получением N-[[3,6-дихлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 96%) в виде серо-белого осадка. LC-MS: 418.9 (M+H).
К охлажденному на льду раствору N-[[3,6-дихлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (2.1 г, 5.01 ммоль) в ДХМ (20 мл) добавили периодинан Десса-Мартина (2.7 г, 6.50 ммоль) по порциям и реакционную смесь перемешивали при комнатной температуре в течение 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. Получившуюся реакционную смесь разбавили диэтиловым эфиром (25 мл) и влили внасыщенный раствор бикарбоната натрия (30 мл), содержащего тиосульфат натрия (4 г) и перемешивали до тех пор, пока не наблюдались два разных слоя. Органический слой отделили и водную фазу экстрагировали этилацетатом (50 мл x 2). Объединенный органический слой промыли насыщенным водным раствором бикарбоната натрия (50 мл x 2) с последующим солевым раствором (25 мл x 2). Органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением N-[[3,6-дихлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 95%) в виде бледно-коричневого масла, которое использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 416.7 (M+H).
К раствору N-[[3,6-дихлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, неочищенный) в диоксане (20 мл) добавили 4 M HCl в диоксане (2.0 мл) по каплям и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром и высушили с получением 2-[2-(аминометил)-3,6-дихлор-фенил]сульфанилпиридин-3-карбальдегида (1.8 г, неочищенный) в виде бледно-желтого осадка. Это соединение использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 313.0 (M+H).
К перемешанной суспензии 2-[2-(аминометил)-3,6-дихлор-фенил]сульфанилпиридин-3-карбальдегида (1.8 г, неочищенный) в 5% бикарбонате натрия (15 мл) добавили Fmoc-OSU (2.1 г, 6.322 ммоль) в ацетонитриле (25 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Затем реакционную смесь разбавили этилацетатом (50 мл) и промыли солевым раствором (50 мл x 1), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (30% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-[[3,6-дихлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамата (0.98 г, 38% за две стадии) в виде серо-белого осадка. LC-MS: 534.8 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.21-4.14 (3H, m), 4.45 (2H, d, J = 4.4 Hz), 7.31 (2H, t, J = 7.32 Hz), 7.42-7.35 (3H, m), 7.55 (1H, t, J = 4.4 Hz), 7.68-7.62 (4H, m), 7.88 (2H, d, J = 7.52 Hz), 8.36 (1H, dd, J = 7.52, 1.48 Hz), 8.43 (1H, dd, J = 4.8, 1.76 Hz), 10.19 (1H, s).
Промежуточное соединение 31
9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-6-(трифторметил)фенил]метил]карбамат

К охлажденному на льду раствору NaH (1.13 г, 27.80 ммоль) в ДМФ (10 мл) добавили 2-тионикотиновую кислоту (2.15 г, 13.90 ммоль) в ДМФ (10 мл) и реакционную смесь перемешивали в течение 15 мин. В получившуюся реакционную смесь добавили раствор 3-хлор-2-фтор-6-метил-бензальдегида (2.1 г, 9.26 ммоль) в ДМФ (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 9 ч. Затем реакционную смесь охладили до 0°C и добавили K2CO3 (3.84 г, 27.80 ммоль) с последующим метилйодидом (3.10 мл, 27.80 ммоль). Получившуюся реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Затем реакционную смесь погасили насыщеным раствором NH4Cl (20 мл) и экстрагировали этилацетатом (60 мл). Органический слой отделили, промыли водой (2 x 30 мл) с последующим солевым раствором (2 x 30 мл) и высушили над безводным сульфатом натрия. Органический слой сконцентрировали при пониженном давлении и неочищенное соединение очистили посредством флеш-хроматографии с получением метил 2-[6-хлор-2-формил-3-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (1.3 г, 37%) в виде серо-белого осадка. LC-MS: 375.7(M+H).
К дегазированному раствору метил 2-[6-хлор-2-формил-3-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (1.4 г, 3.72 ммоль) в ТГФ (30 мл) добавили этоксид титана (IV) (8.49 г, 37.25 ммоль) с последующим трет-бутилсульфинамидом (4.50 г, 37.25 ммоль) и получившуюся реакционную смесь нагревали до 60°C в течение 2 ч. Затем реакционную смесь разбавили водой (30 мл) и экстрагировали EtOAc (70 мл). Органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-хлор-3-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (1.25 г, 70%) в виде серо-белого осадка. Он представлял собой смесь этиловго и метилового эфиров. MS, установленная: 478.7 (M+H).
К охлажденному на льду раствору LAH (0.297 г, 7.83 ммоль) в ТГФ (10 мл) добавили метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-хлор-3-(трифторметил)фенил]сульфанилпиридин-3-карбоксилат (1.25 г, 2.61 ммоль) в ТГФ (15 мл) и реакционную смесь перемешивали в течение 0.5 ч при этой же температуре. Затем реакционную смесь погасили насыщенным раствором сульфата натрия (2 мл) и EtOAc (80 мл). Реакционную смесь отфильтровали через целит и фильтрат сконцентрировали при пониженном давлении с получением N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-6-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.1 г, 93%) в виде серо-белого осадка. MS, установленная: 452.8 (M+H).
К охлажденному на льду раствору N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-6-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.1 г, 2.42 ммоль ) в ДХМ (30 мл) добавили периодинан Десса-Мартина (2.06 г, 4.85 ммоль) и реакционную смесь оставили перемешиваться при комнатной ттемпературе в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь влили в насыщенный раствор бикарбоната натрия и экстрагировали с помощью ДХМ (3 x 50 мл). Объединенный органический слой промыли тиосульфатом натрия, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-6-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.0 г, 91%) в виде серо-белого осадка. MS, установленная: 450.8 (M+H).
К охлажденному на льду раствору N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-6-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.2 г, 2.66 ммоль) в диоксане (20 мл) добавили 4 M HCl в диоксане (15 мл) и реакционную смесь оставили перемешиваться при комнатной температуре в течение 1 ч. ТСХ показала израсходование исходного соединения. Летучие компоненты эвапорировали при пониженном давлении с получением 2-[2-(аминометил)-6-хлор-3-(трифторметил)фенил]сульфанилпиридин-3-карбальдегида (0.91 г, 99%) в виде серо-белого осадка.
К охлажденной на льду суспензии 2-[2-(аминометил)-6-хлор-3-(трифторметил)фенил]сульфанилпиридин-3-карбальдегида (0.91 г, 2.62 ммоль) в ацетонитриле (15 мл) добавили 5% водный раствор NaHCO3 (12 мл) и Fmoc-OSu (0.708 г, 2.09 ммоль) в CH3CN (15 мл) и реакционную смесь перемешивали при комнатной ттемпературе в течение 4 ч. Затем её разбавили этилацетатом (80 мл) и водой (30 мл). Органический слой отделили, промыли водой, солевым раствором и высушили над безводным сульфатом натрия. Органический слой сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-6-(трифторметил)фенил]метил]карбамата (0.590 г, 40%) в виде серо-белого осадка. LC-MS: 569.0 (M+H).
1H-NMR: (400 MHz, CDCl3): δ 4.21-4.16 (3H, m), 4.43 (2H, br s), 7.33-7.29 (2H, m), 7.43-7.36 (3H, m), 7.56 (1H, br s), 7.66 (2H, m), 7.94-7.84 (4H, m), 8.38 (1H, d, J = 7.4 Hz), 8.43 (1H, d, J = 3.8 Hz), 10.19 (1H, s).
Промежуточное соединение 32
9H-флуорен-9-илметил N-[[3,6-дифтор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат
К раствору 2-тионикотиновой кислоты (4.0 г, 25.77 ммоль) в этаноле (80 мл, продутый аргоном) добавили этоксид натрия (4.385 г, 64.437 ммоль) и 2,3,6-трифтор-бензальдегид (4.95 г, 30.93 ммоль) последовательно и реакционную смесь нагревали до кипения в течение 4 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты удалили при пониженном давлении с получением 2-(3,6-дифтор-2-формил-фенил)сульфанилпиридин-3-карбоновой кислоты (12 г, неочищенная) в виде коричневого осадка, который использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 296.1(M+H).
К охлажденному на льду раствору 2-(3,6-дифтор-2-формил-фенил)сульфанилпиридин-3-карбоновой кислоты (12.0 г, неочищенный) в ДМФ (25 мл) в атмосфере аргона добавили K2CO3 (5.617 г, 40.64 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 мин. В получившуюся реакционную смесь добавили MeI (2.53 мл, 40.64 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Затем реакционную смесь разбавили водой (100 мл) и водную фазу экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили с помощью хроматографии на системе Combiflash (10% этилацетат в гексане) с получением метил 2-(3,6-дифтор-2-формил-фенил)сульфанилпиридин-3-карбоксилата (2.3 г, 29% за две стадии) в виде желтого осадка. LC-MS: 311.1(M+ 2H), MS, установленная: 310.1(M+H).
К перемешанному раствору метил 2-(3,6-дифтор-2-формил-фенил)сульфанилпиридин-3-карбоксилата (2.3 г, 7.43 ммоль) в безводном ТГФ (100 мл) в атмосфере аргона добавили этоксид титана (IV) (4.24 г, 18.59 ммоль) с последующим трет-бутилсульфинамидом (2.25 г, 18.59 ммоль). Получившуюся реакционную смесь перемешивали при комнатной температуре в течение 1 ч и нагревали до 60°C в течение 4 ч. Затем реакционную смесь охладили до комнатной температуры, влили в воду (100 мл) и отфильтровали через слой целита. Слой целита промыли этилацетатом. Органический слой отделили и водный слой экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили с помощью хроматографии на системе Combiflash (25% этилацетат в гексане) с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3,6-дифтор-фенил]сульфанилпиридин-3-карбоксилата (1.6 г, 52%) в виде вязкого масла. LC-MS: 412.6 (M+H).
К охлажденному на льду раствору метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3,6-дифтор-фенил]сульфанилпиридин-3-карбоксилата (1.6 г, 3.88 ммоль) в ТГФ (30 мл) в атмосфере аргона добавили LAH (0.368 г, 9.70 ммоль) по порциям и реакционную смесь перемешивали при 0°C в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили этилацетатом и насыщенным раствором сульфата натрия. Затем реакционную смесь отфильтровали через целит и промыли EtOAc. Фильтрат сконцентрировали с получением N-[[3,6-дифтор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (1.4 г, 94%) в виде серо-белого осадка. LC-MS: 387.0 (M+H).
К охлажденному на льду раствору N-[[3,6-дифтор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (1.4 г, 3.62 ммоль) в ДХМ (50 мл) добавили периодинан Десса-Мартина (2.239 г, 5.43 ммоль) по порциям и реакционную смесь перемешивали при комнатной температуре в течение 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили с помощью ДХМ (50 мл) и насыщенного раствора бикарбоната натрия (50 мл). Органический слой отделили и водный слой экстрагировали с помощью ДХМ (50 мл x 2). Объединенные органические слои промыли раствором тиосульфата натрия с последующим солевым раствором. Летучие компоненты удалили при пониженном давлении с получением N-[[3,6-дифтор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (1.4 г, колич.) в виде вязкого масла. LC-MS: 384.9 (M+H).
К охлажденному на льду раствору N-[[3,6-дифтор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (1.4 г, 4.14 ммоль) в диоксане (20 мл) добавили 4M HCl в диоксане (30 мл) и реакционную смесь перемешивали при комнатной температуре в течение периода 2 ч. Прохождение реакции контролировали с помощью LC-MS. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром (30 мл x 2) и хорошо высушили с получением 2-[2-(аминометил)-3,6-дифтор-фенил]сульфанилпиридин-3-карбальдегида (1.6 г, неочищенный) в виде желтого осадка. LC-MS: 281.0 (M+H).
К перемешанной суспензии 2-[2-(аминометил)-3,6-дифтор-фенил]сульфанилпиридин-3-карбальдегида (1.6 г, неочищенный) в 5% растворе бикарбоната натрия и ацетонитриле (30 мл, 1:1) добавили Fmoc-OSu (1.08 г, 3.21 ммоль) в ацетонитриле (15 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты удалили при пониженном давлении и неочищенную реакционную смесь разбавили водой (50 мл). Водную фазу экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой промыли солевым раствором (50 мл x 1), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (20% этилацетат в гексане) с получением необходимого соединения, которое дополнительно промыли n-пентаном (5 мл) и высушили с получением 9H-флуорен-9-илметил N-[[3,6-дифтор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамата (0.85 г, 47% за две стадии) в виде белого осадка. LC-MS: 502.9 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.20-4.11 (3H, m), 4.32 (2H, d, J = 4.2 Hz), 7.30 (2H, m), 7.47-7.35 (5H, m), 7.66-7.64 (3H, m), 7.87 (2H, d, J = 7.5 Hz), 8.35 (1H, dd, J = 7.6, 1.8 Hz), 8.42 (1H, dd, J = 4.8, 1.8 Hz), 10.18 (1H, s).
Промежуточное соединение 33
9H-флуорен-9-илметил N-[[3-хлор-2-(2-формилфенил)сульфанил-5-метокси-фенил]метил]карбамат
К перемешанному раствору 3-хлор-2-гидрокси-5-метокси-бензальдегида (2.4 г, 12.903 ммоль) в ДХМ (25 мл) добавили Et3N (2.72 мл, 19.355 ммоль), трифлатный ангидрид (3.27 мл, 19.355 ммоль) при -5°C и реакционную массу перемешивали при -5°C в течение 30 мин. Реакционную массу разбавили с помощью ДХМ и промыли насыщенным раствором бикарбоната натрия. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-8% этилацетата в гексане с получением (2-хлор-6-формил-4-метокси-фенил)трифторметансульфоната (2.4 г, 58%) в виде бесцветной жидкости.
К перемешанному и дегазированному раствору (2-хлор-6-формил-4-метокси-фенил) трифторметансульфоната (2.915 г, 9.167 ммоль) в диоксане (25 мл) добавили DIPEA (3.159 мл, 18.333 ммоль), Ксантфос (165.205 мг, 0.458 ммоль), Pd2(dba)3 (209.848 мг, 0.229 ммоль), метил 2-сульфанилбензоат (770 мг, 4.583 ммоль) и реакционную массу нагревали до 110°C в течение 2.5 ч. Реакционную смесь отфильтровали через слой целита, промыли этилацетатом и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-3% этилацетата и гексана с получением метил 2-(2-хлор-6-формил-4-метокси-фенил)сульфанилбензоата (1.2 г, 78%) в виде светло-желтого осадка.
К перемешанному раствору метил 2-(2-хлор-6-формил-4-метокси-фенил)сульфанилбензоата (1.2 г,3.571 ммоль) в ТГФ (25 мл) добавили 2-метилпропан-2-сульфинамид( 433мг, 3.571 ммоль), Ti(OEt)4(3.74 мл, 17.857 ммоль) и реакционную массу нагревали до 70°C в течение 4 ч. Реакционную массу погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через слой целита, промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением этил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-хлор-4-метокси-фенил]сульфанилбензоата (1.8 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 453.8 (M+H).
К перемешанному раствору этил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-хлор-4-метокси-фенил]сульфанилбензоата (1.8 г, 3.974 ммоль) в ТГФ (25 мл) добавили LiBH4 (0.865 г, 39.735 ммоль) при 0°C и реакционную массу нагревали до 50°C в течение 4 ч. Растворитель эвапорировали и реакционную смесь погасили NH4Cl и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-5-метокси-фенил]метил]-2-метил-пропан-2-сульфинамида (1.4 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 413.9 (M+H).
К перемешанному раствору N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-5-метокси-фенил]метил]-2-метил-пропан-2-сульфинамида (1.4 г , 3.39 ммоль) в MeOH (25 мл), добавили 4M HCl в диоксане (12 мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении до [2-[2-(аминометил)-6-хлор-4-метокси-фенил]сульфанилфенил]метанола (1.4 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 310.0 (M+H).
К перемешанной суспензии [2-[2-(аминометил)-6-хлор-4-метокси-фенил]сульфанилфенил]метанола (1.4 г, 4.531ммоль) в 5% NaHCO3 (20 мл) добавили Fmoc OSU(1.528 г, 4.531 ммоль) в CH3CN (20 мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении до 9H-флуорен-9-илметил N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-5-метокси-фенил]метил]карбамата (1.4 г, неочищенный) в виде серо-белого осадка. MS, установленная: 531.8 (M+H).
К перемешанному раствору N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-5-метокси-фенил]метил]карбамата (1.4 г, 2.637 ммоль) в ДХМ/ТГФ(1:1, 50мл) добавили MnO2 (4.584 г, 52.731 ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита, фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-13% этилацетата в гексане до 9H-флуорен-9-илметил N-[[3-хлор-2-(2-формилфенил)сульфанил-5-метокси-фенил]метил]карбамата (600мг, 32%, 5 стадий) в виде серо-белого осадка.
1H-NMR: (400 MHz, DMSO-d6) δ 3.84 (3H; s); 4.20-4.29 (5H; m); 6.51 (1H; d; J = 8.0 Hz); 6.97 (1H; br s); 7.26 (1H; br s); 7.33-7.36 (3H; m); 7.399-7.44 (2H; m); 7.69 (2H; d; J = 7.40 Hz); 7.80 (1H; m); 7.89 (2H; d; J = 7.52 Hz); 7.99 (1H; d; J =7.4 Hz); 10.18 (1H; s)
Промежуточное соединение 34
9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-5-метокси-3-метил-фенил]метил]карбамат

К перемешанному и дегазированному раствору 2-формил-4-метокси-6-метилфенил трифторметансульфоната (3.01 г, 10.106ммоль) в диоксане (10мл) добавили DIPEA (3.53мл, 20.212ммоль), Ксантфос (292мг, 0.505ммоль), Pd2(dba)3 (231мг, 0.253ммоль), метил 2-сульфанилбензоат (850мг, 5.053ммоль) и реакционную массу нагревали до 110°C в течение 2 ч. Реакционную смесь отфильтровали через слой целита, промыли этилацетатом и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-5% этилацетата и гексана с получением метил 2-(2-формил-4-метокси-6-метил-фенил)сульфанилбензоата (1.3 г, 81%) в виде серо-белого осадка.
К перемешанному раствору метил 2-(2-формил-4-метокси-6-метил-фенил)сульфанилбензоата (1.3 г, 4.109ммоль) в ТГФ (10мл) добавили 2-метилпропан-2-сульфинамид (498мг, 4.109ммоль), Ti(OEt)4(4.33мл, 20.545ммоль) и реакционную массу нагревали до 70°C в течение 16 ч. Реакционную массу погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через слой целита, промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением этил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4-метокси-6-метил-фенил]сульфанилбензоата (1.5г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 434 (M+H).
К перемешанному раствору этил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4-метокси-6-метил-фенил]сульфанилбензоата (1.5 г, 3.459ммоль) в ТГФ (15мл) добавили LiBH4 (751мг, 34.595ммоль) при 0°C и реакционную массу нагревали до 50°C в течение 4 ч. Растворитель эвапорировали и реакционную смесь погасили NH4Cl и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением N-[[2-[2-(гидроксиметил)фенил]сульфанил-5-метокси-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.3г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 394 (M+H).
К перемешанному раствору N-[[2-[2-(гидроксиметил)фенил]сульфанил-5-метокси-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.3 г, 3.303ммоль) в MeOH(20мл), добавили 4M HCl в диоксане (10мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении с получением [2-[2-(аминометил)-4-метокси-6-метил-фенил]сульфанилфенил]метанола (1.1 г, неочищенный),который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 290 (M+H).
К перемешанной суспензии [2-[2-(аминометил)-4-метокси-6-метил-фенил]сульфанилфенил]метанола (1.1 г, 3.375ммоль) в 5% NaHCO3(20мл) добавили Fmoc OSU(1.1 г, 3.375ммоль) в CH3CN(20мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[2-[2-(гидроксиметил)фенил]сульфанил-5-метокси-3-метил-фенил]метил]карбамата (1.2 г, 57%, 4 стадии) в виде серо-белого осадка. MS, установленная: 511.9 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[[2-[2-(гидроксиметил)фенил]сульфанил-5-метокси-3-метил-фенил]метил]карбамата (1.2 г, 2.345ммоль) в ДХМ/ТГФ(1:1, 20мл) добавили MnO2(4.07 г, 46.907ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита, фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-20% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-5-метокси-3-метил-фенил]метил]карбамата (800мг, 67%) в виде серо-белого осадка.
1H-NMR: (400 MHz, DMSO-d6) δ 2.13 (3H; s); 3.79 (3H; s); 4.20-4.29 (5H; m); 6.42 (1H; d; J = 8.0 Hz); 6.87 (1H; br s); 6.99 (1H; br s); 6.29-6.33 (3H; m); 6.42 (3H; t; J = 5.4 Hz); 7.69 (2H; d; J = 7.40 Hz); 7.77-7.82 (1H; m); 7.89 (2H; d; J = 7.52 Hz); 7.96 (1H; d; J =7.4 Hz); 10.21 (1H; s)
Промежуточное соединение 35
9H-флуорен-9-илметил N-[[5-фтор-2-(2-формилфенил)сульфанил-фенил]метил]карбамат

К охлажденному на льду раствору 2,5-дифтор-бензальдегида (5.21 г, 30.98 ммоль) и 2-меркапто-бензойной кислоты метилового эфира (4.0 г, 28.17 ммоль) в ДМФ (20 мл, продули аргоном в течение 10 мин) добавили карбонат калия (7.78 г, 56.33 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 мин. Затем реакционную смесь разбавили водой (100 мл) и водн. фазу экстрагировали этилацетатом (3 x 50 мл). Объединенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (5% этилацетат в гексане) с получением метил 2-(4-фтор-2-формил-фенил)сульфанилбензоата (2.4 г, 27%) в виде серо-белого осадка. MS, установленная: 291.1(M+H).
К перемешанному раствору метил 2-(4-фтор-2-формил-фенил)сульфанилбензоата (2.9 г, 10 ммоль) в безводном ТГФ (50 мл) в атмосфере аргона добавили этоксид титана (IV) (4.56 г, 20 ммоль) с последующим трет-бутилсульфинамидом (2.42 г, 20 ммоль) и получившуюся реакционную смесь нагревали до 70°C в течение 4 ч. Затем реакционную смесь охладили до комнатной температуры, влили в воду (100 мл), желатинизированную белую массу отфильтровали через целит. Слой целита тщательно промыли этилацетатом (50 мл). Органический слой отделили. Водный слой экстрагировали этилацетатом (3 x 50 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4-фтор-фенил]сульфанилбензоата (3.9 г, 99%) в виде белого осадка. MS, установленная: 394.1(M+H).
К охлажденной на льду суспензии LAH (1.15 г, 30.53 ммоль) добавили раствор метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4-фтор-фенил]сульфанилбензоата (4.0 г, 10.17 ммоль) в ТГФ (50 мл) и реакционную смесь перемешивали при 0°C в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили этилацетатом и насыщенным раствором сульфата натрия. Реакционную смесь отфильтровали через целит и тщательно промыли EtOAc (50 мл). Фильтрат сконцентрировали с получением N-[[5-фтор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (3.6 г, 96%) в виде серо-белого осадка. MS, установленная: 367.8(M+H).
К охлажденному на льду раствору N-[[5-фтор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (3.0 г, 8.17 ммоль) в ДХМ (150 мл) добавили периодинан Десса-Мартина (5.2 г, 12.26 ммоль) по порциям и реакционную смесь перемешивали при комнатной температуре в течение 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили с помощью ДХМ (50 мл) и насыщенного раствора бикарбоната натрия (50 мл). Органический слой отделили и водный слой экстрагировали с помощью ДХМ (2 x 50 мл). Объединенный органический слой промыли насыщенным растворм бикарбоната натрия с последующим солевым раствором. Органический слой высушили над Na2SO4, и эвапорировали при пониженном давлении. Соединение очистили посредством флеш-хроматографии (50% EtOAc в гексане) с получением N-[[5-фтор-2-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 67%) в виде белого осадка. MS, установленная: 365.9(M+H).
К охлажденному на льду раствору N-[[5-фтор-2-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, неочищенный) в диоксане (20 мл) добавили 4M HCl в диоксане (30 мл) и реакционную смесь перемешивали при комнатной температуре в течение периода 2 ч. Прохождение реакции контролировали с помощью ЖХМС. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром (2 x 30 мл) и высушили с получением 2-[2-(аминометил)-4-фтор-фенил]сульфанилбензальдегида (1.37 г, неочищенный) в виде желтого осадка.
К перемешанной суспензии 2-[2-(аминометил)-4-фтор-фенил]сульфанилбензальдегида (1.37 г, неочищенный) в 5% растворе бикарбоната натрия и ацетонитрила (30 мл, 1:1) добавили раствор Fmoc-OSu (1.047 г, 3.05 ммоль) в ацетонитриле (15 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты удалили при пониженном давлении и неочищенную реакционную смесь разбавили водой (50 мл). Водн. фазу экстрагировали этилацетатом (50 мл x 3). Объединенные органические слои промыли солевым раствором (50 мл), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили с помощью флеш-хроматографии (20% этилацетат в гексане) с получением необходимого соединения, которое дополнительно промыли н-пентаном (5 мл) и высушили с получением 9H-флуорен-9-илметил N-[[5-фтор-2-(2-формилфенил)сульфанил-фенил]метил]карбамата (0.6 г, 23% за две стадии) в виде белого осадка. LC-MS: 484.2 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.23-4.21 (3H, m), 4.33 (2H, d, J = 6.9 Hz), 6.63 (1H, d, J = 8.0 Hz), 7.17 (1H, dd, J = 10.0, 2.7 Hz), 7.35-7.24 (4H, m), 7.45-7.36 (3H, m), 7.48 (1H, t, J = 6.3 Hz), 7.58 (1H, dd, J = 8.5, 5.9 Hz), 7.69 (2H, d, J = 7.4 Hz), 7.89 (2H, d, J = 7.8 Hz), 7.98 (1H, dd, J = 7.5, 1.3 Hz), 10.19 (1H, s).
Промежуточное соединение 36
9H-флуорен-9-илметил N-[[3-хлор-2-(2-формилфенил)сульфанил-5-метил-фенил]метил]карбамат

К охлажденному на льду раствору 3-хлор-2-фтор-5-метил-бензальдегида (4 г, 23.25 ммоль) и 2-меркапто-бензойной кислоты метилового эфира (3.91 г, 23.25 ммоль) в ДМФ (30 мл) в атмосфере аргона добавили карбонат калия (6.4 г, 46.51ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После завершения реакционную смесь разбавили водой (50 мл) и экстрагировали этилацетатом (30 мл x 3). Объединенный органический слой промыли солевым раствором (15 мл x 3), высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии с использованием 10% этилацетата в гексане в качестве элюента с получением метил 2-(2-хлор-6-формил-4-метил-фенил)сульфанилбензоата (4.5 г, 61%) в виде бледно-желтого осадка. LC-MS: 321.0 (M+H).
К раствору метил 2-(2-хлор-6-формил-4-метил-фенил)сульфанилбензоата (3 г, 9.375 ммоль) в безводном ТГФ (100 мл) добавили трет-бутилсульфинамид (1.7 г, 14.062 ммоль) с последующим этоксидом титана (IV) (3.2 г, 14.062 ммоль) и реакционную смесь нагревали до 70°C в течение 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл), отфильтровали через целит и промыли этилацетатом. Органический слой отделили, промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-хлор-4-метил-фенил]сульфанилбензоата (3 г, 76%) в виде серо-белого осадка. LC-MS: 424.0(M+H).
К охлажденной на льду суспензии LAH (0.807 г, 21.27 ммоль) в ТГФ (50 мл) добавили метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-6-хлор-4-метил-фенил]сульфанилбензоат (3 г, 7.092 ммоль) в ТГФ (30 мл) и реакционную смесь перемешивали в течение 30 мин при 0°C. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили насыщенным сульфатом натрия (5 мл) и отфильтровали через целит. Остаток промыли этилацетатом (3 x 50 мл) и фильтрат сконцентрировали с получением N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-5-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.5 г, 90%) в виде белого осадка. LC-MS: 397.8 (M+H).
К охлажденному на льду раствору N-[[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-5-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 5.04 ммоль) в ДХМ (100 мл) добавили периодинан Десса-Мартина (2.34 г, 5.54 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь влили в насыщенный раствор бикарбоната натрия и экстрагировали с помощью ДХМ (3 x 100 мл). Объединенный органический слой промыли тиосульфатом натрия, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили с помощью хроматографии на системе Combiflash (30% EtOAc в гексане) с получением N-[[3-хлор-2-(2-формилфенил)сульфанил-5-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.5 г, 76%) в виде серо-белого осадка. LC-MS: 396.1 (M+H).
К охлажденному на льду раствору N-[[3-хлор-2-(2-формилфенил)сульфанил-5-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.5 г, 3.79 ммоль) в диоксане (20 мл) добавили 4M HCl в диоксане (2 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты эвапорировали при пониженном давлении с получением 2-[2-(аминометил)-6-хлор-4-метил-фенил]сульфанилбензальдегида (1.2 г, неочищенный) в виде серо-белого осадка. LC-MS: 292.1 (M+H).
К суспензии 2-[2-(аминометил)-6-хлор-4-метил-фенил]сульфанилбензальдегида (1.2 г, 4.12 ммоль) в 5% водном растворе NaHCO3 (5 мл) добавили раствор Fmoc-OSu (0.973 г, 2.88 ммоль) в CH3CN (20 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили этилацетатом (50 мл) и органический слой отделили . Органический слой промыли водой с последующим солевым раствором и высушили над безводным сульфатом натрия. Органический слой сконцентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили посредством флеш-хроматографии (17% EtOAc в гексане) с получением 9H-флуорен-9-илметил N-[[3-хлор-2-(2-формилфенил)сульфанил-5-метил-фенил]метил]карбамата (1.0 г, 53%) в виде белого осадка. LC-MS: 513.9 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 2.37 (3H, s), 4.22-4.18 (1H, m), 4.32-4.28 (4H, m), 6.48 (1H, d, J = 8.0 Hz), 7.22 (1H, s)., 7.38-7.31 (3H, m), 7.46-7.40 (3H, m), 7.54 (1H, s)., 7.69 (2H, d, J = 7.4 Hz), 7.85 (1H, t, J = 6.1 Hz), 7.89 (2H, d, J = 7.5 Hz), 7.99 (1H, dd, J = 7.52, 1.16 Hz), 10.19 (1H, s).
Промежуточное соединение 37
9H-флуорен-9-илметил N-[[3,5-дихлор-2-(2-формилфенил)сульфанил-фенил]метил]карбамат

К охлажденному на льду раствору 3,5-дихлор-2-фтор-бензальдегида (2.78 г, 16.57 ммоль) в ДМФ (20 мл, продули аргоном в течение 10 мин) в атмосфере аргона медленно добавили 2-меркапто-бензойной кислоты метиловый эфир (4.0 г, 20.72 ммоль) и карбонат калия (8.59 г, 62.17 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 мин. Затем реакционную смесь разбавили водой (100 мл) и водн. фазу экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (5% этилацетат в гексане) с получением метил 2-(2,4-дихлор-6-формил-фенил)сульфанилбензоата (1.6 г, 23%) в виде серо-белого осадка. LC-MS: 339.8 (M+H).
К перемешанному раствору метил 2-(2,4-дихлор-6-формил-фенил)сульфанилбензоата (1.6 г, 4.69 ммоль) в безводном ТГФ (50 мл) в атмосфере аргона добавили этоксид титана (IV) (2.14 г, 9.38 ммоль) с последующим трет-бутилсульфинамидом (1.137 г, 9.38 ммоль). Получившуюся реакционную смесь перемешивали при комнатной температуре в течение 1 ч и нагревали до 60°C в течение 4 ч. Затем реакционную смесь охладили до комнатной температуры, влили в воду (100 мл) и отфильтровали через слой целита. Слой целита промыли этилацетатом. Органический слой отделили и водный слой экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили с помощью хроматографии на системе Combiflash (25% этилацетат в гексане) с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4,6-дихлор-фенил]сульфанилбензоата (2.0 г, 95%) в виде вязкого масла. LC-MS: 443.9(M+H).
К охлажденному на льду раствору метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4,6-дихлор-фенил]сульфанилбензоата (2.0 г, 4.5 ммоль) в ТГФ (50 мл) в атмосфере аргона добавили LAH (0.512 г, 13.50 ммоль) по порциям и реакционную смесь перемешивали при 0°C в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили этилацетатом и насыщенным раствором сульфата натрия. Затем реакционную смесь отфильтровали через целит и промыли с помощью EtOAc. Фильтрат сконцентрировали с получением N-[[3,5-дихлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.8 г, 95%) в виде серо-белого осадка. LC-MS: 417.7 (M+H).
К охлажденному на льду раствору N-[[3,5-дихлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.8 г, 4.30 ммоль) в ДХМ (50 мл) добавили периодинан Десса-Мартина (2.24 г, 6.45 ммоль) по порциям и реакционную смесь перемешивали при комнатной температуре в течение 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили с помощью ДХМ (50 мл) и насыщенного раствора бикарбоната натрия (50 мл). Органический слой отделили и водный слой экстрагировали с помощью ДХМ (50 мл x 2). Объединенный органический слой промыли раствором тиосульфата натрия с последующим солевым раствором. Летучие компоненты удалили при пониженном давлении с получением N-[[3,5-дихлор-2-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, неочищенный) в виде вязкого масла, которое использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 416.0 (M+H).
К охлажденному на льду раствору N-[[3,5-дихлор-2-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, неочищенный) в диоксане (20 мл) добавили 4M HCl в диоксане (30 мл) и реакционную смесь перемешивали при комнатной температуре в течение периода 2 ч. Прохождение реакции контролировали с помощью ЖХМС. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром (30 мл x 2) и хорошо высушили с получением 2-[2-(аминометил)-4,6-дихлор-фенил]сульфанилбензальдегида (1.2 г, неочищенный) в виде желтого осадка. LC-MS: 312.1(M+H)
К перемешанной суспензии 2-[2-(аминометил)-4,6-дихлор-фенил]сульфанилбензальдегида (1.2 г, неочищенный) в 5% растворе бикарбоната натрия и ацетонитриле (30 мл, 1:1) добавили раствор Fmoc-OSu (1.047 г, 3.10 ммоль) в ацетонитриле (15 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции летучие компоненты удалили при пониженном давлении и неочищенную реакционную смесь разбавили водой (50 мл). Водную фазу экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой промыли солевым раствором (50 мл x 1), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (20% этилацетат в гексане) с получением необходимого соединения, которое дополнительно промыли н-пентаном (5 мл) и высушили с получением 9H-флуорен-9-илметил N-[[3,5-дихлор-2-(2-формилфенил)сульфанил-фенил]метил]карбамата (0.75 г, 33% за три стадии) в виде белого осадка. LC-MS: 533.7 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.22-4.19 (2H, m), 4.31-4.29 (3H, m), 6.51 (1H, d, J = 7.9 Hz), 7.37-7.31 (3H, m), 7.47-7.38 (4H, m), 7.68 (2H, d, J = 7.4 Hz), 7.85 (1H, d, J = 2.0 Hz), 7.89 (2H, d, J = 7.5 Hz), 7.94 (1H, t, J = 5.9 Hz), 8.01 (1H, d, J = 7.4 Hz), 10.18 (1H, s).
Промежуточное соединение 38
9H-флуорен-9-илметил N-[[5-хлор-2-(2-формилфенил)сульфанил-3-метил-фенил]метил]карбамат

К перемешанному раствору 5-хлор-2-фтор-3-метилбензойной кислоты (2.0 г, 10.605 ммоль) в ТГФ (20мл) добавили LiAlH4 (21.0 мл, 21.0 ммоль) по каплям при охлаждении на льду и перемешивали при 25°C в течение 30 мин. Затем его погасили насыщенным раствором Na2SO4 и экстрагировали этилацетатом, промыли солевым раствором и высушили над Na2SO4 и сконцентрировали под вакуумом с получением (5-хлор-2-фтор-3-метил-фенил)метанола (1.8 г, неочищенный) в виде светло-желтой жидкости. К перемешанному раствору (5-хлор-2-фтор-3-метил-фенил)метанола (1.8 г, 10.345 ммоль) в ДХМ/ТГФ(1:1,40 мл) добавили MnO2(8.993 г, 103.448 ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита, фильтрат эвапорировали при пониженном давлении Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 2% этилацетата в гексане с получением 5-хлор-2-фтор-3-метил-бензальдегида (1.2 г, 64.86%, 2 стадии) в виде желтой жидкости.
К раствору 5-хлор-2-фтор-3-метил-бензальдегида (1.0 г, 5.814 ммоль) в ДМФ (15.0 мл) добавили Cs2CO3 (4.727 г, 14.535 ммоль) и метил 2-сульфанилбензоат (0.978 г, 5.814 ммоль) и перемешивали при 60°C в течение 2.5 ч. Реакционную смесь разбавили водой и экстрагировали EtOAc. Объединенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением соединения, которое очистили с помощью обычной колонки с силикагелем с использованием 0-2% этилацетата в гексане с получением метил 2-(4-хлор-2-формил-6-метил-фенил)сульфанилбензоата (1.5 г, 80.43 %) в виде желтого осадка. MS, установленная: 321.2 (M+H).
К перемешанному раствору метил 2-(4-хлор-2-формил-6-метил-фенил)сульфанилбензоата (1.5 г,4.688 ммоль) в ТГФ (25 мл) добавили 2-метилпропан-2-сульфинамид (568 мг, 4.688 ммоль), Ti(OEt)4 (4.914 мл, 23.438 ммоль) и реакционную массу нагревали до 70°C в течение 16 ч. Реакционную массу погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через слой целита, промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением этил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-4-хлор-6-метил-фенил]сульфанилбензоата (2.0 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 438.2 (M+H).
К перемешанному раствору этил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-4-хлор-6-метил-фенил]сульфанилбензоата (2.0 г, 4.577 ммоль) в ТГФ (25мл) добавили LiBH4 (0.997 г, 45.767 ммоль) при 0°C и реакционную массу нагревали до 50°C в течение 4 ч. Растворитель эвапорировали и реакционную смесь погасили с помощью NH4Cl и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением N-[[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.8 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 398.1 (M+H).
К перемешанному раствору N-[[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.8 г , 4.534 ммоль) в MeOH (40мл), добавили 4M HCl в диоксане (20мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении с получением [2-[2-(аминометил)-4-хлор-6-метил-фенил]сульфанилфенил]метанола (1.6 г , неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 293.8 (M+H).
К перемешанной суспензии [2-[2-(аминометил)-4-хлор-6-метил-фенил]сульфанилфенил]метанола (1.6 г, 5.461 ммоль) в 5% NaHCO3(20мл) добавили Fmoc OSU(1.841 г, 5.461 ммоль) в CH3CN(20мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-3-метил-фенил]метил]карбамата (1.4 г, 72%, 4 стадии) в виде серо-белого осадка. MS, установленная: 516.2 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[[5-хлор-2-[2-(гидроксиметил)фенил]сульфанил-3-метил-фенил]метил]карбамата (1.6 г, 3.107 ммоль) в ДХМ/ТГФ(1:1, 50мл) добавили MnO2(5.401 г, 62.136 ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита, фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-20% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[5-хлор-2-(2-формилфенил)сульфанил-3-метил-фенил]метил]карбамата (1.1 г, 68%) в виде серо-белого осадка. MS, установленная: 514.4 (M+H).
1H-NMR: (400 MHz, DMSO-d6) δ 2.32 (3H; s); 4.19-4.29 (5H; m); 6.47 (1H; d; J = 7.8 Hz); 6.29-6.37 (4H; m); 7.37-7.44 (3H; m); 7.51 (1H; br s); 7.69 (2H; d; J = 7.36 Hz); 7.87 (1H; m); 7.96 (2H; d; J =7.4 Hz); 7.99 (1H; d; J = 7.6 Hz); 10.20 (1H; s)
Промежуточное соединение 39
9H-флуорен-9-илметил N-[[2-(4-фтор-2-формил-фенил)сульфанилфенил]метил]карбамат

К охлажденному на льду раствору 2,5-дифтор-бензальдегида (5.21 г, 30.98 ммоль) и метил 2-сульфанилбензоата (4.0 г, 28.17 ммоль) в ДМФ (20 мл, продули аргоном в течение 10 мин) добавили карбонат калия (7.78 г, 56.33 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 мин. Затем реакционную смесь разбавили водой (100 мл) и водную фазу экстрагировали этилацетатом (3 x 50 мл). Объединенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (5% этилацетат в гексане) с получением метил 2-(4-фтор-2-формил-фенил)сульфанилбензоата (2.4 г, 27%) в виде серо-белого осадка. MS, установленная: 291.1(M+H).
Раствор метил 2-(4-фтор-2-формил-фенил)сульфанилбензоата (т.е. 3a) (2.0 г, 6.89 ммоль), этиленгликоля (1.28 г, 20.69 ммоль), p-TSA (0.131 г, 0.69 ммоль) в толуоле (100.0 мл) нагревали до 140°C в течение 6 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и органический слой отделили . Водн. слой дополнительно экстрагировали этилацетатом (50 мл x 2). Объединенный органический слой высушили над безводным сульфатом натрия и растворитель выпарили при пониженном давлении с получением метил 2-[2-(1,3-диоксолан-2-ил)-4-фтор-фенил]сульфанилбензоата (1.70 г, 74%) в виде серо-белого осадка. LC-MS: 335.0(M+NH4)
К охлажденной на льду суспензии LAH (0.454 г, 11.97 ммоль) в ТГФ (50 мл) добавили метил 2-[2-(1,3-диоксолан-2-ил)-4-фтор-фенил]сульфанилбензоат (1.6 г, 4.79 ммоль) в ТГФ (30 мл) и реакционную смесь перемешивали в течение 30 мин при 0°C. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили насыщенным раствором сульфата натрия (5 мл) и отфильтровали через целит. Остаток промыли этилацетатом (3 x 50 мл) и фильтрат сконцентрировали при пониженном давлении с получением [2-[2-(1,3-диоксолан-2-ил)-4-фтор-фенил]сульфанилфенил]метанола (1.4 г, 96%) в виде белого осадка. MS, установленная: 324.1(M+18)
Суспензию [2-[2-(1,3-диоксолан-2-ил)-4-фтор-фенил]сульфанилфенил]метанола (2.56 г, 9.80 ммоль), азида натрия (0.486 г, 7.84 ммоль) в тетрахлориде углерода (5.0 мл) и ДМФ (15.0 мл) нагревали до 80°C в течение 5 ч. Прогресс реакции контролировали с помощью ТСХ. Реакционную смесь разбавили водой (20 мл) и соединение экстрагировали этилацетатом (30 мл x 2). Объединенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством колоночной хроматографии на силикагеле (30% этилацетат в гексане) с получением 2-[2-[2-(азидометил)фенил]сульфанил-5-фтор-фенил]-1,3-диоксолана (0.9 г, 70%) в виде вязкого масла. MS, установленная: 349.1(M+NH4)
К раствору 2-[2-[2-(азидометил)фенил]сульфанил-5-фтор-фенил]-1,3-диоксолана (0.9 г, 2.71 ммоль) в этаноле (20 мл) добавили Pd-C (0.3 г) и реакционную смесь взбалтывали под давлением баллона с водородом в течение 16 ч. Затем реакционную смесь отфильтровали через целит. Фильтрат сконцентрировали при пониженном давлении с получением [2-[2-(1,3-диоксолан-2-ил)-4-фтор-фенил]сульфанилфенил]метанамина (0.800 г, 96%) в виде вязкого масла. MS, установленная: 305.9(M+H).
К суспензии [2-[2-(1,3-диоксолан-2-ил)-4-фтор-фенил]сульфанилфенил]метанамина (0.800 г, 2.62 ммоль) в 5% бикарбонате натрия (3 мл) добавили Fmoc-OSu (0.619 г, 1.84 ммоль) в ацетонитриле (20 мл) и реакционную смесь перемешивали при комнатной ттемпературе в течение 3 ч. Летучие компоненты удалили при пониженном давлении и неочищенную реакционную смесь разбавили водой (50 мл). Водную фазу экстрагировали этилацетатом (50 мл x 3). Объединенный органический слой промыли солевым раствором (50 мл x 1), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (19% этилацетат в гексане) с последующей промывкой диэтиловым эфиром : пентаном (5 мл, 1:1) с получением 9H-флуорен-9-илметил N-[[2-[2-(1,3-диоксолан-2-ил)-4-фтор-фенил]сульфанилфенил]метил]карбамата (0.750 г, 54%) в виде белого осадка. MS, установленная: 528.1(M+H).
К раствору 9H-флуорен-9-илметил N-[[2-[2-(1,3-диоксолан-2-ил)-4-фтор-фенил]сульфанилфенил]метил]карбамата (0.750 г, 1.42 ммоль) в ацетоне (40 мл) добавили 5 н HCl (15 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Летучие компоненты удалили при пониженном давлении и экстрагировали этилацетатом (30 мл x 3). Объединенный органический слой промыли 5% раствором NaHCO3 (50 мл) и затем водой (50 мл). Органический слой сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (17% этилацетат в гексане) с последующей промывкой диэтиловым эфиром-пентаном (5 мл, 1:1) с получением 9H-флуорен-9-илметил N-[[2-(4-фтор-2-формил-фенил)сульфанилфенил]метил]карбамата (0.550 г, 80%) в виде серо-белого осадка. LC-MS: 483.8 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.26-4.19 (3H, m), 4.33 (2H, d, J = 6.8 Hz), 6.86 (1H, dd, J = 8.8, 5.0 Hz), 7.48-7.31 (9H, m), 7.70 (2H, d, J = 7.4 Hz), 7.86-7.79 (2H, m), 7.89 (2H, d, J = 7.5Hz), 10.21 (1H, s).
Промежуточное соединение 40
9H-флуорен-9-илметил N-[[2-[(3-формил-2-пиридил)сульфанил]-3-метил-фенил]метил]карбамат

Суспензию Na2S.xH2O (1.35 г, 17.374 ммоль) и MgSO4 (4 г) в N,N-диметилацетамиде (40мл) перемешивали при 80°C в течение периода 30 минут в атмосфере азота с последующим добавлением 2-фтор-3-метил-бензальдегида (2 г, 14.478 ммоль) при этой температуре. Перемешивание продолжили в течение дополнительных 30 мин при 80°C. Реакционную смесь охладили до 0°C, уксусный ангидрид (1.9 мл, 20.269 ммоль) добавили по каплям и смесь перемешивали при 0°C в течение дополнительных 30 мин. Реакционную смесь разбавили этилацетатом и промыли водой. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-5% этилацетата в гексане с получением S-(2-формил-6-метил-фенил) этантиоата (830мг, 29%) в виде серо-белого осадка.
К перемешанному раствору полученного S-(2-формил-6-метил-фенил) этантиоата (800мг, 4.118ммоль) в ТГФ(20мл) добавили 2-метил 2-пропансульфинамид (499мг, 4.118ммоль) и Ti(OEt)4 (4.349мл, 20.592ммоль) и нагревали до 70°C в течение 45 мин. Реакционную смесь погасили солевым раствором и экстрагировали этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-10% этилацетата в гексане с получением S-[2-[(Z)-трет-бутилсульфинилиминометил]-6-метил-фенил] этантиоата (800мг,65%) в виде бесцветной вязкой жидкости. MS, установленная: 298.2 (M+H).
Раствор S-[2-[(Z)-трет-бутилсульфинилиминометил]-6-метил-фенил]этантиоата (800мг, 2.69ммоль) в ТГФ (30 мл) дегазировали аргоном в течение приблизительно 10 минут и затем NaBH4 (1017мг, 26.896ммоль) добавили по порциям при охлаждении и перемешивали в течение 30 мин. Реакцию затем погасили ацетоном (10мл) (дегазированный аргоном) и перемешивали при охлаждении в течение 1 ч. Реакционную массу сконцентрировали при пониженном давлении и высвободили в аргоне с получением 2-метил-N-[(3-метил-2-сульфанил-фенил)метил]пропан-2-сульфинамида (650мг, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 258.0 (M+H).
К перемешанному раствору 2-метил-N-[(3-метил-2-сульфанил-фенил)метил]пропан-2-сульфинамида (1.4 г, 5.439ммоль) и 2-хлор-никотиновой кислоты трет-бутилового эфира (1.16 г, 5.439ммоль) в ацетонитриле (20мл) добавили K2CO3(1.5 г, 10.877ммоль) и реакционную смесь нагревали до 70°C в течение 4 ч. Реакционную смесь разбавили этилацетатом и промыли водой. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили хроматографией на силикагеле с использованием 5-40% этилацетата в гексане с получением трет-бутил 2-[2-[(трет-бутилсульфиниламино)метил]-6-метил-фенил]сульфанилпиридин-3-карбоксилата (700мг, 30%, 2 стадии) в виде серо-белого осадка. MS, установленная: 435 (M+H).
К перемешанному раствору трет-бутил 2-[2-[(трет-бутилсульфиниламино)метил]-6-метил-фенил]сульфанилпиридин-3-карбоксилата (1.4 г, 3.665ммоль) в ТГФ (20мл) добавили LiBH4 (795мг, 36.654ммоль) и реакционную смесь нагревали до 70°C в течение 4 ч. Реакционную смесь погасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-60% этилацетата в гексане с получением N-[[2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (800мг, 57%) в виде серо-белого осадка. MS, установленная: 364.8 (M+H).
К перемешанному раствору N-[[2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (800мг, 2.195ммоль) в MeOH(15мл), добавили 4M HCl/диоксан(30мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении с получением [2-[2-(аминометил)-6-метил-фенил]сульфанил-3-пиридил]метанола (650мг, неочищенный) в виде серо-белого осадка. MS, установленная: 260.9 (M+H).
К перемешанной суспензии [2-[2-(аминометил)-6-метил-фенил]сульфанил-3-пиридил]метанола (650мг, 2.19ммоль) в 5% NaHCO3(20мл) добавили Fmoc OSU(738мг, 2.19ммоль) в CH3CN(30мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную смесь разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-3-метил-фенил]метил]карбамата ( 700мг, 66%, 2 стадии) в виде серо-белого осадка. MS, установленная: 482.9 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[[2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-3-метил-фенил]метил]карбамата (700мг, 1.45ммоль) в ДХМ/ТГФ(1:1, 20 мл) добавили MnO2(2.52 г, 29.009ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную смесь отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили хроматографией на силикагеле с использованием 5-30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[2-[(3-формил-2-пиридил)сульфанил]-3-метил-фенил]метил]карбамата (490мг, 70%) в виде серо-белого осадка. NMR соответствует.
1H-NMR: (400 MHz, DMSO-d6) δ 2.32 (3H; s); 4.18-4.29 (5H; m); 7.16 (1H; d; J = 7.48 Hz); 7.28-7.37 (5H; m); 7.40-7.44 (3H; m); 7.69 (2H; d; J = 7.20 Hz); 7.87 (1H; m); 7.96 (2H; d; J =7.48 Hz); 8.31 (1H; d; J = 7.32 Hz); 8.40 (1H; br d; J = 4.04 Hz); 10.23 (1H; s)
Промежуточное соединение 41
9H-флуорен-9-илметил N-[(1S)-1-[3-хлор-2-(2-формилфенил)сульфанил-фенил]этил]карбамат

Раствор 1-(3-хлор-2-фторфенил)этан-1-она (4 г, 23.176ммоль), (2-сульфанилфенил)метанола (3.25 г, 23.176ммоль), 63% водн. NaOH(1.2мл) и HMPA(40мл) нагревали до 100°C в течение 5 ч. Реакционную смесь разбавили водой и экстрагировали EtOAc. Объединенные органические слои промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное неочищенное вещество очистили хроматографией на силикагеле (100-200 меш) с использвоанием 0-20% EtOAc в гексане с получением 1-[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этанона (4 г, 59%) в виде бесцветной вязкой жидкости.
К перемешанному раствору 1-[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этанона (4 г, 13.662ммоль) в ТГФ(40мл) добавили (S) 2-метил 2-пропансульфинамид (1.65 г, 13.662ммоль) и Ti(OEt)4 (14.4мл, 68.308ммоль) и нагревали до 70°C в течение 16 ч. Реакционную смесь погасили солевым раствором и экстрагировали этилацетатом. Отделенные органические слои высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 0-30% этилацетата в гексане с получением N-[1-[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этилиден]-2-метил-пропан-2-сульфинамида (3.2 г, 59%) в виде желтого осадка. MS, установленная: 395.9 (M+H).
К перемешанному раствору N-[1-[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этилиден]-2-метил-пропан-2-сульфинамида (600мг, 1.515ммоль) в ТГФ (20 мл) добавили L-селектрид (7.5 мл, 7.5ммоль) при 25°C и перемешивали при этой температуре в течение 16 ч. Затем реакционную смесь погасили насыщенным раствором NH4Cl и экстрагировали этилацетатом, высушили над Na2SO4 и сконцентрировали под вакуумом с получением N-[(1S)-1-[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этил]-2-метил-пропан-2-сульфинамида (600мг, неочищенный) в виде серо-белого вязкого осадка. MS, установленная: 398.0 (M+H).
К перемешанному раствору N-[(1S)-1-[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этил]-2-метил-пропан-2-сульфинамида (500мг, 1.256ммоль) в MeOH(20мл), добавили 4M HCl/диоксан(10мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении с получением [2-[2-[(1S)-1-аминоэтил]-6-хлор-фенил]сульфанилфенил]метанола (400мг, неочищенный) в виде серо-белого осадка. MS, установленная: 294.0 (M+H).
К перемешанной суспензии [2-[2-[(1S)-1-аминоэтил]-6-хлор-фенил]сульфанилфенил]метанола (480мг, 1.453ммоль) в 5% NaHCO3(10мл) добавили Fmoc OSU(489мг, 1.453ммоль) в CH3CN(10мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную смесь разбавили водой и экстрагировали этилацетатом. Отделенные органические слои промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[(1S)-1-[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этил]карбамата (420мг, 54%, 3 стадии) в виде серо-белого осадка. MS, установленная: 516.2 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[(1S)-1-[3-хлор-2-[2-(гидроксиметил)фенил]сульфанил-фенил]этил]карбамата (420 мг, 0.814ммоль) в ДХМ/ТГФ(1:1, 20 мл) добавили MnO2(1.414 г, 16.277ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-20% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[(1S)-1-[3-хлор-2-(2-формилфенил)сульфанил-фенил]этил]карбамата (350мг, 83%) в виде серо-белого осадка.1H-NMR: (400 MHz, DMSO-d6) δ 1.26 (3H; d; J = 6.76 Hz); 4.18-4.23 (3H; m); 5.23 (1H; m); 6.59 (1H; d; J = 8.04 Hz); 7.31-7.43 (5H; m); 7.58 (2H; m); 7.68 (2H; m); 7.90 (2H; d; J = 7.4 Hz); 7.96 (1H; d; J =7.4 Hz); 8.03 (1H; d; J = 7.36 Hz); 10.21 (1H; s)
Промежуточное соединение 42
9H-флуорен-9-илметил N-[[3-хлор-2-(4-фтор-2-формил-фенил)сульфанил-фенил]метил]карбамат

К перемешанному раствору 4-фтор-3-формил-бензойной кислоты (2.5 г, 14.535 ммоль) в ТГФ (20 мл), добавили трет-бутил 2,2,2-трихлорэтанкарбоксимидат (9.112 мл, 50.872 ммоль) с последующим медленным добавлением BF3.OEt2 (1.54 мл, 14.535 ммоль) при 0°C и перемешивали при комнатной температуре в течение 2 ч. После завершения реакции реакционную смесь погасили водой и экстрагировали этилацетатом. Объединенные органические слои промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью обычной колонки с силикагелем с использованием 1% этилацетата в гексане с получением трет-бутил 5-фтор-2-сульфанил-бензоата (1.7 г, 51%) в виде желтого осадка.
К перемешанному раствору трет-бутил 5-фтор-2-сульфанилбензоата (2 г, 8.761ммоль) и 3-хлор-2-фтор-бензальдегида (1.38 г, 8.761ммоль) в ДМФ (12мл) добавили K2CO3 (2.4 г, 17.522ммоль) и реакционную массу перемешивали при 25°C в течение 1 ч. Реакционную смесь разбавили этилацетатом и промыли водой. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-2% этилацетата в гексане с получением трет-бутил 2-(2-хлор-6-формил-фенил)сульфанил-5-фтор-бензоата (1.8 г, 56%) в виде желтого осадка.
К перемешанному раствору трет-бутил 2-(2-хлор-6-формил-фенил)сульфанил-5-фтор-бензоата (1.8 г, 4.907ммоль) в ТГФ(20мл) добавили 2-метил 2-пропансульфинамид (595мг, 4.907ммоль) и Ti(OEt)4 (5.18мл, 24.534ммоль) и нагревали до 70°C в течение 1 ч. Реакционную смесь погасили солевым раствором и экстрагировали этилацетатом. Отделенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением трет-бутил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-6-хлор-фенил]сульфанил-5-фтор-бензоата (2 г, неочищенный) в виде желтого осадка. MS, установленная: 470.2 (M+H).
К перемешанному раствору трет-бутил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-6-хлор-фенил]сульфанил-5-фтор-бензоата (2 г, 4.255ммоль) в ТГФ (30мл) добавили LiBH4 (923мг, 42.55ммоль) и реакционную смесь нагревали до 70°C в течение 8 ч. Реакционную смесь погасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением N-[[3-хлор-2-[4-фтор-2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.7 г, неочищенный), который сразу использовали на следующей стадии. MS, установленная: 401.7 (M+H).
К перемешанному раствору N-[[3-хлор-2-[4-фтор-2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.7 г, 4.2229ммоль) в MeOH(24мл), добавили 4M HCl/диоксан(12мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 20 мин. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении с получением [2-[2-(аминометил)-6-хлор-фенил]сульфанил-5-фтор-фенил]метанола (1.4 г, неочищенный) в виде вязкой жидкости. MS, установленная: 298.1(M+H).
К перемешанной суспензии [2-[2-(аминометил)-6-хлор-фенил]сульфанил-5-фтор-фенил]метанола (1.4 г, 4.188ммоль) в 5% NaHCO3(20мл) добавили Fmoc OSU(1.41 г, 4.188ммоль) в CH3CN(20мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенные органические слои промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[4-фтор-2-(гидроксиметил)фенил]сульфанил-фенил]метил]карбамата (2 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 520.1 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[[3-хлор-2-[4-фтор-2-(гидроксиметил)фенил]сульфанил-фенил]метил]карбамата (1 г, 1.923ммоль) в ДХМ/ТГФ(1:1, 20 мл) добавили MnO2(3.3г, 38.459ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную смесь отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-40% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3-хлор-2-(4-фтор-2-формил-фенил)сульфанил-фенил]метил]карбамата (420мг, 42%, 5 стадии) в виде серо-белого осадка.
1H-NMR: (400 MHz, DMSO-d6) δ 4.12-4.33 (5H; m); 6.55-6.59 (1H; m); 7.30-7.41 (5H; m); 7.56 (1H; t; J = 7.72 Hz); 7.61-7.66 (3H; m); 7.84-7.90 (4H; m); 10.19 (1H; s).
Промежуточное соединение 43
9H-флуорен-9-илметил N-[[2-[(3-формил-2-пиридил)сульфанил]-5-метокси-фенил]метил]карбамат
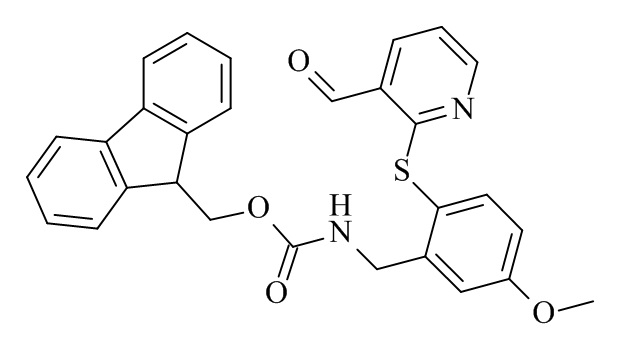
Суспензию Na2S.xH2O(1.2г, 15.57 ммоль) и MgSO4(4г) в N,N-диметилацетамиде (40мл) перемешивали при 90°C в течение периода 90 минут в атмосфере азота с последующим добавлением 2-фтор-5-метокси-бензальдегида (2 г, 12.975 ммоль) при этой температуре. Перемешивание продолжили в течение дополнительных 5 ч при 90°C. Реакционную смесь охладили до 0°C, уксусный ангидрид (12.2мл, 129.752 ммоль) добавили по каплям и смесь перемешивали при 0°C в течение 30 мин и 25°C в течение 16 ч. Реакционную смесь разбавили этилацетатом и промыли водой. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением S-(2-формил-4-метокси-фенил) этантиоата (2 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 211.0 (M+H).
К перемешанному раствору S-(2-формил-4-метокси-фенила) (2.8 г, 13.333 ммоль) в ТГФ(20мл) добавили 2-метил 2-пропансульфинамид (1.616 г, 13.333 ммоль) и Ti(OEt)4 (2.795 мл, 13.333 ммоль) и нагревали до 70°C в течение 45 мин. Реакционную смесь погасили солевым раствором и экстрагировали этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-10% этилацетата в гексане с получением S-[2-[(Z)-трет-бутилсульфинилиминометил]-4-метокси-фенил] этантиоата (980мг,17%, 2 стадии) в виде бесцветной вязкой жидкости. MS, установленная: 313.8 (M+H).
Раствор S-[2-[(Z)-трет-бутилсульфинилиминометил]-4-метокси-фенил] этантиоата (980 мг, 3.131 ммоль) в ТГФ (15мл) дегазировали аргоном в течение приблизительно 10 минут и затем NaBH4 (1.184 г, 31.31 ммоль) добавили по порциям при охлаждении и перемешивали в течение 30 мин при 0°C. Реакцию затем погасили ацетоном (10мл) (дегазированный аргоном) и перемешивали при охлаждении в течение 1 ч. Реакционную массу сконцентрировали при пониженном давлении и высвободили в аргоне с получением N-[(5-метокси-2-сульфанил-фенил)метил]-2-метил-пропан-2-сульфинамида (855мг, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки.
К перемешанному раствору N-[(5-метокси-2-сульфанил-фенил)метил]-2-метил-пропан-2-сульфинамида (854 мг, 3.128 ммоль) и 2-хлор-никотиновой кислоты трет-бутилового эфира (668.497 мг, 3.128 ммоль) в ацетонитриле (15мл) добавили K2CO3(1.08 г, 7.821 ммоль) и реакционную массу нагрели до 70°C в течение 4 ч. Реакционную массу разбавили этилацетатом и промыли водой. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 10-60% этилацетата в гексане с получением трет-бутил 2-[2-[(трет-бутилсульфиниламино)метил]-4-метокси-фенил]сульфанилпиридин-3-карбоксилата (420мг, 30%, 2 стадии) в виде белого вязкого осадка. MS, установленная: 450.8 (M+H).
К перемешанному раствору трет-бутил 2-[2-[(трет-бутилсульфиниламино)метил]-4-метокси-фенил]сульфанилпиридин-3-карбоксилата (470 мг, 1.044 ммоль) в ТГФ (12мл) добавили LiBH4 (227.48 мг, 10.44 ммоль) и реакционную массу нагревали до 70°C в течение 4 ч. Реакционную массу погасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным и эвапорировали при пониженном давлении с получением N-[[2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-5-метокси-фенил]метил]-2-метил-пропан-2-сульфинамида (370мг, неочищенный) в виде серо-белого вязкого осадка. MS, установленная: 380.9 (M+H).
К перемешанному раствору N-[[2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-5-метокси-фенил]метил]-2-метил-пропан-2-сульфинамида (370.0 мг, 0.974 ммоль) в MeOH (10мл), добавили 4M HCl/диоксан(5мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении с получением [2-[2-(аминометил)-4-метокси-фенил]сульфанил-3-пиридил]метанола (300мг, неочищенный) в виде серо-белого осадка. MS, установленная: 276.9 (M+H).
К перемешанной суспензии [2-[2-(аминометил)-4-метокси-фенил]сульфанил-3-пиридил]метанола (300 мг, 1.087 ммоль) в 5% NaHCO3(5мл) добавили Fmoc OSU(366.522 мг, 1.087 ммоль) в CH3CN(5мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[[2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-5-метокси-фенил]метил]карбамата (350мг, неочищенный) в виде серо-белого осадка. MS, установленная: 498.8 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[[2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-5-метокси-фенил]метил]карбамата (350мг, 0.703ммоль) в ДХМ/ТГФ(1:1, 20 мл) добавили MnO2(610.954 мг, 7.028 ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 5-30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[2-[(3-формил-2-пиридил)сульфанил]-5-метокси-фенил]метил]карбамата (250мг, 48%, 4 стадии) в виде серо-белого осадка.
1H-NMR: (400 MHz, DMSO-d6) δ 3.79 (3H; s); 4.17-4.21 (3H; m); 4.26-4.28 (2H; m); 6.90-6.92 (1H; m); 6.96 (1H; m); 7.30-7.36 (3H; m); 7.39-7.44 (3H; m); 7.69 (2H; d; J = 7.48 Hz); 7.84 (1H; m); 7.90 (2H; d; J = 7.4 Hz); 8.30 (1H; d; J = 7.4 Hz); 8.4 (1H; d; J = 3.56 Hz); 10.19 (1H; s)
Промежуточное соединение 44
9H-флуорен-9-илметил N-[[2-(4-фтор-2-формил-фенил)сульфанил-3-метил-фенил]метил]карбамат
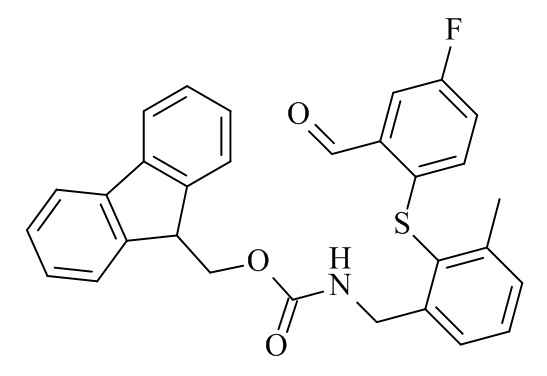
К перемешанному раствору трет-бутил 5-фтор-2-сульфанилбензоата (1.2 г, 5.256 ммоль) и 2-фтор-3-метил-бензальдегида (726мг, 5.256ммоль) в ДМФ (12мл) добавили Cs2CO3 (3.4 г, 10.513ммоль) и реакционную массу нагревали до 70°C в течение 3 ч. Реакционную смесь разбавили этилацетатом и промыли водой. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили хроматографией на силикагеле с использованием 0-2% этилацетата в гексане с получением трет-бутил 5-фтор-2-(2-формил-6-метил-фенил)сульфанил-бензоата (600мг, 33%) в виде бесцветной вязкой жидкости.
К перемешанному раствору трет-бутил 5-фтор-2-(2-формил-6-метил-фенил)сульфанил-бензоата (1.2 г, 3.464ммоль) в ТГФ(20мл) добавили 2-метил 2-пропансульфинамид (420мг, 3.464ммоль) и Ti(OEt)4 (3.65мл, 17.32ммоль) и нагревали до 70°C в течение 1 ч. Реакционную смесь погасили солевым раствором и экстрагировали этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением трет-бутил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-6-метил-фенил]сульфанил-5-фтор-бензоата (1.3 г, неочищенный) в виде желтого осадка. MS, установленная: 449.7 (M+H).
К перемешанному раствору трет-бутил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-6-метил-фенил]сульфанил-5-фтор-бензоата (1.3 г, 2.891ммоль) в ТГФ (20мл) добавили LiBH4 (627мг, 28.914ммоль) и реакционную массу нагревали до 70°C в течение 8 ч. Реакционную смесь погасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-50% EA/Hex с получением N-[[2-[4-фтор-2-(гидроксиметил)фенил]сульфанил-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (1 г, 75%, 2 стадии) в виде серо-белого осадка. MS, установленная: 382.0 (M+H).
К перемешанному раствору N-[[2-[4-фтор-2-(гидроксиметил)фенил]сульфанил-3-метил-фенил]метил]-2-метил-пропан-2-сульфинамида (1 г, 2.62ммоль) в MeOH(10мл), добавили 4M HCl/диоксан(5мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении с получением [2-[2-(аминометил)-6-метил-фенил]сульфанил-5-фтор-фенил]метанола (800мг, неочищенный) в виде вязкой жидкости. MS, установленная: 277.9(M+H).
К перемешанной суспензии [2-[2-(аминометил)-6-метил-фенил]сульфанил-5-фтор-фенил]метанола (800мг, 2.549ммоль) в 5% NaHCO3(10мл) добавили Fmoc OSU(859мг, 2.549ммоль) в CH3CN(10мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили хроматографией на силикагеле с использованием 5-30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[2-[4-фтор-2-(гидроксиметил)фенил]сульфанил-3-метил-фенил]метил]карбамата (800мг, 61%, 2 стадии) в виде серо-белого осадка. MS, установленная: 500.1 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[[2-[4-фтор-2-(гидроксиметил)фенил]сульфанил-3-метил-фенил]метил]карбамата (800мг, 1.661ммоль) в ДХМ/ТГФ(1:1, 20 мл) добавили MnO2(2.88 г, 33.221ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную смесь отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили хроматографией на силикагеле с использованием 5-20% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[2-(4-фтор-2-формил-фенил)сульфанил-3-метил-фенил]метил]карбамата (510мг, 61%) в виде серо-белого осадка. MS, установленная: 498.1 (M+H).
1H-NMR: (400 MHz, DMSO-d6) δ 2.2 (3H; s); 4.19-4.21 (1H; m); 4.23-4.30 (4H; m); 6.45 (1H; m); 7.23 (1H; br s; J = 6.88 Hz); 7.32-7.45 (7H; m); 7.67 (1H; d; J = 7.04 Hz); 7.78-7.90 (4H; m); 10.20 (1H; s).
Промежуточное соединение 45
9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-5-(трифторметил)фенил]метил]карбамат
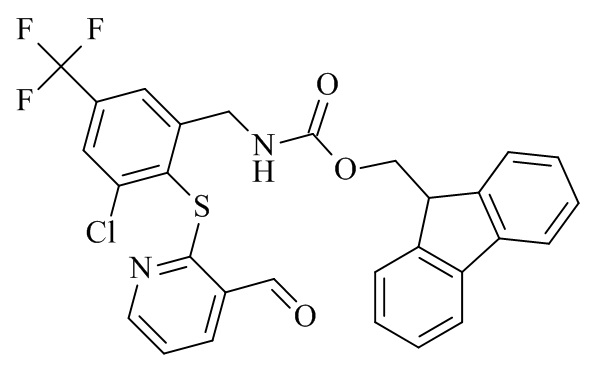
К перемешанному раствору 2-меркапто-никотиновой кислоты метилового эфира (1.23 г, 7.283ммоль) в ДМФ (15мл) добавили KOtBu (817мг, 7.283ммоль) и реакционную массу перемешивали при 25°C в течение 30 мин. Затем 3-хлор-2-фтор-5-трифторметил-бензальдегид (1.5 г, 6.621ммоль) добавили в реакционную смесь и её нагрели до 80°C в течение 1 ч. Реакционную смесь погасили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением метил 2-[2-хлор-6-формил-4-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (2.3 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 375.5 (M+H).
К перемешанному раствору метил 2-[2-хлор-6-формил-4-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (2.3 г, 6.121ммоль) в ТГФ(20мл) добавили 2-метилпропан-2-сульфинамид (742мг, 6.121ммоль) и Ti(OEt)4 (6.4мл, 30.605ммоль) и нагревали до 70°C в течение 1 ч. Реакционную смесь погасили солевым раствором и экстрагировали этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением этил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-6-хлор-4-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (2.8 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 492.6 (M+H).
К перемешанному раствору этил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-6-хлор-4-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (2.8 г, 5.68ммоль) в ТГФ (20мл) добавили LAH (1M в ТГФ,11.36мл, 11.36ммоль) при 0°C и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную смесь погасили насыщенным раствором сульфата натия и экстрагировали этилацетатом. Отделенные органические слои промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили by silica chromatography using 10-60% этилацетат в гексане с получением N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-5-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.4 г, 47%, 3 стадии) в виде серо-белого осадка. MS, установленная: 452.8 (M+H).
К перемешанному раствору N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-5-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.4 г, 3.091ммоль) в MeOH(40мл), добавили 4M HCl в диоксане (20мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции смесь сконцентрировали при пониженном давлении с получением [2-[2-(аминометил)-6-хлор-4-(трифторметил)фенил]сульфанил-3-пиридил]метанола (1 г, неочищенный) в виде серо-белого осадка, который сразу использовали на следующей стадии. MS, установленная: 348.7 (M+H).
К перемешанной суспензии [2-[2-(аминометил)-6-хлор-4-(трифторметил)фенил]сульфанил-3-пиридил]метанола (1 г, 2.596ммоль) в 5% NaHCO3(20мл) добавили Fmoc OSU(875мг, 2.596ммоль) в CH3CN(20 мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную смесь разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью обычной колонки с силикагелем с использованием 5-30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-5-(трифторметил)фенил]метил]карбамата (1.1 г, 62%, 2 стадии) в виде серо-белого осадка. MS, установленная: 570.8 (M+H).
К перемешанному раствору N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-5-(трифторметил)фенил]метил]карбамата (1.1 г, 1.926ммоль) в ДХМ/ТГФ(1:1, 40 мл) добавили MnO2(3.34 г, 38.528ммоль)) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита, фильтрат эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью обычной колонки с силикагелем с использованием 5-20% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-5-(трифторметил)фенил]метил]карбамата в виде серо-белого осадка( 650мг, 59%)
1H-NMR: (400 MHz, DMSO-d6) δ 4.20-4.21 (1H; m); 4.22-4.28 (2H; m); 4.34-4.35 (2H; m); 7.28-7.32 (2H; m); 7.39-7.43 (3H; m); 7.66-7.68 (3H; m); 7.89 (2H; d; J = 7.4 Hz); 7.96-7.97 (1H; m); 7.99 (1H; br s); 8.39-8.43 (2H; m); 10.19 (1H; s)
Промежуточное соединение 46
9H-флуорен-9-илметил N-[[3-(2-формилфенил)сульфанил-4-пиридил]метил]карбамат

К перемешанному раствору 2-хлор-пиридин-3-карбальдегида (2.0 г, 14.124 ммоль) and methyl thio salicylate (2.376 г, 14.124 ммоль) в ДМФ (20мл) добавили Cs2CO3 (9.181 г,28.249 ммоль) и реакционную массу нагрели до 70°C в течение 2 ч. Реакционную смесь разбавили этилацетатом и промыли водой. Отделенные органические слои промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили хроматографией на силикагеле с использованием 10-50% этилацетата в гексане с получением метил 2-[(3-формил-2-пиридил)сульфанил]бензоата (3 г, 77%) в виде желтого осадка.
К перемешанному раствору метил 2-[(3-формил-2-пиридил)сульфанил]бензоата (3.02 г ,11.062 ммоль) в ТГФ(25мл) добавили 2-метил 2-пропансульфинамид (1.341 г, 11.062 ммоль) и Ti(OEt)4 (11.597 мл, 55.311 ммоль) и нагревали до 70°C в течение 90 мин. Реакционную смесь погасили солевым раствором и экстрагировали этилацетатом. Отделенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением этил 2-[[3-[(Z)-трет-бутилсульфинилиминометил]-2-пиридил]сульфанил]бензоата (3.5 г, неочищенный) в виде желтого осадка. MS, установленная: 390.7 (M+H).
К перемешанному раствору этил 2-[[3-[(Z)-трет-бутилсульфинилиминометил]-2-пиридил]сульфанил]бензоата (3.5 г, 8.974 ммоль) в ТГФ (25мл) добавили LiBH4 (1.955 г, 89.744 ммоль) и реакционную смесь нагрвали до 70°C в течение 3 ч. Реакционную смесь погасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Отделенные органические слои промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением N-[[2-[2-(гидроксиметил)фенил]сульфанил-3-пиридил]метил]-2-метил-пропан-2-сульфинамида (3 г, неочищенный) в виде серо-белого осадка. MS, установленная: 350.8 (M+H).
К перемешанному раствору N-[[2-[2-(гидроксиметил)фенил]сульфанил-3-пиридил]метил]-2-метил-пропан-2-сульфинамида (3.0 г, 8.571 ммоль) в MeOH(30мл), добавили 4M HCl/диоксан(15мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции смесь сконцентрировали при пониженном давлении с получением [2-[[3-(аминометил)-2-пиридил]сульфанил]фенил]метанола (2.5 г, неочищенный) в виде вязкой жидкости. MS, установленная: 247.1(M+H).
К перемешанной суспензии [2-[[3-(аминометил)-2-пиридил]сульфанил]фенил]метанола (2.5 г, 10.163 ммоль) в 5% NaHCO3(20мл) добавили Fmoc OSU(3.427 г, 10.163 ммоль) в CH3CN(20мл) при 25°C и реакционную смесь перемешивали при 25°C в течение 3 ч. Затем реакционную смесь разбавили водой и экстрагировали этилацетатом. Отделенные органические слои промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили хроматографией на силикагеле с использованием 5-50% этилацетат в гексане с получением 9H-флуорен-9-илметил N-[[2-[2-(гидроксиметил)фенил]сульфанил-3-пиридил]метил]карбамата (1.6 г, 31%, 4 стадии) в виде серо-белого осадка. MS, установленная: 468.8 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[[2-[2-(гидроксиметил)фенил]сульфанил-3-пиридил]метил]карбамата (2.0 г, 4.274 ммоль) в ДХМ/ТГФ (1:1, 50 мл) добавили MnO2(7.43 г, 85.47 ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную смесь отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 10-70% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3-(2-формилфенил)сульфанил-4-пиридил]метил]карбамата (600мг, 28%, 3 стадии) в виде серо-белого осадка.
1H-NMR: (400 MHz, DMSO-d6) δ 4.11-4.24 (3H; m); 4.37-4.38 (2H; m); 6.62 (2H; d; J = 7.52 Hz); 7.25 (1H; m); 7.32-7.35 (3H; m); 7.42-7.47 (3H; m); 7.47-7.49 (1H; m); 7.70 (2H; d; J = 7.16 Hz); 7.92 (2H; br d; J = 6.88 Hz); 8.01 (1H; br d; J = 6.92 Hz); 8.5 (1H; br s); 8.66 (1H; d; J = 4.76 Hz); 10.21 (1H; s)
Промежуточное соединение 47
9H-флуорен-9-илметил N-[[3,5-дихлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат

К перемешанному раствору 2-меркапто-никотиновой кислоты (2.44 г, 15.755ммоль), в ДМФ (30мл) добавили KOtBu (3.2 г, 28.645ммоль) и реакционную смесь перемешивали при 25°C в течение 30 мин. Затем 2,3,5-трихлор-бензальдегид (3 г, 14.323ммоль) добавили в реакционную смесь и её нагревали до 80°C в течение 4 ч. Затем K2CO3(5.93 г, 42.968ммоль) добавили с последующим добавлением MeI (2.67мл, 42.968 ммоль) и реакционную массу перемешивали при 25°C в течение 16 ч. Реакционную смесь погасили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-15% этилацетата в гексане с получением метил 2-(2,4-дихлор-6-формил-фенил)сульфанилпиридин-3-карбоксилата (2.3 г, 46%) в виде желтого осадка. MS, установленная: 341.8 (M+H).
К перемешанному раствору метил 2-(2,4-дихлор-6-формил-фенил)сульфанилпиридин-3-карбоксилата (2.3 г, 6.721ммоль) в ТГФ(20мл) добавили 2-метилпропан-2-сульфинамида (815мг, 6.721ммоль) и Ti(OEt)4 (7.09мл, 33.606ммоль) и реакционную массу нагревали до 70°C в течение 1 ч. Реакционную смесь погасили солевым раствором и экстрагировали этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением этил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-4,6-дихлор-фенил]сульфанилпиридин-3-карбоксилата (2.6 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 458.7 (M+H).
К перемешанному раствору метил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-4,6-дихлор-фенил]сульфанилпиридин-3-карбоксилата (2.6 г, 5.659ммоль) в ТГФ (25мл) добавили LAH(1M в ТГФ, 11.31мл, 11.31ммоль) при 0°C и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную смесь погасили насыщенным раствором сульфата натрия и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 10-60% этилацетата в гексане с получением N-[[3,5-дихлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (1.5 г, 53%, 2стадии) в виде серо-белого осадка. MS, установленная: 418.8 (M+H).
К перемешанному раствору N-[[3,5-дихлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]-2-метил-пропан-2-сульфинамида (1.9 г, 11.429 ммоль) в MeOH(20мл) добавили 4M HCl в диоксане(12мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции смесь сконцентрировали при пониженном давлении с получением [2-[2-(аминометил)-4,6-дихлор-фенил]сульфанил-3-пиридил]метанола (1.9 г, неочищенный) в виде серо-белого осадка, который сразу использовали на следующей стадии. MS, установленная: 315.1 (M+H).
К перемешанной суспензии [2-[2-(аминометил)-4,6-дихлор-фенил]сульфанил-3-пиридил]метанола (1.9 г, 6.051 ммоль) в 5% NaHCO3(25мл) добавили Fmoc OSU(2.04 г, 6.051 ммоль) в CH3CN(25мл) при 25°C и реакционную массу перемешивали при 25°C в течение 3 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[[3,5-дихлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]карбамата (2.5 г, неочищенный), который сразу использовали на следующей стадии. MS, установленная: 537.0 (M+H).
К перемешанному раствору 9H-флуорен-9-илметил N-[[3,5-дихлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]карбамата (2.5 г, 4.664 ммоль) в ДХМ/ТГФ(1:1, 70 мл) добавили MnO2(4.055 г, 46.642 ммоль) и реакционную массу перемешивали при 25°C в течение 3 ч. Реакционную массу отфильтровали через слой целита, фильтрат эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили хроматографией на силикагеле с использованием 5-40% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3,5-дихлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамата в виде серо-белого осадка( 1.7 г, 69%, 3 стадии).
1H-NMR: (400 MHz, DMSO-d6) δ 4.21-4.30 (5H; m); 7.25-7.43 (6H;m); 7.67 (2H; d; J = 7.26 Hz); 7.79 (1H; s); 7.90 (2H; br d; J = 7.16 Hz); 8.36 (1; br d; J = 7.36 Hz); 8.40 (1H; br s); 10.18 (1H; s)
Промежуточное соединение 48
9H-флуорен-9-илметил N-[[6-хлор-2-[(3-формил-2-пиридил)сульфанил]-3-(трифторметил)фенил]метил]карбамат

К перемешанному раствору этил 2-меркапто-никотиновой кислоты (2.116 г, 13.636 ммоль) в ДМФ (30мл) добавили KOtBu (2.782 г, 24.793 ммоль) и реакционную массу перемешивали при 25°C в течение 30 мин. Затем 2,6-дихлор-3-трифторметил-бензальдегид (3.0 г, 12.397 ммоль) добавили в реакционную смесь и её нагрели до 80°C в течение 4 ч. Затем K2CO3(5.14 г, 37.19 ммоль) добавили с последующим добавлением MeI (2.325 мл, 39.19 ммоль) и реакционную смесь перемешивали при 25°C в течение 16 ч. Реакционную смесь погасили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили хроматографией на силикагеле с использованием 0-10% метилацетата в гексане с получением метил 2-[3-хлор-2-формил-6-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (3.3 г, 71%) в виде желтого осадка.
К перемешанному раствору метилацетата в гексане с получением метил 2-[3-хлор-2-формил-6-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (3.5 г, 9.314ммоль) в ТГФ(30мл) добавили 2-метилпропан-2-сульфинамид (1.12 г, 9.314 ммоль) и Ti(OEt)4 (9.837мл, 46.572ммоль) и реакционную массу нагревали до 70°C в течение 1 ч. Реакционную смесь погасили солевым раствором и экстрагировали этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3-хлор-6-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (4.2 г, неочищенный) который сразу использовали на следующей стадии без дополнительной очистки. MS, установленная: 492.5 (M+H).
К перемешанному раствору метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3-хлор-6-(трифторметил)фенил]сульфанилпиридин-3-карбоксилата (4.2 г, 8.52ммоль) в ТГФ (40мл) добавили LAH (1M в ТГФ, 17.04мл, 17.04ммоль) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную смесь погасили насыщенным раствором сульфата натрия и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 10-60% этилацетата в гексане с получением N-[[6-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-3-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.7 г, 52%, 2стадии) в виде серо-белого осадка. MS, установленная: 452.9 (M+H).
К перемешанному раствору N-[[6-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-3-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1.5 г, 3.319 ммоль) в MeOH(20мл), добавили 4M HCl в диоксане(10мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь сконцентрировали при пониженном давлении с получением [2-[2-(аминометил)-3-хлор-6-(трифторметил)фенил]сульфанил-3-пиридил]метанола (1.5 г, неочищенный) в виде желтого вязкого осадка, который сразу использовали на следующей стадии. MS, установленная: 348.7 (M+H).
К перемешанному раствору [2-[2-(аминометил)-3-хлор-6-(трифторметил)фенил]сульфанил-3-пиридил]метанола (2.0 г, 3.509 ммоль) в ДХМ/ТГФ(1:1, 60мл) добавили MnO2(3.05 г, 35.088 ммоль) и реакционную массу перемешивали при 25°C в течение 3 ч. Реакционную массу отфильтровали через слой целита, фильтрат эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили хроматографией на силикагеле с использованием 5-40% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[6-хлор-2-[(3-формил-2-пиридил)сульфанил]-3-метил-фенил]метил]карбамата в виде серо-белого осадка ( 1.1 г, 58%, 3 стадии).
1H-NMR: (400 MHz, DMSO-d6) δ 4.16-4.22 (3H; m); 4.32-4.45 (2H; m); 7.32 (2H; br t; J = 7.28 Hz); 7.40 (3H; br t; J =7.28 Hz); 7.60 (1H; m); 7.67 (2H; br d; J = 7.24 Hz); 7.73 (2H; br d; J = 7.96 Hz); 7.86 (3H; m); 8.32 (1H; br d; J = 6.56 Hz); 8.46 (1H; m); 10.18 (1H; s).
Промежуточное соединение 49
9H-флуорен-9-илметил N-[[5-этил-2-(2-формилфенил)сульфанил-фенил]метил]карбамат

К раствору 2-фтор-5-йод-бензальдегида (2.0 г, 8 ммоль) в диоксан: вода (30 мл) добавили пинаколовый эфир винилбороновой кислоты (1.6 мл, 9.6 ммоль) и Cs2CO3 (3.9 г, 12 ммоль) последовательно. Затем реакционную смесь дегазировали аргоном и добавили Pd(PPh3)4 (0.184 г, 0.16 ммоль). Получившуюся реакционную смесь нагрели до 70°C в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь экстрагировали EtOAc (3 x 50 мл). Объединенный органический слой промыли водой с последующим солевым раствором и высушили над безводным сульфатом натрия. Растворитель эвапорировали при пониженном давлении с получением неочищенного соединения, которое дополнительно очистили посредством флеш-хроматографии (гексан) с получением 2-фтор-5-винил-бензальдегида (0.83 г, 69%) в виде бесцветного масла.
К дегазированному раствору 2-фтор-5-винил-бензальдегида (0.83 г, 5.5 ммоль) в безводном ДМФ (4 мл) добавили K2CO3 (1.2 г, 13.8 ммоль) и метилтиосалицилат (0.91мл, 0.66 ммоль). Затем реакционную смесь перемешивали в течение 1 ч. Прогресс реакции контролировали с помощью ТСХ. После завершения реакции реакционную смесь разбавили водой (30 мл) и экстрагировали EtOAc (3 x 20 мл). Объединенный органический слой промыли водой с последующим солевым раствором и высушили над Na2SO4. Растворитель эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью хроматографии на системе Combiflash (20% этилацетат в гексане) с получением метил 2-(2-формил-4-винил-фенил)сульфанилбензоата (1.4 г, 85%) в виде желтого масла. MS, установленная: 299.2(M+H).
К дегазированному раствору метил 2-(2-формил-4-винил-фенил)сульфанилбензоата (1.4 г, 4.6 ммоль) в этилацетате (25 мл) добавили PtO2 (0.05 г) и реакционную смесь перемешивали в атмосфере водорода в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь отфильтровали через целит и фильтрат сконцентрировали при пониженном давлении с получением метил 2-(4-этил-2-формил-фенил)сульфанилбензоата (1.4 г, 99%) в виде белого осадка. MS, установленная: 301.0(M+H).
К раствору метил 2-(4-этил-2-формил-фенил)сульфанилбензоата (1.4 г, 4.6 ммоль) в ТГФ (30 мл) добавили 2-метилпропан-2-сульфинамид (1.4 г, 11.66 ммоль) с последующим этоксидом титана (2.4 мл, 11.66 ммоль) и реакционную смесь нагревали при 55°C в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. После завершения реакции реакционную смесь разбавили водой (30 мл) и отфильтровали через целит. Органический слой отделили, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-4-этил-фенил]сульфанилбензоата (1.6 г, 85%) в виде бесцветного масла. MS, установленная: 404.3 (M+H).
К охлажденному на льду раствору LAH (0.471 г, 12.40 ммоль) в безводном ТГФ (10 мл) добавили раствор метил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-4-этил-фенил]сульфанилбензоата (2.5 г, 6.20 ммоль) в ТГФ (20 мл) и получившуюся реакционную смесь перемешивали в течение 0.5 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили насыщенным раствором сульфата натрия (5 мл) и этилацетатом. Затем реакционную смесь отфильтровали через целит и промыли этилацетатом (50 мл). Фильтрат сконцентрировали при пониженном давлении с получением N-[[5-этил-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 93%), который использовали как есть на следующей стадии. MS, установленная: 378.1 (M+H).
К охлажденному на льду раствору N-[[5-этил-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.2 г, 4.23 ммоль) в ацетонитриле (20 мл) добавили 5% раствор бикарбоната натрия (12 мл) с последующим раствором Fmoc-Osu (1.4 г, 4.29 ммоль) в ацетонитриле (10 мл) и реакционную смесь перемешивали при комнатной ттемпературе в течение 4 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (50 мл) и этилацетатом (80 мл). Органический слой разделили, из него удалили летучие компоненты при пониженном давлении с получением неочищенного соединения, которое затем очистили посредством флеш-хроматографии (20% этилацетат в гексане) до 9H-флуорен-9-илметил N-[[5-этил-2-(2-формилфенил)сульфанил-фенил]метил]карбамата (0.670 г, 35%) в виде белого осадка. LC-MS: 494.0 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 1.20 (3H, t, J = 7.6 Hz), 2.65 (2H, q, J = 7.6 Hz), 4.30-4.23 (5H, m), 6.66 (1H, d, J = 8.0 Hz), 7.36-7.23 (5H, m), 7.48-7.38 (4H, m), 7.70 (2H, d, J = 7.4 Hz), 7.83 (1H, t, J = 5.9 Hz), 7.89 (2H, d, J = 7.5 Hz), 7.95 (1H, d, J = 7.6 Hz), 10.21 (1H, s).
Промежуточное соединение 50
9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-5-фенил-фенил]метил]карбамат

Раствор 4-фтор-бифенила (2 г, 11.61 ммоль) и PMDTA (3 мл) в ТГФ (50 мл) охладили до -78°C и 1.6 M nBuLi (10.88 мл, 17.42 ммоль) добавили по каплям. Получившуюся реакционную смесь перемешивали в течение 40 мин при -60°C. Реакционную смесь охладили до -78°C снова и добавили ДМФ (2.12 мл, 29.03 ммоль). Затем реакционную смесь перемешивали при -78°C в течение 30 мин перед тем, как дать нагреться реакционной смеси до комнатной температуры. Реакционную смесь погасили водным NH4Cl и всю смесь экстрагировали диэтиловым эфиром (30 мл). Объединенный органический слой промыли солевым раствором (30 мл) и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (10% этилацетат в гексане) с получением 2-фтор-5-фенил-бензальдегида (1.8 г, 77%) в виде вязкого масла.
К раствору 2-фтор-5-фенил-бензальдегида (2.5 г, 10 ммоль) в диоксане-воде (1:1) (30 мл) добавили фенилбороновый эфир (1.45 г, 12 ммоль) и Cs2CO3 (4.87 г, 15 ммоль) последовательно. Раствор затем дегазировали аргоном в течение 30 мин. К этому раствору добавили Pd(PPh3)4 (0.23 г, 0.2 ммоль) и нагревали до 70°C в течение 2 ч. Затем реакционную смесь отфильтровали, фильтрат сконцентрировали и разбавили водой (50 мл). Водн. слой экстрагировали этилацетатом (100 мл x 2). Объединенный органический слой промыли солевым раствором (50 мл) и высушили над безводным сульфатом натрия. Органический слой сконцентрировали с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (10% этилацетат в гексане) с получением 2-фтор-5-фенил-бензальдегида (1.7 г, 85%) в виде вязкого масла.
К раствору 2-фтор-5-фенил-бензальдегида (1.7 г, 8.5 ммоль) и метилтиосалицилата (1.43 г, 8.5 ммоль) в ДМФ (20 мл) добавили K2CO3 (2.35 г, 17 ммоль) и реакционную смесь нагревали до 60°C в течение 16 ч. Затем реакционную смесь разбавили водой и экстрагировали этилацетатом (100 мл x 2). Объединенный органический слой промыли солевым раствором (40 мл x 2), высушили над сульфатом натрия и сконцентрировали с получением неочищенного соединения, которое дополнительно очистили с помощью хроматографии на системе Combiflash (30% этилацетат в гексане) с получением метил 2-(2-формил-4-фенил-фенил)сульфанилбензоата (1.8 г, 60%) в виде серо-белого осадка. ЖХМС: 349.1(M+H).
К перемешанному раствору метил 2-(2-формил-4-фенил-фенил)сульфанилбензоата (1.7 г, 4.88 ммоль) в безводном ТГФ (50 мл) добавили 2-метилпропан-2-сульфинамид (1.18 г, 9.77 ммоль) и тетраэтоксид титана (2.23 г, 9.77 ммоль) последовательно и получившуюся реакционную смесь нагревали при 60°C в течение 5 ч. Затем реакционную смесь влили в воду со льдом и отфильтровали через небольшой слой целита. Фильтрат экстрагировали этилацетатом (100 мл x 2), промыли солевым раствором (100 мл x 2), высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством колоночной флеш-хроматографии (10-20% этилацетат в гексане) с получением метил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-4-фенил-фенил]сульфанилбензоата (1.8 г, неочищенный) в виде вязкой массы. MS, установленная: 452.1(M+H).
К охлажденной на льду суспензии LAH (0.279 г, 7.54 ммоль) в ТГФ (50 мл) добавили раствор метил 2-[2-[(Z)-трет-бутилсульфинилиминометил]-4-фенил-фенил]сульфанилбензоата (1.7 г, неочищенный) в ТГФ (50 мл) и реакционную смесь перемешивали при 0°C в течение 30 мин. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили насыщенным раствором сульфата натрия (5 мл) и разбавили этилацетатом (20 мл). Реакционную смесь отфильтровали через целит и фильтрат сконцентрировали с получением N-[[2-[2-(гидроксиметил)фенил]сульфанил-5-фенил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.4 г, неочищенный) в виде белого осадка. MS, установленная: 426.1(M+H).
К охлажденному на льду раствору N-[[2-[2-(гидроксиметил)фенил]сульфанил-5-фенил-фенил]метил]-2-метил-пропан-2-сульфинамида (2 г, неочищенный) в ДХМ (50 мл) добавили периодинан Десса-Мартина (2.59 г, 6.12 ммоль) по порциям и реакционную смесь перемешивали при комнатной температуре в течение 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили с помощью ДХМ (50 мл) и насыщенного раствора бикарбоната натрия (50 мл). Органический слой отделили и водный слой экстрагировали с помощью ДХМ (50 мл x 2). Объединенный органический слой промыли раствором тиосульфата натрия с последующим солевым раствором. Летучие компоненты удалили при пониженном давлении с получением N-[[2-(2-формилфенил)сульфанил-5-фенил-фенил]метил]-2-метил-пропан-2-сульфинамида (0.8 г, 40% за четыре стадии) в виде вязкого масла. MS, установленная: 423.9 (M+H).
К охлажденному на льду раствору N-[[2-(2-формилфенил)сульфанил-5-фенил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.5 г, 3.5 ммоль) в диоксане (20 мл) добавили 4M HCl в диоксане и реакционную смесь перемешивали при этой же температуре в течение 1 ч. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое тритурировали диэтиловым эфиром с получением 2-[2-(аминометил)-4-фенил-фенил]сульфанилбензальдегида (0.9 г, 79%) в виде белого осадка. MS, установленная: 320.0 (M+H).
К перемешанной суспензии 2-[2-(аминометил)-4-фенил-фенил]сульфанилбензальдегида (0.7 г, 1.88 ммоль) в 5% растворе бикарбоната натрия (12 мл) добавили раствор Fmoc-OSu (0.443 г, 1.314 ммоль) в ацетонитриле (30 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Летучие компоненты удалили при пониженном давлении и неочищенную реакционную смесь разбавили водой (10 мл). Затем водную фазу экстрагировали этилацетатом (50 мл x 3) и промыли солевым раствором (50 мл), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (10% этилацетат в гексане) до 9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-5-фенил-фенил]метил]карбамата (0.45 г, 44%) в виде белого осадка. LC-MS: 542.2 (M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 4.22-4.19 (1H, m), 4.28 (2H, d, J = 7.0 Hz), 4.35 (2H, d, J = 5.6 Hz), 6.82 (1H, d, J = 7.9 Hz), 7.25 (2H, t, J = 7.4 Hz), 7.44-7.36 (4H, m), 7.55-7.47 (4H, m), 7.69-7.67 (5H, m), 7.76(1H, s)., 7.87 (2H, d, J = 7.4 Hz), 7.99-7.96 (2H, m), 10.24 (1H, s).
Промежуточное соединение 51
9H-флуорен-9-илметил N-[[5-трет-бутил-2-(2-формилфенил)сульфанил-фенил]метил]карбамат

К перемешанному раствору 1-трет-бутил-4-фторбензола (2.0 г, 13.15 ммоль) в безводном ТГФ (20 мл) добавили PMDTA (3.4 мл, 19.73 ммоль) и n-BuLi (1.6 M в ТГФ, 12.3 мл, 26.31 ммоль) при -78°C и получившуюся реакционную смесь перемешивали при этой температуре в течение 1 ч. В реакционную смесь добавили ДМФ (2.6 мл, 32.89 ммоль) при -78°C и перемешивали дополнительно при этой температуре в течение 1 ч. Затем реакционную смесь погасили посредством добавления насыщенного NH4Cl (20 мл) и экстрагировали диэтиловым эфиром (2 x 25 мл). Объединенный органический слой промыли водой (20 мл), солевым раствором (20 мл), высушили над безводным Na2SO4 и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (1% этилацетат в гексане) с получением 5-трет-бутил-2-фтор-бензальдегида (2.1 г, 88%)в виде бледно-желтого масла.
К перемешанному раствору 5-трет-бутил-2-фтор-бензальдегида (1.3 г, 7.22 ммоль) в безводном ДМФ (20 мл) добавили метилтиосалицилат (2.0 мл, 14.44 ммоль) и KOtBu (1.6 г, 14.44 ммоль) последовательно и получившуюся реакционную смесь нагревали до 50°C в течение 16 ч. Затем реакционную смесь охладили до комнатной температуры, разбавили водой (30 мл) и экстрагировали этилацетатом (2 x 25 мл). Объединенный органический слой промыли водой (30 мл), солевым раствором (30 мл), высушили над безводным Na2SO4 и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (1.8 % этилацетат в гексане) с получением метил 2-(4-трет-бутил-2-формил-фенил)сульфанилбензоата (0.7 г, 30%)в виде бледно-желтого масла. MS, установленная: 329.3(M+H).
К перемешанному раствору метил 2-(4-трет-бутил-2-формил-фенил)сульфанилбензоата (0.7 г, 2.13 ммоль) в безводном ТГФ (20 мл) добавили 2-метилпропан-2-сульфинамид (0.6 г, 5.33 ммоль) с последующим этоксидом титана (IV) (1.1 мл, 5.33 ммоль) и получившуюся реакционную смесь нагревали до 70°C в течение 2 ч. Затем реакционную смесь охладили до комнатной температуры, разбавили водой, отфильтровали через целит. Фильтрат экстрагировали этилацетатом (2 x 20 мл). Объединенный органический слой промыли водой (10 мл) с последующим солевым раствором (10 мл) и высушили над безводным Na2SO4. Органический слой сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (18% этилацетат в гексане) с получением метил 2-[4-трет-бутил-2-[(E)-трет-бутилсульфинилиминометил]фенил]сульфанилбензоата (0.9 г, 97%)в виде бледно-желтого масла.
К охлажденному на льду раствору LAH (0.2 г, 6.26 ммоль) в безводном ТГФ (20 мл) добавили раствор метил 2-[4-трет-бутил-2-[(E)-трет-бутилсульфинилиминометил]фенил]сульфанилбензоата (0.9 г, 2.08 ммоль) в безводном ТГФ (20 мл) и получившуюся реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Затем реакционную смесь погасили этилацетатом (30 мл), отфильтровали через целит и сконцентрировали при пониженном давлении с получением N-[[5-трет-бутил-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (0.7 г, 82%) в виде белого осадка.
К охлажденному на льду раствору N-[[5-трет-бутил-2-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (0.7 г, 1.72 ммоль) в безводном ДХМ (10 мл) добавили периодинан Десса-Мартина (0.8 г, 1.90 ммоль) и получившуюся реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь погасили насыщенным раствором NaHCO3 (25 мл) и экстрагировали с помощью ДХМ (2 x 25 мл). Объединенный органический слой промыли водой (15 мл), высушили над безводным Na2SO4 и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (50% этилацетат в гексане) с получением N-[[5-трет-бутил-2-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (0.55 г, 78%) в виде серо-белого осадка.
К охлажденному на льду раствору N-[[5-трет-бутил-2-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (0.55 г, 1.36 ммоль) в диоксане (2 мл) добавили 4M диоксан в HCl (2 мл) и получившуюся реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Летучие компоненты удалили при пониженном давлении с получением 2-[2-(аминометил)-4-трет-бутил-фенил]сульфанилбензальдегида (0.45 г, 100%) в виде желтого осадка. Неочищенное соединение использовали как есть на следующей стадии.
К охлажденному на льду раствору 2-[2-(аминометил)-4-трет-бутил-фенил]сульфанилбензальдегида (0.45 г, 1.34 ммоль) в ацетонитриле (10 мл) добавили 5% раствор NaHCO3 (3 мл) с последующим Fmoc-OSu (0.3 г, 0.94 ммоль) и получившуюся реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Затем реакционную смесь разбавили водой (10 мл) и экстрагировали этилацетатом (2 x 20 мл). Объединенный органический слой промыли водой (10 мл) с последующим солевым раствором (10 мл), высушили над безводным Na2SO4 и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили посредством флеш-хроматографии (15% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-[[5-трет-бутил-2-(2-формилфенил)сульфанил-фенил]метил]карбамата (0.45 г, 64%) в виде желтого осадка. LC-MS: 522.4 (M+H).
1H-NMR: (400 MHz, CDCl3): δ 1.34 (9H, s), 4.17 (1H, t, J = 7.1 Hz), 4.34 (2H, d, J = 7.1 Hz), 4.46 (2H, d, J = 6.2 Hz), 5.14 (1H, br), 6.76 (1H, d, J = 8.2 Hz), 7.30-7.27 (3H, m), 7.42-7.32 (5H, m), 7.55-7.51 (3H, m), 7.74 (2H, d, J = 7.4 Hz), 7.84 (1H, d, J = 7.9 Hz), 10.30 (1H, s).
Промежуточное соединение 52
9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-5-изопропил-фенил]метил]карбамат
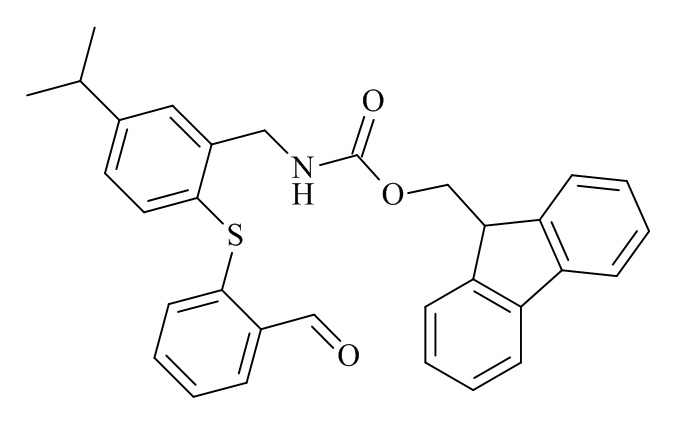
К раствору 5-бромо-2-фтор-бензальдегида (2 г, 9.85 ммоль) в диоксане:воде (1:1) (40 мл, 1:1) добавили изопренилбороновый эфир (1.98 г, 11.82 ммоль) и Cs2CO3 (8 г, 24.63 ммоль) последовательно. Реакционную смесь затем дегазировали аргоном в течение 0.5 ч и в нее добавили Pd(PPh3)4 (0.22 г, 0.19 ммоль). Реакционную смесь затем нагревали при 70°C в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь отфильтровали. Фильтрат сконцентрировали и разбавили этилацетатом (100 мл). Органический слой промыли водой с последующим солевым раствором и высушили над безводным сульфатом натрия. Органический слой сконцентрировали с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (20% этилацетат в гексане) с получением 2-фтор-5-изопропенил-бензальдегида (1.2 г, 74%) в виде вязкого масла.
К охлажденному на льду раствору 2-фтор-5-изопропенил-бензальдегида (1.3 г, 7.92 ммоль) и метилтиосалицилата (1.59 г, 9.51 ммоль) в ДМФ (30 мл) в атмосфере аргона добавили карбонат калия (2.73 г, 19.81 ммоль) и реакционную смесь нагревали при 60°C в течение 3 ч. Затем реакционную смесь разбавили водой (50 мл) и экстрагировали этилацетатом (40 мл x 3). Органический слой промыли солевым раствором (40 мл x 3), высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (30% этилацетат в гексане) с получением метил 2-(2-формил-4-изопропенил-фенил)сульфанилбензоата (2.2 г, 89%) в виде бледно-желтого осадка. MS, установленная: 313.1(M+H).
К дегазированному раствору метил 2-(2-формил-4-изопропенил-фенил)сульфанилбензоата (1.6 г, 5.12 ммоль) в ТГФ (50 мл) добавили никель Ренея (0.2 г) и реакционную смесь затем перемешивали в атмосфере водорода в течение 16 ч. Затем реакционную смесь отфильтровали через целит, промыли ТГФ и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (60% этилацетат в гексане) с получением метил 2-[2-(гидроксиметил)-4-изопропил-фенил]сульфанилбензоата (1.4 г, 87%) в виде вязкого масла. MS, установленная: 317.1(M+H).
К охлажденному на льду раствору метил 2-[2-(гидроксиметил)-4-изопропил-фенил]сульфанилбензоата (1.4 г, 4.43 ммоль) в ДХМ (50 мл) добавили периодинан Десса-Мартина (2.25 г, 5.31 ммоль) по порциям и реакционную смесь перемешивали при комнатной температуре в течение 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили с помощью ДХМ (50 мл) и насыщенного раствора бикарбоната натрия (50 мл x 2). Органический слой отделили и водный слой экстрагировали с помощью ДХМ (50 мл x 2). Объединенный органический слой промыли раствором тиосульфата натрия с последующим солевым раствором. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (30% этилацетат в гексане) с получением метил 2-(2-формил-4-изопропил-фенил)сульфанилбензоата (1.2 г, 86%) в виде вязкого масла. MS, установленная: 314.9(M+H).
К перемешанному раствору метил 2-(2-формил-4-изопропил-фенил)сульфанилбензоата (1.2 г, 3.82 ммоль) в безводном ТГФ (50 мл) добавили 2-метилпропан-2-сульфинамид (1.15 г, 9.55 ммоль) и тетраэтоксид титана (2.17 г, 9.77 ммоль) последовательно. Получившуюся реакционную смесь нагревали до 60°C в течение 5 ч в атмосфере аргона. Затем реакционную смесь влили в воду со льдом и отфильтровали через целит. Фильтрат экстрагировали этилацетатом (100 мл x 2), промыли солевым раствором (100 мл x 2), высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством колонки для флеш-хроматографии (10-20% этилацетат в гексане) с получением метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4-изопропил-фенил]сульфанилбензоата (1.45 г, 91%) в виде коричневого осадка. MS, установленная: 418.2 (M+H).
К охлажденной на льду суспензии LAH (0.25 г, 6.95 ммоль) в ТГФ (30 мл) добавили раствор полученного метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-4-изопропил-фенил]сульфанилбензоата (1.45 г, 3.47 ммоль) в ТГФ (20 мл) и реакционную смесь перемешивали в течение 30 мин при 0°C. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь погасили насыщенным раствором сульфата натрия (5 мл) и разбавили этилацетатом (20 мл). Реакционную смесь отфильтровали через целит. Фильтрат сконцентрировали с получением N-[[2-[2-(гидроксиметил)фенил]сульфанил-5-изопропил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.1 г, 81%) в виде белого осадка. MS, установленная: 392.0(M+H).
К охлажденному на льду раствору N-[[2-[2-(гидроксиметил)фенил]сульфанил-5-изопропил-фенил]метил]-2-метил-пропан-2-сульфинамида (1 г, 2.55 ммоль) в диоксане (20 мл) добавили 4M HCl в диоксане и получившуюся реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое тритурировали диэтиловым эфиром и высушили с получением [2-[2-(аминометил)-4-изопропил-фенил]сульфанилфенил]метанола (0.735 г, 87%) в виде белого осадка. MS, установленная: 287.9(M+H).
К перемешанной суспензии [2-[2-(аминометил)-4-изопропил-фенил]сульфанилфенил]метанола (0.7 г, 2.16 ммоль) в 5% растворе бикарбоната натрия (12 мл) добавили Fmoc-OSu (0.51 г, 1.51 ммоль) в ацетонитриле (30 мл) и реакционную смесь перемешивали при комнатной ттемпературе в течение 3 ч. Летучие компоненты сконцентрировали под вакуумом, затем разбавили водой (50 мл) и экстрагировали этилацетатом (50 мл x 3) и промыли солевым раствором (50 мл), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили посредством флеш-хроматографии (20% этилацетат в гексане) с получением [2-(2-этил-4-изопропил-фенил)сульфанилфенил]метанола (0.7 г, 63%) в виде белого осадка. MS, установленная: 510.2(M+H).
К охлажденному на льду раствору [2-(2-этил-4-изопропил-фенил)сульфанилфенил]метанола (0.7 г, 1.38 ммоль) в ДХМ (30 мл) добавили периодинан Десса-Мартина (0.75 г, 1.78 ммоль) по порциям и реакционную смесь перемешивали при комнатной температуре в течение 2 ч в атмосфере аргона. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили с помощью ДХМ (50 мл) и насыщенного раствора бикарбоната натрия (50 мл x 2). Органический слой отделили и водный слой экстрагировали с помощью ДХМ (50 мл x 2). Объединенный органический слой промыли раствором тиосульфата натрия с последующим солевым раствором. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (30% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-5-изопропил-фенил]метил]карбамата (0.530 г, 76%) в виде белого осадка. LC-MS: 508.1(M+H).
1H-NMR: (400 MHz, DMSO-d6): δ 1.21 (6H, d, J = 6.9 Hz), 2.92 (1H, sep, J = 6.9 Hz), 4.28-4.19 (5H, m), 6.67 (1H, d, J = 8.0 Hz), 7.49-7.25 (9H, m), 7.70 (2H, d, J = 7.4 Hz), 7.85 (1H, t, J = 5.7 Hz), 7.89 (2H, d, J = 7.5 Hz), 7.96 (1H, d, J = 7.3 Hz), 10.21 (1H, s).
Промежуточное соединение 53
9H-флуорен-9-илметил N-[[2-фтор-6-(2-формилфенил)сульфанил-фенил]метил]карбамат

К суспензии метил 2-сульфанилбензоата (3 г, 21.11 ммоль) и K2CO3 (5.8 г, 42.22 ммоль) в ДМФ (50 мл) добавили 2,6-дифторбензальдегид (3.5 г, 21.11 ммоль) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (3 x 250 мл). Объединенный органический слой высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (20% этилацетат в гексане) с получением соединения метил 2-(3-фтор-2-формил-фенил)сульфанилбензоата (4.1 г, 67%) в виде коричневого осадка.
К раствору метил 2-(3-фтор-2-формил-фенил)сульфанилбензоата (2.5 г, 8.62 ммоль) и 2-метилпропан-2-сульфинамида (2.60 г, 21.55 ммоль) в ТГФ(100 мл) добавили тетраэтоксид титана (4.9 г, 21.52 ммоль) и реакционную смесь нагревали до 70°C в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (3 x 250 мл). Объединенные органические слои высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3-фтор-фенил]сульфанилбензоата (3.2 г, 94%), который использовали как есть на следующей стадии без очистки. LC-MS: 393.8 (M+H).
К охлажденной на льду суспензии LAH (0.9 г, 25.95 ммоль) добавили раствор метил 2-[2-[(E)-трет-бутилсульфинилиминометил]-3-фтор-фенил]сульфанилбензоата (3.4 г, 8.65 ммоль) в ТГФ (50 мл) и реакционную смесь перемешивали в течение 1 ч при этой же температуре. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водным раствором сульфата натрия (50 мл) и экстрагировали этилацетатом (3 x 100 мл). Объединенные органические слои высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое промыли гексаном и пентаном с получением N-[[2-фтор-6-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.8 г, 88%) в виде коричневого осадка. LC-MS: 367.7(M+H).
К раствору N-[[2-фтор-6-[2-(гидроксиметил)фенил]сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2.8 г, 7.62 ммоль) в ДХМ (50 мл) добавили Периодинан Десса-Мартина (8.07 г, 19.04 ммоль) и реакционную смесь перемешивали при КТ в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили растворм бикарбоната натрия (100 мл) и экстрагировали с помощью ДХМ (3 x 100 мл). Объединенные органические слои высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью колоночной хроматографии на силикагеле с получением твердого N-[[2-фтор-6-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (2 г, 72%) в виде белого осадка. LC-MS: 365.7(M+H).
К охлажденному на льду раствору N-[[2-фтор-6-(2-формилфенил)сульфанил-фенил]метил]-2-метил-пропан-2-сульфинамида (1.8 г, 2.88 ммоль) в диоксане (40 мл) добавили 4M HCl в диоксане (20 мл) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Прогресс реакции контролировали с помощью ТСХ. Летучие компоненты удалили при пониженном давлении и неочищенное соединение тритурировали диэтиловым эфиром с получением 2-[2-(аминометил)-3-фтор-фенил]сульфанилбензальдегида (2 г, неочищенный) в виде белого осадка. LC-MS: 361.7(M+H).
К суспензии 2-[2-(аминометил)-3-фтор-фенил]сульфанилбензальдегида (2 г, 4.96 ммоль) в 5% водном NaHCO3 (15 мл) добавили раствор Fmoc-OSu (1.1 г, 3.47 ммоль) в ацетонитриле (50 мл) и реакционную смесь перемешивали при комнатной ттемпературе в течение 3 ч. Затем реакционную смесь разбавили этилацетатом и промыли водой с последующим солевым раствором. Органический слой высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии с получением 9H-флуорен-9-илметил N-[[2-фтор-6-(2-формилфенил)сульфанил-фенил]метил]карбамата (0.550 г, 16% за две стадии) в виде серо-белого осадка. LC-MS: 483.9 (M+H).
Промежуточное соединение 54
9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат

К охлажденному на льду раствору хлорида натрия (6.81 г, 75.68 ммоль) в воде (30 мл) добавили раствор 3-хлор-2-фтор-бензальдегида (3 г, 18.92 ммоль) в ацетоне (75 мл) и реакционную смесь перемешивали в течение 5 мин. В получившуюся реакционную смесь добавили сульфаминовую кислоту (5.50 г, 56.761 ммоль) одной порцией при 0°C и перемешивание продолжили в течение 30 мин. Прогресс реакции контролировали с помощью ТСХ. После заверешения реакции реакционную смесь разбавили водой (5 мл) и отфильтровали. Фильтрат экстрагировали этилацетатом (3 x 50 мл), объединенный органический слой высушили над безводным сульфатом натрия, отфильтровали и сконцентрировали при пониженном давлении с получением 3-хлор-2-фтор-бензойной кислоты (3.2 г, 97%) в виде белого осадка. LC-MS: 172.9(M-H).
К раствору 3-хлор-2-фтор-бензойной кислоты (0.55 г, 3.151 ммоль) в метаноле (20 мл) добавили конц. серную кислоту (1 мл) и реакционную смесь нагревали до 80°C в течение 16 ч. Летучие компоненты сконцентрировали при пониженном давлении и неочищенную реакционную смесь разбавили этилацетатом. Затем реакционную смесь промыли насыщенным раствором бикарбоната натрия с последующим солевым раствором. Органические слои высушили над безводным сульфатом натрия, отфильтровали и сконцентрировали с получением метил 3-хлор-2-фтор-бензоата (0.5 г, 84%) в виде бесцветной жидкости.
К перемешанному раствору метил 3-хлор-2-фтор-бензоата (0.05 г, 0.265 ммоль) в ДМФ (2 мл) добавили Na2S (0.05 г) и реакционную смесь нагревали до 70°C в течение 5 ч. Затем реакционную смесь подкислили 10% HCl и экстрагировали EtOAc (3 x 25 мл). Объединенные органические слои промыли водой с последующим солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали с получением метил 3-хлор-2-сульфанил-бензоата (0.035 г, неочищенный) в виде желтого осадка. LC-MS: 201.1(M-H).
К перемешанному раствору метил 3-хлор-2-сульфанил-бензоата (0.05 г, 0.247 ммоль) в ДМФ (2 мл) добавили K2CO3 (136мг, 0.987 ммоль) и 2-фтор-пиридин-3-карбальдегид (61 мг, 0.493 ммоль) последовательно и реакционную смесь нагревали до 70°C в течение 16 ч. Затем реакционную смесь разбавили EtOAc и промыли солевым раствором. Органический слой высушили над безводным сульфатом натрия, отфильтровали и сконцентрировали с получением неочищенного соединения, которое очистили посредством колоночной хроматографии (25% этилацетат в гексане) с получением метил 3-хлор-2-[(3-формил-2-пиридил)сульфанил]бензоата (0.015 г, 12% за две стадии) в виде белого осадка. LC-MS: 308.0 (M+H).
Смесь метил 3-хлор-2-[(3-формил-2-пиридил)сульфанил]бензоата (1.3 г, 4.23 ммоль), этиленгликоля (0.789 г, 12.70 ммоль), p-TSA (0.081 г, 0.423 ммоль) в толуоле (30.0 мл) нагревали до 140°C в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. Затем реакционную смесь разбавили водой (100 мл) и водную фазу экстрагировали этилацетатом (50 мл x 2). Объединенные органические слои высушили над безводным сульфатом натрия и растворитель выпарили при пониженном давлении с получением неочищенного метил 3-хлор-2-[[3-(1,3-диоксолан-2-ил)-2-пиридил]сульфанил]бензоата (1.4 г, 94%) в виде бесцветного масла, которое использовали как есть на следующей стадии. LC-MS: 351.9 (M+H).
К охлажденному на льду раствору метил 3-хлор-2-[[3-(1,3-диоксолан-2-ил)-2-пиридил]сульфанил]бензоата (1.4 г, неочищенный) в ТГФ (25 мл) добавили порошок LAH по порциям (0.302 г, 7.96 ммоль) и реакционную смесь перемешивали в течение 30 мин при КТ. Затем реакционную смесь погасили этилацетатом и насыщенным раствормо сульфата натрия. Затем реакционную смесь отфильтровали через целит и фильтрат экстрагировали этилацетатом. Органический слой промыли солевым раствором и высушили над сульфатом натрия, отфильтровали и сконцентрировали с получением неочищенного соединения, которое дополнительно очистили посредством колоночной хроматографии (50% этилацетат в гексане) с получением [3-хлор-2-[[3-(1,3-диоксолан-2-ил)-2-пиридил]сульфанил]фенил]метанола (1.2 г, 93%) в виде белого осадка. LC-MS: 324.1(M+H).
Раствор [3-хлор-2-[[3-(1,3-диоксолан-2-ил)-2-пиридил]сульфанил]фенил]метанола (1 г, неочищенный), трифенилфосфина (2.5 г, 0.040 ммоль), азида натрия (2 г, 0.007 ммоль) в тетрахлориде углерода (0.1 мл) и ДМФ (5.0 мл) нагревали до 70°C в течение 3 ч. Прогресс реакции контролировали с помощью ТСХ. Реакционную смесь разбавили водой (20 мл) и водную фазу экстрагировали этилацетатом (30 мл x 2). Объединенные органические слои высушили над безводным сульфатом натрия и растворитель выпарили при пониженном давлении с получением неочищенного соединения, которое очистили посредством колоночной хроматографии (30% этилацетат в гексане) с получением 2-[2-(азидометил)-6-хлор-фенил]сульфанил-3-(1,3-диоксолан-2-ил)пиридина (0.12 г, 11%) в виде вязкого масла. LC-MS: 348.9 (M+H).
К перемешанному раствору 2-[2-(азидометил)-6-хлор-фенил]сульфанил-3-(1,3-диоксолан-2-ил)пиридина (0.45 г, 1.29 ммоль) в этаноле (20 мл) добавили Pd-C (0.138 г, 7.96 ммоль) и реакционную смесь встряхивали под давлением водорода в течение 16 ч. Затем реакционную смесь отфильтровали через целит и фильтрат сконцентрировали под вакуумом с получением [3-хлор-2-[[3-(1,3-диоксолан-2-ил)-2-пиридил]сульфанил]фенил]метанамина (0.350 г, 83%) в виде вязкого масла, которое использовали как есть на следующей стадии без дополнительной очистки. LC-MS: 322.9 (M+H).
К раствору [3-хлор-2-[[3-(1,3-диоксолан-2-ил)-2-пиридил]сульфанил]фенил]метанамина (0.35 г, неочищенный) в 5% бикарбонате натрия (0.5 мл) добавили Fmoc-OSu (0.31 г, 0.93 ммоль) в ацетонитриле (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Прохождение реакции контроллировали с помощью ТСХ. После заверешения реакции летучие компоненты удалили при пониженном давлении и неочищенную реакционную смесь разбавили водой (10 мл). Водную фазу экстрагировали этилацетатом (10 мл x 3). Объединенные органические слои промыли солевым раствором (10 мл), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили с помощью хроматографии на системе Combiflash (30% этилацетат в гексане) с получением необходимого соединения, которое дополнительно промыли диэтиловым эфиром (5 мл) с последующим пентаном (5 мл) и высушили с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[[3-(1,3-диоксолан-2-ил)-2-пиридил]сульфанил]фенил]метил]карбамата (0.300 г, 59%) в виде серо-белого осадка. LC-MS: 544.9 (M+H).
К раствору 9H-флуорен-9-илметил N-[[3-хлор-2-[[3-(1,3-диоксолан-2-ил)-2-пиридил]сульфанил]фенил]метил]карбамата (0.3 г, 0.642 ммоль) в ацетоне (10 мл) добавили конц. HCl (2 мл) и реакционную смесь перемешивали в течение 4 ч при комнатной температуре. После заверешения реакции летучие компоненты удалили при пониженном давлении и неочищенную реакционную смесь погасили насыщенным раствором бикарбоната натрия. Затем получившуюся реакционную смесь экстрагировали этилацетатом (3 x 25 мл). Объединенные органические слои промыли солевым раствором, высушили над безводным сульфатом натрия, отфильтровали и сконцентрировали с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (50% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамата (0.115 г, 36%) в виде серо-белого осадка. LC-MS: 500.9 (M+H).
1H-NMR (400 MHz, CDCl3): δ 4.13-4.16 (1H; m); 4.39 (2H; d; J = 6.76 Hz); 4.57 (2H; d; J = 6.76 Hz); 7.18-7.20 (1H; m); 7.26-7.29 (1H; m): 7.35-7.39 (3H; m); 7.37-7.50 (4H; m); 7.74 (2H; d; J = 7.56 Hz); 7.74-7.79 (1H; m); 8.29-8.30 (1H; m); 10.45 (1H: s).
Промежуточное соединение 55
3-{(S)-2-Carboxy-2-[этил-(9H-флуорен-9-илметоксикарбонил)-амино]-этил}-индол-1-карбоновой кислоты трет-бутиловый эфир
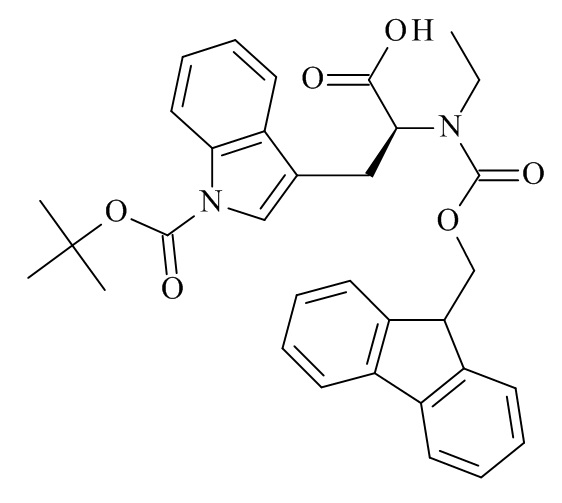
Раствор (2S)-2-амино-3-(1-трет-бутоксикарбонилиндол-3-ил)пропановой кислоты (2 г, 6.57 ммоль), o-нитробензолсульфонилхлорида (1.64 г, 7.42 ммоль) в насыщенном растворе карбоната натрия и диоксане (132 мл, 1:1) перемешивали в течение 18 ч. Затем pH раствора довели до 7.0 с помощью 0.5 M HCl. Растворитель удалили при пониженном давлении и неочищенную реакционную смесь экстрагировали эфиром (3 x 50 мл). Объединенный органический слой промыли водой, высушили над сульфатом натрия и сконцентрировали с получением (2S)-3-(1-трет-бутоксикарбонилиндол-3-ил)-2-[(2-нитрофенил)сульфониламино]пропановой кислоты (2.4 г, 75%) в виде желтого осадка. В раствор (2S)-3-(1-трет-бутоксикарбонилиндол-3-ил)-2-[(2-нитрофенил)сульфониламино]пропановой кислоты (1.6 г, 3.26 ммоль) в безводном ДМФ (25 мл) добавили карбонат калия (1.5 г, 11.44 ммоль) и этилйодид (1.5, 9.8 ммоль) последовательно и реакционную смесь перемешивали в течение 8 ч. Затем реакционную смесь влили в воду (25 мл) и водный слой экстрагировали эфиром (3 x 30 мл). Объединенные органические слои промыли водой, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (20% этилацетат в гексане) с получением трет-бутил 3-[(2S)-3-этокси-2-[этил-(2-нитрофенил)сульфонил-амино]-3-оксо-пропил]индол-1-карбоксилата (0.3 г, 17%) в виде вязкого масла. LC-MS: 544.1(M-H)
К раствору трет-бутил 3-[(2S)-3-этокси-2-[этил-(2-нитрофенил)сульфонил-амино]-3-оксо-пропил]индол-1-карбоксилата (3.4 г, 6.2 ммоль) в безводном ДМФ (50 мл) добавили K2CO3 (2.5 г, 18.72 ммоль) и тиофенол (0.825 г, 7.4ммоль) последовательно и реакционную смесь перемешивали в течение 2 ч при КТ. После заверешения реакции реакционную смесь погасили водой (50 мл) и экстрагировали этилацетатом (100 мл x 3). Органический слой отделили, промыли водой (50 мл x 2) и высушили над Na2SO4. Органический слой эвапорировали при пониженном давлении и полученное таким образом неочищенное соединение очистили посредством хроматографии (20% этилацетат в гексане) с получением трет-бутил 3-[(2S)-3-этокси-2-(этиламино)-3-оксо-пропил]индол-1-карбоксилата (1.5 г, 67%) в виде вязкой массы. LC-MS: 361.0 (M+H).
К раствору трет-бутил 3-[(2S)-3-этокси-2-(этиламино)-3-оксо-пропил]индол-1-карбоксилата (1.5 г, 4.17 ммоль) в ТГФ - воде (40 мл, 3:1) добавили LiOH (0.21 г 5.0 ммоль) и реакционную смесь перемешивали в течение 24 ч при комнатной температуре. После заверешения реакции реакционную смесь нейтрализовали с помощью 0.5 н HCl и эвапорировали при пониженном давлении. Полученное неочищенное соединение промыли водой (50 мл) и хорошо высушили с получением (2S)-3-(1-трет-бутоксикарбонилиндол-3-ил)-2-(этиламино)пропановой кислоты (1.3 г, 96%) в виде белого осадка. LC-MS: 332.9(M+H).
К раствору (2S)-3-(1-трет-бутоксикарбонилиндол-3-ил)-2-(этиламино)пропановой кислоты (1.4 г, 4.2 ммоль) в ТГФ: воде (40 мл, 1:1) добавили 5% NaHCO3 с последующим Fmoc-OSU (1.4 г, 4.2 ммоль) и реакционную смесь перемешивали в течение 5 ч при комнатной температуре. Затем реакционную смесь разбавили водой и экстрагировали этилацетатом (50 мл x 3). Органический слой отделили, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством флеш-хроматографии (50% этилацетат в гексане) с получением требуемого соединения. Полученное таким образом соединение высушили добавлением тоуола и его дистилляцией (10 мл x 5). Получившийся осадок промыли диэтиловым эфиром-н-пентаном (20 мл, 1:4) и высушили с получением (2S)-3-(1-трет-бутоксикарбонилиндол-3-ил)-2-[этил(9H-флуорен-9-илметоксикарбонил)амино]пропановой кислоты (0.48 г, 21%) в виде серо-белого осадка. LC-MS: 554.9 (M+H).
Промежуточное соединение 56
[5-бромо-2-(3-формил-пиридин-2-илсульфанил)-3-метил-бензил]-карбаминовой кислоты 9H-флуорен-9-илметиловый эфир
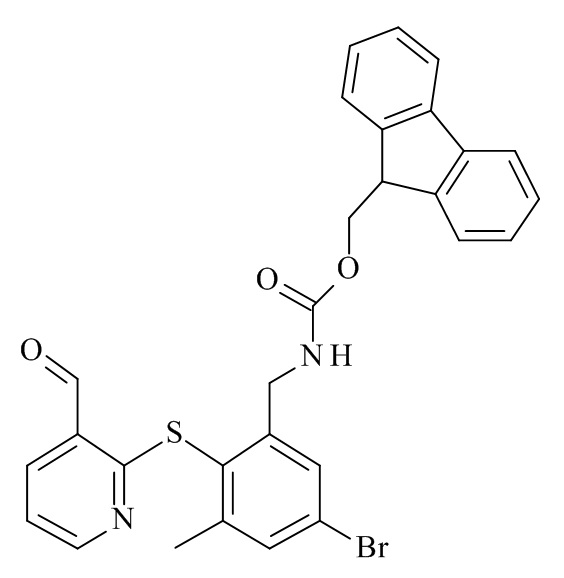
К перемешанному раствору 2-меркапто-никотиновой кислоты (3.94 г, 25.3ммоль) в ДМФ (60мл) добавили NaH (1.844 г, 46.076ммоль) при 0°C и получившуюся реакционную смесь перемешивали при 25°C в течение 1 ч. Затем 5-бромо-2-фтор-3-метил-бензальдегид (5 г, 23ммоль) добавили в реакционную смесь и её нагревали до 80°C в течение 32 ч. После завершения реакции, реакционную смесь охладили до комнатной температуры, добавили K2CO3 (9.6 г, 69.1ммоль) и метилйодид (4.4 мл, 69.1 моль), перемешивали при 25°C в течение 16 ч. Реакционную смесь разбавили водой, экстрагировали EtOAc. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили обычной силикагелевой (100-200 меш) колоночной хроматографией с элюцией 12% EtOAc в гексане с получением 2-(4-бромо-2-формил-6-метил-фенилсульфанил)-никотиновой кислоты метилового эфира (2.5 г, 29%) в виде желтого осадка. LC-MS: 366.0 [M+H]+
К перемешанному раствору 2-(4-бромо-2-формил-6-метил-фенилсульфанил)-никотиновой кислоты метилового эфира (2.55 г, 6.9ммоль) в ТГФ (15мл), 2-метилпропан-2-сульфинамид (770мг, 6.9ммоль) и Ti(OEt)4 (7.3 мл, 34.8ммоль) добавили при комнатной температуре и реакционную смесь нагревали до 70°C в течение 16 ч. Реакционную смесь погасили солевым раствором, отфильтровали через слой целита и промыли этилацетатом. Органический слой разделили, высушили над безводным Na2SO4, сконцентрировали с получением неочищенного соединения, которое очистили посредством колоночной хроматографии с элюцией 10% EtOAc в гексане с получением требуемого соединения 2-(4-бромо-2-метил-6-{[(Z)-2-метил-пропан-2-сульфинилимино]-метил}-фенилсульфанил)-никотиновой кислоты этилового эфира (2.75 г, 82%) в виде серо-белого осадка. LC-MS: 485.0 [M+H]+
К перемешанному и дегазированному раствору 2-(4-бромо-2-метил-6-{[(Z)-2-метил-пропан-2-сульфинилимино]-метил}-фенилсульфанил)-никотиновой кислоты этилового эфира (3.11 г, 6.6ммоль) в ТГФ (15мл), добавили LAH (1M в ТГФ,13 мл, 13.3ммоль) при 0°C и реакционную массу перемешивали при 25°C в течение 1 ч. Реакционную смесь погасили насыщенным раствором Na2SO4 и экстрагировали с помощью EtOAc. Отделенный органический слой промыли водой, солевым раствором и высушили (Na2SO4) и сконцентрировали с получением 2-метил-пропан-2-сульфиновой кислоты 5-бромо-2-(3-гидроксиметил-пиридин-2-илсульфанил)-3-метил-бензиламида (2.3 г, 78%) в виде серо-белого осадка. LC-MS: 445.0[M+H]+
К перемешанному раствору 2-метил-пропан-2- сульфиновой кислоты 5-бромо-2-(3-гидроксиметил-пиридин-2-илсульфанил)-3-метил- бензиламида (3 г, 6.8ммоль) в метаноле (20 мл) добавили 4M HCl в 1,4-диоксане (20 мл) при 0°C, и перемешивали в течение 2 ч при этой температуре. После завершения реакции реакционную смесь сконцентрировали с получением [2-(2-аминометил-4-бромо-6-метил-фенилсульфанил)-пиридин-3-ил]-метанола HCl соли (2.6 г, неочищенный) в виде серо-белого осадка. Это неочищенное соединение использовали на следующей стадии без дополнительной очистки.
К перемешанному раствору [2-(2-аминометил-4-бромо-6-метил-фенилсульфанил)-пиридин-3-ил]-метанола (2.6 г, 6.9ммоль) в 5% растворе NaHCO3 (15мл) добавили Fmoc-OSU (2.4 г, 6.9ммоль) в CH3CN (15 мл) при 25°C, и перемешивание продолжили при этой температуре в течение 3 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили промывкой н-пентаном с получением требуемого соединения [5-бромо-2-(3-гидроксиметил-пиридин-2-илсульфанил)-3-метил-бензил]-карбаминовой кислоты 9H-флуорен-9-илметилового эфира (3.6 г, 92%) в виде серо-белого осадка. LC-MS: 561.1[M+H]+
К перемешанному раствору [5-бромо-2-(3-гидроксиметил-пиридин-2-илсульфанил)-3-метил-бензил]-карбаминовой кислоты 9H-флуорен-9-илметилового эфира (6.4 г, 11.4ммоль) в ДХМ:ТГФ (1:1, 60 мл) добавили MnO2 (20 г, 228ммоль) при комнатной температуре и перемешивание продолжили при этой температуре в течение 2 ч. После израсходования исходного соединения по данным ТСХ на силикагеле, реакционную смесь отфильтровали через слой целита, фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество промыли н-пентаном и н-гексаном с получением [5-бромо-2-(3-формил-пиридин-2-илсульфанил)-3-метил-бензил]-карбаминовой кислоты 9H-флуорен-9-илметилового эфира (5.5 г, 86%). LC-MS: 560.1 [M+H]+
1H-NMR: (400 MHz, DMSO-d6): δ 2.36 (3H, s), 4.22-4.26 (5H, m), 7.33-7.39 (7H, m), 7.54 (1H, brs), 7.63 (2H, d, J = 7.2 Hz), 7.81 (1H, m), 7.90 (2H, d, J = 7.3 Hz), 8.32 (1H, m), 8.41 (1H, m), 10.20 (1H,s).
Промежуточное соединение 57
9H-флуорен-9-илметил N-({2-[(3-формилпиридин-2-ил)сульфанил]-5-фенил-3-(трифторметил)фенил}метил)карбамат

К перемешанному раствору 2-меркаптоникотиновой кислоты (3.2 г, 20.3ммоль) в ДМФ (50мл) добавили NaH (60%, 1.47 г, 36.9ммоль) и реакционную массу перемешивали при 25°C в течение 30 мин. Затем 5-бромо-2-фтор-3-трифторметил-бензальдегид (5.0 мг, 18.5ммоль) добавили и реакционную смесь перемешивали при 80°C в течение 1 ч. Затем K2CO3 (7.6 г, 55.3ммоль) добавили с последующим добавлением MeI (3.4мл, 55.3 ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу погасили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 0-30% этилацетата в гексане с получением метил 2-{[4-бромо-2-формил-6-(трифторметил)фенил]сульфанил}пиридин-3-карбоксилата (5 г, 64%) в виде желтого осадка.
К перемешанному раствору метил 2-{[4-бромо-2-формил-6-(трифторметил)фенил]сульфанил}пиридин-3-карбоксилата (4.5 г, 10.7ммоль) в ТГФ(100мл) добавили 2-метилпропан-2-сульфинамид (2.6 г, 21.4ммоль), Ti(OEt)4 (6.7мл, 32.1ммоль) и реакционную массу нагревали до 70°C в течение 1 ч. Реакционную массу погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через слой целита, промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-({4-бромо-2-[(1E)-[(2-метилпропан-2-сульфинил)имино]метил]-6-(трифторметил)фенил}сульфанил)пиридин-3-карбоксилата (5.5 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 523.0 [M+H]+
К перемешанному раствору метил 2-({4-бромо-2-[(1E)-[(2-метилпропан-2-сульфинил)имино]метил]-6-(трифторметил)фенил}сульфанил)пиридин-3-карбоксилата (5.5 г, 10.5ммоль) в ТГФ (100мл) добавили LAH (2M в ТГФ, 10.5мл, 21 ммоль) при 0°C и реакционную массу перемешивали при 0°C в течение 1 ч. Реакционную смесь погасили насыщенным раствором сульфата натрия и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением N-[(5-бромо-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-3-(трифторметил)фенил)метил]-2-метилпропан-2-сульфинамида (5.0 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 496.7 [M+H]+
К перемешанному раствору N-[(5-бромо-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-3-(трифторметил)фенил)метил]-2-метилпропан-2-сульфинамида (3.6 г, 7.2ммоль) в ДХМ (50мл) добавили имидазол (1.5 г, 21.7ммоль) и TBDMSCl (1.6 мг, 10.9ммоль) при 0°C и перемешивали при 25°C в течение 2 ч. Реакционную массу погасили водным раствором NaHCO3 и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью колоночной хроматографии на системе Combiflash с использованием 20% этилацетата в гексане с получением N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-(трифторметил)фенил}метил)-2-метилпропан-2-сульфинамида (3.1 г, 70%, 3 стадии) в виде серо-белого осадка. LC-MS: 611.1 [M+H]+
К перемешанному раствору соединения N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-(трифторметил)фенил}метил)-2-метилпропан-2-сульфинамида (250мг, 0.4ммоль) в толуоле(8мл) добавили фенилбороновую кислоту (140.5мг, 0.7ммоль), Na2CO3 (129.9мг, 1.2ммоль), воду (2.0 мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем к ней добавили Pd(PPh3)4 (47.23мг, 0.04ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 100°C в течение 12 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита и промыли с помощью EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом с получением неочищенного материала, который очистили с помощью колоночной хроматографии на системе Combiflash с использованием 0-25% этилацетата в гексане с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-5-фенил-3-(трифторметил)фенил}метил)-2-метилпропан-2-сульфинамида (200мг, 80%) в виде бесцветной вязкой жидкости. LC-MS: 609.0 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-5-фенил-3-(трифторметил)фенил}метил)-2-метилпропан-2-сульфинамида (2.2 г, 3.6ммоль) в MeOH(20мл) добавили 4M HCl в диоксане(10мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-4-фенил-6-(трифторметил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (1.2 г, неочищенный), которую сразу использовали на следующей стадии. LC-MS: 390.7 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-4-фенил-6-(трифторметил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (1.2 г, 3.1ммоль) в 5% NaHCO3 (30 мл) добавили Fmoc-OSU (1.13 г, 3.35ммоль ) в диоксане (30 мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 3 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили посредством колоночной хроматографии (10%-30% этилацетат-гексан) с получением 9H-флуорен-9-илметил N-[(2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-фенил-3-(трифторметил)фенил)метил]карбамата (1.5 г, 79%, 2 стадии) в виде белого осадка.
К перемешанному раствору 9H-флуорен-9-илметил N-[(2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-фенил-3-(трифторметил)фенил)метил]карбамата (1.5 г, 2.45 ммоль) в ДХМ:ТГФ(1:1, 50 мл) добавили MnO2 (3.15 г, 36.7 ммоль) и реакционную массу перемешивали при 25°C в течение 4 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью хроматографии на системе Combiflash (10%-30% этилацетат-гексан) с получением 9H-флуорен-9-илметил N-({2-[(3-формилпиридин-2-ил)сульфанил]-5-фенил-3-(трифторметил)фенил}метил)карбамата (1.0 г, 66% ) в виде белого осадка с чистотой 95.56%. LC-MS: 611.2 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 3.98 - 4.08 (1H, m), 4.21 (1H, d, J = 5.9 Hz), 4.27 (3H, d, J = 6.6 Hz), 7.24 (2H, t, J = 6.3 Hz), 7.36 - 7.40 (3H, m), 7.51 (4H, dq, J = 13.3, 6.8 Hz), 7.67 (2H, d, J = 7.1 Hz), 7.78 (3H, d, J = 7.4 Hz), 7.87 (2H, d, J = 7.5 Hz), 7.89 - 7.97 (1H, m), 8.00 (2H, d, J = 17.9 Hz), 8.37 - 8.47 (2H, m), 10.20 (1H, s)
Промежуточное соединение 58
9H-флуорен-9-илметил N-({5-бромо-2-[(3-формилпиридин-2-ил)сульфанил]-3-(трифторметил)фенил}метил)карбамат

К перемешанному раствору 2-меркаптоникотиновой кислоты (3.2 г, 20.3ммоль) в ДМФ (50мл) добавили NaH (60%, 1.47 г, 36.9ммоль) и реакционную массу перемешивали при 25°C в течение 30 мин. Затем 5-бромо-2-фтор-3-трифторметил-бензальдегид (5.0 мг, 18.5ммоль) добавили и реакционную смесь перемешивали при 80°C в течение 1 ч. Затем K2CO3 (7.6 г, 55.3ммоль) добавили с последующим добавлением MeI (3.4мл, 55.3 ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу погасили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 0-30% этилацетат в гексане с получением метил 2-{[4-бромо-2-формил-6-(трифторметил)фенил]сульфанил}пиридин-3-карбоксилата (5 г, 64%) в виде желтого осадка.
К перемешанному раствору метил 2-{[4-бромо-2-формил-6-(трифторметил)фенил]сульфанил}пиридин-3-карбоксилата (4.5 г, 10.7ммоль) в ТГФ(100мл) добавили 2-метилпропан-2-сульфинамид (2.6 г, 21.4ммоль), Ti(OEt)4 (6.7мл, 32.1ммоль) и реакционную массу нагревали до 70°C в течение 1 ч. Реакционную массу погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через слой целита, промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-({4-бромо-2-[(1E)-[(2-метилпропан-2-сульфинил)имино]метил]-6-(трифторметил)фенил}сульфанил)пиридин-3-карбоксилата (5.5 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 523.0 [M+H]+
К перемешанному раствору метил 2-({4-бромо-2-[(1E)-[(2-метилпропан-2-сульфинил)имино]метил]-6-(трифторметил)фенил}сульфанил)пиридин-3-карбоксилата (5.5 г, 10.5ммоль) в ТГФ (100мл) добавили LAH (2M в ТГФ, 10.5мл, 21.0ммоль) при 0°C и реакционную массу перемешивали при 0°C в течение 1 ч. Реакционную смесь погасили насыщенным раствором сульфата натрия и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением N-[(5-бромо-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-3-(трифторметил)фенил)метил]-2-метилпропан-2-сульфинамида (5.0 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 496.7 [M+H]+
К перемешанному раствору N-[(5-бромо-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-3-(трифторметил)фенил)метил]-2-метилпропан-2-сульфинамида (1.5 г, 3.0ммоль) в MeOH( 50мл), добавили 4M HCl в диоксане( 8мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-4-бромо-6-(трифторметил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (1 г), которую сразу использовали на следующей стадии. LC-MS: 392.7 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-4-бромо-6-(трифторметил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (1.2 г, 2.8ммоль) в 5% NaHCO3(120мл) добавили Fmoc OSU (1.04 г, 3.1ммоль) в диоксане ( 50 мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 3 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили на обычной колонке с силикагелем 10%-30% этилацетат-гексаном с получением 9H-флуорен-9-илметил N-[(5-бромо-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-3-(трифторметил)фенил)метил]карбамата (1.2 г, 68%, 2 стадии) в виде серо-белого осадка. LC-MS: 617.0 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(5-бромо-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-3-(трифторметил)фенил)метил]карбамата (1.5 г, 2.4ммоль) в ДХМ:ТГФ (1:1, 50 мл) добавили MnO2(3.14 г, 36.6ммоль) и реакционную массу перемешивали при 25°C в течение 4 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью хроматографии на системе Combiflash с элюцией 10%-30% этилацетатом в гексане с получением 9H-флуорен-9-илметил N-({5-бромо-2-[(3-формилпиридин-2-ил)сульфанил]-3-(трифторметил)фенил}метил)карбамата (700 мг, 46% ) в виде белого осадка с чистотой 95.13%. LC-MS: 615.1 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.21 - 4.30 (5H, m), 7.31-7.34 (2H, m), 7.40-7.41 (3H, m), 7.68 (3H, m), 7.69 (2H, d, J = 7.0 Hz), 7.81 (1H, m), 7.80-7.90 (3H, m), 8.01 (1H, m), 8.37 - 8.39 (2H, m), 10.16 (1H, s)
Промежуточное соединение 59
9H-флуорен-9-илметил N-({5-бромо-3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]фенил}метил)карбамат
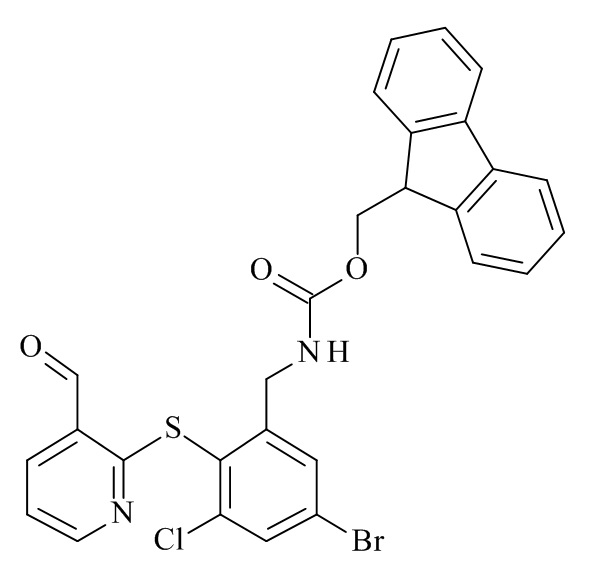
К перемешанному раствору 2-меркаптоникотиновой кислоты (10.7 г, 69.5ммоль) в ДМФ (150мл) добавили NaH (60%, 5.1 г, 126.3ммоль) и реакционную массу перемешивали при 25°C в течение 30 мин. Затем добавили 5-бромо-3-хлор-2-фтор-бензальдегид (15 г, 63.1ммоль) и реакционную смесь перемешивали при 70°C в течение 4 ч. Затем K2CO3 (26.1 г, 189.5ммоль) добавили с последующим добавлением MeI (11.8мл, 189.5ммоль) и реакционную массу перемешивали при 25°C в течение 16 ч. Реакционную смесь погасили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-8% этилацетата в гексане с получением метил 2-[(4-бромо-2-хлор-6-формилфенил)сульфанил]пиридин-3-карбоксилата (12 г, 49%) в виде желтого осадка.
К перемешанному раствору метил 2-[(4-бромо-2-хлор-6-формилфенил)сульфанил]пиридин-3-карбоксилата (15 г, 38.9ммоль) в ТГФ(80мл) добавили 2-метилпропан-2-сульфинамид (4.71 г, 38.9ммоль), Ti(OEt)4 (40.7мл, 194.3 ммоль) и реакционную массу нагревали до 70°C в течение 2 ч. Реакционную массу погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через слой целита, промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением этил 2-({4-бромо-2-хлор-6-[(1Z)-[(2-метилпропан-2-сульфинил)имино]метил]фенил}сульфанил)пиридин-3-карбоксилата (17 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 502.7 [M+H]+
К перемешанному раствору этил 2-({4-бромо-2-хлор-6-[(1Z)-[(2-метилпропан-2-сульфинил)имино]метил]фенил}сульфанил)пиридин-3-карбоксилата (17 г, 33.8ммоль) в ТГФ (80мл) добавили LAH (2M в ТГФ, 25.3мл, 50.7ммоль) при 0°C и реакционную массу перемешивали при 0°C в течение 1 ч. Реакционную смесь погасили насыщенным раствором сульфата натрия и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением N-[(5-бромо-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]-2-метилпропан-2-сульфинамида (16 г) в виде серо-белого осадка. LC-MS: 464.8 [M+H]+
К перемешанному раствору N-[(5-бромо-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]-2-метилпропан-2-сульфинамида (12 г, 12.9ммоль) в MeOH(30мл), добавили 4M HCl в диоксане (30мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. Реакционную массу эвапорировали при пониженном давлении с получением (5-бромо-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метанаминия HCl соли (4.5 г), которую сразу использовали на следующей стадии.
К перемешанной суспензии (2-{[2-(аминометил)-3-бромо-6-хлорфенил]сульфанил}пиридин-3-ил)метанола HCl соли (2.5 г, 6.5ммоль) в 5% NaHCO3 (100мл) добавили Fmoc OSU (2.4 г, 7.1ммоль) в диоксане (50мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 16 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-50% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[(5-бромо-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]карбамата ( 1.9 г, 50%, 4 стадии) в виде серо-белого осадка. LC-MS: 583.0 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(5-бромо-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]карбамата (2.3 г, 3.9ммоль) в ДХМ:ТГФ (1:1, 40 мл) добавили MnO2 (3.4 г, 39.6ммоль) и реакционную массу перемешивали при 25°C в течение 16 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({5-бромо-3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]фенил}метил)карбамата (1.9 г, 82%) в виде серо-белого осадка с чистотой 97.5%. LC-MS: 580.8 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.26 (2H, d, J = 5.8 Hz), 4.29 (2H, d, J = 6.8 Hz), 7.33 (2H, t, J = 7.3 Hz), 7.41 (3H, q, J = 5.8, 4.4 Hz), 7.51 (1H, s), 7.68 (2H, d, J = 7.4 Hz), 7.86 - 7.91 (4H, m), 8.38 (1H, d, J = 7.4 Hz),8.43 (1H, d, J = 3.3 Hz), 10.18 (1H, s).
Промежуточное соединение 60
9H-флуорен-9-илметил N-({6-бромо-3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]фенил}метил)карбамат

К перемешанному раствору 2-меркаптоникотиновой кислоты (2.4 г, 15.5ммоль) в ДМФ (25мл) добавили NaH (60%, 1.23 г, 30.95ммоль) и реакционную массу перемешивали при 25°C в течение 30 мин. Затем 6-бромо-3-хлор-2-фтор-бензальдегид (4.05 г, 17.05ммоль) добавили и реакционную смесь перемешивали при 90°C в течение 16 ч. Затем K2CO3 (6.4 г, 46.4ммоль) добавили с последующим добавлением MeI (2.9мл, 46.4ммоль) и реакционную массу перемешивали при 25°C в течение 5 ч. Реакционную смесь погасили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 0-30% этилацетата в гексане с получением метил 2-[(3-бромо-6-хлор-2-формилфенил)сульфанил]пиридин-3-карбоксилата (4 г, 67%) в виде желтого осадка. LC-MS: 387.9 [M+H]+
К перемешанному раствору метил 2-[(3-бромо-6-хлор-2-формилфенил)сульфанил]пиридин-3-карбоксилата (5.0 г,12.9ммоль) в ТГФ(50мл) добавили 2-метилпропан-2-сульфинамид (1.57 г, 12.9ммоль), Ti(OEt)4 (8.147 мл, 38.9ммоль) и реакционную массу нагревали до 70°C в течение 45 мин. Реакционную массу погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через слой целита, промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением этил 2-({3-бромо-6-хлор-2-[(1E)-[(2-метилпропан-2-сульфинил)имино]метил]фенил}сульфанил)пиридин-3-карбоксилата (6 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 504.6 [M+H]+
К перемешанному раствору этил 2-({3-бромо-6-хлор-2-[(1E)-[(2-метилпропан-2-сульфинил)имино]метил]фенил}сульфанил)пиридин-3-карбоксилата (6.0 г, 11.9ммоль) в ТГФ (50мл) добавили LAH (2M в ТГФ, 8.9мл, 17.9ммоль) при 0°C и реакционную массу перемешивали при 0°C в течение 1 ч. Реакционную смесь погасили насыщенным раствором сульфата натрия и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении .Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 50-90% этилацетата в гексане с получением N-[(6-бромо-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]-2-метилпропан-2-сульфинамида (4.0 г) в виде серо-белого осадка. LC-MS: 464.9 [M+H]+
К перемешанному раствору N-[(6-бромо-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]-2-метилпропан-2-сульфинамида (4.0 г, 8.6ммоль) в MeOH(40мл), добавили 4M HCl в диоксане (20мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 20 мин. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-3-бромо-6-хлорфенил]сульфанил}пиридин-3-ил)метанола HCl соли (4 г), которую сразу использовали на следующей стадии.
К перемешанной суспензии (2-{[2-(аминометил)-3-бромо-6-хлорфенил]сульфанил}пиридин-3-ил)метанола HCl соли (4.0 г, 11.1ммоль) в 5% NaHCO3(25мл) добавили Fmoc-OSU (3.7 г, 11.1ммоль) в CH3CN (25мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 3 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(6-бромо-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]карбамата (4.5 г), который сразу использовали на следующей стадии. LC-MS: 582.8 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(6-бромо-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]карбамата (2.0 г, 3.4ммоль) в ДХМ:ТГФ (1:1, 40мл) добавили MnO2(3 г, 34.4ммоль) и реакционную массу перемешивали при 25°C в течение 1 ч. Реакционную массу отфильтровали через слой целита, фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 0-10% метанола в ДХМ с получением 9H-флуорен-9-илметил N-({6-бромо-3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]фенил}метил)карбамата (1.3 г) в виде серо-белого осадка с чистотой 90.7% ЖХМС. LC-MS: 581.1 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.14 - 4.25 (3H, m), 4.46 (2H, d, J = 3.9 Hz), 7.31 (2H, t, J = 7.5 Hz), 7.34 - 7.45 (3H, m), 7.48 - 7.54 (1H, m), 7.56 (1H, d, J = 8.5 Hz), 7.67 (2H, d, J = 7.4 Hz), 7.81 (1H, d, J = 8.6 Hz),7.88 (2H, d, J = 7.6 Hz), 8.37 (1H, d, J = 7.5 Hz), 8.44 (1H, dd, J = 4.8, 1.8 Hz), 10.19 (1H, s).
Промежуточное соединение 61
9H-флуорен-9-илметил N-({2-[(3-формилпиридин-2-ил)сульфанил]-3,5-бис(трифторметил)фенил}метил)карбамат
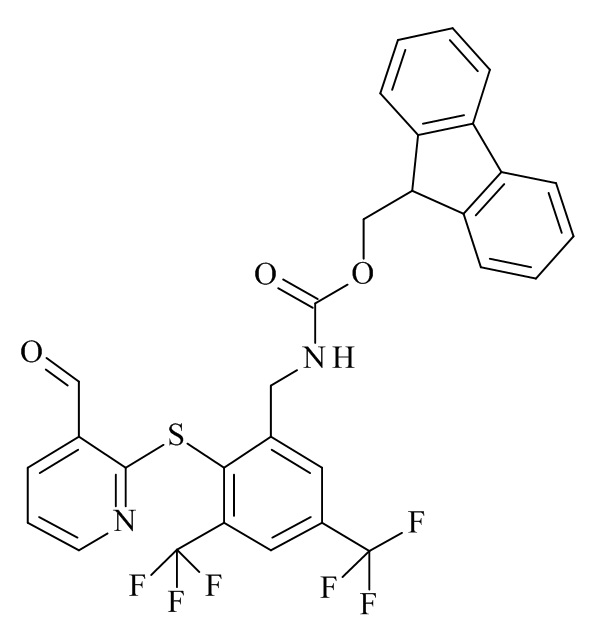
К перемешанному раствору 1-фтор-2,4-бис(трифторметил)бензола (3 г, 12.9ммоль), TMEDA( 2.3мл, 15.5ммоль) в ТГФ (30мл) добавили nBuLi (2.2M в ТГФ, 6.4мл, 14.2ммоль) при -78 o C и реакционную массу перемешивали при -78°C в течение 1 ч. Затем 1-формилпиперидин (2.2мл, 19.4ммоль) добавили в реакционную смесь при -78°C и её перемешивали при -78°C в течение 1 ч и затем при 25°C в течение 1 ч. Реакционную массу погасили насыщенным раствором хлорида аммония и экстрагировали пентаном. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением 2-фтор-3,5-бис(трифторметил)бензальдегида (2.2 г).
К перемешанному раствору 2-меркаптоникотиновой кислоты (3.9 г,25.4ммоль) в ДМФ (50мл) добавили NaH (60%, 1.8 г, 46.1ммоль) и реакционную массу перемешивали при 25°C в течение 30 мин. Затем 2-фтор-3,5-бис(трифторметил)бензальдегид (6 г, 23.1ммоль) добавили и реакционную смесь перемешивали при 70°C в течение 4 ч. Затем K2CO3 (9.6 г, 69.2ммоль) добавили с последующим добавлением MeI (4.3мл, 69.2 ммоль) и реакционную массу перемешивали при 25°C в течение 16 ч. Реакционную смесь погасили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-8% этилацетата в гексане с получением метил 2-{[2-формил-4,6-бис(трифторметил)фенил]сульфанил}пиридин-3-карбоксилата (1.4 г,11%, 2 стадии) в виде желтого осадка. LC-MS: 409.5
К перемешанному раствору метил 2-{[2-формил-4,6-бис(трифторметил)фенил]сульфанил}пиридин-3-карбоксилата (1.4 г, 3.4ммоль) в ТГФ(10мл) добавили 2-метилпропан-2-сульфинамид (415мг, 3.4 моль), Ti(OEt)4 (3.6мл, 17.1ммоль) и реакционную массу нагревали до 70°C в течение 1 ч. Реакционную массу погасили насыщенным раствором хлорида аммония. Полученный осадок отфильтровали через слой целита и промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением этил 2-({2-[(1E)-[(2-метилпропан-2-сульфинил)имино]метил]-4,6-бис(трифторметил)фенил}сульфанил)пиридин-3-карбоксилата (1.6 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 527.1 [M+H]+
К перемешанному раствору этил 2-({2-[(1E)-[(2-метилпропан-2-сульфинил)имино]метил]-4,6-бис(трифторметил)фенил}сульфанил)пиридин-3-карбоксилата (1.5 г, 2.8ммоль) в ТГФ (15мл) добавили LAH (2M в ТГФ, 2.13мл,4.3ммоль) при 0°C и реакционную массу перемешивали при 0°C в течение 2 ч. Реакционную смесь погасили насыщенным раствором сульфата натрия и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-60% этилацетата в гексане с получением N-[(2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-3,5-бис(трифторметил)фенил)метил]-2-метилпропан-2-сульфинамида (800мг, 48%, 2стадии) в виде серо-белого осадка. LC-MS: 486.7 [M+H]+
К перемешанному раствору N-[(2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-3,5-бис(трифторметил)фенил)метил]-2-метилпропан-2-сульфинамида (800мг,1.6ммоль) в MeOH (8мл), добавили 4M HCl в диоксане (4 мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-4,6-бис(трифторметил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (650мг, неочищенный), которую сразу использовали на следующей стадии. LC-MS: 382.8 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-4,6-бис(трифторметил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (650мг, 1.6ммоль) в 5% NaHCO3 (100мл) добавили Fmoc-OSU (523мг, 1.6ммоль) в ацетонитриле (20 мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-3,5-бис(трифторметил)фенил)метил]карбамата (950 мг) в виде серо-белого осадка. LC-MS: 605.2 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-3,5-бис(трифторметил)фенил)метил]карбамата (950мг, 1.6ммоль) в ДХМ/ТГФ(1:1, 20мл) добавили MnO2 (2.7 г, 31.46ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита. Фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 5-20% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({2-[(3-формилпиридин-2-ил)сульфанил]-3,5-бис(трифторметил)фенил}метил)карбамата (600 мг) в виде серо-белого осадка с чистотой 95% ЖХМС. LC-MS: 602.9 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.22 (1H, d, J = 6.8 Hz), 4.29 (4H, d, J = 6.8 Hz), 7.31 (2H, t, J = 7.4 Hz), 7.41 (3H, t, J = 6.0 Hz), 7.67 (2H, d, J = 7.5 Hz), 7.89 (2H, d, J = 7.4 Hz), 7.94 (1H, s), 8.01 (1H, s), 8.12 (1H, s), 8.41 (2H, d, J = 7.2 Hz), 10.18 (1H, s).
Промежуточное соединение 62
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(морфолин-4-ил)фенил}метил)карбамат

К перемешанному раствору N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (1.5 г, 2.6ммоль) в толуоле (10мл) добавили морфолин (272мг, 3.1ммоль) и трет-бутоксид натрия (675мг, 7.0ммоль) и дегазировали в атмосфере аргона в течение 5 мин. Затем к нему добавили 2-дитретбутилфосфинобифенил (70мг, 0.2ммоль) и Pd(dba)2 (120мг, 0.21ммоль) и нагревали до 110°C в течение 16 ч. Реакционную смесь отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью колоночной хроматографии на системе Combiflash с использоанием 20-80% этилацетата в гексане с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(морфолин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (530 мг) в виде коричневого вязкого осадка. LC-MS: 584.3 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(морфолин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (530 мг, 0.9ммоль) в MeOH (10мл), добавили 4M HCl в диоксане (5мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(морфолин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (500 мг), которую сразу использовали на следующей стадии. LC-MS: 365.8 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-(морфолин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (500мг, 1.4ммоль) в 5% NaHCO3 (10мл) добавили Fmoc-OSU (461мг, 1.4ммоль) в ацетонитриле (10мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 16 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(морфолин-4-ил)фенил)метил]карбамата (530 мг) в виде серо-белого осадка. LC-MS: 588.2 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(морфолин-4-ил)фенил)метил]карбамата (530мг, 0.90ммоль) в ДХМ:ТГФ (1:1, 40мл) добавили MnO2 (1.18 г, 13.5ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили посредством колоночной хроматографии с использованием 30-80% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(морфолин-4-ил)фенил}метил)карбамата (230 мг, 42%, 3 стадии) в виде серо-белого осадка. LC-MS: 585.8 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 3.19 (4H, s), 3.70 (4H, s), 4.18 - 4.28 (5H, m), 6.91 (1H, s), 7.07 (1H, s), 7.27 - 7.36 (3H, m), 7.41 (2H, d, J = 7.2 Hz), 7.69 (2H, d, J = 6.9 Hz), 7.79 (1H, s), 7.90 (2H, d, J = 7.7 Hz), 8.32 (1H, d, J = 6.5 Hz), 8.42 (1H, s), 10.20 (1H, s).
Промежуточное соединение 63
(9H-флуорен-9-ил)метил 3-хлор-2-((3-формилпиразин-2-ил)тио)-5-(трифторметил)бензилкарбамат
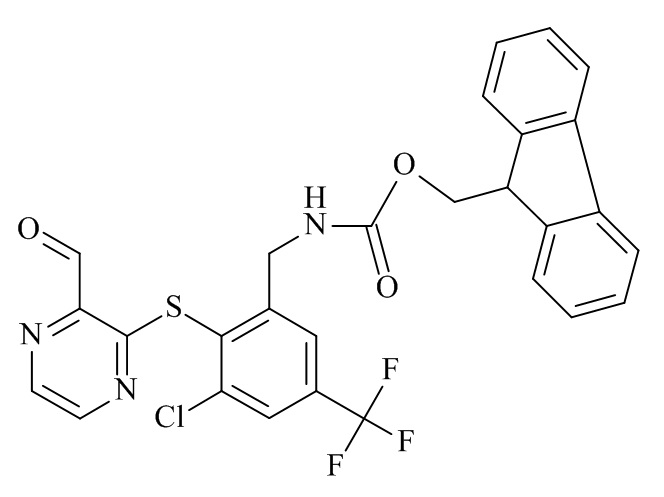
Смесь 3-меркаптопиразин-2-карбоновой кислоты (1 г, 6.4 ммоль, Экв: 1), 3-хлор-2-фтор-5-(трифторметил)бензальдегида (1.45 г, 942 μl, 6.4 ммоль, Экв: 1) и K2CO3 (1.77 г, 12.8 ммоль, Экв: 2) в ДМФ (10.7 мл) перемешивали при 60°C в течение 2 ч. Реакционную смесь охладили до комнатной температуры. Затем йодометан (4.54 г, 2 мл, 32 ммоль, Экв: 5) добавили и перемешивание при комнатной температуре продолжили в течение 2 ч. Реакционную смесь сконцентрировали под вакуумом. Остаток обработали водой и экстрагировали EtOAc. Органические слои промыли водой и солевым раствором, высушили над Na2SO4 и сконцентрировали под вакуумом. Метил 3-((2-хлор-6-формил-4-(трифторметил)фенил)тио)пиразин-2-карбоксилат получили в виде коричневого осадка (1.84 г) и использовали без дополнительной очистки. MS ESI (m/z): 377.0 [(M+H)+]
К смеси метил 3-((2-хлор-6-формил-4-(трифторметил)фенил)тио)пиразин-2-карбоксилата (1.84 г, 4.88 ммоль, Экв: 1), 2-метилпропан-2-сульфинамида (592 мг, 4.88 ммоль, Экв: 1) в ТГФ (20.4 мл) добавили этоксид титана (IV) (5.57 г, 5.12 мл, 24.4 ммоль, Экв: 5). Реакционную смесь нагрели до 70°C и перемешивали в течение 2 ч. Смесь погасили солевым раствором, отфильтровали через стекловолокнистую бумагу и промыли несколько раз с помощью EtOAc. Органические слои промыли солевым раствором, высушили над Na2SO4 и сконцентрировали под вакуумом. Этил 3-((2-(((трет-бутилсульфинил)имино)метил)-6-хлор-4-(трифторметил)фенил)тио)пиразин-2-карбоксилат получили в виде светло-коричневого осадка (2.26 г) и использовали без дополнительной очистки. MS ESI (m/z): 494.2 [(M+H)+]
К смеси этил 3-((2-(((трет-бутилсульфинил)имино)метил)-6-хлор-4-(трифторметил)фенил)тио)пиразин-2-карбоксилата (2.2 г, 3.56 ммоль, Экв: 1) и хлорида кальция (1.38 г, 12.5 ммоль, Экв: 3.5) в этаноле (14.8 мл) и ТГФ (20.8 мл) добавили NaBH4 (607 мг, 16 ммоль, Экв: 4.5) при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч, затем при комнатной температуре в течение 1 ч. Смесь погасили при 0°C насыщ. водн. раствором NH4Cl, экстрагировали этилацетатом и органические слои промыли водой. Объединенные органические слои высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. N-(3-хлор-2-((3-(гидроксиметил)пиразин-2-ил)тио)-5-(трифторметил)бензил)-2-метилпропан-2-сульфинамид получили в виде светло-коричневой пены (2.0 г) и использовали без дополнительной очистки. MS ESI (m/z): 454.2 [(M+H)+]
К смеси N-(3-хлор-2-((3-(гидроксиметил)пиразин-2-ил)тио)-5-(трифторметил)бензил)-2-метилпропан-2-сульфинамида (2 г, 3.52 ммоль, Экв: 1) в MeOH (17.6 мл) добавили 4M HCl в диоксане (8.81 мл, 35.2 ммоль, Экв: 10) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь сконцентрировали под вакуумом. (3-((2-(аминометил)-6-хлор-4-(трифторметил)фенил)тио)пиразин-2-ил)метанола гидрохлорид получили в виде черно-коричневой пены (2.3 г) и использовали без дополнительной очистки. MS ESI (m/z): 350.1 [(M+H)+]
К смеси (3-((2-(аминометил)-6-хлор-4-(трифторметил)фенил)тио)пиразин-2-ил)метанола гидрохлорида (2.3 г, 3.57 ммоль, Экв: 1) и бикарбоната натрия (600 мг, 7.15 ммоль, Экв: 2) в ацетонитриле (11.9 мл) и воде (11.9 мл) добавили Fmoc-OSu (1.21 г, 3.57 ммоль, Экв: 1). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Снова добавили Fmoc-OSu (120мг, 0.1 экв) и смесь перемешивали в течение дополнительного 1 ч. Смесь затем разбавили EtOAc и водой, экстрагировали этилацетатом и органические слои промыли водой. Объединенные органические слои высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. (9H-флуорен-9-ил)метил 3-хлор-2-((3-(гидроксиметил)пиразин-2-ил)тио)-5-(трифторметил)бензилкарбамат получили в виде желтой пены (2.7 г) и использовали без дополнительной очистки. MS ESI (m/z): 572.2 [(M+H)+]
К раствору (9H-флуорен-9-ил)метил 3-хлор-2-((3-(гидроксиметил)пиразин-2-ил)тио)-5-(трифторметил)бензилкарбамата (2.7 г, 3.54 ммоль, Экв: 1) в ДХМ (50.6 мл) добавили периодинан Десса-Мартина (1.8 г, 4.25 ммоль, Экв: 1.2) при 0°C. Охлаждающую ванну удалили и смесь перемешивали 30 мин при комнатной температуре. Смесь разбавили насыщ. водн. раствором NaHCO3 и экстрагировали EtOAc. Органические слои промыли насыщ. водн. раствором Na2S2O3, объединили, высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью хроматографии на силикагеле с использованием гептана/ EtOAc в качестве элюента. Полученный материал тритурировали с EtOAc. Соединение, указанное в заголовке (9H-флуорен-9-ил)метил 3-хлор-2-((3-формилпиразин-2-ил)тио)-5-(трифторметил)бензилкарбамат получили в виде светло-желтого осадка (1.02 г). MS ESI (m/z): 570.2 [(M+H)+]
Промежуточное соединение 64
(9H-флуорен-9-ил)метил 3-хлор-2-((3-формилпиразин-2-ил)тио)-6-(трифторметил)бензилкарбамат

Это соединение получили по аналогии с Промежуточным соединением 63 с использованием в качестве исходного вещества 3-хлор-2-фтор-6-(трифторметил)бензальдегида и 3-меркаптопиразин-2-карбоновой кислоты. Соединение, указанное в заголовке, получили в виде светло-желтой пены (0.454 г). MS ESI (m/z): 570.2 [(M+H)+]
Промежуточное соединение 65
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пиридин-3-ил)фенил}метил)карбамат

К перемешанному раствору 2-меркаптоникотиновой кислоты (10.8 г, 69.5ммоль) в ДМФ (150мл) добавили NaH (60%, 5.1 г, 126.3ммоль) и реакционную массу перемешивали при 25°C в течение 30 мин. Затем 5-бромо-3-хлор-2-фтор-бензальдегид (15 г, 63.2ммоль) добавили и реакционную смесь перемешивали при 70°C в течение 4 ч. Затем K2CO3 (26.2 г, 189.5ммоль) добавили с последующим добавлением MeI (11.8мл, 189.58ммоль) и реакционную массу перемешивали при 25°C в течение 16 ч. Реакционную смесь погасили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 0-8% этилацетата в гексане с получением метил 2-[(4-бромо-2-хлор-6-формилфенил)сульфанил]пиридин-3-карбоксилата (12 г, 49%) в виде желтого осадка.
К перемешанному раствору метил 2-[(4-бромо-2-хлор-6-формилфенил)сульфанил]пиридин-3-карбоксилата (15 г, 38.9ммоль) в ТГФ (80мл) добавили 2-метилпропан-2-сульфинамид (4.7 г, 38.9ммоль), Ti(OEt)4 (40.7мл, 194.3ммоль) и реакционную массу нагревали до 70°C в течение 2 ч. Реакционную массу погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через слой целита и промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением этил 2-({4-бромо-2-хлор-6-[(1Z)-[(2-метилпропан-2-сульфинил)имино]метил]фенил}сульфанил)пиридин-3-карбоксилата (17 г), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 502.7 [M+H]+
К перемешанному раствору этил 2-({4-бромо-2-хлор-6-[(1Z)-[(2-метилпропан-2-сульфинил)имино]метил]фенил}сульфанил)пиридин-3-карбоксилата (17 г, 33.8ммоль) в ТГФ (80мл) добавили LAH (2M в ТГФ, 25.3мл, 50.7ммоль) при 0°C и реакционную массу перемешивали при 0°C в течение 1 ч. Реакционную смесь погасили насыщенным раствором сульфата натрия и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением N-[(5-бромо-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]-2-метилпропан-2-сульфинамида (16 г) в виде серо-белого осадка. LC-MS: 464.8 [M+H]+
К перемешанному раствору соединения N-[(5-бромо-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]-2-метилпропан-2-сульфинамида (6 г, 12.9ммоль) в ДХМ (60мл) добавили имидазол (2.6 г, 38.8ммоль) и TBDMSCl (2.9 г, 19.4ммоль) при 0°C и перемешивали при 25°C в течение 3 ч. Реакционную массу погасили водным раствором NaHCO3 и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью колоночной хроматографии на системе Combiflash с использованием 5-20% этилацетата в гексане с получением N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (6 г, 69%) в виде серо-белого осадка. LC-MS: 578.8 [M+H]+
К перемешанному раствору соединения N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (2 г, 3.5ммоль) в диоксане (20 мл) добавили пиридин-3-бороновую кислоту ( 553мг, 4.5ммоль), Na2CO3 (1.1 г, 10.4ммоль), воду (10мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем к ней добавили Pd(PPh3)4 (200мг, 0.17ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита, промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом с получением неочищенного соединения, которое очистили с помощью обычной колонки с силикагелем с использованием 5-80% этилацетата в гексане с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(пиридин-3-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.3 г, 65%) в виде желтого осадка. LC-MS: 576.2 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(пиридин-3-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.3 г, 2.2ммоль) в MeOH (20мл), добавили 4M HCl в диоксане (10мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(пиридин-3-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (900мг, неочищенный), которую сразу использовали на следующей стадии. LC-MS: 358.0 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-(пиридин-3-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (900мг, 2.3ммоль) в 5% NaHCO3 (20мл) добавили Fmoc-OSU (769мг, 2.3ммоль) в ацетонитриле (30мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пиридин-3-ил)фенил)метил]карбамат (1.2 г, неочищенный) в виде серо-белого осадка. LC-MS: 580.0 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пиридин-3-ил)фенил)метил]карбамата (1.2 г, 2.1ммоль) в ДХМ:ТГФ (1:1, 40мл) добавили MnO2 (3.6 г, 41.4ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-20% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пиридин-3-ил)фенил}метил)карбамата (700 мг, 53%, 3 стадии ) в виде серо-белого осадка с чистотой 93.6%. LC-MS: 577.9 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.21 (1H, d, J = 7.0 Hz), 4.28 (2H, d, J = 6.9 Hz), 4.37 (2H, d, J = 5.5 Hz), 7.25 (2H, t, J = 7.4 Hz), 7.33 - 7.44 (3H, m), 7.55 (1H, dd, J = 7.7, 4.9 Hz), 7.67 (2H, d, J = 7.6 Hz), 7.73 (1H, s), 7.87 (2H, d, J = 7.8 Hz), 7.96 (1H, s), 8.15 (1H, d, J = 7.2 Hz), 8.38 (1H, d, J = 6.7 Hz), 8.45 (1H, d, J = 3.3 Hz), 8.67 (1H, d, J = 3.9 Hz), 8.98 (1H, s), 10.22 (1H, s).
Промежуточное соединение 66
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пиридин-4-ил)фенил}метил)карбамат
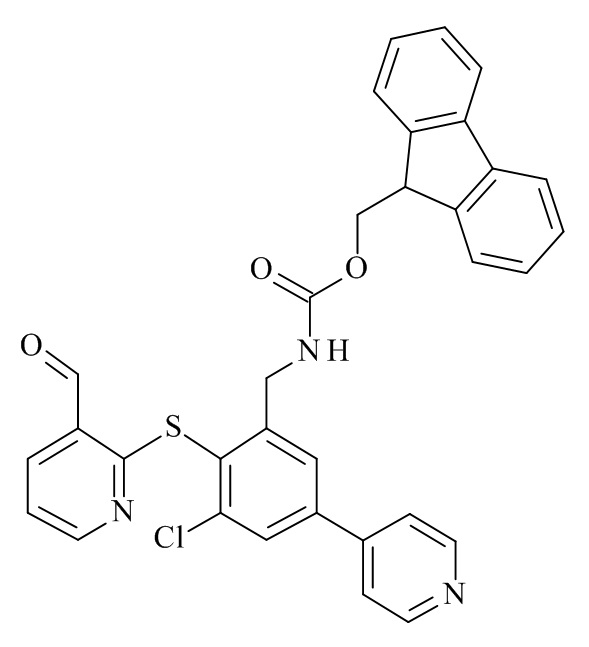
К перемешанному раствору соединения N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (2 г, 3.5ммоль) в диоксане (20 мл) добавили пиридин-4-бороновую кислоту ( 553мг, 4.5ммоль), Na2CO3 (1.1 г, 10.4ммоль), воду (10мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в него добавили Pd(PPh3)4 (200мг, 0.17ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита, промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом с получением неочищенного соединения, которое очистили с помощью обычной колонки с силикагелем с использованием 5-80% этилацетата в гексане с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(пиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.2 г, 60%) в виде желтого осадка. LC-MS: 576.1 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(пиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.2 г, 2.1ммоль) в MeOH (20мл), добавили 4M HCl в диоксане (10мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 1 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(пиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (850мг, неочищенный), которую сразу использовали на следующей стадии. LC-MS: 357.8 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-(пиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (850мг, 2.1ммоль) в 5% NaHCO3 (20мл) добавили Fmoc-OSU (726мг, 2.1ммоль) в ацетонитриле (30мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пиридин-4-ил)фенил)метил]карбамата (1.1 г, неочищенный) в виде серо-белого осадка. LC-MS: 579.9 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пиридин-4-ил)фенил)метил]карбамата (1.1 г, 1.9 ммоль) в ДХМ:ТГФ (1:1, 40мл) добавили MnO2 (3.3 г, 37.9ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 5-20% этилацетат в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пиридин-4-ил)фенил}метил)карбамата (650 мг) в виде серо-белого осадка с чистотой 95% ЖХМС. LC-MS: 578.0 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.16 - 4.25 (1H, m), 4.28 (2H, d, J = 6.5 Hz), 4.34 - 4.40 (2H, m), 7.26 (2H, t, J = 7.4 Hz), 7.39 (3H, t, J = 7.3 Hz), 7.67 (2H, d, J = 7.3 Hz), 7.75 (3H, d, J = 5.3 Hz), 7.88 (2H, d, J = 7.4 Hz), 8.01 (1H, s), 8.38 (1H, d, J = 6.9 Hz), 8.44 (1H, d, J = 4.6 Hz), 8.69 (2H, d, J = 5.6 Hz), 10.22 (1H, s).
Промежуточное соединение 67
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(2-метоксипиридин-4-ил)фенил}метил)карбамат

К перемешанному раствору соединения N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (1.5 г, 2.6 ммоль) в диоксане (10мл) добавили (2-метоксипиридин-4-ил)бороновую кислоту (516мг, 3.4ммоль), Na2CO3 (825мг, 7.8ммоль), воду (5мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем к нему добавили Pd(PPh3)4 (150мг, 0.13 ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагрели до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита и промыли с помощью EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(2-метоксипиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.5 г) в виде желтого осадка. LC-MS: 605.8 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(2-метоксипиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.5 г, 2.5ммоль) в MeOH (30мл), добавили 4M HCl в диоксане (15мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(2-метоксипиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (950 мг), которую сразу использовали на следующей стадии. LC-MS: 388.8 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-(2-метоксипиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (950мг, 2.2ммоль) в 5% NaHCO3 (20мл) добавили Fmoc-OSU (754мг, 2.2ммоль) в ацетонитриле (30мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(2-метоксипиридин-4-ил)фенил)метил]карбамата (1.3 г) в виде серо-белого осадка. LC-MS: 609.9 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(2-метоксипиридин-4-ил)фенил)метил]карбамата (1.3 г, 2.1ммоль) в ДХМ:ТГФ (1:1, 40мл) добавили MnO2 (3.7 г, 42.6ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 5-20% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(2-метоксипиридин-4-ил)фенил}метил)карбамата (650 мг) в виде серо-белого осадка с чистотой 96.9% ЖХМС purity. LC-MS: 608 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 3.92 (3H, s), 4.21 (1H, d, J = 6.3 Hz), 4.27 (2H, d, J = 6.7 Hz), 4.36 (2H, d, J = 5.8 Hz), 7.20 (1H, s), 7.26 (2H, t, J = 7.3 Hz), 7.37 (4H, dd, J = 16.2, 7.0 Hz), 7.67 (2H, d, J = 7.3 Hz), 7.76 (1H, s), 7.84 - 7.93 (3H, m), 7.98 (1H, s), 8.28 (1H, d, J = 5.3 Hz), 8.38 (1H, d, J = 7.8 Hz), 8.44 (1H, d, J = 5.6 Hz), 10.21 (1H, s).
Промежуточное соединение 68
(9H-флуорен-9-ил)метил 3,6-дихлор-2-((2-формилпиридин-3-ил)тио)бензилкарбамат

Это соединение получили по аналогии с Промежуточным соединением 63 с использованием в качестве исходного вещества 3,6-дихлор-2-фторбензальдегида и 3-меркаптопиколиновой кислоты вплоть до второй последней стадии. Последня стадия: Смесь (9H-флуорен-9-ил)метил 3,6-дихлор-2-((2-(гидроксиметил)пиридин-3-ил)тио)бензилкарбамата (18 мг, 33.5 мкмоль, Экв: 1) и диоксида марганца (58.2 мг, 670 мкмоль, Экв: 20) в ТГФ (335 мкл) и ДХМ (335 мкл) перемешивали при комнатной температуре в течение 1 ч. Получившуюся смесь отфильтровали через стекловолкнистое стекло и промыли с помощью ДХМ. Фильтрат сконцентрировали под вакуумом. Соединение, указанное в заголовке, получили в виде белого осадка. MS ESI (m/z): 535.2 [(M+H)+]
Промежуточное соединение 69
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(2-метилпиридин-4-ил)фенил}метил)карбамат

К перемешанному раствору соединения N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (1.5 г, 2.6ммоль) в диоксане (10мл) добавили (2-метилпиридин-4-ил)бороновую кислоту (462мг, 3.4ммоль), Na2CO3 (825мг, 7.8ммоль), воду (5мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в него добавили Pd(PPh3)4 (150мг, 0.13ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита и промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(2-метилпиридин-4-ил)фенил}метил) -2-метилпропан-2-сульфинамида (1.5 г, неочищенный) в виде желтого осадка. LC-MS: 589.8 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(2-метилпиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.5 г, 2.5ммоль) в MeOH (30мл), добавили 4M HCl в диоксане (15мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(2-метилпиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (940 мг), которую сразу использовали на следующей стадии. LC-MS: 371.8 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-(2-метилпиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (940мг, 2.3ммоль) в 5% NaHCO3 (20мл) добавили Fmoc-OSU (776мг, 2.2ммоль) в ацетонитриле (30мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(2-метилпиридин-4-ил)фенил)метил]карбамата (1.3 г, неочищенный) в виде серо-белого осадка. LC-MS: 593.8 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(2-метилпиридин-4-ил)фенил)метил]карбамата (1.3 г, 2.19ммоль) в ДХМ/ТГФ(1:1, 40мл) добавили MnO2 (3.8 г, 43.8ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-20% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(2-метилпиридин-4-ил)фенил}метил)карбамата (600 мг) в виде серо-белого осадка с чистотой 86% ЖХМС. LC-MS: 592.0 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 2.50 (3H, s), 4.21 (1H, d, J=6.7 Hz), 4.28 (2H, d, J = 6.6 Hz), 4.37 (2H, d, J = 5.1 Hz), 7.25 (2H, t, J = 7.5 Hz), 7.34 - 7.43 (3H, m), 7.50 - 7.60 (3H, m), 7.57 - 7.71 (6H, m), 7.76 (1H, s), 7.84 - 7.95 (3H, m), 7.98 (1H, s), 8.39 (1H, d, J = 7.5 Hz), 8.44 (1H, d, J = 3.3 Hz), 8.55 (1H, d, J = 5.2 Hz), 10.22 (1H, s).
Промежуточное соединение 70
9H-флуорен-9-илметил N-{[5-(6-{[(трет-бутокси)карбонил]амино}пиридин-3-ил)-3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]фенил]метил}карбамат

К перемешанному раствору соединения N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (600мг, 1.0ммоль) в диоксане (5мл) добавили 5-(тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-амин (296мг, 1.3ммоль), Na2CO3 (330мг, 3.1ммоль), воду (2.5мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем к нему добавили Pd(PPh3)4 (60мг,0.05ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита и промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 10-70% этилацетата в гексане с получением N-{[5-(6-аминопиридин-3-ил)-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил]метил}-2-метилпропан-2-сульфинамида (500 мг) в виде желтого осадка. LC-MS: 590.8 [M+H]+
К перемешанному раствору N-{[5-(6-аминопиридин-3-ил)-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил]метил}-2-метилпропан-2-сульфинамида (500мг, 1.1ммоль) в MeOH (10мл), добавили 4M HCl в диоксане (5мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-4-(6-аминопиридин-3-ил)-6-хлорфенил]сульфанил}пиридин-3-ил)метанола HCl соли (450 мг), которую сразу использовали на следующей стадии. LC-MS: 372.8 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-4-(6-аминопиридин-3-ил)-6-хлорфенил]сульфанил}пиридин-3-ил)метанола HCl соли (450мг, 1.1ммоль) в 5% NaHCO3 (10мл) добавили Fmoc-OSU (370мг, 1.1ммоль) в ацетонитриле (15мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-{[5-(6-аминопиридин-3-ил)-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата (600 мг) в виде серо-белого осадка. LC-MS: 594.9 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-{[5-(6-аминопиридин-3-ил)-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата (550мг, 0.9ммоль) в трет-бутаноле (30мл) добавили boc-ангидрид (242мг,1.1ммоль) и реакционную массу перемешивали при 25°C в течение 16 ч. Реакционную массу эвапорировали при пониженном давлении, и полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-40% этилацетат в гексане с получением 9H-флуорен-9-илметил N-{[5-(6-{[(трет-бутокси)карбонил]амино}пиридин-3-ил)-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата (330 мг) в виде желтого осадка. LC-MS: 695.2 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-{[5-(6-{[(трет-бутокси)карбонил]амино}пиридин-3-ил)-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата (350мг, 0.50ммоль) в ДХМ:ТГФ (1:1, 10 мл) добавили MnO2 (875мг, 10.1ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-{[5-(6-{[(трет-бутокси)карбонил]амино}пиридин-3-ил)-3-хлор-2-[(3-формилпиридин-2-ил)сульфанил] фенил]метил}карбамата (220 мг, 63%) в виде серо-белого осадка с чистотой 94.7% ЖХМС. LC-MS: 693.1 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 1.50 (9H, s), 4.21 (1H, d, J = 6.9 Hz), 4.27 (2H, d, J = 7.7 Hz), 4.35 (2H, d, J = 5.3 Hz), 7.27 (2H, t, J = 7.8 Hz), 7.38 (3H, t, J = 7.1 Hz), 7.67 (3H, d, J = 7.8 Hz), 7.85 - 7.92 (5H, m), 8.11 (1H, d, J = 9.5 Hz), 8.33 - 8.41 (1H, m), 8.44 (1H, d, J = 4.2 Hz), 8.66 (1H, s), 10.02 (1H, s), 10.21 (1H, s).
Промежуточное соединение 71
(9H-флуорен-9-ил)метил 3,6-дихлор-2-((3-формилпиразин-2-ил)тио)бензилкарбамат
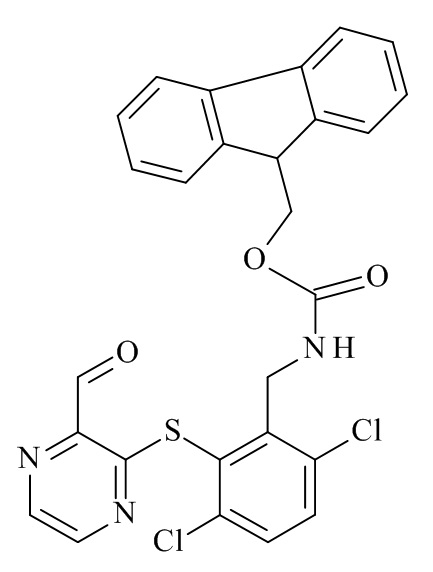
Это соединение получили по аналогии с Промежуточным соединением 68 с использованием в качестве исходного вещества 3,6-дихлор-2-фторбензальдегида и 3-меркаптопиразин-2-карбоновой кислоты. Соединение, указанное в заголовке, получили в виде светло-желтой пены (500 мг). MS ESI (m/z): 536.2 [(M+H)+]
Промежуточное соединение 72
(9H-флуорен-9-ил)метил 3-хлор-2-((2-формилпиридин-3-ил)тио)-6-(трифторметил)бензилкарбамат

Это соединение получили по аналогии с Промежуточным соединением 63 с использованием в качестве исходного вещества 3-хлор-2-фтор-6-(трифторметил)бензальдегида и 3-меркаптопиколиновой кислоты. Соединение, указанное в заголовке, получили в виде светло-коричневого осадка (618 мг). MS ESI (m/z): 569.1 [(M+H)+]
Промежуточное соединение 73
(9H-флуорен-9-ил)метил 3-хлор-2-((2-формилпиридин-3-ил)тио)-5-(трифторметил)бензилкарбамат

Это соединение получили по аналогии с Промежуточным соединением 63 с использованием в качестве исходного вещества 3-хлор-2-фтор-5-(трифторметил)бензальдегида и 3-меркаптопиколиновой кислоты. Соединение, указанное в заголовке, получили в виде коричневого осадка (183 мг). MS ESI (m/z): 569.1 [(M+H)+]
Промежуточное соединение 74
(9H-флуорен-9-ил)метил((2-хлор-3-((2-формилфенил)тио)пиридин-4-ил)метил)карбамат

К смеси 2-меркаптобензоата (2 г, 1.64 мл, 11.5 ммоль, Экв: 1) в ДМФ (19.2 мл) добавили 2-хлор-3-фторизоникотинальдегид (1.86 г, 11.6 ммоль, Экв: 1.01) и K2CO3 (3.17 г, 23 ммоль, Экв: 1.99) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавили водой и экстрагировали с помощью EtOAc. Органические слои промыли солевым раствором, объединили, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью хроматографии на силикагеле с использованием гептана/ EtOAc в качестве растворителя. Метил 2-((2-хлор-4-формилпиридин-3-ил)тио)бензоат получили в виде желтого осадка (2.12 г) и использовали без дополнительной очистки. MS ESI (m/z): 308.1 [(M+H)+]
Смесь метил 2-((2-хлор-4-формилпиридин-3-ил)тио)бензоата (1.28 г, 4.16 ммоль, Экв: 1), ацетата натрия (478 мг, 5.82 ммоль, Экв: 1.4) и гидроксиламина гидрохлорида (376 мг, 5.41 ммоль, Экв: 1.3) в уксусной кислоте (16.6 мл) перемешивали при комнатной температуре в течение 30 мин. Затем цинк (1.36 г, 20.8 ммоль, Экв: 5) добавили и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь погасили водой и экстрагировали с помощью EtOAc. Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Метил 2-((4-(аминометил)-2-хлорпиридин-3-ил)тио)бензоат получили в виде белого осадка (935 мг) и использовали без дополнительной очистки. MS ESI (m/z): 309.1 [(M+H)+]
К смеси метил 2-((4-(аминометил)-2-хлорпиридин-3-ил)тио)бензоата (1 г, 3.24 ммоль, Экв: 1) и бикарбоната натрия (1.36 г, 16.2 ммоль, Экв: 5) в ТГФ (10.8 мл) и воде (10.8 мл) добавили Fmoc-OSu (1.09 г, 3.24 ммоль, Экв: 1) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь отфильтровали через спеченое стекло и промыли диизопропиловым эфиром, осадок собрали и высушили. Метил 2-((4-(((((9H-флуорен-9-ил)метокси)карбонил)амино)метил)-2-хлорпиридин-3-ил)тио)бензоат получили в виде белого осадка (1.9 г) и использовали без дополнительной очистки. MS ESI (m/z): 531.2 [(M+H)+].
К суспензии метил 2-((4-(((((9H-флуорен-9-ил)метокси)карбонил)амино)метил)-2-хлорпиридин-3-ил)тио)бензоата (1.9 г, 3.58 ммоль, Экв: 1) в тетрагидрофуране (24.6 мл) добавили LiBH4 (390 мг, 17.9 ммоль, Экв: 5) и реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Реакцию погасили насыщ. водн. раствором NH4Cl и разбавили водой. Смесь экстрагировали с помощью EtOAc. Объединенные органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью хроматографии на силикагеле с использованием гептана/ EtOAc в качестве элюента. (9H-флуорен-9-ил)метил((2-хлор-3-((2-(гидроксиметил)фенил)тио)пиридин-4-ил)метил)карбамат получили в виде белой пены (716 мг) и использовали без дополнительной очистки. MS ESI (m/z): 503.2 [(M+H)+].
Смесь (9H-флуорен-9-ил)метил((2-хлор-3-((2-(гидроксиметил)фенил)тио)пиридин-4-ил)метил)карбамата (280 мг, 557 мкмоль, Экв: 1) и диоксида марганца (484 мг, 5.57 ммоль, Экв: 10) в ТГФ (3.98 мл) и ДХМ (3.98 мл) перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь отфильтровали через спеченое стекло и сконцентрировали под вакуумом. Соединение, указанное в заголовке, получили в виде белого осадка (265 мг). MS ESI (m/z): 501.2 [(M+H)+]
Промежуточное соединение 75
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-[2-(4-метилпиперазин-1-ил)пиридин-4-ил]фенил}метил)карбамат
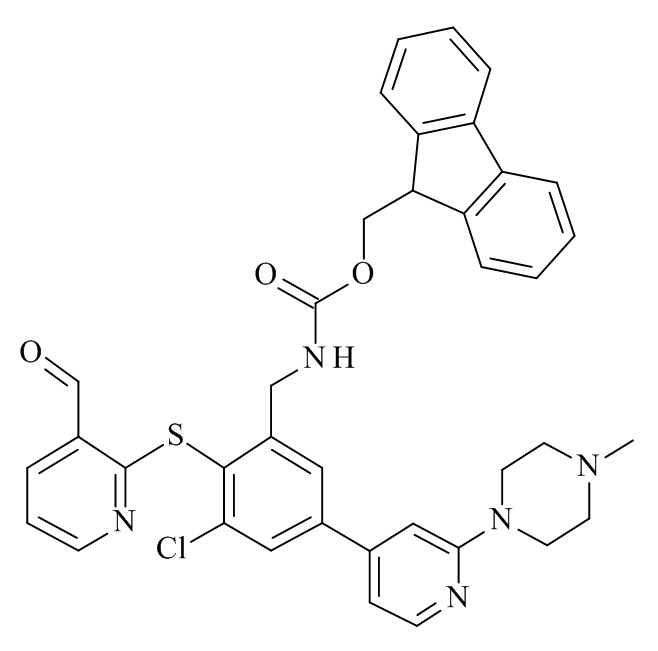
К перемешанному раствору соединения N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (1.5 г, 2.6ммоль) в диоксане (10мл) добавили [2-(4-метилпиперазин-1-ил)пиридин-4-ил]бороновую кислоту (746мг, 3.4ммоль), Na2CO3 (825мг, 7.8ммоль), воду (5мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в него добавили Pd(PPh3)4 (150мг, 0.13ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита и промыли этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-[2-(4-метилпиперазин-1-ил)пиридин-4-ил]фенил}метил)-2-метилпропан-2-сульфинамида (1.6 г) в виде желтого осадка. LC-MS: 674.1 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-[2-(4-метилпиперазин-1-ил)пиридин-4-ил]фенил}метил)-2-метилпропан-2-сульфинамида (1.6 г, 2.4ммоль) в MeOH (30мл), добавили 4M HCl в диоксане (15мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-[2-(4-метилпиперазин-1-ил)пиридин-4-ил]фенил]сульфанил}пиридин-3-ил) метанола HCl соли (1 г), которую сразу использовали на следующей стадии. LC-MS: 456.1 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-[2-(4-метилпиперазин-1-ил)пиридин-4-ил]фенил]сульфанил}пиридин-3-ил) метанола HCl соли (1 г, 2.0ммоль) в 5% NaHCO3 (20мл) добавили Fmoc-OSU (685мг, 2.0ммоль) в ацетонитриле (30мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-[2-(4-метилпиперазин-1-ил)пиридин-4-ил]фенил)метил]карбамата (1.3 г) в виде серо-белого осадка. LC-MS: 678.1 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-[2-(4-метилпиперазин-1-ил)пиридин-4-ил]фенил)метил]карбамата (1.0 г, 1.5ммоль) в ДХМ:ТГФ (1:1, 20 мл) добавили MnO2 (2.5 г, 29.5ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-5% метанола в ДХМ с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-[2-(4-метилпиперазин-1-ил)пиридин-4-ил]фенил}метил)карбамата (600 мг) в виде серо-белого осадка с чистотой 96.5%. LC-MS: 675.8 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 2.22 (3H, s), 2.39 (4H, s), 3.56 (4H, s), 4.26 (3H, d, J = 6.0 Hz), 4.36 (2H, d, J = 4.9 Hz), 6.95 (1H, d, J = 5.4 Hz), 7.11 (1H, s), 7.26 (2H, t, J = 5.9 Hz), 7.34 - 7.42 (3H, m), 7.67 (2H, d, J = 7.3 Hz), 7.72 (1H, s), 7.88 (3H, d, J = 7.8 Hz), 7.98 (1H, s), 8.20 (1H, d, J = 4.9 Hz), 8.38 (1H, d, J = 6.9 Hz), 8.44 (1H, d, J = 2.8 Hz), 10.22 (1H, s).
Промежуточное соединение 76
3-хлор-5-({[(9H-флуорен-9-илметокси)карбонил]амино}метил)-4-[(3-формилпиридин-2-ил)сульфанил]фенил]бороновая кислота
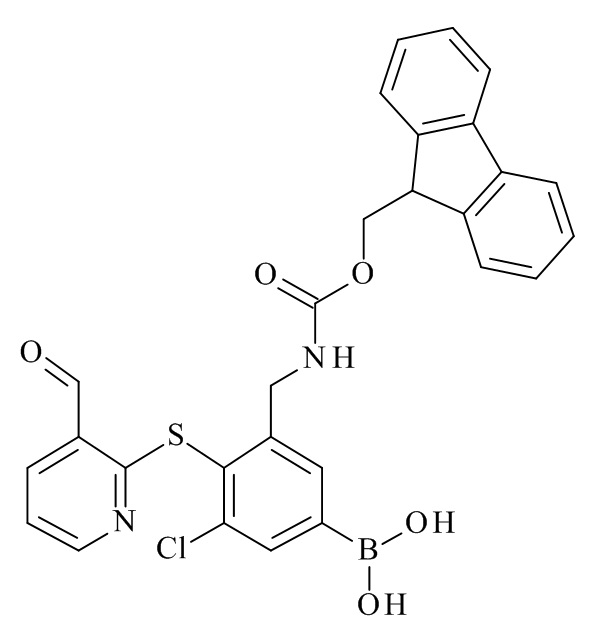
К перемешанному раствору N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (1.5 г, 2.6ммоль) в диоксане (12.0 мл) добавили биспинаколатодиборан (1.6 г, 6.2ммоль) и ацетат калия (1.0 г,10.4ммоль) и дегазировали в атмосфере аргона в течение 5 мин. Затем к нему добавили PdCl2(dppf) (424мг, 0.52ммоль) и нагревали до 110°C в течение 16 ч. Реакционную смесь отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении и фильтрат затем экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.6 г), который сразу использовали на следующей стадии. LC-MS: 625.3 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.6 г, 2.6ммоль) в MeOH (24мл), добавили 4M HCl в диоксане (12мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]сульфанил}пиридин-3-ил)метанола а виде HCl соли (1.6 г), которую сразу использовали на следующей стадии. LC-MS: = 407 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (1.6 г, 3.9ммоль) в 5% NaHCO3 (25мл) добавили Fmoc OSU (1.329 г, 3.9ммоль) в ацетонитриле (25 мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 16 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)метил]карбамата (1.8 г) в виде коричневого вязкого осадка; который использовали на следующей стадии без дополнительной очистки. LC-MS: 629.1 [M+H]
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)метил]карбамата (1.0 г, 1.59ммоль) в ДХМ:ТГФ (1:1, 20мл) добавили MnO2 (3.74 г, 43ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили промывкой этилацетатом с получением [3-хлор-5-({[(9H-флуорен-9-илметокси)карбонил]амино}метил)-4-[(3-формилпиридин-2-ил)сульфанил]фенил]бороновой кислоты (270 мг) в виде серо-белого вязкого осадка. LC-MS: 544.9 [M+H]+
1H-NMR: (400 MHz, DMSO-d6): δ 4.02-4.08 (2H, m), 4.15-4.22 (2H, m), 4.28-4.29 (2H, m) 7.27-7.32 (4H, m), 7.39-7.40 (2H, m), 7.57-7.69 (2H, m), 7.80-7.81 (2H, m), 7.85-7.95 (2H, m); 8.20-8.40 (m; 2H); 10.19 (1H, s).
Промежуточное соединение 77
(9H-флуорен-9-ил)метил 3-хлор-2-((4-формилпиридин-3-ил)тио)-6-(трифторметил)бензилкарбамат

Это соединение получили по аналогии с Промежуточным соединением 63 с использованием в качестве исходного вещества 3-хлор-2-фтор-6-(трифторметил)бензальдегида и 3-меркаптоизоникотиновой кислоты гидрохлорида. Только стадия восстановления проводилаь следующим образом:
К раствору этил 3-((2-(((трет-бутилсульфинил)имино)метил)-6-хлор-3-(трифторметил)фенил)тио)изоникотината (295мг, 598 мкмоль, Экв: 1) в ДХМ (6 мл) добавили по каплям 1M DIBAL-H в ТГФ (1.8 мл, 1.8 ммоль, Экв: 3) при комнатной температуре и перемешивали в течение 2 ч. Реакционную смесь погасили при 0°C насыщенным водн. раствором NH4Cl, разбавили водой и экстрагировали с помощью EtOAc. Объединенные органические слои высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Соединение, указанное в заголовке, получили в виде светло-коричневой пены (183 мг). MS ESI (m/z): 569.1 [(M+H)+]
Промежуточное соединение 78
(9H-флуорен-9-ил)метил 3-хлор-2-((4-формилпиридин-3-ил)тио)-5-(трифторметил)бензилкарбамат

Это соединение получили по аналогии с Промежуточным соединением 77 с использованием в качестве исходного вещества 3-хлор-2-фтор-5-(трифторметил)бензальдегида и 3-меркаптоизоникотиновой кислоты гидрохлорида, за исключением последней стадии, которую выполнили аналогично RO7117947-000. Соединение, указанное в заголовке, получили в виде белого осадка (110 мг). MS ESI (m/z): 569.1 [(M+H)+]
Промежуточное соединение 79
9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-4-фенил-фенил]метил]карбамат

К перемешанному раствору 1-бромо-2-хлор-3-фторбензола (1.0 г, 4.79 ммоль) в толуоле (20мл) добавили фенилбороновую кислоту( 875 мг, 7.18 ммоль), Na2CO3 (1.52 г,14.35 ммоль), воду (5 мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем к нему добавили Pd(PPh3)4 (553 мг, 0.48 ммоль) и снова дегазировали в течение 5 мин. Реакционную смесь нагревали до 100°C в течение 16 ч. Реакционную смесь снова охладили до 25°C, отфильтровали через целит и промыли этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенный продукт, который очистили с помощью колоночной хроматографии на системе Combiflash с использованием гексана с получением 2-хлор-1-фтор-3-фенилбензола (920мг, 93%) в виде желтой вязкой жидкости.
К перемешанному раствору 2-хлор-1-фтор-3-фенилбензола (4.0 г, 19.42 ммоль) в ТГФ (25 мл) добавили LDA (2M в ТГФ,14.4 мл) при -78°C и реакционную массу перемешивали в этих условиях в течение 1 ч. Затем в реакционную смесь добавили ДМФ (5 мл) при -78°C и перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь погасили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного продукта, который очистили колоночной хроматографией на силикагеле с использованием 0-10% этилацетата в гексане с получением 3-хлор-2-фтор-4-фенилбензальдегид в виде светло-желтого осадка (2.5 г, 54%).
К перемешанному раствору 2-меркаптоникотиновой кислоты (3.6 г,23.2 ммоль) в ДМФ (30мл) добавили NaH (60%, 1.11 г, 46.4 ммоль) и реакционную смесь перемешивали при 25°C в течение 30 мин. Затем 3-хлор-2-фтор-4-фенилбензальдегид (5.971 г, 25.519 ммоль) добавили и реакционную смесь перемешивали при 90°C в течение 6 ч. Затем K2CO3 (9.62 г, 69.6 ммоль) добавили с последующим добавлением метилйодида (4.33 мл, 69.597 ммоль) и реакционную смесь перемешивали при 25°C в течение 16 ч. Реакционную смесь погасили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Неочищенный продукт очистили с помощью обычной колонки с силикагелем с использованием 0-20% этилацетата в гексане с получением метил 2-[(2-хлор-6-формил-3-фенил-фенил)сульфанил]пиридин-3-карбоксилата (4.5 г, 50%) в виде вязкого осадка.
LC-MS: m/z = 383.9 (M+H)+ для моноизотопной массы 383.04
К перемешанному раствору метил 2-[(2-хлор-6-формил-3-фенил-фенил)сульфанил]пиридин-3-карбоксилата (4.5 г,11.75 ммоль) в ТГФ (40мл) добавили 2-метилпропан-2-сульфинамид(1.42 г, 11.75 ммоль), Ti(OEt)4 (12.317 мл, 58.747 ммоль) и реакционную смесь нагревали до 70°C в течение 45 мин. Реакционную смесь погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через целит, промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением метил 2-({2-хлор-6-[(1Z)-[(2-метилпропан-2-сульфинил)имино]метил]-3-фенил-фенил}сульфанил)пиридин-3-карбоксилата (4.8 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки.
LC-MS: m/z = 486.8 (M+H)+ для моноизотопной массы 486.08
К перемешанному раствору метил 2-({2-хлор-6-[(1Z)-[(2-метилпропан-2-сульфинил)имино]метил]-3-фенил-фенил}сульфанил)пиридин-3-карбоксилата (4.8 г, 9.88 ммоль) в ТГФ (40мл) добавили LAH (2M в ТГФ, 7.4 мл, 14.81 ммоль) при 0°C и реакционную смесь перемешивали при 0°C в течение 1 ч. Реакционную смесь погасили насыщенным раствором сульфата натрия и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученный неочищенный продукт очистили с помощью обычной колонки с силикагелем с использованием 50-90% этилацетата в гексане с получением N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-4-фенил-фенил)метил]-2-метилпропан-2-сульфинамида (4.0 г, 74% 2 стадии) в виде серо-белого осадка.
LC-MS: m/z = 460.8 (M+H)+ для моноизотопной массы 460.10
К перемешанному раствору N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-4-фенил-фенил)метил]-2-метилпропан-2-сульфинамида (4.0 г, 8.7 ммоль ) в MeOH (40мл), добавили 4M HCl в диоксане(20 мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 3 ч. Растворитель эвапорировали при пониженном давлении с получением (2-{[6-(аминометил)-2-хлор-3-фенил-фенил]сульфанил}пиридин-3-ил)метанола HCl соли (3.5 г, неочищенный), которую сразу использовали на следующей стадии.
LC-MS: m/z = 356.9 (M+H)+ для моноизотопной массы 356.08
К перемешанной суспензии (2-{[6-(аминометил)-2-хлор-3-фенил-фенил]сульфанил}пиридин-3-ил)метанола HCl соли (3.5 г, 9.831 ммоль) в 5% NaHCO3 (25мл) добавили Fmoc OSU (3.32 г, 9.83 ммоль) в CH3CN (25мл) при 25°C и реакционную смесь перемешивали при этой температуре в течение 16 ч. Затем реакционную смесь разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-4-фенил-фенил)метил]карбамата (3.7 г, неочищенный), который сразу использовали на следующей стадии.
LC-MS: m/z = 579.1 (M+H)+ для моноизотопной массы 578.14
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-4-фенил-фенил)метил]карбамата (3.7 г, 6.40 ммоль ) в ДХМ/ТГФ (1:1, 60 мл) добавили MnO2 (5.57 г, 64.01 ммоль) и реакционную смесь перемешивали при 25°C в течение 1 ч. Реакционную смесь отфильтровали через слои целита; фильтрат эвапорировали при пониженном давлении. Неочищенный продукт очистили с помощью обычной колонки с силикагелем с использованием 10-30% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-4-фенил-фенил}метил)карбамата (3.5 г, 70 %) в виде серо-белого осадка.
LC-MS: m/z = 577.0 (M+H)+ для моноизотопной массы 576.13
1H NMR (400 MHz, DMSO-d6) δ 10.20 (s, 1 H), 8.47 (d, 1 H), 8.36 (d, 1 H), 7.89 (d, 2 H), 7.69 (d, 2 H), 7.51 - 7.31 (m, 12 H), 4.33 - 4.29 (m, 4 H), 4.22 (m, 1 H)
Промежуточное соединение 80
9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-5-фенил-3-(трифторметил)фенил]метил]карбамат
К перемешанному раствору 5-бромо-2-фтор-3-трифторметилбензальдегида (4.63 г, 21.4 ммоль) и метил 2-сульфанилбензоата (3.0 г, 17.9 ммоль) в ДМФ (30мл) добавили K2CO3 (4.93 г, 35.7 ммоль) и реакционную смесь перемешивали при 25°C в течение 1 ч. Реакционную смесь разбавили этилацетатом и промыли водой. Отделенный органический слой промыли насыщенным раствором NaCl, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученный неочищенный продукт очистили с помощью колоночной хроматографии на системе Combiflash с использованием 10%EA/гексан с получением метил 2-{[4-бромо-2-формил-6-(трифторметил)фенил]сульфанил}бензоата (6 г, 80%) в виде серо-белого осадка.
К перемешанному раствору метил 2-{[4-бромо-2-формил-6-(трифторметил)фенил]сульфанил}бензоата (0.5 г, 1.19ммоль) в ТГФ (5мл) добавили 2-метилпропан-2-сульфинамид (288.6 мг, 2.38 моль), Ti(OEt)4 (0.75мл, 3.57ммоль) и реакционную массу нагревали до 70°C в течение 2 ч. Реакционную смесь погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через целит, промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением этил 2-({4-бромо-2-[(1Z)-[(2-метилпропан-2-сульфинил)имино]метил]-6-(трифторметил)фенил}сульфанил)бензоата (0.6 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки.
LC-MS: смесь метилового и этилового эфира, соотношение приблизительно 3:1; m/z = 522.2 (M+H)+ для метилового эфира (MW 520.99 для моноизотопной массы) и 536.2 (M+H)+ для этилового эфира (MW 535.01 для моноизотопной массы)
К перемешанному раствору этил 2-({4-бромо-2-[(1Z)-[(2-метилпропан-2-сульфинил)имино]метил]-6-(трифторметил)фенил}сульфанил)бензоата (0.9 г, 1.724ммоль) в ТГФ (20мл) добавили LiAlH4(2M в ТГФ,1.7мл, 3.44ммоль) при 0°C и реакционную смесь перемешивали при 0°C в течение 1 ч. Реакционную смесь погасили насыщенным раствором сульфата натрия и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением N-[[5-бромо-2-[2-(гидроксиметил)фенил]сульфанил-3-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (0.8 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки.
LC-MS: m/z = 495.9 (M+H)+ для моноизотопной массы 495.01
К перемешанному раствору N-[[5-бромо-2-[2-(гидроксиметил)фенил]сульфанил-3-(трифторметил)фенил]метил]-2-метил-пропан-2-сульфинамида (1 г, 2 ммоль) в ДХМ (30мл) добавили имидазол (0.41 г, 6 ммоль) и TBDMSCl (0.455 г, 3. ммоль) при 0°C и перемешивали при 25°C в течение 1 ч. Реакционную массу погасили водным раствором NaHCO3 и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Неочищенный продукт очистили обычной колоночной хроматографией на силикагеле с использованием 10% этилацетата в гексане с получением N-({5-бромо-2-[(2-{[(трет-бутилдиметилсилил)окси]метил}фенил)сульфанил]-3-(трифторметил)фенил}метил)-2-метилпропан-2-сульфинамида 9 (0.95 г, 77%) в виде бесцветной вязкой жидкости.
LC-MS: m/z = 611.8 (M+H)+ для моноизотопной массы 609.10
К перемешанному раствору N-({5-бромо-2-[(2-{[(трет-бутилдиметилсилил)окси]метил}фенил)сульфанил]-3-(трифторметил)фенил}метил)-2-метилпропан-2-сульфинамида (5.5 г, 9.55ммоль) в толуоле (88мл) добавили фенилбороновую кислоту (1.75 г, 14.3 ммоль), Na2CO3 (3.03 г, 28.6 ммоль), воду (22мл), смесь дегазировали в течение 10 мин в атмосфере аргона. Затем в неё добавили Pd(PPh3)4 (1.1 г, 0.955ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 110°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через целит, промыли этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении. Неочищенный продукт очистили обычной колоночной хроматографией на силикагеле с элюцией 50% этилацетатом в гексане с получением N-({2-[(2-{[(трет-бутилдиметилсилил)окси]метил}фенил)сульфанил]-5-фенил-3-(трифторметил)фенил}метил)-2-метилпропан-2-сульфинамида (4.7 г, 81%) в виде желтого осадка.
К перемешанному раствору N-({2-[(2-{[(трет-бутилдиметилсилил)окси]метил}фенил)сульфанил]-5-фенил-3-(трифторметил)фенил}метил)-2-метилпропан-2-сульфинамида (1.5 г, 2.47ммоль) в MeOH (20мл) добавили 4M HCl в диоксане (6мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Растворитель эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-4-фенил-6-(трифторметил)фенил]сульфанил} фенил) метанола гидрохлорида (1.1 г, неочищенный), который сразу использовали на следующей стадии.
LC-MS: m/z = 390.2 (M+H)+ для моноизотопной массы 389.11
К перемешанной суспензии (2-{[2-(аминометил)-4-фенил-6-(трифторметил)фенил]сульфанил}фенил) метанола гидрохлорида (3.5 г, 9 ммоль) в 5% NaHCO3 (250мл) добавили Fmoc N-гидроксисукцинимидный эфир (3.03 г, 9 ммоль) в CH3CN (70мл) при 25°C и реакционную смесь перемешивали при этой температуре в течение 16 ч. Затем реакционную смесь разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[[2-[2-(гидроксиметил)фенил]сульфанил-5-фенил-3-(трифторметил)фенил]метил]карбамата (3.7 г, неочищенный), который сразу использовали на следующей стадии.
LC-MS: m/z = 594.3 (M + H - H2O)+ для моноизотопной массы 611.17
К перемешанному раствору 9H-флуорен-9-илметил N-[(2-{[2-(гидроксиметил)фенил]сульфанил}-5-фенил-3-(трифторметил)фенил)метил]карбамата (3.5 г, 5.7 ммоль) в ДХМ/ТГФ (1:1, 160мл) добавили MnO2 (7.47 г, 85.9 ммоль) и реакционную смесь перемешивали при 25°C в течение 1 ч. Реакционную смесь отфильтровали через целит; фильтрат эвапорировали при пониженном давлении. Неочищенный продукт очистили с помощью обычной колонки с силикагелем с использованием 10% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({2-[(2-формилфенил)сульфанил]-5-фенил-3-(трифторметил)фенил}метил)карбамата (3.2 г, 91%) в виде серо-белого осадка.
LC-MS: m/z = 592.4 (M + H - H2O)+ для моноизотопной массы 609.16
1H NMR (400 MHz, DMSO-d6) δ 10.19 (s, 1 H), 8.11 (s, 1 H), 8.03 - 7.93 (m, 3 H), 7.86 (d, 2 H), 7.78 (d, 2 H), 7.66 (d, 2 H), 7.56 - 7.43 (m, 4 H), 7.38 (t, 3 H), 7.23 (t, 2 H), 6.50 (d, 1 H), 4.33 - 4.26 (m, 4 H), 4.20 (m, 1 H)
Промежуточное соединение 81
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-6-фенил-фенил}метил)карбамат
К перемешанному раствору N-[(6-бромо-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]-2-метилпропан-2-сульфинамида (8.9 г, 19.2ммоль) в ДХМ (50мл) добавили имидазол (3.9 г, 57.6ммоль) и TBDMSCl (4.33 г, 28.8ммоль) при 0°C и перемешивали при 25°C в течение 2 ч. Реакционную массу погасили водн. раствором NaHCO3 и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью колоночной хроматографии на системе Combiflash с использованием 0-20% этилацетата в гексане с получением N-({6-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (9 г) в виде серо-белого осадка. LC-MS: 578.6 [M+H]+
К перемешанному раствору соединения N-({6-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (1.5 г, 2.6ммоль) в диоксане (10мл) добавили фенилбороновую кислоту (411мг, 3.4ммоль), Na2CO3 (825мг, 7.8ммоль), воду (5мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в неё добавили Pd(PPh3)4 (150мг, 0.13ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита , промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-6-фенил-фенил}метил)-2-метилпропан-2-сульфинамида (1.3 г) в виде желтого осадка. LC-MS: 575.0 [M+H]+
К перемешанному раствору N N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-6-фенил-фенил}метил)-2-метилпропан-2-сульфинамида (1.3 г, 2.26ммоль) в MeOH (20мл), добавили 4M HCl в диоксане (10мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-3-фенил-фенил]сульфанил}пиридин-3-ил)метанола HCl соли (890мг, неочищенный), которую сразу использовали на следующей стадии.
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-3-фенил-фенил]сульфанил}пиридин-3-ил)метанола HCl соли (890мг, 2.3ммоль) в 5% NaHCO3 (10мл) добавили Fmoc OSU (762мг, 2.3ммоль) в ацетонитриле (20мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-6-фенил-фенил)метил]карбамата (1.2 г) в виде серо-белого осадка. LC-MS: 578.8 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-6-фенил-фенил)метил]карбамата (1.2 г, 2.1ммоль) в ДХМ/ТГФ(1:1, 40мл) добавили MnO2 (3.6 г, 41.4ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через целит, фильтрат эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью обычной колонки с силикагелем с использованием 10-40% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-6-фенил-фенил}метил)карбамата (710 мг) в виде серо-белого осадка с чистотой 98%. LC-MS: 576.8 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.08 - 4.15 (5H, m), 7.34 (4H, q, J = 7.3, 6.2 Hz), 7.42 (7H, d, J = 8.1 Hz), 7.58 (1H, s), 7.64 - 7.71 (3H, m), 7.89 (2H, d, J = 7.5 Hz), 8.33 (1H, d, J = 7.7 Hz), 8.48 (1H, d, J = 3.2 Hz), 10.21 (1H, s).
Промежуточное соединение 82
9H-флуорен-9-илметил N-{[5-(3-{[(трет-бутокси) карбонил] амино} пирролидин-1-ил)-3-хлор-2-[(3-формилпиридин-2-ил)сульфанил] фенил]метил}карбамат

К перемешанному раствору N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (750мг, 1.3ммоль) в толуоле (7 мл) добавили трет-бутил пирролидин-3-карбоксилат (290.5мг, 1.5ммоль) и трет-бутоксид натрия (337.3мг, 3.5ммоль) и дегазировали в атмосфере аргона в течение 5 мин. Затем в неё добавили 2-дитрет-бутилфосфинобифенил (34.9мг, 0.12ммоль) и Pd(dba)2 (59.8мг, 0.1ммоль) и нагревали до 110°C в течение 16 ч. Реакционную смесь отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью колоночной хроматографии на системе Combiflash с использованием 60% этилацетата в гексане с получением трет-бутил N-(1-{4-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-{[(2-метилпропан-2-сульфинил) амино]метил} фенил}пирролидин-3-ил)карбамата (450 мг) в виде серо-белого осадка. LC-MS: 683.1 [M+H]+
К перемешанному раствору трет-бутил N-(1-{4-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-{[(2-метилпропан-2-сульфинил)амино]метил}фенил}пирролидин-3-ил)карбамата (900мг, 1.3ммоль) в ТГФ (10 мл) добавили TBAF в 1(M) ТГФ(1.9 мл) и реакционную смесь перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь экстрагировали этилацетатом, промыли водой, солевым раствором, высушили над Na2SO4 и эвапорировали при пониженном давлении с получением трет-бутил N-[1-(3-хлор-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-{[(2-метилпропан-2-сульфинил)амино]метил}фенил)пирролидин-3-ил]карбамата (700 мг), который сразу использовали на следующей стадии. LC-MS: 568.6 [M+H]+
К перемешанному раствору трет-бутил N-[1-(3-хлор-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-{[(2-метилпропан-2-сульфинил)амино]метил}фенил)пирролидин-3-ил]карбамата (700мг, 1.2ммоль) в MeOH (8мл), добавили 4M HCl в диоксане (4мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 15 минут. Реакционную массу эвапорировали при пониженном давлении с получением трет-бутил N-{1-[3-(аминометил)-5-хлор-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил} фенил] пирролидин-3-ил}карбамата гидрохлорида (600 мг), который сразу использовали на следующей стадии. LC-MS: 464.9 [M+H]+
К перемешанной суспензии трет-бутил N-{1-[3-(аминометил)-5-хлор-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]пирролидин-3-ил}карбамата HCl соли (600мг, 1.3ммоль) в 5% NaHCO3 (10мл) добавили Fmoc-OSU (436.0мг, 1.3ммоль) в диоксане (10мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-{[5-(3-{[(трет-бутокси) карбонил]амино}пирролидин-1-ил)-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата (700 мг) в виде серо-белого осадка; который использовали на следующей стадии без дополнительной очистки. LC-MS: 687.0 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-{[5-(3-{[(трет-бутокси)карбонил]амино}пирролидин-1-ил)-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата (700мг, 1.02ммоль)) в ДХМ:ТГФ (1:1, 20 мл) добавили MnO2 (1.8 г, 20.4ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 30%-80% этилацетата в гексане с получением 9H-флуорен-9-илметил N-{[5-(3-{[(трет-бутокси) карбонил] амино} пирролидин-1-ил)-3-хлор-2-[(3-формилпиридин-2-ил)сульфанил] фенил]метил}карбамата (250 мг) в виде серо-белого осадка с чистотой 96% ЖХМС. LC-MS: 685.1 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 1.40 (9H, s), 1.87 - 1.96 (1H, m), 2.14 (1H, dd, J = 12.4, 7.0 Hz), 3.09 (1H, dd, J = 8.4, 3.6 Hz), 3.26 (1H, dd, J = 8.6, 7.0 Hz), 3.34 - 3.42 (1H, m), 3.49 (1H, dd, J = 9.6, 7.0 Hz), 4.24 (5H, dd, J = 18.9, 6.4 Hz), 6.51 (1H, s), 6.60 (1H, s), 7.32 (4H, q, J = 5.8 Hz), 7.41 (2H, t, J = 5.8 Hz), 7.68 (2H, d, J = 7.1 Hz), 7.78 (1H, s), 7.89 (2H, d, J = 7.2 Hz), 8.29 (1H, d, J = 7.2 Hz), 8.42 (1H, d, J = 3.7 Hz), 10.21 (1H, s).
Промежуточное соединение 83
9H-флуорен-9-илметил N-{[3-хлор-5-(3, 6-дигидро-2H-пиран-4-ил)-2-[(3-формилпиридин-2-ил)сульфанил] фенил]метил}карбамат

К перемешанному раствору N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (1.2 г, 2.1ммоль) в диоксане (10мл) добавили 2-(3,6-дигидро-2H-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (567мг, 2.7ммоль), Na2CO3 (660мг, 6.2ммоль), воду (5мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в неё добавили Pd(PPh3)4 (120мг, 0.1ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагрели до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита и промыли этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(3,6-дигидро-2H-пиран-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.2 г) в виде желтого вязкого осадка; который использовали на следующей стадии без дополнительной очистки. LC-MS: 580.9 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(3,6-дигидро-2H-пиран-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.2 г, 2.0ммоль) в MeOH (10мл) добавили 4M HCl в диоксане (5мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(3, 6-дигидро-2H-пиран-4-ил)фенил]сульфанил} пиридин-3-ил) метанола гидрохлорида (820 мг), который сразу использовали на следующей стадии. LC-MS: 362.8 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-(3,6-дигидро-2H-пиран-4-ил)фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (820мг, 2.0ммоль) в 5% NaHCO3 (10мл) добавили Fmoc-OSU (692мг, 2.0ммоль) в ацетонитриле (20мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-{[3-хлор-5-(3, 6-дигидро-2H-пиран-4-ил)-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил} фенил]метил}карбамата (1 г) в виде серо-белого осадка, который использовали на следующей стадии без дополнительной очистки. LC-MS: 584.9 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-{[3-хлор-5-(3,6-дигидро-2H-пиран-4-ил)-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата (1.0 г, 1.7ммоль) в ДХМ:ТГФ (1:1, 40мл) добавили MnO2 (2.97 г, 34.2ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 10%-40% этилацетата в гексане с получением 9H-флуорен-9-илметил N-{[3-хлор-5-(3,6-дигидро-2H-пиран-4-ил)-2-[(3-формилпиридин-2-ил)сульфанил]фенил]метил}карбамата (550 мг) в виде серо-белого осадка с чистотой 94% ЖХМС. LC-MS: 582.8 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 2.39 - 2.48 (3H, m), 3.80 (2H, t, J = 4.6 Hz), 4.22 (3H, s), 4.27 (3H, d, J = 6.7 Hz), 6.39 (1H, s), 7.31 (2H, t, J = 7.0 Hz), 7.37 - 7.47 (4H, m), 7.60 (1H, s), 7.69 (2H, d, J = 7.5 Hz), 7.89 (3H, t, J = 7.1 Hz), 8.36 (1H, d, J = 7.6 Hz), 8.42 (1H, d, J = 4.8 Hz), 10.20 (1H, s).
Промежуточное соединение 84
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пиразин-2-ил)фенил}метил)карбамат
К перемешанному и дегазированному раствору N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (1.5 г, 2.6ммоль) в диоксане (12мл) добавили 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (1.6 г, 6.2ммоль) и ацетат калия (1.0 г,10.4ммоль), PdCl2dppf (424мг, 0.52ммоль) и реакционную массу нагревали до 110°C в течение 16 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.6 г), который сразу использовали на следующей стадии. LC-MS: 625.3 [M+H]+
К перемешанному раствору 2-бромпиразина (500мг, 3.1ммоль) в диоксане (5мл) добавили N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил}метил)-2-метилпропан-2-сульфинамид (2.3 г, 3.7ммоль), Na2CO3 (1.0 г ,9.4ммоль), воду (2мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в неё добавили Pd(PPh3)4 (363мг, 0.31ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита и промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-10% метанола в ДХМ с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(пиразин-2-ил)фенил}метил)-2-метилпропан-2-сульфинамида (450 мг) в виде серо-белого осадка. LC-MS: 577.1 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(пиразин-2-ил)фенил}метил)-2-метилпропан-2-сульфинамида (450мг,0.781ммоль) в MeOH (8мл), добавили 4M HCl в диоксане (4мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(пиразин-2-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (400 мг), которую сразу использовали на следующей стадии. LC-MS: 358.9 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-(пиразин-2-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (400 мг, 1.1ммоль) в 5% NaHCO3 (6мл) добавили Fmoc-OSU (376мг, 1.1ммоль) в диоксане (6мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пиразин-2-ил)фенил)метил]карбамата (500мг, неочищенный) в виде серо-белого осадка. LC-MS: 581.1 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пиразин-2-ил)фенил)метил]карбамата (500мг, 0.86ммоль) в ДХМ:ТГФ (1:1, 20мл) добавили MnO2 (1.49 г, 17.24ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 10-80% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пиразин-2-ил)фенил}метил)карбамата (130 мг) в виде серо-белого осадка. LC-MS: 578.8 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.24 - 4.32 (3H, m), 4.34 - 4.41 (2H, m), 7.28 (2H, t, J = 6.9 Hz), 7.37 - 7.42 (3H, m), 7.69 (2H, d, J = 7.7 Hz), 7.88 (2H, d, J = 7.5 Hz), 7.92 - 8.00 (1H, m), 8.17 - 8.22 (1H, m), 8.28 - 8.34 (1H, m), 8.35 - 8.42 (1H, m), 8.41 - 8.47 (1H, m), 8.68 - 8.75 (2H, m), 9.35 (1H, s), 10.22 (1H, s).
Промежуточное соединение 85
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-6-(морфолин-4-ил)фенил}метил)карбамат

К перемешанному раствору 2-меркаптоникотиновой кислоты (719мг, 4.6ммоль) в ДМФ (10мл) добавили NaH (60%, 336мг, 8.4ммоль) и реакционную массу перемешивали при 25°C в течение 30 мин. Затем 6-бромо-3-хлор-2-фтор-бензальдегид (1 г, 4.2ммоль) добавили и реакционную смесь перемешивали при 90°C в течение 4 ч. Затем K2CO3 (1.74 г, 12.6ммоль) добавили с последующим добавлением MeI (0.8мл, 12.6 ммоль) и реакционную массу перемешивали при 25°C в течение 16 ч. Реакционную смесь погасили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-15% этилацетата в гексане с получением метил 2-[(3-бромо-6-хлор-2-формилфенил)сульфанил]пиридин-3-карбоксилата (800мг, 49%) в виде желтого осадка. LC-MS: 388.0 [M+H]+
К перемешанному раствору соединения метил 2-[(3-бромо-6-хлор-2-формилфенил)сульфанил]пиридин-3-карбоксилата ( 1.3 г, 3.4ммоль) в толуоле (10мл) добавили мрфолин (352мг, 4.0ммоль) и Cs2CO3 (2.9 г, 9.1ммоль) и дегазировали в атмосфере аргона в течение 5 мин. Затем в неё добавили Ксантфос (175мг, 0.3ммоль), Pd2(dba)3 (247мг,0.27ммоль) и нагревали до 110°C в течение 16 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью колоночной хроматографии на системе Combiflash с использованием 20-60% этилацетата в гексане с получением метил 2-{[6-хлор-2-формил-3-(морфолин-4-ил)фенил]сульфанил}пиридин-3-карбоксилата (260 мг) в виде коричневого вязкого осадка. LC-MS: 393.0 [M+H]+
К перемешанному раствору метил 2-{[6-хлор-2-формил-3-(морфолин-4-ил)фенил]сульфанил}пиридин-3-карбоксилата (550мг,1.4ммоль) в ТГФ(10мл) добавили 2-метилпропан-2-сульфинамид (170мг, 1.40ммоль), Ti(OEt)4 (1.5мл, 7.0ммоль) и реакционную массу нагрели до 70°C в течение 45 мин. Реакционную массу погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через слой целита, промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением этил 2-[(6-хлор-2-{[(2-метилпропан-2-сульфинил)имино]метил}-3-(морфолин-4-ил)фенил)сульфанил]пиридин-3-карбоксилата (600мг, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 509.6 [M+H]+
К перемешанному раствору 2-[(6-хлор-2-{[(2-метилпропан-2-сульфинил)имино]метил}-3-(морфолин-4-ил)фенил)сульфанил]пиридин-3-карбоксилата (600мг, 1.2ммоль) в ТГФ (30мл) добавили LAH(2M в ТГФ, 1.2мл, 2.3ммоль) при 0°C и реакционную массу перемешивали при 0°C в течение 1 ч. Реакционную смесь погасили насыщенным раствором сульфата натрия и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-6-(морфолин-4-ил)фенил)метил]-2-метилпропан-2-сульфинамида ( 530мг, неочищенный) в виде белого осадка. LC-MS: 469.6 [M+H]+
К перемешанному раствору N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-6-(морфолин-4-ил)фенил)метил]-2-метилпропан-2-сульфинамида (530мг, 1.1ммоль) в MeOH (10мл) добавили 4M HCl в диоксане (5мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-3-(морфолин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли(450 мг), которую сразу использовали на следующей стадии. LC-MS: 365.8 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-3-(морфолин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (450мг, 1.2ммоль) в 5% NaHCO3 (10мл) добавили Fmoc-OSU (415.7мг, 1.2ммоль) в диоксане (10мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 20-60% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-6-(морфолин-4-ил)фенил)метил]карбамата (300 мг) в виде серо-белого осадка. LC-MS: 588.0 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-6-(морфолин-4-ил)фенил)метил]карбамата (300мг, 0.51ммоль) в ДХМ:ТГФ (1:1, 12мл) добавили MnO2 (888мг, 10.2ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 30-50% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-6-(морфолин-4-ил)фенил}метил)карбамата (160 мг) в виде серо-белого осадка с чистотой 97% ЖХМС. LC-MS: 585.8 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 2.79 - 2.94 (4H, m), 3.66 (4H, s), 4.12 - 4.23 (3H, m), 4.43 (2H, d, J = 3.9 Hz), 7.27 - 7.41 (7H, m), 7.57 (1H, d, J = 8.6 Hz), 7.63 (2H, d, J = 7.3 Hz), 7.88 (2H, d, J = 7.1 Hz), 8.30 - 8.37 (1H, m), 8.37 - 8.44 (1H, m), 10.21 (1H, s).
Промежуточное соединение 86
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пиридазин-4-ил)фенил}метил)карбамат

К перемешанному раствору соединения N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (1.2 г, 2.1ммоль) в диоксане (10мл) добавили (пиридазин-4-ил)бороновую кислоту (514мг, 2.5ммоль), Na2CO3 (661мг, 6.4ммоль), воду (5мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в неё добавили Pd(PPh3)4 (240 мг,0.21ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита, промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 1-5% метанола в ДХМ с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(пиридазин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (400 мг) в виде светло-желтого осадка. LC-MS: 576.8 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(пиридазин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (400мг, 0.7ммоль) в MeOH (10мл), добавили 4M HCl в диоксане (5мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(пиридазин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (250 мг), которую сразу использовали на следующей стадии. LC-MS: 358.7 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-(пиридазин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (250мг, 0.7ммоль) в 5% NaHCO3 (5мл) добавили Fmoc-OSU (235мг, 0.7ммоль) в ацетонитриле (5мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пиридазин-4-ил)фенил)метил]карбамата (300мг, неочищенный) в виде серо-белого осадка. LC-MS: 581.1 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пиридазин-4-ил)фенил)метил]карбамата (300мг, 0.5ммоль) в ДХМ/ТГФ(1:1, 10мл) добавили MnO2 (900мг, 10.4ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 30-80% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пиридазин-4-ил)фенил}метил)карбамата (130 мг) в виде серо-белого осадка с чистотой 95.2% ЖХМС purity. LC-MS: 578.7 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.21 (1H, d, J = 7.0 Hz), 4.28 (2H, d, J = 6.8 Hz), 4.38 (2H, d, J = 5.3 Hz), 7.27 (2H, d, J = 7.4 Hz), 7.34 - 7.45 (4H, m), 7.67 (2H, d, J = 7.1 Hz), 7.87 (4H, d, J = 6.5 Hz), 8.03 - 8.09 (1H, m), 8.16 (1H, s), 8.39 (1H, d, J = 6.5 Hz), 8.44 (1H, d, J = 3.3 Hz), 9.36 (1H, d, J = 5.1 Hz), 9.69 (1H, s), 10.21 (1H, s).
Промежуточное соединение 87
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-фенил фенил}метил)карбамат

К перемешанному раствору соединения N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (1.2 г ,1.9ммоль) в толуоле (10мл) добавили фенилбороновую кислоту (311мг, 2.5ммоль), Na2CO3 (625мг, 5.9ммоль), воду (5мл) и дегазировали в течение 15 мин в атмосфере аргона. Затем в неё добавили Pd(PPh3)4 (114мг, 0.1ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 110°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита, промыли этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-фенил-фенил}метил)-2-метилпропан-2-сульфинамида (1.2 г) в виде бесцветной вязкой жидкости. LC-MS: 575.3 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-фенил-фенил}метил)-2-метилпропан-2-сульфинамида (1.2 г, 2.1ммоль) в MeOH (10мл), добавили 4M HCl в диоксане (5мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-фенил-фенил]сульфанил}пиридин-3-ил)метанола HCl соли (800 мг), которую сразу использовали на следующей стадии. LC-MS: 356.9 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-фенил-фенил]сульфанил}пиридин-3-ил)метанола HCl соли (800мг, 2.0ммоль) в 5% NaHCO3 (20мл) добавили Fmoc-OSU (685мг, 2.0ммоль) в ацетонитриле (40мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-фенил-фенил)метил]карбамата (1.1 г) в виде серо-белого осадка. LC-MS: 579.3 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-фенил-фенил)метил]карбамата (1.1 г, 1.9 ммоль) в ДХМ:ТГФ (1:1, 40 мл) добавили MnO2 (3.3 г, 38ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-20% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-фенил-фенил}метил)карбамата (800 мг) в виде серо-белого осадка с чистотой 96% ЖХМС. LC-MS: 577.0 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.16 - 4.24 (1H, m), 4.27 (2H, d, J = 7.0 Hz), 4.36 (2H, d, J = 5.6 Hz), 7.25 (2H, t, J = 7.5 Hz), 7.36 - 7.42 (3H, m), 7.49 (3H, dt, J = 15.5, 7.1 Hz), 7.70 (5H, dd, J = 23.8, 7.0 Hz), 7.83 - 7.89 (3H, m), 7.92 (1H, t, J = 6.1 Hz), 8.38 (1H, d, J = 6.1 Hz), 8.45 (1H, d, J = 4.6 Hz), 10.22 (1H, s).
Промежуточное соединение 88
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пиридин-2-ил)фенил}метил)карбамат

К перемешанному раствору N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (2 г, 3.5ммоль) в толуоле (20мл) добавили 2-(трибутилстаннил)пиридин (1.9 г, 5.2ммоль) и LiCl (44мг, 1.0ммоль) и дегазировали в атмосфере аргона в течение 10 мин. Затем в неё добавили Pd(PPh3)4 (400мг, 0.34ммоль) и реакционную массу нагревали до 110°C в течение 16 ч. Затем реакционную смесь отфильтровали через слой целита и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-60% этилацетата в гексане с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(пиридин-2-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.4 г) в виде бесцветной вязкой жидкости. LC-MS: 576.2 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(пиридин-2-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.4 г, 2.4ммоль) в MeOH (12мл), добавили 4M HCl в диоксане (6мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(пиридин-2-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (850 мг), которую сразу использовали на следующей стадии. LC-MS: 357.8 [M+H]+
К перемешанной суспензии ((2-{[2-(аминометил)-6-хлор-4-(пиридин-2-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (850мг, 2.2ммоль) в 5% NaHCO3 (20мл) добавили Fmoc-OSU (727мг, 2.2ммоль) в ацетонитриле (40мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пиридин-2-ил)фенил)метил]карбамата (1.2 г) в виде серо-белого осадка. LC-MS: 580.2 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пиридин-2-ил)фенил)метил]карбамата (1.2 г, 2.1ммоль) в ДХМ:ТГФ (1:1, 40 мл) добавили MnO2 (3.6 г, 41.4ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 10-50% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пиридин-2-ил)фенил}метил)карбамата (800 мг) в виде серо-белого осадка с чистотой 98.0% ЖХМС. LC-MS: 578.1 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.24 - 4.30 (3H, m), 4.33 - 4.39 (2H, m), 7.27 (2H, t, J = 7.4 Hz), 7.35 - 7.49 (4H, m), 7.69 (2H, d, J = 7.1 Hz), 7.88 (2H, d, J = 7.1 Hz), 7.96 (2H, dd, J = 10.0, 2.1 Hz), 8.05 (1H, d, J = 7.1 Hz), 8.16 (1H, s), 8.22 (1H, s), 8.34 - 8.42 (1H, m), 8.44 (1H, d, J = 2.7 Hz), 8.68 (1H, d, J = 3.3 Hz), 10.22 (1H, s).
Промежуточное соединение 89
(9H-флуорен-9-ил)метил 5-бромо-3-хлор-2-((2-формилфенил)тио)бензилкарбамат

К раствору диизопропиламина (4.02 г, 5.66 мл, 39.7 ммоль, Экв: 1.04) в ТГФ (28 мл) добавили по каплям (10 мин) при -20°C н-бутиллитий, 1.6 M в гексане (24.8 мл, 39.7 ммоль, Экв: 1.04) и перемешивали при 0°C в течение 20 минут. Смесь охладили до -78°C с последующим покапельным добавлением (20 минут) 4-бромо-2-хлор-1-фторбензола (8 г, 38.2 ммоль, Экв: 1) и желтую суспензию перемешивали при -78°C в течение 45 мин. Затем добавили по каплям (5 минут - экзотермично) N,N-диметилформамид (4.19 г, 4.44 мл, 57.3 ммоль, Экв: 1.5), охлаждающую ванну удалили и смеси дали нагреться до -20°C с достижением полной конверсии. При -20°C прозрачный раствор погасили насыщ. NH4Cl (80 мл) и экстрагировали с помощью TBME (80 мл). Водный слой экстрагировали снова с помощью TBME (40 мл). Органические слои высушили и эвапорировали. Остаток (9.03 г, 100%) очистили с помощью флеш-хроматографии (силикагель) с получением 5-бромо-3-хлор-2-фторбензальдегида (6.88 г, 76%) в виде белого осадка.
GC-MS: m/z = 236.9 (M+H)+ (моноизотопная масса 235.90)
К раствору 5-бромо-3-хлор-2-фторбензальдегида (1.19 г, 5 ммоль, Экв: 1) в ДМФ (12 мл) добавили при 22°C метил 2-меркаптобензоат (867 мг, 709 мкл, 5 ммоль, Экв: 1) с последующим карбонатом калия (691 мг, 5 ммоль, Экв: 1) и перемешивали при 22°C в течение 5 мин с получением практически полной конверсии. Через всего 30 минут мутную суспензию погасили водой (25 мл) и экстрагировали этилацетатом (2 x 25 мл). Органические слои - содержащие осадок - объединили, осадок отфильтровали, промыли этилацетатом (2 x 6 мл) и высушили в глубоком вакууме с получением метил 2-((4-бромо-2-хлор-6-формилфенил)тио)бензоата (1.5 г, 3.89 ммоль, 77.8 % выход) в виде светло-желтого осадка.
GC-MS: m/z = 325.9 (M + H - HCOOMe)+ для моноизотопной массы 383.92 для P1
К суспензии метил 2-((4-бромо-2-хлор-6-формилфенил)тио)бензоата (1.43 г, 3.71 ммоль, Экв: 1) и 2-метилпропан-2-сульфинамида (449 мг, 3.71 ммоль, Экв: 1) в ТГФ (16 мл) добавили при 22°C этоксид титана (IV) (4.23 г, 3.84 мл, 18.5 ммоль, Экв: 5) с получением прозрачного желтого раствора с последующим нагреванием до кипения и перемешивали при 70°C в течение 1 ч с получением практически полной конверсии. Через всего 3 ч прозрачный желтый раствор охладили до 22°C и погасили насыщ. NaCl (20 мл). Смесь отфильтровали через дикалит и промыли этилацетатом (2 x 20 мл). Фильтрат высушили и эвапорировали с получением (E)-метил 2-((4-бромо-2-(((трет-бутилсульфинил)имино)метил)-6-хлорфенил)тио)бензоата (1.73 г, 3.54 ммоль, 95.4 % выход) (1.73 г, 95%) в виде светло-желтой пены.
NMR: смесь этилового и метилового эфиров P2/P1 приблизительно 3:2 --> выход является правильным (приблизительно 94%)
LC-MS: m/z = 488.0 и 490.0 (M+H)+ для P1 и второй основной пик с 502.0 и 504.0 (M+H)+ для P2
К раствору (E)-метил 2-((4-бромо-2-(((трет-бутилсульфинил)имино)метил)-6-хлорфенил)тио)бензоата (1.679 г, 3.43 ммоль, Экв: 1) в ТГФ (17 мл) добавили при 22°C LiBH4 (748 мг, 34.3 ммоль, Экв: 10), белый цвет сразу поменялся на интенсивный зеленый и температура поднялась до 31°C. Смесь перемешивали в течение 10 мин до 22°C с получением почти полноговосстановления двойной связи, но все еще присутствовал эфир. Тем временем желтую реакционную смесь нагревали до 50°C и перемешивали при 50°C в течение всего 20 ч: полная конверсия. Смесь охладили до 22°C, погасили по каплям насыщенным NH4Cl (50 мл) и полностью экстрагирвоали EtOAc (1 x 50 мл). Органический слой промыли насыщенным NaCl (50 мл), высушили и эвапорировали с получением 1.53 г (96%) неочищенного продукта в виде серо-белого осадка; суспендировали в 3 мл ДХМ, осадок отфильтровали, промыли с помощью ДХМ (1 x 2 мл) и Hep/EtOAc-смеси 4:1 (2 x 4 мл), высушили в глубоком вакууме с получением соединения P-1.1 (811 мг, 51%) в виде белого осадка. NMR: OK, но содержал сигналы , характерные борану; LC-MS: m/z = 462.0 (M+H)+ Для разрушающегося боранового комплекса. P-1.1 растворили в ТГФ/EtOAc 2:5 (70 мл) и экстрагировали с помощью 5% KH2PO4 (75 мл - pH 5) и насыщ. NaCl (75 мл); органический слой высушили и эвапорировали с получением N-(5-бромо-3-хлор-2-((2-(гидроксиметил)фенил)тио)бензил)-2-метилпропан-2-сульфинамида (P-1.1 = 766 мг, 48%) в виде белого осадка. NMR: OK; LC-MS: m/z = 462.1 (M+H)+ Ранее полученный фильтрат очистили с помощью флеш-хроматографии (силикагель, 40 г, EtOAc в гептане 30% до 90%, затем MeOH в ДХМ 9%) с получением дополнительного продукта P-1.2 (363 мг, 23%) в виде белого осадка. NMR: OK - чистый; LC-MS: m/z = 462.0 (M+H)+ для моноизотопной массы 460.99 Примечания: общий выход чистого продукта: P-1.1 + P-1.2 = 1.129 г = 71%
К суспензии N-(5-бромо-3-хлор-2-((2-(гидроксиметил)фенил)тио)бензил)-2-метилпропан-2-сульфинамида (330 мг, 713 мкмоль, Экв: 1) в метаноле (3.3 мл) добавили при 0°C HCl, 4 M в диоксане (1.78 мл, 7.13 ммоль, Экв: 10), дали нагреться до 22°C, осадок растворился полностью и смесь перемешивали перемешивали при 22°C в течение 30 мин с достижением полной конверсии. Растворитель удалили при пониженном давлении и высушили в глубоком вакууме с получением (2-((2-(аминометил)-4-бромо-6-хлорфенил)тио)фенил)метанола гидрохлорида. (334 мг, 119%) серо-белый осадок.
LC-MS: m/z = 358.0 (M+H)+ (свободный амин MW 358.68; 356.96 для моноизотопной массы)
К раствору (2-((2-(аминометил)-4-бромо-6-хлорфенил)тио)фенил)метанола гидрохлорида (267 мг, 676 мкмоль, Экв: 1) в метаноле (15 мл) добавили при 22°C пиридин (214 мг, 219 мкл, 2.7 ммоль, Экв: 4) с последующей суспензией (9H-флуорен-9-ил)метил(2,5-диоксопирролидин-1-ил)карбоната (239 мг, 709 мкмоль, Экв: 1.05) в метаноле (3 мл) и перемешивали при 22°C в течение 1 ч, но исходное соединение еще наблюдалось. Через всего 16 ч дополнительное количесвто осадка преципитировалось и конверсия практически завершилась. Осадок отфильтровали, промыли метанолом (2 x 3 мл) и высушили в глубоком вакууме с получением (9H-флуорен-9-ил)метил 5-бромо-3-хлор-2-((2-(гидроксиметил)фенил)тио)бензилкарбамата (230 мг, 59%) в виде белого осадка.
LC-MS: m/z = 562.0 (M + H - H2O)+ для моноизотопной массы 579.03
К раствору (9H-флуорен-9-ил)метил 5-бромо-3-хлор-2-((2-(гидроксиметил)фенил)тио)бензилкарбамата (205 мг, 353 мкмоль, Экв: 1) в ТГФ (7 мл) и ДХМ (7 мл) (слегка нагретому для растворения всех твердых веществ) добавили при 22°C диоксида марганца (614 мг, 7.06 ммоль, Экв: 20) и перемешивали при 22°C в течение 3 ч с достижением полной конверсии. Смесь отфильтровали (0.45 RC шприц-фильтр), промыли с помощью ТГФ/ДХМ 1:1 (2 x 2 мл) и фильтрат эвапорировали с получением 193 мг неочищенного продукта. Неочищенный продукт суспендировали в 6 мл ДХМ/MeOH 1:1, осадок отфильтровали и промыли MeOH (1 x 2 мл) и ДХМ (1 x 2 мл), высушили в глубоком вакууме с получением соединения, указанного в заголовке (99 мг, 49%) в виде белого осадка.
Фильтрат сконцентрировали (ДХМ удалили) и получившуюся суспензию снова отфильтровали. Осадок промыли MeOH (2 x 2 мл), высушили в глубоком вакууме с получением соединения, указанного в заголовке (60 мг, 29%) в виде белого осадка.
LC-MS: m/z = 560.0 (M + H - H2O)+ для моноизотопной массы 577.01 (слабая ионизация для молекулярной массы; основной сигнал для катиона бензила после потери воды) общий выход: 159 мг = 78%
1H NMR (600 MHz, CDCl3) δ 10.26 (s, 1 H), 7.86 (br d,J=7.4 Hz, 1 H), 7.76 (br d,J=7.5 Hz, 3 H), 7.70 (d,J=2.1 Hz, 1H), 7.65 (s, 1 H), 7.52 (br d,J=7.3 Hz, 2 H), 7.28 - 7.45 (m, 8 H), 6.56 (br d,J=8.0 Hz, 1 H), 5.16 - 5.26 (m, 1 H), 4.48 (br d,J=6.3 Hz, 2H), 4.38 (br d, J=6.7 Hz, 2 H), 4.16 (br t,J=6.9 Hz, 1 H)
Промежуточное соединение 90
(9H-флуорен-9-ил)метил((2,5-дихлор-3-((2-формилфенил)тио)пиридин-4-ил)метил)карбамат

Это соединение получили по аналогии с Промежуточным соединением 68 с использованием в качестве исходного вещества 2,3,5-трихлоризоникотинальдегида и метил 2-меркаптобензоата. Соединение, указанное в заголовке, получили в виде белого осадка (2.7 g).1H NMR (300MHz, ХЛОРОФОРМ-d) δ = 10.27 (s, 1H), 8.52 (s, 1H), 7.94 - 7.83 (m, 1H), 7.75 (d, J=7.7 Hz, 2H), 7.53 - 7.28 (m, 8H), 6.56 (br d, J=7.5 Hz, 1H), 5.24 (br s, 1H), 4.76 (br d, J=6.0 Hz, 2H), 4.30 (br d, J=6.4 Hz, 2H), 4.10 (br s, 1H)
Промежуточное соединение 91
(9H-флуорен-9-ил)метил((2-хлор-5-((2-формилфенил)тио)пиридин-4-ил)метил)карбамат

Это соединение получили по аналогии с Промежуточным соединением 68 с использованием в качестве исходного вещества 2-хлор-5-фторизоникотинальдегида и метил 2-меркаптобензоата. Соединение, указанное в заголовке, получили в виде белого осадка (220 мг). MS ESI (m/z): 501.2 [(M+H)+]
Промежуточное соединение 92
(9H-флуорен-9-ил)метил 3-хлор-2-((3-формилпиридин-4-ил)тио)-5-(трифторметил)бензилкарбамат

К перемешанному раствору 3-хлор-2-фтор-5-(трифторметил)бензальдегида (5 г, 22.07 ммоль) в ТГФ (100 мл) добавили 2-метилпропан-2-сульфинамид (2.675 г, 22.07 ммоль) и Ti(OEt)4(23.3 мл, 110.35 ммоль) и нагревали при 70°C в течение 2 ч. Реакционную смесь погасили солевым раствором, этилацетат добавили и отфильтровали. Слои разделили и водный слой экстрагировали этилацетатом. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили с помощью хроматографии на силикагеле с использованием этилацетата в гексане (0-5%) в качестве элюирующего растворителя с получением N-[(1Z)-[3-хлор-2-фтор-5-(трифторметил)фенил]метилиден]-2-метил пропан-2-сульфинамида (5.54 г, 76.13%) в виде желтой жидкости. LC-MS: 330.1[M+H]+.
К суспензии Na2S.xH2O (0.473 г, 6.07 ммоль) в DMA(30 мл) добавили MgSO4(4 г) и нагревали при 105°C в течение 1 ч. Затем N-[(1Z)-[3-хлор-2-фтор-5-(трифторметил)фенил]метилиден]-2-метил пропан-2-сульфинамид (1 г, 3.03 ммоль) в DMA (2 мл), MgSO4(0.2 г) добавили в реакционную смесь при этой температуре и продолжили нагревание в течение дополнительного 1 ч. Затем реакционную смесь охладили до 0°C, медленно добавили Ac2O (1.2 мл, 6.07 ммоль) и перемешивали при 0°C в течение дополнительных 30 мин. Реакционную смесь затем погасили водой (50 мл) и экстрагировали этилацетатом. Объединенные органические слои промыли водой, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением неочищенного соединения, которое очистили (объединили с другой параллельной порцией) с помощью хроматографии на силикагеле с использованием этилацетата в н-гексане (0-6%) в качестве элюирующего растворителя с получением N-[(1Z)-[2-(ацетилсульфанил)-3-хлор-5-(трифторметил)фенил]метилиден]-2-метилпропан-2-сульфинамида (1.12 г, 48%) в виде коричневой жидкости. LC-MS: 385.7 [M+H]+.
Раствор N-[(1Z)-[2-(ацетилсульфанил)-3-хлор-5-(трифторметил)фенил]метилиден]-2-метил пропан-2-сульфинамида (160 мг, 0.42 ммоль) в ТГФ (5 мл) дегазировали аргоном и затем добавили DTT (64 мг, 0.42 ммоль). Затем реакционную смесь охладили до 0°C, NaBH4(156.9 мг, 4.15 ммоль) добавили по порциям в реакционную смесь и перемешивали при этой температуре в течение 30 мин. Реакционную смесь затем погасили водой (дегазированной аргоном) и экстрагировали этилацетатом (дегазированный аргоном) при 0°C. Органический слой разделили, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом (все стадии проводили в атмосфере аргона) с получением N-{[3-хлор-2-сульфанил-5-(трифторметил)фенил]метил}-2-метил пропан-2-сульфинамида (130 мг, неочищенный) в виде светло-желтого осадка, который использовали как есть на следующей стадии. LC-MS: 344.2 [M-H]-.
К перемешанному раствору N-{[3-хлор-2-сульфанил-5-(трифторметил)фенил]метил}-2-метилпропан-2-сульфинамида (неочищенны, 100 мг, 0.29 ммоль) в диоксане (дегазированный аргоном, 3мл) добавили DTT (44.6 мг, 0.29 ммоль), 4-хлорпиридин-3-карбальдегид (49.1мг, 0.35ммоль), DIPEA (0.2 мл, 1.16 ммоль) и продули аргоном. Затем ксантфос (16.7 мг, 0.03 ммоль), Pd2(dba)3(13.2 мг, 0.01 ммоль) добавили в реакционную смесь, снова продули аргоном и нагревали при 110°C в течение 1.5 ч. Реакционную смесь погасили водой (20 мл) и экстрагировали этилацетатом. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили с помощью хроматографии на силикагеле с использованием этилацетата в н-гексане (0-50%) в качестве элюирующего растворителя с получением N-({3-хлор-2-[(3-формилпиридин-4-ил)сульфанил]-5-(трифторметил)фенил}метил)-2-метилпропан-2-сульфинамида (61 мг, 42%, over 2 стадии) в виде коричневого осадка. LC-MS: 451.02 [M+H]+.
К перемешанному раствору N-({3-хлор-2-[(3-формилпиридин-4-ил)сульфанил]-5-(трифторметил)фенил}метил)-2-метилпропан-2-сульфинамида (700 мг, 1.55 ммоль) в ТГФ (10 мл) добавили NaBH4 (88.1 мг, 2.33 ммоль) по порциям при 0°C и перемешивали при 25°C в течение 30 мин. Реакционную смесь затем погасили насыщенным водным раствором хлорида аммония (15 мл) и экстрагировали этилацетатом. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-4-ил]сульфанил}-5-(трифторметил)фенил)метил]-2-метилпропан-2-сульфинамида (685 мг, неочищенный) и использовали без дополнительной очистки. LC-MS: 452.8 [M+H]+.
К перемешанному раствору N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-4-ил]сульфанил}-5-(трифторметил)фенил)метил]-2-метил пропан-2-сульфинамида (неочищенный, 680 мг, 1.5 ммоль) в MeOH (10 мл), добавили 4 н HCl в диоксане (20 мл) при 0°C и перемешивали при 25°C в течение 30 мин. После заверешения реакции реакционную смесь сконцентрировали под вакуумом с получением (4-{[2-(аминометил)-6-хлор-4-(трифторметил)фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (566 мг, неочищенный) в виде коричневого осадка и использовали без дополнительной очистки. LC-MS: 348.6 [M+H]+.
К перемешанной суспензии (4-{[2-(аминометил)-6-хлор-4-(трифторметил)фенил]сульфанил} пиридин-3-ил)метанола гидрохлорида (неочищенный, 560 мг, 1.45 ммоль) в 5% водном NaHCO3(15 мл) добавили Fmoc-OSu (490.3 мг, 1.45 ммоль) в ацетонитриле (25 мл) и перемешивали при 25°C в течение 30 мин. Реакционную смесь разбавили водой (25 мл) и экстрагировали этилацетатом. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили с помощью хроматографии на силикагеле с использованием этилацетата в н-гексане (0-80%) в качестве элюирующего растворителя с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-4-ил]сульфанил}-5-(трифторметил)фенил)метил]карбамата (305 мг, 49%за 3 стадии). LC-MS: 570.6 [M+H]+.
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-4-ил]сульфанил}-5-(трифторметил)фенил)метил]карбамата (410 мг, 0.72 ммоль) в ДХМ (10 мл) и ТГФ (10 мл) добавили MnO2 (624.2 мг, 7.18 ммоль) и перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь отфильтровали и сконцентрировали под вакуумом с получением неочищенного соединения, которое очистили посредством колоночной хроматографии на силикагеле с использованием этилацетата в н-гексане (0-20%) в качестве элюирующего растворителя с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-4-ил)сульфанил]-5-(трифторметил)фенил}метил)карбамата (151 мг, 37%) в виде белого осадка. LC-MS: 569.2 [M+H]+.
1H NMR: (400 MHz, Хлороформ-d) δ 4.11-4.21 (1H, m), 4.40 (2H, d, J = 6.8Hz), 4.48-4.55 (2H, m), 5.24 (1H, ddt, J = 6.1, 3.5, 1.0Hz), 6.36-6.44 (1H, m), 7.26-7.34 (2H, m), 7.39 (2H, t, J = 6.6Hz), 7.48- 7.56 (2H, m), 7.71-7.77 (3H, m), 7.80 (1H, s), 8.35-8.44 (1H, m), 8.94 (1H, s), 10.24 (1H, s).
Промежуточное соединение 93
(9H-флуорен-9-ил)метил((5-хлор-4-((3-формилпиридин-2-ил)тио)пиридин-3-ил)метил)карбамат

Это соединение получили по аналогии с Промежуточным соединением 78 с использованием в качестве исходного вещества 4,5-дихлорникотинальдегида и 2-меркаптоникотиновой кислоты. Соединение, указанное в заголовке, получили в виде светло-желтой пены (151 мг). MS ESI (m/z): 502.1 [(M+H)+]
Промежуточное соединение 94
(9H-флуорен-9-ил)метил((5-хлор-4-((2-формилфенил)тио)пиридин-3-ил)метил)карбамат

Это соединение получили по аналогии с Промежуточным соединением 77 с использованием в качестве исходного вещества 4,5-дихлорникотинальдегида и метил 2-меркаптобензоата. Соединение, указанное в заголовке, получилив виде светло-желтой пены (361 мг). MS ESI (m/z): 501.1 [(M+H)+]
Промежуточное соединение 95
(9H-флуорен-9-ил)метил((2-хлор-5-((3-формилпиридин-2-ил)тио)пиридин-4-ил)метил)карбамат
Смесь 2-меркаптоникотиновой кислоты (2.5 г, 16.1 ммоль, Экв: 1) и Na2CO3 (5.12 г, 48.3 ммоль, Экв: 3) в ДМСО (53.7 мл) в пробирке для работы под давлением продули аргоном. Затем 2-хлор-5-фторизоникотинальдегид (2.57 г, 1.79 мл, 16.1 ммоль, Экв: 1) добавили, пробирку закрыли и реакционную смесь перемешивали при 90°C в течение 1.5 ч. Смесь охладили до комнатной температуры, затем медленно добавили диметилсульфат (6.1 г, 4.62 мл, 48.3 ммоль, Экв: 3) и смесь перемешивали при комнатной температуре в течение 1 ч. Затем раствор 25% водн. аммония (4.5 г, 5 мл, 66.1 ммоль, Экв: 4.1) и 5 мл воды добавили медленно при макс. 24°C и смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь влили в воду и экстрагировали с помощью EtOAc. Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью хроматографии на силикагеле с использованием гепатана/этилацетата в качестве элюента. Метил 2-((6-хлор-4-формилпиридин-3-ил)тио)никотинат получили в виде желтого осадка (848 мг). MS ESI (m/z): 309.0 [(M+H)+]
Промежуточное соединение 96
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-[2-(морфолин-4-ил)пиридин-4-ил]фенил}метил)карбамат

К перемешанному раствору N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (1.5 г, 2.6ммоль) в диоксане (10 мл) добавили 4-[4-(тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил]морфолин (905мг, 3.12ммоль), Na2CO3 (827мг, 7.8ммоль), воду (5 мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в неё добавили Pd(PPh3)4 (300мг, 0.26ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита и промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством колоночной хроматографии (SiO2; 100-200 меш; 50-90% EtOAc/гексаны) с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил} пиридин-2-ил)сульфанил]-3-хлор-5-[2-(морфолин-4-ил)пиридин-4-ил]фенил}метил)-2-метилпропан-2-сульфинамида (1.1 г, 63%) в виде серо-белого осадка. LC-MS: 661.5 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-[2-(морфолин-4-ил)пиридин-4-ил]фенил}метил)-2-метилпропан-2-сульфинамида (1.1 г, 1.7ммоль) в MeOH (20 мл) добавили 4M HCl в диоксане (10 мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-[2-(морфолин-4-ил)пиридин-4-ил] фенил]сульфанил} пиридин-3-ил) метанола гидрохлорида (900 мг), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 443.2 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-[2-(морфолин-4-ил)пиридин-4-ил] фенил]сульфанил} пиридин-3-ил) метанола гидрохлорида (900мг,1.98ммоль) в 5% NaHCO3(15 мл) добавили Fmoc-OSU (0.667 г, 1.98ммоль) в диоксане (15 мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 16 ч. Затем реакционную массу разбавили водой и экстрагировали с помощью 10% метанола в дихлорметане. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-[2-(морфолин-4-ил)пиридин-4-ил]фенил)метил]карбамата (1.0 г) в виде вязкого осадка, который использовали на следующей стадии без дополнительной очистки. LC-MS: 665.3 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-[2-(морфолин-4-ил)пиридин-4-ил]фенил)метил]карбамата в ДХМ:ТГФ (1:1, 20 мл) добавили MnO2(2.62 г, 30.1ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили посредством колоночной хроматографии (SiO2; 100-200 меш; 40-70% EtOAc/гексаны) с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-[2-(морфолин-4-ил)пиридин-4-ил]фенил}метил)карбамата (290 мг) в виде серо-белого осадка с чистотой 88.5%. LC-MS: 663.2 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 3.53 (4H, s), 3.69 (4H, s), 4.21 (1H, d, J = 5.9 Hz), 4.26 (2H, d, J = 6.4 Hz), 4.36 (2H, d, J = 5.1 Hz), 6.99 (1H, d, J = 4.5 Hz), 7.13 (1H, s), 7.27 (1H, d, J = 7.3 Hz), 7.39 (3H, t, J = 7.0 Hz), 7.61 (1H, d, J = 11.7 Hz), 7.67 (2H, d, J = 7.4 Hz), 7.73 (1H, s), 7.88 (3H, d, J = 7.5 Hz), 7.99 (1H, s), 8.22 (1H, d, J = 5.0 Hz), 8.38 (1H, d, J = 7.1 Hz), 8.43 (1H, s), 10.22 (1H, s).
Промежуточное соединение 97
9H-флуорен-9-илметил N-{[3-хлор-5-(2-хлорпиридин-4-ил)-2-[(3-формилпиридин-2-ил)сульфанил] фенил]метил}карбамат

К перемешанному раствору N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (2.5 г, 4.3ммоль) в диоксане (20 мл) добавили (2-хлорпиридин-4-ил)бороновую кислоту (818 мг, 5.2ммоль), Na2CO3 (1.4 г,13ммоль), воду (10 мл) и дегазировали в течение 10 мин в атмосфере аргона. К нему добавили Pd(PPh3)4 (501мг,0.43ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Реакционную смесь охладили до 25°C, отфильтровали через слой целита и промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили колоночной хроматографией на силикагеле (SiO2; 100-200 меш; 50-90% EtOAC/гексаны) с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(2-хлорпиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (2.8 г) в виде серо-белого осадка. LC-MS: 609.8 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(2-хлорпиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (2.8 г, 4.6ммоль) в MeOH (30 мл), добавили 4M HCl в диоксане (15 мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(2-хлорпиридин-4-ил)фенил]сульфанил} пиридин-3-ил) метанола гидрохлорида (1.5 г) в виде серо-белого вязкого осадка, который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 392.2 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-(2-хлорпиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (1.5 г, 3.8ммоль) в 5% NaHCO3(20 мл) добавили Fmoc-OSU (1.3 г, 3.8ммоль) в диоксане (20мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 16 ч. Затем реакционную массу разбавили водой и экстрагировали с помощью EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-{[3-хлор-5-(2-хлорпиридин-4-ил)-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата (2.7 г) в виде серо-белого осадка; который использовали на следующей стадии без дополнительной очистки. LC-MS: 614.3 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-{[3-хлор-5-(2-хлорпиридин-4-ил)-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата в ДХМ:ТГФ (1:1, 40 мл) добавили MnO2(7.66 г, 88.1ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили посредством колоночной хроматографии (SiO2; 100-200 меш; 40-80% EtOAc/гексаны) до 9H-флуорен-9-илметил N-{[3-хлор-5-(2-хлорпиридин-4-ил)-2-[(3-формилпиридин-2-ил)сульфанил]фенил]метил}карбамата (1.5 г) в виде серо-белого осадка с чистотой 96.46%. LC-MS: 612.2 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.19 - 4.37 (5H, m), 7.27 (2H, t, J = 7.36 Hz), 7.36-7.39 (3H, m), 7.67 (2H, d, J = 7.2 Hz), 7.81 (3H, m), 7.88 (2H, d, J = 7.21 Hz), 7.94 (1H, m), 8.37 (1H, d, J = 7.31 Hz), 8.34 (1H, m), 8.54 (1H, d, J = 5.12 Hz), 10.21 (1H, s)
Промежуточное соединение 98
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(6-гидроксипиридин-3-ил)фенил}метил)карбамат

Раствор N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (2.5 г, 4.3 ммоль), (6-гидроксипиридин-3-ил)бороновой кислоты (0.79 г, 5.6ммоль) и карбоната натрия (1.38 г, 13 ммоль) в 1,4-диоксане (20 мл) и воде (5 мл) в закрытой пробирке дегазировали аргоном в течение 10 мин и Pd(PPh3)4 (0.25 г, 0.22ммоль) добавили. Реакционную смесь нагревали при 120°C в течение 16 ч. Прогресс реакции контролировали с помощью ТСХ. Неочищенную смесь разбавили водой и экстрагировали с помощью EtOAc (100 мл x 2). Объединенный органический слой промыли солевым раствором и высушили над сульфатом натрия, эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью хроматографии на системе Combiflash (70% этилацетат в гексане) с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(6-гидроксипиридин-3-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.0 г) в виде коричнево-оранжевого осадка. LC-MS: 592.1 [M+H]+
К охлажденному на льду раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(6-гидроксипиридин-3-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.0 г, 1.69ммоль) в MeOH (20 мл) добавили 4M HCl/диоксан (10 мл) и реакционную смесь перемешивали при 25°C в течение 2 ч. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром (50 мл x 2) с получением 5-(3-хлор-5-этил-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)пиридин-2-ола гидрохлорида (1.0 г, неочищенный) в виде желтого осадка. LC-MS: 373.8 [M+H]+
К перемешанному раствору 5-(3-хлор-5-этил-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)пиридин-2-ола гидрохлорида (1.0 г, 2.69ммоль) в CH3CN (20 мл) добавили 5% раствор NaHCO3 (20 мл) с последующим Fmoc-OSu (0.9 г, 2.69ммоль) в CH3CN (10 мл) по каплям и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную смесь разбавили водой (50.0 мл) и экстрагировали этилацетатом (3 x 50мл).Объединенный органический слой промыли солевым раствором (3 x 20мл), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(6-гидроксипиридин-3-ил)фенил)метил]карбамата (1.0 г) в виде белого осадка. LC-MS: 593.8 [M+H]+
К охлажденному на льду раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(6-гидроксипиридин-3-ил)фенил)метил]карбамата (1.2 г) в ДХМ (30мл) добавили периодинан Десса-Мартина (1.28 г, 3.02ммоль) по порциям. Получившуюся смесь затем перемешивали при комнатной ттемпературе в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. После завершения реакции реакционную смесь влили в насыщенный раствор бикарбоната натрия (100 мл) и органический слой отделили . Органический слой промыли раствором тиосульфата натрия (2 x 50мл), высушили над сульфатом натрия и сконцентрировали при пониженном давлении и получившееся неочищенное соединение очистили с помощью хроматографии на системе Combiflash (70% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(6-гидроксипиридин-3-ил)фенил}метил)карбамата (0.25 г) в виде коричнево-оранжевого осадка с чистотой 92% ЖХМС. LC-MS: 594.3 [M+H]+
1H NMR (400 MHz, DMSO-d6) δ 4.21 (1H, d, J=6.1 Hz), 4.26 (2H, d, J=6.7 Hz), 4.32 (2H, d, J=5.8 Hz), 6.45 (1H, d, J=9.5 Hz), 7.28 (2H, t, J=7.4 Hz), 7.34 - 7.44 (3H, m), 7.57 (1H, d, J=1.5 Hz), 7.67 (2H, d, J=7.5 Hz), 7.78 - 7.92 (7H, m), 8.36 (1H, dd, J=7.6, 1.7 Hz), 8.43 (1H, dd, J=4.7, 1.7 Hz), 10.20 (1H, s), 12.04 (1H, s)
Промежуточное соединение 99
9H-флуорен-9-илметил N-({3-хлор-5-[6-(диметиламино)пиридин-3-ил]-2-[(3-формилпиридин-2-ил)сульфанил]фенил}метил)карбамат

Раствор N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (2.5 г, 4.33ммоль), [6-(диметиламино)пиридин-3-ил]бороновой кислоты (0.93 г, 5.63ммоль) и карбоната натрия (1.38 г, 13ммоль) в 1, 4-диоксане (20 мл) и воде (5 мл) дегазировали аргоном в течение 10 мин и Pd (PPh3)4 (0.25 г, 0.22ммоль) добавили. Затем реакционную смесь нагревали при 120°C в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. Неочищенную реакционную смесь разбавили водой и экстрагировали с помощью EtOAc (100мл x 2). Объединенный органический слой промыли солевым раствором и высушили над сульфатом натрия и сконцентрировали при пониженном давлении. Неочищенное соединение очистили с помощью хроматографии на системе Combiflash (80% этилацетат в гексане) с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-[6-(диметиламино)пиридин-3-ил]фенил}метил)-2-метилпропан-2-сульфинамида (0.85 г) в виде серо-белого осадка. LC-MS: 618.8 [M+H]+
К охлажденному на льду раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил} пиридин-2-ил)сульфанил]-3-хлор-5-[6-(диметиламино)пиридин-3-ил]фенил}метил)-2-метилпропан-2-сульфинамида (0.85 г, 1.4ммоль) в MeOH (20 мл) добавили 4M HCl в диоксане (8.0 мл) и реакционную смесь перемешивали при 25°C в течение 2 ч. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром (50мл x 2) с получением [2-({2-хлор-4-[6-(диметиламино)пиридин-3-ил]-6-этилфенил}сульфанил)пиридин-3-ил]метанола гидрохлорида (1.0 г) в виде желтого осадка. LC-MS: 400.8 [M+H]+
К перемешанной суспензии [2-({2-хлор-4-[6-(диметиламино)пиридин-3-ил]-6-этилфенил}сульфанил)пиридин-3-ил]метанола гидрохлорида (1.0 г, неочищенный, 2.5ммоль) в CH3CN (20.0 мл) добавили 5% NaHCO3 (20 мл) с последующим Fmoc-OSu (0.84 г, 2.5ммоль) в CH3CN (30 мл) и реакционную смесь перемешивали при 25°C в течение 2 ч. После заверешения реакции реакционную смесь разбавили водой (50мл) и экстрагировали этилацетатом (3 x 50мл). Объединенный органический слой промыли солевым раствором (3 x 20мл), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-({3-хлор-5-[6-(диметиламино)пиридин-3-ил]-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил}метил)карбамата (1.1 г) в виде белого осадка. LC-MS: 623.3 [M+H]+
К охлажденному на льду раствору 9H-флуорен-9-илметил N-({3-хлор-5-[6-(диметиламино)пиридин-3-ил]-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил}метил)карбамата (1.1 г) в ДХМ (30мл) добавили периодинан Десса-Мартина (1.12 г, 2.65ммоль) по порциям и реакционную смесь затем перемешивали при 25°C в течение 2 ч. Затем реакционную смесь влили в насыщенный раствор бикарбоната натрия (2 x 50мл) и органический слой отделили . Органический слой промыли раствором тиосульфата натрия (2 x 50мл), высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью хроматографии на системе Combiflash (2% MeOH в ДХМ) с получением 9H-флуорен-9-илметил N-({3-хлор-5-[6-(диметиламино)пиридин-3-ил]-2-[(3-формилпиридин-2-ил)сульфанил]фенил}метил)карбамата (0.35 г) в виде коричнево-оранжевого осадка с чистотой 91% ЖХМС. LC-MS: 621.2 [M+H]+
1H NMR (400 MHz, DMSO-d6) δ 3.10 (6H, s), 4.22 (1H, d, J=6.1 Hz), 4.27 (2H, d, J=6.6 Hz), 4.33 (2H, d, J=5.9 Hz), 7.29 (2H, t, J=7.5 Hz), 7.33 - 7.46 (4H, m), 7.62 (1H, s), 7.69 (2H, d, J=7.5 Hz), 7.81 (1H, d, J=1.6 Hz), 7.88 (4H, d, J=8.1 Hz), 8.37 (1H, dd, J=7.6, 1.6 Hz), 8.45 (1H, dd, J=4.6, 1.6 Hz), 8.52 (1H, d, J=2.2 Hz), 10.21 (1H, s)
Промежуточное соединение 100
9H-флуорен-9-илметил N-[[4-бромо-3-хлор-2-(2-формилфенил)сульфанил-фенил]метил]карбамат

К механически перемешанному раствору диизопропиламина (5.02 г, 7.08 мл, 49.7 ммоль, Экв: 1.04) в ТГФ (35 мл) добавили по каплям (5 мин) при -20°C н-бутиллитий, 1.6 M в гексане (31 мл, 49.7 ммоль, Экв: 1.04) и перемешивали при 0°C в течение 20 минут. Смесь охладили до -78°C с последующим покапельным добавлением (20 минут) раствора 1-бромо-2-хлор-3-фторбензола (10 г, 47.7 ммоль, Экв: 1) в ТГФ (10 мл) и мутную желтую суспензию перемешивали при -78°C в течение 60 мин. Затем добавили по каплям (5 минут-экзотермично) N,N-диметилформамид (5.23 г, 5.55 мл, 71.6 ммоль, Экв: 1.5), охлаждающую ванну удалили и смеси дали нагреться до -20°C с достижением полной конверсии. При -20°C прозрачный желтый раствор погасили насыщенным NH4Cl (100 мл) и экстрагировали с помощью TBME (100 мл). Водный слой экстрагировали снова с помощью TBME (50 мл). Органические слои высушили и эвапорировали при только 50 мбар в течение непродолжительного времени. Желтый остаток растворили в гептане/этилацетате 10:1 (прибл. 30 мл) при 55°C, сконцентрировали до 1/3 и перемешивали при 22°C, несмотря на начало кристаллизации. Через 30 минут суспензию охладили до 0°C в течение 30 минут, осадок отфильтровали, промыли гептаном (2 x 15 мл) и высушили (только непродолжительное время) с получением 4-бромо-3-хлор-2-фторбензальдегида (5.27 г, 47%) в виде светло-желтого осадка.
Фильтрат эвапорировали и очистили с помощью флеш-хроматографии (силикагель, 70 г, абсорбированный на соребнте изолют HM-N, EtOAc в гептане, 0% до 5% ) с получением дополнительного соединения (4.073 г, 36%) в виде серо-белого осадка.
GC-MS: m/z = 235.9 M.+ (моноизотопная масса 235.90)
К раствору 4-бромо-3-хлор-2-фторбензальдегида (4.073 г, 17.2 ммоль, Экв: 1) в ДМФ (41 мл) добавили при 22°C карбонат калия (2.37 г, 17.2 ммоль, Экв: 1) с последующим метил 2-меркаптобензоатом (2.98 г, 2.43 мл, 17.2 ммоль, Экв: 1) (собственная температура поднялась до 24°C при охлаждении на водяной бане) и перемешивали в течение 1 ч с достижением полной конверсии. Желтую эмульсию погасили водой (100 мл - экзотермично) и экстрагировали этилацетатом (100 мл), однако разделения фаз не было. Добавление 5 г хлорида натрия дало разделение слоев. Водный слой экстрагировали этилацетатом (1 x 50 мл). Органические слои промыли насыщ. NaCl (1 x 50 мл), высушили и эвапорировали. Остаток очистили с помощью флеш-хроматографии (силикагель, 330 г, абсордированный на 10 г Изолюта HM-N, EtOAc в гептане 0% до 10% до 20% до 40%) с получением метил 2-((3-бромо-2-хлор-6-формилфенил)тио)бензоата (2.546 г, 39%) в виде светло-желтого осадка.
LC-MS: m/z = 385.0 (M+H)+ (моноизотопная масса 383.92)
К мутному раствору метил 2-((3-бромо-2-хлор-6-формилфенил)тио)бензоата (2.48 г, 6.43 ммоль, Экв: 1) и 2-метилпропан-2-сульфинамида (779 мг, 6.43 ммоль, Экв: 1) в ТГФ (28 мл) добавили при 22°C этоксид титана (IV) (7.33 г, 6.67 мл, 32.2 ммоль, Экв: 5) с получением прозрачного желтого раствора с последующим нагреванием до кипения и перемешивали при 70°C в течение 30 мин с достижением полной конверсии. Мутны светло-желтый раствор охладили до 22°C и погасили насыщ. NaCl (30 мл) с получением густой суспензии. Смесь отфильтровали через дикалит и промыли этилацетатом (2 x 30 мл). Фильтрат (1-фазная система) высушили и эвапорировали с получением смеси (E)-метил 2-((3-бромо-6-(((трет-бутилсульфинил)имино)метил)-2-хлорфенил)тио)бензоата и (E)-этил 2-((3-бромо-6-(((трет-бутилсульфинил)имино)метил)-2-хлорфенил)тио)бензоата (3.04 г, 6.22 ммоль, 97 % выход) в виде желтого осадка.
NMR: смесь метилового и этилового эфира, соотношение приблизительно 3:1
LC-MS: m/z = 488.0 (M+H)+ для метилового эфира (MW 486.97 для моноизотопной массы) и 502.0 (M+H)+ для этилового эфира
К раствору (E)-метил 2-((3-бромо-6-(((трет-бутилсульфинил)имино)метил)-2-хлорфенил)тио)бензоата (3.04 г, 6.22 ммоль, Экв: 1, 3:1 смесь метилового и этиловго эфиров) в ТГФ (60 мл) добавили при 22°C борогидрид лития (1.35 г, 62.2 ммоль, Экв: 10) за одну порцию при охлаждении на водяной бане, несмотря на то, что цвет сразу изменился на интенсивно зеленый и собственная температура повысилась до 31°C. После деколоризации (5 минут) смесь нагревали до 50°C и перемешивали при 50°C в течение 24 ч с достижением полной конверсии. Смесь охладили до 22°C, погасили по каплям (кипение и экзотермичность - охладили на бане вода со льдом) насыщенным NH4Cl (50 мл) и полсностью экстрагировали этилацетатом (1 x 50 мл). Органический слой промыли 5% KH2PO4 (1 x 50 мл, pH 5 до разрушения боранового комплекса) и насыщенным NaCl (1 x 50 мл), высушили и эвапорировали с получением неочищенного продукта в виде белого осадка. Осадок растворили в 50 мл этилацетата при кипении с обратным холодильником, охладили до 22°C, при этом 50 мл гептана добавили за одну порцию. Раствор перемешивали в течение 30 минут при 22°C, несмотря на начало кристаллизации. Затем охладили до 5°C и перемешивали в течение 30 минут, осадок отфильтровали, промыли EtOAc/Hep 1:1 (1 x 20 мл) и пентаном (1 x 20 мл) и высушили в глубоком вакууме с получением N-(4-бромо-3-хлор-2-((2-(гидроксиметил)фенил)тио)бензил)-2-метилпропан-2-сульфинамида (2.296 г, 80%) в виде белого осадка.
LC-MS: m/z = 484.0 (M + Na)+ (моноизотопная масса 460.99)
К суспензии N-(4-бромо-3-хлор-2-((2-(гидроксиметил)фенил)тио)бензил)-2-метилпропан-2-сульфинамида (1.5 г, 3.24 ммоль, Экв: 1) в метаноле (15 мл) добавили при 0°C HCl, 4 M в диоксане (8.1 мл, 32.4 ммоль, Экв: 10), дали нагреться до 22°C, при этом осадок полностью растворился, и перемешивали при 22°C в течение 60 мин с достижением полной конверсии. Растворитель удалили при пониженном давлении и высушили в глубоком вакууме до (2-((6-(аминометил)-3-бромо-2-хлорфенил)тио)фенил)метанола гидрохлорида (1.56 г, 122%) в виде серо-белой пены.
NMR: содержал трет-бутилсульфинову кислоту, без дополнительной очистки - использовали как есть на следующей стадии
LC-MS: m/z = 358.0 (M+H)+ (моноизотопная масса 356.96)
К раствору (2-((6-(аминометил)-3-бромо-2-хлорфенил)тио)фенил)метанола гидрохлорида (1.51 г, 3.82 ммоль, Экв: 1) в метаноле (90 мл) добавили при 22°C пиридин (1.21 г, 1.24 мл, 15.3 ммоль, Экв: 4) с последующим (9H-флуорен-9-ил)метил(2,5-диоксопирролидин-1-ил)карбонатом (1.35 г, 4.01 ммоль, Экв: 1.05) и перемешивали при 22°C в течение 20 ч, при этом преципитировался еще осадок с достижением полной конверсии. Осадок отфильтровали, промыли метанолом/пентаном 1:2 (1 x 30 мл), пентаном (1 x 30 мл) и высушили в глубоком вакууме с получением (9H-флуорен-9-ил)метил 4-бромо-3-хлор-2-((2-(гидроксиметил)фенил)тио) бензилкарбамата (1.174 г, 53%) в виде белого осадка.
LC-MS: m/z = 602.0 (M + Na)+ (моноизотопная масса 579.03)
К раствору (9H-флуорен-9-ил)метил 4-бромо-3-хлор-2-((2-(гидроксиметил)фенил)тио)бензилкарбамата (1.115 г, 1.92 ммоль, Экв: 1) в ТГФ (38 мл) и ДХМ (38 мл) добавили при 22°C диоксид марганца (3.34 г, 38.4 ммоль, Экв: 20) и перемешивали при 22°C в течение 3 ч с достижением полной конверсии. Смесь отфильтровали (мембранный фильтр), промыли ТГФ/ДХМ 1:1 (2 x 10 мл) и фильтрат эвапорировали с получением неочищенного продукта в виде желтой пены. Остаток растворили практически полностью в 15 мл ДХМ, но затем началась кристаллизация в шприце (планировали ввести на колонку). Осадок отфильтровали, промыли с помощью ДХМ (2 x 5 мл) и высушили с получением 208 мг (= 19%, P1) белый осадок. Фильтрат очистили с помощью флеш-хроматографии (силикагель, 40 г, EtOAc в гептане 0% до 100%, затем MeOH в ДХМ 10%), фракции продукта объединили с P1 и все эвапорироали и высушили в глубоком вакууме с получением (9H-флуорен-9-ил)метил 4-бромо-3-хлор-2-((2-формилфенил)тио)бензилкарбамата (0.95 г, 86%) в виде белого осадка.
LC-MS: m/z = 560.1 (M + H - H2O)+ (моноизотопная масса 577.01)
1H NMR (600 MHz, CDCl3) δ 10.26 (s, 1 H), 7.86 (br d,J=7.1 Hz, 1 H), 7.73 - 7.78 (m, 3 H), 7.51 (br d,J=7.5 Hz, 2 H), 7.40 (t, J=7.4 Hz, 3 H), 7.28 - 7.33 (m, 1 H), 7.27 - 7.31 (m, 2 H), 7.27 - 7.36 (m, 2 H), 6.55 (br dJ,=7.7 Hz, 1 H), 5.22 (br t,J=5.9 Hz, 1 H), 4.45 (br d, J=6.3 Hz, 2 H), 4.38 (d,J=6.7 Hz, 2 H), 4.15 (t,J=6.5 Hz, 2 H)
Промежуточное соединение 101
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(4-метансульфонилфенил)фенил}метил)карбамат
Раствор N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (2.5 г, 4.33ммоль), (3,5-диметил-1,2-оксазол-4-ил)бороновой кислоты (0.79 г, 5.63 ммоль) и карбонат натрия (1.38 г, 13 ммоль) в 1, 4-диоксане (20 мл) и воде (5мл) дегазировали аргоном в течение 10 мин и Pd(PPh3)4 (0.25 г, 0.22ммоль) добавили. Затем реакционную смесь нагревали при 120°C в течение 16 ч. Прогресс реакции контролировали с помощью ТСХ. Неочищенную реакционную смесь разбавили водой, экстрагировали с помощью EtOAc (25мл x 2), промыли солевым раствором и высушили над сульфатом натрия. Органический слой сконцентрировали при пониженном давлении и полученное таким образом неочищенное соединение очистили с помощью хроматографии на системе Combiflash (70% этилацетат в гексане) с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил} пиридин-2-ил)сульфанил]-3-хлор-5-(3,5-диметил-1,2-оксазол-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (2 г) в виде коричнево-оранжевого осадка. LC-MS: 594.2 [M+H]+
К охлажденному на льду раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(3,5-диметил-1,2-оксазол-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (2.0 г, 3.4ммоль) в MeOH (20мл) добавили 4M HCl в диоксане (15мл) и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое затем промыли диэтиловым эфиром (50мл x 2) с получением (2-{[2-(аминометил)-6-хлор-4-(3,5-диметил-1,2-оксазол-4-ил)фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (1.0 г, неочищенный) в виде желтого осадка. LC-MS: 376.1 [M+H]+
К перемешанному раствору (2-{[2-(аминометил)-6-хлор-4-(3,5-диметил-1,2-оксазол-4-ил)фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (1.0 г, неочищенный) в CH3CN (20мл) добавили 5% раствор NaHCO3 (20мл) с последующим Fmoc-OSu (0.9 г, 2.67ммоль) в CH3CN (10.0мл) по каплям и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную смесь разбавили водой (50мл) и экстрагировали этилацетатом (3 x 50мл). Объединенный органический слой промыли солевым раствором (3 x 20мл), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-{[3-хлор-5-(3,5-диметил-1,2-оксазол-4-ил)-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата (1.4 г) в виде коричневого осадка. LC-MS: 597.8 [M+H]+
К охлажденному на льду раствору 9H-флуорен-9-илметил N-{[3-хлор-5-(3,5-диметил-1,2-оксазол-4-ил)-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата (1.4 г) в ДХМ (30.0мл) добавили периодинан Десса-Мартина (1.49 г, 3.51ммоль) по порциям и реакционную смесь перемешивали при 25°C в течение 2 ч. Прогресс реакции контролировали с помощью ТСХ. После завершения реакции реакционную смесь влили в насыщенный раствор бикарбоната натрия (100 мл) и органический слой отделили . Органический слой промыли раствором тиосульфата натрия (2 x 50мл), высушили над сульфатом натрия и сконцентрировали при пониженном давлении и получившееся неочищенное соединение очистили с помощью хроматографии на системе Combiflash (1% метанол в ДХМ) с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(4-метансульфонилфенил)фенил}метил)карбамата (0.3 г) в виде коричнево-оранжевого осадка с чистотой 96% ЖХМС. LC-MS: 596.3 [M+H]+
1H NMR (400 MHz, DMSO-d6) δ 2.25 (3H, s), 2.41 (3H, s), 4.20 (1H, t, J=6.8 Hz), 4.29 (4H, d, J=6.4 Hz), 7.26 (3H, d, J=8.5 Hz), 7.36 - 7.40 (3H, m), 7.62 (1H, s), 7.66 (2H, d, J=7.5 Hz), 7.87 - 7.91 (3H, m), 8.38 (1H, d, J=7.7 Hz), 8.47 (1H, dd, J=4.8, 1.6 Hz), 10.21 (1H, s)
Промежуточное соединение 102
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(4-метансульфонилфенил)фенил}метил)карбамат

К перемешанному раствору N-[(5-бромо-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]-2-метилпропан-2-сульфинамида (10 г, 21.56ммоль) в ДХМ (100 мл) добавили имидазол (4.4 г, 64.68ммоль) и TBDMSCl (4.87 г, 32.34ммоль) последовательно и реакционную смесь перемешивали при 25°C в течение 2 ч. После заверешения реакции реакционную смесь промыли раствором бикарбоната натрия и экстрагировали с помощью ДХМ (100мл x 3). Объединенный органический слой сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили с помощью хроматографии на системе Combiflash (60% этилацетат в гексане) с получением N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (10 г) в виде серо-белого осадка. LC-MS: 579.2 [M+2H]+
Раствор N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (2.6 г, 4.51ммоль), (4-метансульфонил фенил)бороновой кислоты (1.17 г, 5.86ммоль) и карбоната натрия (1.43 г, 13.52ммоль) в 1, 4-диоксане (20мл) и воде (5.0мл) дегазировали аргоном в течение 10 мин и Pd(PPh3)4 (0.26 г, 0.23ммоль) добавили. Затем реакционную смесь нагревали при 120°C в течение 4 ч. Прогресс реакции контролировали с помощью ТСХ. Неочищенную смесь разбавили водой, экстрагировали с помощью EtOAc (50мл x 2), промыли солевым раствором и высушили над сульфатом натрия и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили хроматографией на колонке (70% этилацетат в гексане) с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(4-метансульфонилфенил)фенил}метил)-2-метилпропан-2-сульфинамида (2. г, 68%) в виде желтого осадка. LC-MS: 653.4[M+H]+
К охлажденному на льду раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(4-метансульфонилфенил)фенил}метил)-2-метилпропан-2-сульфинамида (2.0 г, 3.1ммоль) в MeOH (20мл) добавили 4M HCl в диоксане (15мл) и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром (50мл x 2) с получением (2-{[2-(аминометил)-6-хлор-4-(4-метансульфонил)фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (1.2 г) в виде желтого осадка. LC-MS: 435.0 [M+H]+
К перемешанному раствору (2-{[2-(аминометил)-6-хлор-4-(4-метансульфонилфенил)фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (1.2 г, 2.76ммоль) в CH3CN (20мл) добавили 5% раствор NaHCO3 (20мл) с последующим Fmoc-OSu (0.93 г, 2.77ммоль) в CH3CN (10.0мл) по каплям и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную смесь разбавили водой (50мл) и экстрагировали этилацетатом (3 x 50мл). Объединенный органический слой промыли солевым раствором (3 x 20мл), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(4-метансульфонилфенил)фенил)метил]карбамата (1.2 г) в виде желтого осадка. LC-MS: 656.6 [M+H]+
К охлажденному на льду раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(4-метансульфонилфенил)фенил)метил]карбамата (0.9 г, неочищенный) в ДХМ (30мл) добавили периодинан Десса-Мартина (0.87 г, 2.05ммоль) по порциям и реакционную смесь затем перемешивали при 25°C в течение 2 ч. Затем реакционную смесь влили в насыщенный раствор бикарбоната натрия (100мл) и органический слой отделили . Органический слой промыли раствором тиосульфата натрия (50 x 2мл), высушили над сульфатом натрия и сконцентрировали при пониженном давлении и получившееся неочищенное соединение очистили с помощью хроматографии на системе Combiflash (1% метанол в ДХМ) с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(4-метансульфонилфенил)фенил}метил)карбамата (0.3 г, 15% за 3 стадии) в виде коричнево-оранжевого осадка с чистотой 96% ЖХМС. LC-MS: 655.3 [M+H]+
1H NMR (400 MHz, DMSO-d6) δ 3.29 (3H, s), 4.21 (1H, d, J=6.7 Hz), 4.27 (2H, d, J=7.0 Hz), 4.37 (2H, d, J=6.1 Hz), 7.24 (2H, t, J=7.4 Hz), 7.37 (2H, d, J=7.4 Hz), 7.38 - 7.45 (1H, m), 7.67 (2H, d, J=7.4 Hz), 7.73 (1H, s), 7.87 (2H, d, J=7.5 Hz), 7.93 (1H, t, J=5.6 Hz), 7.96 - 8.00 (2H, m), 8.04 (3H, t, J=9.6 Hz), 8.39 (1H, dd, J=7.6, 1.6 Hz), 8.46 (1H, dd, J=4.7, 1.6 Hz), 10.22 (1H, s)
Промежуточное соединение 103
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(5-метансульфонилпиридин-3-ил)фенил}метил)карбамат

Раствор N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (0.6 г, 1.04ммоль), (5-метансульфонилпиридин-3-ил)бороновой кислоты (0.27 г, 1.35ммоль) и карбоната натрия (0.33 г, 3.12ммоль) в 1, 4-диоксане (25мл) и воде (5 мл) в закрытой пробирке дегазировали аргоном в течение 10 мин и Pd(PPh3)4 (0.06 г, 0.05ммоль) добавили. Реакционную смесь нагревали при 120°C в течение 4 ч. Прогресс реакции контролировали с помощью ТСХ. Неочищенную смесь разбавили водой и экстрагировали с помощью EtOAc (50мл x 2). Объединенные органические слои промыли солевым раствором, высушили над сульфатом натрия, эвапорировали при пониженном давлении и неочищенное соединение очистили посредством колоночной хроматографии (70% этилацетат в гексане) с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(5-метансульфонилпиридин-3-ил)фенил}метил)-2-метилпропан-2-сульфинамида (0.42 г, 62%) в виде желтого осадка. LC-MS: 653.6 [M+H]+
К охлажденному на льду раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(5-метансульфонилпиридин-3-ил)фенил}метил)-2-метилпропан-2-сульфинамида (1.2 г, 1.83ммоль) в MeOH (20мл) добавили 4M HCl в диоксане (12мл) и реакционную смесь перемешивали при 25°C в течение 2 ч. Летучие компоненты удалили при пониженном давлении с получением неочищенного соединения, которое промыли диэтиловым эфиром (50мл x 2) и высушили с получением (2-{[2-(аминометил)-6-хлор-4-(5-метансульфонилпиридин-3-ил)фенил]сульфанил}пиридин-3-ил)метанола (1 г, неочищенный) в виде белого осадка. LC-MS: 436.1 [M+H]+
К перемешанному раствору {2-[2-аминометил-6-хлор-4-(5-метансульфонил-пиридин-3-ил)-фенилсульфанил]-пиридин-3-ил}-метанола гидрохлорида (1 г, 2.3ммоль) в CH3CN (20мл) добавили 5% раствор NaHCO3 (20мл) с последующим Fmoc-OSu (0.78 г, 2.3ммоль) в CH3CN (10мл) по каплям и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную смесь разбавили водой (50мл) и экстрагировали этилацетатом (3 x 50мл). Объединенный органический слой промыли солевым раствором (3 x 20мл), высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(5-метансульфонилпиридин-3-ил)фенил)метил]карбамата (1.1 г, неочищенный) в виде белого осадка. LC-MS: 658.4 [M+H]+
К охлажденному на льду раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(5-метансульфонилпиридин-3-ил)фенил)метил]карбамата (1.1 г, неочищенный) в ДХМ (30мл) добавили периодинан Десса-Мартина (1.06 г, 2.51ммоль) по порциям и реакционную смесь затем перемешивали при 25°C в течение 2 ч. Затем реакционную смесь влили в насыщенный раствор бикарбоната натрия (2 x 50мл) и органический слой отделили . Органический слой промыли раствором тиосульфата натрия (2 x 50мл), высушили над сульфатом натрия и сконцентрировали при пониженном давлении и получившееся неочищенное соединение очистили колоночной хроматографией (50% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(5-метансульфонилпиридин-3-ил)фенил}метил)карбамата (0.55 г) в виде коричнево-оранжевого осадка с чистотой 91% ЖХМС. LC-MS: 656.3 [M+H]+
1H NMR (400 MHz, DMSO-d6) δ 3.42 (3H, s), 4.20 (1H, d, J=6.7 Hz), 4.27 (2H, d, J=6.9 Hz), 4.38 (2H, d, J=5.6 Hz), 7.25 (2H, t, J=7.4 Hz), 7.37 (3H, t, J=7.5 Hz), 7.65 (2H, d, J=7.5 Hz), 7.82 - 7.92 (4H, m), 8.13 (1H, s), 8.39 (1H, d, J=7.5 Hz), 8.43 (1H, d, J=4.7 Hz), 8.66 (1H, s), 9.14 (1H, s), 9.30 (1H, s), 10.22 (1H, s)
Промежуточное соединение 104
4-[3-хлор-5-[(9H-флуорен-9-илметоксикарбониламино)-метил]-4-(3-формил-пиридин-2-илсульфанил)-фенил]-3,5-диметил-пиразол-1-карбоновой кислоты 9H-флуорен-9-илметиловый эфир

Раствор N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (2.5 г, 4.33 ммоль), 3,5-диметил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола (1.25 г, 5.63ммоль) и карбоната натрия (1.38 г, 12.99ммоль) в 1, 4-диоксане (20мл) и воде (5.0мл) дегазировали аргоном в течение 10 мин и Pd(PPh3)4 (0.25 г, 0.22ммоль) добавили. Затем реакционную смесь нагревали при 120°C в течение 16 ч. Прогресс реакции контролировали с помощью ТСХ. Затем неочищенную реакционную смесь разбавили водой и экстрагировали с помощью EtOAc (50мл x 2), промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили колоночной хроматографией (90% этилацетат в гексане) с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(3,5-диметил-1H-пиразол-4-ил)фенил}метил)-2-метил пропан-2-сульфинамида (0.9 г) в виде коричневого осадка. LC-MS: 593.1 [M+H]+
К охлажденному на льду раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(3,5-диметил-1H-пиразол-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (0.9 г, 1.517ммоль) в MeOH (20мл) добавили 4M HCl в диоксане (10.0мл) и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем летучие компоненты удалили при пониженном давлении с получением бледно-оранжевого неочищенного твердого соединения, которое затем промыли диэтиловым эфиром (50мл x 2) с получением (2-{[2-(аминометил)-6-хлор-4-(3,5-диметил-1H-пиразол-4-ил)фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (0.9 г, неочищенный) в виде желтого осадка. LC-MS: 374.8 [M+H]+
К перемешанному раствору (2-{[2-(аминометил)-6-хлор-4-(3,5-диметил-1H-пиразол-4-ил)фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (1.1 г, 2.94ммоль) в CH3CN (20мл) добавили 5% раствор NaHCO3 (10мл) с последующим Fmoc-OSu (1.98 г, 5.88ммоль) в CH3CN (10.0мл) по каплям и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную смесь разбавили водой (50мл) и экстрагировали этилацетатом (3 x 50мл). Объединенный органический слой промыли солевым раствором (3 x 20мл), высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью хроматографии на системе Combiflash (2-5% метанол в ДХМ) с получением 9H-флуорен-9-илметил N-{[3-хлор-5-(3,5-диметил-1H-пиразол-4-ил)-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата(0.4 г) в виде белого осадка и 9H-флуорен-9-илметил 4-[3-хлор-5-({[(9H-флуорен-9-илметокси)карбонил]амино}метил)-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]-3,5-диметил-1H-пиразол-1-карбоксилата (0.6 г) в виде серо-белого осадка. LC-MS: 819.7 [M+H]+
К охлажденному на льду раствору 9H-флуорен-9-илметил 4-[3-хлор-5-({[(9H-флуорен-9-илметокси) карбонил]амино}метил)-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]-3,5-диметил-1H-пиразол-1-карбоксилата (0.5 г, 0.61ммоль) в ДХМ (20.0мл) добавили периодинан Десса-Мартина (0.39 г, 0.92ммоль) по порциям и реакционную смесь перемешивали при 25°C в течение 2 ч. Затем реакционную смесь влили в насыщенный раствор бикарбоната натрия (100мл) и органический слой отделили . Органический слой промыли раствором тиосульфата натрия (2 x 50мл), высушили над сульфатом натрия и сконцентрировали при пониженном давлении и получившееся неочищенное соединение очистили с помощью хроматографии на системе Combiflash (1% метанол в ДХМ) с получением 9H-флуорен-9-илметил 4-[3-хлор-5-({[(9H-флуорен-9-илметокси)карбонил]амино}метил)-4-[(3-формилпиридин-2-ил)сульфанил]фенил]-3,5-диметил-1H-пиразол-1-карбоксилата (0.27 г, 54%) в виде коричнево-оранжевого осадка с чистотой 91% ЖХМС. LC-MS: 817.4 [M+H]+
1H NMR (400 MHz, DMSO-d6) δ 2.03 (3H, s), 2.21 (3H, s), 4.29 (5H, d, J=5.9 Hz), 4.48 (1H, t, J=5.6 Hz), 4.84 (2H, d, J=6.0 Hz), 7.15 - 7.22 (6H, m), 7.28 - 7.36 (6H, m), 7.41 (4H, t, J=7.5 Hz), 7.50 (1H, s), 7.65 (2H, d, J=7.4 Hz), 7.80 (2H, d, J=7.5 Hz), 7.88 (5H, t, J=6.6 Hz), 8.38 (1H, d, J=7.3 Hz), 8.47 (1H, d, J=3.6 Hz), 10.21 (1H, s)
Промежуточное соединение 105
9H-флуорен-9-илметил N-{[3-хлор-5-(2-фторпиридин-4-ил)-2-[(3-формилпиридин-2-ил)сульфанил] фенил]метил}карбамат

К перемешанному раствору N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (10.0 г,17.3ммоль) в диоксане (50мл) добавили (2-фторпиридин-4-ил)бороновую кислоту (2.93 г, 20.8ммоль), Na2CO3 (5.51 г, 52ммоль), воду (25мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в неё добавили Pd(PPh3)4 (2.0 г, 1.73ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагрели до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита и промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством колоночной хроматографии (SiO2; 100-200 меш; 50-90% EtOAc/гексаны) с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(2-фторпиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (7.5 г, 72%) в виде серо-белого осадка. LC-MS: 593.9 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(2-фторпиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (7.5 г, 12.6ммоль) в MeOH (50мл), добавили 4M HCl в диоксане (25 мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(2-фторпиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (6.5 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 376.0 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-(2-фторпиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (6.5 г,17.33ммоль) в 5% NaHCO3(50 мл) добавили Fmoc-OSU (5.84 г, 17.33ммоль) в диоксане (50мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 16 ч. Затем реакционную массу разбавили водой и экстрагировали с помощью 10% метанола в дихлорметане. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении до 9H-флуорен-9-илметил N-{[3-хлор-5-(2-фторпиридин-4-ил)-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата (8.0 г) в виде серо-белого осадка; который использовали на следующей стадии без дополнительной очистки. LC-MS: 598.1 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-{[3-хлор-5-(2-фторпиридин-4-ил)-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]метил}карбамата в ДХМ/ТГФ (1:1, 100 мл) добавили MnO2(23.3 г, 268.0ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили посредством колоночной хроматографии (SiO2; 100-200 меш; 40-80% EtOAc/гексаны) с получением 9H-флуорен-9-илметил N-{[3-хлор-5-(2-фторпиридин-4-ил)-2-[(3-формилпиридин-2-ил)сульфанил]фенил]метил}карбамата (5.2 г) в виде серо-белого осадка с чистотой 95.7%. LC-MS: 596.1 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.20 (1H, t, J = 7.1 Hz), 4.28 (2H, d, J = 6.9 Hz), 4.38 (2H, d, J = 5.5 Hz), 7.26 (2H, t, J = 7.4 Hz), 7.36 - 7.40 (3H, m), 7.62 (1H, s), 7.67 (2H, d, J = 7.5 Hz), 7.74 (1H, d, J = 5.0 Hz), 7.82 (1H, s), 7.87 (3H, d, J = 7.5 Hz), 8.08 (1H, s), 10.21 (1H, s).
Промежуточное соединение 106 RO7189105-000
(9H-флуорен-9-ил)метил((5-хлор-2-((2-формилфенил)тио)пиридин-3-ил)метил)карбамат
Это соединение получили по аналогии с Промежуточным соединением 68 с использованием в качестве исходного вещества 2,5-дихлорникотинальдегида и метил 2-меркаптобензоата. Соединение, указанное в заголовке, получилив виде светло-желтой пены (230 мг). MS ESI (m/z): 501.1 [(M+H)+]
Промежуточное соединение 107
9H-флуорен-9-илметил N-({3-хлор-5-циано-2-[(3-формилпиридин-2-ил)сульфанил]фенил}метил)карбамат

К перемешанному раствору 5-бромо-3-хлор-2-фторбензальдегида (1.5 г, 6.3ммоль) в NMP (11.5мл) добавили CuCN (680мг, 7.59ммоль) и нагревали при 170°C в течение 30 мин в условиях микроволнового облучения. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-15% этилацетата в гексане с получением 3-хлор-4-фтор-5-формилбензонитрила (562 мг, 48%) в виде желтого осадка.
К перемешанному раствору 2-меркаптоникотиновой кислоты (1.4 г, 9.0ммоль) в ДМФ (15мл) добавили NaH (60%,0.393 г, 16.39ммоль) и реакционную массу перемешивали при 25°C в течение 30 мин. Затем 3-хлор-4-фтор-5-формилбензонитрил (1.5 г, 8.19ммоль) добавили и реакционную смесь перемешивали при 70°C в течение 4 ч. Затем K2CO3 (3.39 г, 24.59ммоль) добавили с последующим добавлением MeI (1.54мл, 24.6ммоль) и реакционную массу перемешивали при 25°C в течение 16 ч. Реакционную смесь погасили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 4-20% этилацетата в гексане с получением метил 2-[(2-хлор-4-циано-6-формилфенил)сульфанил] пиридинe-3-карбоксилата (1.0 г, 36%) в виде светло-желтого осадка.
К перемешанному раствору метил 2-[(2-хлор-4-циано-6-формилфенил)сульфанил]пиридин-3-карбоксилата (1.0 г, 3.01ммоль) в ТГФ (20мл) добавили 2-метилпропан-2-сульфинамид (365мг, 3.01ммоль), Ti(OEt)4 (3.15мл, 15.06ммоль) и реакционную массу нагревали до 70°C в течение 45 мин. Реакционную массу погасили насыщенным раствором хлорида аммония, полученный осадок отфильтровали через слой целита, промыли этилацетатом. Отделенный органический слой высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением этил 2-[(2-хлор-4-циано-6-{[(2-метилпропан-2-сульфинил)имино]метил} фенил)сульфанил] пиридин-3-карбоксилата (1.2 г), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 449.8 [M+H]+
К перемешанному раствору этил 2-[(2-хлор-4-циано-6-{[(2-метилпропан-2-сульфинил)имино]метил} фенил)сульфанил]пиридин-3-карбоксилата (1.3 г, 2.89ммоль) в ТГФ (15 мл) добавили LiBH4 (189.0мг, 8.68ммоль) при 0°C и реакционную массу нагревали до 70°C в течение 2 ч. Реакционную смесь погасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Отделенный органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-60% этилацетата в гексане с получением N-[(3-хлор-5-циано-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]-2-метилпропан-2-сульфинамидв в виде серо-белого осадка (510 мг). LC-MS: 410.1 [M+H]+
К перемешанному раствору N-[(3-хлор-5-циано-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]-2-метилпропан-2-сульфинамида (510мг, 1.25ммоль) в MeOH (8мл), добавили 4M HCl в диоксане (4мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 20 мин. После завершения реакции реакционную смесь погасили насыщенным раствором бикарбоната натрия, экстрагировали этилацетатом, промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением 3-(аминометил)-5-хлор-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}бензонитрила HCl соли (350мг, неочищенный), которую сразу использовали на следующей стадии. LC-MS: 306.0 [M+H]+
К перемешанной суспензии 3-(аминометил)-5-хлор-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}бензонитрила HCl соли (350мг, 1.15ммоль) в 5% NaHCO3(10мл) добавили Fmoc-OSU (386.95мг, 1.148ммоль) в диоксане (10мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 16 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-5-циано-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]карбамата (450 мг), который сразу использовали на следующей стадии. LC-MS: 528.1 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-5-циано-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил)метил]карбамата (450мг, 0.85ммоль) в ДХМ:ТГФ (1:1, 14мл) добавили MnO2(1.48 г, 17.07ммоль) и реакционную массу перемешивали при 25°C в течение 1 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 20-40% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-5-циано-2-[(3-формилпиридин-2-ил)сульфанил]фенил}метил)карбамата (200 мг) в виде серо-белого осадка с чистотой 94% ЖХМС. LC-MS: 525.8 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.15 - 4.38 (5H, m), 7.28 - 7.36 (2H, m), 7.42 (2H, t, J = 8.2 Hz), 7.68 (2H, d, J = 7.9 Hz), 7.89 (2H, d, J = 7.1 Hz), 8.11 - 8.21 (1H, m), 8.36 - 8.48 (2H, m), 10.14 - 10.23 (1H, m).
Промежуточное соединение 108
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-{2-окса-5-азабицикло[2.2.1]гептан-5-ил}фенил}метил)карбамат

К перемешанному раствору N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (500мг, 0.86ммоль) в толуоле (5мл) добавили 2-окса-5-азабицикло[2.2.1]гептана гидрохлорид (141мг, 1.04ммоль) и трет-бутоксид натрия (333 мг, 3.46ммоль) и дегазировали в атмосфере аргона в течение 5 мин. Затем в неё добавили 2-дитретбутил фосфинобифенил (23.3мг, 0.078ммоль) и Pd(dba)2 (39.9мг, 0.07ммоль) и нагревали при 110°C в течение 16 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью колоночной хроматографии на системе Combiflash с использованием 5% метанола в дихлорметане с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил} пиридин-2-ил)сульфанил]-3-хлор-5-{2-окса-5-азабицикло [2.2.1]гептан-5-ил}фенил}метил)-2-метилпропан-2-сульфинамида (300 мг, 58%) в виде светло-желтого осадка. LC-MS: 595.8 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-{2-окса-5-азабицикло[2.2.1]гептан-5-ил}фенил}метил)-2-метилпропан-2-сульфинамида (900мг, 1.51ммоль) в MeOH (10мл), добавили 4M HCl в диоксане (5мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-{2-окса-5-азабицикло [2.2.1]гептан-5-ил} фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (700 мг), который сразу использовали на следующей стадии. LC-MS: 377.6 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-{2-окса-5-азабицикло[2.2.1]гептан-5-ил}фенил]сульфанил}пиридин-3-ил)метанола HCl соли (700 мг, 1.85ммоль) в 5% NaHCO3(10мл) добавили Fmoc-OSU (626мг, 1.85ммоль) в диоксане (10мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 16 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-{2-окса-5-азабицикло [2.2.1]гептан-5-ил}фенил)метил]карбамата (800 мг) в виде серо-белого осадка, который использовали на следующей стадии без дополнительной очистки. LC-MS: 600.2 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-{2-окса-5-азабицикло[2.2.1]гептан-5-ил}фенил)метил]карбамата (800мг,1.33ммоль) в ДХМ:ТГФ (1:1, 20мл) добавили MnO2(2.32 г, 26.7ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 30%-80% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-{2-окса-5-азабицикло[2.2.1]гептан-5-ил}фенил}метил)карбамата (170 мг) в виде серо-белого осадка с чистотой 90.89%. LC-MS: 598.0 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 3.02 (1H, d, J = 9.5 Hz), 3.44 (1H, d, J = 10.1 Hz), 3.64 (1H, d, J = 7.1 Hz), 3.71 (1H, d, J = 8.0 Hz), 4.22 (5H, dd, J = 16.7, 6.3 Hz), 4.62 (2H, d, J = 22.8 Hz), 6.56 (1H, s), 6.79 (1H, s), 7.27 - 7.38 (3H, m), 7.42 (2H, t, J = 6.9 Hz), 7.69 (2H, d, J = 7.7 Hz), 7.70 - 7.78 (1H, m), 7.89 (2H, d, J = 7.7 Hz), 8.30 (1H, d, J = 7.1 Hz), 8.43 (1H, d, J = 5.0 Hz), 10.20 (1H, s).
Промежуточное соединение 109
9H-флуорен-9-илметил N-({5-[3-(бензилокси)проп-1-ин-1-ил]-3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]фенил}метил)карбамат

К перемешанной и дегазированной суспензии N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил} пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (2 г, 3.46ммоль), [(проп-2-ин-1-илокси)метил]бензола (1мл, 6.9ммоль) в триэтиламине (8мл) добавили CuI (13мг, 0.07ммоль), ацетат палладия (8мг, 0.04ммоль), PPh3(18мг, 0.07ммоль) и реакционную массу нагревали до 80°C в течение 6 ч. Реакционную массу эвапорировали при пониженном давлении и полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 0-30% этилацетата в гексане с получением N-({5-[3-(бензилокси)проп-1-ин-1-ил]-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (1 г,45%) в виде бесцветной вязкой жидкости. LC-MS: 643.2 [M+H]+
К перемешанному раствору N-({5-[3-(бензилокси)проп-1-ин-1-ил]-2-[(3-{[(трет-бутилдиметилсилил)окси]метил} пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (1 г, 1.5ммоль) в MeOH (8мл), добавили 4M HCl в диоксане (4мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-4-[3-(бензилокси)проп-1-ин-1-ил]-6-хлорфенил]сульфанил}пиридин-3-ил)метанола HCl соли (700 мг), которую сразу использовали на следующей стадии. LC-MS: 425.1 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-4-[3-(бензилокси)проп-1-ин-1-ил]-6-хлорфенил]сульфанил}пиридин-3-ил)метанола HCl соли (700мг, 1.5ммоль) в 5% NaHCO3(20мл) добавили Fmoc-OSU (511мг, 1.5ммоль) в диоксане (40мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную смесь разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-({5-[3-(бензилокси)проп-1-ин-1-ил]-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил} фенил}метил)карбамата (850 мг) в виде серо-белого осадка, который использовали на следующей стадии без дополнительной очистки. LC-MS: 647.0 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-({5-[3-(бензилокси)проп-1-ин-1-ил]-3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил} фенил}метил)карбамата (850мг, 1.31ммоль) в ДХМ:ТГФ (1:1, 40мл) добавили MnO2(2.28 г, 26.3ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 10%-50% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({5-[3-(бензилокси)проп-1-ин-1-ил]-3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]фенил}метил)карбамата (500 мг) в виде серо-белого осадка с чистотой 91%. LC-MS: 645.3 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.26 - 4.30 (5H, m), 4.49 (2H, s), 4.62 (2H, s), 7.30 - 7.42 (11H, m), 7.68 (3H, d, J = 7.0 Hz), 7.88 (3H, d, J = 7.1 Hz), 8.38 (1H, d, J = 7.6 Hz), 8.42 (1H, d, J = 4.6 Hz), 10.19 (1H, s).
Промежуточное соединение 110
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-6-(пиридин-4-ил)фенил}метил)карбамат

К перемешанному раствору соединения N-({6-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (4 г, 6.93ммоль) в диоксане (30мл) добавили пиридин-4-бороновую кислоту (1.1 г, 9.01ммоль), Na2CO3 (2.2 г, 20.79 ммоль), воду (15мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в неё добавили Pd(PPh3)4 (0.8 г,0.69ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита, промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом с получением неочищенного соединения, которое очистили с помощью обычной колонки с силикагелем с использованием 5-80% этилацетата в гексане с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-6-(пиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (2.2 г, 55%) в виде серо-белого осадка. LC-MS: 575.8 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-6-(пиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (2.2 г, 3.82ммоль) в MeOH (20мл), добавили 4M HCl в диоксане (10мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-3-(пиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли(1.3 г), которую сразу использовали на следующей стадии. LC-MS: 358.2 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-3-(пиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (1.3 г, 3.64ммоль) в 5% NaHCO3(20мл) добавили Fmoc-OSU (1.22 г, 3.64ммоль) в диоксане (20мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 16 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-6-(пиридин-4-ил)фенил)метил]карбамата (2 г), который сразу использовали на следующей стадии. LC-MS: 580.2 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-6-(пиридин-4-ил)фенил)метил]карбамата (2.0 г, 3.45ммоль) в ДХМ:ТГФ (1:1, 40мл) добавили MnO2(6.0 г, 69ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 40-80% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-6-(пиридин-4-ил)фенил}метил)карбамата (650 мг) в виде серо-белого осадка с чистотой 90% ЖХМС. LC-MS: 577.9 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.10 - 4.14 (5H, m), 7.33 - 7.46 (8H, m), 7.58 (1H, s), 7.65 (2H, d, J = 7.3 Hz), 7.73 (1H, d, J = 8.3 Hz), 7.89 (2H, d, J = 7.4 Hz), 8.35 (1H, d, J = 7.7 Hz), 8.48 (1H, d, J = 3.1 Hz), 8.59 (2H, d, J = 5.5 Hz), 10.21 (1H, s).
Промежуточное соединение 111 (RO7189173-000-001)
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-6-(пиридин-3-ил)фенил}метил)карбамат

К перемешанному раствору соединения N-({6-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (4 г, 6.9ммоль) в диоксане (40мл) добавили пиридин-3-бороновую кислоту (1.1 г, 8.9ммоль), Na2CO3 (2.2 г, 20.7ммоль), воду (20мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в неё добавили Pd(PPh3)4 (400мг, 0.34 ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагрели до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита, промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-6-(пиридин-3-ил)фенил}метил)-2-метилпропан-2-сульфинамида (4 г, неочищенный), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 575.6 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-6-(пиридин-3-ил)фенил}метил)-2-метилпропан-2-сульфинамида (4 г, 6.9ммоль) в MeOH (40мл), добавили 4M HCl в диоксане (20мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-3-(пиридин-3-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (2.5 г), которую сразу использовали на следующей стадии. LC-MS: 357.8 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-3-(пиридин-3-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (2.5 г, 6.3ммоль) в 5% NaHCO3(40мл) добавили Fmoc-OSU (2.13 г, 6.3ммоль) в диоксане (80мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-6-(пиридин-3-ил)фенил)метил]карбамата (3 г), который сразу использовали на следующей стадии. LC-MS: 580.0 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-6-(пиридин-3-ил)фенил)метил]карбамата (3 г, 5.17ммоль) в ДХМ:ТГФ (1:1, 60мл) добавили MnO2(8.99 г, 103.4ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 10-50% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-6-(пиридин-3-ил)фенил}метил)карбамата (1.2 г) в виде серо-белого осадка с чистотой 89% ЖХМС. LC-MS: 577.7 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.07 - 4.16 (5H, m), 7.29 - 7.50 (7H, m), 7.59 (1H, s), 7.65 (2H, d, J = 7.5 Hz), 7.72 (1H, d, J = 8.3 Hz), 7.88 (3H, t, J = 7.8 Hz), 8.34 (1H, d, J = 6.3 Hz), 8.48 (1H, d, J = 4.6 Hz), 8.61 (1H, d, J = 4.1 Hz), 8.65 (1H, s), 10.21 (1H, s).
Промежуточное соединение 112
9H-флуорен-9-илметил N-[[2-(2-формилфенил)сульфанил-6-морфолин-4-илпиридин-3-ил]метил]карбамат

К раствору 2,6-дихлорникотинальдегида (200 мг, 1.14 ммоль, Экв: 1) и Et3N (115 мг, 158 мкл, 1.14 ммоль, Экв: 1) в ДМФ (2.6 мл) добавили раствор морфолина (99 мг, 99.4 мкл, 1.14 ммоль, Экв: 1) в ДМФ (520 мкл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь сконцентрировали под вакуумом и полученный 2-хлор-6-морфолиноникотинальдегид (350 мг, желтый осадок) использовали на следующей стадии без дополнительной очистки. MS ESI (m/z): 227.1 [(M+H)+]
Это соединение получили по аналогии с Промежуточным соединением 68 с использованием в качестве исходного вещества 2-хлор-6-морфолиноникотинальдегида и метил 2-меркаптобензоата. Соединение, указанное в заголовке, получили в виде светло-желтого осадка (50 мг). MS ESI (m/z): 552.2 [(M+H)+]
Промежуточное соединение 113
(9H-флуорен-9-ил)метил((4-((2-формилфенил)тио)-2-морфолинопиридин-3-ил)метил)карбамат
К перемешанному раствору метил 2-сульфанилбензоата (5 г, 29.72ммоль) в ДМФ (50мл) добавили Cs2CO3(19.369 г, 59.45 ммоль) с последующим 2,4-дихлорпиридин-3-карбальдегидом (5.231 г 29.72 ммоль) и нагревали при 70°C в течение 2 ч. Реакционную смесь разбавили водой и экстрагировали этилацетатом. Объединенные органические слои промыли водой, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили посредством колоночной хроматографии на силикагеле с использованием этилацетата в н-гексане (0-8%) в качестве элюирующего растворителя с получением метил 2-[(2-хлор-3-формилпиридин-4-ил)сульфанил]бензоата (6.1 г, 66.69 %) в виде светло-желтого осадка. LC-MS: 307.9 [M+H]+.
К перемешанному раствору метил 2-[(2-хлор-3-формилпиридин-4-ил)сульфанил]бензоата (2.5 г, 8.12 ммоль) в толуоле (30 мл) добавили Cs2CO3(7.93 г, 24.35 ммоль), морфолин (0.8 мл, 9.74 ммоль) и продули аргоном. Затем ксантфос (0.235 г, 0.41 ммоль), Pd2(dba)3(0.372 г, 0.41 ммоль) добавили в реакционную смесь, снова продули аргоном и нагревали при 110°C в течение 6 ч. Реакционную смесь погасили водой и экстрагировали этилацетатом. Объединенные органические слои промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили посредством колоночной хроматографии на силикагеле с использованием этилацетата в н-гексане (0-40%) в качестве элюирующего растворителя с получением метил 2-{[3-формил-2-(морфолин-4-ил)пиридин-4-ил]сульфанил}бензоата (2.1 г, 72%) в виде белого осадка. LC-MS: 359.6 [M+H]+.
К перемешанному раствору метил 2-{[3-формил-2-(морфолин-4-ил)пиридин-4-ил]сульфанил}бензоата (2.1 г, 5.87 ммоль) в ТГФ (40 мл) добавили 2-метилпропан-2-сульфинамид (0.711 г, 5.87 ммоль) и Ti(OEt)4(6.2 мл, 29.33 ммоль) и нагревали при 70°C в течение 2 ч. Реакционную смесь погасили солевым раствором, этилацетат добавили и отфильтровали. Водный слой экстрагировали этилацетатом, высушили Объединенные органические слои над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили колоночной хроматографией на системе Combiflash с использоанием этилацетата в гексане (0-40%) в качестве элюирующего растворителя с получением метил 2-({3-[(1E)-[(2-метилпропан-2-сульфинил)имино]метил]-2-(морфолин-4-ил)пиридин-4-ил}сульфанил)бензоата (690 мг, 26%) в виде желтого осадка. LC-MS: 462.1 [M+H]+.
К перемешанному раствору метил 2-({3-[(1E)-[(2-метилпропан-2-сульфинил)имино]метил]-2-(морфолин-4-ил)пиридин-4-ил}сульфанил)бензоата (900 мг, 1.95 ммоль) в ТГФ (15 мл) добавили LiAlH4 (2M в ТГФ, 1.95 мл, 3.91 ммоль) при 0°C и перемешивали при 25°C в течение 30 мин. Реакционную смесь погасили водным насыщенным раствором сульфата натрия (15 мл), отфильтровали и сконцентрировали под вакуумом с получением N-[(4-{[2-(гидроксиметил)фенил]сульфанил}-2-(морфолин-4-ил)пиридин-3-ил)метил]-2-метилпропан-2-сульфинамида (720 мг, неочищенный), который использовали без дополнительной очистки. LC-MS: 435.7 [M+H]+.
К перемешанному раствору N-[(4-{[2-(гидроксиметил)фенил]сульфанил}-2-(морфолин-4-ил)пиридин-3-ил)метил]-2-метилпропан-2-сульфинамида (неочищенный, 700 мг, 1.62 ммоль) в MeOH (6 мл) добавили 4 н HCl в диоксане (10 мл) при 0°C и перемешивали при 25°C в течение 30 мин. Реакционную смесь сконцентрировали под вакуумом с получением (2-{[3-(аминометил)-2-(морфолин-4-ил)пиридин-4-ил]сульфанил} фенил)метанола гидрохлорида (670 мг, неочищенный) в виде коричневого осадка и использовали без дополнительной очистки. LC-MS: 332.4 [M+H]+.
К перемешанной суспензии (2-{[3-(аминометил)-2-(морфолин-4-ил)пиридин-4-ил]сульфанил}фенил) метанола гидрохлорида (неочищенный, 650 мг, 1.64 ммоль) в 5% водном NaHCO3(5 мл) добавили Fmoc-OSu (609.241 мг, 1.81 ммоль) в диоксане (5 мл) и перемешивали при 25°C в течение 30 мин. Реакционную смесь отфильтровали и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили с помощью хроматографии на силикагеле с использованием этилацетата в н-гексане (0-40%) в качестве элюирующего растворителя с получением 9H-флуорен-9-илметил N-[(4-{[2-(гидроксиметил)фенил]сульфанил}-2-(морфолин-4-ил)пиридин-3-ил)метил]карбамата (700 мг, 65% за 3 стадии) в виде белого осадка. LC-MS: 553.9 [M+H]+.
К перемешанной суспензии 9H-флуорен-9-илметил N-[(4-{[2-(гидроксиметил)фенил]сульфанил}-2-(морфолин-4-ил)пиридин-3-ил)метил]карбамата (650 мг, 1.18 ммоль) в ДХМ (10 мл) добавили периодинан Десса-Мартина (747.8 мг, 1.76 ммоль) при 0°C и перемешивали при 25°C в течение 2 ч. Реакционную смесь разбавили с помощью ДХМ, промыли водным насыщенным раствором NaHCO3, с последующим солевым раствором. Органический слой разделили, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили посредством колоночной хроматографии на силикагеле с использованием этилацетата в н-гексане (0-40%) в качестве элюирующего растворителя с получением 9H-флуорен-9-илметил N-({4-[(2-формилфенил)сульфанил]-2-(морфолин-4-ил)пиридин-3-ил}метил)карбамата (230 мг, 36 %) в виде белого осадка. LC-MS: 551.9 [M+H]+.
1H NMR: (400MHz, DMSO-d6) δ 3.07 (4H, s), 3.70 (4H, s), 4.18-4.26 (1H, m), 4.32 (2H, d, J = 6.6Hz), 4.40-4.47 (2H, m), 6.41 (1H, d, J = 5.3Hz), 7.28 (2H, t, J = 6.7Hz), 7.38 (2H, t, J = 6.9Hz), 7.48 (1H, d, J = 7.7Hz), 7.65-7.77 (5H, m), 7.87 (2H, d, J = 7.2Hz), 7.99 (1H, d, J = 6.4Hz), 8.04 (1H, d, J = 5.2 Hz), 10.29 (1H, s).
Промежуточное соединение 114
(9H-флуорен-9-ил)метил((6-бромо-3-((3-формилпиридин-2-ил)тио)пиридин-2-ил)метил)карбамат

Это соединение получили по аналогии с Промежуточным соединением 95 с использованием в качестве исходного вещества 6-бромо-3-фторпиколинальдегида и 2-меркаптоникотиновой кислоты. Соединение, указанное в заголовке, получили в виде светло-красной пены (133 мг). MS ESI (m/z): 546.0, 548.0 [(M+H)+]
Промежуточное соединение 115
[2-(4-бромо-2-формил-фенилсульфанил)-3-хлор-бензил]-карбаминовой кислоты 9H-флуорен-9-илметиловый эфир
К суспензии безводного сульфида натрия (4.14 г, 2.23 мл, 53 ммоль, Экв: 2) в безводном ДМФ (100 мл) добавили при 22°C метил 3-хлор-2-фторбензоат (5.00 г, 26.5 ммоль, Экв: 1), нагревали до 70°C при этом цвет поменялся на темно-зеленый, и перемешивали при 70°C в течение 2 ч, при этом цвет поменялся на желтый с достижением полной конверсии. Смесь охладили до 5°C и погасили медленным покапельным добавлением в охлажденный на льду 10% раствор HCl (200 мл), разбавили насыщенным NaCl (200 мл) и экстрагировали этилацетатом (2 x 300 мл). Органические слои высушили и эвапорировали с получением желтого масла. Неочищенный продукт очистили с помощью флеш-хроматографии (силикагель, 80 г, адсорбированный на Isolute HM-N, EtOAc в гептане 0% до 10% до 50%) с получением метил 3-хлор-2-меркаптобензоата (2.95 г, 55%) в виде светло-желтого масла.
К раствору метил 3-хлор-2-меркаптобензоата (2.5 г, 12.3 ммоль, Экв: 1) в ДМФ (50 мл) добавили при 22°C 5-бромо-2-фторбензальдегид (3.76 г, 18.5 ммоль, Экв: 1.5) с последующим карбонатом калия (1.7 г, 12.3 ммоль, Экв: 1), нагревали до 70°C и перемешивали при 70°C в течение 3 ч с достижением полной конверсии. Суспензию охладили до 22°C, преципитировавшийся осадок отфильтровали, промыли эфиром (1 x 15 мл). Фильтрат эвапорировали и желтое мутное масло очистили с помощью флеш-хроматографии (силикагель, 120 г, адсорбированный на сорбенте Isolute HM-N, EtOAc в гептане 0% до 30%) с получением метил 2-((4-бромо-2-формилфенил)тио)-3-хлорбензоата (2.536 г, 53%) в виде светло-желтого осадка.
LC-MS: m/z = 385.0 (M+H)+ (моноизотопная масса 383.92)
К раствору метил 2-((4-бромо-2-формилфенил)тио)-3-хлорбензоата (2.41 г, 6.25 ммоль, Экв: 1) в толуоле (72 мл) добавили при 22°C этиленгликоль (776 мг, 697 мкл, 12.5 ммоль, Экв: 2) с последующим моногидратом п-толуолсульфоновой кислоты (119 мг, 625 мкмоль, Экв: 0.1), нагревали до кипения в аппарате Дена-Старка и перемешивали при 111°C (масляная баня 145°C) в течение 10 ч, но подтвердилось только 72% конверсии по данным ЖХ-МС. Дополнительное добавление 1.4 мл этиленгликоля (= 4 экв.) с последующими дополнительными 119 мг (= 0.1 экв.) моногидрата п-толуолсульфоновой кислоты и снова перемешивание при кипении с обратным холодильником как описано в течение 4 ч дало больше примесей (ЖХ-МС) и не дало дополнительной конверсии. Растворитель удалили при пониженном давлении, остаток обработали насыщенным NaHCO3 (100 мл) и экстрагировали этилацетатом (2 x 100 мл). Органические слои высушили и эвапорировали. Остаток очистили с помощью флеш-хроматографии (силикагель, 120 г, адсорбированный на Isolute HM-N, Гептан/ДХМ 2:1 до 100% ДХМ) с получением метил 2-((4-бромо-2-(1,3-диоксолан-2-ил)фенил)тио)-3-хлорбензоата (2.257 г, 84%) в виде бесцветного масла.
LC-MS: m/z = 429.0 (M+H)+ (для моноизотопной массы 427.95)
К раствору метил 2-((4-бромо-2-(1,3-диоксолан-2-ил)фенил)тио)-3-хлорбензоата (2.2 г, 5.12 ммоль, Экв: 1) в тетрагидрофуране (44 мл) добавили по каплям при 0°C алюмогидрид лития, 2 M в ТГФ (7.68 мл, 15.4 ммоль, Экв: 3) и перемешивали при 0°C в течение 3 ч с достижением полной конверсии. Смесь погасили посредством покапельного добавления 2.5 мл воды (прибл. 2.5 экв - экзотермично, выделение газа) и перемешивали в течение 1 ч при 0°C. Затем дали нагреться до 22°C, обработали Na2SO4 и разбавили этилацетатом (16 мл) и отфильтровали. Фильтрат эвапорировали и высушили с получением соединения, указанного в заголовке (1.711 г, 83%) в виде бесцветного масла. Использовали как есть на следующей стадии.
LC-MS: 69% с m/z = 339.1 (M + H - этиленгликоль)+ для продукта (для моноизотопной массы 399.95) и 20% примесей с m/z = 261.0 (M + H - этиленгликоль)+ дезбром побочный продукт
К раствору (2-((4-бромо-2-(1,3-диоксолан-2-ил)фенил)тио)-3-хлорфенил)метанола (1.65 г, 4.11 ммоль, Экв: 1) в дихлорметане (17 мл) добавили при 0°C триэтиламин (1.25 г, 1.72 мл, 12.3 ммоль, Экв: 3) и затем по каплям (5 минут) метансульфонилхлорид (706 мг, 480 мкл, 6.16 ммоль, Экв: 1.5) при сохранении собственной температуры ниже 5°C и перемешивали при 0°C в течение 30 мин с достижением полной конверсии. Смесь погасили водой (50 мл) и экстрагировали дихлорметаном (2 x 50 мл). Органические слои высушили и эвапорировали. Остаток очистили с помощью флеш-хроматографии (силикагель, 80 г, адсорбированный на Isolute HM-N, EtOAc в гептане 0% до 50%) с получением 2-((4-бромо-2-(1,3-диоксолан-2-ил)фенил)тио)-3-хлорбензилметансульфоната (1.132 г, 57%) в виде бесцветного масла.
LC-MS: m/z = 479.0 (M+H)+ (477.93 для моноизотопной массы)
К раствору 2-((4-бромо-2-(1,3-диоксолан-2-ил)фенил)тио)-3-хлорбензилметансульфоната (1.05 г, 2.19 ммоль, Экв: 1) в тетрагидрофуране (8 мл) добавили при -78°C аммоний (11.2 г, 14.2 мл, 657 ммоль, Экв: 300) посредством конденсации при -78°C и последующим переносом в автоклав, охлажденный сухим льдом, с помощью воронки, закрыли дали нагреться до 22°C. Затем через всего 2 ч автоклав снова охладили до приблизительно -50°C, клапан открыли и дали нагреться при этом избыток аммония абсорбировали в промывочной бутылке, содержащей 5 M HCl. Оставшуюся реакционную смесь продули аргоном в течение 20 минут и смесь отфильтровали. Фильтрат эвапорировали с получением (2-((4-бромо-2-(1,3-диоксолан-2-ил)фенил)тио)-3-хлорфенил)метанамина (715 мг, 82%) в виде бесцветного масла.
LC-MS: m/z = 400.0 (M+H)+ (398.97 для моноизотопной массы)
К эмульсии (2-((4-бромо-2-(1,3-диоксолан-2-ил)фенил)тио)-3-хлорфенил)метанамина (660 мг, 1.65 ммоль, Экв: 1) в бикарбонате натрия, 5% водн. (8.3 г, 7.69 мл, 4.94 ммоль, Экв: 3) добавили при 22°C раствор (9H-флуорен-9-ил)метил(2,5-диоксопирролидин-1-ил) карбоната (556 мг, 1.65 ммоль, Экв: 1) в ацетонитриле (6.6 мл) и перемешивали при 22°C в течение 2 ч. Органический растворитель удалили при пониженном давлении, разбавили водой (10 мл) и экстрагировали этилацетатом (2 x 20 мл). Органические слои промыли насыщенным NaCl (1 x 20 мл), высушили и эвапорировали. Остаток очистили с помощью флеш-хроматографии (силикагель, 24 г, адсорбированный на Isolute HM-N, EtOAc в гептане 0% до 30%) с получением (9H-флуорен-9-ил)метил 2-((4-бромо-2-(1,3-диоксолан-2-ил)фенил)тио)-3-хлорбензилкарбамата (920 мг, 90%) в виде белой пены.
LC-MS: m/z = 622.0 (M+H)+ (621.04 для моноизотопной массы)
К раствору (9H-флуорен-9-ил)метил 2-((4-бромо-2-(1,3-диоксолан-2-ил)фенил)тио)-3-хлорбензилкарбамата (872 мг, 1.4 ммоль, Экв: 1) в ацетоне (26 мл) добавили при 22°C соляную кислоту, 5 M водн. (11.2 мл, 56 ммоль, Экв: 40) и перемешивали при 22°C в течение 2 ч, при этом белый осадок преципитировался с достижением полной конверсии. Смесь сконцентрировали при пониженном давлении до половины объема и осадок отфильтровали, промыли ацетонитрилом (1 x 5 мл), пентаном (2 x 5 мл) и высушили в глубоком вакууме с получением (9H-флуорен-9-ил)метил 2-((4-бромо-2-формилфенил)тио)-3-хлорбензилкарбамата (785 мг, 97%) в виде белого осадка.
LC-MS: m/z = 560.0 (M + H - H2O)+ (MW 577.0 для моноизотопной массы)
1H NMR (400 MHz, CDCl3) δ 10.25 (s, 1 H), 7.96 (m, 1 H), 7.76 (m, 3 H), 7.52 (br s, 3 H), 7.41 (m, 6 H), 7.28 (m, 3 H), 6.45 (br d, J=8.5 Hz, 1 H), 5.22 (br t,J=5.9 Hz, 1 H), 4.50 (m, 2 H), 4.39 (d, J=6.9 Hz, 2 H), 4.15 (m, 2 H)
Промежуточное соединение 116
9H-флуорен-9-илметил N-{[3-хлор-5-(4-цианофенил)-2-[(3-формилпиридин-2-ил)сульфанил] фенил]метил}карбамат

К перемешанному раствору соединения N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (2 г, 3.46ммоль) в диоксане (20мл) добавили (4-цианофенил)бороновую кислоту (661мг, 4.49ммоль), Na2CO3 (1.1 г, 10.38), и дегазировали в течение 10 мин в атмосфере аргона. Затем в него добавили Pd(PPh3)4 (200мг, 0.17ммоль) и снова дегазировали в течение 10 мин. Реакционную массу нагрели до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита, промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили колоночной хроматографией на силикагеле (SiO2; 100-200 меш; 0%-30% этилацетат в гексане) с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(4-цианофенил)фенил}метил)-2-метилпропан-2-сульфинамида (1.4 г, 67%) в виде серо-белого осадка. LC-MS: 600.2 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(4-цианофенил)фенил}метил)-2-метилпропан-2-сульфинамида (1.4 г, 2.33ммоль) в MeOH (8мл), добавили 4M HCl в диоксане (4мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением 4-[3-(аминометил)-5-хлор-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]бензонитрила гидрохлорида (1 г), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 381.7 [M+H]+
К перемешанной суспензии 4-[3-(аминометил)-5-хлор-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]бензонитрила гидрохлорида (1 г, 2.39ммоль) в 5% NaHCO3(20мл) добавили Fmoc-OSU (0.81 г, 2.39ммоль) в диоксане (40мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-{[3-хлор-5-(4-цианофенил)-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил} фенил]метил}карбамата (1.6 г) в виде серо-белого осадка, который использовали на следующей стадии без дополнительной очистки. LC-MS: 604.1 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-{[3-хлор-5-(4-цианофенил)-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил} фенил]метил}карбамата (1.6 г, 2.65ммоль) в ДХМ:ТГФ (1:1, 80мл) добавили MnO2(4.6 г, 52.97ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили колоночной хроматографией на силикагеле (SiO2; 100-200 меш; 10%-50% EtOAc/Hexane) с получением 9H-флуорен-9-илметил N-{[3-хлор-5-(4-цианофенил)-2-[(3-формилпиридин-2-ил)сульфанил]фенил]метил}карбамата (730 мг) в виде серо-белого осадка с чистотой 97% ЖХМС. LC-MS: 602.1 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.20 (1H, d, J = 6.8 Hz), 4.27 (2H, d, J = 7.1 Hz), 4.37 (2H, d, J = 5.5 Hz), 7.25 (2H, t, J = 7.5 Hz), 7.39 (3H, q, J = 7.8, 6.9 Hz), 7.66 (2H, d, J = 7.2 Hz), 7.74 (1H, s), 7.89 (3H, t, J = 7.6 Hz), 7.97 (5H, q, J = 8.9 Hz), 8.38 (1H, d, J = 7.6 Hz), 8.44 (1H, d, J = 4.4 Hz), 10.22 (1H, s).
Промежуточное соединение 117
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-6-(2-метилпиридин-4-ил)фенил}метил)карбамат

К перемешанному раствору соединения N-({6-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (3 г, 5.18ммоль) в диоксане (20мл) добавили (2-метилпиридин-4-ил)бороновую кислоту (924мг, 6.74ммоль), Na2CO3 (1.65 г, 15.56ммоль), воду (10 мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в него добавили Pd(PPh3)4 (300мг, 0.25ммоль) и снова дегазировали в течение 10 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-6-(2-метилпиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (3 г) в виде серо-белого осадка. LC-MS: 589.7 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-6-(2-метилпиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (3 г, 5.08ммоль) в MeOH (12мл), добавили 4M HCl в диоксане (6мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-3-(2-метилпиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола (1.7 г), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 371.9 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-3-(2-метилпиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола (1.7 г, 4.16ммоль) в 5% NaHCO3(20мл) добавили Fmoc-OSU (1.4 г, 4.16 ммоль) в диоксане (40мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-6-(2-метилпиридин-4-ил)фенил)метил]карбамата (2 г, неочищенный) в виде серо-белого осадка; который использовали на следующей стадии без дополнительной очистки. LC-MS: 593.6 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-6-(2-метилпиридин-4-ил)фенил)метил]карбамата (2.0 г, 3.36 ммоль) в ДХМ:ТГФ (1:1, 60 мл) добавили MnO2(5.85 г, 67.32 ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили колоночной хроматографией на силикагеле (SiO2; 100-200 меш; 10%-50% EtOAc/Гексан) с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-6-(2-метилпиридин-4-ил)фенил}метил)карбамата (650 мг, 21%, 4 стадии) в виде серо-белого осадка с чистотой 94.83%. LC-MS: 591.7 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 2.43 (3H, s), 4.12 (5H, s), 7.25 (1H, d, J = 4.8 Hz), 7.28 - 7.35 (4H, m), 7.33 - 7.40 (1H, m), 7.39 (1H, d, J = 4.3 Hz), 7.43 (2H, d, J = 8.1 Hz), 7.60 (1H, s), 7.66 (2H, d, J = 7.4 Hz), 7.71 (1H, d, J = 8.3 Hz), 7.89 (2H, d, J = 7.5 Hz), 8.35 (1H, d, J = 7.6 Hz), 8.44 (1H, d, J = 5.0 Hz), 8.47 (1H, d, J = 3.5 Hz), 10.21 (1H, s).
Промежуточное соединение 118 (RO7125868-000-001)
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пиримидин-5-ил)фенил}метил)карбамат

К перемешанному раствору N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (650мг, 1.13ммоль) в толуоле (7мл) добавили 4-(трибутилстаннил)пиримидин(623мг, 1.69ммоль) и LiCl (14мг, 0.034ммоль) и дегазировали в атмосфере аргона в течение 10 мин. Затем в него добавили Pd(PPh3)4 (130.1мг, 0.11ммоль) и реакционную массу нагревали до 110°C в течение 16 ч. Затем реакционную смесь отфильтровали через слой целита и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 1-8% метанола в ДХМ с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(пиримидин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (260мг, 40%) в виде светло-желтого осадка. LC-MS: 576.8 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(пиримидин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (260 мг, 0.45ммоль) в MeOH (8мл), добавили 4M HCl в диоксане (4мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(пиримидин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (200 мг), которую сразу использовали на следующей стадии. LC-MS: 358.9 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-(пиримидин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (200мг, 0.56ммоль) в 5% NaHCO3(5мл) добавили Fmoc-OSU (188мг, 0.56ммоль) в диоксане (5мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пиримидин-4-ил)фенил)метил]карбамата (250 мг) в виде серо-белого осадка. LC-MS: 581.0 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пиримидин-4-ил)фенил)метил]карбамата (250мг, 0.43ммоль) в ДХМ:ТГФ (1:1, 10мл) добавили MnO2(749.3мг, 8.62ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 30-80% этилацетата в гексане с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пиразин-2-ил)фенил}метил)карбамата (145 мг) в виде серо-белого осадка с чистотой 96% LCMA. LC-MS: 578.8 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.23 (1H, dd, J = 5.0, 1.2 Hz), 4.28 (2H, d, J = 6.5 Hz), 4.38 (2H, d, J = 5.4 Hz), 7.28 (2H, t, J = 6.5 Hz), 7.40 (3H, t, J = 6.6 Hz), 7.69 (2H, d, J = 7.4 Hz), 7.89 (2H, d, J = 7.6 Hz), 7.95 - 8.03 (1H, m), 8.18 (1H, d, J = 5.2 Hz), 8.26 (1H, s), 8.34 (1H, s), 8.39 (1H, d, J = 7.8 Hz), 8.42 - 8.47 (1H, m), 8.95 (1H, d, J = 5.2 Hz), 9.25 (1H, s), 10.22 (1H, s).
Промежуточное соединение 119
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(4-сульфамоилфенил)фенил}метил)карбамат

К перемешанному раствору соединения N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (3 г, 5.19ммоль) в диоксане (30мл) добавили (4-сульфамоилфенил)бороновую кислоту (1.35 г, 6.7ммоль), Na2CO3 (1.65 г, 15.5ммоль), воду (15мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в неё добавили Pd(PPh3)4 (300мг, 0.26ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита и промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением 4-{4-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-{[(2-метилпропан-2-сульфинил)амино]метил}фенил}бензол-1-сульфонамида (3 г) в виде бесцветной вязкой жидкости. LC-MS: 654.0 [M+H]+
К перемешанному раствору 4-{4-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-{[(2-метилпропан-2-сульфинил)амино]метил}фенил}бензол-1-сульфонамида (3 г, 4.58ммоль) в MeOH (12мл), добавили 4M HCl в диоксане (6мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением 4-[3-(аминометил)-5-хлор-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]бензол-1-сульфонамида гидрохлорида (2.2 г), который сразу использовали на следующей стадии. LC-MS: 435.7 [M+H]+
К перемешанной суспензии 4-[3-(аминометил)-5-хлор-4-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}фенил]бензол-1-сульфонамида гидрохлорида (2 г, 4.23ммоль) в 5% NaHCO3(20мл) добавили Fmoc-OSU (1.43 г, 4.23ммоль) в диоксане (40мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали с помощью 10% метанола в дихлорметане. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(4-сульфамоилфенил)фенил)метил]карбамата (2.5 г) в виде серо-белого осадка. LC-MS: 657.9 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(4-сульфамоилфенил)фенил)метил]карбамата (2.5 г, 3.8ммоль) в ДХМ/ТГФ(1:1, 60мл) добавили MnO2(6.6 г, 75.9ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили колонкой с силикагелем (SiO2; 100-200 меш; 10-50% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(4-сульфамоилфенил)фенил}метил)карбамата (520 мг) в виде серо-белого осадка с чистотой 95% ЖХМС. LC-MS: 654.2 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.21 (1H, d, J = 6.5 Hz), 4.28 (2H, d, J = 6.8 Hz), 4.37 (2H, d, J = 5.7 Hz), 7.25 (2H, t, J = 7.4 Hz), 7.39 (4H, q, J = 7.4 Hz), 7.48 (2H, s), 7.67 (2H, d, J =7.5 Hz), 7.72 (1H, s), 7.89 (4H, dd, J = 12.8, 7.0 Hz), 7.93 - 8.02 (1H, m), 8.38 (1H, d, J = 6.3 Hz), 8.45 (1H, d, J = 3.4 Hz), 10.22 (1H, s).
Промежуточное соединение 120
(9H-флуорен-9-ил)метил 2-((5-бромо-2-формилфенил)тио)-3-хлорбензилкарбамат

К суспензии безводного сульфида натрия (2.46 г, 1.32 мл, 31.5 ммоль, Экв: 2) в безводном ДМФ (73 мл) добавили при 22°C метил 4-бромо-2-фторбензоат (3.67 г, 15.7 ммоль, Экв: 1), нагрели до 70°C, при этом белый цвет сменился на коричневый и перемешивали при 70°C в течение 2 ч с достижением полной конверсии. Смесь охладили до 5°C и погасили медленным покапельным добавлением в охлажденный на льду 10% раствор HCl (100 мл), разбавили насыщенным NaCl (100 мл), при этом собственную температуру поддерживали ниже 10°C и экстрагировали этилацетатом (2 x 100 мл). Органические слои высушили и эвапорировали с получением желтого полутвердого осадка. Неочищенный продукт очистили с помощью флеш-хроматографии (силикагель, 80 г, адсорбированный на Isolute HM-N, EtOAc в гептане 5% до 10% до 20% до 60%) с получением метил 4-бромо-2-меркаптобензоата (1.29 г, 33%) в виде светло-желтого масла.
LC-MS: m/z = 245.0 (M - H)- (MW 245.94 для моноизотопной массы)
К раствору метил 4-бромо-2-меркаптобензоата (1.29 г, 5.22 ммоль, Экв: 1) в ДМФ (25.8 мл) добавили при 22°C 3-хлор-2-фторбензальдегид (1.24 г, 7.83 ммоль, Экв: 1.5) с последующим карбонатом калия (721 мг, 5.22 ммоль, Экв: 1), нагрели до 70°C и перемешивали при 70°C в течение 30 мин с получением почти полной конверсии. Суспензию охладили до 22°C, преципитировавшийся осадок отфильтровали (дикалит) и промыли эфиром (1 x 15 мл). Фильтрат эвапорировали в глубоком вакууме и желтое масло очистили с помощью флеш-хроматографии (силикагель, 80 г, EtOAc в гептане 0% до 20% до 60%) с получением метил 4-бромо-2-((2-хлор-6-формилфенил)тио)бензоата (1.73 г, 86%) в виде светло-желтого осадка.
LC-MS: m/z = 385.0 (M+H)+ (моноизотопная масса 383.92)
К раствору метил 4-бромо-2-((2-хлор-6-формилфенил)тио)бензоата (1.73 г, 4.49 ммоль, Экв: 1) and 2-метилпропан-2-сульфинамида (544 мг, 4.49 ммоль, Экв: 1) в ТГФ (19 мл) добавили при 22°C этоксид титана (IV) (5.12 г, 4.65 мл, 22.4 ммоль, Экв: 5) с получением прозрачного желтого раствора с последующим нагреванием до кипения и перемешивали при 70°C в течение 1 ч с достижением полной конверсии. Светло-желтую мутную суспензию охладили до 22°C и погасили насыщенным раствором NaCl (25 мл) с получением вязкой суспензии. Смесь отфильтровали через дикалит и промыли этилацетатом (2 x 25 мл). Фильтрат (2-фазная система) поместили в разделительную воронку, водный слой отделили и органический слой высушили и эвапорировали с получением смеси (E)-метил 4-бромо-2-((2-(((трет-бутилсульфинил)имино)метил)-6-хлорфенил)тио)бензоата и (E)-этил 4-бромо-2-((2-(((трет-бутилсульфинил)имино)метил)-6-хлорфенил)тио)бензоата (2.16 г, 97%) в виде светло-желтой пены.
NMR: смесь метилового и этилового эфира, соотношение приблизительно 7:4.
LC-MS: m/z = 488.1 and 502.1 (M+H)+ (MW для моноизотопной массы: 486.97 и 500.98)
К раствору (E)-метил 4-бромо-2-((2-(((трет-бутилсульфинил)имино)метил)-6-хлорфенил)тио)бензоата и (E)-этил 4-бромо-2-((2-(((трет-бутилсульфинил)имино)метил)-6-хлорфенил)тио)бензоата (соотношение 7:4, 2.16 г, 4.42 ммоль, Экв: 1) в ТГФ (21.6 мл) добавили при 22°C борогидрид лития (963 мг, 44.2 ммоль, Экв: 10), при этом цвет сразу поменялся на интенсивно зеленый и собственная температура поднялась до 31°C. Смесь нагревали до 50°C и перемешивали при 50°C в течение 20 ч с достижением полной конверсии. Смесь охладили до 22°C, погасили по каплям (кипение и экзотермичность - охлаждение на бане вода со льдом) насыщенным NH4Cl (100 мл) и полностью экстрагировали этилацетатом (1 x 50 мл) перемешиванием в течение 30 минут до прекращения выделения газа. Органический слой промыли 5% KH2PO4 (1 x 50 мл, pH 5) и насыщ. NaCl (1 x 50 мл), высушили и эвапорировали с получением неочищенного продукта в виде белого осадка. Осадок суспендировали в 20 мл этилацетата при кипении с обратным холодильником. Масялную баню удалили, 20 мл гептана добавили за одну порцию и охладили до 22°C при этом преципитировался осадок. Суспензию охладили до 5°C и перемешивали в течение 60 минут, осадок отфильтровали, промыли EtOAc/гептан 1:1 (1 x 10 мл) и высушили в глубоком вакууме с получением N-(2-((5-бромо-2-(гидроксиметил)фенил)тио)-3-хлорбензил)-2-метилпропан-2-сульфинамида (1.538 г, 75%) в виде белого осадка.
LC-MS: m/z = 462.1 (M+H)+ для моноизотопной массы 460.99
К суспензии N-(2-((5-бромо-2-(гидроксиметил)фенил)тио)-3-хлорбензил)-2-метилпропан-2-сульфинамида (1.478 г, 3.19 ммоль, Экв: 1) в метаноле (14.8 мл) добавили при 0°C HCl, 4 M в диоксане (7.98 мл, 31.9 ммоль, Экв: 10), дали нагреться до 22°C при этом осадок полностью растворился, и перемешивали при 22°C в течение 30 мин с достижением полной конверсии. После всего 60 минут растворитель удалили при пониженном давлении и высушили в глубоком вакууме с получением (2-((2-(аминометил)-6-хлорфенил)тио)-4-бромфенил)метанола гидрохлорида (1.26 г, 100%) в виде белого осадка.
LC-MS: m/z = 358.0 (M+H)+ (свободный амин MW 356.96 для моноизотопной массы)
К раствору (2-((2-(аминометил)-6-хлорфенил)тио)-4-бромфенил)метанола гидрохлорида (1.23 г, 3.11 ммоль, Экв: 1) в метаноле (73.4 мл) добавили при 22°C пиридин (985 мг, 1.01 мл, 12.5 ммоль, Экв: 4) с последующим (9H-флуорен-9-ил)метил(2,5-диоксопирролидин-1-ил)карбонатом (1.1 г, 3.27 ммоль, Экв: 1.05) и перемешивали при 22°C в течение 3 дней, при этом преципитировалось дополнительное количество осадка с достижением полной конверсии. Осадок отфильтровали, промыли метанолом (2 x 15 мл) и высушили в глубоком вакууме с получением (9H-флуорен-9-ил)метил 2-((5-бромо-2-(гидроксиметил)фенил)тио)-3-хлорбензилкарбамата (1.538 г, 85%) в виде белого осадка.
LC-MS: m/z = 562.2 (M + H - H2O)+ (MW 579.03 для моноизотопной массы)
К раствору (9H-флуорен-9-ил)метил 2-((5-бромо-2-(гидроксиметил)фенил)тио)-3-хлорбензилкарбамата (1.485 г, 2.56 ммоль, Экв: 1) в ТГФ (50 мл) и ДХМ (50 мл) добавили при 22°C диоксида марганца (4.44 г, 51.1 ммоль, Экв: 20) и перемешивали при 22°C в течение 3 ч с достижением полной конверсии. Смесь отфильтровали (мебранный фильтр), промыли ТГФ/ДХМ 1:1 (2 x 15 мл) и фильтрат эвапорировали с получением продукта в виде желтого осадка. Неочищенный продукт суспендировали в 15 мл MeOH (ультразвуковая ванна в течение 30 минут и затем суспендировали при 22°C в течение 30 минут), осадок отфильтровали, промыли MeOH (2 x 6 мл), высушили в глубоком вакууме с получением (9H-флуорен-9-ил)метил 2-((5-бромо-2-формилфенил)тио)-3-хлорбензилкарбамата (1.287 г, 87%) в виде серо-белого осадка.
LC-MS: m/z = 578.0 (M+H)+ для моноизотопной массы 577.01
1H NMR (600 MHz, DMSO-d6) δ 10.15 (s, 1 H), 7.95 (d,J=8.2 Hz, 1 H), 7.86 - 7.91 (m, 2 H), 7.66 - 7.69 (m, 1 H), 7.68 (d, J=7.6 Hz,1 H), 7.57 - 7.64 (m, 2 H), 7.37 - 7.44 (m, 2 H), 7.37 - 7.40 (m, 1 H), 7.33 (tJ,=7.5 Hz, 2 H), 6.52 (s, 1 H), 4.31 (dd,J=9.8, 6.5 Hz, 4 H), 4.20 (br d, J=6.5 Hz, 1 H)
Промежуточное соединение 121
9H-флуорен-9-илметил N-{[3-хлор-6-(2-фторпиридин-4-ил)-2-[(3-формилпиридин-2-ил)сульфанил] фенил]метил}карбамат

К перемешанному раствору N-({6-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (4.0 г, 6.93ммоль) в диоксане (30мл) добавили (2-фторпиридин-4-ил)бороновую кислоту (1.17 г, 8.3ммоль), Na2CO3 (2.2 г, 20.8ммоль), воду (15мл) и дегазировали в течение 10 мин в атмосфере аргона. Затем в неё добавили Pd(PPh3)4 (801мг, 0.69ммоль) и снова дегазировали в течение 5 мин. Реакционную массу нагревали до 120°C в течение 16 ч. Затем реакционную смесь охладили до 25°C, отфильтровали через слой целита и промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством колоночной хроматографии (SiO2; 100-200 меш; 40-80% EtOAc/Гексан) с получением N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-6-(2-фторпиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (2 г, 48%) в виде светло-желтого вязкого осадка. LC-MS: 593.8 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-6-(2-фторпиридин-4-ил)фенил}метил)-2-метилпропан-2-сульфинамида (2 г, 3.37ммоль) в ТГФ (20мл), добавили 4M HCl в диоксане (10мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-3-(2-фторпиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (1.2 г), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 376.0 [M+H]+.
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-3-(2-фторпиридин-4-ил)фенил]сульфанил}пиридин-3-ил)метанола гидрохлорида (1.2 г, 3.2ммоль) в 5% NaHCO3(20мл) добавили Fmoc-OSU (1.08 г, 3.2ммоль) в диоксане (20мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 16 ч. Затем реакционную массу разбавили водой и экстрагировали с помощью 10% метанола в дихлорметане. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении до 9H-флуорен-9-илметил N-{[3-хлор-6-(2-фторпиридин-4-ил)-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил} фенил]метил}карбамата (2 г) в виде серо-белого осадка; который использовали на следующей стадии без дополнительной очистки. LC-MS: 597.8 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-{[3-хлор-6-(2-фторпиридин-4-ил)-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил} фенил]метил}карбамата в ДХМ:ТГФ (1:1, 30мл) добавили MnO2(5.82 г, 67.0ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили посредством колоночной хроматографии (SiO2; 100-200 меш; 40-80% EtOAc/Гексан) с получением 9H-флуорен-9-илметил N-{[3-хлор-6-(2-фторпиридин-4-ил)-2-[(3-формилпиридин-2-ил)сульфанил] фенил]метил}карбамата (610 мг) в виде серо-белого осадка с чистотой 90% ЖХМС. LC-MS: 596.0 [M+H]+
1H NMR (400 MHz, DMSO-d6): δ 4.10 (3H, s), 4.14 - 4.19 (2H, m), 7.27 - 7.51 (8H, m), 7.59 (1H, s), 7.64 (2H, d, J = 7.4 Hz), 7.74 (1H, d, J = 8.3 Hz), 7.82 - 7.98 (2H, m), 8.25 (1H, d, J = 4.7 Hz), 8.35 (1H, d, J = 6.2 Hz), 8.44 - 8.49 (1H, m), 10.20 (1H, s).
Промежуточное соединение 122
9H-флуорен-9-илметил N-[[5-[2-(трет-бутоксикарбониламино)-4-пиридил]-3-хлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат

К перемешанному раствору N-[[5-бромо-2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 3.46ммоль) в 1,4-диоксане (20мл) добавили трет-бутил N-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2-пиридил]карбамат (1.44 г, 4.5ммоль), Na2CO3(11мг, 0.1 ммоль), воду (10 мл) и реакционную массу продули аргоном в течение 15 мин. Затем Pd(PPh3)4 (0.2 г, 0.17ммоль) добавили и реакционную массу нагрели до 120°C в закрытой пробирке в течение 16 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении с получением N-[[5-(2-амино-4-пиридил)-2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-фенил]метил]-2-метил-пропан-2-сульфинамида (2 г) в виде коричневой смолы. LC-MS: 590.7 [M+H]+
К перемешанному раствору N-[[5-(2-амино-4-пиридил)-2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 3.38ммоль) в ТГФ (10мл) добавили 4M HCl в диоксане (10мл, 40ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением [2-[2-(аминометил)-4-(2-амино-4-пиридил)-6-хлор-фенил]сульфанил-3-пиридил]метанола гидрохлорида (1.2 г) в виде серо-белого осадка. LC-MS: 373.0[M+H]+
К перемешанной суспензии [2-[2-(аминометил)-4-(2-амино-4-пиридил)-6-хлор-фенил]сульфанил-3-пиридил]метанола гидрохлорида (1.2 г, 2.93ммоль) в 5% NaHCO3 (20мл) добавили Fmoc-OSU (988.8мг, 2.93ммоль) в 1,4-диоксане (30мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 5-80% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[5-(2-амино-4-пиридил)-3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]карбамата (1.4 г) в виде серо-белого осадка. LC-MS: 594.7[M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[[5-(2-амино-4-пиридил)-3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]карбамата (1.4 г, 2.35ммоль) в трет-бутаноле (10мл) добавили BOC ангидрид (2.7мл, 11.76ммоль) и реакционную смесь перемешивали при 25°C в течение 16 ч. Реакционную массу эвапорировали при пониженном давлении и полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-40% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[5-[2-(трет-бутоксикарбониламино)-4-пиридил]-3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]карбамата (850 мг) в виде серо-белого осадка. LC-MS: 695.2[M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[[5-[2-(трет-бутоксикарбониламино)-4-пиридил]-3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]карбамата (850мг, 1.22ммоль) ДХМ:ТГФ (1:1, 40мл) добавили MnO2 (2.13 г, 24.45ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 10-50% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[5-[2-(трет-бутоксикарбониламино)-4-пиридил]-3-хлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамата (425 мг) в виде серо-белого осадка. LC-MS: 693.1 [M+H]+
1H-NMR: (400 MHz, DMSO-d6): δ 1.42 (9H; s); 4.27-4.36 (5H, m), 7.22-7.25 (m; 2H); 7.35-7.40 (4H; m); 7.64-7.87 (2H; m); 7.85-7.87 (2H; m); 7.94 (1H; m); 8.09 (1H; s); 8.34-8.39 2H; m); 8.46 (1H; m); 9.94 (1H; s); 10.21 (1H, s).
Промежуточное соединение 123
9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-6-(4-сульфамоилфенил)фенил]метил]карбамат
К перемешанному раствору N-[[6-бромо-2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 3.46ммоль) в 1,4-диоксане (20мл) добавили (4-аминосульфонилфенил)бороновую кислоту (904мг, 4.5ммоль), карбонат натрия (1.1 г, 10.38ммоль), воду (10мл) и реакционную смесь продули аргоном в течение 15 мин. Затем Pd(PPh3)4 (2мг, 0.002ммоль) добавили и реакционную смесь нагревали до 120°C в закрытой пробирке в течение 16 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении с получением 4-[3-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-2-[(трет-бутилсульфиниламино)метил]-4-хлор-фенил]бензолсульфонамида (2 г) в виде коричневой смолы. LC-MS: 654.1 [M+H]+
К перемешанному раствору 4-[3-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-2-[(трет-бутилсульфиниламино)метил]-4-хлор-фенил]бензолсульфонамида (2.0 г, 3.06ммоль) в ТГФ (20мл) добавили 4M HCl в диоксане (8.0мл, 32ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением 4-[2-(аминометил)-4-хлор-3-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]бензолсульфонамида гидрохлорида (1.3 г) в виде серо-белого осадка. LC-MS: 435.8 [M+H]+
К перемешанной суспензии 4-[2-(аминометил)-4-хлор-3-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]бензолсульфонамида гидрохлорида (1.3 г, 2.75ммоль) в 5% NaHCO3 (20.0 мл) добавили Fmoc-OSU (0.93 г, 2.75ммоль) в 1,4-диоксане (30мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-6-(4-сульфамоилфенил)фенил]метил]карбамата (1.5 г) в виде серо-белого осадка. LC-MS: 657.9[M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-6-(4-сульфамоилфенил)фенил]метил]карбамата (1.5 г, 2.28ммоль) в ДХМ:ТГФ (1:1, 30мл) добавили MnO2 (3.96 г, 45.58ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 10-50% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-6-(4-сульфамоилфенил)фенил]метил]карбамата (640 мг) в виде серо-белого осадка. LC-MS: 656.0 [M+H]+
1H-NMR: (400 MHz, DMSO-d6): δ 4.13-4.11 (5H, m), 7.31-7.45 (7H; m); 7.5-7.72 (5h: m); 7.86-7.90 (4H; m); 8.35 (1H; m); 8.48 (1H; m); 10.21 (1H, s).
Промежуточное соединение 124
9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-6-(4-метилсульфонилфенил)фенил]метил]карбамат

К перемешанному раствору N-[[6-бромо-2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 3.46ммоль) в 1,4-диоксане (20мл) добавили 4-(метилсульфонил)фенилбороновую кислоту (0.9 г, 4.5ммоль), карбонат натрия (1.1 г, 10.38ммоль), воду (10мл) и реакционную смесь продули аргоном в течение 15 мин. Pd(PPh3)4 (0.2 г, 0.17ммоль) добавили и реакционную массу нагревали до 120°C в закрытой пробирке в течение 16 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении с получением N-[[2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-6-(4-метилсульфонилфенил)фенил]метил]-2-метил-пропан-2-сульфинамида (2 г) в виде коричневой смолы. LC-MS: 653.2 [M+H]+
К перемешанному раствору N-[[2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-6-(4-метилсульфонилфенил)фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 3.06ммоль) в ТГФ (20мл) добавили 4M HCl в диоксане (8.0мл, 32ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением [2-[2-(аминометил)-6-хлор-3-(4-метилсульфонилфенил)фенил]сульфанил-3-пиридил]метанола гидрохлорида (1.4 г) в виде серо-белого осадка. LC-MS: 434.7 [M+H]+
К перемешанной суспензии [2-[2-(аминометил)-6-хлор-3-(4-метилсульфонилфенил)фенил]сульфанил-3-пиридил]метанола гидрохлорида (1.4 г, 2.97 ммоль) в 5% NaHCO3 (20мл) добавили Fmoc-OSU (1.0 г, 2.97ммоль) в 1,4-диоксане (40мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали с помощью 10% метанола в ДХМ. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-6-(4-метилсульфонилфенил)фенил]метил]карбамата (1.8 г) в виде серо-белого осадка. LC-MS: 656.8 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-6-(4-метилсульфонилфенил)фенил]метил]карбамата (1.8 г, 2.74ммоль) в ДХМ:ТГФ (1:1, 80мл) добавили MnO2 (4.76 г, 54.78ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 10-50% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-6-(4-метилсульфонилфенил)фенил]метил]карбамата (920 мг) в виде серо-белого осадка. LC-MS: 654.9 [M+H]+
1H-NMR: (400 MHz, DMSO-d6): δ 3.18 (3H; s); 4.03-4.11 (5H, m), 7.30-7.38 (3H; m); 7.38-7.45 (3H; m); 7.58 (1H; m); 7.64-7.71 (5h; m); 7.89 (2H; m); 7.95-7.97 (2H; m); 8.35 (1H; br d; J = 7.04 Hz); 8.48 (1H; m); 10.20 (1H, s).
Промежуточное соединение 125
(9H-флуорен-9-ил)метил 2-((5-фтор-3-формилпиридин-2-ил)тио)бензилкарбамат

К перемешанному раствору метил 2-сульфанилбензоата (2.5 г, 14.86 ммоль) в ДМФ (30 мл) добавили Cs2CO3(7.267 г, 22.29 ммоль) с последующим 2-хлор-5-фторпиридин-3-карбальдегидом (2.371 г, 14.86 ммоль) и нагревали при 70°C в течение 30 мин. Реакционную смесь разбавили водой и экстрагировали этилацетатом. Объединенные органические слои промыли водой, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение, очистили посредством колоночной хроматографии на силикагеле с использованием этилацетата в н-гексане (0-6%) в качестве элюирующего растворителя с получением метил 2-[(5-фтор-3-формилпиридин-2-ил)сульфанил]бензоата (2.65 г, 61%) в виде серо-белого осадка. LC-MS: 292.0 [M+H]+.
К перемешанному раствору метил 2-[(5-фтор-3-формилпиридин-2-ил)сульфанил]бензоата (2.6 г, 8.93 ммоль) в толуоле (50 мл) добавили этиленгликоль (1.5 мл, 26.78 ммоль), p-TSA (0.17 г, 0.89 ммоль) и нагревали при 100°C в течение 2 ч. Реакционную смесь отфильтровали и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили с помощью хроматографии на силикагеле с использованием этилацетата в н-гексане (0-10%) в качестве элюирующего растворителя с получением метил 2-{[3-(1,3-диоксолан-2-ил)-5-фторпиридин-2-ил]сульфанил}бензоата (2.26 г, 75%) в виде светло-желтой жидкости. LC-MS: 335.7 [M+H]+.
К перемешанному раствору метил 2-{[3-(1,3-диоксолан-2-ил)-5-фторпиридин-2-ил]сульфанил}бензоата (1.5 г, 4.47 ммоль) в ТГФ (15 мл) добавили LiBH4(0.292 г, 13.42 ммоль) при 0°C и нагревали при 60°C в течение 4 ч. Реакционную смесь погасили насыщенным водным раствором хлорида аммония, разбавили водой и экстрагировали этилацетатом. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили посредством колоночной хроматографии на силикагеле с использованием этилацетата в н-гексане (0-10%) в качестве элюирующего растворителя с получением (2-{[3-(1,3-диоксолан-2-ил)-5-фторпиридин-2-ил]сульфанил}фенил)метанола (855 мг, 62%) в виде серо-белого осадка. LC-MS: 308.1 [M+H]+.
К перемешанному раствору (2-{[3-(1,3-диоксолан-2-ил)-5-фторпиридин-2-ил]сульфанил}фенил)метанола (250 мг, 0.81 ммоль) в ТГФ (5 мл) добавили DPPA (0.3 мл, 1.22 ммоль) с последующим DBU (0.2 мл, 1.22 ммоль) и перемешивали при 25°C в течение 15 ч. Реакционную смесь разбавили водой и экстрагировали этилацетатом. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили посредством колоночной хроматографии на силикагеле с использованием этилацетата в н-гексане (0-8%) в качестве элюирующего растворителя с получением 2-{[2-(азидометил)фенил]сульфанил}-3-(1,3-диоксолан-2-ил)-5-фторпиридина (200 мг, 74%) в виде светло-желтой жидкости. LC-MS: 332.9 [M+H]+.
К перемешанному раствору 2-{[2-(азидометил)фенил]сульфанил}-3-(1,3-диоксолан-2-ил)-5-фторпиридина (200 мг, 0.60 ммоль) в 2-пропаноле (5 мл) добавили 1,3-пропандитиол (6.5 мл, 0.06 ммоль), Et3N (0.2 мл, 1.20 ммоль), NaBH4(34 мг, 0.90 ммоль) и перемешивали при 25°C в течение 2 ч. Реакционную смесь сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили колоночной хроматографией на аминосиликагеле с использованием этилацетата в н-гексане в качестве элюирующего растворителя с получением (2-{[3-(1,3-диоксолан-2-ил)-5-фторпиридин-2-ил]сульфанил}фенил)метанамина (125 мг, 68%) в виде бесцветной жидкости. LC-MS: 306.8 [M+H]+.
К перемешанной суспензии [2-[[3-(1,3-диоксолан-2-ил)-5-фтор-2-пиридил]сульфанил]фенил]метанамина (400 мг, 1.31 ммоль) в 5% водной NaHCO3(5 мл) добавили Fmoc-OSu (440.44 мг, 1.31 ммоль) в ацетонитриле (8 мл) и перемешивали при 25°C в течение 4 ч. Реакционную смесь разбавили водой и экстрагировали этилацетатом. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили колоночной хроматографией на системе Combiflash с использованием этилацетата в н-гексане (0-10%) в качестве элюирующего растворителя с получением 9H-флуорен-9-илметил N-[[2-[[3-(1,3-диоксолан-2-ил)-5-фтор-2-пиридил]сульфанил] фенил]метил]карбамата (330 мг, 47.82% выход) в виде белого осадка. LC-MS: 528.8 [M+H]+.
К раствору 9H-флуорен-9-илметил N-[[2-[[3-(1,3-диоксолан-2-ил)-5-фтор-2-пиридил]сульфанил]фенил]метил]карбамата (485 мг, 0.920 ммоль) в ацетоне (15мл) добавили водную HCl (12 н, 3мл, 36 ммоль) и реакционную смесь перемешивали при 25°C в течение 4 ч. Реакционную смесь сконцентрировали под вакуумом, разбавили остаток водо (10 мл), погасили водным насыщенным раствором бикарбоната натрия (10мл) и экстрагировали этилацетатом. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили посредством колоночной хроматографии на силикагеле с использованием этилацетата в н-гексане (0-8%) в качестве элюирующего растворителя с получением 9H-флуорен-9-илметил N-({2-[(5-фтор-3-формил пиридин-2-ил)сульфанил]фенил}метил)карбамата (146 мг, 33% выход) в виде белого осадка. LC-MS: 484.9 [M+H]+.
1H NMR: (400 MHz, DMSO-d,) δ 4.20 (3H, d, J = 5.6Hz), 4.31 (2H, d, J = 6.8Hz), 7.31-7.35 (4H, m), 7.41 (2H, d, J = 7.4Hz), 7.49 (2H, dd, J = 15.3, 7.3Hz), 7.69 (2H, d, J = 7.3Hz), 7.76 (1H, t, J = 4.5Hz), 7.89 (2H, d, J = 7.2Hz), 8.31 (1H, dd, J = 8.6, 2.7Hz), 8.54 (1H, d, J = 3.2Hz), 10.19 (1H, s).
Промежуточное соединение 126
9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-5-имидазол-1-ил-фенил]метил]карбамат

К перемешанному раствору N-[[5-бромо-2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-фенил]метил]-2-метил-пропан-2-сульфинамида (500мг, 0.86ммоль) в 1,4-диоксане (10мл) добавили имидазол (70.66мг, 1.04ммоль), K3PO4 (0.37 г, 1.73ммоль) и DMEDA (0.04мл, 0.35ммоль) и дегазировали в атмосфере аргона в течение 5 мин. Затем в него добавили CuI (32.94мг, 0.17ммоль) и нагревали при 110°C в течение 16 ч. Реакционную смесь затем экстрагировали этилацетатом и отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством колоночной хроматографии (1%-10% MeOH в ДХМ) с получением N-[[2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-5-имидазол-1-ил-фенил]метил]-2-метил-пропан-2-сульфинамида (125 мг) в виде светло-желтого осадка. LC-MS: 565.0 [M+H]+
К перемешанному раствору N-[[2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-5-имидазол-1-ил-фенил]метил]-2-метил-пропан-2-сульфинамида (500мг, 0.88ммоль) в ТГФ (10мл) добавили 4M HCl в диоксане (4.0мл, 16ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением [2-[2-(аминометил)-6-хлор-4-имидазол-1-ил-фенил]сульфанил-3-пиридил]метанола гидрохлорида (300 мг) в виде светло коричневой смолы. LC-MS: 346.9 [M+H]+
К перемешанной суспензии [2-[2-(аминометил)-6-хлор-4-имидазол-1-ил-фенил]сульфанил-3-пиридил]метанола гидрохлорида (300мг, 0.78ммоль) в 5% NaHCO3 (10мл) добавили Fmoc-OSU (264мг, 0.78ммоль) в 1,4-диоксане (20 мл) при 25°C и реакционную смесь перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-5-имидазол-1-ил-фенил]метил]карбамата.
К перемешанному раствору 9H-флуорен-9-илметил N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-5-имидазол-1-ил-фенил]метил]карбамата (400мг, 0.7ммоль) в ДХМ:ТГФ (1:1, 40мл) добавили MnO2 (1222мг, 14.06ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 0-3% метанола в ДХМ с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-5-имидазол-1-ил-фенил]метил]карбамата (127 мг) в виде серо-белого осадка. LC-MS: 566.7 [M+H]+
1H-NMR: (400 MHz, DMSO-d6): δ 4.02-4.08 (1H, m), 4.19-4.28 (2H, m), 4.28-4.48 (2H, m) 7.18 (1H; m); 7.27-7.26 (2H, m), 7.35-7.39 (3H, m), 7.65-7.67 (2H, m), 7.81-7.82 (2H, m), 7.85-7.86 (2H; m); 7.89-7.90 (1H; m); 8.36-8.43 (3H; m); 10.21 (1H, s).
Промежуточное соединение 127
9H-флуорен-9-илметил N-[[6-[6-(трет-бутоксикарбониламино)-3-пиридил]-3-хлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат
К перемешанному раствору N-[[6-бромо-2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 3.46ммоль) в 1,4-диоксане (20мл) добавили 2-амино-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин (989.8мг, 4.5ммоль), карбонат натрия (1.1 г, 10.38ммоль), воду (10мл) и реакционную массу продули аргоном в течение 15 мин. Затем Pd(PPh3)4 (199.97мг, 0.170ммоль) добавили и реакционную массу нагревали до 120°C в закрытой пробирке в течение 16 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении с получением N-[[6-(6-амино-3-пиридил)-2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-фенил]метил]-2-метил-пропан-2-сульфинамида (2 г) в виде светло-коричневой смолы. LC-MS: 590.7 [M+H]+
К перемешанному раствору N-[[6-(6-амино-3-пиридил)-2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 3.38ммоль) в ТГФ (20мл) добавили 4M HCl в диоксане (10.0мл, 40 ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением [2-[2-(аминометил)-3-(6-амино-3-пиридил)-6-хлор-фенил]сульфанил-3-пиридил]метанола гидрохлорида (1.3 г) в виде светло-желтого осадка. LC-MS: 372.8 [M+H]+
К перемешанной суспензии [2-[2-(аминометил)-3-(6-амино-3-пиридил)-6-хлор-фенил]сульфанил-3-пиридил]метанола гидрохлорида (1.3 г, 3.18 ммоль) в 5% NaHCO3 (20мл) добавили Fmoc-OSU (1.07 г, 3.18 ммоль) в 1,4-диоксане (40мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали с помощью 10% метанола в ДХМ. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 0-5% метанола в ДХМ с получением 9H-флуорен-9-илметил N-[[6-(6-амино-3-пиридил)-3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]карбамата (1.2 г) в виде серо-белого осадка. LC-MS: 594.8 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[[6-(6-амино-3-пиридил)-3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]карбамата (1.2 г, 2.02ммоль) в трет-бутаноле (10мл) добавили BOC ангидрид (2.32мл, 10.08ммоль) и реакционную массу перемешивали при 25°C в течение 16 ч. Реакционную массу эвапорировали при пониженном давлении и полученное таким образом неочищенное соединение очистили с помощью обычной колонки с силикагелем с использованием 5-40% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[6-[6-(трет-бутоксикарбониламино)-3-пиридил]-3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]карбамата (800мг, 1.15ммоль) в виде серо-белого осадка. LC-MS: 695.0 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[[6-[6-(трет-бутоксикарбониламино)-3-пиридил]-3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]карбамата (800мг, 1.15ммоль) в ДХМ:ТГФ (1:1, 40мл) добавили MnO2 (2.0 г, 23.01ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 10-50% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[6-[6-(трет-бутоксикарбониламино)-3-пиридил]-3-хлор-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамата (420 мг) в виде серо-белого осадка. LC-MS: 693.1 [M+H]+
1H-NMR: (400 MHz, DMSO-d6): δ 1.46 (9H; s); 4.27-4.36 (5H, m), 7.22-7.25 (7H; m); 7.57-7.70 (4H; m); 7.80-7.89 (4H; m); 8.30-8.35 (2H; m); 8.47 (1H; m); 9.91 (1H; s); 10.21 (1H; s).
Промежуточное соединение 128
9H-флуорен-9-илметил N-[[3-хлор-5-(2-циано-4-пиридил)-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамат
К перемешанному раствору соединения N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (2 г, 3.46ммоль) в диоксане (20мл) добавили 4-(тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-карбонитрил (1.03 г, 4.5ммоль), Na2CO3 (1.1 г, 10.3ммоль) и дегазировали в течение 10 мин в атмосфере аргона. Затем в него добавили Pd(PPh3)4 (200мг, 0.173ммоль) и снова дегазировали в течение 10 мин. Реакционную массу нагрели до 120°C в течение 16 ч. Реакционную смесь снова охладили до 25°C, отфильтровали через слой целита, промыли EtOAc. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили колоночной хроматографией на силикагеле (SiO2; 100-200 меш; 10%-60% этилацетат в гексане) с получением N-[[2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-5-(2-циано-4-пиридил)фенил]метил]-2-метил-пропан-2-сульфинамида ( 850 мг) в виде желтого осадка. LC-MS: 600.9 [M+H]+
К перемешанному раствору N-[[2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-5-(2-циано-4-пиридил)фенил]метил]-2-метил-пропан-2-сульфинамида (850мг, 1.41ммоль) в ТГФ (20мл), добавили 4M HCl в диоксане (10мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением 4-[3-(аминометил)-5-хлор-4-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]пиридин-2-карбонитрила гидрохлорида (550 мг), который сразу использовали на следующей стадии без дополнительной очистки. LC-MS: 382.7 [M+H]+
К перемешанной суспензии 4-[3-(аминометил)-5-хлор-4-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]пиридин-2-карбонитрила гидрохлорида (550мг, 1.31ммоль) в 5% NaHCO3(20мл) добавили Fmoc-OSU (442мг, 1.31ммоль) в диоксане (20мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали с помощью 10% метанола в ДХМ. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[[3-хлор-5-(2-циано-4-пиридил)-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]карбамата (750 мг) в виде серо-белого осадка, который использовали на следующей стадии без дополнительной очистки. LC-MS: 605.0 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[[3-хлор-5-(2-циано-4-пиридил)-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]метил]карбамата (750мг, 1.24 ммоль) в ДХМ:ТГФ (1:1, 60 мл) добавили MnO2(2.15 г, 24.79ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили колоночной хроматографией на силикагеле (SiO2; 100-200 меш; 10%-50% этилацетат в гексане) с получением 9H-флуорен-9-илметил N-[[3-хлор-5-(2-циано-4-пиридил)-2-[(3-формил-2-пиридил)сульфанил]фенил]метил]карбамата (430 мг) в виде серо-белого осадка.LC-MS: 603.1 [M+H]+
1H-NMR: (400 MHz, DMSO-d6): δ 4.02-4.08 (1H, m), 4.19-4.28 (2H, m), 4.28-4.29 (2H, m) 7.27-7.26 (2H, m), 7.35-7.39 (2H, m), 7.65-7.67 (2H, m), 7.86-7.87 (4H, m), 8.11-8.12 (1H; m); 8.14-8.15 (1H; m); 8.38-8.40 (1H; m); 8.40-8.41 (1H; m); 8.51-8.52 (1H; m); 8.78 (1H; br d; J = 7.2 Hz) 10.21 (1H, s).
Промежуточное соединение 129
9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-6-(6-гидрокси-3-пиридил)фенил]метил]карбамат

К перемешанному раствору N-[[6-бромо-2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 3.46ммоль) в 1,4-диоксане (20 мл) добавили (6-гидроксипиридинe-3-ил)бороновую кислоту (0.62 г, 4.5ммоль), карбонат натрия (1.1 г, 10.38ммоль), воду (10мл) и реакционную массу продули аргоном в течение 15 мин. Затем Pd(PPh3)4 (199.97мг, 0.17ммоль) добавили и реакционную массу нагревали до 120°C в закрытой пробирке в течение 16 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении с получением N-[[2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-6-(6-гидрокси-3-пиридил)фенил]метил]-2-метил-пропан-2-сульфинамида (2 г) в виде светло-желтой смолы. LC-MS: 592.1. [M+H]+
К перемешанному раствору N-[[2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-6-(6-гидрокси-3-пиридил)фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 3.38 ммоль) в ТГФ (20мл) добавили 4M HCl в диоксане (12.0 мл, 48 ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением 5-[2-(аминометил)-4-хлор-3-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]пиридин-2-ола гидрохлорида (1.3 г) в виде серо-белого осадка. LC-MS: 374.0 [M+H]+
К перемешанной суспензии 5-[2-(аминометил)-4-хлор-3-[[3-(гидроксиметил)-2-пиридил]сульфанил]фенил]пиридин-2-ола гидрохлорида (1.3 г, 3.18ммоль) в 5% NaHCO3 (20мл) добавили Fmoc-OSU (1.07 г, 3.18ммоль) в 1,4-диоксане (40мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали с помощью 10% метанола в ДХМ. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-6-(6-гидрокси-3-пиридил)фенил]метил]карбамата (1.5 г) в виде светло-желтого осадка. LC-MS: 596.0 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-6-(6-гидрокси-3-пиридил)фенил]метил]карбамата (1.5 г, 2.52ммоль) в ДХМ/ТГФ(1:1, 40мл) добавили MnO2 (4.37 г, 50.33ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 0-3% метанола в ДХМ с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-6-(6-гидрокси-3-пиридил)фенил]метил]карбамата (140 мг) в виде серо-белого осадка. LC-MS: 593.9 [M+H]+
1H-NMR: (400 MHz, DMSO-d6): δ 4.13-4.19 (5H, m), 7.32-7.34 (3H, m), 7.40-7.42 (4H, m), 7.49-7.52 (2H, m), 7.65-7.67 (3H, m), 7.82 (2H, brd, J = 6.92 Hz), 8.34 (1H, brd, J = 5.2 Hz), 8.45 (1H, s), 10.20 (1H, s), 11.81 (1H, s).
Промежуточное соединение 130
9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-5-(1H-пиррол-3-ил)фенил]метил]карбамат

К перемешанному раствору N-[[5-бромо-2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 3.46ммоль) в 1,4-диоксане (20 мл) добавили трет-бутил 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиррол-1-карбоксилат (1.32 г, 4.5ммоль), карбонат натрия (1.1 г, 10.38ммоль), воду (10мл) и реакционную смесь продули аргоном в течение 15 мин. Затем Pd(PPh3)4 (199.89мг, 0.17ммоль) добавили и реакционную массу нагревали до 120°C в закрытой пробирке в течение 16 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении с получением N-[[2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-5-(1H-пиррол-3-ил)фенил]метил]-2-метил-пропан-2-сульфинамида (2 г) в виде желтой смолы LC-MS: 564.3. [M+H]+
К перемешанному раствору N-[[2-[[3-[[трет-бутил(диметил)силил]оксиметил]-2-пиридил]сульфанил]-3-хлор-5-(1H-пиррол-3-ил)фенил]метил]-2-метил-пропан-2-сульфинамида (2.0 г, 3.54ммоль) в тетрагидрофуране (10мл) добавили 4M HCl в диоксане (6.0мл, 24 ммоль) и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением [2-[2-(аминометил)-6-хлор-4-(1H-пиррол-3-ил)фенил]сульфанил-3-пиридил]метанола гидрохлорида (1.3 г) в виде серо-белого осадка. LC-MS: 345.8 [M+H]+
К перемешанной суспензии [2-[2-(аминометил)-6-хлор-4-(1H-пиррол-3-ил)фенил]сульфанил-3-пиридил]метанола гидрохлорида (1.3 г, 3.4ммоль) в 5% NaHCO3 (20мл) добавили Fmoc-OSU (1.15 г, 3.4 ммоль) в 1,4-диоксане (40мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 2 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом. Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении до 9H-флуорен-9-илметил N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-5-(1H-пиррол-3-ил)фенил]метил]карбамата (1.5 г) в виде серо-белого осадка. LC-MS: 568.0 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[[3-хлор-2-[[3-(гидроксиметил)-2-пиридил]сульфанил]-5-(1H-пиррол-3-ил)фенил]метил]карбамата (1.5 г, 2.64ммоль) в ДХМ/ТГФ(1:1, 60мл) добавили MnO2 (4.59 г, 52.81ммоль) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении. Полученное неочищенное вещество очистили с помощью обычной колонки с силикагелем с использованием 10-50% этилацетата в гексане с получением 9H-флуорен-9-илметил N-[[3-хлор-2-[(3-формил-2-пиридил)сульфанил]-5-(1H-пиррол-3-ил)фенил]метил]карбамата (535 мг) в виде светло-желтого осадка. LC-MS: 566.1 [M+H]+
1H-NMR: (400 MHz, DMSO-d6): δ 4.19-4.28 (5H, m), 6.48 (1H; brs); 6.85 (1H; brs); 7.28-7.29 (2H; m); 7.32-7.37 (2H; m); 7.47-7.42 (2H; m); 7.53 (1H; brs); 7.69-7.70 (3H; m); 7.81-7.83 (1H; m); 7.88 (2H; d; J = 7.44 Hz); 8.34 (1H; d; J = 7.0 Hz); 8.34 (1H; brs); 10.21 (1H, s); 11.13 (1H; s).
Промежуточное соединение 131
(9H-флуорен-9-ил)метил 2-((5-бромо-3-формилпиридин-2-ил)тио)бензилкарбамат
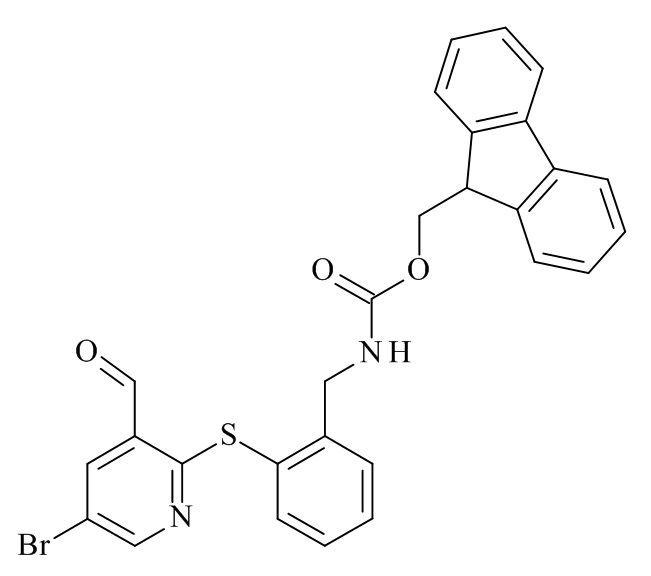
Это соединение получили по аналогии с Промежуточным соединением 125 с использованием в качестве исходного вещества 5-бромо-2-хлор-пиридин-3-карбальдегида и метилтиосалицилата, за исключеним последней стадии, которую выполнили следующим образом.
К раствору 9H-флуорен-9-илметил N-[[2-[[5-бромо-3-(1,3-диоксолан-2-ил)-2-пиридил]сульфанил] фенил]метил]карбамата (800 мг, 1.36 ммоль) в ацетоне (15 мл) и воде (3 мл) добавили пиридиния п-толуолсульфонат (204.62 мг, 0.810 ммоль) и реакционную смесь нагревали при 60°C в течение 25 ч. Реакционную смесь сконцентрировали под вакуумом, разбавили остаток водой (20 мл), погасили 5% водным насыщенным раствором бикарбоната натрия (10 мл) и экстрагировали этилацетатом. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили посредством колоночной хроматографии на силикагеле с использованием этилацетата в н-гексане (0-8%) в качестве элюирующего растворителя с получением 9H-флуорен-9-илметил N-[[2-[(5-бромо-3-формил-2-пиридил)сульфанил]фенил]метил]карбамата (120 мг, 27% выход) в виде серо-белого осадка. LC-MS: 545.2 [M+H]+.
1H NMR: (400 MHz, DMSO-d6) δ 4.19 (3H, d, J = 5.8Hz), 4.30 (2H, d, J = 7.0Hz), 7.34 (4H, d, J = 7.1Hz), 7.42 (2H, t, J = 7.5Hz), 7.49 (2H, dd, J = 12.8, 7.1Hz), 7.69 (2H, d, J = 7.7Hz), 7.75 (1H, t, J = 5.8Hz), 7.89 (2H, d, J = 7.2Hz), 8.58 (2H, s), 10.13 (1H, s).
Промежуточное соединение 132
(9H-флуорен-9-ил)метил((2-(диметиламино)-4-((3-формилпиридин-2-ил)тио)пиридин-3-ил)метил)карбамат

К перемешанному раствору 2-меркаптоникотиновой кислоты (10 г, 64.45 ммоль) в ДМСО (40 мл) добавили trifluoroacetic acid (0.49 мл, 6.44 ммоль) при 0°C и реакционную смесь нагревали при 60°C в течение 24 h. Реакционную смесь снова охладили to 0°C, ДМФ (100 мл) и карбонат калия (8.91 г, 64.45 ммоль), затем добавили и перемешивали в течение 30 мин при 0°C. Затем iodomethane (12.04 мл, 193.34 ммоль) медленно добавили при 0°C и реакционную смесь перемешивали при 25°C в течение 16 ч. Затем реакционную смесь охладили до 0°C, a solution of acetic acid (13 мл) в воде (150 мл) добавили slowly and получившуюся смесь перемешивали при 25°C в течение 6 ч. Precipitated white solid отфильтровали, промыли водой (3x70 мл) followed by hexane (3x30 мл), высушили под вакуумом с получением метил 2-[(3-метоксикарбонил-2-пиридил)дисульфанил]пиридин-3-карбоксилата (8.24 г, неочищенный) в виде белого осадка, который использовали без дополнительной очистки. LC-MS: 336.6 [M+H]+.
К перемешанному раствору метил 2-[(3-метоксикарбонил-2-пиридил)дисульфанил]пиридин-3-карбоксилата (8.2 г, 24.38 ммоль) в 1,4-диоксане (34 мл) добавили трифенилфосфин (8.95 г, 34.13 ммоль) и воду (18 мл) последовательно при 25°C и нагревали при 65°C в течение 16 ч. Реакционную смесь сконцентрировали под вакуумом. Остаток, полученный таким образом, разбавили EtOH (85 мл) и нагревали при 75°C в течение 15 мин. Затем реакционную смесь медленно охладили до 25°C и затем до 0°C за 4 ч. Осадок затем собрали посредством фильтрации и хорошо высушили под вакуумом с получением метил 2-сульфанилпиридин-3-карбоксилата (7.54 г, 69.17% выход за 2 стадии) в виде желтого осадка. LC-MS: 170.1 [M+H]+.
К перемешанному раствору метил 2-сульфанилпиридин-3-карбоксилата (800 мг, 4.73 ммоль) в ДМФ (8 мл) добавили карбонат калия (1306.91 мг, 9.46 ммоль) при 0°C по порциям и перемешивали в течение 15 мин. Затем 2-хлор-4-фтор-пиридин-3-карбальдегид (829.81 мг, 5.2 ммоль) в ДМФ (2 мл) добавили медленно при этой же температуре и медленно дали достигнуть 25°C и перемешивали в течение 2 ч. После завершения реакции реакционную смесь охладили до 0°C, погасили уксусной кислотой (0.5 мл), с последующей водой (12 мл) и перемешивали при 25°C в течение 1 ч. Преципитированный таким образом осадок собрали посредством фильтрации, промыли н-гексаном и затем высушили под вакуумом с получением метил 2-[(2-хлор-3-формил-4-пиридил)сульфанил]пиридин-3-карбоксилата (1.05 г, 71.93% выход) в виде желтого осадка. LC-MS: 308.8 [M+H]+.
В закрытой пробирке, к перемешанному раствору метил 2-[(2-хлор-3-формил-4-пиридил)сульфанил]пиридин-3-карбоксилата (1.0 г, 3.24 ммоль) в 1,4-диоксане (10 мл) добавили диметиламин (2M в ТГФ, 16.19 мл, 32.39 ммоль) и нагревали при 120°C в течение 12 ч. Реакционную смесь сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили с помощью хроматографии на силикагеле с использованием этилацетата в н-гексане (0-30%) в качестве элюирующего растворителя с получением метил 2-[[2-(диметиламино)-3-формил-4-пиридил]сульфанил]пиридин-3-карбоксилата (930 мг, 90.47%) в виде желтого осадка. LC-MS: 317.8 [M+H]+.
К перемешанному раствору метил 2-[[2-(диметиламино)-3-формил-4-пиридил]сульфанил]пиридин-3-карбоксилата (910 мг, 2.87 ммоль) в тетрагидрофуране (20 мл) добавили 2-метил-2-пропансульфинамид (347.53 мг, 2.87 ммоль) и этоксид титана (IV) (1.8 мл, 8.6 ммоль) и нагревали при 70°C в течение 2 ч. Реакционную смесь погасили солевым раствором (30 мл), этилацетат (50 мл) добавили и отфильтровали. Водный слой экстрагировали этилацетатом, Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили посредством колоночной хроматографии на силикагеле с использованием этилацетата в гексане (0-20%) в качестве элюирующего растворителя с получением этил 2-[[3-[(E)-трет-бутилсульфинилиминометил]-2-(диметиламино)-4-пиридил]сульфанил]пиридин-3-карбоксилата (1.22 г, неочищенный, смесь этилового и изопропилового эфира) в виде коричневой вязкой жидкости, которую использовали без дополнительной очистки. LC-MS: 434.6, 448.6 [M+H]+.
К перемешанному раствору этил 2-[[3-[(E)-трет-бутилсульфинилиминометил]-2-(диметиламино)-4-пиридил]сульфанил]пиридин-3-карбоксилата (1.2 г, 2.76 ммоль) в тетрагидрофуране (15 мл) медленно добавили алюмогидрид лития (2M в ТГФ, 2.7 мл, 5.52 ммоль) при 0°C. Реакционной смеси затем дали медленно достигнуть 25°C и перемешивали в течение 30 мин. Затем реакционную смесь погасили водным насыщенным раствором сульфата натрия (25 мл), разбавили этилацетатом (50 мл) и отфильтровали. Водный слой затем экстрагировали этилацетатом, объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением N-[[2-(диметиламино)-4-[[3-(гидроксиметил)-2-пиридил]сульфанил]-3-пиридил]метил]-2-метил-пропан-2-сульфинамида (1.01 г, неочищенный) в виде светло-коричневой жидкости, которую использовали без дополнительной очистки. LC-MS: 394.8 [M+H]+.
К перемешанному раствору N-[[2-(диметиламино)-4-[[3-(гидроксиметил)-2-пиридил]сульфанил]-3-пиридил]метил]-2-метил-пропан-2-сульфинамида (1 г, 2.53 ммоль) в метаноле (10 мл) добавили хлороводород (4 M в диоксане) (15.0 мл) при 0°C. Реакционной смеси затем дали достигнуть 25°C и перемешивали в течение 30 мин. Затем реакционную смесь сконцентрировали под вакуумом с получением [2-[[3-(аминометил)-2-(диметиламино)-4-пиридил]сульфанил]-3-пиридил]метанола гидрохлорида (805 мг, неочищенный) в виде серо-белого осадка, который использовали без дополнительной очистки. LC-MS: 291.2 [M+H]+.
К перемешанному раствору [2-[[3-(аминометил)-2-(диметиламино)-4-пиридил]сульфанил]-3-пиридил]метанола гидрохлорида (800 мг, 2.45 ммоль) в водном 5% NaHCO3 (15.0 мл, 2.45 ммоль) добавили Fmoc-OSu (825.68 мг, 2.45 ммоль) в ацетонитриле (20 мл) и перемешивали при 25°C в течение 1 ч. Реакционную смесь разбавили водой (10 мл) и экстрагировали этилацетатом. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили тритурированием с 30% этилацетатом в н-гексане с получением 9H-флуорен-9-илметил N-[[2-(диметиламино)-4-[[3-(гидроксиметил)-2-пиридил]сульфанил]-3-пиридил]метил]карбамата (680 мг, 46% выход за 4 стадии) в виде белого осадка. LC-MS: 512.8[M+H]+.
К перемешанному раствору 9H-флуорен-9-илметил N-[[2-(диметиламино)-4-[[3-(гидроксиметил)-2-пиридил]сульфанил]-3-пиридил]метил]карбамата (500 мг, 0.980 ммоль) в дихлорметане (10 мл) и тетрагидрофуране (10 мл) добавили оксид марганца (IV) (1695.93 мг, 19.51 ммоль) и перемешивали при 25°C в течение 1 ч. После завершения реакции реакционную смесь отфильтровали и сконцентрировали под вакуумом. Полученное таким образом неочищенное соединение очистили тритурированием с 20% этилацетатом в н-гексане с получением 9H-флуорен-9-илметил N-[[2-(диметиламино)-4-[(3-формил-2-пиридил)сульфанил]-3-пиридил]метил]карбамата (247.7 мг, 49.74% выход) в виде белого осадка. LC-MS: 330.1[M+H]+.
1H NMR: (400 MHz, DMSO-d6) δ 2.83 (6H, s), 4.19 (1H, d, J = 6.6Hz), 4.23 (2H, d, J = 6.9Hz), 4.28 (2H, d, J = 3.9Hz), 6.92 (1H, d, J = 5.0Hz), 7.30 (2H, t, J = 7.1Hz), 7.36 - 7.48 (3H, m), 7.52 - 7.59 (1H, m), 7.66 (2H, d, J = 7.4Hz), 7.88 (2H, d, J = 7.4Hz), 8.12 (1H, d, J = 5.1Hz), 8.28 - 8.35 (1H, m), 8.53 (1H, dd, J = 4.6, 1.6Hz), 10.19 (1H, s).
Промежуточное соединение 133
(9H-флуорен-9-ил)метил((2-хлор-4-((3-формилпиридин-2-ил)тио)пиридин-3-ил)метил)карбамат

К перемешанному раствору 2-меркаптоникотиновой кислоты (10 г, 64.45 ммоль) в ДМСО (40 мл) добавили трифторуксусную кислоту (0.49 мл, 6.44 ммоль) при 0°C и реакционную смесь нагревали при 60°C в течение 24 ч. Затем реакционную смесь охладили до 0°C, ДМФ (100 мл) и карбонат калия (8.91 г, 64.45 ммоль) затем добавили и перемешивали в течение 30 мин при 0°C. Затем йодометан (12.04 мл, 193.34 ммоль) медленно добавили при 0°C и реакционную смесь перемешивали при 25°C в течение 16 ч. Реакционную смесь снова охладили до 0°C, раствор уксусной кислоты (13 мл) в воде (150 мл) медленно добавили и получившуюся смесь перемешивали при 25°C в течение 6 ч. Преципитированный белый осадок отфильтровали, промыли водой (3x70 мл) с последующим гексаном (3x30 мл), высушили под вакуумом с получением метил 2-[(3-метоксикарбонил-2-пиридил)дисульфанил]пиридин-3-карбоксилата (8.24 г, неочищенный) в виде белого осадка. LC-MS: 336.6 [M+H]+.
К перемешанному раствору метил 2-[(3-метоксикарбонил-2-пиридил)дисульфанил]пиридин-3-карбоксилата (8.2 г, 24.38 ммоль) в 1,4-диоксане (34 мл) добавили трифенилфосфин (8.95 г, 34.13 ммоль) и воду (18 мл) последовательно при 25°C и нагревали при 65°C в течение 16 ч. Затем реакционную смесь сконцентрировали под вакуумом. Остаток, полученный таким образом, разбавили EtOH (85 мл) и нагревали при 75°C в течение 15 мин. Реакционную смесь снова охладили до 25°C и затем медленно до 0°C за 4 ч. Осадок затем собрали посредством фильтрации и высушили под вакуумом с получением метил 2-сульфанилпиридин-3-карбоксилата (7.54 г, 69.17% выход за 2 стадии) в виде желтого осадка. LC-MS: 170.1 [M+H]+.
Соединение, указанное в заголовке затем получили по аналогии с Промежуточным соединением 63 с использованием в качестве исходного вещества 2-хлор-4-фтор-пиридин-3-карбальдегида и метил 2-сульфанилпиридин-3-карбоксилата. Соединение, указанное в заголовке, получили в виде белого осадка (655 мг). MS ESI (m/z): 502.0 [(M+H)+]
1H NMR: (400 MHz, DMSO-d6) δ 4.18 (1H, d, J = 6.2Hz), 4.24 (2H, d, J = 6.8Hz), 4.37 (2H, d, J = 4.2Hz), 7.31 (2H, t, J = 7.3Hz), 7.40 (2H, t, J = 7.4Hz), 7.45 (1H, dd, J = 7.4, 5.0Hz), 7.50 (1H, d, J = 5.0Hz), 7.67 (3H, d, J = 7.3Hz), 7.88 (2H, d, J = 7.4Hz), 8.35 - 8.39 (2H, m), 8.52 (1H, d, J = 3.3Hz), 10.18 (1H, s).
Промежуточное соединение 134
9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пирролидин-1-ил)фенил}метил)карбамат
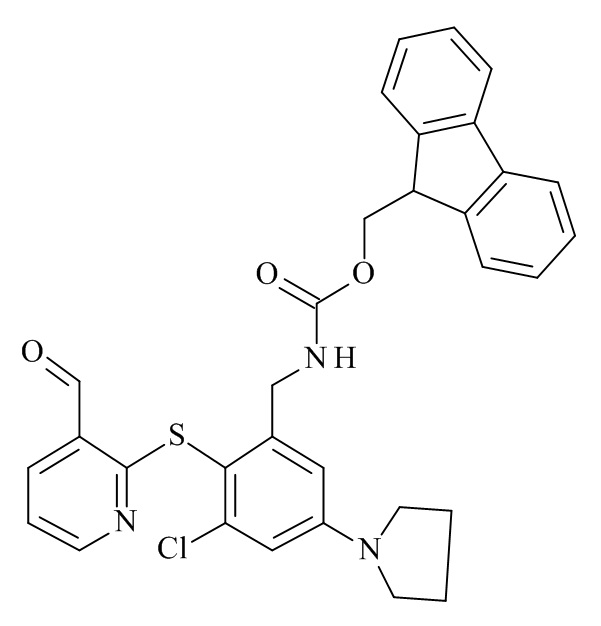
К перемешанному раствору N-({5-бромо-2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлорфенил}метил)-2-метилпропан-2-сульфинамида (500 мг, 0.867 ммоль) в толуоле (5мл) добавили пирролидин (73.955 мг, 1.04 ммоль) и трет-бутоксид натрия (224.844 мг, 2.34 ммоль) и дегазировали в атмосфере аргона в течение 5 мин. Затем в него добавили 2-дитретбутилфосфинобифенил (23.272 мг, 0.078 ммоль) и Pd(dba)2 (39.861 мг, 0.069 ммоль) и нагревали до 110°C в течение 16 ч. Реакционную смесь отфильтровали через слой целита и фильтрат эвапорировали при пониженном давлении с получением N-({2-[(3-{[(трет-Бутилдиметилсилил)окси]метил} пиридин-2-ил)сульфанил]-3-хлор-5-(пирролидин-1-ил)фенил}метил)-2-метилпропан-2-сульфинамида (500 мг, неочищенный) в виде серо-белого осадка; который сразу использовали на следующей стадии. LC-MS: 584.3 [M+H]+
К перемешанному раствору N-({2-[(3-{[(трет-бутилдиметилсилил)окси]метил}пиридин-2-ил)сульфанил]-3-хлор-5-(пирролидин-1-ил)фенил}метил)-2-метилпропан-2-сульфинамида (600 мг,1.058 ммоль) в MeOH (10мл), добавили 4M HCl в диоксане (5мл) при 0°C и реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную массу эвапорировали при пониженном давлении с получением (2-{[2-(аминометил)-6-хлор-4-(пирролидин-1-ил)фенил]сульфанил}пиридин-3-ил)метанола в виде HCl соли (350мг, неочищенный) в виде серо-белого осадка, который сразу использовали на следующей стадии. LC-MS: 349.8 [M+H]+
К перемешанной суспензии (2-{[2-(аминометил)-6-хлор-4-(пирролидин-1-ил)фенил]сульфанил}пиридин-3-ил)метанола HCl соли (1.0 г, 2.865 ммоль) в 5% NaHCO3(10мл) добавили Fmoc OSU (966 мг, 2.865 ммоль) в диоксане (10мл) при 25°C и реакционную массу перемешивали при этой температуре в течение 16 ч. Затем реакционную массу разбавили водой и экстрагировали этилацетатом.Отделенный органический слой промыли солевым раствором, высушили над сульфатом натрия и эвапорировали при пониженном давлении с получением 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пирролидин-1-ил)фенил)метил]карбамата (1.1 г, неочищенный) в виде серо-белого осадка; который использовали на следующей стадии без дополнительной очистки. LC-MS: 571.8 [M+H]+
К перемешанному раствору 9H-флуорен-9-илметил N-[(3-хлор-2-{[3-(гидроксиметил)пиридин-2-ил]сульфанил}-5-(пирролидин-1-ил)фенил)метил]карбамата (1.1 г,1.926 ммоль) в ДХМ/ТГФ(1:1, 20мл) добавили MnO2(2.512 г, 28.897 ммоль)) и реакционную массу перемешивали при 25°C в течение 2 ч. Реакционную массу отфильтровали через слой целита; фильтрат эвапорировали при пониженном давлении. Полученное таким образом неочищенное соединение очистили колночной хроматографией на системе Combiflash (40 г; 40-80% EtOAC/гексаны) с получением an загрязненной смеси, которыую очистили обратно-фазовой препаративной ВЭЖХ с получением 9H-флуорен-9-илметил N-({3-хлор-2-[(3-формилпиридин-2-ил)сульфанил]-5-(пирролидин-1-ил)фенил}метил)карбамата (150 мг, 10%, 4 стадии) в виде серо-белого осадка. LC-MS: 570.0 [M+H]+
1H-NMR: (400 MHz, DMSO-d6): δ 1.90-1.95 (4H, m), 3.23 (4H, m), 4.20-4.27 (5H, m), 6.51 (1H, s), 6.62(1H,s) 7.30-7.32 (3H, m), 7.39-7.41 (2H, m), 7.68 (2H, d, J=7.2Hz), 7.70 (1H, m), 7.90(2H,d, J=7.12Hz), 8.31 (1H, m), 8.4(1H,s), 10.21 (1H, s).
Промежуточное соединение 135
3-[(12S,15S,18S)-15-(4-трет-бутоксикарбониламино-бутил)-18-(3-трет-бутоксикарбониламино-пропил)-6-бромо-4-хлор-13-метил-11,14,17-триоксо-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12-илметил]-индол-1-карбоновой кислоты трет-бутиловый эфир
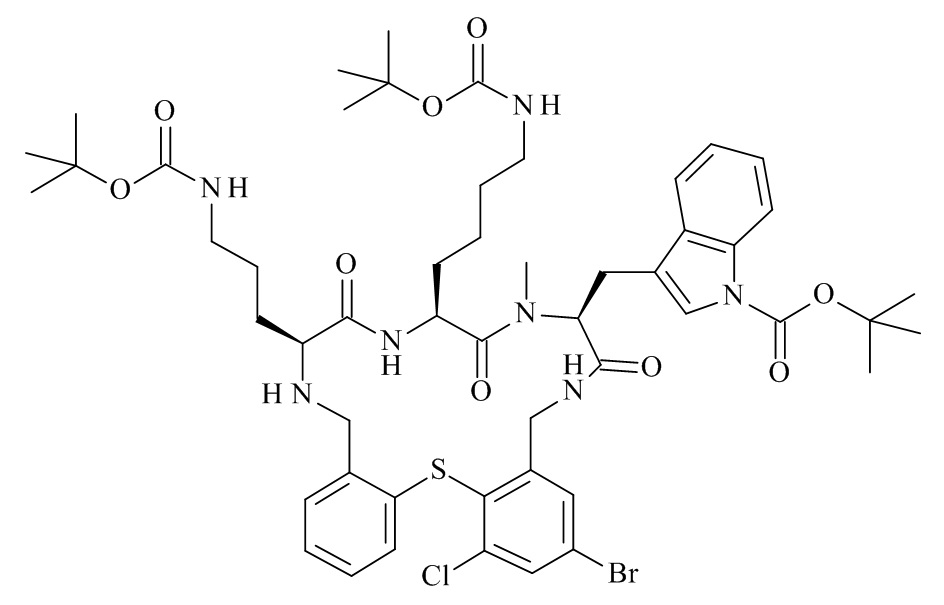
Промежуточное соединение 135 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза, но BOC-защитные группы оставили интактными (без депротекции с помощью ТФУ) с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 89
MS (M+H)+: ожидаемая 1082.37; наблюдаемая 1082.5
Промежуточное соединение 136
3-[(12S,15S,18S)-15-(4-трет-Бутоксикарбониламино-бутил)-18-(3-трет-бутоксикарбониламино-пропил)-5-бромо-4-хлор-13-метил-11,14,17-триоксо-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12-илметил]-индол-1-карбоновой кислоты трет-бутиловый эфир

Промежуточное соединение 136 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза, но BOC-защитные группы оставили интактными (без депротекции с помощью ТФУ) с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 100
MS (M+H)+: ожидаемая 1082.37; наблюдаемая 1082.5
Промежуточное соединение 137
3-[(12S,15S,18S)-15-(4-трет-Бутоксикарбониламино-бутил)-18-(3-трет-бутоксикарбониламино-пропил)-23-бромо-4-хлор-13-метил-11,14,17-триоксо-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12-илметил]-индол-1-карбоновой кислоты трет-бутиловый эфир

Промежуточное соединение 137 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза, но BOC-защитные группы оставили интактными (без депротекции с помощью ТФУ) с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 115
MS (M+H)+: ожидаемая 1082.37; наблюдаемая 1082.5
Промежуточное соединение 138
3-[(12S,15S,18S)-15-(4-трет-Бутоксикарбониламино-бутил)-18-(3-трет-бутоксикарбониламино-пропил)-24-бромо-4-хлор-13-метил-11,14,17-триоксо-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12-илметил]-индол-1-карбоновой кислоты трет-бутиловый эфир

Промежуточное соединение 138 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза, но BOC-защитные группы оставили интактными (без депротекции с помощью ТФУ) с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 120
MS (M+H)+: ожидаемая 1082.37; наблюдаемая 1082.6
Промежуточное соединение 138
3-[(12S,15S,18S)-15-(4-трет-Бутоксикарбониламино-бутил)-18-(3-трет-бутоксикарбониламино-пропил)-24-бромо-4-хлор-13-метил-11,14,17-триоксо-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12-илметил]-индол-1-карбоновой кислоты трет-бутиловый эфир
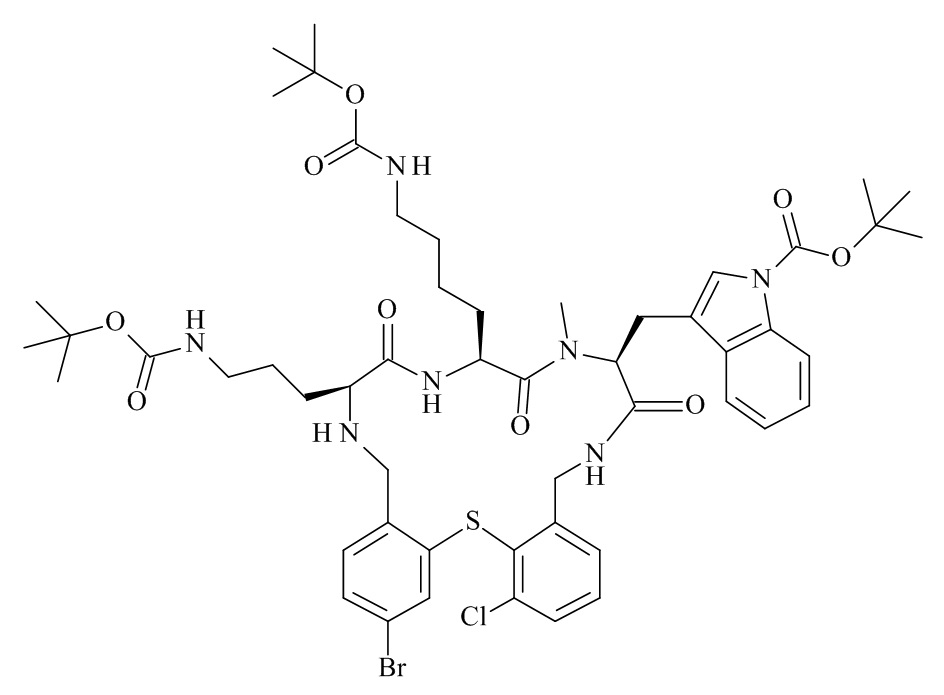
Промежуточное соединение 138 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза, но BOC-защитные группы оставили интактными (без депротекции с помощью ТФУ) с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 120
MS (M+H)+: ожидаемая 1082.37; наблюдаемая 1082.6
Промежуточное соединение 139
(7S,10S,13S)-10-(4-аминобутил)-7-(3-аминопропил)-20-хлор-6,7,9,10,12,13,15,16-октагидро-12-метил-13-[(2-метил-1H-индол-3-ил)метил]-18-[2-(4-метил-1-пиперазинил)-4-пиридинил]пиридо[2,3-b][1,5,8,11,14]бензотиатетраазациклогептадецин-8,11,14(5H)-трион
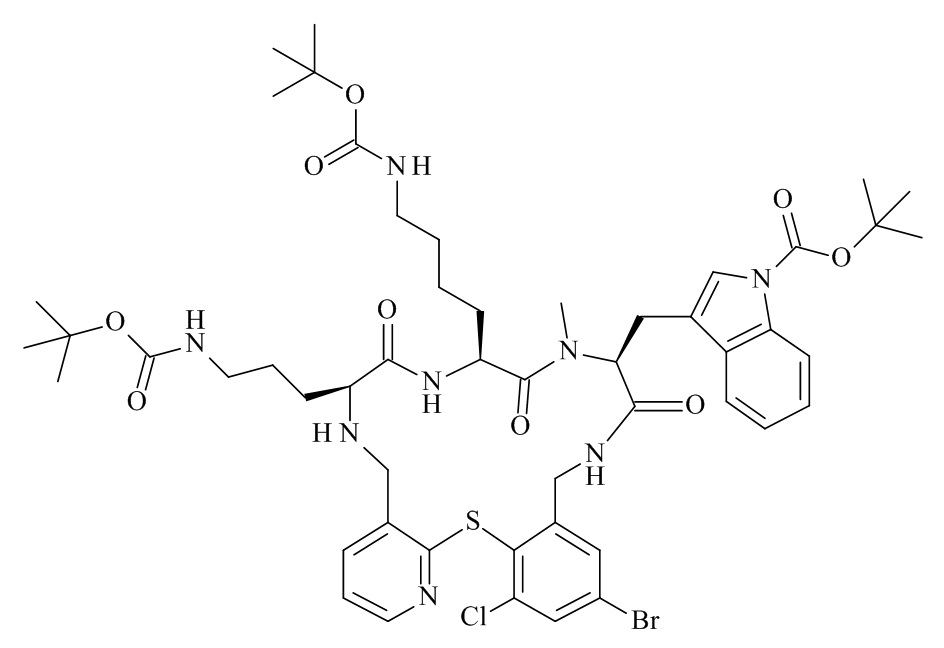
Промежуточное соединение 138 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза, но BOC-защитные группы оставили интактными (без депротекции с помощью ТФУ) с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 60
MS (M+H)+: ожидаемая 1083.3; наблюдаемая 1084.5
Промежуточное соединение 140
1H-индол-1-карбоновая кислота, 3-[[(7S,10S,13S)-17-бромо-20-хлор-10-[4-[[(1,1-диметилэтокси)карбонил]амино]бутил]-7-[3-[[(1,1-диметилэтокси)карбонил]амино]пропил]-5,6,7,8,9,10,11,12,13,14,15,16-додекагидро-12-метил-8,11,14-триоксопиридо[2,3-b][1,5,8,11,14]бензотиатетраазациклогептадецин-13-ил]метил]-, 1,1-диметилэтиловый эфир
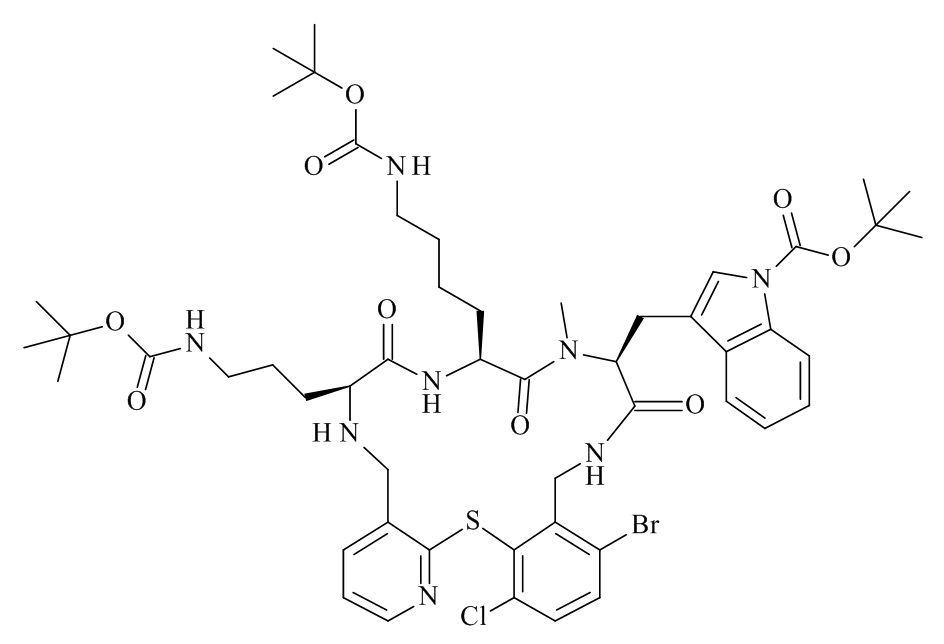
Промежуточное соединение 140 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза, но BOC-защитные группы оставили интактными (без депротекции с помощью ТФУ) с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 59
MS (M+H)+: ожидаемая 1083.3; наблюдаемая 1084.5
Промежуточное соединение 141
(2S)-5-[трет-бутил(диметил)силил]окси-2-(9H-флуорен-9-илметоксикарбониламино)пентановая кислота
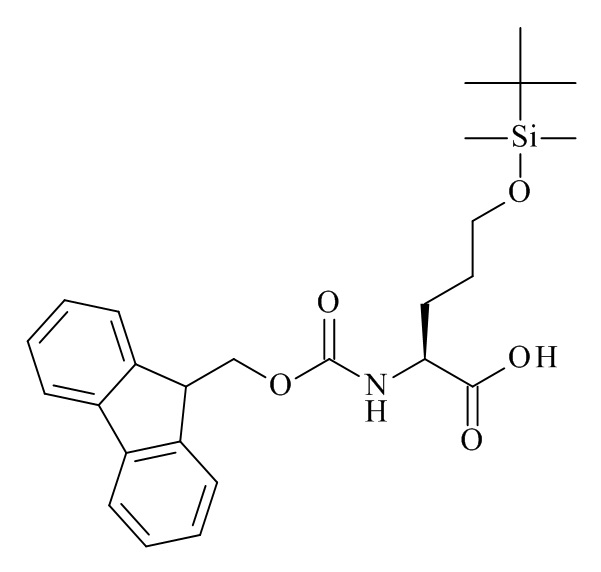
Соединение, указанное в заголовке, получили в соответствии со следующей схемой:

Стадия 1: Получение бензил (2S)-2-(9H-флуорен-9-илметоксикарбониламино)-5-гидрокси-пентаноата (соединение i141b)
К смеси (4S)-5-бензилокси-4-(9H-флуорен-9-илметоксикарбониламино)-5-оксо-пентановой кислоты (i141a, 1.84 г, 4 ммоль) и 4-метилморфолина (607 мг, 0.66 мл, 6 ммоль) в безводном ТГФ (20 мл) при -10°C добавили по каплям изобутилхлорформиат (660 мг, 4.8 ммоль). Получившуюся реакционную смесь перемешивали при -10°C в течение 2 часов, затем влили в смесь NaBH4 (460 мг, 12 ммоль) и льда (10 г) и перемешивали в течение дополнительных 30 минут. Реакционную смесь разбавили охлажденной на льду водой, и экстрагировали с помощью EA дважды. Объединенную органическую фазу высушили и сконцентрировали. Остаток очистили на колонке с силикагелем с получением соединения i141b (1.34 г). MS (M+H+): 446.
Стадия 2: Получение бензил (2S)-5-[трет-бутил(диметил)силил]окси-2-(9H-флуорен-9-илметоксикарбониламино)пентаноата (соединение i141c)
К смеси бензил (2S)-2-(9H-флуорен-9-илметоксикарбониламино)-5-гидрокси-пентаноата (соединение i141b, 1.34 г, 3 ммоль) и имидазола (610 мг, 9 ммоль) в ДХМ (15 мл) добавили раствор трет-бутилхлордиметилсилана (540 мг, 3.6 ммоль) в ДХМ (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, и затем сконцентрировали. Остаток растворили в PE/EA=5/1, и промыли водой. Органическую фазу отделили и сконцентрировали. Остаток очистили на колонке с силикагелем с получением соединения i141c(1.3 г). MS (M+H+): 560.
Стадия 3: Получение (2S)-5-[трет-бутил(диметил)силил]окси-2-(9H-флуорен-9-илметоксикарбониламино)пентановой кислоты (промежуточное соединение i141)
К раствору бензил (2S)-5-[трет-бутил(диметил)силил]окси-2-(9H-флуорен-9-илметоксикарбониламино)пентаноата (соединение i141c, 1.3 г, 2.3 ммоль) в EtOH/i-PrOH/H2O=89/5/6 (15 мл) добавили катализатор Линдлара (Aldrich, 390 мг). Реакционную смесь нагревали при 40°C под баллоном с H2 в течение 5 часов. После охлаждения до комнатной температуры реакционную смесь отфильтровали. Фильтрат обработали водн. раствором HCl (1 N) до pH=6 и сконцентрировали. Остаток растворили в EA, промыли солевым раствором, высушили, и сконцентрировали с получением неочищенного соединения i141 (1.0 г). MS (M+H+): 470.
Общая методика для Пептидного Макроциклического Синтеза
1. Твердофазный пептидный синтез
Трипептидную последовательность синтезировали вручную с помощью протокола твердофазного синтеза из уровня техники (Fmoc-химия) к указано, например: Kates and Albericio, Eds., “Solid Phase Synthesis: A practical guide”, Marcel Decker, New York, Basel, 2000.
В качестве твердой подложки использовали смолу 2-хлортритилхлорида (1.6 мэкв. /г, 100-200 меш). Смолу загрузили 0.6 эквивалентами аминокислоты и 8 экв. DIPEA в безводном ДХМ в течение ночи при КТ. После интенсивной промывки с помощью ДМФ и ДХМ, Fmoc-группу отщепили смесью 50% пиперидина в ДХМ/ДМФ (1:1) в ДМФ (свежеприготовленный) в течение 30 мин при КТ. После промывки с помощью ДМФ, ДХМ и MeOH смолу высушили под вакуумом при КТ в течение ночи. Загрузку смолы определили с помощью увеличения веса.
Вторую аминокислоту связали с 4 экв реагента Мукаямы в качестве связывающего реагента, 6 экв DIPEA в ДМФ/ДХМ (1:1) в течение ночи при КТ. Смолу интенсивно промыли с помощью ДМФ и ДХМ и степень связывания контролировали с помощью тестового расщепления.
Fmoc-группу из дипептида отщепили с помощью смеси 50% пиперидин (25%)/ДХМ (25%) в ДМФ в течение максимум 5 мин с последующей промывкой ДМФ и ДХМ. Степень отщепления снова контролировали тестовым расщеплением.
Третью аминокислоту присоединили с использованием избытка 4 экв HATU в качестве связывающего реагента и 6 экв DIPEA. Полное связывание проводили при КТ в течение 2-4 часов со степенью отщепления снова контролировали тестовым расщеплением.
Fmoc-группу от трипептида отщепили с помощью смеси 20% пиперидина в ДМФ в течение 2 x 15-20мин при КТ с последующей промывкой ДМФ и ДХМ (тестовое расщепление).
N-метилирование на шариках:
В случае, когда не были коммерчески доступны N-метилированные аминокислоты, их алкилировали на твердой фазе следующим образом:
- Смоле дали набухнуть в ТГФ (прибл. 10 мл/г смолы). 12 экв DIPEA добавили и реакционную смесь встряхивали при КТ в течение 15 мин. 3 экв 2-нитробензол-1-сульфонилхлорида и смолу встряхивали при КТ в течение ночи. Затем смоле дали стечь, промыли с помощью ДХМ и ДМФ. Степень связывания контролировали с помощью тестового расщепления.
- Для второй стадии смолу суспендировали в ДМФ, 12 экв MTBD (7-метил-1,5,7-триазабицикло[4.4.0]дец-5-ен) добавили и реакционную смесь встряхивали при КТ в течение 10 мин. Затем 3 экв метил-4-нитробензолсульфоната добавили и суспензию встряхивали при КТ. Через 30 мин. смоле дали стечь и промыли ДМФ и ДХМ. Степень связывания контролировали с помощью тестового расщепления.
- Для удаления 2-нитробензол-1-1сульфонамид защитной группы смолу суспендировали в ДМФ, 12 экв DBU добавили, суспензию встряхивали в течение 5 мин, затем 12 экв меркаптоэтанола добавили и реакционную смесь встряхивали при КТ в течение 1 ч. Смоле дали стечь и промыли ДМФ и ДХМ. Степень депротекции контролировали с помощью тестового расщепления.
2. Восстановительное аминирование:
Смолу с трипептидом промыли с помощью ДХМ, соовтетствующее промежуточное соединение растворили в смеси NMP/TMOF/AcOH (49.7/49.7/0.6) и раствор добавили к смоле. Смесь встряхивали при КТ в течение 30 мин до 3 ч, затем 10 экв NaCNBH3 добавили и реакционную смесь встряхивали при КТ в течение ночи. В заключение смолу промыли ДМФ, ДХМ, MeOH/ДХМ (1:1) и ДМФ.
Fmoc-группу на третьей аминокислоте отщепили с помощью смеси 20% пиперидина в ДМФ в течение 2x 15-20мин при КТ с последующей промывкой ДМФ и ДХМ (тестовое расщепление).
3. Отщепление:
Смесь для отщепления 20% HFIP в ДХМ добавили к смоле и смесь перемешивали в течение 2 ч при КТ. Смолу отфильтровали и раствор эвапорировали досуха. Остаток растворили в воде/ацетонитриле и лиофилизировали.
4. Циклизация:
Полученное линейное соединение циклизовали посредством растворения порошка в ДМФ. 1.2 экв HATU и 5 экв DIPEA добавили и реакционную смесь перемешивали при КТ. Прохождение реакции контролировали с помощью ВЭЖХ. После заверешения реакции растворитель эвапорировали, получившийся остаток растворили в воде/ацетонитриле (1:1) и лиофилизировали.
5. Очистка:
Пептидные макроциклы очистили с использованием обратно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) с использованием колонки Reprospher 100 C18-TDE (250 x 20 мм, 5 мкм размер частиц) в качестве стационарной фазы и воды/ацетонитрила в качестве элюента (градиент 40-100% MeCN в течение 60 мин). Фракции собрали и анализировали с помощью ЖХ/МС. Образцы чистого продукта объединили и лиофилизировали. Идентификацию продукта провели с помощью масс-спектрометрии.
6. Общая депротекция:
Финальную BOC-депротекцию провели с помощью обработки 50% ТФУ (ДХМ) в течение 2 ч при КТ. Реакционный раствор сконцентрировали и остаток лиофилизировали с получением незащищенного продукта в виде ТФУ соли. Все пептиды получили в виде белого порошка с чистотой >90%.
Общая методика связывания по Сузуки производных бороновых кислот с промежуточными соединениями Пептидных Макроциклов:
В реакционной пробирке в раствор защищенного бромида Макроциклического Промежуточного Соединения (46.1 мкмоль, Экв: 1) в диоксане (1.2 мл) добавили при 22°C воду (400 мкл) с последующим карбонатом натрия (115 мкмоль, Экв: 2.5) и Производное Бороновой Кислоты (92.3 мкмоль, Экв: 2). Смесь дегазировали барботированием аргоном через реакционную смесь в течение 5 минут. Затем добавили тетракис(трифенилфосфин)палладий (0) (2.31 мкмоль, Экв: 0.05), пробирку продули инертным газом, закрыли и реакционную смесь перемешивали при 80°C в течение 2 ч или до заершения конверсии.
Смесь эвапорировали, обработали водой (2 мл) и экстрагировали с помощью ДХМ (2 x 2 мл). Органические слои высушили, эвапорировали досуха, очистили с помощью препаративной ВЭЖХ и лиофилизировали с получением чистого продукта в виде лиофилизированного осадка.
Boc-депротекция
К раствору лиофилизированного осадка (15 мкмоль) в ДХМ (1.6 мл) добавили при 22°C ТФУ (0.4 мл) (5.22 ммоль = ca. 350 экв.) и перемешивали в течение 2 ч с достижением полной конверсии.
Через всего 2 ч смесь эвапорировали, остаток растворили в ACN и H2O (содержит 0.1% ТФУ), оставили на 4 ч при 22°C и высушили заморозкой / лиофилизировали с получением пептидного макроцикла в виде белого лиофилизированного осадка.
Пример 1
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 1 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 4
MS (M+H)+: ожидаемая 696.3; наблюдаемая 670.3
Пример 2
(12S,15S,18S)-15,18-бис-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион
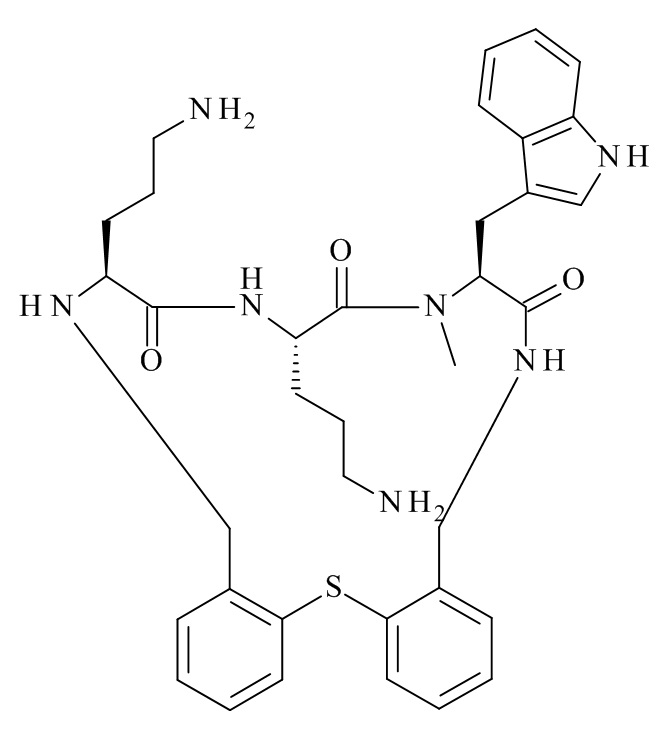
Пример 2 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Orn(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 4
MS (M+H)+: ожидаемая 655.3; наблюдаемая 656.3
Пример 3
(12S,15S,18S)-15-(4-амино-бутил)-12-(1H-индол-3-илметил)-13-метил-18-пиперидин-4-ил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 3 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. 2-(Fmoc-амино)-2-(1-Boc-4-пиперидил)уксусная кислота.
Линкер: Промежуточное соединение 4
MS (M+H)+: ожидаемая 695.4; наблюдаемая 696.4
Пример 4
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 4 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 3
MS (M+H)+: ожидаемая 703.3; наблюдаемая 704.3
Пример 5
N-[(11S,14S,17S)-14-(4-амино-бутил)-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-илметил]-гуанидин

Пример 5 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Agp(Boc2)-OH.
Линкер: Промежуточное соединение 4
MS (M+H)+: ожидаемая 683.3; наблюдаемая 684.3
Пример 6
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-5-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион
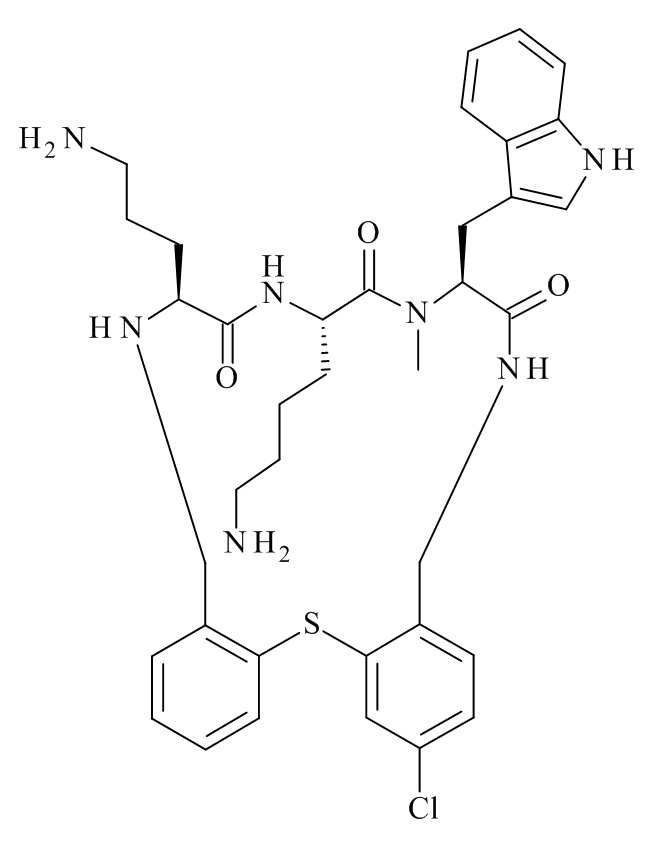
Пример 6 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 2
MS (M+H)+: ожидаемая 703.3; наблюдаемая 704.3
Пример 7
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-6-метокси-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 7 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 5
MS (M+H)+: ожидаемая 699.4; наблюдаемая 700.4
Пример 8
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-4,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 8 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 6
MS (M+H)+: ожидаемая 683.4; наблюдаемая 684.4
Пример 9
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-5,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 9 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 7
MS (M+H)+: ожидаемая 683.4; наблюдаемая 684.4
Пример 10
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-6,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 10 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 8
MS (M+H)+: ожидаемая 683.4; наблюдаемая 684.4
Пример 11
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 11 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 1
MS (M+H)+: ожидаемая 703.3; наблюдаемая 705.2
Пример 12
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-4-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 12 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 9
MS (M+H)+: ожидаемая 737.3; наблюдаемая 738.1
Пример 13
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-5-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 13 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 10
MS (M+H)+: ожидаемая 737.3; наблюдаемая 738.4
Пример 14
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-6-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 14 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 11
MS (M+H)+: ожидаемая 737.3; наблюдаемая 738.3
Пример 15
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(6-хлор-1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 15 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-6-Cl-Trp-OH, с последующим N-метилированием Trp альфа-N на шариках,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 4
MS (M+H)+: ожидаемая 703.3; наблюдаемая 704.3
Пример 16
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(6-хлор-1-метил-1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

N-Метилирование по азоту индола произвелось до N-алкилирования активироанного Trp альфа-N. Пример 16 выделили из неочищенной смеси примера 15 с использованием обычных условий очистки ВЭЖХ.
MS (M+H)+: ожидаемая 717.3; наблюдаемая 718.3
Пример 17
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-13-метил-12-(1-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион
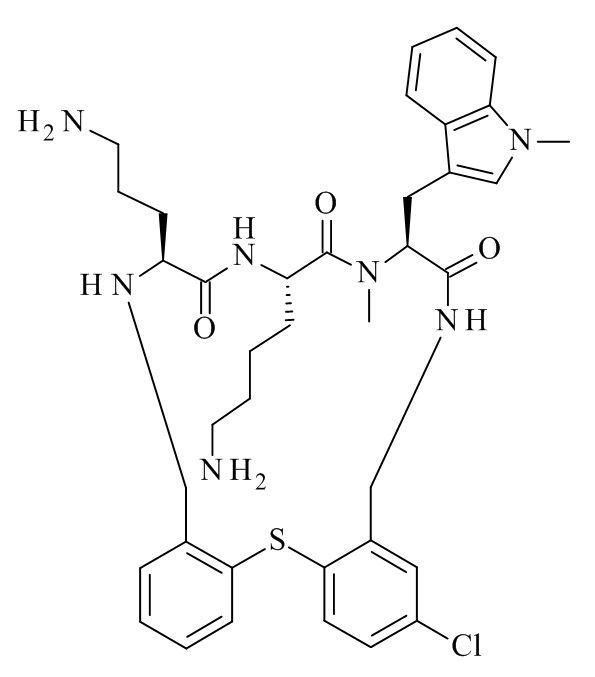
Пример 17 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-Trp(NMe)-OH, с последующим N-метилированием Trp альфа-N на шариках,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 3
MS (M+H)+: ожидаемая 717.3; наблюдаемая 718.3
Пример 18
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-12-(6-хлор-1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 18 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-6-Cl-Trp-OH, с последующим N-метилированием Trp альфа-N на шариках,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 3
MS (M+H)+: ожидаемая 737.3; наблюдаемая 738.3
Пример 19
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-12-(6-хлор-1-метил-1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

N-Метилирование по азоту индола произвелось до N-алкилирования активированного Trp альфа-N. Пример 19 выделили из неочищенной смеси примера 18 с использованием обычных условий очистки ВЭЖХ.
MS (M+H)+: ожидаемая 751.3; наблюдаемая 752.3
Пример 20
(9S,12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-12-(1H-индол-3-илметил)-9,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 20 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 12
MS (M+H)+: ожидаемая 717.3; наблюдаемая 718.3
Пример 21
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6,7-дихлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион
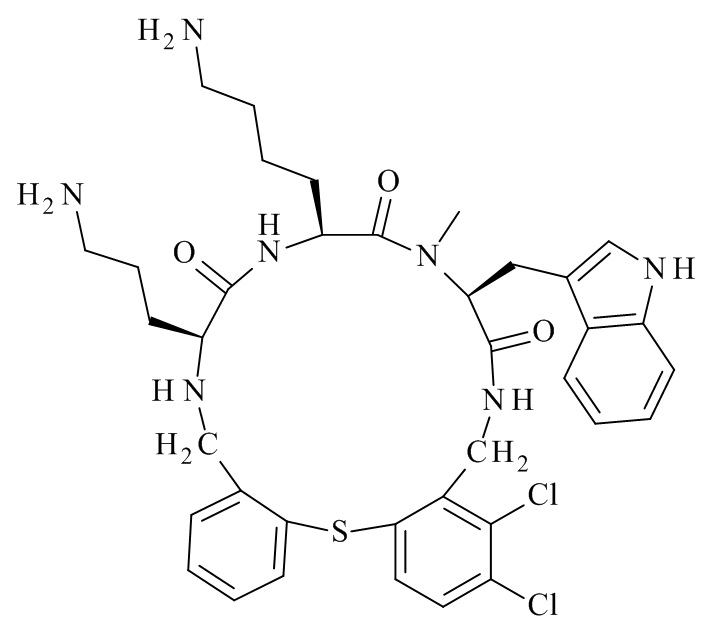
Пример 21 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 14
MS (M+H)+: ожидаемая 737.3; наблюдаемая 738.3
Пример 22
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-7-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 22 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 15
MS (M+H)+: ожидаемая 703.3; наблюдаемая 704.3
Пример 23
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,7-дихлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 23 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 13
MS (M+H)+: ожидаемая 737.3; наблюдаемая 738.4
Пример 24
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-7-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 24 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 16
MS (M+H)+: ожидаемая 771.3; наблюдаемая 772.2
Пример 25
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-6-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион
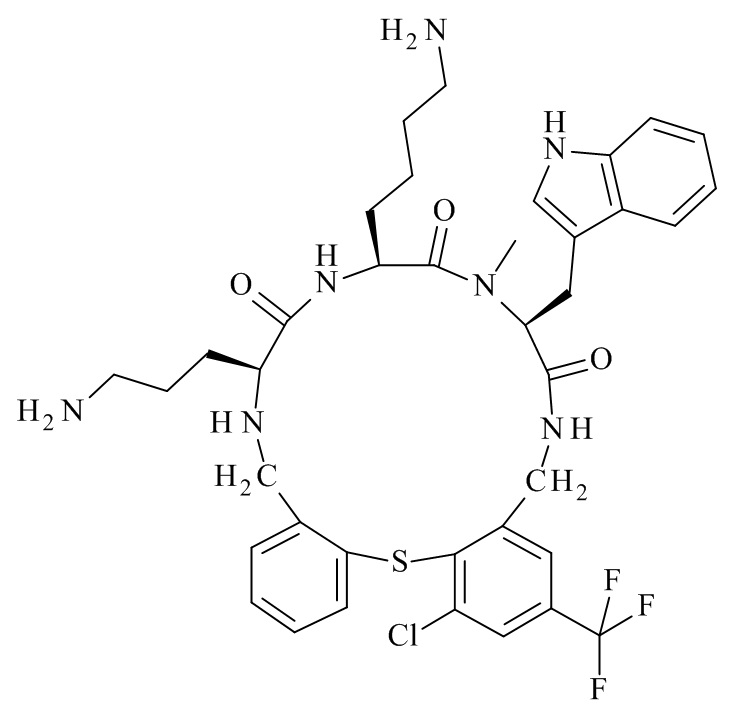
Пример 25 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 21
MS (M+H)+: ожидаемая 771.2; наблюдаемая 772.3
Пример 26
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-7-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 26 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 22
MS (M+H)+: ожидаемая 721.3; наблюдаемая 722.3
Пример 27
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,6-дихлор-23-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 27 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 26
MS (M+H)+: ожидаемая 755.3; наблюдаемая 756.3
Пример 28
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 28 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 54
MS (M+H)+: ожидаемая 704.3; наблюдаемая 705.4
Пример 29
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,7-дифтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 29 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 17
MS (M+H)+: ожидаемая 705.3; наблюдаемая 706.3
Пример 30
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 30 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 19
MS (M+H)+: ожидаемая 687.3; наблюдаемая 688.3
Пример 31
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-12-(1H-индол-3-илметил)-13-метил-4-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 31 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 20
MS (M+H)+: ожидаемая 771.3; наблюдаемая 772.3
Пример 32
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-13-метил-12-(2-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 32 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-2-метил-L-Trp-OH, с последующим N-метилированием на шариках Trp альфа-N,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 4
MS (M+H)+: ожидаемая 683.4; наблюдаемая 684.4
Пример 33
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион
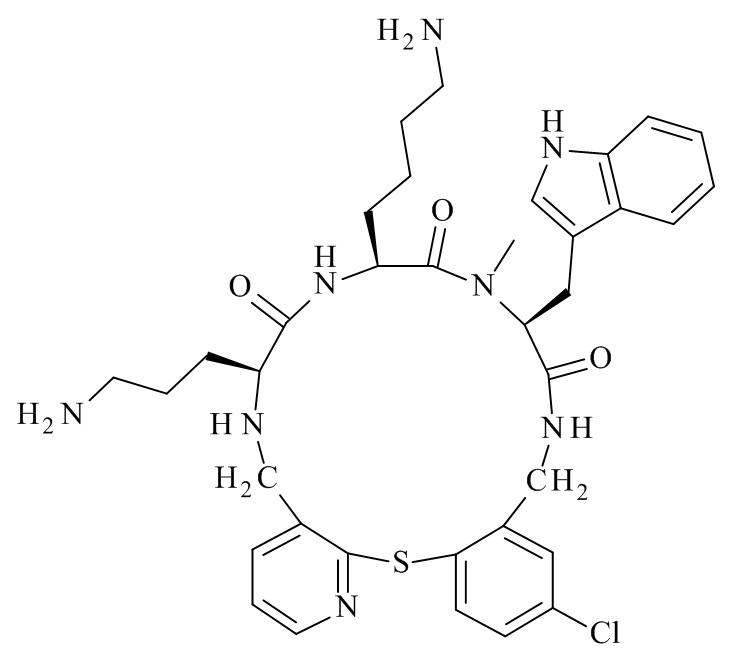
Пример 33 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 24
MS (M+H)+: ожидаемая 704.3; наблюдаемая 705.3
Пример 34
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 34 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 25
MS (M+H)+: ожидаемая 704.3; наблюдаемая 705.4
Пример 35
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-22-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион
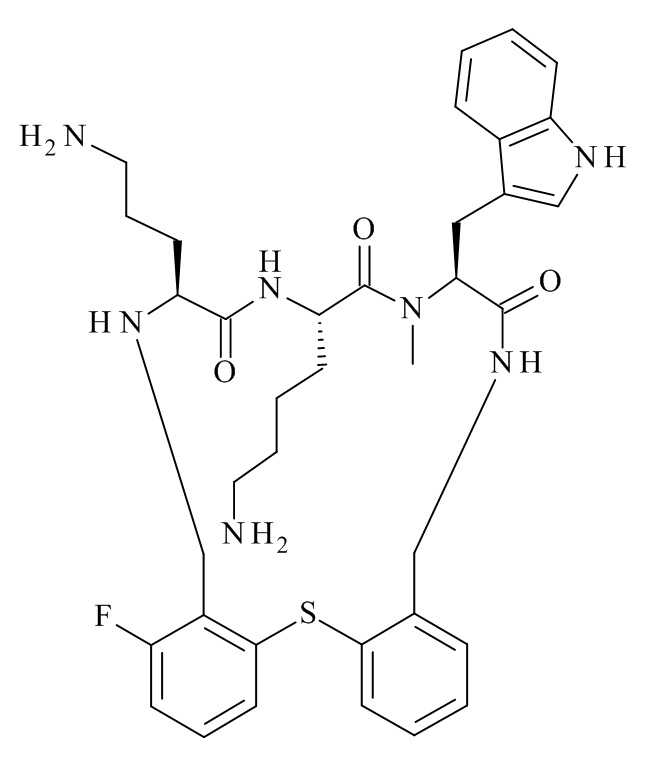
Пример 35 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 53
MS (M+H)+: ожидаемая 687.3; наблюдаемая 688.3
Пример 36
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-16-метил-25-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион
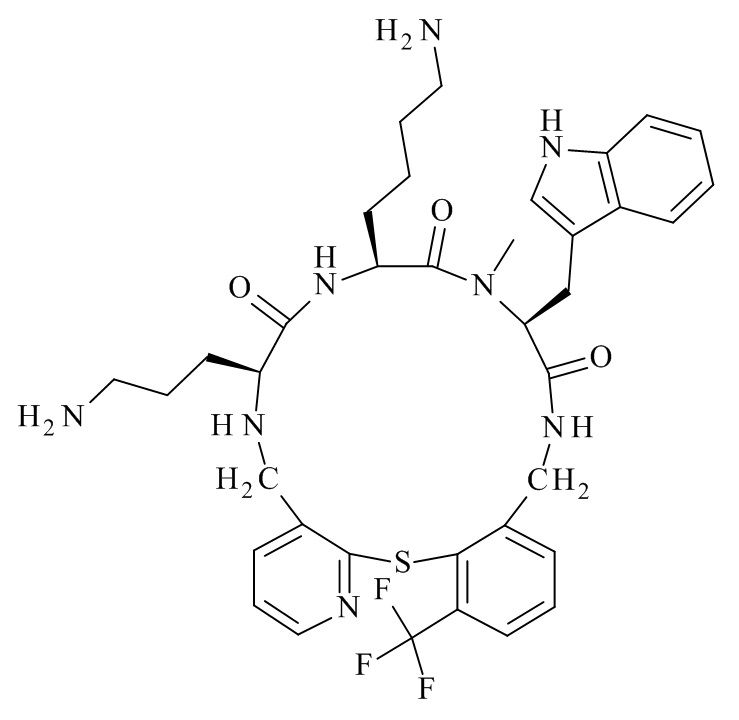
Пример 36 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 23
MS (M+H)+: ожидаемая 738.3; наблюдаемая 739.2
Пример 37
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,23-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 37 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 29
MS (M+H)+: ожидаемая 738.3; наблюдаемая 739.2
Пример 38
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 38 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 30
MS (M+H)+: ожидаемая 738.3; наблюдаемая 739.3
Пример 39
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 39 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 31
MS (M+H)+: ожидаемая 772.3; наблюдаемая 9773.2
Пример 40
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дифтор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
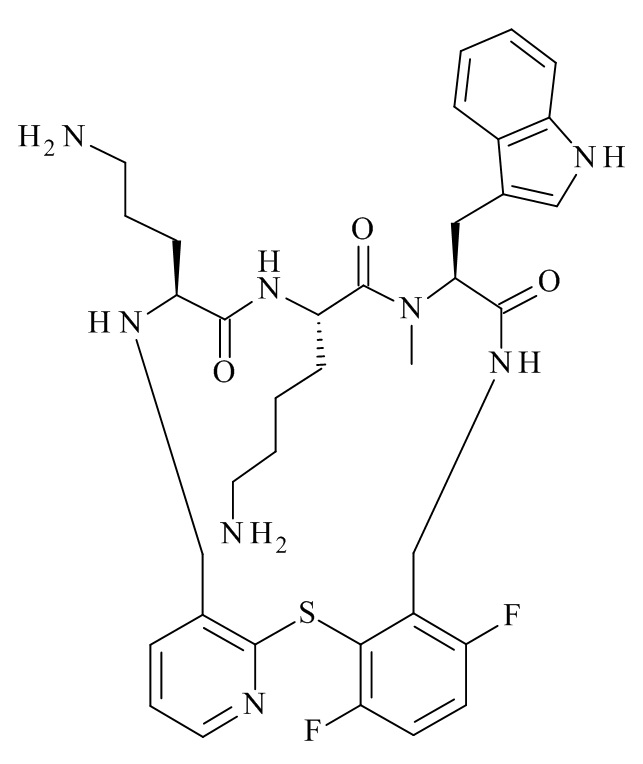
Пример 40 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 32
MS (M+H)+: ожидаемая 706.3; наблюдаемая 707.3
Пример 41
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-6,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 41 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 36
MS (M+H)+: ожидаемая 717.3; наблюдаемая 718.3
Пример 42
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,6-дихлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион
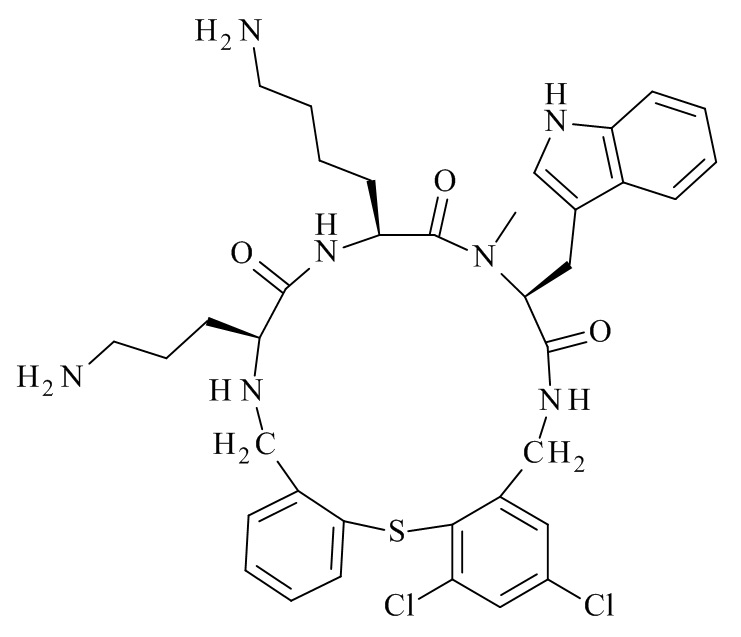
Пример 42 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 37
MS (M+H)+: ожидаемая 737.3; наблюдаемая 738.3
Пример 43
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-13-этил-12-(1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 43 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NEt-L-Trp(BOC)-OH (промежуточное соединение 55),
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 3
MS (M+H)+: ожидаемая 717.3; наблюдаемая 718.3
Пример 44
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-13-этил-12-(1H-индол-3-илметил)-6-метокси-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион
Пример 44 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NEt-L-Trp(BOC)-OH (промежуточное соединение 55),
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 5
MS (M+H)+: ожидаемая 729.4; наблюдаемая 730.4
Пример 45
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-13-этил-12-(1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 45 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NEt-L-Trp(BOC)-OH (промежуточное соединение 55),
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 1
MS (M+H)+: ожидаемая 717.3; наблюдаемая 718.3
Пример 46
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-13-этил-12-(1H-индол-3-илметил)-4-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 46 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NEt-L-Trp(BOC)-OH (промежуточное соединение 55),
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 6
MS (M+H)+: ожидаемая 697.4; наблюдаемая 698.4
Пример 47
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион
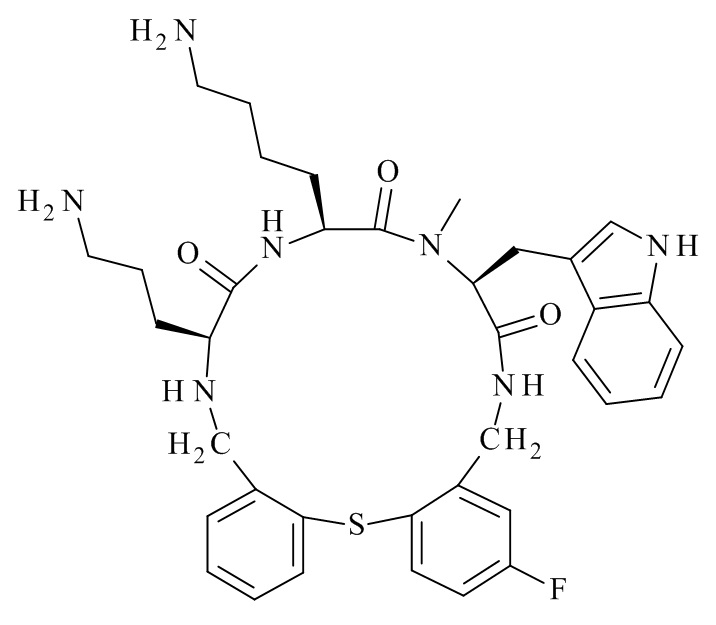
Пример 47 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 35
MS (M+H)+: ожидаемая 687.3; наблюдаемая 688.3
Пример 48
(12S,15S,18S)-15-(4-амино-бутил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-18-(4-метиламино-бутил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 48 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-Lys(Me,BOC)-OH.
Линкер: Промежуточное соединение 1
MS (M+H)+: ожидаемая 731.4; наблюдаемая 732.4
Пример 49
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-6-метокси-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 49 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 33
MS (M+H)+: ожидаемая 733.3; наблюдаемая 734.3
Пример 50
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-6-метокси-4,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 50 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 34
MS (M+H)+: ожидаемая 713.4; наблюдаемая 714.4
Пример 51
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-16,25-диметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 51 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 40
MS (M+H)+: ожидаемая 684.4; наблюдаемая 685.3
Пример 52
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-хлор-22-фтор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
Пример 52 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 28
MS (M+H)+: ожидаемая 722.3; наблюдаемая 723.3
Пример 53
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион
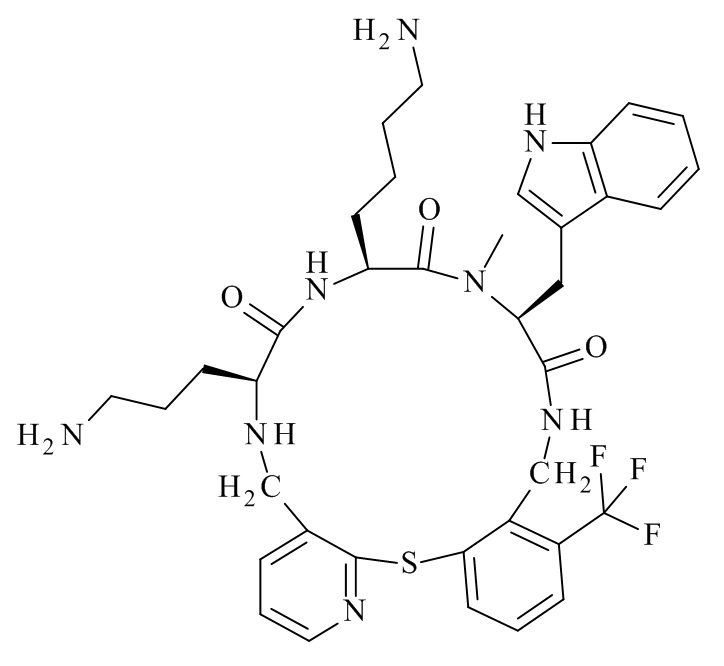
Пример 53 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 23
MS (M+H)+: ожидаемая 738.3; наблюдаемая 739.3
Пример 54
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-22-фтор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 54 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 27
MS (M+H)+: ожидаемая 722.3; наблюдаемая 723.3
Пример 55
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-12-(1H-индол-3-илметил)-4,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 55 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 38
MS (M+H)+: ожидаемая 717.3; наблюдаемая 718.3
Пример 56
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-23-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион
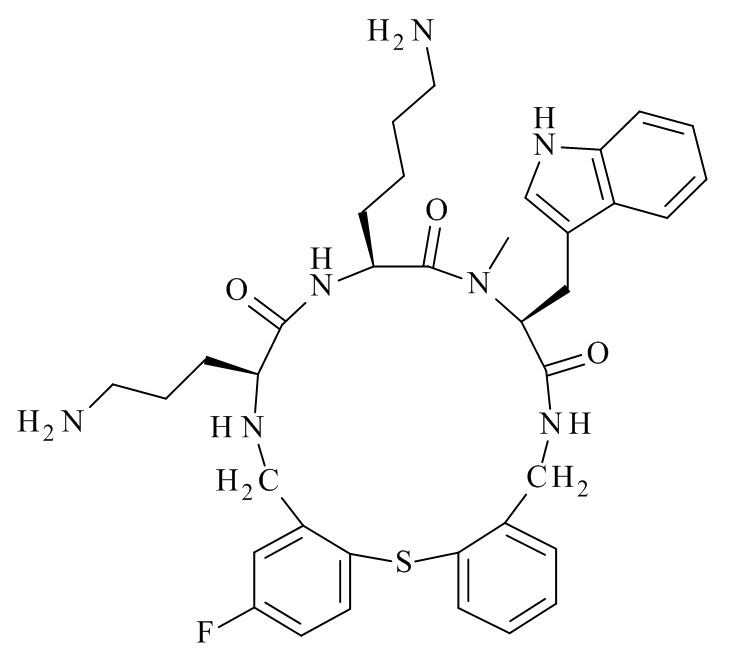
Пример 56 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 39
MS (M+H)+: ожидаемая 687.3; наблюдаемая 688.3
Пример 57
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-хлор-13-метил-12-(2-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 57 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-2-метил-L-Trp-OH, с последующим N-метилированием на шариках Trp альфа-N,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 3
MS (M+H)+: ожидаемая 717.3; наблюдаемая 718.3
Пример 58
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,13-диметил-12-(2-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 58 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-2-метил-L-Trp-OH, с последующим N-метилированием на шариках Trp альфа-N,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 6
MS (M+H)+: ожидаемая 697.7; наблюдаемая 698.4
Пример 59
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4,6-дихлор-13-метил-12-(2-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 59 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-2-метил-L-Trp-OH, с последующим N-метилированием на шариках Trp альфа-N,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 37
MS (M+H)+: ожидаемая 751.3; наблюдаемая 752.3
Пример 60
(9S,12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-9,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 60 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 41
MS (M+H)+: ожидаемая 717.3; наблюдаемая 718.3
Пример 61
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-23-метокси-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 61 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 43
MS (M+H)+: ожидаемая 700.3; наблюдаемая 701.6
Пример 62
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 62 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 45
MS (M+H)+: ожидаемая 772.3; наблюдаемая 773.3
Пример 63
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-2-тиа-5,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион
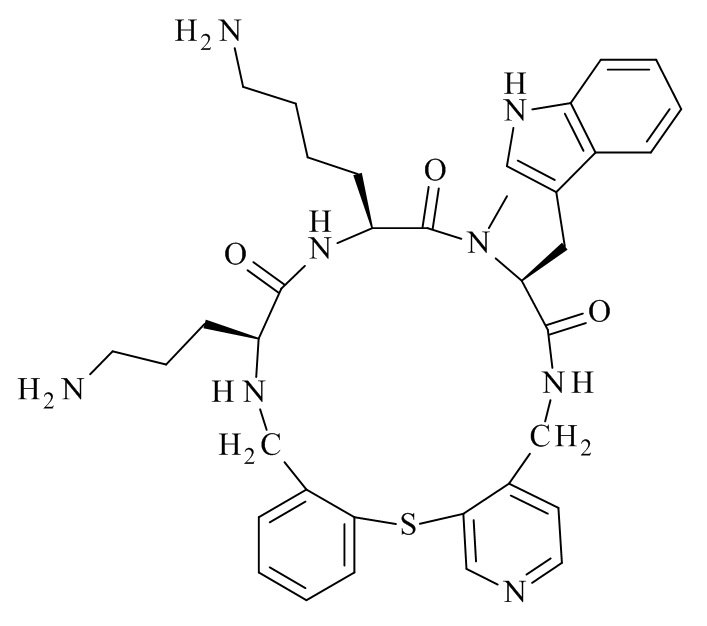
Пример 63 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 46
MS (M+H)+: ожидаемая 670.3; наблюдаемая 671.3
Пример 64
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-23-фтор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 64 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 42
MS (M+H)+: ожидаемая 721.3; наблюдаемая 772.3
Пример 65
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-23-фтор-12-(1H-индол-3-илметил)-4,13-диметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 65 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 44
MS (M+H)+: ожидаемая 701.3; наблюдаемая 702.6
Пример 66
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-этил-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 66 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 49
MS (M+H)+: ожидаемая 997.4; наблюдаемая 998.4
Пример 67
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 67 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 47
MS (M+H)+: ожидаемая 738.3; наблюдаемая 739.3
Пример 68
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22-хлор-17-(1H-индол-3-илметил)-16-метил-25-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 68 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 48
MS (M+H)+: ожидаемая 772.3; наблюдаемая 773.3
Пример 69
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-6-фенил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 69 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 50
MS (M+H)+: ожидаемая 745.4; наблюдаемая 746.4
Пример 70
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-трет-бутил-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион
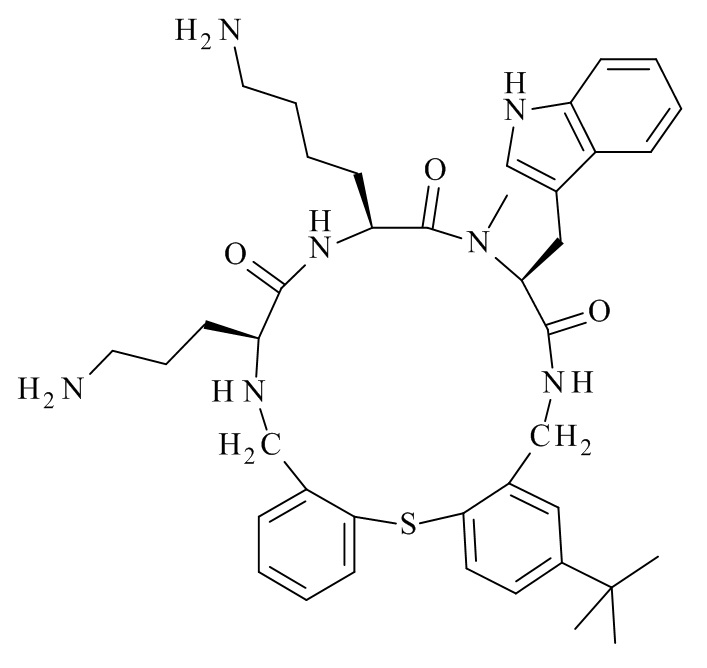
Пример 70 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 51
MS (M+H)+: ожидаемая 725.4; наблюдаемая 726.4
Пример 71
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-метокси-13-метил-12-(2-метил-1H-индол-3-илметил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11,14,17-трион

Пример 71 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-2-метил-L-Trp-OH, с последующим N-метилированием на шариках Trp альфа-N,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 5
MS (M+H)+: ожидаемая 713.9; наблюдаемая 714.4
Пример 72
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-6-изопропил-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 72 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 52
MS (M+H)+: ожидаемая 711.4; наблюдаемая 712.4
Пример 73
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-22-фтор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион
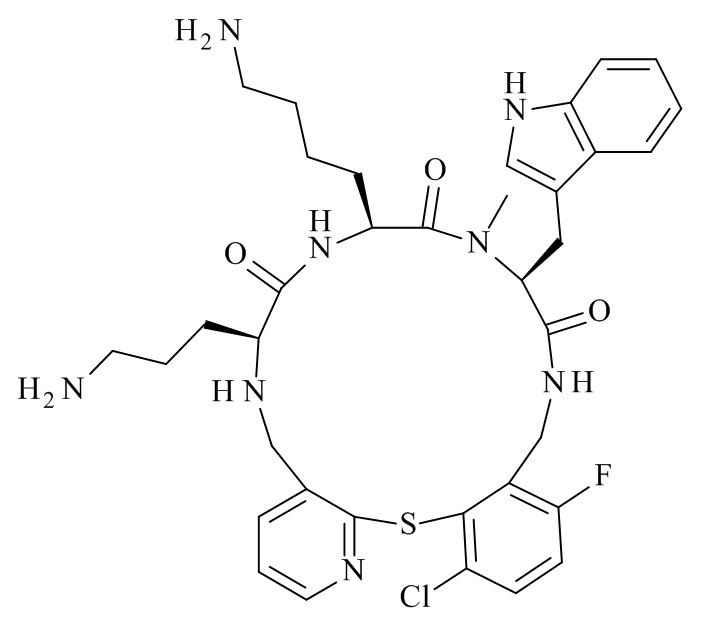
Пример 73 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 27
MS (M+H)+: ожидаемая 722.3; наблюдаемая 723.3
Пример 74
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 74 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-2-метил-L-Trp-OH, с последующим N-метилированием на шариках Trp альфа-N,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 45
MS (M+H)+: ожидаемая 786.6; наблюдаемая 787.3
Пример 75
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 75 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-2-метил-L-Trp-OH, с последующим N-метилированием на шариках Trp альфа-N,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 31
MS (M+H)+: ожидаемая 786.3; наблюдаемая 787.3
Пример 76
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
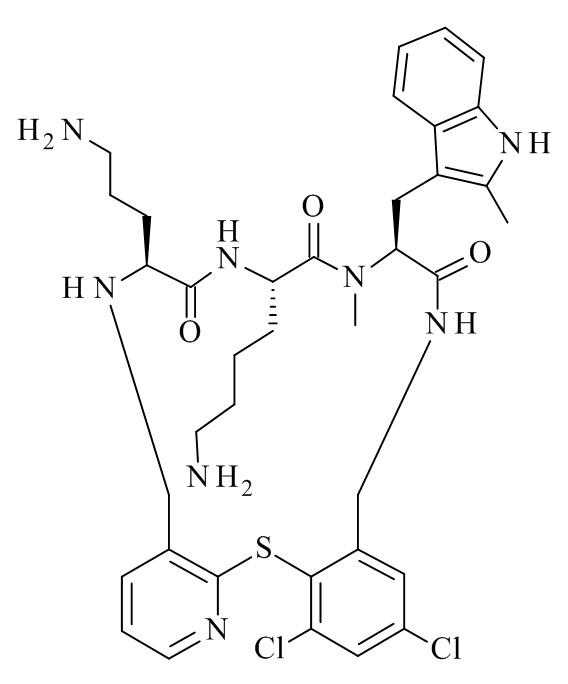
Пример 76 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-2-метил-L-Trp-OH, с последующим N-метилированием на шариках Trp альфа-N,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 47
MS (M+H)+: ожидаемая 752.3; наблюдаемая 753.3
Пример 77
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-этил-17-(1H-индол-3-илметил)-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 77 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NEt-L-Trp(BOC)-OH (промежуточное соединение 55),
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 45
MS (M+H)+: ожидаемая 786.3; наблюдаемая 787.4
Пример 78
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-16-этил-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 78 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NEt-L-Trp(BOC)-OH (промежуточное соединение 55),
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 30
MS (M+H)+: ожидаемая 752.3; наблюдаемая 753.3
Пример 79
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-этил-17-(1H-индол-3-илметил)-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
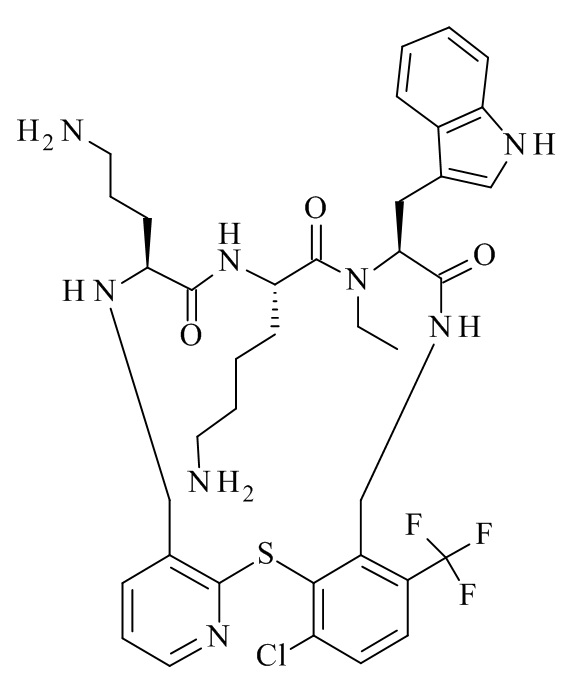
Пример 79 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NEt-L-Trp(BOC)-OH (промежуточное соединение 55),
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 31
MS (M+H)+: ожидаемая 786.3; наблюдаемая 787.3
Пример 80
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-16-этил-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 80 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NEt-L-Trp(BOC)-OH (промежуточное соединение 55),
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 47
MS (M+H)+: ожидаемая 752.3; наблюдаемая 753.3
Пример 81
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23,25-дихлор-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 81 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 47
MS (M+H)+: ожидаемая 724.2; наблюдаемая 725.2
Пример 82
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-17-(1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 82 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 30
MS (M+H)+: ожидаемая 724.2; наблюдаемая 725.2
Пример 83
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-этил-17-(1H-индол-3-илметил)-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21, 23-гексаен-12,15,18-трион
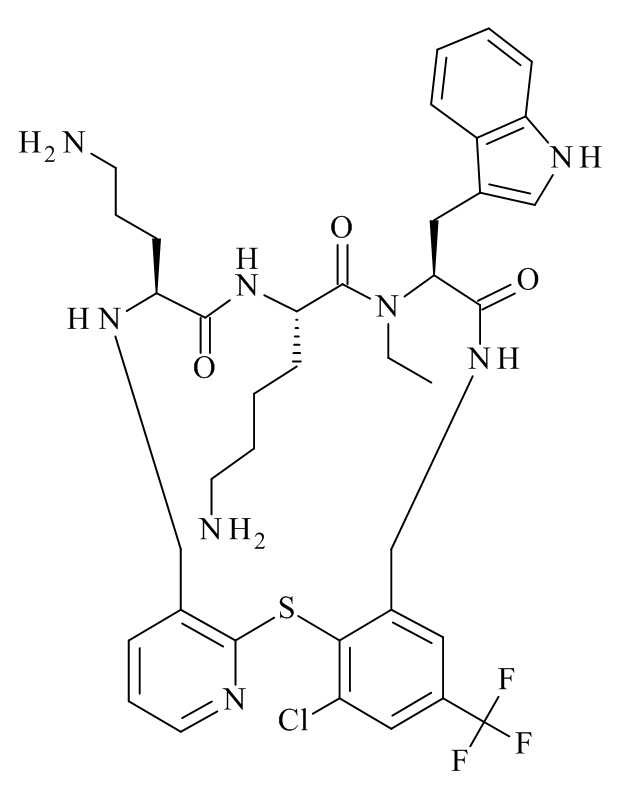
Пример 83 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NEt-L-Trp(BOC)-OH (промежуточное соединение 55),
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 45
MS (M+H+): ожидаемая 796.3; наблюдаемая 787.3
Пример 84
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-бромо-16-этил-17-(1H-индол-3-илметил)-25-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 84 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NEt-L-Trp(BOC)-OH (промежуточное соединение 55),
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 56
MS (M+H+): ожидаемая 776.8; наблюдаемая 777.3
Пример 85
(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-11-(3-метил-3H-имидазол-4-илметил)-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 85 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-(3-метил-3H-имидазол-4-ил)-пропионовая кислота.
Линкер: Промежуточное соединение 45
MS (M+H+): ожидаемая 809.3; наблюдаемая 810.3
Пример 86
(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-11-пиридин-3-илметил-23-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
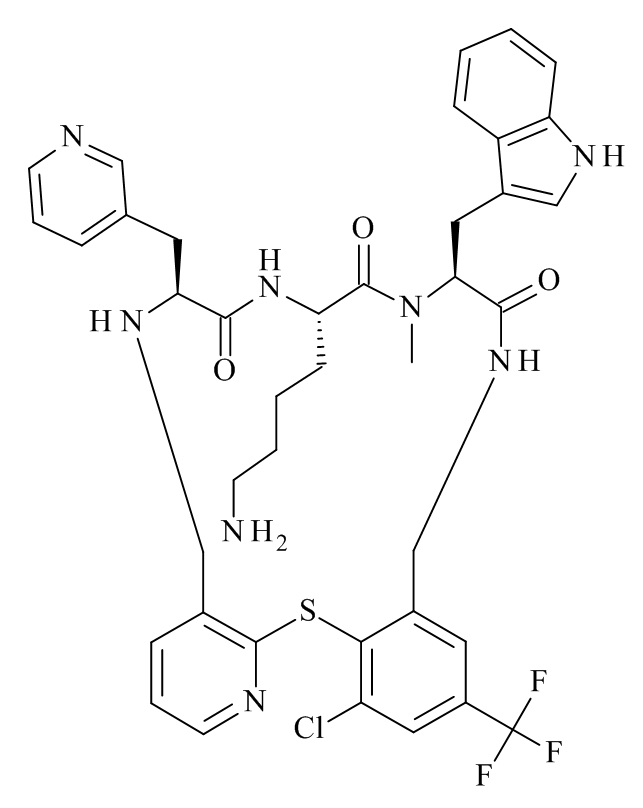
Пример 86 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-пиридин-3-ил-пропионовая кислота.
Линкер: Промежуточное соединение 45
MS (M+H+): ожидаемая 806.3; наблюдаемая 807.3
Пример 87
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-16-метил-23-фенил-25-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 87 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 57
MS (M+H+): ожидаемая 806.3; наблюдаемая 807.3
Пример 88
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-бромо-17-(1H-индол-3-илметил)-16-метил-25-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 88 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 58
MS (M+H+): ожидаемая 816.8; наблюдаемая 817.5
Пример 89
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-бромо-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 89 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 59
MS (M+H+): ожидаемая 783.2; наблюдаемая 784.2
Пример 90
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22-бромо-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 90 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 60
MS (M+H+): ожидаемая 783.2; наблюдаемая 784.2
Пример 91
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-16-метил-23,25-бис-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 91 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 61
MS (M+H+): ожидаемая 805.9; наблюдаемая 807.3
Пример 92
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-морфолин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 92 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 62
MS (M+H+): ожидаемая 789.4; наблюдаемая 790.3
Пример 93
(14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион
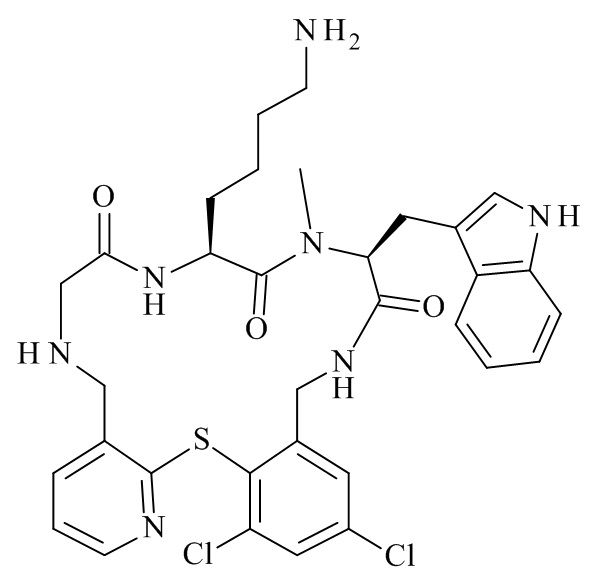
Пример 93 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Gly-OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 682.7; наблюдаемая 683.2
Пример 94
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-11,16-диметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион
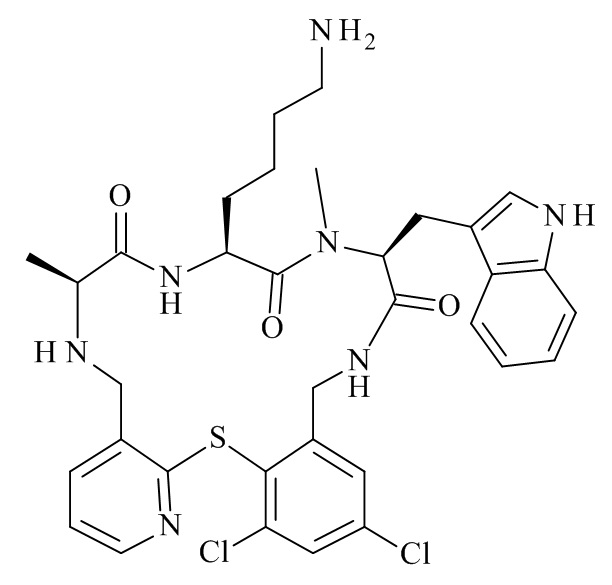
Пример 94 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Ala-OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 695.7; наблюдаемая 696.2
Пример 95
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-11-изопропил-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 95 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Leu-OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 723.7; наблюдаемая 724.3
Пример 96
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-11-гидроксиметил-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 96 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Ser(tBu)-OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 711.7; наблюдаемая 712.2
Пример 97
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-трифторметил-2-тиа-4,7,10,13,16,19-гексааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион

Пример 97 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 63
MS (M+H+): ожидаемая 773.3; наблюдаемая 774.3
Пример 98
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,7,10,13,16,19-гексааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион
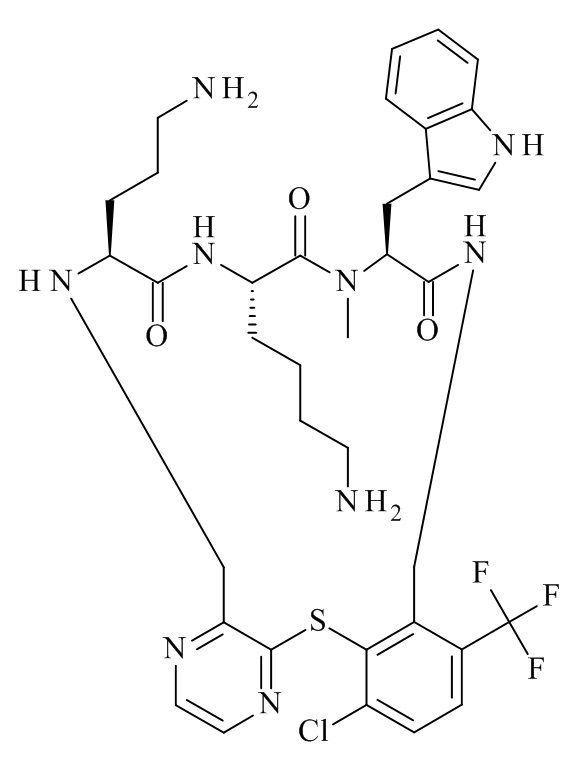
Пример 98 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 64
MS (M+H+): ожидаемая 773.3; наблюдаемая 774.3
Пример 99
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пиридин-3-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15, 18-трион

Пример 99 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 65
MS (M+H+): ожидаемая 781.4; наблюдаемая 782.4
Пример 100
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пиридин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 100 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 66
MS (M+H+): ожидаемая 781.4; наблюдаемая 782.4
Пример 101
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-11-изобутил-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23--гексаен-12,15,18-трион
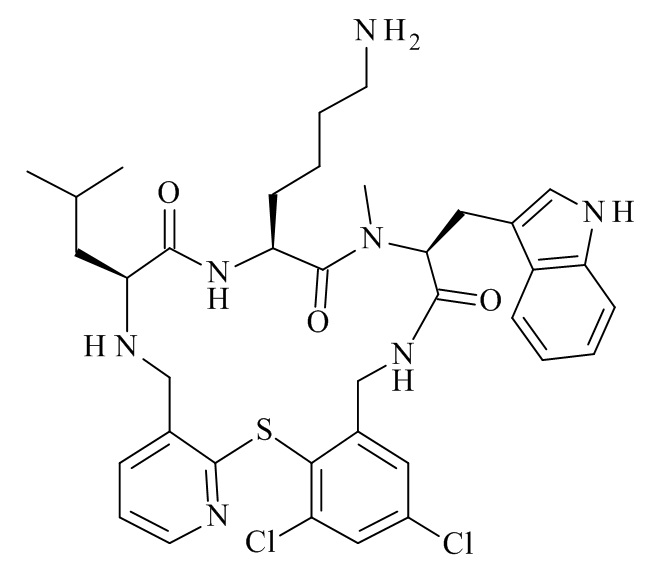
Пример 101 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Leu-OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 737.8; наблюдаемая 738.3
Пример 102
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-23-(2-метокси-пиридин-4-ил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 102 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 67
MS (M+H+): ожидаемая 811.4; наблюдаемая 812.4
Пример 103
3-[(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11-ил]-пропионамид

Пример 103 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Gln(Trt) -OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 752.7; наблюдаемая 753.3
Пример 104
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-7,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион

Пример 104 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 68
MS (M+H+): ожидаемая 738.4; наблюдаемая 739.3 [(M+H)+]
Пример 105
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-(2-метил-пиридин-4-ил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 105 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 65
MS (M+H+): ожидаемая 795.4; наблюдаемая 796.4
Пример 106
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-11-((S)-1-гидрокси-этил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион
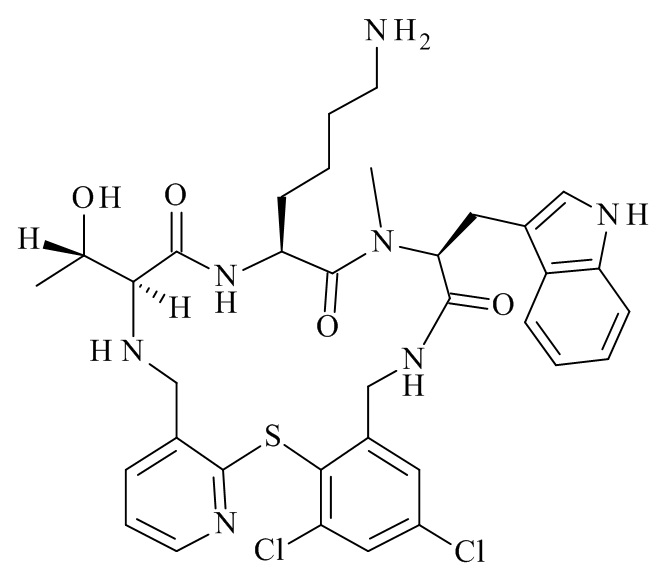
Пример 106 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Thr(tBu)-OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 725.7; наблюдаемая 726.3
Пример 107
(14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-11,11,16-триметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 107 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-Aib-OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 709.7; наблюдаемая 710.3
Пример 108
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-11-нафтален-2-илметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 108 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-2-Nal-OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 821.8; наблюдаемая 822.3
Пример 109
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-(6-амино-пиридин-3-ил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 109 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 70
MS (M+H+): ожидаемая 796.4; наблюдаемая 797.3
Пример 110
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,7,10,13,16,19-гексааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 110 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 71
MS (M+H+): ожидаемая 739.3; наблюдаемая 740.3 [(M+H)+]
Пример 111
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-7,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
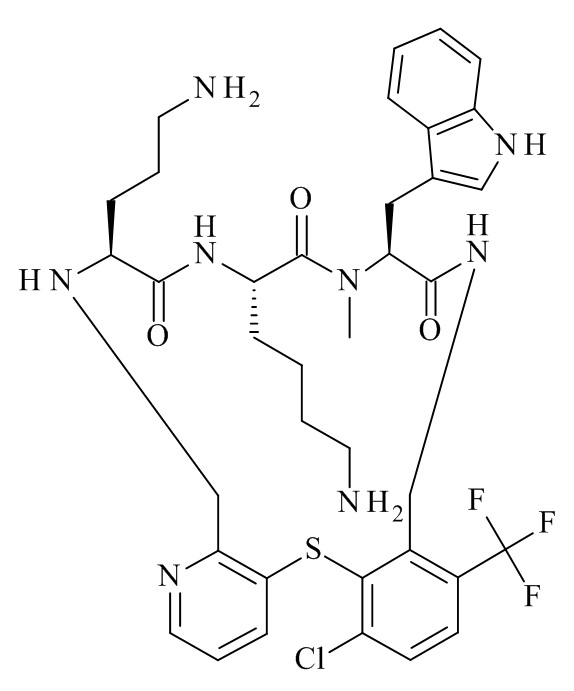
Пример 111 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 72
MS (M+H+): ожидаемая 772.3; наблюдаемая 773.3 [(M+H)+]
Пример 112
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-трифторметил-2-тиа-7,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 112 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 73
MS (M+H+): ожидаемая 772.3; наблюдаемая 773.3 [(M+H)+]
Пример 113
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-5,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 113 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 74
MS (M+H+): ожидаемая 704.3; наблюдаемая 705.3 [(M+H)+]
Пример 114
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-11-нафтален-1-илметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 114 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-1-Nal-OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 821.8; наблюдаемая 822.3
Пример 115
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-[2-(4-метил-пиперазин-1-ил)-пиридин-4-ил]-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 115 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 75
MS (M+H+): ожидаемая 821.8; наблюдаемая 822.3
Пример 116
{(7S,10S,13S)-10-(4-аминобутил)-7-(3-аминопропил)-20-хлор-13-[(1H-индол-3-ил)метил]-12-метил-8,11,14-триоксо-5,6,7,8,9,10,11,12,13,14,15,16-додекагидропиридо[2,3-b][1,5,8,11,14]бензотиатетраазациклогептадецин-18-ил}бороновая кислота

Пример 116 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 76
MS (M+H+): ожидаемая 748.1; наблюдаемая 749.4
Пример 117
(12S,15S,18S)-15-(3-амино-пропил)-18-бифенил-4-илметил-12-(1H-индол-3-илметил)-19-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 117 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-Trp(BOC)-OH,
2. Fmoc-L-Orn(BOC)-OH,
3. Fmoc-L-NMe-Bip(BOC)-OH.
Линкер: Промежуточное соединение 4
MS (M+H)+: ожидаемая 765.35; наблюдаемая 765.42
Пример 118
(11S,14S,17S)-14-(4-амино-бутил)-11-(2-амино-этоксиметил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 118 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-NMe-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. (S)-3-(2-трет-Бутоксикарбониламино-этокси)-2-(9H-флуорен-9-илметоксикарбониламино)-пропионовая кислота
Линкер: Промежуточное соединение 31
MS (M+H)+: ожидаемая 789.29; наблюдаемая 789.34
Пример 119
(11S,14S,17S)-11,14-бис-(2-амино-этоксиметил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 119 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-NMe-Trp(BOC)-OH,
2. (S)-3-(2-трет-Бутоксикарбониламино-этокси)-2-(9H-флуорен-9-илметоксикарбониламино)-пропионовая кислота
3. (S)-3-(2-трет-Бутоксикарбониламино-этокси)-2-(9H-флуорен-9-илметоксикарбониламино)-пропионовая кислота
Линкер: Промежуточное соединение 31
MS (M+H)+: ожидаемая 791.26; наблюдаемая 791.27
Пример 120
(11S,14S,17S)-14-(2-амино-этоксиметил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 120 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
- Fmoc-L-NMe-Trp(BOC)-OH,
- (S)-3-(2-трет-Бутоксикарбониламино-этокси)-2-(9H-флуорен-9-илметоксикарбониламино)-пропионовая кислота
- Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 31
MS (M+H)+: ожидаемая 775.27; наблюдаемая 775.22
Пример 121
3-[(11S,14S,17S)-14-(4-амино-бутил)-22,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11-ил]-пропионамид
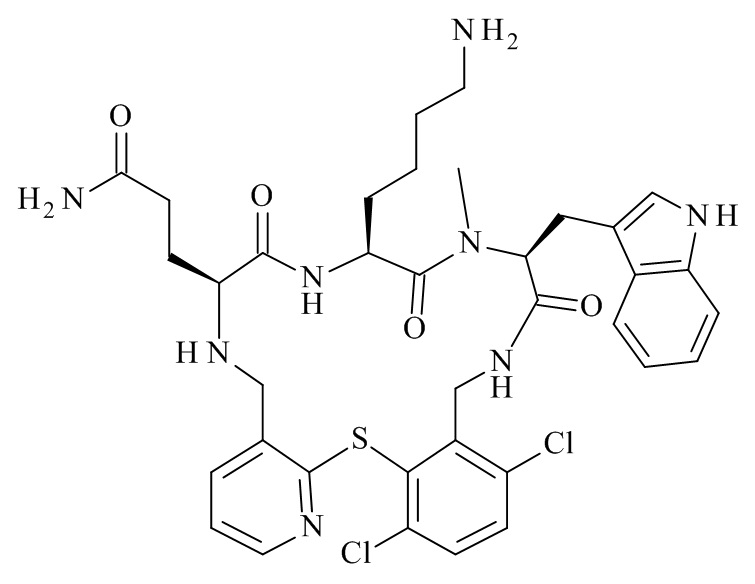
Пример 121 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Gln(Trt)-OH.
Линкер: Промежуточное соединение 30
MS (M+H+): ожидаемая 752.7; наблюдаемая 753.3
Пример 122
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-5,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 122 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 77. Макроциклизация: 2.4 экв. HATU, 10 экв. DIPEA, в ДМФ при КТ 4 ч. Депротекция: ДХМ/ТФУ 2:1. Соединение, указанное в заголовке, получили в виде светло-желтого порошка (6 мг). MS ESI (m/z): 773.3 [(M+H)+]
Пример 123
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-трифторметил-2-тиа-5,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион
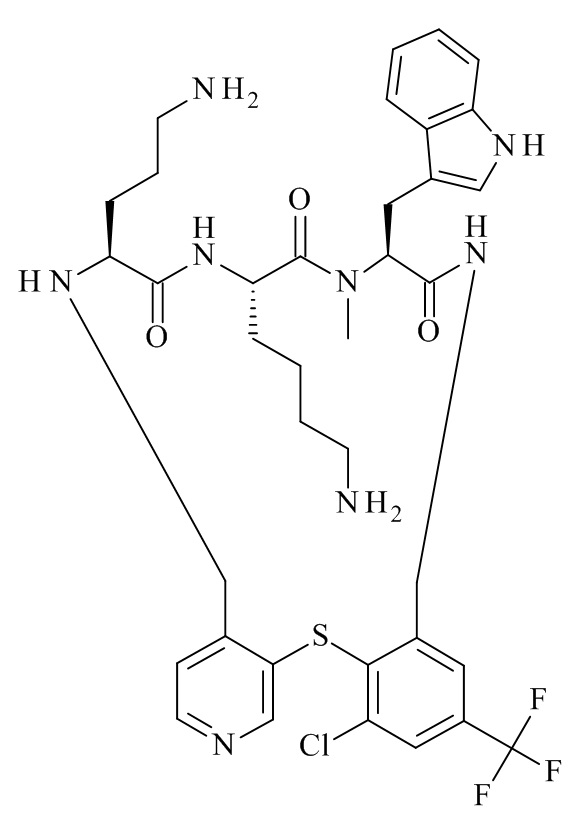
Пример 123 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 78. Макроциклизация: 2.4 экв. HATU, 10 экв. DIPEA, в ДМФ при КТ 2 ч. Депротекция: ДХМ/ТФУ 2:1. Соединение, указанное в заголовке, получили в виде красного осадка (12 мг). MS ESI (m/z): 773.3 [(M+H)+]
Пример 124
(11R,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-24-фенил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Example124 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-D-Orn(BOC)-OH.
Линкер: Промежуточное соединение 79
MS (M+H)+: ожидаемая 767.32; наблюдаемая 767.33
Пример 125
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-24-фенил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион
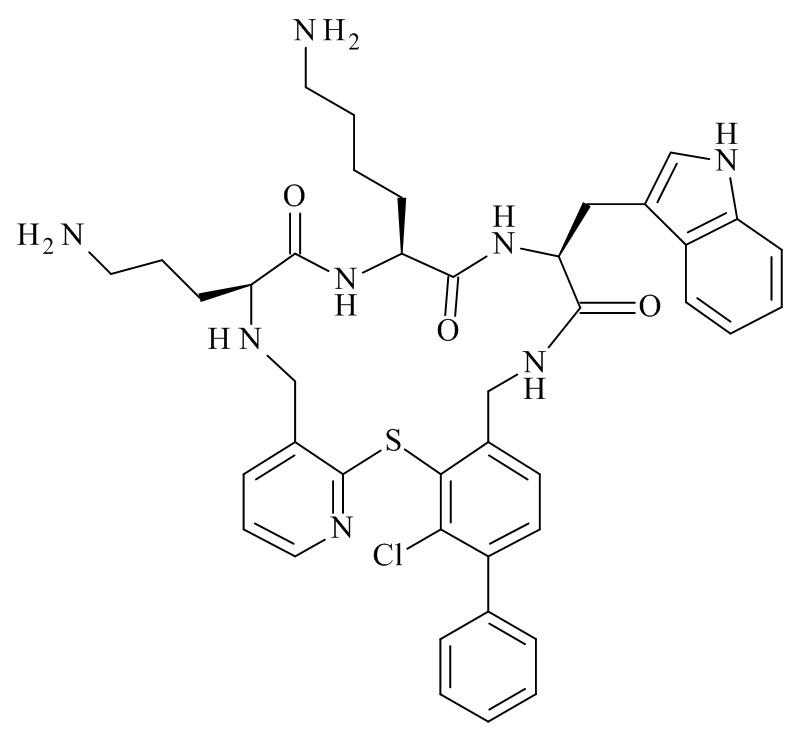
Пример 125 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 79
MS (M+H)+: ожидаемая 767.32; наблюдаемая 767.32
Пример 126
(11R,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-24-фенил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион
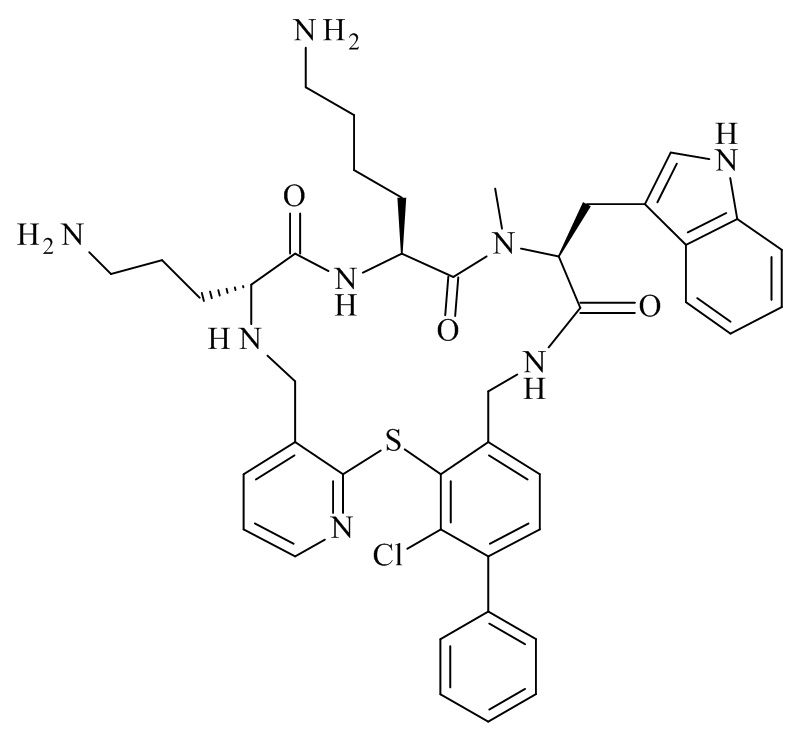
Пример 126 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-NMe-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-D-Orn(BOC)-OH.
Линкер: Промежуточное соединение 79
MS (M+H)+: ожидаемая 781.33; наблюдаемая 781.34
Пример 127
2-[(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-ацетамид

Пример 127 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Asn(Trt)-OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 738.7; наблюдаемая 739.2
Пример 128
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-12-(1H-индол-3-илметил)-13-метил-6-фенил-4-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион
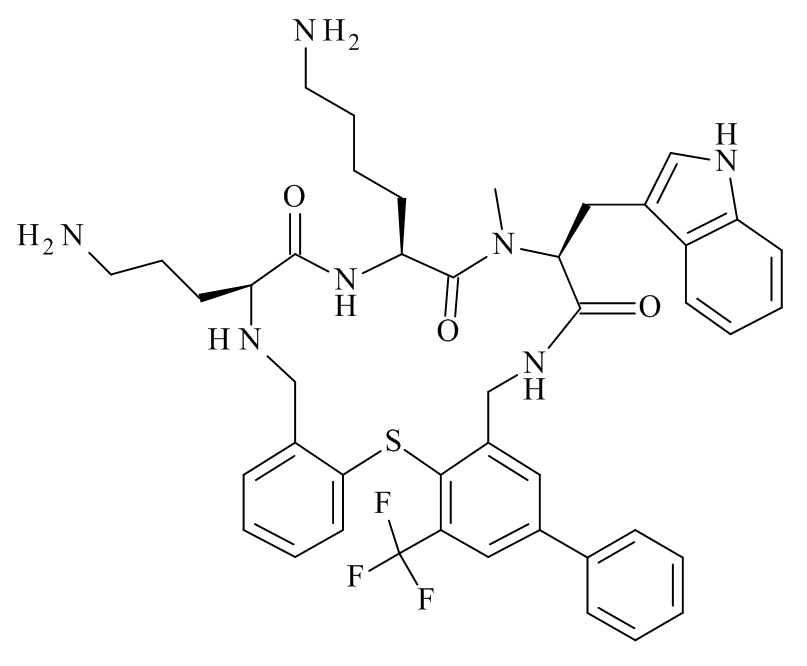
Пример 128 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-NMe-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 80
MS (M+H)+: ожидаемая 814.36; наблюдаемая 814.37
Пример 129
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-фенил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 129 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 81
MS (M+H+): ожидаемая 780.4; наблюдаемая 781.3
Пример 130
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пирролидин-1-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 130 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 134
MS (M+H+): ожидаемая 773.4; наблюдаемая 774.4
Пример 131
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(5-фтор-1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион
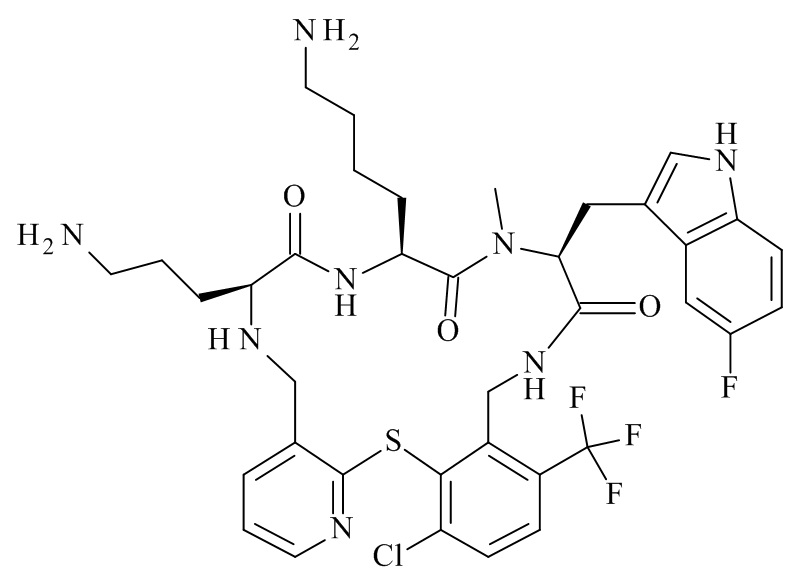
Пример 131 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-NMe-5-F-Trp-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 31
MS (M+H)+: ожидаемая 791.28; наблюдаемая 791.44
Пример 132
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-хинолин-2-илметил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 132 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-NMe-β-(2-хинолил)-Ala-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 31
MS (M+H)+: ожидаемая 785.29; наблюдаемая 785.43
Пример 133
(12S,15S,18S)-15,18-бис-(3-амино-пропил)-4,6-дихлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 133 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Orn(BOC) -OH.
3. Fmoc-L-Orn(BOC) -OH.
Линкер: Промежуточное соединение 47
MS (M+H)+: ожидаемая 724.25; наблюдаемая 724.20
Пример 134
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-23-(2-метокси-пиридин-4-ил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23гексаен-11-ил]-пропионамид

Пример 134 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Gln(Trt)-OH.
Линкер: Промежуточное соединение 67
MS (M+H+): ожидаемая 825.4; наблюдаемая 826.3
Пример 135
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(5-хлор-1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 135 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-NMe-5-Cl-Trp-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 31
MS (M+H)+: ожидаемая 807.25; наблюдаемая 807.39
Пример 136
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(2,3-дигидро-1H-индол-3-илметил)-16-метил-22-трифторметил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-12,15,18-трион

Пример 136 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-NMe-DHT(BOC)-OH (где DHT представляет собой дигидротриптофан),
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 31
MS (M+H)+: ожидаемая 775.30; наблюдаемая 775.42
Пример 137
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-морфолин-4-ил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропионамид
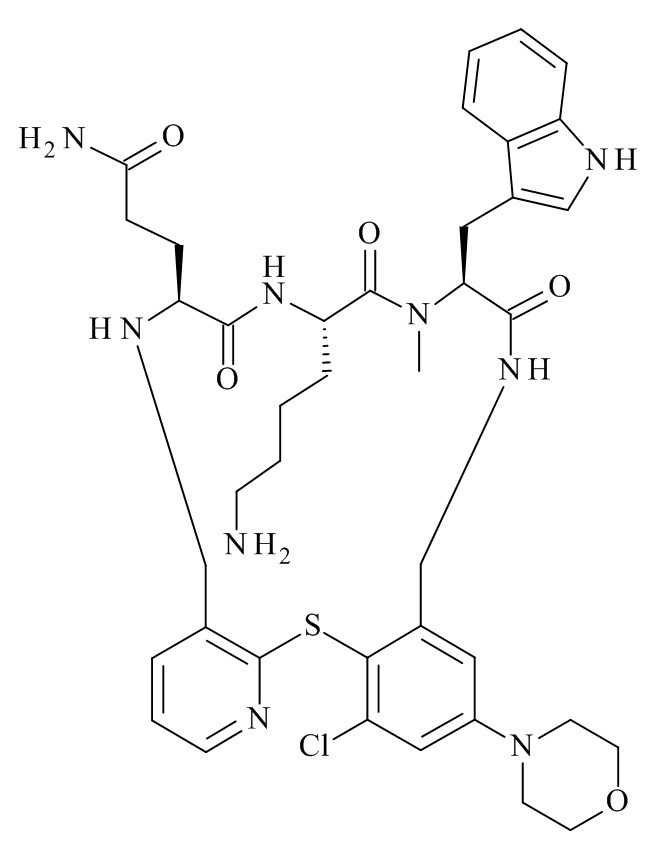
Пример 137 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Gln(Trt)-OH.
Линкер: Промежуточное соединение 62
MS (M+H+): ожидаемая 803.4; наблюдаемая 804.3
Пример 138
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(3,6-дигидро-2H-пиран-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 138 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 83
MS (M+H+): ожидаемая 786.4; наблюдаемая 787.4
Пример 139
{3-[(11S,14S,17S)-14-(4-амино-бутил)-22,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропилкарбаминовой кислоты бензиловый эфир
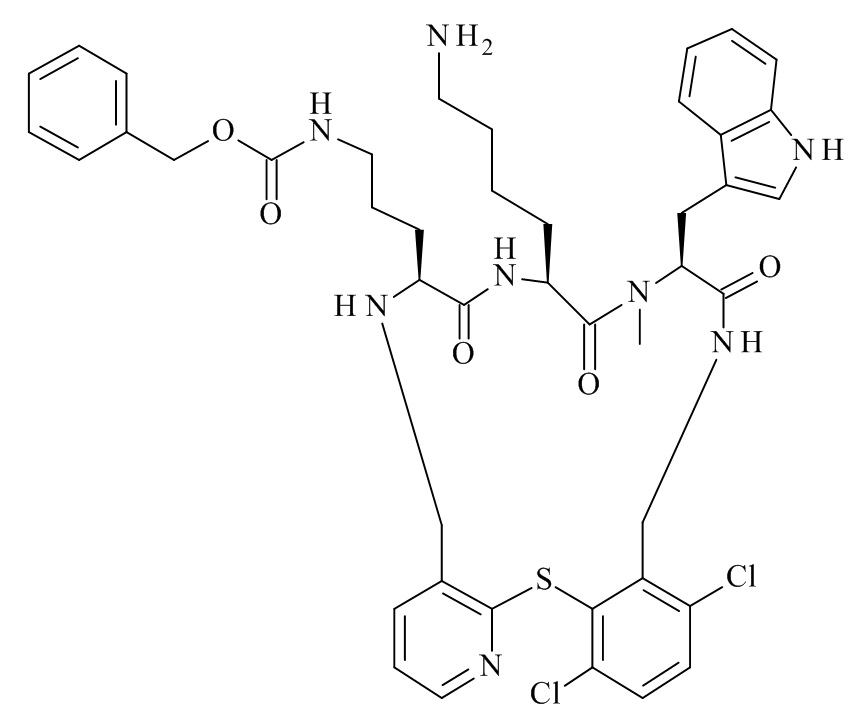
Пример 139 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(CBZ)-OH.
Линкер: Промежуточное соединение 30
MS (M+H+): ожидаемая 872.9; наблюдаемая 873.3
Пример 140
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-6-фенил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион
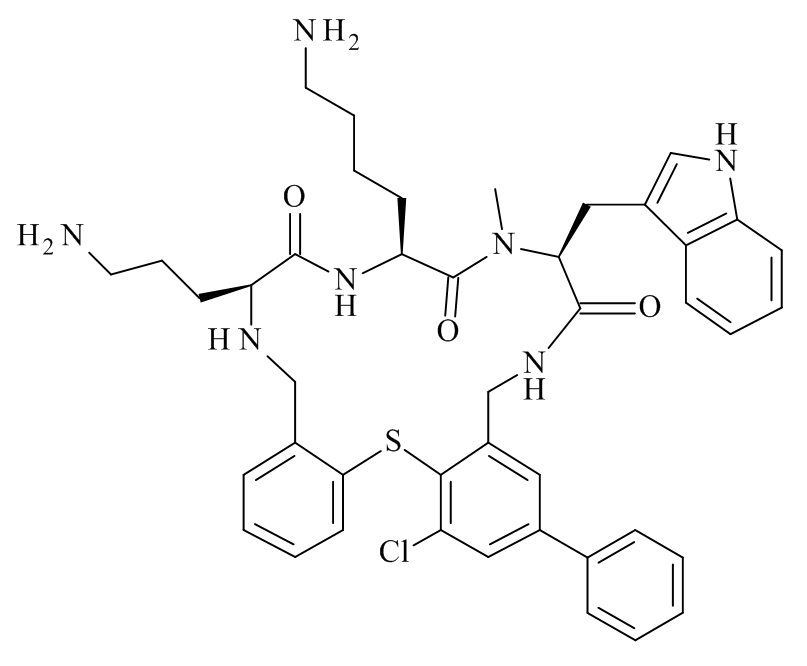
Пример 140 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 135
- Производное Бороновой Кислоты: фенилбороновая кислота
MS (M+H)+: ожидаемая 780.34; наблюдаемая 780.5
Пример 141
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-6-(2-хлор-фенил)-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 141 получили в соответствии с общей методикой для связывания по Сузуки Производных Бороновых Кислот до Пептидных Макроциклических Промежуточных соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 135
- Производное Бороновой Кислоты: (2-хлорфенил)бороновая кислота
MS (M+H)+: ожидаемая 814.30; наблюдаемая 814.5
Пример 142
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-6-пиридин-3-ил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 142 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 135
- Производное Бороновой Кислоты: пиридин-3-илбороновая кислота
MS (M+H)+: ожидаемая 781.33; наблюдаемая 781.6
Пример 143
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-6-пиридин-4-ил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 143 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 135
- Производное Бороновой Кислоты: пиридин-4-илбороновая кислота
MS (M+H)+: ожидаемая 781.33; наблюдаемая 781.5
Пример 144
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-6-(1-метил-1H-пиразол-3-ил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион
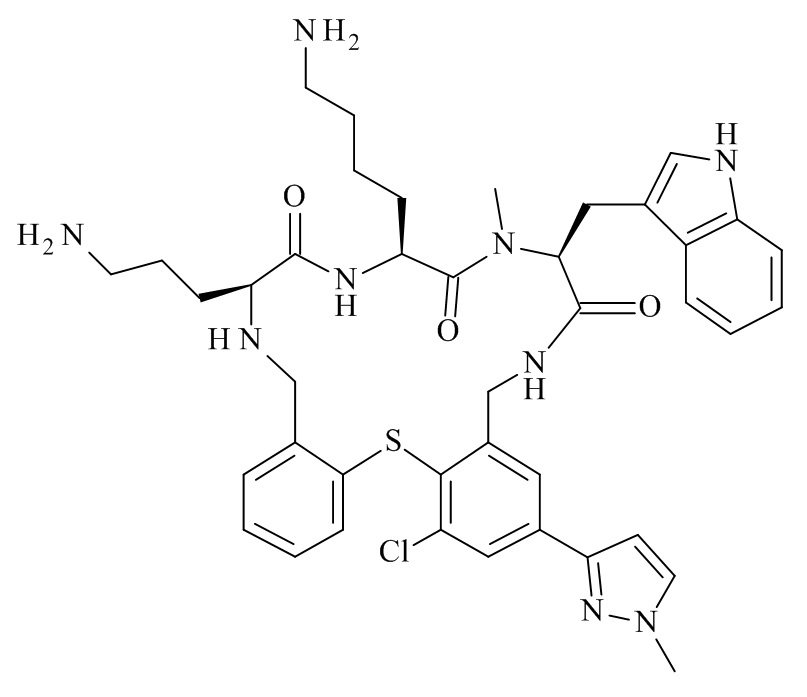
Пример 144 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 135
- Производное Бороновой Кислоты: 1-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол
MS (M+H)+: ожидаемая 783.34; наблюдаемая 784.4
Пример 145
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-(2-метил-пиридин-4-ил)-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропионамид

Пример 145 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Gln(Trt)-OH.
Линкер: Промежуточное соединение 69
MS (M+H+): ожидаемая 809.4; наблюдаемая 810.3
Пример 146
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пиразин-2-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
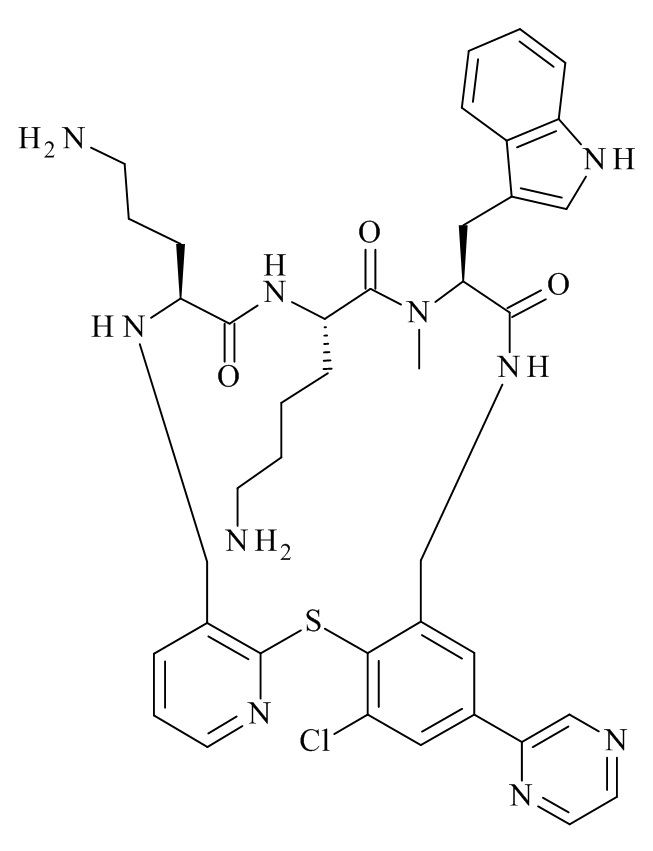
Пример 146 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 84
MS (M+H+): ожидаемая 782.4; наблюдаемая 783.3
Пример 147
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-морфолин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 147 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 85
MS (M+H+): ожидаемая 789.4; наблюдаемая 790.4
Пример 148
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пиридазин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 148 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 86
MS (M+H+): ожидаемая 782.4; наблюдаемая 783.3
Пример 149
11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-фенил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 149 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 87
MS (M+H+): ожидаемая 780.4; наблюдаемая 781.5
Пример 150
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пиридин-2-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15-18-трион

Пример 150 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 88
MS (M+H+): ожидаемая 781.4; наблюдаемая 782.6
Пример 151
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-6-бромо-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 151 получили BOC-депротекцией промежуточного соединения 135.
MS (M+H)+: ожидаемая 782.22; наблюдаемая 782.3
Пример 152
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-1,4-дихлор-9-метил-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 90. Макроциклизация: 1.4 экв. HATU, 10 экв. DIPEA, в ДХМ при КТ в течение ночи. Депротекция: ДХМ/ТФУ 1:1 при 40°C. Соединение, указанное в заголовке, получили в виде голубого порошка (13 мг). MS ESI (m/z): 739.3 [(M+H)+]
Пример 153
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-3-хлор-9-метил-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 91 с сипользованием NMP/MeOH/AcOH 1:1:0.012 в качестве смеси растворителей. Макроциклизация: 2.4 экв. HATU, 10 экв. DIPEA, в ДХМ при КТ в течение ночи. Депротекция: ДХМ/ТФУ 1:1 при 30°C. Соединение, указанное в заголовке, получили в виде серо-белого порошка (6 мг). MS ESI (m/z): 705.3 [(M+H)+]
Пример 154
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-6-(1-метил-1H-имидазол-4-ил)-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 154 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 135
- Производное Бороновой Кислоты: 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-имидазол
MS (M+H)+: ожидаемая 784.34; наблюдаемая 784.4
Пример 155
3-[(11S,14S,17S)-14-(4-амино-бутил)-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-23-фенил-25-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11-ил]-пропионамид

Пример 155 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-NMe-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Gln(TRT)-OH.
Линкер: Промежуточное соединение 80
MS (M+H)+: ожидаемая 828.34; наблюдаемая 828.6
Пример 156
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-20-хлор-12-метил-18-(трифторметил)-6,7,9,10,12,13,15,16-октагидробензо[b]пиридо[3,4-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 92 с сипользованием NMP/MEOH/AcOH 1:1:0.01 в качестве смеси растворителей. Макроциклизация: 2.4 экв. HATU, 10 экв. DIPEA, в ДХМ при КТ 1 ч. Депротекция: ДХМ/ТФУ 1:1 при 30°C. Соединение, указанное в заголовке, получили в виде белого осадка (3 мг). MS ESI (m/z): 773.3 [(M+H)+]
Пример 157
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-20-хлор-12-метил-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:3',4'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 93 с использованием ДМФ/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДХМ при КТ 1 ч. Депротекция: ДХМ/ТФУ 1:1, затем концентрирование под вакуумом, добавление воды и перемешивание в течение ночи. Соединение, указанное в заголовке, получили в виде оранжевого осадка (31 мг). MS ESI (m/z): 706.4 [(M+H)+]
Пример 158
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-1-хлор-9-метил-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[3,4-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1 экв. Промежуточного соединения 94 с использованием NMP/MeOH/AcOH 1:1:0.01 в качестве смеси растворителей. Макроциклизация: 2.4 экв. HATU, 10 экв. DIPEA, в ДХМ при КТ 1 ч. Депротекция: ДХМ/ТФУ 1:1 при 30°C. Соединение, указанное в заголовке, получили в виде желтого осадка (9 мг). MS ESI (m/z): 705.3 [(M+H)+]
Пример 159
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-18-хлор-12-метил-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:4',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 95 с использованием NMP/MeOH/AcOH 1:1:0.01 в качестве смеси растворителей. Макроциклизация: 2.4 экв. HATU, 10 экв. DIPEA, в ДХМ при КТ 1 ч. Депротекция: ДХМ/ТФУ 1:1 при 30°C. Соединение, указанное в заголовке, получили в виде светло-желтого осадка (4 мг). MS ESI (m/z): 706.5 [(M+H)+]
Пример 160
3-[(11S,14S,17S)-14-(3-амино-пропил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропионамид

Пример 160 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Gln(Trt)-OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 738.7; наблюдаемая 739.7
Пример 161
3-[(11S,14S,17S)-11-(3-амино-пропил)-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-23-фенил-25-трифторметил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-14-ил]-пропионамид
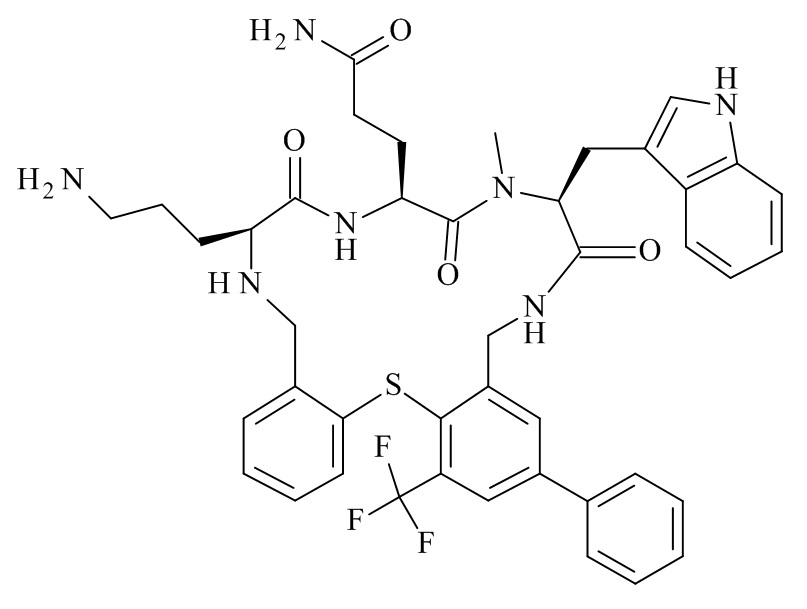
Пример 161получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
Аминокислоты:
1. Fmoc-L-NMe-Trp(BOC)-OH,
2. Fmoc-L-Gln(TRT)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 80
MS (M+H)+: ожидаемая 814.33; наблюдаемая 814.4
Пример 162
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-(2-морфолин-4-ил-пиридин-4-ил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 162 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 96
MS (M+H+): ожидаемая 867.6; наблюдаемая 868.5
Пример 163 (RO7188308-001-001)
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-23-пиридин-2-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил] -пропионамид

Пример 163 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Gln(Trt)-OH.
Линкер: Промежуточное соединение 88
MS (M+H+): ожидаемая 795.4; наблюдаемая 796.6
Пример 164
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(2-хлор-пиридин-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион

Пример 164 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 97
MS (M+H+): ожидаемая 815.8; наблюдаемая 816.6
Пример 165
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(6-гидрокси-пиридин-3-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23- гексаен-12,15,18-трион
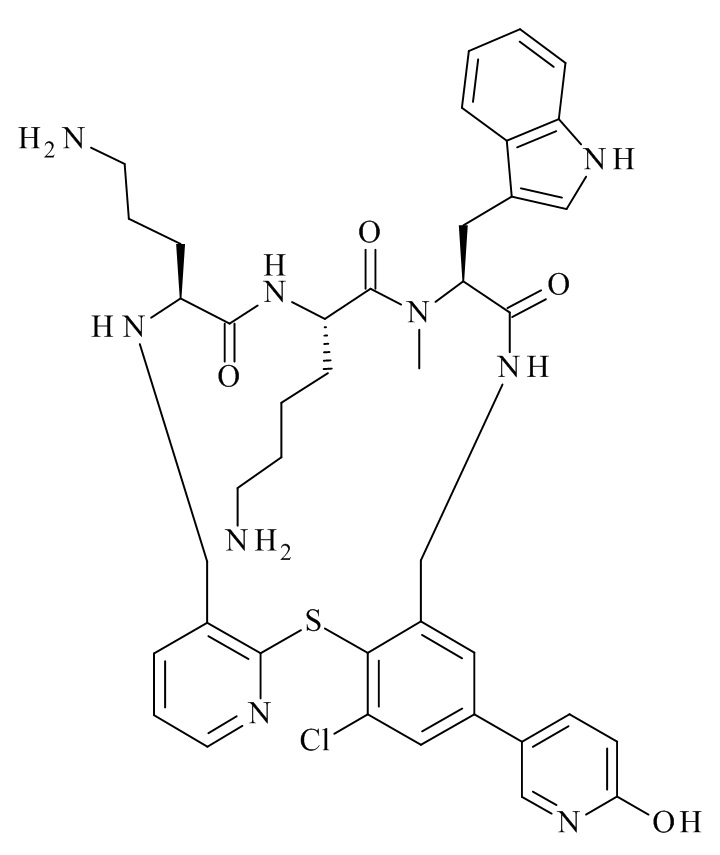
Пример 165 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 98
MS (M+H+): ожидаемая 797.4; наблюдаемая 798.3
Пример 166
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(6-диметиламино-пиридин-3-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 166 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 99
MS (M+H+): ожидаемая 824.5; наблюдаемая 825.5
Пример 167
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-12-метил-18-(2-метилпиридин-4-ил)-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:4',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 95 с использованием NMP/MeOH/AcOH 1:1:0.01 в качестве смеси растворителей. Макроциклизация: 2.4 экв. HATU, 10 экв. DIPEA, в ДХМ при КТ 1 ч. Сузуки по аналогии с примером 189 с использованием (2-метилпиридин-4-ил)бороновой кислоты. Депротекция: ДХМ/ТФУ 1:1, концентрирование под вакуумом, затем перемешивание в ацетонитриле/воде. Соединение, указанное в заголовке, получили в виде коричневого осадка (12 мг). MS ESI (m/z): 763.5 [(M+H)+]
Пример 168
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-5-бромо-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 168 получили BOC-депротекцией промежуточного соединения 136.
MS (M+H)+: ожидаемая 782.22; наблюдаемая 782.5
Пример 169
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-23-(3,5-диметил-изоксазол-4-ил)-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропионамид

Пример 169 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Gln(Trt)-OH.
Линкер: Промежуточное соединение 101
MS (M+H+): ожидаемая 813.4; наблюдаемая 814.3
Пример 170
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-23-(2-метил-пиридин-4-ил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
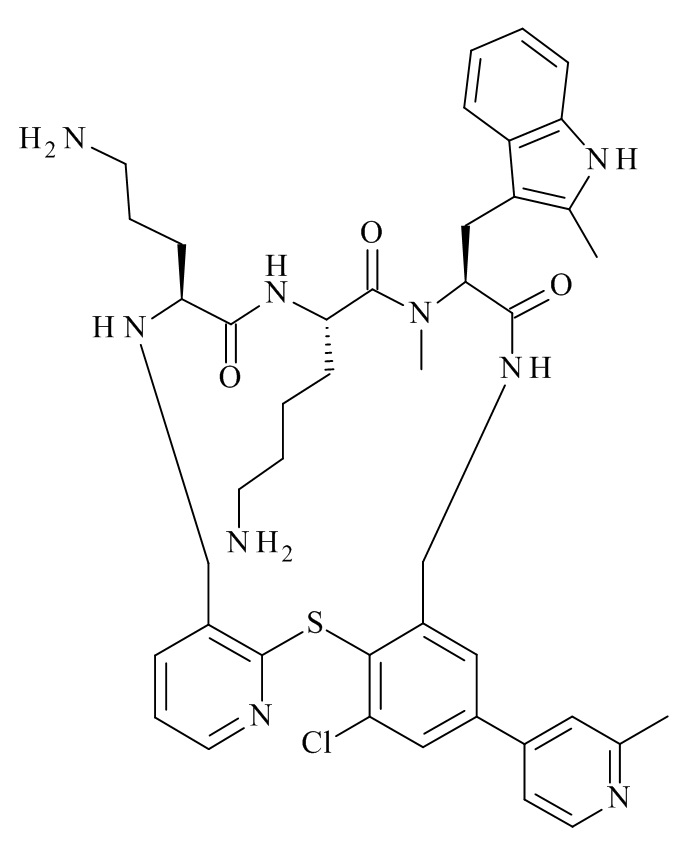
Пример 170 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-(2-метил-1H-индол-3-ил)-пропионовая кислота
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 69
MS (M+H+): ожидаемая 809.5; наблюдаемая 810.4
Пример 171
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(2-метокси-пиридин-4-ил)-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 171 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-(2-метил-1H-индол-3-ил)-пропионовая кислота,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 67
MS (M+H+): ожидаемая 825.4; наблюдаемая 826.4
Пример 172
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-23-(4-метансульфонил-фенил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 172 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 102
MS (M+H+): ожидаемая 858.5; наблюдаемая 859.3
Пример 173
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-23-(5-метансульфонил-пиридин-3-ил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
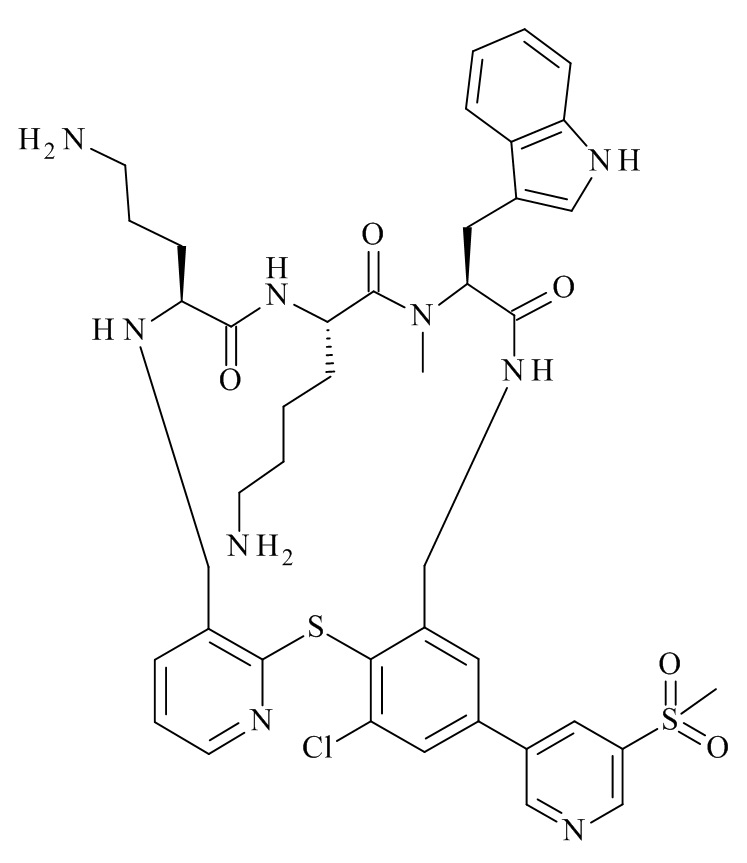
Пример 173 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 103
MS (M+H+): ожидаемая 859.5; наблюдаемая 860.3
Пример 174
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-(3-амино-пирролидин-1-ил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
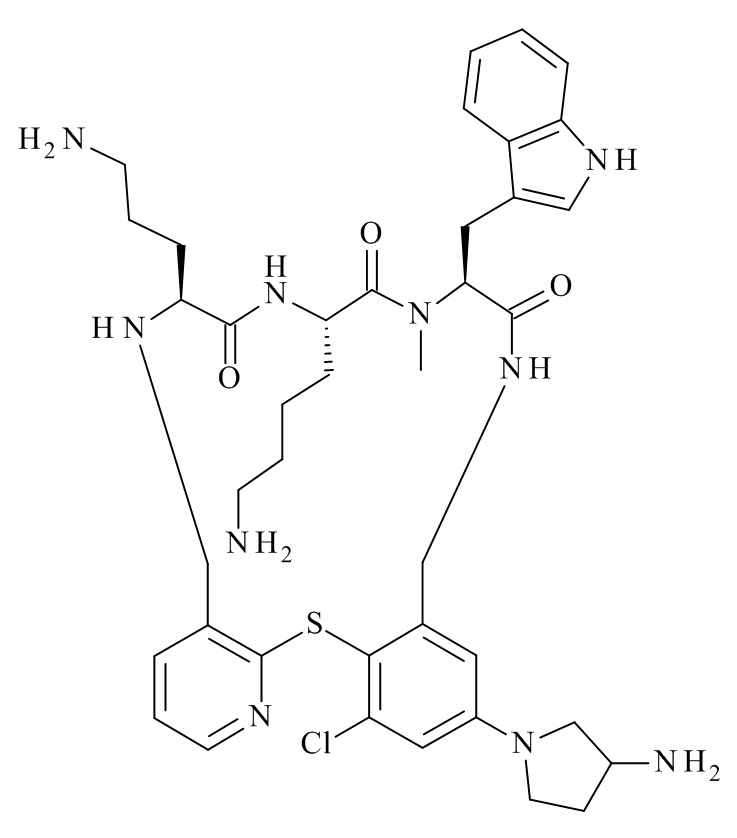
Пример 174 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 82
MS (M+H+): ожидаемая 788.4; наблюдаемая 789.4
Пример 175
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(3,5-диметил-1H-пиразол-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 175 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 104
MS (M+H+): ожидаемая 798.4; наблюдаемая 799.4
Пример 176
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-5-фенил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион
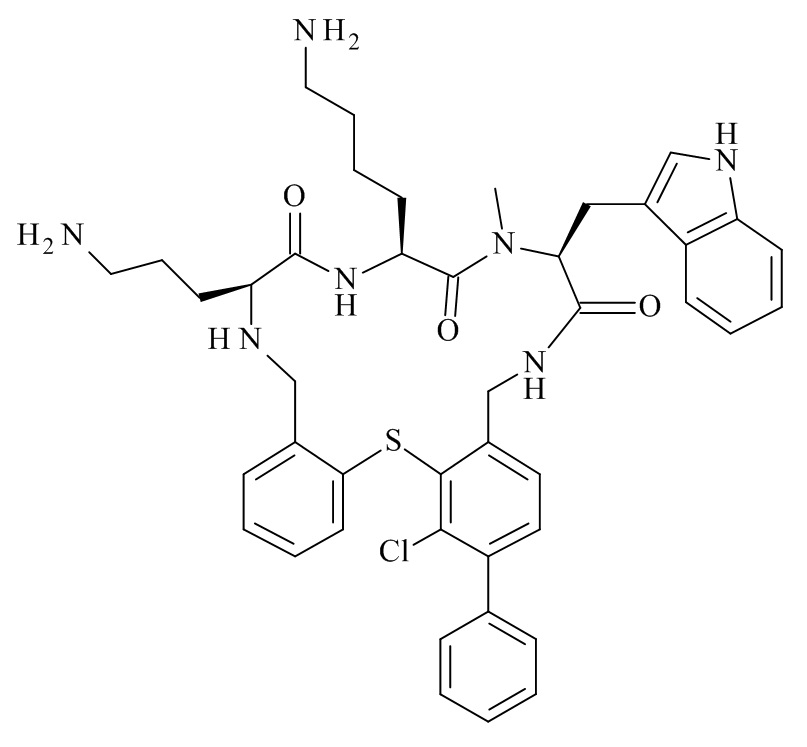
Пример 176 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 136
- Производное Бороновой Кислоты: фенилбороновая кислота
MS (M+H)+: ожидаемая 780.34; наблюдаемая 780.5
Пример 177
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(2-фтор-пиридин-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 177 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC) -OH.
Линкер:Промежуточное соединение 105
MS (M+H+): ожидаемая 799.4; наблюдаемая 800.6
Пример 178
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-12-метил-18-(6-метилпиридин-3-ил)-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:4',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион
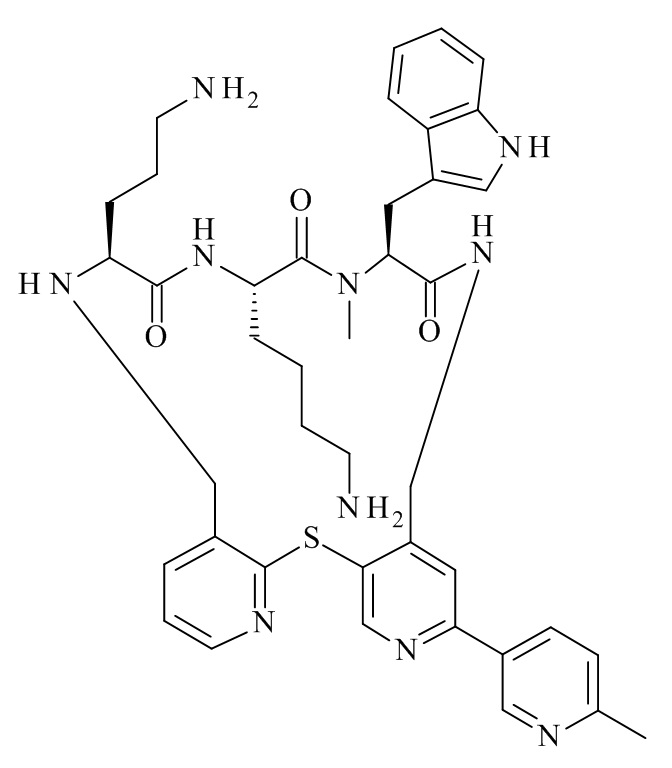
Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 95 с использованием NMP/MeOH/AcOH 1:1:0.012 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДХМ при КТ 1 ч. Сузуки по аналогии с примером 189 с использованием (6-метилпиридин-3-ил)бороновой кислоты. Депротекция: ДХМ/ТФУ 1:1, сконцентрировали под вакуумом, затем перемешивание в ацетонитриле/воде. Соединение, указанное в заголовке, получили в виде оранжеого осадка (9 мг). MS ESI (m/z): 763.6 [(M+H)+]
Пример 179
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-3-хлор-9-метил-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[3,2-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион
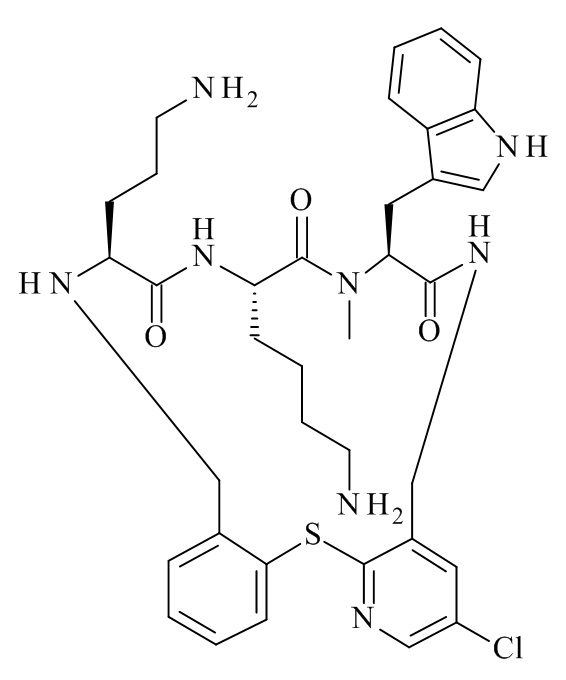
Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 106 в NMP/MeOH/AcOH 1:1:0.012 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДХМ при КТ 1 ч. Депротекция: ДХМ/ТФУ 1:1, затем концентрирование под вакуумом и перемешивание с ацнетонитрилом/водой 1:1. Соединение, указанное в заголовке, получилив виде светло-желтой пены (46 мг). MS ESI (m/z): 705.5 [(M+H)+]
Пример 180
[(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-илметил]-мочевина

Пример 180 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-уреидо-пропионовая кислота.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 753.7; наблюдаемая 754.2
Пример 181
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-23-пиридин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
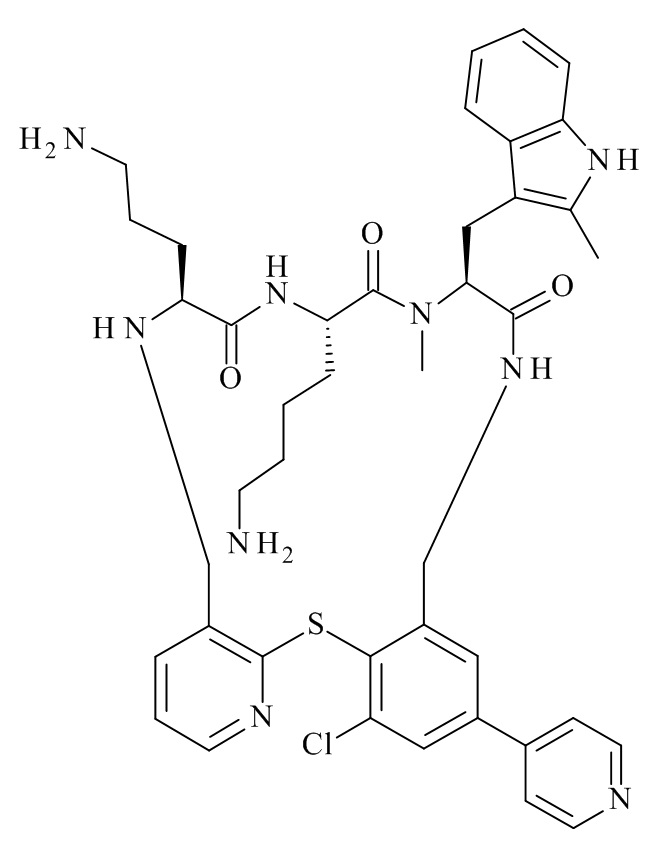
Пример 181 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-(2-метил-1H-индол-3-ил)-пропионовая кислота,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 66
MS (M+H+): ожидаемая 795.4; наблюдаемая 796.4
Пример 182
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(2-хлор-пиридин-4-ил)-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 182 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-(2-метил-1H-индол-3-ил)-пропионовая кислота,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 97
MS (M+H+): ожидаемая 829.9; наблюдаемая 830.3
Пример 183
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(2-фтор-пиридин-4-ил)-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4, 6,21,23-гексаен-12,15,18-трион

Пример 183 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-(2-метил-1H-индол-3-ил)-пропионовая кислота,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 105
MS (M+H+): ожидаемая 813.4; наблюдаемая 814.4
Пример 184
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-23-фенил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропионамид

Пример 184 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Gln(Trt)-OH.
Линкер: Промежуточное соединение 87
MS (M+H+): ожидаемая 794.4; наблюдаемая 795.6
Пример 185
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-23-карбонитрил

Пример 185 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 107
MS (M+H+): ожидаемая 729.3; наблюдаемая 730.4
Пример 186
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(3,5-диметил-изоксазол-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 186 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 101
MS (M+H+): ожидаемая 799.4; наблюдаемая 800.3
Пример 187
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-(2-окса-5-аза-бицикло[2.2.1]гепт-5-ил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
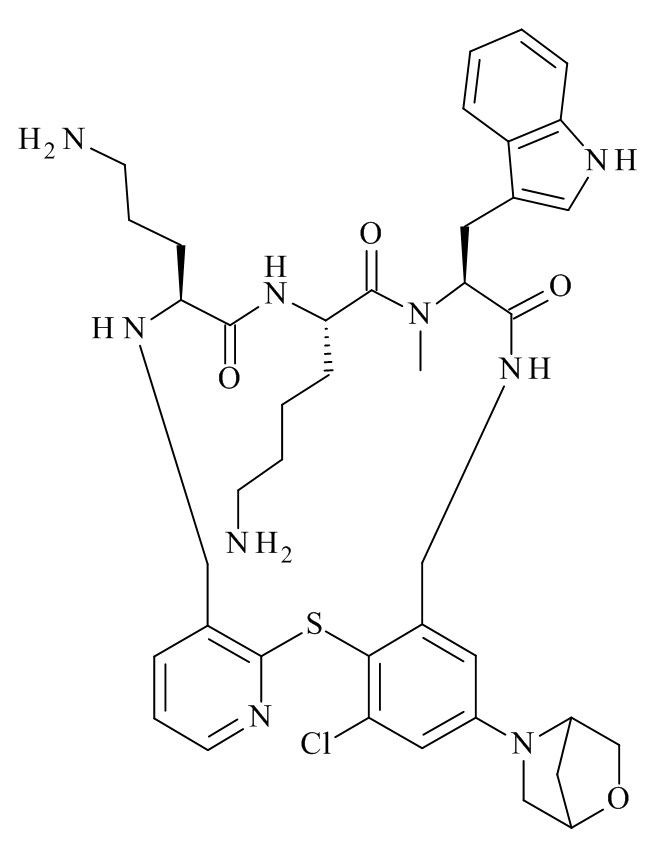
Пример 187 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 108
MS (M+H+): ожидаемая 801.4; наблюдаемая 802.4
Пример 188
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-(3-бензилокси-проп-1-инил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 188 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 109
MS (M+H+): ожидаемая 848.5; наблюдаемая 849.4
Пример 189
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-4-хлор-9-метил-1-фенил-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион
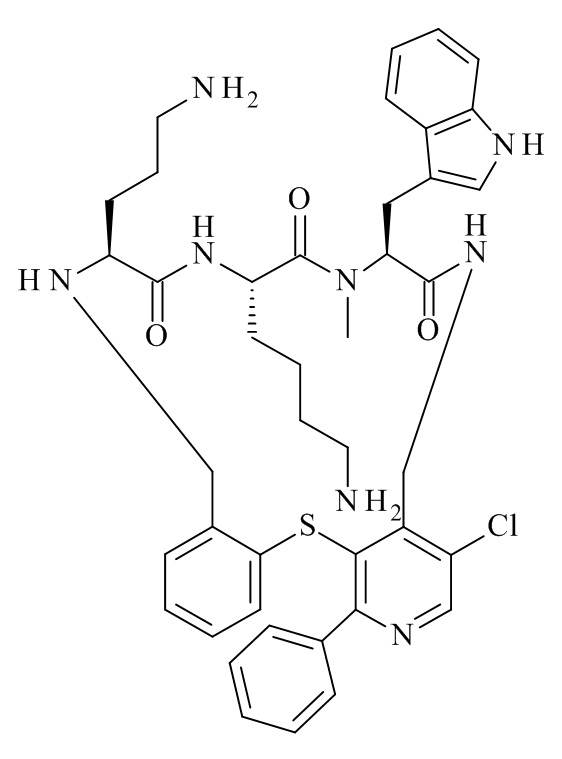
Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 90 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДМФ при КТ 2 ч.
В пробирке для работы под давлением в раствор трет-бутил 3-(((8S,11S,14S)-11-(4-((трет-бутоксикарбонил)амино)бутил)-14-(3-((трет-бутоксикарбонил)амино)пропил)-1,4-дихлор-9-метил-7,10,13-триоксо-5,6,7,8,9,10,11,12,13,14,15,16-додекагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-8-ил)метил)-1H-индол-1-карбоксилата (0.025 г, 24 мкмоль, Экв: 1) и фенилбороновой кислоты пинаколового эфира (6.38 мг, 31.2 мкмоль, Экв: 1.3) в диоксане (192 мкл) добавили 2M водный карбонат натрия (48.1 мкл). Смесь продули аргоном в течение 2 мин, при этом обрабатывали ультразвуком пробирку в УЗ ванне. Затем Pd(Ph3P)4 (5.56 мг, 4.81 мкмоль, Экв: 0.2) добавили, продувку продолжили в течение 1 минуты, пробирку закрыли и реакционную смесь нагревали до 80°C в течение 1.5 часов, затем до 100°C в течение ночи. Реакционную смесь разбавили этилацетатом, 1M водным раствором Na2CO3 и солевым раствором. Смесь экстрагировали этилацетатом и органические слои промыли солевым раствором. Объединенные органические слои высушили над сульфатом натрия, отфильтровали и сконцентрировали под вакуумом. Полученный материал сразу использовали без дополнительной очистки на стадии депротекции.
Депротекция: ДХМ/ТФУ 2:1, затем концентрирование под вакуумом при комнатной температуре и перемешивание в ацетонитриле/воде 1:1. Полученный раствор сразу очистили препаративной обратно-фазовой ВЭЖХ (Колонка: Phenomenex Gemini-NX 5u 110A, l: 100 мм, диаметр: 30 мм) с использованием воды, содержащей 0.1% ТФУ / ацетонитрил в качестве элюента. Соединение, указанное в заголовке, получили в виде светло-коричневого порошка (17 мг). MS ESI (m/z): 781.4 [(M+H)+]
Пример 190
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-пиридин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион

Пример 190 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 110
MS (M+H+): ожидаемая 781.4; наблюдаемая 782.5
Пример 191
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-пиридин-3-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 191 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 111
MS (M+H+): ожидаемая 781.4; наблюдаемая 781.3
Пример 192
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-9-метил-2-морфолино-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[3,2-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион
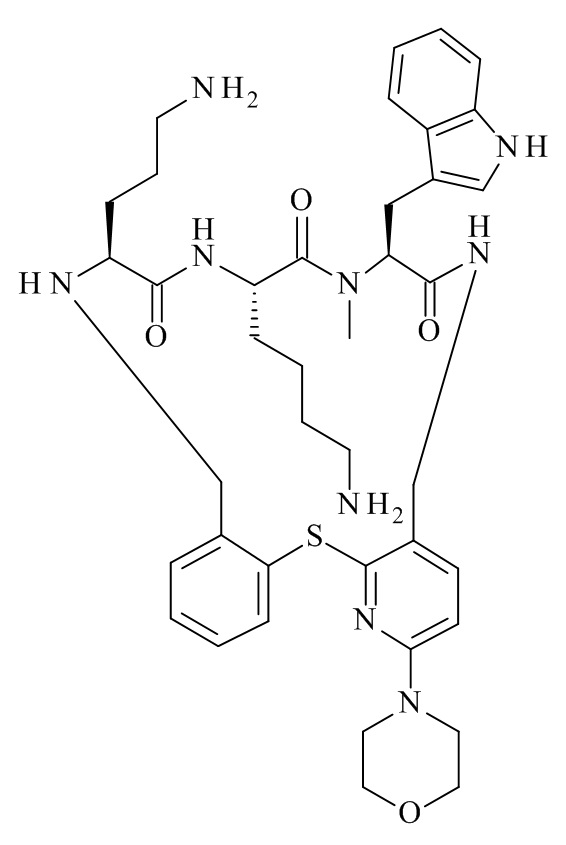
Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 0.9 экв. Промежуточного соединения 112 в NMP/MeOH/AcOH 1:1:0.012 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДХМ при КТ 1 ч. Депротекция: ДХМ/ТФУ 1:1. Соединение, указанное в заголовке, получили в виде белого порошка (16 мг). MS ESI (m/z): 756.6 [(M+H)+]
Пример 193
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-9-метил-4-морфолино-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[3,4-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион
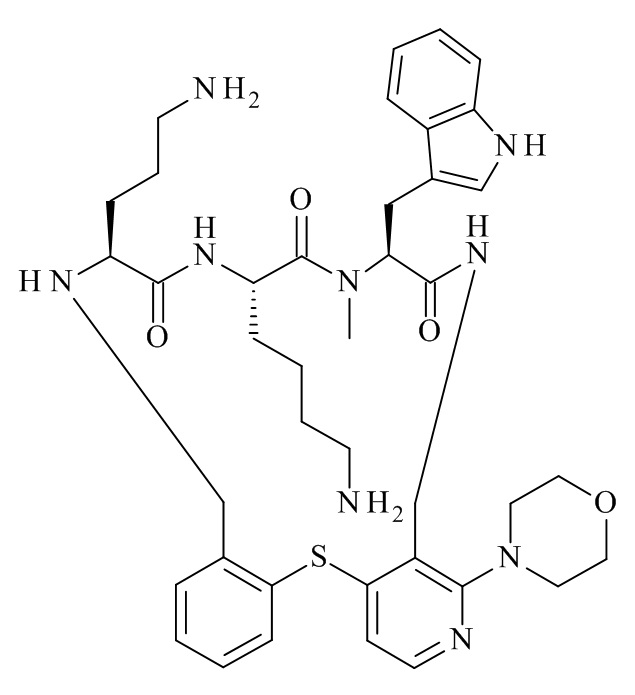
Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.3 экв. Промежуточного соединения 113 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 5 экв. DIPEA, в ДМФ при КТ 3 ч. Депротекция: ДХМ/ТФУ 2:1, концентрирование под вакуумом, затем перемешивание в воде. Соединение, указанное в заголовке, получили в виде коричневой пены (87 мг). MS ESI (m/z): 756.5 [(M+H)+]
Пример 194
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-4-хлор-9-метил-1-(пиридин-3-ил)-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион
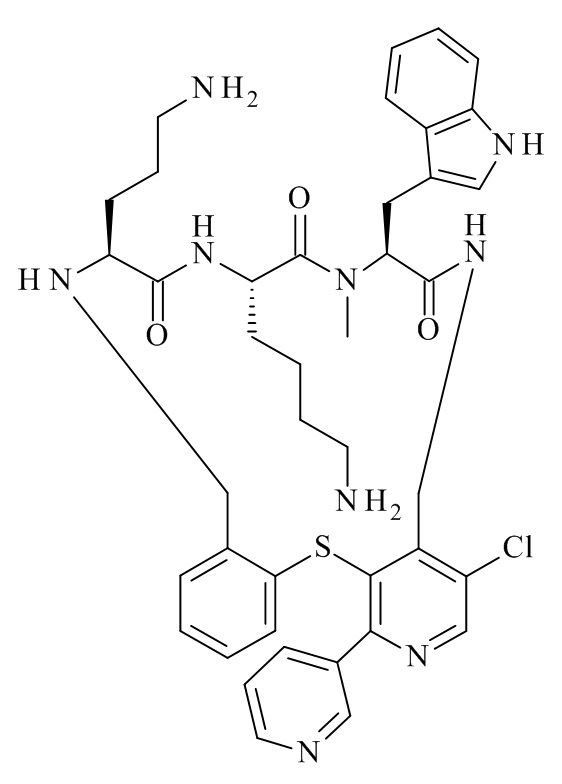
Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.3 экв. Промежуточного соединения 90 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДМФ при КТ 2 ч. Сузуки по аналогии с примером 189 с использованием 3-пиридинкарбоново кислоты пинаколового эфира. Депротекция: ДХМ/ТФУ 2:1, концентрирование под вакуумом, перемешивание с водой. Соединение, указанное в заголовке, получили в виде белой пены (29 мг). MS ESI (m/z): 782.6 [(M+H)+]
Пример 195
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-4-хлор-9-метил-1-(пиридин-4-ил)-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.3 экв. Промежуточного соединения 90 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДМФ при КТ 2 ч. Сузуки по аналогии с примером 189 с использованием 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина. Депротекция: ДХМ/ТФУ 2:1, концентрирование под вакуумом, перемешивание в воде . Соединение, указанное в заголовке, получили в виде белой пены (23 мг). MS ESI (m/z): 782.5 [(M+H)+]
Пример 196
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-4-хлор-1-(2-метоксипиридин-4-ил)-9-метил-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.3 экв. Промежуточного соединения 90 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДМФ при КТ 2 ч. Сузуки по аналогии с примером 189 с использованием 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина. Депротекция: ДХМ/ТФУ 2:1, концентрирование под вакуумом, перемешивание в воде . Соединение, указанное в заголовке, получили в виде белой пены (33 мг). MS ESI (m/z): 812.3 [(M+H)+]
Пример 197
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-18-бромо-12-метил-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:2',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 114 с использованием NMP/MeOH/AcOH 1:1:0.012 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДХМ при КТ 1 ч. Депротекция: ДХМ/ТФУ 2:1, концентрирование под вакуумом, перемешивание в воде . Соединение, указанное в заголовке, получили в виде белого порошка (11 мг). MS ESI (m/z): 752.3 [(M+H)+]
Пример 198
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-4-хлор-9-метил-1-(2-(трифторметил)пиридин-4-ил)-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.3 экв. Промежуточного соединения 90 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДМФ при КТ 2 ч. Сузуки по аналогии с примером 189 с использованием 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2-(трифторметил)пиридина. Депротекция: ДХМ/ТФУ 2:1, концентрирование под вакуумом, перемешивание в воде. Соединение, указанное в заголовке, получили в виде белой пены (25 мг). MS ESI (m/z): 850.6 [(M+H)+]
Пример 199
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(5-метансульфонил-пиридин-3-ил)-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 199 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-(2-метил-1H-индол-3-ил)-пропионовая кислота,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 103
MS (M+H+): ожидаемая 873.5; наблюдаемая 874.5
Пример 200
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-22-пиридин-3-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 200 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-(2-метил-1H-индол-3-ил)-пропионовая кислота,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)OH.
Линкер: Промежуточное соединение 111
MS (M+H+): ожидаемая 795.4; наблюдаемая 796.4
Пример 201
(8S,11S,14S)-8-((1H-индол-3-ил)метил)-11-(4-аминобутил)-14-(3-аминопропил)-4-хлор-9-метил-1-морфолино-5,6,8,9,11,12,15,16-октагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-7,10,13(14H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.3 экв. Промежуточного соединения 90 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДМФ при КТ 2 ч.
В пробирке для работы под давлением морфолин (8.38 мг, 8.38 мкл, 96.1 мкмоль, Экв: 10) добавили в трет-бутил 3-(((8S,11S,14S)-11-(4-((трет-бутоксикарбонил)амино)бутил)-14-(3-((трет-бутоксикарбонил)амино)пропил)-1,4-дихлор-9-метил-7,10,13-триоксо-5,6,7,8,9,10,11,12,13,14,15,16-додекагидробензо[b]пиридо[4,3-p][1,5,8,11,14]тиатетраазациклогептадецин-8-ил)метил)-1H-индол-1-карбоксилат (0.01 г, 9.61 мкмоль, Экв: 1) и фторид цезия (2.92 мг, 19.2 мкмоль, Экв: 2), пробирку продули аргоном, закрыли и нагревали до 100°C в течение ночи. Реакционную смесь растворили в ацетонитриле, обработали водой и смесь лиофилизировали. Полученный материал использовали без дополнительной очистки
Депротекция: ДХМ/ТФУ 2:1, концентрирование под вакуумом, перемешивание в воде . Соединение, указанное в заголовке, получили в виде светло-коричневой пены (10 мг). MS ESI (m/z): 790.4 [(M+H)+]
Пример 202
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-22-пиридин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 202 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-(2-метил-1H-индол-3-ил)-пропионовая кислота,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 110
MS (M+H+): ожидаемая 795.4; наблюдаемая 796.4
Пример 203
(7S,10S,13S)-10-(4-аминобутил)-7-(3-аминопропил)-20-хлор-6,7,9,10,12,13,15,16-октагидро-12-метил-13-[(2-метил-1H-индол-3-ил)метил]-18-[2-(4-метил-1-пиперазинил)-4-пиридинил]пиридо[2,3-b][1,5,8,11,14]бензотиатетраазациклогептадецин-8,11,14(5H)-трион

Пример 203 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-(2-метил-1H-индол-3-ил)-пропионовая кислота,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 75
MS (M+H+): ожидаемая 894.5; наблюдаемая 894.4
Пример 204 (RO7192360-001-001)
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-12-метил-18-морфолино-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:4',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 95 в NMP/MeOH/AcOH 1:1:0.012 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДХМ при КТ 1 ч.
Суспензию трет-бутил 3-(((7S,10S,13S)-10-(4-((трет-бутоксикарбонил)амино)бутил)-7-(3-((трет-бутоксикарбонил)амино)пропил)-18-хлор-12-метил-8,11,14-триоксо-5,6,7,8,9,10,11,12,13,14,15,16-додекагидродипиридо[2,3-b:4',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-13-ил)метил)-1H-индол-1-карбоксилата (25 мг, 24.8 мкмоль, Экв: 1) в морфолине (82.8 мкл) в пробирке для работы под давлением нагрели до 100°C и перемешивали в течение 2 ч. Реакционную смесь разбавили ацетонитрилом /водой и лиофилизировали. Трет-бутил 3-(((7S,10S,13S)-10-(4-((трет-бутоксикарбонил)амино)бутил)-7-(3-((трет-бутоксикарбонил)амино)пропил)-12-метил-18-морфолино-8,11,14-триоксо-5,6,7,8,9,10,11,12,13,14,15,16-додекагидродипиридо[2,3-b:4',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-13-ил)метил)-1H-индол-1-карбоксилат получили в виде белого порошка и использовали без очистки.
Депротекция: ДХМ/ТФУ 1:1, концентрирование под вакуумом, затем перемешивание with water. Соединение, указанное в заголовке, получили в виде белого порошка (3 мг). MS ESI (m/z): 757.6 [(M+H)+]
Пример 205
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-18-(2-метоксипиридин-4-ил)-12-метил-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:4',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного Соединения 95 в NMP/MeOH/AcOH 1:1:0.012 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДХМ при КТ 1 ч. Сузуки по аналогии с примером 189 с использованием 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина. Депротекция: ДХМ/ТФУ 1:1, концентрирование под вакуумом, перемешивание с водой. Соединение, указанное в заголовке, получили в виде белого порошка (3 мг). MS ESI (m/z): 779.5 [(M+H)+]
Пример 206
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-23-бромо-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион
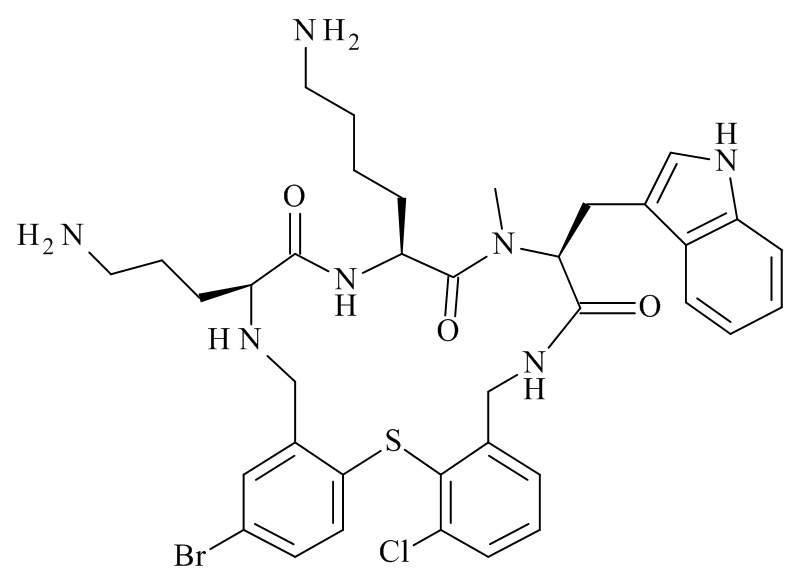
Пример 206 получили BOC-депротекцией промежуточного соединения 137.
MS (M+H)+: ожидаемая 782.22; наблюдаемая 782.2
Пример 207
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-23-фенил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 207 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 137
- Производное Бороновой Кислоты: фенилбороновая кислота
MS (M+H)+: ожидаемая 780.34; наблюдаемая 780.5
Пример 208
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-23-пиридин-3-ил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион
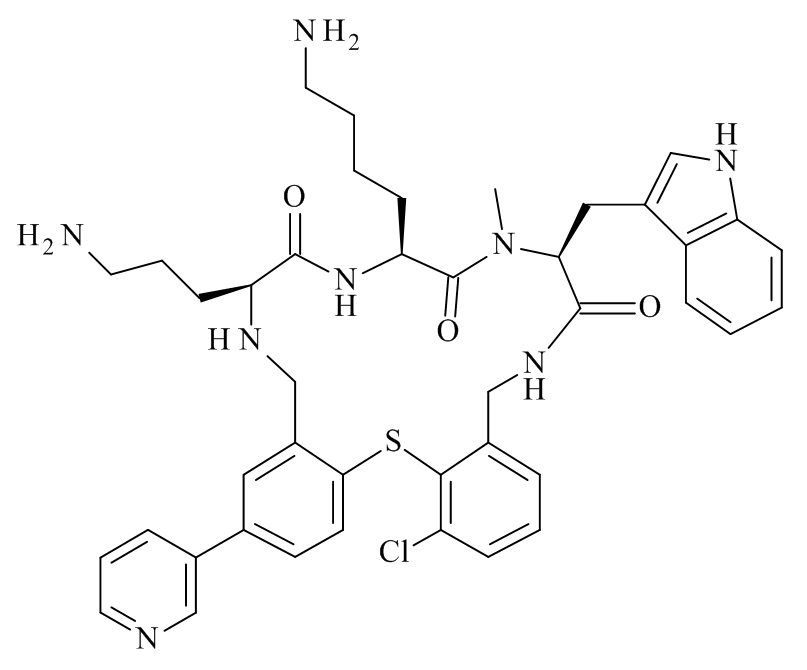
Пример 208 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 137
- Производное Бороновой Кислоты: пиридин-3-илбороновая кислота
MS (M+H)+: ожидаемая 781.33; наблюдаемая 781.3
Пример 209
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(2,6-дифтор-пиридин-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3(8),4,6,22,24-гексаен-12,15,18-трион

Пример 209 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 139
- Производное Бороновой Кислоты: (2,6-дифторпиридин-4-ил)бороновая кислота
MS (M+H+): ожидаемая 817.3; наблюдаемая 818.3
Пример 210
3-[(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-N-метил-пропионамид

Пример 210 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-4-метилкарбамоил-бутановая кислота
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 766.8; наблюдаемая 767.3
Пример 211
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-23-ил]-бензонитрил
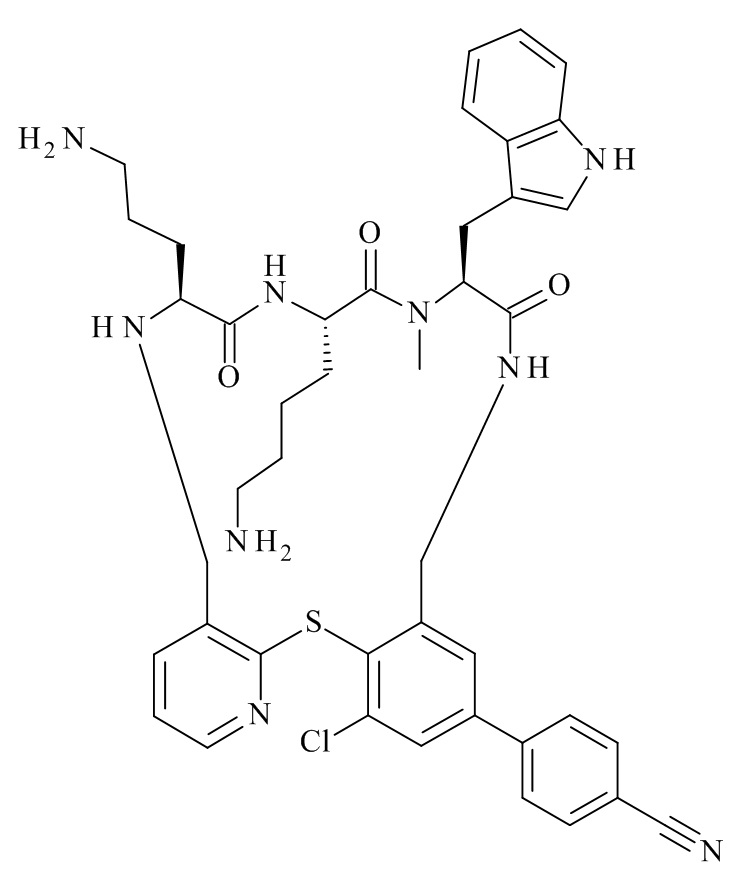
Пример 211 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 116
MS (M+H+): ожидаемая 805.4; наблюдаемая 806.3
Пример 212
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-(2-метил-пиридин-4-ил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 212 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 117
MS (M+H+): ожидаемая 795.4; наблюдаемая 796.4
Пример 213
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-пиримидин-4-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион

Пример 213 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 118
MS (M+H+): ожидаемая 782.4; наблюдаемая 783.4
Пример 214
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-23-ил]-бензолсульфонамид
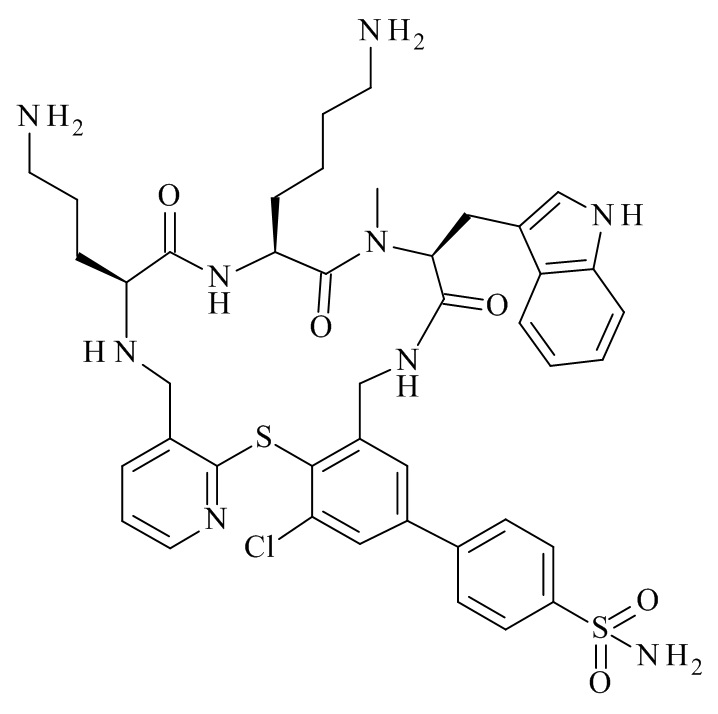
Пример 214 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 119
MS (M+H+): ожидаемая 859.5; наблюдаемая 860.7
Пример 215
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-12-метил-18-(2-метилпиридин-4-ил)-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:2',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 114 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДХМ при КТ 1 ч. Сузуки по аналогии с примером 189 с использованием 2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина. Депротекция: ДХМ/ТФУ 1:1, концентрирование под вакуумом, перемешивание в воде . Соединение, указанное в заголовке, получили в виде желтого осадка (50 мг). MS ESI (m/z): 763.4 [(M+H)+]
Пример 216
(12S,15S,18S)-15-(4-амино-бутил)-23-(4-аминометил-фенил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 216 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 137
- Производное Бороновой Кислоты: (4-(((трет-бутоксикарбонил)амино)метил)фенил)бороновая кислота
MS (M+H)+: ожидаемая 809.36; наблюдаемая 809.7
Пример 217
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-18-(2-метоксипиридин-4-ил)-12-метил-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:2',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 114 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДХМ при КТ 1 ч. Сузуки по аналогии с примером 189 с использованием 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина. Депротекция: ДХМ/ТФУ 1:1, концентрирование под вакуумом, перемешивание в воде . Соединение, указанное в заголовке, получили в виде желтого порошка (40 мг). MS ESI (m/z): 779.6 [(M+H)+]
Пример 218
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-12-метил-18-морфолино-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:2',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 114 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДХМ при КТ 1 ч.
Суспензию трет-бутил 3-(((7S,10S,13S)-18-бромо-10-(4-((трет-бутоксикарбонил)амино)бутил)-7-(3-((трет-бутоксикарбонил)амино)пропил)-12-метил-8,11,14-триоксо-5,6,7,8,9,10,11,12,13,14,15,16-додекагидродипиридо[2,3-b:2',3'-p][1,5,8,11,14]тиатетраазациклогептадецин-13-ил)метил)-1H-индол-1-карбоксилата (30 мг, 28.5 мкмоль, Экв: 1) в морфолине (143 мкл) в закрытой пробирке нагрели до 70°C в течение ночи. Реакционную смесь сконцентрировали под вакуумом и использовали без дополнительной очистки.
Депротекция: ДХМ/ТФУ 1:1, концентрирование под вакуумом, перемешивание в воде. Соединение, указанное в заголовке, получили в виде оранжевого порошка (14 мг). MS ESI (m/z): 757.5 [(M+H)+]
Пример 219
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-24-бромо-4-хлор-12-(1H-индол-3-илметил)-13-метил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 219 получили BOC-депротекцией промежуточного соединения 138.
MS (M+H)+: ожидаемая 782.22; наблюдаемая 782.3
Пример 220
(12S,15S,18S)-15-(4-амино-бутил)-18-(3-амино-пропил)-4-хлор-12-(1H-индол-3-илметил)-13-метил-24-фенил-2-тиа-10,13,16,19-тетрааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3,5,7,21,23-гексаен-11,14,17-трион

Пример 220 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 138
- Производное Бороновой Кислоты: фенилбороновая кислота
MS (M+H)+: ожидаемая 780.34; наблюдаемая 780.5
Пример 221
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-22-пиридин-3-ил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-11-ил]-пропионамид

Пример 221 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Gln(Trt)-OH.
Линкер: Промежуточное соединение 111
MS (M+H+): ожидаемая 795.4; наблюдаемая 796.4
Пример 222
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-22-(2-фтор-пиридин-4-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23гексаен-12,15,18-трион
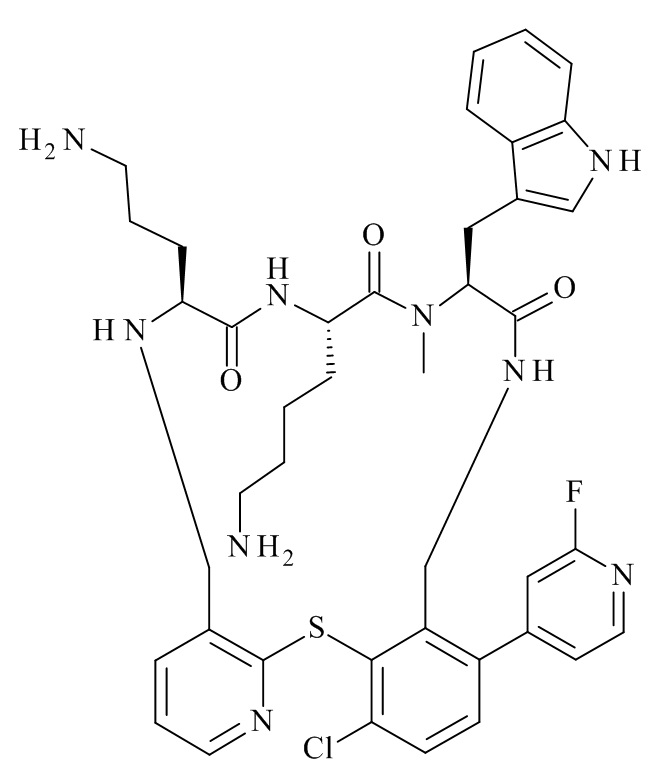
Пример 222 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 121
MS (M+H+): ожидаемая 799.4; наблюдаемая 800.3
Пример 223
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-23-(2-амино-пиридин-4-ил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион
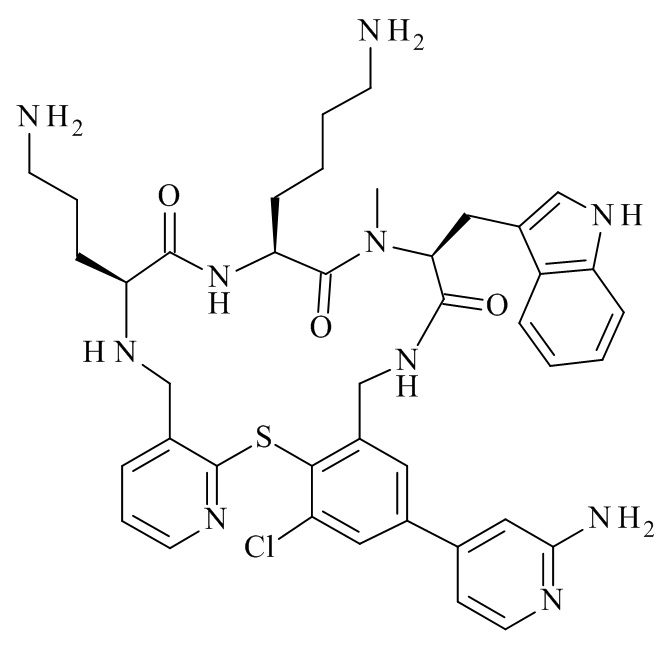
Пример 223 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 122
MS (M+H+): ожидаемая 796.4; наблюдаемая 797.7
Пример 224
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-22-ил]-бензолсульфонамид

Пример 224 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 123
MS (M+H+): ожидаемая 859.5; наблюдаемая 860.7
Пример 225
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-22-(4-метансульфонил-фенил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион
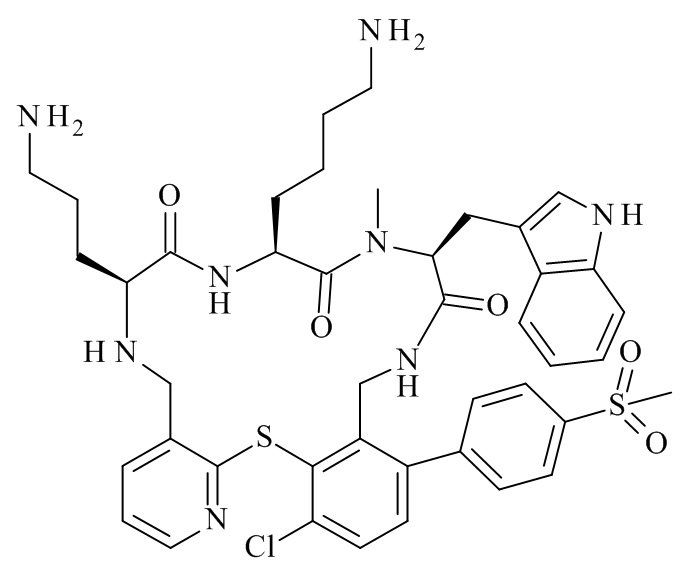
Пример 225 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 124
MS (M+H+): ожидаемая 858.5; наблюдаемая 859.7
Пример 226
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-3-фтор-12-метил-6,7,9,10,12,13,15,16-октагидробензо[b]пиридо[3,2-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион
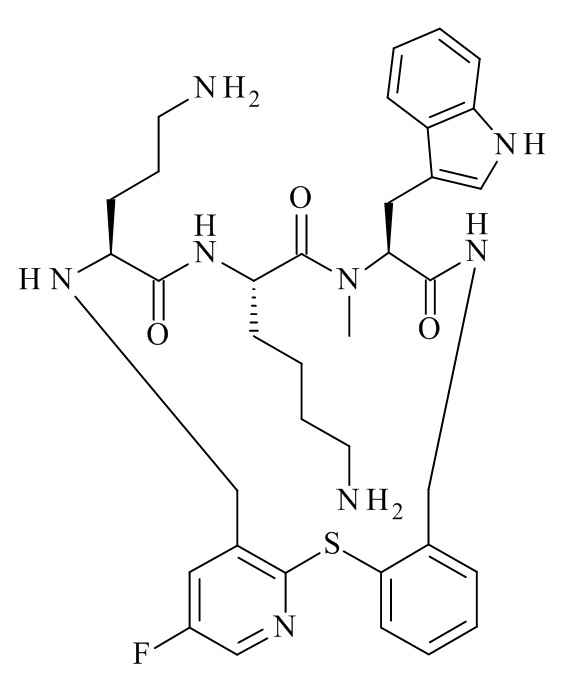
Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 125 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.4 экв. HATU, 4 экв. DIPEA, в ДМФ при КТ 2 ч. Депротекция: ДХМ/ТФУ 2:1, концентрирование под вакуумом, перемешивание в воде. Соединение, указанное в заголовке, получили в виде белого порошка (39 мг). MS ESI (m/z): 698.6 [(M+H)+]
Пример 227
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-имидазол-1-ил-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион

Пример 227 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 126
MS (M+H+): ожидаемая 770.4; наблюдаемая 771.2
Пример 228
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-22-(6-амино-пиридин-3-ил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион
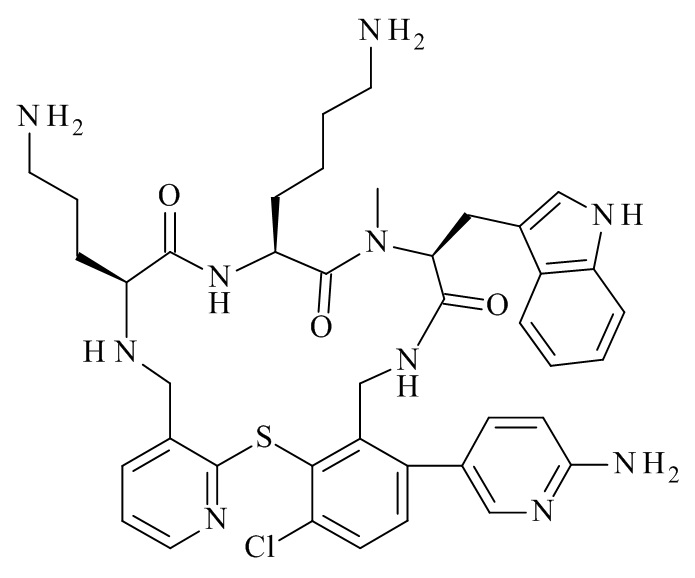
Пример 228 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 127
MS (M+H+): ожидаемая 796.4; наблюдаемая 797.3
Пример 229
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-23-ил]-пиридин-2-карбонитрил

Пример 229 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 128
MS (M+H+): ожидаемая 806.4; наблюдаемая 807.4
Пример 230
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-22-(6-гидрокси-пиридин-3-ил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-12,15,18-трион

Пример 230 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 129
MS (M+H+): ожидаемая 797.4; наблюдаемая 798.2
Пример 231
3-[(11S,14S,17S)-14-(4-амино-бутил)-25-хлор-22-(2-фтор-пиридин-4-ил)-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(21),3,5,7,22,24-гексаен-11-ил]-пропионамид

Пример 231 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(Trt)-OH.
Линкер: Промежуточное соединение 121
MS (M+H+): ожидаемая 813.4; наблюдаемая 814.3
Пример 232
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-23-(1H-пиррол-3-ил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 232 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 130
MS (M+H+): ожидаемая 769.4; наблюдаемая 770.3
Пример 233
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-23-карбонитрил

Пример 233 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-(2-метил-1H-индол-3-ил)-пропионовая кислота,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 107
MS (M+H+): ожидаемая 743.3; наблюдаемая 744.3
Пример 234
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-23-(4-метансульфонил-фенил)-16-метил-17-(2-метил-1H-индол-3-илметил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 234 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-(2-метил-1H-индол-3-ил)-пропионовая кислота,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 102
MS (M+H+): ожидаемая 872.5; наблюдаемая 873.3
Пример 235 (RO7198462-001-001)
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-16-метил-17-(2-метил-1H-индол-3-илметил)-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-23-ил]-бензолсульфонамид

Пример 235 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. (S)-2-(9H-флуорен-9-илметоксикарбониламино)-3-(2-метил-1H-индол-3-ил)-пропионовая кислота,
2. Fmoc-L-Lys(BOC)-OH,
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 119
MS (M+H+): ожидаемая 873.5; наблюдаемая 874.3
Пример 236
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-3-бромо-12-метил-6,7,9,10,12,13,15,16-октагидробензо[b]пиридо[3,2-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 131 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДМФ при КТ 3 ч. Депротекция: ДХМ/ТФУ 2:1, концентрирование под вакуумом, перемешивание в воде. Соединение, указанное в заголовке, получили в виде белого порошка (12 мг). MS ESI (m/z): 749.6 [(M+H)+]
Пример 237
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-17-(диметиламино)-12-метил-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:3',4'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион

Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 132 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДМФ при КТ 2 ч. Депротекция: ДХМ/ТФУ 2:1, концентрирование под вакуумом, затем перемешивание в воде . Соединение, указанное в заголовке, получили в виде светло-желтого осадка (59 мг). MS ESI (m/z): 715.6 [(M+H)+]
Пример 238
(7S,10S,13S)-13-((1H-индол-3-ил)метил)-10-(4-аминобутил)-7-(3-аминопропил)-12-метил-17-(пиридин-3-ил)-6,7,9,10,12,13,15,16-октагидродипиридо[2,3-b:3',4'-p][1,5,8,11,14]тиатетраазациклогептадецин-8,11,14(5H)-трион
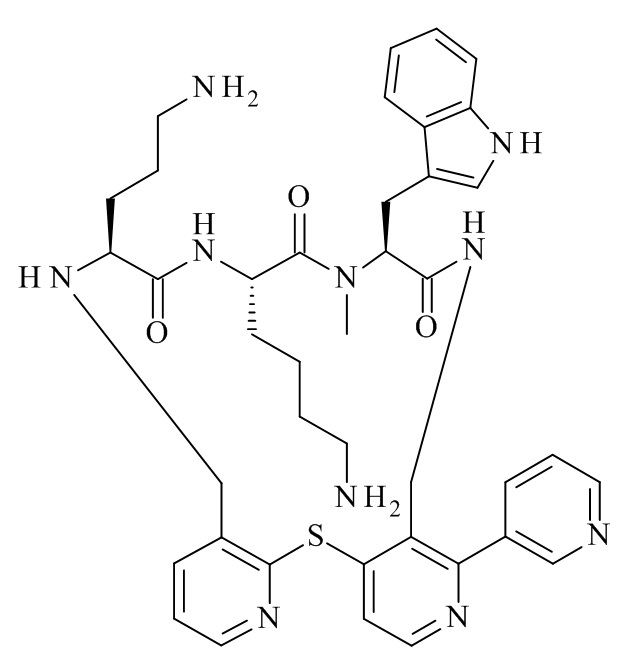
Данное соединение получили по аналогии с Общей Методикой для Пептидного Макроциклического Синтеза с использованием следующих реагентов/условий: аминокислоты: Fmoc-NMe-L-Trp(Boc)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Orn(Boc)-OH. Восстановительное аминирование: 1.2 экв. Промежуточного соединения 133 с использованием NMP/MeOH/AcOH 1:1:0.02 в качестве смеси растворителей. Макроциклизация: 1.2 экв. HATU, 4 экв. DIPEA, в ДМФ при КТ 2 ч. Сузуки по аналогии с примером 189 с использованием 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина. Депротекция: ДХМ/ТФУ 2:1. Соединение, указанное в заголовке, получили в виде желтого аморфного осадка (6 мг). MS ESI (m/z): 749.4 [(M+H)+]
Пример 239
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-22-ил]-бензойная кислота
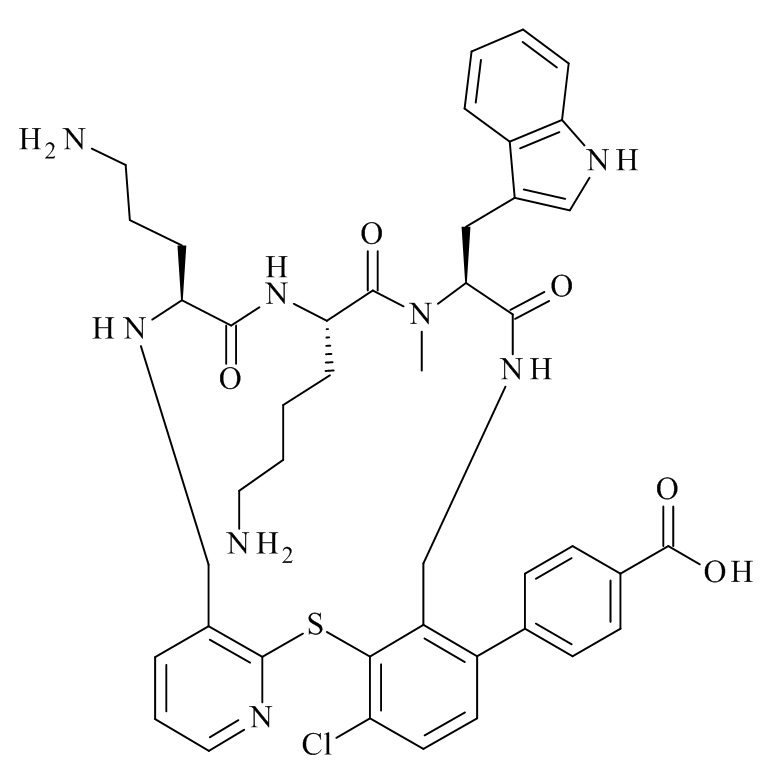
Пример 239 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 140
- Производное Бороновой Кислоты: 4-(трет-Бутоксикарбонил)фенилбороновая кислота
MS (M+H+): ожидаемая 824.3; наблюдаемая 825.3
Пример 240
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-22-[4-(2,3-дигидрокси-пропокси)-фенил]-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
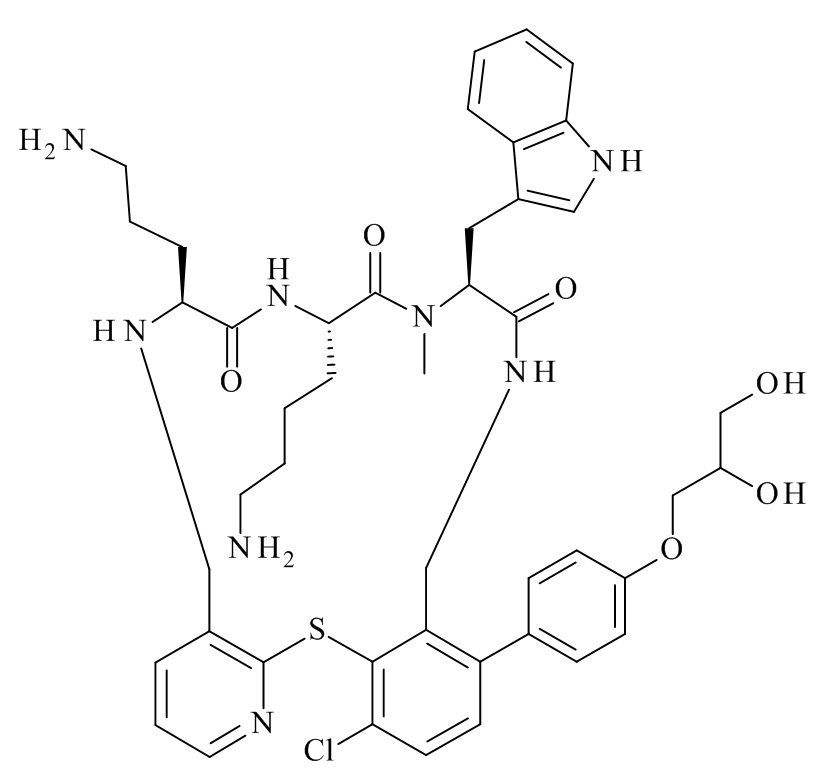
Пример 240 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 140
- Производное Бороновой Кислоты: 2-(4-((2,2-диметил-1,3-диоксолан-4-ил)метокси)фенил)-4,4,5,5-тетраметил-1,3,2-диоксабороланe
MS (M+H+): ожидаемая 870.4; наблюдаемая 871.4
Пример 241
{4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-22-ил]-фенокси}-уксусная кислота
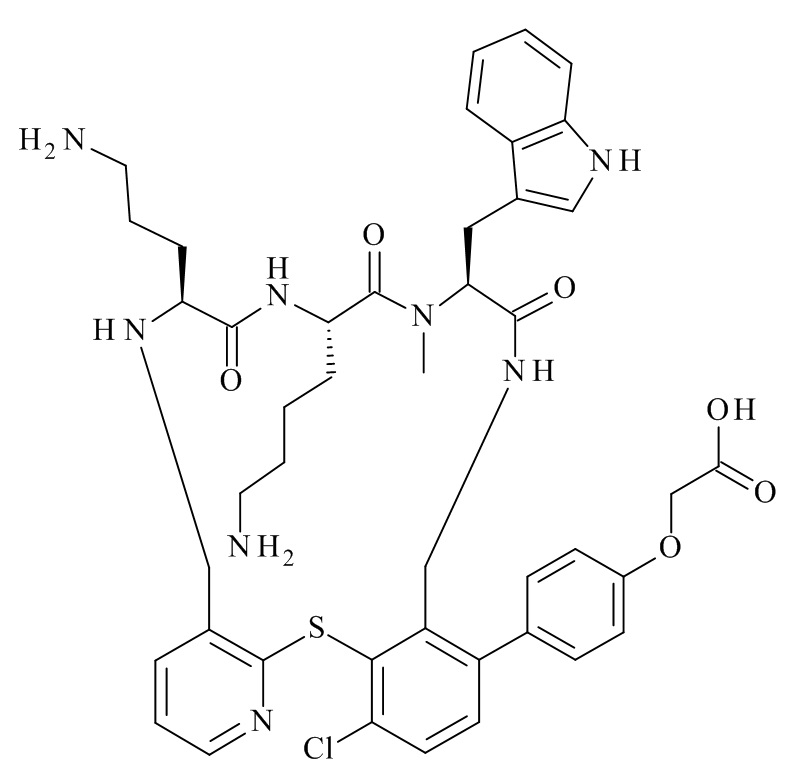
Пример 241 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 140
- Производное Бороновой Кислоты: трет-бутил 2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)ацетат
MS (M+H+): ожидаемая 8554.3; наблюдаемая 855.3
Пример 242
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-[4-(пиперидин-4-илокси)-фенил]-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6, 21,23-гексаен-12,15,18-трион

Пример 242 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 140
- Производное Бороновой Кислоты: трет-бутил 4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)пиперидин-1-карбоксилат
MS (M+H+): ожидаемая 879.4; наблюдаемая 880.4
Пример 243
(11S,14S,17S)-14-(4-амино-бутил)-22-(4-аминометил-фенил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 243 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 140
- Производное Бороновой Кислоты: (4-(((трет-бутоксикарбонил)амино)метил)фенил)бороновая кислота
MS (M+H+): ожидаемая 809.4; наблюдаемая 810.4
Пример 244
(11S,14S,17S)-14-(4-амино-бутил)-22-[3-(2-амино-этил)-фенил]-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 244 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 140
- Производное Бороновой Кислоты: (3-(2-((трет-бутоксикарбонил)амино)этил)фенил)бороновая кислота
MS (M+H+): ожидаемая 823.4; наблюдаемая 824.3
Пример 245
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-(4-пиперазин-1-ил-фенил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,2-гексаен-12,15,18-трион

Пример 245 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 140
- Производное Бороновой Кислоты: [4-(4-трет-бутоксикарбонилпиперазин-1-ил)фенил]бороновая кислота
MS (M+H+): ожидаемая 864.4; наблюдаемая 865.4
Пример 246
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-22-ил]-N-(2-гидрокси-этил)-бензолсульфонамид

Пример 246 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 140
- Производное Бороновой Кислоты: [4-(2-гидроксиэтилсульфамоил)фенил]бороновая кислота
MS (M+H+): ожидаемая 903.3; наблюдаемая 904.3
Пример 247
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-22-ил]-N-(2-гидрокси-этил)-бензамид

Пример 247 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 140
- Производное Бороновой Кислоты: [4-(2-гидроксиэтилкарбамоил)фенил]бороновая кислота
MS (M+H+): ожидаемая 867.4; наблюдаемая 868.4
Пример 248
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен--22-ил]-N-(2-диметиламино-этил)-бензамид

Пример 248 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 140
- Производное Бороновой Кислоты: [4-[2-(диметиламино)этилкарбамоил]фенил]бороновая кислота;гидрохлорид
MS (M+H+): ожидаемая 894.4; наблюдаемая 895.3
Пример 249
4-[(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-12,15,18-триоксо-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-22-ил]-N-(2-морфолин-4-ил-этил)-бензамид

Пример 249 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 140
- Производное Бороновой Кислоты: [4-(2-морфолиноэтилкарбамоил)фенил]бороновая кислота
MS (M+H+): ожидаемая 936.4; наблюдаемая 937.4
Пример 250
(11S,14S,17S)-14-(4-амино-бутил)-11-(3-амино-пропил)-25-хлор-17-(1H-индол-3-илметил)-16-метил-22-(4-пиперидин-4-ил-фенил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
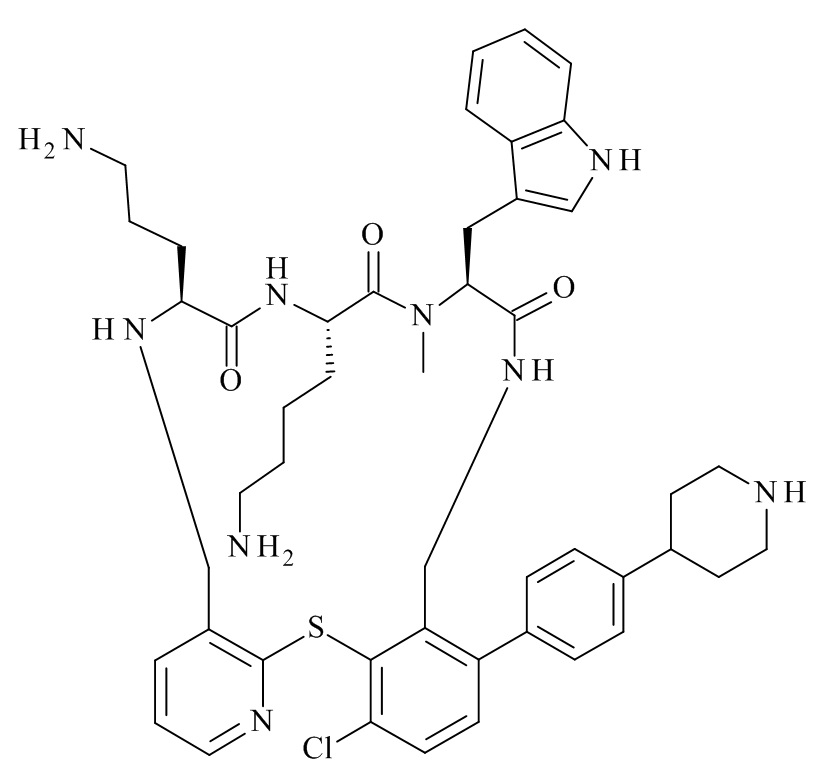
Пример 250 получили в соответствии с общей методикой для связывания по Сузуки производных бороновых кислот до Пептидных Макроциклических Промежуточных Соединений с использованием следующих исходных соединений:
- Макроциклическое Промежуточное соединение: Промежуточное соединение 140
- Производное Бороновой Кислоты: [4-(1-трет-бутоксикарбонил-4-пиперидил)фенил]бороновая кислота
MS (M+H+): ожидаемая 863.4; наблюдаемая 864.4
Пример 251
(11S,14S,17S)-11-(3-амино-пропил)-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-14-(4-метиламино-бутил)-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 251 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. (S)-6-(трет-Бутоксикарбонил-метил-амино)-2-(9H-флуорен-9-илметоксикарбониламино)-гексановая кислота
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 753.7; наблюдаемая 753.6
Пример 252
(11S,14S,17S)-14-(4-амино-бутил)-23,25-дихлор-11-(3-гидрокси-пропил)-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион
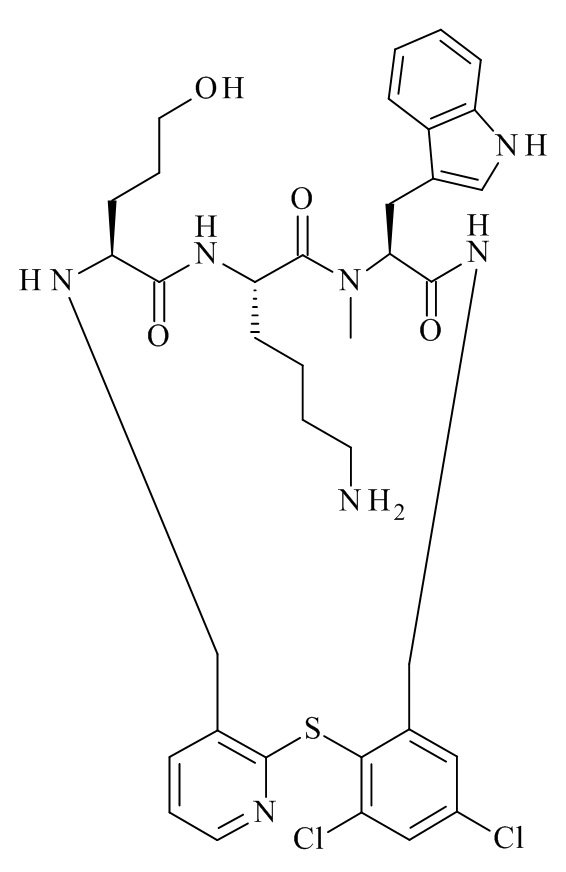
Пример 252 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Lys(BOC)-OH,
3. Промежуточное соединение 141)
Линкер: Промежуточное соединение 47
TBS Депротекция
Депротектированный общим способом макроцикл (110 мг, 0.1 ммоль, полуенный в соответствии с общими методиками) смешали с раствором тетрабутиламмония фторида в ТГФ (1.0 M, 1 мл) и перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь сконцентрировали и остаток очистили на колонке с силикагелем с последующей препаративной ВЭЖХ (Waters SunFire C18, 5 мкм, OBD™ 30 × 100 мм; подвижная фаза: A, ацетонитрил и B, 0.1% ТФУ в воде) с получением требуемого макроциклического спирта (20 мг).
Финальная BOC-Депротекция
К раствору макроциклического спирта, полученного выше (20 мг, 21 мкмоль) в дихлорметане (500 мкл) добавили ТФУ (250 мкл). Смесь перемешивали при комнатной температуре в течение 2 часов, и затем сконцентрировали под вакуумом при комнатной температуре. Остаток растворили в ~2 мл воды и перемешивали при комнатной температуре в течение ночи. MeCN/H2O (v/v=1/1, 1.5 мл) добавили и смесь лиофилизировали с получением конечного продукта (16 мг).
MS (M+H+): ожидаемая 739.2; наблюдаемая 740.3
Пример 253
(11S,14S,17S)-11-(3-амино-пропил)-14-бутил-23,25-дихлор-17-(1H-индол-3-илметил)-16-метил-2-тиа-4,10,13,16,19-пентааза-трицикло[19.4.0.0*3,8*]пентакоза-1(25),3(8),4,6,21,23-гексаен-12,15,18-трион

Пример 253 получили в соответствии с общей методикой для Пептидного Макроциклического Синтеза с использованием следующих исходных соединений:
1. Fmoc-NMe-L-Trp(BOC)-OH,
2. Fmoc-L-Nle-OH (Fmoc-L-норлейцин),
3. Fmoc-L-Orn(BOC)-OH.
Линкер: Промежуточное соединение 47
MS (M+H+): ожидаемая 723.2; наблюдаемая 724.3.
Пример 254
Тестирование противомикробной восприимчивости:
Определение минимальной ингибирующей концентрации (MIC)
Противомикробную активность соединений in vitro определяли методом микроразведений для минимальной ингибирующей концентрации (MIC), выполненном в соответствии с руководством Института клинических и лабораторных стандартов (CLSI - M07-A9 Jan 2012. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard - Ninth Edition, Clinical and Laboratory Standards Institue, Wayne/PA, US and the CLSI - M100-S24 Jan 2014. Performance Standards for Antimicrobial Susceptibility Testing; Approved Standard - Fourth Informational Supplement, Clinical and Laboratory Standards Institue, Wayne/PA, US).
Стоковый раствор соединения приготовили свежим при 10 x от необходимой самой высокой концентрации для определения MIC, т.e. при 1280 мг/л, восстановлением сухого соедиения в смеси 50:50 вода:ДМСО.
Полистирольные необработанный 96 луночный микропланшеты использовали для приготовления панели, содержащей серийные двукрытные разведения при двойно конечной тестируемой концентрации (например, диапазон от 64 до 0.06 мкг/мл) в питательной среде Мюллера-Хинтона, уравновешенной по катионам (CAMHB).
Посенвную культуру получили “методом прямой суспензии колоний”. Колонии A. baumannii ATCC19606 или клинические изоляты суспендировали в солевом растворе и доводили до 0.5 по шкале МакФарланда, разбавили 100 раз в среде CAMHB и 50 мкл добавили в каждую лунку (конечная концентрация клеток ~ 5x10(5) КОЕ/мл и конечная концентрация /лунка 100 мкл). Микропланшеты закрыли и нкубировали при 35 ± 2°C.
Значения MIC считывали через 20 часов инкубирования и записывались в виде наименьшей концетрации противомикробного средства, которая ингибировала более 80% роста организма под данным невооруженного взгляда и с использованием микропланшетного ридера оптической плотности (OD 600 нм).
В Таблицах 2, 3, 4 и 5 приведены минимальные ингибирующие концентрации (MIC) в микрограммах на милилитр соединения настоящего изобретения, полученных против A. baumannii штамма ATCC19606 (Таблицы 2, 3, 4 и 5).
Конкретные соединения настоящего изобретения проявляют MIC (ATCC19606) ≤ 64 мкг/мл .
Более конкретные соединения настоящего изобретения проявляют MIC (ATCC19606) ≤ 16 мкг/мл .
Наиболее предпочтительные соединения настоящего изобретения проявляют MIC (ATCC19606) ≤ 2 мкг/мл .
Пример 255
Тестирование противомикробной восприимчивости:
Определение 50% ингибирующей концентрации (IC50)
Противомикробную активность соединений in vitro альтернативно определяли в соответствии со следующей методикой:
В анализе использовалась 10-точечная питательная среда Iso-Sensitest для количественного измерения in vitro активности соединений против A. baumannii ATCC 17978.
Стоковые соединения в ДМСО серийно двукратно разводили (например, диапазон от 50 до 0.097 мкМ конечная концентрация) в 384 луночных микропланшетах и инокулировали 49 мкл бактериальной суспензии в питательной среде Iso-Sensitest с получением финальной концентрации ~ 5x10(5) КОЕ/мл в конечном объеме/лунка 50 мкл/лунка. Микропланшеты инкубировали при 35 ± 2°C.
Рост бактериальных клеток определяли измерением оптической плотности при λ=600 нм каждые 20 минут в течение временного промежутка в 16 ч.
Ингибирование роста рассчитывали в течение логарифмического роста бактериальных клеток с определением концентрации, ингибирующей 50% (IC50) и 90% (IC90) роста.
В Таблицах 3, 4 и 5 даный 50% ингибирующие концентрации (IC50) в микромолях на литр соединений настоящего изобретения, полученные проотив A. baumannii штамма ATCC17978.
Конкретные соединения настоящего изобретения проявляют IC50 (ATCC17978) ≤ 10 мкмоль/l.
Более конкретные соединения настоящего изобретения проявляют IC50 (ATCC17978) ≤ 1 мкмоль/l.
Наиболее предпочтительные соединения настоящего изобретения проявляют IC50 (ATCC17978) ≤ 0.5 мкмоль/l.
Таблица 2. Минимальная ингибирующая концентрация (MIC) в микрограммах на милилитр соединений настоящего изобретения, полученная против A. baumannii штамма ATCC19606.
Таблица 3. Минимальная ингибирующая концентрация (MIC) в микрограммах на милилитр соединений настоящего изобретения, полученная против A. baumannii штамма ATCC19606 и 50% ингибирующая концентрация (IC50) в микромолях на литр соединений настоящего изобретения, полученная против A. baumannii штамма ATCC17978.
Таблица 4. Минимальная ингибирующая концентрация (MIC) в микрограммах на милилитр соединений настоящего изобретения, полученная против A. baumannii strain ATCC19606 и 50% ингибирующая концентрация (IC50) в микромолях на литр соединений настоящего изобретения, полученная против A. baumannii штамм ATCC17978.
Таблица 5. Минимальная ингибирующая концентрация (MIC) в микрограммах на милилитр соединений настоящего изобретения, полученная против A. baumannii штамм ATCC19606 и 50% ингибирующая концентрация (IC50) в микромолях на литр соединений настоящего изобретения, полученная против A. baumannii штамм ATCC17978.
Реферат
Изобретение относится к новым соединениям формулы (I), а также к фармацевтическим композициям на их основе и применению. Технический результат: получены новые соединения, которые могут быть применимы в качестве лекарственных средств для лечения заболеваний и инфекций, вызванных. 8 н. и 14 з.п. ф-лы, 5 табл., 255 пр.(I)
Формула







Комментарии