Рекомбинантная вакцина вируса лейкемии кошек, содержащая оптимизированный ген оболочки вируса лейкемии кошек - RU2591817C2
Код документа: RU2591817C2
Чертежи


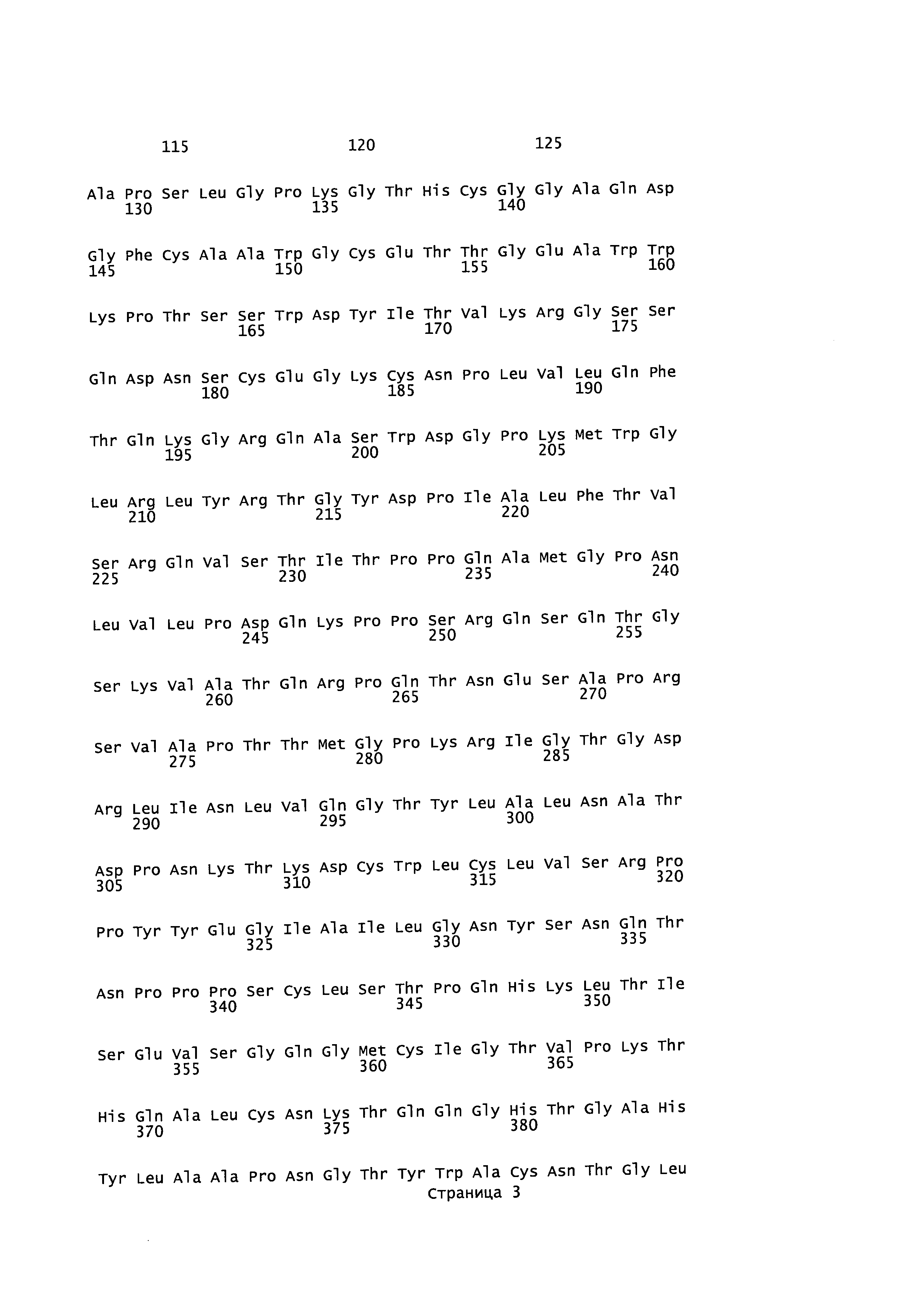
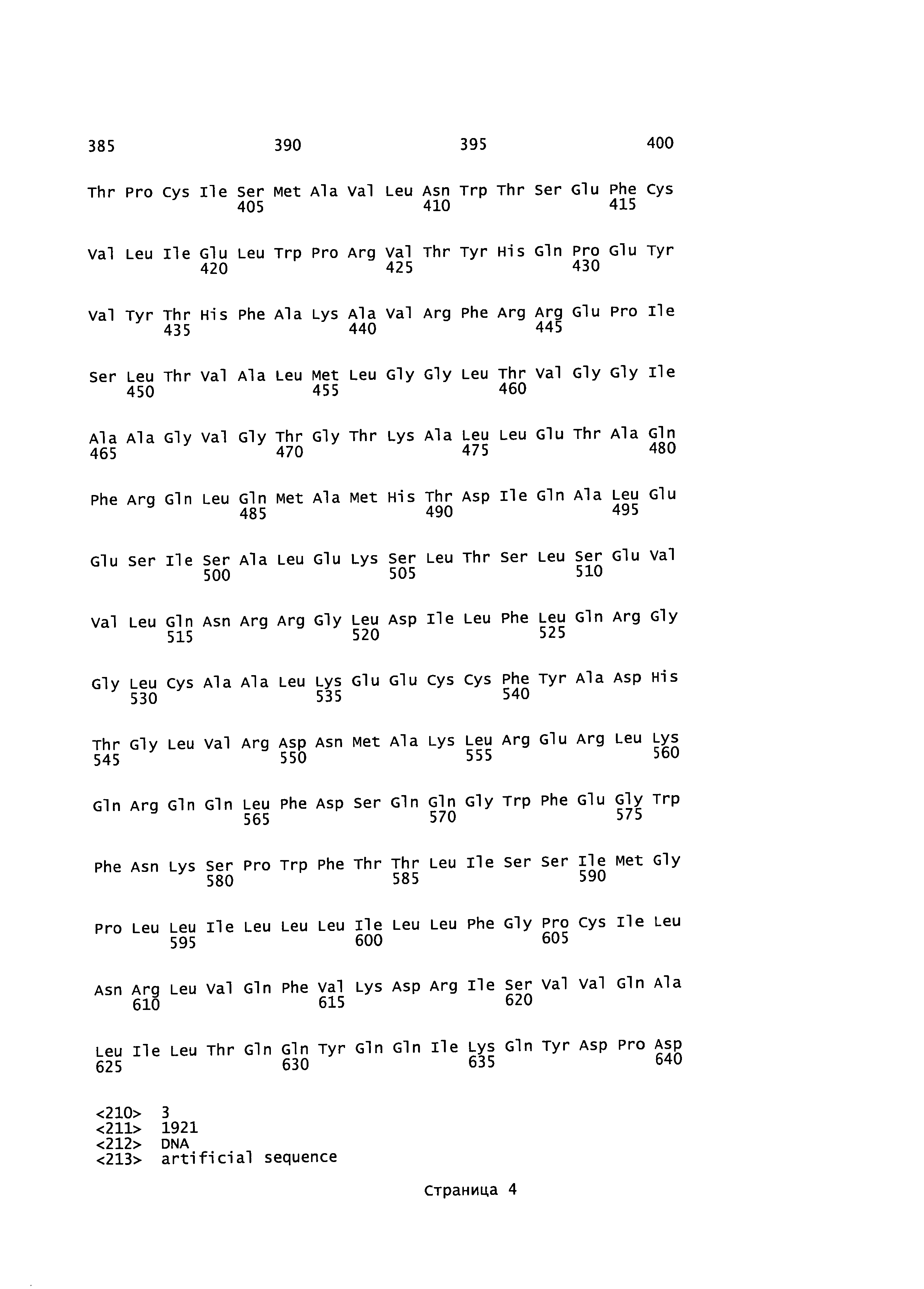






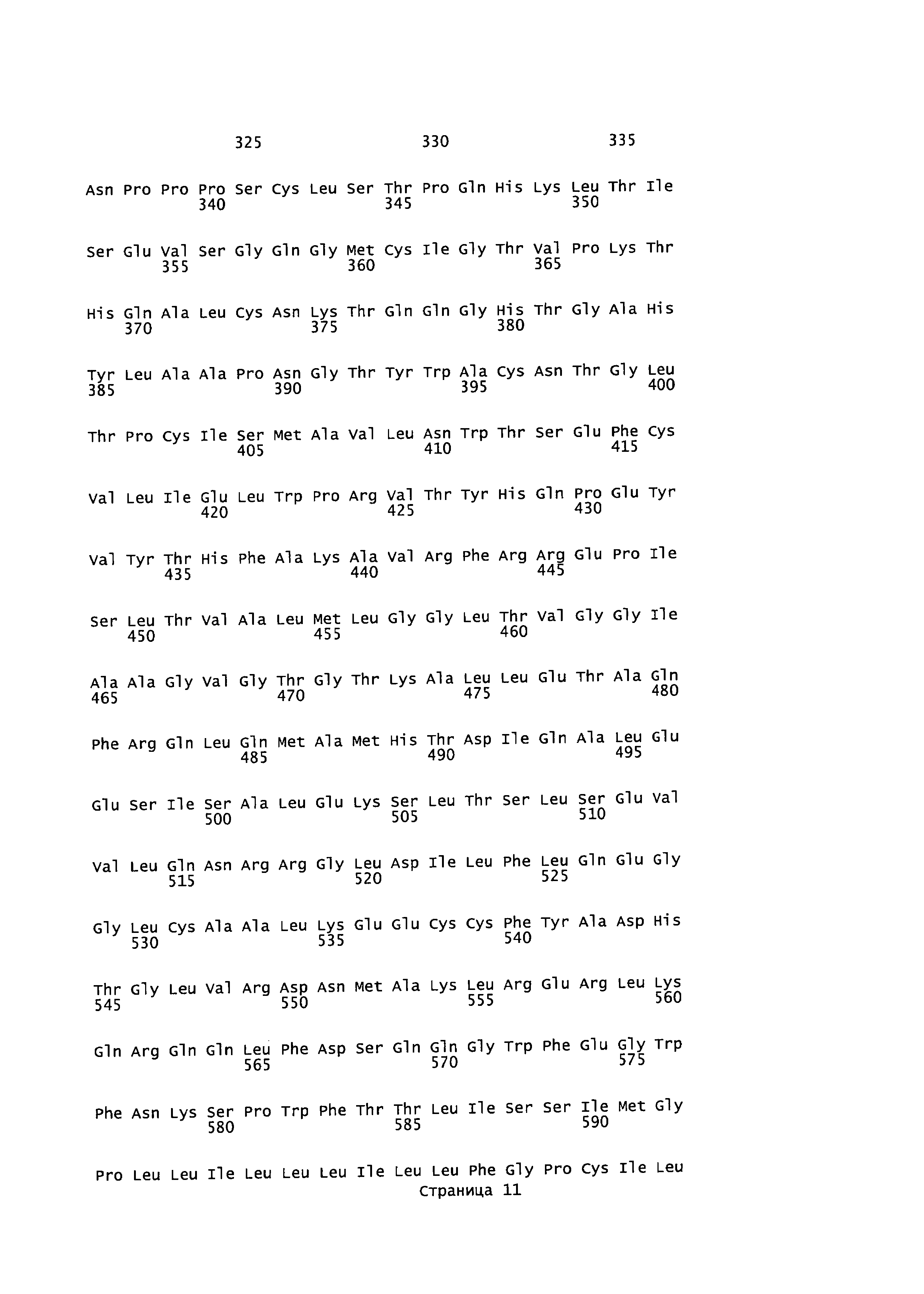























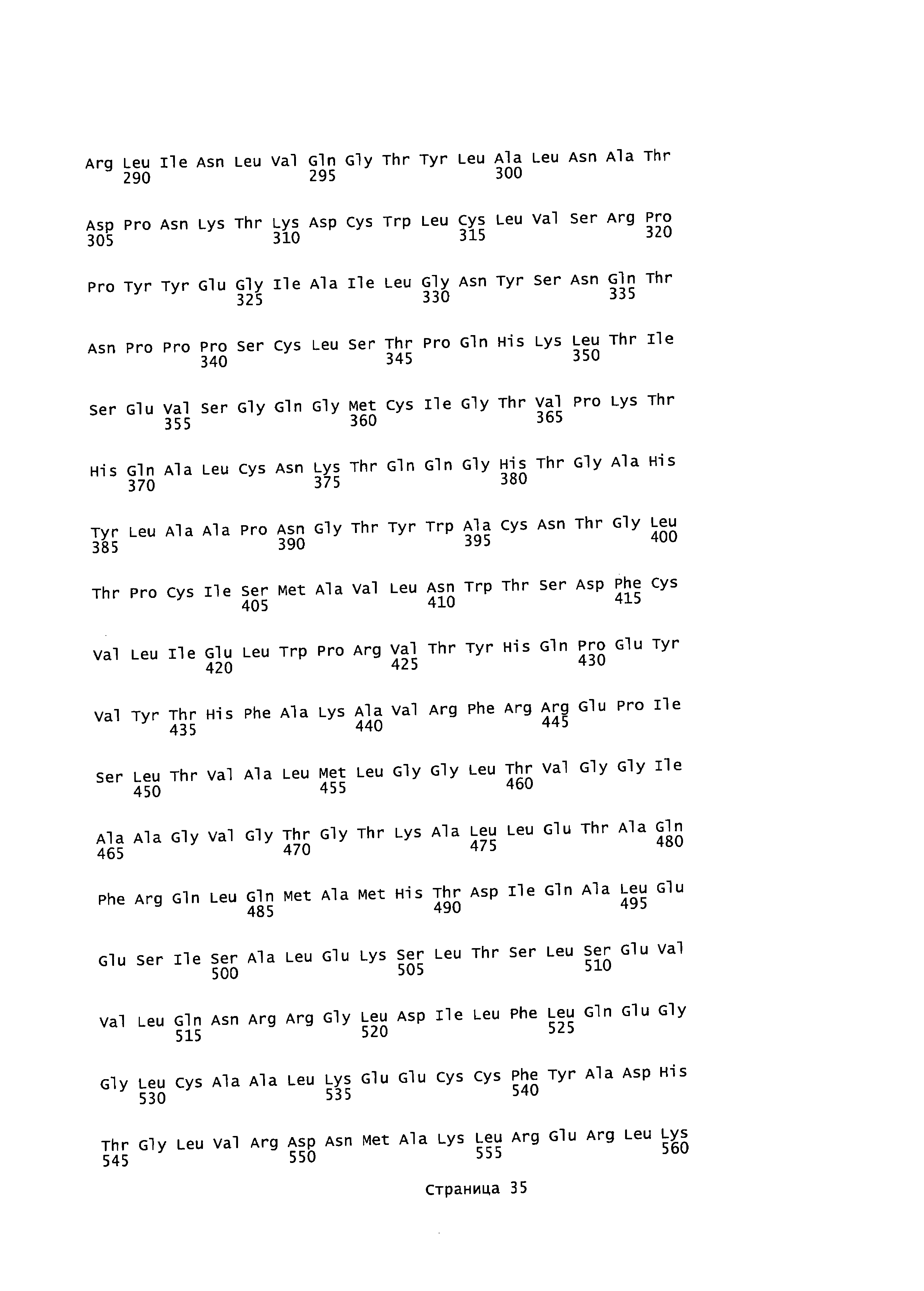



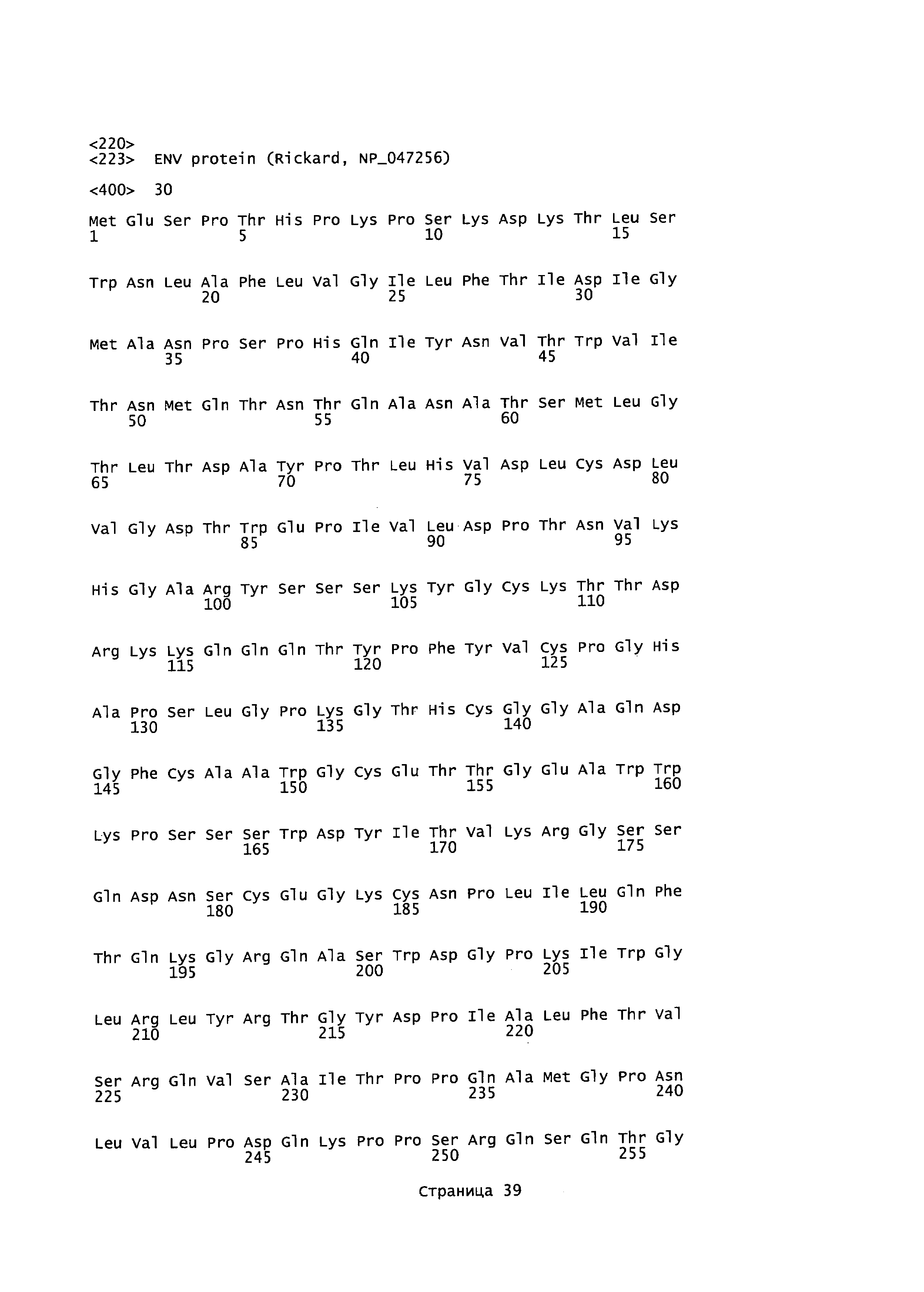





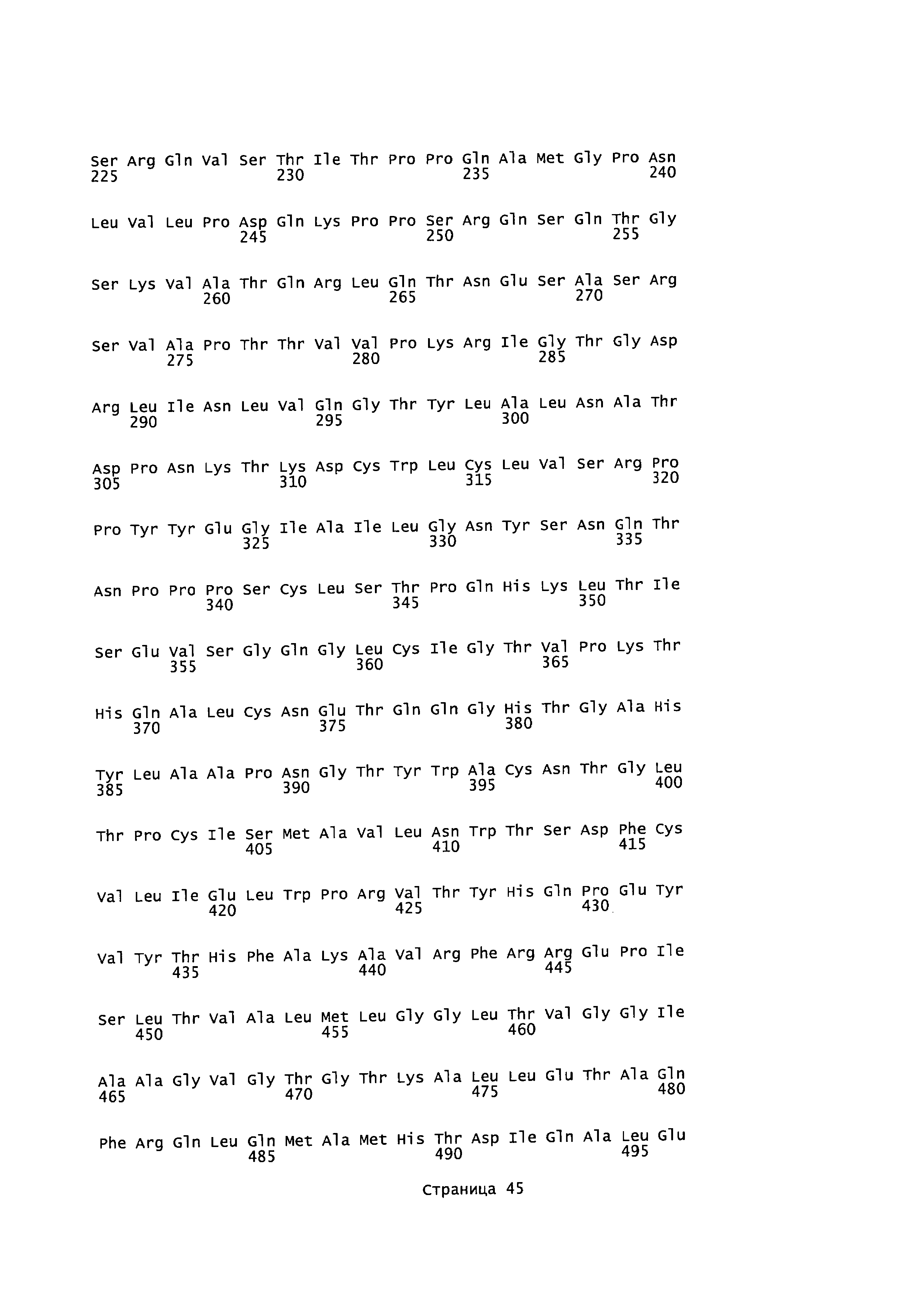




































































Описание
Перекрестная ссылка на родственные заявки
[0001] Данная заявка заявляет приоритет для предварительной заявки США 61/509,912, поданной 20 июля 2011 года.
Область техники изобретения
[0002] Настоящее изобретение относится к композициям или вакцинам для борьбы с инфекциями у животных, вызываемыми вирусом лейкемии кошек. В частности, настоящее изобретение относится к векторам, которые содержат и экспрессируют in vivo или in vitro оптимизированные антигены к оболочке вируса лейкемии кошек, которые вызывают иммунную реакцию в организме животных против вируса лейкемии кошек, включая композиции, содержащие упомянутые векторы, способам вакцинации против вируса лейкемии кошек и наборам для применения с такими способами и композициями.
Уровень техники
[0003] Вирус лейкемии кошек (Feline Leukemia Virus (FeLV), ВЛК) является частой причиной заражения домашних кошек во всем мире и одной из причин значительной заболеваемости и смертности. Распространенность антигенемии может варьировать от 1 до 5 процентов у здоровых кошек до от 15 до 30 процентов у больных кошек (Hosie M.J. et al., Veterinary Records, 1989, 128, 293-297; Braley J., Feline Practice, 1994, 22, 25-29; Malik R. et al., Australian Veterinary Journal, 1997, 75, 323-327; Arjona A. et al., Journal of Clinical Microbiology, 2000, 38, 3448-3449). Вирус может вызвать пожизненную инфекцию, характеризуемую персистентной вирусемией и летальным исходом. Большинство связанных с FeLV заболеваний персистентно встречается у зараженных животных, и они всегда являются серьезными и, скорее всего, со смертельным исходом. Среди наиболее часто диагностируемых заболеваний отмечаются лимфомы, миелоидные лейкозы, иммунодефицит и нерегенеративная анемия. Инфекцию может контролировать идентификацией и изолированием персистентно вирусемических кошек, которые являются источником инфекции. Вакцины также помогли предотвратить распространение вируса. Несколько FeLV-вакцин доступны. Большинство из них содержат либо инактивированный вирус, либо рекомбинантные субъединицы. Их эффективность является спорной (Sparkes A.H., Journal of Small Animal Practice, 1997, 38, 187-194). Отмечались случаи разложения вакцины.
[0004] Альтернативный способ заключается в использовании рекомбинантного вирусного вектора. Вектор вируса канареек и особенно вектор ALVAC были испытаны на экспрессию генов FeLV (Tartaglia J. et al., Journal of Virology, 1993, 67, 2370-2375; Poulet H. et al., Veterinary Record, 2003, 153, 141-145). Также доступна коммерческая рекомбинантная вакцина FELV (EURIFEL® FELV, Merial).
[0005] Геном FeLV кодирует три гена: ген GAG, кодирующий основные структурные компоненты вируса, ген ENV, который кодирует гликопротеин оболочки, и ген POL, кодирующий белок полимеразы (Thomsen D.R., et al., Journal of General Virology, 73, 1819-1824, 1992). Ген оболочки FELV (ENV) кодирует белок-предшественник gp85, который протеолитически обрабатывается клеточными ферментами с получением основного гликопротеина оболочки gp70 и связанного с ним трансмембранного белка р15Е (DeNoronha, F, et al., 1978, Virology 85:617-621; Nunberg, J.H., et al., 1983, PNAS 81:3675-3679). Трансмембранный белок р15Е содержит последовательность, консервативную среди гаммаретровирусов с иммуносупрессивными свойствами (Mathes, L.E. et al., 1978, Nature). Гликопротеин оболочки FELV является одним из основных иммуногенов и представляет собой мишень FELV-специфических цитотоксических Т-клеточных ответов, а также нейтрализующих антител (Flynn, J.N., et al., 2002, J. Virol.). В заявке на патент США 2008/0008683 обсуждается полипептид, который способен модулировать иммуносупрессивные свойства вирусного белка против хозяина, в котором он экспрессируется. Ген GAG FeLV кодирует полипептид-предшественник, который расщепляется протеазой (ген PRO FeLV), чтобы генерировать белки капсида. Белки капсида являются также основным иммуногеном, вызывая FELV-специфические цитотоксические Т-клеточные ответы, а также нейтрализующие антитела (Flynn, J.N., et al., 2002, J. Virol.). Ген POL кодирует три белка: протеазу (PRO), обратную транскриптазу и интегразу. Автопроцессинг протеазой части гена приводит ко всем трем белкам области POL (Thomsen D.R., et al., 1992).
[0006] Существует общая потребность в улучшении эффективности и безопасности вакцин FeLV и в более эффективной защите в полевых условиях.
Сущность изобретения
[0007] Задачей настоящего изобретения может быть любой или все предлагаемые рекомбинантные векторы или вирусы, а также способы получения таких вирусов и предоставление композиций и/или вакцин, а также способов для лечения и профилактики инфекции, вызванной FeLV
[0008] Настоящее изобретение относится к рекомбинантному вектору, такому как рекомбинантный вирус, например, рекомбинантный поксвирус, который содержит и экспрессирует по меньшей мере одну экзогенную молекулу нуклеиновой кислоты, и по меньшей мере одна экзогенная молекула нуклеиновой кислоты может содержать молекулу нуклеиновой кислоты, кодирующую представляющий интерес иммуноген или эпитоп из FeLV белков, таких как ENV FeLV и/или GAG/PRO FeLV.
[0009] В частности, настоящее изобретение относится к рекомбинантному вектору, такому как рекомбинантный вирус, например, рекомбинантный поксвирус, который содержит и экспрессирует по меньшей мере одну экзогенную молекулу нуклеиновой кислоты и, по меньшей мере одна экзогенная молекула нуклеиновой кислоты может содержать полипептиды FeLV и/или их варианты или фрагменты.
[0010] Настоящее изобретение дополнительно относится к композициям или вакцине, содержащим такой вектор экспрессии или продукт(ы) экспрессии такого вектора экспрессии.
[0011] Настоящее изобретение дополнительно относится к способам индукции иммунологического (или иммуногенного) или защитного ответа против FeLV, а также к способам предотвращения FeLV или болезненного состояния(ий), вызываемого FeLV, содержащим введение вектора экспрессии или продукта экспрессии экспрессирующего вектора, или композиции, содержащей вектор экспрессии, или композиции, содержащей продукт экспрессии экспрессирующего вектора.
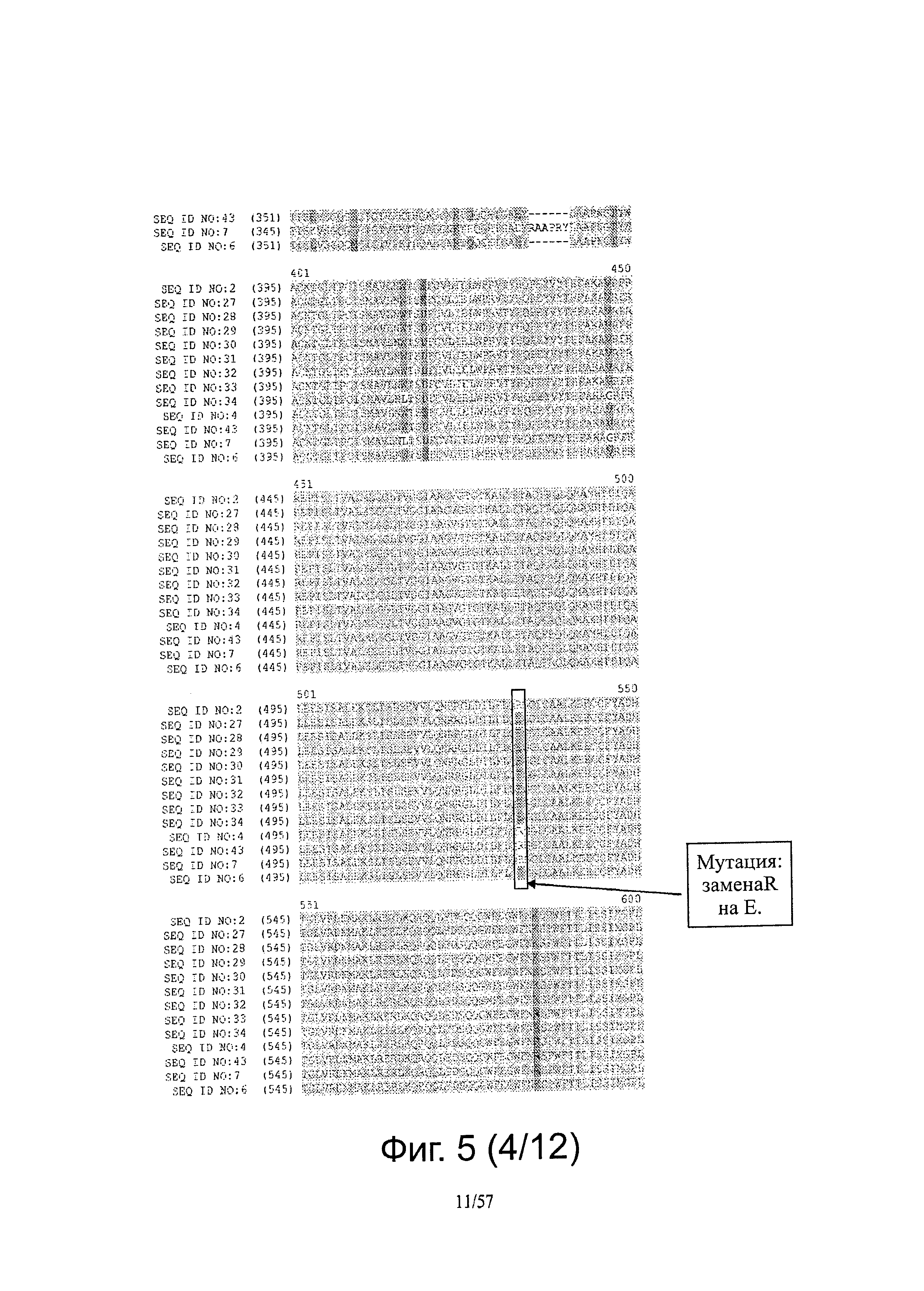
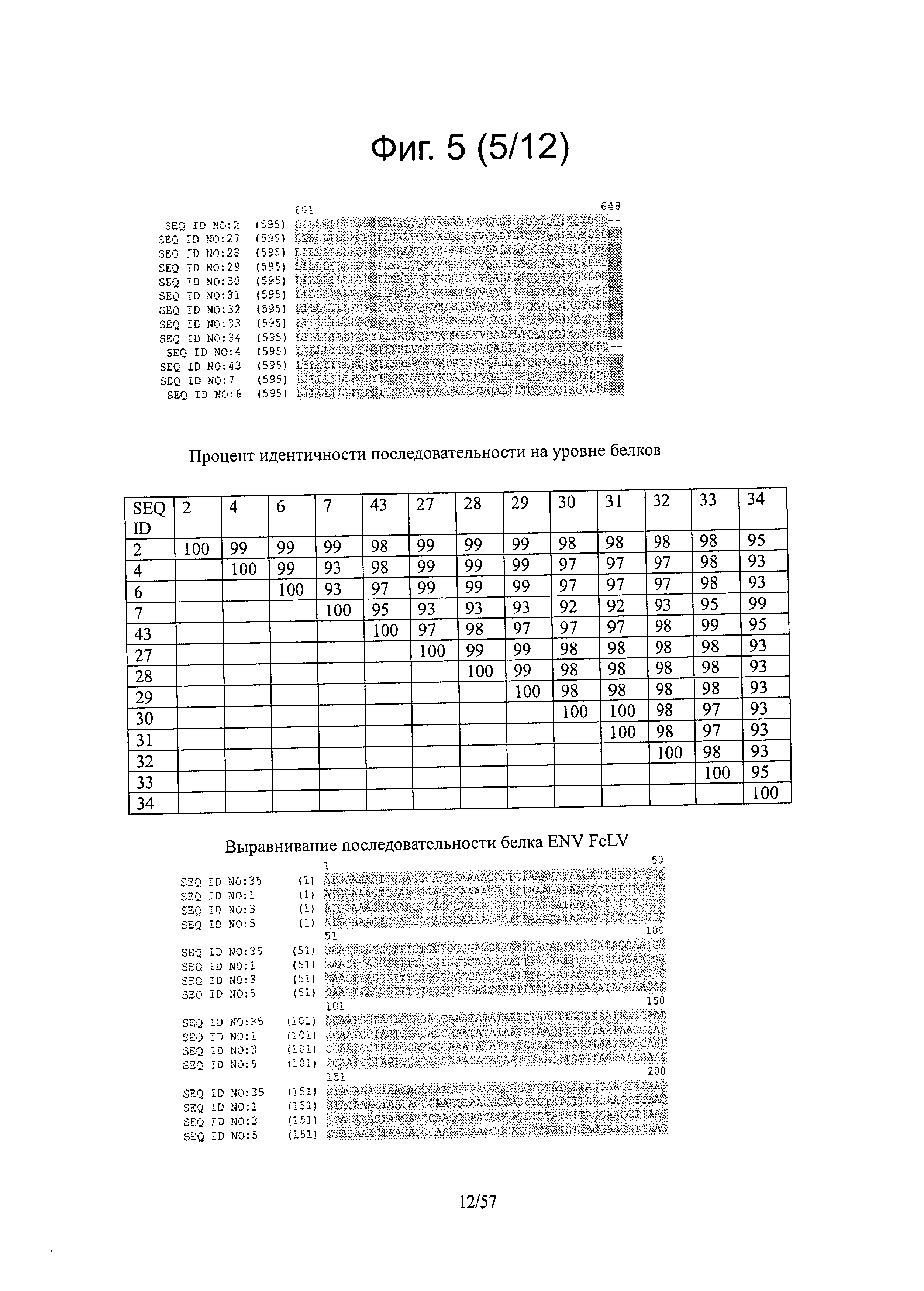
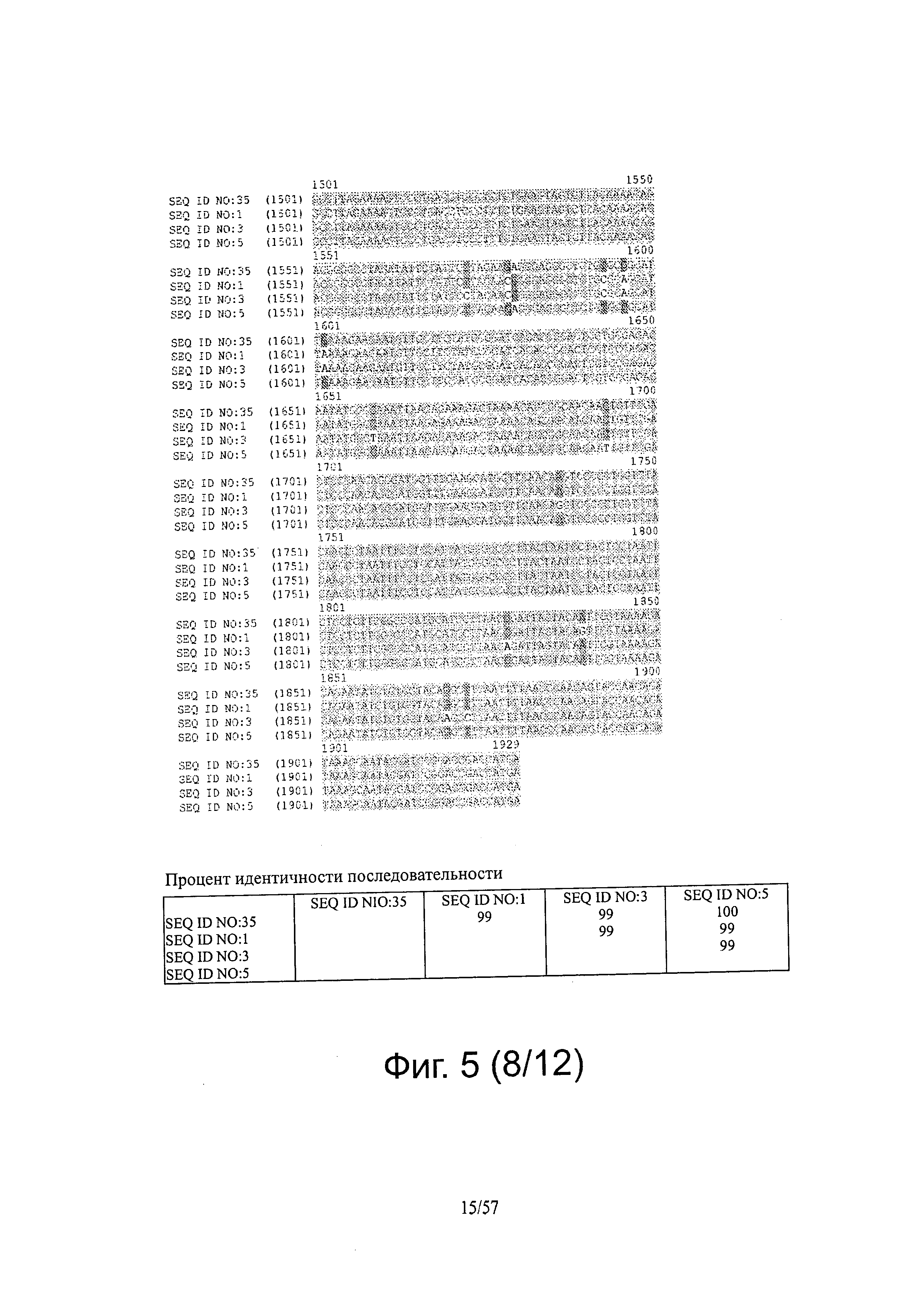
[0012] Настоящее изобретение также относится к продуктам экспрессии из вируса, а также антителам, полученным из продуктов экспрессии, или экспрессии их т vivo и применениям для таких продуктов и антител, например, в диагностических применениях.
[0013] Данные и другие варианты осуществления раскрыты или очевидны из приведенного ниже подробного описания и охватываются им.
Краткое описание чертежей
[0014] Нижеследующее подробное описание, приведенное в качестве примера, и которое не предназначено для ограничения изобретения описанными определенными вариантами осуществления, можно понимать в сочетании с прилагаемыми фигурами, включенными в настоящее описание посредством ссылки, в которых:
[0015] На фигуре 1 представлена таблица, идентифицирующая номер SEQ ID NO, присвоенный полинуклеотидной и белковой последовательности.
[0016] На фигуре 2 изображена карта плазмиды pH6C5env (208.2).
[0017] На фигуре 3 представлены последовательности для фрагмента плазмиды pCXL208.2 (pH6C5env), содержащего ДНК ENV FELV и левые и правые "плечи" (SEQ ID NO:36) и белок ENV FELV (SEQ ID NO:7) из плазмиды pHCMV-ENV FeLV.
[0018] На фигуре 4 представлена рестрикционная карта для плазмиды рРВ713.
[0019] На фигуре 5 представлены выравнивания последовательностей ДНК ENV FeLV и белков.
[0020] На фигуре 6 представлена рестрикционная карта плазмиды рРВ712.
[0021] На фигуре 7 показано выравнивание последовательности ДНК между ДНК GAG/PRO дикого типа (SEQ ID NO:11) и кодон-оптимизированной ДНК GAG/PRO (SEQ ID NO:10).
[0022] На фигуре 8 представлена схема клонирования.
[0023] На фигуре 9 представлена рестрикционная карта плазмиды pJY1874.1.
[0024] На фигуре 10 представлена последовательность белка GAG-PRO FELV.
[0025] На фигуре 11 показана нуклеотидная последовательность фрагмента ДНК, содержащего "плечи" pJY1874.1 и вставку (SEQ ID NO:38).
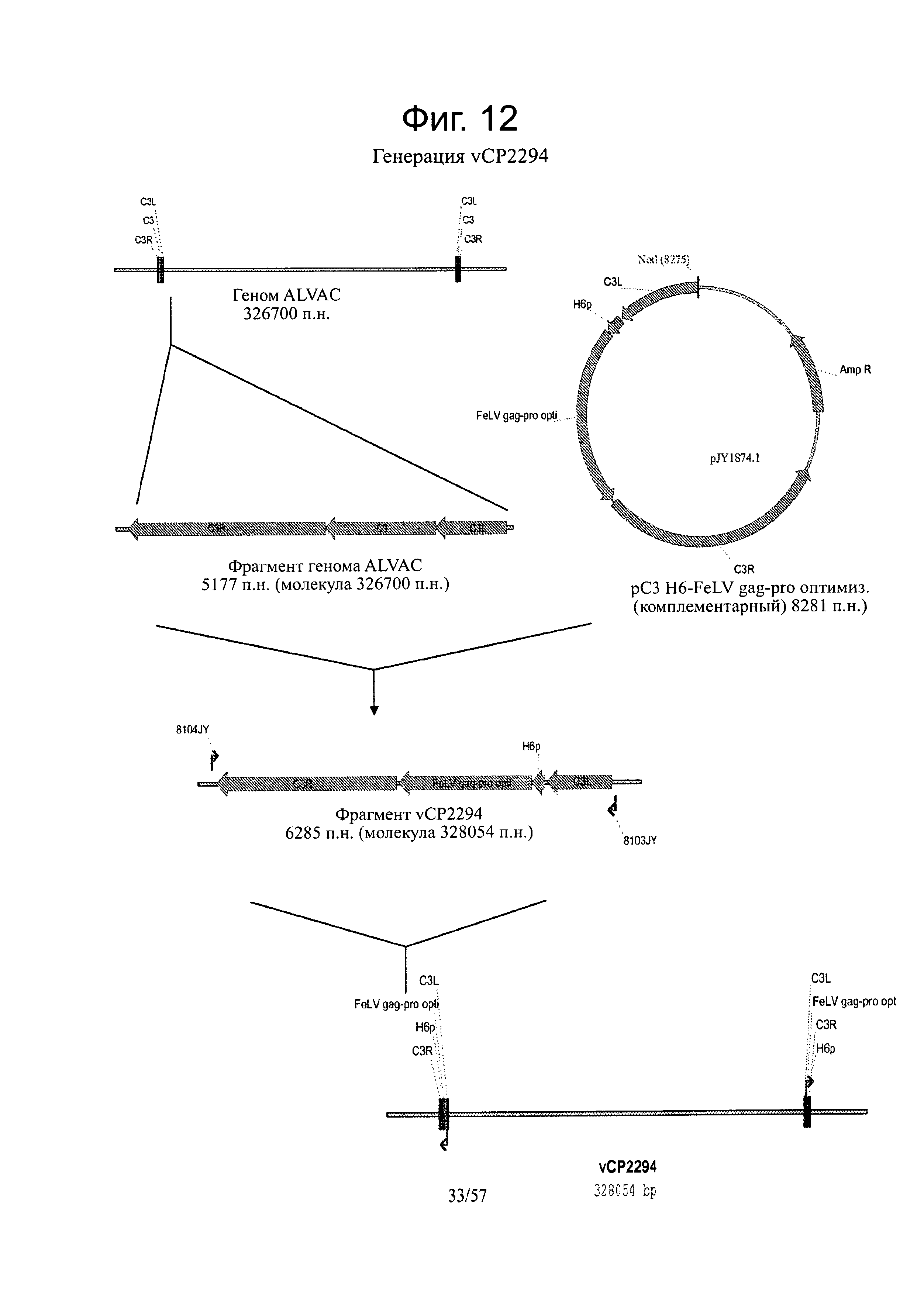
[0026] На фигуре 12 представлена схема клонирования для изготовления плазмиды vCP2294.
[0027] На фигуре 13 показана карта области СЗ плазмиды vCP2294 с местоположением праймеров.
[0028] На фигуре 14 приведена последовательность плазмиды vCP2294 (аннотированная).
[0029] На фигуре 15 представлена схема клонирования для изготовления плазмиды VCP2296.
[0030] На фигуре 16 показана карта области С5уплазмиды СР2296 с местоположением праймеров.
[0031] На фигуре 17 представлена схема клонирования для изготовления плазмиды VCP2295.
[0032] На фигуре 18 приведена последовательность плазмиды VCP2295.
[0033] Фигура 19 представляет собой график, показывающий эволюцию среднего уровня провирусемии в пересчете на группу после заражения.
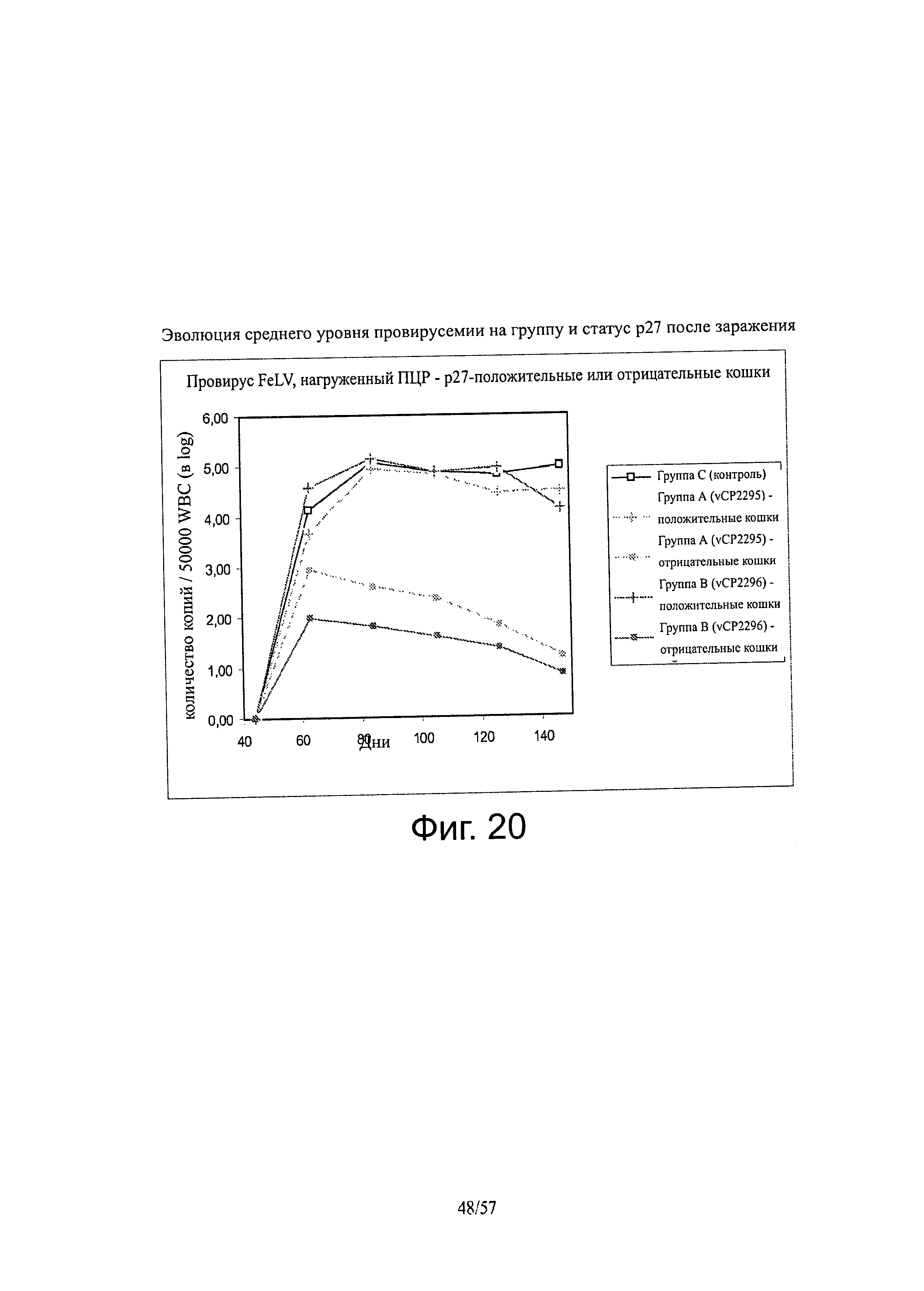
[0034] Фигура 20 представляет собой график, показывающий эволюцию среднего уровня провирусемии в пересчете на группу и статус р27 после заражения.
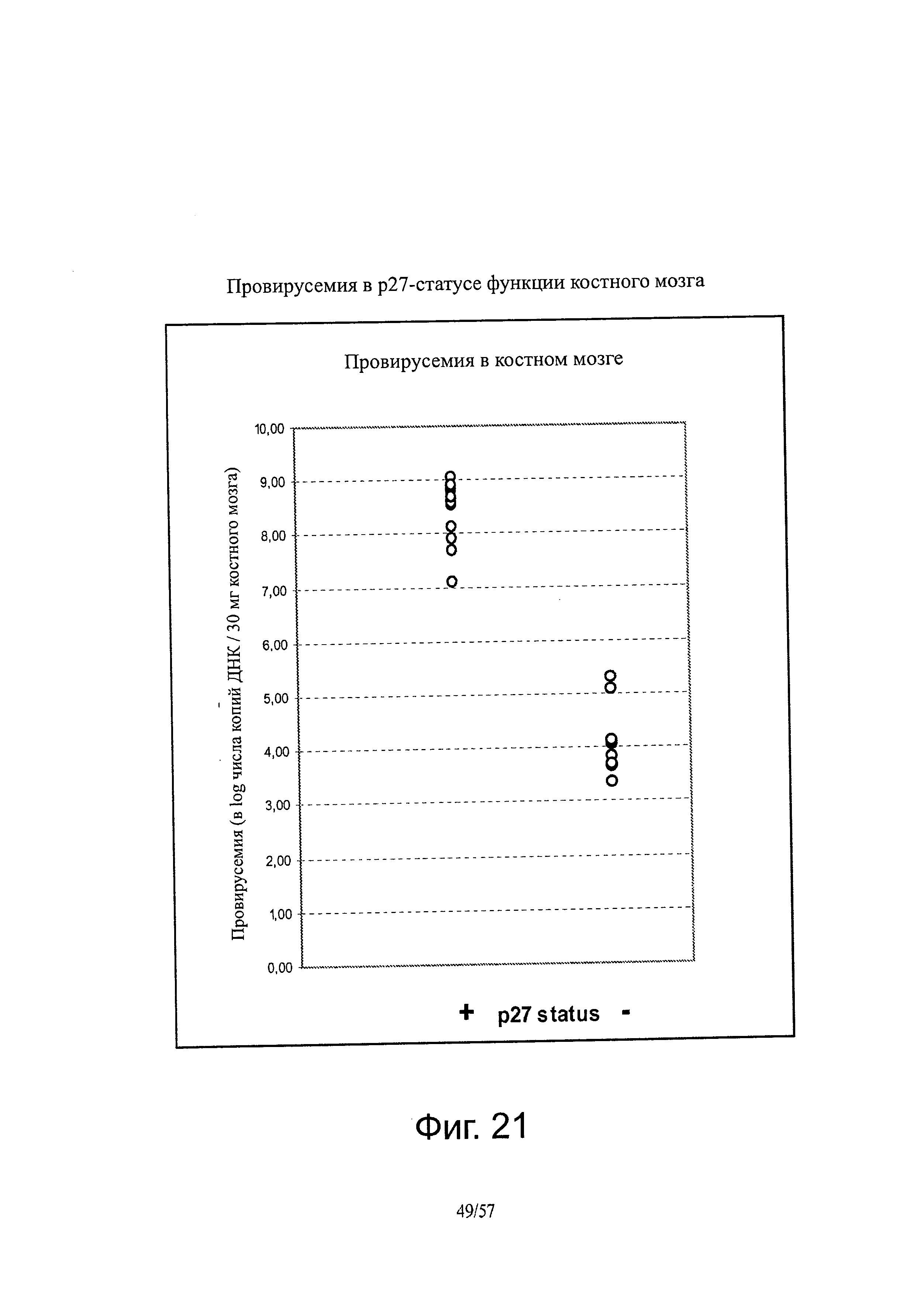
[0035] Фигура 21 представляет собой график, показывающий провирусемию в костном мозге, коррелирующую со статусом р27.
[0036] На фигуре 22 показан специфический IFN-ответ FELV на D35.
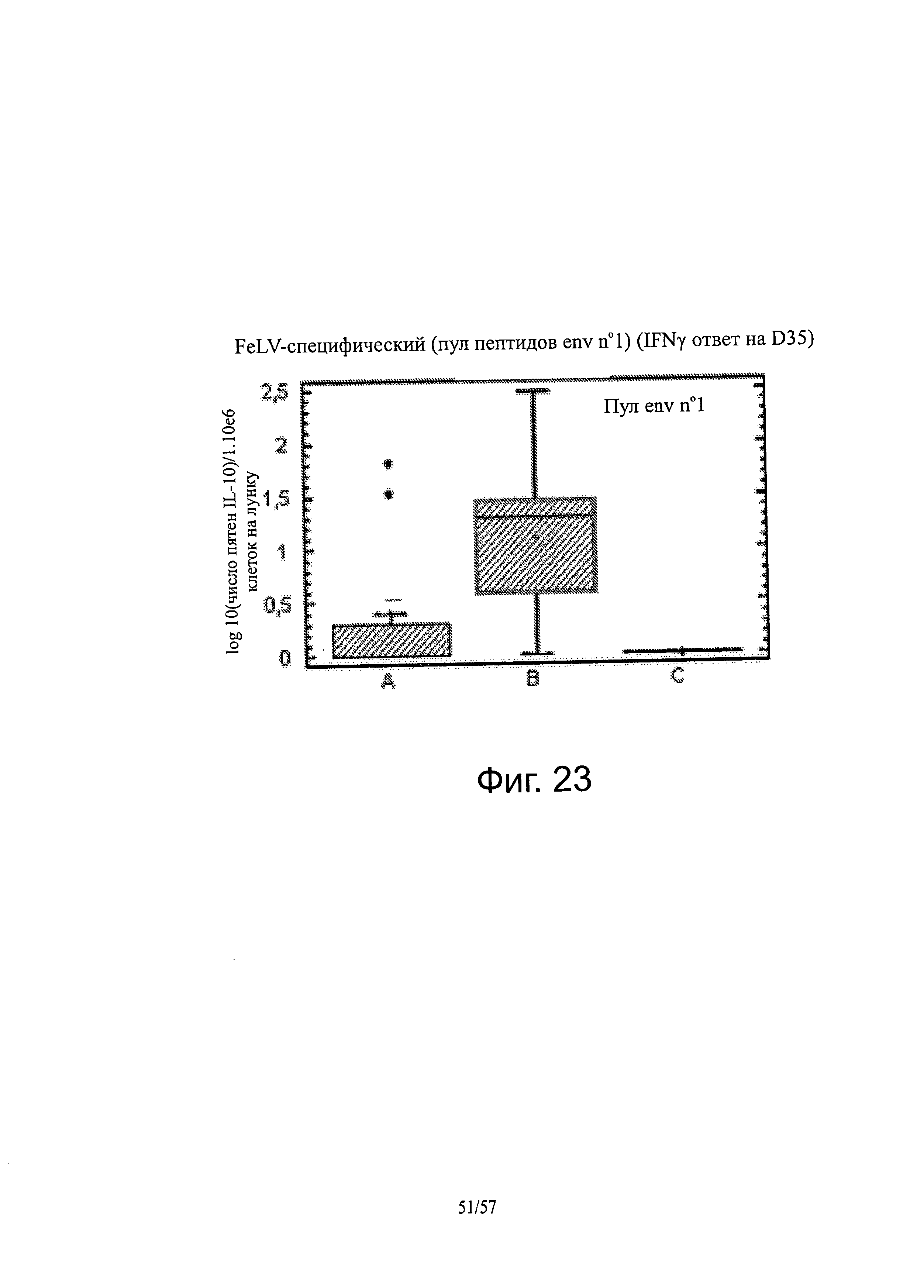
[0037] На фигуре 23 показан FELV-специфический (ENV-пептидный пул №1) IFNγ-ответ на D35.
[0038] На фигуре 24 показана FELV-специфический (ENV-пептидные пулы) IL-10-ответ на D35.
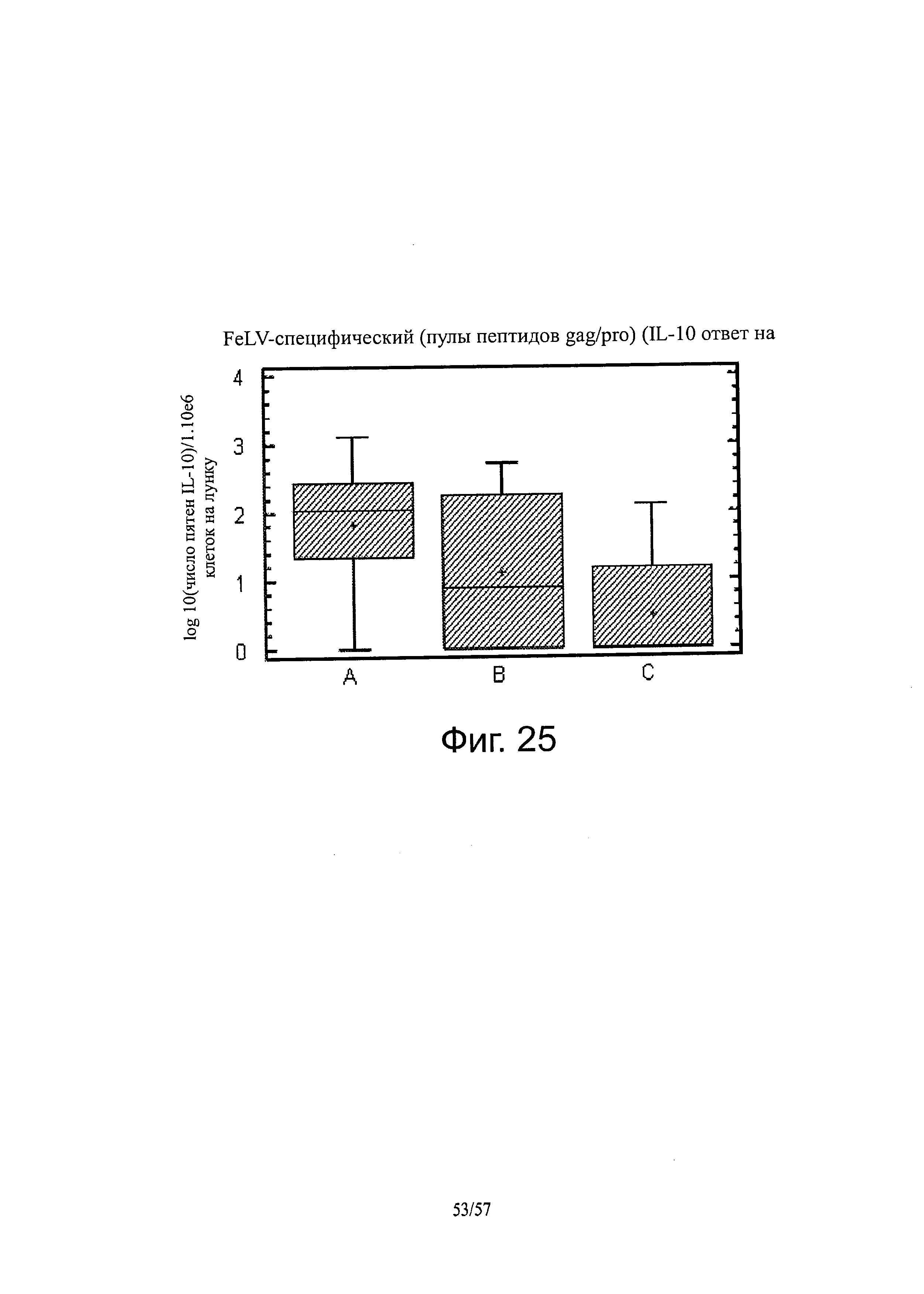
[0039] На фигуре 25 показано FELV-специфический (пептидные пулы GAG/PRO) - IL-20-ответ на D35.
[0040] На фигурах 26 a-b представлено FELV-специфическое (стимуляция ENV) - отношение IFNγ/IL-10 на D35.
[0041] На фигуре 27 представлен FELV-специфический (стимуляция GAG/PRO) - IFNγ-ответ на D126.
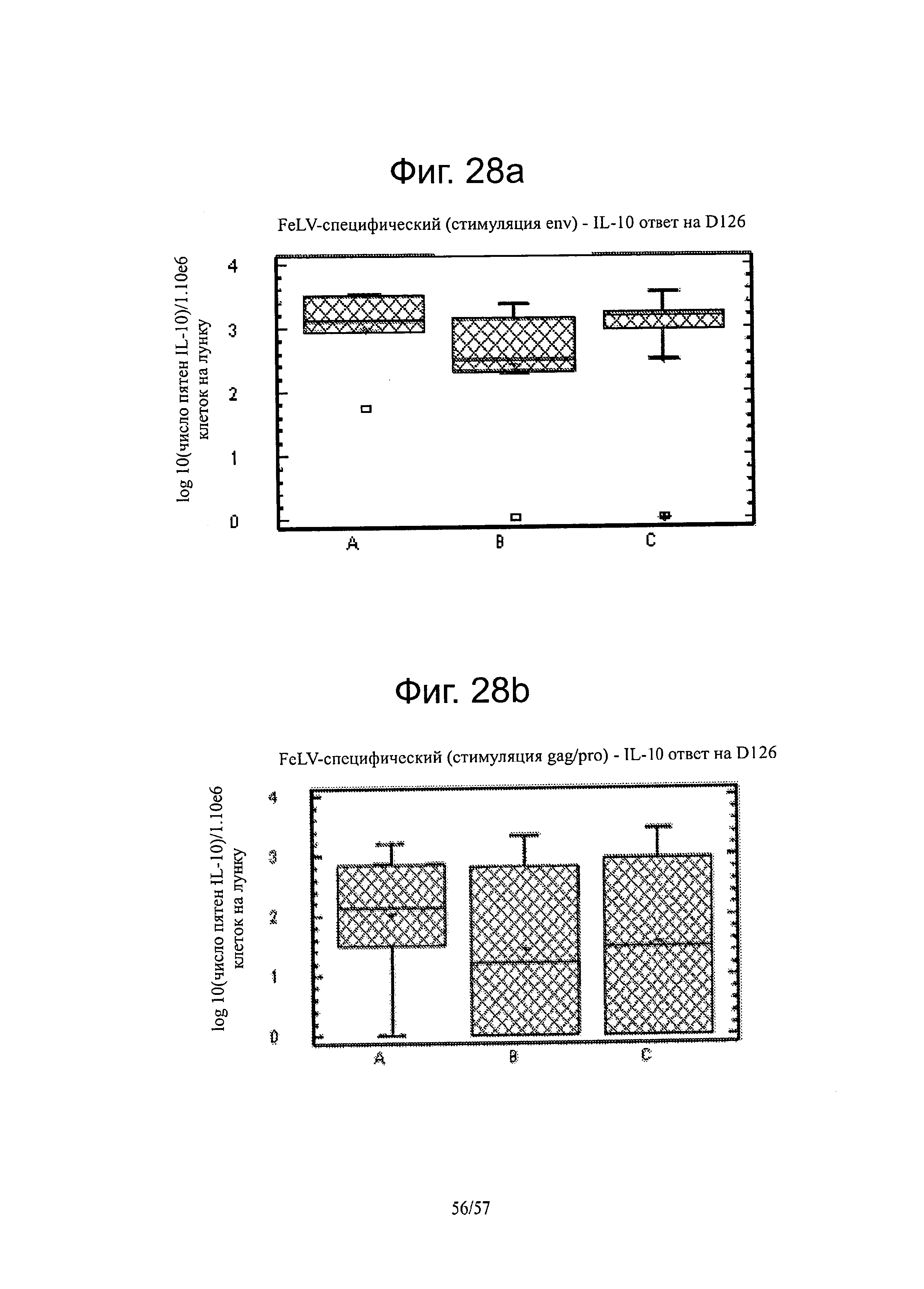
[0042] На фигуре 28а представлен FELV-специфический (стимуляция ENV) - IL-10-ответ на D126. На фигуре 28b представлен FELV-специфический (стимуляция GAG/PRO) - IL-10-ответ на D126.
[0043] На фигуре 29 представлено FELV-специфическое отношение IFNγ/IL-10 пептидных пулов ENV и GAG/PRO FELV на D35.
Подробное описание
[0044] Следует отметить, что в данном описании и, в особенности, в формуле изобретения, такие понятия, как "содержит", "содержащийся", "содержащий" и т.п. могут иметь значения, присвоенные им в патентном законодательстве США, например, они могут означать "включает в себя", "включено", "включающий" и т.п., и что такие понятия, как "состоящий по существу из" и "состоит по существу из" имеют значение, приписанное им в патентном законодательстве США, например, они позволяют, чтобы элементы прямо не перечислялись, но исключают элементы, которые находимы в предшествующем уровне техники или которые влияют на или основную или новую характеристику изобретения.
[0045] Если не указано иное, технические термины используются в соответствии с обычным употреблением. Определения общих терминов в области молекулярной биологии можно найти у Benjamin Lewin, Genes V. опубликовано Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.). The Encyclopedia of Molecular Biology, опубликовано Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); и Robert A. Meyers (ed.), Molecular Biology and Biotechnology: a Comprehensive Desk Reference, опубликовано VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8).
[0046] Артикли единственного числа "a", "an" и "the" включают в себя множественное число, если в контексте явно не указано иное. Сходным образом, слово "или" предназначено для включения "и", если из контекста явно не следует иное. Слово "или" означает любой член определенного списка, а также включает в себя любую комбинацию членов данного списка.
[0047] Термин "полипептид или ДНК ENV FeLV" относится к любому нативному или оптимизированному/мутированному полипептиду или ДНК ENV FeLV и их производным и вариантам. Например, оптимизированная/мутированная ДНК ENV FeLV может быть кодон-оптимизированной ДНК FeLV, ДНК ENV FeLV может быть оптимизирована для получения единичной аминокислотной мутации в полипептиде FeLV. Оптимизированный/мутированный полипептид ENV FeLV может содержать мутацию одной аминокислоты или мутацию двух аминокислот или мутацию многих аминокислот.
[0048] Термин "животное" используется здесь, чтобы включить всех млекопитающих, птиц и рыб. Животное в целях настоящего изобретения может быть выбрано из группы, состоящей из семейства лошадиных (например, лошадь), семейства собачьих (например, собаки, волки, лисы, волки, шакалы), семейства кошачьих (например, львы, тигры, домашние кошки, дикие кошки, другие большие кошки и другие животные из семейства кошачьих, включая гепардов и рысей), семейства жвачных (например, крупный рогатый скот), семейства свиней (например, свинья), семейства овец (например, овцы, козы, ламы, зубры), семейства птичьих (например, курица, утка, гусь, индейка, перепела, фазаны, попугаи, зяблики, ястреб, ворона, страус, эму и казуар), приматов (например, полуобезьяна, долгопят, обезьяна, гиббон, обезьяны), людей и рыб. Термин "животное" также включает в себя отдельное животное на всех стадиях развития, включая эмбриональный и фетальный стадии.
[0049] Термины "полипептид" и "белок" используются в данном описании взаимозаменяемо для обозначения полимера последовательных аминокислотных остатков.
[0050] Термин "нуклеиновая кислота", "нуклеотид" и "полинуклеотид" относится к РНК или ДНК и их производным, таким как аналоги, содержащие модифицированные остовы. Следует иметь в виду, что настоящее изобретение относится к полинуклеотидам, содержащим последовательности, комплементарные тем, которые описаны в настоящем документе. Полинуклеотиды согласно изобретению могут быть получены различными способами (например, химическим синтезом, клонированием генов и т.д.) и могут принимать различные формы (например, линейная или разветвленная, одно- или двухцепочечная или их гибрид, праймеры, зонды и т.д.).
[0051] Термин "ген" используется в широком смысле для обозначения любого сегмента полинуклеотида, связанного с биологической функцией. Таким образом, гены или полинуклеотиды включают в себя интроны и экзоны, как в геномной последовательности, или только кодирующие последовательности, как в кДНК, такие как открытой рамки считывания (open reading frame (ORF), начиная от стартового кодона (метионин-кодон) и заканчивая сигналом терминации (стоп-кодон). Гены и полинуклеотиды также могут включать в себя области, которые регулируют их экспрессию, например, инициации транскрипции, трансляции и терминации транскрипции. Таким образом, также включены промоторы и области связывания рибосомы (обычно эти регуляторные элементы лежат приблизительно от 60 до 250 нуклеотидов выше по направлению транскрипции от стартового кодона кодирующей последовательности или гена; Doree S M et al.; Pandher K et al.; Chung J Y et al.), терминаторы транскрипции (обычно, терминатор находится в пределах приблизительно 50 нуклеотидов ниже по направлению транскрипции от стоп-кодона кодирующей последовательности или гена; Ward С K et al.). Ген или полинуклеотид также относится к фрагменту нуклеиновой кислоты, который экспрессирует мРНК или функциональную РНК или кодирует специфический белок, и который включает в себя регуляторные последовательности.
[0052] Термин "иммуногенный полипептид" или "иммуногенный фрагмент", используемый здесь, относится к полипептиду или фрагменту полипептида, который содержит аллель-специфической мотив, эпитоп или другую последовательность таким образом, что полипептид или фрагмент связываются с молекулой МНС и индуцируют цитотоксический ответ Т-лимфоцитов ("cytotoxic Т lymphocyte, CTL") и/или ответ В-клеток (например, продуцирование антител), и/или ответ лимфоцитов Т-хелперов и/или ответ гиперчувствительности замедленного типа (delayed type hypersensitivity, DTH) против антигена, из которого получен иммуногенный полипептид или иммуногенный фрагмент. DTH-ответ представляет собой иммунную реакцию, в которой зависимая от Т-клеток активация макрофагов и воспаление являются причиной повреждения тканей. DTH-реакция на подкожную инъекцию антигена часто используется в качестве анализа на клеточно-опосредованный иммунитет.
[0053] По определению, эпитоп представляет собой антигенную детерминанту, которая является иммунологически активной в том смысле, что, будучи только введенным хозяину, он способен вызывать иммунный ответ гуморального (В-клетки) и/или клеточного типа (Т-клетки). Это определенные химические группы или пептидные последовательности на молекуле, которые являются антигенными. Антитело специфически связывается с определенным антигенным эпитопом на полипептиде. Определенные, не ограничивающие примеры эпитопа включают в себя последовательность из от четырех до пяти пептидных остатков в полипептиде, последовательность из от трех до пяти гликозидных остатков в полисахариде. В животном организме большинство антигенов представит несколько или даже много антигенных детерминант одновременно. Такой полипептид также может быть квалифицирован как иммуногенный полипептид, и эпитоп может быть идентифицирован, как описано далее.
[0054] "Изолированный" биологический компонент (например, нуклеиновая кислота или белок или органелла) относится к компоненту, который был по существу отделен или очищен от других биологических компонентов в клетке организма, в котором данный компонент встречается естественным образом, для примера, от других хромосомной и экстра-хромосомной ДНК и РНК, белков и органелл. Нуклеиновые кислоты и белки, которые были "изолированы", включают в себя нуклеиновые кислоты и белки, очищенные стандартными способами очистки. Данный термин также охватывает нуклеиновые кислоты и белки, полученные с помощью рекомбинантной техники, а также химического синтеза.
[0055] Понятие "очищенный" в целях настоящего изобретения не требует абсолютную чистоту, а скорее, он предназначен как относительное понятие. Так, например, препарат очищенного полипептида представляет собой препарат, в котором полипептид более обогащен, чем полипептид в своем природном окружении. Препарат полипептида по существу очищен так, что данный полипептид представляет несколько вариантов осуществления, составляя по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% от общего содержания полипептидов в препарате. То же самое относится к полинуклеотидам. Полипептиды, описанные здесь, могут быть очищены любым из способов, известных в данной области.
[0056] Рекомбинантный полинуклеотид представляет собой такой полинуклеотид, который имеет последовательность, которая не встречается в природе или имеет последовательность, которая сделана искусственным объединением двух, в иных случаях, разделенных сегментов последовательности. Такое искусственное сочетание часто осуществляется химическим синтезом или, чаще, искусственным манипулированием изолированными сегментами нуклеиновых кислот, например, с использованием способов генетической инженерии. В одном варианте осуществления рекомбинантный полинуклеотид кодирует слитый белок.
[0057] Один объект настоящего изобретения относится к оптимизированным или мутантным полипептидам из FeLV. Другой объект настоящего изобретения относится к оптимизированным или мутантным полипептидам ENV FeLV. Еще один объект настоящего изобретения относится к оптимизированному белку ENV FeLV, в котором мутация происходит, но не ограничиваясь этим, в положении аминокислоты 527 в SEQ ID NO:2, 4, 6, 27, 28, 29, 30, 31, 32, 33, 34 или 43 или в положении аминокислоты 533 в SEQ ID NO:7. Еще один объект настоящего изобретения относится к мутации, которая представляет собой замену аргинина (R), аспарагиновой кислоты (D) или метионина (М) на глутаминовую кислоту (Е) в положении аминокислоты 527 в SEQ ID NO:2, 4, 6, 27, 28, 29, 30, 31, 32, 33, 34 или 43 или в положении аминокислоты 533 в SEQ ID NO:7. Специалисту в данной области следует понимать, что на основе выравнивания последовательностей описанная мутация охватывает мутацию в соответствующем положении аминокислоты в других полипептидах ENV FeLV, которые не перечислены в настоящей заявке, где соответствующее положение аминокислоты эквивалентно положению аминокислоты 527 в SEQ ID NO:2, 4, 6, 27, 28, 29, 30, 31, 32, 33, 34 или 43 или аминокислоты в положении 533 в SEQ ID NO:7. Выравнивание белковых последовательностей некоторых из полипептидов ENV FeLV иллюстрируется на фигуре Id. В одном варианте осуществления оптимизированный или мутантный полипептид ENV FeLV содержит аминокислотную мутацию в положении аминокислоты 527 в SEQ ID NO:6 или в соответствующем положении аминокислоты белков ENV FeLV. В еще одном варианте осуществления оптимизированный или мутантный полипептид ENV FeLV содержит замену аминокислоты R, D или М на Е в положении аминокислоты 527 в SEQ ID NO:6 или в соответствующем положении аминокислоты полипептида ENV FeLVa. В еще одном варианте осуществления оптимизированный или мутантный полипептид ENV FeLV содержит аминокислотную замену R на Е в положении аминокислоты 527 в SEQ ID NO:6 или в соответствующем положении аминокислоты полипептида ENV FeLVa. В еще одном варианте осуществления мутантный полипептид ENV FeLV имеет последовательность, представленную в SEQ ID NO:2, 4, 7 или 43.
[0058] Кроме того, гомологи полипептидов из FeLV предназначены, чтобы быть в пределах объема настоящего изобретения. В целях настоящего изобретения, термин "гомологи" включает в себя ортологи, аналоги и паралоги. Термин аналоги" относится к двум полинуклеотидам или полипептидам, которые имеют такую же или аналогичную функцию, но которые эволюционировали порознь в неродственных организмах. Термин "ортологи" относится к двум полинуклеотидам или полипептидам из разных видов, но которые произошли от общего гена-предшественника видообразованием. Как правило, ортологи кодируют полипептиды, имеющие такие же или аналогичные функции. Термин "паралоги" относится к двум полинуклеотидам или полипептидам, которые связаны с друг другом процессом дупликации гена в геноме. Паралоги обычно имеют разные функции, но данные функции могут быть родственны друг другу. Аналоги, ортологи и паралоги полипептида FeLV дикого типа могут отличаться от полипептида FeLV дикого типа посттрансляционными модификациями, различиями в аминокислотной последовательности или тем и другим. В частности, гомологи по данному изобретению будут обычно проявлять по меньшей мере от 80 до 85%, от 85 до 90%, от 90 до 95% или 95%, 96%, 97%, 98%, 99% идентичности последовательностей со всеми или частью полипептидной или полинуклеотидной последовательностями FeLV дикого типа и будет демонстрировать аналогичную функцию.
[0059] Другой объект настоящего изобретения относится к оптимизированному или мутированному полипептиду ENV FeLV, имеющему по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, 96%, 97%, 98% или 99% идентичности последовательности с полипептидом, имеющим последовательность, представленную в SEQ ID NO:2, 4, 6, 27, 28, 29, 30, 31, 32, 33 или 34.
[0060] Еще один объект настоящего изобретения относится к фрагментам и вариантам оптимизированных или мутированных полипептидов ENV FeLV, упомянутых выше, которые могут быть легко получены специалистом в данной области с использованием хорошо известных способов молекулярной биологии.
[0061] Варианты представляют собой гомологичные полипептиды, имеющие аминокислотную последовательность, по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности, представленную в SEQ ID NO:2, 4, 6, 27, 28, 29, 30, 31, 32, 33 или 34.
[0062] Варианты включают в себя аллельные варианты. Термин "аллельный вариант" относится к полинуклеотиду или полипептиду, содержащему полиморфизмы, которые приводят к изменениям в аминокислотных последовательностях белка и которые существуют в природной популяции (например, вид или разновидность вируса). Такие природные аллельные вариации могут обычно приводить к от 1 до 5% дисперсии в полинуклеотиде или полипептиде. Аллельные варианты могут быть идентифицированы секвенированием последовательности интересующей нуклеиновой кислоты в ряде различных видов, которое может быть легко осуществлено с помощью гибридизационных зондов для определения того же генетического локуса гена в данных видах. Любые и все такие вариации нуклеиновых кислот и получаемые в результате полиморфизмы аминокислот или изменения, которые являются результатом изменения природных аллелей и которые не изменяют функциональную активность интересующего гена, предназначены, чтобы быть в пределах объема настоящего изобретения.
[0063] В целях настоящего изобретения, термин "производное" или "вариант" относится к полипептиду или нуклеиновой кислоте, кодирующей полипептид, который имеет одно или более изменений консервативных аминокислот или другие незначительные изменения, такие, что (1) соответствующий полипептид имеет по существу эквивалентную функцию по сравнению с полипептидом дикого типа или (2) антитело, выработанное против полипептида, является иммунореактивным с полипептидом дикого типа. Данные варианты или производные включают в себя полипептиды, имеющие незначительные модификации первичных аминокислотных последовательностей оптимизированного или мутированного полипептида ENV FeLV, которые могут привести к появлению пептидов, имеющих по существу эквивалентную активность по сравнению с немодифицированным аналогом полипептида. Такие модификации могут быть преднамеренными, как с помощью сайт-направленного мутагенеза, или могут быть спонтанными. Термин "вариант" дополнительно предусматривает делеции, добавления и замены в последовательности, до тех пор пока полипептид функционирует для получения иммунного ответа, как определено здесь. Модификациями могут быть любое изменение аминокислоты в положениях аминокислот, отличных от положения 527 из SEQ ID NO:2, 4, 6, 27, 28, 29, 30, 31, 32, 33, 34 или 43, или в положении 533 аминокислоты из SEQ ID NO:7.
[0064] Термин "консервативный вариант" означает замену аминокислотного остатка другим биологически аналогичным остатком или замену нуклеотида в последовательности нуклеиновой кислоты таким образом, что закодированный аминокислотный остаток не изменяется или представляет собой другой биологически аналогичный остаток. В этом отношении особенно предпочтительные замены обычно будут консервативными по своей природе, т.е. те замены, которые имеют место внутри семейства аминокислот. Например, аминокислоты в целом разделены на четыре семейства: (1) кислые - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан и (4) незаряженные полярные - глицин, аспарагин, глутамин, цистеин, серии, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Примеры консервативных вариантов включают в себя замещение одного гидрофобного остатка, такого как изолейцин, валин, лейцин или метионин на другой гидрофобный остаток, или замещение одного полярного остатка на другой полярный остаток, такое как замещение аргинина на лизин, глутаминовой кислоты на аспарагиновую кислоту или глутамина на аспарагин и тому подобное, или аналогичное консервативное замещение аминокислоты структурно родственными аминокислотами, которые не будут иметь существенное влияние на биологическую активность. Белки, имеющие по существу такую же аминокислотную последовательность, как эталонная молекула, но обладающие незначительными заменами аминокислот, которые существенно не влияют на иммуногенность белка, находятся, таким образом, в рамках определения эталонного полипептида. Все полипептиды, полученные в результате таких модификаций, включены в данный документ. Термин "консервативный вариант" также включает в себя применение замещенной аминокислоты вместо незамещенной родительской аминокислоты при условии, что антитела, выработанные к замещенному полипептиду, также имеют иммунную реакцию по отношению к незамещенному полипептиду.
[0065] Иммуногенный фрагмент полипептида ENV FELV содержит по меньшей мере 8, 10, 15 или 20 последовательных аминокислот, по меньшей мере 21 аминокислот, по меньшей мере 23 аминокислот, по меньшей мере 25 аминокислот или по меньшей мере 30 аминокислот из полипептида ENV FeLV, имеющие последовательность, как представлено в SEQ ID NO:2, 4, 6, 7, 27, 28, 29, 30, 31, 32, 33, 34 или 43, или их варианты. В другом варианте осуществления фрагмент полипептида ENV FELV включает в себя специфический антигенный эпитоп, найденный на полноразмерном полипептиде ENV FeLVa.
[0066] Процедуры для определения фрагментов полипептида и эпитопа, такие как генерирование библиотек перекрывающихся пептидов (Hemmer В. et al.), Pepscan (Geysen H. M. et al., 1984; Geysen H. M. et al., 1985; Van der Zee R. et al.; Geysen H. M.) и алгоритмы (De Groot A. et al.; Hoop T. et al.; Parker K. et al.), могут быть использованы в практике настоящего изобретения без ненужного экспериментирования. Как правило, антитела специфически связываются с определенным антигенным эпитопом. Определенные, не ограничивающие примеры эпитопов включают в себя последовательность из от четырех до пяти пептидных остатков в полипептиде, последовательность из от трех до пяти гликозидных остатков в полисахариде. У животных большинство антигенов представит несколько или даже много антигенных детерминант одновременно. Предпочтительно, где эпитоп представляет собой белковый фрагмент более крупной молекулы, он будет иметь по существу ту же иммунологическую активность как и весь белок.
[0067] Один объект настоящего изобретения относится к полинуклеотиду, кодирующему полипептид ENV FeLV. Другой объект настоящего изобретения относится к полинуклеотиду ENV FeLV, кодирующему мутантный или оптимизированный полипептид ENV FeLV, в котором мутация происходит в положении аминокислоты 527 в SEQ ID NO:2, 4, 6, 27, 28, 29, 30, 31, 32, 33, 34 или 43, или в положении аминокислоты 533 в SEQ ID NO:7. Еще один объект настоящего изобретения относится к полинуклеотиду ENV FeLV, кодирующему оптимизированный или мутантный полипептид ENV FeLV, где мутация представляет собой замену аргинина (R), аспарагиновой кислоты (D) или метионина (М) на глутаминовую кислоту (Е) в положении аминокислоты 527 из SEQ ID NO:2, 4, 6, 7, 28, 29, 30, 31, 32, 33, 34 или 43, или в положении аминокислоты 533 в SEQ ID NO:7. Еще один объект настоящего изобретения относится к полинуклеотиду ENV FeLV, кодирующему оптимизированный или мутантный полипептид ENV FeLV, имеющий аминокислотную мутацию в положении аминокислоты 527 в SEQ ID NO:6 или в соответствующем положении аминокислоты белков ENV FeLV. Другой объект настоящего изобретения относится к полинуклеотиду ENV FeLV, кодирующему оптимизированный или мутантный полипептид ENV FeLV, имеющий аминокислотную замену Е на R, D или М в положении аминокислоты 527 в SEQ ID NO:6 или в соответствующем положении аминокислоты полипептида ENV FeLV. Еще один объект настоящего изобретения относится к полинуклеотиду ENV FeLV, кодирующему оптимизированный или мутантный полипептид ENV FeLV, имеющий аминокислотную замену Е на R в положении аминокислоты 527 в SEQ ID NO:6 или в соответствующем положении аминокислоты полипептида ENV FeLVa. В еще одном варианте осуществления полинуклеотид ENV FeLV кодирует полипептид ENV FeLV, имеющий последовательность, представленную в SEQ ID NO:2, 4, 7 или 43. В еще одном варианте осуществления полинуклеотид ENV FeLV кодирует полипептид ENV FeLV, имеющий по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, 96%, 97%, 98% или 99% идентичности последовательности с полипептидом, имеющим последовательность, представленную в SEQ ID NO:2, 4, 6, 7, 27, 28, 29, 30, 31, 32, 33, 34 или 43, или консервативный вариант, аллельный вариант, гомолог или иммуногенный фрагмент, содержащий по меньшей мере восемь или по меньшей мере десять последовательных аминокислот одного из данных полипептидов или комбинацию данных полипептидов.
[0068] Другой объект настоящего изобретения относится к полипептиду GAG-PRO FeLV, имеющему по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, 96%, 97%, 98% или 99% идентичности последовательности с полипептидом, имеющим последовательность, представленную в SEQ ID NO:12.
[0069] Другой объект настоящего изобретения относится к полинуклеотиду ENV FeLV, имеющему нуклеотидную последовательность, как указано в SEQ ID NO:1, 3 или 5, или его варианту. Еще один объект настоящего изобретения относится к полинуклеотиду ENV FeLV, имеющему по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 95%, 96%, 97%, 98% или 99% идентичности последовательности с полинуклеотидом, имеющим последовательность, представленную в SEQ ID NO:1, 3 или 5, или его вариантом.
[0070] Еще один объект настоящего изобретения относится к полинуклеотиду GAG-PRO FeLV, имеющему по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 95%, 96%, 97%, 98% или 99% идентичности последовательности с полинуклеотидом, имеющим последовательность, представленную в SEQ ID NO:10 или 11, или его вариантом.
[0071] Данные полинуклеотиды могут включать в себя последовательности ДНК, кДНК и РНК, которые кодируют полипептиды ENV или GAG-PRO FeLV. Понятно, что все полинуклеотиды, кодирующие полипептиды ENV или GAG-PRO FeLV, также включены в данном документе, пока они кодируют полипептид с распознанной активностью, такой как связывание с антителом, которое распознает полипептид, индукция иммунного ответа на полипептид, или воздействие на выживаемость при заболевании лейкемией, когда его вводят субъекту, который подвергается воздействию паразита или у которого наблюдается уменьшение в проявлении или симптоме FeLV-инфекции.
[0072] Полинуклеотиды настоящего раскрытия включают в себя последовательности, которые являются вырожденными как результат генетического кода, например, с использованием кодона, оптимизированного для определенного хозяина. В целях настоящего изобретения "оптимизированный" относится к полинуклеотиду, который генетически модифицируют, чтобы увеличить его экспрессию в данном виде. Чтобы обеспечить оптимизированные полинуклеотиды, кодирующие полипептид ENV или GAG-PRO FeLV, последовательность ДНК гена ENV или GAG-PRO FeLV могут быть изменены с тем, чтобы 1) содержать ко доны, предпочитаемые генами, характеризующимися высоким уровнем экспрессии генов в определенном виде; 2) характеризоваться содержанием А+Т или G+С в составе нуклеотидных оснований, которое по существу найдено в упомянутом виде; 3) образовать последовательность инициации упомянутого вида; или 4) удалить последовательности, которые вызывают дестабилизацию, неуместное полиаденилирование, деградацию и терминацию РНК или которые образуют шпильки вторичной структуры или участки сплайсинга РНК. Повышенная экспрессия белка FeLV в упомянутом виде может быть достигнута за счет использования частоты распределения использования кодонов у эукариот и прокариот, или в определенном виде. Термин "частота предпочтительного использования кодонов" относится к предпочтению, проявляемому определенной клеткой-хозяином в использовании нуклеотидных кодонов для указания данной аминокислоты. Имеется 20 природных аминокислот, большинство из которых определяются более чем одним кодоном. Таким образом, все вырожденные нуклеотидные последовательности включены в данное раскрытие до тех пор, пока аминокислотная последовательность полипептида FeLV, кодируемая нуклеотидной последовательностью, функционально не изменяется.
[0073] Идентичность последовательностей между двумя аминокислотными последовательностями может быть установлена попарным сравнением по алгоритму BLAST NCBI (National Center for Biotechnology Information, Национальный центр биотехнологической информации) и матрице BLOSUM62, используя стандартные параметры (см., например, алгоритм BLAST или BLASTX, доступные на сайте сервера "National Center for Biotechnology Information"(NCBI, Bethesda, MD, США), а также у Altschul et al.; и, таким образом, в данном документе алгоритмы или BLAST или BLASTX с матрицей BLOSUM62 обозначены термином "бласты").
[0074] Идентичность последовательностей между двумя нуклеотидными последовательностями также можно определить, используя программу "Align" Myers and Miller, ("Optimal Alignments in Linear Space", CABIOS 4, 11-17, 1988) и доступную в NCBI, а также ту же или другие программы, доступные через Интернет на сайтах с ними, таких как сайт NCBI.
[0075] Альтернативно или дополнительно, термин "идентичность", например, по отношению к нуклеотидной или аминокислотной последовательности, может указывать на количественную меру гомологии между двумя последовательностями. Процент гомологии последовательности может быть вычислен как:
[0076] (Nref-Ndif)*100/Nref, где Ndif представляет собой общее число неидентичных остатков в двух последовательностей при выравнивании и где Nref представляет собой количество остатков в одной из последовательностей. Таким образом, последовательность ДНК AGTCAGTC будет иметь 75% идентичности последовательности с последовательностью ААТСААТС (Nref=8; Ndif=2).
[0077] Альтернативно или дополнительно, "идентичность" в отношении последовательностей может относиться к числу позиций с идентичными нуклеотидами или аминокислотами, разделенному на число нуклеотидов или аминокислот в более короткой из двух последовательностей, где выравнивание двух последовательностей может определяется в соответствии с алгоритмом Уилбур и Липман (Wilbur and Lipman), например, с использованием размера окна в 20 нуклеотидов, длины слова из 4 нуклеотидов и штрафа за пробел, равного 4, и компьютерный анализ и интерпретация данных последовательностей, включая выравнивание, можно удобно проводить с использованием коммерчески доступных программ (например, Intelligenetics™ Suite, Intelligenetics Inc. CA). Когда говорят, что последовательности РНК похожи или имеют степень идентичности последовательностей или гомологию с последовательностями ДНК, считается, что количество тимидина (Т) в последовательности ДНК равно количеству урацила (U) в последовательности РНК. Таким образом, последовательности РНК находятся в пределах объема настоящего изобретения и могут быть получены из последовательностей ДНК, считая количество тимидина (Т) в последовательности ДНК равным количеству урацила (U) в последовательностях РНК.
[0078] Идентичность последовательностей или сходство последовательностей для двух аминокислотных последовательностей, или идентичность последовательностей для двух нуклеотидных последовательностей можно определить с помощью пакета программного обеспечения Vector NTI (Invitrogen, 1600 Faraday Ave., Carlsbad, CA).
[0079] Полинуклеотиды ENV или GAG-PRO FeLV могут включать в себя рекомбинантную ДНК, которая встроена в вектор, в автономно реплицируемую плазмиду или вирус, или в геномную ДНК прокариота или эукариота, или которая существует в виде отдельной молекулы (например, кДНК) независимо от других последовательностей.
[0080] Рекомбинантные векторы, описанные в данном документе, могут включать в себя полинуклеотид, кодирующий полипептид, его вариант или его фрагмент. Рекомбинантные векторы могут включать в себя плазмиды и вирусные векторы и могут быть использованы для in vitro или in vivo экспрессии. Рекомбинантные векторы могут включать в себя дополнительно сигнальный пептид. Сигнальные пептиды представляют собой короткие пептидные цепи (длиной от 3 до 60 аминокислот), которые направляют посттрансляционный транспорт белка (который синтезируется в цитоплазме) к некоторым органеллам, таким как ядро, митохондриальный матрикс, эндоплазматический ретикулум, хлоропласт, апопласт и пероксисома. Как правило, природные белки ENV FELV могут быть транслированы как предшественники, имеющие N-концевую последовательность сигнального пептида и домен "зрелого" белка. Сигнальный пептид может быть быстро отщеплен во время трансляции. Сигнальная последовательность может представлять собой естественную последовательность из белка ENV FeLV или сигнальный пептид из секретируемого белка, например, сигнальный пептид из белка тканевого активатора плазминогена (tPA), в частности, человеческий tPA (S. Friezner Degen et al.; R. Rickles et al.; D. Berg. et al.), или сигнальный пептид из инсулин-подобного фактора роста 1 (IGF1), в частности, лошадиный IGF1 (K. Otte et al.), собачий IGF1 (Р. Delafontaine et al.), кошачий IGF1 (WO03/022886), бычий IGF1 (S. Lien et al.), свиной IGF1 (М. Muller et al.), куриный IGF1 (Y. Kajimoto et al.), индюшачий IGF1 (номер доступа GenBank AF074980). Сигнальный пептид из IGF1 могут быть природным или оптимизированным, что может быть достигнуто удалением криптических сайтов сплайсинга и/или адаптацией в отношении использования кодонов. Во время трансляции непроцессированный полипептид может быть расщеплен в сайте расщепления, что приводит к зрелому полипептиду. Сайт расщепления может быть предсказан с использованием способа Von Heijne(1986).
[0081] Плазмида может включать в себя блок транскрипции ДНК, например, последовательность нуклеиновой кислоты, которая позволяет реплицировать плазмиду в клетке-хозяине, такая как сайт инициации репликации (прокариотический или эукариотический). Плазмида может также включать в себя один или более селективные маркерные гены и другие генетические элементы, известные в данной области техники. Круглые и линейные формы плазмид охватываются настоящим изобретением.
[0082] Еще один объект настоящего изобретения относится к вектору экспрессии in vivo, содержащему полинуклеотидную последовательность, которая содержит и экспрессирует in vivo в организме хозяина оптимизированные или мутантные полипептиды ENV FeLV и/или их варианты или их фрагменты. Вектор экспрессии может дополнительно содержать полинуклеотид, кодирующий полипептид GAG-PRO FeLV и/или его варианты или фрагменты.
[0083] Вектор экспрессии in vivo может включать в себя любой блок транскрипции, содержащий представляющий интерес полинуклеотид или ген и те основные элементы для его экспрессии in vivo. Данные векторы экспрессии могут представлять собой плазмиды или рекомбинантные вирусные векторы. Для экспрессии in vivo промотор может быть вирусного или клеточного происхождения. В одном варианте осуществления промотор может представлять собой ранний промотор (CMV-промотор IE) цитомегаловируса (cytomegalovirus (CMV)), ранний или поздний промотор вируса SV40 или промотор LTR вируса саркомы Рауса (Rous), промотор гена цитоскелета, такой как промотор desmin (Kwissa M. et al.), или промотор актина (Miyazaki J. et al.). Когда несколько гены присутствуют в той же самой плазмиде, они могут быть представлены в одной транскрипционной единице или в различных единицах.
[0084] В целях настоящего изобретения термин "плазмида" может включать в себя любой блок транскрипции ДНК, содержащий полинуклеотид согласно изобретению и элементы, необходимые для его in vivo экспрессии в клетке или в клетках требуемого хозяина или мишени; и, в этом отношении, следует отметить, что суперскрученная или не суперскрученная, кольцевая плазмида, а также линейная форма, предназначены, чтобы быть в пределах объема настоящего изобретения. Плазмиды могут также содержать другие регулирующие транскрипцию элементы, такие как, например, стабилизирующие последовательности типа интрона. В некоторых вариантах осуществления плазмиды могут включать в себя первый интрон CMV-IE (WO 89/01036), интрон II гена бета-глобина кролика (van Ooyen et al.), сигнальную последовательность белка, кодируемую активатором плазминогена ткани (tPA; Montgomery et al.), и/или сигнал полиаденилирования (полиА), в частности, полиА из гена бычьего гормона роста (bGH) (US 5,122,458) или полиА из гена бета-глобина кролика или вируса SV40.
[0085] Еще один объект настоящего изобретения относится к композиции, содержащей: а) вектор экспрессии in vivo, где данный вектор содержит полинуклеотид, кодирующий один или более полипептид, выбранный из группы, состоящей из полипептида ENV FeLV, варианта или фрагмента полипептида ENV FeLV и их смеси, и b) фармацевтически или ветеринарно приемлемый носитель, разбавитель или эксципиент.
[0086] Другой объект настоящего изобретения относится к композиции, содержащей: а) вектор экспрессии in vivo, где данный вектор содержит полинуклеотид, кодирующий один или более полипептид, выбранный из группы, состоящей из полипептида ENV FeLV, полипептида GAG/PRO FeLV, варианта или фрагмента полипептида ENV FeLV, и их смеси, и b) фармацевтически или ветеринарно приемлемый носитель, разбавитель или эксципиент.
[0087] Еще один объект настоящего изобретения относится к композиции, содержащей: а) вектор экспрессии in vivo, где данный вектор содержит полинуклеотид, кодирующий полипептид ENV FeLV, полипептид GAG/PRO FeLV, и b) фармацевтически или ветеринарно приемлемый носитель, разбавитель или эксципиент.
[0088] Полипептиды ENV FELV и GAG/PRO FELV описаны выше.
[0089] В одном варианте осуществления настоящее изобретение относится к композиции, содержащей: а) вектор экспрессии in vivo, где данный вектор содержит полинуклеотид, кодирующий оптимизированный или мутированный ENV FeLV, имеющий замену аминокислоты R, D или М на Е в положении аминокислоты 527 в SEQ ID NO:6 или в соответствующем положении аминокислоты полипептида FeLV, и полинуклеотид, кодирующий полипептид GAG/PRO FeLV, имеющий последовательность, идентичную по меньшей мере на 90% с полипептидом, имеющим последовательность, как указано в SEQ ID NO:12, и b) фармацевтически или ветеринарно приемлемый носитель, разбавитель или эксципиент. В еще одном варианте осуществления композиция по настоящему изобретению содержит: а) вектор экспрессии, содержащий первый полинуклеотид, кодирующий полипептид, ENV FeLV, имеющий аминокислотную последовательность, как указано в SEQ ID NO:2 или 4, и второй полинуклеотид, кодирующий полипептид GAG/PRO FeLV, имеющий аминокислотную последовательность, как представлено в SEQ ID NO:12, и b) фармацевтически или ветеринарно приемлемый носитель, разбавитель или эксципиент.
[0090] Термин "композиция" включает в себя любую композицию вакцины или иммунологическую композицию, как только она была введена хозяину, включая собак, кошек и людей, которая вызывает иммунный ответ в организме хозяина, и/или защищает хозяина от лейкемии и/или которая может предотвратить имплантацию паразита, и/или которая может предотвратить развитие болезни у инфицированных субъектов, и/или которая может ограничить распространение убегающих паразитов во внутренние органы. Это может быть осуществлено после вакцинации в соответствии с настоящим изобретением посредством индукции секреции цитокинов, в частности секреции IFN-гамма (в качестве примера способа измерения секреции IFN-гамма может быть использован анализ Quantikine® immunoassay from R&D Systems Inc. (catalog number# CAIF00) (Djoba Siawaya JF et al.)).
[0091] Фармацевтически приемлемые применяемые носители или наполнители являются общепринятыми. Remington′s Pharmaceutical Sciences, by E. W. Martin, Mack Publishing Co., Easton, PA, 15th Edition (1975) описывает композиции и составы, продходящие для фармацевтической доставки полипептидов, плазмид, вирусных векторов, раскрытых в данном документе. В общем, природа носителя или эксципиента будет зависеть от специфического способа введения, который используется. Например, парентеральные составы обычно включают в себя инъекционные жидкости, которые включают в себя фармацевтически и физиологически приемлемые жидкости, такие как вода, физиологический раствор, сбалансированные солевые растворы, водный раствор декстрозы, глицерин или тому подобное, в качестве носителя. Для твердых композиций (например, лиофилизированная пастила, порошок, пилюли, таблетки или капсулы), обычные нетоксичные твердые носители или наполнители могут включать в себя, например, маннит, лактозу, крахмал или стеарат магния. В дополнение к биологически нейтральным носителям или наполнителям, иммуногенные композиции для введения могут содержать незначительные количества нетоксичных вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, консерванты и рН-буферные агенты и т.п., например ацетат натрия или монолаурат сорбитана.
[0092] Композиции или вакцины по настоящему изобретению могут включать в себя векторы, кодирующие любой полинуклеотид согласно настоящему изобретению, как описано выше.
[0093] Различные инсерции могут быть выполнены в том же самом векторе, используя различные сайты введения или используя тот же самый сайт инсерции. Когда используется тот же самый сайт инсерции, каждая полинуклеотидная инсерция, которая может представлять любой вышеупомянутый полинуклеотид по настоящему изобретению, может быть вставлена под контролем одних и тех же и/или различных промоторов. Инсерция может быть сделана хвост к хвосту, голова к голове, хвост к голове, или голова к хвосту. IRES-элементы (внутренний сайт посадки рибосом (Internal Ribosome Entry Site) см. ЕР 0803573) также могут быть использованы для разделения и экспрессии нескольких инсерции, функционально связанные с теми же и/или различными промоторами.
[0094] В одном варианте осуществления настоящее изобретение относится к вектору экспрессии, содержащему вышеупомянутый полинуклеотид. Вектор экспрессии может представлять любой вектор экспрессии in vivo, или вектор экспрессии in vitro.
[0095] В более общем смысле данное изобретение охватывает векторы экспрессии in vivo, включая любую плазмиду (ЕР-А2-1001025; Chaudhuri P.) содержащую и экспрессирующую in vivo в организме хозяина полинуклеотид или ген полипептида ENV FeLV, его варианта или его фрагмента и элементы, необходимые для его экспрессии in vivo.
[0096] В определенном, не ограничивающем примере, плазмиды pVR1020 или pVR1012 (VICAL Inc.; Luke С. et al.; Hartikka J. et al.), pVR2001-TOPA (или pVR2001-TOPO) (Oliveira F. et al.) или рАВ110 (US 6,852,705) могут быть использованы в качестве вектора для инсерции полинуклеотидной последовательности. Плазмида PVR1020 происходит из pVR1012 и содержит сигнальную последовательность tPA человека. PVR1020 представляет собой основу плазмиды, доступную от Vical, Inc (Сан-Диего, Калифорния), которая была использована ранее, см., например, патенты США №6451769 и 7078507. Как описано у Oliveira et al., плазмида pVR2001-TOPO (или pVR2001-TOPA) представляет собой pVR1020, модифицированную добавлением топоизомеразы, фланкирующей сайт клонирования и содержащую кодирующую и экспрессирующую секреторный сигнальный пептид, например, сигнальный пептид тканевого активатора плазминогена (tPA), что увеличивает вероятность получения секретируемого белка(см. фигуру 1 у Oliveira F. et al.).
[0097] Каждая плазмида может содержать или состоять или состоять по существу из полинуклеотида согласно настоящему изобретению, функционально связанного с промотором или находящегося под контролем промотора или зависимого от промотора, где данный промотор может быть предпочтительно примыкающим к полинуклеотиду, чья экспрессия желательна. В общем, целесообразно использовать сильный промотор, который функционален в эукариотических клетках. Один пример полезного промотора может представлять собой немедленный ранний промотор цитомегаловируса (CMV-IE) человеческого или мышиного происхождения, или он может необязательно иметь другое происхождение, например, от крысы или морской свинки. Промотор CMV-IE может содержать фактическую часть промотора, которая может или может не быть связана с усилительной частью. Ссылка может быть сделана на ЕР 260148, ЕР 323597, США 5168062, 5385839, и 4968615, а также на WO 87/03905. Промотор CMV-IE может преимущественно быть человеческим CMV-IE (Boshart M. et al.) или мышиным CMV-IE. В более общем плане, промотор может иметь либо вирусное либо клеточное происхождение. Сильный вирусный промотор, кроме CMV-IE, который может быть с успехом использован согласно практике данного изобретения представляет собой ранний/поздний промотор вируса SV40 или промотор LTR вируса саркомы Рауса. Сильный клеточный промотор, который может быть с успехом использован в практике настоящего изобретения, представляет собой промотор гена цитоскелета, например, промотор desmin (Kwissa M. et al.) или промотор актина (Miyazaki J. et al.). Функциональные субфрагменты данных промоторов, т.е. участки данных промоторов, которые поддерживают достаточную активность промотора, включены в объем настоящего изобретения, например, усеченные промоторы CMV-IE, в соответствии с WO 98/00166 или США 6,156,567 и могут быть использованы в практике настоящего изобретения. Промотор, применяемый в практике настоящего изобретения, следовательно, может включать в себя производные и/или субфрагменты полноразмерного промотора, которые поддерживают соответствующую промоторную активность и, следовательно, функционируют в качестве промотора, и которые могут преимущественно иметь активность промотора, которая по существу аналогична таковой фактического или полноразмерного промотора, из которого происходит производное или субфрагмент, например, сродни активности усеченных промоторов CMV-IE патента США 6156567 по сравнению с активностью полноразмерных промоторов CMV-IE. Таким образом, промотор CMV-IE в практике настоящего изобретения может содержать или состоять по существу из или состоять из промоторного участка полноразмерного промотора и/или энхансерного участка полноразмерного промотора, а также их производных и/или их субфрагментов.
[0098] Предпочтительно, плазмиды содержат или состоят по существу из других элементов, контролирующих экспрессию. Особенно выгодно встраивать стабилизирующую последовательностей), например, интронную последовательность(и), например, первый интрон из hCMV-IE (WO 89/01036), интрон II гена β-глобина кролика (van Ooyen et al.). Что касается сигнала полиаденилирования (полиА) для плазмид и вирусных векторов, отличных от вирусов оспы, может быть использован сигнал поли(А) гена бычьего гормона роста (bGH) (см. патент США 5,122,458), или сигнал поли(А) гена β-глобина кролика или сигнал поли(А) вируса SV40.
[0099] В более общем смысле данное изобретение охватывает векторы экспрессии in vivo, включая любой рекомбинантный вирусный вектор, содержащий полинуклеотид или ген, кодирующий один или более ENV FeLV и/или их варианты или их фрагменты, включая любые элементы, необходимые для его экспрессии in vivo.
[0100] Указанные рекомбинантные вирусные векторы могут быть выбраны из, например, поксвирусов, особенно вирусов Avipox, таких как вирусы птичьей оспы или вирусы оспы канареек. В одном варианте осуществления вирус птичьей оспы представляет собой TROVAC (см. WO 96/40241). В другом варианте осуществления вектор оспы канареек представляет собой ALVAC. Использование данных рекомбинантных вирусных векторов и инсерция интересующих полинуклеотидов или генов полностью описаны в патенте США 5174993, в патенте США 5505941 и США 5766599 для птичьей оспы и в патенте США 5756103 для оспы канареек. Более чем один сайт инсерции внутри вирусного генома может быть использован для введения множественных генов, представляющих интерес.
[0101] В одном варианте осуществления вирусный вектор представляет собой аденовирус, такой как аденовирус человека (HAV) или собачий аденовирус (CAV).
[0102] В другом варианте осуществления вирусный вектор представляет собой человеческий аденовирус, в частности, аденовирус серотипа 5, оказывающийся некомпетентным для репликации делецией в области Е1 вирусного генома, в особенности, от приблизительно нуклеотида 459 до приблизительно нуклеотида 3510, со ссылкой на последовательность hAd5, раскрытую в Genbank под регистрационным номером М73260 и в указанной публикации Chroboczek et al, 1992. Удаленный аденовирус распространяется в E1-экспрессирующих 293 клетках (Graham et al., 1977) или в клетках PER, особенно PER.C6 (Falloux et al., 1998). Аденовирус человека может дополнительно или альтернативно быть удален в области Е3, особенно от приблизительно нуклеотида 28592 до приблизительно нуклеотида 30470. Делеция в области Е1 может быть сделана в сочетании с делецией в области Е3 (см., например Shriver et al.; Graham et al.; Ilan et al.; U.S. Patent Nos. 6,133,028 and 6,692,956; Tripathy et al.; Tapnell; Danthinne et al.; Berkner; Berkner et al.; Chavier et al.). Сайты инсерции могут представлять собой Е1 и/или Е3 локус (область) в конечном счете после частичной или полной делеции областей Е1 и/или Е3. Предпочтительно, когда вектор экспрессии представляет собой аденовирус, полинуклеотид, который должен быть экспрессирован, вводится под контролем промотора, функционального в эукариотических клетках, такого как сильный промотор, преимущественно промотор немедленного раннего гена цитомегаловируса (промотор CMV-IE), особенно область энхансер/промотор от приблизительно нуклеотида 734 до приблизительно нуклеотида 7 у Boshart et al., или область энхансер/промотор из вектора pCI от Promega Corp. Промотор CMV-IE является преимущественно мышиного или человеческого происхождения. Также может быть использован промотор фактора элонгации 1α. Также может быть использован специфический промотор мышцы (Li et al.). Сильные промоторы также описаны в настоящем документе в отношении плазмидных векторов. В одном варианте осуществления последовательность сплайсинга может быть расположена ниже области энхансер/промотор по направлению транскрипции. Например, интрон 1, изолированный из гена CMV-IE (Stenberg et al.), интрон, изолированный из гена β-глобина кролика или человека, особенно интрон 2 из гена β-глобина, интрон, изолированный из гена иммуноглобулина, последовательность сплайсинга от раннего гена SV40 или последовательность химерного интрона, изолированная из вектора pCI из Promege Corp. Последовательность поли(А) и терминаторная последовательность могут быть вставлены ниже (по направлению транскрипции) полинуклеотида, который должен быть экспрессирован, например, сигнал полиаденилирования бычьего гена гормона роста, в особенности от приблизительно нуклеотида 2339 до приблизительно нуклеотида 2550 в последовательности с регистрационным номером GenBank, No BOVGHRH, гена β-глобина кролика или позднего гена SV40.
[0103] В другом варианте осуществления вирусный вектор представляет собой собачий аденовирус, особенно CAV-2 (см., например Fischer et al.; патенты США №№5,529,780 и 5,688,920, WO 95/14102). Для CAV, сайты инсерции могут находиться в области Е3 и/или в области, расположенной между областью Е4 и правой областью ITR (см. патенты США №№6,090,393 и 6,156,567). В одном варианте осуществления инсерция находится под контролем промотора, такого как промотор немедленного раннего гена цитомегаловируса (промотор CMV-IE), либо промотор, уже описанный для вектора аденовируса человека. Последовательность поли(А) и терминаторная последовательность могут быть вставлены ниже (по направлению транскрипции) полинуклеотида, который должен быть экспрессирован, например, сигнал полиаденилирования бычьего гена гормона роста или гена β-глобина кролика.
[0104] В другом варианте осуществления вирусный вектор представляет собой вирус герпеса, такой как кошачий вирус герпеса (FHV). В одном варианте осуществления полинуклеотид, который должен быть экспрессирован, вводится под контролем промотора, функционального в эукариотических клетках, предпочтительно промотора CMV-IE (мышиный или человеческий). Последовательность поли(А) и терминаторная последовательность могут быть вставлены ниже (по направлению транскрипции) полинуклеотида, который должен быть экспрессирован, например, сигнал полиаденилирования бычьего гена гормона роста или гена β-глобина кролика.
[0105] Для рекомбинантных векторов на основе поксвирусного вектора, вируса коровьей оспы или аттенуированного вируса коровьей оспы, (например, MVA, модифицированный штамм Анкара, полученный после более 570 пассирований вакцинного штамма Анкара на куриных эмбриональных фибробластах, см. Stickl & Hochstein-Mintzel; Sutter et al.; доступны как ATCC VR-1508, или NYVAC, см. патент США №5,494,807, и патент США №5,494,807, в которых обсуждается конструкция NYVAC, а также вариации NYVAC с дополнительными ORF, удаленными из штамма Копенгаген генома вируса осповакцины, а также введение гетерологичных кодирующих молекул нуклеиновой кислоты в сайты данного рекомбинанта, а также использование соответствующих промоторов, см. также WO 96/40241), могут быть использованы вирус Avipox или аттенуированный вирус Avipox (например, оспы канареек, оспы кур, оспы голубей, pigeonpox, оспы перепелок, ALVAC или TROVAC; см., например, патенты США №5505941, 5494807). Аттенуированные вирусы оспы канареек описаны в патенте США №5756103 (ALVAC) и WO 01/05934. Делается также ссылка на патент США №5766599, который относится к аттенуированному штамму оспы кур TROVAC. Ссылка делается на вирус оспы канареек, доступный из ATCC под номером доступа VR-111. Также доступны многочисленные вакцинные штаммы вирусов птичьей оспы, например, штамм DIFTOSEC СТ, продаваемый фирмой Merial, и вакцина NOBILIS VARIOLE, выпускаемая фирмой Intervet. Для получения информации о способе, используемом для генерации рекомбинант и управления рекомбинантами, специалист в данной области техники может обратиться к документам, упомянутым в настоящем документе и в WO 90/12882, например, как к вирусу коровьей оспы, упоминаемому в патентах США №4769330, 4722848, 4603112, 5110587, 5494807 и 5762938, в частности; как к вирусу птичьей оспы, упоминаемому в патентах США №5174993, 5505941 и 5766599, в частности, как к вирусу оспы канареек, упоминаемому в патенте США №5756103, в частности. Когда вектор экспрессии представляет собой вирус осповакцины, сайт инсерции или сайты для полинуклеотида или полинуклеотидов, которые будут экспрессироваться, преимущественно находятся в гене тимидинкиназы (TK) или сайте инсерции, гене гемагглютинина (НА) или сайте инсерции, области, кодирующей тельца включения типа A (ATI), см. также документы, упомянутые в настоящем документе, особенно те, которые касаются вируса коровьей оспы. В случае оспы канареек, преимущественно сайт или сайты инсерции представляют собой ORF С3, С5 и/или С6, см. также документы, цитируемые здесь, особенно те, которые относятся к вирусу оспы канареек. В случае птичьей оспы, преимущественно сайт или сайты представляют собой OPC F7 и/или F8, см. также документы, цитируемые здесь, особенно те, которые относятся к вирусу птичьей оспы. Сайт или сайты инсерции для вируса MVA представляют собой преимущественно те, как приводится в различных публикациях, включая Carroll M. W. et al.; Stittelaar K. J. et al.; Sutter G. et al.; и в этой связи также отмечено, что полный геном МВА описан в Antoine G., Virology, что позволяет специалисту в данной области использовать другие сайты инсерции или другие промоторы. Предпочтительно, чтобы полинуклеотид, который будет экспрессироваться, был вставлен под контролем специфического поксвирусного промотора, например, промотор 7,5 кДа коровьей оспы (Cochran et al.), промотор I3L коровьей оспы (Riviere et al.), промотор НА коровьей оспы (Shida), промотор ATI коровьей оспы (Funahashi et al.), промотор Н6 коровьей оспы (Taylor J. et al.; Guo P. J. et al.; Perkus M. et al.), в частности.
[0106] Любой из полинуклеотидов, раскрытых здесь, может быть экспрессирован in vitro переносом ДНК или экспрессионными векторами в подходящей клетке-хозяине. Клетка-хозяин может быть прокариотической или эукариотической. Термин "клетка-хозяин" также включает в себя любое потомство субъекта клетки-хозяина. Способы персистентной передачи, что означает, что чужеродный полинуклеотид непрерывно поддерживается в клетке-хозяине, известны в данной области. Клетки-хозяева могут включать в себя бактерии (например, кишечная палочка), дрожжи, клетки насекомых и клетки позвоночных. Способы экспрессии последовательностей ДНК в эукариотических клетках хорошо известны в данной области. В качестве способа экспрессии in vitro, рекомбинантные бакуловирусные векторы (например, Autographa California Nuclear Polyhedrosis Virus (AcNPV)) могут быть использованы с нуклеиновыми кислотами, раскрытыми здесь. Например, промоторы полиэдрина могут быть использованы с клетками насекомых (например, клетки Spodoptera frugiperda, такие как клетки Sf9, доступные в АТСС под регистрационным номером CRL 1711, или клетки SF21) (см., например, Smith et al.; Pennock et al.; Vialard et al.; Verne A.; O′Reilly et al.; Kidd I. M. & Emery V.C.; EP 0370573, EP 0265785; США 4,745,051). Для экспрессии, может быть использован стартовый пакет BaculoGold Starter Package (Cat # 21001K) от Pharmingen (Becton Dickinson). В качестве способа экспрессии in vitro, рекомбинантная кишечная палочка может быть использована с вектором. Например, при клонировании в бактериальных системах могут быть использованы индуцируемые промоторы, такие как промотор арабинозы, pL бактериофага lambda, plac, ptrp, ptac (гибридный промотор ptrp-lac) и т.п. Трансформация клетки-хозяина рекомбинантной ДНК может быть осуществлена с помощью обычных методик, хорошо известных специалистам в данной области. Там, где хозяин является прокариотическим, таким как E.coli, компетентные клетки, которые способны к поглощению ДНК, могут быть получены из клеток, собранных после экспоненциальной фазы роста и затем обработанных способом с CaCl2 с использованием процедур, хорошо известных в данной области. Кроме того, могут быть использованы MgCl2 или RbCl. Трансформация может быть также выполнена электропорацией. Когда хозяин является эукариотическим, могут быть использованы такие способы трансдукции ДНК, как соосаждение фосфатом кальция, обычные механические способы, такие как микроинъекция, электропорация, инсерция плазмиды, заключенной в липосомы, или вирусные векторы. Эукариотические клетки также могут быть совместно трансформированы с полинуклеотидными последовательностями L. longipalpis и второй молекулой чужеродной ДНК, кодирующей селектируемый фенотип, такой как ген тимидинкиназы вируса простого герпеса. Другой способ заключается в использовании эукариотического вирусного вектора (см. выше), например, вируса герпеса или аденовируса (например, собачьего аденовируса 2) для временной трансдукции эукариотических клеток и экспрессии белка (Gluzman EA). Кроме того, может быть использован трансфекционный агент, такой как диолеоил-фосфатидилхолин-этаноламин (DOPE).
[0107] Изолирование и очистка рекомбинантно экспрессированного полипептида могут быть осуществлены обычными средствами, включая препаративную хроматографию (например, гель-хроматографию, ионообменную, аффинную), селективное осаждение и ультрафильтрацию. Примеры состояния известных способов, которые могут быть использованы, но без ограничения, можно найти в "Protein Purification Applications", второе издание, под редакцией Симона Роу и доступном в Oxford University Press. Такой рекомбинантно экспрессированный полипептид является частью настоящего изобретения. Способы получения любого полипептида согласно настоящему изобретению, как описано выше, также охвачены рамками настоящего изобретения, в частности, применение рекомбинантного экспрессирующего вектора, содержащего полинуклеотид в соответствии с изобретением и клетки-хозяина.
[0108] Вакцины, содержащие рекомбинантные вирусные векторы в соответствии с изобретением, могут быть сублимационно высушены (лиофилизированы), преимущественно со стабилизатором. Сублимационная сушка (лиофилизирование) может быть выполнена в соответствии с хорошо известными стандартными процедурами лиофилизирования. Фармацевтически или ветеринарно приемлемые стабилизаторы могут представлять собой углеводы (например, сорбит, маннит, лактоза, сахароза, глюкоза, декстран, трегалоза), глутамат натрия (Tsvetkov Т et al.; Israeli E et al.), белки, такие как пептон, альбумин, лактальбумин или казеин, белок, содержащий вещества, такие как обезжиренное молоко (Mills С K et al.; Wolff E et al.), и буферы (например, фосфатный буфер, фосфатный буфер щелочного металла). Адъювант может быть использован для растворения лиофилизированных препаратов.
[0109] Любая композиция вакцины согласно настоящему изобретению может также преимущественно содержать один или более адъювант.
[0110] Вакцины на основе плазмиды могут быть изготовлены с катионными липидами, преимущественно с DMRIE (N-(2-гидроксиэтил)-N,N-диметил-2,3-бис(тетрадецилокси)-1-пропанаммоний; WO 96/34109), и предпочтительно в сочетании с нейтральным липидом, например DOPE (диолеоил-фосфатидилхолин-этаноламин; Behr J.P.), в целях образования DMRIE-DOPE. В одном варианте осуществления смесь изготавливают непосредственно перед употреблением, и перед ее введением целесообразно ждать от около 10 мин до около 60 мин, например, около 30 минут, для соответствующей смеси. При использовании DOPE молярное соотношение DMRIE/DOPE может составлять от 95/5 до 5/95 и предпочтительно 1/1. Массовое соотношение плазмида/адъювант DMRIE или DMRIE-DOPE представляет собой, например, от 50/1 до 1/10, от 10/1 до 1/5 или от 1/1 до 1/2.
[0111] При желании к композиции может быть добавлен цитокин, особенно GM-CSF, или цитокины, индуцирующие ТЫ (например, IL-12). Данные цитокины могут быть добавлены к композиции в виде плазмиды, кодирующей белок цитокина. В одном варианте осуществления цитокины имеют собачье происхождение, например, собачий GM-CSF, чья последовательность гена была депонирована в базе данных GenBank (инвентарный номер S49738). Данная последовательность может быть использована для создания упомянутой плазмиды аналогично тому, что было сделано в WO 00/77210.
[0112] Вакцина на основе рекомбинантного вирусного вектора может быть объединена с fMLP (N-формил-метионил-лейцил-фенилаланин; патент США 6,017,537) и/или адъювантом Carbomer (Phameuropa Vol 8, №2, июнь 1996.). Специалисты в данной области могут также обратиться к патенту США 2909462, который описывает подобные акриловые полимеры, сшитые с полигидроксилированным соединением, имеющим по меньшей мере три гидроксильные группы, преимущественно не более 8, причем атомы водорода по меньшей мере трех гидроксильных групп заменяются ненасыщенными алифатическими радикалами, содержащими по меньшей мере 2 атома углерода. Например, радикалы представляют собой радикалы, содержащие от 2 до 4 атомов углерода, например, винилы, аллилы и другие этиленненасыщенные группы. Ненасыщенные радикалы могут сами содержать и другие заместители, такие как метил.
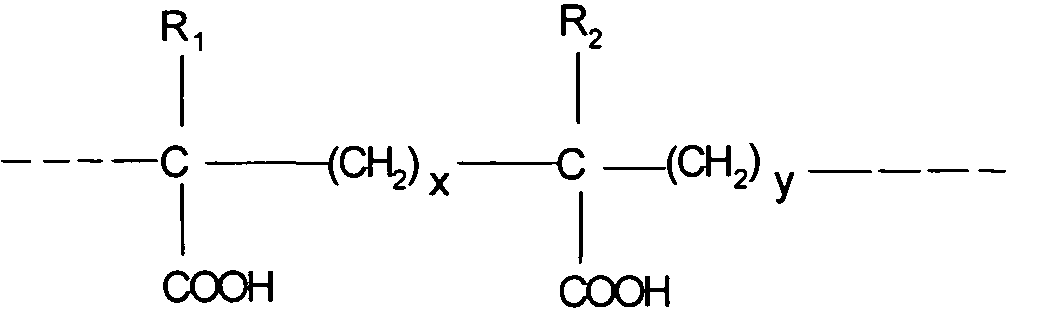
Продукты, продаваемые под названием CARBOPOL® (BF Goodrich, Goodrich, Ohio, USA) являются подходящими. Продукты сшиты с аллилсахарозой или с аллилпентаэритритом. Среди них могут быть преимущественно упомянуты CARBOPOL® 974Р, 934Р и 971Р.
[0113] В числе сополимеров малеинового ангидрида и алкенильного производного, сополимеры ЕМА® (Monsanto), которые представляют собой сополимеры малеинового ангидрида и этилена, линейные или поперечно-сшитые, например сшитые с дивиниловым эфиром, являются преимещественными. Можно сослаться на J. Fields et al.
[0114] Полимеры акриловой или метакриловой кислоты и сополимеры ЕМА® образованы, например, из основных блоков следующей формулы, в которой:
- R1 и R2, одинаковые или разные, обозначают Н или СН3
- x равен 0 или 1, предпочтительно x равен 1
- y равен 1 или 2, при x+y=2
Для сополимеров ЕМА®, x=0 и y=2. Для карбомеров, x=y=1.
[0115] Растворение данных полимеров в воде приводит к кислотному раствору, который нейтрализуют, предпочтительно до физиологического значения рН, с тем чтобы обеспечить раствор адъюванта, в который встроена сама вакцина. Карбоксильные группы полимера находятся затем частично в COO--форме.
[0116] В одном варианте осуществления раствор адъюванта, в частности, карбомера (Pharmeuropa, том 8, №2, июнь 1996), готовят в дистиллированной воде, предпочтительно в присутствии хлорида натрия, причем полученный раствор имеет кислое значение рН. Данный исходный раствор разбавляют, добавляя его к требуемому количеству (для получения желаемой конечной концентрации), или значительной его части, воды, содержащей NaCl, предпочтительно физиологический раствор (9 г/л NaCl), весь сразу несколькими порциями, с сопутствующей или последующей нейтрализацией (рН от 7,3 до 7,4), преимущественно с помощью NaOH. Данный раствор при физиологическом значении рН используется для смешивания с вакциной, которая может быть особенно хранящейся в лиофилизированном, жидком или замороженном виде.
[0117] Концентрация полимера в конечном составе вакцины может составлять от 0,01% до 2% масс./об., от 0,06 до 1% масс./об., или от 0,1 до 0,6% масс./об.
[0118] Субъединичная вакцина может быть объединена с адъювантами, такими как эмульсии масло-в-воде, вода-в-масле-в-воде на основе минерального масла и/или растительного масла и неионогенных сурфактантов, таких как блок-сополимеры, TWEEN®, SPAN®. Такими эмульсии являются особенно те, которые описаны на странице 147 "Vaccine Design - The Subunit and Adjuvant Approach", Pharmaceutical Biotechnology, 1995, или эмульсии TS, в частности, эмульсия TS6 и эмульсии LF, особенно, эмульсия LF2 (для обеих эмульсий ТС и LF, см. WO 04/024027). Другие подходящие адъюванты представляют собой, например, витамин Е, сапонины и CARBOPOL® (Noveon, см. WO 99/51269, WO 99/44633), гидроксид алюминия или фосфат алюминия ("Vaccine Design - The Subunit and Adjuvant Approach", Pharmaceutical Biotechnology, т.6, 1995), биологические адъюванты (например, C4b, в частности, мышиный C4b (Ogata R Т et al.) или лошадиный C4b, GM-CSF, в частности, лошадиный GM-CSF (патент США 6,645,740)), токсины (например, холерные токсины СТА или СТВ, термолабильные токсины LTA или LTB Escherichia coli (Olsen С W et al.; Fingerut E et al.; Zurbriggen R et al. Peppoloni S et al) и CpG (т.е. CpG #2395 (см. Jurk M et al.), CpG #2142 (см. SEQ ID NO:890 в ЕР 1,221,955).
[0119] Композиция или вакцина может также содержать или включать в себя один или несколько антигенов FeLV, например, ген ENV, или ENV и GAG, или ENV и GAG и PRO.
[0120] Композиция или вакцина может также быть связана с по меньшей мере одним антигеном FeLV, например инактивированным FeLV. В определенном варианте осуществления штамм FeLV может быть штаммом FeLV типа А, или сочетанием штаммов типа FeLV типа А и В, или сочетанием штаммов FeLV типа А и типа С, или сочетание штаммов типа А, типа В и типа С. Такие штаммы FeLV могут быть инактивированы с помощью химических или физических способов. Химические способы представляют собой, в частности, BPL, формальдегид. Физические способы представляют собой, в частности, ультразвук. Один способ инактивации FeLV для применения в вакцине описан у R. Cordeiro Giunchetti et al., Vaccine, 2007. Инактивированная вакцина FeLV могут быть объединена с адъювантами, как те, что описаны выше для субъединиц вакцин.
[0121] Другой объект настоящего изобретения относится к способам вакцинации хозяина против FeLV с использованием вакцинных композиций, описанных в данном документе.
[0122] Хозяином может быть любой или все из семейства кошачьих (например, домашние кошки, котята, большие кошки и дикие кошки). В одном варианте осуществления хозяин является кошкой.
[0123] Способы введения могут быть, например, внутримышечно (intramuscular (IM)) или внутрикожно (intradermal (ID)) или трансдермально (transdermal (TD)) или подкожно (subcutaneous (SC)). Средство введения может представлять собой, например, шприц с иглой или безыгольное устройство или шприц с иглой, соединенный с прибором для электропереноса (electrotransfer (ET)) или безыгольное устройство, соединенное с прибором для ET.
[0124] Другой объект изобретения относится к применению вакцины на основе плазмиды в соответствии с настоящим изобретением для введения хозяину, где данное введение сочетается с процедурой ET. Введение вакцины на основе плазмиды осуществляется преимущественно внутримышечно. Средство для введения представляет собой, например, шприц и иглу. Одну или несколько инъекций можно вводить последовательно. В случае нескольких инъекций, они могут быть выполнены с интервалом друг от друга, составляющим от 2 до 6 недель, например, около 3 недель. В одном варианте осуществления дополнительно назначается ревакцинация через полгода или через год.
[0125] Для вакцин на основе плазмид, предпочтительными путями введения могут быть ID или IM. Данное введение может осуществляться посредством применения шприца с иглой или безыгольного устройства, подобного Dermojet или Biojector (Bioject, Oregon, США) или Vetjet™ (Merial) или Vitajet™ (Bioject Inc.), см. патент США 2006/0034867. Доза может составлять от 50 мкг до 500 мкг в пересчете на плазмиду. Когда добавляют DMRIE-DOPE, могут быть использованы 100 мкг на плазмиду. Когда используются GM-CSF или другие цитокины, плазмида, кодирующая данный белок, может присутствовать в дозе от около 200 мкг до около 500 мкг и может составлять 200 мкг. Объем дозы может составлять от 0,01 мл до 0,5 мл, например, 0,25 мл. Введение может быть осуществлено с несколькими точками инъекции.
[0126] Альтернативно, вакцины на основе плазмид могут быть введены посредством пути IM, соединенным с процедурой электропереноса (ET). Процедура ET может быть выполнена с использованием устройства для электропереноса и спецификаций производителя (т.е. генератор Sphergen G250 (Sphergen SARL, Evry Genopole, Франция); система электропорации ДНК MedPulser® (Innovio Biomedical Corporation, San Diego, California, USA)). В одном варианте осуществления устройство для электропереноса имеет однополярное поле. Интенсивность поля может составлять от около 50 до около 250 В/см, от около 50 до около 200 В/см или от около 50 до около 175 В/см. Длительность импульса может составлять от около 1 до около 50 мс или от около 15 до около 25 мс. Частота может составлять от около 1 до около 50 Гц или от около 5 до около 15 Гц. Межимпульсный интервал может составлять от около 1 до 1000 мс или от около 1 до около 200 мс. Число импульсов может составлять от 1 до 20 или от 5 до 10. Внутритканевая интенсивность может составлять преимущественно до около 2 А. Расстояние между электродами может составлять от около 0,2 до около 1 см или от около 0,2 до около 0,5 см.
[0127] Для вакцин на основе рекомбинантных вирусных векторов путями введения могут быть преимущественно SC или IM или TD или ID. Данное введение может быть осуществлено шприцом с иглой или безыгольным устройством, подобным Dermojet или Biojector (Bioject, Oregon, США) или Vetjet™ (Merial) или Vitajet™ (Bioject Inc.), см. патент США 2006/0034867. Доза может составлять от 103 БОЕ до около 109 БОЕ на рекомбинантный поксвирусный вектор. Когда вектор представляет собой вирус канареек, доза может составлять, например, от около 105 БОЕ до около 109 БОЕ, от около 106 БОЕ до около 108 БОЕ или от около 106 БОЕ до около 107 БОЕ. Объем дозы может составлять от около 0,01 мл до 0,2 мл, и предпочтительно 0,1 мл. Введение может содержать несколько точек инъекции.
[0128] Для пути IM объем предоставленной вакцины может составлять от 0,2 до 2 мл, в частности, от около 0,5 до 1 мл. Те же самые дозы используются для любого из векторов по настоящему изобретению.
[0129] Для субъединичных вакцин путь введения может быть преимущественно через SC или IM или TD или ID. Данное введение может быть осуществлено шприцом с иглой или безыгольным устройством, подобным Dermojet или Biojector (Bioject, Oregon, США) или Vetjet™ (Merial) или Vitajet™ (Bioject Inc.) Доза может составлять от около 50 до около 500 мкг, в частности, от около 50 до около 150 мкг, более определенно, от около 50 до около 100 мкг. Объем предоставленной субъединичной вакцины составляет от 0,2 до 2 мл, в частности, от 0,5 до 1 мл.
[0130] Другой объект настоящего изобретения относится к вакцинной стратегии, основанной на режиме двухкратного введения по схеме "prime-boost", где первичное (primo) введение и бустерное введение(я) используют композицию, содержащую фармацевтически или ветеринарно приемлемый эксципиент, разбавитель или носитель и вектор экспрессии in vivo, содержащий полинуклеотидную последовательность, которая содержит и экспрессирует полипептид FELV и/или его варианты или его фрагменты.
[0131] Настоящее изобретение относится к применению векторов экспрессии in vivo режиме двухкратного введения по схеме "prime-boost", содержащему первичное введение вакцины, содержащей фармацевтически или ветеринарно приемлемый носитель, разбавитель или эксципиент, вектор экспрессии in vivo, содержащий полинуклеотидную последовательность для экспрессии in vivo полипептидов FeLV и/или их вариантов или их фрагментов, с последующим бустерным введением вакцины, содержащей фармацевтически или ветеринарно приемлемый носитель, разбавитель или эксципиент, вектор экспрессии in vivo, содержащий полинуклеотидную последовательность для экспрессии in vivo полипептидов FeLV и/или их вариантов или их фрагментов, как описано выше, чтобы защитить хозяина от FeLV и/или предотвратить прогрессирование заболевания у инфицированных хозяев.
[0132] Введение по схеме "prime-boost" содержит по меньшей мере одно первичное введение и по меньшей мере одно бустерное введение с использованием по меньшей мере одного общего полипептида и/или его вариантов или его фрагментов. Вакцина, используемая в первичном введении, может отличаться по своей природе от той, которая используется в качестве последующей бустерной вакцины. Первичное введение может содержать одно или более введений. Аналогично, введение буст-вакцины может содержать одно или более введений.
[0133] Пути введения, дозы и объемы таковы, как ранее описано в данном документе.
[0134] Введения по схеме "prime-boost" могут преимущественно проводиться с интервалом между ними, составляющим от 2 до 6 недель, например, около 3 недель. Согласно одному из вариантов осуществления также предусматривается бустерная вакцинация через полгода или бустерная вакцинация через год, преимущественно с помощью вакцины на основе вирусного вектора. Животные могут быть по меньшей мере от 6 до 8 недель во время первого введения.
[0135] В одном варианте осуществления режим введения по схеме "prime-boost" содержит по меньшей мере одно первичное введение вакцины на основе плазмиды по настоящему изобретению и по меньшей мере одно бустерное введение рекомбинантного вирусного вектора на основе вакцины по настоящему изобретению.
[0136] В другом варианте осуществления режим введения по схеме "prime-boost" содержит по меньшей мере одно первичное введение вакцины на основе рекомбинантного вирусного вектора по настоящему изобретению и по меньшей мере одно бустерное введение субъединичной вакцины по настоящему изобретению.
[0137] В другом варианте режим введения по схеме "prime-boost" содержит по меньшей мере одно первичное введение вакцины на основе рекомбинантного вирусного вектора по настоящему изобретению и по меньшей мере одно бустерное введение вакцины на основе плазмиды по настоящему изобретению.
[0138] В одном варианте осуществления настоящее изобретение относится к способу вакцинации субъекта, восприимчивого к FeLV, содержащему режим введения по схеме "prime-boost", где упомянутый режим содержит первичное введение вакцины или композиции, содержащей, в фармацевтически или ветеринарно приемлемом носителе, разбавителе или эксципиенте, плазмиду, содержащую полинуклеотид для экспрессии, in vivo, полипептида FeLV, варианта или фрагмента полипептида FeLV или их смеси, с последующим бустерным введением вакцины, содержащей, в фармацевтически или ветеринарно приемлемом носителе или эксципиенте, рекомбинантный вирусный вектор, содержащий полинуклеотид для экспрессии, in vivo, того же полипептида(ов) FeLV, его варианта, его фрагмента для защиты субъекта от FeLV и/или предотвращения развития болезни в инфицированном субъекте.
[0139] В другом варианте осуществления настоящее изобретение относится к способу вакцинации субъекта, восприимчивого к FeLV, содержащему режим введения по схеме "prime-boost", где упомянутый режим содержит первичное введение вакцины или композиции, содержащей, в фармацевтически или ветеринарно приемлемом носителе, разбавителе или эксципиенте, рекомбинантный вирусный вектор, содержащий полинуклеотид для экспрессии, in vivo, полипептида FeLV, варианта или фрагмента полипептида FeLV или их смеси, с последующим бустерным введением вакцины, содержащей, в фармацевтически или ветеринарно приемлемом носителе или эксципиенте, плазмиду, содержащую полинуклеотид, для экспрессии, in vivo, полипептида(ов) FeLV, его варианта, его фрагмента для защиты субъекта от FeLV и/или предотвращения развития болезни в инфицированном субъекте.
[0140] В еще одном варианте осуществления настоящее изобретение относится к способу вакцинации субъекта, восприимчивого к FeLV, содержащему режим введения по схеме "prime-boost", где упомянутый режим содержит первичное введение вакцины или композиции, содержащей, в фармацевтически или ветеринарно приемлемом носителе, разбавителе или эксципиенте, рекомбинантный вирусный вектор, содержащий полинуклеотид для экспрессии, in vivo, полипептида FeLV, варианта или фрагмента полипептида FeLV или их смеси, с последующим бустерным введением вакцины, содержащей, в фармацевтически или ветеринарно приемлемом носителе или эксципиенте, такой же полипептид(ы) FeLV, его вариант, его фрагмент, для защиты субъекта от FeLV и/или предотвращения развития болезни в инфицированном субъекте.
[0141] Другой объект настоящего изобретения относится к набору для вакцинации по схеме "prime-boost" в соответствии с настоящим изобретением. Данный набор может содержать по меньшей мере две ампулы: первую ампулу, содержащую вакцину для первичной вакцинации в соответствии с настоящим изобретением и вторую ампулу, содержащую вакцину для бустерной вакцинации в соответствии с настоящим изобретением. Данный набор может преимущественно содержать дополнительные первые или вторые ампулы для дополнительных первичных вакцинаций или дополнительных бустернных вакцинаций.
[0142] В одном варианте осуществления набор может содержать две ампулы, одну, содержащую вакцину на основе плазмиды для первичной вакцинации в соответствии с настоящим изобретением, другую ампулу, содержащую вакцину на основе рекомбинантного вирусного вектора для бустерной вакцинации в соответствии с настоящим изобретением.
[0143] В другом варианте осуществления набор может содержать две ампулы, одну, содержащую вакцину на основе рекомбинантного вирусного вектора для первичной вакцинации в соответствии с настоящим изобретением, другую ампулу, содержащую субъединичную вакцину для бустерной вакцинации в соответствии с настоящим изобретением.
[0144] В другом варианте осуществления набор может содержать две ампулы, одну, содержащую вакцину на основе рекомбинантного вирусного вектора для первичной вакцинации в соответствии с настоящим изобретением, другую ампулу, содержащую вакцину на основе плазмиды для бустерной вакцинации в соответствии с настоящим изобретением.
[0145] Настоящее изобретение далее будет описано с помощью следующих неограничивающих примеров.
Примеры
[0146] Без дополнительного вдавания в подробности можно полагать, что специалист в данной области техники может, используя предшествующие описания, осуществить на практике данное изобретение в его полном объеме. Следующие подробные примеры должны рассматриваться только как иллюстративные, а не ограничивающие предшествующее описание никоим образом. Специалисты в данной области техники быстро распознают возможные вариации приведенных методик, как в отношении реагентов, так и в отношении реакционных условий и способов.
[0147] Конструирование инсерций ДНК, плазмид и рекомбинантных вирусных векторов проводили с использованием стандартных способов молекулярной биологии, описанных J. Sambrook et al. (Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1989). Все рестрикционные фрагменты, используемые в настоящем изобретении, были изолированы с использованием набора "Geneclean" (Bio 101 Inc, La Jolla, CA).
Пример 1. Конструирование pH6C5env плазмиды рРВ713
Конструирование pH6C5env-pCXL208.2, плазмиды с инсерцией С5 для генерации рекомбинантов FELV-ENV/ALVAC(2)
[0148] Рекомбинантный вирус ALVAC(1), который содержит ENV FELV, встроенный в локус С5, и GAG/POL (+T5NT), встроенный в локус С3 (патентованный материал Merial), был использован для амплификации гена ENV FELV. Праймеры 7862CXL и 7847CXL были использованы для ПЦР-амплификации.
7862CXL: ACG CCG CTC GAG CGG GGA ТСТ СТТ ТАТ ТСТ АТА СТТ A (SEQ ID NO:25)
Xho I H6 промотор
7847CXL: CTC GGA TCC AGAAAAA TCA TGG TCG GTC CGG АТС (SEQ ID NO:26)
Bam HI T5NT остановка
[0149] Амплифицированный ПЦР-фрагмент (2.1Kb) содержит ген ENV FeLV, промотор H6 непосредственно перед (по направлению транскрипции) ENV и последовательность T5NT с последующим стоп-кодоном ENV. ПЦР-фрагмент затем переваривали с XhoI/BamHI и лигировали в переваренную XhoI/BamHI донорную плазмиду pH6C5ALVAC (патентованный материал Merial), чтобы генерировать pCXL208.2, чья последовательность была подтверждена.
[0150] Карта плазмиды pCXL208.2 и ее последовательность показаны на фигуре 2 и 3.
Конструирование pH6C5env плазмиды рРВ713
[0151] ENV FELV гликозилируют и расщепляют для получения гликопротеина gp70 ENV и р15Е ENV. Белковая последовательность мутантного гена ENV FeLV штамма 82K представлена на фигуре 5. Мутация представляет собой замену Arg на Glu в положении 527 гена ENV FELV.
[0152] Плазмида pHCMV-ENV FELV была получена из Institut Gustave-Roussy (Villejuif, Франция). Последовательность предоставленного мутантного фрагмента ENV FeLV (SEQ ID NO:3) содержит 5 мутаций (нуклеотидов) в сравнении с контрольной последовательностью (Глазго, Genbank, регистрационный номер М12500, SEQ ID NO:35). Среди пяти нуклеотидных мутаций, две мутации представляют собой молчащие мутации (без изменения аминокислоты), но введен новый сайт рестрикции (=FspI); три мутации ввели мутацию в аминокислотной последовательности ENV FeLV (Arg вместо Glu; как показано на фигуре 5, SEQ ID NO:4).
[0153] Плазмиду phCMV-ENV FELV переваривали RsrII/SacII для получения фрагмента RsrII-SacII (фрагмент В: 520 п.н.). Плазмиду pCXL208.2 переваривали RsrII/SacII для получения фрагмента RsrII-SacII (фрагмент А: 6231 б.п.). Фрагменты А и В лигировали с получением плазмиды рРВ713 (6756 п.н.). Идентичность рРВ713 была подтверждена перевариванием FspI. Рестрикционная карта рРВ713 и последовательности рРВ713 показаны на фигуре 4.
Конструирование pH6C5env плазмиды рРВ712
[0154] Плазмиду PhCMV-ENV FELV расщепляли RsrII/SacII для получения фрагмента RsrII-SacII (фрагмент А: 520 б.п.). Плазмиду рРВ575 (патентованный материал Merial) расщепляли RsrII/SacII, чтобы генерировать фрагмент RsrII-SacII (фрагмент В: 5971 п.н.). Фрагменты А и В лигировали с получением плазмиды рРВ712 (6496 п.н.). Идентичность рРВ712 была подтверждена перевариванием EcoRI. Последовательность мутированной области FeLV, присутствующей в клоне рРВ712 контролировали секвенированием ДНК (Cogenics, Франция) с универсальным праймером М13 и обратным праймером М13. Два кандидата были отобраны (№1 и №2). Последовательности 2-х клонов были идентичными, но отличались от SEQ ID NO:4 (мутация одной аминокислоты Glu на Arg). Имеется восемь нуклеотидных мутаций, ведущих к только одной замене аминокислот. Сравнения последовательностей ДНК и белка между мутантным FeLV (SEQ ID NO:1) в рРВ712 и мутантным FeLV (SEQ ID NO:3) в pHCMV-ENV FeLV показаны на фигуре 5. Сравнение последовательностей белков ENV FeLV различных штаммов приведено на фигуре 5.
Пример 2. Конструирование донорной плазмиды С3 ALVAC для генерации рекомбинанта ALVAC, экспрессирующего кодон-оптимизированный GAG-PRO FELV
[0155] Кодон-оптимизированый ген GAG-PRO FeLV (Feline leukemia virus, вирус кошачьей лейкемии) был использован в создании vCP2294. Ген GAG-PRO FeLV был оптимизирован для экспрессии гена в клетках млекопитающих. Сравнение последовательностей на уровне ДНК между кодон-оптимизированным геном GAG-PRO (SEQ ID NO:10) и геном GAG-PRO дикого типа (GenBank, регистрационный номер М18247, SEQ ID NO:11) приведено на фигуре 7.
[0156] Схема конструирования изложена на фигуре 8. Плазмида pJY1320.1 (патентованный материал Merial), содержащая кассету кодон-оптимизированного GAG-PRO Н6р-FeLV, была использована в качестве матрицы для ПЦР-амплификации. Н6Р представляет собой промотор Н6 вируса коровьей оспы. Праймеры 13301JY и 13302JY были использованы для ПЦР-амплификации. ПЦР-фрагмент клонировали в вектор pCR2.1-TOPO. Полученную в результате плазмиду pJY1857.5 секвенировали и подтвердили, что она имеет правильные последовательности GAG-PRO Н6р-FeLV. Для того чтобы построить РС3 FELV Н6р-GAG-PRO, фрагмент ДНК NruI/SpeI, который содержит 3′-частичный промотор Н6 и полноразмерный GAG-PRO, изолировали из pJY1857.5 и лигировали в pJY1738.2 (патентованный материал Merial), переваренную Nru I/Spe I, чтобы создать pJY1874.1 (как показано на фигурах 9, 10 и 11), для которой была подтверждена правильность последовательностей.
Прямой праймер 13301JY (SEQ ID NO:13)

Обратный праймер 13302JY (SEQ ID NO:14)

[0157] В инфицированных FeLV клетках, GAG-PRO получают прочитыванием терминатора. GAG дополнительно расщепляется до белков МА (р15), СА (p30) и NC во время поздней стадии сборки вируса.
Пример 3. Генерация и характеристика рекомбинанта ALVAC, содержащего кодон-оптимизированный GAG-PRO H6P FELV, вставленный в С3-локус ALVAC (vFP2294)
[0158] IVR (рекомбинантный in vitro) проводили трансфекцией клеток первичных фибробластов куриного эмбриона (1°CEF) с 10 мкг Not I-линеаризованной донорной плазмидой pJY1874.1 с использованием реагента FuGENE-6® (Roche). Первичные клетки фибробластов куриного эмбриона (1°CEF), используемые для рекомбинации in vitro, выращивали в 10% FBS (JRH: γ-облученные # 12107-500М), DMEM (BRL/Gibco#11960-051 или 11960-044) с добавлением 4 мМ глутамина (BRL/Gibco#25030-081) и 1 мМ пирувата натрия (BRL/Gibco#11360-070) в присутствии 1х антибиотики/антимикотики (P/S/A/A, BRL/Gibco#15240-062). Трансфицированные клетки впоследствии заражали ALVAC в качестве спасательного вируса при MOI (multiplicity of infection, множественность заражения), равной 10 (ALVAC #НМ1372 7 апреля 04). Через 24 часааса трансфицированные-инфицированные клетки собирали, обрабатывали ультразвуком и использовали для скрининга рекомбинантного вируса.
[0159] Рекомбинантные бляшки подвергали скринингу на основе способа подъемной гибридизации (lift hybridization) с целью выявления бляшек с помощью специфического зонда GAG FeLV размером 1,4 т.п.н., меченного пероксидазой хрена (HRP) в соответствии с протоколом производителя (Amersham Cat#RPN3001). После пяти последовательных раундов очистки бляшек был получен рекомбинант, обозначаемый как vCP2294.1.1.1.1.1, и подтвержден гибридизацией как 100% положительный для инсерции GAG FeLV и как 100% отрицательный для С3 ORF.
[0160] Одну бляшку выбирали из 5-го раунда очистки бляшек и разращивали, чтобы получить исходные культуры Р1 (1х колба Т25), Р2 (1х колба Т75) и Р3 (6 x цилиндрические бутылки). Инфицированная клеточная культуральная жидкость из цилиндрических бутылей была собрана и сконцентрирована для получения исходной культуры вируса vCP2294.1.1.1.1.1.
[0161] Схема для генерации рекомбинанта vCP2294 изображена на фигуре 12.
Анализ рекомбинанта: следующие анализы проводились на исходных культурах Р3.
Подтверждение генетической чистоты
[0162] Исходные культуры Р3 были подтверждены повторной гибридизацией как на 100% положительные для GAG FeLV и на 100% отрицательные для С3 ORF.
Геномный анализ
[0163] Геномную ДНК из vCP2294.1.1.1.1.1 экстрагировали, переваривали BamHI, HindIII или Pst I и прогоняли в 0,8% агарозном геле. Гель с геномной ДНК, переваренной BamHI, HindIII или PstI, переносили на нейлоновую мембрану и проводили Саузерн-блот-анализ зондированием с зондом GAG FeLV размером 1,4 кб. Несколько полос наблюдались в соответствии с ожидаемыми размерами, что указывало на правильность инсерции гена GAG-PRO FeLV в локус С3.
Экспрессионный анализ
1) Вестерн-блот
[0164] Первичные клетки CEF инфицировали исходной культурой Р3 vCP2294.1.1.1.1.1 при MOI (множественность инфицирования), равной 10, и инкубировали при 37°С в течение 24 часов. Затем собирали надосадочную культуральную жидкость и клетки. Клеточный осадок лизировали буфером для лизиса Reporter Gene Assay Lysis Buffer, производимым Roche (каталожный номер 1897675). Как надосадочную жидкость, так и лизат получали с системой NuPAGE® System с добавлением антиоксиданта. Белки разделяли в геле 10% Bis-Tris Pre-cast gel NuPage® и затем переносили на мембрану PVDF. Антитела против GAG FeLV выявили белок с молекулярной массой, составляющей около 70 кДа, обнаруженный как в надосадочной жидкости, так и в клеточном осадке, а также белок с молекулярной массой, составляющей около 57 кДа, который был обнаружен только в клеточном осадке.
2) Иммунный анализ бляшек
[0165] Гомогенность популяции была на 100% положительной по отношению к белку GAG FELV для рекомбинантного vCP2294.1.1.1.1.1, о чем свидетельствует иммунный анализ бляшек с использованием анти-GAG FELV антител.
Анализ последовательности
[0166] Более детальный анализ геномной ДНК исходной культуры Р3 проводили с помощью ПЦР-амплификацией и анализом последовательностей фланкирующих участков ("плечей") локуса С3 и инсерции FeLV. Праймеры 8103JY и 8104JY, расположенные за "плечами" локуса С3 в геноме ALVAC, использовали для амплификации всего фрагмента C3L-FELV-C3R. Результаты показали, что последовательности инсерции FeLV и C3L и C3R из ALVAC являются правильными.
[0167] Праймеры для амплифицирования зонда GAG FELV:
11369JY: 5′ ATGATGAACGTGGGCTGGCCT 3′ (SEQ ID NO:17)
11377JY: 5′ TCTCCTAAGTTGAGCAGGGTG 3′ (SEQ ID NO:18)
[0168] Праймеры для ПЦР-амплификации C3L-FeLV GAG-PRO кассеты-C3R:
8103JY: 5′ GAGGCATCCAACATATAAAGAAGACTAAAG 3′ (SEQ ID NO:19)
8104JY: 5′ TAGTTAAATACTCATAACTCATATCTG 3′ (SEQ ID NO:20)
[0169] На фигуре 13 представлена карта области vCP2294 С3, показывающая местоположения праймеров. Последовательность vCP2294 изображена на фигуре 14.
Пример 4. Генерация и характеристика рекомбинанта ALVAC, содержащего модифицированный ген ENV FELV, вставленный в С5-локус vCP2294, кодон-оптимизированный GAG-PRO-vCP2296 ALVAC С3 Н6Р FeLV
[0170] IVR выполнили трансфекцией клеток 1°CEF с 10 мкг Not I-линеаризованной донорной плазмиды рРВ713 с использованием реагента FuGENE-6® (Roche). Трансфицированные клетки затем инфицировали vCP2294 (кодон-оптимизированный GAG-PRO-vCP2296 ALVAC С3 Н6Р FeLV, пример 2) в качестве вируса спасения при MOI, равной 10. Через 24 часа трансфицированные инфицированные клетки собирали, обрабатывали ультразвуком и использовали для скрининга рекомбинантного вируса.
[0171] Рекомбинантные бляшки подвергали скринингу на основе способа подъемной гибридизации с целью выявления бляшек с помощью специфического зонда ENV FeLV размером 503 п.н., меченного пероксидазой хрена (HRP) в соответствии с протоколом производителя (Amersham Cat#RPN3001). После четырех последовательных раундов очистки бляшек был получен рекомбинант, обозначаемый как vCP2296.6.1.1.2, и подтвержден гибридизацией как 100% положительный для инсерции ENV FELV и 100% отрицательный для пустых сайтов С5.
[0172] Одну бляшку выбрали из 4-го раунда очистки бляшек и разрастили, чтобы получить исходные культуры Р1 (1х колба Т25), Р2 (1х колба Т75) и Р3 (6 x цилиндрические бутылки). Инфицированная клеточная культуральная жидкость из цилиндрических бутылей была собрана и сконцентрирована для получения исходной культуры вируса vCP2296.6.1.1.2.
[0173] Конструирование vCP2296 изображено на фигуре 15.
Анализ рекомбинанта: следующие анализы проводились на исходных культурах Р3.
Подтверждение генетической чистоты
[0174] Исходные культуры Р3 были подтверждены повторной гибридизацией как на 100% положительные для обоих GAG FeLV и ENV FeLV и на 100% отрицательные для обоих С3 и С5 ORF.
Экспрессионный анализ
1) Вестерн-блот
[0175] Первичные клетки CEF инфицировали исходной культурой Р3 vCP2296.6.1.1.2 при MOI, равной 10, и инкубировали при 37°С в течение 24 часов. Затем собирали надосадочную культуральную жидкость и клетки. Клеточный осадок лизировали буфером для лизиса Reporter Gene Assay Lysis Buffer, производимым Roche (каталожный номер 1897675). Как надосадочную жидкость, так и лизат получали с системой NuPAGE® System с добавлением антиоксиданта. Белки разделяли в геле 10% Bis-Tris Pre-cast gel NuPage® и затем переносили на мембрану PVDF. Антитела против GAG FeLV выявили белок с молекулярной массой, составляющей около 70 кДа, обнаруженный как в надосадочной жидкости, так и в клеточном осадке, и белок с молекулярной массой, составляющей около 80 кДа, который также экспрессировался как в надосадочной жидкости, так и клеточном осаде, выявленный инкубацией с антителом против ENV FeLV.
2) Иммунный анализ бляшек
[0176] Гомогенность популяции была на 100% положительной по отношению к белку ENV FELV для рекомбинантного vCP2296.1.1.2, о чем свидетельствует иммунный анализ бляшек с использованием антител к ENV FELV.
Анализ последовательности
[0177] Инсерцию гена ENV FeLV в сайтах С5 vCP2296.6.1.1.2 амплифицировали с помощью ПЦР. Праймеры 7931 DC и 7932DC, расположенные за "плечами" локуса С5 в геноме ALVAC (см. фигуру 16), использовали для амплификации всего фрагмента C5L-FELV-C5R.
Праймеры для амплифицирования зонда ENV FELV:
7900CXL 5′ AGGAGGGCTTTAGTCCCTGTTCCGA 3′ (SEQ ID NO:21)
7934CXL 5′ ACTAAAGACTGTTGGCTCTGCCTG 3′ (SEQ ID NO:22)
Праймеры для ПЦР-амплификации C5L-ENV FeLV кассетны-C5R:
7931DC 5′ GAATCTGTTAGTTAGTTACTTGGAT 3′ (SEQ ID NO:23)
7932DC 5′ TGATTATAGCTATTATCACAGACTC 3′ (SEQ ID NO:24)
Пример 5. Генерация и характеристика рекомбинанта ALVAC, содержащего нативный ген ENV FELV, вставленный в С5-локус vCP2294, кодон-оптимизированный GAG-PRO-vCP2295 ALVAC С3 Н6Р FeLV
[0178] Донорная плазмида pCXL208.2 содержит нативный ген ENV (SEQ ID NO:5).
[0179] IVR выполнили трансфекцией клеток 1°CEF с 10 мкг Not I-линеаризованной донорной плазмидой pCXL208.2 использованием реагента FuGENE-6® (Roche). Трансфицированные клетки затем инфицировали vCP2294 (пример 2) в качестве вируса спасения при MOI, равной 10. Через 24 часа трансфицированные инфицированные клетки собирали, обрабатывали ультразвуком и использовали для скрининга рекомбинантного вируса.
[0180] Рекомбинантные бляшки подвергали скринингу на основе способа подъемной гибридизации с целью выявления бляшек с помощью специфического зонда FeLV ENV размером 503 п.н., меченного пероксидазой хрена (HRP) в соответствии с протоколом производителя (Amersham Cat#RPN3001). После четырех последовательных раундов очистки бляшек был получен рекомбинант, обозначаемый как vCP2295.2.2.2.1, и подтвержден гибридизацией как 100% положительный для инсерции ENV FELV и 100% отрицательный для пустых сайтов С5.
[0181] Одну бляшку выбрали из 4-го раунда очистки бляшек и разрастили, чтобы получить исходные культуры Р1 (1х колба Т25), Р2 (1х колба Т75) и Р3 (6 x цилиндрические бутылки). Инфицированная клеточная культуральная жидкость из цилиндрических бутылей была собрана и сконцентрирована для получения исходной культуры вируса vCP2295.2.2.2.1. Схема для генерации рекомбинанта vCP2295 представлена на фигуре 17.
Анализ рекомбинанта: следующие анализы проводились на исходных культурах Р3.
Подтверждение генетической чистоты
[0182] Исходные культуры Р3 были подтверждены повторной гибридизацией как на 100% положительные для обоих GAG FeLV и ENV FeLV и на 100% отрицательные для обоих С3 и С5 ORF.
Экспрессионный анализ
1) Вестерн-блот
[0183] Первичные клетки CEF инфицировали исходной культурой Р3 vCP2295.2.2.2.1 при MOI, равной 10, и инкубировали при 37°С в течение 24 часов. Затем собирали надосадочную культуральную жидкость и клетки. Клеточный осадок лизировали буфером для лизиса Reporter Gene Assay Lysis Buffer, производимым Roche (каталожный номер 1897675). Как надосадочную жидкость, так и лизат получали с системой NuPAGE® System с добавлением антиоксиданта. Белки разделяли в геле 10% Bis-Tris Pre-cast gel NuPage® и затем переносили на мембрану PVDF. Антитела против GAG FeLV выявили белок с молекулярной массой, составляющей около 70 кДа, обнаруженный как в надосадочной жидкости, так и в клеточном осадке, и белок с молекулярной массой, составляющей около 80 кДа, который также экспрессировался как в надосадочной жидкости, так и клеточном осаде, выявленный инкубацией с антителом против ENV FeLV.
2) Иммунный анализ бляшек
[0184] Гомогенность популяции была на 100% положительной по отношению к белку ENV FELV для рекомбинантного vCP2295.2.2.2., о чем свидетельствует иммунный анализ бляшек с использованием антител к ENV FELV.
Анализ последовательности
[0185] Подробный анализ геномной ДНК исходной культуры Р3 проводили с помощью ПЦР-амплификации и анализа последовательностей фланкирующих "плечей" локуса С5 и инсерции FeLV. Праймеры 7931DC и 7932DC, расположенные за "плечами" локуса С5 в геноме ALVAC, использовали для амплификации всего фрагмента C5L-FELV-C5R. Результаты показали, что последовательности инсерции FeLV и C5L и C5R из ALVAC являются правильными.
[0186] Последовательность рекомбинанта vCP2295 изображена на фигуре 18.
Пример 6. Оценка эффективности векторной вакцины против оспы канареек (vCP2296, ENV FeLV), вводимой подкожно, через модель вакцинация/заражение
Материалы/Способы
[0187] Сорок четыре кошки, мужского пола и женского пола, в возрасте от 57 до 63 дней при первой вакцинации (в среднем 58 дней; стандартное отклонение 1,3 дней) были случайным образом распределены на две группы по двадцать два животных. Кошки в 1-ой группе были вакцинированы подкожно (subcutaneously, SQ) в день 0 и на 21-й день 1 мл векторной вакцины (vCP2296) FELV-оспа канареек при 106.2 Tissue Culture Dose50 (доза заражения 50% культуры ткани, TCID50)/мл. Кошки во 2-й группе получили две дозы в 1 мл плацебо вакцины, содержащие стерильный физиологический раствор, в день 0 и на 21-й день и служили в качестве отрицательных контролей. На 42-й и 43-й дни (через 3 недели после второй вакцинации) всех кошек заражали 1 мл суспензии вирулентного штамма FeLV (61-Е), содержащей 104,5 и 104,7 TCID50/мл; (дни 42 и 43 соответственно) введением орально-носовым путем. Образцы крови собирали в дни -6, 42 (перед заражением) и через приблизительно 3 недели после заражения с недельным интервалом в течение до 12 недель подряд (от 62-го дня до 146-го дня), и сыворотки тестировали на FeLV-антигенемию (белок р27 FeLV).
[0188] Клиническую оценку проводили, начиная за 2 дня до 1-ой вакцинации вплоть до 42-го дня. Ректальную температуру регистрировали ежедневно в дни -2-0 (до вакцинации), 1-2, 19-21 (до вакцинации) и 22-23. Кроме того, места инъекции оценивались первые 2 дня после каждой вакцинации и с интервалом в неделю после вакцинации до дня заражения, и осмотр включал в себя оценку на отек, покраснение и боль при пальпации.
Результаты: Сохранение р27 FeLV-антигенемии после заражения
[0189] Считалось, что кошка имеет персистентную р27 FELV-антигенемию, когда при проверке на р27 FELV получали положительный результат в течение 3 последовательных недель или 5 непоследовательных недель. Девятнадцать из 22-х кошек (86,4%) из группы плацебо стали персистентно FeLV-антигенемическими по сравнению с 5/21 (23,8%) в вакцинированной группе. Заболеваемость кошек с персистентной FeLV-антигенемией, приходящаяся на заражение FeLV, была значительно ниже (р=0,00005) в вакцинированной группе, чем в группе плацебо. Расчетная превентивная фракция составляла 72,43% с 95%-ным доверительным интервалом от 43,04% до 89,78%. Таким образом, было отмечено снижение на 72% вероятности того, что животное станет персистентным FeLV-антигенемическим, у вакцинированного животного по сравнению с животным из группы плацебо.
Вывод
[0190] Две дозы векторной вакцины FELV-оспы канареек Merial (vCP2296), вводимых SQ путем, оказались эффективными против заражения FeLV, о чем свидетельствуют следующие результаты:
1. При заражении было показано, что тестируемая вакцина является эффективной в предотвращении персистентной FeLV антигенемии у 16 из 21 (76,2%) вакцинированных - зараженных кошек со значительно меньшим количеством вакцинированных кошек с развивающейся персистентной антигенемией по сравнению с контрольной группой (р=0,00005; превентивная фракция 72%; первичная переменная эффективности).
2. Эффективное заражение было подтверждено, о чем свидетельствует развитие персистентной FeLV-антигенемии у 86% (19/22) контрольных кошек.
3. Ни одна из вакцинированных кошек не показала местные или системные реакции после вакцинации.
Пример 7. Сравнение эффективности рекомбинантного гена оспы канареек-FeLV с нативным геном ENV (vCP2295) и рекомбинантного гена оспы канареек-FeLV с оптимизированным геном ENV (vCP2296) заражением кошек
Материалы/Способы
[0191] Всего тридцать SPF (свободных от специфических патогенов (specific pathogen free)) котят, 15 котят мужского пола и 15 котят женского пола, в возрасте от 8 до 12 недель (9 недель в среднем на день 0), были случайным образом распределены на 3 группы по 10 котят в зависимости от их пола, помета и возраста.
[0192] В дни 0 и 28, до вакцинации, контролировали состояние организма всех котят. Затем кошкам из групп А и В вводили вакцину под общей анестезией подкожной инъекцией в межлопаточной области. На 44-й день штамм, которым производили заражение, оттаивали при 37°С, 32 мл штамма смешивали с 8 мл среды F15 с 10% фетальной телячьей сыворотки и держали на измельченном льду до инокуляции. Все кошки подвергались общей анестезии. Затем каждой кошке вносили через орально-носовой путь 1 мл инокулята (0,25 мл в каждую носовую полость) и 0,5 мл перорально (язык, глотка и миндалины).
Результаты
[0193] Заборы крови проводили у бодрствующих кошек в день 0, на 5-й, 7-и, 15-й, 26-й, 35-й, 49-й, 70-й, 77-й, 84-й, 91-й, 96-й, 105-й, 112-й, 133-й день и под общим наркозом (от 0,1 до 0,2 мл/кг Zoletll" 50, внутримышечно) на 44-й, 56-й, 63-й, 119-й, 126-й, 140-й и 147-й день.
1. Тест на антигенемию
[0194] Образцы крови собирали в сухие пробирки в день 0, перед вакцинацией, на 44-й день перед заражением и каждую неделю, начиная с третьей недели после заражения, то есть, на 63-й, 70-й, 77-й, 84-й, 91-й, 98-й, 105-й, 112-й, 119-й, 126-й, 133-й, 140-й и 147-й день для титрования антигена р27 FeLV с помощью набора Witness FeLV kit (Synbiotics Corporation, МО, США). Ответ был бинарным (наличие/отсутствие). Были определены три категории ответа: а) 0: нет антигенемии (все титрования были отрицательными), b) 1: транзиентная антигенемия (менее трех положительных последовательных титрований и менее пяти положительных титрований), с) 2: персистентная антигенемия (положительный ответ в по меньшей мере пяти случаях или наличие не менее трех положительных последовательных титрований).
[0195] В vCP2295-вакцинированной группе (группа А) 40% кошек были защищены от персистентной антигенемии: 4/10 кошек никогда не были определены как положительные и 6/10 кошек показали персистентную антигенемию. В vCP2296-вакцинированной группе (группа В) 60% кошек были защищены от персистентной р27-антигенемии. 5/10 никогда не были определены как положительные, и 1/10 кошек показала персистентную антигенемию: р27 мог быть обнаружен в сыворотке данной кошки на 63-й и 84-й день. 4/10 кошек показали персистентную антигенемию. В контрольной группе (группа С) 100% кошек показали персистентную антигенемию. Результаты приведены в таблице 2.
[0196] Сравнение 3 групп по частоте кошек, у которых не была установлена (антигенемия = 0), была установлена транзиентная (антигенемия = 1) или персистентная (антигенемия = 2) антигенемия, дало значительное p-значение ("точный критерий Фишера": р=0,028). Между группой В и группой С была засвидетельствована тенденция к достижению статистической значимости (скорректированное методом Бонферрони p-значение: А против С: р=0,260, В против С: р=0,056, А против В: р=1).
2. Тест на провирусемию
[0197] Подсчеты лейкоцитарной формулы использовали, чтобы выразить провирусемию (провирусемия) в количестве копий провируса на 50000 WBC (white blood cell, белых кровяных клеток). Образцы крови собирали в ЭДТА-пробирки на 44-й день перед заражением и каждые 3 недели после заражения, то есть на 63-й, 84-й, 105-й, 126-й и 147-й день, для подсчета лейкоцитарной формулы и мониторинга FeLV-провирусемии на РВМС (peripheral blood mononucleated cells (мононуклеированные клетки периферической крови)) с помощью количественной ПЦР. В связи с тем, что данный критерий был связан с повторными измерениями, а также в связи с индивидуальным случайным эффектом, данные по провирусемии анализировали с использованием смешанной модели с повторными измерениями.
a) Провирусемия в крови
[0198] На фигуре 19 представлена эволюция среднего уровня провирусемии на группу после заражения. Фигура 17 отображает эволюцию среднего уровня провирусемии на группу и статуса р27-антигенемии после заражения. В обеих вакцинированных группах р27-антигенемия хорошо коррелировала с уровнем провирусемии (фигура 20).
b) Провирусемия в костном мозге
[0199] Уровень провирусемии в костном мозге р27-негативных кошек составлял от 3 до 5 log 10, тогда как он достигал от 8 до 9 log 10 у р27-положительных кошек. Уровень провирусемии хорошо коррелировал с индивидуальным статусом по р27-антигенемии и с индивидуальным уровнем провирусемии в крови (как показано на фигуре 21).
3. Клеточный иммунный ответ
[0200] Образцы крови собирали в пробирки, обработанные гепарином, на 5-й, 7-й, 15-й, 28-й, 35-й, 49-й, 56-й, 63-й, 119-й и 126-й день для иммунологического мониторинга FeLV. IFNγ-клеточно-опосредованный иммунный ответ контролировали с помощью анализа ELISpot (enzyme-linked immunosorbent spot) после стимуляции РВМС дендритными клетками (dendritic cells (DC)), загруженными FeLV-пулами пептидов на 35-й и 126-й день. ILlO-опосредованный иммунитет контролировали с помощью ELISpot после стимуляции РВМС FeLV-пулами пептидов на 35-й, 63-й и 126-й день. Нормативные Т-клетки контролировали на 5-й, 15-й, 35-й, 49-й, 63-й и 126-й день.
А) Способы
a). Выделение кошачьих РВМС
[0201] РВМС выделяли центрифугированием в градиенте плотности PANCOLL® (600 g в течение 30 минут без торможения). РВМС дважды промывали в стерильном PBS (забуференный фосфатом физиологический раствор) (центрифугирование 400 g в течение 10 минут), а затем подсчитывали с помощью роботизированного счетчика клеток АВХ Pentra 120. Клетки промывали один последний раз в PBS и ресуспендировали при концентрации, равной 5.106/мл в стерильной полной среде RPMI (соответствует RPMI + пенициллин-стрептомицин (PS) + β-меркаптоэтанол (βМ)) + 10% фетальной сыворотки теленка (FCS).
b). Генерация дендритных клеток
[0202] Выделенные в помощью фиколла РВМС культивировали в течение 20 часов в плоских 6-луночных планшетах. Неприкрепившиеся клетки удаляли, и свежую полную среду, дополненную кошачьим IL-4 и кошачьим GM-CSF, добавляли в лунки. Дифференциация моноцитов в DC длилась 7 дней.
в). Анализ ELISpot-IFN:
[0203] Интенсивность FeLV-специфических клеточных иммунных реакций в различных группах животных количественно определяли с использованием анализов IFN-ELISPOT. Планшеты НА ELISPOT покрывали в течение ночи при 4°C с 100 мкл/лунка очищенного моноклонального антитела (монАТ) к собачьему IFN, разбавленного (1/25) в карбонатном/бикарбонатном буфере (0.2 М, рН 9.6). Планшеты с покрытием промывали три раза в стерильном PBS, и незанятые сайты блокировали с помощью стерильной полной среды RPMI-10% FCS в течение 2 ч при комнатной температуре (RT).
[0204] Дендритные клетки загружали пулами пептидов, кодирующими белки ENV и GAG FeLV, на 15-й, 35-й и 126-й день. Вкратце, 100.103 DC были повторно стимулированы отдельно пулами пептидов n°1 и 2 для ENV FeLV или пулами пептидов №2, 3, 6 и 8 GAG-PRO FeLV при 1 мкг/мл в конечном объеме, равном 100 мкл, полной среды RPMI-10% FCS. Загруженные дендритные клетки переносили в планшеты ELISPOT, и 500.103 РВМС добавляли в каждую лунку. Дендритные клетки были загружены нерелевантным пептидом в качестве отрицательного контроля. Клетки стимулировали в течение от 20 до 24 ч при 37°С в присутствии 5% CO2. Клетки затем элиминировали и проводили клеточный лизис. Холодную дистиллированную воду добавляли к каждой лунке (200 мкл) в течение 5 мин при RT. Затем планшеты промывали три раза в PBS-0,05% Tween и инкубировали при 4°С со 100 мкл биотинилированного монАТ к кошачьему IFNγ (разбавленного в 1/100 в PBS-0,05% Tween). Затем планшеты промывали три раза в PBS-0,05% Tween и 100 мкл разбавленного раствора HRP-стрептавидина добавляли в каждую лунку для инкубации в течение 1 ч при 37°С. Затем планшеты промывали три раза в PBS-0,05% Tween и инкубировали в течение 15 минут при RT в темноте с раствором субстрата АЕС. Планшеты интенсивно промывали водопроводной водой и сушили. Пятна подсчитывали с системой камеры CCD (Microvision, Redmond, WA, США). Частоту клеток, образующих пептид-специфические IFNγ-пятна (spot forming cells (SFC)), рассчитывали следующим образом: количество пептид-специфических IFN-SFC = количество IFNγ-SFC при индивидуальной рестимуляции FeLV-пептидным пулом - количество IFNγ-SFC при рестимуляции нерелевантным пептидным пулом. Результаты выражали как log 10.
d). Анализ IL-10-ELISpot
[0205] Анализ IL-10-ELISpot выполняли в соответствии с инструкциями производителя (R&D Systems, Миннеаполис, Миннесота, США). 500.103 очищенных РВМС непосредственно повторно стимулировали с использованием пулов перекрывающихся пептидов для кодирования последовательностей ENV и GAG-PRO FeLV, при 1 мкг/мл в конечном объеме, равном 200 мкл, полной среды RPMI-10% FCS, и помещали в планшетах ELISPOT с IFN-покрытием. 500.103 РВМС стимулировали повторно с нерелевантным пептидом в качестве отрицательного контроля. Частоту клеток, образующих пептид-специфические IL-10-пятна (SFC), рассчитывали следующим образом:
количество пептид-специфических IL-10-SFC = количество IL-10 SFC при индивидуальной рестимуляции FeLV-пептидным пулом - количество IL-10 SFC при рестимуляции нерелевантным пептидом.
Результаты выражали как log 10.
В) Результаты
а) Клеточный иммунный ответ после вакцинации
i) Мониторинг FELV-специфических ответов IFN-секретирующих клеток после вакцинации
[0206] Способность РВМС производить IFN в ответ на рестимуляцию с использованием DC, загруженных пептидными пулами ENV и GAG-PRO FeLV, анализировали с использованием анализа IFN-ELISpot. Анализ суммы IFN+SFC (клетки, образующие пятна (spot forming cells)), индуцированных при активации in vitro с дендритными клетками, нагруженными пулами пептидов кодирования последовательностей ENV и GAG-PRO FeLV, показал, что vCP2296-вакцинация индуцирует более высокую частоту FELV-специфических IFN-секретирующих клеток на 35-й день по сравнению с vCP2295-вакцинацией. Невакцинированные группы не индуцировали никаких IFNγ-секретирующих клеток (фигура 22).
[0207] Различия между vCP2295 и vCP2296 в их способности индуцировать IFNγ-продуцирующие клетки были яснее при фокусировке на специфическом ответе пулов ENV FELV №1 и №2. Анализ частоты IFN + SFC в РВМС при активации in vitro с дендритными клетками, нагруженными пулом пептидов ENV FeLV №1 (кодирование начала последовательности ENV FeLV) показал различие между vCP2296-вакцинацией (группа В) и vCP2295-вакцинацией (группа А) на 35-й день, в крови. Невакцинированные группы не индуцируют никаких IFNγ-секретирующих клеток (фигура 23).
ii) Мониторинг FELV-специфических клеток, секретирующих IL-10, после вакцинации
Мониторинг FELV-специфических клеток, секретирующих IL-10: анализ специфических ENV FeLV ответов в крови
[0208] На 35-й день после вакцинации способность РВМС производить IL-10 в ответ на рестимуляцию пулами пептидов ENV FELV была проанализирована с использованием анализа IL-10-ELISpot. vCP2295-вакцинация индуцировала более высокую частоту ENV FELV-специфических клеток, секретирующих IL-10, по сравнению с vCP2296-вакцинацией и контрольной группой (фигура 24).
Мониторинг FELV-специфических клеток, секретирующих IL-10: анализ специфических GAG-PRO FeLV ответов в крови
[0209] На 35-й день после вакцинации способность РВМС производить IL-10 в ответ на рестимуляцию пулами пептидов GAG-PRO FeLV анализировали с использованием анализа IL-10-ELISpot. vCP2295-вакцинация, как правило, индуцировала больше GAG-PRO FeLV-специфических клеток, секретирующих IL-10, по сравнению с vCP2296-вакцинацией (фигура 25).
[0210] В заключение vCP2295-вакцинация (группа А) индуцировала более высокую частоту ENV FELV-специфических клеток, секретирующих IL-10, в периферической крови, по сравнению с vCP2296-вакцинацией (группа В) и контрольной группой (группа С).
iii) Соотношение FELV-специфических клеток, продуцирующих IFNγ и IL-10, после вакцинации.
[0211] В целях дополнительной оценки двух рекомбинантных вакцин и баланса между ответом Th1 и нормативным ответом, соотношение между количеством FELV-специфических IFNγ SFC и количеством FELV-специфических IL-10 SFC после in vitro рестимуляции ENV или GAG-PRO для каждой вакцинированной группы. Сравнение соотношения FELV-специфических IFNγ IL-10 SFC для каждой группы показало, что vCP2296-вакцинация индуцировала более сбалансированный ответ по сравнению с иммунным ответом, индуцированным vCP2295-вакцинацией, который был смещен к IL-10 ответу. Данное различие было более очевидным в ответ на рестимуляцию ENV FeLV, чем на рестимуляцию GAG-PRO (фигуры 26а и 26b).
b) Мониторинг клеточного иммунного ответа после экспериментального заражения
i) Мониторинг ответов FELV-специфических IFNγ-секретирующих клеток после заражения
[0212] После заражения (126-й день) способность РВМС производить IFNγ в ответ на рестимуляцию DC, загруженными пулами пептидов ENV и GAG-PRO FeLV, была проанализирована с использованием анализа IFNγ-ELISpot. У vCP2296-вакцинированных кошек поддерживалась более высокая частота ENV FELV-специфических IFNγ-секретирующих клеток в РВМС позже после заражения (126-й день) по сравнению с vCP2295-вакцинированными кошками. Никаких GAG-PRO FeLV-специфических IFNγ-секретирующих клеток не наблюдалось в данный момент времени, для любой группы (фигура 27).
ii) Мониторинг ответов FELV-специфических IL-10-секретирующих клеток после заражения
[0213] После заражения (126-й день) способность РВМС производить IL-10 в ответ на рестимуляцию пулами пептидов ENV и GAG-PRO FeLV была проанализирована с использованием анализа IL-10-ELISpot. Заражение FELV специфически увеличивало ENV FELV-специфический IL-10-клеточный ответ во всех группах по сравнению с ответом на 35-й день, без различия между 3-мя группами (фигура 28а). Заражение не влияло на антиген-специфическую реакцию, направленную против области GAG-PRO FeLV, и vCP2295-вакцинированные кошки сохраняли свой GAG-PRO FeLV-специфический IL-10 ответ (фигура 28b). После заражения vCP2295-вакцинированные кошки (группа А) проявляли только FELV-специфический IL-10 иммунный ответ, тогда как у vCP2296-вакцинированных кошек (группа В) развивался FELV-специфический IL-10 иммунный ответ, но также сохранялся их FELV-специфический IFN-ответ.
c) Частота FELV-специфических клеток, продуцирующих IFNγ и IL-10, в защищенных и зараженных животных
[0214] Защищенные и зараженные животные были определены в соответствии с результатами р27-антигенемии. Защищенные и инфицированные животные были разделены внутри каждой группы (фигура 29), и соотношение IFNγ/IL-I0 для каждой подгруппы была рассчитано для оценки того, может ли соотношение IFNγ/IL-I0 SFC после вакцинации свидетельствовать о защите.
[0215] В vCP2296-вакцинированной группе: четыре кошки из 10 продемонстрировали высокое соотношение IFNγ/IL-I0, связанное с высоким IFN-ответом и низким IL-10-ответом, и были защищены. Две кошки из 10 не продемонстрировали никакой IFNγ- или IL-10-ответ и были защищены. Четыре кошки из 10 продемонстрировали низкое соотношение IFNγ/IL-I0, связанное с высоким IL-10 ответом. Три из данных кошек продемонстрировали высокий IFNγ-ответ, и одна из них не продемонстрировала никакого IFNγ-ответа. Данные кошки не были защищены.
[0216] В vCP2295-вакцинированной группе: восемь кошек из 10 продемонстрировали низкое соотношение IFNγ/IL-10, связанное с высоким IL-10-ответом и низким IFNγ-ответом. Шесть из них были инфицированы и две из них были защищены. Две кошки из 10 продемонстрировали как IFNγ-, так и IL-10 ответы и высокое соотношение IFNγ/IL-10. Данные кошки были защищены.
[0217] Защищенные кошки либо из vCP2295- или из vCP2296-вакцинированной группы характеризуются более высоким соотношением IFNγ/IL-10 в крови (фигура 26) по сравнению с зараженными кошками. Кроме того, защищенные кошки из vCP2296-вакцинированной группы имеют более высокое соотношение IFNγ/IL-10 SFC по сравнению с защищенными кошками из vCP2295-вакцинированной группы.
[0218] Защита коррелировала с повышенным соотношением IFNγ/IL-10, и у защищенных кошек из группы vCP2296-вакцинации развился FeLV-специфический клеточный иммунитет, сдвинутый в сторону продукции IFNγ по сравнению с vCP2295-вакцинированными кошками.
Вывод
[0219] Шестьдесят процентов кошек, вакцинированных vCP2296 (оптимизированный ген ENV), были защищены от персистентной антигенемии, и 40% кошек, вакцинированных vCP2295 (нативный ген ENV) были защищены от персистентной антигенемии. Сравнение трех групп отображает существенное различие защиты между вакцинированными и невакцинированными группами и тенденцию к значительному различию группы В, вакцинированной оптимизированным геном ENV (vCP2296) и группы А, вакцинированной нативным геном ENV (vCP2295).
[0220] Провирусемия и результаты антигенемии хорошо коррелировали: кошки с персистентной антигенемией обладали сильной и персистентной провирусемией до конца исследования. Кошки без антигенемии обладали слабой и регрессирующей провирусемией. Р27-негативные кошки были в состоянии контролировать провирусемию. Были подтверждены различия между vCP2295- и vCP2296-вакцинацией, в соответствии с индукцией FeLV-специфических клеток, продуцирующих IFNγ и IL-10 на протяжении вакцинации и фаз заражения. Была продемонстрирована индукция FELV-специфических IFNγ-продуцирующих клеток вакцинами FeLV оспы канареек, особенно когда ген ENV мутировал в иммуносупрессивной последовательности (vCP2296). Интересно, что данные IFNγ-продуцирующие FELV-специфические клетки, индуцированные vCP2296-вакцинацией, еще обнаруживались более чем через 100 дней после заражения, демонстрируя, что vCP2296-вакцинация индуцировали генерацию FeLV-специфических Т-клеток памяти. С другой стороны, vCP2295 был более сильным, чтобы вызвать дифференциацию FeLV-специфических IL-10-продуцирующих клеток. Частота FELV-специфических IL-10-продуцирующих клеток была выше у vCP2295-вакцинированных кошек по сравнению с vCP2296-вакцинированными и невакцинированными контрольными кошками после вакцинации. IL-10 известен своими регулирующими свойствами, принимающими участие либо в ингибировании иммунного ответа или в его прекращении. Более высокое соотношение FELV-специфических IFNγ/IL-10 SFC после вакцинации коррелировало с защитой (оцениваемой по антигенемии). Все кошки, представляющие высокое соотношение IFNγ/IL-10 и низкий IL-10-ответ, были защищены. Данное наблюдение было в соответствии с потенциально иммуно-супрессивной ролью IL-10-продуцирующих клеток и с противовирусной функцией IFNγ-продуцирующих клеток. Модификация гена ENV в вакцине vCP2296 снизила иммуносупрессивные свойства конструкта и обеспечила иммунологическое преимущество данного конструкта по сравнению с нативным геном ENV в vCP2295.
[0221] Данное исследование показало, что модификация гена ENV из FeLV привела к другому качеству иммунного ответа, связанному с лучшей защитой от персистентной антигенемии. Модификация гена ENV из FeLV позволяет FeLV оспы канареек работать при более низкой дозе, чем тот же конструкт с нативным геном ENV FeLV.
[0222] Очевидно, что точные детали описанных способов могут быть изменены или модифицированы без отклонения от сущности описанного изобретения. Авторы заявляют все такие модификации и вариации, которые попадают в пределы объема и сущности приведенной ниже формулы изобретения.
[0223] Все документы, процитированные или упомянутые в данном документе ("здесь цитируемые документы"), и все документы, цитируемые или упоминаемые в цитируемых здесь документах, вместе с инструкциями, описаниями, спецификациями продуктов и описаниями спецификации продуктов любого производителя для любых продуктов, упомянутыми здесь или в любом документе, включенном в качестве ссылки в данном описании, включены в данное описание в качестве ссылки, и могут быть использованы в практике настоящего изобретения.
Реферат
Группа изобретений относится к ветеринарии и может быть использована для вакцинации животных против вируса лейкемии кошек (FeLV). Композиция по изобретению содержит вектор экспрессии, содержащий первый полинуклеотид, кодирующий оптимизированный полипептид оболочки ENV вируса лейкемии кошек FeLV, и второй полинуклеотид, кодирующий полипептид GAG/PRO FeLV. Также настоящее изобретение относится к векторам, которые содержат и экспрессируют антигены FeLV и наборам для вакцинации. Использование изобретений позволяет индуцировать иммунный ответ против FeLV. 4 н. и 19 з.п. ф-лы, 2 табл., 29 ил., 7 пр.

Комментарии