Применение нитрокарбоновых кислот для лечения, диагностики и профилактики агрессивных форм заживления - RU2567049C2
Код документа: RU2567049C2
Чертежи







Описание
Каждая клетка организма реагирует на внешние воздействия посредством множества молекулярных механизмов и структурных изменений. В частности, могут активироваться гены, которые производят изменения в клеточном метаболизме, фенотипе, экспрессии мембранных рецепторов, мембранной функциональности и высвобождении молекул и везикул, которые затем инициируют местную или системную реакцию. Величина или степень клеточной реакции, как правило, коррелирует с величиной клеточного повреждения. Повреждение может быть вызвано ионизацией, превышением критического значения температуры или ее падением ниже критического значения, а также превышением критического значения рН или его падением ниже критического значения, осмотическим давлением или концентрацией электролитов, токсинами, детергентами, механическими повреждениями, воздействием сил растяжения или сдвига, превышением критического значения давления или его падением ниже критического значения (баротравмой) и т.д. Степень повреждения индивидуальной клетки или группы клеток определяет степень клеточной реакции (соответственно, форму реакции). Эти формы реакции могут (1) иметь минимальные последствия, такие как раскрытие межклеточных плотных контактов, (2) иметь результатом местно ограниченный эффект, такой как продуцирование соединений внеклеточного матрикса, а также местные и отдаленные реакции (например, локальную адгезию фибрина и высвобождение микрочастиц для рекрутинга прогениторных клеток из костного мозга) или (3) вызывать комплекс местных или системных реакций, который может активировать всю иммунную систему организма. Целью этих форм реакции является восстановление клеточной целостности, что также известно как заживление. Процесс заживления можно упрощенно подразделить на три формы реакции: (1) пассивное заживление, т.е. измененные клеточные функции и клеточная морфология восстанавливаются полностью без изменения текстуры или функции ткани, (2) активный процесс заживления, который имеет функцию репарации и восполнения поврежденных или разрушенных структур (например, образование внеклеточного матрикса для заполнения дефектов, а также разложение фрагментов разрушенных клеток, клеточный митоз с контактной инактивацией), и (3) агрессивный процесс заживления, т.е. образование внеклеточного матрикса и клеточная пролиферация, которые выходят за пределы количества материала, необходимого для восполнения дефекта. Агрессивный процесс заживления возможен при продолжающемся повреждении клеток (например, при продолжающемся воздействии сил растяжения или сдвига, токсинов, при химических раздражениях или при обширном повреждении тканей или при бактериальной колонизации).
Процесс пассивного заживления ведет к «restitutio ad integrum» (восстановлению целостности), т.е. функциональные или структурные изменения не происходят.
Активное заживление представляет собой процесс заживления, который, как правило, поддерживает функциональность ткани посредством восстановления ее целостности. Однако текстура вновь образованных тканей может отличаться от структуры, существовавшей до ранения или травмы, что не вызывает нарушения функции затронутых органов или структур и не сопровождается эстетическими или косметическими дефектами.
В отличие от этого, агрессивный процесс заживления ведет к функциональной или структурной дисфункции ткани или затронутого органа, а также к эстетическим проблемам, что требует дополнительного медицинских лечебных мероприятий. Агрессивный процесс заживления может приводить к неблагоприятным побочным эффектам того первоначального изменения, которое является причинным фактором заболевания, и/или к неблагоприятным побочным эффектам терапевтического мероприятия, таким как сращивание слоев соединительной ткани посредством прочной адгезии или повышенная ригидность ткани. Массивная адгезия слоев ткани часто делает затруднительным хирургический доступ или в результате адгезии могут возникать функциональные расстройства в том же или другом органе. Кроме того, повышенная ригидность ткани может служить причиной функциональных расстройств или неблагоприятных косметических эффектов. В случае васкулопатии это может приводить к снижению кровоснабжения органа.
Точные условия, которые являются причиной активных или агрессивных форм заживления, пока еще неизвестны. Однако известно, что многие медицинские состояния имеют свойственный им риск развития агрессивной формы заживления.
Известно, что клетки могут реагировать по-разному на одни и те же стимулы/раздражители и что на эту пластичность могут влиять внешние мероприятия и внутренние воздействия. Далее в настоящем документе описаны некоторые известные формы таких реакций, а также их способность поддаваться определенным влияниям.
Клетки имеют множество чувствительных элементов, которые могут воспринимать большинство раздражителей или факторов, способных повреждать клетки. В одном аспекте это относится к восприятию сил сдвига. Многие клетки изменяют свой фенотип в ответ на активацию этих сенсоров, результатом чего может быть дальнейшие изменения метаболизма, происходящие параллельно. Можно показать, что за эту реакцию являются ответственными тонкие механические изменения. Однако на восприятие механических импульсов, действующих на цитоскелет, влияют компоненты клеточной стенки или физические характеристики самой клеточной мембраны.
Дополнительным обстоятельством, которое может служить причиной агрессивной формы заживления, является воспаление, сопутствующее процессу заживления. Это можно объяснить воспалительным процессом и одновременной активацией путей клеточного сигналинга, которая может происходить в процессе заживления. Однако воспаление само по себе не приводит к агрессивной форме заживления. Имеется бесчисленное множество клинических ситуаций и/или заболеваний, классифицируемых как воспаления в медицинских учебниках, которые полностью проходят без каких бы то ни было повреждений и/или дисфункций в затронутых тканях или органах (например, при пневмонии, гастрите, остеомиелите, вызываемых бактериями, вирусами или микробами). Кроме того, воспаление клинически характеризуется совпадением нескольких патологических изменений, приводящих локально к гиперемии и отеку, а также к вовлечению местных и системных защитных систем, что индуцирует инфильтрацию белых кровяных клеток (лейкоцитов). Однако в активной форме заживления можно также наблюдать и инвазию макрофагов, происходящую для удаления клеточных фрагментов без индуцирования воспалительного процесса.
Хотя воспалительный процесс может быть вовлеченным в агрессивную форму заживления, однако характерные изменения, происходящие при агрессивном заживлении - такие как дифференцировка, миграция и деление эндотелиальных и мезенхимных клеток, а также фибробластов, которые дополнительно продуцируют внеклеточный матрикс, - могут вызываться многими условиями, не охватываемыми термином «воспаление». Это подтверждается тем фактом, что стимулирующие медиаторы продуцируются клетками разных типов и даже затронутыми клетками посредством стимуляции по механизму аутокринной петли. Классическим примером этого является реактивный процесс в стенке левого желудочка, являющийся последствием повышенного давления крови, которое вызывает гипертрофию, сопровождаемую фиброзными изменениями текстуры ткани без участия белых кровяных клеток. Другим хрестоматийным примером является изменение внутриклеточного и/или внеклеточного рН. Как правило, воспаление влечет за собой ацидоз в затронутой ткани. Однако не каждый сдвиг рН в ткани обусловлен воспалением или выздоровлением после воспаления. Он может иметь место при многих других заболеваниях или состояниях, таких как язва желудка, инсульт или эпилептические судороги.
Тяжелая травматизация клеток, органелл или тканей может приводить к воспалительной реакции, которая, в свою очередь, может усилить повреждение клеток, органелл или тканей, а также индуцировать агрессивную форму заживления. Однако блокирование одного или нескольких ключевых путей передачи воспалительного сигнала ослабляет, но не ингибирует, воспалительную реакцию на травму. Поэтому эффекты, оказываемые на воспалительные пути нитрованными жирными кислотами, не могут объяснить то влияние, которое производится согласно настоящему изобретению на реакцию клеток, органелл или тканей на раздражение, травму или повреждение. Предлагали гипотезу о том, что механизмом действия, которое приводит к различным формам реакции раздраженных клеток, органелл или тканей, является стабилизация самих мембран или их составных частей. Другими словами, нитрокарбоновые кислоты, включенные в эти мембраны, делают их более устойчивыми в отношении физических, химических или электрических раздражений, тем самым модулируя реакцию клеток, органелл или тканей на эти раздражения. Это может приводить к ослаблению повреждения клеток, органелл или тканей, являющегося результатом раздражения. Кроме того, инициация компонентов процесса заживления (репарации) запускается медиаторами, подобными трансформирующему фактору роста β-1 и IGFBP-5 [пятая форма белка, связывающего IGF (инсулиноподобный фактор роста)] (Allan et al., J Endocrinol 2008, 199, 155-164; Sureshbabu et al., Biochem Soc Trans 2009, 37, 882-885). Высвобождение медиаторов, стимулирующих фибробласты, контролируется интегринами, что представляет собой реакцию на многие факторы клеточного стресса (Wipff et al., Eur J Cell Biol 2008, 87, 601-615). Кроме того, экспрессируются рецепторы клеточных мембран, такие как рецептор ангиотензина II-1 и инактиватора-1 активатора плазминогена (PAI-1), которые могут опосредовать миграционные и/или митотические реакции (Pedroja et al., J Biol Chem 2009, 284, 20708-20717; de Cavanagh et al., Am J Physiol Heart Circ Physiol 2009, 296, H550-558). Кроме того, предполагали существование «аутокринной петли» ангиотензина-TGF-бета1 в миофибробластах легких человека (Uhal et al., Curr Pharm Des 2007, 11, 1247-1256). Было найдено, что это справедливо и для ожоговых повреждений (Gabriel et al., J Burn Care Res 2009, 30, 471-481). Другими словами, этот каскад реакций, как ответ на травму, делает сами затронутые клетки и клетки, соседние с ними, способными реагировать посредством изменения их морфологии, миграции, клеточного деления или продуцирования соединений внеклеточного матрикса. Было показано, что результатом стимуляции неактивированных кератоцитов или фибробластов является фиброз.
Для отграничения воспаления как патофизиологической причины развития агрессивной формы заживления от других случаев, в которых нитрокарбоновые кислоты, как было заявлено, эффективно предупреждают или оказывают лечебное действие на агрессивные формы заживления, должны совпадать, по меньшей мере, три ключевые особенности (как определено ниже), прежде чем заболевание или состояние можно будет правильно определить как подлинное воспаление. Все другие клинические состояния/заболевания, в которые не вовлечено подлинное воспаление или в которых признаки воспаления имеют второстепенное значение, можно называть невоспалительными. Эта точка зрения дополнительно обосновывается научными данными о том, что блокирование одного или более из медиаторов воспаления фармакологическим воздействием, как правило, не может предупреждать развития агрессивной формы заживления. Это так же справедливо и для различных физиологических веществ (например, глюкокортикоидов) или фармацевтических веществ (антител к цитокинам), которые, как было показано, имеют противовоспалительные или антипролиферативные эффекты.
Это так же справедливо и для ингибирования различных клеточных сигнальных путей, которые опосредуют воспалительный стимул.
Восприятие и передача сигнала клеткой в значительной степени регулируется физическими физико-химическими свойствами клеточной мембраны.
Активация рецепторов, активируемых пролифератором пероксисом (PPAR), или стимуляция продуцирования гемоксигеназы-1, как было найдено, уменьшает клеточную пролиферацию в нескольких модельных клеточных культурах; однако клинические испытания не подтвердили наличия достоверного ингибирования процессов патологического заживления.
Влияние нитрокарбоновых кислот на клеточные мембраны пока еще не изучено. Неожиданно было обнаружено, что нитрокарбоновые кислоты согласно настоящему изобретению обладают эффектами (по всей вероятности, неспецифическими), действующими на физико-химические свойства мембран клеток и органелл, результатом чего являются изменения клеточного восприятия и передачи сигналов различных белков или компонентов мембран, что тем самым настраивает клеточную реактивность на воздействия факторов окружающей среды. Это можно было бы использовать для модифицирования реактивности клеток или органелл, вовлеченных в патологические изменения/ранения/травмы, тем самым предупреждая агрессивную реакцию заживления или ослабляя ее.
Этот эффект нитрокарбоновых кислот нельзя объяснить известными механизмами, воздействующими на пути внутриклеточных реакций, зарегистрированными для нитрокарбоновых кислот, или их комбинированным ингибированием или стимуляцией. Кроме того, результатом терапевтического введения нитрокарбоновых кислот в клеточные мембраны является комплексное ингибирование передачи клеточного повреждения внутри и вне клетки, так что внутренние и внешние пути клеточной реакции не инициируются или не активируются.
Нитрокарбоновые кислоты пока еще не были испытаны на наличие анестезирующего эффекта. Неожиданно было обнаружено, что уменьшение восприятия боли может быть достигнуто местным применением нитрокарбоновых кислот. Как предполагают, за этот феномен является ответственным ингибирование восприятия боли, поскольку на высвобождение и обратный захват нейромедиаторов в синаптической щели влияет состав мембраны. Эти эффекты невозможно объяснить влиянием нитрокарбоновых кислот на отдельные пути клеточных сигналов или их комбинированным активированием или ингибированием. Таким образом, применение нитрокарбоновых кислот согласно настоящему изобретению для создания вышеописанных эффектов представляет собой инновационную профилактическую и терапевтическую концепцию.
Таким образом, задачей настоящего изобретения является нахождение соединений, которые способны ингибировать агрессивную форму заживления. Указанная задача решена предоставлением технических сведений независимых пунктов формулы настоящего изобретения. Дополнительные полезные варианты осуществления настоящего изобретения представлены в зависимых пунктах формулы изобретения, в настоящем описании и в примерах.
Неожиданно было обнаружено, что эту задачу можно решить, применяя нитрокарбоновые кислоты для терапии и профилактики таких заболеваний, в которые вовлечена такая агрессивная форма заживления. Неожиданно было также обнаружено, что покрытие имплантатов и медицинских устройств нитрокарбоновыми кислотами (в настоящем документе также называемыми нитрованными жирными кислотами) является особо полезным для процесса заживления для устранения возможности развития агрессивных форм заживления (даже при подпороговых концентрациях, при которых невозможно ожидать никакого фармакологического действия).
Механизм действия включает в себя модулирование реакции мембран клеток или органелл на раздражение и/или стимул, потенциально вызывающие патологическую реакцию, включая клеточную дегрануляцию, клеточную дедифференцировку, клеточную миграцию, клеточное деление, продуцирование внеклеточного матрикса, образование инородных тел и клеточную смерть. Дополнительным профилактическим и терапевтическим эффектом является стабилизация свойств клеточной мембраны (устойчивость к механическим, химическим или электрическим раздражениям) и ее функциональности (мембранного потенциала, регуляции ионных каналов, трансмембранной передачи сигналов). Кроме того, эти соединения должны ослаблять симптомы, которые могут появляться при заболеваниях, в которые вовлечена такая агрессивная форма заживления.
Описание
Неожиданно было обнаружено, что нитрокарбоновые кислоты общей формулы (X)

можно применять для лечения или профилактики заболевания или состояния, демонстрирующего агрессивную реакцию заживления тканей, клеток или органелл у млекопитающего, включая людей, и можно также применять для изготовления фармацевтической композиции или композиции для пассивного покрытия для лечения или профилактики заболевания или состояния, демонстрирующего агрессивную реакцию заживления тканей, клеток или органелл.
Такие заболевания или состояния демонстрируют агрессивную реакцию заживления, которая является результатом внешнего раздражения, ранения или травмы, причем указанные заболевания или состояния, при которых имеют место такое внешнее раздражение, ранение или травма, являются выбранными из группы, включающей в себя ожог, химический ожог, ожог щелочью, жжение, гипотермию, обморожение, прижигание, гранулему, некроз, язву, перелом, реакцию на чужеродное тело, порез, царапину, рваную рану, гематому, разрыв, контузию, образование трещин или прободение. Кроме того, такие заболевания или состояния являются результатом эндогенного раздражения или стимуляции посредством острых или хронических физических, химических или электрических средств. Примерами заболеваний или состояний, при которых имеют место такое эндогенное раздражение или стимуляция, являются фасцит, тендинит, невропатия или гипертрофия предстательной железы.
В формуле (X) остаток R* представляет собой водород, остаток полиэтиленгликоля, остаток полипропиленгликоля, холестерил, фитостерил, эргостерил, остаток кофермента A или алкильную группу, состоящую из 1-10 атомов углерода (предпочтительно, из 1-7 атомов углерода), причем эта алкильная группа может содержать одну или более двойных связей и/или одну или более тройных связей, может быть циклической и/или может быть замещенной одной или более нитрогруппами и/или одним или более заместителями S1-S20.
Термин «нитрокарбоновая кислота» относится также к сложным эфирам нитрокарбоновых кислот. Таким образом, термин «нитрокарбоновая кислота» явным образом охватывает также те соединения, где R* не является водородом - а именно, сложные эфиры нитрокарбоновых кислот. Следовательно, везде, где используется термин «нитрокарбоновая кислота», подразумеваются и соответствующие сложные эфиры, которые представлены общей формулой (Х), где R* не является -H.
Предпочтительно, R* представляет собой один из следующих заместителей: -CH2F, -CHF2, -CF3, -CH2Cl, -CH2Br, -CH2I, -CH2-CH2F, -CH2-CHF2, -CH2-CF3, -CH2-CH2Cl, -CH2-CH2Br, -CH2-CH2I, цикло-C3H5, цикло-C4H7, цикло-C5H9, цикло-C6H11, цикло-C7H13, цикло-C8H15, -Ph, -CH2-Ph, -CPh3, -CH3, -C2H5, -C3H7, -CH(CH3)2, -C4H9, -CH2-CH(CH3)2, -CH(CH3)-C2H5, -C(CH3)3, -C5H11, -CH(CH3)-C3H7, -CH2-CH(CH3)-C2H5, -CH(CH3)-CH(CH3)2, -C(CH3)2-C2H5, -CH2-C(CH3)3, -CH(C2H5)2, -C2H4-CH(CH3)2, -C6H13, -C7H15, -C6H17, -C9H19, -C10H21, -C3H6-CH(CH3)2, -C2H4-CH(CH3)-C2H5, -CH(CH3)-C4H9, -CH2-CH(CH3)-C3H7, -CH(CH3)-CH2-CH(CH3)2, -CH(CH3)-CH(CH3)-C2H5, -CH2-CH(CH3)-CH(CH3)2, -CH2-C(CH3)2-C2H5, -C(CH3)2-C3H7, -C(CH3)2-CH(CH3)2, -C2H4-C(CH3)3, -CH(CH3)-C(CH3)3, -CH=CH2, -CH2-CH=CH2, -C(CH3)=CH2, -CH=CH-CH3, -C2H4-CH=CH2, -CH2-CH=CH-CH3, -CH=CH-C2H5, -CH2-C(CH3)=CH2, -CH(CH3)-CH=CH, -CH=C(CH3)2, -C(CH3)=CH-CH3, -CH=CH-CH=CH2, -C3H6-CH=CH2, -C2H4-CH=CH-CH3, -CH2-CH=CH-C2H5, -CH=CH-C3H7, -CH2-CH=CH-CH=CH2, -CH=CH-CH=CH-CH3, -CH=CH-CH2-CH=CH2, -C(CH3)=CH-CH=CH2, -CH=C(CH3)-CH=CH2, -CH=CH-C(CH3)=CH2, -C2H4-C(CH3)=CH2, -CH2-CH(CH3)-CH=CH2, -CH(CH3)-CH2-CH=CH2, -CH2-CH=C(CH3)2, -CH2-C(CH3)=CH-CH3, -CH(CH3)-CH=CH-CH3, -CH=CH-CH(CH3)2, -CH=C(CH3)-C2H5, -C(CH3)=CH-C2H5, -C(CH3)=C(CH3)2, -C(CH3)2-CH=CH2, -CH(CH3)-C(CH3)=CH2, -C(CH3)=CH-CH=CH2, -CH=C(CH3)-CH=CH2, -CH=CH-C(CH3)=CH2, -C4H8-CH=CH2, -C3H6-CH=CH-CH3, -C2H4-CH=CH-C2H5, -CH2-CH=CH-C3H7, -CH=CH-C4H9, -C3H6-C(CH3)=CH2, -C2H4-CH(CH3)-CH=CH2, -CH2-CH(CH3)-CH2-CH=CH2, -CH(CH3)-C2H4-CH=CH2, -C2H4-CH=C(CH3)2, -C2H4-C(CH3)=CH-CH3, -CH2-CH(CH3)-CH=CH-CH3, -CH(CH3)-CH2-CH=CH-CH3, -CH2-CH=CH-CH(CH3)2, -CH2-CH=C(CH3)-C2H5, -CH2-C(CH3)=CH-C2H5, -CH(CH3)-CH=CH-C2H5, -CH=CH-CH2-CH(CH3)2, -CH=CH-CH(CH3)-C2H5, -CH=C(CH3)-C3H7, -C(CH3)=CH-C3H7, -CH2-CH(CH3)-C(CH3)=CH2, -CH(CH3)-CH2-C(CH3)=CH2, -CH(CH3)-CH(CH3)-CH=CH2, -CH2-C(CH3)2-CH=CH2, -C(CH3)2-CH2-CH=CH2, -CH2-C(CH3)=C(CH3)2, -CH(CH3)-CH=C(CH3)2, -C(CH3)2-CH=CH-CH3, -CH(CH3)-C(CH3)=CH-CH3, -CH=C(CH3)-CH(CH3)2, -C(CH3)=CH-CH(CH3)2, -C(CH3)=C(CH3)-C2H5, -CH=CH-C(CH3)3, -C(CH3)2-C(CH3)=CH2, -CH(C2H5)-C(CH3)=CH2, -C(CH3)(C2H5)-CH=CH2, -CH(CH3)-C(C2H5)=CH2, -CH2-C(C3H7)=CH2, -CH2-C(C2H5)=CH-CH3, -CH(C2H5)-CH=CH-CH3, -C(C4H9)=CH2, -C(C3H7)=CH-CH3, -C(C2H5)=CH-C2H5, -C(C2H5)=C(CH3)2, -C[C(CH3)3]=CH2, -C[CH(CH3)(C2H5)]=CH2, -C[CH2-CH(CH3)2]=CH2, -C2H4-CH=CH-CH=CH2, -CH2-CH=CH-CH2-CH=CH2, -CH=CH-C2H4-CH=CH2, -CH2-CH=CH-CH=CH-CH3, -CH=CH-CH2-CH=CH-CH3, -CH=CH-CH=CH-C2H5, -CH2-CH=CH-C(CH3)=CH2, -CH2-CH=C(CH3)-CH=CH2, -CH2-C(CH3)=CH-CH=CH2, -CH(CH3)-CH=CH-CH=CH2, -CH=CH-CH2-C(CH3)=CH2, -CH=CH-CH(CH3)-CH=CH2, -CH=C(CH3)-CH2-CH=CH2, -C(CH3)=CH-CH2-CH=CH2, -CH=CH-CH=C(CH3)2, -CH=CH-C(CH3)=CH-CH3, -CH=C(CH3)-CH=CH-CH3, -C(CH3)=CH-CH=CH-CH3, -CH=C(CH3)-C(CH3)=CH2, -C(CH3)=CH-C(CH3)=CH2, -C(CH3)=C(CH3)-CH=CH2, -CH=CH-CH=CH-CH=CH2, -C≡CH, -C≡C-CH3, -CH2-C≡CH, -C2H4-C≡CH, -CH2-C≡C-CH3, -C≡C-C2H5, -C3H6-C≡CH, -C2H4-C≡C-CH3, -CH2-C≡C-C2H5, -C≡C-C3H7, -CH(CH3)-C≡CH, -C≡C-C4H9, -CH2-CH(CH3)-C≡CH, -CH(CH3)-CH2-C≡CH, -CH(CH3)-C≡C-CH3, -C4H8-C≡CH, -C3H6-C≡C-CH3, -C2H4-C≡C-C2H5, -CH2-C≡C-C3H7, -C2H4-CH(CH3)-C≡CH, -CH2-CH(CH3)-CH2-C≡CH, -CH(CH3)-C2H4-C≡CH, -CH2-CH(CH3)-C≡C-CH3, -CH(CH3)-CH2-C≡C-CH3, -CH(CH3)-C≡C-C2H5, -CH2-C≡C-CH(CH3)2, -C≡C-CH(CH3)-C2H5, -C≡C-CH2-CH(CH3)2, -C≡C-C(CH3)3, -CH(C2H5)-C≡C-CH3, -C(CH3)2-C≡C-CH3, -CH(C2H5)-CH2-C≡CH, -CH2-CH(C2H5)-C≡CH, -C(CH3)2-CH2-C≡CH, -CH2-C(CH3)2-C≡CH, -CH(CH3)-CH(CH3)-C≡CH, -CH(C3H7)-C≡CH, -C(CH3)(C2H5)-C≡CH, -C≡C-C≡CH, -CH2-C≡C-C≡CH, -C≡C-C≡C-CH3, -CH(C≡CH)2, -C2H4-C≡C-C≡CH, -CH2-C≡C-CH2-C≡CH, -C≡C-C2H4-C≡CH, -CH2-C≡C-C≡C-CH3, -C≡C-CH2-C≡C-CH3, -C≡C-C=C-C2H5, -C≡C-CH(CH3)-C≡CH, -CH(CH3)-C≡C-C≡CH, -CH(C≡CH)-CH2-C≡CH, -C(C≡CH)2-CH3, -CH2-CH(C≡CH)2, -CH(C≡CH)-C≡C-CH3 или любую из алкильных цепей нитрокарбоновых кислот, указанных в настоящем документе. Термин «алкильная цепь нитрокарбоновой кислоты» относится к нитрокарбоновой кислоте без карбоксильной кислотной группы. Например, алкильной цепью 9-нитро-цис-гексадеценовой кислоты является 8-нитро-цис-пентадецен-1-ил.
Другими словами, фрагмент O-R* представляет собой -OH, полиэтиленгликолил, полипропиленгликолил, холестероил, фитостероил, эргостероил, кофермент A или алкоксильную группу, состоящую из 1-10 атомов углерода, причем эта алкоксильная группа может содержать одну или более двойных связей и/или одну или более тройных связей и/или может быть замещенной одной или более нитрогруппами и/или одним или более заместителями S1-S20. Предпочтительно, O-R* обозначает метаноил, этаноил, пропаноил, изопропаноил, бутаноил, втор-бутаноил, изобутаноил, трет-бутаноил, винилалкоголил (-O-CH=CH2), аллилалкоголил (-O-CH2-CH=CH2). Наиболее предпочтительная группа O-R* представляет собой -OH.
Кроме того, как указано в общей формуле (Х), к одному из атомов углерода углеродной цепи присоединена, по меньшей мере, одна нитрогруппа (-NO2). Нитрогруппа, показанная в общей формуле (Х), не имеет конкретного положения, она может быть присоединенной к любому из атомов углерода (от α до ω) алкильной цепи, т.е. цепи атомов углерода. Наиболее предпочтительно, нитро группа (одна или более) является присоединенной к виниловому фрагменту ненасыщенной алкильной цепи ненасыщенной карбоновой кислоты, где термин «ненасыщенная карбоновая кислота» также охватывает и сложные эфиры ненасыщенных карбоновых кислот, как определено выше. Это означает, что нитрогруппа (одна или более), наиболее предпочтительно, является присоединенной к двойной связи в ненасыщенной алкильной цепи ненасыщенной карбоновой кислоты. Однако цепь углеродных атомов, которую называют алкильной цепью, может содержать более одной нитрогруппы. Кроме того, цепь углеродных атомов может также содержать двойные связи и/или тройные связи и может быть линейной или разветвленной и может содержать дополнительные заместители, определенные как заместители S1-S20. Таким образом, термин «алкильная цепь» относится не только к линейным и насыщенным алкильным группам, но и к мононенасыщенным, полиненасыщенным, разветвленным и дополнительно замещенным алкильным группам или алкенильным группам или алкинильным группам, соответственно. Предпочтительными являются моно-, ди- и полиненасыщенные цепи углеродных атомов ненасыщенных карбоновых кислот (включая сложные эфиры ненасыщенных карбоновых кислот). Наиболее предпочтительными являются двойные связи в цепи атомов углерода карбоновой кислоты, тогда как тройные связи и насыщенные цепи углеродных атомов ненасыщенной карбоновой кислоты являются менее предпочтительными.
Таким образом, термин «цепь атомов углерода» относится к алкильной цепи, к которой присоединена, по меньшей мере, одна нитрогруппа, и которая состоит из 1-40 атомов углерода, причем эта алкильная цепь может содержать одну или более двойных связей и/или одну или более тройных связей и может быть циклической и/или может быть замещенной одной или более нитрогруппами и/или одним или более заместителями S1-S20. Для случая, когда термин «алкил» представляется неясным вследствие того, что алкильная группа является насыщенной и может не содержать двойных или тройных связей, предоставлено следующее определение, заменяющее эту часть в п.1 и п.8: термин «цепь углеродных атомов» относится к алкильной цепи или к алкенильной цепи или к алкинильной цепи, к которой присоединена, по меньшей мере, одна нитрогруппа и которая состоит из 1-40 атомов углерода, причем эта алкильная цепь может быть циклической и может быть замещенной одной или более нитрогруппами и/или одним или более заместителями S1-S20, алкенильная цепь содержит одну или более двойных связей и может быть циклической и может быть замещенной одной или более нитрогруппами и/или одним или более заместителями S1-S20, а алкинильная цепь содержит одну или более тройных связей и может быть циклической и может быть замещенной одной или более нитрогруппами и/или одним или более заместителями S1-S20. Термин «может быть замещенной одной или более нитрогруппами» следует понимать как то, что одна или более нитрогрупп может присутствовать на цепи атомов углерода в дополнение к одной нитрогруппе, которая требуется обязательно и которая явным образом указана и изображена на общей формуле (Х).
Термин «цепь углеродных атомов» относится к алкильной цепи, которая является насыщенной или которая может содержать одну или более двойных связей и/или тройных связей, или этот термин относится к алкильной цепи (подразумеваются только насыщенные цепи атомов углерода), к алкенильной цепи или к алкинильной цепи, к которой присоединена, по меньшей мере, одна нитрогруппа, которая является нитрогруппой, явным образом изображенной и указанной в общей формуле (Х). Цепь атомов углерода содержит, предпочтительно, от 1 до 10 двойных связей или виниловых фрагментов (более предпочтительно, от 1 до 5). Цепь атомов углерода состоит из 1-40 атомов углерода (предпочтительно, от 2 до 30 атомов углерода и, более предпочтительно, от 4 до 24 атомов углерода), причем эта алкильная цепь может содержать одну или более двойных связей и/или одну или более тройных связей и/или может быть замещенной одной или более нитрогруппами и/или одним или более заместителями S1-S20,
Каждый из заместителей S1-S20 независимо один от другого представляет собой -OH, -OP(O)(OH)2, -P(O)(OH)2, -P(O)(OCH3)2, -OCH3, -OC2H5, -OC3H7, -O-цикло-C3H5, -OCH(CH3)2, -OC(CH3)3, -OC4H9, -OPh, -OCH2-Ph, -OCPh3, -SH, -SCH3, -SC2H5, -F, -Cl, -Br, -I, -CN, -OCN, -NCO, -SCN, -NCS, -CHO, -COCH3, -COC2H5, -COC3H7, -CO-цикло-C3H5, -COCH(CH3)2, -COC(CH3)3, -COOH, -COOCH3, -COOC2H5, -COOC3H7, -COO-цикло-C3H5, -COOCH(CH3)2, -COOC(CH3)3, -OOC-CH3, -OOC-C2H5, -OOC-C3H7, -OOC-цикло-C3H5, -OOC-CH(CH3)2, -OOC-C(CH3)3, -CONH2, -CONHCH3, -CONHC2H5, -CONHC3H7, -CON(CH3)2, -CON(C2H5)2, -CON(C3H7)2, -NH2, -NHCH3, -NHC2H5, -NHC3H7, -NH-цикло-C3H5, -NHCH(CH3)2, -NHC(CH3)3, -N(CH3)2, -N(C2H5)2, -N(C3H7)2, -N(цикло-C3H5)2, -N[CH(CH3)2]2, -N[C(CH3)3]2, -SOCH3, -SOC2H5, -SOC3H7, -SO2CH3, -SO2C2H5, -SO2C3H7, -SO3H, -SO3CH3, -SO3C2H5i -SO3C3H7, -OCF3, -OC2F5, -O-COOCH3, -O-COOC2H5, -O-COOC3H7, -O-COO-цикло-C3H5, -O-COOCH(CH3)2, -O-COOC(CH3)3, -NH-CO-NH2, -NH-CO-NHCH3, -NH-CO-NHC2H5, -NH-CO-N(CH3)2, -NH-CO-N(C2H5)2, -O-CO-NH2, -O-CO-NHCH3, -O-CO-NHC2H5, -O-CO-NHC3H7, -O-CO-N(CH3)2, -O-CO-N(C2H5)2, -O-CO-OCH3( -O-CO-OC2H5( -O-CO-OC3H7, -O-CO-O-цикло-C3H5, -O-CO-OCH(CH3)2, -O-CO-OC(CH3)3, -CH2F, -CHF2, -CF3, -CH2Cl, -CH2Br, -CH2I, -CH2-CH2F, -CH2-CHF2, -CH2-CF3, -CH2-CH2Cl, -CH2-CH2Br, -CH2-CH2I, -CH3, -C2H5, -C3H7, -цикло-C3H5, -CH(CH3)2, -C(CH3)3, -C4H9, -CH2-CH(CH3)2, -CH(CH3)-C2H5, -C5H11, -Ph, -CH2-Ph, -CPh3, -CH=CH2, -CH2-CH=CH2, -C(CH3)=CH2, -CH=CH-CH3, -C2H4-CH=CH2, -CH=C(CH3)2, -C≡CH, -C≡C-CH3, -CH2-C≡CH, -P(O)(OC2H5)2, холестерил (C27H45O-), фосфатидилинозит, нуклеотиды, аналоги, представляющие собой простые эфиры, липоамины, дигидролипоамины, лизобифосфатидную кислоту, анандамид, длинноцепочечный N-ацилэтаноламид, sn-1-заместители с глицерином или диглицерином, sn-2-заместители с глицерином или диглицерином, sn-3-заместители, церамид, сфингозин, ганглиозид, галоактозилцерамид, аминоэтилфосфоновую кислоту.
Однако предпочтительными являются ненасыщенные нитрокарбоновые кислоты, и кроме того, предпочтительными являются ненасыщенные нитрокарбоновые кислоты с одной или двумя нитрогруппами.
В следующем конкретном описании подробно представлены области применения. Области показаний для применения, а также описанные типы показаний для применения или нанесения нитрокарбоновых кислот и/или их производных не исключают применения при существенно аналогичных показаниях для применения или состояниях, при которых желательно модифицировать процесс или форму заживления или применить другие формы. Нитрокарбоновые кислоты согласно настоящему изобретению можно применять для профилактики и лечения всех заболеваний и/или состояний, которые демонстрируют агрессивную реакцию заживления или при которых велика вероятность такой реакции. Эти заболевания и/или состояния включают в себя следующие группы:
1. Нанесение покрытий на медицинские устройства
Другим аспектом является реакция тканей на постоянный контакт с инородными материалами. Даже небольшие отклонения от биосовместимости (главным образом, с химическими соединениями) приводят к клеточной реакции. Кроме того, в этом случае индукция процесса заживления зависит от интенсивности раздражения. Результатом этого часто является образование плотной фиброзной стенки вокруг инородного тела. В результате этого могут развиваться функциональные или косметические дефекты. Вещества согласно настоящему изобретению должны влиять и на реакцию тканей на повреждающее раздражение. Таким образом можно ослабить эту реакцию тканей на контакт с инородным телом.
Неожиданно было обнаружено, что эту задачу можно решить, применяя нитрокарбоновые кислоты или их фармацевтически приемлемые соли или нанося, по меньшей мере, одно из этих соединений в виде покрытия на медицинские устройства, которые временно или постоянно находятся в тесном контакте с тканями и/или органами. Причиной этого благоприятного эффекта могут быть эффекты, описанные выше (преимущественно, эффекты, индуцирующие активную форму заживления клеток в ответ на интервенционное лечение). Кроме того, немедленное начало фазы лечения ускоряет заживление раны.
Настоящая заявка конкретно направлена на применение нитрокарбоновой кислоты в качестве поверхностного покрытия для профилактики патофизиологической или нефизиологичной реакции на раздражение, являющейся результатом медицинского воздействия, связанного с раздражением поверхностью нативного имплантата. Покрытие можно наносить на все имплантаты и имплантируемые материалы независимо от их формы или структуры. Материалы, на которые можно наносить указанные покрытия, включают в себя, но не ограничиваются ими, металлы или сплавы металлов, полимеры, ткани (гомо-, алло-, ксенотрансплантаты). Покрытие наносят и на инструменты (пинцеты, щипцы, ретракторы) и на материалы (шовный материал, трубки и катетеры), которые применяют при медицинских или косметических процедурах.
Медицинские имплантаты и устройства
Таким образом, другой аспект настоящего изобретения направлен на медицинские устройства и медицинские имплантаты, покрытые, по меньшей мере, одной нитрокарбоновой кислотой общей формулы (Х)

где остатки O-R* и «цепь углеродных атомов» определены как указано выше.
Согласно настоящему изобретению, термины «медицинское устройство» или «медицинские устройства» следует применять как общее название, которое включает в себя имплантаты любого вида.
Предпочтительным вариантом осуществления настоящего изобретения является применение инструментов/материала/перевязочных средств/имплантатов с нанесенными покрытиями при хирургических, пластических или косметических процедурах, вызывающих повреждения, при которых указанное раздражение или повреждение является выбранным из группы, включающей в себя разрез, разрыв, рассечение, резекцию, накладывание хирургического шва, ушивание раны, хирургическую обработку раны, прижигание, отсасывание, дренирование, имплантацию, пересадку ткани или перелом. Кроме того, оно может быть результатом интервенционной процедуры. Имплантаты, на которые наносят покрытия, выбирают из группы, состоящей из или включающей в себя тканезамещающие имплантаты, грудные имплантаты, мягкие имплантаты, имплантируемые протезы суставов, хрящевые имплантаты, естественные или искусственные (например, дакроновые) тканевые имплантаты, аутогенные тканевые имплантаты, искусственные хрусталики, хирургические противоспаечные барьеры, направляющие трубки для регенерации нервов, родовспомогательный инструментарий, шунты, тканевые каркасы; материалы, относящиеся к тканям, включая фрагменты подслизистого матрикса тонкого кишечника (SIS), стоматологические приспособления и стоматологические имплантаты, инфузионные трубки для лекарственных средств, манжеты, дренажные устройства (глазные, легочные, брюшные, уринальные, спинальные), трубки (эндотрахеальные, трахеостомические), хирургические сетки, лигатуры, шовные материалы, скобки, накладки, поддерживающие повязки, пенообразные материалы, пленки, имплантируемые электрические стимуляторы, насосы, приспособления для введения троакара, резервуары, катетеры для инъекций или стимуляции или для введения сенсоров, покровный материал для ран, шовный материал, хирургические инструменты, такие как скальпели, ланцеты, ножницы, пинцеты или крючки, клинические перчатки, инъекционные иглы, эндопротезы и экзопротезы.
Остеосинтетические материалы (материалы, подходящие для остеосинтеза), катетеры (такие как катетеры Демерса, бранулы (инфузионные канюли)), покровные материалы для ран, такие как гели, пасты, коллоиды, адгезивы, альгинаты, пенообразные материалы, поглотители, марля, вата, корпия, ватно-марлевые повязки, бинты. Шовные материалы, такие как хирургические нити, филаменты, скобки, проволока и т.п., сетки на раны.
Нитрокарбоновые кислоты согласно настоящему изобретению можно также применять для покрытия любого другого клинически используемого материала, для которого существует вероятность контакта с тканями или клетками, подвергающимися опасности. Примерами таких материалов являются покровные материалы для ран, шовный материал, хирургические инструменты, такие как скальпели, ланцеты, ножницы, пинцеты или крючки, медицинские устройства и приспособления, клинические перчатки, инъекционные иглы, эндопротезы (соответственно, имплантаты) и экзопротезы и т.д. Соединения согласно настоящему изобретению оказывают свой положительный эффект или защитное действие посредством тех же механизмов, что описаны выше.
Согласно настоящему изобретению артериальные имплантаты не должны охватываться термином «имплантат». Они явным образом исключены из настоящей заявки.
Согласно настоящему изобретению, общий принцип применения нитрованных жирных кислот для ослабления или ингибирования нефизиологичной реакции клетки, приведенной в контакт с нитрованными жирными кислотами, на раздражитель, которые подтверждены клинически значимыми испытаниями, как показано в примерах, обеспечивает их широкое применение в разнообразных медицинских или косметических процедурах, проводимых с использованием разнообразных устройств и имплантатов, которые приводят в тесный контакт с тканями организма. Вышеуказанные процедуры и устройства или имплантаты можно использовать в многочисленных областях клинического применения, к которым относятся косметические, эстетические или терапевтические мероприятия, обладающие свойственным им риском индуцирования неблагоприятной реакции затронутых клеток, тканей или органов. В предпочтительном варианте осуществления настоящего изобретения клинические состояния или заболевания представляют собой ожоги, келоиды, грыжесечение, травматизацию нервов, хирургическую обработку некроза, реконструкцию груди с использованием имплантата. Они являются примерами симптомов, при которых демонстрируемые эффекты нитрованных жирных кислот ингибируют патофизиологическую стимуляцию, являющуюся причиной высокой степени развития патологической формы заживления при указанных симптомах.
2. Защита и терапия форм агрессивного заживления, представляющих собой реакцию на изменения, повреждения или травматизацию тканей, обусловленную хирургическими или интервенционными манипуляциями или ранениями
Нитрокарбоновые кислоты согласно настоящему изобретению можно также применять для предупреждения, ослабления или лечения патофизиологического или нефизиологичного процесса заживления или аномального или нежелательного образования или срастания ткани. Один аспект защиты органов представляет собой профилактику или лечение реакции ткани или органа на эндогенное или экзогенное повреждение. Эти типы повреждения могут быть физическими (в том числе механическими, тепловыми), химическими (в том числе метаболическими) или электрическими. Это повреждение может быть в форме механической раны, телесного повреждения, пореза, рассечений, резекций, хирургической обработки ран, контузии, ожога, обморожения, афтозных язв, гранулемы, некроза, прижигания (химического ожога), перелома, отсасывания, растяжения, хирургического дренирования, имплантаций и т.п. Тяжесть клеточных повреждений является решающим фактором для того, чтобы реакция на раздражение индуцировала стимул к активной или агрессивной форме заживления. Неожиданно было обнаружено, что в данном случае ослабление (или даже ингибирование) агрессивной формы заживления могло бы быть продемонстрировано посредством системного или местного применения нитрокарбоновых кислот или их производных.
Следующий аспект защиты тканей относится к медицинским вмешательствам для поддержания или индуцирования закрытия раны или залечивания раны (например, как последствия травмы). Хирургические процедуры обычно сопровождаются повреждением здоровой ткани. Ткани часто отделяют одну от другой, хирургически удаляют или сшивают. В результате этого образуются раневые поверхности с поврежденной тканью. Это также может приводить к агрессивному процессу заживления. Часто происходит массивная агрегация слоев соединительной ткани. Результатом этого является ригидность затронутых слоев ткани, последствием которой могут быть функциональные и/или косметические дефекты. Нахождение доступа через такую рубцовую ткань является значительно более трудным; в некоторых случаях становится невозможным даже проведение необходимой операции. Посредством инициирования процесса активного заживления можно в значительной степени избежать рубцевание этого типа.
Настоящая заявка направлена также на применение нитрокарбоновой кислоты для лечения или профилактики патофизиологической или нефизиологичной реакции на раздражение, которое является результатом медицинского воздействия, связанного с возможным раздражением или повреждением клеток, органов или тканей или результатом хирургических, пластических или косметических процедур, являющихся причиной повреждений, где указанное раздражение или повреждение является выбранным из группы, включающей в себя разрез, разрыв, рассечение, резекцию, накладывание хирургического шва, ушивание раны, хирургическую обработку раны, прижигание, отсасывание, дренирование, имплантацию, пересадку ткани, перелом или остеосинтез. Кроме того, оно может быть результатом интервенционной процедуры, такой как аспирация, радиационное или лазерное облучение или сварка тканей.
Нитрокарбоновые кислоты можно применять системно, местно или через медицинское устройство (см. ниже).
К предпочтительным клиническим ситуациям/заболеваниям, при которых нитрованные жирные кислоты оказывают благоприятные эффекты относятся, но не ограничиваются ими, повреждения нервов, опухоли ЦНС, келоиды, катаракта, разрастание ткани, лазерная абляция, ожоги или обработка любой травмы, любой тип хирургического вмешательства или сшивания тканей или адаптация.
Таким образом, настоящая заявка направлена на применение нитрокарбоновой кислоты для ингибирования развития в клетках, органеллах или тканях патофизиологической или нефизиологичной реакции на раздражение.
Неожиданно было обнаружено, что эту задачу можно решить, применяя нитрокарбоновые кислоты или их фармацевтически приемлемые соли или нанося их в виде покрытия на медицинские устройства. Как было доказано, причиной этого благоприятного эффекта являются эффекты, описанные выше (преимущественно, эффекты, индуцирующие активную форму заживления клеток в ответ на интервенционное лечение). Кроме того, немедленное начало фазы лечения ускоряет заживление раны.
3. Защита тканей, органов in situ или ex vivo от повреждений при консервации холодом
Интервенционное или хирургическое воздействие на ткани или органы часто требует временного прерывания кровотока. Для защиты тканей или органов от повреждений, обусловленных энергетическим воздействием, применяют несколько способов их консервации. Для этой цели широко применяют гипотермию, при этом более низкие температуры дают возможность предохранять ткань или орган в течение более продолжительных периодов. Однако пониженные температуры могут вызывать повреждения клеточной мембраны и индуцировать некроз (Apoptosis versus necrosis during cold storage and rewarming of human renal proximal tubular cells. Salahudeen AK, Joshi M, Jenkins JK. Transplantation. 2001 Sep 15; 72 (5): 798-804). Было найдено, что повреждения, индуцированные консервацией холодом, имеют другие механизмы повреждения - эти механизмы действуют посредством прямого изменения мембранных компонентов и цитоскелета. Было обнаружено, что вещества, которые, как известно, способны распределяться в клеточной мембране, могут уменьшать повреждения, индуцированные консервацией холодом. (Improved cold preservation of kidney tubular cells by means of adding bioflavonoids to organ preservation solutions. Ahlenstiel T, Burkhardt G, Kohler H, Kuhlmann MK., Transplantation. 2006 Jan 27; 81 (2): 231-9).
Было найдено, что нитрованные жирные кислоты (в настоящем документе также называемые нитрокарбоновыми кислотами) обладают эффектами, стабилизирующими мембраны, как можно было показать на примерах. Неожиданно было обнаружено, что физико-химические изменения, индуцированные вследствие распределения нитрованных жирных кислот в клеточной мембране, повышают устойчивость клеточной мембраны к изменениям, индуцируемым холодом.
Неожиданно было также обнаружено, что реакция клеток (соответственно, ткани) на такие изменения может быть задержана или даже полностью ингибирована предшествующим или последующим, местным и/или системным применением нитрокарбоновых кислот. Время воздействия и временной интервал, в течение которого следует их применять, может значительно различаться у клеток и тканей разных типов, соответственно степени повреждения. Это также справедливо и для дозирования и фармацевтической формы нитрокарбоновых кислот и их производных.
Таким образом, соединения нитрокарбоновых кислот можно применять для консервации холодом тканей и органов в предоперационной, межоперационной и послеоперационной фазе и применять к защищаемым тканям для защиты органов и в трансплантатах органов. К предпочтительным показаниям для их применения относятся, но не ограничиваются ими, прививаемая трансплантация, свободная трансплантация ткани для восполнения дефектов, т.е. после резекции опухоли или некроза, пластика органа или ткани, т.е. образование кармана, донорство ткани или органа.
4. Стабилизация функций мембран в клетках и органеллах
Мембраны в клетках и органеллах имеют много определенных функций. В качестве примера некоторых из них можно указать, что некоторые клетки сердца деполяризуются через регулярные временные интервалы, тем самым обеспечивая регулярное сердцебиение. Другие клетки должны передавать электрические импульсы, тогда как функцией еще одной группы других клеток является восприятие физических или химических раздражителей. Эти функции мембран обычно обеспечиваются специализированными структурами и особым составом мембранных компонентов. Ключевую роль в этом играют мембранные белки. Они интегрированы в фосфолипидный слой мембраны. Данные, полученные в последнее время, показывают, что на функцию мембранных белков могут влиять окружающие фосфолипиды. В одном из клинических исследований было показано, что вероятность внезапной смерти среди лиц с повышенным риском сердечной недостаточности можно уменьшить регулярным введением жирных кислот. Неожиданно было обнаружено, что применением нитрокарбоновых кислот поддерживаются некоторые клеточные функции, включая электрическую стабильность, и повышается их стойкость в отношении внутренних и внешних воздействий.
Примеры заболеваний, которые можно таким образом лечить нитрокарбоновыми кислотами, включают в себя, но не ограничиваются ими, нарушения сердечного ритма (сердечные аритмии), такие как предсердные экстрасистолы, трепетание предсердий, фибрилляция предсердий, желудочковые экстрасистолы, желудочковая тахикардия, пируэтная желудочковая тахикардия, трепетание желудочков, фибрилляция желудочков, синдром Вольффа-Паркинсона-Уайта, синдром Лауна-Ганонга-Левина, а также острую или хроническую боль, синдром гиперчувствительности, невропатическую боль, атопии, такие как крапивница, аллергический ринит и сенная лихорадка, энтеропатии, такие как спру или глютеновая болезнь.
Таким образом, настоящее изобретение также относится к применению нитрокарбоновой кислоты для профилактики и лечения патофизиологической или нефизиологичной реакции клеточных мембран, которая неблагоприятно воздействует на свойства, функцию и реактивность мембран клеток и органелл или плазматических мембран и результатом которой является хроническое или острое раздражение или стимуляция. Это хроническое или острое раздражение или стимуляция может быть вызвано физической травмой, химической травмой, электрической травмой, ядами или токсинами, иммунологическими биомолекулами или недостаточным питанием.
5. Конкретные ситуации эндогенных и экзогенных повреждений клеток или тканей
Соединениями согласно настоящему изобретению можно также лечить заболевания, к которым относится патофизиологическая или нефизиологичная пролиферация фибробластов. Их можно также применять для профилактики этих заболеваний.
Таким образом, настоящая заявка также направлена на применение нитрокарбоновой кислоты для лечения или профилактики патофизиологической или нефизиологичной реакции на раздражение, которая является результатом внешнего раздражения, ранения или травмы, таких как ожог, химический ожог, ожог щелочью, жжение, гипотермия, обморожение, прижигание, гранулема, некроз, язва, перелом, реакция на чужеродное тело, порез, царапина, рваная рана, гематома, разрыв, контузия, образование трещин или прободение. В альтернативном случае, патофизиологическая или нефизиологичная реакция на раздражение может быть результатом эндогенного раздражения или стимуляции посредством острых или хронических физических, химических или электрических средств. Типичным примером хронического механического раздражения является фасцикулит и эпикондилит или их форма тендинита, невропатия или гипертрофия предстательной железы.
6. Применение при заболеваниях или состояниях, обусловленных накоплением токсинов
Нитрокарбоновые кислоты согласно настоящему изобретению можно также применять для лечения заболеваний и/или состояний, при которых в органе или в целом организме накапливается токсин. Их можно также применять для профилактики, если такое накопление токсина представляет собой серьезную угрозу, особенно для субъектов с высоким риском.
Токсические эффекты могут также возникать от воздействия ядов и органических или неорганических веществ или от их приема внутрь. Другие причины могут являться следствием хронического или острого раздражения или стимуляции, физической, химической или электрической травмы, иммунологических биомолекул и недостаточного питания.
Настоящее изобретение, таким образом, относится также к лечению или профилактике заболеваний и состояний, связанных с токсином или ядом, таких как невропатия, острая боль, хроническая боль, синдром гиперчувствительности, невропатическая боль, синдром жжения ног, болезнь Ван-Бурена и атрофия Зудека.
Было показано, что нитрованные жирные кислоты ослабляют или ингибируют реакции на раздражающий стимул, которые включают в себя весьма многочисленные раздражители, как показано в примерах. Поэтому местное, локальное или системное применение нитрованных жирных кислот является полезным при вышеуказанных клинических ситуациях и/или заболеваниях (но и не только при них).
Резюмируя, можно утверждать, что нитрокарбоновые кислоты согласно настоящему изобретению можно применять для ингибирования развития у клеток, органелл или тканей патофизиологической или нефизиологичной реакции на раздражитель, который, если на него не воздействовать, привел бы к агрессивной реакции заживления.
7. Применение при заболеваниях и состояниях с дополнительным воспалительным компонентом
Во вступительной части было указано, что следует отличать генуинное воспаление от заболеваний и/или состояний с воспалительным компонентом.
Следует отметить, что нитрокарбоновые кислоты согласно настоящему изобретению не следует применять для лечения генуинных воспалений. Но их можно применять для лечения и/или профилактики патологических или нефизиологичных форм реакции заживления, сопутствующих заболеваниям или состояниям, которые могут включать в себя такой воспалительный компонент. Они не предназначены для профилактики или терапии первичного заболевания с воспалительным компонентом.
Аналогичным образом, имеются заболевания и состояния с иммунологическим компонентом. Их следует таким же образом отличать от генуинных иммунологических заболеваний. Полезные эффекты нитрокарбоновых кислот согласно настоящему изобретению относятся к изменениям клеток, органелл или тканей, которые появляются прежде, чем генуинное воспаление или генуинное иммунологическое заболевание становятся явными и начинают неблагоприятно воздействовать на их структуры.
Как известно в данной области техники, реакция ткани, клетки или органеллы на одно и то же раздражение в организме может быть совершенно различной вследствие различий локальных условий, которые обычно являются непредсказуемыми. Соответственно, различные клинические ситуации, как известно, являются связанными с риском агрессивной формы заживления, которое можно предупреждать или лечить нитрокарбоновыми кислотами, поэтому их применение показано в указанных клинических условиях. Это не должно ограничиваться заявленными медицинскими показаниями, но может быть распространено на все клинические ситуации за исключением генуинных воспалений. Однако ситуация, когда генуинное воспаление сопутствует хирургическим или интервенционным процедурам, с присущим им риском агрессивного заживления, не входит в эти исключения, поскольку благоприятные эффекты относятся к хирургической травме, а не к генуинному воспалению.
Преимущественно, нитрокарбоновые кислоты показаны для уменьшения известных реактивных изменений соединительной ткани (особенно фиброза) при заболеваниях, дополнительно демонстрирующих острое или хроническое первично дегенеративное течение. Примерами таких заболеваний являются остеомиелофиброз, хронический полиартрит, атрофия слизистых тканей или эпидермы, язвенный дерматит, заболевания соединительной ткани, такие как дерматомиозит, хронический васкулит, узелковый полиартериит, ангиит Зика, синдром Такаясу, гранулематоз Вегенера, болезнь Кавасаки, болезнь Бюргера, глютеновая болезнь, гипертрофия предстательной железы, артропатия, периартропатия, фибромиалгия, болезнь Рота-Бернгардта, кистевой туннельный синдром и компрессионная невропатия.
Таким образом, настоящее изобретение также относится к применению нитрокарбоновой кислоты для лечения, диагностики или профилактики фиброза или патофизиологической или нефизиологичной реакции на раздражение, которая является результатом заболевания с воспалительным компонентом, причем указанное заболевание не является генуинным воспалительным заболеванием. Такое заболевание с воспалительным компонентом следует выбирать из группы, включающей в себя энтеропатии, такие как спру или целиакия, или из группы, включающей в себя бронхоэктазию, эмфизему, хроническое обструктивное заболевание легких (COPD), дерматозы, такие как атрофический контактный дерматоз, или из группы, включающей в себя подагрический артрит, остеоартроз, дегенеративно-артрозные состояния, синдром токсического шока, амилоидоз, язвенный дерматит и нефросклероз. В качестве альтернативы, этот терапевтический подход относится также к иммунологическому процессу или заболеванию, которое не является генуинным воспалительным заболеванием, такому, как муковисцидоз, атопический дерматоз, атрофия слизистой ткани или эпидермы, заболевания соединительной ткани, такие как синдром Шарпа и дерматомиозит, афтозная язва, синдром Стивенса-Джонсона или токсический эпидермальный некролиз.
Нитрокарбоновые кислоты
Нитрокарбоновые кислоты представляют собой подгруппу карбоновых кислот (органических кислот), характеризующихся наличием, по меньшей мере, одной нитрогруппы, заменяющей водородный атом. Таким образом, нитрокарбоновые кислоты, которые применяют согласно настоящему изобретению представляют собой карбоновую кислоту, имеющую всего от 2 до 50 (предпочтительно, от 4 до 40 и, более предпочтительно, от 6 до 30 атомов углерода (всего - включая боковые цепи, заместители и углеродный атом карбоксилата), причем алкильная цепь или цепь углеродных атомов нитрокарбоновой кислоты может быть насыщенной, олефиновой, ацетиленовой, полиненасыщенной, линейной или разветвленной и может содержать добавочный заместитель в дополнение к указанной, по меньшей мере, одной нитрогруппе. Указанный один или более из дополнительных заместителей S1-S20, который может присутствовать на алкильной цепи или цепи углеродных атомов нитрокарбоновых кислот выбирают из группы, состоящей из, или содержащей: -OH, -OP(O)(OH)2, -P(O)(OH)2, -P(O)(OCH3)2, -OCH3, -OC2H5, -OC3H7, -O-цикло-C3H5, -OCH(CH3)2, -OC(CH3)3, -OC4H9, -OPh, -OCH2-Ph, -OCPh3, -SH, -SCH3, -SC2H5, -F, -Cl, -Br, -I, -CN, -OCN, -NCO, -SCN, -NCS, -CHO, -COCH3, -COC2H5, -COC3H7, -CO-цикло-C3H5, -COCH(CH3)2, -COC(CH3)3, -COOH, -COOCH3, -COOC2H5, -COOC3H7, -COO-цикло-C3H5, -COOCH(CH3)2, -COOC(CH3)3, -OOC-CH3, -OOC-C2H5, -OOC-C3H7, -OOC-цикло-C3H5, -OOC-CH(CH3)2, -OOC-C(CH3)3, -CONH2, -CONHCH3, -CONHC2H5, -CONHC3H7, -CON(CH3)2, -CON(C2H5)2, -CON(C3H7)2, -NH2, -NHCH3, -NHC2H5, -NHC3H7, -NH-цикло-C3H5, -NHCH(CH3)2, -NHC(CH3)3, -N(CH3)2, -N(C2H5)2, -N(C3H7)2, -N(цикло-C3H5)2, -N[CH(CH3)2]2, -N[C(CH3)3]2, -SOCH3, -SOC2H5, -SOC3H7, -SO2CH3, -SO2C2H5, -SO2C3H7, -SO3H, -SO3CH3, -SO3C2H5, -SO3C3H7, -OCF3, -OC2F5, -O-COOCH3, -O-COOC2H5, -O-COOC3H7, -O-COO-цикло-C3H5, -O-COOCH(CH3)2, -O-COOC(CH3)3, -NH-CO-NH2, -NH-CO-NHCH3, -NH-CO-NHC2H5, -NH-CO-N(CH3)2, -NH-CO-N(C2H5)2, -O-CO-NH2, -O-CO-NHCH3, -O-CO-NHC2H5, -O-CO-NHC3H7, -O-CO-N(CH3)2, -O-CO-N(C2H5)2, -O-CO-OCH3, -O-CO-OC2H5, -O-CO-OC3H7, -O-CO-O-цикло-C3H5, -O-CO-OCH(CH3)2, -O-CO-OC(CH3)3, -CH2F, -CHF2, -CF3, -CH2Cl, -CH2Br, -CH2I, -CH2-CH2F, -CH2-CHF2, -CH2-CF3, -CH2-CH2Cl, -CH2-CH2Br, -CH2-CH2I, -CH3, -C2H5, -C3H7, -цикло-C3H5, -CH(CH3)2, -C(CH3)3, -C4H9, -CH2-CH(CH3)2, -CH(CH3)-C2H5, -C5H11, -Ph, -CH2-Ph, -CPh3, -CH=CH2, -CH2-CH=CH2, -C(CH3)=CH2, -CH=CH-CH3, -C2H4-CH=CH2, -CH=C(CH3)2, -C≡CH, -C≡C-CH3, -CH2-C≡CH, -P(O)(OC2H5)2, C27H45O- (холестерил), нуклеотиды, липоамины, дигидролипоамины, лизобифосфатидную кислоту, анандамид, длинноцепочечный N-ацилэтаноламид, sn-1-заместители с глицерином или диглицерином, sn-2-заместители с глицерином или диглицерином, sn-3-заместители, церамид, сфингозин, галоактозилцерамид, аминоэтилфосфоновую кислоту.
Согласно настоящему изобретению, вышеуказанные нитрокарбоновые кислоты следует применять для профилактики или терапии медицинских состояний или заболеваний, перечисленных в следующих главах.
Кроме того, нитрокарбоновые кислоты, применяемые в настоящем изобретении, имеют, по меньшей мере, одну нитрогруппу (-NO2), которая может быть присоединенной к любому одному из атомов углеродной цепи, включая любые боковые цепи.
Предпочтительной подгруппой нитрокарбоновых кислот являются нитрованные жирные кислоты. Жирные кислоты имеют, как правило, длинную алифатическую цепь, которая может быть ненасыщенной или которая может содержать одну или более двойных связей и/или одну или более тройных связей.
Примерами нитрокарбоновых кислот с насыщенными алкильными цепями являются: нитрооктановая кислота (нитрокаприловая кислота), нитродекановая кислота (нитрокаприновая кислота), нитрододекановая кислота (нитролауриновая кислота), нитротетрадекановая кислота (нитромиристиновая кислота), нитрогексадекановая кислота (нитропальмитиновая кислота), нитрогептадекановая кислота (нитромаргариновая кислота), нитрооктадекановая кислота (нитростеариновая кислота), нитроэйкозановая кислота (нитроарахидиновая кислота), нитродокозановая кислота (нитробегеновая кислота), нитротетракозановая кислота (нитролигноцериновая кислота). Эти и другие насыщенные нитрокарбоновые кислоты могут содержать 1, 2, 3, 4, 5 или 6 дополнительных нитрогрупп и могут содержать один или более из заместителей S1-S20, как указано выше.
Согласно настоящему изобретению, предпочтительной подгруппой нитрокарбоновых кислот являются ненасыщенные нитрокарбоновые кислоты. Согласно настоящему изобретению, можно применять цис- и транс-изомеры, а также (в зависимости от заместителей, которые могут создавать хиральные центры) энантиомеры, диастереомеры и их рацематы. Нитрогруппа может быть связанной с любым подходящим положением углеродной цепи.
Предпочтительными ненасыщенными нитрокарбоновыми кислотами являются: нитро-цис-9-тетрадеценовая кислота (нитромиристолеиновая кислота), нитро-цис-9-гексадеценовая кислота (нитропальмитолеиновая кислота), нитро-цис-6-гексадеценовая кислота (нитросальпеновая кислота), нитро-цис-6-октадеценовая кислота (нитропетроселиновая кислота), нитро-цис-9-октадеценовая кислота (нитроолеиновая кислота), нитро-цис-11-октадеценовая кислота (нитровакценовая кислота), нитро-цис-9-эйкозеновая кислота (нитрогадолеиновая кислота), нитро-цис-11-эйкозеновая кислота (нитрогондоиновая кислота), нитро-цис-13-докозеновая кислота (нитроэруковая кислота), нитро-цис-15-тетракозеновая кислота (нитронервоновая кислота), нитро-t9-октадеценовая кислота (нитроэлаидиновая кислота), нитро-t11-октадеценовая кислота (нитро-трет-вакценовая кислота), нитро-t3-гексадеценовая кислота, нитро-9,12-октадекадиеновая кислота (нитролинолевая кислота), нитро-6,9,12-октадекатриеновая кислота (нитро-γ-линолевая кислота), нитро-8,11,14-эйкозатриеновая кислота (нитродигомо-γ-линолевая кислота), нитро-5,8,11,14-эйкозатриеновая кислота (нитроарахидоновая кислота), нитро-7,10,13,16-докозатетраеновая кислота, нитро-4,7,10,13,16-докозапентаеновая кислота, нитро-9,12,15-октадекатриеновая кислота (нитро-α-линоленовая кислота), нитро-6,9,12,15-октадекатетраеновая кислота (нитростеаридоновая кислота), нитро-8,11,14,17-эйкозатетраеновая кислота, нитро-5,8,11,14,17-эйкозапентаеновая кислота (нитро-EPA), нитро-7,10,13,16,19-докозапентаеновая кислота (нитро-DPA), нитро-4,7,10,13,16,19-докозагексаеновая кислота (нитро-DHA), нитро-5,8,11-эйкозатриеновая кислота (нитропроизводное кислоты Мида), нитро-9c,11t,13-трет-элеостеариновая кислота, нитро-8t,10t,12c-календовая кислота, нитро-9c,11t,13c-катальповая кислота, нитро-4,7,9,11,13,16,19-докозагептадекановая кислота (нитростеллагептаеновая кислота), нитротаксоловая кислота, нитропиноленовая кислота, нитросциадоновая кислота, нитро-6-октадециновая кислота (нитротаририновая кислота), нитро-t11-октадецен-9-иновая кислота (нитросанталбовая кислота или нитроксименовая кислота), нитро-9-октадециновая кислота (нитростеароловая кислота), нитро-6-октадецен-9-иновая кислота (нитро-6,9-октадецениновая кислота), нитро-t10-гептадецен-8-иновая кислота (нитропируловая кислота), нитро-9-октадецен-12-иновая кислота (нитрокрепениновая кислота), нитро-t7,t11-октадекадиен-9-иновая кислота (нитрогейстериновая кислота), нитро-t8,t10-октадекадиен-12-иновая кислота и нитро-5,8,11,14-эйкозатетраиновая кислота (нитро-ETYA).
Особо предпочтительными являются 12-нитролинолевая кислота, 9-нитро-цис-олеиновая кислота, 10-нитро-цис-линолевая кислота, 10-нитро-цис-олеиновая кислота, 5-нитроэйкозатриеновая кислота, 16-нитро-все-цис-4,7,10,13,16-докозапентаеновая кислота (нитропроизводное кислоты Осбонда), 9-нитро-все-цис-9-12,15-октадекатриеновая кислота (нитролиноленовая кислота), 14-нитро-все-цис-7,10,13,16,19-докозапентаеновая кислота (нитро-EPA), 15-нитро-цис-15-тетракозеновая кислота (нитронервоновая кислота), 9-нитро-транс-олеиновая кислота, 9,10-нитро-цис-олеиновая кислота, 13-нитрооктадека-9,11,13-триеновая кислота (нитропунициновая кислота), 10-нитро-транс-олеиновая кислота, 9-нитро-цис-гексадеценовая кислота, 11-нитро-5,8,11,14-эйкозатриеновая кислота, 9,10-нитро-транс-олеиновая кислота, 9-нитро-9-транс-гексадеценовая кислота (нитропальмитолеиновая кислота), 13-нитро-цис-13-докозеновая кислота (нитроэруковая кислота), 8,14-нитро-цис-5,8,11,14-эйкозатетраеновая кислота (динитроарахидоновая кислота), 4,16-нитродокозагексаеновая кислота (нитро-DHA), 9-нитро-цис-6,9,12-октадекатриеновая кислота (нитро-GLA), 6-нитро-цис-6-октадеценовая кислота (нитропетроселиновая кислота) и 11-нитро-цис-5,8,11,14-эйкозатетраеновая кислота (нитроарахидоновая кислота).
Предпочтительными вариантами осуществления настоящего изобретения являются нитроолеиновые кислоты, такие как нитро-ETYA, нитролинолевые кислоты, нитроарахидоновые кислоты, 10-нитролинолевая кислота, 12-нитролинолевая кислота, 9-нитроолеиновая кислота и 10-нитроолеиновая кислота. В случае, если положение нитрогруппы не указано или если оно определено дополнительно (например, 9-нитроолеиновая), это относится к смеси нитрокарбоновых кислот, такой как смесь нитроолеиновых кислот, и особенно это относится к такой смеси нитрокарбоновых кислот, какую получают согласно реакционной процедуре, предназначенной для получения этих нитрокарбоновых кислот.
Другим вариантом осуществления настоящего изобретения является применение динитрокарбоновых кислот. Положение двух нитрогрупп является произвольным. Особо предпочтительной является нитро-ETYA.
Нитрокарбоновые кислоты предпочтительной подгруппы, которые можно применять согласно настоящему изобретению, имеют, по меньшей мере, одну двойную связь и, по меньшей мере, одну нитрогруппу, которая, предпочтительно, присоединена к углеродному атому олефинового фрагмента, как показано в общей формуле (I), т.е. к углеродному атому двойной связи, или в альфа-положении к двойной связи, как показано в общей формуле (II). Предпочтительные нитрокарбоновые кислоты представлены следующей структурной формулой (I) или (II).

где
по меньшей мере, один из заместителей R1 и R2 представляет собой нитрогруппу (-NO2), а другой заместитель из R1 и R2 представляет собой нитрогруппу, водород или алкильный остаток, содержащий от 1 до 5 атомов углерода; R3 представляет собой водород или алкильную цепь из 1-20 атомов углерода, причем эта алкильная цепь может быть замещенной одним или более из заместителей S1-S20 и может быть также замещенной одной или более нитрогруппами (-NO2) и/или может дополнительно содержать двойные и/или тройные связи;
L представляет собой алкильный линкер из 1-20 атомов углерода, причем этот алкильный линкер может быть замещенным одним или более из заместителей S1-S20 и, необязательно, одной или более нитрогруппами (-NO2) и/или может дополнительно содержать двойные и/или тройные связи,
следующая общая формула (II):
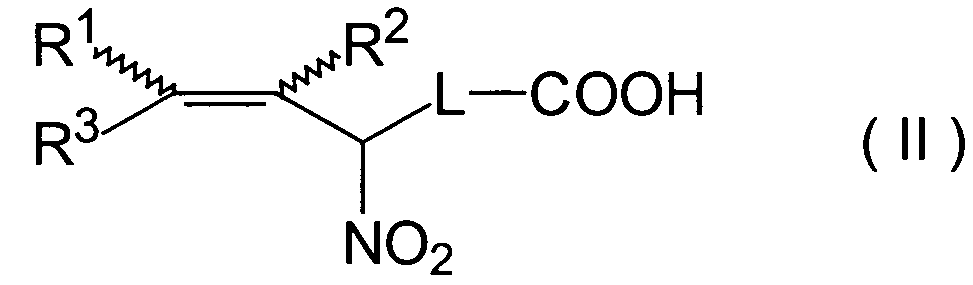
где
R1 и R2 независимо один от другого являются выбранными из нитрогруппы, водорода или алкильного остатка, содержащего от 1 до 5 атомов углерода;
R3 представляет собой водород или алкильную цепь из 1-20 атомов углерода, причем эта алкильная цепь может быть замещенной одним или более из заместителей S1-S20 и может быть также замещенной одной или более нитрогруппами (-NO2) и/или может дополнительно содержать двойные и/или тройные связи;
L в общих формулах (I) и (II) представляет собой алкильный линкер из 1-20 атомов углерода, причем этот алкильный линкер может быть замещенным одним или более из заместителей S1-S20 и, необязательно, одной или более нитрогруппами (-NO2) и/или может дополнительно содержать двойные и/или тройные связи, а в случае, когда R1 и/или R2 представляют собой алкильный остаток, содержащий от 1 до 5 атомов углерода, этот алкильный остаток может быть замещенным одним или более из заместителей S1-S20 и, необязательно, одной или более нитрогруппами (-NO2) и/или может дополнительно содержать двойные и/или тройные связи.
Наиболее предпочтительны нитрокарбоновые кислоты или сложные эфиры нитрокарбоновых кислот, произведенные посредством нитрования (введения, по меньшей мере, одной нитрогруппы) и последующей этерификации (если это желательно) или посредством первой этерификации и последующего нитрования, из следующих жирных кислот: гексановой кислоты, октановой кислоты, декановой кислоты, додекановой кислоты, тетрадекановой кислоты, гексадекановой кислоты, гептадекановой кислоты, октадекановой кислоты, эйкозановой кислоты, докозановой кислоты, тетракозановой кислоты, цис-9-тетрадеценовой кислоты, цис-9-гексадеценовой кислоты, цис-6-октадеценовой кислоты, цис-9-октадеценовой кислоты, цис-11-октадеценовой кислоты, цис-9-эйкозеновой кислоты, цис-11-эйкозеновой кислоты, цис-13-докозеновой кислоты, цис-15-тетракозеновой кислоты, t9-октадеценовой кислоты, t11-октадеценовой кислоты, t3-гексадеценовой кислоты, 9,12-октадекадиеновой кислоты, 6,9,12-октадекатриеновой кислоты, 8,11,14-эйкозатриеновой кислоты, 5,8,11,14-эйкозатетраеновой кислоты, 7,10,13,16-докозатетраеновой кислоты, 4,7,10,13,16-докозапентаеновой кислоты, 9,12,15-октадекатриеновой кислоты, 6,9,12,15-октадекатетраеновой кислоты, 8,11,14,7-эйкозатетраеновой кислоты, 5,8,11,14,17-эйкозапентаеновой кислоты, 7,10,13,16,19-докозапентаеновой кислоты, 4,7,10,13,16,19-докозагексаеновой кислоты, 5,8,11-эйкозатриеновой кислоты, 9c,11t,13t-элеостеариновой кислоты, 8t,10t,12c-календовой кислоты, 9c,11t,13c-катальповой кислоты, 4,7,9,11,13,16,19-докозагептадекановой кислоты, таксоловой кислоты, пиноленовой кислоты, сциадоновой кислоты, 6-октадециновой кислоты, t11-октадецен-9-иновой кислоты, 9-октадециновой кислоты, 6-октадецен-9-иновой кислоты, t10-гептадецен-8-иновой кислоты, 9-октадецен-12-иновой кислоты, t7,t11-октадекадиен-9-иновой кислоты, t8,t10-октадекадиен-12-иновой кислоты, 5,8,11,14-эйкозатетраиновой кислоты, ретиноевой кислоты, изопальмитиновой кислоты, пристановой кислоты, фитановой кислоты, 11,12-метиленоктадекановой кислоты, 9,10-метиленгексадекановой кислоты, коронаровой кислоты, (R,S)-липоевой кислоты, (S)-липоевой кислоты, (R)-липоевой кислоты, 6,8-бис(метилсульфанил)-октановой кислоты, 4,6-бис(метилсульфанил)-гексановой кислоты, 2,4-бис(метилсульфанил)-бутановой кислоты, 1,2-дитиоланкарбоновой кислоты, (R,S)-6,8-дитианоктановой кислоты, (R)-6,8-дитианоктановой кислоты, (S)-6,8-дитианоктановой кислоты, таририновой кислоты, санталбовой кислоты, стеароловой кислоты, 6,9-октадецениновой кислоты, пируловой кислоты, крепениновой кислоты, гейстериновой кислоты, t8,t10-октадекадиен-12-иновой кислоты, ETYA, цереброновой кислоты, гидроксинервоновой кислоты, рицинолеиновой кислоты, лесквероловой кислоты, брассиловой кислоты и тапсиевой кислоты.
Примерами нитрокарбоновых кислот, соответствующих общей формуле (I) или (II) являются:


Способы синтеза нитрокарбоновых кислот раскрыты в публикации Gorczynski, Michael J.; Huang, Jinming; King, S. Bruce; Organic Letters, 2006, 8, 11, 2305-2308 и показаны на Фигурах 1-5.
В другом предпочтительном варианте осуществления настоящего изобретения нитрокарбоновые кислоты являются этерифицированными. Это означает, что карбоксильная группа кислоты преобразована в сложный эфир с использованием спирта. Подходящими спиртами, которые можно применять для получения сложных эфиров нитрокарбоновых кислот, являются метанол, этанол, пропанол, изопропанол, бутанол, втор-бутанол, изобутанол, трет-бутанол, виниловый спирт, аллиловый спирт, полиэтиленгликоль, полипропиленгликоль, холестерин, фитостерин, эргостерин, кофермент A или и любой другой спирт, имеющий цепь углеродных атомов из 1-10 атомов углерода, причем эта цепь углеродных атомов может содержать одну или более двойных связей и/или одну или более тройных связей и/или может быть замещенной одной или более нитрогруппами и/или одним или более заместителями S1-S20.
Следует указать, что согласно настоящему изобретению применение чистых нитрокарбоновых кислот не является необходимым. В настоящем изобретении можно применять смеси различных нитрокарбоновых кислот, которые можно получать из одной карбоновой кислоты, а также из разных карбоновых кислот.
Согласно настоящему изобретению, можно применять все фармацевтически приемлемые соли вышеуказанных нитрокарбоновых кислот. Нитрокарбоновые кислоты могут образовывать соли посредством диссоциирования H+ от карбоксильной группы кислоты и связывания органического или неорганического основания.
Примерами подходящих органических и неорганических оснований, являются основания, произведенные из ионов металлов, например, алюминия, ионов щелочных металлов, таких как натрий или калий, ионов щелочноземельных металлов, таких как кальций или магний, или иона соли амина или щелочных или щелочноземельных гидроксидов, карбонатов или бикарбонатов. Примеры включают в себя водный гидроксид натрия, гидроксид лития, карбонат калия, бикарбонат аммония и натрия, соли аммония, первичные, вторичные и третичные амины, такие как, например, низшие алкиламины, такие как метиламин, трет-бутиламин, прокаин, этаноламин, арилалкиламины, такие как дибензиламин и Ν,Ν-дибензилэтилендиамин, низшие алкилпиперидины, такие как N-этилпиперидин, циклоалкиламины, такие как циклогексиламин или дициклогексиламин, морфолин, глюкамин, N-метил- и N,N-диметилглюкамин, 1-адамантиламин, бензатин или соли, произведенные из аминокислот, таких как аргинин, лизин, орнитин, или амиды изначально нейтральных или кислотных аминокислот и т.п.
Клетки воспринимают множество физических и химических стимулов; однако в большинстве случае должен быть достигнут определенный порог или должно произойти соединение нескольких стимулов (медиаторов), чтобы произошло раздражение и была вызвана клеточная реакция. Это является причиной того, что для индуцирования клеточных явлений, таких как миграция, пролиферация, апоптоз или продуцирование белков матрикса, в большинстве нефизиологичных или патологических состояний должно произойти одновременное активирование или пассивирование сразу нескольких путей. В настоящее время пока еще неизвестно ни одного вещества, способного полностью ингибировать эти реакции на раздражающий стимул (в клинических условиях и/или при заболеваниях).
Однако клеточная реакция на раздражающие стимулы ослабляется, когда клетку подвергают консервации холодом. Этот эффект осуществляется посредством физических изменений клеточных мембран. Более плотно упакованные мембраны уменьшают чувствительную способность рецепторов и молекул адгезии (Anbazhagan V, Schneider D (2010)). Мембранное окружение модулирует самоассоциацию человеческого домена GpA TM, что имеет значение для складывания мембранных белков и трансмембранной передачи сигналов (Biochim Biophys Acta 1798 (10): 1899-1907). Сходный эффект имеет и повышение гидрофобности клеточной мембраны. Поэтому регулирование гидрофобности клеточной мембраны, сопровождаемое изменением плотности фосфолипидного бислоя могло бы иметь эффекты, подобные эффектам консервации холодом. Фактически, увеличение гидрофобности, сопровождаемое значительным изменением физических свойств мембран, осуществляли нитрованные жирные кислоты. Как было документально зарегистрировано в многих экспериментах и частично представлено в примерах, физические и физико-химические свойства клеточных мембран изменяются посредством простого распределения нитрованных жирных кислот в клеточной мембране, что тем самым снижает клеточную ноцицепцию на уровне клеточной мембраны, не создавая специфических помех для рецепторов или клеточных сигнальных молекул. Как дополнительно изложено в примерах, ослаблением клеточной ноцицепции и/или чувствительности на мембранном уровне объясняется, почему нитрованные жирные кислоты можно успешно применять в разнообразных условиях, ослабляя или ингибируя реакцию раздражающего стимула. Поскольку этот эффект нитрованных жирных кислот на клеточную ноцицепцию можно было продемонстрировать с клетками многих типов, можно сделать вывод о том, что возможно перенесение этого принципа действия на сопоставимые клеточные линии также и в других клинических условиях. Кроме того, эксперименты доказали, что (1) нитрованные жирные кислоты ослабляют или блокируют ноцицепцию/восприятие ключевых раздражающих стимулов, природа которых является физической (напряжение сдвига) или химической (токсины, медиаторы), и (2) ослабляются или полностью отсутствуют типичные реакции, играющие ключевую роль при многих заболеваниях или клинических состояниях, индуцированных раздражением.
Поскольку нитрогруппа, как правило, повышает гидрофобность молекулы жирной кислоты, что демонстрирует общий принцип эффектов, документально зарегистрированных в примерах, превосходство нитрованных жирных кислот по сравнению с нативными жирными кислотами в модулировании ноцицепции и/или восприятия стимула является очевидным также и для других нитрованных ненасыщенных жирных кислот.
В научной литературе документально зарегистрировано, что нитрованные жирные кислоты создают помехи для ключевых клеточных медиаторов. Создание таких помех для рецептора PPAR-гамма или повышающая регуляция экспрессии гемоксигеназы, возможно, могла бы вносить свой вклад в ослабление передачи сигнала по определенным путям, приводя к индуцированию миграции, пролиферации и даже апоптоза, что направлено против эффектов нитрованных жирных кислот. Однако, это не происходит по нескольким причинам: (1) До сих пор не было никаких документально зарегистрированных данных о том, что блокирование или активация этих путей (по отдельности или в комбинациях) приводит к полному ингибированию миграции, пролиферации или продуцирования внеклеточного матрикса, (2) изменение физических/физико-химических свойств мембран предшествует межклеточным взаимодействиям путей или экспрессии генов, (3) клетки, на которые воздействуют нитрованные жирные кислоты, не активировались раздражителем; поэтому стимуляция гемоксигеназы происходила бы без последствий для этих клеток, (4) доказанный ключевой элемент действия нитрованных жирных кислот, а именно, изменение ноцицепции и чувствительности рецепторов семейства TRP, не имеет никакого сходства с ингибированием путей, документально зарегистрированным до настоящего момента. Кроме того, как описано в примерах, можно было показать, что нитрокарбоновые кислоты оказывают свои противофиброзные эффекты независимо от активации PPAR или продуцирования гемоксигеназы-1.
Как указано выше, различные заболевания и клинические состояния имеют результатом типичные наборы, комбинации и/или последствия раздражающих стимулов, которые приводят к единообразным реакциям в клетках многих типов. Поэтому в клинических условиях или при заболеваниях, которыми вызываются нефизиологичные или патологические формы заживления, обусловленные раздражителем одного и того же вида в одной клеточной популяции, можно предположить, что в различных ситуациях будет обеспечена и одинаковая эффективность нитрованных жирных кислот.
Цитотоксические эффекты нитрованных жирных кислот пока еще не были описаны.
Имплантаты
Имплантаты мягких тканей применяют при многих косметических, пластических и восстановительных хирургических процедурах, их можно вводить в различные части тела, включая, без ограничения, лицо, нос, челюсть, грудь, подбородок, ягодицы, грудную клетку, губу и щеку. Имплантаты мягких тканей применяют для реконструкции хирургически или травматически созданных тканевых пустот, увеличения тканей или органов, оконтуривания тканей, восстановления массы стареющих тканей и для исправления складок мягких тканей или морщин (ритид).
Имплантаты мягких тканей можно применять для увеличения ткани для улучшения косметического (эстетического) эффекта или при восстановительной хирургии после заболевания или хирургической резекции. Характерными примерами имплантатов мягких тканей, на которые могут быть нанесены средства, ингибирующие развитие фиброза, или иначе сконструированных имплантатов, содержащих и/или высвобождающих такие средства, предоставляемые согласно настоящему изобретению, включают в себя, например, солевые имплантаты молочных желез, силиконовые имплантаты молочных желез, имплантаты молочных желез, наполненные триглицеридами, подбородочные и нижнечелюстные имплантаты, назальные имплантаты, щечные имплантаты, губные имплантаты и другие лицевые имплантаты, пекторальные и грудные имплантаты, малярные и субмалярные имплантаты и ягодичные имплантаты. Имплантаты мягких тканей имеют множество конструкций и могут быть образованы из разнообразных материалов, соответственно форме и характеристикам окружающих анатомических структур. В одном аспекте настоящего изобретения имплантаты мягких тканей, подходящие для комбинирования с ингибитором фиброза, образуют из полимера, такого как силикон, поли(тетрафторэтилен), полиэтилен, полиуретан, полиметилметакрилат, полимерный сложные эфир, полиамид и полипропилен. Имплантаты мягких тканей могут быть в форме оболочки (или конверта), который наполняют жидким материалом, таким как солевой раствор. В одном аспекте настоящего изобретения имплантаты мягких тканей включают в себя силикон или диметилсилоксан или являются образованными из них. Силиконовые имплантаты могут быть твердыми, но гибкими и очень прочными и стабильными. Их изготавливают с различной степенью твердости по дюрометру - мягкими или довольно твердыми, что определяется степенью полимеризации. Короткие полимерные цепи образуют жидкий силикон с меньшей вязкостью, при удлинении цепей получают гелеобразные вещества, а в результате поперечного сшивания полимерных цепей образуется силиконовая резина с высокой вязкостью. Диспергированный твердый силикон можно также смешивать с водой и гидрогелевым носителем, делая возможным врастание фиброзной ткани. Эти имплантаты конструируют для увеличения площади мягких тканей, а не подлежащей костной структуры. В определенных аспектах настоящего изобретения имплантаты на силиконовой основе (например, подбородочные имплантаты могут быть прикрепленными к подлежащей кости одним или несколькими титановыми винтами. Силиконовые имплантаты можно применять для увеличения массы ткани в различных частях тела, включая, например, области молочных желез, носа, подбородка, скуловую область (например, щеки) и грудную/пекторальную область. Силиконовый гель с низкой вязкостью первоначально применяли для наполнения имплантатов молочных желез, а высоковязкий силикон применяют для расширителей тканей и внешних оболочек имплантатов молочных желез, наполненных солевым раствором или силиконом. В другом аспекте настоящего изобретения имплантаты мягких тканей включают в себя поли(тетрафторэтилен) (PTFE) или являются образованными из него. В определенных аспектах настоящего изобретения этот поли(тетрафторэтилен) представляет собой вспененный политетрафторэтилен (ePTFE).
В еще одном ином аспекте настоящего изобретения имплантаты мягких тканей включают в себя полиэтилен или являются образованными из него. Полиэтиленовые имплантаты часто применяют, например, для увеличения подбородка. Полиэтиленовые имплантаты могут быть пористыми - для того, чтобы они могли интегрироваться в окружающую ткань. Могут быть доступными полиэтиленовые имплантаты с различными биохимическими свойствами, включая химическую стойкость, прочность на растяжение и твердость. Полиэтиленовые имплантаты можно применять для восстановления лица с включением скуловых, подбородочных, назальных и черепных имплантатов.
В еще одном ином аспекте настоящего изобретения имплантаты мягких тканей включают в себя полипропилен или являются образованными из него. Полипропиленовые имплантаты представляют собой слабо переплетенный полимер, имеющий свойства, сходные со свойствами полиэтилена.
В еще одном ином аспекте настоящего изобретения имплантаты мягких тканей включают в себя полиамид или являются образованными из него. Полиамид представляет собой соединение нейлона, сотканного в виде сетки, которую можно применять для лицевой восстановительной имплантации или для увеличения массы ткани. Эти имплантаты легко формуются и сшиваются, и со временем рассасываются.
В еще одном другом аспекте настоящего изобретения имплантаты мягких тканей включают в себя полимерный сложный эфир или являются образованными из него. Полимерные сложные эфиры, не подвергающиеся биодеградации, могут быть подходящими в качестве имплантатов для тех областей применения, где требуется достаточная прочность на растяжение и стабильность (например, для увеличения груди, подбородка и носа).
В еще одном другом аспекте настоящего изобретения имплантаты мягких тканей включают в себя полиметилметакрилат или являются образованными из него. Эти имплантаты имеют высокую молекулярную массу и обладают достаточной прочностью на сжатие и жесткостью даже при свойственной им высокой пористости. Полиметилметакрилат можно применять для увеличения подбородка и скуловой области, а также при черепной и челюстно-лицевой реконструкции.
В еще одном другом аспекте настоящего изобретения имплантаты мягких тканей включают в себя полиуретан или являются образованными из него. Полиуретан можно применять в виде пены для покрытия имплантатов молочных желез. Этот полимер стимулирует врастание ткани, результатом чего являются меньшая степень развития капсулярных контрактур в имплантатах молочных желез. Коммерчески доступные поли(тетрафторэтиленовые) имплантаты мягких тканей, подходящие для применения в комбинации с ингибитором фиброза, включают в себя поли(тетрафторэтиленовые) имплантаты щеки, подбородка и носа.
Предпочтительными материалами для имплантатов являются полимеры природного или синтетического происхождения, не подвергающиеся биологическому рассасыванию. Примеры полимеров, не подвергающихся биологическому рассасыванию, включают в себя, но не ограничиваются ими, фторированные полимеры (например фторэтилены, пропилены, фторПЭГи), полиолефины, такие как полиэтилен, полимерные сложные эфиры, такие как полиэтилентерефталат (PET), полипропилен, целлюлозу, политетрафторэтилен (PTFE), нейлоны, полиамиды, полиуретаны, силиконы, полиэтилен со сверхвысокой молекулярной массой (UHMWPE), полибутиловые сложные эфиры, полиарилэфиркетон, их сополимеры и комбинации, поли(тетрафторэтилен) (ePTFE), полиметилметакрилат, полимерный сложный эфир или полисахарид, где указанный полисахарид представляет собой гликозаминогликан.
Другими предпочтительными материалами являются органосилан или органосиликат, углеродный композит, титан, тантал, углерод, фосфат кальция, цирконий, ниобий, гафний, гидроксиапатит.
Амфифильное соединение может быть линейным, разветвленным, блок-сополимером или привитым сополимером. Гидрофильные части могут быть произведенными из гидрофильных полимеров или соединений или из членов группы, включающей в себя полиамиды, полиэтиленоксид, гидрофильные полиуретаны, полилактоны, полиимиды, полилактамы, поливинилпирролидон, поливиниловые спирты, полиакриловую кислоту, полиметакриловую кислоту, поли(гидроксиэтилметакрилат), желатин, декстран, олигосахариды, такие как хитозан, гиалуроновая кислота, альгинат, хондроитинсульфат, их смеси и комбинации. Гидрофобные части являются произведенными из гидрофобных полимеров или соединений, выбранных из группы, включающей в себя полиэтилен, полипропилен, гидрофобные полиуретаны, полиакрилаты, полиметакрилаты, фторполимеры, поликапролактон, полилактид, полигликолид, фосфолипиды и полимочевины, поли(этилен/винилацетат), поливинилхлорид, полимерные сложные эфиры, полиамиды, поликарбонат, полистиролы, политетрафторэтилен, силиконы, силоксаны, жирные кислоты и хитозан, имеющий высокие степени ацетилирования, и их смеси и комбинации. Амфифильное соединение может включать в себя любую биологически совместимую комбинацию гидрофильных и гидрофобных частей.
Аутогенные тканевые имплантаты
Аутогенные тканевые имплантаты включает в себя, без ограничения, жировую ткань, аутогенные жировые имплантаты, кожные имплантаты, кожные или тканевые вставки, лоскуты мышечной ткани и имплантаты извлеченных клеток. Имплантаты жировой ткани могут также быть известными как аутогенные жировые имплантаты, пересадка жира, свободный перенос жира, аутологический перенос/трансплантация жира, кожно-жировые имплантаты, липоскульптура, липоструктура, восстановление объема, микролипоинекция и инъекция жира.
Аутогенные тканевые имплантаты могут также состоять из лоскутов на ножках, которые обычно получают со спины (например, мышечно-кожный лоскут широчайшей мышцы спины) или живота (например, мышечно-кожный лоскут прямой и поперечной мышц живота, лоскут TRAM). Лоскуты на ножках можно также получать с ягодиц, бедра или паховой области.
Аутогенный тканевый имплантат может также представлять собой суспензию аутологических кожных фибробластов, которые можно применять для создания косметических эффектов. Этот способ применяют для исправления косметических и эстетических дефектов кожи, инъецируя суспензию аутологических кожных фибробластов внутрикожно и в подкожную ткань рядом с дефектным участком. К типичным дефектам, корректируемым этим способом, относятся морщины, растяжения, атрофические рубцы, углубления на коже нетравматического происхождения, рубцы от обыкновенных угрей и гипоплазия губы. Фибробласты являются гистосовместимыми с субъектом, которому их инъецируют; их размножают в течение некоторого периода времени посредством пассажа в безбелковой среде системы культивирования клеток.
Аутогенный тканевый имплантат может также представлять собой дермальную вставку, полученную из кожи донора после применения лазерного луча для отсечения эпидермального слоя кожи и открытия собственно дермы, которую затем вставляют в виде «пробки» в углубления на коже лица. Этот аутогенный тканевый имплантат можно применять для заполнения углублений на коже лица, таких как морщины и рубцовые углубления от обыкновенных угрей. Пересадку кожи применяют также для коррекции углублений на тех участках кожи, где эпидерма удалена посредством дермабразии.
Хирургические сетки
Хирургические сетки могут быть изготовленными, например, в виде грыжевого бандажа, предохранительных повязок при стрессовом недержании мочи, поддерживающих сеток, применяемых при вагинальном пролапсе, повязок на раны, литых силиконовых фиксаторов, креплений катетеров, фиксаторов электродов кардиостимуляторов, тампонов для хирургических швов, фиксаторов линий хирургических швов, заплаток для дефектных перегородок сердца, манжеток катетеров.
Обычными полимерами для хирургических сеток являются полипропилен (диаметр волокон в диапазоне от 0,08 мм до 0,20 мм, размер пор от примерно 0,8 мм до 3,0 мм и масса от 25 до 100 г/м2), полимерный сложный эфир (размер пор от примерно 0,5 до 2,0 мм и масса от примерно 14 до 163 г/м2), политетрафторэтилен (размер пор от примерно 0,8 до 3,5 мм и масса от примерно 44 до 98 г/м2), полимерный сложный эфир Needle Felt (PETNF) (диапазон от 203 до 322 г/м2), политетрафторэтилен Needle Felt (PTFENF) (масса 900 и 1800 г/м2) и Dacron (полиэтилентерефталат).
Полипропиленовые и политетрафторэтиленовые сетки применяют для грыжевых бандажей, предохранительных повязок при стрессовом недержании мочи и поддерживающих сеток, применяемых при вагинальном пролапсе. Сетки из полимерного сложного эфира применяют для грыжевых бандажей, повязок на раны, литых силиконовых фиксаторов, креплений катетеров и фиксаторов электродов кардиостимуляторов. Сетки из PETNF и PTEFENF применяют для шовных тампонов, фиксаторов линий швов, лоскутов для дефектных перегородок сердца и манжеток катетеров.
Таким образом, настоящее изобретение относится к медицинским устройствам или имплантатам, на которые нанесена, по меньшей мере, одна нитрокарбоновая кислота общей формулы (X)

где
O-R* представляет собой -OH, полиэтиленгликолил, полипропиленгликолил, холестероил, фитостероил, эргостероил, кофермент A или алкоксильную группу, состоящую из 1-10 атомов углерода, причем эта алкоксильная группа может содержать одну или более двойных связей и/или одну или более тройных связей и/или может быть замещенной одной или более нитрогруппами и/или одним или более заместителями S1-S20,
«цепь углеродных атомов» относится к алкильной цепи, к которой присоединена, по меньшей мере, одна нитрогруппа, состоящая из 1-40 атомов углерода, причем эта алкильная цепь может содержать одну или более двойных связей и/или одну или более тройных связей и может быть циклической и/или может быть замещенной одной или более нитрогруппами и/или одним или более заместителями S1-S20,
S1-S20 независимо один от другого представляют собой -OH, -OP(O)(OH)2, -P(O)(OH)2, -P(O)(OCH3)2, -OCH3, -OC2H5, -OC3H7, -O-цикло-C3H5, -OCH(CH3)2, -OC(CH3)3, -OC4H9, -OPh, -OCH2-Ph, -OCPh3, -SH, -SCH3, -SC2H5, -F, -Cl, -Br, -I, -CN, -OCN, -NCO, -SCN, -NCS, -CHO, -COCH3, -COC2H5, -COC3H7, -CO-цикло-C3H5, -COCH(CH3)2, -COC(CH3)3, -COOH, -COOCH3, -COOC2H5, -COOC3H7, -COO-цикло-C3H5, -COOCH(CH3)2, -COOC(CH3)3, -OOC-CH3, -OOC-C2H5, -OOC-C3H7, -OOC-цикло-C3H5, -OOC-CH(CH3)2, -OOC-C(CH3)3, -CONH2, -CONHCH3, -CONHC2H5, -CONHC3H7, -CON(CH3)2, -CON(C2H5)2, -CON(C3H7)2, -NH2, -NHCH3, -NHC2H5, -NHC3H7, -NH-цикло-C3H5, -NHCH(CH3)2, -NHC(CH3)3, -N(CH3)2, -N(C2H5)2, -N(C3H7)2, -N(цикло-C3H5)2, -N[CH(CH3)2]2, -N[C(CH3)3]2, -SOCH3, -SOC2H5, -SOC3H7, -SO2CH3, -SO2C2H5, -SO2C3H7, -SO3H, -SO3CH3, -SO3C2H5, -SO3C3H7, -OCF3, -OC2F5, -O-COOCH3, -O-COOC2H5, -O-COOC3H7, -O-COO-цикло-C3H5, -O-COOCH(CH3)2, -O-COOC(CH3)3, -NH-CO-NH2, -NH-CO-NHCH3, -NH-CO-NHC2H5, -NH-CO-N(CH3)2, -NH-CO-N(C2H5)2, -O-CO-NH2, -O-CO-NHCH3, -O-CO-NHC2H5, -O-CO-NHC3H7, -O-CO-N(CH3)2, -O-CO-N(C2H5)2, -O-CO-OCH3, -O-CO-OC2H5, -O-CO-OC3H7, -O-CO-O-цикло-C3H5, -O-CO-OCH(CH3)2, -O-CO-OC(CH3)3, -CH2F, -CHF2, -CF3, -CH2Cl, -CH2Br, -CH2I, -CH2-CH2F, -CH2-CHF2, -CH2-CF3, -CH2-CH2Cl, -CH2-CH2Br, -CH2-CH2I, -CH3, -C2H5, -C3H7, -цикло-C3H5, -CH(CH3)2, -C(CH3)3, -C4H9, -CH2-CH(CH3)2, -CH(CH3)-C2H5, -C5H11, -Ph, -CH2-Ph, -CPh3, -CH=CH2, -CH2-CH=CH2, -C(CH3)=CH2, -CH=CH-CH3, -C2H4-CH=CH2, -CH=C(CH3)2, -C≡CH, -C≡C-CH3, -CH2-C≡CH, -P(O)(OC2H5)2, холестерил, нуклеотиды, липоамины, дигидролипоамины, лизобифосфатидную кислоту, анандамид, длинноцепочечный N-ацилэтаноламид, sn-1-заместители с глицерином или диглицерином, sn-2-заместители с глицерином или диглицерином, sn-3-заместители, церамид, сфингозин, ганглиозид, галоактозилцерамид или аминоэтилфосфоновую кислоту.
Особо предпочтительно, если, по меньшей мере, одна нитрокарбоновая кислота, применяемая для нанесения в виде покрытия на медицинское устройство, является выбранной из 12-нитролинолевой кислоты, 9-нитро-цис-олеиновой кислоты, 10-нитро-цис-линолевой кислоты, 10-нитро-цис-олеиновой кислоты, 5-нитро-эйкозатриеновой кислоты, 16-нитро-все-цис-4,7,10,13,16-докозапентаеновой кислоты, 9-нитро-все-цис-9-12,15-октадекатриеновой кислоты, 14-нитро-все-цис-7,10,13,16,19-докозапентаеновой кислоты, 15-нитро-цис-15-тетракозеновой кислоты, 9-нитро-транс-олеиновой кислоты, 9,10-нитро-цис-олеиновой кислоты, 13-нитрооктадека-9,11,13-триеновой кислоты, 10-нитро-транс-олеиновой кислоты, 9-нитро-цис-гексадеценовой кислоты, 11-нитро-5,8,11,14-эйкозатриеновой кислоты, 9,10-нитро-транс-олеиновой кислоты, 9-нитро-9-транс-гексадеценовой кислоты, 13-нитро-цис-13-докозеновой кислоты, 8,14-нитро-цис-5,8,11,14-эйкозатетраеновой кислоты, 4,16-нитродокозагексаеновой кислоты, 9-нитро-цис-6,9,12-октадекатриеновой кислоты, 6-нитро-цис-6-октадеценовой кислоты, 11-нитро-цис-5,8,11,14-эйкозатетраеновой кислоты и их комбинаций.
Особо предпочтительно также, если нитрокарбоновая кислота является произведенной из гексановой кислоты, октановой кислоты, декановой кислоты, додекановой кислоты, тетрадекановой кислоты, гексадекановой кислоты, гептадекановой кислоты, октадекановой кислоты, эйкозановой кислоты, докозановой кислоты, тетракозановой кислоты, цис-9-тетрадеценовой кислоты, цис-9-гексадеценовой кислоты, цис-6-октадеценовой кислоты, цис-9-октадеценовой кислоты, цис-11-октадеценовой кислоты, цис-9-эйкозеновой кислоты, цис-11-эйкозеновой кислоты, цис-13-докозеновой кислоты, цис-15-тетракозеновой кислоты, t9-октадеценовой кислоты, t11-октадеценовой кислоты, t3-гексадеценовой кислоты, 9,12-октадекадиеновой кислоты, 6,9,12-октадекатриеновой кислоты, 8,11,14-эйкозатриеновой кислоты, 5,8,11,14-эйкозатетраеновой кислоты 7,10,13,16-докозатетраеновой кислоты, 4,7,10,13,16-докозапентаеновой кислоты, 9,12,15-октадекатриеновой кислоты, 6,9,12,15-октадекатетраеновой кислоты, 8,11,14,17-эйкозатетраеновой кислоты, 5,8,11,14,17-эйкозапентаеновой кислоты, 7,10,13,16,19-докозапентаеновой кислоты, 4,7,10,13,16,19-докозагексаеновой кислоты, 5,8,11-эйкозатриеновой кислоты, 9c,11t,13t-элеостеариновой кислоты, 8t,10t,12c-календовой кислоты, 9c,11t,13c-катальповой кислоты, 4,7,9,11,13,16,19-докозагептадекановой кислоты, таксоловой кислоты, пиноленовой кислоты, сциадоновой кислоты, 6-октадециновой кислоты, t11-октадецен-9-иновой кислоты, 9-октадециновой кислоты, 6-октадецен-9-иновой кислоты, t10-гептадецен-8-иновой кислоты, 9-октадецен-12-иновой кислоты, t7,t11-октадекадиен-9-иновой кислоты, t8,t10-октадекадиен-12-иновой кислоты, 5,8,11,14-эйкозатетраиновой кислоты, ретиноевой кислоты, изопальмитиновой кислоты, пристановой кислоты, фитановой кислоты, 11,12-метиленоктадекановой кислоты, 9,10-метиленгексадекановой кислоты, коронаровой кислоты, (R,S)-липоевой кислоты, (S)-липоевой кислоты, (R)-липоевой кислоты, 6,8-бис(метилсульфанил)-октановой кислоты, 4,6-бис(метилсульфанил)-гексановой кислоты, 2,4-бис(метилсульфанил)- бутановой кислоты, 1,2-дитиоланкарбоновой кислоты, (R,S)-6,8-дитианоктановой кислоты, (R)-6,8-дитианоктановой кислоты, (S)-6,8-дитианоктановой кислоты, таририновой кислоты, санталбовой кислоты, стеароловой кислоты, 6,9-октадецениновой кислоты, пируловой кислоты, крепениновой кислоты, гейстериновой кислоты, t8,t10-октадекадиен-12-иновой кислоты, ETYA, цереброновой кислоты, гидроксинервоновой кислоты, рицинолеиновой кислоты, лесквероловой кислоты, брассиловой кислоты и тапсиевой кислоты.
Полученные данные
Примеры 2, 3, 7, 9 и 11 показывают эффективность нитрованных жирных кислот при ингибировании чувствительности к физическим стрессорам, а также к главным экзогенным медиаторам, усиливающим эффект раздражителя и способным индуцировать пролиферацию фибробластов и продуцирование внеклеточного матрикса. Оба условия преобладают в клинических ситуациях, которые включают в себя медицинские воздействия, такие как хирургические, пластические или косметические процедуры, являющиеся причиной повреждений, при которых указанное раздражение или повреждение является выбранным из группы, включающей в себя разрез, разрыв, рассечение, резекцию, накладывание хирургического шва, ушивание раны, хирургическую обработку раны, прижигание, отсасывание, дренирование, имплантацию, пересадку ткани, или является результатом интервенционной процедуры, причем эта интервенционная процедура является выбранной из аспирации желчных и панкреатических протоков, пищевода или кишечника.
Примеры 3, 7, 8 и 10 предоставляют убедительные свидетельства того, что нитрованные жирные кислоты подавляют ноцицепцию и чувствительность макрофагов и фибробластов к раздражителям искусственных поверхностей, тем самым ингибируя ключевые явления, которые иначе приводили бы к образованию инородного тела. Тем самым удаляются и дополнительные стимулы фиброза. В сочетании с эффектами, описанными в примерах 1, 9 и 11, где наблюдали ингибирующий эффект нитрованных жирных кислот в отношении фибробластов, находящихся под воздействием хемокинов, эти результаты показали эффективность подавления нефизиологичной или патофизиологической реакции в клинических условиях, при которых медицинские средства, такие как покровный материал для ран и перевязочные материалы, шовный материал, хирургические инструменты, клинические перчатки, инъекционные иглы, спирали, канюли, трубки, эндопротезы тазобедренного сустава, материалы для остеосинтеза, медицинская целлюлоза, бандажные материалы, тампоны для ран, тканезамещающие материалы, хирургические шовные материалы, компрессы, губки, медицинский текстиль, мази, гели, пленкообразующие аэрозоли или сетки приводят во временный или постоянный тесный контакт с тканями. В результате этого можно справедливо утверждать, что поверхность с покрытием из нитрованной жирной кислоты улучшает биологическую совместимость.
Примеры 4, 6, 9 и 10 подтверждают предположение о том, что в клинических ситуациях, при которых имеет место воздействие эндогенных или экзогенных токсинов, хемокинов и/или раздражителей, можно ингибировать нефизиологичные или патологические реакции тучных клеток. Поскольку активация тучных клеток представляет собой дополнительное ключевое событие в механизме индукции фиброза, стабилизация тучных клеток способна предотвратить развитие заболеваний, индуцированных вторично. Поэтому нитрованные жирные кислоты можно применять для многих клинических состояний и заболеваний, таких как остеомиелофиброз, хронический полиартрит, атрофия слизистых тканей или эпидермы, язвенный дерматит, заболевания соединительной ткани, такие как дерматомиозит, хронический васкулит, узелковый полиартериит, болезнь Бюргера, глютеновая болезнь, болезнь Ван-Бурена, гипертрофия предстательной железы; а также заболевания с воспалительным компонентом, такие как энтеропатии, подобные спру или целиакии, или из группы, включающей в себя бронхоэктазию, эмфизему, хроническое обструктивное заболевание легких (COPD), дерматозы, такие как атрофический контактный дерматоз, или из группы, включающей в себя подагрический артрит, остеоартроз, дегенеративно-артрозные состояния, синдром токсического шока, амилоидоз, язвенный дерматит и нефросклероз, муковисцидоз, атопический дерматоз, атрофия слизистой ткани или эпидермы, заболевания соединительной ткани, такие как синдром Шарпа и дерматомиозит, афтозная язва, синдром Стивенса-Джонсона или токсический эпидермальный некролиз.
Пример 11 показывает, что нитрованные жирные кислоты подавляют ключевой медиатор, ответственный за нефизиологичное и патологическое образование белков внеклеточного матрикса и являющийся главным участником и/или элементом, ответственным за дисфункцию или неправильное функционирование и/или симптомы при различных клинических состояниях и заболеваниях. В таких ситуациях можно предположить, что будет происходить дальнейшее ослабление неблагоприятных эффектов, обусловленное ингибирующим действием нитрованных жирных кислот в отношении раздражителей, стимулирующих миграцию и пролиферацию фибробластов, как подтверждено результатами примеров 1, 3 и 8. Такие условия и/или заболевания включают в себя, но не ограничиваются ими, экзогенные раздражения (подобные ранению или травме), инфаркты органов, гипотермию, ожог, химический ожог, ожог щелочью, жгучее обморожение, прижигание, гранулему, некроз, язву, перелом, реакцию на чужеродное тело, порез, царапину, рваную рану, гематому, разрыв, контузию, образование трещин, прободение или острое или хроническое физическое, химическое или электрическое раздражение, включая фасцит, тендинит или гипертрофию предстательной железы, болезнь Ван-Бурена, гипертрофию миокарда.
Пример 5 дает убедительное свидетельство того, что ключевой механизм действия нитрованных жирных кислот основан на ослаблении или ингибировании чувствительности мембранных белков и передачи сигнала. Поскольку рецептор TRPV-1 является представителем рецепторов, ответственных за ноцицепцию, показано модулирование нефизиологичного или патологического раздражения ноцицептивных рецепторов нитрованными жирными кислотами. Поэтому нитрованные жирные кислоты можно применять при клинических состояниях и/или заболеваниях, при которых ноцицепция вызвана эндогенными или экзогенными раздражителями. Такие состояния являются подобными ранению или травме, инфаркту органа, отравлению, гипотермии, ожогу, химическому ожогу, ожогу щелочью, жгучему обморожению, прижиганию, некрозу, язве, перелому, порезу, царапине, рваной ране, гематоме, разрыву, контузии, образованию трещин, прободению или хроническому физическому, химическому или электрическому раздражению, подобному фасциту, тендиниту, невропатии, острой или хронической боли, синдрому гиперчувствительности, невропатической боли, атопиям, таким как крапивница, аллергический ринит и сенная лихорадка, энтеропатиям, таким как спру или глютеновая болезнь.
Способы применения и фармацевтические композиции
Согласно настоящему изобретению, нитрокарбоновые кислоты следует применять в качестве терапевтических средств для лечения и профилактики агрессивных клеточных реакций (соответственно, такой формы заживления). Для того, чтобы применить средство согласно настоящему изобретению в качестве лекарственного средства для организма млекопитающего, включая людей, требуется подходящая фармацевтическая композиция.
Согласно описанным эффектам, производимым нитрокарбоновыми кислотами на клетки и органеллы, и как представлено в примерах, имеется множество клинических ситуаций, при которых нитрокарбоновые кислоты ослабляют агрессивные клеточные реакции. Согласно настоящему изобретению нитрокарбоновые кислоты можно применять как пассивное покрытие на материалах, приводимых в тесный контакт с пораженными тканями. Количество нитрокарбоновых кислот, нанесенных на поверхность инородных материалов для биологического пассивирования, является слишком малым для демонстрации фармакологических эффектов.
Однако, согласно настоящему изобретению, результатом физических и физико-химических взаимодействий между нитрокарбоновыми кислотами, находящимися на граничной поверхности с инородными материалами, и прилегающими клетками является отсутствие контактной активации клетки, обусловленной таким раздражителем. Таким образом, главная движущая сила развития агрессивной формы заживления ослабляется без необходимости попадания нитрокарбоновых кислот в клеточные слои, отдаленные от плоскости раздела фаз. Поэтому такой способ применения можно использовать для биологического пассивирования без инициации фармакологического действия. В других клинических ситуациях необходимо локально ограниченное распределение нитрокарбоновых кислот для нанесения покрытия на пораженные клетки. Концентрации, требующиеся для эффективного ослабления развития агрессивной формы заживления, также находятся ниже порога фармацевтического действия. Кроме того, нитрокарбоновые кислоты можно применять в качестве терапевтических средств для лечения и профилактики таких форм заживления. Для того, чтобы применить средство согласно настоящему изобретению для млекопитающего, включая людей, требуется подходящая фармацевтическая композиция.
Такие композиции содержат нитрокарбоновую кислоту в качестве активного или пассивного ингредиента или комбинацию, по меньшей мере, одной нитрокарбоновой кислоты, по меньшей мере, с одним дополнительным активным средством, совместно, по меньшей мере, с одним из фармацевтически приемлемых носителей, эксципиентов, связующих, дезинтегрантов, глидантов, разбавителей, смазывающих средств, окрашивающих средств, подсластителей, ароматизаторов, консервантов или им подобных веществ. Фармацевтические композиции согласно настоящему изобретению можно изготавливать известным образом в традиционных твердых или жидких носителях или разбавителях и с традиционным фармацевтически изготовленным адъювантом, при подходящем уровне дозирования. Если фармацевтическая композиция содержит два соединения, представляющих собой нитрокарбоновые кислоты, их количественное содержание в комбинации составляет от 20% масс. соединения 1 и 80% масс. соединения 2 до 80% масс. соединения 1 и 20% масс. соединения 2. Более предпочтительно, указанные два соединения содержатся в комбинации в количестве от 30% масс. соединения 1 и 70% масс. соединения 2 до 70% масс. соединения 1 и 30% масс. соединения 2. Еще более предпочтительно, указанные два соединения содержатся в комбинации в количестве от 40% масс. соединения 1 и 60% масс. соединения 2 до 60% масс. соединения 1 и 40% масс. соединения 2.
Предпочтительно, указанная, по меньшей мере, одна нитрокарбоновая кислота является подходящей для внутривенного, внутриартериального, внутрибрюшинного, интерстициального, интратекального введения, капельного вливания, инфильтрации, накладывания, приема внутрь (соответственно, перорального введения) и подходящей для введения посредством ингаляции.
Вводимые формы включают в себя, например, пилюли, таблетки, таблетки покрытые оболочкой, капсулы, липосомальные препараты, микро- и нано-препараты, порошки и формы депо. Кроме того, настоящее изобретение также включает в себя фармацевтические препараты для парентерального применения, включая дермальное, интрадермальное, внутрижелудочное, внутрикожное, внутрисосудистое, внутриартериальное, внутривенное, внутримышечное, внутрибрюшинное, интраназальное, интравагинальное, интрабуккальное, чрескожное, ректальное, подкожное, сублингвальное, местное или трансдермальное применение, причем указанные препараты, в дополнение к обычным носителями и/или разбавителям, содержат пептид или комбинацию пептидов согласно настоящему изобретению.
Настоящее изобретение также включает в себя молоко млекопитающего, искусственное молоко млекопитающего, а также заменители молока млекопитающего, в виде препарата для перорального введения комбинации пептидов новорожденным и детям младшего возраста - в качестве фармацевтических препаратов и/или в качестве диетических пищевых добавок.
Фармацевтические композиции согласно настоящему изобретению обычно будут вводить вместе с подходящим материалом-носителем, выбранным с учетом желаемой формы введения, т.е. для перорального введения - в форме таблеток, капсул (наполненных твердым веществом, наполненных полутвердым веществом или наполненных жидкостью), порошков для приготовления растворов, аэрозольных препаратов, соответствующих традиционной фармацевтической практике. Другие подходящие препараты представляют собой гели, эликсиры, диспергируемые гранулы, сиропы, суспензии, кремы, лосьоны, растворы, эмульсии, дисперсии и т.п. Дозированные формы, подходящие для замедленного высвобождения, включают в себя таблетки, имеющие слои, распадающиеся с разной скоростью, или полимерные матрицы с регулируемым высвобождением, импрегнированные активными компонентами и оформленные в виде таблеток или капсул, содержащих такие импрегнированные или инкапсулированные пористые полимерные матрицы. Фармацевтические композиции могут содержать от 5 до 95% масс. указанной, по меньшей мере, одной нитрокарбоновой кислоты, хотя содержание указанной, по меньшей мере, одной нитрокарбоновой кислоты может также составлять до 100% фармацевтической композиции.
В качестве фармацевтически приемлемого носителя, эксципиента и/или разбавителя можно применять лактозу, крахмал, сахарозу, целлюлозу, стеарат магния, дикальцийфосфат, сульфат кальция, тальк, маннит, этиловый спирт (капсулы, наполненные жидкостью), альбумин, PEG, HES, аминокислоты, такие как аргинин, холестериловый сложный эфир, жидкие кристаллы, цеолиты.
Подходящие связующие включают в себя крахмал, желатин, природные сахара, циклодекстрины, кукурузные подсластители, природные и синтетические камеди, такие как камедь акации, альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль и воски. К смазывающим средствам, которые можно указать для применения в этих дозированных формах, относятся борная кислота, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтегранты включают в себя крахмал, метилцеллюлозу, гуаровую камедь и т.п. Там, где это приемлемо, можно также включать подсластители, ароматизаторы и консерванты. Некоторые из терминов, указанных выше (а именно, дезинтегранты, разбавители, смазывающие средства, связующие и т.п.), более подробно обсуждаются ниже.
Кроме того, композиции согласно настоящему изобретению можно составлять в виде готовой формы с замедленным высвобождением, обеспечивая регулируемую скорость высвобождения любого одного или более из компонентов или активных ингредиентов для оптимизации терапевтических эффектов. Дозированные формы, подходящие для замедленного высвобождения, включают в себя многослойные таблетки, содержащие слои с различными скоростями дезинтеграции или полимерные матрицы с регулируемым высвобождением, импрегнированные активными компонентами и оформленные в виде таблеток или капсул, содержащих такие импрегнированные или инкапсулированные пористые полимерные матрицы.
Аэрозольные препараты, подходящие для ингаляции, могут включать в себя растворы и твердые вещества в форме порошков, которые могут быть в комбинации с фармацевтически приемлемым носителем, таким как сжатый газ (например, азот).
Для приготовления суппозиториев сначала расплавляют низкоплавкий воск, такой как смесь глицеридов жирных кислот (как масло какао), и в нем, перемешивая, однородно диспергируют активный ингредиент. Расплавленную однородную смесь затем разливают в формы удобного размера и дают возможность охладиться и затвердеть.
В настоящее изобретение включены также препараты в твердой форме, которые предназначены для преобразования, незадолго перед применением, в препарат в жидкой форме для перорального или парентерального введения. Такие жидкие формы включают в себя растворы, суспензии и эмульсии.
Указанную, по меньшей мере, одну нитрокарбоновую кислоту согласно настоящему изобретению можно также доставлять трансдермально. Трансдермальные композиции могут принимать форму кремов, лосьонов, аэрозолей и/или эмульсий и могут быть включенными в трансдермальные пластыри матричного или резервуарного типа, как традиционно принято в данной области для этой цели.
Считают, что трансдермальный препарат указанной, по меньшей мере, одной нитрокарбоновой кислоты согласно настоящему изобретению повышает биодоступность указанной нитрокарбоновой кислоты в циркулирующей крови или в подкожных тканях. Одной из проблем, связанных с введением нитрокарбоновой кислоты (одной или более), является потеря биологической активности вследствие образования веществ, нерастворимых в водных средах, или вследствие разложения. Поэтому необходимо достигнуть стабилизации нитрокарбоновой кислоты (одной или более) для поддержания ее текучести и поддержания ее биологической активности после введения пациентам, нуждающимся в этом. Прежние попытки предоставить активные средства для фармакологического лечения включали в себя введение лекарственного средства в полимерную матрицу, из которой активный ингредиент высвобождался в системный кровоток. Известные средства доставки с замедленным высвобождением активных веществ раскрыты, например, в US4235988, US4188373, US4100271, US447471, US4474752, US4474753 или US4478822, относящихся к полимерным фармацевтическим средствам доставки фармацевтически активных химических материалов к мембранам слизистых оболочек. Фармацевтические носители представляют собой водные растворы определенных конденсатов полиоксиэтилена с полиоксипропиленом. Описано, что эти полимерные фармацевтические носители обеспечивают повышенную абсорбцию лекарственного средства мембраной слизистой оболочки и двукратное или большее продление действия лекарственного средства. Заместители представляют собой блок-сополимеры полиоксипропилена и полиоксиэтилена, применяемые для стабилизации лекарственные средств.
Водные растворы блок-сополимеров полиоксиэтилена с полиоксипропиленом (полоксомеры) с пластификатором или без него можно применять в качестве стабилизаторов для пептидов. Полоксомеры, также известные под торговым наименованием «Плюроники» (например, Плюроник F127, Плюроник P85, Плюроник F68) обладают свойствами поверхностно-активных веществ, что делает их полезными для промышленных областей применения. В предпочтительном варианте осуществления настоящего изобретения предоставлен препарат в форме наногеля.
Термин «капсула» относится к специальному контейнеру или емкости, изготовленной из метилцеллюлозы, поливиниловых спиртов или денатурированных желатинов или крахмала для удерживания или содержания композиций, содержащих активные ингредиенты. Капсулы с твердой оболочкой обычно изготавливают из смесей желатинов, выделенных из свиных костей и кожи, образующих гели с относительно высокой прочностью. Сама капсула может содержать небольшие количества красителей, замутняющих средств, пластификаторов и консервантов.
Термин «таблетка» означает сжатую или прессованную твердую дозированную форму, содержащую активные ингредиенты с подходящими разбавителями. Таблетку можно изготавливать сжатием или прессованием смесей или гранулятов, полученных влажным гранулированием, сухим гранулированием, как хорошо известно квалифицированному специалисту в данной области техники.
Термин «оральные гели» относится к активным ингредиентам, диспергированным или солюбилизированным в гидрофильной или гидрофобной полутвердой матрице.
Термин «порошки для реконструкции» относится к порошковым смесям, содержащим активные ингредиенты и подходящие разбавители, которые можно суспендировать в воде или в соках. Одним из примеров таких форм перорального введения для новорожденных и детей младшего возраста является заменитель человеческого грудного молока, который производят из молочного порошка и порошка молочной сыворотки, необязательно, с частичным замещением лактозой.
Подходящими разбавителями являются вещества, которые обычно составляют главную часть композиции или дозированной формы. Подходящие разбавители включают в себя сахара, такие как лактоза, сахароза, маннит и сорбит, крахмалы, произведенные из пшеницы, кукурузы, риса и картофеля, и целлюлозы, такие как микрокристаллическая целлюлоза, липиды, триглицериды, масла, гидрогели, такие как желатин, органогели. Количество разбавителей в композиции может находиться в диапазоне от примерно 5 до примерно 95% общей массы композиции (предпочтительно, от примерно 25 до примерно 75%, более предпочтительно, от примерно 30 до примерно 60% масс. и, наиболее предпочтительно, от примерно 40 до 50% масс.).
Нитрокарбоновую кислоту (одну или более) согласно настоящему изобретению можно применять для образования хорошо известных дозированных форм, состоящих из множества дискретных частиц, общее количество которых представляет собой назначенную терапевтически применяемую дозу лекарственного средства. Принятые перорально, лекарственные формы, состоящие из множества частиц, обычно свободно диспергируются в желудочно-кишечном тракте и максимально увеличивают абсорбцию. Конкретный пример этого описан в US 6068859, раскрывающем лекарственные формы, состоящие из множества частиц, которые обеспечивают регулируемое высвобождение азитромицина. Другим преимуществом лекарственных форм, состоящих из множества частиц, является улучшенная стабильность лекарственного средства. Полоксомерный компонент лекарственной формы, состоящей из множества частиц, является весьма инертным, благодаря чему минимизируется разложение лекарственного средства.
Предпочтительно, указанную, по меньшей мере, одну нитрокарбоновую кислоту можно составлять в препарате с полоксамером и смолой для образования мицелл, подходящих для перорального введения пациентам, нуждающимся в данном лекарственном средстве.
Жидкие формы препаратов включают в себя растворы, суспензии, эмульсии и жидкие кристаллы. В качестве примера можно указать водные или водно-пропиленгликолевые растворы для парентеральных инъекций или добавление подсластителей и замутняющих средств для пероральных растворов, суспензий и эмульсий. Жидкие формы препаратов могут также включать в себя растворы для интраназального введения.
Диаметр частиц лиофилизированного препарата, вводимых посредством ингаляции, предпочтительно, составляет от 2 до 5 мкм (более предпочтительно, от 3 до 4 мкм). Лиофилизированный препарат является особенно подходящим для введения с использованием ингалятора - например ингалятора OPTINEB® или VENTA-NEB® (NEBU-TEC, Elsenfeld, Germany). Лиофилизированный продукт можно регидратировать в стерильной дистиллированной воде или в любой другой жидкости, подходящей для ингаляционного введения.
В качестве альтернативы, для внутривенного введения лиофилизированный продукт можно регидратировать в стерильной дистиллированной воде или в любой другой жидкости, подходящей для внутривенного введения.
Предпочтительная дозированная концентрация для внутривенного, перорального или ингаляционного введения составляет от 100 до 2000 мкмоль/мл (более предпочтительно, от 200 до 800 мкмоль/мл).
Способ лечения
Настоящее изобретение относится к способу профилактики и/или лечения агрессивной формы заживления или к ослаблению реакции на раздражающий стимул посредством введения пациенту, нуждающемуся в этом, фармацевтической композиции или посредством нанесения на медицинское устройство или имплантат пассивирующего покрытия, содержащего, по меньшей мере, одну нитрокарбоновую кислоту согласно настоящему изобретению в терапевтически эффективном количестве, так чтобы оно было эффективным, по меньшей мере, при одном из вышеуказанных клинических состояний или заболеваний.
Нитрокарбоновые кислоты согласно настоящему изобретению можно применять для профилактики и/или продолжения лечения, связанного с проведением медицинских манипуляций и/или необходимого при наличии раздражения и/или ранения, причиной которых является агрессивная форма заживления или другое вышеуказанное заболевание или состояние, в комбинации с введением другого терапевтического соединения. Используемый в настоящем документе термин «в комбинации с введением» соединения, терапевтического агента или известного лекарственного средства совместно с нитрокарбоновой кислотой (одной или более) согласно настоящему изобретению означает введение указанного лекарственного средства и указанной нитрокарбоновой кислоты (одной или более) в такое время, когда указанное известное лекарственное средство и указанная нитрокарбоновая кислота (одна или более) будут иметь терапевтический эффект. В некоторых случаях этот терапевтический эффект будет синергическим. Для такого совместного введения можно использовать одновременное (т.е. в одно и то же время), предшествующее или последующее введение указанного лекарственного средства относительно введения нитрокарбоновой кислоты (одной или более) согласно настоящему изобретению. Специалист с обычной квалификацией в данной области без затруднений определил бы подходящее время, последовательность и дозы для введения конкретных лекарственных средств согласно настоящему изобретению.
Кроме того, настоящее изобретение относится к способу модулирования заболевания, демонстрирующего агрессивную реакцию заживления тканей, клеток или органелл, которая не обусловлена генуинным воспалением у млекопитающего, включая людей, который включает в себя введение указанному млекопитающему эффективного количества нитрокарбоновой кислоты или ее солей или гидратов, эффективных для предупреждения или лечения указанной агрессивной реакции заживления.
Определения
Термин «агрессивный процесс заживления» определен как реакция организма на физическое, электрическое, термическое, химическое изменение или травму клеток или тканей, вызывающие ответ затронутых или соседних клеток, инициирующий миграцию, дифференцировку, пролиферацию или апоптоз затронутых или соседних клеток и ведущий (1) к образованию внеклеточного матрикса и/или (2) к накоплению клеток, (3) что вместе или по отдельности производит количество материала, превышающего потребности заполнения дефекта, и/или (4) к образованию или инвазии клеток, которые повреждают/нарушают/разрушают функциональность ткани/органа, и/или (5) клетки и/или структуры внеклеточного матрикса взаимно связывают/склеивают/аглютинируют/«спекают» ткани в нефизиологичной форме, приводя (6) к симптомам нарушенной функциональности ткани или органа и/или (7) к косметическим или эстетическим дефектам.
Постоянным клиническим и гистологическим признаком агрессивного процесса заживления, который может быть установлен квалифицированным специалистом в данной области, является присутствие либо внеклеточного матрикса, либо пролиферированных клеток, которые образовались в процессе заживления, в результате чего создается такое количество твердого материала, которое превышает потребности заполнения дефекта или повреждает затронутые ткани и тем самым снижает их функциональность и/или является причиной косметических/эстетических дефектов.
Термины «патофизиологический» или «патологический», используемый в настоящем документе, относятся ко всем формам заживления, которые не принимают физиологического курса и в то же время развивают патологические симптомы, которые требуют медицинского вмешательства. Другими словами, эти термины относятся к любой биохимической, функциональной или структурной реакции клетки, органеллы или ткани, рассматриваемых в целом, или реакции в клетке, органелле или ткани, которая является типичной для определенной патологии данных клеток или тканей.
Термин «нефизиологичный», используемый в настоящем документе, относится, как правило, ко всем формам заживления, которые не принимают физиологического курса, но не всегда развивают патологические или другие симптомы и поэтому не всегда нуждаются в медицинском внимании. Другими словами, этот термин относится к любой биохимической, функциональной или структурной реакции клетки, органеллы или ткани, рассматриваемых в целом, или реакции в клетке, органелле или ткани, которая не является характерной для данного типа клеток или тканей при нормальном развитии или функционировании.
Термин «раздражающий стимул» относится к любому экзогенному или эндогенному стимулу, способному индуцировать биохимическое, функциональное или структурное изменение в клетке, органелле или ткани, которое можно охарактеризовать как патофизиологическое или нефизиологичное.
Термин «ответ/реакция», используемый в этом контексте, относится к любой биохимической, функциональной или структурной реакции в клетке, органелле или ткани, которую можно охарактеризовать как патофизиологическую или нефизиологичную.
Термин «генуинный» определяет этиологическую связь с физиологическими или патофизиологическими причинами некоторого клинического состояния или заболевания.
Генуинное воспаление или первичное воспалительное заболевание определены как клинические состояния, при которых одновременно активировано несколько путей в иммунной системе бактериальными, вирусными или микробными агентами и в которые вовлечены, по меньшей мере, три из следующих иммунологических условий/реакций:
1. инфильтрация нейтрофилов и лимфоцитов (ТН-2-подобных клеток);
2. индукция iNOS (NOS-2);
3. продуцирование TNF-альфа;
4. индукция COX-2;
5. индукция 5-липоксигеназы.
Термины «профилактика» или «лечение» включает в себя введение нитрокарбоновой кислоты (одной или более) согласно настоящему изобретению для предупреждения, ингибировании или устранения симптомов и/или дисфункции или неправильного функционирования и/или эстетических/косметических дефектов, обусловленных реакцией клетки/ткани/органа на раздражитель, причиной которой является агрессивная форма заживления, патологическая или нефизиологичная реакция. В некоторых случаях лечение нитрокарбоновой кислотой (одной или более) согласно настоящему изобретению будут проводить в комбинации с другими защитными соединениями для предупреждения, ингибирования или устранения симптомов заболевания.
Термин «активный агент» или «терапевтический агент», используемый в настоящем документе, относится к агенту, который может предупреждать, ингибировать или устранять симптомы и/или прогредиентное течение заболевания, обусловленного раздражением/повреждением/медицинской манипуляцией, причиной которого является агрессивная форма заживления, или любого другого заболевания или состояния, указанного выше. Для такого агента требуется фармацевтический препарат или лекарственная форма, которая обеспечит желаемое фармакодинамическое распределение в тканях, органах или в целом организме. Однако согласно настоящему изобретению, термин «активный» не всегда означает, что указанный агент должен оказывать специфическое действие на один или более из специфических рецепторов или других мест связывания в клетке или должен оказывать прямое блокирующее или активирующее действие на специфические внутриклеточные сигнальные каскады. Кроме того, главный эффект основан на изменении физических или физико-химических свойств мембран клеток/органелл.
Термин «пассивный агент», используемый в настоящем документе, относится к агенту, который может предупреждать, ингибировать или устранять симптомы и/или прогредиентное течение заболевания, обусловленного раздражением, повреждением и/или медицинской манипуляцией и демонстрирующего агрессивную форму заживления, или другого заболевания или состояния, указанного выше, посредством ослабления ноцицепции, чувствительности к контактным активаторам или пассиваторам, подобным искусственным поверхностям или токсинам, без обладания специфическим сродством к одному или более из этих клеточных или тканевых сайтов. Пассивный агент приходит в тесный контакт с этими сайтами на границе раздела фаз, тем самым предупреждая патофизиологическую или нефизиологичную реакцию клетки или ткани на раздражающий стимул посредством воздействия на физические или физико-химические свойства клеточной мембраны, не показывая специфического фармакологического действия, подобного активированию рецепторов и без присутствия в слоях клеток или тканей, отдаленных от плоскости раздела фаз.
Термин «терапевтический эффект», используемый в настоящем документе, относится к эффективному предоставлению защитного эффекта для предупреждения, ингибирования или устранения симптомов и/или прогредиентного течения заболевания, обусловленного раздражением, повреждением или медицинской манипуляцией, причиной которого является агрессивная форма заживления, или любого другого заболевания или состояния, указанного выше.
Термин «терапевтически эффективное количество», используемый в настоящем документе, означает количество нитрокарбоновой кислоты (одной или более) согласно настоящему изобретению, достаточное для создания терапевтического эффекта, как определено выше, у субъекта или пациента, нуждающегося в лечении.
Термины «субъект» или «пациент», используемые в настоящем документе, означают любое млекопитающее, включая, но не ограничиваясь ими, человеческие существа, включая пациентов-людей, или субъекта, которому можно вводить композиции согласно настоящему изобретению. Термин «млекопитающие» включают в себя пациентов-людей и приматов, отличных от людей, а также экспериментальных животных, таких как кролики, крысы, мыши и другие животные.
Нитрокарбоновую кислоту (одну или более) согласно настоящему изобретению можно применять для профилактики и/или лечения прогредиентного течения заболевания, обусловленного раздражением, повреждением или медицинской манипуляцией, причиной которого является агрессивная форма заживления, или любого другого заболевания или состояния, указанного выше, в комбинационном введении с другим терапевтическим соединением. Используемый в настоящем документе термин «комбинационное введение» соединения, терапевтического агента или известного лекарственного средства с нитрокарбоновой кислотой (одной или более) согласно настоящему изобретению означает введение указанного лекарственного средства и нитрокарбоновой кислоты (одной или более) в такое время, когда и указанное известное лекарственное средство, и указанная нитрокарбоновая кислота (одна или более) будут иметь терапевтический эффект. В некоторых случаях этот терапевтический эффект будет синергическим. Для такого совместного введения можно использовать одновременное (т.е. в одно и то же время), предшествующее или последующее введение указанного лекарственного средства относительно введения нитрокарбоновой кислоты (одной или более) согласно настоящему изобретению. Специалист с обычной квалификацией в данной области без затруднений определил бы подходящее время, последовательность и дозы для введения конкретных лекарственных средств согласно настоящему изобретению.
Определение активности нитрокарбоновой кислоты
Нитрокарбоновую кислоту считают обладающей терапевтической активностью, если она демонстрирует одну из следующих активностей, перечисленных в п.п. от а) до g).
a) Нитрокарбоновая кислота может ингибировать активность чрезмерно активного биологического пути.
b) Нитрокарбоновая кислота (одна или более) может ингибировать продуцирование избыточно продуцируемой биологической молекулы.
c) Нитрокарбоновая кислота может ингибировать активность избыточно продуцируемой биологической молекулы.
d) Нитрокарбоновая кислота может повышать активность биологического пути с заниженной активностью.
e) Нитрокарбоновая кислота может повышать продуцирования заниженно продуцируемой биологической молекулы.
f) Нитрокарбоновая кислота может воспроизводить активность заниженно продуцируемой биологической молекулы.
g) Нитрокарбоновая кислота может модулировать патофизиологические или нефизиологичные клеточные реакции на физиологические, патофизиологические и нефизиологичные стимулы.
h) Нитрокарбоновая кислота может стабилизировать клеточные/плазматические мембраны, тем самым модулируя физические и/или биологические свойства.
i) Нитрокарбоновая кислота может предупреждать, ингибировать или устранять симптомы и/или прогредиентное развитие раздражения, повреждения или медицинской манипуляции, причиной которых является агрессивная форма заживления.
Термин «ингибирование», используемый в настоящем документе, определен как уменьшение активности или продуцирования по некоторому биологическому пути или активности некоторой молекулы на 10-100%. Более предпочтительное уменьшение активности или продуцирования по некоторому биологическому пути или активности некоторой молекулы составляет от 25 до 100%. Еще более предпочтительное уменьшение активности или продуцирования по некоторому биологическому пути или активности некоторой молекулы составляет от 50 до 100%.
Термин «увеличение», используемый в настоящем документе, определен как увеличение активности или продуцирования по некоторому биологическому пути или активности некоторой молекулы на 10-100%. Более предпочтительное увеличение активности или продуцирования по некоторому биологическому пути или активности некоторой молекулы составляет от 25 до 100%. Еще более предпочтительное увеличение активности или продуцирования по некоторому биологическому пути или активности некоторой молекулы составляет от 50 до 100%.
Термин «воспроизводить», используемый в настоящем документе, определен как 10-100%-ное увеличение активности некоторого биологического пути в зависимости от недопродуцируемой биологической молекулы. Более предпочтительное увеличение активности указанного биологического пути составляет от 25 до 100%. Еще более предпочтительное увеличение активности указанного биологического пути составляет от 50 до 100%.
Нанесение покрытия на медицинские устройства и контактное применение нитрокарбоновой кислоты
Непосредственное контактное применение является предпочтительным способом их профилактического или терапевтического применения. Предпочтительным вариантом осуществления настоящего изобретения является нанесение, по меньшей мере, одной нитрокарбоновой кислоты в виде покрытия на медицинское устройство или на поверхность имплантата, или на поверхность раздела фаз.
Дополнительными веществами, которые следует указать как применяемые для нанесения на медицинские средства или на поверхность имплантата, или на поверхность раздела фаз вместе с нитрокарбоновыми кислотами согласно настоящему изобретению, являются 2-пирролидон, трибутилцитрат, триэтилцитрат и их ацетилированные производные, дибутилфталат, бензиловый сложный эфир бензойной кислоты, диэтаноламин, диэтилфталат, изопропилмиристат и -пальмитат, триацетин, DMSO, контрастные средства, содержащие йод, PETN, изопропилмиристат и изопропилпальмитат.
В зависимости от целевого места на медицинском устройстве или имплантате может понадобиться полимерная матрица. С ее помощью можно предотвратить преждевременное отделение слоя чистого активного средства, состоящего, по меньшей мере, из одной нитрокарбоновой кислоты. В качестве матриц можно применять биологически стойкие и биологически разрушаемые полимеры, которые перечислены ниже. Особенно предпочтительны полисульфоны, полиуретаны, полилактиды, парилены и гликозиды и их сополимеры.
Кроме того, нитрокарбоновую кислоту можно вводить в организм или наносить на поверхность медицинского устройства или имплантата вместе с одним или более дополнительных активных ингредиентов, таких как антипролиферативные средства, противовоспалительные средства, антибиотики, антиметаболические средства, антиангиогенные средства, противовирусные средства или анальгетики.
Другим способом доставки нитрокарбоновой кислоты является покрытие устройства липидным двойным слоем. Данная техника основана на ковалентном связывании жирных кислот или их аналогов, таких как сфингозины, на поверхности. Предпочтительной группой жирных кислот являются тетраэфирные липиды. На второй стадии на поверхность наносят нитрокарбоновые кислоты, применяя так называемый способ Лэнгмюра.
На медицинские устройства, которые можно применять согласно настоящему изобретению, можно наносить покрытия, с одной стороны, нанося их на твердый материал.
Концентрация указанной, по меньшей мере, одной нитрокарбоновой кислоты и другого активного средства (если таковое присутствует) находится в диапазоне 0,001-500 мг на см2 общей покрытой поверхности эндопротеза, причем площадь поверхности рассчитывают, учитывая общую поверхность.
Способы согласно настоящему изобретению приспособлены для нанесения покрытия, например, на эндопротезы, и в частности на несосудистые стенты, такие как трахеальные стенты, бронхиальные стенты, уретральные стенты, пищеводные стенты, желчные стенты, стенты для применения в тонком кишечнике, стенты для применения в толстом кишечнике и другие металлические имплантаты.
Настоящее изобретение также относится к полимерным (т.е. неметаллическим) имплантатам, таким как полимерные протезы, подобные хирургическим сеткам, кардиостимуляторы или ритмоводители для мозга, тканевые трансплантаты, имплантаты молочных желез и любой другой имплантат, применяемый в косметических или восстановительных целях (в частности, имплантаты на силиконовой основе).
Кроме того, настоящее изобретение относится также к катетерам и устройствам из проволоки, и в частности, к дренажным катетерам или электродам.
Настоящее изобретение также относится к трансплантатам, таким как аллотрансплантаты, ксенотрансплантаты и гомотрансплантаты.
Кроме того, согласно настоящему изобретению, можно наносить покрытия на спирали, канюли, трубки, а также, как правило, на имплантаты, материалы для остеосинтеза, медицинскую целлюлозу, перевязочные материалы, тампоны для ран, хирургические шовные материалы, компрессы, губки, медицинский текстиль, мази, гели или пленкообразующие аэрозоли, сетки, волокна или ткани или части вышеуказанных медицинских устройств.
Материалы для таких медицинских продуктов можно выбирать из группы, включающей в себя: парилены (такие как парилен C, парилен D, парилен N, парилен F), полиакриловую кислоту, полиакрилаты, полиметилметакрилат, полибутилметакрилат, полиизобутилметакрилат, полиакриламид, полиакрилонитрил, полиамид, полиэфирамид, полиэтиленамин, полиимид, полипропилен, поликарбонат, поликарбоуретан, поливинилкетон, поливинилгалогенид, поливинилиденгалогенид, полимерный виниловый простой эфир, поливиниловые ароматические производные, полимерные сложные виниловые эфиры, поливинилпирролидон, полиоксиметилен, полиэтилен, полипропилен, политетрафтрорэтилен, полиуретан, полиолефиновый эластомер, полиизобутилен, камеди EPDM, фторсиликон, карбоксиметилхитозан, полиэтилентерефталат, поливалерат, карбоксиметилцеллюлозу, целлюлозу, вискозу, триацетат вискозы, нитрат целлюлозы, ацетат целлюлозы, гидроксиэтилцеллюлозу, бутират целлюлозы, поли-4-гидроксибутират, ацетат-бутират целлюлозы, этилвинилацетатный сополимер, полисульфон, полиэфирсульфон, эпоксидную смолу, смолы ABS, силиконовый преполимер, силикон, полисилоксан, поливинилгалоген, простой эфир целлюлозы, триацетат целлюлозы, хитозан, производные хитозана, полимеризуемые масла, поливалеролактоны, поли-ε-декалактон, полилактид, полигликолид, сополимеры полилактидов и полигликолидов, поли-ε-капролактон, полигидроксимасляную кислоту, полигидроксибутират, полигидроксивалерат, полигидроксибутират-co-валерат, поли(1,4-диоксан-2,3-дион), поли(1,3-диоксан-2-он), поли-пара-диоксанон, полиангидрид, полимерный ангидрид малеиновой кислоты, полигидроксиметакрилат, полицианоакрилат, поликапролактондиметилакрилат, поли-β-малеиновую кислоту, поликапролактонбутилакрилат, мультиблок-полимеры олигокапролактондиола и олигодиоксанондиола, полимерные простые и сложные эфирные мультиблок-полимеры PEG и поли(бутилентерефталата), полипивотолактон, триметилкарбонат полигликолевой кислоты, поликапролактонгликолид, поли(γ-этилглутамат), поли(DTH-иминокарбонат), поли(DTE-co-DT-карбонат), поли(бисфенол-A-иминокарбонат), полимерные сложные ортоэфиры, политриметилкарбонат, полииминокарбонат, поливиниловые спирты, амиды полимерных сложных эфиров, гликозилированные полимерные сложные эфиры, полимерные сложные фосфоэфиры, полифосфазены, поли[(п-карбоксифенокси)пропан], полигидроксипентановую кислоту, полиэтиленоксид-пропиленоксид, мягкие полиуретаны, полиуретаны с аминокислотными остатками в скелете, полиэфирэстеры, полиэтиленоксид, полиалкеноксалаты, каррагенаны, крахмал, коллаген, полимеры на белковой основе, полиаминокислоты, синтетические полиаминокислоты, зеин, модифицированный зеин, полигидроксиалканоаты, пектиновую кислоту, актиновую кислоту, фибрин, модифицированный фибрин, казеин, модифицированный казеин, карбоксиметилсульфат, альбумин, гиалуроновую кислоту, гепарансульфат, гепарин, хондроитинсульфат, декстран, циклодекстрин, сополимеры PEG и полипропиленгликоля, гуммиарабик, гуаровую или другие камедевые смолы, желатин, коллаген, коллаген-N-гидроксисукцинимид, липиды, липоиды, полимеризуемые масла и их модификации, сополимеры и смеси вышеуказанных веществ, или из группы, состоящей из них. Эти материалы можно также изготавливать из шелка или льна. Особо предпочтительно применение парилена (парилена C, парилена D, парилена N, парилена F).
Медицинские устройства с нанесенными покрытиями, предпочтительно, применяют для поддержания функциональности и/или структуры обрабатываемых участков или раскрытого состояния любой тубулярной структуры - например, мочевых путей, пищевода, трахеи, желчных путей, почечных протоков, двенадцатиперстной кишки, привратника желудка, тонкого и толстого кишечника, но также и для поддержания раскрытого состояния искусственных трубок, таких которые применяют для толстого кишечника или трахеи.
Таким образом, медицинские устройства с нанесенными покрытиями можно применять для предупреждения, ослабления или лечения патофизиологического или нефизиологичного процесса заживления или неуместного или нежелательного образования или срастания ткани. Это относится к интервенционному лечению тубулярных структур, таких как желчный проток, пищевод или кишки, к лечению любой травмы, при любом типе хирургической операции или сшивания или переформирования ткани, а также для консервирования органов и защиты органов.
Другая возможность состоит в применении этого краевого участка в качестве резервуара для активных веществ или, соответственно, для введения активных веществ специально в этот краевой участок, причем эти активные вещества могут быть отличными от тех, которые могут присутствовать в/на полностью покрытой поверхности полого тела.
Материалы для имплантатов и материалы для обработки ран
Имплантаты, и особенно полимерные имплантаты, могут быть изготовленными из обычных материалов, особенно полимеров, как они более подробно описаны ниже (особенно из полиамида, такого как РА 12, полимерного сложного эфира, полиуретана, полиакрилатов, полимерных простых эфиров и т.д.).
Как указано в начальном разделе, кроме выбора, по меньшей мере, одной нитрокарбоновой кислоты, для получения медицинского устройства, оптимально пассивирующего раздражители, важны и некоторые дополнительные факторы. Физические и химические свойства указанной, по меньшей мере, одной нитрокарбоновой кислоты и необязательно добавляемого дополнительного агента, а также их возможные взаимодействия, концентрация агента, высвобождение агента, комбинация агентов, выбор полимеров и способы нанесения покрытия, являются теми важными параметрами, которые оказывают прямое влияние друг на друга, и поэтому их следует точно определять для каждого варианта осуществления настоящего изобретения. Регулируя эти параметры, можно обеспечить поглощение указанного агента или активной комбинации соседними клетками участка дилатации.
С одной стороны, слои могут состоять из слоев чистого агента, причем, по меньшей мере, один из этих слоев содержит, по меньшей мере, одну нитрокарбоновую кислоту, а с другой стороны - из полимерных слоев, не содержащих агента или содержащих его, или их комбинаций.
В качестве способов изготовления такого медицинского устройства можно применять способ пипетирования (капиллярный способ), способ опрыскивания аэрозолем (способ многократного опрыскивания), способ погружения, электропрядение и/или лазерную технику. В зависимости от выбранного варианта осуществления настоящего изобретения, выбирают наиболее подходящий способ изготовления медицинского устройства, причем можно применять комбинацию двух или более способов.
Общее описание способов нанесения покрытия
Способ пипетирования - капиллярный способ
Этот способ включает в себя следующие стадии:
a) предоставление имплантата,
b) предоставление кроющего устройства с выходным отверстием, дающим возможность точечно выделять кроющий раствор,
c) помещение выходного отверстия, дающего возможность точечно выделять кроющий раствор, к ближнему или дальнему концу складки имплантата и
d) выпуск определенного количества кроющего раствора через выпускное отверстие на ближний или дальний конец имплантата.
Можно включать еще и необязательную стадию е) для сушки:
e) высушивание кроющего раствора при вращении имплантата вокруг его продольной оси в направлении к просвету складок.
Этот способ можно применять с любым кроющим раствором, вязкость которого позволяет ему перемещаться под действием капиллярных сил (или дополнительно под действием силы гравитации) к объекту в течении 5 минут (предпочтительно, в течение 2 минут) и таким образом почти полностью заполнять объект.
Способ опрыскивания аэрозолем:
Этот способ включает в себя следующие стадии:
a) предоставление имплантата,
b) предоставление кроющего устройства, по меньшей мере, с одним выпускным отверстием,
c) позиционирование указанного, по меньшей мере, одного выпускного отверстия в направлении поверхности имплантата,
d) выпуск определенного количества кроющего раствора из указанного, по меньшей мере, одного выпускного отверстия на имплантат; и
e) высушивание кроющего раствора на имплантате.
Можно включать еще и необязательную стадию f) для сушки:
f) высушивание кроющего раствора или равномерное распределение покрытия на поверхности имплантата при вращении имплантата вокруг его продольной оси.
Этот способ можно применять с любым кроющим раствором, вязкость которого дает возможность распылять с помощью небольших сопел или небольших выпускных отверстий.
Способ погружения:
В этом способе имплантат погружают в бак или контейнер, содержащий кроющий раствор. Эту процедуру повторяют до тех пор, пока не будет получено полное и равномерно распределенное покрытие на поверхности имплантата. Для лучшего распределения покрытия имплантат можно, необязательно, погружать в бак при непрерывном изменении его положения - например, при непрерывном вращении или при повороте на определенные углы. Способ погружения можно комбинировать с ротационной сушкой, описанной ниже.
Способ пипетирования или капиллярный способ:
В этом способе применяют пипетку или шприц, или любое другое устройство, способное точечно выпускать композицию, содержащую активное вещество.
Пипетка или шприц, или выпускное сопло или другое устройство, способное точечно выпускать композицию, содержащую активное вещество, наполняют указанной композицией, и его выпускное сопло направляют, предпочтительно к ближнему или дальнему концу имплантата. Выпускаемая композиция перемещается под действием капиллярных сил вдоль имплантата до достижения противоположного конца.
Способ с осаждением пара:
Этот способ включает в себя следующие стадии:
I) Предоставление вакуумной камеры,
II) Помещение имплантата или медицинских устройств в медицинскую камеру, используя держатели,
III) Заполнение полостей внутри вакуумной камеры кроющим раствором,
IV) Создания вакуума в вакуумной камере,
V) Генерирование ультразвука, по меньшей мере, в одной из полостей, содержащих кроющий раствор,
VI) Нанесение кроющего раствора, диспергированного ультразвуком, на имплантат или медицинское устройство,
VII) Продувание вакуумной камеры воздухом и удаление имплантата или медицинского устройства.
В этом способе один или более имплантатов и/или одно или более медицинских устройств помещают в вакуумную камеру, имеющую, по меньшей мере, одну полость, содержащую кроющий раствор. Эта, по меньшей мере, одна полость сконструирована так чтобы в ней можно было бы генерировать ультразвук. В этом способе нанесения покрытия создают вакуум с давлением не более 100 Па (предпочтительно, не более 10 Па и, особо предпочтительно, не более 3 Па). После этого внутри указанной, по меньшей мере, одной полости генерируют ультразвук. При этом содержащиеся в ней вещества диспергируются ультразвуком и осаждаются на объекте, предназначенном для нанесения покрытия. Те части объектов, на которые покрытие не должно наноситься, можно для защиты прикрывать легко удаляемой фольгой.
Предпочтительно, через камеру желательно пропускают небольшой поток инертного газа. Газофазное нанесение покрытия можно повторять несколько раз до получения желаемой толщины покрытия. Этот способ нанесения покрытия особенно подходит для имплантатов и медицинских устройств, имеющих пористую поверхность.
Фигуры
Фиг. 1: Образование нитрокарбоновой кислоты посредством свободно-радикальных реакций
Фиг. 2: Реакции нитрования при высоких давлениях кислорода
Фиг. 3: Образование нитрокарбоновой кислоты посредством электрофильного замещения
Фиг. 4: Нитрование алкенов, катализируемое PhSeBr
Фиг. 5: Образование сложных эфиров нитрованной карбоновой кислоты
Фиг. 6: Фибробласты внутри непокрытой сетки в 7-й, 21-й день и после 8 недель (а-с) и фибробласты в сетке, покрытой нитролинолевой кислотой, в 7-й, 21-й день и после 8 недель (d-f)
Фиг. 7: Фибробласты культуры с непокрытой сеткой (а) и с сеткой, покрытой нитроолеиновой кислотой (b) после 21 дня. Фибробласты внутри непокрытых сеток демонстрируют более выраженную дендритную форму и содержат больше актин-миозиновых волокон (внутриклеточные зеленые филаменты), чем фибробласты внутри покрытых сеток. Масштабный отрезок - 75 мкм.
Примеры
Эту группу нитрокарбоновых кислот (нитрованных жирных кислот) испытывали во всех экспериментах, если не указано иначе. В качестве контроля использовали соответствующие ненитрованные нитрокарбоновые кислоты (нативные FA; FA - обозначение жирной кислоты). Эти соединения также называют нативными жирными кислотами.
Пример 1
Исследование для определения эффекта нитрокарбоновых кислот на биологическое загрязнение и прилипание клеток к материалам протезов
Исследовали каркасные полимеры (полиуретан, поливинилхлорид, полилактат), которые применяют в качестве материалов имлантатов. Твердые и пористые пленки (с размером пор в диапазоне от 50 до 150 мкм) чистых каркасных полимеров нарезали на фрагменты (5×5 мм). После очистки с NaOH и этанолом на них погружением наносили покрытие из нативных и нитрокарбоновых кислот. Фрагменты с покрытием, нанесенным способом погружения, суспендировали в пробирке, заполненной аргоном и нагревали при 60°С в течение 24 часов в темноте. Фрагменты пленок с покрытием и без покрытия помещали в пробирку из боросиликатного стекла, в которой была возможность зафиксировать два края фрагментов пленки у стенки стеклянной пробирки, тем самым обеспечивая их вертикальное положение в центре пробирки. Пробирки на 12 часов заполняли различными растворами. Применяли следующие растворы: 0,9%-ный раствор соли; 2%-ный бычий альбумин; 2%-ный бычий альбумин с добавлением фибронектина или ламинина; и бычья сыворотка. В конце времени воздействия пробирки дважды осторожно промывали 0,9%-ным раствором соли. Одну группу пленок анализировали на абсорбцию белка, применяя способ окрашивания специфическими антителами. Идентично подготовленную группу пленок дополнительно обрабатывали для клеточных культур. В пробирки с пленками добавляли суспензию, содержавшую преинкубированные фибробласты и 1% FCS (эмбриональной телячьей сыворотки). Пробирки наклоняли и фиксировали в таком положении, чтобы пленки в суспензии были вертикально ориентированы. Пробирки помещали на качалку, обеспечивая непрерывное возвратно-поступательное движение суспензии в продольном направлении пробирок. Пробирки имели по два отверстия в верхней половине (наклоненных пробирок), чем допускался свободный обмен атмосферы над раствором с окружающей атмосферой. Отдельные группы инкубировали в стандартных условиях в течение 24, 48 и 96 часов, соответственно. После этого пленки осторожно удаляли и ополаскивали 0,9%-ным раствором соли. Наличие и форму клеток на обеих сторонах пленки оценивали после окрашивания (Гимза), используя отражающий оптический микроскоп, работающий в отраженном свете.
Результаты:
1. Все нативные пленки демонстрировали относительно однородные слои альбумина, за исключением контрольных пленок (с раствором соли). Белковые слои были более плотными, когда в растворах присутствовали фибронектин или ламинин или когда использовали сыворотку. Специфическим окрашиванием на факторы комплемента выявлено их присутствие на поверхности. Пленки, покрытые нативными жирными кислотами, демонстрировали более низкие количества альбумина, но самое низкое количество альбумина было на пленках, покрытых нитрованными жирными кислотами. Это имело место, когда пленки находились под воздействием сыворотки. Фибронектин и ламинин были плотно распределены на нативных пленках, но их количество было меньшим на пленках, покрытых нативными жирными кислотами; однако это не наблюдалось на пленках, покрытых нитрованными жирными кислотами. Кроме того, количество факторов комплемента соответствовало количеству альбумина на поверхностях.
1. В исследованиях с клетками результатом обработки нативных пленок раствором соли в течение 24 часов были лишь единичные фибробласты, прикрепленные к верхней поверхности. После 36 часов было прикреплено несколько фибробластов, а после 92 часов наблюдались уже клеточные «островки». На нижней поверхности пленок присутствие клеток было заметно только после 96 часов. Пленки, покрытые нативными жирными кислотами и обработанные раствором соли, после 24 часов демонстрировали большие локальные скопления фибробластов, которые частично сливались после 36 часов, а после 92 часов наблюдалось более или менее полное заселение нижней поверхности. На нижней поверхности насчитывалось лишь слегка меньшее количество клеток по сравнению с верхней поверхностью. Пленки, покрытые нитрованными жирными кислотами, были почти полностью покрытыми фибробластами через 24 часа, а после 36 часов они были полностью покрыты на обеих сторонах. Нативные пленки, обработанные альбумином или сывороткой, демонстрировали повышенную скорость прикрепления фибробластов: при добавлении фибронектина и ламинина - после 36 часов, без их воздействия - после 92 часов. Пленки, покрытые нативной жирной кислотой и обработанные альбумином или сывороткой, демонстрировали более высокую заселенность клетками по сравнению с пленками без покрытия. Количество клеток на пленках, покрытых нитрованными жирными кислотами, после воздействия альбумина или сыворотки было сходным с количеством клеток, наблюдавшимся на пленках, обработанных раствором соли, но слегка меньшим, чем число клеток на нативных пленках. Предварительная обработки ламинином или фибронектином повышала заселенность клетками пленок без покрытия (в меньшей степени на пленках, покрытых нативными жирными кислотами), но не пленок, покрытых нитрованными жирными кислотами. Для всех использованных нитрованных жирных кислот большая часть результатов была в одном и том же диапазоне. Относительные различия можно представить следующим образом:

Форма клеток на различных покрытиях была заметно различной. Если на нативных пленках и на пленках, покрытых нативными жирными кислотами, обработанных альбумином или сывороткой, клетки были уплощенными и имели продолговатую или полигональную (дендритную) форму, то клетки, прикрепленные к поверхностям, содержавшим нативные жирные кислоты и не подвергнутым предварительной обработке, или прикрепленные к поверхностям, покрытым нитрованными жирными кислотами, имели округлую форму лишь с единичными выступами и демонстрировали неполное прикрепление к пленкам.
2. Измеряли концентрацию TGF-β в культуральной среде. Как правило, концентрации TGF-β в экспериментах с нативными пленками и с пленками, покрытыми нативными жирными кислотами и предварительно обработанными альбумином или сывороткой, коррелировали с измеренной численностью клеток. Однако этого не было в случае исследований, проведенных с пленками, покрытыми нитрованными жирными кислотами, где определяли значительно меньшие концентрации TGF-β. В отношении формы фибробластов наблюдалось следующая закономерность: значения TGF-β были более низкими в присутствии клеток округлой формы.
Выводы: Погружное нанесение на каркасные полимеры покрытия с нитрованными жирными кислотами уменьшает адсорбцию белков внеклеточного матрикса. Прикрепление фибробластов на каркасы, покрытые нитрованными жирными кислотами, по-видимому, не зависит от адсорбции белков матрикса на искусственной поверхности. Это могло бы быть причиной более низкого продуцирования TGF-β, что свидетельствовало бы об уменьшении стимуляции продуцирования белков матрикса.
Пример 2
Исследование для оценки эффектов нитрокарбоновых кислот на адгезию, размножение и рост эндотелиальных клеток
Каркасный полистирол получали и предварительно обрабатывали так же, как в примере 1, используя те же нитрокарбоновые кислоты, что перечислены в Таблице 1. Образцы пленки помещали в культуральные чашки, содержавшие гелевую матрицу, в которой эндотелиальным клеткам пупочной вены человека (HUVEC) давали возможность расти до конфлюэнтности. Культуральная среда состояла из 5%-ной FCS, которую заменяли каждые 5 дней. Культивирование проводили согласно стандартным условиям. Пленки оценивали на 3-й, 7-й и 14-день после осторожного извлечения из культуральных чашек, ополаскивания раствором соли и окрашивания метиленовым синим. Используя оптический микроскоп, работающий в режиме отражения, пленки немедленно обследовали, оценивая размножение клеток (распространение к центру пленки), слияние клеток, образование многослойных структур и форму клеток. Размножение клеток было самым быстрым на непокрытых пленках, что приводило к почти полной конфлюэнтности на 3-й день. Размножение клеток было более медленным на пленках, покрытых нативными жирными кислотами, с достижением полной конфлюэнтности на 7-й день. На пленках, покрытых нитрованными жирными кислотами, размножение было намного более медленным, не достигая конфлюэнтности даже на 14-й день. На 3-й день на непокрытых пленках наблюдали появление многослойных формаций, которые динамично прогрессировали во времени. В отличие от этого, на пленках, покрытых нативными жирными кислотами, многослойные формации на 3-й день не наблюдались, их присутствие на внешней части наблюдали только на 7-й и 14-день. На пленках, покрытых нитрованными жирными кислотами, многослойные формации не наблюдались никогда. Форма клеток, размноженных на нативных пленках, была плоской и полигональной, тогда как на пленках, покрытых нативными жирными кислотами, она была менее полигональной.
На пленках, покрытых нитрованными жирными кислотами, клетки имели округлый внешний вид в течение всего времени наблюдения и, по-видимому, имели меньшую площадь контакта с поверхностью пленки. Для всех использованных нитрованных жирных кислот большая часть результатов была в одном и том же диапазоне. Относительные различия можно представить следующим образом:
Пример 3
Исследование для оценки эффектов нативных и нитрованных жирных кислот на механические изменения фибробластов
Для имитации эффектов хронического воздействия сил сдвига на заживляющуюся рану была установлена модель in vitro. На дно чашки Петри помещали плоский баллон. Сверху помещали силиконовый лист вплотную к боковой поверхности чашки Петри. Затем на верхнюю поверхность этого листа заливали 3-мм слой агара. На агаровые пластины помещали коммерчески доступные полипропиленовые сетки для вправления грыжи (микропористую сетку, легкую и макропористую сетку с рассасывающимися полиглактиновыми волокнами и тяжелую микропористую сетку), которые фиксировали в 4 точках на боковой поверхности чашки Петри. Эта конструкция давала возможность растягивать сетки при заполнении баллонов воздухом, что проводили с 10-секундными интервалами, используя автоматически насосное устройство. Модель можно применять для оценки эффекта сил сдвига, действующих трехмерно (3D), на рост клеток при их культивировании. В культуральные чашки добавляли преинкубированную суспензию фибробластов (1,5×105 клеток) в культуральной среде (10% FCS) и давали им возможность расти в течение 48 часов. Циклическое растягивание начинали на 3-й день. Гистологический анализ проводили из центральных частей сеток на 7-день, на 21-й день и спустя 8 недель. Каркасы отделяли от культуральных пластин и осторожно ополаскивали. Затем их разрезали на части, заливали и далее обрабатывали для стандартного гистологического и иммуногистологического анализа. Старались получать поверхность среза, которая была бы перпендикулярной к поверхностной плоскости сеток. Гистологический анализ оценивал численность клеток, содержание внеклеточного матрикса (ЕСМ) и величину белкового синтеза. Сетки были покрыты погружным способом нативными и нитрованными жирными кислотами или оставлены чистыми - так же, как в примере 1. Сетки без покрытия служили контрольными образцами.
Результаты: Число клеток, присутствующих на непокрытых сетках на 7-й день, было низким (< 25% площади); после 21-го дня оно заветно возрастало (50-75% площади). Текстуру завершенного клеточного матрикса наблюдали после 8 недель. Сетки, покрытые нативными жирными кислотами, демонстрировали более высокую численность клеток, чем наблюдалось в контрольных сетках, причем на 7-й день клетки были расположены преимущественно вдоль волокон (25-50% площади. Численность клеток увеличивалась к 21-му дню (50-75% площади) и была полной после 8 недель. В экспериментах с сетками, покрытыми нитрованным жирным кислотами, численность клеток была сходной с численностью, наблюдавшейся в экспериментах с нативными жирными кислотами; однако на 7-й день наблюдали более частое связывание фибробластов с волокнами сеток. К 21-му дню и после 8 недель численность клеток была меньшей по сравнению с нативными жирными кислотами (75-100%). Внешняя форма клеток была заметно разной. В экспериментах с непокрытыми сетками фибробласты имели дендритную форму с ламеллярными отростками в течение всего периода исследования, тогда как форма фибробластов в покрытых сетках была более округлой, что было более выражено в сетках, покрытых нитрованными жирными кислотами. Во время исследования они постепенно приобретали веретенообразный внешний вид. Меньшее число контактов между фибробластами наблюдали в сетках, покрытых нитрованными жирными кислотами по сравнению с сетками, покрытыми нативными жирными кислотами или совсем без покрытия.
Результаты подсчета актин-миозиновых филаментов можно резюмировать следующим образом: На 7-й день экспрессия актин-миозиновых филаментов в фибробластах была одинаковой во всех образцах. Плотность актин-миозиновых филаментов увеличивалась вплоть до конца исследования в фибробластах, находившихся в непокрытых сетках и в сетках, покрытых нативными жирными кислотами. Однако фибробласты в сетках, покрытых нитрованными жирными кислотами, имели более низкую плотность актин-миозиновых филаментов, чем филаменты в непокрытых сетках, и происходило лишь небольшое увеличение плотности актин-миозиновых филаментов между 21-м днем и окончанием исследования (Фиг. 7). Количественный анализ белкового синтеза выявил увеличение белкового синтеза в фибробластах, находившихся в непокрытых сетках в течение всего периода наблюдения. Эти данные были параллельными (но на более низком уровне) с результатами анализа фибробластов в сетках, покрытых нативными жирными кислотами. Белковый синтез в фибробластах, находившихся в сетках, покрытых нитрованными жирными кислотами, был более низким, чем в сетках, покрытых нативными жирными кислотами, и значительно более низким, чем в непокрытых сетках.

Выводы: В модели хронического напряжения сдвига покрытие полимерных сеток жирными кислотами уменьшает пролиферацию фибробластов и продуцирование белков внеклеточного матрикса. Однако в сетках, покрытых нитрованными жирными кислотами, пролиферация клеток и продуцирование матрикса было еще более пониженным, а число клеток, которые, по-видимому, были в фазе покоя, после 8 недель было более высоким по сравнению с непокрытыми сетками или сетками, покрытыми нативными жирными кислотами.
Пример 4
Исследование для оценки реакции на токсины у клеток, инкубированных с нитрокарбоновыми кислотами
Для определения мембраностабилизирующих и антицитотоксических свойств нитрованных жирных кислот была выбрана модель in vitro, использующая клетки кожной мастоцитомы собаки. Клетки культивировали согласно стандартной процедуре. Цитотоксические эффекты количественно анализировали, измеряя не только приток Ca2+ и высвобождение гистамина и TNFα, но и используя МТТ-тест. Суспензии клеток инкубировали с 0,9% раствором соли, с одной из нитрокарбоновых кислот, перечисленных в Таблице 1, или с соответствующей нативной жирной кислотой, при конечной концентрации 10 и 100 мкмоль, которые добавляли в среду за 15 мин до добавления токсина.
Мастопаран, суспендированный в буферном растворе, добавляли к преинкубированной суспензии тучных клеток до конечной концентрации 10 или 30 мкмоль, соответственно. Измерения проводили после инкубации в течение 1 часа. Мастопаран вызывал дозозависимый приток Ca2+, высвобождение гистамина и индукцию апоптоза после преинкубации с раствором соли и нативными жирными кислотами. Преинкубация тучных клеток с нитрованными жирными кислотами ослабляла указанное влияние на приток Ca2+, высвобождение гистамина и индукцию апоптоза с почти полным отсутствием апоптоза при концентрации 100 мкмоль.
Стрептолизин О добавляли к преинкубированным суспензиям до конечной концентрации 500 нг/мл. Измерения проводили спустя 2 часа. Измеряли высвобождение гистамина и TNFα в указанных суспензиях. После преинкубации с раствором соли наблюдали значительное высвобождение гистамина и TNFα. Преинкубация с нативными жирными кислотами при высокой концентрации (100 мкмоль) незначительно уменьшала высвобождение обоих этих веществ. Результатом преинкубации с нитрованными жирными кислотами было дозозависимое уменьшение высвобождения гистамина, которое было значительно более низким при высоких концентрациях (100 мкмоль).
Клеточные пластины подвергали воздействию единичной дозы (250 мДж/см2) ультрафиолетового излучения спектра В, используя лампу (Saalmann, Herford, Germany), испускающую большую часть своей энергии в диапазоне ультрафиолета спектра В (от 295 до 315 нм). Уровни триптазы в супернатантах определяли спустя 30 минут, а концентрации TNFα - спустя 60 минут. После преинкубации с раствором соли происходило заметное повышение уровня триптазы. Преинкубация с нативными жирными кислотами приводила к дозозависимому уменьшению высвобождения триптазы, что было значительным при более низкой дозе облучения, но не после воздействия высокой дозы облучения. В отличие от этого, результатом преинкубации с нитрованными жирными кислотами при обеих концентрациях было значительное уменьшение высвобождения триптазы по сравнению с раствором соли при более низкой дозе облучения и значительное уменьшение высвобождения триптазы после преинкубации с высокой концентрацией нитрованных жирных кислот, когда клетки подвергали воздействию высокой дозы облучения. Концентрации TNFα значительно увеличивались в образцах, предварительно обработанных раствором соли. После преинкубации с нативными и нитрованными жирными кислотами было найдено уменьшение роста уровня TNFα, параллельное уменьшению, найденному при измерениях триптазы, причем после преинкубации с нитрованными жирными кислотами оно было значительно более низким, чем с нативными жирными кислотами, когда клетки подвергали воздействию высокой дозы облучения. Для всех использованных нитрованных жирных кислот большая часть результатов была в одном и том же диапазоне. Относительные различия можно представить следующим образом:

Выводы: Преинкубация тучных клеток с нитрованными жирными кислотами уменьшает дестабилизацию мембран, вызываемую токсинами. Поскольку известно, что дегрануляция тучных клеток, вызываемая мастопараном, опосредуется мембранными белками, можно предполагать, что нитрованные жирные кислоты действуют как модификаторы трансмембранной передачи сигнала посредством изменения физических свойств мембран. Этот вывод подтверждают результаты, полученные со стрептолизином О, который оказывает свои токсические эффекты, взаимодействуя с мембранным холестерином. Это взаимодействие, вероятно, ингибируется нитрованными жирными кислотами. То же самое, по-видимому, является причиной ослабления цитотоксических эффектов, вызываемых энергией облучения. Таким образом, полученные результаты означают, что преинкубация с нитрованными жирными кислотами ослабляет действие токсинов, уменьшая проницаемость мембран и влияя на пути мембранной передачи сигналов.
Пример 5
Исследование для оценки влияния нативных и нитрованных жирных кислот на передачу сигналов у рецепторов семейства белков TRP
Для определения влияния нитрованных жирных кислот на рецепторную передачу сигналов использовали модель in vitro. Срезы сетчатки, взятые у трупов мышей, получали как описано в публикации Snellman and Nawy (Snellman J, Nawy S (2004). cGMP-dependent kinase regulates response sensitivity of the mouse on bipolar cell. J Neurosci 24: 6621-6628). Целую сетчатку выделяли и нарезали на 100-мкм срезы с помощью тканевого микротома, которые затем переносили в регистрационную камеру. Эту камеру непрерывно перфузировали средой Эймса и продували кислородом. Добавляли пикротоксин (100 мкМ), стрихнин (10 мкМ) и TPMPA (50 мкМ). Каждую нитрованную жирную кислоту добавляли в двух экспериментах до конечной концентрации 10 мкмоль и в еще одной паре экспериментов до конечной концентрации 50 мкмоль. В двух экспериментах соответствующую нативную жирную кислоту добавляли до конечной концентрации 10 и 50 мкмоль и в двух экспериментах, которые служили в качестве контрольных, добавляли раствор соли. В течение всего исследования мониторировали ток, измеряемый тканевыми электродами. После инкубации раствора в течение 2 часов добавляли капсаицин (агонист TRPV-1) до конечной концентрации 10 мкмоль. Эксперименты проводили, используя либо 10 мМ Hepes, либо 10 мМ Mes, доводя рН раствора до 6,4 или 4,4, соответственно. Кроме того, эксперименты проводили с преинкубацией (5 минут) с капсазеипином (агонистом TRPV-1) или без нее. Температуру раствора поддерживали постоянной при 35°С.
Как уменьшение рН, так и применение капсаицина, индуцировало ток в образцах, преинкубированных в растворе соли. Преинкубация с капсазепином ингибировала эффект капсаицина. Преинкубация с низкой концентрацией нативной кислоты не оказывала эффекта на реакцию тока, вызванную капсаицином и повышением кислотности; однако преинкубация с высокой концентрацией уменьшала ток, индуцированный капсаицином, но не ток, индуцированный кислой средой. Преинкубация с низкой концентрацией нитрованных жирных кислот оказывала умеренное действие на реакцию тока, вызванную капсаицином. Однако преинкубация с высокой концентрацией нитрованных жирных кислот почти полностью ингибировала реакцию тока на капсаицин и приводила к уменьшению реакции тока на повышение кислотности (60% по сравнению с раствором соли).
Выводы: Рецепторы TRPV служат в качестве ноцицепторов в периферической нервной системе с преобладанием подтипа TRPV-1. Его стимуляция приводит к ощущению боли. Нитрованные жирные кислоты уменьшают потенциал агониста на рецепторном уровне - вероятно, посредством ингибирования мембранной передачи сигнала, опосредуемой мембранными белками.

Пример 6
Исследование для оценки влияния нативных и нитрованных жирных кислот на цитотоксичность, опосредуемую мембранными белками в эпителиальных клетках
Эпителиальные клетки легкого человека (А549) культивировали и переносили в изотоническую среду. Суспензию клеток инкубировали в растворе соли, нативной жирной кислоты (10 и 50 мкмоль) или нитрованной жирной кислоты (10 и 50 мкмоль) в течение 2 часов. Добавляли фторид натрия (NaF) до конечной концентрации 1-8 ммоль. Клетки отделяли и промывали после воздействия в течение 24 часов. Для определения скоростей апоптоза использовали МТТ-тест. В контрольной группе NaF индуцировал апоптоз дозозависимым образом. Инкубация с низкой концентрацией нативных жирных кислот не влияла на апоптоз, однако высокая концентрация нативных жирных кислот умеренно замедляла его. Инкубация с низкой концентрацией нитрованных жирных кислот замедляла апоптоз в такой же степени, как и инкубация с высокой концентрацией нативных жирных кислот; однако преинкубация с высокой концентрацией нитрованных жирных кислот почти полностью предотвращала апоптоз.
Выводы: Было продемонстрировано, что в линиях эпителиальных клеток легкого человека апоптоз, индуцируемый NaF, связан с мембранными белками. Поэтому уменьшение цитотоксичности NaF, наблюдаемое при инкубации клеток с нитрованной жирной кислотой, по-видимому, следует приписать модифицированию передачи сигналов трансмембранных белков, индуцируемому изменением текучести мембраны, вызванным нитрованными жирными кислотами.

Пример 7
Исследование для оценки влияния нитрокарбоновых кислот на адгезию сывороточных белков и активацию монобластов, индуцируемую материалом имплантата
Для определения эффекта, вызванного покрытием материалов имплантатов нитрованными жирными кислотами и состоящего в уменьшении адсорбции молекул адгезии и в активации моноцитов, стерильные силиконовые листы разрезали на небольшие фрагменты и способом погружения покрывали нитрокарбоновыми кислотами или соответствующими нативными жирными кислотами. Для каждой жирной кислоты две группы силиконовых фрагментов инкубировали в свежей сыворотке человека в течение 1 часа при 37°С; две другие группы инкубировали в растворах соли. Одну группу покрытых и непокрытых фрагментов немедленно анализировали на наличие белков адгезии, а другую группу силиконовых фрагментов после ополаскивания помещали в 96-луночные планшеты. В каждую лунку добавляли мононуклеарные клетки периферической крови человека (PBMCs), полученные от трех здоровых субъектов. Лунки инкубировали в течение 3 дней в стандартных условиях. В супернатантах культуральных сред определяли уровни lL-1β, lL-6, lL-8 и хемоаттрактантного белка 1 (MCP-1) в начале и в конце экспериментов.
Перед определением адсорбции белков на силиконовых фрагментах их на 5 минут погружали в раствор соли. После этого одну сторону ополаскивали раствором соли, как это проводилось для обеих сторон в группе, использованной для культивирования. Имела место заметная адсорбция фибриногена и якорного комплекса моноцитов C5b-9 на непокрытом силиконе. Покрытие соответствующей жирной кислотой, не подвергнутой нитрованию, имело результатом слабое уменьшение количества детектируемого белка, тогда как покрытие нитрованными жирными кислотами почти полностью устраняло адсорбцию белков. Никакие белки не были найдены на поверхности ополоснутых образцов, покрытых нитрованными жирными кислотами, что, таким образом, указывало на слабую адгезивность в отношении сывороточных белков.
Результаты: Результатом обработки непокрытых образцов сывороткой было существенное увеличение уровней IL-8 и MCP-1 и заметное увеличение уровней IL1-бета и IL-6, секретируемых культивируемыми клетками PBMC. Покрытие силиконовых листов нативной жирной кислотой имело результатом умеренное уменьшение продуцирования цитокинов в образцах, не подвергнутых кондиционированию сывороткой. Заметное снижение уровней IL-1β, IL и MCP-1 было найдено в образцах, кондиционированых с сывороткой, по сравнению с непокрытыми образцами; однако уровень IL-8 был понижен лишь слегка. В отличие от этого, цитокины не были детектированы в образцах, покрытых нитрованными жирными кислотами, предварительно кондиционированных раствором соли, а в образцах, инкубированных с сывороткой, они были найдены на нижнем пороге детектирования (однако IL-8 совсем не был детектирован).
Выводы: Силикон, как и другие материалы, применяемые для имплантатов, быстро адсорбирует сывороточные белки - например, фибриноген и белки комплемента, причем последний образует якорный комплекс моноцитов C5b-9. Адсорбция сывороточных белков приводит к заметному высвобождению цитокинов, производимых моноцитами. Если нативные жирные кислоты оказывали лишь небольшой эффект на адсорбцию белков и последующее высвобождение цитокинов, их нитрованные производные приводили к заметному уменьшению адсорбции белков и облегчали удаление моноцитарного якорного комплекса C5b-9. Низкой адгезией белков объясняется отсутствие значительной активации моноцитов и продуцирования цитокинов.
Пример 8
Исследование для оценки влияния нитрокарбоновых кислот на адгезию и пролиферацию моноцитов и фибробластов на хирургическом шовном материале
Для определения иммунных реакций на инородный материал и их последствий для фиброгенеза использовали совместные культуры фибробластов и моноцитов. Коммерчески доступные шовные материалы (пропилен, полиамид и шелк) способом глубокого погружения покрывали соответствующими нативными и нитрованными жирными кислотами. Необработанный шовный материал служил контролем. Обработанные и необработанные шовные материалы разрежали на мелкие фрагменты и помещали в 96-луночные планшеты.
Мышиные макрофагоподобные клетки RAW 264.7 и мышиные фибробласты L929 культивировали до плотности популяции 5×105 для каждой культуры. Суспензии клеток объединяли при численности, равной примерно 2,5×105 клеток в 1 мл, для каждой клеточной популяции, которую добавляли в лунки. Образцы шовного материала были полностью покрыты суспензией. Лунки непрерывно и осторожно покачивали в течение инкубационного периода.
Спустя 24 и 48 часов собирали супернатанты, которые анализировали на профиброзные цитокины IL-13, IL-4 и IL-6, TGF-β1, коллаген-1.
Результаты: В непокрытых шовных материалах было заметное увеличение всех цитокинов и коллагена-1. В супернатантах шовных материалов, покрытых нативной жирной кислотой, после 24 часов инкубации было найдено значительное уменьшение IL-13 и TGF-β1 по сравнению с непокрытым шовным материалом, которое после 48 часов больше не было достоверным. Содержание других цитокинов и коллагена было более низким по сравнению со значениями, найденными для непокрытого шовного материала. В супернатантах образцов, покрытых нитрованными жирными кислотами, содержание цитокинов и коллагена было значительно более низким по сравнению со значениями, полученными для шовных материалов, покрытых нативными жирными кислотами.
Выводы: Традиционный хирургический шовный материал, подвергнутый воздействию культивируемых моноцитов, вызывает быстрое увеличение продуцирования цитокинов, которые стимулируют фиброгенез. Соответственно, совместно культивируемые фибробласты быстро реагируют продуцированием компонентов внеклеточного матрикса. Продуцирование цитокинов можно уменьшить, покрывая шовный материал нативной жирной кислотой; значительное снижение продуцирования цитокинов имеет место, когда для покрытия материала применяют нитрованные жирные кислоты.
Пример 9
Исследование эффективности нитрокарбоновых кислот в модели индукции фиброза
Повреждение роговицы может в итоге приводить к образованию шрама, образующемуся по механизму фиброза роговицы, который характеризуется присутствием миофибробластов и аномальным отложением компонентов внеклеточного матрикса (ЕСМ). Для исследования реакции заживления на травму стромы роговицы применяли in vitro общепризнанную модель. Трехмерную (3D) модель стромы роговицы in vitro создавали с фибробластами роговицы человека, стимулированными стабильным витамином С, которые имитировали развитие роговицы. В течение 7 дней в среду добавляли TGF-β1. По сравнению с контрольной группой 3D-размер клеток значительно увеличивался, клетки становились длинными и плоскими, были видны многочисленные филаментозные клетки, уровень коллагена поднимался, и были видны коллагеновые волокна - такие как волокна, присутствующие при фиброзе роговицы. Добавление нитрованных жирных кислот в среду с TGF-β1 при экспозиции в течении 10, 30 и 60 минут значительно подавляло фиброз по сравнению с 0,9%-ным раствором соли и с соответствующими нативными жирными кислотами, добавленными в аналогичных концентрациях. Обработки нитрованными жирными кислотами не сопровождались никакими морфологическими изменениями миофибробластов. Отложение ЕСМ происходило параллельно с развитием фиброза, и значительно уменьшалось в присутствии нитрованных жирных кислот по сравнению с контрольными группами.

Пример 10
Исследование эффективности 6-нитро-цис-6-октадеценовой кислоты (нитропетроселиновой кислоты) и 11-нитро-цис-5,8,11,14-эйкозатетраеновой кислоты (нитроарахидоновой кислоты) в модели инородного тела
Организмы реагируют на контакт с неполностью биосовместимой поверхностью стереотипной цепью реакций. Ей предшествует агрегация белков плазмы, которые инициируют адгезию моноцитов. В ответ на несовместимость происходят структурные изменения и слияние указанных моноцитов с образованием гигантских клеток. Образование гигантских клеток представляет собой ключевой компонент развития реакции на инородное тело. Было найдено, что интерлейкин-4 (IL-4), произведенный активированными макрофагами, является важным для образования гигантских клеток. Предсказуемость реакции на инородное тело оценивали в модели in vitro, мониторируя слияние макрофагов в ответ на воздействие IL-4. С использованием этой модели полимерное покрытие материала подложки, изготовленной из нержавеющей стали, содержавшее переменные количества нитрованных жирных кислот или нативных жирных кислот, или покрытия, состоявшие лишь из одного полимера, подвергали воздействию плазмы с различными концентрациями витронектина. По сравнению с покрытиями одним полимером, слияние макрофагов полностью ингибировалось применявшимися концентрациями нитрованных жирных кислот, тогда как жирные кислоты, не подвергнутые нитрованию, показывали лишь небольшое ингибирование. Соответственно, концентрации IL-4, измеренные в супернатанте культуральных сред клеточных культур, подвергнутых воздействию нитрованных жирных кислот, росли незначительно, тогда как в культурах с одним полимером или с покрытием нативной жирной кислотой наблюдали значительный рост.
Эти результаты указывают, что реакция на инородное тело при воздействии искусственного материала, покрытого полимерной поверхностью, содержащей нитрованные жирные кислоты, была значительно ослабленной.
Пример 11
Исследование эффективности нитрованных жирных кислот при подавлении образования внеклеточного матрикса, индуцируемого TGF-β1 в кардиомиоцитах
Характерными особенностями фиброзного ремоделирования в сердце являются усиленная экспрессия и отложение белков внеклеточного матрикса (ЕСМ). Это объясняют увеличенными механическими силами, обусловленными аутокринным высвобождением β-формы трансформирующего фактора роста (TGF-бета). Было показано, что в изолированных отдельных кардиомиоцитах стимуляция фактором TGF-β имеет результатом отложение белков внеклеточного матрикса, что позволяет предположить, что кардиомиоциты представляют собой первичный источник фиброзных изменений, наблюдаемых при гипертрофии желудочка. Для исследования влияния напряжения сдвига на кардиомиоциты использовали общепринятую модельную клеточную культуру. Кардиомиоциты культивировали и переносили на матригелевый субстрат. Пластины с конфлюэнтным слоем клеток помещали в устройство, моделирующее повреждение, вызванное усилием сдвига (SFID). Конструкция SFID основана на конструкции типа конус-плита, которая является хорошо определенной реологической моделью, в которой над поверхностью клеток вращающимся конусом создается однородно распределенный ламинарный поток. Коническую поверхность помещают над стационарной плоской пластиной и, вращая конус, выравнивающий уровень сдвигового напряжения жидкости, приводят в движение жидкую среду, находящуюся между этими двумя поверхностями.
Пиковое напряжение сдвига 100 дин/см2 можно прилагать без значительного открепления клеток, достигая максимальной тяжести повреждения на уровне 46%. Клетки подвергали воздействию 1%-ной FCS без нитрованной жирной кислоты и соответствующей нативной жирной кислоты или при их присутствии в дозе от 10 мкмоль до 100 мкмоль, за 10 секунд до приложения силы сдвига. Пики силы сдвига до 100 дин/см2, каждый продолжительностью 30 мсек, с частотой повторения 60 раз в минуту прилагали в течение 5, 10, 30 и 60 минут. После этого клеточные пластины промывали и помещали в 1%-ную FCS на 24 часа. Анализировали супернатант, полученный при исследовании силы сдвига, а также при последующей фазе культивирования. Можно было показать, что в контрольных группах уровни TGF-β и белков ЕСМ (коллагена I, фибронектина, ламинина, эластина) после обработки повышались. Нитрованные жирные кислоты значительно уменьшали концентрацию/количество TGF-β и белков ЕСМ дозозависимым образом с максимальным подавлением, достигнутым при концентрации 50 мкмль/л.

Пример 12
Биосовместимое покрытие солевого грудного имплантата нитроолеиновой кислотой при добавлении катализатора и синтетического полимера, в частности поливинилпирролидона
Нераскрытые стенты из поли(тетрафторэтилена) освобождали от жира, обрабатывая их в течение 15 минут ацетоном и этанолом в ультразвуковой бане, и сушили при 40°С в сушильном шкафу. После этого грудной имплантат в течение ночи промывали деминерализованной водой. Примерно 10 мг KMnO4 растворяли в 500 мкл воды и добавляли максимально возможное количество PVP. Смесь ламинарно разливали по полипропиленовой подложке и давали высохнуть при комнатной температуре в течение ночи. 2,5 мг этой хрупкой смеси растворяли в 1 мл хлороформа и раствор, полученный в результате этого, после добавления 10,5 мкл нитроолеиновой кислоты аэрозольно наносили пистолетным пульверизатором (EVOLUTION от Harder & Steenbeck) с расстояния 6 см на вращающийся 18-мм стент из нержавеющей стали LVM. После этого покрытый грудной имплантат в течение 24 ч выдерживали при 40°С.
Пример 13
Полное покрытие сетки нитролинолевой кислотой способом пипетирования
Сетку развертывали в горизонтальном положении и таким образом закрепляли на поворотной оси. Таким образом постепенно вдоль продольной оси последовательными рядами наносили нитролинолевую кислоту, растворенную в этаноле, с помощью тефлоновой канюли, надетой на конец шприца, до тех пор пока не наблюдался непрерывный слой нитролинолевой кислоты. Затем сетку сушили.
Предпочтительно, к раствору агента добавляют адъювант, который облегчает проникновение агента в клетки. Например, смешивают 150 мг нитролинолевой кислоты, 4,5 мл ацетона, 100 мкл иодопромида и 450 мкл этанола.
Пример 14
Полное покрытие силиконового грудного имплантата нитроарахидоновой кислотой посредством конденсации пара
Силиконовый грудной имплантат помещали на платформу в вакуумной камере. Раствором нитроарахидоновой кислоты в диметиловом простом эфире заполняли емкость внутри вакуумной камеры. Внутри вакуумной камеры создавали вакуум 3 Па. На полость, содержащую раствор покрытия, воздействовали ультразвуком (10 МГц, давление 12 МПа, 5 мин.). Затем диспергированный таким образом кроющий раствор вводили в вакуумную камеру для конденсации на поверхности имплантата. Процедуру повторяли шесть раз.
Пример 15
Исследование для определения влияния покрытия поверхностей нитрокарбоновыми кислотами на фиброгенез в модели с имплантацией мягкого имплантата, применяемой in vivo
Подготовка силиконовых имплантатов:
Использовали силиконовые минипротезы типа мешка с гелем (POLYTECH Health & Aesthetics GmbH, Dieburg, Germany), имеющие диаметр 2 см и объем приблизительно 2 мл. Материалы и конструкция были сравнимыми с обычными грудными имплантатами, они состояли из силиконовой резиновой оболочки, содержавшей в качестве наполнителя вязкий силиконовый гель. Модели имплантатов, использованные в экспериментах, имели два небольших ушка, за которые можно подвешивать имплантаты при проведении процедур нанесения покрытия.
Каждый имплантат обрабатывали следующим образом: сначала очищали, обрабатывая ультразвуком в течение 2 мин последовательно в каждом из следующих растворителей: в ацетоне, толуоле, еще раз в ацетоне, в этаноле и в воде. Имплантаты в течение 60 мин обрабатывали раствором Пиранья (Piranha) и ополаскивали деионизированной водой. Затем их на 45 мин погружали в 20%-ный водный раствор фторида аммония для получения поверхности Si, пассивированной водородом. Раствор фторида аммония в течение 15 мин продували азотом для удаления растворенного кислорода. Подготовленные имплантаты переносили в стеклянную камеру, наполненную инертной атмосферой, где их подвешивали, так чтобы никакая часть их поверхности не контактировали с контейнером. Контейнер наполняли раствором 1-гексадецена и нагревали при 150°С при давлении 2 торр в течение 120 мин. Подготовленные имплантаты очищали последовательно в ацетоне, этаноле и воде. Образование самоорганизующегося монослоя контролировали, измеряя гидрофобность поверхности; угол смачивания составлял примерно 105°. Затем сухие имплантаты, подвешенные в контейнере, на 120 мин погружали в ванну с этанольным раствором олеиновой кислоты или нитроолеиновой кислоты при температуре 40°. После этого раствору давали возможность медленно вытекать через выпускное отверстие в дне контейнера. Опорожненный контейнер заполняли инертным газом, в котором образцы выдерживали в течение 24 часов. Затем образцы три раза промывали в ванне с этанольным раствором, после чего ополаскивали стерильной водой. После сушки контейнер с подготовленным имплантатом стерилизовали с использованием этиленоксида и хранили при -20°С.
Для испытаний in vivo 24 непокрытых и 24 покрытых имплантата были исследованы в 24 самках крыс Sprague-Dawley (190-230 г). У анестезированных животных посредством тупого отделения, производя парные околопозвоночные разрезы, делали двусторонние спинные подкожные карманы. Каждому животному на противоположные стороны вводили один покрытый имплантат и один контрольный имплантат, меняя эти стороны у последующих животных. Животных содержали и кормили соответственно институциональным стандартам в течение 120 дней. Животных усыпляли хлороформом. Имплантаты и сцепленную с ними ткань извлекали резекцией единым блоком. В имплантаты вводили канюли и жидкий силиконовый гель заменяли парафином. После этого весь блок ткани стандартным образом подготавливали для гистологического анализа и окрашивали красителями H&E или Masson's trichrome.
Результаты: В непокрытых имплантатах у всех животных наблюдали заметную фиброзную капсулу. Покрытие нативными жирными кислотами уменьшало толщину фиброзной капсулы в различной степени. Однако в имплантатах, покрытых нитрованной жирной кислотой, фиброзная капсула отсутствовала. Имелись лишь небольшие участки соединительной ткани; поэтому количество внеклеточного матрикса было значительно меньшим, чем у непокрытых силиконовых имплантатов или у имплантатов, покрытых нативной жирной кислотой. Кроме того, образование инородного тела не наблюдалось после покрытия нитрованной жирной кислотой, но было найдено после покрытия нативной жирной кислотой и в непокрытых имплантатах.

Пример 16
Исследование для оценки эффектов нитрокарбоновых кислот на повреждение, индуцированное холодом, в модели целой ткани ex vivo
Для определения возможности применения нитрованных жирных кислот для предохранения клеток и тканей от холодовых или криоповреждений, применяли in vitro модель с использованием эпикарда мыши. Экспериментальная процедура должна уменьшить до минимума возможность ишемического или реперфузионного повреждения, но в то же время она должна давать возможность отличать смерть клеток, индуцированную вкладом ишемии или реперфузионного повреждения, которая, как известно, происходит почти исключительно посредством апоптоза, тогда как клеточная смерть, индуцированная повреждением холодом, почти всегда является результатом некроза.
У 24 анестезированных крыс Wistar (180-270 г) обоего пола осторожно вырезали околосердечную сумку. Старались захватить перикард пинцетом только за края разреза и уменьшить травматизацию центральных частей перикарда до минимума. После резекции края разреза и прежний участок апекса перикарда разрезали, получая плоские полосы ткани, которые немедленно помещали в культуральную среду (DMEM), содержавшую 10% FCS и антибиотики (пенициллин, стрептомицин). Образцы ткани культивировали в кислородной атмосфере при 18°С в течение 2 дней. После этого температуру культуры постепенно повышали до 37°С в течение 5 дней. Затем полосы перикарда разрезали на 4 фрагмента одинакового размера. Один фрагмент, служивший контролем, культивировали далее без циклов охлаждения. В каждом из трех исследований, один фрагмент при температуре 18°С на 10 мин погружали в раствор (0,9% соли и 1% SDS), содержавший 200 мкмоль нитрованной жирной кислоты или 200 мкмоль соответствующей нативной жирной кислоты. При таких же условиях один фрагмент перикарда погружали в раствор без жирных кислот. Все образцы охлаждали, непрерывно понижая температуру со скоростью 3°С/мин от температуры окружающей среды до минимальной температуры -15°С. Спустя 1 час образцы повторно нагревали со скоростью 3°С/мин, непрерывно повышая температуру до достижения 18°С. После этого повторяли идентичный цикл охлаждения и нагревания. После второго цикла охлаждения фрагменты ткани дополнительно культивировали в культуральной среде в течение 1 дня, давая возможность непрерывно адаптироваться к температуре окружающей среды, составлявшей 37°С. Для получения аналитических препаратов фрагменты перикарда разрезали и обрабатывали далее. Для количественного анализа апоптоза использовали прямой тест TUNEL (Roche), для подсчета числа некротических клеток применяли тест с исключением аннексина V/йодида пропидия (Roche), жизнеспособность определяли тестом WST-8. Кроме того, в супернатантах количественно анализировали высвобождение LDH.
Результаты: В контрольных образах, не подвергнутых воздействию холодом, было лишь небольшое высвобождение LDH в супернатант. Соответственно, были найдено, что только изолированные клетки являются отрицательными по йодиду пропидия/положительными по аннексину и положительными в тесте TUNEL, что указывало на развитие апоптоза; было найдено, что сходное число клеток является положительным по йодиду пропидия/аннексину и TUNEL-отрицательным, что указывало на развитие некроза клеток. Тест МТТ показал высокую жизнеспособность клеток образцов. В отличие от этого, необработанные образцы, подвергнутые воздействию холодом, демонстрировали очень сильное увеличение LDH, а жизнеспособность была понижена до менее 40% жизнеспособности контрольных образцов в тесте МТТ. Клетки, отрицательные по йодиду пропидия/положительные по аннексину и TUNEL-положительные, находили лишь эпизодически (<5%); однако это лишь слегка превышало уровень контрольных образцов. Была найдена высокая доля (45-60%) клеток, положительных по йодиду пропидия/аннексину и TUNEL-отрицательных, что указывало на большое число клеток, претерпевавших преимущественно некроз. В образцах, подвергнутых воздействию нативных жирных кислот, высвобождение LDH было незначительно меньшим, чем в необработанных образцах. Кроме того, по данным МТТ-теста, жизнеспособность клеток была понижена в такой же степени, как и в необработанных образцах. Сравнимое соотношение числа клеток, претерпевавших апоптоз или некроз, и их степени наблюдали в тесте TUNNEL и при мечении йодидом пропидия/аннексином. Однако в образцах, инкубированных с каждой из нитрованных жирных кислот, было лишь небольшое увеличение LDH, что соответствовало высокой жизнеспособности, которая составляла примерно 90% жизнеспособности контрольных образцов. Число клеток, претерпевавших апоптоз, было лишь слегка более низким, чем после предварительной обработки нативными жирными кислотами. Однако в образцах, инкубированных с нитрованными жирными кислотами, число клеток, претерпевавших некроз, было значительно более низким (15-20%), чем в образцах, инкубированных с нативными жирными кислотами.

Выводы: Эксперименты показали, что при регулируемых условиях культивирования можно культивировать перикард без существенной потери жизнеспособных клеток. Было обнаружено повреждение клеток, индуцированное холодом, классифицированное как повреждение, индуцирующее преимущественно некроз, что соответствует другим научным сообщениям. Это указывает на то, что эффекты, разрушительные для клеточных мембран, которые происходят при кристаллизации и декристаллизации, соответственно, как сообщают в литературе, индуцируют некроз и только в незначительной степени апоптоз. Почти полное отсутствие апоптозных клеток указывает на то, что данная экспериментальная процедура предотвращала развитие ишемического и реперфузионного повреждения. Нативные жирные кислоты не оказывали существенного влияния на развитие повреждений, индуцированных холодом. С другой стороны, в модели интактного тела было доказано, что нитрованные жирные кислоты способны в большой степени предотвращать повреждение клеток, индуцированное холодом. Поэтому нитрованные жирные кислоты полезны для уменьшения повреждения клеток при консервации холодом.
Для того, чтобы исключить возможность ишемической или реперфузионной (реоксигенационной) индукции клеточной смерти в одной серии экспериментов контрольный образец инкубировали с ингибитором всех каспаз (Q-VD-OPH, BioVision, USA), растворенном в DMSO, перед тем, как образец подвергали воздействию холода. Доля клеток, претерпевавших апоптоз, была в диапазоне, наблюдавшемся у контрольных образцов, подвергнутых воздействию холода, что указывает на то, что при выбранной экспериментальной процедуре почти не было ишемических/реперфузионных повреждений.
Пример 17
Исследование для оценки влияния нитрокарбоновых кислот на реакцию на эндогенные стимуляторы, заключавшуюся в продуцировании внеклеточного матрикса в фибробластах кожи
Для того, чтобы определить, играет ли роль стимуляции PPAR-гамма нитрованными жирными кислотами в ингибировании агрессивной реакции заживления на раздражающий стимул согласно настоящему изобретению, проведено исследование фибробластов кожи человека. Посредством сайт-специфического мутагенеза, основанного на полимеразной цепной реакции, создавали клеточный клон с доминантно-негативным мутантом PPAR-гамма (L466A). Присутствие или отсутствие PPAR-гамма определяли, используя реакцию с антителами PPAR-гамма, которую прослеживали с системой детектирования увеличения хемолюминисценции. Кроме того, одну серию клеток инкубировали с избирательным необратимым лигандом PPAR-гамма (GW9662, 1 мкмоль), который эффективно блокирует рецепторы PPAR-гамма.
Последующее культивирование фибробластов кожи человека проводили в среде ЕМЕМ, содержавшей 5 мМ глюкозы с добавлением 10% FCS в стандартных условиях культивирования. Клеткам давали возможность расти до кунфлюэнтности в 96-луночном планшете. Фибробласты дикого типа и фибробласты, дефицитные по PPAR-гамма, исследовали в группах из 2×10 образцов, включавших в себя: (1) бланк-контроль; (2) контроль со стимуляцией; (3) преинкубация с антагонистом PPAR-гамма GW9662 (Cayman Chemical); (4) преинкубация с агонистом PPAR-гамма троглитазоном (25 мкмоль). В группы из 2×4 образцов в среду добавляли жирные кислоты до конечной концентрации 10 и 50 мкмоль, соответственно; в другие группы из 2×4 образцов в среду добавляли нитрованные жирные кислоты в той же концентрации, а группы из 2×2 образцов служили контролем. В культуральную среду десяти проб добавляли TGF-β2 в концентрации 25 нг/мл. Культивирование продолжали в течение 48 часов и затем пробы обрабатывали для анализа коллагена-1, измеряемого посредством детектирования повышенной хемолюминисценции иммунного комплекса.
Результаты: В бланк-контролях концентрация коллагена-1 была низкой, лишь незначительно раличной у PPAR-гамма-позитивных и PPAR-гамма-негативных клеток, и то же самое имело место и для случая PPAR-позитивных клеток, инкубированных с агонистом или антагонистом PPAR. Как в культуре PPAR-позитивных клеток, так и в культуре PPAR-негативных клеток, стимуляция TGF-β2 имела результатом заметное увеличение уровня коллагена-1 в контрольных экспериментах и в клетках, преинкубированных с антагонистом PPAR-гамма. Преинкубация с агонистом PPAR уменьшала концентрации коллагена-1 на 35-40% по сравнению с контролем в PPAR-позитивных клетках, но не в PPAR-негативных клетках. Результатом добавления нативных жирных кислот к культурам нестимулированных клеток были концентрации коллагена-1, неотличимые от его концентраций в идентичных экспериментах без добавления жирных кислот. В культурах PPAR-позитивных и PPAR-негативных клеток, которые стимулировали TGF-β2 и преинкубировали с нативными жирными кислотами, происходило увеличение концентраций коллагена-1, которое было на 15-25% ниже, чем было измерено в контрольных культурах, и идентичный результат был получен с клетками, преинкубированными с антагонистом PPAR-гамма. В PPAR-гамма-позитивных клетках, преинкубированных с агонистом PPAR и нативными жирными кислотами, имело место 25-35%-ное снижение концентраций коллагена-1 по сравнению с контрольными образцами; это снижение было меньшим, чем снижение, достигнутое при применении одного агониста PPAR.
Преинкубация с нитрованными жирными кислотами понижала содержание коллагена-1 в нестимулированных PPAR-гамма-позитивных и PPAR-гамма-негативных клетках, а также в клеточных культурах, которые преинкубировали с агонистами или антагонистами PPAR-гамма. Преинкубация с нитрованными жирными кислотами почти полностью ингибировала продуцирование коллагена-1 в PPAR-гамма-позитивных и PPAR-гамма-негативных клетках после стимуляции TGF-β2. Преинкубация с агонистом или антагонистом PPAR-гамма не оказывала никакого заметного влияния на ингибиторный эффект нитрованных жирных кислот.
Выводы: Фибробласты кожи человека продуцируют коллаген-1 в ответ на стимуляцию TGF-β2. Этот стимулирующий эффект ослабляется агонистом рецептора PPAR-гамма в PPAR-позитивных, но не в PPAR-негативных клетках. Эффект, опосредуемый PPAR-гамма, ослаблялся преинкубацией с нативными жирными кислотами. В отличие от этого, нитрованные жирные кислоты полностью ингибировали продуцирование коллагена-1, стимулируемую TGF-β2 в PPAR-позитивных и негативных клетках. Поскольку ни отсутствие рецепторов PPAR-гамма, ни блокада рецепторов PPAR-гамма не влияли на ингибирование клеточного сигнала TGF-β2, полученного посредством преинкубации с нитрованными жирными кислотами, для этих данных можно исключить механизм, опосредуемый PPAR-гамма.
Пример 18
Исследование для оценки влияния нитрокарбоновых кислот на фиброгенез, представляющий собой реакцию на травматическое и термическое повреждение при заживлении раны кожи in vivo
Для определения влияния нитрованных жирных кислот на фиброгенез, происходящий в ответ на травматическое и термическое повреждение ткани исследовали in vivo модель с крысами.
У 12 анестезированных взрослых крыс (150-200 г) обоего пола после дезинфекции делали околопозвоночные разрезы скальпелем (два с каждой стороны) длиной приблизительно 1 см и глубиной 1 мм. Кровотечение останавливали ручной компрессией. По всей длине краев раны на одном разрезе с каждой стороны дополнительно проводили прижигание 3-мм шаровым электродом, соединенным с электрохирургическим генератором DRE ASG-120. Затем края раны с одной стороны покрывали стерильным этанольным 0,9% раствором соли или стерильным этанольным раствором жирных кислот (100 микромоль) или стерильным этанольным раствором нитрованных жирных кислот (100 микромоль), используя стерильную кисть. На место разреза, адаптируя его вручную, накладывали ватную полоску размером 1×10 мм, замоченную в этанольном растворе, содержавшем 0,9% соли, нативную жирную кислоту или нитрованные жирные кислоты.
Результат адаптации и ватные полоски закрепляли адгезивной пленкой. Животных содержали и кормили согласно интституционным стандартам. Пленки на ранах осторожно удаляли спустя 2 недели. Спустя 8 недель животных подвергали эвтаназии. Отделяли участки кожи с ранениями, включая эпидерму, дерму и подкожную рыхлую ткань с окружающей нормальной тканью. Удаленные ткани фиксировали в формалине и затем заливали в парафине. Режущая плоскость была вертикальной по отношению к продольной оси прежних разрезов. Срезы (4-6 мкм) окрашивали красителями H&E и Masson trichrome для оценки количества и плотности коллагена.
Результаты: Гистологический анализ разрезов, обработанных 0,9%-ным раствором соли, показал типичную картину образования рубца со средней шириной 2,2 мм. В разрезах с добавочным прижиганием численность клеток была большей, чем в простых разрезах, большей была и площадь образования рубца (средняя ширина 3,5 мм). Степень образования рубца и численность клеток в разрезах, подвергнутых воздействию нативными жирными кислотами, не отличалась значительно от того, что было найдено в разрезах, обработанных раствором соли (средняя ширина 2,0 мм). Однако степень образования рубца, а также численность клеток, были пониженными, если за разрезом следовало прижигание и воздействие нативных жирных кислот (средняя ширина 2,5 мм). Обработка резаных ран нитрованными жирными кислотами значительно уменьшала образующийся рубец по сравнению с обработкой раствором соли (средняя ширина 1,1 мм), но в то же время показывала большую численность клеток. То же самое справедливо для ран с дополнительным прижиганием и воздействием нитрованных жирных кислот (средняя ширина 1,6 мм).
Выводы: Нитрованные жирные кислоты уменьшают площади фиброзных рубцов после хирургического разреза кожи и наложения шва на края раны. Этот эффект еще более выражен, когда края раны дополнительно травмированы прижиганием.
Пример 19
Исследование для оценки влияния нитрокарбоновых кислот на повреждение ткани, обусловленное баротравмой ex vivo
Для определения воздействия нитрованных жирных кислот на механическую травму клеток трахеи была разработана модель ex vivo. Трахеи осторожно вырезали у взрослых крыс Wistar, усыпленных тиопенталом, введенным внутрь брюшной полости. Целые (интактные) трахеи культивировали в среде DMEM 10 (Sigma) с добавленными антибиотиками и противогрибковыми лекарственными средствами в течение 48 часов при 37°С. Трахеи разрезали на 5 фрагментов равного размера. Один фрагмент анализировали немедленно, два фрагмента погружали в 0,9%-ный раствор соли, один фрагмент погружали в раствор, содержавший нативную жирную кислоту в SDS (1%), и один фрагмент погружали в раствор, содержавший нитрованную жирную кислоту, соответственно, на 15 минут каждый. Измеряли внутренние диаметры трахеальных колец. Расширительный баллонный катетер, применяемый при сосудистых интервенциях, выбирали таким образом, чтобы номинальный диаметр баллона был на 15-20% больше диаметра трахеи. Одно трахеальное кольцо, предварительно обработанное 0,9%-ным раствором соли оставляли необработанным; другие препарированные трахеальные кольца монтировали на баллонном катетере, который затем раздували до давления 4 атм. Баллоны держали раздутыми в течение 4 часов, поместив их в культуральную среду. После этого трахеальные кольца культивировали далее в отдельных флаконах в течение 24 часов.
В отдельной группе исследований для ингибирования синтеза гемоксигеназы-1 (HO-1) применяли смысловые/антисмысловые олигодезоксинуклеотиды для HO-1 (Invitrogen), направленные против кодона инициации трансляции в кДНК HO-1. Перед травматизацией клетки трансфецировали, используя трансфекционный реагент Superfect (Qiagen). В другой группе экспериментов за 6 часов до травматизации в культуральную среду добавляли ингибитор гемоксигеназы SnPP IX (Porphyrin Products, London, UK) в дозе 10 мкмоль.
Для анализа кольца разрезали на небольшие полосы, применяя технику неприкосновенности. Жизнеспособность определяли по тесту МТТ, а апоптоз детектировали тестом TUNEL. Антитела Anti-HO-1 (StressGen, Tebu, Le-Perray-en-Yvelines, France) определяли вестерн-блоттингом и иммуноцитохимическим анализом.
Результаты: При сравнении резектатов и контрольных образцов было обнаружено, что большая часть (>90%) клеток в трахеальных кольцах, культивированных ex vivo и затем культивированных в течение 36 часов, оставалась жизнеспособной и демонстрировала низкую частоту клеток, претерпевающих апоптоз (<5%). Механическая травма вызывала очень сильное снижение жизнеспособности (<20% по сравнению с контрольными образцами), что соответствовало массовому количеству клеток, являвшихся апоптозными (60-80%). Предварительная обработка нативными жирными кислотами оказывала лишь небольшой эффект, по сравнению с контролем, демонстрируя жизнеспособность у 20-30% клеток и апоптоз у 50-70% клеток; нитрованные жирные кислоты значительно повышали жизнеспособность клеток (на 70-90% по сравнению с контрольными образцами), что сопровождалось параллельным снижением численности апоптозных клеток (20-30% по сравнению с контрольными образцами).
В дальнейших исследованиях было обнаружено умеренное повышение уровня НО-1 в необработанных контрольных образцах по сравнению с контрольными образцами, исследованными незадолго до резекции. Результатом механической травматизации необработанных трахеальных колец было значительное повышение уровня НО-1 (30-кратное) по сравнению с культивированными контрольными образцами. Предварительная обработка нативными жирными кислотами имела результатом некоторое снижение (25-кратное) продуцирования НО-1, тогда как нитрованные жирные кислоты приводили к большему повышению уровня HO-1 (38-кратному). Как трансфекция клеток, так и добавление ингибитора НО-1 уменьшали продуцирование НО-1 до нижнего предела детектирования или до ее полного отсутствия в необработанных контрольных образцах, а также в образцах, обработанных нативными жирными кислотами или нитрованными жирными кислотами. В образцах с блокированным продуцированием НО-1 травматизация уменьшала жизнеспособность в большей степени, чем в образцах без блокады (0-10% жизнеспособных клеток), и ее результатом была более высокая доля апоптоза (90-100%). Нативные жирные кислоты ослабляли этот эффект, доводя долю жизнеспособных клеток до 10-20%, и уменьшая долю апоптозных клеток до 80-90%. В отличие от этого, в клетках с блокированным синтезом НО-1 нитрованные жирные кислоты приводили к результатам, почти идентичным тем, что были получены с образцами без ингибирования НО-1: доля жизнеспособных клеток - 60-90%, доля апоптоза - 20-30%.

Выводы: Результатом механической травматизации ткани трахеи является высокий уровень гибели клеток. Предварительная обработки ткани трахеи нативными жирными кислотами приводила к умеренному снижению уровня гибели клеток. Однако неблагоприятные эффекты травматизации значительно ослаблялись нитрованными жирными кислотами. Продуцирование НО-1, индуцированное травматизацией, по-видимому, играет определенную роль в снижении уровня гибели клеток в контрольной группе и в образцах, обработанных нативными жирными кислотами; однако это не имеет места в образцах, предварительно обработанных нитрованными жирными кислотами. Следовательно, нитрованные жирные кислоты оказывают свое цитопротекторное действие на травматизированные клетки трахеи по механизму, не зависящему от НО-1.
Реферат
Изобретение относится к области медицины и представляет собой покрытие для медицинского устройства, ингибирующее агрессивную форму заживления, содержащее, по меньшей мере, одну нитрокарбоновую кислоту. Изобретение обеспечивает предоставление покрытий для медицинских устройств, которые обладают преимуществами в отношении стабильности, прилипания клеток, роста клеток, биозагрязнения, биосовместимости и биостойкости. 4 з.п. ф-лы, 7 ил., 1 табл., 19 пр.

Комментарии