Композиции, включающие антибактериальное средство и тазобактам - RU2593363C2
Код документа: RU2593363C2
Описание
Эта заявка испрашивает приоритет индийской патентной заявки № 1587/MUM/2011, поданной 28 мая 2011, описание которой полностью включено в настоящее описание посредством ссылки, как если бы она была полностью приведена в настоящем описании. Все ссылки, включая патенты, патентные заявки и литературу, приведенную в описании изобретения, в явном виде полностью включены в настоящее описание посредством ссылки.
Область техники
Настоящее изобретение относится к антибактериальным средствам.
Предшествующий уровень техники
Фактические данные Всемирной организации здравоохранения (№ 194, переработанные в январе 2002) указывают на то, что бактериальные инфекции, которые наиболее всего задействованы в заболеваниях человека, также являются теми, у которых появление микробной резистентности наиболее очевидно: диарейные заболевания, инфекции дыхательных путей, менингит, инфекции, передаваемые половым путем, и внутрибольничные инфекции. Некоторые важные примеры бактерий, устойчивых к типичным антибактериальным средствам, включают: пенициллин-резистентный Streptococcus pneumoniae, ванкомицин-резистентные энтерококки и метицилин-резистентный Staphylococcus aureus. Однако резистентность к β-лактаму, фторхинолонам и аминогликозидам у грамотрицательных бактерий в настоящее время представляет собой наибольшую проблему для клинических врачей. β-лактамные антибиотики традиционно составляют основу терапии для лечения широкого диапазона инфекций, вызываемых грамотрицательными бактериями, включая вызываемые Klebsiella, Escherichia coli, Enterobacter, Serratia, P. aeruginosa и т.д.
Проблему появления у бактерий резистентности к лекарству часто решают путем перехода к следующей линии антибактериальных средств, которые могут быть более дорогими и иногда более токсическими. Однако даже это может не быть окончательным решением проблемы, поскольку бактерии часто со временем развивают резистентность к новым антибактериальным средствам. Бактерии являются особенно эффективными в развитии резистентности благодаря их способности очень быстро размножаться и передавать гены резистентности при делении.
Некоторые антибактериальные комбинации были изучены в предшествующем уровне техники, включая таковые, изученные авторами Mayer et al. (Investigation of the aminoglycosides, fluoroquinolones and third-generation cephalosporin combinations against clinical isolates of Pseudomonas spp. J. Antimicrob. Chemother., 43, 651-657, 1999); Gradelski et al. (Synergistic activities of gatifloxacin in combination with other antibacterial agents against clinical isolates of Pseudomonas aeruginosa and related species. Antimicrob. Agents Chemother., 45, 3220-3222, 2001); Fish et al. (Synergistic activity of cephalosporins plus fluroquinolones against Pseudomonas aeruginosa with resistance to one or both drugs. J. Antimicrob. Chemother., 50, 1045-1049, 2002) и Davis et al. (In vitro activity of gatifloxacin alone and in combination with cefepime, meropenem, piperacillin and gentamicin against multidrug-resistant organisms, J. Antimicrob. Chemother., 51, 1203-1211, 2003). Fish et al. обнаружили, что комбинация цефепима или цефтазидима с ципрофлоксацином, левофлоксацином, гатифлоксацином или моксифлоксацином является синергической в отношении 10 клинических штаммов Pseudomonas aeruginosa, включая таковые, резистентные и к цефалоспоринам, и к фторхинолонам. В другом исследовании, N. Sivagurunathan et al. (Synergy of gatifloxacin with cefoperazone and cefoperazone-sulbactam against resistant strains of Pseudomonas aeruginosa. J. Medical Microb., 57, 1514-1517, 2008), наблюдали in vitro синергию гатифлоксацина и цефоперазона и комбинации гатифлоксацин-цефоперазон-сульбактам в отношении резистентных штаммов Pseudomonas aeruginosa. В некоторых случаях эти комбинации антибиотиков также с успехом применяли для эффективного лечения нозокомиальных инфекций, вызываемых Pseudomonas aeruginosa (Al-Hasan et.al, β-Lactam and Fluroquinolonecombination antibiotic therapy for bateremia caused by Gram-negative bacilli. Antimicrob. Agents Chemother., 53(4), 1386-1394, 2009).
Бактерии имеют несколько механизмов приобретения резистентности к антибактериальным средствам, включая такой как, например, инактивация или модификация лекарственного средства (например, ферментативная дезактивация пенициллина G у некоторых пенициллин-резистентных бактерий путем образования β-лактамаз), альтерация сайта-мишени (например, альтерация пенициллинсвязывающего белка, сайта связывания пенициллинов у MRSA и других устойчивых к пенициллину бактерий), альтерация метаболического пути (например, некоторые сульфамид-резистентные бактерии не нуждаются в пара-аминобензойной кислоте (ПАБК), важном предшественнике синтеза фолиевой кислоты и нуклеиновых кислот у бактерий, ингибированных сульфамидами) или пониженное накопление антибактериальных средств благодаря эффлюксным насосам (например, путем снижения проницаемости и/или увеличения активного исходящего потока антибактериальных средств через поверхность клеток).
Существует четыре основных механизма, посредством которых бактерии могут противостоять β-лактамным антибиотикам: (i) образование β-лактамаз; (ii) мутации в целевых пенициллинсвязывающих белках-мишенях; (iii) пониженная экспрессия белков/поринов наружной мембраны; и (iv) эффлюксные насосы. Образование β-лактамаз является главным механизмом резистентности к этому классу антибиотиков. Введение расширенного спектра β-лактамов в течение 1980-х получило отклик у грамотрицательных организмов в виде образования расширенного спектра β-лактамаз (бета-лактамазы расширенного спектра). Бета-лактамазы расширенного спектра представляют собой плазмид-опосредованные β-лактамазы, известные как расширенный спектр, поскольку они могут гидролизовать более широкий спектр β-лактамных антибиотиков, включая третьи и четвертые генерации цефалоспоринов.
Резистентность к β-лактамам, β-лактам-β-лактамаз-ингибиторам, цефалоспоринам и монобактаму широко распространена. Такая резистентность осложняет возможность лечения серьезных инфекций мочевых путей, инфекций дыхательных путей и инфекций кровотока. По всему миру распространенность бета-лактамазы расширенного спектра у Klebsiella и E. coli составляет в диапазоне 30-50% в зависимости от географического положения. В случае бета-лактамаз расширенного спектра в настоящее время наиболее широко применяемой в клинических условиях является терапия карбапенемами. В настоящее время со всеми штаммами, идентифицированными как устойчивые к ингибиторованию бета-лактамазы расширенного спектра, борются только посредством карбапенемов. Это экстенсивное и широкое применение карбапенемов вызвало селекцию карбапенем-резистентных штаммов.
Поэтому существует потребность в разработке композиций, способных действовать против бета-лактамаз расширенного спектра, которые в настоящее время являются резистентными к доступному β-лактам-β-лактамаз ингибитору (и с ними можно бороться только посредством карбапенемов). К удивлению, обнаружено, что фармацевтическая композиция, включающая эффективное количество антибактериального средства и тазобактама или его фармацевтически приемлемой соли в определенном соотношении тазобактама к антибактериальному средству в композиции, проявляет неожиданно более сильное антибактериальное действие даже в отношении грамотрицательных патогенов, образующих высокорезистентные бета-лактамазы расширенного спектра.
Сущность настоящего изобретения
Соответственно, описаны фармацевтические композиции, включающие эффективное количество антибактериального средства и тазобактама или его фармацевтически приемлемой соли.
В одном общем аспекте настоящего изобретения описана фармацевтическая композиция, включающая эффективное количество (a) по меньшей мере, одного антибактериального средства, выбранного из цефепима, цефпирома, цефтобипрола, цефтаролина, цефклидина, цефлупренама, цефоселиса, цефозопрана, цефкинома, моксалактама, фломоксефа, биапенема, панипенема, дорипенема, эртапенема, меропенема, имипенема, разупенема, темоциллина, CXA-101 или их фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к антибактериальному средству в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм антибактериального средства.
В другом общем аспекте настоящего изобретения описан способ лечения или борьбы с бактериальной инфекцией у пациента, включающий введение указанному пациенту терапевтически эффективного количества фармацевтической композиции, включающей эффективное количество (a) по меньшей мере, одного антибактериального средства, выбранного из цефепима, цефпирома, цефтобипрола, цефтаролина, цефклидина, цефлупренама, цефоселиса, цефозопрана, цефкинома, моксалактама, фломоксефа, биапенема, панипенема, дорипенема, эртапенема, меропенема, имипенема, разупенема, темоциллина, CXA-101 или их фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к антибактериальному средству в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм антибактериального средства.
В другом общем аспекте настоящего изобретения фармацевтическая композиция, включающая эффективное количество (a) по меньшей мере, одного антибактериального средства, выбранного из цефепима, цефпирома, цефтобипрола, цефтаролина, цефклидина, цефлупренама, цефоселиса, цефозопрана, цефкинома, моксалактама, фломоксефа, биапенема, панипенема, дорипенема, эртапенема, меропенема, имипенема, разупенема, темоциллина, CXA-101 или их фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к антибактериальному средству в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм антибактериального средства, применена при лечении или борьбе с бактериальной инфекцией у пациента.
В другом общем аспекте настоящего изобретения описана фармацевтическая композиция, включающая эффективное количество (a) цефепима или его фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к цефепиму в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм цефепима.
В еще одном другом общем аспекте настоящего изобретения описан способ лечения или борьбы с бактериальной инфекцией у пациента, включающий введение указанному пациенту терапевтически эффективного количества фармацевтической композиции, включающей эффективное количество (a) цефепима или его фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к цефепиму в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм цефепима.
Во все еще другом общем аспекте настоящего изобретения фармацевтическая композиция, включающая эффективное количество (a) цефепима или его фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к цефепиму в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм цефепима, применена для лечении или борьбы с бактериальной инфекцией у пациента.
В еще одном общем аспекте настоящего изобретения описана фармацевтическая композиция, включающая эффективное количество (a) цефпирома или его фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к цефпирому в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм цефпирома.
В другом общем аспекте настоящего изобретения описан способ лечения или борьбы с бактериальной инфекцией у пациента, включающий введение указанному пациенту терапевтически эффективного количества фармацевтической композиции, включающей эффективное количество (a) цефпирома или его фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к цефпирому в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм цефпирома.
В другом общем аспекте настоящего изобретения фармацевтическая композиция, включающая эффективное количество (a) цефпирома или его фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к цефпирому в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм цефпирома, применена для лечения или борьбы с бактериальной инфекцией у пациента.
Подробности одного или более вариантов осуществления настоящего изобретения сформулированы в описании ниже. Другие особенности, цели и преимущества настоящего изобретения будут очевидны из следующего описания, включая формулу изобретения.
Подробное описание настоящего изобретения
Далее будут приведены ссылки на варианты осуществления настоящего изобретения, и в настоящем описании будет применен определенный язык для их описания. Тем не менее, следует понимать, что они не подразумевают никакого ограничения объема настоящего изобретения. Изменения и дополнительные модификации особенностей настоящего изобретения, проиллюстрированных в настоящем описании, и дополнительные применения принципов настоящего изобретения, как проиллюстрировано в настоящем описании, нужно рассматривать как входящие в объем настоящего изобретения. Следует принять во внимание, что в описании и приложенной формуле изобретения формы, указывающие на единственное число, включают множественное число, если содержание явно не указывает иначе.
Авторы настоящего изобретения к удивлению обнаружили, что фармацевтическая композиция, включающая эффективное количество антибактериального соединения и тазобактама или его фармацевтически приемлемой соли в определенном соотношении тазобактама к антибактериальному соединению в композиции, проявляет неожиданно более сильное антибактериальное действие даже в отношении грамотрицательных патогенов, образующих высокорезистентные бета-лактамазы расширенного спектра.
Термин «инфекция» включает присутствие бактерий в или на пациенте, ингибирование роста которых привело бы к благоприятному эффекту для пациента. Также термин «инфекция», в дополнение к ссылке на присутствие бактерий, также относится к нормальной флоре, которая не является желательной. Термин «инфекция» включает инфекцию, вызываемую бактериями.
Термин «лечить», «лечащий» или «лечение» относится к применению фармацевтической композиции с целью профилактики и/или в терапевтических целях. Термин «профилактическое лечение» относится к лечению пациента, который еще не заражен, но является склонным к заражению или иным образом имеет риск инфицирования. Термин «терапевтическое лечение» относится к применению лечения к пациенту, уже страдающему от инфекции.
Термин «введение» или «вводить» включает доставку пациенту, включая, например, доставку любым адекватным способом, который служит для доставки композиции или ее активных ингредиентов к месту локализации инфекции. Способ введения может измениться в зависимости от различных факторов, таких как, например, компоненты фармацевтической композиции, место локализации потенциальной или актуальной инфекции, вовлеченные микроорганизмы, тяжесть инфекции, возраст и физическое состояние пациента. Некоторые неограничивающие примеры способов введения композиции или соединения пациенту согласно этому изобретению включают пероральное, внутривенное, местное, введение в дыхательные пути, интраперитонеальное, внутримышечное, парентеральное, подъязычное, трансдермальное, интраназальное, аэрозольное, внутриглазное, эндотрахеальное, внутриректальное, вагинальное, посредством генной пушки, кожными пластырями, глазными каплями, ушными каплями или жидкостью для полоскания рта. В случае фармацевтической композиции, включающей более одного активного ингредиента, одним из способов введения такой композиции является смешивание активных ингредиентов (например, в форме подходящей лекарственной единицы, такой как таблетка, капсула, раствор, порошок и т.д.) с последующим введением лекарственной формы. Альтернативно, активные ингредиенты могут также быть введены по отдельности (одновременно или один за другим), в том случае, если эти ингредиенты достигают благотворных терапевтических уровней, таким образом, что композиция в целом обладает синергическим действием.
Термин «терапевтически эффективное количество» или «эффективное количество» относится к количеству, которое обладает терапевтическим действием или является количеством, требуемым для оказания терапевтического действия на пациента. Например, терапевтически эффективное количество антибактериального средства или фармацевтической композиции представляет собой количество антибактериального средства или фармацевтической композиции, требуемое для оказания желаемого терапевтического действия, что может быть оценено по результатам клинических испытаний, исследований заражения модельных животных и/или исследований in vitro (например, в агар-агаре или бульонной среде). Терапевтическое количество зависит от нескольких факторов, включая, но не ограничиваясь ими, вовлеченные микроорганизмы, характеристики пациента (например, рост, вес, пол, возраст и история болезни), тяжесть инфекции и конкретный тип применяемого антибактериального средства. В целях профилактического лечения терапевтически или профилактически эффективным количеством является такое количество, которое является эффективным для предотвращения микробной инфекции.
Термин «рост» относится к росту микроорганизмов и включает размножение или увеличение популяции микроорганизма. Термин также включает поддержание протекающих метаболических процессов у микроорганизма, включая процессы, которые поддерживают жизнь микроорганизма.
Термин «синергический» или «синергия» относится к взаимодействию двух или более агентов таким образом, что их совместное действие оказывается больше суммы их индивидуальных действий.
Термин «антибактериальное средство» относится к соединению, способному ингибировать, снижать или предотвращать рост бактерий, способному ингибировать или снижать способность бактерий вызывать инфекцию у хозяина; или способному ингибировать или снижать способность бактерий размножаться или оставаться инфекционными в окружающей среде. Термин «антибактериальное средство» также относится к соединениям, способным снижать инвазивную способность или вирулентность бактерий. Антибактериальные средства согласно этому изобретению включают антибиотические агенты.
«Носитель» или «эксципиент» представляет собой соединение или материал, применяемый для улучшения введения соединения, например, увеличения растворимости соединения. Твердые носители включают, например, крахмал, лактозу, двукальциевый фосфат, сахарозу и каолин. Жидкие носители включают, например, стерилизованную воду, солевой раствор, буферы, неионогенные поверхностно-активные вещества и пищевые масла, такие как арахисовое масло и кунжутные масла. Кроме того, различные вспомогательные средства, традиционно применяемые в области техники, могут быть включены. Эти и другие такие соединения описаны в литературе, например, в Merck Index, Merck & Company, Rahway, N.J. Соображения по включению различных компонентов в фармацевтические композиции описаны, например, в Oilman et al. (Eds.) (1990); Goodman and Gilman's: The Pharmacological Basis of Therapeutics, 8th Ed., Pergamon Press.
Термин «CXA-101», как применено в настоящем описании, относится к цефтолозану (Регистрационный номер CAS: 689293-68-3; Химическое название: (6R,7R)-3-[(5-амино-4-{[(2-аминоэтил)карбамоил]амино}-1-метил-1H-пиразол-2-иум-2-ил)метил]-7-({(2Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-[(1-карбокси-1-метилэтокси)имино]ацетил}амино)-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоксилат). CXA-101 имеет химическую структуру, как показано в формуле (I) ниже:

Специалист в области техники понимает, что могут существовать различные активные соединения, приведенные в настоящем описании, и которые могут применяться в виде их фармацевтически приемлемых солей, пролекарств, метаболитов, сложных эфиров, простых эфиров, гидратов, полиморфов, сольватов, комплексных соединений, энантиомеров, продуктов присоединения или других фармацевтически приемлемых производных соединений. Поэтому ссылка на соединения подразумевает включение таких фармацевтически приемлемых солей, пролекарств, метаболитов, сложных эфиров, простых эфиров, гидратов, полиморфов, сольватов, комплексных соединений, энантиомеров, продуктов присоединения или других фармацевтически приемлемых производных соединений. Например, термины «антибактериальные средства», «цефепим» или «цефпиром» включают их фармацевтически приемлемые соли, пролекарства, метаболиты, сложные эфиры, простые эфиры, гидраты, полиморфы, сольваты, комплексные соединения, энантиомеры, продукты присоединения или любые другие их фармацевтически приемлемые производные соединения.
В одном общем аспекте настоящего изобретения описана фармацевтическая композиция, включающая эффективное количество (a) по меньшей мере, одного антибактериального средства, выбранного из цефепима, цефпирома, цефтобипрола, цефтаролина, цефклидина, цефлупренама, цефоселиса, цефозопрана, цефкинома, моксалактама, фломоксефа, биапенема, панипенема, дорипенема, эртапенема, меропенема, имипенема, разупенема, темоциллина, CXA-101 или их фармацевтически приемлемых солей; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к антибактериальному средству составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм антибактериального средства.
И антибактериальное средство, и тазобактам могут присутствовать в композиции в своих свободных формах или в форме своих фармацевтически приемлемых солей, пролекарств, метаболитов, сложных эфиров, простых эфиров, гидратов, полиморфов, сольватов, комплексных соединений, энантиомеров, продуктов присоединения или в форме любых других фармацевтически приемлемых производных соединений. Указанное соотношение антибактериального средства и тазобактама в композиции вычисляют на основе их свободных форм. Например, если композиция включает цефепим гидрохлорид и тазобактам натрия, соотношение тазобактама к цефепиму вычисляют с применением эквивалентного количества цефепима и тазобактама, присутствующих в композиции.
В некоторых вариантах осуществления тазобактам в композиции присутствует в виде тазобактама натрия.
Количество антибактериального средства в композиции может изменяться в зависимости от требований. В некоторых вариантах осуществления антибактериальное средство присутствует в количестве от приблизительно 0,1 до приблизительно 10 граммов.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 1 грамм антибактериального средства и приблизительно 1 грамм тазобактама.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 2 грамма антибактериального средства и приблизительно 2 грамма тазобактама.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 2 грамма антибактериального средства и приблизительно 1 грамм тазобактама.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 1 грамм антибактериального средства и приблизительно 0,750 грамм тазобактама.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 1 грамм антибактериального средства и приблизительно 0,5 грамм тазобактама.
В другом общем аспекте настоящего изобретения описана фармацевтическая композиция, включающая эффективное количество (a) цефепима или его фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к цефепиму в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм цефепима.
В некоторых вариантах осуществления фармацевтическая композиция включает от приблизительно 0,1 до приблизительно 10 граммов цефепима.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 1 грамм цефепима и приблизительно 1 грамм тазобактама.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 2 грамма цефепима и приблизительно 2 грамма тазобактама.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 2 грамма цефепима и приблизительно 1 грамм тазобактама.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 1 грамм цефепима и приблизительно 0,750 грамм тазобактама.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 1 грамм цефепима и приблизительно 0,5 грамм тазобактама.
В другом общем аспекте настоящего изобретения описана фармацевтическая композиция, включающая эффективное количество (a) цефпирома или его фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к цефпирому в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм цефпирома.
В некоторых вариантах осуществления фармацевтическая композиция включает от приблизительно 0,1 до приблизительно 10 граммов цефпирома.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 1 грамм цефпирома и приблизительно 1 грамм тазобактама.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 2 грамма цефпирома и приблизительно 2 грамма тазобактама.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 2 грамма цефпирома и приблизительно 1 грамм тазобактама.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 1 грамм цефпирома и приблизительно 0,750 грамм тазобактама.
В некоторых вариантах осуществления фармацевтическая композиция включает приблизительно 1 грамм цефпирома и приблизительно 0,5 грамм тазобактама.
Фармацевтические композиции согласно настоящему изобретению могут включать один или более фармацевтически приемлемых носителей или эксципиентов. Типичные неограничивающие примеры таких носителей или эксципиентов включают маннит, лактозу, крахмал, стеарат магния, сахарин натрий, тальк, целлюлозу, кроскармеллозу натрия, глюкозу, желатин, сахарозу, карбонат магния, смачивающие агенты, эмульгирующие агенты, улучшающие растворимость агенты, pH буферизующие агенты, лубриканты, стабилизирующие агенты, связующие агенты и т.д.
Фармацевтическая композиция согласно настоящему изобретению может быть составлена в композицию в виде множества лекарственных форм. Типичные, неограничивающие примеры лекарственных форм включают твердую, полутвердую, жидкую и аэрозольные лекарственные формы, такие как таблетки, капсулы, порошки, растворы, суспензии, суппозитории, аэрозоли и т.п.
В некоторых вариантах осуществления фармацевтическая композиция согласно этому изобретению находится в форме порошка или раствора.
В другом общем аспекте настоящего изобретения описаны способы лечения или борьбы с бактериальной инфекцией с применением фармацевтических композиций согласно этому изобретению.
В некоторых вариантах осуществления описан способ лечения или борьбы с бактериальной инфекцией у пациента, включающий введение указанному пациенту терапевтически эффективного количества фармацевтической композиции согласно этому изобретению.
В некоторых вариантах осуществления описан способ лечения или борьбы с бактериальной инфекцией у пациента, включающий введение указанному пациенту терапевтически эффективного количества фармацевтической композиции, включающей эффективное количество (a) по меньшей мере, одного антибактериального средства, выбранного из цефепима, цефпирома, цефтобипрола, цефтаролина, цефклидина, цефлупренама, цефоселиса, цефозопрана, цефкинома, моксалактама, фломоксефа, биапенема, панипенема, дорипенема, эртапенема, меропенема, имипенема, разупенема, темоциллина, CXA-101 или их фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к антибактериальному средству в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм антибактериального средства.
В некоторых вариантах осуществления фармацевтическая композиция, включающая эффективное количество (a) по меньшей мере, одного антибактериального средства, выбранного из цефепима, цефпирома, цефтобипрола, цефтаролина, цефклидина, цефлупренама, цефоселиса, цефозопрана, цефкинома, моксалактама, фломоксефа, биапенема, панипенема, дорипенема, эртапенема, меропенема, имипенема, разупенема, темоциллина, CXA-101 или их фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к антибактериальному средству в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм антибактериального средства, применяют при лечении или борьбе с бактериальной инфекцией у пациента.
В некоторых вариантах осуществления описан способ лечения или борьбы с бактериальной инфекцией у пациента, включающий введение указанному пациенту терапевтически эффективного количества фармацевтической композиции, включающей эффективное количество (a) цефепима или его фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к цефепиму в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм цефепима.
В некоторых других вариантах осуществления фармацевтическую композицию, включающую эффективное количество (a) цефепима или его фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к цефепиму в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм цефепима, применяют при лечении или борьбе с бактериальной инфекцией у пациента.
В некоторых вариантах осуществления описан способ лечения или борьбы с бактериальной инфекцией у пациента, включающий введение указанному пациенту терапевтически эффективного количества фармацевтической композиции, включающей эффективное количество (a) цефпирома или его фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к цефпирому в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм цефпирома.
В некоторых других вариантах осуществления фармацевтическую композицию, включающую эффективное количество (a) цефпирома или его фармацевтически приемлемой соли; и (b) тазобактама или его фармацевтически приемлемой соли, в которой соотношение тазобактама к цефпирому в композиции составляет в диапазоне от приблизительно 0,5 до приблизительно 2 граммов тазобактама на грамм цефпирома, применяют при лечении или борьбе с бактериальной инфекцией у пациента.
В других вариантах осуществления в способах согласно этому изобретению фармацевтическую композицию согласно этому изобретению применяют любым соответствующим способом, который служит для доставки композиции или ее составляющих до желаемого места. Способ введения может изменяться в зависимости от различных факторов, таких как, например, компоненты фармацевтической композиции, участок потенциальной или фактической инфекции, вовлеченный микроорганизм, тяжесть инфекции, возраст и физическое состояние пациента. Некоторые неограничивающие примеры введения композиции пациенту согласно этому изобретению включают пероральное, внутривенное, местное, введение в дыхательные пути, интраперитонеальное, внутримышечное, парентеральное, подъязычное, трансдермальное, интраназальное, аэрозольное, внутриглазное, эндотрахеальное, внутриректальное, вагинальное, введение генной пушкой, кожными пластырями, глазными каплями, ушными каплями или с жидкостью для полоскания рта.
Композиции согласно настоящему изобретению включают тазобактам в комбинации с другим активным ингредиентом (например, антибактериальное средство, цефепим, цефпиром и т.д.). Специалист в области техники оценит, что активные ингредиенты в этом случае могут быть составлены в композицию в виде различных лекарственных форм, в которых тазобактам и другой активный ингредиент (например, антибактериальное средство, цефепим, цефпиром и т.д.) присутствуют или вместе (смесь), или в виде отдельных компонентов. Когда различные ингредиенты в композиции составлены в композицию в виде смеси, такая композиция может быть доставлена путем введения такой смеси. Композиция или лекарственная форма, в которой ингредиенты не находятся в виде смеси, а представляют собой отдельные компоненты, такая композиция/лекарственная форма может быть введена несколькими способами. В одном возможном варианте ингредиенты могут быть смешаны в желаемых соотношениях, и затем смесь введена так, как требуется. Альтернативно, компоненты могут быть введены по отдельности в соответствующих соотношениях для достижения такого же или эквивалентного терапевтического уровня или действия, которое было бы достигнуто при введении эквивалентной смеси.
В другом общем аспекте настоящего изобретения описаны способы профилактического лечения пациента, включающие введение пациенту, подверженному риску инфекции, вызываемой бактериями, профилактически эффективного количества фармацевтической композиции согласно настоящему изобретению.
В целом, фармацевтические композиции и способ, раскрытый в настоящем описании, являются, в частности, эффективными против бактерий, которые, как считали ранее, обладают резистентностью в отношении одного или более из известных антибактериальных средств или известных композиций. Некоторые неограничивающие примеры таких бактерий, которые, как известно, приобрели резистентность к различным антибактериальным средствам, включают E. coli, Pseudomonas aeruginosa, Staphylococcus aureus, Enterobacter, Klebsiella, Citrobacter и т.д.
Большое разнообразие микробных инфекций можно лечить с применением композиций и способа согласно этому изобретению.
Примеры бактериальных инфекций, которые можно лечить и/или предотвращать с применением способов и/или фармацевтических композиций согласно этому изобретению, включают, не ограничиваясь ими, инфекции E. coli (например, мочевых путей), Yersinia pestis (легочная чума), стафилококковую инфекцию, стрептококковую инфекцию, микобактериальную инфекцию, бактериальную пневмонию, шигеллезную дизентерию, зубчатую инфекцию, кандидозную инфекциюя, криптококковую инфекцию, инфекцию метицилин-резистентного Staphylococcus aureus, сибирскую язву, туберкулез или инфекции, вызываемые Pseudomonas aeruginosa и т.д.
Способы и/или композиции согласно этому изобретению являются полезными при лечении инфекции, вызываемой Pseudomonas aeruginosa, так же как инфекции метициллин-резистентного Staphylococcus aureus МРЗС, который является одним из главных болезнетворных организмов, вызывающих внутрибольничные инфекции, интраабдоминальные инфекции и инфекции мочевых путей. Поскольку эти бактерии обладают резистентностью к множеству лекарственных средств, лечение этих бактериальных инфекций является сложным, представляя собой серьезную проблему в клинических условиях.
Для специалиста в области техники будет очевидно, что разнообразные замены и модификации могут быть сделаны в изобретении, раскрытом в настоящем описании, не отступая от объема и сущности настоящего изобретения. Например, специалисты в области техники признают, что настоящее изобретение может быть осуществлено на практике с применением множества различных соединений в пределах приведенных общих описаний.
Примеры
Следующие примеры иллюстрируют варианты осуществления настоящего изобретения, которые в настоящее время являются наиболее известными. Однако необходимо понимать, что следующее примеры являются только примерными или иллюстративными для применения принципов настоящего изобретения. Многочисленные модификации и альтернативные композиции, способы и системы могут быть разработаны специалистами в области техники, не отступая от сущности и объема настоящего изобретения. Прилагаемая формула настоящего изобретения предназначена для охвата таких модификаций и конструкций. Таким образом, в то время как настоящее изобретение выше было описано в частности, следующие примеры обеспечивают дополнительные детали в отношении того, что сейчас считается наиболее практическими и предпочтительными вариантами осуществления настоящего изобретения.
Пример 1
Результаты действия цефепима и других цефалоспориновых антибактериальных средств в комбинации с тазобактамом против высокорезистентных штаммов, образующих бета-лактамазы расширенного спектра, показаны в таблице 1. В типичном исследовании выращиваемые в течение ночи бактериальные культуры разбавляли соответственно и делали посев на агаровых средах, содержащих двойное разведение антибиотика. Наблюдение за ростом или отсутствием роста проводили через 16-20 ч инкубации при 35+2°C окружающей атмосферы. Всю последовательность действий осуществляли согласно рекомендациям Института клинических и лабораторных стандартов (CLSI).
Этой экспериментальной схеме следовали в примерах 2-4 и 6 ниже (Таблицы 2-4 и 7).
Данные в таблице 1 показывают, что только комбинация цефепима и тазобактама демонстрирует мощное действие против высокорезистентных штаммов, образующих бета-лактамазы расширенного спектра. Как можно видеть из данных в таблице 1, такой эффект не наблюдали с другими тестированными цефалоспоринами или их комбинациями с тазобактамом. Как правило, комбинация цефепима и тазобактама показывала мощное ингибирование высокорезистентных штаммов, таким образом, снижая минимальные ингибирующие концентрации (усиленное действие) этой комбинации до 2-4 мкг/мл по сравнению с отсутствием ингибирования как цефалоспоринами, так и их комбинациями (Минимальные ингибирующие концентрации составляют 64-128 мкг/мл).
Пример 2
Результаты действия цефепима в комбинации с тазобактамом и пенициллинов в комбинации с соответствующими им ингибиторами бета-лактамаз расширенного спектра против высокорезистентных штаммов, образующих бета-лактамазы расширенного спектра, показаны в таблице 2.
Данные в таблице 2 показывает, что только комбинация цефепима и тазобактама может демонстрировать мощное действие против высокорезистентных штаммов, образующих бета-лактамазы расширенного спектра. Как правило, комбинация цефепима и тазобактама показывала мощное ингибирование высокорезистентных штаммов, таким образом, снижая минимальные ингибирующие концентрации (усиленное действие) этой комбинации до 2-4 мкг/мл по сравнению с отсутствием ингибирования как пенициллином, так и его комбинацией с тазобактамом (Минимальные ингибирующие концентрации составляют >64 мкг/мл).
Пример 3
Результаты действия цефпирома и других цефалоспоринов в комбинации с тазобактамом против высокорезистентных штаммов, образующих бета-лактамазы расширенного спектра, показаны в таблице 3.
Данные в таблице 3 также подтверждают, что только комбинация цефпирома и тазобактама может демонстрировать мощное действие против высокорезистентных штаммов, образующих бета-лактамазы расширенного спектра. Такой эффект не наблюдали ни с какими другими цефалоспоринами или их комбинациями с тазобактамом. Как правило, комбинация цефпирома и тазобактама показывала мощное ингибирование высокорезистентных штаммов, таким образом, снижая минимальные ингибирующие концентрации (усиленное действие) этой комбинации до 2-8 мкг/мл по сравнению с отсутствием ингибирования как цефалоспоринами, так и их комбинациями с минимальными ингибирующими концентрациями, составляющими 64-128 мкг/мл.
Пример 4
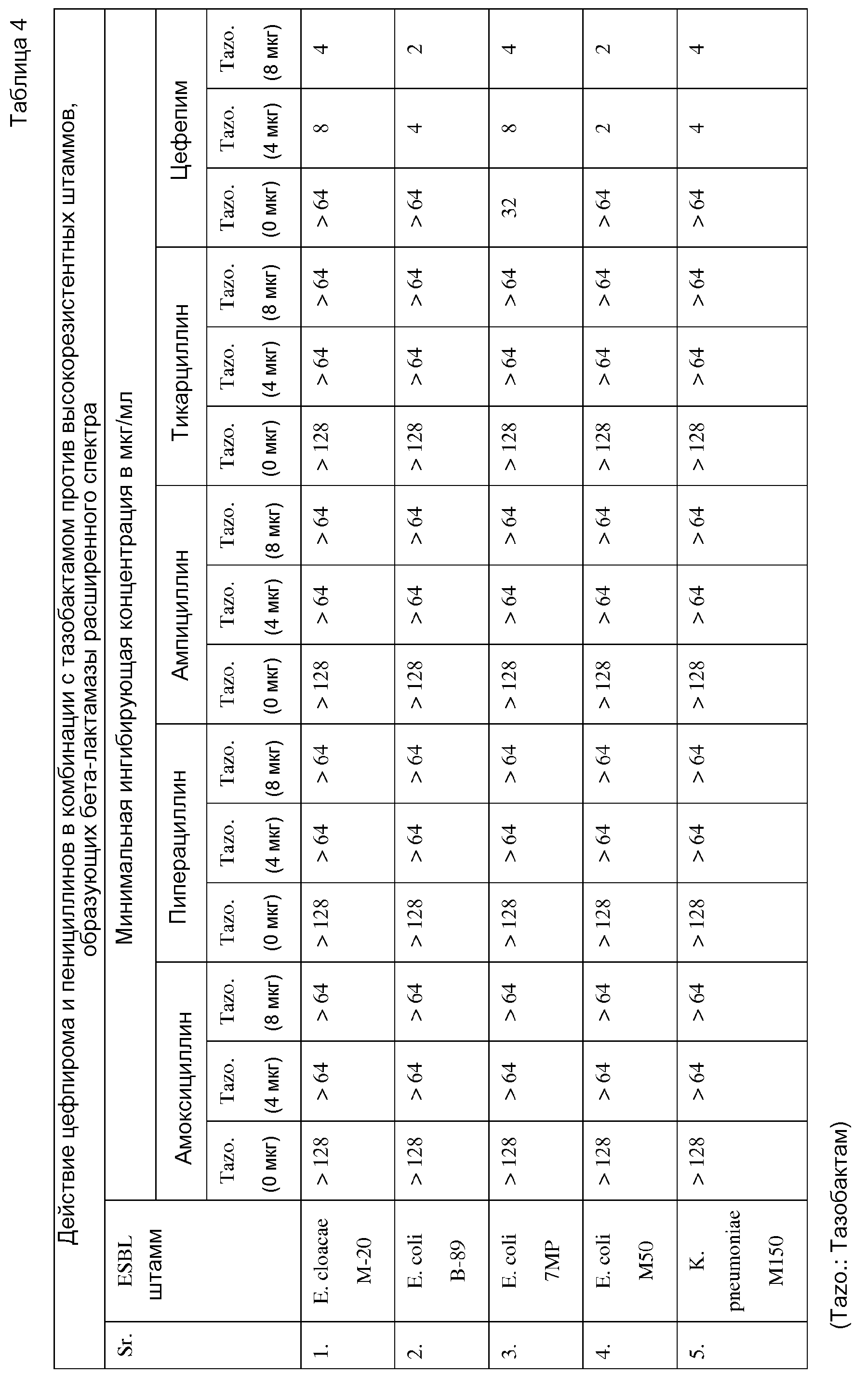
Результаты действия цефпирома в комбинации с тазобактамом и пенициллинов в комбинации с соответствующими им ингибиторами бета-лактамаз расширенного спектра против высокорезистентных штаммов, образующих бета-лактамазы расширенного спектра, показаны в таблице 4.
Данные в таблице показывают 4, что только комбинация цефпирома и тазобактама может демонстрировать мощное действие против высокорезистентных штаммов, образующих бета-лактамазы расширенного спектра. Как правило, комбинация цефпирома и тазобактама показывает мощное ингибирование высокорезистентных штаммов, таким образом, снижая минимальные ингибирующие концентрации (усиленное действие) до 2-4 мкг/мл по сравнению с отсутствием ингибирования как цефалоспоринами, так и их комбинациями, приводящими минимальные ингибирующие концентрации к наибольшим значениям >64 мкг/мл.
Пример 5
Действие цефепима в комбинации с тазобактамом и различных пенициллинов в комбинации с соответствующими ингибиторами бета-лактамаз расширенного спектра также исследовали на действие против высокорезистентных штаммов, образующих бета-лактамазы расширенного спектра, путем количественного анализа диффузии лекарственного средства, проводимого согласно рекомендациям CLSI (Института клинических и лабораторных стандартов (CLSI), Стандарты действия для тестирования на восприимчивость к противомикробным средствам, 20-е информационное приложение, М100 - S20, том 30, № 1, 2010).
В типичном исследовании выращиваемые в течение ночи бактериальные культуры после соответствующего разведения высевали на расплавленную, охлажденную агаровую среду, залитую в чашки. Антибиотики на дисках диаметром 6 мм размещали на поверхности агара. Зоны ингибирования наблюдали через 16-18 ч инкубации при 35+2°C окружающей атмосферы. Всю последовательность действий осуществляли согласно рекомендациям CLSI (Таблицы 5 и 6). Эти испытания, как правило, применяются для определения возможности лечения определенной инфекции с применением антибиотика и/или его комбинаций. Например, в случае лечения инфекции, вызываемой E. coli (M138), с применением Augmentin® [коммерчески доступная комбинация: Амоксициллин (500 мг)+Клавулановая кислота (125 мг)], величины зон ингибирования должны быть в диапазоне чувствительности (S). В целом, предполагается, что антибиотик или рассматриваемая комбинация не будут эффективны при лечении инфекции, если величины зон ингибирования находятся в диапазоне устойчивости (R).
Оценка восприимчивости этих комбинаций на основе CLSI (которая определяет решения при лечении в условиях больницы/общества) показала, что только комбинация цефепима и тазобактама может менять профиль восприимчивости штаммов, образующих бета-лактамазы расширенного спектра, c 'Устойчивого' на 'Чувствительный', указывая на выгодную клиническую полезность комбинации цефепим-тазобактам согласно настоящему изобретению. Этот результат является удивительным и имеющим превосходство, ввиду того, что никакая другая комбинация, которая доступна в настоящее время, не может продемонстрировать клинически осуществимое действие против этих штаммов.
Схожее исследование также проводили с цефпиромом в комбинации с тазобактамом, и результаты показаны в таблице 6. Здесь также можно видеть, что только комбинация цефпирома и тазобактама может изменить профиль восприимчивости штаммов, образующих бета-лактамазы расширенного спектра, указывая на выгодную клиническую полезность комбинации тазобактам-цефпиром согласно настоящему изобретению. Этот результат является удивительным и имеющим превосходство, ввиду того, что никакая другая комбинация, которая доступна в настоящее время, не может продемонстрировать клинически осуществимое действие против этих штаммов.
Пример 6
Результаты действия различных ингибиторов бета-лактамазы расширенного спектра, таких как клавулановая кислота, сульбактам и тазобактам в комбинации с цефепимом и цефпиромом, показаны в таблице 7. Данные в таблице 7, ясно и неожиданно показывают, что антибактериальное действие цефепима и цефпирома усиливалось только посредством комбинации с тазобактамом, а не с другими ингибиторами бета-лактамаз расширенного спектра, такими как клавулановая кислота и сульбактам.
Результаты, приведенные в таблицах 1-7, ясно и неожиданно показывают, что только определенные комбинации антибактериальных средств (включая цефепим или цефпиром) с тазобактамом обеспечивают необычный и неожиданный синергический антибактериальный эффект против высокорезистентных штаммов, образующих бета-лактамазы расширенного спектра. Такой значительный антибактериальный эффект не обнаруживали при объединении других цефалоспоринов второй или третьей генерации (например, цефподоксим, цефтазидим, цефтриаксон и т.д.) или пенициллинов (например, амоксициллин, пиперациллин, ампициллин, тикарциллин и т.д.) с любым из доступных в настоящее время ингибиторов бета-лактамаз расширенного спектра (клавулановая кислота, тазобактам и сульбактам) в сопоставимых концентрациях. В таблицах 5 и 6 приведены доказательства концепции и показано, что только цефепим (0,5 г) или цефпиром (0,5 г) в комбинации с тазобактамом (0,5 г) обладает огромным благоприятным ингибирующим действием высокорезистентных штаммов, образующих бета-лактамазы расширенного спектра, демонстрируя замечательное терапевтическое продвижение в лечении инфекций, вызываемых такими патогенными штаммами. Поэтому можно предполагать, что более высокие дозы этих комбинаций в патентуемом соотношении также будут обеспечивать схожую терапевтическую пользу.






Реферат
Группа изобретений касается лечения бактериальных инфекций. Предложена антибактериальная комбинация, включающая (а), по меньшей мере, одно антибактериальное средство, выбранное из цефепима, цефпирома, или их соли; и (b) тазобактам или его соли, при этом указанная комбинация дополнительно характеризуется тем, что она включает: (i) 1 г антибактериального средства и 1 г тазобактама; или (ii) 2 г антибактериального средства и 2 г тазобактама; или (iii) 0,5 г антибактериального средства и 0,5 г тазобактама (варианты). Предложено применение заявленных вариантов антибактериальной комбинации для лечения или борьбы с бактериальной инфекцией у пациента (варианты). Технический результат состоит в синергизме антибактериального действия и в эффективности против бактериальной инфекции у пациента, вызванной высокорезистентными штаммами, образующими бета-лактамазы широкого спектра. 7 н. и 8 з.п. ф-лы, 7 табл.

Комментарии