Способы лечения шума в ушах, индуцированного улитковой экситотоксичностью - RU2380094C2
Код документа: RU2380094C2
Чертежи







Описание
Предпосылки создания настоящего изобретения
Область техники
Настоящее изобретение относится к способам доставки фармацевтических соединений во внутреннее ухо, предназначенных для лечения шума в ушах, индуцированного улитковой экситотоксичностью. Более подробно, настоящее изобретение относится к местному введению антагонистов рецептора N-метил-D-аспартата (NMDA) во внутреннее ухо для подавления рецептора NMDA, который опосредует аномальную активность слухового нерва, которая возникает в результате острой, повторной, пролонгированной или хронической улитковой экситотоксичности, вызванной явлениями, такими как акустическая травма, пресбиакузис, ишемия, аноксия, лечение одним или более определенными ототоксичными лекарственными средствами или внезапная глухота, и, таким образом, для подавления шума в ушах, возникающего в результате таких явлений.
Предшествующий уровень техники
Шум в ушах или ощущение шума при отсутствии внешней звуковой стимуляции является распространенным нарушением функции внутреннего уха. Установлено, что 8,6 миллионов американцев, что составляет приблизительно 3% населения США, страдают от хронического шума в ушах (Centers for Disease Control and Prevention, Vital and Health Statistics, Series 10, #200, окт. 1999). По данным Американской ассоциации разговорной речи и слуха (American Speech-Language-Hearing Association, ASHA) миллион или более человек считают, что шум в ушах отрицательно влияет на образ жизни (0,3% населения). По данным обследования населения Европы установлено, что от 7 до 14% населения жалуются врачам на шум в ушах, в то время как приблизительно от 1 до 2,4% населения страдают от шума в ушах, который потенциально нарушает нормальный образ жизни (Vesterarger V., British Medical Journal, т.314, №7082, с.728-731 (1997)).
Несмотря на широкую распространенность шума в ушах и его значительное влияние на здоровье и качество жизни людей, страдающих от него, в настоящее время способ его эффективного лечения отсутствует. Существующие в настоящее время подходы к лечению шума в ушах включают отказ от ототоксичных лекарственных препаратов, снижение количества потребляемых спиртных напитков, кофеина и никотина, снижение стресса, использование носимых устройств для маскирования фоновых шумов и шума в ушах (некоторые из них используют в комбинации со слуховыми аппаратами), поведенческую терапию, такую как гипноз, когнитивную терапию и биообратную связь, терапию переобучения к существованию с шумом в ушах (TRT), фармакологические и другие дополнительные способы лечения.
Шум в ушах не является заболеванием, а, скорее, является общим симптомом различных нарушений слуха, как, например, боль сопровождает множество различных заболеваний. В большинстве случаев указанное заболевание связано с индуцированной шумом потерей слуха, пресбиакузисом и болезнью Меньера
(Nicolas-Puel и др., International Tinnitus Journal, т.8 (1), c.37-44 (2002)). Другие более редкие причины включают лечение ототоксичными лекарственными средствами (аминогликозидные антибиотики, большие дозы петлевых диуретиков, нестероидные противовоспалительные лекарственные средства и определенные химиотерапевтические агенты), сниженный кровоток в сосудах (ишемия), аутоиммунные процессы, инфекционные заболевания, звукопроводящая тугоухость, отосклероз, травму головы и т.п. В более 90% случаев шум в ушах связан с потерей слуха известной природы, и в более 70% случаев причина шума в ушах связана с внутренним ухом (Nicolas-Puel и др., International Tinnitus Journal, т.8 (1), с.37-44 (2002)).
В течение последних 10 лет основные достижения в исследовании физиопатологии внутреннего уха привели к установлению ключевой роли синаптического комплекса внутренних волосковых клеток в развитии шума в ушах, индуцированного улитковой экситотоксичностью, которая является наиболее распространенной причиной возникновения шума в ушах. Экситотоксичность, впервые описанная в работе Olney и др., J. Neuropathol. Exp. Neurol., т.31 (3), с.464-488 (1972), в основном характеризуется избыточным синаптическим высвобождением глутамата, который является наиболее важным нейромедиатором центральной нервной системы и слуховой системы. Он активирует постсинаптические глутаматные рецепторы (ионотропный и метаботропный), что приводит к деполяризации и нейрональному возбуждению. Однако, если активация рецептора становится избыточной вследствие избыточного высвобождения глутамата, как в случае экситотоксичности, происходит повреждение нейронов-мишеней и в конечном итоге их гибель (Puel J.L, Prog Neurobiol., т.47 (6), с.449-76 (1995)).
Улитковая экситотоксичность возникает как при действии избыточного шума, такого как в случае острой или повторной акустической травмы (которая приводит к индуцированной шумом потере слуха или пресбиакузису), внезапной глухоты или аноксии/ишемии (Pujol and Fuel, Ann. NY Acad. Sci., т.884, с.249-254 (1999)), так и при лечении одним или более определенными ототоксичными лекарственными средствами. Высвобождение избыточных количеств глутамата индуцируется избыточным давлением звука, попадающего в улитку в случае акустической травмы, или сниженным кровотоком в направлении регулируемой глутаматом системы в случае аноксии/ишемии и, соответственно, внезапной глухоты. Во всех случаях экситотоксичность характеризуется двухстадийным механизмом: сначала происходит острое набухание афферентных дендритов типа I, опосредованное ионотропными глутаматными рецепторами, которое приводит к разрушению постсинаптических структур и к потере функции. В течение 5 сут наблюдается синаптическое восстановление (неосинаптогенез) с полным или частичным восстановлением улитковых потенциалов (Puel и др., Acta Otolaryngol., т.117 (2), с.214-218 (1997)). Во второй фазе экситотоксичности, которая развивается после значительного и/или повторного повреждения, происходит запуск каскада метаболических событий, вызванный потоком ионов кальция, который приводит к гибели нейронов спиральных нервных узлов.
Улитковая экситотоксичность может индуцировать шум в ушах за счет разрыва постсинаптических структур и, при условии, что разрыв не является конечным, последующего неосинаптогенеза в синаптическом комплексе внутренних волосковых клеток (Puel и др., Audiol. Neurootol., т.7 (1), с.49-54 (2002)). Ключевую роль в функциональном восстановлении после экситотоксичности играют рецепторы NMDA, которые не вовлечены в активность волокон слухового нерва в физиологических условиях (Puel и др., Audiol. Neurootol., т.7 (1), с.49-54 (2002)), а регулируются с повышением функции в процессе неосинаптогенеза (Puel и др., С.R. Acad. Sci. III., т.318 (1), 67-75 (1995)), в основном вследствие их высокой проницаемости для ионов кальция (Са2+) (Sattler и Tymianski, Mol. Neurobiol., т.24 (1-3), с.107-129 (2001)). Как было установлено на модели механизмов синаптического улиткового восстановления у животных, блокировка рецепторов NMDA при местном введении антагониста рецептора NMDA, D-AP5, замедляет функциональное восстановление и повторный рост слуховых дендритов (Gervais D'Aldin и др., Int. J. Dev. Neurosci., т.15 (4-5),
с.619-629 (1997)). Таким образом, можно заключить, что глутамат кроме его роли в качестве быстрого возбуждающего нейромедиатора играет нейротропную роль через активацию рецепторов NMDA.
Предполагается, что регуляция в повышением уровня мРНК рецепторов NMDA, индуцируемая улитковой экситотоксичностью, вызывает анормальное спонтанное «сгорание» волокон слухового нерва, что может восприниматься как шум в ушах (Puel J.-L. и др., Audiol. Neurootol, т.7 (1), с.49-54 (2002)). В процессе неосинаптогенеза афферентные дендриты находятся в критическом состоянии и, следовательно, чувствительны к возбуждению при активации рецепторов NMDA. Чтобы исключить любое подобное аномальное возбуждение и, следовательно, шум в ушах, который может продолжаться практически до бесконечности вследствие незавершенного неосинаптогенеза, существует крайняя необходимость в разработке способа лечения, при котором оказывается антагонистическое действие на рецепторы NMDA. Было установлено, что при локальном введении антагонистов рецепторов NMDA в улитку наблюдается подавление экситотоксичности, индуцированной акустической травмой или ишемией (Duan и др., Proc. Natl. Acad. Sci. USA, т.97 (13), с.7597-7602 (2000), Puel, Prog. Neurobiol, т.47 (6), с.449-476 (1995); Puel и др., J. Сотр. Neurol., т.341 (2), с.241-256 (1994)). Поскольку экситотоксичность можно блокировать также при введении 2-амино-3-(3-гидрокси-5-метилизоксазол-4-ил)пропионата (АМРА) или антагонистов каинатного рецептора, т.к. с их участием происходит острое набухание афферентных дендритов (Puel и др., J. Comp. Neurol., т.341 (2), с.241-256 (1994)), данный способ лечения может оказывать значительный отрицательный эффект на слуховую функцию. Так как возбудительная нейротрансмиссия между внутренними волосковыми клетками и волокнами слуховых нервов в основном опосредуется рецепторами АМРА (Ruel и др., J. Physiol. London, т.518, с.667-680 (1999)), их блокировка подавляет не только нежелательную избыточную стимуляцию слухового нерва, но также и требуемое стандартное возбуждение и, таким образом, может вызывать потерю слуха.
Предполагаемое вовлечение рецепторов NMDA в развитие шума в ушах было подтверждено только при исследовании in vivo на поведенческой модели индуцированного салицилатом шума в ушах (Guitton и др., J. of Neuroscience, т.23 (9), с.3944-3952 (2003)). Поведенческая модель, которая разработана для оценки шума в ушах, поскольку шум в ушах нельзя наблюдать напрямую, основана на принципе активного уклонения: животное запрыгивает на шест, если слышит определенные звуки. Введение салицилата приводит к значительному повышению числа прыжков даже в отсутствии внешних звуков (ложная ответная реакция), указывая на ощущение шума в ушах. После доставки антагонистов NMDA МК-801, 7-СК и гациклидина в улитки животных через круглое отверстие мембраны число ложных ответов значительно снижается, указывая на подавление шума в ушах.
Несмотря на то что полученные результаты впервые свидетельствуют о подтверждении участия рецепторов NMDA в развитии шума в ушах, их нельзя однозначно применять ко всем нарушениям внутреннего уха, поскольку индуцированный салицилатом шум в ушах является очень специфической формой шума в ушах. Уже более 100 лет известно, что салицилат, активный компонент аспирина, в больших дозах вызывает шум в ушах (Cazals Y., Prog. Neurobiol., т.62. с.583-631 (2000)). Он может вызывать ощущения, аналогичные шуму в ушах, как в случае улитковой экситотоксичности или в других случах различной природы, но такой шум в ушах обычно обратим и основан на определенном молекулярном механизме. Применение мефенамата, известного ингибитора циклооксигеназы, вместо салицилата также приводит к увеличению числа ложных ответов, что позволяет предположить наличие взаимосвязи индуцированного салицилатом шума в ушах с ингибированием пути циклооксигеназы. В то время как шум в ушах, вызванный улитковой экситотоксичностью, является результатом каскада опосредованных глутаматом процессов, приводящих к регуляции с повышением уровня мРНК рецепторов NMDA, индуцированный салицилатом шум в ушах опосредован изменениями в метаболизме арахидоновой кислоты, см., например, Cazals Y., Prog. Neurobiol., т.62, с.583-631 (2000)). Было установлено, что салицилат ингибирует активность циклооксигеназы (см., например, Vane и Botting, Am. J. Med., т.104, 2S-8S (1998)). Полученные данные свидетельствуют о том, что арахидоновая кислота усиливает электроток в участках рецепторов NMDA (Miller и др., Nature, т.355,
с.722-725 (1992); Horimoto и др., NeuroReport, т.7, с.2463-2467 (1996); Casado и Ascher, J. Physiol., т.513, с.317-330 (1998)). По данным электрофизиологических исследований установлено, что арахидоновая кислота повышает степень открытия канала рецептора NMDA в различных системах, включая тучные клетки мозжечка, диссоциированные пирамидальные клетки, кортикальные нейроны и гипокампальные срезы у взрослых пациентов (см., например. Miller и др., Nature, т.355, с.722-725 (1992); Horimoto и др., NeuroReport, т.7, с.2463-2467 (1996); Yamakura и Shimoji, Prog. Neurobiol., т.59, с.279-298 (1999)). В отличие от шума в ушах, индуцированного экситотоксичностью, в данном случае отсутствует морфологическое повреждение синаптического комплекса внутренних волосковых клеток и прежде всего синаптических окончаний, вовлеченных в развитие индуцированного салицилатом шума в ушах.
В патенте США №5716961 (Sands) описано введение антагониста, специфичного к рецептору NMDA, с целью лечения шума в ушах. На клеточной культуре наблюдались нейрозащитные свойства указанного антагониста в случае глутаматной экситотоксичности. Однако фармацевтическое действие соединения и эффективность в патофизиологических условиях in vivo не описаны, т.е. нет взаимосвязи с шумом в ушах, индуцированным улитковой экситотоксичностью, что является серьезным недостатком в связи со сложностью строения синаптического комплекса внутренних волосковых клеток. В указанном патенте описано также пероральное введение антагониста рецептора NMDA и обсуждается местное введение только, если пациент не может глотать или возникают сложности при пероральном введении. Местное введение обсуждается в общем виде в форме «растворов, лосьонов, мазей, бальзамов и т.п.».
Системное введение антагонистов рецепторов NMDA для лечения нарушений внутреннего уха в большинстве случаев является неэффективным, поскольку улитка аналогично мозгу защищена биологическим барьером. Для достижения требуемого терапевтического эффекта требуются относительно высокие дозы, но максимально переносимые дозы ограничиваются наличием различных побочных эффектов антагонистов рецепторов NMDA, таких как снижение способности к обучению, памяти и подвижности. По данным различных испытаний на пациентах при лечении нарушений ЦНС человека антагонистами рецепторов NMDA установлено, что уровни в плазме после системного введения значительно ниже требуемых для максимальной нейрозащиты (на модели животных), т.к. клинические дозы необходимо снижать вследствие ряда отрицательных действий на ЦНС, кататонии, повышенного кровяного давления и анестезии (Кеmр и McKernan, Nature Neuroscience, т.5, с.1039-1042 (2002)). С другой стороны, было установлено, что местное введение антагониста рецепторов NMDA-AMPA, кароверина, во внутреннее ухо приводит к повышенной внутриулитковой концентрации и не приводит к повышению вторичной концентрации в плазме и цереброспинальной жидкости, которые наблюдаются при системном введении (Chen et al., Audiol. Neurootol., т.8, с.49-56 (2003)).
В патенте США №6066652 (Zenner и др.) описан способ лечения шума в ушах при введении адамантана, известного анатагониста рецепторов NMDA. Авторы описывают результаты клинических испытаний системного введения, свидетельствующие о снижении шума в ушах в процессе лечения. В патенте обсуждается гипотеза для объяснения полученных данных в связи с участием внешних волосковых клеткок и пресинапса, при этом роль рецепторов NMDA не упоминается.
Как указано выше, несмотря на то что существует несколько указаний, подтверждающих предположение о том, что рецепторы NMDA играют важную роль в развитии шума в ушах, индуцированного улитковой экситотоксичностью, молекулярные механизмы такого нарушения еще не определены, и, следовательно, нельзя однозначно предсказать, будет ли использование антагонистов рецепторов NMDA эффективно блокировать указанный тип шума в ушах. Для подтверждения гипотезы и разработки специфических и действительно эффективных способов лечения существует необходимость в дальнейших патофизиологических исследованиях развития шума в ушах.
Краткое описание сущности настоящего изобретения
Настоящее изобретение относится к способам профилактики и/или лечения шума в ушах, индуцированного улитковой экситотоксичностью у человека. Способы включают введение человеку терапевтически эффективного количества композиции, содержащей антагонист рецептора NMDA. Согласно способу лечения шума в ушах вводимый антагонист рецептора NMDA эффективно подавляет или снижает опосредованную рецептором NMDA аномальную активность слухового нерва человека, нуждающегося в таком лечении. При профилактике шума в ушах вводимый антагонист рецептора NMDA позволяет предотвратить развитие опосредованной рецептором NMDA аномальной активности слухового нерва у человека, нуждающегося в таком лечении. Шум в ушах, который требуется предотвратить и/или лечить, связан с акустической травмой, пресбиакузисом, ишемией, аноксией, лечением одним или более ототоксичными лекарственными средствами, внезапной глухотой или другими явлениями, связанными с улитковой экситотоксичностью.
Краткое описание фигур
На фигуре 1 показаны результаты измерений потенциала действия соединения (CAP)
через 7 сут после травмы у контрольных животных. Потерю слуха, вызванную акустической травмой, оценивали при регистрации CAP через 7 сут после травмы. В день 7 после акустической травмы наблюдается четкий сдвиг пороговой величины (максимум 13 дБ±2,0 при 10 кГц).
На фигуре 2 показаны измерения числа баллов и числа ложных ответных реакций после акустической травмы у контрольных животных. (А) Акустическая травма приводит к снижению числа правильных поведенческих ответных реакций на звуковую стимуляцию с последующим частичным восстановлением в течение времени, что свидетельствует об индуцированной потере слуха. (В) Число ложных ответных реакций значительно отличается среди исследованных животных после акустической травмы. У животных группы 1 шум в ушах не наблюдался, у животных группы 2 возникал только временный шум в ушах, в то время как у животных группы 3 возникал сначала временный шум в ушах, а затем стойкий шум в ушах.
На фигуре 3 показано, что потеря волосковых клеток в зависимости от потери слуха, вызванной акустической травмой, не играет важной роли в развитии шума в ушах. Лечение препаратом D-JNKI-1 предотвращает потерю слуха после острой акустической травмы, как установлено, за счет быстрого восстановления уровня после травмы (А), но не оказывает значительного влияния на предотвращение шума в ушах, т.к. распространенность и характеристики шума в ушах не отличаются от наблюдаемых параметров для нелеченных животных (В).
Данные, показанные на фигуре 4, свидетельствуют о том, что при местном введении антагониста рецепторов NMDA 7-СК через круглое отверстие мембраны наблюдается предотвращение шума в ушах. (А) Среднее поведенческое число баллов снижается в день 1 по сравнению с днем 0 и последовательно восстанавливается, однако улучшение происходит медленнее, чем у нелеченных животных. (В) Местное введение антагониста рецепторов NMDA 7-CK приводит к подавлению стойкого шума в ушах, индуцированного улитковой экситотоксичностью, наблюдались только случаи временного шума в ушах.
Данные, показанные на фигуре 5, свидетельствуют о том, что при местном введении антагониста рецепторов NMDA S-(+)-кетамина через круглое отверстие мембраны наблюдается предотвращение шума в ушах. (А) Среднее поведенческое число баллов снижается в день 1 по сравнению с днем 0 и последовательно восстанавливается, однако улучшение происходит медленнее по сравнению с нелеченными животными. (В) При местном введении антагониста рецепторов NMDA S-(+)-кетамина наблюдается подавление стойкого шума в ушах, индуцированного улитковой экситотоксичностью, наблюдались только случаи временного шума в ушах.
На фигуре 6 показано, что акустическая травма приводит к значительному морфологическому повреждению синаптического комплекса сенсорных волосковых клеток внешнего уха (ОНС) и волосковых клеток внутреннего уха (IHC) в отличие от последствий введения салицилата. Стереоструктура ресничных узлов ОНС и IHC сохраняется после введения салицилата через 2 сут (6А), в то время как у животных после акустической травмы наблюдается значительное повреждение ресничных узлов ОНС наряду с нарушением структуры и в некоторых случаях даже слиянием (указано черными стрелками) ресничных узлов IHC (6D). При небольшом увеличении в синаптическом комплексе IHC наблюдается отсутствие ультраструктурных аномальностей после введения салицилата (6В), в то время как для травмированных животных наблюдается значительное и обширное набухание (указано стрелками) радиальных афферентных дендритов в базальном стволе IHC в диапазоне использованных частот, что служит подтверждением экситотоксичности (6Е). Следует отметить наличие многочисленных вакуолей в верхушечной части IHC и анормальную форму ресничных узлов (указано стрелками). При большем увеличении в базальном стволе IHC также наблюдается отсутствие аномальных изменений у животных после введения салицилата (6С). Два афферентных нервных окончания (указанных буквами а1 и а2) являются нормальными, и отчетливо наблюдается присутствие характерного пресинаптического тела на поверхности афферента а2. В отличие от этой картины на фигуре 6F показаны набухший (а1) и разрушенный (а2) нервные окончания, а также пресинаптическое тело на афференте а2. Масштаб для фигур А и D составляет 10 мкм (сканирующая электронная микроскопия), для фигур В и Е - 5 мкм и для фигур С и F - 0,25 мкм (для всех фигур просвечивающая электронная микроскопия).
На фигуре 7 показан уровень экспрессии субъединицы NR1 улиткового рецептора NMDA после обработки салицилатом или после акустической травмы, которую оценивали методом иммунного вестернблотинга. Как показано на фигуре, обработка салицилатом не индуцирует какой-либо значительной модификации экспрессии субъединицы NR1 рецептора NMDA (на 4% выше по сравнению с контрольными животными). В отличие от этой картины акустическая травма приводит к выраженной сверхэкспрессии через 5 сут после нанесения травмы (на 50% выше по сравнению с контрольными животными), что согласуется с симптомами устойчивого шума в ушах. Однако через 24 ч после травмы отсутствует заметная сверхэкспрессия (+8%), что позволяет предположить существенное различие в механизмах временного и стойкого шума в ушах после акустической травмы. Для определения идентичности молекулярной массы субъединицы NR1 из мозга и улитки проводили анализ тканей контрольных животных методом иммуноблотинга.
Подробное описание вариантов осуществления настоящего изобретения
Введение
Настоящее изобретение основано на экспериментальных данных, полученных на модели шума в ушах у экспериментальных животных, индуцированного улитковой экситотоксичностью. Настоящее изобретение относится к применению фармацевтических соединений, которые проявляют селективную антагонистическую активность в отношении рецепторов NMDA. Не основываясь на какой-либо теории, можно предположить, что антагонист рецептора NMDA по настоящему изобретению связывается с рецептором NMDA по одному из множества участков связывания, блокируя таким образом (частично или полностью) открытие ионного канала рецептора. Рецептор NMDA активируется по сложному механизму, т.е. при связывании с глутаматом и глицином, которое требуется для открытия ионного канала и обеспечения потока кальция (Kemp и McKernan, Nature Neuroscience, т.5, с.1039-1042 (2002)). Глутамат выполняет роль нейромедиатора при его высвобождении из пресинаптических окончаний зависимым от активности способом, в то время как глицин действует в качестве модулятора, который присутствует во внеклеточной жидкости на постоянном уровне. Интеграл ионного канала до рецептора NMDA блокируется магнием в зависимости от напряжения, а при деполяризации блокирование дезактивируется. Связывание антагониста рецептора NMDA с любым из трех участков связывания с антагонистом приводит к частичной или полной блокировке рецептора NMDA, и, следовательно, блокируется или снижается степень открытия ионного канала и деполяризация нейрона. Антагонист рецептора NMDA таким образом подавляет аномальное возбуждение слухового нерва через регулируемые с увеличением уровня рецепторы NMDA, которое опосредовано улитковой экситотоксичностью и, таким образом, также снижается или устраняется ощущение шума в ушах. После доставки антагонистов рецепторов NMDA данные рецепторы уже не регулируются с увеличением уровня. При специфическом действии на рецепторы NMDA, которые регулируются с увеличением только в патофизиологических условиях, для подавления аномальной активности слухового нерва, опосредованной рецептором NMDA, можно исключить побочное действие на слух, поскольку нормальная слуховая нейротрансмиссия первично опосредуется рецепторами АМРА.
В одном варианте осуществления в настоящем изобретении предлагается способ лечения шума в ушах, индуцированного улитковой экситотоксичностью у человека. Указанный способ включает введение человеку терапевтически эффективного количества фармацевтической композиции, включающей антагонист рецептора NMDA. Антагонист рецептора NMDA вводят в количестве и в течение периода времени, которые являются эффективными для подавления или снижения аномальной активности слухового нерва, опосредованной рецептором NMDA, у человека, нуждающегося в таком лечении. Подавление или снижение аномальной активности слухового нерва, опосредованной рецептором NMDA, приводит к подавлению или снижению шума в ушах у леченного пациента. В предпочтительном варианте воплощения указанного способа антагонист рецептора NMDA вводят после проявления явления, индуцирующего улитковую экситотоксичность у человека или в процессе этого явления.
В другом варианте осуществления настоящего изобретения предлагается способ профилактики шума в ушах, индуцированного улитковой экситотоксичностью у человека. Указанный способ включает введение человеку терапевтически эффективного количества фармацевтической композиции, включающей антагонист рецептора NMDA. Антагонист рецептора NMDA вводят в количестве и в течение периода времени, которые являются эффективными для профилактики аномальной активности слухового нерва, опосредованной рецептором NMDA, у человека, нуждающегося в таком лечении. Профилактика аномальной активности слухового нерва, опосредованной рецептором NMDA, позволяет предотвратить шум в ушах у леченного пациента. В предпочтительном варианте воплощения указанного способа антагонист рецептора NMDA вводят перед проявлением явления, индуцирующего улитковую экситотоксичность у человека, или в процессе этого явления. Объектом настоящего изобретения является профилактика и/или лечение шума в ушах, индуцированного улитковой экситотоксичностью. Шум в ушах, индуцированный улитковой экситотоксичностью, не обязательно должен быть вызван явлением определенного вида, однако указанное явление должно вызывать экситотоксичность и индуцировать шум в ушах. Природа указанного явления не обязательно должна быть известной или описанной в связи с профилактикой и/или лечением шума в ушах. Шум в ушах, который необходимо предотвратить или вылечить, является острым, подострым или хроническим.
В предшествующем уровне техники известно, что шум в ушах возникает в результате улитковой экситотоксичности после акустической травмы, пресбиакузиса, ишемии, аноксии, лечения одним или более ототоксичными лекарственными средствами или внезапной глухоты. Профилактика шума в ушах, индуцированного акустической травмой, описана в настоящем описании в разделе Примеры. Специалисты в данной области могут ожидать с большой степенью достоверности, что предлагаемые в настоящем способы лечения по настоящему изобретению являются эффективными для профилактики и/или лечения шума в ушах, индуцированного не только акустической травмой, но и пресбиакузисом, ишемией, аноксией, лечением одним или более ототоксичными лекарственными средствами или внезапной глухотой в связи с одинаковой причиной возникновения шума в ушах в результате всех указанных явлений. Акустическая травма, пресбиакузис, ишемия, аноксия, лечение одним или более ототоксичными лекарственными средствами или внезапная глухота являются острыми, повторными или продолжительными. Специалисты в данной области могут ожидать, что способы по настоящему изобретению являются эффективными для профилактики и/или лечения шума в ушах, индуцированного другими причинами, отличными от акустической травмы, пресбиакузиса, ишемии, аноксии, лечения одним или более ототоксичными лекарственными средствами или внезапной глухоты, но только в том случае, если шум в ушах индуцирован улитковой экситотоксичностью. Улитковая экситотоксичность, возникающая в результате указанных явлений, является острой, повторной или продолжительной в зависимости от продолжительности явления, индуцирующего улитковую экситотоксичность.
Термин «ототоксичное лекарственное средство», использованный в данном контексте, означает любое соединение, которое характеризуется при терапевтическом введении способностью индуцировать шум в ушах в результате улитковой экситотоксичности. Улитковая экситотоксичность возникает в результате побочного действия при введении ототоксичных лекарственных средств, которые в большинстве случаев вводят в качестве терапевтических соединений для лечения состояний, которые обычно не связаны со слухом или слуховыми ощущениями. Указанные ототоксичные лекарственные средства включают, например, аминогликозидные антибиотики и химиотерапевтические агенты, такие как цисплатин. Корреляция использования таких ототоксичных лекарственных средств и случаев возникновения шума в ушах известны в данной области техники, но в настоящее время способы эффективного лечения не описаны. Использование большого числа указанных лекарственных средств в настоящее время ограничено их ототоксичным действием, таким образом разработка способа снижения такого действия позволит расширить диапазон использования указанных средств в терапии.
Соединения
Фармацевтические композиции на основе соединений, предназначенных для введения способами по настоящему изобретению, включают селективный антагонист рецептора NMDA, который связывается с рецептором NMDA либо по конкурентному участку связывания антагониста рецептора NMDA, либо по неконкурентному участку связывания антагониста рецептора NMDA, расположенному в области ионного канала, или по участку связывания глицина. Примеры соединений включают, без ограничения перечисленным, ифенпродил, кетамин, мемантин, дизоцилпин (МК-801), гациклидин, траксопродил (неконкурентные антагонисты рецепторов NMDA), D-2-амино-5-фосфонопентановую кислоту (D-AP5), 3-((±)2-кар6оксипиперазин-4-ил)пропил-1-фосфоновую кислоту (СРР), конантокины (конкурентные антагонисты рецептора NMDA), 7-хлоркинуренат (7-СК) и ликостинел (антагонисты участков связывания глицина). Антагонистом рецептора NMDA для использования по настоящему изобретению является любое производное, аналог и/или энантиомерная форма антагониста рецептора NMDA, которые сохраняют функцию антагониста рецептора NMDA. Композиция для введения по настоящему изобретению включает один или более антагонистов рецептора NMDA.
Согласно настоящему изобретению в качестве антагонистов рецепторов NMDA предпочтительно используют арилциклоалкиламины. Класс арилциклоалкиламинов (сохраняющих функцию антагонистов рецепторов NMDA) включает соединения общей формулы I:
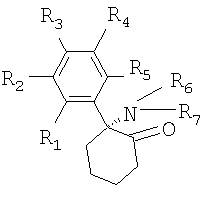
где R1, R2, R3, R4 и R5 независимо означают Н, Cl, F, I, СН3, СН2СН3, NH2, ОН или СООН, a R6 и R7 независимо означают Н, СН3, СН2СН3, ОН, Cl, F или наиболее предпочтительно I.
Предпочтительным арилциклоалкиламином является кетамин (C13H16ClNO (свободное основание), 2-(2-хлорфенил)-2-(метиламино)циклогексанон), структурная формула которого представлена формулой II:

Любое производное, аналог и/или энантиомерную форму кетамина или арилциклоалкиламина формул II или I соответственно можно использовать в качестве анатагонистов рецептора NMDA.
Кетамин является неконкурентным антагонистом рецептора NMDA, который связывается с участком связывания РСР, отдельным участком связывания в составе комплекса рецептора NMDA, который расположен в ионном канале, блокируя таким образом трансмембранный поток ионов. Кетамин получают способами, описанными в патенте США №3254124. Более предпочтительным соединением является (S)-кетамин, поскольку его аффинность связывания с участком связывания РСР в составе рецептора NMDA в 3-4 выше по сравнению с (R)-кетамином (Vollenweider и др., Eur. Neuropsychopharmacol, т.7, с.25-38 (1997)). Синтез оптических изомеров проводят, как описано в патентах DE 2062620 или WO 01/98265, включенных в настоящее описание в качестве ссылок. В предпочтительном варианте осуществления настоящего изобретения кетамин вводят также в виде гидрохлорида (C13H17Cl2NO), образующегося из свободного основания (гидрохлорид кетамина).
Другие предпочтительные соединения по настоящему соединению принадлежат к классу замещенных хиназолинов, которые сохраняют функцию антагонистов NMDA. Хиназолиновые соединения по настоящему изобретению в качестве антагонистов NMDA характеризуются общей формулой III:

где R'1, R'2, R'3 и R'4 независимо означают H, Cl, F, I, СН3, СН2СН3, NH2, ОН или COOH, a R'5 и R'6 независимо означают СООН, ОН, CONH2, H, СН3, СН2СН3, ОН, Cl, F и наиболее предпочтительно I.
Наиболее предпочтительными соединениями класса хиназолинов являются 7-хлоркинуренаты (7-СК) формулы IV:

Любые производные, энантиомеры или аналоги 7-СК формулы IV или любого другого соединения формулы III можно использовать в способах по настоящему изобретению.
Способы введения и композиции
Доставку соединений в организм пациента осуществляют пероральным, внутривенным, подкожным, внутрибрюшинным, внутримышечным, ректальным или местным способами, при этом наиболее предпочтительным является местное введение во внутреннее ухо, поскольку введение терапевтически эффективных доз при системном введении может вызвать нежелательные побочные действия. Специалистам в данной области техники представляется очевидным, что введение антагониста NMDA по настоящему изобретению осуществляют множеством способов. Единственным требованием при введении соединений по настоящему изобретению является следующее условие: терапевтически эффективное количество фармацевтической композиции, включающей антагонист NMDA, должно достигать участка опосредованной рецептором NMDA аномальной активности слухового нерва пациента.
Введение соединения во внутреннее ухо осуществляют множеством способов доставки. Такие способы включают устройства или носители лекарственных средств для направленного транспорта и/или доставки соединения к мишени, т.е. к мембранам круглого или овального окон улитки, где средство диффундирует во внутреннее ухо или активирует его вливание. Примеры включают ушные тампоны (см., например, патент США №6120484, Silverstein), катетеры для круглого окна улитки (см., например, патенты США №5421818, 5474529, 5476446, 6045528, Arenberg, или №6377849 и 2002/0082554, Lenarz) или различные виды гелей, пенок, фибринов или других носителей лекарственных средств, которые вводят в нишу круглого окна или овального окна и смешивают с соединением для замедленного высвобождения (см., например, документы WO 97/38698, Manning; Silverstein и др., Otolaryngology - Head and Neck Surgery, т.120, №5, с.649-655 (1999); Balough и др., Otolaryngology - Head and Neck Surgery, т.119, №5, с.427-431 (1998)). Указанные способы включают также применение устройств, которые вставляют в улитковый канал или в другой отдел улитки (см., например, патент США №6309410, Kuzma). Соединение вводят также во внутреннее ухо инъекцией через барабанную перепонку, при этом среднее ухо или его часть заполнена раствором или другим носителем соединения (см., например, Hoffer и др., Otolaryngologic Clinics of North America, т.36, №2, с.353-358 (2003)). Предпочтительным способом введения во внутреннее ухо является диффузия через мембрану внутреннего окна, которая является относительно легкодоступной из пространства внутреннего уха, при этом внутреннее ухо остается неповрежденным, что позволяет таким образом исключить любые возможные проблемы, связанные с утечками внутриулитковых жидкостей.
Соединение в составе фармацевтической композиции по настоящему изобретению получают в форме фармацевтически приемлемой соли. Примеры таких солей включают, без ограничения перечисленным, соли органических кислот (например, уксусная, молочная, лимонная, яблочная, фумаровая, винная, стеариновая, аскорбиновая, янтарная, бензойная, метансульфоновая, толуолсульфоновая или памоевая кислоты), неорганических кислот (например, хлористоводородная, азотная, дифосфорная, серная или фосфорная кислоты) и полимерных кислот (например, дубильная кислота, карбоксиметилцеллюлоза, полиуксусная, полигликолевая кислоты или сополимеры полиуксусной и полигликолевой кислот).
Фармацевтические композиции, предназначенные для любого способа введения по настоящему изобретению, включают терапевтически эффективное количество активного ингредиента и, при необходимости, неорганический или органический, твердый или жидкий фармацевтически приемлемый носитель. Фармацевтические композиции, пригодные для местного введения во внутреннее ухо, включают водные растворы или суспензии, которые, например, в случае лиофилизированных композиций включают активный ингредиент в отдельности или в комбинации с носителем, получают непосредственно перед использованием. Они включают также гели, которые являются биодеградабельными или небиодеградабельными, водными или неводными или на основе микросфер. Примеры таких гелей включают, без ограничения перечисленным, полоксамеры, гуалуронаты, ксилоглюканы, хитозаны, полиэфиры, поли(лактиды), поли(гликолиды) или их сополимеры PLGA, изобутира-ацетат сахарозы и моноолеат глицерина. Фармацевтические композиции, пригодные для энтерального или парентерального введения, включают таблетки, или желатиновые капсулы, или водные растворы, или суспензии, как описано выше.
Фармацевтические композиции подвергают стерилизации и/или в них добавляют адьюванты, например консерванты, стабилизаторы, увлажнители и/или эмульгаторы, соли для регулировки осмотического давления и/или буферные вещества. Кроме того, в фармацевтические композиции при необходимости добавляют фармакологически активные вещества. Фармацевтические композиции получают известными в фармацевтике способами, например стандартным смешиванием, гранулированием, кондиционированием, растворением или лиофилизацией, при этом содержание активного ингредиента в таких композициях составляет приблизительно от 0,01 до 100%, предпочтительно приблизительно от 0,1 до 50% (в лиофилизированных препаратах вплоть до 100%).
В предпочтительном варианте фармацевтическую композицию по настоящему изобретению получают в виде состава для местного введения. Пригодными носителями для введения в ухо являются органические или неорганические вещества, фармацевтически приемлемые и не взаимодействующие с активными соединениями, например солевой раствор, спирты, растительные масла, бензиловые спирты, алкиленовые спирты, полиэтиленгликоли, триацетат глицерина, желатин, углеводы, такие как лактоза или крахмал, стеарат магния, тальк и вазелин. Указанные препараты стерилизуют и/или в них добавляют вспомогательные вещества, такие как замасливатели, консерванты, такие как тиомерсаль (например, 50%), стабилизаторы и/или увлажнители, эмульгаторы, соли для регуляции соматического давления, буферные вещества, красители и/или ароматизаторы.
При необходимости такие композиции также содержат один или более других активных ингредиентов. Композиции по настоящему изобретению для введения в ухо включают различные ингредиенты, включая другие биологически активные агенты, такие как антибиотики, например фторхинолоны, противовоспалительные агенты, такие как стероиды, кортизон, анальгетики, антипирин, бензокаин, прокаин и т.п.
Композиции по настоящему изобретению для местного введения включают другие фармацевтически приемлемые ингредиенты. В предпочтительных вариантах осуществления настоящего изобретения эксципиент для местного введения выбирают из агентов, которые при введении в ухо не ускоряют доставку в кровоток или ЦНС. Например, в основном эксципиент для местного введения не должен оказывать значительное окклюзионное действие, при котором повышается подкожное проникновение через слизистую в кровоток. Такие окклюзионные носители включают углеводородные основы, безводные поглощающие основы, такие как гидрофильное вазелиновое масло и безводный ланолин (например, аквафор) и основы типа эмульсии вода-в-масле, такие как ланолин и кольдкрем. Наиболее предпочтительные в основном неокклюзионные носители включают водорастворимые носители, такие как основы типа эмульсии масло-в-воде (кремы и гидрофильные мази) и водорасторимые основы, такие как носители на основе полиэтиленгликолей и водные растворы, образующие гели с различными агентами, такими как метилцеллюлоза, гидроксиэтилцеллюлоза и гидроксипропилметилцеллюлоза (например, гель KY).
Пригодные эксципиенты и носители для мебстного введения можно выбрать из известных для специалистов агентов, которые описаны в справочниках, таких как Remington's Pharmaceutical Sciences, т.18, Mark Publishing Co., Easton, PA (1990), прежде всего гл.87. Например, биологически активные агенты по настоящему изобретению можно смешивать с усиливающими агентами, которые повышают проницаемость агента.
Соединение вводят до того, как шум в ушах индуцирован экситотоксичностью, в процессе индуцирования или после него. Количество введенного соединения изменяется в зависимости от способа введения, продолжительности лечения, от состояния субъекта, нуждающегося в лечении, степени тяжести шума в ушах и эффективности использованного конкретного соединения, возраста, массы тела, общего состояния здоровья, пола, диеты, времени и способа введения, степени выведения активного вещества из организма, а также от комбинации лекарственных средств, которые следует подробно обсудить с лечащим врачом. Продолжительность лечения изменяется приблизительно от 1 ч до нескольких суток, недель или месяцев вплоть до хронического лечения. Терапевтически эффективное количество соединения для доставки изменяется в диапазоне приблизительно от 0,1 нг/ч до приблизительно 100 мкг/ч. Соединения по изобретению вводят стандартным способом, принятым для введения других соединений, предназначенных для введения в ухо. Например, кетамин вводят в ухо для лечения шума в ушах предпочтительно в дозе от приблизительно 10 мкг/30 мл до приблизительно 10000 мкг/30 мл, предпочтительно от приблизительно 500 мкг/30 мл до приблизительно 0,01-2 мкг в дозе. Термин «доза» для местного введения означает количество агента, введенного однократно, например приблизительно 0,05-1 мкг кетамина вводят в ухо в виде двух капель. Другие лекарственные средства для лечения шума в ушах, упомянутые в данном описании, вводят аналогичным способом с учетом эффективности лекарственного средства.
Термин «терапевтически эффективная доза» означает эффективное количество для подавления или снижения аномальной активности слухового нерва, опосредованной рецептором NMDA, у леченного субъекта. Терапевтически эффективная доза также означает эффективное количество для подавления или снижения шума в ушах у больного. Как указано выше, терапевтически эффективная доза изменяется в зависимости от выбранного для лечения специфического антагониста рецептора NMDA и от способа введения. Например, для введения антагониста рецептора NMDA внутривенно требуется более высокая доза по сравнению с дозой для введения той же самой фармацевтической композиции местным способом в круглое окно мембраны или в овальное окно мембраны уха. Кроме того, требуются более низкие дозы антагониста рецептора NMDA, так как антагонист рецептора NMDA по настоящему изобретению характеризуется более высокой аффинностью связывания с рецептором NMDA по сравнению с антагонистом рецептора NMDA, характеризующимся более низкой аффинностью связывания. Следовательно, предпочтительными являются антагонисты рецептора NMDA с более высокой аффинностью связывания. Как указано выше, (S)-кетамин, аффинность связывания которого с участком связывания РСР в 3-4 раза больше по сравнению с R-кетамином (Vollenweider и др., Eur. Neuropsychopharmacol, 7, 25-38 (1997)), является более предпочтительным для применения согласно способам по изобретению. Продолжительность лечения также изменяется в зависимости от конкретной формы шума в ушах, которую необходимо вылечить, то есть острая, подострая или хроническая форма. Рекомендуется предпочтительно использовать более кратковременное лечение, которое является достаточным, если шум в ушах не возникает повторно после прекращения лечения. Более продолжительное лечение необходимо для пациентов, у которых после кратковременного лечения шум в ушах остается устойчивым.
В настоящем изобретении прелагается также способ получения лекарственного средства, предназначенного для лечения или профилактики шума в ушах, прежде всего индуцированного улитковой экситотоксичностью (как описано в данном контексте), с использованием терапевтически эффективного количества фармацевтической композиции, содержащей антагонист рецептора NMDA, прежде всего эффективного для подавления или снижения аномальной активности слухового нерва, опосредованной рецептором NMDA. Прежде всего предпочтительным является применение соединения класса арилциклоалкиламинов и хиназолинов, предпочтительно применение соединения общей формулы I или III, более предпочтительно применение антагониста рецептора NMDA, выбранного из группы, включающей кетамин, 7-хлоркинуренат, D-AP5, МК 901 и гациклидин. Более того, предпочтительно применение фармацевтической композиции по изобретению, полученной в виде состава для местного введения, прежде всего в виде раствора, геля или другого состава с контролируемым высвобождением, мази или крема, или при введении активным способом доставки лекарственного средства, предназначенного для введения местным способом в круглое окно мембраны, или овальное окно мембраны внутреннего уха, или непосредственно во внутреннее ухо соответственно.
Примеры
Пример 1
Материалы и методы
В испытаниях использовали разработанную авторами модель животных с шумом в ушах, индуцированным улитковой экситотоксичностью, которую вызывают акустической травмой. Так как шум в ушах в основном нельзя наблюдать напрямую, а улитковая эститотоксичность не у всех индивидуумов вызывает шум в ушах, а также в связи с тем, что ощущение шума в ушах может исчезнуть всего через несколько часов после явления цитотоксичности или может продолжаться в течение длительного периода времени, определение и реализация таких моделей животных представляют значительную проблему. Например, при испытаниях для регистрации достаточного числа случаев шума в ушах и для наблюдения шума в ушах в течение определенного времени требуется большое число животных. В связи с невозможностью четко выявить наличие шума в ушах, индуцированного экситотоксичностью, рекомендуется проводить испытания на ранней стадии развития этого заболевания.
Эксперименты проводили в две стадии. На первой стадии регистрировали потерю слуха после острой акустической травмы и случаи возникновения шума в ушах без введения терапевтического соединения. На второй стадии исследовали эффективность трех фармацевтических соединений при подавлении шума в ушах: S-(+)-кетамин, антагонист рецептора NMDA (фирмы Sigma-Aldrich), 7-хлоркинуренат (7-СК, фирмы Sigma-Aldrich) (в качестве стандарта) - другой антагонист рецептора NMDA, который уже был исследован ранее на модели индуцированного салицилатом шума в ушах (Guitton и др., J. of Neuroscience 23 (9): 3944-3952 (2003)) и продукт D-JNKI-1, пептидный ингибитор N-концевой киназы c-Jun (Xigen S.A.), известный защитный агент против гибели слуховых волосковых клеток и потери слуха, вызванных акустической травмой (Wang и др., J. of Neuroseience 23 (24): 8596-8607 (2003)). Полученные на первой стадии результаты использовали в качестве контроля.
Животные
В экспериментах использовали крыс Long-Evans, так как известна их чрезвычайно высокая подвижность опорно-двигательного аппарата по сравнению с другими крысами. В ходе эксперимента животных помещали каждого в отдельности в клетку и выдерживали при постоянной температуре в течение цикла день/ночь 12 ч/12 ч. Все поведенческие испытания проводили в темноте, то есть в обычный период активности животных, причем каждое животное оценивали индивидуально приблизительно в одно и то же время. В свободное от эксперимента время животным обеспечивали свободный доступ к корму и воде. В эксперименте использовали всего 60 животных: 30 особей на первой стадии (25 особей оценивали поведенческим методом, а 5 особей электрофизиологическим методом), а 30 особей на второй стадии по 10 особей для каждого фармацевтического соединения.
Острая акустическая травма
Акустическую травму индуцировали непрерывным чистым тоном при 6 кГц, генерированным синтезатором сигналов фирмы Hewlett-Packard 8904A. Животных анестезировали и выдерживали при звуковом давлении 130 дБ (SPD) в течение 20 мин, причем звук подавали через программируемый аттенюатор с использованием наушника JBL 075, установленного в произвольном положении на уровне ушей и на расстоянии 10 см от головы животного. Уровень звука измеряли с использованием калиброванного микрофона Bruel and Kjaer (4314) и калиброванного усилителя Bruel and Kjaer (2606).
Подготовка к поведенческим испытаниям и проведение испытаний
Животных обучали активному уклонению (Guitton и др., J. of Neuroscience 23 (9): 3944-3952 (2003)). Поведенческие испытания проводили при оценке выполнения животными задания при подаче звука в клетку с электрическим дном и специальным столбом для запрыгивания. Животных обучали в течение 10 циклов, каждый в течение от 15 до 20 мин, и при подаче непрерывного стимула чистого тона (SPL) при 50 дБ в течение 3 с при частоте 10 кГц. Безусловный стимул подавали в форме электрошока в лапы животных (7 мА) в течение максимум 30 с, интервал между стимулами составлял 1 с. Электрошок отключали как только животное правильно запрыгивало на столб. Интервалы между попытками составляли по крайней мере 1 мин.
Оценку способности животных измеряли в виде баллов по числу правильных запрыгиваний на столб в ответ на звук. Если оценка поведения животного составляла по крайней мере 80% в трех последовательных циклах испытаний, такое животное считали успешно обученным и использовали в эксперименте.
Эксперименты проводили один раз в сутки и определяли число баллов и число ложных ответных реакций в течение одного цикла в течение 10 мин в ходе 10 попыток. Ложная ответная реакция означает запрыгивание на столб между испытаниями без звуковой стимуляции, то есть в течение периодов тишины. Предполагают, что такие ложные ответы связаны с ощущением шума в ушах, так как животные запрыгивают на столб как бы в ответ на звуковой стимул (Guitton и др., J. of Neuroscience 23 (9): 3944-3952 (2003)). Звуковые стимулы рандомизировали, а электрошок в лапы подавали только, если животное не запрыгивало на столб в ответ на звук.
Элекрофизиологический метод
Потенциал действия соединения (CAP) на слуховой нерв измеряли с использованием электрода, имплантированного в круглое окно мембраны животных (электрод сравнения устанавливали в мышцу шеи). Электрод сравнения и электрод, установленный в круглом окне улитки, припаяны к штекеру, закрепленному на голове животного. 10 тональных посылок в секунду (в течение 9 мс и с циклом повышение/падение 1 мс) генерировали из генератора произвольной функции (LeCroy Corp., model 9100R) и подавали в ухо животного через наушник JBL 075. В ходе эксперимента исследовали 10 частот (2, 4, 6, 8, 10, 12, 16, 20, 26 и 32) при уровне тональных посылок от 0 до 100 дБ SPL с шагом 5 дБ. Отклик ушного нерва усиливали (Grass P511K, Astro-Med Inc.), фильтровали (от 110 Гц до 3 кГц) и усредняли на компьютере (Dimension Pentium, Dell). Амплитуды CAP измеряли от пика к пику между первым отрицательным снижением N1 и последующей положительной волной Р1. Предел CAP определяли по интенсивности звука (в дБ SPL), которая требуется для индуцирования измеряемой ответной реакции (более 5 мкВ).
Фармакологические испытания
Животных анестезировали однократной дозой при внутрибрюшинной инъекции 0,3 мл/кг 6% фенобарбитала (Sanofi) и проводили операцию в асептических условиях сразу после первого цикла поведенческих испытаний (день 0). Две буллы вскрывали через задний ушной отдел (вскрытие со спины). После обнажения двух улиток на каждое круглое окно помещали тампон для гелей и пенок (Gelita tampon, B.Braun Medical AG), пропитанный 2,5 мкл искусственной перилимфы, содержащей фармацевтические соединения. Концентрация всех трех фармацевтических соединений составляла 50 мкМ. Затем буллы закрывали зубным цементом (Unifast, GC Corp.), раны дезинфицировали и зашивали. Затем животных подвергали действию травматического звука. Поведенческие испытания снова возобновляли через 24 ч после звуковой травмы (день 1) и повторяли их ежедневно в течение 8 суток.
Статистический метод
В каждом цикле поведенческих испытаний значимые параметры сравнивали двухфакторным методом (группа×время, повторные измерения по последнему фактору) дисперсионного анализа (ANOVA) для определения влияния измерений (влияние группы), влияния времени и взаимосвязи группа×время. Анализ ANOVA проводили с использованием критерия post hoc (критерий Turkey). Статистический анализ величины CAP проводили однофакторным методом ANOVA с использованием критерия Dunnett. Все результаты представлены в виде средних величин ± среднее отклонение.
Результаты
Стадия 1, в отсутствие терапевтического соединения
Как ожидалось, травматический звук приводит к стойкой потере слуха (испытания 5 особей электрофизиологическим методом). Как показано на фиг.1, устойчивый сдвиг порога при максимальной величине 13 дБ±2,0 наблюдается при 10 кГц в день 7 после акустической травмы (которую наносили в день 1).
Акустическая травма приводит также к снижению общего числа баллов (поведенческие испытания 25 особей). Как показано на фиг.2, число баллов значительно снижается от исходного высокого уровня в день 0 (то есть перед акустической травмой) 87%±1,6 до 59%±1,0 в день 1, в который наносили акустическую травму (p<0,001). В день 2 наблюдается частичное восстановление функции (69%±1,2) и в день 4 средний уровень возрастает до 80%±2,0. По данным статистического анализа результатов наблюдаемое снижение числа баллов является значимым (p<0,05), также как и за период от дня 2 до дня 8 (80%±1,4 в последний день). Сниженная способность животных правильно реагировать на использованный в экспериментах звуковой стимул согласуется с тем фактом, что индуцированная травматическим звуком потеря слуха значительно снижает их способность к восприятию звука на частоте акустического стимула.
Установлено также, что после акустической травмы число ложных ответных реакций значительно различается среди исследованных животных, как показано на фиг.2В. В одной группе животных (группа 1, n=11) совсем не наблюдается возрастания числа ложных реакций даже после акустической травмы (0,18 ложных ответов ± 0,12 в день 0 и день 1). Для остальных 14 животных наблюдается значительное увеличение ложных ответов от 0,34±0,13 в день 0 до 4,28±0,22 в день 1. Такое повышение является обратимым для 6 животных (группа 2), у которых число ложных ответов снижается до нормального уровня в день 2 и последующие дни. Однако для других 8 животных (группа 3) после временного увеличения наблюдается еще большее возрастание ложных ответов. Максимальное число ложных реакций в этой второй фазе составляет 3,87±0,29 в день 5, и эффект остается статистически значимым до дня 8 (2,25±0,25 ложных реакций в последний день испытаний). Иными словами, зарегистрировано первое обратимое возрастание, за которым следует устойчивое возрастание числа ложных ответных реакций на звуковой стимул. Это означает, что после акустической травмы у некоторых животных шум в ушах совсем не наблюдается (группа 1), у некоторых наблюдается только во временной форме (группа 2), а у некоторых животных сначала наблюдается временная форма, а затем в течение остального периода испытаний стойкая форма. Такие результаты в основном соответствуют развитию заболевания у человека.
Стадия 2, введение терапевтических соединений
Для исследования взаимосвязи механизма развития шума в ушах после акустической травмы и гибели волосковых клеток улитки и/или после индуцирования экситотоксичности соединение D-JNKI-1 вводили в круглое окно мембраны. Как показано на фиг.3А, фармацевтическое соединение не устраняет снижение числа баллов в период от дня 0 (88%±2,5) до дня 1 (65%±1,7). Однако такое лечение приводит к быстрому и полному восстановлению функции до исходного уровня перед травмой в день 2 (90%±2,6), который затем сохраняется (92%±2,0 в день 8).
Несмотря на способность соединения D-JNKI-1 предотвращать потерю слуха после акустической травмы указанное соединение не оказывает значительного действия на число ложных ответных реакций и таким образом не предотвращает шум в ушах. Как показано на фиг.3В, графики ложных реакций практически идентичны по сравнению с графиками для контрольной группы (фиг.2В): для группы 1 (n=4) ложные ответы совсем не наблюдаются (0,25±0,25 ложных реакций в оба дня), для двух других групп наблюдается статистически значимое возрастание (p<0,05) числа ложных реакций в период от дня 0 (0,33±0,21) до дня 1 (4,66±0,42). Если для группы 2 (n=2) наблюдается повторное краткосрочное, полностью обратимое возрастание, то для группы 3 (n=4) возрастание сопровождается устойчивым возрастанием числа ложных реакций (3,50±0,29 ложных реакций в день 4 и 2,25±0,25 в день 8). Полученные результаты свидетельствуют о том, что потеря волосковых клеток, индуцированная акустической травмой, не играет значительной роли в развитии шума в ушах, а основной причиной шума в ушах является улитковая эститотоксичность.
При местном введении двух антагонистов рецептора NMDA: 7-СК и S-(+)-кетамина, наблюдаются схожие результаты. Как показано на фиг.4А и 5А, среднее число баллов значительно снижается в период от дня 0 до дня 1, а затем снова возрастает, но с меньшей скоростью по сравнению с нелеченными животными. В отличие от нелеченных животных в группах животных, леченных антагонистами рецептора NMDA, стабилизация числа баллов наблюдается только в день 6 (89%±2,3 и 88%±2,5 для животных, леченных S-(+)-кетамином и 7-СК соответственно). Такое различие можно объяснить (частичным) блокированием рецепторов NMDA, которое замедляет неосинаптогенез, в процессе которого эти рецепторы проявляют нейротропное действие, и таким образом наблюдается замедленное восстановление функции.
С другой стороны, при введении обоих антагонистов NMDA наблюдается значительное влияние на число ложных реакций (фиг.4В и 5В). В отличие от нелеченных животных или от животных, леченных D-JNKI-1, ни в одной из групп не зарегистрировано устойчивого возрастания числа ложных реакций после исходного временного возрастания. Не наблюдается также никакого возрастания числа ложных реакций (группа 1, n=5 и n=4 для животных, которым вводили S-(+)-кетамин и 7-СК соответственно), при этом число ложных реакций в день 0 и день 1 составляло 0,22±0,22, или наблюдалось лишь обратимое возрастание сразу после акустической травмы (группа 2, n=5 и n=6 для животных, которым вводили S-(+)-кетамин и 7-СК соответственно), причем число ложных реакций возрастает от 0,2±0,2 (S-(+)-кетамин) и от 0,33±0,21 (7-СК) в день 0 до 5±0,48 (S-(+)-кетамин) и 4,66±0,42 (7-СК) в день 1. Таким образом, после возникновения временного шума в ушах стойкий шум в ушах не развивается. Полученные результаты свидетельствуют о том, что при местном введении антагонистов рецептора NMDA в улитку наблюдается подавление стойкого шума в ушах, индуцированного улитковой экситотоксичностью.
Пример 2
Материалы и методы
Для оценки различных механизмов развития шума в ушах, индуцированного салицилатом и экситотоксичностью, проводили сравнительный морфологический анализ улитковых сенсоневральных структур, а также иммунологический анализ вестерн-блотингом указанных структур, выделенных из тканей животных с шумом в ушах, индуцированным двумя явлениями различного типа.
Морфологический анализ
Двум группам крыс (Long Evans) no 3 особи в каждой группе вводили два раза в сутки внутрибрюшинной инъекцией 350 мг/кг салицилата натрия в течение 2 сут или наносили животным травму, как описано в примере 1. После обезглавливания крыс в условиях глубокой анестезии (50 мг/кг пентобарбитала) улитки отделяли от височной кости и промывали фиксирующим раствором, содержащим 2,5% глутарового альдегида в 0,1 М фосфатно-солевом растворе (ФСБ), pH 7,3. Затем полученные препараты обрабатывали для исследования в сканирующем (СЭМ) или просвечивающем (ПЭМ) электронном микроскопе. Для исследований в СЭМ слуховую капсулу иссекали и сосудистые полоски, покровные перепонки и мембраны Рейсснера удаляли. После промывки в ФСБ (pH 7,3) препараты дегидратировали в растворе этанола с возрастающей концентрацией (30-100%), сушили при критической температуре в CO2, покрывали золотом-палладием и исследовали в микроскопе Hitachi S4000. Для исследований в ПЭМ улитки фиксировали в 1% водном растворе тетраоксида осмия в течение 2 ч, промывали фосфатным буферным раствором, дегидратировали в растворе этанола с возрастающей концентрацией (30-100%), затем инкапсулировали в смолу Epon. Прозрачные ультратонкие срезы кортиева органа получали из верхушечной половины улитки. Срезы помещали на формваровую или ячеистую сетку, проявляли уранилацетатом и цитратом свинца, исследовали в микроскопе Hitachi 7100.
Иммунологический анализ
Трем группам крыс (Long Evans) пo 3 особи в каждой группе вводили два раза в сутки внутрибрюшинной инъекцией 350 мг/кг салицилата натрия в течение 24 ч или наносили животным травму, как описано выше. Известно, что использованная доза салицилата индуцирует шум в ушах (Guitton и др., J. of Neuroscience 23 (9): 3944-3952 (2003)). Другую группу животных (3 особи) использовали в качестве контроля, то есть животным вводили внутрибрюшинно 0,9% раствор NaCl в объеме, равном объему дозы салицилата. Образцы отбирали в салицилатной и контрольной группе через 24 ч и соответственно через 5 сут после явления в группе животных с акустической травмой. По результатам эксперимента 1 временный шум в ушах наблюдается через 24 ч после травмы, а развитие стойкого шума в ушах начинается в день 3. Следовательно, следует ожидать, что стойкий шум в ушах сохраняется в день 5. Так как салицилат не индуцирует стойкий шум в ушах, то любое лечение и измерение в течение 24 ч не приведут к результатам, которые отличаются от результатов, полученных после 24 ч.
Ткани помещали в холодный ФСБ и гомогенизировали в буферном растворе для образцов, лизаты центрифугировали для удаления нерастворимого в ПАВ материала и полученные образцы фракционировали методом электрофореза в 10% SDS-полиакриламидном геле в буферном растворе трис-трицин. После электрофореза белки переносили в электрофоретически на нитроцеллюлозную мембрану (PVDF transfer membrane Hybond-P, Amersham Pharmacia Biotech, США). Блоты сначала инкубировали в присутствии первичных антител против субъединицы NR1 рецептора NMDA (разведение 1:1000, кроличьи поликлональные антитела, Chemicon international, США) и первичных антител антиактин (разведение 1:50000, мышиные моноклональные антитела анти-α-актин, Sigma, США) в течение ночи при 4°С. Для подтверждения идентичности молекулярной массы субъединицы NR1 из мозга и улитки проводили иммуноблотинг белков из мозга контрольных животных. Затем проводили инкубацию при 4°С в течение 2 ч в присутствии антител к антикроличьему IgG, биотинилированных специфических интактных антител (1:3500, Amersham Lifescience, США). После промывки буферным трис-солевым раствором (TBS-T, 5×10 мин) образцы инкубировали при 4°С в течение 2 ч в присутствии конъюгата стрептавидина со щелочной фосфатазой (1:3500, Amersham Lifescience, США). Комплексы белков с антителами проявляли реагентом BCIP/NBT (Sigma, США). Сканирование вестерн-блотингов проводили для полуколичественной оценки уровней экспрессии белка NR1 и актина с использованием программного обеспечения Biorad Fluor-S software (Quantity one).
Результаты
Как и ожидалось, механизмы развития шума в ушах, индуцированного салицилатом и экситотоксичностью, отличаются, что подтверждается различными результатами морфологического и физиологического анализов. Как показано на фиг.6, при введении салицилата не затрагиваются стереоресничный узел слуховых клеток внешнего уха (ОСН) и внутреннего уха (IHC), в то время как у животных после акустической травмы наблюдаются значительные повреждения и нарушение структуры стереоресничных узлов ОСН, а в некоторых случаях и слияние стереоресничных узлов ICH. После введения салицилата не происходит аномальных изменений ультраструктуры синаптического комплекса ICH, в то время как у травмированных животных наблюдается обширное и значительное набухание радиальных афферентных дендритов в базальном стволе ICH в области использованной частоты, что подтверждает наличие экситотоксичности. При этом наблюдается множество вакуолей в верхушечной части IHC и аномальное изменение формы стереоресничного узла. При высоком увеличении базального ствола ICH также не наблюдается аномальности в ткани животных, которым вводили салицилат. Наблюдаются нормальные афферентные нервные окончания и четко видно характерное пресинаптическое тело. В отличие от действия салицилата после травмы появляются набухшие и поврежденные нервные окончания.
На фиг.7 показана экспрессия субъединицы NR1 рецептора NMDA из ткани улитки после воздействия салицилата или акустической травмы по данным иммунологического анализа вестерн-блотингом. При воздействии салицилатом не происходит заметной модификации экспрессии субъединицы NR1 рецептора NMDA (на 4% выше по сравнению с контрольными животными). И наоборот, после акустической травмы наблюдается четкая сверхэкспрессия NR1 через 5 сут после явления (на 50% выше по сравнению с контрольными животными), что согласуется в наличием стойкого шума в ушах. Различие в уровнях экспрессии субъединицы NR1 рецептора NMDA свидетельствует о том, что при индуцированном акустической травмой шуме в ушах происходит регуляция с увеличением уровня рецепторов NMDA, а при индуцированном салицилатом шуме в ушах такой регуляции не наблюдается. Полученные результаты подтверждают данные о том, что индуцирование шума в ушах салицилатом происходит по другому механизму, как указано выше. Кроме того, на фиг.7 показано, что через 24 ч после травмы не наблюдается значительной сверхэкспрессии (выше на 8%), что также согласуется с фундаментальным различием между механизмами временного и стойкого шума в ушах после акустической травмы.
В заключение следует отметить, что результаты морфологического и иммунологического анализов подтверждают наличие фундаментального различия в механизмах развития индуцированного салицилатом и экситотоксичностью шума в ушах. Экситотоксичность в отличие от салицилата приводит к повреждению внутренних волосковых клеток в синаптическом комплексе и к индуцированию регуляции с повышением уровня рецепторов NMDA, что, в свою очередь, приводит к развитию стойкого шума в ушах. Так как существуют два различных пути регуляции улитковой ответной реакции NMDA, эффективность антагонистов рецептора NMDA в подавлении стойкого шума в ушах, индуцированного улитковой экситотоксичностью, нельзя исследовать на модели индуцированного салицилатом шума в ушах.
Реферат
Изобретение относится к медицине и касается лечения и профилактики шума в ушах, индуцированного экситотоксическим повреждением улитки. Для этого вводят терапевтически эффективное количество фармацевтической композиции, содержащей арилциклоалкиламин, являющийся избирательным антагонистом NMDA-рецептора. Выбор избирательного антагониста NMDA-рецептора из группы арилциклоалкиламинов именно при экситотоксическом повреждении улитки позволяет лечить или предотвращать обусловленный этим повреждением шум в ушах, не оказывая при этом отрицательного воздействия на слух. 2 н. и 7 з.п. ф-лы, 7 ил.

Комментарии