Восстановление оксидов металлов в электролизере - RU2298050C2
Код документа: RU2298050C2
Описание
Настоящее изобретение относится к восстановлению оксидов металлов в электролизере.
Настоящее изобретение было осуществлено в ходе научно-исследовательского проекта по электролитическому восстановлению диоксида титана (TiO2), выполненного Заявителем.
В ходе данного научно-исследовательского проекта Заявителем была выполнена экспериментальная работа на электролизере, который включает в себя графитовый тигель, который образует анод электролизера, ванну расплавленного электролита на основе CaCl2 в этом тигле и катод, который содержит твердый диоксид титана.
Одной целью экспериментальной работы было воспроизведение результатов, представленных в Международной заявке PCT/GB 99/01781 (Публикация №WO 99/64638) на имя Cambridge University Technical Services Limited и в научно-технических статьях, опубликованных ее авторами.
Международная заявка Кембриджа раскрывает два возможных применения "открытия" в области металлургической электрохимии.
Одно из этих применений представляет собой прямое получение металла из оксида металла.
В контексте данной заявки "открытие" заключается в осознании того, что электролизер может быть использован для ионизации кислорода, содержащегося в оксиде металла, так что кислород растворяется в электролите. В Международной заявке Кембриджа раскрывается, что при приложении соответствующего потенциала к электролизеру с оксидом металла в качестве катода имеет место реакция, в результате которой кислород ионизуется и затем способен растворяться в находящемся в электролизере электролите.
По заявке на Европейский патент №9995507.1, которая соответствует указанной Международной заявке Кембриджа, Европейским патентным ведомством был выдан патент.
Формула изобретения выданного Европейского патента, среди прочего, раскрывает способ электролитического восстановления оксида металла (такого, как диоксид титана), который включает работу электролизера при потенциале, который ниже потенциала осаждения катионов, присутствующих в электролите.
Заявка Кембриджа на Европейский патент не определяет, что понимается под потенциалом осаждения и не включает никаких специальных примеров, которые указывают значения потенциала осаждения для конкретных катионов.
В противоположность полученным Кембриджем данным, в экспериментальной работе, выполненной Заявителем, установлено, что является существенным, чтобы электролизер работал при потенциале, который выше потенциала, при котором катионы Ca++ в электролите могут осаждаться в виде металлического Ca на катоде.
В частности, в результате экспериментальной работы Заявителем найден способ восстановления оксида металла, такого как оксиды титана, в твердом состоянии в электролизере, который включает в себя анод, катод, образованный, по меньшей мере частично, из оксида металла, и расплавленный электролит, который содержит катионы металла, способного химически восстанавливать катодный оксид металла, при этом способ включает в себя стадию работы электролизера при потенциале, который выше потенциала, при котором катионы металла, способного химически восстанавливать катодный оксид металла, осаждаются в виде металла на катоде, в результате чего данный металл химически восстанавливает катодный оксид металла.
Вышеуказанный способ описан в Австралийской предварительной заявке PS3049 на имя Заявителя, поданной 20 июня 2002 г., и его раскрытие в описании, поданном с указанной заявкой, включено в настоящее описание путем перекрестной ссылки.
В дополнение к вышеуказанному, экспериментальная работа (и связанная теоретическая аналитическая работа), выполненная Заявителем, позволила определить ряд важных факторов, которые играют роль в действительном процессе восстановления.
Соответствующие экспериментальные данные показывают, что: (i) газ, образованный Cl2, выделяется на аноде электролизера при потенциалах значительно ниже теоретического потенциала разложения электролита CaCl2; (ii) CaxTiyO2 присутствует на катоде в процессе некоторых стадий электролиза; (iii) CaO образуется в расплавленной электролитической ванне.
Принимая во внимание приведенное выше, Заявитель сделал заключение, что способ восстановления оксидов титана включает в себя ряд стадий и что некоторые из указанных стадий представлены реакциями (1)-(8), показанными ниже. Реакции (1)-(8) относятся к восстановлению оксидов титана с использованием электролизера с CaCl2 (содержащим O-анионы) в качестве электролита и графитовым анодом с их стандартными потенциалами при 950°C.
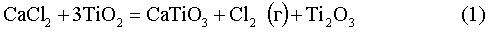
Е0950C=-1,45 В
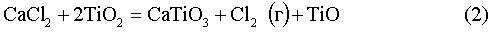
Е0950C=-1,63 В
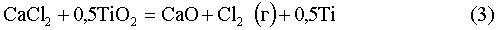
Е0950C=-2,4 В
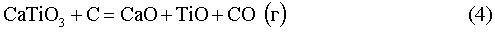
Е0950C=-0,86 В
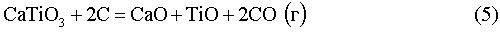
Е0950C=-0,96 В

Е0950C=-0,58 В

Е0950C=-1,07 В

Реакции (1)-(8) не являются исчерпывающим перечнем возможных реакций, и поэтому могут иметь место другие реакции. В частности. Заявитель предполагает, что могут иметь место другие реакции с участием субоксидов титана, представленных формулой CaTinO2n-1, и титанатов кальция, представленных формулой CaTinO3n-1.
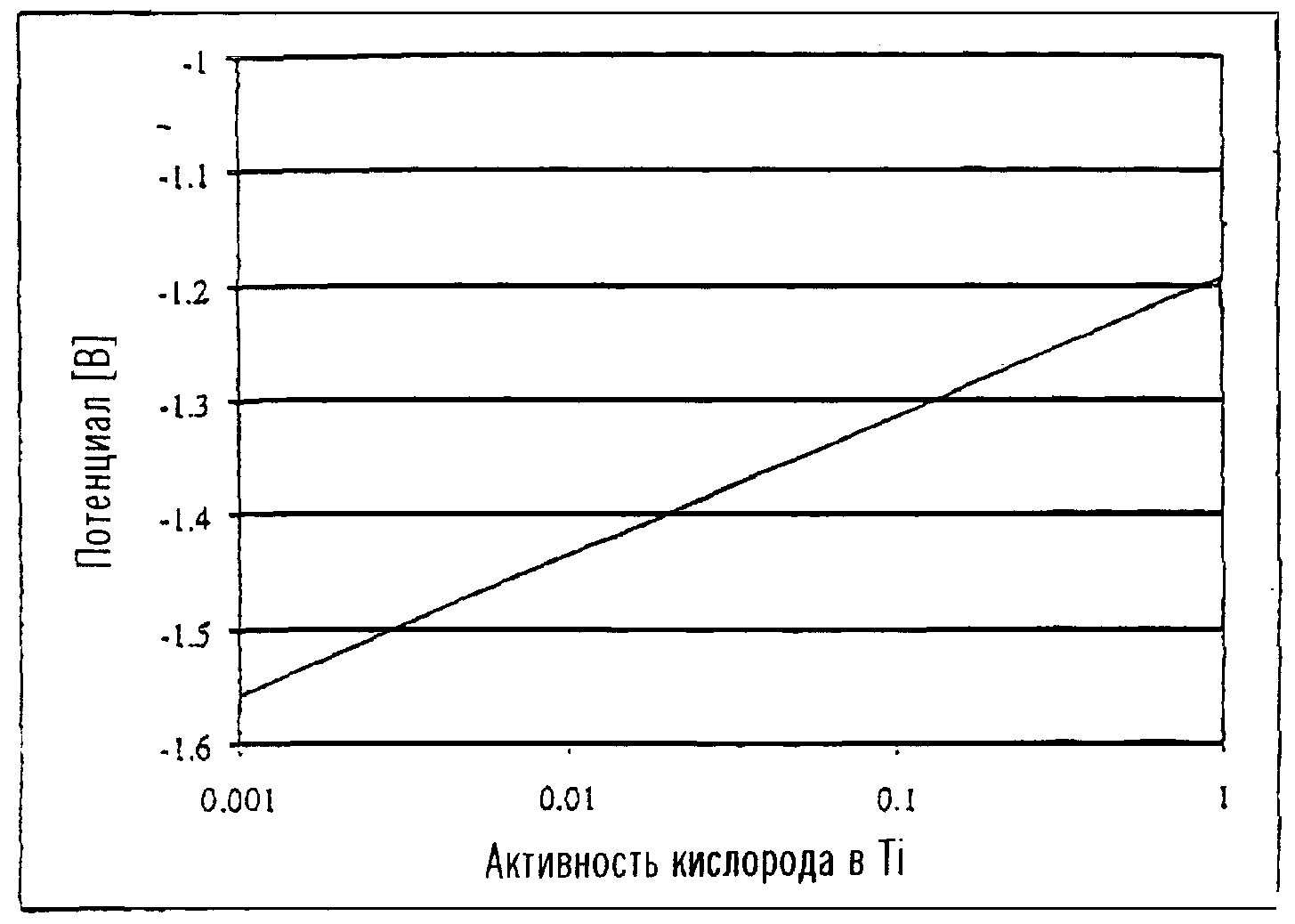
Потенциал реакции (8), в частности, изменяется в зависимости от концентрации кислорода в титане. График, представленный на чертеже, показывает изменение потенциала с концентрацией кислорода в титане в электролизере, работающем при 950°C. График подготовлен Заявителем с использованием опубликованных данных.
Из графика видно, что реакция (8) требует более высоких потенциалов при более низких концентрациях кислорода, и, таким образом, имеется повышенная стойкость к удалению кислорода по мере снижения концентрации кислорода.
Растворимость различных оксидов титана в CaCl2 при расчете потенциалов для реакций (1)-(8) не учитывалась. Значение этого состоит в том, что некоторые из реакций (1)-(8) могут иметь место при потенциалах, которые выше или ниже потенциалов, приведенных выше при заданной температуре 950°C.
Например, пониженная активность TiO снижает значение потенциалов реакций (2), (4) и (6) (т.е. делает потенциалы более положительными) и в то же самое время увеличивает потенциал реакции (7) (т.е. делает его более отрицательным).
Принимая во внимание приведенное выше, Заявитель установил, что оказывается чрезвычайно трудным восстановить оксид титана в электролизере до титана (αTi) высокой чистоты, т.е. до низкой концентрации кислорода (не более 100 массовых миллионных долей кислорода) при одностадийной работе.
В частности, Заявитель установил, что необходимо обновлять электролит и/или изменять потенциал электролизера на более поздней стадии или на более поздних стадиях работы электролизера для того, чтобы восстановить оксид титана в электролизере до α-титана высокой чистоты, т.е. до низкой концентрации кислорода.
Согласно настоящему изобретению предусматривается способ восстановления оксида титана в твердом состоянии в электролизере, который включает в себя анод, катод, образованный, по меньшей мере частично, из оксида титана, и расплавленный электролит, который содержит катионы металла, способного химически восстанавливать катодный оксид титана, при этом способ включает в себя работу электролизера при потенциале, который выше потенциала, при котором катионы металла, способного химически восстанавливать катодный оксид титана, осаждаются в виде металла на катоде, в результате чего данный металл химически восстанавливает катодный оксид титана, и отличается обновлением электролита и/или изменением потенциала электролизера на более поздних (последних) стадиях работы электролизера с учетом реакций, имеющих место в электролизере, и концентрации кислорода в оксидах титана в электролизере для того, чтобы получить титан (α-Ti) высокой чистоты.
Термин "высокая чистота" означает, что концентрация кислорода в титане составляет не более 100 массовых миллионных долей (млн. д.).
В действительности настоящее изобретение относится к выбору условий работы электролизера, включая потенциал электролизера и/или состав электролита, во время различных стадий работы электролизера с учетом реакций, которые имеют место в электролизере. Заявителем исследовано на данной стадии, что коммерческая работа проводится при постоянном токе и что может оказаться невозможным достигнуть напряжений, требуемых для удаления кислорода до очень низких уровней, потому что изменяется состав электролита. В этих обстоятельствах обновление или изменение состава электролита является важным для того, чтобы получить α-титан высокой чистоты.
Вышеуказанный способ делает возможным получение титана высокой чистоты по кислороду в электролизере и без очистки или иной обработки титана вне электролизера.
Способ может включать в себя обновление электролита путем введения нового электролита в существующий электролит или регулирование состава электролита иным образом.
Кроме того, способ может включать в себя осуществление способа в ряде электролизеров и последовательный перенос частично восстановленного оксида титана в каждый из электролизеров указанного ряда.
Состав электролита в каждом электролизере может быть выбран с учетом реакций, имеющих место в данном электролизере, и концентрации кислорода в оксиде титана в данном электролизере.
Потенциал электролизера можно изменять на различных стадиях способа на непрерывной основе или по-стадийно (ступенчато).
Предпочтительно, металл, осажденный на катоде, является растворимым в электролите и может раствориться в электролите и поэтому мигрировать в окрестность катодного оксида титана.
Предпочтительно, электролитом является электролит на основе CaCl2, который содержит CaO в качестве одного из компонентов электролита.
В такой ситуации предпочтительно, чтобы потенциал электролизера был выше потенциала, при котором металлический Ca может осаждаться на катоде, т.е. потенциала разложения CaO.
Потенциал разложения CaO может изменяться в очень значительном интервале в зависимости от таких факторов, как состав анода, температура электролита и состав электролита.
В электролизере, содержащем CaCl2, насыщенный CaO, при 1373 К (1100°C), и графитовый анод, это требует минимального потенциала электролизера в 1,34 В.
Также предпочтительно, чтобы потенциал электролизера был ниже потенциала разложения CaCl2.
В электролизере, содержащем CaCl2, насыщенный CaO, при 1373 К (1100°C), и графитовый анод, требуется, чтобы потенциал электролизера был ниже 3,5 В.
Потенциал разложения CaCl2 может изменяться в очень значительном интервале в зависимости от таких факторов, как состав анода, температура электролита и состав электролита.
Например, соль, содержащая 80% CaCl2 и 20% KCl при температуре 900 К (657°C), разлагается на Ca (металл) и Cl2 (газ) при потенциале выше 3,4 В, а соль, содержащая 100% CaCl2 при 1373 К (1100°C), разлагается при 3,0 В.
В общих чертах, в электролизере, содержащем CaO-CaCl2 - соль (ненасыщенную) при температуре в интервале 600-1100°C и графитовый анод, предпочтительно, чтобы потенциал электролизера был между 1,3 и 3,5 В.
Электролитом на основе CaCl2 может быть коммерчески доступный источник CaCl2, такой как дигидрат хлорида кальция, который частично разлагается при нагревании и дает CaO или иным образом включает в себя CaO.
Альтернативно или дополнительно электролит на основе CaCl2 может содержать CaCl2 и CaO, которые вводят по отдельности или предварительно смешивают с образованием электролита.
Предпочтительно анодом является графит или инертный анод.
Электролизер может быть того типа, который представлен на чертежах описания, поданного с Австралийской предварительной заявкой PS 3049.
Реферат
Изобретение относится к способу восстановления оксида титана в твердом состоянии. Способ ведут в электролизере с анодом, катодом, образованным, по меньшей мере частично, из оксида титана, и расплавленным электролитом, который содержит катионы металла, способного химически восстанавливать катодный оксид титана. Работу электролизера осуществляют при потенциале, который выше потенциала, при котором катионы металла, способного химически восстанавливать катодный оксид титана, осаждаются в виде металла на катоде, в результате чего данный металл химически восстанавливает катодный оксид титана. Отличие способа заключается также в том, что электролиз ведут с обновлением электролита и/или изменением потенциала электролизера на более поздних стадиях работы электролизера с учетом реакций, имеющих место в электролизере, и концентрации кислорода в оксиде титана для того, чтобы получить титан высокой чистоты. Техническим результатом является получение титана высокой чистоты по кислороду в электролизере без очистки или иной обработки вне электролизера. 8 з.п. ф-лы, 1 ил.
Формула
Документы, цитированные в отчёте о поиске
Способ получения металлов
