Трансдермальный пластырь для введения фентанила - RU2351318C2
Код документа: RU2351318C2
Чертежи





Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу и пластырю (пэтчу) для трансдермального введения фентанила и его аналогов в целях обезболивания. В частности, изобретение относится к субнасыщенному пластырю для введения субъекту фентанила и его аналогов через кожу в течение длительного периода времени.
Предпосылки создания изобретения
Фентанил и его аналоги, такие как альфентанил, карфентанил, лофентанил, ремифентанил, суфентанил, трефентанил и подобные, являются сильнодействующими синтетическими опиоидами, показавшими полезность как в медицине, так и в ветеринарии. В медицине альфентанил, фентанил, ремифентанил и суфенталин одобрены разрешительными органами для применения в качестве анестезирующих средств общего действия. В качестве аналгезирующих средств для применения при лечении хронической боли также разрешены лоллипоп, содержащий фентанил, для перорального трансмукозального введения и фентанилсодержащий трансдермальный пластырь.
Трансдермальное введение таких соединений для лечения как острой, так и хронической боли предлагалось, и имеется множество патентов, описывающих различные способы трансдермального введения фентанила и его аналогов. Предполагается, что патенты США №№4466953, 4470962, 4588580, 4626539, 5006342, 5186939, 5310559, 5474783, 5656286, 5762952, 5948433, 5985317, 5958446, 5993849, 6024976, 6063399 и 6139866 являются характерными и включены в данное описание в качестве ссылок. В указанных патентах сообщается, что фентанил можно вводить из мази или крема для местного применения или из трансдермального пластыря.
Трансдермальный пластырь, как правило, представляет собой небольшую лейкопластырную повязку, содержащую доставляемое лекарственное средство, и такие повязки могут иметь несколько форм. Самый простой тип представляет собой монолитный лейкопластырь, включающий содержащий лекарственное средство резервуар, расположенный на подложке. Резервуар, как правило, получают из фармацевтически приемлемого эффективного при прижатии адгезива, но в некоторых случаях его можно получить из неадгезивного материала, соприкасающаяся с кожей поверхность которого снабжается тонким слоем подходящего адгезива. Скорость, с которой лекарственное средство вводится пациенту из таких пластырей, может изменяться из-за обычных изменений проницаемости кожи для лекарственного средства от человека к человеку и от одного участка кожи к другому.
Более сложные пластыри являются пластырями с резервуарами типа многослойных или жидкостных, в которых между резервуаром с лекарственным средством и соприкасающимся с кожей адгезивом располагается мембрана, регулирующая скорость высвобождения лекарственного средства. Такая мембрана, уменьшая in vitro скорость высвобождения лекарственного средства из пластыря, служит для ослабления эффекта изменения проницаемости кожи. Такой тип пластыря, как правило, предпочтителен, когда вводят сильное лекарственное средство, но имеет недостаток, заключающийся в том, что обычно для достижения одной и той же скорости введения необходимо перекрывать большую площадь кожи, чем в случае сплошного пластыря.
Резервуары с лекарственным средством трансдермальных пластырей либо могут содержать лекарственное средство, полностью растворенное в резервуаре (субнасыщенные пластыри, см., например, пат. США №№4704282, 4725439, 4867982, 4908027, 5004610, 5152997, 5164190, 5342623, 5344656, 5364630, 5462745, 5633008 и 6165497), либо могут содержать избыток нерастворенного лекарственного средства, превышающий концентрацию насыщения (пластыри-депо). Поскольку трансдермальные пластыри доставляют лекарственное средство путем диффузии через кожу, скорость доставки из пластыря определяется законом Фика и пропорциональна уровню насыщения лекарственного средства в резервуаре.
В пластыре-депо избыточное лекарственное средство дает возможность сохранять резервуар насыщенным лекарственным средством после наложения пластыря, и он может доставлять лекарственное средство с наивысшей скоростью до тех пор, пока такой избыток имеется. Однако субнасыщенный пластырь, как правило, показывает постоянное снижение степени насыщения лекарственным средством в резервуаре, и скорость введения лекарственного средства во время использования будет иметь тенденцию к непрерывному снижению. Таким образом, пластыри-депо могут быть предпочтительными, когда желательна относительно постоянная скорость введения лекарственного средства, но наличие в пластыре нерастворенного лекарственного средства или других составляющих может вызвать при хранении и применении проблемы со стабильностью и другие проблемы.
Фентанил и его аналоги являются сильнодействующими опиоидами с относительно узкими терапевтическими индексами. “Является сильнодействующим” означает, что относительно низкие концентрации лекарственного средства в крови являются достаточными для получения нужного действия. “Имеющий узкий терапевтический индекс” означает, что терапевтическое действие получают только в узком интервале концентраций; концентрации ниже такого интервала являются неэффективными, а концентрации, превышающие указанный интервал, связаны с тяжелыми, и в случае опиоидов - возможно летальными, побочными действиями. Такая комбинация характеристик в сочетании с изменениями реакции на опиоидные аналгетики от пациента к пациенту предписывает особую осторожность при введении опиоидных лекарственных средств.
Из-за широких отклонений в индивидуальной фармакокинетике (например, скоростей выведения лекарственного средства) и фармакодинамической реакции на опиоиды (например, субъективный характер боли и опасность, связанная с передозировкой) пациенты, как правило, нуждаются в титровании по восходящей для определения соответствующей дозы. Это означает, что пациент сначала получает дозу, которая считается безопасной, и дозу постепенно увеличивают до получения адекватной аналгезии. Поскольку со временем может иметь место как толерантность в отношении опиоидов, так и усиление боли, для устранения боли дозы могут существенно повыситься и/или сопровождаться дозами других аналгетиков. Кроме того, для некоторых пациентов для лечения случаев приступов боли будет требоваться спасительное применение другого опиоида вместе с их основным лечением трансдермальными опиоидами.
Хотя на известном уровне техники имеется много предложений по трансдермальному введению фентанила и его аналогов с целью обезболивания с использованием трансдермальных пластырей различного типа, описанных выше, фактически только один такой продукт разрешен к применению в Соединенных Штатах. Этот продукт DURAGESIC® представляет собой пластырь, который вводит фентанил в течение 3 суток и показан для лечения хронической боли в отличие от послеоперационной или другой острой боли. Описание указанного пластыря и его применения включено в данное описание в качестве ссылки (Physicians Desk Reference, 56th Edition, 2002, pages 1786-1789). Предполагается, что фентаниловый пластырь DURAGESIC® впоследствии следует удалять и заменять свежим пластырем по прошествии каждых 3 суток для обеспечения ослабления хронической боли, и предполагается, что дозы могут возрастать со временем, и что может иметь место сопутствующее применение других аналгетиков в случае приступа боли.
В силу сильного действия и узкого терапевтического индекса фентанила система с фентанилом DURAGESIC® создана как пластырь-депо с жидкостным резервуаром с регулируемой скоростью типа, описанного в примерах 1-4 патента США №4588580.
Было обнаружено, что фентанил и его аналоги можно безопасно и эффективно, на предмет обезболивания, доставлять в течение по меньшей мере 3 суток из монолитных субнасыщенных пластырей без регулирования скорости, имеющих характеристики, описанные далее в данном описании. В результате упрощается изготовление пластыря, его устойчивость улучшается, и пластырь становится удобным для пациента.
Предлагается монолитный субнасыщенный пластырь без регулирования скорости, являющийся биологическим эквивалентным или фармацевтически эквивалентным трансдермальному пластырю-депо DURAGESIC® с регулируемой скоростью и жидким резервуаром.
Определения
В описании настоящего изобретения будут использоваться приведенные далее термины, и предполагается, что они имеют значения, указанные ниже. Используемая в данном описании и прилагаемой формуле изобретения форма единственного числа включает ссылки на множественное число, если содержание не указывает четко иное.
Используемый в данном описании термин “аналог фентанила” (далее - “аналог”) относится к весьма сильнодействующим и эффективным аналгезирующим средствам, таким как альфентанил, карфентанил, лофентанил, ремифентанил, суфентанил, трефентанил и подобным.
Используемый в данном описании термин “лекарственное средство” относится к фентанилу и его аналогам.
Используемый в данном описании термин “субнасыщенный пластырь” относится к пластырю, в котором концентрация лекарственного средства ниже предела его растворимости. Резервуар с лекарственным средством содержит однофазную полимерную композицию, свободную от нерастворенных компонентов, где лекарственное средство и все другие компоненты присутствуют в концентрациях, не превышающих, а предпочтительно - меньше их концентраций насыщения в резервуаре.
Используемый в данном описании термин “однофазная полимерная композиция” относится к композиции, в которой лекарственное средство и все другие компоненты растворены в полимере и присутствуют в концентрациях, не превышающих, а предпочтительно - меньше их концентраций насыщения в резервуаре, так что нерастворенных компонентов, присутствующих в композиции на протяжении существенной части периода введения, не имеется; и где все компоненты в сочетании с полимером образуют одну фазу.
Используемый в данном описании термин “компонент” относится к элементу в пределах резервуара с лекарственным средством, включая, но не ограничиваясь перечисленным, лекарственное средство, определение которому дано выше, добавки, усилители проникновения, стабилизаторы, красители, разбавители, пластификатор, загуститель, пигменты, носители, инертные наполнители, антиоксиданты, эксципиенты, желирующие вещества, антиирританты, сосудосуживающие средства и т.п.
Используемый в данном описании термин “мембрана, регулирующая скорость” относится к мембране, регулирующей скорость высвобождения лекарственного средства, описанного выше.
Термин “фентаниловый пластырь DURAGESIC®” относится к фентаниловому пластырю, описанному выше (см. также Physicians Desk Reference, 56th Edition, 2002, pages 1786-1789).
Используемый в данном описании термин “Сmax” относится к максимальной концентрации лекарственного средства, т.е. фентанила или его аналога, в крови или плазме.
Используемый в данном описании термин “стандартизированная Сmax (нг/(мл·см2))” относится к Сmax (нг/мл) на единицу площади (см2) доставки активного лекарственного средства системы, например площади резервуара с лекарственным средством.
Используемый в данном описании термин “нормализованная Сmax ((нг/мл)/(мг/ч))” относится к Сmax (нг/мл), разделенной на скорость введения лекарственного средства (мг/ч).
Используемый в данном описании термин “плотность потока лекарственного средства в стационарном состоянии” относится к плотности потока лекарственного средства (in vitro и in vivo) в интервале 1-20 мкг·см-2·ч-1в значительной части периода введения.
Используемый в данном описании термин “биологическая доступность” относится к скорости и степени, с которой активный ингредиент или активная группа поглощаются из лекарственного продукта и становятся доступными в месте действия. Скорость и степень устанавливают по фармакокинетическим параметрам, таким как площадь под кривой зависимости концентрации лекарственного средства в крови или плазме от времени (AUC) и максимальная концентрация лекарственного средства в крови или плазме (Сmax).
Два разных продукта считаются “биологически эквивалентными”, если дают, по существу, одинаковый фармакокинетический эффект при исследовании в подобных условиях эксперимента. Биоэквивалентность можно продемонстрировать несколькими способами in vivo и in vitro. Такие способы, предпочтительные по нисходящей, включают фармакокинетические, фармакодинамические, клинические исследования и исследования in vitro. В частности, биоэквивалентность демонстрируют с использованием фармакокинетических измерений, таких как площадь под кривой зависимости концентрации лекарственного средства в крови или плазме от времени (AUC) и максимальная концентрация лекарственного средства в крови или плазме (Сmax), используя статистические критерии, что подробнее описано далее.
Два разных продукта считаются “фармакологически эквивалентными”, если оказывают, по существу, одинаковое лечебное действие при исследовании в подобных условиях эксперимента, что демонстрируется несколькими способами in vivo и in vitro, подробнее описанными далее. Лечебное действие зависит от разных факторов, таких как эффективность лекарственного средства, растворимость и диффузионная способность лекарственного средства в коже, толщина кожи, концентрация лекарственного средства в коже в месте применения, концентрация лекарственного средства в резервуаре и т.п., что подробнее описывается далее. Вообще, фармакологическую эквивалентность демонстрируют с использованием таких измерений, как максимальная концентрация лекарственного средства в крови или плазме, нормализованная по скорости введения лекарственного средства (т.е. нормализованная Cmax, определение которой дается выше), и максимальная концентрация лекарственного средства в крови или плазме, стандартизированная на единицу площади доставки активного лекарственного средства системы (т.е. стандартизированная Cmax, определение которой дается выше).
Когда сравнивают два разных продукта, скорость введения которых пропорциональна размеру пластыря, биоэквивалентность или фармакологическую эквивалентность можно установить либо путем нормализации максимальной концентрации лекарственного средства в крови или плазме (Cmax) по скорости введения лекарственного средства (нормализованная Cmax), либо путем стандартизации максимальной концентрации лекарственного средства в крови или плазме (Cmax) на единицу площади доставки активного лекарственного средства системы (стандартизированная Cmax). Однако, когда сравнивают два продукта с разной скоростью введения на единицу площади для того, чтобы установить биоэквивалентность или фармакологическую эквивалентность, необходимо нормализовать максимальную концентрацию лекарственного средства в крови или плазме (Cmax), основываясь на скорости введения лекарственного средства.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способу и пластырю для трансдермального введения субъекту, в целях обезболивания, фентанила и его аналогов через кожу в течение длительного периода времени. В частности, настоящее изобретение относится к монолитному субнасыщенному пластырю без регулирования скорости для трансдермальной доставки фентанила и его аналогов со скоростью введения, достаточной для того, чтобы вызвать и поддерживать аналгезию в течение по меньшей мере трех суток. В предпочтительных вариантах воплощения лекарственное средство представляет собой фентанил, предпочтительно основную форму фентанила. В других предпочтительных вариантах вополощения лекарственное средство представляет собой суфентанил, предпочтительно основную форму суфентанила.
В другом аспекте настоящее изобретение относится к монолитному субнасыщенному пластырю без регулирования скорости, который биологически эквивалентен фентаниловому пластырю-депо DURAGESIC® с регулируемой скоростью и жидкостным резервуаром. В другом аспекте настоящее изобретение относится к монолитному субнасыщенному пластырю без регулирования скорости, который фармакологически эквивалентен фентаниловому пластырю-депо DURAGESIC® с регулируемой скоростью и жидкостным резервуаром.
В еще одном аспекте изобретение относится к трансдермальному пластырю для введения лекарственного средства через кожу, содержащему (а) подложку и (b) резервуар, расположенный на подложке, причем по меньшей мере соприкасающаяся с кожей поверхность резервуара является липкой; где резервуар состоит из однофазной полимерной композиции, свободной от нерастворенных компонентов, содержащей количество лекарственного средства, достаточное для того, чтобы вызвать и поддерживать аналгезию в течение, по меньшей мере, трех суток.
Указанные и другие варианты воплощения настоящего изобретения будут понятны для специалистов в данной области техники в свете данного описания.
Краткое описание фигур
Фигура 1 показывает схематическое поперечное сечение одного варианта воплощения трансдермальной лечебной системы по изобретению.
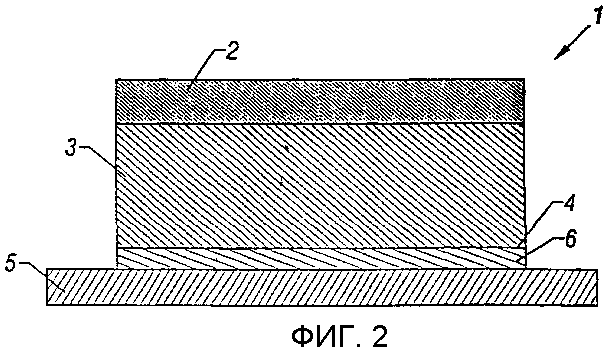
Фигура 2 показывает поперечное сечение другого варианта воплощения данного изобретения.
Фигура 3 иллюстрирует плотность трансдермального потока in vitro из различных фентаниловых пластырей.
Фигура 4 иллюстрирует плотность трансдермального потока in vitro из различных фентаниловых и суфентаниловых пластырей.
Фигура 5 иллюстрирует плотность трансдермального потока in vitro из различных фентаниловых и суфентаниловых пластырей.
Фигура 6 иллюстрирует плотность трансдермального потока in vitro из различных фентаниловых и суфентаниловых пластырей как функцию содержания лекарственного средства.
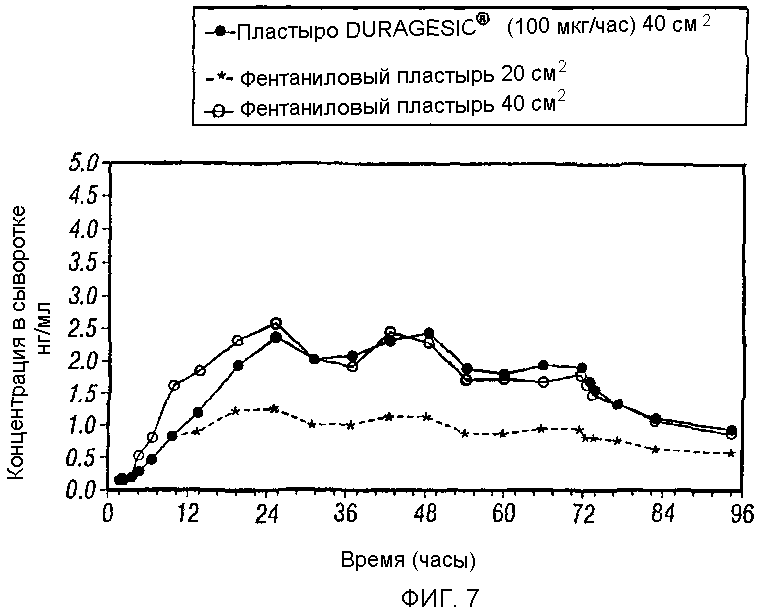
Фигура 7 иллюстрирует концентрацию фентанила в сыворотке после трансдермального применения различных фентаниловых пластырей в течение 72 часов на протяжении 96 часов после применения.
Фигура 8 иллюстрирует концентрацию фентанила в сыворотке после трансдермального применения различных фентаниловых пластырей в течение 72 часов на протяжении 120 часов после применения.
Подробное описание изобретения
В практике настоящего изобретения будут использоваться, если не оговорено иное, обычные способы, применяемые при разработке фармацевтических продуктов специалистами в данной области техники. Такие методики полностью объясняются в литературе. См., например, Patini G.A. and Chein Y.W., Swarbrick J. and Boylan J.C., eds, Encyclopedia of Pharmaceutical Technology, New York; Marcel Dekker, Inc., 1999, и Gale R., Hunt J. and Prevo M., Mathiowitz E., ed., Encyclopedia of Controlled Drug Delivery Patches, Passive, New York; J. Wiley & Sons, Inc., 1999.
Все патенты, заявки на патенты и публикации, упомянутые в данном описании выше и далее, включены в данное описание в качестве ссылок.
Способы осуществления изобретения
Настоящее изобретение относится к способу и пластырю для трансдермальной доставки субъекту, в целях обезболивания, фентанила и его аналогов через кожу в течение длительного периода времени. В частности, настоящее изобретение относится к монолитному субнасыщенному пластырю без регулирования скорости для трансдермальной доставки фентанила и его аналогов со скоростью и в количествах, достаточных для того, чтобы вызвать и поддерживать аналгезию у пациента, нуждающегося в этом, в течение, по меньшей мере, трех суток и вплоть до 7 суток.
Если теперь обратиться к фигурам 1 и 2, то предпочтительный вариант воплощения трансдермального монолитного пластыря 1 согласно данному изобретению включает подложку 2, резервуар с лекарственным средством 3, расположенный на подложке 2, где по меньшей мере соприкасающаяся с кожей поверхность 4 резервуара 3 является липкой, и удаляемый защитный слой 5. Резервуар 3 состоит из однофазной полимерной композиции, в которой лекарственное средство и все остальные компоненты присутствуют в концентрациях, не превышающих, и предпочтительно, меньше их концентраций насыщения в резервуаре 3. Это обстоятельство приводит к композиции, в которой отсутствуют нерастворенные компоненты. В предпочтительных вариантах воплощения резервуар 3 формируют из фармацевтически приемлемого адгезива.
Если теперь обратиться к фигуре 2, то резервуар 3 формируют из материала, не обладающего адекватными адгезивными свойствами. В таком варианте воплощения монолитного пластыря 1 соприкасающаяся с кожей поверхность 4 может быть получена с тонким адгезионным покрытием 6. Резервуар 3 представляет собой однофазную полимерную композицию, как описано ранее.
Подложка 2 может представлять собой воздухопроницаемый или герметический материал, содержащий ткань, поливинилацетат, поливинилиденхлорид, полиэтилен, полиуретан, полиэстр, сополимер этилена и винилацетата (EVA), полиэтилентерефталат, полибутилентерефталат, бумагу с покрытием, алюминиевую фольгу и т.п. и их сочетания. В предпочтительном варианте воплощения подложка содержит материалы на основе полиэтилена низкой плотности (LDPE), материалы на основе полиэтилена средней плотности (MDPE) или материалы на основе полиэтилена высокой плотности (HDPE), например SARANEX (Dow Chemical, Midland, Ml). Подложка может быть монолитной или многослойной. В предпочтительных вариантах воплощения подложка является многослойной, содержащей слой нелинейного LDPE/слой линейного LDPE/слой нелинейного LDPE. Подложка имеет толщину от примерно 0,012 мм (0,5 мил) до примерно 0,125 мм (5 мил); предпочтительно - от 0,025 мм (1 мил) до примерно 0,1 мм (4 мил), предпочтительнее - от 0,0625 мм (1,5 мил) до примерно 0,0875 мм (3,5 мил).
Резервуар с лекарственным средством 3 располагается на подложке, где по меньшей мере соприкасающаяся с кожей поверхность резервуара является липкой. Резервуар 3 можно сформировать из обычных материалов, известных в технике. Например, резервуар с лекарственным средством получают из полимерного материала, в котором лекарственное средство имеет растворимость, разумную для доставляемого лекарственного средства в нужном интервале, такого как полиуретан, сополимер этилена и винилацетата (EVA), полиакрилат, блок-сополимер стирола и т.п. В предпочтительных вариантах воплощения резервуар 3 получают из фармацевтически приемлемого эффективного при прижатии адгезива, предпочтительно адгезива на основе полиакрилата или блок-сополимера стирола, что подробнее описано далее.
Липкий резервуар 3 или адгезивное покрытие 6 получают из обычных эффективных при прижатии адгезивов, известных в технике. Примерами адгезивов, эффективных при прижатии, являются, но не ограничиваются перечисленным, полиакрилаты, полисилоксаны, полиизобутилен (PIB), полиизопрен, полибутадиен, блок-сополимеры стирола и подобные им. Примерами адгезивов на основе блок-сополимеров стирола являются, но не ограничиваются перечисленным, блок-сополимер типа стирол-изопрен-стирол (SIS), сополимер типа стирол-бутадиен-стирол (SBS), сополимеры типа стирол-этиленбутен-стирол (SEBS) и их двублочные аналоги.
Акриловые полимеры включают сополимеры или терполимеры, содержащие, по меньшей мере, два или более компонентов, например, выбранных из группы, состоящей из акриловых кислот, алкилакрилатов, метакрилатов, способных к сополимеризации с другими мономерами или мономерами с функциональными группами. Примерами мономеров являются, но не ограничиваются перечисленным, акриловая кислота, метакриловая кислота, метоксиэтилакрилат, этилакрилат, бутилакрилат, бутилметакрилат, гексилакрилат, гексилметакрилат, 2-этилбутилакрилат, 2-этилбутилметакрилат, изооктилакрилат, изооктилметакрилат, 2-этилгексилакрилат, 2-этилгексилметакрилат, децилакрилат, децилметакрилат, додецилакрилат, додецилметакрилат, тридецилакрилат, тридецилметакрилат, гидроксиэтилакрилат, гидроксипропилакрилат, акриламид, диметилакриламид, акрилонитрил, диметиламиноэтилакрилат, диметиламиноэтилметакрилат, трет-бутиламиноэтилакрилат, трет-бутиламиноэтилметакрилат, метоксиэтилакрилат, метоксиэтилметакрилат и подобные мономеры. Другими примерами соответствующих акрилатных адгезивов, подходящих для практического применения изобретения, являются адгезивы, описанные в Satas, “Acrylic Adhesives”, Handbook of pressure-Sensitive Adhesive Technology, 2nd ed., pp.396-456 (D. Satas, ed.), Van Nostrand Reinhold, New York (1989). Акрилатные адгезивы доступны коммерчески (National Starch and Chemical Corporation, Bridgewater, NJ; Solutia, MA). Другими примерами адгезивов на основе полиакрилатов являются адгезивы, перечисленные далее, идентифицированные как продукты под номерами, изготовляемые National Starch (Product Bulletin, 2000): 87-4098, 87-2287, 87-4287, 87-5216, 87-2051, 87-2052, 87-2054, 87-2196, 87-9259, 87-9261, 87-2979, 87-2510, 87-2353, 87-2100, 87-2852, 87-2074, 87-2258, 87-9085, 87-9301 и 87-5298.
Акриловые полимеры включают поперечно-сшитые полимеры и полимеры без поперечных связей. Полимеры сшивают известными способами для получения нужных полимеров. В предпочтительных вариантах воплощения адгезив представляет собой полиакрилатный адгезив с температурой стеклования (Tg) ниже -10оС, предпочтительнее - с Tg от примерно -20 до примерно -30оС. Молекулярная масса полиакрилатного адгезива, выраженная как среднемассовая (ММ), до каких-либо реакций сшивания колеблется от примерно 25000 до 10000000, предпочтительно - от 50000 до примерно 3000000, и предпочтительнее - от 100000 до 1000000. После сшивания ММ приближается к бесконечно большой, как известно специалистам в области химии полимеров.
Как описано выше, резервуар 3 содержит однофазную полимерную композицию, свободную от нерастворенных компонентов, содержащую количество лекарственного средства, достаточное для того, чтобы вызвать и поддерживать аналгезию у человека, по меньшей мере, в течение трех суток. Лекарственное средство выбирают из группы, состоящей из фентанила и его аналогов, таких как альфентанил, карфентанил, лофентанил, ремифентанил, суфентанил, трефентанил и т.п. В предпочтительных вариантах воплощения резервуар с лекарственным средством содержит от примерно 0,05 до примерно 1,75 мг/см2 лекарственного средства, предпочтительно - от примерно 0,07 до примерно 1,50 мг/см2 лекарственного средства; предпочтительно - от примерно 0,08 до примерно 1,25 мг/см2 лекарственного средства; предпочтительнее - от примерно 0,09 до примерно 1,0 мг/см2 лекарственного средства; более предпочтительно - от примерно 0,1 до примерно 0,75 мг/см2 лекарственного средства; и еще предпочтительнее - от примерно 0,12 до примерно 0,5 мг/см2 лекарственного средства. Лекарственное средство должно быть растворимым в полимере, образующем резервуар 3, в форме, описанной ниже. В предпочтительных вариантах воплощения лекарственное средство находится в форме основания, и предпочтительными лекарственными средствами являются фентанил или суфентанил. В особенно предпочтительных вариантах воплощения резервуар с лекарственным средством содержит от примерно 0,05 до примерно 1,75 мг/см2 фентанила; предпочтительно - от примерно 0,07 до примерно 1,50 мг/см2 фентанила; предпочтительно - от примерно 0,08 до примерно 1,25 мг/см2 фентанила; предпочтительнее - от примерно 0,09 до примерно 1,0 мг/см2 фентанила; более предпочтительно - от примерно 0,1 до примерно 0,75 мг/см2 фентанила; и еще предпочтительнее - от примерно 0,12 до примерно 0,5 мг/см2 фентанила; где фентанил находится в форме основания и в полностью растворенном состоянии. В других предпочтительных вариантах воплощения резервуар с лекарственным средством содержит от примерно 0,05 до примерно 1,75 мг/см2 суфентанила; предпочтительно - от примерно 0,07 до примерно 1,50 мг/см2 суфентанила; предпочтительно - от примерно 0,08 до примерно 1,25 мг/см2 суфентанила; предпочтительнее - от примерно 0,09 до примерно 1,0 мг/см2 суфентанила; более предпочтительно - от примерно 0,1 до примерно 0,75 мг/см2 суфентанила; наиболее предпочтительно - от примерно 0,12 до примерно 0,5 мг/см2 суфентанила; и еще предпочтительнее - от примерно 0,25 до примерно 0,4 мг/см2 суфентанила; где суфентанил находится в форме основания и в полностью растворенном состоянии.
Материал, образующий резервуар 3, имеет насыщенность в отношении лекарственного средства от примерно 1 мас.% до примерно 25 мас.% от всей полимерной композиции; предпочтительно - от примерно 2 мас.% до примерно 15 мас.%; предпочтительнее - от примерно 4 мас.% до примерно 12 мас.% от всей полимерной композиции; и даже предпочтительнее - от примерно 6 мас.% до примерно 10 мас.% от всей полимерной композиции. Резервуар 3, с адгезивным покрытием 6 или без него, имеет толщину от примерно 0,0125 мм (0,5 мил) до примерно 0,1 мм (4 мил); предпочтительно - от примерно 0,025 мм (1 мил) до примерно 0,0875 мм (3,5 мил); предпочтительнее - от примерно 0,0375 мм (1,5 мил) до примерно 0,075 мм (3 мил); и даже предпочтительнее - от примерно 0,04 мм (1,6 мил) до примерно 0,05 мм (2 мил). В предпочтительных вариантах воплощения лекарственное средство представляет собой фентанил, предпочтительно в форме основания, где материал, образующий резервуар 3, имеет насыщенность в отношении фентанила от примерно 1 мас.% до примерно 25 мас.% от всей полимерной композиции; предпочтительно - от примерно 3 мас.% до примерно 15 мас.%, предпочтительнее - от примерно 5 мас.% до примерно 12 мас.%; и даже предпочтительнее - от примерно 7 мас.% до примерно 10 мас.% от всей полимерной композиции. Резервуар 3, с адгезивным покрытием 6 или без него, имеет толщину от примерно 0,0125 мм (0,5 мил) до примерно 0,1 мм (4 мил); предпочтительно - от примерно 0,025 мм (1 мил) до примерно 0,075 мм (3 мил); предпочтительнее - от 0,0375 мм (1,5 мил) до примерно 0,0625 мм (2,5 мил); и даже предпочтительнее - от примерно 0,04 мм (1,6 мил) до примерно 0,05 мм (2 мил). В других предпочтительных вариантах воплощения лекарственное средство представляет собой суфентанил, предпочтительно в форме основания, где материал, образующий резервуар 3, имеет насыщенность в отношении суфентанила от примерно 1 мас.% до примерно 25 мас.% от всей полимерной композиции; предпочтительно - от примерно 3 мас.% до примерно 15 мас.%; предпочтительнее - от примерно 5 мас.% до примерно 12 мас.%; и даже предпочтительнее - от примерно 7 мас.% до примерно 10 мас.% от всей полимерной композиции. Резервуар 3, с адгезивным покрытием 6 или без него, имеет толщину от примерно 0,0125 мм (0,5 мил) до примерно 0,1 мм (4 мил); предпочтительно - от примерно 0,025 мм (1 мил) до примерно 0,075 мм (3 мил); предпочтительнее - от 0,0375 мм (1,5 мил) до примерно 0,0625 мм (2,5 мил); и даже предпочтительнее - от примерно 0,04 мм (1,6 мил) до примерно 0,5 мм (2 мил).
В других предпочтительных вариантах воплощения резервуар 3 может содержать, необязательно, дополнительные компоненты, такие как добавки, усилители проникновения, стабилизаторы, красители, разбавители, пластификатор, загустители, пигменты, носители, инертные наполнители, антиоксиданты, эксципиенты, желирующие вещества, антиирританты, сосудосуживающие средства и другие вещества, обычные и известные в технике трансдермальных препаратов, при условии, что такие вещества присутствуют в концентрациях ниже концентрации насыщения в резервуаре.
Примерами усилителя проникновения являются, но не ограничиваются перечисленным, глицериновые эфиры жирных кислот, таких как каприновая, каприловая, додециловая, олеиновая кислоты; сложные эфиры жирных кислот и изосорбита, сахарозы, полиэтиленгликоль; капроилмолочная кислота; этерифицированный лаурат-2; этерифицированный лаурил-2-ацетат; этерифицированный лаурил-2-бензоат; этерифицированная лаурил-3-карбоновая кислота; этерифицированный лаурат-4; этерифицированная лаурил-5-карбоновая кислота; этерифицированный олеат-2; глицерилпироглутаматолеат; глицерилолеат; N-лауроилсаркозин; N-миристоилсаркозин; N-октил-2-пирролидон; лауриламинопропионовая кислота; этерифицированный полипропиленгликоль-4-лаурил-2; этерифицированный полипропиленгликоль-4-лаурил-5-диметиллаурамид; лаурамиддиэтаноламин (DEA). Предпочтительными усилителями являются, но не ограничиваются ими, лаурилпироглутамат (LP), глицерилмонолаурат (GML), глицерилмонокаприлат, глицерилмонокапринат, глицерилмоноолеат (GMO) и сорбитанмонолаурат. Другие примеры подходящих усилителей проникновения описываются, например, в патентах США №№5785991, 5843468, 5882676 и 6004578.
В некоторых вариантах воплощения резервуар содержит разбавители, способные замедлить быстрое прилипание, повышающие вязкость и/или ужесточающие структуру матрицы, такие как полибутилметакрилат (эльвацит (ELVACITE), производимый ICI Acrylic, например эльвацит 1010, эльвацит 1020, эльвацит 20), высокомолекулярные акрилаты, т.е. акрилаты со средней молекулярной массой по меньшей мере 500000, и т.п.
В некоторых вариантах воплощения в композицию адгезива включают пластификатор или загуститель для улучшения адгезионных свойств. Примерами подходящих загустителей являются, но не ограничиваются перечисленным, алифатические углеводороды, ароматические углеводороды; гидрированные сложные эфиры; политерпены; гидрированные древесные смолы; смолы, повышающие липкость, такие как ESCOREZ, полимеры алифатических углеводородов, полученные катионной полимеризацией нефтехимического сырья или термической полимеризацией и последующим гидрированием нефтехимического сырья, повышающие липкость эфиры канифоли и подобные материалы; минеральное масло и их сочетания.
Используемый агент, повышающий липкость, должен быть совместимым со смесью полимеров. Например, блок-сополимеры стирола можно ввести в композицию с совместимыми смолами натурального каучука, повышающими липкость, с совместимыми смолами с блокированными концевыми группами, такими как полиметилстирол, или пластификаторами, такими как минеральное масло. Как правило, полимер составляет примерно 5-50% от всей композиции адгезива, агент, повышающий липкость, составляет примерно 30-85% от всей композиции адгезива, и минеральное масло составляет примерно 2-40% от всей композиции адгезива.
Пластырь 1 также содержит удаляемый защитный слой 5. Защитный слой 5 получают из полимерных материалов, которые, необязательно, можно металлизировать. Примерами полимерных материалов являются полиуретан, поливинилацетат, поливинилиденхлорид, полипропилен, поликарбонат, полистирол, полиэтилен, полиэтилентерефталат, полибутилентерефталат, бумага и подобные материалы и их сочетания. В предпочтительных вариантах воплощения защитный слой состоит из силицированной пленки сложного полиэфира.
Выше описаны самые разные материалы, которые можно использовать для получения различных слоев пластырей для трансдермальной доставки согласно данному изобретению. Данное изобретение также предполагает применение иных материалов, чем конкретно описанные в описании, в том числе материалов, которые могут появиться в технике, способных осуществлять необходимые функции.
Введение лекарственного средства
При нанесении на кожу лекарственное средство из резервуара с лекарственным средством 3 трансдермального пластыря 1 диффундирует в кожу, где всасывается в кровоток для оказания системного аналгезирующего действия. Начало аналгезии зависит от различных факторов, таких как эффективность лекарственного средства, растворимость и диффузионная способность лекарственного средства в коже, толщина кожи, концентрация лекарственного средства в коже в месте применения, концентрация лекарственного средства в резервуаре с лекарственным средством и т.п. (что касается относительной проникающей способности и эффективности фентанила и его аналогов, см., например, патент США №4588580). Предпочтительно, чтобы пациент испытывал адекватное действие в пределах шести часов после начала применения. Однако это существенно только для начала применения. При повторном последующем применении оставшееся лекарственное средство в месте применения пластыря поглощается организмом приблизительно с той же скоростью, с какой поглощается лекарственное средство из нового пластыря в новом месте нанесения. Таким образом, пациент не должен испытывать какого-либо прекращения аналгезии.
Концентрация лекарственного средства в коже в местах применения также существенна для установления верхнего предела размера трансдермального пластыря и, напротив, нижнего предела при удобной скорости введения. Вообще, когда используют пластырь по изобретению, общее количество лекарственного средства в коже в месте применения пластыря колеблется от примерно 0,05 до примерно 200 мкг/см2. Когда такой пластырь удаляют, обезболивающее действие продолжается до тех пор, пока количество оставшегося лекарственного средства в коже не уменьшится до достаточно низкого уровня ниже минимальной эффективной концентрации лекарственного средства в плазме. Например, после удаления фентанилового пластыря концентрации фентанила в сыворотке падают постепенно и достигают 50% снижения содержания в плазме в пределах приблизительно 17 часов (см., например, листовку-вкладыш для пластыря DURAGESIC®). Такие количества для других лекарственных средств будут изменяться в зависимости от растворимости лекарственного средства и размера пластыря. Например, растворимость суфентанила в эпидермисе достигает от примерно 25% до примерно 50% от растворимости фентанила. С учетом большой эффективности фентанила и его аналогов предпочтительно поддерживать количество лекарственного средства, растворенного в коже, на уровне, подходящем для быстрого прекращения лечения.
Когда желательна постоянная аналгезия, истощенный пластырь следует удалить и нанести свежий пластырь на новом месте. Например, для обеспечения ослабления хронической боли пластырь можно последовательно удалять и заменять свежим пластырем по окончании периода введения. Так как поглощение лекарственного средства из свежего пластыря в новом месте применения, как правило, происходит, по существу, с той же скоростью, что и поглощение организмом оставшегося лекарственного средства в месте предыдущего применения пластыря, содержание в крови будет, по существу, постоянным. Кроме того, предполагается, что дозы могут возрастать со временем и что может иметь место использование других анальгетиков для того, чтобы справиться с приступом боли.
В предпочтительных вариантах воплощения изобретение относится к трансдермальному пластырю, обнаруживающему нормализованную Cmax в интервале от примерно 3,3 до примерно 82,5 (нг/мл)/(мг/ч), предпочтительно - от примерно 6,6 до примерно 50 (нг/мл)/(мг/ч), предпочтительнее - от примерно 13 до примерно 40 (нг/мл)/(мг/ч), и даже предпочтительнее - от примерно 20 до примерно 35 (нг/мл)/(мг/ч); и стандартизированную Cmax в интервале от примерно 0,001 до примерно 0,2 нг/(мл·см2), предпочтительно - от примерно 0,005 до примерно 0,15 нг/(мл·см2), предпочтительнее - от примерно 0,008 до примерно 0,1 нг/(мл·см2), и даже предпочтительнее - от примерно 0,01 до примерно 0,08 нг/(мл·см2). Трансдермальный пластырь имеет размер от примерно 0,5 до примерно 150 см2; предпочтительно - от примерно 2 до примерно 100 см2; предпочтительнее - от примерно 4 до примерно 50 см2, и даже предпочтительнее - от примерно 10 до примерно 20 см2. При нанесении на кожу трансдермальный пластырь обнаруживает плотность потока лекарственного средства в стационарном состоянии от примерно 0,1 до примерно 20 мкг·см-2·ч-1; предпочтительно - от примерно 0,75 до примерно 10 мкг·см-2·ч-1; предпочтительно - от примерно 1 до примерно 8 мкг·см-2·ч-1; предпочтительнее - от примерно 1,5 до примерно 5 мкг·см-2·ч-1; предпочтительнее - от примерно 2 до примерно 3 мкг·см-2·ч-1, и даже предпочтительнее - от примерно 1 до примерно 2,5 мкг·см-2·ч-1. Скорости введения в стационарном состоянии, которые можно получить согласно данному изобретению, колеблются от примерно 0,1 до примерно 500 мкг/ч; предпочтительно - от примерно 1 до примерно 300 мкг/ч; предпочтительнее - от примерно 2 до примерно 250 мкг/ч и даже предпочтительнее - от примерно 5 до примерно 200 мкг/ч.
В других предпочтительных вариантах воплощения изобретение относится к трансдермальному фентаниловому пластырю, обнаруживающему нормализованную Cmax в интервале от примерно 3,3 до примерно 82,5 (нг/мл)/(мг/ч), предпочтительно - от примерно 10 до примерно 62 (нг/мл)/(мг/ч), предпочтительнее - от примерно 16 до примерно 41 (нг/мл)/(мг/ч), и даже предпочтительнее - от примерно 20 до примерно 35 (нг/мл)/(мг/ч); и стандартизированную Cmax в интервале от примерно 0,01 до примерно 0,2 нг/(мл·см2), предпочтительно - от примерно 0,02 до примерно 0,15 нг/(мл·см2), предпочтительнее - от примерно 0,03 до примерно 0,1 нг/(мл·см2), и даже предпочтительнее - от примерно 0,04 до примерно 0,08 нг/(мл·см2). Трансдермальный фентаниловый пластырь имеет размер от примерно 1 до примерно 150 см2; предпочтительно - от примерно 2 до примерно 125 см2; предпочтительнее - от примерно 4 до примерно 100 см2; предпочтительнее - от примерно 5 до примерно 75 см2, и даже предпочтительнее - от примерно 5 до примерно 50 см2. При нанесении на кожу трансдермальный фентаниловый пластырь обнаруживает плотность потока лекарственного средства в стационарном состоянии от примерно 1 до примерно 10 мкг·см-2·ч-1; предпочтительно - от примерно 1,5 до примерно 8 мкг·см-2·ч-1; предпочтительнее - от примерно 2 до примерно 5 мкг·см-2·ч-1, и даже предпочтительнее - от примерно 2 до примерно 3 мкг·см-2·ч-1. Скорости введения в стационарном состоянии, которые можно получить для фентанилового пластыря согласно данному изобретению, колеблются от примерно 1 до примерно 300 мкг/ч; предпочтительно - от примерно 2 до примерно 250 мкг/ч; и предпочтительнее - от примерно 5 до примерно 200 мкг/ч.
В других предпочтительных вариантах воплощения изобретение относится к трансдермальному суфентаниловому пластырю, обнаруживающему нормализованную Cmax в интервале от примерно 0,04 до примерно 10 (нг/мл)/(мг/ч), предпочтительно - от примерно 1 до примерно 8 (нг/мл)/(мг/ч), предпочтительнее - от примерно 2 до примерно 5,5 (нг/мл)/(мг/ч), и даже предпочтительнее - от примерно 2,5 до примерно 5 (нг/мл)/(мг/ч); и стандартизированную Cmax в интервале от примерно 0,001 до примерно 0,05 нг/(мл·см2), предпочтительно - от примерно 0,005 до примерно 0,04 нг/(мл·см2), предпочтительнее - от примерно 0,0075 до примерно 0,025 нг/(мл·см2), и предпочтительнее - от примерно 0,01 до примерно 0,02 нг/(мл·см2). Трансдермальный суфентаниловый пластырь имеет размер от примерно 0,5 до примерно 40 см2; предпочтительно - от примерно 1 до примерно 35 см2; и предпочтительнее - от примерно 2 до примерно 30 см2. При нанесении на кожу трансдермальный суфентаниловый пластырь обнаруживает плотность потока лекарственного средства в стационарном состоянии от примерно 0,1 до примерно 10 мкг·см-2·ч-1; предпочтительно - от примерно 0,5 до примерно 8 мкг·см-2· ч-1; предпочтительнее - от примерно 0,75 до примерно 6 мкг·см-2·ч-1; предпочтительнее - от примерно 1 до примерно 5 мкг·см-2·ч-1; и даже предпочтительнее - от примерно 1 до примерно 2,5 мкг·см-2·ч-1. Скорости введения в стационарном состоянии, которые можно получить для суфентанилового пластыря согласно данному изобретению, колеблются от примерно 0,1 до примерно 200 мкг/ч; предпочтительно - от примерно 0,25 до примерно 150 мкг/ч; предпочтительнее - от примерно 0,5 до примерно 100 мкг/ч; предпочтительнее - от примерно 0,75 до примерно 50 мкг/ч; и даже предпочтительнее - от примерно 1 до примерно 40 мкг/ч.
Введение поддерживается, по меньшей мере, в течение трех суток и вплоть до 7 суток, причем предпочтительным считается режим в 3-4 суток. В предпочтительных вариантах воплощения по меньшей мере 3%, но не более 40%, от общего количества лекарственного средства в пластыре вводится на протяжении приблизительно первых 24 часов применения; по меньшей мере 6%, но не более 50%, от общего количества лекарственного средства вводится на протяжении приблизительно первых 48 часов применения; и по меньшей мере 10%, но не более 75%, от общего количества лекарственного средства вводится на протяжении указанного периода введения. В предпочтительных вариантах воплощения пластырь представляет собой фентаниловый пластырь, где по меньшей мере 5%, но не более 40%, от общего количества лекарственного средства в пластыре вводится на протяжении приблизительно первых 24 часов применения; по меньшей мере 15%, но не более 50%, от общего количества лекарственного средства вводится на протяжении приблизительно первых 48 часов применения; и по меньшей мере 25%, но не более 75%, от общего количества лекарственного средства вводится на протяжении указанного периода введения. В других вариантах воплощения пластырь представляет собой суфентаниловый пластырь, где по меньшей мере 3%, но не более 40%, от общего количества лекарственного средства в пластыре вводится на протяжении приблизительно первых 24 часов применения; по меньшей мере 6%, но не более 50%, от общего количества лекарственного средства вводится на протяжении приблизительно первых 48 часов применения; и по меньшей мере 10%, но не более 75%, от общего количества лекарственного средства вводится на протяжении указанного периода введения.
Предпочтительным вариантом воплощения данного изобретения является пластырь, биологически эквивалентный фентаниловой системе DURAGESIC®. В частности, монолитный фентаниловый пластырь по изобретению дает, по существу, такие же фармакокинетические эффекты (измеренная площадь под кривой зависимости концентрации лекарственного средства в крови или плазме от времени (AUC) и максимальная концентрация (Cmax) лекарственного средства) при сравнении с трансдермальной фентаниловой системой DURAGESIC®, когда их исследуют в подобных условиях эксперимента, что подробнее описано далее.
В других предпочтительных вариантах воплощения пластырь данного изобретения фармакологически эквивалентен фентаниловой системе DURAGESIC®. В частности, монолитный фентаниловый пластырь по изобретению оказывает, по существу, одинаковое лечебное действие при сравнении с трансдермальной фентаниловой системой DURAGESIC®, когда их исследуют в подобных условиях эксперимента, что подробнее описано далее.
Вообще, стандартное исследование биоэквивалентности проводят перекрестным способом на небольшом числе добровольцев, как правило, на 24-36 здоровых нормальных взрослых людях. Вводят однократные дозы, содержащие испытываемый продукт, например трансдермальный пластырь по изобретению, и эталонный продукт, например фентаниловую систему DURAGESIC®, и измеряют во времени содержание лекарственного средства в крови или плазме. Характеристики таких кривых зависимости концентрации от времени, такие как площадь под кривой зависимости концентрации лекарственного средства в крови или плазме от времени (AUC) и максимальная концентрация лекарственного средства в крови или плазме (Cmax), проверяют статистическими процедурами, как подробнее описано далее. Вообще, определяют два односторонних статистических критерия с использованием преобразованного логарифмически параметра (AUC и Cmax) из исследования биоэквивалентности. Два односторонних критерия вычисляют при уровне значимости 0,05 и доверительном интервале 90%. Испытываемую и эталонную композиции считают биологически эквивалентными, если доверительный интервал вблизи отношения средней величины (испытываемый/эталонный продукт) для фармакокинетического параметра имеет нижнюю границу не менее 80% и верхнюю границу не более 125%.
Два различных продукта, вообще, считаются “фармакологически эквивалентными”, если оказывают, по существу, одинаковое лечебное действие, что демонстрируется несколькими способами in vivo и in vitro, как описано выше. Лечебное действие зависит от разных факторов, таких как эффективность лекарственного средства, растворимость и диффузионная способность лекарственного средства в коже, толщина кожи, концентрация лекарственного средства в коже в месте применения, концентрация лекарственного средства в резервуаре с лекарственным средством и т.п., как подробнее описано далее. Вообще, фармакологическую эквивалентность демонстрируют с использованием таких измерений, как максимальная концентрация лекарственного средства в крови или плазме, нормализованная по скорости введения лекарственного средства (т.е. нормализованная Cmax, определение которой дается выше), и максимальная концентрация лекарственного средства в крови или плазме, стандартизированная на единицу активной площади системы доставки лекарственного средства (т.е. стандартизированная Cmax, определение которой дается выше).
Когда для того, чтобы установить биоэквивалентность или фармакологическую эквивалентность, сравнивают два разных продукта, для которых скорость введения лекарственного средства пропорциональна размеру пластыря, различие отсутствует, если максимальная концентрация лекарственного средства в крови или плазме (Cmax) нормализована по скорости введения лекарственного средства или стандартизирована на единицу активной площади системы доставки лекарственного средства. Однако, когда для того, чтобы установить биоэквивалентность или фармакологическую эквивалентность, сравнивают два разных продукта с разной скоростью введения лекарственного средства на единицу площади, необходимо нормализовать максимальную концентрацию лекарственного средства в крови или плазме (Cmax) на основании скорости введения лекарственного средства.
Способы получения
Трансдермальные устройства изготовляют согласно обычным методам. Раствор полимерного вещества резервуара, описанного выше, загружают в планетарный смеситель, затем добавляют нужные количества лекарственного средства, предпочтительно - фентанила или суфентанила, предпочтительнее - фентанила основания или суфентанила основания, и, необязательно, усилитель проникновения. Предпочтительно полимерное вещество резервуара представляет собой клейкий полимер, растворимый в органическом растворителе, например этаноле, этилацетате, гексане и т.п. Затем смеситель закрывают и включают на период времени, за который достигается приемлемая однородность ингредиентов. Смеситель посредством соединительных устройств соединяют с подходящей головкой для отливки пленки, расположенной на конце линии отливка/сушка пленки. В смесителе создают избыточное давление с использованием азота и подают раствор в головку для отливки. Раствор отливают в виде влажной пленки на движущийся тонкий лист силицированного полиэфира. Лист пропускают по технологическим линиям и используют ряд печей для выпаривания растворителя из отлитой пленки до приемлемого предельного остатка. Затем высушенную пленку резервуара ламинируют с выбранной подложкой и ламинат наматывают на приемные цилиндры. При последующих операциях вырубают отдельные трансдермальные пластыри, разделяют и упаковывают по одному с использованием подходящих пакетиков для хранения. Пластыри упаковывают в картонную коробку с использованием обычного оборудования. В другом способе резервуар с лекарственным средством можно получить с использованием сухого смешивания и термического формирования пленки с использованием оборудования, известного в технике. Предпочтительно материалы смешивают в сухом состоянии и экструдируют с использованием щелевой экструзионной головки с последующим каландрованием до подходящей толщины.
Экспериментальная часть
Ниже приводятся примеры конкретных вариантов осуществления настоящего изобретения. Примеры предлагаются только в иллюстративных целях и никоим образом не предназначены для ограничения объема настоящего изобретения.
Следует прилагать усилия для обеспечения точности в отношении используемых показателей (т.е. количеств, температур и т.п.), но некоторые экспериментальные ошибки и отклонения, конечно, возможны.
Конкретные примеры различных трансдермальных пластырей изобретения, способные вводить фентанил и его аналоги на протяжении длительного времени, будут описываться в примерах, приведенных далее. Пластыри с прилипающим резервуаром, где резервуар состоит из однофазной полимерной композиции, свободной от нерастворенных компонентов, содержащей количество фентанила или суфентанила в концентрации субнасыщения, в настоящее время считаются предпочтительными согласно данному изобретению. В приведенных далее примерах все проценты являются массовыми, если не указано иное.
Пример 1
Получают монолитные трансдермальные пластыри согласно фигуре 1 размерами 5,5, 11, 22, 33 и 44 см2, содержащие, соответственно, каждый, 2,2, 4,4, 8,8, 13,2 и 17,6 мг фентанила основания.
Полиакрилатный адгезив (National Starch 87-2287, 100 г) растворяют в растворителе (этилацетат, 128 мл). К раствору полиакрилатного адгезива добавляют фентанил основание в количествах, достаточных для получения смеси, содержащей 3,4 мас.% фентанила в растворе адгезива, и перемешивают для растворения лекарственного средства. Раствор отливают в слой резервуара толщиной 2 мил и выпаривают растворитель. После выпаривания растворителя на адгезивный слой резервуара с лекарственным средством с использованием стандартных процедур ламинируют подложку толщиной 3 мил, состоящую из нескольких слоев, - слой нелинейного LDPE/слой линейного LDPE/слой нелинейного LDPE. Из полученного ламината вырубают отдельные пластыри размерами 5,5, 11, 22, 33 и 44 см2, содержащие, соответственно, каждый, 2,2, 4,4, 8,8, 13,2 и 17,6 мг фентанила, и получают монолитные трансдермальные пластыри, содержащие 0,4 мг/см2 фентанила основания.
Пример 2
Получают монолитные трансдермальные пластыри согласно фигуре 1 размерами 5,5, 11, 22, 33 и 44 см2, содержащие, соответственно, каждый, 2,2, 4,4, 8,8, 13,2 и 17,6 мг фентанила основания.
Полиакрилатный адгезив (National Starch 87-4287, 100 г) растворяют в растворителе (этилацетат, 160 мл). К раствору полиакрилатного адгезива добавляют фентанил основание в количествах, достаточных для получения смеси, содержащей 2,8 мас.% фентанила в растворе адгезива, и перемешивают для растворения лекарственного средства. Раствор отливают в слой резервуара толщиной 2 мил и выпаривают растворитель. После выпаривания растворителя на адгезивный слой резервуара с лекарственным средством с использованием стандартных процедур ламинируют подложку толщиной 1,7 мил, состоящую из нескольких слоев, - слой полиэтилена/полиуретана/слой сложного полиэфира. Из полученного ламината вырубают отдельные пластыри размерами 5,5, 11, 22, 33 и 44 см2, содержащие, соответственно, каждый, 2,2, 4,4, 8,8, 13,2 и 17,6 мг фентанила, и получают монолитные трансдермальные пластыри, содержащие 0,4 мг/см2 фентанила основания.
Пример 3
Получают монолитные трансдермальные пластыри размерами 5,5, 11, 22, 33 и 44 см2, содержащие, соответственно, 2,2, 4,4, 8,8, 13,2 и 17,6 мг фентанила основания, как описано в примерах 1 и 2, за следующими исключениями. Материалы смешивают в сухом состоянии в отсутствие этилацетата и экструдируют с использованием щелевой экструзионной головки с последующим каландрованием до подходящей толщины.
Пример 4
Получают монолитные трансдермальные пластыри согласно фигуре 1 размерами 5,2, 10,5, 21, 31,5 и 42 см2, содержащие, соответственно, каждый, 2, 4, 8, 12 и 16 мг фентанила основания. Полиакрилатный адгезив (National Starch 87-2287, 500 г) и глицерилмонолаурат (GML, 10 г) растворяют в растворителе (этилацетат, 640 мл). К раствору полиакрилатного адгезива добавляют фентанил основание в количествах, достаточных для получения смеси, содержащей 4 мас.% фентанила в растворе адгезива, и перемешивают для растворения лекарственного средства. Раствор отливают в слой резервуара толщиной 1,8 мил и выпаривают растворитель. После выпаривания растворителя на адгезивный слой резервуара с лекарственным средством с использованием стандартных процедур ламинируют подложку толщиной 3 мил, состоящую из нескольких слоев, - слой нелинейного LDPE/слой линейного LDPE/слой нелинейного LDPE. Из полученного ламината вырубают отдельные пластыри размерами 5,2, 10,5, 21, 31,5 и 42 см2, содержащие, соответственно, каждый, 2, 4, 8, 12 и 16 мг фентанила, и получают монолитные трансдермальные пластыри, содержащие 0,35 мг/см2 фентанила основания.
Пример 5
Получают монолитные трансдермальные пластыри размерами 5,2, 10,5, 21, 31,5 и 42 см2, содержащие, соответственно, каждый, 2, 4, 8, 12 и 16 мг фентанила, как описано в примере 4, за следующими исключениями. Материалы смешивают в сухом состоянии в отсутствие этилацетата и экструдируют с использованием щелевой экструзионной головки с последующим каландрованием до подходящей толщины.
Пример 6
Получают монолитные трансдермальные пластыри размерами 2,54 см2, содержащие, соответственно, каждый, 0,25, 0,5, 0,75, 1,0 и 1,1 мг (что соответствует 2, 4, 6, 8 и 9 мас.% соответственно) суфентанила и полиакрилатный адгезив (National Starch 87-4287), как описано выше в примерах 1 и 2.
Пример 7
Получают так, как описано в примере 6, монолитные трансдермальные системы размерами 2,54 см2, содержащие 1,1 мг суфентанила и усилитель проницаемости, причем каждая система сдержит, соответственно, одно из следующих веществ: лаурилпироглутамат (1,1 мг, 9 мас.%), глицерилмонокаприлат (1,2 мг, 10 мас.%) и глицерилмонокапринат (0,625 мг, 5 мас.%).
Подобным образом получают, как описано выше, монолитные трансдермальные системы, содержащие, каждая, соответственно, 0,25, 0,5, 0,75 и 1,0 мг (что соответствует 2, 4, 6 и 8 мас.% соответственно) суфентанила и усилитель проницаемости.
Пример 8
Проводят исследования in vitro с использованием различных трансдермальных фентаниловых пластырей - монолитных фентаниловых пластырей и фентаниловой системы DURAGESIC®. Монолитные фентаниловые пластыри, содержащие 0,4 мг/см2 фентанила основания на пластырь в 2,54 см2, получают так, как описано в примере 1. Сравнительные плотности трансдермального потока иллюстрируются фигурой 3. Исследования in vitro плотности потока фентанила проводят с использованием двухкамерной диффузионной ячейки со срезом эпидермиса с трупа человека, установленным между половинами ячейки. Трансдермальный пластырь приклеивают с одной стороны кожи, а принимающую лекарственное средство среду помещают в ячейке с рецепторной стороны. Прибор помещают в водяную баню, в которой поддерживают температуру 32±0,3оС. Образцы рецепторной среды собирают в течение 72 часов для анализа методом ВЭЖХ на концентрацию лекарственного средства. Зная объем рецептора, площадь кожи, на которую воздействуют, промежуток времени между взятием образцов и концентрацию лекарственного средства, вычисляют скорость переноса фентанила. Усредненная по времени скорость просачивания лекарственного средства составляет приблизительно 1,5 (±20% RSD) мкг/час·см2, что является средним значением, по меньшей мере, четырех экспериментов с использованием, по меньшей мере, четырех отдельных доноров кожи при трехкратном повторе (т.е. n=12).
Как показывает фигура 3, плотность потока лекарственного средства из монолитного субнасыщенного пластыря с нерегулируемой скоростью выше, чем из фентанилового пластыря-депо с жидкостным резервуаром с регулируемой скоростью DURAGESIC® на протяжении, по меньшей мере, 24 часов. От 24 часов до 72 часов плотность потока из монолитного субнасыщенного пластыря с нерегулируемой скоростью падает по сравнению с плотностью потока лекарственного средства из фентанилового пластыря-депо с регулируемой скоростью DURAGESIC® с жидкостным резервуаром.
Пример 9
Проводят исследования in vitro плотности потока фентанила, как описано в примере 8, с использованием разных монолитных фентаниловых и суфентаниловых пластырей. Монолитные фентаниловые пластыри, содержащие, каждый, 0,4 мг/см2 фентанила основания и 0,25, 0,5, 0,75, 1,0 и 1,1 мг/см2 (что соответствует 2, 4, 6, 8 и 9 мас.%, соответственно) суфентанила в пластыре 2,54 см2, получают так, как описано в примерах 1-7. Сравнительная трансдермальная плотность потока иллюстрируется фигурами 4, 5 и 6.
Пример 10
Проводят исследования in vivo плотности потока с использованием различных трансдермальных пластырей, описанных в примере 1, и фентаниловой системы DURAGESIC®, и сравнительные фармакокинетические параметры сводят в таблицы 1 и 2, приведенные ниже. Фармакокинетические параметры пластырей оценивают следующим образом.
Исследование представляет собой рандомизированное перекрестное трехфазное исследование с единым центром, одной дозой, открытой меткой, восемью последовательностями, восемью обработками. Здоровым взрослым людям произвольно назначают одну из 8 последовательных обработок. Существует минимальный период промывки, исчисляемый, по меньшей мере, 72 часами и не более чем 14 сутками между периодами обработки. Период промывки начинается после удаления исследуемой системы. Каждый субъект получает налтрексон за 14 часов до применения системы и дважды в сутки во время применения. Систему удаляют через 72 часа после нанесения. Серийные образцы крови берут у каждого субъекта в период каждой обработки перед получением дозы и через 0,5, 1, 2, 3, 5, 8, 12, 18, 24, 30, 36, 42, 48, 54, 60, 66, 72, 73, 74, 78, 84 и 96 часов после получения дозы. Образцы крови анализируют с использованием радиоиммуноанализа на уровни концентрации фентанила.
Результаты исследования in vivo приводятся в таблицах 1 и 2. Фигура 7 показывает концентрации фентанила в сыворотке после трансдермального применения различных фентаниловых пластырей - одного применения фентанилового пластыря (20 см2); двух применений фентанилового пластыря (40 см2) и фентаниловой системы DURAGESIC® (100 мкг/ч, 40 см2) на протяжении вплоть до 96 часов после первого применения.
Пример 11
Проводят исследование плотности потока in vivo с использованием различных трансдермальных фентаниловых пластырей - монолитных фентаниловых пластырей, описанных в примере 1, и фентаниловой системы DURAGESIC®, как описано в примере 9, за следующими исключениями.
Исследование представляет собой рандомизированное перекрестное двухфазное исследование с единым центром, одной дозой, открытой меткой, двумя последовательностями, двумя обработками. Здоровым взрослым людям произвольно назначают одну из двух последовательных обработок. Существует минимальный период промывки, исчисляемый, по меньшей мере, 72 часами и не более чем 14 сутками между периодами обработки. Период промывки начинается после удаления исследуемой системы. Каждый субъект получает налтрексон за 14 часов до применения системы и дважды в сутки во время применения. Систему удаляют через 72 часа после нанесения. Серийные образцы крови берут у каждого субъекта в период каждой обработки перед получением дозы и через 0,5, 1, 2, 3, 5, 8, 12, 18, 24, 30, 36, 42, 48, 54, 60, 66, 72, 73, 74, 78, 84, 96, 108 и 120 часов после получения дозы. Образцы крови анализируют с использованием радиоиммуноанализа на уровни концентрации фентанила.
Результаты исследования in vivo приводятся в таблице 3. Фигура 8 показывает концентрации фентанила в сыворотке после трансдермального применения различных фентаниловых пластырей - фентанилового пластыря по изобретению (100 мкг/ч, 40 см2) и фентаниловой системы DURAGESIC® (100 мкг/ч, 40 см2) на протяжении до 120 часов после первого применения. Характеристики указанных кривых зависимости концентрации от времени, такие как площадь под кривой зависимости концентрации в сыворотке от времени (AUC) и максимальная концентрация лекарственного средства в крови или плазме (Cmax), проверяют с помощью статистических процедур, описанных ранее. Два односторонних статистических критерия получают с использованием преобразованного логарифмически параметра (AUC и Cmax) из исследования in vivo (биоэквивалентности). Вычисляют два односторонних критерия при уровне значимости 0,05 и доверительном интервале 90%. Испытываемую и эталонную композиции считают биологически эквивалентными, если доверительный интервал вблизи отношения средней величины (испытываемый/эталонный продукт, т.е. обработка В/обработка А) для фармакокинетического параметра имеет нижнюю границу не менее 80% и верхнюю границу не более 125%. Результаты статистического анализа преобразованных логарифмически фармакокинетических (РК) параметров приводятся в таблице 4.
Таким образом, как следует из результатов, приведенных выше в таблице и иллюстрированных фигурами 3-8, монолитный субнасыщенный трансдермальный пластырь настоящего изобретения, включающий резервуар, состоящий из однофазной полимерной композиции, содержащей, по существу, лекарственное средство в субнасыщенной концентрации, является продуктом, биологически эквивалентным насыщенной фентаниловой системе DURAGESIC® с регулируемой скоростью. В частности, монолитные субнасыщенные пластыри по изобретению показывают фармакокинетические параметры, сравнимые с параметрами трансдермальной фентаниловой системы DURAGESIC®.
Настоящее изобретение описывается и отличается одной или несколькими из перечисленных далее особенностей и/или характеристик, или одной или в сочетании с одной или несколькими другими особенностями и характеристиками.
Трансдермальный пластырь для введения через кожу фентанила или его аналогов, содержащий (а) подложку; (b) резервуар, расположенный на подложке, причем, по меньшей мере, соприкасающаяся с кожей поверхность указанного резервуара является липкой; причем указанный резервуар состоит из однофазной полимерной композиции, свободной от нерастворенных компонентов, содержащей количество фентанила или его аналога, достаточное для того, чтобы вызвать и поддерживать аналгезию у человека в течение, по меньшей мере, трех суток и вплоть до семи суток; пластырь обнаруживает нормализованную Cmax, колеблющуюся от примерно 3,3 до примерно 82,5 (нг/мл)/(мг/ч) и стандартизированную Cmax от примерно 0,001 до примерно 0,2 нг/(мл·см2), и плотность потока лекарственного средства в стационарном состоянии от примерно 0,1 до примерно 20 мкг·см-2·ч-1. Предпочтительно резервуар формируют из липкого полимера, предпочтительнее адгезив представляет собой полиакрилатный адгезив. Резервуар содержит лекарственное средство, выбранное из группы, состоящей из фентанила, альфентанила, лофентанила, ремифентанила, суфентанила и трефентанила. Предпочтительно лекарственное средство находится в форме основания, и предпочтительным лекарственным средством является фентанил или суфентанил. Резервуар с лекарственным средством содержит полимер, имеющий насыщенность в отношении фентанила и его аналогов от примерно 1 мас.% до примерно 25 мас.%; от примерно 0,05 до примерно 1,75 мг/см2 фентанила или его аналогов и имеет толщину от примерно 0,0125 мм (0,5 мил) до примерно 0,1 мм (4 мил). Резервуар, необязательно, содержит усилитель. Пластырь имеет подложку, содержащую полимер, выбранный из группы, состоящей из полиуретана, поливинилацетата, поливинилиденхлорида, полиэтилена, полиэтилентерефталата (РЕТ), ламинатов РЕТ-полиолефина и полибутилентерефталата, предпочтительно материалов на основе полиэтилена низкой плотности (LDPE); где подложка имеет толщину от примерно 2 мил до примерно 5 мил. Предпочтительно лекарственное средство находится в форме основания, и предпочтительным лекарственным средством является фентанил, где фентанил имеет растворимость в резервуаре от 7 мас.% до 12 мас.%; резервуар формируют из адгезива, предпочтительно - полиакрилатного адгезива, предпочтительнее - полиакрилатного адгезива с Tg ниже -10оС. В предпочтительных вариантах воплощения резервуар содержит от примерно 0,05 до примерно 1,75 мг/см2 фентанила основания; предпочтительно - от примерно 0,07 до примерно 1,50 мг/см2 фентанила основания; предпочтительно - от примерно 0,08 до примерно 1,25 мг/см2 фентанила основания; предпочтительнее - от примерно 0,09 до примерно 1,0 мг/см2 фентанила основания; более предпочтительно - от примерно 0,1 до примерно 0,75 мг/см2 фентанила основания; и даже предпочтительнее - от примерно 0,12 до примерно 0,5 мг/см2 фентанила основания. В других предпочтительных вариантах воплощения лекарственное средство представляет собой форму основания, и предпочтительным лекарственным средством является суфентанил, где суфентанил имеет растворимость в резервуаре от 1 мас.% до 25 мас.%; резервуар получают из адгезива, предпочтительно - полиакрилатного адгезива, предпочтительнее - полиакрилатного адгезива с Tg ниже -10оС. В предпочтительных вариантах воплощения резервуар содержит от примерно 0,05 до примерно 1,75 мг/см2 суфентанила основания; предпочтительно - от примерно 0,07 до примерно 1,50 мг/см2 суфентанила основания; предпочтительно - от примерно 0,08 до примерно 1,25 мг/см2 суфентанила основания; предпочтительно - от примерно 0,09 до примерно 1,0 мг/см2 суфентанила основания; предпочтительнее - от примерно 0,1 до примерно 0,75 мг/см2 суфентанила основания; более предпочтительно - от примерно 0,12 до примерно 0,5 мг/см2 суфентанила основания; и даже предпочтительнее - от примерно 0,25 до примерно 0,4 мг/см2 суфентанила основания.
Трансдермальный пластырь для введения через кожу фентанила или его аналогов, содержащий (а) подложку; (b) резервуар, расположенный на подложке, причем, по меньшей мере, соприкасающаяся с кожей поверхность указанного резервуара является липкой; причем указанный резервуар состоит из однофазной полимерной композиции, свободной от нерастворенных компонентов, содержащей количество фентанила или его аналога, достаточное для того, чтобы вызвать и поддерживать аналгезию у человека в течение, по меньшей мере, трех суток; где пластырь является биологически эквивалентным или фармакологически эквивалентным трансдермальной фентаниловой системе DURAGESIC®; пластырь обнаруживает нормализованную Cmax, колеблющуюся от примерно 3,3 до примерно 82,5 (нг/мл)/(мг/ч) и стандартизированную Cmax от примерно 0,001 до примерно 0,2 нг/(мл·см2), и плотность потока лекарственного средства в стационарном состоянии от примерно 0,1 до примерно 20 мкг·см-2·ч-1. Предпочтительно лекарственное средство находится в форме основания, и предпочтительным лекарственным средством является фентанил, где фентанил имеет растворимость в резервуаре от 7 мас.% до 12 мас.%; резервуар получают из адгезива, предпочтительно - полиакрилатного адгезива, предпочтительнее - полиакрилатного адгезива с Tg ниже -10оС. В предпочтительных вариантах воплощения резервуар содержит от примерно 0,05 до примерно 1,75 мг/см2 фентанила основания; предпочтительно - от примерно 0,07 до примерно 1,50 мг/см2 фентанила основания; предпочтительно - от примерно 0,08 до примерно 1,25 мг/см2 фентанила основания; предпочтительнее - от примерно 0,09 до примерно 1,0 мг/см2 фентанила основания; более предпочтительно - от примерно 0,1 до примерно 0,75 мг/см2 фентанила основания; и даже предпочтительнее - от примерно 0,12 до примерно 0,5 мг/см2 фентанила основания. В других предпочтительных вариантах воплощения лекарственное средство находится в форме основания, и предпочтительным лекарственным средством является суфентанил, где суфентанил имеет растворимость в резервуаре от 1 мас.% до 25 мас.%; резервуар получают из адгезива, предпочтительно - полиакрилатного адгезива, предпочтительнее - полиакрилатного адгезива с Tg ниже -10оС. В предпочтительных вариантах воплощения резервуар содержит от примерно 0,05 до примерно 1,75 мг/см2 суфентанила основания; предпочтительно - от примерно 0,07 до примерно 1,50 мг/см2 суфентанила основания; предпочтительно - от примерно 0,08 до примерно 1,25 мг/см2 суфентанила основания; предпочтительнее - от примерно 0,09 до примерно 1,0 мг/см2 суфентанила основания; более предпочтительно - от примерно 0,1 до примерно 0,75 мг/см2 суфентанила основания; предпочтительнее - от примерно 0,12 до примерно 0,5 мг/см2 суфентанила основания; и даже предпочтительнее - от примерно 0,25 до примерно 0,4 мг/см2 суфентанила основания.
Монолитный трансдермальный пластырь для введения фентанила, содержащий липкий резервуар с фентанилом на подложке, причем указанный резервуар состоит из однофазной полимерной композиции, свободной от нерастворенных компонентов, содержащей полиакрилатный адгезив, достаточно насыщенный фентанилом для того, чтобы растворенный фентанил содержался в количестве, достаточном для того, чтобы вызвать и поддерживать аналгезию у человека в течение, по меньшей мере, трех суток и вплоть до семи суток, где фентанил имеет растворимость в указанном резервуаре, по меньшей мере, 4 мас.%; резервуар имеет толщину от примерно 0,0125 мм (0,5 мил) до примерно 0,1 мм (4 мил); причем пластырь полностью свободен от мембраны, регулирующей скорость, причем пластырь обнаруживает нормализованную Cmax, колеблющуюся от примерно 3,3 до примерно 82,5 (нг/мл/(мг/ч) и стандартизированную Cmax от примерно 0,01 до примерно 0,2 нг/(мл·см2), и плотность потока лекарственного средства в стационарном состоянии примерно 1-10 мкг·см-2·ч-1; и где пластырь является биологически эквивалентным трансдермальной фентаниловой системе DURAGESIC®.
Монолитный трансдермальный пластырь для введения суфентанила, содержащий липкий резервуар с суфентанилом на подложке, причем указанный резервуар состоит из однофазной полимерной композиции, свободной от нерастворенных компонентов, содержащей полиакрилатный адгезив, достаточно насыщенный суфентанилом для того, чтобы растворенный суфентанил содержался в количестве, достаточном для того, чтобы вызвать и поддерживать аналгезию у человека в течение, по меньшей мере, трех суток и вплоть до семи суток, где суфентанил имеет растворимость в указанном резервуаре, по меньшей мере, 5 мас.%; резервуар имеет толщину от примерно 0,0125 мм (0,5 мил) до примерно 0,1 мм (4 мил); причем пластырь полностью свободен от мембраны, регулирующей скорость, причем пластырь обнаруживает нормализованную Cmax, колеблющуюся от примерно 0,04 до примерно 10 (нг/мл)/(мг/ч) и стандартизированную Cmax от примерно 0,001 до примерно 0,05 нг/(мл·см2), и плотность потока лекарственного средства в стационарном состоянии от примерно 1 до примерно 10 мкг·см-2·ч-1; и где пластырь является фармакологически эквивалентным трансдермальной фентаниловой системе DURAGESIC®.
Вышеописанные примеры вариантов воплощения предназначены для пояснения изобретения во всех отношениях, а не для ограничения объема настоящего изобретения.
Таким образом, настоящее изобретение можно осуществить во многих вариациях, которые специалист в данной области техники может вывести из приведенного описания. Все такие вариации и модификации охватываются объемом и сущностью настоящего изобретения.
Реферат
Изобретение относится к медицине. Описан способ и монолитный субнасыщенный пластырь с нерегулируемой скоростью для введения субъекту через кожу фентанила и его аналогов в целях обезболивания на протяжении длительного периода времени. 4 з.п. ф-лы, 8 ил., 4 табл.
Формула
(a) подложку;
(b) резервуар, расположенный на подложке, причем, по меньшей мере, соприкасающаяся с кожей поверхность указанного резервуара представляет собой полиакрилатный адгезив, причем указанный резервуар включает полиакрилатный адгезив и свободен от нерастворенного фентанила и его аналогов, где указанный полиакрилатный адгезив содержит растворенные в нем фентанил или его аналог в количестве, достаточном для того, чтобы вызвать и поддерживать аналгезию у человека в течение от одних до трех суток, и где полиакрилатный адгезив содержит полиакрилат, полученный путем полимеризации мономерных компонентов,
где указанный резервуар имеет толщину от 0,0125 (0,5 мил) до 0,1 мм (4 мил).

Комментарии