Композиция для чрескожной доставки лекарственного средства - RU2449766C2
Код документа: RU2449766C2
Чертежи





Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к системе чрескожной доставки лекарственных средств. Более конкретно, настоящее изобретение относится к системе чрескожной доставки терапевтически эффективного количества лекарственного средства, которое включает ингибитор ангиотензин-превращающего фермента и соответствующее пролекарство ингибитора ангиотензин-превращающего фермента.
Уровень техники
В настоящее время известно использование системы для чрескожной доставки лекарственного средства, например лекарственного средства, содержащего чувствительный к надавливанию адгезив, в качестве средства для введения терапевтически эффективных количеств лекарственного средства. Для таких известных систем доставки используют включение лекарственного средства в носитель, такой как полимерный и/или чувствительный к надавливанию адгезивный состав или другие формы носителей. Чувствительный к надавливанию адгезив должен эффективно приклеиваться к коже и обеспечивать миграцию лекарственного средства из носителя через кожу и в кровоток пациента.
В частности, в системах чрескожной доставки лекарственных средств используют стероиды, такие как эстрадиол и норэтиндрон, например, при гормон-заместительной терапии. Указанные стероиды можно вводить отдельно, например, с помощью системы чрескожной доставки эстрадиола, известной под торговым названием Vivelle® and Vivelle-Dot™, которая выпускается фирмой Noven Pharmaceuticals, Inc. of Miami, Флорида. См. также патент США №6221383. В другом варианте два или более стероидов можно вводить одновременно, например, в составе системы чрескожной доставки эстрадиола/ацетата норэтиндрона, под товарным знаком CombiPatch™, которая также выпускается фирмой Noven Pharmaceuticals. См. также патент США №6221383 и патент США №5474783.
Способ получения систем для чрескожной доставки более одного лекарственного средства в основном представляет значительную проблему в связи с различными взаимодействиями каждого лекарственного средства с носителем, компонентами и т.п., особенно если присутствует другое лекарственное средство. Кроме того, государственные организации, контролирующие качество фармацевтических продуктов, такие как Администрация по контролю качества пищевых и лекарственных препаратов США (FDA), предъявляют все более жесткие требования к испытаниям многокомпонентных лекарственных средств, как каждого компонента в отдельности, так и в составе смеси для оценки эффективности. Таким образом, лекарственное средство, такое как стероид, в основном вводят только в одной форме (например, в форме норэтиндрона или ацетата норэтиндрона). См., например, патент США №6149935.
В заявке WO 99/15156 описано использование стероида в качестве добавки, которая действует как ингибитор кристаллизации в устройствах для чрескожной доставки лекарственных средств, если лекарственным средством является гормон. В заявке WO 99/15156 указано, что в устройстве содержится стероид в количестве, которое является недостаточным для обеспечения заметного фармацевтического или физиологического действия. См. также другие патенты США №№5633242, 4906169, 5711962, 6153216, 5898032, 5811117 и 6024974.
Одной из проблем при доставке лекарственных средств, таких как стероиды, из чрескожных систем для доставки лекарственных средств является скорость высвобождения лекарственного средства (обычно называемая "скорость потока" или "скорость проникновения") из системы чрескожной доставки. Более подробно, во многих областях использования требуется более высокая скорость потока лекарственного средства (например, стероида) из системы. Существует также множество областей использования, в которых требуется более низкая скорость потока лекарственного средства (например, стероида) из системы. Другими словами, одна из проблем при чрескожной доставке лекарственных средств заключается в контроле переноса лекарственного средства из композиции через кожу в кровоток субъекта и, таким образом, в контроле (регулировании) уровня лекарственного средства в крови.
Один из известных способов избирательного контроля скорости проникновения лекарственного средства из чрескожной композиции описан в патенте США №5474783, права на который принадлежат заявителю настоящего изобретения. В этом патенте для изменения растворимости лекарственного средства в системе носителя используют два или более полимера. Несмотря на то, что этот способ контроля скорости проникновения обычно достаточно эффективен, не во всех случаях возможен контроль скорости проникновения лекарственного средства до необходимого уровня, например для обеспечения увеличения или уменьшения продолжительности доставки лекарственного средства и для увеличения или уменьшения периода до начала терапевтического действия.
Другая проблема доставки лекарственных средств, в частности стероидов, заключается в тенденции лекарственных средств (например, стероидов) к кристаллизации в носителе чрескожной системы. В результате снижается количество стероида, доступного для чрескожного введения. Хотя добавка солюбилизирующих агентов, таких как поливинилпирролидон (PVP), ингибирует кристаллизацию, в некоторых областях применения требуется более сильный ингибирующий эффект.
В патенте США №6368616 В1 описана двухфазная (водная или масляная) жидкая композиция, включающая по меньшей мере: (А) нестероидное противовоспалительное лекарственное средство (NSAID), (Б) спирт (агент, предназначенный для снижения температуры плавления, столбец 4, строка 60), (В) воду и (Г) второй агент, снижающий температуру плавления. Указанные композиции являются двухфазными, содержащими твердые вещества, которые в значительной степени плавятся при 25°C. Термин "второй агент, снижающий температуру плавления", определенный в патенте ′616, означает растворители, усиливающие агенты, вспомогательные вещества или лекарственные средства, такие как обезболивающие средства или нестероидные противовоспалительные средства (NSAID).
В патенте США №4529601 описаны два различных, основных местноанестезирующих средства, которые плавятся одновременно при комнатной температуре. Температуры плавления предпочтительно составляют менее 40°C, более предпочтительно менее 25°C.
Раскрытие изобретения
Первая задача настоящего изобретения заключается в преодолении недостатков, описанных выше в предшествующем уровне техники. Другой задачей изобретения является разработка системы чрескожной доставки лекарственных средств с более эффективным контролем (регулированием) скорости проникновения лекарственного средства, периода до начала действия и/или продолжительности доставки и/или действия лекарственного средства. Еще одной задачей настоящего изобретения является создание системы чрескожной доставки лекарственных средств усовершенствованной скоростью потока лекарственного агента по сравнению с системами равного размера. Следующей задачей настоящего изобретения является разработка композиции, в которой снижена степень образования кристаллов в системе чрескожной доставки лекарственного средства или они не образуются.
Вышеуказанные и другие задачи изобретения достигаются согласно одному аспекту изобретения путем получения композиции, предпочтительно композиции для нанесения на кожу, причем композиция содержит смесь, включающую терапевтически эффективное количество лекарственного средства, которое содержит исходное лекарственное средство и пролекарство, а также фармацевтически приемлемый носитель, причем исходное лекарственное средство и пролекарство каждое в отдельности содержатся в эффективном количестве для обеспечения фармакологического действия. В предпочтительном варианте воплощения настоящего изобретения композиция характеризуется более коротким или более длинным периодом до начала терапевтического действия по сравнению с идентичной композицией, содержащей фармакологически эквивалентные количества исходного лекарственного средства или пролекарства в отдельности. В другом предпочтительном варианте воплощения настоящего изобретения композиция характеризуется уровнями лекарственного средства в крови, различающимися в сравнении с идентичной композицией, содержащей фармакологически эквивалентные количества исходного лекарственного средства или пролекарства в отдельности. В еще одном предпочтительном варианте воплощения композиция характеризуется более низкой или более высокой скоростью проникновения лекарственного средства по сравнению с идентичной композицией, содержащей фармакологически эквивалентные количества исходного лекарственного средства и пролекарства в отдельности. В другом предпочтительном варианте воплощения композиция характеризуется увеличенной или уменьшеной продолжительностью терапевтического действия по сравнению с идентичной композицией, содержащей фармакологически эквивалентные количества исходного лекарственного средства или пролекарства в отдельности. В еще одном предпочтительном варианте воплощения пролекарство является более липофильным, чем исходное лекарственное средство, и характеризуется более высокой скоростью проникновения через кожу. В другом предпочтительном варианте воплощения температура плавления смеси исходного лекарственного средства и пролекарства ниже, чем температура плавления исходного лекарственного средства или пролекарства каждого в отдельности. Согласно еще одному предпочтительному варианту воплощения носитель включает чувствительный к надавливанию адгезив, который содержит два или более полимеров, причем скорость проникновения лекарственного средства регулируется за счет изменения типа и/или соотношения двух или более полимеров.
Согласно одному аспекту изобретения разработана композиция для чрескожной доставки лекарственного средства, которая осуществляется из смеси, включающей терапевтически эффективное количество лекарственного средства, содержащего ингибитор ангиотензин-превращающего фермента (АПФ) и соответствующее пролекарство ингибитора АПФ, а также фармацевтически приемлемый носитель. Предпочтительным ингибитором АПФ является рамиприл, а пролекарством метиловый и/или этиловый эфир рамиприла.
Остальные задачи, аспекты и преимущества настоящего изобретения представляются очевидными при прочтении подробного описания следующих предпочтительных вариантов воплощения.
Краткое описание чертежей
На фиг.1 представлен график зависимости скорости потока лекарственного средства от времени из композиции, содержащей ацетат норэтиндрона и эстрадиол, и из композиции, содержащей смесь норэтиндрона/ацетата норэтиндрона и эстрадиола.
На фиг.2 представлен график зависимости скорости потока ацетата норэтиндрона от времени из композиции, содержащей ацетат норэтиндрона и эстрадиол, смеси норэтиндрона/ацетата норэтиндрона из композиции, содержащей норэтиндрон/ацетат норэтиндрона и эстрадиол, и норэтиндрона из композиции, содержащей норэтиндрон и эстрадиол.
На фиг.3 представлен график зависимости от времени скорости потока смеси тестостерона/ацетата тестостерона из композиции, содержащей тестостерон/ацетат тестостерона, скорости потока ацетата тестостерона из той же композиции, скорости потока тестостерона из той же композиции, и скорости потока тестостерона из системы чрескожной доставки лекарственных средств с торговым названием Testoderm®, выпускаемой фирмой Alza Inc.
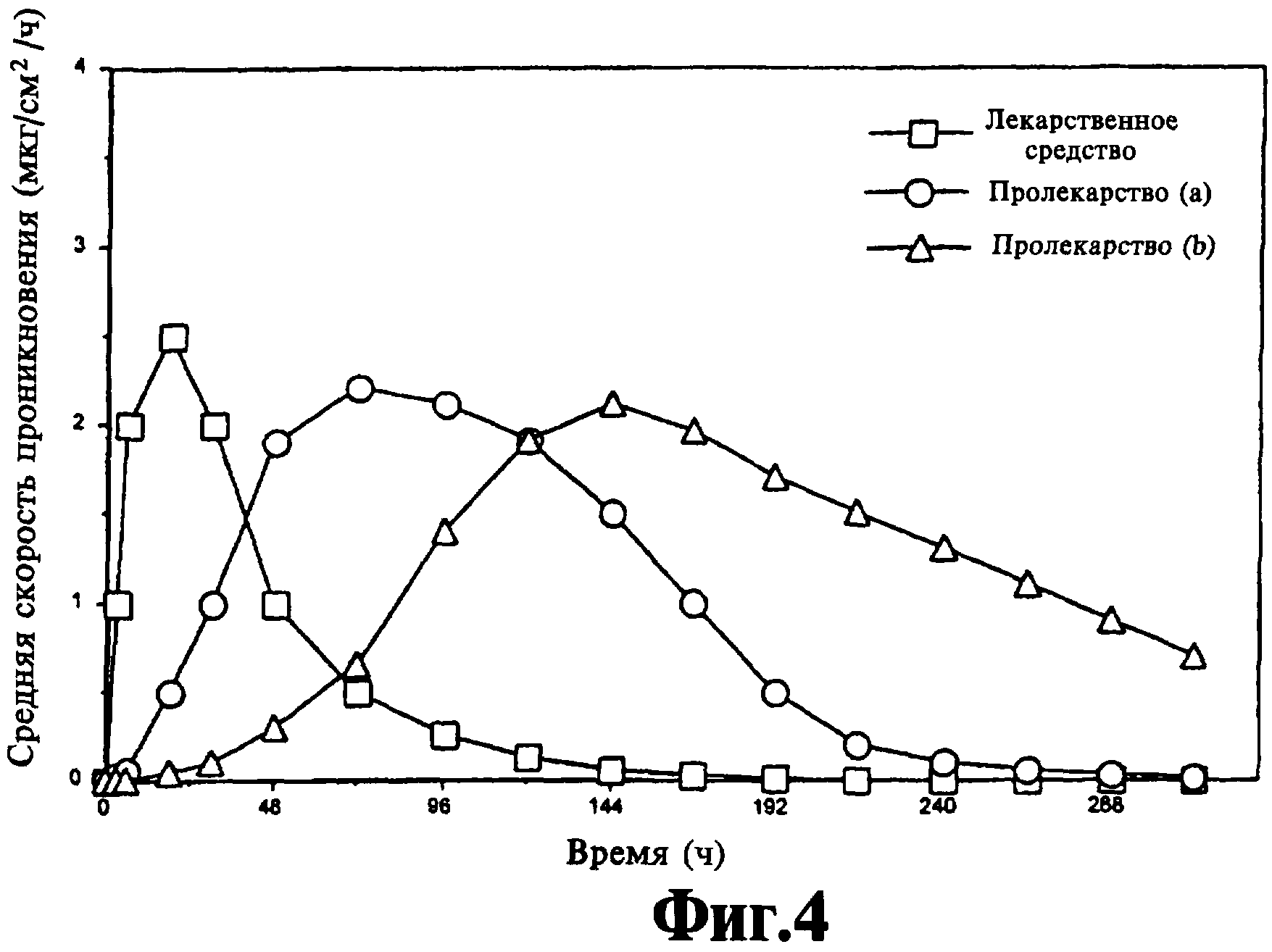
На фиг.4 представлен график зависимости теоретической скорости проникновения лекарственного средства и пролекарства от времени из единой чрескожной композиции, содержащей исходное лекарственное средство и два пролекарства.
На фиг.5 представлено кумулятивное проникновение норэтиндрона из различных комбинаций лекарственного средства/пролекарства.
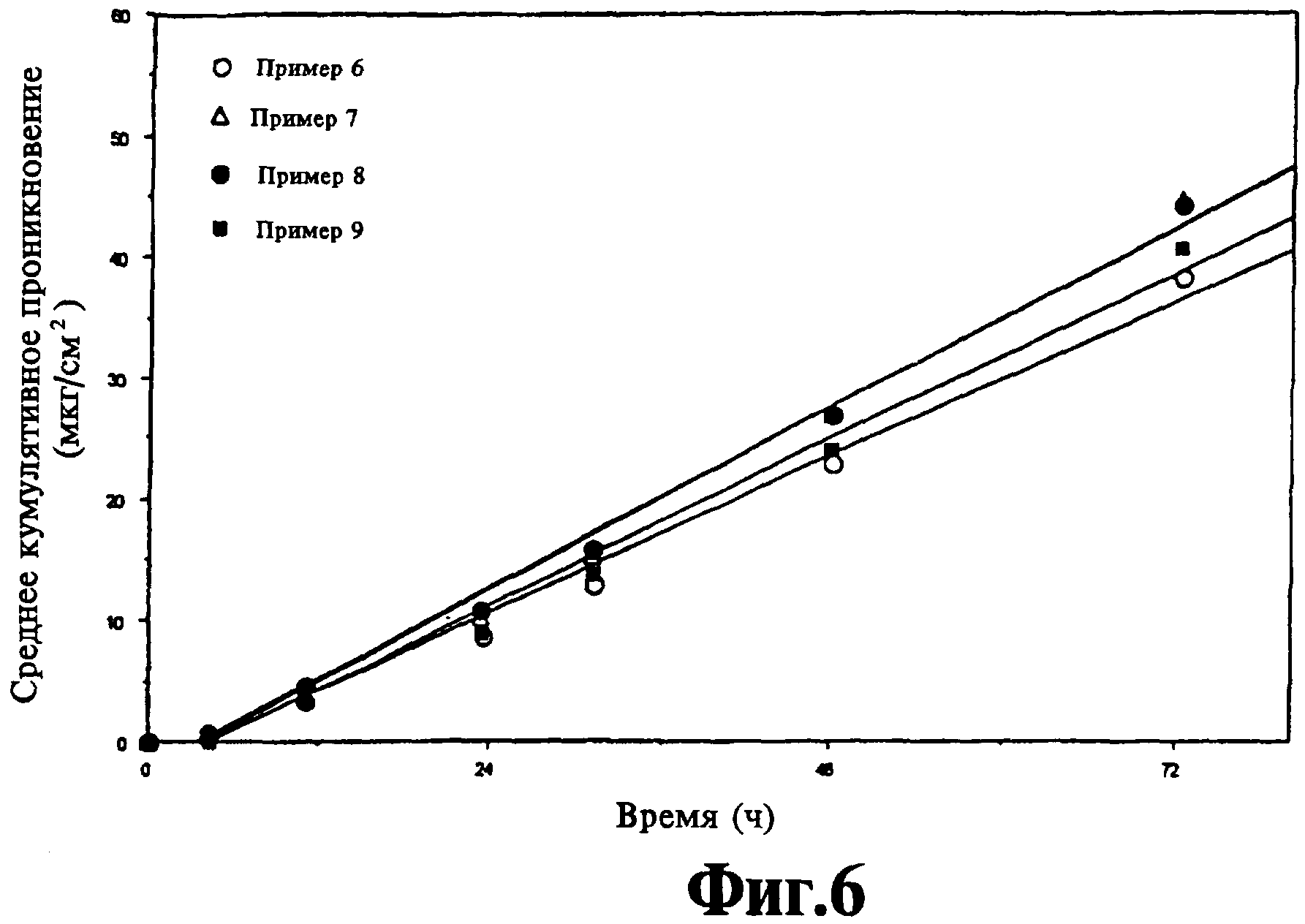
На фиг.6 представлено кумулятивное проникновение ацетата норэтиндрона из различных комбинаций лекарственного средства/пролекарства.
На фиг.7 представлено суммарное кумулятивное проникновение норэтиндрона и ацетата норэтиндрона из различных комбинаций лекарственного средства/пролекарства.
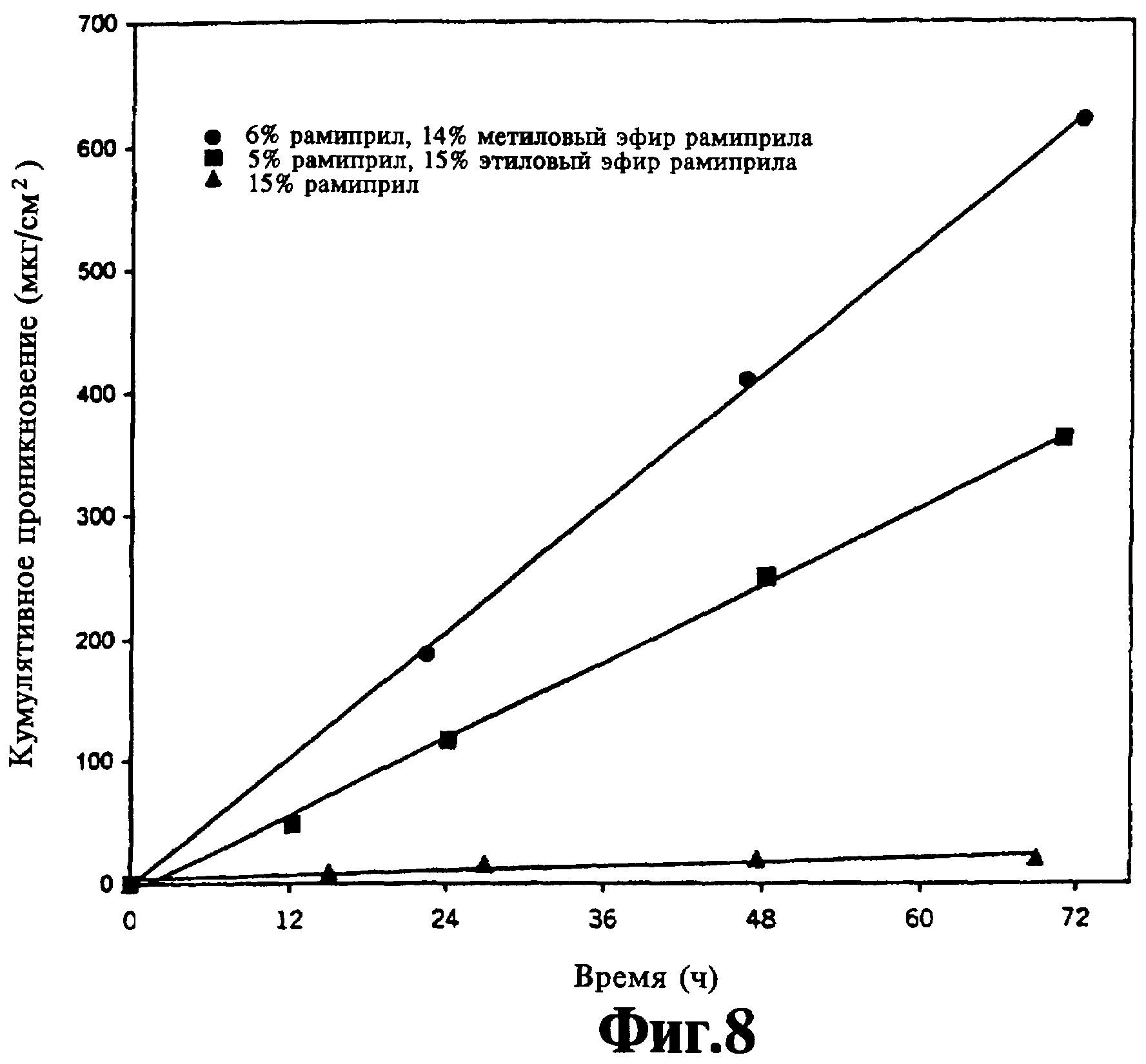
На фиг.8 представлено кумулятивное проникновение рамиприла и его пролекарств.
На фиг.9 представлено кумулятивное проникновение пролекарств рамиприла в присутствии в отсутствие усиливающих агентов.
Осуществление изобретения
В настоящем изобретении, среди прочего, разработана композиция для чрескожной доставки лекарственных средств, предназначенная для введения терапевтически эффективного количества лекарственного средства за счет доставки смеси исходного лекарственного средства и пролекарства.
Термин "чрескожная доставка", использованный в данном описании, означает как чрескожное (подкожное или кожное) введение, так и чресслизистое введение, то есть доставку за счет прохождения лекарственного средства через кожу или слизистую ткань в кровоток.
Термин "скорость потока" (называемый также "скорость проникновения"), использованный в данном описании, означает впитывание лекарственного средства через кожу или слизистую оболочку, которое описывается первым законом диффузии Фика:
J=-D(dCm/dx)
где J означает скорость потока в г/см2/с;
D означает коэффициент диффузии лекарственного средства через кожу или слизистую оболочку в см2/с;
dCm/dx означает градиент концентрации лекарственного средства через кожу или слизистую оболочку.
Термин "лекарственное средство", использованный в данном описании, означает активное соединение, которое оказывает положительное терапевтическое, профилактическое и/или фармакологически или физиологически полезное действие, или их смесь, доставляемую в живой организм для обеспечения требуемого, желательно положительного действия. Более подробно, в объем изобретения включено любое лекарственное средство, способное вызывать у растений или животных фармакологическую ответную реакцию местного или системного типа независимо от природы терапевтического, диагностического или профилактического действия. Лекарственное средство может обладать фармакологической активностью, или может потребоваться дальнейшая его биотрансформация. Термин "лекарственное средство" включает оба термина: "исходное лекарственное средство" и "пролекарство", как описано ниже. Лекарственное средство следует использовать в количестве, достаточном для проведения профилактики, лечения, диагностики или терапии заболевания или другого состояния, в зависимости от конкретного случая.
Термин "исходное лекарственное средство", использованный в данном описании, идентичен термину "лекарственное средство", за исключением того, что исходное лекарственное средство не подвергается биотранформации для его превращения в фармакологически более активное соединение.
Термин "пролекарство", использованный в данном описании, означает фармакологически менее активное производное исходного лекарственного средства, причем для высвобождения более активного исходного лекарственного средства требуется самопроизвольная или ферментативная биотрансформация упомянутого пролекарства в организме. К пролекарствам относятся модифицированные исходные лекарственные средства или их производные, которые содержат группы, расщепляемые в условиях метаболизма. Если в физиологических условиях происходит сольволиз пролекарства или происходит его ферментативная деградация, то пролекарства превращаются в исходные лекарственные средства, проявляющие фармацевтическую активность in vivo. Можно использовать пролекарства одноступенчатого, двухступенчатого или трехступенчатого типа и т.д., в зависимости от числа стадий биотрасформации, требуемых для высвобождения активного исходного лекарственного средства в организме, причем число стадий означает число функциональных групп, содержащихся в молекуле предшественника. Общеизвестные в данной области техники пролекарства включают производные кислот, такие как, например, сложные эфиры, полученные при взаимодействии исходных кислот с подходящим спиртом, или амиды, полученные при взаимодействии исходного кислотного соединения с амином, или ацилированные производные основных соединений, полученные при взаимодействии с основными группами. См. книги: Bundgard, Design of Prodrugs (Создание пролекарств), стр.7-9, 21-24, Elsevier, Amsterdam 1985; Silverman, The Organic Chemistry of Drug Design and Drug Action (Органическая химия, используемая при создании лекарственных средств, и их действие), стр.352-401, Academic Press, San Diego, Calif., 1992; Burger's Medicinal Chemistry and Drug Chemistry (Медицинская химия и химия лекарственных средств), 5-е изд., т.1, стр.172-178, 949-982 (1995).
Термин "фармакологически эквивалентное количество", использованный в данном описании, означает количество исходного лекарственного средства или пролекарства, которое обеспечивает терапевтическое действие, эквивалентное действию определенного суммарного количества исходного лекарственного средства и пролекарства.
Термин "уровень лекарственного средства в крови", использованный в данном описании, означает концентрацию в крови исходного лекарственного средства или пролекарства, наблюдаемую в определенный период времени, обычно начиная с момента введения.
Согласно одному аспекту изобретения авторы обнаружили, что скорость проникновения и уровень в крови лекарственного средства, введенного субъекту чрескожным способом, можно легко контролировать путем использования пролекарства в комбинации с исходным лекарственным средством. При введении комбинации исходного лекарственного средства с пролекарством на уровень в крови можно влиять с учетом двух основных факторов: (1) общая растворимость комбинации исходного лекарственного средства/пролекарства в носителе и (2) выбор типа пролекарства для влияния на его перенос через кожу и на его метаболитическое превращение в исходное лекарственное средство в организме субъекта.
Путем изменения общей растворимости исходного лекарственного средства/пролекарства в носителе можно увеличивать и/или уменьшать общую концентрацию насыщения исходного лекарственного средства/пролекарства и, следовательно, скорость высвобождения лекарственного средства из носителя. Общую растворимость исходного лекарственного средства/пролекарства в носителе можно контролировать за счет регулирования концентрации исходного лекарственного средства и пролекарства относительно друг друга. Этот метод основан на различии в величинах растворимости исходного лекарственного средства и пролекарства в композиции благодаря различию в полярности исходного лекарственного средства и пролекарства, а также других факторов, таких как образование водородных связей. С помощью изменения заместителей в молекуле можно значительно влиять на растворимость. Кроме того, для изменения растворимости исходного лекарственного средства и пролекарства в композиции можно использовать сорастворители и другие солюбилизирующие агенты.
Другой родственный метод изменения общей растворимости исходного лекарственного средства/пролекарства заключается в изменении растворимости с помощью выбора полимеров в составе носителя. Изменение растворимости на основе выбора полимеров для оптимизации скорости проникновения исходного лекарственного средства или пролекарства без изменения растворимости пролекарства или исходного лекарственного средства описан в патенте США №5474783, указанном выше и полностью включенном в данное описание в качестве ссылки. Те же самые принципы в отношении растворимости лекарственного средства в смеси полимеров можно также применять к носителю в смеси с комбинацией исходного лекарственного средства/пролекарства.
Термин "смесь", использованный в данном описании, означает полное отсутствие или в значительной степени отсутствие химических реакций или поперечной сшивки (в отличии от простых водородных связей) между полимерами в составе полимерного адгезива-носителя.
Полимеры, содержащиеся в составе многокомпонентного полимерного адгезива-носителя, являются инертными в отношении лекарственного средства и предпочтительно не смешиваются друг с другом. Формирование смеси нескольких полимеров позволяет получить адгезив-носитель с характеристическим "параметром общей (конечной) растворимости", выбор которого обеспечивает преимущество упомянутой смеси и позволяет осуществлять выборочную модуляцию скорости доставки лекарственного средства с помощью изменения растворимости лекарственного средства в составе многокомпонентного полимерного адгезива-носителя.
Параметр растворимости (SP), использованный в данном описании, означает сумму всех межмолекулярных сил притяжения, с помощью которых эмпирически определяют степень взаимной растворимости многих типов молекул. Обсуждение параметров растворимости представлено в статье Vaughan, "Using Solubility Parameters in Cosmetics Formulation" (Использование параметров растворимости для создания косметических составов), J. Sоc. Cosmet. Chem. (1985), т.36, стр.319-333. Разработаны многочисленные методы для определения параметров растворимости с использованием широкого спектра возможностей от теоретических расчетов до полностью эмпирических корреляций. Самым пригодным методом является метод Хильдебранда, с помощью которого рассчитывают параметр растворимости по молекулярной массе, температуре кипения и данных плотности, которые обычно известны для многих материалов и которые обычно позволяют получить величины в диапазоне, необходимом для других методов расчета:
SP=ΔEv/V)1/2,
где V означает молекулярную массу/плотность и ΔЕv означает энергию парообразования.
В другом виде
SP=(ΔHv/V-RT/V)1/2,
где ΔНv означает теплоту парообразования;
R означает газовую постоянную и
Т означает абсолютную температуру, K.
Для материалов, таких как высокомолекулярные полимеры, которые характеризуются слишком низкими значениями давления насыщенного пара, которые невозможно определить, и, следовательно, для которых не известна величина ΔНv, разработан ряд методов с использованием суммарного вклада атомов и групп в величину ΔНv:
ΔНv=ΣiΔhi,
где Δhi означает вклад i-го атома или группы в молекулярную теплоту парообразования. Один простой метод описан в статье R.F.Fedors, Polymer Engineering and Science, (1974), т.14, стр.147. Согласно этому методу величины ΔHv и V рассчитывают, просто предполагая, что
ΔEv=ΣiΔei и V=Σivi,
где ΔEi и vi означают аддитивные вклады атомов и групп в энергию парообразования и молярный объем, соответственно.
Другой метод расчета параметра растворимости материала описан Small, J. Applied Chem. (1953), т.3, стр.71.
Параметры растворимости некоторых адгезивных полимеров представлены в патенте США №5474783.
Скорость чрескожного проникновения комбинации исходного лекарственного средства/пролекарства контролируют изменением полимерных компонентов в составе полимерного адгезива-носителя, то есть изменением разницы между параметрами растворимости многокомпонентного полимерного адгезива-носителя и комбинации исходного лекарственного средства/пролекарства.
Скорость чрескожного проникновения можно также контролировать изменением относительных соотношений полимеров, включенных в состав полимерного адгезива-носителя.
Полимерный адгезив-носитель предпочтительно формируют таким образом, чтобы упомянутый носитель представлял собой адгезив, чувствительный к надавливанию при комнатной температуре и обладал другими требуемыми характеристиками для адгезивов, которые используют при получении систем для доставки лекарственных средств. Такие характеристики включают достаточно высокую степень прилипания к коже, возможность отклеивать систему или удалять ее другим способом без значительных повреждений кожи, сохранение свойств липкости при хранении и т.д. В основном, температура стеклования (Тg) многокомпонентного полимерного адгезива-носителя, измеренная на дифференциальном сканирующем калориметре, должна составлять приблизительно от -70°C до 0°C.
Выбор конкретной полимерной композиции в основном определяется исходным лекарственным средством/пролекарством, предназначенными для включения в устройство (доставки), а также требуемой скоростью доставки исходного лекарственного средства/пролекарства. Специалисты в данной области техники могут легко определить скорость доставки лекарственных средств из полимерного чрескожного адгезива-носителя, чтобы выбрать подходящую комбинацию полимеров и лекарственного средства в конкретной области применения. Для определения скорости доставки лекарственного средства из полимера используют различные методы. Например, скорость доставки можно определить измерением переноса лекарственного средства из одной камеры в другую через кожу трупа в определенный период времени с последующим расчетом скорости доставки или скорости потока лекарственного средства с использованием полученных данных. Особые полимеры, такие как предпочтительные акриловые и силиконовые полимеры, описаны ниже.
Другой метод контроля уровня (лекарственного средства) в плазме крови субъекта заключается в выборе пролекарства с учетом его молекулярной массы или полярности. С увеличением молекулярной массы пролекарства увеличивается период времени до начала проникновения эффективного количества пролекарства по сравнению с периодом для исходного лекарственного средства.
Аналогичным образом при увеличении молекулярной массы пролекарства скорость проникновения пролекарства уменьшается по сравнению с исходным лекарственным средством. Следовательно, если требуется непрерывная доставка лекарственного средства в течение определенного периода, можно использовать увеличение концентраций пролекарств с более высокими молекулярными массами, чтобы компенсировать снижение скоростей проникновения исходных лекарственных средств.
Естественно, следует понимать, что существует некоторая взаимосвязь между двумя описанными выше общими концепциями. Например, молекулярная масса может влиять как на количество солюбилизированного в носителе пролекарства, так и на его перенос через кожу.
Другой метод получения комбинации исходного лекарственного средства/пролекарства для контроля уровня в крови заключается в выборе пролекарств с учетом их различной полярности. Как указано в одновременно находящейся на рассмотрении заявке, регистрационный номер 10/014785, можно предположить, что более липофильное пролекарство ускоряет прохождение пролекарства в роговой слой неповрежденной кожи субъекта, в котором пролекарство в конечном счете гидролизуется с образованием фармакологически активного и более полярного исходного лекарственного средства. Гидролиз блокированной функциональной группы в пролекарстве с образованием функциональных групп исходного лекарственного средства в свою очередь ускоряет диффузию лекарственного средства через кожу в кровь субъекта. Таким образом, в начальной стадии более липофильное пролекарство проходит в липофильный роговой слой с более высокой скоростью, чем соответствующее исходное лекарственное средство. В процессе прохождения через кожу по меньшей мере часть пролекарства гидролизуется с образованием исходного лекарственного средства. В процессе гидролиза более полярное исходное лекарственное средство вытесняется из липофильной кожи в относительно полярный кровоток. Таким образом, с помощью выбора пролекарства с учетом его полярности можно контролируемым способом увеличивать скорость проникновения через кожу по сравнению со скоростью проникновения соответствующего исходного лекарственного средства. Следовательно, добавление пролекарства к исходному лекарственному средству позволяет получать композиции с более высокой скоростью проникновения и более коротким периодом до начала терапевтического действия.
Аналогичным образом с использованием пролекарств можно также контролировать период до начала действия и продолжительность действия, так как системный метаболизм исходного лекарственного средства можно снизить с помощью использования пролекарств. См. статью Bundgaard. Таким образом, выбор соответствующего пролекарства позволяет увеличивать даже продолжительность эффективной терапии, если учитывать величины скорости превращения in vivo в совокупность активного исходного лекарственного средства. Исходную дозу можно вводить в виде совокупности активного исходного лекарственного средства, в то время как происходит одновременное введение пролекарства пролонгированного действия. Пролекарство пролонгированного действия подвергается метаболизму, например в течение периода от нескольких суток до нескольких недель, при этом поддерживаются терапевтические уровни активного исходного лекарственного средства. Примеры коммерческих препаратов эфиров пролонгированного действия включают деканоат галоперидола (Haldol®) и энантат тестостерона (Delatestryl®). В результате парентерального введения таких молекул поддерживаются терапевтические уровни исходного лекарственного средства в течение 2-4 недель. Аналогичный пролонгированный эффект можно ожидать и при использовании чрескожных систем доставки лекарственных средств.
Авторы также показали, что комбинация исходного лекарственного средства и пролекарства по изобретению может влиять на температуру плавления, и следовательно, на кристаллизацию исходного лекарственного средства/пролекарства в составе носителя. Максимально возможная нагрузка лекарственного средства на чрескожную подложку без кристаллизации зависит от многих факторов. К таким факторам относится функциональность лекарственного средства (кислотная, основная), полярность лекарственного средства или отсутствие полярности, растворители, полимеры в составе матрицы и выбор других наполнителей. Обычно для оптимизации чрескожной доставки данного лекарственного средства используют множество комбинаций, содержащих растворители, полимеры и наполнители.
Температура плавления чистого лекарственного средства должна быть постоянной в нормальных условиях от партии к партии для обеспечения фармацевтической приемлемости продуктов, используемых в качестве исходного материала. Авторы обнаружили фармацевтически приемлемый способ снижения чистоты (и тем самым температуры плавления) данного лекарственного средства, при этом удается поддерживать фармацевтически эквивалентное действие, причем способ заключается в использовании комбинации исходного лекарственного средства/пролекарства. Два соединения взаимодействуют с образованием смеси с более низкой температурой плавления по сравнению с температурами плавления индивидуальных соединений. Такое снижение температуры плавления комбинации исходного лекарственного средства/пролекарства приводит к значительному повышению скорости проникновения при условии соответствующего включения в чрескожную подложку. Такое повышение в основном происходит за счет достижения большей нагрузки некристаллизующегося лекарственного средства в составе таких смесей. Эксперименты показали (а) увеличение скорости потока лекарственного средства, характерное для потока смесей исходного лекарственного средства/пролекарства, по сравнению с каждым компонентом в отдельности и увеличение скорости проникновения исходного лекарственного средства, которая достигается при увеличении нагрузки пролекарства.
Использование пролекарства для повышения скорости проникновения лекарственного средства является предпочтительным по сравнению с включением низкомолекулярных усиливающих агентов, таких как этанол, полиатомные спирты или терпены, так как такие пролекарства также вносят вклад в осуществление доставки терапевтически эффективной дозы. Более того, при использовании пролекарств, а не низкомолекулярных усиливающих агентов, можно снизить или исключить проблемы, связанные с раздражением, стабильностью и обработкой, которые возникают при использовании указанных усиливающих агентов в процессе изготовления чрескожных систем.
Снижение температуры плавления различных комбинаций норэтиндрона и ацетата норэтиндрона, а также эстрадиола и пролекарства эстрадиола показано в таблицах I и II. Указанные количества исходного лекарственного средства и пролекарства смешивают путем просеивания кристаллических порошкообразных лекарственных средств через сито с размером ячеек 250 мкм. Образец каждой смеси помещают в капиллярную трубку и измеряют температуры плавления согласно инструкциям, приведенным в справочнике по стандартам (USP Reference Standarts), с использованием прибора Хаака для измерения температуры плавления. Все смеси, полученные при смешивании в различных соотношениях, характеризуются более низкими величинами температуры плавления по сравнению с индивидуальными соединениями, хотя оптимальное снижение диапазона температур плавления наблюдается, если количество пролекарства превышает количество исходного лекарственного средства.
Аналогичные измерения проводят для эстрадиола и некоторых его соответствующих пролекарств при соотношении 1:1. Результаты, представленные в таблице II, также свидетельствуют о снижении диапазона температур плавления. Показано, что наиболее эффективным для снижения температуры плавления эстрадиола является использование пролекарства эстрадиола с низкой температурой плавления.
Показано, что снижение температуры плавления достигается при смешивании исходного лекарственного средства с пролекарством и что это явление по-видимому связано с ингибированием кристаллизации в таких подложках для чрескожных композиций. Исследование изменения температуры плавления при смешивании двух или более лекарственных средств в составе комбинации представляет собой улучшенный способ для предсказания и обеспечения ингибирования кристаллизации лекарственного средства. Использование влияния взаимодействий на температуру плавления представляет собой более простую методологию по сравнению с использованием влияния на кристаллизацию параметров растворимости, так как существует множество факторов, определяющих параметр растворимости, которые в большинстве случаев трудно определить. В связи с этим измерение снижения температуры плавления обеспечивают другой метод для формирования комбинаций требуемых лекарственных средств с последующим испытанием эффективности проникновения через кожу в составе подходящих матриц-подложек.
Наиболее подходящими пролекарствами являются пролекарства, которые обеспечивают снижение температуры плавления комбинации исходного лекарственного средства/пролекарства на самую высокую величину. Прежде всего, для контроля скорости проникновения, которая в ином случае является слишком высокой, или быстрой, или при которой наблюдается исчерпывание лекарственного средства до завершения требуемого периода времени, используют комбинации исходного лекарственного средства/пролекарства, которые характеризуются более высокими температурами плавления (по сравнению с самой низкой температурой плавления для индивидуальных соединений).
Эти критерии становятся важными, прежде всего, при формировании следующего поколения систем чрескожной доставки лекарственных средств (прежде всего, для гормон-заместительной терапии), если требуется доставлять терапевтически эффективное количество лекарственного средства в течение периода вплоть до одной недели или более. Для достижения продолжительной доставки обычно требуется увеличение концентрации лекарственного средства, что в свою очередь приводит к проблемам с кристаллизацией. Определение температуры плавления комбинаций исходного лекарственного средства/пролекарства позволяет разработать способ и средство для оптимизации и контроля скорости проникновения.
Результаты влияния температуры плавления на кристаллизацию комбинации лекарственного средства (то есть исходных лекарственных средств и пролекарств) свидетельствуют о том, что в предпочтительных вариантах воплощения настоящего изобретения можно использовать пролекарства с более низкими температурами плавления по сравнению с исходным лекарственным средством.
Комбинации лекарственных средств по настоящему изобретению включают рамиприл и его пролекарства, предпочтительно метиловый эфир рамиприла и этиловый эфир рамиприла. В основном, в настоящем изобретении предпочтительным является массовое соотношение исходного лекарственного средства/пролекарства от 10:1 до 1:10, более предпочтительно от 6:1 до 1:6 и наиболее предпочтительно от 1:3 до 3:1.
Согласно наиболее предпочтительному аспекту изобретения исходным лекарственным средством является рамиприл, а пролекарством является метиловый эфир рамиприла и/или этиловый эфир рамиприла. В соответствии с настоящим изобретением авторы обнаружили, что использование рамиприла в смеси с одним из его пролекарств, в данном случае с метиловым или этиловым эфиром, позволяет модифицировать скорость потока (в данном случае увеличивать скорость потока) по сравнению с исходным лекарственным средством или пролекарством в отдельности. Предпочтительным является использование метилового эфира рамиприла в смеси с исходным рамиприлом, так как при этом обеспечивается более высокая скорость потока по сравнению с этиловым эфиром. Предпочтительное массовое соотношение рамиприла/метилового эфира рамиприла в основном составляет от 2:1 до 1:9. Предпочтительное массовое соотношение рамиприла/этилового эфира рамиприла в основном составляет от 1:1 до 1:5, более предпочтительно от 1,1:1 до 1,1:5.
Суммарное количество исходного лекарственного средства/пролекарства в композиции может изменяться в широком диапазоне и зависеть от целого ряда факторов, таких как носитель, продолжительность введения, требуемое терапевтическое действие и т.п. Минимальное количество исходного лекарственного средства/пролекарства в системе определяют в зависимости от количества исходного лекарственного средства/пролекарства, проходящего через кожу в течение периода времени, когда композиция оказывает терапевтическое действие. В большинстве случаев количество исходного лекарственного средства/пролекарства в композиции может изменяться в диапазоне от приблизительно 0,1 мас.% до приблизительно 50 мас.% и, предпочтительно, в случае более низких доз, от приблизительно 0,3% до приблизительно 20%. Другие возможные диапазоны могут составлять от 0,1 до 10 мас.% или от 0,1 до 6 мас.%.
Лекарственное средство содержится в носителе. Термины "носитель" или "наполнитель", используемые в настоящем описании, относятся к материалам носителей, подходящим для чрескожного способа введения лекарственного средства и включают любые материалы, известные в данной области техники, например любые жидкости, гели, растворители, жидкие разбавители, солюбилизаторы, полимеры и т.п., которые являются нетоксичными и практически не взаимодействуют с другими компонентами композиции или кожи, не вызывая негативного действия. Носитель присутствует в количестве, достаточном для обеспечения функции носителя для исходного лекарственного средства/пролекарства. Предпочтительно носитель присутствует в количестве от 2 до 99 мас.%, более предпочтительно от 30 до 90 мас.% и наиболее предпочтительно от 40 до 80 мас.%. Носитель предпочтительно практически не содержит воды и наиболее предпочтительно вода полностью отсутствует в носителе.
Предпочтительными носителями, прежде всего, являются эластичные, фиксированные композиции. Термин "эластичная, фиксированная система" означает твердую форму, способную прилегать к поверхности, с которой она контактирует, и способную поддерживать контактирование в такой твердой форме для ускорения местного введения при отсутствии негативного физиологического ответа в организме и значительного разложения носителя при контактировании с водой в процессе введения лекарственного средства пациенту. Наиболее предпочтительными носителями эластичного, фиксированного типа являются полимерные носители, такие как чувствительные к надавливанию полимерные адгезивные матрицы, в которых исходное лекарственное средство/пролекарство диспергировано непосредственно в чувствительном к надавливанию адгезиве-носителе или в носителе резервуарного типа.
Примеры подходящих адгезивов в качестве эластичных, фиксированных систем матричного типа для доставки включают вещества, описанные в патентах США №№5474783 и 5656386, права на которые принадлежат фирме Noven Pharmaceuticals Inc., Miami, Fla. (полностью включенных в настоящее описание в качестве ссылок). Другие эластичные, фиксированные системы, известные в данной области техники, включают пленки, пластыри, покрытия и повязки, а также многослойные системы для доставки лекарственных средств, в которых исходное лекарственное средство/пролекарство солюбилизировано или находится в одном или более отдельных слоев, и системы доставки резервуарного типа, в которых исходное лекарственное средство/пролекарство солюбилизировано или находится в резервуаре или полости, отдельно от адгезива, который прикрепляется непосредственно к коже или слизистой оболочке.
Как указано выше, наиболее предпочтительными носителями являются чувствительные к надавливанию эластичные, фиксированные адгезивы-носители. Они могут включать любые вязкоэластичные материалы, которые мгновенно приклеиваются к большинству поверхностей с помощью легкого надавливания и которые сохраняют липкость в течение продолжительных периодов времени. Полимер является чувствительным к надавливанию адгезивом в пределах значения термина, использованного в настоящем описании, если он обладает свойствами чувствительного к надавливанию адгезива или проявляет функцию чувствительного к надавливанию адгезива при добавлении веществ для повышения клейкости, пластификаторов или других добавок. Термин "чувствительный к надавливанию адгезив" включает также смеси различных полимеров или смеси полимеров, таких как полиизобутилены (ПИБ) различной молекулярной массы, при этом каждая полученная смесь является чувствительной к надавливанию. Другие используемые чувствительные к надавливанию адгезивы на основе каучука включают углеводородные полимеры, такие как природный и синтетический полиизопрен, полибутилен и полиизобутилен, стирол/бутадиеновые полимеры, стирол-изопрен-стирол блок-сополимеры, углеводородные полимеры, такие как бутилкаучук, галогенсодержащие полимеры, такие как политетрафторэтилен, поливинилхлорид, поливинилиденхлорид, полихлордиен, а также полиакрилонитрил и другие сополимеры.
Другие используемые чувствительные к надавливанию адгезивы ("PSA") могут включать акриловые чувствительные к надавливанию адгезивы и силиконовые чувствительные к надавливанию адгезивы, описанные в патентах США №№5474783 и 5656386. Подходящие коммерческие акриловые полимеры могут включать коммерческие адгезивы и полиакрилатные адгезивы с торговым названием Duro-Tak фирмы National Starch and Chemical Corporation, Bridgewater, N.J., такие как Duro-Tak 87-2194, Duro-Tak 87-2196, Duro-Tak 87-1197, 87-4194, 87-2510, 87-2097 и 87-2852. Другие подходящие акриловые адгезивы выпускаются под торговыми названиями фирмы Gelva-Multipolymer Solution (GMS) (Monsanto, St.Louis, Mo.), такими как GMS 737, 788, 1151, 3087 и 7882.
Подходящие силиконовые чувствительные к надавливанию адгезивы могут включать адгезивы, описанные в книге Sobieski et al., "Silicone Pressure Sensitive Adhesives" (Силиконовые чувствительные к надавливанию адгезивы), Handbook of Pressure-Sensitive Adhesive Technology, 2-е изд., стр., 508-517 (под ред. D.Satas), Van Nostrand Reinhold, New York (1989), полностью включенной в настоящее описание в качестве ссылки. Другие используемые силиконовые чувствительные к надавливанию адгезивы описаны в следующих патентах США №№4591622, 4584355, 4585836 и 4655767. Подходящие силиконовые чувствительные к надавливанию адгезивы являются коммерческими препаратами и включают силиконовые адгезивы с торговыми названиями ВIO-PSА7-4503, ВIO-РSА7-4603, ВIO-РSА 7-4301, 7-4202, 7-4102, 7-4106 и BIO-PSA 7-4303 фирмы Dow Corning Corporation, Medical Products, Midland, Mich.
Количество полимерного носителя может изменяться в диапазоне от 2 до 99 мас.%, предпочтительно от 30 до 90 мас.% и наиболее предпочтительно от 40 до 80 мас.%.
Чувствительные к надавливанию адгезивы могут быть смешаны с лекарственными средствами для улучшения растворимости лекарственных средств в системе носителя, как описано в патенте США №5474783. В наиболее предпочтительном варианте воплощения настоящего изобретения многокомпонентная полимерная адгезивная смесь включает чувствительную к надавливанию адгезивную смесь акрилового полимера, силиконового полимера и растворимого поливинилпирролидона (PVP) (как указано ниже). Акриловый и силиконовый полимеры присутствуют в массовом соотношении предпочтительно от приблизительно 2:98 до приблизительно 96:4, более предпочтительно от приблизительно 2:98 до приблизительно 90:10 и наиболее предпочтительно от приблизительно 2:98 до приблизительно 86:14. Количества акрилового полимера (иначе называемого полиакрилат) и силиконового полимера (иначе называемого полисилоксан) изменяют для модификации концентрации насыщения исходного лекарственного средства/пролекарства в тройной многокомпонентной адгезивной полимерной системе, чтобы контролировать скорость доставки исходного лекарственного средства/пролекарства из системы через кожу. Другие используемые диапазоны включают приблизительно 5-85 мас.% акрилового полимера, 10-90 мас.% полиизобутилена и 5-95 мас.% силиконового полимера.
Система для чрескожной доставки лекарственного средства может также содержать известные агенты, ускоряющие доставку исходного лекарственного средства/пролекарства через кожу. Такие агенты называют агентами, усиливающими проникновение через кожу, ускорителями, вспомогательными веществами, ускорителями впитывания, в основном их называют "усиливающими агентами", которые описаны в патенте США №6221383. Они могут включать полиатомные спирты, такие как дипропиленгликоль, пропиленгликоль и полиэтиленгликоль, которые повышают растворимость исходного лекарственного средства/пролекарства; масла, такие как оливковое масло, сквален и ланолин; простые жирные эфиры, такие как цетиловый эфир и олеиловый эфир; сложные эфиры жирных кислот, такие как изопропилмиристат, который увеличивает диффузию исходного лекарственного средства/пролекарства; мочевину и производные мочевины, такие как аллантоин, который действует на способность кератина к удерживанию влаги; полярные растворители, такие как диметилдецилфосфоксид, метилоктилсульфоксид, диметиллауриламид, додецилпирролидон, изосорбит, диметилацетонид, диметилсульфоксид, децилметилсульфоксид и диметилформамид, который воздействует на проницаемость кератина; салициловую кислоту, которая смягчает кератин; аминокислоты, которые способствуют проникновению; бензилникотинат, который открывает фолликулы волос и высокомолекулярные ПАВ, такие как соли лаурилсульфата, которые изменяют поверхностное состояние кожи и вводимых лекарственных средств. Другие агенты включают олеиновую и линолевую кислоты, аскорбиновую кислоту, пантенол, бутилированный гидрокситолуол, токоферол, токоферилацетат, токофериллинолеат, пропилолеат и изопропилпальмитат. Наиболее предпочтительными являются комбинации полиатомных спиртов, таких как глицерин, дипропиленгликоль, бутиленгликоль, пропиленгликоль и одного или более олеилового спирта и одной или более олеиновой кислоты.
В некоторых вариантах воплощения настоящего изобретения можно также использовать пластификатор или агент для повышения клейкости, включенные в состав для улучшения адгезивных характеристик чувствительной к надавливанию адгезивной композиции. Такие пластификаторы или агенты для повышения клейкости включают: (1) алифатические углеводороды, (2) смешанные алифатические и ароматические углеводороды, (3) ароматические углеводороды, (4) замещенные ароматические углеводороды, (5) гидрированные сложные эфиры, (6) политерпены и (7) гидрированные древесные смолы.
Используемые агенты для повышения клейкости предпочтительно должны быть совместимыми с полимерными смесями. В предпочтительных вариантах воплощения настоящего изобретения агентом для повышения клейкости является силиконовая жидкость (например, 360 Medical Fluid фирмы Dow Coning Corporation, Midland, Mich или минеральное масло). Силиконовую жидкость используют для смесей, содержащих полисилоксан в качестве основного компонента. В других вариантах воплощения настоящего изобретения, в которых основным компонентом является синтетический каучук, предпочтительным агентом для повышения клейкости является минеральное масло.
Для растворения молекул исходного лекарственного средства/пролекарства с низкой растворимостью в полимерной системе добавляют сорастворитель для исходного лекарственного средства/пролекарства и полимера. Сорастворители, такие как лецитин, производные ретиналя, токоферол, дипропиленгликоль, триацетин, пропиленгликоль, насыщенные и ненасыщенные жирные кислоты, минеральное масло, силиконовая жидкость, спирты, бутилбензилфталат и т.п. используют в настоящем изобретении в зависимости от растворимости исходного лекарственного средства/пролекарства в многокомпонентной полимерной адгезивной системе.
Для ингибирования кристаллизации кроме комбинаций исходного лекарственного средства/пролекарства, можно использовать другие агенты-ингибиторы кристаллизации. Одним из известных агентов является поливинилпирролидон (PVP), предпочтительно растворимый PVP, подробно описанный в патенте США №6221383. Термин "поливинилпирролидон" или "PVP", означает полимер, гомополимер или сополимер, содержащий в качестве мономерного звена N-винилпирролидон. Типичными PVP являются гомополимерные PVP и сополимеры винилацетата и винилпирролидона. Гомополимерные PVP известны в фармацевтической промышленности в виде препаратов с различными названиями, включая повидон, поливидон, поливидонум, растворимый поливидонум и поли(1-винил-2-пирролидон). Сополимер винилацетата и винилпирролидона известен в фармацевтической промышленности как кополивидон и кополивидонум. Термин "растворимый", использованный в отношении PVP, означает, что полимер растворим в воде и практически не содержит поперечных связей, характеризуется молекулярной массой приблизительно менее 2000000. PVP, использованный в настоящем изобретении, предпочтительно характеризуется молекулярной массой от приблизительно 2000 до 1100000, более предпочтительно от 5000 до 100000 и наиболее предпочтительно от 7000 до 54000.
Количество и тип PVP, требуемые для описанных выше предпочтительных вариантов воплощения настоящего изобретения, зависят от количества и типа исходного лекарственного средства/пролекарства, содержащихся в адгезиве, а также от типа адгезива, причем эти указанные характеристики PVP могут быть легко определены по стандартной методике. Обычно PVP присутствует в количестве от приблизительно 1 мас.% до приблизительно 20 мас.%, предпочтительно от приблизительно 3 мас.% до приблизительно 15 мас.%. Однако количество PVP может быть более 20%, например, вплоть до 40%, в зависимости от используемого конкретного исходного лекарственного средства/пролекарства и требуемых свойств смеси. Один из коммерческих препаратов PVP с торговым названием коллидон, такой как коллидон 10, коллидон 17PF, коллидон 25, коллидон 90, коллидон 30 и VA 64, выпускается фирмой BASF AG, Ludwigshafen, Германия. Другой использованный PVP с торговым названием коллидон CL-M выпускается фирмой BASF AG.
Кроме того, в композиции по настоящему изобретению могут быть включены различные загустители, наполнители и другие добавки, известные для использования в системах для чрескожной доставки лекарственных средств. Если композиции адсорбируют воду, например, если в качестве сорастворителя используют лецитин, наиболее приемлемыми являются гидрофильные соединения. Одним из типов гидрофильных соединений, которые успешно применяются, является глина. Показано, что добавление глины приводит к повышению адгезионной способности в чрескожных составах без снижения скорости доставки исходного лекарственного средства/пролекарства. Подходящие глины включают алюмосиликатную глину, каолинит, монтмориллонит, атапульгит, иллит, бентонит, галлуазит и т.п.
Устройство или отдельная система для введения дозы по настоящему изобретению может быть получена любым способом, известным в данной области техники. После формирования композиции для нанесения на кожу композицию покрывают защитным слоем любым способом, известным в данной области техники. Такие методики включают покрытие каландрованием, термоплавкое покрытие, покрытие раствором и т.п. Защитные материалы известны в данной области техники и могут включать пластиковые пленки из полиэтилена, винилацетатных смол, сополимеров этилена и винилацетата, поливинилхлорида, полиуретана и т.п., металлическую фольгу, нетканые материалы, ткани и коммерческие ламинаты. Толщина защитного слоя в основном находится в диапазоне от 2 до 1000 мкм, а толщина композиции для нанесения на кожу, расположенной на защитном материале, составляет диапазон от приблизительно 12 до 250 мкм.
Подходящие материалы для верхнего удаляемого слоя также известны в данной области техники и включают коммерческие продукты фирмы Dow Corning Corporation с названием Bio-Release®, liner и Syl-off® 7610 liner. В предпочтительных вариантах воплощения настоящего изобретения, в которых полисилоксан является составной частью многокомпонентного полимерного адгезива-носителя, удаляемый слой должен быть совместим с силиконовым адгезивом. Примером подходящего коммерческого продукта для удаляемого слоя является пленка 3М' 1022 Scotch Pak®. Конфигурация системы чрескожной доставки по настоящему изобретению может представлять собой любую требуемую форму или размер. Например, отдельная система для введения дозы характеризуется площадью поверхности в диапазоне от 1 до 200 см2. Предпочтительные размеры составляют 5-60 см2.
В предпочтительном варианте воплощения настоящего изобретения, в котором носителем является эластичный и фиксированый полимер, смешивают один или более полимеров, по выбору с PVP для создания чувствительной к надавливанию адгезивной композиции или чрескожной системы для доставки лекарственных средств (с включенным исходным лекарственным средством/пролекарством), в которой контролируется доставка включенного исходного лекарственного средства/пролекарства через эпидермис. В предпочтительном варианте воплощения настоящего изобретения чрескожную систему для доставки лекарственных средств получают путем смешивания растворимого PVP, полиакрилата, полисилоксана, исходного лекарственного средства/пролекарства, по выбору усиливающего(их) агента(ов), сорастворителя(лей) и агентов для повышения клейкости, при необходимости в соответствующем летучем растворителе(лях), затем путем формования смеси и удаления растворителя(лей) упариванием до образованием пленки. Подходящие летучие растворители включают, без ограничения перечисленным: спирты, такие как изопропанол и этанол, ароматические растворители, такие как ксилолы и толуол, алифатические растворители, такие как гексан, циклогексан и гептан, сложные эфиры алкановых кислот, такие как этилацетат и бутилацетат.
Пример общего способа получения композиции согласно изобретению:
1. Соответствующие количества растворителя(лей), по выбору усиливающего(их) агента(ов), по выбору поливинилпирролидона (PVP) и органического(их) растворителя(лей) (например, толуол) смешивают в сосуде и тщательно перемешивают.
2. Затем к смеси добавляют исходное лекарственное средство/пролекарство и продолжают перемешивание до образования гомогенной смеси исходного лекарственого средства/пролекарства.
3. К смеси исходного лекарственного средства/пролекарства добавляют соответствующие количества полимера и тщательно перемешивают.
4. Затем состав переносят в устройство для покрытия, где на него наносят защитную удаляемую пленку требуемой толщины. Продукт с покрытием помещают в термостат для удаления всех летучих растворителей, использованных при обработке.
5. Высушенный продукт с удаляемой пленкой укладывают на защитный материал и сворачивают в рулоны для хранения.
6. Из свернутых в рулон материалов штампуют "системы" соответствующих размера и формы и упаковывают их в пакеты.
Порядок стадий, количество компонентов и продолжительность и время встряхивания или перемешивания можно изменять в зависимости от используемых полимера, исходного лекарственного средства/пролекарства, сорастворителей и усиливающих агентов. Эти факторы могут быть определены специалистами в данной области техники, учитывая необходимость создания однородного продукта. Предполагают, что для получения требуемых результатов можно использовать ряд других способов, включая изменение порядка некоторых стадий. Системы для введения дозы могут быть различной формы и различного размера. Площадь поверхности может изменяться в диапазоне от 1 до 200 см2, а предпочтительные размеры составляют: 5, 10, 15, 20, 30, 40 и 60 см.
ПРИМЕРЫ
Приведенные ниже примеры включены в качестве иллюстрации систем для чрескожной доставки и композиций, включенных в объем изобретения. Данные примеры не ограничивают область изобретения. Массовые проценты, указанные в примерах, рассчитаны с использованием сухой массы системы, если не указано иное.
В примерах используют следующие коммерческие адгезивы: торговое название "Duro-Tak 87-2287" фирмы NATIONAL STARCH AND CHEMICAL CORPORATION, Bridgewater, N.J., для полиакрилатных адгезивов в органических растворах.
"Bio-PSA 7-4603" является торговым названием фирмы DOW CORNING CORPORATION, MEDICAL PRODUCTS, Midland, Mich. для полисилоксановых адгезивов в органических растворителях.
"Gelva-Multipolymer Solution (QMS) 737 и 788" являются торговыми названиями фирмы Monsanto Company, Saint Louis, Mo. для полиакрилатных адгезивов в органическом растворе.
"KOLLIDON 30 и VA 64" являются торговыми названиями фирмы BASF Aktiengesellschaft, Ludwigschaften, Германия, для поливинилпирролидоновых полимеров и сополимера винилацетата и винилпирролидона.
Пример 1 и пример 1 для сравнения (ПС)
Композицию для чрескожной доставки получают из следующих компонентов, %:
Скорость потока стероида через кожу трупа in vitro из композиции, полученной в примере 1, показана на фиг.1 и обозначена треугольниками (Δ и ▲). В качестве примера для сравнения показана скорость потока для коммерческого продукта CombiPatch™, который содержит эстрадиол и ацетат норэтиндрона каждый в отдельности (обозначены кружками (о или •). Как показано на фиг.1, скорость потока из смеси норэтиндрона/ацетата норэтиндрона, полученной в примере 1, значительно превышает скорость потока ацетата норэтиндрона из продукта CombiPatch, в то время как скорость потока эстрадиола не изменяется. Скорость потока эстрадиола остается практически постоянной.
Пример 2 и пример 2 для сравнения (ПС)
Композиции для доставки стероид/соответствующее производное стероида получают из следующих компонентов, %:
Скорость потока смеси норэтиндрона/ацетата норэтиндрона через кожу трупа in vitro из композиции, полученной в примере 2, показана на фиг.2 и обозначена кружками (•). В качестве примеров для сравнения приведены скорости потока из композиций, содержащих норэтиндрон и ацетат норэтиндрона каждого в отдельности (обозначены квадратами (■) и треугольниками (▲), соответственно). Как показано на фиг.2, скорость потока смеси норэтиндрона/ацетата норэтиндрона значительно превышает скорость потока норэтиндрона и ацетата норэтиндрона, каждого в отдельности, при этом состав носителя практически не изменяется.
Пример 3 и пример 3 для сравнения
Композиции для чрескожной доставки стероида/соответствующего производного стероида получают из следующих компонентов, %:
Скорость потока смеси тестостерона/ацетата тестостерона через кожу трупа in vitro из композиции, полученной в примере 3, показана на фиг.3 (обозначена квадратами (■). Показаны также отдельные скорости потока тестостерона и ацетата тестостерона из композиции, полученной в примере 3 (обозначены кружками (•) и темными треугольниками (▲), соответственно). Показана также скорость потока из коммерческой композиции тестостерона, выпускаемой под торговым названием Testoderm® фирмой Alza Inc. (обозначена прозрачными треугольниками (Δ). Как показано на фиг.3, скорость потока смеси тестостерона/ацетата тестостерона, полученной в примере 3, значительно превышает скорость потока из композиции Testoderm®. Скорости потока тестостерона и ацетата тестостерона каждого в отдельности из композиции, полученной в примере 3, превышают скорость потока из композиции Testoderm®. Полученные результаты свидетельствуют о том, что каждая совокупность лекарственного средства доставляется в количестве, достаточном для проявления физиологического действия.
Пример 4 и пример 4 для сравнения
Композиции для чрескожной доставки стероида/соответствующего производного стероида получают из следующих компонентов:
В композициях, полученных в примерах 4-1 и 4-2, наблюдается образование кристаллов через 3 сут. В композициях, полученных в примерах 4-3 и 4-4, образование кристаллов не наблюдается через 13 сут. Полученные результаты свидетельсвуют о том, что ацетат эстрадиола не является эффективным для ингибирования роста кристаллов, в то время как пропионат и энантат являются эффективными.
Примеры 5-9
Композиции для чрескожной доставки исходного лекарственного средства/пролекарства получают из следующих компонентов:
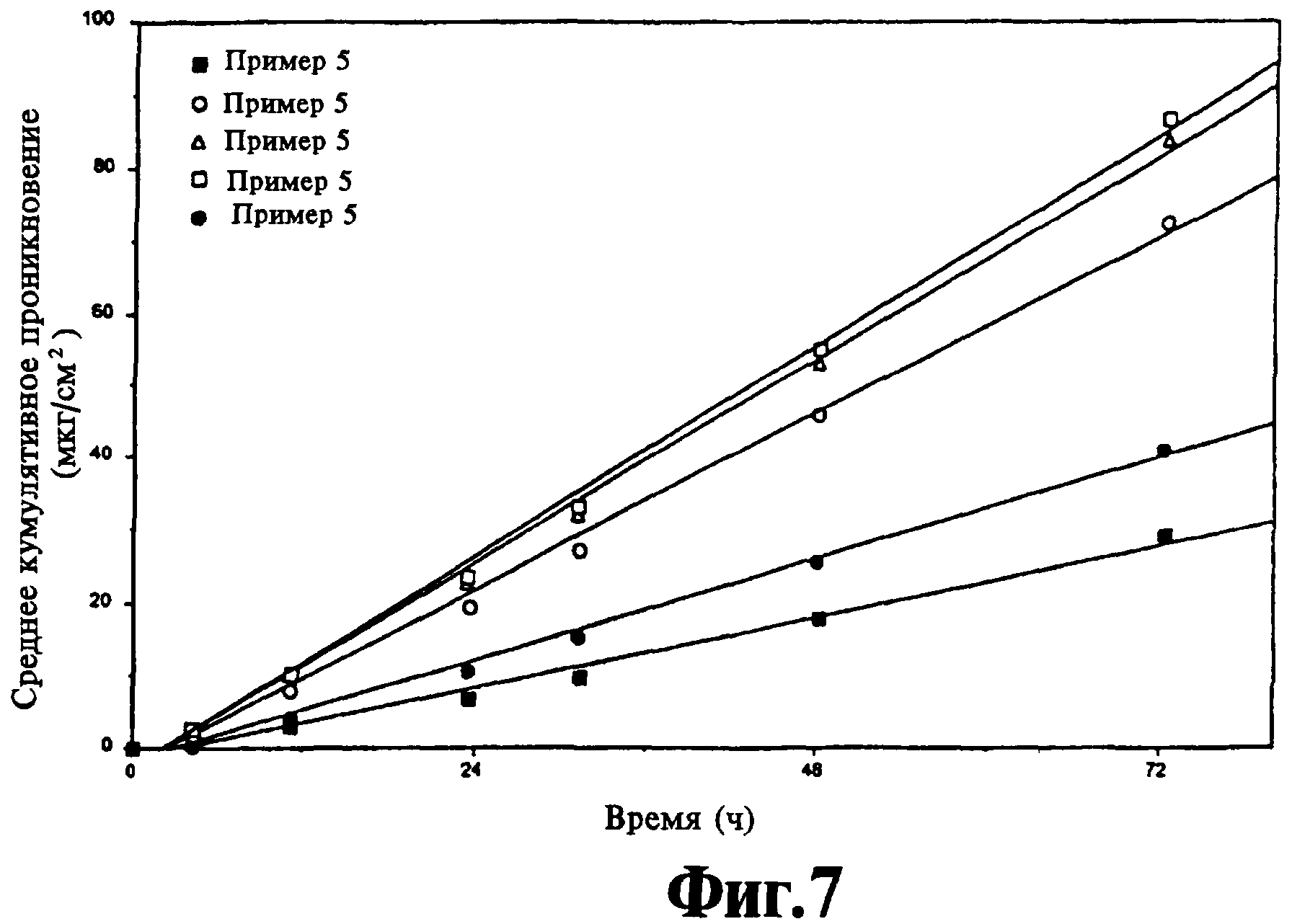
Примеры 5 и 9 являются примерами для сравнения. Скорость проникновения норэтиндрона/ацетата норэтиндрона показана на фиг.5-7. На фиг.5 показано среднее кумулятивное проникновение норэтиндрона из композиций, полученных в примерах 5-8. На фиг.6 показано среднее кумулятивное проникновение ацетата норэтиндрона из композиций, полученных в примерах 6-9. На фиг.7 показано среднее кумулятивное проникновение смеси норэтиндрона и ацетата норэтиндрона из композиции, полученной в примерах 5-9. На всех фигурах показано повышенное проникновение из комбинации исходного лекарственного средства/пролекарства по сравнению с пролекарством (в данном случае ацетат норэтиндрона) или с исходным лекарственным средством.
Композиции, полученные в примерах 6-8, исследуют на образование кристаллов. Каждую смесь формуют на полиэфирной удаляемой пленке (ScotchPak® 1022, 3М, Minneapolis, Michigan) с использованием аппликатора с влажной щелью объемом 15 мл. Полученные пленки сушат на воздухе в течение 5 мин при температуре и влажности окружающей среды в вытяжном шкафу и в течение еще 5 мин в воздушно-конвекционной печи при 92°C для удаления всех летучих растворителей. После завершения сушки удаляемую пленку, покрытую сухой композицией лекарственного средства, наносят на полиэфирную сторону защитного материала из полиэфира/этиленвинилацетата (ScotchPak® 1022, 3М, Minneapolis, Michigan). Затем штампуют отдельные системы для доставки лекарственного средства размером 10 см2 и исследуют их с использованием микроскопа с увеличением в 25 раз. В смесях не наблюдается образования кристаллов через 60 сут.
Показано, что при смешивании исходного лекарственного средства и пролекарства достигается уменьшение температуры плавления и что данное явление, по-видимому, связано с ингибированием роста кристаллов в таких чрескожных системах.
Пример 10
Влияние пролекарств на скорость потока исследуют с использованием ингибитора АПФ - рамиприла. Скорости потоков двух соответствующих пролекарств - метилового эфира рамиприла и этилового эфира рамиприла - сравнивают перед смешиванием с исходным лекарственным средством. Как показано на фиг.9, при отсутствии агентов, усиливающих проникновение, скорость потока пролекарства на основе метилового эфира увеличивается на 73% по сравнению со скоростью потока пролекарства на основе этилового эфира в составах носителей, содержащих 20% лекарственного средства, 20% полиакрилатного адгезива (DURO-TAK® 87-90880), 60% полисилоксанового адгезива (BIO-PSA®7-4102). При добавлении в составы 3% олеилового спирта и 5% дипропиленгликоля (при этом снижается содержание полисилоксанового адгезива до 52%) скорость потока увеличивается практически в 2 раза. В каждом случае при использовании пролекарства на основе эфира вместо исходного лекарственного средства наблюдается увеличение скорости потока по меньшей мере в 10 раз (см. скорость потока рамиприла (▲), фиг.8, - только 15% рамиприла может быть солюбилизировано без образования кристаллов - по сравнению со скоростью потока этилового эфира рамиприла без усиливающих агентов (Δ), фиг.9). Предпочтительными является также адгезивы, не содержащие функциональных групп, и адгезивы, содержащие гидроксильные группы.
Однако при смешивании рамиприла и соответствующего пролекарства в комбинациях, содержащих усиливающие агенты, наблюдается более значительное увеличение скорости потока. Как показано на фиг.8, использование комбинации рамиприла/пролекарства приводит к значительному увеличению скорости потока, почти в 2 раза при использовании комбинации с метиловым эфиром. Во всех композициях, включающих комбинации рамиприла/метилового эфира рамиприла, скорость потока увеличивается по сравнению со скоростью потока одного лекарственного средства без добавления пролекарства. Оптимальная скорость потока (при концентрации лекарственного средства 20%) наблюдается при соотношении рамиприла/метилового эфира рамиприла приблизительно 1:2,33, причем скорость потока не увеличивается за пределами соотношения 1:3.
Для комбинаций рамиприл/этиловый эфир рамиприла оптимальная скорость потока достигается (при концентрации лекарственного средства 20%) при соотношении рамиприл/пролекарство 1:3, при этом наблюдается увеличение скорости потока приблизительно на 20% по сравнению со скоростью потока при использовании одного этилового эфира рамиприла. Однако при соотношении приблизительно 1:1 скорость потока заметно уменьшается приблизительно на 19% по сравнению со скоростью потока одного этилового эфира рамиприла. Тем не менее, использование комбинации рамиприла/этилового эфира рамиприла приводит к значительному увеличению скорости потока по сравнению со скоростью потока одного рамиприла. Таким образом показано, что использование комбинаций рамиприла/пролекарства приводит к увеличению скорости потока по сравнению с использованием совокупности лекарственного средства в отдельности, однако использование метилового эфира рамиприла является более эффективным (приводит к еще большему увеличению скорости потока по сравнению его с этиловым эфиром).
Несмотря на то, что в данном описании представлен ряд предпочтительных вариантов воплощения настоящего изобретения, следует понимать, что возможны различные изменения, усовершенствования и модификации в пределах сущности и объема изобретения, определенных в пунктах формулы изобретения.
Реферат
Изобретение относится к медицине и фармацевтической промышленности, а именно к композиции для чрескожной доставки лекарственного средства, которая осуществляется из смеси, содержащей: терапевтически эффективное количество лекарственного средства, включающего исходное лекарственное средство и пролекарство, а также фармацевтически приемлемый носитель, причем как исходное лекарственное средство, так и пролекарство присутствуют в количестве, достаточном для проявления фармакологического действия. В предпочтительном варианте воплощения изобретения смесь включает терапевтически эффективное количество фармацевтически активного агента, который содержит ингибитор АПФ, такой как рамиприл, а пролекарством является пролекарство ингибитора АПФ, такое как этиловый эфир рамиприла и/или метиловый эфир рамиприла. 4 з.п. ф-лы, 9 ил., 2 табл., 10 пр.

Комментарии