Усовершенствованный способ получения металлов - RU2649104C2
Код документа: RU2649104C2
Чертежи

























Описание
Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к новому и усовершенствованному способу получения металлов. Более конкретно, способ упрощает получение высокочистых металлов, в особенности переходных и редкоземельных металлов, из их оксидов простым способом восстановления, которым избегаются затруднительная, отнимающая много времени и энергозатратная обработка согласно прототипу, и сопутствующие недостатки, связанные с применением и получением коррозионно-агрессивных и летучих веществ.
Уровень техники
[0002] Получение металлов, таких как переходные и редкоземельные металлы, неизменно связано с указанными некоторыми техническими проблемами. С конкретной ссылкой на особенно полезный переходный металл, титан представляет собой девятый наиболее распространенный элемент и обладает уникальными и желательными свойствами, такими как высокая температура плавления, высокая коррозионная стойкость и способность формировать легковесные сплавы, но он не стал широко используемым вследствие стоимости его производства. Диоксид титана, который нашел широко распространенное применение в качестве белого пигмента в красках, является легкодоступным из земной коры, но отделение металлического титана от кислорода в диоксиде титана традиционно создает некоторые проблемы в плане требований к расходу времени и энергии, и трудностей в обращении, связанных с коррозионно-агрессивными и летучими реагентами и побочным продуктами.
[0003] Как правило, извлечение металлов с высокой реакционной способностью требует применения дорогостоящих электролитических методов1-15. Однако наиболее общеупотребительными способами получения титана являются процессы восстановления. В процессе Кролла в качестве исходного материала используют ильменит или рутил, и его подвергают обработке углеродом и хлором для получения тетрахлорида титана, который затем восстанавливают с использованием металлического магния. Полученный таким образом хлорид магния отделяют дистилляцией. Однако этот способ является трудоемким и занимает несколько дней до завершения. Процесс Хантера подобен процессу Кролла, но использует скорее натрий, нежели магний, для проведения восстановления тетрахлорида титана. FFC-процесс, который был разработан в Кембриджском университете, также является предельно трудоемким и включает восстановление гранул диоксида титана в ванне из расплавленного хлорида кальция. Однако, несмотря на обстоятельные опытные работы в течение ряда лет, в этом процессе все еще не удается достигнуть полного удаления оксидного слоя16, 17.
[0004] Альтернативные продолжительные, находящиеся в процессе выполнения научно-исследовательские работы также не привели к достижению более дешевого пути производства. Например, некоторые исследователи пытались проводить электроосаждение титана из ионных растворов, но столкнулись с трудностями в устранении многовалентных ионов титана и высокоактивных дендритных продуктов4-8.
[0005] Восстановительные процессы для изготовления металлического титана из диоксида титана типично сталкиваются с затруднениями, связанными с присутствием разнообразных низших оксидов или фаз Магнели в TiО2, поскольку титан может существовать в нескольких состояниях окисления, которые делают восстановление более сложным и затруднительным. Однако авторы настоящего изобретения успешно разрешили эту проблему и эффективно восстановили титан во всех низших степенях окисления, тем самым обеспечив получение металлического титана очень высокой чистоты.
[0006] Более конкретно, авторы настоящего изобретения исследовали прямое раскисление диоксида титана с использованием металлического кальция, чтобы получить металлический титан, и создали способ, который является простым и быстрым, по сравнению с традиционными способами и установками для получения металлического титана, который не содержит примеси кислорода, в то же время обеспечивая возможность крупных сокращений производственных расходов. Было найдено, что подход, который был разработан, применим для получения широкого круга других металлов, в наибольшей степени других переходных и редкоземельных металлов.
Сущность изобретения
[0007] Таким образом, согласно настоящему изобретению представлен способ получения металлов, причем указанный способ включает стадии, в которых:
(а) смешивают оксид металла в резервуаре с восстановителем, включающим металл Группы II или его гидрид, в присутствии воды и/или органического растворителя;
(b) нагревают смесь оксида металла и восстановителя;
(с) вымывают полученный материал водой; и
(d) промывают вымытый материал разбавленной водной кислотой.
[0008] Как правило, металл представляет собой переходный металл или редкоземельный металл, и оксид металла представляет собой оксид переходного металла или оксид редкоземельного металла.
[0009] Чаще всего металл представляет собой переходный металл, примеры которого включают титан, тантал, ниобий, гафний и цирконий, и подходящие оксиды металлов могут быть выбраны, например, из диоксида титана, пентаоксида тантала, пентаоксида ниобия, диоксида гафния и диоксида циркония.
[0010] Процесс нагревания типично проводят в камере или в печи. В особенности подходящая температура реакции варьирует в диапазоне от 750 до 1100°С, как правило, от 800° до 1000°С, например, около 900°С, и термическая обработка обычно может быть проведена в течение периода времени от 2 до 8 часов, наиболее предпочтительно от около 3 до 7 часов, например, в течение около 5 часов. Надлежащим образом может быть использовано давление от 0 до 10-3 мбар (0-0,1 Па). Восстановитель оптимально выбирают из кальция или магния, или гидридов кальция и магния. Оксид металла и восстановитель смешивают друг с другом в присутствии воды или органического растворителя, и, в определенных вариантах осуществления изобретения, полученную смесь высушивают в вакууме перед восстановлением.
[0011] Для цели смешения может быть использован любой органический растворитель, включающий, например, спирты, альдегиды, кетоны, простые эфиры, сложные эфиры, алканы или циклоалканы. Конкретные примеры растворителей включают метанол, этанол, бутанол, изопропиловый спирт, изобутиловый спирт, этиленгликоль, глицерин, пропиленгликоль, амиловый спирт, цетиловый спирт, сорбит, циклогексан-1,2,3,4,5,6-гексол, ментол, формальдегид, ацетальдегид, коричный альдегид, глюкозу, фруктозу, ацетофенон, бензофенон, ацетон, ацетилацетон, циклопропанон, метилвинилкетон, циклобутанон, диметиловый простой эфир, диэтиловый простой эфир, диоксан, тетрагидрофуран, анизол, краун-эфиры, бутилацетат, лактоны, гексан и циклогексан.
[0012] Массовое отношение оксида металла к восстановителю типично варьирует в диапазоне от 1:10 до 10:1, более типично от 1:5 до 4:1.
[0013] Последующая обработка вымыванием водой после восстановления может быть удобным образом выполнена при температуре окружающей среды, как правило, между 15 и 30°С, в основном в течение времени между 30 минутами и 3 часами.
[0014] Промывание вымытого материала проводят с использованием разбавленных водных минеральных кислот, включающих неорганические кислоты, такие как соляная, серная, фосфорная или азотная кислота. Кислоты, как правило, используются при концентрациях между 0,01 и 3М. Промывание типично проводят при температуре окружающей среды, обычно между 15 и 30°С. В особенности пригодной кислотой для обработки вымыванием в случае металлического титана является 0,01-0,05М соляная кислота, и металл, как правило, получается с чистотой около 98,5-99,1%.
[0015] Таким образом, способ включает прямое восстановление оксидов металлов металлами Группы II или их гидридами, которые оптимально выбираются из кальция, магния, гидрида кальция и гидрида магния, и процесс восстановления включает полное удаление ионов кислорода из оксида металла, например, диоксида титана. Время, занимаемое до завершения восстановления, является гораздо меньшим, чем для способов согласно прототипу, и процесс создает гораздо более низкие выбросы углекислого газа, чем известные способы, и, как следствие, является более экологически устойчивым, более благоприятным для окружающей среды, и приспособленным для промышленности.
[0016] Настоящий способ также является преимущественным, поскольку он включает процесс прямого восстановления в твердом состоянии, что, в особенности в случае титана, дает высокочистый твердый металл (губчатый) с полным удалением оксидного слоя из оксида металла. В порядке сопоставления, большинством способов согласно прототипу получается жидкий титан.
Краткое описание чертежей
[0017] Далее варианты осуществления изобретения дополнительно описаны со ссылкой на сопроводительные чертежи, в которых:
фигура 1(а) представляет вид рентгенофлуоресцентного (XRF) спектра титана, полученного способом согласно изобретению;
фигура 1(b) представляет XRF-спектр стандартного образца титана;
фигура 2(а) представляет полученную в сканирующем электронном микроскопе (SEM) микрофотографию и соответствующий энергодисперсионный рентгеновский (EDX) спектр порошка TiО2, использованного для восстановления способом согласно изобретению;
фигура 2(b) представляет SEM-микрофотографию и соответствующий EDX-спектр металлического титана, полученного после 5 часов восстановления способом согласно изобретению;
фигура 2(с) представляет SEM-микрофотографию (при большом и малом увеличении) и соответствующий EDX-спектр металлического титана, полученного после восстановления и вымывания способом согласно изобретению;
фигура 3(а) представляет картину рентгенодифракционного (XRD) спектра металлического титана после восстановления и вымывания способом согласно изобретению;
фигура 3(b) представляет XRD-спектр диоксида титана, использованного для восстановления способом согласно изобретению;
фигура 4(а) представляет рамановский спектр порошка диоксида титана (в анатазной форме);
фигура 4(b) представляет рамановский спектр металлического титана, полученного после восстановления и вымывания способом согласно изобретению;
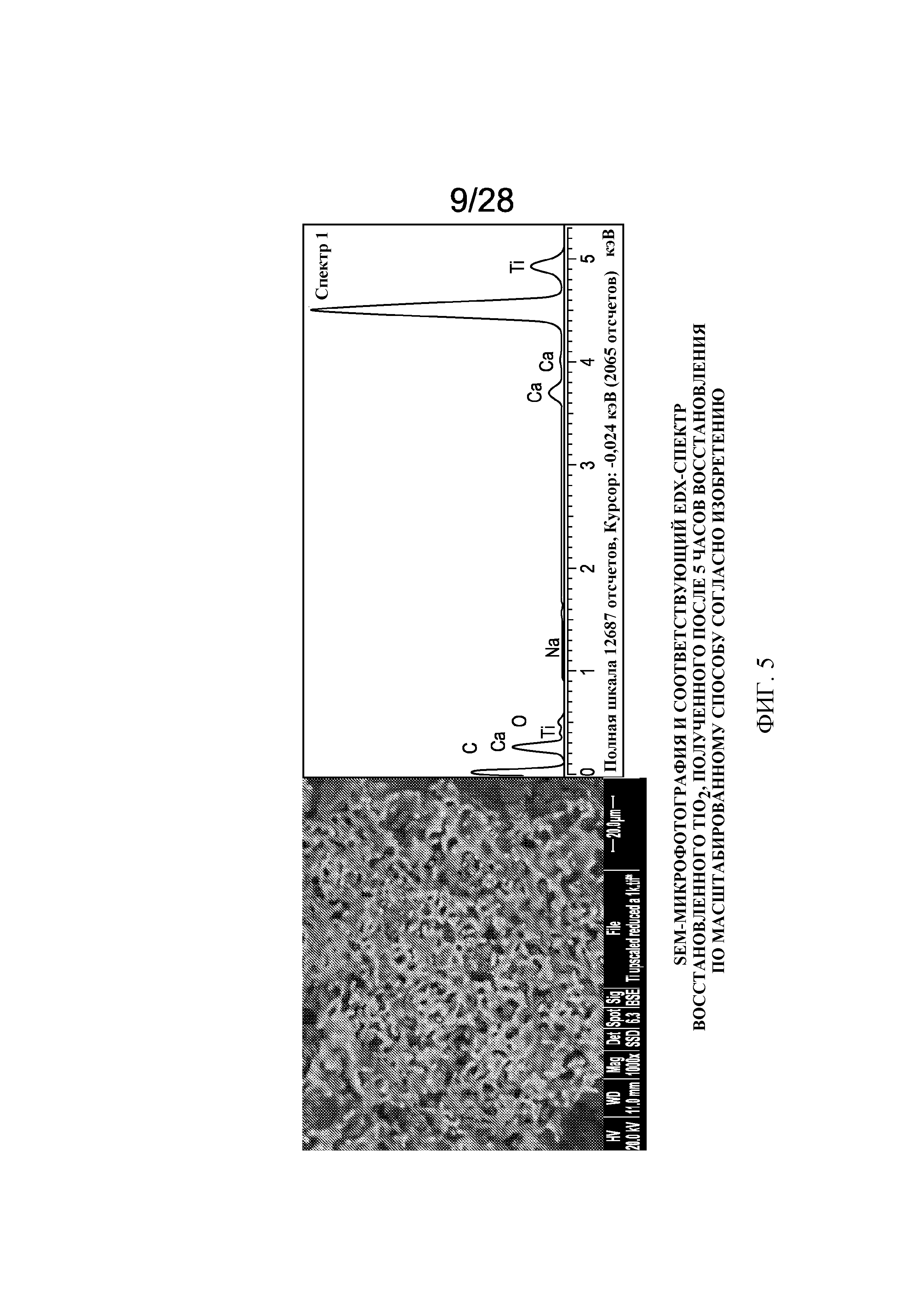
фигура 5 представляет SEM-микрофотографию и соответствующий EDX-спектр восстановленного TiО2, полученного после 5 часов восстановления по способу согласно изобретению в укрупненном масштабе;
фигура 6 представляет SEM-микрофотографию и соответствующий EDX-спектр титановой губки, полученной после вымывания восстановленного TiО2, полученного из масштабированного способа согласно изобретению;
фигура 7(а) представляет SEM-микрофотографию и соответствующий EDX-спектр порошка Та2О5, использованного для восстановления способом согласно изобретению;
фигура 7(b) представляет SEM-микрофотографию и соответствующий EDX-спектр восстановленного Та2О5, полученного после 5 часов восстановления способом согласно изобретению;
фигура 8 представляет карту данных рентгеноспектрального электронно-зондового (EDX) микроанализа по элементам образца восстановленного Та2О5;
фигура 9 представляет SEM-микрофотографию и соответствующий EDX-спектр металлической танталовой губки, полученной после вымывания восстановленного Та2О5;
фигура 10 представляет карту EDX-микроанализа по элементам металлической танталовой губки;
фигура 11(а) представляет SEM-микрофотографию и соответствующий EDX-спектр порошка Nb2О5, использованного для восстановления способом согласно изобретению;
фигура 11(b) представляет SEM-микрофотографию и соответствующий EDX-спектр восстановленного Nb2О5, полученного после 5 часов восстановления способом согласно изобретению;
фигура 12 представляет карту EDX-микроанализа по элементам образца восстановленного Nb2О5;
фигура 13 представляет SEM-микрофотографию и соответствующий EDX-спектр металлической ниобиевой губки, полученной после вымывания восстановленного Nb2О5; и
фигура 14 представляет карту EDX-микроанализа по элементам металлической ниобиевой губки;
фигура 15(а) представляет SEM-микрофотографию и соответствующий EDX-спектр порошка HfО2, использованного для восстановления способом согласно изобретению;
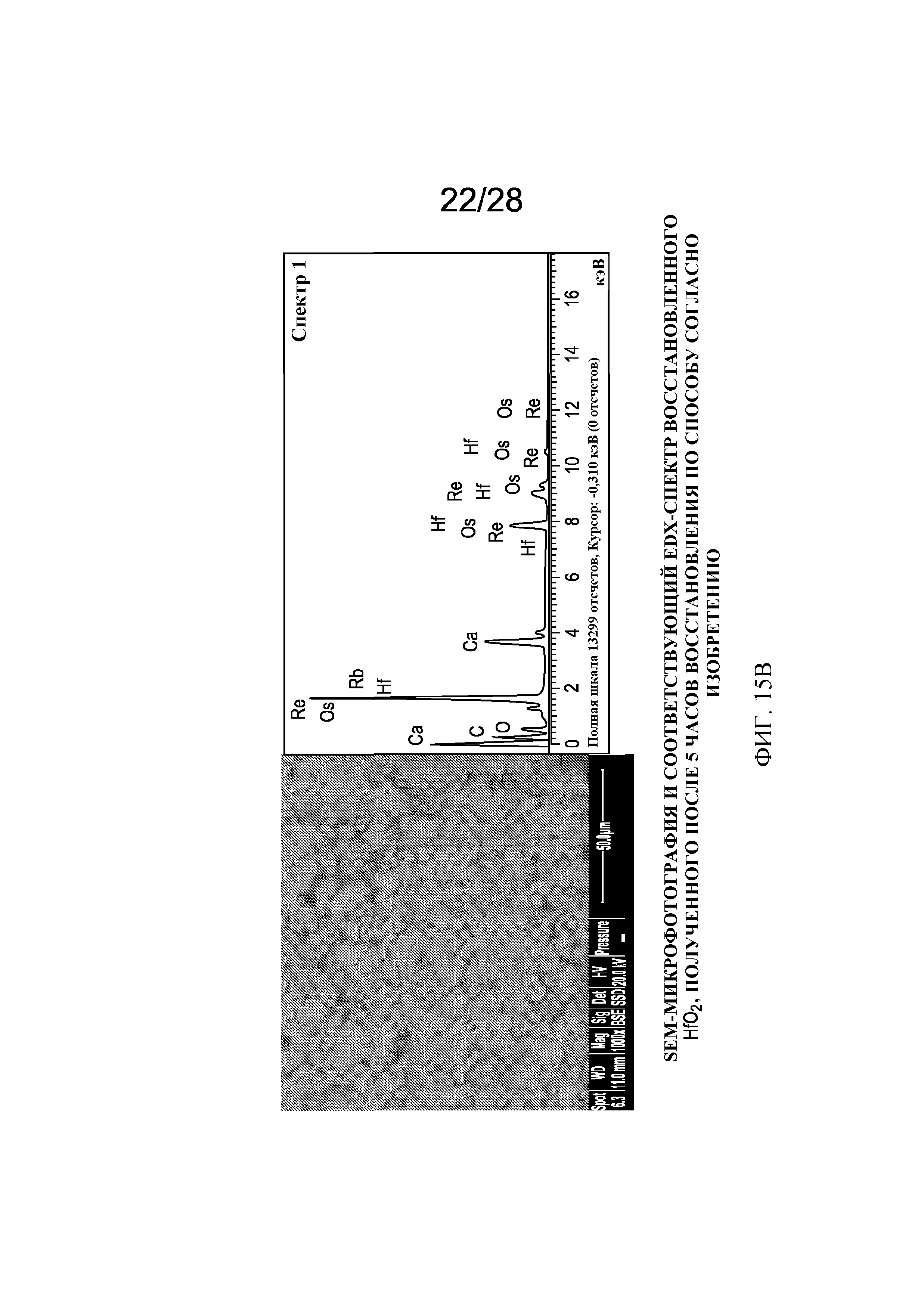
фигура 15(b) представляет SEM-микрофотографию и соответствующий EDX-спектр восстановленного HfО2, полученного после 5 часов восстановления способом согласно изобретению;
фигура 16 представляет SEM-микрофотографию и соответствующий EDX-спектр гафниевой губки, полученной после вымывания восстановленного HfО2;
фигура 17(а) представляет SEM-микрофотографию и соответствующий EDX-спектр порошка ZrО2, использованного для восстановления способом согласно изобретению;
фигура 17(b) представляет SEM-микрофотографию и соответствующий EDX-спектр восстановленного ZrО2, полученного после 5 часов восстановления способом согласно изобретению;
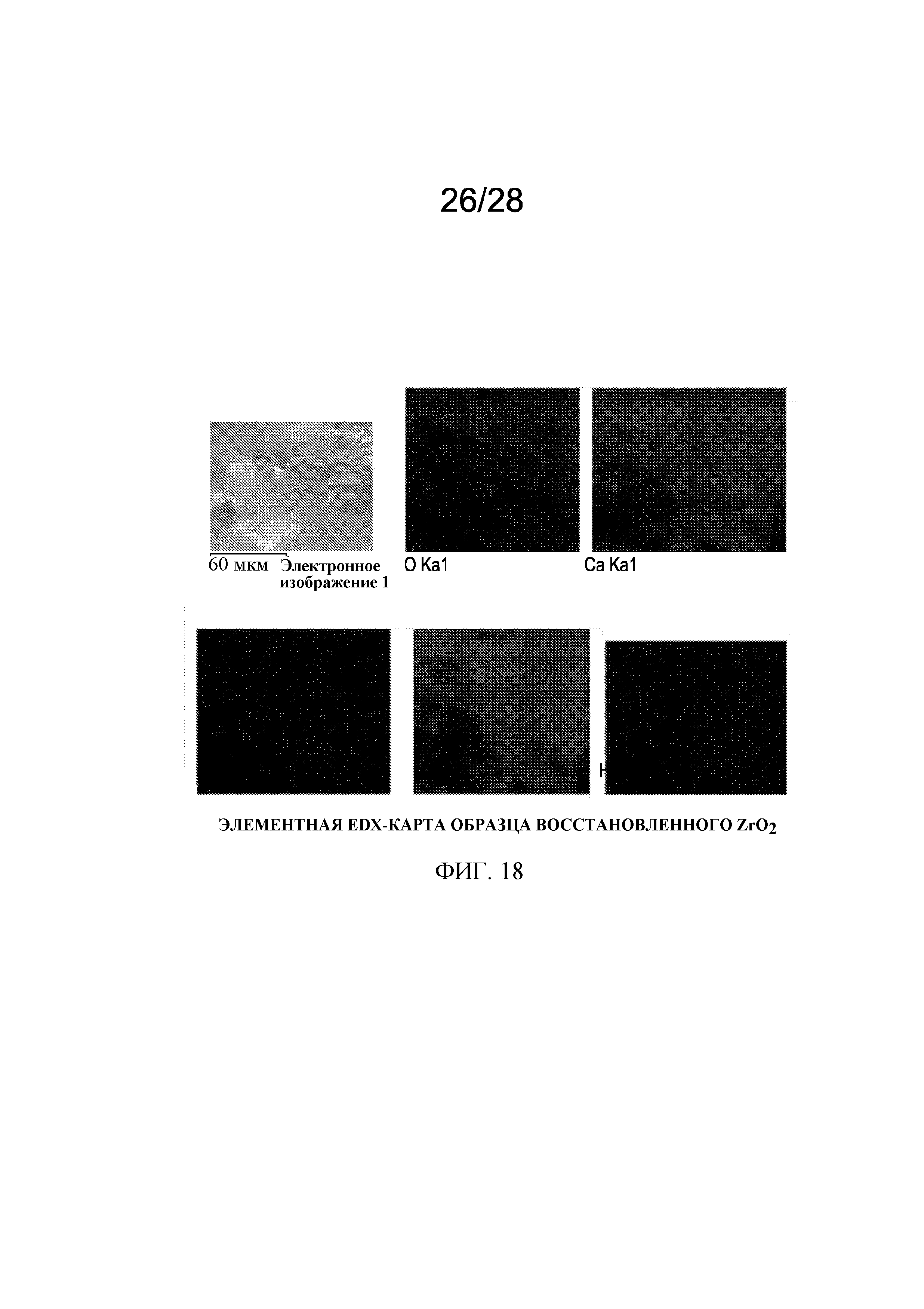
фигура 18 представляет элементную карту EDX-микроанализа по элементам, присутствующим в образце восстановленного ZrО2;
фигура 19 представляет SEM-микрофотографию и соответствующий EDX-спектр образца оксида циркония, полученного после вымывания восстановленного ZrО2; и
фигура 20 представляет элементную карту EDX-микроанализа по элементам, присутствующим в восстановленном и вымытом оксиде циркония.
Описание изобретения
[0018] Настоящее изобретение представляет способ получения металла, как было определено выше. Способ особенно пригоден для получения переходных металлов, таких как металлические титан, тантал, ниобий, гафний и цирконий, и редкоземельных металлов.
[0019] В случае титана, способ типично включает стадии, в которых смешивают диоксид титана с восстановителем, включающим металл Группы II или его гидрид, в присутствии воды и/или органического растворителя, высушивают смесь в вакууме, нагревают высушенную смесь при температуре в диапазоне от 750 до 1100°С в течение периода времени от 2 до 8 часов, в то же время поддерживая условия парциального давления от 0 до 10-3 мбар (0-0,1 Па), и обрабатывают полученный материал водным кислотным раствором.
[0020] Таким образом, в типичной экспериментальной методике от около 1 до 10 г диоксида титана (анатаза, производимого фирмой VWR International) смешивали с металлическим кальцием или магнием, или с гидридом кальция или гидридом магния, в количестве от около 0,5 до 50 г, с использованием воды или любого органического растворителя (например, спиртов, кетонов, простых эфиров, гексана или циклогексана), для стимулирования процесса смешения. Полученную смесь высушивали в вакууме, переносили в лодочку для восстановления, и помещали в печь. Затем проводили восстановление при температуре 900°С под низким давлением (от 0 до 10-3 мбар (0-0,1 Па)) в течение 5 часов. Содержимое лодочки для восстановления извлекали из печи, вымывали водой и затем промывали 0,05М соляной кислотой. Полученный после вымывания и промывания образец высушивали и анализировали для получения значения чистоты в процентах для металлического титана, который сформировался.
[0021] Подробности количественного анализа четырех титановых образцов, полученных способом согласно изобретению, показаны в Таблице 1. Следует отметить, что продолжительность вымывания, проведенного в случае Образца 2, была недостаточной, приводя к высокому уровню содержания остаточного кальция, и тем самым необходимо подчеркнуть особенную важность этой стадии способа.
[0022] На образцах металлического титана, полученных согласно заявляемому способу, были проведены дополнительные аналитические испытания, причем методы включали рентгеновский флуоресцентный анализ (XRF), сканирующую электронную микроскопию (SEM), энергодисперсионную рентгеновскую спектроскопию (EDX), рентгеновскую дифракцию (XRD) и рамановскую спектроскопию. Теперь результаты этих исследований будут обсуждены со ссылкой на сопроводительные фигуры 1-4.
[0023] Так, фигуры 1(а) и 1(b) показывают картины XRF-анализа для образца металлического титана, полученного способом согласно изобретению, и для контрольного образца стандартного металлического титана, и можно видеть, что картина XRF-спектра для металлического титана, полученного заявленным способом, почти идентична спектру контрольного образца титана, хотя и с некоторыми примесями в следовых количествах.
[0024] Из XRF-анализа ясно, что оба спектра почти идентичны, и поэтому степень чистоты, показанная методом EDX, находится в близком согласии с величиной, полученной количественным анализом (>98%). Кроме того, небольшой пик титана наблюдается при 9,04 эВ, показывая, что металл, полученный заявленным способом, является чистым. Этот пик возникает в результате возбуждения электронов на внутренних орбиталях.
[0025] Дополнительные описательные исследования были проведены с использованием методов SEM и EDX, и результаты этих исследований показаны в фигурах 2(а), 2(b) и 2(с), которые представляют данные в отношении образца диоксида титана, использованного для процесса восстановления, образца металлического титана, полученного после 5 часов восстановления согласно заявленному способу, и образца металлического титана, полученного после восстановления и вымывания согласно заявленному способу. Соответствующие выведенные аналитические обобщения в отношении трех из этих образцов показаны в Таблицах 2, 3 и 4.
[0026] Согласно этим исследованиям обнаружено, что исходный образец TiО2 содержал 20,74% титана и 79,26% кислорода, и, после восстановления, было найдено, что в образце присутствовали 34,0% титана и 49,0% кислорода. После вымывания было найдено, что в образце присутствуют 99,10% титана, без проявления кислородного пика. Это показывает, что из диоксида титана был удален весь кислород. В фигуре 2(b) формирование титановых друз (светлые пятна) на матрице из оксида кальция (серые участки) четко проявляется на SEM-микрофотографии, и интенсивность титанового пика можно видеть в EDX-спектре.
[0027] Из этих экспериментальных результатов очевидно, что раскрытый способ представляет новый и альтернативный путь получения металлического Ti, который способен удалять весь кислород из TiО2, и заявленный способ применим для восстановления других оксидов металлов, и может найти широкое применение во многих отраслях промышленности.
[0028] С привлечением фигур 3(а) и 3(b), они соответственно показывают картины XRD-спектров, зарегистрированных для металлического титана, полученного после восстановления и вымывания диоксида титана способом согласно изобретению, и диоксида титана как исходного материала, использованного для восстановления. На основе анализа картины дифракции найдено, что вся фаза оксида титана была полностью преобразована в фазу металлического титана. Диоксид титана соответствует анатазной форме, которая применяется для исследования. В фигуре 3(а) все d-значения, соответствующие металлическому титану, можно видеть без каких-либо признаков присутствия низших оксидов титана, причем «d» представляет расстояние между атомными слоями в кристалле, или интервал между плоскостями в атомной кристаллической решетке. Таким образом, образованный металл виден в чистом состоянии, которое представляет собой α-фазу титана, тем самым обеспечивая дополнительное подтверждение данных количественного анализа, зарегистрированных с помощью XRF и SEM-EDX.
[0029] Результаты, полученные с использованием рамановской спектроскопии, показаны в фигурах 4(а) и 4(b). Чтобы молекула была активной для комбинационного рассеяния света, то есть, поляризованной, она должна проявлять либо колебания, либо вращения. Диоксид титана является активным в спектре рамановского рассеяния, так как он может проявлять колебания или вращения благодаря наличию связей О-Ti-О или Ti-О. Эти характеристики идентифицируются пиками, показанными в фигуре 4(а), и спектральные данные подтверждают, что использованный диоксид титана представлял собой анатаз. Металл, полученный после восстановления и вымывания, был подвергнут анализу с использованием рамановской спектроскопии, и результаты показаны в фигуре 4(b). На этом образце не был зарегистрирован четко выраженный рамановский спектр, демонстрируя тем самым, что материал находится в форме чистого металла, и подтверждая полученные ранее факты. Теоретически металлы не могут быть поляризованы, поскольку попадающий на металл падающий свет отражается, и в результате в кристаллической решетке не возникают колебания или вращения.
[0030] Таким образом, способ согласно настоящему изобретению представляет процесс прямого восстановления в твердом состоянии, который дает высокочистый твердый металл при полном удалении оксидного слоя из оксида металла. Время, затрачиваемое до завершения процесса, является гораздо более коротким, чем для прототипных способов, и способ также является более экологически устойчивым и благоприятным для окружающей среды, чем известные способы.
[0031] В свете успешного выделения титановой губки (3,6 г) сверхвысокой чистоты из порошка диоксида титана (анатаза) описанным выше способом, способ затем был проведен в более крупном масштабе. Около 50 г анатаза (TiО2, приобретенного в фирме VWR International) смешали с металлическим кальцием в стехиометрических соотношениях в цилиндрическом металлическом тигле в присутствии растворителя, такого как ацетон. Образец высушили и затем перенесли в вакуумную печь. После 5 часов восстановления печь охладили, и образец перенесли в стакан, и подвергли вымыванию 0,05М соляной кислотой (HCl) для удаления оксида кальция, образованного во время восстановления; для завершения этого вымывания провели многократное вымывание с использованием свежего промывного раствора. Полученный после восстановления и вымывания образец высушили в сушильном шкафу перед анализом.
[0032] Анатаз (TiО2), использованный для этого процесса, был таким же образцом, как описанный ранее, приобретенным в фирме VWR International, и имел такие же технические характеристики, как подробно указано выше. После восстановления состав восстановленного анатаза был найден таким, как показано в Таблице 5.
[0033] Восстановленный материал, имеющий вышеуказанный состав, подвергли вымыванию несколько раз в 0,05М HCl для удаления оксида кальция из образца. После вымывания материал отфильтровали и в заключение промыли ацетоном и высушили в сушильном шкафу. Высушенный образец проанализировали на содержание титана, и результаты показаны в Таблице 6.
[0034] Аналитические испытания были проведены на образцах диоксида титана, после восстановления, и до и после вымывания, причем методы включали сканирующую электронную микроскопию (SEM) и энергодисперсионную рентгеновскую спектроскопию (EDX). Результаты этих исследований иллюстрированы в сопроводительных фигурах.
[0035] Так, фигура 5 показывает результаты SEM- и EDX-исследований, проведенных на образце диоксида титана после восстановления способом согласно изобретению, тогда как соответственные результаты исследований, проведенных на образце восстановленного диоксида титана после вымывания способом согласно изобретению, показаны в фигуре 6.
[0036] Так, опять очевидно, что из анатаза (TiО2) может быть получена титановая губка сверхвысокой чистоты, и, в этом масштабированном способе 50 г TiО2, использованного для восстановления, дали около 35 г титановой губки.
[0037] Настоящий способ является в особенности благоприятным, будучи примененным для получения металлического титана из диоксида титана, и открывает особенно привлекательные возможности промышленного производства в этом отношении. Титан широко применяется в авиации, автомобилестроении и в медицине, а также в других надлежащих областях, таких как теплообменники, варианты применения в оборонной промышленности, для медицинских имплантатов, спортивного снаряжения, и для бурения на морских промыслах. Например, самолет, такой как Airbus A380 и Boeing 787, содержат Ti в количестве 9% (75 тонн) и 14% (150 тонн), соответственно. В автомобильной промышленности применение титана привело к снижению расхода топлива примерно на 10%, и тем самым, в свою очередь, уменьшило вредные выбросы.
[0038] В 2009 году общее количество титана, использованного в мировом масштабе в автомобильной промышленности, составило около 3000 тонн; как ожидается, это количество год от года будет возрастать. В атомной промышленности применение титана с каждым годом увеличивается (500-600 тонн), тогда как установки для опреснения морской воды сооружаются в основном из титана. В прибрежных регионах с жарким климатом, таких как Ближний Восток, существует растущая потребность в таких установках. При ежедневной выходной мощности в 240000-270000 кубических метров воды установка потребовала бы около 70 метрических тонн титана.
[0039] Таким образом, очевидно, что потенциальный рынок для титана является огромным и постоянно растущим, и доступность «более дешевого» металлического титана будет содействовать удовлетворению возрастающих запросов в производстве.
[0040] Тантал используется в высокотемпературных вариантах применения, в особенности в авиационных двигателях, электрических устройствах, таких как конденсаторы, в хирургических имплантатах, и при обращении с коррозионно-агрессивными химикатами. Он устойчив к коррозии и невосприимчив к химическому воздействию. Он также применяется в конденсаторах и электронных трубках в электронных схемах.
[0041] Металлический тантал может быть получен способом согласно изобретению путем восстановления пентаоксида тантала (Та2О5). В типичной процедуре около 5 г пентаоксида тантала (Та2О5) смешивали в лодочке с кальцием в стехиометрическом соотношении. Смесь перемешивали с растворителем и затем высушивали. Высушенный образец переносили в восстановительную печь и создавали вакуум. После 5 часов восстановления печь охлаждали, и образец подвергали вымыванию 0,05М соляной кислотой (HCl) в течение 2 часов для удаления оксида кальция, образовавшегося во время восстановления. Восстановленный и промытый материал отфильтровывали и высушивали в сушильном шкафу перед анализом.
[0042] Было показано, что использованный для восстановления Та2О5 первоначально содержал 82% тантала и 17,36% кислорода. После восстановления состав был найден таким, как показано в Таблице 7.
[0043] Восстановленный материал, имеющий вышеуказанный состав, подвергли вымыванию 0,05М HCl в течение 2 часов. После вымывания материал отфильтровали и в заключение промыли ацетоном и высушили в сушильном шкафу. Высушенный образец проанализировали на содержание тантала, и результаты показаны в Таблице 8.
[0044] Аналитические испытания были проведены на образцах пентаоксида тантала, до и после восстановления и вымывания, причем методы включали сканирующую электронную микроскопию (SEM) и энергодисперсионную рентгеновскую спектроскопию (EDX). Теперь результаты этих исследований будут обсуждены со ссылкой на сопроводительные фигуры.
[0045] Так, фигуры 7(а) и 7(b) показывают результаты SEM- и EDX-исследований, проведенных на образце пентаоксида тантала до и после восстановления способом согласно изобретению. На микрофотографии восстановленного образца более светлые участки отнесены на счет восстановленного тантала, тогда как выглядящая серой часть представляет фазу оксида кальция; здесь также представляется, что оксид кальция образует базовую матрицу для восстановленного тантала.
[0046] Фигура 8 представляет карту данных EDX-микроанализа по элементам образца восстановленного пентаоксида, которая показывает распределение каждого элемента, показанного в образце, с которого сделана микрофотография.
[0047] Результаты SEM- и EDX-исследований, проведенных на образце восстановленного пентаоксида тантала после вымывания способом согласно изобретению, показаны в фигуре 9, и из SEM-микрофотографии очевидно, что во время вымывания удаляется большинство загрязняющих примесей, оставляя после этого высокочистый тантал. Размер частиц губки представляется значительно выросшим. Соответствующий EDX-спектр показывает присутствие адсорбированного кислорода в системе, содержание которого по анализу было найдено составляющим менее 5%.
[0048] Карта данных элементного EDX-микроанализа танталовой губки показана в фигуре 10, и это показывает присутствие адсорбированного кислорода, диспергированного во всем образце.
[0049] Таким образом, как в случае с получением титана из диоксида титана, очевидно, что пентаоксид тантала может быть эффективно восстановлен до металлического тантала в присутствии кальция, способом согласно изобретению.
[0050] Ниобий применяется для изготовления устойчивых к высокой температуре сплавов и специальной нержавеющей стали. Небольшие количества ниобия придают повышенную прочность другим металлам, в особенности тем, которые подвергаются воздействию низких температур. Таким образом, он используется в таких вариантах применения, как ядерные реакторы, реактивные двигатели, ракеты, режущие инструменты, трубопроводы, супермагниты и сварочные электроды. Ниобий-оловянные и ниобий-титановые сплавы применяются в качестве проволок для сверхпроводящих магнитов, способных создавать чрезвычайно сильные магнитные поля, тогда как ниобий в своей чистой форме используется для изготовления сверхпроводящих разгонных устройств для ускорителей заряженных частиц. Ниобиевые сплавы применяются в хирургических имплантатах, поскольку они не взаимодействуют с тканями тела человека.
[0051] Металлический ниобий также может быть получен способом согласно изобретению восстановлением пентаоксида ниобия (Nb2О5). В типичной процедуре около 5 г пентаоксида ниобия (Nb2О5) смешивали в лодочке с кальцием в стехиометрическом соотношении. Смесь перемешивали с растворителем и затем высушивали. Высушенный образец переносили в восстановительную печь и создавали вакуум. После 5 часов восстановления печь охлаждали, и образец подвергали вымыванию 0,05М соляной кислотой (HCl) в течение 2 часов для удаления оксида кальция, образовавшегося во время восстановления. Восстановленный и промытый материал отфильтровывали и высушивали в сушильном шкафу перед анализом.
[0052] Было показано, что использованный для восстановления Nb2О5 первоначально содержал 60% ниобия, 38,5% кислорода и 1,7% натрия. После восстановления состав был найден таким, как показано в Таблице 9.
[0053] Восстановленный материал, имеющий вышеуказанный состав, подвергли вымыванию действием 0,05М HCl в течение 2 часов. После вымывания материал отфильтровали и в заключение промыли ацетоном и высушили в сушильном шкафу. Высушенный образец проанализировали на содержание ниобия, и результаты показаны в Таблице 10.
[0054] Аналитические испытания были проведены на образцах пентаоксида ниобия, до и после восстановления и вымывания, причем методы включали сканирующую электронную микроскопию (SEM) и энергодисперсионную рентгеновскую спектроскопию (EDX). Теперь результаты этих исследований будут обсуждены со ссылкой на сопроводительные фигуры.
[0055] Так, фигуры 11(а) и 11(b) показывают результаты SEM- и EDX-исследований, проведенных на образце пентаоксида ниобия до и после восстановления способом согласно изобретению. На микрофотографии восстановленного образца более светлые участки приписаны восстановленному ниобию, тогда как выглядящая серой часть представляет фазу оксида кальция; здесь также представляется, что оксид кальция образует базовую матрицу для восстановленного ниобия.
[0056] Фигура 12 представляет карту данных EDX-микроанализа по элементам образца восстановленного пентаоксида, которая показывает распределение каждого элемента, показанного в образце, с которого сделана микрофотография.
[0057] Результаты SEM- и EDX-исследований, проведенных на образце восстановленного пентаоксида ниобия после вымывания по способу согласно изобретению, показаны в фигуре 13, и из SEM-микрофотографии очевидно, что во время вымывания удаляется большинство загрязняющих примесей, оставляя после этого высокочистый ниобий. Размер частиц губки представляется значительно выросшим. Соответствующий EDX-спектр показывает присутствие как кальция, так и кислорода в системе, что свидетельствует о том, что реакция еще не завершилась. Согласно анализу, содержание кислорода было найдено составляющим около 5%, и содержание кальция составляло 0,2%.
[0058] Карта данных элементного EDX-микроанализа ниобиевой губки показана в фигуре 14, и это показывает присутствие кислорода и кальция, диспергированных по всему образцу.
[0059] Таким образом, как в случае получения титана из диоксида титана, и получения тантала из пентаоксида тантала, очевидно, что пентаоксид ниобия может быть эффективно восстановлен до металлического ниобия в присутствии кальция, по способу согласно изобретению. Однако необходимо оптимизировать температуру и продолжительность восстановления, чтобы получить из оксида металл со сверхвысокой чистотой.
[0060] Гафний представляет собой пластичный металл. На его свойства влияют примеси циркония в нем, и гафний и цирконий очень трудно отделить друг от друга. Гафний имеет хорошее сечение поглощения тепловых нейтронов (почти в 600 раз выше, чем у циркония), и он также имеет превосходные механические свойства и является чрезвычайно устойчивым к коррозии. Он используется в ядерных реакторах в качестве регулирующих стержней.
[0061] Металлический гафний также может быть получен способом согласно изобретению восстановлением диоксида гафния (HfО2). В типичной методике около 5 г диоксида гафния (HfО2) смешивали в лодочке с кальцием в стехиометрическом соотношении. Смесь перемешивали с растворителем и затем высушивали. Высушенный образец переносили в восстановительную печь и создавали вакуум. После 5 часов восстановления печь охлаждали, и образец подвергали вымыванию 0,05М соляной кислотой (HCl) в течение 2 часов для удаления оксида кальция, образовавшегося во время восстановления. Восстановленный и промытый материал отфильтровывали и высушивали в сушильном шкафу перед анализом.
[0062] Было показано, что использованный для восстановления HfО2первоначально содержал 66,28% гафния, 31,18% кислорода и 0,73% натрия. После восстановления состав был найден таким, как показано в Таблице 11.
[0063] Восстановленный материал, имеющий вышеуказанный состав, подвергли вымыванию в 0,05М HCl в течение 2 часов. После вымывания материал отфильтровали и в заключение промыли ацетоном и высушили в сушильном шкафу. Высушенный образец проанализировали на содержание гафния, и результаты показаны в Таблице 12.
[0064] Аналитические испытания были проведены на образцах диоксида гафния, до и после восстановления и вымывания, причем методы включали сканирующую электронную микроскопию (SEM) и энергодисперсионную рентгеновскую спектроскопию (EDX). Теперь результаты этих исследований будут обсуждены со ссылкой на сопроводительные фигуры.
[0065] Так, фигуры 15(а) и 15(b) показывают результаты SEM- и EDX-исследований, проведенных на образце диоксида гафния до и после восстановления способом согласно изобретению. На микрофотографии восстановленного образца не было идентифицировано отчетливое разделение между фазой восстановленного гафния и кальциевой фазой. Как представляется, реакция восстановления может быть не завершена, так как EDX четко показывает присутствие как кальция, так и кислорода. Микрофотография иллюстрирует однородную дисперсию без светлых и серых областей.
[0066] Результаты SEM- и EDX-исследований, проведенных на образце восстановленного диоксида гафния после вымывания по способу согласно изобретению, показаны в фигуре 16, и из результатов очевидно, что диоксид гафния требует одного или обоих из более длительного времени или более высокой температуры для достижения полного восстановления.
[0067] Поэтому представляется, что получение гафния из диоксида гафния может быть успешно достигнуто последующими дополнительными исследованиями для оптимизации, направленными на получение и выделение металла со сверхвысокой чистотой.
[0068] Цирконий представляет собой серовато-белый блестящий металл, который используется в таких сплавах, как циркалой, который находит конкретное применение в области ядерной энергетики, так как он почти не поглощает нейтроны. Он также применяется в каталитических конвертерах и кирпичной футеровке печей.
[0069] Металлический цирконий также может быть получен способом согласно изобретению восстановлением диоксида циркония (ZrО2). В типичной процедуре около 5 г диоксида циркония (ZrО2) смешивали в лодочке с кальцием в стехиометрическом соотношении. Смесь перемешивали с растворителем с образованием суспензии и затем высушивали в сушильном шкафу. Высушенный образец переносили в восстановительную печь и создавали вакуум. После 5 часов восстановления печь охлаждали, и образец подвергали вымыванию 0,05М соляной кислотой (HCl) в течение 2 часов для удаления оксида кальция, образованного во время восстановления. Восстановленный и промытый материал отфильтровывали и высушивали в сушильном шкафу перед анализом.
[0070] Было показано, что использованный для восстановления ZrО2первоначально содержал 71,27% циркония, 25,42% кислорода, 0,49% натрия, 0,79% гафния и 2,03% рения. После восстановления состав был найден таким, как показано в Таблице 13.
[0071] Восстановленный материал, имеющий вышеуказанный состав, подвергли вымыванию с использованием 0,05М HCl в течение 2 часов. После вымывания материал отфильтровали и в заключение промыли ацетоном и высушили в сушильном шкафу. Высушенный образец проанализировали на содержание циркония, и результаты показаны в Таблице 14.
[0072] Аналитические испытания были проведены на образцах диоксида циркония, до и после восстановления и вымывания, причем методы включали сканирующую электронную микроскопию (SEM) и энергодисперсионную рентгеновскую спектроскопию (EDX). Теперь результаты этих исследований будут обсуждены со ссылкой на сопроводительные фигуры.
[0073] Так, фигуры 17(а) и 17(b) показывают результаты SEM- и EDX-исследований, проведенных на образце диоксида циркония до и после восстановления по способу согласно изобретению. На микрофотографии восстановленного образца не было идентифицировано отчетливое разделение между фазой восстановленного циркония и кальциевой фазой. Как представляется, реакция восстановления может быть не завершена, так как EDX четко показывает присутствие кальция и кислорода. Микрофотография иллюстрирует однородную дисперсию с очень малыми светлыми и значительно более крупными серыми областями.
[0074] Фигура 18 показывает элементную EDX-карту образца восстановленного диоксида, которая показывает распределение каждого элемента, показанного в образце, с которого сделана микрофотография.
[0075] Результаты SEM- и EDX-исследований, проведенных на образце восстановленного диоксида циркония после вымывания по способу согласно изобретению, показаны в фигуре 19, и элементная EDX-карта образца восстановленного и промытого диоксида циркония представлены в фигуре 20.
[0076] Таким образом, из вышеуказанного анализа следует, что успешное восстановление диоксида циркония требует более длительного времени или более высокой температуры для завершения процесса. Однако из данных ясно, что этот металл может быть получен восстановлением оксида, но необходима дальнейшая оптимизация для возможности выделения металла со сверхвысокой чистотой.
[0077] На всем протяжении текста и в пунктах патентной формулы этого описания слова «включает» и «содержит», и их варианты, означают «включающий, но не ограниченный этим», и они не предполагают исключения (и не исключают) других составных частей, добавок, компонентов, целочисленных значений или стадий. На всем протяжении текста и в пунктах патентной формулы этого описания выражение в единственном числе охватывает множественное число, если контекст не оговаривает иного. В частности, где используется неопределенный артикль, описание следует понимать как предусматривающее множественность, а также единственность в своем роде, если контекст не оговаривает иного.
[0078] Признаки, целочисленные значения, характеристики, соединения, химические фрагменты или группы, описанные в связи с конкретным аспектом, вариантом осуществления или примером изобретения, должны пониматься как применимые к любому другому описанному здесь аспекту, варианту осуществления или примеру, за исключением несовместимости с ними. Все признаки, раскрытые в этом описании (в том числе в любых пунктах прилагаемой патентной формулы, реферате и чертежах), и/или все стадии любого способа или процесса, таким образом раскрытого, могут быть объединены в любом сочетании, за исключением комбинаций, где по меньшей мере некоторые из таких признаков и/или стадий являются взаимоисключающими. Изобретение не ограничивается подробностями любых вышеизложенных вариантов осуществления. Изобретение распространяется на любые новые признаки, или любую новую их комбинацию, раскрытые в этом описании (в том числе в любых пунктах прилагаемой патентной формулы, реферате и чертежах), или любые новые стадии, или любую новую комбинацию стадий любого раскрытого таким образом способа или процесса.
[0079] Обращается внимание читателя на все статьи и документы, которые зарегистрированы одновременно с настоящим описанием или ранее него в связи с этой заявкой и которые открыты для открытого доступа с этим описанием, и содержание всех таких статей и документов включено здесь ссылкой.
Список цитированной литературы
1. Massalski, T.B., Okamoto, H., Subramanian, P.R. & Kacprzak, L. (редакторы), Binary Alloy Phase Diagrams (Фазовые диаграммы бинарных сплавов), 2-ое издание, том 3, стр. 2924-2927 (ASM International, Materials Park, 1990).
2. Kroll, W.J., The production of ductile titanium (Производство пластичного титана), Trans. Am. Electrochem. Soc., том 78, стр. 35-47 (1940).
3. Ikeshima, T., в «Titanium Science and Technology», Proc. 5th Int. Conf. Titanium, München 1984 (Труды 5-ой Международной конференции по титану, Мюнхен) (редакторы Lutjering, G., Zwicker, U. & Bunk, W.) стр. 3-14 (DGM-Deutsche Gesellschaft fur Materialkunde e.V., Oberursal, 1985).
4. Cobel, G. , Fisher, J. & Synder, L. E., в «Titanium '80, Science and Technology», Proc. 4th Int. Conf. Titanium, Kyoto 1980 (Труды 4-ой Международной конференции по титану, Киото) (редакторы Kimura, H. & Izumi, O.) стр. 1969-1976 (The Metallurgical Society of AIME, Warrendale, 1980).
5. Opie, W.R. & Moles, O.W., A basket cathode electrolytic cell for production of titanium (Электролизер с корзиночным катодом для получения титана), Trans. Met. Soc. ΑΙΜΕ, том 218, стр. 646-649 (1960).
6. Ginatta, M.V., Method of producing metals by cathodic dissolution of their compounds (Способ получения металлов катодным растворением их соединений), Патент США № 4400247 (23 августа 1983).
7. Froes, F.H., Titanium and other light metals: let's do something about cost (Титан и другие легкие металлы: давайте сделаем что-либо в отношении стоимости), JOM, том 50, стр. 15 (1998).
8. Hartman, A.D., Gerdemann, S.J. & Hansen, J.S., Producing lower-cost titanium for automotive applications (Получение недорогого титана для применения в автомобилях), JOM, том 50, стр. 16-19 (1998).
9. Suzuki, K., The high-quality precision casting of titanium alloys (Высококачественное точное литье титановых сплавов), JOM, том 50, стр. 20-23 (1998).
10. Okabe, T., Ohkubo, C, Watanabe, I., Okuno, O. & Takada, Y, The present status of dental titanium casting (Современное состояние зубопротезного титанового литья), JOM, том 50, стр. 24-29 (1998).
11. Froes, F.H., The production of low-cost titanium powders (Получение недорогих титановых порошков), JOM, том 50, стр. 41-43 (1998).
12. Tapphorn, R.M. & Gabel, H., The solid-state spray forming of low-oxide titanium components (Формирование компонентов из низших оксидов титана напылением в твердом состоянии), JOM, том 50, стр. 45-46, 76 (1998).
13. Elliott, G.R.B., The continuous production of titanium powder using circulating molten salt (Непрерывное производство титанового порошка с использованием циркулирующей расплавленной соли), JOM, том 50, стр. 48-49 (1998).
14. Sohn, H.Y., Ti and TiAl powders by the flash reduction of chloride vapors (Ti- и TiAl-порошки флэш-восстановлением хлоридных паров), JOM, том 50, стр. 50-51 (1998).
15. Segall, A.E., Papyrin, A.N., Conway, J.C.(младш.) & Shapiro, D., A cold-gas spray coating process for enhancing titanium (Способ нанесения покрытия напылением в холодном газе для упрочнения титана), JOM, том 50, стр. 52-54 (1998).
16. George Zheng Chen, Derek J. Fray и Tom W. Farthing, Direct electrochemical reduction of titanium dioxide to titanium in molten chloride (Прямое электрохимическое восстановление диоксида титана до титана в расплавленном хлориде), Nature, том 407, стр. 361-364, (2000).
17. Oosthuizen, In search of low cost titanium: the Fray Farthing Chen (FFC) Cambridge Process (В поисках дешевого титана: Кембриджский процесс Фрэя-Фартинга-Чена (FFC)), (The Journal of South African Inst, of Min. and Met.), том 111, стр. 1-5, (2011).
Реферат
Изобретение относится к способу получения переходных металлов. Для осуществления указанного способа проводят стадии, на которых смешивают оксид переходного металла в резервуаре с восстановителем, включающим металл Группы II или его гидрид, в присутствии воды и/или органического растворителя, осуществляют термическую обработку смеси оксида переходного металла и восстановителя в течение времени от 2 до 8 ч при давлении от 0 до 10мбар (0-0,1 Па), вымывают полученный материал водой и промывают вымытый материал водным кислотным раствором. Обеспечивается получение высокочистого твердого переходного металла. 15 з.п. ф-лы, 20 ил., 14 табл.
Формула
Документы, цитированные в отчёте о поиске
Способ получения ниобиевых и/или танталовых порошков и агломераты ниобиевого порошка

Комментарии