Способ извлечения никеля из ni-fe-mg-латеритной руды с высоким содержанием магния - RU2149910C1
Код документа: RU2149910C1
Чертежи















Описание
Настоящее изобретение относится к гидрометаллургическому извлечению никеля из оксидных руд, в частности латеритных руд с высоким содержанием магния, таких как сапролиты.
Описание известных технических решений
Известно, что никельсодержащие руды, например руды, называемые латеритами, содержащие лимонит и сапролит, являются наиболее крупными в мире потенциальными источниками никеля и кобальта.
Неспособность к обогащению этих руд обычными методами приводит к неэкономичности таких руд, поскольку они не могут быть подвергнуты концентрированию магнитной сепарацией или пенной флотацией, если их сравнивать с ферроникелевыми сульфидными рудами, которые легко могут быть концентрированы до достаточно высокого уровня содержания никеля с помощью хорошо известных методов, таких как пенная флотация и штейновая плавка.
Одним из процессов извлечения никеля и кобальта является хорошо известный процесс Моа Бей, включающий в себя кислотное выщелачивание при повышенных температурах и давлениях, при котором оксид железа и оксисульфат алюминия в значительной степени нерастворимы.
В процессе Моа Бей латеритная руда при крупности помола минус 20 меш (95% вещества проходит через сито 325 меш Американского стандарта) превращается в пульпу с содержанием твердого вещества приблизительно 45% и никель и кобальт селективно выщелачиваются достаточным количеством серной кислоты при повышенных температурах и давлении (например, при 230 - 250oC и избыточном давлении от 405 до 580 фунт/дюйм2 (от 28,5 до 40,8 кг/см2), с тем чтобы растворить около 95% как никеля, так и кобальта за 60 - 90 мин. После сброса давления выщелоченная пульпа промывается противоточным декантированием и промытая пульпа уходит в отвалы. Затем выщелачивающий раствор, имеющий довольно низкое значение pH (например, между 0 и 0,5), нейтрализуется коралловым шламом до pH порядка 2,4 в серии из четырех баков при общем времени пребывания приблизительно 20 мин и обработанный таким образом жидкий продукт (содержащий приблизительно 5,65 г/л никеля, 0,8 г/л железа и 2,3 г/л алюминия) после разделения твердой и жидкой фракций подвергается сульфидному осаждению. В автоклаве при температуре приблизительно 120oC (250oF) и давлении около 150 фунт/дюйм2 (10,55 кг/см2) выщелачивающая жидкость нагревается и проводится сульфидное осаждение с помощью H2S в качестве осаждающего реагента.
В исходной схеме обработки смешанных сульфидов сульфидный осадок промывали и отстаивали до содержания твердой фазы приблизительно 65%. Затем его окисляли в автоклаве при температуре приблизительно 177oC (350oF) и давлении около 700 фунт/дюйм2 (50 кг/см2).
Затем этот раствор, содержащий никель и кобальт, нейтрализовали аммиаком до получения pH 5,35, достаточного для почти полного осаждения остаточного железа, алюминия и хрома, используя воздух в качестве окисляющего агента.
После этого осадок отделяли от раствора, а раствор никеля и кобальта корректировали до pH, равного приблизительно 1,5. Для селективного осаждения всех присутствующих примесей меди, свинца и цинка вводили H2S. Осадок отделяли от раствора фильтрованием и извлекали никель различными способами, один из которых состоит в обработке никельсодержащего раствора водородом при повышенных температуре и давлении с получением порошка никеля.
Вышеупомянутый процесс подобен процессу, описанному в разделе "Известные технические решения", представленном в патенте США N 4097575, описание которого включено в настоящее описание в качестве ссылки.
Некоторые латеритные руды, в частности сапролитные руды, обычно имеют высокое содержание магния и относительно низкое содержание железа в сравнении с лимонитом, с которым приходится бороться для эффективного извлечения никеля из маточного выщелоченного раствора и отделения никеля от железа, магния и других примесей.
Промышленная практика состоит в плавке высококачественных сапролитовых руд, содержащих обычно более 2% никеля, для получения либо ферроникелевого, либо никелевого штейна.
Что касается лимонита, то в этом случае никель извлекается из руды выщелачиванием под высоким давлением с использованием серной кислоты в качестве выщелачивающего агента и/или восстановительным обжигом с последующим аммиачным выщелачиванием.
Кислотное выщелачивание сапролитной руды не получило промышленного распространения по той причине, что не разработан процесс извлечения никеля из выщелачивающего раствора, который был бы прост и экономичен.
Типичный латерит с высоким содержанием магния и железа обычно содержит по весу не менее 5% магния и даже, например, 10 и более процентов.
Процесс Моа Бей не подходит для обработки таких руд из-за избыточного расхода серной кислоты вследствие высокого содержания в руде магния в форме MgO.
Мы обнаружили способ выщелачивания латеритов сапролитного типа при нормальном атмосферном давлении и нормальной температуре (например, комнатной температуре в случае выщелачивания в кучах/колоннах и, приблизительно, от 60 до 80oC в случае выщелачивания с перемешиванием), в котором побочные продукты - оксиды магния и железа - могут с пользой применяться для повторного их использования в выщелачивающей системе в качестве средств регулирования pH маточного никелевого раствора перед экстракцией никеля из этого раствора.
Цели настоящего изобретения
Таким образом, цель настоящего изобретения состоит в извлечении никеля из Ni-Fe-Mg-содержащих
латеритных руд, имеющих относительно высокое содержание магния и железа.
Другая цель настоящего изобретения состоит в создании способа, которым оксиды магния и железа можно удалять из выщелачивающей жидкости до извлечения никеля из маточного раствора.
Эти и другие цели будут более понятны при рассмотрении нижеследующего описания и прилагаемых к нему чертежей.
Описание чертежей
Фиг. 1 представляет схему процесса в случае выщелачивания в кучах или в чанах латеритных руд с высоким содержанием магния (например, сапролита) с использованием в
качестве выщелачивающего раствора соляной кислоты.
Фиг. 2 представляет вариант схемы, изображенной на фиг. 1, где для извлечения никеля из руды применен метод выщелачивания с перемешиванием, а остальная часть процесса, следующая за выщелачиванием, аналогична схеме с фиг. 1.
Фиг. 3 иллюстрирует вариант реализации процесса, в котором применен двухстадийный метод выщелачивания с использованием противоточного процесса, где вся руда выщелачивается на второй стадии, а твердые вещества, остающиеся после выщелачивания на второй стадии, повторно возвращаются на первую стадию.
Фиг. 4 относится к использованию серной кислоты для выщелачивания в кучах или чанах латеритной руды с высоким содержанием магния.
Фиг. 5 изображает набор кривых, сравнивающих выщелачивание с перемешиванием сапролита и лимонита.
Фиг. 6 иллюстрирует соотношение между кислотностью и количеством добавленной руды и временем в ходе нейтрализации при выщелачивании с перемешиванием.
Фиг. 7 показывает кривые, изображающие экстракцию никеля при выщелачивании в чанах при различных условиях проведения процесса.
Фиг. 8 представляет кривые, изображающие экстракцию никеля в H2SO4 при выщелачивании в чанах при различных условиях.
Фиг. 9 представляет собой
блок-схему процесса выщелачивания в кучах сапролита с использованием соляной кислоты; и
Фиг. 10 представляет графическую иллюстрацию различных видов выщелачивания.
Общее
описание изобретения
В соответствии с настоящим изобретением латеритные руды с высоким содержанием магния (например, сапролит), такие как Ni-Fe-Mg-содержащие руды, содержащие по весу по
меньшей мере около 5% магния, по меньшей мере около 10% железа и по меньшей мере 0,5% никеля подвергают растворению за счет контактирования руды с минеральной кислотой, выбранной из группы таких
кислот, как HCl, H2SO4 и HNO3, при концентрации кислоты, достаточной для растворения никеля, например, не менее 0,25 молярной.
Выщелачивание проводится при температуре по меньшей мере от приблизительно комнатной температуры и находящейся в пределах до приблизительно 95oC в течение времени, достаточного для растворения существенного количества никеля и некоторой части железа и магния и получения маточного раствора этих веществ.
Вслед за выщелачиванием и удалением твердого остатка при необходимости проводят корректировку pH раствора до диапазона от приблизительно 1 до 3.
Затем раствор приводят в соприкосновение с ионообменной смолой, селективно абсорбирующей никель и рафинирующей остаточный раствор, содержащий магний и железо. Часть рафинированных веществ может повторно использоваться на стадии выщелачивания, а неиспользуемая часть подвергаться пирогидролизу с получением MgO и Fe2O3.
После этого абсорбированный никель экстрагируется из ионообменной смолы за счет контактирования смолы с минеральной кислотой с образованием раствора никеля в виде экстракта никеля, из которого затем извлекается никель. Что касается элюата, то он может быть повторно использован после корректировки кислотности с целью увеличения концентрации никеля для пирогидролиза.
Подробное описание изобретения
По существу, процесс согласно настоящему изобретению состоит из выщелачивания в кучах, в чанах или выщелачивания с перемешиванием
руды с минеральными кислотами, например HCl, H2SO4 и HNO3.
Вслед за растворением никеля pH выщелачивающего раствора доводят до, приблизительно, от 1 до 3 с использованием оксидов магния и железа, образовавшихся в данном процессе, или свежей руды.
После отделения от выщелачивающего раствора твердой фазы раствор подвергается обработке ионообменной смолой, в частности смолой производства фирмы Dow Chemical, называемой XFS-4195, на которой происходит селективная абсорбция никеля и остается обедненный никелем раствор (рафинат) или промывная вода, возвращаемая в систему выщелачивания для ее повторного использования.
Когда в качестве выщелачивающих агентов используют соляную или азотную кислоту, происходит образование хлорида никеля или нитрата никеля с последующим его концентрированием ионным обменом. Раствор хлорида никеля или нитрата никеля подвергают пирогидролизу для получения оксида никеля и вторичной кислоты, например соляной (HCl) или азотной (HNO3).
Пирогидролиз позволяет выделить окись магния или окись железа, которые можно повторно использовать для корректирования pH выщелачивающего раствора до уровня порядка 1 - 3 при приготовлении маточного раствора для экстракции никеля ионным обменом.
Пирогидролиз позволяет также восстановить MgO исключительно как побочный продукт или продукт, используемый для нейтрализации при повышении pH рафината до 6 или 7 с целью высаждения и отделения железа и других примесей. Полученный после фильтрования раствор MgCl2 является маточным раствором для пирогидролиза.
Оксид никеля, образующийся в результате пирогидролиза, может быть использован для производства металлического никеля, либо оксид никеля в комбинации с оксидом железа можно использовать для производства ферроникеля.
Схема проведения процесса согласно настоящему изобретению среди прочих возможных схем может включать какую-либо из схем, представленных на фиг. 1, 2, 3, 4 или 9.
Латеритные руды обрабатывают в зависимости от количества представленных в них оксидов магния и железа. Эти руды подразделяются на категории в зависимости от относительного содержания в них магния и железа, например высокомагниевые и низкожелезистые руды (сапролит), или низкомагниевые и высокожелезистые руды, такие как лимонит.
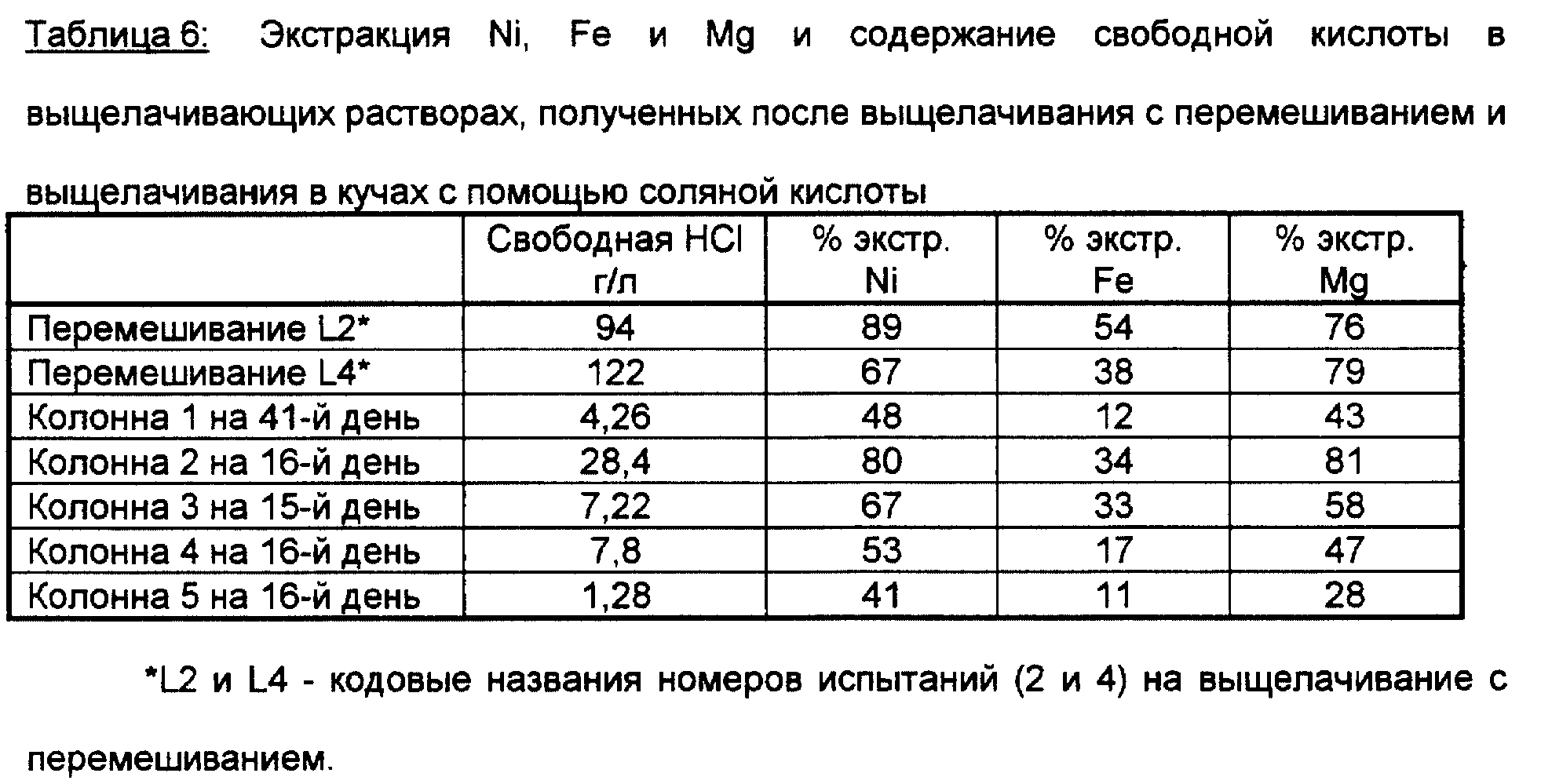
Все же содержание железа в некоторых сапролитах может быть относительно высоким (отметьте себе сапролит N 3 в таблице 1, который содержит 17,5 весовых процентов железа), хотя и не столь высоким, как в лимонитных рудах. В таблице 1 три сапролитные руды сравниваются с лимонитом.
Различия в выщелачиваемости, исследованные в испытаниях с перемешиванием, наблюдаемые между сапролитными рудами и лимонитной рудой, четко видны при рассмотрении кривых, представленных на фиг. 5, где показано, что выщелачиваемость этих двух руд совершенно различна при тех же условиях перемешивания в среде выщелачивающей соляной кислоты.
Как ясно видно из таблицы 1, сапролитные руды имеют относительно высокое содержание магния - порядка 7,06%, 8,73% и 13,7% по весу. Лимонит имеет значительно более низкое содержание магния - приблизительно 2,84% по весу.
Что касается сапролита 1 или сапролита 2, то при их обработке применяли следующие условия выщелачивания соляной кислотой.
Выщелачивание соляной кислотой
Образец руды - Сапролит 1 или сапролит 2
Размер частиц - 80 вес.%
проходит сквозь сито 200 меш
Концентрация HCl - 18% при 6М
Концентрация твердого вещества - 36 вес.% при 600 г/л
Температура выщелачивания - Комнатная температура (23oC) и 60 - 80oC
Время выщелачивания - 5 ч
В результате выщелачивания с перемешиванием при комнатной температуре была достигнута экстракция 67%, а в более высоком
температурном диапазоне (от 60oC до 70oC) - 89%. Было установлено, что скорость выщелачивания никеля достаточно велика во время первых 30 минут, а затем относительно постоянна во
все оставшееся время выщелачивания. Примеси, такие как магний, железо и марганец среди прочих проявляют такую же кинетику, приводя, таким образом, к довольно высокому расходу кислоты на начальной
стадии выщелачивания, что свидетельствует о том, что выщелачивание никеля сопровождалось разложением сапролита.
В вышеупомянутом исследовании выщелачивания концентрация свободной HCl, оставшейся в выщелачивающем растворе, составляла 2М. Поскольку высокая кислотность может вызывать определенные трудности при работе на ионообменной стадии процесса извлечения никеля, к горячему (например, 70oC) выщелачивающему раствору добавляют взвесь оксида магния, получаемого при пирогидролизе, для нейтрализации остаточной свободной кислоты в растворе до уровня pH приблизительно 1.
Преимущество процесса согласно настоящему изобретению состоит в том, что нейтрализующий агент, например MgO, является вторичным побочным продуктом самого процесса. Таким образом, переработка руды с высоким содержанием магния позволяет использовать систему вторичного использования продуктов, в которой оксиды, состоящие из оксида магния и оксида железа, отделяются от выщелачивающего раствора в виде твердого осадка после растворения никеля и кобальта из руды, а затем используются в качестве нейтрализующих веществ для снижения активности конечного раствора никеля до pH в диапазоне от 1 до 3.
Иллюстрация кинетики нейтрализации приведена в таблице 2.
Другой способ нейтрализации выщелачивающего раствора состоит в использовании свежей сапролитной руды, содержащей оксиды как магния, так и железа.
Свежая сапролитная руда добавляется к раствору при температуре раствора около 70oC. Как и в случае добавления вторичной окиси магния в чистом виде, в этом случае также наблюдали уменьшение кислотности и почти полное выпадение в осадок гидроокиси железа при достижении уровня кислотности 4 - 7 г/л. Свежедобавленная руда частично выщелачивается. Кинетика реакции замедляется при уменьшении кислотности. Для нейтрализации 600 мл выщелачивающего раствора, содержащего 81 г/л соляной кислоты, требуется 849 г свежей сапролитной руды. Полученные результаты представлены в таблице 3.
Общая экстракция на стадиях выщелачивания и нейтрализации была вблизи значения 60,7%, хотя извлечение на этой стадии было около 29,8%. Как можно отметить, конечный образец содержал 16,8 г/л никеля.
Для устранения необходимости в отдельной стадии разделения твердой и жидкой фаз стадии выщелачивания и нейтрализации проводили непрерывно без осуществления разделения фаз между стадиями выщелачивания и нейтрализации. Во время нейтрализации шлам из свежей руды с содержанием 600 г/л вводили в раствор с постоянной скоростью 10 мл/мин. Полученные результаты представлены в таблице 4.
Как можно отметить, концентрация никеля после нейтрализации уменьшается, переходя от 10,2 г/л после выщелачивания к 5,48 г/л после нейтрализации. Это происходит из-за увеличения количества воды, которая поступает в раствор вместе со шламом. Фактически же количество никеля, извлеченного после нейтрализации, увеличивается. Сопоставление кислотности и количества добавленной руды со временем представлено на фиг. 6. Экстракция никеля в этом процессе составила 22,8%.
Противоточный процесс выщелачивания представляется особенно привлекательным, когда стадия нейтрализации проводится с использованием свежей порции сапролитной руды. В этом процессе осадок, образовавшийся на стадии нейтрализации, выщелачивается в тех же условиях, что и исходный выщелачивающий раствор, а полученный выщелочной раствор затем нейтрализуется свежей порцией сапролитной руды. Этот противоточный процесс проиллюстрирован на фиг. 3.
Нижеследующий пример приведен в качестве иллюстрации противоточного процесса и он сопровождается соответствующей фиг. 2.
Пример 1
В условиях противоточного процесса 300 г свежей руды выщелачивали с помощью 0,5 л 6 М раствора соляной кислоты при 80oC и фильтровали полученную взвесь для
получения выщелачивающего раствора, необходимого для проведения стадии нейтрализации. К этому раствору при температуре 80oC добавляли свежую руду и снижали этим кислотность раствора до,
приблизительно, 10 г/л. Затем полученную взвесь фильтровали, а полученный раствор обрабатывали ионным обменом. Отфильтрованный осадок сушили и добавляли его к 6 М раствору соляной кислоты при 80oC. Эту взвесь фильтровали и осадок отправляли в отходы. Полученный на этой стадии раствор затем может быть нагрет и к нему можно добавить свежую руду После фильтрования жидкость может пройти
через ионообменную смолу и цикл можно повторить таким же образом.
Выщелачивание в колоннах или кучах
В этом процессе были использованы пять колонн высотой приблизительно 60
дюймов и диаметром 4 дюйма (10,16 см). Сапролитную руду 3 (см. таблицу 1) с размерами частиц менее 3/4 дюйма (1,9 см) агломерировали с кислотой до ее загрузки в колонны. Скорость орошающего потока
составляла 1,35 мл/мин, что соответствует потоку 10 литров на квадратный метр в час.
Как отмечено в испытании на выщелачивание с перемешиванием, "глинообразная" сапролитная руда во время фильтрации обладает плохой проницаемостью. Таким образом, таблетирование руды представляется важным приемом, обеспечивающим равномерное распределение реагента по всему объему кучи или колонны и достаточную целостность формы гранул, сопротивляющихся гравиметрическому потоку, а также гарантирует сохранение желаемой проницаемости при орошении и просачивании раствора реагента через кучу или колонну.
Во время эксперимента по выщелачиванию руды поддерживалась постоянная скорость потока раствора реагента, равная 10 литров на квадратный метр в час, а параметры таблетирования
были следующими:
Влажность (сухого остатка) - 20 - 60%
Кислотность жидкости - 0 - 12 молярная HCl
Размер частиц таблеток - 1 дюйм + 8 меш
Насыпная плотность колонны
- 0,9 - 1,2 кг/л
Пористость столба руды - 25 - 40%
Практические условия проведения процесса представлены в таблице 5.
Фиг. 7 изображает кинетику экстракции никеля при различных условиях. Проведенные испытания показали, что в начальный период выщелачивания кинетика выщелачивания пропорциональна объему агломерационной кислоты, а позже становится пропорциональной кислотности выщелачивающего раствора. Значительного влияния размера частиц на кинетику выщелачивания в колоннах или кучах не отмечалось, по крайней мере в диапазоне размеров частиц менее 3/4 дюйма (1, 9 см), использованных в этих испытаниях.
Данные, приведенные в таблице 6, сопоставляют остаточную кислотность выщелачивающего раствора с экстракцией никеля, магния и железа как в процессе с перемешиванием, так и в процессе выщелачивания в колоннах. Высокая кислотность, примененная в процессе с перемешиванием, выражается в высокой степени экстракции железа и высокой остаточной кислотности выщелачивающего раствора. Как уже отмечалось выше в отношении нейтрализации выщелачивающего раствора с помощью оксида магния или смеси оксидов магния и железа, либо с помощью свежей руды, более низкая кислотность, достигаемая после нейтрализации, вызывает осаждение железа внутри колонны, что благоприятно выражается в более низкой экстракции железа, за исключением того, что более высокая экстракция никеля сопровождается также экстракцией магния.
Последовательное выщелачивание в колоннах
Чтобы полностью использовать высокую остаточную кислотность
выщелачивающего раствора, имеющую место при колонном способе выщелачивания, повысить чистоту никеля и скорректировать pH раствора до величин порядка 1 - 1,5, необходимых для последующего ионного
обмена, раствор, выходящий из колонн 2 и 3, доводили до определенной входной кислотности и подавали в колонны 4 и 5, соответственно. Было установлено, что скорости экстракции не испытывают
значительного влияния от присутствия различных ионов в подаваемом растворе.
Две колонны - N 1 и N 2 - были установлены для нейтрализации выщелачивающего раствора, кислотность которого слишком высока для эффективного ионообменного извлечения никеля. Агломерация для колонны N 1 проводилась с использованием 1,4 М раствора соляной кислоты, а для колонны N 2 - с водой. Когда выщелачивающий раствор из колонн 4 и 5 подавали в N 1 и N 2, было обнаружено, что в этих условиях никель и магний медленно выщелачиваются, а железо в сколько-нибудь значительных количествах не извлекается. Кислотность конечного выщелачивающего раствора оставалась в пределах 5 - 8 г/л остаточной кислоты даже когда содержание свободной кислоты в подаваемом растворе менялось от 9 г/л до 20 г/л.
Выщелачивание в колоннах серной кислотой
Были использованы три колонны меньшего размера, имеющие 4 фута (121,92 см) высоты и диаметр 4 дюйма (10,16 см).
Образец сапролита 1, представленный в таблице 1, агломерировали до размеров частиц -3/4 дюйма + 10 меш, а затем набивали в каждую из колонн. Проводили быстрое выщелачивание, в котором скорость потока увеличивали с 10 до 100 литров на квадратный метр в час.
Условия проведения таблетирования руды (или агломерирования) и ее выщелачивания в сравнении с величиной экстракции никеля, железа и магния сведены в табл. 7 и 8.
Проводили испытания с использованием колонны большего размера, имеющей диаметр 6 дюймов (15,24 см) и высоту 15 футов (457,2 см). В колонну загружали 103 кг сапролита с размерами частиц менее 1 дюйма (2,54 см). Руду агломерировали с использованием 25,6 литра серной кислоты с концентрацией 180 г/л. Концентрация кислоты в выщелачивающем растворе составляла 30 г/л, а скорость потока раствора поддерживали равной 5 литров на квадратный метр в час.
На 66-й день экстракция никеля, железа и магния составила 21,71%, 2,26% и 18,05%, соответственно. На фиг. 8 показана кинетика экстракции никеля при различных условиях для трех маленьких колонн и большой колонны.
Извлечение никеля ионным обменом (IX)
Хелатообразующая ионообменная смола марки Dow XFS-4195 была использована для селективного извлечения никеля из элюатов солянокислотного и сернокислотного выщелачивания в колоннах. Активной
функциональной группой был бис-пиколиамин. Поскольку смола является аминной, эта смола протонируется в растворе кислоты. В таблице 9 перечислены коэффициенты абсорбции для различных элементов.
Теоретическая емкость по никелю составляет приблизительно 30 граммов никеля на литр плотноупакованной смолы.
Извлечение никеля из солянокислотного колонного выщелачивающего раствора
Для обработки четырех типов выщелачивающего раствора, отбираемого с выхода выщелачивающих колонн с N 2 по N 5, соответственно, (солянокислотное выщелачивание), была использована одна колонка IX
объемом 100 мл. Состав приведен в таблице 10.
Рабочие условия были следующими:
Объем слоя (BV) - 0,1 л
Скорость потока - 0,05 BV/мин
Загрузка - 6 BV
Промыв N 1 - 1 BV
Десорбирующий раствор - 1 BV
Промыв N 2 - 1 BV
Десорбирующий раствор состоял из 3М раствора HCl или, приблизительно, 109 г/л HCl.
Было установлено, что IX-разделение магния и никеля было полным, а IX-разделение железа и никеля зависело от pH подаваемого раствора. Для разделения никеля и железа желательными являлись более высокие значения pH. В таблице 11 приведено сравнение состава подаваемого раствора с десорбирующим раствором при различных значениях pH подаваемого раствора.
Извлечение никеля из сернокислого
колонного выщелачивающего раствора
Для определения извлечения никеля из сернокислого выщелачивающего раствора при комнатной температуре были использованы две IX-колонки объемом 0,2 и 3 л.
Полученные результаты представлены в таблицах 12 и 13.
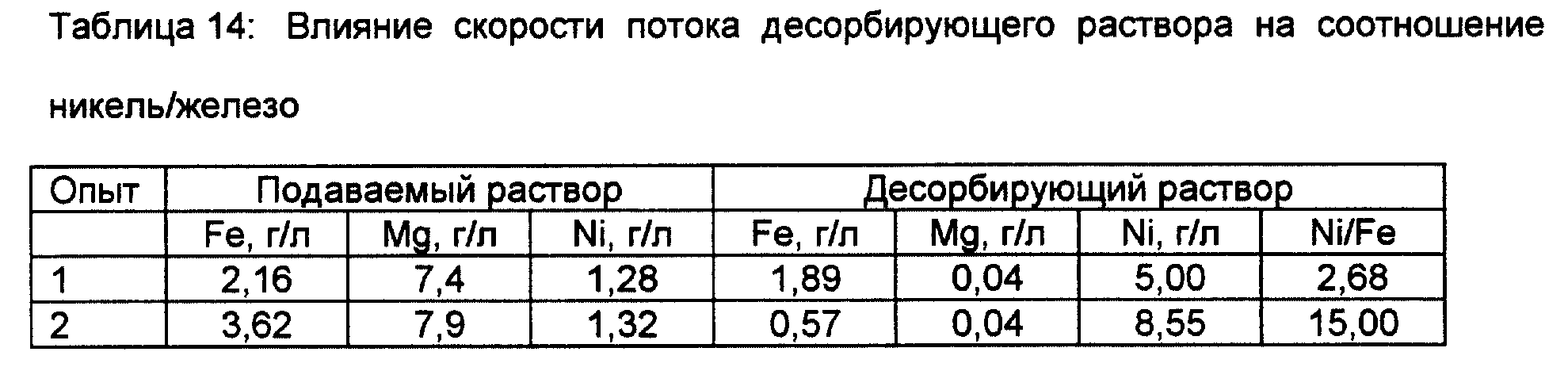
Составы подаваемых и десорбирующих растворов, полученных в каждой из использованных процедур, представлены в таблице 14, из которой видно, что чем меньше скорость потока, тем выше степень отделения никеля от железа.
Поскольку для пирогидролиза желательна высокая концентрация хлоридов, рафинат IX может быть повторно возвращен в колонны в качестве выщелачивающего раствора после корректировки его кислотности, а десорбирующий раствор IX также может быть повторно использован в качестве десорбирующего раствора для повышения концентрации никеля до проведения пирогидролиза никеля.
Как совершенно очевидно, при осуществлении предложенной заявителем настоящего изобретения новой концепции могут быть использованы различные схемы проведения процесса.
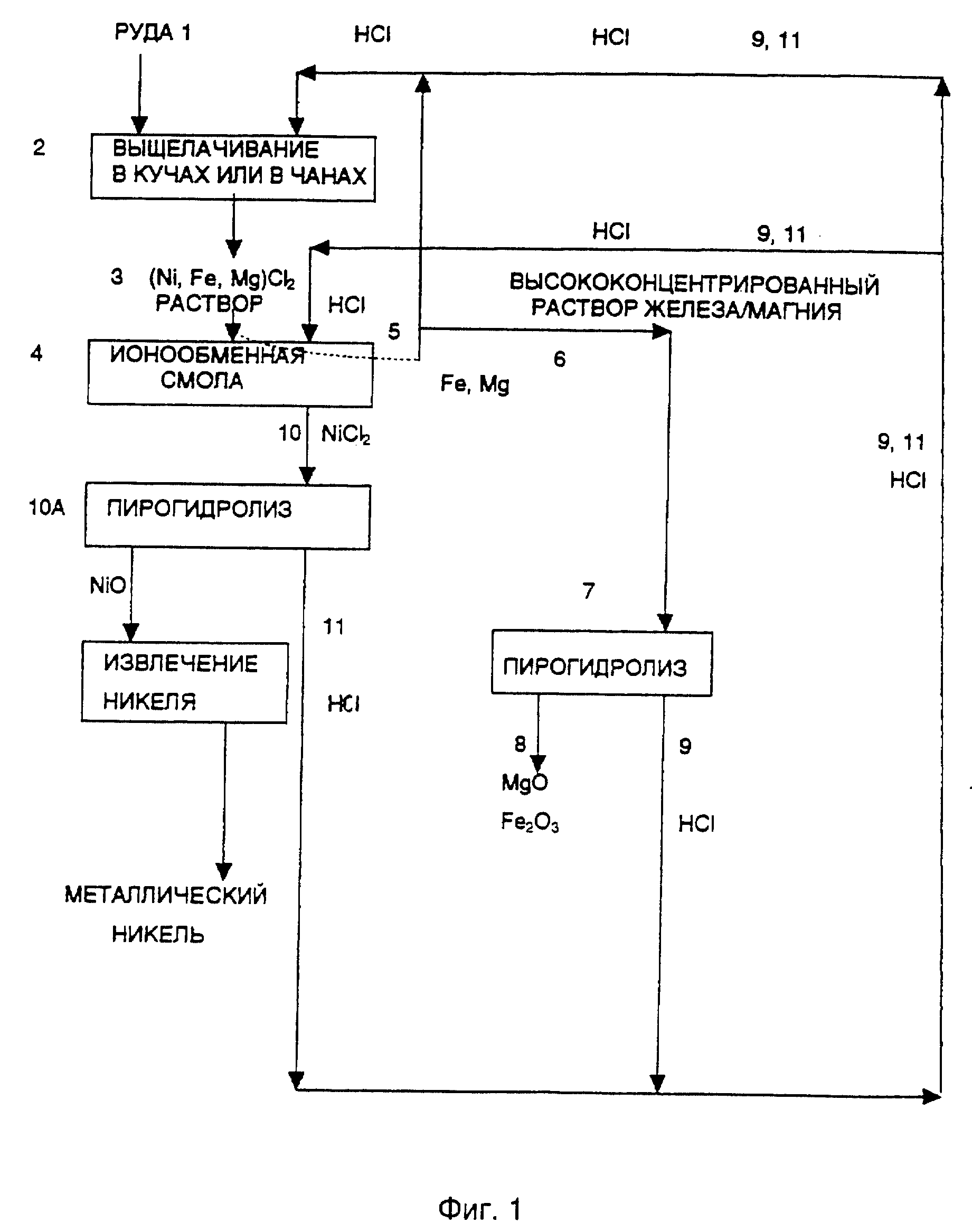
В этой связи обратимся к схеме, представленной на фиг. 1, предназначенной для выщелачивания в кучах или в чанах, где руда (1) складывается в кучу, схематически показанную в позиции (2), в которую подается HCl с концентрацией около 3 молярной, наливаемая сверху и проходящая всю кучу до самого низа, просачиваясь в промежутки между кусками руды, причем размеры кусков руды не превышают, приблизительно, 3/4 дюйма (1,9 см).
Выщелачивающий раствор (3), содержащий хлориды никеля, железа и магния, при необходимости нейтрализуют до pH в диапазоне, приблизительно, от 1 до 2. Затем выщелачивающий раствор проходит через ионообменный слой, состоящий из смолы Dow XFS-4195.
Никель селективно абсорбируется на смоле (4), и получается рафинат, содержащий Mg и Fe, часть которого (5) возвращается на стадию выщелачивания, посредством чего увеличивается концентрация магния и железа в рафинате.
Часть рафината (6), имеющего высокое содержание магния и железа, подвергается пирогидролизу (7) для получения MgO и Fe2O3 (8), а также HCl (9), которая возвращается к слою ионообменной смолы (4) для экстракции никеля в виде хлорида никеля (10) и на стадию выщелачивания (2) по линии (9). Полученный десорбирующий раствор повторно возвращается в цикл после корректировки его кислотности с помощью соляной кислоты, что повышает содержание никеля.
Хлорид никеля (10), экстрагируемый из ионообменной смолы, может быть подвергнут пирогидролизу (11) с получением оксида никеля, или, в зависимости от концентрации никеля в растворе, раствор хлорида никеля может быть направлен на электролиз для получения электролитического никеля.
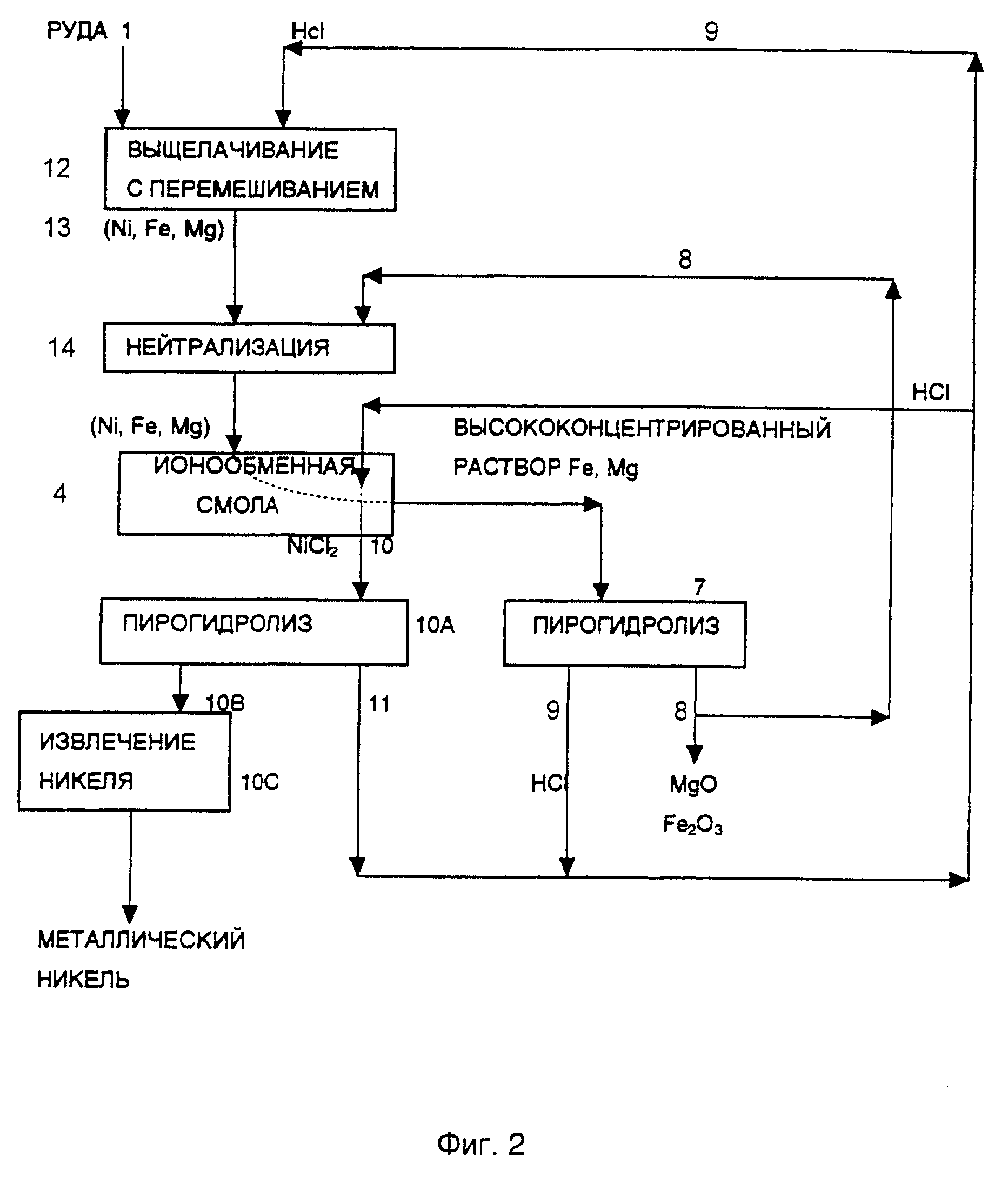
Схема процесса, изображенная на фиг. 2, аналогична схеме с фиг. 1 с тем исключением, что для обработки руды здесь используется выщелачивание с перемешиванием.
После выщелачивания с перемешиванием (12) руды (1), проводимого при концентрации соляной кислоты порядка 6 молярной и температуре около 80oC, получается раствор (13), содержащий никель, железо и магний. После отделения от рудной породы этот раствор проходит через стадию нейтрализации (14). Раствор нейтрализуется до pH, приблизительно, 1 - 2 с использованием восстановленной окиси магния или смеси окиси магния со свежей рудой, которая будет рассмотрена ниже.
Никельсодержащий раствор пропускается через слой ионообменной смолы (4), состоящий из смолы, селективно абсорбирующей никель, например Dow XFS-4195, относящейся к типу бис(2-пиколил)аминов или N-(2-гидроксиэтил-2-гидроксипропил)аминов.
Другим типом смолы для селективной абсорбции никеля, которая может быть использована в этом процессе, является макропористый полистирольный сополимер с привитой слабоосновной хелатной пиколиаминной производной функциональной группой, а конкретно, N-(2-гидроксипропил)-2-пиколиамином.
Никель экстрагируется из ионообменной смолы в виде NiCl2 (10) с помощью HCl, которая обычно представляет собой вторично используемую соляную кислоту. Хлорид никеля может быть подвергнут пирогидролизу (10A) с образованием NiO (10B), который может быть восстановлен до металлического никеля, например восстановлением водородом (10C) с образованием порошка никеля (10D).
С другой стороны, в зависимости от концентрации никеля в растворе, никель может быть извлечен электролизом.
После абсорбции никеля ионообменной смолой (4) оставшийся раствор, содержащий железо и магний в высоких концентрациях, подвергается пирогидролизу (7), сопровождающемуся образованием вторичной соляной кислоты (9) и (MgO + Fe2O3) (8), которые направляются для вторичного использования на стадию нейтрализации (14). Вторичная соляная кислота направляется либо на стадию обработки слоя ионообменной смолы (4), либо на стадию выщелачивания с перемешиванием (12), либо на обе эти стадии, что позволяет сохранять и вторично использовать всю соляную кислоту в системе, за исключением добавки корректирующего pH количества кислоты, если это необходимо.
Другой вариант схемы воплощения технического решения настоящего изобретения представлен на фиг. 3.
В этом случае применяется двухстадийное выщелачивание, в котором твердая фаза (15), остающаяся после выщелачивания руды на второй стадии выщелачивания, вторично направляется на первую стадию выщелачивания.
Руда (16) (сапролит с высоким содержанием магния) подается на вторую стадию выщелачивания (17), где она выщелачивается с использованием жидкости, поступающей с первой стадии выщелачивания (18), с целью уменьшения остаточной кислотности. Выщелачивание на первой стадии проводится на твердом остатке (15), поступающем со второй стадии выщелачивания (17). К твердой фазе (15) добавляется 18%-ный раствор соляной кислоты (19), продукты реакции которых поступают на стадию разделения твердой и жидкой фаз (20A), где осадок (21) выводится из системы, а оставшаяся жидкость (22) подается на вторую стадию выщелачивания (17) для получения смеси твердая фаза/жидкость (17A), из которой твердая часть вторично направляется на первую стадию выщелачивания для ее дальнейшего выщелачивания.
Раствор (17B) поступает на стадию нейтрализации (23), куда повторно направляется MgO (24) для образования смеси твердой и жидкой фаз (25), из которой удаляется твердый осадок Fe2O3. После этого жидкость, содержащая хлорид никеля, обрабатывается вторичным MgO на стадии (26) для осаждения Ni(OH)2 (27) и образования MgCl2 (28), причем после этого раствор MgCl2 подвергается пирогидролизу (29) для получения MgO (24) для его вторичного использования в данной системе в качестве нейтрализующего вещества, и HCl (30), которая повторно используется на первой стадии выщелачивания (18).
На фиг. 4 показана схема процесса выщелачивания в колоннах или в кучах латеритной руды с высоким содержанием магния (например, сапролита) с использованием в качестве выщелачивающего агента серной кислоты.
Агломерированная руда (31) с размером частиц менее одного дюйма (2,54 см) вводится в колонну (32) или сгребается в самоподдерживающуюся кучу, через которую проходит раствор серной кислоты (33) с концентрацией от 0,1 до 2М, причем эта кислота просачивается сквозь пустоты между таблетками агломерированной руды с верхней части столба до его низа.
Затем выщелачивающая жидкость, вытекающая из низа колонны или кучи, подвергается нейтрализации (34) с использованием в качестве нейтрализующего агента свежей руды (31), как это показано на схеме, в последовательно установленной колонне или в баке с перемешиванием.
Затем нейтрализованный выщелачивающий раствор, отделенный от твердого осадка, проходит через слой ионообменной смолы (35), селективно абсорбирующей никель, такой например, как смола Dow XFS-4195. После абсорбции никеля через слой смолы пропускается H2SO4 (36) с концентрацией от 1 до 2М для экстракции никеля в виде сульфата никеля (37), а выходящая серная кислота, содержащая магний и железо, захваченные при абсорбции никеля, вторично поступает частично на стадию выщелачивания никеля в колонну (32) и частично - на стадию нейтрализации (38) известью (39).
Вследствие нейтрализации известью Fe2O3 осаждается и остается раствор MgSO4 (40). Раствор сульфата магния может быть подвергнут дальнейшей обработке с получением MgO и серной кислоты для вторичного использования в системе.
На фиг. 9 показана модифицированная схема с фиг. 1, позволяющая отделить магний от железа посредством нейтрализации и повторно использовать кислотную воду, образующуюся в этом процессе. Таким образом можно регулировать накопление хлорида в выщелачивающем растворе, приводящее к снижению сорбционной емкости смолы по никелю. Руда выщелачивается подобным же способом с использованием комбинированных потоков соляной кислоты (41 и 42), получаемой в ходе пирогидролиза и из кислотной воды (43 и 44), производимой на промывочной стадии ионного обмена, а также из кислотной воды, используемой для промывки кучи по завершении стадии выщелачивания.
Рафинатный раствор с высоким содержанием железа и магния (45) нейтрализуется до pH 6 - 7 и осадок твердой Fe(OH)3 отфильтровывается. Оставшаяся жидкость, состоящая из раствора MgCl2, подвергается пирогидролизу (46) для получения MgO (47), конденсированной воды (48) и HCl (41), которые все повторно используются в процессе. MgO может быть и целевым продуктом.
Часть из элюентного раствора NiCl2 используется в процессе десорбции смолы после повышения его кислотности. Остальная часть раствора NiCl2 поступает на пирогидролиз для получения NiO.
При подготовке руды к выщелачиванию руда, как уже отмечалось, измельчается с помощью щековой дробилки с зазором между измельчающими поверхностями дробилки приблизительно от 1 до 3/4 дюйма (от 2,54 до 1,9 см). Руда пропускается через щековую дробилку один раз.
Типичные значения размеров кусков измельченной руды представлены в таблице 15.
При производстве таблетированной руды может быть использована хорошо известная в технике роторная таблетмашина. В проведенных испытаниях таблетки получали, главным образом, агломерированием по способу циркуляционного перемещения смеси руды с жидкостью с образованием шарообразных сферических гранул. В тех случаях, когда присутствовали грубодисперсные частицы, эти грубодисперсные частицы обычно покрывали тонкодисперсными частицами для образования агломерированных таблеток вместе с таблетками, образованными из тонкодисперсных частиц.
Типичное распределение по размерам агломерированных таблеток, используемых для выщелачивания в кучах, показано в таблице 16.
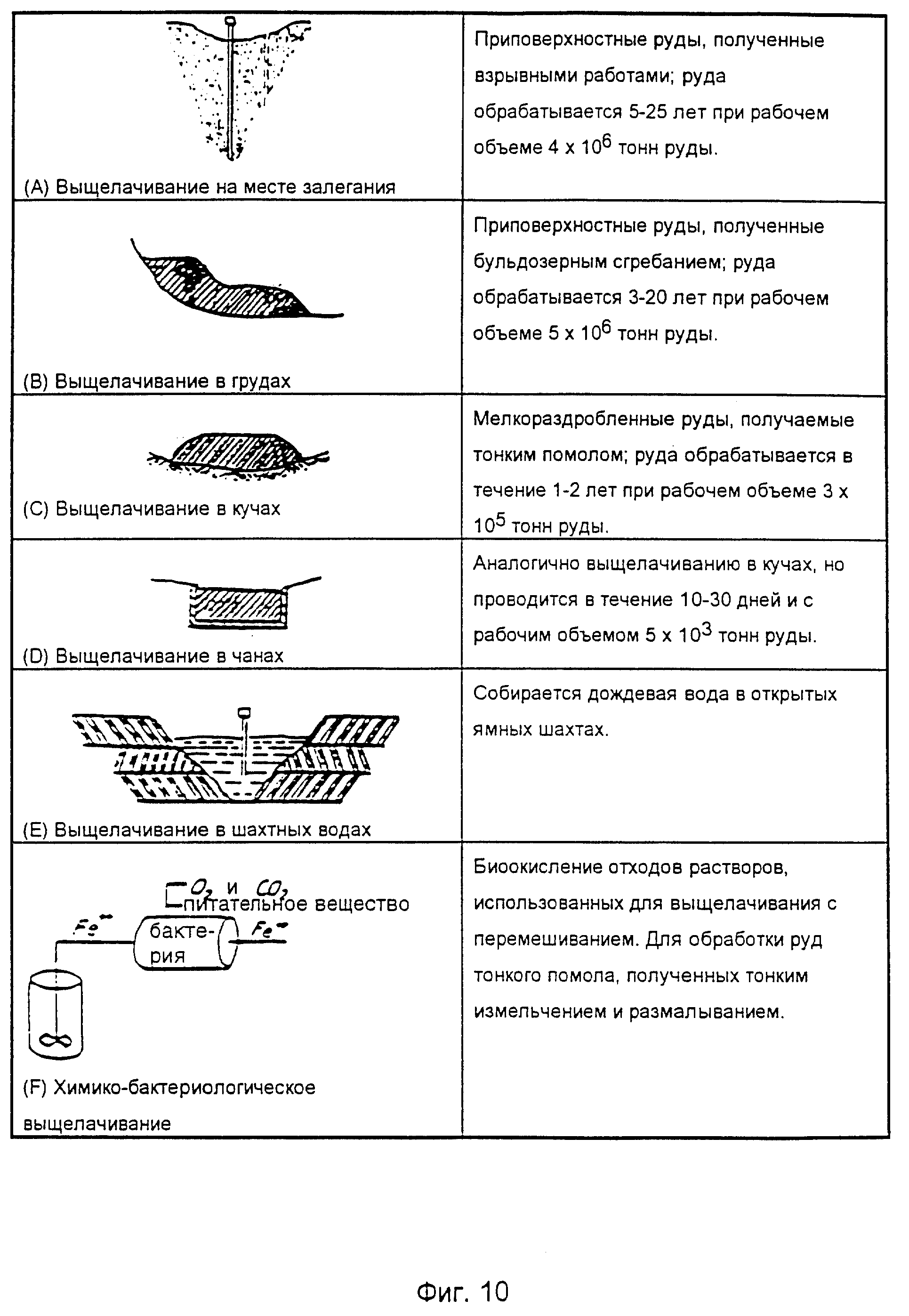
На фиг. 10 показаны различные типы операции выщелачивания.
В разделе (A) приведена иллюстрация выщелачивания на месте залегания рудного тела, называемого приповерхностными рудами, с рабочей производительностью 4•106 тонн руды за указанное время осуществления процесса.
В разделе (B) показано "выщелачивание в грудах", при котором груда руды образуется с помощью бульдозеров. Рабочая производительность составляет примерно 5•106 тонн руды за указанный период времени.
В разделе (C) показано выщелачивание в кучах, имеющее рабочую производительность около 3•105 тонн руды за указанный период.
Выщелачивание в чанах иллюстрируется в разделе (D). Этот тип выщелачивания аналогичен выщелачиванию в кучах при рабочей производительности 5•103 тонн руды за указанный период времени.
В разделе (E) показано выщелачивание пластовыми водами, осуществляемое за счет пластовых вод, собираемых от дождевых осадков в открытых ямных шахтах.
Все вышеприведенные методы называются статическими операциями.
В разделе (F) данного чертежа показан более динамичный подход к выщелачиванию, в котором руда вначале размалывается и обрабатывается бактериями вместе с, например, раствором сульфата железа в реакторе с мешалкой.
В сущности, варианты технических решений, представленные на фиг. 1 - 4, имеют центральную тему, а именно - извлечение никеля из латеритной руды с высоким содержанием магния (например, из сапролита) без необходимости в плавке оксидной руды для производства ферроникелевых или никелевых штейнов, которая давно применяется на практике.
Новизну ключевых аспектов настоящего изобретения можно обобщить в следующем виде:
(1) Экстракция никеля из сапролитной руды с высоким
содержанием магния при атмосферном давлении и обычной температуре;
(2) Агломерация сапролитной руды глинообразной консистенции в таблетки с целью достижения равномерного распределения
выщелачивающего раствора по всей куче руды или колонне, включая достаточную устойчивость формы таблеток при гравиметрическом протекании жидкости сквозь толщу руды;
(3) Экстракция никеля при
атмосферном давлении и температуре около 60 - 80oC в процессе выщелачивания с перемешиванием, выщелачивания в кучах или в чанах;
(4) Отделение никеля от железа и магния с помощью
ионообменной обработки маточного раствора при его контактировании с ионообменной смолой, избирательно сорбирующей никель из растворов, содержащих также железо и магний, при pH в диапазоне от 1 до 3;
(5) Корректировка значения pH выщелачивающего раствора в ходе последовательного процесса выщелачивания в кучах с использованием свежей руды или вторично используемых оксидов железа и магния,
получаемых на стадиях пирогидролиза; и
(6) Использование вторичных продуктов процесса, таких как:
(a) повторное использование регенерированной кислоты в системе выщелачивания;
(b) повторное использование рафинатного раствора в системе выщелачивания, как показано на фиг. 1;
(c) повторное использование промывного раствора в системе выщелачивания, как показано
на фиг. 9; и
(d) повторное использование MgO и Fe(OH)3, образующихся в процессе выщелачивания, в системе выщелачивания для корректировки pH.
При реализации описанного здесь гидрометаллургического процесса получается достаточно чистый никель, извлеченный из руды с высоким содержанием магния.
Хотя настоящее изобретение было здесь описано применительно к наиболее предпочтительным вариантам его реализации, следует понимать, что возможны многочисленные его модификации и вариации, не отходящие от смысла и области применения настоящего изобретения, что должно быть совершенно очевидно специалистам в данной области техники. Такие модификации и вариации считаются подпадающими под действие настоящего изобретения и прилагаемой к нему формулы изобретения.
Реферат
Способ может быть использован для извлечения никеля из латеритных руд с высоким содержанием магния, содержащих также и железо. Руды, называемые сапролитными, подвергают выщелачиванию (2) минеральными кислотами из группы, включающей HCI, H2SO4 и HNO3, причем предпочтение отдается НСI. После выщелачивания (например, НСI) полученный маточный раствор отделяется от нерастворимого твердого вещества и никель предпочтительно извлекается из раствора за счет контакта раствора с ионообменной смолой, избирательно адсорбирующей никель. Оставшийся рафинированный раствор, содержащий хлориды железа и магния, может быть подвергнут пирогидролизу с целью получения соответствующих их оксидов и свободной НСI, которая повторно может быть использована в системе выщелачивания. Никель извлекается из ионообменной смолы с помощью десорбирующего раствора кислоты, после чего растворенный никель извлекается из этого никельсодержащего десорбирующего раствора, повышается степень чистоты извлеченного никеля. 4 с. и 14 з.п. ф-лы, 10 ил, 16 табл.

Комментарии